タンパク質の製造方法
【課題】 タンパク質のアミノ酸配列(当該タンパク質遺伝子/cDNAの開始コドンから終止コドンまででコードされる配列)を変えることなく、機能性糖鎖が付加され得るペプチド、あるいは機能性糖鎖が付加されないペプチドをタンパク質に連結し、分泌生産性、各種機能、安定性などを向上させた目的タンパク質を製造すること。
【解決手段】 分泌タンパク質をコードするDNAに、少なくとも1つのAsnを含むアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、そのアミノ酸配列を付加した分泌タンパク質であって本来の活性を損なうことなく分泌生産量が増大した分泌タンパク質の製造方法を提供する。
【解決手段】 分泌タンパク質をコードするDNAに、少なくとも1つのAsnを含むアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、そのアミノ酸配列を付加した分泌タンパク質であって本来の活性を損なうことなく分泌生産量が増大した分泌タンパク質の製造方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はタンパク質に新たな性質を付与することを特徴とするペプチドを付加したタンパク質の製造方法に関する。タンパク質に新たな性質を付与するとは、タンパク質の分泌生産性の向上、タンパク質の生理活性等の向上、タンパク質の安定性の向上などを意味する。
【0002】
詳細には、少なくとも1つのAsnを含むアミノ酸配列を付加した分泌タンパク質であって本来の活性を損なうことなく分泌生産量が増大した分泌タンパク質の製造方法、および下記(1)のアミノ酸配列モチーフを付加した目的のタンパク質であって本来の活性を損なうことなく新たな性質を付与した目的のタンパク質の製造方法、およびThrまたはSerを少なくとも1つ有するペプチドにおいて、Thr/SerにO結合型糖鎖が結合したそのアミノ酸配列を付加した目的のタンパク質であって本来の活性を損なうことなく新たな性質を付与した目的のタンパク質の製造方法に関する。
(1)Asn Xaa Thr/Ser
(ただし、(1)でXaaは任意のアミノ酸を示す。)
【背景技術】
【0003】
多くのタンパク質には翻訳後修飾として糖鎖付加がなされている。糖鎖付加の様式には2種類あって、タンパク質中のN(Asn)−X(Pro以外のアミノ酸)−S(Ser)/T(Thr)という配列中のAsnに糖鎖が付加される場合はN結合型糖鎖、タンパク質中のSer、Thrの水酸基を介して糖鎖が付加される場合はO結合型糖鎖とよぶ。一般に、N結合型糖鎖には上記のようなコンセンサス配列があるため、糖鎖付加の予測や制御が容易であるといえる。
【0004】
糖鎖はタンパク質が適正なfoldingをとる際に必要であったり、当該タンパク質の分泌促進、機能発現、血中での安定化、分子間相互作用などにも関与していたりする。このような機能性糖鎖をタンパク質に効率よく付加させるために、タンパク質中にあるN結合型糖鎖付加のコンセンサス配列を改変したり、これをタンパク質中に人為的に導入して、タンパク質に結合する糖鎖の数を増やすことが検討されてきている(特許文献1、非特許文献1参照)。
【0005】
例えば、コンセンサス配列NXS/Tにおいて、X部分のアミノ酸を置換することによって糖鎖付加効率を改善することが可能である(非特許文献1参照)。しかし、置換するアミノ酸の種類によっては立体構造変化が大きくなり、タンパク質機能に影響を及ぼす恐れがある。また、目的にあった糖鎖付加効率を追求するためには、X部分に関してもともとのアミノ酸とプロリンを除く18種類のアミノ酸について検討する必要があり、手間がかかる。
【0006】
新たにN結合型糖鎖付加のコンセンサス配列をタンパク質中に導入する場合でも、置換するアミノ酸の種類や位置によっては本来のタンパク質機能を損ねる恐れがあり、至適な変異導入条件を検討する必要がある。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平5−86099号公報
【非特許文献】
【0008】
【非特許文献1】Susan H. Shakin−Eshleman et al., J. Biol. Chem. 271, 6363−6366 (1996)
【非特許文献2】Lorenzo Frigerio et al., Plant Cell. 13, 1109−1126 (2001)
【非特許文献3】Tetsuro Orita et al., J. Biochem. 115, 345−350 (1994)
【非特許文献4】Ernst Bause et al., Biochem. J. 195, 639−644 (1981)
【非特許文献5】Gerry A. F. Nicolaes et al., Biochemistry 38, 13584−13591 (1999)
【非特許文献6】Atsushi Nishikawa et al., Biochem. J. 355, 245−248 (2001)
【非特許文献7】Lakshmi Kasturi et al., Biochem. J. 323, 415−419 (1997)
【非特許文献8】Melinda Bence et al., FEBS J. 278, 4338−4350 (2011)
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明の課題は、目的タンパク質のアミノ酸配列(当該タンパク質遺伝子/cDNAの開始コドンから終止コドンまででコードされる配列)を変えることなく、ペプチドまたは糖鎖が付加したペプチドを連結したタンパク質を合成し、分泌生産性、各種機能、安定性などを向上させた目的タンパク質を製造することである。
【課題を解決するための手段】
【0010】
本発明者らは、N結合型糖鎖付加のコンセンサス配列であるNXT/S配列(XはPro以外のアミノ酸)を含むペプチド、および類似のペプチドをタンパク質に連結した場合に、タンパク質にどのような影響があらわれるのかを検討した。その結果、驚くべきことに、糖鎖が付加されたペプチドがタンパク質に連結されたことによって、タンパク質の分泌生産量が著しく増大することを見出した。さらに驚くべきことに、糖鎖が付加しないペプチドでも同様な効果を見出し、特に、アスパラギンが配列に含まれることが重要であることを突き止め、本発明を完成するに至った。
【0011】
すなわち、本発明は下記<1>〜<4>のタンパク質の製造方法である。
<1> 分泌タンパク質をコードするDNAに、少なくとも1つのAsnを含むアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、そのアミノ酸配列を付加した分泌タンパク質であって本来の活性を損なうことなく分泌生産量が増大した分泌タンパク質の製造方法。
【0012】
<2> 目的のタンパク質をコードするDNAに、下記(1)のアミノ酸配列モチーフを少なくとも1つ有するアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、そのアミノ酸配列を付加した目的のタンパク質であって本来の活性を損なうことなく新たな性質を付与した目的のタンパク質の製造方法。
(1)Asn Xaa Thr/Ser
(ただし、(1)でXaaは任意のアミノ酸を示す。)
【0013】
<3> 目的のタンパク質をコードするDNAに、ThrまたはSerを少なくとも1つ有するアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、ThrまたはSerにO結合型糖鎖が結合したそのアミノ酸配列を付加した目的のタンパク質であって本来の活性を損なうことなく新たな性質を付与した目的のタンパク質の製造方法。
【0014】
<4> そのアミノ酸配列がプロテアーゼ切断配列を有するものであり、製造したタンパク質にそのプロテアーゼを反応させて、製造したタンパク質からそのアミノ酸配列を切断することを特徴とする<1>から<3>に記載のタンパク質の製造方法。
【発明の効果】
【0015】
本発明者らは、タンパク質にN結合型糖鎖付加のコンセンサス配列であるNXT/S配列(XはPro以外のアミノ酸)を含むペプチドやそれに類似のペプチドを連結した場合、当該タンパク質の分泌生産量が増大することを見出した。この原因としては、ペプチド付加の単独効果、あるいは糖鎖が付加されたペプチドがタンパク質に連結された効果が考えられる。従来、タンパク質に機能性糖鎖を効率よく付加させるためには、タンパク質の糖鎖付加部位周辺配列を改変したり、新たにN結合型糖鎖付加のコンセンサス配列を導入したりするなど、タンパク質への変異導入が必要であった。そのため、野生型タンパク質の諸性質を損ねる恐れがあった。本発明では、タンパク質のアミノ酸配列(当該タンパク質遺伝子/cDNAの開始コドンから終止コドンまででコードされる配列)を変えることなくペプチドや糖鎖を付加することが可能で、必要に応じて、後から付加したペプチドおよび糖鎖を除去することもできることから、より野生型に近いタンパク質を効率よく調製できる。
【0016】
糖鎖のないペプチド付加の効果として、ある種のペプチドをタンパク質に連結することにより、目的タンパク質の諸性質が変化する場合があることが知られている。例えば小胞体局在シグナルであるKDELというアミノ酸配列(この配列には糖鎖は付加されない)をタンパク質のC末端に連結すると、当該タンパク質が小胞体に局在するようになる(非特許文献2参照)。本発明では、糖鎖が付加されないペプチドをタンパク質に連結させたときにおいても、場合によっては分泌生産性の向上が認められることを見出した。
【図面の簡単な説明】
【0017】
【図1】実施例1に用いたヒトIL−6組換え体の構造の特徴を示す模式図。
【図2】IL−6に存在する各N結合型糖鎖付加のコンセンサス配列を改変した変異体の分泌状況を示すブロット。
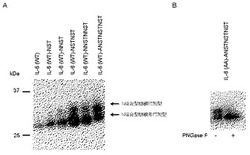
【図3】IL−6(WT)、IL−6(AA)の分泌におけるペプチド付加の効果を示すブロット。
【図4】IL−6(AA)に、糖鎖が結合しないペプチドを付加した場合の効果。
【図5】Factor Xa切断配列入りペプチドを付加したIL−6に対してPNGase F処理、Factor Xa処理を施した際の状況を示すブロット。矢印が示すバンドはN型糖鎖の結合したペプチドが切断除去された分子を示す。
【図6】実施例2に用いたヒトNGALの構造の特徴を示す模式図。
【図7】NGALの分泌におけるペプチド付加の効果を示すズロット。
【図8】実施例3に用いたヒトキモトリプシンCの構造の特徴を示す模式図。
【図9】キモトリプシンC、CTRC(N52S)の分泌におけるペプチド付加の効果を示すブロット。
【発明を実施するための形態】
【0018】
本発明のタンパク質製造方法は、下記<1>〜<4>である。
<1> 分泌タンパク質をコードするDNAに、少なくとも1つのAsnを含むアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、そのアミノ酸配列を付加した分泌タンパク質であって本来の活性を損なうことなく分泌生産量が増大した分泌タンパク質の製造方法。
【0019】
<2> 目的のタンパク質をコードするDNAに、下記(1)のアミノ酸配列モチーフを少なくとも1つ有するアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、そのアミノ酸配列を付加した目的のタンパク質であって本来の活性を損なうことなく新たな性質を付与した目的のタンパク質の製造方法。
(1)Asn Xaa Thr/Ser
(ただし、(1)でXaaは任意のアミノ酸を示す。)
【0020】
<3> 目的のタンパク質をコードするDNAに、ThrまたはSerを少なくとも1つ有するアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、ThrまたはSerにO結合型糖鎖が結合したそのアミノ酸配列を付加した目的のタンパク質であって本来の活性を損なうことなく新たな性質を付与した目的のタンパク質の製造方法。
【0021】
<4> そのアミノ酸配列がプロテアーゼ切断配列を有するものであり、製造したタンパク質にそのプロテアーゼを反応させて、製造したタンパク質からそのアミノ酸配列を切断することを特徴とする<1>から<3>に記載のタンパク質の製造方法。
【0022】
本発明に用いるペプチドとしては、上記<1>〜<4>のアミノ酸配列モチーフを有するペプチドであれば特に限定はないが、例えばNST、NSTNST、ANSTNSTNST、NSA、NNST、NSANSA、NQST、QNST、NNSTNNST、NNSA、ANST、NAST、NNAT、PNST、WNST、NNTT、NATS、NSTNSA、NSANSTといったペプチドが挙げられる。より好ましくは、糖鎖が付加されたNST、NSTNST、ANSTNSTNST、NNST、NQST、QNST、NNSTNNST、NNSA、ANST、NAST、NNAT、PNST、WNST、NNTT、NATS、NSTNSA、NSANSTである。また、プロテアーゼ切断部位を有するペプチドとしては、IEGRNST、IEGRNSTNST、IEGRIEGRNSTNST、IEGRIEGRNSANSA、IEGRIEGRAAANSTNST(以上、 Factor Xa切断部位入りペプチド)、DDDDKNST、DDDDKNSTNST、DDDDKDDDDKNSTNST(以上、エンテロキナーゼ切断部位入りペプチド)、LEVLFQGPNSTNST(PreScission protease切断部位入りペプチド)などである。(配列表配列番号1〜26)
【0023】
さらに目的タンパク質とペプチドの間には、スペーサーとしてのアミノ酸や制限酵素サイトによってコードされるアミノ酸などが連結していてもよい。また、連結したペプチドの後続には検出のためのタグが結合してもよい。
【0024】
N結合型糖鎖の結合の確認は、特に限定しないが、糖鎖除去反応前後の分子量変化を観察することにより行うことができる。糖鎖除去反応に用いる酵素として、例えばペプチド:N−グリコシダーゼF(Peptide:N−glycosidase F、PNGase F)が好ましい。
【0025】
本発明においてペプチドをコードするDNAは、上記<1>〜<4>のアミノ酸配列モチーフを有するペプチドをコードする塩基配列のDNA、およびその相補鎖を、アニールさせることにより合成し、T4リガーゼを用いて各種組換えベクターに挿入するが、ペプチドをコードするDNAの組換えベクターへの挿入法はこの方法に限定されるものではない。また、ベクター挿入時に制限酵素サイトを利用する場合は、制限酵素サイトによってコードされるアミノ酸もペプチドに連結される。
【0026】
本発明における組換えベクターは、特にその種類は限定されず、例えば、自立的に複製するベクター(例えばプラスミドやファージベクター)でもよいし、あるいは、宿主細胞に導入された際に宿主細胞のゲノムに組み込まれ、組み込まれた染色体と共に複製されるものであってもよい。
【0027】
好ましくは、本発明で用いるベクターは発現ベクターである。発現ベクターにおいて本発明のDNAは、タンパク質をコードするDNA、およびプロモーター等の転写に必要な要素が機能的に連結されている。プロモーターは宿主細胞において転写活性を示すDNA配列であり、宿主の種類に応じて適宜選択することができる。また、これらの発現ベクターはアンピシリン耐性遺伝子などの適当な選択マーカー遺伝子を含んでいてもよい。発現ベクターの例としては、例えば、pBluescript II SK+ベクター(Stratagene)、pcDNA3.1/Myc−His ver.A(Invitrogen)などが挙げられるが、本発明に用いる発現ベクターはこれらに限定されるものではない。
【0028】
本発明で用いるDNAは、遺伝子導入試薬、例えばリン酸カルシウムやリポソームを利用するもの、あるいはFuGene 6 transfection reagent(従来はRoche、現在はPromega)などの非リポソーム系トランスフェクション試薬などを用いて、あるいはエレクトロポレーション法やマイクロインジェクション法などにより、宿主細胞へ導入する。
【0029】
本発明における形質転換体として、細胞は糖鎖付加能を有する細胞、例えば、原核生物ではカンピロバクターやオリゴサッカリルトランスフェラーゼ遺伝子を導入された大腸菌など、また真核生物では、酵母、糸状菌、植物細胞、昆虫細胞、哺乳類由来培養細胞などが挙げられるが、遺伝子導入のしやすさ、タンパク質生産量の高さ、哺乳類型糖鎖が付加できる点などで、哺乳類由来培養細胞のうち、HEK293細胞、CHO細胞、COS−7細胞などを用いるのが特に好ましい。
【0030】
本発明の形質転換体を用いて本発明のタンパク質を製造する方法として、形質転換体の培養、タンパク質の取得、精製などの工程が挙げられる。形質転換体の培養は、37℃のCO2インキュベーター内で、遺伝子導入後一定時間(5〜15時間)までは10%牛血清含有培地にて行い、その後は目的タンパク質の精製を容易にするために無血清培地に交換して継続培養する(+9〜48時間)。目的タンパク質の取得は、当該タンパク質が分泌タンパク質で、培地中に分泌されているようであれば、培地を回収してタンパク質源とし、これをアフィニティークロマトグラフィーなどの各種クロマトグラフィーに供して精製する。目的タンパク質が培地中に分泌されず、細胞内に蓄積している場合には、細胞を回収し、ここに細胞溶解剤を加えるとともに超音波破砕により細胞を破砕して目的タンパク質を細胞溶解剤中に放出させ、これを適当な緩衝液などで希釈するなどしたものをタンパク質源として、上記と同様にして各種クロマトグラフィーにより精製する。
【0031】
本発明のタンパク質を製造する方法は、細胞を用いる方法に限定されるものではなく、無細胞タンパク質合成系によって製造することもできる。無細胞タンパク質合成系としては、例えば、コムギ胚芽、大腸菌、ウサギ網状赤血球、昆虫細胞などから調製したものが挙げられる。目的タンパク質をコードするDNAを逆転写が可能なベクターに組み込み、これより逆転写反応によって合成したmRNAを適当な無細胞タンパク質合成系に加えて目的タンパク質を合成する。そして、その反応液より目的タンパク質を上記と同様にして精製する。
【0032】
本発明のタンパク質から付加したペプチドを除去するには、Factor Xa、エンテロキナーゼ、PreScission proteaseなどのプロテアーゼを利用するが、これらのプロテアーゼに限定されるものではない。またプロテアーゼ処理後において、配列によっては付加したペプチドの一部がタンパク質に連結されたままになる場合もある。
【実施例】
【0033】
以下に記載する実施例により、本発明をさらに詳細に説明するが、本発明はこの実施例によって限定されるものではない。
【実施例1】
【0034】
ヒトインターロイキン−6(IL−6)の場合
本実施例ではヒト胸腺由来のIL−6をモデルとして、ペプチドの付加がIL−6の分泌生産量へ及ぼす影響を調べた。IL−6には、N結合型糖鎖付加のコンセンサス配列であるNXS/T配列が2カ所に存在するが(N73:NKS、N172:NAS)(図1)、N172には通常、糖鎖は結合していない。またO結合型糖鎖がT166に結合することが報告されている(非特許文献3参照)。
【0035】
まず、ヒト胸腺由来cDNA(Clontech)を鋳型として、プライマーNG526+、NG527−(配列表配列番号27、28)とPrimeSTAR HS DNA polymerase(TAKARA)を用いてPCR増幅を行い、ここで増幅したIL−6の全長cDNAをpBluescript II SK+ベクター(Stratagene)のEcoRVサイトにクローニングした。これよりBamHI、XhoIで切り出したDNA断片をpcDNA3.1/Myc−His ver.A(Invitrogen)のBamHI−XhoIサイトに挿入したものを、野生型IL−6(WT)の発現ベクターとした。
【0036】
つぎに、IL−6の糖鎖付加状況を改善した際の分泌への影響をみるため、N73:NKSのSerをThrに交換した変異体(IL−6変異体S75T)、N172:NASのSerをThrに交換した変異体(IL−6変異体S174T)、およびそれら両方をThrに交換した変異体(IL−6変異体S75T/S174T)を作製した。N73:NKSのSerをThrに交換するためにはプライマーNG528+、NG529−(配列表配列番号29、30)の各プライマーの組み合わせと、PrimeSTAR HS DNA polymerase(TAKARA)を用いて、上記IL−6cDNAを含むpBluescript IIプラスミドを鋳型としてPCRによる変異導入でS/T交換を行った。また、N172:NASのSerをThrに交換するためにはプライマーNG530+、NG531−(配列表配列番号31、32)の各プライマーの組み合わせを用いて、上記と同様にしてPCRによる変異導入でS/T交換を行った。
【0037】
さらに、両コンセンサス配列のS部分をAlaに置換して糖鎖が付加されないようにした変異体(AA)は、プライマーNG544+、NG545−(配列表配列番号33、34、N73:NKA用)、プライマーNG546+、NG547−(配列表配列番号35、36、N172:NAA)の各プライマーの組み合わせを用いて、上記と同様にPCRによる変異導入を順次行って作製した。いずれの変異導入断片もBamHI、XhoIで切り出した後、pcDNA3.1/Myc−His ver.AのBamHI−XhoIサイトに挿入して発現ベクターとした。
【0038】
また、Asn Xaa Thr/Serのアミノ酸モチーフを含むペプチドがIL−6の分泌に及ぼす影響を調べるため、各種ペプチドつきIL−6の発現ベクターを構築した。ペプチドNSTをコードするDNAは、プライマーNG404+、NG405−(配列表配列番号37、38)をアニーリングさせて作製した。ペプチドNNST(配列表配列番号3)をコードするDNAは、プライマーNG451+、NG452−(配列表配列番号39、40)をアニーリングさせて作製した。ペプチドNSTNST(配列表配列番号1)をコードするDNAは、プライマーNG453+、NG454−(配列表配列番号41、42)をアニーリングさせて作製した。ペプチドNNSTNNST(配列表配列番号7)をコードするDNAは、プライマーNG468+、NG469−(配列表配列番号43、44)をアニーリングさせて作製した。ペプチドANSTNSTNST(配列表配列番号2)をコードするDNAは、プライマーNG493+、NG494−(配列表配列番号45、46)をアニーリングさせて作製した。
【0039】
また、糖鎖がつかないペプチドNSANSA(配列表配列番号4)をコードするDNAは、プライマーNG455+、NG456−(配列表配列番号47、48)をアニーリングさせて作製した。Factor Xa切断配列入りペプチドIEGRIEGRNSTNST(配列表配列番号20)をコードするDNAは、プライマーNG948+、NG949−(配列表配列番号49、50)をアニーリングさせて作製した。なお、いずれのペプチドをコードするDNAにも、IL−6への連結とベクターへの挿入のためにXhoI、XbaIの制限酵素サイトがそれぞれ5’側、3’側に存在するため、実際のペプチドにはN末端側にはLeu Gluが、C末端側にはSer Argが付加される。これらのDNAを野生型IL−6の発現ベクター、あるいはN結合型糖鎖が付加されないようにした変異体IL−6(AA)の発現ベクターに組み込み、各ペプチドつきIL−6の発現ベクターとした。
【0040】
それぞれの発現ベクターはFuGene 6 transfection reagent(Roche)を用いてHEK293細胞、あるいはCOS−7細胞に導入した。トランスフェクション後、これらの細胞は37℃のCO2インキュベーターで一晩培養し、ここで培地交換を行って(3.5cm dish、MEM培地+10%牛血清2mlをMEM培地1mlに交換)、さらに一定時間培養を行った(トランスフェクションから48時間後まで)。培養終了後、培養上清を回収して少量のNTA Agarose(Qiagen)を添加し、4℃で2時間撹拌して培養上清中に分泌された組換え体IL−6をこれに吸着させ回収した。分泌生産量を解析する場合は、このNTA AgaroseをPBS緩衝液で洗浄後、SDS sample bufferと混合し、煮沸処理後、SDS−ポリアクリルアミドゲル電気泳動(SDS−PAGE)に供した。
【0041】
IL−6の細胞増殖活性を調べる場合は、このNTA AgaroseからIL−6を0.2Mイミダゾールにて溶出し、これをアミコンウルトラ−4(Millipore)にて脱塩濃縮した。この試料に対して、必要に応じてFactor Xaなどの特異的プロテアーゼによる処理を施して連結したペプチドを除去し、さらにNTA Agaroseカラム(スルー画分を採取)、抗IL−6抗体カラムの組み合わせによりペプチドを除去したIL−6の再精製を行った。このようにして調製したIL−6を用いてマウスハイブリドーマ細胞株7TD1細胞を刺激し、その増殖への影響を細胞増殖キットII(XTTアッセイ、Roche)により測定した。
【0042】
分泌生産量を解析する場合は、泳動終了後、ウェスタンブロットを行うため、ゲル中のタンパク質はブロッティング装置を用いてPVDFメンブレン(Immobilon−P、Millipore)に転写し、これを3%スキムミルク含有TBS−T緩衝液内で室温1時間震盪してブロッキング処理を行った。つぎにこのメンブレンを一次抗体溶液(抗myc−tag抗体、MBLを3%スキムミルク含有TBS−T緩衝液で1000倍希釈したもの)に浸漬させ、室温で1時間震盪した。その後、メンブレンを3%スキムミルク含有TBS−T緩衝液で2回洗浄し、二次抗体溶液(HRP−conjugated抗マウスIgG抗体、Zymedを3%スキムミルク含有TBS−T緩衝液で5000倍希釈したもの)に浸漬させ、室温で1時間震盪した。そして、メンブレンを3%スキムミルク含有TBS−T緩衝液で2回洗浄し、SuperSignal West Femto Maximum Sensitivity Substrate(Thermo)を用いて化学発光反応を行い、Chemidoc XRS(Bio−Rad)で陽性バンドを検出した。
<比較例1>
【0043】
まず、IL−6のN結合型糖鎖に何らかの機能があるのかを検討するため、野生型IL−6、S75T変異体、S174T変異体、S75T/S174T変異体をHEK293細胞で発現させてみた。これらの変異体はN結合型糖鎖付加のコンセンサス配列中にあるSerをThrに変えることにより、各糖鎖付加部位の糖鎖付加効率を増大させることを期待したものである(非特許文献4〜7参照)。その結果、野生型IL−6の分泌量を1としたとき、各変異体分子の分泌量は、S75T変異体で2.4倍、S174T変異体で1.4倍、S75T/S174T変異体で2.5倍となった(図2)。S75T変異体およびS75T/S174T変異体では糖鎖付加型のIL−6の割合も増加していた。この結果より、IL−6の分泌には糖鎖が重要な役割を果たしていることが示唆された。
【0044】
<実施例1.1>
そこで、野生型IL−6のC末端にN結合型糖鎖が付加し得る、Asn Xaa Thr/Serのアミノ酸モチーフを含む各種ペプチドを連結し、分泌におけるその効果を調べた。その結果、いずれのペプチドを連結した場合でも、野生型にくらべると分泌量の増大が認められた(図3A)。野生型IL−6の分泌量を1としたとき、ペプチドを連結した分子の分泌量は、NSTペプチドの連結で1.5倍、NNSTペプチド(配列表配列番号3)の連結で1.9倍、NSTNSTペプチド(配列表配列番号1)の連結で7.1倍、NNSTNNSTペプチド(配列表配列番号7)の連結で5.0倍、ANSTNSTNSTペプチド(配列表配列番号2)の連結で5.6倍になった。ANSTNSTNSTペプチドを連結した場合では、N結合型糖鎖付加型のIL−6が顕著に増加したが、他のペプチドを連結した場合も含めて糖鎖が付加していないIL−6の分泌も増加している。このペプチドを連結したIL−6全体の分泌量の増大効果は、比較例1の変異体による糖鎖付加率増加による効果と同等かそれを上回った。
【0045】
N73、N172に糖鎖がつかなくした変異体IL−6(AA)にANSTNSTNSTペプチドを連結した分子をHEK293細胞に発現させたとき、分泌されてきた分子に対してPNGase F処理を施したところ、処理前後で分子量変化が認められたことから、挿入したペプチドに実際にN結合型糖鎖が結合していたことが示された(図3B)。
【0046】
いずれのペプチドを連結した場合でも、N結合型糖鎖非付加型IL−6の分泌量も増大しているが、これはペプチドへの糖鎖付加の有無にかかわらず、ペプチドを連結したこと自体の単独効果で分泌が促進される可能性、あるいはN結合型糖鎖付加型分子の存在がN結合型糖鎖非付加型分子の分泌を促進している可能性が考えられる。実際、驚くべきことに、糖鎖が結合しないペプチドNSANSA(配列表配列番号4)をIL−6(AA)に連結した場合でも、IL−6(AA)や野生型IL−6にくらべて分泌量が1.5倍に増加することが判明した(図4)。
【0047】
<実施例1.2>
IL−6の場合、各種ペプチドの連結で分泌量を増大させることができたが、分泌してきたタンパク質の挿入ペプチド部分に糖鎖がついたままだと、タンパク質の機能発現を阻害する場合も想定される。また、連結したペプチドの存在自体が同様の問題を引き起こす可能性もある。そこで、N結合型糖鎖が付加し得る、Asn Xaa Thr/Serのアミノ酸モチーフを含むペプチドを連結して分泌させたタンパク質から、連結したペプチド部分を除去することを検討した。NSTNSTペプチドの前部に特異的プロテアーゼFactor Xaの切断認識配列IEGRを2つ挿入したペプチドIEGRIEGRNSTNST(配列表配列番号20)を作製し、これをIL−6に連結してHEK293細胞に分泌生産させた。このペプチド付きIL−6を回収し、Factor Xa処理を施したところ、ペプチド部分以降(mycタグを含む)が切断除去されたIL−6が検出された(図5矢印)。従って、連結するペプチドの配列を工夫すれば、後からこれを除去して、野生型のアミノ酸配列を含む目的タンパク質を得ることが可能であることが示された。
【0048】
なお、本発明により製造したIL−6から連結したペプチドを特異的プロテアーゼ処理により除去したIL−6は、野生型IL−6と同等の細胞増殖活性を保持していた。
【実施例2】
【0049】
ヒトNeutrophil gelatinase−associated lipocalin(NGAL)の場合
本実施例ではヒトNGALをモデルとして、ペプチドの付加がNGALの分泌生産量へ及ぼす影響を調べた。NGALには、N結合型糖鎖付加のコンセンサス配列であるNXS/T配列が1カ所存在する(N85:NVT)(図6)。
【0050】
まず、ヒト膵がん細胞KLM−1のtotal RNAより調製したcDNAを鋳型として、プライマーNG28+、NG29−(配列表配列番号51、52)とPrimeSTAR HS DNA polymerase(TAKARA)を用いてPCR増幅を行い、ここで増幅したNGALの全長cDNAをpBluescript II SK+ベクター(Stratagene)のEcoRVサイトにクローニングした。これよりEcoRI、XhoIで切り出したDNA断片をpcDNA3.1/Myc−His ver.A(Invitrogen)のEcoRI−XhoIサイトに挿入したものを、野生型NGAL(WT)の発現ベクターとした。
【0051】
またAsn Xaa Thr/Serのアミノ酸モチーフを含むペプチドがNGALの分泌に及ぼす影響を調べるため、各種ペプチドつきNGALの発現ベクターを構築した。ペプチドNSTをコードするDNAは、プライマーNG404+、NG405−(配列表配列番号37、38)をアニーリングさせて作製した。ペプチドNNST(配列表配列番号3)をコードするDNAは、プライマーNG451+、NG452−(配列表配列番号39、40)をアニーリングさせて作製した。ペプチドNSTNST(配列表配列番号1)をコードするDNAは、プライマーNG453+、NG454−(配列表配列番号41、42)をアニーリングさせて作製した。ペプチドNNSTNNST(配列表配列番号7)をコードするDNAは、プライマーNG468+、NG469−(配列表配列番号43、44)をアニーリングさせて作製した。ペプチドANSTNSTNST(配列表配列番号2)をコードするDNAは、プライマーNG493+、NG494−(配列表配列番号45、46)をアニーリングさせて作製した。
【0052】
なお、いずれのペプチドをコードするDNAにも、NGALへの連結とベクターへの挿入のためにXhoI、XbaIの制限酵素サイトがそれぞれ5’側、3’側に存在するため、実際のペプチドにはN末端側にはLeu Gluが、C末端側にはSer Argが付加される。これらのDNAを野生型NGALの発現ベクターに組み込み、各ペプチドつきNGALの発現ベクターとした。
【0053】
それぞれの発現ベクターはFuGene 6 transfection reagent(Roche)を用いてHEK293細胞に導入した。トランスフェクション後、これらの細胞は37℃のCO2インキュベーターで一晩培養し、ここで培地交換を行って(3.5cm dish、MEM培地+10%牛血清2mlをMEM培地1mlに交換)、さらに一定時間培養を行った(トランスフェクションから48時間後まで)。培養終了後、培養上清を回収して少量のNTA Agarose(Qiagen)を添加し、4℃で2時間撹拌して培養上清中に分泌された組換え体NGALをこれに吸着させ回収した。分泌生産量を解析する場合は、このNTA AgaroseをPBS緩衝液で洗浄後、SDS sample bufferと混合し、煮沸処理後、SDS−ポリアクリルアミドゲル電気泳動(SDS−PAGE)に供した。
【0054】
分泌生産量を解析する場合は、泳動終了後、ウェスタンブロットを行うため、ゲル中のタンパク質はブロッティング装置を用いてPVDFメンブレン(Immobilon−P、Millipore)に転写し、これを3%スキムミルク含有TBS−T緩衝液内で室温1時間震盪してブロッキング処理を行った。つぎにこのメンブレンを一次抗体溶液(抗myc−tag抗体、MBLを3%スキムミルク含有TBS−T緩衝液で1000倍希釈したもの)に浸漬させ、室温で1時間震盪した。その後、メンブレンを3%スキムミルク含有TBS−T緩衝液で2回洗浄し、二次抗体溶液(HRP−conjugated抗マウスIgG抗体、Zymedを3%スキムミルク含有TBS−T緩衝液で5000倍希釈したもの)に浸漬させ、室温で1時間震盪した。そして、メンブレンを3%スキムミルク含有TBS−T緩衝液で2回洗浄し、SuperSignal West Femto Maximum Sensitivity Substrate(Thermo)を用いて化学発光反応を行い、Chemidoc XRS(Bio−Rad)で陽性バンドを検出した。
【0055】
<実施例2>
野生型NGALのC末端にN結合型糖鎖が付加し得る、Asn Xaa Thr/Serのアミノ酸モチーフを含む各種ペプチドを連結し、分泌におけるその効果を調べた。その結果、いずれのペプチドを連結した場合でも、野生型にくらべると分泌量の増大が認められた(図7)。野生型NGALの分泌量を1としたとき、ペプチドを連結した分子の分泌量は、NSTペプチドの連結で1.4倍、NNSTペプチド(配列表配列番号3)の連結で2.6倍、NSTNSTペプチド(配列表配列番号1)の連結で2.4倍、NNSTNNSTペプチド(配列表配列番号7)の連結で3.8倍、ANSTNSTNSTペプチド(配列表配列番号2)の連結で6.8倍になった。
【実施例3】
【0056】
ヒトキモトリプシンC(CTRC)の場合
本実施例ではヒトCTRCをモデルとして、ペプチドの付加がCTRCの分泌生産量へ及ぼす影響を調べた。CTRCには、N結合型糖鎖付加のコンセンサス配列であるNXS/T配列が3カ所に存在するが(N25:NLS、N52:NDT、N226:NGS)(図8)、N25とN226には通常、糖鎖は結合していない。またN52に結合する糖鎖が分泌に重要な役割を果たしており、糖鎖が結合しないN52S変異体では分泌が低下することが報告されている(非特許文献8参照)。
【0057】
まず、ヒト膵臓由来cDNA(Clontech)を鋳型として、プライマーNG1064+、NG1065−(配列表配列番号53、54)とPrimeSTAR HS DNA polymerase(TAKARA)を用いてPCR増幅を行い、ここで増幅したCTRCの全長cDNAをpBluescript II SK+ベクター(Stratagene)のEcoRVサイトにクローニングした。これよりEcoRI、XhoIで切り出したDNA断片をpcDNA3.1/Myc−His ver.A(Invitrogen)のEcoRI−XhoIサイトに挿入したものを、野生型CTRC(WT)の発現ベクターとした。
【0058】
つぎに、CTRCの糖鎖付加状況を改善した際の分泌への影響をみるため、N52:NDTのAsnをSerに交換した変異体(CTRC変異体N52S:CTRC(N52S))を作製した。N52:NDTのAsnをSerに交換するためにはプライマーNG1066+、NG1067−(配列表配列番号55、56)の各プライマーの組み合わせと、PrimeSTAR HS DNA polymerase(TAKARA)を用いて、上記CTRCcDNAを含むpBluescript IIプラスミドを鋳型としてPCRによる変異導入でN/S交換を行った。
【0059】
また、Asn Xaa Thr/Serのアミノ酸モチーフを含むペプチドがCTRCの分泌に及ぼす影響を調べるため、NSTNST(配列表配列番号1)、ANSTNSTNST(配列表配列番号2)の各ペプチドつきCTRC、およびANSTNSTNST(配列表配列番号2)ペプチドつきCTRC(N52S)の発現ベクターを構築した。ペプチドNSTNST(配列表配列番号1)をコードするDNAは、プライマーNG453+、NG454−(配列表配列番号41、42)をアニーリングさせて作製した。ペプチドANSTNSTNST(配列表配列番号2)をコードするDNAは、プライマーNG493+、NG494−(配列表配列番号45、46)をアニーリングさせて作製した。
【0060】
なお、NSTNSTペプチドおよびANSTNSTNSTペプチドをコードするDNAには、CTRCへの連結とベクターへの挿入のためにXhoI、XbaIの制限酵素サイトがそれぞれ5’側、3’側に存在するため、実際のペプチドにはN末端側にはLeu Gluが、C末端側にはSer Argが付加される。これらDNAをCTRCおよびCTRC(N52S)の発現ベクターに組み込み、ペプチドつきCTRCとペプチドつきCTRC(N52S)の発現ベクターとした。
【0061】
それぞれの発現ベクターはFuGene 6 transfection reagent(Roche)を用いてHEK293細胞に導入した。トランスフェクション後、これらの細胞は37℃のCO2インキュベーターで一晩培養し、ここで培地交換を行って(3.5cm dish、MEM培地+10%牛血清2mlをMEM培地1mlに交換)、さらに一定時間培養を行った(トランスフェクションから48時間後まで)。培養終了後、培養上清を回収して少量のNTA Agarose(Qiagen)を添加し、4℃で2時間撹拌して培養上清中に分泌された組換え体CTRCおよびその変異体をこれに吸着させ回収した。分泌生産量を解析する場合は、このNTA AgaroseをPBS緩衝液で洗浄後、SDS sample bufferと混合し、煮沸処理後、SDS−ポリアクリルアミドゲル電気泳動(SDS−PAGE)に供した。
【0062】
分泌生産量を解析する場合は、泳動終了後、ウェスタンブロットを行うため、ゲル中のタンパク質はブロッティング装置を用いてPVDFメンブレン(Immobilon−P、Millipore)に転写し、これを3%スキムミルク含有TBS−T緩衝液内で室温1時間震盪してブロッキング処理を行った。つぎにこのメンブレンを一次抗体溶液(抗myc−tag抗体、MBLを3%スキムミルク含有TBS−T緩衝液で1000倍希釈したもの)に浸漬させ、室温で1時間震盪した。その後、メンブレンを3%スキムミルク含有TBS−T緩衝液で2回洗浄し、二次抗体溶液(HRP−conjugated抗マウスIgG抗体、Zymedを3%スキムミルク含有TBS−T緩衝液で5000倍希釈したもの)に浸漬させ、室温で1時間震盪した。そして、メンブレンを3%スキムミルク含有TBS−T緩衝液で2回洗浄し、SuperSignal West Femto Maximum Sensitivity Substrate(Thermo)を用いて化学発光反応を行い、Chemidoc XRS(Bio−Rad)で陽性バンドを検出した。
【0063】
<実施例3>
CTRCおよびCTRC(N52S)のC末端にN結合型糖鎖が付加し得る、Asn Xaa Thr/Serのアミノ酸モチーフを含むNSTNST(配列表配列番号1)ペプチド、またはANSTNSTNSTペプチド(配列表配列番号2)を連結し、分泌におけるその効果を調べた。その結果、CTRC(N52S)は野生型CTRCにくらべて分泌量が低下したが、これにANSTNSTNSTペプチド(配列表配列番号2)を連結したところ、野生型より分泌量の増大が認められた(図9)。また、野生型CTRCにNSTNST(配列表配列番号1)ペプチド、あるいはANSTNSTNSTペプチド(配列表配列番号2)を連結した場合でも、分泌量の増大が認められた(図9)。野生型CTRCの分泌量を1としたとき、CTRC(N52S)の分泌量は0.5〜0.7、これにANSTNSTNSTペプチド(配列表配列番号2)を連結した分子の分泌量は7.4倍になった。また、野生型CTRCにNSTNST(配列表配列番号1)ペプチドを連結した分子の分泌量は1.6倍、ANSTNSTNSTペプチド(配列表配列番号2)を連結した分子の分泌量は1.5倍になった。
【産業上の利用可能性】
【0064】
本発明のタンパク質製造方法は、有用タンパク質の分泌生産の増大や、糖鎖付加により機能改変や新機能が付与されたタンパク質の製造、あるいは血中安定性が増大したタンパク質の製造などに利用できる。
【技術分野】
【0001】
本発明はタンパク質に新たな性質を付与することを特徴とするペプチドを付加したタンパク質の製造方法に関する。タンパク質に新たな性質を付与するとは、タンパク質の分泌生産性の向上、タンパク質の生理活性等の向上、タンパク質の安定性の向上などを意味する。
【0002】
詳細には、少なくとも1つのAsnを含むアミノ酸配列を付加した分泌タンパク質であって本来の活性を損なうことなく分泌生産量が増大した分泌タンパク質の製造方法、および下記(1)のアミノ酸配列モチーフを付加した目的のタンパク質であって本来の活性を損なうことなく新たな性質を付与した目的のタンパク質の製造方法、およびThrまたはSerを少なくとも1つ有するペプチドにおいて、Thr/SerにO結合型糖鎖が結合したそのアミノ酸配列を付加した目的のタンパク質であって本来の活性を損なうことなく新たな性質を付与した目的のタンパク質の製造方法に関する。
(1)Asn Xaa Thr/Ser
(ただし、(1)でXaaは任意のアミノ酸を示す。)
【背景技術】
【0003】
多くのタンパク質には翻訳後修飾として糖鎖付加がなされている。糖鎖付加の様式には2種類あって、タンパク質中のN(Asn)−X(Pro以外のアミノ酸)−S(Ser)/T(Thr)という配列中のAsnに糖鎖が付加される場合はN結合型糖鎖、タンパク質中のSer、Thrの水酸基を介して糖鎖が付加される場合はO結合型糖鎖とよぶ。一般に、N結合型糖鎖には上記のようなコンセンサス配列があるため、糖鎖付加の予測や制御が容易であるといえる。
【0004】
糖鎖はタンパク質が適正なfoldingをとる際に必要であったり、当該タンパク質の分泌促進、機能発現、血中での安定化、分子間相互作用などにも関与していたりする。このような機能性糖鎖をタンパク質に効率よく付加させるために、タンパク質中にあるN結合型糖鎖付加のコンセンサス配列を改変したり、これをタンパク質中に人為的に導入して、タンパク質に結合する糖鎖の数を増やすことが検討されてきている(特許文献1、非特許文献1参照)。
【0005】
例えば、コンセンサス配列NXS/Tにおいて、X部分のアミノ酸を置換することによって糖鎖付加効率を改善することが可能である(非特許文献1参照)。しかし、置換するアミノ酸の種類によっては立体構造変化が大きくなり、タンパク質機能に影響を及ぼす恐れがある。また、目的にあった糖鎖付加効率を追求するためには、X部分に関してもともとのアミノ酸とプロリンを除く18種類のアミノ酸について検討する必要があり、手間がかかる。
【0006】
新たにN結合型糖鎖付加のコンセンサス配列をタンパク質中に導入する場合でも、置換するアミノ酸の種類や位置によっては本来のタンパク質機能を損ねる恐れがあり、至適な変異導入条件を検討する必要がある。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平5−86099号公報
【非特許文献】
【0008】
【非特許文献1】Susan H. Shakin−Eshleman et al., J. Biol. Chem. 271, 6363−6366 (1996)
【非特許文献2】Lorenzo Frigerio et al., Plant Cell. 13, 1109−1126 (2001)
【非特許文献3】Tetsuro Orita et al., J. Biochem. 115, 345−350 (1994)
【非特許文献4】Ernst Bause et al., Biochem. J. 195, 639−644 (1981)
【非特許文献5】Gerry A. F. Nicolaes et al., Biochemistry 38, 13584−13591 (1999)
【非特許文献6】Atsushi Nishikawa et al., Biochem. J. 355, 245−248 (2001)
【非特許文献7】Lakshmi Kasturi et al., Biochem. J. 323, 415−419 (1997)
【非特許文献8】Melinda Bence et al., FEBS J. 278, 4338−4350 (2011)
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明の課題は、目的タンパク質のアミノ酸配列(当該タンパク質遺伝子/cDNAの開始コドンから終止コドンまででコードされる配列)を変えることなく、ペプチドまたは糖鎖が付加したペプチドを連結したタンパク質を合成し、分泌生産性、各種機能、安定性などを向上させた目的タンパク質を製造することである。
【課題を解決するための手段】
【0010】
本発明者らは、N結合型糖鎖付加のコンセンサス配列であるNXT/S配列(XはPro以外のアミノ酸)を含むペプチド、および類似のペプチドをタンパク質に連結した場合に、タンパク質にどのような影響があらわれるのかを検討した。その結果、驚くべきことに、糖鎖が付加されたペプチドがタンパク質に連結されたことによって、タンパク質の分泌生産量が著しく増大することを見出した。さらに驚くべきことに、糖鎖が付加しないペプチドでも同様な効果を見出し、特に、アスパラギンが配列に含まれることが重要であることを突き止め、本発明を完成するに至った。
【0011】
すなわち、本発明は下記<1>〜<4>のタンパク質の製造方法である。
<1> 分泌タンパク質をコードするDNAに、少なくとも1つのAsnを含むアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、そのアミノ酸配列を付加した分泌タンパク質であって本来の活性を損なうことなく分泌生産量が増大した分泌タンパク質の製造方法。
【0012】
<2> 目的のタンパク質をコードするDNAに、下記(1)のアミノ酸配列モチーフを少なくとも1つ有するアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、そのアミノ酸配列を付加した目的のタンパク質であって本来の活性を損なうことなく新たな性質を付与した目的のタンパク質の製造方法。
(1)Asn Xaa Thr/Ser
(ただし、(1)でXaaは任意のアミノ酸を示す。)
【0013】
<3> 目的のタンパク質をコードするDNAに、ThrまたはSerを少なくとも1つ有するアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、ThrまたはSerにO結合型糖鎖が結合したそのアミノ酸配列を付加した目的のタンパク質であって本来の活性を損なうことなく新たな性質を付与した目的のタンパク質の製造方法。
【0014】
<4> そのアミノ酸配列がプロテアーゼ切断配列を有するものであり、製造したタンパク質にそのプロテアーゼを反応させて、製造したタンパク質からそのアミノ酸配列を切断することを特徴とする<1>から<3>に記載のタンパク質の製造方法。
【発明の効果】
【0015】
本発明者らは、タンパク質にN結合型糖鎖付加のコンセンサス配列であるNXT/S配列(XはPro以外のアミノ酸)を含むペプチドやそれに類似のペプチドを連結した場合、当該タンパク質の分泌生産量が増大することを見出した。この原因としては、ペプチド付加の単独効果、あるいは糖鎖が付加されたペプチドがタンパク質に連結された効果が考えられる。従来、タンパク質に機能性糖鎖を効率よく付加させるためには、タンパク質の糖鎖付加部位周辺配列を改変したり、新たにN結合型糖鎖付加のコンセンサス配列を導入したりするなど、タンパク質への変異導入が必要であった。そのため、野生型タンパク質の諸性質を損ねる恐れがあった。本発明では、タンパク質のアミノ酸配列(当該タンパク質遺伝子/cDNAの開始コドンから終止コドンまででコードされる配列)を変えることなくペプチドや糖鎖を付加することが可能で、必要に応じて、後から付加したペプチドおよび糖鎖を除去することもできることから、より野生型に近いタンパク質を効率よく調製できる。
【0016】
糖鎖のないペプチド付加の効果として、ある種のペプチドをタンパク質に連結することにより、目的タンパク質の諸性質が変化する場合があることが知られている。例えば小胞体局在シグナルであるKDELというアミノ酸配列(この配列には糖鎖は付加されない)をタンパク質のC末端に連結すると、当該タンパク質が小胞体に局在するようになる(非特許文献2参照)。本発明では、糖鎖が付加されないペプチドをタンパク質に連結させたときにおいても、場合によっては分泌生産性の向上が認められることを見出した。
【図面の簡単な説明】
【0017】
【図1】実施例1に用いたヒトIL−6組換え体の構造の特徴を示す模式図。
【図2】IL−6に存在する各N結合型糖鎖付加のコンセンサス配列を改変した変異体の分泌状況を示すブロット。
【図3】IL−6(WT)、IL−6(AA)の分泌におけるペプチド付加の効果を示すブロット。
【図4】IL−6(AA)に、糖鎖が結合しないペプチドを付加した場合の効果。
【図5】Factor Xa切断配列入りペプチドを付加したIL−6に対してPNGase F処理、Factor Xa処理を施した際の状況を示すブロット。矢印が示すバンドはN型糖鎖の結合したペプチドが切断除去された分子を示す。
【図6】実施例2に用いたヒトNGALの構造の特徴を示す模式図。
【図7】NGALの分泌におけるペプチド付加の効果を示すズロット。
【図8】実施例3に用いたヒトキモトリプシンCの構造の特徴を示す模式図。
【図9】キモトリプシンC、CTRC(N52S)の分泌におけるペプチド付加の効果を示すブロット。
【発明を実施するための形態】
【0018】
本発明のタンパク質製造方法は、下記<1>〜<4>である。
<1> 分泌タンパク質をコードするDNAに、少なくとも1つのAsnを含むアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、そのアミノ酸配列を付加した分泌タンパク質であって本来の活性を損なうことなく分泌生産量が増大した分泌タンパク質の製造方法。
【0019】
<2> 目的のタンパク質をコードするDNAに、下記(1)のアミノ酸配列モチーフを少なくとも1つ有するアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、そのアミノ酸配列を付加した目的のタンパク質であって本来の活性を損なうことなく新たな性質を付与した目的のタンパク質の製造方法。
(1)Asn Xaa Thr/Ser
(ただし、(1)でXaaは任意のアミノ酸を示す。)
【0020】
<3> 目的のタンパク質をコードするDNAに、ThrまたはSerを少なくとも1つ有するアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、ThrまたはSerにO結合型糖鎖が結合したそのアミノ酸配列を付加した目的のタンパク質であって本来の活性を損なうことなく新たな性質を付与した目的のタンパク質の製造方法。
【0021】
<4> そのアミノ酸配列がプロテアーゼ切断配列を有するものであり、製造したタンパク質にそのプロテアーゼを反応させて、製造したタンパク質からそのアミノ酸配列を切断することを特徴とする<1>から<3>に記載のタンパク質の製造方法。
【0022】
本発明に用いるペプチドとしては、上記<1>〜<4>のアミノ酸配列モチーフを有するペプチドであれば特に限定はないが、例えばNST、NSTNST、ANSTNSTNST、NSA、NNST、NSANSA、NQST、QNST、NNSTNNST、NNSA、ANST、NAST、NNAT、PNST、WNST、NNTT、NATS、NSTNSA、NSANSTといったペプチドが挙げられる。より好ましくは、糖鎖が付加されたNST、NSTNST、ANSTNSTNST、NNST、NQST、QNST、NNSTNNST、NNSA、ANST、NAST、NNAT、PNST、WNST、NNTT、NATS、NSTNSA、NSANSTである。また、プロテアーゼ切断部位を有するペプチドとしては、IEGRNST、IEGRNSTNST、IEGRIEGRNSTNST、IEGRIEGRNSANSA、IEGRIEGRAAANSTNST(以上、 Factor Xa切断部位入りペプチド)、DDDDKNST、DDDDKNSTNST、DDDDKDDDDKNSTNST(以上、エンテロキナーゼ切断部位入りペプチド)、LEVLFQGPNSTNST(PreScission protease切断部位入りペプチド)などである。(配列表配列番号1〜26)
【0023】
さらに目的タンパク質とペプチドの間には、スペーサーとしてのアミノ酸や制限酵素サイトによってコードされるアミノ酸などが連結していてもよい。また、連結したペプチドの後続には検出のためのタグが結合してもよい。
【0024】
N結合型糖鎖の結合の確認は、特に限定しないが、糖鎖除去反応前後の分子量変化を観察することにより行うことができる。糖鎖除去反応に用いる酵素として、例えばペプチド:N−グリコシダーゼF(Peptide:N−glycosidase F、PNGase F)が好ましい。
【0025】
本発明においてペプチドをコードするDNAは、上記<1>〜<4>のアミノ酸配列モチーフを有するペプチドをコードする塩基配列のDNA、およびその相補鎖を、アニールさせることにより合成し、T4リガーゼを用いて各種組換えベクターに挿入するが、ペプチドをコードするDNAの組換えベクターへの挿入法はこの方法に限定されるものではない。また、ベクター挿入時に制限酵素サイトを利用する場合は、制限酵素サイトによってコードされるアミノ酸もペプチドに連結される。
【0026】
本発明における組換えベクターは、特にその種類は限定されず、例えば、自立的に複製するベクター(例えばプラスミドやファージベクター)でもよいし、あるいは、宿主細胞に導入された際に宿主細胞のゲノムに組み込まれ、組み込まれた染色体と共に複製されるものであってもよい。
【0027】
好ましくは、本発明で用いるベクターは発現ベクターである。発現ベクターにおいて本発明のDNAは、タンパク質をコードするDNA、およびプロモーター等の転写に必要な要素が機能的に連結されている。プロモーターは宿主細胞において転写活性を示すDNA配列であり、宿主の種類に応じて適宜選択することができる。また、これらの発現ベクターはアンピシリン耐性遺伝子などの適当な選択マーカー遺伝子を含んでいてもよい。発現ベクターの例としては、例えば、pBluescript II SK+ベクター(Stratagene)、pcDNA3.1/Myc−His ver.A(Invitrogen)などが挙げられるが、本発明に用いる発現ベクターはこれらに限定されるものではない。
【0028】
本発明で用いるDNAは、遺伝子導入試薬、例えばリン酸カルシウムやリポソームを利用するもの、あるいはFuGene 6 transfection reagent(従来はRoche、現在はPromega)などの非リポソーム系トランスフェクション試薬などを用いて、あるいはエレクトロポレーション法やマイクロインジェクション法などにより、宿主細胞へ導入する。
【0029】
本発明における形質転換体として、細胞は糖鎖付加能を有する細胞、例えば、原核生物ではカンピロバクターやオリゴサッカリルトランスフェラーゼ遺伝子を導入された大腸菌など、また真核生物では、酵母、糸状菌、植物細胞、昆虫細胞、哺乳類由来培養細胞などが挙げられるが、遺伝子導入のしやすさ、タンパク質生産量の高さ、哺乳類型糖鎖が付加できる点などで、哺乳類由来培養細胞のうち、HEK293細胞、CHO細胞、COS−7細胞などを用いるのが特に好ましい。
【0030】
本発明の形質転換体を用いて本発明のタンパク質を製造する方法として、形質転換体の培養、タンパク質の取得、精製などの工程が挙げられる。形質転換体の培養は、37℃のCO2インキュベーター内で、遺伝子導入後一定時間(5〜15時間)までは10%牛血清含有培地にて行い、その後は目的タンパク質の精製を容易にするために無血清培地に交換して継続培養する(+9〜48時間)。目的タンパク質の取得は、当該タンパク質が分泌タンパク質で、培地中に分泌されているようであれば、培地を回収してタンパク質源とし、これをアフィニティークロマトグラフィーなどの各種クロマトグラフィーに供して精製する。目的タンパク質が培地中に分泌されず、細胞内に蓄積している場合には、細胞を回収し、ここに細胞溶解剤を加えるとともに超音波破砕により細胞を破砕して目的タンパク質を細胞溶解剤中に放出させ、これを適当な緩衝液などで希釈するなどしたものをタンパク質源として、上記と同様にして各種クロマトグラフィーにより精製する。
【0031】
本発明のタンパク質を製造する方法は、細胞を用いる方法に限定されるものではなく、無細胞タンパク質合成系によって製造することもできる。無細胞タンパク質合成系としては、例えば、コムギ胚芽、大腸菌、ウサギ網状赤血球、昆虫細胞などから調製したものが挙げられる。目的タンパク質をコードするDNAを逆転写が可能なベクターに組み込み、これより逆転写反応によって合成したmRNAを適当な無細胞タンパク質合成系に加えて目的タンパク質を合成する。そして、その反応液より目的タンパク質を上記と同様にして精製する。
【0032】
本発明のタンパク質から付加したペプチドを除去するには、Factor Xa、エンテロキナーゼ、PreScission proteaseなどのプロテアーゼを利用するが、これらのプロテアーゼに限定されるものではない。またプロテアーゼ処理後において、配列によっては付加したペプチドの一部がタンパク質に連結されたままになる場合もある。
【実施例】
【0033】
以下に記載する実施例により、本発明をさらに詳細に説明するが、本発明はこの実施例によって限定されるものではない。
【実施例1】
【0034】
ヒトインターロイキン−6(IL−6)の場合
本実施例ではヒト胸腺由来のIL−6をモデルとして、ペプチドの付加がIL−6の分泌生産量へ及ぼす影響を調べた。IL−6には、N結合型糖鎖付加のコンセンサス配列であるNXS/T配列が2カ所に存在するが(N73:NKS、N172:NAS)(図1)、N172には通常、糖鎖は結合していない。またO結合型糖鎖がT166に結合することが報告されている(非特許文献3参照)。
【0035】
まず、ヒト胸腺由来cDNA(Clontech)を鋳型として、プライマーNG526+、NG527−(配列表配列番号27、28)とPrimeSTAR HS DNA polymerase(TAKARA)を用いてPCR増幅を行い、ここで増幅したIL−6の全長cDNAをpBluescript II SK+ベクター(Stratagene)のEcoRVサイトにクローニングした。これよりBamHI、XhoIで切り出したDNA断片をpcDNA3.1/Myc−His ver.A(Invitrogen)のBamHI−XhoIサイトに挿入したものを、野生型IL−6(WT)の発現ベクターとした。
【0036】
つぎに、IL−6の糖鎖付加状況を改善した際の分泌への影響をみるため、N73:NKSのSerをThrに交換した変異体(IL−6変異体S75T)、N172:NASのSerをThrに交換した変異体(IL−6変異体S174T)、およびそれら両方をThrに交換した変異体(IL−6変異体S75T/S174T)を作製した。N73:NKSのSerをThrに交換するためにはプライマーNG528+、NG529−(配列表配列番号29、30)の各プライマーの組み合わせと、PrimeSTAR HS DNA polymerase(TAKARA)を用いて、上記IL−6cDNAを含むpBluescript IIプラスミドを鋳型としてPCRによる変異導入でS/T交換を行った。また、N172:NASのSerをThrに交換するためにはプライマーNG530+、NG531−(配列表配列番号31、32)の各プライマーの組み合わせを用いて、上記と同様にしてPCRによる変異導入でS/T交換を行った。
【0037】
さらに、両コンセンサス配列のS部分をAlaに置換して糖鎖が付加されないようにした変異体(AA)は、プライマーNG544+、NG545−(配列表配列番号33、34、N73:NKA用)、プライマーNG546+、NG547−(配列表配列番号35、36、N172:NAA)の各プライマーの組み合わせを用いて、上記と同様にPCRによる変異導入を順次行って作製した。いずれの変異導入断片もBamHI、XhoIで切り出した後、pcDNA3.1/Myc−His ver.AのBamHI−XhoIサイトに挿入して発現ベクターとした。
【0038】
また、Asn Xaa Thr/Serのアミノ酸モチーフを含むペプチドがIL−6の分泌に及ぼす影響を調べるため、各種ペプチドつきIL−6の発現ベクターを構築した。ペプチドNSTをコードするDNAは、プライマーNG404+、NG405−(配列表配列番号37、38)をアニーリングさせて作製した。ペプチドNNST(配列表配列番号3)をコードするDNAは、プライマーNG451+、NG452−(配列表配列番号39、40)をアニーリングさせて作製した。ペプチドNSTNST(配列表配列番号1)をコードするDNAは、プライマーNG453+、NG454−(配列表配列番号41、42)をアニーリングさせて作製した。ペプチドNNSTNNST(配列表配列番号7)をコードするDNAは、プライマーNG468+、NG469−(配列表配列番号43、44)をアニーリングさせて作製した。ペプチドANSTNSTNST(配列表配列番号2)をコードするDNAは、プライマーNG493+、NG494−(配列表配列番号45、46)をアニーリングさせて作製した。
【0039】
また、糖鎖がつかないペプチドNSANSA(配列表配列番号4)をコードするDNAは、プライマーNG455+、NG456−(配列表配列番号47、48)をアニーリングさせて作製した。Factor Xa切断配列入りペプチドIEGRIEGRNSTNST(配列表配列番号20)をコードするDNAは、プライマーNG948+、NG949−(配列表配列番号49、50)をアニーリングさせて作製した。なお、いずれのペプチドをコードするDNAにも、IL−6への連結とベクターへの挿入のためにXhoI、XbaIの制限酵素サイトがそれぞれ5’側、3’側に存在するため、実際のペプチドにはN末端側にはLeu Gluが、C末端側にはSer Argが付加される。これらのDNAを野生型IL−6の発現ベクター、あるいはN結合型糖鎖が付加されないようにした変異体IL−6(AA)の発現ベクターに組み込み、各ペプチドつきIL−6の発現ベクターとした。
【0040】
それぞれの発現ベクターはFuGene 6 transfection reagent(Roche)を用いてHEK293細胞、あるいはCOS−7細胞に導入した。トランスフェクション後、これらの細胞は37℃のCO2インキュベーターで一晩培養し、ここで培地交換を行って(3.5cm dish、MEM培地+10%牛血清2mlをMEM培地1mlに交換)、さらに一定時間培養を行った(トランスフェクションから48時間後まで)。培養終了後、培養上清を回収して少量のNTA Agarose(Qiagen)を添加し、4℃で2時間撹拌して培養上清中に分泌された組換え体IL−6をこれに吸着させ回収した。分泌生産量を解析する場合は、このNTA AgaroseをPBS緩衝液で洗浄後、SDS sample bufferと混合し、煮沸処理後、SDS−ポリアクリルアミドゲル電気泳動(SDS−PAGE)に供した。
【0041】
IL−6の細胞増殖活性を調べる場合は、このNTA AgaroseからIL−6を0.2Mイミダゾールにて溶出し、これをアミコンウルトラ−4(Millipore)にて脱塩濃縮した。この試料に対して、必要に応じてFactor Xaなどの特異的プロテアーゼによる処理を施して連結したペプチドを除去し、さらにNTA Agaroseカラム(スルー画分を採取)、抗IL−6抗体カラムの組み合わせによりペプチドを除去したIL−6の再精製を行った。このようにして調製したIL−6を用いてマウスハイブリドーマ細胞株7TD1細胞を刺激し、その増殖への影響を細胞増殖キットII(XTTアッセイ、Roche)により測定した。
【0042】
分泌生産量を解析する場合は、泳動終了後、ウェスタンブロットを行うため、ゲル中のタンパク質はブロッティング装置を用いてPVDFメンブレン(Immobilon−P、Millipore)に転写し、これを3%スキムミルク含有TBS−T緩衝液内で室温1時間震盪してブロッキング処理を行った。つぎにこのメンブレンを一次抗体溶液(抗myc−tag抗体、MBLを3%スキムミルク含有TBS−T緩衝液で1000倍希釈したもの)に浸漬させ、室温で1時間震盪した。その後、メンブレンを3%スキムミルク含有TBS−T緩衝液で2回洗浄し、二次抗体溶液(HRP−conjugated抗マウスIgG抗体、Zymedを3%スキムミルク含有TBS−T緩衝液で5000倍希釈したもの)に浸漬させ、室温で1時間震盪した。そして、メンブレンを3%スキムミルク含有TBS−T緩衝液で2回洗浄し、SuperSignal West Femto Maximum Sensitivity Substrate(Thermo)を用いて化学発光反応を行い、Chemidoc XRS(Bio−Rad)で陽性バンドを検出した。
<比較例1>
【0043】
まず、IL−6のN結合型糖鎖に何らかの機能があるのかを検討するため、野生型IL−6、S75T変異体、S174T変異体、S75T/S174T変異体をHEK293細胞で発現させてみた。これらの変異体はN結合型糖鎖付加のコンセンサス配列中にあるSerをThrに変えることにより、各糖鎖付加部位の糖鎖付加効率を増大させることを期待したものである(非特許文献4〜7参照)。その結果、野生型IL−6の分泌量を1としたとき、各変異体分子の分泌量は、S75T変異体で2.4倍、S174T変異体で1.4倍、S75T/S174T変異体で2.5倍となった(図2)。S75T変異体およびS75T/S174T変異体では糖鎖付加型のIL−6の割合も増加していた。この結果より、IL−6の分泌には糖鎖が重要な役割を果たしていることが示唆された。
【0044】
<実施例1.1>
そこで、野生型IL−6のC末端にN結合型糖鎖が付加し得る、Asn Xaa Thr/Serのアミノ酸モチーフを含む各種ペプチドを連結し、分泌におけるその効果を調べた。その結果、いずれのペプチドを連結した場合でも、野生型にくらべると分泌量の増大が認められた(図3A)。野生型IL−6の分泌量を1としたとき、ペプチドを連結した分子の分泌量は、NSTペプチドの連結で1.5倍、NNSTペプチド(配列表配列番号3)の連結で1.9倍、NSTNSTペプチド(配列表配列番号1)の連結で7.1倍、NNSTNNSTペプチド(配列表配列番号7)の連結で5.0倍、ANSTNSTNSTペプチド(配列表配列番号2)の連結で5.6倍になった。ANSTNSTNSTペプチドを連結した場合では、N結合型糖鎖付加型のIL−6が顕著に増加したが、他のペプチドを連結した場合も含めて糖鎖が付加していないIL−6の分泌も増加している。このペプチドを連結したIL−6全体の分泌量の増大効果は、比較例1の変異体による糖鎖付加率増加による効果と同等かそれを上回った。
【0045】
N73、N172に糖鎖がつかなくした変異体IL−6(AA)にANSTNSTNSTペプチドを連結した分子をHEK293細胞に発現させたとき、分泌されてきた分子に対してPNGase F処理を施したところ、処理前後で分子量変化が認められたことから、挿入したペプチドに実際にN結合型糖鎖が結合していたことが示された(図3B)。
【0046】
いずれのペプチドを連結した場合でも、N結合型糖鎖非付加型IL−6の分泌量も増大しているが、これはペプチドへの糖鎖付加の有無にかかわらず、ペプチドを連結したこと自体の単独効果で分泌が促進される可能性、あるいはN結合型糖鎖付加型分子の存在がN結合型糖鎖非付加型分子の分泌を促進している可能性が考えられる。実際、驚くべきことに、糖鎖が結合しないペプチドNSANSA(配列表配列番号4)をIL−6(AA)に連結した場合でも、IL−6(AA)や野生型IL−6にくらべて分泌量が1.5倍に増加することが判明した(図4)。
【0047】
<実施例1.2>
IL−6の場合、各種ペプチドの連結で分泌量を増大させることができたが、分泌してきたタンパク質の挿入ペプチド部分に糖鎖がついたままだと、タンパク質の機能発現を阻害する場合も想定される。また、連結したペプチドの存在自体が同様の問題を引き起こす可能性もある。そこで、N結合型糖鎖が付加し得る、Asn Xaa Thr/Serのアミノ酸モチーフを含むペプチドを連結して分泌させたタンパク質から、連結したペプチド部分を除去することを検討した。NSTNSTペプチドの前部に特異的プロテアーゼFactor Xaの切断認識配列IEGRを2つ挿入したペプチドIEGRIEGRNSTNST(配列表配列番号20)を作製し、これをIL−6に連結してHEK293細胞に分泌生産させた。このペプチド付きIL−6を回収し、Factor Xa処理を施したところ、ペプチド部分以降(mycタグを含む)が切断除去されたIL−6が検出された(図5矢印)。従って、連結するペプチドの配列を工夫すれば、後からこれを除去して、野生型のアミノ酸配列を含む目的タンパク質を得ることが可能であることが示された。
【0048】
なお、本発明により製造したIL−6から連結したペプチドを特異的プロテアーゼ処理により除去したIL−6は、野生型IL−6と同等の細胞増殖活性を保持していた。
【実施例2】
【0049】
ヒトNeutrophil gelatinase−associated lipocalin(NGAL)の場合
本実施例ではヒトNGALをモデルとして、ペプチドの付加がNGALの分泌生産量へ及ぼす影響を調べた。NGALには、N結合型糖鎖付加のコンセンサス配列であるNXS/T配列が1カ所存在する(N85:NVT)(図6)。
【0050】
まず、ヒト膵がん細胞KLM−1のtotal RNAより調製したcDNAを鋳型として、プライマーNG28+、NG29−(配列表配列番号51、52)とPrimeSTAR HS DNA polymerase(TAKARA)を用いてPCR増幅を行い、ここで増幅したNGALの全長cDNAをpBluescript II SK+ベクター(Stratagene)のEcoRVサイトにクローニングした。これよりEcoRI、XhoIで切り出したDNA断片をpcDNA3.1/Myc−His ver.A(Invitrogen)のEcoRI−XhoIサイトに挿入したものを、野生型NGAL(WT)の発現ベクターとした。
【0051】
またAsn Xaa Thr/Serのアミノ酸モチーフを含むペプチドがNGALの分泌に及ぼす影響を調べるため、各種ペプチドつきNGALの発現ベクターを構築した。ペプチドNSTをコードするDNAは、プライマーNG404+、NG405−(配列表配列番号37、38)をアニーリングさせて作製した。ペプチドNNST(配列表配列番号3)をコードするDNAは、プライマーNG451+、NG452−(配列表配列番号39、40)をアニーリングさせて作製した。ペプチドNSTNST(配列表配列番号1)をコードするDNAは、プライマーNG453+、NG454−(配列表配列番号41、42)をアニーリングさせて作製した。ペプチドNNSTNNST(配列表配列番号7)をコードするDNAは、プライマーNG468+、NG469−(配列表配列番号43、44)をアニーリングさせて作製した。ペプチドANSTNSTNST(配列表配列番号2)をコードするDNAは、プライマーNG493+、NG494−(配列表配列番号45、46)をアニーリングさせて作製した。
【0052】
なお、いずれのペプチドをコードするDNAにも、NGALへの連結とベクターへの挿入のためにXhoI、XbaIの制限酵素サイトがそれぞれ5’側、3’側に存在するため、実際のペプチドにはN末端側にはLeu Gluが、C末端側にはSer Argが付加される。これらのDNAを野生型NGALの発現ベクターに組み込み、各ペプチドつきNGALの発現ベクターとした。
【0053】
それぞれの発現ベクターはFuGene 6 transfection reagent(Roche)を用いてHEK293細胞に導入した。トランスフェクション後、これらの細胞は37℃のCO2インキュベーターで一晩培養し、ここで培地交換を行って(3.5cm dish、MEM培地+10%牛血清2mlをMEM培地1mlに交換)、さらに一定時間培養を行った(トランスフェクションから48時間後まで)。培養終了後、培養上清を回収して少量のNTA Agarose(Qiagen)を添加し、4℃で2時間撹拌して培養上清中に分泌された組換え体NGALをこれに吸着させ回収した。分泌生産量を解析する場合は、このNTA AgaroseをPBS緩衝液で洗浄後、SDS sample bufferと混合し、煮沸処理後、SDS−ポリアクリルアミドゲル電気泳動(SDS−PAGE)に供した。
【0054】
分泌生産量を解析する場合は、泳動終了後、ウェスタンブロットを行うため、ゲル中のタンパク質はブロッティング装置を用いてPVDFメンブレン(Immobilon−P、Millipore)に転写し、これを3%スキムミルク含有TBS−T緩衝液内で室温1時間震盪してブロッキング処理を行った。つぎにこのメンブレンを一次抗体溶液(抗myc−tag抗体、MBLを3%スキムミルク含有TBS−T緩衝液で1000倍希釈したもの)に浸漬させ、室温で1時間震盪した。その後、メンブレンを3%スキムミルク含有TBS−T緩衝液で2回洗浄し、二次抗体溶液(HRP−conjugated抗マウスIgG抗体、Zymedを3%スキムミルク含有TBS−T緩衝液で5000倍希釈したもの)に浸漬させ、室温で1時間震盪した。そして、メンブレンを3%スキムミルク含有TBS−T緩衝液で2回洗浄し、SuperSignal West Femto Maximum Sensitivity Substrate(Thermo)を用いて化学発光反応を行い、Chemidoc XRS(Bio−Rad)で陽性バンドを検出した。
【0055】
<実施例2>
野生型NGALのC末端にN結合型糖鎖が付加し得る、Asn Xaa Thr/Serのアミノ酸モチーフを含む各種ペプチドを連結し、分泌におけるその効果を調べた。その結果、いずれのペプチドを連結した場合でも、野生型にくらべると分泌量の増大が認められた(図7)。野生型NGALの分泌量を1としたとき、ペプチドを連結した分子の分泌量は、NSTペプチドの連結で1.4倍、NNSTペプチド(配列表配列番号3)の連結で2.6倍、NSTNSTペプチド(配列表配列番号1)の連結で2.4倍、NNSTNNSTペプチド(配列表配列番号7)の連結で3.8倍、ANSTNSTNSTペプチド(配列表配列番号2)の連結で6.8倍になった。
【実施例3】
【0056】
ヒトキモトリプシンC(CTRC)の場合
本実施例ではヒトCTRCをモデルとして、ペプチドの付加がCTRCの分泌生産量へ及ぼす影響を調べた。CTRCには、N結合型糖鎖付加のコンセンサス配列であるNXS/T配列が3カ所に存在するが(N25:NLS、N52:NDT、N226:NGS)(図8)、N25とN226には通常、糖鎖は結合していない。またN52に結合する糖鎖が分泌に重要な役割を果たしており、糖鎖が結合しないN52S変異体では分泌が低下することが報告されている(非特許文献8参照)。
【0057】
まず、ヒト膵臓由来cDNA(Clontech)を鋳型として、プライマーNG1064+、NG1065−(配列表配列番号53、54)とPrimeSTAR HS DNA polymerase(TAKARA)を用いてPCR増幅を行い、ここで増幅したCTRCの全長cDNAをpBluescript II SK+ベクター(Stratagene)のEcoRVサイトにクローニングした。これよりEcoRI、XhoIで切り出したDNA断片をpcDNA3.1/Myc−His ver.A(Invitrogen)のEcoRI−XhoIサイトに挿入したものを、野生型CTRC(WT)の発現ベクターとした。
【0058】
つぎに、CTRCの糖鎖付加状況を改善した際の分泌への影響をみるため、N52:NDTのAsnをSerに交換した変異体(CTRC変異体N52S:CTRC(N52S))を作製した。N52:NDTのAsnをSerに交換するためにはプライマーNG1066+、NG1067−(配列表配列番号55、56)の各プライマーの組み合わせと、PrimeSTAR HS DNA polymerase(TAKARA)を用いて、上記CTRCcDNAを含むpBluescript IIプラスミドを鋳型としてPCRによる変異導入でN/S交換を行った。
【0059】
また、Asn Xaa Thr/Serのアミノ酸モチーフを含むペプチドがCTRCの分泌に及ぼす影響を調べるため、NSTNST(配列表配列番号1)、ANSTNSTNST(配列表配列番号2)の各ペプチドつきCTRC、およびANSTNSTNST(配列表配列番号2)ペプチドつきCTRC(N52S)の発現ベクターを構築した。ペプチドNSTNST(配列表配列番号1)をコードするDNAは、プライマーNG453+、NG454−(配列表配列番号41、42)をアニーリングさせて作製した。ペプチドANSTNSTNST(配列表配列番号2)をコードするDNAは、プライマーNG493+、NG494−(配列表配列番号45、46)をアニーリングさせて作製した。
【0060】
なお、NSTNSTペプチドおよびANSTNSTNSTペプチドをコードするDNAには、CTRCへの連結とベクターへの挿入のためにXhoI、XbaIの制限酵素サイトがそれぞれ5’側、3’側に存在するため、実際のペプチドにはN末端側にはLeu Gluが、C末端側にはSer Argが付加される。これらDNAをCTRCおよびCTRC(N52S)の発現ベクターに組み込み、ペプチドつきCTRCとペプチドつきCTRC(N52S)の発現ベクターとした。
【0061】
それぞれの発現ベクターはFuGene 6 transfection reagent(Roche)を用いてHEK293細胞に導入した。トランスフェクション後、これらの細胞は37℃のCO2インキュベーターで一晩培養し、ここで培地交換を行って(3.5cm dish、MEM培地+10%牛血清2mlをMEM培地1mlに交換)、さらに一定時間培養を行った(トランスフェクションから48時間後まで)。培養終了後、培養上清を回収して少量のNTA Agarose(Qiagen)を添加し、4℃で2時間撹拌して培養上清中に分泌された組換え体CTRCおよびその変異体をこれに吸着させ回収した。分泌生産量を解析する場合は、このNTA AgaroseをPBS緩衝液で洗浄後、SDS sample bufferと混合し、煮沸処理後、SDS−ポリアクリルアミドゲル電気泳動(SDS−PAGE)に供した。
【0062】
分泌生産量を解析する場合は、泳動終了後、ウェスタンブロットを行うため、ゲル中のタンパク質はブロッティング装置を用いてPVDFメンブレン(Immobilon−P、Millipore)に転写し、これを3%スキムミルク含有TBS−T緩衝液内で室温1時間震盪してブロッキング処理を行った。つぎにこのメンブレンを一次抗体溶液(抗myc−tag抗体、MBLを3%スキムミルク含有TBS−T緩衝液で1000倍希釈したもの)に浸漬させ、室温で1時間震盪した。その後、メンブレンを3%スキムミルク含有TBS−T緩衝液で2回洗浄し、二次抗体溶液(HRP−conjugated抗マウスIgG抗体、Zymedを3%スキムミルク含有TBS−T緩衝液で5000倍希釈したもの)に浸漬させ、室温で1時間震盪した。そして、メンブレンを3%スキムミルク含有TBS−T緩衝液で2回洗浄し、SuperSignal West Femto Maximum Sensitivity Substrate(Thermo)を用いて化学発光反応を行い、Chemidoc XRS(Bio−Rad)で陽性バンドを検出した。
【0063】
<実施例3>
CTRCおよびCTRC(N52S)のC末端にN結合型糖鎖が付加し得る、Asn Xaa Thr/Serのアミノ酸モチーフを含むNSTNST(配列表配列番号1)ペプチド、またはANSTNSTNSTペプチド(配列表配列番号2)を連結し、分泌におけるその効果を調べた。その結果、CTRC(N52S)は野生型CTRCにくらべて分泌量が低下したが、これにANSTNSTNSTペプチド(配列表配列番号2)を連結したところ、野生型より分泌量の増大が認められた(図9)。また、野生型CTRCにNSTNST(配列表配列番号1)ペプチド、あるいはANSTNSTNSTペプチド(配列表配列番号2)を連結した場合でも、分泌量の増大が認められた(図9)。野生型CTRCの分泌量を1としたとき、CTRC(N52S)の分泌量は0.5〜0.7、これにANSTNSTNSTペプチド(配列表配列番号2)を連結した分子の分泌量は7.4倍になった。また、野生型CTRCにNSTNST(配列表配列番号1)ペプチドを連結した分子の分泌量は1.6倍、ANSTNSTNSTペプチド(配列表配列番号2)を連結した分子の分泌量は1.5倍になった。
【産業上の利用可能性】
【0064】
本発明のタンパク質製造方法は、有用タンパク質の分泌生産の増大や、糖鎖付加により機能改変や新機能が付与されたタンパク質の製造、あるいは血中安定性が増大したタンパク質の製造などに利用できる。
【特許請求の範囲】
【請求項1】
分泌タンパク質をコードするDNAに、少なくとも1つのAsnを含むアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、そのアミノ酸配列を付加した分泌タンパク質であって本来の活性を損なうことなく分泌生産量が増大した分泌タンパク質の製造方法。
【請求項2】
目的のタンパク質をコードするDNAに、下記(1)のアミノ酸配列モチーフを少なくとも1つ有するアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、そのアミノ酸配列を付加した目的のタンパク質であって本来の活性を損なうことなく新たな性質を付与した目的のタンパク質の製造方法。
(1)Asn Xaa Thr/Ser
(ただし、(1)でXaaは任意のアミノ酸を示す。)
【請求項3】
目的のタンパク質をコードするDNAに、ThrまたはSerを少なくとも1つ有するアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、ThrまたはSerにO結合型糖鎖が結合したそのアミノ酸配列を付加した目的のタンパク質であって本来の活性を損なうことなく新たな性質を付与した目的のタンパク質の製造方法。
【請求項4】
そのアミノ酸配列がプロテアーゼ切断配列を有するものであり、製造したタンパク質にそのプロテアーゼを反応させて、製造したタンパク質からそのアミノ酸配列を切断することを特徴とする請求項1から3に記載のタンパク質の製造方法。
【請求項1】
分泌タンパク質をコードするDNAに、少なくとも1つのAsnを含むアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、そのアミノ酸配列を付加した分泌タンパク質であって本来の活性を損なうことなく分泌生産量が増大した分泌タンパク質の製造方法。
【請求項2】
目的のタンパク質をコードするDNAに、下記(1)のアミノ酸配列モチーフを少なくとも1つ有するアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、そのアミノ酸配列を付加した目的のタンパク質であって本来の活性を損なうことなく新たな性質を付与した目的のタンパク質の製造方法。
(1)Asn Xaa Thr/Ser
(ただし、(1)でXaaは任意のアミノ酸を示す。)
【請求項3】
目的のタンパク質をコードするDNAに、ThrまたはSerを少なくとも1つ有するアミノ酸配列をコードするDNAを連結してなるDNAを含む組換えベクターを含む形質転換体を培養することを特徴とする、ThrまたはSerにO結合型糖鎖が結合したそのアミノ酸配列を付加した目的のタンパク質であって本来の活性を損なうことなく新たな性質を付与した目的のタンパク質の製造方法。
【請求項4】
そのアミノ酸配列がプロテアーゼ切断配列を有するものであり、製造したタンパク質にそのプロテアーゼを反応させて、製造したタンパク質からそのアミノ酸配列を切断することを特徴とする請求項1から3に記載のタンパク質の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2013−55935(P2013−55935A)
【公開日】平成25年3月28日(2013.3.28)
【国際特許分類】
【出願番号】特願2012−181173(P2012−181173)
【出願日】平成24年8月17日(2012.8.17)
【出願人】(000173924)公益財団法人野口研究所 (108)
【Fターム(参考)】
【公開日】平成25年3月28日(2013.3.28)
【国際特許分類】
【出願日】平成24年8月17日(2012.8.17)
【出願人】(000173924)公益財団法人野口研究所 (108)
【Fターム(参考)】
[ Back to top ]

