タンパク質への外来分子の部位特異的な連結及びその利用
【課題】トランスグルタミナーゼ(TGase)を用いて、ペプチド又はタンパク質へ部位特異的に外来分子を連結する方法の提供。
【解決手段】ペプチド又はタンパク質はTGase(トランスグルタミナーゼ)が認識可能なリシン(Lys)残基又は第1級アミンを有し、そして分子はアニオン性(例えば、核酸)であり、かつTGaseが認識可能なグルタミン(Gln)残基を有する。好ましい態様においては、TGaseは微生物由来のものであり、かつTGaseが認識可能なGln残基(Q)は、カルボベンゾイル-L-グルタミルグリシン(Z-QG)として存在しTGaseが認識可能なグルタミン(Gln)残基(K)は、MKHKGSとして存在する。in situ ハイブリダイゼーション、DNA/プロテインチップ、バイオセンサーに応用可能である。
【解決手段】ペプチド又はタンパク質はTGase(トランスグルタミナーゼ)が認識可能なリシン(Lys)残基又は第1級アミンを有し、そして分子はアニオン性(例えば、核酸)であり、かつTGaseが認識可能なグルタミン(Gln)残基を有する。好ましい態様においては、TGaseは微生物由来のものであり、かつTGaseが認識可能なGln残基(Q)は、カルボベンゾイル-L-グルタミルグリシン(Z-QG)として存在しTGaseが認識可能なグルタミン(Gln)残基(K)は、MKHKGSとして存在する。in situ ハイブリダイゼーション、DNA/プロテインチップ、バイオセンサーに応用可能である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、タンパク質の部位特異的な修飾方法に関する。より詳細には、トランスグルタミナーゼを用いて、タンパク質に部位特異的に核酸を連結する方法に関する。本発明は、in situ ハイブリダイゼーション、DNA/プロテインチップ、バイオセンサーに応用可能である。
【背景技術】
【0002】
タンパク質に何らかの修飾を施すことにより、タンパク質機能の向上や、天然にはない機能を付与することが可能になる。有機分子により修飾を施されたタンパク質は、タンパク質ハイブリッドと呼ばれる。特に、高分子−タンパク質ハイブリッドの利用価値は高く、工・医・薬学の幅広い分野で利用されている。これまでに、酵素やタンパク質の安定化を目的としてポリエチレングリコール(PEG)による修飾が盛んに検討されてきた。
【0003】
最近、核酸(DNA or PNA or RNA)-タンパク質ハイブリッドに注目が集まっている。なぜなら、核酸の配列依存的な相補性により、タンパク質に無限の組み合わせの分子認識能を付与することが可能なためである。実際、DNAチップをベースとしたproteinチップ(非特許文献1)や、DNA-タンパク質ハイブリッドとPCR法と組み合わせた高感度検出系(非特許文献2)の構築等が報告されている。しかしながら、DNA-タンパク質ハイブリッドの調製はそれほど容易ではない。タンパク質にCys残基が存在する場合は、チオール基間のジスルフィド結合や、チオール−マレイミド間の選択的な化学修飾反応が検討されてきたが、前者では結合の安定性、後者では対象タンパク質に唯一のCys残基がタンパク質表面に露出して存在しない限り反応特異性の面で不十分である。したがって、タンパク質にDNAを安定かつ部位特異的に導入するための修飾法の確立が望まれている。
【0004】
これを達成する最も有力な手段として、これまでにexpressed protein ligation(EPL)技術を利用する手法が提案されている(PNA-protein conjugateについて非特許文献3及びDNA-protein conjugateについて、非特許文献4)。EPL技術を利用すれば、タンパク質の特定部位に、共有結合的にDNAを導入することが可能である。しかしながら、この方法は、目的タンパク質をインテインとの融合タンパク質として調製しなければならないこと、修飾部位がC末端に限定されること、導入するDNAにCys残基を導入する必要があること、といった制限がある。
【0005】
また、タンパク質とDNAのハイブリッド化に酵素トランスグルタミナーゼ(TGase)を利用する試みもある。TGaseは、ペプチドやタンパク質中のGln残基側鎖とLys残基側鎖のε-アミノ基又は第1級アミンとの間を共有結合で架橋する反応を触媒する。TGaseを使ってタンパク質DNAハイブリッドを調製する場合、タンパク質側のGln残基とLys残基とのいずれをターゲットとするかで、ハイブリッド化する有機分子のデザインが異なる。これまで、タンパク質とポリリシン、タンパク質とPEG、又はタンパク質と分岐型糖鎖とのハイブリッド化等が検討されてきた(特許文献1及び非特許文献5〜8)。これらのケースでは、ポリリシン又はアミノ化PEG若しくはアミノ化糖鎖が、タンパク質側のTGase活性なGln残基との架橋が試みられた。また、TGaseに関しては、カルボベンゾイル-L-グルタミルグリシン(Z-QG)がグルタミン残基を供与する良基質として知られている(先行技術文献9〜11)ほか、TGaseに対してグルタミン供与体となりうる基質のアミノ酸配列に関連した報告がある(前掲先行技術文献6、並びに先行技術文献12〜14)。
【0006】
一方、本発明者らはTGaseの工学的応用について研究してきたが、TGaseに対しLys残基を供与し、良基質として働くMKHKGS(非特許文献15及び16)、GSGMKETAAARFERAHMDSGS(改変型S-peptide:非特許文献17)、MGGSTKHKIPGGS(非特許文献18)、N末端トリ又はペンタグリシン(N-terminal GGG or N-terminal GGGGG:非特許文献19)といったタグを見いだしている。
【先行技術文献】
【0007】
【特許文献1】特開平8-89278号公報
【非特許文献1】Angew. Chem. Int. Ed., 44, 7635, 2005
【非特許文献2】Nature Methods, 2, 31, 2005
【非特許文献3】Chem. Commun., 822, 2003
【非特許文献4】Bioorg. Med, Chem, Lett., 14, 2407, 2004
【非特許文献5】Biochemistry, 35, 13072, 1996
【非特許文献6】Bioconjugate Chem., 11, 502, 2000
【非特許文献7】Bioconjugate Chem., 12, 701, 2001
【非特許文献8】J. Am. Chem. Soc., 126, 14013, 2004
【非特許文献9】J. Biol. Chem., 240, 2951-2960, 1965
【非特許文献10】Agric. Biol. Chem., 53, 2613-2617, 1989
【非特許文献11】Analytical Biochemistry, 249, 54-60, 1997
【非特許文献12】Biosci. Biotechnol. Biochem., 64, 2608-2613, 2000
【非特許文献13】J. Am. Chem. Soc., 128, 4542-4543, 2006
【非特許文献14】Analytical Biochemistry, 281, 68-76, 2000
【非特許文献15】Biomacromolecules, 6, 35, 2005
【非特許文献16】Biomacromolecules, 6, 2299, 2005
【非特許文献17】Bioconjugate Chem., 15, 491-497, 2004
【非特許文献18】Biotechnol. Bioeng., 86, 399-404
【非特許文献19】FEBS Lett., 579, 2092-2096, 2005
【発明の開示】
【0008】
本発明者らは、TGaseを使ってタンパク質DNAハイブリッドを調製するに際し、まずアミノ化DNAを用いることとした。そして、TGase活性なGln残基を有するタンパク質として、TGaseの良基質であるジメチルカゼインを選択し、アミノ化DNAとのハイブリッド化を試みたが、架橋化反応は進行しなかった。詳細な理由は不明であるが、ポリアニオンであるDNAがTGase反応におけるカチオン性アミノ基の反応性を低下させている可能性がある。
【0009】
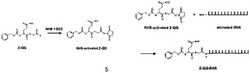
そこで発想を転換し、MTGの良基質として知られるジペプチドZ-Gln-Gly(Z-QG)のカルボキシル基を活性エステル(NHS)化し、これをアミノ化DNAと縮合することで、TGase活性なGln残基を有するDNA(Z-QG-DNA)を合成した(図1)。
【0010】
次に、TGase活性なLys残基を有するNK6-AP(MKHKGS配列をN末端に有するアルカリホスファターゼ)とZ-QG-DNAとを混合し、TGase反応に供したところ、NK6-APとZ-QG-DNAのハイブリッド化が可能なことが明らかとなった(図2)。また、ハイブリッド化前後でAPの酵素活性は充分に保持されており、DNAが目的タンパク質(NK6-AP)のペプチドタグ選択的に導入されていることが明らかとなった。さらに、MKHKGS配列をC末端に有するアルカリホスファターゼ、MKHKGS配列をN末端に有する緑色蛍光タンパク質(EGFP)及びグルタチオン-S-トランスフェラーゼ(GST)についても、同様の操作によりDNAとのハイブリッド化が可能なことを確認し、本発明を完成した。
【0011】
I. 複合体、複合体の形成方法、複合体の製造方法:
本発明は、トランスグルタミナーゼ(TGase)を用いて、ペプチド又はタンパク質へ部位特異的に外来分子を連結する方法であって:分子が、アニオン性であり、かつTGaseが認識可能なグルタミン(Gln)残基を有し;そして、ペプチド又はタンパク質が、TGaseが認識可能なリシン(Lys)残基又は第1級アミンを有するものである、前記方法を提供する。また、本発明は、トランスグルタミナーゼ(TGase)を用いて、ペプチド又はタンパク質へ部位特異的に外来分子を連結する方法であって:
ペプチド又はタンパク質が、TGaseが認識可能なリシン(Lys)残基又は第1級アミンを有するものであり、そして
分子が、アニオン性であり、かつTGaseが認識可能なグルタミン(Gln)残基を有するものである、前記方法を提供する。
【0012】
本発明において用いることのできる、タンパク質又はペプチドに組み込まれる外来分子は、アニオン性の分子である。本明細書で「アニオン性分子」というときは、溶液中でアニオンとしての性質を有するものであり、これには、核酸が含まれる。核酸には、DNA、PNA又はRNAが含まれる。アニオン性分子の好ましい例は核酸である。核酸の配列及び長さには特に制限はない。長さに関しては、40mer程度であれば、本発明に充分に用いることができることが確認されている(実施例参照)。
【0013】
本発明においては、アニオン性分子は、用いるTGaseが認識可能なGln残基を有する。アニオン性分子が核酸である場合、該核酸は、5’末端、又は3’末端またはそれ以外の所望の部分に、必要に応じスペーサーを介して、TGaseが認識可能なGln残基が結合したものである。
【0014】
TGaseが認識可能なGln残基は、カルボベンゾイル-L-グルタミルグリシン(Z-QG)として存在することが好ましい。また、微生物由来TGaseの良基質として、LLQG(配列番号:1)、LAQG(配列番号:2)、LGQG(配列番号:3)、PLAQSH(配列番号:4)、FERQHMDS(配列番号:5)、若しくはTEQKLISEEDL(配列番号:6)のアミノ酸配列からなるペプチド、又はGLGQGGG(配列番号:7)、GFGQGGG(配列番号:8)、GVGQGGG(配列番号:9)、若しくはGGLQGGG(配列番号:10)のアミノ酸配列からなるペプチドが知られている。また、guinea pig liver由来のTGaseの良基質として、カルボベンゾイル-L-グルタミルフェニルアラニン(Z-QF)、又はEAQQIVM(配列番号:11)のアミノ酸配列からなるペプチド、又はGGGQLGG(配列番号:12)、GGGQVGG(配列番号:13)、GGGQRGG(配列番号:14)、GQQQLG(配列番号:15)、PNPQLPF(配列番号:16)若しくはPKPQQFM(配列番号:17)のアミノ酸配列からなるペプチドが知られている。TGaseが認識可能なGln残基は、用いるTGaseの種類に応じ、このようなペプチドとして存在してもよい。
【0015】
なお、N末端がグリシン(G)である基質ペプチドは、N末端アミノ基がTGaseの基質になりうるため、自己架橋による副産物が生じうる。したがって、N末端がグリシン(G)である基質ペプチドについては、N末端アミノ基の水素を適切な基で置換することによりTGaseの基質とはならないように保護して、所望の連結を行うことができるようにするとよい。なお、本明細書において「N末端保護」というときは、特別な場合を除き、このような意味で用いている。そして、N末端保護の手段により、反応性が異なることが知られている。詳細には、ほ乳類由来TGaseに関して、GQQQLGのN末アセチル化による保護(即ち、Ac-GQQQLG)、またN末端アミノ酸をDOPA(L-3,4-dihydroxyphenylalanine)にする(即ち、DOPA-GQQQLG)と反応性が向上することが知られている。このような保護の例を、本発明においても利用することができる。
【0016】
TGaseが認識可能なGln残基を有するアニオン性分子は、TGaseが認識可能なGln残基を有する上述のようなペプチドを所望の分子(例えば、核酸)に結合することにより調製することができる。ペプチドは、用いるTGaseによって、良く認識されるものを選択することが好ましく、また、できるだけ短いものを選択することが好ましい場合がある。また、上述以外に、種々ペプチドを選択しうるが、そのアミノ配列中にTGaseが認識可能なLys残基又は第1級アミンが共存しないようなものを選択することが好ましい。共存する場合には、TGaseにより、自己架橋する可能性があり、目的のタンパク質(又はペプチド)−核酸複合体の収率に好ましくない影響を与える場合があるからである。
【0017】
微生物由来のTGase(「MTGase」又は「MTG」のように記載される場合がある。)を用いる場合、TGaseが認識可能なGln残基は、Z-QGとして存在することが好ましい。TGaseが認識可能なGln残基を有するDNAであって、該Gln残基がZ-QGをとして存在するもの、すなわちZ-QG−DNAの調製方法の例としては、次のようなものがある:NH2-(CH2)6-等を末端に付加することによりアミノ化した所望の塩基配列を有するDNAを準備し、一方、Z-QGは、下記のようにNHSで活性化しておく。
【0018】
【化1】

【0019】
そして、アミノ化DNAと活性エステル化Z-QGとを縮合することで、Z-QG−DNAを得ることができる。精製は、ゲル濾過カラムで行うことができ、同定は、TOF-MSで行うことができる。また、HPLCで、生成物の確認及び収率を求めることができる。
【0020】
また、C末端のカルボキシル基を活性エステル化する上述の方法に加えて、TGaseが認識可能なGln残基を有するペプチドをDNAに導入する方法として、アミノ基と反応性の高い官能基をペプチドに導入する方法がある。例えば、アルデヒド化、アシルアジド化、スルフォニルクロライド化、エポキシ化、イソシアネート化、又はイソチオシアネート化した基質ペプチドを調製できれば、これをアミノ化DNAと反応させることにより、TGaseが認識可能なGln残基を有するDNAを調製することができる。但し、これらの反応性官能基は、基質ペプチドにおいてTGase認識に影響がない部分に導入する必要がある。したがって、上述のように、Gln残基とは離れたC末端のカルボキシル基を活性化する方法は、この目的において最も優れたものの一つである。TGaseの反応に影響がなければ、グルタミン酸やアスパラギン酸のカルボキシル基を活性化することにより、アミノ化DNAと反応させてもよい
。
【0021】
本発明においては、アニオン性分子により修飾されるペプチド又はタンパク質は、用いるTGaseが認識可能なLys残基又は第1級アミンを有する。なお、本明細書では、タンパク質を例に説明することがあるが、その説明は、特別な場合を除き、ペプチドにも当てはまる。本明細書では、Lys残基を例に説明することがあるが、その説明は、特別な場合を除き、第1級アミンにも当てはまる。
【0022】
TGaseに対し、Lys残基(又は第1級アミン)供与体となる基質は、Gln残基供与体となる基質に比較して構造的な制約が少ないと考えられる。したがって、修飾しようとするタンパク質(又はペプチド)が、TGaseが認識可能なLys残基を元来有している場合もあり、そのような場合は、新たにTGaseが認識可能なLys残基を含むタグをタンパク質に付加しなくてもよい場合がある。
【0023】
一方、TGaseが認識可能なLys残基(K)は、MKHKGS(配列番号:18)のアミノ酸配列を有するペプチドとして存在してもよい。このようなTGaseが認識可能なLys残基を含むペプチドによるタグ化は、アニオン性分子を、タンパク質の所望の部位、例えばC末端又はN末端に連結する目的で用いてもよい。TGaseが認識可能なLys残基を含む他のペプチド又はそのアミノ酸配列の例としては、改変型S-peptide(GSGMKETAAARFERAHMDSGS(配列番号:19))、MGGSTKHKIPGGS(配列番号:20)、N末端グリシン(N-terminal GGG、N-terminal GGGGG(配列番号:21))、N末端MKHKGSと対象タンパク質間のリンカー部位を伸ばしたMKHKGSGGGSGGGS(配列番号:22)がある。
【0024】
C末端又はN末端にTGaseが認識可能なLys残基を含むペプチドを付加したタンパク質は、遺伝子工学的な手法を用いて、組換えタンパク質として調製することができる。C末端又はN末端にTGaseの基質ペプチドタグが導入された当該組換えタンパク質の精製は、それぞれN末端又はC末端に付加した(His)6-tagを利用し(TGaseの反応性の低下を回避するために、基質ペプチドタグを入れた末端とは異なる末端にHis-tagを入れるようにデザインするとよい。)、ゲル濾過カラムにより行うことができ、またアミノ酸配列の確認は当該タンパク質をコードするプラスミドベクターの遺伝子配列をDNAシーケンサーにて確認するか、N末端に導入された基質ペプチドについてはN末端分析により直接同定することができる。タンパク質の精製の確認は SDS-PAGE で行うことができる。
【0025】
ペプチド又はタンパク質の好ましい例は、容易に検出可能な性質を有するものであり、例えばアルカリホスファターゼ(AP)、緑色蛍光タンパク質(GFP)、グルタチオン-S-トランスフェラーゼ(GST)、ルシフェラーゼ、ペルオキシダーゼ、抗体エピトープ配列を含むペプチド及びビオチン等である。ペプチドタグが容易に導入可能との観点からは、遺伝子工学的に製造可能なタンパク質が好ましい。
【0026】
本発明においては、トランスグルタミナーゼ(TGase)として、種々のものを用いうる。現在、TGaseとして、哺乳類(guinea pig、ヒト)、無脊椎動物(昆虫、カブトガニ、ウニ)、植物、菌類、原生生物(粘菌)由来のものが知られており、またヒトの場合については、8種類のアイソザイムが見つかっている。本発明において用いることのできるTGaseの好ましい例は、微生物由来のものである。
【0027】
本発明のTGaseを用いたタンパク質への部位特異的な外来分子の連結方法の、最も好ましい態様の一つは、微生物由来のTGase、Z-QG及びMKHKGSを組み合わせて用いるものである。
【0028】
本発明においてMTGを用いた場合、予想されているMTGの触媒反応から、Lys残基を有するタンパク質又はペプチドとZ-QG-DNAとの連結反応は、MTG活性中心であるシステイン(Cys)残基の、Z-QG-DNAのGlnへの求核置換反応によるアシル−酵素複合体の形成と、続いて起こるタンパク質のLysによるアシル−酵素複合体への求核置換反応によるMTGの脱離、の2段階で進行すると予想される。
本発明者らの検討によると、タンパク質濃度に対し15倍以上のZ-QG-DNA濃度とした場合においても、反応率(ペプチド又はタンパク質−核酸複合体に転化した、TGaseが認識可能なLys残基又は1級アミンを有するペプチド又はタンパク質の割合。例えば、AP-DNA複合体に転化したNK6-APの割合。)は50〜60%にまでしか到達しないことから、この反応の律速段階は2段階目であると予想された。そこでタンパク質としてNK6-APを用い、NK6-AP過剰の条件下での連結反応による反応効率の向上を試みたところ、充分に高い(例えば80%以上、好ましくは95%以上の)反応率を得るには、Z-QG-DNAに対するNK6-APの濃度比が2以上であることが好ましいことが分かった(実施例7参照)。また、Z-QG-DNAの濃度は、おそらく1μM以上であることが好ましいと思われた。
【0029】
したがって、本発明の好ましい態様においては、TGaseが認識可能なGln残基を有するアニオン性分子に対する、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質のモル濃度比は、好ましくは2以上であり、より好ましくは5以上である。なお、本明細書で単に「濃度比」というときは、特別な場合を除き、モル濃度による比を指す。Z-QG-DNAに対するNK6-APのモル濃度比は、[NK6-AP]/[Z-QG-DNA]と表すこともできる。
【0030】
また、本明細書の実施例のように、TGaseとしてMTGを用いて連結反応を行う場合には、上述のようにモル濃度比が適切な範囲となるようにすることに加えて、pH5.5〜8.0、温度4〜50℃(例えば、室温)で行うことが好ましい。このようにすれは、12時間以内、好ましくは6時間以内、より好ましくは3時間以内に、充分に高い反応率が達成可能である(実施例7参照)。
【0031】
このような高い反応率が達成できる方法により得られたペプチド又はタンパク質−核酸複合体溶液には、未反応のアニオン性分子(例えば、遊離のZ-QG-DNA)がほとんど存在せず、以下で詳述する、ペプチド又はタンパク質の固定化、又は標的分子の検出にそのまま用いたとしても、複合体と未反応分子との競合が実質的に生じないか、生じたとしても目的とする固定化又は検出の結果には実質的な影響を与えないほど少ないと考えられる。したがって、複合体溶液を精製することなく、直接固定化又は検出へと利用できるメリットがある(実施例8参照)。
【0032】
本発明以前に、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質とTGaseが認識可能なGln残基を有する外来分子とをTGaseを用いて連結することにより、タンパク質複合体を得る手段は存在しなかった。したがって、本発明の方法により連結された複合体は、物質として新規なものということができる。
【0033】
よって本発明はまた、以下のものも提供する:
(3)TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られる、ペプチド又はタンパク質−核酸複合体。
【0034】
本明細書において、本発明の複合体に関連して、「TGaseにより連結する」というときは、特別な場合を除き、得られる連結部は、Lys残基とGln残基とが、ε(γ-グルタミル)リシン結合を形成することにより構成されている。
【0035】
本発明の複合体は、好ましい態様においては、TGaseが認識可能なLys残基を有するペプチド又はタンパク質と、Z-QG、又はLLQG、LAQG、LGQG、PLAQSH、FERQHMDS、若しくはTEQKLISEEDLのアミノ酸配列からなるペプチド、又はGLGQGGG、GFGQGGG、GVGQGGG、若しくはGGLQGGGのアミノ酸配列からなる、N末端保護ペプチド(好ましくは、N末端がアセチル基又はL-3,4-ジヒドロキシルフェニルアラニル基で保護されたペプチド)、又はZ-QF、又はEAQQIVMのアミノ酸配列からなるペプチド、又はGGGQLGG、GGGQVGG、GGGQRGG、GQQQLG、PNPQLPF若しくはPKPQQFMのアミノ酸配列からなる、N末端保護ペプチド(好ましくは、N末端がアセチル基又はL-3,4-ジヒドロキシルフェニルアラニル基で保護されたペプチド)を有する核酸とが、ε(γ-グルタミル)リシン結合で連結した構造からなる。
【0036】
なお、guinea pig liver TGase について、EAQQIVM については、Q3 >> Q4 という報告がある(Anal. Biochem., 281, 68, 2000)。但し、Factor XIIIa では、EAQQIVM においてはQ3が優先的に反応しうる。また、PKPQQFM については、Q4 >> Q5 という報告がある(Biochemistry, 35, 13072, 1996)。また、EAQQIVM については、コア配列と考えられるAQQIV部分のみを用いることも有用であろう。
【0037】
ペプチド又はタンパク質の好ましい例は、容易に検出可能な性質を有するものであり、例えばAP、GFP、GST、ルシフェラーゼ、ペルオキシダーゼ、抗体エピトープ配列を含むペプチド及びビオチン等である。ペプチドタグが容易に導入可能との観点からは、遺伝子工学的に製造可能なタンパク質が好ましい。ペプチド又はタンパク質におけるTGaseが認識可能なLys残基(K)は、MKHKGSのアミノ酸配列を有するペプチドとして存在してもよい。このようなTGaseが認識可能なLys残基を含むペプチドタグは、ペプチド又はタンパク質の所望の部位、例えばC末端又はN末端に付加することができる。TGaseが認識可能なLys残基を含む他のペプチド又はそのアミノ酸配列の例としては、改変型S-peptide(GSGMKETAAARFERAHMDSGS)、MGGSTKHKIPGGS、N末端グリシン(N-terminal GGG、N-terminal GGGGG)、N末端MKHKGSと対象タンパク質間のリンカー部位を伸ばしたMKHKGSGGGSGGGSがある。
【0038】
複合体の好ましい態様の一つは、CK6-APとZ-QG-DNAとの複合体及びNK6-APとZ-QG-DNAとの複合体である。このような複合体は、安定な酵素であるAPと、安定な分子であるDNAが、アミド結合という安定な共有結合で連結されているため、複合体全体としても安定性であるというメリットがある。
【0039】
本発明の複合体の形成方法は、対象となるペプチド又はタンパク質を、部位特異的に外来分子で修飾することにより、複合体を形成させるものであるが、従来法に比較して、以下の特徴及びメリットを有する:
・対象タンパク質は、TGaseが認識可能なLys残基又は第1級アミンを有する天然タンパク質、TGaseが認識可能なLys残基又は第1級アミンを導入することができるあらゆるタンパク質を包含する。また、インテインのような大きなタンパク質性タグを必要としない。
・タンパク質の修飾部位は、C末端に限定されない。TGase活性なLys残基が存在するか、そのようなLys残基を有するタグを導入することができる部位であれば、修飾可能である
。C末端、N末端に加え、loop領域のようなタンパク質構造中の揺らぎの大きな部位も修飾対象となりうる。
・外来分子として核酸を選択する場合、その塩基配列及び長さには、特に制限がない。
【0040】
本発明の複合体、複合体の形成方法、複合体の製造方法は、DNAチップをベースとしたプロテインチップ開発、DNAチップのハイブリダイゼーション検出用高感度分子プローブ、in situ ハイブリダイゼーションのための分子プローブ(特にAP-DNA)、(機能性)DNAとのハイブリッド化による分子センサーの構築、アンチセンスオリゴDNAとのハイブリッド化による創薬に応用可能である。
【0041】
II. 複合体の利用:
本発明はまた、以下のものも提供する:
(4)ペプチド又はタンパク質の基材表面への固定化方法であって、
a) 基材表面に固定化された核酸、
b) ペプチド又はタンパク質−核酸複合体であって、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られるものであり;さらに核酸部分が、固定化核酸の有する塩基配列の全部又は一部に相補的な核酸配列を有するものである、前記ペプチド又はタンパク質−核酸複合体
を用い、
固定化核酸と、ペプチド又はタンパク質−核酸複合体の核酸部分とを、ハイブリダイズさせて固定化物を形成する工程を含むものである、前記固定化方法。
(5)ペプチド又はタンパク質の基材表面への固定化物の製造方法であって:
基材表面に予め固定化されている核酸と、ペプチド又はタンパク質−核酸複合体の核酸部分とを、ハイブリダイズさせて固定化物を形成する工程を含み、
ペプチド又はタンパク質−核酸複合体が、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られるペプチド又はタンパク質−核酸複合体である、前記製造方法。
【0042】
本発明のこれらの方法における基材表面への核酸の固定化のためには、従来技術、例えばDNAマイクロアレイ等を調製する際に用いられる技術を適用することができる。「基材」は、ガラス、シリコンなどのプラスチック製の、チップ、ビーズ、ウェル、プレート等の形態とすることができ、核酸は、従来技術を用いて、基材表面に非共有結合(静電結合)的に、又は共有結合で固定することができる。あらかじめ調製した核酸を基板に固定化してもよく、基板上で直接核酸を合成してもよい。簡便には、アビジンで被覆された市販のプレートを用い、ビオチン化した所望のDNAを固定することができる。
【0043】
本発明のこれらの方法において、ペプチド又はタンパク質−核酸複合体として、これまで述べてきたような本発明の複合体が用いられるが、そのペプチド又はタンパク質部分は、目的に応じ、種々の性質・構造のものとすることができる。また、その核酸部分は、固定化核酸の有する塩基配列の全部又は一部に相補的な核酸配列を有するものとする。
【0044】
本発明のこれらの方法においては、固定化核酸と、ペプチド又はタンパク質−核酸複合体の核酸部分とを、ハイブリダイズさせることにより固定化する。ハイブリダイズのための条件は、当業者であれば、用いる核酸部分の長さ・塩基配列等に応じて、適宜設計することができる。本発明のこれらの方法については、実施例4及び8、並びに図6、7及び13を参照することができる。なお、本発明者らは、上述したように、複合体連結反応溶液を精製することなく、直接固定化に利用できることを確認しており、また、ペプチド又はタンパク質−核酸複合体は、相補的な塩基配列を有する固定化核酸にはハイブリダイズするが、非相補的な塩基配列を有する固定化核酸にはハイブリダイズしないことも確認している。
【0045】
本発明はまた、以下のものも提供する:
(6)標的分子の検出方法であって:
ペプチド又はタンパク質−核酸複合体であって、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られるものであり;さらにペプチド又はタンパク質
部分が容易に検出可能な性質を有し、かつ核酸部分が標的分子に特異的に結合可能な塩基配列を有するものである、前記ペプチド又はタンパク質−核酸複合体を準備し;そして
対象物中に存在する標的分子と複合体とを核酸部分により特異的に結合させ;そして
結合している複合体を、ペプチド又はタンパク質部分により検出する工程を含む、前記検出方法。
【0046】
本発明の検出方法は、標的物質の定性、定量、識別、染色、局在化の調査等の目的で用いることができる。
本発明のこの方法においては、ペプチド又はタンパク質−核酸複合体として、本発明の複合体が用いられるが、また、核酸部分は、標的分子に特異的に結合可能な核酸配列を有するものとする。ペプチド又はタンパク質部分は、容易に検出可能な性質を有するものであり、好ましい例は、アルカリホスファターゼ(AP)、緑色蛍光タンパク質(GFP)、グルタチオン-S-トランスフェラーゼ(GST)、ルシフェラーゼ、ペルオキシダーゼ、抗体エピトープ配列を含むペプチド及びビオチン等である。ペプチドタグが容易に導入可能との観点からは、遺伝子工学的に製造可能なタンパク質が好ましい。この方法において、標的分子は、核酸、比較的低分子の有機化合物(ATP)、タンパク質、ペプチド、金属イオン、複雑な構造を持つ多量体、ウイルス等でありうる。検出対象は、DNA転写膜、又は細胞若しくは個体組織切片等である。
【0047】
本発明の検出方法は、標的核酸分子の検出方法として特に有用である。すなわち、標的分子が核酸であり、複合体の核酸部分が標的核酸分子の配列の全部又は一部と相補的な配列を有するものであり、標的核酸分子と複合体の核酸部分とをハイブリダイズさせることにより特異的に結合させる工程を含むものは、本発明の検出方法の特に好ましい実施態様の一つである。
【0048】
この態様において、検出対象は、(1)DNA転写膜、又は(2)細胞若しくは個体組織切片等である。 (1)の場合、標的核酸はPCRにより増幅されたDNA又はゲノム断片DNA、であり(2)の場合、標的核酸は細胞又は個体組織中に含まれる核酸(mRNA又はDNA)となる。この方法は、従来法、例えばジゴキシゲニン(DIG)標識化プローブを用いる方法に比較して、種々の点で優れている。例えば、DIG法では、プローブのDIG修飾及び標識化された抗DIG抗体が必要であり、それに伴う煩雑な洗浄操作が必要となるが、本発明の複合体(例えば、Z-QG-DNA-AP)を用いれば、DIG標識化プローブ及び標識化抗DIG抗体が不要になるため、試薬、手間及び時間を大幅に削減することが可能となる。
【0049】
なお、TGaseを使うと、ペプチドタグを介して組換え酵素どうしを架橋化した酵素ポリマーの調製も可能となる。したがって、酵素ポリマーを得て、それと核酸を連結することで、1つの認識部位(核酸)に対して複数のシグナル増幅部位(酵素)を配置することが可能となる。このような改変により、さらに検出感度の向上が可能になると思われる。
【0050】
本発明はまた、以下のものも提供する:
(7)標的分子の検出方法であって:
標的分子の検出方法であって:
a) 基材表面に固定化された核酸、
b) 固定化核酸の全部又は一部に相補的な配列(固定化核酸相補的配列)、及び標的分子に特異性的に結合可能な配列(標的分子特異的配列)を有するアプタマー核酸、並びに
c) ペプチド又はタンパク質−核酸複合体であって、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られるものであり;さらにペプチド又はタンパク質部分が容易に検出可能な性質を有し、かつ核酸部分がアプタマー核酸の標的分子特異的配列の全部又は一部に相補的な配列を有するものである、前記ペプチド又はタンパク質−核酸複合体
を用い、
1) 固定化核酸に、アプタマー核酸を供し、固定化核酸とアプタマー核酸の固定化核酸相補的配列を有する部分とをハイブリダイズさせることにより、アプタマー核酸を固定化し;
2) 固定化アプタマー核酸に、標的分子を含む可能性のある試料を供し、標的分子が存在する場合には標的分子とアプタマー核酸の標的分子特異的配列を有する部分とを結合させ、かつタンパク質−核酸複合体を供し、標的分子が存在しない場合にはタンパク質−核酸複合体の核酸部分とアプタマー核酸とをハイブリダイズさせることにより、タンパク質を固定化し;
3) 固定化タンパク質の有無又はその量をタンパク質の性質に基づいて検出することにより、試料中の標的分子を検出する
工程を含む、前記検出方法。
【0051】
本発明のこの方法における基材表面への核酸の固定化のためには、上述のペプチド又はタンパク質の固定化方法に関して説明したのと同様の技術を適用することができる。
この方法ではさらに、固定化核酸の全部又は一部に相補的な配列(固定化核酸相補的配列)、及び標的分子に特異性的に結合可能な配列(標的分子特異的配列)を有する核酸(アプタマー核酸)が用いられる。標的分子は、核酸、比較的低分子の有機化合物、タンパク質、ペプチド、金属イオン、複雑な構造を持つ多量体、ウイルス等でありうる。標的分子特異的配列を有する部分は、従来技術、例えばSELEX(試験管内人工進化法)工程を用いることにより産生することができ、また標的分子に対して非常に高い標的親和性及び特異性を有するものとすることができる。標的分子特異的配列を有する部分は、修飾ヌクレオチドで構成されていてもよい。
【0052】
この方法において、ペプチド又はタンパク質−核酸複合体として、本発明の複合体が用いられるが、そのペプチド又はタンパク質部分は、容易に検出可能な性質を有するものであり、好ましい例は、アルカリホスファターゼ(AP)、緑色蛍光タンパク質(GFP)、グルタチオン-S-トランスフェラーゼ(GST)、ルシフェラーゼ、ペルオキシダーゼ、抗体エピトープ配列を含むペプチド及びビオチン等である。ペプチドタグが容易に導入可能との観点からは、遺伝子工学的に製造可能なタンパク質が好ましい。また、核酸部分は、アプタマー核酸の標的分子特異的配列の全部又は一部に相補的な配列を有する。
【0053】
この方法においては、 固定化核酸に、アプタマー核酸を供し、固定化核酸とアプタマー核酸の固定化核酸相補的配列を有する部分とをハイブリダイズさせることにより、アプタマー核酸を固定化するが、このハイブリダイズのための条件は、当業者であれば、用いる核酸部分の長さ・塩基配列等に応じて、適宜設計することができる。
【0054】
また、この方法においては、次いで固定化アプタマー核酸に、標的分子を含む可能性のある試料を供し、標的分子が存在する場合には標的分子とアプタマー核酸の標的分子特異的配列を有する部分とを結合させ、さらにタンパク質−核酸複合体を供し、標的分子が存在しない場合にはタンパク質−核酸複合体の核酸部分とアプタマー核酸とをハイブリダイズさせる。試料は、細胞若しくは組織抽出液、体液等でありうる。
【0055】
さらにこの方法においては、固定化タンパク質の有無又はその量をタンパク質の性質に基づいて検出することにより、試料中の標的分子を検出することができる。
アプタマー核酸においては、固定化核酸相補的配列を有する部分と、標的分子特異的配列を有する部分とは、重複してもよく、連続してもよく、また適当なスペーサーを介して両者が存在するように設計することができる。標的分子特異的配列を有する部分(アプタマー領域)が分子認識のためにある立体構造をとることを考慮すると、該部分は、固定化核酸相補的配列を有する部分とは少なくとも重複しないようにするのがよい。
【0056】
アプタマー核酸は、固定化核酸相補的配列及び標的分子特異的配列以外に、所望の場合にはタンパク質−核酸複合体と適切にハイブリダイズするための配列をさらに含んでいてもよい。ペプチド又はタンパク質−核酸複合体の核酸部分は、アプタマー核酸の標的分子特異的配列の全部又は一部に相補的な配列を有するが、この特異的配列の全部又は一部に相補的な配列からなる領域が長い(標的分子特異的配列と重複が多い)と、却ってアプタマー核酸とはハイブリダイズできない場合が生じうる。また短い(重複が少ない)と、標的分子が存在し、アプタマー核酸と結合している場合にも、ペプチド又はタンパク質−核酸複合体とアプタマー核酸とがハイブリダイズしてしまう場合が生じうる。当業者であれば、このような考慮して、固定化核酸、アプタマー核酸、ペプチド又はタンパク質−核酸複合体の核酸部分を、適宜設計することができる。
【0057】
本発明のこの方法については、実施例5並びに図8及び9を参照することができる。
【実施例】
【0058】
〔実施例1:アルカリホスファターゼとDNAとの連結〕
(1) Z-QG-DNAの合成
MTGの良基質として知られるジペプチドZ-Gln-Gly(Z-QG)のカルボキシル基を活性エステル(NHS)化し、これをアミノ化DNAと縮合することで、TGase活性なGln残基を有するDNA(Z-QG-DNA)を合成した(図1)。
【0059】
Step 1: NHS(N-hydroxysuccinimide, 0.5M,キシダ化学)とZ-QG(0.5M, Sigma-Aldrich)をDMSO 1mLに溶解し、EDC((3-dimethyl-aminopropy1)carbodiimide, 同仁化学)0.6M
DMSO溶液)1mLを滴下し、室温で24時間攪拌した。
【0060】
Step 2: 0.2Mホウ酸緩衝液(pH9)に溶解したアミノ化DNA (24-mer, 5'-NH2-(CH2)6-AGC GGA TAA CAA TTT CAC ACA GGA-3'(配列番号:23), Gene Net) 水溶液250μLに、上記のNHS化Z-QG DMSO溶液50μLを添加した。室温で3時間撹拝後、NAP-10ゲル濾過カラムによりZ-QG-DNAを精製した。Z-QG-DNAの同定はTOF-MSで行い、HPLCで生成物の確認及び収率85%(アミノ化DNA基準)を求めた。
【0061】
(2) NK6-AP、CK6-APの合成
TGase活性なLys残基を有するNK6-AP(MKHKGS配列をN末端に有するアルカリホスファターゼ)及びCK6-AP(MKHKGS配列をC末端に有するアルカリホスファターゼ)を合成した。
【0062】
具体的な調製法を以下に示す。
2.1) NK6-AP発現ベクターの構築
pET22b(+)(Novagen)からPCRによりpET22b(+)のApaIサイト上流からpel B leaderの終りまでを増幅した。この時、pelB leader側にK6-tag(MKHKGS)をコードするDNAとBamHIサイトが導入されるようにプライマーを設計した。増幅後、生成したDNAをApaI/BamHIで処理した。pET22-APを同じくApaI/BamHIで処理した後、脱リン酸化反応を行いその後、増幅したDNAを挿入することでNK6-AP発現ベクター:pET22-NK6-APを調製した。
【0063】
2.2) CK6-AP発現ベクターの構築
pET22-APから、PCRによりAPをコードするDNAを増幅した。この時APのN末端側に制限酵素BamHIサイトとHis-tagをコードするDNAが、またC末端側にK6-tag(MKHKGS)をコードするDNAとHindIIIサイトが導入されるようにプライマーを設計した。増幅後、生成したDNAをBamHI/HindIIIで処理した。pET22b(+)を同じくBamHI/HindIIIで処理した後、脱リン酸化反応を行いその後、増幅したDNAを挿入することでCK6-AP発現ベクター:pET22-CK6-APを調製した。
【0064】
2.3) 各組換えAPの発現および精製
各組換えAPは大腸菌BL21株(Novagen)を用いて発現させた。まずそれぞれの発現ベクターを大腸菌BL21株に導入し形質転換体を得た。形質転換体はアンピシリン(100mg/L)を含むLB培地にて前培養を3時間程度行った(37℃、250rpm)。その後アンピシリン(100mg/L)を含むLB培地中(1L)にてOD600 = 0.6に達するまで培養を行い(37℃、250rpm)、IPTGを終濃度0.1mMになるように添加した。IPTG添加後、27℃、200rpmにて24時間培養を行った。
得られた菌体は遠心分離により集菌し、ショ糖緩衝液 (50 mM Tris-HCl, pH 7.4, にEDTA 1 mM、ショ糖20wt%を溶解させたもの)により2回洗浄を行い、浸透圧衝撃法用緩衝液 (5 mM MgCl2溶液) を用い細胞を再懸濁させた後、超音波処理により細胞を粉砕した。その後遠心分離により無細胞抽出液を回収し、これをHis-tagおよびゲル濾過カラムを用いて精
製することで、各組換えAPを得た。各組換えAPのアミノ酸配列の確認は、当該組換えAPをコードするプラスミドベクターのDNA配列の確認をDNAシーケンサーにて行い、精製の確認はSDS-PAGE で行った。
【0065】
(3) TGase反応
次に、NK6-AP又はCK6-APとZ-QG-DNAを混合し、TGase反応に供した。
具体的には、以下の条件で、反応した。
・CK6-AP又はNK6-AP : 2.8 μM
・Z-QG-DNA : 44 μM
・MTG(分子量38,000、Ca2+イオン非依存性、pH5〜8で活性) : 1.1 U/ml
・Buffer : 50 mM Tris-HCl pH 7.0
・Temp 25℃
・Time 24 hour
(4) AP活性の測定
TGase反応の前及び後のAP活性を、以下のように確認した。
・反応後の溶液(NK-6AP(pH7.0)): 5μl/ml
・p-ニトロフェニルリン酸 : 1mM
・pH 8.0
・Temp 25℃
一分間当たりに1μmolのp-ニトロフェノールを生成するAPの量を1Uと定義した。
【0066】
(4) 結果
CK6-AP又はNK6-APとZ-QG-DNAの連結が可能なことが明らかとなった(図2)。また、連結後のAPの酵素活性は、連結前の酵素活性と同等であったことから(図3)、目的タンパク質の機能損失を伴わないタンパク質とDNAの連結が可能なことが明らかとなった。これは、DNAが目的タンパク質(NK6-AP)のペプチドタグ選択的に導入されていることも示している。
【0067】
〔実施例2:EGFP又はGSTとDNAとの連結〕
MKHKGS配列をN末端に有する緑色蛍光タンパク質(EGFP)及びグルタチオン-S-トランスフェラーゼ(GST)についても、実施例1の実験操作でDNAとの連結が可能なことが確認された(図4)。
【0068】
〔実施例3:種々の長さのDNAとの連結〕
異なる長さのDNAとの連結を試みた。
Z-QG-DNAの合成:
実施例1のZ-QG-DNAの合成において、アミノ化DNAの長さを20、30又は40 merとした。それ以外の点は、実施例1と同様の実験操作を行った。
結果:
DNAの鎖長に依存せず連結が可能であった(図5,3、4及び5レーンはそれぞれ20、30及び40mer Z-QG-DNAとNK6-APとの連結の結果)。高分子同士を連結する際の酵素反応の優位性を示している。
【0069】
〔実施例4:DNA部位を介した配向制御型タンパク質固定化〕
得られたタンパク質-DNA複合体を核酸部位の相補性(DNA hybridization)を介して固定化することを試みた。核酸部位選択的な固定化の達成は、DNAチップをベースとしたproteinチップや、in situ hybridizationへの応用を可能にする。
【0070】
方法:
アビジンでコートされた96穴マイクロプレート(Nunc immobilizer, Streptavidin plates)上に、NK6-APとの連結に用いたDNAの相補的配列を有するビオチン化DNAを固定化し
た。ここに実施例1で得られたNK6-AP-Z-QG-DNAを、まず His-tagを使ってNiキレートカラムにより未反応 DNA とタンパク質成分を分離し、その後、PD10ゲル濾過カラムで溶出時に用いられたイミダゾールを徐去した後に添加し、洗浄操作の後、NK6-AP-Z-QG-DNAの酵素活性を指標として固定化挙動を検討した。概念図を図6に示す。
【0071】
実験は、下記の手順にしたがって行った。
1) アビジンコートされた96-wellプレートを、TBST (25mM Tris, 2.7mM KCl, 0.137M NaCl, 0.05 vol% Tween20)でprewashした。
2) 100 μLの500 nM biotin-cDNA(TBSに溶解)を加え、1時間インキュベートした後、TBSTで洗浄した。
3) 100 μLの NK6-AP-Z-QG-DNA(0.3U/L、TBSに溶解)を加え、1時間インキュベートした後、TBSTで洗浄した。
4) ECF基質(アマシャム バイオサイエンス株式会社)を加えた。
5) AP活性を、FX-Pro molecular imager (Bio-Rad)で検出した(Ex 430 nm/Em 560 nm)。
【0072】
結果:
結果を図7に示した。APに連結したDNAの相補鎖を固定化したウェルにのみAP活性が検出されたことから、NK6-APとZ-QG-DNAとの複合体(NK6-AP-Z-QG-DNA)は、DNA部位を介してタンパク質機能を保持したまま固定化されたことが明らかであった。この結果は、DNA hybridizationを介したタンパク質の固定化が可能なことを示すとともに、DNAが有する多様な機能(分子認識能:DNA aptamerや触媒能:DNAzyme)を、目的タンパク質の機能に影響をあたえることなく容易に付与することが可能なことも示している。
【0073】
〔実施例5:AP-DNA conjugateを利用した小分子の検出〕
AP-DNA conjugateの応用例として、ATPに特異性を有するDNAアプタマーを用いる小分子(ATP)検出系の構築を試みた。その概念を図8に示す。
【0074】
方法:
アビジン被覆ブラックマイクロプレート(Nunc イモビライザー)はNunc社から購入した。アルカリフォスファターゼ(AP)の基質ECFはアマシャム バイオサイエンス株式会社から購入した。 ATP (adenosine triphosphate)、ADP、AMP、GTP (guanosine triphosphate)はSigma社から購入した。
【0075】
本実施例で用いたDNA類の配列は以下の通りある。
【0076】
【化2】

【0077】
・ATP存在下での蛍光性基質ECFを用いたAP活性測定
1) 5×SSCT緩衝液(クエン酸ナトリウム500 mM、NaCl 750 mM、tween 0.05 v/v%、pH 7)でアビジン被覆ブラックマイクロプレートの各wellをprewashした。
2) 5×SSC緩衝液を用いてビオチン化DNA溶液 0.5 μMを調製し 、各wellに100 μlロードして一時間室温で放置した。
3) 5×SSCT緩衝液で、フリーのビオチン化DNAを洗い流した。
4) DNAアプタマー溶液 0.1 mM、0.5 μlと5×SSC緩衝液99.5 μlを加えて調製した100 μlの水溶液 を各wellにロードして一時間室温で放置した。
5) 5×SSCT緩衝液で、フリーのDNAアプタマーを洗い流した。
6) 5×SSC緩衝液を用いて各小分子溶液を1 mM、48 μl調製したのち、各wellにロードして一時間室温で放置した。
7) 洗浄操作を行わずに、調製したAP-DNA複合体溶液 2 μlを各wellにロードして一時間室温で放置した。
8) 5×SSCT緩衝液で、フリーのAP-DNA複合体を洗い流した。
9) ECFの原液をTris-HCl緩衝液(pH 8、1 M)で10倍希釈し、この調製した溶液を各wellに100 μlロードし、一時間室温で反応を行った。
10) 蛍光イメージャーで各wellの蛍光測定を行った。
【0078】
結果:
結果を図9に示した。ATPに応答したAPシグナルの変化が観察された。AP-DNA複合体が図7に示す概念に基づき、小分子検出のための分子素子として利用可能なことが明らかとなった。また、この系においては、検出限界が1mMであることが明らかとなった。
【0079】
〔実施例6:AP-DNA複合体形成に関するpHの影響〕
NK6-AP又はCK6-APとZ-QG-DNAの複合体の形成を、種々のpHにおいて行った。
方法:
以下の条件で、反応した。
・CK6-AP又はNK6-AP : 2.8 μM
・Z-QG-DNA : 44 μM
・MTG : 1.1 U/ml
・Buffer : 50 mM MES pH 5.5-7.0
・Buffer : 50 mM Tris-HCl pH 7.0-8.0
・Temp 25℃
・Time 24 hour
反応産物は、そのままSDS-PAGEに供した。
【0080】
結果:
結果を下表及び図10に示した。CK6-AP、NK6-APとも、pH5.5〜8.0においてZ-QG-DNAとの反応が十分に進み、AP-DNA複合体を得ることができた。
【0081】
【表1】

【0082】
NK6-AP又はCK6-APとZ-QG-DNAとの連結においては、pH依存性が通常の溶液系とは異なり、低pHで収率が向上する傾向が見られた。
APはダイマーであり、SDS-PAGEから上記に示すように、約50%以上の収率で複合体が得られていることから、少なくともダイマーあたり1つのDNAが連結しているものと予想された。
【0083】
〔実施例7:タンパク質過剰の条件下でのNK6-APとDNAとの連結〕
予想されているMTGの触媒反応から、ここでの連結反応はMTG活性中心であるシステイン(Cys)残基の、Z-QG-DNAのGlnへの求核置換反応によるアシル−酵素複合体の形成と、続いて起こるタンパク質のLysによるアシル−酵素複合体への求核置換反応によるMTGの脱離、の2段階で進行すると予想される。
【0084】
上述の通り、タンパク質濃度に対し15倍以上のZ-QG-DNA濃度においても、反応率は50〜60%にまでしか到達しないことから、この反応の律速段階は2段階目であると予想される。そこでタンパク質としてNK6-APを用い、NK6-AP過剰の条件下での連結反応による反応効率の向上を試みた。
【0085】
方法:
以下の条件で反応した。
・NK6-AP(実施例1で調製したもの) : 0〜16 μM
・Z-QG-DNA(実施例1で調製したもの DNAは24 mer) : 1.6 μM
・MTG : 1.1 U/ml
・Buffer : 50 mM Tris-HCl pH 7.0
・Temp 25℃
・Time 0〜12 hour
【0086】
結果:
結果を図11に示した。Z-QG-DNA濃度に対し5倍以上のNK6-AP濃度にすることにより、12時間後において反応率(AP-DNA複合体に転化したZ-QG-DNAの割合)は95%以上に達した。またZ-QG-DNA濃度に対し、5倍のNK6-AP濃度の条件下において、連結反応率の時間変化測定を行ったところ、3時間でほぼ反応が完結することが明らかとなった(図12)。
この実施例で得られたNK6-AP-DNA複合体反応溶液には、遊離のZ-QG-DNAがほとんど存在せず、競合的なハイブリダイゼーションがないため、実施例4のように反応後に溶液をHis-tag精製することなく、直接核酸部位選択的な固定化へと利用できると考えられる。
【0087】
なお、充分な反応率を得るには、Z-QG-DNA に対する NK6-AP のモル濃度比が2以上であることが好ましく、必要であると考えられ、また、Z-QG-DNAの濃度は、1 μM 以上が好ましいと考えられた。
【0088】
〔実施例8:複合体の精製を必要としない核酸部位選択的なタンパク質固定化〕
複合体を精製せずに、核酸部位選択的なタンパク質固定化に用いた。また、新たなコントロール実験として、非相補鎖DNAを提示したプレートへのNK6-AP-DNA複合体の固定化も試みた。
【0089】
方法:
実験は、下記の手順にしたがって行った。
1)アビジンコートされた96-wellプレートを、TBST (25mM Tris, 2.7mM KCl, 0.137M NaCl, 0.05 vol% Tween20)でprewashした。
2)100 μLの500 nM biotin-cDNA(実施例4で用いたものと同じ。)、またはbiotin-non-cDNA(DNA部分の配列は 5'-biotin-(CH2)6-ACC CTT CCT C-3'(配列番号:27))それぞれをTBSに溶解して加え、1時間インキュベートした後、TBSTで洗浄した。
3)実施例7における反応溶液(5倍のNK6-AP濃度の条件下において、3時間反応を行ったもの)を2000倍希釈したものを100 μL加え、1時間インキュベートした後、TBSTで洗浄した。
4)ECF基質(アマシャム バイオサイエンス株式会社)を加えた。
5)AP活性を、FX-Pro molecular imager(Bio-Rad)で検出した(Ex 430 nm/Em 560 nm)。
【0090】
結果:
結果を図13に示した。相補鎖を固定化したウェルにのみAP活性が検出されたことから、反応溶液を精製することなく、NK6-AP-Z-QG-DNAを固定化可能であることが明らかであった。また非相補鎖には固定化されないことが明らかとなった。
【図面の簡単な説明】
【0091】
【図1】図1は、Z-QG-DNAの調製スキームを示した図である。
【図2】図2は、CK6-AP又はNK6-APとZ-QC-DNAとから、MTGを用いて複合体を調製した実験の結果を示した写真である(実施例1)。
【図3】図3は、複合体形成実験に関し、反応(NK6-AP(pH7.0))前後におけるAP活性を比較したグラフである(実施例1)。
【図4】図4は、APの代わりにEGFP又はGSTを同様に用いて、DNAとの複合体を調製した実験の結果を示した写真である(実施例2)。
【図5】図5は、異なる長さのZ-QC-DNAとNK6-APとの複合体を調製した実験の結果を示した写真である(実施例3)。
【図6】図6は、AP-DNA複合体の固定化の概念を示した図である。
【図7】図7は、DNAハイブリダイゼーションを利用するタンパク質の固定化の概念図、及びそれに関する実験の結果を示した写真からなる。
【図8】図8は、DNAアプタマーとAP-DNA複合体とを組み合わせた小分子(ATP)検出を示した図である。
【図9】図9は、41merのアプタマーを用いたATP検出実験に関し、ATP濃度と蛍光強度との関係を示したグラフである。
【図10】図10は、CK6-AP又はNK6-APとZ-QC-DNAとからMTGを用いて複合体を調製する際のpHの与える影響を検討した実験の結果を示した写真である。AはCK6-AP、BはNK6-APについての結果を示す。
【図11】図11は、タンパク質過剰の条件下で、NK6-APとZ-QC-DNAとから、MTGを用いて複合体を調製した実験の反応効率を示したグラフである(実施例7)。
【図12】図12は、Z-QG-DNA濃度に対し5倍のNK6-AP濃度の条件下において、連結反応率の時間変化測定を行った結果のグラフである(実施例7)。
【図13】図13は、複合体の精製を必要としない核酸部位選択的な固定化タンパク質固定化の実験の結果を示した写真である(実施例8)。
【技術分野】
【0001】
本発明は、タンパク質の部位特異的な修飾方法に関する。より詳細には、トランスグルタミナーゼを用いて、タンパク質に部位特異的に核酸を連結する方法に関する。本発明は、in situ ハイブリダイゼーション、DNA/プロテインチップ、バイオセンサーに応用可能である。
【背景技術】
【0002】
タンパク質に何らかの修飾を施すことにより、タンパク質機能の向上や、天然にはない機能を付与することが可能になる。有機分子により修飾を施されたタンパク質は、タンパク質ハイブリッドと呼ばれる。特に、高分子−タンパク質ハイブリッドの利用価値は高く、工・医・薬学の幅広い分野で利用されている。これまでに、酵素やタンパク質の安定化を目的としてポリエチレングリコール(PEG)による修飾が盛んに検討されてきた。
【0003】
最近、核酸(DNA or PNA or RNA)-タンパク質ハイブリッドに注目が集まっている。なぜなら、核酸の配列依存的な相補性により、タンパク質に無限の組み合わせの分子認識能を付与することが可能なためである。実際、DNAチップをベースとしたproteinチップ(非特許文献1)や、DNA-タンパク質ハイブリッドとPCR法と組み合わせた高感度検出系(非特許文献2)の構築等が報告されている。しかしながら、DNA-タンパク質ハイブリッドの調製はそれほど容易ではない。タンパク質にCys残基が存在する場合は、チオール基間のジスルフィド結合や、チオール−マレイミド間の選択的な化学修飾反応が検討されてきたが、前者では結合の安定性、後者では対象タンパク質に唯一のCys残基がタンパク質表面に露出して存在しない限り反応特異性の面で不十分である。したがって、タンパク質にDNAを安定かつ部位特異的に導入するための修飾法の確立が望まれている。
【0004】
これを達成する最も有力な手段として、これまでにexpressed protein ligation(EPL)技術を利用する手法が提案されている(PNA-protein conjugateについて非特許文献3及びDNA-protein conjugateについて、非特許文献4)。EPL技術を利用すれば、タンパク質の特定部位に、共有結合的にDNAを導入することが可能である。しかしながら、この方法は、目的タンパク質をインテインとの融合タンパク質として調製しなければならないこと、修飾部位がC末端に限定されること、導入するDNAにCys残基を導入する必要があること、といった制限がある。
【0005】
また、タンパク質とDNAのハイブリッド化に酵素トランスグルタミナーゼ(TGase)を利用する試みもある。TGaseは、ペプチドやタンパク質中のGln残基側鎖とLys残基側鎖のε-アミノ基又は第1級アミンとの間を共有結合で架橋する反応を触媒する。TGaseを使ってタンパク質DNAハイブリッドを調製する場合、タンパク質側のGln残基とLys残基とのいずれをターゲットとするかで、ハイブリッド化する有機分子のデザインが異なる。これまで、タンパク質とポリリシン、タンパク質とPEG、又はタンパク質と分岐型糖鎖とのハイブリッド化等が検討されてきた(特許文献1及び非特許文献5〜8)。これらのケースでは、ポリリシン又はアミノ化PEG若しくはアミノ化糖鎖が、タンパク質側のTGase活性なGln残基との架橋が試みられた。また、TGaseに関しては、カルボベンゾイル-L-グルタミルグリシン(Z-QG)がグルタミン残基を供与する良基質として知られている(先行技術文献9〜11)ほか、TGaseに対してグルタミン供与体となりうる基質のアミノ酸配列に関連した報告がある(前掲先行技術文献6、並びに先行技術文献12〜14)。
【0006】
一方、本発明者らはTGaseの工学的応用について研究してきたが、TGaseに対しLys残基を供与し、良基質として働くMKHKGS(非特許文献15及び16)、GSGMKETAAARFERAHMDSGS(改変型S-peptide:非特許文献17)、MGGSTKHKIPGGS(非特許文献18)、N末端トリ又はペンタグリシン(N-terminal GGG or N-terminal GGGGG:非特許文献19)といったタグを見いだしている。
【先行技術文献】
【0007】
【特許文献1】特開平8-89278号公報
【非特許文献1】Angew. Chem. Int. Ed., 44, 7635, 2005
【非特許文献2】Nature Methods, 2, 31, 2005
【非特許文献3】Chem. Commun., 822, 2003
【非特許文献4】Bioorg. Med, Chem, Lett., 14, 2407, 2004
【非特許文献5】Biochemistry, 35, 13072, 1996
【非特許文献6】Bioconjugate Chem., 11, 502, 2000
【非特許文献7】Bioconjugate Chem., 12, 701, 2001
【非特許文献8】J. Am. Chem. Soc., 126, 14013, 2004
【非特許文献9】J. Biol. Chem., 240, 2951-2960, 1965
【非特許文献10】Agric. Biol. Chem., 53, 2613-2617, 1989
【非特許文献11】Analytical Biochemistry, 249, 54-60, 1997
【非特許文献12】Biosci. Biotechnol. Biochem., 64, 2608-2613, 2000
【非特許文献13】J. Am. Chem. Soc., 128, 4542-4543, 2006
【非特許文献14】Analytical Biochemistry, 281, 68-76, 2000
【非特許文献15】Biomacromolecules, 6, 35, 2005
【非特許文献16】Biomacromolecules, 6, 2299, 2005
【非特許文献17】Bioconjugate Chem., 15, 491-497, 2004
【非特許文献18】Biotechnol. Bioeng., 86, 399-404
【非特許文献19】FEBS Lett., 579, 2092-2096, 2005
【発明の開示】
【0008】
本発明者らは、TGaseを使ってタンパク質DNAハイブリッドを調製するに際し、まずアミノ化DNAを用いることとした。そして、TGase活性なGln残基を有するタンパク質として、TGaseの良基質であるジメチルカゼインを選択し、アミノ化DNAとのハイブリッド化を試みたが、架橋化反応は進行しなかった。詳細な理由は不明であるが、ポリアニオンであるDNAがTGase反応におけるカチオン性アミノ基の反応性を低下させている可能性がある。
【0009】
そこで発想を転換し、MTGの良基質として知られるジペプチドZ-Gln-Gly(Z-QG)のカルボキシル基を活性エステル(NHS)化し、これをアミノ化DNAと縮合することで、TGase活性なGln残基を有するDNA(Z-QG-DNA)を合成した(図1)。
【0010】
次に、TGase活性なLys残基を有するNK6-AP(MKHKGS配列をN末端に有するアルカリホスファターゼ)とZ-QG-DNAとを混合し、TGase反応に供したところ、NK6-APとZ-QG-DNAのハイブリッド化が可能なことが明らかとなった(図2)。また、ハイブリッド化前後でAPの酵素活性は充分に保持されており、DNAが目的タンパク質(NK6-AP)のペプチドタグ選択的に導入されていることが明らかとなった。さらに、MKHKGS配列をC末端に有するアルカリホスファターゼ、MKHKGS配列をN末端に有する緑色蛍光タンパク質(EGFP)及びグルタチオン-S-トランスフェラーゼ(GST)についても、同様の操作によりDNAとのハイブリッド化が可能なことを確認し、本発明を完成した。
【0011】
I. 複合体、複合体の形成方法、複合体の製造方法:
本発明は、トランスグルタミナーゼ(TGase)を用いて、ペプチド又はタンパク質へ部位特異的に外来分子を連結する方法であって:分子が、アニオン性であり、かつTGaseが認識可能なグルタミン(Gln)残基を有し;そして、ペプチド又はタンパク質が、TGaseが認識可能なリシン(Lys)残基又は第1級アミンを有するものである、前記方法を提供する。また、本発明は、トランスグルタミナーゼ(TGase)を用いて、ペプチド又はタンパク質へ部位特異的に外来分子を連結する方法であって:
ペプチド又はタンパク質が、TGaseが認識可能なリシン(Lys)残基又は第1級アミンを有するものであり、そして
分子が、アニオン性であり、かつTGaseが認識可能なグルタミン(Gln)残基を有するものである、前記方法を提供する。
【0012】
本発明において用いることのできる、タンパク質又はペプチドに組み込まれる外来分子は、アニオン性の分子である。本明細書で「アニオン性分子」というときは、溶液中でアニオンとしての性質を有するものであり、これには、核酸が含まれる。核酸には、DNA、PNA又はRNAが含まれる。アニオン性分子の好ましい例は核酸である。核酸の配列及び長さには特に制限はない。長さに関しては、40mer程度であれば、本発明に充分に用いることができることが確認されている(実施例参照)。
【0013】
本発明においては、アニオン性分子は、用いるTGaseが認識可能なGln残基を有する。アニオン性分子が核酸である場合、該核酸は、5’末端、又は3’末端またはそれ以外の所望の部分に、必要に応じスペーサーを介して、TGaseが認識可能なGln残基が結合したものである。
【0014】
TGaseが認識可能なGln残基は、カルボベンゾイル-L-グルタミルグリシン(Z-QG)として存在することが好ましい。また、微生物由来TGaseの良基質として、LLQG(配列番号:1)、LAQG(配列番号:2)、LGQG(配列番号:3)、PLAQSH(配列番号:4)、FERQHMDS(配列番号:5)、若しくはTEQKLISEEDL(配列番号:6)のアミノ酸配列からなるペプチド、又はGLGQGGG(配列番号:7)、GFGQGGG(配列番号:8)、GVGQGGG(配列番号:9)、若しくはGGLQGGG(配列番号:10)のアミノ酸配列からなるペプチドが知られている。また、guinea pig liver由来のTGaseの良基質として、カルボベンゾイル-L-グルタミルフェニルアラニン(Z-QF)、又はEAQQIVM(配列番号:11)のアミノ酸配列からなるペプチド、又はGGGQLGG(配列番号:12)、GGGQVGG(配列番号:13)、GGGQRGG(配列番号:14)、GQQQLG(配列番号:15)、PNPQLPF(配列番号:16)若しくはPKPQQFM(配列番号:17)のアミノ酸配列からなるペプチドが知られている。TGaseが認識可能なGln残基は、用いるTGaseの種類に応じ、このようなペプチドとして存在してもよい。
【0015】
なお、N末端がグリシン(G)である基質ペプチドは、N末端アミノ基がTGaseの基質になりうるため、自己架橋による副産物が生じうる。したがって、N末端がグリシン(G)である基質ペプチドについては、N末端アミノ基の水素を適切な基で置換することによりTGaseの基質とはならないように保護して、所望の連結を行うことができるようにするとよい。なお、本明細書において「N末端保護」というときは、特別な場合を除き、このような意味で用いている。そして、N末端保護の手段により、反応性が異なることが知られている。詳細には、ほ乳類由来TGaseに関して、GQQQLGのN末アセチル化による保護(即ち、Ac-GQQQLG)、またN末端アミノ酸をDOPA(L-3,4-dihydroxyphenylalanine)にする(即ち、DOPA-GQQQLG)と反応性が向上することが知られている。このような保護の例を、本発明においても利用することができる。
【0016】
TGaseが認識可能なGln残基を有するアニオン性分子は、TGaseが認識可能なGln残基を有する上述のようなペプチドを所望の分子(例えば、核酸)に結合することにより調製することができる。ペプチドは、用いるTGaseによって、良く認識されるものを選択することが好ましく、また、できるだけ短いものを選択することが好ましい場合がある。また、上述以外に、種々ペプチドを選択しうるが、そのアミノ配列中にTGaseが認識可能なLys残基又は第1級アミンが共存しないようなものを選択することが好ましい。共存する場合には、TGaseにより、自己架橋する可能性があり、目的のタンパク質(又はペプチド)−核酸複合体の収率に好ましくない影響を与える場合があるからである。
【0017】
微生物由来のTGase(「MTGase」又は「MTG」のように記載される場合がある。)を用いる場合、TGaseが認識可能なGln残基は、Z-QGとして存在することが好ましい。TGaseが認識可能なGln残基を有するDNAであって、該Gln残基がZ-QGをとして存在するもの、すなわちZ-QG−DNAの調製方法の例としては、次のようなものがある:NH2-(CH2)6-等を末端に付加することによりアミノ化した所望の塩基配列を有するDNAを準備し、一方、Z-QGは、下記のようにNHSで活性化しておく。
【0018】
【化1】

【0019】
そして、アミノ化DNAと活性エステル化Z-QGとを縮合することで、Z-QG−DNAを得ることができる。精製は、ゲル濾過カラムで行うことができ、同定は、TOF-MSで行うことができる。また、HPLCで、生成物の確認及び収率を求めることができる。
【0020】
また、C末端のカルボキシル基を活性エステル化する上述の方法に加えて、TGaseが認識可能なGln残基を有するペプチドをDNAに導入する方法として、アミノ基と反応性の高い官能基をペプチドに導入する方法がある。例えば、アルデヒド化、アシルアジド化、スルフォニルクロライド化、エポキシ化、イソシアネート化、又はイソチオシアネート化した基質ペプチドを調製できれば、これをアミノ化DNAと反応させることにより、TGaseが認識可能なGln残基を有するDNAを調製することができる。但し、これらの反応性官能基は、基質ペプチドにおいてTGase認識に影響がない部分に導入する必要がある。したがって、上述のように、Gln残基とは離れたC末端のカルボキシル基を活性化する方法は、この目的において最も優れたものの一つである。TGaseの反応に影響がなければ、グルタミン酸やアスパラギン酸のカルボキシル基を活性化することにより、アミノ化DNAと反応させてもよい
。
【0021】
本発明においては、アニオン性分子により修飾されるペプチド又はタンパク質は、用いるTGaseが認識可能なLys残基又は第1級アミンを有する。なお、本明細書では、タンパク質を例に説明することがあるが、その説明は、特別な場合を除き、ペプチドにも当てはまる。本明細書では、Lys残基を例に説明することがあるが、その説明は、特別な場合を除き、第1級アミンにも当てはまる。
【0022】
TGaseに対し、Lys残基(又は第1級アミン)供与体となる基質は、Gln残基供与体となる基質に比較して構造的な制約が少ないと考えられる。したがって、修飾しようとするタンパク質(又はペプチド)が、TGaseが認識可能なLys残基を元来有している場合もあり、そのような場合は、新たにTGaseが認識可能なLys残基を含むタグをタンパク質に付加しなくてもよい場合がある。
【0023】
一方、TGaseが認識可能なLys残基(K)は、MKHKGS(配列番号:18)のアミノ酸配列を有するペプチドとして存在してもよい。このようなTGaseが認識可能なLys残基を含むペプチドによるタグ化は、アニオン性分子を、タンパク質の所望の部位、例えばC末端又はN末端に連結する目的で用いてもよい。TGaseが認識可能なLys残基を含む他のペプチド又はそのアミノ酸配列の例としては、改変型S-peptide(GSGMKETAAARFERAHMDSGS(配列番号:19))、MGGSTKHKIPGGS(配列番号:20)、N末端グリシン(N-terminal GGG、N-terminal GGGGG(配列番号:21))、N末端MKHKGSと対象タンパク質間のリンカー部位を伸ばしたMKHKGSGGGSGGGS(配列番号:22)がある。
【0024】
C末端又はN末端にTGaseが認識可能なLys残基を含むペプチドを付加したタンパク質は、遺伝子工学的な手法を用いて、組換えタンパク質として調製することができる。C末端又はN末端にTGaseの基質ペプチドタグが導入された当該組換えタンパク質の精製は、それぞれN末端又はC末端に付加した(His)6-tagを利用し(TGaseの反応性の低下を回避するために、基質ペプチドタグを入れた末端とは異なる末端にHis-tagを入れるようにデザインするとよい。)、ゲル濾過カラムにより行うことができ、またアミノ酸配列の確認は当該タンパク質をコードするプラスミドベクターの遺伝子配列をDNAシーケンサーにて確認するか、N末端に導入された基質ペプチドについてはN末端分析により直接同定することができる。タンパク質の精製の確認は SDS-PAGE で行うことができる。
【0025】
ペプチド又はタンパク質の好ましい例は、容易に検出可能な性質を有するものであり、例えばアルカリホスファターゼ(AP)、緑色蛍光タンパク質(GFP)、グルタチオン-S-トランスフェラーゼ(GST)、ルシフェラーゼ、ペルオキシダーゼ、抗体エピトープ配列を含むペプチド及びビオチン等である。ペプチドタグが容易に導入可能との観点からは、遺伝子工学的に製造可能なタンパク質が好ましい。
【0026】
本発明においては、トランスグルタミナーゼ(TGase)として、種々のものを用いうる。現在、TGaseとして、哺乳類(guinea pig、ヒト)、無脊椎動物(昆虫、カブトガニ、ウニ)、植物、菌類、原生生物(粘菌)由来のものが知られており、またヒトの場合については、8種類のアイソザイムが見つかっている。本発明において用いることのできるTGaseの好ましい例は、微生物由来のものである。
【0027】
本発明のTGaseを用いたタンパク質への部位特異的な外来分子の連結方法の、最も好ましい態様の一つは、微生物由来のTGase、Z-QG及びMKHKGSを組み合わせて用いるものである。
【0028】
本発明においてMTGを用いた場合、予想されているMTGの触媒反応から、Lys残基を有するタンパク質又はペプチドとZ-QG-DNAとの連結反応は、MTG活性中心であるシステイン(Cys)残基の、Z-QG-DNAのGlnへの求核置換反応によるアシル−酵素複合体の形成と、続いて起こるタンパク質のLysによるアシル−酵素複合体への求核置換反応によるMTGの脱離、の2段階で進行すると予想される。
本発明者らの検討によると、タンパク質濃度に対し15倍以上のZ-QG-DNA濃度とした場合においても、反応率(ペプチド又はタンパク質−核酸複合体に転化した、TGaseが認識可能なLys残基又は1級アミンを有するペプチド又はタンパク質の割合。例えば、AP-DNA複合体に転化したNK6-APの割合。)は50〜60%にまでしか到達しないことから、この反応の律速段階は2段階目であると予想された。そこでタンパク質としてNK6-APを用い、NK6-AP過剰の条件下での連結反応による反応効率の向上を試みたところ、充分に高い(例えば80%以上、好ましくは95%以上の)反応率を得るには、Z-QG-DNAに対するNK6-APの濃度比が2以上であることが好ましいことが分かった(実施例7参照)。また、Z-QG-DNAの濃度は、おそらく1μM以上であることが好ましいと思われた。
【0029】
したがって、本発明の好ましい態様においては、TGaseが認識可能なGln残基を有するアニオン性分子に対する、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質のモル濃度比は、好ましくは2以上であり、より好ましくは5以上である。なお、本明細書で単に「濃度比」というときは、特別な場合を除き、モル濃度による比を指す。Z-QG-DNAに対するNK6-APのモル濃度比は、[NK6-AP]/[Z-QG-DNA]と表すこともできる。
【0030】
また、本明細書の実施例のように、TGaseとしてMTGを用いて連結反応を行う場合には、上述のようにモル濃度比が適切な範囲となるようにすることに加えて、pH5.5〜8.0、温度4〜50℃(例えば、室温)で行うことが好ましい。このようにすれは、12時間以内、好ましくは6時間以内、より好ましくは3時間以内に、充分に高い反応率が達成可能である(実施例7参照)。
【0031】
このような高い反応率が達成できる方法により得られたペプチド又はタンパク質−核酸複合体溶液には、未反応のアニオン性分子(例えば、遊離のZ-QG-DNA)がほとんど存在せず、以下で詳述する、ペプチド又はタンパク質の固定化、又は標的分子の検出にそのまま用いたとしても、複合体と未反応分子との競合が実質的に生じないか、生じたとしても目的とする固定化又は検出の結果には実質的な影響を与えないほど少ないと考えられる。したがって、複合体溶液を精製することなく、直接固定化又は検出へと利用できるメリットがある(実施例8参照)。
【0032】
本発明以前に、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質とTGaseが認識可能なGln残基を有する外来分子とをTGaseを用いて連結することにより、タンパク質複合体を得る手段は存在しなかった。したがって、本発明の方法により連結された複合体は、物質として新規なものということができる。
【0033】
よって本発明はまた、以下のものも提供する:
(3)TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られる、ペプチド又はタンパク質−核酸複合体。
【0034】
本明細書において、本発明の複合体に関連して、「TGaseにより連結する」というときは、特別な場合を除き、得られる連結部は、Lys残基とGln残基とが、ε(γ-グルタミル)リシン結合を形成することにより構成されている。
【0035】
本発明の複合体は、好ましい態様においては、TGaseが認識可能なLys残基を有するペプチド又はタンパク質と、Z-QG、又はLLQG、LAQG、LGQG、PLAQSH、FERQHMDS、若しくはTEQKLISEEDLのアミノ酸配列からなるペプチド、又はGLGQGGG、GFGQGGG、GVGQGGG、若しくはGGLQGGGのアミノ酸配列からなる、N末端保護ペプチド(好ましくは、N末端がアセチル基又はL-3,4-ジヒドロキシルフェニルアラニル基で保護されたペプチド)、又はZ-QF、又はEAQQIVMのアミノ酸配列からなるペプチド、又はGGGQLGG、GGGQVGG、GGGQRGG、GQQQLG、PNPQLPF若しくはPKPQQFMのアミノ酸配列からなる、N末端保護ペプチド(好ましくは、N末端がアセチル基又はL-3,4-ジヒドロキシルフェニルアラニル基で保護されたペプチド)を有する核酸とが、ε(γ-グルタミル)リシン結合で連結した構造からなる。
【0036】
なお、guinea pig liver TGase について、EAQQIVM については、Q3 >> Q4 という報告がある(Anal. Biochem., 281, 68, 2000)。但し、Factor XIIIa では、EAQQIVM においてはQ3が優先的に反応しうる。また、PKPQQFM については、Q4 >> Q5 という報告がある(Biochemistry, 35, 13072, 1996)。また、EAQQIVM については、コア配列と考えられるAQQIV部分のみを用いることも有用であろう。
【0037】
ペプチド又はタンパク質の好ましい例は、容易に検出可能な性質を有するものであり、例えばAP、GFP、GST、ルシフェラーゼ、ペルオキシダーゼ、抗体エピトープ配列を含むペプチド及びビオチン等である。ペプチドタグが容易に導入可能との観点からは、遺伝子工学的に製造可能なタンパク質が好ましい。ペプチド又はタンパク質におけるTGaseが認識可能なLys残基(K)は、MKHKGSのアミノ酸配列を有するペプチドとして存在してもよい。このようなTGaseが認識可能なLys残基を含むペプチドタグは、ペプチド又はタンパク質の所望の部位、例えばC末端又はN末端に付加することができる。TGaseが認識可能なLys残基を含む他のペプチド又はそのアミノ酸配列の例としては、改変型S-peptide(GSGMKETAAARFERAHMDSGS)、MGGSTKHKIPGGS、N末端グリシン(N-terminal GGG、N-terminal GGGGG)、N末端MKHKGSと対象タンパク質間のリンカー部位を伸ばしたMKHKGSGGGSGGGSがある。
【0038】
複合体の好ましい態様の一つは、CK6-APとZ-QG-DNAとの複合体及びNK6-APとZ-QG-DNAとの複合体である。このような複合体は、安定な酵素であるAPと、安定な分子であるDNAが、アミド結合という安定な共有結合で連結されているため、複合体全体としても安定性であるというメリットがある。
【0039】
本発明の複合体の形成方法は、対象となるペプチド又はタンパク質を、部位特異的に外来分子で修飾することにより、複合体を形成させるものであるが、従来法に比較して、以下の特徴及びメリットを有する:
・対象タンパク質は、TGaseが認識可能なLys残基又は第1級アミンを有する天然タンパク質、TGaseが認識可能なLys残基又は第1級アミンを導入することができるあらゆるタンパク質を包含する。また、インテインのような大きなタンパク質性タグを必要としない。
・タンパク質の修飾部位は、C末端に限定されない。TGase活性なLys残基が存在するか、そのようなLys残基を有するタグを導入することができる部位であれば、修飾可能である
。C末端、N末端に加え、loop領域のようなタンパク質構造中の揺らぎの大きな部位も修飾対象となりうる。
・外来分子として核酸を選択する場合、その塩基配列及び長さには、特に制限がない。
【0040】
本発明の複合体、複合体の形成方法、複合体の製造方法は、DNAチップをベースとしたプロテインチップ開発、DNAチップのハイブリダイゼーション検出用高感度分子プローブ、in situ ハイブリダイゼーションのための分子プローブ(特にAP-DNA)、(機能性)DNAとのハイブリッド化による分子センサーの構築、アンチセンスオリゴDNAとのハイブリッド化による創薬に応用可能である。
【0041】
II. 複合体の利用:
本発明はまた、以下のものも提供する:
(4)ペプチド又はタンパク質の基材表面への固定化方法であって、
a) 基材表面に固定化された核酸、
b) ペプチド又はタンパク質−核酸複合体であって、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られるものであり;さらに核酸部分が、固定化核酸の有する塩基配列の全部又は一部に相補的な核酸配列を有するものである、前記ペプチド又はタンパク質−核酸複合体
を用い、
固定化核酸と、ペプチド又はタンパク質−核酸複合体の核酸部分とを、ハイブリダイズさせて固定化物を形成する工程を含むものである、前記固定化方法。
(5)ペプチド又はタンパク質の基材表面への固定化物の製造方法であって:
基材表面に予め固定化されている核酸と、ペプチド又はタンパク質−核酸複合体の核酸部分とを、ハイブリダイズさせて固定化物を形成する工程を含み、
ペプチド又はタンパク質−核酸複合体が、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られるペプチド又はタンパク質−核酸複合体である、前記製造方法。
【0042】
本発明のこれらの方法における基材表面への核酸の固定化のためには、従来技術、例えばDNAマイクロアレイ等を調製する際に用いられる技術を適用することができる。「基材」は、ガラス、シリコンなどのプラスチック製の、チップ、ビーズ、ウェル、プレート等の形態とすることができ、核酸は、従来技術を用いて、基材表面に非共有結合(静電結合)的に、又は共有結合で固定することができる。あらかじめ調製した核酸を基板に固定化してもよく、基板上で直接核酸を合成してもよい。簡便には、アビジンで被覆された市販のプレートを用い、ビオチン化した所望のDNAを固定することができる。
【0043】
本発明のこれらの方法において、ペプチド又はタンパク質−核酸複合体として、これまで述べてきたような本発明の複合体が用いられるが、そのペプチド又はタンパク質部分は、目的に応じ、種々の性質・構造のものとすることができる。また、その核酸部分は、固定化核酸の有する塩基配列の全部又は一部に相補的な核酸配列を有するものとする。
【0044】
本発明のこれらの方法においては、固定化核酸と、ペプチド又はタンパク質−核酸複合体の核酸部分とを、ハイブリダイズさせることにより固定化する。ハイブリダイズのための条件は、当業者であれば、用いる核酸部分の長さ・塩基配列等に応じて、適宜設計することができる。本発明のこれらの方法については、実施例4及び8、並びに図6、7及び13を参照することができる。なお、本発明者らは、上述したように、複合体連結反応溶液を精製することなく、直接固定化に利用できることを確認しており、また、ペプチド又はタンパク質−核酸複合体は、相補的な塩基配列を有する固定化核酸にはハイブリダイズするが、非相補的な塩基配列を有する固定化核酸にはハイブリダイズしないことも確認している。
【0045】
本発明はまた、以下のものも提供する:
(6)標的分子の検出方法であって:
ペプチド又はタンパク質−核酸複合体であって、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られるものであり;さらにペプチド又はタンパク質
部分が容易に検出可能な性質を有し、かつ核酸部分が標的分子に特異的に結合可能な塩基配列を有するものである、前記ペプチド又はタンパク質−核酸複合体を準備し;そして
対象物中に存在する標的分子と複合体とを核酸部分により特異的に結合させ;そして
結合している複合体を、ペプチド又はタンパク質部分により検出する工程を含む、前記検出方法。
【0046】
本発明の検出方法は、標的物質の定性、定量、識別、染色、局在化の調査等の目的で用いることができる。
本発明のこの方法においては、ペプチド又はタンパク質−核酸複合体として、本発明の複合体が用いられるが、また、核酸部分は、標的分子に特異的に結合可能な核酸配列を有するものとする。ペプチド又はタンパク質部分は、容易に検出可能な性質を有するものであり、好ましい例は、アルカリホスファターゼ(AP)、緑色蛍光タンパク質(GFP)、グルタチオン-S-トランスフェラーゼ(GST)、ルシフェラーゼ、ペルオキシダーゼ、抗体エピトープ配列を含むペプチド及びビオチン等である。ペプチドタグが容易に導入可能との観点からは、遺伝子工学的に製造可能なタンパク質が好ましい。この方法において、標的分子は、核酸、比較的低分子の有機化合物(ATP)、タンパク質、ペプチド、金属イオン、複雑な構造を持つ多量体、ウイルス等でありうる。検出対象は、DNA転写膜、又は細胞若しくは個体組織切片等である。
【0047】
本発明の検出方法は、標的核酸分子の検出方法として特に有用である。すなわち、標的分子が核酸であり、複合体の核酸部分が標的核酸分子の配列の全部又は一部と相補的な配列を有するものであり、標的核酸分子と複合体の核酸部分とをハイブリダイズさせることにより特異的に結合させる工程を含むものは、本発明の検出方法の特に好ましい実施態様の一つである。
【0048】
この態様において、検出対象は、(1)DNA転写膜、又は(2)細胞若しくは個体組織切片等である。 (1)の場合、標的核酸はPCRにより増幅されたDNA又はゲノム断片DNA、であり(2)の場合、標的核酸は細胞又は個体組織中に含まれる核酸(mRNA又はDNA)となる。この方法は、従来法、例えばジゴキシゲニン(DIG)標識化プローブを用いる方法に比較して、種々の点で優れている。例えば、DIG法では、プローブのDIG修飾及び標識化された抗DIG抗体が必要であり、それに伴う煩雑な洗浄操作が必要となるが、本発明の複合体(例えば、Z-QG-DNA-AP)を用いれば、DIG標識化プローブ及び標識化抗DIG抗体が不要になるため、試薬、手間及び時間を大幅に削減することが可能となる。
【0049】
なお、TGaseを使うと、ペプチドタグを介して組換え酵素どうしを架橋化した酵素ポリマーの調製も可能となる。したがって、酵素ポリマーを得て、それと核酸を連結することで、1つの認識部位(核酸)に対して複数のシグナル増幅部位(酵素)を配置することが可能となる。このような改変により、さらに検出感度の向上が可能になると思われる。
【0050】
本発明はまた、以下のものも提供する:
(7)標的分子の検出方法であって:
標的分子の検出方法であって:
a) 基材表面に固定化された核酸、
b) 固定化核酸の全部又は一部に相補的な配列(固定化核酸相補的配列)、及び標的分子に特異性的に結合可能な配列(標的分子特異的配列)を有するアプタマー核酸、並びに
c) ペプチド又はタンパク質−核酸複合体であって、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られるものであり;さらにペプチド又はタンパク質部分が容易に検出可能な性質を有し、かつ核酸部分がアプタマー核酸の標的分子特異的配列の全部又は一部に相補的な配列を有するものである、前記ペプチド又はタンパク質−核酸複合体
を用い、
1) 固定化核酸に、アプタマー核酸を供し、固定化核酸とアプタマー核酸の固定化核酸相補的配列を有する部分とをハイブリダイズさせることにより、アプタマー核酸を固定化し;
2) 固定化アプタマー核酸に、標的分子を含む可能性のある試料を供し、標的分子が存在する場合には標的分子とアプタマー核酸の標的分子特異的配列を有する部分とを結合させ、かつタンパク質−核酸複合体を供し、標的分子が存在しない場合にはタンパク質−核酸複合体の核酸部分とアプタマー核酸とをハイブリダイズさせることにより、タンパク質を固定化し;
3) 固定化タンパク質の有無又はその量をタンパク質の性質に基づいて検出することにより、試料中の標的分子を検出する
工程を含む、前記検出方法。
【0051】
本発明のこの方法における基材表面への核酸の固定化のためには、上述のペプチド又はタンパク質の固定化方法に関して説明したのと同様の技術を適用することができる。
この方法ではさらに、固定化核酸の全部又は一部に相補的な配列(固定化核酸相補的配列)、及び標的分子に特異性的に結合可能な配列(標的分子特異的配列)を有する核酸(アプタマー核酸)が用いられる。標的分子は、核酸、比較的低分子の有機化合物、タンパク質、ペプチド、金属イオン、複雑な構造を持つ多量体、ウイルス等でありうる。標的分子特異的配列を有する部分は、従来技術、例えばSELEX(試験管内人工進化法)工程を用いることにより産生することができ、また標的分子に対して非常に高い標的親和性及び特異性を有するものとすることができる。標的分子特異的配列を有する部分は、修飾ヌクレオチドで構成されていてもよい。
【0052】
この方法において、ペプチド又はタンパク質−核酸複合体として、本発明の複合体が用いられるが、そのペプチド又はタンパク質部分は、容易に検出可能な性質を有するものであり、好ましい例は、アルカリホスファターゼ(AP)、緑色蛍光タンパク質(GFP)、グルタチオン-S-トランスフェラーゼ(GST)、ルシフェラーゼ、ペルオキシダーゼ、抗体エピトープ配列を含むペプチド及びビオチン等である。ペプチドタグが容易に導入可能との観点からは、遺伝子工学的に製造可能なタンパク質が好ましい。また、核酸部分は、アプタマー核酸の標的分子特異的配列の全部又は一部に相補的な配列を有する。
【0053】
この方法においては、 固定化核酸に、アプタマー核酸を供し、固定化核酸とアプタマー核酸の固定化核酸相補的配列を有する部分とをハイブリダイズさせることにより、アプタマー核酸を固定化するが、このハイブリダイズのための条件は、当業者であれば、用いる核酸部分の長さ・塩基配列等に応じて、適宜設計することができる。
【0054】
また、この方法においては、次いで固定化アプタマー核酸に、標的分子を含む可能性のある試料を供し、標的分子が存在する場合には標的分子とアプタマー核酸の標的分子特異的配列を有する部分とを結合させ、さらにタンパク質−核酸複合体を供し、標的分子が存在しない場合にはタンパク質−核酸複合体の核酸部分とアプタマー核酸とをハイブリダイズさせる。試料は、細胞若しくは組織抽出液、体液等でありうる。
【0055】
さらにこの方法においては、固定化タンパク質の有無又はその量をタンパク質の性質に基づいて検出することにより、試料中の標的分子を検出することができる。
アプタマー核酸においては、固定化核酸相補的配列を有する部分と、標的分子特異的配列を有する部分とは、重複してもよく、連続してもよく、また適当なスペーサーを介して両者が存在するように設計することができる。標的分子特異的配列を有する部分(アプタマー領域)が分子認識のためにある立体構造をとることを考慮すると、該部分は、固定化核酸相補的配列を有する部分とは少なくとも重複しないようにするのがよい。
【0056】
アプタマー核酸は、固定化核酸相補的配列及び標的分子特異的配列以外に、所望の場合にはタンパク質−核酸複合体と適切にハイブリダイズするための配列をさらに含んでいてもよい。ペプチド又はタンパク質−核酸複合体の核酸部分は、アプタマー核酸の標的分子特異的配列の全部又は一部に相補的な配列を有するが、この特異的配列の全部又は一部に相補的な配列からなる領域が長い(標的分子特異的配列と重複が多い)と、却ってアプタマー核酸とはハイブリダイズできない場合が生じうる。また短い(重複が少ない)と、標的分子が存在し、アプタマー核酸と結合している場合にも、ペプチド又はタンパク質−核酸複合体とアプタマー核酸とがハイブリダイズしてしまう場合が生じうる。当業者であれば、このような考慮して、固定化核酸、アプタマー核酸、ペプチド又はタンパク質−核酸複合体の核酸部分を、適宜設計することができる。
【0057】
本発明のこの方法については、実施例5並びに図8及び9を参照することができる。
【実施例】
【0058】
〔実施例1:アルカリホスファターゼとDNAとの連結〕
(1) Z-QG-DNAの合成
MTGの良基質として知られるジペプチドZ-Gln-Gly(Z-QG)のカルボキシル基を活性エステル(NHS)化し、これをアミノ化DNAと縮合することで、TGase活性なGln残基を有するDNA(Z-QG-DNA)を合成した(図1)。
【0059】
Step 1: NHS(N-hydroxysuccinimide, 0.5M,キシダ化学)とZ-QG(0.5M, Sigma-Aldrich)をDMSO 1mLに溶解し、EDC((3-dimethyl-aminopropy1)carbodiimide, 同仁化学)0.6M
DMSO溶液)1mLを滴下し、室温で24時間攪拌した。
【0060】
Step 2: 0.2Mホウ酸緩衝液(pH9)に溶解したアミノ化DNA (24-mer, 5'-NH2-(CH2)6-AGC GGA TAA CAA TTT CAC ACA GGA-3'(配列番号:23), Gene Net) 水溶液250μLに、上記のNHS化Z-QG DMSO溶液50μLを添加した。室温で3時間撹拝後、NAP-10ゲル濾過カラムによりZ-QG-DNAを精製した。Z-QG-DNAの同定はTOF-MSで行い、HPLCで生成物の確認及び収率85%(アミノ化DNA基準)を求めた。
【0061】
(2) NK6-AP、CK6-APの合成
TGase活性なLys残基を有するNK6-AP(MKHKGS配列をN末端に有するアルカリホスファターゼ)及びCK6-AP(MKHKGS配列をC末端に有するアルカリホスファターゼ)を合成した。
【0062】
具体的な調製法を以下に示す。
2.1) NK6-AP発現ベクターの構築
pET22b(+)(Novagen)からPCRによりpET22b(+)のApaIサイト上流からpel B leaderの終りまでを増幅した。この時、pelB leader側にK6-tag(MKHKGS)をコードするDNAとBamHIサイトが導入されるようにプライマーを設計した。増幅後、生成したDNAをApaI/BamHIで処理した。pET22-APを同じくApaI/BamHIで処理した後、脱リン酸化反応を行いその後、増幅したDNAを挿入することでNK6-AP発現ベクター:pET22-NK6-APを調製した。
【0063】
2.2) CK6-AP発現ベクターの構築
pET22-APから、PCRによりAPをコードするDNAを増幅した。この時APのN末端側に制限酵素BamHIサイトとHis-tagをコードするDNAが、またC末端側にK6-tag(MKHKGS)をコードするDNAとHindIIIサイトが導入されるようにプライマーを設計した。増幅後、生成したDNAをBamHI/HindIIIで処理した。pET22b(+)を同じくBamHI/HindIIIで処理した後、脱リン酸化反応を行いその後、増幅したDNAを挿入することでCK6-AP発現ベクター:pET22-CK6-APを調製した。
【0064】
2.3) 各組換えAPの発現および精製
各組換えAPは大腸菌BL21株(Novagen)を用いて発現させた。まずそれぞれの発現ベクターを大腸菌BL21株に導入し形質転換体を得た。形質転換体はアンピシリン(100mg/L)を含むLB培地にて前培養を3時間程度行った(37℃、250rpm)。その後アンピシリン(100mg/L)を含むLB培地中(1L)にてOD600 = 0.6に達するまで培養を行い(37℃、250rpm)、IPTGを終濃度0.1mMになるように添加した。IPTG添加後、27℃、200rpmにて24時間培養を行った。
得られた菌体は遠心分離により集菌し、ショ糖緩衝液 (50 mM Tris-HCl, pH 7.4, にEDTA 1 mM、ショ糖20wt%を溶解させたもの)により2回洗浄を行い、浸透圧衝撃法用緩衝液 (5 mM MgCl2溶液) を用い細胞を再懸濁させた後、超音波処理により細胞を粉砕した。その後遠心分離により無細胞抽出液を回収し、これをHis-tagおよびゲル濾過カラムを用いて精
製することで、各組換えAPを得た。各組換えAPのアミノ酸配列の確認は、当該組換えAPをコードするプラスミドベクターのDNA配列の確認をDNAシーケンサーにて行い、精製の確認はSDS-PAGE で行った。
【0065】
(3) TGase反応
次に、NK6-AP又はCK6-APとZ-QG-DNAを混合し、TGase反応に供した。
具体的には、以下の条件で、反応した。
・CK6-AP又はNK6-AP : 2.8 μM
・Z-QG-DNA : 44 μM
・MTG(分子量38,000、Ca2+イオン非依存性、pH5〜8で活性) : 1.1 U/ml
・Buffer : 50 mM Tris-HCl pH 7.0
・Temp 25℃
・Time 24 hour
(4) AP活性の測定
TGase反応の前及び後のAP活性を、以下のように確認した。
・反応後の溶液(NK-6AP(pH7.0)): 5μl/ml
・p-ニトロフェニルリン酸 : 1mM
・pH 8.0
・Temp 25℃
一分間当たりに1μmolのp-ニトロフェノールを生成するAPの量を1Uと定義した。
【0066】
(4) 結果
CK6-AP又はNK6-APとZ-QG-DNAの連結が可能なことが明らかとなった(図2)。また、連結後のAPの酵素活性は、連結前の酵素活性と同等であったことから(図3)、目的タンパク質の機能損失を伴わないタンパク質とDNAの連結が可能なことが明らかとなった。これは、DNAが目的タンパク質(NK6-AP)のペプチドタグ選択的に導入されていることも示している。
【0067】
〔実施例2:EGFP又はGSTとDNAとの連結〕
MKHKGS配列をN末端に有する緑色蛍光タンパク質(EGFP)及びグルタチオン-S-トランスフェラーゼ(GST)についても、実施例1の実験操作でDNAとの連結が可能なことが確認された(図4)。
【0068】
〔実施例3:種々の長さのDNAとの連結〕
異なる長さのDNAとの連結を試みた。
Z-QG-DNAの合成:
実施例1のZ-QG-DNAの合成において、アミノ化DNAの長さを20、30又は40 merとした。それ以外の点は、実施例1と同様の実験操作を行った。
結果:
DNAの鎖長に依存せず連結が可能であった(図5,3、4及び5レーンはそれぞれ20、30及び40mer Z-QG-DNAとNK6-APとの連結の結果)。高分子同士を連結する際の酵素反応の優位性を示している。
【0069】
〔実施例4:DNA部位を介した配向制御型タンパク質固定化〕
得られたタンパク質-DNA複合体を核酸部位の相補性(DNA hybridization)を介して固定化することを試みた。核酸部位選択的な固定化の達成は、DNAチップをベースとしたproteinチップや、in situ hybridizationへの応用を可能にする。
【0070】
方法:
アビジンでコートされた96穴マイクロプレート(Nunc immobilizer, Streptavidin plates)上に、NK6-APとの連結に用いたDNAの相補的配列を有するビオチン化DNAを固定化し
た。ここに実施例1で得られたNK6-AP-Z-QG-DNAを、まず His-tagを使ってNiキレートカラムにより未反応 DNA とタンパク質成分を分離し、その後、PD10ゲル濾過カラムで溶出時に用いられたイミダゾールを徐去した後に添加し、洗浄操作の後、NK6-AP-Z-QG-DNAの酵素活性を指標として固定化挙動を検討した。概念図を図6に示す。
【0071】
実験は、下記の手順にしたがって行った。
1) アビジンコートされた96-wellプレートを、TBST (25mM Tris, 2.7mM KCl, 0.137M NaCl, 0.05 vol% Tween20)でprewashした。
2) 100 μLの500 nM biotin-cDNA(TBSに溶解)を加え、1時間インキュベートした後、TBSTで洗浄した。
3) 100 μLの NK6-AP-Z-QG-DNA(0.3U/L、TBSに溶解)を加え、1時間インキュベートした後、TBSTで洗浄した。
4) ECF基質(アマシャム バイオサイエンス株式会社)を加えた。
5) AP活性を、FX-Pro molecular imager (Bio-Rad)で検出した(Ex 430 nm/Em 560 nm)。
【0072】
結果:
結果を図7に示した。APに連結したDNAの相補鎖を固定化したウェルにのみAP活性が検出されたことから、NK6-APとZ-QG-DNAとの複合体(NK6-AP-Z-QG-DNA)は、DNA部位を介してタンパク質機能を保持したまま固定化されたことが明らかであった。この結果は、DNA hybridizationを介したタンパク質の固定化が可能なことを示すとともに、DNAが有する多様な機能(分子認識能:DNA aptamerや触媒能:DNAzyme)を、目的タンパク質の機能に影響をあたえることなく容易に付与することが可能なことも示している。
【0073】
〔実施例5:AP-DNA conjugateを利用した小分子の検出〕
AP-DNA conjugateの応用例として、ATPに特異性を有するDNAアプタマーを用いる小分子(ATP)検出系の構築を試みた。その概念を図8に示す。
【0074】
方法:
アビジン被覆ブラックマイクロプレート(Nunc イモビライザー)はNunc社から購入した。アルカリフォスファターゼ(AP)の基質ECFはアマシャム バイオサイエンス株式会社から購入した。 ATP (adenosine triphosphate)、ADP、AMP、GTP (guanosine triphosphate)はSigma社から購入した。
【0075】
本実施例で用いたDNA類の配列は以下の通りある。
【0076】
【化2】

【0077】
・ATP存在下での蛍光性基質ECFを用いたAP活性測定
1) 5×SSCT緩衝液(クエン酸ナトリウム500 mM、NaCl 750 mM、tween 0.05 v/v%、pH 7)でアビジン被覆ブラックマイクロプレートの各wellをprewashした。
2) 5×SSC緩衝液を用いてビオチン化DNA溶液 0.5 μMを調製し 、各wellに100 μlロードして一時間室温で放置した。
3) 5×SSCT緩衝液で、フリーのビオチン化DNAを洗い流した。
4) DNAアプタマー溶液 0.1 mM、0.5 μlと5×SSC緩衝液99.5 μlを加えて調製した100 μlの水溶液 を各wellにロードして一時間室温で放置した。
5) 5×SSCT緩衝液で、フリーのDNAアプタマーを洗い流した。
6) 5×SSC緩衝液を用いて各小分子溶液を1 mM、48 μl調製したのち、各wellにロードして一時間室温で放置した。
7) 洗浄操作を行わずに、調製したAP-DNA複合体溶液 2 μlを各wellにロードして一時間室温で放置した。
8) 5×SSCT緩衝液で、フリーのAP-DNA複合体を洗い流した。
9) ECFの原液をTris-HCl緩衝液(pH 8、1 M)で10倍希釈し、この調製した溶液を各wellに100 μlロードし、一時間室温で反応を行った。
10) 蛍光イメージャーで各wellの蛍光測定を行った。
【0078】
結果:
結果を図9に示した。ATPに応答したAPシグナルの変化が観察された。AP-DNA複合体が図7に示す概念に基づき、小分子検出のための分子素子として利用可能なことが明らかとなった。また、この系においては、検出限界が1mMであることが明らかとなった。
【0079】
〔実施例6:AP-DNA複合体形成に関するpHの影響〕
NK6-AP又はCK6-APとZ-QG-DNAの複合体の形成を、種々のpHにおいて行った。
方法:
以下の条件で、反応した。
・CK6-AP又はNK6-AP : 2.8 μM
・Z-QG-DNA : 44 μM
・MTG : 1.1 U/ml
・Buffer : 50 mM MES pH 5.5-7.0
・Buffer : 50 mM Tris-HCl pH 7.0-8.0
・Temp 25℃
・Time 24 hour
反応産物は、そのままSDS-PAGEに供した。
【0080】
結果:
結果を下表及び図10に示した。CK6-AP、NK6-APとも、pH5.5〜8.0においてZ-QG-DNAとの反応が十分に進み、AP-DNA複合体を得ることができた。
【0081】
【表1】

【0082】
NK6-AP又はCK6-APとZ-QG-DNAとの連結においては、pH依存性が通常の溶液系とは異なり、低pHで収率が向上する傾向が見られた。
APはダイマーであり、SDS-PAGEから上記に示すように、約50%以上の収率で複合体が得られていることから、少なくともダイマーあたり1つのDNAが連結しているものと予想された。
【0083】
〔実施例7:タンパク質過剰の条件下でのNK6-APとDNAとの連結〕
予想されているMTGの触媒反応から、ここでの連結反応はMTG活性中心であるシステイン(Cys)残基の、Z-QG-DNAのGlnへの求核置換反応によるアシル−酵素複合体の形成と、続いて起こるタンパク質のLysによるアシル−酵素複合体への求核置換反応によるMTGの脱離、の2段階で進行すると予想される。
【0084】
上述の通り、タンパク質濃度に対し15倍以上のZ-QG-DNA濃度においても、反応率は50〜60%にまでしか到達しないことから、この反応の律速段階は2段階目であると予想される。そこでタンパク質としてNK6-APを用い、NK6-AP過剰の条件下での連結反応による反応効率の向上を試みた。
【0085】
方法:
以下の条件で反応した。
・NK6-AP(実施例1で調製したもの) : 0〜16 μM
・Z-QG-DNA(実施例1で調製したもの DNAは24 mer) : 1.6 μM
・MTG : 1.1 U/ml
・Buffer : 50 mM Tris-HCl pH 7.0
・Temp 25℃
・Time 0〜12 hour
【0086】
結果:
結果を図11に示した。Z-QG-DNA濃度に対し5倍以上のNK6-AP濃度にすることにより、12時間後において反応率(AP-DNA複合体に転化したZ-QG-DNAの割合)は95%以上に達した。またZ-QG-DNA濃度に対し、5倍のNK6-AP濃度の条件下において、連結反応率の時間変化測定を行ったところ、3時間でほぼ反応が完結することが明らかとなった(図12)。
この実施例で得られたNK6-AP-DNA複合体反応溶液には、遊離のZ-QG-DNAがほとんど存在せず、競合的なハイブリダイゼーションがないため、実施例4のように反応後に溶液をHis-tag精製することなく、直接核酸部位選択的な固定化へと利用できると考えられる。
【0087】
なお、充分な反応率を得るには、Z-QG-DNA に対する NK6-AP のモル濃度比が2以上であることが好ましく、必要であると考えられ、また、Z-QG-DNAの濃度は、1 μM 以上が好ましいと考えられた。
【0088】
〔実施例8:複合体の精製を必要としない核酸部位選択的なタンパク質固定化〕
複合体を精製せずに、核酸部位選択的なタンパク質固定化に用いた。また、新たなコントロール実験として、非相補鎖DNAを提示したプレートへのNK6-AP-DNA複合体の固定化も試みた。
【0089】
方法:
実験は、下記の手順にしたがって行った。
1)アビジンコートされた96-wellプレートを、TBST (25mM Tris, 2.7mM KCl, 0.137M NaCl, 0.05 vol% Tween20)でprewashした。
2)100 μLの500 nM biotin-cDNA(実施例4で用いたものと同じ。)、またはbiotin-non-cDNA(DNA部分の配列は 5'-biotin-(CH2)6-ACC CTT CCT C-3'(配列番号:27))それぞれをTBSに溶解して加え、1時間インキュベートした後、TBSTで洗浄した。
3)実施例7における反応溶液(5倍のNK6-AP濃度の条件下において、3時間反応を行ったもの)を2000倍希釈したものを100 μL加え、1時間インキュベートした後、TBSTで洗浄した。
4)ECF基質(アマシャム バイオサイエンス株式会社)を加えた。
5)AP活性を、FX-Pro molecular imager(Bio-Rad)で検出した(Ex 430 nm/Em 560 nm)。
【0090】
結果:
結果を図13に示した。相補鎖を固定化したウェルにのみAP活性が検出されたことから、反応溶液を精製することなく、NK6-AP-Z-QG-DNAを固定化可能であることが明らかであった。また非相補鎖には固定化されないことが明らかとなった。
【図面の簡単な説明】
【0091】
【図1】図1は、Z-QG-DNAの調製スキームを示した図である。
【図2】図2は、CK6-AP又はNK6-APとZ-QC-DNAとから、MTGを用いて複合体を調製した実験の結果を示した写真である(実施例1)。
【図3】図3は、複合体形成実験に関し、反応(NK6-AP(pH7.0))前後におけるAP活性を比較したグラフである(実施例1)。
【図4】図4は、APの代わりにEGFP又はGSTを同様に用いて、DNAとの複合体を調製した実験の結果を示した写真である(実施例2)。
【図5】図5は、異なる長さのZ-QC-DNAとNK6-APとの複合体を調製した実験の結果を示した写真である(実施例3)。
【図6】図6は、AP-DNA複合体の固定化の概念を示した図である。
【図7】図7は、DNAハイブリダイゼーションを利用するタンパク質の固定化の概念図、及びそれに関する実験の結果を示した写真からなる。
【図8】図8は、DNAアプタマーとAP-DNA複合体とを組み合わせた小分子(ATP)検出を示した図である。
【図9】図9は、41merのアプタマーを用いたATP検出実験に関し、ATP濃度と蛍光強度との関係を示したグラフである。
【図10】図10は、CK6-AP又はNK6-APとZ-QC-DNAとからMTGを用いて複合体を調製する際のpHの与える影響を検討した実験の結果を示した写真である。AはCK6-AP、BはNK6-APについての結果を示す。
【図11】図11は、タンパク質過剰の条件下で、NK6-APとZ-QC-DNAとから、MTGを用いて複合体を調製した実験の反応効率を示したグラフである(実施例7)。
【図12】図12は、Z-QG-DNA濃度に対し5倍のNK6-AP濃度の条件下において、連結反応率の時間変化測定を行った結果のグラフである(実施例7)。
【図13】図13は、複合体の精製を必要としない核酸部位選択的な固定化タンパク質固定化の実験の結果を示した写真である(実施例8)。
【特許請求の範囲】
【請求項1】
トランスグルタミナーゼ(TGase)を用いて、ペプチド又はタンパク質へ部位特異的に外来分子を連結する方法であって:
ペプチド又はタンパク質が、TGaseが認識可能なリシン(Lys)残基又は第1級アミンを有するものであり、そして
分子が、アニオン性であり、かつTGaseが認識可能なグルタミン(Gln)残基を有するものである、前記方法。
【請求項2】
分子が、TGaseが認識可能なGln残基を有するDNA、PNA又はRNAである、請求項1に記載の方法。
【請求項3】
TGaseが微生物由来のものであり、かつTGaseが認識可能なGln残基(Q)が、カルボベンゾイル-L-グルタミルグリシン(Z-QG)、又はLLQG、LAQG、LGQG、PLAQSH、FERQHMDS、若しくはTEQKLISEEDLのアミノ酸配列からなるペプチド、又はGLGQGGG、GFGQGGG、GVGQGGG、若しくはGGLQGGGのアミノ酸配列からなる、N末端保護ペプチド(好ましくは、N末端がアセチル基又はL-3,4-ジヒドロキシルフェニルアラニル基で保護されたペプチド)として存在するか、又は
TGaseがほ乳類由来のものであり、かつTGaseが認識可能なGln残基(Q)が、Z-QG、カルボベンゾイル-L-グルタミルフェニルアラニン(Z-QF)、又はEAQQIVMのアミノ酸配列からなるペプチド、又はGGGQLGG、GGGQVGG、GGGQRGG、GQQQLG、PNPQLPF若しくはPKPQQFMのアミノ酸配列からなる、N末端保護ペプチド(好ましくは、N末端がアセチル基又はL-3,4-ジヒドロキシルフェニルアラニル基で保護されたペプチド)として存在する、請求項3に記載の方法。
【請求項4】
TGaseが認識可能なGln残基を有するアニオン性分子に対する、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質のモル濃度比が、2以上(好ましくは5以上)である、請求項1〜3のいずれか1項に記載の方法。
【請求項5】
TGaseを用いて、ペプチド又はタンパク質と外来分子との複合体を製造する方法であって:
分子が、アニオン性であり、かつTGaseが認識可能なGln残基を有し;そして
ペプチド又はタンパク質が、TGaseが認識可能なLys残基又は第1級アミンを有するものである、前記方法。
【請求項6】
分子が、TGaseが認識可能なGln残基を有するDNA、PNA又はRNAである、請求項5に記載の方法。
【請求項7】
TGaseが微生物由来のものであり、かつTGaseが認識可能なGln残基(Q)が、カルボベンゾイル-L-グルタミルグリシン(Z-QG)、又はLLQG、LAQG、LGQG、PLAQSH、FERQHMDS、若しくはTEQKLISEEDLのアミノ酸配列からなるペプチド、又はGLGQGGG、GFGQGGG、GVGQGGG、若しくはGGLQGGGのアミノ酸配列からなる、N末端保護ペプチド(好ましくは、N末端がアセチル基又はL-3,4-ジヒドロキシルフェニルアラニル基で保護されたペプチド)として存在するか、又は
TGaseがほ乳類由来のものであり、かつTGaseが認識可能なGln残基(Q)が、Z-QG、カルボベンゾイル-L-グルタミルフェニルアラニン(Z-QF)、又はEAQQIVMのアミノ酸配列からなるペプチド、又はGGGQLGG、GGGQVGG、GGGQRGG、GQQQLG、PNPQLPF若しくはPKPQQFMのアミノ酸配列からなる、N末端保護ペプチド(好ましくは、N末端がアセチル基又はL-3,4-ジヒドロキシルフェニルアラニル基で保護されたペプチド)として存在する、請求項6に記載の方法。
【請求項8】
TGaseが認識可能なGln残基を有するアニオン性分子に対する、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質のモル濃度比が、2以上(好ましくは5以上)である、請求項5〜7のいずれか1項に記載の方法。
【請求項9】
TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られる、ペプチド又はタンパク質−核酸複合体。
【請求項10】
TGaseが認識可能なLys残基を有するペプチド又はタンパク質と、Z-QG、又はLLQG、LAQG、LGQG、PLAQSH、FERQHMDS、若しくはTEQKLISEEDLのアミノ酸配列からなるペプチド、又はGLGQGGG、GFGQGGG、GVGQGGG、若しくはGGLQGGGのアミノ酸配列からなる、N末端保護ペプチド(好ましくは、N末端がアセチル基又はL-3,4-ジヒドロキシルフェニルアラニル基で保護されたペプチド)、又はZ-QF、又はEAQQIVMのアミノ酸配列からなるペプチド、又はGGGQLGG、GGGQVGG、GGGQRGG、GQQQLG、PNPQLPF若しくはPKPQQFMのアミノ酸配列からなる、N末端保護ペプチド(好ましくは、N末端がアセチル基又はL-3,4-ジヒドロキシルフェニルアラニル基で保護されたペプチド)を有する核酸とが、ε(γ-グルタミル)リシン結合で連結している、請求項9に記載の複合体。
【請求項11】
タンパク質が、アルカリホスファターゼ、緑色蛍光タンパク質又はグルタチオン-S-トランスフェラーゼである、請求項9又は10に記載の複合体。
【請求項12】
ペプチド又はタンパク質の基材表面への固定化方法であって:
a) 基材表面に固定化された核酸、
b) ペプチド又はタンパク質−核酸複合体であって、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られるものであり;さらに核酸部分が、固定化核酸の有する塩基配列の全部又は一部に相補的な核酸配列を有するものである、前記ペプチド又はタンパク質−核酸複合体
を用い、
固定化核酸と、ペプチド又はタンパク質−核酸複合体の核酸部分とを、ハイブリダイズさせて固定化物を形成する工程を含むものである、前記固定化方法。
【請求項13】
ペプチド又はタンパク質の基材表面固定化物の製造方法であって:
a) 基材表面に固定化された核酸、
b) ペプチド又はタンパク質−核酸複合体であって、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られるものであり;さらに核酸部分が、固定化核酸の有する塩基配列の全部又は一部に相補的な核酸配列を有するものである、前記ペプチド又はタンパク質−核酸複合体
を用い、
固定化核酸と、ペプチド又はタンパク質−核酸複合体の核酸部分とを、ハイブリダイズさせて固定化物を形成する工程を含むものである、前記固定化物の製造方法。
【請求項14】
標的分子の検出方法であって:
ペプチド又はタンパク質−核酸複合体であって、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られるものであり;さらにペプチド又はタンパク質部分が容易に検出可能な性質を有し、かつ核酸部分が標的分子に特異的に結合可能な塩基配列を有するものである、前記ペプチド又はタンパク質−核酸複合体を準備し;そして
対象物中に存在する標的分子と複合体とを核酸部分により特異的に結合させ;そして
結合している複合体を、ペプチド又はタンパク質部分により検出する工程を含む、前記検出方法。
【請求項15】
標的分子が核酸であり、複合体の核酸部分が標的核酸分子の配列の全部又は一部と相補的な配列を有するものであり、
標的核酸分子と複合体の核酸部分とをハイブリダイズさせることにより特異的に結合させる工程を含む、請求項14に記載の検出方法。
【請求項16】
標的分子の検出方法であって:
a) 基材表面に固定化された核酸、
b) 固定化核酸の全部又は一部に相補的な配列(固定化核酸相補的配列)、及び標的分子に特異性的に結合可能な配列(標的分子特異的配列)を有するアプタマー核酸、並びに
c) ペプチド又はタンパク質−核酸複合体であって、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られるものであり;さらにペプチド又はタンパク質部分が容易に検出可能な性質を有し、かつ核酸部分がアプタマー核酸の標的分子特異的配列の全部又は一部に相補的な配列を有するものである、前記ペプチド又はタンパク質−核酸複合体
を用い、
1) 固定化核酸に、アプタマー核酸を供し、固定化核酸とアプタマー核酸の固定化核酸相補的配列を有する部分とをハイブリダイズさせることにより、アプタマー核酸を固定化し;
2) 固定化アプタマー核酸に、標的分子を含む可能性のある試料を供し、標的分子が存在する場合には標的分子とアプタマー核酸の標的分子特異的配列を有する部分とを結合させ、かつタンパク質−核酸複合体を供し、標的分子が存在しない場合にはタンパク質−核酸複合体の核酸部分とアプタマー核酸とをハイブリダイズさせることにより、タンパク質を固定化し;
3) 固定化タンパク質の有無又はその量をタンパク質の性質に基づいて検出することにより、試料中の標的分子を検出する
工程を含む、前記検出方法。
【請求項1】
トランスグルタミナーゼ(TGase)を用いて、ペプチド又はタンパク質へ部位特異的に外来分子を連結する方法であって:
ペプチド又はタンパク質が、TGaseが認識可能なリシン(Lys)残基又は第1級アミンを有するものであり、そして
分子が、アニオン性であり、かつTGaseが認識可能なグルタミン(Gln)残基を有するものである、前記方法。
【請求項2】
分子が、TGaseが認識可能なGln残基を有するDNA、PNA又はRNAである、請求項1に記載の方法。
【請求項3】
TGaseが微生物由来のものであり、かつTGaseが認識可能なGln残基(Q)が、カルボベンゾイル-L-グルタミルグリシン(Z-QG)、又はLLQG、LAQG、LGQG、PLAQSH、FERQHMDS、若しくはTEQKLISEEDLのアミノ酸配列からなるペプチド、又はGLGQGGG、GFGQGGG、GVGQGGG、若しくはGGLQGGGのアミノ酸配列からなる、N末端保護ペプチド(好ましくは、N末端がアセチル基又はL-3,4-ジヒドロキシルフェニルアラニル基で保護されたペプチド)として存在するか、又は
TGaseがほ乳類由来のものであり、かつTGaseが認識可能なGln残基(Q)が、Z-QG、カルボベンゾイル-L-グルタミルフェニルアラニン(Z-QF)、又はEAQQIVMのアミノ酸配列からなるペプチド、又はGGGQLGG、GGGQVGG、GGGQRGG、GQQQLG、PNPQLPF若しくはPKPQQFMのアミノ酸配列からなる、N末端保護ペプチド(好ましくは、N末端がアセチル基又はL-3,4-ジヒドロキシルフェニルアラニル基で保護されたペプチド)として存在する、請求項3に記載の方法。
【請求項4】
TGaseが認識可能なGln残基を有するアニオン性分子に対する、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質のモル濃度比が、2以上(好ましくは5以上)である、請求項1〜3のいずれか1項に記載の方法。
【請求項5】
TGaseを用いて、ペプチド又はタンパク質と外来分子との複合体を製造する方法であって:
分子が、アニオン性であり、かつTGaseが認識可能なGln残基を有し;そして
ペプチド又はタンパク質が、TGaseが認識可能なLys残基又は第1級アミンを有するものである、前記方法。
【請求項6】
分子が、TGaseが認識可能なGln残基を有するDNA、PNA又はRNAである、請求項5に記載の方法。
【請求項7】
TGaseが微生物由来のものであり、かつTGaseが認識可能なGln残基(Q)が、カルボベンゾイル-L-グルタミルグリシン(Z-QG)、又はLLQG、LAQG、LGQG、PLAQSH、FERQHMDS、若しくはTEQKLISEEDLのアミノ酸配列からなるペプチド、又はGLGQGGG、GFGQGGG、GVGQGGG、若しくはGGLQGGGのアミノ酸配列からなる、N末端保護ペプチド(好ましくは、N末端がアセチル基又はL-3,4-ジヒドロキシルフェニルアラニル基で保護されたペプチド)として存在するか、又は
TGaseがほ乳類由来のものであり、かつTGaseが認識可能なGln残基(Q)が、Z-QG、カルボベンゾイル-L-グルタミルフェニルアラニン(Z-QF)、又はEAQQIVMのアミノ酸配列からなるペプチド、又はGGGQLGG、GGGQVGG、GGGQRGG、GQQQLG、PNPQLPF若しくはPKPQQFMのアミノ酸配列からなる、N末端保護ペプチド(好ましくは、N末端がアセチル基又はL-3,4-ジヒドロキシルフェニルアラニル基で保護されたペプチド)として存在する、請求項6に記載の方法。
【請求項8】
TGaseが認識可能なGln残基を有するアニオン性分子に対する、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質のモル濃度比が、2以上(好ましくは5以上)である、請求項5〜7のいずれか1項に記載の方法。
【請求項9】
TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られる、ペプチド又はタンパク質−核酸複合体。
【請求項10】
TGaseが認識可能なLys残基を有するペプチド又はタンパク質と、Z-QG、又はLLQG、LAQG、LGQG、PLAQSH、FERQHMDS、若しくはTEQKLISEEDLのアミノ酸配列からなるペプチド、又はGLGQGGG、GFGQGGG、GVGQGGG、若しくはGGLQGGGのアミノ酸配列からなる、N末端保護ペプチド(好ましくは、N末端がアセチル基又はL-3,4-ジヒドロキシルフェニルアラニル基で保護されたペプチド)、又はZ-QF、又はEAQQIVMのアミノ酸配列からなるペプチド、又はGGGQLGG、GGGQVGG、GGGQRGG、GQQQLG、PNPQLPF若しくはPKPQQFMのアミノ酸配列からなる、N末端保護ペプチド(好ましくは、N末端がアセチル基又はL-3,4-ジヒドロキシルフェニルアラニル基で保護されたペプチド)を有する核酸とが、ε(γ-グルタミル)リシン結合で連結している、請求項9に記載の複合体。
【請求項11】
タンパク質が、アルカリホスファターゼ、緑色蛍光タンパク質又はグルタチオン-S-トランスフェラーゼである、請求項9又は10に記載の複合体。
【請求項12】
ペプチド又はタンパク質の基材表面への固定化方法であって:
a) 基材表面に固定化された核酸、
b) ペプチド又はタンパク質−核酸複合体であって、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られるものであり;さらに核酸部分が、固定化核酸の有する塩基配列の全部又は一部に相補的な核酸配列を有するものである、前記ペプチド又はタンパク質−核酸複合体
を用い、
固定化核酸と、ペプチド又はタンパク質−核酸複合体の核酸部分とを、ハイブリダイズさせて固定化物を形成する工程を含むものである、前記固定化方法。
【請求項13】
ペプチド又はタンパク質の基材表面固定化物の製造方法であって:
a) 基材表面に固定化された核酸、
b) ペプチド又はタンパク質−核酸複合体であって、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られるものであり;さらに核酸部分が、固定化核酸の有する塩基配列の全部又は一部に相補的な核酸配列を有するものである、前記ペプチド又はタンパク質−核酸複合体
を用い、
固定化核酸と、ペプチド又はタンパク質−核酸複合体の核酸部分とを、ハイブリダイズさせて固定化物を形成する工程を含むものである、前記固定化物の製造方法。
【請求項14】
標的分子の検出方法であって:
ペプチド又はタンパク質−核酸複合体であって、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られるものであり;さらにペプチド又はタンパク質部分が容易に検出可能な性質を有し、かつ核酸部分が標的分子に特異的に結合可能な塩基配列を有するものである、前記ペプチド又はタンパク質−核酸複合体を準備し;そして
対象物中に存在する標的分子と複合体とを核酸部分により特異的に結合させ;そして
結合している複合体を、ペプチド又はタンパク質部分により検出する工程を含む、前記検出方法。
【請求項15】
標的分子が核酸であり、複合体の核酸部分が標的核酸分子の配列の全部又は一部と相補的な配列を有するものであり、
標的核酸分子と複合体の核酸部分とをハイブリダイズさせることにより特異的に結合させる工程を含む、請求項14に記載の検出方法。
【請求項16】
標的分子の検出方法であって:
a) 基材表面に固定化された核酸、
b) 固定化核酸の全部又は一部に相補的な配列(固定化核酸相補的配列)、及び標的分子に特異性的に結合可能な配列(標的分子特異的配列)を有するアプタマー核酸、並びに
c) ペプチド又はタンパク質−核酸複合体であって、TGaseが認識可能なLys残基又は第1級アミンを有するペプチド又はタンパク質と、TGaseが認識可能なGln残基を有する核酸とを、TGaseにより連結することにより得られるものであり;さらにペプチド又はタンパク質部分が容易に検出可能な性質を有し、かつ核酸部分がアプタマー核酸の標的分子特異的配列の全部又は一部に相補的な配列を有するものである、前記ペプチド又はタンパク質−核酸複合体
を用い、
1) 固定化核酸に、アプタマー核酸を供し、固定化核酸とアプタマー核酸の固定化核酸相補的配列を有する部分とをハイブリダイズさせることにより、アプタマー核酸を固定化し;
2) 固定化アプタマー核酸に、標的分子を含む可能性のある試料を供し、標的分子が存在する場合には標的分子とアプタマー核酸の標的分子特異的配列を有する部分とを結合させ、かつタンパク質−核酸複合体を供し、標的分子が存在しない場合にはタンパク質−核酸複合体の核酸部分とアプタマー核酸とをハイブリダイズさせることにより、タンパク質を固定化し;
3) 固定化タンパク質の有無又はその量をタンパク質の性質に基づいて検出することにより、試料中の標的分子を検出する
工程を含む、前記検出方法。
【図1】


【図12】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図13】




【図12】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図13】


【公開番号】特開2008−54658(P2008−54658A)
【公開日】平成20年3月13日(2008.3.13)
【国際特許分類】
【出願番号】特願2006−299023(P2006−299023)
【出願日】平成18年11月2日(2006.11.2)
【出願人】(504145342)国立大学法人九州大学 (960)
【Fターム(参考)】
【公開日】平成20年3月13日(2008.3.13)
【国際特許分類】
【出願日】平成18年11月2日(2006.11.2)
【出願人】(504145342)国立大学法人九州大学 (960)
【Fターム(参考)】
[ Back to top ]

