タンパク質リシンメチル化酵素Set7/9の阻害物質を含有する疾患の予防・治療剤
【課題】本発明の目的は、ヒストンメチル化酵素Set7/9阻害剤、がん細胞の増殖抑制剤、及び、エストロゲン受容体の過剰に起因する疾患の予防・治療剤を提供することにある。
【解決手段】本発明者らは、上記課題を解決するべく、発明者らが独自に開発したハイスループットなHMT活性測定法を適用してスクリーニングを実施し、シプロヘプタジンをSet7/9の阻害物質として同定した。さらに、シプロヘプタジンは、in vitroにおいてSet7/9を選択的に阻害し、乳がん細胞のERαの発現レベルを低下させ、乳がん細胞のエストロゲン依存的な増殖を抑制した。このことから、Set7/9阻害物質が、エストロゲン受容体の過剰に起因する疾患の予防・治療剤になりうることを見いだし、本発明を完成するに至った。
【解決手段】本発明者らは、上記課題を解決するべく、発明者らが独自に開発したハイスループットなHMT活性測定法を適用してスクリーニングを実施し、シプロヘプタジンをSet7/9の阻害物質として同定した。さらに、シプロヘプタジンは、in vitroにおいてSet7/9を選択的に阻害し、乳がん細胞のERαの発現レベルを低下させ、乳がん細胞のエストロゲン依存的な増殖を抑制した。このことから、Set7/9阻害物質が、エストロゲン受容体の過剰に起因する疾患の予防・治療剤になりうることを見いだし、本発明を完成するに至った。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヒストンメチル化酵素Set7/9阻害剤、がん細胞の増殖抑制剤、及び、エストロゲン受容体の過剰に起因する疾患の予防・治療剤に関する。
【背景技術】
【0002】
ステロイドホルモンの一種であるエストロゲンは、その核内受容体であるエストロゲン受容体(ERα)を介して特定の遺伝子の転写を活性化する(図1)。エストロゲンが結合したERαは、リン酸化を受けた後二量体化し、例えばNCOA1等のco-activatorとERE(estrogen response element)に結合して下流の遺伝子の転写を活性化する。エストロゲンシグナルの生理的な役割として、乳腺細胞の増殖促進、卵巣排卵制御、脂質代謝制御、及び、インスリン作用などが知られている。また、多くの乳がん(約75%)ではERαを過剰に発現しており、ERα依存的に細胞増殖することから、エストロゲンシグナルを標的とした抗がん剤がこれまでに開発されている。
【0003】
エストロゲンシグナルを標的とした既存の抗がん剤としては、タモキシフェン等のERαのアンタゴニストの他、エストロゲン生成に関わるアロマターゼの阻害剤などが存在する(図2)。しかし、タモキシフェンには、長期間投与すると、乳がん細胞に耐性が生じるという問題点がある。また、タモキシフェンは生体内でCYP2D6(チトクローム P450 2D6)によりエンドキシフェンに代謝されて強い抗腫瘍効果を発揮するという作用機序を有するため、CYP2D6を欠損した患者では効果が弱いという問題点もある。一方、前述のアロマターゼの阻害剤の場合、エストロゲン量そのものを低下させてしまうため、生体に必要なエストロゲンの機能まで損なわれるという問題点がある。例えば、エストロゲンは破骨細胞のアポトーシスを誘導し、骨密度の維持に寄与しているため、アロマターゼ阻害剤により、骨代謝異常などの副作用が生じる場合がある。このように、エストロゲンシグナルを標的とした既存の抗がん剤には問題点があった。
【0004】
一方、ERαの分解制御に関連して、ERαの302番目のリシン残基(K302)が、ユビキチン化やメチル化といったタンパク質の翻訳後修飾を受けることが知られている。ユビキチン化とは、ユビキチンと呼ばれる76アミノ酸からなるタンパク質のC末端グリシン残基が、3つの酵素、すなわち、ユビキチン活性化酵素(E1)、ユビキチン結合酵素(E2)、さらにユビキチン転移酵素(ユビキチンリガーゼ)(E3)からなるユビキチンシステムによって標的タンパク質のリシン残基に結合され、ユビキチンが標的タンパク質に付加される反応である。また、メチル化とは、タンパク質やDNA、様々な基質にメチル基が置換または付加される反応である。タンパク質のメチル化では、メチル化酵素の触媒作用によって、通常、アルギニン残基又はリシン残基にメチル基が付加される。アルギニン残基は2箇所までメチル化され、リシン残基は3箇所までメチル化され得る。
【0005】
前述のE3ユビキチンリガーゼのうち、ERαのE3ユビキチンリガーゼとしては、MDM2、CHIP、及び、BRCA1/BARD複合体が知られており、ERαのK302がユビキチン化されると、ERαはプロテアソームで分解される(非特許文献1)。一方で、メチル化酵素Set7/Set9(両者は同一酵素であり、以後Set7/9と簡略表記する)は、ERαのK302をメチル化することでERαのユビキチン化を阻害し、プロテアソームでのERαの分解を阻害すると考えられている(非特許文献2)。すなわち、Set7/9によるERαのメチル化は、ERαのユビキチン化を抑制することにより、ERαの安定性を増加させる(図3)。
【0006】
Set7/9は、当初ヒストンH3のK4(4番目のリシン残基)のεアミノ基をメチル化する酵素として発見されたが、現在はERαやp53等の非ヒストンタンパク質をメチル化することが知られている。Set7/9の既知の標的タンパク質を表1に示す。
【0007】
【表1】

【0008】
また、Set7/9は、メチル化活性に必要なSETドメインを有するが、他のメチル化酵素G9aやSUV39H1と異なり、システインに富んだpre−SETドメインや、post−SETドメインを持たないという特徴がある(図4)。そして、そのX線結晶構造解析から、多くのメチル化酵素と異なり、Set7/9は主にモノメチル化反応を触媒すると考えられている(非特許文献3)。このように、Set7/9に関する知見はいくつか得られていたものの、Set7/9の機能(標的タンパク質のメチル化)を阻害する物質はこれまで知られていなかった。
【0009】
また、シプロヘプタジン(cyproheptadine)は、抗アレルギー薬(抗ヒスタミン薬)として臨床で用いられている化合物である。しかし、このシプロヘプタジンがSet7/9の機能を阻害することは全く知られていなかった。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】Eakin C M et al., PNAS, 104, 5794-5799 (2007)
【非特許文献2】Subramanian K et al., Molecular Cell, 30, 336-347 (2008)
【非特許文献3】Xiao B et al., Nature, 421, 652-656 (2003)
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は、ヒストンメチル化酵素Set7/9阻害剤、がん細胞の増殖抑制剤、及び、エストロゲン受容体の過剰に起因する疾患の予防・治療剤を提供することを目的とする。
【課題を解決するための手段】
【0012】
本発明者らは、上記課題を解決するべく、メチル化酵素Set7/9に着目し、本発明者らが独自に開発したハイスループットなヒストンメチル化酵素活性の測定方法(特願2010−202484)を利用して、ケミカルライブラリーの13,000種の化合物から、Set7/9阻害剤のスクリーニングを行い、シプロヘプタジンを同定した。そこで、本発明者らは、シプロヘプタジンについて解析を行い、(a)シプロヘプタジンがin vitroにおいてSet7/9を選択的に阻害すること、(b)シプロヘプタジンが、乳がん細胞においてERαの発現レベルを低下させること、(c)シプロヘプタジンが、乳がん細胞のエストロゲン依存的な増殖を抑制すること、及び、(d)シプロヘプタジンが、乳がん細胞を移植したマウスにおいて、抗腫瘍効果(腫瘍の増殖抑制効果)を発揮することを見いだし、本発明を完成するに至った。
【0013】
すなわち、本発明は、(1)シプロヘプタジン又はその塩を含有するヒストンメチル化酵素Set7/9阻害剤に関する。
【0014】
また、本発明は、(2)ヒストンメチル化酵素Set7/9の阻害物質を含有する、がん細胞の増殖抑制剤や、(3)ヒストンメチル化酵素Set7/9の阻害物質が、シプロヘプタジン又はその塩である上記(2)に記載のがん細胞の増殖抑制剤や、(4)がん細胞が、乳がん細胞である上記(3)に記載のがん細胞の増殖抑制剤に関する。
【0015】
さらに、本発明は、(5)ヒストンメチル化酵素Set7/9の阻害物質を含有する、エストロゲン受容体の過剰に起因する疾患の予防・治療剤や、(6)ヒストンメチル化酵素Set7/9の阻害物質が、シプロヘプタジン又はその塩である上記(5)に記載の疾患の予防・治療剤や、(7)エストロゲン受容体の過剰に起因する疾患が、がんである上記(5)又は(6)に記載の疾患の予防・治療剤や、(8)がんが、乳がんである上記(7)に記載の疾患の予防・治療剤に関する。
【発明の効果】
【0016】
本発明によれば、ヒストンメチル化酵素Set7/9を阻害することや、がん細胞の増殖を抑制することや、エストロゲン受容体の過剰に起因する疾患を予防及び/又は治療することができる。
【0017】
また、本発明のヒストンメチル化酵素Set7/9阻害剤や、がん細胞の増殖抑制剤や、エストロゲン受容体の過剰に起因する疾患の予防・治療剤は、エストロゲンシグナルを標的とした既存の抗がん剤等と作用機序が異なる。したがって、本発明は、かかる既存の抗がん剤で十分な増殖抑制効果や予防・治療効果が得られなかったがんに対しても、増殖抑制効果や予防・治療効果が期待でき、また、かかる既存の抗がん剤との併用効果も期待できる。
【0018】
さらに、シプロヘプタジンは、抗アレルギー薬として既に市販されていて、重篤な副作用などの問題もほとんど無いことが期待され、実際、マウスへの投与試験では、毒性などの重篤な副作用は見られなかった。そのため、シプロヘプタジンを用いる場合は、今後の臨床開発に要するコストや労力が少なくて済み、実用性もきわめて高いという利点がある。
【図面の簡単な説明】
【0019】
【図1】ERαを介したエストロゲンシグナルの活性化について説明した図である。
【図2】エストロゲンシグナルを標的とした既存の抗がん剤、タモキシフェン及びアロマターゼ阻害剤について説明した図である。
【図3】ユビキチン化とメチル化によるERαの分解制御について説明した図である。
【図4】Set7/9の機能、構造について説明した図である。
【図5】蛍光ペプチド(ぺプチジルMCA)を用いたヒストンメチル化酵素測定法の原理を説明した図である。
【図6】蛍光ペプチド(ぺプチジルMCA)を用いたヒストンメチル化酵素の特異性を評価した結果を示す図である。Set7/9及びG9aはそれぞれの基質を特異的にメチル化し、Set7/9はその基質の中でもERα由来のAc−ERα(299−302)−MCAと最も高い反応性を示した。
【図7】Set7/9のメチル化活性がシプロヘプタジンにより阻害されることを、蛍光検出及びウェスタンブロッティング法により示した図である。
【図8】シプロヘプタジンによるSet7/9のメチル化活性の阻害様式が、拮抗阻害であることを示す図である。
【図9】シプロヘプタジンの添加、又はSet7/9のノックダウンによりERαのタンパク質発現量が低下するが、シプロヘプタジンの添加によりARのタンパク質発現量は変化しないことを示す図である。
【図10】シプロヘプタジンの添加が、タモキシフェンの添加と同様に、EREの活性を抑制することを示す図である。
【図11】シプロヘプタジンの添加が、タモキシフェンの添加と同様に、エストロゲン刺激によるpS2のmRNAの発現を抑制することを示す図である。
【図12】シプロヘプタジンの添加が、タモキシフェンの添加と同様に、MCF7細胞のエストロゲン依存的な増殖を抑制することを示す図である。
【図13】シプロヘプタジンの添加が、乳がん細胞の増殖を抑制することを示す図である。
【図14】シプロヘプタジンの添加が、カンプトテシンにより誘導されるp53の発現及び増殖抑制効果に、影響を与えないことを示す図である。
【図15】シプロヘプタジンの抗腫瘍試験に用いる移植用マウスにおける、がん細胞の移植部位等を示す図である。
【図16】シプロヘプタジンの抗腫瘍試験の投薬スケジュールや結果を示す図である。左上のグラフは、各群のマウスにおける相対腫瘍増殖率の平均値の推移を示し、右上のグラフは、各群のマウスの平均体重の増減の推移を示し、左下の表は、経過日数11日及び15日の各群のマウスにおける相対腫瘍増殖率の平均値を示し、右下の図は投薬スケジュールを示す。投薬スケジュールの上段の▼は、[Cyproheptadine塩酸水和物20mg/kg×1 i.p.]群における投与サンプルの投与日を示し、中段の▼は、[Cyproheptadine塩酸水和物40mg/kg×1 i.p.]群における投与サンプルの投与日を示し、下段の▼は、[Cyproheptadine塩酸水和物20mg/kg×8 i.p.]群における投与サンプルの投与日を示す。
【図17】シプロヘプタジンの急性毒性の有無を確認する試験の投薬スケジュールや、各群のマウスの平均体重の増減の推移を示す図である。投薬スケジュールの上段の▲は、[Cyproheptadine塩酸水和物20mg/kg×1 i.p.]群における投与サンプルの投与日を示し、中段の▲は、[Cyproheptadine塩酸水和物40mg/kg×1 i.p.]群における投与サンプルの投与日を示し、下段の▲は、[Cyproheptadine塩酸水和物20mg/kg×8 i.p.]群における投与サンプルの投与日を示す。
【発明を実施するための形態】
【0020】
本発明のヒストンメチル化酵素Set7/9阻害剤(以下、「本発明のSet7/9阻害剤」とも略す。)としては、シプロヘプタジン又はその塩(以下、「シプロヘプタジン等」とも表示する。)を含有している限り特に制限されず、また、本発明のがん細胞の増殖抑制剤(以下、「本発明の増殖抑制剤」とも略す。)や、本発明のエストロゲン受容体(ERα)の過剰に起因する疾患の予防・治療剤(以下、単に「本発明の予防・治療剤」とも表示する。)としては、Set7/9の阻害物質(以下、「Set7/9阻害物質」とも略す。)を含有している限り特に制限されない。本発明のSet7/9阻害剤に関して、シプロヘプタジン等がSet7/9を阻害する作用機序は不明である。また、本発明の増殖抑制剤や本発明の予防・治療剤の作用機序の詳細は不明であるが、Set7/9阻害物質(例えば、シプロヘプタジン等)が、Set7/9によるERαのメチル化を阻害し、ERαのユビキチン化及びその分解を促進して、細胞内の過剰なERα量を低下させることで、がん細胞に対する増殖抑制効果を発揮したり、ERαの過剰に起因する疾患に対する予防効果及び/又は治療効果を発揮する可能性が考えられる。なお、以下、本発明のSet7/9阻害剤、本発明の増殖抑制剤、及び、本発明の予防・治療剤をまとめて、単に「本発明の剤」とも表示する。
【0021】
上記の本発明におけるSet7/9阻害物質としては、以下の一般式(化1)で表されるシプロヘプタジン(4-(5H-ジベンゾ[a,d]シクロヘプテン-5-イリデン)-1-メチルピペリジン)又はその塩を好適に例示することができる。
【0022】
【化1】

【0023】
シプロヘプタジンの塩としては、特に制限されないが、薬学的に許容される無機酸又は有機酸の酸付加塩を好適に例示することができ、前述の無機酸の付加塩としては、塩酸塩、臭化水素酸塩、硫酸塩、硝酸塩、リン酸塩等を好適に例示することができ、前述の有機酸の付加塩としては、酢酸塩、乳酸塩、クエン酸塩、酒石酸塩、コハク酸塩、マレイン酸塩、フマル酸塩、アスコルビン酸塩等を好適に例示することができ、中でも、塩酸塩を特に好適に例示することができる。シプロヘプタジンやその塩は、市販のシプロヘプタジン塩酸塩を利用して適宜製造することができる。
【0024】
本発明におけるSet7/9阻害物質とは、Set7/9(すなわち、Set7/9タンパク質)が標的タンパク質又は標的ペプチドをメチル化することを阻害する物質を意味する。前述のSet7/9タンパク質及びSet7/9遺伝子としては、哺乳動物由来のものを好適に例示することができ、中でも、ヒト、マウス、ラット、モルモット、ウサギ、トリ、ヒツジ、ブタ、ウシ、ウマ、ネコ、イヌ、サル、チンパンジー由来のものをより好適に例示することができ、中でも、ヒト由来のものとして、Genbankのアクセッション番号NM_030648、GI:83035135に記載されたSet7/9タンパク質やSet7/9遺伝子を特に好適に例示することができる。かかるヒトSet7/9遺伝子の塩基配列として、配列番号1に示される塩基配列を例示することができ、ヒトSet7/9のアミノ酸配列として、配列番号2に示されるアミノ酸配列を例示することができる。Set7/9の上記標的ペプチドとしては、ヒトのヒストンH3のアミノ酸番号1−4のアミノ酸残基からなるペプチド(ARTK;配列番号6)や、ヒトのp53のアミノ酸番号369−372のアミノ酸残基からなるペプチド(LKSK;配列番号7)や、ヒトのERαのアミノ酸番号299−302のアミノ酸残基からなるペプチド(KRSK;配列番号8)を好適に例示することができる。
【0025】
ある物質がSet7/9阻害活性を有しているかどうかは、本発明者らが独自に開発したヒストンメチル化酵素活性の測定方法(特願2010−202484)を好適に利用することができる。かかる測定方法の詳細は、前記特許出願に記載されているが、その測定原理の概要を図5に示す。図5から分かるように、まず、ヒストンメチル化酵素の基質となるペプチドと色素標識(MCA:4-methyl-coumaryl-7-amide)を有するペプチジルM
CAを、基質化合物として用意する。このペプチジルMCAにトリプシンを作用させると、ペプチジルMCAのLysとMCAの間のアミド結合が切断されて、AMC(7-amino-4-methyl-coumarin)が遊離する。一方、このペプチジルMCAは、そのリシンのε位のアミノ基がヒストンメチル化酵素(HMT)によりメチル化を受けると、リシンとAMC間のアミド結合はトリプシンにより分解されなくなる。AMCは、AMCがペプチドと結合したクマリン(即ちぺプチジルMCA)と蛍光特性が異なるため、その相違を利用して、トリプシンの作用完了後に、AMCのみの蛍光強度、あるいはメチル化されて残存するぺプチジルMCAのみの蛍光強度を測定することで、ヒストンメチル化酵素の活性を定量的に測定することが可能となる。AMCのみの蛍光強度を測定する場合は、例えば、励起波長λex=390nm、蛍光波長λem=460nmで測定することを好適に例示することができ、ぺプチジルMCAのみの蛍光強度を測定する場合は、例えば、励起波長λex=330nm、蛍光波長λem=395nm、より好ましくは励起波長λex=330nm、蛍光波長λem=380nmで測定することを好適に例示することができる。
【0026】
本発明の剤に含有されるSet7/9阻害物質あるいはシプロヘプタジンの量としては、Set7/9阻害効果が得られる限り特に制限されないが、例えば、本発明の剤の全量に対して例えば0.0001〜99.9999質量%、好ましくは0.001〜80質量%、より好ましくは0.001〜50質量%、さらに好ましくは0.005〜20質量%を好適に例示することができる。
【0027】
本発明の剤には、Set7/9阻害効果が得られる限り、本発明におけるSet7/9阻害物質あるいはシプロヘプタジン以外に、他のがん細胞の増殖抑制剤や、前述の疾患に対する予防効果及び/又は治療効果を奏する他の物質などの任意成分を含んでいてもよい。
【0028】
本発明の剤の剤型としては、例えば、散剤、顆粒剤、錠剤、溶液剤、乳剤、懸濁剤、シロップ剤、カプセル剤、坐剤、注射剤などを例示することができる。これらの製剤は、本発明におけるSet7/9阻害物質に、製剤上の必要に応じて、適宜の薬学的に許容される担体、例えば、溶媒、賦形剤、結合剤、溶解補助剤、懸濁化剤、乳化剤、等張化剤、緩衝剤、安定化剤、無痛化剤、防腐剤、抗酸化剤、着色剤、滑沢剤、崩壊剤、湿潤剤、吸着剤、甘味剤、希釈剤などの任意成分を配合することにより製造することができる。
【0029】
本発明の剤の投与方法は、対象においてSet7/9阻害効果が得られる限り特に制限されず、直腸内投与、口腔内投与、皮下投与、筋肉内投与、静脈内投与等の非経口投与、あるいは、経口投与を例示することができる。また、インビトロの系の場合は、本発明の剤を対象細胞に添加等することにより、本発明の剤を対象細胞に接触させることや、本発明の剤を対象細胞内に注入することを例示することができる。
【0030】
本発明の剤の投与量としては、対象においてSet7/9阻害効果が得られる限り特に制限されず、投与対象となる個体、器官、局所部位、組織、投与対象となる個体の年齢・体重等に応じて、適宜選択することができる。本発明の予防・治療剤の投与量の好適な例としては、Set7/9阻害物質換算で、例えば、1日当たり0.0001〜1000mg/kg体重、好ましくは、0.001〜100mg/kg体重、さらに好ましくは0.01〜10mg/kg体重となるように、1日につき、例えば、1〜3回投与すること等を好適に例示することができる。また、本発明の剤をインビトロの系で用いる場合は、Set7/9阻害物質換算で、0.01nM〜10M、好ましくは1nM〜100mMとなるように対象細胞に接触させることを好適に例示することができる。なお、本発明におけるSet7/9阻害物質として、シプロヘプタジン等を用いる場合は、Set7/9阻害物質換算として、シプロヘプタジン塩酸塩換算を利用することが好ましい。
【0031】
本発明の剤の投与対象としては、哺乳動物又は哺乳動物細胞を好適に例示することができ、かかる哺乳動物の中でも、ヒト、マウス、ラット、モルモット、ウサギ、トリ、ヒツジ、ブタ、ウシ、ウマ、ネコ、イヌ、サル、チンパンジーをより好適に例示することができ、中でも、ヒトを特に好適に例示することができる。
【0032】
本発明の予防・治療剤が予防・治療する対象とするエストロゲン受容体の過剰に起因する疾患としては、エストロゲン受容体の過剰に起因する疾患である限り特に制限されないが、例えば、女性特有の組織、子宮や卵巣、乳房における筋腫やがん等を好適に例示することができ、中でも、乳がん、乳腺線維腺腫、乳腺症、子宮筋腫、子宮腺筋症、子宮内膜増殖症、子宮内膜がん、子宮体がん、胞状奇胎、絨毛がん、卵巣腫瘍、卵巣嚢腫、卵巣がんをより好適に例示することができ、中でも、乳がんを特に好適に例示することができる。
【0033】
本発明の増殖抑制剤が対象とするがん細胞としては、本発明におけるSet7/9阻害物質が増殖抑制効果を発揮する限り特に制限されないが、乳がん細胞を好適に例示することができ、中でも、ヒト乳がん細胞をより好適に例示することができ、中でも、MCF−7、HBC−4、BSY−1、HBC−5、MDA−MB−231をさらに好適に例示することができ、中でも、MCF−7を特に例示することができる。
【0034】
なお、本発明の他の態様として、本発明のSet7/9阻害剤、増殖抑制剤、又は、予防・治療剤の製造における、本発明におけるSet7/9阻害物質あるいはシプロヘプタジン等の使用:や、本発明におけるSet7/9阻害物質あるいはシプロヘプタジン等の、本発明のSet7/9阻害剤、増殖抑制剤、又は、予防・治療剤としての使用:や、本発明におけるSet7/9阻害物質あるいはシプロヘプタジン等を、本発明のSet7/9阻害剤、増殖抑制剤、又は、予防・治療剤に使用する方法:や、Set7/9の阻害における、本発明におけるSet7/9阻害物質あるいはシプロヘプタジン等の使用:や、がん細胞の増殖抑制における、本発明におけるSet7/9阻害物質あるいはシプロヘプタジン等の使用:や、エストロゲン受容体の過剰に起因する疾患の予防・治療における、本発明におけるSet7/9阻害物質あるいはシプロヘプタジン等の使用:や、本発明のSet7/9阻害剤を対象又は対象細胞へ投与することを特徴とするSet7/9の阻害方法:や、本発明のSet7/9阻害剤を対象又は対象細胞へ投与することを特徴とするがん細胞の増殖抑制方法:や、本発明のSet7/9阻害剤を対象又は対象細胞へ投与することを特徴とするエストロゲン受容体の過剰に起因する疾患の予防・治療方法も例示することができる。これらの使用や方法における文言の内容やその好ましい態様は、前述したとおりである。
【0035】
以下、実施例により本発明をより具体的に説明するが、本発明の技術的範囲はこれらの例示に限定されるものではない。
【実施例】
【0036】
[His−Set7/9、GST−G9a及びGST−ヒストンH3(1−20)タンパク質の調製]
配列番号2に示すSet7/9とヒスチジンタグの融合タンパク質(His−Set7/9)を発現するベクターとして、pET28a(+)−Set7/9を国立遺伝学研究所から入手した
。また、配列番号4に示すmG9a(706番目のアミノ酸からストップコドン)とGSTタグの融合タンパク質を発現するベクターとして、pGEX-4T-1-mG9aを京都大学から入手した。また、GSTとヒストンH3の1−57番目のアミノ酸配列からなる融合タンパク質(GST−ヒストンH3(1−57))を発現するベクターとして、pGEX-4T-3-histone H3を京都大学から入手した。これらの発現ベクターを大腸菌に形質転換してタンパク質を産生させ、大腸菌を破砕し、NiビーズまたはグルタチオンセファロースによりHis−Set7/9、GST−G9a及びGST−ヒストンH3(1−57)タンパク質を精製した。
【0037】
[ペプチジルMCAの作製]
メチル化酵素Set7/9及びG9aによるメチル化の基質として、ペプチジルMCAの標的リシンのN末端側に特定のアミノ酸配列を有するペプチジルMCAを合成した。すなわち、Set7/9によるメチル化の基質であるヒストンH3の一部のアミノ酸配列(アミノ酸番号1−4:配列番号6)を、標的リシンのN末端側に有するペプチジルMCAとして、Ac(アセチル基)−ARTK−MCAを作製し、Set7/9によるメチル化の基質であるp53の一部のアミノ酸配列(アミノ酸番号369−372:配列番号7)を、標的リシンのN末端側に有するペプチジルMCAとして、Ac−LKSK−MCAを作製し、Set7/9によるメチル化の基質であるERαの一部のアミノ酸配列(アミノ酸番号299−302:配列番号8)を、標的リシンのN末端側に有するペプチジルMCAとして、Ac−KRSK−MCAを作製し、G9aによるメチル化の基質であるヒストンH3の一部のアミノ酸配列(アミノ酸番号1−9:配列番号9)を、標的リシンのN末端側に有するペプチジルMCAとして、Ac−ARTKQTARK−MCAを作製した。これらのペプチジルMCAは、以降本明細書において、それぞれAc−histone H3(1−4)−MCA、Ac−p53(369−372)−MCA、Ac−ERα(299−302)−MCA、Ac−histone H3(1−9)−MCAと表す。
【0038】
[蛍光ペプチドを用いたヒストンメチル化酵素の特異性の評価]
蛍光ペプチドを用いたヒストンメチル化酵素測定法により、ヒストンメチル化酵素Set7/9の基質特異性を調べた。96穴プレート(黒)に10μLの2×HMT activity buffer(100mM Tris−HCl(pH8.5)、20mM MgCl2、40mM KCl、20mM 2−メルカプトエタノール、500mM スクロース)、0.4μLのBSA溶液(150μg/mL)、His−Set7/9又はGST−G9a、及び、蒸留水を加えて計18μLの反応液を調製し、室温で1時間インキュベートした。次いで、1μLのSAM(S-(5’-Adenosyl)-L-methyonine chloride;His−set7/9に対しては2mM、GST−G9aに対しては20mM)及び1μLのペプチジルMCA溶液(1.2mM)を添加し、37℃で1時間インキュベートした。その後、30μLのトリプシン溶液(20mg/mL)を添加し、37℃で15分間インキュベートした。反応液の蛍光強度を励起波長λex=330nm、蛍光波長λem=380nmで測定することによりトリプシン添加後残存するメチル化されたペプチジルMCA量を測定し、メチル化酵素の活性を評価した。
【0039】
図6に示すように、標的リシンのN末端側のアミノ酸配列を変化させることで、HMTの基質特異性を評価することができた。Set7/9のメチル化の対象となる部位のコンセンサス配列はX(任意のアミノ酸)−塩基性アミノ酸−親水性アミノ酸−K(リシン残基)であり、標的リシンはヒストンH3のK4、p53のK372、ERαのK302であり、その中でもERα由来のAc−ERα(299−302)−MCAがSet7/9と最も高い反応性を示した(図6左パネル)。一方、これらを基質としないG9aを用いた場合は、メチル化活性は検出されず、G9aの基質であるAc−histone H3(1−9)−MCAを基質とした場合のみメチル化活性が検出された(図6右パネル)。
【0040】
[Set7/9の阻害剤のスクリーニング]
RIKEN NPdepo(理化学研究所ケミカルバイオロジー研究領域天然化合物バンク)の13,000化合物に対し、以下の条件でSet7/9の阻害剤のスクリーニングを行った。384穴プレート(黒)に5μLの2×HMT activity buffer(100mM Tris−HCl(pH8.5)、20mM MgCl2、40mM KCl、20mM 2−メルカプトエタノール、500mM スクロース)、0.2μLのBSA溶液(150μg/mL)、His−Set7/9、1mg/mlの被検物質を0.5μL、及び蒸留水を加えて計9μLの反応液を調製し、室温で1時間インキュベートした。次いで、0.5μLのSAM(2mM)及び0.5μLのAc−ERα(299-302)−MCA溶液(1.2mM)を添加して、37℃で1時間インキュベートした。その後、15μLのトリプシン溶液(20mg/mL)を添加して、37℃で15分間インキュベートした。反応液の蛍光強度を励起波長λex=390nm、蛍光波長λem=460nmで測定することによりAMC量を、また励起波長λex=330nm、蛍光波長λem=380nmで測定することによりメチル化されたペプチジルMCA量を測定し、メチル化酵素の活性を評価した。スクリーニングの結果、抗アレルギー薬として臨床で用いられている、セロトニン受容体及びヒスタミン受容体(H1)のアンタゴニストであるシプロヘプタジン(Cyproheptadine、別名periactin)がSet7/9のメチル化活性を抑制したことから、シプロヘプタジンをSet7/9の阻害剤として同定した。
【0041】
[シプロヘプタジンによるSet7/9活性の阻害作用;fluorescence-based assay]
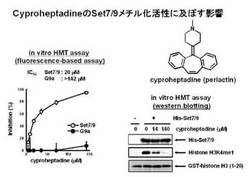
シプロヘプタジンによるヒストンメチル化酵素阻害作用がSet7/9特異的であるか調べるために、次の条件でin vitro HMTアッセイを行った。96穴プレート(黒)に2×HMT activity buffer(100mM Tris−HCl、20mM MgCl2、40mM KCl、20mM 2−メルカプトエタノール、500mM スクロース)を10μL、BSA(150μg/mL)を0.4μL、His−Set7/9(0.25mg/mL)を4μL、及び各濃度のシプロヘプタジンを1μL添加し、蒸留水を加えて計18μLの反応液を調製した後、室温で1時間インキュベートした。その後、SAM(2mM)を1μL、Ac−ERα(299−302)−MCA(1.2mM)を1μL添加した。暗所、37℃で1時間反応させた後、トリプシン(20mg/mL)を30μL添加し、更に暗所、37℃で15分間反応させた。その後蛍光プレートリーダーでメチル化されたペプチジルMCAの蛍光強度(励起波長λex=330nm、蛍光波長λem=380nm)を測定した。薬剤のSet7/9メチル化活性の阻害率を、(コントロールの蛍光強度−薬剤存在下の蛍光強度)/(コントロールの蛍光強度−His−Set9非存在下の蛍光強度)×100という数式により算出した。G9aへの影響は、His−Set7/9をGST−G9aに、また蛍光基質をAc−histone H3(1−9)−MCAに、更にSAMを2mM溶液から20mM溶液に置き換えて同様に検討した(図7左)。この結果より、シプロヘプタジンはG9aを阻害することなく、Set7/9を選択的に阻害することが示された。
【0042】
[シプロヘプタジンによるSet7/9活性の阻害作用;Western blotting]
また、シプロヘプタジンによる、ヒストンH3のK4に対するSet7/9のメチル化活性の阻害効果を調べるために、GST−ヒストンH3(1−57)を基質として用いてin vitro HMTアッセイを行い、ウェスタンブロッティングにより検出した。2×HMT activity buffer(100mM Tris−HCl(pH8.5)、20mM MgCl2、40mM KCl、20mM 2−メルカプトエタノール、500mM スクロース)を10μL、BSA(30μg/mL)を2μL、His−Set7/9(1.7mg/mL)を2.4μL、及び各濃度のシプロヘプタジンを1μL添加し、蒸留水を加えて計16μLにした後、室温で1時間インキュベートした。その後、SAM(10mM)を2μL、GST−ヒストンH3(1−57)(0.2mg/mL)を2μL添加した。37℃で1時間反応させた後、10μLのサンプルbuffer(176mM Tris−HCl(pH6.8)、7.1% SDS、0.35% ブロモフェノールブルー、35% グリセロール、15% 2−メルカプトエタノール)を加え、100℃で3分間ボイルすることでタンパク質を変性させた。その後、SDS−PAGEを行い、ウェスタンブロッティング法により、各タンパク質を検出した。用いた一次抗体は、抗6×His抗体(MBL社製、PM032)、ヒストンH3のK4のメチル化を検出する抗ヒストンH3K4me1抗体(Upstate社製、07-436)、及び抗GST抗体(Cell Signaling社製、2622)である。図7右下パネルに示すように、シプロヘプタジン濃度依存的に、Set7/9のヒストンH3のK4におけるメチル化が阻害されることが確認できた。
【0043】
[シプロヘプタジンによるSet7/9活性の阻害のキネティクス]
シプロヘプタジンがSet7/9活性を阻害するしくみを調べるために、Set7/9とAc−ERα(299−302)−MCAによるin vitro HMTアッセイにおける、シプロヘプタジンの阻害様式を調べた。SAMの濃度に対してLine weaver-Burkプロットをとると反拮抗阻害を表したのに対し(図8左パネル)、ペプチジルMCAに対してLine weaver-Burkプロットをとると拮抗阻害を表したことから(図8中央パネル)、シプロヘプタジンによるSet7/9活性の阻害は、酵素とメチル基受容体の相互作用部位に結合する阻害様式であることがわかった。さらに、シプロヘプタジンの濃度に対してDixonプロットをとることにより、シプロヘプタジンによるSet7/9活性の阻害反応の阻害定数Kiは15μMであることがわかった(図8右パネル)。
【0044】
[シプロヘプタジンがERαの発現に及ぼす影響]
HEK293T(ヒト胎児腎臓由来)細胞、HeLa(ヒト子宮頸がん由来)細胞、MCF7(ヒト乳がん由来)細胞におけるERα及びSet7/9の発現量をウェスタンブロッティング法により調べたところ、MCF7細胞でのみ両者の発現が確認された(図9の上段左パネル)。そこで、以下の実験ではMCF7細胞を使用した。
【0045】
次に、シプロヘプタジンによるERαの発現量への影響を調べた。12穴プレートに1穴あたりMCF7細胞を1×105個まき、24時間後、各濃度のシプロヘプタジンを添加した。48時間培養した後、細胞を回収し、RIPA buffer(25mM HEPES(pH7.8)、1.5% TritonX-100、1% デオキシコール酸ナトリウム、0.1% SDS、0.5M NaCl、5mM EDTA、50mM NaF、0.1mM オルトバナジン酸トリナトリウム)を加え、細胞を可溶化した。得られた各細胞可溶化液のタンパク質濃度をそろえた後、タンパク質溶液の1/2量のサンプルbuffer(176mM Tris−HCl(pH6.8)、7.1% SDS、0.35% ブロモフェノールブルー、35% グリセロール、15% 2−メルカプトエタノール)を加え、100℃で3分間ボイルすることでタンパク質を変性させた。その後、SDS−PAGEを行い、ウェスタンブロッティング法により、ERα、Set7/9、α−tubulinを検出した(図9)。用いた一次抗体は抗ERα抗体(Cell Signaling社製、2513)、抗Set7/9抗体(Cell Signaling社製、2813)、及び抗α−tubulin抗体(SIGMA社製、T5168)である。この結果より、シプロヘプタジンの濃度依存的に、ERαの発現量が低下することが示された(図9の上段中央パネル)。
【0046】
さらに、Set7/9ノックダウンによるERαの発現量への影響を調べた。12穴プレートに1穴あたりMCF7細胞を1×105個まき、配列番号10〜13で示される4種類のSet7/9に対するsiRNA(short interfering RNA)、siSet7/9を導入し、48時間後に上述と同様の手法で細胞を回収し、ウェスタンブロッティング法によりERα、Set7/9、α−tubulinを検出した。添加したsiSet7/9量に依存してSet7/9発現量及びERα発現量が減少した(図9の上段右パネル)。その一方で、同様にしてAR(Androgen Receptor)を発現しているLNCaP(ヒト前立腺がん細胞由来)細胞を用いて、シプロヘプタジン添加によりAR発現量が影響を受けるか調べたところ、ARの発現量は変化しなかった(図9の下段左パネル及び中央パネル)。
【0047】
[シプロヘプタジンがER転写活性に及ぼす影響]
シプロヘプタジンのER転写活性に及ぼす影響を調べるために、dual luciferase assayにより、ERE(estrogen responsive element)レポーターアッセイを行った(図10上段)。24穴プレートに1穴あたりMCF7細胞を1.5×104個まき、24時間後、PBS 500μLで細胞を洗浄した後、チャコール処理でステロイドホルモンを除去したFBSを10%含む、フェノールレッド不含のRPMI培地を500μL添加した。48時間培養した後、再度培地を、チャコール処理FBSを10%含むフェノールレッド不含のRPMI培地(500μL)に交換し、リポフェクトアミン2000を用いてpGL4-3×ERE-TA2(0.5μg)及びpGL4.74[hRluc/TK](0.1μg)を細胞にトランスフェクションした。トランスフェクション後6時間後に各濃度の薬剤(タモキシフェン又はシプロヘプタジン)を添加し、更に18時間培養した後、エストロゲンの一種であるβ−エストラジオールを、各濃度添加した。24時間培養した後、培地を除去し、lysis buffer(20mM Tris−HCl(pH7.5)、150mM NaCl、1mM EDTA、0.5% TritonX-100)120μLを加え、−80℃で30分以上静置し細胞を溶解した。この細胞可溶化液を50μLずつ96穴プレート(白)に移し、50μLのluciferase buffer(50mM Tris−HCl(pH8.0)、5mM MgSO4、0.5mM CoA、0.5mM ATP、0.25mM D−ルシフェリン)および100μLのrenilla buffer(50mM Tris−HCl(pH8.0)、0.5M NaCl、10mM EDTA、1μM coelenterazine)を順次加え、その都度、発光強度を発光プレートリーダーで測定することにより、firefly luciferase及びrenilla luciferaseの発光強度を取得した。得られたfirefly luciferaseの値をrenilla luciferaseの値で割ることにより、EREの活性を算出した。リガンド(β−エストラジオール)依存的にEREは活性化されるが(図10下段左パネル)、タモキシフェンやシプロヘプタジン添加によりこの活性化は抑えられることがわかった(図10下段右パネル)。シプロヘプタジンは、タモキシフェンと同様に、ERαの発現を抑制する濃度で、エストロゲンによる細胞増殖の促進を阻害した。
【0048】
[シプロヘプタジンがエストロゲン刺激によるpS2のmRNAの発現に及ぼす影響]
pS2は、エストロゲンに応答し、ERαに依存して発現するエストロゲンシグナルのマーカー遺伝子である。シプロヘプタジンのエストロゲンシグナルへの影響をより詳細に調べるために、シプロヘプタジンが、エストロゲン刺激によるpS2のmRNAの発現に及ぼす影響を調べた。60mmディッシュにMCF7細胞を1×105個まき、24時間後、PBS 3mLで細胞を洗浄した後、チャコール処理でステロイドホルモンを除去したFBSを10%含むフェノールレッド不含のRPMI培地を3mL添加した。48時間培養した後、再度チャコール処理でステロイドホルモンを除去したFBSを10%含むフェノールレッド不含のRPMI培地3mLに交換した後、各濃度の薬剤(タモキシフェン又はシプロヘプタジン)を添加した。24時間培養した後、10nMのβ−エストラジオールを添加した。更に24時間培養した後、細胞をTrizol Reagent(Invitrogen社製)で回収し、RNAを抽出した。Oligo (dT) 12-18 Primerを用い、逆転写酵素(M-MLV Reverse Transcriptase RNaseH Minus(Point Mutant)(Promega社製))によりcDNAを作製し、これをテンプレートとして、配列番号14及び15、又は、配列番号16及び17に示すプライマーを用いてPCRを行い、pS2又はGAPDHのmRNAの発現を検出した。pS2はエストロゲンに応答して、ERα依存的に、EREプロモーターを介して発現した(図11左パネル)。しかし、ERαの発現を抑制し、EREプロモーター活性を阻害する濃度のシプロヘプタジンをMCF7細胞に添加すると、タモキシフェンと同様にエストロゲン刺激によるpS2のmRNAの発現は抑制された(図11右パネル)。
【0049】
[シプロヘプタジンがエストロゲン依存的な細胞増殖に及ぼす影響]
シプロヘプタジンがエストロゲン依存的な細胞増殖に及ぼす影響を調べた。24穴プレートに1穴あたりMCF7細胞を1.5×104個まき、24時間後、PBS 500μLで細胞を洗浄した後、チャコール処理でステロイドホルモンを除去したFBSを10%含むフェノールレッド不含のRPMI培地を500μL添加した。その後、各濃度の薬剤(タモキシフェン又はシプロヘプタジン)を添加した後、各濃度のβ−エストラジオールを添加した。96時間培養した後、細胞をトリプシンではがし、血球計算盤で細胞数を測定した。MCF7はβ−エストラジオール濃度依存的な細胞増殖を示すが(図12左パネル)、タモキシフェン及びシプロヘプタジンの添加により、その細胞増殖が抑えられることがわかった(図12右パネル)。すなわち、タモキシフェンと同様に、シプロヘプタジンはエストロゲン添加による細胞増殖の亢進を阻害し、その濃度はERαの発現を抑制する濃度と一致することが示された。
【0050】
[シプロヘプタジンが乳がん細胞の増殖に及ぼす影響]
シプロヘプタジンが、乳がん細胞の増殖に及ぼす影響を調べた。5種類の乳がん細胞(HBC−4、BSY−1、HBC−5、MCF−7、MDA−MB−231)をそれぞれ96ウェルプレートにまき込み、翌日サンプル溶液を添加、2日間培養した。これらの細胞増殖を、細胞内のタンパク質総量を検出するスルホローダミンBによる比色定量で測定し、GI50値(50%の増殖抑制を示すシプロヘプタジン濃度)を算出した(図13)。シプロヘプタジンはいずれの乳がん細胞においても細胞増殖の亢進を阻害することが示された。
【0051】
[シプロヘプタジンのカンプトテシンにより誘導されるp53の発現及び細胞増殖抑制に及ぼす影響]
p53の372番目のリジン残基(K372)は、Set7/9によりメチル化されることで安定化することが報告されている(Nature, 432, 353-360, 2004)。シプロヘプタジンによりERα以外のSet7/9の基質が影響を受けるか調べるため、p53について調べた。12穴プレートに1穴あたりMCF7細胞を1×105個まき、24時間後、0.3μg/mLのカンプトテシン(Camptothecin、CPT)を添加した。0〜12時間培養した後、細胞を回収し、RIPA buffer(25mM HEPES(pH7.8)、1.5% TritonX-100、1% デオキシコール酸ナトリウム、0.1% SDS、0.5M NaCl、5mM EDTA、50mM NaF、0.1mM オルトバナジン酸トリナトリウム)で細胞を可溶化した。得られた各細胞可溶化液のタンパク質濃度をそろえた後、タンパク質溶液の1/2量のサンプルbuffer(176mM Tris−HCl(pH6.8)、7.1% SDS、0.35% ブロモフェノールブルー、35% グリセロール、15% 2−メルカプトエタノール)を加え、100℃で3分間ボイルすることでタンパク質を変性させた。その後、SDS−PAGEを行い、ウェスタンブロッティング法により、p53、Set7/9、α−tubulinを検出した。用いた一次抗体は抗p53抗体(SANTA CRUZ BIOTECHNOLOGY社製、sc-6243)、抗Set7/9抗体(Cell Signaling社製、2813)、及び抗α−tubulin抗体(SIGMA社製、T5168)である。p53はCPTにより安定化するが(図14左上パネル)、ERαの発現を抑制する濃度のシプロヘプタジンを添加しても、CPTにより誘導されるp53の発現量は変化しなかった(図14右上パネル)。また、配列番号10〜13で示される4種のsiSet7/9を用いたSet7/9の発現ノックダウンでも、p53の発現量は減少しなかった(図14左下パネル)。さらに、96穴プレートに1穴あたり100μLのRPMI培地にMCF7細胞を1穴あたり0.4×104個まき、24時間後に、シプロヘプタジン0又は43μM存在下でCPTを1穴あたり100μLのRPMI培地に溶解して添加した。37℃、5%CO2下で48時間細胞をインキュベートした後、20μLのWST−1試薬(DOJINDO Laboratories製)を添加し、更に2時間インキュベートした。その後マイクロプレートリーダーで吸光度を測定してWST−1アッセイを行い、CPTの半数阻害濃度IC50を算出した。その結果、シプロヘプタジン添加によって、p53による細胞増殖抑制は影響を受けなかった(図14右下パネル)。In vivoにおいてSet7/9はp53を制御していない可能性が考えられる。
【0052】
[in vivoにおける、シプロヘプタジンの抗腫瘍試験]
シプロヘプタジンが、in vivoにおいて抗腫瘍効果(腫瘍の増殖抑制効果)を発揮することを確認するために、以下のような方法で抗腫瘍試験を行った。
【0053】
愛媛大学大学院医学系研究科より入手したMCF7細胞を、DMEM培地(Wako社製、044-29765)を含む直径10cmのディッシュ中で、37℃、48時間培養した。ディッシュ4枚分のMCF7細胞につき、450μLのHank’s Buffer(GIBCO社製、HBSS 14170)でMCF7細胞を懸濁し、移植用のMCF7細胞液を得た。
【0054】
上記のMCF7細胞液の移植対象として、雌のヌードマウス(Balb/C-nu/nu、日本チャールスリバー株式会社製)を36匹用意し、それらを4つの群に分けた。これらの各ヌードマウスの右肩皮下、2箇所の乳腺の計3箇所(図15参照)に、上記移植用のMCF7細胞液を1箇所あたり150μL(細胞数は約2×107個)ずつ注入することによって、MCF7細胞の移植を行った。移植から13日目に4群について投与サンプルの投与を開始した。以下、投与サンプルの投与開始日の前日を0日としたときの経過日数を、単に「経過日数」と表示する。1つ目の群では、コントロールとして、10mg/kgのビヒクルを経過日数1日から8日まで、1日1回腹腔内投与(i.p.)し、2つ目の群では、20mg/kgのシプロヘプタジン塩酸水和物(SIGMA社製)を経過日数1日に1回腹腔内投与し、3つ目の群では、40mg/kgのシプロヘプタジン塩酸水和物を経過日数1日に1回腹腔内投与し、4つ目の群では、20mg/kgのシプロヘプタジン塩酸水和物を経過日数1日から8日まで、1日1回腹腔内投与した(図16の右下の投薬スケジュール)。
【0055】
上記の4つの群の各マウスについて、経過日数が、1日、4日、8日、11日、及び、15日のときに、腫瘍の体積と体重を測定した。各群について、経過日数が1日のとき(投与日)の腫瘍の体積の平均測定値を1とした場合の、腫瘍の体積の平均測定値の相対比率を、相対腫瘍増殖率として、グラフに表した(図16の左上のグラフ)。また、各群について、経過日数が1日のときのマウスの平均体重を0とした場合の、体重の平均値の増減(g)もグラフに表した(図16の右上のグラフ)。これらの結果から、シプロヘプタジン塩酸水和物を投与した3つのいずれの群(Cyproheptadine塩酸水和物20mg/kg×1 i.p.;Cyproheptadine塩酸水和物40mg/kg×1 i.p.;Cyproheptadine 塩酸水和物20mg/kg×8 i.p.)でも、コントロール群(vehicle 10mg/kg×8 i.p.)と比較して相対腫瘍増殖率の低下がみられ、中でも経過日数11日及び15日では、有意な低下がみられた(図16の左下の表)。そして、各群の体重の平均値の増減に有意な差はみられなかったことから、相対腫瘍増殖率の低下は、シプロヘプタジン塩酸水和物の作用であることが示された。なお、シプロヘプタジン塩酸水和物のこの抗腫瘍効果は、シプロヘプタジン塩酸水和物の投与量や投薬回数による大きな差はみられなかった(図16の左上のグラフ)。
【0056】
また、シプロヘプタジンの急性毒性の有無を確認するために、さきほどと同じ投薬スケジュール(図17の下の投薬スケジュール)にて前述の4つの群の投与サンプルの投与実験を行った。ただし、コントロール群については、前述の10mg/kgのビヒクルに代えて、20mg/kgのビヒクルを用いた。投与後のマウスの様子を観察したところ、シプロヘプタジン塩酸水和物の投与から10分経過後くらいから、じっと動かなくなり、傾眠又は嗜眠様の症状を示したが、投与から2時間経過後にはその症状がみられなくなった。経過日数が1〜15日のときの、各群の体重の平均値の増減をグラフに表した(図17の上グラフ)。その結果、投与開始の翌日(経過日数2日)に、シプロヘプタジン塩酸水和物の投与量に依存して、体重の減少度合いが大きくなったが、経過日数が増えるにつれて徐々に体重が回復し、いずれの経過日数においても、各群の間に有意差はみられなかった。これらの結果から、シプロヘプタジンは毒性の点で特に問題ないことが示された。
【産業上の利用可能性】
【0057】
本発明は、ヒストンメチル化酵素Set7/9阻害剤の分野や、がん細胞の増殖抑制剤の分野や、エストロゲン受容体の過剰に起因する疾患の予防・治療剤の分野に好適に利用することができる。
【技術分野】
【0001】
本発明は、ヒストンメチル化酵素Set7/9阻害剤、がん細胞の増殖抑制剤、及び、エストロゲン受容体の過剰に起因する疾患の予防・治療剤に関する。
【背景技術】
【0002】
ステロイドホルモンの一種であるエストロゲンは、その核内受容体であるエストロゲン受容体(ERα)を介して特定の遺伝子の転写を活性化する(図1)。エストロゲンが結合したERαは、リン酸化を受けた後二量体化し、例えばNCOA1等のco-activatorとERE(estrogen response element)に結合して下流の遺伝子の転写を活性化する。エストロゲンシグナルの生理的な役割として、乳腺細胞の増殖促進、卵巣排卵制御、脂質代謝制御、及び、インスリン作用などが知られている。また、多くの乳がん(約75%)ではERαを過剰に発現しており、ERα依存的に細胞増殖することから、エストロゲンシグナルを標的とした抗がん剤がこれまでに開発されている。
【0003】
エストロゲンシグナルを標的とした既存の抗がん剤としては、タモキシフェン等のERαのアンタゴニストの他、エストロゲン生成に関わるアロマターゼの阻害剤などが存在する(図2)。しかし、タモキシフェンには、長期間投与すると、乳がん細胞に耐性が生じるという問題点がある。また、タモキシフェンは生体内でCYP2D6(チトクローム P450 2D6)によりエンドキシフェンに代謝されて強い抗腫瘍効果を発揮するという作用機序を有するため、CYP2D6を欠損した患者では効果が弱いという問題点もある。一方、前述のアロマターゼの阻害剤の場合、エストロゲン量そのものを低下させてしまうため、生体に必要なエストロゲンの機能まで損なわれるという問題点がある。例えば、エストロゲンは破骨細胞のアポトーシスを誘導し、骨密度の維持に寄与しているため、アロマターゼ阻害剤により、骨代謝異常などの副作用が生じる場合がある。このように、エストロゲンシグナルを標的とした既存の抗がん剤には問題点があった。
【0004】
一方、ERαの分解制御に関連して、ERαの302番目のリシン残基(K302)が、ユビキチン化やメチル化といったタンパク質の翻訳後修飾を受けることが知られている。ユビキチン化とは、ユビキチンと呼ばれる76アミノ酸からなるタンパク質のC末端グリシン残基が、3つの酵素、すなわち、ユビキチン活性化酵素(E1)、ユビキチン結合酵素(E2)、さらにユビキチン転移酵素(ユビキチンリガーゼ)(E3)からなるユビキチンシステムによって標的タンパク質のリシン残基に結合され、ユビキチンが標的タンパク質に付加される反応である。また、メチル化とは、タンパク質やDNA、様々な基質にメチル基が置換または付加される反応である。タンパク質のメチル化では、メチル化酵素の触媒作用によって、通常、アルギニン残基又はリシン残基にメチル基が付加される。アルギニン残基は2箇所までメチル化され、リシン残基は3箇所までメチル化され得る。
【0005】
前述のE3ユビキチンリガーゼのうち、ERαのE3ユビキチンリガーゼとしては、MDM2、CHIP、及び、BRCA1/BARD複合体が知られており、ERαのK302がユビキチン化されると、ERαはプロテアソームで分解される(非特許文献1)。一方で、メチル化酵素Set7/Set9(両者は同一酵素であり、以後Set7/9と簡略表記する)は、ERαのK302をメチル化することでERαのユビキチン化を阻害し、プロテアソームでのERαの分解を阻害すると考えられている(非特許文献2)。すなわち、Set7/9によるERαのメチル化は、ERαのユビキチン化を抑制することにより、ERαの安定性を増加させる(図3)。
【0006】
Set7/9は、当初ヒストンH3のK4(4番目のリシン残基)のεアミノ基をメチル化する酵素として発見されたが、現在はERαやp53等の非ヒストンタンパク質をメチル化することが知られている。Set7/9の既知の標的タンパク質を表1に示す。
【0007】
【表1】

【0008】
また、Set7/9は、メチル化活性に必要なSETドメインを有するが、他のメチル化酵素G9aやSUV39H1と異なり、システインに富んだpre−SETドメインや、post−SETドメインを持たないという特徴がある(図4)。そして、そのX線結晶構造解析から、多くのメチル化酵素と異なり、Set7/9は主にモノメチル化反応を触媒すると考えられている(非特許文献3)。このように、Set7/9に関する知見はいくつか得られていたものの、Set7/9の機能(標的タンパク質のメチル化)を阻害する物質はこれまで知られていなかった。
【0009】
また、シプロヘプタジン(cyproheptadine)は、抗アレルギー薬(抗ヒスタミン薬)として臨床で用いられている化合物である。しかし、このシプロヘプタジンがSet7/9の機能を阻害することは全く知られていなかった。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】Eakin C M et al., PNAS, 104, 5794-5799 (2007)
【非特許文献2】Subramanian K et al., Molecular Cell, 30, 336-347 (2008)
【非特許文献3】Xiao B et al., Nature, 421, 652-656 (2003)
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は、ヒストンメチル化酵素Set7/9阻害剤、がん細胞の増殖抑制剤、及び、エストロゲン受容体の過剰に起因する疾患の予防・治療剤を提供することを目的とする。
【課題を解決するための手段】
【0012】
本発明者らは、上記課題を解決するべく、メチル化酵素Set7/9に着目し、本発明者らが独自に開発したハイスループットなヒストンメチル化酵素活性の測定方法(特願2010−202484)を利用して、ケミカルライブラリーの13,000種の化合物から、Set7/9阻害剤のスクリーニングを行い、シプロヘプタジンを同定した。そこで、本発明者らは、シプロヘプタジンについて解析を行い、(a)シプロヘプタジンがin vitroにおいてSet7/9を選択的に阻害すること、(b)シプロヘプタジンが、乳がん細胞においてERαの発現レベルを低下させること、(c)シプロヘプタジンが、乳がん細胞のエストロゲン依存的な増殖を抑制すること、及び、(d)シプロヘプタジンが、乳がん細胞を移植したマウスにおいて、抗腫瘍効果(腫瘍の増殖抑制効果)を発揮することを見いだし、本発明を完成するに至った。
【0013】
すなわち、本発明は、(1)シプロヘプタジン又はその塩を含有するヒストンメチル化酵素Set7/9阻害剤に関する。
【0014】
また、本発明は、(2)ヒストンメチル化酵素Set7/9の阻害物質を含有する、がん細胞の増殖抑制剤や、(3)ヒストンメチル化酵素Set7/9の阻害物質が、シプロヘプタジン又はその塩である上記(2)に記載のがん細胞の増殖抑制剤や、(4)がん細胞が、乳がん細胞である上記(3)に記載のがん細胞の増殖抑制剤に関する。
【0015】
さらに、本発明は、(5)ヒストンメチル化酵素Set7/9の阻害物質を含有する、エストロゲン受容体の過剰に起因する疾患の予防・治療剤や、(6)ヒストンメチル化酵素Set7/9の阻害物質が、シプロヘプタジン又はその塩である上記(5)に記載の疾患の予防・治療剤や、(7)エストロゲン受容体の過剰に起因する疾患が、がんである上記(5)又は(6)に記載の疾患の予防・治療剤や、(8)がんが、乳がんである上記(7)に記載の疾患の予防・治療剤に関する。
【発明の効果】
【0016】
本発明によれば、ヒストンメチル化酵素Set7/9を阻害することや、がん細胞の増殖を抑制することや、エストロゲン受容体の過剰に起因する疾患を予防及び/又は治療することができる。
【0017】
また、本発明のヒストンメチル化酵素Set7/9阻害剤や、がん細胞の増殖抑制剤や、エストロゲン受容体の過剰に起因する疾患の予防・治療剤は、エストロゲンシグナルを標的とした既存の抗がん剤等と作用機序が異なる。したがって、本発明は、かかる既存の抗がん剤で十分な増殖抑制効果や予防・治療効果が得られなかったがんに対しても、増殖抑制効果や予防・治療効果が期待でき、また、かかる既存の抗がん剤との併用効果も期待できる。
【0018】
さらに、シプロヘプタジンは、抗アレルギー薬として既に市販されていて、重篤な副作用などの問題もほとんど無いことが期待され、実際、マウスへの投与試験では、毒性などの重篤な副作用は見られなかった。そのため、シプロヘプタジンを用いる場合は、今後の臨床開発に要するコストや労力が少なくて済み、実用性もきわめて高いという利点がある。
【図面の簡単な説明】
【0019】
【図1】ERαを介したエストロゲンシグナルの活性化について説明した図である。
【図2】エストロゲンシグナルを標的とした既存の抗がん剤、タモキシフェン及びアロマターゼ阻害剤について説明した図である。
【図3】ユビキチン化とメチル化によるERαの分解制御について説明した図である。
【図4】Set7/9の機能、構造について説明した図である。
【図5】蛍光ペプチド(ぺプチジルMCA)を用いたヒストンメチル化酵素測定法の原理を説明した図である。
【図6】蛍光ペプチド(ぺプチジルMCA)を用いたヒストンメチル化酵素の特異性を評価した結果を示す図である。Set7/9及びG9aはそれぞれの基質を特異的にメチル化し、Set7/9はその基質の中でもERα由来のAc−ERα(299−302)−MCAと最も高い反応性を示した。
【図7】Set7/9のメチル化活性がシプロヘプタジンにより阻害されることを、蛍光検出及びウェスタンブロッティング法により示した図である。
【図8】シプロヘプタジンによるSet7/9のメチル化活性の阻害様式が、拮抗阻害であることを示す図である。
【図9】シプロヘプタジンの添加、又はSet7/9のノックダウンによりERαのタンパク質発現量が低下するが、シプロヘプタジンの添加によりARのタンパク質発現量は変化しないことを示す図である。
【図10】シプロヘプタジンの添加が、タモキシフェンの添加と同様に、EREの活性を抑制することを示す図である。
【図11】シプロヘプタジンの添加が、タモキシフェンの添加と同様に、エストロゲン刺激によるpS2のmRNAの発現を抑制することを示す図である。
【図12】シプロヘプタジンの添加が、タモキシフェンの添加と同様に、MCF7細胞のエストロゲン依存的な増殖を抑制することを示す図である。
【図13】シプロヘプタジンの添加が、乳がん細胞の増殖を抑制することを示す図である。
【図14】シプロヘプタジンの添加が、カンプトテシンにより誘導されるp53の発現及び増殖抑制効果に、影響を与えないことを示す図である。
【図15】シプロヘプタジンの抗腫瘍試験に用いる移植用マウスにおける、がん細胞の移植部位等を示す図である。
【図16】シプロヘプタジンの抗腫瘍試験の投薬スケジュールや結果を示す図である。左上のグラフは、各群のマウスにおける相対腫瘍増殖率の平均値の推移を示し、右上のグラフは、各群のマウスの平均体重の増減の推移を示し、左下の表は、経過日数11日及び15日の各群のマウスにおける相対腫瘍増殖率の平均値を示し、右下の図は投薬スケジュールを示す。投薬スケジュールの上段の▼は、[Cyproheptadine塩酸水和物20mg/kg×1 i.p.]群における投与サンプルの投与日を示し、中段の▼は、[Cyproheptadine塩酸水和物40mg/kg×1 i.p.]群における投与サンプルの投与日を示し、下段の▼は、[Cyproheptadine塩酸水和物20mg/kg×8 i.p.]群における投与サンプルの投与日を示す。
【図17】シプロヘプタジンの急性毒性の有無を確認する試験の投薬スケジュールや、各群のマウスの平均体重の増減の推移を示す図である。投薬スケジュールの上段の▲は、[Cyproheptadine塩酸水和物20mg/kg×1 i.p.]群における投与サンプルの投与日を示し、中段の▲は、[Cyproheptadine塩酸水和物40mg/kg×1 i.p.]群における投与サンプルの投与日を示し、下段の▲は、[Cyproheptadine塩酸水和物20mg/kg×8 i.p.]群における投与サンプルの投与日を示す。
【発明を実施するための形態】
【0020】
本発明のヒストンメチル化酵素Set7/9阻害剤(以下、「本発明のSet7/9阻害剤」とも略す。)としては、シプロヘプタジン又はその塩(以下、「シプロヘプタジン等」とも表示する。)を含有している限り特に制限されず、また、本発明のがん細胞の増殖抑制剤(以下、「本発明の増殖抑制剤」とも略す。)や、本発明のエストロゲン受容体(ERα)の過剰に起因する疾患の予防・治療剤(以下、単に「本発明の予防・治療剤」とも表示する。)としては、Set7/9の阻害物質(以下、「Set7/9阻害物質」とも略す。)を含有している限り特に制限されない。本発明のSet7/9阻害剤に関して、シプロヘプタジン等がSet7/9を阻害する作用機序は不明である。また、本発明の増殖抑制剤や本発明の予防・治療剤の作用機序の詳細は不明であるが、Set7/9阻害物質(例えば、シプロヘプタジン等)が、Set7/9によるERαのメチル化を阻害し、ERαのユビキチン化及びその分解を促進して、細胞内の過剰なERα量を低下させることで、がん細胞に対する増殖抑制効果を発揮したり、ERαの過剰に起因する疾患に対する予防効果及び/又は治療効果を発揮する可能性が考えられる。なお、以下、本発明のSet7/9阻害剤、本発明の増殖抑制剤、及び、本発明の予防・治療剤をまとめて、単に「本発明の剤」とも表示する。
【0021】
上記の本発明におけるSet7/9阻害物質としては、以下の一般式(化1)で表されるシプロヘプタジン(4-(5H-ジベンゾ[a,d]シクロヘプテン-5-イリデン)-1-メチルピペリジン)又はその塩を好適に例示することができる。
【0022】
【化1】

【0023】
シプロヘプタジンの塩としては、特に制限されないが、薬学的に許容される無機酸又は有機酸の酸付加塩を好適に例示することができ、前述の無機酸の付加塩としては、塩酸塩、臭化水素酸塩、硫酸塩、硝酸塩、リン酸塩等を好適に例示することができ、前述の有機酸の付加塩としては、酢酸塩、乳酸塩、クエン酸塩、酒石酸塩、コハク酸塩、マレイン酸塩、フマル酸塩、アスコルビン酸塩等を好適に例示することができ、中でも、塩酸塩を特に好適に例示することができる。シプロヘプタジンやその塩は、市販のシプロヘプタジン塩酸塩を利用して適宜製造することができる。
【0024】
本発明におけるSet7/9阻害物質とは、Set7/9(すなわち、Set7/9タンパク質)が標的タンパク質又は標的ペプチドをメチル化することを阻害する物質を意味する。前述のSet7/9タンパク質及びSet7/9遺伝子としては、哺乳動物由来のものを好適に例示することができ、中でも、ヒト、マウス、ラット、モルモット、ウサギ、トリ、ヒツジ、ブタ、ウシ、ウマ、ネコ、イヌ、サル、チンパンジー由来のものをより好適に例示することができ、中でも、ヒト由来のものとして、Genbankのアクセッション番号NM_030648、GI:83035135に記載されたSet7/9タンパク質やSet7/9遺伝子を特に好適に例示することができる。かかるヒトSet7/9遺伝子の塩基配列として、配列番号1に示される塩基配列を例示することができ、ヒトSet7/9のアミノ酸配列として、配列番号2に示されるアミノ酸配列を例示することができる。Set7/9の上記標的ペプチドとしては、ヒトのヒストンH3のアミノ酸番号1−4のアミノ酸残基からなるペプチド(ARTK;配列番号6)や、ヒトのp53のアミノ酸番号369−372のアミノ酸残基からなるペプチド(LKSK;配列番号7)や、ヒトのERαのアミノ酸番号299−302のアミノ酸残基からなるペプチド(KRSK;配列番号8)を好適に例示することができる。
【0025】
ある物質がSet7/9阻害活性を有しているかどうかは、本発明者らが独自に開発したヒストンメチル化酵素活性の測定方法(特願2010−202484)を好適に利用することができる。かかる測定方法の詳細は、前記特許出願に記載されているが、その測定原理の概要を図5に示す。図5から分かるように、まず、ヒストンメチル化酵素の基質となるペプチドと色素標識(MCA:4-methyl-coumaryl-7-amide)を有するペプチジルM
CAを、基質化合物として用意する。このペプチジルMCAにトリプシンを作用させると、ペプチジルMCAのLysとMCAの間のアミド結合が切断されて、AMC(7-amino-4-methyl-coumarin)が遊離する。一方、このペプチジルMCAは、そのリシンのε位のアミノ基がヒストンメチル化酵素(HMT)によりメチル化を受けると、リシンとAMC間のアミド結合はトリプシンにより分解されなくなる。AMCは、AMCがペプチドと結合したクマリン(即ちぺプチジルMCA)と蛍光特性が異なるため、その相違を利用して、トリプシンの作用完了後に、AMCのみの蛍光強度、あるいはメチル化されて残存するぺプチジルMCAのみの蛍光強度を測定することで、ヒストンメチル化酵素の活性を定量的に測定することが可能となる。AMCのみの蛍光強度を測定する場合は、例えば、励起波長λex=390nm、蛍光波長λem=460nmで測定することを好適に例示することができ、ぺプチジルMCAのみの蛍光強度を測定する場合は、例えば、励起波長λex=330nm、蛍光波長λem=395nm、より好ましくは励起波長λex=330nm、蛍光波長λem=380nmで測定することを好適に例示することができる。
【0026】
本発明の剤に含有されるSet7/9阻害物質あるいはシプロヘプタジンの量としては、Set7/9阻害効果が得られる限り特に制限されないが、例えば、本発明の剤の全量に対して例えば0.0001〜99.9999質量%、好ましくは0.001〜80質量%、より好ましくは0.001〜50質量%、さらに好ましくは0.005〜20質量%を好適に例示することができる。
【0027】
本発明の剤には、Set7/9阻害効果が得られる限り、本発明におけるSet7/9阻害物質あるいはシプロヘプタジン以外に、他のがん細胞の増殖抑制剤や、前述の疾患に対する予防効果及び/又は治療効果を奏する他の物質などの任意成分を含んでいてもよい。
【0028】
本発明の剤の剤型としては、例えば、散剤、顆粒剤、錠剤、溶液剤、乳剤、懸濁剤、シロップ剤、カプセル剤、坐剤、注射剤などを例示することができる。これらの製剤は、本発明におけるSet7/9阻害物質に、製剤上の必要に応じて、適宜の薬学的に許容される担体、例えば、溶媒、賦形剤、結合剤、溶解補助剤、懸濁化剤、乳化剤、等張化剤、緩衝剤、安定化剤、無痛化剤、防腐剤、抗酸化剤、着色剤、滑沢剤、崩壊剤、湿潤剤、吸着剤、甘味剤、希釈剤などの任意成分を配合することにより製造することができる。
【0029】
本発明の剤の投与方法は、対象においてSet7/9阻害効果が得られる限り特に制限されず、直腸内投与、口腔内投与、皮下投与、筋肉内投与、静脈内投与等の非経口投与、あるいは、経口投与を例示することができる。また、インビトロの系の場合は、本発明の剤を対象細胞に添加等することにより、本発明の剤を対象細胞に接触させることや、本発明の剤を対象細胞内に注入することを例示することができる。
【0030】
本発明の剤の投与量としては、対象においてSet7/9阻害効果が得られる限り特に制限されず、投与対象となる個体、器官、局所部位、組織、投与対象となる個体の年齢・体重等に応じて、適宜選択することができる。本発明の予防・治療剤の投与量の好適な例としては、Set7/9阻害物質換算で、例えば、1日当たり0.0001〜1000mg/kg体重、好ましくは、0.001〜100mg/kg体重、さらに好ましくは0.01〜10mg/kg体重となるように、1日につき、例えば、1〜3回投与すること等を好適に例示することができる。また、本発明の剤をインビトロの系で用いる場合は、Set7/9阻害物質換算で、0.01nM〜10M、好ましくは1nM〜100mMとなるように対象細胞に接触させることを好適に例示することができる。なお、本発明におけるSet7/9阻害物質として、シプロヘプタジン等を用いる場合は、Set7/9阻害物質換算として、シプロヘプタジン塩酸塩換算を利用することが好ましい。
【0031】
本発明の剤の投与対象としては、哺乳動物又は哺乳動物細胞を好適に例示することができ、かかる哺乳動物の中でも、ヒト、マウス、ラット、モルモット、ウサギ、トリ、ヒツジ、ブタ、ウシ、ウマ、ネコ、イヌ、サル、チンパンジーをより好適に例示することができ、中でも、ヒトを特に好適に例示することができる。
【0032】
本発明の予防・治療剤が予防・治療する対象とするエストロゲン受容体の過剰に起因する疾患としては、エストロゲン受容体の過剰に起因する疾患である限り特に制限されないが、例えば、女性特有の組織、子宮や卵巣、乳房における筋腫やがん等を好適に例示することができ、中でも、乳がん、乳腺線維腺腫、乳腺症、子宮筋腫、子宮腺筋症、子宮内膜増殖症、子宮内膜がん、子宮体がん、胞状奇胎、絨毛がん、卵巣腫瘍、卵巣嚢腫、卵巣がんをより好適に例示することができ、中でも、乳がんを特に好適に例示することができる。
【0033】
本発明の増殖抑制剤が対象とするがん細胞としては、本発明におけるSet7/9阻害物質が増殖抑制効果を発揮する限り特に制限されないが、乳がん細胞を好適に例示することができ、中でも、ヒト乳がん細胞をより好適に例示することができ、中でも、MCF−7、HBC−4、BSY−1、HBC−5、MDA−MB−231をさらに好適に例示することができ、中でも、MCF−7を特に例示することができる。
【0034】
なお、本発明の他の態様として、本発明のSet7/9阻害剤、増殖抑制剤、又は、予防・治療剤の製造における、本発明におけるSet7/9阻害物質あるいはシプロヘプタジン等の使用:や、本発明におけるSet7/9阻害物質あるいはシプロヘプタジン等の、本発明のSet7/9阻害剤、増殖抑制剤、又は、予防・治療剤としての使用:や、本発明におけるSet7/9阻害物質あるいはシプロヘプタジン等を、本発明のSet7/9阻害剤、増殖抑制剤、又は、予防・治療剤に使用する方法:や、Set7/9の阻害における、本発明におけるSet7/9阻害物質あるいはシプロヘプタジン等の使用:や、がん細胞の増殖抑制における、本発明におけるSet7/9阻害物質あるいはシプロヘプタジン等の使用:や、エストロゲン受容体の過剰に起因する疾患の予防・治療における、本発明におけるSet7/9阻害物質あるいはシプロヘプタジン等の使用:や、本発明のSet7/9阻害剤を対象又は対象細胞へ投与することを特徴とするSet7/9の阻害方法:や、本発明のSet7/9阻害剤を対象又は対象細胞へ投与することを特徴とするがん細胞の増殖抑制方法:や、本発明のSet7/9阻害剤を対象又は対象細胞へ投与することを特徴とするエストロゲン受容体の過剰に起因する疾患の予防・治療方法も例示することができる。これらの使用や方法における文言の内容やその好ましい態様は、前述したとおりである。
【0035】
以下、実施例により本発明をより具体的に説明するが、本発明の技術的範囲はこれらの例示に限定されるものではない。
【実施例】
【0036】
[His−Set7/9、GST−G9a及びGST−ヒストンH3(1−20)タンパク質の調製]
配列番号2に示すSet7/9とヒスチジンタグの融合タンパク質(His−Set7/9)を発現するベクターとして、pET28a(+)−Set7/9を国立遺伝学研究所から入手した
。また、配列番号4に示すmG9a(706番目のアミノ酸からストップコドン)とGSTタグの融合タンパク質を発現するベクターとして、pGEX-4T-1-mG9aを京都大学から入手した。また、GSTとヒストンH3の1−57番目のアミノ酸配列からなる融合タンパク質(GST−ヒストンH3(1−57))を発現するベクターとして、pGEX-4T-3-histone H3を京都大学から入手した。これらの発現ベクターを大腸菌に形質転換してタンパク質を産生させ、大腸菌を破砕し、NiビーズまたはグルタチオンセファロースによりHis−Set7/9、GST−G9a及びGST−ヒストンH3(1−57)タンパク質を精製した。
【0037】
[ペプチジルMCAの作製]
メチル化酵素Set7/9及びG9aによるメチル化の基質として、ペプチジルMCAの標的リシンのN末端側に特定のアミノ酸配列を有するペプチジルMCAを合成した。すなわち、Set7/9によるメチル化の基質であるヒストンH3の一部のアミノ酸配列(アミノ酸番号1−4:配列番号6)を、標的リシンのN末端側に有するペプチジルMCAとして、Ac(アセチル基)−ARTK−MCAを作製し、Set7/9によるメチル化の基質であるp53の一部のアミノ酸配列(アミノ酸番号369−372:配列番号7)を、標的リシンのN末端側に有するペプチジルMCAとして、Ac−LKSK−MCAを作製し、Set7/9によるメチル化の基質であるERαの一部のアミノ酸配列(アミノ酸番号299−302:配列番号8)を、標的リシンのN末端側に有するペプチジルMCAとして、Ac−KRSK−MCAを作製し、G9aによるメチル化の基質であるヒストンH3の一部のアミノ酸配列(アミノ酸番号1−9:配列番号9)を、標的リシンのN末端側に有するペプチジルMCAとして、Ac−ARTKQTARK−MCAを作製した。これらのペプチジルMCAは、以降本明細書において、それぞれAc−histone H3(1−4)−MCA、Ac−p53(369−372)−MCA、Ac−ERα(299−302)−MCA、Ac−histone H3(1−9)−MCAと表す。
【0038】
[蛍光ペプチドを用いたヒストンメチル化酵素の特異性の評価]
蛍光ペプチドを用いたヒストンメチル化酵素測定法により、ヒストンメチル化酵素Set7/9の基質特異性を調べた。96穴プレート(黒)に10μLの2×HMT activity buffer(100mM Tris−HCl(pH8.5)、20mM MgCl2、40mM KCl、20mM 2−メルカプトエタノール、500mM スクロース)、0.4μLのBSA溶液(150μg/mL)、His−Set7/9又はGST−G9a、及び、蒸留水を加えて計18μLの反応液を調製し、室温で1時間インキュベートした。次いで、1μLのSAM(S-(5’-Adenosyl)-L-methyonine chloride;His−set7/9に対しては2mM、GST−G9aに対しては20mM)及び1μLのペプチジルMCA溶液(1.2mM)を添加し、37℃で1時間インキュベートした。その後、30μLのトリプシン溶液(20mg/mL)を添加し、37℃で15分間インキュベートした。反応液の蛍光強度を励起波長λex=330nm、蛍光波長λem=380nmで測定することによりトリプシン添加後残存するメチル化されたペプチジルMCA量を測定し、メチル化酵素の活性を評価した。
【0039】
図6に示すように、標的リシンのN末端側のアミノ酸配列を変化させることで、HMTの基質特異性を評価することができた。Set7/9のメチル化の対象となる部位のコンセンサス配列はX(任意のアミノ酸)−塩基性アミノ酸−親水性アミノ酸−K(リシン残基)であり、標的リシンはヒストンH3のK4、p53のK372、ERαのK302であり、その中でもERα由来のAc−ERα(299−302)−MCAがSet7/9と最も高い反応性を示した(図6左パネル)。一方、これらを基質としないG9aを用いた場合は、メチル化活性は検出されず、G9aの基質であるAc−histone H3(1−9)−MCAを基質とした場合のみメチル化活性が検出された(図6右パネル)。
【0040】
[Set7/9の阻害剤のスクリーニング]
RIKEN NPdepo(理化学研究所ケミカルバイオロジー研究領域天然化合物バンク)の13,000化合物に対し、以下の条件でSet7/9の阻害剤のスクリーニングを行った。384穴プレート(黒)に5μLの2×HMT activity buffer(100mM Tris−HCl(pH8.5)、20mM MgCl2、40mM KCl、20mM 2−メルカプトエタノール、500mM スクロース)、0.2μLのBSA溶液(150μg/mL)、His−Set7/9、1mg/mlの被検物質を0.5μL、及び蒸留水を加えて計9μLの反応液を調製し、室温で1時間インキュベートした。次いで、0.5μLのSAM(2mM)及び0.5μLのAc−ERα(299-302)−MCA溶液(1.2mM)を添加して、37℃で1時間インキュベートした。その後、15μLのトリプシン溶液(20mg/mL)を添加して、37℃で15分間インキュベートした。反応液の蛍光強度を励起波長λex=390nm、蛍光波長λem=460nmで測定することによりAMC量を、また励起波長λex=330nm、蛍光波長λem=380nmで測定することによりメチル化されたペプチジルMCA量を測定し、メチル化酵素の活性を評価した。スクリーニングの結果、抗アレルギー薬として臨床で用いられている、セロトニン受容体及びヒスタミン受容体(H1)のアンタゴニストであるシプロヘプタジン(Cyproheptadine、別名periactin)がSet7/9のメチル化活性を抑制したことから、シプロヘプタジンをSet7/9の阻害剤として同定した。
【0041】
[シプロヘプタジンによるSet7/9活性の阻害作用;fluorescence-based assay]
シプロヘプタジンによるヒストンメチル化酵素阻害作用がSet7/9特異的であるか調べるために、次の条件でin vitro HMTアッセイを行った。96穴プレート(黒)に2×HMT activity buffer(100mM Tris−HCl、20mM MgCl2、40mM KCl、20mM 2−メルカプトエタノール、500mM スクロース)を10μL、BSA(150μg/mL)を0.4μL、His−Set7/9(0.25mg/mL)を4μL、及び各濃度のシプロヘプタジンを1μL添加し、蒸留水を加えて計18μLの反応液を調製した後、室温で1時間インキュベートした。その後、SAM(2mM)を1μL、Ac−ERα(299−302)−MCA(1.2mM)を1μL添加した。暗所、37℃で1時間反応させた後、トリプシン(20mg/mL)を30μL添加し、更に暗所、37℃で15分間反応させた。その後蛍光プレートリーダーでメチル化されたペプチジルMCAの蛍光強度(励起波長λex=330nm、蛍光波長λem=380nm)を測定した。薬剤のSet7/9メチル化活性の阻害率を、(コントロールの蛍光強度−薬剤存在下の蛍光強度)/(コントロールの蛍光強度−His−Set9非存在下の蛍光強度)×100という数式により算出した。G9aへの影響は、His−Set7/9をGST−G9aに、また蛍光基質をAc−histone H3(1−9)−MCAに、更にSAMを2mM溶液から20mM溶液に置き換えて同様に検討した(図7左)。この結果より、シプロヘプタジンはG9aを阻害することなく、Set7/9を選択的に阻害することが示された。
【0042】
[シプロヘプタジンによるSet7/9活性の阻害作用;Western blotting]
また、シプロヘプタジンによる、ヒストンH3のK4に対するSet7/9のメチル化活性の阻害効果を調べるために、GST−ヒストンH3(1−57)を基質として用いてin vitro HMTアッセイを行い、ウェスタンブロッティングにより検出した。2×HMT activity buffer(100mM Tris−HCl(pH8.5)、20mM MgCl2、40mM KCl、20mM 2−メルカプトエタノール、500mM スクロース)を10μL、BSA(30μg/mL)を2μL、His−Set7/9(1.7mg/mL)を2.4μL、及び各濃度のシプロヘプタジンを1μL添加し、蒸留水を加えて計16μLにした後、室温で1時間インキュベートした。その後、SAM(10mM)を2μL、GST−ヒストンH3(1−57)(0.2mg/mL)を2μL添加した。37℃で1時間反応させた後、10μLのサンプルbuffer(176mM Tris−HCl(pH6.8)、7.1% SDS、0.35% ブロモフェノールブルー、35% グリセロール、15% 2−メルカプトエタノール)を加え、100℃で3分間ボイルすることでタンパク質を変性させた。その後、SDS−PAGEを行い、ウェスタンブロッティング法により、各タンパク質を検出した。用いた一次抗体は、抗6×His抗体(MBL社製、PM032)、ヒストンH3のK4のメチル化を検出する抗ヒストンH3K4me1抗体(Upstate社製、07-436)、及び抗GST抗体(Cell Signaling社製、2622)である。図7右下パネルに示すように、シプロヘプタジン濃度依存的に、Set7/9のヒストンH3のK4におけるメチル化が阻害されることが確認できた。
【0043】
[シプロヘプタジンによるSet7/9活性の阻害のキネティクス]
シプロヘプタジンがSet7/9活性を阻害するしくみを調べるために、Set7/9とAc−ERα(299−302)−MCAによるin vitro HMTアッセイにおける、シプロヘプタジンの阻害様式を調べた。SAMの濃度に対してLine weaver-Burkプロットをとると反拮抗阻害を表したのに対し(図8左パネル)、ペプチジルMCAに対してLine weaver-Burkプロットをとると拮抗阻害を表したことから(図8中央パネル)、シプロヘプタジンによるSet7/9活性の阻害は、酵素とメチル基受容体の相互作用部位に結合する阻害様式であることがわかった。さらに、シプロヘプタジンの濃度に対してDixonプロットをとることにより、シプロヘプタジンによるSet7/9活性の阻害反応の阻害定数Kiは15μMであることがわかった(図8右パネル)。
【0044】
[シプロヘプタジンがERαの発現に及ぼす影響]
HEK293T(ヒト胎児腎臓由来)細胞、HeLa(ヒト子宮頸がん由来)細胞、MCF7(ヒト乳がん由来)細胞におけるERα及びSet7/9の発現量をウェスタンブロッティング法により調べたところ、MCF7細胞でのみ両者の発現が確認された(図9の上段左パネル)。そこで、以下の実験ではMCF7細胞を使用した。
【0045】
次に、シプロヘプタジンによるERαの発現量への影響を調べた。12穴プレートに1穴あたりMCF7細胞を1×105個まき、24時間後、各濃度のシプロヘプタジンを添加した。48時間培養した後、細胞を回収し、RIPA buffer(25mM HEPES(pH7.8)、1.5% TritonX-100、1% デオキシコール酸ナトリウム、0.1% SDS、0.5M NaCl、5mM EDTA、50mM NaF、0.1mM オルトバナジン酸トリナトリウム)を加え、細胞を可溶化した。得られた各細胞可溶化液のタンパク質濃度をそろえた後、タンパク質溶液の1/2量のサンプルbuffer(176mM Tris−HCl(pH6.8)、7.1% SDS、0.35% ブロモフェノールブルー、35% グリセロール、15% 2−メルカプトエタノール)を加え、100℃で3分間ボイルすることでタンパク質を変性させた。その後、SDS−PAGEを行い、ウェスタンブロッティング法により、ERα、Set7/9、α−tubulinを検出した(図9)。用いた一次抗体は抗ERα抗体(Cell Signaling社製、2513)、抗Set7/9抗体(Cell Signaling社製、2813)、及び抗α−tubulin抗体(SIGMA社製、T5168)である。この結果より、シプロヘプタジンの濃度依存的に、ERαの発現量が低下することが示された(図9の上段中央パネル)。
【0046】
さらに、Set7/9ノックダウンによるERαの発現量への影響を調べた。12穴プレートに1穴あたりMCF7細胞を1×105個まき、配列番号10〜13で示される4種類のSet7/9に対するsiRNA(short interfering RNA)、siSet7/9を導入し、48時間後に上述と同様の手法で細胞を回収し、ウェスタンブロッティング法によりERα、Set7/9、α−tubulinを検出した。添加したsiSet7/9量に依存してSet7/9発現量及びERα発現量が減少した(図9の上段右パネル)。その一方で、同様にしてAR(Androgen Receptor)を発現しているLNCaP(ヒト前立腺がん細胞由来)細胞を用いて、シプロヘプタジン添加によりAR発現量が影響を受けるか調べたところ、ARの発現量は変化しなかった(図9の下段左パネル及び中央パネル)。
【0047】
[シプロヘプタジンがER転写活性に及ぼす影響]
シプロヘプタジンのER転写活性に及ぼす影響を調べるために、dual luciferase assayにより、ERE(estrogen responsive element)レポーターアッセイを行った(図10上段)。24穴プレートに1穴あたりMCF7細胞を1.5×104個まき、24時間後、PBS 500μLで細胞を洗浄した後、チャコール処理でステロイドホルモンを除去したFBSを10%含む、フェノールレッド不含のRPMI培地を500μL添加した。48時間培養した後、再度培地を、チャコール処理FBSを10%含むフェノールレッド不含のRPMI培地(500μL)に交換し、リポフェクトアミン2000を用いてpGL4-3×ERE-TA2(0.5μg)及びpGL4.74[hRluc/TK](0.1μg)を細胞にトランスフェクションした。トランスフェクション後6時間後に各濃度の薬剤(タモキシフェン又はシプロヘプタジン)を添加し、更に18時間培養した後、エストロゲンの一種であるβ−エストラジオールを、各濃度添加した。24時間培養した後、培地を除去し、lysis buffer(20mM Tris−HCl(pH7.5)、150mM NaCl、1mM EDTA、0.5% TritonX-100)120μLを加え、−80℃で30分以上静置し細胞を溶解した。この細胞可溶化液を50μLずつ96穴プレート(白)に移し、50μLのluciferase buffer(50mM Tris−HCl(pH8.0)、5mM MgSO4、0.5mM CoA、0.5mM ATP、0.25mM D−ルシフェリン)および100μLのrenilla buffer(50mM Tris−HCl(pH8.0)、0.5M NaCl、10mM EDTA、1μM coelenterazine)を順次加え、その都度、発光強度を発光プレートリーダーで測定することにより、firefly luciferase及びrenilla luciferaseの発光強度を取得した。得られたfirefly luciferaseの値をrenilla luciferaseの値で割ることにより、EREの活性を算出した。リガンド(β−エストラジオール)依存的にEREは活性化されるが(図10下段左パネル)、タモキシフェンやシプロヘプタジン添加によりこの活性化は抑えられることがわかった(図10下段右パネル)。シプロヘプタジンは、タモキシフェンと同様に、ERαの発現を抑制する濃度で、エストロゲンによる細胞増殖の促進を阻害した。
【0048】
[シプロヘプタジンがエストロゲン刺激によるpS2のmRNAの発現に及ぼす影響]
pS2は、エストロゲンに応答し、ERαに依存して発現するエストロゲンシグナルのマーカー遺伝子である。シプロヘプタジンのエストロゲンシグナルへの影響をより詳細に調べるために、シプロヘプタジンが、エストロゲン刺激によるpS2のmRNAの発現に及ぼす影響を調べた。60mmディッシュにMCF7細胞を1×105個まき、24時間後、PBS 3mLで細胞を洗浄した後、チャコール処理でステロイドホルモンを除去したFBSを10%含むフェノールレッド不含のRPMI培地を3mL添加した。48時間培養した後、再度チャコール処理でステロイドホルモンを除去したFBSを10%含むフェノールレッド不含のRPMI培地3mLに交換した後、各濃度の薬剤(タモキシフェン又はシプロヘプタジン)を添加した。24時間培養した後、10nMのβ−エストラジオールを添加した。更に24時間培養した後、細胞をTrizol Reagent(Invitrogen社製)で回収し、RNAを抽出した。Oligo (dT) 12-18 Primerを用い、逆転写酵素(M-MLV Reverse Transcriptase RNaseH Minus(Point Mutant)(Promega社製))によりcDNAを作製し、これをテンプレートとして、配列番号14及び15、又は、配列番号16及び17に示すプライマーを用いてPCRを行い、pS2又はGAPDHのmRNAの発現を検出した。pS2はエストロゲンに応答して、ERα依存的に、EREプロモーターを介して発現した(図11左パネル)。しかし、ERαの発現を抑制し、EREプロモーター活性を阻害する濃度のシプロヘプタジンをMCF7細胞に添加すると、タモキシフェンと同様にエストロゲン刺激によるpS2のmRNAの発現は抑制された(図11右パネル)。
【0049】
[シプロヘプタジンがエストロゲン依存的な細胞増殖に及ぼす影響]
シプロヘプタジンがエストロゲン依存的な細胞増殖に及ぼす影響を調べた。24穴プレートに1穴あたりMCF7細胞を1.5×104個まき、24時間後、PBS 500μLで細胞を洗浄した後、チャコール処理でステロイドホルモンを除去したFBSを10%含むフェノールレッド不含のRPMI培地を500μL添加した。その後、各濃度の薬剤(タモキシフェン又はシプロヘプタジン)を添加した後、各濃度のβ−エストラジオールを添加した。96時間培養した後、細胞をトリプシンではがし、血球計算盤で細胞数を測定した。MCF7はβ−エストラジオール濃度依存的な細胞増殖を示すが(図12左パネル)、タモキシフェン及びシプロヘプタジンの添加により、その細胞増殖が抑えられることがわかった(図12右パネル)。すなわち、タモキシフェンと同様に、シプロヘプタジンはエストロゲン添加による細胞増殖の亢進を阻害し、その濃度はERαの発現を抑制する濃度と一致することが示された。
【0050】
[シプロヘプタジンが乳がん細胞の増殖に及ぼす影響]
シプロヘプタジンが、乳がん細胞の増殖に及ぼす影響を調べた。5種類の乳がん細胞(HBC−4、BSY−1、HBC−5、MCF−7、MDA−MB−231)をそれぞれ96ウェルプレートにまき込み、翌日サンプル溶液を添加、2日間培養した。これらの細胞増殖を、細胞内のタンパク質総量を検出するスルホローダミンBによる比色定量で測定し、GI50値(50%の増殖抑制を示すシプロヘプタジン濃度)を算出した(図13)。シプロヘプタジンはいずれの乳がん細胞においても細胞増殖の亢進を阻害することが示された。
【0051】
[シプロヘプタジンのカンプトテシンにより誘導されるp53の発現及び細胞増殖抑制に及ぼす影響]
p53の372番目のリジン残基(K372)は、Set7/9によりメチル化されることで安定化することが報告されている(Nature, 432, 353-360, 2004)。シプロヘプタジンによりERα以外のSet7/9の基質が影響を受けるか調べるため、p53について調べた。12穴プレートに1穴あたりMCF7細胞を1×105個まき、24時間後、0.3μg/mLのカンプトテシン(Camptothecin、CPT)を添加した。0〜12時間培養した後、細胞を回収し、RIPA buffer(25mM HEPES(pH7.8)、1.5% TritonX-100、1% デオキシコール酸ナトリウム、0.1% SDS、0.5M NaCl、5mM EDTA、50mM NaF、0.1mM オルトバナジン酸トリナトリウム)で細胞を可溶化した。得られた各細胞可溶化液のタンパク質濃度をそろえた後、タンパク質溶液の1/2量のサンプルbuffer(176mM Tris−HCl(pH6.8)、7.1% SDS、0.35% ブロモフェノールブルー、35% グリセロール、15% 2−メルカプトエタノール)を加え、100℃で3分間ボイルすることでタンパク質を変性させた。その後、SDS−PAGEを行い、ウェスタンブロッティング法により、p53、Set7/9、α−tubulinを検出した。用いた一次抗体は抗p53抗体(SANTA CRUZ BIOTECHNOLOGY社製、sc-6243)、抗Set7/9抗体(Cell Signaling社製、2813)、及び抗α−tubulin抗体(SIGMA社製、T5168)である。p53はCPTにより安定化するが(図14左上パネル)、ERαの発現を抑制する濃度のシプロヘプタジンを添加しても、CPTにより誘導されるp53の発現量は変化しなかった(図14右上パネル)。また、配列番号10〜13で示される4種のsiSet7/9を用いたSet7/9の発現ノックダウンでも、p53の発現量は減少しなかった(図14左下パネル)。さらに、96穴プレートに1穴あたり100μLのRPMI培地にMCF7細胞を1穴あたり0.4×104個まき、24時間後に、シプロヘプタジン0又は43μM存在下でCPTを1穴あたり100μLのRPMI培地に溶解して添加した。37℃、5%CO2下で48時間細胞をインキュベートした後、20μLのWST−1試薬(DOJINDO Laboratories製)を添加し、更に2時間インキュベートした。その後マイクロプレートリーダーで吸光度を測定してWST−1アッセイを行い、CPTの半数阻害濃度IC50を算出した。その結果、シプロヘプタジン添加によって、p53による細胞増殖抑制は影響を受けなかった(図14右下パネル)。In vivoにおいてSet7/9はp53を制御していない可能性が考えられる。
【0052】
[in vivoにおける、シプロヘプタジンの抗腫瘍試験]
シプロヘプタジンが、in vivoにおいて抗腫瘍効果(腫瘍の増殖抑制効果)を発揮することを確認するために、以下のような方法で抗腫瘍試験を行った。
【0053】
愛媛大学大学院医学系研究科より入手したMCF7細胞を、DMEM培地(Wako社製、044-29765)を含む直径10cmのディッシュ中で、37℃、48時間培養した。ディッシュ4枚分のMCF7細胞につき、450μLのHank’s Buffer(GIBCO社製、HBSS 14170)でMCF7細胞を懸濁し、移植用のMCF7細胞液を得た。
【0054】
上記のMCF7細胞液の移植対象として、雌のヌードマウス(Balb/C-nu/nu、日本チャールスリバー株式会社製)を36匹用意し、それらを4つの群に分けた。これらの各ヌードマウスの右肩皮下、2箇所の乳腺の計3箇所(図15参照)に、上記移植用のMCF7細胞液を1箇所あたり150μL(細胞数は約2×107個)ずつ注入することによって、MCF7細胞の移植を行った。移植から13日目に4群について投与サンプルの投与を開始した。以下、投与サンプルの投与開始日の前日を0日としたときの経過日数を、単に「経過日数」と表示する。1つ目の群では、コントロールとして、10mg/kgのビヒクルを経過日数1日から8日まで、1日1回腹腔内投与(i.p.)し、2つ目の群では、20mg/kgのシプロヘプタジン塩酸水和物(SIGMA社製)を経過日数1日に1回腹腔内投与し、3つ目の群では、40mg/kgのシプロヘプタジン塩酸水和物を経過日数1日に1回腹腔内投与し、4つ目の群では、20mg/kgのシプロヘプタジン塩酸水和物を経過日数1日から8日まで、1日1回腹腔内投与した(図16の右下の投薬スケジュール)。
【0055】
上記の4つの群の各マウスについて、経過日数が、1日、4日、8日、11日、及び、15日のときに、腫瘍の体積と体重を測定した。各群について、経過日数が1日のとき(投与日)の腫瘍の体積の平均測定値を1とした場合の、腫瘍の体積の平均測定値の相対比率を、相対腫瘍増殖率として、グラフに表した(図16の左上のグラフ)。また、各群について、経過日数が1日のときのマウスの平均体重を0とした場合の、体重の平均値の増減(g)もグラフに表した(図16の右上のグラフ)。これらの結果から、シプロヘプタジン塩酸水和物を投与した3つのいずれの群(Cyproheptadine塩酸水和物20mg/kg×1 i.p.;Cyproheptadine塩酸水和物40mg/kg×1 i.p.;Cyproheptadine 塩酸水和物20mg/kg×8 i.p.)でも、コントロール群(vehicle 10mg/kg×8 i.p.)と比較して相対腫瘍増殖率の低下がみられ、中でも経過日数11日及び15日では、有意な低下がみられた(図16の左下の表)。そして、各群の体重の平均値の増減に有意な差はみられなかったことから、相対腫瘍増殖率の低下は、シプロヘプタジン塩酸水和物の作用であることが示された。なお、シプロヘプタジン塩酸水和物のこの抗腫瘍効果は、シプロヘプタジン塩酸水和物の投与量や投薬回数による大きな差はみられなかった(図16の左上のグラフ)。
【0056】
また、シプロヘプタジンの急性毒性の有無を確認するために、さきほどと同じ投薬スケジュール(図17の下の投薬スケジュール)にて前述の4つの群の投与サンプルの投与実験を行った。ただし、コントロール群については、前述の10mg/kgのビヒクルに代えて、20mg/kgのビヒクルを用いた。投与後のマウスの様子を観察したところ、シプロヘプタジン塩酸水和物の投与から10分経過後くらいから、じっと動かなくなり、傾眠又は嗜眠様の症状を示したが、投与から2時間経過後にはその症状がみられなくなった。経過日数が1〜15日のときの、各群の体重の平均値の増減をグラフに表した(図17の上グラフ)。その結果、投与開始の翌日(経過日数2日)に、シプロヘプタジン塩酸水和物の投与量に依存して、体重の減少度合いが大きくなったが、経過日数が増えるにつれて徐々に体重が回復し、いずれの経過日数においても、各群の間に有意差はみられなかった。これらの結果から、シプロヘプタジンは毒性の点で特に問題ないことが示された。
【産業上の利用可能性】
【0057】
本発明は、ヒストンメチル化酵素Set7/9阻害剤の分野や、がん細胞の増殖抑制剤の分野や、エストロゲン受容体の過剰に起因する疾患の予防・治療剤の分野に好適に利用することができる。
【特許請求の範囲】
【請求項1】
シプロヘプタジン又はその塩を含有するヒストンメチル化酵素Set7/9阻害剤。
【請求項2】
ヒストンメチル化酵素Set7/9の阻害物質を含有する、がん細胞の増殖抑制剤。
【請求項3】
ヒストンメチル化酵素Set7/9の阻害物質が、シプロヘプタジン又はその塩である請求項2に記載のがん細胞の増殖抑制剤。
【請求項4】
がん細胞が、乳がん細胞である請求項3に記載のがん細胞の増殖抑制剤。
【請求項5】
ヒストンメチル化酵素Set7/9の阻害物質を含有する、エストロゲン受容体の過剰に起因する疾患の予防・治療剤。
【請求項6】
ヒストンメチル化酵素Set7/9の阻害物質が、シプロヘプタジン又はその塩である請求項5に記載の疾患の予防・治療剤。
【請求項7】
エストロゲン受容体の過剰に起因する疾患が、がんである請求項5又は6に記載の疾患の予防・治療剤。
【請求項8】
がんが、乳がんである請求項7に記載の疾患の予防・治療剤。
【請求項1】
シプロヘプタジン又はその塩を含有するヒストンメチル化酵素Set7/9阻害剤。
【請求項2】
ヒストンメチル化酵素Set7/9の阻害物質を含有する、がん細胞の増殖抑制剤。
【請求項3】
ヒストンメチル化酵素Set7/9の阻害物質が、シプロヘプタジン又はその塩である請求項2に記載のがん細胞の増殖抑制剤。
【請求項4】
がん細胞が、乳がん細胞である請求項3に記載のがん細胞の増殖抑制剤。
【請求項5】
ヒストンメチル化酵素Set7/9の阻害物質を含有する、エストロゲン受容体の過剰に起因する疾患の予防・治療剤。
【請求項6】
ヒストンメチル化酵素Set7/9の阻害物質が、シプロヘプタジン又はその塩である請求項5に記載の疾患の予防・治療剤。
【請求項7】
エストロゲン受容体の過剰に起因する疾患が、がんである請求項5又は6に記載の疾患の予防・治療剤。
【請求項8】
がんが、乳がんである請求項7に記載の疾患の予防・治療剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公開番号】特開2012−102087(P2012−102087A)
【公開日】平成24年5月31日(2012.5.31)
【国際特許分類】
【出願番号】特願2011−224604(P2011−224604)
【出願日】平成23年10月12日(2011.10.12)
【出願人】(504174135)国立大学法人九州工業大学 (489)
【出願人】(000173588)公益財団法人がん研究会 (34)
【Fターム(参考)】
【公開日】平成24年5月31日(2012.5.31)
【国際特許分類】
【出願日】平成23年10月12日(2011.10.12)
【出願人】(504174135)国立大学法人九州工業大学 (489)
【出願人】(000173588)公益財団法人がん研究会 (34)
【Fターム(参考)】
[ Back to top ]

