タンパク質低発現化ペプチドをコードする遺伝子およびその使用方法
【課題】標的のタンパク質と融合させることによって標的タンパク質を低発現化することができるペプチドをコードする遺伝子、及びその遺伝子を用いたタンパク質の低発現化方法を提供すること。
【解決手段】低発現化ペプチドを融合した増強緑色蛍光タンパク質(EGFP)の生体内での発現は従来のPEST配列、CL1-PEST配列を融合させた場合と比較して、著しく、有意に低かった。本発明はこの様なタンパク質低発現化ペプチド及びそれをコードする遺伝子、及びこれらを利用したタンパク質低発現化方法を提供する。これにより、低発現化されたレポーター蛋白質を利用し、ノイズが低く高感度に遺伝子応答等を評価することが可能となる。さらに本発明の、タンパク質の低発現化は、低発現化ペプチドによるプロテアソーム分解系の促進によると考えられ、プロテアソーム分解阻害物質のスクリーニングに応用可能である。
【解決手段】低発現化ペプチドを融合した増強緑色蛍光タンパク質(EGFP)の生体内での発現は従来のPEST配列、CL1-PEST配列を融合させた場合と比較して、著しく、有意に低かった。本発明はこの様なタンパク質低発現化ペプチド及びそれをコードする遺伝子、及びこれらを利用したタンパク質低発現化方法を提供する。これにより、低発現化されたレポーター蛋白質を利用し、ノイズが低く高感度に遺伝子応答等を評価することが可能となる。さらに本発明の、タンパク質の低発現化は、低発現化ペプチドによるプロテアソーム分解系の促進によると考えられ、プロテアソーム分解阻害物質のスクリーニングに応用可能である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、タンパク質を不安定化し、生体内でのタンパク質のターンオーバーを促進し、結果的にタンパク質の低発現化をもたらす技術に関する。より詳細には、本発明はタンパク質低発現化ペプチドを標的タンパク質(例えば、増強緑色蛍光タンパク(EGPF)等のレポータータンパク質)に融合し、標的タンパク質の生体内での低発現化を行う技術、及びそれを利用して生体内での遺伝子発現をより正確に観察する技術、さらには低発現化を元に戻すことを利用したプロテアソーム阻害剤のスクリーニング系に関する。
【背景技術】
【0002】
ライフサイエンス特に細胞生物学の分野において、緑色蛍光タンパク質(GFPあるいはEGPF)は、遺伝子発現のレポーターとして使用したり、また、タンパク質の細胞内局在を調べるために広く用いられている。例えば、GFP(またはEGPF)遺伝子に転写活性領域を挿入し、それを導入した培養細胞を一定時間、薬剤等で処理した後、細胞を集め(あるいはそのままで)、488 nm付近の励起波長で励起して発せられる508 nm付近の蛍光強度を測定することで、細胞内で合成されたGFP量を定量し転写活性を評価するシステム等が知られている。GFPをレポータータンパク質として用いた分析系は、発光量から転写活性を評価するので定量性に優れており、既にGFPの発光量測定を利用したシステム関連製品が多く開発され、市販化されている。
【0003】
このGFPは、細胞内において比較的安定なタンパク質である。このような特性を有するため、細胞内に蓄積し易く、検出が容易という利点がある。
【0004】
しかしながら、GFP等のレポータータンパク質を用いて、遺伝子発現の経時的な変化(例えば、プロモーター転写活性)をモニターする場合、レポータータンパク質の安定性ゆえに正確な測定が阻害される場合がある。これは、レポータータンパク質が、その発現が検出された後も安定に存在し、シグナルを発し続けるため、その後のモニタリングにおけるバックグラウンドを増大させる結果となるためであり、いわゆる、S/N比(シグナル/ノイズ)が低下する。よって、ある刺激に対する生体の反応をレポータータンパク質の発現量の変化によって正確且つ適切に(タイムラグなく)観察・評価するためには、レポータータンパク質が発現し、そのシグナルが検出された後、適当な寿命で、分解(不活性化)されることが望ましい。
【0005】
細胞内タンパク質の安定性はそれぞれのタンパク質ごとに幅広く異なっている。タンパク質の速いターンオーバーは、しばしば、タンパク質の分解を誘発するシグナルによって引き起こされる。これらのシグナルには、PEST配列のようなペプチド、リン酸化のような修飾、あるいはタンパク質間相互作用などが上げられる(例えば、非特許文献1、2、3を参照。)。
【0006】
中でも、タンパク質の分解を促進するペプチドは注目を集めている(特許文献1を参照。)。特にPEST配列は、マウスではオルニチンデカルボキシラーゼ(ODC)(生体にあってはポリアミン合成の鍵となる酵素である)のC末端側に位置し、ODCの活性そのものには直接関与しないが、ODCの短寿命(分解促進)の原因になっていることが確認され、この配列を標的タンパク質と融合することによる標的タンパク質の分解促進が試みられている(非特許文献4を参照。)。なお、PESTとは、プロリン(P)、グルタミン酸(E)、セリン(S)及びスレオニン(T)の豊富なアミノ酸配列を意味する。しかしながら、PEST配列によっても分解促進がそれほど進まないタンパク質の例なども報告され、PEST以外のより分解活性の高いアミノ酸配列の探索も望まれるところである(特許文献2を参照。)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特許公表2002-512015
【特許文献2】特許公開2009-136154
【非特許文献】
【0008】
【非特許文献1】Rogers,S.R.,Wells,R.,and Rechsteiner,M.(1986) Science, 234,364-368.
【非特許文献2】Papavassiliou,A.G.,Treier,M.,Chavrier,C,and Bohmann,D. (1992)Science, 258,1941-1944.
【非特許文献3】Scheffner,M.,Werness,B.A.,Huibregtse,J.M.,Luvine,A.J.,Howley,P.M. (1990)Cell 63,1129-1136.
【非特許文献4】Xianqiang Li, Xianqiang Zhao, Yu Fang,Xin Jiang, Tommy Duong, Connie Fan, Chiao-Chain Huang, and Steven R.Kain (1998) J.Biol.Chem. 273,34970-34975
【発明の概要】
【発明が解決しようとする課題】
【0009】
ところで、本発明者らは、エイズの原因ウイルスであるhuman immunodeficiency virus type-1 (HIV-1)が有する大きな特徴の一つ、易変異原性に着目して研究を進めている。
【0010】
感染個体内においてHIV-1は、免疫や抗HIV薬等による複製阻害の圧力を受ける。それに対してHIV-1は、易変異原性により自身のゲノム内に高頻度に変異を導入することにより免疫回避や薬剤耐性の形質を獲得し、自身の複製・生存を可能にしている。
【0011】
本発明者らは、そのようなHIV-1の柔軟な複製環境に対する適応能力に着目し、様々なHIV-1株(クローン)間の特徴を、種々の指標で比較し、その差異が生じる原因・機構を明らかにすれば、そこには新規の有用な生化学的活性を見いだせると考えた。
【0012】
そこで、本発明者らは、先ずHIV-1の病原性因子の一つとして知られているNefに注目し、HIV-1株間におけるその発現量とCD4ダウンレギュレーション活性を指標に差を調べた。HIV-1NL4-3株とHIV-1JR-CSF株由来のNefを比較した結果、両者の間でその発現量とCD4ダウンレギュレーション活性に著しい差異があることを見出し、その差異はHIV-1NL4-3株のNefの発現量が著しく低いことが要因であることを明らかにした。
【0013】
発明者らは、次いでHIV-1JR-CSF株由来およびHIV-1NL4-3株由来Nefのアミノ酸配列を並べ詳細に検討したところ、C末端領域でHIV-1NL4-3株由来Nefのアミノ酸配列で言うと129−206残基(以下、株にかかわらず、当該領域に相当する配列を「NDS配列」という。)において、比較的ホモロジーが低いことに着目した。発明者らは、この領域のペプチドがNefタンパクの低発現(分解)の原因と考え、HIV-1JR-CSF株の相当領域をこのペプチドで置き換えたキメラを作成し、Nefタンパク発現を検討したところ、発現の著しい低下を認めた。また、後に詳述するが、EGFPにこの配列を付加した場合も、顕著なEGFP発現の低下を認めた。
【0014】
本発明は、かかる見地より完成されたものであって、標的のタンパク質と融合させることによって標的タンパク質を低発現化することができるペプチドをコードする遺伝子、及びその遺伝子を用いたタンパク質の低発現化方法を提供することを目的とする。また、本発明は前記の方法を用いて低発現化されたレポータータンパク質を利用して、より正確にプロモーター活性分析をする方法、ならびに低発現化能が低下しその発現量が回復することを利用したプロテアソーム阻害剤のスクリーニング系を提供することを目的とする。
【課題を解決するための手段】
【0015】
上記課題を解決するために、請求項1に係る発明では、少なくとも人又は猿の免疫不全ウイルスが有するnef遺伝子由来のタンパク質低発現化ペプチドがコードされた遺伝子を提供する。
【0016】
また、請求項2に係る発明では、以下の(1)〜(4)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子を提供する。
(1)配列番号1の第385-618番目の塩基で表される塩基配列。
(2)配列番号2の第129-206番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列。
(3)配列番号2の第129-206番目のアミノ酸で表されるアミノ酸配列において、1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第129-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
(4)上記(1)〜(3)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第129-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【0017】
また、請求項3に係る発明では、以下の(5)〜(8)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子を提供する。
(5)配列番号1の第424-618番目の塩基で表される塩基配列;
(6)配列番号2の第142-206番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(7)配列番号2の第142-206番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第142-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(8)上記(5)〜(7)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第142-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【0018】
また、請求項4に係る発明では、以下の(9)〜(12)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子を提供する。
(9)配列番号1の第385-558番目の塩基で表される塩基配列;
(10)配列番号2の第129-186番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(11)配列番号2の第129-186番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第129-186番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(12)上記(9)〜(11)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第129-186番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【0019】
また、請求項5に係る発明では、以下の(13)〜(16)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子を提供する。
(13)配列番号3の第415-651番目の塩基で表される塩基配列;
(14)配列番号4の第139-216番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(15)配列番号4の第139-216番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号4の第139-216番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(16)上記(13)〜(15)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号4第139-216番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【0020】
また、請求項6に係る発明では、以下の(17)〜(20)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子を提供する。
(17)配列番号5の第481-789番目の塩基で表される塩基配列;
(18)配列番号6の第161-263番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(19)配列番号6の第161-263番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号6の第161-263番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(20)上記(17)〜(19)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号6第161-263番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【0021】
また、請求項7に係る発明では、任意の標的タンパク質をコードする塩基配列の5’末端及び/又は3’末端に、請求項1〜6いずれか1項に記載の遺伝子の塩基配列を付加した遺伝子構築物とした。
【0022】
また、請求項8に係る発明では、任意の標的タンパク質をコードする塩基配列の5’末端及び/又は3’末端に、リンカーを介して請求項1〜6いずれか1項に記載の遺伝子の塩基配列を付加した遺伝子構築物とした。
【0023】
また、請求項9に係る発明では、請求項7又は請求項8に記載の遺伝子構築物において、前記任意の標的タンパク質は、任意の抗体であることに特徴を有する。
【0024】
また、請求項10に係る発明では、請求項7又は請求項8に記載の遺伝子構築物において、前記任意の標的タンパク質は、ウイルス構造タンパク質であることに特徴を有する。
【0025】
また、請求項11に係る発明では、プロモーターを備え、同プロモーターの制御下に、レポータータンパク質をコードする塩基配列と、請求項1〜6いずれか1項に記載の遺伝子の塩基配列とを有する遺伝子構築物とした。
【0026】
また、請求項12に係る発明では、請求項11に記載の遺伝子構築物において、前記レポータータンパク質が増強緑色蛍光タンパク(EGFP)であることに特徴を有する。
【0027】
また、請求項13に係る発明では、請求項7〜12のいずれか1項に記載の遺伝子構築物を含む発現ベクターとした。
【0028】
また、請求項14に係る発明では、請求項7〜12のいずれか1項に記載の遺伝子構築物及び/又は請求項13に記載の発現ベクターを、一過的又は安定的に発現するように導入された細胞とした。
【0029】
また、請求項15に係る発明では、請求項14に記載の細胞を備えた生物とした。
【0030】
また、請求項16に係る発明では、請求項14に記載の細胞、又は、請求項15に記載の生物を、それぞれ異なる条件下で培養し、レポータータンパク質のシグナルを測定し、プロモーターの転写活性を比較することからなる、プロモーター活性の分析方法とした。
【0031】
また、請求項17に係る発明では、請求項14に記載の細胞、又は、請求項15に記載の生物を、被検化合物の存在下及び非存在下で培養し、レポータータンパク質のシグナルを測定し、プロモーターの転写活性を比較することにより、前記被検化合物のプロモーターに対する影響を評価する方法とした。
【0032】
また、請求項18に係る発明では、請求項17に記載の方法により被検化合物のプロモーターに対する影響の評価を行って、前記被験化合物の中から、所定の化合物をスクリーニングするスクリーニングキットとした。
【0033】
また、請求項19に係る発明では、請求項14に記載の細胞、又は、請求項15に記載の生物を、被検化合物の存在下及び非存在下で培養し、レポータータンパク質のシグナルを測定比較することからなる、前記被検化合物の低タンパク質発現活性に対する影響を評価する方法とした。
【0034】
また、請求項20に係る発明では、請求項19に記載の方法において、低タンパク質発現活性に影響を及ぼす披検化合物がプロテアソーム阻害剤候補物質であることに特徴を有する。
【0035】
また、請求項21に係る発明では、請求項19に記載の方法により、被検化合物の低タンパク質発現活性に対する影響の評価を行って、前記被験化合物の中から所定の化合物をスクリーニングするスクリーニングキットであって、前記被験化合物は、プロテアソーム阻害剤候補物質であることを特徴とするスクリーニングキットとした。
【0036】
さらに、請求項22に係る発明では、以下の(1)〜(3)の工程を含む、標的タンパク質を低発現化させる方法とした。
(1)請求項1〜6いずれか1項に記載の遺伝子を、標的タンパク質をコードする遺伝子と連結させる工程、
(2)工程(1)で得た組換え遺伝子を、発現ベクターに取り込む工程、
(3)工程(2)で得た発現ベクターを宿主細胞に導入し、発現させる工程。
【発明の効果】
【0037】
本発明によれば、標的のタンパク質と融合させることによって標的タンパク質を低発現化することができるペプチドをコードする遺伝子、及びその遺伝子を用いたタンパク質の低発現化方法を提供することができる。また、前記の方法を用いて低発現化されたレポータータンパク質を利用して、より正確にプロモーター活性分析をする方法、ならびに低発現化能が低下しその発現量が回復することを利用したプロテアソーム阻害剤のスクリーニング系を提供することができる。
【図面の簡単な説明】
【0038】
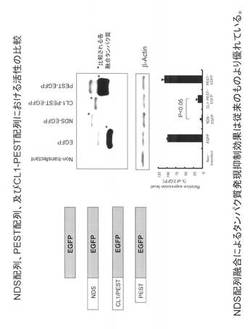
【図1】HIV-1NL4-3株由来のNef遺伝子の発現量が著しく低いことを示す図である。
【図2】HIV-1NL4-3株由来のNefのC末端側(アミノ酸番号129〜206領域)をHIV-1JR-CSFのC末端の相当領域(139〜216)と置き換えたキメラ発現系構築の模式図である。
【図3】HIV-1NL4-3株由来のNefのC末端側(アミノ酸番号129〜206領域)に、Nefタンパク発現低下活性のあることを示した図である。
【図4】HIV-1NL4-3株由来のNef(アミノ酸番号129〜206領域)、PEST,およびPEST/CL1 をそれぞれ、EGFPのN末端に付加し、EGFPの発現低下活性を比較した図である。
【図5】本発明の配列を用いた、高感度レポーターアッセイ系の説明図である。
【図6】本発明の配列を用いた、プロテアソーム阻害剤候補物質スクリーニング系の説明図である。
【図7】EGFPのC末端側にNDSを連結し、その発現レベルを示した説明図である。
【図8A】各NDS誘導体が示す発現レベルを示した説明図である。
【図8B】各NDSが示す発現レベルを示した説明図である。
【図9】NDS-Rluc、野生型RlucおよびCP-Rlucの発光量の違いを示した説明図である。
【図10】プロテアソーム阻害剤で処理した際の発現量の違いを示した説明図である。
【発明を実施するための最良の形態】
【0039】
以下、本発明に係る実施形態について、図面を参照しながら説明する。
【0040】
本発明は、標的のタンパク質と融合させることによって標的タンパク質を低発現化することができるペプチドをコードする遺伝子、及びその遺伝子を用いたタンパク質の低発現化方法を提供することを目的の一つとしている。
【0041】
具体的には、タンパク質低発現化ペプチドがコードされた遺伝子は、少なくとも人又は猿の免疫不全ウイルスが有するnef遺伝子由来のタンパク質低発現化ペプチドがコードされた遺伝子である。
【0042】
また、より具体的に、前述の標的タンパク質を低発現化することができるペプチドをコードする遺伝子は、以下の(1)〜(20)に示す少なくともいずれか1つの塩基配列を有する。(1)配列番号1の第385-618番目の塩基で表される塩基配列;
(2)配列番号2の第129-206番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(3)配列番号2の第129-206番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第129-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(4)上記(1)〜(3)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第129-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(5)配列番号1の第424-618番目の塩基で表される塩基配列;
(6)配列番号2の第142-206番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(7)配列番号2の第142-206番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第142-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(8)上記(5)〜(7)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第142-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(9)配列番号1の第385-558番目の塩基で表される塩基配列;
(10)配列番号2の第129-186番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(11)配列番号2の第129-186番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第129-186番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(12)上記(9)〜(11)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第129-186番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(13)配列番号3の第415-651番目の塩基で表される塩基配列;
(14)配列番号4の第139-216番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(15)配列番号4の第139-216番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号4の第139-216番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(16)上記(13)〜(15)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号4第139-216番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(17)配列番号5の第481-789番目の塩基で表される塩基配列;
(18)配列番号6の第161-263番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(19)配列番号6の第161-263番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号6の第161-263番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(20)上記(17)〜(19)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号6第161-263番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【0043】
これらの低発現化配列(NDS配列)を融合させることにより任意の標的タンパク質の生体内での発現を有意に低下させることができる。例えば、本発明の低発現化ペプチドを融合させることにより、EGFPの生体内での発現量はPEST配列あるいはCL1-PEST配列を融合した場合と比較して、著しく低下する。特にPEST配列を例えば、EGFPのN末端に付加した場合にはほとんど低下効果は見られないのに対して、本発明のペプチド配列ではN末端に付加しても1/10以上の低下活性を示した。このようにして本発明の低発現化ペプチドをレポータータンパク質に融合させることにより、図5に示すように、S/N比の高い(バックグラウンドの低い)遺伝子応答をより高感度で的確に評価できるレポーターアッセイ系の構築が可能となる。
【0044】
さらに、本発明の低発現化ペプチド(NDS配列)付加による標的タンパク質の発現低下は、上記配列付加によるプロテアソーム分解系によるタンパク質分解促進の結果と考えられる。特に、近年、プロテアソーム阻害剤は多発性骨髄腫の治療薬(Bortezomib)に利用され、また免疫プロテアソーム阻害が関節リウマチに有効であることが報告され、他の自己免疫疾患も含めプロテアソーム阻害戦略が注目されている。そこで、本発明では、本発明のタンパク質発現低下ペプチド配列によるレポーターシグナルの低下を逆に元に戻すことを利用した、抗がん薬や自己免疫疾患の治療薬開発を目指したプロテアソーム阻害候補物質のスクリーニング系を提供することができる(図6参照。)。
【0045】
さらには、例えば抗体治療において、特定の抗体遺伝子に本発明塩基配列を付加することにより、抗原―抗体複合体の分解が促進され治療効果が高まることが考えられる。
【0046】
本発明において、「タンパク質低発現化」とは、所定の標的タンパク質の生体内での安定性を不安定化し、分解を促進された結果、ウェスタンブロッティングや蛍光光度計などによる測定に置いてタンパク質が低下して検出されることを指す。本発明におけるタンパク質の低発現化は、低発現化ペプチドを標的タンパク質に融合することにより、標的タンパク質を含む融合タンパク質のペプチダーゼに対する感受性高め、結果としてより迅速に標的タンパク質がペプチダーゼによって分解されることによると考えられる。
【0047】
本発明における「タンパク質低発現化ペプチド」とは、上記のように標的タンパク質と融合することによって生体内における標的タンパク質の量を低下させる機能を有するペプチドを意味する。一実施形態において本発明のタンパク質低発現化ペプチドは、例えば、配列番号2の129〜206番目のアミノ酸で表されるペプチドや、配列番号2の142〜206番目のアミノ酸で表されるペプチドや、配列番号2の129〜186番目のアミノ酸で表されるペプチドや、配列番号4の139〜216番目のアミノ酸で表されるペプチドや、配列番号6の161〜263番目のアミノ酸で表されるペプチド、又は前記各ペプチドにおいて1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ前記ペプチドと実質的に同一のタンパク質低発現化活性を有するタンパク質である。
【0048】
一実施形態において、本発明の好ましいタンパク質低発現化ペプチドは、
(a)配列番号2の第129〜206番目のアミノ酸で表されるタンパク質低発現化ペプチドの一部のペプチド断片又は前記ペプチドを含むより大きなペプチド断片あって、配列番号2の第129〜206番目で表される低発現化ペプチドと実質的に同程度の活性を有するペプチド断片;
(b)配列番号2の第142〜206番目のアミノ酸で表されるタンパク質低発現化ペプチドの一部のペプチド断片又は前記ペプチドを含むより大きなペプチド断片あって、配列番号2の第142〜206番目で表される低発現化ペプチドと実質的に同程度の活性を有するペプチド断片;
(c)配列番号2の第129〜186番目のアミノ酸で表されるタンパク質低発現化ペプチドの一部のペプチド断片又は前記ペプチドを含むより大きなペプチド断片あって、配列番号2の第129〜186番目で表される低発現化ペプチドと実質的に同程度の活性を有するペプチド断片;
(d)配列番号4の第139〜216番目のアミノ酸で表されるタンパク質低発現化ペプチドの一部のペプチド断片又は前記ペプチドを含むより大きなペプチド断片あって、配列番号4の第139〜216番目で表される低発現化ペプチドと実質的に同程度の活性を有するペプチド断片;
(e)配列番号6の第161〜263番目のアミノ酸で表されるタンパク質低発現化ペプチドの一部のペプチド断片又は前記ペプチドを含むより大きなペプチド断片あって、配列番号6の第161〜263番目で表される低発現化ペプチドと実質的に同程度の活性を有するペプチド断片;
である。
【0049】
本発明における「タンパク質低発現化ペプチドをコードする塩基配列」とは、上記タンパク質低発現化ペプチドをコードする任意の塩基配列を含む塩基配列であり、例えば、前記(1)〜(20)の塩基配列を云う。
【0050】
本発明において、「実質的に同一のタンパク質低発現化活性」とは、タンパク質低発現化タンパク質のタンパク質低発現化活性が、配列番号2の129〜206番目のアミノ酸で表されるペプチドや、配列番号2の142〜206番目のアミノ酸で表されるペプチドや、配列番号2の129〜186番目のアミノ酸で表されるペプチドや、配列番号4の139〜216番目のアミノ酸で表されるペプチドや、配列番号6の161〜263番目のアミノ酸で表されるペプチドの有する活性と比較して、実験誤差の範囲内であるか、又はそれ以上の活性を有することを意味する。
【0051】
本発明において、「ストリンジェントな条件」とは、特異的なハイブリダイゼーションのみが起き、非特異的なハイブリダイゼーションが起きないような条件をいう。このような条件は、通常「1×SSC、0.1%SDS、37℃」程度であり、好ましくは「0.5×SSC、0.1%SDS、42℃」程度であり、更に好ましくは「0.2×SSC、0.1%SDS、65℃」程度である。このようなストリンジェントな条件下で上記(1)〜(3)の塩基配列とハイブリダイズする配列は通常前記(1)の配列と高い相同性を有する。ここで、高い相同性とは、60%以上の相同性、好ましくは、75%以上の相同性、更に好ましくは90%以上の相同性、特に好ましくは95%以上の相同性を意味する。
【0052】
置換、付加、欠失又は挿入により変異したアミノ酸の数は、配列番号2の129〜206番目のアミノ酸で表されるペプチドや、配列番号2の142〜206番目のアミノ酸で表されるペプチドや、配列番号2の129〜186番目のアミノ酸で表されるペプチドや、配列番号4の139〜216番目のアミノ酸で表されるペプチドや、配列番号6の161〜263番目のアミノ酸で表されるペプチドと同程度のタンパク質低発現化活性を有する限りその個数は制限されないが、好ましくは20アミノ酸以下であり、より好ましくは15アミノ酸以下、更に好ましくは10アミノ酸以下、最も好ましくは5アミノ酸以下である。
【0053】
本発明において、「任意の抗体」とは抗体医薬で用いられる抗体をイメージしている。たとえば特定の抗体遺伝子に本発明塩基配列を付加することにより、抗原―抗体複合体の分解が促進され治療効果が高まることが考えられる。
【0054】
本発明において、「レポータータンパク質」とは、その遺伝子が発現して活性型タンパク質が形成されるとシグナルを発し、そのシグナルを測定することにより別の、目的の遺伝子の発現の検出を可能にするタンパク質をいう。よって、本発明のレポータータンパク質は、そのようなシグナルを発する性質を有し、その測定(あるいは検出)が比較的容易なタンパク質であれば特に制限されないが、例えばベータガラクトシダーゼ、ベータグルクロニダーゼ、ベータラクタマーゼ、ジアホラーゼ、アルカリホスファターゼ、パーオキシダーゼ、ルシフェラーゼ(ホタルルシフェラーゼ、ウミシイタケルシフェラーゼ)、緑色蛍光タンパク質(GFP、EGFP)及びエクオリン等を挙げることができる。好ましくは、緑色蛍光タンパク質(GFP、EGFP)、ルシフェラーゼである。
【0055】
本発明の一実施形態は、プロモーター配列並びに前記プロモーター配列の制御下にレポータータンパク質をコードする塩基配列及び本発明のタンパク質低発現化ペプチドをコードする塩基配列を有する遺伝子構築物である。ここで云うプロモーター配列とは、低発現化されたレポータータンパク質からのシグナルを利用して、その性質シグナルが解析される対象となるものである。本発明におけるプロモーター配列とは、プロモーター、エンハンサー及びサイレンサー等のシス作用性遺伝子発現制御配列、或いはその可能性があると考えられる塩基配列を意味し、そのような作用を有する配列であれば特に限定されない。本発明によりレポータータンパク質の発現が低下し(寿命が短縮される結果として)、それを利用して機能を解析する好ましいプロモーターとしては、HRE (hypoxia responsive element)を含むプロモーター, LTR (long terminal repeat)プロモーター、ERE (estrogen receptor response element)を含むプロモーター、及びCRE (cyclic AMP responsive element)を含むプロモーター などが挙げられる。
【0056】
本発明の遺伝子ないし遺伝子構築物を宿主に導入し、発現させることにより、プロモーターの機能や転写活性の変動を測定することができる。本発明の遺伝子構築体を細胞へ導入する方法としては、リン酸カルシウム法、DEAE‐デキストラン法、カチオニックリポソーム法などの化学的手法、アデノウイルスベクター、ワクシニアウイルスベクターやレトロウイルスベクター、HVJリポソームなどの生物学的手法、エレクトロポレーション、DNA直接注射、遺伝子銃などの物理的手法など、いずれの方法であってもよい。化学的手法やエレクトロポレーション法が一般的である。
【0057】
本発明における一過的な遺伝子導入とは、対象となる細胞にEGFP遺伝子構築物、例えばプラスミド状のもの、を前記方法で遺伝子導入し、導入された細胞・導入されなかった細胞を分離する(安定的に染色体に組み込まれた細胞を選択する)工程を実施することなく、導入後比較的短時間後に細胞試験に用いることを指す。安定的な遺伝子導入とは、導入された遺伝子が宿主の染色体に組み込まれるように導入することを意味する。
【0058】
好ましい本発明の一実施形態は、本発明のタンパク質低発現化遺伝子(NDS配列)を含む遺伝子構築物が導入された生物又はその一部である。本発明のタンパク質低発現化タンパク質をコードする遺伝子を生物に導入することで、特定のタンパク質の発現が低下されたトランスジェニック生物を作成することができる。ここで、本発明の遺伝子又は遺伝子構築物を導入する生物とは、特に制限されないが、微生物、植物、動物から必要に応じて選択される。好ましくは、ウシ、ウマ、ヒツジ、サル、ブタ、マウス、ラット、ハムスター、モルモット、ウサギ、イヌ等である。また、生物の一部とは、器官、組織、細胞等を意味する。
【0059】
本発明の遺伝子又は遺伝子構築物を導入する宿主細胞は、特に制限なく原核細胞、真核細胞(例えば、酵母、植物、動物(哺乳類、鳥類、昆虫等))等から必要に応じて適宜選択することができる。好ましくは、ヒト、ウシ、ウマ、ヒツジ、サル、ブタ、マウス、ラット、ハムスター、モルモット、ウサギ、イヌ等の哺乳類細胞であり、より好ましくはヒト由来の細胞である。特に、プロテアソーム阻害剤のスクリーニング系に本発明を用いる場合は、各種、ヒト由来の細胞(免疫担当細胞、多発性骨髄腫その他がん細胞など)を用いることが好ましい。
【0060】
本発明のタンパク質低発現化ペプチド(NDS配列)を融合させて、標的タンパク質を低発現化させる場合、本発明のタンパク質低発現化ペプチドは標的タンパク質のN末端側とC末端側のいずれに融合されてもよいが、好ましくはC末端側である。しかしながら、N末端に融合しても低発現活性を示す点は本発明ペプチドの有利な特徴の一つでもある。本発明のタンパク質低発現化ペプチドと標的タンパク質は、リンカー配列などを介して融合されてもよく、そのような配列を介在なく連続的に融合されていてもよい。
【0061】
本発明のタンパク質低発現化ペプチドは、単独で標的タンパク質と融合しても良いが、標的タンパク質を低発現化するという機能を発揮する限りにおいて、他のペプチドと組み合せて標的タンパク質と融合しても良い。他のペプチドとしては、例えば、PEST、CL1配列などのタンパク質不安定化配列、またはPTD (protein transduction domain)のようなタンパク質を細胞外から細胞内へ細胞膜を透過して取り込ませることができる配列を挙げることができる。また、本発明のタンパク質低発現化ペプチドは、2つ以上が連結された状態で標的タンパク質と融合されてもよい。
【0062】
本発明の好ましい一実施形態は、タンパク質低発現化タンパク質をコードした遺伝子又はそれを含む遺伝子構築物が導入された生物又はその一部を異なる条件下で培養して、レポータータンパク質のシグナルを測定し、プロモーターの転写活性を比較することから成る、プロモーター活性の分析方法である。ここで、異なる条件とは、例えば、温度、光、撹拌等によるストレスに関する条件、または化学物質、環境ホルモン、薬剤等による液性因子に関する条件等をさす。
【0063】
レポータータンパク質のシグナルとは、レポータータンパク質自身が発する又はレポータータンパク質と他の物質とが反応して発せられる検出可能な信号である。例えば、緑色蛍光タンパクであれば、プロモーターの制御下にその遺伝子の発現(蛍光)自体がシグナルとなる。発せられた蛍光は、マルチプレート用の蛍光光度計等を用いて測定、あるいは蛍光顕微鏡下で観察可能である。条件の変化に対応して発せられるシグナルを検出し、分析することによって、レポータータンパク質遺伝子の発現を制御しているプロモーターの性質を調べることが可能である。本発明の低発現化タンパク質によってレポーターの寿命が短縮されているため(分解が促進されているため)、比較的短い間隔で変化する条件に対応するプロモーターの応答も正確に測定することが可能である。
【0064】
本発明の別の好ましい一実施形態は、タンパク質発現低下化遺伝子若しくはそれを含む遺伝子構築物が導入された生物又はその一部を被検化合物の存在下及び非存在下で培養し、レポータータンパク質のシグナルを測定し、プロモーターの転写活性を比較することからなる、前記被検化合物のプロモーターに対する影響の評価方法である。ここで、被検化合物とは、特に制限はないが、好ましくは公知の又は新規な薬物であり、目的に応じて適宜選択される。被検化合物の存在下及び非存在下とは、被検化合物の量的な変化をも含む意味である。
【0065】
本発明のまた別の好ましい一実施形態は、タンパク質発現低下化遺伝子若しくはそれを含む遺伝子構築物が導入された生物又はその一部を被検化合物の存在下及び非存在下で培養し、レポータータンパク質のシグナルを測定比較することからなる、前記被検化合物の低タンパク発現活性に対する影響を評価する方法である。ここで、被検化合物とは、特に制限はないが、好ましくは公知の又は新規な薬物であり、プロテアソーム阻害剤候補物質、プロテアソーム分解に至るまでの一連の過程を阻害する候補物質などをさす(図6参照。)。
【実施例】
【0066】
以下、本発明の実施例を説明する。
実施例1〜7において、用いた材料および方法をまとめて述べ、引き続き、実施例8〜10で結果について述べる。
【0067】
[実施例1]
1. 野生型Nef発現ベクターの構築
Nef発現ベクターを作製するにあたり、動物細胞発現plasmidとしてinvitrogen製のpcDNA3.1D/V5-His-TOPO及びpcDNA4/HisMax Cが利用された。
pcDNA3.1D/V5-His-TOPOの特徴はC末端側にV5 epitope tagを融合させてNefタンパク質を発現させることができる。pcDNA4/HisMax Cの特徴は、開始コドンの上流にSP163配列(translational enhancer)が挿入されており、これによってタンパク質の発現を著しく増大させることができる。このvectorはアミノ末端側にXpress epitopeを融合させる形でタンパク質を発現させる。今回のNefタンパク質はアミノ末端にそのようなtagを融合させると本来の機能を消失することから、このvectorを利用してNef発現ベクターを作製するにあたり、Xpress epitope tagコードDNAを除き、さらにC末端側にV5 epitope tagを融合する形で作製している。
【0068】
Nef遺伝子はHIV-1NL4-3株を発現するpNL4-3プラスミドおよびHIV-1JR-CSF株を発現するpYK-JR-CSFを利用した。
【0069】
野生型Nef発現ベクターは以下の4種類を作製した。
pcDNA3.1/Nef JR-CSF-V5
pcDNA3.1/Nef NL4-3-V5
pcDNA4/HisMax/NefJR-CSF-V5
pcDNA4/HisMax/NefNL4-3-V5
【0070】
4種類の各野生型Nef発現ベクターの作製方法について以下に示す。
【0071】
(1-1. pcDNA3.1/Nef JR-CSF-V5の作製方法)
pYK-JRCSFを鋳型にしてNef F primerTOPO及びNef R primerTOPOをprimerとしてPfu Turbo DNA polymerase (Stratagene製)を用いてマニュアルに従いPCRを行うことで Nef領域DNAを増幅した。増幅したDNAをpcDNA3.1D/V5-His-TOPO(invitrogen製)のマニュアルに従いTOPO cloningを行った。DNA配列解析を行いpcDNA3.1/Nef JR-CSF-V5を得た。
【0072】
(用いたprimer pair)
Nef F primerTOPO : 5-CACCATGGGTGGCAAGTGGTCAAA AAG-3
Nef R primerTOPO : 5-GCAGTTCTTGAAGTACTCCGGATG-3
[1-2. pcDNA3.1/Nef NL4-3-V5の作製方法]
【0073】
(1-2. pcDNA3.1/Nef NL4-3-V5の作製方法)
pNL4-3を鋳型にして、NefNLCHFprimer及びNefNLCHRprimerをprimerとしてPfu Turbo DNA polymeraseを用いてPCRを行い、Nef領域DNAを増幅し、cloning vector であるpT7blue (Novagen製)にsubcloningした。DNAシーケンスを確認後、得られたクローンをBamHIおよびNot Iで切り出し、同じくBamHI及びNot IでcutしたpcDNA3.1D/V5-His-TOPOにligationし、pcDNA3.1/Nef NL4-3-V5を得た。
【0074】
(用いたprimer pair)
NefNLCHFprimer : 5-CTCGGATCCGGATTTTGCTATAAGATGGGTGGC -3
NefNLCHRprimer : 5-GAGCGGCCGCCGCAGTTCTTGAAGTACTC-3
【0075】
(1-3. pcDNA4/HisMax/NefJR-CSF-V5の作製方法)
pcDNA4/HisMax/Cを鋳型にして以下のprimer pairを用いてPfu Turbo DNA polymeraseを用いてPCRによりvectorを増幅させた。この増幅産物はアミノ末端側に融合されるXpress epitopeコードDNA領域を含まないSP163配列から上流(HisMaxR primer)と、pcDNA4/HisMax/Cのマルチクローニングサイト(MCS)のKpn I siteから下流 (HisMaxF primer)の間を増幅している。
【0076】
(用いたprimer pair)
HisMaxR primer : 5-GGTTTCGGAGGCCGTCCGG-3
HisMaxF primer : 5-GTACCAGGATCCAGTGTGGTG-3
【0077】
先に作製したpcDNA3.1/Nef JR-CSF-V5を鋳型にして以下のprimer pairを用いてNef JR-CSF-V5の開始コドンからV5 epitope コード領域とstopコドンを含む領域までをPfu Turbo DNA polymeraseを用いてPCRにより増幅した。
(用いたprimer pair)
HismaxNefF : 5-ATGGGTGGCAAGTGGTCAAA-3
TopoR primer : 5-TCAATGGTGATGGTGATGATG-3
【0078】
増幅させたvector領域と、T4 polynucleotide kinaseでリン酸化処理したNef JR-CSF_V5領域DNAをligationさせ、得られたplasmid cloneのDNA配列解析を行いpcDNA4/HisMax/NefJR-CSF-V5を得た。
【0079】
(1-4. pcDNA4/HisMax/NefNL4-3-V5の作製方法)
pcDNA4/HisMax/NefJR-CSF-V5を鋳型にして、Pfu Turbo DNA polymeraseを用いてPCRによりHisMaxR primerおよびHisMaxF2 primerを用いてvector領域を増幅した。このvector領域にはNefのC末端側に融合されるV5 epitopeをコードDNAが含まれる。
【0080】
(用いたprimer pair)
HisMaxR primer : 5-GGTTTCGGAGGCCGTCCGG-3
HisMaxF2 primer : 5-GGCCGCTGCAGTCTAGAGG-3
【0081】
pcDNA3.1/Nef NL4-3-V5を鋳型にして、Pfu Turbo DNA polymeraseを用いてPCRによりHisMaxNefおよびNefR primerを用いてNefNL4-3DNAを増幅した。この増幅DNAはNefのC末端側に融合されるV5 epitopeをコードするDNAを含まない。
【0082】
(用いたprimer pair)
HismaxNefF : 5-ATGGGTGGCAAGTGGTCAAA-3
Nef R primer TOPO : 5-GCAGTTCTTGAAGTACTCCGGATG-3
【0083】
増幅させたvector領域と、T4 polynucleotide kinaseでリン酸化処理したNefNL4-3DNAをligationさせ、得られたplasmid cloneのDNA配列解析を行い、pcDNA4/HisMax/NefNL4-3-V5 を得た。
【0084】
[実施例2]
(2. 変異型Nef NL4-3/JR-CSF chimera_V5発現ベクターの作製方法)
Nef JR-CSF の1〜139アミノ酸残基に、NefNL4-3の129〜206アミノ酸残基を連結され、さらにV5エピトープがC末端側に融合されるNef NL4-3/JR-CSF chimera_V5を発現するベクターを構築した。
【0085】
pcDNA4/HisMax/NefJR-CSF-V5を鋳型としてNef JR-CSFのアミノ末端側をコードする587 bpのDNA#1とpcDNA4/HisMax/NefNL4-3-V5 を鋳型としてNefNL4-3のC末端側をコードする357 bpのDNA#2をPCRで増幅する。増幅されたDNA#1の3’側67 bpとDNA#2の5’側67bpは同じ配列となる。DNA#1とDNA#2を混合しPCRを行うと、PCR中に67 bpのオーバーラップする配列がハイブリダイズしDNA#1とDNA#2が連結した877 bpのDNA#3が増幅する。
【0086】
DNA#3をHindIIIおよびSacIIでcutしたDNAフラグメントと、pcDNA4/HisMax/NefJR-CSF-V5を同じくHindIIIおよびSacIIでcutして得られたvector領域をligationし、NefNL4-3/JR-CSF chimera_V5発現ベクターであるpcDNA4/HisMax/Nef NL4-3/JR-CSF chimera_V5を得た。
【0087】
(DNA#1を増幅するために使用したprimer pair)
NefJRHind F : 5-AACTTAAGCTTAGCGCAGAG-3
NefJRChimR1 : 5-GTGTAGTTCTGCCAATCAG-3
【0088】
(DNA#2を増幅するために使用したprimer pair)
NefNLchimF1 : 5-GACAAGATATCCTTGATCTG-3
NefNLSacR : 5-GGTTAGGGATAGGCTTAC-3
【0089】
[実施例3]
(3. NDS、PEST、またはCL1-PEST融合型EGFP発現ベクターの作製方法)
【0090】
EGFPのアミノ末端側に融合できるタンパク質を高発現するベクターであるpEGFP-N1_G4S3_SP163_His/Xpress/Aが利用された。このベクターはClontech製のEGFP融合タンパク質発現ベクターであるpEGFP-N1のマルチクローニングサイトにinvitrogen製のタンパク質発現ベクターpcDNA4/HisMax AのSP163及び6xHis/Xpress epitopeコードDNA、およびリンカー配列(GlyGlyGlyGlySer)x3をコードするDNAが導入されたベクターである。pEGFP-N1と比較してEGFP融合タンパク質の発現が亢進し、さらにXpress epitope tagを付加したタンパク質発現が可能となり、抗Xpress抗体によるタンパク質検出が可能になる。
【0091】
pEGFP-N1_G4S3_SP163_His/Xpress/Aのマルチクローニングサイト(EcoRI、Sal I)にEcoRI site及びSal I siteを含むprimerで増幅したNDS、PEST、またはCL1-PESTをコードするDNAが挿入され、pEGFP-N1_G4S3_SP163_His/Xpress/A/NDS、pEGFP-N1_G4S3_SP163_His/Xpress/A/PEST、及びpEGFP-N1_G4S3_SP163_His/Xpress/A/CL1-PESTが得られた。PESTおよびCL1-PESTコードDNAのPCRによる増幅には、Promega製のpGL4.78[hRlucCP/Hygro] vectorが鋳型として利用された。
【0092】
(NDSコードDNAを増幅するために使用したprimer pair)
NDS129_206_EcoRF: TAGAATTCTGCCAGGGCCAGGGGTC
NDS129_206_SaL R: TACGTCGACTGGCAGTTCTTGAAGTAC
PESTおよびCL1-PESTをコードするDNAを増幅するために使用したprimers
CL1PEST_EcoRF : TAGAATTCTGGCTTGCAAGAAC
PEST_EcoRF : TAGAATTCTGAGCCACGGCTTC
PEST_SalR : TACGTCGACTGGACGTTGATCCTG
【0093】
NDSのアミノ酸配列 78残基
PGPGVRYPLTFGWCYKLVPVEPDKVEEANKGENTSLLHPVSLHGMDDPEREVLEWRFDSRLAFHHVARELHPEYFKNC
CL1-PESTのアミノ酸配列 57残基
ACKNWFSSLSHFVIHLNSHGFPPEVEEQAAGTLPMSCAQESGMDRHPAACASARINV
PESTのアミノ酸配列 40残基
SHGFPPEVEEQAAGTLPMSCAQESGMDRHPAACASARINV
【0094】
[実施例4]
(4. 細胞培養法)
Human embryonic kidney (HEK)293細胞は、10%FCS、100 IU/ml penicillin、及び 100 μg/ml streptomycinを含むDulbecco’s modified Eagle’s medium (DMEM)で37℃、5%CO2下で培養された。CD4を安定発現するHEK293//CD4細胞は、10%FCS、100 IU/ml penicillin、100 μg/ml streptomycin、及び200 μg/ml G418を含むDMEMで37℃、5%CO2下で培養された。
【0095】
[実施例5]
(5. トランスフェクション及び細胞の可容化)
1 x 106 cells/wellのHEK293細胞を6well plateに播き、一夜培養後、1 well あたり2.5 μgの各種Nef発現plasmidまたはEGFP融合タンパク質発現plasmidをLipofectamineLTX reagent (invitrogen)を用いて、マニュアルに従いトランスフェクションを行った。48時間培養後、細胞をplateから剥がし、PBS (-)で2回洗浄後、lysis buffer (50 mM Tris-HCl pH8.0, 150 mM NaCl, 1% Triton X-100)で細胞を懸濁し4℃で30分間放置し細胞を可容化した。
【0096】
[実施例6]
(6. SDS-PAGE及びwestern blot 分析)
得られた細胞可容化上清をLaemmiliの方法に従いsodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE)に供し、以下に示すようにwestern blot法によりタンパク質を検出した。
【0097】
SDS-PAGEにより分離したタンパク質をpolyvinylidine difluoride (PVDF)膜に電気的に転写した。得られた転写PVDF膜は5%スキムミルクでマスキングされた。発現する各Nefタンパク質はC末端側にV5 epitopeが融合しているので、Nefの検出には抗V5抗体が利用された。EGFP融合タンパク質はXpress epitope tagが付加されていることから、抗Xpress抗体が利用された。1%スミムミルク含有TBS buffer (10 mM Tris-HCl pH7.5, 500 mM NaCl) で5,000倍希釈した抗V5抗体または抗Xpress抗体で転写PVDF膜を4時間処理し、転写PVDF膜をTBS bufferで洗浄後、1%スミムミルク含有TBS bufferで1,000倍希釈したペルオキシダーゼ標識抗マウスIgG抗体で1時間処理した。再び転写PVDF膜をTBS bufferで洗浄後、Western Lighting Plus-ECL Enhanced Chemiluminescence substrate (PerkinElmer Inc)を用いてマニュアルに従いタンパク質の検出を行った。検出されたタンパク質のバンドの強度はFujifilm Image Gauge Softwareを用いて定量された。
【0098】
[実施例7]
(7. Nef安定発現HEK293/CD4細胞の構築)
5の方法に準じて2.5 μgのpcDNA4/HisMax/NefJR-CSF-V5又はpcDNA4/HisMax/NefNL4-3-V5をHEK293/CD4細胞にトランスフェクトし、4の方法で48時間培養後、500 μg/ml となるようにZeocinを添加しさらに継体培養した。得られたZeocin耐性のHEK293/CD4細胞におけるNefの発現を、western blot および免疫染色で確認した後、細胞を限外希釈し96 well plateの1wellあたり1個となるように細胞を播き zeocin存在下培養した。顕微鏡下でコロニーが1つである細胞を選択し、細胞を増殖させクローンを得た。
【0099】
[実施例 8]
本発明のきっかけになった実験であるが、HEK293/CD4細胞に野生株である、HIV-1JR-CSF由来のNef遺伝子およびHIV-1NL4-3株由来のNef遺伝子を発現ベクターに導入して、Nefタンパク質の発現量を比較した。その結果、図1に示すように、一過性発現系においても、また安定発現系に置いてもHIV-1NL4-3株由来のNef遺伝子の発現量が著しく低かった。一過性発現系では、1/5以下、安定発現系では、1/10〜1/100であった。
【0100】
[実施例 9]
HIV-1JR-CSF 由来のNefタンパクおよびHIV-1NL4-3株由来のNefタンパク質のアミノ酸のアラインメントの結果、HIV-1NL4-3株由来のNefのアミノ酸番号129〜206のC末端側領域がHIV-1JR-CSFのC末端のアミノ酸配列(139〜216に相当)とホモロジーが低いことに着目し、HIV-1NL4-3株由来のNefのアミノ酸番号129〜206領域をHIV-1JR-CSFのC末端の相当領域と置き換えたキメラを作成し(図2参照)、Nefタンパク発現を検討した。その結果、図3に示すように、キメラ遺伝子のNefタンパク発現は1/10以下と著しく低下した。この結果から、HIV-1NL4-3株由来のNefのアミノ酸番号129〜206領域が、タンパク発現低下活性を持つことが示された。
【0101】
[実施例 10]
次に、本発明配列(HIV-1NL4-3株由来のNefのアミノ酸番号129〜206領域)を増強緑色蛍光タンパク(EGFP)のN末端側に付加し発現低下活性を、既に公知で実際市販されている、タンパク発現抑制配列である、PEST,CL1/PESTと比較した。N末端に付加したせいか、PESTには、全く発現低下活性は見られず、CL1/PESTは、およそ1/10の低下活性が見られた。これに対し、図4に示すように、本発明配列は、1/20〜1/50と著しい低下活性を示した。このように、本発明配列は、C末端のみでなく、N末端に付加しても効果があると言う利点がある。
【0102】
[実施例 11]
(11. 注目するタンパク質(EGFP)のC末端側へのNDSの連結およびリンカー配列の挿入の効果)
タンパク質によっては、N末端側あるいはC末端側に別の配列を付加することで、本来の機能を消失する場合がある。したがって、NDSの付加による注目するタンパク質の低発現化を誘導させるにあたって、タンパク質のN末端側およびC末端側の何れにNDSを連結してもその低発現化を誘導できれば、NDSの汎用性が高まる。先に述べた実施例10では、EGFPのN末端側にNDSを連結することでEGFPの低発現化の誘導を確認したが、本実施例11では、EGFPのC末端側にNDSを連結した場合のEGFPの低発現化誘導の確認を行った。また併せて、タンパク質を融合する際に構造的にフレキシビリティーの高いリンカーを挿入することで低発現誘導に差異が認められるかどうか検討した。
【0103】
具体的には、EGFPをコードするDNAの3’側の終止コドンを除去しNDS、CL1-PEST、及びPEST配列をコードするDNAを連結したDNAを作成し動物細胞用の発現ベクター(pcDNA4)のマルチクローニングサイトに導入した。
【0104】
また上述の発現ベクターにおいて、EGFPとNDS、CL1-PEST、及びPESTの間にGlyGlyGlySerGlyGlyGlySerGlyGlyGlySer (GGGSx3)のリンカー配列をコードしたDNAを挿入したものも調製した。
【0105】
得られたDNAをHEK293細胞にリポフェクトアミンLTXによりトランスフェクションし48時間後に細胞を回収し、常法に従いウエスタンイムノブロットを行った。
【0106】
その結果を図7に示す。図7は、EGFPのC末端側にNDSを連結し、その発現レベルを示した説明図である。NDSの他に既に実用化されているCL1-PEST, PEST配列を同様にEGFPに連結した場合と比較した。その結果、NDSをEGFPに連結することにより、その発現レベルが顕著に低下し、その効果はCL1-PESTおよびPESTよりも強力であった。
【0107】
また、図7AはEGFPとNDSの間にGGGSx3のリンカー配列が挿入されており、図7Bではそのリンカーは挿入されていない。結果に示すとおり、リンカーを挿入した場合がより効果的に発現レベルの低下が認められた。
【0108】
このように、前述の実施例10及び本実施例11の結果から、NDSを任意のタンパク質に付加する場合、そのN末端側およびC末端側の何れに連結しても低発現化が誘導できることが示された。またリンカー配列を挿入することで低発現能が増強されることが明らかになった。
【0109】
[実施例 12]
(12.各NDS誘導体(変異体)が示す多様なタンパク質低発現化レベル)
次に、HIV-1 NL4-3 Nef由来のNDS(78アミノ酸残基)のN末端側13残基を欠損させたAA142-206-EGFP、NDSのC末端側20残基を欠損させたAA129-186-EGFP、およびN末端側とC末端側の両方を欠損させたAA142-186-EGFPを発現するベクターを作成し、これらの発現レベルとNDS-EGFPおよびEGFPとの発現レベルとの比較を行った。
【0110】
具体的には、HEK293細胞に上述の発現ベクターを、リポフェクトアミンLTXを利用してトランスフェクションし48時間後に細胞を回収し、常法に従いウエスタンイムノブロットを行った。
作成したNDSの変異体の配列と野生型NDS(HIV-1 NL4-3 Nef由来)の配列は以下の通りである。
NDS: PGPGVRYPLTFGWCYKLVPVEPDKVEEANKGENTSLLHPVSLHGMDDPEREVLEWRFDSRLAFHHVARELHPEYFKNC
AA142-206:
CYKLVPVEPDKVEEANKGENTSLLHPVSLHGMDDPEREVLEWRFDSRLAFHHVARELHPEYFKNC
AA129-186:
PGPGVRYPLTFGWCYKLVPVEPDKVEEANKGENTSLLHPVSLHGMDDPEREVLEWRFD
AA142-186:
CYKLVPVEPDKVEEANKGENTSLLHPVSLHGMDDPEREVLEWRFD
【0111】
その結果、図8Aに示すとおり、NDS配列のN末端側13残基を欠損させたAA142-206-EGFP、C末端側20残基を欠損させたAA142-186-EGFPは野生型NDS-EGFPと比較して発現レベルが上昇したがEGFPよりも低いレベルであった。両方を欠損させたAA142-186-EGFPの発現レベルはEGFPの発現レベルとほぼ同等であり、低発現化を誘導しなかった。低発現化効果の順位としてはNDS-EGFP > AA129-186-EGFP > AA242-206-EGFP > AA142-186-EGFP = EGFPであった。この結果から、注目するタンパク質の低発現化を誘導するとき、これらの配列を利用すれば多様性を持たせることができ、目的に応じた発現レベルを示すタンパク質を作製することが出来る。
【0112】
[実施例 13]
次に、HIV-1 NL4-3株ではない他の株のNef由来のNDSを用いてタンパク質の低発現化の検証を行った。すなわち、上述してきた実施例におけるNDSはNefNL4-3由来配列であったが、他のHIV-1株であるJRCSF株のNefのNDSの相同領域 (JNDS)および同じレンチウイルスでありサルにエイズを引き起こすSIVmac239のNefのNDS相当領域(macNDS)を、同様にEGFPのアミノ末端側にリンカーを介して連結し発現するベクターを作成した。
【0113】
検討したJNDSおよびmacNDS配列は以下の通りである。
JNDS:
AGPGVRFPLTFGWCFKLVPVDPEKVEEANEGENNCLLHPMSQHGMDDPEKEVLVWKFDSKLALHHVARELHPEYFKNC
macNDS:
SGPGIRYPKTFGWLWKLVPVNVSDEAQEDEEHYLMHPAQTSQWDDPWGEVLAWKFDPTLAYTYEAYVRYPEEFGSKSGLSEEEVRRRLTARGLLNMADKKETR
【0114】
その結果図8Bに示すとおり、macNDS-EGFPおよびJNDS-EGFPの発現レベルはNDS-EGFPより低く、macNDSの低発現効果はもっとも強力であった。本実施例12の結果より、HIV-1 NL4-3株のNef由来NDSより低発現効果が強力なNDS誘導体を得た。
【0115】
[実施例 14]
(14.NDSの連結によるRenilla luciferaseの発現レベルの低下)
次に、NDS連結によるタンパク質の低発現効果はEGFPだけでなく普遍的に起こるかどうかについて検討を行った。
具体的には、NDS-EGFPの発現ベクターのEGFPコード領域をRenilla luciferase (Rluc)をコードするDNAと置換しRlucのアミノ末端側にNDSを連結して発現するNDS-Rluc発現ベクターを構築した。また、同様にCP-Rlucを構築した。得られたDNAをHEK293細胞にトランスフェクションし、24時間後、coelenterazineを基質とする生物発光反応をルミノメーターで検出した。
【0116】
その結果、図9に示すように、NDS-Rlucの発光レベルは野生型RlucおよびCP-Rlucよりも低いレベルであった。このことから、NDSはEGFPだけでなく、Rlucも連結することで低発現化を誘導することが明らかになった。NDSの低発現性の誘導がより普遍的に任意のタンパク質で起こりうることが示唆された。またRlucはレポータータンパク質として汎用されており、NDSによる低発現化をRlucのレポータータンパク質としての高感度化・高S/N比化を付与すると考えられる。
【0117】
[実施例 15]
(15.プロテアソーム阻害剤処理によるNDS融合タンパク質の発現レベルの上昇効果) 次に、プロテアソーム阻害剤処理でNefNL4-3およびNDS-EGFPの発現レベルの回復が認められるかどうかを検討した。
【0118】
具体的には、NefNL4-3またはNDS-EGFPの発現ベクターをHEK293にトランスフェクトし、48時間後、MG132を20μM処理した。処理0時間、3時間、及び6時間後に細胞を回収し、常法に従いウエスタンイムノブロットにより発現レベルを調べた。
【0119】
その結果、図10に示すとおり、プロテアソーム阻害剤MG132を処理すると、時間依存的な発現量の回復が認められた。ことことから、NDSによる低発現化には少なくともプロテアソームによる分解が関連していることが示唆された。
【0120】
プロテアソーム阻害剤は、がんの一種である多発性骨髄腫の治療薬として現在臨床応用されている。また近年、リウマチの治療ターゲットとしてもプロテアソームは注目を集めている。NDSによる低発現化の機構としてプロテアソームによる分解が関連していることから、NDSを連結させたレポータータンパク質は、プロテアソームを標的とする治療薬開発のためのスクリーニング系に利用できると考えられる。
【0121】
最後に、上述した各実施の形態の説明は本発明の一例であり、本発明は上述の実施の形態に限定されることはない。このため、上述した各実施の形態以外であっても、本発明に係る技術的思想を逸脱しない範囲であれば、設計等に応じて種々の変更が可能であることは勿論である。
【技術分野】
【0001】
本発明は、タンパク質を不安定化し、生体内でのタンパク質のターンオーバーを促進し、結果的にタンパク質の低発現化をもたらす技術に関する。より詳細には、本発明はタンパク質低発現化ペプチドを標的タンパク質(例えば、増強緑色蛍光タンパク(EGPF)等のレポータータンパク質)に融合し、標的タンパク質の生体内での低発現化を行う技術、及びそれを利用して生体内での遺伝子発現をより正確に観察する技術、さらには低発現化を元に戻すことを利用したプロテアソーム阻害剤のスクリーニング系に関する。
【背景技術】
【0002】
ライフサイエンス特に細胞生物学の分野において、緑色蛍光タンパク質(GFPあるいはEGPF)は、遺伝子発現のレポーターとして使用したり、また、タンパク質の細胞内局在を調べるために広く用いられている。例えば、GFP(またはEGPF)遺伝子に転写活性領域を挿入し、それを導入した培養細胞を一定時間、薬剤等で処理した後、細胞を集め(あるいはそのままで)、488 nm付近の励起波長で励起して発せられる508 nm付近の蛍光強度を測定することで、細胞内で合成されたGFP量を定量し転写活性を評価するシステム等が知られている。GFPをレポータータンパク質として用いた分析系は、発光量から転写活性を評価するので定量性に優れており、既にGFPの発光量測定を利用したシステム関連製品が多く開発され、市販化されている。
【0003】
このGFPは、細胞内において比較的安定なタンパク質である。このような特性を有するため、細胞内に蓄積し易く、検出が容易という利点がある。
【0004】
しかしながら、GFP等のレポータータンパク質を用いて、遺伝子発現の経時的な変化(例えば、プロモーター転写活性)をモニターする場合、レポータータンパク質の安定性ゆえに正確な測定が阻害される場合がある。これは、レポータータンパク質が、その発現が検出された後も安定に存在し、シグナルを発し続けるため、その後のモニタリングにおけるバックグラウンドを増大させる結果となるためであり、いわゆる、S/N比(シグナル/ノイズ)が低下する。よって、ある刺激に対する生体の反応をレポータータンパク質の発現量の変化によって正確且つ適切に(タイムラグなく)観察・評価するためには、レポータータンパク質が発現し、そのシグナルが検出された後、適当な寿命で、分解(不活性化)されることが望ましい。
【0005】
細胞内タンパク質の安定性はそれぞれのタンパク質ごとに幅広く異なっている。タンパク質の速いターンオーバーは、しばしば、タンパク質の分解を誘発するシグナルによって引き起こされる。これらのシグナルには、PEST配列のようなペプチド、リン酸化のような修飾、あるいはタンパク質間相互作用などが上げられる(例えば、非特許文献1、2、3を参照。)。
【0006】
中でも、タンパク質の分解を促進するペプチドは注目を集めている(特許文献1を参照。)。特にPEST配列は、マウスではオルニチンデカルボキシラーゼ(ODC)(生体にあってはポリアミン合成の鍵となる酵素である)のC末端側に位置し、ODCの活性そのものには直接関与しないが、ODCの短寿命(分解促進)の原因になっていることが確認され、この配列を標的タンパク質と融合することによる標的タンパク質の分解促進が試みられている(非特許文献4を参照。)。なお、PESTとは、プロリン(P)、グルタミン酸(E)、セリン(S)及びスレオニン(T)の豊富なアミノ酸配列を意味する。しかしながら、PEST配列によっても分解促進がそれほど進まないタンパク質の例なども報告され、PEST以外のより分解活性の高いアミノ酸配列の探索も望まれるところである(特許文献2を参照。)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特許公表2002-512015
【特許文献2】特許公開2009-136154
【非特許文献】
【0008】
【非特許文献1】Rogers,S.R.,Wells,R.,and Rechsteiner,M.(1986) Science, 234,364-368.
【非特許文献2】Papavassiliou,A.G.,Treier,M.,Chavrier,C,and Bohmann,D. (1992)Science, 258,1941-1944.
【非特許文献3】Scheffner,M.,Werness,B.A.,Huibregtse,J.M.,Luvine,A.J.,Howley,P.M. (1990)Cell 63,1129-1136.
【非特許文献4】Xianqiang Li, Xianqiang Zhao, Yu Fang,Xin Jiang, Tommy Duong, Connie Fan, Chiao-Chain Huang, and Steven R.Kain (1998) J.Biol.Chem. 273,34970-34975
【発明の概要】
【発明が解決しようとする課題】
【0009】
ところで、本発明者らは、エイズの原因ウイルスであるhuman immunodeficiency virus type-1 (HIV-1)が有する大きな特徴の一つ、易変異原性に着目して研究を進めている。
【0010】
感染個体内においてHIV-1は、免疫や抗HIV薬等による複製阻害の圧力を受ける。それに対してHIV-1は、易変異原性により自身のゲノム内に高頻度に変異を導入することにより免疫回避や薬剤耐性の形質を獲得し、自身の複製・生存を可能にしている。
【0011】
本発明者らは、そのようなHIV-1の柔軟な複製環境に対する適応能力に着目し、様々なHIV-1株(クローン)間の特徴を、種々の指標で比較し、その差異が生じる原因・機構を明らかにすれば、そこには新規の有用な生化学的活性を見いだせると考えた。
【0012】
そこで、本発明者らは、先ずHIV-1の病原性因子の一つとして知られているNefに注目し、HIV-1株間におけるその発現量とCD4ダウンレギュレーション活性を指標に差を調べた。HIV-1NL4-3株とHIV-1JR-CSF株由来のNefを比較した結果、両者の間でその発現量とCD4ダウンレギュレーション活性に著しい差異があることを見出し、その差異はHIV-1NL4-3株のNefの発現量が著しく低いことが要因であることを明らかにした。
【0013】
発明者らは、次いでHIV-1JR-CSF株由来およびHIV-1NL4-3株由来Nefのアミノ酸配列を並べ詳細に検討したところ、C末端領域でHIV-1NL4-3株由来Nefのアミノ酸配列で言うと129−206残基(以下、株にかかわらず、当該領域に相当する配列を「NDS配列」という。)において、比較的ホモロジーが低いことに着目した。発明者らは、この領域のペプチドがNefタンパクの低発現(分解)の原因と考え、HIV-1JR-CSF株の相当領域をこのペプチドで置き換えたキメラを作成し、Nefタンパク発現を検討したところ、発現の著しい低下を認めた。また、後に詳述するが、EGFPにこの配列を付加した場合も、顕著なEGFP発現の低下を認めた。
【0014】
本発明は、かかる見地より完成されたものであって、標的のタンパク質と融合させることによって標的タンパク質を低発現化することができるペプチドをコードする遺伝子、及びその遺伝子を用いたタンパク質の低発現化方法を提供することを目的とする。また、本発明は前記の方法を用いて低発現化されたレポータータンパク質を利用して、より正確にプロモーター活性分析をする方法、ならびに低発現化能が低下しその発現量が回復することを利用したプロテアソーム阻害剤のスクリーニング系を提供することを目的とする。
【課題を解決するための手段】
【0015】
上記課題を解決するために、請求項1に係る発明では、少なくとも人又は猿の免疫不全ウイルスが有するnef遺伝子由来のタンパク質低発現化ペプチドがコードされた遺伝子を提供する。
【0016】
また、請求項2に係る発明では、以下の(1)〜(4)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子を提供する。
(1)配列番号1の第385-618番目の塩基で表される塩基配列。
(2)配列番号2の第129-206番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列。
(3)配列番号2の第129-206番目のアミノ酸で表されるアミノ酸配列において、1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第129-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
(4)上記(1)〜(3)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第129-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【0017】
また、請求項3に係る発明では、以下の(5)〜(8)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子を提供する。
(5)配列番号1の第424-618番目の塩基で表される塩基配列;
(6)配列番号2の第142-206番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(7)配列番号2の第142-206番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第142-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(8)上記(5)〜(7)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第142-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【0018】
また、請求項4に係る発明では、以下の(9)〜(12)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子を提供する。
(9)配列番号1の第385-558番目の塩基で表される塩基配列;
(10)配列番号2の第129-186番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(11)配列番号2の第129-186番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第129-186番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(12)上記(9)〜(11)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第129-186番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【0019】
また、請求項5に係る発明では、以下の(13)〜(16)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子を提供する。
(13)配列番号3の第415-651番目の塩基で表される塩基配列;
(14)配列番号4の第139-216番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(15)配列番号4の第139-216番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号4の第139-216番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(16)上記(13)〜(15)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号4第139-216番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【0020】
また、請求項6に係る発明では、以下の(17)〜(20)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子を提供する。
(17)配列番号5の第481-789番目の塩基で表される塩基配列;
(18)配列番号6の第161-263番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(19)配列番号6の第161-263番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号6の第161-263番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(20)上記(17)〜(19)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号6第161-263番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【0021】
また、請求項7に係る発明では、任意の標的タンパク質をコードする塩基配列の5’末端及び/又は3’末端に、請求項1〜6いずれか1項に記載の遺伝子の塩基配列を付加した遺伝子構築物とした。
【0022】
また、請求項8に係る発明では、任意の標的タンパク質をコードする塩基配列の5’末端及び/又は3’末端に、リンカーを介して請求項1〜6いずれか1項に記載の遺伝子の塩基配列を付加した遺伝子構築物とした。
【0023】
また、請求項9に係る発明では、請求項7又は請求項8に記載の遺伝子構築物において、前記任意の標的タンパク質は、任意の抗体であることに特徴を有する。
【0024】
また、請求項10に係る発明では、請求項7又は請求項8に記載の遺伝子構築物において、前記任意の標的タンパク質は、ウイルス構造タンパク質であることに特徴を有する。
【0025】
また、請求項11に係る発明では、プロモーターを備え、同プロモーターの制御下に、レポータータンパク質をコードする塩基配列と、請求項1〜6いずれか1項に記載の遺伝子の塩基配列とを有する遺伝子構築物とした。
【0026】
また、請求項12に係る発明では、請求項11に記載の遺伝子構築物において、前記レポータータンパク質が増強緑色蛍光タンパク(EGFP)であることに特徴を有する。
【0027】
また、請求項13に係る発明では、請求項7〜12のいずれか1項に記載の遺伝子構築物を含む発現ベクターとした。
【0028】
また、請求項14に係る発明では、請求項7〜12のいずれか1項に記載の遺伝子構築物及び/又は請求項13に記載の発現ベクターを、一過的又は安定的に発現するように導入された細胞とした。
【0029】
また、請求項15に係る発明では、請求項14に記載の細胞を備えた生物とした。
【0030】
また、請求項16に係る発明では、請求項14に記載の細胞、又は、請求項15に記載の生物を、それぞれ異なる条件下で培養し、レポータータンパク質のシグナルを測定し、プロモーターの転写活性を比較することからなる、プロモーター活性の分析方法とした。
【0031】
また、請求項17に係る発明では、請求項14に記載の細胞、又は、請求項15に記載の生物を、被検化合物の存在下及び非存在下で培養し、レポータータンパク質のシグナルを測定し、プロモーターの転写活性を比較することにより、前記被検化合物のプロモーターに対する影響を評価する方法とした。
【0032】
また、請求項18に係る発明では、請求項17に記載の方法により被検化合物のプロモーターに対する影響の評価を行って、前記被験化合物の中から、所定の化合物をスクリーニングするスクリーニングキットとした。
【0033】
また、請求項19に係る発明では、請求項14に記載の細胞、又は、請求項15に記載の生物を、被検化合物の存在下及び非存在下で培養し、レポータータンパク質のシグナルを測定比較することからなる、前記被検化合物の低タンパク質発現活性に対する影響を評価する方法とした。
【0034】
また、請求項20に係る発明では、請求項19に記載の方法において、低タンパク質発現活性に影響を及ぼす披検化合物がプロテアソーム阻害剤候補物質であることに特徴を有する。
【0035】
また、請求項21に係る発明では、請求項19に記載の方法により、被検化合物の低タンパク質発現活性に対する影響の評価を行って、前記被験化合物の中から所定の化合物をスクリーニングするスクリーニングキットであって、前記被験化合物は、プロテアソーム阻害剤候補物質であることを特徴とするスクリーニングキットとした。
【0036】
さらに、請求項22に係る発明では、以下の(1)〜(3)の工程を含む、標的タンパク質を低発現化させる方法とした。
(1)請求項1〜6いずれか1項に記載の遺伝子を、標的タンパク質をコードする遺伝子と連結させる工程、
(2)工程(1)で得た組換え遺伝子を、発現ベクターに取り込む工程、
(3)工程(2)で得た発現ベクターを宿主細胞に導入し、発現させる工程。
【発明の効果】
【0037】
本発明によれば、標的のタンパク質と融合させることによって標的タンパク質を低発現化することができるペプチドをコードする遺伝子、及びその遺伝子を用いたタンパク質の低発現化方法を提供することができる。また、前記の方法を用いて低発現化されたレポータータンパク質を利用して、より正確にプロモーター活性分析をする方法、ならびに低発現化能が低下しその発現量が回復することを利用したプロテアソーム阻害剤のスクリーニング系を提供することができる。
【図面の簡単な説明】
【0038】
【図1】HIV-1NL4-3株由来のNef遺伝子の発現量が著しく低いことを示す図である。
【図2】HIV-1NL4-3株由来のNefのC末端側(アミノ酸番号129〜206領域)をHIV-1JR-CSFのC末端の相当領域(139〜216)と置き換えたキメラ発現系構築の模式図である。
【図3】HIV-1NL4-3株由来のNefのC末端側(アミノ酸番号129〜206領域)に、Nefタンパク発現低下活性のあることを示した図である。
【図4】HIV-1NL4-3株由来のNef(アミノ酸番号129〜206領域)、PEST,およびPEST/CL1 をそれぞれ、EGFPのN末端に付加し、EGFPの発現低下活性を比較した図である。
【図5】本発明の配列を用いた、高感度レポーターアッセイ系の説明図である。
【図6】本発明の配列を用いた、プロテアソーム阻害剤候補物質スクリーニング系の説明図である。
【図7】EGFPのC末端側にNDSを連結し、その発現レベルを示した説明図である。
【図8A】各NDS誘導体が示す発現レベルを示した説明図である。
【図8B】各NDSが示す発現レベルを示した説明図である。
【図9】NDS-Rluc、野生型RlucおよびCP-Rlucの発光量の違いを示した説明図である。
【図10】プロテアソーム阻害剤で処理した際の発現量の違いを示した説明図である。
【発明を実施するための最良の形態】
【0039】
以下、本発明に係る実施形態について、図面を参照しながら説明する。
【0040】
本発明は、標的のタンパク質と融合させることによって標的タンパク質を低発現化することができるペプチドをコードする遺伝子、及びその遺伝子を用いたタンパク質の低発現化方法を提供することを目的の一つとしている。
【0041】
具体的には、タンパク質低発現化ペプチドがコードされた遺伝子は、少なくとも人又は猿の免疫不全ウイルスが有するnef遺伝子由来のタンパク質低発現化ペプチドがコードされた遺伝子である。
【0042】
また、より具体的に、前述の標的タンパク質を低発現化することができるペプチドをコードする遺伝子は、以下の(1)〜(20)に示す少なくともいずれか1つの塩基配列を有する。(1)配列番号1の第385-618番目の塩基で表される塩基配列;
(2)配列番号2の第129-206番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(3)配列番号2の第129-206番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第129-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(4)上記(1)〜(3)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第129-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(5)配列番号1の第424-618番目の塩基で表される塩基配列;
(6)配列番号2の第142-206番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(7)配列番号2の第142-206番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第142-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(8)上記(5)〜(7)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第142-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(9)配列番号1の第385-558番目の塩基で表される塩基配列;
(10)配列番号2の第129-186番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(11)配列番号2の第129-186番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第129-186番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(12)上記(9)〜(11)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第129-186番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(13)配列番号3の第415-651番目の塩基で表される塩基配列;
(14)配列番号4の第139-216番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(15)配列番号4の第139-216番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号4の第139-216番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(16)上記(13)〜(15)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号4第139-216番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(17)配列番号5の第481-789番目の塩基で表される塩基配列;
(18)配列番号6の第161-263番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(19)配列番号6の第161-263番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号6の第161-263番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(20)上記(17)〜(19)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号6第161-263番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【0043】
これらの低発現化配列(NDS配列)を融合させることにより任意の標的タンパク質の生体内での発現を有意に低下させることができる。例えば、本発明の低発現化ペプチドを融合させることにより、EGFPの生体内での発現量はPEST配列あるいはCL1-PEST配列を融合した場合と比較して、著しく低下する。特にPEST配列を例えば、EGFPのN末端に付加した場合にはほとんど低下効果は見られないのに対して、本発明のペプチド配列ではN末端に付加しても1/10以上の低下活性を示した。このようにして本発明の低発現化ペプチドをレポータータンパク質に融合させることにより、図5に示すように、S/N比の高い(バックグラウンドの低い)遺伝子応答をより高感度で的確に評価できるレポーターアッセイ系の構築が可能となる。
【0044】
さらに、本発明の低発現化ペプチド(NDS配列)付加による標的タンパク質の発現低下は、上記配列付加によるプロテアソーム分解系によるタンパク質分解促進の結果と考えられる。特に、近年、プロテアソーム阻害剤は多発性骨髄腫の治療薬(Bortezomib)に利用され、また免疫プロテアソーム阻害が関節リウマチに有効であることが報告され、他の自己免疫疾患も含めプロテアソーム阻害戦略が注目されている。そこで、本発明では、本発明のタンパク質発現低下ペプチド配列によるレポーターシグナルの低下を逆に元に戻すことを利用した、抗がん薬や自己免疫疾患の治療薬開発を目指したプロテアソーム阻害候補物質のスクリーニング系を提供することができる(図6参照。)。
【0045】
さらには、例えば抗体治療において、特定の抗体遺伝子に本発明塩基配列を付加することにより、抗原―抗体複合体の分解が促進され治療効果が高まることが考えられる。
【0046】
本発明において、「タンパク質低発現化」とは、所定の標的タンパク質の生体内での安定性を不安定化し、分解を促進された結果、ウェスタンブロッティングや蛍光光度計などによる測定に置いてタンパク質が低下して検出されることを指す。本発明におけるタンパク質の低発現化は、低発現化ペプチドを標的タンパク質に融合することにより、標的タンパク質を含む融合タンパク質のペプチダーゼに対する感受性高め、結果としてより迅速に標的タンパク質がペプチダーゼによって分解されることによると考えられる。
【0047】
本発明における「タンパク質低発現化ペプチド」とは、上記のように標的タンパク質と融合することによって生体内における標的タンパク質の量を低下させる機能を有するペプチドを意味する。一実施形態において本発明のタンパク質低発現化ペプチドは、例えば、配列番号2の129〜206番目のアミノ酸で表されるペプチドや、配列番号2の142〜206番目のアミノ酸で表されるペプチドや、配列番号2の129〜186番目のアミノ酸で表されるペプチドや、配列番号4の139〜216番目のアミノ酸で表されるペプチドや、配列番号6の161〜263番目のアミノ酸で表されるペプチド、又は前記各ペプチドにおいて1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ前記ペプチドと実質的に同一のタンパク質低発現化活性を有するタンパク質である。
【0048】
一実施形態において、本発明の好ましいタンパク質低発現化ペプチドは、
(a)配列番号2の第129〜206番目のアミノ酸で表されるタンパク質低発現化ペプチドの一部のペプチド断片又は前記ペプチドを含むより大きなペプチド断片あって、配列番号2の第129〜206番目で表される低発現化ペプチドと実質的に同程度の活性を有するペプチド断片;
(b)配列番号2の第142〜206番目のアミノ酸で表されるタンパク質低発現化ペプチドの一部のペプチド断片又は前記ペプチドを含むより大きなペプチド断片あって、配列番号2の第142〜206番目で表される低発現化ペプチドと実質的に同程度の活性を有するペプチド断片;
(c)配列番号2の第129〜186番目のアミノ酸で表されるタンパク質低発現化ペプチドの一部のペプチド断片又は前記ペプチドを含むより大きなペプチド断片あって、配列番号2の第129〜186番目で表される低発現化ペプチドと実質的に同程度の活性を有するペプチド断片;
(d)配列番号4の第139〜216番目のアミノ酸で表されるタンパク質低発現化ペプチドの一部のペプチド断片又は前記ペプチドを含むより大きなペプチド断片あって、配列番号4の第139〜216番目で表される低発現化ペプチドと実質的に同程度の活性を有するペプチド断片;
(e)配列番号6の第161〜263番目のアミノ酸で表されるタンパク質低発現化ペプチドの一部のペプチド断片又は前記ペプチドを含むより大きなペプチド断片あって、配列番号6の第161〜263番目で表される低発現化ペプチドと実質的に同程度の活性を有するペプチド断片;
である。
【0049】
本発明における「タンパク質低発現化ペプチドをコードする塩基配列」とは、上記タンパク質低発現化ペプチドをコードする任意の塩基配列を含む塩基配列であり、例えば、前記(1)〜(20)の塩基配列を云う。
【0050】
本発明において、「実質的に同一のタンパク質低発現化活性」とは、タンパク質低発現化タンパク質のタンパク質低発現化活性が、配列番号2の129〜206番目のアミノ酸で表されるペプチドや、配列番号2の142〜206番目のアミノ酸で表されるペプチドや、配列番号2の129〜186番目のアミノ酸で表されるペプチドや、配列番号4の139〜216番目のアミノ酸で表されるペプチドや、配列番号6の161〜263番目のアミノ酸で表されるペプチドの有する活性と比較して、実験誤差の範囲内であるか、又はそれ以上の活性を有することを意味する。
【0051】
本発明において、「ストリンジェントな条件」とは、特異的なハイブリダイゼーションのみが起き、非特異的なハイブリダイゼーションが起きないような条件をいう。このような条件は、通常「1×SSC、0.1%SDS、37℃」程度であり、好ましくは「0.5×SSC、0.1%SDS、42℃」程度であり、更に好ましくは「0.2×SSC、0.1%SDS、65℃」程度である。このようなストリンジェントな条件下で上記(1)〜(3)の塩基配列とハイブリダイズする配列は通常前記(1)の配列と高い相同性を有する。ここで、高い相同性とは、60%以上の相同性、好ましくは、75%以上の相同性、更に好ましくは90%以上の相同性、特に好ましくは95%以上の相同性を意味する。
【0052】
置換、付加、欠失又は挿入により変異したアミノ酸の数は、配列番号2の129〜206番目のアミノ酸で表されるペプチドや、配列番号2の142〜206番目のアミノ酸で表されるペプチドや、配列番号2の129〜186番目のアミノ酸で表されるペプチドや、配列番号4の139〜216番目のアミノ酸で表されるペプチドや、配列番号6の161〜263番目のアミノ酸で表されるペプチドと同程度のタンパク質低発現化活性を有する限りその個数は制限されないが、好ましくは20アミノ酸以下であり、より好ましくは15アミノ酸以下、更に好ましくは10アミノ酸以下、最も好ましくは5アミノ酸以下である。
【0053】
本発明において、「任意の抗体」とは抗体医薬で用いられる抗体をイメージしている。たとえば特定の抗体遺伝子に本発明塩基配列を付加することにより、抗原―抗体複合体の分解が促進され治療効果が高まることが考えられる。
【0054】
本発明において、「レポータータンパク質」とは、その遺伝子が発現して活性型タンパク質が形成されるとシグナルを発し、そのシグナルを測定することにより別の、目的の遺伝子の発現の検出を可能にするタンパク質をいう。よって、本発明のレポータータンパク質は、そのようなシグナルを発する性質を有し、その測定(あるいは検出)が比較的容易なタンパク質であれば特に制限されないが、例えばベータガラクトシダーゼ、ベータグルクロニダーゼ、ベータラクタマーゼ、ジアホラーゼ、アルカリホスファターゼ、パーオキシダーゼ、ルシフェラーゼ(ホタルルシフェラーゼ、ウミシイタケルシフェラーゼ)、緑色蛍光タンパク質(GFP、EGFP)及びエクオリン等を挙げることができる。好ましくは、緑色蛍光タンパク質(GFP、EGFP)、ルシフェラーゼである。
【0055】
本発明の一実施形態は、プロモーター配列並びに前記プロモーター配列の制御下にレポータータンパク質をコードする塩基配列及び本発明のタンパク質低発現化ペプチドをコードする塩基配列を有する遺伝子構築物である。ここで云うプロモーター配列とは、低発現化されたレポータータンパク質からのシグナルを利用して、その性質シグナルが解析される対象となるものである。本発明におけるプロモーター配列とは、プロモーター、エンハンサー及びサイレンサー等のシス作用性遺伝子発現制御配列、或いはその可能性があると考えられる塩基配列を意味し、そのような作用を有する配列であれば特に限定されない。本発明によりレポータータンパク質の発現が低下し(寿命が短縮される結果として)、それを利用して機能を解析する好ましいプロモーターとしては、HRE (hypoxia responsive element)を含むプロモーター, LTR (long terminal repeat)プロモーター、ERE (estrogen receptor response element)を含むプロモーター、及びCRE (cyclic AMP responsive element)を含むプロモーター などが挙げられる。
【0056】
本発明の遺伝子ないし遺伝子構築物を宿主に導入し、発現させることにより、プロモーターの機能や転写活性の変動を測定することができる。本発明の遺伝子構築体を細胞へ導入する方法としては、リン酸カルシウム法、DEAE‐デキストラン法、カチオニックリポソーム法などの化学的手法、アデノウイルスベクター、ワクシニアウイルスベクターやレトロウイルスベクター、HVJリポソームなどの生物学的手法、エレクトロポレーション、DNA直接注射、遺伝子銃などの物理的手法など、いずれの方法であってもよい。化学的手法やエレクトロポレーション法が一般的である。
【0057】
本発明における一過的な遺伝子導入とは、対象となる細胞にEGFP遺伝子構築物、例えばプラスミド状のもの、を前記方法で遺伝子導入し、導入された細胞・導入されなかった細胞を分離する(安定的に染色体に組み込まれた細胞を選択する)工程を実施することなく、導入後比較的短時間後に細胞試験に用いることを指す。安定的な遺伝子導入とは、導入された遺伝子が宿主の染色体に組み込まれるように導入することを意味する。
【0058】
好ましい本発明の一実施形態は、本発明のタンパク質低発現化遺伝子(NDS配列)を含む遺伝子構築物が導入された生物又はその一部である。本発明のタンパク質低発現化タンパク質をコードする遺伝子を生物に導入することで、特定のタンパク質の発現が低下されたトランスジェニック生物を作成することができる。ここで、本発明の遺伝子又は遺伝子構築物を導入する生物とは、特に制限されないが、微生物、植物、動物から必要に応じて選択される。好ましくは、ウシ、ウマ、ヒツジ、サル、ブタ、マウス、ラット、ハムスター、モルモット、ウサギ、イヌ等である。また、生物の一部とは、器官、組織、細胞等を意味する。
【0059】
本発明の遺伝子又は遺伝子構築物を導入する宿主細胞は、特に制限なく原核細胞、真核細胞(例えば、酵母、植物、動物(哺乳類、鳥類、昆虫等))等から必要に応じて適宜選択することができる。好ましくは、ヒト、ウシ、ウマ、ヒツジ、サル、ブタ、マウス、ラット、ハムスター、モルモット、ウサギ、イヌ等の哺乳類細胞であり、より好ましくはヒト由来の細胞である。特に、プロテアソーム阻害剤のスクリーニング系に本発明を用いる場合は、各種、ヒト由来の細胞(免疫担当細胞、多発性骨髄腫その他がん細胞など)を用いることが好ましい。
【0060】
本発明のタンパク質低発現化ペプチド(NDS配列)を融合させて、標的タンパク質を低発現化させる場合、本発明のタンパク質低発現化ペプチドは標的タンパク質のN末端側とC末端側のいずれに融合されてもよいが、好ましくはC末端側である。しかしながら、N末端に融合しても低発現活性を示す点は本発明ペプチドの有利な特徴の一つでもある。本発明のタンパク質低発現化ペプチドと標的タンパク質は、リンカー配列などを介して融合されてもよく、そのような配列を介在なく連続的に融合されていてもよい。
【0061】
本発明のタンパク質低発現化ペプチドは、単独で標的タンパク質と融合しても良いが、標的タンパク質を低発現化するという機能を発揮する限りにおいて、他のペプチドと組み合せて標的タンパク質と融合しても良い。他のペプチドとしては、例えば、PEST、CL1配列などのタンパク質不安定化配列、またはPTD (protein transduction domain)のようなタンパク質を細胞外から細胞内へ細胞膜を透過して取り込ませることができる配列を挙げることができる。また、本発明のタンパク質低発現化ペプチドは、2つ以上が連結された状態で標的タンパク質と融合されてもよい。
【0062】
本発明の好ましい一実施形態は、タンパク質低発現化タンパク質をコードした遺伝子又はそれを含む遺伝子構築物が導入された生物又はその一部を異なる条件下で培養して、レポータータンパク質のシグナルを測定し、プロモーターの転写活性を比較することから成る、プロモーター活性の分析方法である。ここで、異なる条件とは、例えば、温度、光、撹拌等によるストレスに関する条件、または化学物質、環境ホルモン、薬剤等による液性因子に関する条件等をさす。
【0063】
レポータータンパク質のシグナルとは、レポータータンパク質自身が発する又はレポータータンパク質と他の物質とが反応して発せられる検出可能な信号である。例えば、緑色蛍光タンパクであれば、プロモーターの制御下にその遺伝子の発現(蛍光)自体がシグナルとなる。発せられた蛍光は、マルチプレート用の蛍光光度計等を用いて測定、あるいは蛍光顕微鏡下で観察可能である。条件の変化に対応して発せられるシグナルを検出し、分析することによって、レポータータンパク質遺伝子の発現を制御しているプロモーターの性質を調べることが可能である。本発明の低発現化タンパク質によってレポーターの寿命が短縮されているため(分解が促進されているため)、比較的短い間隔で変化する条件に対応するプロモーターの応答も正確に測定することが可能である。
【0064】
本発明の別の好ましい一実施形態は、タンパク質発現低下化遺伝子若しくはそれを含む遺伝子構築物が導入された生物又はその一部を被検化合物の存在下及び非存在下で培養し、レポータータンパク質のシグナルを測定し、プロモーターの転写活性を比較することからなる、前記被検化合物のプロモーターに対する影響の評価方法である。ここで、被検化合物とは、特に制限はないが、好ましくは公知の又は新規な薬物であり、目的に応じて適宜選択される。被検化合物の存在下及び非存在下とは、被検化合物の量的な変化をも含む意味である。
【0065】
本発明のまた別の好ましい一実施形態は、タンパク質発現低下化遺伝子若しくはそれを含む遺伝子構築物が導入された生物又はその一部を被検化合物の存在下及び非存在下で培養し、レポータータンパク質のシグナルを測定比較することからなる、前記被検化合物の低タンパク発現活性に対する影響を評価する方法である。ここで、被検化合物とは、特に制限はないが、好ましくは公知の又は新規な薬物であり、プロテアソーム阻害剤候補物質、プロテアソーム分解に至るまでの一連の過程を阻害する候補物質などをさす(図6参照。)。
【実施例】
【0066】
以下、本発明の実施例を説明する。
実施例1〜7において、用いた材料および方法をまとめて述べ、引き続き、実施例8〜10で結果について述べる。
【0067】
[実施例1]
1. 野生型Nef発現ベクターの構築
Nef発現ベクターを作製するにあたり、動物細胞発現plasmidとしてinvitrogen製のpcDNA3.1D/V5-His-TOPO及びpcDNA4/HisMax Cが利用された。
pcDNA3.1D/V5-His-TOPOの特徴はC末端側にV5 epitope tagを融合させてNefタンパク質を発現させることができる。pcDNA4/HisMax Cの特徴は、開始コドンの上流にSP163配列(translational enhancer)が挿入されており、これによってタンパク質の発現を著しく増大させることができる。このvectorはアミノ末端側にXpress epitopeを融合させる形でタンパク質を発現させる。今回のNefタンパク質はアミノ末端にそのようなtagを融合させると本来の機能を消失することから、このvectorを利用してNef発現ベクターを作製するにあたり、Xpress epitope tagコードDNAを除き、さらにC末端側にV5 epitope tagを融合する形で作製している。
【0068】
Nef遺伝子はHIV-1NL4-3株を発現するpNL4-3プラスミドおよびHIV-1JR-CSF株を発現するpYK-JR-CSFを利用した。
【0069】
野生型Nef発現ベクターは以下の4種類を作製した。
pcDNA3.1/Nef JR-CSF-V5
pcDNA3.1/Nef NL4-3-V5
pcDNA4/HisMax/NefJR-CSF-V5
pcDNA4/HisMax/NefNL4-3-V5
【0070】
4種類の各野生型Nef発現ベクターの作製方法について以下に示す。
【0071】
(1-1. pcDNA3.1/Nef JR-CSF-V5の作製方法)
pYK-JRCSFを鋳型にしてNef F primerTOPO及びNef R primerTOPOをprimerとしてPfu Turbo DNA polymerase (Stratagene製)を用いてマニュアルに従いPCRを行うことで Nef領域DNAを増幅した。増幅したDNAをpcDNA3.1D/V5-His-TOPO(invitrogen製)のマニュアルに従いTOPO cloningを行った。DNA配列解析を行いpcDNA3.1/Nef JR-CSF-V5を得た。
【0072】
(用いたprimer pair)
Nef F primerTOPO : 5-CACCATGGGTGGCAAGTGGTCAAA AAG-3
Nef R primerTOPO : 5-GCAGTTCTTGAAGTACTCCGGATG-3
[1-2. pcDNA3.1/Nef NL4-3-V5の作製方法]
【0073】
(1-2. pcDNA3.1/Nef NL4-3-V5の作製方法)
pNL4-3を鋳型にして、NefNLCHFprimer及びNefNLCHRprimerをprimerとしてPfu Turbo DNA polymeraseを用いてPCRを行い、Nef領域DNAを増幅し、cloning vector であるpT7blue (Novagen製)にsubcloningした。DNAシーケンスを確認後、得られたクローンをBamHIおよびNot Iで切り出し、同じくBamHI及びNot IでcutしたpcDNA3.1D/V5-His-TOPOにligationし、pcDNA3.1/Nef NL4-3-V5を得た。
【0074】
(用いたprimer pair)
NefNLCHFprimer : 5-CTCGGATCCGGATTTTGCTATAAGATGGGTGGC -3
NefNLCHRprimer : 5-GAGCGGCCGCCGCAGTTCTTGAAGTACTC-3
【0075】
(1-3. pcDNA4/HisMax/NefJR-CSF-V5の作製方法)
pcDNA4/HisMax/Cを鋳型にして以下のprimer pairを用いてPfu Turbo DNA polymeraseを用いてPCRによりvectorを増幅させた。この増幅産物はアミノ末端側に融合されるXpress epitopeコードDNA領域を含まないSP163配列から上流(HisMaxR primer)と、pcDNA4/HisMax/Cのマルチクローニングサイト(MCS)のKpn I siteから下流 (HisMaxF primer)の間を増幅している。
【0076】
(用いたprimer pair)
HisMaxR primer : 5-GGTTTCGGAGGCCGTCCGG-3
HisMaxF primer : 5-GTACCAGGATCCAGTGTGGTG-3
【0077】
先に作製したpcDNA3.1/Nef JR-CSF-V5を鋳型にして以下のprimer pairを用いてNef JR-CSF-V5の開始コドンからV5 epitope コード領域とstopコドンを含む領域までをPfu Turbo DNA polymeraseを用いてPCRにより増幅した。
(用いたprimer pair)
HismaxNefF : 5-ATGGGTGGCAAGTGGTCAAA-3
TopoR primer : 5-TCAATGGTGATGGTGATGATG-3
【0078】
増幅させたvector領域と、T4 polynucleotide kinaseでリン酸化処理したNef JR-CSF_V5領域DNAをligationさせ、得られたplasmid cloneのDNA配列解析を行いpcDNA4/HisMax/NefJR-CSF-V5を得た。
【0079】
(1-4. pcDNA4/HisMax/NefNL4-3-V5の作製方法)
pcDNA4/HisMax/NefJR-CSF-V5を鋳型にして、Pfu Turbo DNA polymeraseを用いてPCRによりHisMaxR primerおよびHisMaxF2 primerを用いてvector領域を増幅した。このvector領域にはNefのC末端側に融合されるV5 epitopeをコードDNAが含まれる。
【0080】
(用いたprimer pair)
HisMaxR primer : 5-GGTTTCGGAGGCCGTCCGG-3
HisMaxF2 primer : 5-GGCCGCTGCAGTCTAGAGG-3
【0081】
pcDNA3.1/Nef NL4-3-V5を鋳型にして、Pfu Turbo DNA polymeraseを用いてPCRによりHisMaxNefおよびNefR primerを用いてNefNL4-3DNAを増幅した。この増幅DNAはNefのC末端側に融合されるV5 epitopeをコードするDNAを含まない。
【0082】
(用いたprimer pair)
HismaxNefF : 5-ATGGGTGGCAAGTGGTCAAA-3
Nef R primer TOPO : 5-GCAGTTCTTGAAGTACTCCGGATG-3
【0083】
増幅させたvector領域と、T4 polynucleotide kinaseでリン酸化処理したNefNL4-3DNAをligationさせ、得られたplasmid cloneのDNA配列解析を行い、pcDNA4/HisMax/NefNL4-3-V5 を得た。
【0084】
[実施例2]
(2. 変異型Nef NL4-3/JR-CSF chimera_V5発現ベクターの作製方法)
Nef JR-CSF の1〜139アミノ酸残基に、NefNL4-3の129〜206アミノ酸残基を連結され、さらにV5エピトープがC末端側に融合されるNef NL4-3/JR-CSF chimera_V5を発現するベクターを構築した。
【0085】
pcDNA4/HisMax/NefJR-CSF-V5を鋳型としてNef JR-CSFのアミノ末端側をコードする587 bpのDNA#1とpcDNA4/HisMax/NefNL4-3-V5 を鋳型としてNefNL4-3のC末端側をコードする357 bpのDNA#2をPCRで増幅する。増幅されたDNA#1の3’側67 bpとDNA#2の5’側67bpは同じ配列となる。DNA#1とDNA#2を混合しPCRを行うと、PCR中に67 bpのオーバーラップする配列がハイブリダイズしDNA#1とDNA#2が連結した877 bpのDNA#3が増幅する。
【0086】
DNA#3をHindIIIおよびSacIIでcutしたDNAフラグメントと、pcDNA4/HisMax/NefJR-CSF-V5を同じくHindIIIおよびSacIIでcutして得られたvector領域をligationし、NefNL4-3/JR-CSF chimera_V5発現ベクターであるpcDNA4/HisMax/Nef NL4-3/JR-CSF chimera_V5を得た。
【0087】
(DNA#1を増幅するために使用したprimer pair)
NefJRHind F : 5-AACTTAAGCTTAGCGCAGAG-3
NefJRChimR1 : 5-GTGTAGTTCTGCCAATCAG-3
【0088】
(DNA#2を増幅するために使用したprimer pair)
NefNLchimF1 : 5-GACAAGATATCCTTGATCTG-3
NefNLSacR : 5-GGTTAGGGATAGGCTTAC-3
【0089】
[実施例3]
(3. NDS、PEST、またはCL1-PEST融合型EGFP発現ベクターの作製方法)
【0090】
EGFPのアミノ末端側に融合できるタンパク質を高発現するベクターであるpEGFP-N1_G4S3_SP163_His/Xpress/Aが利用された。このベクターはClontech製のEGFP融合タンパク質発現ベクターであるpEGFP-N1のマルチクローニングサイトにinvitrogen製のタンパク質発現ベクターpcDNA4/HisMax AのSP163及び6xHis/Xpress epitopeコードDNA、およびリンカー配列(GlyGlyGlyGlySer)x3をコードするDNAが導入されたベクターである。pEGFP-N1と比較してEGFP融合タンパク質の発現が亢進し、さらにXpress epitope tagを付加したタンパク質発現が可能となり、抗Xpress抗体によるタンパク質検出が可能になる。
【0091】
pEGFP-N1_G4S3_SP163_His/Xpress/Aのマルチクローニングサイト(EcoRI、Sal I)にEcoRI site及びSal I siteを含むprimerで増幅したNDS、PEST、またはCL1-PESTをコードするDNAが挿入され、pEGFP-N1_G4S3_SP163_His/Xpress/A/NDS、pEGFP-N1_G4S3_SP163_His/Xpress/A/PEST、及びpEGFP-N1_G4S3_SP163_His/Xpress/A/CL1-PESTが得られた。PESTおよびCL1-PESTコードDNAのPCRによる増幅には、Promega製のpGL4.78[hRlucCP/Hygro] vectorが鋳型として利用された。
【0092】
(NDSコードDNAを増幅するために使用したprimer pair)
NDS129_206_EcoRF: TAGAATTCTGCCAGGGCCAGGGGTC
NDS129_206_SaL R: TACGTCGACTGGCAGTTCTTGAAGTAC
PESTおよびCL1-PESTをコードするDNAを増幅するために使用したprimers
CL1PEST_EcoRF : TAGAATTCTGGCTTGCAAGAAC
PEST_EcoRF : TAGAATTCTGAGCCACGGCTTC
PEST_SalR : TACGTCGACTGGACGTTGATCCTG
【0093】
NDSのアミノ酸配列 78残基
PGPGVRYPLTFGWCYKLVPVEPDKVEEANKGENTSLLHPVSLHGMDDPEREVLEWRFDSRLAFHHVARELHPEYFKNC
CL1-PESTのアミノ酸配列 57残基
ACKNWFSSLSHFVIHLNSHGFPPEVEEQAAGTLPMSCAQESGMDRHPAACASARINV
PESTのアミノ酸配列 40残基
SHGFPPEVEEQAAGTLPMSCAQESGMDRHPAACASARINV
【0094】
[実施例4]
(4. 細胞培養法)
Human embryonic kidney (HEK)293細胞は、10%FCS、100 IU/ml penicillin、及び 100 μg/ml streptomycinを含むDulbecco’s modified Eagle’s medium (DMEM)で37℃、5%CO2下で培養された。CD4を安定発現するHEK293//CD4細胞は、10%FCS、100 IU/ml penicillin、100 μg/ml streptomycin、及び200 μg/ml G418を含むDMEMで37℃、5%CO2下で培養された。
【0095】
[実施例5]
(5. トランスフェクション及び細胞の可容化)
1 x 106 cells/wellのHEK293細胞を6well plateに播き、一夜培養後、1 well あたり2.5 μgの各種Nef発現plasmidまたはEGFP融合タンパク質発現plasmidをLipofectamineLTX reagent (invitrogen)を用いて、マニュアルに従いトランスフェクションを行った。48時間培養後、細胞をplateから剥がし、PBS (-)で2回洗浄後、lysis buffer (50 mM Tris-HCl pH8.0, 150 mM NaCl, 1% Triton X-100)で細胞を懸濁し4℃で30分間放置し細胞を可容化した。
【0096】
[実施例6]
(6. SDS-PAGE及びwestern blot 分析)
得られた細胞可容化上清をLaemmiliの方法に従いsodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE)に供し、以下に示すようにwestern blot法によりタンパク質を検出した。
【0097】
SDS-PAGEにより分離したタンパク質をpolyvinylidine difluoride (PVDF)膜に電気的に転写した。得られた転写PVDF膜は5%スキムミルクでマスキングされた。発現する各Nefタンパク質はC末端側にV5 epitopeが融合しているので、Nefの検出には抗V5抗体が利用された。EGFP融合タンパク質はXpress epitope tagが付加されていることから、抗Xpress抗体が利用された。1%スミムミルク含有TBS buffer (10 mM Tris-HCl pH7.5, 500 mM NaCl) で5,000倍希釈した抗V5抗体または抗Xpress抗体で転写PVDF膜を4時間処理し、転写PVDF膜をTBS bufferで洗浄後、1%スミムミルク含有TBS bufferで1,000倍希釈したペルオキシダーゼ標識抗マウスIgG抗体で1時間処理した。再び転写PVDF膜をTBS bufferで洗浄後、Western Lighting Plus-ECL Enhanced Chemiluminescence substrate (PerkinElmer Inc)を用いてマニュアルに従いタンパク質の検出を行った。検出されたタンパク質のバンドの強度はFujifilm Image Gauge Softwareを用いて定量された。
【0098】
[実施例7]
(7. Nef安定発現HEK293/CD4細胞の構築)
5の方法に準じて2.5 μgのpcDNA4/HisMax/NefJR-CSF-V5又はpcDNA4/HisMax/NefNL4-3-V5をHEK293/CD4細胞にトランスフェクトし、4の方法で48時間培養後、500 μg/ml となるようにZeocinを添加しさらに継体培養した。得られたZeocin耐性のHEK293/CD4細胞におけるNefの発現を、western blot および免疫染色で確認した後、細胞を限外希釈し96 well plateの1wellあたり1個となるように細胞を播き zeocin存在下培養した。顕微鏡下でコロニーが1つである細胞を選択し、細胞を増殖させクローンを得た。
【0099】
[実施例 8]
本発明のきっかけになった実験であるが、HEK293/CD4細胞に野生株である、HIV-1JR-CSF由来のNef遺伝子およびHIV-1NL4-3株由来のNef遺伝子を発現ベクターに導入して、Nefタンパク質の発現量を比較した。その結果、図1に示すように、一過性発現系においても、また安定発現系に置いてもHIV-1NL4-3株由来のNef遺伝子の発現量が著しく低かった。一過性発現系では、1/5以下、安定発現系では、1/10〜1/100であった。
【0100】
[実施例 9]
HIV-1JR-CSF 由来のNefタンパクおよびHIV-1NL4-3株由来のNefタンパク質のアミノ酸のアラインメントの結果、HIV-1NL4-3株由来のNefのアミノ酸番号129〜206のC末端側領域がHIV-1JR-CSFのC末端のアミノ酸配列(139〜216に相当)とホモロジーが低いことに着目し、HIV-1NL4-3株由来のNefのアミノ酸番号129〜206領域をHIV-1JR-CSFのC末端の相当領域と置き換えたキメラを作成し(図2参照)、Nefタンパク発現を検討した。その結果、図3に示すように、キメラ遺伝子のNefタンパク発現は1/10以下と著しく低下した。この結果から、HIV-1NL4-3株由来のNefのアミノ酸番号129〜206領域が、タンパク発現低下活性を持つことが示された。
【0101】
[実施例 10]
次に、本発明配列(HIV-1NL4-3株由来のNefのアミノ酸番号129〜206領域)を増強緑色蛍光タンパク(EGFP)のN末端側に付加し発現低下活性を、既に公知で実際市販されている、タンパク発現抑制配列である、PEST,CL1/PESTと比較した。N末端に付加したせいか、PESTには、全く発現低下活性は見られず、CL1/PESTは、およそ1/10の低下活性が見られた。これに対し、図4に示すように、本発明配列は、1/20〜1/50と著しい低下活性を示した。このように、本発明配列は、C末端のみでなく、N末端に付加しても効果があると言う利点がある。
【0102】
[実施例 11]
(11. 注目するタンパク質(EGFP)のC末端側へのNDSの連結およびリンカー配列の挿入の効果)
タンパク質によっては、N末端側あるいはC末端側に別の配列を付加することで、本来の機能を消失する場合がある。したがって、NDSの付加による注目するタンパク質の低発現化を誘導させるにあたって、タンパク質のN末端側およびC末端側の何れにNDSを連結してもその低発現化を誘導できれば、NDSの汎用性が高まる。先に述べた実施例10では、EGFPのN末端側にNDSを連結することでEGFPの低発現化の誘導を確認したが、本実施例11では、EGFPのC末端側にNDSを連結した場合のEGFPの低発現化誘導の確認を行った。また併せて、タンパク質を融合する際に構造的にフレキシビリティーの高いリンカーを挿入することで低発現誘導に差異が認められるかどうか検討した。
【0103】
具体的には、EGFPをコードするDNAの3’側の終止コドンを除去しNDS、CL1-PEST、及びPEST配列をコードするDNAを連結したDNAを作成し動物細胞用の発現ベクター(pcDNA4)のマルチクローニングサイトに導入した。
【0104】
また上述の発現ベクターにおいて、EGFPとNDS、CL1-PEST、及びPESTの間にGlyGlyGlySerGlyGlyGlySerGlyGlyGlySer (GGGSx3)のリンカー配列をコードしたDNAを挿入したものも調製した。
【0105】
得られたDNAをHEK293細胞にリポフェクトアミンLTXによりトランスフェクションし48時間後に細胞を回収し、常法に従いウエスタンイムノブロットを行った。
【0106】
その結果を図7に示す。図7は、EGFPのC末端側にNDSを連結し、その発現レベルを示した説明図である。NDSの他に既に実用化されているCL1-PEST, PEST配列を同様にEGFPに連結した場合と比較した。その結果、NDSをEGFPに連結することにより、その発現レベルが顕著に低下し、その効果はCL1-PESTおよびPESTよりも強力であった。
【0107】
また、図7AはEGFPとNDSの間にGGGSx3のリンカー配列が挿入されており、図7Bではそのリンカーは挿入されていない。結果に示すとおり、リンカーを挿入した場合がより効果的に発現レベルの低下が認められた。
【0108】
このように、前述の実施例10及び本実施例11の結果から、NDSを任意のタンパク質に付加する場合、そのN末端側およびC末端側の何れに連結しても低発現化が誘導できることが示された。またリンカー配列を挿入することで低発現能が増強されることが明らかになった。
【0109】
[実施例 12]
(12.各NDS誘導体(変異体)が示す多様なタンパク質低発現化レベル)
次に、HIV-1 NL4-3 Nef由来のNDS(78アミノ酸残基)のN末端側13残基を欠損させたAA142-206-EGFP、NDSのC末端側20残基を欠損させたAA129-186-EGFP、およびN末端側とC末端側の両方を欠損させたAA142-186-EGFPを発現するベクターを作成し、これらの発現レベルとNDS-EGFPおよびEGFPとの発現レベルとの比較を行った。
【0110】
具体的には、HEK293細胞に上述の発現ベクターを、リポフェクトアミンLTXを利用してトランスフェクションし48時間後に細胞を回収し、常法に従いウエスタンイムノブロットを行った。
作成したNDSの変異体の配列と野生型NDS(HIV-1 NL4-3 Nef由来)の配列は以下の通りである。
NDS: PGPGVRYPLTFGWCYKLVPVEPDKVEEANKGENTSLLHPVSLHGMDDPEREVLEWRFDSRLAFHHVARELHPEYFKNC
AA142-206:
CYKLVPVEPDKVEEANKGENTSLLHPVSLHGMDDPEREVLEWRFDSRLAFHHVARELHPEYFKNC
AA129-186:
PGPGVRYPLTFGWCYKLVPVEPDKVEEANKGENTSLLHPVSLHGMDDPEREVLEWRFD
AA142-186:
CYKLVPVEPDKVEEANKGENTSLLHPVSLHGMDDPEREVLEWRFD
【0111】
その結果、図8Aに示すとおり、NDS配列のN末端側13残基を欠損させたAA142-206-EGFP、C末端側20残基を欠損させたAA142-186-EGFPは野生型NDS-EGFPと比較して発現レベルが上昇したがEGFPよりも低いレベルであった。両方を欠損させたAA142-186-EGFPの発現レベルはEGFPの発現レベルとほぼ同等であり、低発現化を誘導しなかった。低発現化効果の順位としてはNDS-EGFP > AA129-186-EGFP > AA242-206-EGFP > AA142-186-EGFP = EGFPであった。この結果から、注目するタンパク質の低発現化を誘導するとき、これらの配列を利用すれば多様性を持たせることができ、目的に応じた発現レベルを示すタンパク質を作製することが出来る。
【0112】
[実施例 13]
次に、HIV-1 NL4-3株ではない他の株のNef由来のNDSを用いてタンパク質の低発現化の検証を行った。すなわち、上述してきた実施例におけるNDSはNefNL4-3由来配列であったが、他のHIV-1株であるJRCSF株のNefのNDSの相同領域 (JNDS)および同じレンチウイルスでありサルにエイズを引き起こすSIVmac239のNefのNDS相当領域(macNDS)を、同様にEGFPのアミノ末端側にリンカーを介して連結し発現するベクターを作成した。
【0113】
検討したJNDSおよびmacNDS配列は以下の通りである。
JNDS:
AGPGVRFPLTFGWCFKLVPVDPEKVEEANEGENNCLLHPMSQHGMDDPEKEVLVWKFDSKLALHHVARELHPEYFKNC
macNDS:
SGPGIRYPKTFGWLWKLVPVNVSDEAQEDEEHYLMHPAQTSQWDDPWGEVLAWKFDPTLAYTYEAYVRYPEEFGSKSGLSEEEVRRRLTARGLLNMADKKETR
【0114】
その結果図8Bに示すとおり、macNDS-EGFPおよびJNDS-EGFPの発現レベルはNDS-EGFPより低く、macNDSの低発現効果はもっとも強力であった。本実施例12の結果より、HIV-1 NL4-3株のNef由来NDSより低発現効果が強力なNDS誘導体を得た。
【0115】
[実施例 14]
(14.NDSの連結によるRenilla luciferaseの発現レベルの低下)
次に、NDS連結によるタンパク質の低発現効果はEGFPだけでなく普遍的に起こるかどうかについて検討を行った。
具体的には、NDS-EGFPの発現ベクターのEGFPコード領域をRenilla luciferase (Rluc)をコードするDNAと置換しRlucのアミノ末端側にNDSを連結して発現するNDS-Rluc発現ベクターを構築した。また、同様にCP-Rlucを構築した。得られたDNAをHEK293細胞にトランスフェクションし、24時間後、coelenterazineを基質とする生物発光反応をルミノメーターで検出した。
【0116】
その結果、図9に示すように、NDS-Rlucの発光レベルは野生型RlucおよびCP-Rlucよりも低いレベルであった。このことから、NDSはEGFPだけでなく、Rlucも連結することで低発現化を誘導することが明らかになった。NDSの低発現性の誘導がより普遍的に任意のタンパク質で起こりうることが示唆された。またRlucはレポータータンパク質として汎用されており、NDSによる低発現化をRlucのレポータータンパク質としての高感度化・高S/N比化を付与すると考えられる。
【0117】
[実施例 15]
(15.プロテアソーム阻害剤処理によるNDS融合タンパク質の発現レベルの上昇効果) 次に、プロテアソーム阻害剤処理でNefNL4-3およびNDS-EGFPの発現レベルの回復が認められるかどうかを検討した。
【0118】
具体的には、NefNL4-3またはNDS-EGFPの発現ベクターをHEK293にトランスフェクトし、48時間後、MG132を20μM処理した。処理0時間、3時間、及び6時間後に細胞を回収し、常法に従いウエスタンイムノブロットにより発現レベルを調べた。
【0119】
その結果、図10に示すとおり、プロテアソーム阻害剤MG132を処理すると、時間依存的な発現量の回復が認められた。ことことから、NDSによる低発現化には少なくともプロテアソームによる分解が関連していることが示唆された。
【0120】
プロテアソーム阻害剤は、がんの一種である多発性骨髄腫の治療薬として現在臨床応用されている。また近年、リウマチの治療ターゲットとしてもプロテアソームは注目を集めている。NDSによる低発現化の機構としてプロテアソームによる分解が関連していることから、NDSを連結させたレポータータンパク質は、プロテアソームを標的とする治療薬開発のためのスクリーニング系に利用できると考えられる。
【0121】
最後に、上述した各実施の形態の説明は本発明の一例であり、本発明は上述の実施の形態に限定されることはない。このため、上述した各実施の形態以外であっても、本発明に係る技術的思想を逸脱しない範囲であれば、設計等に応じて種々の変更が可能であることは勿論である。
【特許請求の範囲】
【請求項1】
少なくとも人又は猿の免疫不全ウイルスが有するnef遺伝子由来のタンパク質低発現化ペプチドがコードされた遺伝子。
【請求項2】
以下の(1)〜(4)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子:
(1)配列番号1の第385-618番目の塩基で表される塩基配列;
(2)配列番号2の第129-206番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(3)配列番号2の第129-206番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第129-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(4)上記(1)〜(3)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第129-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【請求項3】
以下の(5)〜(8)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子:
(5)配列番号1の第424-618番目の塩基で表される塩基配列;
(6)配列番号2の第142-206番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(7)配列番号2の第142-206番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第142-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(8)上記(5)〜(7)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第142-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【請求項4】
以下の(9)〜(12)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子:
(9)配列番号1の第385-558番目の塩基で表される塩基配列;
(10)配列番号2の第129-186番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(11)配列番号2の第129-186番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第129-186番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(12)上記(9)〜(11)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第129-186番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【請求項5】
以下の(13)〜(16)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子:
(13)配列番号3の第415-651番目の塩基で表される塩基配列;
(14)配列番号4の第139-216番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(15)配列番号4の第139-216番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号4の第139-216番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(16)上記(13)〜(15)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号4第139-216番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【請求項6】
以下の(17)〜(20)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子:
(17)配列番号5の第481-789番目の塩基で表される塩基配列;
(18)配列番号6の第161-263番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(19)配列番号6の第161-263番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号6の第161-263番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(20)上記(17)〜(19)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号6第161-263番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【請求項7】
任意の標的タンパク質をコードする塩基配列の5’末端及び/又は3’末端に、請求項1〜6いずれか1項に記載の遺伝子の塩基配列を付加した遺伝子構築物。
【請求項8】
任意の標的タンパク質をコードする塩基配列の5’末端及び/又は3’末端に、リンカーを介して請求項1〜6いずれか1項に記載の遺伝子の塩基配列を付加した遺伝子構築物。
【請求項9】
前記任意の標的タンパク質は、任意の抗体であることを特徴とする請求項7又は請求項8に記載の遺伝子構築物。
【請求項10】
前記任意の標的タンパク質は、ウイルス構造タンパク質である請求項7又は請求項8に記載の遺伝子構築物。
【請求項11】
プロモーターを備え、同プロモーターの制御下に、レポータータンパク質をコードする塩基配列と、請求項1〜6いずれか1項に記載の遺伝子の塩基配列とを有する遺伝子構築物。
【請求項12】
前記レポータータンパク質が増強緑色蛍光タンパク(EGFP)であることを特徴とする請求項11に記載の遺伝子構築物。
【請求項13】
請求項7〜12のいずれか1項に記載の遺伝子構築物を含む発現ベクター。
【請求項14】
請求項7〜12のいずれか1項に記載の遺伝子構築物及び/又は請求項13に記載の発現ベクターを、一過的又は安定的に発現するように導入された細胞。
【請求項15】
請求項14に記載の細胞を備えた生物。
【請求項16】
請求項14に記載の細胞、又は、請求項15に記載の生物を、それぞれ異なる条件下で培養し、レポータータンパク質のシグナルを測定し、プロモーターの転写活性を比較することからなる、プロモーター活性の分析方法。
【請求項17】
請求項14に記載の細胞、又は、請求項15に記載の生物を、被検化合物の存在下及び非存在下で培養し、レポータータンパク質のシグナルを測定し、プロモーターの転写活性を比較することにより、前記被検化合物のプロモーターに対する影響を評価する方法。
【請求項18】
請求項17に記載の方法により被検化合物のプロモーターに対する影響の評価を行って、前記被験化合物の中から、所定の化合物をスクリーニングするスクリーニングキット。
【請求項19】
請求項14に記載の細胞、又は、請求項15に記載の生物を、被検化合物の存在下及び非存在下で培養し、レポータータンパク質のシグナルを測定比較することからなる、前記被検化合物の低タンパク質発現活性に対する影響を評価する方法。
【請求項20】
低タンパク質発現活性に影響を及ぼす披検化合物がプロテアソーム阻害剤候補物質であることを特徴とする請求項19に記載の方法。
【請求項21】
請求項19に記載の方法により、被検化合物の低タンパク質発現活性に対する影響の評価を行って、前記被験化合物の中から所定の化合物をスクリーニングするスクリーニングキットであって、前記被験化合物は、プロテアソーム阻害剤候補物質であることを特徴とするスクリーニングキット。
【請求項22】
以下の(1)〜(3)の工程を含む、標的タンパク質を低発現化させる方法:
(1)請求項1〜6いずれか1項に記載の遺伝子を、標的タンパク質をコードする遺伝子と連結させる工程、
(2)工程(1)で得た組換え遺伝子を、発現ベクターに取り込む工程、
(3)工程(2)で得た発現ベクターを宿主細胞に導入し、発現させる工程。
【請求項1】
少なくとも人又は猿の免疫不全ウイルスが有するnef遺伝子由来のタンパク質低発現化ペプチドがコードされた遺伝子。
【請求項2】
以下の(1)〜(4)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子:
(1)配列番号1の第385-618番目の塩基で表される塩基配列;
(2)配列番号2の第129-206番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(3)配列番号2の第129-206番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第129-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(4)上記(1)〜(3)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第129-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【請求項3】
以下の(5)〜(8)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子:
(5)配列番号1の第424-618番目の塩基で表される塩基配列;
(6)配列番号2の第142-206番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(7)配列番号2の第142-206番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第142-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(8)上記(5)〜(7)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第142-206番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【請求項4】
以下の(9)〜(12)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子:
(9)配列番号1の第385-558番目の塩基で表される塩基配列;
(10)配列番号2の第129-186番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(11)配列番号2の第129-186番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号2の第129-186番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(12)上記(9)〜(11)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号2第129-186番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【請求項5】
以下の(13)〜(16)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子:
(13)配列番号3の第415-651番目の塩基で表される塩基配列;
(14)配列番号4の第139-216番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(15)配列番号4の第139-216番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号4の第139-216番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(16)上記(13)〜(15)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号4第139-216番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【請求項6】
以下の(17)〜(20)に示す少なくともいずれか1つの塩基配列を有する、タンパク質低発現化ペプチドをコードする遺伝子:
(17)配列番号5の第481-789番目の塩基で表される塩基配列;
(18)配列番号6の第161-263番目のアミノ酸で表されるアミノ酸配列をコードする塩基配列;
(19)配列番号6の第161-263番目のアミノ酸で表されるアミノ酸配列において、
1又は複数個のアミノ酸が置換、付加、欠失若しくは挿入され、且つ配列番号6の第161-263番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列;
(20)上記(17)〜(19)から選ばれる少なくともいずれか1つの塩基配列とストリンジェントな条件下でハイブリダイズし、且つ配列番号6第161-263番目のアミノ酸で表されるペプチドと実質的に同一のタンパク質低発現化活性を有するペプチドをコードする塩基配列。
【請求項7】
任意の標的タンパク質をコードする塩基配列の5’末端及び/又は3’末端に、請求項1〜6いずれか1項に記載の遺伝子の塩基配列を付加した遺伝子構築物。
【請求項8】
任意の標的タンパク質をコードする塩基配列の5’末端及び/又は3’末端に、リンカーを介して請求項1〜6いずれか1項に記載の遺伝子の塩基配列を付加した遺伝子構築物。
【請求項9】
前記任意の標的タンパク質は、任意の抗体であることを特徴とする請求項7又は請求項8に記載の遺伝子構築物。
【請求項10】
前記任意の標的タンパク質は、ウイルス構造タンパク質である請求項7又は請求項8に記載の遺伝子構築物。
【請求項11】
プロモーターを備え、同プロモーターの制御下に、レポータータンパク質をコードする塩基配列と、請求項1〜6いずれか1項に記載の遺伝子の塩基配列とを有する遺伝子構築物。
【請求項12】
前記レポータータンパク質が増強緑色蛍光タンパク(EGFP)であることを特徴とする請求項11に記載の遺伝子構築物。
【請求項13】
請求項7〜12のいずれか1項に記載の遺伝子構築物を含む発現ベクター。
【請求項14】
請求項7〜12のいずれか1項に記載の遺伝子構築物及び/又は請求項13に記載の発現ベクターを、一過的又は安定的に発現するように導入された細胞。
【請求項15】
請求項14に記載の細胞を備えた生物。
【請求項16】
請求項14に記載の細胞、又は、請求項15に記載の生物を、それぞれ異なる条件下で培養し、レポータータンパク質のシグナルを測定し、プロモーターの転写活性を比較することからなる、プロモーター活性の分析方法。
【請求項17】
請求項14に記載の細胞、又は、請求項15に記載の生物を、被検化合物の存在下及び非存在下で培養し、レポータータンパク質のシグナルを測定し、プロモーターの転写活性を比較することにより、前記被検化合物のプロモーターに対する影響を評価する方法。
【請求項18】
請求項17に記載の方法により被検化合物のプロモーターに対する影響の評価を行って、前記被験化合物の中から、所定の化合物をスクリーニングするスクリーニングキット。
【請求項19】
請求項14に記載の細胞、又は、請求項15に記載の生物を、被検化合物の存在下及び非存在下で培養し、レポータータンパク質のシグナルを測定比較することからなる、前記被検化合物の低タンパク質発現活性に対する影響を評価する方法。
【請求項20】
低タンパク質発現活性に影響を及ぼす披検化合物がプロテアソーム阻害剤候補物質であることを特徴とする請求項19に記載の方法。
【請求項21】
請求項19に記載の方法により、被検化合物の低タンパク質発現活性に対する影響の評価を行って、前記被験化合物の中から所定の化合物をスクリーニングするスクリーニングキットであって、前記被験化合物は、プロテアソーム阻害剤候補物質であることを特徴とするスクリーニングキット。
【請求項22】
以下の(1)〜(3)の工程を含む、標的タンパク質を低発現化させる方法:
(1)請求項1〜6いずれか1項に記載の遺伝子を、標的タンパク質をコードする遺伝子と連結させる工程、
(2)工程(1)で得た組換え遺伝子を、発現ベクターに取り込む工程、
(3)工程(2)で得た発現ベクターを宿主細胞に導入し、発現させる工程。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8A】


【図8B】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8A】


【図8B】


【図9】


【図10】


【公開番号】特開2011−101639(P2011−101639A)
【公開日】平成23年5月26日(2011.5.26)
【国際特許分類】
【出願番号】特願2010−232990(P2010−232990)
【出願日】平成22年10月15日(2010.10.15)
【出願人】(504159235)国立大学法人 熊本大学 (314)
【Fターム(参考)】
【公開日】平成23年5月26日(2011.5.26)
【国際特許分類】
【出願日】平成22年10月15日(2010.10.15)
【出願人】(504159235)国立大学法人 熊本大学 (314)
【Fターム(参考)】
[ Back to top ]

