タンパク質凝集の分析方法
【課題】 小型の測定機で簡単かつ迅速にタンパク質凝集体を含む試料を分析可能とする。
【解決手段】 タンパク質及び/又はその凝集体を含む試料を電気化学測定により分析するタンパク質凝集の分析方法であって、タンパク質として電気化学的に活性なアミノ酸残基を含むタンパク質を用いるとともに、タンパク質及び/又はその凝集体を電極表面に接触させた状態で電気化学測定を行う。タンパク質は非標識タンパク質であることが好ましい。電気化学測定法として、電極の電位を変化させながら電流値を測定する。試料としてタンパク質を溶液中で所定時間インキュベーションして凝集させた後の溶液を用い、インキュベーションの経過に伴う電流値の変化から、タンパク質の凝集の度合いを調べる。電気化学的に活性なアミノ酸残基を含むタンパク質として、トリプトファン残基及び/又はチロシン残基を含むタンパク質を用いる。具体的には、アミロイドβタンパク質、プリオンタンパク質が挙げられる。
【解決手段】 タンパク質及び/又はその凝集体を含む試料を電気化学測定により分析するタンパク質凝集の分析方法であって、タンパク質として電気化学的に活性なアミノ酸残基を含むタンパク質を用いるとともに、タンパク質及び/又はその凝集体を電極表面に接触させた状態で電気化学測定を行う。タンパク質は非標識タンパク質であることが好ましい。電気化学測定法として、電極の電位を変化させながら電流値を測定する。試料としてタンパク質を溶液中で所定時間インキュベーションして凝集させた後の溶液を用い、インキュベーションの経過に伴う電流値の変化から、タンパク質の凝集の度合いを調べる。電気化学的に活性なアミノ酸残基を含むタンパク質として、トリプトファン残基及び/又はチロシン残基を含むタンパク質を用いる。具体的には、アミロイドβタンパク質、プリオンタンパク質が挙げられる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、タンパク質及び/又はその凝集体を分析するタンパク質凝集の分析方法に関する。
【背景技術】
【0002】
ある種のタンパク質は、タンパク質含有溶液のpHや温度を変化させたり、溶液に特定の試薬を添加したりすることによって凝集するという性質を示すことが知られている。このようなタンパク質としては、アルツハイマー病患者の脳組織において観察される老人斑の主成分であるアミロイドβタンパク質が代表的であり、この凝集の度合いを測定するための方法や装置等についてこれまでに様々な方法が提案されている(例えば非特許文献1〜3参照。)。具体的には、円二色性分光光度計を用いて測定する方法、蛍光色素であるチオフラビンTを用いて凝集体の蛍光強度を測定する方法、原子間力顕微鏡等の電子顕微鏡を用いて凝集体を観察する方法等が挙げられる。また、アミロイドβタンパク質の凝集を電気化学的に測定する方法が知られている。例えば特許文献1の実施例8においては、試料にニトリロ三酢酸(NTA)と電子シグナリングのためのフェロセン誘導体を持つコロイドを加え、少なくとも一部のHis標識β−アミロイドペプチドがコロイド粒子に付着するようにし、次にコロイド装飾原線維(His標識β−アミロイドペプチド)に結合する結合リガンド(抗体)を持つ磁気ビーズを加え、それらを磁気的に動作電極に誘引し、交流ボルタンメトリー(ACV)分析する方法が記載されている。
【非特許文献1】Stine Jr, W.B.; Dahigren, K.N.; Kraff, G.A.; LaDu, M.J. J. Biol. Chem. 2003, 278, 11612.
【非特許文献2】Ono, K.; Yoshiike, Y., Takashima, A.; Hasegawa, K.; Naiki, H.; Yamada, M. J. Neurochem., 2003, 87, 172.
【非特許文献3】Yoshiike, Y.; Tanemura, K,; Murayama, O.; Akagi, T.; Murayama, M.; Sata, S.; Sun, X.; Tanaka, N.; Takashima. A. J. boil. Chem. 2001, 276, 32292.
【特許文献1】特表2004−526124号公報
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかしながら、既存のタンパク質凝集体を含む試料を分析する方法は、以下のような問題がある。例えば、円二色性分光光度計を用いる方法や蛍光強度を測定する方法においては、検出用の光学系が必要となるため、測定機の大型化を招いてしまう。電子顕微鏡観察による方法においては、熟練した分析技術を必要としたり、分析に先立って前処理を行わなければならず操作が煩雑である等の数々の問題があり、多検体の迅速な分析には不向きである。
【0004】
また、特許文献1記載の方法では、例えば磁気ビーズ等の何らかの表面に抗体等のタンパク質やその凝集体を特異的に結合させる必要があり、測定操作の煩雑化を招く。さらに、電気化学的測定を可能とするために、例えばフェロセン誘導体等の添加物やさらにはコロイド粒子等の様々な測定材料が必要となる結果、測定準備に長時間を要したり、測定操作の著しい煩雑化を招く。
【0005】
そこで本発明はこのような従来の実情に鑑みて提案されたものであり、タンパク質凝集体を含む試料の分析を小型の測定機で簡単かつ迅速に行うことが可能なタンパク質凝集の分析方法を提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明者らが長期にわたり検討を重ねた結果、試料中のタンパク質及び/又はその凝集体を電極表面へ固定させることなく、電極表面へ直接接触させた状態で電気化学測定により分析することがタンパク質凝集の分析に有効であることを見出した。
【0007】
本発明は以上のような知見に基づいて完成されたものである。すなわち、本発明に係るタンパク質凝集の分析方法は、タンパク質及び/又はその凝集体を含む試料を電気化学測定により分析するタンパク質凝集の分析方法であって、前記タンパク質として電気化学的に活性なアミノ酸残基を含むタンパク質を用いるとともに、前記タンパク質及び/又はその凝集体を電極表面に直接接触させた状態で前記電気化学測定を行うことを特徴とする。
【0008】
トリプトファン残基及び/又はチロシン残基等の電気化学的に活性なアミノ酸残基を含むタンパク質が凝集すると、凝集によるタンパク質立体構造の変化に伴い前記アミノ酸残基のタンパク質表面への露出状態が変化する結果、前記アミノ酸残基の電気化学的活性が変化する。そして本発明では、前記アミノ酸残基の電気化学的活性を、タンパク質及び/又はその凝集体を電極表面に直接接触させた状態で電気化学測定を行うことにより検出する。タンパク質の凝集の進行に伴って電気化学測定法による測定結果が変化するので、これを指標としてタンパク質の凝集の度合いの経時的変化等、タンパク質凝集の分析が可能となる。なお、分析に際してタンパク質の標識及び電極表面の修飾等は不要であり、既存の方法に比較して分析操作が大幅に簡略化される。
【0009】
また、本発明で利用する電気化学測定法は、円二色性分光光度計等の分光光度計や電子顕微鏡を用いる方法に比べても有利である。電気化学測定法は、多検体の迅速分析に適しているため、試料の迅速な分析が実現される。また、分析に際してタンパク質の標識、電子顕微鏡観察時のような前処理、電極表面への固定等は不要であり、従来の分析方法に比べて分析操作が簡略化される。さらに、電気化学測定法に用いる測定機は光学系を持たないため小型であり、比較的安価であるという利点も備える。
【発明の効果】
【0010】
本発明によれば、電気化学測定法を利用するとともに、タンパク質及び/又はその凝集体を電極表面に直接接触させて電気化学的に活性なアミノ酸残基の電気化学的活性を検出することで、タンパク質凝集の迅速かつ簡単な分析を実現することができる。また、以上のようなタンパク質凝集の分析方法においては、測定機として光学系が不要であるため、小型かつ安価な測定機で分析可能であり、分析コストを低減することができる。さらに、本発明によれば、従来の光学系を利用した分析法等に比べて少量のサンプルで分析を実現できる。
【発明を実施するための最良の形態】
【0011】
以下、本発明を適用したタンパク質凝集の分析方法について詳細に説明する。
本発明は、電気化学的に活性なアミノ酸残基を含むタンパク質やその凝集体の凝集の分析に有用である。電気化学的に活性なアミノ酸残基としては、例えばチロシン残基、トリプトファン残基から選ばれる少なくとも1種が挙げられる。本発明では、タンパク質が本来有するアミノ酸残基の電気化学的活性の変化をタンパク質凝集の指標として利用するため、分析対象となるタンパク質の標識は不要である。すなわち、本発明では、タンパク質凝集を分析するにあたって、非標識で迅速な分析が可能である。特に、本発明の分析方法は、アミロイドβタンパク質やプリオンタンパク質の凝集の分析に適用することが好ましい。なお、本発明において「タンパク質」とは、少数のアミノ酸が結合したペプチドも含む意味として用いる。
【0012】
本発明は、前記タンパク質やその凝集体を含む試料を電気化学測定法により分析し、例えばタンパク質の凝集の度合い等を測定するものである。電気化学測定法としては、電極電位を変化させながら電流値を測定する方法を利用することができ、具体的には矩形波ボルタンメトリー、サイクリックボルタンメトリー、微分パルスボルタンメトリー等の各種のボルタンメトリー法等を利用することができる。ボルタンメトリー法の中でも矩形波ボルタンメトリー法は高感度であるため好ましい。
【0013】
以下、電気化学測定法としてボルタンメトリー法を利用する場合について具体的に説明する。ボルタンメトリー法においては、ポテンシオスタットや、作用電極、参照電極、補助電極等を備える電気化学計測用セル等、通常の電気化学測定機を用いることができる。
【0014】
先ず、タンパク質及び/又はその凝集体(以下、単に凝集体と称する。)等を含む試料溶液と作用電極とを直接接触させ、タンパク質及び/又はその凝集体を作用電極表面に接触させる。作用電極の材料としては、例えばグラッシーカーボン等、この種の電気化学測定法に用いられる材料を制限なく用いることができる。
【0015】
ここで、タンパク質及び/又はその凝集体と作用電極表面とが直接接触するとは、タンパク質及び/又はその凝集体と作用電極とが物理的に接触している状態を指し、具体的には、タンパク質及び/又はその凝集体と作用電極表面との間に、例えばタンパク質及び/又はその凝集体に特異的に結合する抗体等が介在しない状態を指す。タンパク質や凝集体を作用電極表面へ直接接触させることで、タンパク質に含まれる電気化学的に活性なアミノ酸残基の電気化学的活性の変化を直接測定することになるため、分析操作がより簡略化されるとともに、検出感度を高めることができる。例えば、作用電極表面にタンパク質や凝集体を結合させる目的でタンパク質や凝集体に特異的な抗体を作用電極表面に固定しておくことは、分析操作の煩雑化を招くばかりか検出感度の低下を引き起こすため好ましくない。
【0016】
タンパク質及び/又はその凝集体を作用電極表面に直接接触させるには、例えば、分析対象となるタンパク質及び/又はその凝集体に特異的に結合する抗体を作用電極表面へ固定化することなく、作用電極表面に例えばタンパク質及び/又はその凝集体を吸着させればよい。吸着は、作用電極と試料溶液とを所定時間接触させることにより実現される。作用電極と試料溶液とを前記時間接触させることにより、試料溶液中のほとんどのタンパク質及び/又はその凝集体が作用電極表面に接触(吸着)することになり、タンパク質凝集の度合いを電流値に正確に反映させることができる。
【0017】
作用電極と試料溶液との接触時間は、電極の面積や試料溶液中のタンパク質及び/又はその凝集体の量等に応じて適宜設定する必要があるが、短すぎると検出感度が低下するおそれがあるため、例えば1分間以上とすることが好ましい。作用電極と試料溶液との接触時間の経過に伴い電気化学測定によって得られる信号強度が増加していき、例えば60分間としても分析は可能であるが、接触時間がある程度経過すると信号強度はそれ以上増加しなくなる。したがって、高感度検出と迅速分析との兼ね合いを考慮すると、接触時間は1分間以上5分間以下とすることがより好ましく、5分間とすることが最も好ましい。作用電極と試料溶液との接触時間がある程度経過すると信号強度がそれ以上増加しなくなる理由は、試料溶液中のほぼ全てのタンパク質及び/又はその凝集体が作用電極表面に対して吸着し終えるためと推測される。
【0018】
なお、電極表面へのタンパク質及び/又はその凝集体の吸着は必須ではなく、電気化学測定の際にタンパク質及び/又はその凝集体と電極表面とが直接接触している時間が得られれば、タンパク質及び/又はその凝集体を電極表面へ吸着させなくても構わない。この場合、例えば小容器に満たしたタンパク質やその凝集体等を含む試料溶液に各電極を浸漬し、当該試料溶液を撹拌子で撹拌しながらボルタンメトリー法等の電気化学的測定を行えばよい。
【0019】
次に、ボルタンメトリー法により電気化学測定を行う。具体的には、タンパク質及び/又はその凝集体が例えば吸着した作用電極を緩衝液等でリンスした後、適当な電解液に各電極を浸漬し、電極電位を変化させながら電流値を測定する。
【0020】
ところで、タンパク質の凝集によってタンパク質の立体構造の変化(例えばタンパク質分子表面への電気化学的に活性なアミノ酸残基の露出状態が変わるような変化)が起こり、その結果、タンパク質中の電気化学的に活性なアミノ酸残基の電気化学的活性が変化する。このアミノ酸残基の電気化学的活性の変化に起因してこれらアミノ酸残基の酸化シグナルが変化する結果、凝集前のタンパク質と凝集後のタンパク質の凝集体とでピーク電流値が変化する。このピーク電流値変化を指標として、例えば試料における凝集体の有無やタンパク質凝集の度合い等を知ることができる。例えばタンパク質としてチロシン残基を1つ含むアミロイドβタンパク質を用いる場合、凝集反応時間の経過、すなわち凝集の進行に伴って測定結果であるピーク電流値が低下する傾向を示す。このため、ピーク電流値の変化を指標として、アミロイドβタンパク質の凝集の度合いを知ることができる。
【0021】
以上のように、本発明の分析方法によれば、例えば矩形波ボルタンメトリー等の電気化学測定を利用するとともに、タンパク質及び/又はその凝集体を電極表面に接触させて電気化学的に活性なアミノ酸残基の電気化学的活性を検出するため、小型の測定機にてタンパク質凝集の度合いを迅速かつ簡単に知ることができる。
【0022】
本発明のタンパク質凝集の分析方法は、神経変性疾患の治療薬のスクリーニング方法に用いることができる。神経変性疾患として例えばアルツハイマー病の治療薬をスクリーニングする場合、先ず、アミロイドβタンパク質を含む溶液中に候補薬を添加して所定時間インキュベーションし、アミロイドβタンパク質の凝集反応を進める。凝集反応後の溶液を試料とし、本発明の分析方法を用いて試料(アミロイドβタンパク質及び/又はその凝集体)のピーク電流値を測定する。そして、測定されたピーク電流値と、例えば候補薬未投与時のアミロイドβタンパク質のピーク電流値とを比較することにより、候補薬投与試料におけるアミロイドβタンパク質の凝集の度合い、すなわち候補薬投与によりアミロイドβタンパク質の凝集が抑制又は阻害されたか否かを知ることができる。したがって、アミロイドβタンパク質の凝集を抑制又は阻害する作用を持つ候補薬を判別することができる。
【0023】
なお、本発明の神経変性疾患の治療薬のスクリーニング方法は、凝集にアミロイドβタンパク質が関与するアルツハイマー病に限らず、タンパク質凝集が疾患の発症や進行等の原因となるあらゆる神経変性疾患の治療薬のスクリーニングに適用することができる。いずれの神経変性疾患のスクリーニング方法においても、各疾患に関与するタンパク質を用いればよい。
【0024】
アルツハイマー病以外の神経変性疾患としては、例えばプリオンタンパク質が関与するウシ海綿状脳症(いわゆる狂牛病)、クロイツフェルト・ヤコブ病、スクレイピー、ゲルストマン−シュトラウスラー−シャインカー症候群、致死性家族性不眠症、クールー病等のような伝達性海綿状脳症が挙げられる。また、神経変性疾患としては、ABRIが関与する家族性英国型痴呆、α−シヌクレインが関与するパーキンソン病、ゲルソインが関与するフィンランド型家族性アミロイドーシス、ハンチンチンが関与するハンチントン病、タウタンパク質が関与する前頭側頭性痴呆、トランスチレチンが関与する老人性全身性アミロイドーシス、TTRが関与する家族性アミロイドポリニューロパチー等も挙げられるがこれらに限定されるものではない。
【0025】
本発明のタンパク質凝集の分析方法は、神経変性疾患の治療薬の治療効果の評価方法に用いることができる。神経変性疾患として例えばアルツハイマー病の治療効果を評価する場合、所定の治療を受けた患者等からアミロイドβタンパク質やその凝集体を含むと考えられる検体を採取し、この検体から試料溶液を調製する。そして、本発明の分析方法を用いて試料(アミロイドβタンパク質及び/又はその凝集体)のピーク電流値を測定する。そして、測定されたピーク電流値と、例えば治療前の患者由来の試料、他の治療法を受けた患者由来の試料、治療期間の異なる試料等のピーク電流値とを比較することにより、凝集の度合い、すなわち当該治療法のアルツハイマー病の治療に対する有効性を知ることができる。したがって、本発明により当該治療法のアルツハイマー病に対する治療効果を評価することができる。
【0026】
なお、本発明の神経変性疾患の治療効果の評価方法は、凝集にアミロイドβタンパク質が関与するアルツハイマー病に限らず、タンパク質凝集が疾患の発症や進行等の原因となるあらゆる神経変性疾患の治療効果の評価に適用することができる。
【実施例】
【0027】
以下、本発明を適用した具体的な実施例について、実験結果に基づいて説明する。なお、本発明は以下の実施例の記載に限定されるものではない。
【0028】
アミロイドβタンパク質(Aβ)は、アルツハイマー病患者の脳組織において観察される老人斑の主成分であり、疎水性が高く、インビトロで容易に凝集するという性質を持つ。Aβとしては40個のアミノ酸からなるAβ−40と、42個のアミノ酸からなるAβ−42とがあり、Aβ−40の方がAβ−42より凝集し易いことが知られている。また、Aβ−40及びAβ−42は、それぞれ電気化学的に活性なチロシン残基を1残基含んでいる。Aβ−40及びAβ−42は凝集に伴って構造変化し、その結果チロシン残基の電気化学的活性に変化が生じるものと推測される。そこで以下の実験では、タンパク質としてAβ−40及びAβ−42を用い、凝集反応前のAβ−40及びAβ−42、並びに凝集反応後のAβ−40及びAβ−42についてボルタンメトリー法による電気化学測定を行った。また、従来法であるチオフラビンTを用いた蛍光法との比較を行った。
【0029】
<試料溶液>
0.02%アンモニア溶液にAβ−40又はAβ−42を添加し、短時間ボルテックスすることによりAβ−40溶液又はAβ−42溶液(200μM)を調製し、0.1mlバイアル中、−80℃で保存した。分析直前に、各バイアルを室温(24±1℃)にした。Aβ−40又はAβ−42(80μM)は、トリス塩酸バッファー(pH7.0)中、37±1℃の条件でインキュベーションすることにより、自発的に凝集した。所定時間インキュベーションした後の溶液を、試料溶液として以下に説明するような電気化学測定又は蛍光測定に供した。特に言及しない限り、全ての分析は室温で実施した。
【0030】
<電気化学測定>
矩形波ボルタンメトリー(SWV)により電気化学的測定を行った。測定の際には、ポテンシオスタットとしてAutolab PGSTAT12電気化学分析システム(Eco Chemie社製)、及び電気化学分析用のソフトウェア(GPES)を用いた。また、作用電極としてグラッシーカーボン電極(i.d.3mm)、参照電極(Ag/AgCl)、及び補助電極として白金ワイヤから構成される3電極システム(Bioanalytical Systems社)を用いた。分析には1ml電気化学セルを用いた。
【0031】
電気化学測定は、以下のように、吸着工程と、ボルタンメトリー法による分析工程との2段階を含んでいる。先ず、分析前に全ての電極をミリQ水によりリンスし、乾燥した。なお、電気化学測定を行う毎に、マイクロクロスパッド上で1分間、アルミナを用いたグラッシーカーボン電極表面の研磨、及び超音波を利用したミリQ水中での2分間のリンスを行った。実験直前に、電極に0.5Vの電圧を、3分間印加し、その後、ミリQ水によりリンスした。引き続いて、グラッシーカーボン電極上に15μlの試料溶液を滴下し、5分間吸着させた。それから、トリス塩酸バッファーでグラッシーカーボン電極を5秒間リンスした。
【0032】
その後、トリス塩酸バッファーを電解液として用い、作用電極表面からの電解液中への分析物の溶解を最小限に抑える目的で、電極を電解液中に挿入した後、直ちにボルタモグラムを記録した。なお、矩形波ボルタンメトリー法においては、25mVの振幅、200Hz、5mVのステップポテンシャルで0Vから+1.2Vまで電極電位を走査したときの電流を測定した。ボルタモグラムは、Savitzky−Golay(level 4)を用いてスムージングを行い、GPESでベースラインを校正した。
【0033】
<蛍光測定>
Aβペプチド(80μM)の凝集の経時的変化を、分光蛍光光度計とチオフラビンTとにより分析した。チオフラビンTは、線維構造に特異的に結合する蛍光色素である。AβとのチオフラビンTとの結合は、励起波長450nm、蛍光波長490nmで検出した。各試料溶液における最終濃度が40μMとなるようにチオフラビンTを添加した。検出前に反応混合物を10分間浸透した。Aβ−42の蛍光強度測定は20分毎、Aβ−40及び対照試料(ウシ血清アルブミン:BSA)の蛍光強度測定は30分毎に行った。分光蛍光光度計ユニット(FP−777、日本分光社製)及び200μlの石英キュベットを用い、未変性及び結合チオフラビンTの蛍光シグナルを検出した。
【0034】
<結果>
先ず、凝集前のAβ−40及びAβ−42について矩形波ボルタンメトリーを用いて電気化学測定を行った結果を、図1に示す。図1に示すように、これら2つのタンパク質のピークは非常に類似していることが確認された。また、図示は省略するが、矩形波ボルタンメトリーによる電気化学測定により、Aβ−40及びAβ−42の濃度の増加とともにピーク電流値が増加していき、ある程度の高濃度を越えるとピーク電流値はそれ以上増加しなくなりほぼ一定の値を示すことが確認された。さらに、矩形波ボルタンメトリー法による検出限界は、Aβ−40及びAβ−42ともに約0.7μg/mlであることが本発明者らにより確認された。
【0035】
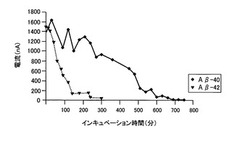
次に、Aβ−42及びAβ−40をインキュベーションした後の試料溶液を矩形波ボルタンメトリー法により分析した結果を、図2に示す。図2に示すように、タンパク質としてAβ−42を用いた場合、インキュベーション時間の経過に伴ってピーク電流値が減少し、インキュベーション開始300分後にはピークが観察されなくなった。これに対して、タンパク質としてAβ−40を用いた場合、インキュベーション開始700分後付近までピークが観察された。先にも説明したように、Aβ−40の方がAβ−42より凝集し易い性質を示す。このことから、矩形波ボルタンメトリー法による電気化学測定の結果は、Aβの凝集の度合いを表していることが確認された。
【0036】
なお、Aβの凝集の進行に伴いピーク電流値が減少する理由は、Aβの凝集によってAβの立体構造が変化し、Aβ中のチロシン残基が電気化学的に活性化され難い状態へと変化し、その結果、チロシン残基が例えば電気化学的に酸化されることに起因する酸化電流が減少したためと推測される。
【0037】
ここで、従来法である蛍光試薬チオフラビンTを用いた蛍光強度測定により同様の検討を行った。結果を図3に示す。図3に示すように、チオフラビンTを用いた方法においても、矩形波ボルタンメトリーを用いた場合と同一の傾向、すなわち、Aβ−42の凝集速度の方が速いことが確認された。
【0038】
以上の実験結果から、チオフラビンTを用いた方法等の従来の光学的測定法等と同様に電気化学測定法によってタンパク質の凝集の度合いを測定可能であることが確認され、タンパク質凝集体を含む試料の分析における本発明の有効性が確認された。
【図面の簡単な説明】
【0039】
【図1】8μMのAβ−42及び4μMのAβ−40について、室温で矩形波ボルタンメトリーによる電気化学的測定を行った結果を示す図である。
【図2】アミロイドβタンパク質(Aβ−42及びAβ−40)を含む試料溶液を矩形波ボルタンメトリーにより分析したときのピーク電流値の経時的変化を示す図である。
【図3】図3(a)はAβ−42を含む試料溶液をチオフラビンTを用いて蛍光分析したときの蛍光強度の経時的変化を示す図である。図3(b)はAβ−40を含む試料溶液をチオフラビンTを用いて蛍光分析したときの蛍光強度の経時的変化を示す図である。
【技術分野】
【0001】
本発明は、タンパク質及び/又はその凝集体を分析するタンパク質凝集の分析方法に関する。
【背景技術】
【0002】
ある種のタンパク質は、タンパク質含有溶液のpHや温度を変化させたり、溶液に特定の試薬を添加したりすることによって凝集するという性質を示すことが知られている。このようなタンパク質としては、アルツハイマー病患者の脳組織において観察される老人斑の主成分であるアミロイドβタンパク質が代表的であり、この凝集の度合いを測定するための方法や装置等についてこれまでに様々な方法が提案されている(例えば非特許文献1〜3参照。)。具体的には、円二色性分光光度計を用いて測定する方法、蛍光色素であるチオフラビンTを用いて凝集体の蛍光強度を測定する方法、原子間力顕微鏡等の電子顕微鏡を用いて凝集体を観察する方法等が挙げられる。また、アミロイドβタンパク質の凝集を電気化学的に測定する方法が知られている。例えば特許文献1の実施例8においては、試料にニトリロ三酢酸(NTA)と電子シグナリングのためのフェロセン誘導体を持つコロイドを加え、少なくとも一部のHis標識β−アミロイドペプチドがコロイド粒子に付着するようにし、次にコロイド装飾原線維(His標識β−アミロイドペプチド)に結合する結合リガンド(抗体)を持つ磁気ビーズを加え、それらを磁気的に動作電極に誘引し、交流ボルタンメトリー(ACV)分析する方法が記載されている。
【非特許文献1】Stine Jr, W.B.; Dahigren, K.N.; Kraff, G.A.; LaDu, M.J. J. Biol. Chem. 2003, 278, 11612.
【非特許文献2】Ono, K.; Yoshiike, Y., Takashima, A.; Hasegawa, K.; Naiki, H.; Yamada, M. J. Neurochem., 2003, 87, 172.
【非特許文献3】Yoshiike, Y.; Tanemura, K,; Murayama, O.; Akagi, T.; Murayama, M.; Sata, S.; Sun, X.; Tanaka, N.; Takashima. A. J. boil. Chem. 2001, 276, 32292.
【特許文献1】特表2004−526124号公報
【発明の開示】
【発明が解決しようとする課題】
【0003】
しかしながら、既存のタンパク質凝集体を含む試料を分析する方法は、以下のような問題がある。例えば、円二色性分光光度計を用いる方法や蛍光強度を測定する方法においては、検出用の光学系が必要となるため、測定機の大型化を招いてしまう。電子顕微鏡観察による方法においては、熟練した分析技術を必要としたり、分析に先立って前処理を行わなければならず操作が煩雑である等の数々の問題があり、多検体の迅速な分析には不向きである。
【0004】
また、特許文献1記載の方法では、例えば磁気ビーズ等の何らかの表面に抗体等のタンパク質やその凝集体を特異的に結合させる必要があり、測定操作の煩雑化を招く。さらに、電気化学的測定を可能とするために、例えばフェロセン誘導体等の添加物やさらにはコロイド粒子等の様々な測定材料が必要となる結果、測定準備に長時間を要したり、測定操作の著しい煩雑化を招く。
【0005】
そこで本発明はこのような従来の実情に鑑みて提案されたものであり、タンパク質凝集体を含む試料の分析を小型の測定機で簡単かつ迅速に行うことが可能なタンパク質凝集の分析方法を提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明者らが長期にわたり検討を重ねた結果、試料中のタンパク質及び/又はその凝集体を電極表面へ固定させることなく、電極表面へ直接接触させた状態で電気化学測定により分析することがタンパク質凝集の分析に有効であることを見出した。
【0007】
本発明は以上のような知見に基づいて完成されたものである。すなわち、本発明に係るタンパク質凝集の分析方法は、タンパク質及び/又はその凝集体を含む試料を電気化学測定により分析するタンパク質凝集の分析方法であって、前記タンパク質として電気化学的に活性なアミノ酸残基を含むタンパク質を用いるとともに、前記タンパク質及び/又はその凝集体を電極表面に直接接触させた状態で前記電気化学測定を行うことを特徴とする。
【0008】
トリプトファン残基及び/又はチロシン残基等の電気化学的に活性なアミノ酸残基を含むタンパク質が凝集すると、凝集によるタンパク質立体構造の変化に伴い前記アミノ酸残基のタンパク質表面への露出状態が変化する結果、前記アミノ酸残基の電気化学的活性が変化する。そして本発明では、前記アミノ酸残基の電気化学的活性を、タンパク質及び/又はその凝集体を電極表面に直接接触させた状態で電気化学測定を行うことにより検出する。タンパク質の凝集の進行に伴って電気化学測定法による測定結果が変化するので、これを指標としてタンパク質の凝集の度合いの経時的変化等、タンパク質凝集の分析が可能となる。なお、分析に際してタンパク質の標識及び電極表面の修飾等は不要であり、既存の方法に比較して分析操作が大幅に簡略化される。
【0009】
また、本発明で利用する電気化学測定法は、円二色性分光光度計等の分光光度計や電子顕微鏡を用いる方法に比べても有利である。電気化学測定法は、多検体の迅速分析に適しているため、試料の迅速な分析が実現される。また、分析に際してタンパク質の標識、電子顕微鏡観察時のような前処理、電極表面への固定等は不要であり、従来の分析方法に比べて分析操作が簡略化される。さらに、電気化学測定法に用いる測定機は光学系を持たないため小型であり、比較的安価であるという利点も備える。
【発明の効果】
【0010】
本発明によれば、電気化学測定法を利用するとともに、タンパク質及び/又はその凝集体を電極表面に直接接触させて電気化学的に活性なアミノ酸残基の電気化学的活性を検出することで、タンパク質凝集の迅速かつ簡単な分析を実現することができる。また、以上のようなタンパク質凝集の分析方法においては、測定機として光学系が不要であるため、小型かつ安価な測定機で分析可能であり、分析コストを低減することができる。さらに、本発明によれば、従来の光学系を利用した分析法等に比べて少量のサンプルで分析を実現できる。
【発明を実施するための最良の形態】
【0011】
以下、本発明を適用したタンパク質凝集の分析方法について詳細に説明する。
本発明は、電気化学的に活性なアミノ酸残基を含むタンパク質やその凝集体の凝集の分析に有用である。電気化学的に活性なアミノ酸残基としては、例えばチロシン残基、トリプトファン残基から選ばれる少なくとも1種が挙げられる。本発明では、タンパク質が本来有するアミノ酸残基の電気化学的活性の変化をタンパク質凝集の指標として利用するため、分析対象となるタンパク質の標識は不要である。すなわち、本発明では、タンパク質凝集を分析するにあたって、非標識で迅速な分析が可能である。特に、本発明の分析方法は、アミロイドβタンパク質やプリオンタンパク質の凝集の分析に適用することが好ましい。なお、本発明において「タンパク質」とは、少数のアミノ酸が結合したペプチドも含む意味として用いる。
【0012】
本発明は、前記タンパク質やその凝集体を含む試料を電気化学測定法により分析し、例えばタンパク質の凝集の度合い等を測定するものである。電気化学測定法としては、電極電位を変化させながら電流値を測定する方法を利用することができ、具体的には矩形波ボルタンメトリー、サイクリックボルタンメトリー、微分パルスボルタンメトリー等の各種のボルタンメトリー法等を利用することができる。ボルタンメトリー法の中でも矩形波ボルタンメトリー法は高感度であるため好ましい。
【0013】
以下、電気化学測定法としてボルタンメトリー法を利用する場合について具体的に説明する。ボルタンメトリー法においては、ポテンシオスタットや、作用電極、参照電極、補助電極等を備える電気化学計測用セル等、通常の電気化学測定機を用いることができる。
【0014】
先ず、タンパク質及び/又はその凝集体(以下、単に凝集体と称する。)等を含む試料溶液と作用電極とを直接接触させ、タンパク質及び/又はその凝集体を作用電極表面に接触させる。作用電極の材料としては、例えばグラッシーカーボン等、この種の電気化学測定法に用いられる材料を制限なく用いることができる。
【0015】
ここで、タンパク質及び/又はその凝集体と作用電極表面とが直接接触するとは、タンパク質及び/又はその凝集体と作用電極とが物理的に接触している状態を指し、具体的には、タンパク質及び/又はその凝集体と作用電極表面との間に、例えばタンパク質及び/又はその凝集体に特異的に結合する抗体等が介在しない状態を指す。タンパク質や凝集体を作用電極表面へ直接接触させることで、タンパク質に含まれる電気化学的に活性なアミノ酸残基の電気化学的活性の変化を直接測定することになるため、分析操作がより簡略化されるとともに、検出感度を高めることができる。例えば、作用電極表面にタンパク質や凝集体を結合させる目的でタンパク質や凝集体に特異的な抗体を作用電極表面に固定しておくことは、分析操作の煩雑化を招くばかりか検出感度の低下を引き起こすため好ましくない。
【0016】
タンパク質及び/又はその凝集体を作用電極表面に直接接触させるには、例えば、分析対象となるタンパク質及び/又はその凝集体に特異的に結合する抗体を作用電極表面へ固定化することなく、作用電極表面に例えばタンパク質及び/又はその凝集体を吸着させればよい。吸着は、作用電極と試料溶液とを所定時間接触させることにより実現される。作用電極と試料溶液とを前記時間接触させることにより、試料溶液中のほとんどのタンパク質及び/又はその凝集体が作用電極表面に接触(吸着)することになり、タンパク質凝集の度合いを電流値に正確に反映させることができる。
【0017】
作用電極と試料溶液との接触時間は、電極の面積や試料溶液中のタンパク質及び/又はその凝集体の量等に応じて適宜設定する必要があるが、短すぎると検出感度が低下するおそれがあるため、例えば1分間以上とすることが好ましい。作用電極と試料溶液との接触時間の経過に伴い電気化学測定によって得られる信号強度が増加していき、例えば60分間としても分析は可能であるが、接触時間がある程度経過すると信号強度はそれ以上増加しなくなる。したがって、高感度検出と迅速分析との兼ね合いを考慮すると、接触時間は1分間以上5分間以下とすることがより好ましく、5分間とすることが最も好ましい。作用電極と試料溶液との接触時間がある程度経過すると信号強度がそれ以上増加しなくなる理由は、試料溶液中のほぼ全てのタンパク質及び/又はその凝集体が作用電極表面に対して吸着し終えるためと推測される。
【0018】
なお、電極表面へのタンパク質及び/又はその凝集体の吸着は必須ではなく、電気化学測定の際にタンパク質及び/又はその凝集体と電極表面とが直接接触している時間が得られれば、タンパク質及び/又はその凝集体を電極表面へ吸着させなくても構わない。この場合、例えば小容器に満たしたタンパク質やその凝集体等を含む試料溶液に各電極を浸漬し、当該試料溶液を撹拌子で撹拌しながらボルタンメトリー法等の電気化学的測定を行えばよい。
【0019】
次に、ボルタンメトリー法により電気化学測定を行う。具体的には、タンパク質及び/又はその凝集体が例えば吸着した作用電極を緩衝液等でリンスした後、適当な電解液に各電極を浸漬し、電極電位を変化させながら電流値を測定する。
【0020】
ところで、タンパク質の凝集によってタンパク質の立体構造の変化(例えばタンパク質分子表面への電気化学的に活性なアミノ酸残基の露出状態が変わるような変化)が起こり、その結果、タンパク質中の電気化学的に活性なアミノ酸残基の電気化学的活性が変化する。このアミノ酸残基の電気化学的活性の変化に起因してこれらアミノ酸残基の酸化シグナルが変化する結果、凝集前のタンパク質と凝集後のタンパク質の凝集体とでピーク電流値が変化する。このピーク電流値変化を指標として、例えば試料における凝集体の有無やタンパク質凝集の度合い等を知ることができる。例えばタンパク質としてチロシン残基を1つ含むアミロイドβタンパク質を用いる場合、凝集反応時間の経過、すなわち凝集の進行に伴って測定結果であるピーク電流値が低下する傾向を示す。このため、ピーク電流値の変化を指標として、アミロイドβタンパク質の凝集の度合いを知ることができる。
【0021】
以上のように、本発明の分析方法によれば、例えば矩形波ボルタンメトリー等の電気化学測定を利用するとともに、タンパク質及び/又はその凝集体を電極表面に接触させて電気化学的に活性なアミノ酸残基の電気化学的活性を検出するため、小型の測定機にてタンパク質凝集の度合いを迅速かつ簡単に知ることができる。
【0022】
本発明のタンパク質凝集の分析方法は、神経変性疾患の治療薬のスクリーニング方法に用いることができる。神経変性疾患として例えばアルツハイマー病の治療薬をスクリーニングする場合、先ず、アミロイドβタンパク質を含む溶液中に候補薬を添加して所定時間インキュベーションし、アミロイドβタンパク質の凝集反応を進める。凝集反応後の溶液を試料とし、本発明の分析方法を用いて試料(アミロイドβタンパク質及び/又はその凝集体)のピーク電流値を測定する。そして、測定されたピーク電流値と、例えば候補薬未投与時のアミロイドβタンパク質のピーク電流値とを比較することにより、候補薬投与試料におけるアミロイドβタンパク質の凝集の度合い、すなわち候補薬投与によりアミロイドβタンパク質の凝集が抑制又は阻害されたか否かを知ることができる。したがって、アミロイドβタンパク質の凝集を抑制又は阻害する作用を持つ候補薬を判別することができる。
【0023】
なお、本発明の神経変性疾患の治療薬のスクリーニング方法は、凝集にアミロイドβタンパク質が関与するアルツハイマー病に限らず、タンパク質凝集が疾患の発症や進行等の原因となるあらゆる神経変性疾患の治療薬のスクリーニングに適用することができる。いずれの神経変性疾患のスクリーニング方法においても、各疾患に関与するタンパク質を用いればよい。
【0024】
アルツハイマー病以外の神経変性疾患としては、例えばプリオンタンパク質が関与するウシ海綿状脳症(いわゆる狂牛病)、クロイツフェルト・ヤコブ病、スクレイピー、ゲルストマン−シュトラウスラー−シャインカー症候群、致死性家族性不眠症、クールー病等のような伝達性海綿状脳症が挙げられる。また、神経変性疾患としては、ABRIが関与する家族性英国型痴呆、α−シヌクレインが関与するパーキンソン病、ゲルソインが関与するフィンランド型家族性アミロイドーシス、ハンチンチンが関与するハンチントン病、タウタンパク質が関与する前頭側頭性痴呆、トランスチレチンが関与する老人性全身性アミロイドーシス、TTRが関与する家族性アミロイドポリニューロパチー等も挙げられるがこれらに限定されるものではない。
【0025】
本発明のタンパク質凝集の分析方法は、神経変性疾患の治療薬の治療効果の評価方法に用いることができる。神経変性疾患として例えばアルツハイマー病の治療効果を評価する場合、所定の治療を受けた患者等からアミロイドβタンパク質やその凝集体を含むと考えられる検体を採取し、この検体から試料溶液を調製する。そして、本発明の分析方法を用いて試料(アミロイドβタンパク質及び/又はその凝集体)のピーク電流値を測定する。そして、測定されたピーク電流値と、例えば治療前の患者由来の試料、他の治療法を受けた患者由来の試料、治療期間の異なる試料等のピーク電流値とを比較することにより、凝集の度合い、すなわち当該治療法のアルツハイマー病の治療に対する有効性を知ることができる。したがって、本発明により当該治療法のアルツハイマー病に対する治療効果を評価することができる。
【0026】
なお、本発明の神経変性疾患の治療効果の評価方法は、凝集にアミロイドβタンパク質が関与するアルツハイマー病に限らず、タンパク質凝集が疾患の発症や進行等の原因となるあらゆる神経変性疾患の治療効果の評価に適用することができる。
【実施例】
【0027】
以下、本発明を適用した具体的な実施例について、実験結果に基づいて説明する。なお、本発明は以下の実施例の記載に限定されるものではない。
【0028】
アミロイドβタンパク質(Aβ)は、アルツハイマー病患者の脳組織において観察される老人斑の主成分であり、疎水性が高く、インビトロで容易に凝集するという性質を持つ。Aβとしては40個のアミノ酸からなるAβ−40と、42個のアミノ酸からなるAβ−42とがあり、Aβ−40の方がAβ−42より凝集し易いことが知られている。また、Aβ−40及びAβ−42は、それぞれ電気化学的に活性なチロシン残基を1残基含んでいる。Aβ−40及びAβ−42は凝集に伴って構造変化し、その結果チロシン残基の電気化学的活性に変化が生じるものと推測される。そこで以下の実験では、タンパク質としてAβ−40及びAβ−42を用い、凝集反応前のAβ−40及びAβ−42、並びに凝集反応後のAβ−40及びAβ−42についてボルタンメトリー法による電気化学測定を行った。また、従来法であるチオフラビンTを用いた蛍光法との比較を行った。
【0029】
<試料溶液>
0.02%アンモニア溶液にAβ−40又はAβ−42を添加し、短時間ボルテックスすることによりAβ−40溶液又はAβ−42溶液(200μM)を調製し、0.1mlバイアル中、−80℃で保存した。分析直前に、各バイアルを室温(24±1℃)にした。Aβ−40又はAβ−42(80μM)は、トリス塩酸バッファー(pH7.0)中、37±1℃の条件でインキュベーションすることにより、自発的に凝集した。所定時間インキュベーションした後の溶液を、試料溶液として以下に説明するような電気化学測定又は蛍光測定に供した。特に言及しない限り、全ての分析は室温で実施した。
【0030】
<電気化学測定>
矩形波ボルタンメトリー(SWV)により電気化学的測定を行った。測定の際には、ポテンシオスタットとしてAutolab PGSTAT12電気化学分析システム(Eco Chemie社製)、及び電気化学分析用のソフトウェア(GPES)を用いた。また、作用電極としてグラッシーカーボン電極(i.d.3mm)、参照電極(Ag/AgCl)、及び補助電極として白金ワイヤから構成される3電極システム(Bioanalytical Systems社)を用いた。分析には1ml電気化学セルを用いた。
【0031】
電気化学測定は、以下のように、吸着工程と、ボルタンメトリー法による分析工程との2段階を含んでいる。先ず、分析前に全ての電極をミリQ水によりリンスし、乾燥した。なお、電気化学測定を行う毎に、マイクロクロスパッド上で1分間、アルミナを用いたグラッシーカーボン電極表面の研磨、及び超音波を利用したミリQ水中での2分間のリンスを行った。実験直前に、電極に0.5Vの電圧を、3分間印加し、その後、ミリQ水によりリンスした。引き続いて、グラッシーカーボン電極上に15μlの試料溶液を滴下し、5分間吸着させた。それから、トリス塩酸バッファーでグラッシーカーボン電極を5秒間リンスした。
【0032】
その後、トリス塩酸バッファーを電解液として用い、作用電極表面からの電解液中への分析物の溶解を最小限に抑える目的で、電極を電解液中に挿入した後、直ちにボルタモグラムを記録した。なお、矩形波ボルタンメトリー法においては、25mVの振幅、200Hz、5mVのステップポテンシャルで0Vから+1.2Vまで電極電位を走査したときの電流を測定した。ボルタモグラムは、Savitzky−Golay(level 4)を用いてスムージングを行い、GPESでベースラインを校正した。
【0033】
<蛍光測定>
Aβペプチド(80μM)の凝集の経時的変化を、分光蛍光光度計とチオフラビンTとにより分析した。チオフラビンTは、線維構造に特異的に結合する蛍光色素である。AβとのチオフラビンTとの結合は、励起波長450nm、蛍光波長490nmで検出した。各試料溶液における最終濃度が40μMとなるようにチオフラビンTを添加した。検出前に反応混合物を10分間浸透した。Aβ−42の蛍光強度測定は20分毎、Aβ−40及び対照試料(ウシ血清アルブミン:BSA)の蛍光強度測定は30分毎に行った。分光蛍光光度計ユニット(FP−777、日本分光社製)及び200μlの石英キュベットを用い、未変性及び結合チオフラビンTの蛍光シグナルを検出した。
【0034】
<結果>
先ず、凝集前のAβ−40及びAβ−42について矩形波ボルタンメトリーを用いて電気化学測定を行った結果を、図1に示す。図1に示すように、これら2つのタンパク質のピークは非常に類似していることが確認された。また、図示は省略するが、矩形波ボルタンメトリーによる電気化学測定により、Aβ−40及びAβ−42の濃度の増加とともにピーク電流値が増加していき、ある程度の高濃度を越えるとピーク電流値はそれ以上増加しなくなりほぼ一定の値を示すことが確認された。さらに、矩形波ボルタンメトリー法による検出限界は、Aβ−40及びAβ−42ともに約0.7μg/mlであることが本発明者らにより確認された。
【0035】
次に、Aβ−42及びAβ−40をインキュベーションした後の試料溶液を矩形波ボルタンメトリー法により分析した結果を、図2に示す。図2に示すように、タンパク質としてAβ−42を用いた場合、インキュベーション時間の経過に伴ってピーク電流値が減少し、インキュベーション開始300分後にはピークが観察されなくなった。これに対して、タンパク質としてAβ−40を用いた場合、インキュベーション開始700分後付近までピークが観察された。先にも説明したように、Aβ−40の方がAβ−42より凝集し易い性質を示す。このことから、矩形波ボルタンメトリー法による電気化学測定の結果は、Aβの凝集の度合いを表していることが確認された。
【0036】
なお、Aβの凝集の進行に伴いピーク電流値が減少する理由は、Aβの凝集によってAβの立体構造が変化し、Aβ中のチロシン残基が電気化学的に活性化され難い状態へと変化し、その結果、チロシン残基が例えば電気化学的に酸化されることに起因する酸化電流が減少したためと推測される。
【0037】
ここで、従来法である蛍光試薬チオフラビンTを用いた蛍光強度測定により同様の検討を行った。結果を図3に示す。図3に示すように、チオフラビンTを用いた方法においても、矩形波ボルタンメトリーを用いた場合と同一の傾向、すなわち、Aβ−42の凝集速度の方が速いことが確認された。
【0038】
以上の実験結果から、チオフラビンTを用いた方法等の従来の光学的測定法等と同様に電気化学測定法によってタンパク質の凝集の度合いを測定可能であることが確認され、タンパク質凝集体を含む試料の分析における本発明の有効性が確認された。
【図面の簡単な説明】
【0039】
【図1】8μMのAβ−42及び4μMのAβ−40について、室温で矩形波ボルタンメトリーによる電気化学的測定を行った結果を示す図である。
【図2】アミロイドβタンパク質(Aβ−42及びAβ−40)を含む試料溶液を矩形波ボルタンメトリーにより分析したときのピーク電流値の経時的変化を示す図である。
【図3】図3(a)はAβ−42を含む試料溶液をチオフラビンTを用いて蛍光分析したときの蛍光強度の経時的変化を示す図である。図3(b)はAβ−40を含む試料溶液をチオフラビンTを用いて蛍光分析したときの蛍光強度の経時的変化を示す図である。
【特許請求の範囲】
【請求項1】
タンパク質及び/又はその凝集体を含む試料を電気化学測定により分析するタンパク質凝集の分析方法であって、
前記タンパク質として電気化学的に活性なアミノ酸残基を含むタンパク質を用いるとともに、前記タンパク質及び/又はその凝集体を電極表面に直接接触させた状態で前記電気化学測定を行うことを特徴とするタンパク質凝集の分析方法。
【請求項2】
前記タンパク質は非標識タンパク質であることを特徴とする請求項1記載のタンパク質凝集の分析方法。
【請求項3】
前記電気化学測定法として、前記電極の電位を変化させながら電流値を測定することを特徴とする請求項1又は2記載のタンパク質凝集の分析方法。
【請求項4】
前記試料として前記タンパク質を溶液中で所定時間インキュベーションして凝集させた後の溶液を用い、
前記インキュベーションの経過に伴う前記電流値の変化から、前記タンパク質の凝集の度合いを調べることを特徴とする請求項3記載のタンパク質凝集の分析方法。
【請求項5】
前記電気化学的に活性なアミノ酸残基を含むタンパク質として、トリプトファン残基及び/又はチロシン残基を含むタンパク質を用いることを特徴とする請求項1〜4のいずれか1項記載のタンパク質凝集の分析方法。
【請求項6】
前記トリプトファン残基及び/又はチロシン残基を含むタンパク質としてアミロイドβタンパク質を用いることを特徴とする請求項5記載のタンパク質凝集の分析方法。
【請求項7】
前記トリプトファン残基及び/又はチロシン残基を含むタンパク質としてプリオンタンパク質を用いることを特徴とする請求項5記載のタンパク質凝集の分析方法。
【請求項8】
請求項1〜5のいずれか1項記載のタンパク質凝集の分析方法を用いることを特徴とする神経変性疾患の治療薬のスクリーニング方法。
【請求項9】
前記神経変性疾患がアルツハイマー病であることを特徴とする請求項8記載の神経変性疾患の治療薬のスクリーニング方法。
【請求項10】
前記神経変性疾患がウシ海綿状脳症であることを特徴とする請求項8記載の神経変性疾患の治療薬のスクリーニング方法。
【請求項11】
請求項1〜5のいずれか1項記載のタンパク質凝集の分析方法を用いることを特徴とする神経変性疾患の治療効果の評価方法。
【請求項12】
前記神経変性疾患がアルツハイマー病であることを特徴とする請求項11記載の神経変性疾患の治療効果の評価方法。
【請求項13】
前記神経変性疾患がウシ海綿状脳症であることを特徴とする請求項11記載の神経変性疾患の治療効果の評価方法。
【請求項1】
タンパク質及び/又はその凝集体を含む試料を電気化学測定により分析するタンパク質凝集の分析方法であって、
前記タンパク質として電気化学的に活性なアミノ酸残基を含むタンパク質を用いるとともに、前記タンパク質及び/又はその凝集体を電極表面に直接接触させた状態で前記電気化学測定を行うことを特徴とするタンパク質凝集の分析方法。
【請求項2】
前記タンパク質は非標識タンパク質であることを特徴とする請求項1記載のタンパク質凝集の分析方法。
【請求項3】
前記電気化学測定法として、前記電極の電位を変化させながら電流値を測定することを特徴とする請求項1又は2記載のタンパク質凝集の分析方法。
【請求項4】
前記試料として前記タンパク質を溶液中で所定時間インキュベーションして凝集させた後の溶液を用い、
前記インキュベーションの経過に伴う前記電流値の変化から、前記タンパク質の凝集の度合いを調べることを特徴とする請求項3記載のタンパク質凝集の分析方法。
【請求項5】
前記電気化学的に活性なアミノ酸残基を含むタンパク質として、トリプトファン残基及び/又はチロシン残基を含むタンパク質を用いることを特徴とする請求項1〜4のいずれか1項記載のタンパク質凝集の分析方法。
【請求項6】
前記トリプトファン残基及び/又はチロシン残基を含むタンパク質としてアミロイドβタンパク質を用いることを特徴とする請求項5記載のタンパク質凝集の分析方法。
【請求項7】
前記トリプトファン残基及び/又はチロシン残基を含むタンパク質としてプリオンタンパク質を用いることを特徴とする請求項5記載のタンパク質凝集の分析方法。
【請求項8】
請求項1〜5のいずれか1項記載のタンパク質凝集の分析方法を用いることを特徴とする神経変性疾患の治療薬のスクリーニング方法。
【請求項9】
前記神経変性疾患がアルツハイマー病であることを特徴とする請求項8記載の神経変性疾患の治療薬のスクリーニング方法。
【請求項10】
前記神経変性疾患がウシ海綿状脳症であることを特徴とする請求項8記載の神経変性疾患の治療薬のスクリーニング方法。
【請求項11】
請求項1〜5のいずれか1項記載のタンパク質凝集の分析方法を用いることを特徴とする神経変性疾患の治療効果の評価方法。
【請求項12】
前記神経変性疾患がアルツハイマー病であることを特徴とする請求項11記載の神経変性疾患の治療効果の評価方法。
【請求項13】
前記神経変性疾患がウシ海綿状脳症であることを特徴とする請求項11記載の神経変性疾患の治療効果の評価方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2007−17348(P2007−17348A)
【公開日】平成19年1月25日(2007.1.25)
【国際特許分類】
【出願番号】特願2005−200662(P2005−200662)
【出願日】平成17年7月8日(2005.7.8)
【出願人】(304024430)国立大学法人北陸先端科学技術大学院大学 (169)
【Fターム(参考)】
【公開日】平成19年1月25日(2007.1.25)
【国際特許分類】
【出願日】平成17年7月8日(2005.7.8)
【出願人】(304024430)国立大学法人北陸先端科学技術大学院大学 (169)
【Fターム(参考)】
[ Back to top ]

