タンパク質安定化調合物
【課題】凍結乾燥された骨形態形成タンパク質(BMP)を安定化して、BMPが再水和時に生物活性の少なくとも60%を保持し、再水和した液体生成物を外科医が容易に扱うことができるタンパク質安定化調合物を提供する。
【解決手段】凍結乾燥された組成物、およびそれに続くそれらの保管と復元のための賦形剤としてトレハロースを主として含む、BMPが安定化された調合物および組成物。また、緩衝剤および界面活性剤を含む他の賦形剤をも含むことができる。
【解決手段】凍結乾燥された組成物、およびそれに続くそれらの保管と復元のための賦形剤としてトレハロースを主として含む、BMPが安定化された調合物および組成物。また、緩衝剤および界面活性剤を含む他の賦形剤をも含むことができる。
【発明の詳細な説明】
【開示の内容】
【0001】
〔技術分野〕
本発明は、処理、保存、および復元の過程で、骨形態形成タンパク質(BMP)および密接に関連のある成長分化因子(GDF)を安定化するための方法および調合物(formulations)に関する。さらに特定すれば、本発明は、rhGDF−5を送達するための媒体として使用される種々の基質を含む、凍結乾燥、保存、および復元(reconstitution)の過程でrhGDF−5を保護するための、トレハロースおよび他の賦形剤を含む調合物に関する。さらに、本発明は、様々な筋骨格の欠陥および症状を治療するためにそのような調合物を調製および使用するための方法を含む。
【0002】
〔発明の背景〕
生物学的分子(生体分子)は、三次元構造または立体配座(conformation)を有し、生体分子の生物活性および性質についてはこの構造に依存している。そのような生体分子の例は、デオキシリボ核酸(DNA)、リボ核酸(RNA)、およびタンパク質を含む。これらの生体分子は生命に必須であり、様々な医学的疾患および症状の治療における、治療薬および治療標的を代表する。タンパク質は、広範な生体分子のクラスを代表する。酵素、成長因子、受容体、抗体、およびシグナル分子等の異なるクラスのタンパク質は、それらの生物活性について立体配座構造に依存している。他のタンパク質のクラスは、例えばコラーゲンおよび軟骨のように、主として構造的なものであり(structural)、それ自体は生物活性を有していない。
【0003】
pH、温度、溶媒、オスモル濃度(osmolality)、その他の変化等の様々な環境に生体分子を曝露することは、生体分子の立体配座状態を不可逆的に変化させることまたは変性することができ、生体分子を生物学的に不活性にする。これらの生体分子の不活性化に関与する機構のうちいくつかは、凝集、酸化、加水分解および脱アミドを含む様々なタイプの結合切断、ならびに、架橋結合および他の共有結合を含む様々なタイプの結合形成を含み、例としてジスルフィド結合の転位(rearrangement)がある。
【0004】
骨形態形成タンパク質および密接に関連のある成長分化因子は(単量体および二量体の形で)、タンパク質のTGF−βスーパーファミリーに属している。このタンパク質のクラスは、当初はその異所性軟骨内性骨形成を誘導する能力によって同定された、骨形態形成タンパク質のファミリーのメンバーを含む(Chengら、「Osteogenic activity of the fourteen types of human bone morphogenic proteins」 J. Bone Joint Surg. Am. 85A: 1544-52 (2003)を参照)。これらのタンパク質のいくつかには別名がある(Loriesら、Cytokine Growth Factor Rev 16:287-98 (2005)を参照)。このファミリーの全てのメンバーは、カルボキシ末端側の活性ドメインを含む共通の構造的特徴を共有し、成熟したときの鎖長でおよそ97〜106アミノ酸である。全てのメンバーは、3つの分子内ジスルフィド結合および1つの分子間ジスルフィド結合を形成する、高度に保存されたシステイン残基のパターンを共有する。活性型は、ジスルフィド結合した単一のファミリーメンバーのホモ二量体、または2つの異なるメンバーのヘテロ二量体であることができる。(MassagueのAnnu. Rev. Cell Biol. 6:957 (1990)、SampathらのJ. Biol. Chem. 265:13198 (1990)、OzkaynakらのEMBO J. 9:2085-93 (1990)、WhartonらのPNAS 88:9214-18 (1991)、CelesteらのPNAS 87:9843-47 (1990)、LyonsらのPNAS 86:4554-58 (1989)、米国特許番号第5,011,691号、および米国特許番号第5,266,683号、を参照)。
【0005】
多くの糖が、溶液中で生体分子を安定化し、分離した細胞および生体分子に保護を提供できることが周知である。これらの化合物は、様々な種において凍結防止剤および浸透圧調節剤として周知である(YanceyのJ. Exper. Biol. 208:2819-30 (2005)を参照)。凍結乾燥された薬剤用タンパク質の開発において、糖(サッカライドおよび多価アルコール)は、タンパク質の安定性を改善し、有効期間を延長するためにしばしば調合物に加えられる。糖の安定化作用の機構に関して、2つの主要な理論がある。1)糖賦形剤は、固体の状態でタンパク質を希釈することに寄与し、希釈することによって、タンパク質−タンパク質相互作用を減少させ、凝集等の分子劣化を防止する。2)糖賦形剤は、ガラス様基質を提供し、基質中ではタンパク質の移動度、したがって反応性が最小化される。これらの機構の双方において、糖が非結晶質のタンパク質に接触する相のままであることが重要な意味を持つ。高温および高湿度等の様々な環境因子が、糖の結晶化を誘発し得る。したがって、使用される条件および物質を、検討中の特定の生体分子およびシステムに適するように最適化することが重要である。
【0006】
凍結乾燥(フリーズドライ)は、生体分子を保存するために通常使用される方法である。フリーズドライは一般的に、生体分子の生物活性に対して、凍結融解(freeze-thawing)または温度によって誘発される変性よりも破壊的であると考えられている。損傷の程度は、異なる生体分子および異なる条件で大幅に変化し、様々な研究者が異なったシステムを研究してきた。水溶液の凍結は、不安定な化合物に凍結そのものよりも損傷を与える可能性のある溶質濃度の初期上昇を作り出す。糖、タンパク質、ポリマー、緩衝液、および界面活性剤等の賦形剤は、生体分子の活性を安定化するために添加可能であるが、その効果の程度は限られており、システムに依存して異なる。Croweらは、乾燥したリン脂質二重層およびタンパク質の糖による安定化を記載しており(Biochem. J. 242:1-10 (1987))、また、「The trehalose myth revisited: Introduction to a symposium on stabilization of cells in the dry state」 Cryobiology 43,89-105 (2001)の中で、細胞のトレハロース安定化の機構の最近の理解を概説している。現在の考えは、生存可能で有用な凍結乾燥されたタンパク質を保持するためには、2つの別個の異なった必要条件があるというものである。その必要条件とは、1)タンパク質は、凍結過程の間に保護されなければならない、2)タンパク質は、後続の乾燥および復元の間に保護されなければならない。これらは、必ずしもある1つの賦形剤または条件セットによって満たされる必要は無い、異なった必要条件である。
【0007】
様々な研究者が、様々な生体分子を保護するために様々な賦形剤を使用することについて報告してきた。例えば、Glogerらは(Intl. J. Pharm. 260:59-68 (2003))、タンパク質を安定化するために低分子量のデキストランを使用した、アビスクミン(aviscumine)の溶解保護(lyoprotection)を記載しており、緩衝系およびポリソルベート80のみが凍結過程においてタンパク質を保護することに適しているが、乾燥過程においてタンパク質を保護するためにはデキストランが必要であることを示した。Goodnoughらは(Appl. Env. Biol. 58(10):3426-28 (1992))、安定化剤として血清アルブミンを使用し、また様々な他の賦形剤を使用した、凍結乾燥過程におけるボツリヌス毒素A型の安定化を研究し、どの賦形剤も有益な効果を持たなかったが、凍結乾燥混合液から塩化ナトリウムを除くことによって、またpHを制御することによって、活性毒素の回収率が劇的に改善されたことを報告した。Costantinoらは(J. Pharm. Sci. 87 (11):1412-20 (1998))、凍結乾燥された組み換えヒト成長ホルモンの安定性および構造に対する様々なサッカライドの効果を記載しており、試験された全ての賦形剤がタンパク質の安定性を劇的に改善したことを示した。Ramosらは(Appl. Envir. Microbiol. 63 (10):4020-25 (1997))、2−O−β−マンノシルグリセレート(2-O-β-mannosylglycerate)は、様々な起源から単離されたいくつかのデヒドロゲナーゼ酵素の熱ストレスからの保護において効果的であることを示し、また、2−O−β−マンノシルグリセレートによって与えられる保護は、研究された全ての酵素に対してトレハロースに類似しているかあるいはトレハロースより優れていたが、パイロコッカスフリオサス(P. furiosis)から単離されたグルタミン酸デヒドロゲナーゼの保護においては効果的ではなかったことを示した。Brusらは(J. Control. Rel. 95:119-31 (2004))、フリーズドライによるオリゴヌクレオチド−ポリエチレンイミン(PEI)複合体の安定化を研究し、これらの複合体はスクロースまたはトレハロース等の糖の添加から利益を得ることは無かったが、プラスミド−PEI複合体はそのような糖の添加から利益を得たことを報告した。これらの研究者は、様々な生体分子に対して様々な方法によって測定された、異なった程度の成功を報告している。これらの研究者でBMPの保護について報告した者はいない。
【0008】
したがって、何が生体分子の溶解保護を提供できる賦形剤の最適な組み合わせであるのかについては、相反する証拠が存在する。全ての生体分子に対して最適となるような如何なる賦形剤の組み合わせも存在しないが、研究中の生体分子に対する望みどおりの結果を得るためには、かなり著しい程度の実験が必要である。凍結乾燥、保管、および使用の過程でBMPを保護するための、薬学的に許容できる賦形剤の組み合わせに対する需要が残っている。
【0009】
〔発明の概要〕
本発明は、概して、様々な調合物および組成物におけるBMPの安定化と、それによる少なくとも60%の生物活性の保持、ならびに、例えば温度および湿度などの保存条件における要件の改善に関する。本発明は、BMPを含む凍結乾燥された組成物のための、およびそれに続くそれらの保管と復元のための賦形剤としてトレハロースを主として含む調合物を含み、緩衝剤および界面活性剤を含む他の賦形剤をさらに含む。
【0010】
本発明者らは、驚くべきことに、凍結乾燥中およびその後においてBMPの生物活性を保持する上でトレハロースが十分であり、かつ他の賦形剤よりも優れていることを発見した。多くの他の生体分子の安定化においては、得られる保護の量に関して糖の間でほとんど差異は無いが、BMPに対しては大きな差異がある。この発見は、追加の賦形剤に対する副作用の可能性が無い、患者の様々な筋骨格の欠陥を治療するための組成物を提供する。本発明者らはまた、驚くべきことに、アスコルビン酸およびグルタチオン等の抗酸化物質の添加は、トレハロースと共に凍結乾燥されたBMPの安定性を増加させず、むしろトレハロースによって提供された安定性を減じることも発見した。
【0011】
本発明の目的は、凍結乾燥されたBMPを安定化するのに十分な量のトレハロースを使用して、BMPが再水和時に生物活性の少なくとも60%を保持し、再水和した液体生成物を外科医が容易に扱うことができるようにすることである。
【0012】
本発明の別の目的は、凍結乾燥されたBMPを安定化するのに十分な量のトレハロース、少なくとも1種のBMP、および追加の賦形剤を使用して、BMPが再水和時に生物活性の少なくとも60%を保持し、再水和した液体生成物を外科医が容易に扱うことができるようにすることであり、追加の賦形剤は、緩衝剤、界面活性剤、およびそれらの混合物からなる群より選択される。
【0013】
本発明の別の目的は、凍結乾燥されたBMPを安定化するのに十分な量のトレハロース、少なくとも1種のBMP、および細分化されたコラーゲン繊維(morselized collagen fibers)を使用して、安定で再水和時に生物活性の少なくとも60%を保持するBMPを含む、凍結乾燥された生体適合性の流動性材料を調製する方法および組成物を提供し、再水和した生成物を外科医が容易に扱うことができるようにすることである。
【0014】
本発明の別の目的は、凍結乾燥されたBMPを安定化するのに十分な量のトレハロース、少なくとも1種のBMP、および生体適合性基質を使用して、安定で再水和時に生物活性の少なくとも60%を保持するBMPを含む、凍結乾燥された生体適合性基質を調製するための方法および組成物を提供し、再水和した生成物を外科医が容易に扱うことができるようにすることである。例となる生体適合性基質には、コラーゲン、ミネラル化コラーゲン(mineralized collagen)、リン酸カルシウム塩、カルシウム含有セラミックス、自原性(autogenic)、同種異系および異種発生性を含む様々な源(sources)からの骨、ならびに、ポリラクチド(PLA)、ポリグリコリド(PGA)、PLA−PGAコポリマー、ポリカーボネート、ポリカプロラクトン、およびそれらの混合物を含むポリマーが含まれる。
【0015】
本発明の別の目的は、凍結乾燥されたBMPを安定化するのに十分な量のトレハロース、少なくとも1種のBMP、生体適合性基質および追加の賦形剤を使用して、安定で再水和時に生物活性の少なくとも60%を保持するBMPを含む、凍結乾燥された生体適合性基質を調製するための方法および組成物を提供し、再水和した展性の生成物を外科医が容易に扱うことができるようにすることであり、追加の賦形剤は、緩衝剤、界面活性剤、およびそれらの混合物からなる群より選択される。
【0016】
本発明の別の目的は、トレハロース、低分子量デキストラン、シクロデキストリン、ポリエチレングリコール、ポリエチレングリコールエステル、およびそれらの混合物からなる群より選択される1つまたはそれ以上の溶解保護剤を、凍結乾燥されたBMPを安定化するのに十分な量使用し、且つ、少なくとも1種のBMPを使用して凍結乾燥されたBMPを調製する方法および組成物を提供し、BMPが再水和時に生物活性の少なくとも60%を保持し、再水和した生成物産物を外科医が容易に扱うことができるようにすることである。
【0017】
本発明の別の目的は、トレハロース、低分子量デキストラン、シクロデキストリン、ポリエチレングリコール、ポリエチレングリコールエステル、およびそれらの混合物からなる群より選択される1つまたはそれ以上の溶解保護剤、少なくとも1種のBMP、ならびにコラーゲンを使用して、安定で再水和時に生物活性の少なくとも60%を保持するBMPを含む、凍結乾燥された生体適合性コラーゲン基質を調製する方法および組成物を提供し、再水和した展性の生成物を外科医が容易に扱うことができるようにすることである。
【0018】
本発明の別の目的は、トレハロース、低分子量デキストラン、シクロデキストリン、ポリエチレングリコール、ポリエチレングリコールエステル、およびそれらの混合物からなる群より選択される1つまたはそれ以上の溶解保護剤、少なくとも1種のBMP、ならびに細分化されたコラーゲン繊維を使用して、安定で再水和時に生物活性の少なくとも60%を保持するBMPを含む、凍結乾燥された生体適合性の流動性物質を調製する方法および組成物を提供し、再水和した生成物を外科医が容易に扱うことができるようにすることである。
【0019】
本発明のさらに別の目的は、少なくとも一つの溶解保護剤と少なくとも一つのBMPとの凍結乾燥混合物を含む組成物を使用して、患者を治療することである。このような組成物は、復元された(reconstituted)BMP溶液を、例えば骨折、骨の裂け目(bone gap)、骨空隙、椎間板、軟骨欠損、腱、靭帯、および類似物等の患者の解剖学的構造の領域に直接適用することによって、または復元されたBMP溶液を、例えば人工股関節、人工膝関節、人工肩関節、人工椎間板および類似物等の骨に接触する人工インプラント、腱アンカー、靭帯アンカー、縫合糸、ステープルおよび類似物、ならびに骨置換ケージ、自己由来骨細片、同種異系骨細片、異種骨細片、脱ミネラル化骨細片および類似物などの、患者に植え込まれる装置に適用することによって、様々な筋骨格の欠陥を治療する際に治癒過程を改善させるために有用である。
【0020】
水溶液または乾燥固体の原体形態(bulk forms)のBMPは不安定であり、タンパク質の生物活性を保持するためには−20℃より低い温度での冷蔵が必要である。BMPは、凝集、ジスルフィド結合の転位、脱アミドおよび酸化の影響を受けやすいため、凍結乾燥されたBMPの生物活性を保存および保護するための調合物に対する需要が存在する。
【0021】
改善された安定性および保存性を有する凍結乾燥BMP製品に対する需要が存在する。
【0022】
水溶液を用いて復元し、椎間板、非関節軟骨および関節軟骨等の軟組織へ注入してそのような組織の再生を促進するために使用される、凍結乾燥BMP製品に対する需要が存在する。
【0023】
外科医が使用するために植え込み可能な生体適合性骨格に適正なBMP濃度で供給され、供給されることによって、浪費および望まれない手術部位への導入を含む、汚染、不適切な投与量、ならびにこぼれを含む、取り扱いに関連するリスクの多くを最小化するか、または排除する凍結乾燥BMP製品に対する需要が存在する。
【0024】
手術部位に容易に適用されることができる生体適合性の流動性物質に復元されることができる、凍結乾燥BMP製品に対する需要が存在する。
【0025】
〔発明の詳細な説明〕
BMPが発見されて以来、様々な筋骨格の欠陥や症状の処置における治療的使用に適した組成物を見出すための多数の研究活動があった。現在では、凍結乾燥固体として販売されるBMPを含む製品が存在し、その製品は、使用時に液体状態に復元されて外科医によって植え込まれるべき骨格または外科的治療部位に対して適用されなければならない。現在のrhBMP−2の調合物は、スクロースNF、グリシンUSP、L−グルタミン酸FCC、塩化ナトリウムUSP、およびポリソルベート80NFを賦形剤として使用しており、室温(15〜25℃)で保存してよい。現在のOP−1の調合物は、ウシコラーゲンのみを使用し、2〜8℃で保存しなければならない。復元されたBMPの安定性に対する賦形剤の有効性を記載した報文は存在しない。
【0026】
他の者は、マンニトール、スクロースおよびそれらの混合物を使用することによって、PLGA等のポリマー基質中にBMPを埋め込むことによって、メチオニン等の抗酸化剤を添加することによって、ヒスチジン、アルギニン、シクロデキストリンおよびウシ血清アルブミン等の他の賦形剤を添加することによって、ならびにTWEEN80等の界面活性剤を添加することによって、またはそれらの組み合わせによって、凍結乾燥過程におけるBMPの安定性を増進しようと試みてきた。これらの試みは、様々な程度の限定的な成功を収めてきた。
【0027】
米国特許番号第5,318,898号および第5,516,654号は、培養液中に硫酸デキストランを使用することによるBMP産生の改良プロセスを開示しているが、その利点がどのようにして達成されたかの機構を議論しておらず、また、タンパク質を安定化するための他の有用な賦形剤も開示していない。米国特許番号第5,385,887号において、Yimらは、BMPを送り込むための凍結乾燥された組成物および調合物を開示しており、その組成物はBMP、糖、グリシンおよびグルタミン酸を含む。Yimらは、W−20アルカリフォスファターゼ分析で証明されるように、凍結乾燥された調合物が生物活性を保っていることを開示しているが、彼らは、他の調合物に対してどれか一つの調合物についてでも量的な利点を示すような調合物に関する比較データを開示していない。これらの発明者は、BMPの溶解保護に関するトレハロースのスクロースに対する優位性を議論も認識もしていない。
【0028】
本発明は、凍結乾燥、保存、および、患者を治療するための水溶液を用いた復元に有用で、安定なBMPの調合物を調製および使用する方法および組成物を提供する。本発明は、説明に役立つ実施形態について以下に記載されており、BMPの例としてrhGDF−5を使用する。本発明が多くの異なった適用および実施形態で実施されてよいこと、ならびに本発明がその適用において本明細書に示される特定の実施例に特に限定されないことを当業者は理解するであろう。以下に続く実施例は、本発明の様々な実施形態および利点のいくつかを説明するが、当業者は、本発明の範囲および意図を逸脱することなく、他の類似の実施形態をとることができることを理解するであろう。
【0029】
本発明は、1つの態様において、後に続く骨および軟骨の欠陥の外科的治療における使用のために、安定な凍結乾燥されたBMPを調製するための方法および組成物を提供する。本明細書において熟慮されているように、そのような組成物は、少なくとも一種のBMP、および、BMPを安定化するのに十分な量のトレハロースを含む。そのような組成物は、復元されたタンパク質溶液を、例えば骨折、骨の裂け目、骨空隙、椎間板、癒合のために外科的に準備された椎間板隙、軟骨欠損、腱、靭帯および類似物等の患者の解剖学的構造の領域に直接に適用するか、あるいは、人工股関節、人工膝関節、人工肩関節、人工椎間板、腱アンカー、靭帯アンカー、縫合糸、ステープル、骨ケージ、自己由来骨細片、同種異系骨細片、異種骨細片、脱ミネラル化骨細片および類似物等の、骨または軟骨に接触して患者に植え込まれるべき物質に対して、直接適用することによって、様々な筋骨格の欠陥の治療に有用である。
【0030】
本明細書中で使用されているように、用語「モルフォゲン(morphogen)」「骨モルフォゲン(bone morphogen)」、「骨形成タンパク質(bone morphogenic protein)」、「骨形態形成タンパク質(bone morphogenetic protein)」、「BMP」、「骨原性タンパク質(osteogenic protein)」、「骨原性因子(osteogenic factor)」、「成長分化因子(Growth & Differentiation Factor)」、および「GDF」は、rhGDF−5によって代表されるクラスのタンパク質を包含する。しかし、通常の当業者は理解するであろうことであるが、rhGDF−5は単に、BMPとして機能することのできる真の組織モルフォゲンのTGF−βファミリーサブクラスの代表であり、説明を限定する意図は無い。用語「凍結防止剤(cryoprotectant)」は、凍結の過程で生体分子を安定化することのできる分子を指し示すために使用され、現在の文脈においては、フリーズドライ(凍結乾燥)の過程で生体分子を安定化することのできる分子を指し示す用語「溶解保護剤(lyoprotectant)」と等価である。本明細書中で使用されているように、用語「細分化された(morselized)」は以下の操作によって得られた生成物を、また用語「細分化(morselization)」は以下の操作の過程を指し示しており、操作とは、切断、せん断、分断、粉砕、微粉砕、あるいはそうでない場合、個々の粒子または繊維の全体のサイズが減じられるように、ある量の生体適合性基質、例えばコラーゲン、のサイズを減じることである。本明細書中で使用されているように、用語「賦形剤」は、少なくとも一つのBMPに添加される少なくとも一つの追加的な化合物を指し示し、追加的な化合物は、アミノ酸、タンパク質、緩衝剤、界面活性剤およびそれらの混合物からなる群より選択される。
【0031】
rhGDF−5は、pH4.5〜pH10.5の範囲の中性のpHでは溶解性が低いことが知られている。このpH範囲においてrhGDF−5製品を調合して製造することは難しいであろう。ゆえに本発明者らは、タンパク質調合物の開発に好適なpH範囲を選択するために重要な、pH3およびpH4の緩衝液中でのrhGDF−5の溶解度を評価するための研究を設計した。研究の結果は実施例11に記載されている。rhGDF−5の溶解度は、緩衝液のpHにのみ依存するのではなく、緩衝溶液のイオン強度にも依存する。pH4において、およそ10mg/mLのrhGDF−5溶液は、5および10mMのリン酸ナトリウム緩衝液中で白濁していた一方で、50および100mMのリン酸ナトリウム緩衝液中では、rhGDF−5は大きな粒子を形成し、最終的には沈殿した。別の研究では(データは示されていない)、rhGDF−5がpH3.5およびpH4の5mMリン酸緩衝液に3.5mg/mLで調合され、この場合にも、溶液は白濁していた。
【0032】
通常、タンパク質物質の溶解度は、過飽和/沈殿した溶液の遠心分離または濾過の後にタンパク質濃度を測定することによって決定される。しかし、いくつかの白濁したタンパク質溶液は、遠心分離または濾過するのが困難である。不溶の粒子を除去するために白濁した溶液を遠心分離または濾過(0.22μm)にかけた後でさえ、非常に多くの場合、粒子が非常に微細であることから濾液は依然として白濁しているため成功せず、時にはタンパク質がフィルター表面に固着し、したがって濾液はほとんどのタンパク質を失う。ゆえに、rhGDF−5が、3.5mg/mLまたは10mg/mLでpH3.5またはpH4の緩衝液中に調合された場合、透明な溶液を得ることは困難であろう。
【0033】
rhGDF−5が、10mg/mLで5mM、10mM、および25mMのpH3.0のリン酸ナトリウム溶液中に調合された場合、タンパク質溶液は透明であったが、rhGDF−5が、10mg/mLで50mMおよび100mMのリン酸ナトリウム等のより高いイオン強度の溶液中に調合された場合、rhGDF−5溶液は白濁していた。したがって、好ましい実施形態においては、rhGDF−5は、およそpH3.0の低イオン強度の緩衝液中に調合されるべきである。
【0034】
本発明による一つの実施形態においては、組成物は、少なくとも一つのBMPと、BMPを安定化するのに十分な量のトレハロースとの混合水溶液を凍結乾燥することによって調製することができ、生体適合性基質を含む生成物について、トレハロースのBMPに対する乾燥重量比率は、1mgのBMPにつき約1mg〜約500mgのトレハロースの範囲であり、さらに好ましくは、1mgのBMPにつき約5mg〜約200mgのトレハロースの範囲である。トレハロースの添加は、凍結乾燥された調合物のタンパク質の溶解度および安定性を改善する。凍結乾燥は、当業者に一般的に周知の慣例にしたがって行われる。
【0035】
別の実施形態においては、本発明による組成物は、少なくとも一つのBMP、BMPを安定化するのに十分な量のトレハロース、および、緩衝剤の混合水溶液を凍結乾燥することによって調製することができる。緩衝剤の添加は、凍結乾燥された調合物のタンパク質の溶解度および安定性を改善する。当業者に周知の生体適合性緩衝剤は、グリシン、酢酸のナトリウム塩、カリウム塩またはカルシウム塩、クエン酸のナトリウム塩、カリウム塩またはカルシウム塩、乳酸のナトリウム塩、カリウム塩またはカルシウム塩、一塩基リン酸(mono-basic phosphate)、二塩基リン酸(di-basic phosphate)、三塩基リン酸(tri-basic phosphate)、およびそれらの混合物を含むリン酸のナトリウム塩またはカリウム塩を含む。緩衝剤は、充填剤(bulking agent)として機能するために、組成物に対して添加されたグリシンを付加的に有することができる。グリシンは、1mgのBMPにつき約0.04mg〜約200mgのグリシンの割合で、さらに好ましくは、0.04mgのBMPにつき約1mg〜約80mgのグリシンの割合で添加される。緩衝剤および充填剤の添加は、pHが約2.0〜約5.0のpH単位の間に制御されている場合に、さらに好ましくは、約2.5〜約4.5のpH単位の間に制御されている場合に、トレハロースのみを有する組成物よりもわずかに優れたタンパク質の安定性を提供する。
【0036】
また別の実施形態において、本発明による組成物および方法は、少なくとも一つのBMPと、BMPを安定化するのに十分な量のトレハロースと、緩衝剤と、ポリソルベート80、ポリソルベート20およびそれらの混合物からなる群より選択される界面活性剤との混合水溶液を凍結乾燥することによって調製することができる。界面活性剤は、1mgのBMPにつき約0.001mg〜約0.2mgの濃度で添加される。界面活性剤の添加は、溶解度および凍結乾燥の特性を変化させることによって、タンパク質に付加的な安定性を提供する。凍結乾燥は、当業者に一般的に周知の慣例にしたがって行われる。
【0037】
本発明の別の実施形態において、安定な凍結乾燥されたBMPを調製するための組成物および方法は、少なくとも一つのBMP、少なくとも一つのBMPを安定化するのに十分な量の溶解保護剤であるトレハロース、および少なくとも一つの付加的な賦形剤によって構成され、付加的な賦形剤は、緩衝剤および界面活性剤からなる群より選択される。そのような緩衝剤および界面活性剤の添加は、トレハロースを単一の賦形剤として有する組成物よりも、凍結乾燥されたBMPの安定性に増加する改善を提供する。
【0038】
別の実施形態において、本発明による組成物および方法は、少なくとも一つのBMPと少なくとも一つの賦形剤との溶液を凍結乾燥されたコラーゲンの上に堆積させることによって調製でき、その後にBMP/コラーゲン混合物の凍結乾燥ができる。コラーゲンは、オプションとして、ヒーロス(Healos)(登録商標)として知られ、米国特許番号第5,972,385号、第5,866,165号、第5,776,193号、第5,455,231号、および第5,231,169号に記載されている物質によって提供されるように、架橋またはミネラル化されるか、あるいは架橋およびミネラル化されることができる。本実施形態において提供される組成物は、整形外科の分野における病状の治療に特に有用であり、骨、軟骨、または腱を生成させるために外科医が容易に手術部位に設置することのできる、柔軟な、展性の素材を提供する。BMP/コラーゲン混合物は、滅菌水、生理食塩水および骨髄穿刺液を含む水溶液を用いて復元することができ、骨折、骨の裂け目、骨空隙、脊椎固定術のために外科的に準備された椎間板隙等の患者の欠陥部位に直接適用されることができる。さらに、BMP/コラーゲン混合物は、骨細片と、脊椎固定術の過程で椎間板隙に挿入されるインプラントとの間の空間に充填するため、裂けるかまたは損傷した腱、裂けるかまたは損傷した靭帯、関節軟骨の軟骨欠損および関節軟骨の肋軟骨下欠損等の損傷または欠失した軟骨のある領域に充填するために使用することができる。
【0039】
別の実施形態において、本発明による組成物および方法は、少なくとも一つのBMPと少なくとも一つの賦形剤との凍結乾燥された混合物を調製することによって、凍結乾燥されたBMP混合物を水、生理食塩水または骨髄穿刺液を用いて復元することによって、そして、復元されたBMP溶液を凍結乾燥コラーゲンの上に乗せてからBMP/コラーゲン混合物の外科的植え込みを行うことによって、利用することができる。コラーゲンは、オプションとして、ヒーロス(登録商標)として知られている物質によって提供されるように、架橋またはミネラル化されるか、あるいは架橋およびミネラル化されることができる。本実施形態において提供される組成物および方法は、整形外科の分野における病状の治療に特に有用であり、骨、軟骨または腱を生成させるために外科医が容易に手術部位に設置することのできる、柔軟な、展性の素材を提供する。BMP/コラーゲン混合物は、骨折、骨の裂け目、骨空隙、脊椎固定術のために外科的に準備された椎間板隙等の患者の欠陥部位に直接適用することができ、骨細片と脊椎固定術の過程で椎間板隙に挿入されるインプラントとの間の空間を満たすために、また、裂けるかまたは損傷した腱、裂けるかまたは損傷した靭帯、関節軟骨の軟骨欠損、および関節軟骨の肋軟骨下欠損等の損傷または欠失した軟骨のある領域を満たすために使用することができる。本実施形態において提供される組成物および方法はまた、BMPをコラーゲン物質から分離した成分および容器として有することによって、保存および調製を簡略化するために特に有用である。
【0040】
別の実施形態において、本発明による組成物および方法は、少なくとも一つのBMPと少なくとも一つの賦形剤との溶液を、凍結乾燥され、細分化されたコラーゲン上に堆積させることによって調製でき、その後、BMP/細分化されたコラーゲン混合物の凍結乾燥ができる。細分化されたコラーゲンは、任意に、架橋またはミネラル化されるか、あるいは架橋およびミネラル化されていることができる。このような細分化によって、直径約25ミクロン、長さ約110ミクロンの小さいコラーゲン繊維が提供され、手術部位に注入するのに好適な流動性の組成物をもたらす。このような組成物の復元は、滅菌水、生理食塩水または骨髄穿刺液等の水溶液とコラーゲンゲルとの混合物を使用して行うことができ、コラーゲンゲルが復元された生成物の粘度を制御する。コラーゲンゲルは、約0.1%〜約30%(質量/質量)のコラーゲンを、さらに好ましくは約0.3%〜約3.0%(質量/質量)のコラーゲンを含み、コラーゲンゲルの粘度は、好ましくは約10cP〜約400cP、さらに好ましくは約70cP〜約100cPである。コラーゲンゲルのpHは、好ましくは約4.0pH単位〜約8.0pH単位である。このような組成物は、骨折、骨の裂け目、骨空隙、および脊椎固定術のために外科的に準備された椎間板隙を含むがそれらに限定されない様々な筋骨格の症状を治療するために有用であり、骨細片と脊椎固定術の過程で椎間板隙に挿入されるインプラントとの間の空間を満たすために、また、裂けるかまたは損傷した腱、裂けるかまたは損傷した靭帯、関節軟骨の軟骨欠損および関節軟骨の肋軟骨下欠損等のような損傷または欠失した軟骨のある領域を満たすために有用である。
【0041】
別の実施形態において、本発明による組成物および方法は、少なくとも一つのBMPと少なくとも一つの賦形剤との凍結乾燥混合物を調製することによって、凍結乾燥されたBMP混合物を水または生理食塩水を用いて復元することによって、そして、復元されたBMP溶液を椎間板に注入することによって、利用することができる。本実施形態において提供される組成物および方法は、椎間板を治療する際に特に有用である。
【0042】
〔発明の実施例〕
以下の実施例において、使用される実験方法は以下の通りである。
RP−HPLC純度研究のために、復元されたrhGDF−5試験試料を、10mM塩酸(HCl)を用いて0.1mg/mLの濃度に希釈し、Vydac218TP52カラム上で50℃、0.3mL/分の流速で逆相HPLCにかけた。rhGDF−5は、214nmでのUV検出を用いて、0.15%トリフルオロ酢酸中でアセトニトリル勾配を用いて溶出された。
【0043】
円偏光二色性(CD)研究のために、AVIVモデル60DS円偏光二色性分光偏光計上で円偏光二色性分光分析を行った。対応する賦形剤の走査を用いたベースライン擬似測定(baseline placebo runs)を、試料の走査から減算した。走査は平均残基重量(Mean Residue Weight)(115の値)を用いて正規化し、以下の等式に代入した。

=[0.1×M残基]/[濃度(mg/mL)×光路長]
【0044】

の値は、平均残基楕円率(mean residue ellipticities)を与えるために各々の波長で計算した。最後に、プログラムPROSECv.2.1(1987年にAVIVアソシエイツ(AVIV Associates)により著作権取得)を使用して、二次構造見積りが決定された。
【0045】
示差走査熱量測定(DSC)を、マイクロカル(MicroCal)VP−DSC機器上で行った。走査速度は60℃/時間であった。温度範囲は5〜100℃であった。機器ベースライン走査(擬似データ)を、試験試料熱走査から減算した。タンパク質濃度は0.33mg/mLであった。
【0046】
結晶化度判定(Crystallinity Assessment)のために偏光顕微鏡法(PLM)が使用された。相対湿度が1%の乾燥エアバッグ中で、微量の固体試料をバイアルから取り出した。固体試料はガラススライド上に広げられ、固体試料上に一滴のシリカオイルが滴下された。次に、ソニー製CCD−IRIS/RGBカラービデオカメラおよび偏光付属品が備えられたゼイス光学顕微鏡(Zeiss Optical Microscope)を用いて、スライドを検査した。画像を取り込むためにフラッシュバス(Flash Bus)FBGソフトウェアが使用された。
【0047】
rhGDF−5原体(bulk rhGDF-5)は、10mM塩酸中に3.8mg/mLの濃度で、−80℃の凍結形態でバイオファーム社(Biopharm)から入手した。凍結タンパク質原体は、調合物に使用する前に、2〜8℃で一晩かけて解凍した。
【0048】
実施例1:ヒーロス(登録商標)細片(非滅菌)とrhGDF−5(0.5mg/mL、5mL/細片)およびトレハロース50mg/mL。各々の細片は、2.5mgのrhGDF−5と250mgのトレハロースを有した。
【0049】
トレハロース溶液の調製:
25.48gのトレハロース二水和物が注意深く秤量され、滅菌ポリプロピレン瓶に移され、それに室温で350mLの純水が加えられ、透明な溶液が得られるまでゆっくりと撹拌された。透明な溶液に対して、pHを3.9に調整するために0.1規定の塩酸が一滴ずつ加えられ、次に、400mLの最終液量を得るために純水を用いて液量が調整された。pHが測定され、4.2であることが見出された。溶液は0.22ミクロンのフィルターを通して濾過され、タンパク質溶液を希釈するために直接使用された。
【0050】
rhGDF−5溶液のトレハロース溶液を用いた希釈:
22.39mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、そこに液量を150mLに調整するために注意深くトレハロース溶液が加えられた。pHが測定され、2.5であることが見出された。溶液は室温で15分間撹拌された。タンパク質濃度を正確に計算するために、UV吸光係数を得た。UVの示度に基づいて、さらにトレハロース溶液を加えて、170mLの溶液中に0.5mg/mLの望ましい濃度を得た。pHが測定され、2.7であることが見出された。UVの示度は0.499mg/mLのタンパク質含有量を示した。
【0051】
rhGDF−5/トレハロース溶液は、0.22ミクロンのフィルターを通して濾過され、ヒーロス(登録商標)細片上に分注するために直接使用された。滅菌ピペットを使用して、各々の細片についてrhGDF−5/トレハロース溶液の合計が5mLになるように、細片上の2点に2.5mLのrhGDF−5/トレハロース溶液が同様に分注された。細片は小さな2cm×5cmのPETGトレイに挿入され、小さなトレイは大きなPETGトレイに挿入され、凍結乾燥された。各々の大きなトレイは24の細片を収容する。
【0052】
表1a:表1a:25℃における、細片あたりトレハロース(250mg)およびrhGDF−5(2.5mg)を用いたヒーロス(登録商標)の安定性(実施例1)
【表1】

【0053】
表1b:2〜8℃における、細片あたりトレハロース(250mg)およびrhGDF−5(2.5mg)を用いたヒーロス(登録商標)の安定性(実施例1)
【表2】

【0054】
実施例2:ヒーロス(登録商標)細片(非滅菌)とrhGDF−5(0.5mg/mL、5mL/細片)およびマンニトール50mg/mL。各々の細片は、2.5mgのrhGDF−5と250mgのマンニトールを有した。
【0055】
マンニトール溶液の調製:
23.03gのマンニトールが注意深く秤量され、滅菌ポリプロピレン瓶に移され、それに室温で350mLの純水が加えられ、透明な溶液が得られるまでゆっくりと撹拌された。pHが測定され、7.2であることが見出された。pHを3.8に調整するために0.1規定の塩酸が一滴ずつ加えられ、次に、400mLの最終液量を得るために純水を用いて液量が調整された。pHが測定され、3.9であることが見出された。溶液は0.22ミクロンのフィルターを通して濾過され、タンパク質溶液を希釈するために直接使用された。
【0056】
rhGDF−5溶液のマンニトール溶液を用いた希釈:
22.37mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、そこに液量を150mLに調整するために注意深くマンニトール溶液が加えられた。pHが測定され、2.7であることが見出された。溶液は室温で15分間撹拌された。正確なタンパク質濃度を計算するために、UV吸光係数が取得された。UVの示度に基づいて、170mLの溶液中に0.5mg/mLの望ましい濃度を得るためにさらにマンニトール溶液が加えられた。pHが測定され、2.8であることが見出された。UVの示度は0.493mg/mLのタンパク質含有量を示した。
【0057】
rhGDF−5/マンニトール溶液は、0.22ミクロンのフィルターを通して濾過され、ヒーロス(登録商標)細片上に分注するために直接使用された。滅菌ピペットを使用して、各々の細片につきrhGDF−5/マンニトール溶液の合計が5mLになるように、2.5mLのrhGDF−5/マンニトール溶液が細片上の2点に同様に分注された。細片は小さな2cm×5cmのPETGトレイに挿入され、小さなトレイは大きなPETGトレイに挿入され、凍結乾燥された。各々の大きなトレイは24の細片を収容する。
【0058】
表2a:25℃における、細片あたりマンニトール(250mg)およびrhGDF−5(2.5mg)を用いたヒーロス(登録商標)の安定性(実施例2)
【表3】

【0059】
表2b:2〜8℃における、細片あたりマンニトール(250mg)およびrhGDF−5(2.5mg)を用いたヒーロス(登録商標)の安定性(実施例2)
【表4】

【0060】
実施例3:ヒーロス(登録商標)細片(滅菌)とrhGDF−5(0.5mg/mL、5mL/細片)およびトレハロース100mg/mL。各々の細片は、2.5mgのrhGDF−5と500mgのトレハロースを有した。
【0061】
トレハロース溶液の調製:
25.49gのトレハロース二水和物が注意深く秤量され、滅菌ポリプロピレン瓶に移され、そこに室温で190mLの純水が加えられ、透明な溶液が得られるまでゆっくりと撹拌された。透明なトレハロース溶液のpHが測定され、6.2であることが見出された。pHを調整するためにトレハロース溶液に塩酸は加えられなかった。200mLの最終液量を得るために、純水を用いて液量が調整された。pHが測定され、6.3であることが見出された。溶液は、タンパク質溶液を希釈するために直接使用された。
【0062】
rhGDF−5溶液のトレハロース溶液を用いた希釈:
23.03mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、そこに液量を170mLに調整するために注意深くトレハロース溶液が加えられた。pHが測定され、3.0であることが見出された。溶液は室温で15分間撹拌された。タンパク質濃度を正確に計算するために、UV吸光係数が取得された。UVの示度に基づいて、さらにトレハロース溶液が加えられ、175mLの溶液中に0.5mg/mLの望ましい濃度を得られた。pHが測定され、3.0であることが見出された。UVの示度は0.518mg/mLのタンパク質濃度を示した。
【0063】
rhGDF−5/トレハロース溶液は、0.22ミクロンのフィルターを通して濾過され、滅菌ヒーロス(登録商標)細片上に分注するために直接使用された。滅菌ピペットを使用して、各々の細片について、rhGDF−5/トレハロース溶液の合計が5mLになるように、細片上の2点に2.5mLのrhGDF−5/トレハロース溶液が同様に分注された。細片はスチールトレイに置かれ、トレイは注意深く滅菌二重パウチに封入され、滅菌条件下での凍結乾燥のために移された。
【0064】
表3a:2〜8℃における、細片あたりトレハロース(500mg)/rhGDF−5(2.5mg)を用いたヒーロス(登録商標)の安定性(実施例3)
【表5】

【0065】
実施例4:ヒーロス(登録商標)細片(滅菌)と低用量rhGDF−5(5mL/細片、0.5mg/mL)、トレハロース40mg/mL、およびグリシン10mg/mL。各々の細片は、2.5mgのrhGDF−5、200mgのトレハロースおよび50mgのグリシンを有した。
【0066】
トレハロース/グリシン溶液の調製:
17.84gのトレハロース二水和物および4.03gのグリシンが注意深く秤量され、滅菌ポリプロピレン瓶に移され、それに室温で300mLの純水が加えられ、透明な溶液が得られるまでゆっくりと撹拌された。pHが測定され、5.5であることが見出された。どのような酸も加えること無く、液量は純水を用いて350mLに調整された。pHが測定され、5.5であることが見出された。
【0067】
rhGDF−5溶液のトレハロース/グリシン溶液を用いた希釈:
39.47mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、それに液量を295mLに調整するために注意深くトレハロース/グリシン溶液が加えられた。pHが測定され、4.1であることが見出された。溶液は室温で15分間撹拌された。タンパク質濃度を正確に計算するために、UV吸光係数が取得された。UVの示度に基づいてトレハロース溶液が加えられ、300mLの溶液中に0.5mg/mLの望ましい濃度を得た。pHが測定され、4.1であることが見出された。UVの示度は0.507mg/mLのタンパク質濃度を示した。
【0068】
溶液は0.22ミクロンのフィルターを通して濾過され、滅菌ヒーロス(登録商標)細片上に分注するために直接使用された。滅菌ピペットを使用して、各々の細片についてrhGDF−5溶液の合計が5mLになるように、細片上の2点に2.5mLのrhGDF−5/トレハロース/グリシン溶液が同様に分注された。細片はスチールトレイに置かれ、トレイは注意深く滅菌二重パウチに封入され、滅菌条件下での凍結乾燥のために移された。
【0069】
表4a:2〜8℃における、細片あたりトレハロース(200mg)/rhGDF−5(2.5mg)/グリシン(50mg)を用いたヒーロス(登録商標)の安定性(実施例4)
【表6】

【0070】
表4b:25℃における、細片あたりトレハロース(200mg)/rhGDF−5(2.5mg)/グリシン(50mg)を用いたヒーロス(登録商標)の安定性(実施例4)
【表7】

【0071】
実施例5:ヒーロス(登録商標)細片(滅菌)とrhGDF−5(0.5mg/mL、2.5mg/細片)、トレハロース40mg/mL、グリシン10mg/mL、およびポリソルベート0.1mg/mL。各々の細片は、2.5mgのrhGDF−5、200mgのトレハロース、50mgのグリシン、および0.5mgのポリソルベート80を有した。
【0072】
ポリソルベート80溶液の調製:
23.03mgのポリソルベート80が50mLの滅菌使い捨てチューブの中に秤量され、それに25mLの純水が加えられ、均一な溶液を得るために2分間振り混ぜられた。
【0073】
トレハロース/グリシン/ポリソルベート溶液の調製:
10.19gのトレハロース二水和物、および2.303gのグリシンが注意深く秤量され、滅菌ポリプロピレン瓶に移され、それに25mLの上記のポリソルベート80溶液が加えられた。ポリソルベートのチューブは、25mLの純水で2回ゆすがれ、ゆすぎ液はトレハロース/グリシン/ポリソルベート溶液に移された。合計液量を190mLにするために追加量の純水がトレハロース/グリシン/ポリソルベート溶液に加えられた。溶液は透明な溶液を得るために2分間撹拌された。溶液のpHが測定され、5.6であることが見出された。液量は純水を用いて200mLに調整された。pHが測定され、5.5であることが見出された。
【0074】
rhGDF−5溶液のトレハロース/グリシン/ポリソルベート溶液を用いた希釈:
23.03mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、それに液量を170mLに調整するために注意深くトレハロース/グリシン/ポリソルベート溶液が加えられた。pHが測定され、4.1であることが見出された。溶液は室温で15分間撹拌された。タンパク質濃度を正確に計算するために、UV吸光係数が取得された。UVの示度に基づいてさらにトレハロース/グリシン/ポリソルベート溶液が加えられ、175mLの溶液中に0.5mg/mLの望ましい濃度を得た。pHが測定され、4.1であることが見出された。UVの示度は0.510mg/mLのタンパク質濃度を示した。
【0075】
溶液は0.22ミクロンのフィルターを通して濾過され、層流フード(laminar flow hood)中の無菌条件下で滅菌ヒーロス(登録商標)細片上に分注するために直接使用された。滅菌ピペットを使用して、各々の細片についてrhGDF−5/トレハロース/グリシン/ポリソルベート溶液の合計が5mLになるように、細片上の2点に2.5mLのrhGDF−5/トレハロース/グリシン/ポリソルベート溶液が同様に分注された。細片はスチールトレイに置かれ、トレイは注意深く滅菌二重パウチに封入され、滅菌条件下での凍結乾燥のために移された。
【0076】
表5a:2〜8℃における、細片あたりトレハロース(200mg)/rhGDF−5(2.5mg)/グリシン(50mg)/ポリソルベート80(0.5mg)を用いたヒーロス(登録商標)の安定性(実施例4)
【表8】

【0077】
実施例6:rhGDF−5(0.5mg/mL)にトレハロース(50mg/mL)を加えた凍結乾燥されたバイアル生成物
トレハロース溶液の調製:
滅菌ポリプロピレン瓶に12.16gのトレハロース二水和物および磁気撹拌子が入れられ、それに室温で190mLの純水が加えられた。溶液は、トレハロースが完全に溶解されるまで室温で撹拌された。pHが測定され、6.5であることが見出された。透明なトレハロース溶液に対して、pHを5.8に調整するために0.1規定の塩酸が一滴ずつ加えられた。液量は純水で200mLに調整され、pHが測定され、5.5であることが見出された。溶液は0.22ミクロンのフィルターを通して濾過され、タンパク質溶液を希釈するために直接使用された。
【0078】
rhGDF−5溶液のトレハロース溶液を用いた希釈:
14.47mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、そこに最終液量を100mLにするために、瓶を旋回しながらトレハロース溶液がゆっくりと加えられた。溶液は、室温で15分間、時折旋回された。pHが測定され、3.0であることが見出された。UVの示度に基づいてさらにトレハロース溶液が加えられ、110mLの溶液中に0.5mg/mLの望ましい濃度を得た。pHが測定され、3.1であることが見出された。UVの示度は0.510mg/mLのタンパク質濃度を示した。溶液は0.22ミクロンのフィルターを通して濾過され、バイアルに分注するために直接使用された。
【0079】
バイアルへの充填:1.1mLのrhGDF−5/トレハロース溶液が、5mLのタイプ1フリントガラスバイアルに手動で分注され、凍結乾燥機への装填に先立って各々のバイアルはストッパーで部分的に閉じられた。凍結乾燥後、ストッパーは押し込まれ、圧着された。生成物は白色から灰白色のケーク(cake)として得られた。
【0080】
表6a:2〜8℃における、rhGDF−5(0.5mg/mL)にトレハロース(50mg/mL)を加えたバイアルの安定性(実施例6)
【表9】

【0081】
表6b:25℃における、rhGDF−5(0.5mg/mL)にトレハロース(50mg/mL)を加えたバイアルの安定性(実施例6)
【表10】

【0082】
実施例7:rhGDF−5(0.5mg/mL)にマンニトール(50mg/mL)を加えた凍結乾燥されたバイアル生成物
マンニトール溶液の調製:
滅菌ポリプロピレン瓶に11.52gのマンニトールおよび磁気撹拌子が入れられ、それに室温で185mLの純水が加えられた。混合液は、マンニトールが完全に溶解されるまで室温で10分間撹拌された。pHが測定され、6.6であることが見出された。透明な溶液に対して、pHを5.5に調整するために0.1規定の塩酸が一滴ずつ加えられた。液量は純水で200mLに調整され、pHが測定され、5.7であることが見出された。溶液は0.22ミクロンのフィルターを通して濾過され、タンパク質溶液を希釈するために直接使用された。
【0083】
rhGDF−5溶液のマンニトール溶液を用いた希釈:
ポリプロピレンフラスコに14.48mLのrhGDF−5溶液が注意深く移され、そこに液量が100mLになるまでマンニトール溶液が注意深く加えられた。溶液は室温で15分間撹拌された。タンパク質濃度を正確に計算するために、UV吸光係数が取得された。UVの示度に基づいてさらにマンニトール溶液が加えられ、110mLの溶液中に0.5mg/mLの望ましいタンパク質濃度を得た。pHが測定され、3.1であることが見出された。UVの示度は0.498mg/mLのタンパク質濃度を示した。溶液は0.22ミクロンのフィルターを通して濾過され、バイアルに分注するために直接使用された。
【0084】
バイアルへの充填:1.1mLのマンニトール/rhGDF−5溶液が、5mLのタイプ1フリントガラスバイアルに手動で分注され、凍結乾燥機への装填に先立って各々のバイアルはストッパーで部分的に閉じられた。凍結乾燥後、ストッパーは押し込まれ、圧着された。生成物は白色から灰白色のケークとして得られた。
【0085】
表7a:2〜8℃における、rhGDF−5(0.5mg/mL)にマンニトール(50mg/mL)を加えたバイアルの安定性(実施例7)
【表11】

【0086】
表7b:25℃における、rhGDF−5(0.5mg/mL)にマンニトール(50mg/mL)を加えたバイアルの安定性(実施例7)
【表12】

【0087】
実施例8:グリシン−塩酸pH3.0緩衝液中でrhGDF−5(0.5mg/mL)にトレハロース(50mg/mL)を加えた凍結乾燥されたバイアル生成物
トレハロース溶液の調製:
滅菌ポリプロピレン瓶に12.16gのトレハロース二水和物および磁気撹拌子が入れられ、それに室温で200mLの5mMグリシン−塩酸緩衝液pH3.0が加えられた。溶液は、トレハロースが完全に溶解されるまで室温で撹拌された。トレハロース/グリシン溶液のpHは、3.1であった。溶液は0.22ミクロンのフィルターを通して濾過され、タンパク質溶液を希釈するために直接使用された。
【0088】
rhGDF−5溶液のトレハロース溶液を用いた希釈:
rhGDF−5原体の溶液が、分子量3000のカットオフの膜を用いて、2〜8℃で一晩、5mMグリシン−塩酸緩衝液に対して透析された。透析後、溶液は3.8mg/mLにわずかに濃縮された。14.47mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、そこに最終液量を100mLにするために、瓶を旋回しながらトレハロース−グリシン溶液がゆっくりと加えられた。溶液は、室温で15分間、時折旋回された。pHが測定され、3.0であることが見出された。UVの示度に基づいてさらにトレハロース−グリシン溶液が加えられ、110mLの溶液中に0.5mg/mLの望ましいタンパク質濃度を得た。pHが測定され、3.0であることが見出された。UVの示度は0.507mg/mLのタンパク質濃度を示した。溶液は0.22ミクロンのフィルターを通して濾過され、バイアルに分注するために直接使用された。
【0089】
バイアルへの充填:1.1mLのrhGDF−5/トレハロース溶液が、5mLのタイプ1フリントガラスバイアルに手動で分注され、凍結乾燥機への装填に先立って各々のバイアルはストッパーで部分的に閉じられた。凍結乾燥後、ストッパーは押し込まれ、圧着された。生成物は白色から灰白色のケークとして得られた。
【0090】
表8:グリシン−塩酸緩衝液pH3.0中でrhGDF−5(0.5mg/mL)にトレハロース(50mg/mL)を加えたバイアルの安定性(実施例8)
【表13】

【0091】
実施例9:pH3.0のリン酸緩衝液中でrhGDF−5(0.5mg/mL)にトレハロース(50mg/mL)を加えた凍結乾燥されたバイアル生成物
トレハロース溶液の調製:
滅菌ポリプロピレン瓶に12.16gのトレハロース二水和物および磁気撹拌子が入れられ、それに室温で200mLの5mMリン酸緩衝液pH3.0が加えられた。溶液は、トレハロースが完全に溶解されるまで室温で撹拌された。トレハロース/リン酸緩衝溶液のpHは、3.0であった。溶液は0.22ミクロンのフィルターを通して濾過され、タンパク質溶液を希釈するために直接使用された。
【0092】
rhGDF−5溶液のトレハロース溶液を用いた希釈:
rhGDF−5原体の溶液が、分子量3000のカットオフの膜を用いて、2〜8℃で一晩、リン酸緩衝液に対して透析された。透析後、溶液は3.8mg/mLにわずかに濃縮された。14.47mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、そこに最終液量を100mLにするために、瓶を旋回しながらトレハロース/リン酸緩衝溶液がゆっくりと加えられた。溶液は、室温で15分間、時折旋回された。pHが測定され、3.0であることが見出された。UVの示度に基づいてトレハロース/リン酸緩衝溶液が加えられ、110mLの溶液中に0.5mg/mLの望ましいタンパク質濃度を得た。pHが測定され、3.0であることが見出された。UVの示度は0.50mg/mLのタンパク質濃度を示した。溶液は0.22ミクロンのフィルターを通して濾過され、バイアルに分注するために直接使用された。
【0093】
バイアルへの充填:1.1mLのrhGDF−5/トレハロース溶液が、5mLのタイプ1フリントガラスバイアルに手動で分注され、凍結乾燥機への装填に先立って各々のバイアルはストッパーで部分的に閉じられた。凍結乾燥後、ストッパーは押し込まれ、圧着された。生成物は白色から灰白色のケークとして得られた。
【0094】
表9:pH3.0のリン酸緩衝液中でrhGDF−5(0.5mg/mL)にトレハロース(50mg/mL)を加えたバイアルの安定性(実施例9)
【表14】

【0095】
実施例10:細分化されたコラーゲン円柱と2.5mgのrhGDF−5および250mgのトレハロース
トレハロース溶液の調製:
9.56gのトレハロース二水和物が注意深く秤量され、滅菌ポリプロピレン瓶に移され、そこに室温で145mLの純水が加えられ、透明な溶液が得られるまでゆっくりと撹拌された。透明なトレハロース溶液のpHが測定され、5.3であることが見出された。150mLの最終液量をえるために、純水を用いて液量が調整された。溶液のpHが測定され、5.3であることが見出された。溶液は、タンパク質溶液を希釈するために直接使用された。
【0096】
rhGDF−5溶液のトレハロース溶液を用いた希釈:
16.45mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、それに、液量を120mLに調整するために、トレハロース溶液が注意深く加えられた。pHが測定され、2.9であることが見出された。溶液は、室温で15分間撹拌された。タンパク質濃度を正確に計算するために、UV吸光係数が取得された。UVの示度に基づいて、さらにトレハロース溶液が加えられ、125mLの溶液中に0.5mg/mLの望ましいタンパク質濃度を得た。pHが測定され、2.9であることが見出された。UVの示度は0.498mg/mLのタンパク質濃度を示した。
【0097】
rhGDF−5/トレハロース溶液の細分化されたコラーゲン円柱への投与
溶液は0.22ミクロンのフィルターを通して濾過され、溶液は、テフロン型中に詰められた、事前に形成された細分化されたコラーゲン円柱上に分注するために直接使用された。各々の円柱には、凍結乾燥に先立って5mLのrhGDF−5/トレハロース溶液が投与された。
【0098】
表10:2〜8℃における、円柱あたりrhGDF−5(2.5mg)およびトレハロース(250mg)を用いた細分化されたコラーゲン円柱の安定性(実施例10)
【表15】

【0099】
下記の表11中のデータは、2〜8℃の試料のRP−HPLC試験には遅い溶出ピークが存在するが、−20℃の試料には存在しないことにより実証されているように、賦形剤を含まずにヒーロス(登録商標)上に分注され凍結乾燥されたrhGDF−5は、−20℃では安定だが、2〜8℃では安定でないことを示す。
【0100】
表11:2〜8℃および−20℃における、賦形剤を含まない5mLのrhGDF−5(0.5mg/mL)を用いたヒーロス(登録商標)細片の安定性
【表16】

【0101】
賦形剤および可溶性コラーゲンゲルを用いて流動性の細分化されたコラーゲン/rhGDF−5を作成する異なった実施例が開発され、各々の実施例の性能、安定性および製造の容易さに関して評価された。
【0102】
細分化されたコラーゲン実施例1:
−細分化されたコラーゲン円柱とrhGDF−5が乾燥形態に凍結乾燥される
−湿潤形態のコラーゲンゲルは分離しておかれる
−双方は2〜8℃で別々の注入器中に分離しておかれる
−双方は注入に先立って混合される
【0103】
細分化されたコラーゲン実施例2:
−細分化されたコラーゲン円柱とrhGDF−5とコラーゲンゲルとが湿潤形態で混合される(凍結乾燥されない)
−全てが2〜8℃で一本の注入器中に湿潤形態でおかれ、使用可能な状態
【0104】
細分化されたコラーゲン実施例3:
−細分化されたコラーゲン円柱とrhGDF−5とコラーゲンゲルとが乾燥形態で凍結乾燥される
−全てが2〜8℃で一本の注入器中に乾燥形態で入れられる
−注入に先立って水で再水和する
【0105】
細分化されたコラーゲン実施例4:
−細分化されたコラーゲン円柱とコラーゲンゲルは共にペースト状
−rhGDF−5は乾燥形態で分離しておかれる
−双方は2〜8℃で別々の注入器中に分離しておかれる
−双方は注入に先立って混合される
【0106】
細分化されたコラーゲン実施例5:
−細分化されたコラーゲン円柱とコラーゲンゲルは共に乾燥形態
−rhGDF−5は乾燥形態で分離しておかれる
−双方は2〜8℃で別々の注入器中に分離しておかれる
−rhGDF−5を滅菌水または骨髄穿刺液を用いて復元する
−注入に先立って、乾燥した細分化されたコラーゲンおよびコラーゲンは、復元されたrhGDF−5溶液と混合される
【0107】
緩衝剤および抗酸化剤の存在および非存在下で、マンニトール、スクロースおよびトレハロース等のいくつかの賦形剤を用いて、rhGDF−5の安定性が、RP−HPLC、示差走査熱量測定(DSC)、円偏光二色性分光分析(CD)、偏光顕微鏡法(PLM)、および生物学的検定の技術を使用して評価された。スクロースを含有する幾つかの凍結乾燥されたrhGDF−5の調合物は、保存の過程で望ましくない黄色およびガラス状ケーク構造を発生させたため、有望ではなかった。
【0108】
凍結乾燥されたrhGDF−5の調合物の融解挙動が、DSCを使用して研究された。DSCデータは、トレハロースおよびマンニトールに基づく調合物のどちらも、rhGDF−5原体の熱安定性を大幅に改善することを示した。
【0109】
図1、図2および図3は、rhGDF−5のトレハロース調合物およびマンニトール調合物のDSCプロファイルの比較を、rhGDF−5原体のDSCプロファイルと比較して示す。rhGDF−5原体は、2つの主要な転移を示し、一つは40℃近傍であり、もう一つは85℃近傍である。高温の転移はおそらくタンパク質の熱変性を表わしている。最初の吸熱転移の融解温度(Tm)が賦形剤の存在下で7〜14℃増加していることは、興味深いことである。この点のみで考えた場合、この研究は、トレハロースおよびマンニトールの双方とも安定化剤として同様に効果的である可能性があることを示唆する。
【0110】
トレハロース/rhGDF−5調合物のPLM(偏光顕微鏡法)は、図4に示されている。試料は主立った複屈折現象を示さない。したがって、系は非晶質であり、これは治療的応用に理想的である。図5は、保存期間の後のマンニトール/rhGDF−5調合物のPLMを示す。試料中には多くの結晶が観察され、保存の過程でマンニトールが結晶化したことを示している。この結果は、トレハロースがrhGDF−5に対するより良い溶解保護剤であることを示唆する。遠紫外CDスペクトルは、トレハロースに基づく調合物が、天然タンパク質原体の二次構造分布に相当する二次構造分布を有することを明らかにした。
【0111】
様々な賦形剤と共に凍結乾燥されたrhGDF−5のPR−HPLCによるリアルタイムの安定性研究は、トレハロース存在下のrhGDF−5が、50mg/mLまたは100mg/mLの何れの濃度でも、緩衝剤が有っても無くても、また、ポリソルベートが有っても無くても、2〜8℃および15〜25℃の保存条件で一貫してrhGDF−5に改善された安定性を与えたことを明瞭に示した一方で、マンニトールは類似の保存条件下で同等のレベルの安定性を提供することができなかった。
【0112】
凍結乾燥されたケーク調合物のリアルタイム安定性研究は、室温および2〜8℃の保存条件で、主ピークが大幅に減少する一方で凝集ピークが増加することによって証明されるように、マンニトールはタンパク質を安定化しないことを明瞭に示した。凝集物は、免疫反応および副作用を引き起こす可能性があるため、タンパク質調合物の中で最も望ましくない種である。対照的に、トレハロースは、リアルタイム安定性研究に証明されるように、特に2〜8℃の保存条件で、凝集物の形成を阻害して主ピークを保護することによって、タンパク質を非常に良く安定化した。したがって、トレハロースは、調合物中でrhGDF−5を安定化することにおいてマンニトールよりも優れている。また、リアルタイム安定性データは、pHを制御するための緩衝剤としてリン酸またはグリシンを有するrhGDF−5/トレハロース調合物が、緩衝剤を含まないrhGDF−5/トレハロース調合物よりもさらに優れていることを示す。リアルタイム安定性データは、rhGDF−5/トレハロース/グリシン調合物の理想的な保存は2〜8℃であり、また、25℃での保存も適切であることを示す。
【0113】
トレハロースに基づくrhGDF−5調合物の好ましい生化学的および生物物理的データに加えて、これらの調合物はまた、アルカリフォスファターゼの生物学的分析においても有効性を示した。分析の物理的化学的方法、生体外分析、およびリアルタイム安定性データは、様々な筋骨格疾病の治療における使用に対して、コラーゲンに基づいた組み合わせ生成物と同様に、凍結乾燥された単体生成物(stand-alone product)においてもrhGDF−5の安定化におけるトレハロースの優れた賦形剤としての見込みを示す。
【0114】
実施例11:異なったイオン強度の溶液および2つのpH緩衝液(pH3およびpH4)中のrhGDF−5の溶解度
この研究においては、様々なイオン強度のリン酸ナトリウム緩衝溶液が使用された。タンパク質原体の溶液は、およそ10mg/mLに濃縮され、pH3またはpH4の、5、10、25、50および100mMのリン酸緩衝液を用いて透析された。透析後、試料は透明性を点検され、UV−Vis分光光度計上でタンパク質濃度が分析された。詳細な手順は下記に記載されている。
【0115】
緩衝液の調製
pH3の100mMリン酸緩衝液:
13.5mLの濃縮H3PO4(14.8M)溶液が2000mLビーカーに移され、それに、1900mLの目盛りまで脱イオン水が加えられた。溶液は、NaOH溶液でpH3に滴定され、2000mLのメスシリンダーに移された。2000mLにするために追加の水が加えられた。内容物はビーカーに再び移され、十分に混合された。
【0116】
pH3の50mMリン酸緩衝液:
6.76mLの濃縮H3PO4(14.8M)溶液が2000mLビーカーに移され、それに、1900mLの目盛りまで脱イオン水が加えられた。溶液は、NaOH溶液でpH3に滴定され、2000mLのメスシリンダーに移された。2000mLにするために追加の水が加えられた。内容物はビーカーに再び移され、十分に混合された。
【0117】
pH3の25mMリン酸緩衝液:
3.39mLの濃縮H3PO4(14.8M)溶液が2000mLビーカーに移され、続いて1900mLの目盛りまで脱イオン水が加えられた。溶液はNaOH溶液でpH3に滴定され、2000mLのメスシリンダーに移された。2000mLにするために追加の水が加えられた。内容物はビーカーに再び移され、十分に混合された。
【0118】
pH3の10mMリン酸緩衝液:
1.35mLの濃縮H3PO4(14.8M)溶液が2000mLビーカーに移され、それに、1900mLの目盛りまで脱イオン水が加えられた。溶液はNaOH溶液でpH3に滴定され、2000mLのメスシリンダーに移された。2000mLにするために追加の水が加えられた。内容物はビーカーに再び移され、十分に混合された。
【0119】
pH3の5mMリン酸緩衝液:
0.676mLの濃縮H3PO4(14.8M)が2000mLビーカーに移され、続いて1900mLの目盛りまで脱イオン水が加えられた。溶液はNaOH溶液でpH3に滴定され、2000mLのメスシリンダーに移された。2000mLにするために追加の水が加えられた。内容物はビーカーに再び移され、十分に混合された。
【0120】
試料調製
タンパク質原体rhGDF−5(ロット番号2142131)が2〜8℃で解凍された。タンパク質原体溶液(3.8mg/mLで24mL)が、遠心濾過装置(ポールライフサイエンス社(Pall Life Science)、カタログ番号OD010C37、分画分子量10K(10K MWCO))を使用して、およそ6mLの液量まで濃縮された。およそ0.9mLの濃縮されたrhGDF−5溶液は、各々の透析カセット(ピアス社(Pierce)、カタログ番号66380)に移され、室温で一晩、リン酸緩衝液に対して透析された。濃縮されたrhGDF−5溶液は、注意深く透析カセットから取り除かれ、溶液の透明性を点検するために小さなガラスバイアルに入れられた。UV−Vis分光光度計上で、分析手法の項に記載されているように、タンパク質濃度が決定された。
【0121】
pH4における溶解度
pH4.0の緩衝液は、NaOH溶液をpH3の緩衝液にさらに加えることによって、pH3の緩衝液から調製された。タンパク質溶液は、室温で一晩、pH4の緩衝液に対して透析された。試料は溶液の透明度およびタンパク質濃度を分析された。
【0122】
分析手法
小さなガラスバイアル中の溶液試料は、透明度および粒子に関して点検された。試料バイアルは黒色背景に対して垂直の光を使用して検査された。試験試料の透明度は、対照として純水試料と比較された。各々の溶液試料のpHは、較正されたpHメーターを使用して直接測定された。
【0123】
結果
10mg/mLのrhGDF−5溶液の溶解度研究の結果は、5、10および25mMのリン酸ナトリウムのより低いイオン強度の緩衝液は、透明な溶液をもたらして良い溶解度を示す一方で、50および100mMのリン酸ナトリウムのより高いイオン強度の緩衝液は、白濁した溶液をもたらして低い溶解度を示すことを表した。pH4では、5および10mMのリン酸ナトリウム緩衝液は白濁した溶液をもたらし、低い溶解度を示した。25、50および100mMのリン酸ナトリウム緩衝液は、遠心後に透明な溶液をもたらしたが、タンパク質の回収量はほとんどゼロであり、タンパク質が沈殿したことを示した。したがって、pH3近傍の低イオン強度の緩衝液は、より高いpHのより高いイオン強度の緩衝液よりも好ましい。
【0124】
実施例12:5%トレハロースを含む様々な緩衝液中の様々な温度でのrhGDF−5の安定性
この研究では、凍結乾燥および5℃での保存の過程の5%トレハロース溶液中の0.7mg/mLのrhGDF−5の保護に対する様々な緩衝液の影響に関して試験された。試験された緩衝液は、5mMグリシン−塩酸pH3、5mMリン酸ナトリウムpH3、5mMクエン酸ナトリウムpH3、10mM乳酸ナトリウムpH3、0.01%TFA水溶液、1mM塩酸、および、トレハロースを含まない1mM塩酸中のrhGDF−5の対照溶液である。緩衝液は以下のように調製された。
【0125】
5mMグリシン緩衝液、pH3
2000mLビーカーに0.75gのグリシン(分子量75.05)および1900mLの脱イオン水が入れられ、溶液は撹拌しながら塩酸溶液でpH3に滴定された。2000mLにするために追加の水が加えられ、十分に混合された。
【0126】
5mMクエン酸緩衝液、pH3
2000mLビーカーに2.11gのクエン酸一水和物(分子量210.14)および1900mLの脱イオン水が入れられ、溶液は水酸化ナトリウム(NaCl)溶液でpH3に滴定された。2000mLにするために追加の水が加えられ、溶液は混合された。
【0127】
5mMリン酸緩衝液、pH3
0.676mLのリン酸溶液(14.8M)が1900mLの脱イオン水を含む2000mLビーカーに移され、溶液は水酸化ナトリウム溶液でpH3に滴定された。2000mLにするために追加の水が加えられ、溶液は十分に混合された。
【0128】
10mM乳酸緩衝液、pH3
2000mLサイズのビーカーに1.81gの乳酸(分子量90.08)および1900mLの脱イオン水が入れられ、得られた溶液は水酸化ナトリウム溶液でpH3に滴定された。2000mLにするために追加の水が加えられ、溶液は十分に混合された。
【0129】
1mM塩酸溶液
1mLの2規定塩酸溶液が1900mLの脱イオン水を含む2000mLビーカーに移された。溶液の最終液量は、さらに脱イオン水を加えることによって2000mLの目盛りに調整された。
【0130】
0.01%TFA溶液
0.2mLのTFA溶液が1900mLの脱イオン水を含む2000mLビーカーに移された。溶液の最終液量は、追加の水を加えることによって2000mLに調整され、溶液は十分に混合された。
【0131】
調合物の調製
タンパク質原体rhGDF−5(ロット番号2142131)が2〜8℃で解凍された。タンパク質原体溶液(3.8mg/mLで55mL)が、遠心濾過装置(ポールライフサイエンス社、カタログ番号OD010C37、分画分子量10K)を使用して、およそ10mLの液量まで濃縮された。およそ1.4mLの濃縮されたrhGDF−5溶液は、各々の透析カセット(ピアス社、カタログ番号66380)に移され、カセットは2〜8℃で一晩、試験緩衝液に対して透析された。
【0132】
rhGDF−5溶液は、注意深く透析カセットから取り除かれ、小さなガラス瓶に移された。UV−Vis分光光度計を使用して、溶液のタンパク質濃度が測定された。タンパク質は、およそ0.7mg/mLの割合で試験緩衝液中に5%(質量/体積)トレハロースと共に調合され、0.22μmのフィルターを通して濾過された。溶液は、凍結乾燥に先立って、2〜8℃で保存された。
【0133】
充填および凍結乾燥
各々の調合溶液は、3mLのガラスバイアル(ウエスト製薬サービス(West Pharmaceutical Services)、カタログ番号68000316)に、1mL/バイアルで充填された。バイアルはストッパー(ウエスト製薬サービス、カタログ番号99150630)で部分的に閉じられ、凍結乾燥機(FTSシステム社、LyoStar II)に移された。凍結乾燥過程をモニターするために、熱電対が偽バイアル内に置かれた。対照として、トレハロースを含まない別の調合物もまた試験された。4.5mg/mLのrhGDF−5を含む1mM塩酸溶液200μLが、各々のガラスバイアルに移され、凍結乾燥された。
【0134】
分析手法
凍結乾燥ケークの完全性
凍結乾燥された試料は、各々の時点で、凍結乾燥されたケークのひび割れ、収縮および崩壊について点検された。
【0135】
復元時間
1mLの脱イオン水が、各々の凍結乾燥された試料に加えられ、穏やかに混合された。復元時間が記録された。
【0136】
溶液の透明性−外観
小さなガラスバイアル中の溶液試料は、透明性および粒子に関して点検された。試料バイアルは、黒色背景に対して垂直の光を使用して検査された。試験試料の透明度は、対照として純水試料と比較された。
【0137】
pH方法
各々の溶液試料のpHは、較正されたpHメーターを使用して直接測定された。
【0138】
UV分光法
タンパク質濃度は、UV−Vis分光光度計を使用して決定された。rhGDF−5の濃度は、280nmにおける1.16mL/mg×cmの吸光係数を使用して計算された。
【0139】
HPLC法
非還元rpHPLC法(商標 0051 D)が、タンパク質の修飾された種をモニターするために使用された。試験試料は、50mM酢酸を用いておよそ0.1mg rhGDF−5/mLの溶液に希釈された。希釈された試料(各々が50μL)は、HPLCカラム(Vydac 218TP52、C18カラム)に注入された。試料は、0.15%(体積/体積)TFAを含む水および0.15%(体積/体積)TFAを含むアセトニトリルを移動相として、0.3mL/分で溶出された。溶出されたピークは214nmで検出された。各々のピーク面積の割合を計算して、主ピークおよび微小ピーク(分解ピーク)の変化をモニターした。
【0140】
サイズ排除クロマトグラフィー(SEC)
タンパク質の凝集物が、SEC法を使用してモニターされた。典型的には、各々の試験試料の30μLがSECカラム(TOSOHバイオサイエンス社(TOSOH Bioscience)、カタログ番号 08540)に直接注入され、0.1%(体積/体積)TFAおよび45%(体積/体積)アセトニトリルを含む水を用いて0.5mL/分の速度で溶出された。タンパク質のピークは280nmでモニターされ、凝集の割合が計算された。
【0141】
ゲル電気泳動
タンパク質の凝集物および分解された小片も、ゲル電気泳動法を使用してモニターされた。典型的には、およそ10μgのタンパク質が乾燥され、10%β−メルカプトエタノールを含むか、または含まない70μLのSDS−PAGE試料緩衝液(インビトロジェン社(Invitrogen)、カタログ番号LC2676)を用いて復元された。試料は95℃で5分間インキュベートされた。各々の試料のおよそ18μLがゲル(インビトロジェン社、カタログ番号NP0341Box)に供給された。ゲルは、ランニング緩衝液(インビトロジェン社、カタログ番号NP0002)を使用して、200ボルトで約35分間泳動された。ゲルは、次にSimplyblue溶液(インビトロジェン社、カタログ番号LC6060)を用いて染色され、脱イオン水を用いて脱色された。ゲルは、走査され、画像が収集された。
【0142】
生物活性分析
6ヶ月における安定性試料(グリシン調合物および塩酸調合物)だけが生物活性について分析された。細胞に基づいた分析(商標 0046)を使用し、試料の安定性を決定するためにアルカリフォスファターゼ活性を測定した。
【0143】
水分含有量
含水量分析が、カールフィッシャー滴定法を使用してPDDによって行われた。
【0144】
結果
凍結乾燥されたケークの完全性
全ての保存条件の試験試料ケークは、時間ゼロから9ヶ月の時点まで、固体および白から灰白色の外観を呈した。トレハロースまたはスクロース等の糖が充填剤として使用される際に通常観察されるように、ケークの周囲にわずかな収縮が観察されるか、あるいは、ケークはバイアルのガラス壁からわずかに離れていた。全ての試験試料でケークの崩壊は無かった。通常、ケークの崩壊は、復元時間を変化させ、タンパク質の不安定性につながる可能性がある。トレハロースの存在しない調合物では、白色で、ふわふわした軽いケークが得られた。
【0145】
復元時間
試験時には、1mLの水が各々の試料バイアルに加えられた。試料は穏やかに混合され、復元時間が記録された。ケークの溶解が完了するためには、およそ30秒〜40秒が必要とされた。
【0146】
溶液の透明性
復元された溶液試料は、黒色背景上で垂直の光の下で検査され、全ての試験試料は透明および無色であることが見出された。
【0147】
pH
復元された溶液のpHが、較正されたpHメーターを使用して測定された。研究の過程を通して、全ての調合物に渡って大幅なpH値の変化は無かった。トレハロース/緩衝剤を含む調合物試料のpHは、3.0±0.2付近であった。トレハロースを含まない調合物のpHは約4.0であった。
【0148】
UV分光法
タンパク質濃度は、UV−VIS分光光度計上で測定された。研究を通して、グリシン緩衝液、リン酸緩衝液、クエン酸緩衝液、乳酸緩衝液または0.01%TFAを含むrhGDF−5/トレハロース調合物のタンパク質濃度に大幅な変化は無かった。280nmでの吸光度は、25℃/60%および40℃/75%相対湿度で保存された場合、rhGDF−5/トレハロース/塩酸調合物において増加した。タンパク質の濃度は、40℃で保存された調合物で増加していたように見えた。時間ゼロでの0.7mg/mLの初期タンパク質濃度は、6ヶ月の時点で1mg/mLに増加した。これは、トレハロースが、280nmで類似の吸光度を有するフルフラール化合物に分解した可能性を意味すると思われる。
【0149】
非還元rhHPLCの結果
非還元rhHPLC法を使用して、メチオニンの酸化、脱アミド反応および他の反応によって形成されるrhGDF−5の分解種をモニターした。塩酸調合物およびトレハロースを含まない調合物を除いて、2〜8℃および25℃で9ヶ月間保存された全ての調合物について、主ピークの割合に大幅な変化は無かった。両調合物は、9ヶ月の時点で、主ピークは90%より少なかった。
【0150】
しかし、調合物が、40℃/75%相対湿度等の促進された保存条件で保存された場合、一つの調合物(すなわち、rhGDF−5/トレハロース/グリシン)だけが、6ヶ月の時点で主ピークは91%より多かった。促進された保存条件下では、他の調合物はrhGDF−5/トレハロース/グリシン調合物ほど安定ではなかった。特に、rhGDF−5/トレハロース/塩酸調合物は、6ヶ月の時点で主ピークは66%しかなかった。図6および図7は、40℃/75%相対湿度で6ヶ月保存された、rhGDF−5/トレハロース/グリシン調合物およびrhGDF−5/トレハロース/塩酸調合物のHPLCクロマトグラムを示す。図8、図9、および図10は、5℃、25℃、および40℃での保存を試験された様々な緩衝液のタンパク質回収割合(%)を示す。
【0151】
rpHPLC分析の結果は、トレハロースとグリシン緩衝液の組み合わせが、保存の過程で、凍結乾燥されたrhGDF−5に最良の安定性を提供することを示す。さらに、塩酸の強酸が、タンパク質およびトレハロース双方に対して不安定化の効果を有する可能性があるため、rhGDF−5/トレハロース/塩酸の調合物は、より不安定である。
【0152】
実施例13:5%トレハロースを含むpH3グリシン緩衝液中の様々な温度でのrhGDF−5の安定性
この研究では、rhGDF−5は、5%(質量/体積)トレハロースおよびpH3の5mMグリシン−塩酸緩衝液に、およそ0.01、0.03、0.1、2.5、4.5および9mg/mLで調合された。調合溶液を用いて、1mL/バイアルの割合で3mLガラスバイアルに充填され、バイアルは凍結乾燥された。凍結乾燥された試料バイアルは、2〜8℃、25℃/60%相対湿度、および、40℃/75%相対湿度で保存された。各々の設定された時点で、試料は、生成物の安定性について分析された。この研究で使用された方法は、ケーク外観、復元時間、溶液透明度、pH、rpHPLC(逆相高速液体クロマトグラフィー)、UV(紫外分光法)、SEC(サイズ排除クロマトグラフィー)およびゲル電気泳動を含む。3つの保存条件での6ヶ月の保存の後、下は0.1mg/mLから上は0.9mg/mLまでのタンパク質濃度で、調合物に大幅な変化は観察されなかったことが見出された。0.01および0.03mg/mL等の、タンパク質濃度が低すぎた場合、既存の方法は、微小な変化を検出するのに十分強力ではなかった。
【0153】
この研究の結果は、様々なタンパク質濃度で、トレハロースおよびグリシン−塩酸を含む凍結乾燥rhGDF−5調合物は、2〜8℃、25℃/60%相対湿度で少なくとも6ヶ月間安定であったことを示す。40℃/75%相対湿度の促進された保存条件で保存された生成物に、6ヶ月の時点で、rpHPLCプロファイルのわずかな変化が見られた。
【0154】
実施例14:5%トレハロースを含むpH3グリシン緩衝液中の様々な温度での異なった濃度のrhGDF−5の安定性
この研究では、rhGDF−5は、5%(質量/体積)トレハロースおよびpH3の5mMグリシン緩衝液に、0.01、0.03、0.1、2.5、4.5および9.0mg/mLのrhGDF−5濃度で調合された。さらに、比較のために、4.5mg/mLのrhGDF−5の一つの調合物が、10%(質量/体積)トレハロースおよび5mMグリシン緩衝液(pH3)を用いて調製された。調合溶液は次に、1mL/バイアルの割合で3mLガラスバイアルに充填され、凍結乾燥された。凍結乾燥された試料は、安定チャンバ(stability chamber)に保存された。
【0155】
5mMグリシン−塩酸緩衝液、pH3
3×0.75gのグリシン(分子量75.07)が、3個の2000mLビーカーに秤量され、およそ1900mLの脱イオン水が各々のビーカーに加えられた。溶液は、塩酸溶液を用いてpH3に滴定された。各々のビーカーに、2000mLの最終液量にするために追加の水が加えられ、十分に混合された。
【0156】
調合物調製
タンパク質原体rhGDF−5(ロット番号2142131)が2〜8℃で解凍された。タンパク質溶液(3.8mg/mLで96mL)が、4つの遠心濾過装置(ポールライフサイエンス社、カタログ番号OD010C37、分画分子量10K)を使用して、全てを含めた合計液量がおよそ24mLになるまで濃縮された。およそ3×8mLの濃縮されたrhGDF−5溶液は、3つの透析カセット(ピアス社、カタログ番号66380)に移され、2〜8℃で一晩、グリシン−塩酸緩衝液に対して透析された。
【0157】
rhGDF−5溶液は、透析カセットから小さなガラス瓶に移された。UV−Vis分光光度計を使用して、タンパク質濃度が測定された。タンパク質は、上に記載されたように、5%または10%(質量/体積)トレハロースおよび5mMグリシン緩衝液に、様々な濃度で調合された。調合溶液は、0.22μmのフィルターを用いて濾過され、凍結乾燥に先立って、2〜8℃で保存された。
【0158】
充填および凍結乾燥
各々の調合溶液は、3mLのガラスバイアル(ウエスト製薬サービス、カタログ番号68000316)に、1mL/バイアルの割合で充填された。ストッパー(ウエスト製薬サービス、カタログ番号99150630)が、バイアル上に部分的に置かれた。試料バイアルは、凍結乾燥機(FTSシステム社、LuoStar II)に移された。凍結乾燥過程の温度プロファイルをモニターするために、熱電対が偽バイアル内に置かれた。
【0159】
使用された分析方法は、実施例11および実施例12中で上記されたものと同様である。
【0160】
結果
凍結乾燥されたケークの完全性
全ての保存条件の試料ケークは、時間ゼロから6ヶ月の時点まで固体および白色の外観を呈した。ケークの周囲にわずかな収縮が観察されるか、または、ケークはバイアルのガラス壁からわずかに離れていた。これは、トレハロースまたはスクロース等の糖が充填剤として使用される場合にきわめてよく起こる。全ての試験試料でケークの崩壊は見られなかった。
【0161】
復元時間
試験時には、1mLの水が各々の試料バイアルに加えられた。バイアルは穏やかに混合され、復元時間が記録された。ケークが溶解するためには、およそ30秒〜40秒かかった。
【0162】
溶液の透明性
タンパク質溶液が黒色背景に対して垂直の光を用いて検査された場合、全ての復元試料は透明および無色の外観を呈した。
【0163】
pH
復元された溶液が、pHを測定するために使用された。研究の過程を通して、全ての試料に大幅なpHの変化は観察されなかった。調合物のpH値は、3.0〜3.3の範囲内であった。
【0164】
UV分光法
UV分光法を使用して、タンパク質濃度が測定された。UVスペクトルはまた、タンパク質の凝集に関する情報(ベースライン光散乱)も提供することができた。0.01〜0.1mg/mLのタンパク質濃度に対しては、10mmキュベットが使用された。2〜9mg/mLのタンパク質濃度に対しては、希釈せずまたは試料を破壊すること無く、1mmキュベットが使用された。安定性研究の過程を通じて、0.1〜9mg/mLの試料にタンパク質濃度の大幅な変化は観察されなかった。0.01および0.03mg/mLの低濃度試料に対しては、吸光度が低すぎたために、より変動が見られた。将来の研究として、低濃度試料のために、新たな試料調製方法が必要とされるべきである。
【0165】
非還元rhHPLCの結果
非還元rhHPLC法を用いて、メチオニンの酸化および脱アミド等のrhGDF−5の分解種をモニターした。2〜8℃、25℃および40℃で6ヶ月間の保存を通して全ての試料において、主ピークの割合の大幅な変化は観測されなかった。6ヶ月間保存された試料のrhGDF−5の主ピークは、依然として96%以上回収され、これは時間ゼロの試料から得られたデータに匹敵していた。0.01および0.03mg/mLの低濃度試料は、HPLC法によって分析することが困難であった。将来の研究のために新たな試料調製が必要とされるべきである。
【0166】
SEC
タンパク質の凝集をモニターするために、SECが使用された。6ヶ月の安定性研究を通して試験された全ての試料の凝集に、大幅な変化は見出されなかった。0.01および0.03mg/mLの低濃度試料は分析されなかった。
【0167】
ゲル電気泳動
タンパク質の凝集および分解種もゲル電気泳動法を使用してモニターされた。6ヶ月の保存を通して全ての試料に大幅な変化は見出されなかった。
【0168】
タンパク質の断片は、還元SDS−PAGEで発見されなかったことから、保存の過程でどの試料にも形成されなかった。
【0169】
水分含有量
試料の水分含有量は低く、0.19〜0.32%の範囲であった。タンパク質濃度と水分含有量との間には、相関または傾向は見られなかった。
【0170】
rpHPLCおよびSECクロマトグラフィーによって証明されるように、結果は、トレハロースおよびグリシン緩衝液存在下の凍結乾燥されたrhGDF−5生成物が、2〜8℃、25℃/60%相対湿度、および、40℃/75%相対湿度で少なくとも6ヶ月間安定であることを示す。タンパク質は、0.1〜9mg/mL(凍結乾燥前)の範囲の様々な濃度で、5%(質量/体積)トレハロース/5mMグリシン−塩酸緩衝液(pH3)を用いて調合することができ、凍結乾燥することができる。タンパク質が、0.01mg/mLおよび0.03mg/mL等の低濃度で調合された場合、既存の方法は変化を検出することにいくつかの限界を有する。
【0171】
本発明は、実例となる実施形態に関連して記載されてきた。本発明の範囲を逸脱すること無く上記の調合物にある種の変更が行われてよいため、上記の記載に含まれるか、または添付の図に示される全ての事柄は、限定的な意味ではなく実例として解釈されるべきであることが意図される。例えば、本発明の説明に役立つ実施形態の調合物は、BMPと共に使用されることに限定されず、あらゆる適切な生物系についての他の生体分子と共に使用できることを、当業者は認識するであろう。
【0172】
特許請求の範囲は、本明細書に記載される発明の包括的および特定的な特徴全て、ならびに、文言上その範囲にあると言ってよい発明の範疇についての主張の全てを網羅することを意図したものであることもまた理解されるべきである。
【0173】
〔実施の態様〕
(1)組成物において、
少なくとも一種のBMPと、
前記BMPを安定化するために十分な量のトレハロースと、
を含む、組成物。
(2)実施態様1に記載の組成物において、
約2.5〜約3.5のpHを有するグリシン緩衝溶液、
をさらに含む、組成物。
(3)実施態様1に記載の組成物において、
前記BMPが、rhGDF−5である、組成物。
(4)実施態様2に記載の組成物において、
前記BMPが、rhGDF−5である、組成物。
(5)BMPを安定化するための方法において、
a)少なくとも一種のBMPおよび前記BMPを安定化するために十分な量のトレハロースを含む組成物を提供することと、
b)前記混合物を凍結乾燥することと、
を含む、方法。
(6)実施態様5に記載の方法において、
約2.5〜約3.5のpHを有するグリシン緩衝溶液を加えること、
をさらに含む、方法。
(7)実施態様5または実施態様6に記載の方法において、
前記BMPが、rhGDF−5である、方法。
(8)哺乳動物に植え込むための装置において、
少なくとも一種の凍結乾燥BMPであって、実施態様5に記載の方法にしたがって凍結乾燥された、少なくとも一種の凍結乾燥BMP、
を含む、装置。
(9)実施態様8に記載の装置において、
生物分解性のコラーゲン基質、
をさらに含む、装置。
(10)実施態様8に記載の装置において、
前記BMPが、rhGDF−5である、装置。
(11)哺乳動物に植え込むための装置において、
少なくとも一種の凍結乾燥されたBMPであって、実施態様6に記載の方法にしたがって凍結乾燥された、少なくとも一種の凍結乾燥BMP、
を含む、装置。
(12)実施態様11に記載の装置において、
生物分解性のコラーゲン基質、
をさらに含む、装置。
(13)実施態様11に記載の装置において、
前記BMPが、rhGDF−5である、装置。
【図面の簡単な説明】
【0174】
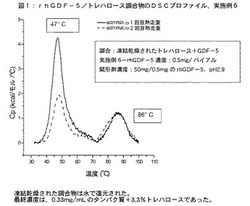
【図1】図1は、実施例6に記載されている、rhGDF−5のトレハロース調合物のDSCプロファイルを示す。
【図2】図2は、実施例7に記載されている、rhGDF−5のマンニトール調合物のDSCプロファイルを示す。
【図3】図3は、rhGDF−5天然タンパク質のDSCプロファイルを示す。
【図4】図4は、実施例6に記載されている、rhGDF−5のトレハロース調合物の偏光顕微鏡検査を示す。
【図5】図5は、実施例7に記載されている、rhGDF−5のマンニトール調合物の偏光顕微鏡検査を示す。
【図6】図6は、実施例12に記載されている、40℃/75%相対湿度で6ヶ月後のrhGDF−5/トレハロース/グリシン調合物のrpHPLCプロファイルを示す。
【図7】図7は、実施例12に記載されている、40℃/75%相対湿度で6ヶ月後のrhGDF−5/トレハロース/塩酸調合物のrpHPLCのプロファイルを示す。
【図8】図8は、実施例12に記載されている、5℃で保存した場合の、試験された各種緩衝液の各種時点でのタンパク質回収率(%)を示す。
【図9】図9は、実施例12に記載されている、25℃で保存した場合の、試験された各種緩衝液の各種時点でのタンパク質回収率(%)を示す。
【図10】図10は、実施例12に記載されている、40℃で保存した場合の、試験された各種緩衝液の各種時点でのタンパク質回収率(%)を示す。
【図11】図11は、実施例14に記載されている、pH3グリシン緩衝液中、5%または10%トレハロースで凍結乾燥された、各種濃度のrhGDF−5の、選択された温度での安定性を示す。
【開示の内容】
【0001】
〔技術分野〕
本発明は、処理、保存、および復元の過程で、骨形態形成タンパク質(BMP)および密接に関連のある成長分化因子(GDF)を安定化するための方法および調合物(formulations)に関する。さらに特定すれば、本発明は、rhGDF−5を送達するための媒体として使用される種々の基質を含む、凍結乾燥、保存、および復元(reconstitution)の過程でrhGDF−5を保護するための、トレハロースおよび他の賦形剤を含む調合物に関する。さらに、本発明は、様々な筋骨格の欠陥および症状を治療するためにそのような調合物を調製および使用するための方法を含む。
【0002】
〔発明の背景〕
生物学的分子(生体分子)は、三次元構造または立体配座(conformation)を有し、生体分子の生物活性および性質についてはこの構造に依存している。そのような生体分子の例は、デオキシリボ核酸(DNA)、リボ核酸(RNA)、およびタンパク質を含む。これらの生体分子は生命に必須であり、様々な医学的疾患および症状の治療における、治療薬および治療標的を代表する。タンパク質は、広範な生体分子のクラスを代表する。酵素、成長因子、受容体、抗体、およびシグナル分子等の異なるクラスのタンパク質は、それらの生物活性について立体配座構造に依存している。他のタンパク質のクラスは、例えばコラーゲンおよび軟骨のように、主として構造的なものであり(structural)、それ自体は生物活性を有していない。
【0003】
pH、温度、溶媒、オスモル濃度(osmolality)、その他の変化等の様々な環境に生体分子を曝露することは、生体分子の立体配座状態を不可逆的に変化させることまたは変性することができ、生体分子を生物学的に不活性にする。これらの生体分子の不活性化に関与する機構のうちいくつかは、凝集、酸化、加水分解および脱アミドを含む様々なタイプの結合切断、ならびに、架橋結合および他の共有結合を含む様々なタイプの結合形成を含み、例としてジスルフィド結合の転位(rearrangement)がある。
【0004】
骨形態形成タンパク質および密接に関連のある成長分化因子は(単量体および二量体の形で)、タンパク質のTGF−βスーパーファミリーに属している。このタンパク質のクラスは、当初はその異所性軟骨内性骨形成を誘導する能力によって同定された、骨形態形成タンパク質のファミリーのメンバーを含む(Chengら、「Osteogenic activity of the fourteen types of human bone morphogenic proteins」 J. Bone Joint Surg. Am. 85A: 1544-52 (2003)を参照)。これらのタンパク質のいくつかには別名がある(Loriesら、Cytokine Growth Factor Rev 16:287-98 (2005)を参照)。このファミリーの全てのメンバーは、カルボキシ末端側の活性ドメインを含む共通の構造的特徴を共有し、成熟したときの鎖長でおよそ97〜106アミノ酸である。全てのメンバーは、3つの分子内ジスルフィド結合および1つの分子間ジスルフィド結合を形成する、高度に保存されたシステイン残基のパターンを共有する。活性型は、ジスルフィド結合した単一のファミリーメンバーのホモ二量体、または2つの異なるメンバーのヘテロ二量体であることができる。(MassagueのAnnu. Rev. Cell Biol. 6:957 (1990)、SampathらのJ. Biol. Chem. 265:13198 (1990)、OzkaynakらのEMBO J. 9:2085-93 (1990)、WhartonらのPNAS 88:9214-18 (1991)、CelesteらのPNAS 87:9843-47 (1990)、LyonsらのPNAS 86:4554-58 (1989)、米国特許番号第5,011,691号、および米国特許番号第5,266,683号、を参照)。
【0005】
多くの糖が、溶液中で生体分子を安定化し、分離した細胞および生体分子に保護を提供できることが周知である。これらの化合物は、様々な種において凍結防止剤および浸透圧調節剤として周知である(YanceyのJ. Exper. Biol. 208:2819-30 (2005)を参照)。凍結乾燥された薬剤用タンパク質の開発において、糖(サッカライドおよび多価アルコール)は、タンパク質の安定性を改善し、有効期間を延長するためにしばしば調合物に加えられる。糖の安定化作用の機構に関して、2つの主要な理論がある。1)糖賦形剤は、固体の状態でタンパク質を希釈することに寄与し、希釈することによって、タンパク質−タンパク質相互作用を減少させ、凝集等の分子劣化を防止する。2)糖賦形剤は、ガラス様基質を提供し、基質中ではタンパク質の移動度、したがって反応性が最小化される。これらの機構の双方において、糖が非結晶質のタンパク質に接触する相のままであることが重要な意味を持つ。高温および高湿度等の様々な環境因子が、糖の結晶化を誘発し得る。したがって、使用される条件および物質を、検討中の特定の生体分子およびシステムに適するように最適化することが重要である。
【0006】
凍結乾燥(フリーズドライ)は、生体分子を保存するために通常使用される方法である。フリーズドライは一般的に、生体分子の生物活性に対して、凍結融解(freeze-thawing)または温度によって誘発される変性よりも破壊的であると考えられている。損傷の程度は、異なる生体分子および異なる条件で大幅に変化し、様々な研究者が異なったシステムを研究してきた。水溶液の凍結は、不安定な化合物に凍結そのものよりも損傷を与える可能性のある溶質濃度の初期上昇を作り出す。糖、タンパク質、ポリマー、緩衝液、および界面活性剤等の賦形剤は、生体分子の活性を安定化するために添加可能であるが、その効果の程度は限られており、システムに依存して異なる。Croweらは、乾燥したリン脂質二重層およびタンパク質の糖による安定化を記載しており(Biochem. J. 242:1-10 (1987))、また、「The trehalose myth revisited: Introduction to a symposium on stabilization of cells in the dry state」 Cryobiology 43,89-105 (2001)の中で、細胞のトレハロース安定化の機構の最近の理解を概説している。現在の考えは、生存可能で有用な凍結乾燥されたタンパク質を保持するためには、2つの別個の異なった必要条件があるというものである。その必要条件とは、1)タンパク質は、凍結過程の間に保護されなければならない、2)タンパク質は、後続の乾燥および復元の間に保護されなければならない。これらは、必ずしもある1つの賦形剤または条件セットによって満たされる必要は無い、異なった必要条件である。
【0007】
様々な研究者が、様々な生体分子を保護するために様々な賦形剤を使用することについて報告してきた。例えば、Glogerらは(Intl. J. Pharm. 260:59-68 (2003))、タンパク質を安定化するために低分子量のデキストランを使用した、アビスクミン(aviscumine)の溶解保護(lyoprotection)を記載しており、緩衝系およびポリソルベート80のみが凍結過程においてタンパク質を保護することに適しているが、乾燥過程においてタンパク質を保護するためにはデキストランが必要であることを示した。Goodnoughらは(Appl. Env. Biol. 58(10):3426-28 (1992))、安定化剤として血清アルブミンを使用し、また様々な他の賦形剤を使用した、凍結乾燥過程におけるボツリヌス毒素A型の安定化を研究し、どの賦形剤も有益な効果を持たなかったが、凍結乾燥混合液から塩化ナトリウムを除くことによって、またpHを制御することによって、活性毒素の回収率が劇的に改善されたことを報告した。Costantinoらは(J. Pharm. Sci. 87 (11):1412-20 (1998))、凍結乾燥された組み換えヒト成長ホルモンの安定性および構造に対する様々なサッカライドの効果を記載しており、試験された全ての賦形剤がタンパク質の安定性を劇的に改善したことを示した。Ramosらは(Appl. Envir. Microbiol. 63 (10):4020-25 (1997))、2−O−β−マンノシルグリセレート(2-O-β-mannosylglycerate)は、様々な起源から単離されたいくつかのデヒドロゲナーゼ酵素の熱ストレスからの保護において効果的であることを示し、また、2−O−β−マンノシルグリセレートによって与えられる保護は、研究された全ての酵素に対してトレハロースに類似しているかあるいはトレハロースより優れていたが、パイロコッカスフリオサス(P. furiosis)から単離されたグルタミン酸デヒドロゲナーゼの保護においては効果的ではなかったことを示した。Brusらは(J. Control. Rel. 95:119-31 (2004))、フリーズドライによるオリゴヌクレオチド−ポリエチレンイミン(PEI)複合体の安定化を研究し、これらの複合体はスクロースまたはトレハロース等の糖の添加から利益を得ることは無かったが、プラスミド−PEI複合体はそのような糖の添加から利益を得たことを報告した。これらの研究者は、様々な生体分子に対して様々な方法によって測定された、異なった程度の成功を報告している。これらの研究者でBMPの保護について報告した者はいない。
【0008】
したがって、何が生体分子の溶解保護を提供できる賦形剤の最適な組み合わせであるのかについては、相反する証拠が存在する。全ての生体分子に対して最適となるような如何なる賦形剤の組み合わせも存在しないが、研究中の生体分子に対する望みどおりの結果を得るためには、かなり著しい程度の実験が必要である。凍結乾燥、保管、および使用の過程でBMPを保護するための、薬学的に許容できる賦形剤の組み合わせに対する需要が残っている。
【0009】
〔発明の概要〕
本発明は、概して、様々な調合物および組成物におけるBMPの安定化と、それによる少なくとも60%の生物活性の保持、ならびに、例えば温度および湿度などの保存条件における要件の改善に関する。本発明は、BMPを含む凍結乾燥された組成物のための、およびそれに続くそれらの保管と復元のための賦形剤としてトレハロースを主として含む調合物を含み、緩衝剤および界面活性剤を含む他の賦形剤をさらに含む。
【0010】
本発明者らは、驚くべきことに、凍結乾燥中およびその後においてBMPの生物活性を保持する上でトレハロースが十分であり、かつ他の賦形剤よりも優れていることを発見した。多くの他の生体分子の安定化においては、得られる保護の量に関して糖の間でほとんど差異は無いが、BMPに対しては大きな差異がある。この発見は、追加の賦形剤に対する副作用の可能性が無い、患者の様々な筋骨格の欠陥を治療するための組成物を提供する。本発明者らはまた、驚くべきことに、アスコルビン酸およびグルタチオン等の抗酸化物質の添加は、トレハロースと共に凍結乾燥されたBMPの安定性を増加させず、むしろトレハロースによって提供された安定性を減じることも発見した。
【0011】
本発明の目的は、凍結乾燥されたBMPを安定化するのに十分な量のトレハロースを使用して、BMPが再水和時に生物活性の少なくとも60%を保持し、再水和した液体生成物を外科医が容易に扱うことができるようにすることである。
【0012】
本発明の別の目的は、凍結乾燥されたBMPを安定化するのに十分な量のトレハロース、少なくとも1種のBMP、および追加の賦形剤を使用して、BMPが再水和時に生物活性の少なくとも60%を保持し、再水和した液体生成物を外科医が容易に扱うことができるようにすることであり、追加の賦形剤は、緩衝剤、界面活性剤、およびそれらの混合物からなる群より選択される。
【0013】
本発明の別の目的は、凍結乾燥されたBMPを安定化するのに十分な量のトレハロース、少なくとも1種のBMP、および細分化されたコラーゲン繊維(morselized collagen fibers)を使用して、安定で再水和時に生物活性の少なくとも60%を保持するBMPを含む、凍結乾燥された生体適合性の流動性材料を調製する方法および組成物を提供し、再水和した生成物を外科医が容易に扱うことができるようにすることである。
【0014】
本発明の別の目的は、凍結乾燥されたBMPを安定化するのに十分な量のトレハロース、少なくとも1種のBMP、および生体適合性基質を使用して、安定で再水和時に生物活性の少なくとも60%を保持するBMPを含む、凍結乾燥された生体適合性基質を調製するための方法および組成物を提供し、再水和した生成物を外科医が容易に扱うことができるようにすることである。例となる生体適合性基質には、コラーゲン、ミネラル化コラーゲン(mineralized collagen)、リン酸カルシウム塩、カルシウム含有セラミックス、自原性(autogenic)、同種異系および異種発生性を含む様々な源(sources)からの骨、ならびに、ポリラクチド(PLA)、ポリグリコリド(PGA)、PLA−PGAコポリマー、ポリカーボネート、ポリカプロラクトン、およびそれらの混合物を含むポリマーが含まれる。
【0015】
本発明の別の目的は、凍結乾燥されたBMPを安定化するのに十分な量のトレハロース、少なくとも1種のBMP、生体適合性基質および追加の賦形剤を使用して、安定で再水和時に生物活性の少なくとも60%を保持するBMPを含む、凍結乾燥された生体適合性基質を調製するための方法および組成物を提供し、再水和した展性の生成物を外科医が容易に扱うことができるようにすることであり、追加の賦形剤は、緩衝剤、界面活性剤、およびそれらの混合物からなる群より選択される。
【0016】
本発明の別の目的は、トレハロース、低分子量デキストラン、シクロデキストリン、ポリエチレングリコール、ポリエチレングリコールエステル、およびそれらの混合物からなる群より選択される1つまたはそれ以上の溶解保護剤を、凍結乾燥されたBMPを安定化するのに十分な量使用し、且つ、少なくとも1種のBMPを使用して凍結乾燥されたBMPを調製する方法および組成物を提供し、BMPが再水和時に生物活性の少なくとも60%を保持し、再水和した生成物産物を外科医が容易に扱うことができるようにすることである。
【0017】
本発明の別の目的は、トレハロース、低分子量デキストラン、シクロデキストリン、ポリエチレングリコール、ポリエチレングリコールエステル、およびそれらの混合物からなる群より選択される1つまたはそれ以上の溶解保護剤、少なくとも1種のBMP、ならびにコラーゲンを使用して、安定で再水和時に生物活性の少なくとも60%を保持するBMPを含む、凍結乾燥された生体適合性コラーゲン基質を調製する方法および組成物を提供し、再水和した展性の生成物を外科医が容易に扱うことができるようにすることである。
【0018】
本発明の別の目的は、トレハロース、低分子量デキストラン、シクロデキストリン、ポリエチレングリコール、ポリエチレングリコールエステル、およびそれらの混合物からなる群より選択される1つまたはそれ以上の溶解保護剤、少なくとも1種のBMP、ならびに細分化されたコラーゲン繊維を使用して、安定で再水和時に生物活性の少なくとも60%を保持するBMPを含む、凍結乾燥された生体適合性の流動性物質を調製する方法および組成物を提供し、再水和した生成物を外科医が容易に扱うことができるようにすることである。
【0019】
本発明のさらに別の目的は、少なくとも一つの溶解保護剤と少なくとも一つのBMPとの凍結乾燥混合物を含む組成物を使用して、患者を治療することである。このような組成物は、復元された(reconstituted)BMP溶液を、例えば骨折、骨の裂け目(bone gap)、骨空隙、椎間板、軟骨欠損、腱、靭帯、および類似物等の患者の解剖学的構造の領域に直接適用することによって、または復元されたBMP溶液を、例えば人工股関節、人工膝関節、人工肩関節、人工椎間板および類似物等の骨に接触する人工インプラント、腱アンカー、靭帯アンカー、縫合糸、ステープルおよび類似物、ならびに骨置換ケージ、自己由来骨細片、同種異系骨細片、異種骨細片、脱ミネラル化骨細片および類似物などの、患者に植え込まれる装置に適用することによって、様々な筋骨格の欠陥を治療する際に治癒過程を改善させるために有用である。
【0020】
水溶液または乾燥固体の原体形態(bulk forms)のBMPは不安定であり、タンパク質の生物活性を保持するためには−20℃より低い温度での冷蔵が必要である。BMPは、凝集、ジスルフィド結合の転位、脱アミドおよび酸化の影響を受けやすいため、凍結乾燥されたBMPの生物活性を保存および保護するための調合物に対する需要が存在する。
【0021】
改善された安定性および保存性を有する凍結乾燥BMP製品に対する需要が存在する。
【0022】
水溶液を用いて復元し、椎間板、非関節軟骨および関節軟骨等の軟組織へ注入してそのような組織の再生を促進するために使用される、凍結乾燥BMP製品に対する需要が存在する。
【0023】
外科医が使用するために植え込み可能な生体適合性骨格に適正なBMP濃度で供給され、供給されることによって、浪費および望まれない手術部位への導入を含む、汚染、不適切な投与量、ならびにこぼれを含む、取り扱いに関連するリスクの多くを最小化するか、または排除する凍結乾燥BMP製品に対する需要が存在する。
【0024】
手術部位に容易に適用されることができる生体適合性の流動性物質に復元されることができる、凍結乾燥BMP製品に対する需要が存在する。
【0025】
〔発明の詳細な説明〕
BMPが発見されて以来、様々な筋骨格の欠陥や症状の処置における治療的使用に適した組成物を見出すための多数の研究活動があった。現在では、凍結乾燥固体として販売されるBMPを含む製品が存在し、その製品は、使用時に液体状態に復元されて外科医によって植え込まれるべき骨格または外科的治療部位に対して適用されなければならない。現在のrhBMP−2の調合物は、スクロースNF、グリシンUSP、L−グルタミン酸FCC、塩化ナトリウムUSP、およびポリソルベート80NFを賦形剤として使用しており、室温(15〜25℃)で保存してよい。現在のOP−1の調合物は、ウシコラーゲンのみを使用し、2〜8℃で保存しなければならない。復元されたBMPの安定性に対する賦形剤の有効性を記載した報文は存在しない。
【0026】
他の者は、マンニトール、スクロースおよびそれらの混合物を使用することによって、PLGA等のポリマー基質中にBMPを埋め込むことによって、メチオニン等の抗酸化剤を添加することによって、ヒスチジン、アルギニン、シクロデキストリンおよびウシ血清アルブミン等の他の賦形剤を添加することによって、ならびにTWEEN80等の界面活性剤を添加することによって、またはそれらの組み合わせによって、凍結乾燥過程におけるBMPの安定性を増進しようと試みてきた。これらの試みは、様々な程度の限定的な成功を収めてきた。
【0027】
米国特許番号第5,318,898号および第5,516,654号は、培養液中に硫酸デキストランを使用することによるBMP産生の改良プロセスを開示しているが、その利点がどのようにして達成されたかの機構を議論しておらず、また、タンパク質を安定化するための他の有用な賦形剤も開示していない。米国特許番号第5,385,887号において、Yimらは、BMPを送り込むための凍結乾燥された組成物および調合物を開示しており、その組成物はBMP、糖、グリシンおよびグルタミン酸を含む。Yimらは、W−20アルカリフォスファターゼ分析で証明されるように、凍結乾燥された調合物が生物活性を保っていることを開示しているが、彼らは、他の調合物に対してどれか一つの調合物についてでも量的な利点を示すような調合物に関する比較データを開示していない。これらの発明者は、BMPの溶解保護に関するトレハロースのスクロースに対する優位性を議論も認識もしていない。
【0028】
本発明は、凍結乾燥、保存、および、患者を治療するための水溶液を用いた復元に有用で、安定なBMPの調合物を調製および使用する方法および組成物を提供する。本発明は、説明に役立つ実施形態について以下に記載されており、BMPの例としてrhGDF−5を使用する。本発明が多くの異なった適用および実施形態で実施されてよいこと、ならびに本発明がその適用において本明細書に示される特定の実施例に特に限定されないことを当業者は理解するであろう。以下に続く実施例は、本発明の様々な実施形態および利点のいくつかを説明するが、当業者は、本発明の範囲および意図を逸脱することなく、他の類似の実施形態をとることができることを理解するであろう。
【0029】
本発明は、1つの態様において、後に続く骨および軟骨の欠陥の外科的治療における使用のために、安定な凍結乾燥されたBMPを調製するための方法および組成物を提供する。本明細書において熟慮されているように、そのような組成物は、少なくとも一種のBMP、および、BMPを安定化するのに十分な量のトレハロースを含む。そのような組成物は、復元されたタンパク質溶液を、例えば骨折、骨の裂け目、骨空隙、椎間板、癒合のために外科的に準備された椎間板隙、軟骨欠損、腱、靭帯および類似物等の患者の解剖学的構造の領域に直接に適用するか、あるいは、人工股関節、人工膝関節、人工肩関節、人工椎間板、腱アンカー、靭帯アンカー、縫合糸、ステープル、骨ケージ、自己由来骨細片、同種異系骨細片、異種骨細片、脱ミネラル化骨細片および類似物等の、骨または軟骨に接触して患者に植え込まれるべき物質に対して、直接適用することによって、様々な筋骨格の欠陥の治療に有用である。
【0030】
本明細書中で使用されているように、用語「モルフォゲン(morphogen)」「骨モルフォゲン(bone morphogen)」、「骨形成タンパク質(bone morphogenic protein)」、「骨形態形成タンパク質(bone morphogenetic protein)」、「BMP」、「骨原性タンパク質(osteogenic protein)」、「骨原性因子(osteogenic factor)」、「成長分化因子(Growth & Differentiation Factor)」、および「GDF」は、rhGDF−5によって代表されるクラスのタンパク質を包含する。しかし、通常の当業者は理解するであろうことであるが、rhGDF−5は単に、BMPとして機能することのできる真の組織モルフォゲンのTGF−βファミリーサブクラスの代表であり、説明を限定する意図は無い。用語「凍結防止剤(cryoprotectant)」は、凍結の過程で生体分子を安定化することのできる分子を指し示すために使用され、現在の文脈においては、フリーズドライ(凍結乾燥)の過程で生体分子を安定化することのできる分子を指し示す用語「溶解保護剤(lyoprotectant)」と等価である。本明細書中で使用されているように、用語「細分化された(morselized)」は以下の操作によって得られた生成物を、また用語「細分化(morselization)」は以下の操作の過程を指し示しており、操作とは、切断、せん断、分断、粉砕、微粉砕、あるいはそうでない場合、個々の粒子または繊維の全体のサイズが減じられるように、ある量の生体適合性基質、例えばコラーゲン、のサイズを減じることである。本明細書中で使用されているように、用語「賦形剤」は、少なくとも一つのBMPに添加される少なくとも一つの追加的な化合物を指し示し、追加的な化合物は、アミノ酸、タンパク質、緩衝剤、界面活性剤およびそれらの混合物からなる群より選択される。
【0031】
rhGDF−5は、pH4.5〜pH10.5の範囲の中性のpHでは溶解性が低いことが知られている。このpH範囲においてrhGDF−5製品を調合して製造することは難しいであろう。ゆえに本発明者らは、タンパク質調合物の開発に好適なpH範囲を選択するために重要な、pH3およびpH4の緩衝液中でのrhGDF−5の溶解度を評価するための研究を設計した。研究の結果は実施例11に記載されている。rhGDF−5の溶解度は、緩衝液のpHにのみ依存するのではなく、緩衝溶液のイオン強度にも依存する。pH4において、およそ10mg/mLのrhGDF−5溶液は、5および10mMのリン酸ナトリウム緩衝液中で白濁していた一方で、50および100mMのリン酸ナトリウム緩衝液中では、rhGDF−5は大きな粒子を形成し、最終的には沈殿した。別の研究では(データは示されていない)、rhGDF−5がpH3.5およびpH4の5mMリン酸緩衝液に3.5mg/mLで調合され、この場合にも、溶液は白濁していた。
【0032】
通常、タンパク質物質の溶解度は、過飽和/沈殿した溶液の遠心分離または濾過の後にタンパク質濃度を測定することによって決定される。しかし、いくつかの白濁したタンパク質溶液は、遠心分離または濾過するのが困難である。不溶の粒子を除去するために白濁した溶液を遠心分離または濾過(0.22μm)にかけた後でさえ、非常に多くの場合、粒子が非常に微細であることから濾液は依然として白濁しているため成功せず、時にはタンパク質がフィルター表面に固着し、したがって濾液はほとんどのタンパク質を失う。ゆえに、rhGDF−5が、3.5mg/mLまたは10mg/mLでpH3.5またはpH4の緩衝液中に調合された場合、透明な溶液を得ることは困難であろう。
【0033】
rhGDF−5が、10mg/mLで5mM、10mM、および25mMのpH3.0のリン酸ナトリウム溶液中に調合された場合、タンパク質溶液は透明であったが、rhGDF−5が、10mg/mLで50mMおよび100mMのリン酸ナトリウム等のより高いイオン強度の溶液中に調合された場合、rhGDF−5溶液は白濁していた。したがって、好ましい実施形態においては、rhGDF−5は、およそpH3.0の低イオン強度の緩衝液中に調合されるべきである。
【0034】
本発明による一つの実施形態においては、組成物は、少なくとも一つのBMPと、BMPを安定化するのに十分な量のトレハロースとの混合水溶液を凍結乾燥することによって調製することができ、生体適合性基質を含む生成物について、トレハロースのBMPに対する乾燥重量比率は、1mgのBMPにつき約1mg〜約500mgのトレハロースの範囲であり、さらに好ましくは、1mgのBMPにつき約5mg〜約200mgのトレハロースの範囲である。トレハロースの添加は、凍結乾燥された調合物のタンパク質の溶解度および安定性を改善する。凍結乾燥は、当業者に一般的に周知の慣例にしたがって行われる。
【0035】
別の実施形態においては、本発明による組成物は、少なくとも一つのBMP、BMPを安定化するのに十分な量のトレハロース、および、緩衝剤の混合水溶液を凍結乾燥することによって調製することができる。緩衝剤の添加は、凍結乾燥された調合物のタンパク質の溶解度および安定性を改善する。当業者に周知の生体適合性緩衝剤は、グリシン、酢酸のナトリウム塩、カリウム塩またはカルシウム塩、クエン酸のナトリウム塩、カリウム塩またはカルシウム塩、乳酸のナトリウム塩、カリウム塩またはカルシウム塩、一塩基リン酸(mono-basic phosphate)、二塩基リン酸(di-basic phosphate)、三塩基リン酸(tri-basic phosphate)、およびそれらの混合物を含むリン酸のナトリウム塩またはカリウム塩を含む。緩衝剤は、充填剤(bulking agent)として機能するために、組成物に対して添加されたグリシンを付加的に有することができる。グリシンは、1mgのBMPにつき約0.04mg〜約200mgのグリシンの割合で、さらに好ましくは、0.04mgのBMPにつき約1mg〜約80mgのグリシンの割合で添加される。緩衝剤および充填剤の添加は、pHが約2.0〜約5.0のpH単位の間に制御されている場合に、さらに好ましくは、約2.5〜約4.5のpH単位の間に制御されている場合に、トレハロースのみを有する組成物よりもわずかに優れたタンパク質の安定性を提供する。
【0036】
また別の実施形態において、本発明による組成物および方法は、少なくとも一つのBMPと、BMPを安定化するのに十分な量のトレハロースと、緩衝剤と、ポリソルベート80、ポリソルベート20およびそれらの混合物からなる群より選択される界面活性剤との混合水溶液を凍結乾燥することによって調製することができる。界面活性剤は、1mgのBMPにつき約0.001mg〜約0.2mgの濃度で添加される。界面活性剤の添加は、溶解度および凍結乾燥の特性を変化させることによって、タンパク質に付加的な安定性を提供する。凍結乾燥は、当業者に一般的に周知の慣例にしたがって行われる。
【0037】
本発明の別の実施形態において、安定な凍結乾燥されたBMPを調製するための組成物および方法は、少なくとも一つのBMP、少なくとも一つのBMPを安定化するのに十分な量の溶解保護剤であるトレハロース、および少なくとも一つの付加的な賦形剤によって構成され、付加的な賦形剤は、緩衝剤および界面活性剤からなる群より選択される。そのような緩衝剤および界面活性剤の添加は、トレハロースを単一の賦形剤として有する組成物よりも、凍結乾燥されたBMPの安定性に増加する改善を提供する。
【0038】
別の実施形態において、本発明による組成物および方法は、少なくとも一つのBMPと少なくとも一つの賦形剤との溶液を凍結乾燥されたコラーゲンの上に堆積させることによって調製でき、その後にBMP/コラーゲン混合物の凍結乾燥ができる。コラーゲンは、オプションとして、ヒーロス(Healos)(登録商標)として知られ、米国特許番号第5,972,385号、第5,866,165号、第5,776,193号、第5,455,231号、および第5,231,169号に記載されている物質によって提供されるように、架橋またはミネラル化されるか、あるいは架橋およびミネラル化されることができる。本実施形態において提供される組成物は、整形外科の分野における病状の治療に特に有用であり、骨、軟骨、または腱を生成させるために外科医が容易に手術部位に設置することのできる、柔軟な、展性の素材を提供する。BMP/コラーゲン混合物は、滅菌水、生理食塩水および骨髄穿刺液を含む水溶液を用いて復元することができ、骨折、骨の裂け目、骨空隙、脊椎固定術のために外科的に準備された椎間板隙等の患者の欠陥部位に直接適用されることができる。さらに、BMP/コラーゲン混合物は、骨細片と、脊椎固定術の過程で椎間板隙に挿入されるインプラントとの間の空間に充填するため、裂けるかまたは損傷した腱、裂けるかまたは損傷した靭帯、関節軟骨の軟骨欠損および関節軟骨の肋軟骨下欠損等の損傷または欠失した軟骨のある領域に充填するために使用することができる。
【0039】
別の実施形態において、本発明による組成物および方法は、少なくとも一つのBMPと少なくとも一つの賦形剤との凍結乾燥された混合物を調製することによって、凍結乾燥されたBMP混合物を水、生理食塩水または骨髄穿刺液を用いて復元することによって、そして、復元されたBMP溶液を凍結乾燥コラーゲンの上に乗せてからBMP/コラーゲン混合物の外科的植え込みを行うことによって、利用することができる。コラーゲンは、オプションとして、ヒーロス(登録商標)として知られている物質によって提供されるように、架橋またはミネラル化されるか、あるいは架橋およびミネラル化されることができる。本実施形態において提供される組成物および方法は、整形外科の分野における病状の治療に特に有用であり、骨、軟骨または腱を生成させるために外科医が容易に手術部位に設置することのできる、柔軟な、展性の素材を提供する。BMP/コラーゲン混合物は、骨折、骨の裂け目、骨空隙、脊椎固定術のために外科的に準備された椎間板隙等の患者の欠陥部位に直接適用することができ、骨細片と脊椎固定術の過程で椎間板隙に挿入されるインプラントとの間の空間を満たすために、また、裂けるかまたは損傷した腱、裂けるかまたは損傷した靭帯、関節軟骨の軟骨欠損、および関節軟骨の肋軟骨下欠損等の損傷または欠失した軟骨のある領域を満たすために使用することができる。本実施形態において提供される組成物および方法はまた、BMPをコラーゲン物質から分離した成分および容器として有することによって、保存および調製を簡略化するために特に有用である。
【0040】
別の実施形態において、本発明による組成物および方法は、少なくとも一つのBMPと少なくとも一つの賦形剤との溶液を、凍結乾燥され、細分化されたコラーゲン上に堆積させることによって調製でき、その後、BMP/細分化されたコラーゲン混合物の凍結乾燥ができる。細分化されたコラーゲンは、任意に、架橋またはミネラル化されるか、あるいは架橋およびミネラル化されていることができる。このような細分化によって、直径約25ミクロン、長さ約110ミクロンの小さいコラーゲン繊維が提供され、手術部位に注入するのに好適な流動性の組成物をもたらす。このような組成物の復元は、滅菌水、生理食塩水または骨髄穿刺液等の水溶液とコラーゲンゲルとの混合物を使用して行うことができ、コラーゲンゲルが復元された生成物の粘度を制御する。コラーゲンゲルは、約0.1%〜約30%(質量/質量)のコラーゲンを、さらに好ましくは約0.3%〜約3.0%(質量/質量)のコラーゲンを含み、コラーゲンゲルの粘度は、好ましくは約10cP〜約400cP、さらに好ましくは約70cP〜約100cPである。コラーゲンゲルのpHは、好ましくは約4.0pH単位〜約8.0pH単位である。このような組成物は、骨折、骨の裂け目、骨空隙、および脊椎固定術のために外科的に準備された椎間板隙を含むがそれらに限定されない様々な筋骨格の症状を治療するために有用であり、骨細片と脊椎固定術の過程で椎間板隙に挿入されるインプラントとの間の空間を満たすために、また、裂けるかまたは損傷した腱、裂けるかまたは損傷した靭帯、関節軟骨の軟骨欠損および関節軟骨の肋軟骨下欠損等のような損傷または欠失した軟骨のある領域を満たすために有用である。
【0041】
別の実施形態において、本発明による組成物および方法は、少なくとも一つのBMPと少なくとも一つの賦形剤との凍結乾燥混合物を調製することによって、凍結乾燥されたBMP混合物を水または生理食塩水を用いて復元することによって、そして、復元されたBMP溶液を椎間板に注入することによって、利用することができる。本実施形態において提供される組成物および方法は、椎間板を治療する際に特に有用である。
【0042】
〔発明の実施例〕
以下の実施例において、使用される実験方法は以下の通りである。
RP−HPLC純度研究のために、復元されたrhGDF−5試験試料を、10mM塩酸(HCl)を用いて0.1mg/mLの濃度に希釈し、Vydac218TP52カラム上で50℃、0.3mL/分の流速で逆相HPLCにかけた。rhGDF−5は、214nmでのUV検出を用いて、0.15%トリフルオロ酢酸中でアセトニトリル勾配を用いて溶出された。
【0043】
円偏光二色性(CD)研究のために、AVIVモデル60DS円偏光二色性分光偏光計上で円偏光二色性分光分析を行った。対応する賦形剤の走査を用いたベースライン擬似測定(baseline placebo runs)を、試料の走査から減算した。走査は平均残基重量(Mean Residue Weight)(115の値)を用いて正規化し、以下の等式に代入した。

=[0.1×M残基]/[濃度(mg/mL)×光路長]
【0044】

の値は、平均残基楕円率(mean residue ellipticities)を与えるために各々の波長で計算した。最後に、プログラムPROSECv.2.1(1987年にAVIVアソシエイツ(AVIV Associates)により著作権取得)を使用して、二次構造見積りが決定された。
【0045】
示差走査熱量測定(DSC)を、マイクロカル(MicroCal)VP−DSC機器上で行った。走査速度は60℃/時間であった。温度範囲は5〜100℃であった。機器ベースライン走査(擬似データ)を、試験試料熱走査から減算した。タンパク質濃度は0.33mg/mLであった。
【0046】
結晶化度判定(Crystallinity Assessment)のために偏光顕微鏡法(PLM)が使用された。相対湿度が1%の乾燥エアバッグ中で、微量の固体試料をバイアルから取り出した。固体試料はガラススライド上に広げられ、固体試料上に一滴のシリカオイルが滴下された。次に、ソニー製CCD−IRIS/RGBカラービデオカメラおよび偏光付属品が備えられたゼイス光学顕微鏡(Zeiss Optical Microscope)を用いて、スライドを検査した。画像を取り込むためにフラッシュバス(Flash Bus)FBGソフトウェアが使用された。
【0047】
rhGDF−5原体(bulk rhGDF-5)は、10mM塩酸中に3.8mg/mLの濃度で、−80℃の凍結形態でバイオファーム社(Biopharm)から入手した。凍結タンパク質原体は、調合物に使用する前に、2〜8℃で一晩かけて解凍した。
【0048】
実施例1:ヒーロス(登録商標)細片(非滅菌)とrhGDF−5(0.5mg/mL、5mL/細片)およびトレハロース50mg/mL。各々の細片は、2.5mgのrhGDF−5と250mgのトレハロースを有した。
【0049】
トレハロース溶液の調製:
25.48gのトレハロース二水和物が注意深く秤量され、滅菌ポリプロピレン瓶に移され、それに室温で350mLの純水が加えられ、透明な溶液が得られるまでゆっくりと撹拌された。透明な溶液に対して、pHを3.9に調整するために0.1規定の塩酸が一滴ずつ加えられ、次に、400mLの最終液量を得るために純水を用いて液量が調整された。pHが測定され、4.2であることが見出された。溶液は0.22ミクロンのフィルターを通して濾過され、タンパク質溶液を希釈するために直接使用された。
【0050】
rhGDF−5溶液のトレハロース溶液を用いた希釈:
22.39mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、そこに液量を150mLに調整するために注意深くトレハロース溶液が加えられた。pHが測定され、2.5であることが見出された。溶液は室温で15分間撹拌された。タンパク質濃度を正確に計算するために、UV吸光係数を得た。UVの示度に基づいて、さらにトレハロース溶液を加えて、170mLの溶液中に0.5mg/mLの望ましい濃度を得た。pHが測定され、2.7であることが見出された。UVの示度は0.499mg/mLのタンパク質含有量を示した。
【0051】
rhGDF−5/トレハロース溶液は、0.22ミクロンのフィルターを通して濾過され、ヒーロス(登録商標)細片上に分注するために直接使用された。滅菌ピペットを使用して、各々の細片についてrhGDF−5/トレハロース溶液の合計が5mLになるように、細片上の2点に2.5mLのrhGDF−5/トレハロース溶液が同様に分注された。細片は小さな2cm×5cmのPETGトレイに挿入され、小さなトレイは大きなPETGトレイに挿入され、凍結乾燥された。各々の大きなトレイは24の細片を収容する。
【0052】
表1a:表1a:25℃における、細片あたりトレハロース(250mg)およびrhGDF−5(2.5mg)を用いたヒーロス(登録商標)の安定性(実施例1)
【表1】

【0053】
表1b:2〜8℃における、細片あたりトレハロース(250mg)およびrhGDF−5(2.5mg)を用いたヒーロス(登録商標)の安定性(実施例1)
【表2】

【0054】
実施例2:ヒーロス(登録商標)細片(非滅菌)とrhGDF−5(0.5mg/mL、5mL/細片)およびマンニトール50mg/mL。各々の細片は、2.5mgのrhGDF−5と250mgのマンニトールを有した。
【0055】
マンニトール溶液の調製:
23.03gのマンニトールが注意深く秤量され、滅菌ポリプロピレン瓶に移され、それに室温で350mLの純水が加えられ、透明な溶液が得られるまでゆっくりと撹拌された。pHが測定され、7.2であることが見出された。pHを3.8に調整するために0.1規定の塩酸が一滴ずつ加えられ、次に、400mLの最終液量を得るために純水を用いて液量が調整された。pHが測定され、3.9であることが見出された。溶液は0.22ミクロンのフィルターを通して濾過され、タンパク質溶液を希釈するために直接使用された。
【0056】
rhGDF−5溶液のマンニトール溶液を用いた希釈:
22.37mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、そこに液量を150mLに調整するために注意深くマンニトール溶液が加えられた。pHが測定され、2.7であることが見出された。溶液は室温で15分間撹拌された。正確なタンパク質濃度を計算するために、UV吸光係数が取得された。UVの示度に基づいて、170mLの溶液中に0.5mg/mLの望ましい濃度を得るためにさらにマンニトール溶液が加えられた。pHが測定され、2.8であることが見出された。UVの示度は0.493mg/mLのタンパク質含有量を示した。
【0057】
rhGDF−5/マンニトール溶液は、0.22ミクロンのフィルターを通して濾過され、ヒーロス(登録商標)細片上に分注するために直接使用された。滅菌ピペットを使用して、各々の細片につきrhGDF−5/マンニトール溶液の合計が5mLになるように、2.5mLのrhGDF−5/マンニトール溶液が細片上の2点に同様に分注された。細片は小さな2cm×5cmのPETGトレイに挿入され、小さなトレイは大きなPETGトレイに挿入され、凍結乾燥された。各々の大きなトレイは24の細片を収容する。
【0058】
表2a:25℃における、細片あたりマンニトール(250mg)およびrhGDF−5(2.5mg)を用いたヒーロス(登録商標)の安定性(実施例2)
【表3】

【0059】
表2b:2〜8℃における、細片あたりマンニトール(250mg)およびrhGDF−5(2.5mg)を用いたヒーロス(登録商標)の安定性(実施例2)
【表4】

【0060】
実施例3:ヒーロス(登録商標)細片(滅菌)とrhGDF−5(0.5mg/mL、5mL/細片)およびトレハロース100mg/mL。各々の細片は、2.5mgのrhGDF−5と500mgのトレハロースを有した。
【0061】
トレハロース溶液の調製:
25.49gのトレハロース二水和物が注意深く秤量され、滅菌ポリプロピレン瓶に移され、そこに室温で190mLの純水が加えられ、透明な溶液が得られるまでゆっくりと撹拌された。透明なトレハロース溶液のpHが測定され、6.2であることが見出された。pHを調整するためにトレハロース溶液に塩酸は加えられなかった。200mLの最終液量を得るために、純水を用いて液量が調整された。pHが測定され、6.3であることが見出された。溶液は、タンパク質溶液を希釈するために直接使用された。
【0062】
rhGDF−5溶液のトレハロース溶液を用いた希釈:
23.03mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、そこに液量を170mLに調整するために注意深くトレハロース溶液が加えられた。pHが測定され、3.0であることが見出された。溶液は室温で15分間撹拌された。タンパク質濃度を正確に計算するために、UV吸光係数が取得された。UVの示度に基づいて、さらにトレハロース溶液が加えられ、175mLの溶液中に0.5mg/mLの望ましい濃度を得られた。pHが測定され、3.0であることが見出された。UVの示度は0.518mg/mLのタンパク質濃度を示した。
【0063】
rhGDF−5/トレハロース溶液は、0.22ミクロンのフィルターを通して濾過され、滅菌ヒーロス(登録商標)細片上に分注するために直接使用された。滅菌ピペットを使用して、各々の細片について、rhGDF−5/トレハロース溶液の合計が5mLになるように、細片上の2点に2.5mLのrhGDF−5/トレハロース溶液が同様に分注された。細片はスチールトレイに置かれ、トレイは注意深く滅菌二重パウチに封入され、滅菌条件下での凍結乾燥のために移された。
【0064】
表3a:2〜8℃における、細片あたりトレハロース(500mg)/rhGDF−5(2.5mg)を用いたヒーロス(登録商標)の安定性(実施例3)
【表5】

【0065】
実施例4:ヒーロス(登録商標)細片(滅菌)と低用量rhGDF−5(5mL/細片、0.5mg/mL)、トレハロース40mg/mL、およびグリシン10mg/mL。各々の細片は、2.5mgのrhGDF−5、200mgのトレハロースおよび50mgのグリシンを有した。
【0066】
トレハロース/グリシン溶液の調製:
17.84gのトレハロース二水和物および4.03gのグリシンが注意深く秤量され、滅菌ポリプロピレン瓶に移され、それに室温で300mLの純水が加えられ、透明な溶液が得られるまでゆっくりと撹拌された。pHが測定され、5.5であることが見出された。どのような酸も加えること無く、液量は純水を用いて350mLに調整された。pHが測定され、5.5であることが見出された。
【0067】
rhGDF−5溶液のトレハロース/グリシン溶液を用いた希釈:
39.47mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、それに液量を295mLに調整するために注意深くトレハロース/グリシン溶液が加えられた。pHが測定され、4.1であることが見出された。溶液は室温で15分間撹拌された。タンパク質濃度を正確に計算するために、UV吸光係数が取得された。UVの示度に基づいてトレハロース溶液が加えられ、300mLの溶液中に0.5mg/mLの望ましい濃度を得た。pHが測定され、4.1であることが見出された。UVの示度は0.507mg/mLのタンパク質濃度を示した。
【0068】
溶液は0.22ミクロンのフィルターを通して濾過され、滅菌ヒーロス(登録商標)細片上に分注するために直接使用された。滅菌ピペットを使用して、各々の細片についてrhGDF−5溶液の合計が5mLになるように、細片上の2点に2.5mLのrhGDF−5/トレハロース/グリシン溶液が同様に分注された。細片はスチールトレイに置かれ、トレイは注意深く滅菌二重パウチに封入され、滅菌条件下での凍結乾燥のために移された。
【0069】
表4a:2〜8℃における、細片あたりトレハロース(200mg)/rhGDF−5(2.5mg)/グリシン(50mg)を用いたヒーロス(登録商標)の安定性(実施例4)
【表6】

【0070】
表4b:25℃における、細片あたりトレハロース(200mg)/rhGDF−5(2.5mg)/グリシン(50mg)を用いたヒーロス(登録商標)の安定性(実施例4)
【表7】

【0071】
実施例5:ヒーロス(登録商標)細片(滅菌)とrhGDF−5(0.5mg/mL、2.5mg/細片)、トレハロース40mg/mL、グリシン10mg/mL、およびポリソルベート0.1mg/mL。各々の細片は、2.5mgのrhGDF−5、200mgのトレハロース、50mgのグリシン、および0.5mgのポリソルベート80を有した。
【0072】
ポリソルベート80溶液の調製:
23.03mgのポリソルベート80が50mLの滅菌使い捨てチューブの中に秤量され、それに25mLの純水が加えられ、均一な溶液を得るために2分間振り混ぜられた。
【0073】
トレハロース/グリシン/ポリソルベート溶液の調製:
10.19gのトレハロース二水和物、および2.303gのグリシンが注意深く秤量され、滅菌ポリプロピレン瓶に移され、それに25mLの上記のポリソルベート80溶液が加えられた。ポリソルベートのチューブは、25mLの純水で2回ゆすがれ、ゆすぎ液はトレハロース/グリシン/ポリソルベート溶液に移された。合計液量を190mLにするために追加量の純水がトレハロース/グリシン/ポリソルベート溶液に加えられた。溶液は透明な溶液を得るために2分間撹拌された。溶液のpHが測定され、5.6であることが見出された。液量は純水を用いて200mLに調整された。pHが測定され、5.5であることが見出された。
【0074】
rhGDF−5溶液のトレハロース/グリシン/ポリソルベート溶液を用いた希釈:
23.03mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、それに液量を170mLに調整するために注意深くトレハロース/グリシン/ポリソルベート溶液が加えられた。pHが測定され、4.1であることが見出された。溶液は室温で15分間撹拌された。タンパク質濃度を正確に計算するために、UV吸光係数が取得された。UVの示度に基づいてさらにトレハロース/グリシン/ポリソルベート溶液が加えられ、175mLの溶液中に0.5mg/mLの望ましい濃度を得た。pHが測定され、4.1であることが見出された。UVの示度は0.510mg/mLのタンパク質濃度を示した。
【0075】
溶液は0.22ミクロンのフィルターを通して濾過され、層流フード(laminar flow hood)中の無菌条件下で滅菌ヒーロス(登録商標)細片上に分注するために直接使用された。滅菌ピペットを使用して、各々の細片についてrhGDF−5/トレハロース/グリシン/ポリソルベート溶液の合計が5mLになるように、細片上の2点に2.5mLのrhGDF−5/トレハロース/グリシン/ポリソルベート溶液が同様に分注された。細片はスチールトレイに置かれ、トレイは注意深く滅菌二重パウチに封入され、滅菌条件下での凍結乾燥のために移された。
【0076】
表5a:2〜8℃における、細片あたりトレハロース(200mg)/rhGDF−5(2.5mg)/グリシン(50mg)/ポリソルベート80(0.5mg)を用いたヒーロス(登録商標)の安定性(実施例4)
【表8】

【0077】
実施例6:rhGDF−5(0.5mg/mL)にトレハロース(50mg/mL)を加えた凍結乾燥されたバイアル生成物
トレハロース溶液の調製:
滅菌ポリプロピレン瓶に12.16gのトレハロース二水和物および磁気撹拌子が入れられ、それに室温で190mLの純水が加えられた。溶液は、トレハロースが完全に溶解されるまで室温で撹拌された。pHが測定され、6.5であることが見出された。透明なトレハロース溶液に対して、pHを5.8に調整するために0.1規定の塩酸が一滴ずつ加えられた。液量は純水で200mLに調整され、pHが測定され、5.5であることが見出された。溶液は0.22ミクロンのフィルターを通して濾過され、タンパク質溶液を希釈するために直接使用された。
【0078】
rhGDF−5溶液のトレハロース溶液を用いた希釈:
14.47mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、そこに最終液量を100mLにするために、瓶を旋回しながらトレハロース溶液がゆっくりと加えられた。溶液は、室温で15分間、時折旋回された。pHが測定され、3.0であることが見出された。UVの示度に基づいてさらにトレハロース溶液が加えられ、110mLの溶液中に0.5mg/mLの望ましい濃度を得た。pHが測定され、3.1であることが見出された。UVの示度は0.510mg/mLのタンパク質濃度を示した。溶液は0.22ミクロンのフィルターを通して濾過され、バイアルに分注するために直接使用された。
【0079】
バイアルへの充填:1.1mLのrhGDF−5/トレハロース溶液が、5mLのタイプ1フリントガラスバイアルに手動で分注され、凍結乾燥機への装填に先立って各々のバイアルはストッパーで部分的に閉じられた。凍結乾燥後、ストッパーは押し込まれ、圧着された。生成物は白色から灰白色のケーク(cake)として得られた。
【0080】
表6a:2〜8℃における、rhGDF−5(0.5mg/mL)にトレハロース(50mg/mL)を加えたバイアルの安定性(実施例6)
【表9】

【0081】
表6b:25℃における、rhGDF−5(0.5mg/mL)にトレハロース(50mg/mL)を加えたバイアルの安定性(実施例6)
【表10】

【0082】
実施例7:rhGDF−5(0.5mg/mL)にマンニトール(50mg/mL)を加えた凍結乾燥されたバイアル生成物
マンニトール溶液の調製:
滅菌ポリプロピレン瓶に11.52gのマンニトールおよび磁気撹拌子が入れられ、それに室温で185mLの純水が加えられた。混合液は、マンニトールが完全に溶解されるまで室温で10分間撹拌された。pHが測定され、6.6であることが見出された。透明な溶液に対して、pHを5.5に調整するために0.1規定の塩酸が一滴ずつ加えられた。液量は純水で200mLに調整され、pHが測定され、5.7であることが見出された。溶液は0.22ミクロンのフィルターを通して濾過され、タンパク質溶液を希釈するために直接使用された。
【0083】
rhGDF−5溶液のマンニトール溶液を用いた希釈:
ポリプロピレンフラスコに14.48mLのrhGDF−5溶液が注意深く移され、そこに液量が100mLになるまでマンニトール溶液が注意深く加えられた。溶液は室温で15分間撹拌された。タンパク質濃度を正確に計算するために、UV吸光係数が取得された。UVの示度に基づいてさらにマンニトール溶液が加えられ、110mLの溶液中に0.5mg/mLの望ましいタンパク質濃度を得た。pHが測定され、3.1であることが見出された。UVの示度は0.498mg/mLのタンパク質濃度を示した。溶液は0.22ミクロンのフィルターを通して濾過され、バイアルに分注するために直接使用された。
【0084】
バイアルへの充填:1.1mLのマンニトール/rhGDF−5溶液が、5mLのタイプ1フリントガラスバイアルに手動で分注され、凍結乾燥機への装填に先立って各々のバイアルはストッパーで部分的に閉じられた。凍結乾燥後、ストッパーは押し込まれ、圧着された。生成物は白色から灰白色のケークとして得られた。
【0085】
表7a:2〜8℃における、rhGDF−5(0.5mg/mL)にマンニトール(50mg/mL)を加えたバイアルの安定性(実施例7)
【表11】

【0086】
表7b:25℃における、rhGDF−5(0.5mg/mL)にマンニトール(50mg/mL)を加えたバイアルの安定性(実施例7)
【表12】

【0087】
実施例8:グリシン−塩酸pH3.0緩衝液中でrhGDF−5(0.5mg/mL)にトレハロース(50mg/mL)を加えた凍結乾燥されたバイアル生成物
トレハロース溶液の調製:
滅菌ポリプロピレン瓶に12.16gのトレハロース二水和物および磁気撹拌子が入れられ、それに室温で200mLの5mMグリシン−塩酸緩衝液pH3.0が加えられた。溶液は、トレハロースが完全に溶解されるまで室温で撹拌された。トレハロース/グリシン溶液のpHは、3.1であった。溶液は0.22ミクロンのフィルターを通して濾過され、タンパク質溶液を希釈するために直接使用された。
【0088】
rhGDF−5溶液のトレハロース溶液を用いた希釈:
rhGDF−5原体の溶液が、分子量3000のカットオフの膜を用いて、2〜8℃で一晩、5mMグリシン−塩酸緩衝液に対して透析された。透析後、溶液は3.8mg/mLにわずかに濃縮された。14.47mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、そこに最終液量を100mLにするために、瓶を旋回しながらトレハロース−グリシン溶液がゆっくりと加えられた。溶液は、室温で15分間、時折旋回された。pHが測定され、3.0であることが見出された。UVの示度に基づいてさらにトレハロース−グリシン溶液が加えられ、110mLの溶液中に0.5mg/mLの望ましいタンパク質濃度を得た。pHが測定され、3.0であることが見出された。UVの示度は0.507mg/mLのタンパク質濃度を示した。溶液は0.22ミクロンのフィルターを通して濾過され、バイアルに分注するために直接使用された。
【0089】
バイアルへの充填:1.1mLのrhGDF−5/トレハロース溶液が、5mLのタイプ1フリントガラスバイアルに手動で分注され、凍結乾燥機への装填に先立って各々のバイアルはストッパーで部分的に閉じられた。凍結乾燥後、ストッパーは押し込まれ、圧着された。生成物は白色から灰白色のケークとして得られた。
【0090】
表8:グリシン−塩酸緩衝液pH3.0中でrhGDF−5(0.5mg/mL)にトレハロース(50mg/mL)を加えたバイアルの安定性(実施例8)
【表13】

【0091】
実施例9:pH3.0のリン酸緩衝液中でrhGDF−5(0.5mg/mL)にトレハロース(50mg/mL)を加えた凍結乾燥されたバイアル生成物
トレハロース溶液の調製:
滅菌ポリプロピレン瓶に12.16gのトレハロース二水和物および磁気撹拌子が入れられ、それに室温で200mLの5mMリン酸緩衝液pH3.0が加えられた。溶液は、トレハロースが完全に溶解されるまで室温で撹拌された。トレハロース/リン酸緩衝溶液のpHは、3.0であった。溶液は0.22ミクロンのフィルターを通して濾過され、タンパク質溶液を希釈するために直接使用された。
【0092】
rhGDF−5溶液のトレハロース溶液を用いた希釈:
rhGDF−5原体の溶液が、分子量3000のカットオフの膜を用いて、2〜8℃で一晩、リン酸緩衝液に対して透析された。透析後、溶液は3.8mg/mLにわずかに濃縮された。14.47mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、そこに最終液量を100mLにするために、瓶を旋回しながらトレハロース/リン酸緩衝溶液がゆっくりと加えられた。溶液は、室温で15分間、時折旋回された。pHが測定され、3.0であることが見出された。UVの示度に基づいてトレハロース/リン酸緩衝溶液が加えられ、110mLの溶液中に0.5mg/mLの望ましいタンパク質濃度を得た。pHが測定され、3.0であることが見出された。UVの示度は0.50mg/mLのタンパク質濃度を示した。溶液は0.22ミクロンのフィルターを通して濾過され、バイアルに分注するために直接使用された。
【0093】
バイアルへの充填:1.1mLのrhGDF−5/トレハロース溶液が、5mLのタイプ1フリントガラスバイアルに手動で分注され、凍結乾燥機への装填に先立って各々のバイアルはストッパーで部分的に閉じられた。凍結乾燥後、ストッパーは押し込まれ、圧着された。生成物は白色から灰白色のケークとして得られた。
【0094】
表9:pH3.0のリン酸緩衝液中でrhGDF−5(0.5mg/mL)にトレハロース(50mg/mL)を加えたバイアルの安定性(実施例9)
【表14】

【0095】
実施例10:細分化されたコラーゲン円柱と2.5mgのrhGDF−5および250mgのトレハロース
トレハロース溶液の調製:
9.56gのトレハロース二水和物が注意深く秤量され、滅菌ポリプロピレン瓶に移され、そこに室温で145mLの純水が加えられ、透明な溶液が得られるまでゆっくりと撹拌された。透明なトレハロース溶液のpHが測定され、5.3であることが見出された。150mLの最終液量をえるために、純水を用いて液量が調整された。溶液のpHが測定され、5.3であることが見出された。溶液は、タンパク質溶液を希釈するために直接使用された。
【0096】
rhGDF−5溶液のトレハロース溶液を用いた希釈:
16.45mLのrhGDF−5溶液が注意深くポリプロピレンフラスコに移され、それに、液量を120mLに調整するために、トレハロース溶液が注意深く加えられた。pHが測定され、2.9であることが見出された。溶液は、室温で15分間撹拌された。タンパク質濃度を正確に計算するために、UV吸光係数が取得された。UVの示度に基づいて、さらにトレハロース溶液が加えられ、125mLの溶液中に0.5mg/mLの望ましいタンパク質濃度を得た。pHが測定され、2.9であることが見出された。UVの示度は0.498mg/mLのタンパク質濃度を示した。
【0097】
rhGDF−5/トレハロース溶液の細分化されたコラーゲン円柱への投与
溶液は0.22ミクロンのフィルターを通して濾過され、溶液は、テフロン型中に詰められた、事前に形成された細分化されたコラーゲン円柱上に分注するために直接使用された。各々の円柱には、凍結乾燥に先立って5mLのrhGDF−5/トレハロース溶液が投与された。
【0098】
表10:2〜8℃における、円柱あたりrhGDF−5(2.5mg)およびトレハロース(250mg)を用いた細分化されたコラーゲン円柱の安定性(実施例10)
【表15】

【0099】
下記の表11中のデータは、2〜8℃の試料のRP−HPLC試験には遅い溶出ピークが存在するが、−20℃の試料には存在しないことにより実証されているように、賦形剤を含まずにヒーロス(登録商標)上に分注され凍結乾燥されたrhGDF−5は、−20℃では安定だが、2〜8℃では安定でないことを示す。
【0100】
表11:2〜8℃および−20℃における、賦形剤を含まない5mLのrhGDF−5(0.5mg/mL)を用いたヒーロス(登録商標)細片の安定性
【表16】

【0101】
賦形剤および可溶性コラーゲンゲルを用いて流動性の細分化されたコラーゲン/rhGDF−5を作成する異なった実施例が開発され、各々の実施例の性能、安定性および製造の容易さに関して評価された。
【0102】
細分化されたコラーゲン実施例1:
−細分化されたコラーゲン円柱とrhGDF−5が乾燥形態に凍結乾燥される
−湿潤形態のコラーゲンゲルは分離しておかれる
−双方は2〜8℃で別々の注入器中に分離しておかれる
−双方は注入に先立って混合される
【0103】
細分化されたコラーゲン実施例2:
−細分化されたコラーゲン円柱とrhGDF−5とコラーゲンゲルとが湿潤形態で混合される(凍結乾燥されない)
−全てが2〜8℃で一本の注入器中に湿潤形態でおかれ、使用可能な状態
【0104】
細分化されたコラーゲン実施例3:
−細分化されたコラーゲン円柱とrhGDF−5とコラーゲンゲルとが乾燥形態で凍結乾燥される
−全てが2〜8℃で一本の注入器中に乾燥形態で入れられる
−注入に先立って水で再水和する
【0105】
細分化されたコラーゲン実施例4:
−細分化されたコラーゲン円柱とコラーゲンゲルは共にペースト状
−rhGDF−5は乾燥形態で分離しておかれる
−双方は2〜8℃で別々の注入器中に分離しておかれる
−双方は注入に先立って混合される
【0106】
細分化されたコラーゲン実施例5:
−細分化されたコラーゲン円柱とコラーゲンゲルは共に乾燥形態
−rhGDF−5は乾燥形態で分離しておかれる
−双方は2〜8℃で別々の注入器中に分離しておかれる
−rhGDF−5を滅菌水または骨髄穿刺液を用いて復元する
−注入に先立って、乾燥した細分化されたコラーゲンおよびコラーゲンは、復元されたrhGDF−5溶液と混合される
【0107】
緩衝剤および抗酸化剤の存在および非存在下で、マンニトール、スクロースおよびトレハロース等のいくつかの賦形剤を用いて、rhGDF−5の安定性が、RP−HPLC、示差走査熱量測定(DSC)、円偏光二色性分光分析(CD)、偏光顕微鏡法(PLM)、および生物学的検定の技術を使用して評価された。スクロースを含有する幾つかの凍結乾燥されたrhGDF−5の調合物は、保存の過程で望ましくない黄色およびガラス状ケーク構造を発生させたため、有望ではなかった。
【0108】
凍結乾燥されたrhGDF−5の調合物の融解挙動が、DSCを使用して研究された。DSCデータは、トレハロースおよびマンニトールに基づく調合物のどちらも、rhGDF−5原体の熱安定性を大幅に改善することを示した。
【0109】
図1、図2および図3は、rhGDF−5のトレハロース調合物およびマンニトール調合物のDSCプロファイルの比較を、rhGDF−5原体のDSCプロファイルと比較して示す。rhGDF−5原体は、2つの主要な転移を示し、一つは40℃近傍であり、もう一つは85℃近傍である。高温の転移はおそらくタンパク質の熱変性を表わしている。最初の吸熱転移の融解温度(Tm)が賦形剤の存在下で7〜14℃増加していることは、興味深いことである。この点のみで考えた場合、この研究は、トレハロースおよびマンニトールの双方とも安定化剤として同様に効果的である可能性があることを示唆する。
【0110】
トレハロース/rhGDF−5調合物のPLM(偏光顕微鏡法)は、図4に示されている。試料は主立った複屈折現象を示さない。したがって、系は非晶質であり、これは治療的応用に理想的である。図5は、保存期間の後のマンニトール/rhGDF−5調合物のPLMを示す。試料中には多くの結晶が観察され、保存の過程でマンニトールが結晶化したことを示している。この結果は、トレハロースがrhGDF−5に対するより良い溶解保護剤であることを示唆する。遠紫外CDスペクトルは、トレハロースに基づく調合物が、天然タンパク質原体の二次構造分布に相当する二次構造分布を有することを明らかにした。
【0111】
様々な賦形剤と共に凍結乾燥されたrhGDF−5のPR−HPLCによるリアルタイムの安定性研究は、トレハロース存在下のrhGDF−5が、50mg/mLまたは100mg/mLの何れの濃度でも、緩衝剤が有っても無くても、また、ポリソルベートが有っても無くても、2〜8℃および15〜25℃の保存条件で一貫してrhGDF−5に改善された安定性を与えたことを明瞭に示した一方で、マンニトールは類似の保存条件下で同等のレベルの安定性を提供することができなかった。
【0112】
凍結乾燥されたケーク調合物のリアルタイム安定性研究は、室温および2〜8℃の保存条件で、主ピークが大幅に減少する一方で凝集ピークが増加することによって証明されるように、マンニトールはタンパク質を安定化しないことを明瞭に示した。凝集物は、免疫反応および副作用を引き起こす可能性があるため、タンパク質調合物の中で最も望ましくない種である。対照的に、トレハロースは、リアルタイム安定性研究に証明されるように、特に2〜8℃の保存条件で、凝集物の形成を阻害して主ピークを保護することによって、タンパク質を非常に良く安定化した。したがって、トレハロースは、調合物中でrhGDF−5を安定化することにおいてマンニトールよりも優れている。また、リアルタイム安定性データは、pHを制御するための緩衝剤としてリン酸またはグリシンを有するrhGDF−5/トレハロース調合物が、緩衝剤を含まないrhGDF−5/トレハロース調合物よりもさらに優れていることを示す。リアルタイム安定性データは、rhGDF−5/トレハロース/グリシン調合物の理想的な保存は2〜8℃であり、また、25℃での保存も適切であることを示す。
【0113】
トレハロースに基づくrhGDF−5調合物の好ましい生化学的および生物物理的データに加えて、これらの調合物はまた、アルカリフォスファターゼの生物学的分析においても有効性を示した。分析の物理的化学的方法、生体外分析、およびリアルタイム安定性データは、様々な筋骨格疾病の治療における使用に対して、コラーゲンに基づいた組み合わせ生成物と同様に、凍結乾燥された単体生成物(stand-alone product)においてもrhGDF−5の安定化におけるトレハロースの優れた賦形剤としての見込みを示す。
【0114】
実施例11:異なったイオン強度の溶液および2つのpH緩衝液(pH3およびpH4)中のrhGDF−5の溶解度
この研究においては、様々なイオン強度のリン酸ナトリウム緩衝溶液が使用された。タンパク質原体の溶液は、およそ10mg/mLに濃縮され、pH3またはpH4の、5、10、25、50および100mMのリン酸緩衝液を用いて透析された。透析後、試料は透明性を点検され、UV−Vis分光光度計上でタンパク質濃度が分析された。詳細な手順は下記に記載されている。
【0115】
緩衝液の調製
pH3の100mMリン酸緩衝液:
13.5mLの濃縮H3PO4(14.8M)溶液が2000mLビーカーに移され、それに、1900mLの目盛りまで脱イオン水が加えられた。溶液は、NaOH溶液でpH3に滴定され、2000mLのメスシリンダーに移された。2000mLにするために追加の水が加えられた。内容物はビーカーに再び移され、十分に混合された。
【0116】
pH3の50mMリン酸緩衝液:
6.76mLの濃縮H3PO4(14.8M)溶液が2000mLビーカーに移され、それに、1900mLの目盛りまで脱イオン水が加えられた。溶液は、NaOH溶液でpH3に滴定され、2000mLのメスシリンダーに移された。2000mLにするために追加の水が加えられた。内容物はビーカーに再び移され、十分に混合された。
【0117】
pH3の25mMリン酸緩衝液:
3.39mLの濃縮H3PO4(14.8M)溶液が2000mLビーカーに移され、続いて1900mLの目盛りまで脱イオン水が加えられた。溶液はNaOH溶液でpH3に滴定され、2000mLのメスシリンダーに移された。2000mLにするために追加の水が加えられた。内容物はビーカーに再び移され、十分に混合された。
【0118】
pH3の10mMリン酸緩衝液:
1.35mLの濃縮H3PO4(14.8M)溶液が2000mLビーカーに移され、それに、1900mLの目盛りまで脱イオン水が加えられた。溶液はNaOH溶液でpH3に滴定され、2000mLのメスシリンダーに移された。2000mLにするために追加の水が加えられた。内容物はビーカーに再び移され、十分に混合された。
【0119】
pH3の5mMリン酸緩衝液:
0.676mLの濃縮H3PO4(14.8M)が2000mLビーカーに移され、続いて1900mLの目盛りまで脱イオン水が加えられた。溶液はNaOH溶液でpH3に滴定され、2000mLのメスシリンダーに移された。2000mLにするために追加の水が加えられた。内容物はビーカーに再び移され、十分に混合された。
【0120】
試料調製
タンパク質原体rhGDF−5(ロット番号2142131)が2〜8℃で解凍された。タンパク質原体溶液(3.8mg/mLで24mL)が、遠心濾過装置(ポールライフサイエンス社(Pall Life Science)、カタログ番号OD010C37、分画分子量10K(10K MWCO))を使用して、およそ6mLの液量まで濃縮された。およそ0.9mLの濃縮されたrhGDF−5溶液は、各々の透析カセット(ピアス社(Pierce)、カタログ番号66380)に移され、室温で一晩、リン酸緩衝液に対して透析された。濃縮されたrhGDF−5溶液は、注意深く透析カセットから取り除かれ、溶液の透明性を点検するために小さなガラスバイアルに入れられた。UV−Vis分光光度計上で、分析手法の項に記載されているように、タンパク質濃度が決定された。
【0121】
pH4における溶解度
pH4.0の緩衝液は、NaOH溶液をpH3の緩衝液にさらに加えることによって、pH3の緩衝液から調製された。タンパク質溶液は、室温で一晩、pH4の緩衝液に対して透析された。試料は溶液の透明度およびタンパク質濃度を分析された。
【0122】
分析手法
小さなガラスバイアル中の溶液試料は、透明度および粒子に関して点検された。試料バイアルは黒色背景に対して垂直の光を使用して検査された。試験試料の透明度は、対照として純水試料と比較された。各々の溶液試料のpHは、較正されたpHメーターを使用して直接測定された。
【0123】
結果
10mg/mLのrhGDF−5溶液の溶解度研究の結果は、5、10および25mMのリン酸ナトリウムのより低いイオン強度の緩衝液は、透明な溶液をもたらして良い溶解度を示す一方で、50および100mMのリン酸ナトリウムのより高いイオン強度の緩衝液は、白濁した溶液をもたらして低い溶解度を示すことを表した。pH4では、5および10mMのリン酸ナトリウム緩衝液は白濁した溶液をもたらし、低い溶解度を示した。25、50および100mMのリン酸ナトリウム緩衝液は、遠心後に透明な溶液をもたらしたが、タンパク質の回収量はほとんどゼロであり、タンパク質が沈殿したことを示した。したがって、pH3近傍の低イオン強度の緩衝液は、より高いpHのより高いイオン強度の緩衝液よりも好ましい。
【0124】
実施例12:5%トレハロースを含む様々な緩衝液中の様々な温度でのrhGDF−5の安定性
この研究では、凍結乾燥および5℃での保存の過程の5%トレハロース溶液中の0.7mg/mLのrhGDF−5の保護に対する様々な緩衝液の影響に関して試験された。試験された緩衝液は、5mMグリシン−塩酸pH3、5mMリン酸ナトリウムpH3、5mMクエン酸ナトリウムpH3、10mM乳酸ナトリウムpH3、0.01%TFA水溶液、1mM塩酸、および、トレハロースを含まない1mM塩酸中のrhGDF−5の対照溶液である。緩衝液は以下のように調製された。
【0125】
5mMグリシン緩衝液、pH3
2000mLビーカーに0.75gのグリシン(分子量75.05)および1900mLの脱イオン水が入れられ、溶液は撹拌しながら塩酸溶液でpH3に滴定された。2000mLにするために追加の水が加えられ、十分に混合された。
【0126】
5mMクエン酸緩衝液、pH3
2000mLビーカーに2.11gのクエン酸一水和物(分子量210.14)および1900mLの脱イオン水が入れられ、溶液は水酸化ナトリウム(NaCl)溶液でpH3に滴定された。2000mLにするために追加の水が加えられ、溶液は混合された。
【0127】
5mMリン酸緩衝液、pH3
0.676mLのリン酸溶液(14.8M)が1900mLの脱イオン水を含む2000mLビーカーに移され、溶液は水酸化ナトリウム溶液でpH3に滴定された。2000mLにするために追加の水が加えられ、溶液は十分に混合された。
【0128】
10mM乳酸緩衝液、pH3
2000mLサイズのビーカーに1.81gの乳酸(分子量90.08)および1900mLの脱イオン水が入れられ、得られた溶液は水酸化ナトリウム溶液でpH3に滴定された。2000mLにするために追加の水が加えられ、溶液は十分に混合された。
【0129】
1mM塩酸溶液
1mLの2規定塩酸溶液が1900mLの脱イオン水を含む2000mLビーカーに移された。溶液の最終液量は、さらに脱イオン水を加えることによって2000mLの目盛りに調整された。
【0130】
0.01%TFA溶液
0.2mLのTFA溶液が1900mLの脱イオン水を含む2000mLビーカーに移された。溶液の最終液量は、追加の水を加えることによって2000mLに調整され、溶液は十分に混合された。
【0131】
調合物の調製
タンパク質原体rhGDF−5(ロット番号2142131)が2〜8℃で解凍された。タンパク質原体溶液(3.8mg/mLで55mL)が、遠心濾過装置(ポールライフサイエンス社、カタログ番号OD010C37、分画分子量10K)を使用して、およそ10mLの液量まで濃縮された。およそ1.4mLの濃縮されたrhGDF−5溶液は、各々の透析カセット(ピアス社、カタログ番号66380)に移され、カセットは2〜8℃で一晩、試験緩衝液に対して透析された。
【0132】
rhGDF−5溶液は、注意深く透析カセットから取り除かれ、小さなガラス瓶に移された。UV−Vis分光光度計を使用して、溶液のタンパク質濃度が測定された。タンパク質は、およそ0.7mg/mLの割合で試験緩衝液中に5%(質量/体積)トレハロースと共に調合され、0.22μmのフィルターを通して濾過された。溶液は、凍結乾燥に先立って、2〜8℃で保存された。
【0133】
充填および凍結乾燥
各々の調合溶液は、3mLのガラスバイアル(ウエスト製薬サービス(West Pharmaceutical Services)、カタログ番号68000316)に、1mL/バイアルで充填された。バイアルはストッパー(ウエスト製薬サービス、カタログ番号99150630)で部分的に閉じられ、凍結乾燥機(FTSシステム社、LyoStar II)に移された。凍結乾燥過程をモニターするために、熱電対が偽バイアル内に置かれた。対照として、トレハロースを含まない別の調合物もまた試験された。4.5mg/mLのrhGDF−5を含む1mM塩酸溶液200μLが、各々のガラスバイアルに移され、凍結乾燥された。
【0134】
分析手法
凍結乾燥ケークの完全性
凍結乾燥された試料は、各々の時点で、凍結乾燥されたケークのひび割れ、収縮および崩壊について点検された。
【0135】
復元時間
1mLの脱イオン水が、各々の凍結乾燥された試料に加えられ、穏やかに混合された。復元時間が記録された。
【0136】
溶液の透明性−外観
小さなガラスバイアル中の溶液試料は、透明性および粒子に関して点検された。試料バイアルは、黒色背景に対して垂直の光を使用して検査された。試験試料の透明度は、対照として純水試料と比較された。
【0137】
pH方法
各々の溶液試料のpHは、較正されたpHメーターを使用して直接測定された。
【0138】
UV分光法
タンパク質濃度は、UV−Vis分光光度計を使用して決定された。rhGDF−5の濃度は、280nmにおける1.16mL/mg×cmの吸光係数を使用して計算された。
【0139】
HPLC法
非還元rpHPLC法(商標 0051 D)が、タンパク質の修飾された種をモニターするために使用された。試験試料は、50mM酢酸を用いておよそ0.1mg rhGDF−5/mLの溶液に希釈された。希釈された試料(各々が50μL)は、HPLCカラム(Vydac 218TP52、C18カラム)に注入された。試料は、0.15%(体積/体積)TFAを含む水および0.15%(体積/体積)TFAを含むアセトニトリルを移動相として、0.3mL/分で溶出された。溶出されたピークは214nmで検出された。各々のピーク面積の割合を計算して、主ピークおよび微小ピーク(分解ピーク)の変化をモニターした。
【0140】
サイズ排除クロマトグラフィー(SEC)
タンパク質の凝集物が、SEC法を使用してモニターされた。典型的には、各々の試験試料の30μLがSECカラム(TOSOHバイオサイエンス社(TOSOH Bioscience)、カタログ番号 08540)に直接注入され、0.1%(体積/体積)TFAおよび45%(体積/体積)アセトニトリルを含む水を用いて0.5mL/分の速度で溶出された。タンパク質のピークは280nmでモニターされ、凝集の割合が計算された。
【0141】
ゲル電気泳動
タンパク質の凝集物および分解された小片も、ゲル電気泳動法を使用してモニターされた。典型的には、およそ10μgのタンパク質が乾燥され、10%β−メルカプトエタノールを含むか、または含まない70μLのSDS−PAGE試料緩衝液(インビトロジェン社(Invitrogen)、カタログ番号LC2676)を用いて復元された。試料は95℃で5分間インキュベートされた。各々の試料のおよそ18μLがゲル(インビトロジェン社、カタログ番号NP0341Box)に供給された。ゲルは、ランニング緩衝液(インビトロジェン社、カタログ番号NP0002)を使用して、200ボルトで約35分間泳動された。ゲルは、次にSimplyblue溶液(インビトロジェン社、カタログ番号LC6060)を用いて染色され、脱イオン水を用いて脱色された。ゲルは、走査され、画像が収集された。
【0142】
生物活性分析
6ヶ月における安定性試料(グリシン調合物および塩酸調合物)だけが生物活性について分析された。細胞に基づいた分析(商標 0046)を使用し、試料の安定性を決定するためにアルカリフォスファターゼ活性を測定した。
【0143】
水分含有量
含水量分析が、カールフィッシャー滴定法を使用してPDDによって行われた。
【0144】
結果
凍結乾燥されたケークの完全性
全ての保存条件の試験試料ケークは、時間ゼロから9ヶ月の時点まで、固体および白から灰白色の外観を呈した。トレハロースまたはスクロース等の糖が充填剤として使用される際に通常観察されるように、ケークの周囲にわずかな収縮が観察されるか、あるいは、ケークはバイアルのガラス壁からわずかに離れていた。全ての試験試料でケークの崩壊は無かった。通常、ケークの崩壊は、復元時間を変化させ、タンパク質の不安定性につながる可能性がある。トレハロースの存在しない調合物では、白色で、ふわふわした軽いケークが得られた。
【0145】
復元時間
試験時には、1mLの水が各々の試料バイアルに加えられた。試料は穏やかに混合され、復元時間が記録された。ケークの溶解が完了するためには、およそ30秒〜40秒が必要とされた。
【0146】
溶液の透明性
復元された溶液試料は、黒色背景上で垂直の光の下で検査され、全ての試験試料は透明および無色であることが見出された。
【0147】
pH
復元された溶液のpHが、較正されたpHメーターを使用して測定された。研究の過程を通して、全ての調合物に渡って大幅なpH値の変化は無かった。トレハロース/緩衝剤を含む調合物試料のpHは、3.0±0.2付近であった。トレハロースを含まない調合物のpHは約4.0であった。
【0148】
UV分光法
タンパク質濃度は、UV−VIS分光光度計上で測定された。研究を通して、グリシン緩衝液、リン酸緩衝液、クエン酸緩衝液、乳酸緩衝液または0.01%TFAを含むrhGDF−5/トレハロース調合物のタンパク質濃度に大幅な変化は無かった。280nmでの吸光度は、25℃/60%および40℃/75%相対湿度で保存された場合、rhGDF−5/トレハロース/塩酸調合物において増加した。タンパク質の濃度は、40℃で保存された調合物で増加していたように見えた。時間ゼロでの0.7mg/mLの初期タンパク質濃度は、6ヶ月の時点で1mg/mLに増加した。これは、トレハロースが、280nmで類似の吸光度を有するフルフラール化合物に分解した可能性を意味すると思われる。
【0149】
非還元rhHPLCの結果
非還元rhHPLC法を使用して、メチオニンの酸化、脱アミド反応および他の反応によって形成されるrhGDF−5の分解種をモニターした。塩酸調合物およびトレハロースを含まない調合物を除いて、2〜8℃および25℃で9ヶ月間保存された全ての調合物について、主ピークの割合に大幅な変化は無かった。両調合物は、9ヶ月の時点で、主ピークは90%より少なかった。
【0150】
しかし、調合物が、40℃/75%相対湿度等の促進された保存条件で保存された場合、一つの調合物(すなわち、rhGDF−5/トレハロース/グリシン)だけが、6ヶ月の時点で主ピークは91%より多かった。促進された保存条件下では、他の調合物はrhGDF−5/トレハロース/グリシン調合物ほど安定ではなかった。特に、rhGDF−5/トレハロース/塩酸調合物は、6ヶ月の時点で主ピークは66%しかなかった。図6および図7は、40℃/75%相対湿度で6ヶ月保存された、rhGDF−5/トレハロース/グリシン調合物およびrhGDF−5/トレハロース/塩酸調合物のHPLCクロマトグラムを示す。図8、図9、および図10は、5℃、25℃、および40℃での保存を試験された様々な緩衝液のタンパク質回収割合(%)を示す。
【0151】
rpHPLC分析の結果は、トレハロースとグリシン緩衝液の組み合わせが、保存の過程で、凍結乾燥されたrhGDF−5に最良の安定性を提供することを示す。さらに、塩酸の強酸が、タンパク質およびトレハロース双方に対して不安定化の効果を有する可能性があるため、rhGDF−5/トレハロース/塩酸の調合物は、より不安定である。
【0152】
実施例13:5%トレハロースを含むpH3グリシン緩衝液中の様々な温度でのrhGDF−5の安定性
この研究では、rhGDF−5は、5%(質量/体積)トレハロースおよびpH3の5mMグリシン−塩酸緩衝液に、およそ0.01、0.03、0.1、2.5、4.5および9mg/mLで調合された。調合溶液を用いて、1mL/バイアルの割合で3mLガラスバイアルに充填され、バイアルは凍結乾燥された。凍結乾燥された試料バイアルは、2〜8℃、25℃/60%相対湿度、および、40℃/75%相対湿度で保存された。各々の設定された時点で、試料は、生成物の安定性について分析された。この研究で使用された方法は、ケーク外観、復元時間、溶液透明度、pH、rpHPLC(逆相高速液体クロマトグラフィー)、UV(紫外分光法)、SEC(サイズ排除クロマトグラフィー)およびゲル電気泳動を含む。3つの保存条件での6ヶ月の保存の後、下は0.1mg/mLから上は0.9mg/mLまでのタンパク質濃度で、調合物に大幅な変化は観察されなかったことが見出された。0.01および0.03mg/mL等の、タンパク質濃度が低すぎた場合、既存の方法は、微小な変化を検出するのに十分強力ではなかった。
【0153】
この研究の結果は、様々なタンパク質濃度で、トレハロースおよびグリシン−塩酸を含む凍結乾燥rhGDF−5調合物は、2〜8℃、25℃/60%相対湿度で少なくとも6ヶ月間安定であったことを示す。40℃/75%相対湿度の促進された保存条件で保存された生成物に、6ヶ月の時点で、rpHPLCプロファイルのわずかな変化が見られた。
【0154】
実施例14:5%トレハロースを含むpH3グリシン緩衝液中の様々な温度での異なった濃度のrhGDF−5の安定性
この研究では、rhGDF−5は、5%(質量/体積)トレハロースおよびpH3の5mMグリシン緩衝液に、0.01、0.03、0.1、2.5、4.5および9.0mg/mLのrhGDF−5濃度で調合された。さらに、比較のために、4.5mg/mLのrhGDF−5の一つの調合物が、10%(質量/体積)トレハロースおよび5mMグリシン緩衝液(pH3)を用いて調製された。調合溶液は次に、1mL/バイアルの割合で3mLガラスバイアルに充填され、凍結乾燥された。凍結乾燥された試料は、安定チャンバ(stability chamber)に保存された。
【0155】
5mMグリシン−塩酸緩衝液、pH3
3×0.75gのグリシン(分子量75.07)が、3個の2000mLビーカーに秤量され、およそ1900mLの脱イオン水が各々のビーカーに加えられた。溶液は、塩酸溶液を用いてpH3に滴定された。各々のビーカーに、2000mLの最終液量にするために追加の水が加えられ、十分に混合された。
【0156】
調合物調製
タンパク質原体rhGDF−5(ロット番号2142131)が2〜8℃で解凍された。タンパク質溶液(3.8mg/mLで96mL)が、4つの遠心濾過装置(ポールライフサイエンス社、カタログ番号OD010C37、分画分子量10K)を使用して、全てを含めた合計液量がおよそ24mLになるまで濃縮された。およそ3×8mLの濃縮されたrhGDF−5溶液は、3つの透析カセット(ピアス社、カタログ番号66380)に移され、2〜8℃で一晩、グリシン−塩酸緩衝液に対して透析された。
【0157】
rhGDF−5溶液は、透析カセットから小さなガラス瓶に移された。UV−Vis分光光度計を使用して、タンパク質濃度が測定された。タンパク質は、上に記載されたように、5%または10%(質量/体積)トレハロースおよび5mMグリシン緩衝液に、様々な濃度で調合された。調合溶液は、0.22μmのフィルターを用いて濾過され、凍結乾燥に先立って、2〜8℃で保存された。
【0158】
充填および凍結乾燥
各々の調合溶液は、3mLのガラスバイアル(ウエスト製薬サービス、カタログ番号68000316)に、1mL/バイアルの割合で充填された。ストッパー(ウエスト製薬サービス、カタログ番号99150630)が、バイアル上に部分的に置かれた。試料バイアルは、凍結乾燥機(FTSシステム社、LuoStar II)に移された。凍結乾燥過程の温度プロファイルをモニターするために、熱電対が偽バイアル内に置かれた。
【0159】
使用された分析方法は、実施例11および実施例12中で上記されたものと同様である。
【0160】
結果
凍結乾燥されたケークの完全性
全ての保存条件の試料ケークは、時間ゼロから6ヶ月の時点まで固体および白色の外観を呈した。ケークの周囲にわずかな収縮が観察されるか、または、ケークはバイアルのガラス壁からわずかに離れていた。これは、トレハロースまたはスクロース等の糖が充填剤として使用される場合にきわめてよく起こる。全ての試験試料でケークの崩壊は見られなかった。
【0161】
復元時間
試験時には、1mLの水が各々の試料バイアルに加えられた。バイアルは穏やかに混合され、復元時間が記録された。ケークが溶解するためには、およそ30秒〜40秒かかった。
【0162】
溶液の透明性
タンパク質溶液が黒色背景に対して垂直の光を用いて検査された場合、全ての復元試料は透明および無色の外観を呈した。
【0163】
pH
復元された溶液が、pHを測定するために使用された。研究の過程を通して、全ての試料に大幅なpHの変化は観察されなかった。調合物のpH値は、3.0〜3.3の範囲内であった。
【0164】
UV分光法
UV分光法を使用して、タンパク質濃度が測定された。UVスペクトルはまた、タンパク質の凝集に関する情報(ベースライン光散乱)も提供することができた。0.01〜0.1mg/mLのタンパク質濃度に対しては、10mmキュベットが使用された。2〜9mg/mLのタンパク質濃度に対しては、希釈せずまたは試料を破壊すること無く、1mmキュベットが使用された。安定性研究の過程を通じて、0.1〜9mg/mLの試料にタンパク質濃度の大幅な変化は観察されなかった。0.01および0.03mg/mLの低濃度試料に対しては、吸光度が低すぎたために、より変動が見られた。将来の研究として、低濃度試料のために、新たな試料調製方法が必要とされるべきである。
【0165】
非還元rhHPLCの結果
非還元rhHPLC法を用いて、メチオニンの酸化および脱アミド等のrhGDF−5の分解種をモニターした。2〜8℃、25℃および40℃で6ヶ月間の保存を通して全ての試料において、主ピークの割合の大幅な変化は観測されなかった。6ヶ月間保存された試料のrhGDF−5の主ピークは、依然として96%以上回収され、これは時間ゼロの試料から得られたデータに匹敵していた。0.01および0.03mg/mLの低濃度試料は、HPLC法によって分析することが困難であった。将来の研究のために新たな試料調製が必要とされるべきである。
【0166】
SEC
タンパク質の凝集をモニターするために、SECが使用された。6ヶ月の安定性研究を通して試験された全ての試料の凝集に、大幅な変化は見出されなかった。0.01および0.03mg/mLの低濃度試料は分析されなかった。
【0167】
ゲル電気泳動
タンパク質の凝集および分解種もゲル電気泳動法を使用してモニターされた。6ヶ月の保存を通して全ての試料に大幅な変化は見出されなかった。
【0168】
タンパク質の断片は、還元SDS−PAGEで発見されなかったことから、保存の過程でどの試料にも形成されなかった。
【0169】
水分含有量
試料の水分含有量は低く、0.19〜0.32%の範囲であった。タンパク質濃度と水分含有量との間には、相関または傾向は見られなかった。
【0170】
rpHPLCおよびSECクロマトグラフィーによって証明されるように、結果は、トレハロースおよびグリシン緩衝液存在下の凍結乾燥されたrhGDF−5生成物が、2〜8℃、25℃/60%相対湿度、および、40℃/75%相対湿度で少なくとも6ヶ月間安定であることを示す。タンパク質は、0.1〜9mg/mL(凍結乾燥前)の範囲の様々な濃度で、5%(質量/体積)トレハロース/5mMグリシン−塩酸緩衝液(pH3)を用いて調合することができ、凍結乾燥することができる。タンパク質が、0.01mg/mLおよび0.03mg/mL等の低濃度で調合された場合、既存の方法は変化を検出することにいくつかの限界を有する。
【0171】
本発明は、実例となる実施形態に関連して記載されてきた。本発明の範囲を逸脱すること無く上記の調合物にある種の変更が行われてよいため、上記の記載に含まれるか、または添付の図に示される全ての事柄は、限定的な意味ではなく実例として解釈されるべきであることが意図される。例えば、本発明の説明に役立つ実施形態の調合物は、BMPと共に使用されることに限定されず、あらゆる適切な生物系についての他の生体分子と共に使用できることを、当業者は認識するであろう。
【0172】
特許請求の範囲は、本明細書に記載される発明の包括的および特定的な特徴全て、ならびに、文言上その範囲にあると言ってよい発明の範疇についての主張の全てを網羅することを意図したものであることもまた理解されるべきである。
【0173】
〔実施の態様〕
(1)組成物において、
少なくとも一種のBMPと、
前記BMPを安定化するために十分な量のトレハロースと、
を含む、組成物。
(2)実施態様1に記載の組成物において、
約2.5〜約3.5のpHを有するグリシン緩衝溶液、
をさらに含む、組成物。
(3)実施態様1に記載の組成物において、
前記BMPが、rhGDF−5である、組成物。
(4)実施態様2に記載の組成物において、
前記BMPが、rhGDF−5である、組成物。
(5)BMPを安定化するための方法において、
a)少なくとも一種のBMPおよび前記BMPを安定化するために十分な量のトレハロースを含む組成物を提供することと、
b)前記混合物を凍結乾燥することと、
を含む、方法。
(6)実施態様5に記載の方法において、
約2.5〜約3.5のpHを有するグリシン緩衝溶液を加えること、
をさらに含む、方法。
(7)実施態様5または実施態様6に記載の方法において、
前記BMPが、rhGDF−5である、方法。
(8)哺乳動物に植え込むための装置において、
少なくとも一種の凍結乾燥BMPであって、実施態様5に記載の方法にしたがって凍結乾燥された、少なくとも一種の凍結乾燥BMP、
を含む、装置。
(9)実施態様8に記載の装置において、
生物分解性のコラーゲン基質、
をさらに含む、装置。
(10)実施態様8に記載の装置において、
前記BMPが、rhGDF−5である、装置。
(11)哺乳動物に植え込むための装置において、
少なくとも一種の凍結乾燥されたBMPであって、実施態様6に記載の方法にしたがって凍結乾燥された、少なくとも一種の凍結乾燥BMP、
を含む、装置。
(12)実施態様11に記載の装置において、
生物分解性のコラーゲン基質、
をさらに含む、装置。
(13)実施態様11に記載の装置において、
前記BMPが、rhGDF−5である、装置。
【図面の簡単な説明】
【0174】
【図1】図1は、実施例6に記載されている、rhGDF−5のトレハロース調合物のDSCプロファイルを示す。
【図2】図2は、実施例7に記載されている、rhGDF−5のマンニトール調合物のDSCプロファイルを示す。
【図3】図3は、rhGDF−5天然タンパク質のDSCプロファイルを示す。
【図4】図4は、実施例6に記載されている、rhGDF−5のトレハロース調合物の偏光顕微鏡検査を示す。
【図5】図5は、実施例7に記載されている、rhGDF−5のマンニトール調合物の偏光顕微鏡検査を示す。
【図6】図6は、実施例12に記載されている、40℃/75%相対湿度で6ヶ月後のrhGDF−5/トレハロース/グリシン調合物のrpHPLCプロファイルを示す。
【図7】図7は、実施例12に記載されている、40℃/75%相対湿度で6ヶ月後のrhGDF−5/トレハロース/塩酸調合物のrpHPLCのプロファイルを示す。
【図8】図8は、実施例12に記載されている、5℃で保存した場合の、試験された各種緩衝液の各種時点でのタンパク質回収率(%)を示す。
【図9】図9は、実施例12に記載されている、25℃で保存した場合の、試験された各種緩衝液の各種時点でのタンパク質回収率(%)を示す。
【図10】図10は、実施例12に記載されている、40℃で保存した場合の、試験された各種緩衝液の各種時点でのタンパク質回収率(%)を示す。
【図11】図11は、実施例14に記載されている、pH3グリシン緩衝液中、5%または10%トレハロースで凍結乾燥された、各種濃度のrhGDF−5の、選択された温度での安定性を示す。
【特許請求の範囲】
【請求項1】
組成物において、
少なくとも一種のBMPと、
前記BMPを安定化するために十分な量のトレハロースと、
を含む、組成物。
【請求項2】
請求項1に記載の組成物において、
約2.5〜約3.5のpHを有するグリシン緩衝溶液、
をさらに含む、組成物。
【請求項3】
請求項1に記載の組成物において、
前記BMPが、rhGDF−5である、組成物。
【請求項4】
請求項2に記載の組成物において、
前記BMPが、rhGDF−5である、組成物。
【請求項5】
BMPを安定化するための方法において、
a)少なくとも一種のBMPおよび前記BMPを安定化するために十分な量のトレハロースを含む組成物を提供することと、
b)前記混合物を凍結乾燥することと、
を含む、方法。
【請求項6】
請求項5に記載の方法において、
約2.5〜約3.5のpHを有するグリシン緩衝溶液を加えること、
をさらに含む、方法。
【請求項7】
請求項5または請求項6に記載の方法において、
前記BMPが、rhGDF−5である、方法。
【請求項8】
哺乳動物に植え込むための装置において、
少なくとも一種の凍結乾燥BMPであって、請求項5に記載の方法にしたがって凍結乾燥された、少なくとも一種の凍結乾燥BMP、
を含む、装置。
【請求項9】
請求項8に記載の装置において、
生物分解性のコラーゲン基質、
をさらに含む、装置。
【請求項10】
請求項8に記載の装置において、
前記BMPが、rhGDF−5である、装置。
【請求項11】
哺乳動物に植え込むための装置において、
少なくとも一種の凍結乾燥されたBMPであって、請求項6に記載の方法にしたがって凍結乾燥された、少なくとも一種の凍結乾燥BMP、
を含む、装置。
【請求項12】
請求項11に記載の装置において、
生物分解性のコラーゲン基質、
をさらに含む、装置。
【請求項13】
請求項11に記載の装置において、
前記BMPが、rhGDF−5である、装置。
【請求項1】
組成物において、
少なくとも一種のBMPと、
前記BMPを安定化するために十分な量のトレハロースと、
を含む、組成物。
【請求項2】
請求項1に記載の組成物において、
約2.5〜約3.5のpHを有するグリシン緩衝溶液、
をさらに含む、組成物。
【請求項3】
請求項1に記載の組成物において、
前記BMPが、rhGDF−5である、組成物。
【請求項4】
請求項2に記載の組成物において、
前記BMPが、rhGDF−5である、組成物。
【請求項5】
BMPを安定化するための方法において、
a)少なくとも一種のBMPおよび前記BMPを安定化するために十分な量のトレハロースを含む組成物を提供することと、
b)前記混合物を凍結乾燥することと、
を含む、方法。
【請求項6】
請求項5に記載の方法において、
約2.5〜約3.5のpHを有するグリシン緩衝溶液を加えること、
をさらに含む、方法。
【請求項7】
請求項5または請求項6に記載の方法において、
前記BMPが、rhGDF−5である、方法。
【請求項8】
哺乳動物に植え込むための装置において、
少なくとも一種の凍結乾燥BMPであって、請求項5に記載の方法にしたがって凍結乾燥された、少なくとも一種の凍結乾燥BMP、
を含む、装置。
【請求項9】
請求項8に記載の装置において、
生物分解性のコラーゲン基質、
をさらに含む、装置。
【請求項10】
請求項8に記載の装置において、
前記BMPが、rhGDF−5である、装置。
【請求項11】
哺乳動物に植え込むための装置において、
少なくとも一種の凍結乾燥されたBMPであって、請求項6に記載の方法にしたがって凍結乾燥された、少なくとも一種の凍結乾燥BMP、
を含む、装置。
【請求項12】
請求項11に記載の装置において、
生物分解性のコラーゲン基質、
をさらに含む、装置。
【請求項13】
請求項11に記載の装置において、
前記BMPが、rhGDF−5である、装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2008−231091(P2008−231091A)
【公開日】平成20年10月2日(2008.10.2)
【国際特許分類】
【外国語出願】
【出願番号】特願2007−322176(P2007−322176)
【出願日】平成19年12月13日(2007.12.13)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.テフロン
【出願人】(507324119)ジョンソン・アンド・ジョンソン・リジェネレイティブ・セラピューティックス・エルエルシー (4)
【氏名又は名称原語表記】Johnson & Johnson Regenerative Therapeutics, LLC
【住所又は居所原語表記】325 Paramount Drive, Raynham, MA 02767, United States of America
【Fターム(参考)】
【公開日】平成20年10月2日(2008.10.2)
【国際特許分類】
【出願番号】特願2007−322176(P2007−322176)
【出願日】平成19年12月13日(2007.12.13)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.テフロン
【出願人】(507324119)ジョンソン・アンド・ジョンソン・リジェネレイティブ・セラピューティックス・エルエルシー (4)
【氏名又は名称原語表記】Johnson & Johnson Regenerative Therapeutics, LLC
【住所又は居所原語表記】325 Paramount Drive, Raynham, MA 02767, United States of America
【Fターム(参考)】
[ Back to top ]

