タンパク質欠損性障害の治療のための併用療法
【課題】タンパク質補充療法を活性部位特異的シャペロン(ASSC)と組み合わせることによって、投与されるタンパク質の安定性及び有効性を高め、タンパク質補充療法を改善する方法の提供。更には、精製タンパク質とASSCとを含有する組成物、及びその組成物を投与することによって治療する方法の提供。
【解決手段】精製タンパク質が酵素であり、前記活性部位特異的シャペロンが前記酵素の可逆的競合阻害剤である方法。さらに、該可逆的競合阻害剤が、1−デオキシガラクトノジリマイシン、α−アロ−ホモノジリマイシン、α−ガラクト−ホモノジリマイシン、α−1−C−ブチル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、N−メチル−カリステジンA3及びN−メチル−カリステジンB2からなる群より選ばれる化合物である方法。
【解決手段】精製タンパク質が酵素であり、前記活性部位特異的シャペロンが前記酵素の可逆的競合阻害剤である方法。さらに、該可逆的競合阻害剤が、1−デオキシガラクトノジリマイシン、α−アロ−ホモノジリマイシン、α−ガラクト−ホモノジリマイシン、α−1−C−ブチル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、N−メチル−カリステジンA3及びN−メチル−カリステジンB2からなる群より選ばれる化合物である方法。
【発明の詳細な説明】
【発明の詳細な説明】
【0001】
(関連出願)
この出願は、2003年1月31日に出願された出願番号第60/444,136号の米国仮出願の優先権を主張するものであり、その開示内容はそのまま、レファレンスとして本明細書に包含される。
【技術分野】
【0002】
この出願は、タンパク質補充療法と活性部位特異的シャペロン(ASSC)とを併用することによって、投与されるタンパク質の安定性及び有効性を高め、タンパク質補充療法を改善する方法を提供する。本出願は更に、精製タンパク質とASSCとを含有する組成物を提供する。
【背景技術】
【0003】
〔タンパク質欠損症〕
タンパク質は、特定の遺伝子のゲノムヌクレオチド配列に従って、細胞内で、転写、翻訳、及びその他のプロセスを経て合成される。タンパク質欠損症は、(i)タンパク質の不合成、(ii)生物学的活性を有しないタンパク質の合成、又は(iii)正常な、若しくは部分的な生物学的活性を有するが、本来存在すべきコンパートメントに到達するように適切にプロセシングされることができないタンパク質の合成、を生じさせる、コード遺伝子の変異によって生じる可能性がある。遺伝子変異によって発症するタンパク質欠損性障害は、遺伝子病とも呼ばれる。
【0004】
タンパク質欠損症には、遺伝子変異によって生じるものの他に、疾患に起因して、又は疾患の治療(例えば、化学療法)の副作用として、又は栄養不足の結果として生じるものもある。
【0005】
現行療法: タンパク質欠損症によって生じる障害は極めて多いが、それらの一部は、誤って折り畳まれた変異型タンパク質(コンフォメーション障害。下記参照)に起因するものである。タンパク質欠損症の現行療法の一つはタンパク質補充療法である。典型的なタンパク質補充療法では、対応する野生型タンパク質を精製して、静脈内、皮下若しくは筋肉内に注入するか、又は、対応する野生型タンパク質を、生体内分解性を有する徐放性固形製剤の形で体内に注入することが行われている。注入されたタンパク質の分解が速いため、治療有効量のタンパク質の確保及び維持が、タンパク質補充療法における主要な問題の1つとなっている。この問題に対処するために、現在のところ、多額の費用がかかる高用量注入が実施されている。
【0006】
タンパク質補充療法には、更にいくつかの問題点がある。例えば、正しく折り畳まれたタンパク質を大量に製造し、精製し、保管することが困難であること、グリコシル化された天然型タンパク質を得るのが困難であること、抗タンパク質免疫反応が生じること、重大な中枢神経系が関与する障害では、タンパク質が血液脳関門を越えられないこと等が挙げられる。
【0007】
機能性タンパク質をコードする核酸配列を含有する組換えベクター、又は機能性タンパク質を発現する遺伝子改変ヒト細胞を用いる遺伝子治療もまた、タンパク質欠損性障害、及びタンパク質補充療法が有効であるその他の障害を治療するために使用されている。この手法もまた、有望ではあるが、ベクターが分裂細胞に感染し、又は形質導入することができない、標的遺伝子の発現レベルが低い、遺伝子送達後の発現が制御されるといった技術的問題によって制限される。
【0008】
第3の、タンパク質欠損症を治療するための比較的近年の手法は、小分子阻害剤を用いて、欠損している酵素タンパク質の生体内基質を減少させ、これにより病態を改善するというものである。この「基質剥奪」手法は、特に、リソソーム蓄積症又はスフィンゴ糖脂質蓄積症と呼ばれる、約40の関連酵素障害からなる一群の障害に関して報告されている。これらの遺伝性障害は、細胞内の糖脂質の分解を触媒するリソソーム酵素の欠損により、脂質の異常な蓄積が生じ、細胞機能が破壊されることを特徴とする。治療用に提案されている小分子阻害剤は、特に、糖脂質の合成に関与する酵素を阻害し、欠損酵素によって分解される必要のある細胞内糖脂質の量を減少させるためのものである。この手法もまた、糖脂質が生物学的機能にとって必要であり、過剰な剥奪が副作用を引き起こす可能性がある点で制限される。具体的には、糖脂質は、脳において、ニューロンのガングリオシドから他のニューロンにシグナルを伝達するために用いられる。糖脂質が少なすぎるか、又は多すぎると、ニューロンによるシグナルの伝達が妨げられる。
【0009】
以下で特異的シャペロン戦略として検討する第4の手法は、変異型タンパク質を小胞体における分解から救済するものである。
【0010】
〔小胞体におけるタンパク質のプロセシング〕
タンパク質は細胞質内で合成され、新たに合成されたタンパク質はほとんど折り畳まれていない状態で小胞体(ER)の内腔に分泌される。一般に、タンパク質のフォールディング(折り畳み)は自己組織化の原理によって支配されている。新たに合成されたポリペプチドは、それらのアミノ酸配列に基づいて天然型コンフォメーションに折り畳まれる(Anfinsen ら,Adv. Protein Chem. 1975;29:205-300)。インビボでは、タンパク質のフォールディングは複雑である。これは、通常は疎水性コア内に覆い隠されているアミノ酸が近隣のタンパク質と非特異的に相互作用する凝集プロセスが、周囲の温度と高いタンパク質濃度との組合せによって刺激されるためである。この問題を回避するために、タンパク質のフォールディングは、通常は新生ポリペプチド鎖が凝集するのを防止し、タンパク質が天然型コンフォメーションにリフォールディングされるように、折り畳まれていないタンパク質に結合する分子シャペロンと呼ばれる一群の特殊なタンパク質によって促進される(Hartl, Nature 1996; 381: 571-580)。
【0011】
分子シャペロンは、ほぼあらゆるタイプの細胞、及びほとんどの細胞コンパートメントに存在する。一部はタンパク質の輸送に関係しており、細胞が熱ショック、グルコース枯渇等のストレス下で生存するのを可能にする(Gething ら,Nature 1992; 355:33-45;Caplan, Trends Cell. Biol. 1999; 9:262-268;Linら,Mol. Biol. Cell. 1993; 4:109-1119;Bergeron ら,Trends Biochem. Sci. 1994;19:124-128)。ER内の分子シャペロンの中で特性が最も明らかになっているのは、Bip(免疫グロブリン重鎖結合タンパク質、Grp78)である(Haas, Curr. Top. Microbiol. Immunol.1991; 167:71-82)。他の分子シャペロンと同様に、Bipは、ER内で、多数の成熟途上の分泌タンパク質及び膜タンパク質と相互作用するが、この相互作用は、フォールディングが円滑に進行する場合は、通常は弱く、短期間で終わる。天然型のタンパク質コンフォメーションが実現されると、分子シャペロンはもはやそのタンパク質とは相互作用しない。フォールディング、組織化、又は適正なグリコシル化が行われないタンパク質へのBipの結合は安定的になり、ER関連分解経路を介したタンパク質の分解を導く。このプロセスは、ERの「品質管理」システムとして機能し、一方で、正しく折り畳まれ、かつ組織化されたタンパク質だけが更なる成熟のためにERから輸送され、他方で、正しく折り畳まれていないタンパク質が保持され、引き続き分解に供されることを確実にする(Hurtley ら,Annu. Rev. Cell. Biol. 1989;5:277-307)。
【0012】
特定のDNA変異は、変異型タンパク質の正しいフォールディングを更に妨げる(多くの場合は不可能にする)アミノ酸置換を生じさせる。これらの誤ったフォールディングを是正するために、研究者らは様々な分子の使用を試みてきた。高濃度のグリセロール、ジメチルスルホキシド(DMSO)、トリメチルアミンN−オキシド(TMAO)、又は重水素水は、数種の疾患において、変異型タンパク質の分解経路を抑制し、細胞内輸送を増加させることが明らかにされている(Brown ら,Cell Stress Chaperones 1996;1:117-125;Burrows ら,Proc. Natl.Acad. Sci. USA. 2000; 97:1796-801)。これらの化合物は、一般的なタンパク質フォールディングを改善させる非特異的な化学シャペロンであると考えられているが、その機能の機序はまだ知られていない。このクラスの化合物は、細胞内におけるタンパク質フォールディングの欠陥を生化学的に試験するには有用であるが、効力を得るのに高用量を必要とするため、臨床で使用するのは困難又は不適切である。また、これらの化合物は特異性を有していない。
【0013】
〔特異的シャペロン戦略〕
従来の特許及び刊行物には、内因性の酵素タンパク質(具体的には、誤って折り畳まれたリソソーム酵素)をER品質管理機構による分解から救済する治療戦略が記載されている。この戦略では、特定のリソソーム障害に関連する欠陥リソソーム酵素に対して特異的な小分子の可逆的競合阻害剤を用いる。この戦略は、次のとおりである。変異型酵素タンパク質はER内では誤って折り畳まれるので(Ishii ら,Biochem. Biophys. Res. Comm. 1996;220:812-815)、この酵素タンパク質は正常の輸送経路(ER→ゴルジ装置→エンドソーム→リソソーム)では遅滞し、急速に分解される。このため、変異型タンパク質の正しいフォールディングを促進する機能性化合物は、変異型タンパク質に対する部位特異的シャペロンとして機能し、ER品質管理システムからの円滑な脱出を促進する。インビトロにおいて、酵素の触媒中心を占め、そのコンフォメーションを安定化させる酵素阻害剤が存在することは知られている。従って、これらの特異的シャペロンは、活性部位特異的シャペロン(ASSC)と称することができる。
【0014】
この戦略は、Fan らへ付与された米国特許第6,274,597号、第6,583,158号、第6,589,964号及び第6,599,919号、並びに2002年11月26日に出願された係属中の米国特許出願第10/304,396号において、リソソーム蓄積症に関与する酵素に関して具体的に明らかにされている。上記特許及び出願の内容はそのまま、レフファレンスとして本明細書に包含される。例えば、ガラクトースの小分子誘導体であり、変異型ファブリー酵素 α−ガラクトシダーゼA(α−Gal A)の強力な競合阻害剤である1−デオキシガラクトノジリマイシン(DGJ)は、中性pHで変異型α−Gal A(R301Q)のインビトロ安定性を効果的に高め、R301Q又はQ279E変異を有するファブリー病患者から株化したリンパ芽球における変異型酵素活性を増強した。更に、変異型(R301Q)α−Gal Aを過剰発現するトランスジェニックマウスへのDGJの経口投与は、主要臓器中の酵素活性を大幅に上昇させた(Fan ら,Nature Med. 1999; 5:112-115)。ミスフォールディング(誤って折り畳まれた)タンパク質の救済の成否は、酵素阻害濃度が必要とされる基質剥奪手法とは対照的に、酵素を完全に阻害するのに必要な濃度より低い特異的阻害剤のインビボ濃度が実現されるかどうかによる。
【0015】
リソソーム蓄積症に加えて、現在では極めて多数の、かつ多様な疾患が、ER内のタンパク質の遅滞と、タンパク質の最終的な分解とを引き起こす非天然型のタンパク質コンフォメーションの採用に起因するコンフォメーション疾患であると認識されている(Kuznetsov ら,N. Engl. J. Med. 1998;339:1688-1695;Thomas ら,TrendsBiochem. Sci. 1995; 20:456-459;Bychkova ら,FEBS Lett. 1995; 359:6-8;Brooks, FEBS Lett.1997; 409:115-120)。ASSCは、酵素以外の変異型タンパク質の発現を支援することが明らかにされている。例えば、小さな合成化合物が、変異型の癌抑制タンパク質p53のDNA結合ドメインを安定化させ、それによってそのタンパク質に活性コンフォメーションを維持させることが見出されている(Foster ら,Science 1999; 286:2507-10)。受容体の合成は、小分子の受容体アンタゴニスト及びリガンドによって支援されることが明らかにされている(Morello ら,J. Clin. Invest. 2000; 105:887-95;Petaja-Repo ら,EMBO J. 2002; 21: 1628-37)。膜チャネルタンパク質、及びその他の細胞膜トランスポーターの薬理学的な救済も、チャネル遮断薬又は基質を用いて明らかにされている(Rajamani ら,Circulation 2002; 105:2830-5;Zhou ら,J. Biol. Chem. 1999; 274:31123-26;Loo ら,J. Biol. Chem 1997; 272:709-12)。上記参考文献はすべて、ASSCが、酵素、受容体、膜チャネルタンパク質及びDNA転写調節因子を含む(それらに限定されない)変異型タンパク質を特異的に救済することができることを示している。
【0016】
ASSCはまた、変異型タンパク質に加えて、野生型タンパク質を安定化させ、それらの産生量及び安定性の増大させることが明らかにされている。1つの例として、特異的ASSCであるDGJは、野生型α−GalA配列をコードするベクターでトランスフェクトされたCOS−7細胞内で、野生型α−GalAの量及び活性を増大させることができることが明らかにされている。ASSCは、本来ならばER品質管理システム内で遅滞するはずの過剰発現した野生型酵素を救済する。これは、COS−7細胞内の酵素の過剰発現及び過剰産生がこのシステムの能力を超えており、凝集及び分解を生じさせるためである(2003年2月28日出願の米国特許出願第10/377,179号を参照されたい)。
【0017】
要約すると、当分野では、補充タンパク質の投与を要するタンパク質欠損症又はその他の障害の治療等におけるタンパク質補充療法の生物学的効率及び費用効率を改善する方法が必要とされている。
【発明の概要】
【0018】
本発明は、精製タンパク質の安定性を高める方法であって、薬学的に許容される担体中の前記タンパク質を活性部位特異的シャペロンと接触させることを含む方法を提供する。
【0019】
精製タンパク質は組換えタンパク質であってもよく、また、活性を保持していれば、全長型及び切断型のいずれであってもよい。
【0020】
本発明はまた、タンパク質のシェルフライフをインビトロで延長させる方法であって、薬学的に許容される担体中の前記タンパク質を活性部位特異的シャペロンと接触させることによって行う方法を提供する。
【0021】
薬学的に許容される担体中のタンパク質は、凍結乾燥されていても、水溶液にされていてもよい。
【0022】
本発明は更に、薬学的に許容される担体中の精製タンパク質を投与された個体において、前記タンパク質の半減期を延長させ、前記タンパク質のインビボ活性を持続させる方法であって、薬学的に許容される担体中で前記タンパク質を活性部位特異的シャペロンと接触させることを含む方法を提供する。
【0023】
本発明は、タンパク質補充を必要とする障害(例えば、タンパク質欠損性障害)を有する個体を治療する方法であって、前記個体に、精製された補充タンパク質と、前記補充タンパク質を安定化することができる活性部位特異的シャペロン(ASSC)と、を投与することを含む方法を提供する。
【0024】
1つの態様では、補充タンパク質はコンフォメーション障害に関連するタンパク質である。
【0025】
好ましい態様では、コンフォメーション障害はリソソーム蓄積症である。
【0026】
1つの態様では、リソソーム蓄積症はファブリー病である。
【0027】
別の態様では、リソソーム蓄積症はゴーシェ病である。
【0028】
本発明はまた、タンパク質補充療法と同時に、ERにおける欠陥のあるフォールディング又はプロセシングに起因して欠損している変異型の内因性タンパク質の安定性を高める方法を提供する。内因性タンパク質の安定性及び活性は、変異型タンパク質に対応する投与された補充タンパク質の安定性が高まると同時に増強される。
【0029】
本発明は更に、非哺乳動物宿主細胞によって組換えタンパク質の産生量を増加させる方法であって、前記タンパク質に対するASSCを含有する培地中で前記宿主細胞を前記ASSCと接触させることによって行う方法を提供する。
【0030】
本発明は更に、薬学的に許容される担体中に、精製タンパク質と、前記タンパク質に対するASSCと、を含有する組成物を提供する。
【図面の簡単な説明】
【0031】
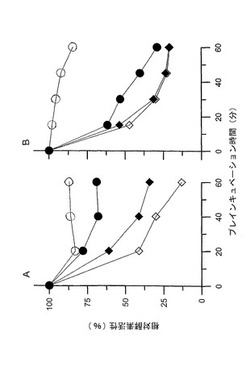
【図1】図1は、ヒト野生型α−Gal A cDNAを含有する組換えバキュロウイルスを感染させたSf−9細胞の培地から精製した野生型α−Gal A、及びヒト変異型(R301Q)α−Gal Aを過剰発現するトランスジェニックマウスの心臓のホモジネートとして収集された変異型α−Gal Aの安定性が各々、部位特異的シャペロンである1−デオキシガラクトノジリマイシン(DGJ、1μM)を用いることによって向上したことを明らかにしている。これらのマウスには、実験前1週間、飲料水として0.5mM DGJを与えた。変異型(A)及び野生型(B)の酵素は各々、変異型酵素に対しては37℃で、野生型酵素に対しては42℃で、0.1Mクエン酸−リン酸緩衝液(pH7.0)中、濃度1μM(○)、0.1μM(●)、0.03μM(◆)又は0μM(DGJなし;◇)のDGJの存在下でプレインキュベートした。酵素活性は、プレインキュベーションが行われていない酵素に対する相対値で報告されている。DGJは、変異型及び野生型の酵素の変性/分解を防止する安定剤として機能することができる。
【発明を実施するための形態】
【0032】
本発明は、タンパク質を活性部位特異的シャペロン(ASSC)と接触させることによって、疾患又は障害を治療するためのタンパク質補充療法の有効性を向上させる点で有利である。本発明の利点は、(a)非哺乳動物細胞からのタンパク質の産生効率の向上、(b)シェルフライフの長期化、並びにインビボ半減期及び活性の改善に現れる、治療用タンパク質の安定性の向上、(c)細胞膜の横断を含む生体内移動の過程における、タンパク質活性部位の構造の維持、及び(d)合成中に誤って折り畳まれ、結果的に小胞体から除去される内因性変異型タンパク質の救済、からもたらされる。
【0033】
本発明は更に、タンパク質と、そのタンパク質を特異的に安定化する活性部位特異的シャペロン(ASSC)と、を含有する製剤を提供する。
【0034】
本発明は、ASSCを、遺伝子障害及びその他の障害の治療のための、タンパク質補充療法との併用療法において用いることができるという発見に基づいている。ASSCは、当分野で既知の方法により、スクリーニングし、同定することができる。特定の障害に対して有用な特異的なASSCが同定されると、ASSCは、タンパク質補充療法を受けている患者に、適切な細胞コンパートメントへの補充タンパク質の取込みを増大させ、循環中の、また、必要に応じて細胞内への輸送中のタンパク質の安定性を向上させるために投与することができる。シャペロンは、製造中、保管中及びインビボ使用中の活性型タンパク質を安定化することができる。
【0035】
〔定義〕
本明細書で用いる用語は一般に、本発明の状況、及び各用語が使用される特定の状況において、当分野における通常の意味を有する。本発明の組成物及び方法、並びにその製造方法及び使用方法を説明するに際して、実施者への追加の指針を提供するために、一定の用語については、下記で、又は本明細書のいずれかの箇所で考察する。
【0036】
固有の定義: 「タンパク質補充」という用語は、非天然型の精製タンパク質を、そのようなタンパク質を欠損している個体に導入することを意味する。投与されるタンパク質は、天然から(例えば、RSV又は単核球症を治療するためのヒトガンマグロブリンから)、又は(下記で詳細に説明するように)組換え発現によって得ることができる。この用語は更に、本来ならば精製タンパク質の投与を必要とする、又はそれが有益である、例えば、タンパク質不全症に罹患している個体に、精製タンパク質を導入することも意味する。導入されるタンパク質は、インビトロで製造された精製組換えタンパク質であっても、例えば、胎盤若しくは動物の乳汁等、単離された組織若しくは液体から、又は植物から精製されたタンパク質であってもよい。
【0037】
「タンパク質欠損症を特徴とする障害」という用語は、タンパク質の欠如又は不足によって生じる病態を示すあらゆる障害を意味する。この用語は、生物学的に不活性なタンパク質産物を生じさせるタンパク質フォールディング障害(すなわちコンフォメーション障害)を包含する。タンパク質不全症は、感染症、免疫抑制、臓器不全、腺機能異常、放射線病、栄養欠乏症、中毒、又はその他の環境若しくは外界に起因する障害に伴うものであってもよい。
【0038】
「正しいコンフォメーションを安定化させる」という用語は、化合物又はペプチド又はその他の分子が、野生型若しくは変異型のタンパク質の構造を天然の形若しくは適正な形に維持することができるように、野生型タンパク質に、又はインビトロで(例えば、製剤中で)、及びインビボで野生型の機能を発揮することができる変異型タンパク質に結合することができることを意味する。この効果は、実地では、(i)タンパク質のシェルフライフの向上、(ii)タンパク質の単位/量当たりの活性の上昇、又は(iii)インビボにおける効力の増大、のいずれか一つ、又は二つ以上を通じて現れてもよい。これは、発現中のERからの収率の上昇、温度上昇に起因するアンフォールディングに対する抵抗性の増大、又は不安定化剤の存在を通じて、また、類似の手段によって、実験で観察することができる。
【0039】
本明細書では、「コンフォメーション障害」又は「コンフォメーション疾患」という用語は、ER内におけるタンパク質の遅滞及び破壊をもたらす可能性があり、通常は、正常の生物学的活性を備える自然条件下の野生型タンパク質によっては形成されないタンパク質コンフォメーションを採用することによって生じる障害を意味する。タンパク質レベルの低下は、生理学的不均衡を生じさせ、疾患又は障害として現れる。ある特定の態様では、コンフォメーション障害はリソソーム蓄積症である。
【0040】
本明細書では、「活性部位」という用語は、何らかの特異的な生物学的活性を有するタンパク質の領域を意味する。例えば、それは、基質若しくはその他の結合パートナーに結合し、化学結合の生成及び破壊に直接関与するアミノ酸残基を提供する部位であってもよい。本発明における活性部位は、酵素の触媒部位、抗体の抗原結合部位、受容体のリガンド結合ドメイン、調節因子の結合ドメイン、又は分泌タンパク質の受容体結合ドメインを包含してもよい。これらの活性部位はまた、転写因子及び調節因子の転写活性化ドメイン、タンパク質−タンパク質相互作用ドメイン又はDNA結合ドメインも包含してもよい。
【0041】
本明細書では、「活性部位特異的シャペロン」という用語は、タンパク質活性部位と特異的相互作用を可逆的に行い、安定的な分子コンフォメーションの形成を促進するタンパク質、ペプチド、核酸、炭水化物等を含むあらゆる分子を意味する。本明細書では、「活性部位特異的シャペロン」という用語は、Bip、カルネキシン若しくはカルレティキュリンのような、細胞のERに存在する内因性の一般的シャペロン、又は重水素水、DMSO若しくはTMAOのような、一般的で非特異的な化学的シャペロンを包含しない。
【0042】
一般的な定義: 本明細書では、「精製(された)」という用語は、非関連物質(すなわち混入物)の存在を減少させ、又は排除する条件下で単離された物質を意味する。非関連物質には、目的の物質が得られる天然物質も含まれる。例えば、精製タンパク質は、好ましくは、細胞内で結合している他のタンパク質又は核酸を実質的に含んでいない。精製核酸分子は、好ましくは、細胞内で一緒に見出すことのできるタンパク質又は他の非関連核酸分子を実質的に含んでいない。本明細書では、「実質的に含んでいない」という用語は、物質の分析試験の状況において実効的に用いられる。混入物を実質的に含んでいない精製物質は、好ましくは純度95%以上であり、より好ましくは純度97%以上であり、更に好ましくは純度99%以上である。純度は、クロマトグラフィー、ゲル電気泳動、イムノアッセイ、組成分析、生物学的アッセイ、及び当分野で既知のその他の方法によって評価することができる。ある特定の態様では、「精製(された)」は、混入物のレベルが、ヒト又は非ヒト動物へ投与することができるレベルとして規制官庁が許容したレベル以下であることを意味する。
【0043】
好ましい態様では、「約」及び「およそ」という用語は、一般に、測定値の性質又は精度を前提として許容可能な、測定された数量に対する誤差の程度を意味する。典型的な誤差の程度は、例えば、所定の数値又は数値範囲の20パーセント(%)以内、好ましくは10%以内、より好ましくは5%以内である。或いは、特に生物学的な系では、「約」及び「およそ」という用語は、所定の数値の1桁の範囲内、好ましくは10倍又は5倍以内、より好ましくは2倍以内の数値を意味することもある。本明細書に示した数量は、特に断らない限り近似値である。これは、明示的に記載されていなくても、「約」又は「およそ」という用語の存在を推定することができることを意味する。
【0044】
「遺伝子」は、機能的「遺伝子産物」をコードするヌクレオチドの配列である。一般に、遺伝子産物は機能性タンパク質である。しかし、遺伝子産物は、RNA(例えば、tRNA又はrRNA)等の細胞内の別のタイプの分子であってもよい。本発明における遺伝子産物は、細胞内で見出すことのできるmRNA配列も意味する。
【0045】
「発現する」及び「発現」という用語は、遺伝子又はDNA配列内の情報を顕在化させること、例えば、RNA(例えば、rRNA若しくはmRNA)又はタンパク質を、対応する遺伝子又はDNA配列の転写及び翻訳に関与する細胞機能を活性化することによって産生することを意味する。DNA配列が細胞によって発現されると、RNA(例えば、mRNA若しくはrRNA)又はタンパク質等の「発現産物」が形成される。発現産物自体、例えば、結果的に生じるRNA又はタンパク質もまた、細胞によって「発現した」ということができる。
【0046】
「トランスフェクション」という用語は、細胞内への外来の核酸の導入を意味する。「形質転換」という用語は、宿主細胞が、導入された遺伝子又は配列を発現して所望の物質を産生するように、宿主細胞内に「外来」(すなわち外因性又は細胞外)の遺伝子、DNA配列又はRNA配列を導入することを意味する。所望の物質は、本発明では典型的には、導入された遺伝子若しくは配列によってコードされたRNA、又は導入された遺伝子若しくは配列によってコードされたタンパク質若しくは酵素である。導入された遺伝子又は配列は、「クローン化」された、又は「外来」の遺伝子又は配列と呼ばれることもあり、調節配列又は制御配列(例えば、細胞の遺伝子機構によって用いられる開始、終止、プロモーター、シグナル、分泌又はその他の配列)を含んでいてもよい。遺伝子又は配列は、非機能性配列、又は機知の機能を有しない配列を含んでいてもよい。導入されたDNA若しくはRNAを受容し、発現する宿主細胞は、「形質転換」されており、「形質転換体」又は「クローン」である。宿主細胞へ導入されるDNA又はRNAはいかなる細胞に由来してもよく、起源は、宿主細胞と同一の属若しくは種の細胞であっても、異なる属若しくは種の細胞であってもよい。
【0047】
「ベクター」、「クローニングベクター」及び「発現ベクター」という用語は、宿主を形質転換させて、導入配列の発現(例えば、転写及び翻訳)を促進するように、DNA配列又はRNA配列(例えば、外来遺伝子)を宿主細胞内に導入することができるビヒクルを意味する。
【0048】
「発現系」という用語は、例えば、ベクターによって運ばれ、宿主細胞に導入された外来DNAによってコードされているタンパク質の発現に適した条件下の、宿主細胞及びこれに適合するベクターを意味する。一般的発現系には、大腸菌(E. coli)宿主細胞及びプラスミドベクター、Sf9、Hi5若しくはS2細胞等の昆虫宿主細胞及びバキュロウイルスベクター、及び発現系、並びに哺乳動物宿主細胞及びベクターが含まれる。
【0049】
「変異型」及び「変異」という用語は、遺伝物質、例えば、DNA中のあらゆる検出可能な変化、又はこのような変化のあらゆるプロセス、機序若しくは結果を意味する。これには、遺伝子の構造(例えば、DNA配列)が変化させられる遺伝子変異、あらゆる変異プロセスから生じるあらゆる遺伝子又はDNA、及び改変された遺伝子又はDNA配列によって発現した発現産物(例えば、RNA、タンパク質又は酵素)が含まれる。
【0050】
本明細書では、「変異型タンパク質」という用語は、タンパク質配列の変化を生じさせる遺伝子変異を含有する遺伝子から翻訳されたタンパク質を意味する。ある特定の態様では、このような変異は、タンパク質がER内の通常の条件下で天然型コンフォメーションを実現することができない原因となる。このコンフォメーションが実現されないと、これらのタンパク質はタンパク質輸送系における正常な経路を通じて細胞内の正しい場所へ輸送されず、むしろ分解されてしまうことになる。変異には他に、活性の減少、又はより迅速な代謝回転を引き起こすことができるものがある。
【0051】
「野生型遺伝子」は、インビボで正常な機能的生物学的活性を保持することのできるタンパク質をコードする核酸配列を意味する。野生型核酸配列は、生物学的活性にほとんど又は全く影響を及ぼさないアミノ酸置換を生じさせるに過ぎない場合は、公表された既知の配列とは異なるヌクレオチドの変化を含んでもよい。「野生型」という用語はまた、内因性の、又は天然型のタンパク質と比較して、活性を上昇させ、又は増強させることのできるタンパク質をコードするように操作された核酸配列を含んでもよい。
【0052】
「野生型タンパク質」は、インビボで発現した、又は導入されたときに機能的生物学的活性を保持することのできる野生型遺伝子によってコードされているあらゆるタンパク質を意味する。「正常な野生型の活性」という用語は、細胞内のタンパク質の正常な生理学的機能を意味する。このような機能性は、タンパク質の機能性を示すことが知られているあらゆる手段によって試験することができる。
【0053】
「遺伝的に改変された」という用語は、特定の遺伝子産物をコードするコーディング配列を含有する核酸を、コーディング配列の発現を制御する調節エレメントと共に導入した後に、その遺伝子産物を発現する細胞を意味する。核酸の導入は、遺伝子ターゲティング及び相同的組換えを含む、当分野で既知のあらゆる方法によって行うことができる。本明細書では、この用語はまた、例えば、遺伝子活性化技術によって、そのような細胞では正常に発現されない内因性の遺伝子又は遺伝子産物を発現し、又は過剰発現するように遺伝子操作された細胞も意味する。
【0054】
「薬学的に許容される」というフレーズは、本発明の医薬組成物に関して用いられるかどうかに関わらず、生理学的に許容され、ヒトに投与された場合に通常は、望ましくない反応を生じない分子的実体及び組成物を意味する。本明細書では、「薬学的に許容される」という用語は、好ましくは、動物、より具体的にはヒトにおいて用いることができるものとして、米国連邦政府又は州政府の規制官庁によって承認されている、又は米国薬局方、若しくはその他の一般に認知された薬局方に記載されていることを意味する。「担体」という用語は、化合物と共に投与される希釈剤、アジュバント、賦形剤又はビヒクルを意味する。このような製薬学的担体は、無菌の液体(水、油等)であってもよい。水、生理食塩水、又はデキストロース若しくはグリセロールの水溶液は、好ましくは、担体として、特に注射液として用いられる。適切な製薬学的担体は、E. W. Martin の“Remington's Pharmaceutical Sciences”18th Edition に記載されている。
【0055】
「治療有効量」及び「有効量」という用語は、治療反応を生じさせるのに十分な化合物の量を意味する。ASSC及びタンパク質が複合体の形態で投与される態様では、「治療有効量」及び「有効量」という用語は、治療反応を生じさせるのに十分な複合体の量を意味する。治療反応は、使用者(例えば、臨床医)が治療に有効な反応として認識するどうような反応であってもよい。そこで、治療反応は一般に、疾患又は障害の一つ、又は二つ以上の症状の改善を意味する。
【0056】
精製された治療用タンパク質の生体内における生成中若しくは輸送中、又は保管中に阻害性を保持するASSCの濃度もまた、インビボで投与された場合のASSCの希釈(及び平衡状態の変化によって生じる結合の変化)、バイオアベイラビリティ及び代謝のために、本発明における「有効量」を構成してもよいことに留意すべきである。
【0057】
〔タンパク質欠損症を特徴とする障害〕
現在、特定の組織におけるタンパク質欠損又は機能喪失を特徴とする約1100種の遺伝性障害が知られている。理論上は、これらの障害はタンパク質補充療法によって治療可能である。本発明の方法は、現在又は将来において利用可能なタンパク質補充療法に用いるのに現在のところ適しているタンパク質に関する併用療法を企図している。このような障害では、個体のある一部の細胞又は全部の細胞が機能性のタンパク質を十分に有さず、又は不活性形のタンパク質を有し、又は生物学的機能に関して不十分なレベルのタンパク質を有する。
【0058】
更に、ERにおいて変異型タンパク質のフォールディングを変化させ、そのタンパク質の遅滞を生じさせ、結果的にタンパク質欠損症を発症させる変異に起因するコンフォメーション障害と同定された疾患のリストは増加しつつある。これには、嚢胞性線維症、α1−アンチトリプシン欠損症、家族性高コレステロール血症、ファブリー病、アルツハイマー病(Selkoe, Annu. Rev. Neurosci. 1994; 17:489-517)、骨形成不全症(Chessler ら,J. Biol. Chem. 1993;268:18226-18233)、炭水化物欠損性糖タンパク質症候群(Marquardt ら,Eur. J. Cell. Biol. 1995; 66:268-273)、マロトー・ラミー症候群(Bradford ら,Biochem. J. 1999; 341:193-201)、遺伝性盲目症(Kaushal ら,Biochemistry 1994; 33:6121-8)、グランツマン血小板無力症(Kato ら,Blood 1992; 79:3212-8)、遺伝性第VII因子欠損症(Arbini ら,Blood1996; 87:5085-94)、眼皮膚型白皮症(Halaban ら,Proc. Natl. Acad. Sci. USA. 2000; 97:5889-94)及びプロテインC欠損症(Katsumi ら,Blood 1996; 87:4164-75)が含まれる。近年、X連鎖疾患である副腎白質ジストロフィー(ALD)における1つの変異によって、欠陥のあるペルオキシソームトランスポーターのミスフォールディング(誤った折り畳み)が引き起こされたが、これは罹患細胞の低温培養によって救済することができた(Walter ら,Am J Hum Genet 2001; 69:35-48)。一般に、変異は遺伝子の全配列に渡って均一に発生すると認められている。このため、欠損しているタンパク質のミスフォールディングの結果生じる表現型が、多数の他の遺伝子障害において存在すると予測される。
【0059】
(リソソーム蓄積症)
遺伝性タンパク質欠損性障害の多くは酵素欠損症である。上述したように、大きな一群の遺伝性酵素障害はリソソーム酵素における変異を伴い、リソソーム蓄積症(LSD)とも呼ばれる。リソソーム蓄積症は、スフィンゴ糖脂質、グリコーゲン及びムコ多糖類の蓄積によって発症する疾患群である。リソソーム障害の例には、ゴーシェ病(Beutler ら,The Metabolic and Molecular Basesof Inherited Disease,8th ed.2001 Scriver ら(編),3635-3668頁,McGraw-Hill, New York)、GM1−ガングリオシドーシス(上記参照、3775-3810 頁)、フコシドーシス(The Metabolic and MolecularBases of Inherited Disease 1995. Scriver, C. R., Beaudet, A. L., Sly, W. S. andValle, D. (編),2529-2561 頁,McGraw-Hill,New York)、ムコ多糖症(上記参照、3421-3452 頁)、ポンペ病(上記参照、3389-3420 頁)、ハーラー・シャイエ病(Weismann ら,Science 1970; 169, 72-74)、ニーマン・ピック病A型及びB型(TheMetabolic and Molecular Bases of Inherited Disease 8th ed. 2001. Scriver ら(編),3589-3610 頁,McGraw-Hill, New York)及びファブリー病(上記参照、3733-3774 頁)が含まれるが、それらに限定されない。LSD及びそれらに関連する欠損性酵素のリストは、下記表1に記載した。以下では、そのうちの2種について具体的に考察する。
【0060】
ファブリー病:
ファブリー病は、欠損性リソソームα−ガラクトシダーゼA(α−GalA)活性によって生じるスフィンゴ糖脂質のX連鎖先天性代謝異常である(Desnickら,The Metabolic and Molecular Bases of InheritedDisease, 8th Edition Scriver ら(編),3733-3774 頁,McGraw-Hill, New York、2001;Bradyら,N. Engl. J. Med. 1967; 276, 1163-1167)。この酵素欠損は、α−ガラクトシル残基、主としてグロボトリアオシルセラミド(GL−3)を伴う中性スフィンゴ糖脂質の、体液及び組織リソソームにおける進行性沈着をもたらす。この疾患の発生頻度は、男性では約1:40,000であり、世界中の異なる人種で報告されている。古典的な態様で罹患した男性の場合、臨床症状には、被角血管腫、先端感覚異常、発汗減少症、並びに特徴的な角膜及び水晶体混濁(The Metabolic and Molecular Bases of Inherited Disease, 8th Edition2001, Scriver ら(編),3733-3774 頁,McGraw-Hill,New York)が含まれる。罹患した男性の余命は短縮され、心臓、脳、及び/又は腎臓の血管性疾患の結果として、通常は40年後又は50年後に死亡する。これとは対照的に、より軽度の「心臓型」の患者は、通常は5〜15%の正常α−Gal A活性を有し、左心室肥大又は心筋症を示す。古典的な患者が重度に易感染性であるのに対して、これらの心臓型患者は事実上無症候性のままである。近年、心臓型は、説明のつかない左心室肥大性心筋症に罹っている成人男性患者の11%において見出されたが、これはファブリー病が以前の推定より高い頻度で発症する可能性があることを示唆している(Nakao ら,N. Engl. J. Med. 1995; 333:288-293)。α−Gal A遺伝子はXq22にマッピングされており(Bishop ら,Am. J. Hum. Genet. 1985; 37:A144)、α−GalAをコードする全長cDNA及び全12−kbゲノム配列が報告されている(Calhoun ら,Proc. Natl. Acad. Sci. USA 1985; 82:7364-7368;Bishop ら,Proc. Natl. Acad. Sci. USA 1986;83:4859-4863;Tsuji ら,Eur. J.Biochem. 1987; 165:275-280;及び Komreich ら,Nucleic Acids Res. 1989; 17:3301-3302)。ファブリー病を生じさせる変異には、顕著な遺伝的異質性が存在する(The Metabolic and Molecular Bases of Inherited Disease, 8th Edition2001, Scriver ら(編),3733-3774 頁,McGraw-Hill,New York;Eng ら,Am. J. Hum.Genet. 1993; 53:1186-1197;Eng ら,Mol. Med. 1997; 3:174-182;及び Davies ら,Eur. J. Hum. Genet. 1996; 4:219-224)。現在までに、小さな欠失及び挿入、並びにより大きな遺伝子再構成に加えて、様々なミスセンス変異、ナンセンス変異及びスプライシング変異が報告されている。
【0061】
ゴーシェ病:
ゴーシェ病は、脂肪グルコセレブロシドを分解するリソソーム酵素β−グルコセレブロシダーゼの欠損症である。脂肪はその後、大部分が肝臓、脾臓及び骨髄に蓄積する。ゴーシェ病は、疼痛、疲労、黄疸、骨損傷、貧血、そして死亡さえ生じさせる可能性がある。ゴーシェ病には3つの臨床的表現型がある。I型の患者は若年期又は青年期に罹患し、外傷を受けやすく、貧血に起因する疲労、低血小板、肝臓及び脾臓の肥大、骨格の弱体化を経験し、場合によっては、肺障害及び腎障害を抱える。脳併発の徴候はない。早期に発症するII型では、肝臓及び脾臓の肥大は3カ月齢までに発生し、広範な脳併発が見られる。2歳までは死亡率が高い。III型は、肝臓及び脾臓の肥大、並びに脳発作を特徴とする。β−グルコセレブロシダーゼ遺伝子は、ヒトlq21染色体上に位置する。そのタンパク質前駆体は536アミノ酸を含有し、その成熟タンパク質は497アミノ酸長である。
【0062】
ゴーシェ病は東欧出身のユダヤ人の子孫(アシュケナジ)の間でかなり一般的に見られるが、いかなる民族の人間も罹患する可能性がある。ゴーシェ病は、アシュケナジユダヤ人集団間では最も一般的な遺伝子障害であり、その発生率はおよそ450人に1人である。一般の人々では、およそ100,000人に1人がゴーシェ病に罹患する。全米ゴーシェ財団(National Gaucher Foundation)によると、2,500人の米国人がゴーシェ病に罹患している。
【0063】
(その他の酵素欠損性障害)
グルコース6−リン酸デヒドロゲナーゼ(G6PD)欠損症は、最も一般的なX連鎖ヒト酵素欠損症である。G6PD酵素は、DNA及びRNA両方の必須成分であるリボースの産生に不可欠な酸化/還元反応を触媒する。G6PDは更に、細胞の内部のNADPHを適正なレベルに維持することにも関与している。NADPHは数多くの生合成反応において必要な補因子である。この欠損症を有する個体は、新生児黄疸、腹痛及び/又は背痛、めまい、頭痛、呼吸困難(不規則呼吸)及び動悸を含む臨床症状を呈する。
【0064】
酵素欠損症には、遺伝性障害の他に、原発性又は続発性障害から生じる組織又は器官に対する損傷に起因するものもある。例えば、膵臓組織の損傷、又は膵炎はアルコール依存症によって生じ、消化に必要な膵酵素の欠損症を生じさせる。現在、膵炎は酵素補充療法を用いて治療されている。
【0065】
【表1−1】

【0066】
【表1−2】

【0067】
〔タンパク質補充療法を用いて治療されるその他の障害〕
タンパク質欠損症を特徴とする障害の他にも、補充タンパク質を投与して、生物学的プロセスを強化又は刺激することによって治療される障害がある。例えば、貧血を有する個体には、組換えエリスロポエチン(EPOGEN(登録商標)、PROCRIT(登録商標)、EPOIETIN(登録商標))を投与して、赤血球の産生を刺激し、組織への酸素の輸送を増加させる。更に、組換えインターフェロンである、インターフェロンα2b(INTRON A(登録商標)、PEG−INTRON(登録商標)、REBETOL(登録商標))及びインターフェロンβ1a(AVONEX(登録商標)、BETASERON(登録商標))は各々、B型肝炎及び多発性硬化症を治療するために投与される。投与されるタンパク質としては他にも、嚢胞性線維症の患者の肺機能を改善するために用いられる、DNAを選択的に開裂する酵素である組換えヒトデオキシリボヌクレアーゼI(rhDNase−PULMOZYME(登録商標))、甲状腺亜全摘術又は甲状腺全摘術を受け、そのため甲状腺ホルモンを摂取しなければならない甲状腺癌患者に用いるために開発された組換え甲状腺刺激ホルモン(THYROGEN(登録商標))、化学療法に起因する好中球減少症を治療するための組換えG−CSF(NEUPOGEN(登録商標))、及び膵炎を有する個体における消化酵素がある。タンパク質療法はまた、高度に特異的で、明確な活性部位を有する抗体を用いた感染症及び癌の治療といった領域においても重要である。抗体治療薬には、RS(respiratory syncitial)ウイルスに対するRESPIRGRAM(登録商標)、乳癌に対するHERCEPTIN(登録商標)、関節炎及び炎症性疾患に対するREMICAID(登録商標)及びHUMIRA(登録商標)等がある。抗体に対するASSCは周知であり、標的抗原又は構造的に連関するアナログ(例えば、活性標的の修飾体又は類似体)を用いることができる。タンパク質療法用のものとして、現在市販されている、又は臨床試験で評価されているタンパク質のリストについては、下記表2を参照されたい。
【0068】
【表2−1】

【0069】
【表2−2】

【0070】
【表2−3】

【0071】
【表2−4】

【0072】
〔タンパク質欠損性障害及びその他の障害の治療〕
既に簡単に触れたが、遺伝子治療、タンパク質補充療法、及び小分子阻害剤療法は、タンパク質欠損症から生じる遺伝子障害、及び補充タンパク質の投与が有益な障害の治療のための治療戦略として開発されてきた。
【0073】
タンパク質補充療法は、野生型の、又は生物学的機能を有するタンパク質を外部から注入することによってタンパク質の量を増加させるものである。この療法は、上述した、ゴーシェ病及びファブリー病を含む多数の遺伝子障害のために開発されてきた。野生型酵素は、組換え細胞発現系(例えば、哺乳動物細胞又は昆虫細胞− Desnick らへの米国特許第5,580,757号;Selden らへの米国特許第6,395,884号及び第6,458,574号;Calhoun らへの米国特許第6,461,609号;Miyamura らへの米国特許第6,210,666号;Selden らへの米国特許第6,083,725号;Rasmussen らへの米国特許第6,451,600号;Rasmussen らへの米国特許第5,236,838号;並びに Ginns らへの米国特許第5,879,680号を参照されたい)、ヒト胎盤、又は動物の乳汁(Reuser らへの米国特許第6,188,045号を参照されたい。)から精製される。注入後、外因性酵素は、非特異的な、又は受容体特異的な機序を介して組織に取り込まれると考えられる。一般に、取込み効率は高くなく、外因性タンパク質の循環時間は短い(Ioannu ら,Am. J. Hum. Genet. 2001; 68:14-25)。更に、外因性タンパク質は不安定であり、細胞内で急速な分解を受けやすい。
【0074】
タンパク質補充療法及び遺伝子治療の他にも、LSDの治療に関して、酵素阻害剤を用いる小分子療法、すなわち上述した欠損酵素前駆体の基質の剥奪に対して有用な小分子阻害剤が報告されている。小分子阻害剤は、ファブリー病、ゴーシェ病、ポンペ病、テイ・サックス病、サンドホフ病及びGM2ガングリオシドーシス等のLSDの治療に関して報告されている(Platt らへの米国特許第5,472,969号、第5,580,884号、第5,798,366号及び第5,801,185号を参照されたい)。
【0075】
〔ASSC及びタンパク質補充を用いる併用療法〕
本発明は、インビトロでは製剤又は組成物中の精製タンパク質の安定性を高めて、また、インビボでは、タンパク質に対するASSCを共投与することによってそのタンパク質の安定性を高めて、タンパク質補充療法の有効性を増加させるものである。標的タンパク質に対する好適なASSCのスクリーニングは、例えば、2003年2月28日出願の米国特許出願第10/377,179号(この開示内容はそのまま、レファレンスとして本明細書に包含される。)に記載されているような、当分野における通常の方法を用いて行うことができる。
【0076】
(補充タンパク質の製造)
本発明の方法を用いて治療することができる障害には、LSD、グルコース6−リン酸デヒドロゲナーゼ欠損症、遺伝性気腫、家族性高コレステロール血症、家族性肥大型心筋症、フェニルケトン尿症、貧血、B型肝炎及び多発性硬化症が含まれるが、これらに限定されない。
【0077】
本発明の方法に有用な補充タンパク質は、当分野の範囲内の通常の分子生物学、微生物学及び組換えDNAの技術を用いて単離精製することができる。例えば、補充タンパク質をコードする核酸は、文献記載の組換えDNAの発現を用いて単離することができる。例えば、Sambrook, Fritsch & Maniatis, Molecular Cloning: A LaboratoryManual, Second Edition (1989), Cold Spring Harbor Laboratory Press, Cold SpringHarbor, New York(本明細書では、「Sambrook ら,1989」と記す);DNA Cloning: A Practical Approach,Volumes I and II(D. N. Glover 編、1985);Oligonucleotide Synthesis(M. J. Gait 編、1984);NucleicAcid Hybridization[B. D. Hames & S. J. EHiggins 編 (1985)];Transcription And Translation[B. D. Hames & S. J. Higgins 編 (1984)];Animal Cell Culture[R. I. Freshney 編 (1986)];Immobilized Cells And Enzymes[IRL Press, (1986)];B. EPerbal, A PracticalGuide To Molecular Cloning (1984);F. M. Ausubel ら(編),Current Protocols in Molecular Biology, John Wiley & Sons, Inc.(1994) を参照されたい。タンパク質をコードする核酸は、遺伝子が生物学的に活性なタンパク質をコードする限り、全長型及び切断型のいずれであってもよい。例えば、ファブリー病に関連する欠損酵素であるα−Gal Aの生物学的に活性な切断型は Miyamura らへの米国特許第6,210,666号に記載されている。
【0078】
同定単離された、標的タンパク質をコードする遺伝子は、次に適当なクローニングベクターに挿入することができる。当分野で既知の極めて多数のベクター−宿主系を用いることができる。使用可能なベクターにはプラスミド又は改変ウイルスが含まれるが、これらに限定されない。しかし、ベクター系は用いられる宿主細胞と適合しなければならない。ベクターの例としては、λ誘導体等の大腸菌バクテリオファージ、又はpBR322誘導体若しくはpUCプラスミド誘導体等のプラスミド(例えば、pGEXベクター、pmal−c、pFLAG等)が挙げられるが、それらに限定されない。クローニングベクターへの挿入は、例えば、相補的付着末端を有するクローニングベクターにDNAフラグメントをライゲートすることによって行うことができる。しかし、DNAをフラグメント化するために用いられる相補的制限部位がクローニングベクター内に存在しない場合は、DNA分子の末端を酵素によって修飾することができる。或いは、DNAの末端にヌクレオチド配列(リンカー)をライゲートすることによっていかなる所望の部位も作り出すことができる。これらのライゲートされたリンカーは制限エンドヌクレアーゼ認識配列をコードする化学的に合成された特異的なオリゴヌクレオチドを含んでもよい。組換えタンパク質の生産量は、N末端にシグナルペプチドを配置して分泌を促進すること、ポリアデニル化部位を含有する3’非翻訳配列を含めること等の遺伝子操作によって最大化することができる。
【0079】
好ましい態様では、宿主細胞に形質導入するのに用いられる構築体は、アデノウイルス、アデノ随伴ウイルス、ヘルペスウイルス、流行性耳下腺炎ウイルス、ポリオウイルス、レトロウイルス、シンドビスウイルス及びワクシニアウイルスを含む(それらに限定されない)ウイルスに由来するベクターである。
【0080】
組換え分子は、形質転換、トランスフェクション、感染、エレクトロポレーション等を介して、遺伝子配列の多数のコピーが生成されるように宿主細胞内に導入することができる。クローン化された遺伝子は、シャトルベクタープラスミドに含有されるのが好ましい。シャトルベクタープラスミドは、クローニング細胞(例えば、大腸菌)内で増殖し、容易に精製することができ、必要に応じて、引き続き適当な発現細胞系に挿入することができる。
【0081】
宿主−ベクター系になりうるものには、ウイルス(例えば、ワクシニアウイルス、アデノウイルス等)に感染した哺乳動物細胞系;ウイルス(例えば、バキュロウイルス)に感染した昆虫細胞系;酵母ベクターを含有する酵母等の微生物;又はバクテリオファージ、DNA、プラスミドDNA又はコスミドDNAを用いて形質転換された細菌が含まれるが、それらに限定されない。ベクターの発現エレメントは、その強度及び特異性において様々である。用いられる宿主−ベクター系に応じて、多数の適当な転写及び翻訳エレメントのいずれか一つを用いることができる。宿主細胞は各々、タンパク質の翻訳時及び翻訳後のプロセシング及び修飾(例えば、グリコシル化、[例えばシグナル配列の]分割)に関して、特徴的で特異的な機序を有している。発現した外来のタンパク質の所望の修飾及びプロセシング(グリコシル化、シアリル化、リン酸化等)が確実に行われるように、適当な細胞系又は宿主系を選択することができる。例えば、細菌系中の発現を用いると、非グリコシル化コアタンパク質産物を生成させることができる。しかしながら、細菌中で発現したタンパク質は正しく折り畳まれない可能性がある。酵母中の発現は、グリコシル化産物を生成することができる。真核細胞内の発現は、異種タンパク質が「天然の」グリコシル化及びフォールディングを受ける可能性を増大させることができる。更に、哺乳動物細胞内の発現は、タンパク質を再構成又は構成するための道具を提供することができる。更に、タンパク質分解性開裂等のプロセシング反応へ影響の程度は、ベクター/宿主発現系によって異なりうる。発現効率は、米国特許第6,274,597号に記載された特定のシャペロン、及び上述した関連するファミリーのメンバーの使用によって増加させることができる。
【0082】
組換え発現タンパク質の精製は、硫酸アンモニウム沈降法、並びに疎水性相互作用樹脂、カチオン交換樹脂、アニオン交換樹脂又はクロマトフォーカシング樹脂を含有するカラムクロマトグラフィーのような、当分野で既知の方法を用いて行うことができる。或いは、イムノアフィニティークロマトグラフィーを用いると、タンパク質に、又は組換えタンパク質に融合したタグに特異的に結合する適当なポリクローナル又はモノクローナル抗体を用いて、組換えタンパク質を精製することができる。好ましい態様では、本発明の方法に用いられる組換えタンパク質の純度は、少なくとも95%、好ましくは97%、及び最も好ましくは98%超である。
【0083】
(補充タンパク質の投与)
細胞による補充タンパク質の取込み及びターゲティングを行うために、多くの方法を用いることができる。膜輸送を媒介し、それによって細胞質にポリペプチドを送達することができるペプチド配列が同定されている。例えば、このようなペプチドは、アンテナペディア(Antennapedia)ホメオドメインヘリックス3に由来するものであり、ペネトラチン(国際公開公報第00/29427号;また、Fischer ら,J. Pept. Res. 2000; 55:163-72;DeRossi ら,Trends in Cell Biol. 1998; 8:84-7;Brugidou ら,Biochem. Biophys .Res. Comm.1995; 214:685-93 を参照されたい)、ヘルペス単純ウイルス由来のVP22タンパク質(Phelanら,Nat. Biotechnol. 1998; 16:440-3)、及びHIV TAT転写活性化因子等の膜輸送ベクターを生成することができる。アンテナペディアドメイン及びHIVTATドメイン(Vives ら,J. Biol. Chem. 1997;272:16010-17 を参照されたい。)を含むタンパク質形質導入ドメインは特徴的な正電荷を有し、このことによって、治療タンパク質及びDNAを細胞内へ運搬するのに用いることができるカチオン性 12-mer ペプチドの開発が導かれた(Mi ら,Mol. Therapy 2000; 2:339-47)。上述したタンパク質形質導入ドメインは、共有結合性の架橋が化学的に行われるか、又は融合タンパク質として生成されることによって、標的タンパク質に共有結合する。更に近年、非共有結合性の合成タンパク質形質導入ドメインが Active Motif Inc.(カリフォルニア州カールズバッド)によって開発された。このドメインは、疎水性相互作用を介して標的タンパク質と結合し、好都合なことに、一旦細胞の内側に入ると、タンパク質から解離する(Morris ら,Nat. Biotechnol. 2001; 19:1173-6)。更に、脂質担体が裸の(naked)DNAの送達に用いることができることは既に認められているが、近年、タンパク質を細胞内に送達することも明らかにされている(Zelphati ら,J. Biol. Chem. 2001; 276:35103-10)。タンパク質移送技術の概観については、Bonetta, The Scientist 2002; 16(7):38 を参照されたい。
【0084】
特定の態様では、本発明の方法で用いられる補充タンパク質はリソソーム蓄積症に関連する酵素である(表1参照)。このような酵素の野生型バージョンをコードする核酸の配列は、文献中に、又は GenBank 等の公開されたデータベースに見出すことができる。例えば、GenBankでは、α−Gal A(AGA)はX14448、ヒトグルコセレブロシダーゼ(GCB)はJ03059、ヒトα−イズロニダーゼ(IDUA)はM74715、ヒト酸性α−グルコシダーゼ(GAA)はM34424、ヒトイズロン酸2−スルファターゼ(IDS)はAF011889、ヒト酸性スフィンゴミエリナーゼ(ASM)はM59916である。
【0085】
LSDにおける酵素補充: LSDに対する補充酵素のいくつかは、現在、欧州及び米国において入手することができる。その例として、ゴーシェ病治療用の、グルコセレブロシダーゼの組換え型である Cerezyme(登録商標);αガラクトシダーゼAの組換え型である Fabrazyme(登録商標));MPS1治療用の組換え酵素であるAldurazyme(商標)(これらはすべて Genzyme Corp. 製である);及びポンペ病患者用の組換えαグルコシダーゼが挙げられる(Van den Hout ら,Lancet 2000; 56:397-8)。
【0086】
(活性部位特異的シャペロン)
本発明によって企図されたASSCとしては、基質又は結合パートナー類似体を含む小分子(例えば、分子量が約2kD未満である、より好ましくは分子量が約1kD未満である有機又は無機分子);小リガンド由来ペプチド又はそれらの類似体;DNA、RNA等の核酸;Fv及び一本鎖抗体を含む抗体、並びにFabフラグメント;高分子(例えば、分子量が約2kDを超える分子)、並びにD−及び/又はL−形アミノ酸のライブラリー等、コンビナトリアルケミストリーに由来するライブラリーのメンバー;ランダムな、又は部分的に縮重した定方向のホスホペプチドライブラリーのメンバー等のホスホペプチドが挙げられるが、それらに限定されない(例えば、Songyang ら,Cell 1993; 72:767-778 を参照されたい)。
【0087】
合成ライブラリー(Needels ら,Proc. Natl. Acad. Sci. USA 1993;90:10700-4;Ohlmeyer ら,Proc. Natl. Acad. Sci. USA 1993;90:10922-10926;Lamら,国際公開公報第92/00252号;Kocis ら,国際公開公報第94/28028号)は、本発明におけるASSCとなりうるものを提供するソースである。合成化合物ライブラリーは、Maybridge Chemical Co.(英国コーンウォール州 Trevillet)、Comgenex(ニュージャージー州プリンストン)、Brandon Associates(ニューハンプシャー州メリマク)、及び Microsource(コネチカット州ミルフォード)から市販されている。希少な化学ライブラリーは Aldrich(ウィスコンシン州ミルウォーキー)から入手可能である。或いは、細菌、真菌、植物及び動物抽出物の形状にある天然化合物のライブラリーは、例えば Pan Laboratories(ワシントン州ボセル)若しくは MycoSearch(ノースカロライナ州)から入手可能であり、又は、容易に作製することができる。更に、天然のライブラリー及び化合物、並びに合成的に製造したライブラリー及び化合物は、Res. 1986; 155:119-29 に記載の方法で容易に改変することができる。
【0088】
好ましい態様では、本発明に有用なASSCはリソソーム酵素の阻害剤であり、Asano ら,J. Med. Chem 1994; 37:3701-06;Dale ら,Biochemistry 1985; 24:3530-39;Goldman ら,J. Nat. Prod. 1996; 59:1137-42;Legler ら,Carbohydrate Res. 1986; 155:119-29 に記載されたグルコース及びガラクトースイミノ−糖誘導体を含んでいる。このような誘導体には、表1に列挙した化合物が含まれるが、それらに限定されない。これらの化合物の一部は、Toronto Research Chemicals, Inc.(カナダ国ノースヨーク)及びSigma 等の市販のソースから購入することができる。
【0089】
好ましい態様では、本発明に有用なASSCは、Dormer ら,J. Cell Sci. 2001; 114:4073-81 及び Ma ら,J. Biol. Chem. 2002; 277:37235-41 に記載されるようなベンゾ(c)キノリジニウム化合物を含む嚢胞性線維症膜貫通型コンダクタンス調節因子(CFTR)の活性化因子である。
【0090】
別の好ましい態様では、本発明に有用なASSCは、Petaja-Repo ら,EMBO J 2002; 21:1628-37;Morello ら,J. Clin. Invest. 2000; 105:887-95;Saliba ら,J. Cell Sci. 2002; 115:2907-18 に記載されている、Gタンパク質結合受容体(δオピオイド受容体、V2バソプレッシン受容体等)のリガンド、及び光色素のロドプシンである。
【0091】
別の好ましい態様では、本発明に有用なASSCは、Foster ら,Science 1999; 286:2507-10;Friedler ら,PNAS 2002; 99:937-42 に記載されている、p53のDNA結合ドメインを安定化させる化合物である。
【0092】
更に別の好ましい態様では、本発明のために有用なASSCは、Zhou ら,J. Biol. Chem. 1999; 274:31123-26;Taschenbergerら,J. Biol. Chem. 2002; 277:17139-46 に記載されている、ヒトQT延長症候群におけるHERGカリウムチャネル、家族性高インスリン症における膵ATP過敏性カリウム(KATP)チャネル等のイオンチャネルタンパク質のブロッカーである。
【0093】
(製剤)
一つの態様では、ASSC及び補充タンパク質は単一組成物で調製される。このような組成物は、保管中及びインビボ投与中のタンパク質の安定性を高め、それによって治療有効性を高める。製剤の投与経路としては、静脈内、皮下及び腹腔内投与のような非経口投与が好適であるが、経口、鼻腔内又は経皮的投与のような他の投与経路に適当な製剤も企図されている。
【0094】
別の態様では、補充タンパク質及びASSCは別個の組成物で調製される。この態様では、シャペロン及び補充タンパク質を、例えば、静脈内注入等の同一経路によって、又は例えば、補充タンパク質は静脈内注入で、ASSCは経口投与等の異なる経路で投与することができる。
【0095】
注射使用に適した医薬製剤には、無菌水溶液(水溶性)若しくは分散液、及び無菌注射液若しくは分散液の即時調製用無菌粉末が含まれる。いずれの場合にも、製剤は無菌でなければならず、容易に注射することが可能な程度に流動性を有しなければならない。製剤は、製造及び保管の条件下で安定性を有しなければならず、細菌及び真菌等の微生物の汚染作用から守られなければならない。担体は、例えば、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、ポリエチレングリコール等)、及びそれらの適当な混合物、並びに植物油を含有する溶媒及び分散媒であってもよい。適正な流動性は、例えば、レシチン等のコーティングの使用によって、必要な粒径の維持によって(分散液の場合)、また、界面活性剤の使用によって維持することができる。微生物の作用は、例えば、パラベン、クロロブタノール、フェノール、ベンジルアルコール、ソルビン酸等、種々の抗菌剤及び抗真菌剤によって防止することができる。多くの場合に、例えば、糖又は塩化ナトリウム等の等張性物質を含有させるのが好ましい。注射用組成物の持続性吸収は、例えば、モノステアリン酸アルミニウム、ゼラチン等、吸収を遅延させる物質を組成物中に用いることによって達成することができる。
【0096】
無菌注射液は、精製タンパク質及びASSCを上述した種々の他の成分と共に必要量だけ適当な溶媒中に溶解し、必要に応じて、その後に濾過又は最終滅菌を実施することによって調製される。一般に、分散液は滅菌された種々の有効成分を、基本分散媒、及び上述した成分から必要とされる他の成分を含有する無菌ビヒクル中に導入することによって調製される。無菌注射液調製用の無菌粉末の場合、調製方法としては、事前に滅菌濾過された溶液から、有効成分の粉末、及びその他のすべての所望成分が得られる、真空乾燥法及びフリーズドライ技術が好ましい。
【0097】
製剤は、賦形剤を含有するのが好ましい。製剤中に含めることのできる薬学的に許容される賦形剤は、クエン酸緩衝液、リン酸緩衝液、酢酸緩衝液、重炭酸緩衝液等の緩衝液;アミノ酸、尿素、アルコール、アスコルビン酸、リン脂質;血清アルブミン、コラーゲン、ゼラチン等のタンパク質;EDTA若しくはEGTA、及び塩化ナトリウム等の塩類;リポソーム;ポリビニルピロリドン;デキストラン、マンニトール、ソルビトール、グリセロール等の糖類;プロピレングリコール及びポリエチレングリコール(例えば、PEG−4000、PEG−6000);グリセロール;グリシン若しくはその他のアミノ酸;及び脂質である。製剤と共に用いる緩衝系としては、クエン酸緩衝液、酢酸緩衝液、重炭酸緩衝液及びリン酸緩衝液が挙げられる。リン酸緩衝液が好ましい。
【0098】
製剤は、非イオン性界面活性剤を含有するのが更に好ましい。好ましい非イオン性界面活性剤としては、ポリソルベート(Polysorbate)20、ポリソルベート80、トリトン(Triton)X−100、トリトンX−114、ノニデット(Nonidet)P−40、オクチルα−グルコシド、オクチルβ−グルコシド、ブリジ(Brij)35、プルロニック(Pluronic)及びトゥィーン(Tween)20が挙げられる。
【0099】
タンパク質及びシャペロン製剤を凍結乾燥するために、タンパク質濃度は0.1〜10mg/mLとすることができる。凍結乾燥混合物には、グリシン、マンニトール、アルブミン、デキストラン等の充填剤を添加することができる。更に、凍結乾燥混合物には、二糖類、アミノ酸、PEG等、凍結保護剤になりうる物質を添加することができる。上記に列挙した緩衝液、賦形剤及び界面活性剤のいずれも添加することができる。
【0100】
吸入投与用製剤は、ラクトース又はその他の賦形剤を含有していてもよい。或いは、ポリオキシエチレン−9−ラウリルエーテル、グリコール酸エステル又はデオキシコール酸エステルを含有している水溶液であってもよい。好ましい吸入用エーロゾルは、質量密度が小さく、径の大きい粒子を有することを特徴とする。1立方センチメートル当たり0.4g未満の質量密度、及び5μm超の平均径を備える粒子は、全身循環内に吸入用治療薬を効率的に送達する。このような粒子は肺内の奥深くへ吹き込まれ、吸入された粒子が治療上有効な装填物を送達するまで肺の天然浄化機構から免れる(Edwards ら,Science 1997; 276:1868-1872)。本発明の補充タンパク質製剤は、例えば、米国特許第5,654,007号、第5,780,014号及び第5,814,607号(これらの開示内容は、各々そのまま、レファレンスとして本明細書に包含される。)に記載の調製方法及び製剤を用いることによって、エーロゾル形で投与することができる。鼻腔内投与用製剤は、点鼻剤の形状で投与するために、すなわち鼻腔内に塗布されるゲルとして、油性溶液を含んでもよい。
【0101】
皮膚表面への局所投与用製剤は、組成物をローション、クリーム、軟膏、石けん等、皮膚学的に許容される担体を用いて組成物を分散させることによって調製することができる。特に有用であるのは、皮膚の上方で膜又は層を形成して、適用を局所化し、移動を阻害することができる担体である。体内組織の表面に局所投与するには、組成物を液状の組織接着剤、又は組織表面への吸着を強化するものとして既知である他の物質中に分散させればよい。或いは、ペクチン含有製剤等の組織コーティング液を用いてもよい。
【0102】
好ましい態様では、本発明の製剤は、規定用量の組成物が投与される点で便利なデバイス中の、液状又は粉末状の製剤として供給される。このようなデバイスとしては、皮下若しくは筋肉内注射のためのニードルレスインジェクター、及び定量エーロゾルデリバリーデバイスが挙げられる。場合によっては、製剤は、経皮的投与のために皮膚へ適用されるパッチ若しくはドレッシングのように徐放性放出に適した形状で、又は経粘膜投与用の分解性デバイスを介して供給することができる。製剤(例えば、ASSC)が錠剤又はカプセル剤の形で投与される場合は、製剤は取外し可能なカバー付きのボトルに入れた状態で、又はブリスター包装のパッチとして供給することができる。
【0103】
インビトロ安定性: 医薬製剤のシェルフライフ中の安定性を確保することは大きな課題である。タンパク質製剤を開発する前に、有効成分内の固有又は潜在的な不安定性を調査して対処しなければならない。タンパク質及びペプチド治療薬の不安定性は、化学的不安定性及び物理的不安定性に分類される。化学的不安定性の例は、加水分解、酸化及びアミド分解である。物理的不安定性の例は、表面への凝集、沈降及び吸着である。更に、タンパク質は、pH、温度、剪断応力、凍結/解凍応力、及びこれらの応力の組み合わせ等の応力を受ける可能性がある。
【0104】
製剤に関して最もよく知られた問題の一つは、生体内活性の損失を生じさせる製剤の凝集である。賦形剤の添加は、このプロセスを緩和することができるが、これを完全に防止することはできない。活性の損失は物理的アッセイによって検出することができる場合もできない場合もあり、大きな(時には15〜20%の)変動係数を備えるバイオアッセイ又は力価アッセイでしか明白にならないので、実際の損失量を決定するのは困難である。
【0105】
ASSCは、酵素の分解及び酵素タンパク質の凝集を防止することによって酵素活性を強化することが明らかにされている(Fan ら,Nat. Med. 1999; 5:112-5; 図1)。ASSC及び補充タンパク質が同一組成物中に含まれる態様では、本発明の調製組成物は、無菌性を保持し、また、これは重要なことであるが、適正な流通及び保管中に補充タンパク質の活性を保護するのに適した容器で提供することができる。投与されたタンパク質をインビボで安定化させることに加えて、ASSCは、インビトロでも補充タンパク質に可逆的に結合してそのコンフォメーションを安定化させ、それによって製剤の凝集及び分解を防止し、シェルフライフを延長させる。ASSC/補充タンパク質相互作用の分析結果は、例えば、示差走査熱量計、円偏向二色性等、当分野で周知の技術を用いて評価することができる。
【0106】
例えば、組成物の水性注射用製剤は、ニードル及びシリンジを用いて内容物を抜去するのに適したストッパー付きバイアルに入れて供給され、ASSCの存在は補充タンパク質の凝集を阻害する。バイアルは、単回使用型又は複数回使用型のいずれであってもよい。製剤はまた、プレフィルドシリンジとして供給することもできる。別の態様では、製剤は乾燥又は凍結乾燥状態にあり、これは標準的な、又は既製の生理的希釈液を用いて液体状態に戻すことを必要とする。この場合は、ASSCの存在は、液体状態に戻す間、また戻した後、補充タンパク質を安定化させて凝集を防止する。製剤が、静脈内投与ライン又はカテーテルへ接続されている滅菌バッグ中にある場合のように、静脈内投与用の液体である場合も、ASSCの存在は同一の利点を与える。
【0107】
投与される補充タンパク質を安定化させることに加えて、ASSCの存在は、医薬製剤を約7.0〜7.5の中性pHで保管することを可能にする。これは、通常は安定性を維持するために更に低いpHで保管しなければならないタンパク質にとっては、利点となる。例えば、表1に列挙した酵素のようなリソソーム酵素は、低いpH(例えば、5.0以下)で安定性のコンフォメーションを維持する。しかしながら、低いpHでの補充酵素の長期保管は、酵素及び/又は製剤の分解を促進するおそれがある。
【0108】
個別製剤: 補充酵素及びASSCが個別製剤中に含まれる場合は、ASSCは、上述したすべての形状を含めて、どの投与経路に適した形状であってもよい。例えば、無菌水溶液の形状であってもよく、また、投与前のインビトロの凝集を防止するために、液体状態に戻す間、また戻した直後に補充タンパク質の製剤に添加される凍結乾燥粉末の形状であってもよい。或いは、ASSCは、例えば、結合剤(例えば、事前にゼラチン化されたトウモロコシデンプン、ポリビニルピロリドン又はヒドロキシプロピルメチルセルロース)、充填剤(例えば、ラクトース、微結晶セルロース又はリン酸水素カルシウム)、潤沢剤(例えば、ステアリン酸マグネシウム、タルク又はシリカ)、錠剤分解剤(例えば、バレイショデンプン又はグリコール酸デンプンナトリウム)、湿潤剤(例えば、ラウリル硫酸ナトリウム)等、薬学的に許容される賦形剤を用いて、従来型の手段によって調製された錠剤又はカプセル剤の形状で経口投与用に調製することができる。錠剤を、当分野で周知の方法によってコーティングしてもよい。経口投与用の液体製剤は、例えば、液剤、シロップ剤若しくは懸濁剤の形状を取ってもよく、また、使用前に水若しくはその他の適当なビヒクルを用いて液体状態に戻す乾燥製剤として提供してもよい。このような液体製剤は、懸濁化剤(例えば、ソルビトールシロップ、セルロース誘導体又は水素化食用脂肪)、乳化剤(例えば、レシチン又はアカシア)、非水性ビヒクル(例えば、アーモンド油、油性エステル、エチルアルコール又は精留植物油)、保存料(例えば、p−オキシ安息香酸メチル又はプロピル又はソルビン酸)等、薬学的に許容される添加物を用いて、従来型の手段によって調製することができる。製剤はまた、必要に応じて、緩衝塩、着香剤、着色剤及び甘味剤を含んでもよい。経口投与用製剤は、活性化合物の制御された放出を生じさせるように適当に調製することができる。
【0109】
(投与)
投与経路は、静脈内、皮下、動脈内、腹腔内、点眼、筋肉内、経口腔、経直腸、経膣、眼窩内、大脳内、皮内、頭蓋内、髄腔内、脳室内、クモ膜下、槽内、関節内、肺内、鼻腔内、経粘膜、経皮及び吸入経由のいずれであってもよく、また、経口及び非経口のいずれであってもよい。
【0110】
上述した非経口製剤の投与は、製剤の定期的ボーラス注射であってもよく、また、外部(例えば、静注バッグ)又は内部(例えば、生体内分解性インプラント、人工臓器、若しくは補充タンパク質を産生する埋め込まれた細胞集団)にあるリザーバーからの静脈内又は腹腔内投与によって投与されてもよい。例えば、米国特許第4,407,957号及び第5,798,113号(これらの開示内容は、各々そのまま、レファレンスとして本明細書に包含される。)を参照されたい。肺内送達方法及び装置は、米国特許第5,654,007号、第5,780,014号及び第5,814,607号(これらの開示内容は、各々そのまま、レファレンスとして本明細書に包含される。)に記載されている。その他の有用な非経口送達システムには、エチレン−酢酸ビニルコポリマー粒子、浸透圧ポンプ、埋込み型注入システム、ポンプ送達、封入細胞送達、リポソーム送達、ニードル送達式注射、ニードルレス注射、ネブライザー、エーロゾル噴霧器、エレクトロポレーション及び経皮パッチが含まれる。ニードルレス注射器は、米国特許第5,879,327号、第5,520,639号、第5,846,233号及び第5,704,911号に記載されており、それらの開示内容は各々そのまま、レファレンスとして本明細書に包含される。上述した製剤は、いずれもこれらの方法で投与することができる。
【0111】
補充タンパク質及び/又はASSCの皮下注射は自己投与を可能にする利点を有しているが、更に、静脈内投与に比較して長い血漿半減期を生じさせる。更に、プレフィルド注射ペン及びニードルレス注射器等、患者に便宜なように設計された様々なデバイスは、本明細書で考察するように本発明の製剤と一緒に用いることができる。
【0112】
投与の時機: 補充タンパク質及びASSCが個別製剤中に含まれる場合は、同時に投与してもよく、又はASSCを補充タンパク質の前に、若しくは後に投与してもよい。例えば、補充タンパク質が静脈内投与される場合に、ASSCは0〜6時間の時間以内、又はその後に投与してもよい。或いは、シャペロンはタンパク質投与の0〜6時間前に投与してもよい。
【0113】
ASSC及び補充タンパク質が個別に投与され、ASSC(例えば、小分子)が短い循環中半減期を有する好ましい態様では、ASSCは循環中の一定レベルを維持するために、例えば、1日1回等、持続的に経口投与してもよい。このような一定レベルは、患者にとって非毒性であり、また、非阻害性の治療作用を付与するのに、投与中の標的補充タンパク質との相互作用に関して最適であると決定されているレベルである。
【0114】
別の態様では、ASSCは、補充タンパク質の代謝回転に必要とされる期間(これはASSCの投与によって延長される。)投与される。
【0115】
投与の時機とは無関係に、投与は、タンパク質及びASSCの濃度を、シャペロンがインビボにおけるタンパク質を安定化させるが、タンパク質の活性を防止又は阻害しないような濃度にして行われなければならない。これはまた、補充タンパク質及びASSCが同一製剤中で投与される場合にも当てはまる。
【0116】
インビボ安定性: インビトロ製剤について上述したように、補充タンパク質に対するASSCの存在は血漿半減期を延長させるという利点を有し、それによって長期間に渡り有効な補充タンパク質レベルが維持され、その結果、罹患組織の補充タンパク質への暴露が増加し、組織中へのタンパク質の取込みが増大する。これは、苦痛緩和の促進、投与頻度の減少、及び/又は投与量の減少といった、患者に有利な効果を与える。これはまた、治療コストを減少させる。
【0117】
野生型補充タンパク質を安定化させるのに加えて、ASSCはまた、例えば、LSD等のコンフォメーション障害の際に、ER内における正しいフォールディング及びプロセシングを妨害する変異の結果として欠損した内因性の変異型タンパク質の発現を安定化し、強化する。
【0118】
(用量)
投与されたタンパク質及び内因性の変異型タンパク質を安定化させるために有効なASSCの用量は、当業者によってタンパク質及び対応するASSCに応じて、個別的に決定することができる。補充タンパク質及びASSCの両方の半減期(tl/2)、ピーク血漿濃度(cmax)、ピーク血漿濃度に達するまでの時間(tmax)、曲線下面積(AUC)より求まる暴露量、及び組織分布、並びにASSC−補充タンパク質結合に関するデータ(親和性定数、結合及び解離定数、並びに結合価)等、薬物動態学的及び薬力学的データは、活性を阻害せずに補充タンパク質を安定化させ、その結果、治療効果を与えるのに必要な適合量を決定する、当分野で既知の通常の方法を用いて得ることができる。
【0119】
細胞培養アッセイ又は動物試験から得られたデータを用いると、ヒト及び非ヒト動物に適用すべき治療用量範囲を策定することができる。本発明の治療方法に用いられる化合物の用量は、毒性をほとんど又は全く有することなく、ED50濃度(試験した集団の50%に対して有効である濃度)を含む循環中濃度の範囲内にあるのが好ましい。いずれの治療に関しても、適用される特定の用量は、用いられる特定の剤形、用いられる投与経路、個体(例えば、患者)の状態等の要素に応じて、この範囲内で変動してもよい。
【0120】
治療有効量は、まず細胞培養アッセイから推定し、IC50を含む循環中濃度範囲に収まるように動物モデルで定式化することができる。化合物のIC50濃度は、(例えば、細胞培養アッセイから決定されるような、)症状が最も強く阻害される場合の半分の阻害が達成される濃度である。例えば、ヒト患者等、特定の個体に用いるのに適当な用量は、次に、そのような情報を用いてより正確に決定することができる。
【0121】
血漿中の化合物の測定値は、高速液体クロマトグラフィー(HPLC)、ガスクロマトグラフィー等の技術によって、患者等の個体においてルーチン的に測定することができる。
【0122】
組成物の毒性及び治療有効性は、標準的な薬学的手段によって、すなわち、例えば、細胞培養アッセイによって、又は実験動物を用いてLD50及びED50を決定することによって確認することができる。パラメータのLD50及びED50は当分野で周知であり、各々、集団の50%に対して致死性である化合物の用量、及び集団の50%にとって治療有効性である化合物の用量を意味する。毒性作用と治療作用との用量比は治療指数と言われており、比率:LD50/ED50として表示することができる。大きな治療指数を示すASSCが好ましい。
【0123】
現行の方法によると、補充タンパク質の濃度は、典型的には、週1回又は2週間に1回投与される場合、0.05〜5.0mg/kg(体重)である。タンパク質は、0.1μg/kg〜約10mg/kg、好ましくは約0.1mg/kg〜約2mg/kgの範囲内の用量で投与することができる。例えば、ファブリー病の治療のためには、組換えα−Gal Aの投与量は、典型的には0.1〜0.3mg/kgであり、週1回又は2週間に1回投与される。患者の生涯に渡って、タンパク質の定期的な繰返し投与が必要である。皮下注射は、薬剤へのより長期間の全身性曝露を維持する。皮下用量は、2週間に1回又は1週間に1回で、好ましくは体重1kg当たりα−GalA 0.1〜5.0mgである。α−Gal Aはまた、例えば、静脈内ボーラス注射、スロープッシュ静脈内注射で、又は持続的静脈内注射によって静脈内投与される。持続的IV注入(例えば、2〜6時間に渡って)は血中の一定レベルの維持を可能にする。
【0124】
ASSCの最適濃度は、その活性、組織中若しくは循環中のASSCのバイオアベイラビリティ、及び組織中若しくは循環中のASSCの代謝を妨害せずに、インビボ、組織中又は循環中の組換えタンパク質を安定化させるのに必要とされる量によって決定される。例えば、ASSCが酵素阻害剤である場合、阻害剤の濃度は酵素に対して特異的なシャペロンのIC50値を計算することによって決定することができる。化合物のバイオアベイラビリティ及び代謝を考慮すると、IC50値と同程度の濃度、又はIC50値をわずかに超える濃度は、酵素活性の量を増加させるのに必要な、又は投与された酵素の酵素活性を延長させるのに必要な阻害剤の量等、酵素活性に及ぼす作用に基づいて評価することができる。例えば、α−Gal A酵素に対する化合物デオキシガラクトノジリマイシン(DGJ)のIC50値は0.04μMであり、これはDGJが強力な阻害剤であることを示している。従って、α−GalAの細胞内濃度は投与されたα−Gal Aの細胞内濃度よりはるかに低いと推測される。以下の実施例を参照されたい。
【実施例】
【0125】
本発明を、以下に示す実施例によって更に説明する。このような実施例の使用は単に例示するためのものであり、決して本発明又は例示された用語の範囲及び意味を限定するものではない。同様に、本発明は、本明細書に記載した特に好ましい態様のいずれにも限定されるものではない。実際に、本発明の多数の修正態様及び変形態様は、本明細書を読めば、当業者には明らかであり、本発明の精神及び範囲から逸脱せずに実施することができる。従って、本発明は、添付の特許請求の範囲の条件、及び特許請求の範囲が及ぶ全範囲の等価物によってのみ限定されることになる。
【0126】
〔実施例1:ASSCを用いたα−Gal Aのインビトロ安定化〕
方法: 野生型α−Gal Aは、ヒト野生型α−Gal A cDNAを有する組換えバキュロウイルスで感染させたSf−9細胞の培地から精製し、変異型α−Gal Aは、ヒト変異型(R301Q)α−Gal Aを過剰発現するトランスジェニックマウスの心臓のホモジネートとして収集した。これらのマウスには、実験前1週間、飲料水として0.5mMDGJを与えた。変異型酵素及び野生型酵素は各々、変異型酵素に対しては37℃で、及び野生型酵素に対しては42℃で、0.1Mクエン酸−リン酸緩衝液(pH7.0)中、濃度1μM、0.1μM、0.03μMのDGJの存在下、又はDGJの非存在下でプレインキュベートした。野生型及び変異型(R301Q)α−GalAは、DGJ(種々の濃度)の非存在又は存在下で、ある期間に渡ってインキュベートし、この混合液を5容積の0.1Mクエン酸緩衝液(pH4.5)を用いて希釈した後、基質として4−MU−α−Gal Aを用いて残留酵素活性を決定した。酵素活性は、プレインキュベーションを実施していない酵素に対する相対値で報告されている。
【0127】
結果: 図1に示したように、変異酵素は、DGJ存在下のインキュベーションを行わずに、37℃で20分間、インキュベートした後は、中性pH下で安定性を示さなかった(図1A)。野生型酵素もまた、DGJ存在下のインキュベーションを行わずに、42℃でインキュベートすると、中性pH下で酵素活性を大きく損失した(図1B)。両方の酵素の安定性は、濃度1μMのDGJを含めることによって改善することができた。すなわち、反応混合液中には、60分間、80%を超える酵素活性が維持された。これは、ASSC(DGJ)が、変異型及び野生型酵素の変性/分解を予防する安定剤として機能することができることを示している。
【0128】
〔実施例2:ASSCを用いた野生型α−Gal Aの細胞内強化〕
方法: 組換えバキュロウイルスを用いてトランスフェクトした昆虫細胞又は組換えCHO細胞から精製したヒト野生型α−Gal Aは、従来の参考文献によれば、α−2−マクログロブリン(α−2−M)と複合体を形成することができる(Osada ら,Biochem Biophys Res Commun.1993; 142:100-6)。コーヒー豆由来α−Galとα−2−Mとの複合体は、ファブリー病ヘミ接合体由来の培養線維芽細胞によって細胞内へ取り込むことができるので、α−Gal A及びα−2−Mの複合体は同様に細胞によって細胞内へ取り込まれると考えられる。或いは、野生型α−Gal Aは、Blomら,Am JHum Gen. 2003; 72:23-31 に記載されているように、残留酵素活性を伴わないファブリー病患者由来の皮膚線維芽細胞の培地内に添加することもできる。
【0129】
結果: コーヒー豆α−Gal Aの半減期は、既に報告されているように約2時間である(Osada ら,Biochem Biophys Res Commun. 1987;143:954-8)。α−Gal A−α−2−M複合体、又は培地に添加されたα−Gal Aの半減期は、培地中にDGJを含めることによって延長させることができると考えられるが、それはDGJがインビトロにおける酵素の安定化に有効であることが明らかにされているからである(図1)。これは、DGJが、細胞によって細胞内に取り込まれた外因性α−Gal Aの持続時間を延長することができることを示すものである。
【0130】
〔実施例3:補充酵素の注入によって治療されたファブリー病マウスへのDGJの共投与〕
ファブリー病に対する酵素補充療法は、上述したように GenzymeCorporation によって開発されてきた。補充酵素の注入によって治療されたファブリー病ノックアウト(KO)マウスへのDGJの共投与は、安定性、例えば、補充酵素のインビボ半減期を増加させるが、それはASSCDGJが酵素を安定化させて分解を防止するためである。DGJは、既に報告されているプロトコールに従って、野生型α−GalAの注入後にKOマウスへ経口投与される(Ioannu ら,Am J HumGenet. 2001; 68:14-25)。心臓、腎臓、脾臓、肝臓及び肺、並びに血清を含む様々な組織中のα−GalA活性は、ある期間に渡って決定され、DGJを摂取していないコントロールマウス、及びDGJだけを摂取して酵素を摂取していないマウスからのα−Gal A活性と比較される。時間の延長は、ASSCの共投与が酵素補充療法の有効性を改善することができることを示すものである。
【0131】
本発明の範囲は、本明細書に記載の特定の態様によって限定されるものではない。実際に、本明細書に記載の態様以外の様々な修正態様は、上述の説明及び添付の図面から当業者には明らかである。このような修正態様は添付の特許請求の範囲内に含まれるものとする。
【0132】
この明細書を通じて、特許、特許出願、出版物、手順書等に言及してきたが、それらの開示内容はそのまま、レファレンスとして本明細書に包含される。
【発明の詳細な説明】
【0001】
(関連出願)
この出願は、2003年1月31日に出願された出願番号第60/444,136号の米国仮出願の優先権を主張するものであり、その開示内容はそのまま、レファレンスとして本明細書に包含される。
【技術分野】
【0002】
この出願は、タンパク質補充療法と活性部位特異的シャペロン(ASSC)とを併用することによって、投与されるタンパク質の安定性及び有効性を高め、タンパク質補充療法を改善する方法を提供する。本出願は更に、精製タンパク質とASSCとを含有する組成物を提供する。
【背景技術】
【0003】
〔タンパク質欠損症〕
タンパク質は、特定の遺伝子のゲノムヌクレオチド配列に従って、細胞内で、転写、翻訳、及びその他のプロセスを経て合成される。タンパク質欠損症は、(i)タンパク質の不合成、(ii)生物学的活性を有しないタンパク質の合成、又は(iii)正常な、若しくは部分的な生物学的活性を有するが、本来存在すべきコンパートメントに到達するように適切にプロセシングされることができないタンパク質の合成、を生じさせる、コード遺伝子の変異によって生じる可能性がある。遺伝子変異によって発症するタンパク質欠損性障害は、遺伝子病とも呼ばれる。
【0004】
タンパク質欠損症には、遺伝子変異によって生じるものの他に、疾患に起因して、又は疾患の治療(例えば、化学療法)の副作用として、又は栄養不足の結果として生じるものもある。
【0005】
現行療法: タンパク質欠損症によって生じる障害は極めて多いが、それらの一部は、誤って折り畳まれた変異型タンパク質(コンフォメーション障害。下記参照)に起因するものである。タンパク質欠損症の現行療法の一つはタンパク質補充療法である。典型的なタンパク質補充療法では、対応する野生型タンパク質を精製して、静脈内、皮下若しくは筋肉内に注入するか、又は、対応する野生型タンパク質を、生体内分解性を有する徐放性固形製剤の形で体内に注入することが行われている。注入されたタンパク質の分解が速いため、治療有効量のタンパク質の確保及び維持が、タンパク質補充療法における主要な問題の1つとなっている。この問題に対処するために、現在のところ、多額の費用がかかる高用量注入が実施されている。
【0006】
タンパク質補充療法には、更にいくつかの問題点がある。例えば、正しく折り畳まれたタンパク質を大量に製造し、精製し、保管することが困難であること、グリコシル化された天然型タンパク質を得るのが困難であること、抗タンパク質免疫反応が生じること、重大な中枢神経系が関与する障害では、タンパク質が血液脳関門を越えられないこと等が挙げられる。
【0007】
機能性タンパク質をコードする核酸配列を含有する組換えベクター、又は機能性タンパク質を発現する遺伝子改変ヒト細胞を用いる遺伝子治療もまた、タンパク質欠損性障害、及びタンパク質補充療法が有効であるその他の障害を治療するために使用されている。この手法もまた、有望ではあるが、ベクターが分裂細胞に感染し、又は形質導入することができない、標的遺伝子の発現レベルが低い、遺伝子送達後の発現が制御されるといった技術的問題によって制限される。
【0008】
第3の、タンパク質欠損症を治療するための比較的近年の手法は、小分子阻害剤を用いて、欠損している酵素タンパク質の生体内基質を減少させ、これにより病態を改善するというものである。この「基質剥奪」手法は、特に、リソソーム蓄積症又はスフィンゴ糖脂質蓄積症と呼ばれる、約40の関連酵素障害からなる一群の障害に関して報告されている。これらの遺伝性障害は、細胞内の糖脂質の分解を触媒するリソソーム酵素の欠損により、脂質の異常な蓄積が生じ、細胞機能が破壊されることを特徴とする。治療用に提案されている小分子阻害剤は、特に、糖脂質の合成に関与する酵素を阻害し、欠損酵素によって分解される必要のある細胞内糖脂質の量を減少させるためのものである。この手法もまた、糖脂質が生物学的機能にとって必要であり、過剰な剥奪が副作用を引き起こす可能性がある点で制限される。具体的には、糖脂質は、脳において、ニューロンのガングリオシドから他のニューロンにシグナルを伝達するために用いられる。糖脂質が少なすぎるか、又は多すぎると、ニューロンによるシグナルの伝達が妨げられる。
【0009】
以下で特異的シャペロン戦略として検討する第4の手法は、変異型タンパク質を小胞体における分解から救済するものである。
【0010】
〔小胞体におけるタンパク質のプロセシング〕
タンパク質は細胞質内で合成され、新たに合成されたタンパク質はほとんど折り畳まれていない状態で小胞体(ER)の内腔に分泌される。一般に、タンパク質のフォールディング(折り畳み)は自己組織化の原理によって支配されている。新たに合成されたポリペプチドは、それらのアミノ酸配列に基づいて天然型コンフォメーションに折り畳まれる(Anfinsen ら,Adv. Protein Chem. 1975;29:205-300)。インビボでは、タンパク質のフォールディングは複雑である。これは、通常は疎水性コア内に覆い隠されているアミノ酸が近隣のタンパク質と非特異的に相互作用する凝集プロセスが、周囲の温度と高いタンパク質濃度との組合せによって刺激されるためである。この問題を回避するために、タンパク質のフォールディングは、通常は新生ポリペプチド鎖が凝集するのを防止し、タンパク質が天然型コンフォメーションにリフォールディングされるように、折り畳まれていないタンパク質に結合する分子シャペロンと呼ばれる一群の特殊なタンパク質によって促進される(Hartl, Nature 1996; 381: 571-580)。
【0011】
分子シャペロンは、ほぼあらゆるタイプの細胞、及びほとんどの細胞コンパートメントに存在する。一部はタンパク質の輸送に関係しており、細胞が熱ショック、グルコース枯渇等のストレス下で生存するのを可能にする(Gething ら,Nature 1992; 355:33-45;Caplan, Trends Cell. Biol. 1999; 9:262-268;Linら,Mol. Biol. Cell. 1993; 4:109-1119;Bergeron ら,Trends Biochem. Sci. 1994;19:124-128)。ER内の分子シャペロンの中で特性が最も明らかになっているのは、Bip(免疫グロブリン重鎖結合タンパク質、Grp78)である(Haas, Curr. Top. Microbiol. Immunol.1991; 167:71-82)。他の分子シャペロンと同様に、Bipは、ER内で、多数の成熟途上の分泌タンパク質及び膜タンパク質と相互作用するが、この相互作用は、フォールディングが円滑に進行する場合は、通常は弱く、短期間で終わる。天然型のタンパク質コンフォメーションが実現されると、分子シャペロンはもはやそのタンパク質とは相互作用しない。フォールディング、組織化、又は適正なグリコシル化が行われないタンパク質へのBipの結合は安定的になり、ER関連分解経路を介したタンパク質の分解を導く。このプロセスは、ERの「品質管理」システムとして機能し、一方で、正しく折り畳まれ、かつ組織化されたタンパク質だけが更なる成熟のためにERから輸送され、他方で、正しく折り畳まれていないタンパク質が保持され、引き続き分解に供されることを確実にする(Hurtley ら,Annu. Rev. Cell. Biol. 1989;5:277-307)。
【0012】
特定のDNA変異は、変異型タンパク質の正しいフォールディングを更に妨げる(多くの場合は不可能にする)アミノ酸置換を生じさせる。これらの誤ったフォールディングを是正するために、研究者らは様々な分子の使用を試みてきた。高濃度のグリセロール、ジメチルスルホキシド(DMSO)、トリメチルアミンN−オキシド(TMAO)、又は重水素水は、数種の疾患において、変異型タンパク質の分解経路を抑制し、細胞内輸送を増加させることが明らかにされている(Brown ら,Cell Stress Chaperones 1996;1:117-125;Burrows ら,Proc. Natl.Acad. Sci. USA. 2000; 97:1796-801)。これらの化合物は、一般的なタンパク質フォールディングを改善させる非特異的な化学シャペロンであると考えられているが、その機能の機序はまだ知られていない。このクラスの化合物は、細胞内におけるタンパク質フォールディングの欠陥を生化学的に試験するには有用であるが、効力を得るのに高用量を必要とするため、臨床で使用するのは困難又は不適切である。また、これらの化合物は特異性を有していない。
【0013】
〔特異的シャペロン戦略〕
従来の特許及び刊行物には、内因性の酵素タンパク質(具体的には、誤って折り畳まれたリソソーム酵素)をER品質管理機構による分解から救済する治療戦略が記載されている。この戦略では、特定のリソソーム障害に関連する欠陥リソソーム酵素に対して特異的な小分子の可逆的競合阻害剤を用いる。この戦略は、次のとおりである。変異型酵素タンパク質はER内では誤って折り畳まれるので(Ishii ら,Biochem. Biophys. Res. Comm. 1996;220:812-815)、この酵素タンパク質は正常の輸送経路(ER→ゴルジ装置→エンドソーム→リソソーム)では遅滞し、急速に分解される。このため、変異型タンパク質の正しいフォールディングを促進する機能性化合物は、変異型タンパク質に対する部位特異的シャペロンとして機能し、ER品質管理システムからの円滑な脱出を促進する。インビトロにおいて、酵素の触媒中心を占め、そのコンフォメーションを安定化させる酵素阻害剤が存在することは知られている。従って、これらの特異的シャペロンは、活性部位特異的シャペロン(ASSC)と称することができる。
【0014】
この戦略は、Fan らへ付与された米国特許第6,274,597号、第6,583,158号、第6,589,964号及び第6,599,919号、並びに2002年11月26日に出願された係属中の米国特許出願第10/304,396号において、リソソーム蓄積症に関与する酵素に関して具体的に明らかにされている。上記特許及び出願の内容はそのまま、レフファレンスとして本明細書に包含される。例えば、ガラクトースの小分子誘導体であり、変異型ファブリー酵素 α−ガラクトシダーゼA(α−Gal A)の強力な競合阻害剤である1−デオキシガラクトノジリマイシン(DGJ)は、中性pHで変異型α−Gal A(R301Q)のインビトロ安定性を効果的に高め、R301Q又はQ279E変異を有するファブリー病患者から株化したリンパ芽球における変異型酵素活性を増強した。更に、変異型(R301Q)α−Gal Aを過剰発現するトランスジェニックマウスへのDGJの経口投与は、主要臓器中の酵素活性を大幅に上昇させた(Fan ら,Nature Med. 1999; 5:112-115)。ミスフォールディング(誤って折り畳まれた)タンパク質の救済の成否は、酵素阻害濃度が必要とされる基質剥奪手法とは対照的に、酵素を完全に阻害するのに必要な濃度より低い特異的阻害剤のインビボ濃度が実現されるかどうかによる。
【0015】
リソソーム蓄積症に加えて、現在では極めて多数の、かつ多様な疾患が、ER内のタンパク質の遅滞と、タンパク質の最終的な分解とを引き起こす非天然型のタンパク質コンフォメーションの採用に起因するコンフォメーション疾患であると認識されている(Kuznetsov ら,N. Engl. J. Med. 1998;339:1688-1695;Thomas ら,TrendsBiochem. Sci. 1995; 20:456-459;Bychkova ら,FEBS Lett. 1995; 359:6-8;Brooks, FEBS Lett.1997; 409:115-120)。ASSCは、酵素以外の変異型タンパク質の発現を支援することが明らかにされている。例えば、小さな合成化合物が、変異型の癌抑制タンパク質p53のDNA結合ドメインを安定化させ、それによってそのタンパク質に活性コンフォメーションを維持させることが見出されている(Foster ら,Science 1999; 286:2507-10)。受容体の合成は、小分子の受容体アンタゴニスト及びリガンドによって支援されることが明らかにされている(Morello ら,J. Clin. Invest. 2000; 105:887-95;Petaja-Repo ら,EMBO J. 2002; 21: 1628-37)。膜チャネルタンパク質、及びその他の細胞膜トランスポーターの薬理学的な救済も、チャネル遮断薬又は基質を用いて明らかにされている(Rajamani ら,Circulation 2002; 105:2830-5;Zhou ら,J. Biol. Chem. 1999; 274:31123-26;Loo ら,J. Biol. Chem 1997; 272:709-12)。上記参考文献はすべて、ASSCが、酵素、受容体、膜チャネルタンパク質及びDNA転写調節因子を含む(それらに限定されない)変異型タンパク質を特異的に救済することができることを示している。
【0016】
ASSCはまた、変異型タンパク質に加えて、野生型タンパク質を安定化させ、それらの産生量及び安定性の増大させることが明らかにされている。1つの例として、特異的ASSCであるDGJは、野生型α−GalA配列をコードするベクターでトランスフェクトされたCOS−7細胞内で、野生型α−GalAの量及び活性を増大させることができることが明らかにされている。ASSCは、本来ならばER品質管理システム内で遅滞するはずの過剰発現した野生型酵素を救済する。これは、COS−7細胞内の酵素の過剰発現及び過剰産生がこのシステムの能力を超えており、凝集及び分解を生じさせるためである(2003年2月28日出願の米国特許出願第10/377,179号を参照されたい)。
【0017】
要約すると、当分野では、補充タンパク質の投与を要するタンパク質欠損症又はその他の障害の治療等におけるタンパク質補充療法の生物学的効率及び費用効率を改善する方法が必要とされている。
【発明の概要】
【0018】
本発明は、精製タンパク質の安定性を高める方法であって、薬学的に許容される担体中の前記タンパク質を活性部位特異的シャペロンと接触させることを含む方法を提供する。
【0019】
精製タンパク質は組換えタンパク質であってもよく、また、活性を保持していれば、全長型及び切断型のいずれであってもよい。
【0020】
本発明はまた、タンパク質のシェルフライフをインビトロで延長させる方法であって、薬学的に許容される担体中の前記タンパク質を活性部位特異的シャペロンと接触させることによって行う方法を提供する。
【0021】
薬学的に許容される担体中のタンパク質は、凍結乾燥されていても、水溶液にされていてもよい。
【0022】
本発明は更に、薬学的に許容される担体中の精製タンパク質を投与された個体において、前記タンパク質の半減期を延長させ、前記タンパク質のインビボ活性を持続させる方法であって、薬学的に許容される担体中で前記タンパク質を活性部位特異的シャペロンと接触させることを含む方法を提供する。
【0023】
本発明は、タンパク質補充を必要とする障害(例えば、タンパク質欠損性障害)を有する個体を治療する方法であって、前記個体に、精製された補充タンパク質と、前記補充タンパク質を安定化することができる活性部位特異的シャペロン(ASSC)と、を投与することを含む方法を提供する。
【0024】
1つの態様では、補充タンパク質はコンフォメーション障害に関連するタンパク質である。
【0025】
好ましい態様では、コンフォメーション障害はリソソーム蓄積症である。
【0026】
1つの態様では、リソソーム蓄積症はファブリー病である。
【0027】
別の態様では、リソソーム蓄積症はゴーシェ病である。
【0028】
本発明はまた、タンパク質補充療法と同時に、ERにおける欠陥のあるフォールディング又はプロセシングに起因して欠損している変異型の内因性タンパク質の安定性を高める方法を提供する。内因性タンパク質の安定性及び活性は、変異型タンパク質に対応する投与された補充タンパク質の安定性が高まると同時に増強される。
【0029】
本発明は更に、非哺乳動物宿主細胞によって組換えタンパク質の産生量を増加させる方法であって、前記タンパク質に対するASSCを含有する培地中で前記宿主細胞を前記ASSCと接触させることによって行う方法を提供する。
【0030】
本発明は更に、薬学的に許容される担体中に、精製タンパク質と、前記タンパク質に対するASSCと、を含有する組成物を提供する。
【図面の簡単な説明】
【0031】
【図1】図1は、ヒト野生型α−Gal A cDNAを含有する組換えバキュロウイルスを感染させたSf−9細胞の培地から精製した野生型α−Gal A、及びヒト変異型(R301Q)α−Gal Aを過剰発現するトランスジェニックマウスの心臓のホモジネートとして収集された変異型α−Gal Aの安定性が各々、部位特異的シャペロンである1−デオキシガラクトノジリマイシン(DGJ、1μM)を用いることによって向上したことを明らかにしている。これらのマウスには、実験前1週間、飲料水として0.5mM DGJを与えた。変異型(A)及び野生型(B)の酵素は各々、変異型酵素に対しては37℃で、野生型酵素に対しては42℃で、0.1Mクエン酸−リン酸緩衝液(pH7.0)中、濃度1μM(○)、0.1μM(●)、0.03μM(◆)又は0μM(DGJなし;◇)のDGJの存在下でプレインキュベートした。酵素活性は、プレインキュベーションが行われていない酵素に対する相対値で報告されている。DGJは、変異型及び野生型の酵素の変性/分解を防止する安定剤として機能することができる。
【発明を実施するための形態】
【0032】
本発明は、タンパク質を活性部位特異的シャペロン(ASSC)と接触させることによって、疾患又は障害を治療するためのタンパク質補充療法の有効性を向上させる点で有利である。本発明の利点は、(a)非哺乳動物細胞からのタンパク質の産生効率の向上、(b)シェルフライフの長期化、並びにインビボ半減期及び活性の改善に現れる、治療用タンパク質の安定性の向上、(c)細胞膜の横断を含む生体内移動の過程における、タンパク質活性部位の構造の維持、及び(d)合成中に誤って折り畳まれ、結果的に小胞体から除去される内因性変異型タンパク質の救済、からもたらされる。
【0033】
本発明は更に、タンパク質と、そのタンパク質を特異的に安定化する活性部位特異的シャペロン(ASSC)と、を含有する製剤を提供する。
【0034】
本発明は、ASSCを、遺伝子障害及びその他の障害の治療のための、タンパク質補充療法との併用療法において用いることができるという発見に基づいている。ASSCは、当分野で既知の方法により、スクリーニングし、同定することができる。特定の障害に対して有用な特異的なASSCが同定されると、ASSCは、タンパク質補充療法を受けている患者に、適切な細胞コンパートメントへの補充タンパク質の取込みを増大させ、循環中の、また、必要に応じて細胞内への輸送中のタンパク質の安定性を向上させるために投与することができる。シャペロンは、製造中、保管中及びインビボ使用中の活性型タンパク質を安定化することができる。
【0035】
〔定義〕
本明細書で用いる用語は一般に、本発明の状況、及び各用語が使用される特定の状況において、当分野における通常の意味を有する。本発明の組成物及び方法、並びにその製造方法及び使用方法を説明するに際して、実施者への追加の指針を提供するために、一定の用語については、下記で、又は本明細書のいずれかの箇所で考察する。
【0036】
固有の定義: 「タンパク質補充」という用語は、非天然型の精製タンパク質を、そのようなタンパク質を欠損している個体に導入することを意味する。投与されるタンパク質は、天然から(例えば、RSV又は単核球症を治療するためのヒトガンマグロブリンから)、又は(下記で詳細に説明するように)組換え発現によって得ることができる。この用語は更に、本来ならば精製タンパク質の投与を必要とする、又はそれが有益である、例えば、タンパク質不全症に罹患している個体に、精製タンパク質を導入することも意味する。導入されるタンパク質は、インビトロで製造された精製組換えタンパク質であっても、例えば、胎盤若しくは動物の乳汁等、単離された組織若しくは液体から、又は植物から精製されたタンパク質であってもよい。
【0037】
「タンパク質欠損症を特徴とする障害」という用語は、タンパク質の欠如又は不足によって生じる病態を示すあらゆる障害を意味する。この用語は、生物学的に不活性なタンパク質産物を生じさせるタンパク質フォールディング障害(すなわちコンフォメーション障害)を包含する。タンパク質不全症は、感染症、免疫抑制、臓器不全、腺機能異常、放射線病、栄養欠乏症、中毒、又はその他の環境若しくは外界に起因する障害に伴うものであってもよい。
【0038】
「正しいコンフォメーションを安定化させる」という用語は、化合物又はペプチド又はその他の分子が、野生型若しくは変異型のタンパク質の構造を天然の形若しくは適正な形に維持することができるように、野生型タンパク質に、又はインビトロで(例えば、製剤中で)、及びインビボで野生型の機能を発揮することができる変異型タンパク質に結合することができることを意味する。この効果は、実地では、(i)タンパク質のシェルフライフの向上、(ii)タンパク質の単位/量当たりの活性の上昇、又は(iii)インビボにおける効力の増大、のいずれか一つ、又は二つ以上を通じて現れてもよい。これは、発現中のERからの収率の上昇、温度上昇に起因するアンフォールディングに対する抵抗性の増大、又は不安定化剤の存在を通じて、また、類似の手段によって、実験で観察することができる。
【0039】
本明細書では、「コンフォメーション障害」又は「コンフォメーション疾患」という用語は、ER内におけるタンパク質の遅滞及び破壊をもたらす可能性があり、通常は、正常の生物学的活性を備える自然条件下の野生型タンパク質によっては形成されないタンパク質コンフォメーションを採用することによって生じる障害を意味する。タンパク質レベルの低下は、生理学的不均衡を生じさせ、疾患又は障害として現れる。ある特定の態様では、コンフォメーション障害はリソソーム蓄積症である。
【0040】
本明細書では、「活性部位」という用語は、何らかの特異的な生物学的活性を有するタンパク質の領域を意味する。例えば、それは、基質若しくはその他の結合パートナーに結合し、化学結合の生成及び破壊に直接関与するアミノ酸残基を提供する部位であってもよい。本発明における活性部位は、酵素の触媒部位、抗体の抗原結合部位、受容体のリガンド結合ドメイン、調節因子の結合ドメイン、又は分泌タンパク質の受容体結合ドメインを包含してもよい。これらの活性部位はまた、転写因子及び調節因子の転写活性化ドメイン、タンパク質−タンパク質相互作用ドメイン又はDNA結合ドメインも包含してもよい。
【0041】
本明細書では、「活性部位特異的シャペロン」という用語は、タンパク質活性部位と特異的相互作用を可逆的に行い、安定的な分子コンフォメーションの形成を促進するタンパク質、ペプチド、核酸、炭水化物等を含むあらゆる分子を意味する。本明細書では、「活性部位特異的シャペロン」という用語は、Bip、カルネキシン若しくはカルレティキュリンのような、細胞のERに存在する内因性の一般的シャペロン、又は重水素水、DMSO若しくはTMAOのような、一般的で非特異的な化学的シャペロンを包含しない。
【0042】
一般的な定義: 本明細書では、「精製(された)」という用語は、非関連物質(すなわち混入物)の存在を減少させ、又は排除する条件下で単離された物質を意味する。非関連物質には、目的の物質が得られる天然物質も含まれる。例えば、精製タンパク質は、好ましくは、細胞内で結合している他のタンパク質又は核酸を実質的に含んでいない。精製核酸分子は、好ましくは、細胞内で一緒に見出すことのできるタンパク質又は他の非関連核酸分子を実質的に含んでいない。本明細書では、「実質的に含んでいない」という用語は、物質の分析試験の状況において実効的に用いられる。混入物を実質的に含んでいない精製物質は、好ましくは純度95%以上であり、より好ましくは純度97%以上であり、更に好ましくは純度99%以上である。純度は、クロマトグラフィー、ゲル電気泳動、イムノアッセイ、組成分析、生物学的アッセイ、及び当分野で既知のその他の方法によって評価することができる。ある特定の態様では、「精製(された)」は、混入物のレベルが、ヒト又は非ヒト動物へ投与することができるレベルとして規制官庁が許容したレベル以下であることを意味する。
【0043】
好ましい態様では、「約」及び「およそ」という用語は、一般に、測定値の性質又は精度を前提として許容可能な、測定された数量に対する誤差の程度を意味する。典型的な誤差の程度は、例えば、所定の数値又は数値範囲の20パーセント(%)以内、好ましくは10%以内、より好ましくは5%以内である。或いは、特に生物学的な系では、「約」及び「およそ」という用語は、所定の数値の1桁の範囲内、好ましくは10倍又は5倍以内、より好ましくは2倍以内の数値を意味することもある。本明細書に示した数量は、特に断らない限り近似値である。これは、明示的に記載されていなくても、「約」又は「およそ」という用語の存在を推定することができることを意味する。
【0044】
「遺伝子」は、機能的「遺伝子産物」をコードするヌクレオチドの配列である。一般に、遺伝子産物は機能性タンパク質である。しかし、遺伝子産物は、RNA(例えば、tRNA又はrRNA)等の細胞内の別のタイプの分子であってもよい。本発明における遺伝子産物は、細胞内で見出すことのできるmRNA配列も意味する。
【0045】
「発現する」及び「発現」という用語は、遺伝子又はDNA配列内の情報を顕在化させること、例えば、RNA(例えば、rRNA若しくはmRNA)又はタンパク質を、対応する遺伝子又はDNA配列の転写及び翻訳に関与する細胞機能を活性化することによって産生することを意味する。DNA配列が細胞によって発現されると、RNA(例えば、mRNA若しくはrRNA)又はタンパク質等の「発現産物」が形成される。発現産物自体、例えば、結果的に生じるRNA又はタンパク質もまた、細胞によって「発現した」ということができる。
【0046】
「トランスフェクション」という用語は、細胞内への外来の核酸の導入を意味する。「形質転換」という用語は、宿主細胞が、導入された遺伝子又は配列を発現して所望の物質を産生するように、宿主細胞内に「外来」(すなわち外因性又は細胞外)の遺伝子、DNA配列又はRNA配列を導入することを意味する。所望の物質は、本発明では典型的には、導入された遺伝子若しくは配列によってコードされたRNA、又は導入された遺伝子若しくは配列によってコードされたタンパク質若しくは酵素である。導入された遺伝子又は配列は、「クローン化」された、又は「外来」の遺伝子又は配列と呼ばれることもあり、調節配列又は制御配列(例えば、細胞の遺伝子機構によって用いられる開始、終止、プロモーター、シグナル、分泌又はその他の配列)を含んでいてもよい。遺伝子又は配列は、非機能性配列、又は機知の機能を有しない配列を含んでいてもよい。導入されたDNA若しくはRNAを受容し、発現する宿主細胞は、「形質転換」されており、「形質転換体」又は「クローン」である。宿主細胞へ導入されるDNA又はRNAはいかなる細胞に由来してもよく、起源は、宿主細胞と同一の属若しくは種の細胞であっても、異なる属若しくは種の細胞であってもよい。
【0047】
「ベクター」、「クローニングベクター」及び「発現ベクター」という用語は、宿主を形質転換させて、導入配列の発現(例えば、転写及び翻訳)を促進するように、DNA配列又はRNA配列(例えば、外来遺伝子)を宿主細胞内に導入することができるビヒクルを意味する。
【0048】
「発現系」という用語は、例えば、ベクターによって運ばれ、宿主細胞に導入された外来DNAによってコードされているタンパク質の発現に適した条件下の、宿主細胞及びこれに適合するベクターを意味する。一般的発現系には、大腸菌(E. coli)宿主細胞及びプラスミドベクター、Sf9、Hi5若しくはS2細胞等の昆虫宿主細胞及びバキュロウイルスベクター、及び発現系、並びに哺乳動物宿主細胞及びベクターが含まれる。
【0049】
「変異型」及び「変異」という用語は、遺伝物質、例えば、DNA中のあらゆる検出可能な変化、又はこのような変化のあらゆるプロセス、機序若しくは結果を意味する。これには、遺伝子の構造(例えば、DNA配列)が変化させられる遺伝子変異、あらゆる変異プロセスから生じるあらゆる遺伝子又はDNA、及び改変された遺伝子又はDNA配列によって発現した発現産物(例えば、RNA、タンパク質又は酵素)が含まれる。
【0050】
本明細書では、「変異型タンパク質」という用語は、タンパク質配列の変化を生じさせる遺伝子変異を含有する遺伝子から翻訳されたタンパク質を意味する。ある特定の態様では、このような変異は、タンパク質がER内の通常の条件下で天然型コンフォメーションを実現することができない原因となる。このコンフォメーションが実現されないと、これらのタンパク質はタンパク質輸送系における正常な経路を通じて細胞内の正しい場所へ輸送されず、むしろ分解されてしまうことになる。変異には他に、活性の減少、又はより迅速な代謝回転を引き起こすことができるものがある。
【0051】
「野生型遺伝子」は、インビボで正常な機能的生物学的活性を保持することのできるタンパク質をコードする核酸配列を意味する。野生型核酸配列は、生物学的活性にほとんど又は全く影響を及ぼさないアミノ酸置換を生じさせるに過ぎない場合は、公表された既知の配列とは異なるヌクレオチドの変化を含んでもよい。「野生型」という用語はまた、内因性の、又は天然型のタンパク質と比較して、活性を上昇させ、又は増強させることのできるタンパク質をコードするように操作された核酸配列を含んでもよい。
【0052】
「野生型タンパク質」は、インビボで発現した、又は導入されたときに機能的生物学的活性を保持することのできる野生型遺伝子によってコードされているあらゆるタンパク質を意味する。「正常な野生型の活性」という用語は、細胞内のタンパク質の正常な生理学的機能を意味する。このような機能性は、タンパク質の機能性を示すことが知られているあらゆる手段によって試験することができる。
【0053】
「遺伝的に改変された」という用語は、特定の遺伝子産物をコードするコーディング配列を含有する核酸を、コーディング配列の発現を制御する調節エレメントと共に導入した後に、その遺伝子産物を発現する細胞を意味する。核酸の導入は、遺伝子ターゲティング及び相同的組換えを含む、当分野で既知のあらゆる方法によって行うことができる。本明細書では、この用語はまた、例えば、遺伝子活性化技術によって、そのような細胞では正常に発現されない内因性の遺伝子又は遺伝子産物を発現し、又は過剰発現するように遺伝子操作された細胞も意味する。
【0054】
「薬学的に許容される」というフレーズは、本発明の医薬組成物に関して用いられるかどうかに関わらず、生理学的に許容され、ヒトに投与された場合に通常は、望ましくない反応を生じない分子的実体及び組成物を意味する。本明細書では、「薬学的に許容される」という用語は、好ましくは、動物、より具体的にはヒトにおいて用いることができるものとして、米国連邦政府又は州政府の規制官庁によって承認されている、又は米国薬局方、若しくはその他の一般に認知された薬局方に記載されていることを意味する。「担体」という用語は、化合物と共に投与される希釈剤、アジュバント、賦形剤又はビヒクルを意味する。このような製薬学的担体は、無菌の液体(水、油等)であってもよい。水、生理食塩水、又はデキストロース若しくはグリセロールの水溶液は、好ましくは、担体として、特に注射液として用いられる。適切な製薬学的担体は、E. W. Martin の“Remington's Pharmaceutical Sciences”18th Edition に記載されている。
【0055】
「治療有効量」及び「有効量」という用語は、治療反応を生じさせるのに十分な化合物の量を意味する。ASSC及びタンパク質が複合体の形態で投与される態様では、「治療有効量」及び「有効量」という用語は、治療反応を生じさせるのに十分な複合体の量を意味する。治療反応は、使用者(例えば、臨床医)が治療に有効な反応として認識するどうような反応であってもよい。そこで、治療反応は一般に、疾患又は障害の一つ、又は二つ以上の症状の改善を意味する。
【0056】
精製された治療用タンパク質の生体内における生成中若しくは輸送中、又は保管中に阻害性を保持するASSCの濃度もまた、インビボで投与された場合のASSCの希釈(及び平衡状態の変化によって生じる結合の変化)、バイオアベイラビリティ及び代謝のために、本発明における「有効量」を構成してもよいことに留意すべきである。
【0057】
〔タンパク質欠損症を特徴とする障害〕
現在、特定の組織におけるタンパク質欠損又は機能喪失を特徴とする約1100種の遺伝性障害が知られている。理論上は、これらの障害はタンパク質補充療法によって治療可能である。本発明の方法は、現在又は将来において利用可能なタンパク質補充療法に用いるのに現在のところ適しているタンパク質に関する併用療法を企図している。このような障害では、個体のある一部の細胞又は全部の細胞が機能性のタンパク質を十分に有さず、又は不活性形のタンパク質を有し、又は生物学的機能に関して不十分なレベルのタンパク質を有する。
【0058】
更に、ERにおいて変異型タンパク質のフォールディングを変化させ、そのタンパク質の遅滞を生じさせ、結果的にタンパク質欠損症を発症させる変異に起因するコンフォメーション障害と同定された疾患のリストは増加しつつある。これには、嚢胞性線維症、α1−アンチトリプシン欠損症、家族性高コレステロール血症、ファブリー病、アルツハイマー病(Selkoe, Annu. Rev. Neurosci. 1994; 17:489-517)、骨形成不全症(Chessler ら,J. Biol. Chem. 1993;268:18226-18233)、炭水化物欠損性糖タンパク質症候群(Marquardt ら,Eur. J. Cell. Biol. 1995; 66:268-273)、マロトー・ラミー症候群(Bradford ら,Biochem. J. 1999; 341:193-201)、遺伝性盲目症(Kaushal ら,Biochemistry 1994; 33:6121-8)、グランツマン血小板無力症(Kato ら,Blood 1992; 79:3212-8)、遺伝性第VII因子欠損症(Arbini ら,Blood1996; 87:5085-94)、眼皮膚型白皮症(Halaban ら,Proc. Natl. Acad. Sci. USA. 2000; 97:5889-94)及びプロテインC欠損症(Katsumi ら,Blood 1996; 87:4164-75)が含まれる。近年、X連鎖疾患である副腎白質ジストロフィー(ALD)における1つの変異によって、欠陥のあるペルオキシソームトランスポーターのミスフォールディング(誤った折り畳み)が引き起こされたが、これは罹患細胞の低温培養によって救済することができた(Walter ら,Am J Hum Genet 2001; 69:35-48)。一般に、変異は遺伝子の全配列に渡って均一に発生すると認められている。このため、欠損しているタンパク質のミスフォールディングの結果生じる表現型が、多数の他の遺伝子障害において存在すると予測される。
【0059】
(リソソーム蓄積症)
遺伝性タンパク質欠損性障害の多くは酵素欠損症である。上述したように、大きな一群の遺伝性酵素障害はリソソーム酵素における変異を伴い、リソソーム蓄積症(LSD)とも呼ばれる。リソソーム蓄積症は、スフィンゴ糖脂質、グリコーゲン及びムコ多糖類の蓄積によって発症する疾患群である。リソソーム障害の例には、ゴーシェ病(Beutler ら,The Metabolic and Molecular Basesof Inherited Disease,8th ed.2001 Scriver ら(編),3635-3668頁,McGraw-Hill, New York)、GM1−ガングリオシドーシス(上記参照、3775-3810 頁)、フコシドーシス(The Metabolic and MolecularBases of Inherited Disease 1995. Scriver, C. R., Beaudet, A. L., Sly, W. S. andValle, D. (編),2529-2561 頁,McGraw-Hill,New York)、ムコ多糖症(上記参照、3421-3452 頁)、ポンペ病(上記参照、3389-3420 頁)、ハーラー・シャイエ病(Weismann ら,Science 1970; 169, 72-74)、ニーマン・ピック病A型及びB型(TheMetabolic and Molecular Bases of Inherited Disease 8th ed. 2001. Scriver ら(編),3589-3610 頁,McGraw-Hill, New York)及びファブリー病(上記参照、3733-3774 頁)が含まれるが、それらに限定されない。LSD及びそれらに関連する欠損性酵素のリストは、下記表1に記載した。以下では、そのうちの2種について具体的に考察する。
【0060】
ファブリー病:
ファブリー病は、欠損性リソソームα−ガラクトシダーゼA(α−GalA)活性によって生じるスフィンゴ糖脂質のX連鎖先天性代謝異常である(Desnickら,The Metabolic and Molecular Bases of InheritedDisease, 8th Edition Scriver ら(編),3733-3774 頁,McGraw-Hill, New York、2001;Bradyら,N. Engl. J. Med. 1967; 276, 1163-1167)。この酵素欠損は、α−ガラクトシル残基、主としてグロボトリアオシルセラミド(GL−3)を伴う中性スフィンゴ糖脂質の、体液及び組織リソソームにおける進行性沈着をもたらす。この疾患の発生頻度は、男性では約1:40,000であり、世界中の異なる人種で報告されている。古典的な態様で罹患した男性の場合、臨床症状には、被角血管腫、先端感覚異常、発汗減少症、並びに特徴的な角膜及び水晶体混濁(The Metabolic and Molecular Bases of Inherited Disease, 8th Edition2001, Scriver ら(編),3733-3774 頁,McGraw-Hill,New York)が含まれる。罹患した男性の余命は短縮され、心臓、脳、及び/又は腎臓の血管性疾患の結果として、通常は40年後又は50年後に死亡する。これとは対照的に、より軽度の「心臓型」の患者は、通常は5〜15%の正常α−Gal A活性を有し、左心室肥大又は心筋症を示す。古典的な患者が重度に易感染性であるのに対して、これらの心臓型患者は事実上無症候性のままである。近年、心臓型は、説明のつかない左心室肥大性心筋症に罹っている成人男性患者の11%において見出されたが、これはファブリー病が以前の推定より高い頻度で発症する可能性があることを示唆している(Nakao ら,N. Engl. J. Med. 1995; 333:288-293)。α−Gal A遺伝子はXq22にマッピングされており(Bishop ら,Am. J. Hum. Genet. 1985; 37:A144)、α−GalAをコードする全長cDNA及び全12−kbゲノム配列が報告されている(Calhoun ら,Proc. Natl. Acad. Sci. USA 1985; 82:7364-7368;Bishop ら,Proc. Natl. Acad. Sci. USA 1986;83:4859-4863;Tsuji ら,Eur. J.Biochem. 1987; 165:275-280;及び Komreich ら,Nucleic Acids Res. 1989; 17:3301-3302)。ファブリー病を生じさせる変異には、顕著な遺伝的異質性が存在する(The Metabolic and Molecular Bases of Inherited Disease, 8th Edition2001, Scriver ら(編),3733-3774 頁,McGraw-Hill,New York;Eng ら,Am. J. Hum.Genet. 1993; 53:1186-1197;Eng ら,Mol. Med. 1997; 3:174-182;及び Davies ら,Eur. J. Hum. Genet. 1996; 4:219-224)。現在までに、小さな欠失及び挿入、並びにより大きな遺伝子再構成に加えて、様々なミスセンス変異、ナンセンス変異及びスプライシング変異が報告されている。
【0061】
ゴーシェ病:
ゴーシェ病は、脂肪グルコセレブロシドを分解するリソソーム酵素β−グルコセレブロシダーゼの欠損症である。脂肪はその後、大部分が肝臓、脾臓及び骨髄に蓄積する。ゴーシェ病は、疼痛、疲労、黄疸、骨損傷、貧血、そして死亡さえ生じさせる可能性がある。ゴーシェ病には3つの臨床的表現型がある。I型の患者は若年期又は青年期に罹患し、外傷を受けやすく、貧血に起因する疲労、低血小板、肝臓及び脾臓の肥大、骨格の弱体化を経験し、場合によっては、肺障害及び腎障害を抱える。脳併発の徴候はない。早期に発症するII型では、肝臓及び脾臓の肥大は3カ月齢までに発生し、広範な脳併発が見られる。2歳までは死亡率が高い。III型は、肝臓及び脾臓の肥大、並びに脳発作を特徴とする。β−グルコセレブロシダーゼ遺伝子は、ヒトlq21染色体上に位置する。そのタンパク質前駆体は536アミノ酸を含有し、その成熟タンパク質は497アミノ酸長である。
【0062】
ゴーシェ病は東欧出身のユダヤ人の子孫(アシュケナジ)の間でかなり一般的に見られるが、いかなる民族の人間も罹患する可能性がある。ゴーシェ病は、アシュケナジユダヤ人集団間では最も一般的な遺伝子障害であり、その発生率はおよそ450人に1人である。一般の人々では、およそ100,000人に1人がゴーシェ病に罹患する。全米ゴーシェ財団(National Gaucher Foundation)によると、2,500人の米国人がゴーシェ病に罹患している。
【0063】
(その他の酵素欠損性障害)
グルコース6−リン酸デヒドロゲナーゼ(G6PD)欠損症は、最も一般的なX連鎖ヒト酵素欠損症である。G6PD酵素は、DNA及びRNA両方の必須成分であるリボースの産生に不可欠な酸化/還元反応を触媒する。G6PDは更に、細胞の内部のNADPHを適正なレベルに維持することにも関与している。NADPHは数多くの生合成反応において必要な補因子である。この欠損症を有する個体は、新生児黄疸、腹痛及び/又は背痛、めまい、頭痛、呼吸困難(不規則呼吸)及び動悸を含む臨床症状を呈する。
【0064】
酵素欠損症には、遺伝性障害の他に、原発性又は続発性障害から生じる組織又は器官に対する損傷に起因するものもある。例えば、膵臓組織の損傷、又は膵炎はアルコール依存症によって生じ、消化に必要な膵酵素の欠損症を生じさせる。現在、膵炎は酵素補充療法を用いて治療されている。
【0065】
【表1−1】

【0066】
【表1−2】

【0067】
〔タンパク質補充療法を用いて治療されるその他の障害〕
タンパク質欠損症を特徴とする障害の他にも、補充タンパク質を投与して、生物学的プロセスを強化又は刺激することによって治療される障害がある。例えば、貧血を有する個体には、組換えエリスロポエチン(EPOGEN(登録商標)、PROCRIT(登録商標)、EPOIETIN(登録商標))を投与して、赤血球の産生を刺激し、組織への酸素の輸送を増加させる。更に、組換えインターフェロンである、インターフェロンα2b(INTRON A(登録商標)、PEG−INTRON(登録商標)、REBETOL(登録商標))及びインターフェロンβ1a(AVONEX(登録商標)、BETASERON(登録商標))は各々、B型肝炎及び多発性硬化症を治療するために投与される。投与されるタンパク質としては他にも、嚢胞性線維症の患者の肺機能を改善するために用いられる、DNAを選択的に開裂する酵素である組換えヒトデオキシリボヌクレアーゼI(rhDNase−PULMOZYME(登録商標))、甲状腺亜全摘術又は甲状腺全摘術を受け、そのため甲状腺ホルモンを摂取しなければならない甲状腺癌患者に用いるために開発された組換え甲状腺刺激ホルモン(THYROGEN(登録商標))、化学療法に起因する好中球減少症を治療するための組換えG−CSF(NEUPOGEN(登録商標))、及び膵炎を有する個体における消化酵素がある。タンパク質療法はまた、高度に特異的で、明確な活性部位を有する抗体を用いた感染症及び癌の治療といった領域においても重要である。抗体治療薬には、RS(respiratory syncitial)ウイルスに対するRESPIRGRAM(登録商標)、乳癌に対するHERCEPTIN(登録商標)、関節炎及び炎症性疾患に対するREMICAID(登録商標)及びHUMIRA(登録商標)等がある。抗体に対するASSCは周知であり、標的抗原又は構造的に連関するアナログ(例えば、活性標的の修飾体又は類似体)を用いることができる。タンパク質療法用のものとして、現在市販されている、又は臨床試験で評価されているタンパク質のリストについては、下記表2を参照されたい。
【0068】
【表2−1】

【0069】
【表2−2】

【0070】
【表2−3】

【0071】
【表2−4】

【0072】
〔タンパク質欠損性障害及びその他の障害の治療〕
既に簡単に触れたが、遺伝子治療、タンパク質補充療法、及び小分子阻害剤療法は、タンパク質欠損症から生じる遺伝子障害、及び補充タンパク質の投与が有益な障害の治療のための治療戦略として開発されてきた。
【0073】
タンパク質補充療法は、野生型の、又は生物学的機能を有するタンパク質を外部から注入することによってタンパク質の量を増加させるものである。この療法は、上述した、ゴーシェ病及びファブリー病を含む多数の遺伝子障害のために開発されてきた。野生型酵素は、組換え細胞発現系(例えば、哺乳動物細胞又は昆虫細胞− Desnick らへの米国特許第5,580,757号;Selden らへの米国特許第6,395,884号及び第6,458,574号;Calhoun らへの米国特許第6,461,609号;Miyamura らへの米国特許第6,210,666号;Selden らへの米国特許第6,083,725号;Rasmussen らへの米国特許第6,451,600号;Rasmussen らへの米国特許第5,236,838号;並びに Ginns らへの米国特許第5,879,680号を参照されたい)、ヒト胎盤、又は動物の乳汁(Reuser らへの米国特許第6,188,045号を参照されたい。)から精製される。注入後、外因性酵素は、非特異的な、又は受容体特異的な機序を介して組織に取り込まれると考えられる。一般に、取込み効率は高くなく、外因性タンパク質の循環時間は短い(Ioannu ら,Am. J. Hum. Genet. 2001; 68:14-25)。更に、外因性タンパク質は不安定であり、細胞内で急速な分解を受けやすい。
【0074】
タンパク質補充療法及び遺伝子治療の他にも、LSDの治療に関して、酵素阻害剤を用いる小分子療法、すなわち上述した欠損酵素前駆体の基質の剥奪に対して有用な小分子阻害剤が報告されている。小分子阻害剤は、ファブリー病、ゴーシェ病、ポンペ病、テイ・サックス病、サンドホフ病及びGM2ガングリオシドーシス等のLSDの治療に関して報告されている(Platt らへの米国特許第5,472,969号、第5,580,884号、第5,798,366号及び第5,801,185号を参照されたい)。
【0075】
〔ASSC及びタンパク質補充を用いる併用療法〕
本発明は、インビトロでは製剤又は組成物中の精製タンパク質の安定性を高めて、また、インビボでは、タンパク質に対するASSCを共投与することによってそのタンパク質の安定性を高めて、タンパク質補充療法の有効性を増加させるものである。標的タンパク質に対する好適なASSCのスクリーニングは、例えば、2003年2月28日出願の米国特許出願第10/377,179号(この開示内容はそのまま、レファレンスとして本明細書に包含される。)に記載されているような、当分野における通常の方法を用いて行うことができる。
【0076】
(補充タンパク質の製造)
本発明の方法を用いて治療することができる障害には、LSD、グルコース6−リン酸デヒドロゲナーゼ欠損症、遺伝性気腫、家族性高コレステロール血症、家族性肥大型心筋症、フェニルケトン尿症、貧血、B型肝炎及び多発性硬化症が含まれるが、これらに限定されない。
【0077】
本発明の方法に有用な補充タンパク質は、当分野の範囲内の通常の分子生物学、微生物学及び組換えDNAの技術を用いて単離精製することができる。例えば、補充タンパク質をコードする核酸は、文献記載の組換えDNAの発現を用いて単離することができる。例えば、Sambrook, Fritsch & Maniatis, Molecular Cloning: A LaboratoryManual, Second Edition (1989), Cold Spring Harbor Laboratory Press, Cold SpringHarbor, New York(本明細書では、「Sambrook ら,1989」と記す);DNA Cloning: A Practical Approach,Volumes I and II(D. N. Glover 編、1985);Oligonucleotide Synthesis(M. J. Gait 編、1984);NucleicAcid Hybridization[B. D. Hames & S. J. EHiggins 編 (1985)];Transcription And Translation[B. D. Hames & S. J. Higgins 編 (1984)];Animal Cell Culture[R. I. Freshney 編 (1986)];Immobilized Cells And Enzymes[IRL Press, (1986)];B. EPerbal, A PracticalGuide To Molecular Cloning (1984);F. M. Ausubel ら(編),Current Protocols in Molecular Biology, John Wiley & Sons, Inc.(1994) を参照されたい。タンパク質をコードする核酸は、遺伝子が生物学的に活性なタンパク質をコードする限り、全長型及び切断型のいずれであってもよい。例えば、ファブリー病に関連する欠損酵素であるα−Gal Aの生物学的に活性な切断型は Miyamura らへの米国特許第6,210,666号に記載されている。
【0078】
同定単離された、標的タンパク質をコードする遺伝子は、次に適当なクローニングベクターに挿入することができる。当分野で既知の極めて多数のベクター−宿主系を用いることができる。使用可能なベクターにはプラスミド又は改変ウイルスが含まれるが、これらに限定されない。しかし、ベクター系は用いられる宿主細胞と適合しなければならない。ベクターの例としては、λ誘導体等の大腸菌バクテリオファージ、又はpBR322誘導体若しくはpUCプラスミド誘導体等のプラスミド(例えば、pGEXベクター、pmal−c、pFLAG等)が挙げられるが、それらに限定されない。クローニングベクターへの挿入は、例えば、相補的付着末端を有するクローニングベクターにDNAフラグメントをライゲートすることによって行うことができる。しかし、DNAをフラグメント化するために用いられる相補的制限部位がクローニングベクター内に存在しない場合は、DNA分子の末端を酵素によって修飾することができる。或いは、DNAの末端にヌクレオチド配列(リンカー)をライゲートすることによっていかなる所望の部位も作り出すことができる。これらのライゲートされたリンカーは制限エンドヌクレアーゼ認識配列をコードする化学的に合成された特異的なオリゴヌクレオチドを含んでもよい。組換えタンパク質の生産量は、N末端にシグナルペプチドを配置して分泌を促進すること、ポリアデニル化部位を含有する3’非翻訳配列を含めること等の遺伝子操作によって最大化することができる。
【0079】
好ましい態様では、宿主細胞に形質導入するのに用いられる構築体は、アデノウイルス、アデノ随伴ウイルス、ヘルペスウイルス、流行性耳下腺炎ウイルス、ポリオウイルス、レトロウイルス、シンドビスウイルス及びワクシニアウイルスを含む(それらに限定されない)ウイルスに由来するベクターである。
【0080】
組換え分子は、形質転換、トランスフェクション、感染、エレクトロポレーション等を介して、遺伝子配列の多数のコピーが生成されるように宿主細胞内に導入することができる。クローン化された遺伝子は、シャトルベクタープラスミドに含有されるのが好ましい。シャトルベクタープラスミドは、クローニング細胞(例えば、大腸菌)内で増殖し、容易に精製することができ、必要に応じて、引き続き適当な発現細胞系に挿入することができる。
【0081】
宿主−ベクター系になりうるものには、ウイルス(例えば、ワクシニアウイルス、アデノウイルス等)に感染した哺乳動物細胞系;ウイルス(例えば、バキュロウイルス)に感染した昆虫細胞系;酵母ベクターを含有する酵母等の微生物;又はバクテリオファージ、DNA、プラスミドDNA又はコスミドDNAを用いて形質転換された細菌が含まれるが、それらに限定されない。ベクターの発現エレメントは、その強度及び特異性において様々である。用いられる宿主−ベクター系に応じて、多数の適当な転写及び翻訳エレメントのいずれか一つを用いることができる。宿主細胞は各々、タンパク質の翻訳時及び翻訳後のプロセシング及び修飾(例えば、グリコシル化、[例えばシグナル配列の]分割)に関して、特徴的で特異的な機序を有している。発現した外来のタンパク質の所望の修飾及びプロセシング(グリコシル化、シアリル化、リン酸化等)が確実に行われるように、適当な細胞系又は宿主系を選択することができる。例えば、細菌系中の発現を用いると、非グリコシル化コアタンパク質産物を生成させることができる。しかしながら、細菌中で発現したタンパク質は正しく折り畳まれない可能性がある。酵母中の発現は、グリコシル化産物を生成することができる。真核細胞内の発現は、異種タンパク質が「天然の」グリコシル化及びフォールディングを受ける可能性を増大させることができる。更に、哺乳動物細胞内の発現は、タンパク質を再構成又は構成するための道具を提供することができる。更に、タンパク質分解性開裂等のプロセシング反応へ影響の程度は、ベクター/宿主発現系によって異なりうる。発現効率は、米国特許第6,274,597号に記載された特定のシャペロン、及び上述した関連するファミリーのメンバーの使用によって増加させることができる。
【0082】
組換え発現タンパク質の精製は、硫酸アンモニウム沈降法、並びに疎水性相互作用樹脂、カチオン交換樹脂、アニオン交換樹脂又はクロマトフォーカシング樹脂を含有するカラムクロマトグラフィーのような、当分野で既知の方法を用いて行うことができる。或いは、イムノアフィニティークロマトグラフィーを用いると、タンパク質に、又は組換えタンパク質に融合したタグに特異的に結合する適当なポリクローナル又はモノクローナル抗体を用いて、組換えタンパク質を精製することができる。好ましい態様では、本発明の方法に用いられる組換えタンパク質の純度は、少なくとも95%、好ましくは97%、及び最も好ましくは98%超である。
【0083】
(補充タンパク質の投与)
細胞による補充タンパク質の取込み及びターゲティングを行うために、多くの方法を用いることができる。膜輸送を媒介し、それによって細胞質にポリペプチドを送達することができるペプチド配列が同定されている。例えば、このようなペプチドは、アンテナペディア(Antennapedia)ホメオドメインヘリックス3に由来するものであり、ペネトラチン(国際公開公報第00/29427号;また、Fischer ら,J. Pept. Res. 2000; 55:163-72;DeRossi ら,Trends in Cell Biol. 1998; 8:84-7;Brugidou ら,Biochem. Biophys .Res. Comm.1995; 214:685-93 を参照されたい)、ヘルペス単純ウイルス由来のVP22タンパク質(Phelanら,Nat. Biotechnol. 1998; 16:440-3)、及びHIV TAT転写活性化因子等の膜輸送ベクターを生成することができる。アンテナペディアドメイン及びHIVTATドメイン(Vives ら,J. Biol. Chem. 1997;272:16010-17 を参照されたい。)を含むタンパク質形質導入ドメインは特徴的な正電荷を有し、このことによって、治療タンパク質及びDNAを細胞内へ運搬するのに用いることができるカチオン性 12-mer ペプチドの開発が導かれた(Mi ら,Mol. Therapy 2000; 2:339-47)。上述したタンパク質形質導入ドメインは、共有結合性の架橋が化学的に行われるか、又は融合タンパク質として生成されることによって、標的タンパク質に共有結合する。更に近年、非共有結合性の合成タンパク質形質導入ドメインが Active Motif Inc.(カリフォルニア州カールズバッド)によって開発された。このドメインは、疎水性相互作用を介して標的タンパク質と結合し、好都合なことに、一旦細胞の内側に入ると、タンパク質から解離する(Morris ら,Nat. Biotechnol. 2001; 19:1173-6)。更に、脂質担体が裸の(naked)DNAの送達に用いることができることは既に認められているが、近年、タンパク質を細胞内に送達することも明らかにされている(Zelphati ら,J. Biol. Chem. 2001; 276:35103-10)。タンパク質移送技術の概観については、Bonetta, The Scientist 2002; 16(7):38 を参照されたい。
【0084】
特定の態様では、本発明の方法で用いられる補充タンパク質はリソソーム蓄積症に関連する酵素である(表1参照)。このような酵素の野生型バージョンをコードする核酸の配列は、文献中に、又は GenBank 等の公開されたデータベースに見出すことができる。例えば、GenBankでは、α−Gal A(AGA)はX14448、ヒトグルコセレブロシダーゼ(GCB)はJ03059、ヒトα−イズロニダーゼ(IDUA)はM74715、ヒト酸性α−グルコシダーゼ(GAA)はM34424、ヒトイズロン酸2−スルファターゼ(IDS)はAF011889、ヒト酸性スフィンゴミエリナーゼ(ASM)はM59916である。
【0085】
LSDにおける酵素補充: LSDに対する補充酵素のいくつかは、現在、欧州及び米国において入手することができる。その例として、ゴーシェ病治療用の、グルコセレブロシダーゼの組換え型である Cerezyme(登録商標);αガラクトシダーゼAの組換え型である Fabrazyme(登録商標));MPS1治療用の組換え酵素であるAldurazyme(商標)(これらはすべて Genzyme Corp. 製である);及びポンペ病患者用の組換えαグルコシダーゼが挙げられる(Van den Hout ら,Lancet 2000; 56:397-8)。
【0086】
(活性部位特異的シャペロン)
本発明によって企図されたASSCとしては、基質又は結合パートナー類似体を含む小分子(例えば、分子量が約2kD未満である、より好ましくは分子量が約1kD未満である有機又は無機分子);小リガンド由来ペプチド又はそれらの類似体;DNA、RNA等の核酸;Fv及び一本鎖抗体を含む抗体、並びにFabフラグメント;高分子(例えば、分子量が約2kDを超える分子)、並びにD−及び/又はL−形アミノ酸のライブラリー等、コンビナトリアルケミストリーに由来するライブラリーのメンバー;ランダムな、又は部分的に縮重した定方向のホスホペプチドライブラリーのメンバー等のホスホペプチドが挙げられるが、それらに限定されない(例えば、Songyang ら,Cell 1993; 72:767-778 を参照されたい)。
【0087】
合成ライブラリー(Needels ら,Proc. Natl. Acad. Sci. USA 1993;90:10700-4;Ohlmeyer ら,Proc. Natl. Acad. Sci. USA 1993;90:10922-10926;Lamら,国際公開公報第92/00252号;Kocis ら,国際公開公報第94/28028号)は、本発明におけるASSCとなりうるものを提供するソースである。合成化合物ライブラリーは、Maybridge Chemical Co.(英国コーンウォール州 Trevillet)、Comgenex(ニュージャージー州プリンストン)、Brandon Associates(ニューハンプシャー州メリマク)、及び Microsource(コネチカット州ミルフォード)から市販されている。希少な化学ライブラリーは Aldrich(ウィスコンシン州ミルウォーキー)から入手可能である。或いは、細菌、真菌、植物及び動物抽出物の形状にある天然化合物のライブラリーは、例えば Pan Laboratories(ワシントン州ボセル)若しくは MycoSearch(ノースカロライナ州)から入手可能であり、又は、容易に作製することができる。更に、天然のライブラリー及び化合物、並びに合成的に製造したライブラリー及び化合物は、Res. 1986; 155:119-29 に記載の方法で容易に改変することができる。
【0088】
好ましい態様では、本発明に有用なASSCはリソソーム酵素の阻害剤であり、Asano ら,J. Med. Chem 1994; 37:3701-06;Dale ら,Biochemistry 1985; 24:3530-39;Goldman ら,J. Nat. Prod. 1996; 59:1137-42;Legler ら,Carbohydrate Res. 1986; 155:119-29 に記載されたグルコース及びガラクトースイミノ−糖誘導体を含んでいる。このような誘導体には、表1に列挙した化合物が含まれるが、それらに限定されない。これらの化合物の一部は、Toronto Research Chemicals, Inc.(カナダ国ノースヨーク)及びSigma 等の市販のソースから購入することができる。
【0089】
好ましい態様では、本発明に有用なASSCは、Dormer ら,J. Cell Sci. 2001; 114:4073-81 及び Ma ら,J. Biol. Chem. 2002; 277:37235-41 に記載されるようなベンゾ(c)キノリジニウム化合物を含む嚢胞性線維症膜貫通型コンダクタンス調節因子(CFTR)の活性化因子である。
【0090】
別の好ましい態様では、本発明に有用なASSCは、Petaja-Repo ら,EMBO J 2002; 21:1628-37;Morello ら,J. Clin. Invest. 2000; 105:887-95;Saliba ら,J. Cell Sci. 2002; 115:2907-18 に記載されている、Gタンパク質結合受容体(δオピオイド受容体、V2バソプレッシン受容体等)のリガンド、及び光色素のロドプシンである。
【0091】
別の好ましい態様では、本発明に有用なASSCは、Foster ら,Science 1999; 286:2507-10;Friedler ら,PNAS 2002; 99:937-42 に記載されている、p53のDNA結合ドメインを安定化させる化合物である。
【0092】
更に別の好ましい態様では、本発明のために有用なASSCは、Zhou ら,J. Biol. Chem. 1999; 274:31123-26;Taschenbergerら,J. Biol. Chem. 2002; 277:17139-46 に記載されている、ヒトQT延長症候群におけるHERGカリウムチャネル、家族性高インスリン症における膵ATP過敏性カリウム(KATP)チャネル等のイオンチャネルタンパク質のブロッカーである。
【0093】
(製剤)
一つの態様では、ASSC及び補充タンパク質は単一組成物で調製される。このような組成物は、保管中及びインビボ投与中のタンパク質の安定性を高め、それによって治療有効性を高める。製剤の投与経路としては、静脈内、皮下及び腹腔内投与のような非経口投与が好適であるが、経口、鼻腔内又は経皮的投与のような他の投与経路に適当な製剤も企図されている。
【0094】
別の態様では、補充タンパク質及びASSCは別個の組成物で調製される。この態様では、シャペロン及び補充タンパク質を、例えば、静脈内注入等の同一経路によって、又は例えば、補充タンパク質は静脈内注入で、ASSCは経口投与等の異なる経路で投与することができる。
【0095】
注射使用に適した医薬製剤には、無菌水溶液(水溶性)若しくは分散液、及び無菌注射液若しくは分散液の即時調製用無菌粉末が含まれる。いずれの場合にも、製剤は無菌でなければならず、容易に注射することが可能な程度に流動性を有しなければならない。製剤は、製造及び保管の条件下で安定性を有しなければならず、細菌及び真菌等の微生物の汚染作用から守られなければならない。担体は、例えば、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、ポリエチレングリコール等)、及びそれらの適当な混合物、並びに植物油を含有する溶媒及び分散媒であってもよい。適正な流動性は、例えば、レシチン等のコーティングの使用によって、必要な粒径の維持によって(分散液の場合)、また、界面活性剤の使用によって維持することができる。微生物の作用は、例えば、パラベン、クロロブタノール、フェノール、ベンジルアルコール、ソルビン酸等、種々の抗菌剤及び抗真菌剤によって防止することができる。多くの場合に、例えば、糖又は塩化ナトリウム等の等張性物質を含有させるのが好ましい。注射用組成物の持続性吸収は、例えば、モノステアリン酸アルミニウム、ゼラチン等、吸収を遅延させる物質を組成物中に用いることによって達成することができる。
【0096】
無菌注射液は、精製タンパク質及びASSCを上述した種々の他の成分と共に必要量だけ適当な溶媒中に溶解し、必要に応じて、その後に濾過又は最終滅菌を実施することによって調製される。一般に、分散液は滅菌された種々の有効成分を、基本分散媒、及び上述した成分から必要とされる他の成分を含有する無菌ビヒクル中に導入することによって調製される。無菌注射液調製用の無菌粉末の場合、調製方法としては、事前に滅菌濾過された溶液から、有効成分の粉末、及びその他のすべての所望成分が得られる、真空乾燥法及びフリーズドライ技術が好ましい。
【0097】
製剤は、賦形剤を含有するのが好ましい。製剤中に含めることのできる薬学的に許容される賦形剤は、クエン酸緩衝液、リン酸緩衝液、酢酸緩衝液、重炭酸緩衝液等の緩衝液;アミノ酸、尿素、アルコール、アスコルビン酸、リン脂質;血清アルブミン、コラーゲン、ゼラチン等のタンパク質;EDTA若しくはEGTA、及び塩化ナトリウム等の塩類;リポソーム;ポリビニルピロリドン;デキストラン、マンニトール、ソルビトール、グリセロール等の糖類;プロピレングリコール及びポリエチレングリコール(例えば、PEG−4000、PEG−6000);グリセロール;グリシン若しくはその他のアミノ酸;及び脂質である。製剤と共に用いる緩衝系としては、クエン酸緩衝液、酢酸緩衝液、重炭酸緩衝液及びリン酸緩衝液が挙げられる。リン酸緩衝液が好ましい。
【0098】
製剤は、非イオン性界面活性剤を含有するのが更に好ましい。好ましい非イオン性界面活性剤としては、ポリソルベート(Polysorbate)20、ポリソルベート80、トリトン(Triton)X−100、トリトンX−114、ノニデット(Nonidet)P−40、オクチルα−グルコシド、オクチルβ−グルコシド、ブリジ(Brij)35、プルロニック(Pluronic)及びトゥィーン(Tween)20が挙げられる。
【0099】
タンパク質及びシャペロン製剤を凍結乾燥するために、タンパク質濃度は0.1〜10mg/mLとすることができる。凍結乾燥混合物には、グリシン、マンニトール、アルブミン、デキストラン等の充填剤を添加することができる。更に、凍結乾燥混合物には、二糖類、アミノ酸、PEG等、凍結保護剤になりうる物質を添加することができる。上記に列挙した緩衝液、賦形剤及び界面活性剤のいずれも添加することができる。
【0100】
吸入投与用製剤は、ラクトース又はその他の賦形剤を含有していてもよい。或いは、ポリオキシエチレン−9−ラウリルエーテル、グリコール酸エステル又はデオキシコール酸エステルを含有している水溶液であってもよい。好ましい吸入用エーロゾルは、質量密度が小さく、径の大きい粒子を有することを特徴とする。1立方センチメートル当たり0.4g未満の質量密度、及び5μm超の平均径を備える粒子は、全身循環内に吸入用治療薬を効率的に送達する。このような粒子は肺内の奥深くへ吹き込まれ、吸入された粒子が治療上有効な装填物を送達するまで肺の天然浄化機構から免れる(Edwards ら,Science 1997; 276:1868-1872)。本発明の補充タンパク質製剤は、例えば、米国特許第5,654,007号、第5,780,014号及び第5,814,607号(これらの開示内容は、各々そのまま、レファレンスとして本明細書に包含される。)に記載の調製方法及び製剤を用いることによって、エーロゾル形で投与することができる。鼻腔内投与用製剤は、点鼻剤の形状で投与するために、すなわち鼻腔内に塗布されるゲルとして、油性溶液を含んでもよい。
【0101】
皮膚表面への局所投与用製剤は、組成物をローション、クリーム、軟膏、石けん等、皮膚学的に許容される担体を用いて組成物を分散させることによって調製することができる。特に有用であるのは、皮膚の上方で膜又は層を形成して、適用を局所化し、移動を阻害することができる担体である。体内組織の表面に局所投与するには、組成物を液状の組織接着剤、又は組織表面への吸着を強化するものとして既知である他の物質中に分散させればよい。或いは、ペクチン含有製剤等の組織コーティング液を用いてもよい。
【0102】
好ましい態様では、本発明の製剤は、規定用量の組成物が投与される点で便利なデバイス中の、液状又は粉末状の製剤として供給される。このようなデバイスとしては、皮下若しくは筋肉内注射のためのニードルレスインジェクター、及び定量エーロゾルデリバリーデバイスが挙げられる。場合によっては、製剤は、経皮的投与のために皮膚へ適用されるパッチ若しくはドレッシングのように徐放性放出に適した形状で、又は経粘膜投与用の分解性デバイスを介して供給することができる。製剤(例えば、ASSC)が錠剤又はカプセル剤の形で投与される場合は、製剤は取外し可能なカバー付きのボトルに入れた状態で、又はブリスター包装のパッチとして供給することができる。
【0103】
インビトロ安定性: 医薬製剤のシェルフライフ中の安定性を確保することは大きな課題である。タンパク質製剤を開発する前に、有効成分内の固有又は潜在的な不安定性を調査して対処しなければならない。タンパク質及びペプチド治療薬の不安定性は、化学的不安定性及び物理的不安定性に分類される。化学的不安定性の例は、加水分解、酸化及びアミド分解である。物理的不安定性の例は、表面への凝集、沈降及び吸着である。更に、タンパク質は、pH、温度、剪断応力、凍結/解凍応力、及びこれらの応力の組み合わせ等の応力を受ける可能性がある。
【0104】
製剤に関して最もよく知られた問題の一つは、生体内活性の損失を生じさせる製剤の凝集である。賦形剤の添加は、このプロセスを緩和することができるが、これを完全に防止することはできない。活性の損失は物理的アッセイによって検出することができる場合もできない場合もあり、大きな(時には15〜20%の)変動係数を備えるバイオアッセイ又は力価アッセイでしか明白にならないので、実際の損失量を決定するのは困難である。
【0105】
ASSCは、酵素の分解及び酵素タンパク質の凝集を防止することによって酵素活性を強化することが明らかにされている(Fan ら,Nat. Med. 1999; 5:112-5; 図1)。ASSC及び補充タンパク質が同一組成物中に含まれる態様では、本発明の調製組成物は、無菌性を保持し、また、これは重要なことであるが、適正な流通及び保管中に補充タンパク質の活性を保護するのに適した容器で提供することができる。投与されたタンパク質をインビボで安定化させることに加えて、ASSCは、インビトロでも補充タンパク質に可逆的に結合してそのコンフォメーションを安定化させ、それによって製剤の凝集及び分解を防止し、シェルフライフを延長させる。ASSC/補充タンパク質相互作用の分析結果は、例えば、示差走査熱量計、円偏向二色性等、当分野で周知の技術を用いて評価することができる。
【0106】
例えば、組成物の水性注射用製剤は、ニードル及びシリンジを用いて内容物を抜去するのに適したストッパー付きバイアルに入れて供給され、ASSCの存在は補充タンパク質の凝集を阻害する。バイアルは、単回使用型又は複数回使用型のいずれであってもよい。製剤はまた、プレフィルドシリンジとして供給することもできる。別の態様では、製剤は乾燥又は凍結乾燥状態にあり、これは標準的な、又は既製の生理的希釈液を用いて液体状態に戻すことを必要とする。この場合は、ASSCの存在は、液体状態に戻す間、また戻した後、補充タンパク質を安定化させて凝集を防止する。製剤が、静脈内投与ライン又はカテーテルへ接続されている滅菌バッグ中にある場合のように、静脈内投与用の液体である場合も、ASSCの存在は同一の利点を与える。
【0107】
投与される補充タンパク質を安定化させることに加えて、ASSCの存在は、医薬製剤を約7.0〜7.5の中性pHで保管することを可能にする。これは、通常は安定性を維持するために更に低いpHで保管しなければならないタンパク質にとっては、利点となる。例えば、表1に列挙した酵素のようなリソソーム酵素は、低いpH(例えば、5.0以下)で安定性のコンフォメーションを維持する。しかしながら、低いpHでの補充酵素の長期保管は、酵素及び/又は製剤の分解を促進するおそれがある。
【0108】
個別製剤: 補充酵素及びASSCが個別製剤中に含まれる場合は、ASSCは、上述したすべての形状を含めて、どの投与経路に適した形状であってもよい。例えば、無菌水溶液の形状であってもよく、また、投与前のインビトロの凝集を防止するために、液体状態に戻す間、また戻した直後に補充タンパク質の製剤に添加される凍結乾燥粉末の形状であってもよい。或いは、ASSCは、例えば、結合剤(例えば、事前にゼラチン化されたトウモロコシデンプン、ポリビニルピロリドン又はヒドロキシプロピルメチルセルロース)、充填剤(例えば、ラクトース、微結晶セルロース又はリン酸水素カルシウム)、潤沢剤(例えば、ステアリン酸マグネシウム、タルク又はシリカ)、錠剤分解剤(例えば、バレイショデンプン又はグリコール酸デンプンナトリウム)、湿潤剤(例えば、ラウリル硫酸ナトリウム)等、薬学的に許容される賦形剤を用いて、従来型の手段によって調製された錠剤又はカプセル剤の形状で経口投与用に調製することができる。錠剤を、当分野で周知の方法によってコーティングしてもよい。経口投与用の液体製剤は、例えば、液剤、シロップ剤若しくは懸濁剤の形状を取ってもよく、また、使用前に水若しくはその他の適当なビヒクルを用いて液体状態に戻す乾燥製剤として提供してもよい。このような液体製剤は、懸濁化剤(例えば、ソルビトールシロップ、セルロース誘導体又は水素化食用脂肪)、乳化剤(例えば、レシチン又はアカシア)、非水性ビヒクル(例えば、アーモンド油、油性エステル、エチルアルコール又は精留植物油)、保存料(例えば、p−オキシ安息香酸メチル又はプロピル又はソルビン酸)等、薬学的に許容される添加物を用いて、従来型の手段によって調製することができる。製剤はまた、必要に応じて、緩衝塩、着香剤、着色剤及び甘味剤を含んでもよい。経口投与用製剤は、活性化合物の制御された放出を生じさせるように適当に調製することができる。
【0109】
(投与)
投与経路は、静脈内、皮下、動脈内、腹腔内、点眼、筋肉内、経口腔、経直腸、経膣、眼窩内、大脳内、皮内、頭蓋内、髄腔内、脳室内、クモ膜下、槽内、関節内、肺内、鼻腔内、経粘膜、経皮及び吸入経由のいずれであってもよく、また、経口及び非経口のいずれであってもよい。
【0110】
上述した非経口製剤の投与は、製剤の定期的ボーラス注射であってもよく、また、外部(例えば、静注バッグ)又は内部(例えば、生体内分解性インプラント、人工臓器、若しくは補充タンパク質を産生する埋め込まれた細胞集団)にあるリザーバーからの静脈内又は腹腔内投与によって投与されてもよい。例えば、米国特許第4,407,957号及び第5,798,113号(これらの開示内容は、各々そのまま、レファレンスとして本明細書に包含される。)を参照されたい。肺内送達方法及び装置は、米国特許第5,654,007号、第5,780,014号及び第5,814,607号(これらの開示内容は、各々そのまま、レファレンスとして本明細書に包含される。)に記載されている。その他の有用な非経口送達システムには、エチレン−酢酸ビニルコポリマー粒子、浸透圧ポンプ、埋込み型注入システム、ポンプ送達、封入細胞送達、リポソーム送達、ニードル送達式注射、ニードルレス注射、ネブライザー、エーロゾル噴霧器、エレクトロポレーション及び経皮パッチが含まれる。ニードルレス注射器は、米国特許第5,879,327号、第5,520,639号、第5,846,233号及び第5,704,911号に記載されており、それらの開示内容は各々そのまま、レファレンスとして本明細書に包含される。上述した製剤は、いずれもこれらの方法で投与することができる。
【0111】
補充タンパク質及び/又はASSCの皮下注射は自己投与を可能にする利点を有しているが、更に、静脈内投与に比較して長い血漿半減期を生じさせる。更に、プレフィルド注射ペン及びニードルレス注射器等、患者に便宜なように設計された様々なデバイスは、本明細書で考察するように本発明の製剤と一緒に用いることができる。
【0112】
投与の時機: 補充タンパク質及びASSCが個別製剤中に含まれる場合は、同時に投与してもよく、又はASSCを補充タンパク質の前に、若しくは後に投与してもよい。例えば、補充タンパク質が静脈内投与される場合に、ASSCは0〜6時間の時間以内、又はその後に投与してもよい。或いは、シャペロンはタンパク質投与の0〜6時間前に投与してもよい。
【0113】
ASSC及び補充タンパク質が個別に投与され、ASSC(例えば、小分子)が短い循環中半減期を有する好ましい態様では、ASSCは循環中の一定レベルを維持するために、例えば、1日1回等、持続的に経口投与してもよい。このような一定レベルは、患者にとって非毒性であり、また、非阻害性の治療作用を付与するのに、投与中の標的補充タンパク質との相互作用に関して最適であると決定されているレベルである。
【0114】
別の態様では、ASSCは、補充タンパク質の代謝回転に必要とされる期間(これはASSCの投与によって延長される。)投与される。
【0115】
投与の時機とは無関係に、投与は、タンパク質及びASSCの濃度を、シャペロンがインビボにおけるタンパク質を安定化させるが、タンパク質の活性を防止又は阻害しないような濃度にして行われなければならない。これはまた、補充タンパク質及びASSCが同一製剤中で投与される場合にも当てはまる。
【0116】
インビボ安定性: インビトロ製剤について上述したように、補充タンパク質に対するASSCの存在は血漿半減期を延長させるという利点を有し、それによって長期間に渡り有効な補充タンパク質レベルが維持され、その結果、罹患組織の補充タンパク質への暴露が増加し、組織中へのタンパク質の取込みが増大する。これは、苦痛緩和の促進、投与頻度の減少、及び/又は投与量の減少といった、患者に有利な効果を与える。これはまた、治療コストを減少させる。
【0117】
野生型補充タンパク質を安定化させるのに加えて、ASSCはまた、例えば、LSD等のコンフォメーション障害の際に、ER内における正しいフォールディング及びプロセシングを妨害する変異の結果として欠損した内因性の変異型タンパク質の発現を安定化し、強化する。
【0118】
(用量)
投与されたタンパク質及び内因性の変異型タンパク質を安定化させるために有効なASSCの用量は、当業者によってタンパク質及び対応するASSCに応じて、個別的に決定することができる。補充タンパク質及びASSCの両方の半減期(tl/2)、ピーク血漿濃度(cmax)、ピーク血漿濃度に達するまでの時間(tmax)、曲線下面積(AUC)より求まる暴露量、及び組織分布、並びにASSC−補充タンパク質結合に関するデータ(親和性定数、結合及び解離定数、並びに結合価)等、薬物動態学的及び薬力学的データは、活性を阻害せずに補充タンパク質を安定化させ、その結果、治療効果を与えるのに必要な適合量を決定する、当分野で既知の通常の方法を用いて得ることができる。
【0119】
細胞培養アッセイ又は動物試験から得られたデータを用いると、ヒト及び非ヒト動物に適用すべき治療用量範囲を策定することができる。本発明の治療方法に用いられる化合物の用量は、毒性をほとんど又は全く有することなく、ED50濃度(試験した集団の50%に対して有効である濃度)を含む循環中濃度の範囲内にあるのが好ましい。いずれの治療に関しても、適用される特定の用量は、用いられる特定の剤形、用いられる投与経路、個体(例えば、患者)の状態等の要素に応じて、この範囲内で変動してもよい。
【0120】
治療有効量は、まず細胞培養アッセイから推定し、IC50を含む循環中濃度範囲に収まるように動物モデルで定式化することができる。化合物のIC50濃度は、(例えば、細胞培養アッセイから決定されるような、)症状が最も強く阻害される場合の半分の阻害が達成される濃度である。例えば、ヒト患者等、特定の個体に用いるのに適当な用量は、次に、そのような情報を用いてより正確に決定することができる。
【0121】
血漿中の化合物の測定値は、高速液体クロマトグラフィー(HPLC)、ガスクロマトグラフィー等の技術によって、患者等の個体においてルーチン的に測定することができる。
【0122】
組成物の毒性及び治療有効性は、標準的な薬学的手段によって、すなわち、例えば、細胞培養アッセイによって、又は実験動物を用いてLD50及びED50を決定することによって確認することができる。パラメータのLD50及びED50は当分野で周知であり、各々、集団の50%に対して致死性である化合物の用量、及び集団の50%にとって治療有効性である化合物の用量を意味する。毒性作用と治療作用との用量比は治療指数と言われており、比率:LD50/ED50として表示することができる。大きな治療指数を示すASSCが好ましい。
【0123】
現行の方法によると、補充タンパク質の濃度は、典型的には、週1回又は2週間に1回投与される場合、0.05〜5.0mg/kg(体重)である。タンパク質は、0.1μg/kg〜約10mg/kg、好ましくは約0.1mg/kg〜約2mg/kgの範囲内の用量で投与することができる。例えば、ファブリー病の治療のためには、組換えα−Gal Aの投与量は、典型的には0.1〜0.3mg/kgであり、週1回又は2週間に1回投与される。患者の生涯に渡って、タンパク質の定期的な繰返し投与が必要である。皮下注射は、薬剤へのより長期間の全身性曝露を維持する。皮下用量は、2週間に1回又は1週間に1回で、好ましくは体重1kg当たりα−GalA 0.1〜5.0mgである。α−Gal Aはまた、例えば、静脈内ボーラス注射、スロープッシュ静脈内注射で、又は持続的静脈内注射によって静脈内投与される。持続的IV注入(例えば、2〜6時間に渡って)は血中の一定レベルの維持を可能にする。
【0124】
ASSCの最適濃度は、その活性、組織中若しくは循環中のASSCのバイオアベイラビリティ、及び組織中若しくは循環中のASSCの代謝を妨害せずに、インビボ、組織中又は循環中の組換えタンパク質を安定化させるのに必要とされる量によって決定される。例えば、ASSCが酵素阻害剤である場合、阻害剤の濃度は酵素に対して特異的なシャペロンのIC50値を計算することによって決定することができる。化合物のバイオアベイラビリティ及び代謝を考慮すると、IC50値と同程度の濃度、又はIC50値をわずかに超える濃度は、酵素活性の量を増加させるのに必要な、又は投与された酵素の酵素活性を延長させるのに必要な阻害剤の量等、酵素活性に及ぼす作用に基づいて評価することができる。例えば、α−Gal A酵素に対する化合物デオキシガラクトノジリマイシン(DGJ)のIC50値は0.04μMであり、これはDGJが強力な阻害剤であることを示している。従って、α−GalAの細胞内濃度は投与されたα−Gal Aの細胞内濃度よりはるかに低いと推測される。以下の実施例を参照されたい。
【実施例】
【0125】
本発明を、以下に示す実施例によって更に説明する。このような実施例の使用は単に例示するためのものであり、決して本発明又は例示された用語の範囲及び意味を限定するものではない。同様に、本発明は、本明細書に記載した特に好ましい態様のいずれにも限定されるものではない。実際に、本発明の多数の修正態様及び変形態様は、本明細書を読めば、当業者には明らかであり、本発明の精神及び範囲から逸脱せずに実施することができる。従って、本発明は、添付の特許請求の範囲の条件、及び特許請求の範囲が及ぶ全範囲の等価物によってのみ限定されることになる。
【0126】
〔実施例1:ASSCを用いたα−Gal Aのインビトロ安定化〕
方法: 野生型α−Gal Aは、ヒト野生型α−Gal A cDNAを有する組換えバキュロウイルスで感染させたSf−9細胞の培地から精製し、変異型α−Gal Aは、ヒト変異型(R301Q)α−Gal Aを過剰発現するトランスジェニックマウスの心臓のホモジネートとして収集した。これらのマウスには、実験前1週間、飲料水として0.5mMDGJを与えた。変異型酵素及び野生型酵素は各々、変異型酵素に対しては37℃で、及び野生型酵素に対しては42℃で、0.1Mクエン酸−リン酸緩衝液(pH7.0)中、濃度1μM、0.1μM、0.03μMのDGJの存在下、又はDGJの非存在下でプレインキュベートした。野生型及び変異型(R301Q)α−GalAは、DGJ(種々の濃度)の非存在又は存在下で、ある期間に渡ってインキュベートし、この混合液を5容積の0.1Mクエン酸緩衝液(pH4.5)を用いて希釈した後、基質として4−MU−α−Gal Aを用いて残留酵素活性を決定した。酵素活性は、プレインキュベーションを実施していない酵素に対する相対値で報告されている。
【0127】
結果: 図1に示したように、変異酵素は、DGJ存在下のインキュベーションを行わずに、37℃で20分間、インキュベートした後は、中性pH下で安定性を示さなかった(図1A)。野生型酵素もまた、DGJ存在下のインキュベーションを行わずに、42℃でインキュベートすると、中性pH下で酵素活性を大きく損失した(図1B)。両方の酵素の安定性は、濃度1μMのDGJを含めることによって改善することができた。すなわち、反応混合液中には、60分間、80%を超える酵素活性が維持された。これは、ASSC(DGJ)が、変異型及び野生型酵素の変性/分解を予防する安定剤として機能することができることを示している。
【0128】
〔実施例2:ASSCを用いた野生型α−Gal Aの細胞内強化〕
方法: 組換えバキュロウイルスを用いてトランスフェクトした昆虫細胞又は組換えCHO細胞から精製したヒト野生型α−Gal Aは、従来の参考文献によれば、α−2−マクログロブリン(α−2−M)と複合体を形成することができる(Osada ら,Biochem Biophys Res Commun.1993; 142:100-6)。コーヒー豆由来α−Galとα−2−Mとの複合体は、ファブリー病ヘミ接合体由来の培養線維芽細胞によって細胞内へ取り込むことができるので、α−Gal A及びα−2−Mの複合体は同様に細胞によって細胞内へ取り込まれると考えられる。或いは、野生型α−Gal Aは、Blomら,Am JHum Gen. 2003; 72:23-31 に記載されているように、残留酵素活性を伴わないファブリー病患者由来の皮膚線維芽細胞の培地内に添加することもできる。
【0129】
結果: コーヒー豆α−Gal Aの半減期は、既に報告されているように約2時間である(Osada ら,Biochem Biophys Res Commun. 1987;143:954-8)。α−Gal A−α−2−M複合体、又は培地に添加されたα−Gal Aの半減期は、培地中にDGJを含めることによって延長させることができると考えられるが、それはDGJがインビトロにおける酵素の安定化に有効であることが明らかにされているからである(図1)。これは、DGJが、細胞によって細胞内に取り込まれた外因性α−Gal Aの持続時間を延長することができることを示すものである。
【0130】
〔実施例3:補充酵素の注入によって治療されたファブリー病マウスへのDGJの共投与〕
ファブリー病に対する酵素補充療法は、上述したように GenzymeCorporation によって開発されてきた。補充酵素の注入によって治療されたファブリー病ノックアウト(KO)マウスへのDGJの共投与は、安定性、例えば、補充酵素のインビボ半減期を増加させるが、それはASSCDGJが酵素を安定化させて分解を防止するためである。DGJは、既に報告されているプロトコールに従って、野生型α−GalAの注入後にKOマウスへ経口投与される(Ioannu ら,Am J HumGenet. 2001; 68:14-25)。心臓、腎臓、脾臓、肝臓及び肺、並びに血清を含む様々な組織中のα−GalA活性は、ある期間に渡って決定され、DGJを摂取していないコントロールマウス、及びDGJだけを摂取して酵素を摂取していないマウスからのα−Gal A活性と比較される。時間の延長は、ASSCの共投与が酵素補充療法の有効性を改善することができることを示すものである。
【0131】
本発明の範囲は、本明細書に記載の特定の態様によって限定されるものではない。実際に、本明細書に記載の態様以外の様々な修正態様は、上述の説明及び添付の図面から当業者には明らかである。このような修正態様は添付の特許請求の範囲内に含まれるものとする。
【0132】
この明細書を通じて、特許、特許出願、出版物、手順書等に言及してきたが、それらの開示内容はそのまま、レファレンスとして本明細書に包含される。
【特許請求の範囲】
【請求項1】
精製タンパク質の安定性を高める方法であって、
薬学的に許容される担体中の前記タンパク質を有効量の活性部位特異的シャペロンと接触させることを含む方法。
【請求項2】
前記精製タンパク質が酵素であり、前記活性部位特異的シャペロンが前記酵素の可逆的競合阻害剤である、請求項1記載の方法。
【請求項3】
前記酵素がリソソーム蓄積症に関連した酵素である、請求項2記載の方法。
【請求項4】
前記酵素がα−ガラクトシダーゼAである、請求項3記載の方法。
【請求項5】
前記酵素がβ−グルコセレブロシダーゼである、請求項3記載の方法。
【請求項6】
前記可逆的競合阻害剤が、次式:
【化1】

[式中、
R0はH又はC1〜C12アルキル鎖を表し、
R0’は、H、又は、場合によりフェニル基、ヒドロキシル基若しくはシクロヘキシル基で置換されている、1〜12個の炭素原子を含有する直鎖状若しくは分枝鎖状の飽和炭素鎖を表し、
R1及びR1’は独立して、H、OH、又は炭素数1〜4のアルキル基、アルコキシ基若しくはヒドロキシアルキル基を表し、
R2及びR2’は独立して、H、OH又はC1〜C12アルキル基を表し、
R4及びR4’は独立して、H又はOHを表し、
R7はH又はOHを表す。]
の化合物である、請求項4記載の方法。
【請求項7】
前記可逆的競合阻害剤が、1−デオキシガラクトノジリマイシン、α−アロ−ホモノジリマイシン、α−ガラクト−ホモノジリマイシン、α−1−C−ブチル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、N−メチル−カリステジンA3及びN−メチル−カリステジンB2からなる群より選ばれる化合物である、請求項6記載の方法。
【請求項8】
前記可逆的競合阻害剤が1−デオキシガラクトノジリマイシンである、請求項7記載の方法。
【請求項9】
前記可逆的競合阻害剤が、次式:
【化2】

[式中、
R0はH又はC1〜C12アルキル鎖を表し、
R0’は、H、又は、場合によりフェニル基、ヒドロキシル基若しくはシクロヘキシル基で置換されている、1〜12個の炭素原子を含有する直鎖状若しくは分枝鎖状の飽和炭素鎖を表し、
R1及びR1’は独立して、H、OH、又は炭素数1〜4のアルキル基、アルコキシ基若しくはヒドロキシアルキル基を表し、
R2及びR2’は独立して、H、OH又はC1〜C12アルキル基を表し、
R4はOHを表し、
R4’はHを表し、
R7はOHを表す。]
の化合物である、請求項5記載の方法。
【請求項10】
前記可逆的競合阻害剤が、イソファゴミン、N−ドデシル−イソファゴミン、N−ノニルイソファゴミン、N−ドデシル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、カリステジンB3及びカリステジンC1からなる群より選ばれる化合物である、請求項9記載の方法。
【請求項11】
前記可逆的競合阻害剤がイソファゴミンである、請求項10記載の方法。
【請求項12】
前記可逆的競合阻害剤がN−ドデシル−イソファゴミンである、請求項10記載の方法。
【請求項13】
タンパク質のシェルフライフをインビトロで延長させる方法であって、
薬学的に許容される担体中の前記タンパク質を有効量の活性部位特異的シャペロンと接触させることによって行う方法。
【請求項14】
前記タンパク質、前記薬学的に許容される担体、及び前記活性部位特異的シャペロンが凍結乾燥粉末の形態で調製される、請求項13記載の方法。
【請求項15】
前記タンパク質、前記薬学的に許容される担体、及び前記活性部位特異的シャペロンが無菌水溶液の形態で調製される、請求項13記載の方法。
【請求項16】
前記タンパク質が酵素であり、前記活性部位特異的シャペロンが前記酵素の可逆的競合阻害剤である、請求項13記載の方法。
【請求項17】
前記酵素がリソソーム蓄積症に関連している、請求項16記載の方法。
【請求項18】
前記酵素がα−ガラクトシダーゼAである、請求項17記載の方法。
【請求項19】
前記酵素がβ−グルコセレブロシダーゼである、請求項17記載の方法。
【請求項20】
前記可逆的競合阻害剤が、次式:
【化3】

[式中、
R0はH又はC1〜C12アルキル鎖を表し、
R0’は、H、又は、場合によりフェニル基、ヒドロキシル基若しくはシクロヘキシル基で置換されている、1〜12個の炭素原子を含有する直鎖状若しくは分枝鎖状の飽和炭素鎖を表し、
R1及びR1’は独立して、H、OH、又は炭素数1〜4のアルキル基、アルコキシ基若しくはヒドロキシアルキル基を表し、
R2及びR2’は独立して、H、OH又はC1〜C12アルキル基を表し、
R4及びR4’は独立して、H又はOHを表し、
R7はH又はOHを表す。]
の化合物である、請求項18記載の方法。
【請求項21】
前記可逆的競合阻害剤が、1−デオキシガラクトノジリマイシン、α−アロ−ホモノジリマイシン、α−ガラクト−ホモノジリマイシン、α−1−C−ブチル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、N−メチル−カリステジンA3及びN−メチル−カリステジンB2からなる群より選ばれる化合物である、請求項20記載の方法。
【請求項22】
前記可逆的競合阻害剤が1−デオキシガラクトノジリマイシンである、請求項21記載の方法。
【請求項23】
前記可逆的競合阻害剤が、次式:
【化4】

[式中、
R0はH又はC1〜C12アルキル鎖を表し、
R0’は、H、又は、場合によりフェニル基、ヒドロキシル基若しくはシクロヘキシル基で置換されている、1〜12個の炭素原子を含有する直鎖状若しくは分枝鎖状の飽和炭素鎖を表し、
R1及びR1’は独立して、H、OH、又は炭素数1〜4のアルキル基、アルコキシ基若しくはヒドロキシアルキル基を表し、
R2及びR2’は独立して、H、OH又はC1〜C12アルキル基を表し、
R4はOHを表し、
R4’はHを表し、
R7はH又はOHを表す。]
の化合物である、請求項19記載の方法。
【請求項24】
前記可逆的競合阻害剤が、イソファゴミン、N−ドデシル−イソファゴミン、N−ノニル−イソファゴミン、N−ドデシル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、カリステジンB3及びカリステジンC1からなる群より選ばれる化合物である、請求項23記載の方法。
【請求項25】
前記可逆的競合阻害剤がイソファゴミンである、請求項24記載の方法。
【請求項26】
前記可逆的競合阻害剤がN−ドデシル−イソファゴミンである、請求項24記載の方法。
【請求項27】
薬学的に許容される担体中の精製タンパク質を投与された個体において、前記タンパク質の半減期を延長させ、前記タンパク質のインビボ活性を持続させる方法であって、
薬学的に許容される担体中で前記タンパク質を有効量の活性部位特異的シャペロンと接触させることを含む方法。
【請求項28】
前記タンパク質が前記活性部位特異的シャペロンと共投与される、請求項27記載の方法。
【請求項29】
前記タンパク質が酵素であり、前記活性部位特異的シャペロンが前記酵素の可逆的競合阻害剤である、請求項27記載の方法。
【請求項30】
前記酵素がリソソーム蓄積症に関連している、請求項29記載の方法。
【請求項31】
前記酵素がα−ガラクトシダーゼAである、請求項30記載の方法。
【請求項32】
前記酵素がβ−グルコセレブロシダーゼである、請求項30記載の方法。
【請求項33】
前記可逆的競合阻害剤が、次式:
【化5】

[式中、
R0はH又はC1〜C12アルキル鎖を表し、
R0’は、H、又は、場合によりフェニル基、ヒドロキシル基若しくはシクロヘキシル基で置換されている、1〜12個の炭素原子を含有する直鎖状若しくは分枝鎖状の飽和炭素鎖を表し、
R1及びR1’は独立して、H、OH、又は炭素数1〜4のアルキル基、アルコキシ基若しくはヒドロキシアルキル基を表し、
R2及びR2’は独立して、H、OH又はC1〜C12アルキル基を表し、
R4及びR4’は独立して、H又はOHを表し、
R7はH又はOHを表す。]
の化合物である、請求項31記載の方法。
【請求項34】
前記可逆的競合阻害剤が、1−デオキシガラクトノジリマイシン、α−アロ−ホモノジリマイシン、α−ガラクト−ホモノジリマイシン、α−1−C−ブチル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、N−メチル−カリステジンA3及びN−メチル−カリステジンB2からなる群より選ばれる化合物である、請求項33記載の方法。
【請求項35】
前記可逆的競合阻害剤が1−デオキシガラクトノジリマイシンである、請求項34記載の方法。
【請求項36】
前記可逆的競合阻害剤が、次式:
【化6】

[式中、
R0はH又はC1〜C12アルキル鎖を表し、
R0’は、H、又は、場合によりフェニル基、ヒドロキシル基若しくはシクロヘキシル基で置換されている、1〜12個の炭素原子を含有する直鎖状若しくは分枝鎖状の飽和炭素鎖を表し、
R1及びR1’は独立して、H、OH、又は炭素数1〜4のアルキル基、アルコキシ基若しくはヒドロキシアルキル基を表し、
R2及びR2’は独立して、H、OH又はC1〜C12アルキル基を表し、
R4はOHを表し、
R4’はHを表し、
R7はH又はOHを表す。]
の化合物である、請求項32記載の方法。
【請求項37】
前記可逆的競合阻害剤が、イソファゴミン、N−ドデシル−イソファゴミン、N−ノニル−イソファゴミン、N−ドデシル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、カリステジンB3及びカリステジンC1からなる群より選ばれる化合物である、請求項36記載の方法。
【請求項38】
前記可逆的競合阻害剤がイソファゴミンである、請求項37記載の方法。
【請求項39】
前記可逆的競合阻害剤がN−ドデシル−イソファゴミンである、請求項37記載の方法。
【請求項40】
非哺乳動物宿主細胞によって組換えタンパク質の産生量を増加させる方法であって、
前記宿主細胞が前記組換えタンパク質をコードする核酸配列を含有する発現ベクターを保有し、
前記タンパク質に対する活性部位特異的シャペロンを含有する培地中で前記宿主細胞を培養することを含む方法。
【請求項41】
前記タンパク質が酵素であり、前記活性部位特異的シャペロンが前記酵素の可逆的競合阻害剤である、請求項40記載の方法。
【請求項42】
前記酵素がリソソーム蓄積症に関連している、請求項41記載の方法。
【請求項43】
前記酵素がα−ガラクトシダーゼAである、請求項42記載の方法。
【請求項44】
前記酵素がβ−グルコセレブロシダーゼである、請求項42記載の方法。
【請求項45】
前記可逆的競合阻害剤が、次式:
【化7】

[式中、
R0はH又はC1〜C12アルキル鎖を表し、
R0’は、H、又は、場合によりフェニル基、ヒドロキシル基若しくはシクロヘキシル基で置換されている、1〜12個の炭素原子を含有する直鎖状若しくは分枝鎖状の飽和炭素鎖を表し、
R1及びR1’は独立して、H、OH、又は炭素数1〜4のアルキル基、アルコキシ基若しくはヒドロキシアルキル基を表し、
R2及びR2’は独立して、H、OH又はC1〜C12アルキル基を表し、
R4及びR4’は独立して、H又はOHを表し、
R7はH又はOHを表す。]
の化合物である、請求項43記載の方法。
【請求項46】
前記可逆的競合阻害剤が、1−デオキシガラクトノジリマイシン、α−アロ−ホモノジリマイシン、α−ガラクト−ホモノジリマイシン、α−1−C−ブチル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、N−メチル−カリステジンA3及びN−メチル−カリステジンB2からなる群より選ばれる化合物である、請求項45記載の方法。
【請求項47】
前記可逆的競合阻害剤が1−デオキシガラクトノジリマイシンである、請求項46記載の方法。
【請求項48】
前記可逆的競合阻害剤が、次式:
【化8】

[式中、
R0はH又はC1〜C12アルキル鎖を表し、
R0’は、H、又は、場合によりフェニル基、ヒドロキシル基若しくはシクロヘキシル基で置換されている、1〜12個の炭素原子を含有する直鎖状若しくは分枝鎖状の飽和炭素鎖を表し、
R1及びR1’は独立して、H、OH、又は炭素数1〜4のアルキル基、アルコキシ基若しくはヒドロキシアルキル基を表し、
R2及びR2’は独立して、H、OH又はC1〜C12アルキル基を表し、
R4はOHを表し、
R4’はHを表し、
R7はH又はOHを表す。]
の化合物である、請求項44記載の方法。
【請求項49】
前記可逆的競合阻害剤が、イソファゴミン、N−ドデシル−イソファゴミン、N−ノニル−イソファゴミン、N−ドデシル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、カリステジンB3及びカリステジンC1からなる群より選ばれる化合物である、請求項48記載の方法。
【請求項50】
前記可逆的競合阻害剤がイソファゴミンである、請求項49記載の方法。
【請求項51】
前記可逆的競合阻害剤がN−ドデシル−イソファゴミンである、請求項49記載の方法。
【請求項52】
薬学的に許容される担体中に、精製タンパク質と、前記タンパク質に対する活性部位特異的シャペロンと、を含有する医薬組成物。
【請求項53】
前記タンパク質が酵素であり、前記活性部位特異的シャペロンが前記酵素の可逆的競合阻害剤である、請求項52記載の組成物。
【請求項54】
前記酵素がリソソーム蓄積症に関連している、請求項53記載の組成物。
【請求項55】
前記酵素がα−ガラクトシダーゼAである、請求項54記載の組成物。
【請求項56】
前記酵素がβ−グルコセレブロシダーゼである、請求項54記載の組成物。
【請求項57】
前記可逆的競合阻害剤が、1−デオキシガラクトノジリマイシン、α−アロ−ホモノジリマイシン、α−ガラクト−ホモノジリマイシン、α−1−C−ブチル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、N−メチル−カリステジンA3及びN−メチル−カリステジンB2からなる群より選ばれる化合物である、請求項55記載の組成物。
【請求項58】
前記可逆的競合阻害剤が1−デオキシガラクトノジリマイシンである、請求項57記載の組成物。
【請求項59】
前記可逆的競合阻害剤が、イソファゴミン、N−ドデシル−イソファゴミン、N−ノニル−イソファゴミン、N−ドデシル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、カリステジンB3及びカリステジンC1からなる群より選ばれる化合物である、請求項56記載の組成物。
【請求項60】
前記可逆的競合阻害剤がイソファゴミンである、請求項59記載の組成物。
【請求項61】
前記可逆的競合阻害剤がN−ドデシル−イソファゴミンである、請求項59記載の方法。
【請求項62】
タンパク質補充を必要とする障害を有する個体を治療する方法であって、
前記個体に、有効量の精製された野生型補充タンパク質と、有効量の、前記補充タンパク質に対する活性部位特異的シャペロンと、を含有する組成物を投与することを含む方法。
【請求項63】
前記障害がファブリー病であり、
前記補充タンパク質がα−ガラクトシダーゼAであり、
前記活性部位特異的シャペロンが、1−デオキシガラクトノジリマイシン、α−アロ−ホモノジリマイシン、α−ガラクト−ホモノジリマイシン、α−1−C−ブチル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、N−メチル−カリステジンA3及びN−メチル−カリステジンB2からなる群より選ばれる、請求項62記載の方法。
【請求項64】
前記活性部位特異的シャペロンが1−デオキシガラクトノジリマイシンである、請求項63記載の方法。
【請求項65】
前記障害がゴーシェ病であり、
前記補充タンパク質がβ−グルコセレブロシダーゼであり、
前記活性部位特異的シャペロンが、イソファゴミン、N−ドデシル−イソファゴミン、N−ノニル−イソファゴミン、N−ドデシル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、カリステジンB3及びカリステジンC1からなる群より選ばれる、請求項62記載の方法。
【請求項66】
前記活性部位特異的シャペロンがイソファゴミンである、請求項65記載の方法。
【請求項67】
前記活性部位特異的シャペロンがN−ドデシル−イソファゴミンである、請求項65記載の方法。
【請求項1】
精製タンパク質の安定性を高める方法であって、
薬学的に許容される担体中の前記タンパク質を有効量の活性部位特異的シャペロンと接触させることを含む方法。
【請求項2】
前記精製タンパク質が酵素であり、前記活性部位特異的シャペロンが前記酵素の可逆的競合阻害剤である、請求項1記載の方法。
【請求項3】
前記酵素がリソソーム蓄積症に関連した酵素である、請求項2記載の方法。
【請求項4】
前記酵素がα−ガラクトシダーゼAである、請求項3記載の方法。
【請求項5】
前記酵素がβ−グルコセレブロシダーゼである、請求項3記載の方法。
【請求項6】
前記可逆的競合阻害剤が、次式:
【化1】

[式中、
R0はH又はC1〜C12アルキル鎖を表し、
R0’は、H、又は、場合によりフェニル基、ヒドロキシル基若しくはシクロヘキシル基で置換されている、1〜12個の炭素原子を含有する直鎖状若しくは分枝鎖状の飽和炭素鎖を表し、
R1及びR1’は独立して、H、OH、又は炭素数1〜4のアルキル基、アルコキシ基若しくはヒドロキシアルキル基を表し、
R2及びR2’は独立して、H、OH又はC1〜C12アルキル基を表し、
R4及びR4’は独立して、H又はOHを表し、
R7はH又はOHを表す。]
の化合物である、請求項4記載の方法。
【請求項7】
前記可逆的競合阻害剤が、1−デオキシガラクトノジリマイシン、α−アロ−ホモノジリマイシン、α−ガラクト−ホモノジリマイシン、α−1−C−ブチル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、N−メチル−カリステジンA3及びN−メチル−カリステジンB2からなる群より選ばれる化合物である、請求項6記載の方法。
【請求項8】
前記可逆的競合阻害剤が1−デオキシガラクトノジリマイシンである、請求項7記載の方法。
【請求項9】
前記可逆的競合阻害剤が、次式:
【化2】

[式中、
R0はH又はC1〜C12アルキル鎖を表し、
R0’は、H、又は、場合によりフェニル基、ヒドロキシル基若しくはシクロヘキシル基で置換されている、1〜12個の炭素原子を含有する直鎖状若しくは分枝鎖状の飽和炭素鎖を表し、
R1及びR1’は独立して、H、OH、又は炭素数1〜4のアルキル基、アルコキシ基若しくはヒドロキシアルキル基を表し、
R2及びR2’は独立して、H、OH又はC1〜C12アルキル基を表し、
R4はOHを表し、
R4’はHを表し、
R7はOHを表す。]
の化合物である、請求項5記載の方法。
【請求項10】
前記可逆的競合阻害剤が、イソファゴミン、N−ドデシル−イソファゴミン、N−ノニルイソファゴミン、N−ドデシル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、カリステジンB3及びカリステジンC1からなる群より選ばれる化合物である、請求項9記載の方法。
【請求項11】
前記可逆的競合阻害剤がイソファゴミンである、請求項10記載の方法。
【請求項12】
前記可逆的競合阻害剤がN−ドデシル−イソファゴミンである、請求項10記載の方法。
【請求項13】
タンパク質のシェルフライフをインビトロで延長させる方法であって、
薬学的に許容される担体中の前記タンパク質を有効量の活性部位特異的シャペロンと接触させることによって行う方法。
【請求項14】
前記タンパク質、前記薬学的に許容される担体、及び前記活性部位特異的シャペロンが凍結乾燥粉末の形態で調製される、請求項13記載の方法。
【請求項15】
前記タンパク質、前記薬学的に許容される担体、及び前記活性部位特異的シャペロンが無菌水溶液の形態で調製される、請求項13記載の方法。
【請求項16】
前記タンパク質が酵素であり、前記活性部位特異的シャペロンが前記酵素の可逆的競合阻害剤である、請求項13記載の方法。
【請求項17】
前記酵素がリソソーム蓄積症に関連している、請求項16記載の方法。
【請求項18】
前記酵素がα−ガラクトシダーゼAである、請求項17記載の方法。
【請求項19】
前記酵素がβ−グルコセレブロシダーゼである、請求項17記載の方法。
【請求項20】
前記可逆的競合阻害剤が、次式:
【化3】

[式中、
R0はH又はC1〜C12アルキル鎖を表し、
R0’は、H、又は、場合によりフェニル基、ヒドロキシル基若しくはシクロヘキシル基で置換されている、1〜12個の炭素原子を含有する直鎖状若しくは分枝鎖状の飽和炭素鎖を表し、
R1及びR1’は独立して、H、OH、又は炭素数1〜4のアルキル基、アルコキシ基若しくはヒドロキシアルキル基を表し、
R2及びR2’は独立して、H、OH又はC1〜C12アルキル基を表し、
R4及びR4’は独立して、H又はOHを表し、
R7はH又はOHを表す。]
の化合物である、請求項18記載の方法。
【請求項21】
前記可逆的競合阻害剤が、1−デオキシガラクトノジリマイシン、α−アロ−ホモノジリマイシン、α−ガラクト−ホモノジリマイシン、α−1−C−ブチル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、N−メチル−カリステジンA3及びN−メチル−カリステジンB2からなる群より選ばれる化合物である、請求項20記載の方法。
【請求項22】
前記可逆的競合阻害剤が1−デオキシガラクトノジリマイシンである、請求項21記載の方法。
【請求項23】
前記可逆的競合阻害剤が、次式:
【化4】

[式中、
R0はH又はC1〜C12アルキル鎖を表し、
R0’は、H、又は、場合によりフェニル基、ヒドロキシル基若しくはシクロヘキシル基で置換されている、1〜12個の炭素原子を含有する直鎖状若しくは分枝鎖状の飽和炭素鎖を表し、
R1及びR1’は独立して、H、OH、又は炭素数1〜4のアルキル基、アルコキシ基若しくはヒドロキシアルキル基を表し、
R2及びR2’は独立して、H、OH又はC1〜C12アルキル基を表し、
R4はOHを表し、
R4’はHを表し、
R7はH又はOHを表す。]
の化合物である、請求項19記載の方法。
【請求項24】
前記可逆的競合阻害剤が、イソファゴミン、N−ドデシル−イソファゴミン、N−ノニル−イソファゴミン、N−ドデシル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、カリステジンB3及びカリステジンC1からなる群より選ばれる化合物である、請求項23記載の方法。
【請求項25】
前記可逆的競合阻害剤がイソファゴミンである、請求項24記載の方法。
【請求項26】
前記可逆的競合阻害剤がN−ドデシル−イソファゴミンである、請求項24記載の方法。
【請求項27】
薬学的に許容される担体中の精製タンパク質を投与された個体において、前記タンパク質の半減期を延長させ、前記タンパク質のインビボ活性を持続させる方法であって、
薬学的に許容される担体中で前記タンパク質を有効量の活性部位特異的シャペロンと接触させることを含む方法。
【請求項28】
前記タンパク質が前記活性部位特異的シャペロンと共投与される、請求項27記載の方法。
【請求項29】
前記タンパク質が酵素であり、前記活性部位特異的シャペロンが前記酵素の可逆的競合阻害剤である、請求項27記載の方法。
【請求項30】
前記酵素がリソソーム蓄積症に関連している、請求項29記載の方法。
【請求項31】
前記酵素がα−ガラクトシダーゼAである、請求項30記載の方法。
【請求項32】
前記酵素がβ−グルコセレブロシダーゼである、請求項30記載の方法。
【請求項33】
前記可逆的競合阻害剤が、次式:
【化5】

[式中、
R0はH又はC1〜C12アルキル鎖を表し、
R0’は、H、又は、場合によりフェニル基、ヒドロキシル基若しくはシクロヘキシル基で置換されている、1〜12個の炭素原子を含有する直鎖状若しくは分枝鎖状の飽和炭素鎖を表し、
R1及びR1’は独立して、H、OH、又は炭素数1〜4のアルキル基、アルコキシ基若しくはヒドロキシアルキル基を表し、
R2及びR2’は独立して、H、OH又はC1〜C12アルキル基を表し、
R4及びR4’は独立して、H又はOHを表し、
R7はH又はOHを表す。]
の化合物である、請求項31記載の方法。
【請求項34】
前記可逆的競合阻害剤が、1−デオキシガラクトノジリマイシン、α−アロ−ホモノジリマイシン、α−ガラクト−ホモノジリマイシン、α−1−C−ブチル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、N−メチル−カリステジンA3及びN−メチル−カリステジンB2からなる群より選ばれる化合物である、請求項33記載の方法。
【請求項35】
前記可逆的競合阻害剤が1−デオキシガラクトノジリマイシンである、請求項34記載の方法。
【請求項36】
前記可逆的競合阻害剤が、次式:
【化6】

[式中、
R0はH又はC1〜C12アルキル鎖を表し、
R0’は、H、又は、場合によりフェニル基、ヒドロキシル基若しくはシクロヘキシル基で置換されている、1〜12個の炭素原子を含有する直鎖状若しくは分枝鎖状の飽和炭素鎖を表し、
R1及びR1’は独立して、H、OH、又は炭素数1〜4のアルキル基、アルコキシ基若しくはヒドロキシアルキル基を表し、
R2及びR2’は独立して、H、OH又はC1〜C12アルキル基を表し、
R4はOHを表し、
R4’はHを表し、
R7はH又はOHを表す。]
の化合物である、請求項32記載の方法。
【請求項37】
前記可逆的競合阻害剤が、イソファゴミン、N−ドデシル−イソファゴミン、N−ノニル−イソファゴミン、N−ドデシル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、カリステジンB3及びカリステジンC1からなる群より選ばれる化合物である、請求項36記載の方法。
【請求項38】
前記可逆的競合阻害剤がイソファゴミンである、請求項37記載の方法。
【請求項39】
前記可逆的競合阻害剤がN−ドデシル−イソファゴミンである、請求項37記載の方法。
【請求項40】
非哺乳動物宿主細胞によって組換えタンパク質の産生量を増加させる方法であって、
前記宿主細胞が前記組換えタンパク質をコードする核酸配列を含有する発現ベクターを保有し、
前記タンパク質に対する活性部位特異的シャペロンを含有する培地中で前記宿主細胞を培養することを含む方法。
【請求項41】
前記タンパク質が酵素であり、前記活性部位特異的シャペロンが前記酵素の可逆的競合阻害剤である、請求項40記載の方法。
【請求項42】
前記酵素がリソソーム蓄積症に関連している、請求項41記載の方法。
【請求項43】
前記酵素がα−ガラクトシダーゼAである、請求項42記載の方法。
【請求項44】
前記酵素がβ−グルコセレブロシダーゼである、請求項42記載の方法。
【請求項45】
前記可逆的競合阻害剤が、次式:
【化7】

[式中、
R0はH又はC1〜C12アルキル鎖を表し、
R0’は、H、又は、場合によりフェニル基、ヒドロキシル基若しくはシクロヘキシル基で置換されている、1〜12個の炭素原子を含有する直鎖状若しくは分枝鎖状の飽和炭素鎖を表し、
R1及びR1’は独立して、H、OH、又は炭素数1〜4のアルキル基、アルコキシ基若しくはヒドロキシアルキル基を表し、
R2及びR2’は独立して、H、OH又はC1〜C12アルキル基を表し、
R4及びR4’は独立して、H又はOHを表し、
R7はH又はOHを表す。]
の化合物である、請求項43記載の方法。
【請求項46】
前記可逆的競合阻害剤が、1−デオキシガラクトノジリマイシン、α−アロ−ホモノジリマイシン、α−ガラクト−ホモノジリマイシン、α−1−C−ブチル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、N−メチル−カリステジンA3及びN−メチル−カリステジンB2からなる群より選ばれる化合物である、請求項45記載の方法。
【請求項47】
前記可逆的競合阻害剤が1−デオキシガラクトノジリマイシンである、請求項46記載の方法。
【請求項48】
前記可逆的競合阻害剤が、次式:
【化8】

[式中、
R0はH又はC1〜C12アルキル鎖を表し、
R0’は、H、又は、場合によりフェニル基、ヒドロキシル基若しくはシクロヘキシル基で置換されている、1〜12個の炭素原子を含有する直鎖状若しくは分枝鎖状の飽和炭素鎖を表し、
R1及びR1’は独立して、H、OH、又は炭素数1〜4のアルキル基、アルコキシ基若しくはヒドロキシアルキル基を表し、
R2及びR2’は独立して、H、OH又はC1〜C12アルキル基を表し、
R4はOHを表し、
R4’はHを表し、
R7はH又はOHを表す。]
の化合物である、請求項44記載の方法。
【請求項49】
前記可逆的競合阻害剤が、イソファゴミン、N−ドデシル−イソファゴミン、N−ノニル−イソファゴミン、N−ドデシル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、カリステジンB3及びカリステジンC1からなる群より選ばれる化合物である、請求項48記載の方法。
【請求項50】
前記可逆的競合阻害剤がイソファゴミンである、請求項49記載の方法。
【請求項51】
前記可逆的競合阻害剤がN−ドデシル−イソファゴミンである、請求項49記載の方法。
【請求項52】
薬学的に許容される担体中に、精製タンパク質と、前記タンパク質に対する活性部位特異的シャペロンと、を含有する医薬組成物。
【請求項53】
前記タンパク質が酵素であり、前記活性部位特異的シャペロンが前記酵素の可逆的競合阻害剤である、請求項52記載の組成物。
【請求項54】
前記酵素がリソソーム蓄積症に関連している、請求項53記載の組成物。
【請求項55】
前記酵素がα−ガラクトシダーゼAである、請求項54記載の組成物。
【請求項56】
前記酵素がβ−グルコセレブロシダーゼである、請求項54記載の組成物。
【請求項57】
前記可逆的競合阻害剤が、1−デオキシガラクトノジリマイシン、α−アロ−ホモノジリマイシン、α−ガラクト−ホモノジリマイシン、α−1−C−ブチル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、N−メチル−カリステジンA3及びN−メチル−カリステジンB2からなる群より選ばれる化合物である、請求項55記載の組成物。
【請求項58】
前記可逆的競合阻害剤が1−デオキシガラクトノジリマイシンである、請求項57記載の組成物。
【請求項59】
前記可逆的競合阻害剤が、イソファゴミン、N−ドデシル−イソファゴミン、N−ノニル−イソファゴミン、N−ドデシル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、カリステジンB3及びカリステジンC1からなる群より選ばれる化合物である、請求項56記載の組成物。
【請求項60】
前記可逆的競合阻害剤がイソファゴミンである、請求項59記載の組成物。
【請求項61】
前記可逆的競合阻害剤がN−ドデシル−イソファゴミンである、請求項59記載の方法。
【請求項62】
タンパク質補充を必要とする障害を有する個体を治療する方法であって、
前記個体に、有効量の精製された野生型補充タンパク質と、有効量の、前記補充タンパク質に対する活性部位特異的シャペロンと、を含有する組成物を投与することを含む方法。
【請求項63】
前記障害がファブリー病であり、
前記補充タンパク質がα−ガラクトシダーゼAであり、
前記活性部位特異的シャペロンが、1−デオキシガラクトノジリマイシン、α−アロ−ホモノジリマイシン、α−ガラクト−ホモノジリマイシン、α−1−C−ブチル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、N−メチル−カリステジンA3及びN−メチル−カリステジンB2からなる群より選ばれる、請求項62記載の方法。
【請求項64】
前記活性部位特異的シャペロンが1−デオキシガラクトノジリマイシンである、請求項63記載の方法。
【請求項65】
前記障害がゴーシェ病であり、
前記補充タンパク質がβ−グルコセレブロシダーゼであり、
前記活性部位特異的シャペロンが、イソファゴミン、N−ドデシル−イソファゴミン、N−ノニル−イソファゴミン、N−ドデシル−デオキシノジリマイシン、カリステジンA3、カリステジンB2、カリステジンB3及びカリステジンC1からなる群より選ばれる、請求項62記載の方法。
【請求項66】
前記活性部位特異的シャペロンがイソファゴミンである、請求項65記載の方法。
【請求項67】
前記活性部位特異的シャペロンがN−ドデシル−イソファゴミンである、請求項65記載の方法。
【図1】




【公開番号】特開2012−102128(P2012−102128A)
【公開日】平成24年5月31日(2012.5.31)
【国際特許分類】
【出願番号】特願2012−270(P2012−270)
【出願日】平成24年1月4日(2012.1.4)
【分割の表示】特願2006−503265(P2006−503265)の分割
【原出願日】平成16年2月2日(2004.2.2)
【出願人】(500072792)マウント シナイ スクール オブ メディシン オブ ニューヨーク ユニバーシティー (7)
【Fターム(参考)】
【公開日】平成24年5月31日(2012.5.31)
【国際特許分類】
【出願日】平成24年1月4日(2012.1.4)
【分割の表示】特願2006−503265(P2006−503265)の分割
【原出願日】平成16年2月2日(2004.2.2)
【出願人】(500072792)マウント シナイ スクール オブ メディシン オブ ニューヨーク ユニバーシティー (7)
【Fターム(参考)】
[ Back to top ]

