タンパク質相互作用、抗がん剤、並びにそれらのスクリーニング方法
【課題】体細胞分裂のメカニズムを解明すること、そのメカニズムに基づく新規な抗がん剤を提供すること。
【解決手段】本発明者らは、今回、Sgo(hSgo1又はhSgo2)とPP2Aが相互作用すること、及び、hSog1とPP2Aは、体細胞分裂の前期から中期にかけて、ともに、染色体(の動原体)付近に局在すること、を新規に見出した。これらの発明事項は、体細胞分裂の中期まで姉妹染色分体の動原体部分における接着が保持されるメカニズムを示唆する。そこで、本発明では、これらの知見に基づき、SgoとPP2Aの相互作用を阻害又は抑制する抗がん剤を提供する。これらの物質には、細胞分裂を特異的に阻害又は抑制する作用があるため、抗がん剤に適用できる可能性がある。
【解決手段】本発明者らは、今回、Sgo(hSgo1又はhSgo2)とPP2Aが相互作用すること、及び、hSog1とPP2Aは、体細胞分裂の前期から中期にかけて、ともに、染色体(の動原体)付近に局在すること、を新規に見出した。これらの発明事項は、体細胞分裂の中期まで姉妹染色分体の動原体部分における接着が保持されるメカニズムを示唆する。そこで、本発明では、これらの知見に基づき、SgoとPP2Aの相互作用を阻害又は抑制する抗がん剤を提供する。これらの物質には、細胞分裂を特異的に阻害又は抑制する作用があるため、抗がん剤に適用できる可能性がある。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、SgoとPP2Aのタンパク質相互作用、前記相互作用を阻害又は抑制する物質を含有する抗がん剤、前記相互作用を用いたスクリーニング方法などに関する。
【背景技術】
【0002】
体細胞分裂の場合、細胞周期は、DNA合成準備期(G1期)、DNA合成期(S期)、分裂準備期(G2期)、分裂期(M期)の4つの時期に分類される。分裂期(M期)は、さらに、前期(pro期)、中期(meta期)、後期(ana期)、終期(telo期)に細分類される。
【0003】
体細胞分裂の際、染色体は娘細胞に正確に分配される。DNA合成期(S期)に染色体は複製されて一対の姉妹染色分体を形成する。細胞分裂の前期(pro期)に染色体(姉妹染色分体)は凝縮し、中期(meta期)に一対の姉妹染色分体が細胞の赤道面に整列し、後期(ana期)に姉妹染色分体は分離して紡錐体(spindle)の両極に向かって移動する。
【0004】
各姉妹染色分体上には、動原体(セントロメア)が存在する。動原体には、細胞分裂の中期に紡錘糸が結合する。これにより、紡錘体が形成され、各姉妹染色分体には、紡錘体の両極に向かう張力が働くようになる。
【0005】
一方、一対の姉妹染色分体は、その形成直後から分裂期の中期まで、コヒーシン複合体によって接着されており、分離しない。そのため、細胞分裂の中期では、紡錐体による張力と、コヒーシン複合体による接着力とのバランスにより、一対の姉妹染色分体が細胞の赤道面に整列する。
【0006】
そして、細胞分裂の後期には、セパレース(エンドペプチダーゼ)によりコヒーシン複合体が分解されるため、姉妹染色分体間の接着力が働かなくなる。そのため、紡錘糸による張力により、姉妹染色分体は分離して紡錐体の両極に向かって移動する。
【0007】
コヒーシン複合体は、4つのサブユニットで構成される(非特許文献1参照)。体細胞分裂におけるコヒーシン複合体は、2つのSMCファミリータンパク質(Smc1、及び、Smc3)及び2つの非SMCファミリータンパク質(Scc1、及び、Scc3(動物細胞ではSA))で構成される。一方、減数分裂におけるコヒーシン複合体は、Scc1がRec8に置き換わった構造を備える。なお、「SMC」は、structural maintenance of chromosomeである。
【0008】
コヒーシン複合体は、Smc1とSmc3が2量体を形成して2本の姉妹染色分体をリング状に取り囲み、Scc1が、Scc3の助けでそのリングを閉じることにより、一対の染色分体を接着させると推測されている(非特許文献2参照)。
【0009】
コヒーシン複合体は、Plk1(polo−like kinase)によりリン酸化され、分解されることが知られている(非特許文献3参照)。DNA合成期には、一対の姉妹染色分体は、コヒーシン複合体により、多数の点で接着される。それに対し、細胞分裂の前中期には、姉妹染色分体は、動原体付近以外では、ほとんどが分離している。これは、細胞分裂の前期において、コヒーシン複合体の大部分がPlkによりリン酸化され、姉妹染色分体から解離するためであると推測されている。
【0010】
Sgo(shugoshin/Mei−S332)は、減数分裂の際の染色体分配に関わるタンパク質として同定された。減数分裂の際、このタンパク質が、動原体部分のコヒーシン複合体に結合してそれを保護し、減数第一分裂の際における姉妹染色体の分離を防止することが報告されている(非特許文献4参照)。また、近年、ヒトの体細胞分裂においても、このタンパク質(human Sgo1)が、動原体からのコヒーシン複合体の分離を阻害していることが報告されている(非特許文献5参照)。その他、Sgoとがんとの関連性については、乳がんの細胞でSgo1の発現が上昇することが報告されている(例えば、非特許文献6参照)。
【0011】
ここで、本発明と関連のあるタンパク質、PP2Aについて、以下説明する。
【0012】
PP2A(PROTEIN PHOSPHATASE 2A)は、真核細胞における代表的なセリン/スレオニンフォスファターゼ(脱リン酸化酵素)の一つで、細胞内の多くの代謝・反応系に関与している。
【0013】
PP2Aは3つのサブユニットからなるヘテロトリマーである。PP2Aのコア構造は、Cサブユニット(Catalytic C subunit;PP2A−C)とAサブユニット(Scaffold A subunit;PP2A−A)のダイマーであり、そのコア構造にBサブユニット(Regulatory B subunit;PP2A−B)がリクルートされる。Cサブユニットは酵素活性中心を有し、Bサブユニット(PP2A−B)は、基質特異性や細胞内局在を調節する。
【0014】
Bサブユニット(PP2A−B)は、Bファミリー(「B55」又は「PR55」)、B’ファミリー(「B56」又は「PR61」)、B’’ファミリー(「PR72」)、B’’’ファミリー(「PR93/PR110」)に分類される。そのうち、Bファミリー(B55)には、α、β、γ、δの4種類が、B’ファミリー(B56)には、α、β、γ、δ、εの5種類が、それぞれ知られている。リクルートされるBサブユニット(PP2A−B)の種類によって、酵素反応の種類(基質の種類)が選択されると推測されている(非特許文献7参照)。
【非特許文献1】Nasmyth K. et al “The structure and function of SMC and kleisincomplexes.” Annu Rev Biochem, 2005; 74 :595-648
【非特許文献2】Ivanov D. et al “A topological interaction between cohesin rings anda circular minichromosome.” Cell, 2005 Sep 23; 122(6): 89-60
【非特許文献3】Sumura I. et al “The dissociation ofcohesin from chromosomes in prophase is regulated by Polo-like kinase.” MolCell, 2002 Mar; 9(3): 515-25
【非特許文献4】Kitajima TS. et al “The conserved kinetochore protein shugoshinprotects centromeric cohesion during meiosis.” Nature, 2004 Feb 5; 427(6974):510-7. Epub 2004 Jan 18.
【非特許文献5】Kitajima TS. et al “Human Bub1 defines the persistent cohesion sitealong the mitotic chromosome by affecting Shugoshin localization.” Curr Biol,2005 Feb 22; 15(4): 353-9
【非特許文献6】Scanlan MJ. et al “Humoral immunity to human breast cancer: antigendefinition and quantitative analysis of mRNA expression.” Cancer Immun, 2001Mar 30; 1:4.
【非特許文献7】Janssens V. et al “Protein phosphatase 2A: a highly regulated familyof serine/threonine phosphatases implicated in cell growth and signalling.”Biochem J. 2001 Feb 1; 353(Pt3): 417-39
【発明の開示】
【発明が解決しようとする課題】
【0015】
上述の各知見より、体細胞分裂の際、Sgoが、姉妹染色分体の動原体付近におけるコヒーシン複合体を保護し、動原体からのコヒーシン複合体の分離(細胞分裂中期における姉妹染色分体の分離)を阻害している可能性が示唆される。しかし、その具体的なメカニズムに関してはほとんど解明されていない。
【0016】
一方、がん細胞は、短い細胞周期で過剰な細胞分裂を繰り返す。従って、体細胞分裂のメカニズムは、抗がん剤のターゲットとなる可能性がある。
【0017】
そこで、本発明は、体細胞分裂のメカニズムを解明すること、及び、そのメカニズムに基づく新規な抗がん剤を提供することを主な目的とする。
【課題を解決するための手段】
【0018】
本発明では、まず、SgoとPP2Aの相互作用(PP2Aと相互作用するSgo、及び、Sgoと相互作用するPP2A)を提供する。ここで、Sgoは、human Sgo1、及び、human Sgo2の両者(以下、「hSgo1」及び「hSgo2」とする。)を含む。
【0019】
上述の通り、細胞分裂の前期において、コヒーシン複合体の大部分はPlkによりリン酸化され、姉妹染色分体から解離すると推測されている。一方、姉妹染色分体の動原体付近では、hSgo1と動原体が結合して保護することにより、コヒーシン複合体が姉妹染色分体から解離せず、両染色分体の接着状態が保持されると考えられている。
【0020】
本発明者らは、今回、SgoとPP2Aが相互作用すること、及び、hSog1とPP2Aは、体細胞分裂の前期から中期にかけて、ともに、染色体(の動原体)付近に局在すること、を新規に見出した。
【0021】
PP2Aが脱リン酸化酵素であることを勘案すると、これらの発明事項は、以下の体細胞分裂時におけるメカニズムを示唆する。体細胞分裂の前期から中期にかけて、Sgoが姉妹染色分体の動原体に結合し、SgoとPP2Aは、ともに、動原体付近に局在する。これにより、PP2Aの脱リン酸化が、Plk1によるコヒーシン複合体のリン酸化に対して相反的に作用するため、動原体付近におけるコヒーシン複合体のリン酸化が抑制され、姉妹染色分体間の接着は保持される。
【0022】
即ち、本発明は、体細胞分裂の中期まで姉妹染色分体の動原体部分における接着が保持されるメカニズムを解明した点で、重要な意義を有する。
【0023】
続いて、本発明では、SgoとPP2Aの相互作用を阻害又は抑制する抗がん剤を提供する。
【0024】
上述の通り、がん細胞は、短い細胞周期で過剰な細胞分裂を繰り返す。それに対し、SgoとPP2Aの相互作用を阻害又は抑制する物質は、細胞分裂を特異的に阻害又は抑制できるため、抗がん剤に適用できる可能性がある。
【0025】
なお、Sgoは細胞分裂において特異的に機能するタンパク質であるため、
本発明に係る抗がん剤は、体細胞分裂を行っている細胞に特異的に作用すると推定できる。従って、本剤は、副作用が少ない可能性が高い。即ち、正常細胞は、がん細胞に比べて、体細胞分裂を行う頻度は低いため、本剤による影響は少ないと考える。また、本剤は、他の代謝系にほとんど影響を与えない可能性が高いため、副作用は少ないと考える。
【0026】
以下、本発明に係るタンパク質について、説明する。
【0027】
本発明に係るhSgo1のアミノ酸配列を配列番号1に、hSgo2のアミノ酸配列を配列番号2に、それぞれ示す。なお、本発明に係るSgoは、hSgo1、hSgo2、並びに前記いずれかのタンパク質のアミノ酸配列と相同性を有し、PP2Aと相互作用するものを全て包含する。即ち、例えば、Sgoのスプライシング・バリアント(同一の遺伝子に由来するが、スプライシングにより、配列の一部が異なっているタンパク質、以下同じ)や、前記アミノ酸配列中の一部に、置換、欠損、挿入、付加部分が含まれるものも、本発明に係るSgoに包含される。
【0028】
本発明に係るPP2AのB56サブユニットのアミノ酸配列を、配列番号3から配列番号7に示す。それぞれ、配列番号3はPP2A−B56α、配列番号4はPP2A−B56β、配列番号5はPP2A−B56γ、配列番号6はPP2A−B56δ、配列番号7はPP2A−B56εのアミノ酸配列である。なお、本発明に係るPP2Aは、PP2Aの各サブユニット(Cサブユニット、Aサブユニット、及び、B56サブユニット(配列番号3から配列番号7のいずれかに記載のアミノ酸配列を有するサブユニット))、並びにそれらのアミノ酸配列と相同性を有し、Sgoと相互作用するものを全て包含する。即ち、例えば、PP2Aのいずれかのサブユニットのスプライシング・バリアントや、前記アミノ酸配列中の一部に、置換、欠損、挿入、付加部分が含まれるものも、本発明に係るPP2Aに包含される。
【発明の効果】
【0029】
本発明は、体細胞分裂に関わるメカニズムの解明の一助となる。また、新規な作用機序に基づく抗がん剤又はそのスクリーニング方法などに応用できる。
【発明を実施するための最良の形態】
【0030】
<本発明に係る相互作用について>
はじめに、SgoとPP2Aの相互作用について、図1を用いて、以下説明する。
【0031】
図1は、SgoとPP2Aの相互作用、及び、その相互作用に基づく細胞分裂のメカニズムを示す模式図である。図1中、左側の模式図は、ヒトの体細胞分裂(Human mitosis)に関わるメカニズムを、右側の模式図は、分裂酵母の減数分裂(Fission yeast meiosis)に関わるメカニズムを、それぞれ表す。
【0032】
体細胞分裂において、hSgo1は、PP2AのB56サブユニットと相互作用する。hSgo1はPP2Aとともに、染色体上の動原体付近に局在する。PP2A(のCサブユニット)は、コヒーシン複合体のScc3(SA)の脱リン酸化(dephosphorylation)を行う。これにより、コヒーシン複合体の分解(リン酸化)が相反的に阻害され、姉妹染色分体の分離が阻害される。なお、hSgo1それ自体も、動原体と結合することによって、動原体付近のコヒーシン複合体をPlk(リン酸化酵素)から保護している。
【0033】
hSgo2は、PP2AのAサブユニットと相互作用する。hSgo2は、体細胞分裂において、hSgo1とPP2Aの複合体を動原体に局在させる働きを担っていると推測する。
【0034】
一方、減数分裂においても、hSgo1は、PP2AのB56サブユニットと相互作用する。hSgo1は、PP2Aを動原体に局在させ、PP2Aは、コヒーシン複合体のRec8サブユニットを脱リン酸化する。これにより、第一減数分裂時におけるコヒーシン複合体の分解(染色体の分離)を阻害している。
【0035】
<SgoとPP2Aの相互作用を阻害又は抑制する抗がん剤について>
上述の通り、SgoとPP2Aの相互作用を阻害又は抑制する物質は、抗がん剤として適用できる可能性がある。
【0036】
SgoとPP2Aの相互作用を阻害又は抑制する物質として、例えば、(1)Sgoの立体構造中の、PP2Aとの結合部位に対して特異的に結合する物質、(2)Sgoの立体構造中の、PP2Aとの結合部位の近傍に結合することにより、前記相互作用を阻害又は抑制する物質、(3)Sgoと結合して、Sgoの立体構造を変化させる物質、(4)PP2Aの立体構造中の、Sgoとの結合部位に対して特異的に結合する物質、(5)PP2Aの立体構造中の、Sgoとの結合部位の近傍に結合することにより、前記相互作用を阻害又は抑制する物質、(6)PP2Aと結合して、PP2Aの立体構造を変化させる物質、(7)抗Sgo抗体、抗Sgoアプタマー、抗PP2A抗体、抗PP2Aアプタマー、(8)Sgoの発現を抑制する物質、(9)PP2Aの発現を抑制する物質、などを想定できる。以下、図2を用いて順に説明する。
【0037】
図2は、本発明に係る抗がん剤の作用メカニズムを模式的に示す図である。符号1はSgoを、符号2はPP2Aを、符号AはSgoとPP2Aの相互作用を示す。図2に示す通り、Sgo(符号1)は、立体構造中に、PP2Aとの相互作用部位11を有し、PP2A(符号2)は、立体構造中に、Sgoとの相互作用部位21を有する。
【0038】
(1)Sgoの立体構造中の、PP2Aとの結合部位に対して特異的に結合する物質について:例えば、この物質(符号M1)が、Sgoの立体構造中の、PP2Aとの結合部位11に対して特異的に結合した場合、SgoとPP2Aの相互作用が阻害又は抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。なお、これらの物質には、該部位(符号11)に特異的に結合する抗Sgo抗体も含まれる。
【0039】
(2)Sgoの立体構造中の、PP2Aとの結合部位の近傍に結合することにより、SgoとPP2Aの相互作用を阻害又は抑制する物質について:例えば、この物質(符号M2)が、Sgoの立体構造中の、PP2Aとの結合部位11の近傍に結合した場合、前記と同様、SgoとPP2Aの相互作用が阻害又は抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。なお、これらの物質には、該部位に特異的に結合する抗Sgo抗体も含まれる。
【0040】
(3)Sgoと結合して、前記タンパク質の立体構造を変化させる物質について:例えば、この物質(符号M3)がSgoと結合して、Sgoの立体構造を変化させた場合、前記と同様、SgoとPP2Aの相互作用が阻害又は抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。
【0041】
(4)PP2Aの立体構造中の、Sgoとの結合部位に対して特異的に結合する物質について:例えば、この物質(符号M4)がPP2Aの立体構造中の、Sgoとの結合部位21に対して特異的に結合した場合、前記と同様、SgoとPP2Aの相互作用が阻害又は抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。なお、これらの物質には、該部位(符号21)に特異的に結合する抗PP2A抗体も含まれる。
【0042】
(5)PP2Aの立体構造中の、Sgoとの結合部位の近傍に結合することにより、前記相互作用を阻害又は抑制する物質について:例えば、この物質(符号M5)がPP2Aの立体構造中の、Sgoとの結合部位21の近傍に結合した場合、前記と同様、SgoとPP2Aの相互作用が阻害又は抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。なお、これらの物質には、該部位に特異的に結合する抗PP2A抗体も含まれる。
【0043】
(6)PP2Aと結合して、PP2Aの立体構造を変化させる物質について:例えば、この物質(符号M6)がPP2Aと結合して、PP2Aの立体構造を変化させた場合、前記と同様、SgoとPP2Aの相互作用が阻害又は抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。
【0044】
(7)抗Sgo抗体、抗Sgoアプタマー、抗PP2A抗体、抗PP2Aアプタマーについて:抗Sgo抗体又は抗Sgoアプタマー(符号M7)、及び、抗PP2A抗体又は抗PP2Aアプタマー(符号M8)は、Sgo又はPP2Aと特異的に結合し、その機能を抑制する。そのため、前記と同様、SgoとPP2Aの相互作用が阻害又は抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。ここで、アプタマーは、抗体代替分子であり、標的分子を特異的に認識するオリゴヌクレオチドである。抗体又はアプタマーは、公知の方法により作製できる。
【0045】
(8)Sgoの発現を抑制する物質について:例えば、この物質(図示せず)によりSgoの発現が抑制された場合、SgoとPP2Aの相互作用が抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。なお、Sgoは細胞分裂に特異的なタンパク質であるため、Sgoの発現を抑制する物質は、がん細胞以外の正常細胞にあまり影響を与えない可能性が高い。即ち、本物質は、副作用が少ない可能性が高い。
【0046】
このような物質として、例えば、Sgoをコードする遺伝子の塩基配列の一部と同じ塩基配列を有する二本鎖RNAであって、RNA干渉によって、そのタンパク質の発現を抑制する二本鎖RNA、及び、Sgoのプロモーター領域に作用する物質、が挙げられる。なお、RNA干渉に基づく二本鎖RNAは、公知方法により設計・作製できる(以下同じ)。
【0047】
(9)PP2Aの発現を抑制する物質について:
例えば、この物質(図示せず)によりPP2Aの発現が抑制された場合、前記と同様、SgoとPP2Aの相互作用が抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。
【0048】
このような物質として、例えば、PP2Aをコードする遺伝子の塩基配列の一部と同じ塩基配列を有する二本鎖RNAであって、RNA干渉によって、そのタンパク質の発現を抑制する二本鎖RNA、及び、PP2Aのプロモーター領域に作用する物質、が挙げられる。
【0049】
<本発明に係るスクリーニング方法について>
上述の通り、SgoとPP2Aの相互作用を阻害又は抑制する物質は、抗がん剤に適用できる可能性がある。従って、例えば、SgoとPP2Aの相互作用を阻害又は抑制する物質を探索することにより、新規薬剤を見つけ出すことができる可能性がある。
【0050】
相互作用の検出は、例えば、タンパク質間の結合を検出することによって行うことができる。タンパク質間の結合は、既知の方法、例えば、共免疫沈降法、免疫ブロット法、カラムを用いたプルダウン法、質量分析計を用いた方法、蛍光標識を用いたイメージング、又はそれらの組み合わせなどにより行うことができる。
【0051】
本発明に係るスクリーニング方法は、キット化が可能である。その場合、例えば、Sgo、PP2A、抗Sgo抗体、抗PP2A抗体、相互作用検出(共免疫沈降法、免疫ブロット法、免疫染色法など)に用いる試薬などを、検出方法に応じて適宜組み合わせ、キット化する。
【実施例1】
【0052】
実施例1では、Sgo1とPP2Aの相互作用を調べた。
【0053】
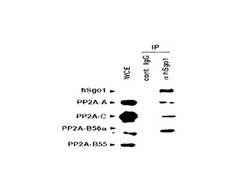
まず、培養したHeLa細胞を、lysis bufferを用いて溶解し、細胞抽出液を得た。次に、抗hSgo1抗体を用いて免疫沈降を行い、内因性のhSgo1及びその相互作用複合体を回収した。次に、SDS−PAGE(ポリアクリルアミド電気泳動、以下同じ)により、回収した相互作用複合体をゲル内で展開させた後、抗PP2A−A抗体、抗PP2A−C抗体、抗PP2A−B56α抗体、抗PP2A−B55抗体、の各抗体を用いて、免疫ブロットを行った。
【0054】
結果を図3に示す。図3は、抗hSgo1抗体を用いて免疫沈降を行った場合における免疫ブロット写真である。
【0055】
図3中、「IP(immunoprecipitation)」は、その抗体を用いて免疫沈降を行ったことを表し、「cont. IgG」は、対照としてIgG抗体を用いて免疫沈降を行ったことを、「αhSgo1」は、抗hSgo1抗体を用いて免疫抗体を行ったことを、それぞれ表す。なお、「WCE(whole cell extract)」は、細胞抽出液を免疫ブロットしたことを表す(コントロール)。
【0056】
図3の免疫ブロット写真の左側に記載された「hSgo1」、「PP2A−A」、「PP2A−C」、「PP2A−B56α」、「PP2A−B55」は、それぞれ、免疫ブロットに用いた抗体を表す。
【0057】
図3に示す通り、抗hSgo1抗体を用いて免疫沈降を行った場合、抗PP2A−A抗体、抗PP2A−C抗体、抗PP2A−B56α抗体を用いて免疫ブロットを行ったレーンで、バンドを検出した。また、抗PP2A−B56α抗体を用いて免疫ブロットを行ったレーンで、最も濃いバンドを検出した。
【0058】
一方、抗PP2A−B55を用いて免疫ブロットを行ったレーンでは、バンドが検出されなかった。
【0059】
これらの結果は、hSgo1とPP2Aが相互作用することを示し、hSgo1がPP2AのB56サブユニットと直接相互作用することを示唆する。
【0060】
なお、本発明者らが別途行った実験より、hSgo1がPP2AのB56サブユニットに直接相互作用すること、及び、その際、hSgo1が、B56サブユニットを介して、PP2A(Aサブユニット及びCサブユニット)と相互作用することが確認された。
【実施例2】
【0061】
実施例2では、免疫染色により、体細胞分裂の各期におけるhSgo1及びPP2Aの細胞内局在を検討した。
【0062】
まず、ホルムアルデヒドで細胞を固定し、界面活性剤(Triton X−100)で細胞膜の浸透性を高めた。次に、細胞を抗Sgo抗体又は抗PP2A−B56α抗体(一次抗体)で処理した後、蛍光物質で標識した抗体(二次抗体)で処理し、「細胞内タンパク質(Sgo又はPP2A)−一次抗体−二次抗体(蛍光物質)」の複合体を形成させた。そして、光学顕微鏡を用いて、体細胞分裂の各期における細胞について、Sgo又はPP2Aの細胞内局在を観察した。
【0063】
結果を図4に示す。
【0064】
図4は、抗Sgo抗体又は抗PP2A−B56α抗体を用いて行った、体細胞分裂の各期における免疫染色の光学顕微鏡写真である。図4中の各光学顕微鏡写真について、一番左側の列の各写真は、抗PP2A−B56α抗体を用いて行った免疫染色の写真、真ん中の列の書く写真は、抗Sgo抗体を用いて行った免疫染色の写真、一番右側の列の各写真は、DNA染色と抗Sgo抗体及び抗PP2A−B56α抗体を用いて行った免疫染色の両方を行った場合の写真である。一方、各段は、細胞周期のステージが、上から、中間期(interphase)、前期(pro)、前中期(prometa)、中期(meta)、後期の前半(early ana)、後期の後半(late ana)における写真である。
【0065】
図4に示す通り、hSgo1とPP2A−B56は、ともに、細胞分裂の前期から中期にかけて、核(内の動原体)付近に局在していた。
【実施例3】
【0066】
実施例3では、RNA干渉によりPP2A又はSgoの発現を抑制した場合における染色体の状態を観察した。
【0067】
まず、hSgo1、hSgo2、及び、PP2A−Aサブユニットの各siRNAを作製した。hSgo1のsiRNAの塩基配列を配列番号8に、hSgo2のsiRNAの塩基配列を配列番号9に、PP2A−AサブユニットのsiRNAの塩基配列を配列番号10に、それぞれ示す。
【0068】
次に、培養液中にsiRNAを添加し、培養細胞にsiRNAを取り込ませ、所定時間培養した。
【0069】
次に、実施例1などと同様の方法により細胞抽出液を抽出し、SDS−PAGEにより細胞抽出液中のタンパク質を分離し、ゲル内で展開させた後、免疫ブロットを行った。免疫ブロットは、抗PP2A−A抗体、抗hSgo1抗体、抗hSgo2抗体、抗γ−tubulin抗体の各抗体を用いて行った。
【0070】
また、siRNAを取り込ませ、所定時間培養した細胞について、ギムザ染色を行い、光学顕微鏡で、細胞分裂中期の細胞における染色体の状態を観察した。
【0071】
結果を図5から図7に示す。
【0072】
図5は、RNA干渉によりPP2Aの発現を抑制したことを示す免疫ブロット写真である。図5中、「control」はRNA干渉を行っていない細胞について免疫ブロットを行ったレーンであることを(コントロール)、「PP2A−A RNAi」はRNA干渉によりPP2A−Aの発現を抑制した場合のレーンであることを、それぞれ表す。図中、「PP2A−A」、「hSgo1」、「hSgo2」、「γ−tubulin」は、それぞれ、免疫ブロットを行った際に用いた抗体の種類を表す。
【0073】
図5より、RNA干渉によりPP2Aの発現が抑制されたことが確認された。
【0074】
図6は、RNA干渉により各タンパク質の発現を抑制した場合における細胞分裂中期の細胞のギムザ染色写真である。図6中、「control」はRNA干渉を行っていない細胞の写真、「PP2A−A RNAi」はRNA干渉によりPP2A−Aの発現を抑制した細胞の写真、「hSgo2 RNAi」は同じくhSgo2の発現を抑制した細胞の写真、「hSgo1 RNAi」は同じくhSgo1の発現を抑制した細胞の写真である。「cen lost(centromere lost)」は動原体付近の接着が失われている細胞の写真、「separated」は姉妹染色分体が完全に分離している細胞の写真である。
【0075】
図7は、RNA干渉により各タンパク質の発現を抑制した場合において、動原体の接着が失われている細胞及び姉妹染色分体が完全に分離している細胞の細胞数の割合を示すグラフである。
【0076】
図6及び図7に示す通り、PP2A−Aの発現を抑制した場合、hSgo1の発現を抑制した場合と同様、姉妹染色分体の分離が促進した。この結果は、体細胞分裂の中期において、PP2Aが、姉妹染色分体間の接着の保持に関与していることを示唆する。
【0077】
即ち、実施例1及び実施例2の結果、及び、PP2Aが脱リン酸化酵素であることを勘案すると、本実験結果は、体細胞分裂の中期において、PP2Aが、hSgo1と相互作用して動原体付近に局在し、コヒーシン複合体のリン酸化を相反的に阻害することにより、姉妹染色分体間の接着を保持している可能性を示唆する。
【0078】
その他、図6及び図7に示す通り、hSgo2の発現を抑制した場合も、hSgo1の発現を抑制した場合と同様、姉妹染色分体の分離が促進した。この結果は、体細胞分裂の中期において、hSgo2も、姉妹染色分体間の接着の保持に関与していることを示唆する。
【実施例4】
【0079】
実施例4では、Sgo2とPP2Aの相互作用について、実験を行った。
【0080】
実験手順は実施例1と同様である。
【0081】
結果を図8に示す。図8は、抗hSgo2抗体を用いて免疫沈降を行った場合における免疫ブロット写真である。
【0082】
図8中、「IP(immunoprecipitation)」は、その抗体を用いて免疫沈降を行ったことを表し、「cont. IgG」は、対照としてIgG抗体を用いて免疫沈降を行ったことを、「αhSgo2」は、抗hSgo2抗体を用いて免疫抗体を行ったことを、それぞれ表す。なお、「WCE(whole cell extract)」は、細胞抽出液を免疫ブロットしたことを表す(コントロール)。
【0083】
図8の免疫ブロット写真の左側に記載された「hSgo2」、「PP2A−A」、「PP2A−C」、「PP2A−B56α」、「PP2A−B55」は、それぞれ、免疫ブロットに用いた抗体を表す。
【0084】
図8に示す通り、抗hSgo2抗体を用いて免疫沈降を行った場合、抗PP2A−A抗体及び抗PP2A−C抗体を用いて免疫ブロットを行ったレーンで、バンドを検出した。また、抗PP2A−A抗体を用いて免疫ブロットを行ったレーンで、濃いバンドを検出した。
【0085】
一方、抗PP2A−B55及び抗PP2A−B55抗体を用いて免疫ブロットを行ったレーンでは、バンドが検出されなかった。
【0086】
これらの結果は、hSgo2とPP2Aが相互作用することを示し、hSgo2がPP2AのAサブユニットと直接相互作用することを示唆する。
【0087】
なお、本発明者らが別途行った実験より、hSgo2がPP2AのAサブユニットに特異的に相互作用することが確認された。また、本発明者らが別途行った実験より、hSgo2が、体細胞分裂において、PP2A(及びhSgo1)の動原体への局在に関与することが示唆された。
【図面の簡単な説明】
【0088】
【図1】SgoとPP2Aの相互作用、及び、その相互作用に基づく細胞分裂のメカニズムを示す模式図。
【図2】本発明に係る抗がん剤の作用メカニズムを模式的に示す図。
【図3】実施例1において、抗hSgo1抗体を用いて免疫沈降を行った場合における免疫ブロット写真。
【図4】実施例2において、抗Sgo抗体又は抗PP2A−B56α抗体を用いて行った、体細胞分裂の各期における免疫染色の光学顕微鏡写真。
【図5】実施例3において、RNA干渉によりPP2Aの発現を抑制したことを示す免疫ブロット写真。
【図6】実施例3において、RNA干渉により各タンパク質の発現を抑制した場合における細胞分裂中期の細胞ギムザ染色写真。
【図7】実施例3において、RNA干渉により各タンパク質の発現を抑制した場合において、動原体の接着が失われている細胞及び姉妹染色分体が完全に分離している細胞の細胞数の割合を示すグラフ。
【図8】実施例4において、抗hSgo2抗体を用いて免疫沈降を行った場合における免疫ブロット写真。
【技術分野】
【0001】
本発明は、SgoとPP2Aのタンパク質相互作用、前記相互作用を阻害又は抑制する物質を含有する抗がん剤、前記相互作用を用いたスクリーニング方法などに関する。
【背景技術】
【0002】
体細胞分裂の場合、細胞周期は、DNA合成準備期(G1期)、DNA合成期(S期)、分裂準備期(G2期)、分裂期(M期)の4つの時期に分類される。分裂期(M期)は、さらに、前期(pro期)、中期(meta期)、後期(ana期)、終期(telo期)に細分類される。
【0003】
体細胞分裂の際、染色体は娘細胞に正確に分配される。DNA合成期(S期)に染色体は複製されて一対の姉妹染色分体を形成する。細胞分裂の前期(pro期)に染色体(姉妹染色分体)は凝縮し、中期(meta期)に一対の姉妹染色分体が細胞の赤道面に整列し、後期(ana期)に姉妹染色分体は分離して紡錐体(spindle)の両極に向かって移動する。
【0004】
各姉妹染色分体上には、動原体(セントロメア)が存在する。動原体には、細胞分裂の中期に紡錘糸が結合する。これにより、紡錘体が形成され、各姉妹染色分体には、紡錘体の両極に向かう張力が働くようになる。
【0005】
一方、一対の姉妹染色分体は、その形成直後から分裂期の中期まで、コヒーシン複合体によって接着されており、分離しない。そのため、細胞分裂の中期では、紡錐体による張力と、コヒーシン複合体による接着力とのバランスにより、一対の姉妹染色分体が細胞の赤道面に整列する。
【0006】
そして、細胞分裂の後期には、セパレース(エンドペプチダーゼ)によりコヒーシン複合体が分解されるため、姉妹染色分体間の接着力が働かなくなる。そのため、紡錘糸による張力により、姉妹染色分体は分離して紡錐体の両極に向かって移動する。
【0007】
コヒーシン複合体は、4つのサブユニットで構成される(非特許文献1参照)。体細胞分裂におけるコヒーシン複合体は、2つのSMCファミリータンパク質(Smc1、及び、Smc3)及び2つの非SMCファミリータンパク質(Scc1、及び、Scc3(動物細胞ではSA))で構成される。一方、減数分裂におけるコヒーシン複合体は、Scc1がRec8に置き換わった構造を備える。なお、「SMC」は、structural maintenance of chromosomeである。
【0008】
コヒーシン複合体は、Smc1とSmc3が2量体を形成して2本の姉妹染色分体をリング状に取り囲み、Scc1が、Scc3の助けでそのリングを閉じることにより、一対の染色分体を接着させると推測されている(非特許文献2参照)。
【0009】
コヒーシン複合体は、Plk1(polo−like kinase)によりリン酸化され、分解されることが知られている(非特許文献3参照)。DNA合成期には、一対の姉妹染色分体は、コヒーシン複合体により、多数の点で接着される。それに対し、細胞分裂の前中期には、姉妹染色分体は、動原体付近以外では、ほとんどが分離している。これは、細胞分裂の前期において、コヒーシン複合体の大部分がPlkによりリン酸化され、姉妹染色分体から解離するためであると推測されている。
【0010】
Sgo(shugoshin/Mei−S332)は、減数分裂の際の染色体分配に関わるタンパク質として同定された。減数分裂の際、このタンパク質が、動原体部分のコヒーシン複合体に結合してそれを保護し、減数第一分裂の際における姉妹染色体の分離を防止することが報告されている(非特許文献4参照)。また、近年、ヒトの体細胞分裂においても、このタンパク質(human Sgo1)が、動原体からのコヒーシン複合体の分離を阻害していることが報告されている(非特許文献5参照)。その他、Sgoとがんとの関連性については、乳がんの細胞でSgo1の発現が上昇することが報告されている(例えば、非特許文献6参照)。
【0011】
ここで、本発明と関連のあるタンパク質、PP2Aについて、以下説明する。
【0012】
PP2A(PROTEIN PHOSPHATASE 2A)は、真核細胞における代表的なセリン/スレオニンフォスファターゼ(脱リン酸化酵素)の一つで、細胞内の多くの代謝・反応系に関与している。
【0013】
PP2Aは3つのサブユニットからなるヘテロトリマーである。PP2Aのコア構造は、Cサブユニット(Catalytic C subunit;PP2A−C)とAサブユニット(Scaffold A subunit;PP2A−A)のダイマーであり、そのコア構造にBサブユニット(Regulatory B subunit;PP2A−B)がリクルートされる。Cサブユニットは酵素活性中心を有し、Bサブユニット(PP2A−B)は、基質特異性や細胞内局在を調節する。
【0014】
Bサブユニット(PP2A−B)は、Bファミリー(「B55」又は「PR55」)、B’ファミリー(「B56」又は「PR61」)、B’’ファミリー(「PR72」)、B’’’ファミリー(「PR93/PR110」)に分類される。そのうち、Bファミリー(B55)には、α、β、γ、δの4種類が、B’ファミリー(B56)には、α、β、γ、δ、εの5種類が、それぞれ知られている。リクルートされるBサブユニット(PP2A−B)の種類によって、酵素反応の種類(基質の種類)が選択されると推測されている(非特許文献7参照)。
【非特許文献1】Nasmyth K. et al “The structure and function of SMC and kleisincomplexes.” Annu Rev Biochem, 2005; 74 :595-648
【非特許文献2】Ivanov D. et al “A topological interaction between cohesin rings anda circular minichromosome.” Cell, 2005 Sep 23; 122(6): 89-60
【非特許文献3】Sumura I. et al “The dissociation ofcohesin from chromosomes in prophase is regulated by Polo-like kinase.” MolCell, 2002 Mar; 9(3): 515-25
【非特許文献4】Kitajima TS. et al “The conserved kinetochore protein shugoshinprotects centromeric cohesion during meiosis.” Nature, 2004 Feb 5; 427(6974):510-7. Epub 2004 Jan 18.
【非特許文献5】Kitajima TS. et al “Human Bub1 defines the persistent cohesion sitealong the mitotic chromosome by affecting Shugoshin localization.” Curr Biol,2005 Feb 22; 15(4): 353-9
【非特許文献6】Scanlan MJ. et al “Humoral immunity to human breast cancer: antigendefinition and quantitative analysis of mRNA expression.” Cancer Immun, 2001Mar 30; 1:4.
【非特許文献7】Janssens V. et al “Protein phosphatase 2A: a highly regulated familyof serine/threonine phosphatases implicated in cell growth and signalling.”Biochem J. 2001 Feb 1; 353(Pt3): 417-39
【発明の開示】
【発明が解決しようとする課題】
【0015】
上述の各知見より、体細胞分裂の際、Sgoが、姉妹染色分体の動原体付近におけるコヒーシン複合体を保護し、動原体からのコヒーシン複合体の分離(細胞分裂中期における姉妹染色分体の分離)を阻害している可能性が示唆される。しかし、その具体的なメカニズムに関してはほとんど解明されていない。
【0016】
一方、がん細胞は、短い細胞周期で過剰な細胞分裂を繰り返す。従って、体細胞分裂のメカニズムは、抗がん剤のターゲットとなる可能性がある。
【0017】
そこで、本発明は、体細胞分裂のメカニズムを解明すること、及び、そのメカニズムに基づく新規な抗がん剤を提供することを主な目的とする。
【課題を解決するための手段】
【0018】
本発明では、まず、SgoとPP2Aの相互作用(PP2Aと相互作用するSgo、及び、Sgoと相互作用するPP2A)を提供する。ここで、Sgoは、human Sgo1、及び、human Sgo2の両者(以下、「hSgo1」及び「hSgo2」とする。)を含む。
【0019】
上述の通り、細胞分裂の前期において、コヒーシン複合体の大部分はPlkによりリン酸化され、姉妹染色分体から解離すると推測されている。一方、姉妹染色分体の動原体付近では、hSgo1と動原体が結合して保護することにより、コヒーシン複合体が姉妹染色分体から解離せず、両染色分体の接着状態が保持されると考えられている。
【0020】
本発明者らは、今回、SgoとPP2Aが相互作用すること、及び、hSog1とPP2Aは、体細胞分裂の前期から中期にかけて、ともに、染色体(の動原体)付近に局在すること、を新規に見出した。
【0021】
PP2Aが脱リン酸化酵素であることを勘案すると、これらの発明事項は、以下の体細胞分裂時におけるメカニズムを示唆する。体細胞分裂の前期から中期にかけて、Sgoが姉妹染色分体の動原体に結合し、SgoとPP2Aは、ともに、動原体付近に局在する。これにより、PP2Aの脱リン酸化が、Plk1によるコヒーシン複合体のリン酸化に対して相反的に作用するため、動原体付近におけるコヒーシン複合体のリン酸化が抑制され、姉妹染色分体間の接着は保持される。
【0022】
即ち、本発明は、体細胞分裂の中期まで姉妹染色分体の動原体部分における接着が保持されるメカニズムを解明した点で、重要な意義を有する。
【0023】
続いて、本発明では、SgoとPP2Aの相互作用を阻害又は抑制する抗がん剤を提供する。
【0024】
上述の通り、がん細胞は、短い細胞周期で過剰な細胞分裂を繰り返す。それに対し、SgoとPP2Aの相互作用を阻害又は抑制する物質は、細胞分裂を特異的に阻害又は抑制できるため、抗がん剤に適用できる可能性がある。
【0025】
なお、Sgoは細胞分裂において特異的に機能するタンパク質であるため、
本発明に係る抗がん剤は、体細胞分裂を行っている細胞に特異的に作用すると推定できる。従って、本剤は、副作用が少ない可能性が高い。即ち、正常細胞は、がん細胞に比べて、体細胞分裂を行う頻度は低いため、本剤による影響は少ないと考える。また、本剤は、他の代謝系にほとんど影響を与えない可能性が高いため、副作用は少ないと考える。
【0026】
以下、本発明に係るタンパク質について、説明する。
【0027】
本発明に係るhSgo1のアミノ酸配列を配列番号1に、hSgo2のアミノ酸配列を配列番号2に、それぞれ示す。なお、本発明に係るSgoは、hSgo1、hSgo2、並びに前記いずれかのタンパク質のアミノ酸配列と相同性を有し、PP2Aと相互作用するものを全て包含する。即ち、例えば、Sgoのスプライシング・バリアント(同一の遺伝子に由来するが、スプライシングにより、配列の一部が異なっているタンパク質、以下同じ)や、前記アミノ酸配列中の一部に、置換、欠損、挿入、付加部分が含まれるものも、本発明に係るSgoに包含される。
【0028】
本発明に係るPP2AのB56サブユニットのアミノ酸配列を、配列番号3から配列番号7に示す。それぞれ、配列番号3はPP2A−B56α、配列番号4はPP2A−B56β、配列番号5はPP2A−B56γ、配列番号6はPP2A−B56δ、配列番号7はPP2A−B56εのアミノ酸配列である。なお、本発明に係るPP2Aは、PP2Aの各サブユニット(Cサブユニット、Aサブユニット、及び、B56サブユニット(配列番号3から配列番号7のいずれかに記載のアミノ酸配列を有するサブユニット))、並びにそれらのアミノ酸配列と相同性を有し、Sgoと相互作用するものを全て包含する。即ち、例えば、PP2Aのいずれかのサブユニットのスプライシング・バリアントや、前記アミノ酸配列中の一部に、置換、欠損、挿入、付加部分が含まれるものも、本発明に係るPP2Aに包含される。
【発明の効果】
【0029】
本発明は、体細胞分裂に関わるメカニズムの解明の一助となる。また、新規な作用機序に基づく抗がん剤又はそのスクリーニング方法などに応用できる。
【発明を実施するための最良の形態】
【0030】
<本発明に係る相互作用について>
はじめに、SgoとPP2Aの相互作用について、図1を用いて、以下説明する。
【0031】
図1は、SgoとPP2Aの相互作用、及び、その相互作用に基づく細胞分裂のメカニズムを示す模式図である。図1中、左側の模式図は、ヒトの体細胞分裂(Human mitosis)に関わるメカニズムを、右側の模式図は、分裂酵母の減数分裂(Fission yeast meiosis)に関わるメカニズムを、それぞれ表す。
【0032】
体細胞分裂において、hSgo1は、PP2AのB56サブユニットと相互作用する。hSgo1はPP2Aとともに、染色体上の動原体付近に局在する。PP2A(のCサブユニット)は、コヒーシン複合体のScc3(SA)の脱リン酸化(dephosphorylation)を行う。これにより、コヒーシン複合体の分解(リン酸化)が相反的に阻害され、姉妹染色分体の分離が阻害される。なお、hSgo1それ自体も、動原体と結合することによって、動原体付近のコヒーシン複合体をPlk(リン酸化酵素)から保護している。
【0033】
hSgo2は、PP2AのAサブユニットと相互作用する。hSgo2は、体細胞分裂において、hSgo1とPP2Aの複合体を動原体に局在させる働きを担っていると推測する。
【0034】
一方、減数分裂においても、hSgo1は、PP2AのB56サブユニットと相互作用する。hSgo1は、PP2Aを動原体に局在させ、PP2Aは、コヒーシン複合体のRec8サブユニットを脱リン酸化する。これにより、第一減数分裂時におけるコヒーシン複合体の分解(染色体の分離)を阻害している。
【0035】
<SgoとPP2Aの相互作用を阻害又は抑制する抗がん剤について>
上述の通り、SgoとPP2Aの相互作用を阻害又は抑制する物質は、抗がん剤として適用できる可能性がある。
【0036】
SgoとPP2Aの相互作用を阻害又は抑制する物質として、例えば、(1)Sgoの立体構造中の、PP2Aとの結合部位に対して特異的に結合する物質、(2)Sgoの立体構造中の、PP2Aとの結合部位の近傍に結合することにより、前記相互作用を阻害又は抑制する物質、(3)Sgoと結合して、Sgoの立体構造を変化させる物質、(4)PP2Aの立体構造中の、Sgoとの結合部位に対して特異的に結合する物質、(5)PP2Aの立体構造中の、Sgoとの結合部位の近傍に結合することにより、前記相互作用を阻害又は抑制する物質、(6)PP2Aと結合して、PP2Aの立体構造を変化させる物質、(7)抗Sgo抗体、抗Sgoアプタマー、抗PP2A抗体、抗PP2Aアプタマー、(8)Sgoの発現を抑制する物質、(9)PP2Aの発現を抑制する物質、などを想定できる。以下、図2を用いて順に説明する。
【0037】
図2は、本発明に係る抗がん剤の作用メカニズムを模式的に示す図である。符号1はSgoを、符号2はPP2Aを、符号AはSgoとPP2Aの相互作用を示す。図2に示す通り、Sgo(符号1)は、立体構造中に、PP2Aとの相互作用部位11を有し、PP2A(符号2)は、立体構造中に、Sgoとの相互作用部位21を有する。
【0038】
(1)Sgoの立体構造中の、PP2Aとの結合部位に対して特異的に結合する物質について:例えば、この物質(符号M1)が、Sgoの立体構造中の、PP2Aとの結合部位11に対して特異的に結合した場合、SgoとPP2Aの相互作用が阻害又は抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。なお、これらの物質には、該部位(符号11)に特異的に結合する抗Sgo抗体も含まれる。
【0039】
(2)Sgoの立体構造中の、PP2Aとの結合部位の近傍に結合することにより、SgoとPP2Aの相互作用を阻害又は抑制する物質について:例えば、この物質(符号M2)が、Sgoの立体構造中の、PP2Aとの結合部位11の近傍に結合した場合、前記と同様、SgoとPP2Aの相互作用が阻害又は抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。なお、これらの物質には、該部位に特異的に結合する抗Sgo抗体も含まれる。
【0040】
(3)Sgoと結合して、前記タンパク質の立体構造を変化させる物質について:例えば、この物質(符号M3)がSgoと結合して、Sgoの立体構造を変化させた場合、前記と同様、SgoとPP2Aの相互作用が阻害又は抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。
【0041】
(4)PP2Aの立体構造中の、Sgoとの結合部位に対して特異的に結合する物質について:例えば、この物質(符号M4)がPP2Aの立体構造中の、Sgoとの結合部位21に対して特異的に結合した場合、前記と同様、SgoとPP2Aの相互作用が阻害又は抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。なお、これらの物質には、該部位(符号21)に特異的に結合する抗PP2A抗体も含まれる。
【0042】
(5)PP2Aの立体構造中の、Sgoとの結合部位の近傍に結合することにより、前記相互作用を阻害又は抑制する物質について:例えば、この物質(符号M5)がPP2Aの立体構造中の、Sgoとの結合部位21の近傍に結合した場合、前記と同様、SgoとPP2Aの相互作用が阻害又は抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。なお、これらの物質には、該部位に特異的に結合する抗PP2A抗体も含まれる。
【0043】
(6)PP2Aと結合して、PP2Aの立体構造を変化させる物質について:例えば、この物質(符号M6)がPP2Aと結合して、PP2Aの立体構造を変化させた場合、前記と同様、SgoとPP2Aの相互作用が阻害又は抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。
【0044】
(7)抗Sgo抗体、抗Sgoアプタマー、抗PP2A抗体、抗PP2Aアプタマーについて:抗Sgo抗体又は抗Sgoアプタマー(符号M7)、及び、抗PP2A抗体又は抗PP2Aアプタマー(符号M8)は、Sgo又はPP2Aと特異的に結合し、その機能を抑制する。そのため、前記と同様、SgoとPP2Aの相互作用が阻害又は抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。ここで、アプタマーは、抗体代替分子であり、標的分子を特異的に認識するオリゴヌクレオチドである。抗体又はアプタマーは、公知の方法により作製できる。
【0045】
(8)Sgoの発現を抑制する物質について:例えば、この物質(図示せず)によりSgoの発現が抑制された場合、SgoとPP2Aの相互作用が抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。なお、Sgoは細胞分裂に特異的なタンパク質であるため、Sgoの発現を抑制する物質は、がん細胞以外の正常細胞にあまり影響を与えない可能性が高い。即ち、本物質は、副作用が少ない可能性が高い。
【0046】
このような物質として、例えば、Sgoをコードする遺伝子の塩基配列の一部と同じ塩基配列を有する二本鎖RNAであって、RNA干渉によって、そのタンパク質の発現を抑制する二本鎖RNA、及び、Sgoのプロモーター領域に作用する物質、が挙げられる。なお、RNA干渉に基づく二本鎖RNAは、公知方法により設計・作製できる(以下同じ)。
【0047】
(9)PP2Aの発現を抑制する物質について:
例えば、この物質(図示せず)によりPP2Aの発現が抑制された場合、前記と同様、SgoとPP2Aの相互作用が抑制されるため、細胞分裂が抑制される。従って、この物質は、抗がん剤として有効な可能性がある。
【0048】
このような物質として、例えば、PP2Aをコードする遺伝子の塩基配列の一部と同じ塩基配列を有する二本鎖RNAであって、RNA干渉によって、そのタンパク質の発現を抑制する二本鎖RNA、及び、PP2Aのプロモーター領域に作用する物質、が挙げられる。
【0049】
<本発明に係るスクリーニング方法について>
上述の通り、SgoとPP2Aの相互作用を阻害又は抑制する物質は、抗がん剤に適用できる可能性がある。従って、例えば、SgoとPP2Aの相互作用を阻害又は抑制する物質を探索することにより、新規薬剤を見つけ出すことができる可能性がある。
【0050】
相互作用の検出は、例えば、タンパク質間の結合を検出することによって行うことができる。タンパク質間の結合は、既知の方法、例えば、共免疫沈降法、免疫ブロット法、カラムを用いたプルダウン法、質量分析計を用いた方法、蛍光標識を用いたイメージング、又はそれらの組み合わせなどにより行うことができる。
【0051】
本発明に係るスクリーニング方法は、キット化が可能である。その場合、例えば、Sgo、PP2A、抗Sgo抗体、抗PP2A抗体、相互作用検出(共免疫沈降法、免疫ブロット法、免疫染色法など)に用いる試薬などを、検出方法に応じて適宜組み合わせ、キット化する。
【実施例1】
【0052】
実施例1では、Sgo1とPP2Aの相互作用を調べた。
【0053】
まず、培養したHeLa細胞を、lysis bufferを用いて溶解し、細胞抽出液を得た。次に、抗hSgo1抗体を用いて免疫沈降を行い、内因性のhSgo1及びその相互作用複合体を回収した。次に、SDS−PAGE(ポリアクリルアミド電気泳動、以下同じ)により、回収した相互作用複合体をゲル内で展開させた後、抗PP2A−A抗体、抗PP2A−C抗体、抗PP2A−B56α抗体、抗PP2A−B55抗体、の各抗体を用いて、免疫ブロットを行った。
【0054】
結果を図3に示す。図3は、抗hSgo1抗体を用いて免疫沈降を行った場合における免疫ブロット写真である。
【0055】
図3中、「IP(immunoprecipitation)」は、その抗体を用いて免疫沈降を行ったことを表し、「cont. IgG」は、対照としてIgG抗体を用いて免疫沈降を行ったことを、「αhSgo1」は、抗hSgo1抗体を用いて免疫抗体を行ったことを、それぞれ表す。なお、「WCE(whole cell extract)」は、細胞抽出液を免疫ブロットしたことを表す(コントロール)。
【0056】
図3の免疫ブロット写真の左側に記載された「hSgo1」、「PP2A−A」、「PP2A−C」、「PP2A−B56α」、「PP2A−B55」は、それぞれ、免疫ブロットに用いた抗体を表す。
【0057】
図3に示す通り、抗hSgo1抗体を用いて免疫沈降を行った場合、抗PP2A−A抗体、抗PP2A−C抗体、抗PP2A−B56α抗体を用いて免疫ブロットを行ったレーンで、バンドを検出した。また、抗PP2A−B56α抗体を用いて免疫ブロットを行ったレーンで、最も濃いバンドを検出した。
【0058】
一方、抗PP2A−B55を用いて免疫ブロットを行ったレーンでは、バンドが検出されなかった。
【0059】
これらの結果は、hSgo1とPP2Aが相互作用することを示し、hSgo1がPP2AのB56サブユニットと直接相互作用することを示唆する。
【0060】
なお、本発明者らが別途行った実験より、hSgo1がPP2AのB56サブユニットに直接相互作用すること、及び、その際、hSgo1が、B56サブユニットを介して、PP2A(Aサブユニット及びCサブユニット)と相互作用することが確認された。
【実施例2】
【0061】
実施例2では、免疫染色により、体細胞分裂の各期におけるhSgo1及びPP2Aの細胞内局在を検討した。
【0062】
まず、ホルムアルデヒドで細胞を固定し、界面活性剤(Triton X−100)で細胞膜の浸透性を高めた。次に、細胞を抗Sgo抗体又は抗PP2A−B56α抗体(一次抗体)で処理した後、蛍光物質で標識した抗体(二次抗体)で処理し、「細胞内タンパク質(Sgo又はPP2A)−一次抗体−二次抗体(蛍光物質)」の複合体を形成させた。そして、光学顕微鏡を用いて、体細胞分裂の各期における細胞について、Sgo又はPP2Aの細胞内局在を観察した。
【0063】
結果を図4に示す。
【0064】
図4は、抗Sgo抗体又は抗PP2A−B56α抗体を用いて行った、体細胞分裂の各期における免疫染色の光学顕微鏡写真である。図4中の各光学顕微鏡写真について、一番左側の列の各写真は、抗PP2A−B56α抗体を用いて行った免疫染色の写真、真ん中の列の書く写真は、抗Sgo抗体を用いて行った免疫染色の写真、一番右側の列の各写真は、DNA染色と抗Sgo抗体及び抗PP2A−B56α抗体を用いて行った免疫染色の両方を行った場合の写真である。一方、各段は、細胞周期のステージが、上から、中間期(interphase)、前期(pro)、前中期(prometa)、中期(meta)、後期の前半(early ana)、後期の後半(late ana)における写真である。
【0065】
図4に示す通り、hSgo1とPP2A−B56は、ともに、細胞分裂の前期から中期にかけて、核(内の動原体)付近に局在していた。
【実施例3】
【0066】
実施例3では、RNA干渉によりPP2A又はSgoの発現を抑制した場合における染色体の状態を観察した。
【0067】
まず、hSgo1、hSgo2、及び、PP2A−Aサブユニットの各siRNAを作製した。hSgo1のsiRNAの塩基配列を配列番号8に、hSgo2のsiRNAの塩基配列を配列番号9に、PP2A−AサブユニットのsiRNAの塩基配列を配列番号10に、それぞれ示す。
【0068】
次に、培養液中にsiRNAを添加し、培養細胞にsiRNAを取り込ませ、所定時間培養した。
【0069】
次に、実施例1などと同様の方法により細胞抽出液を抽出し、SDS−PAGEにより細胞抽出液中のタンパク質を分離し、ゲル内で展開させた後、免疫ブロットを行った。免疫ブロットは、抗PP2A−A抗体、抗hSgo1抗体、抗hSgo2抗体、抗γ−tubulin抗体の各抗体を用いて行った。
【0070】
また、siRNAを取り込ませ、所定時間培養した細胞について、ギムザ染色を行い、光学顕微鏡で、細胞分裂中期の細胞における染色体の状態を観察した。
【0071】
結果を図5から図7に示す。
【0072】
図5は、RNA干渉によりPP2Aの発現を抑制したことを示す免疫ブロット写真である。図5中、「control」はRNA干渉を行っていない細胞について免疫ブロットを行ったレーンであることを(コントロール)、「PP2A−A RNAi」はRNA干渉によりPP2A−Aの発現を抑制した場合のレーンであることを、それぞれ表す。図中、「PP2A−A」、「hSgo1」、「hSgo2」、「γ−tubulin」は、それぞれ、免疫ブロットを行った際に用いた抗体の種類を表す。
【0073】
図5より、RNA干渉によりPP2Aの発現が抑制されたことが確認された。
【0074】
図6は、RNA干渉により各タンパク質の発現を抑制した場合における細胞分裂中期の細胞のギムザ染色写真である。図6中、「control」はRNA干渉を行っていない細胞の写真、「PP2A−A RNAi」はRNA干渉によりPP2A−Aの発現を抑制した細胞の写真、「hSgo2 RNAi」は同じくhSgo2の発現を抑制した細胞の写真、「hSgo1 RNAi」は同じくhSgo1の発現を抑制した細胞の写真である。「cen lost(centromere lost)」は動原体付近の接着が失われている細胞の写真、「separated」は姉妹染色分体が完全に分離している細胞の写真である。
【0075】
図7は、RNA干渉により各タンパク質の発現を抑制した場合において、動原体の接着が失われている細胞及び姉妹染色分体が完全に分離している細胞の細胞数の割合を示すグラフである。
【0076】
図6及び図7に示す通り、PP2A−Aの発現を抑制した場合、hSgo1の発現を抑制した場合と同様、姉妹染色分体の分離が促進した。この結果は、体細胞分裂の中期において、PP2Aが、姉妹染色分体間の接着の保持に関与していることを示唆する。
【0077】
即ち、実施例1及び実施例2の結果、及び、PP2Aが脱リン酸化酵素であることを勘案すると、本実験結果は、体細胞分裂の中期において、PP2Aが、hSgo1と相互作用して動原体付近に局在し、コヒーシン複合体のリン酸化を相反的に阻害することにより、姉妹染色分体間の接着を保持している可能性を示唆する。
【0078】
その他、図6及び図7に示す通り、hSgo2の発現を抑制した場合も、hSgo1の発現を抑制した場合と同様、姉妹染色分体の分離が促進した。この結果は、体細胞分裂の中期において、hSgo2も、姉妹染色分体間の接着の保持に関与していることを示唆する。
【実施例4】
【0079】
実施例4では、Sgo2とPP2Aの相互作用について、実験を行った。
【0080】
実験手順は実施例1と同様である。
【0081】
結果を図8に示す。図8は、抗hSgo2抗体を用いて免疫沈降を行った場合における免疫ブロット写真である。
【0082】
図8中、「IP(immunoprecipitation)」は、その抗体を用いて免疫沈降を行ったことを表し、「cont. IgG」は、対照としてIgG抗体を用いて免疫沈降を行ったことを、「αhSgo2」は、抗hSgo2抗体を用いて免疫抗体を行ったことを、それぞれ表す。なお、「WCE(whole cell extract)」は、細胞抽出液を免疫ブロットしたことを表す(コントロール)。
【0083】
図8の免疫ブロット写真の左側に記載された「hSgo2」、「PP2A−A」、「PP2A−C」、「PP2A−B56α」、「PP2A−B55」は、それぞれ、免疫ブロットに用いた抗体を表す。
【0084】
図8に示す通り、抗hSgo2抗体を用いて免疫沈降を行った場合、抗PP2A−A抗体及び抗PP2A−C抗体を用いて免疫ブロットを行ったレーンで、バンドを検出した。また、抗PP2A−A抗体を用いて免疫ブロットを行ったレーンで、濃いバンドを検出した。
【0085】
一方、抗PP2A−B55及び抗PP2A−B55抗体を用いて免疫ブロットを行ったレーンでは、バンドが検出されなかった。
【0086】
これらの結果は、hSgo2とPP2Aが相互作用することを示し、hSgo2がPP2AのAサブユニットと直接相互作用することを示唆する。
【0087】
なお、本発明者らが別途行った実験より、hSgo2がPP2AのAサブユニットに特異的に相互作用することが確認された。また、本発明者らが別途行った実験より、hSgo2が、体細胞分裂において、PP2A(及びhSgo1)の動原体への局在に関与することが示唆された。
【図面の簡単な説明】
【0088】
【図1】SgoとPP2Aの相互作用、及び、その相互作用に基づく細胞分裂のメカニズムを示す模式図。
【図2】本発明に係る抗がん剤の作用メカニズムを模式的に示す図。
【図3】実施例1において、抗hSgo1抗体を用いて免疫沈降を行った場合における免疫ブロット写真。
【図4】実施例2において、抗Sgo抗体又は抗PP2A−B56α抗体を用いて行った、体細胞分裂の各期における免疫染色の光学顕微鏡写真。
【図5】実施例3において、RNA干渉によりPP2Aの発現を抑制したことを示す免疫ブロット写真。
【図6】実施例3において、RNA干渉により各タンパク質の発現を抑制した場合における細胞分裂中期の細胞ギムザ染色写真。
【図7】実施例3において、RNA干渉により各タンパク質の発現を抑制した場合において、動原体の接着が失われている細胞及び姉妹染色分体が完全に分離している細胞の細胞数の割合を示すグラフ。
【図8】実施例4において、抗hSgo2抗体を用いて免疫沈降を行った場合における免疫ブロット写真。
【特許請求の範囲】
【請求項1】
PP2Aと相互作用するSgo。
【請求項2】
PP2AのB56サブユニットと相互作用することを特徴とする請求項1記載のSgo。
【請求項3】
PP2Aとともにを染色分体に局在することを特徴とする請求項1記載のSgo。
【請求項4】
Sgoと相互作用するPP2A。
【請求項5】
B56サブユニットで相互作用することを特徴とする請求項4記載のPP2A。
【請求項6】
リン酸化コヒーシンを脱リン酸化させ、染色分体の分離を阻害することを特徴とする請求項4記載のPP2A。
【請求項7】
SgoとPP2Aの相互作用を阻害又は抑制する物質を少なくとも含有する抗がん剤。
【請求項8】
前記物質は、Sgoの立体構造中の、PP2Aとの結合部位に対して特異的に結合する物質であることを特徴とする請求項7記載の抗がん剤。
【請求項9】
前記物質は、Sgoの立体構造中の、PP2Aとの結合部位の近傍に結合することにより、前記相互作用を阻害又は抑制する物質であることを特徴とする請求項7記載の抗がん剤。
【請求項10】
前記物質は、Sgoと結合して、Sgoの立体構造を変化させる物質であることを特徴とする請求項7記載の抗がん剤。
【請求項11】
前記物質は、PP2Aの立体構造中の、Sgoとの結合部位に対して特異的に結合する物質であることを特徴とする請求項7記載の抗がん剤。
【請求項12】
前記物質は、PP2Aの立体構造中の、Sgoとの結合部位の近傍に結合することにより、前記相互作用を阻害又は抑制する物質であることを特徴とする請求項7記載の抗がん剤。
【請求項13】
前記物質は、PP2Aと結合して、前記タンパク質の立体構造を変化させる物質であることを特徴とする請求項7記載の抗がん剤。
【請求項14】
前記物質は、抗Sgo抗体、抗Sgoアプタマー、抗PP2A抗体、抗PP2Aアプタマーのいずれかであることを特徴とする請求項7記載の抗がん剤。
【請求項15】
請求項1記載のSgoの発現を抑制する物質を少なくとも含有する抗がん剤。
【請求項16】
前記物質は、Sgoをコードする遺伝子の塩基配列の一部と同じ塩基配列を有する二本鎖RNAであって、RNA干渉によって、前記タンパク質の発現を抑制する二本鎖RNAであることを特徴とする請求項15記載の抗がん剤。
【請求項17】
前記物質は、Sgoのプロモーター領域に作用する物質であることを特徴とする請求項15記載の抗がん剤。
【請求項18】
請求項4記載のPP2Aの発現を抑制する物質を少なくとも含有する抗がん剤。
【請求項19】
前記物質は、PP2Aをコードする遺伝子の塩基配列の一部と同じ塩基配列を有する二本鎖RNAであって、RNA干渉によって、前記タンパク質の発現を抑制する二本鎖RNAであることを特徴とする請求項18記載の抗がん剤。
【請求項20】
前記物質は、PP2Aのプロモーター領域に作用する物質であることを特徴とする請求項18記載の抗がん剤。
【請求項21】
SgoとPP2Aの相互作用を阻害又は抑制する物質を探索する抗がん剤のスクリーニング方法。
【請求項1】
PP2Aと相互作用するSgo。
【請求項2】
PP2AのB56サブユニットと相互作用することを特徴とする請求項1記載のSgo。
【請求項3】
PP2Aとともにを染色分体に局在することを特徴とする請求項1記載のSgo。
【請求項4】
Sgoと相互作用するPP2A。
【請求項5】
B56サブユニットで相互作用することを特徴とする請求項4記載のPP2A。
【請求項6】
リン酸化コヒーシンを脱リン酸化させ、染色分体の分離を阻害することを特徴とする請求項4記載のPP2A。
【請求項7】
SgoとPP2Aの相互作用を阻害又は抑制する物質を少なくとも含有する抗がん剤。
【請求項8】
前記物質は、Sgoの立体構造中の、PP2Aとの結合部位に対して特異的に結合する物質であることを特徴とする請求項7記載の抗がん剤。
【請求項9】
前記物質は、Sgoの立体構造中の、PP2Aとの結合部位の近傍に結合することにより、前記相互作用を阻害又は抑制する物質であることを特徴とする請求項7記載の抗がん剤。
【請求項10】
前記物質は、Sgoと結合して、Sgoの立体構造を変化させる物質であることを特徴とする請求項7記載の抗がん剤。
【請求項11】
前記物質は、PP2Aの立体構造中の、Sgoとの結合部位に対して特異的に結合する物質であることを特徴とする請求項7記載の抗がん剤。
【請求項12】
前記物質は、PP2Aの立体構造中の、Sgoとの結合部位の近傍に結合することにより、前記相互作用を阻害又は抑制する物質であることを特徴とする請求項7記載の抗がん剤。
【請求項13】
前記物質は、PP2Aと結合して、前記タンパク質の立体構造を変化させる物質であることを特徴とする請求項7記載の抗がん剤。
【請求項14】
前記物質は、抗Sgo抗体、抗Sgoアプタマー、抗PP2A抗体、抗PP2Aアプタマーのいずれかであることを特徴とする請求項7記載の抗がん剤。
【請求項15】
請求項1記載のSgoの発現を抑制する物質を少なくとも含有する抗がん剤。
【請求項16】
前記物質は、Sgoをコードする遺伝子の塩基配列の一部と同じ塩基配列を有する二本鎖RNAであって、RNA干渉によって、前記タンパク質の発現を抑制する二本鎖RNAであることを特徴とする請求項15記載の抗がん剤。
【請求項17】
前記物質は、Sgoのプロモーター領域に作用する物質であることを特徴とする請求項15記載の抗がん剤。
【請求項18】
請求項4記載のPP2Aの発現を抑制する物質を少なくとも含有する抗がん剤。
【請求項19】
前記物質は、PP2Aをコードする遺伝子の塩基配列の一部と同じ塩基配列を有する二本鎖RNAであって、RNA干渉によって、前記タンパク質の発現を抑制する二本鎖RNAであることを特徴とする請求項18記載の抗がん剤。
【請求項20】
前記物質は、PP2Aのプロモーター領域に作用する物質であることを特徴とする請求項18記載の抗がん剤。
【請求項21】
SgoとPP2Aの相互作用を阻害又は抑制する物質を探索する抗がん剤のスクリーニング方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2007−182409(P2007−182409A)
【公開日】平成19年7月19日(2007.7.19)
【国際特許分類】
【出願番号】特願2006−2924(P2006−2924)
【出願日】平成18年1月10日(2006.1.10)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2005年11月25日 第28回日本分子生物学会年会組織委員会発行の「第28回日本分子生物学会年会講演要旨集」に発表
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成19年7月19日(2007.7.19)
【国際特許分類】
【出願日】平成18年1月10日(2006.1.10)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2005年11月25日 第28回日本分子生物学会年会組織委員会発行の「第28回日本分子生物学会年会講演要旨集」に発表
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

