ターゲット核酸断片の検出方法
【課題】ポリメラーゼ反応に伴って生成する核酸量を、当該ポリメラーゼ反応に伴って生成するピロリン酸を用いて定量的に測定する方法を提供すること。
【解決手段】(1)少なくとも一部の塩基配列が既知であるターゲット核酸断片、前記ターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸、少なくとも一種のポリメラーゼ、及びポリメラーゼ反応に必要な2価の陽イオンを含む反応混合物を使用して、前記ターゲット核酸断片を鋳型にして前記プライマーの3’末端を起点とするポリメラーゼ伸長反応を行う工程;及び(2)前記ポリメラーゼ伸長反応に伴って生成するピロリン酸を検出することによって前記ポリメラーゼ伸長反応が連続して進行するか否かを判定する工程;を含むターゲット核酸断片の検出方法において、ポリメラーゼ伸長反応の進行に伴って生成するピロリン酸を検出するための最初の反応をポリメラーゼ伸長反応と同時に行うことを特徴とする、上記の検出方法。
【解決手段】(1)少なくとも一部の塩基配列が既知であるターゲット核酸断片、前記ターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸、少なくとも一種のポリメラーゼ、及びポリメラーゼ反応に必要な2価の陽イオンを含む反応混合物を使用して、前記ターゲット核酸断片を鋳型にして前記プライマーの3’末端を起点とするポリメラーゼ伸長反応を行う工程;及び(2)前記ポリメラーゼ伸長反応に伴って生成するピロリン酸を検出することによって前記ポリメラーゼ伸長反応が連続して進行するか否かを判定する工程;を含むターゲット核酸断片の検出方法において、ポリメラーゼ伸長反応の進行に伴って生成するピロリン酸を検出するための最初の反応をポリメラーゼ伸長反応と同時に行うことを特徴とする、上記の検出方法。
【発明の詳細な説明】
【0001】
【発明の属する技術分野】
本発明は、ポリメラーゼ伸長反応によって生成する核酸量を正確に測定する方法に関する。より詳細には、本発明は、ターゲット核酸を鋳型とするポリメラーゼ伸長反応が進行したか否かを、伸長反応の副生成物として生じるピロリン酸量を定量することに関する。
【0002】
【従来の技術】
分子生物学の研究分野、遺伝子検査等の臨床応用分野において、ターゲット核酸断片を鋳型としたポリメラーゼ伸長反応の進行の検出を利用した遺伝子検出法が数多く開発されている。特に、PCR法は、(Polymerase Chain Reaction:特公平4−67960号、特公平4−67957号)は、非常に低濃度のターゲット核酸の検出を可能にした点により、現在、最も汎用されている技術の1つとなっている。
【0003】
さらに、これらのポリメラーゼ伸長反応後のDNA産物を検出する方法は多数存在する。例えば、アガロースゲルやポリアクリルアミドゲルを利用した電気泳動法は最も汎用されている技術の1つであり、簡便に行うことの出来る技術であるが、定量性と迅速性に欠けることが問題点であった。
【0004】
さらに、定量性、迅速性の向上を目指して、ターゲット核酸断片を鋳型としたポリメラーゼ伸長反応の進行の検出を利用した核酸の検出法が開発されている。ターゲット核酸断片の特定核酸領域をPCRにより増幅する際、増幅産物の生成の過程を蛍光強度の変化としてリアルタイムで検出する方法(Real Time PCR法)は、PCR後に増幅産物を電気泳動し、結果を解析するという工程を必要としないことから迅速性の点で良い方法である。しかし、これらの方法は、FRET(fluorescence resonance energy transfer)を利用した方法で、実施には蛍光強度の変化を測定することのできる装置と、安価ではない蛍光標識されたオリゴヌクレオチドを必要とする点で問題があり、未だ特殊技術の域を出ていない。
【0005】
一方、ターゲット核酸断片の特定領域にヌクレアーゼ耐性を有するオリゴヌクレオチドプライマーをハイブリダイズさせ、デオキシヌクレオシド3リン酸(dNTP)、DNAポリメラーゼ、ヌクレアーゼの存在下で伸長反応、分解反応を繰り返して、生成するピロリン酸又はデオキシヌクレオシドモノリン酸を検出する方法が、特開平7−231799号公報に開示されている。ポリメラーゼ伸長反応に伴って生成するピロリン酸を検出することによるターゲット核酸断片の検出方法は、ポリメラーゼ伸長反応の副産物である一般化学物質を検出することで、ターゲット核酸断片の検出を可能にしている点で優れている。
【0006】
しかしながら、ピロリン酸を検出することによるターゲット核酸断片の検出方法は、様々な問題点が指摘されている.例えば、特許2997043号公報において、ピロホスホロリシスがプライマー伸長反応に有害であることが示されている。また、ピロリン酸は加水分解を受けリン酸に解離するため、ポリメラーゼ反応中に生成するピロリン酸ではなく、リン酸を測定することが有効であることが特開平7−59600号公報に記されている.しかし、ポリメラーゼ反応において生成するピロリン酸は、完全にリン酸に変換されないので、この方法は定量性に欠けるという問題点がある。英国特許2324865号には、これらの問題点を解決するため、ポリメラーゼ反応後に、ピロフォスファターゼ等のピロリン酸を分解する因子を添加して、リン酸に変換した後、このリン酸を測定する方法が記載されている。
【0007】
また、増幅反応に供される酵素であるポリメラーゼは、2価のカチオンを要求することが多く、特にMg2+を用いることが多い。ポリメラーゼ反応の過程で生成するピロリン酸は、このMg2+をキレートするため、高濃度のMg2+存在化においては、ピロリン酸の生成に伴い、ピロリン酸マグネシウムが生じることが知られている(Mori et al.:BBRC 289,150−154(2001))。
【0008】
さらに、本発明者は、通常のポリメラーゼが要求するMg2+の濃度領域においても、ポリメラーゼ反応時にかかる熱とMg2+の濃度によって、当該反応中にピロリン酸とMg2+が反応し定量的にピロリン酸を測定できなくなるという問題が生じることを見出した。従って、前述の英国特許2324865号の方法では、ポリメラーゼ反応に伴って生成する核酸量を、ピロリン酸を用いて定量的に測定することはできない。
【0009】
【特許文献1】
特公平4−67960号
【特許文献2】
特公平4−67957号
【特許文献3】
特開平7−231799号公報
【特許文献4】
特許2997043号公報
【特許文献5】
特開平7−59600号公報
【特許文献6】
英国特許2324865号
【非特許文献1】
Mori et al.:BBRC 289,150−154(2001)
【0010】
【発明が解決しようとする課題】
本発明は上記した従来技術の問題点を解消することを解決すべき課題とした。即ち。本発明は、ポリメラーゼ反応に伴って生成する核酸量を、当該ポリメラーゼ反応に伴って生成するピロリン酸を用いて定量的に測定する方法を提供することを解決すべき課題とした。
【0011】
【課題を解決するための手段】
本発明者は、上記課題を解決するために鋭意検討した結果、ポリメラーゼ反応液に、ピロリン酸を検出するための最初の反応に必要な試薬をあらかじめ添加しておき、ポリメラーゼ反応と共にピロリン酸検出のための最初の反応を行わせることによって、上記課題を解決できることを見出し、本発明を完成させるに至った。
【0012】
即ち、本発明によれば、(1)少なくとも一部の塩基配列が既知であるターゲット核酸断片、前記ターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸、少なくとも一種のポリメラーゼ、及びポリメラーゼ反応に必要な2価の陽イオンを含む反応混合物を使用して、前記ターゲット核酸断片を鋳型にして前記プライマーの3’末端を起点とするポリメラーゼ伸長反応を行う工程;及び(2)前記ポリメラーゼ伸長反応に伴って生成するピロリン酸を検出することによって前記ポリメラーゼ伸長反応が連続して進行するか否かを判定する工程;を含むターゲット核酸断片の検出方法において、ポリメラーゼ伸長反応の進行に伴って生成するピロリン酸を検出するための最初の反応をポリメラーゼ伸長反応と同時に行うことを特徴とする、上記の検出方法が提供される。
【0013】
好ましくは、ピロリン酸を検出するための最初の反応は、ピロフォスファターゼにより当該ピロリン酸をリン酸に分解させる反応である。
好ましくは、ピロリン酸の検出反応は、ピロフォスファターゼ、キサントシンまたはイノシン、プリンヌクレオシドホスホリラーゼ、キサンチンオキシダーゼ、ペルオキシダーゼ及び発色剤を用いる反応であり、ピロフォスファターゼによる当該ピロリン酸をリン酸に分解させる反応をポリメラーゼ伸長反応と同時に行う。
好ましくは、ピロリン酸の検出を、キサントシンまたはイノシン、プリンヌクレオシドホスホリラーゼ、キサンチンオキシダーゼ、ペルオキシダーゼ及び発色剤を含有する試薬層を備える無機リン酸定量用乾式分析素子を用いて行う。
【0014】
好ましくは、ピロリン酸の検出反応は、アデノシン−5’−ホスファサルフェート、ATPスルフリラーゼ、発光酵素、発光基質を用いる反応であって、ピロリン酸を検出するための最初の反応がアデノシン−5’−ホスファサルフェートとATPスルフリラーゼにより、当該ピロリン酸をATPに変換させる反応である。
【0015】
好ましくは、前記発光酵素はルシフェラーゼであり、前記発光基質はルシフェリンである。
【0016】
本発明の別の側面によれば、分析するターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)、少なくとも一種のポリメラーゼ、ピロリン酸を検出するための最初の反応に必要な反応試薬、及び乾式分析素子を含む、上記したターゲット核酸の検出方法を行なうためのキットが提供される。
好ましくは、ピロリン酸を検出するための最初の反応に必要な反応試薬はピロフォスファターゼであり、乾式分析素子は無機リン酸定量用乾式分析素子である。
好ましくは、ピロリン酸を検出するための最初の反応に必要な反応試薬はアデノシン−5’−ホスファサルフェートとATPスルフリラーゼであり、乾式分析素子はアデノシン5’−三リン酸定量用乾式分析素子である。
【0017】
【発明の実施の形態】
以下、本発明の実施の形態について説明する。
本発明のターゲット核酸断片の分析方法においては、あらかじめピロリン酸を検出するための最初の反応に必要な反応試薬(例えば、耐熱性のピロフォスファターゼなど)を添加した反応液を使用することによりポリメラーゼ反応とピロリン酸をリン酸に分解させる反応とを同時に行い、次いで、この反応液を用いて、比色法によってピロリン酸から生成したリン酸の検出を行う。
【0018】
本発明では、より好ましくは、ピロリン酸から生成したリン酸の検出を乾式分析素子を用いて行う。本発明におけるターゲット核酸断片の分析方法では、ターゲット核酸の存在または存在量を検出したり、あるいはターゲット核酸断片の塩基配列を検出することができる。なお、ここでいう存在量の検出とは、ターゲット核酸の定量を含む概念である。ターゲット核酸断片の塩基配列の検出の具体例としては、ターゲット核酸断片の変異または多型の検出などが挙げられる。
【0019】
本発明に係るターゲット核酸断片の分析方法の第一の好ましい形態を以下に列記する。
(イ)ピロリン酸から生成したリン酸の検出を、キサントシンまたはイノシン、プリンヌクレオシドホスホリラーゼ、キサンチンオキシダーゼ、ペルオキシダーゼ及び発色剤を含有する試薬層を備えることを特徴とする無機リン酸(無機燐)定量用乾式分析素子を用いて行う。
(ロ)ポリメラーゼが、DNAポリメラーゼI、DNAポリメラーゼIのクレノー断片、Bst DNAポリメラーゼ、及び逆転写酵素(リバーストランスクリプターゼ)からなるグループから選択されるポリメラーゼを用いる。
(ハ)ポリメラーゼ反応液として、少なくとも一部の塩基配列が既知であるターゲット核酸断片、前記ターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、上記(ロ)に記載の少なくとも一種のポリメラーゼ、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)、及びピロリン酸をリン酸に変換する耐熱性のピロフォスファターゼからなる反応液を用いる。
【0020】
また、本発明の別の形態は、分析するターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)、少なくとも一種のポリメラーゼ、ピロリン酸を検出するための最初の反応に必要な反応試薬(例えば、耐熱性のピロフォスファターゼ)、及び無機リン酸定量用乾式分析素子の各要素を含むキットにある。
【0021】
さらに、本発明の第二の好ましい形態は、少なくとも一部の塩基配列が既知であるターゲット核酸断片、前記ターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸、及び少なくとも一種のポリメラーゼを反応させ、前記ターゲット核酸断片を鋳型にした前記プライマーの3’末端を起点とするポリメラーゼ伸長反応の進行の有無の検出を前記ポリメラーゼ伸長反応に伴って生成するピロリン酸を検出することにより行う際に、ピロリン酸の検出を、ピロリン酸をアデノシン5’−三リン酸に変換して、アデノシン5’−三リン酸をルシフェラーゼの存在下、ルシフェリンと反応させて、生成する発光の強度を測定する方法である。
【0022】
本発明の第二の形態での、ターゲット核酸断片分析方法の好ましい形態を以下に列記する。
(イ)ピロリン酸の検出を、ピロリン酸をアデノシン5’−三リン酸に変換して、さらに、アデノシン5’−三リン酸をルシフェラーゼの存在下、ルシフェリンと反応させて、生成する化学発光強度を測定することにより行う。
(ロ)ポリメラーゼが、DNAポリメラーゼI、DNAポリメラーゼIのク レノー断片、Bst DNAポリメラーゼ、及び逆転写酵素(リバーストランスクリプターゼ)からなるグループから選択されるポリメラーゼを用いる。
(ハ)ポリメラーゼ反応液が、少なくとも一部の塩基配列が既知であるターゲット核酸断片、前記ターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、上記(ロ)に記載の少なくとも一種のポリメラーゼ、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)、及びピロリン酸をアデノシン5’−三リン酸に変換するATPスルフリラーゼとアデノシン5’−ホスファサルフェートからなる反応液を用いる。
【0023】
また、本発明の別の形態は、分析するターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)、少なくとも一種のポリメラーゼ、ピロリン酸を検出するための最初の反応に必要な反応試薬(例えば、ピロリン酸をアデノシン5’−三リン酸に変換するATPスルフリラーゼとアデノシン5’−ホスファサルフェート)、及びアデノシン5’−三リン酸定量用乾式分析素子の各要素を含むキットにある。
【0024】
以下に本発明の実施の形態について更に詳細に説明する。
(A)ターゲット核酸断片:
本発明において分析の対象となるターゲット核酸断片とは、少なくとも一部の塩基配列が既知であるポリヌクレオチドであり、動物、微生物、細菌、植物などすべての生物から単離されるゲノミックDNA断片が対象となり得る。またウイルスから単離可能なRNA断片またはDNA断片、およびmRNAを鋳型として合成されたcDNA断片も対象とすることが可能である。ターゲット核酸断片はできる限り精製され、核酸断片以外の余分な成分が取り除かれていることが望ましい。例えば、動物(例えば人間)の血液から単離したゲノミックDNA断片を対象とする場合または血液中に存在する感染細菌やウイルスの核酸(DNAまたはRNA)断片を対象とする場合、単離の過程で破壊された白血球細胞膜、赤血球中から溶出したヘモグロビン、および血液中存在するその他の一般化学物質は、十分に取り除いておく必要がある。特にヘモグロンビンは、続いておこなうポリメラーゼ伸長反応を阻害する。また血液中に一般生化学物質として存在するピロリン酸やリン酸は、ポリメラーゼ伸長反応により生成するピロリン酸の正確な検出の妨害要因になる。
【0025】
(B)ターゲット核酸断片と相補的なプライマー:
本発明において使用するターゲット核酸断片と相補的なプライマーは、ターゲット核酸断片の塩基配列が既知である目的の部位に対して相補的な塩基配列を有するオリゴヌクレオチドである。このターゲット核酸断片と相補的なプライマーがターゲット核酸断片の目的の部位にハイブリダイゼーションすることで、プライマーの3’末端を起点に、ターゲット核酸を鋳型としポリメラーゼ伸長反応が進行する。即ち、本発明においてはプライマーがターゲット核酸断片の目的の部位を認識して特異的にハイブリダイゼーションするか否かがポイントとなる。本発明で使用するプライマーの好ましい塩基数は5〜60塩基である。特に好ましくは15〜40塩基である。プライマーの塩基数は少なすぎると、ターゲット核酸断片の目的の部位との特異的性が低下するだけでなく、ターゲット核酸断片とのハイブリッド自体が安定に形成できない。また、プライマーの塩基数は多すぎると、プライマー間またはプライマー内で塩基間の水素結合により2本鎖を形成してしまい、やはり特異性が低下する。
【0026】
本発明の方法を用いてターゲット核酸断片の存在を検出する場合、ターゲット核酸断片の異なる部位に対して、それぞれの部位に相補的なプライマーを複数使用することも可能である。このようにターゲット核酸断片を複数の部位で認識することで、ターゲット核酸断片の存在の検出において、特異性が向上する。また、ターゲット核酸断片の一部を増幅(例えばPCR法)する場合には、その増幅法に応じて複数のプライマーを設計することも可能である。本発明の方法を用いてターゲット核酸断片の塩基配列を検出する場合、特に変異または多型の有無を検出する場合は、目的の変異または多型の部分を含むように、変異または多型に対応する塩基の種類でプライマーを設計する。そうすることで、ターゲット核酸断片の変異または多型の有無により、ターゲット核酸断片へのプライマーのハイブリダイゼーションの有無に差異が生じ、結果的にポリメラーゼ伸長反応の差異として検出することが可能になる。また、変異または多型に対応する部分をプライマーの3’末端付近に設定することでポリメラーゼの反応部位の認識に差異が生じ、結果的にポリメラーゼ伸長反応の差異として検出することも可能である。
【0027】
(C)ポリメラーゼ:
本発明において使用するポリメラーゼは、ターゲット核酸がDNAの場合は、ターゲット核酸断片の一本鎖に変性された部分にプライマーがハイブリダイゼーションすることで形成された2本鎖の部分を起点として、5’→3’の方向に、デオキシヌクレオシド3リン酸(dNTP)を材料として、ターゲット核酸断片を鋳型にして相補的な伸長反応を触媒するDNAポリメラーゼである。具体的に使用されるDNAポリメラーゼとしては、DNAポリメラーゼI、DNAポリメラーゼIのクレノー断片、Bst DNAポリメラーゼ等がある。DNAポリメラーゼは目的に応じて選択または組み合わせることが可能である。例えば、ターゲット核酸断片の一部を増幅(例えばPCR法)する場合には、耐熱性に優れたTaq DNAポリメラーゼを用いることが有効である。その他、目的に応じて、3’→5’方向へのヘキソキナーゼ活性を持つ、DNAポリメラーゼα、T4DNAポリメラーゼ、及びT7 DNAポリメラーゼを併用することも可能である。
【0028】
また、RNAウイルスのゲノミック核酸またはmRNAがターゲット核酸断片である場合には、逆転写活性を有するリバーストランスクリプターゼを使用することが可能である。さらにリバーストランスクリプターゼとTaq DNAポリメラーゼを併用することも可能である。
【0029】
(D)ピロリン酸検出反応試薬:
ポリメラーゼ伸長反応は、ポリメラーゼが活性化する至適温度で反応が行われるため、しばしば高温を伴う。特に、PCR反応の場合、94℃以上の高温反応を伴う。そのため、ピロリン酸の検出反応を、ポリメラーゼ反応と同時に行わせる場合、耐熱性であることが好ましい。
(E) ポリメラーゼ伸長反応:本発明において対象となるポリメラーゼ伸長反応には、前記(A)に記載されているようなターゲット核酸断片の1本鎖に変性された部分の一部に特異的にハイブリダイゼーションした、前記(B)に記載されているようなターゲット核酸断片と相補的なプライマーの3’末端を起点として、デオキシヌクレオシド3リン酸(dNTP)を材料として、前記(C)に記載されているようなポリメラーゼを触媒として、ターゲット核酸断片を鋳型にして進行する相補的な核酸の伸長反応の全てが含まれる。この相補的な核酸の伸長反応とは、少なくとも2回(2塩基分)、連続しての伸長反応が起こることをさしている。
【0030】
以下に、例として代表的なポリメラーゼ伸長反応、およびポリメラーゼ伸長反応を伴うターゲット核酸断片の目的部位の増幅反応の例を示す。ターゲット核酸断片を鋳型にして、5’→3’の方向へのポリメラーゼ伸長反応を一度だけ行う場合が最も単純である。このポリメラーゼ伸長反応は等温の条件で実施することができる。この場合には、ポリメラーゼ伸長反応の結果として生成するピロリン酸の量は、最初のターゲット核酸断片の量に比例する。即ち定量的にターゲット核酸断片の存在を検出するのに適した方法である。
【0031】
ターゲット核酸の量が少ない場合は、ポリメラーゼ伸長反応を利用した何らかの手段でターゲット核酸の目的部分を増幅することが好ましい。ターゲット核酸の増幅には、これまで開発、発明されてきた各種の方法を使用することができる。
【0032】
核酸増幅法としては、PCR(特公平4−67960号、特公平4−67957号)、LCR(特開平5−2934号)、SDA(Strand Displacement Amplification:特開平5−130870号)、RCA(Rolling Circle Amplification:Proc.Natl.Acad.Sci, Vol.92, 4641−4645 (1995))、ICAN(Isothermal and Chimeric primer−initiated Amplification of Nucleic Acids)、LAMP(Loop−Mediated Isothermal Amplification of DNA;Bio Industry, 第18巻、2号(2001))、NASBA(Nucleic acid Sequence−based Amplification method; Nature, 350, 91 (1991))、及びTMA(Transcription mediated amplification method; J.Clin Microbiol.第31巻、3270(1993))等が挙げられる。
【0033】
ターゲット核酸の増幅法で最も一般的で普及している方法はPCR(ポリメラーゼチェーンリアクション)法である。PCR法では、反応液の温度の上げ下げを周期的にコントロールすることにより、変性(核酸断片を2本鎖から1本鎖に変性する工程)→アニーリング(1本鎖に変性した核酸断片にプライマーをハイブイリダイズさせる工程)→ポリメラーゼ(TaqDNAポリメラーゼ)伸長反応→ディネイチャーの周期的な工程を繰り返すことで、ターゲット核酸断片の目的部分を増幅する方法である。最終的に、ターゲット核酸断片の目的部位は初期量の100万倍にも増幅し得る。
【0034】
ターゲット核酸断片がRNA断片の場合は、逆転写活性を有するリバーストランスクリプターゼを使用し、RNA鎖を鋳型にして伸長反応を行うことが可能である。さらにリバーストランスクリプターゼとTaq DNAポリメラーゼを併用し、RT(リバーストランスクリプション)反応に引き続いてPCR反応を行う、RT−PCR法を用いることができる。
【0035】
LCR(特開平5−2934号)は、一本鎖DNAに2本の相補的なオリゴヌクレオチドプローブ鎖をend−to−tailに結合させて、耐熱性リガーゼで2本のオリゴヌクレオチド鎖間のニックを封じる。その結合したDNA鎖が変性で遊離し、また鋳型となり、増幅するという方法である。プローブ配列を工夫し、増幅が起きたか否かでSNP判定することができる。また、LCRを改良して、2つのプライマー間にギャップを設定し、その間をポリメラーゼで埋める方法(Gap−LCR:Nucleic Acids Research、第23巻、4号、675(1995))も開発されている。この方法を用いると、ポリメラーゼ伸長反応によるピロリン酸の生成を測定することでSNPを判定することも可能になる。
【0036】
SDA(Strand Displacement Amplification:特開平5−130870号)は、エクソヌクレアーゼを用いたサイクリングアッセイ法であり、ポリメラーゼ伸長反応を利用したターゲット核酸断片の目的部位の増幅法の一つである。この方法は、ターゲット核酸断片の目的部位に特異的にハイブリダイゼーションしたプライマーを起点としたポリメラーゼ伸長反応とともに、5’→3’エクソヌクレアーゼを作用させて、プライマーを逆方向から分解する方法である。分解したプライマーの代わりに新たなプライマーがハイブリダイゼーションし、再度DNAポリメラーゼによる伸長反応が進行する。このポリメラーゼによる伸長反応と、この先に伸長した鎖を外すエクソヌクレアーゼによる分解反応が順次、周期的に繰り返される。ここで、ポリメラーゼによる伸長反応とエクソヌクレアーゼによる分解反応は等温条件で実施することが可能である。プライマー配列を工夫することで、ポリメラーゼ反応が起きたか否かでSNP判定することが可能である。
【0037】
LAMP法は、近年開発されたターゲット核酸断片の目的部位の増幅法である。この方法は、ターゲット核酸断片の少なくとも6箇所の特定部位を相補的に認識する少なくとも4種のプライマーと、5’→3’方向へのヌクレアーゼ活性がなく、かつ鋳型上の2本鎖DNAを1本鎖DNAとして遊離させながら伸長反応を触媒する鎖置換型のBstDNAポリメラーゼを使用することで、等温条件でターゲット核酸断片の目的部位を、特別な構造として増幅する方法である。このプライマー配列を工夫し、増幅が起きたか否かでSNP判定することが可能である。また、このLAMP法の増幅効率は高く、ポリメラーゼ伸長反応で生成するピロリン酸の蓄積量も非常に多くなるので、ピロリン酸を検出することでSNPを検出することが容易になる。するピロリン酸の蓄積量も多くなり、検出が容易になる。
【0038】
ICAN法も、近年開発されたターゲット核酸断片の目的部位の増幅法である。RNA−DNAキメラプライマー、鎖置換活性と鋳型交換活性を有するDNAポリメラーゼ、RNaseHを用いる等温の遺伝子増幅法である。キメラプライマーが鋳型と結合した後、DNAポリメラーゼにより相補鎖が合成される。その後、RNaseHがキメラプライマー由来のRNA部分を切断し、切断部分から鎖置換反応と鋳型交換反応を伴った伸長反応が起きるこの反応が繰り返し起こることにより遺伝子が増幅される。このプライマー配列を工夫し、増幅が起きたか否かでSNP判定することが可能である。また、このICAN法の増幅効率は高く、ポリメラーゼ伸長反応で生成するピロリン酸の蓄積量も非常に多くなるので、ピロリン酸を検出することでSNPを検出することが容易になる。
【0039】
(E) ピロリン酸(PPi)の検出:
従来からピロリン酸(PPi)の検出法としては、式1に示された方法が知られている。この方法では、ピロリン酸(PPi)をスルフリラーゼによりアデノシン3リン酸(ATP)に変換し、アデノシン3リン酸がルシフェラーゼによりルシフェリンに作用して生じる発光を検出する。
【0040】
【化1】

【0041】
本発明に適したピロリン酸の検出方法は式2または式3に示した方法である。式2または式3に示した方法は、ピロリン酸(PPi)をピロフォスファターゼで無機リン酸(Pi)に変換し、プリンヌクレオシドホスホリラーゼ(PNP)により無機リン酸(Pi)をキサントシンまたはイノシンと反応させ、生じたキサンチンまたはヒポキサンチンをキサンチンオキシダーゼ(XOD)により酸化して尿酸を生成させ、この酸化過程で生じる過酸化水素(H2O2)を用いてペルオキシダーゼ(POD)により発色剤(色素前駆体)を発色させ、これを比色するものである。これら式2または式3に示した方法では結果を比色で検出できるため、目視または簡単な比色測定装置を用いてピロリン酸(PPi)の検出が可能である。
【0042】
【化2】

【0043】
【化3】

【0044】
ピロフォスファターゼ(EC3,6,1,1)、プリンヌクレオシドホスホリラーゼ(PNP,EC2.4.2.1)、キサンチンオキシダーゼ(XOD,EC1.2.3.2)及びペルオキシダーゼ(POD,EC1.11.1.7)は市販のものを使用することができる。発色剤(すなわち色素前駆体)は、過酸化水素とペルオキシダーゼ(POD)により色素を生成させるものであればよく、例えば、ロイコ色素の酸化によって色素を生成する組成物(例、米国特許4,089,747等に記載のトリアリールイミダゾールロイコ色素、特開昭59−193352号公報(EP 0122641A)等に記載のジアリールイミダゾーロイコ色素);酸化されたときに他の化合物とカップリングにより色素を生成する化合物を含む組成物(例えば4−アミノアンチピリン類とフェノール類又はナフトール類)などを使用することができる。
【0045】
(F)乾式分析素子:
本発明において使用することのできる乾式分析素子とは、一層または複数層の機能層からなる分析素子であって、その少なくとも一層(または複数の層に渡って)に検出試薬を含有させ、層内での反応により生じた生成色素を、分析素子の外から反射光あるいは透過光により比色定量するものである。
【0046】
このような乾式分析素子を用いて定量分析するには、液体試料を展開層の表面に一定量点着する。展開層で展開された液体試料は試薬層に達し、ここで試薬と反応し、発色する。点着後、乾式分析素子を適当な時間、一定温度に保って(インクベーション)発色反応を充分に進行させた後、例えば透明支持体側から照明光を試薬層に照射し、特定波長域で反射光量を測定して反射光学濃度を求め、予め求めておいた検量線に基づいて定量分析を行う。
【0047】
乾式分析素子においては、検出を行うまでは乾燥状態で貯蔵・保管されるため、試薬を用時調製する必要がなく、また一般に乾燥状態の方が試薬の安定性が高いことから、試薬溶液を用時調製しなければならないいわゆる湿式法より簡便性、迅速性に優れている。また、微量の液体試料で、精度の高い検査を迅速に行うことができる検査方法としても優れている。
【0048】
(G)ピロ燐酸から転換されたリン酸を定量するための乾式分析素子:
本発明で使用することのできるピロ燐酸から転換されたリン酸を定量するためのは、公知の多種の乾式分析素子と同様の層構成とすることができる。乾式分析素子は、前記(E)項(ピロ燐酸(PPi)の検出)における、式2または式3の反応を行うための試薬(但し、ピロフォスファターゼなどの、ピロリン酸を検出するための最初の反応のための試薬を除く)の他、支持体、展開層、検出層、光遮蔽層、接着層、吸水層、下塗り層その他の層を含む多重層としてもよい。このような乾式分析素子として、例えば特開昭49−53888号公報(対応米国特許3,992,158)、特開昭51−40191号公報(対応米国特許4,042,335)、及び特開昭55−164356号公報(対応米国特許4,292,272)、特開昭61−4959号公報(対応EPC公開特許0166365A)の各明細書に開示されたものがある。
【0049】
光透過性水不透過性支持体を用いる場合の乾式分析素子は、実用的に次のような構成を取り得る。ただし、本発明の内容はこれに限定されない。
(1) 支持体上に試薬層を有するもの。
(2) 支持体上に検出層、試薬層をこの順に有するもの。
(3) 支持体上に検出層、光反射層、試薬層をこの順に有するもの。
(4) 支持体上に第2試薬層、光反射層、第1試薬層をこの順に有するもの。
(5) 支持体上に検出層、第2試薬層、光反射層、第1試薬層をこの順に有するもの。
【0050】
上記(1)ないし(3)において試薬層は異なる複数の層から成ってもよい。例えば第1試薬層には、式2または式3に示すPNP反応に必要な基質キサントシンまたは基質イノシンと酵素PNPを、第2試薬層には、式2または式3に示すXOD反応に必要な酵素XODを、そして第3試薬層には、式2または式3に示すPOD反応に必要な酵素PODと発色色素(色素前駆体)を、それぞれ含有させてもよい。あるいは試薬層を2層として、第1試薬層ではPNP反応を、第2試薬層ではXOD反応とPOD反応を進行させてもよい。又は、第1試薬層ではPNP反応とXOD反応を、第2試薬層でPOD反応を進行させてもよい。
【0051】
なお支持体と試薬層又は検出層との間には吸水層を設けてもよい。また各層の間には濾過層を設けてもよい。また試薬層の上には展開層を設けてもよく、その間に接着層を設けてもよい。
【0052】
支持体は光不透過性(不透明)、光半透過性(半透明)、光透過性(透明)のいずれのものも用いることができるが、一般的には光透過性で水不透過性の支持体が好ましい。光透過性水不透過性支持体の材料として好ましいものはポリエチレンテレフタレート、ポリスチレンである。親水性層を強固に接着させるため通常、下塗り層を設けるか、親水化処理を施す。
【0053】
試薬層として多孔性層を用いる場合、その多孔性媒体は繊維質であってもよいし、非繊維質であってもよい。繊維質材料としては、例えば濾紙、不織布、織物布地(例えば平織り布地)、編物布地(例えばトリコット編物布地)、ガラス繊維濾紙等を用いることができる。非繊維質材料としては特開昭49−53888号公報等に記載の酢酸セルロースなどからなるメンブランフイルター、特開昭49−53888号公報、特開昭55−90859号公報(対応米国特許4,258,001)特開昭58−70163号公報(対応米国特許4,486,537)等に記載の無機物又は有機物微粒子からなる連続空隙含有粒状構造物層等のいずれでもよい。特開昭61−4959号公報(対応欧州公開EP 0166365A)、特開昭62−116258号公報、特開昭62−138756号公報(対応欧州公開EP 0226465A)、特開昭62−138757号公報(対応欧州公開EP 0226465A)、特開昭62−138758号公報(対応欧州公開EP 0226465A)等に記載の部分接着された複数の多孔性層の積層物も好適である。
【0054】
多孔性層は、供給される液体の量にほぼ比例した面積に液体を展開する、いわゆる計量作用を有する展開層であってもよい。展開層としては、これらのうち織物布地、編物布地などが好ましい。織物布地などは特開昭57−66359号公報に記載されたようなグロー放電処理をしてもよい。展開層には、展開面積、展開速度等を調節するため特開昭60−222770号公報(対応:EP 0162301A)、特開昭63−219397号公報(対応西独特許公開DE 3717913A)、特開昭63−112999号公報(対応:DE 3717913A)、特開昭62−182652号公報(対応:DE 3717913A)に記載したような親水性高分子あるいは界面活性剤を含有させてもよい。
【0055】
例えば紙、布、高分子からなる多孔質膜等に本発明の試薬を予め含浸又は塗布した後、支持体上に設けた他の水浸透性層、例えば検出層の上に、特開昭55−1645356号公報のような方法で接着させるのも有用な方法である。
【0056】
こうして作られる試薬層の厚さは特に制限されないが、塗布層として設ける場合には、1μm〜50μm程度、好ましくは2μm〜30μmの範囲が適当である。ラミネートによる積層など、塗布以外の方法による場合、厚さは数十μmから数百μmの範囲で大きく変化し得る。
【0057】
親水性ポリマーバインダーからなる水浸透性層で試薬層を構成する場合、使用できる親水性ポリマーとしては、例えば、以下のものがある。ゼラチン及びこれらの誘導体(例えばフタル化ゼラチン)、セルロース誘導体(例えばヒドロキシエチルセルロース)、アガロース、アルギン酸ナトリウム、アクリルアミド共重合体やメタアクリルアミド共重合体(例えば、アクリルアミド又はメタアクリルアミドと各種ビニル性モニマーとの共重合体)、ポリヒドロキシエチルメタクリレート、ポリビニルアルコール、ポリビニルピロリドン、ポリアクリル酸ナトリウム、アクリル酸と各種ビニル性モノマーとの共重合体などである。
【0058】
親水性ポリマーバインダーで構成される試薬層は、特公昭53−21677号公報(対応米国特許3,992,158)、特開昭55−164356号公報(対応米国特許4,292,272)、特開昭54−101398号公報(対応米国特許4,132,528)等の明細書に記載の方法に従って本発明の試薬組成物と親水性ポリマーを含む水溶液又は水分散液を支持体又は検出層等の他の層の上に塗布し乾燥することにより設けることができる。親水性ポリマーをバインダーとする試薬層の乾燥時の厚さは約2μm〜約50μm、好ましくは約4μm〜約30μmの範囲、被覆量では約2g/m2〜約50g/m2、好ましくは約4g/m2〜約30g/m2の範囲である。
【0059】
試薬層には式2または式3の試薬組成物の他に、塗布特性、拡散性化合物の拡散性、反応性、保存性等の諸性能の向上を目的として、酵素の活性化剤、補酵素、界面活性剤、pH緩衝剤組成物、微粉末、酸化防止剤、その他、有機物あるいは無機物からなる各種添加剤を加える事ができる。試薬層に含有させることができる緩衝剤の例としては、日本化学学会編「化学便覧 基礎」(丸善(株)、1966年発行)1312−1320頁、R.M.C.Dawson et al編、「Data for Biochemical Research」第2版(Oxford at the Clarendon Press,1969年発行)476−508頁、「Biochemistry」5,467−477頁(1966年)、「Analytical Biochemistry」104,300−310頁(1980年)に記載のpH緩衝剤系がある。pH緩衝剤系の具体例として硼酸塩を含む緩衝剤;クエン酸又はクエン酸塩を含む緩衝剤;グリシンを含む緩衝剤;ビシン(Bicine)を含む緩衝剤;HEPESを含む緩衝剤;MESを含む緩衝剤などのグッド緩衝剤等がある。なお燐酸塩を含む緩衝剤は、ピロ燐酸検出用乾式分析素子に使用することはできない。
【0060】
本発明で使用することのできる、ピロ燐酸定量用乾式分析素子は前述の諸特許明細書に記載の公知の方法により調製することができる。ピロ燐酸定量用乾式分析素子は一辺約5mmから約30mmの正方形またはほぼ同サイズの円形等の小片に裁断し、特公昭57−283331号公報(対応米国特許4,169,751)、実開昭56−142454号公報(対応米国特許4,387,990)、特開昭57−63452号公報、実開昭58−32350号公報、特表昭58−501144号公報(対応国際公:WO083/00391)等に記載のスライド枠に収めて化学分析スライドとして用いることが製造,包装,輸送,保存,測定操作等の観点で好ましい。使用目的によっては、長いテープ状でカセットまたはマガジンに収めて用いたり、又は小片を開口のある容器内に収めて用いたり、又は小片を開口カードに貼付または収めて用いたり、あるいは裁断した小片をそのまま用いることなどもできる。
【0061】
本発明で使用することのできるピロ燐酸定量用乾式分析素子は前述の諸特許明細書等に記載の操作と同様の操作により液体試料中の被検物であるピロ燐酸の定量検出ができる。例えば約2μL〜約30μL、好ましくは4μL〜15μLの範囲の水性液体試料液を試薬層に点着する。点着した分析素子を約20℃〜約45℃の範囲の一定温度で、好ましくは約30℃〜約40℃の範囲内の一定温度で1〜10分間インキュベーションする。分析素子内の発色又は変色を光透過性支持体側から反射測光し、予め作成した検量線を用いて比色測定法の原理により検体中のピロ燐酸の量を求めることができる。点着する液体試料の量、インキュベーション時間及び温度を一定にすることにより定量分析を高精度に実施できる。
【0062】
測定操作は特開昭60−125543号公報、特開昭60−220862号公報、特開昭61−294367号公報、特開昭58−161867号公報(対応米国特許4,424,191)などに記載の化学分析装置により極めて容易な操作で高精度の定量分析を実施できる。なお、目的や必要精度によっては目視により発色の度合いを判定して、半定量的な測定を行ってもよい。
【0063】
本発明で使用することのできる乾式分析素子においては、分析を行うまでは乾燥状態で貯蔵・保管されるため、試薬を用時調製する必要がなく、また一般に乾燥状態の方が試薬の安定性が高いことから、試薬溶液を用時調製しなければならないいわゆる湿式法より簡便性、迅速性に優れている。また、微量の液体試料で、精度の高い検査を迅速に行うことができる検査方法としても優れている。
本発明で使用することのできる乾式分析素子としてはまた、特開平7−197号公報に記載の乾式分析素子を使用することも可能である。
【0064】
(H)キット:
本発明のターゲット核酸の分析は、分析するターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)、少なくとも一種のポリメラーゼ、ピロリン酸を検出するための最初の反応に必要な反応試薬(例えば、耐熱性のピロフォスファターゼ等)、及びピロリン酸定量用乾式分析素子を含むキットを用いて実施することができる。
【0065】
キットの形態は、少なくとも一部の塩基配列が既知であるターゲット核酸断片を含む液体を供給することのできる開口部、ターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)、少なくとも一種のポリメラーゼ、及びピロリン酸を検出するための最初の反応に必要な反応試薬(例えば、耐熱性のピロフォスファターゼ等)を保持することのできる少なくとも一つの反応セル部、ピロ燐酸定量用乾式分析素子を保持することのできる検出部、及びそれら前記開口部、反応セル部、検出部の間を連結し、液体を移動させることのできる細管または溝を備えているカートリジであってもよい。
【0066】
このようなカートリッジとしては、米国特許5,919,711に記載されているカートリッジ等を利用することが可能である。
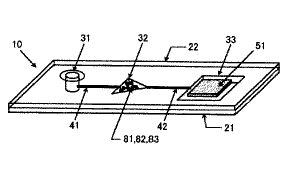
図1には、本発明におけるカートリッジ形態のキットの一例を示した。キット10において、開口部31からターゲット核酸を含有する試料液を供給することができる。開口部31は細管41によって、反応セル32と連結されている。反応セル32には、予めターゲット核酸断片の一部と相補的な少なくとも一種のプライマー81、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)82、少なくとも一種のポリメラーゼ83、およびピロリン酸を検出するための最初の反応に必要な反応試薬(例えば、耐熱性のピロフォスファターゼ等)が保持されている。さらに、反応セル32は細管42によって検出部33と連結されている。検出部33には予め乾式分析素子51が保持されている。反応セル32でポリメラーゼ伸長反応が進行した試料液は、細管42を移動して、検出部33のピロ燐酸定量用乾式分析素子51上に供給され、ポリメラーゼ伸長反応により生成したピロ燐酸を検出する。上記キット10において、開口部31と反応セル32の間、及び反応セル32と検出部33の間の液体の移動は、遠心力、電気泳動または電気浸透などを用いることが可能である。また、反応セル32、細管41及び42、検出部33は、基体21と蓋22によって密封されていることが望ましい。
【0067】
図1に示したようなカートリッジ形態のキット10を使用する場合、図2に示したように、反応セル32および検出部33の温度コントロール部61及び62と、ピロ燐酸定量用乾式分析素子51内の発色または色変化を反射光により検出することのできる検出部71及び72を備えている装置を合わせて使用することが望ましい。
【0068】
本発明で使用することのできるカートリッジ形態のキットは、図1に示されているものに限らない。ポリメラーゼ伸長反応に必要な試薬はそれぞれ別のスペースに保持されていても良い。その場合は、反応時にそれぞれの試薬が反応セルに移動してくるようにすれば良い。また、反応セルは複数であっても良い。
【0069】
また、1つのカートリッジ上に「開口部−細管−反応セル−細管−検出部」の組を平行に並べて、または同心円の半径方向に並べて、複数組設置することも可能である。この場合、例えば反応セルに保持するターゲット核酸断片の一部と相補的な少なくとも一種のプライマーの塩基配列を、ターゲットとする核酸の種類に応じて変更することで、同時に複数種のターゲット核酸を検出することが可能なキットを提供できる。
以下、実施例にて本発明を詳細に説明する。しかしながら、本実施例により本発明の技術的範囲が限定されるものではない。
【0070】
【実施例】
実施例1:無機燐酸定量用乾式分析素子を用いたPCR増幅産物の検出
(1) 無機燐酸定量用乾式分析素子の作製
ゼラチン下塗層が設けられている厚さ180μmの無色透明ポリエチレンテレフタレート(PET)平滑フイルムシート(支持体)上に下記の表1に記載の組成(a)の水溶液を、以下の被覆率となるように塗布し、乾燥して試薬層を設けた。
【0071】
【表1】

【0072】
この試薬層の上に下記の表2記載の組成(b)の接着層水溶液を以下の被覆率となるように塗布し、乾燥して接着層を設けた。
【0073】
【表2】

【0074】
次いで接着層の上に30g/m2の割合で水を全面に供給してゼラチン層を膨潤させ、その上に純ポリエステル製のブロード織物布地をほぼ一様に軽く圧力をかけてラミネートして多孔性展開層を設けた。
【0075】
次にこの展開層の上から下記の表3記載の組成(c)の水溶液を以下の被覆率となるようにほぼ均一塗布し乾燥させ、燐酸定量用乾式分析素子を作成した。
【0076】
【表3】

【0077】
(2)鋳型用プラスミドの調製
β−Actin遺伝子(約1500bp)が挿入されたプラスミド(pBluescriptベクター)を大腸菌コンピテントセル(JM109)に導入した。これをLB培地中で1晩培養した。これよりプラスミドを抽出・精製することにより、β−Actin遺伝子断片が挿入されたプラスミドを得た.さらに、分光光度計を用いて得られたプラスミド量の定量を行い、既知量のサンプルを得た。
【0078】
(3)PCR増幅反応
上記(1)で調製した既知量のプラスミドを用いて、以下の条件でPCR増幅反応を行った。系列1はPCR反応後の液に20unitsのピロフォスファターゼで処理(37℃、60分)し、系列2はPCR反応液中にピロフォスファターゼを添加して、それぞれの系列について、PCRの各サイクル(0、10、20、25、30、35、40)終了後にサンプリングを行った。そして、それぞれのサイクル終了後のPCR反応増幅産物を(1)で作製したリン酸スライドに点着し、増幅産物由来のリン酸量の定量を行うとともに、BioAnalyzer(Agilent社製)を用いてDNA増幅産物量の定量を行い、それらより得られる値を比較した。以下にPCR反応の諸条件を示す。
【0079】
<プライマ−>
pBluescriptに挿入したβ−Actin遺伝子断片に特異的な配列を有する以下のプライマーセットを使用した。
プライマ−(upper):
5’−GGGCATGGGTCAGAAGGATT−3’(配列番号1)
プライマ−(lower):
5’−CCGTGGTGGTGAAGCTGTAG−3’(配列番号2)
【0080】
(4)ポリメラーゼ伸長反応によるターゲット核酸断片の増幅
以下の表4に示す反応液の組成で、PCRによる標的核酸断片の増幅を実施した。PCRは、[デネイチャー:94℃・30秒、アニーリング:60℃・30秒、ポリメラーゼ伸長反応:72℃・1分]を所定のサイクル繰り返することで実施した。
【0081】
【表4】

【0082】
(5)燐酸スライドを用いたPCR反応における増幅産物量の検出
前記(4)におけるPCR増幅反応後の溶液を、そのまま上記(1)で製作した無機燐酸定量用乾式分析素子上に各々20μL点着し、燐酸定量用乾式分析素子を37℃にて5分間インキュベ−ション後、波長650nmにて支持体側から測定して5分後の反射光学濃度(ODR)が得られた。このODRをあらかじめ作成してあったODRをリン酸濃度に変換する検量線を用いて読みかえ、これをさらにDNAの濃度に換算した.これらの値を表5に示し,各サイクルにおけるDNAの生成量のグラフを図3に示した。
【0083】
ここで、リン酸濃度からDNAの濃度への変換は以下の式に従った。
ポリメラーゼ反応が以下の反応式に従う。
(DNA)n−1 + dNTP → (DNA)n + PPi
→(PPaseの作用により)2ip
(PPiはピロリン酸、ipはリン酸を示す)
これより、dNTPが1分子合成される毎に、PPi1分子(ip2分子)生成する。よって、〔dNTP〕=〔PPi〕=0.5×〔ip〕(mM)となる。
dNTPの濃度は、即ち、生成したDNAの濃度であり、dNTPの分子量を約300とすると、(DNA,ng/μL)=300×〔PPi〕=150×〔ip〕
【0084】
【表5】

【0085】
上記の結果より、ピロフォスファターゼをPCR反応後に添加した場合、30サイクル以降のDNA量の測定値が減少するのに対して、ピロフォスファターゼをあらかじめPCR反応液に添加しておくと、DNA量は30サイクル以降も変わりなく測定できていることがわかる。さらに、以下の実験で実際のPCR測定産物を定量することによって、あらかじめピロフォスファターゼを添加しておく方が、DNA量を精度良く測定できることを確認した。
【0086】
(6)BioAnalyzerを用いたPCR反応における増幅産物量の検出
次に、前記(4)におけるPCR増幅反応後の溶液をBioAnalyzer(Agilent社製)を用いてPCR増幅反応後のDNA量を定量した。
各サイクルにおけるDNAの生成量の値を表6に、グラフを図4に示した。
【0087】
【表6】

【0088】
上記結果より、Agilent社のBioAnalyzerを用いて測定した場合、ピロフォスファターゼの添加がPCR反応の前後のいずれの場合においても、DNA増幅産物量に変わりがないことがわかる。また、前記、燐酸スライドを用いた結果と比較すると、ピロフォスファターゼをあらかじめPCR反応溶液に添加しておくことが、PCRの副生成物であるピロリン酸を用いてPCR増幅産物を定量するには重要であることがわかる。
【0089】
【発明の効果】
本発明によれば、ポリメラーゼ反応に伴って生成する核酸量を、当該ポリメラーゼ反応に伴って生成するピロリン酸を用いて定量的に測定することができる。
【0090】
【配列表】

【図面の簡単な説明】
【図1】図1は、本発明のカートリッジ形態でのキットの例を示す斜視図である。
【図2】図2は、本発明のカートリッジ形態でのキットを使用する場合のシステム構成を示す斜視図である。
【図3】図3は、燐酸スライドを用いたPCR反応における増幅産物量の検出結果を示す。
【図4】図4は、BioAnalyzerを用いたPCR反応における増幅産物量の検出結果を示す。
【符号の説明】
10 キット
21 基体
22 蓋
31 開口部
32 反応セル
33 検出部
41 細管
42 細管
51 乾式分析素子
61 温度コントロール部
62 温度コントロール部
71 検出部
72 検出部
81 プライマー
82 デオキシヌクレオシド3リン酸(dNTP)
83 ポリメラーゼ
【0001】
【発明の属する技術分野】
本発明は、ポリメラーゼ伸長反応によって生成する核酸量を正確に測定する方法に関する。より詳細には、本発明は、ターゲット核酸を鋳型とするポリメラーゼ伸長反応が進行したか否かを、伸長反応の副生成物として生じるピロリン酸量を定量することに関する。
【0002】
【従来の技術】
分子生物学の研究分野、遺伝子検査等の臨床応用分野において、ターゲット核酸断片を鋳型としたポリメラーゼ伸長反応の進行の検出を利用した遺伝子検出法が数多く開発されている。特に、PCR法は、(Polymerase Chain Reaction:特公平4−67960号、特公平4−67957号)は、非常に低濃度のターゲット核酸の検出を可能にした点により、現在、最も汎用されている技術の1つとなっている。
【0003】
さらに、これらのポリメラーゼ伸長反応後のDNA産物を検出する方法は多数存在する。例えば、アガロースゲルやポリアクリルアミドゲルを利用した電気泳動法は最も汎用されている技術の1つであり、簡便に行うことの出来る技術であるが、定量性と迅速性に欠けることが問題点であった。
【0004】
さらに、定量性、迅速性の向上を目指して、ターゲット核酸断片を鋳型としたポリメラーゼ伸長反応の進行の検出を利用した核酸の検出法が開発されている。ターゲット核酸断片の特定核酸領域をPCRにより増幅する際、増幅産物の生成の過程を蛍光強度の変化としてリアルタイムで検出する方法(Real Time PCR法)は、PCR後に増幅産物を電気泳動し、結果を解析するという工程を必要としないことから迅速性の点で良い方法である。しかし、これらの方法は、FRET(fluorescence resonance energy transfer)を利用した方法で、実施には蛍光強度の変化を測定することのできる装置と、安価ではない蛍光標識されたオリゴヌクレオチドを必要とする点で問題があり、未だ特殊技術の域を出ていない。
【0005】
一方、ターゲット核酸断片の特定領域にヌクレアーゼ耐性を有するオリゴヌクレオチドプライマーをハイブリダイズさせ、デオキシヌクレオシド3リン酸(dNTP)、DNAポリメラーゼ、ヌクレアーゼの存在下で伸長反応、分解反応を繰り返して、生成するピロリン酸又はデオキシヌクレオシドモノリン酸を検出する方法が、特開平7−231799号公報に開示されている。ポリメラーゼ伸長反応に伴って生成するピロリン酸を検出することによるターゲット核酸断片の検出方法は、ポリメラーゼ伸長反応の副産物である一般化学物質を検出することで、ターゲット核酸断片の検出を可能にしている点で優れている。
【0006】
しかしながら、ピロリン酸を検出することによるターゲット核酸断片の検出方法は、様々な問題点が指摘されている.例えば、特許2997043号公報において、ピロホスホロリシスがプライマー伸長反応に有害であることが示されている。また、ピロリン酸は加水分解を受けリン酸に解離するため、ポリメラーゼ反応中に生成するピロリン酸ではなく、リン酸を測定することが有効であることが特開平7−59600号公報に記されている.しかし、ポリメラーゼ反応において生成するピロリン酸は、完全にリン酸に変換されないので、この方法は定量性に欠けるという問題点がある。英国特許2324865号には、これらの問題点を解決するため、ポリメラーゼ反応後に、ピロフォスファターゼ等のピロリン酸を分解する因子を添加して、リン酸に変換した後、このリン酸を測定する方法が記載されている。
【0007】
また、増幅反応に供される酵素であるポリメラーゼは、2価のカチオンを要求することが多く、特にMg2+を用いることが多い。ポリメラーゼ反応の過程で生成するピロリン酸は、このMg2+をキレートするため、高濃度のMg2+存在化においては、ピロリン酸の生成に伴い、ピロリン酸マグネシウムが生じることが知られている(Mori et al.:BBRC 289,150−154(2001))。
【0008】
さらに、本発明者は、通常のポリメラーゼが要求するMg2+の濃度領域においても、ポリメラーゼ反応時にかかる熱とMg2+の濃度によって、当該反応中にピロリン酸とMg2+が反応し定量的にピロリン酸を測定できなくなるという問題が生じることを見出した。従って、前述の英国特許2324865号の方法では、ポリメラーゼ反応に伴って生成する核酸量を、ピロリン酸を用いて定量的に測定することはできない。
【0009】
【特許文献1】
特公平4−67960号
【特許文献2】
特公平4−67957号
【特許文献3】
特開平7−231799号公報
【特許文献4】
特許2997043号公報
【特許文献5】
特開平7−59600号公報
【特許文献6】
英国特許2324865号
【非特許文献1】
Mori et al.:BBRC 289,150−154(2001)
【0010】
【発明が解決しようとする課題】
本発明は上記した従来技術の問題点を解消することを解決すべき課題とした。即ち。本発明は、ポリメラーゼ反応に伴って生成する核酸量を、当該ポリメラーゼ反応に伴って生成するピロリン酸を用いて定量的に測定する方法を提供することを解決すべき課題とした。
【0011】
【課題を解決するための手段】
本発明者は、上記課題を解決するために鋭意検討した結果、ポリメラーゼ反応液に、ピロリン酸を検出するための最初の反応に必要な試薬をあらかじめ添加しておき、ポリメラーゼ反応と共にピロリン酸検出のための最初の反応を行わせることによって、上記課題を解決できることを見出し、本発明を完成させるに至った。
【0012】
即ち、本発明によれば、(1)少なくとも一部の塩基配列が既知であるターゲット核酸断片、前記ターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸、少なくとも一種のポリメラーゼ、及びポリメラーゼ反応に必要な2価の陽イオンを含む反応混合物を使用して、前記ターゲット核酸断片を鋳型にして前記プライマーの3’末端を起点とするポリメラーゼ伸長反応を行う工程;及び(2)前記ポリメラーゼ伸長反応に伴って生成するピロリン酸を検出することによって前記ポリメラーゼ伸長反応が連続して進行するか否かを判定する工程;を含むターゲット核酸断片の検出方法において、ポリメラーゼ伸長反応の進行に伴って生成するピロリン酸を検出するための最初の反応をポリメラーゼ伸長反応と同時に行うことを特徴とする、上記の検出方法が提供される。
【0013】
好ましくは、ピロリン酸を検出するための最初の反応は、ピロフォスファターゼにより当該ピロリン酸をリン酸に分解させる反応である。
好ましくは、ピロリン酸の検出反応は、ピロフォスファターゼ、キサントシンまたはイノシン、プリンヌクレオシドホスホリラーゼ、キサンチンオキシダーゼ、ペルオキシダーゼ及び発色剤を用いる反応であり、ピロフォスファターゼによる当該ピロリン酸をリン酸に分解させる反応をポリメラーゼ伸長反応と同時に行う。
好ましくは、ピロリン酸の検出を、キサントシンまたはイノシン、プリンヌクレオシドホスホリラーゼ、キサンチンオキシダーゼ、ペルオキシダーゼ及び発色剤を含有する試薬層を備える無機リン酸定量用乾式分析素子を用いて行う。
【0014】
好ましくは、ピロリン酸の検出反応は、アデノシン−5’−ホスファサルフェート、ATPスルフリラーゼ、発光酵素、発光基質を用いる反応であって、ピロリン酸を検出するための最初の反応がアデノシン−5’−ホスファサルフェートとATPスルフリラーゼにより、当該ピロリン酸をATPに変換させる反応である。
【0015】
好ましくは、前記発光酵素はルシフェラーゼであり、前記発光基質はルシフェリンである。
【0016】
本発明の別の側面によれば、分析するターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)、少なくとも一種のポリメラーゼ、ピロリン酸を検出するための最初の反応に必要な反応試薬、及び乾式分析素子を含む、上記したターゲット核酸の検出方法を行なうためのキットが提供される。
好ましくは、ピロリン酸を検出するための最初の反応に必要な反応試薬はピロフォスファターゼであり、乾式分析素子は無機リン酸定量用乾式分析素子である。
好ましくは、ピロリン酸を検出するための最初の反応に必要な反応試薬はアデノシン−5’−ホスファサルフェートとATPスルフリラーゼであり、乾式分析素子はアデノシン5’−三リン酸定量用乾式分析素子である。
【0017】
【発明の実施の形態】
以下、本発明の実施の形態について説明する。
本発明のターゲット核酸断片の分析方法においては、あらかじめピロリン酸を検出するための最初の反応に必要な反応試薬(例えば、耐熱性のピロフォスファターゼなど)を添加した反応液を使用することによりポリメラーゼ反応とピロリン酸をリン酸に分解させる反応とを同時に行い、次いで、この反応液を用いて、比色法によってピロリン酸から生成したリン酸の検出を行う。
【0018】
本発明では、より好ましくは、ピロリン酸から生成したリン酸の検出を乾式分析素子を用いて行う。本発明におけるターゲット核酸断片の分析方法では、ターゲット核酸の存在または存在量を検出したり、あるいはターゲット核酸断片の塩基配列を検出することができる。なお、ここでいう存在量の検出とは、ターゲット核酸の定量を含む概念である。ターゲット核酸断片の塩基配列の検出の具体例としては、ターゲット核酸断片の変異または多型の検出などが挙げられる。
【0019】
本発明に係るターゲット核酸断片の分析方法の第一の好ましい形態を以下に列記する。
(イ)ピロリン酸から生成したリン酸の検出を、キサントシンまたはイノシン、プリンヌクレオシドホスホリラーゼ、キサンチンオキシダーゼ、ペルオキシダーゼ及び発色剤を含有する試薬層を備えることを特徴とする無機リン酸(無機燐)定量用乾式分析素子を用いて行う。
(ロ)ポリメラーゼが、DNAポリメラーゼI、DNAポリメラーゼIのクレノー断片、Bst DNAポリメラーゼ、及び逆転写酵素(リバーストランスクリプターゼ)からなるグループから選択されるポリメラーゼを用いる。
(ハ)ポリメラーゼ反応液として、少なくとも一部の塩基配列が既知であるターゲット核酸断片、前記ターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、上記(ロ)に記載の少なくとも一種のポリメラーゼ、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)、及びピロリン酸をリン酸に変換する耐熱性のピロフォスファターゼからなる反応液を用いる。
【0020】
また、本発明の別の形態は、分析するターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)、少なくとも一種のポリメラーゼ、ピロリン酸を検出するための最初の反応に必要な反応試薬(例えば、耐熱性のピロフォスファターゼ)、及び無機リン酸定量用乾式分析素子の各要素を含むキットにある。
【0021】
さらに、本発明の第二の好ましい形態は、少なくとも一部の塩基配列が既知であるターゲット核酸断片、前記ターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸、及び少なくとも一種のポリメラーゼを反応させ、前記ターゲット核酸断片を鋳型にした前記プライマーの3’末端を起点とするポリメラーゼ伸長反応の進行の有無の検出を前記ポリメラーゼ伸長反応に伴って生成するピロリン酸を検出することにより行う際に、ピロリン酸の検出を、ピロリン酸をアデノシン5’−三リン酸に変換して、アデノシン5’−三リン酸をルシフェラーゼの存在下、ルシフェリンと反応させて、生成する発光の強度を測定する方法である。
【0022】
本発明の第二の形態での、ターゲット核酸断片分析方法の好ましい形態を以下に列記する。
(イ)ピロリン酸の検出を、ピロリン酸をアデノシン5’−三リン酸に変換して、さらに、アデノシン5’−三リン酸をルシフェラーゼの存在下、ルシフェリンと反応させて、生成する化学発光強度を測定することにより行う。
(ロ)ポリメラーゼが、DNAポリメラーゼI、DNAポリメラーゼIのク レノー断片、Bst DNAポリメラーゼ、及び逆転写酵素(リバーストランスクリプターゼ)からなるグループから選択されるポリメラーゼを用いる。
(ハ)ポリメラーゼ反応液が、少なくとも一部の塩基配列が既知であるターゲット核酸断片、前記ターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、上記(ロ)に記載の少なくとも一種のポリメラーゼ、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)、及びピロリン酸をアデノシン5’−三リン酸に変換するATPスルフリラーゼとアデノシン5’−ホスファサルフェートからなる反応液を用いる。
【0023】
また、本発明の別の形態は、分析するターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)、少なくとも一種のポリメラーゼ、ピロリン酸を検出するための最初の反応に必要な反応試薬(例えば、ピロリン酸をアデノシン5’−三リン酸に変換するATPスルフリラーゼとアデノシン5’−ホスファサルフェート)、及びアデノシン5’−三リン酸定量用乾式分析素子の各要素を含むキットにある。
【0024】
以下に本発明の実施の形態について更に詳細に説明する。
(A)ターゲット核酸断片:
本発明において分析の対象となるターゲット核酸断片とは、少なくとも一部の塩基配列が既知であるポリヌクレオチドであり、動物、微生物、細菌、植物などすべての生物から単離されるゲノミックDNA断片が対象となり得る。またウイルスから単離可能なRNA断片またはDNA断片、およびmRNAを鋳型として合成されたcDNA断片も対象とすることが可能である。ターゲット核酸断片はできる限り精製され、核酸断片以外の余分な成分が取り除かれていることが望ましい。例えば、動物(例えば人間)の血液から単離したゲノミックDNA断片を対象とする場合または血液中に存在する感染細菌やウイルスの核酸(DNAまたはRNA)断片を対象とする場合、単離の過程で破壊された白血球細胞膜、赤血球中から溶出したヘモグロビン、および血液中存在するその他の一般化学物質は、十分に取り除いておく必要がある。特にヘモグロンビンは、続いておこなうポリメラーゼ伸長反応を阻害する。また血液中に一般生化学物質として存在するピロリン酸やリン酸は、ポリメラーゼ伸長反応により生成するピロリン酸の正確な検出の妨害要因になる。
【0025】
(B)ターゲット核酸断片と相補的なプライマー:
本発明において使用するターゲット核酸断片と相補的なプライマーは、ターゲット核酸断片の塩基配列が既知である目的の部位に対して相補的な塩基配列を有するオリゴヌクレオチドである。このターゲット核酸断片と相補的なプライマーがターゲット核酸断片の目的の部位にハイブリダイゼーションすることで、プライマーの3’末端を起点に、ターゲット核酸を鋳型としポリメラーゼ伸長反応が進行する。即ち、本発明においてはプライマーがターゲット核酸断片の目的の部位を認識して特異的にハイブリダイゼーションするか否かがポイントとなる。本発明で使用するプライマーの好ましい塩基数は5〜60塩基である。特に好ましくは15〜40塩基である。プライマーの塩基数は少なすぎると、ターゲット核酸断片の目的の部位との特異的性が低下するだけでなく、ターゲット核酸断片とのハイブリッド自体が安定に形成できない。また、プライマーの塩基数は多すぎると、プライマー間またはプライマー内で塩基間の水素結合により2本鎖を形成してしまい、やはり特異性が低下する。
【0026】
本発明の方法を用いてターゲット核酸断片の存在を検出する場合、ターゲット核酸断片の異なる部位に対して、それぞれの部位に相補的なプライマーを複数使用することも可能である。このようにターゲット核酸断片を複数の部位で認識することで、ターゲット核酸断片の存在の検出において、特異性が向上する。また、ターゲット核酸断片の一部を増幅(例えばPCR法)する場合には、その増幅法に応じて複数のプライマーを設計することも可能である。本発明の方法を用いてターゲット核酸断片の塩基配列を検出する場合、特に変異または多型の有無を検出する場合は、目的の変異または多型の部分を含むように、変異または多型に対応する塩基の種類でプライマーを設計する。そうすることで、ターゲット核酸断片の変異または多型の有無により、ターゲット核酸断片へのプライマーのハイブリダイゼーションの有無に差異が生じ、結果的にポリメラーゼ伸長反応の差異として検出することが可能になる。また、変異または多型に対応する部分をプライマーの3’末端付近に設定することでポリメラーゼの反応部位の認識に差異が生じ、結果的にポリメラーゼ伸長反応の差異として検出することも可能である。
【0027】
(C)ポリメラーゼ:
本発明において使用するポリメラーゼは、ターゲット核酸がDNAの場合は、ターゲット核酸断片の一本鎖に変性された部分にプライマーがハイブリダイゼーションすることで形成された2本鎖の部分を起点として、5’→3’の方向に、デオキシヌクレオシド3リン酸(dNTP)を材料として、ターゲット核酸断片を鋳型にして相補的な伸長反応を触媒するDNAポリメラーゼである。具体的に使用されるDNAポリメラーゼとしては、DNAポリメラーゼI、DNAポリメラーゼIのクレノー断片、Bst DNAポリメラーゼ等がある。DNAポリメラーゼは目的に応じて選択または組み合わせることが可能である。例えば、ターゲット核酸断片の一部を増幅(例えばPCR法)する場合には、耐熱性に優れたTaq DNAポリメラーゼを用いることが有効である。その他、目的に応じて、3’→5’方向へのヘキソキナーゼ活性を持つ、DNAポリメラーゼα、T4DNAポリメラーゼ、及びT7 DNAポリメラーゼを併用することも可能である。
【0028】
また、RNAウイルスのゲノミック核酸またはmRNAがターゲット核酸断片である場合には、逆転写活性を有するリバーストランスクリプターゼを使用することが可能である。さらにリバーストランスクリプターゼとTaq DNAポリメラーゼを併用することも可能である。
【0029】
(D)ピロリン酸検出反応試薬:
ポリメラーゼ伸長反応は、ポリメラーゼが活性化する至適温度で反応が行われるため、しばしば高温を伴う。特に、PCR反応の場合、94℃以上の高温反応を伴う。そのため、ピロリン酸の検出反応を、ポリメラーゼ反応と同時に行わせる場合、耐熱性であることが好ましい。
(E) ポリメラーゼ伸長反応:本発明において対象となるポリメラーゼ伸長反応には、前記(A)に記載されているようなターゲット核酸断片の1本鎖に変性された部分の一部に特異的にハイブリダイゼーションした、前記(B)に記載されているようなターゲット核酸断片と相補的なプライマーの3’末端を起点として、デオキシヌクレオシド3リン酸(dNTP)を材料として、前記(C)に記載されているようなポリメラーゼを触媒として、ターゲット核酸断片を鋳型にして進行する相補的な核酸の伸長反応の全てが含まれる。この相補的な核酸の伸長反応とは、少なくとも2回(2塩基分)、連続しての伸長反応が起こることをさしている。
【0030】
以下に、例として代表的なポリメラーゼ伸長反応、およびポリメラーゼ伸長反応を伴うターゲット核酸断片の目的部位の増幅反応の例を示す。ターゲット核酸断片を鋳型にして、5’→3’の方向へのポリメラーゼ伸長反応を一度だけ行う場合が最も単純である。このポリメラーゼ伸長反応は等温の条件で実施することができる。この場合には、ポリメラーゼ伸長反応の結果として生成するピロリン酸の量は、最初のターゲット核酸断片の量に比例する。即ち定量的にターゲット核酸断片の存在を検出するのに適した方法である。
【0031】
ターゲット核酸の量が少ない場合は、ポリメラーゼ伸長反応を利用した何らかの手段でターゲット核酸の目的部分を増幅することが好ましい。ターゲット核酸の増幅には、これまで開発、発明されてきた各種の方法を使用することができる。
【0032】
核酸増幅法としては、PCR(特公平4−67960号、特公平4−67957号)、LCR(特開平5−2934号)、SDA(Strand Displacement Amplification:特開平5−130870号)、RCA(Rolling Circle Amplification:Proc.Natl.Acad.Sci, Vol.92, 4641−4645 (1995))、ICAN(Isothermal and Chimeric primer−initiated Amplification of Nucleic Acids)、LAMP(Loop−Mediated Isothermal Amplification of DNA;Bio Industry, 第18巻、2号(2001))、NASBA(Nucleic acid Sequence−based Amplification method; Nature, 350, 91 (1991))、及びTMA(Transcription mediated amplification method; J.Clin Microbiol.第31巻、3270(1993))等が挙げられる。
【0033】
ターゲット核酸の増幅法で最も一般的で普及している方法はPCR(ポリメラーゼチェーンリアクション)法である。PCR法では、反応液の温度の上げ下げを周期的にコントロールすることにより、変性(核酸断片を2本鎖から1本鎖に変性する工程)→アニーリング(1本鎖に変性した核酸断片にプライマーをハイブイリダイズさせる工程)→ポリメラーゼ(TaqDNAポリメラーゼ)伸長反応→ディネイチャーの周期的な工程を繰り返すことで、ターゲット核酸断片の目的部分を増幅する方法である。最終的に、ターゲット核酸断片の目的部位は初期量の100万倍にも増幅し得る。
【0034】
ターゲット核酸断片がRNA断片の場合は、逆転写活性を有するリバーストランスクリプターゼを使用し、RNA鎖を鋳型にして伸長反応を行うことが可能である。さらにリバーストランスクリプターゼとTaq DNAポリメラーゼを併用し、RT(リバーストランスクリプション)反応に引き続いてPCR反応を行う、RT−PCR法を用いることができる。
【0035】
LCR(特開平5−2934号)は、一本鎖DNAに2本の相補的なオリゴヌクレオチドプローブ鎖をend−to−tailに結合させて、耐熱性リガーゼで2本のオリゴヌクレオチド鎖間のニックを封じる。その結合したDNA鎖が変性で遊離し、また鋳型となり、増幅するという方法である。プローブ配列を工夫し、増幅が起きたか否かでSNP判定することができる。また、LCRを改良して、2つのプライマー間にギャップを設定し、その間をポリメラーゼで埋める方法(Gap−LCR:Nucleic Acids Research、第23巻、4号、675(1995))も開発されている。この方法を用いると、ポリメラーゼ伸長反応によるピロリン酸の生成を測定することでSNPを判定することも可能になる。
【0036】
SDA(Strand Displacement Amplification:特開平5−130870号)は、エクソヌクレアーゼを用いたサイクリングアッセイ法であり、ポリメラーゼ伸長反応を利用したターゲット核酸断片の目的部位の増幅法の一つである。この方法は、ターゲット核酸断片の目的部位に特異的にハイブリダイゼーションしたプライマーを起点としたポリメラーゼ伸長反応とともに、5’→3’エクソヌクレアーゼを作用させて、プライマーを逆方向から分解する方法である。分解したプライマーの代わりに新たなプライマーがハイブリダイゼーションし、再度DNAポリメラーゼによる伸長反応が進行する。このポリメラーゼによる伸長反応と、この先に伸長した鎖を外すエクソヌクレアーゼによる分解反応が順次、周期的に繰り返される。ここで、ポリメラーゼによる伸長反応とエクソヌクレアーゼによる分解反応は等温条件で実施することが可能である。プライマー配列を工夫することで、ポリメラーゼ反応が起きたか否かでSNP判定することが可能である。
【0037】
LAMP法は、近年開発されたターゲット核酸断片の目的部位の増幅法である。この方法は、ターゲット核酸断片の少なくとも6箇所の特定部位を相補的に認識する少なくとも4種のプライマーと、5’→3’方向へのヌクレアーゼ活性がなく、かつ鋳型上の2本鎖DNAを1本鎖DNAとして遊離させながら伸長反応を触媒する鎖置換型のBstDNAポリメラーゼを使用することで、等温条件でターゲット核酸断片の目的部位を、特別な構造として増幅する方法である。このプライマー配列を工夫し、増幅が起きたか否かでSNP判定することが可能である。また、このLAMP法の増幅効率は高く、ポリメラーゼ伸長反応で生成するピロリン酸の蓄積量も非常に多くなるので、ピロリン酸を検出することでSNPを検出することが容易になる。するピロリン酸の蓄積量も多くなり、検出が容易になる。
【0038】
ICAN法も、近年開発されたターゲット核酸断片の目的部位の増幅法である。RNA−DNAキメラプライマー、鎖置換活性と鋳型交換活性を有するDNAポリメラーゼ、RNaseHを用いる等温の遺伝子増幅法である。キメラプライマーが鋳型と結合した後、DNAポリメラーゼにより相補鎖が合成される。その後、RNaseHがキメラプライマー由来のRNA部分を切断し、切断部分から鎖置換反応と鋳型交換反応を伴った伸長反応が起きるこの反応が繰り返し起こることにより遺伝子が増幅される。このプライマー配列を工夫し、増幅が起きたか否かでSNP判定することが可能である。また、このICAN法の増幅効率は高く、ポリメラーゼ伸長反応で生成するピロリン酸の蓄積量も非常に多くなるので、ピロリン酸を検出することでSNPを検出することが容易になる。
【0039】
(E) ピロリン酸(PPi)の検出:
従来からピロリン酸(PPi)の検出法としては、式1に示された方法が知られている。この方法では、ピロリン酸(PPi)をスルフリラーゼによりアデノシン3リン酸(ATP)に変換し、アデノシン3リン酸がルシフェラーゼによりルシフェリンに作用して生じる発光を検出する。
【0040】
【化1】

【0041】
本発明に適したピロリン酸の検出方法は式2または式3に示した方法である。式2または式3に示した方法は、ピロリン酸(PPi)をピロフォスファターゼで無機リン酸(Pi)に変換し、プリンヌクレオシドホスホリラーゼ(PNP)により無機リン酸(Pi)をキサントシンまたはイノシンと反応させ、生じたキサンチンまたはヒポキサンチンをキサンチンオキシダーゼ(XOD)により酸化して尿酸を生成させ、この酸化過程で生じる過酸化水素(H2O2)を用いてペルオキシダーゼ(POD)により発色剤(色素前駆体)を発色させ、これを比色するものである。これら式2または式3に示した方法では結果を比色で検出できるため、目視または簡単な比色測定装置を用いてピロリン酸(PPi)の検出が可能である。
【0042】
【化2】

【0043】
【化3】

【0044】
ピロフォスファターゼ(EC3,6,1,1)、プリンヌクレオシドホスホリラーゼ(PNP,EC2.4.2.1)、キサンチンオキシダーゼ(XOD,EC1.2.3.2)及びペルオキシダーゼ(POD,EC1.11.1.7)は市販のものを使用することができる。発色剤(すなわち色素前駆体)は、過酸化水素とペルオキシダーゼ(POD)により色素を生成させるものであればよく、例えば、ロイコ色素の酸化によって色素を生成する組成物(例、米国特許4,089,747等に記載のトリアリールイミダゾールロイコ色素、特開昭59−193352号公報(EP 0122641A)等に記載のジアリールイミダゾーロイコ色素);酸化されたときに他の化合物とカップリングにより色素を生成する化合物を含む組成物(例えば4−アミノアンチピリン類とフェノール類又はナフトール類)などを使用することができる。
【0045】
(F)乾式分析素子:
本発明において使用することのできる乾式分析素子とは、一層または複数層の機能層からなる分析素子であって、その少なくとも一層(または複数の層に渡って)に検出試薬を含有させ、層内での反応により生じた生成色素を、分析素子の外から反射光あるいは透過光により比色定量するものである。
【0046】
このような乾式分析素子を用いて定量分析するには、液体試料を展開層の表面に一定量点着する。展開層で展開された液体試料は試薬層に達し、ここで試薬と反応し、発色する。点着後、乾式分析素子を適当な時間、一定温度に保って(インクベーション)発色反応を充分に進行させた後、例えば透明支持体側から照明光を試薬層に照射し、特定波長域で反射光量を測定して反射光学濃度を求め、予め求めておいた検量線に基づいて定量分析を行う。
【0047】
乾式分析素子においては、検出を行うまでは乾燥状態で貯蔵・保管されるため、試薬を用時調製する必要がなく、また一般に乾燥状態の方が試薬の安定性が高いことから、試薬溶液を用時調製しなければならないいわゆる湿式法より簡便性、迅速性に優れている。また、微量の液体試料で、精度の高い検査を迅速に行うことができる検査方法としても優れている。
【0048】
(G)ピロ燐酸から転換されたリン酸を定量するための乾式分析素子:
本発明で使用することのできるピロ燐酸から転換されたリン酸を定量するためのは、公知の多種の乾式分析素子と同様の層構成とすることができる。乾式分析素子は、前記(E)項(ピロ燐酸(PPi)の検出)における、式2または式3の反応を行うための試薬(但し、ピロフォスファターゼなどの、ピロリン酸を検出するための最初の反応のための試薬を除く)の他、支持体、展開層、検出層、光遮蔽層、接着層、吸水層、下塗り層その他の層を含む多重層としてもよい。このような乾式分析素子として、例えば特開昭49−53888号公報(対応米国特許3,992,158)、特開昭51−40191号公報(対応米国特許4,042,335)、及び特開昭55−164356号公報(対応米国特許4,292,272)、特開昭61−4959号公報(対応EPC公開特許0166365A)の各明細書に開示されたものがある。
【0049】
光透過性水不透過性支持体を用いる場合の乾式分析素子は、実用的に次のような構成を取り得る。ただし、本発明の内容はこれに限定されない。
(1) 支持体上に試薬層を有するもの。
(2) 支持体上に検出層、試薬層をこの順に有するもの。
(3) 支持体上に検出層、光反射層、試薬層をこの順に有するもの。
(4) 支持体上に第2試薬層、光反射層、第1試薬層をこの順に有するもの。
(5) 支持体上に検出層、第2試薬層、光反射層、第1試薬層をこの順に有するもの。
【0050】
上記(1)ないし(3)において試薬層は異なる複数の層から成ってもよい。例えば第1試薬層には、式2または式3に示すPNP反応に必要な基質キサントシンまたは基質イノシンと酵素PNPを、第2試薬層には、式2または式3に示すXOD反応に必要な酵素XODを、そして第3試薬層には、式2または式3に示すPOD反応に必要な酵素PODと発色色素(色素前駆体)を、それぞれ含有させてもよい。あるいは試薬層を2層として、第1試薬層ではPNP反応を、第2試薬層ではXOD反応とPOD反応を進行させてもよい。又は、第1試薬層ではPNP反応とXOD反応を、第2試薬層でPOD反応を進行させてもよい。
【0051】
なお支持体と試薬層又は検出層との間には吸水層を設けてもよい。また各層の間には濾過層を設けてもよい。また試薬層の上には展開層を設けてもよく、その間に接着層を設けてもよい。
【0052】
支持体は光不透過性(不透明)、光半透過性(半透明)、光透過性(透明)のいずれのものも用いることができるが、一般的には光透過性で水不透過性の支持体が好ましい。光透過性水不透過性支持体の材料として好ましいものはポリエチレンテレフタレート、ポリスチレンである。親水性層を強固に接着させるため通常、下塗り層を設けるか、親水化処理を施す。
【0053】
試薬層として多孔性層を用いる場合、その多孔性媒体は繊維質であってもよいし、非繊維質であってもよい。繊維質材料としては、例えば濾紙、不織布、織物布地(例えば平織り布地)、編物布地(例えばトリコット編物布地)、ガラス繊維濾紙等を用いることができる。非繊維質材料としては特開昭49−53888号公報等に記載の酢酸セルロースなどからなるメンブランフイルター、特開昭49−53888号公報、特開昭55−90859号公報(対応米国特許4,258,001)特開昭58−70163号公報(対応米国特許4,486,537)等に記載の無機物又は有機物微粒子からなる連続空隙含有粒状構造物層等のいずれでもよい。特開昭61−4959号公報(対応欧州公開EP 0166365A)、特開昭62−116258号公報、特開昭62−138756号公報(対応欧州公開EP 0226465A)、特開昭62−138757号公報(対応欧州公開EP 0226465A)、特開昭62−138758号公報(対応欧州公開EP 0226465A)等に記載の部分接着された複数の多孔性層の積層物も好適である。
【0054】
多孔性層は、供給される液体の量にほぼ比例した面積に液体を展開する、いわゆる計量作用を有する展開層であってもよい。展開層としては、これらのうち織物布地、編物布地などが好ましい。織物布地などは特開昭57−66359号公報に記載されたようなグロー放電処理をしてもよい。展開層には、展開面積、展開速度等を調節するため特開昭60−222770号公報(対応:EP 0162301A)、特開昭63−219397号公報(対応西独特許公開DE 3717913A)、特開昭63−112999号公報(対応:DE 3717913A)、特開昭62−182652号公報(対応:DE 3717913A)に記載したような親水性高分子あるいは界面活性剤を含有させてもよい。
【0055】
例えば紙、布、高分子からなる多孔質膜等に本発明の試薬を予め含浸又は塗布した後、支持体上に設けた他の水浸透性層、例えば検出層の上に、特開昭55−1645356号公報のような方法で接着させるのも有用な方法である。
【0056】
こうして作られる試薬層の厚さは特に制限されないが、塗布層として設ける場合には、1μm〜50μm程度、好ましくは2μm〜30μmの範囲が適当である。ラミネートによる積層など、塗布以外の方法による場合、厚さは数十μmから数百μmの範囲で大きく変化し得る。
【0057】
親水性ポリマーバインダーからなる水浸透性層で試薬層を構成する場合、使用できる親水性ポリマーとしては、例えば、以下のものがある。ゼラチン及びこれらの誘導体(例えばフタル化ゼラチン)、セルロース誘導体(例えばヒドロキシエチルセルロース)、アガロース、アルギン酸ナトリウム、アクリルアミド共重合体やメタアクリルアミド共重合体(例えば、アクリルアミド又はメタアクリルアミドと各種ビニル性モニマーとの共重合体)、ポリヒドロキシエチルメタクリレート、ポリビニルアルコール、ポリビニルピロリドン、ポリアクリル酸ナトリウム、アクリル酸と各種ビニル性モノマーとの共重合体などである。
【0058】
親水性ポリマーバインダーで構成される試薬層は、特公昭53−21677号公報(対応米国特許3,992,158)、特開昭55−164356号公報(対応米国特許4,292,272)、特開昭54−101398号公報(対応米国特許4,132,528)等の明細書に記載の方法に従って本発明の試薬組成物と親水性ポリマーを含む水溶液又は水分散液を支持体又は検出層等の他の層の上に塗布し乾燥することにより設けることができる。親水性ポリマーをバインダーとする試薬層の乾燥時の厚さは約2μm〜約50μm、好ましくは約4μm〜約30μmの範囲、被覆量では約2g/m2〜約50g/m2、好ましくは約4g/m2〜約30g/m2の範囲である。
【0059】
試薬層には式2または式3の試薬組成物の他に、塗布特性、拡散性化合物の拡散性、反応性、保存性等の諸性能の向上を目的として、酵素の活性化剤、補酵素、界面活性剤、pH緩衝剤組成物、微粉末、酸化防止剤、その他、有機物あるいは無機物からなる各種添加剤を加える事ができる。試薬層に含有させることができる緩衝剤の例としては、日本化学学会編「化学便覧 基礎」(丸善(株)、1966年発行)1312−1320頁、R.M.C.Dawson et al編、「Data for Biochemical Research」第2版(Oxford at the Clarendon Press,1969年発行)476−508頁、「Biochemistry」5,467−477頁(1966年)、「Analytical Biochemistry」104,300−310頁(1980年)に記載のpH緩衝剤系がある。pH緩衝剤系の具体例として硼酸塩を含む緩衝剤;クエン酸又はクエン酸塩を含む緩衝剤;グリシンを含む緩衝剤;ビシン(Bicine)を含む緩衝剤;HEPESを含む緩衝剤;MESを含む緩衝剤などのグッド緩衝剤等がある。なお燐酸塩を含む緩衝剤は、ピロ燐酸検出用乾式分析素子に使用することはできない。
【0060】
本発明で使用することのできる、ピロ燐酸定量用乾式分析素子は前述の諸特許明細書に記載の公知の方法により調製することができる。ピロ燐酸定量用乾式分析素子は一辺約5mmから約30mmの正方形またはほぼ同サイズの円形等の小片に裁断し、特公昭57−283331号公報(対応米国特許4,169,751)、実開昭56−142454号公報(対応米国特許4,387,990)、特開昭57−63452号公報、実開昭58−32350号公報、特表昭58−501144号公報(対応国際公:WO083/00391)等に記載のスライド枠に収めて化学分析スライドとして用いることが製造,包装,輸送,保存,測定操作等の観点で好ましい。使用目的によっては、長いテープ状でカセットまたはマガジンに収めて用いたり、又は小片を開口のある容器内に収めて用いたり、又は小片を開口カードに貼付または収めて用いたり、あるいは裁断した小片をそのまま用いることなどもできる。
【0061】
本発明で使用することのできるピロ燐酸定量用乾式分析素子は前述の諸特許明細書等に記載の操作と同様の操作により液体試料中の被検物であるピロ燐酸の定量検出ができる。例えば約2μL〜約30μL、好ましくは4μL〜15μLの範囲の水性液体試料液を試薬層に点着する。点着した分析素子を約20℃〜約45℃の範囲の一定温度で、好ましくは約30℃〜約40℃の範囲内の一定温度で1〜10分間インキュベーションする。分析素子内の発色又は変色を光透過性支持体側から反射測光し、予め作成した検量線を用いて比色測定法の原理により検体中のピロ燐酸の量を求めることができる。点着する液体試料の量、インキュベーション時間及び温度を一定にすることにより定量分析を高精度に実施できる。
【0062】
測定操作は特開昭60−125543号公報、特開昭60−220862号公報、特開昭61−294367号公報、特開昭58−161867号公報(対応米国特許4,424,191)などに記載の化学分析装置により極めて容易な操作で高精度の定量分析を実施できる。なお、目的や必要精度によっては目視により発色の度合いを判定して、半定量的な測定を行ってもよい。
【0063】
本発明で使用することのできる乾式分析素子においては、分析を行うまでは乾燥状態で貯蔵・保管されるため、試薬を用時調製する必要がなく、また一般に乾燥状態の方が試薬の安定性が高いことから、試薬溶液を用時調製しなければならないいわゆる湿式法より簡便性、迅速性に優れている。また、微量の液体試料で、精度の高い検査を迅速に行うことができる検査方法としても優れている。
本発明で使用することのできる乾式分析素子としてはまた、特開平7−197号公報に記載の乾式分析素子を使用することも可能である。
【0064】
(H)キット:
本発明のターゲット核酸の分析は、分析するターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)、少なくとも一種のポリメラーゼ、ピロリン酸を検出するための最初の反応に必要な反応試薬(例えば、耐熱性のピロフォスファターゼ等)、及びピロリン酸定量用乾式分析素子を含むキットを用いて実施することができる。
【0065】
キットの形態は、少なくとも一部の塩基配列が既知であるターゲット核酸断片を含む液体を供給することのできる開口部、ターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)、少なくとも一種のポリメラーゼ、及びピロリン酸を検出するための最初の反応に必要な反応試薬(例えば、耐熱性のピロフォスファターゼ等)を保持することのできる少なくとも一つの反応セル部、ピロ燐酸定量用乾式分析素子を保持することのできる検出部、及びそれら前記開口部、反応セル部、検出部の間を連結し、液体を移動させることのできる細管または溝を備えているカートリジであってもよい。
【0066】
このようなカートリッジとしては、米国特許5,919,711に記載されているカートリッジ等を利用することが可能である。
図1には、本発明におけるカートリッジ形態のキットの一例を示した。キット10において、開口部31からターゲット核酸を含有する試料液を供給することができる。開口部31は細管41によって、反応セル32と連結されている。反応セル32には、予めターゲット核酸断片の一部と相補的な少なくとも一種のプライマー81、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)82、少なくとも一種のポリメラーゼ83、およびピロリン酸を検出するための最初の反応に必要な反応試薬(例えば、耐熱性のピロフォスファターゼ等)が保持されている。さらに、反応セル32は細管42によって検出部33と連結されている。検出部33には予め乾式分析素子51が保持されている。反応セル32でポリメラーゼ伸長反応が進行した試料液は、細管42を移動して、検出部33のピロ燐酸定量用乾式分析素子51上に供給され、ポリメラーゼ伸長反応により生成したピロ燐酸を検出する。上記キット10において、開口部31と反応セル32の間、及び反応セル32と検出部33の間の液体の移動は、遠心力、電気泳動または電気浸透などを用いることが可能である。また、反応セル32、細管41及び42、検出部33は、基体21と蓋22によって密封されていることが望ましい。
【0067】
図1に示したようなカートリッジ形態のキット10を使用する場合、図2に示したように、反応セル32および検出部33の温度コントロール部61及び62と、ピロ燐酸定量用乾式分析素子51内の発色または色変化を反射光により検出することのできる検出部71及び72を備えている装置を合わせて使用することが望ましい。
【0068】
本発明で使用することのできるカートリッジ形態のキットは、図1に示されているものに限らない。ポリメラーゼ伸長反応に必要な試薬はそれぞれ別のスペースに保持されていても良い。その場合は、反応時にそれぞれの試薬が反応セルに移動してくるようにすれば良い。また、反応セルは複数であっても良い。
【0069】
また、1つのカートリッジ上に「開口部−細管−反応セル−細管−検出部」の組を平行に並べて、または同心円の半径方向に並べて、複数組設置することも可能である。この場合、例えば反応セルに保持するターゲット核酸断片の一部と相補的な少なくとも一種のプライマーの塩基配列を、ターゲットとする核酸の種類に応じて変更することで、同時に複数種のターゲット核酸を検出することが可能なキットを提供できる。
以下、実施例にて本発明を詳細に説明する。しかしながら、本実施例により本発明の技術的範囲が限定されるものではない。
【0070】
【実施例】
実施例1:無機燐酸定量用乾式分析素子を用いたPCR増幅産物の検出
(1) 無機燐酸定量用乾式分析素子の作製
ゼラチン下塗層が設けられている厚さ180μmの無色透明ポリエチレンテレフタレート(PET)平滑フイルムシート(支持体)上に下記の表1に記載の組成(a)の水溶液を、以下の被覆率となるように塗布し、乾燥して試薬層を設けた。
【0071】
【表1】

【0072】
この試薬層の上に下記の表2記載の組成(b)の接着層水溶液を以下の被覆率となるように塗布し、乾燥して接着層を設けた。
【0073】
【表2】

【0074】
次いで接着層の上に30g/m2の割合で水を全面に供給してゼラチン層を膨潤させ、その上に純ポリエステル製のブロード織物布地をほぼ一様に軽く圧力をかけてラミネートして多孔性展開層を設けた。
【0075】
次にこの展開層の上から下記の表3記載の組成(c)の水溶液を以下の被覆率となるようにほぼ均一塗布し乾燥させ、燐酸定量用乾式分析素子を作成した。
【0076】
【表3】

【0077】
(2)鋳型用プラスミドの調製
β−Actin遺伝子(約1500bp)が挿入されたプラスミド(pBluescriptベクター)を大腸菌コンピテントセル(JM109)に導入した。これをLB培地中で1晩培養した。これよりプラスミドを抽出・精製することにより、β−Actin遺伝子断片が挿入されたプラスミドを得た.さらに、分光光度計を用いて得られたプラスミド量の定量を行い、既知量のサンプルを得た。
【0078】
(3)PCR増幅反応
上記(1)で調製した既知量のプラスミドを用いて、以下の条件でPCR増幅反応を行った。系列1はPCR反応後の液に20unitsのピロフォスファターゼで処理(37℃、60分)し、系列2はPCR反応液中にピロフォスファターゼを添加して、それぞれの系列について、PCRの各サイクル(0、10、20、25、30、35、40)終了後にサンプリングを行った。そして、それぞれのサイクル終了後のPCR反応増幅産物を(1)で作製したリン酸スライドに点着し、増幅産物由来のリン酸量の定量を行うとともに、BioAnalyzer(Agilent社製)を用いてDNA増幅産物量の定量を行い、それらより得られる値を比較した。以下にPCR反応の諸条件を示す。
【0079】
<プライマ−>
pBluescriptに挿入したβ−Actin遺伝子断片に特異的な配列を有する以下のプライマーセットを使用した。
プライマ−(upper):
5’−GGGCATGGGTCAGAAGGATT−3’(配列番号1)
プライマ−(lower):
5’−CCGTGGTGGTGAAGCTGTAG−3’(配列番号2)
【0080】
(4)ポリメラーゼ伸長反応によるターゲット核酸断片の増幅
以下の表4に示す反応液の組成で、PCRによる標的核酸断片の増幅を実施した。PCRは、[デネイチャー:94℃・30秒、アニーリング:60℃・30秒、ポリメラーゼ伸長反応:72℃・1分]を所定のサイクル繰り返することで実施した。
【0081】
【表4】

【0082】
(5)燐酸スライドを用いたPCR反応における増幅産物量の検出
前記(4)におけるPCR増幅反応後の溶液を、そのまま上記(1)で製作した無機燐酸定量用乾式分析素子上に各々20μL点着し、燐酸定量用乾式分析素子を37℃にて5分間インキュベ−ション後、波長650nmにて支持体側から測定して5分後の反射光学濃度(ODR)が得られた。このODRをあらかじめ作成してあったODRをリン酸濃度に変換する検量線を用いて読みかえ、これをさらにDNAの濃度に換算した.これらの値を表5に示し,各サイクルにおけるDNAの生成量のグラフを図3に示した。
【0083】
ここで、リン酸濃度からDNAの濃度への変換は以下の式に従った。
ポリメラーゼ反応が以下の反応式に従う。
(DNA)n−1 + dNTP → (DNA)n + PPi
→(PPaseの作用により)2ip
(PPiはピロリン酸、ipはリン酸を示す)
これより、dNTPが1分子合成される毎に、PPi1分子(ip2分子)生成する。よって、〔dNTP〕=〔PPi〕=0.5×〔ip〕(mM)となる。
dNTPの濃度は、即ち、生成したDNAの濃度であり、dNTPの分子量を約300とすると、(DNA,ng/μL)=300×〔PPi〕=150×〔ip〕
【0084】
【表5】

【0085】
上記の結果より、ピロフォスファターゼをPCR反応後に添加した場合、30サイクル以降のDNA量の測定値が減少するのに対して、ピロフォスファターゼをあらかじめPCR反応液に添加しておくと、DNA量は30サイクル以降も変わりなく測定できていることがわかる。さらに、以下の実験で実際のPCR測定産物を定量することによって、あらかじめピロフォスファターゼを添加しておく方が、DNA量を精度良く測定できることを確認した。
【0086】
(6)BioAnalyzerを用いたPCR反応における増幅産物量の検出
次に、前記(4)におけるPCR増幅反応後の溶液をBioAnalyzer(Agilent社製)を用いてPCR増幅反応後のDNA量を定量した。
各サイクルにおけるDNAの生成量の値を表6に、グラフを図4に示した。
【0087】
【表6】

【0088】
上記結果より、Agilent社のBioAnalyzerを用いて測定した場合、ピロフォスファターゼの添加がPCR反応の前後のいずれの場合においても、DNA増幅産物量に変わりがないことがわかる。また、前記、燐酸スライドを用いた結果と比較すると、ピロフォスファターゼをあらかじめPCR反応溶液に添加しておくことが、PCRの副生成物であるピロリン酸を用いてPCR増幅産物を定量するには重要であることがわかる。
【0089】
【発明の効果】
本発明によれば、ポリメラーゼ反応に伴って生成する核酸量を、当該ポリメラーゼ反応に伴って生成するピロリン酸を用いて定量的に測定することができる。
【0090】
【配列表】

【図面の簡単な説明】
【図1】図1は、本発明のカートリッジ形態でのキットの例を示す斜視図である。
【図2】図2は、本発明のカートリッジ形態でのキットを使用する場合のシステム構成を示す斜視図である。
【図3】図3は、燐酸スライドを用いたPCR反応における増幅産物量の検出結果を示す。
【図4】図4は、BioAnalyzerを用いたPCR反応における増幅産物量の検出結果を示す。
【符号の説明】
10 キット
21 基体
22 蓋
31 開口部
32 反応セル
33 検出部
41 細管
42 細管
51 乾式分析素子
61 温度コントロール部
62 温度コントロール部
71 検出部
72 検出部
81 プライマー
82 デオキシヌクレオシド3リン酸(dNTP)
83 ポリメラーゼ
【特許請求の範囲】
【請求項1】
(1)少なくとも一部の塩基配列が既知であるターゲット核酸断片、前記ターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸、少なくとも一種のポリメラーゼ、及びポリメラーゼ反応に必要な2価の陽イオンを含む反応混合物を使用して、前記ターゲット核酸断片を鋳型にして前記プライマーの3’末端を起点とするポリメラーゼ伸長反応を行う工程;及び(2)前記ポリメラーゼ伸長反応に伴って生成するピロリン酸を検出することによって前記ポリメラーゼ伸長反応が連続して進行するか否かを判定する工程;を含むターゲット核酸断片の検出方法において、ポリメラーゼ伸長反応の進行に伴って生成するピロリン酸を検出するための最初の反応をポリメラーゼ伸長反応と同時に行うことを特徴とする、上記の検出方法。
【請求項2】
ピロリン酸を検出するための最初の反応がピロフォスファターゼにより当該ピロリン酸をリン酸に分解させる反応である、請求項1に記載のターゲット核酸の検出方法。
【請求項3】
ピロリン酸の検出反応が、ピロフォスファターゼ、キサントシンまたはイノシン、プリンヌクレオシドホスホリラーゼ、キサンチンオキシダーゼ、ペルオキシダーゼ及び発色剤を用いる反応であり、ピロフォスファターゼによる当該ピロリン酸をリン酸に分解させる反応をポリメラーゼ伸長反応と同時に行う、請求項1又は2に記載のターゲット核酸の検出方法。
【請求項4】
ピロリン酸の検出を、キサントシンまたはイノシン、プリンヌクレオシドホスホリラーゼ、キサンチンオキシダーゼ、ペルオキシダーゼ及び発色剤を含有する試薬層を備える無機リン酸定量用乾式分析素子を用いて行うことを特徴とする、請求項3に記載のターゲット核酸の検出方法。
【請求項5】
ピロリン酸の検出反応が、アデノシン−5’−ホスファサルフェート、ATPスルフリラーゼ、発光酵素、発光基質を用いる反応であって、ピロリン酸を検出するための最初の反応がアデノシン−5’−ホスファサルフェートとATPスルフリラーゼにより、当該ピロリン酸をATPに変換させる反応である、請求項1に記載のターゲット核酸の検出方法。
【請求項6】
前記発光酵素がルシフェラーゼであり、前記発光基質がルシフェリンである、請求項5記載のターゲット核酸の検出方法。
【請求項7】
分析するターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)、少なくとも一種のポリメラーゼ、ピロリン酸を検出するための最初の反応に必要な反応試薬、及び乾式分析素子を含む、請求項1から6の何れかに記載のターゲット核酸の検出方法を行なうためのキット。
【請求項8】
ピロリン酸を検出するための最初の反応に必要な反応試薬がピロフォスファターゼであり、乾式分析素子が無機リン酸定量用乾式分析素子である、請求項7に記載のキット。
【請求項9】
ピロリン酸を検出するための最初の反応に必要な反応試薬がアデノシン−5’−ホスファサルフェートとATPスルフリラーゼであり、乾式分析素子がアデノシン5’−三リン酸定量用乾式分析素子である、請求項7に記載のキット。
【請求項1】
(1)少なくとも一部の塩基配列が既知であるターゲット核酸断片、前記ターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸、少なくとも一種のポリメラーゼ、及びポリメラーゼ反応に必要な2価の陽イオンを含む反応混合物を使用して、前記ターゲット核酸断片を鋳型にして前記プライマーの3’末端を起点とするポリメラーゼ伸長反応を行う工程;及び(2)前記ポリメラーゼ伸長反応に伴って生成するピロリン酸を検出することによって前記ポリメラーゼ伸長反応が連続して進行するか否かを判定する工程;を含むターゲット核酸断片の検出方法において、ポリメラーゼ伸長反応の進行に伴って生成するピロリン酸を検出するための最初の反応をポリメラーゼ伸長反応と同時に行うことを特徴とする、上記の検出方法。
【請求項2】
ピロリン酸を検出するための最初の反応がピロフォスファターゼにより当該ピロリン酸をリン酸に分解させる反応である、請求項1に記載のターゲット核酸の検出方法。
【請求項3】
ピロリン酸の検出反応が、ピロフォスファターゼ、キサントシンまたはイノシン、プリンヌクレオシドホスホリラーゼ、キサンチンオキシダーゼ、ペルオキシダーゼ及び発色剤を用いる反応であり、ピロフォスファターゼによる当該ピロリン酸をリン酸に分解させる反応をポリメラーゼ伸長反応と同時に行う、請求項1又は2に記載のターゲット核酸の検出方法。
【請求項4】
ピロリン酸の検出を、キサントシンまたはイノシン、プリンヌクレオシドホスホリラーゼ、キサンチンオキシダーゼ、ペルオキシダーゼ及び発色剤を含有する試薬層を備える無機リン酸定量用乾式分析素子を用いて行うことを特徴とする、請求項3に記載のターゲット核酸の検出方法。
【請求項5】
ピロリン酸の検出反応が、アデノシン−5’−ホスファサルフェート、ATPスルフリラーゼ、発光酵素、発光基質を用いる反応であって、ピロリン酸を検出するための最初の反応がアデノシン−5’−ホスファサルフェートとATPスルフリラーゼにより、当該ピロリン酸をATPに変換させる反応である、請求項1に記載のターゲット核酸の検出方法。
【請求項6】
前記発光酵素がルシフェラーゼであり、前記発光基質がルシフェリンである、請求項5記載のターゲット核酸の検出方法。
【請求項7】
分析するターゲット核酸断片の一部と相補的な少なくとも一種のプライマー、少なくとも一種のデオキシヌクレオシド3リン酸(dNTP)、少なくとも一種のポリメラーゼ、ピロリン酸を検出するための最初の反応に必要な反応試薬、及び乾式分析素子を含む、請求項1から6の何れかに記載のターゲット核酸の検出方法を行なうためのキット。
【請求項8】
ピロリン酸を検出するための最初の反応に必要な反応試薬がピロフォスファターゼであり、乾式分析素子が無機リン酸定量用乾式分析素子である、請求項7に記載のキット。
【請求項9】
ピロリン酸を検出するための最初の反応に必要な反応試薬がアデノシン−5’−ホスファサルフェートとATPスルフリラーゼであり、乾式分析素子がアデノシン5’−三リン酸定量用乾式分析素子である、請求項7に記載のキット。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2004−321127(P2004−321127A)
【公開日】平成16年11月18日(2004.11.18)
【国際特許分類】
【出願番号】特願2003−123454(P2003−123454)
【出願日】平成15年4月28日(2003.4.28)
【出願人】(000005201)富士写真フイルム株式会社 (7,609)
【Fターム(参考)】
【公開日】平成16年11月18日(2004.11.18)
【国際特許分類】
【出願日】平成15年4月28日(2003.4.28)
【出願人】(000005201)富士写真フイルム株式会社 (7,609)
【Fターム(参考)】
[ Back to top ]

