ターフェニレン誘導体の製造方法
【課題】有機半導体材料として有望なターフェニレン誘導体の製造方法を提供する。
【解決手段】一般式(1)で示されるターフェニレン誘導体を、テトラハロターフェニル誘導体をジアルキルエーテル中でリチオ化剤を用いてリチオ化し、銅化合物と反応させることにより得る。
【化1】

(ここで、置換基R1〜R8は同一又は異なって、水素原子、フッ素原子、炭素数1〜30のアルキル基、炭素数4〜30のアリール基、炭素数2〜30のアルキニル基、又は炭素数2〜30のアルケニル基を示し、mは0又は1である。)
【解決手段】一般式(1)で示されるターフェニレン誘導体を、テトラハロターフェニル誘導体をジアルキルエーテル中でリチオ化剤を用いてリチオ化し、銅化合物と反応させることにより得る。
【化1】

(ここで、置換基R1〜R8は同一又は異なって、水素原子、フッ素原子、炭素数1〜30のアルキル基、炭素数4〜30のアリール基、炭素数2〜30のアルキニル基、又は炭素数2〜30のアルケニル基を示し、mは0又は1である。)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、有機半導体材料等の電子材料への展開が可能なターフェニレン誘導体の製造方法に関する。
【背景技術】
【0002】
有機薄膜トランジスタに代表される有機半導体デバイスは、省エネルギー、低コスト及びフレキシブルといった無機半導体デバイスにはない特徴を有することから近年注目されるようになった。この有機半導体デバイスは有機半導体活性相、基板、絶縁相、電極等数種類の材料から構成されるが、中でも電荷のキャリアー移動を担う有機半導体活性相は該デバイスの中心的な役割を有している。この有機半導体活性相を構成する有機材料のキャリアー移動能により有機半導体デバイス性能が左右される。
【0003】
有機半導体活性相を作製する方法としては一般的に、高温真空下、有機材料を気化させて実施する真空蒸着法及び有機材料を適当な溶媒に溶解させその溶液を塗布する塗布法が知られている。塗布法においては、塗布は高温高真空条件を用いることなく印刷技術を用いても実施することができる。そのため、塗布法は印刷によりデバイス作製の大幅な製造コストの削減を図ることができることから、経済的に好ましいプロセスである。しかし、従来、有機半導体デバイスとして性能が高い材料ほど塗布法で有機半導体活性相を形成することが困難になるという問題があった。
【0004】
例えば、ペンタセン等の結晶性材料はアモルファスシリコン並みの高いキャリアー移動度を有し、優れた有機半導体デバイス特性を発現することが報告されている(例えば、非特許文献1参照)。又、ペンタセン等のポリアセンを溶解させ塗布法で有機半導体デバイスを製造する試みも報告されている(例えば、特許文献1参照)。しかしながら、ペンタセンはその強い凝集性のため溶解性が低く、塗布法を適用するためには高温加熱等の条件が必要とされ、さらにペンタセンの溶液は極めて容易に空気酸化されることから、塗布法の適用はプロセス的、経済的に困難を伴うものであった。また、ポリ−(3−ヘキシルチオフェン)等の自己組織化材料は溶媒に可溶であり、塗布法による有機半導体デバイス作製が報告されてはいるが、キャリアー移動度が結晶性低分子化合物より1桁低いことから(例えば、非特許文献2参照)、得られた有機半導体デバイスの特性が低いという問題があった。
【0005】
このような中で、ターフェニレン誘導体は剛直な共役縮環化合物であり、有機半導体材料として期待できる化合物である。しかし、これまでに報告されているターフェニレン誘導体の製造方法は収率が低く、且つ多量のブチルリチウムを用いることから効率の良い方法ではなかった(例えば、特許文献2参照)。
【0006】
【非特許文献1】「ジャーナル オブ アプライドフィジックス」(米国)、2002年、92巻、5259−5263頁
【非特許文献2】「サイエンス」(米国)、1998年、280巻、1741−1744頁
【特許文献1】WO2003/016599号
【特許文献2】WO2006/109569号
【発明の開示】
【発明が解決しようとする課題】
【0007】
そこで、本発明は上記の従来技術が有する問題点に鑑み、原料であるテトラハロターフェニル誘導体をジアルキルエーテル中でリチオ化することで収率良くターフェニレン誘導体を製造することを目的とする。
【課題を解決するための手段】
【0008】
本発明者らは上記課題を解決するため鋭意検討の結果、テトラハロターフェニル誘導体を原料に用いる本発明のターフェニレン誘導体の新規な製造方法を見出した
以下に本発明を詳細に説明する。
【0009】
(ターフェニレン誘導体の製造方法)
本発明の一般式(1)で示されるターフェニレン誘導体は、一般式(2)で示されるテトラハロターフェニル誘導体をリチオ化剤を用いてリチオ化し、銅化合物と反応させることにより製造することができる。
【0010】
【化1】

(ここで、置換基R1〜R8は同一又は異なって、水素原子、フッ素原子、炭素数1〜30のアルキル基、炭素数4〜30のアリール基、炭素数2〜30のアルキニル基、又は炭素数2〜30のアルケニル基を示し、mは0又は1である。)
【0011】
【化2】

(ここで、置換基X1〜X4は臭素原子、ヨウ素原子、塩素原子を示す。置換基R1〜R8並びに記号mは請求項1に記載の一般式(1)で示される置換基及び記号と同意義を示す。)
なお、ここでリチオ化とは、一般式(2)におけるX1〜X4をそれぞれリチウムに置換することを意味する。
【0012】
一般式(1)で示されるターフェニレン誘導体の置換基について述べる。
【0013】
置換基R1〜R8における炭素数1〜30のアルキル基は、特に限定はなく、例えばメチル基、プロピル基、ブチル基、イソブチル基、tert−ブチル基、ネオペンチル基、ヘキシル基、ヘプチル基、オクチル基、ノニル基、デシル基、ドデシル基、ペンタデシル基、オクタデシル基、2−エチルヘキシル基、シクロヘキシル基、シクロオクチル基等のアルキル基;トリフルオロメチル基、トリフルオロエチル基、パーフルオロヘキシル基、パーフルオロヘプチル基、パーフルオロオクチル基、パーフルオロノニル基、パーフルオロデシル基、パーフルオロドデシル基、パーフルオロペンタデシル基、パーフルオロオクタデシル基、パーフルオロシクロヘキシル基、パーフルオロシクロオクチル基等のパーフルオロアルキル基;ペンタデカフルオロオクチル基、オクタデカフルオロデシル基、2−エチルパーフルオロヘキシル基等の一部の水素がフッ素に置換されたハロゲン化アルキル基を挙げることができ、好ましくはドデシル基、ペンタデシル基、オクタデシル基、パーフルオロドデシル基、パーフルオロオクタデシル基であり、特に好ましくはドデシル基、ペンタデシル基、パーフルオロドデシル基である。
【0014】
置換基R1〜R8における炭素数4〜30のアリール基は、特に限定はなく、例えばフェニル基、p−トリル基、p−(オクチル)フェニル基、p−(ドデシル)フェニル基、p−(シクロヘキシル)フェニル基、m−(オクチル)フェニル基、m−(ドデシル)フェニル基、p−フルオロフェニル基、ペンタフルオロフェニル基、p−(トリフルオロメチル)フェニル基、p−(パーフルオロオクチル)フェニル基、p−(パーフルオロドデシル)フェニル基、m−(パーフルオロドデシル)フェニル基、2−チエニル基、5−(ドデシル)−2−チエニル基、2,2’−ビチエニル−5−基、ビフェニル基、パーフルオロビフェニル基、1−ナフチル基、2−ナフチル基、1−パーフルオロナフチル基、2−フルオレニル基、9,9−ジメチル−2−フルオレニル基、9−アントラセニル基等を挙げることができ、好ましくはフェニル基、p−(オクチル)フェニル基、p−(パーフルオロオクチル)フェニル基、5−(ドデシル)−2−チエニル基等であり、特に好ましくはフェニル基である。
【0015】
置換基R1〜R8における炭素数2〜30のアルキニル基は、特に限定はなく、例えばエチニル基、メチルエチニル基、イソプロピルエチニル基、tert−ブチルエチニル基、(オクチル)エチニル基、(ドデシル)エチニル基、(トリフルオロメチル)エチニル基、(パーフルオロオクチル)エチニル基、(パーフルオロドデシル)エチニル基、フェニルエチニル基、{p−(オクチル)フェニル}エチニル基、{p−(ドデシル)フェニル}エチニル基、{m−(ドデシル)フェニル}エチニル基、1−ナフチルエチニル基、2−ナフチルエチニル基、9−アントラセニルエチニル基、ベンジルエチニル基、パーフルオロフェニルエチニル基、{p−(トリフルオロメチル)フェニル}エチニル基、{p−(パーフルオロオクチル)フェニル}エチニル基、{p−(パーフルオロドデシル)フェニル}エチニル基、{m−(パーフルオロドデシル)フェニル}エチニル基、5−(ヘキシル)チエニル−2−}エチニル基、{5−(パーフルオロヘキシル)チエニル−2−}エチニル基等を挙げることができ、好ましくは(オクチル)エチニル基、(ドデシル)エチニル基、(パーフルオロオクチル)エチニル基、(パーフルオロドデシル)エチニル基、フェニルエチニル基等である。
【0016】
置換基R1〜R8における炭素数2〜30のアルケニル基は、特に限定はなく、例えばエテニル基、メチルエテニル基、イソプロピルエテニル基、tert−ブチルエテニル基、(オクチル)エテニル基、(ドデシル)エテニル基、(トリフルオロメチル)エテニル基、フェニルエテニル基、{p−(ヘキシル)フェニル}エテニル基、{p−(オクチル)フェニル}エテニル基、{p−(ドデシル)フェニル}エテニル基、{m−(ドデシル)フェニル}エテニル基、2−フェニル−1,2−ジフルオロエテニル基、2−フェニル−1,2−ジメチルエテニル基、ジフェニルエテニル基、トリフェニルエテニル基、1−ナフチルエテニル基、2−ナフチルエテニル基、9−アントラセニルエテニル基、ベンジルエテニル基、フェニル(メチル)エテニル基、(パーフルオロフェニル)エテニル基、{p−(トリフルオロメチル)フェニル}エテニル基、(パーフルオロオクチル)エテニル基、(パーフルオロドデシル)エテニル基、{5−(ヘキシル)チエニル−2−}エテニル基、{5−(パーフルオロヘキシル)チエニル−2−}エテニル基等を挙げることができ、好ましくは(オクチル)エテニル基、(ドデシル)エテニル基、(パーフルオロオクチル)エテニル基、(パーフルオロドデシル)エテニル基等である。なお、該炭素数2〜30のアルケニル基はトランス体及びシス体の何れであってもよく、またそれらの任意の割合の混合物であってもよい。
【0017】
mは0又は1であり、好ましくは1である。
【0018】
本発明の一般式(1)で示されるターフェニレン誘導体の置換基R1〜R8の置換様式として、R1〜R4が、同一又は異なって、水素原子、フッ素原子、及び炭素数1〜30のアルキル基、且つR5〜R8が、同一又は異なって、水素原子、炭素数4〜30のアリール基、炭素数2〜30のアルキニル基、及び炭素数2〜30のアルケニル基からなる群から選ばれる少なくとも一種以上の基であることが好ましい。
【0019】
これらの中でも本発明の一般式(1)で示されるターフェニレン誘導体は、以下の化合物が好ましく、
【0020】
【化3】

【0021】
【化4】

【0022】
【化5】

【0023】
【化6】

【0024】
【化7】

【0025】
【化8】

【0026】
【化9】

特に好ましくは
【0027】
【化10】

である。
【0028】
次に、一般式(1)で示されるターフェニレン誘導体の原料である一般式(2)で示されるテトラハロターフェニル誘導体について述べる。
【0029】
なお、一般式(2)の表記は、一般式(2)が下記一般式(3)及び一般式(4)で示されるパラ位置異性体及びメタ位置異性体を総称するものである。
【0030】
【化11】

【0031】
【化12】

(ここで、一般式(3)及び一般式(4)の置換基X1〜X4及びR1〜R8、並びに記号mは一般式(2)で示される置換基並びに記号と同意義を示す。)
置換基X1〜X4は臭素原子、ヨウ素原子、塩素原子を示し、好ましくは臭素原子、ヨウ素原子であり、特に好ましくはいずれも臭素原子である。
【0032】
置換基R1〜R8は、一般式(1)で示される置換基と同意義を示し、その置換様式として、R1〜R4が、同一又は異なって、水素原子、フッ素原子、炭素数1〜30のアルキル基、且つR5〜R8が、同一又は異なって、水素原子、炭素数4〜30のアリール基、炭素数2〜30のアルキニル基、及び炭素数2〜30のアルケニル基からなる群から選ばれる少なくとも一種以上の基であることが好ましい。
【0033】
一般式(2)で示されるテトラハロターフェニル誘導体としては、以下の化合物が好ましく、
【0034】
【化13】

【0035】
【化14】

【0036】
【化15】

【0037】
【化16】

【0038】
【化17】

【0039】
【化18】

【0040】
【化19】

特に好ましくは
【0041】
【化20】

である。
【0042】
一般式(2)で示されるテトラハロターフェニル誘導体をリチオ化する場合、用いるリチオ化剤は、一般式(2)におけるX1〜X4をリチウムに置換することができるものである限り特に限定はなく、例えばn−ブチルリチウム、sec−ブチルリチウム、tert−ブチルリチウム、メチルリチウム、ヘキシルリチウム等のアルキルリチウム;フェニルリチウム、p−tert−ブチルフェニルリチウム、p−メトキシフェニルリチウム、p−フルオロフェニルリチウム等のアリールリチウム;リチウムジイソプロピルアミド、リチウムヘキサメチルジシラジド等のリチウムアミド;リチウムパウダー等のリチウム金属等を挙げることができ、好ましくはアルキルリチウムであり、特に好ましくはn−ブチルリチウム、sec−ブチルリチウムである。
【0043】
該リチオ化剤の使用量は一般式(2)で示されるテトラハロターフェニル誘導体1当量に対し、3.5〜7当量が好ましく、特に好ましくは4〜6当量、さらに好ましくは4.5〜5.5当量である。
【0044】
該リチオ化は、ジアルキルエーテル中で実施する。該ジアルキルエーテルとしては、例えば、ジメチルエーテル、ジエチルエーテル、メチル−tert−ブチルエーテル、エチル−tert−ブチルエーテル、エチレングリコールジメチルエーテル等が挙げられ、好ましくはジエチルエーテル、エチル−tert−ブチルエーテルである。又、これら溶媒は1種若しくは2種以上の混合物を用いても良い。該リチオ化の温度は−80〜50℃で行うことが好ましく、特に好ましくは−70〜20℃である。反応時間は1〜240分が好ましく、特に好ましくは10〜120分である。なお、リチオ化の進行は、反応液の一部を取り出し、水で反応を停止させた後、薄層クロマトグラフィーあるいはガスクロマトグラフィーで分析することで監視することができる。
【0045】
該リチオ化は、一般式(2)で示されるテトラハロターフェニル誘導体に、リチオ化剤を添加しても良いし、リチオ化剤に一般式(2)で示されるテトラハロターフェニル誘導体を添加するいずれの方法を用いても実施することができる。
【0046】
該リチオ化により生成したリチウム塩は、次いで銅化合物と反応させることにより、一般式(1)で示されるターフェニレン誘導体が得られるものである。係る銅化合物との反応は、前記リチオ化により生成したリチウム塩を含む反応混合物に銅化合物を添加しても良いし、前記リチオ化により生成したリチウム塩を含む反応混合物を銅化合物に添加するいずれの方法を用いても実施することができる。
【0047】
該銅化合物は特に限定はなく、例えば、塩化銅(II)、臭化銅(II)、ヨウ化銅(II)、酢酸銅(II)、アセチルアセトナート銅(II)等の2価銅;塩化銅(I)、臭化銅(I)、ヨウ化銅(I)、酢酸銅(I)等の1価銅等を挙げることができる。好ましくは2価銅であり、特に好ましくは塩化銅(II)、臭化銅(II)である。
【0048】
リチオ化により生成したリチウム塩と銅化合物と反応させる際には、好ましくは溶媒中で実施する。用いる溶媒は特に限定はなく、例えばテトラヒドロフラン(以後、THFと略す)、ジメチルエーテル、ジエチルエーテル、メチル−tert−ブチルエーテル、エチル−tert−ブチルエーテル、エチレングリコールジメチルエーテル、ジオキサン、トルエン、ヘキサン、シクロヘキサン等であり、好ましくはTHF、ジエチルエーテル、エチル−tert−ブチルエーテルである。又、これら溶媒は1種若しくは2種以上の混合物を用いても良い。銅化合物はこれら溶媒との混合物の状態で用いることが好ましい。この用いる銅化合物の量は、一般式(2)で示されるテトラハロターフェニル誘導体1当量に対し、3〜10当量が好ましく、特に好ましくは4〜8当量である。該反応剤との反応温度は−90〜50℃が好ましく、特に好ましくは−80〜30℃であり、反応時間は0.5〜30時間が好ましく、特に好ましくは1〜18時間である。
【0049】
本発明の一般式(1)で示されるターフェニレン誘導体の製造は、好ましくは窒素又はアルゴン等の不活性雰囲気下で実施する。
【0050】
かくして得られた、本発明の一般式(1)で示されるターフェニレン誘導体は、さらに精製することができる。精製する方法は特に限定はなく、例えばカラムクロマトグラフィー、再結晶化、あるいは昇華による方法を挙げることができる。
【0051】
(テトラハロターフェニル誘導体の製造方法)
次に、本発明の一般式(1)で示されるターフェニレン誘導体の前駆体として用いられる一般式(2)で示されるテトラハロターフェニル誘導体の製造方法について述べる。
【0052】
一般式(2)で示されるテトラハロターフェニル誘導体は、下記一般式(5)で示されるテトラハロベンゼンと下記一般式(6)及び/又は下記一般式(7)で示される3−ハロアリール金属試薬をパラジウム及び/又はニッケル触媒存在下で反応させることにより製造することができる。なお、一般式(6)と一般式(7)で示される反応剤が同じ化合物であっても良い。
【0053】
【化21】

(ここで、置換基X5及びX6は臭素原子、ヨウ素原子、塩素原子を示す。置換基X3及びX4は、一般式(2)で示される置換基と同意義を示す。なお、一般式(6)の表記は、置換基X5及びX6がパラ位配向及び/又はメタ位配向であることを総称するものである。)
【0054】
【化22】

(ここで、M1はマグネシウム、ホウ素、亜鉛、錫、ケイ素のハロゲン化物;ハイドロオキサイド;アルコキサイド;アルキル化物を示し、置換基R1、R2、R5、R6、及びX1並びに記号mは、一般式(2)で示される置換基と同意義を示す。)
【0055】
【化23】

(ここで、M2はマグネシウム、ホウ素、亜鉛、錫、ケイ素のハロゲン化物;ハイドロオキサイド;アルコキサイド;アルキル化物を示し、置換基R3、R4、R7、R8、及びX2は、一般式(2)で示される置換基と同意義を示す。)
本発明の一般式(5)、(6)及び(7)について、さらに述べる。
【0056】
一般式(5)の置換基X5及びX6は、臭素原子、ヨウ素原子、塩素原子を示し、好ましくは臭素原子及びヨウ素原子であり、さらに好ましくは臭素原子である。
【0057】
具体的な一般式(5)で示される化合物としては、例えば1,4−ジブロモ−2,5−ジヨードベンゼン、1,2,4,5−テトラブロモベンゼンが挙げられる。
【0058】
一般式(6)、(7)の置換基M1、M2はマグネシウム、ホウ素、亜鉛、錫、ケイ素のハロゲン化物;ハイドロオキサイド;アルコキサイド;アルキル化物であり、上記のパラジウム及び/又はニッケル触媒により脱離され、パラジウム及び/又はニッケルと置換できる基である限り特に限定はなく、例えばMgCl、MgBr、B(OH)2、B(OMe)2、テトラメチルジオキサボロラニル基、ZnCl、ZnBr、ZnI、Sn(Bu−n)3、Si(Bu−n)3、Si(OMe)3等を挙げることができ、好ましくはZnCl、B(OH)2である。
【0059】
具体的な一般式(6)、一般式(7)で示される化合物としては、例えば6,7−ジ(ドデシル)−3−ブロモアントラセニル−2−ボロン酸、6,7−ジ(ドデシル)−3−ブロモアントラセニル−2−ジンククロライド、6,7−ジ(ペンタデシル)−3−ブロモアントラセニル−2−ジンククロライド、6,7−ジ(パーフルオロドデシル)−3−ブロモアントラセニル−2−ボロン酸、6,7−ジ(パーフルオロドデシル)−3−ブロモアントラセニル−2−ジンククロライド等が挙げられる。
【0060】
なお、一般式(6)、一般式(7)で示される3−ハロアリール金属試薬は、それらの原料となる下記一般式(8)で示されるアリールジハロゲン置換体をイソプロピルマグネシウムブロマイド等のグリニャール試薬あるいはn−ブチルリチウム等の有機リチウム試薬によりハロゲン/金属交換反応を行った後、塩化亜鉛、トリメトキシボラン、2−イソプロポキシ−4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン等と反応させることで好適に調製することができる。
【0061】
【化24】

(ここで、X7は臭素原子、ヨウ素原子を示し、置換基R1、R2、R5、R6、及びX1並びに記号mは、一般式(6)で示される置換基と同意義を示す。)
一般式(8)の置換基X7は臭素原子、ヨウ素原子である。また、置換基R1、R2、R5、R6、及びX1は、一般式(8)で示される置換基と同意義を示し、好ましい置換基R1、R2、R5、R6としては水素原子、ドデシル基、ペンタデシル基、オクタデシル基、パーフルオロドデシル基、パーフルオロペンタデシル基、パーフルオロオクタデシル基等であり、好ましいX1は臭素原子である。
【0062】
そして、具体的な一般式(8)で示されるアリールジハロゲン置換体としては、例えば2−ブロモ−3−ヨード−6,7−ジドデシルアントラセン、2−ブロモ−3−ヨード−6,7−ジペンタデシルアントラセン、2−ブロモ−3−ヨード−6−ドデシル−7−フルオロアントラセン、2−ブロモ−3−ヨード−6,7−ジ(パーフルオロドデシル)アントラセン等が挙げられ、その中でも2−ブロモ−3−ヨード−6,7−ジドデシルアントラセン、2−ブロモ−3−ヨード−6,7−ジペンタデシルアントラセン、2−ブロモ−3−ヨード−6,7−ジ(パーフルオロドデシル)アントラセンが好ましい。
【0063】
なお、グリニャール試薬によるハロゲン/金属交換反応は、例えば「ジャーナル オブ オルガニック ケミストリィー」、2000年、65巻、4618−4634頁」に記載されている方法、有機リチウム試薬によるハロゲン/金属交換反応は、例えば「ジャーナル オブ ケミカル リサーチ シノプシス」、1981年、185頁に記載されている方法を用いることもできる。
【0064】
一般式(5)で示されるテトラハロベンゼンと一般式(6)及び一般式(7)で示される3−ハロアリール金属試薬の反応に用いる触媒はパラジウム及び/又はニッケル触媒であれば特に限定はなく、例えばテトラキス(トリフェニルホスフィン)パラジウム、トリス(ジベンジリデンアセトン)ジパラジウム/トリフェニルホスフィン混合物、ジクロロビス(トリフェニルホスフィン)パラジウム、ビス(トリ−tert−ブチルホスフィン)パラジウム、ジアセタトビス(トリフェニルホスフィン)パラジウム、ジクロロ(1,2−ビス(ジフェニルホスフィノ)エタン)パラジウム、酢酸パラジウム/トリフェニルホスフィン混合物、酢酸パラジウム/トリ−tert−ブチルホスフィン混合物、酢酸パラジウム/2−(ジシクロヘキシルホスフィノ)−1,1’−ビフェニル混合物、ジクロロ(エチレンジアミン)パラジウム、ジクロロ(N,N,N’,N’−テトラメチルエチレンジアミン)パラジウム、ジクロロ(N,N,N’,N’−テトラメチルエチレンジアミン)パラジウム/トリフェニルホスフィン混合物等のパラジウム触媒;ジクロロビス(トリフェニルホスフィン)ニッケル、ジクロロ(1,2−ビス(ジフェニルホスフィノ)エタン)ニッケル、ジクロロ(エチレンジアミン)ニッケル、ジクロロ(N,N,N’,N’−テトラメチルエチレンジアミン)ニッケル、ジクロロ(N,N,N’,N’−テトラメチルプロパンジアミン)ニッケル、ジクロロ(N,N,N’,N’−テトラメチルエチレンジアミン)ニッケル/トリフェニルホスフィン混合物、ビス(1,5−シクロオクタジエン)ニッケル/トリフェニルホスフィン混合物等のニッケル触媒;を挙げることができる。中でも、好ましい触媒は0価のパラジウム化合物であり、特に好ましい触媒はテトラキス(トリフェニルホスフィン)パラジウムである。又、これら触媒は1種若しくは2種以上の混合物を用いても良い。
【0065】
一般式(5)で示されるテトラハロベンゼンと一般式(6)及び一般式(7)で示される3−ハロアリール金属試薬をパラジウム及び/又はニッケル触媒存在下で反応させる際には、好ましくは溶媒中で実施する。用いる溶媒に特に限定はなく、例えばTHF、ジエチルエーテル、メチル−tert−ブチルエーテル、エチル−tert−ブチルエーテル、ジオキサン、エチレングリコールジメチルエーテル、トルエン、キシレン、ヘキサン、シクロヘキサン、エタノール、水、N,N−ジメチルホルムアミド、N−メチルピロリドン、トリエチルアミン、ピペリジン、ピロリジン、ジイソプロピルアミン等を挙げることができ、又、これら溶剤は1種若しくは2種以上の混合物を用いても良く、例えばトルエン/水、トルエン/エタノール/水のような2乃至3成分系でも使用することができる。
【0066】
パラジウム触媒、ニッケル触媒の使用量は一般式(5)で示されるテトラハロベンゼン1モルに対し、0.1〜20モル%が好ましく、特に好ましくは1〜10モル%である。
【0067】
一般式(6)、一般式(7)で示される3−ハロアリール金属試薬の使用量は一般式(5)で示されるテトラハロベンゼン1当量に対し、0.8〜3.2当量が好ましく、特に好ましくは1.0〜2.8当量、さらに好ましくは1.1〜2.5当量である。
【0068】
一般式(6)、一般式(7)で示される3−ハロアリール金属試薬は同時に添加しても良いし、別々に添加することもできる。
【0069】
反応の際の温度は10〜120℃が好ましく、特に好ましくは30〜100℃、さらに好ましくは40〜90℃であり、反応時間は1〜100時間が好ましく、特に好ましくは5〜80時間である。
【0070】
なお、反応系中に塩基を存在させることもできる。この場合の塩基の種類としては特に限定はなく、例えば炭酸ナトリウム、炭酸水素ナトリウム、炭酸カリウム、炭酸セシウム、りん酸カリウム、りん酸ナトリウム、ナトリウムtert−ブトキサイド、カリウムtert−ブトキサイド、フッ化リチウム、フッ化ナトリウム、フッ化カリウム等の無機塩基;トリエチルアミン、トリメチルアミン、トリブチルアミン、エチレンジアミン、N,N,N’,N’−テトラメチルエチレンジアミン、ジイソプロピルアミン、ピリジン、テトラブチルアンモニウムフルオライド等の有機塩基を好適なものとして挙げることができる。これらの塩基の使用量は一般式(5)で示されるテトラハロベンゼン1当量に対し、0.5〜10.0当量が好ましく、特に好ましくは2.0〜8.0当量である。さらにこれらの塩基と併用し、相間移動触媒を用いることもできる。相間移動触媒の種類は特に限定はなく、例えばトリオクチルメチルアンモニウムクロライド、テトラブチルアンモニウムクロライド、ベンジルトリメチルアンモニウムクロライド、セチルピリジニウムクロライド等を好適なものとして挙げることができる。これらの相間移動触媒の使用量は一般式(5)で示されるテトラハロベンゼン1当量に対し、0.1〜1.5当量が好ましく、特に好ましくは0.2〜0.8である。
【0071】
さらに反応系中にトリフェニルホスフィン等のホスフィンを存在させることもできる。これらのホスフィンの使用量は、該パラジウム及び/又はニッケル触媒1当量に対し、0.9〜8.0当量が好ましく、特に好ましくは1.0〜3.0当量である。
【0072】
また、一般式(5)で示されるテトラハロベンゼンと一般式(6)及び(7)で示される3−ハロアリール金属試薬の反応により炭素−炭素結合が形成される位置は、テトラハロベンゼンのハロゲンの反応性により制御することができる。即ち、ヨウ素原子の反応性が最も高いことから、一般式(5)のハロゲンのX5及びX6がヨウ素原子で、X3及びX4が臭素あるいは塩素原子の場合、一般式(5)の炭素−X5及び炭素−X6に選択的に炭素−炭素結合が形成される。
【0073】
本発明の製造方法で製造される一般式(1)で示されるフェニレン誘導体は、有機ELディスプレイの発光材料(ドーパント)、ホスト材料、有機発光トランジスタの発光材料に利用することができる。
【発明の効果】
【0074】
本発明は、一般式(1)で示されるターフェニレン誘導体を製造する新規な方法を提供する。本発明の製造方法は原料であるテトラハロターフェニル誘導体をジアルキルエーテル中でリチオ化することで収率良くターフェニレン誘導体を製造することができる。さらに本発明の製造方法では、用いるリチオ化剤及び銅化合物の量を低減することが可能となり、より経済的なターフェニレン誘導体の製造方法を提供することができる。
【実施例】
【0075】
以下、実施例により本発明をさらに詳細に説明するが、本発明はこれら実施例に限定されるものではない。
【0076】
生成物の同定には1H NMRスペクトル及びマススペクトルを用いた。なお、1H NMRスペクトルは日本電子製JEOL GSX−270WB(270MHz)を用いた。マススペクトル(MS)は日本電子製JEOL JMS−700を用いて、試料を直接導入し、電子衝突(EI)法(70エレクトロンボルト)又はFAB法(6キロエレクトロンボルト、キセノンガス、マトリックス(2−ニトロフェニルオクチルエーテル)で測定した。
【0077】
反応の進行の確認等は薄層クロマトグラフィー、ガスクロマトグラフィー(GC)あるいはガスクロマトグラフィー−マススペクトル(GCMS)分析を用いた。
【0078】
ガスクロマトグラフィー分析
装置 島津GC14B
カラム J&Wサイエンティフィック社製、DB−1,30m
ガスクロマトグラフィー−マススペクトル分析
装置 パーキンエルマーオートシステムXL(MS部;ターボマスゴールド)
カラム J&Wサイエンティフィック社製、DB−1,30m
反応用の試薬及び溶媒は、断りのない限り市販品を用いた。なお、グリニャール試薬あるいはブチルリチウム等の有機金属試薬を用いた場合は、市販の脱水溶媒をそのまま用いた。
【0079】
合成例1 (4−ブロモ−5−ヨードフタル酸無水物の合成)
4−ブロモ−5−ヨードフタル酸無水物は「ジャーナル オブ オーガニック ケミストリー」(米国)、1951年、16巻、1577−1581頁を参考に、以下の様に合成した。
【0080】
4−ブロモフタルイミド(東京化成工業製)9.95g(44.0mmol)を窒素ガスで置換した50mlの二口ナスフラスコに入れた。次いでヨウ素5.87g(23.1mmol)及び10%発煙硫酸(ヨツハタ化学工業製)12mlを加え、90℃で23時間反応を行った。反応混合物を室温に冷やして氷に注ぎ入れた後、ガラスフィルターでろ過し、黄色固体12.8gを得た。得られた固体を濃硫酸35mlに溶解させ、130℃で5時間反応を行った。反応混合物を氷冷後、氷水を加えて析出した固体をろ過し、フタル酸誘導体の固体13.8gを得た。次に水酸化ナトリウム3.6gを水18mlに溶かした水溶液に得られた固体を室温で溶かした。この塩基性水溶液に酢酸を加えpHを3〜4に調製し、析出するフタル酸誘導体のモノナトリウム塩の白色沈殿をろ過した。得られた白色沈殿を水に懸濁させ、濃塩酸でpHを1以下にし、再びフタル酸誘導体として白色固体4.93gを得た。この固体をトルエン48mlに溶かし、無水酢酸8.7g(85.7mmol)を加え、105℃で4時間反応を行った。反応液を減圧濃縮して白色固体3.79gを得た。この固体から加熱トルエンに不溶な成分を除き、目的の4−ブロモ−5−ヨードフタル酸無水物5.12g(14.5mmol)を得た。(収率33%)。
1H NMR(CDCl3,22℃):δ=8.51(s,1H),8.23(s,1H)。
MS m/z: 353(M+,100%),309(M+−CO2,18%),282(M+−C2O3,10%),155(M+−C2O3−I,16%),74(M+−C2O3−I−Br,32%)。
【0081】
合成例2 (1,2―ジドデシルベンゼンの合成)
1,2−ジドデシルベンゼンは「日本化学会誌」1989年、6巻、983−987頁に従い以下の様に合成した。
【0082】
1,2−ジクロロベンゼン2.22g(15.1mmol)、ジクロロ〔1,3−ビス(ジフェニルホスフィノ)プロパン〕ニッケル(東京化成工業製)131mg(0.24mmol)、ジエチルエーテル11.5mlの混合液にドデシルマグネシウムブロミド(シグマ−アルドリッチ製、1.0mol/lジエチルエーテル溶液)45.0ml(45.0mmol)を窒素雰囲気中0℃で滴下した。35℃で20時間反応を行い、反応混合物を0℃に冷やして希塩酸を加え、ジエチルエーテルで抽出した。ジエチルエーテル溶液を水、飽和炭酸水素ナトリウム水溶液、水の順に洗浄し、塩化カルシウムで乾燥させた。得られた液体をシリカゲルカラムクロマトグラフィー(溶離液:ヘキサン)及び減圧蒸留で精製し、目的の1,2―ジドデシルベンゼン5.56g(13.4mmol)を得た(収率88%)。
1H NMR(CDCl3,22℃):δ=7.11(m,4H),2.59(t,J=7.8Hz,4H),1.55(m,4H),1.26(m,36H),0.88(t,J=6.8Hz,6H)。
MS m/z: 414(M+,100%),260(M+−C11H23,71%),106(M+−C22H46,98%)。
【0083】
合成例3 (2−ブロモ−3−ヨード−6,7−ジドデシルアントラキノンの合成)
2−ブロモ−3−ヨード−6,7−ジドデシルアントラキノンは「ベリヒテ」(独国)、1933年、66B巻、1876−1891頁を参考に以下の様に合成した。
【0084】
合成例1で得られた4−ブロモ−5−ヨードフタル酸無水物2.82g(8.00mmol)、合成例2で得られた1,2−ジドデシルベンゼン3.32g(8.00mmol)、テトラクロロエタン5.0mlの混合液に塩化アルミニウム2.41g(18.1mmol)を加え、室温で3時間反応を行った。水を加えてクエンチし、さらに水洗浄を行い、加熱真空乾燥後、白色固体を11.1g得た。得られた固体に濃硫酸44mlを添加し、80℃で1時間反応した。反応混合物を氷に注ぎ入れ、析出した固体をろ過して水で洗浄した。乾燥後、シリカゲルカラムクロマトグラフィー(溶離液:ヘキサン/塩化メチレン,10:1)で精製し、2−ブロモ−3−ヨード−6,7−ジドデシルアントラキノンの固体4.20g(5.60mmol)を得た(収率70%)。
1H NMR(CDCl3,22℃):δ=8.73(s,1H),8.45(s,1H),8.05(s,2H),2.75(m,4H),1.62(m,4H),1.26(m,36H),0.88(m,6H)。
MS m/z: 750(M+,100%),440(M+−C22H46,8%),313(M+−C22H46I,2%),233(M+−C22H46IBr,1%)。
【0085】
合成例4 (2−ブロモ−3−ヨード−6,7−ジドデシルアントラセンの合成)(一般式(8)の化合物の合成)
窒素雰囲気下、100mlシュレンク反応容器に合成例3で合成した2−ブロモ−3−ヨード−6,7−ジドデシルアントラキノン1.10g(1.47mmol)を入れた。次いでTHF17mlを加え、水素化ジイソブチルアルミニウム(関東化学製、0.99mol/l、トルエン溶液)3.7ml(3.7mmol)を加え、室温で1.5時間反応を行った。次いで反応混合物に6M塩酸水溶液10mlを加え、65℃で3時間反応を行った。反応混合物を室温まで冷やし、ジエチルエーテルで抽出した。ジエチルエーテル溶液を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧乾燥した。再びTHF17mlを加え、水素化ジイソブチルアルミニウム5.5ml(5.4mmol)を加え、室温で1.5時間反応を行った。次いで反応混合物に6M塩酸水溶液10mlを加え、3時間反応を行った。反応混合物を室温まで冷やし、ジエチルエーテルで抽出した。ジエチルエーテル溶液を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧乾燥した。シリカゲルカラムクロマトグラフィー(溶離液:ヘキサン)で精製し、2−ブロモ−3−ヨード−6,7−ジドデシルアントラセンの黄色固体629mg(0.87mmol)を得た。(収率59%)。
1H NMR(CDCl3,22℃):δ=8.55(s,1H),8.27(s,1H),8.16(s,1H),8.15(s,1H),7.72(s,2H),2.78(m,4H),1.71(m,4H),1.27(m,36H),0.88(m,6H)。
MS m/z: 720(M+,100%),410(M+−C22H46,16%),283(M+−C22H46−I,4%),203(M+−C22H46−I−Br,5%)。
【0086】
合成例5 (1,4−ジブロモ−2,5−ジヨードベンゼンの合成)(一般式(5)の化合物の合成)
1,4−ジブロモ−2,5−ジヨードベンゼンはジャーナル オブ アメリカン ケミカル ソサイエティー、1997年、119巻、4578−4593頁に記載されている方法を参考に合成を行った。
【0087】
メカニカルスターラー付き1lの三口フラスコに過ヨウ素酸16.7g(73.0mmol)及び硫酸525mlを加えた。過ヨウ素酸が溶解した後、ヨウ化カリウム36.4g(219mmol)を少しずつ添加した。その内容物の温度を−30℃に冷却し、1,4−ジブロモベンゼン34.5g(146mmol)を5分間かけて添加した。得られた混合物を−25℃で36時間撹拌した。反応混合物を氷(2kg)中へ注いだ後、濾過し固体を取り出した。その固体をクロロホルムに溶解させ、5%苛性ソーダ水溶液及び水で洗浄し、有機相を無水硫酸マグネシウムで乾燥した。減圧濃縮後、残渣をクロロホルムから再結晶化し、白色結晶を得た(36.0g、収率50%)。
1H NMR(CDCl3,21℃):δ=8.02(s,2H)。
【0088】
1H NMRスペクトルが文献値と一致したことより、1,4−ジブロモ−2,5−ジヨードベンゼンが得られたことを確認した。
【0089】
実施例1 (テトラドデシルジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
1) (テトラブロモ(テトラドデシル)ジアントラセニルベンゼンの合成(一般式(2)で示されるテトラハロターフェニル誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に合成例4で合成した2−ブロモ−3−ヨード−6,7−ジドデシルアントラセン625mg(0.868mmol)及びTHF11mlを添加した。この溶液を−50℃に冷却し、イソプロピルマグネシウムブロマイド(関東化学製、0.65M)のTHF溶液2.8ml(1.82mmol)を滴下し、攪拌した。5分間熟成後、−78℃に冷却し、トリメトキシボラン(和光純薬工業製)180.8mg(1.740mmol)を滴下した。徐々に室温まで昇温した後、3M塩酸水溶液を添加し、30分間攪拌した。トルエンを加え、分相し、有機相を減圧濃縮した(一般式(6)及び(7)の化合物の合成)。減圧乾燥後、そこへ合成例5で合成した1,4−ジブロモ−2,5−ジヨードベンゼン182mg(0.373mmol)、テトラキス(トリフェニルホスフィン)パラジウム(東京化成工業製)27.7mg(0.0240mmol)、トルエン6ml、及びエタノール1.6mlを添加した。さらに炭酸ナトリウム254mg(2.40mmol)と水2mlからなる水溶液を加え、60℃で70時間反応を実施した。容器を水冷し3M塩酸水溶液3mlを添加することで反応を停止させた。トルエンを添加後、分相し、有機相を食塩水で洗浄した。有機相を減圧濃縮し溶媒を留去し、さらに真空乾燥した。得られた残渣にトルエンを添加し、70%tert−ブチルハイドロパーオキサイド溶液(和光純薬工業製)(0.03ml)を添加し、室温で2時間撹拌した。この溶液を水洗浄し、有機相を減圧濃縮した。残渣をシリカゲルカラムクロマトグラフィーで精製し(溶媒;ヘキサン:クロロホルム=2:1)、さらにヘプタンから再結晶化することでテトラブロモ(テトラドデシル)ジアントラセニルベンゼンの薄黄色固体339mgを得た(収率64%)。
1H NMR(CDCl3,22℃):δ=8.34(s,2H),8.32(s,2H),8.28(s,2H),7.97(s,1H),7.92(s,1H),7.79(s,2H),7.78(s,2H),7.73(s,1H),7.72(s,1H),2.81(m,8H),1.71(m,8H),1.28(m,72H),0.88(m,12H)。
【0090】
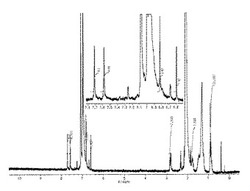
1H NMRスペクトルを図1に示した。
FABMS m/z: 1419(M+,100%),1340(M+−Br,10)。
【0091】
1H NMR及びMS測定より、テトラブロモ(テトラドデシル)ジアントラセニルベンゼンが得られたことを確認した。なお、その構造式を下記に示す。
【0092】
【化25】

2) (テトラドデシルジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に、実施例1の1)で合成したテトラブロモ(テトラドデシル)ジアントラセニルベンゼン304mg(0.214mmol)及びジエチルエーテル10mlを添加した。この懸濁溶液を0℃に冷却し、リチオ化剤としてn−ブチルリチウム(関東化学製1.59M)のヘキサン溶液0.67ml(1.1mmol)を滴下しリチオ化を行い、さらに30分間撹拌することでリチオ化の熟成を行った。一方、別の100mlシュレンク反応容器に塩化銅(II)(和光純薬工業製)201mg(1.49mmol)及びTHF20mlを添加し、−78℃に冷却した。ここへ先のリチオ化物のジエチルエーテル溶液をテフロン(登録商標)キャヌラーを用いて移液した。徐々に昇温し、一晩かけて室温まで反応温度を上げた。1.5M塩酸水溶液及びトルエンを添加した後、分相し、さらに有機相を飽和食塩水で洗浄し、懸濁状態の有機相を濾過し、得られた固体をヘキサンで洗浄した。得られた残渣をトルエンから2回再結晶精製し、テトラドデシルジナフトターフェニレン96.5mgの橙色固体を得た(収率41%)。
1H NMR(重トルエン,60℃):δ=7.71(s,4H),7.58(s,4H),6.82(s,4H),6.59(s,2H),2.81(m,8H),1.77(m,8H),1.31(m,72H),0.88(m,12H)。
【0093】
1H NMRスペクトルを図2に示した。
【0094】
1H NMR測定より、テトラドデシルジナフトターフェニレンが得られたことを確認した。なお、その構造式を下記に示す。
【0095】
【化26】

比較例1 (テトラドデシルジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に、実施例1で合成したテトラブロモ(テトラドデシル)ジアントラセニルベンゼン274mg(0.193mmol)及びTHF10mlを添加した。この懸濁溶液を−78℃に冷却し、リチオ化剤としsec−ブチルリチウム(関東化学製1.0M)のシクロヘキサン/ヘキサン溶液1.5ml(1.5mmol)を滴下しリチオ化を行い、さらに30分間撹拌することでリチオ化の熟成を行った。一方、別の100mlシュレンク反応容器に塩化銅(II)(和光純薬工業製)233mg(1.73mmol)及びTHF20mlを添加し、−78℃に冷却した。ここへ先のリチオ化物のTHF溶液をテフロン(登録商標)キャヌラーを用いて移液した。徐々に昇温し、一晩かけて室温まで反応温度を上げた。1.5M塩酸水溶液及びトルエンを添加した後、分相し、さらに有機相を飽和食塩水で洗浄し、懸濁状態の有機相を濾過し、得られた固体をヘキサンで洗浄した。得られた残渣をトルエンから2回再結晶精製し、テトラドデシルジナフトターフェニレン17.0mgの橙色固体を得た(収率8%)。
【0096】
1H NMR測定より実施例2で得られた目的物と一致したが、ジアルキルエーテル中ではなくTHF中でリチオ化を行ったため低収率であった。
【0097】
実施例2 (テトラドデシルジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
1) (テトラブロモ(テトラドデシル)ジアントラセニルベンゼンの合成(一般式(2)で示されるテトラハロターフェニル誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に合成例4で合成した2−ブロモ−3−ヨード−6,7−ジドデシルアントラセン548mg(0.761mmol)及びTHF10mlを添加した。この溶液を−50℃に冷却し、イソプロピルマグネシウムブロマイド(関東化学製、0.65M)のTHF溶液2.4ml(1.56mmol)を滴下し、攪拌した。5分間熟成後、−78℃に冷却し、トリメトキシボラン(和光純薬工業製)162.1mg(1.560mmol)を滴下した。徐々に室温まで昇温した後、3M塩酸水溶液を添加し、30分間攪拌した。トルエンを加え、分相し、有機相を減圧濃縮した(一般式(6)及び(7)の化合物の合成)。減圧乾燥後、そこへ1,2,4,5−テトラブロモベンゼン(東京化成工業製)136mg(0.345mmol)、テトラキス(トリフェニルホスフィン)パラジウム(東京化成工業製)20.0mg(0.0173mmol)、トルエン5ml、及びエタノール1.4mlを添加した。さらに炭酸ナトリウム219mg(2.07mmol)と水1.7mlからなる水溶液を加え、60℃で40時間反応を実施した。容器を水冷し3M塩酸水溶液3mlを添加することで反応を停止させた。トルエンを添加後、分相し、有機相を食塩水で洗浄した。有機相を減圧濃縮し溶媒を留去し、さらに真空乾燥した。得られた残渣にトルエンを添加し、70%tert−ブチルハイドロパーオキサイド溶液(和光純薬工業製)(0.03ml)を添加し、室温で2時間撹拌した。この溶液を水洗浄し、有機相を減圧濃縮した。残渣をシリカゲルカラムクロマトグラフィーで精製し(溶媒;ヘキサン:クロロホルム=2:1)、さらにヘプタンから再結晶化することでテトラブロモ(テトラドデシル)ジアントラセニルベンゼンの薄黄色固体348mgを得た(収率71%)。
FABMS m/z: 1419(M+,100%),1340(M+−Br,8)。
【0098】
MS測定より、テトラブロモ(テトラドデシル)ジアントラセニルベンゼンが得られたことを確認した。なお、その構造式を下記に示す。
【0099】
【化27】

2)テトラドデシルジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に、実施例2の1)で合成したテトラブロモ(テトラドデシル)ジアントラセニルベンゼン344mg(0.242mmol)及びジエチルエーテル11mlを添加した。この懸濁溶液を0℃に冷却し、リチオ化剤としてn−ブチルリチウム(関東化学製1.59M)のヘキサン溶液0.76ml(1.2mmol)を滴下しリチオ化を行い、さらに30分間撹拌することでリチオ化の熟成を行った。一方、別の100mlシュレンク反応容器に塩化銅(II)(和光純薬工業製)227mg(1.69mmol)及びTHF22mlを添加し、−78℃に冷却した。ここへ先のリチオ化物のジエチルエーテル溶液をテフロン(登録商標)キャヌラーを用いて移液した。徐々に昇温し、一晩かけて室温まで反応温度を上げた。1.5M塩酸水溶液及びトルエンを添加した後、分相し、さらに有機相を飽和食塩水で洗浄し、懸濁状態の有機相を濾過し、得られた固体をヘキサンで洗浄した。得られた残渣をトルエンから2回再結晶精製し、テトラドデシルジナフトターフェニレン101.1mgの橙色固体を得た(収率38%)。
【0100】
1H NMR測定より、実施例2で得られたスペクトルと同一のスペクトルが得られたことからテトラドデシルジナフトターフェニレンが生成していることを確認した。
【0101】
合成例6 (2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ジフェニルアントラセンの合成)(一般式(8)の化合物の合成)
窒素雰囲気下、100mlシュレンク反応容器に合成例3で合成した2−ブロモ−3−ヨード−6,7−ジドデシルアントラキノン541mg(0.722mmol)及びTHF20mlを添加した。−78℃に冷却後、フェニルリチウム(関東化学製、1.0mol/l、シクロヘキサン/ジエチルエーテル溶液)1.5ml(1.5mmolを加えた後、一晩かけて室温まで昇温した。次いで反応混合物に3M塩酸水溶液及びジエチルエーテルを加えた後、分相し、さらにジエチルエーテルで抽出した。ジエチルエーテル溶液を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧濃縮した。得られた残渣に酢酸30ml、ヨウ化ナトリウム749mg(5.0mmol)、及び次亜りん酸ナトリウム・1水和物727mg(6.86mmol)を加え、1時間加熱還流下で反応を行った。反応混合物を室温まで冷やし、トルエンで抽出した。トルエン溶液を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧濃縮した。シリカゲルカラムクロマトグラフィー(溶離液;ヘキサン:トルエン=30:1の混合液)で精製し、2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ジフェニルアントラセンの黄色固体453mgを得た(収率72%)。
【0102】
実施例3 (テトラドデシルテトラフェニルジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
1) (テトラブロモ(テトラドデシル)(テトラフェニル)ジアントラセニルベンゼンの合成)(一般式(2)で示されるテトラハロターフェニル誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に合成例6で合成した2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ジフェニルアントラセン450mg(0.516mmol)及びTHF10mlを添加した。この混合物を−70℃に冷却し、イソプロピルマグネシウムブロマイド(東京化成工業製、0.81M)のTHF溶液1.27ml(1.03mmol)を滴下した。−50℃まで昇温した後、−78℃に冷却し、トリメトキシボラン(和光純薬工業製)109.1mg(1.05mmol)を滴下した。徐々に室温まで昇温した後、3M塩酸水溶液を加えて30分間攪拌後、トルエンを添加し分相した。有機相を減圧濃縮した(一般式(6)及び(7)の化合物の合成)。得られた固形物に、合成例5で合成した1,4−ジブロモ−2,5−ジヨードベンゼン114mg(0.234mmol)、テトラキス(トリフェニルホスフィン)パラジウム(東京化成工業製)13.8mg(0.012mmol)、トルエン5ml、及びエタノール1.2mlを添加した。さらに炭酸ナトリウム148.8mg(1.404mmol)と水1.6mlからなる水溶液を加え、60℃で68時間反応を実施した。室温まで冷却後、トルエン及び水を添加し分相した。有機相を濃縮し、得られた残渣をトルエン5mlに溶解後、70%tert−ブチルハイドロパーオキサイド溶液(和光純薬工業製)0.02mlを添加し、室温で2時間撹拌した。このトルエン溶液を水で2回洗浄後、有機相を減圧濃縮し、得られた残渣に飽和食塩水及びトルエンを添加した。分相し、有機相を水で洗浄し、無水硫酸ナトリウムで乾燥した。有機相を濾過し、減圧濃縮し、得られた残渣をシリカゲルを充填したカラムで濾過した(溶媒:ヘキサン)。得られた粗固体をヘプタンから再結晶化し、目的物の黄色固体250mgを得た(収率62%)。
FABMS m/z: 1723(M+,100%),1643(M+−Br,10)。
【0103】
MS測定より、テトラブロモ(テトラドデシル)(テトラフェニル)ジアントラセニルベンゼンが得られたことを確認した。なお。その構造式を下記に示す。
【0104】
【化28】

2) (テトラドデシルテトラフェニルジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に実施例3の1)で合成したテトラブロモ(テトラドデシル)(テトラフェニル)ジアントラセニルベンゼン238mg(0.138mmol)及びジエチルエーテル7mlを添加した。この混合物を0℃に冷却後、リチオ化剤であるn−ブチルリチウム(関東化学製、1.59M)のヘキサン溶液0.44ml(0.70mmol)を滴下しリチオ化を行い、さらに30分間撹拌することでリチオ化の熟成を行った。別の100mlシュレンク反応容器に、塩化銅(II)(和光純薬工業製)129.9mg(0.966mmol)及びTHF15mlを添加し、−78℃に冷却した。ここへ先のリチオ化物のジエチルエーテル溶液をテフロン(登録商標)キャヌラーを用いて移液した。15時間かけて室温までゆっくり昇温し、3M塩酸水溶液を添加した。分相し、有機相をさらに飽和食塩水で洗浄した。懸濁している有機相を濾過し、固体を濾別した。この固体を水及びヘキサンで洗浄し、得られた固体をトルエンから再結晶化し、目的物の橙色固体79.4mgを得た(収率41%)。
【0105】
目的物のテトラドデシルテトラフェニルジナフトターフェニレンの構造式を下記に示す。
【0106】
【化29】

合成例7 (2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ビス(フェニルエチニル)アントラセンの合成)(一般式(8)の化合物の合成)
窒素雰囲気下、100mlシュレンク反応容器にフェニルアセチレン(東京化成工業製)178mg(1.74mmol)及びTHF20mlを添加した。n−ブチルリチウム(関東化学製、1.59M)のヘキサン溶液1.05ml(1.67mmol)を滴下し、20分間撹拌した。合成例3で合成した2−ブロモ−3−ヨード−6,7−ジドデシルアントラキノン523mg(0.697mmol)を加えた後、混合物を室温で一晩反応させた。次いで反応混合物に3M塩酸水溶液及びジエチルエーテルを加えた後、分相し、さらにジエチルエーテルで抽出した。ジエチルエーテル溶液を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧濃縮した。得られた残渣に酢酸30ml、ヨウ化ナトリウム749mg(5.0mmol)、及び次亜りん酸ナトリウム・1水和物727mg(6.86mmol)を加え、1時間加熱還流下で反応を行った。反応混合物を室温まで冷やし、トルエンで抽出した。トルエン溶液を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧濃縮した。シリカゲルカラムクロマトグラフィー(溶離液;ヘキサン:トルエン=30:1の混合液)で精製し、2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ビス(フェニルエチニル)アントラセンの黄色固体393mgを得た(収率61%)。
【0107】
実施例4 (テトラドデシルテトラキス(フェニルエチニル)ジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
1) (テトラブロモ(テトラドデシル)テトラキス(フェニルエチニル)ジアントラセニルベンゼンの合成)(一般式(2)で示されるテトラハロターフェニル誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に合成例7で合成した2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ビス(フェニルエチニル)アントラセン390mg(0.423mmol)及びTHF8mlを添加した。この混合物を−70℃に冷却し、イソプロピルマグネシウムブロマイド(東京化成工業製、0.81M)のTHF溶液1.04ml(0.84mmol)を滴下した。−50℃まで昇温した後、−78℃に冷却し、トリメトキシボラン(和光純薬工業製)87.8mg(0.845mmol)を滴下した。徐々に室温まで昇温した後、3M塩酸水溶液を加えて室温で30分間攪拌後、トルエンを添加し分相した。有機相を減圧濃縮した(一般式(6)及び(7)の化合物の合成)。得られた固形物に、合成例5で合成した1,4−ジブロモ−2,5−ジヨードベンゼン93.8mg(0.192mmol)、テトラキス(トリフェニルホスフィン)パラジウム(東京化成工業製)11.1mg(0.0096mmol)、トルエン5ml、及びエタノール1.2mlを添加した。さらに炭酸ナトリウム122.1mg(1.15mmol)と水1.6mlからなる水溶液を加え、60℃で74時間反応を実施した。室温まで冷却後、トルエン及び水を添加し分相した。有機相を濃縮し、得られた残渣をトルエン5mlに溶解後、70%tert−ブチルハイドロパーオキサイド溶液(和光純薬工業製)0.02mlを添加し、室温で2時間撹拌した。このトルエン溶液を水で2回洗浄後、有機相を減圧濃縮し、得られた残渣に飽和食塩水及びトルエンを添加した。分相し、有機相を水で洗浄し、無水硫酸ナトリウムで乾燥した。有機相を濾過し、減圧濃縮し、得られた残渣をシリカゲルを充填したカラムで濾過した(溶媒:ヘキサン)。得られた粗固体をヘプタンから再結晶化し、目的物の黄色固体227mgを得た(収率65%)。
FABMS m/z: 1819(M+,100%),1739(M+−Br,10)。
【0108】
MS測定より、テトラブロモ(テトラドデシル)テトラキス(フェニルエチニル)ジアントラセニルベンゼンが得られたことを確認した。なお。その構造式を下記に示す。
【0109】
【化30】

2) (テトラドデシルテトラキス(フェニルエチニル)ジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に実施例4の1)で合成したテトラブロモ(テトラドデシル)テトラキス(フェニルエチニル)ジアントラセニルベンゼン221mg(0.121mmol)及びジエチルエーテル7mlを添加した。この混合物を0℃に冷却後、n−ブチルリチウム(関東化学製、1.59M)のヘキサン溶液0.38ml(0.60mmol)を滴下し、さらに30分間撹拌することでリチオ化の熟成を行った。別の100mlシュレンク反応容器に、塩化銅(II)(和光純薬工業製)113.9mg(0.847mmol)及びTHF15mlを添加し、−78℃に冷却した。ここへ先のリチオ化物のジエチルエーテル溶液をテフロン(登録商標)キャヌラーを用いて移液した。15時間かけて室温までゆっくり昇温し、3M塩酸水溶液を添加した。分相し、有機相をさらに飽和食塩水で洗浄した。懸濁している有機相を濾過し、固体を濾別した。この固体を水及びヘキサンで洗浄し、得られた固体をトルエンから再結晶化し、目的物の橙色固体78.1mgを得た(収率43%)。
【0110】
目的物のテトラドデシルテトラキス(フェニルエチニル)ジナフトターフェニレンの構造式を下記に示す。
【0111】
【化31】

合成例8 (2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ビス(フェニルエテニル)アントラセンの合成)(一般式(8)の化合物の合成)
窒素雰囲気下、100mlシュレンク反応容器にマグネシウム54.7mg(2.25mmol)及びTHF20mlを添加した。ヨウ素5mgを加えた後、β−ブロモスチレン(東京化成工業製)40mgを添加し、撹拌下マグネシウムを活性化させた。β−ブロモスチレン359mg(1.96mmol、計2.17mmol)を緩く還流が起こる程度に滴下した。滴下終了後、30分間撹拌を継続した。合成例3で合成した2−ブロモ−3−ヨード−6,7−ジドデシルアントラキノン678mg(0.904mmol)を加えた後、混合物を室温で一晩反応させた。次いで反応混合物に3M塩酸水溶液及びジエチルエーテルを加えた後、分相し、さらにジエチルエーテルで抽出した。ジエチルエーテル溶液を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧濃縮した。得られた残渣に酢酸30ml、ヨウ化ナトリウム749mg(5.0mmol)、及び次亜りん酸ナトリウム・1水和物727mg(6.86mmol)を加え、1時間加熱還流下で反応を行った。反応混合物を室温まで冷やし、トルエンで抽出した。トルエン溶液を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧濃縮した。シリカゲルカラムクロマトグラフィー(溶離液;ヘキサン:トルエン=30:1の混合液)で精製し、2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ビス(フェニルエテニル)アントラセンの黄色固体468mgを得た(収率56%)。
【0112】
実施例5 (テトラドデシルテトラキス(フェニルエテニル)ジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
1) (テトラブロモ(テトラドデシル)テトラキス(フェニルエテニル)ジアントラセニルベンゼンの合成)(一般式(2)で示されるテトラハロターフェニル誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に合成例8で合成した2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ビス(フェニルエテニル)アントラセン451mg(0.488mmol)及びTHF10mlを添加した。この混合物を−70℃に冷却し、イソプロピルマグネシウムブロマイド(東京化成工業製、0.81M)のTHF溶液1.21ml(0.98mmol)を滴下した。−50℃まで昇温した後、−78℃に冷却し、トリメトキシボラン(和光純薬工業製)101.8mg(0.980mmol)を滴下した。徐々に室温まで昇温した後、3M塩酸水溶液を加えて室温で30分間攪拌後、トルエンを添加し分相した。有機相を減圧濃縮した(一般式(6)及び(7)の化合物の合成)。得られた固形物に、合成例5で合成した1,4−ジブロモ−2,5−ジヨードベンゼン108.3mg(0.222mmol)、テトラキス(トリフェニルホスフィン)パラジウム(東京化成工業製)12.8mg(0.011mmol)、トルエン6ml、及びエタノール1.4mlを添加した。さらに炭酸ナトリウム141.2mg(1.332mmol)と水1.9mlからなる水溶液を加え、60℃で70時間反応を実施した。室温まで冷却後、トルエン及び水を添加し分相した。有機相を濃縮し、得られた残渣をトルエン5mlに溶解後、70%tert−ブチルハイドロパーオキサイド溶液(和光純薬工業製)0.02mlを添加し、室温で2時間撹拌した。このトルエン溶液を水で2回洗浄後、有機相を減圧濃縮し、得られた残渣に飽和食塩水及びトルエンを添加した。分相し、有機相を水で洗浄し、無水硫酸ナトリウムで乾燥した。有機相を濾過し、減圧濃縮し、得られた残渣をシリカゲルを充填したカラムで濾過した(溶媒:ヘキサン)。得られた粗固体をヘプタンから再結晶化し、目的物の黄色固体223mgを得た(収率55%)。
FABMS m/z: 1827(M+,100%),1747(M+−Br,8)。
【0113】
MS測定より、テトラブロモ(テトラドデシル)テトラキス(フェニルエテニル)ジアントラセニルベンゼンが得られたことを確認した。なお。その構造式を下記に示す。
【0114】
【化32】

2) (テトラドデシルテトラキス(フェニルエテニル)ジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に実施例5の1)で合成したテトラブロモ(テトラドデシル)テトラキス(フェニルエテニル)ジアントラセニルベンゼン219mg(0.120mmol)及びジエチルエーテル7mlを添加した。この混合物を0℃に冷却後、n−ブチルリチウム(関東化学製、1.59M)のヘキサン溶液0.38ml(0.60mmol)を滴下し、さらに30分間撹拌することでリチオ化の熟成を行った。別の100mlシュレンク反応容器に、塩化銅(II)(和光純薬工業製)112.9mg(0.840mmol)及びTHF15mlを添加し、−78℃に冷却した。ここへ先のジリチオ化物のジエチルエーテル溶液をテフロン(登録商標)キャヌラーを用いて移液した。15時間かけて室温までゆっくり昇温し、3M塩酸水溶液を添加した。分相し、有機相をさらに飽和食塩水で洗浄した。懸濁している有機相を濾過し、固体を濾別した。この固体を水及びヘキサンで洗浄し、得られた固体をトルエンから再結晶化し、目的物の橙色固体72.4mgを得た(収率40%)。
【0115】
目的物のテトラドデシルテトラキス(フェニルエテニル)ジナフトターフェニレンの構造式を下記に示す。
【0116】
【化33】

【図面の簡単な説明】
【0117】
【図1】実施例1の1)で合成したテトラブロモ(テトラドデシル)ジアントラセニルベンゼンの1H NMRスペクトル
【図2】実施例1の2)で合成したテトラドデシルジナフトターフェニレンの1H NMRスペクトル
【技術分野】
【0001】
本発明は、有機半導体材料等の電子材料への展開が可能なターフェニレン誘導体の製造方法に関する。
【背景技術】
【0002】
有機薄膜トランジスタに代表される有機半導体デバイスは、省エネルギー、低コスト及びフレキシブルといった無機半導体デバイスにはない特徴を有することから近年注目されるようになった。この有機半導体デバイスは有機半導体活性相、基板、絶縁相、電極等数種類の材料から構成されるが、中でも電荷のキャリアー移動を担う有機半導体活性相は該デバイスの中心的な役割を有している。この有機半導体活性相を構成する有機材料のキャリアー移動能により有機半導体デバイス性能が左右される。
【0003】
有機半導体活性相を作製する方法としては一般的に、高温真空下、有機材料を気化させて実施する真空蒸着法及び有機材料を適当な溶媒に溶解させその溶液を塗布する塗布法が知られている。塗布法においては、塗布は高温高真空条件を用いることなく印刷技術を用いても実施することができる。そのため、塗布法は印刷によりデバイス作製の大幅な製造コストの削減を図ることができることから、経済的に好ましいプロセスである。しかし、従来、有機半導体デバイスとして性能が高い材料ほど塗布法で有機半導体活性相を形成することが困難になるという問題があった。
【0004】
例えば、ペンタセン等の結晶性材料はアモルファスシリコン並みの高いキャリアー移動度を有し、優れた有機半導体デバイス特性を発現することが報告されている(例えば、非特許文献1参照)。又、ペンタセン等のポリアセンを溶解させ塗布法で有機半導体デバイスを製造する試みも報告されている(例えば、特許文献1参照)。しかしながら、ペンタセンはその強い凝集性のため溶解性が低く、塗布法を適用するためには高温加熱等の条件が必要とされ、さらにペンタセンの溶液は極めて容易に空気酸化されることから、塗布法の適用はプロセス的、経済的に困難を伴うものであった。また、ポリ−(3−ヘキシルチオフェン)等の自己組織化材料は溶媒に可溶であり、塗布法による有機半導体デバイス作製が報告されてはいるが、キャリアー移動度が結晶性低分子化合物より1桁低いことから(例えば、非特許文献2参照)、得られた有機半導体デバイスの特性が低いという問題があった。
【0005】
このような中で、ターフェニレン誘導体は剛直な共役縮環化合物であり、有機半導体材料として期待できる化合物である。しかし、これまでに報告されているターフェニレン誘導体の製造方法は収率が低く、且つ多量のブチルリチウムを用いることから効率の良い方法ではなかった(例えば、特許文献2参照)。
【0006】
【非特許文献1】「ジャーナル オブ アプライドフィジックス」(米国)、2002年、92巻、5259−5263頁
【非特許文献2】「サイエンス」(米国)、1998年、280巻、1741−1744頁
【特許文献1】WO2003/016599号
【特許文献2】WO2006/109569号
【発明の開示】
【発明が解決しようとする課題】
【0007】
そこで、本発明は上記の従来技術が有する問題点に鑑み、原料であるテトラハロターフェニル誘導体をジアルキルエーテル中でリチオ化することで収率良くターフェニレン誘導体を製造することを目的とする。
【課題を解決するための手段】
【0008】
本発明者らは上記課題を解決するため鋭意検討の結果、テトラハロターフェニル誘導体を原料に用いる本発明のターフェニレン誘導体の新規な製造方法を見出した
以下に本発明を詳細に説明する。
【0009】
(ターフェニレン誘導体の製造方法)
本発明の一般式(1)で示されるターフェニレン誘導体は、一般式(2)で示されるテトラハロターフェニル誘導体をリチオ化剤を用いてリチオ化し、銅化合物と反応させることにより製造することができる。
【0010】
【化1】

(ここで、置換基R1〜R8は同一又は異なって、水素原子、フッ素原子、炭素数1〜30のアルキル基、炭素数4〜30のアリール基、炭素数2〜30のアルキニル基、又は炭素数2〜30のアルケニル基を示し、mは0又は1である。)
【0011】
【化2】

(ここで、置換基X1〜X4は臭素原子、ヨウ素原子、塩素原子を示す。置換基R1〜R8並びに記号mは請求項1に記載の一般式(1)で示される置換基及び記号と同意義を示す。)
なお、ここでリチオ化とは、一般式(2)におけるX1〜X4をそれぞれリチウムに置換することを意味する。
【0012】
一般式(1)で示されるターフェニレン誘導体の置換基について述べる。
【0013】
置換基R1〜R8における炭素数1〜30のアルキル基は、特に限定はなく、例えばメチル基、プロピル基、ブチル基、イソブチル基、tert−ブチル基、ネオペンチル基、ヘキシル基、ヘプチル基、オクチル基、ノニル基、デシル基、ドデシル基、ペンタデシル基、オクタデシル基、2−エチルヘキシル基、シクロヘキシル基、シクロオクチル基等のアルキル基;トリフルオロメチル基、トリフルオロエチル基、パーフルオロヘキシル基、パーフルオロヘプチル基、パーフルオロオクチル基、パーフルオロノニル基、パーフルオロデシル基、パーフルオロドデシル基、パーフルオロペンタデシル基、パーフルオロオクタデシル基、パーフルオロシクロヘキシル基、パーフルオロシクロオクチル基等のパーフルオロアルキル基;ペンタデカフルオロオクチル基、オクタデカフルオロデシル基、2−エチルパーフルオロヘキシル基等の一部の水素がフッ素に置換されたハロゲン化アルキル基を挙げることができ、好ましくはドデシル基、ペンタデシル基、オクタデシル基、パーフルオロドデシル基、パーフルオロオクタデシル基であり、特に好ましくはドデシル基、ペンタデシル基、パーフルオロドデシル基である。
【0014】
置換基R1〜R8における炭素数4〜30のアリール基は、特に限定はなく、例えばフェニル基、p−トリル基、p−(オクチル)フェニル基、p−(ドデシル)フェニル基、p−(シクロヘキシル)フェニル基、m−(オクチル)フェニル基、m−(ドデシル)フェニル基、p−フルオロフェニル基、ペンタフルオロフェニル基、p−(トリフルオロメチル)フェニル基、p−(パーフルオロオクチル)フェニル基、p−(パーフルオロドデシル)フェニル基、m−(パーフルオロドデシル)フェニル基、2−チエニル基、5−(ドデシル)−2−チエニル基、2,2’−ビチエニル−5−基、ビフェニル基、パーフルオロビフェニル基、1−ナフチル基、2−ナフチル基、1−パーフルオロナフチル基、2−フルオレニル基、9,9−ジメチル−2−フルオレニル基、9−アントラセニル基等を挙げることができ、好ましくはフェニル基、p−(オクチル)フェニル基、p−(パーフルオロオクチル)フェニル基、5−(ドデシル)−2−チエニル基等であり、特に好ましくはフェニル基である。
【0015】
置換基R1〜R8における炭素数2〜30のアルキニル基は、特に限定はなく、例えばエチニル基、メチルエチニル基、イソプロピルエチニル基、tert−ブチルエチニル基、(オクチル)エチニル基、(ドデシル)エチニル基、(トリフルオロメチル)エチニル基、(パーフルオロオクチル)エチニル基、(パーフルオロドデシル)エチニル基、フェニルエチニル基、{p−(オクチル)フェニル}エチニル基、{p−(ドデシル)フェニル}エチニル基、{m−(ドデシル)フェニル}エチニル基、1−ナフチルエチニル基、2−ナフチルエチニル基、9−アントラセニルエチニル基、ベンジルエチニル基、パーフルオロフェニルエチニル基、{p−(トリフルオロメチル)フェニル}エチニル基、{p−(パーフルオロオクチル)フェニル}エチニル基、{p−(パーフルオロドデシル)フェニル}エチニル基、{m−(パーフルオロドデシル)フェニル}エチニル基、5−(ヘキシル)チエニル−2−}エチニル基、{5−(パーフルオロヘキシル)チエニル−2−}エチニル基等を挙げることができ、好ましくは(オクチル)エチニル基、(ドデシル)エチニル基、(パーフルオロオクチル)エチニル基、(パーフルオロドデシル)エチニル基、フェニルエチニル基等である。
【0016】
置換基R1〜R8における炭素数2〜30のアルケニル基は、特に限定はなく、例えばエテニル基、メチルエテニル基、イソプロピルエテニル基、tert−ブチルエテニル基、(オクチル)エテニル基、(ドデシル)エテニル基、(トリフルオロメチル)エテニル基、フェニルエテニル基、{p−(ヘキシル)フェニル}エテニル基、{p−(オクチル)フェニル}エテニル基、{p−(ドデシル)フェニル}エテニル基、{m−(ドデシル)フェニル}エテニル基、2−フェニル−1,2−ジフルオロエテニル基、2−フェニル−1,2−ジメチルエテニル基、ジフェニルエテニル基、トリフェニルエテニル基、1−ナフチルエテニル基、2−ナフチルエテニル基、9−アントラセニルエテニル基、ベンジルエテニル基、フェニル(メチル)エテニル基、(パーフルオロフェニル)エテニル基、{p−(トリフルオロメチル)フェニル}エテニル基、(パーフルオロオクチル)エテニル基、(パーフルオロドデシル)エテニル基、{5−(ヘキシル)チエニル−2−}エテニル基、{5−(パーフルオロヘキシル)チエニル−2−}エテニル基等を挙げることができ、好ましくは(オクチル)エテニル基、(ドデシル)エテニル基、(パーフルオロオクチル)エテニル基、(パーフルオロドデシル)エテニル基等である。なお、該炭素数2〜30のアルケニル基はトランス体及びシス体の何れであってもよく、またそれらの任意の割合の混合物であってもよい。
【0017】
mは0又は1であり、好ましくは1である。
【0018】
本発明の一般式(1)で示されるターフェニレン誘導体の置換基R1〜R8の置換様式として、R1〜R4が、同一又は異なって、水素原子、フッ素原子、及び炭素数1〜30のアルキル基、且つR5〜R8が、同一又は異なって、水素原子、炭素数4〜30のアリール基、炭素数2〜30のアルキニル基、及び炭素数2〜30のアルケニル基からなる群から選ばれる少なくとも一種以上の基であることが好ましい。
【0019】
これらの中でも本発明の一般式(1)で示されるターフェニレン誘導体は、以下の化合物が好ましく、
【0020】
【化3】

【0021】
【化4】

【0022】
【化5】

【0023】
【化6】

【0024】
【化7】

【0025】
【化8】

【0026】
【化9】

特に好ましくは
【0027】
【化10】

である。
【0028】
次に、一般式(1)で示されるターフェニレン誘導体の原料である一般式(2)で示されるテトラハロターフェニル誘導体について述べる。
【0029】
なお、一般式(2)の表記は、一般式(2)が下記一般式(3)及び一般式(4)で示されるパラ位置異性体及びメタ位置異性体を総称するものである。
【0030】
【化11】

【0031】
【化12】

(ここで、一般式(3)及び一般式(4)の置換基X1〜X4及びR1〜R8、並びに記号mは一般式(2)で示される置換基並びに記号と同意義を示す。)
置換基X1〜X4は臭素原子、ヨウ素原子、塩素原子を示し、好ましくは臭素原子、ヨウ素原子であり、特に好ましくはいずれも臭素原子である。
【0032】
置換基R1〜R8は、一般式(1)で示される置換基と同意義を示し、その置換様式として、R1〜R4が、同一又は異なって、水素原子、フッ素原子、炭素数1〜30のアルキル基、且つR5〜R8が、同一又は異なって、水素原子、炭素数4〜30のアリール基、炭素数2〜30のアルキニル基、及び炭素数2〜30のアルケニル基からなる群から選ばれる少なくとも一種以上の基であることが好ましい。
【0033】
一般式(2)で示されるテトラハロターフェニル誘導体としては、以下の化合物が好ましく、
【0034】
【化13】

【0035】
【化14】

【0036】
【化15】

【0037】
【化16】

【0038】
【化17】

【0039】
【化18】

【0040】
【化19】

特に好ましくは
【0041】
【化20】

である。
【0042】
一般式(2)で示されるテトラハロターフェニル誘導体をリチオ化する場合、用いるリチオ化剤は、一般式(2)におけるX1〜X4をリチウムに置換することができるものである限り特に限定はなく、例えばn−ブチルリチウム、sec−ブチルリチウム、tert−ブチルリチウム、メチルリチウム、ヘキシルリチウム等のアルキルリチウム;フェニルリチウム、p−tert−ブチルフェニルリチウム、p−メトキシフェニルリチウム、p−フルオロフェニルリチウム等のアリールリチウム;リチウムジイソプロピルアミド、リチウムヘキサメチルジシラジド等のリチウムアミド;リチウムパウダー等のリチウム金属等を挙げることができ、好ましくはアルキルリチウムであり、特に好ましくはn−ブチルリチウム、sec−ブチルリチウムである。
【0043】
該リチオ化剤の使用量は一般式(2)で示されるテトラハロターフェニル誘導体1当量に対し、3.5〜7当量が好ましく、特に好ましくは4〜6当量、さらに好ましくは4.5〜5.5当量である。
【0044】
該リチオ化は、ジアルキルエーテル中で実施する。該ジアルキルエーテルとしては、例えば、ジメチルエーテル、ジエチルエーテル、メチル−tert−ブチルエーテル、エチル−tert−ブチルエーテル、エチレングリコールジメチルエーテル等が挙げられ、好ましくはジエチルエーテル、エチル−tert−ブチルエーテルである。又、これら溶媒は1種若しくは2種以上の混合物を用いても良い。該リチオ化の温度は−80〜50℃で行うことが好ましく、特に好ましくは−70〜20℃である。反応時間は1〜240分が好ましく、特に好ましくは10〜120分である。なお、リチオ化の進行は、反応液の一部を取り出し、水で反応を停止させた後、薄層クロマトグラフィーあるいはガスクロマトグラフィーで分析することで監視することができる。
【0045】
該リチオ化は、一般式(2)で示されるテトラハロターフェニル誘導体に、リチオ化剤を添加しても良いし、リチオ化剤に一般式(2)で示されるテトラハロターフェニル誘導体を添加するいずれの方法を用いても実施することができる。
【0046】
該リチオ化により生成したリチウム塩は、次いで銅化合物と反応させることにより、一般式(1)で示されるターフェニレン誘導体が得られるものである。係る銅化合物との反応は、前記リチオ化により生成したリチウム塩を含む反応混合物に銅化合物を添加しても良いし、前記リチオ化により生成したリチウム塩を含む反応混合物を銅化合物に添加するいずれの方法を用いても実施することができる。
【0047】
該銅化合物は特に限定はなく、例えば、塩化銅(II)、臭化銅(II)、ヨウ化銅(II)、酢酸銅(II)、アセチルアセトナート銅(II)等の2価銅;塩化銅(I)、臭化銅(I)、ヨウ化銅(I)、酢酸銅(I)等の1価銅等を挙げることができる。好ましくは2価銅であり、特に好ましくは塩化銅(II)、臭化銅(II)である。
【0048】
リチオ化により生成したリチウム塩と銅化合物と反応させる際には、好ましくは溶媒中で実施する。用いる溶媒は特に限定はなく、例えばテトラヒドロフラン(以後、THFと略す)、ジメチルエーテル、ジエチルエーテル、メチル−tert−ブチルエーテル、エチル−tert−ブチルエーテル、エチレングリコールジメチルエーテル、ジオキサン、トルエン、ヘキサン、シクロヘキサン等であり、好ましくはTHF、ジエチルエーテル、エチル−tert−ブチルエーテルである。又、これら溶媒は1種若しくは2種以上の混合物を用いても良い。銅化合物はこれら溶媒との混合物の状態で用いることが好ましい。この用いる銅化合物の量は、一般式(2)で示されるテトラハロターフェニル誘導体1当量に対し、3〜10当量が好ましく、特に好ましくは4〜8当量である。該反応剤との反応温度は−90〜50℃が好ましく、特に好ましくは−80〜30℃であり、反応時間は0.5〜30時間が好ましく、特に好ましくは1〜18時間である。
【0049】
本発明の一般式(1)で示されるターフェニレン誘導体の製造は、好ましくは窒素又はアルゴン等の不活性雰囲気下で実施する。
【0050】
かくして得られた、本発明の一般式(1)で示されるターフェニレン誘導体は、さらに精製することができる。精製する方法は特に限定はなく、例えばカラムクロマトグラフィー、再結晶化、あるいは昇華による方法を挙げることができる。
【0051】
(テトラハロターフェニル誘導体の製造方法)
次に、本発明の一般式(1)で示されるターフェニレン誘導体の前駆体として用いられる一般式(2)で示されるテトラハロターフェニル誘導体の製造方法について述べる。
【0052】
一般式(2)で示されるテトラハロターフェニル誘導体は、下記一般式(5)で示されるテトラハロベンゼンと下記一般式(6)及び/又は下記一般式(7)で示される3−ハロアリール金属試薬をパラジウム及び/又はニッケル触媒存在下で反応させることにより製造することができる。なお、一般式(6)と一般式(7)で示される反応剤が同じ化合物であっても良い。
【0053】
【化21】

(ここで、置換基X5及びX6は臭素原子、ヨウ素原子、塩素原子を示す。置換基X3及びX4は、一般式(2)で示される置換基と同意義を示す。なお、一般式(6)の表記は、置換基X5及びX6がパラ位配向及び/又はメタ位配向であることを総称するものである。)
【0054】
【化22】

(ここで、M1はマグネシウム、ホウ素、亜鉛、錫、ケイ素のハロゲン化物;ハイドロオキサイド;アルコキサイド;アルキル化物を示し、置換基R1、R2、R5、R6、及びX1並びに記号mは、一般式(2)で示される置換基と同意義を示す。)
【0055】
【化23】

(ここで、M2はマグネシウム、ホウ素、亜鉛、錫、ケイ素のハロゲン化物;ハイドロオキサイド;アルコキサイド;アルキル化物を示し、置換基R3、R4、R7、R8、及びX2は、一般式(2)で示される置換基と同意義を示す。)
本発明の一般式(5)、(6)及び(7)について、さらに述べる。
【0056】
一般式(5)の置換基X5及びX6は、臭素原子、ヨウ素原子、塩素原子を示し、好ましくは臭素原子及びヨウ素原子であり、さらに好ましくは臭素原子である。
【0057】
具体的な一般式(5)で示される化合物としては、例えば1,4−ジブロモ−2,5−ジヨードベンゼン、1,2,4,5−テトラブロモベンゼンが挙げられる。
【0058】
一般式(6)、(7)の置換基M1、M2はマグネシウム、ホウ素、亜鉛、錫、ケイ素のハロゲン化物;ハイドロオキサイド;アルコキサイド;アルキル化物であり、上記のパラジウム及び/又はニッケル触媒により脱離され、パラジウム及び/又はニッケルと置換できる基である限り特に限定はなく、例えばMgCl、MgBr、B(OH)2、B(OMe)2、テトラメチルジオキサボロラニル基、ZnCl、ZnBr、ZnI、Sn(Bu−n)3、Si(Bu−n)3、Si(OMe)3等を挙げることができ、好ましくはZnCl、B(OH)2である。
【0059】
具体的な一般式(6)、一般式(7)で示される化合物としては、例えば6,7−ジ(ドデシル)−3−ブロモアントラセニル−2−ボロン酸、6,7−ジ(ドデシル)−3−ブロモアントラセニル−2−ジンククロライド、6,7−ジ(ペンタデシル)−3−ブロモアントラセニル−2−ジンククロライド、6,7−ジ(パーフルオロドデシル)−3−ブロモアントラセニル−2−ボロン酸、6,7−ジ(パーフルオロドデシル)−3−ブロモアントラセニル−2−ジンククロライド等が挙げられる。
【0060】
なお、一般式(6)、一般式(7)で示される3−ハロアリール金属試薬は、それらの原料となる下記一般式(8)で示されるアリールジハロゲン置換体をイソプロピルマグネシウムブロマイド等のグリニャール試薬あるいはn−ブチルリチウム等の有機リチウム試薬によりハロゲン/金属交換反応を行った後、塩化亜鉛、トリメトキシボラン、2−イソプロポキシ−4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン等と反応させることで好適に調製することができる。
【0061】
【化24】

(ここで、X7は臭素原子、ヨウ素原子を示し、置換基R1、R2、R5、R6、及びX1並びに記号mは、一般式(6)で示される置換基と同意義を示す。)
一般式(8)の置換基X7は臭素原子、ヨウ素原子である。また、置換基R1、R2、R5、R6、及びX1は、一般式(8)で示される置換基と同意義を示し、好ましい置換基R1、R2、R5、R6としては水素原子、ドデシル基、ペンタデシル基、オクタデシル基、パーフルオロドデシル基、パーフルオロペンタデシル基、パーフルオロオクタデシル基等であり、好ましいX1は臭素原子である。
【0062】
そして、具体的な一般式(8)で示されるアリールジハロゲン置換体としては、例えば2−ブロモ−3−ヨード−6,7−ジドデシルアントラセン、2−ブロモ−3−ヨード−6,7−ジペンタデシルアントラセン、2−ブロモ−3−ヨード−6−ドデシル−7−フルオロアントラセン、2−ブロモ−3−ヨード−6,7−ジ(パーフルオロドデシル)アントラセン等が挙げられ、その中でも2−ブロモ−3−ヨード−6,7−ジドデシルアントラセン、2−ブロモ−3−ヨード−6,7−ジペンタデシルアントラセン、2−ブロモ−3−ヨード−6,7−ジ(パーフルオロドデシル)アントラセンが好ましい。
【0063】
なお、グリニャール試薬によるハロゲン/金属交換反応は、例えば「ジャーナル オブ オルガニック ケミストリィー」、2000年、65巻、4618−4634頁」に記載されている方法、有機リチウム試薬によるハロゲン/金属交換反応は、例えば「ジャーナル オブ ケミカル リサーチ シノプシス」、1981年、185頁に記載されている方法を用いることもできる。
【0064】
一般式(5)で示されるテトラハロベンゼンと一般式(6)及び一般式(7)で示される3−ハロアリール金属試薬の反応に用いる触媒はパラジウム及び/又はニッケル触媒であれば特に限定はなく、例えばテトラキス(トリフェニルホスフィン)パラジウム、トリス(ジベンジリデンアセトン)ジパラジウム/トリフェニルホスフィン混合物、ジクロロビス(トリフェニルホスフィン)パラジウム、ビス(トリ−tert−ブチルホスフィン)パラジウム、ジアセタトビス(トリフェニルホスフィン)パラジウム、ジクロロ(1,2−ビス(ジフェニルホスフィノ)エタン)パラジウム、酢酸パラジウム/トリフェニルホスフィン混合物、酢酸パラジウム/トリ−tert−ブチルホスフィン混合物、酢酸パラジウム/2−(ジシクロヘキシルホスフィノ)−1,1’−ビフェニル混合物、ジクロロ(エチレンジアミン)パラジウム、ジクロロ(N,N,N’,N’−テトラメチルエチレンジアミン)パラジウム、ジクロロ(N,N,N’,N’−テトラメチルエチレンジアミン)パラジウム/トリフェニルホスフィン混合物等のパラジウム触媒;ジクロロビス(トリフェニルホスフィン)ニッケル、ジクロロ(1,2−ビス(ジフェニルホスフィノ)エタン)ニッケル、ジクロロ(エチレンジアミン)ニッケル、ジクロロ(N,N,N’,N’−テトラメチルエチレンジアミン)ニッケル、ジクロロ(N,N,N’,N’−テトラメチルプロパンジアミン)ニッケル、ジクロロ(N,N,N’,N’−テトラメチルエチレンジアミン)ニッケル/トリフェニルホスフィン混合物、ビス(1,5−シクロオクタジエン)ニッケル/トリフェニルホスフィン混合物等のニッケル触媒;を挙げることができる。中でも、好ましい触媒は0価のパラジウム化合物であり、特に好ましい触媒はテトラキス(トリフェニルホスフィン)パラジウムである。又、これら触媒は1種若しくは2種以上の混合物を用いても良い。
【0065】
一般式(5)で示されるテトラハロベンゼンと一般式(6)及び一般式(7)で示される3−ハロアリール金属試薬をパラジウム及び/又はニッケル触媒存在下で反応させる際には、好ましくは溶媒中で実施する。用いる溶媒に特に限定はなく、例えばTHF、ジエチルエーテル、メチル−tert−ブチルエーテル、エチル−tert−ブチルエーテル、ジオキサン、エチレングリコールジメチルエーテル、トルエン、キシレン、ヘキサン、シクロヘキサン、エタノール、水、N,N−ジメチルホルムアミド、N−メチルピロリドン、トリエチルアミン、ピペリジン、ピロリジン、ジイソプロピルアミン等を挙げることができ、又、これら溶剤は1種若しくは2種以上の混合物を用いても良く、例えばトルエン/水、トルエン/エタノール/水のような2乃至3成分系でも使用することができる。
【0066】
パラジウム触媒、ニッケル触媒の使用量は一般式(5)で示されるテトラハロベンゼン1モルに対し、0.1〜20モル%が好ましく、特に好ましくは1〜10モル%である。
【0067】
一般式(6)、一般式(7)で示される3−ハロアリール金属試薬の使用量は一般式(5)で示されるテトラハロベンゼン1当量に対し、0.8〜3.2当量が好ましく、特に好ましくは1.0〜2.8当量、さらに好ましくは1.1〜2.5当量である。
【0068】
一般式(6)、一般式(7)で示される3−ハロアリール金属試薬は同時に添加しても良いし、別々に添加することもできる。
【0069】
反応の際の温度は10〜120℃が好ましく、特に好ましくは30〜100℃、さらに好ましくは40〜90℃であり、反応時間は1〜100時間が好ましく、特に好ましくは5〜80時間である。
【0070】
なお、反応系中に塩基を存在させることもできる。この場合の塩基の種類としては特に限定はなく、例えば炭酸ナトリウム、炭酸水素ナトリウム、炭酸カリウム、炭酸セシウム、りん酸カリウム、りん酸ナトリウム、ナトリウムtert−ブトキサイド、カリウムtert−ブトキサイド、フッ化リチウム、フッ化ナトリウム、フッ化カリウム等の無機塩基;トリエチルアミン、トリメチルアミン、トリブチルアミン、エチレンジアミン、N,N,N’,N’−テトラメチルエチレンジアミン、ジイソプロピルアミン、ピリジン、テトラブチルアンモニウムフルオライド等の有機塩基を好適なものとして挙げることができる。これらの塩基の使用量は一般式(5)で示されるテトラハロベンゼン1当量に対し、0.5〜10.0当量が好ましく、特に好ましくは2.0〜8.0当量である。さらにこれらの塩基と併用し、相間移動触媒を用いることもできる。相間移動触媒の種類は特に限定はなく、例えばトリオクチルメチルアンモニウムクロライド、テトラブチルアンモニウムクロライド、ベンジルトリメチルアンモニウムクロライド、セチルピリジニウムクロライド等を好適なものとして挙げることができる。これらの相間移動触媒の使用量は一般式(5)で示されるテトラハロベンゼン1当量に対し、0.1〜1.5当量が好ましく、特に好ましくは0.2〜0.8である。
【0071】
さらに反応系中にトリフェニルホスフィン等のホスフィンを存在させることもできる。これらのホスフィンの使用量は、該パラジウム及び/又はニッケル触媒1当量に対し、0.9〜8.0当量が好ましく、特に好ましくは1.0〜3.0当量である。
【0072】
また、一般式(5)で示されるテトラハロベンゼンと一般式(6)及び(7)で示される3−ハロアリール金属試薬の反応により炭素−炭素結合が形成される位置は、テトラハロベンゼンのハロゲンの反応性により制御することができる。即ち、ヨウ素原子の反応性が最も高いことから、一般式(5)のハロゲンのX5及びX6がヨウ素原子で、X3及びX4が臭素あるいは塩素原子の場合、一般式(5)の炭素−X5及び炭素−X6に選択的に炭素−炭素結合が形成される。
【0073】
本発明の製造方法で製造される一般式(1)で示されるフェニレン誘導体は、有機ELディスプレイの発光材料(ドーパント)、ホスト材料、有機発光トランジスタの発光材料に利用することができる。
【発明の効果】
【0074】
本発明は、一般式(1)で示されるターフェニレン誘導体を製造する新規な方法を提供する。本発明の製造方法は原料であるテトラハロターフェニル誘導体をジアルキルエーテル中でリチオ化することで収率良くターフェニレン誘導体を製造することができる。さらに本発明の製造方法では、用いるリチオ化剤及び銅化合物の量を低減することが可能となり、より経済的なターフェニレン誘導体の製造方法を提供することができる。
【実施例】
【0075】
以下、実施例により本発明をさらに詳細に説明するが、本発明はこれら実施例に限定されるものではない。
【0076】
生成物の同定には1H NMRスペクトル及びマススペクトルを用いた。なお、1H NMRスペクトルは日本電子製JEOL GSX−270WB(270MHz)を用いた。マススペクトル(MS)は日本電子製JEOL JMS−700を用いて、試料を直接導入し、電子衝突(EI)法(70エレクトロンボルト)又はFAB法(6キロエレクトロンボルト、キセノンガス、マトリックス(2−ニトロフェニルオクチルエーテル)で測定した。
【0077】
反応の進行の確認等は薄層クロマトグラフィー、ガスクロマトグラフィー(GC)あるいはガスクロマトグラフィー−マススペクトル(GCMS)分析を用いた。
【0078】
ガスクロマトグラフィー分析
装置 島津GC14B
カラム J&Wサイエンティフィック社製、DB−1,30m
ガスクロマトグラフィー−マススペクトル分析
装置 パーキンエルマーオートシステムXL(MS部;ターボマスゴールド)
カラム J&Wサイエンティフィック社製、DB−1,30m
反応用の試薬及び溶媒は、断りのない限り市販品を用いた。なお、グリニャール試薬あるいはブチルリチウム等の有機金属試薬を用いた場合は、市販の脱水溶媒をそのまま用いた。
【0079】
合成例1 (4−ブロモ−5−ヨードフタル酸無水物の合成)
4−ブロモ−5−ヨードフタル酸無水物は「ジャーナル オブ オーガニック ケミストリー」(米国)、1951年、16巻、1577−1581頁を参考に、以下の様に合成した。
【0080】
4−ブロモフタルイミド(東京化成工業製)9.95g(44.0mmol)を窒素ガスで置換した50mlの二口ナスフラスコに入れた。次いでヨウ素5.87g(23.1mmol)及び10%発煙硫酸(ヨツハタ化学工業製)12mlを加え、90℃で23時間反応を行った。反応混合物を室温に冷やして氷に注ぎ入れた後、ガラスフィルターでろ過し、黄色固体12.8gを得た。得られた固体を濃硫酸35mlに溶解させ、130℃で5時間反応を行った。反応混合物を氷冷後、氷水を加えて析出した固体をろ過し、フタル酸誘導体の固体13.8gを得た。次に水酸化ナトリウム3.6gを水18mlに溶かした水溶液に得られた固体を室温で溶かした。この塩基性水溶液に酢酸を加えpHを3〜4に調製し、析出するフタル酸誘導体のモノナトリウム塩の白色沈殿をろ過した。得られた白色沈殿を水に懸濁させ、濃塩酸でpHを1以下にし、再びフタル酸誘導体として白色固体4.93gを得た。この固体をトルエン48mlに溶かし、無水酢酸8.7g(85.7mmol)を加え、105℃で4時間反応を行った。反応液を減圧濃縮して白色固体3.79gを得た。この固体から加熱トルエンに不溶な成分を除き、目的の4−ブロモ−5−ヨードフタル酸無水物5.12g(14.5mmol)を得た。(収率33%)。
1H NMR(CDCl3,22℃):δ=8.51(s,1H),8.23(s,1H)。
MS m/z: 353(M+,100%),309(M+−CO2,18%),282(M+−C2O3,10%),155(M+−C2O3−I,16%),74(M+−C2O3−I−Br,32%)。
【0081】
合成例2 (1,2―ジドデシルベンゼンの合成)
1,2−ジドデシルベンゼンは「日本化学会誌」1989年、6巻、983−987頁に従い以下の様に合成した。
【0082】
1,2−ジクロロベンゼン2.22g(15.1mmol)、ジクロロ〔1,3−ビス(ジフェニルホスフィノ)プロパン〕ニッケル(東京化成工業製)131mg(0.24mmol)、ジエチルエーテル11.5mlの混合液にドデシルマグネシウムブロミド(シグマ−アルドリッチ製、1.0mol/lジエチルエーテル溶液)45.0ml(45.0mmol)を窒素雰囲気中0℃で滴下した。35℃で20時間反応を行い、反応混合物を0℃に冷やして希塩酸を加え、ジエチルエーテルで抽出した。ジエチルエーテル溶液を水、飽和炭酸水素ナトリウム水溶液、水の順に洗浄し、塩化カルシウムで乾燥させた。得られた液体をシリカゲルカラムクロマトグラフィー(溶離液:ヘキサン)及び減圧蒸留で精製し、目的の1,2―ジドデシルベンゼン5.56g(13.4mmol)を得た(収率88%)。
1H NMR(CDCl3,22℃):δ=7.11(m,4H),2.59(t,J=7.8Hz,4H),1.55(m,4H),1.26(m,36H),0.88(t,J=6.8Hz,6H)。
MS m/z: 414(M+,100%),260(M+−C11H23,71%),106(M+−C22H46,98%)。
【0083】
合成例3 (2−ブロモ−3−ヨード−6,7−ジドデシルアントラキノンの合成)
2−ブロモ−3−ヨード−6,7−ジドデシルアントラキノンは「ベリヒテ」(独国)、1933年、66B巻、1876−1891頁を参考に以下の様に合成した。
【0084】
合成例1で得られた4−ブロモ−5−ヨードフタル酸無水物2.82g(8.00mmol)、合成例2で得られた1,2−ジドデシルベンゼン3.32g(8.00mmol)、テトラクロロエタン5.0mlの混合液に塩化アルミニウム2.41g(18.1mmol)を加え、室温で3時間反応を行った。水を加えてクエンチし、さらに水洗浄を行い、加熱真空乾燥後、白色固体を11.1g得た。得られた固体に濃硫酸44mlを添加し、80℃で1時間反応した。反応混合物を氷に注ぎ入れ、析出した固体をろ過して水で洗浄した。乾燥後、シリカゲルカラムクロマトグラフィー(溶離液:ヘキサン/塩化メチレン,10:1)で精製し、2−ブロモ−3−ヨード−6,7−ジドデシルアントラキノンの固体4.20g(5.60mmol)を得た(収率70%)。
1H NMR(CDCl3,22℃):δ=8.73(s,1H),8.45(s,1H),8.05(s,2H),2.75(m,4H),1.62(m,4H),1.26(m,36H),0.88(m,6H)。
MS m/z: 750(M+,100%),440(M+−C22H46,8%),313(M+−C22H46I,2%),233(M+−C22H46IBr,1%)。
【0085】
合成例4 (2−ブロモ−3−ヨード−6,7−ジドデシルアントラセンの合成)(一般式(8)の化合物の合成)
窒素雰囲気下、100mlシュレンク反応容器に合成例3で合成した2−ブロモ−3−ヨード−6,7−ジドデシルアントラキノン1.10g(1.47mmol)を入れた。次いでTHF17mlを加え、水素化ジイソブチルアルミニウム(関東化学製、0.99mol/l、トルエン溶液)3.7ml(3.7mmol)を加え、室温で1.5時間反応を行った。次いで反応混合物に6M塩酸水溶液10mlを加え、65℃で3時間反応を行った。反応混合物を室温まで冷やし、ジエチルエーテルで抽出した。ジエチルエーテル溶液を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧乾燥した。再びTHF17mlを加え、水素化ジイソブチルアルミニウム5.5ml(5.4mmol)を加え、室温で1.5時間反応を行った。次いで反応混合物に6M塩酸水溶液10mlを加え、3時間反応を行った。反応混合物を室温まで冷やし、ジエチルエーテルで抽出した。ジエチルエーテル溶液を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧乾燥した。シリカゲルカラムクロマトグラフィー(溶離液:ヘキサン)で精製し、2−ブロモ−3−ヨード−6,7−ジドデシルアントラセンの黄色固体629mg(0.87mmol)を得た。(収率59%)。
1H NMR(CDCl3,22℃):δ=8.55(s,1H),8.27(s,1H),8.16(s,1H),8.15(s,1H),7.72(s,2H),2.78(m,4H),1.71(m,4H),1.27(m,36H),0.88(m,6H)。
MS m/z: 720(M+,100%),410(M+−C22H46,16%),283(M+−C22H46−I,4%),203(M+−C22H46−I−Br,5%)。
【0086】
合成例5 (1,4−ジブロモ−2,5−ジヨードベンゼンの合成)(一般式(5)の化合物の合成)
1,4−ジブロモ−2,5−ジヨードベンゼンはジャーナル オブ アメリカン ケミカル ソサイエティー、1997年、119巻、4578−4593頁に記載されている方法を参考に合成を行った。
【0087】
メカニカルスターラー付き1lの三口フラスコに過ヨウ素酸16.7g(73.0mmol)及び硫酸525mlを加えた。過ヨウ素酸が溶解した後、ヨウ化カリウム36.4g(219mmol)を少しずつ添加した。その内容物の温度を−30℃に冷却し、1,4−ジブロモベンゼン34.5g(146mmol)を5分間かけて添加した。得られた混合物を−25℃で36時間撹拌した。反応混合物を氷(2kg)中へ注いだ後、濾過し固体を取り出した。その固体をクロロホルムに溶解させ、5%苛性ソーダ水溶液及び水で洗浄し、有機相を無水硫酸マグネシウムで乾燥した。減圧濃縮後、残渣をクロロホルムから再結晶化し、白色結晶を得た(36.0g、収率50%)。
1H NMR(CDCl3,21℃):δ=8.02(s,2H)。
【0088】
1H NMRスペクトルが文献値と一致したことより、1,4−ジブロモ−2,5−ジヨードベンゼンが得られたことを確認した。
【0089】
実施例1 (テトラドデシルジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
1) (テトラブロモ(テトラドデシル)ジアントラセニルベンゼンの合成(一般式(2)で示されるテトラハロターフェニル誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に合成例4で合成した2−ブロモ−3−ヨード−6,7−ジドデシルアントラセン625mg(0.868mmol)及びTHF11mlを添加した。この溶液を−50℃に冷却し、イソプロピルマグネシウムブロマイド(関東化学製、0.65M)のTHF溶液2.8ml(1.82mmol)を滴下し、攪拌した。5分間熟成後、−78℃に冷却し、トリメトキシボラン(和光純薬工業製)180.8mg(1.740mmol)を滴下した。徐々に室温まで昇温した後、3M塩酸水溶液を添加し、30分間攪拌した。トルエンを加え、分相し、有機相を減圧濃縮した(一般式(6)及び(7)の化合物の合成)。減圧乾燥後、そこへ合成例5で合成した1,4−ジブロモ−2,5−ジヨードベンゼン182mg(0.373mmol)、テトラキス(トリフェニルホスフィン)パラジウム(東京化成工業製)27.7mg(0.0240mmol)、トルエン6ml、及びエタノール1.6mlを添加した。さらに炭酸ナトリウム254mg(2.40mmol)と水2mlからなる水溶液を加え、60℃で70時間反応を実施した。容器を水冷し3M塩酸水溶液3mlを添加することで反応を停止させた。トルエンを添加後、分相し、有機相を食塩水で洗浄した。有機相を減圧濃縮し溶媒を留去し、さらに真空乾燥した。得られた残渣にトルエンを添加し、70%tert−ブチルハイドロパーオキサイド溶液(和光純薬工業製)(0.03ml)を添加し、室温で2時間撹拌した。この溶液を水洗浄し、有機相を減圧濃縮した。残渣をシリカゲルカラムクロマトグラフィーで精製し(溶媒;ヘキサン:クロロホルム=2:1)、さらにヘプタンから再結晶化することでテトラブロモ(テトラドデシル)ジアントラセニルベンゼンの薄黄色固体339mgを得た(収率64%)。
1H NMR(CDCl3,22℃):δ=8.34(s,2H),8.32(s,2H),8.28(s,2H),7.97(s,1H),7.92(s,1H),7.79(s,2H),7.78(s,2H),7.73(s,1H),7.72(s,1H),2.81(m,8H),1.71(m,8H),1.28(m,72H),0.88(m,12H)。
【0090】
1H NMRスペクトルを図1に示した。
FABMS m/z: 1419(M+,100%),1340(M+−Br,10)。
【0091】
1H NMR及びMS測定より、テトラブロモ(テトラドデシル)ジアントラセニルベンゼンが得られたことを確認した。なお、その構造式を下記に示す。
【0092】
【化25】

2) (テトラドデシルジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に、実施例1の1)で合成したテトラブロモ(テトラドデシル)ジアントラセニルベンゼン304mg(0.214mmol)及びジエチルエーテル10mlを添加した。この懸濁溶液を0℃に冷却し、リチオ化剤としてn−ブチルリチウム(関東化学製1.59M)のヘキサン溶液0.67ml(1.1mmol)を滴下しリチオ化を行い、さらに30分間撹拌することでリチオ化の熟成を行った。一方、別の100mlシュレンク反応容器に塩化銅(II)(和光純薬工業製)201mg(1.49mmol)及びTHF20mlを添加し、−78℃に冷却した。ここへ先のリチオ化物のジエチルエーテル溶液をテフロン(登録商標)キャヌラーを用いて移液した。徐々に昇温し、一晩かけて室温まで反応温度を上げた。1.5M塩酸水溶液及びトルエンを添加した後、分相し、さらに有機相を飽和食塩水で洗浄し、懸濁状態の有機相を濾過し、得られた固体をヘキサンで洗浄した。得られた残渣をトルエンから2回再結晶精製し、テトラドデシルジナフトターフェニレン96.5mgの橙色固体を得た(収率41%)。
1H NMR(重トルエン,60℃):δ=7.71(s,4H),7.58(s,4H),6.82(s,4H),6.59(s,2H),2.81(m,8H),1.77(m,8H),1.31(m,72H),0.88(m,12H)。
【0093】
1H NMRスペクトルを図2に示した。
【0094】
1H NMR測定より、テトラドデシルジナフトターフェニレンが得られたことを確認した。なお、その構造式を下記に示す。
【0095】
【化26】

比較例1 (テトラドデシルジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に、実施例1で合成したテトラブロモ(テトラドデシル)ジアントラセニルベンゼン274mg(0.193mmol)及びTHF10mlを添加した。この懸濁溶液を−78℃に冷却し、リチオ化剤としsec−ブチルリチウム(関東化学製1.0M)のシクロヘキサン/ヘキサン溶液1.5ml(1.5mmol)を滴下しリチオ化を行い、さらに30分間撹拌することでリチオ化の熟成を行った。一方、別の100mlシュレンク反応容器に塩化銅(II)(和光純薬工業製)233mg(1.73mmol)及びTHF20mlを添加し、−78℃に冷却した。ここへ先のリチオ化物のTHF溶液をテフロン(登録商標)キャヌラーを用いて移液した。徐々に昇温し、一晩かけて室温まで反応温度を上げた。1.5M塩酸水溶液及びトルエンを添加した後、分相し、さらに有機相を飽和食塩水で洗浄し、懸濁状態の有機相を濾過し、得られた固体をヘキサンで洗浄した。得られた残渣をトルエンから2回再結晶精製し、テトラドデシルジナフトターフェニレン17.0mgの橙色固体を得た(収率8%)。
【0096】
1H NMR測定より実施例2で得られた目的物と一致したが、ジアルキルエーテル中ではなくTHF中でリチオ化を行ったため低収率であった。
【0097】
実施例2 (テトラドデシルジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
1) (テトラブロモ(テトラドデシル)ジアントラセニルベンゼンの合成(一般式(2)で示されるテトラハロターフェニル誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に合成例4で合成した2−ブロモ−3−ヨード−6,7−ジドデシルアントラセン548mg(0.761mmol)及びTHF10mlを添加した。この溶液を−50℃に冷却し、イソプロピルマグネシウムブロマイド(関東化学製、0.65M)のTHF溶液2.4ml(1.56mmol)を滴下し、攪拌した。5分間熟成後、−78℃に冷却し、トリメトキシボラン(和光純薬工業製)162.1mg(1.560mmol)を滴下した。徐々に室温まで昇温した後、3M塩酸水溶液を添加し、30分間攪拌した。トルエンを加え、分相し、有機相を減圧濃縮した(一般式(6)及び(7)の化合物の合成)。減圧乾燥後、そこへ1,2,4,5−テトラブロモベンゼン(東京化成工業製)136mg(0.345mmol)、テトラキス(トリフェニルホスフィン)パラジウム(東京化成工業製)20.0mg(0.0173mmol)、トルエン5ml、及びエタノール1.4mlを添加した。さらに炭酸ナトリウム219mg(2.07mmol)と水1.7mlからなる水溶液を加え、60℃で40時間反応を実施した。容器を水冷し3M塩酸水溶液3mlを添加することで反応を停止させた。トルエンを添加後、分相し、有機相を食塩水で洗浄した。有機相を減圧濃縮し溶媒を留去し、さらに真空乾燥した。得られた残渣にトルエンを添加し、70%tert−ブチルハイドロパーオキサイド溶液(和光純薬工業製)(0.03ml)を添加し、室温で2時間撹拌した。この溶液を水洗浄し、有機相を減圧濃縮した。残渣をシリカゲルカラムクロマトグラフィーで精製し(溶媒;ヘキサン:クロロホルム=2:1)、さらにヘプタンから再結晶化することでテトラブロモ(テトラドデシル)ジアントラセニルベンゼンの薄黄色固体348mgを得た(収率71%)。
FABMS m/z: 1419(M+,100%),1340(M+−Br,8)。
【0098】
MS測定より、テトラブロモ(テトラドデシル)ジアントラセニルベンゼンが得られたことを確認した。なお、その構造式を下記に示す。
【0099】
【化27】

2)テトラドデシルジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に、実施例2の1)で合成したテトラブロモ(テトラドデシル)ジアントラセニルベンゼン344mg(0.242mmol)及びジエチルエーテル11mlを添加した。この懸濁溶液を0℃に冷却し、リチオ化剤としてn−ブチルリチウム(関東化学製1.59M)のヘキサン溶液0.76ml(1.2mmol)を滴下しリチオ化を行い、さらに30分間撹拌することでリチオ化の熟成を行った。一方、別の100mlシュレンク反応容器に塩化銅(II)(和光純薬工業製)227mg(1.69mmol)及びTHF22mlを添加し、−78℃に冷却した。ここへ先のリチオ化物のジエチルエーテル溶液をテフロン(登録商標)キャヌラーを用いて移液した。徐々に昇温し、一晩かけて室温まで反応温度を上げた。1.5M塩酸水溶液及びトルエンを添加した後、分相し、さらに有機相を飽和食塩水で洗浄し、懸濁状態の有機相を濾過し、得られた固体をヘキサンで洗浄した。得られた残渣をトルエンから2回再結晶精製し、テトラドデシルジナフトターフェニレン101.1mgの橙色固体を得た(収率38%)。
【0100】
1H NMR測定より、実施例2で得られたスペクトルと同一のスペクトルが得られたことからテトラドデシルジナフトターフェニレンが生成していることを確認した。
【0101】
合成例6 (2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ジフェニルアントラセンの合成)(一般式(8)の化合物の合成)
窒素雰囲気下、100mlシュレンク反応容器に合成例3で合成した2−ブロモ−3−ヨード−6,7−ジドデシルアントラキノン541mg(0.722mmol)及びTHF20mlを添加した。−78℃に冷却後、フェニルリチウム(関東化学製、1.0mol/l、シクロヘキサン/ジエチルエーテル溶液)1.5ml(1.5mmolを加えた後、一晩かけて室温まで昇温した。次いで反応混合物に3M塩酸水溶液及びジエチルエーテルを加えた後、分相し、さらにジエチルエーテルで抽出した。ジエチルエーテル溶液を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧濃縮した。得られた残渣に酢酸30ml、ヨウ化ナトリウム749mg(5.0mmol)、及び次亜りん酸ナトリウム・1水和物727mg(6.86mmol)を加え、1時間加熱還流下で反応を行った。反応混合物を室温まで冷やし、トルエンで抽出した。トルエン溶液を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧濃縮した。シリカゲルカラムクロマトグラフィー(溶離液;ヘキサン:トルエン=30:1の混合液)で精製し、2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ジフェニルアントラセンの黄色固体453mgを得た(収率72%)。
【0102】
実施例3 (テトラドデシルテトラフェニルジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
1) (テトラブロモ(テトラドデシル)(テトラフェニル)ジアントラセニルベンゼンの合成)(一般式(2)で示されるテトラハロターフェニル誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に合成例6で合成した2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ジフェニルアントラセン450mg(0.516mmol)及びTHF10mlを添加した。この混合物を−70℃に冷却し、イソプロピルマグネシウムブロマイド(東京化成工業製、0.81M)のTHF溶液1.27ml(1.03mmol)を滴下した。−50℃まで昇温した後、−78℃に冷却し、トリメトキシボラン(和光純薬工業製)109.1mg(1.05mmol)を滴下した。徐々に室温まで昇温した後、3M塩酸水溶液を加えて30分間攪拌後、トルエンを添加し分相した。有機相を減圧濃縮した(一般式(6)及び(7)の化合物の合成)。得られた固形物に、合成例5で合成した1,4−ジブロモ−2,5−ジヨードベンゼン114mg(0.234mmol)、テトラキス(トリフェニルホスフィン)パラジウム(東京化成工業製)13.8mg(0.012mmol)、トルエン5ml、及びエタノール1.2mlを添加した。さらに炭酸ナトリウム148.8mg(1.404mmol)と水1.6mlからなる水溶液を加え、60℃で68時間反応を実施した。室温まで冷却後、トルエン及び水を添加し分相した。有機相を濃縮し、得られた残渣をトルエン5mlに溶解後、70%tert−ブチルハイドロパーオキサイド溶液(和光純薬工業製)0.02mlを添加し、室温で2時間撹拌した。このトルエン溶液を水で2回洗浄後、有機相を減圧濃縮し、得られた残渣に飽和食塩水及びトルエンを添加した。分相し、有機相を水で洗浄し、無水硫酸ナトリウムで乾燥した。有機相を濾過し、減圧濃縮し、得られた残渣をシリカゲルを充填したカラムで濾過した(溶媒:ヘキサン)。得られた粗固体をヘプタンから再結晶化し、目的物の黄色固体250mgを得た(収率62%)。
FABMS m/z: 1723(M+,100%),1643(M+−Br,10)。
【0103】
MS測定より、テトラブロモ(テトラドデシル)(テトラフェニル)ジアントラセニルベンゼンが得られたことを確認した。なお。その構造式を下記に示す。
【0104】
【化28】

2) (テトラドデシルテトラフェニルジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に実施例3の1)で合成したテトラブロモ(テトラドデシル)(テトラフェニル)ジアントラセニルベンゼン238mg(0.138mmol)及びジエチルエーテル7mlを添加した。この混合物を0℃に冷却後、リチオ化剤であるn−ブチルリチウム(関東化学製、1.59M)のヘキサン溶液0.44ml(0.70mmol)を滴下しリチオ化を行い、さらに30分間撹拌することでリチオ化の熟成を行った。別の100mlシュレンク反応容器に、塩化銅(II)(和光純薬工業製)129.9mg(0.966mmol)及びTHF15mlを添加し、−78℃に冷却した。ここへ先のリチオ化物のジエチルエーテル溶液をテフロン(登録商標)キャヌラーを用いて移液した。15時間かけて室温までゆっくり昇温し、3M塩酸水溶液を添加した。分相し、有機相をさらに飽和食塩水で洗浄した。懸濁している有機相を濾過し、固体を濾別した。この固体を水及びヘキサンで洗浄し、得られた固体をトルエンから再結晶化し、目的物の橙色固体79.4mgを得た(収率41%)。
【0105】
目的物のテトラドデシルテトラフェニルジナフトターフェニレンの構造式を下記に示す。
【0106】
【化29】

合成例7 (2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ビス(フェニルエチニル)アントラセンの合成)(一般式(8)の化合物の合成)
窒素雰囲気下、100mlシュレンク反応容器にフェニルアセチレン(東京化成工業製)178mg(1.74mmol)及びTHF20mlを添加した。n−ブチルリチウム(関東化学製、1.59M)のヘキサン溶液1.05ml(1.67mmol)を滴下し、20分間撹拌した。合成例3で合成した2−ブロモ−3−ヨード−6,7−ジドデシルアントラキノン523mg(0.697mmol)を加えた後、混合物を室温で一晩反応させた。次いで反応混合物に3M塩酸水溶液及びジエチルエーテルを加えた後、分相し、さらにジエチルエーテルで抽出した。ジエチルエーテル溶液を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧濃縮した。得られた残渣に酢酸30ml、ヨウ化ナトリウム749mg(5.0mmol)、及び次亜りん酸ナトリウム・1水和物727mg(6.86mmol)を加え、1時間加熱還流下で反応を行った。反応混合物を室温まで冷やし、トルエンで抽出した。トルエン溶液を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧濃縮した。シリカゲルカラムクロマトグラフィー(溶離液;ヘキサン:トルエン=30:1の混合液)で精製し、2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ビス(フェニルエチニル)アントラセンの黄色固体393mgを得た(収率61%)。
【0107】
実施例4 (テトラドデシルテトラキス(フェニルエチニル)ジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
1) (テトラブロモ(テトラドデシル)テトラキス(フェニルエチニル)ジアントラセニルベンゼンの合成)(一般式(2)で示されるテトラハロターフェニル誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に合成例7で合成した2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ビス(フェニルエチニル)アントラセン390mg(0.423mmol)及びTHF8mlを添加した。この混合物を−70℃に冷却し、イソプロピルマグネシウムブロマイド(東京化成工業製、0.81M)のTHF溶液1.04ml(0.84mmol)を滴下した。−50℃まで昇温した後、−78℃に冷却し、トリメトキシボラン(和光純薬工業製)87.8mg(0.845mmol)を滴下した。徐々に室温まで昇温した後、3M塩酸水溶液を加えて室温で30分間攪拌後、トルエンを添加し分相した。有機相を減圧濃縮した(一般式(6)及び(7)の化合物の合成)。得られた固形物に、合成例5で合成した1,4−ジブロモ−2,5−ジヨードベンゼン93.8mg(0.192mmol)、テトラキス(トリフェニルホスフィン)パラジウム(東京化成工業製)11.1mg(0.0096mmol)、トルエン5ml、及びエタノール1.2mlを添加した。さらに炭酸ナトリウム122.1mg(1.15mmol)と水1.6mlからなる水溶液を加え、60℃で74時間反応を実施した。室温まで冷却後、トルエン及び水を添加し分相した。有機相を濃縮し、得られた残渣をトルエン5mlに溶解後、70%tert−ブチルハイドロパーオキサイド溶液(和光純薬工業製)0.02mlを添加し、室温で2時間撹拌した。このトルエン溶液を水で2回洗浄後、有機相を減圧濃縮し、得られた残渣に飽和食塩水及びトルエンを添加した。分相し、有機相を水で洗浄し、無水硫酸ナトリウムで乾燥した。有機相を濾過し、減圧濃縮し、得られた残渣をシリカゲルを充填したカラムで濾過した(溶媒:ヘキサン)。得られた粗固体をヘプタンから再結晶化し、目的物の黄色固体227mgを得た(収率65%)。
FABMS m/z: 1819(M+,100%),1739(M+−Br,10)。
【0108】
MS測定より、テトラブロモ(テトラドデシル)テトラキス(フェニルエチニル)ジアントラセニルベンゼンが得られたことを確認した。なお。その構造式を下記に示す。
【0109】
【化30】

2) (テトラドデシルテトラキス(フェニルエチニル)ジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に実施例4の1)で合成したテトラブロモ(テトラドデシル)テトラキス(フェニルエチニル)ジアントラセニルベンゼン221mg(0.121mmol)及びジエチルエーテル7mlを添加した。この混合物を0℃に冷却後、n−ブチルリチウム(関東化学製、1.59M)のヘキサン溶液0.38ml(0.60mmol)を滴下し、さらに30分間撹拌することでリチオ化の熟成を行った。別の100mlシュレンク反応容器に、塩化銅(II)(和光純薬工業製)113.9mg(0.847mmol)及びTHF15mlを添加し、−78℃に冷却した。ここへ先のリチオ化物のジエチルエーテル溶液をテフロン(登録商標)キャヌラーを用いて移液した。15時間かけて室温までゆっくり昇温し、3M塩酸水溶液を添加した。分相し、有機相をさらに飽和食塩水で洗浄した。懸濁している有機相を濾過し、固体を濾別した。この固体を水及びヘキサンで洗浄し、得られた固体をトルエンから再結晶化し、目的物の橙色固体78.1mgを得た(収率43%)。
【0110】
目的物のテトラドデシルテトラキス(フェニルエチニル)ジナフトターフェニレンの構造式を下記に示す。
【0111】
【化31】

合成例8 (2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ビス(フェニルエテニル)アントラセンの合成)(一般式(8)の化合物の合成)
窒素雰囲気下、100mlシュレンク反応容器にマグネシウム54.7mg(2.25mmol)及びTHF20mlを添加した。ヨウ素5mgを加えた後、β−ブロモスチレン(東京化成工業製)40mgを添加し、撹拌下マグネシウムを活性化させた。β−ブロモスチレン359mg(1.96mmol、計2.17mmol)を緩く還流が起こる程度に滴下した。滴下終了後、30分間撹拌を継続した。合成例3で合成した2−ブロモ−3−ヨード−6,7−ジドデシルアントラキノン678mg(0.904mmol)を加えた後、混合物を室温で一晩反応させた。次いで反応混合物に3M塩酸水溶液及びジエチルエーテルを加えた後、分相し、さらにジエチルエーテルで抽出した。ジエチルエーテル溶液を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧濃縮した。得られた残渣に酢酸30ml、ヨウ化ナトリウム749mg(5.0mmol)、及び次亜りん酸ナトリウム・1水和物727mg(6.86mmol)を加え、1時間加熱還流下で反応を行った。反応混合物を室温まで冷やし、トルエンで抽出した。トルエン溶液を飽和食塩水で洗浄して無水硫酸ナトリウムで乾燥し、減圧濃縮した。シリカゲルカラムクロマトグラフィー(溶離液;ヘキサン:トルエン=30:1の混合液)で精製し、2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ビス(フェニルエテニル)アントラセンの黄色固体468mgを得た(収率56%)。
【0112】
実施例5 (テトラドデシルテトラキス(フェニルエテニル)ジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
1) (テトラブロモ(テトラドデシル)テトラキス(フェニルエテニル)ジアントラセニルベンゼンの合成)(一般式(2)で示されるテトラハロターフェニル誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に合成例8で合成した2−ブロモ−3−ヨード−6,7−ジドデシル−9,10−ビス(フェニルエテニル)アントラセン451mg(0.488mmol)及びTHF10mlを添加した。この混合物を−70℃に冷却し、イソプロピルマグネシウムブロマイド(東京化成工業製、0.81M)のTHF溶液1.21ml(0.98mmol)を滴下した。−50℃まで昇温した後、−78℃に冷却し、トリメトキシボラン(和光純薬工業製)101.8mg(0.980mmol)を滴下した。徐々に室温まで昇温した後、3M塩酸水溶液を加えて室温で30分間攪拌後、トルエンを添加し分相した。有機相を減圧濃縮した(一般式(6)及び(7)の化合物の合成)。得られた固形物に、合成例5で合成した1,4−ジブロモ−2,5−ジヨードベンゼン108.3mg(0.222mmol)、テトラキス(トリフェニルホスフィン)パラジウム(東京化成工業製)12.8mg(0.011mmol)、トルエン6ml、及びエタノール1.4mlを添加した。さらに炭酸ナトリウム141.2mg(1.332mmol)と水1.9mlからなる水溶液を加え、60℃で70時間反応を実施した。室温まで冷却後、トルエン及び水を添加し分相した。有機相を濃縮し、得られた残渣をトルエン5mlに溶解後、70%tert−ブチルハイドロパーオキサイド溶液(和光純薬工業製)0.02mlを添加し、室温で2時間撹拌した。このトルエン溶液を水で2回洗浄後、有機相を減圧濃縮し、得られた残渣に飽和食塩水及びトルエンを添加した。分相し、有機相を水で洗浄し、無水硫酸ナトリウムで乾燥した。有機相を濾過し、減圧濃縮し、得られた残渣をシリカゲルを充填したカラムで濾過した(溶媒:ヘキサン)。得られた粗固体をヘプタンから再結晶化し、目的物の黄色固体223mgを得た(収率55%)。
FABMS m/z: 1827(M+,100%),1747(M+−Br,8)。
【0113】
MS測定より、テトラブロモ(テトラドデシル)テトラキス(フェニルエテニル)ジアントラセニルベンゼンが得られたことを確認した。なお。その構造式を下記に示す。
【0114】
【化32】

2) (テトラドデシルテトラキス(フェニルエテニル)ジナフトターフェニレンの合成)(一般式(1)で示されるターフェニレン誘導体の合成)
窒素雰囲気下、100mlシュレンク反応容器に実施例5の1)で合成したテトラブロモ(テトラドデシル)テトラキス(フェニルエテニル)ジアントラセニルベンゼン219mg(0.120mmol)及びジエチルエーテル7mlを添加した。この混合物を0℃に冷却後、n−ブチルリチウム(関東化学製、1.59M)のヘキサン溶液0.38ml(0.60mmol)を滴下し、さらに30分間撹拌することでリチオ化の熟成を行った。別の100mlシュレンク反応容器に、塩化銅(II)(和光純薬工業製)112.9mg(0.840mmol)及びTHF15mlを添加し、−78℃に冷却した。ここへ先のジリチオ化物のジエチルエーテル溶液をテフロン(登録商標)キャヌラーを用いて移液した。15時間かけて室温までゆっくり昇温し、3M塩酸水溶液を添加した。分相し、有機相をさらに飽和食塩水で洗浄した。懸濁している有機相を濾過し、固体を濾別した。この固体を水及びヘキサンで洗浄し、得られた固体をトルエンから再結晶化し、目的物の橙色固体72.4mgを得た(収率40%)。
【0115】
目的物のテトラドデシルテトラキス(フェニルエテニル)ジナフトターフェニレンの構造式を下記に示す。
【0116】
【化33】

【図面の簡単な説明】
【0117】
【図1】実施例1の1)で合成したテトラブロモ(テトラドデシル)ジアントラセニルベンゼンの1H NMRスペクトル
【図2】実施例1の2)で合成したテトラドデシルジナフトターフェニレンの1H NMRスペクトル
【特許請求の範囲】
【請求項1】
下記一般式(1)で示されるターフェニレン誘導体の製造方法であって、下記一般式(2)で示されるテトラハロターフェニル誘導体をジアルキルエーテル中でリチオ化剤を用いてリチオ化し、銅化合物と反応させることを特徴とするターフェニレン誘導体の製造方法。
【化1】

(ここで、置換基R1〜R8は同一又は異なって、水素原子、フッ素原子、炭素数1〜30のアルキル基、炭素数4〜30のアリール基、炭素数2〜30のアルキニル基、又は炭素数2〜30のアルケニル基を示し、mは0又は1である。)
【化2】

(ここで、置換基X1〜X4は臭素原子、ヨウ素原子、塩素原子を示す。置換基R1〜R8並びに記号mは請求項1に記載の一般式(1)で示される置換基及び記号と同意義を示す。)
なお、一般式(2)の表記は、一般式(2)が下記一般式(3)及び一般式(4)で示されるパラ位置異性体及びメタ位置異性体を総称するものである。
【化3】

【化4】

(ここで、一般式(3)及び一般式(4)の置換基X1〜X4及びR1〜R8、並びに記号mは一般式(2)で示される置換基並びに記号と同意義を示す。)
【請求項2】
リチオ化剤としてアルキルリチウムを用いることを特徴とする請求項1に記載のターフェニレン誘導体の製造方法。
【請求項1】
下記一般式(1)で示されるターフェニレン誘導体の製造方法であって、下記一般式(2)で示されるテトラハロターフェニル誘導体をジアルキルエーテル中でリチオ化剤を用いてリチオ化し、銅化合物と反応させることを特徴とするターフェニレン誘導体の製造方法。
【化1】

(ここで、置換基R1〜R8は同一又は異なって、水素原子、フッ素原子、炭素数1〜30のアルキル基、炭素数4〜30のアリール基、炭素数2〜30のアルキニル基、又は炭素数2〜30のアルケニル基を示し、mは0又は1である。)
【化2】

(ここで、置換基X1〜X4は臭素原子、ヨウ素原子、塩素原子を示す。置換基R1〜R8並びに記号mは請求項1に記載の一般式(1)で示される置換基及び記号と同意義を示す。)
なお、一般式(2)の表記は、一般式(2)が下記一般式(3)及び一般式(4)で示されるパラ位置異性体及びメタ位置異性体を総称するものである。
【化3】

【化4】

(ここで、一般式(3)及び一般式(4)の置換基X1〜X4及びR1〜R8、並びに記号mは一般式(2)で示される置換基並びに記号と同意義を示す。)
【請求項2】
リチオ化剤としてアルキルリチウムを用いることを特徴とする請求項1に記載のターフェニレン誘導体の製造方法。
【図1】


【図2】




【図2】


【公開番号】特開2010−70473(P2010−70473A)
【公開日】平成22年4月2日(2010.4.2)
【国際特許分類】
【出願番号】特願2008−237718(P2008−237718)
【出願日】平成20年9月17日(2008.9.17)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成22年4月2日(2010.4.2)
【国際特許分類】
【出願日】平成20年9月17日(2008.9.17)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

