チオール保護基
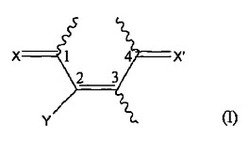

本発明は、チオール化合物中のチオール基を保護するための試薬としての、式(I)の部分を含む化合物の使用に関する(式中、X、X’及びYは、本明細書中に記載したとおりである)。本発明の保護基方法論は、単純かつ選択的なチオール基の保護を可能にする。チオール基を切断してチオール官能基を再生することもまた、容易かつ制御可能である。本発明はさらに、ジスルフィド基の保護に関する類似の保護基方法論を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
(導入)
複雑な有機分子の合成はしばしば、複数の化学的に反応性の官能基を保有する試薬に対して化学変換を実施することを含む。かかるプロセスの重要な局面は、他の官能基に関与する望ましくない副反応を抑制しつつ、特定の官能基で所望の化学変換をもたらす必要性である。従って、化学的保護基の使用は、非常に多数の産業的及び治療的に有用な化合物を産生するのに必要な合成工程を実施する際に十分な特異性を達成することにおいて、重要な道具であることが多い。
【背景技術】
【0002】
化学的保護の基本原理は、概念的には単純であり、その反応性が遮断される分子上の特定の官能基に化学的保護基を導入することによって、その分子上の別の官能基において反応が特異的にもたらされるのを可能にする。しかしながら、この単純な前提の根底には、多様な検討事項がある。これらには、分子の残りの部分に影響を与えない条件下でほぼ定量的な収率を達成するための特定の保護基の導入の必要性、副反応を誘導せずに又はその他の方法でそのプロセスの化学に影響を与えずに、後続の合成工程の間に保護基が完全にインタクトのままであるための要件、及びこれもまた分子上の別の場所に影響を与えない条件下で、必要なくなったときに保護基を除去しやすくする必要性、が挙げられる。さらに、多くの合成方法において、複数の保護基が同時に使用される。かかる方法では、1つの保護基を、任意の他の保護基に影響を与えない条件下で除去できることが、極めて重要であることが多い(いわゆる「直交」保護基ストラテジー)。この文脈において、非常に多数の保護基が知られており、当該分野で慣用的に使用されていることは、驚くべきことではない。
【0003】
チオール官能基(−SH)は、高度に求核性であり、特に酸化プロセスを受けやすいことが周知である。従って、分子中のチオール基の保護は、合成手順の間に特に重要であり得る。例えば、タンパク新生アミノ酸システインの−CH2SH α−置換は、ペプチド合成に関して独自の合成上の問題を提示する。なぜなら、チオール基はその保護されていない形態では、多くの慣用的な操作を妨害するからである。
【0004】
チオール基を保護するための最も一般的なストラテジーはおそらく、直接的アルキル化(例えば、t−ブチル、トリチル又はアセトアミドメチル基による)である。ジスルフィド形成(例えば、t−ブチルチオール基による)及びアシル誘導体化(例えば、チオエステル、チオカーボネート及びチオカルバメートを形成する)もまた、分子の他の部分に化学変換をもたらしつつチオール基を遮蔽するために、しばしば使用される。
【0005】
有機合成方法への組込みに適した新たな保護基がなおも必要とされている。新規チオール保護ストラテジーの開発を支持する特定の検討事項には、十分な特異性でチオールと反応する、必要に応じて容易に切断できる基を見出すこと、分子中の他の官能基(保護されているいないにかかわらず)に対し化学的に不活性な試薬を使用すること、が挙げられる。
【0006】
本発明は、そのC=C二重結合上に求電子性脱離基を保有する1,2−ジカルボニルエテン部分を有する試薬が、チオール化合物中のチオール基を保護するために使用できるという驚くべき知見に基づいている。このストラテジーの利点としては以下が挙げられる:
【0007】
・試薬とチオール化合物との間の反応が、非常に迅速であり、実質的に化学量論的に実施できる。
・試薬が、複雑な有機分子中にしばしば存在する他の官能基(例えば、ヒドロキシル基、アミン基及びカルボキシル基)よりも、チオール官能基に対して選択性が高い。従って、チオール官能基の特異的保護が可能となる。
・化学的保護工程の間に形成されるチオエーテル結合が、容易に逆転可能であり、特に、当業者によって選択された時間で、制御された様式で切断できる。
・コンジュゲート付加反応において求核剤として作用できる試薬によって、チオエーテル結合が切断される。この特異的反応性プロフィールは、広範な合成ストラテジーにおいて利用され得る。例えば、本発明のチオール保護ストラテジーの使用は、保護された分子が、コンジュゲート付加反応求核剤と反応性の他の官能基をいずれも含まない場合、又はかかる試薬に対して化学的に不活性な1個以上のさらなる保護基が存在する場合に、特に有利であり得る。
【0008】
本発明の方法論は、ジスルフィド化合物の保護にも、理想的に適している。なぜなら、第二の求電子性脱離基の組込みが、1,2−ジカルボニルエテン部分がそのC=C二重結合の両方の炭素上に求電子性脱離基を保有し、その試薬をジスルフィド部分中に含まれる硫黄原子の両方と反応できるようにし、それによって、ジスルフィド官能基をマスクする複素環式構造を形成するからである。
【発明の概要】
【課題を解決するための手段】
【0009】
(発明の要旨)
本発明は、チオール化合物中のチオール基を保護するための試薬としての、式(I)の部分を含む化合物の使用を提供する:
【0010】
【化1】

【0011】
式中、
X及びX’は、同じ又は異なって、それぞれ酸素、硫黄又は式=NR1の基を示し、R1は、水素、ヒドロキシル、C1−6アルキル又はフェニルであり、
Yは求電子性脱離基である。
【0012】
本発明はまた、
(i)チオール化合物を、本明細書中に記載される式(I)の部分を含む化合物と反応させて、保護されたチオール基を有する化合物を産生する工程;及び
(ii)その後、該保護されたチオール基を脱保護する工程、
を含むプロセスを提供する。
【0013】
本発明はさらに、式(II)の化合物を提供する:
【0014】
【化2】

【0015】
式中、
X及びX’は、同じ又は異なって、それぞれ酸素、硫黄又は式=NR1の基を示し、R1は、水素、ヒドロキシル、C1−6アルキル又はフェニルであり;
Yは求電子性脱離基であり;
R2は、水素原子又は基IGを示し;
以下のいずれかであり:
R3及びR3’は、同じ又は異なって、それぞれ水素原子又は基IGを示す;又は
R3及びR3’は一緒になって、式−N(R33’)の基を形成し、R33’は水素原子又は基IGを示す;又は
R3及びR3’は一緒になって、式−N(R33’)−N(R33’)−の基を形成し、各R33’は、同じ又は異なって、水素原子又は基IGを示す;
各基IGは、同じ又は異なって、非置換であるか又は1個以上のハロゲン原子で置換されている、C1−20アルキル基、C2−20アルケニル基又はC2−20アルキニル基である部分を示し、式中、(a)0、1又は2個の炭素原子は、C6−10アリーレン、5〜10員のヘテロアリーレン、C3−7カルボシクリレン(carbocyclylene)及び5〜10員のヘテロシクリレン(heterocyclylene)基から選択される基によって置換されており、かつ(b)0、1又は2個の−CH2−基は、−O−、−S−、−S−S−、−C(O)−、−NH−及び−N(C1−6アルキル)−基から選択される基によって置換されており、式中、
(i)該アリーレン、ヘテロアリーレン、カルボシクリレン及びヘテロシクリレン基は、非置換であるか又はハロゲン原子並びにC1−6アルキル、C1−6アルコキシ、C1−6アルキルチオール、−N(C1−6アルキル)(C1−6アルキル)及びニトロ基から選択される1個以上の置換基によって置換されており;
(ii)該カルボシクリレン及びヘテロシクリレン基中の0、1又は2個の炭素原子は、−C(O)−基によって置換されており;
Qは、カルボキシル基又は保護されたカルボキシル基であり;
Q’は、アミン基又は保護されたアミン基であり;
ただし、式(II)の化合物は、14C−N−エチルマレイミド−S−システインでも14C−N−エチルマレイミド−S−N−アセチル−システインでもない。
【0016】
本発明はまた、ジスルフィド化合物中のジスルフィド基を保護するための試薬としての、式(III)の部分を含む化合物の使用を提供する:
【0017】
【化3】

【0018】
式中、
X及びX’は、同じ又は異なって、それぞれ酸素、硫黄又は式=NR1の基を示し、R1は、水素、ヒドロキシル、C1−6アルキル又はフェニルであり;
Y及びY’は、同じ又は異なって、それぞれ求電子性脱離基を示す。
【0019】
なおさらに、本発明は、
(i)ジスルフィド化合物中のジスルフィド基を、本発明の式(III)の部分を含む化合物と反応させて、保護されたジスルフィド基を有する化合物を産生する工程;及び
(ii)その後、該保護されたジスルフィド基を脱保護する工程、
を含むプロセスを提供する。
【図面の簡単な説明】
【0020】
【図1】図1は、実施例51に記載されるプロトコルの結果を示し、該実施例では、タンパク質/ビオチン−PEG−ブロモマレイミド付加物及び未修飾のモデルタンパク質溶液(In)を、ニュートラアビジン被覆したアガロースビーズに添加し、遠心分離し、フロースルー(FT)収集し、ビーズをPBSで洗浄し、両方の洗浄画分を収集し(W1及びW2)、タンパク質を、β−メルカプトエタノールを含むPBS中でインキュベートすることによりビーズから放出させ、サンプルを遠心分離し、切断されたタンパク質を含む溶離液(El)を収集した。
【図2】図2は、LC−MS(y軸=シグナル%;x軸=時間/min)によって測定される、実施例65に記載されるプロトコルに従った、ハロマレイミドからのソマトスタチン−マレイミド付加物の生成を示す。左上:ジクロロマレイミド(丸)、ジブロモマレイミド(四角)及びジヨードマレイミド(三角)からのソマトスタチン付加物の生成。右上:モノブロモマレイミド(丸)、N−メチルモノブロモマレイミド(四角)及びN−メチルジブロモマレイミド(三角)からのソマトスタチン付加物の生成。左下:N−フルオレセイン−ジブロモマレイミド(丸)、N−ビオチン−ジブロモマレイミド(四角)、N−PEG 5000−ジブロモマレイミド(三角)、N−PEG−5000−ジチオフェノールマレイミド(菱形)及びN−PEG 300−ジブロモマレイミド(卵型)からのソマトスタチン付加物の生成。
【図3】図3は、LC−MS(y軸=シグナル%;x軸=時間/min)によって測定される、実施例65に記載されるプロトコルに従った、ジチオマレイミドからのソマトスタチン−マレイミド付加物の生成を示す。左上:当量(丸)、5当量(四角)及び10当量(三角)における、ジ−2−メルカプトエタノールマレイミドからのソマトスタチン付加物の生成。右上:1当量(丸)、5当量(四角)及び10当量(三角)における、ジシステインマレイミドからのソマトスタチン付加物の生成。左下:1当量(丸)、5当量(四角)及び10当量(三角)における、ジチオフェノールマレイミドからのソマトスタチン付加物の生成。右下:1当量(丸)、5当量(四角)及び10当量(三角)における、ジ−2−メルカプトピリジンマレイミドからのソマトスタチン付加物の生成。
【図4】図4は、LC−MS(y軸=シグナル%;x軸=分(min)、時間(h)及び日(d)で示される時間)によって測定される、実施例65に記載されるプロトコルに従った、種々の還元剤によるマレイミド架橋ソマトスタチンの切断を示す。左上:DTTによる総修飾ソマトスタチン−マレイミド(白丸)及び副産物の総量(黒丸)。上中:2−メルカプトエタノールによる総修飾ソマトスタチン−マレイミド(白丸)及び副産物の総量(黒丸)。右上:GSHによる総修飾ソマトスタチン−マレイミド(白丸)及び副産物の総量(黒丸)。左下:TCEPによる総修飾ソマトスタチン−マレイミド(白丸)及び副産物の総量(黒丸)。右下:1,2−エタンジチオールによる総修飾ソマトスタチン−マレイミド(白丸)及び副産物の総量(黒丸)。
【図5】図5は、LC−MS(y軸=シグナル%;x軸=時間/min)によって測定される、実施例65に記載されるプロトコルに従った、種々の量のDTT及び2−メルカプトエタノールによるマレイミド架橋ソマトスタチンの切断を示す。左:50当量(白丸)、20当量(白三角)及び10当量(白四角)のDTTによるソマトスタチンの再生。右:50当量(白丸)、20当量(白三角)及び10当量(白四角)の2−メルカプトエタノールによるソマトスタチンの再生、並びに50当量(黒丸)、20当量(黒三角)及び10当量(黒四角)での副産物の総量。
【図6】図6は、LC−MS(y軸=シグナル%;x軸=時間/min)によって測定される、実施例65に記載されるプロトコルに従った、架橋ソマトスタチンの触媒された切断を示す。図に示すのは、2−メルカプトエタノール(白丸)、2−メルカプトエタノールと共にNaI(白四角)、及び2−メルカプトエタノールと共にベンゼンセレノール(白三角)による、ソマトスタチンの再生、並びに2−メルカプトエタノール(黒丸)、2−メルカプトエタノールと共にNaI(黒四角)、及び2−メルカプトエタノールと共にベンゼンセレノール(黒三角)を使用したときの、総副産物である。
【図7】図7は、LC−MS(y軸=シグナル%;x軸=分(min)、時間(h)及び日(d)で示される時間)によって測定される、実施例65に記載されるプロトコルに従った、2−メルカプトエタノールによるN−官能化マレイミド架橋ソマトスタチンの切断を示す。左上:N−メチルマレイミドソマトスタチン付加物の切断により、ソマトスタチン(白丸)及び総副産物(黒丸)が生じる。上中:N−ビオチンマレイミドソマトスタチン付加物の切断により、ソマトスタチン(白丸)及び総副産物(黒丸)が生じる。右上:N−フルオレセインマレイミドソマトスタチン付加物の切断により、ソマトスタチン(白丸)及び総副産物(黒丸)が生じる。左下:N−PEG 5000マレイミドソマトスタチン付加物の切断により、ソマトスタチン(白丸)及び総副産物(黒丸)が生じる。下中:N−PEG 300マレイミドソマトスタチン付加物の切断により、ソマトスタチン(白丸)及び総副産物(黒丸)が生じる。
【図8】図8は、LC−MS(y軸=シグナル%;x軸=時間/hours)によって測定される、実施例65に記載されるプロトコルに従った、モノブロモマレイミドとソマトスタチンとのジ付加生成物の切断を示す。左上:2−メルカプトエタノールを使用した、ソマトスタチン−マレイミド(白丸)、ソマトスタチン−ビス−マレイミド(黒丸)及び総副産物(三角)。右上:DTTを使用した、ソマトスタチン−マレイミド(白丸)、ソマトスタチン−ビス−マレイミド(黒丸)及び総副産物(三角)。左下:TCEPを使用した、ソマトスタチン−マレイミド(白丸)、ソマトスタチン−ビス−マレイミド(黒丸)及び総副産物(三角)。
【図9】図9は、LC−MS(y軸=シグナル%;x軸=時間/min)によって測定される、実施例65に記載されるプロトコルに従った、種々の量のジチオマレイミドによるソマトスタチンの比較上のin situ架橋を示す。本図は、3:5の比率のTCEP開始剤及びチオフェノール(丸)、5:10の比率のセレノール開始剤とチオフェノール(四角)、及び10:20の比率のセレノール開始剤と2−メルカプトエタノール(三角)、を使用した架橋ソマトスタチンの生成を示す。
【図10】図10は、LC−MS(y軸=シグナル%;x軸=時間/min)によって測定される、実施例65に記載されるプロトコルに従った、ソマトスタチンのin situ PEG化を示す。本図は、5当量のN−PEG5000−ジチオフェノールマレイミド及び3当量のTCEPを使用した(丸)、並びに10当量のN−PEG5000−ジチオフェノールマレイミド及び5当量のベンゼンセレノールを使用した(四角)、PEG化ソマトスタチンの生成を示す。
【図11】図11は、実施例65に記載されたパッチクランプアッセイで得られたホールセルパッチクランプ電流記録を示す。本図は、SSTR2を発現するGIRK 1/2A株化細胞から記録された、代表的な出力波形を示す。細胞を−60mVでクランプし、20μMのソマトスタチン又はその誘導体を20秒間適用した。左上:ソマトスタチン(示された軸において、垂直線は1000pAを示し、水平線は20msを示す)。右上:ジブロモマレイミド架橋ソマトスタチン(示された軸において、垂直線は1000pAを示し、水平線は20msを示す)。左下:フルオレセインジブロモマレイミド架橋ソマトスタチン(示された軸において、垂直線は1000pAを示し、水平線は20msを示す)。右下:PEG化ジブロモマレイミド架橋ソマトスタチン(示された軸において、垂直線は1000pAを示し、水平線は20msを示す)。
【図12】図12は、実施例65に記載されたパッチクランプアッセイにおける、ソマトスタチン及びそのアナログにより活性化された電流の振幅を示す。x軸は、電流の振幅をpA/pFで示す。上の2本のバーはフルオレセインジブロモマレイミド架橋ソマトスタチンに由来し(黒のバーは、百日咳毒素による24時間にわたる細胞の前処理後であり;灰色のバーは前処理なしである)、次の2本のバーはPEG化ジブロモマレイミド架橋ソマトスタチンに由来し(黒のバーは、百日咳毒素による24時間にわたる細胞の前処理後であり;灰色のバーは前処理なしである)、次の3本のバーはジブロモマレイミド架橋ソマトスタチンに由来し(白のバーは、GIRK阻害剤TertiapinQ(100nM)との5分間のプレインキュベーション後であり;黒のバーは、百日咳毒素による24時間にわたる細胞の前処理後であり;灰色のバーは前処理なしである)、下の2本のバーはソマトスタチンに由来する(黒のバーは、百日咳毒素による24時間にわたる細胞の前処理後であり;灰色のバーは前処理なしである)。
【発明を実施するための形態】
【0021】
本明細書中で使用する場合、用語「基」及び「部分」は相互交換可能に使用される。
【0022】
本明細書中で使用する場合、「チオール化合物」は、少なくとも1個のチオール基−SHを含む化合物である。
【0023】
本明細書中で使用する場合、用語「求電子性脱離基」とは、その炭素原子における求核攻撃後に求核剤により置換され得る、飽和又は不飽和の炭素原子に結合した置換基を意味する。当業者は、特定の化合物上に位置付けるため及び特定の求核剤と反応するために適した求電子性脱離基を、慣用的に選択できる。
【0024】
本明細書中で使用する場合、用語「求核剤」とは、電子対を提供することによって化学結合を形成することができる官能基又は化合物を意味する。
【0025】
本明細書中で使用する場合、表現「チオール基を保護する」とは、チオール化合物上に保持されるチオール基(−SH)に保護基を導入することを意味する。保護基を使用する化学的保護の概念は、もちろん、有機合成の分野で十分理解されている。従って、当業者であれば、試薬又はプロセスの特定の使用が、「チオール基を保護する」ことを含むことを即座に認識するであろう。
【0026】
本明細書中で使用する場合、用語「保護基」とは、化合物中の官能基に導入された、その官能基の化学的反応性を修飾する基を意味する。典型的には、保護基は、その官能基を、引き続く化学変換がその化合物にもたらされる場合に使用される反応条件に対して化学的に不活性にするといった方法で、官能基の化学的反応性を修飾する。従って、「チオール保護基」は、化合物中のチオール基に導入された保護基である。
【0027】
当業者が即座に認識するように、保護基は、(保護されていない)官能基と保護基前駆体との間の反応によって、化合物中の官能基に導入される。保護されていないチオール官能基は、保護された化合物が形成される(即ち、化合物と保護基との間にチオール結合−S−が形成される)ときに典型的には離脱するプロトンを保有する。本発明において、保護基前駆体は、式(I)の部分を含む化合物である。チオール化合物上のチオール基が式(I)の部分を含む化合物と反応する場合、チオール基は、求電子性脱離基 Yを置換することによって、C=C二重上の炭素原子の一方に結合する。従って、本発明の保護基は、式(I’)の部分を含む基である:
【0028】
【化4】

【0029】
本明細書中で使用する場合、「保護された官能基」とは、保護基への結合によって化学的に保護された官能基を意味する。本発明によれば、「保護されたチオール基」は、式(I’)の部分を含む基に結合したチオール基である。「保護されたアミン基」は、アミン基(−NH2)を保護することによって得られ得る基である。「保護されたカルボキシル基」は、カルボキシル基(−COOH)を保護することによって得られ得る基である。
【0030】
本明細書中で使用する場合、「脱保護する」とは、保護された官能基から保護基を除去することを意味する。従って、本発明では、保護されたチオール基を脱保護することは、保護されたチオール基から式(I’)の部分を含む基を除去することを含む。
【0031】
本明細書中で使用する場合、2個以上の保護基に関して用語「直交(orthogonal)」とは、保護基の1つ1つが、それが結合した官能基から除去され得、他の保護基が化学的に不活性である反応条件が存在することを意味する。例えば、第一の保護基が塩基性条件下で除去できるが酸性条件下では除去できず、第二の保護基が酸性条件下で除去できるが塩基性条件下では除去できない場合、これら第一及び第二の保護基は、直交保護基を構成する。
【0032】
本明細書中で使用する場合、用語「アルキル」には、直鎖及び分枝鎖の両方の飽和アルキル基が含まれる。好ましくは、アルキル基は、C1−20アルキル基、より好ましくはC1−15、なおより好ましくはC1−12アルキル基、なおより好ましくはC1−6アルキル基であり、最も好ましくはC1−4アルキル基である。特に好ましいアルキル基には、例えば、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、tert−ブチル、ペンチル及びヘキシルが挙げられる。用語「アルキレン」は、しかるべく解釈されるべきである。
【0033】
本明細書中で使用する場合、用語「アルケニル」とは、分枝鎖でも非分枝鎖でもよい、1個以上の炭素−炭素二重結合を含む基をいう。好ましくは、アルケニル基は、C2−20アルケニル基、より好ましくはC2−15アルケニル基、なおより好ましくはC2−12アルケニル基、又は好ましくはC2−6アルケニル基であり、最も好ましくはC2−4アルケニル基である。用語「アルケニレン」は、しかるべく解釈されるべきである。
【0034】
本明細書中で使用する場合、用語「アルキニル」とは、分枝鎖でも非分枝鎖でもよい、1個以上の三重結合を含む炭素鎖をいう。好ましくは、アルキニル基は、C2−20アルキニル基、より好ましくはC2−15アルキニル基、なおより好ましくはC2−12アルキニル基、又は好ましくはC2−6アルキニル基であり、最も好ましくはC2−4アルキニル基である。用語「アルキニレン」は、しかるべく解釈されるべきである。
【0035】
特に指定しない場合、アルキル、アルケニル又はアルキニル基は、典型的には非置換である。しかしながら、かかる基が非置換又は置換であると示されている場合、1個以上の水素原子が、ハロゲン原子置換基で置換されていてもよい。好ましくは、置換されたアルキル、アルケニル又はアルキニル基は、1〜10個の置換基、より好ましくは1〜5個の置換基、なおより好ましくは1、2又は3個の置換基、最も好ましくは1又は2個の置換基、例えば1個の置換基を有する。しかし好ましくは、アルキル、アルケニル又はアルキニル基は、非置換である。
【0036】
アルキル、アルケニル若しくはアルキニル基である部分において、(a)0、1又は2個の炭素原子は、C6−10アリーレン、5〜10員のヘテロアリーレン、C3−7カルボシクリレン及び5〜10員のヘテロシクリレン基から選択される基によって置換されていてもよく、かつ(b)0、1又は2個の−CH2−基は、−O−、−S−、−S−S−、−C(O)−及び−N(C1−6アルキル)−基から選択される基によって置換されていてもよく、合計で0、1又は2個の該炭素原子及び−CH2−基が置換されていることが好ましく、合計で0又は1個がより好ましい。最も好ましくは、炭素原子又は−CH2−基のいずれも置換されていない。
【0037】
−CH2−基を置換するための好ましい基は、−O−、−S−及び−C(O)−基である。炭素原子を置換するための好ましい基は、フェニレン、5〜6員のヘテロアリーレン、C5−6カルボシクリレン及び5〜6員のヘテロシクリレン基である。本明細書中で使用する場合、「0、1又は2個の炭素原子」への言及は、アルキル、アルケニル又はアルキニル鎖中の任意の末端又は非末端炭素原子(その炭素原子に結合した任意の水素原子を含む)を意味する。本明細書中で使用する場合、「0、1又は2個の−CH2−基」への言及は、アルキル、アルケニル又はアルキニル鎖中の末端炭素原子に対応しない基をいう。
【0038】
本明細書中で使用する場合、C6−10アリール基は、6〜10個の炭素原子を有する、単環式又は多環式の6〜10員の芳香族炭化水素環系である。フェニルが好ましい。用語「アリーレン」は、しかるべく解釈されるべきである。
【0039】
本明細書中で使用する場合、5〜10員のヘテロアリール基は、O、S及びNから選択される少なくとも1個のヘテロ原子、例えば、1、2、3又は4個のヘテロ原子を含む、単環式又は多環式の5〜10員の芳香族環系(例えば、5〜6員環)である。環が4個のヘテロ原子を含む場合、これらは好ましくは全てが窒素原子である。用語「ヘテロアリーレン」は、しかるべく解釈されるべきである。
【0040】
単環式ヘテロアリール基の例としては、チエニル、フリル、ピロリル、イミダゾリル、チアゾリル、イソチアゾリル、ピラゾリル、オキサゾリル、イソオキサゾリル、トリアゾリル、チアジアゾリル、オキサジアゾリル、ピリジニル、ピリダジニル、ピリミジニル、ピラジニル、トリアジニル及びテトラゾリル基が挙げられる。
【0041】
多環式ヘテロアリール基の例としては、ベンゾチエニル、ベンゾフリル、ベンズイミダゾリル、ベンゾチアゾリル、ベンゾイソチアゾリル、ベンゾオキサゾリル、ベンゾイソオキサゾリル、ベンゾトリアゾリル、インドリル、イソインドリル及びインダゾリル基が挙げられる。好ましい多環式基としては、インドリル、イソインドリル、ベンズイミダゾリル、インダゾリル、ベンゾフリル、ベンゾチエニル、ベンゾオキサゾリル、ベンゾイソオキサゾリル、ベンゾチアゾリル及びベンゾイソチアゾリル基が挙げられ、より好ましくはベンズイミダゾリル、ベンゾオキサゾリル及びベンゾチアゾリルであり、最も好ましくはベンゾチアゾリルである。しかしながら、単環式ヘテロアリール基が好ましい。
【0042】
好ましくは、ヘテロアリール基は、5〜6員のヘテロアリール基である。特に好ましいヘテロアリール基は、チエニル、ピロリル、イミダゾリル、チアゾリル、イソチアゾリル、ピラゾリル、オキサゾリル、イソオキサゾリル、トリアゾリル、ピリジニル、ピリダジニル、ピリミジニル及びピラジニル基である。より好ましい基は、チエニル、ピリジニル、ピリダジニル、ピリミジニル、ピラジニル、ピロリル及びトリアジニルでり、最も好ましくはピリジニルである。
【0043】
本明細書中で使用する場合、5〜10員のヘテロシクリル基は、1個以上の炭素原子、例えば1、2、3又は4個の炭素原子が、N、O、S、S(O)及びS(O)2から選択される部分で置換されている、非芳香族の、飽和又は不飽和の、単環式又は多環式のC5−10炭素環式環系である。好ましくは、5〜10員のヘテロシクリル基は5〜6員環である。用語「ヘテロシクリエン(heterocyclyene)」は、しかるべく解釈されるべきである。
【0044】
ヘテロシクリル基の例としては、アゼチジニル、オキセタニル、チエタニル(thietanyl)、ピロリジニル、イミダゾリジニル、オキサゾリジニル、イソオキサゾリジニル、チアゾリジニル、イソチアゾリジニル、テトラヒドロフラニル、テトラヒドロチエニル、テトラヒドロピラニル、テトラヒドロチオピラニル、ジチオラニル(dithiolanyl)、ジオキソラニル、ピラゾリジニル、ピペリジニル、ピペラジニル、ヘキサヒドロピリミジニル、メチレンジオキシフェニル、エチレンジオキシフェニル、チオモルホリニル、S−オキソ−チオモルホリニル、S,S−ジオキソ−チオモルホリニル、モルホリニル、1,3−ジオキソラニル、1,4−ジオキソラニル、トリオキソラニル(trioxolanyl)、トリチアニル(trithianyl)、イミダゾリニル、ピラニル、ピラゾリニル、チオキソラニル(thioxolanyl)、チオキソチアゾリジニル、1H−ピラゾール−5−(4H)−オニル、1,3,4−チアジアゾール−2(3H)−チオニル、オキソピロリジニル、オキソチアゾリジニル、オキソピラゾリジニル、スクシンイミド(succinimido)及びマレイミド基及び部分が挙げられる。好ましいヘテロシクリル基は、ピロリジニル、イミダゾリジニル、オキサゾリジニル、イソオキサゾリジニル、チアゾリジニル、イソチアゾリジニル、テトラヒドロフラニル、テトラヒドロチエニル、テトラヒドロピラニル、テトラヒドロチオピラニル、ジチオラニル、ジオキソラニル、ピラゾリジニル、ピペリジニル、ピペラジニル、ヘキサヒドロピリミジニル、チオモルホリニル及びモルホリニル基及び部分である。より好ましいヘテロシクリル基は、テトラヒドロピラニル、テトラヒドロチオピラニル、チオモルホリニル、テトラヒドロフラニル、テトラヒドロチエニル、ピペリジニル、モルホリニル及びピロリジニル基である。
【0045】
疑義を回避するため、ヘテロアリール基及びヘテロシクリル基の上記定義は、環中に存在し得る「N」部分をいうが、熟練の化学者に明らかなように、N原子は、単結合を介して隣接する環原子のそれぞれに結合した場合、プロトン化される(又は以下に規定する置換基を有する)であろう。
【0046】
本明細書中で使用する場合、C3−7カルボシクリル基は、3〜7個の炭素原子を有する、非芳香族の、飽和又は不飽和の炭化水素環である。好ましくは、C3−7カルボシクリル基は、3〜7個の炭素原子、より好ましくは5〜6個の炭素原子を有する、飽和又はモノ不飽和の炭化水素環(即ち、シクロアルキル部分又はシクロアルケニル部分)である。例としては、シクロプロピル、シクロブチル、シクロペンチル及びシクロヘキシル、並びにそれらのモノ不飽和バリアントが挙げられる。特に好ましい炭素環式基は、シクロペンチル及びシクロヘキシルである。用語「カルボシクリレン」は、しかるべく解釈されるべきである。
【0047】
具体的には、カルボシクリレン又はヘテロシクレン基中の0、1又は2個の炭素原子は、−C(O)−基で置換され得る。本明細書中で使用する場合、置換される「炭素原子」は、それらが結合する水素原子を含むことが理解される。1又は2個の炭素原子が置換される場合、2個のかかる炭素原子が置換されることが好ましい。好ましいかかるカルボシクリル基としてはベンゾキノン基が挙げられ、好ましいかかるヘテロシクリル基としてはスクシンイミド及びマレイミド基が挙げられる。
【0048】
特に指定しない場合、アリール、ヘテロアリール、カルボシクリル又はヘテロシクリル基は、典型的には非置換である。しかしながら、かかる基が非置換又は置換であると示されている場合、1個以上の水素原子が、ハロゲン原子又はC1−6アルキル、C1−6アルコキシ、C1−6アルキルチオール、−N(C1−6アルキル)(C1−6アルキル)若しくはニトロ基で置換されていてもよい。好ましくは、置換されたアリール、ヘテロアリール、カルボシクリル又はヘテロシクリル基は、1〜4個の置換、より好ましくは1〜2個の置換基、最も好ましくは1個の置換基を有する。好ましくは、置換されたアリール、ヘテロアリール、カルボシクリル又はヘテロシクリル基は、2個以下のニトロ置換基を有する。好ましい置換基は、ハロゲン原子並びにC1−4アルキル及びC1−4アルコキシ基である。特に好ましい置換基はハロゲン原子である。しかし好ましくは、アリール、ヘテロアリール、カルボシクリル又はヘテロシクリル基は、非置換である。
【0049】
本明細書中で使用する場合、ハロゲン原子は、典型的にはF、Cl、Br又はI原子であり、好ましくはBr又はCl原子であり、より好ましくはBr原子である。
【0050】
本明細書中で使用する場合、C1−6アルコキシ基は、酸素原子に結合したC1−6アルキル(例えば、C1−4アルキル)基である。
【0051】
本明細書中で使用する場合、C1−6アルキルチオール基は、硫黄原子に結合したC1−6アルキル(例えば、C1−4アルキル)基である。
【0052】
本明細書中で使用する場合、5〜10員のヘテロシクリルチオールは、硫黄原子に結合した5〜10員の(例えば、5〜6員の)ヘテロシクリル基である。
【0053】
本明細書中で使用する場合、C6−10アリールチオールは、硫黄原子に結合したC6−10アリール(例えば、フェニル)基である。
【0054】
本明細書中で使用する場合、C3−7カルボシクリルチオールは、硫黄原子に結合したC3−7カルボシクリル(例えば、C5−6カルボシクリル)基である。
【0055】
疑義を回避するため、トリフレート基はトリフルオロメタンスルホネート基であり、トシレート基はp−トルエンスルホネート基であり、メシレート基はメタンスルホネート基である。
【0056】
好ましくは、X及びX’は、同じ又は異なって、それぞれ酸素、硫黄又は式=NHの基を示す。より好ましくは、X及びX’は、同じ又は異なって、それぞれ酸素又は硫黄を示す。好ましくは、X及びX’の少なくとも一方は酸素を示す。最も好ましくは、X及びX’は共に酸素である。
【0057】
Yは、好ましくは、ハロゲン原子又はトリフレート、トシレート、メシレート、N−ヒドロキシスクシンイミジル、N−ヒドロキシスルホスクシンイミジル、C1−6アルキルチオール、5〜10員のヘテロシクリルチオール、C6−10アリールチオール、C3−7カルボシクリルチオール、−OC(O)CH3、−OC(O)CF3、フェニルオキシ、−NRxRyRz+若しくは−PRxRyRz+基である。より好ましくは、Yは、ハロゲン原子又はトリフレート、トシレート、メシレート、N−ヒドロキシスクシンイミジル、N−ヒドロキシスルホスクシンイミジル、C1−6アルキルチオール、5〜10員のヘテロシクリルチオール、C6−10アリールチオール若しくはC3−7カルボシクリルチオールである。なおより好ましくは、Yは、ハロゲン原子又はC1−6アルキルチオール、5〜10員のヘテロシクリルチオール、C6−10アリールチオール若しくはC3−7カルボシクリルチオールである。最も好ましくは、Yは、ハロゲン原子、特に臭素原子である。
【0058】
Rx、Ry及びRzはそれぞれ、好ましくは、水素原子及びC1−6アルキル基から選択される。より好ましくは、Rx、Ry及びRzはそれぞれ、好ましくは、水素原子並びにメチル及びエチル基から選択される。好ましくは、特定の−NRxRyRz+又は−PRxRyRz+基では、Rx、Ry及びRzは同じである。
【0059】
式(I)の部分は、本発明に従ってチオール含有化合物を化学的に保護させる重要な反応性部分を示すことが明らかであろう。式(I)の部分(及び式(II)の部分、別の箇所で詳細に記載される)において、記号
【0060】
【化5】

【0061】
は、別の基への結合点を意味する。これらの結合点を介して結合した基の正体は、本発明には重要でないことが理解されよう。当業者であれば、特定の目的に合うように、これらの結合点を介して結合した基を、例えば、保護すべきチオール化合物又はジスルフィド化合物の具体的な正体に基づいて、選択することが可能であることが容易に理解できよう。
【0062】
好ましくは、式(I)の部分を含む化合物は、式(Ia)の化合物
【0063】
【化6】

【0064】
であり、式中、
X及びX’は、同じ又は異なって、それぞれ酸素、硫黄又は式=NR1の基を示し、R1は、水素、ヒドロキシル、C1−6アルキル又はフェニルであり;
Yは求電子性脱離基であり;
R2は、水素原子又は基IGを示し;
以下のいずれかであり:
R3及びR3’は、同じ又は異なって、それぞれ水素原子又は基IGを示す;又は
R3及びR3’は一緒になって、式−N(R33’)の基を形成し、R33’は水素原子又は基IGを示す;又は
R3及びR3’は一緒になって、式−N(R33’)−N(R33’)−の基を形成し、各R33’は、同じ又は異なって、水素原子又は基IGを示す;
各基IGは、同じ又は異なって、非置換であるか又は1個以上のハロゲン原子で置換されている、C1−20アルキル基、C2−20アルケニル基又はC2−20アルキニル基である部分を示し、式中、(a)0、1又は2個の炭素原子は、C6−10アリーレン、5〜10員のヘテロアリーレン、C3−7カルボシクリレン及び5〜10員のヘテロシクリレン基から選択される基によって置換されており、かつ(b)0、1又は2個の−CH2−基は、−O−、−S−、−S−S−、−C(O)−、−NH−及び−N(C1−6アルキル)−基から選択される基によって置換されており、式中、
(i)該アリーレン、ヘテロアリーレン、カルボシクリレン及びヘテロシクリレン基は、非置換であるか又はハロゲン原子並びにC1−6アルキル、C1−6アルコキシ、C1−6アルキルチオール、−N(C1−6アルキル)(C1−6アルキル)及びニトロ基から選択される1個以上の置換基によって置換されており;
(ii)該カルボシクリレン及びヘテロシクリレン基中の0、1又は2個の炭素原子は、−C(O)−基によって置換されている。
【0065】
好ましくは、R3及びR3’は、同じ又は異なって、それぞれ水素原子又は基IGを示すか、或いはR3及びR3’は一緒になって、式−N(R33’)の基を形成し、R33’は水素原子又は基IGを示す。
【0066】
1つの好ましい実施形態において、R2が基IGである場合、好ましくは、R2は、式(Ia)の3位に直接結合した、−O−、−S−、−NH−及び−N(C1−6アルキル)−から選択される基を含む(即ち、R2は、3位に隣接する−CH2−基が、−O−、−S−、−NH−又は−N(C1−6アルキル)−基によって置換された部分である)。
【0067】
R2は好ましくは、水素原子又はC1−6アルキル基である。最も好ましくは、R2は水素原子である。
【0068】
R3及びR3’が同じ又は異なって、それぞれ水素原子又は基IGを示す場合、好ましくは、R3及びR3’の少なくとも一方は基IGである。好ましくは、R3及びR3’は共に基IGを示す。
【0069】
R3、R3’、又はR3及びR3’が基IGを示す場合、その基IG又は各基IGは好ましくは、式−Z(C1−6アルキル)の基であり、式中、Zは、直接的結合又は基−O−、−S−、−NH−若しくは−N(C1−6アルキル)である。より好ましくは、この実施形態において、その基IG又は各基IGは、式−Z(C1−2アルキル)の基であり、式中、Zは、直接的結合又は基−O−、−NH−若しくは−N(C1−6アルキル)である。最も好ましくは、この実施形態において、その基IG又は各基IGは、式−Z(C1−2アルキル)の基であり、式中、Zは、直接的結合又は基−O−若しくは−N(C1−6アルキル)である。
【0070】
好ましくは、R3及びR3’は一緒になって、式−N(R33’)の基を形成する。
【0071】
R33’は好ましくは、水素原子又はC1−6アルキル基を示し、最も好ましくは、R33’は、水素原子又はメチル若しくはエチル基(例えば、メチル又はエチル基)を示す。
【0072】
IGは好ましくは、非置換のC1−6アルキル基、C2−6アルケニル基又はC2−6アルキニル基である部分を示し、式中、(a)0又は1個の炭素原子は、フェニレン、5〜6員のヘテロアリーレン、C5−6カルボシクリレン及び5〜6員のヘテロシクリレン基から選択される基によって置換されており、該フェニレン、ヘテロアリーレン、カルボシクリレン及びヘテロシクリレン基は、非置換であるか又はハロゲン原子並びにC1−4アルキル及びC1−4アルコキシ基から選択される1又は2個の置換基によって置換されており、かつ(b)0、1又は2個の−CH2−基は、−O−、−S−、−C(O)−、−NH−及び−N(C1−6アルキル)−基から選択される基によって置換されている。
【0073】
より好ましくは、IGは、非置換のC1−6アルキル基である部分を示し、式中、(a)0又は1個の炭素原子は、非置換のフェニレン、5〜6員のヘテロアリーレン、C5−6カルボシクリレン及び5〜6員のヘテロシクリレン基から選択される基によって置換されており、かつ(b)0又は1個の−CH2−基は、−O−、−NH−及び−N(C1−6アルキル)−基から選択される基によって置換されている。
【0074】
なおより好ましくは、IGは、非置換のC1−6アルキル又はフェニル基を示す。
【0075】
最も好ましくは、IGは、非置換のC1−6アルキル基(例えば、メチル又はエチル基)を示す。
【0076】
好ましくは、基IGは、基−NH−が基−C(O)−又は−C(S)−に直接隣接して位置していない限り、いずれの基−NH−も含まない。より好ましくは、基IGは、基−NH−が基−C(O)−に直接隣接して位置していない限り、いずれの基−NH−も含まない。
【0077】
好ましくは、式(Ia)の化合物は、式(Ib)の化合物:
【0078】
【化7】

【0079】
であり、式中、X、X’、Y、R2及びR33’は全て、本明細書中に記載したとおりである。
【0080】
式(Ib)の化合物において、特に好ましくは、
X及びX’はそれぞれ酸素原子を示し;
R33’は水素原子又はC1−6アルキル基を示し;
Yはハロゲン原子を示し;
R2は水素原子又はC1−6アルキル基を示す。
【0081】
1実施形態において、本発明は、チオール化合物中のチオール基を保護するための試薬としての、上記式(I)の部分を含む化合物の使用に関する。典型的には、この使用は、式(I)の部分を含む化合物をチオール化合物と反応させることを含む。式(I)の部分を含む化合物をチオール化合物と反応させることで、チオール基が上記式(I’)の保護基で保護された化合物が産生される。
【0082】
式(I)の部分を含む化合物は、標準的な文献に記載された手順及び当業者に周知の手順に従って、チオール化合物と反応させることができる。典型的な文献情報源は、「Advanced organic chemistry」、第4版(Wiley)、J March、「Comprehensive Organic Transformation」、第2版(Wiley)、R.C.Larock、「Handbook of Heterocyclic Chemistry」、第2版(Pergamon)、A.R.Katritzkyであり、「Synthesis」、「Acc.Chem.Res.」、「Chem.Rev」などに見出されるような総説記事、又は標準的な文献検索オンラインによって同定される又は「Chemical Abstracts」若しくは「Beilstein」などの二次的情報源からの、一次文献情報源である。
【0083】
好ましくは、この使用は、多工程合成手順の間の、チオール化合物中のチオール基を保護するための試薬としての、式(I)の部分を含む化合物の使用である。典型的には、多工程の合成手順は、保護されたチオール基ではない、チオール化合物が保有する官能基(例えば、チオール基ではない官能基)に化学変換をもたらすことを含む、少なくとも1つの合成工程を含む。好ましくは、この少なくとも1つの合成工程は、保護されたチオール基が化学的に不活性であるが、チオール基は化学的に反応性である条件下で実施される。典型的には、多工程の合成手順は、保護されたチオール基を脱保護する工程も含む。
【0084】
さらなる実施形態において、本発明は、チオール化合物を、式(I)の部分を含む化合物と反応させて、保護されたチオール基を有する化合物を産生する工程;及び、その後、該保護されたチオール基を脱保護する工程、を含む、プロセスに関する。従って、このプロセスは、チオール基を選択的に保護し、次いでその後、必要なくなった保護基を除去するための手段を構成する。
【0085】
典型的には、1つ以上の化学反応が、このプロセスの工程(i)と(ii)との間に、チオール化合物にもたされる。当業者が認識するように、これらの工程の性質は、実施される全合成手順によって決定されよう。しかし典型的には、少なくとも1つの工程が、工程(i)の後かつ工程(ii)の前に実施され、この工程は、保護されたチオール基ではない、チオール化合物が保有する官能基(例えば、チオール基ではない官能基)に化学変換をもたらすことを含む。好ましくは、この少なくとも1つの工程は、保護されたチオール基が化学的に不活性であるが、チオール基は化学的に反応性である条件下で実施される。
【0086】
本発明のこのプロセスの1実施形態において、保護されたチオール基を有する化合物は、保護されたチオール基とは異なるさらなる保護された官能基を少なくとも1個、さらに含む。この実施形態において、好ましくは、この少なくとも1個のさらなる保護された官能基は、保護されたチオール基上の保護基に対して直交である保護基を含む。
【0087】
保護されたチオール基を脱保護する工程は、電子不足型アルケンに結合したチオールを切断するための慣用的な方法を使用してもたらすことができる。従って、好ましくは、脱保護は、コンジュゲート付加反応において求核剤として作用できる試薬と共に生成物をインキュベートすることによってもたらされる。
【0088】
コンジュゲート付加反応において求核剤として作用できることが周知の試薬の例としては、ホスフィン化合物、亜リン酸塩化合物、チオール、セレノール、アミン及びソフトカーボン求核化合物が挙げられる。ホスフィン化合物及び亜リン酸塩化合物は共に、3価のリン原子を含む。ホスフィンでは、このリン原子は水素又は炭素原子に結合されるが、亜リン酸塩では、このリン原子は酸素原子に結合される(炭素原子及び酸素原子自体は、それぞれの化合物中の他の基にさらに結合されることが理解される)。チオールは、チオール基−SHを含む有機化合物である。セレノールは、−SeH基を含む有機化合物である。アミンは、アミン官能基を含む化合物である。ソフトカーボン求核剤は、ソフトな求核炭素中心を含む化合物である。例示的なソフトカーボン求核剤は、米国特許第5,414,074号に開示されており、その内容は、その全体が参照によって本明細書中に組み込まれる。当業者であれば当然、慣用として、例えば、本明細書中に記載される試薬の例示的クラスのなかから適切な試薬を慣用的に選択することによって、コンジュゲート付加反応において求核剤として作用できる適切な試薬を選択することができるであろう。
【0089】
脱保護をもたらすために本明細書中で好ましい試薬は、ホスフィン化合物及びチオールである。特に好ましいホスフィンは、トリス(2−カルボキシエチル)ホスフィンであり、これは、「TCEP」として一般に知られ、化合物(例えばタンパク質)中のジスルフィド結合を還元するために、当該分野において一般に使用される。トリス(2−カルボキシエチル)ホスフィンはまた、その塩酸塩などの塩の形態でも供給され得る。特に好ましいチオールは1,2−エタンジチオール、グルタチオン、メルカプトエタノール及びジチオスレイトール(即ち、HSCH2CH(OH)CH(OH)CH2SH、DTTとして一般に知られる)である。例えば、試薬は、トリス(2−カルボキシエチル)ホスフィン、グルタチオン、2−メルカプトエタノール及びジチオスレイトールから選択され得る。
【0090】
疑義を回避するために、本明細書中で使用する場合、用語「コンジュゲート付加反応において求核剤として作用できる試薬」とは、化合物中のα,β−不飽和部分、特に式(IV)の部分
【0091】
【化8】

【0092】
と反応できる試薬を意味し、式中、Xは本明細書中に記載したとおりである。かかる試薬は、ある場合には「Michael付加反応において求核剤として作用できる試薬」としても知られる。明らかに、これらの試薬は、求核炭素中心を介して反応する試薬(例えば、ソフトカーボン求核剤)に限定されず、求核非炭素中心を介して反応する試薬(例えば、本明細書中に記載される例示的試薬)も含む。
【0093】
本発明において、チオール化合物は、チオール基−SHを含む任意の化合物であり得る。しかし典型的には、チオール化合物は有機化合物である。当業者が理解するように、本発明の保護基は、保護基ストラテジーが一般に使用される任意の化合物(例えば、多工程合成手順における中間体)が保有するチオール基に適切に導入され得る。バイオテクノロジーの分野において特に興味が持たれるチオール含有化合物の例は、システイン、及び少なくとも1つのシステイン残基を含むペプチド又はタンパク質である。従って、本発明の使用及びプロセスの好ましい実施形態において、チオール化合物は、システイン、又は少なくとも1個のシステイン残基を含むペプチド若しくはタンパク質である。当業者が理解するように、この実施形態は、システイン又はシステイン残基に関与する慣用的な合成方法(例えば、ペプチド合成の方法、又はペプチド若しくはタンパク質が化学変換に供される方法(例えば、翻訳後修飾を模倣するため、又はプロテオミクス研究に着手すること若しくは治療的タンパク質を産生することを目的とした合成的修飾をもたらすため))を実施する場合に、特に有用である。
【0094】
さらなる実施形態において、本発明は、式(II)の化合物を提供する。この化合物は、化学的に保護されたシステイン分子を構成する。これは例えば、ペプチド及びタンパク質の合成方法において有用である。ペプチド及びタンパク質の合成方法は、当該分野で周知であり、従って、当業者であれば、ペプチド又はタンパク質を産生するための方法を実施するために本発明の方法論を適用することに、困難はないであろう。ペプチドを合成するために当該分野で慣用的に使用される種々の慣用的技術を議論した1つの一般的な参考教科書は、「Amino Acid and Peptide Synthesis」(John Jones,Oxford Scientific Publications,1992)であり、その内容は、その全体が本明細書中で参照により組み込まれる。
【0095】
第一の実施形態において、Qはカルボキシル基であり、Q’はアミン基である。即ち、保護されたシステインは、そのカルボキシル官能基又はそのアミン官能基のいずれかを介して、反応し得る。この化合物は、二次的化合物と直接反応し得るか、或いは、例えばカルボキシル官能基又はアミン官能基上に目的の特定の保護基を配置するための、さらなる化学的保護工程がもたらされ得る。
【0096】
それぞれ第二及び第三の実施形態において、Qは保護されたカルボキシル基であり、Q’はアミン基であるか、或いはQはカルボキシル基であり、Q’は保護されたアミン基である。従って、第二の実施形態において、この分子は、そのアミン基のみを介して反応し得、一方、第三の実施形態において、この分子は、そのカルボキシル基のみを介して反応し得る。
【0097】
第四の実施形態において、Qは保護されたカルボキシル基であり、Q’は保護されたアミン基である。従って、この分子は、その3つの官能基のそれぞれにおいて保護される。これは、これらの保護された官能基のうち1つを脱保護することによって、反応のために準備できる。
【0098】
特に好ましい実施形態において、Qはカルボキシル基であり、Q’は保護されたアミン基である。当業者が理解するように、この分子は特に、固相ペプチド合成の慣用的な方法において使用するのに十分適しており、この方法は典型的には、N保護されたアミノ酸がそのカルボキシル末端で固相(第一サイクルにおいて)又は成長するペプチド鎖(その後のサイクルにおいて)のいずれかと反応する連続サイクルと、その後のN脱保護及びその後の新たなN保護されたアミノ酸とのさらなる反応とを含む。
【0099】
ペプチド及びタンパク質の固相合成のための技術は、当該分野で周知である。広範な反応性基で活性化された多数の固相支持体が、例えばSigma Aldrichから市販されている。従って、当業者であれば、ペプチド又はタンパク質を産生するためのプロセスを実施するために本発明の方法論を適用することに、困難はないであろう。
【0100】
保護されたカルボキシル基及び保護されたアミン基は、当該分野で周知であり、当業者によって慣用的に選択され得る。
【0101】
例示的な保護されたカルボキシル基としては、「Protecting Group Chemistry」(Jeremy Robertson,Oxford University Press,2003)及び「Amino Acid and Peptide Synthesis」(John Jones,Oxford Scientific Publications,1992)に記載された保護されたカルボキシル基が挙げられ、これらの文献のそれぞれの内容は、その全体が参照によって本明細書中に組み込まれる。特に好ましい保護されたカルボキシル基は−COOQであり、式中、Qは、C1−6アルキル、フェニル及びベンジル基から選択される。
【0102】
例示的な保護されたアミン基としては、「Protecting Group Chemistry」(Jeremy Robertson,Oxford University Press,2003)及び「Amino Acid and Peptide Synthesis」(John Jones,Oxford Scientific Publications,1992)に記載された保護されたアミン基が挙げられ、これらの文献のそれぞれの内容は、その全体が参照によって本明細書中に組み込まれる。特に好ましい保護されたアミン基は、トリチル(トリフェニルメチル)及び2−ニトロフェニルスルフェニル基並びに式−NHC(O)OQ’の基であり、式中、Q’は、C1−6アルキル、フェニル、ベンジル、2−(4−ビフェニル)−イソプロピル、9−フルオレニルメチルから選択される。特に好ましい保護されたアミン基は、式−NHC(O)OQ’のものであり、式中、Q’は、t−ブチル又は9−フルオレニルメチルである(即ち、「BOC保護されたアミン」又は「Fmoc保護されたアミン」)。
【0103】
好ましくは、式(II)の化合物は、C−N−エチルマレイミド−S−システインでもC−N−エチルマレイミド−S−N−アセチル−システインでもない。
【0104】
さらなる態様において、本発明は、ジスルフィド化合物中のジスルフィド基を保護するための試薬としての、式(III)の部分を含む式の化合物の使用に関する。
【0105】
ジスルフィド基は、式−S−S−の二価の基である。ジスルフィド中の内部S−S結合は、有機分子中の最も弱い結合である場合が多い。これは、還元的条件下で切断を受けて、2個の−SH部分を生じやすい。従って、ジスルフィド化合物が脂環式である場合、ジスルフィドの還元は、2個のチオール含有分子への、ジスルフィド化合物の切断をもたらす。ジスルフィド ジスルフィドが複素環の一部である場合(例えば、これが、単一分子中に存在する2個のチオール基の縮合によって形成されたものである場合)、ジスルフィド結合の還元は開環をもたらす。両方の場合において、高度に求核性のチオール基が生成される。従って、明らかに、分子中のジスルフィド結合の切断は、有機合成手順に関して重要な結果を招く可能性があり得る。従って、ジスルフィド基が反応性であり得る反応条件を使用して化学変換が実施される場合、望ましくない副反応が生じるのを防ぐために、ジスルフィド基を化学的に保護することが望ましい場合がある。
【0106】
典型的には、ジスルフィド化合物中のジスルフィド基は、複素環の一部を形成する(即ち、これは、単一の分子中に存在する2個のチオール基の縮合によって形成されたものである)。
【0107】
2つの近接するシステイン残基中のチオール基のカップリングによるジスルフィド結合は、タンパク質中に一般的に見出され、それ自体、タンパク質のフォールディング及び安定性において重要な役割を果たす場合が多い。従って、好ましい実施形態において、ジスルフィド化合物は、ジスルフィド基を含むペプチド又はタンパク質である。
【0108】
式(III)の化合物において、基X、X’及びYは好ましくは、上記したのと同じ基である。基Y’は、第二の求電子性脱離基である。好ましい基Y’は、上記した好ましい基Yに対応する。式(III)の化合物において、Y及びY’は、同じでも異なってもよい。しかし好ましくは、Y及びY’は同じである。
【0109】
好ましくは、式(III)の部分を含む化合物は、式(IIIa)の化合物:
【0110】
【化9】

【0111】
であり、式中、X、X’、Y、R3及びR3’は全て上記のとおりであり、Y’はさらなる基Yであり、各基Yは同じ又は異なる。
【0112】
典型的には、この使用は、式(III)の部分を含む化合物を、ジスルフィド化合物と反応させることを含む。式(III)の部分を含む化合物をジスルフィド化合物と反応させることは、ジスルフィド化合物中のジスルフィド基のS−S結合を切断し、次いで、ジスルフィド基の2個の硫黄原子のうち一方が基Yを置換し、ジスルフィド基の2個の硫黄原子のもう一方が基Y’を置換することを含む。
【0113】
式(III)の部分を含む化合物は、標準的な文献に記載された、当業者に周知の手順に従って、ジスルフィド化合物と反応させることができる。典型的な文献情報源は、「Advanced organic chemistry」、第4版(Wiley)、J March、「Comprehensive Organic Transformation」、第2版(Wiley)、R.C.Larock、「Handbook of Heterocyclic Chemistry」、第2版(Pergamon)、A.R.Katritzkyであり、「Synthesis」、「Acc.Chem.Res.」、「Chem.Rev」などに見出されるような総説記事、又は標準的な文献検索オンラインによって同定される又は「Chemical Abstracts」若しくは「Beilstein」などの二次的情報源からの、一次文献情報源である。好ましくは、反応は、ジスルフィド基を還元して2個の別個のチオール基−SHを形成し、これらのチオール基を式(III)の部分と反応させることによって、もたらされる。ジスルフィド基の還元は、慣用的な方法を使用して、例えば、ホスフィン、チオール又は水素化物剤などの還元剤との反応によって、実施できる。好ましい還元剤は、トリス(2−カルボキシエチル)ホスフィン、グルタチオン、メルカプトエタノール及びジチオスレイトールである。
【0114】
好ましくは、この使用は、多工程合成手順の間の、ジスルフィド化合物中のジスルフィド基を保護するための試薬としての、式(III)の部分を含む化合物の使用である。典型的には、多工程の合成手順は、ジスルフィド基ではない、ジスルフィド化合物が保有する官能基に化学変換をもたらすことを含む、少なくとも1つの合成工程を含む。好ましくは、この少なくとも1つの合成工程は、保護されたジスルフィド基が化学的に不活性であるが、ジスルフィド基は化学的に反応性である条件下で実施される。典型的には、多工程の合成手順は、保護されたジスルフィド基を脱保護する(即ち、ジスルフィド結合を再形成する)工程も含む。
【0115】
さらなる実施形態において、本発明は、ジスルフィド化合物中のジスルフィド基を、式(III)の部分を含む化合物と反応させて、保護されたジスルフィド基を有する化合物を産生する工程、及び、その後、該保護されたジスルフィド基を脱保護する工程、を含むプロセスに関する。従って、このプロセスは、ジスルフィド基を選択的に保護し、次いでその後、必要なくなった保護基を除去するための手段を構成する。
【0116】
典型的には、ジスルフィド化合物中のジスルフィド基を、式(III)の部分を含む化合物と反応させる工程は、(a)ジスルフィド基を還元して、2個の別個のチオール基−SHを形成する工程、及び(b)これらのチオール基を式(III)の部分と反応させる工程、を含む。ジスルフィド基の還元は、慣用的な方法を使用して、例えば、ホスフィン、チオール又は水素化物剤などの還元剤との反応によって、実施できる。好ましい還元剤は、トリス(2−カルボキシエチル)ホスフィン、グルタチオン、2−メルカプトエタノール及びジチオスレイトールである。別の好ましい還元剤は、1,2−エタンジチオールである。明らかに、ジスルフィド基は、第一の工程において還元され得、その後式(III)の部分との別個の反応が行われる。或いは、ジスルフィド基の還元及び式(III)の部分との反応は、単一の反応工程(即ち、還元剤及び式(III)の部分の両方が同時に存在する)で実施され得る。
【0117】
典型的には、1つ以上の化学反応が、このプロセスの工程(i)と(ii)との間にもたらされる。当業者が認識するように、これらの工程の性質は、実施される全合成手順によって決定されよう。しかし典型的には、少なくとも1つの工程が、工程(i)の後かつ工程(ii)の前に実施され、この工程は、保護されたジスルフィド基ではない、該化合物が保有する官能基(例えば、ジスルフィド基ではない官能基)に化学変換をもたらすことを含む。好ましくは、この少なくとも1つの工程は、保護されたジスルフィド基が化学的に不活性であるが、ジスルフィド基は化学的に反応性である条件下で実施される。
【0118】
本発明のこのプロセスの1実施形態において、保護されたジスルフィド基を有する化合物は、保護されたジスルフィド基とは異なるさらなる保護された官能基を少なくとも1個、さらに含む。この実施形態において、好ましくは、この少なくとも1個のさらなる保護された官能基は、保護されたジスルフィド基上の保護基に対して直交である保護基を含む。
【0119】
保護されたジスルフィド基を脱保護する工程は、電子不足型アルケンに結合したチオールを切断するための慣用的な方法を使用してもたらすことができる。従って、好ましくは、脱保護は、コンジュゲート付加反応において求核剤として作用できる試薬と共に生成物をインキュベートすることによってもたらされる。従って、ジスルフィド脱保護をもたらすのに好ましい試薬は、チオール脱保護をもたらすための上記試薬に対応する。
【0120】
好ましくは、保護されたジスルフィド基を脱保護する工程は、炭素−炭素二重結合においてチオール結合を切断し、また、そうして形成された2個のチオール基を酸化してジスルフィド基を形成させることを含む。チオール基を酸化してジスルフィド基を形成するのに適切な試薬は、当該分野で周知である。例示的な酸化試薬としては、ヨウ素(I2)及び過酸化水素が挙げられ、ヨウ素が好ましい。
【実施例】
【0121】
以下の実施例は、本発明の根底をなす科学原理を説明する。広範な保護基による、広範なチオール化合物及びジスルフィド化合物の保護及び脱保護が実証されており、本発明の広い適用可能性を証明している。
【0122】
1H及び13C NMRスペクトルは、1Hについては500MHz、13Cについては125MHzの周波数で作動するBruker Avance 500機器で、室温で記録した。1H NMRスペクトルは、CDCl3(7.26ppm)シグナルを参照とした。13C NMRスペクトルは、CDCl3(77.67ppm)シグナルを参照とした。
赤外線スペクトルは、センチメートルの逆数(cm−1)で与えられる周波数で、ATRモードで作動するPerkinElmer Spectrum 100 FT−IRスペクトロメータで実行した。
質量スペクトル及び高分解能質量データは、VG70−SE質量分析計(EIモード及びCIモード)で記録した。
融点(m.p.)はGallenkamp加熱ブロックで取得したものであり、未補正である。
旋光度測定は、10cmのセル長さでPerkinElmer 343旋光計を使用して実施した。
【0123】
略号
Boc Tert−ブチルオキシカルボニル基
Cys システイン
Mal マレイミド
DMF ジメチルホルムアミド
TCEP (トリス(2−カルボキシエチル)ホスフィン)
LC−ESI−MS 液体クロマトグラフィーエレクトロスプレーイオン化質量分析
【0124】
参考例1:ブロモマレイミド(化合物1)の調製
【0125】
【化10】

【0126】
クロロホルム(15mL)中のマレイミド(2.00g、0.02mol)に、クロロホルム(15mL)の臭素(1.16mL、0.02mol)を滴下した。反応混合物を2時間還流し、1時間かけて室温まで冷却した。固体の黄色沈殿物を濾去し、冷クロロホルム(2x50mL)で洗浄して、粗製2,3−ジブロモスクシンイミド(4.09g、0.016mol)の白色結晶を得た。粗製スクシンイミドをテトラヒドロフラン(50mL)中に溶解し、テトラヒドロフラン(10mL)中のトリエチルアミン(2.4mL、0.017mol)を、0℃で5分間かけて添加した。反応混合物を室温まで温め、48時間撹拌した。固体を濾去し、テトラヒドロフラン(50mL)で洗浄して、淡黄色(pale yellow)粉末(2.14g、0.012mol)を59%の収率で得た。
1H NMR (500MHz, CDCl3): δ = 7.67 (br s, 1H, NH), 6.89 (s, 1H, C=CH); 13C NMR (125MHz, CDCl3): δ = 173.8 (C=O), 170.5 (C=O), 136.9 (-(Br)C=C-), 135.4 (-C=CH-); IR (固体, cm-1): 3235 (s), 1709 (s); MS (CI+) m/z, (%): 178 (81M+, 32), 176 (79M+, 32), 125 (25), 86 (100); C4H3O2N79Brについて計算した質量: 175.93472. 実測値: 175.93493; m.p. 148 - 151℃.
【0127】
参考例2:N−メチルブロモマレイミド(化合物2)の調製
【0128】
【化11】

【0129】
メタノール(22.5mL)中のN−メチルマレイミド(0.5g、4.5mmol)に、臭素(0.52mL、10mmol)を滴下した。反応混合物を室温で24時間撹拌した。溶媒を真空中で除去し、反応塊をテトラヒドロフラン(20mL)中に溶解し、トリエチルアミン(0.8mL、5.85mmol)を添加し、次いで室温で24時間撹拌した。この物質をシリカゲルでのフラッシュクロマトグラフィー(石油エーテル:酢酸エチル、7:3)で精製して、青白い(pale white)粉末(0.761g、4.0mmol)を89%の収率で得た。
1H NMR (500MHz, CDCl3): δ = 6.90 (s, 1H, C=CH), 3.09 (s, 3H, N-CH3); 13C NMR (125MHz, CDCl3): δ = 168.6 (C=O), 165.4 (C=O), 131.9 (-C=CH-), 131.4 ((Br)C=C-), 24.7 (-N-CH3); IR (固体, cm-1): 3106 (s), 1708 (s); MS (CI) m/z, (%):192 (81M+, 99), 190(79M+, 100); C5H5O2N79Brについて計算した質量: 189.95037. 実測値: 189.95052; m.p: 77-79℃.
【0130】
実施例1:N−Boc−Cys(Mal)−OMe(化合物4)の調製
【0131】
【化12】

【0132】
N−Boc−Cys−OMe(化合物3)(36mg、0.153mmol)及び酢酸ナトリウム(13mg、0.153mmol)のメタノール(3mL)中撹拌溶液に、メタノール(3mL)中のブロモマレイミド(30mg、0.169mmol)を添加した。1分後、溶媒を真空中で除去した。この物質をシリカゲルでのフラッシュクロマトグラフィー(石油エーテル:酢酸エチル、9:1から7:3の勾配溶出)で精製して、淡黄色粉末(51mg、0.153mmol)を100%の収率で得た。
1H NMR (500MHz, CDCl3): δ =7.63 (s, 1H, NH), 6.27 (s, 1H, C=CH), 5.40 (d, 1H, J = 6.8, NH), 4.67 (ddd, 1H, J = 6.8, 5.4及び5.1, -HN-CH-C(O)-), 3.80 (s, 3H, O-CH3), 3.48 (dd, 1H, J = 13.8及び5.1, -S-CHH-), 3.62 (dd, 1H, J = 14.1及び5.4, -S-CHH-) 1.45 (s, 9H, 3 x CH3); 13C NMR (125MHz, CDCl3): δ = 170.2 (C=O), 168.9 (C=O), 167.6 (C=O), 155.2 (C=O), 155.9 (-C=CH-), 119.7 (-C=CH-), 81.1 ((CH3)CO-), 53.3 (O-CH3), 52.7 (CH), 34.0 (CH2), 28.3 (3 x CH3); IR (固体, cm-1) 3236 (w), 1715 (s); MS (CI+) m/z, (%): 331 (M+H, 5), 275 (20), 231 (100); [C13H18O6N2S]+Hについて計算した質量: 331.09638. 実測値: 331.09684; 20αD: -41.9o (c = 1.0, メタノール); m.p. 145-147℃.
【0133】
実施例2:N−Boc−Cys(N−Me−Mal)−OMe(化合物5)の調製
【0134】
【化13】

【0135】
N−Boc−Cys−OMe(32mg、0.136mmol)のメタノール(4mL)中撹拌溶液に、酢酸ナトリウム(82mg、0.408mmol)を添加した。メタノール(4mL)中のN−メチルブロモマレイミド(25.8mg、0.136mmol)を10分間かけてこれに添加した。この反応は淡黄色(light yellow)に変化した。溶媒を真空中で除去し、残渣をシリカゲルでのフラッシュクロマトグラフィー(石油エーテル:酢酸エチル、9:1から7:3の勾配溶出)で精製して、青白い粉末(39.3mg、0.114mmol)を84%の収率で得た。
1H NMR (500MHz, CDCl3): δ = 6.26 (s, 1H, C=CH), 5.36 (d, 1H, J = 6.3, NH), 4.66 (m, 1H, -HN-CH-), 3.79 (s, 3H, O-CH3), 3.46 (dd, 1H, J = 5.2及び5.0, -S-CHH-), 3.35 (dd, 1H, J = 13.7及び5.1, -S-CHH-), 3.00 (s, 3H, -N-CH3), 1.44 (s, 9H, 3 x CH3); 13C NMR (125MHz, CDCl3): δ = 170.2 (C=O), 169.5 (C=O), 167.9 (C=O), 155.0 (C=O), 149.9(-C=CH-), 118.7 (-C=CH-), 80.9 ((CH3)3CO-), 53.1 (O-CH3), 52.7 (CH), 33.8 (CH2), 28.3 (3 x CH3), 24.1 (-N-CH3); IR (固体, cm-1) 3367.8, 2977.1, 1694.7; MS (ES+) m/z, (%): 367(46), 311 (M, 100); C14H20N2O6NaSについて計算した質量: 367.0940. 実測値: 367.0931; 20αD: -18.55o (c = 1.0, メタノール); m.p. 101-103℃.
【0136】
実施例3:プロピルアミンと比較した、N−Boc−Cys−Omeに対するブロモマレイミド試薬の選択性の実証
N−Boc−Cys−OMe(36mg、0.153mmol)及びプロピルアミン(10μL、0.153mmol)のメタノール(3mL)中撹拌溶液に、メタノール(3mL)中のブロモマレイミド(30mg、0.169mmol)を添加した。1分後、溶媒を真空中で除去した。この物質をシリカゲルでのフラッシュクロマトグラフィー(石油エーテル:酢酸エチル、9:1から7:3の勾配溶出)で精製して、淡黄色粉末(51mg、0.153mmol)を100%で得た。データは、N−Boc−Cys(Mal)−OMe 4について上記で得たものと一致した。
【0137】
実施例4:N−Boc−Cys−OMeを再生するためのN−Boc−Cys(Mal)−OMeの切断
【0138】
【化14】

【0139】
4(50mg、0.151mmol)のジメチルホルムアミド(2mL)中撹拌溶液に、20mLの水性緩衝液(150mM NaCl、100mM NaH2PO4、pH8.0)を添加した。水性緩衝液(150mM NaCl、100mM NaH2PO4、pH8.0)20mL中のトリス(2−カルボキシエチル)ホスフィン(430mg 1.51mmol)を、この溶液に添加した。5分後、この水溶液を酢酸エチル(3x25mL)で抽出し、飽和塩化リチウム溶液(5x25mL)、水(25mL)及びブライン(25mL)で洗浄し、MgSO4で乾燥させた。溶媒を真空中で除去して、無色油状物(34.5mg、0.148mmol)を98%の収率で得た。この油状物の1H NMR及び13C NMRは、これが市販のN−Boc−システイン メチルエステル3であることを示した。
【0140】
実施例5:2,3−ジブロモマレイミドとソマトスタチンとの反応
ソマトスタチンは、分子内の2つのシステイン残基がジスルフィド結合で結合した形態で存在することが知られたペプチドホルモンである。
【0141】
1mgの凍結乾燥ソマトスタチン(Sigma−Aldrich)を、2mlの50mM NaHPO4−、pH6.2、40% MeCN、2.5% DMF中に再可溶化した。500μlを、Eppendorf反応チューブに移し、同緩衝液中で希釈して最終濃度0.25mg/ml(152.6μM)にした。2.0当量のTCEP(50mM NaHPO4−、pH6.2、40% MeCN中100xストック溶液)を添加し、反応を周囲温度で1時間インキュベートした。ジスルフィド結合の還元後、1.4当量の2,3−ジブロモマレイミド(Sigma−Aldrich、50mM NaHPO4−、pH6.2、40% MeCN、2.5% DMF中100xストック溶液)を添加し、溶液を穏やかに混合して、4℃でさらに12時間インキュベートした。
【0142】
マレイミド架橋されたソマトスタチンが、LC−ESI−MS(ES+/ES−)によって検出された。コントロールには、未処理のペプチド、及び2,3−ジブロモマレイミド又はTCEPのみで処理したソマトスタチンを含めた。完全な還元は、TCEP処理したペプチドとマレイミド(Sigma−Aldrich、50mM NaHPO4−、pH6.2、40% MeCN、2.5% DMF中の100xストック溶液)との反応によって検出された。
【0143】
実験データ:
未処理のソマトスタチン:[ES+]1638.04(m/z 1), 819.82 (m/z 2), 546.95 (m/z 3).
マレイミド架橋されたソマトスタチン:[ES+] 1734.14 Da (m/z 1), 867.40 Da (m/z 2), 578.73 (m/z 3).
【0144】
参考例3:GrB2−SH2ドメインL111Cの発現
【0145】
【化15】

【0146】
タンパク質GrB2−SH2ドメインL111Cをモデルタンパク質として使用した。このモデルタンパク質は単一のシステイン残基を含む。
【0147】
LC−MSは、Waters Acquity Single Quad Detector(SQD)に接続したWaters Acquity uPLCで実施した。カラム:Acquity uPLC BEH C18 1.7μm 2.1x50mm。波長:254nm。移動相:95:5 水(0.1%ギ酸):MeCN(0.1%ギ酸)、4分間にわたる勾配(5:95 水(0.1%ギ酸):MeCN(0.1%ギ酸)まで。流速:0.6mL/分。MSモード:ES+。スキャン範囲:m/z=85−2000。スキャン時間:0.25秒。データは連続体モードで得た。MSのエレクトロスプレー供給源は、3.5kVのキャピラリー電圧及び50Vのコーン電圧で操作した。窒素を、総流量600L/hで、ネブライザー及び脱溶媒和ガスとして使用した。総質量スペクトルを、MassLynxソフトウェアにプレインストールされたMaxEnt 1アルゴリズムを使用して、イオンシリーズから再構築した。
【0148】
モデルタンパク質をE.coli中で過剰発現させ、6Hisタグ化タンパク質を、標準的な技術によって、Ni−アフィニティクロマトグラフィー及びサイズ排除クロマトグラフィーの両方を使用して精製した。LC−MSを用いた分析により、所望のタンパク質に対応する質量14169の単一のタンパク質種が示された。
【0149】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、Ellman試薬(5μL、H2O中282mM溶液)を0℃で添加した。この混合物を1秒間ボルテックスし、10分間0℃で維持し、その後、混合物をLC−MSで分析した。分析により、単一の反応が生じて14366の質量を有する単一の生成物が得られたことが示され、C111が官能化に利用可能であることが示された。
【0150】
実施例6:GrB2−SH2ドメインL111Cとブロモマレイミドとの反応
【0151】
【化16】

【0152】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望のタンパク質に対応する質量14265の単一のタンパク質種が示された。
【0153】
この混合物を、0℃にてEllman試薬(5μL、H2O中282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で10分間維持し、その後、混合物をLC−MSで分析した。分析により、Ellman試薬との明白な反応がなかったことが示され、これは、ブロモマレイミドの官能化がC111で生じたことを強調する。
【0154】
実施例7:GrB2−SH2ドメインL111CとN−メチルブロモマレイミドとの反応
【0155】
【化17】

【0156】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−メチルブロモマレイミド(5μL、DMF中2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望のタンパク質に対応する質量14278の単一のタンパク質種が示された。
【0157】
この混合物を、0℃にてEllman試薬(5μL、H2O中282mM溶液)で処理した。この混合物を1秒間ボルテックスし、00℃で10分間維持し、その後、混合物をLC−MSで分析した。分析により、Ellman試薬との明白な反応がなかったことが示され、これは、N−メチルブロモマレイミドの官能化がC111で生じたことを強調する。
【0158】
実施例8:GrB2−SH2ドメインL111C/ブロモマレイミド付加物のホスフィン媒介性の還元的切断
【0159】
【化18】

【0160】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ブロモマレイミド付加物に対応する質量14265の単一のタンパク質種が示された。
【0161】
この混合物を、0℃にてTCEP.HCl(5μL、H2O中282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で3時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ブロモマレイミド付加物が明らかに切断されて、GrB2−SH2ドメインL111C(質量=14168)を85%の収率で生じたことが示された。残りの物質は、未反応のタンパク質/ブロモマレイミド付加物であった。
【0162】
実施例9:GrB2−SH2ドメインL111C/N−メチルブロモマレイミド付加物のホスフィン媒介性の還元的切断
【0163】
【化19】

【0164】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−メチルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−メチルブロモマレイミド付加物に対応する質量14278の単一のタンパク質種が示された。
【0165】
この混合物を、0℃にてTCEP.HCl(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で3時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/N−メチルブロモマレイミド付加物が明らかに切断されて、GrB2−SH2ドメインL111C(質量=14168)を85%の収率で生じたことが示された。残りの物質は、未反応のタンパク質/N−メチルブロモマレイミド付加物であった。
【0166】
実施例10:GrB2−SH2ドメインL111C/ジブロモマレイミド付加物の合成
【0167】
【化20】

【0168】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0169】
実施例11:GrB2−SH2ドメインL111C/ジブロモマレイミド/グルタチオン付加物の合成
【0170】
【化21】

【0171】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0172】
この混合物を、0℃にてグルタチオン(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ジブロモマレイミド/グルタチオン付加物が、唯一の存在したタンパク質種(質量=14572)であることが示された。
【0173】
実施例12:生理学的に適当なグルタチオン濃度(5mM)での、GrB2−SH2ドメインL111C/ジブロモマレイミド/グルタチオン付加物のグルタチオン媒介性の切断
【0174】
【化22】

【0175】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0176】
この混合物を、0℃にてグルタチオン(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ジブロモマレイミド/グルタチオン付加物が、存在する唯一のタンパク質種(質量=14572)であることが示された。
【0177】
この混合物を、0℃にてグルタチオン(5μL、H2O中の100mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、GrB2−SH2ドメインL111Cが、存在する唯一のタンパク質種(質量=14173)であることが示された。
【0178】
実施例13:N−Ac−Cys(Mal)−ベンジルアミンの調製
【0179】
【化23】

【0180】
メタノール(42mL)中のN−Ac−Cys−ベンジルアミン(1.00g、4.00mmol)上記)に、メタノール(42mL)中のブロモマレイミド(777mg、4.37mmol)を5分間かけて滴下した。10分後、溶媒を真空中で除去し、残渣を、石油エーテル中10%の酢酸エチルを使用するフラッシュクロマトグラフィーに供して、所望の化合物(429mg、1.2mmol)をオフホワイトの固体として、ブロモマレイミドの69%の回収率に基づき100%の収率で得た。 δH (500 MHz, MeOD) 7.32-7.20 (m, 5H, 5 x Ar-H), 6.45 (s, 1H, H-12), 4.71 (t, 1H, J = 7.3, H-3), 4.38 (d, 2H, J = 2.7, H2-5), 3.40 (dd, 1H, J = 7.0及び13.6, HH-10), 3.25 (dd, 1H, J = 7.2及び13.6, HH-10), 1.99 (s, 3H, H3-1); δC (125 MHz, MeOD) 173.51 (C=O), 172.22 (C=O), 171.44 (C=O), 170.51 (C=O), 151.58 (C11), 139.48 (C6), 129.54 (2 x Ar-H), 128.51 (2 x Ar-H), 128.26 (C9), 121.01 (C12) 53.04 (C3), 44.25 (C5), 33.72 (C10), 22.42 (C1); IR (薄膜, cm-1) 3187 (w), 1717 (s), 1646 (s); MS (ES+) m/z (相対強度): 370 ([M+Na], 20), 337 (50), 325 (90), 309(100); [C16H17N3O4SN]+Naについて計算した正確な質量はm/z 370.0873を要求、実測値 370.0852 (ES+); UV (アセトニトリル) ε213= 19400, ε247 = 4800及びε337 = 2700 cm-1M-1d3; 白色固体は180℃で分解する。
【0181】
実施例14:(S)−メチル 2−(tert−ブトキシカルボニルアミノ)−3−(1−(2−(5−(ジメチルアミノ)ナフタレン−1−スルホンアミド)エチル)−2,5−ジオキソ−2,5−ジヒドロ−1H−ピロール−3−イルチオ)プロパノアートの調製
【0182】
【化24】

【0183】
ヒートガンを使用して撹拌溶液を短時間加熱することにより、ダンシル−ブロモマレイミド(100mg)をメタノール(200ml)中に溶解した。得られた淡黄色溶液に、N−Boc−Cys−OMe(22μl、0.1mmol、0.5当量)及び酢酸ナトリウム(14.5mg、0.1mmol、0.5当量))を、3時間かけて添加した。反応をTLC(溶離液:40%EtOAc:60%石油エーテル)でモニタリングした。添加が完了したところでメタノールを真空中で除去して、黄色油状物を得た。カラムクロマトグラフィーでの精製により、所望の生成物を得た(48.29mg、0.08mmol、79.7%)。 1H NMR (600MHz CDCl3): δH 8.54(d, J=8.56Hz, 1H, CH), 8.21(d, 1H, J=8.27Hz, CH), 8.13(d, 1H, J=8.57Hz, CH), 7.55(m, 2H, 2 x CH), 7.25(d, J=7.60Hz, 1H, CH), 5.92(s, 1H, CH), 4.44(m, 1H, HN-CH-CO), 3.77(s, 3H, OMe), 3.48(m, 2H, CH2), 3.44(m, 2H, CH2), 3.38(s, 6H, 2 xCH3), 3.13(t, J=5.79, 2H, S-CH2) 2.88(s, 9H, 3 x CH3). 13C NMR (600MHz CDCl3): 173.08, 170.52, 169.69, 168.96 (4x C=O), 157.73 (-C=CH), 153.16, 150.71, 136.48, 131.39, 131.25, 131.18, 130.74, 130.65, 129.31, 124.35, 120.61, 119.22, 81.12, 53.58, 52.95, 45.89, 41.53, 33.98, 28.66. IR: 3324.7 cm-1, 1775 cm-1. [M + H]+: 605.1756, 計算値; 605.1740.
【0184】
実施例15:Glu−Cys(Mal)−Glyの調製
【0185】
【化25】

【0186】
メタノール(3mL)中のグルタチオン(47mg、0.15mmol)に、メタノール(3mL)中のブロモマレイミド(30mg、0.15mmol)を添加した。5分後、溶媒を真空中で除去して、所望の化合物(62mg、0.15mmol)を粘度のある無色油状物として100%の収率で得た。δH (500 MHz, MeOD) 6.47 (s, 1H, H-12), 4.79 (dd, 1H, J = 5.7及び8.2, H-6), 4.06 (t, 1H, J = 6.5, H-2), 3.95 (s, 2H, H2-8), 3.49 (dd, 1H, J = 5.8及び13.9, HH-10), 3.29 (dd, 1H, J = 8.3及び13.6, HH-10), 2.61 (t, 2H, J = 7.1, H2-4), 2.29-2.15 (m, 2H, H2-3); δC(125 MHz, MeOD) 174.68 (C=O), 172.81 (C=O), 172.39 (C=O), 171.89 (C=O), 171.62 (C=O), 170.59 (C=O), 151.75 (C11), 120.91 (C12), 53.79 (C6), 52.76 (C2), 42.01 (C8), 33.92 (C10) 32.42 (C4), 27.03 (C3); IR (油, cm-1) 3259 (m), 2928 (m), 1717 (s); MS (ES-) m/z (相対強度): 401 ([M-H], 100), 272 (30); [C14H18N4O8S]-Hについて計算した正確な質量はm/z 401.0767を要求、実測値 401.0773 (ES-); UV (アセトニトリル) ε204= 8100, ε253 = 5600及びε342 = 1900 cm-1M-1d3.
【0187】
実施例16:Boc−Cys(MeMal)−Phe−iPrの調製の調製
【0188】
【化26】

【0189】
O−(ベンゾトリアゾール−1−イル)−N,N,N’,N’−テトラメチルウロニウム ヘキサフルオロホスフェート(344mg、0.82mmol)を、(2R)−2−[(tert−ブトキシカルボニル)アミノ]−3−[(1−メチル−2,5−ジオキソ−2,5−ジヒドロ−1H−ピロール−3−イル)スルファニル]プロパン酸(313mg、0.95mmol)及び1−ヒドロキシベンゾトリアゾール水和物(139mg)のDMF(2mL)中撹拌溶液に添加し、反応を21℃で3分間撹拌した。(2S)−1−オキソ−3−フェニル−1−(プロパン−2−イルアミノ)プロパン−2−アンモニウム トリフルオロアセテート(262mg、0.82mmol)のDMF(1.5mL)中溶液を反応混合物に添加し、その後、N,N−ジイソプロピルエチルアミン(294μL、1.64mmol)を添加し、反応を21℃で4時間撹拌した。溶媒を真空中で除去し、残渣をEtOAc(60mL)中に溶解し、1M HCl(x3)、H2O(x1)、飽和NaHCO3(x3)、10%LiCl(x1)及び飽和NaCl(x1)で洗浄し、乾燥させ(MgSO4)、濾過し、溶媒を真空中で除去した。沈殿(CHCl3/石油エーテル 40〜60)での精製により、所望の化合物を淡褐色固体として得た(359mg、0.69mmol、84%収率): 1H NMR (600 MHz, CD3CN, 25 °C) δ 7.32-7.28 (m, 2H), 7.25-7.21 (m, 3H), 7.11 (d, J = 7.7 Hz, 1H), 6.46 (d, J = 6.3 Hz, 1H), 6.42 (s, 1H), 4.46 (td, J = 7.6, 6.5 Hz, 1H), 4.31 (td, J = 7.3, 6.4 Hz), 3.88 (ダブレットのセプテット, J = 6.6, 6.3 Hz, 1H), 3.30 (dd, J = 13.7, 5.8 Hz, 1H), 3.16 (dd, J = 13.7, 7.4 Hz, 1H), 2.95 (dd, J = 13.8, 7.5 Hz, 1H), 2.93 (s, 3H), 1.43 (s, 9H), 1.07 (d, J = 6.6 Hz, 3H), 1.02 (d, J = 6.6 Hz, 3H); 13C NMR (151 MHz, CD3CN, 25 °C) δ 169.39, 168.84, 168.77, 167.85, 155.17, 149.33, 136.77, 129.10, 127.98, 126.30, 118.57, 79.49, 54.10, 52.62, 40.91, 37.44, 32.43, 27.15, 22.95, 21.24, 21.17; IR (薄膜) 3301, 2973, 1770, 1701, 1674, 1641, 1525 cm-1; LRMS (EI) 518 (24%, [M]+・), 432 (23), 219 (33), 149 (21) 110 (27), 86 (37), 84 (100); C25H34N4O6S [M]+・について計算したHRMS (EI) 518.2194, 実測値518.2199.
【0190】
実施例17:Boc−Cys(MeMal)−Phe−iPrの脱保護
【0191】
【化27】

【0192】
150mMホスフェート緩衝液(pH8、25mL)中のトリス(2−カルボキシエチル)ホスフィン塩酸塩(138mg、0.48mmol)を、Boc−Cys(MeMal)−Phe−iPr(50mg、97μmol)のMeCN(25mL)中撹拌溶液に添加し、反応を21℃で10分間撹拌した。Boc−Cys−Phe−iPrの合成はLCMS(ES−)408.7(100%)で確認した。
【0193】
参考例4:Grb2−SH2 L111C変異体のクローニング及び発現
【0194】
【化28】

【0195】
Grb2−SH2 L111Cの配列(残基53−163):M G I E M K P H P W F F G K I P R A K A E E M L S K Q R H D G A F L I R E S E S A P G D F S L S V K F G N D V Q H F K V C R D G A G K Y F L W V V K F N S L N E L V D Y H R S T S V S R N Q Q I F L R D I E Q V P Q Q P T Y V Q A G S R S H H H H H H 終止。質量計算値=14171
【0196】
Grb2 SH2ドメインのためのDNA構築物は、1次アミノ酸配列53−163を含んでおり、プラスミドQE−60(Qiagen)にクローニングした。Grb2 SH2 L111C変異体は、変異残基をコードするオリゴヌクレオチドを使用した部位特異的変異誘発(Stratagene Kit)によって構築した。両方の構築物を、T5プロモーターを使用してEscherichia coli(M15[pREP4]、Qiagen)中で発現させ、C末端に6−His Tagを精製のために組み込んだ。培養物(1L)を、シングルコロニーからT.B.中で37℃で増殖させ、0.9のO.D.λ600に達した時点で1.0mM IPTGによって発現を誘導した。培養物に、ほぼ3時間にわたってタンパク質を発現させ、その後細胞をペレット化した。ペレットを、プロテアーゼ阻害剤カクテル(Roche)を含む0.1Mリン酸ナトリウム、300mM NaCl、50mMイミダゾール、pH7.2中で溶解させた。溶解物を遠心分離し、上清をNi−NTAカラム(Qiagen)にアプライした。Grb2−SH2 L111Cを、0.1Mリン酸ナトリウム、300mM NaCl、200mMイミダゾール(pH7.2)によってNi−NTAカラムから溶出させた。収集したGrb2 SH2 L111Cは、クマシー染色したSDS−PAGEで可視化したとき、約95%の純度であった。ドメインスワッピングによるGrb2 SH2ドメインの二量体化は、以前に観察されている。二量体及び単量体のGrb2−SH2を、0.1Mリン酸ナトリウム及び150mM NaCl(pH8.0)で予め平衡化したSephacryl S−100カラム(320mL)で分離した。単量体Grb2−SH2の分子量(約14kDa)及び二量体Grb2−SH2の分子量(約28kDa)に対応する2つのピークが溶出した。Grb2−SH2 L111Cドメインのほぼ60%が、カラムから単量体として溶出した。4℃で数ヶ月の過程にわたって相互変換が殆ど認められなかったことから、分離された単量体及び二量体は、驚くべきことに動力学的に安定であることが見出された。単量体を、Amicon(登録商標)Ultra−4遠心フィルターユニット(Millipore)を使用して濃縮し、タンパク質の最終濃度を、McNemar及び共同研究者が得た吸光係数(15,600M−1)を用い、280nmでの吸光度によって決定した。タンパク質を、100mLアリコート中2mg/mLの濃度で凍結させ、これを実験の際に必要に応じて解凍した。単量体タンパク質の質量(質量14170)はESI−MSを使用して得た。
【0197】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、0℃でEllman試薬(5μL、H2O中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、0℃で10分間維持し、その後、混合物をLC−MSで分析した。分析により、単一の反応が起こって、14370の質量を有する単一の生成物が生じたことが示され、これは、C111が官能化に利用可能であることを示す。
【0198】
実施例18:GrB2−SH2ドメインL111C/ブロモマレイミド付加物の調製
【0199】
【化29】

【0200】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が定量的変換で形成されたことが示された(質量14266)。
【0201】
混合物を、0℃でEllman試薬(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で10分間維持し、その後、混合物をLC−MSで分析した。分析により、Ellman試薬との反応は明白には表れないことが示され、これは、ブロモマレイミド官能化がC111で生じたことを強調する。
【0202】
実施例19:GrB2−SH2ドメインL111C/N−メチルブロモマレイミド付加物の調製
【0203】
【化30】

【0204】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−メチルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した、LC−MSを使用した分析により、所望の生成物が定量的変換で形成されたことが示された(質量14280)。
【0205】
混合物を、0℃でEllman試薬(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で10分間維持し、その後、混合物をLC−MSで分析した。分析により、Ellman試薬との反応は明白には表れないことが示され、これは、N−メチルブロモマレイミド官能化がC111で生じたことを強調している。
【0206】
実施例20:GrB2−SH2ドメインL111C/ブロモマレイミド付加物のホスフィン媒介性の還元的切断
【0207】
【化31】

【0208】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ブロモマレイミド付加物に対応する質量14265の単一のタンパク質種が示された。
【0209】
混合物を、0℃でTCEP.HCl(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で3時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14169)が80%の変換で得られたことが示された。
【0210】
実施例21:GrB2−SH2ドメインL111C/ブロモマレイミド付加物のβ−メルカプトエタノール媒介性の還元的切断
【0211】
【化32】

【0212】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ブロモマレイミド付加物に対応する質量14265の単一のタンパク質種が示された。
【0213】
混合物を、β−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理し、1秒間ボルテックスし、37℃で4時間維持した。分析により、タンパク質/ブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14173)が定量的変換で得られたことが示された。
【0214】
実施例22:GrB2−SH2ドメインL111C/ブロモマレイミド付加物のグルタチオン媒介性の切断
【0215】
【化33】

【0216】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ブロモマレイミド付加物に対応する質量14265の単一のタンパク質種が示された。
【0217】
混合物をグルタチオン(5μL、H2O中の282mM溶液)で処理し、1秒間ボルテックスし、37℃で4時間維持した。分析により、タンパク質/ブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14173)が定量的変換で得られたことが示された。
【0218】
実施例23:GrB2−SH2ドメインL111C/N−メチルブロモマレイミド付加物のホスフィン媒介性の還元的切断
【0219】
【化34】

【0220】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−メチルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−メチルブロモマレイミド付加物に対応する質量14278の単一のタンパク質種が示された。
【0221】
混合物を、0℃でTCEP.HCl(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で3時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/N−メチルブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14168)が85%の変換で得られたことが示された。
【0222】
実施例24:GrB2−SH2ドメインL111C/N−メチルブロモマレイミド付加物のβ−メルカプトエタノール媒介性の還元的切断
【0223】
【化35】

【0224】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−メチルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−メチルブロモマレイミド付加物に対応する質量14280の単一のタンパク質種が示された。
【0225】
混合物を、β−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理し、1秒間ボルテックスし、37℃で4時間維持した。分析により、タンパク質/N−メチルブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14173)が定量的変換で得られたことが示された。
【0226】
実施例25:GrB2−SH2ドメインL111C/N−メチルブロモマレイミド付加物のグルタチオン媒介性の切断
【0227】
【化36】

【0228】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−メチルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−メチルブロモマレイミド付加物に対応する質量14280の単一のタンパク質種が示された。
【0229】
混合物を、グルタチオン(5μL、H2O中の282mM溶液)で処理し、1秒間ボルテックスし、37℃で4時間維持した。分析により、タンパク質/N−メチルブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14173)が定量的変換で得られたことが示された。
【0230】
実施例26:GrB2−SH2ドメインL111C/ブロモマレイミド付加物のエタンジチオール媒介性の切断
【0231】
【化37】

【0232】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ブロモマレイミド付加物に対応する質量14265の単一のタンパク質種が示された。
【0233】
混合物を、エタンジチオール(5μL、H2O中の282mM溶液)で処理し、1秒間ボルテックスし、37℃で4時間維持した。分析により、タンパク質/ブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14173)が定量的変換で得られたことが示された。
【0234】
実施例27:GrB2−SH2ドメインL111C/ブロモマレイミド/2−メルカプトエタノール付加物の調製
【0235】
【化38】

【0236】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ブロモマレイミド付加物に対応する質量14265の単一のタンパク質種が示された。
【0237】
混合物を、0℃で2−メルカプトエタノール(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で3時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ブロモマレイミド/2−メルカプトエタノール付加物(質量=14345)が54%の収率で形成されたことが示された。残りの物質はGrB2−SH2ドメインL111Cであった。
【0238】
実施例28:GrB2−SH2ドメインL111C/N−メチルブロモマレイミド/2−メルカプトエタノール付加物の調製
【0239】
【化39】

【0240】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−メチルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−メチルブロモマレイミド付加物に対応する質量14278の単一のタンパク質種が示された。
【0241】
混合物を、0℃で2−メルカプトエタノール(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で3時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14359)が90%の収率で形成されたことが示された。残りの物質はGrB2−SH2ドメインL111Cであった。
【0242】
実施例29:GrB2−SH2ドメインL111C/ブロモマレイミド/グルタチオン付加物の調製
【0243】
【化40】

【0244】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ブロモマレイミド付加物に対応する質量14265の単一のタンパク質種が示された。
【0245】
混合物を、0℃でグルタチオン(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で3時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ブロモマレイミド/グルタチオン付加物(質量=14574)が44%の変換で形成されたことが示された。残りの物質はGrB2−SH2ドメインL111Cであった。
【0246】
実施例30:GrB2−SH2ドメインL111C/N−メチルブロモマレイミド/グルタチオン付加物の調製
【0247】
【化41】

【0248】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−メチルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−メチルブロモマレイミド付加物に対応する質量14278の単一のタンパク質種が示された。
【0249】
混合物を、0℃で2−メルカプトエタノール(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で3時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/N−メチルブロモマレイミド/グルタチオン付加物(質量=14588)が95%の変換で形成されたことが示された。残りの物質はGrB2−SH2ドメインL111Cであった。
【0250】
実施例31:GrB2−SH2ドメインL111C/ジブロモマレイミド付加物の調製
【0251】
【化42】

【0252】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、所望の生成物が定量的収率で形成されたことが示された(質量14345)。
【0253】
実施例32:GrB2−SH2ドメインL111C/ジブロモマレイミド付加物の2−メルカプトエタノール媒介性の還元的切断
【0254】
【化43】

【0255】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0256】
混合物を、0℃で2−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14171)が定量的収率の収率で得られたことが示された。
【0257】
実施例33:GrB2−SH2ドメインL111C/ジブロモマレイミド付加物のグルタチオン媒介性の還元的切断
【0258】
【化44】

【0259】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0260】
混合物を、0℃でグルタチオン(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14170)が定量的収率で得られたことが示された。
【0261】
実施例34:GrB2−SH2ドメインL111C/ジブロモマレイミド/グルタチオン付加物の調製
【0262】
【化45】

【0263】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0264】
混合物を、0℃でグルタチオン(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14573)が定量的変換で形成されたことが示された。
【0265】
実施例35:GrB2−SH2ドメインL111C/ジブロモマレイミド/β−1−チオグルコース付加物の調製
【0266】
【化46】

【0267】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0268】
混合物を、0℃でβ−1−チオグルコース、ナトリウム塩(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14461)がほぼ定量的収率で形成されたことが示された。
【0269】
実施例36:GrB2−SH2ドメインL111C/ジブロモマレイミド/グルタチオン付加物のグルタチオン媒介性の切断
【0270】
【化47】

【0271】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0272】
混合物を、0℃でグルタチオン(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ジブロモマレイミド/グルタチオン付加物が、唯一の存在するタンパク質種であることが示された(質量=14573)。
【0273】
混合物を、0℃でグルタチオン(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14173)が、定量的収率で形成されたことが示された。
【0274】
実施例37:生理学的に適切なグルタチオン濃度(5mM)での、GrB2−SH2ドメインL111C/ジブロモマレイミド/グルタチオン付加物のグルタチオン媒介性の切断
【0275】
【化48】

【0276】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0277】
混合物を、0℃でグルタチオン(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ジブロモマレイミド/グルタチオン付加物が存在する唯一のタンパク質種であることが示された(質量=14573)。
【0278】
混合物を、0℃でグルタチオン(5μL、H2O中の100mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14173)が定量的収率で形成されたことが示された。
【0279】
実施例38:生理学的に適切なグルタチオン濃度(1mM)での、GrB2−SH2ドメインL111C/ジブロモマレイミド/グルタチオン付加物のグルタチオン媒介性の切断
【0280】
【化49】

【0281】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0282】
混合物を、0℃でグルタチオン(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ジブロモマレイミド/グルタチオン付加物が存在する唯一のタンパク質種であることが示された(質量=14573)。
【0283】
タンパク質/ジブロモマレイミド/グルタチオン付加物の溶液を、緩衝液交換(Micro Bio−Spin 6 Chromatography Column、Bio−Rad)に供して、付加物(95μL、[付加物]0.2mg/mL、20mM HEPES、100mM KCl、1mM MgCl2、1mM EDTA、pH7.4)を得た。これに、グルタチオン(5μL、20mM HEPES、100mM KCl、1mM MgCl2、1mM EDTA、pH7.4中20mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で4時間維持した。分析により、Grb2−SH2(L111C)(質量)14170)が定量的変換で形成されたことが示された。
【0284】
実施例39:GrB2−SH2ドメインL111C/ジブロモマレイミド/グルタチオン付加物のβ−メルカプトエタノール媒介性の切断
【0285】
【化50】

【0286】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0287】
混合物を、0℃でグルタチオン(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ジブロモマレイミド/グルタチオン付加物が存在する唯一のタンパク質種であることが示された(質量=14573)。
【0288】
混合物を、0℃でβ−メルカプトエタノール(5μL、H2O中282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14172)が定量的変換で形成されたことが示された。
【0289】
実施例40:GrB2−SH2ドメインL111C/ジブロモマレイミド/β−1−チオグルコース付加物のグルタチオン媒介性の切断
【0290】
【化51】

【0291】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0292】
混合物を、0℃でβ−1−チオグルコース(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ジブロモマレイミド/β−1−チオグルコース付加物が存在する唯一のタンパク質種であることが示された(質量=14461)。
【0293】
混合物を、0℃でグルタチオン(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14173)が定量的変換で形成されたことが示された。
【0294】
実施例41:GrB2−SH2ドメインL111C/ジブロモマレイミド/β−1−チオグルコース付加物のβ−メルカプトエタノール媒介性の切断
【0295】
【化52】

【0296】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0297】
混合物を、0℃でβ−1−チオグルコース(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ジブロモマレイミド/β−1−チオグルコース付加物が存在する唯一のタンパク質種であることが示された(質量=14461)。
【0298】
混合物を、0℃でβ−メルカプトエタノール(5μL、H2O中282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14172)が定量的変換で形成されたことが示された。
【0299】
実施例42:GrB2−SH2ドメインL111C/N−フェニルブロモマレイミド付加物の調製
【0300】
【化53】

【0301】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−フェニルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が定量的収率で形成されたことが示された(質量14351)。
【0302】
実施例43:GrB2−SH2ドメインL111C/N−フェニルジブロモマレイミド付加物の調製
【0303】
【化54】

【0304】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、20mM MES、150mM NaCl、pH6)に、N−フェニルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が定量的収率で形成されたことが示された(質量14431)。
【0305】
実施例44:GrB2−SH2ドメインL111C/N−フェニルジブロモマレイミド付加物のβ−メルカプトエタノール媒介性の切断
【0306】
【化55】

【0307】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、20mM MES、150mM NaCl、pH6)に、N−フェニルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−フェニルジブロモマレイミド付加物が定量的収率で形成されたことが示された(質量14431)。
【0308】
混合物を、0℃でβ−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14179)が定量的変換で形成されたことが示された。
【0309】
実施例45:GrB2−SH2ドメインL111C/N−フェニルジブロモマレイミド/β−1−チオグルコース付加物の調製
【0310】
【化56】

【0311】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、20mM MES、150mM NaCl、pH6)に、N−フェニルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−フェニルジブロモマレイミド付加物が定量的収率で形成されたことが示された(質量14431)。
【0312】
混合物を、0℃でβ−1−チオグルコース(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/N−フェニルジブロモマレイミド/β−1−チオグルコース付加物が存在する唯一のタンパク質種であることが示された(質量=14547)。
【0313】
実施例46:GrB2−SH2ドメインL111C/N−フェニルジブロモマレイミド/β−1−チオグルコース付加物のβ−メルカプトエタノール媒介性の切断
【0314】
【化57】

【0315】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、20mM MES、150mM NaCl、pH6)に、N−フェニルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−フェニルジブロモマレイミド付加物が定量的収率で形成されたことが示された(質量14431)。
【0316】
混合物を、0℃でβ−1−チオグルコース(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/N−フェニルジブロモマレイミド/β−1−チオグルコース付加物が存在する唯一のタンパク質種であることが示された(質量=14547)。
【0317】
混合物を、0℃でβ−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14178)が定量的変換で形成されたことが示された。
【0318】
実施例47:GrB2−SH2ドメインL111C/ビオチン−PEG−ブロモマレイミド付加物の調製
【0319】
【化58】

【0320】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ビオチン−PEG−ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が定量的収率で形成されたことが示された(質量14634)。
【0321】
実施例48:GrB2−SH2ドメインL111C/ビオチン−PEG−ブロモマレイミド付加物のβ−メルカプトエタノール媒介性の切断
【0322】
【化59】

【0323】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ビオチン−PEG−ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ビオチン−PEG−ブロモマレイミド付加物が定量的収率で形成されたことが示された(質量14634)。
【0324】
混合物を、37℃でβ−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、37℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14180)が定量的変換で形成されたことが示された。
【0325】
実施例49:GrB2−SH2ドメインL111C/ビオチン−PEG−ジブロモマレイミド付加物の調製
【0326】
【化60】

【0327】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ビオチン−PEG−ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で2時間維持した。LC−MSを使用した分析により、所望の生成物が>80%の収率で形成されたことが示された(質量14701)。
【0328】
実施例50:GrB2−SH2ドメインL111C/ビオチン−PEG−ジブロモマレイミド付加物のβ−メルカプトエタノール媒介性の切断
【0329】
【化61】

【0330】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ビオチン−PEG−ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ビオチン−PEG−ジブロモマレイミド付加物が>80%の変換で形成されたことが示された(質量14701)。
【0331】
混合物を、0℃でβ−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14171)が>80%の変換で形成されたことが示された。
【0332】
実施例51:ニュートラアビジン被覆したアガロースビーズ上へのGrB2−SH2ドメインL111C/ビオチン−PEG−ブロモマレイミド付加物のプルダウン及び放出
【0333】
【化62】

【0334】
0℃のモデルタンパク質溶液(200μL、[タンパク質]1.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ビオチン−PEG−ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が定量的収率で形成されたことが示された(質量14634)。
【0335】
タンパク質/ビオチン−PEG−ブロモマレイミド付加物(200μL)及び非修飾モデルタンパク質(200μL)を、濃縮器(Vivaspin、カットオフ10k)中でPBS緩衝液(3x500μL)で独立して洗浄し、タンパク質溶液(300μL)(In)を得た。得られたタンパク質溶液のそれぞれについて、ニュートラアビジン被覆したアガロースビーズ(50%水性スラリー750μL)を、PBS(2x500μL)で洗浄した。次いで、タンパク質溶液(300μL)をビーズに添加し、混合物を4℃で30分間インキュベートした。混合物を遠心分離し、フロースルー(FT)を収集した。ビーズをPBS(2x500μL)で洗浄し、両方の洗浄画分を収集した(W1及びW2)。タンパク質を、β−メルカプトエタノール(25mM)を含むPBS(300μL)中で37℃で2時間インキュベートすることにより、ビーズから放出させた。サンプルを遠心分離し、切断されたGrB2−SH2ドメインL111Cを含む溶離液(El)を収集した。結果を図1に示す。
【0336】
回収されたタンパク質の量は、デンシトメトリーによるタンパク質希釈系列との比較により、44%と決定された。しかしながら、不可逆的に物理吸着されたタンパク質(未修飾のタンパク質コントロールを使用して決定した)に対して補正すると、補正された回収率は71%であった。
【0337】
実施例52:GrB2−SH2ドメインL111C/N−フルオレセインブロモマレイミド付加物の調製
【0338】
【化63】

【0339】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH7.0)に、N−フルオレセインブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が90%の変換で形成されたことが示された(質量14597)。
【0340】
実施例53:GrB2−SH2ドメインL111C/N−フルオレセインブロモマレイミド付加物のβ−メルカプトエタノール媒介性の切断
【0341】
【化64】

【0342】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH7.0)に、N−フルオレセインブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/フルオレセインブロモマレイミド付加物が90%の変換で形成されたことが示された(質量14597)。
【0343】
混合物を、37℃でβ−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、37℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14171)が87%の変換で形成されたことが示された。
【0344】
実施例54:GrB2−SH2ドメインL111C/N−フルオレセインジブロモマレイミド付加物の調製
【0345】
【化65】

【0346】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−フルオレセインジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が61%の変換で形成されたことが示された(質量14675)。
【0347】
実施例55:GrB2−SH2ドメインL111C/N−フルオレセインジブロモマレイミド付加物のβ−メルカプトエタノール媒介性の切断
【0348】
【化66】

【0349】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH7.0)に、N−フルオレセインジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/フルオレセインジブロモマレイミド付加物が61%の変換で形成されたことが示された(質量14597)。
【0350】
混合物を、37℃でβ−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、37℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14171)が85%の変換で形成されたことが示された。
【0351】
実施例56:GrB2−SH2ドメインL111C/BrDDPD付加物の調製
【0352】
【化67】

【0353】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、BrDDPD(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が定量的収率で形成されたことが示された(質量14348)。
【0354】
実施例57:GrB2−SH2ドメインL111C/BrDDPD付加物のβ−メルカプトエタノール媒介性の切断
【0355】
【化68】

【0356】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、BrDDPD(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、タンパク質/BrDDPD付加物が定量的収率で形成されたことが示された(質量14348)。
【0357】
混合物を、4℃で40時間透析し(100mMリン酸ナトリウム、150mM NaCl、pH8.0)、37℃でβ−メルカプトエタノール(5μL、H2O中の2.82M溶液)で処理した。この混合物を1秒間ボルテックスし、37℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14180)が定量的変換で形成されたことが示された。
【0358】
実施例58:GrB2−SH2ドメインL111C/DiBrDDPD付加物の調製
【0359】
【化69】

【0360】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、DiBrDDPD(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が定量的収率で形成されたことが示された(質量14427)。
【0361】
実施例59:GrB2−SH2ドメインL111C/DiBrDDPD付加物のβ−メルカプトエタノール媒介性の切断
【0362】
【化70】

【0363】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、DiBrDDPD(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、タンパク質/DiBrDDPD付加物が定量的収率で形成されたことが示された(質量14427)。
【0364】
混合物を、4℃で40時間透析し(100mMリン酸ナトリウム、150mM NaCl、pH8.0)、次いで37℃でβ−メルカプトエタノール(5μL、H2O中の2.82M溶液)で処理した。この混合物を1秒間ボルテックスし、37℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14180)が定量的変換で形成されたことが示された。
【0365】
実施例60:GrB2−SH2ドメインL111C/DiBrDDPD/β−1−チオグルコース付加物の調製
【0366】
【化71】

【0367】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、DiBrDDPD(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、タンパク質/DiBrDDPD付加物が定量的収率で形成されたことが示された(質量14427)。
【0368】
混合物を、4℃で40時間透析し(100mMリン酸ナトリウム、150mM NaCl、pH8.0)、次いで0℃でβ−1−チオグルコース(5μL、H2O中の28.2mM)で処理した。この混合物を1秒間ボルテックスし、室温で1時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/DiBrDDPD/β−1−チオグルコース付加物が存在する唯一のタンパク質種であることが示された(質量=14543)。
【0369】
実施例61:GrB2−SH2ドメインL111C/DiBrDDPD/β−1−チオグルコース付加物のβ−メルカプトエタノール媒介性の切断
【0370】
【化72】

【0371】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、DiBrDDPD(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、タンパク質/DiBrDDPD付加物が定量的収率で形成されたことが示された(質量14427)。
【0372】
混合物を、4℃で40時間透析し(100mMリン酸ナトリウム、150mM NaCl、pH8.0)、次いで0℃でβ−1−チオグルコース(5μL、H2O中の28.2mM溶液)で処理した。この混合物を1秒間ボルテックスし、室温で1時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/DiBrDDPD/β−1−チオグルコース付加物が存在する唯一のタンパク質種であることが示された(質量=14543)。
【0373】
混合物を、室温でβ−メルカプトエタノール(5μL、H2O中の2.82M溶液)で処理した。この混合物を1秒間ボルテックスし、室温で30分間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14180)が定量的変換で形成されたことが示された。
【0374】
実施例62:GrB2−SH2ドメインL111C/BrDDPD/β−1−チオグルコース付加物の調製
【0375】
【化73】

【0376】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、BrDDPD(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、タンパク質/BrDDPD付加物が定量的収率で形成されたことが示された(質量14348)。
【0377】
混合物を、4℃で40時間透析し(100mMリン酸ナトリウム、150mM NaCl、pH8.0)、次いで0℃でβ−1−チオグルコース(5μL、H2O中の28.2mM溶液)で処理した。この混合物を1秒間ボルテックスし、37℃で1時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/BrDDPD/β−1−チオグルコース付加物が17%の変換で形成されたことが示された(質量=14543)。
【0378】
実施例63:GrB2−SH2ドメインL111C/Z−2,3−ジブロモ−ブタ−2−エン二酸ジメチルエステル付加物の調製
【0379】
【化74】

【0380】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、Z−2,3−ジブロモ−ブタ−2−エン二酸ジメチルエステル(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が形成されたことが示された(質量14440)。
【0381】
実施例64:GrB2−SH2ドメインL111C/Z−2,3−ジブロモ−ブタ−2−エン二酸ジメチルエステル付加物のβ−メルカプトエタノール媒介性の切断
【0382】
【化75】

【0383】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、Z−2,3−ジブロモ−ブタ−2−エン二酸ジメチルエステル(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が定量的収率で形成されたことが示された(質量14370)。
【0384】
混合物を、37℃でβ−メルカプトエタノール(5μL、H2O中の2.82M溶液)で処理した。この混合物を1秒間ボルテックスし、37℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14180)が定量的変換で形成されたことが示された。
【0385】
実施例65:ソマトスタチンの修飾及び再生
還元型ソマトスタチンの調製
【0386】
【化76】

【0387】
凍結乾燥したソマトスタチン(質量=1638)を、緩衝液(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5%DMF)中に可溶化して、152.6μMの濃度(0.25mg/ml)とし、1.1当量のTCEPで、周囲温度で1時間還元した。還元の完了は、4当量のジブロモマレイミドをサンプルアリコートに添加し、LC−MSで分析して確認した。
【0388】
ハロマレイミド及び誘導体によるソマトスタチンの架橋
還元型ソマトスタチンは記載したとおりに生成した。1.1当量のハロマレイミド又はジブロモマレイミド誘導体(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5〜15.0%DMF中100xストック)を周囲温度で添加し、生成物の生成をLC−MSで1時間にわたりモニタリングした。結果を図2に示す。
【0389】
ジチオマレイミドによるソマトスタチンの架橋
還元型ソマトスタチンは記載したとおりに生成した。種々の量のジチオマレイミド(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5〜7.5%DMF中100xストック)を周囲温度で添加し、生成物の生成をLC−MSで1時間にわたりモニタリングした。結果を図3に示す。
【0390】
ブロモマレイミドによるソマトスタチンの修飾
【0391】
【化77】

【0392】
還元型ソマトスタチンは記載したとおりに生成した。2.1当量のブロモマレイミド(50mMリン酸ナトリウム、pH6.2、40%MeCN、7.5%DMF中100xストック)を周囲温度で添加したところ、ジ−付加生成物への完全な変換がLC−MSによって1時間以内に観察された。
【0393】
種々の還元剤による架橋ソマトスタチンの切断
マレイミド架橋ソマトスタチンは、記載したように調製した。100当量の種々の還元剤(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5%DMF中1000xストック)を添加し、未修飾ペプチド及び副産物(還元剤と遊離ペプチド−システインとの混合型ジスルフィド)の生成を、LC−MSによって4℃で2日間モニタリングした。ソマトスタチンとGSHとの混合型ジスルフィドは、MALDI−TOF MSでのみ検出できた。結果を図4に示す。
【0394】
種々の量のDTT及び2−メルカプトエタノールによる、架橋ソマトスタチンの切断
マレイミド架橋ソマトスタチンは、記載したように調製した。種々の量のDTT又は2−メルカプトエタノール(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5%DMF中1000xストック)を添加し、未修飾ペプチド及び副産物(還元剤と遊離ペプチド−システインとの混合型ジスルフィド)の生成を、LC−MSによって4℃で6時間モニタリングした。結果を図5に示す。
【0395】
架橋ソマトスタチンの触媒された切断
マレイミド架橋ソマトスタチンは、記載したように調製した。20当量の2−メルカプトエタノール(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5%DMF中1000xストック)を添加し、その後、緩衝液又は5当量のヨウ化ナトリウム若しくはベンゼンセレノール(50mMリン酸ナトリウム、pH6.2、40%MeCN、7.5%DMF中100xストック)のいずれかを添加し、未修飾ペプチド及び副産物(2−メルカプトエタノール又はベンゼンセレノールと遊離ペプチド−システインとの混合型ジスルフィド)の生成を、LC−MSによって周囲温度で20分間モニタリングした。結果を図6に示す。
【0396】
N−官能化マレイミド架橋ソマトスタチンの切断
ソマトスタチンを、記載したとおりに還元し、N−官能化マレイミド誘導体で架橋した。100当量の2−メルカプトエタノール(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5%DMF中1000xストック)を添加し、未修飾ペプチド及び副産物(2−メルカプトエタノールと遊離ペプチド−システインとの混合型ジスルフィド)の生成をLC−MSにより4℃で2日間モニタリングした。結果を図7に示す。
【0397】
ソマトスタチンへのモノブロモマレイミドのジ−付加生成物の切断
還元型ソマトスタチンを、2.1当量のモノブロモマレイミドと反応させて、ジ−付加生成物を得た。次に、100当量の2−メルカプトエタノール(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5%DMF中1000xストック)を添加し、モノ−付加生成物、未修飾ペプチド及び副産物(2−メルカプトエタノールと遊離ペプチド−システインとの混合型ジスルフィド)の生成を、LC−MSにより周囲温度で2.5時間モニタリングした。結果を図8に示す。
【0398】
ソマトスタチンの比較上のin situ架橋
ソマトスタチンに、種々の量のジチオマレイミド(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5−7.5%DMF中100xストック)を添加し、反応を周囲温度で10分間インキュベートした。次に、種々の量のTCEP又はベンゼンセレノール(100xストック、50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5〜7.5%DMF中で新たに調製した)を添加し、架橋ソマトスタチンの生成を、LC−MSにより周囲温度で1時間にわたりモニタリングした。結果を図9に示す。
【0399】
ソマトスタチンのin situ PEG化
ソマトスタチンに、5当量のN−PEG5000−ジチオフェノールマレイミド又は10当量のN−PEG5000−ジチオフェノールマレイミド(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5%DMF中100xストック)のいずれかを添加し、反応を周囲温度で10分間インキュベートした。次に、3当量のTCEPそれぞれ5当量のベンゼンセレノール(100xストック、50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5−7.5%DMF中に新たに調製)を添加し、PEG化ソマトスタチンの生成を、LC−MSによって周囲温度で2時間にわたってモニタリングした。結果を図10に示す。
【0400】
DiBrDDPDによるソマトスタチンの修飾
【0401】
【化78】

【0402】
凍結乾燥ソマトスタチン(質量=1638)を、緩衝液(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5%DMF)中に可溶化して、152.6μMの濃度(0.25mg/mL)にし、1.1当量のTCEPで21℃で1時間還元した。還元の完了はLCMSによって確認した(質量=1640)。DiBrDDPD(100mol当量)を添加し、反応を21℃で10分間維持した。ソマトスタチン/DiBrDDPD付加物が定量的変換で形成したことが観察された(質量=1803)。
【0403】
パッチクランプを使用した、架橋ソマトスタチンの生物活性保持の実証
得られたソマトスタチンアナログの活性に対して架橋修飾が有害な影響を有するか否かを試験するために、本発明者らは、ジブロモマレイミド架橋アナログ、PEG化ジブロモマレイミド架橋アナログ及びフルオレセインジブロモマレイミド架橋アナログを、パッチクランプアッセイによって試験した。HKIR3.1/3.2チャネル及びヒトソマトスタチンレセプター2を発現するHEK293細胞をこれらの化合物で処理し、ホールセルパッチクランプ電流記録を採取した。3つ全てのアナログが、ソマトスタチン自体と匹敵する振幅で、GIRK電流の強い活性化を誘導した。コントロールとして細胞を百日咳毒素又はGIRK阻害剤Tertiapin Qで処理したとき、電流は大きく阻害された。このデータにより、架橋ソマトスタチンアナログが、ソマトスタチンレセプター2のアゴニズムに関して、ソマトスタチンの生物活性を保持していることが確認される。
【0404】
細胞培養
細胞培養方法及び安定細胞株の生成は、J Biol Chem 275,921−9(2000)に記載のとおりに実施した。Kir3.1チャネル及びKir3.2Aチャネルを安定に発現するHEK293細胞(ヒト胚性腎細胞株)を、10%胎仔ウシ血清及び727μgのG418(Invitrogen)を補充した最小必須培地中で、加湿雰囲気(95%O2、5%CO2)中37℃で維持した。細胞を、落射蛍光を使用したトランスフェクト細胞の可視化のためのpEGFP−N1(Clontech)と共に、SSTR2 DNA(Missouri S&T cDNA Resource Center)で一過的にトランスフェクトした。トランスフェクションは、細胞培養培地(血清も抗生物質も含まない)97μl当たり、5μlのFugene HD(Roche)並びに800ngのSSTR2−DNA及び40ngのEGFP−DNAで実施した。
【0405】
パッチクランプ実験のためのソマトスタチン及びアナログの調製
架橋ソマトスタチンは上記のように調製した。ソマトスタチン及びそのアナログを、緩衝液(50mMリン酸ナトリウム、pH6.2)中で4℃で24時間透析して、有機溶媒を除去した。透析後、濃度を決定し、ペプチドを4℃で保存した。最終濃度20μMのソマトスタチン及びアナログを使用した(希釈は、細胞外パッチクランプ緩衝液中で行った)。
【0406】
電気生理学
ホールセルパッチクランプ電流記録を、フィラメント化ホウケイ酸ガラスキャピラリー(Harvard Apparatus、1.5mm ODx1.17mm ID)から引き出される3−4MΩの抵抗を有するファイアポリッシュピペットを使用して、Axopatch 200B増幅器(Axon Instruments)で実施した。データを取得し、Digidata 1322Aインターフェイス(Axon Instruments)及びpCLAMPソフトウェア(バージョン8.1、Axon Instruments)で分析した。速い灌流システムを使用して、ソマトスタチン及びアナログをアプライした(Rapid Solution Changer、RSC−160、Bio−Logic France)。細胞を−60mVでクランプした。細胞外溶液は以下であった(mM):NaCl 80、KCl 60、CaCl2 2、MgCl2 1、HEPES 10、NaH2PO4 0.33、グルコース 10、pH7.4;一方、細胞内溶液は以下であった(mM):グルコン酸K 110、KCl 20、NaCl 10、MgCl2 1、MgATP 2、EGTA 2 GTP 0.3、pH7.4。アゴニストの適用後、電流は、遅延「ラグ」とその後のピーク振幅への迅速な上昇「ピークまでの時間」で活性化した。アゴニストの除去後、電流は、減衰してベースラインに戻った。各細胞について、薬物適用の圧力から生じたフローアーチファクト(flow artifact)が存在するか否かを評価した。これは、記録の開始時に、排水管の1つからの浴溶液を適用することによって行った。GIRK電流の阻害剤Tertiapin(Alomone)を、最終濃度100nMで使用した。細胞を、Gi/oタンパク質の阻害剤である百日咳毒素(Sigma、100ng/ml)と共に一晩インキュベートした。薬物は濃ストック溶液として調製し、−20℃で維持した。
【0407】
結果を図11及び図12に示す。
【技術分野】
【0001】
(導入)
複雑な有機分子の合成はしばしば、複数の化学的に反応性の官能基を保有する試薬に対して化学変換を実施することを含む。かかるプロセスの重要な局面は、他の官能基に関与する望ましくない副反応を抑制しつつ、特定の官能基で所望の化学変換をもたらす必要性である。従って、化学的保護基の使用は、非常に多数の産業的及び治療的に有用な化合物を産生するのに必要な合成工程を実施する際に十分な特異性を達成することにおいて、重要な道具であることが多い。
【背景技術】
【0002】
化学的保護の基本原理は、概念的には単純であり、その反応性が遮断される分子上の特定の官能基に化学的保護基を導入することによって、その分子上の別の官能基において反応が特異的にもたらされるのを可能にする。しかしながら、この単純な前提の根底には、多様な検討事項がある。これらには、分子の残りの部分に影響を与えない条件下でほぼ定量的な収率を達成するための特定の保護基の導入の必要性、副反応を誘導せずに又はその他の方法でそのプロセスの化学に影響を与えずに、後続の合成工程の間に保護基が完全にインタクトのままであるための要件、及びこれもまた分子上の別の場所に影響を与えない条件下で、必要なくなったときに保護基を除去しやすくする必要性、が挙げられる。さらに、多くの合成方法において、複数の保護基が同時に使用される。かかる方法では、1つの保護基を、任意の他の保護基に影響を与えない条件下で除去できることが、極めて重要であることが多い(いわゆる「直交」保護基ストラテジー)。この文脈において、非常に多数の保護基が知られており、当該分野で慣用的に使用されていることは、驚くべきことではない。
【0003】
チオール官能基(−SH)は、高度に求核性であり、特に酸化プロセスを受けやすいことが周知である。従って、分子中のチオール基の保護は、合成手順の間に特に重要であり得る。例えば、タンパク新生アミノ酸システインの−CH2SH α−置換は、ペプチド合成に関して独自の合成上の問題を提示する。なぜなら、チオール基はその保護されていない形態では、多くの慣用的な操作を妨害するからである。
【0004】
チオール基を保護するための最も一般的なストラテジーはおそらく、直接的アルキル化(例えば、t−ブチル、トリチル又はアセトアミドメチル基による)である。ジスルフィド形成(例えば、t−ブチルチオール基による)及びアシル誘導体化(例えば、チオエステル、チオカーボネート及びチオカルバメートを形成する)もまた、分子の他の部分に化学変換をもたらしつつチオール基を遮蔽するために、しばしば使用される。
【0005】
有機合成方法への組込みに適した新たな保護基がなおも必要とされている。新規チオール保護ストラテジーの開発を支持する特定の検討事項には、十分な特異性でチオールと反応する、必要に応じて容易に切断できる基を見出すこと、分子中の他の官能基(保護されているいないにかかわらず)に対し化学的に不活性な試薬を使用すること、が挙げられる。
【0006】
本発明は、そのC=C二重結合上に求電子性脱離基を保有する1,2−ジカルボニルエテン部分を有する試薬が、チオール化合物中のチオール基を保護するために使用できるという驚くべき知見に基づいている。このストラテジーの利点としては以下が挙げられる:
【0007】
・試薬とチオール化合物との間の反応が、非常に迅速であり、実質的に化学量論的に実施できる。
・試薬が、複雑な有機分子中にしばしば存在する他の官能基(例えば、ヒドロキシル基、アミン基及びカルボキシル基)よりも、チオール官能基に対して選択性が高い。従って、チオール官能基の特異的保護が可能となる。
・化学的保護工程の間に形成されるチオエーテル結合が、容易に逆転可能であり、特に、当業者によって選択された時間で、制御された様式で切断できる。
・コンジュゲート付加反応において求核剤として作用できる試薬によって、チオエーテル結合が切断される。この特異的反応性プロフィールは、広範な合成ストラテジーにおいて利用され得る。例えば、本発明のチオール保護ストラテジーの使用は、保護された分子が、コンジュゲート付加反応求核剤と反応性の他の官能基をいずれも含まない場合、又はかかる試薬に対して化学的に不活性な1個以上のさらなる保護基が存在する場合に、特に有利であり得る。
【0008】
本発明の方法論は、ジスルフィド化合物の保護にも、理想的に適している。なぜなら、第二の求電子性脱離基の組込みが、1,2−ジカルボニルエテン部分がそのC=C二重結合の両方の炭素上に求電子性脱離基を保有し、その試薬をジスルフィド部分中に含まれる硫黄原子の両方と反応できるようにし、それによって、ジスルフィド官能基をマスクする複素環式構造を形成するからである。
【発明の概要】
【課題を解決するための手段】
【0009】
(発明の要旨)
本発明は、チオール化合物中のチオール基を保護するための試薬としての、式(I)の部分を含む化合物の使用を提供する:
【0010】
【化1】

【0011】
式中、
X及びX’は、同じ又は異なって、それぞれ酸素、硫黄又は式=NR1の基を示し、R1は、水素、ヒドロキシル、C1−6アルキル又はフェニルであり、
Yは求電子性脱離基である。
【0012】
本発明はまた、
(i)チオール化合物を、本明細書中に記載される式(I)の部分を含む化合物と反応させて、保護されたチオール基を有する化合物を産生する工程;及び
(ii)その後、該保護されたチオール基を脱保護する工程、
を含むプロセスを提供する。
【0013】
本発明はさらに、式(II)の化合物を提供する:
【0014】
【化2】

【0015】
式中、
X及びX’は、同じ又は異なって、それぞれ酸素、硫黄又は式=NR1の基を示し、R1は、水素、ヒドロキシル、C1−6アルキル又はフェニルであり;
Yは求電子性脱離基であり;
R2は、水素原子又は基IGを示し;
以下のいずれかであり:
R3及びR3’は、同じ又は異なって、それぞれ水素原子又は基IGを示す;又は
R3及びR3’は一緒になって、式−N(R33’)の基を形成し、R33’は水素原子又は基IGを示す;又は
R3及びR3’は一緒になって、式−N(R33’)−N(R33’)−の基を形成し、各R33’は、同じ又は異なって、水素原子又は基IGを示す;
各基IGは、同じ又は異なって、非置換であるか又は1個以上のハロゲン原子で置換されている、C1−20アルキル基、C2−20アルケニル基又はC2−20アルキニル基である部分を示し、式中、(a)0、1又は2個の炭素原子は、C6−10アリーレン、5〜10員のヘテロアリーレン、C3−7カルボシクリレン(carbocyclylene)及び5〜10員のヘテロシクリレン(heterocyclylene)基から選択される基によって置換されており、かつ(b)0、1又は2個の−CH2−基は、−O−、−S−、−S−S−、−C(O)−、−NH−及び−N(C1−6アルキル)−基から選択される基によって置換されており、式中、
(i)該アリーレン、ヘテロアリーレン、カルボシクリレン及びヘテロシクリレン基は、非置換であるか又はハロゲン原子並びにC1−6アルキル、C1−6アルコキシ、C1−6アルキルチオール、−N(C1−6アルキル)(C1−6アルキル)及びニトロ基から選択される1個以上の置換基によって置換されており;
(ii)該カルボシクリレン及びヘテロシクリレン基中の0、1又は2個の炭素原子は、−C(O)−基によって置換されており;
Qは、カルボキシル基又は保護されたカルボキシル基であり;
Q’は、アミン基又は保護されたアミン基であり;
ただし、式(II)の化合物は、14C−N−エチルマレイミド−S−システインでも14C−N−エチルマレイミド−S−N−アセチル−システインでもない。
【0016】
本発明はまた、ジスルフィド化合物中のジスルフィド基を保護するための試薬としての、式(III)の部分を含む化合物の使用を提供する:
【0017】
【化3】

【0018】
式中、
X及びX’は、同じ又は異なって、それぞれ酸素、硫黄又は式=NR1の基を示し、R1は、水素、ヒドロキシル、C1−6アルキル又はフェニルであり;
Y及びY’は、同じ又は異なって、それぞれ求電子性脱離基を示す。
【0019】
なおさらに、本発明は、
(i)ジスルフィド化合物中のジスルフィド基を、本発明の式(III)の部分を含む化合物と反応させて、保護されたジスルフィド基を有する化合物を産生する工程;及び
(ii)その後、該保護されたジスルフィド基を脱保護する工程、
を含むプロセスを提供する。
【図面の簡単な説明】
【0020】
【図1】図1は、実施例51に記載されるプロトコルの結果を示し、該実施例では、タンパク質/ビオチン−PEG−ブロモマレイミド付加物及び未修飾のモデルタンパク質溶液(In)を、ニュートラアビジン被覆したアガロースビーズに添加し、遠心分離し、フロースルー(FT)収集し、ビーズをPBSで洗浄し、両方の洗浄画分を収集し(W1及びW2)、タンパク質を、β−メルカプトエタノールを含むPBS中でインキュベートすることによりビーズから放出させ、サンプルを遠心分離し、切断されたタンパク質を含む溶離液(El)を収集した。
【図2】図2は、LC−MS(y軸=シグナル%;x軸=時間/min)によって測定される、実施例65に記載されるプロトコルに従った、ハロマレイミドからのソマトスタチン−マレイミド付加物の生成を示す。左上:ジクロロマレイミド(丸)、ジブロモマレイミド(四角)及びジヨードマレイミド(三角)からのソマトスタチン付加物の生成。右上:モノブロモマレイミド(丸)、N−メチルモノブロモマレイミド(四角)及びN−メチルジブロモマレイミド(三角)からのソマトスタチン付加物の生成。左下:N−フルオレセイン−ジブロモマレイミド(丸)、N−ビオチン−ジブロモマレイミド(四角)、N−PEG 5000−ジブロモマレイミド(三角)、N−PEG−5000−ジチオフェノールマレイミド(菱形)及びN−PEG 300−ジブロモマレイミド(卵型)からのソマトスタチン付加物の生成。
【図3】図3は、LC−MS(y軸=シグナル%;x軸=時間/min)によって測定される、実施例65に記載されるプロトコルに従った、ジチオマレイミドからのソマトスタチン−マレイミド付加物の生成を示す。左上:当量(丸)、5当量(四角)及び10当量(三角)における、ジ−2−メルカプトエタノールマレイミドからのソマトスタチン付加物の生成。右上:1当量(丸)、5当量(四角)及び10当量(三角)における、ジシステインマレイミドからのソマトスタチン付加物の生成。左下:1当量(丸)、5当量(四角)及び10当量(三角)における、ジチオフェノールマレイミドからのソマトスタチン付加物の生成。右下:1当量(丸)、5当量(四角)及び10当量(三角)における、ジ−2−メルカプトピリジンマレイミドからのソマトスタチン付加物の生成。
【図4】図4は、LC−MS(y軸=シグナル%;x軸=分(min)、時間(h)及び日(d)で示される時間)によって測定される、実施例65に記載されるプロトコルに従った、種々の還元剤によるマレイミド架橋ソマトスタチンの切断を示す。左上:DTTによる総修飾ソマトスタチン−マレイミド(白丸)及び副産物の総量(黒丸)。上中:2−メルカプトエタノールによる総修飾ソマトスタチン−マレイミド(白丸)及び副産物の総量(黒丸)。右上:GSHによる総修飾ソマトスタチン−マレイミド(白丸)及び副産物の総量(黒丸)。左下:TCEPによる総修飾ソマトスタチン−マレイミド(白丸)及び副産物の総量(黒丸)。右下:1,2−エタンジチオールによる総修飾ソマトスタチン−マレイミド(白丸)及び副産物の総量(黒丸)。
【図5】図5は、LC−MS(y軸=シグナル%;x軸=時間/min)によって測定される、実施例65に記載されるプロトコルに従った、種々の量のDTT及び2−メルカプトエタノールによるマレイミド架橋ソマトスタチンの切断を示す。左:50当量(白丸)、20当量(白三角)及び10当量(白四角)のDTTによるソマトスタチンの再生。右:50当量(白丸)、20当量(白三角)及び10当量(白四角)の2−メルカプトエタノールによるソマトスタチンの再生、並びに50当量(黒丸)、20当量(黒三角)及び10当量(黒四角)での副産物の総量。
【図6】図6は、LC−MS(y軸=シグナル%;x軸=時間/min)によって測定される、実施例65に記載されるプロトコルに従った、架橋ソマトスタチンの触媒された切断を示す。図に示すのは、2−メルカプトエタノール(白丸)、2−メルカプトエタノールと共にNaI(白四角)、及び2−メルカプトエタノールと共にベンゼンセレノール(白三角)による、ソマトスタチンの再生、並びに2−メルカプトエタノール(黒丸)、2−メルカプトエタノールと共にNaI(黒四角)、及び2−メルカプトエタノールと共にベンゼンセレノール(黒三角)を使用したときの、総副産物である。
【図7】図7は、LC−MS(y軸=シグナル%;x軸=分(min)、時間(h)及び日(d)で示される時間)によって測定される、実施例65に記載されるプロトコルに従った、2−メルカプトエタノールによるN−官能化マレイミド架橋ソマトスタチンの切断を示す。左上:N−メチルマレイミドソマトスタチン付加物の切断により、ソマトスタチン(白丸)及び総副産物(黒丸)が生じる。上中:N−ビオチンマレイミドソマトスタチン付加物の切断により、ソマトスタチン(白丸)及び総副産物(黒丸)が生じる。右上:N−フルオレセインマレイミドソマトスタチン付加物の切断により、ソマトスタチン(白丸)及び総副産物(黒丸)が生じる。左下:N−PEG 5000マレイミドソマトスタチン付加物の切断により、ソマトスタチン(白丸)及び総副産物(黒丸)が生じる。下中:N−PEG 300マレイミドソマトスタチン付加物の切断により、ソマトスタチン(白丸)及び総副産物(黒丸)が生じる。
【図8】図8は、LC−MS(y軸=シグナル%;x軸=時間/hours)によって測定される、実施例65に記載されるプロトコルに従った、モノブロモマレイミドとソマトスタチンとのジ付加生成物の切断を示す。左上:2−メルカプトエタノールを使用した、ソマトスタチン−マレイミド(白丸)、ソマトスタチン−ビス−マレイミド(黒丸)及び総副産物(三角)。右上:DTTを使用した、ソマトスタチン−マレイミド(白丸)、ソマトスタチン−ビス−マレイミド(黒丸)及び総副産物(三角)。左下:TCEPを使用した、ソマトスタチン−マレイミド(白丸)、ソマトスタチン−ビス−マレイミド(黒丸)及び総副産物(三角)。
【図9】図9は、LC−MS(y軸=シグナル%;x軸=時間/min)によって測定される、実施例65に記載されるプロトコルに従った、種々の量のジチオマレイミドによるソマトスタチンの比較上のin situ架橋を示す。本図は、3:5の比率のTCEP開始剤及びチオフェノール(丸)、5:10の比率のセレノール開始剤とチオフェノール(四角)、及び10:20の比率のセレノール開始剤と2−メルカプトエタノール(三角)、を使用した架橋ソマトスタチンの生成を示す。
【図10】図10は、LC−MS(y軸=シグナル%;x軸=時間/min)によって測定される、実施例65に記載されるプロトコルに従った、ソマトスタチンのin situ PEG化を示す。本図は、5当量のN−PEG5000−ジチオフェノールマレイミド及び3当量のTCEPを使用した(丸)、並びに10当量のN−PEG5000−ジチオフェノールマレイミド及び5当量のベンゼンセレノールを使用した(四角)、PEG化ソマトスタチンの生成を示す。
【図11】図11は、実施例65に記載されたパッチクランプアッセイで得られたホールセルパッチクランプ電流記録を示す。本図は、SSTR2を発現するGIRK 1/2A株化細胞から記録された、代表的な出力波形を示す。細胞を−60mVでクランプし、20μMのソマトスタチン又はその誘導体を20秒間適用した。左上:ソマトスタチン(示された軸において、垂直線は1000pAを示し、水平線は20msを示す)。右上:ジブロモマレイミド架橋ソマトスタチン(示された軸において、垂直線は1000pAを示し、水平線は20msを示す)。左下:フルオレセインジブロモマレイミド架橋ソマトスタチン(示された軸において、垂直線は1000pAを示し、水平線は20msを示す)。右下:PEG化ジブロモマレイミド架橋ソマトスタチン(示された軸において、垂直線は1000pAを示し、水平線は20msを示す)。
【図12】図12は、実施例65に記載されたパッチクランプアッセイにおける、ソマトスタチン及びそのアナログにより活性化された電流の振幅を示す。x軸は、電流の振幅をpA/pFで示す。上の2本のバーはフルオレセインジブロモマレイミド架橋ソマトスタチンに由来し(黒のバーは、百日咳毒素による24時間にわたる細胞の前処理後であり;灰色のバーは前処理なしである)、次の2本のバーはPEG化ジブロモマレイミド架橋ソマトスタチンに由来し(黒のバーは、百日咳毒素による24時間にわたる細胞の前処理後であり;灰色のバーは前処理なしである)、次の3本のバーはジブロモマレイミド架橋ソマトスタチンに由来し(白のバーは、GIRK阻害剤TertiapinQ(100nM)との5分間のプレインキュベーション後であり;黒のバーは、百日咳毒素による24時間にわたる細胞の前処理後であり;灰色のバーは前処理なしである)、下の2本のバーはソマトスタチンに由来する(黒のバーは、百日咳毒素による24時間にわたる細胞の前処理後であり;灰色のバーは前処理なしである)。
【発明を実施するための形態】
【0021】
本明細書中で使用する場合、用語「基」及び「部分」は相互交換可能に使用される。
【0022】
本明細書中で使用する場合、「チオール化合物」は、少なくとも1個のチオール基−SHを含む化合物である。
【0023】
本明細書中で使用する場合、用語「求電子性脱離基」とは、その炭素原子における求核攻撃後に求核剤により置換され得る、飽和又は不飽和の炭素原子に結合した置換基を意味する。当業者は、特定の化合物上に位置付けるため及び特定の求核剤と反応するために適した求電子性脱離基を、慣用的に選択できる。
【0024】
本明細書中で使用する場合、用語「求核剤」とは、電子対を提供することによって化学結合を形成することができる官能基又は化合物を意味する。
【0025】
本明細書中で使用する場合、表現「チオール基を保護する」とは、チオール化合物上に保持されるチオール基(−SH)に保護基を導入することを意味する。保護基を使用する化学的保護の概念は、もちろん、有機合成の分野で十分理解されている。従って、当業者であれば、試薬又はプロセスの特定の使用が、「チオール基を保護する」ことを含むことを即座に認識するであろう。
【0026】
本明細書中で使用する場合、用語「保護基」とは、化合物中の官能基に導入された、その官能基の化学的反応性を修飾する基を意味する。典型的には、保護基は、その官能基を、引き続く化学変換がその化合物にもたらされる場合に使用される反応条件に対して化学的に不活性にするといった方法で、官能基の化学的反応性を修飾する。従って、「チオール保護基」は、化合物中のチオール基に導入された保護基である。
【0027】
当業者が即座に認識するように、保護基は、(保護されていない)官能基と保護基前駆体との間の反応によって、化合物中の官能基に導入される。保護されていないチオール官能基は、保護された化合物が形成される(即ち、化合物と保護基との間にチオール結合−S−が形成される)ときに典型的には離脱するプロトンを保有する。本発明において、保護基前駆体は、式(I)の部分を含む化合物である。チオール化合物上のチオール基が式(I)の部分を含む化合物と反応する場合、チオール基は、求電子性脱離基 Yを置換することによって、C=C二重上の炭素原子の一方に結合する。従って、本発明の保護基は、式(I’)の部分を含む基である:
【0028】
【化4】

【0029】
本明細書中で使用する場合、「保護された官能基」とは、保護基への結合によって化学的に保護された官能基を意味する。本発明によれば、「保護されたチオール基」は、式(I’)の部分を含む基に結合したチオール基である。「保護されたアミン基」は、アミン基(−NH2)を保護することによって得られ得る基である。「保護されたカルボキシル基」は、カルボキシル基(−COOH)を保護することによって得られ得る基である。
【0030】
本明細書中で使用する場合、「脱保護する」とは、保護された官能基から保護基を除去することを意味する。従って、本発明では、保護されたチオール基を脱保護することは、保護されたチオール基から式(I’)の部分を含む基を除去することを含む。
【0031】
本明細書中で使用する場合、2個以上の保護基に関して用語「直交(orthogonal)」とは、保護基の1つ1つが、それが結合した官能基から除去され得、他の保護基が化学的に不活性である反応条件が存在することを意味する。例えば、第一の保護基が塩基性条件下で除去できるが酸性条件下では除去できず、第二の保護基が酸性条件下で除去できるが塩基性条件下では除去できない場合、これら第一及び第二の保護基は、直交保護基を構成する。
【0032】
本明細書中で使用する場合、用語「アルキル」には、直鎖及び分枝鎖の両方の飽和アルキル基が含まれる。好ましくは、アルキル基は、C1−20アルキル基、より好ましくはC1−15、なおより好ましくはC1−12アルキル基、なおより好ましくはC1−6アルキル基であり、最も好ましくはC1−4アルキル基である。特に好ましいアルキル基には、例えば、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、tert−ブチル、ペンチル及びヘキシルが挙げられる。用語「アルキレン」は、しかるべく解釈されるべきである。
【0033】
本明細書中で使用する場合、用語「アルケニル」とは、分枝鎖でも非分枝鎖でもよい、1個以上の炭素−炭素二重結合を含む基をいう。好ましくは、アルケニル基は、C2−20アルケニル基、より好ましくはC2−15アルケニル基、なおより好ましくはC2−12アルケニル基、又は好ましくはC2−6アルケニル基であり、最も好ましくはC2−4アルケニル基である。用語「アルケニレン」は、しかるべく解釈されるべきである。
【0034】
本明細書中で使用する場合、用語「アルキニル」とは、分枝鎖でも非分枝鎖でもよい、1個以上の三重結合を含む炭素鎖をいう。好ましくは、アルキニル基は、C2−20アルキニル基、より好ましくはC2−15アルキニル基、なおより好ましくはC2−12アルキニル基、又は好ましくはC2−6アルキニル基であり、最も好ましくはC2−4アルキニル基である。用語「アルキニレン」は、しかるべく解釈されるべきである。
【0035】
特に指定しない場合、アルキル、アルケニル又はアルキニル基は、典型的には非置換である。しかしながら、かかる基が非置換又は置換であると示されている場合、1個以上の水素原子が、ハロゲン原子置換基で置換されていてもよい。好ましくは、置換されたアルキル、アルケニル又はアルキニル基は、1〜10個の置換基、より好ましくは1〜5個の置換基、なおより好ましくは1、2又は3個の置換基、最も好ましくは1又は2個の置換基、例えば1個の置換基を有する。しかし好ましくは、アルキル、アルケニル又はアルキニル基は、非置換である。
【0036】
アルキル、アルケニル若しくはアルキニル基である部分において、(a)0、1又は2個の炭素原子は、C6−10アリーレン、5〜10員のヘテロアリーレン、C3−7カルボシクリレン及び5〜10員のヘテロシクリレン基から選択される基によって置換されていてもよく、かつ(b)0、1又は2個の−CH2−基は、−O−、−S−、−S−S−、−C(O)−及び−N(C1−6アルキル)−基から選択される基によって置換されていてもよく、合計で0、1又は2個の該炭素原子及び−CH2−基が置換されていることが好ましく、合計で0又は1個がより好ましい。最も好ましくは、炭素原子又は−CH2−基のいずれも置換されていない。
【0037】
−CH2−基を置換するための好ましい基は、−O−、−S−及び−C(O)−基である。炭素原子を置換するための好ましい基は、フェニレン、5〜6員のヘテロアリーレン、C5−6カルボシクリレン及び5〜6員のヘテロシクリレン基である。本明細書中で使用する場合、「0、1又は2個の炭素原子」への言及は、アルキル、アルケニル又はアルキニル鎖中の任意の末端又は非末端炭素原子(その炭素原子に結合した任意の水素原子を含む)を意味する。本明細書中で使用する場合、「0、1又は2個の−CH2−基」への言及は、アルキル、アルケニル又はアルキニル鎖中の末端炭素原子に対応しない基をいう。
【0038】
本明細書中で使用する場合、C6−10アリール基は、6〜10個の炭素原子を有する、単環式又は多環式の6〜10員の芳香族炭化水素環系である。フェニルが好ましい。用語「アリーレン」は、しかるべく解釈されるべきである。
【0039】
本明細書中で使用する場合、5〜10員のヘテロアリール基は、O、S及びNから選択される少なくとも1個のヘテロ原子、例えば、1、2、3又は4個のヘテロ原子を含む、単環式又は多環式の5〜10員の芳香族環系(例えば、5〜6員環)である。環が4個のヘテロ原子を含む場合、これらは好ましくは全てが窒素原子である。用語「ヘテロアリーレン」は、しかるべく解釈されるべきである。
【0040】
単環式ヘテロアリール基の例としては、チエニル、フリル、ピロリル、イミダゾリル、チアゾリル、イソチアゾリル、ピラゾリル、オキサゾリル、イソオキサゾリル、トリアゾリル、チアジアゾリル、オキサジアゾリル、ピリジニル、ピリダジニル、ピリミジニル、ピラジニル、トリアジニル及びテトラゾリル基が挙げられる。
【0041】
多環式ヘテロアリール基の例としては、ベンゾチエニル、ベンゾフリル、ベンズイミダゾリル、ベンゾチアゾリル、ベンゾイソチアゾリル、ベンゾオキサゾリル、ベンゾイソオキサゾリル、ベンゾトリアゾリル、インドリル、イソインドリル及びインダゾリル基が挙げられる。好ましい多環式基としては、インドリル、イソインドリル、ベンズイミダゾリル、インダゾリル、ベンゾフリル、ベンゾチエニル、ベンゾオキサゾリル、ベンゾイソオキサゾリル、ベンゾチアゾリル及びベンゾイソチアゾリル基が挙げられ、より好ましくはベンズイミダゾリル、ベンゾオキサゾリル及びベンゾチアゾリルであり、最も好ましくはベンゾチアゾリルである。しかしながら、単環式ヘテロアリール基が好ましい。
【0042】
好ましくは、ヘテロアリール基は、5〜6員のヘテロアリール基である。特に好ましいヘテロアリール基は、チエニル、ピロリル、イミダゾリル、チアゾリル、イソチアゾリル、ピラゾリル、オキサゾリル、イソオキサゾリル、トリアゾリル、ピリジニル、ピリダジニル、ピリミジニル及びピラジニル基である。より好ましい基は、チエニル、ピリジニル、ピリダジニル、ピリミジニル、ピラジニル、ピロリル及びトリアジニルでり、最も好ましくはピリジニルである。
【0043】
本明細書中で使用する場合、5〜10員のヘテロシクリル基は、1個以上の炭素原子、例えば1、2、3又は4個の炭素原子が、N、O、S、S(O)及びS(O)2から選択される部分で置換されている、非芳香族の、飽和又は不飽和の、単環式又は多環式のC5−10炭素環式環系である。好ましくは、5〜10員のヘテロシクリル基は5〜6員環である。用語「ヘテロシクリエン(heterocyclyene)」は、しかるべく解釈されるべきである。
【0044】
ヘテロシクリル基の例としては、アゼチジニル、オキセタニル、チエタニル(thietanyl)、ピロリジニル、イミダゾリジニル、オキサゾリジニル、イソオキサゾリジニル、チアゾリジニル、イソチアゾリジニル、テトラヒドロフラニル、テトラヒドロチエニル、テトラヒドロピラニル、テトラヒドロチオピラニル、ジチオラニル(dithiolanyl)、ジオキソラニル、ピラゾリジニル、ピペリジニル、ピペラジニル、ヘキサヒドロピリミジニル、メチレンジオキシフェニル、エチレンジオキシフェニル、チオモルホリニル、S−オキソ−チオモルホリニル、S,S−ジオキソ−チオモルホリニル、モルホリニル、1,3−ジオキソラニル、1,4−ジオキソラニル、トリオキソラニル(trioxolanyl)、トリチアニル(trithianyl)、イミダゾリニル、ピラニル、ピラゾリニル、チオキソラニル(thioxolanyl)、チオキソチアゾリジニル、1H−ピラゾール−5−(4H)−オニル、1,3,4−チアジアゾール−2(3H)−チオニル、オキソピロリジニル、オキソチアゾリジニル、オキソピラゾリジニル、スクシンイミド(succinimido)及びマレイミド基及び部分が挙げられる。好ましいヘテロシクリル基は、ピロリジニル、イミダゾリジニル、オキサゾリジニル、イソオキサゾリジニル、チアゾリジニル、イソチアゾリジニル、テトラヒドロフラニル、テトラヒドロチエニル、テトラヒドロピラニル、テトラヒドロチオピラニル、ジチオラニル、ジオキソラニル、ピラゾリジニル、ピペリジニル、ピペラジニル、ヘキサヒドロピリミジニル、チオモルホリニル及びモルホリニル基及び部分である。より好ましいヘテロシクリル基は、テトラヒドロピラニル、テトラヒドロチオピラニル、チオモルホリニル、テトラヒドロフラニル、テトラヒドロチエニル、ピペリジニル、モルホリニル及びピロリジニル基である。
【0045】
疑義を回避するため、ヘテロアリール基及びヘテロシクリル基の上記定義は、環中に存在し得る「N」部分をいうが、熟練の化学者に明らかなように、N原子は、単結合を介して隣接する環原子のそれぞれに結合した場合、プロトン化される(又は以下に規定する置換基を有する)であろう。
【0046】
本明細書中で使用する場合、C3−7カルボシクリル基は、3〜7個の炭素原子を有する、非芳香族の、飽和又は不飽和の炭化水素環である。好ましくは、C3−7カルボシクリル基は、3〜7個の炭素原子、より好ましくは5〜6個の炭素原子を有する、飽和又はモノ不飽和の炭化水素環(即ち、シクロアルキル部分又はシクロアルケニル部分)である。例としては、シクロプロピル、シクロブチル、シクロペンチル及びシクロヘキシル、並びにそれらのモノ不飽和バリアントが挙げられる。特に好ましい炭素環式基は、シクロペンチル及びシクロヘキシルである。用語「カルボシクリレン」は、しかるべく解釈されるべきである。
【0047】
具体的には、カルボシクリレン又はヘテロシクレン基中の0、1又は2個の炭素原子は、−C(O)−基で置換され得る。本明細書中で使用する場合、置換される「炭素原子」は、それらが結合する水素原子を含むことが理解される。1又は2個の炭素原子が置換される場合、2個のかかる炭素原子が置換されることが好ましい。好ましいかかるカルボシクリル基としてはベンゾキノン基が挙げられ、好ましいかかるヘテロシクリル基としてはスクシンイミド及びマレイミド基が挙げられる。
【0048】
特に指定しない場合、アリール、ヘテロアリール、カルボシクリル又はヘテロシクリル基は、典型的には非置換である。しかしながら、かかる基が非置換又は置換であると示されている場合、1個以上の水素原子が、ハロゲン原子又はC1−6アルキル、C1−6アルコキシ、C1−6アルキルチオール、−N(C1−6アルキル)(C1−6アルキル)若しくはニトロ基で置換されていてもよい。好ましくは、置換されたアリール、ヘテロアリール、カルボシクリル又はヘテロシクリル基は、1〜4個の置換、より好ましくは1〜2個の置換基、最も好ましくは1個の置換基を有する。好ましくは、置換されたアリール、ヘテロアリール、カルボシクリル又はヘテロシクリル基は、2個以下のニトロ置換基を有する。好ましい置換基は、ハロゲン原子並びにC1−4アルキル及びC1−4アルコキシ基である。特に好ましい置換基はハロゲン原子である。しかし好ましくは、アリール、ヘテロアリール、カルボシクリル又はヘテロシクリル基は、非置換である。
【0049】
本明細書中で使用する場合、ハロゲン原子は、典型的にはF、Cl、Br又はI原子であり、好ましくはBr又はCl原子であり、より好ましくはBr原子である。
【0050】
本明細書中で使用する場合、C1−6アルコキシ基は、酸素原子に結合したC1−6アルキル(例えば、C1−4アルキル)基である。
【0051】
本明細書中で使用する場合、C1−6アルキルチオール基は、硫黄原子に結合したC1−6アルキル(例えば、C1−4アルキル)基である。
【0052】
本明細書中で使用する場合、5〜10員のヘテロシクリルチオールは、硫黄原子に結合した5〜10員の(例えば、5〜6員の)ヘテロシクリル基である。
【0053】
本明細書中で使用する場合、C6−10アリールチオールは、硫黄原子に結合したC6−10アリール(例えば、フェニル)基である。
【0054】
本明細書中で使用する場合、C3−7カルボシクリルチオールは、硫黄原子に結合したC3−7カルボシクリル(例えば、C5−6カルボシクリル)基である。
【0055】
疑義を回避するため、トリフレート基はトリフルオロメタンスルホネート基であり、トシレート基はp−トルエンスルホネート基であり、メシレート基はメタンスルホネート基である。
【0056】
好ましくは、X及びX’は、同じ又は異なって、それぞれ酸素、硫黄又は式=NHの基を示す。より好ましくは、X及びX’は、同じ又は異なって、それぞれ酸素又は硫黄を示す。好ましくは、X及びX’の少なくとも一方は酸素を示す。最も好ましくは、X及びX’は共に酸素である。
【0057】
Yは、好ましくは、ハロゲン原子又はトリフレート、トシレート、メシレート、N−ヒドロキシスクシンイミジル、N−ヒドロキシスルホスクシンイミジル、C1−6アルキルチオール、5〜10員のヘテロシクリルチオール、C6−10アリールチオール、C3−7カルボシクリルチオール、−OC(O)CH3、−OC(O)CF3、フェニルオキシ、−NRxRyRz+若しくは−PRxRyRz+基である。より好ましくは、Yは、ハロゲン原子又はトリフレート、トシレート、メシレート、N−ヒドロキシスクシンイミジル、N−ヒドロキシスルホスクシンイミジル、C1−6アルキルチオール、5〜10員のヘテロシクリルチオール、C6−10アリールチオール若しくはC3−7カルボシクリルチオールである。なおより好ましくは、Yは、ハロゲン原子又はC1−6アルキルチオール、5〜10員のヘテロシクリルチオール、C6−10アリールチオール若しくはC3−7カルボシクリルチオールである。最も好ましくは、Yは、ハロゲン原子、特に臭素原子である。
【0058】
Rx、Ry及びRzはそれぞれ、好ましくは、水素原子及びC1−6アルキル基から選択される。より好ましくは、Rx、Ry及びRzはそれぞれ、好ましくは、水素原子並びにメチル及びエチル基から選択される。好ましくは、特定の−NRxRyRz+又は−PRxRyRz+基では、Rx、Ry及びRzは同じである。
【0059】
式(I)の部分は、本発明に従ってチオール含有化合物を化学的に保護させる重要な反応性部分を示すことが明らかであろう。式(I)の部分(及び式(II)の部分、別の箇所で詳細に記載される)において、記号
【0060】
【化5】

【0061】
は、別の基への結合点を意味する。これらの結合点を介して結合した基の正体は、本発明には重要でないことが理解されよう。当業者であれば、特定の目的に合うように、これらの結合点を介して結合した基を、例えば、保護すべきチオール化合物又はジスルフィド化合物の具体的な正体に基づいて、選択することが可能であることが容易に理解できよう。
【0062】
好ましくは、式(I)の部分を含む化合物は、式(Ia)の化合物
【0063】
【化6】

【0064】
であり、式中、
X及びX’は、同じ又は異なって、それぞれ酸素、硫黄又は式=NR1の基を示し、R1は、水素、ヒドロキシル、C1−6アルキル又はフェニルであり;
Yは求電子性脱離基であり;
R2は、水素原子又は基IGを示し;
以下のいずれかであり:
R3及びR3’は、同じ又は異なって、それぞれ水素原子又は基IGを示す;又は
R3及びR3’は一緒になって、式−N(R33’)の基を形成し、R33’は水素原子又は基IGを示す;又は
R3及びR3’は一緒になって、式−N(R33’)−N(R33’)−の基を形成し、各R33’は、同じ又は異なって、水素原子又は基IGを示す;
各基IGは、同じ又は異なって、非置換であるか又は1個以上のハロゲン原子で置換されている、C1−20アルキル基、C2−20アルケニル基又はC2−20アルキニル基である部分を示し、式中、(a)0、1又は2個の炭素原子は、C6−10アリーレン、5〜10員のヘテロアリーレン、C3−7カルボシクリレン及び5〜10員のヘテロシクリレン基から選択される基によって置換されており、かつ(b)0、1又は2個の−CH2−基は、−O−、−S−、−S−S−、−C(O)−、−NH−及び−N(C1−6アルキル)−基から選択される基によって置換されており、式中、
(i)該アリーレン、ヘテロアリーレン、カルボシクリレン及びヘテロシクリレン基は、非置換であるか又はハロゲン原子並びにC1−6アルキル、C1−6アルコキシ、C1−6アルキルチオール、−N(C1−6アルキル)(C1−6アルキル)及びニトロ基から選択される1個以上の置換基によって置換されており;
(ii)該カルボシクリレン及びヘテロシクリレン基中の0、1又は2個の炭素原子は、−C(O)−基によって置換されている。
【0065】
好ましくは、R3及びR3’は、同じ又は異なって、それぞれ水素原子又は基IGを示すか、或いはR3及びR3’は一緒になって、式−N(R33’)の基を形成し、R33’は水素原子又は基IGを示す。
【0066】
1つの好ましい実施形態において、R2が基IGである場合、好ましくは、R2は、式(Ia)の3位に直接結合した、−O−、−S−、−NH−及び−N(C1−6アルキル)−から選択される基を含む(即ち、R2は、3位に隣接する−CH2−基が、−O−、−S−、−NH−又は−N(C1−6アルキル)−基によって置換された部分である)。
【0067】
R2は好ましくは、水素原子又はC1−6アルキル基である。最も好ましくは、R2は水素原子である。
【0068】
R3及びR3’が同じ又は異なって、それぞれ水素原子又は基IGを示す場合、好ましくは、R3及びR3’の少なくとも一方は基IGである。好ましくは、R3及びR3’は共に基IGを示す。
【0069】
R3、R3’、又はR3及びR3’が基IGを示す場合、その基IG又は各基IGは好ましくは、式−Z(C1−6アルキル)の基であり、式中、Zは、直接的結合又は基−O−、−S−、−NH−若しくは−N(C1−6アルキル)である。より好ましくは、この実施形態において、その基IG又は各基IGは、式−Z(C1−2アルキル)の基であり、式中、Zは、直接的結合又は基−O−、−NH−若しくは−N(C1−6アルキル)である。最も好ましくは、この実施形態において、その基IG又は各基IGは、式−Z(C1−2アルキル)の基であり、式中、Zは、直接的結合又は基−O−若しくは−N(C1−6アルキル)である。
【0070】
好ましくは、R3及びR3’は一緒になって、式−N(R33’)の基を形成する。
【0071】
R33’は好ましくは、水素原子又はC1−6アルキル基を示し、最も好ましくは、R33’は、水素原子又はメチル若しくはエチル基(例えば、メチル又はエチル基)を示す。
【0072】
IGは好ましくは、非置換のC1−6アルキル基、C2−6アルケニル基又はC2−6アルキニル基である部分を示し、式中、(a)0又は1個の炭素原子は、フェニレン、5〜6員のヘテロアリーレン、C5−6カルボシクリレン及び5〜6員のヘテロシクリレン基から選択される基によって置換されており、該フェニレン、ヘテロアリーレン、カルボシクリレン及びヘテロシクリレン基は、非置換であるか又はハロゲン原子並びにC1−4アルキル及びC1−4アルコキシ基から選択される1又は2個の置換基によって置換されており、かつ(b)0、1又は2個の−CH2−基は、−O−、−S−、−C(O)−、−NH−及び−N(C1−6アルキル)−基から選択される基によって置換されている。
【0073】
より好ましくは、IGは、非置換のC1−6アルキル基である部分を示し、式中、(a)0又は1個の炭素原子は、非置換のフェニレン、5〜6員のヘテロアリーレン、C5−6カルボシクリレン及び5〜6員のヘテロシクリレン基から選択される基によって置換されており、かつ(b)0又は1個の−CH2−基は、−O−、−NH−及び−N(C1−6アルキル)−基から選択される基によって置換されている。
【0074】
なおより好ましくは、IGは、非置換のC1−6アルキル又はフェニル基を示す。
【0075】
最も好ましくは、IGは、非置換のC1−6アルキル基(例えば、メチル又はエチル基)を示す。
【0076】
好ましくは、基IGは、基−NH−が基−C(O)−又は−C(S)−に直接隣接して位置していない限り、いずれの基−NH−も含まない。より好ましくは、基IGは、基−NH−が基−C(O)−に直接隣接して位置していない限り、いずれの基−NH−も含まない。
【0077】
好ましくは、式(Ia)の化合物は、式(Ib)の化合物:
【0078】
【化7】

【0079】
であり、式中、X、X’、Y、R2及びR33’は全て、本明細書中に記載したとおりである。
【0080】
式(Ib)の化合物において、特に好ましくは、
X及びX’はそれぞれ酸素原子を示し;
R33’は水素原子又はC1−6アルキル基を示し;
Yはハロゲン原子を示し;
R2は水素原子又はC1−6アルキル基を示す。
【0081】
1実施形態において、本発明は、チオール化合物中のチオール基を保護するための試薬としての、上記式(I)の部分を含む化合物の使用に関する。典型的には、この使用は、式(I)の部分を含む化合物をチオール化合物と反応させることを含む。式(I)の部分を含む化合物をチオール化合物と反応させることで、チオール基が上記式(I’)の保護基で保護された化合物が産生される。
【0082】
式(I)の部分を含む化合物は、標準的な文献に記載された手順及び当業者に周知の手順に従って、チオール化合物と反応させることができる。典型的な文献情報源は、「Advanced organic chemistry」、第4版(Wiley)、J March、「Comprehensive Organic Transformation」、第2版(Wiley)、R.C.Larock、「Handbook of Heterocyclic Chemistry」、第2版(Pergamon)、A.R.Katritzkyであり、「Synthesis」、「Acc.Chem.Res.」、「Chem.Rev」などに見出されるような総説記事、又は標準的な文献検索オンラインによって同定される又は「Chemical Abstracts」若しくは「Beilstein」などの二次的情報源からの、一次文献情報源である。
【0083】
好ましくは、この使用は、多工程合成手順の間の、チオール化合物中のチオール基を保護するための試薬としての、式(I)の部分を含む化合物の使用である。典型的には、多工程の合成手順は、保護されたチオール基ではない、チオール化合物が保有する官能基(例えば、チオール基ではない官能基)に化学変換をもたらすことを含む、少なくとも1つの合成工程を含む。好ましくは、この少なくとも1つの合成工程は、保護されたチオール基が化学的に不活性であるが、チオール基は化学的に反応性である条件下で実施される。典型的には、多工程の合成手順は、保護されたチオール基を脱保護する工程も含む。
【0084】
さらなる実施形態において、本発明は、チオール化合物を、式(I)の部分を含む化合物と反応させて、保護されたチオール基を有する化合物を産生する工程;及び、その後、該保護されたチオール基を脱保護する工程、を含む、プロセスに関する。従って、このプロセスは、チオール基を選択的に保護し、次いでその後、必要なくなった保護基を除去するための手段を構成する。
【0085】
典型的には、1つ以上の化学反応が、このプロセスの工程(i)と(ii)との間に、チオール化合物にもたされる。当業者が認識するように、これらの工程の性質は、実施される全合成手順によって決定されよう。しかし典型的には、少なくとも1つの工程が、工程(i)の後かつ工程(ii)の前に実施され、この工程は、保護されたチオール基ではない、チオール化合物が保有する官能基(例えば、チオール基ではない官能基)に化学変換をもたらすことを含む。好ましくは、この少なくとも1つの工程は、保護されたチオール基が化学的に不活性であるが、チオール基は化学的に反応性である条件下で実施される。
【0086】
本発明のこのプロセスの1実施形態において、保護されたチオール基を有する化合物は、保護されたチオール基とは異なるさらなる保護された官能基を少なくとも1個、さらに含む。この実施形態において、好ましくは、この少なくとも1個のさらなる保護された官能基は、保護されたチオール基上の保護基に対して直交である保護基を含む。
【0087】
保護されたチオール基を脱保護する工程は、電子不足型アルケンに結合したチオールを切断するための慣用的な方法を使用してもたらすことができる。従って、好ましくは、脱保護は、コンジュゲート付加反応において求核剤として作用できる試薬と共に生成物をインキュベートすることによってもたらされる。
【0088】
コンジュゲート付加反応において求核剤として作用できることが周知の試薬の例としては、ホスフィン化合物、亜リン酸塩化合物、チオール、セレノール、アミン及びソフトカーボン求核化合物が挙げられる。ホスフィン化合物及び亜リン酸塩化合物は共に、3価のリン原子を含む。ホスフィンでは、このリン原子は水素又は炭素原子に結合されるが、亜リン酸塩では、このリン原子は酸素原子に結合される(炭素原子及び酸素原子自体は、それぞれの化合物中の他の基にさらに結合されることが理解される)。チオールは、チオール基−SHを含む有機化合物である。セレノールは、−SeH基を含む有機化合物である。アミンは、アミン官能基を含む化合物である。ソフトカーボン求核剤は、ソフトな求核炭素中心を含む化合物である。例示的なソフトカーボン求核剤は、米国特許第5,414,074号に開示されており、その内容は、その全体が参照によって本明細書中に組み込まれる。当業者であれば当然、慣用として、例えば、本明細書中に記載される試薬の例示的クラスのなかから適切な試薬を慣用的に選択することによって、コンジュゲート付加反応において求核剤として作用できる適切な試薬を選択することができるであろう。
【0089】
脱保護をもたらすために本明細書中で好ましい試薬は、ホスフィン化合物及びチオールである。特に好ましいホスフィンは、トリス(2−カルボキシエチル)ホスフィンであり、これは、「TCEP」として一般に知られ、化合物(例えばタンパク質)中のジスルフィド結合を還元するために、当該分野において一般に使用される。トリス(2−カルボキシエチル)ホスフィンはまた、その塩酸塩などの塩の形態でも供給され得る。特に好ましいチオールは1,2−エタンジチオール、グルタチオン、メルカプトエタノール及びジチオスレイトール(即ち、HSCH2CH(OH)CH(OH)CH2SH、DTTとして一般に知られる)である。例えば、試薬は、トリス(2−カルボキシエチル)ホスフィン、グルタチオン、2−メルカプトエタノール及びジチオスレイトールから選択され得る。
【0090】
疑義を回避するために、本明細書中で使用する場合、用語「コンジュゲート付加反応において求核剤として作用できる試薬」とは、化合物中のα,β−不飽和部分、特に式(IV)の部分
【0091】
【化8】

【0092】
と反応できる試薬を意味し、式中、Xは本明細書中に記載したとおりである。かかる試薬は、ある場合には「Michael付加反応において求核剤として作用できる試薬」としても知られる。明らかに、これらの試薬は、求核炭素中心を介して反応する試薬(例えば、ソフトカーボン求核剤)に限定されず、求核非炭素中心を介して反応する試薬(例えば、本明細書中に記載される例示的試薬)も含む。
【0093】
本発明において、チオール化合物は、チオール基−SHを含む任意の化合物であり得る。しかし典型的には、チオール化合物は有機化合物である。当業者が理解するように、本発明の保護基は、保護基ストラテジーが一般に使用される任意の化合物(例えば、多工程合成手順における中間体)が保有するチオール基に適切に導入され得る。バイオテクノロジーの分野において特に興味が持たれるチオール含有化合物の例は、システイン、及び少なくとも1つのシステイン残基を含むペプチド又はタンパク質である。従って、本発明の使用及びプロセスの好ましい実施形態において、チオール化合物は、システイン、又は少なくとも1個のシステイン残基を含むペプチド若しくはタンパク質である。当業者が理解するように、この実施形態は、システイン又はシステイン残基に関与する慣用的な合成方法(例えば、ペプチド合成の方法、又はペプチド若しくはタンパク質が化学変換に供される方法(例えば、翻訳後修飾を模倣するため、又はプロテオミクス研究に着手すること若しくは治療的タンパク質を産生することを目的とした合成的修飾をもたらすため))を実施する場合に、特に有用である。
【0094】
さらなる実施形態において、本発明は、式(II)の化合物を提供する。この化合物は、化学的に保護されたシステイン分子を構成する。これは例えば、ペプチド及びタンパク質の合成方法において有用である。ペプチド及びタンパク質の合成方法は、当該分野で周知であり、従って、当業者であれば、ペプチド又はタンパク質を産生するための方法を実施するために本発明の方法論を適用することに、困難はないであろう。ペプチドを合成するために当該分野で慣用的に使用される種々の慣用的技術を議論した1つの一般的な参考教科書は、「Amino Acid and Peptide Synthesis」(John Jones,Oxford Scientific Publications,1992)であり、その内容は、その全体が本明細書中で参照により組み込まれる。
【0095】
第一の実施形態において、Qはカルボキシル基であり、Q’はアミン基である。即ち、保護されたシステインは、そのカルボキシル官能基又はそのアミン官能基のいずれかを介して、反応し得る。この化合物は、二次的化合物と直接反応し得るか、或いは、例えばカルボキシル官能基又はアミン官能基上に目的の特定の保護基を配置するための、さらなる化学的保護工程がもたらされ得る。
【0096】
それぞれ第二及び第三の実施形態において、Qは保護されたカルボキシル基であり、Q’はアミン基であるか、或いはQはカルボキシル基であり、Q’は保護されたアミン基である。従って、第二の実施形態において、この分子は、そのアミン基のみを介して反応し得、一方、第三の実施形態において、この分子は、そのカルボキシル基のみを介して反応し得る。
【0097】
第四の実施形態において、Qは保護されたカルボキシル基であり、Q’は保護されたアミン基である。従って、この分子は、その3つの官能基のそれぞれにおいて保護される。これは、これらの保護された官能基のうち1つを脱保護することによって、反応のために準備できる。
【0098】
特に好ましい実施形態において、Qはカルボキシル基であり、Q’は保護されたアミン基である。当業者が理解するように、この分子は特に、固相ペプチド合成の慣用的な方法において使用するのに十分適しており、この方法は典型的には、N保護されたアミノ酸がそのカルボキシル末端で固相(第一サイクルにおいて)又は成長するペプチド鎖(その後のサイクルにおいて)のいずれかと反応する連続サイクルと、その後のN脱保護及びその後の新たなN保護されたアミノ酸とのさらなる反応とを含む。
【0099】
ペプチド及びタンパク質の固相合成のための技術は、当該分野で周知である。広範な反応性基で活性化された多数の固相支持体が、例えばSigma Aldrichから市販されている。従って、当業者であれば、ペプチド又はタンパク質を産生するためのプロセスを実施するために本発明の方法論を適用することに、困難はないであろう。
【0100】
保護されたカルボキシル基及び保護されたアミン基は、当該分野で周知であり、当業者によって慣用的に選択され得る。
【0101】
例示的な保護されたカルボキシル基としては、「Protecting Group Chemistry」(Jeremy Robertson,Oxford University Press,2003)及び「Amino Acid and Peptide Synthesis」(John Jones,Oxford Scientific Publications,1992)に記載された保護されたカルボキシル基が挙げられ、これらの文献のそれぞれの内容は、その全体が参照によって本明細書中に組み込まれる。特に好ましい保護されたカルボキシル基は−COOQであり、式中、Qは、C1−6アルキル、フェニル及びベンジル基から選択される。
【0102】
例示的な保護されたアミン基としては、「Protecting Group Chemistry」(Jeremy Robertson,Oxford University Press,2003)及び「Amino Acid and Peptide Synthesis」(John Jones,Oxford Scientific Publications,1992)に記載された保護されたアミン基が挙げられ、これらの文献のそれぞれの内容は、その全体が参照によって本明細書中に組み込まれる。特に好ましい保護されたアミン基は、トリチル(トリフェニルメチル)及び2−ニトロフェニルスルフェニル基並びに式−NHC(O)OQ’の基であり、式中、Q’は、C1−6アルキル、フェニル、ベンジル、2−(4−ビフェニル)−イソプロピル、9−フルオレニルメチルから選択される。特に好ましい保護されたアミン基は、式−NHC(O)OQ’のものであり、式中、Q’は、t−ブチル又は9−フルオレニルメチルである(即ち、「BOC保護されたアミン」又は「Fmoc保護されたアミン」)。
【0103】
好ましくは、式(II)の化合物は、C−N−エチルマレイミド−S−システインでもC−N−エチルマレイミド−S−N−アセチル−システインでもない。
【0104】
さらなる態様において、本発明は、ジスルフィド化合物中のジスルフィド基を保護するための試薬としての、式(III)の部分を含む式の化合物の使用に関する。
【0105】
ジスルフィド基は、式−S−S−の二価の基である。ジスルフィド中の内部S−S結合は、有機分子中の最も弱い結合である場合が多い。これは、還元的条件下で切断を受けて、2個の−SH部分を生じやすい。従って、ジスルフィド化合物が脂環式である場合、ジスルフィドの還元は、2個のチオール含有分子への、ジスルフィド化合物の切断をもたらす。ジスルフィド ジスルフィドが複素環の一部である場合(例えば、これが、単一分子中に存在する2個のチオール基の縮合によって形成されたものである場合)、ジスルフィド結合の還元は開環をもたらす。両方の場合において、高度に求核性のチオール基が生成される。従って、明らかに、分子中のジスルフィド結合の切断は、有機合成手順に関して重要な結果を招く可能性があり得る。従って、ジスルフィド基が反応性であり得る反応条件を使用して化学変換が実施される場合、望ましくない副反応が生じるのを防ぐために、ジスルフィド基を化学的に保護することが望ましい場合がある。
【0106】
典型的には、ジスルフィド化合物中のジスルフィド基は、複素環の一部を形成する(即ち、これは、単一の分子中に存在する2個のチオール基の縮合によって形成されたものである)。
【0107】
2つの近接するシステイン残基中のチオール基のカップリングによるジスルフィド結合は、タンパク質中に一般的に見出され、それ自体、タンパク質のフォールディング及び安定性において重要な役割を果たす場合が多い。従って、好ましい実施形態において、ジスルフィド化合物は、ジスルフィド基を含むペプチド又はタンパク質である。
【0108】
式(III)の化合物において、基X、X’及びYは好ましくは、上記したのと同じ基である。基Y’は、第二の求電子性脱離基である。好ましい基Y’は、上記した好ましい基Yに対応する。式(III)の化合物において、Y及びY’は、同じでも異なってもよい。しかし好ましくは、Y及びY’は同じである。
【0109】
好ましくは、式(III)の部分を含む化合物は、式(IIIa)の化合物:
【0110】
【化9】

【0111】
であり、式中、X、X’、Y、R3及びR3’は全て上記のとおりであり、Y’はさらなる基Yであり、各基Yは同じ又は異なる。
【0112】
典型的には、この使用は、式(III)の部分を含む化合物を、ジスルフィド化合物と反応させることを含む。式(III)の部分を含む化合物をジスルフィド化合物と反応させることは、ジスルフィド化合物中のジスルフィド基のS−S結合を切断し、次いで、ジスルフィド基の2個の硫黄原子のうち一方が基Yを置換し、ジスルフィド基の2個の硫黄原子のもう一方が基Y’を置換することを含む。
【0113】
式(III)の部分を含む化合物は、標準的な文献に記載された、当業者に周知の手順に従って、ジスルフィド化合物と反応させることができる。典型的な文献情報源は、「Advanced organic chemistry」、第4版(Wiley)、J March、「Comprehensive Organic Transformation」、第2版(Wiley)、R.C.Larock、「Handbook of Heterocyclic Chemistry」、第2版(Pergamon)、A.R.Katritzkyであり、「Synthesis」、「Acc.Chem.Res.」、「Chem.Rev」などに見出されるような総説記事、又は標準的な文献検索オンラインによって同定される又は「Chemical Abstracts」若しくは「Beilstein」などの二次的情報源からの、一次文献情報源である。好ましくは、反応は、ジスルフィド基を還元して2個の別個のチオール基−SHを形成し、これらのチオール基を式(III)の部分と反応させることによって、もたらされる。ジスルフィド基の還元は、慣用的な方法を使用して、例えば、ホスフィン、チオール又は水素化物剤などの還元剤との反応によって、実施できる。好ましい還元剤は、トリス(2−カルボキシエチル)ホスフィン、グルタチオン、メルカプトエタノール及びジチオスレイトールである。
【0114】
好ましくは、この使用は、多工程合成手順の間の、ジスルフィド化合物中のジスルフィド基を保護するための試薬としての、式(III)の部分を含む化合物の使用である。典型的には、多工程の合成手順は、ジスルフィド基ではない、ジスルフィド化合物が保有する官能基に化学変換をもたらすことを含む、少なくとも1つの合成工程を含む。好ましくは、この少なくとも1つの合成工程は、保護されたジスルフィド基が化学的に不活性であるが、ジスルフィド基は化学的に反応性である条件下で実施される。典型的には、多工程の合成手順は、保護されたジスルフィド基を脱保護する(即ち、ジスルフィド結合を再形成する)工程も含む。
【0115】
さらなる実施形態において、本発明は、ジスルフィド化合物中のジスルフィド基を、式(III)の部分を含む化合物と反応させて、保護されたジスルフィド基を有する化合物を産生する工程、及び、その後、該保護されたジスルフィド基を脱保護する工程、を含むプロセスに関する。従って、このプロセスは、ジスルフィド基を選択的に保護し、次いでその後、必要なくなった保護基を除去するための手段を構成する。
【0116】
典型的には、ジスルフィド化合物中のジスルフィド基を、式(III)の部分を含む化合物と反応させる工程は、(a)ジスルフィド基を還元して、2個の別個のチオール基−SHを形成する工程、及び(b)これらのチオール基を式(III)の部分と反応させる工程、を含む。ジスルフィド基の還元は、慣用的な方法を使用して、例えば、ホスフィン、チオール又は水素化物剤などの還元剤との反応によって、実施できる。好ましい還元剤は、トリス(2−カルボキシエチル)ホスフィン、グルタチオン、2−メルカプトエタノール及びジチオスレイトールである。別の好ましい還元剤は、1,2−エタンジチオールである。明らかに、ジスルフィド基は、第一の工程において還元され得、その後式(III)の部分との別個の反応が行われる。或いは、ジスルフィド基の還元及び式(III)の部分との反応は、単一の反応工程(即ち、還元剤及び式(III)の部分の両方が同時に存在する)で実施され得る。
【0117】
典型的には、1つ以上の化学反応が、このプロセスの工程(i)と(ii)との間にもたらされる。当業者が認識するように、これらの工程の性質は、実施される全合成手順によって決定されよう。しかし典型的には、少なくとも1つの工程が、工程(i)の後かつ工程(ii)の前に実施され、この工程は、保護されたジスルフィド基ではない、該化合物が保有する官能基(例えば、ジスルフィド基ではない官能基)に化学変換をもたらすことを含む。好ましくは、この少なくとも1つの工程は、保護されたジスルフィド基が化学的に不活性であるが、ジスルフィド基は化学的に反応性である条件下で実施される。
【0118】
本発明のこのプロセスの1実施形態において、保護されたジスルフィド基を有する化合物は、保護されたジスルフィド基とは異なるさらなる保護された官能基を少なくとも1個、さらに含む。この実施形態において、好ましくは、この少なくとも1個のさらなる保護された官能基は、保護されたジスルフィド基上の保護基に対して直交である保護基を含む。
【0119】
保護されたジスルフィド基を脱保護する工程は、電子不足型アルケンに結合したチオールを切断するための慣用的な方法を使用してもたらすことができる。従って、好ましくは、脱保護は、コンジュゲート付加反応において求核剤として作用できる試薬と共に生成物をインキュベートすることによってもたらされる。従って、ジスルフィド脱保護をもたらすのに好ましい試薬は、チオール脱保護をもたらすための上記試薬に対応する。
【0120】
好ましくは、保護されたジスルフィド基を脱保護する工程は、炭素−炭素二重結合においてチオール結合を切断し、また、そうして形成された2個のチオール基を酸化してジスルフィド基を形成させることを含む。チオール基を酸化してジスルフィド基を形成するのに適切な試薬は、当該分野で周知である。例示的な酸化試薬としては、ヨウ素(I2)及び過酸化水素が挙げられ、ヨウ素が好ましい。
【実施例】
【0121】
以下の実施例は、本発明の根底をなす科学原理を説明する。広範な保護基による、広範なチオール化合物及びジスルフィド化合物の保護及び脱保護が実証されており、本発明の広い適用可能性を証明している。
【0122】
1H及び13C NMRスペクトルは、1Hについては500MHz、13Cについては125MHzの周波数で作動するBruker Avance 500機器で、室温で記録した。1H NMRスペクトルは、CDCl3(7.26ppm)シグナルを参照とした。13C NMRスペクトルは、CDCl3(77.67ppm)シグナルを参照とした。
赤外線スペクトルは、センチメートルの逆数(cm−1)で与えられる周波数で、ATRモードで作動するPerkinElmer Spectrum 100 FT−IRスペクトロメータで実行した。
質量スペクトル及び高分解能質量データは、VG70−SE質量分析計(EIモード及びCIモード)で記録した。
融点(m.p.)はGallenkamp加熱ブロックで取得したものであり、未補正である。
旋光度測定は、10cmのセル長さでPerkinElmer 343旋光計を使用して実施した。
【0123】
略号
Boc Tert−ブチルオキシカルボニル基
Cys システイン
Mal マレイミド
DMF ジメチルホルムアミド
TCEP (トリス(2−カルボキシエチル)ホスフィン)
LC−ESI−MS 液体クロマトグラフィーエレクトロスプレーイオン化質量分析
【0124】
参考例1:ブロモマレイミド(化合物1)の調製
【0125】
【化10】

【0126】
クロロホルム(15mL)中のマレイミド(2.00g、0.02mol)に、クロロホルム(15mL)の臭素(1.16mL、0.02mol)を滴下した。反応混合物を2時間還流し、1時間かけて室温まで冷却した。固体の黄色沈殿物を濾去し、冷クロロホルム(2x50mL)で洗浄して、粗製2,3−ジブロモスクシンイミド(4.09g、0.016mol)の白色結晶を得た。粗製スクシンイミドをテトラヒドロフラン(50mL)中に溶解し、テトラヒドロフラン(10mL)中のトリエチルアミン(2.4mL、0.017mol)を、0℃で5分間かけて添加した。反応混合物を室温まで温め、48時間撹拌した。固体を濾去し、テトラヒドロフラン(50mL)で洗浄して、淡黄色(pale yellow)粉末(2.14g、0.012mol)を59%の収率で得た。
1H NMR (500MHz, CDCl3): δ = 7.67 (br s, 1H, NH), 6.89 (s, 1H, C=CH); 13C NMR (125MHz, CDCl3): δ = 173.8 (C=O), 170.5 (C=O), 136.9 (-(Br)C=C-), 135.4 (-C=CH-); IR (固体, cm-1): 3235 (s), 1709 (s); MS (CI+) m/z, (%): 178 (81M+, 32), 176 (79M+, 32), 125 (25), 86 (100); C4H3O2N79Brについて計算した質量: 175.93472. 実測値: 175.93493; m.p. 148 - 151℃.
【0127】
参考例2:N−メチルブロモマレイミド(化合物2)の調製
【0128】
【化11】

【0129】
メタノール(22.5mL)中のN−メチルマレイミド(0.5g、4.5mmol)に、臭素(0.52mL、10mmol)を滴下した。反応混合物を室温で24時間撹拌した。溶媒を真空中で除去し、反応塊をテトラヒドロフラン(20mL)中に溶解し、トリエチルアミン(0.8mL、5.85mmol)を添加し、次いで室温で24時間撹拌した。この物質をシリカゲルでのフラッシュクロマトグラフィー(石油エーテル:酢酸エチル、7:3)で精製して、青白い(pale white)粉末(0.761g、4.0mmol)を89%の収率で得た。
1H NMR (500MHz, CDCl3): δ = 6.90 (s, 1H, C=CH), 3.09 (s, 3H, N-CH3); 13C NMR (125MHz, CDCl3): δ = 168.6 (C=O), 165.4 (C=O), 131.9 (-C=CH-), 131.4 ((Br)C=C-), 24.7 (-N-CH3); IR (固体, cm-1): 3106 (s), 1708 (s); MS (CI) m/z, (%):192 (81M+, 99), 190(79M+, 100); C5H5O2N79Brについて計算した質量: 189.95037. 実測値: 189.95052; m.p: 77-79℃.
【0130】
実施例1:N−Boc−Cys(Mal)−OMe(化合物4)の調製
【0131】
【化12】

【0132】
N−Boc−Cys−OMe(化合物3)(36mg、0.153mmol)及び酢酸ナトリウム(13mg、0.153mmol)のメタノール(3mL)中撹拌溶液に、メタノール(3mL)中のブロモマレイミド(30mg、0.169mmol)を添加した。1分後、溶媒を真空中で除去した。この物質をシリカゲルでのフラッシュクロマトグラフィー(石油エーテル:酢酸エチル、9:1から7:3の勾配溶出)で精製して、淡黄色粉末(51mg、0.153mmol)を100%の収率で得た。
1H NMR (500MHz, CDCl3): δ =7.63 (s, 1H, NH), 6.27 (s, 1H, C=CH), 5.40 (d, 1H, J = 6.8, NH), 4.67 (ddd, 1H, J = 6.8, 5.4及び5.1, -HN-CH-C(O)-), 3.80 (s, 3H, O-CH3), 3.48 (dd, 1H, J = 13.8及び5.1, -S-CHH-), 3.62 (dd, 1H, J = 14.1及び5.4, -S-CHH-) 1.45 (s, 9H, 3 x CH3); 13C NMR (125MHz, CDCl3): δ = 170.2 (C=O), 168.9 (C=O), 167.6 (C=O), 155.2 (C=O), 155.9 (-C=CH-), 119.7 (-C=CH-), 81.1 ((CH3)CO-), 53.3 (O-CH3), 52.7 (CH), 34.0 (CH2), 28.3 (3 x CH3); IR (固体, cm-1) 3236 (w), 1715 (s); MS (CI+) m/z, (%): 331 (M+H, 5), 275 (20), 231 (100); [C13H18O6N2S]+Hについて計算した質量: 331.09638. 実測値: 331.09684; 20αD: -41.9o (c = 1.0, メタノール); m.p. 145-147℃.
【0133】
実施例2:N−Boc−Cys(N−Me−Mal)−OMe(化合物5)の調製
【0134】
【化13】

【0135】
N−Boc−Cys−OMe(32mg、0.136mmol)のメタノール(4mL)中撹拌溶液に、酢酸ナトリウム(82mg、0.408mmol)を添加した。メタノール(4mL)中のN−メチルブロモマレイミド(25.8mg、0.136mmol)を10分間かけてこれに添加した。この反応は淡黄色(light yellow)に変化した。溶媒を真空中で除去し、残渣をシリカゲルでのフラッシュクロマトグラフィー(石油エーテル:酢酸エチル、9:1から7:3の勾配溶出)で精製して、青白い粉末(39.3mg、0.114mmol)を84%の収率で得た。
1H NMR (500MHz, CDCl3): δ = 6.26 (s, 1H, C=CH), 5.36 (d, 1H, J = 6.3, NH), 4.66 (m, 1H, -HN-CH-), 3.79 (s, 3H, O-CH3), 3.46 (dd, 1H, J = 5.2及び5.0, -S-CHH-), 3.35 (dd, 1H, J = 13.7及び5.1, -S-CHH-), 3.00 (s, 3H, -N-CH3), 1.44 (s, 9H, 3 x CH3); 13C NMR (125MHz, CDCl3): δ = 170.2 (C=O), 169.5 (C=O), 167.9 (C=O), 155.0 (C=O), 149.9(-C=CH-), 118.7 (-C=CH-), 80.9 ((CH3)3CO-), 53.1 (O-CH3), 52.7 (CH), 33.8 (CH2), 28.3 (3 x CH3), 24.1 (-N-CH3); IR (固体, cm-1) 3367.8, 2977.1, 1694.7; MS (ES+) m/z, (%): 367(46), 311 (M, 100); C14H20N2O6NaSについて計算した質量: 367.0940. 実測値: 367.0931; 20αD: -18.55o (c = 1.0, メタノール); m.p. 101-103℃.
【0136】
実施例3:プロピルアミンと比較した、N−Boc−Cys−Omeに対するブロモマレイミド試薬の選択性の実証
N−Boc−Cys−OMe(36mg、0.153mmol)及びプロピルアミン(10μL、0.153mmol)のメタノール(3mL)中撹拌溶液に、メタノール(3mL)中のブロモマレイミド(30mg、0.169mmol)を添加した。1分後、溶媒を真空中で除去した。この物質をシリカゲルでのフラッシュクロマトグラフィー(石油エーテル:酢酸エチル、9:1から7:3の勾配溶出)で精製して、淡黄色粉末(51mg、0.153mmol)を100%で得た。データは、N−Boc−Cys(Mal)−OMe 4について上記で得たものと一致した。
【0137】
実施例4:N−Boc−Cys−OMeを再生するためのN−Boc−Cys(Mal)−OMeの切断
【0138】
【化14】

【0139】
4(50mg、0.151mmol)のジメチルホルムアミド(2mL)中撹拌溶液に、20mLの水性緩衝液(150mM NaCl、100mM NaH2PO4、pH8.0)を添加した。水性緩衝液(150mM NaCl、100mM NaH2PO4、pH8.0)20mL中のトリス(2−カルボキシエチル)ホスフィン(430mg 1.51mmol)を、この溶液に添加した。5分後、この水溶液を酢酸エチル(3x25mL)で抽出し、飽和塩化リチウム溶液(5x25mL)、水(25mL)及びブライン(25mL)で洗浄し、MgSO4で乾燥させた。溶媒を真空中で除去して、無色油状物(34.5mg、0.148mmol)を98%の収率で得た。この油状物の1H NMR及び13C NMRは、これが市販のN−Boc−システイン メチルエステル3であることを示した。
【0140】
実施例5:2,3−ジブロモマレイミドとソマトスタチンとの反応
ソマトスタチンは、分子内の2つのシステイン残基がジスルフィド結合で結合した形態で存在することが知られたペプチドホルモンである。
【0141】
1mgの凍結乾燥ソマトスタチン(Sigma−Aldrich)を、2mlの50mM NaHPO4−、pH6.2、40% MeCN、2.5% DMF中に再可溶化した。500μlを、Eppendorf反応チューブに移し、同緩衝液中で希釈して最終濃度0.25mg/ml(152.6μM)にした。2.0当量のTCEP(50mM NaHPO4−、pH6.2、40% MeCN中100xストック溶液)を添加し、反応を周囲温度で1時間インキュベートした。ジスルフィド結合の還元後、1.4当量の2,3−ジブロモマレイミド(Sigma−Aldrich、50mM NaHPO4−、pH6.2、40% MeCN、2.5% DMF中100xストック溶液)を添加し、溶液を穏やかに混合して、4℃でさらに12時間インキュベートした。
【0142】
マレイミド架橋されたソマトスタチンが、LC−ESI−MS(ES+/ES−)によって検出された。コントロールには、未処理のペプチド、及び2,3−ジブロモマレイミド又はTCEPのみで処理したソマトスタチンを含めた。完全な還元は、TCEP処理したペプチドとマレイミド(Sigma−Aldrich、50mM NaHPO4−、pH6.2、40% MeCN、2.5% DMF中の100xストック溶液)との反応によって検出された。
【0143】
実験データ:
未処理のソマトスタチン:[ES+]1638.04(m/z 1), 819.82 (m/z 2), 546.95 (m/z 3).
マレイミド架橋されたソマトスタチン:[ES+] 1734.14 Da (m/z 1), 867.40 Da (m/z 2), 578.73 (m/z 3).
【0144】
参考例3:GrB2−SH2ドメインL111Cの発現
【0145】
【化15】

【0146】
タンパク質GrB2−SH2ドメインL111Cをモデルタンパク質として使用した。このモデルタンパク質は単一のシステイン残基を含む。
【0147】
LC−MSは、Waters Acquity Single Quad Detector(SQD)に接続したWaters Acquity uPLCで実施した。カラム:Acquity uPLC BEH C18 1.7μm 2.1x50mm。波長:254nm。移動相:95:5 水(0.1%ギ酸):MeCN(0.1%ギ酸)、4分間にわたる勾配(5:95 水(0.1%ギ酸):MeCN(0.1%ギ酸)まで。流速:0.6mL/分。MSモード:ES+。スキャン範囲:m/z=85−2000。スキャン時間:0.25秒。データは連続体モードで得た。MSのエレクトロスプレー供給源は、3.5kVのキャピラリー電圧及び50Vのコーン電圧で操作した。窒素を、総流量600L/hで、ネブライザー及び脱溶媒和ガスとして使用した。総質量スペクトルを、MassLynxソフトウェアにプレインストールされたMaxEnt 1アルゴリズムを使用して、イオンシリーズから再構築した。
【0148】
モデルタンパク質をE.coli中で過剰発現させ、6Hisタグ化タンパク質を、標準的な技術によって、Ni−アフィニティクロマトグラフィー及びサイズ排除クロマトグラフィーの両方を使用して精製した。LC−MSを用いた分析により、所望のタンパク質に対応する質量14169の単一のタンパク質種が示された。
【0149】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、Ellman試薬(5μL、H2O中282mM溶液)を0℃で添加した。この混合物を1秒間ボルテックスし、10分間0℃で維持し、その後、混合物をLC−MSで分析した。分析により、単一の反応が生じて14366の質量を有する単一の生成物が得られたことが示され、C111が官能化に利用可能であることが示された。
【0150】
実施例6:GrB2−SH2ドメインL111Cとブロモマレイミドとの反応
【0151】
【化16】

【0152】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望のタンパク質に対応する質量14265の単一のタンパク質種が示された。
【0153】
この混合物を、0℃にてEllman試薬(5μL、H2O中282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で10分間維持し、その後、混合物をLC−MSで分析した。分析により、Ellman試薬との明白な反応がなかったことが示され、これは、ブロモマレイミドの官能化がC111で生じたことを強調する。
【0154】
実施例7:GrB2−SH2ドメインL111CとN−メチルブロモマレイミドとの反応
【0155】
【化17】

【0156】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−メチルブロモマレイミド(5μL、DMF中2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望のタンパク質に対応する質量14278の単一のタンパク質種が示された。
【0157】
この混合物を、0℃にてEllman試薬(5μL、H2O中282mM溶液)で処理した。この混合物を1秒間ボルテックスし、00℃で10分間維持し、その後、混合物をLC−MSで分析した。分析により、Ellman試薬との明白な反応がなかったことが示され、これは、N−メチルブロモマレイミドの官能化がC111で生じたことを強調する。
【0158】
実施例8:GrB2−SH2ドメインL111C/ブロモマレイミド付加物のホスフィン媒介性の還元的切断
【0159】
【化18】

【0160】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ブロモマレイミド付加物に対応する質量14265の単一のタンパク質種が示された。
【0161】
この混合物を、0℃にてTCEP.HCl(5μL、H2O中282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で3時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ブロモマレイミド付加物が明らかに切断されて、GrB2−SH2ドメインL111C(質量=14168)を85%の収率で生じたことが示された。残りの物質は、未反応のタンパク質/ブロモマレイミド付加物であった。
【0162】
実施例9:GrB2−SH2ドメインL111C/N−メチルブロモマレイミド付加物のホスフィン媒介性の還元的切断
【0163】
【化19】

【0164】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−メチルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−メチルブロモマレイミド付加物に対応する質量14278の単一のタンパク質種が示された。
【0165】
この混合物を、0℃にてTCEP.HCl(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で3時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/N−メチルブロモマレイミド付加物が明らかに切断されて、GrB2−SH2ドメインL111C(質量=14168)を85%の収率で生じたことが示された。残りの物質は、未反応のタンパク質/N−メチルブロモマレイミド付加物であった。
【0166】
実施例10:GrB2−SH2ドメインL111C/ジブロモマレイミド付加物の合成
【0167】
【化20】

【0168】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0169】
実施例11:GrB2−SH2ドメインL111C/ジブロモマレイミド/グルタチオン付加物の合成
【0170】
【化21】

【0171】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0172】
この混合物を、0℃にてグルタチオン(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ジブロモマレイミド/グルタチオン付加物が、唯一の存在したタンパク質種(質量=14572)であることが示された。
【0173】
実施例12:生理学的に適当なグルタチオン濃度(5mM)での、GrB2−SH2ドメインL111C/ジブロモマレイミド/グルタチオン付加物のグルタチオン媒介性の切断
【0174】
【化22】

【0175】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0176】
この混合物を、0℃にてグルタチオン(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ジブロモマレイミド/グルタチオン付加物が、存在する唯一のタンパク質種(質量=14572)であることが示された。
【0177】
この混合物を、0℃にてグルタチオン(5μL、H2O中の100mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、GrB2−SH2ドメインL111Cが、存在する唯一のタンパク質種(質量=14173)であることが示された。
【0178】
実施例13:N−Ac−Cys(Mal)−ベンジルアミンの調製
【0179】
【化23】

【0180】
メタノール(42mL)中のN−Ac−Cys−ベンジルアミン(1.00g、4.00mmol)上記)に、メタノール(42mL)中のブロモマレイミド(777mg、4.37mmol)を5分間かけて滴下した。10分後、溶媒を真空中で除去し、残渣を、石油エーテル中10%の酢酸エチルを使用するフラッシュクロマトグラフィーに供して、所望の化合物(429mg、1.2mmol)をオフホワイトの固体として、ブロモマレイミドの69%の回収率に基づき100%の収率で得た。 δH (500 MHz, MeOD) 7.32-7.20 (m, 5H, 5 x Ar-H), 6.45 (s, 1H, H-12), 4.71 (t, 1H, J = 7.3, H-3), 4.38 (d, 2H, J = 2.7, H2-5), 3.40 (dd, 1H, J = 7.0及び13.6, HH-10), 3.25 (dd, 1H, J = 7.2及び13.6, HH-10), 1.99 (s, 3H, H3-1); δC (125 MHz, MeOD) 173.51 (C=O), 172.22 (C=O), 171.44 (C=O), 170.51 (C=O), 151.58 (C11), 139.48 (C6), 129.54 (2 x Ar-H), 128.51 (2 x Ar-H), 128.26 (C9), 121.01 (C12) 53.04 (C3), 44.25 (C5), 33.72 (C10), 22.42 (C1); IR (薄膜, cm-1) 3187 (w), 1717 (s), 1646 (s); MS (ES+) m/z (相対強度): 370 ([M+Na], 20), 337 (50), 325 (90), 309(100); [C16H17N3O4SN]+Naについて計算した正確な質量はm/z 370.0873を要求、実測値 370.0852 (ES+); UV (アセトニトリル) ε213= 19400, ε247 = 4800及びε337 = 2700 cm-1M-1d3; 白色固体は180℃で分解する。
【0181】
実施例14:(S)−メチル 2−(tert−ブトキシカルボニルアミノ)−3−(1−(2−(5−(ジメチルアミノ)ナフタレン−1−スルホンアミド)エチル)−2,5−ジオキソ−2,5−ジヒドロ−1H−ピロール−3−イルチオ)プロパノアートの調製
【0182】
【化24】

【0183】
ヒートガンを使用して撹拌溶液を短時間加熱することにより、ダンシル−ブロモマレイミド(100mg)をメタノール(200ml)中に溶解した。得られた淡黄色溶液に、N−Boc−Cys−OMe(22μl、0.1mmol、0.5当量)及び酢酸ナトリウム(14.5mg、0.1mmol、0.5当量))を、3時間かけて添加した。反応をTLC(溶離液:40%EtOAc:60%石油エーテル)でモニタリングした。添加が完了したところでメタノールを真空中で除去して、黄色油状物を得た。カラムクロマトグラフィーでの精製により、所望の生成物を得た(48.29mg、0.08mmol、79.7%)。 1H NMR (600MHz CDCl3): δH 8.54(d, J=8.56Hz, 1H, CH), 8.21(d, 1H, J=8.27Hz, CH), 8.13(d, 1H, J=8.57Hz, CH), 7.55(m, 2H, 2 x CH), 7.25(d, J=7.60Hz, 1H, CH), 5.92(s, 1H, CH), 4.44(m, 1H, HN-CH-CO), 3.77(s, 3H, OMe), 3.48(m, 2H, CH2), 3.44(m, 2H, CH2), 3.38(s, 6H, 2 xCH3), 3.13(t, J=5.79, 2H, S-CH2) 2.88(s, 9H, 3 x CH3). 13C NMR (600MHz CDCl3): 173.08, 170.52, 169.69, 168.96 (4x C=O), 157.73 (-C=CH), 153.16, 150.71, 136.48, 131.39, 131.25, 131.18, 130.74, 130.65, 129.31, 124.35, 120.61, 119.22, 81.12, 53.58, 52.95, 45.89, 41.53, 33.98, 28.66. IR: 3324.7 cm-1, 1775 cm-1. [M + H]+: 605.1756, 計算値; 605.1740.
【0184】
実施例15:Glu−Cys(Mal)−Glyの調製
【0185】
【化25】

【0186】
メタノール(3mL)中のグルタチオン(47mg、0.15mmol)に、メタノール(3mL)中のブロモマレイミド(30mg、0.15mmol)を添加した。5分後、溶媒を真空中で除去して、所望の化合物(62mg、0.15mmol)を粘度のある無色油状物として100%の収率で得た。δH (500 MHz, MeOD) 6.47 (s, 1H, H-12), 4.79 (dd, 1H, J = 5.7及び8.2, H-6), 4.06 (t, 1H, J = 6.5, H-2), 3.95 (s, 2H, H2-8), 3.49 (dd, 1H, J = 5.8及び13.9, HH-10), 3.29 (dd, 1H, J = 8.3及び13.6, HH-10), 2.61 (t, 2H, J = 7.1, H2-4), 2.29-2.15 (m, 2H, H2-3); δC(125 MHz, MeOD) 174.68 (C=O), 172.81 (C=O), 172.39 (C=O), 171.89 (C=O), 171.62 (C=O), 170.59 (C=O), 151.75 (C11), 120.91 (C12), 53.79 (C6), 52.76 (C2), 42.01 (C8), 33.92 (C10) 32.42 (C4), 27.03 (C3); IR (油, cm-1) 3259 (m), 2928 (m), 1717 (s); MS (ES-) m/z (相対強度): 401 ([M-H], 100), 272 (30); [C14H18N4O8S]-Hについて計算した正確な質量はm/z 401.0767を要求、実測値 401.0773 (ES-); UV (アセトニトリル) ε204= 8100, ε253 = 5600及びε342 = 1900 cm-1M-1d3.
【0187】
実施例16:Boc−Cys(MeMal)−Phe−iPrの調製の調製
【0188】
【化26】

【0189】
O−(ベンゾトリアゾール−1−イル)−N,N,N’,N’−テトラメチルウロニウム ヘキサフルオロホスフェート(344mg、0.82mmol)を、(2R)−2−[(tert−ブトキシカルボニル)アミノ]−3−[(1−メチル−2,5−ジオキソ−2,5−ジヒドロ−1H−ピロール−3−イル)スルファニル]プロパン酸(313mg、0.95mmol)及び1−ヒドロキシベンゾトリアゾール水和物(139mg)のDMF(2mL)中撹拌溶液に添加し、反応を21℃で3分間撹拌した。(2S)−1−オキソ−3−フェニル−1−(プロパン−2−イルアミノ)プロパン−2−アンモニウム トリフルオロアセテート(262mg、0.82mmol)のDMF(1.5mL)中溶液を反応混合物に添加し、その後、N,N−ジイソプロピルエチルアミン(294μL、1.64mmol)を添加し、反応を21℃で4時間撹拌した。溶媒を真空中で除去し、残渣をEtOAc(60mL)中に溶解し、1M HCl(x3)、H2O(x1)、飽和NaHCO3(x3)、10%LiCl(x1)及び飽和NaCl(x1)で洗浄し、乾燥させ(MgSO4)、濾過し、溶媒を真空中で除去した。沈殿(CHCl3/石油エーテル 40〜60)での精製により、所望の化合物を淡褐色固体として得た(359mg、0.69mmol、84%収率): 1H NMR (600 MHz, CD3CN, 25 °C) δ 7.32-7.28 (m, 2H), 7.25-7.21 (m, 3H), 7.11 (d, J = 7.7 Hz, 1H), 6.46 (d, J = 6.3 Hz, 1H), 6.42 (s, 1H), 4.46 (td, J = 7.6, 6.5 Hz, 1H), 4.31 (td, J = 7.3, 6.4 Hz), 3.88 (ダブレットのセプテット, J = 6.6, 6.3 Hz, 1H), 3.30 (dd, J = 13.7, 5.8 Hz, 1H), 3.16 (dd, J = 13.7, 7.4 Hz, 1H), 2.95 (dd, J = 13.8, 7.5 Hz, 1H), 2.93 (s, 3H), 1.43 (s, 9H), 1.07 (d, J = 6.6 Hz, 3H), 1.02 (d, J = 6.6 Hz, 3H); 13C NMR (151 MHz, CD3CN, 25 °C) δ 169.39, 168.84, 168.77, 167.85, 155.17, 149.33, 136.77, 129.10, 127.98, 126.30, 118.57, 79.49, 54.10, 52.62, 40.91, 37.44, 32.43, 27.15, 22.95, 21.24, 21.17; IR (薄膜) 3301, 2973, 1770, 1701, 1674, 1641, 1525 cm-1; LRMS (EI) 518 (24%, [M]+・), 432 (23), 219 (33), 149 (21) 110 (27), 86 (37), 84 (100); C25H34N4O6S [M]+・について計算したHRMS (EI) 518.2194, 実測値518.2199.
【0190】
実施例17:Boc−Cys(MeMal)−Phe−iPrの脱保護
【0191】
【化27】

【0192】
150mMホスフェート緩衝液(pH8、25mL)中のトリス(2−カルボキシエチル)ホスフィン塩酸塩(138mg、0.48mmol)を、Boc−Cys(MeMal)−Phe−iPr(50mg、97μmol)のMeCN(25mL)中撹拌溶液に添加し、反応を21℃で10分間撹拌した。Boc−Cys−Phe−iPrの合成はLCMS(ES−)408.7(100%)で確認した。
【0193】
参考例4:Grb2−SH2 L111C変異体のクローニング及び発現
【0194】
【化28】

【0195】
Grb2−SH2 L111Cの配列(残基53−163):M G I E M K P H P W F F G K I P R A K A E E M L S K Q R H D G A F L I R E S E S A P G D F S L S V K F G N D V Q H F K V C R D G A G K Y F L W V V K F N S L N E L V D Y H R S T S V S R N Q Q I F L R D I E Q V P Q Q P T Y V Q A G S R S H H H H H H 終止。質量計算値=14171
【0196】
Grb2 SH2ドメインのためのDNA構築物は、1次アミノ酸配列53−163を含んでおり、プラスミドQE−60(Qiagen)にクローニングした。Grb2 SH2 L111C変異体は、変異残基をコードするオリゴヌクレオチドを使用した部位特異的変異誘発(Stratagene Kit)によって構築した。両方の構築物を、T5プロモーターを使用してEscherichia coli(M15[pREP4]、Qiagen)中で発現させ、C末端に6−His Tagを精製のために組み込んだ。培養物(1L)を、シングルコロニーからT.B.中で37℃で増殖させ、0.9のO.D.λ600に達した時点で1.0mM IPTGによって発現を誘導した。培養物に、ほぼ3時間にわたってタンパク質を発現させ、その後細胞をペレット化した。ペレットを、プロテアーゼ阻害剤カクテル(Roche)を含む0.1Mリン酸ナトリウム、300mM NaCl、50mMイミダゾール、pH7.2中で溶解させた。溶解物を遠心分離し、上清をNi−NTAカラム(Qiagen)にアプライした。Grb2−SH2 L111Cを、0.1Mリン酸ナトリウム、300mM NaCl、200mMイミダゾール(pH7.2)によってNi−NTAカラムから溶出させた。収集したGrb2 SH2 L111Cは、クマシー染色したSDS−PAGEで可視化したとき、約95%の純度であった。ドメインスワッピングによるGrb2 SH2ドメインの二量体化は、以前に観察されている。二量体及び単量体のGrb2−SH2を、0.1Mリン酸ナトリウム及び150mM NaCl(pH8.0)で予め平衡化したSephacryl S−100カラム(320mL)で分離した。単量体Grb2−SH2の分子量(約14kDa)及び二量体Grb2−SH2の分子量(約28kDa)に対応する2つのピークが溶出した。Grb2−SH2 L111Cドメインのほぼ60%が、カラムから単量体として溶出した。4℃で数ヶ月の過程にわたって相互変換が殆ど認められなかったことから、分離された単量体及び二量体は、驚くべきことに動力学的に安定であることが見出された。単量体を、Amicon(登録商標)Ultra−4遠心フィルターユニット(Millipore)を使用して濃縮し、タンパク質の最終濃度を、McNemar及び共同研究者が得た吸光係数(15,600M−1)を用い、280nmでの吸光度によって決定した。タンパク質を、100mLアリコート中2mg/mLの濃度で凍結させ、これを実験の際に必要に応じて解凍した。単量体タンパク質の質量(質量14170)はESI−MSを使用して得た。
【0197】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、0℃でEllman試薬(5μL、H2O中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、0℃で10分間維持し、その後、混合物をLC−MSで分析した。分析により、単一の反応が起こって、14370の質量を有する単一の生成物が生じたことが示され、これは、C111が官能化に利用可能であることを示す。
【0198】
実施例18:GrB2−SH2ドメインL111C/ブロモマレイミド付加物の調製
【0199】
【化29】

【0200】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が定量的変換で形成されたことが示された(質量14266)。
【0201】
混合物を、0℃でEllman試薬(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で10分間維持し、その後、混合物をLC−MSで分析した。分析により、Ellman試薬との反応は明白には表れないことが示され、これは、ブロモマレイミド官能化がC111で生じたことを強調する。
【0202】
実施例19:GrB2−SH2ドメインL111C/N−メチルブロモマレイミド付加物の調製
【0203】
【化30】

【0204】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−メチルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した、LC−MSを使用した分析により、所望の生成物が定量的変換で形成されたことが示された(質量14280)。
【0205】
混合物を、0℃でEllman試薬(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で10分間維持し、その後、混合物をLC−MSで分析した。分析により、Ellman試薬との反応は明白には表れないことが示され、これは、N−メチルブロモマレイミド官能化がC111で生じたことを強調している。
【0206】
実施例20:GrB2−SH2ドメインL111C/ブロモマレイミド付加物のホスフィン媒介性の還元的切断
【0207】
【化31】

【0208】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ブロモマレイミド付加物に対応する質量14265の単一のタンパク質種が示された。
【0209】
混合物を、0℃でTCEP.HCl(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で3時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14169)が80%の変換で得られたことが示された。
【0210】
実施例21:GrB2−SH2ドメインL111C/ブロモマレイミド付加物のβ−メルカプトエタノール媒介性の還元的切断
【0211】
【化32】

【0212】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ブロモマレイミド付加物に対応する質量14265の単一のタンパク質種が示された。
【0213】
混合物を、β−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理し、1秒間ボルテックスし、37℃で4時間維持した。分析により、タンパク質/ブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14173)が定量的変換で得られたことが示された。
【0214】
実施例22:GrB2−SH2ドメインL111C/ブロモマレイミド付加物のグルタチオン媒介性の切断
【0215】
【化33】

【0216】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ブロモマレイミド付加物に対応する質量14265の単一のタンパク質種が示された。
【0217】
混合物をグルタチオン(5μL、H2O中の282mM溶液)で処理し、1秒間ボルテックスし、37℃で4時間維持した。分析により、タンパク質/ブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14173)が定量的変換で得られたことが示された。
【0218】
実施例23:GrB2−SH2ドメインL111C/N−メチルブロモマレイミド付加物のホスフィン媒介性の還元的切断
【0219】
【化34】

【0220】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−メチルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−メチルブロモマレイミド付加物に対応する質量14278の単一のタンパク質種が示された。
【0221】
混合物を、0℃でTCEP.HCl(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で3時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/N−メチルブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14168)が85%の変換で得られたことが示された。
【0222】
実施例24:GrB2−SH2ドメインL111C/N−メチルブロモマレイミド付加物のβ−メルカプトエタノール媒介性の還元的切断
【0223】
【化35】

【0224】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−メチルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−メチルブロモマレイミド付加物に対応する質量14280の単一のタンパク質種が示された。
【0225】
混合物を、β−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理し、1秒間ボルテックスし、37℃で4時間維持した。分析により、タンパク質/N−メチルブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14173)が定量的変換で得られたことが示された。
【0226】
実施例25:GrB2−SH2ドメインL111C/N−メチルブロモマレイミド付加物のグルタチオン媒介性の切断
【0227】
【化36】

【0228】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−メチルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−メチルブロモマレイミド付加物に対応する質量14280の単一のタンパク質種が示された。
【0229】
混合物を、グルタチオン(5μL、H2O中の282mM溶液)で処理し、1秒間ボルテックスし、37℃で4時間維持した。分析により、タンパク質/N−メチルブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14173)が定量的変換で得られたことが示された。
【0230】
実施例26:GrB2−SH2ドメインL111C/ブロモマレイミド付加物のエタンジチオール媒介性の切断
【0231】
【化37】

【0232】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ブロモマレイミド付加物に対応する質量14265の単一のタンパク質種が示された。
【0233】
混合物を、エタンジチオール(5μL、H2O中の282mM溶液)で処理し、1秒間ボルテックスし、37℃で4時間維持した。分析により、タンパク質/ブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14173)が定量的変換で得られたことが示された。
【0234】
実施例27:GrB2−SH2ドメインL111C/ブロモマレイミド/2−メルカプトエタノール付加物の調製
【0235】
【化38】

【0236】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ブロモマレイミド付加物に対応する質量14265の単一のタンパク質種が示された。
【0237】
混合物を、0℃で2−メルカプトエタノール(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で3時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ブロモマレイミド/2−メルカプトエタノール付加物(質量=14345)が54%の収率で形成されたことが示された。残りの物質はGrB2−SH2ドメインL111Cであった。
【0238】
実施例28:GrB2−SH2ドメインL111C/N−メチルブロモマレイミド/2−メルカプトエタノール付加物の調製
【0239】
【化39】

【0240】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−メチルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−メチルブロモマレイミド付加物に対応する質量14278の単一のタンパク質種が示された。
【0241】
混合物を、0℃で2−メルカプトエタノール(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で3時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14359)が90%の収率で形成されたことが示された。残りの物質はGrB2−SH2ドメインL111Cであった。
【0242】
実施例29:GrB2−SH2ドメインL111C/ブロモマレイミド/グルタチオン付加物の調製
【0243】
【化40】

【0244】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ブロモマレイミド付加物に対応する質量14265の単一のタンパク質種が示された。
【0245】
混合物を、0℃でグルタチオン(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で3時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ブロモマレイミド/グルタチオン付加物(質量=14574)が44%の変換で形成されたことが示された。残りの物質はGrB2−SH2ドメインL111Cであった。
【0246】
実施例30:GrB2−SH2ドメインL111C/N−メチルブロモマレイミド/グルタチオン付加物の調製
【0247】
【化41】

【0248】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−メチルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−メチルブロモマレイミド付加物に対応する質量14278の単一のタンパク質種が示された。
【0249】
混合物を、0℃で2−メルカプトエタノール(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で3時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/N−メチルブロモマレイミド/グルタチオン付加物(質量=14588)が95%の変換で形成されたことが示された。残りの物質はGrB2−SH2ドメインL111Cであった。
【0250】
実施例31:GrB2−SH2ドメインL111C/ジブロモマレイミド付加物の調製
【0251】
【化42】

【0252】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、所望の生成物が定量的収率で形成されたことが示された(質量14345)。
【0253】
実施例32:GrB2−SH2ドメインL111C/ジブロモマレイミド付加物の2−メルカプトエタノール媒介性の還元的切断
【0254】
【化43】

【0255】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0256】
混合物を、0℃で2−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14171)が定量的収率の収率で得られたことが示された。
【0257】
実施例33:GrB2−SH2ドメインL111C/ジブロモマレイミド付加物のグルタチオン媒介性の還元的切断
【0258】
【化44】

【0259】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0260】
混合物を、0℃でグルタチオン(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ブロモマレイミド付加物が明らかに切断されて、所望の生成物(質量=14170)が定量的収率で得られたことが示された。
【0261】
実施例34:GrB2−SH2ドメインL111C/ジブロモマレイミド/グルタチオン付加物の調製
【0262】
【化45】

【0263】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0264】
混合物を、0℃でグルタチオン(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14573)が定量的変換で形成されたことが示された。
【0265】
実施例35:GrB2−SH2ドメインL111C/ジブロモマレイミド/β−1−チオグルコース付加物の調製
【0266】
【化46】

【0267】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0268】
混合物を、0℃でβ−1−チオグルコース、ナトリウム塩(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14461)がほぼ定量的収率で形成されたことが示された。
【0269】
実施例36:GrB2−SH2ドメインL111C/ジブロモマレイミド/グルタチオン付加物のグルタチオン媒介性の切断
【0270】
【化47】

【0271】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0272】
混合物を、0℃でグルタチオン(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ジブロモマレイミド/グルタチオン付加物が、唯一の存在するタンパク質種であることが示された(質量=14573)。
【0273】
混合物を、0℃でグルタチオン(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14173)が、定量的収率で形成されたことが示された。
【0274】
実施例37:生理学的に適切なグルタチオン濃度(5mM)での、GrB2−SH2ドメインL111C/ジブロモマレイミド/グルタチオン付加物のグルタチオン媒介性の切断
【0275】
【化48】

【0276】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0277】
混合物を、0℃でグルタチオン(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ジブロモマレイミド/グルタチオン付加物が存在する唯一のタンパク質種であることが示された(質量=14573)。
【0278】
混合物を、0℃でグルタチオン(5μL、H2O中の100mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14173)が定量的収率で形成されたことが示された。
【0279】
実施例38:生理学的に適切なグルタチオン濃度(1mM)での、GrB2−SH2ドメインL111C/ジブロモマレイミド/グルタチオン付加物のグルタチオン媒介性の切断
【0280】
【化49】

【0281】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0282】
混合物を、0℃でグルタチオン(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ジブロモマレイミド/グルタチオン付加物が存在する唯一のタンパク質種であることが示された(質量=14573)。
【0283】
タンパク質/ジブロモマレイミド/グルタチオン付加物の溶液を、緩衝液交換(Micro Bio−Spin 6 Chromatography Column、Bio−Rad)に供して、付加物(95μL、[付加物]0.2mg/mL、20mM HEPES、100mM KCl、1mM MgCl2、1mM EDTA、pH7.4)を得た。これに、グルタチオン(5μL、20mM HEPES、100mM KCl、1mM MgCl2、1mM EDTA、pH7.4中20mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で4時間維持した。分析により、Grb2−SH2(L111C)(質量)14170)が定量的変換で形成されたことが示された。
【0284】
実施例39:GrB2−SH2ドメインL111C/ジブロモマレイミド/グルタチオン付加物のβ−メルカプトエタノール媒介性の切断
【0285】
【化50】

【0286】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0287】
混合物を、0℃でグルタチオン(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ジブロモマレイミド/グルタチオン付加物が存在する唯一のタンパク質種であることが示された(質量=14573)。
【0288】
混合物を、0℃でβ−メルカプトエタノール(5μL、H2O中282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14172)が定量的変換で形成されたことが示された。
【0289】
実施例40:GrB2−SH2ドメインL111C/ジブロモマレイミド/β−1−チオグルコース付加物のグルタチオン媒介性の切断
【0290】
【化51】

【0291】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0292】
混合物を、0℃でβ−1−チオグルコース(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ジブロモマレイミド/β−1−チオグルコース付加物が存在する唯一のタンパク質種であることが示された(質量=14461)。
【0293】
混合物を、0℃でグルタチオン(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14173)が定量的変換で形成されたことが示された。
【0294】
実施例41:GrB2−SH2ドメインL111C/ジブロモマレイミド/β−1−チオグルコース付加物のβ−メルカプトエタノール媒介性の切断
【0295】
【化52】

【0296】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で4時間維持した。LC−MSを使用した分析により、タンパク質/ジブロモマレイミド付加物に対応する質量14346の単一のタンパク質種が示された。
【0297】
混合物を、0℃でβ−1−チオグルコース(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/ジブロモマレイミド/β−1−チオグルコース付加物が存在する唯一のタンパク質種であることが示された(質量=14461)。
【0298】
混合物を、0℃でβ−メルカプトエタノール(5μL、H2O中282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14172)が定量的変換で形成されたことが示された。
【0299】
実施例42:GrB2−SH2ドメインL111C/N−フェニルブロモマレイミド付加物の調製
【0300】
【化53】

【0301】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−フェニルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が定量的収率で形成されたことが示された(質量14351)。
【0302】
実施例43:GrB2−SH2ドメインL111C/N−フェニルジブロモマレイミド付加物の調製
【0303】
【化54】

【0304】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、20mM MES、150mM NaCl、pH6)に、N−フェニルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が定量的収率で形成されたことが示された(質量14431)。
【0305】
実施例44:GrB2−SH2ドメインL111C/N−フェニルジブロモマレイミド付加物のβ−メルカプトエタノール媒介性の切断
【0306】
【化55】

【0307】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、20mM MES、150mM NaCl、pH6)に、N−フェニルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−フェニルジブロモマレイミド付加物が定量的収率で形成されたことが示された(質量14431)。
【0308】
混合物を、0℃でβ−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14179)が定量的変換で形成されたことが示された。
【0309】
実施例45:GrB2−SH2ドメインL111C/N−フェニルジブロモマレイミド/β−1−チオグルコース付加物の調製
【0310】
【化56】

【0311】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、20mM MES、150mM NaCl、pH6)に、N−フェニルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−フェニルジブロモマレイミド付加物が定量的収率で形成されたことが示された(質量14431)。
【0312】
混合物を、0℃でβ−1−チオグルコース(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/N−フェニルジブロモマレイミド/β−1−チオグルコース付加物が存在する唯一のタンパク質種であることが示された(質量=14547)。
【0313】
実施例46:GrB2−SH2ドメインL111C/N−フェニルジブロモマレイミド/β−1−チオグルコース付加物のβ−メルカプトエタノール媒介性の切断
【0314】
【化57】

【0315】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、20mM MES、150mM NaCl、pH6)に、N−フェニルブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/N−フェニルジブロモマレイミド付加物が定量的収率で形成されたことが示された(質量14431)。
【0316】
混合物を、0℃でβ−1−チオグルコース(5μL、H2O中の2.82mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/N−フェニルジブロモマレイミド/β−1−チオグルコース付加物が存在する唯一のタンパク質種であることが示された(質量=14547)。
【0317】
混合物を、0℃でβ−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14178)が定量的変換で形成されたことが示された。
【0318】
実施例47:GrB2−SH2ドメインL111C/ビオチン−PEG−ブロモマレイミド付加物の調製
【0319】
【化58】

【0320】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ビオチン−PEG−ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が定量的収率で形成されたことが示された(質量14634)。
【0321】
実施例48:GrB2−SH2ドメインL111C/ビオチン−PEG−ブロモマレイミド付加物のβ−メルカプトエタノール媒介性の切断
【0322】
【化59】

【0323】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ビオチン−PEG−ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ビオチン−PEG−ブロモマレイミド付加物が定量的収率で形成されたことが示された(質量14634)。
【0324】
混合物を、37℃でβ−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、37℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14180)が定量的変換で形成されたことが示された。
【0325】
実施例49:GrB2−SH2ドメインL111C/ビオチン−PEG−ジブロモマレイミド付加物の調製
【0326】
【化60】

【0327】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ビオチン−PEG−ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で2時間維持した。LC−MSを使用した分析により、所望の生成物が>80%の収率で形成されたことが示された(質量14701)。
【0328】
実施例50:GrB2−SH2ドメインL111C/ビオチン−PEG−ジブロモマレイミド付加物のβ−メルカプトエタノール媒介性の切断
【0329】
【化61】

【0330】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ビオチン−PEG−ジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/ビオチン−PEG−ジブロモマレイミド付加物が>80%の変換で形成されたことが示された(質量14701)。
【0331】
混合物を、0℃でβ−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、0℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14171)が>80%の変換で形成されたことが示された。
【0332】
実施例51:ニュートラアビジン被覆したアガロースビーズ上へのGrB2−SH2ドメインL111C/ビオチン−PEG−ブロモマレイミド付加物のプルダウン及び放出
【0333】
【化62】

【0334】
0℃のモデルタンパク質溶液(200μL、[タンパク質]1.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、ビオチン−PEG−ブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が定量的収率で形成されたことが示された(質量14634)。
【0335】
タンパク質/ビオチン−PEG−ブロモマレイミド付加物(200μL)及び非修飾モデルタンパク質(200μL)を、濃縮器(Vivaspin、カットオフ10k)中でPBS緩衝液(3x500μL)で独立して洗浄し、タンパク質溶液(300μL)(In)を得た。得られたタンパク質溶液のそれぞれについて、ニュートラアビジン被覆したアガロースビーズ(50%水性スラリー750μL)を、PBS(2x500μL)で洗浄した。次いで、タンパク質溶液(300μL)をビーズに添加し、混合物を4℃で30分間インキュベートした。混合物を遠心分離し、フロースルー(FT)を収集した。ビーズをPBS(2x500μL)で洗浄し、両方の洗浄画分を収集した(W1及びW2)。タンパク質を、β−メルカプトエタノール(25mM)を含むPBS(300μL)中で37℃で2時間インキュベートすることにより、ビーズから放出させた。サンプルを遠心分離し、切断されたGrB2−SH2ドメインL111Cを含む溶離液(El)を収集した。結果を図1に示す。
【0336】
回収されたタンパク質の量は、デンシトメトリーによるタンパク質希釈系列との比較により、44%と決定された。しかしながら、不可逆的に物理吸着されたタンパク質(未修飾のタンパク質コントロールを使用して決定した)に対して補正すると、補正された回収率は71%であった。
【0337】
実施例52:GrB2−SH2ドメインL111C/N−フルオレセインブロモマレイミド付加物の調製
【0338】
【化63】

【0339】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH7.0)に、N−フルオレセインブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が90%の変換で形成されたことが示された(質量14597)。
【0340】
実施例53:GrB2−SH2ドメインL111C/N−フルオレセインブロモマレイミド付加物のβ−メルカプトエタノール媒介性の切断
【0341】
【化64】

【0342】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH7.0)に、N−フルオレセインブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/フルオレセインブロモマレイミド付加物が90%の変換で形成されたことが示された(質量14597)。
【0343】
混合物を、37℃でβ−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、37℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14171)が87%の変換で形成されたことが示された。
【0344】
実施例54:GrB2−SH2ドメインL111C/N−フルオレセインジブロモマレイミド付加物の調製
【0345】
【化65】

【0346】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、N−フルオレセインジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が61%の変換で形成されたことが示された(質量14675)。
【0347】
実施例55:GrB2−SH2ドメインL111C/N−フルオレセインジブロモマレイミド付加物のβ−メルカプトエタノール媒介性の切断
【0348】
【化66】

【0349】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH7.0)に、N−フルオレセインジブロモマレイミド(5μL、DMF中の2.82mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで0℃で1時間維持した。LC−MSを使用した分析により、タンパク質/フルオレセインジブロモマレイミド付加物が61%の変換で形成されたことが示された(質量14597)。
【0350】
混合物を、37℃でβ−メルカプトエタノール(5μL、H2O中の282mM溶液)で処理した。この混合物を1秒間ボルテックスし、37℃で4時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14171)が85%の変換で形成されたことが示された。
【0351】
実施例56:GrB2−SH2ドメインL111C/BrDDPD付加物の調製
【0352】
【化67】

【0353】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、BrDDPD(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が定量的収率で形成されたことが示された(質量14348)。
【0354】
実施例57:GrB2−SH2ドメインL111C/BrDDPD付加物のβ−メルカプトエタノール媒介性の切断
【0355】
【化68】

【0356】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、BrDDPD(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、タンパク質/BrDDPD付加物が定量的収率で形成されたことが示された(質量14348)。
【0357】
混合物を、4℃で40時間透析し(100mMリン酸ナトリウム、150mM NaCl、pH8.0)、37℃でβ−メルカプトエタノール(5μL、H2O中の2.82M溶液)で処理した。この混合物を1秒間ボルテックスし、37℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14180)が定量的変換で形成されたことが示された。
【0358】
実施例58:GrB2−SH2ドメインL111C/DiBrDDPD付加物の調製
【0359】
【化69】

【0360】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、DiBrDDPD(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が定量的収率で形成されたことが示された(質量14427)。
【0361】
実施例59:GrB2−SH2ドメインL111C/DiBrDDPD付加物のβ−メルカプトエタノール媒介性の切断
【0362】
【化70】

【0363】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、DiBrDDPD(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、タンパク質/DiBrDDPD付加物が定量的収率で形成されたことが示された(質量14427)。
【0364】
混合物を、4℃で40時間透析し(100mMリン酸ナトリウム、150mM NaCl、pH8.0)、次いで37℃でβ−メルカプトエタノール(5μL、H2O中の2.82M溶液)で処理した。この混合物を1秒間ボルテックスし、37℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14180)が定量的変換で形成されたことが示された。
【0365】
実施例60:GrB2−SH2ドメインL111C/DiBrDDPD/β−1−チオグルコース付加物の調製
【0366】
【化71】

【0367】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、DiBrDDPD(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、タンパク質/DiBrDDPD付加物が定量的収率で形成されたことが示された(質量14427)。
【0368】
混合物を、4℃で40時間透析し(100mMリン酸ナトリウム、150mM NaCl、pH8.0)、次いで0℃でβ−1−チオグルコース(5μL、H2O中の28.2mM)で処理した。この混合物を1秒間ボルテックスし、室温で1時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/DiBrDDPD/β−1−チオグルコース付加物が存在する唯一のタンパク質種であることが示された(質量=14543)。
【0369】
実施例61:GrB2−SH2ドメインL111C/DiBrDDPD/β−1−チオグルコース付加物のβ−メルカプトエタノール媒介性の切断
【0370】
【化72】

【0371】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、DiBrDDPD(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、タンパク質/DiBrDDPD付加物が定量的収率で形成されたことが示された(質量14427)。
【0372】
混合物を、4℃で40時間透析し(100mMリン酸ナトリウム、150mM NaCl、pH8.0)、次いで0℃でβ−1−チオグルコース(5μL、H2O中の28.2mM溶液)で処理した。この混合物を1秒間ボルテックスし、室温で1時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/DiBrDDPD/β−1−チオグルコース付加物が存在する唯一のタンパク質種であることが示された(質量=14543)。
【0373】
混合物を、室温でβ−メルカプトエタノール(5μL、H2O中の2.82M溶液)で処理した。この混合物を1秒間ボルテックスし、室温で30分間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14180)が定量的変換で形成されたことが示された。
【0374】
実施例62:GrB2−SH2ドメインL111C/BrDDPD/β−1−チオグルコース付加物の調製
【0375】
【化73】

【0376】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、BrDDPD(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、タンパク質/BrDDPD付加物が定量的収率で形成されたことが示された(質量14348)。
【0377】
混合物を、4℃で40時間透析し(100mMリン酸ナトリウム、150mM NaCl、pH8.0)、次いで0℃でβ−1−チオグルコース(5μL、H2O中の28.2mM溶液)で処理した。この混合物を1秒間ボルテックスし、37℃で1時間維持し、その後、混合物をLC−MSで分析した。分析により、タンパク質/BrDDPD/β−1−チオグルコース付加物が17%の変換で形成されたことが示された(質量=14543)。
【0378】
実施例63:GrB2−SH2ドメインL111C/Z−2,3−ジブロモ−ブタ−2−エン二酸ジメチルエステル付加物の調製
【0379】
【化74】

【0380】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、Z−2,3−ジブロモ−ブタ−2−エン二酸ジメチルエステル(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が形成されたことが示された(質量14440)。
【0381】
実施例64:GrB2−SH2ドメインL111C/Z−2,3−ジブロモ−ブタ−2−エン二酸ジメチルエステル付加物のβ−メルカプトエタノール媒介性の切断
【0382】
【化75】

【0383】
0℃のモデルタンパク質溶液(100μL、[タンパク質]2.0mg/mL、100mMリン酸ナトリウム、150mM NaCl、pH8.0)に、Z−2,3−ジブロモ−ブタ−2−エン二酸ジメチルエステル(5μL、DMF中の282mM溶液)を添加した。この混合物を1秒間ボルテックスし、次いで37℃で1時間維持した。LC−MSを使用した分析により、所望の生成物が定量的収率で形成されたことが示された(質量14370)。
【0384】
混合物を、37℃でβ−メルカプトエタノール(5μL、H2O中の2.82M溶液)で処理した。この混合物を1秒間ボルテックスし、37℃で2時間維持し、その後、混合物をLC−MSで分析した。分析により、所望の生成物(質量=14180)が定量的変換で形成されたことが示された。
【0385】
実施例65:ソマトスタチンの修飾及び再生
還元型ソマトスタチンの調製
【0386】
【化76】

【0387】
凍結乾燥したソマトスタチン(質量=1638)を、緩衝液(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5%DMF)中に可溶化して、152.6μMの濃度(0.25mg/ml)とし、1.1当量のTCEPで、周囲温度で1時間還元した。還元の完了は、4当量のジブロモマレイミドをサンプルアリコートに添加し、LC−MSで分析して確認した。
【0388】
ハロマレイミド及び誘導体によるソマトスタチンの架橋
還元型ソマトスタチンは記載したとおりに生成した。1.1当量のハロマレイミド又はジブロモマレイミド誘導体(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5〜15.0%DMF中100xストック)を周囲温度で添加し、生成物の生成をLC−MSで1時間にわたりモニタリングした。結果を図2に示す。
【0389】
ジチオマレイミドによるソマトスタチンの架橋
還元型ソマトスタチンは記載したとおりに生成した。種々の量のジチオマレイミド(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5〜7.5%DMF中100xストック)を周囲温度で添加し、生成物の生成をLC−MSで1時間にわたりモニタリングした。結果を図3に示す。
【0390】
ブロモマレイミドによるソマトスタチンの修飾
【0391】
【化77】

【0392】
還元型ソマトスタチンは記載したとおりに生成した。2.1当量のブロモマレイミド(50mMリン酸ナトリウム、pH6.2、40%MeCN、7.5%DMF中100xストック)を周囲温度で添加したところ、ジ−付加生成物への完全な変換がLC−MSによって1時間以内に観察された。
【0393】
種々の還元剤による架橋ソマトスタチンの切断
マレイミド架橋ソマトスタチンは、記載したように調製した。100当量の種々の還元剤(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5%DMF中1000xストック)を添加し、未修飾ペプチド及び副産物(還元剤と遊離ペプチド−システインとの混合型ジスルフィド)の生成を、LC−MSによって4℃で2日間モニタリングした。ソマトスタチンとGSHとの混合型ジスルフィドは、MALDI−TOF MSでのみ検出できた。結果を図4に示す。
【0394】
種々の量のDTT及び2−メルカプトエタノールによる、架橋ソマトスタチンの切断
マレイミド架橋ソマトスタチンは、記載したように調製した。種々の量のDTT又は2−メルカプトエタノール(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5%DMF中1000xストック)を添加し、未修飾ペプチド及び副産物(還元剤と遊離ペプチド−システインとの混合型ジスルフィド)の生成を、LC−MSによって4℃で6時間モニタリングした。結果を図5に示す。
【0395】
架橋ソマトスタチンの触媒された切断
マレイミド架橋ソマトスタチンは、記載したように調製した。20当量の2−メルカプトエタノール(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5%DMF中1000xストック)を添加し、その後、緩衝液又は5当量のヨウ化ナトリウム若しくはベンゼンセレノール(50mMリン酸ナトリウム、pH6.2、40%MeCN、7.5%DMF中100xストック)のいずれかを添加し、未修飾ペプチド及び副産物(2−メルカプトエタノール又はベンゼンセレノールと遊離ペプチド−システインとの混合型ジスルフィド)の生成を、LC−MSによって周囲温度で20分間モニタリングした。結果を図6に示す。
【0396】
N−官能化マレイミド架橋ソマトスタチンの切断
ソマトスタチンを、記載したとおりに還元し、N−官能化マレイミド誘導体で架橋した。100当量の2−メルカプトエタノール(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5%DMF中1000xストック)を添加し、未修飾ペプチド及び副産物(2−メルカプトエタノールと遊離ペプチド−システインとの混合型ジスルフィド)の生成をLC−MSにより4℃で2日間モニタリングした。結果を図7に示す。
【0397】
ソマトスタチンへのモノブロモマレイミドのジ−付加生成物の切断
還元型ソマトスタチンを、2.1当量のモノブロモマレイミドと反応させて、ジ−付加生成物を得た。次に、100当量の2−メルカプトエタノール(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5%DMF中1000xストック)を添加し、モノ−付加生成物、未修飾ペプチド及び副産物(2−メルカプトエタノールと遊離ペプチド−システインとの混合型ジスルフィド)の生成を、LC−MSにより周囲温度で2.5時間モニタリングした。結果を図8に示す。
【0398】
ソマトスタチンの比較上のin situ架橋
ソマトスタチンに、種々の量のジチオマレイミド(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5−7.5%DMF中100xストック)を添加し、反応を周囲温度で10分間インキュベートした。次に、種々の量のTCEP又はベンゼンセレノール(100xストック、50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5〜7.5%DMF中で新たに調製した)を添加し、架橋ソマトスタチンの生成を、LC−MSにより周囲温度で1時間にわたりモニタリングした。結果を図9に示す。
【0399】
ソマトスタチンのin situ PEG化
ソマトスタチンに、5当量のN−PEG5000−ジチオフェノールマレイミド又は10当量のN−PEG5000−ジチオフェノールマレイミド(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5%DMF中100xストック)のいずれかを添加し、反応を周囲温度で10分間インキュベートした。次に、3当量のTCEPそれぞれ5当量のベンゼンセレノール(100xストック、50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5−7.5%DMF中に新たに調製)を添加し、PEG化ソマトスタチンの生成を、LC−MSによって周囲温度で2時間にわたってモニタリングした。結果を図10に示す。
【0400】
DiBrDDPDによるソマトスタチンの修飾
【0401】
【化78】

【0402】
凍結乾燥ソマトスタチン(質量=1638)を、緩衝液(50mMリン酸ナトリウム、pH6.2、40%MeCN、2.5%DMF)中に可溶化して、152.6μMの濃度(0.25mg/mL)にし、1.1当量のTCEPで21℃で1時間還元した。還元の完了はLCMSによって確認した(質量=1640)。DiBrDDPD(100mol当量)を添加し、反応を21℃で10分間維持した。ソマトスタチン/DiBrDDPD付加物が定量的変換で形成したことが観察された(質量=1803)。
【0403】
パッチクランプを使用した、架橋ソマトスタチンの生物活性保持の実証
得られたソマトスタチンアナログの活性に対して架橋修飾が有害な影響を有するか否かを試験するために、本発明者らは、ジブロモマレイミド架橋アナログ、PEG化ジブロモマレイミド架橋アナログ及びフルオレセインジブロモマレイミド架橋アナログを、パッチクランプアッセイによって試験した。HKIR3.1/3.2チャネル及びヒトソマトスタチンレセプター2を発現するHEK293細胞をこれらの化合物で処理し、ホールセルパッチクランプ電流記録を採取した。3つ全てのアナログが、ソマトスタチン自体と匹敵する振幅で、GIRK電流の強い活性化を誘導した。コントロールとして細胞を百日咳毒素又はGIRK阻害剤Tertiapin Qで処理したとき、電流は大きく阻害された。このデータにより、架橋ソマトスタチンアナログが、ソマトスタチンレセプター2のアゴニズムに関して、ソマトスタチンの生物活性を保持していることが確認される。
【0404】
細胞培養
細胞培養方法及び安定細胞株の生成は、J Biol Chem 275,921−9(2000)に記載のとおりに実施した。Kir3.1チャネル及びKir3.2Aチャネルを安定に発現するHEK293細胞(ヒト胚性腎細胞株)を、10%胎仔ウシ血清及び727μgのG418(Invitrogen)を補充した最小必須培地中で、加湿雰囲気(95%O2、5%CO2)中37℃で維持した。細胞を、落射蛍光を使用したトランスフェクト細胞の可視化のためのpEGFP−N1(Clontech)と共に、SSTR2 DNA(Missouri S&T cDNA Resource Center)で一過的にトランスフェクトした。トランスフェクションは、細胞培養培地(血清も抗生物質も含まない)97μl当たり、5μlのFugene HD(Roche)並びに800ngのSSTR2−DNA及び40ngのEGFP−DNAで実施した。
【0405】
パッチクランプ実験のためのソマトスタチン及びアナログの調製
架橋ソマトスタチンは上記のように調製した。ソマトスタチン及びそのアナログを、緩衝液(50mMリン酸ナトリウム、pH6.2)中で4℃で24時間透析して、有機溶媒を除去した。透析後、濃度を決定し、ペプチドを4℃で保存した。最終濃度20μMのソマトスタチン及びアナログを使用した(希釈は、細胞外パッチクランプ緩衝液中で行った)。
【0406】
電気生理学
ホールセルパッチクランプ電流記録を、フィラメント化ホウケイ酸ガラスキャピラリー(Harvard Apparatus、1.5mm ODx1.17mm ID)から引き出される3−4MΩの抵抗を有するファイアポリッシュピペットを使用して、Axopatch 200B増幅器(Axon Instruments)で実施した。データを取得し、Digidata 1322Aインターフェイス(Axon Instruments)及びpCLAMPソフトウェア(バージョン8.1、Axon Instruments)で分析した。速い灌流システムを使用して、ソマトスタチン及びアナログをアプライした(Rapid Solution Changer、RSC−160、Bio−Logic France)。細胞を−60mVでクランプした。細胞外溶液は以下であった(mM):NaCl 80、KCl 60、CaCl2 2、MgCl2 1、HEPES 10、NaH2PO4 0.33、グルコース 10、pH7.4;一方、細胞内溶液は以下であった(mM):グルコン酸K 110、KCl 20、NaCl 10、MgCl2 1、MgATP 2、EGTA 2 GTP 0.3、pH7.4。アゴニストの適用後、電流は、遅延「ラグ」とその後のピーク振幅への迅速な上昇「ピークまでの時間」で活性化した。アゴニストの除去後、電流は、減衰してベースラインに戻った。各細胞について、薬物適用の圧力から生じたフローアーチファクト(flow artifact)が存在するか否かを評価した。これは、記録の開始時に、排水管の1つからの浴溶液を適用することによって行った。GIRK電流の阻害剤Tertiapin(Alomone)を、最終濃度100nMで使用した。細胞を、Gi/oタンパク質の阻害剤である百日咳毒素(Sigma、100ng/ml)と共に一晩インキュベートした。薬物は濃ストック溶液として調製し、−20℃で維持した。
【0407】
結果を図11及び図12に示す。
【特許請求の範囲】
【請求項1】
チオール化合物中のチオール基を保護するための試薬としての、式(I)の部分を含む化合物の使用:
【化1】

式中、
X及びX’は、同じ又は異なって、それぞれ酸素、硫黄又は式=NR1の基を示し、R1は、水素、ヒドロキシル、C1−6アルキル又はフェニルであり、
Yは求電子性脱離基である。
【請求項2】
式(I)の部分を含む化合物が、式(Ia)の化合物である、請求項1に記載の使用:
【化2】

式中、
X及びX’は、同じ又は異なって、それぞれ酸素、硫黄又は式=NR1の基を示し、R1は、水素、ヒドロキシル、C1−6アルキル又はフェニルであり;
Yは求電子性脱離基であり;
R2は、水素原子又は基IGを示し;
以下のいずれかであり:
R3及びR3’は、同じ又は異なって、それぞれ水素原子又は基IGを示す;又は
R3及びR3’は一緒になって、式−N(R33’)の基を形成し、R33’は水素原子又は基IGを示す;又は
R3及びR3’は一緒になって、式−N(R33’)−N(R33’)−の基を形成し、各R33’は、同じ又は異なって、水素原子又は基IGを示す;
各基IGは、同じ又は異なって、非置換であるか又は1個以上のハロゲン原子で置換されている、C1−20アルキル基、C2−20アルケニル基又はC2−20アルキニル基である部分を示し、式中、(a)0、1又は2個の炭素原子は、C6−10アリーレン、5〜10員のヘテロアリーレン、C3−7カルボシクリレン及び5〜10員のヘテロシクリレン基から選択される基によって置換されており、かつ(b)0、1又は2個の−CH2−基は、−O−、−S−、−S−S−、−C(O)−、−NH−及び−N(C1−6アルキル)−基から選択される基によって置換されており、式中、
(i)該アリーレン、ヘテロアリーレン、カルボシクリレン及びヘテロシクリレン基は、非置換であるか又はハロゲン原子並びにC1−6アルキル、C1−6アルコキシ、C1−6アルキルチオール、−N(C1−6アルキル)(C1−6アルキル)及びニトロ基から選択される1個以上の置換基によって置換されており;
(ii)該カルボシクリレン及びヘテロシクリレン基中の0、1又は2個の炭素原子は、−C(O)−基によって置換されている。
【請求項3】
Yが、ハロゲン原子又はトリフレート、トシレート、メシレート、N−ヒドロキシスクシンイミジル、N−ヒドロキシスルホスクシンイミジル、C1−6アルキルチオール、5〜10員のヘテロシクリルチオール、C6−10アリールチオール、C3−7カルボシクリルチオール、−OC(O)CH3、−OC(O)CF3、フェニルオキシ、−NRxRyRz+若しくは−PRxRyRz+基であり、式中、Rx、Ry及びRzは、同じ又は異なって、水素原子並びにC1−6アルキル及びフェニル基から選択される、請求項1又は2に記載の使用。
【請求項4】
Yが、ハロゲン原子又はC1−6アルキルチオール、5〜10員のヘテロシクリルチオール、C6−10アリールチオール若しくはC3−7カルボシクリルチオール基である、請求項3に記載の使用。
【請求項5】
X及びX’がそれぞれ酸素を示す、請求項1〜4のいずれか1項に記載の使用。
【請求項6】
IGが、非置換のC1−6アルキル基、C2−6アルケニル基又はC2−6アルキニル基である部分を示し、式中、(a)0又は1個の炭素原子は、フェニレン、5〜6員のヘテロアリーレン、C5−6カルボシクリレン及び5〜6員のヘテロシクリレン基から選択される基によって置換されており、該フェニレン、ヘテロアリーレン、カルボシクリレン及びヘテロシクリレン基は、非置換であるか又はハロゲン原子並びにC1−4アルキル及びC1−4アルコキシ基から選択される1又は2個の置換基によって置換されており、かつ(b)0、1又は2個の−CH2−基は、−O−、−S−、−C(O)−、−NH−及び−N(C1−6アルキル)−基から選択される基によって置換されている、
請求項2〜5のいずれか1項に記載の使用。
【請求項7】
IGが、非置換のC1−6アルキル基である部分を示し、式中、(a)0又は1個の炭素原子は、非置換のフェニレン、5〜6員のヘテロアリーレン、C5−6カルボシクリレン及び5〜6員のヘテロシクリレン基から選択される基によって置換されており、かつ(b)0又は1個の−CH2−基は、−O−、−NH−及び−N(C1−6アルキル)−基から選択される基によって置換されている、
請求項6に記載の使用。
【請求項8】
IGが、非置換のC1−6アルキル又はフェニル基を示す、請求項6に記載の使用。
【請求項9】
R3、R3’及びR33’がそれぞれ基IGを示す、請求項2〜8のいずれか1項に記載の使用。
【請求項10】
式(Ia)の化合物が式(Ib)の化合物
【化3】

(式中、X、X’、Y、R2及びR33’は全て、請求項2〜9のいずれか1項に記載したとおりである)
である、請求項2〜9のいずれか1項に記載の使用。
【請求項11】
X及びX’がそれぞれ酸素原子を示し;
R33’が水素原子又はC1−6アルキル基を示し;
Yがハロゲン原子を示し;
R2が水素原子又はC1−6アルキル基を示す、
請求項10に記載の使用。
【請求項12】
チオール化合物が、システイン、又は少なくとも1個のシステイン残基を含むペプチド若しくはタンパク質である、請求項1〜11のいずれか1項に記載の使用。
【請求項13】
(i)請求項1又は12に記載のチオール化合物を、請求項1〜11のいずれか1項に記載の式(I)の部分を含む化合物と反応させて、保護されたチオール基を有する化合物を産生する工程;及び
(ii)その後、該保護されたチオール基を脱保護する工程、
を含む、プロセス。
【請求項14】
保護されたチオール基を脱保護する工程が、該保護されたチオール基を、コンジュゲート付加反応において求核剤として作用できる試薬と反応させることによってもたらされる、請求項13に記載のプロセス。
【請求項15】
試薬が、ホスフィン化合物又はチオールである、請求項14に記載のプロセス。
【請求項16】
試薬が、トリス(2−カルボキシエチル)ホスフィン、1,2−エタンジチオール、グルタチオン、2−メルカプトエタノール又はジチオスレイトールである、請求項15に記載のプロセス。
【請求項17】
式(II)の化合物:
【化4】

式中、
X、X’、R2、R3及びR3’は全て、請求項2〜11のいずれか1項に記載したとおりであり、Qは、カルボキシル基又は保護されたカルボキシル基であり、Q’は、アミン基又は保護されたアミン基であり;
ただし、式(II)の化合物は、14C−N−エチルマレイミド−S−システインでも14C−N−エチルマレイミド−S−N−アセチル−システインでもない。
【請求項18】
Qがカルボキシル基であり、Q’が保護されたアミン基である、請求項17に記載の化合物。
【請求項19】
ジスルフィド化合物中のジスルフィド基を保護するための試薬としての、式(III)の部分を含む化合物の使用:
【化5】

式中、
X及びX’は、同じ又は異なって、それぞれ酸素、硫黄又は式=NR1の基を示し、R1は、水素、ヒドロキシル、C1−6アルキル又はフェニルであり;
Y及びY’は、同じ又は異なって、それぞれ求電子性脱離基を示す。
【請求項20】
式(III)の部分を含む化合物が、式(IIIa)の化合物である、請求項19に記載の使用:
【化6】

式中、
X、X’、Y、R3及びR3’は全て、請求項2〜11のいずれか1項に記載したとおりであり、Y’はさらなる基Yであり、各基Yは同じ又は異なる。
【請求項21】
(i)ジスルフィド化合物中のジスルフィド基を、請求項19又は20に記載の式(III)の部分を含む化合物と反応させて、保護されたジスルフィド基を有する化合物を産生する工程;及び
(ii)その後、該保護されたジスルフィド基を脱保護する工程、
を含む、プロセス。
【請求項1】
チオール化合物中のチオール基を保護するための試薬としての、式(I)の部分を含む化合物の使用:
【化1】

式中、
X及びX’は、同じ又は異なって、それぞれ酸素、硫黄又は式=NR1の基を示し、R1は、水素、ヒドロキシル、C1−6アルキル又はフェニルであり、
Yは求電子性脱離基である。
【請求項2】
式(I)の部分を含む化合物が、式(Ia)の化合物である、請求項1に記載の使用:
【化2】

式中、
X及びX’は、同じ又は異なって、それぞれ酸素、硫黄又は式=NR1の基を示し、R1は、水素、ヒドロキシル、C1−6アルキル又はフェニルであり;
Yは求電子性脱離基であり;
R2は、水素原子又は基IGを示し;
以下のいずれかであり:
R3及びR3’は、同じ又は異なって、それぞれ水素原子又は基IGを示す;又は
R3及びR3’は一緒になって、式−N(R33’)の基を形成し、R33’は水素原子又は基IGを示す;又は
R3及びR3’は一緒になって、式−N(R33’)−N(R33’)−の基を形成し、各R33’は、同じ又は異なって、水素原子又は基IGを示す;
各基IGは、同じ又は異なって、非置換であるか又は1個以上のハロゲン原子で置換されている、C1−20アルキル基、C2−20アルケニル基又はC2−20アルキニル基である部分を示し、式中、(a)0、1又は2個の炭素原子は、C6−10アリーレン、5〜10員のヘテロアリーレン、C3−7カルボシクリレン及び5〜10員のヘテロシクリレン基から選択される基によって置換されており、かつ(b)0、1又は2個の−CH2−基は、−O−、−S−、−S−S−、−C(O)−、−NH−及び−N(C1−6アルキル)−基から選択される基によって置換されており、式中、
(i)該アリーレン、ヘテロアリーレン、カルボシクリレン及びヘテロシクリレン基は、非置換であるか又はハロゲン原子並びにC1−6アルキル、C1−6アルコキシ、C1−6アルキルチオール、−N(C1−6アルキル)(C1−6アルキル)及びニトロ基から選択される1個以上の置換基によって置換されており;
(ii)該カルボシクリレン及びヘテロシクリレン基中の0、1又は2個の炭素原子は、−C(O)−基によって置換されている。
【請求項3】
Yが、ハロゲン原子又はトリフレート、トシレート、メシレート、N−ヒドロキシスクシンイミジル、N−ヒドロキシスルホスクシンイミジル、C1−6アルキルチオール、5〜10員のヘテロシクリルチオール、C6−10アリールチオール、C3−7カルボシクリルチオール、−OC(O)CH3、−OC(O)CF3、フェニルオキシ、−NRxRyRz+若しくは−PRxRyRz+基であり、式中、Rx、Ry及びRzは、同じ又は異なって、水素原子並びにC1−6アルキル及びフェニル基から選択される、請求項1又は2に記載の使用。
【請求項4】
Yが、ハロゲン原子又はC1−6アルキルチオール、5〜10員のヘテロシクリルチオール、C6−10アリールチオール若しくはC3−7カルボシクリルチオール基である、請求項3に記載の使用。
【請求項5】
X及びX’がそれぞれ酸素を示す、請求項1〜4のいずれか1項に記載の使用。
【請求項6】
IGが、非置換のC1−6アルキル基、C2−6アルケニル基又はC2−6アルキニル基である部分を示し、式中、(a)0又は1個の炭素原子は、フェニレン、5〜6員のヘテロアリーレン、C5−6カルボシクリレン及び5〜6員のヘテロシクリレン基から選択される基によって置換されており、該フェニレン、ヘテロアリーレン、カルボシクリレン及びヘテロシクリレン基は、非置換であるか又はハロゲン原子並びにC1−4アルキル及びC1−4アルコキシ基から選択される1又は2個の置換基によって置換されており、かつ(b)0、1又は2個の−CH2−基は、−O−、−S−、−C(O)−、−NH−及び−N(C1−6アルキル)−基から選択される基によって置換されている、
請求項2〜5のいずれか1項に記載の使用。
【請求項7】
IGが、非置換のC1−6アルキル基である部分を示し、式中、(a)0又は1個の炭素原子は、非置換のフェニレン、5〜6員のヘテロアリーレン、C5−6カルボシクリレン及び5〜6員のヘテロシクリレン基から選択される基によって置換されており、かつ(b)0又は1個の−CH2−基は、−O−、−NH−及び−N(C1−6アルキル)−基から選択される基によって置換されている、
請求項6に記載の使用。
【請求項8】
IGが、非置換のC1−6アルキル又はフェニル基を示す、請求項6に記載の使用。
【請求項9】
R3、R3’及びR33’がそれぞれ基IGを示す、請求項2〜8のいずれか1項に記載の使用。
【請求項10】
式(Ia)の化合物が式(Ib)の化合物
【化3】

(式中、X、X’、Y、R2及びR33’は全て、請求項2〜9のいずれか1項に記載したとおりである)
である、請求項2〜9のいずれか1項に記載の使用。
【請求項11】
X及びX’がそれぞれ酸素原子を示し;
R33’が水素原子又はC1−6アルキル基を示し;
Yがハロゲン原子を示し;
R2が水素原子又はC1−6アルキル基を示す、
請求項10に記載の使用。
【請求項12】
チオール化合物が、システイン、又は少なくとも1個のシステイン残基を含むペプチド若しくはタンパク質である、請求項1〜11のいずれか1項に記載の使用。
【請求項13】
(i)請求項1又は12に記載のチオール化合物を、請求項1〜11のいずれか1項に記載の式(I)の部分を含む化合物と反応させて、保護されたチオール基を有する化合物を産生する工程;及び
(ii)その後、該保護されたチオール基を脱保護する工程、
を含む、プロセス。
【請求項14】
保護されたチオール基を脱保護する工程が、該保護されたチオール基を、コンジュゲート付加反応において求核剤として作用できる試薬と反応させることによってもたらされる、請求項13に記載のプロセス。
【請求項15】
試薬が、ホスフィン化合物又はチオールである、請求項14に記載のプロセス。
【請求項16】
試薬が、トリス(2−カルボキシエチル)ホスフィン、1,2−エタンジチオール、グルタチオン、2−メルカプトエタノール又はジチオスレイトールである、請求項15に記載のプロセス。
【請求項17】
式(II)の化合物:
【化4】

式中、
X、X’、R2、R3及びR3’は全て、請求項2〜11のいずれか1項に記載したとおりであり、Qは、カルボキシル基又は保護されたカルボキシル基であり、Q’は、アミン基又は保護されたアミン基であり;
ただし、式(II)の化合物は、14C−N−エチルマレイミド−S−システインでも14C−N−エチルマレイミド−S−N−アセチル−システインでもない。
【請求項18】
Qがカルボキシル基であり、Q’が保護されたアミン基である、請求項17に記載の化合物。
【請求項19】
ジスルフィド化合物中のジスルフィド基を保護するための試薬としての、式(III)の部分を含む化合物の使用:
【化5】

式中、
X及びX’は、同じ又は異なって、それぞれ酸素、硫黄又は式=NR1の基を示し、R1は、水素、ヒドロキシル、C1−6アルキル又はフェニルであり;
Y及びY’は、同じ又は異なって、それぞれ求電子性脱離基を示す。
【請求項20】
式(III)の部分を含む化合物が、式(IIIa)の化合物である、請求項19に記載の使用:
【化6】

式中、
X、X’、Y、R3及びR3’は全て、請求項2〜11のいずれか1項に記載したとおりであり、Y’はさらなる基Yであり、各基Yは同じ又は異なる。
【請求項21】
(i)ジスルフィド化合物中のジスルフィド基を、請求項19又は20に記載の式(III)の部分を含む化合物と反応させて、保護されたジスルフィド基を有する化合物を産生する工程;及び
(ii)その後、該保護されたジスルフィド基を脱保護する工程、
を含む、プロセス。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公表番号】特表2013−501765(P2013−501765A)
【公表日】平成25年1月17日(2013.1.17)
【国際特許分類】
【出願番号】特願2012−524273(P2012−524273)
【出願日】平成22年8月9日(2010.8.9)
【国際出願番号】PCT/GB2010/001500
【国際公開番号】WO2011/018612
【国際公開日】平成23年2月17日(2011.2.17)
【出願人】(506417186)ユーシーエル ビジネス パブリック リミテッド カンパニー (14)
【Fターム(参考)】
【公表日】平成25年1月17日(2013.1.17)
【国際特許分類】
【出願日】平成22年8月9日(2010.8.9)
【国際出願番号】PCT/GB2010/001500
【国際公開番号】WO2011/018612
【国際公開日】平成23年2月17日(2011.2.17)
【出願人】(506417186)ユーシーエル ビジネス パブリック リミテッド カンパニー (14)
【Fターム(参考)】
[ Back to top ]

