チオール化合物高生産微生物
【課題】L-システインとグルタチオンをともに高率に生産しうる生産株、および該生産株を用いて、L-システインあるいはグルタチオンを高効率で生産する方法の提供。
【解決手段】L-システイン合成系として、L-アスパラギン酸からL-システインに至る合成経路を有する微生物に、さらにL-セリンからL-システインに至るL-システイン合成系遺伝子群を導入する、L-システインあるいはグルタチオンを高効率で生産する方法。
【解決手段】L-システイン合成系として、L-アスパラギン酸からL-システインに至る合成経路を有する微生物に、さらにL-セリンからL-システインに至るL-システイン合成系遺伝子群を導入する、L-システインあるいはグルタチオンを高効率で生産する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、医薬品などの用途に用いられるL-システイン及びグルタチオンなどのチオール化合物の高生産株、及び該生産株を用いた該チオール化合物の生産方法に関するものである。
【背景技術】
【0002】
酵母菌体内の代表的な含硫化合物として、L-システインやグルタチオンがあげられる。L-システインは天然アミノ酸としてタンパク質の構成成分となるほか、医薬品や化粧品の原料として利用される。またグルタチオンは肝機能回復、抗酸化活性などを有するきわめて有用な物質であり、近年、調味料、健康食品への添加、化粧品の基材としての利用など、幅広い用途が期待されている。
【0003】
L-システインやグルタチオン等を高生産する酵母の先行技術として、これまでに多くの技術が開示されている。例えばグルタチオン生成に関係するアミノ酸を添加することによるグルタチオン製造法(特許文献1〜7参照)などがある。しかしながら、これらの方法はグルタチオンの生産量の点で満足のいくものではない。また、突然変異株取得によるグルタチオン製造法(特許文献8〜16参照)などがある。さらに、遺伝子操作を利用した微生物によるグルタチオン製造法がある(特許文献17〜21参照)。これらは、グルタチオン合成能を向上させてはいるが、グルタチオン合成に必要でかつ律速となるL-システインの供給が十分に改良されておらず、グルタチオン高生産には同アミノ酸添加が必要と考えられる。
【0004】
また(特許文献22参照)においては、γ-グルタミルシステイン合成酵素遺伝子を導入した酵母に変異処理を行ない、アザセリン耐性株を取得することで、律速となるL-システインの菌体内合成系を強化したグルタチオン高含有株を取得する技術が開示されている。しかしこの技術では、セリン合成能が強化された酵母株の取得は可能なものの、酵母細胞におけるL-システイン合成系はそのままである。従って、酵母細胞内でL-セリンを高生産した際にL-システイン量が増加するのは、間接的な影響と考えられる。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特公昭47-26314
【特許文献2】特開昭53-94089
【特許文献3】特公昭54-997
【特許文献4】特開昭48-44487
【特許文献5】特開昭51-36357
【特許文献6】特開2003-102468
【特許文献7】特開2009-17849
【特許文献8】特公昭56-46826
【特許文献9】特開昭48-61689
【特許文献10】特公昭53-31956
【特許文献11】特開昭61-209583
【特許文献12】特開2004-180509
【特許文献13】特開2006-42637
【特許文献14】特開2006-42638
【特許文献15】特開2010-29147
【特許文献16】特開2010-29148
【特許文献17】特開昭58-20188
【特許文献18】特開昭58-20196
【特許文献19】特開昭61-52299
【特許文献20】特開昭62-275685
【特許文献21】特開昭64-51098
【特許文献22】特開平6-70752
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明の課題は、上記従来技術の問題点を解消するため、L-システインとグルタチオンをともに高率に生産しうる生産株を新たに開発し、該生産株を用いて、L-システインあるいはグルタチオンを高効率で生産する点にある。
【課題を解決するための手段】
【0007】
本発明者らは上記課題を解決するために鋭意検討を行った結果、L-システイン合成系として、L-アスパラギン酸からL-システインに至る合成経路を有する微生物に、さらにL-セリンからL-システインに至るL-システイン合成系遺伝子群を導入することにより、L-システインとグルタチオンの収率が顕著に増大することを見いだした。さらに、そればかりでなく、全く意外にも、上記遺伝子導入により、L-ヒスチジン、L-アルギニン及びL-セリンの生産も増大するという知見も得て、本発明を完成するに至った。
すなわち本発明は以下のとおりである。
【0008】
(1)L-アスパラギン酸からL-システインに至るL-システイン合成系を保有している微生物、あるいは該L-システイン合成系遺伝子中、L-ホモシステインからL-システインに至る合成系に関与する遺伝子のうち少なくとも一の遺伝子が欠損している微生物に、さらにL-セリンからL-システインに至るL-システイン合成系遺伝子群が導入されていることを特徴とする、遺伝子導入変異株。
(2)微生物が、真菌類に属する微生物であることを特徴とする、上記(1)に記載の遺伝子導入変異株。
(3)微生物が酵母であることを特徴とする上記(2)に記載の遺伝子導入変異株。
(4)L-セリンからL-システインに至るL-システイン合成系遺伝子がセリンアセチルトランスフェラーゼ遺伝子及びO-アセチル-L-セリンスルフヒドラーゼ遺伝子に属する遺伝子であることを特徴とする、上記(1)〜(4)に記載の遺伝子導入変異株。
(5)L-セリンからL-システインに至るL-システイン合成系遺伝子が原核生物、古細菌、あるいは植物由来の遺伝子であることを特徴とする、上記(1)〜(4)に記載の遺伝子導入変異株。
(6)L-セリンからL-システインに至るL-システイン合成系遺伝子が大腸菌由来の遺伝子であることを特徴とする上記(5)に記載の遺伝子導入変異株。
(7)L-セリンからL-システインに至るL-システイン合成系遺伝子がcysEと、cysk及び/またはcysMとであることを特徴とする、上記(6)に記載の遺伝子導入変異株。
(8)上記(1)〜(7)のいずれかに記載の遺伝子導入変異株をL-メチオニン非含有培地で培養し、得られた菌体または該菌体を含む培養物からL-システイン及び/またはグルタチオンを採取することを特徴とする、L-システイン及び/またはグルタチオンの製造方法。
(9)上記(8)に記載の菌体または該菌体を含む培養物から、さらに、L-ヒスチジン、L-アルギニン及びL-セリンのいずれか一種以上を採取することを特徴とする、上記(8)に記載の製造方法。
【発明の効果】
【0009】
本発明の新規遺伝子導入変異株は菌体内にL-システインやグルタチオンを高濃度で含有することが可能であり、メチオニンを除くアミノ酸、無機塩、ビタミン、グルコースなどの炭素源を含む培地を用いて本発明の該変異株を培養することで、L-システインやグルタチオンを極めて高収率で生産できる。本発明の導入遺伝子は、L-セリンからL-システインに至るL-システイン合成系遺伝子であり、このようなL-システイン合成系においては、L-システインが、上記システイン合成系中のセリン-O-アセチルトランスフェラーゼに対し強力なフィードバック阻害を起こすことが知られている。したがって、このようなL-システイン合成系遺伝子を導入しても、L-システインあるいはこれから合成されるグルタチオンの産生量は、ほとんど向上しないことが予想される。
【0010】
これにもかかわらず、実際にL-アスパラギン酸からL-システインに至るL-システイン合成系を保有する微生物あるいはその一部欠損株を宿主として、上記L-セリンからL-システインに至るL-システイン合成系遺伝子を導入したところ、L-システインやグルタチオンの産生量が顕著に増大することが明らかとなった。L-システインによるフィードバック阻害は、L-アスパラギン酸からL-システインに至るL-システイン合成系においても同様に起こっているのであるから、本発明の遺伝子導入変異株によるL-システインやグルタチオンの産生量増大効果は予想ができないものである。
また併せて、L-ヒスチジン、L-アルギニン及びL-セリンの産生も向上するという驚くべき効果を奏しており、本発明の遺伝子導入変異株は、L-システインやグルタチオン等の有用アミノ酸の効率的生産にとって有力な手段になりうる。
【図面の簡単な説明】
【0011】
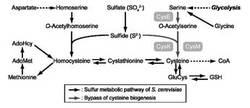
【図1】SAT遺伝子とOASS遺伝子を酵母に導入することで形成される、新たなシステイン合成経路を示す図である。
【図2】CYS3欠損株にSAT遺伝子とOASS遺伝子を導入した株をシステイン含有及び非含有培地に画線し、30℃で2日間培養した結果を示す図である。
【発明を実施するための形態】
【0012】
以下、本発明を詳細に説明する。
本発明は、L-アスパラギン酸からL-システインに至るL-システイン合成系を保有する微生物に、さらにL-セリンからL-システインに至るL-システイン合成系遺伝子を導入した遺伝子導入変異株に関する。
本発明の遺伝子導入株は、L-システインとそれから合成されるグルタチオン(L-システイン含有ペプチド)を高収率で生産する。
【0013】
L-アスパラギン酸からL-システインに至るL-システイン合成系は、L-アスパラギン酸を出発化合物として、数段階のステップでホモセリンが合成され、このホモセリンがアセチル化されO-アセチルホモセリンが合成され、さらに、L-ホモシステイン、シスタチオニンを順次経てL-システインが合成される系である。上記合成系の酵素として、O-アセチルホモセリンとスルフィドからL-ホモシステイン合成を触媒する酵素としてO-アセチルホモセリンスルフヒドリラーゼが、L-ホモシステインからシスタチオニンの合成を触媒する酵素としてシスタチオニン-β-シンターゼが、シスタチオニンからL-システインの合成を触媒する酵素として、シスタチオニン-γ-リアーゼが挙げられる。このように合成されたL-システインから、その後、数段階のステップを経てグルタチオンが合成される。
このような合成系の遺伝子を保有している微生物としては、サッカロミセス属やカンジダ属等に属する酵母、またはアスペルギルス属を始めとするカビ等が挙げられる。
【0014】
本願発明においては、上記L-システイン合成系中、L-ホモシステインからL-システインに至る合成系に関与する遺伝子として少なくとも1の遺伝子を欠損させた微生物も好ましく用いられる。
上記L-システイン合成系遺伝子を保有する微生物及び上記その一部欠損株にL-セリンからL-システインに至るL-システイン合成系遺伝子を導入した場合、いずれの場合においても、L-システイン及びグルタチオンの生産能は顕著に増大するが、特に前者の場合は、グルタチオン生産能の向上が著しく、後者の場合は特にL-システインの生産能が向上する。ヒスチジン、アルギニン、セリンの生産能は、後者の方が高いものの、両者とも生産能が向上している。
【0015】
一方、L-アスパラギン酸からL-システインに至るL-システイン合成系を保有する微生物あるいはその一部を欠損した株に導入する合成系遺伝子は、L-セリンからL-システインに至るL-システイン合成系遺伝子である。このL-システイン合成系はL-セリンを出発物質として、O-アセチルセリンを経てL-システインが合成される系であり、この合成系酵素としては、L-セリンからO-アセチルセリンの合成を触媒する酵素として、セリン-O-アセチルトランスフェラーゼ(SAT)が、O-アセチルセリンとスルフィドからL-システインを合成する触媒として、O-アセチル-L-セリンスルフヒドリラーゼ(OASS)が、それぞれ関与している。
【0016】
これら酵素は、例えば、大腸菌、サルモネラ属菌、シュードモナス属菌等の原核生物、シロイヌナズナ、イネ等の植物、あるいはピロコッカス属菌、メタノコッカス属菌等の古細菌に広く分布している。本発明の導入遺伝子は、これら酵素をコードする遺伝子である。
本発明においては、上記導入するSAT遺伝子あるいはOASS遺伝子としてアイソザイムの関係にある遺伝子を、それぞれ2種以上用いてもよく、またその遺伝子の由来を変更してもよい。
例えば、大腸菌の場合、OASS遺伝子に属する遺伝子としてcysK遺伝子とcysM遺伝子があり、OASS遺伝子としてその両方を用いてもよく、その一方のみを用いてもよい。さらに、この場合、SAT遺伝子として、大腸菌以外の遺伝子を用いてもよい。
【0017】
本発明においては、上記L-アスパラギン酸からL-システインに至るL-システイン合成系を有する微生物あるいはその一部欠損株を宿主細胞として、上記遺伝子をベクターに連結して導入するが、この導入法自体周知の方法が用いられ、例えば、酢酸リチウム法、エレクトロポレーション法、プロトプラスト法等が用いられる。
例えば使用するベクターとして、宿主微生物がサッカロミセス セレビシエ(Saccharomyces cerevisiae)の場合はYEp351GAPIIやYEp352GAPIIを用い、ピキア パストリス(Pichia pastoris)の場合はpGAPZやpFLDを用いる。SATとOASSそれぞれの遺伝子は、それぞれ異なるベクターにクローニングし、両ベクターを同時に宿主へ導入してもよいが、プロモーターとSAT遺伝子及びプロモーターとOASS遺伝子を併せ持つ、一つのベクターを宿主に導入してもよい。
【0018】
このようにして得られた、L-セリンからL-システインに至るL-システイン合成系遺伝子が導入された本発明の遺伝子導入変異株は、L-システイン、グルタチオン、並びにL-ヒスチジン、L-アルギニン及びL-セリンは菌体中に蓄積される。したがって、培養後の菌体あるいは該菌体を含む培養物から、例えば物理的破壊や煮沸等のそれ自体周知の方法で、L-システイン及びグルタチオン、さらにL-ヒスチジン、L-アルギニン及びL-セリンを採取することができる。
以下、本発明の実施例を示すが、本発明はこれら実施例に限定されるものではない。
【実施例】
【0019】
[実施例1]SAT遺伝子及びOASS遺伝子のクローニング
酵母にL-セリンからL-システインの合成系を導入するために、SATとOASSをコードする遺伝子のクローニングを行った。生命システム情報統合データベース(KEGG,http://www.kegg.jp/)に記載されている情報に基づき、SATをコードする遺伝子として大腸菌のcysEを、OASSをコードする遺伝子として大腸菌のcysKおよびcysMを選択し、各遺伝子をPCR法により増幅して単離した。具体的には、大腸菌のDH5a株の染色体DNAを調製し鋳型として使用した。cysEを増幅するためのプライマーとして、
5’-GCGCGAGCTCATGTCGTGTGAAGAACTGGA-3’(EcCysE-f;配列番号1)と
5’-GCGCGTCGACTTAGATCCCATCCCCATACT-3’(EcCysE-r;配列番号2)を使用した。増幅された842 bpのDNA断片はSacIとSalIで消化し、同様に消化したベクター(YEp351GAPII)に導入することで、YEp351GAPII-cysEを得た。cysKを増幅するためのプライマーとして、5’-CGGAATTCATGAGTAAGATTTTTGAAGATAAC-3’(EcCysK-f;配列番号3)と
5’-GCGCGTCGACTTACTGTTGCAATTCTTTCTC-3’(EcCysK-r配列番号4)を使用した。
【0020】
増幅された990 bpのDNA断片はEcoRIとSalIで消化し、同様に消化したベクター(YEp352GAPII)に導入することで、YEp352GAPII-cysKを得た。cysMを増幅するためのプライマーとして、5’-CGGAATTCATGAGTACATTAGAACAAACAATAG-3’(EcCysM-f;配列番号5)と
5’-GCGCGTCGACTTAAATCCCCGCCCCCTG-3’(EcCysM-r;配列番号6)を使用した。増幅された930 bpのDNA断片は、EcoRIとSalIで消化し、同様に消化したベクター(YEp352GAPII)に導入することで、YEp352GAPII-cysMを得た。
【0021】
[実施例2]L-システイン合成能欠損株の作製
酵母のL-システイン合成系を欠損させるために、シスタチオニン-γ-リアーゼをコードするCYS3遺伝子の欠損株の作製を行った。具体的には選択マーカー遺伝子による置換破壊を行うべく、出芽酵母のゲノムデータベース(http://www.yeastgenome.org/)に記載されている情報に基づき、酵母染色体上のCYS3遺伝子の上流50 bpを含むプライマー、
5’-TAGACATTTGCACCTTATACATATACACACAAGACAAAACCAAAAAAAATCGGATCCCCGGGTTAATTAA-3’(配列番号7)と、
下流50 bpを含むプライマー、
5’-TTATCGTACTTAAAAAGGTCCGGTCGAAGGCAGAGACGTGGCACTGGCGAGAATTCGAGCTCGTTTAAAC-3’(配列番号8)を使用した。
【0022】
シゾサッカロミセス ポンベ(Schizosaccharomyces pombe)のhis5+遺伝子を含むDNA断片を、これを含むベクター(pFA6a-His3MX)を鋳型にPCR法で増幅した。酵母への遺伝子導入は酢酸リチウム法を用いた。即ち、サッカロミセス セレビシエ(Saccharomyces cerevisiae)のW303-1A株を酢酸リチウム、PEG3350、サケ精子DNAを含む溶液に懸濁し、これにPCRで増幅した1056 bpの断片を加え、30℃で30分、42℃で20分間静置させることでDNAに接触させた。その後、菌体懸濁液から遠心により上清を除去し、滅菌水に再懸濁後システインを含むがヒスチジンを含まない寒天培地に塗布し、形質転換体を30℃で3日間培養し選抜した。
【0023】
得られた形質転換体のCYS3遺伝子が欠損していることは、形質転換体の染色体を鋳型としたPCR法により、CYS3欠損株が特異的に保持するDNA領域を増幅させることで行った。具体的には、CYS3遺伝子座の上流配列に相補的なプライマー(5’-GTGATCTCAGCCAGTTGTG-3’)(配列番号9)と、
導入したDNA配列特異的なプライマー(5’-GCGGCCATCAAAATGTATGGAT-3’)(配列番号10)を使用してPCR反応を行い、反応産物のアガロースゲル電気泳動を行った。これによって、CYS3欠損株特異的に増幅する416 bpのDNA断片が確認されたことから、形質転換体のCYS3遺伝子は選択マーカーと置換されて欠損していることが確認された。
【0024】
[実施例3]SAT遺伝子及びOASS遺伝子が導入された酵母の育種
SAT遺伝子及びOASS遺伝子を発現するベクターの酵母への導入は、実施例2と同様に酢酸リチウム法により行った。即ち、YEp351GAPIIとYEp351GAPII-cysEの2種類のベクターと、YEp352GAPII、YEp352GAPII-cysK、YEp352GAPII-cysMの3種類のベクターの組み合わせを網羅した、ベクター混合溶液を野生型酵母株(W303-1A)に接触させ、選択培地であるロイシンとウラシルを含まない寒天培地に塗布した。CYS3欠損株(cys3Δ)にも同様の組み合わせでベクターと接触させ、ヒスチジン、ロイシン、ウラシルを含まないがシステインを含む寒天培地に塗布した。その後30℃で3日間培養して、形質転換体を選抜した。
【0025】
大腸菌のSAT及びOASSタンパク質が酵母細胞内で機能的に発現していることを確認するために、システイン要求性を示すcys3Δ株にYEp351GAPII-cysEとYEp352GAPII-cysKを導入した株(TKY4175)、またはYEp351GAPII-cysEとYEp352GAPII-cysM(TKY4176)株のシステイン要求性を調べた。具体的には、TKY4175やTKY4176株、加えて対照株であるYEp351GAPIIとYEp352GAPIIを保持する株(TKY4170)、YEp351GAPIIとYEp352GAPII-cysKを保持する株(TKY4171)、YEp351GAPIIとYEp352GAPII-cysMを保持する株(TKY4172)、YEp351GAPII-cysEとYEp352GAPIIを保持する株(TKY4174)を、ヒスチジン、ロイシン、メチオニン、ウラシル、システインを含まない寒天培地に画線し、30℃で2日間培養した。L-セリンからL-システインの合成系が不完全なTKY4170、TKY4171、TKY4172、TKY4174株は生育しなかったが、SAT及びOASS遺伝子を導入したTKY4175とTKY4176株はシステイン非存在下でも生育できたことから、これら株において大腸菌のSAT及びOASSは機能的に発現していることが確認された。
【0026】
[実施例4]細胞内アミノ酸及びグルタチオンの定量
実施例3で作製したSAT遺伝子及びOASS遺伝子が導入された酵母株の細胞内アミノ酸及びグルタチオンの定量を行った。具体的には、ロイシン、ウラシル、メチオニンを除いた50mlの液体培地に各酵母株を植菌した。菌体の600nmにおける吸光度が0.8から1.0になるまで30℃で震盪培養し、その後培養液を遠心することで酵母細胞を回収した。回収した細胞は、あらかじめ氷上で冷却した新鮮な培地に懸濁し、再度遠心した後に上清を除去することで細胞を洗浄した。この操作は3回繰り返した。回収した細胞の湿重量を秤量した後、5%スルホサリチル酸とガラスビーズを加え、細胞破砕装置(FastPrep)を用いて酵母細胞を破砕し、遠心により不溶物を除いて上清を回収した。この破砕上清は細胞内のアミノ酸及びグルタチオンを含む溶液として、以下に示すアミノ酸及びグルタチオンの定量解析に供した。
【0027】
細胞内のシステインやグルタチオンは、4-フルオロ-7-スルホベンゾフラザン(4-Fluoro-7-sulfobenzofurazan;SBD-F)化することで定量化した。即ち、100μlの細胞抽出液を8μlの5N水酸化ナトリウムで中和し、さらに12μlの12.5mMエチレンジアミン四酢酸-二ナトリウムと、10mg/mlになるように0.5Mホウ酸ナトリウム緩衝液(pH9.5)に溶解したSBD-Fを30μl加え、60℃で1時間静置することでラベル化反応を行った。反応後の試料は氷上で冷却し、さらに150μlの0.1N塩酸を加えることでラベル化反応を停止させた。ラベル化された試料の一部は、逆相カラムを用いた高速液体クロマトグラフィーに供し、SBD-F化されたシステインとグルタチオンを分離し、その蛍光強度を測定することで定量化した。細胞抽出液に含まれるチオール化合物の定量化は、上記と同様の方法でラベル化した市販のL-システイン及びグルタチオンの溶出時間及びピークの高さに基づき行った。
【0028】
細胞内の各種アミノ酸は、4-フルオロ-7-ニトロベンゾフラザン(4-Fluoro-7-nitrobenzofurazan;NBD-F)化することで定量化した。即ち、3μlの細胞抽出液に75μlの蒸留水、12μlの12.5mMエチレンジアミン四酢酸-二ナトリウム、30μlのホウ酸ナトリウム緩衝液(pH8.5)、さらに10mg/mlになるようにアセトニトリルで溶解したNBD-Fを30μl加え、60℃で3分間静置することでラベル化反応を行った。反応後の試料は氷上で冷却し、さらに150μlの0.1N塩酸を加えることでラベル化反応を停止させた。ラベル化反応後の試料は、逆相クロマトグラフィーにより分離し、各NBD-F化アミノ酸の蛍光強度を測定した。同様の方法でラベル化した市販のアミノ酸は標準品として使用し、細胞抽出液に含まれるアミノ酸を定量化した。対照株(TKY3030)における各種化合物量を1として算出し、実施例3で作製した株におけるチオール化合物量は表1に、アミノ酸量は表2に示す。
【0029】
その結果、対照株(TKY3030)に対し、SAT遺伝子及びOASS遺伝子が導入された酵母株では、L-システインが1.8〜2.6倍、グルタチオンが1.3〜3.2倍、L-ヒスチジンが1.4〜1.9倍、L-アルギニンが2.3〜2.8倍、L-セリンが1.5〜2.3倍に増加していることが明らかとなった。
【表1】

【表2】

【技術分野】
【0001】
本発明は、医薬品などの用途に用いられるL-システイン及びグルタチオンなどのチオール化合物の高生産株、及び該生産株を用いた該チオール化合物の生産方法に関するものである。
【背景技術】
【0002】
酵母菌体内の代表的な含硫化合物として、L-システインやグルタチオンがあげられる。L-システインは天然アミノ酸としてタンパク質の構成成分となるほか、医薬品や化粧品の原料として利用される。またグルタチオンは肝機能回復、抗酸化活性などを有するきわめて有用な物質であり、近年、調味料、健康食品への添加、化粧品の基材としての利用など、幅広い用途が期待されている。
【0003】
L-システインやグルタチオン等を高生産する酵母の先行技術として、これまでに多くの技術が開示されている。例えばグルタチオン生成に関係するアミノ酸を添加することによるグルタチオン製造法(特許文献1〜7参照)などがある。しかしながら、これらの方法はグルタチオンの生産量の点で満足のいくものではない。また、突然変異株取得によるグルタチオン製造法(特許文献8〜16参照)などがある。さらに、遺伝子操作を利用した微生物によるグルタチオン製造法がある(特許文献17〜21参照)。これらは、グルタチオン合成能を向上させてはいるが、グルタチオン合成に必要でかつ律速となるL-システインの供給が十分に改良されておらず、グルタチオン高生産には同アミノ酸添加が必要と考えられる。
【0004】
また(特許文献22参照)においては、γ-グルタミルシステイン合成酵素遺伝子を導入した酵母に変異処理を行ない、アザセリン耐性株を取得することで、律速となるL-システインの菌体内合成系を強化したグルタチオン高含有株を取得する技術が開示されている。しかしこの技術では、セリン合成能が強化された酵母株の取得は可能なものの、酵母細胞におけるL-システイン合成系はそのままである。従って、酵母細胞内でL-セリンを高生産した際にL-システイン量が増加するのは、間接的な影響と考えられる。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特公昭47-26314
【特許文献2】特開昭53-94089
【特許文献3】特公昭54-997
【特許文献4】特開昭48-44487
【特許文献5】特開昭51-36357
【特許文献6】特開2003-102468
【特許文献7】特開2009-17849
【特許文献8】特公昭56-46826
【特許文献9】特開昭48-61689
【特許文献10】特公昭53-31956
【特許文献11】特開昭61-209583
【特許文献12】特開2004-180509
【特許文献13】特開2006-42637
【特許文献14】特開2006-42638
【特許文献15】特開2010-29147
【特許文献16】特開2010-29148
【特許文献17】特開昭58-20188
【特許文献18】特開昭58-20196
【特許文献19】特開昭61-52299
【特許文献20】特開昭62-275685
【特許文献21】特開昭64-51098
【特許文献22】特開平6-70752
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明の課題は、上記従来技術の問題点を解消するため、L-システインとグルタチオンをともに高率に生産しうる生産株を新たに開発し、該生産株を用いて、L-システインあるいはグルタチオンを高効率で生産する点にある。
【課題を解決するための手段】
【0007】
本発明者らは上記課題を解決するために鋭意検討を行った結果、L-システイン合成系として、L-アスパラギン酸からL-システインに至る合成経路を有する微生物に、さらにL-セリンからL-システインに至るL-システイン合成系遺伝子群を導入することにより、L-システインとグルタチオンの収率が顕著に増大することを見いだした。さらに、そればかりでなく、全く意外にも、上記遺伝子導入により、L-ヒスチジン、L-アルギニン及びL-セリンの生産も増大するという知見も得て、本発明を完成するに至った。
すなわち本発明は以下のとおりである。
【0008】
(1)L-アスパラギン酸からL-システインに至るL-システイン合成系を保有している微生物、あるいは該L-システイン合成系遺伝子中、L-ホモシステインからL-システインに至る合成系に関与する遺伝子のうち少なくとも一の遺伝子が欠損している微生物に、さらにL-セリンからL-システインに至るL-システイン合成系遺伝子群が導入されていることを特徴とする、遺伝子導入変異株。
(2)微生物が、真菌類に属する微生物であることを特徴とする、上記(1)に記載の遺伝子導入変異株。
(3)微生物が酵母であることを特徴とする上記(2)に記載の遺伝子導入変異株。
(4)L-セリンからL-システインに至るL-システイン合成系遺伝子がセリンアセチルトランスフェラーゼ遺伝子及びO-アセチル-L-セリンスルフヒドラーゼ遺伝子に属する遺伝子であることを特徴とする、上記(1)〜(4)に記載の遺伝子導入変異株。
(5)L-セリンからL-システインに至るL-システイン合成系遺伝子が原核生物、古細菌、あるいは植物由来の遺伝子であることを特徴とする、上記(1)〜(4)に記載の遺伝子導入変異株。
(6)L-セリンからL-システインに至るL-システイン合成系遺伝子が大腸菌由来の遺伝子であることを特徴とする上記(5)に記載の遺伝子導入変異株。
(7)L-セリンからL-システインに至るL-システイン合成系遺伝子がcysEと、cysk及び/またはcysMとであることを特徴とする、上記(6)に記載の遺伝子導入変異株。
(8)上記(1)〜(7)のいずれかに記載の遺伝子導入変異株をL-メチオニン非含有培地で培養し、得られた菌体または該菌体を含む培養物からL-システイン及び/またはグルタチオンを採取することを特徴とする、L-システイン及び/またはグルタチオンの製造方法。
(9)上記(8)に記載の菌体または該菌体を含む培養物から、さらに、L-ヒスチジン、L-アルギニン及びL-セリンのいずれか一種以上を採取することを特徴とする、上記(8)に記載の製造方法。
【発明の効果】
【0009】
本発明の新規遺伝子導入変異株は菌体内にL-システインやグルタチオンを高濃度で含有することが可能であり、メチオニンを除くアミノ酸、無機塩、ビタミン、グルコースなどの炭素源を含む培地を用いて本発明の該変異株を培養することで、L-システインやグルタチオンを極めて高収率で生産できる。本発明の導入遺伝子は、L-セリンからL-システインに至るL-システイン合成系遺伝子であり、このようなL-システイン合成系においては、L-システインが、上記システイン合成系中のセリン-O-アセチルトランスフェラーゼに対し強力なフィードバック阻害を起こすことが知られている。したがって、このようなL-システイン合成系遺伝子を導入しても、L-システインあるいはこれから合成されるグルタチオンの産生量は、ほとんど向上しないことが予想される。
【0010】
これにもかかわらず、実際にL-アスパラギン酸からL-システインに至るL-システイン合成系を保有する微生物あるいはその一部欠損株を宿主として、上記L-セリンからL-システインに至るL-システイン合成系遺伝子を導入したところ、L-システインやグルタチオンの産生量が顕著に増大することが明らかとなった。L-システインによるフィードバック阻害は、L-アスパラギン酸からL-システインに至るL-システイン合成系においても同様に起こっているのであるから、本発明の遺伝子導入変異株によるL-システインやグルタチオンの産生量増大効果は予想ができないものである。
また併せて、L-ヒスチジン、L-アルギニン及びL-セリンの産生も向上するという驚くべき効果を奏しており、本発明の遺伝子導入変異株は、L-システインやグルタチオン等の有用アミノ酸の効率的生産にとって有力な手段になりうる。
【図面の簡単な説明】
【0011】
【図1】SAT遺伝子とOASS遺伝子を酵母に導入することで形成される、新たなシステイン合成経路を示す図である。
【図2】CYS3欠損株にSAT遺伝子とOASS遺伝子を導入した株をシステイン含有及び非含有培地に画線し、30℃で2日間培養した結果を示す図である。
【発明を実施するための形態】
【0012】
以下、本発明を詳細に説明する。
本発明は、L-アスパラギン酸からL-システインに至るL-システイン合成系を保有する微生物に、さらにL-セリンからL-システインに至るL-システイン合成系遺伝子を導入した遺伝子導入変異株に関する。
本発明の遺伝子導入株は、L-システインとそれから合成されるグルタチオン(L-システイン含有ペプチド)を高収率で生産する。
【0013】
L-アスパラギン酸からL-システインに至るL-システイン合成系は、L-アスパラギン酸を出発化合物として、数段階のステップでホモセリンが合成され、このホモセリンがアセチル化されO-アセチルホモセリンが合成され、さらに、L-ホモシステイン、シスタチオニンを順次経てL-システインが合成される系である。上記合成系の酵素として、O-アセチルホモセリンとスルフィドからL-ホモシステイン合成を触媒する酵素としてO-アセチルホモセリンスルフヒドリラーゼが、L-ホモシステインからシスタチオニンの合成を触媒する酵素としてシスタチオニン-β-シンターゼが、シスタチオニンからL-システインの合成を触媒する酵素として、シスタチオニン-γ-リアーゼが挙げられる。このように合成されたL-システインから、その後、数段階のステップを経てグルタチオンが合成される。
このような合成系の遺伝子を保有している微生物としては、サッカロミセス属やカンジダ属等に属する酵母、またはアスペルギルス属を始めとするカビ等が挙げられる。
【0014】
本願発明においては、上記L-システイン合成系中、L-ホモシステインからL-システインに至る合成系に関与する遺伝子として少なくとも1の遺伝子を欠損させた微生物も好ましく用いられる。
上記L-システイン合成系遺伝子を保有する微生物及び上記その一部欠損株にL-セリンからL-システインに至るL-システイン合成系遺伝子を導入した場合、いずれの場合においても、L-システイン及びグルタチオンの生産能は顕著に増大するが、特に前者の場合は、グルタチオン生産能の向上が著しく、後者の場合は特にL-システインの生産能が向上する。ヒスチジン、アルギニン、セリンの生産能は、後者の方が高いものの、両者とも生産能が向上している。
【0015】
一方、L-アスパラギン酸からL-システインに至るL-システイン合成系を保有する微生物あるいはその一部を欠損した株に導入する合成系遺伝子は、L-セリンからL-システインに至るL-システイン合成系遺伝子である。このL-システイン合成系はL-セリンを出発物質として、O-アセチルセリンを経てL-システインが合成される系であり、この合成系酵素としては、L-セリンからO-アセチルセリンの合成を触媒する酵素として、セリン-O-アセチルトランスフェラーゼ(SAT)が、O-アセチルセリンとスルフィドからL-システインを合成する触媒として、O-アセチル-L-セリンスルフヒドリラーゼ(OASS)が、それぞれ関与している。
【0016】
これら酵素は、例えば、大腸菌、サルモネラ属菌、シュードモナス属菌等の原核生物、シロイヌナズナ、イネ等の植物、あるいはピロコッカス属菌、メタノコッカス属菌等の古細菌に広く分布している。本発明の導入遺伝子は、これら酵素をコードする遺伝子である。
本発明においては、上記導入するSAT遺伝子あるいはOASS遺伝子としてアイソザイムの関係にある遺伝子を、それぞれ2種以上用いてもよく、またその遺伝子の由来を変更してもよい。
例えば、大腸菌の場合、OASS遺伝子に属する遺伝子としてcysK遺伝子とcysM遺伝子があり、OASS遺伝子としてその両方を用いてもよく、その一方のみを用いてもよい。さらに、この場合、SAT遺伝子として、大腸菌以外の遺伝子を用いてもよい。
【0017】
本発明においては、上記L-アスパラギン酸からL-システインに至るL-システイン合成系を有する微生物あるいはその一部欠損株を宿主細胞として、上記遺伝子をベクターに連結して導入するが、この導入法自体周知の方法が用いられ、例えば、酢酸リチウム法、エレクトロポレーション法、プロトプラスト法等が用いられる。
例えば使用するベクターとして、宿主微生物がサッカロミセス セレビシエ(Saccharomyces cerevisiae)の場合はYEp351GAPIIやYEp352GAPIIを用い、ピキア パストリス(Pichia pastoris)の場合はpGAPZやpFLDを用いる。SATとOASSそれぞれの遺伝子は、それぞれ異なるベクターにクローニングし、両ベクターを同時に宿主へ導入してもよいが、プロモーターとSAT遺伝子及びプロモーターとOASS遺伝子を併せ持つ、一つのベクターを宿主に導入してもよい。
【0018】
このようにして得られた、L-セリンからL-システインに至るL-システイン合成系遺伝子が導入された本発明の遺伝子導入変異株は、L-システイン、グルタチオン、並びにL-ヒスチジン、L-アルギニン及びL-セリンは菌体中に蓄積される。したがって、培養後の菌体あるいは該菌体を含む培養物から、例えば物理的破壊や煮沸等のそれ自体周知の方法で、L-システイン及びグルタチオン、さらにL-ヒスチジン、L-アルギニン及びL-セリンを採取することができる。
以下、本発明の実施例を示すが、本発明はこれら実施例に限定されるものではない。
【実施例】
【0019】
[実施例1]SAT遺伝子及びOASS遺伝子のクローニング
酵母にL-セリンからL-システインの合成系を導入するために、SATとOASSをコードする遺伝子のクローニングを行った。生命システム情報統合データベース(KEGG,http://www.kegg.jp/)に記載されている情報に基づき、SATをコードする遺伝子として大腸菌のcysEを、OASSをコードする遺伝子として大腸菌のcysKおよびcysMを選択し、各遺伝子をPCR法により増幅して単離した。具体的には、大腸菌のDH5a株の染色体DNAを調製し鋳型として使用した。cysEを増幅するためのプライマーとして、
5’-GCGCGAGCTCATGTCGTGTGAAGAACTGGA-3’(EcCysE-f;配列番号1)と
5’-GCGCGTCGACTTAGATCCCATCCCCATACT-3’(EcCysE-r;配列番号2)を使用した。増幅された842 bpのDNA断片はSacIとSalIで消化し、同様に消化したベクター(YEp351GAPII)に導入することで、YEp351GAPII-cysEを得た。cysKを増幅するためのプライマーとして、5’-CGGAATTCATGAGTAAGATTTTTGAAGATAAC-3’(EcCysK-f;配列番号3)と
5’-GCGCGTCGACTTACTGTTGCAATTCTTTCTC-3’(EcCysK-r配列番号4)を使用した。
【0020】
増幅された990 bpのDNA断片はEcoRIとSalIで消化し、同様に消化したベクター(YEp352GAPII)に導入することで、YEp352GAPII-cysKを得た。cysMを増幅するためのプライマーとして、5’-CGGAATTCATGAGTACATTAGAACAAACAATAG-3’(EcCysM-f;配列番号5)と
5’-GCGCGTCGACTTAAATCCCCGCCCCCTG-3’(EcCysM-r;配列番号6)を使用した。増幅された930 bpのDNA断片は、EcoRIとSalIで消化し、同様に消化したベクター(YEp352GAPII)に導入することで、YEp352GAPII-cysMを得た。
【0021】
[実施例2]L-システイン合成能欠損株の作製
酵母のL-システイン合成系を欠損させるために、シスタチオニン-γ-リアーゼをコードするCYS3遺伝子の欠損株の作製を行った。具体的には選択マーカー遺伝子による置換破壊を行うべく、出芽酵母のゲノムデータベース(http://www.yeastgenome.org/)に記載されている情報に基づき、酵母染色体上のCYS3遺伝子の上流50 bpを含むプライマー、
5’-TAGACATTTGCACCTTATACATATACACACAAGACAAAACCAAAAAAAATCGGATCCCCGGGTTAATTAA-3’(配列番号7)と、
下流50 bpを含むプライマー、
5’-TTATCGTACTTAAAAAGGTCCGGTCGAAGGCAGAGACGTGGCACTGGCGAGAATTCGAGCTCGTTTAAAC-3’(配列番号8)を使用した。
【0022】
シゾサッカロミセス ポンベ(Schizosaccharomyces pombe)のhis5+遺伝子を含むDNA断片を、これを含むベクター(pFA6a-His3MX)を鋳型にPCR法で増幅した。酵母への遺伝子導入は酢酸リチウム法を用いた。即ち、サッカロミセス セレビシエ(Saccharomyces cerevisiae)のW303-1A株を酢酸リチウム、PEG3350、サケ精子DNAを含む溶液に懸濁し、これにPCRで増幅した1056 bpの断片を加え、30℃で30分、42℃で20分間静置させることでDNAに接触させた。その後、菌体懸濁液から遠心により上清を除去し、滅菌水に再懸濁後システインを含むがヒスチジンを含まない寒天培地に塗布し、形質転換体を30℃で3日間培養し選抜した。
【0023】
得られた形質転換体のCYS3遺伝子が欠損していることは、形質転換体の染色体を鋳型としたPCR法により、CYS3欠損株が特異的に保持するDNA領域を増幅させることで行った。具体的には、CYS3遺伝子座の上流配列に相補的なプライマー(5’-GTGATCTCAGCCAGTTGTG-3’)(配列番号9)と、
導入したDNA配列特異的なプライマー(5’-GCGGCCATCAAAATGTATGGAT-3’)(配列番号10)を使用してPCR反応を行い、反応産物のアガロースゲル電気泳動を行った。これによって、CYS3欠損株特異的に増幅する416 bpのDNA断片が確認されたことから、形質転換体のCYS3遺伝子は選択マーカーと置換されて欠損していることが確認された。
【0024】
[実施例3]SAT遺伝子及びOASS遺伝子が導入された酵母の育種
SAT遺伝子及びOASS遺伝子を発現するベクターの酵母への導入は、実施例2と同様に酢酸リチウム法により行った。即ち、YEp351GAPIIとYEp351GAPII-cysEの2種類のベクターと、YEp352GAPII、YEp352GAPII-cysK、YEp352GAPII-cysMの3種類のベクターの組み合わせを網羅した、ベクター混合溶液を野生型酵母株(W303-1A)に接触させ、選択培地であるロイシンとウラシルを含まない寒天培地に塗布した。CYS3欠損株(cys3Δ)にも同様の組み合わせでベクターと接触させ、ヒスチジン、ロイシン、ウラシルを含まないがシステインを含む寒天培地に塗布した。その後30℃で3日間培養して、形質転換体を選抜した。
【0025】
大腸菌のSAT及びOASSタンパク質が酵母細胞内で機能的に発現していることを確認するために、システイン要求性を示すcys3Δ株にYEp351GAPII-cysEとYEp352GAPII-cysKを導入した株(TKY4175)、またはYEp351GAPII-cysEとYEp352GAPII-cysM(TKY4176)株のシステイン要求性を調べた。具体的には、TKY4175やTKY4176株、加えて対照株であるYEp351GAPIIとYEp352GAPIIを保持する株(TKY4170)、YEp351GAPIIとYEp352GAPII-cysKを保持する株(TKY4171)、YEp351GAPIIとYEp352GAPII-cysMを保持する株(TKY4172)、YEp351GAPII-cysEとYEp352GAPIIを保持する株(TKY4174)を、ヒスチジン、ロイシン、メチオニン、ウラシル、システインを含まない寒天培地に画線し、30℃で2日間培養した。L-セリンからL-システインの合成系が不完全なTKY4170、TKY4171、TKY4172、TKY4174株は生育しなかったが、SAT及びOASS遺伝子を導入したTKY4175とTKY4176株はシステイン非存在下でも生育できたことから、これら株において大腸菌のSAT及びOASSは機能的に発現していることが確認された。
【0026】
[実施例4]細胞内アミノ酸及びグルタチオンの定量
実施例3で作製したSAT遺伝子及びOASS遺伝子が導入された酵母株の細胞内アミノ酸及びグルタチオンの定量を行った。具体的には、ロイシン、ウラシル、メチオニンを除いた50mlの液体培地に各酵母株を植菌した。菌体の600nmにおける吸光度が0.8から1.0になるまで30℃で震盪培養し、その後培養液を遠心することで酵母細胞を回収した。回収した細胞は、あらかじめ氷上で冷却した新鮮な培地に懸濁し、再度遠心した後に上清を除去することで細胞を洗浄した。この操作は3回繰り返した。回収した細胞の湿重量を秤量した後、5%スルホサリチル酸とガラスビーズを加え、細胞破砕装置(FastPrep)を用いて酵母細胞を破砕し、遠心により不溶物を除いて上清を回収した。この破砕上清は細胞内のアミノ酸及びグルタチオンを含む溶液として、以下に示すアミノ酸及びグルタチオンの定量解析に供した。
【0027】
細胞内のシステインやグルタチオンは、4-フルオロ-7-スルホベンゾフラザン(4-Fluoro-7-sulfobenzofurazan;SBD-F)化することで定量化した。即ち、100μlの細胞抽出液を8μlの5N水酸化ナトリウムで中和し、さらに12μlの12.5mMエチレンジアミン四酢酸-二ナトリウムと、10mg/mlになるように0.5Mホウ酸ナトリウム緩衝液(pH9.5)に溶解したSBD-Fを30μl加え、60℃で1時間静置することでラベル化反応を行った。反応後の試料は氷上で冷却し、さらに150μlの0.1N塩酸を加えることでラベル化反応を停止させた。ラベル化された試料の一部は、逆相カラムを用いた高速液体クロマトグラフィーに供し、SBD-F化されたシステインとグルタチオンを分離し、その蛍光強度を測定することで定量化した。細胞抽出液に含まれるチオール化合物の定量化は、上記と同様の方法でラベル化した市販のL-システイン及びグルタチオンの溶出時間及びピークの高さに基づき行った。
【0028】
細胞内の各種アミノ酸は、4-フルオロ-7-ニトロベンゾフラザン(4-Fluoro-7-nitrobenzofurazan;NBD-F)化することで定量化した。即ち、3μlの細胞抽出液に75μlの蒸留水、12μlの12.5mMエチレンジアミン四酢酸-二ナトリウム、30μlのホウ酸ナトリウム緩衝液(pH8.5)、さらに10mg/mlになるようにアセトニトリルで溶解したNBD-Fを30μl加え、60℃で3分間静置することでラベル化反応を行った。反応後の試料は氷上で冷却し、さらに150μlの0.1N塩酸を加えることでラベル化反応を停止させた。ラベル化反応後の試料は、逆相クロマトグラフィーにより分離し、各NBD-F化アミノ酸の蛍光強度を測定した。同様の方法でラベル化した市販のアミノ酸は標準品として使用し、細胞抽出液に含まれるアミノ酸を定量化した。対照株(TKY3030)における各種化合物量を1として算出し、実施例3で作製した株におけるチオール化合物量は表1に、アミノ酸量は表2に示す。
【0029】
その結果、対照株(TKY3030)に対し、SAT遺伝子及びOASS遺伝子が導入された酵母株では、L-システインが1.8〜2.6倍、グルタチオンが1.3〜3.2倍、L-ヒスチジンが1.4〜1.9倍、L-アルギニンが2.3〜2.8倍、L-セリンが1.5〜2.3倍に増加していることが明らかとなった。
【表1】

【表2】

【特許請求の範囲】
【請求項1】
L-アスパラギン酸からL-システインに至るL-システイン合成系を保有している微生物あるいは該L-システイン合成系遺伝子中、L-ホモシステインからL-システインに至る合成系に関与する遺伝子のうち少なくとも一の遺伝子が欠損している微生物に、さらにL-セリンからL-システインに至るL-システイン合成系遺伝子が導入されていることを特徴とする、遺伝子導入変異株。
【請求項2】
微生物が、真菌類に属する微生物であることを特徴とする、請求項1に記載の遺伝子導入変異株。
【請求項3】
微生物が酵母であることを特徴とする上記請求項2に記載の遺伝子導入変異株。
【請求項4】
L-セリンからL-システインに至るL-システイン合成系遺伝子がセリンアセチルトランスフェラーゼ遺伝子及びO-アセチル-L-セリンスルフヒドラーゼ遺伝子に属する遺伝子であることを特徴とする、請求項1〜3に記載の遺伝子導入変異株。
【請求項5】
L-セリンからL-システインに至るL-システイン合成系遺伝子が原核生物、古細菌,あるいは植物由来の遺伝子であることを特徴とする、請求項1〜4に記載の遺伝子導入変異株。
【請求項6】
L-セリンからL-システインに至るL-システイン合成系遺伝子が大腸菌由来の遺伝子であることを特徴とする請求項5に記載の遺伝子導入変異株。
【請求項7】
L-セリンからL-システインに至るL-システイン合成系遺伝子がcysEと、cysk及び/またはcysMとであることを特徴とする、請求項6に記載の遺伝子導入変異株。
【請求項8】
請求項1〜7のいずれかに記載の遺伝子導入変異株をL-メチオニン非含有培地で培養し、得られた菌体または該菌体を含む培養物からL-システイン及び/またはグルタチオンを採取することを特徴とする、L-システイン及び/またはグルタチオンの製造方法。
【請求項9】
請求項8に記載の菌体または該菌体を含む培養物から、さらに、L-ヒスチジン、L-アルギニン及びL-セリンのいずれか一種以上を採取することを特徴とする、請求項8に記載の製造方法。
【請求項1】
L-アスパラギン酸からL-システインに至るL-システイン合成系を保有している微生物あるいは該L-システイン合成系遺伝子中、L-ホモシステインからL-システインに至る合成系に関与する遺伝子のうち少なくとも一の遺伝子が欠損している微生物に、さらにL-セリンからL-システインに至るL-システイン合成系遺伝子が導入されていることを特徴とする、遺伝子導入変異株。
【請求項2】
微生物が、真菌類に属する微生物であることを特徴とする、請求項1に記載の遺伝子導入変異株。
【請求項3】
微生物が酵母であることを特徴とする上記請求項2に記載の遺伝子導入変異株。
【請求項4】
L-セリンからL-システインに至るL-システイン合成系遺伝子がセリンアセチルトランスフェラーゼ遺伝子及びO-アセチル-L-セリンスルフヒドラーゼ遺伝子に属する遺伝子であることを特徴とする、請求項1〜3に記載の遺伝子導入変異株。
【請求項5】
L-セリンからL-システインに至るL-システイン合成系遺伝子が原核生物、古細菌,あるいは植物由来の遺伝子であることを特徴とする、請求項1〜4に記載の遺伝子導入変異株。
【請求項6】
L-セリンからL-システインに至るL-システイン合成系遺伝子が大腸菌由来の遺伝子であることを特徴とする請求項5に記載の遺伝子導入変異株。
【請求項7】
L-セリンからL-システインに至るL-システイン合成系遺伝子がcysEと、cysk及び/またはcysMとであることを特徴とする、請求項6に記載の遺伝子導入変異株。
【請求項8】
請求項1〜7のいずれかに記載の遺伝子導入変異株をL-メチオニン非含有培地で培養し、得られた菌体または該菌体を含む培養物からL-システイン及び/またはグルタチオンを採取することを特徴とする、L-システイン及び/またはグルタチオンの製造方法。
【請求項9】
請求項8に記載の菌体または該菌体を含む培養物から、さらに、L-ヒスチジン、L-アルギニン及びL-セリンのいずれか一種以上を採取することを特徴とする、請求項8に記載の製造方法。
【図1】


【図2】




【図2】


【公開番号】特開2012−125170(P2012−125170A)
【公開日】平成24年7月5日(2012.7.5)
【国際特許分類】
【出願番号】特願2010−277916(P2010−277916)
【出願日】平成22年12月14日(2010.12.14)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成24年7月5日(2012.7.5)
【国際特許分類】
【出願日】平成22年12月14日(2010.12.14)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

