チオール基標識方法、チオール基標識用試薬及びサイクリン依存性キナーゼの活性測定方法
【課題】アミノ基に結合する保護物質の存在下で、目的物質とチオール基に結合する標識物質とを反応させることを特徴とする、短時間で簡便に、目的物質のチオール基を、チオール基に結合する標識物質で、特異的に標識する方法及び試薬、並びにチオール基標識方法及び試薬を用いた、サイクリン依存性キナーゼの活性測定方法を提供する。
【解決手段】N−ヒドロキシスクシンイミジルエステルの存在下で、目的物質と5−ヨードアセトアミドフルオレセインとを反応させるチオール基標識方法。更にサイクリン依存性キナーゼの基質タンパク質にチオール基を導入する工程を含むチオール基標識方法。及びサイクリン依存性キナーゼの活性測定方法。
【解決手段】N−ヒドロキシスクシンイミジルエステルの存在下で、目的物質と5−ヨードアセトアミドフルオレセインとを反応させるチオール基標識方法。更にサイクリン依存性キナーゼの基質タンパク質にチオール基を導入する工程を含むチオール基標識方法。及びサイクリン依存性キナーゼの活性測定方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、チオール基に結合する標識物質を用いた、目的物質を標識するための方法及び試薬に関する。さらに本発明は、チオール基に結合する標識物質を用いた、サイクリン依存性キナーゼの活性測定方法に関する。
【背景技術】
【0002】
タンパク質、ペプチド又は核酸等の生体分子の解析や検出等において、チオール基に結合する標識物質を用いて、目的とする生体分子のチオール基を標識することが、生物学や分子生物学等の分野で多用されている。
【0003】
例えば、システインが有するチオール基やシステインにより形成されるジスルフィドは、タンパク質の立体構造やタンパク質の酵素活性に、大きく影響していることが知られている。そのため、チオール基やジスルフィドの位置を同定することは、タンパク質の構造又は活性を解析するときに重要である。例えば、チオール基に結合する標識物質を用いてタンパク質のチオール基を標識することで、タンパク質におけるチオール基の位置を同定する方法が知られている。
【0004】
また、チオール基に結合する標識物質を用いて、サイクリン依存性キナーゼ(以下CDKという)の活性を測定する方法が知られている(特許文献1)。この測定方法では、まず、CDK及びアデノシン5’−O−(3−チオトリホスフェート)(以下ATP−γSという)を用いて、CDKの基質にチオール基を導入する。次に、基質に導入されたチオール基を、チオール基に結合する標識物質で標識する。そして、チオール基に結合する標識物質で標識された基質を測定することで、CDKの活性測定を行っている。
【0005】
ここで、チオール基に結合する標識物質で、標識対象である目的物質を標識する場合、一般的に、過剰量の標識物質で目的物質と反応させる。この際、チオール基に結合する標識物質が、目的物質のアミノ基に、非特異的に結合してしまう場合がある。そのため、上記のタンパク質におけるチオール基の位置の同定やCDK活性測定を正確に行えない場合がある。
【0006】
なお、白金化合物を用いて、目的物質のチオール基を特異的に標識する方法が知られている。この方法では、まずアニオンと目的物質のアミノ基とを結合させた後、白金化合物を用いて目的物質のチオール基を標識している。ここで、目的物質のアミノ基にはアニオンが結合しているため、白金化合物は目的物質のアミノ基には結合しない。そのため、目的物質のチオール基を、白金化合物で特異的に標識することができる。
【0007】
しかしながら、特許文献2の方法は、アニオンと目的物質のアミノ基とを結合させる工程を行った後、目的物質のチオール基を白金化合物で標識する工程を行う必要がある。そのため、工程ごとに、試料の前処理や試薬のpH調製といった操作が必要となる。結果として、作業が繁雑となり、時間を要するという問題があった。
【0008】
【特許文献1】特開2002−335997号公報
【特許文献2】特表2004−530885号公報
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、短時間で簡便に、目的物質のチオール基を、チオール基に結合する標識物質で、特異的に標識する方法及び試薬を提供することを目的とする。
さらに本発明は、上記のチオール基標識方法及び試薬を用いた、サイクリン依存性キナーゼの活性測定方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
すなわち、本発明は、
(1)アミノ基に結合する保護物質の存在下で、目的物質とチオール基に結合する標識物質とを反応させることを特徴とする、チオール基標識方法;
(2)前記目的物質がアミノ酸、ペプチド、タンパク質、核酸、Sオリゴ、又はペプチド核酸である、(1)に記載のチオール基標識方法;
(3)前記保護物質がアミノ基と共有結合するための官能基を有する(1)又は(2)のいずれかに記載のチオール基標識方法;
(4)アミノ基と共有結合する官能基が、スクシンイミド又はイソチオシアネートである、(3)に記載のチオール基標識方法;
(5)前記保護物質が、N−ヒドロキシスクシンイミジルエステルである、(1)〜(4)のいずれかに記載のチオール基標識方法;
(6)前記標識物質が、チオール基と共有結合するための官能基を有する、(1)〜(5)のいずれかに記載のチオール基標識方法;
(7)チオール基と共有結合する官能基が、アルキルハライド、アリールハライド、マレイミド又はアジリジンである、(6)に記載のチオール基標識方法;
(8)前記標識物質が、5−ヨードアセトアミドフルオレセインである、(1)〜(7)のいずれかに記載のチオール基標識方法;
(9)チオール基に結合する標識物質が、蛍光標識物質又は酵素標識物質である、(1)〜(8)のいずれかに記載のチオール基標識方法;
(10)前記反応がpH6.5〜8.5で行われる、(1)〜(9)のいずれかに記載のチオール基標識方法;
(11)チオール基に結合する標識物質で目的物質を標識する試薬であって、アミノ基に結合する保護物質と、チオール基に結合する標識物質とを含有する溶液を含むことを特徴とする、チオール基標識用試薬;
(12)前記溶液のpHが6.5〜8.5である、(11)に記載のチオール基標識用試薬;
(13)前記保護物質が、N−ヒドロキシスクシンイミジルエステルである、(11)又は(12)のいずれかに記載のチオール基標識用試薬;
(14)前記標識物質が、5−ヨードアセトアミドフルオレセインである、(11)〜(13)のいずれかに記載のチオール基標識用試薬;
(15)試料中のサイクリン依存性キナーゼの酵素活性により、アデノシン5’−O−(3−チオトリホスフェート)を用いて、サイクリン依存性キナーゼの基質タンパク質にチオール基を導入する工程と、アミノ基に結合する保護物質の存在下で、チオール基が導入された基質タンパク質と、チオール基に結合する標識物質とを反応させる工程と、標識物質で標識された基質タンパク質を検出する工程と、検出工程で得られた検出結果に基づいて、サイクリン依存性キナーゼの活性を測定する工程とを含む、サイクリン依存性キナーゼの活性測定方法;
(16)前記保護物質が、N−ヒドロキシスクシンイミジルエステルである、(15)に記載のサイクリン依存性キナーゼの活性測定方法;
(17)前記標識物質が、5−ヨードアセトアミドフルオレセインである、(15)又は(16)のいずれかに記載のサイクリン依存性キナーゼの活性測定方法;
(18)反応工程が、pH6.5〜8.5で行われる、(15)〜(17)のいずれかに記載のサイクリン依存性キナーゼの活性測定方法;
を提供するものである。
【発明の効果】
【0011】
本発明によると、短時間で簡便に、目的物質のチオール基を、チオール基に結合する標識物質で、特異的に標識する方法及び試薬が提供される。
さらに本発明によると、上記のチオール基標識方法及び試薬を用いた、サイクリン依存性キナーゼの活性測定方法が提供される。
【発明を実施するための最良の形態】
【0012】
本発明の一実施形態である、チオール基標識方法は、アミノ基に結合する保護物質の存在下で、目的物質とチオール基に結合する標識物質とを反応させることを特徴とする。
【0013】
本実施形態において目的物質とは、チオール基に結合する標識物質による標識の対象となる物質であれば特に限定されない。具体的には、アミノ酸、ペプチド、タンパク質、核酸、Sオリゴ又はペプチド核酸などが挙げられる。この中で好ましくはタンパク質である。目的物質がチオール基を有さない場合には、目的物質にチオール基を導入することにより、標識物質と目的物質との結合が可能になる。例えば、目的物質がチオール基を有さないタンパク質である場合、このタンパク質を基質とするキナーゼとアデノシン5’−O−(3−チオトリホスフェート)(以下ATPγSとする)とを用いてこのタンパク質にチオール基を導入することができる。
【0014】
本実施形態において、アミノ基に結合する保護物質は、チオール基に結合する標識物質と目的物質のチオール基との結合を阻害せず、チオール基に結合する標識物質と目的物質のアミノ基との結合を防ぐ物質であればよい。好ましくはアミノ基と共有結合するための官能基を有している保護物質である。アミノ基と共有結合する官能基としては、スクシンイミド、イソチオシアネートなどが挙げられる。好ましくはスクシンイミド基である。具体的な保護物質としては、N−ヒドロキシスクシンイミジルエステルやフェニルイソチオシアネートなどが挙げられる。
【0015】
本実施形態において、チオール基に結合する標識物質は、目的物質のチオール基と結合し、目的物質を検出できるものであれば良い。好ましくはチオール基と共有結合するための官能基を有している標識物質である。チオール基と共有結合する官能基としては、アルキルハライド、アリールハライド、マレイミド又はアジリジンなどが挙げられる。好ましくは、アルキルハライド基である。
【0016】
また、チオール基に結合する標識物質は、蛍光標識物質であっても酵素標識物質であってもよい。蛍光標識物質に用いられる蛍光物質としては、フルオレセイン、クマリン、エオシン、フェナントロリン、ピレン、ローダミンなどが挙げられる。そのうち、フルオレセインが好ましい。具体的な蛍光標識物質としては、ヨードアセチル−FITC(フルオレセインイソチオシアネート)、5−(ブロモメチル)フルオレセイン、フルオレセイン−5−マレイミド、5−ヨードアセトアミドフルオレセイン(5−IAF)、6−ヨードアセトアミドフルオレセイン(6−IAF)、4−ブロモメチル−7−メトキシクマリン、エオシン−5−マレイミド、エオシン−5−ヨードアセトアミド、N−(1,10−フェナントロリン−5−イル)ブロモアセトアミド、1−ピレンブチリルクロリド、N−(1−ピレンエチル)ヨードアセトアミド、N−(1−ピレンメチル)ヨードアセトアミド(PMIA アミド)、1−ピレンメチルヨードアセテート(PMIA エステル)、ローダミンレッドC2マレンイミドなどが挙げられる。このうち、5−ヨードアセトアミドフルオレセインが好ましい。
標識物質として蛍光標識物質を用いる場合、まず目的物質と蛍光標識物質とを結合させる。次に蛍光物質を特定の波長で励起させて、蛍光を検出する。例えば蛍光物質がフルオレセインの場合、フルオレセインに488nmの波長を照射して励起させ、蛍光画像解析装置で検出する。これにより、目的物質を検出することができる。
【0017】
酵素標識物質に用いられる酵素としては、βガラクトシダーゼ、アルカリホスファターゼ、グルコースオキシダーゼ及びペルオキシダーゼなどが挙げられる。そのうち、ペルオキシダーゼが好ましい。
標識物質として酵素標識物質を用いる場合、まず目的物質と酵素標識物質とを結合させる。次に酵素標識物質で標識された目的物質に、酵素との反応によって発光が生じるような試薬を加える。次に試薬と酵素とを反応させて、発光を生じさせ検出する。これにより、目的物質を検出することができる。例えば酵素としてペルオキシダーゼを用いる場合、試薬としてはECL−プラス(アマシャム・バイオサイエンス社)が挙げられる。なお、試薬は使用する酵素に合わせて適宜選択することができる。
【0018】
本実施形態の、アミノ基に結合する保護物質の存在下で、目的物質とチオール基に結合する標識物質との反応では、標識物質が目的物質のチオール基に結合する反応を阻害せず、標識物質とアミノ基との意図しない結合反応よりも保護物質が十分に目的物質のアミノ基に結合できるpHである必要がある。また、目的物質が生体物質である場合、生体物質の構造変化等を防ぐためには、pHは中性付近が好ましい。特に目的物質がタンパク質である場合、実験内容により、pHによるタンパク質の変性を防ぐ必要がある。そのため、標識物質及び保護物質と目的物質との反応は、中性付近で行われる必要がある。より具体的には、pHは6.5〜8.5で反応させることが好ましい。さらに好ましくはpH7.0〜7.5である。上記pHの範囲で反応が行われる標識物質としては、5−ヨードアセトアミドフルオレセイン、テトラメチルローダミンヨードアセトアミド、テキサスレッドマレイミドなどが挙げられる。また上記pHの範囲で反応が行われる保護物質としては、N−ヒドロキシスクシンイミジルエステル、イソチオシアネートなどが挙げられる。
この反応では前記pHの範囲で緩衝能を有する緩衝液を用いることができる。具体的にはトリス緩衝液やモルフォリンプロパンスルホン酸(MOPS)緩衝液などが挙げられる。またこの緩衝液には、タンパク質分解酵素阻害剤を添加してもよい。例えば、エチレンジアミン四酢酸(EDTA)やジメチルスルホキシド(DMSO)などが挙げられる。
【0019】
さらにこの反応は、通常10分〜2時間でチオール基標識反応を行うことができる。この反応で用いられる標識物質及び保護物質の量は、目的物質の量に応じて添加する。例えば目的物質としてヒストンH1タンパク質、標識物質として5−ヨードアセトアミドフルオレセイン、保護物質としてN−ヒドロキシスクシンイミジルエステルを用いる場合、目的物質のタンパク質1当量に対して、標識物質は50〜500当量、保護物質は100〜2000当量が添加される。
そしてこの反応は、遊離のチオール、例えばβ−メルカプトエタノール(β−ME)、ジチオスレイトール(DTT)、N−アセチルシステインなどが添加されて停止される。
【0020】
本発明の一実施形態である、チオール基標識用試薬は、チオール基に結合する標識物質で目的物質を標識する試薬であって、アミノ基に結合する保護物質と、チオール基に結合する標識物質とを含有する溶液を含むことを特徴とする。
【0021】
本実施形態のチオール基標識試薬のpHとしては、前述と同様のpHでよい。またこの溶液には、前述の緩衝液を用いることができる。この緩衝液にも同様にタンパク質分解酵素阻害剤を添加することができる。
【0022】
本発明の一実施形態である、サイクリン依存性キナーゼの活性測定方法は、試料中のサイクリン依存性キナーゼの酵素活性により、アデノシン5’−O−(3−チオトリホスフェート)を用いて、サイクリン依存性キナーゼの基質タンパク質にチオール基を導入する工程と、アミノ基に結合する保護物質の存在下で、チオール基が導入された基質タンパク質と、チオール基に結合する標識物質とを反応させる工程と、標識物質で標識された基質タンパク質を検出する工程と、検出工程で得られた検出結果に基づいて、サイクリン依存性キナーゼの活性を測定する工程とを含む。
【0023】
本実施形態で用いられる試料は、生体細胞からサイクリン依存性キナーゼの活性を測定するために調製された試料であることが好ましい。生体細胞は、組織サンプル(バイオプシーサンプルや外科切除サンプル等)のようなヒトを含む動物由来の細胞を用いるのが好ましい。
サイクリン依存性キナーゼ(以下CDKという)は、細胞質中に存在しており、核内のサイクリンと結合する。そして、サイクリン依存性キナーゼとサイクリンとの複合体(以下、活性型CDKという)を形成し、活性化状態となる。よって活性測定の対象となるCDKは細胞の内部に含まれている。このため測定するための試料を調製するときには、細胞膜及び核膜を破壊し、CDKを試料中に遊離させた状態で存在させることが好ましい。つまりCDKと基質タンパク質との反応を行う前に、生体細胞に対して可溶化処理を行うことが好ましい。
【0024】
可溶化処理は、生体細胞に可溶化処理用の緩衝液(以下細胞可溶化液とする)を添加して行うことが好ましい。この緩衝液は前述と同様のものを用いることができる。細胞可溶化液には、界面活性剤、タンパク質分解酵素阻害剤や脱リン酸化酵素阻害剤などを含有させることができる。具体的な可溶化処理の方法としては、細胞可溶化液を細胞に添加し、ワーリングブレンダーによる粉砕処理、シリンジによる吸引排出処理又は超音波処理を行う。これにより、生体細胞に対して可溶化処理を行うことができる。
【0025】
界面活性剤は、細胞膜及び核膜を破壊して細胞内物質を取り出すために用いられる。ただし、活性型CDKを分解させない程度の界面活性を有するものが用いられる。例えば、ノニデットP−40、TritonX−100、デオキシコール酸又はCHAPSなどが挙げられる。界面活性剤濃度は、1w/v%以下が好ましい。
【0026】
タンパク質分解酵素阻害剤は、破壊された細胞膜や核膜などの細胞内物質が混在するとき、タンパク質であるCDKやサイクリン分子が破壊されるのを防ぐために用いられる。例えば、EDTA、EGTAのようなメタロプロテアーゼ阻害剤、PMSF、トリプシンインヒビター、キモトリプシンのようなセリンプロテアーゼ阻害剤又はヨードアセトアミド、E−64のようなシステインプロテアーゼ阻害剤などが挙げられる。また、プロテアーゼ阻害剤カクテル(シグマ社)のようなそれらタンパク質分解酵素阻害剤を予め混合した市販品も挙げられる。
【0027】
脱リン酸化酵素阻害剤は、細胞に含まれる脱リン酸化酵素が、測定対象の酵素の活性を低下させることを防ぐ目的で用いられる。例えば、セリン/スレオニン脱リン酸化酵素阻害剤(フッ化ナトリウムなど)、チロシン脱リン酸化酵素阻害剤(オルトバナジン酸ナトリウムなど)などが挙げられる。溶解緩衝液にはこれらの脱リン酸化酵素阻害剤を単独又は混合して用いることができる。
【0028】
本実施形態のCDKとは、具体的には、CDK1、CDK2、CDK3、CDK4、CDK5、CDK6、CDK7及びCDK8等が例示される。
【0029】
可溶化処理を行った細胞から測定目的の活性型CDKを抽出する方法として、例えば免疫沈降法がある。免疫沈降法では、目的の各種CDK1〜8のいずれか一つに特異性を有する抗CDK抗体が用いられる。
【0030】
より詳細には、所定量のタンパク質を含む細胞可溶化液に、測定目的の活性型CDKに対応する抗CDK抗体と、その抗CDK抗体を捕捉するための材料としてプロテインA、プロテインGまたは抗ウサギIgG抗体をコートしたセファロースビーズとの懸濁液を0〜10℃で1〜2時間反応させる。これらビーズは不溶性なので、ビーズに結合した抗CDK抗体とCDKの複合体は不溶性となり沈降する。このビーズを回収することで測定目的の活性型CDKを抽出することができる。
【0031】
本実施形態で用いられる基質タンパク質は、活性測定の対象となる酵素の基質となるものであれば特に限定されない。例えば、活性測定の対象となる酵素がCDK1又はCDK2である場合、基質タンパク質としては、ヒストンH1又は網膜芽細胞腫タンパク質(Retinoblastoma Protein:以下Rbとする)を用いることが好ましい。また、酵素がCDK4又はCDK6である場合は、基質タンパク質としてRbを用いることが好ましい。この基質タンパク質は、硫黄原子を含まないアミノ酸(システイン及びメチオニン以外のアミノ酸)から構成されるタンパク質が好ましい。Rbのようなシステイン残基を含むタンパク質は、システイン残基をアラニンなどの硫黄原子を含まないアミノ酸に置換して用いることが好ましい。基質中のシステイン又はメチオニン残基を、硫黄原子を含まないアミノ酸に置換する方法としては、PCR法や部分点突然変異法などの公知の方法を用いて行うことができる。
【0032】
本実施形態においてCDKの基質タンパク質にチオール基を導入する工程は、活性型CDKの存在下で、CDKの基質タンパク質とATP−γSとを反応させることにより行われる。通常、活性型CDKの存在下では、以下の(化1)に示すように、ATP由来のモノリン酸基が、基質タンパク質のセリン又はスレオニン残基に導入される。本実施形態では、ATPの代わりにATP−γSを用いている。よって、活性型CDKの存在下で、基質タンパク質のセリン又はスレオニン残基にATP−γS由来のチオリン酸基が導入される。これにより、基質タンパク質にチオール基を導入することができる。
【0033】
【化1】

【0034】
本実施形態の保護物質の存在下で、チオール基が導入された基質タンパク質と、標識物質とを反応させる際の反応は、前述のpHと同様でよい。またこの反応において、前述の緩衝液を用いることができる。この緩衝液にも同様にタンパク質分解酵素阻害剤などを添加することができる。
さらにこの反応は、10分〜2時間でチオール基標識反応を行うことができる。この反応で用いられる標識物質及び保護物質の量は、前述と同様の量を添加すればよい。またこの反応は遊離のチオールを添加することで停止される。
【0035】
標識された基質タンパク質を検出する方法としては、蛍光標識物質からの蛍光を検出する方法や、酵素との反応により生成した蛍光物質からの蛍光を検出する方法が挙げられる。具体的な方法については前述に記載の方法と同様である。これにより、目的物質である基質タンパク質を検出することができる。
【0036】
本実施形態の活性の測定は、蛍光標識物質又は反応によって生成した蛍光物質の量を測定し、予め作製した検量線にあてはめて、活性型CDKの活性値が算出される。
予め作製する検量線は、チオール基を導入した既知量の基質タンパク質を用いて作製するのが好ましい。また蛍光標識物質又は酵素との反応に対する挙動が、チオール基を導入した基質タンパク質と同様であることが知られているビオチン化アクチン等が代わりに用いられてもよい。その際、活性型CDKの活性値はビオチン化アクチン等の量から換算される必要がある。
【実施例】
【0037】
本実施例では、チオール基標識方法及び試薬を用いたサイクリン依存性キナーゼの活性測定方法について説明する。
【0038】
実施例(チオール基標識方法を用いたCDK2の活性測定)
〔活性測定用試料の調製〕
50mL遠沈管に、細胞数が1×108から1×109であるK562(白血病由来の培養細胞)を加えた。ここに細胞可溶化液(0.1w/v%NP−40(界面活性剤ノニデットP−40)、50mMのトリス緩衝液(pH7.4)、5mM EDTA、50mMのフッ化ナトリウム、1mMのオルトバナジン酸ナトリウム及び1×プロテアーゼ阻害剤カクテル(Roche社)を含む)を、2×107個の細胞数に対し1mLの割合で加えた。
次に、ピペッティングにより細胞を可溶化し、2mLのエッペンドルフチューブに2mLずつ分注した。これらのチューブを遠心分離(4℃、15000rpm、5分間)にかけ、上清を回収し、これを測定用試料とした。
なお、この測定用試料中に含まれる全タンパク質量をDCタンパク質キット(Bio−Rad社)で測定した。
【0039】
〔測定試料中のCDK2の捕捉〕
96穴フィルタープレートの親水性PVDFメンブレン(ミリポア社)の各ウェルに、免疫沈降用緩衝液(0.1w/v%NP−40及び50mMトリス緩衝液(pH7.4)を含む)を70μL加えた。
ここに抗CDK2抗体を8μgとプロテインAをコートした50v/v%セファロースビーズ(GEヘルスケア社)を30μL加えた。これにより、セファロースビーズと抗CDK2抗体とを結合させた。
次に、測定用試料を、ウェル内の全タンパク質の濃度が23μg/150μLとなるように調節して、ウェル内に加えた。そして前記プレートを4℃で2時間振盪した。これにより、測定試料中のCDK2と、抗CDK2抗体とを反応させた。
反応後、ウェル内のビーズを、ビーズ洗浄液A(1w/v% NP−40及び50mMトリス緩衝液(pH7.4)を含む)で二回洗浄した。次にビーズ洗浄液B(300mM NaCl及び50mM トリス緩衝液(pH7.4)を含む)で一回洗浄した。そしてビーズ洗浄液C(50mMトリス緩衝液(pH7.4)を含む)で一回洗浄した。
【0040】
〔チオール基の導入〕
ウェル内のビーズに、CDKの基質溶液(10μgヒストンH1(カルビオケム社)、2mM ATP−γS(カルビオケム社)、54mM トリス緩衝液(pH=7.4)、20mM 塩化マグネシウム、0.1% TritonX−100を含む)を加えた。基質溶液は、ウェルに収容した混合液の総量が50μLとなるように調節して加えた。これを37℃で30分間振盪してキナーゼ反応を行い、ヒストンH1にチオール基を導入した。キナーゼ反応後、遠心分離(2000rpm、5分間)を行い、上清を回収した。
【0041】
〔蛍光標識試薬の調製〕
蛍光標識試薬A及びBを調製した。蛍光標識試薬Aは、287mM トリス緩衝液(pH7.4)、1.03mM 5−ヨードアセトアミドフルオロセイン(以下5−IAFという)、4.8mM EDTA、4.3%DMSOを含む溶液に、N−ヒドロキシスクシンイミドエステルの濃度がそれぞれ1、10、40mMとなるように添加したものである。
蛍光標識試薬Bは、287mM MOPS−NaOH(pH7.4)、1.03mM 5−IAF、4.8mM EDTA、4.3%DMSOを含む溶液に、N−ヒドロキシスクシンイミドエステルの濃度がそれぞれ1、10mMとなるように添加したものである。
【0042】
なお、バックグラウンド測定用として、抗CDK2抗体の代わりに、ウサギIgG抗体を用いて同様の操作を行った。これにより、セファロースビーズとウサギIgG抗体とを結合させた。
【0043】
〔蛍光標識反応〕
チオール基を導入したヒストンH1を含む、上記回収した上清に、蛍光標識試薬A又はBを加え、遮光条件下で25℃、20分間振盪した。これにより、ヒストンH1に導入されたチオール基の硫黄原子に、5−IAFを結合させた。標識反応後、5−IAFとチオール基との結合反応を停止するために、N−アセチルシステインを加えた。
次に、反応停止後の試料を48μL(5−IAFが結合した基質タンパク質1.76μgを含む)採取した。ここにトリス緩衝生理食塩水(25mMトリス緩衝液(pH=7.4)、150mM NaClを含む)を180μL加えて希釈した。
希釈したサンプル200μLを、96穴フィルタープレートの疎水性PVDFメンブレン(ミリポア社製)の各ウェルにブロッティングした。
このメンブレンを200μLのメンブレン洗浄液(25mMトリス緩衝液(pH=7.4)、150mM NaClを含む)で2回洗浄した。洗浄後、メンブレンの各ウェルにバックグラウンド低減用のブロッキング溶液(4w/v% BSA、25mMトリス緩衝液(pH=7.4)及び150mM NaClを含む)を加えた。
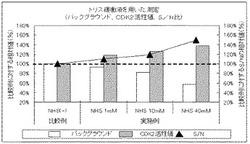
その後、蛍光プレートリーダーInfiniteF−200(テカン社製)を用いて、フィルタープレートの蛍光強度を測定した。蛍光強度は蛍光カウント値(単位はCNT)として表される。
【0044】
比較例
比較例では、蛍光標識試薬A又はBにおいて、N−スクシンイミジルエステルを加えない試薬を用いた以外は実施例と同様にして蛍光強度の測定を行った。
【0045】
結果
実施例及び比較例において測定された蛍光強度のグラフを図1(蛍光標識試薬A)及び図2(蛍光標識試薬B)に示す。バックグラウンド値は、IgG抗体を用いて測定した蛍光強度である。CDK2活性値は、抗CDK2抗体を用いて測定した蛍光強度からバックグラウンド値を差し引いた値である。またS/N比(シグナル/ノイズ比)は、CDK2活性値をバックグラウンド値で除した値である。
なおグラフは、比較例で測定された蛍光強度の蛍光カウント値を100%としたときの相対値で示す。
【0046】
図1及び図2より、蛍光標識試薬A及びBのいずれにおいても、NHSを加えたとき(実施例)は、NHSを加えなかったとき(比較例)よりも、バックグラウンドが低減していることを確認できた。またNHSを加えたときでも、CDK2の活性値が低下することはなかった。
そして、NHSを加えたときはNHSを加えなかったときよりも、S/N比が向上していることが確認できた。
以上より、実施例の方法によって、従来よりも特異的にチオール基を標識でき、正確にチオール基が導入されたヒストンH1タンパク質を定量できる。
【図面の簡単な説明】
【0047】
【図1】実施例及び比較例においてトリス緩衝液を用いて測定された蛍光強度のグラフである。
【図2】実施例及び比較例においてMOPS緩衝液を用いて測定された蛍光強度のグラフである。
【技術分野】
【0001】
本発明は、チオール基に結合する標識物質を用いた、目的物質を標識するための方法及び試薬に関する。さらに本発明は、チオール基に結合する標識物質を用いた、サイクリン依存性キナーゼの活性測定方法に関する。
【背景技術】
【0002】
タンパク質、ペプチド又は核酸等の生体分子の解析や検出等において、チオール基に結合する標識物質を用いて、目的とする生体分子のチオール基を標識することが、生物学や分子生物学等の分野で多用されている。
【0003】
例えば、システインが有するチオール基やシステインにより形成されるジスルフィドは、タンパク質の立体構造やタンパク質の酵素活性に、大きく影響していることが知られている。そのため、チオール基やジスルフィドの位置を同定することは、タンパク質の構造又は活性を解析するときに重要である。例えば、チオール基に結合する標識物質を用いてタンパク質のチオール基を標識することで、タンパク質におけるチオール基の位置を同定する方法が知られている。
【0004】
また、チオール基に結合する標識物質を用いて、サイクリン依存性キナーゼ(以下CDKという)の活性を測定する方法が知られている(特許文献1)。この測定方法では、まず、CDK及びアデノシン5’−O−(3−チオトリホスフェート)(以下ATP−γSという)を用いて、CDKの基質にチオール基を導入する。次に、基質に導入されたチオール基を、チオール基に結合する標識物質で標識する。そして、チオール基に結合する標識物質で標識された基質を測定することで、CDKの活性測定を行っている。
【0005】
ここで、チオール基に結合する標識物質で、標識対象である目的物質を標識する場合、一般的に、過剰量の標識物質で目的物質と反応させる。この際、チオール基に結合する標識物質が、目的物質のアミノ基に、非特異的に結合してしまう場合がある。そのため、上記のタンパク質におけるチオール基の位置の同定やCDK活性測定を正確に行えない場合がある。
【0006】
なお、白金化合物を用いて、目的物質のチオール基を特異的に標識する方法が知られている。この方法では、まずアニオンと目的物質のアミノ基とを結合させた後、白金化合物を用いて目的物質のチオール基を標識している。ここで、目的物質のアミノ基にはアニオンが結合しているため、白金化合物は目的物質のアミノ基には結合しない。そのため、目的物質のチオール基を、白金化合物で特異的に標識することができる。
【0007】
しかしながら、特許文献2の方法は、アニオンと目的物質のアミノ基とを結合させる工程を行った後、目的物質のチオール基を白金化合物で標識する工程を行う必要がある。そのため、工程ごとに、試料の前処理や試薬のpH調製といった操作が必要となる。結果として、作業が繁雑となり、時間を要するという問題があった。
【0008】
【特許文献1】特開2002−335997号公報
【特許文献2】特表2004−530885号公報
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、短時間で簡便に、目的物質のチオール基を、チオール基に結合する標識物質で、特異的に標識する方法及び試薬を提供することを目的とする。
さらに本発明は、上記のチオール基標識方法及び試薬を用いた、サイクリン依存性キナーゼの活性測定方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
すなわち、本発明は、
(1)アミノ基に結合する保護物質の存在下で、目的物質とチオール基に結合する標識物質とを反応させることを特徴とする、チオール基標識方法;
(2)前記目的物質がアミノ酸、ペプチド、タンパク質、核酸、Sオリゴ、又はペプチド核酸である、(1)に記載のチオール基標識方法;
(3)前記保護物質がアミノ基と共有結合するための官能基を有する(1)又は(2)のいずれかに記載のチオール基標識方法;
(4)アミノ基と共有結合する官能基が、スクシンイミド又はイソチオシアネートである、(3)に記載のチオール基標識方法;
(5)前記保護物質が、N−ヒドロキシスクシンイミジルエステルである、(1)〜(4)のいずれかに記載のチオール基標識方法;
(6)前記標識物質が、チオール基と共有結合するための官能基を有する、(1)〜(5)のいずれかに記載のチオール基標識方法;
(7)チオール基と共有結合する官能基が、アルキルハライド、アリールハライド、マレイミド又はアジリジンである、(6)に記載のチオール基標識方法;
(8)前記標識物質が、5−ヨードアセトアミドフルオレセインである、(1)〜(7)のいずれかに記載のチオール基標識方法;
(9)チオール基に結合する標識物質が、蛍光標識物質又は酵素標識物質である、(1)〜(8)のいずれかに記載のチオール基標識方法;
(10)前記反応がpH6.5〜8.5で行われる、(1)〜(9)のいずれかに記載のチオール基標識方法;
(11)チオール基に結合する標識物質で目的物質を標識する試薬であって、アミノ基に結合する保護物質と、チオール基に結合する標識物質とを含有する溶液を含むことを特徴とする、チオール基標識用試薬;
(12)前記溶液のpHが6.5〜8.5である、(11)に記載のチオール基標識用試薬;
(13)前記保護物質が、N−ヒドロキシスクシンイミジルエステルである、(11)又は(12)のいずれかに記載のチオール基標識用試薬;
(14)前記標識物質が、5−ヨードアセトアミドフルオレセインである、(11)〜(13)のいずれかに記載のチオール基標識用試薬;
(15)試料中のサイクリン依存性キナーゼの酵素活性により、アデノシン5’−O−(3−チオトリホスフェート)を用いて、サイクリン依存性キナーゼの基質タンパク質にチオール基を導入する工程と、アミノ基に結合する保護物質の存在下で、チオール基が導入された基質タンパク質と、チオール基に結合する標識物質とを反応させる工程と、標識物質で標識された基質タンパク質を検出する工程と、検出工程で得られた検出結果に基づいて、サイクリン依存性キナーゼの活性を測定する工程とを含む、サイクリン依存性キナーゼの活性測定方法;
(16)前記保護物質が、N−ヒドロキシスクシンイミジルエステルである、(15)に記載のサイクリン依存性キナーゼの活性測定方法;
(17)前記標識物質が、5−ヨードアセトアミドフルオレセインである、(15)又は(16)のいずれかに記載のサイクリン依存性キナーゼの活性測定方法;
(18)反応工程が、pH6.5〜8.5で行われる、(15)〜(17)のいずれかに記載のサイクリン依存性キナーゼの活性測定方法;
を提供するものである。
【発明の効果】
【0011】
本発明によると、短時間で簡便に、目的物質のチオール基を、チオール基に結合する標識物質で、特異的に標識する方法及び試薬が提供される。
さらに本発明によると、上記のチオール基標識方法及び試薬を用いた、サイクリン依存性キナーゼの活性測定方法が提供される。
【発明を実施するための最良の形態】
【0012】
本発明の一実施形態である、チオール基標識方法は、アミノ基に結合する保護物質の存在下で、目的物質とチオール基に結合する標識物質とを反応させることを特徴とする。
【0013】
本実施形態において目的物質とは、チオール基に結合する標識物質による標識の対象となる物質であれば特に限定されない。具体的には、アミノ酸、ペプチド、タンパク質、核酸、Sオリゴ又はペプチド核酸などが挙げられる。この中で好ましくはタンパク質である。目的物質がチオール基を有さない場合には、目的物質にチオール基を導入することにより、標識物質と目的物質との結合が可能になる。例えば、目的物質がチオール基を有さないタンパク質である場合、このタンパク質を基質とするキナーゼとアデノシン5’−O−(3−チオトリホスフェート)(以下ATPγSとする)とを用いてこのタンパク質にチオール基を導入することができる。
【0014】
本実施形態において、アミノ基に結合する保護物質は、チオール基に結合する標識物質と目的物質のチオール基との結合を阻害せず、チオール基に結合する標識物質と目的物質のアミノ基との結合を防ぐ物質であればよい。好ましくはアミノ基と共有結合するための官能基を有している保護物質である。アミノ基と共有結合する官能基としては、スクシンイミド、イソチオシアネートなどが挙げられる。好ましくはスクシンイミド基である。具体的な保護物質としては、N−ヒドロキシスクシンイミジルエステルやフェニルイソチオシアネートなどが挙げられる。
【0015】
本実施形態において、チオール基に結合する標識物質は、目的物質のチオール基と結合し、目的物質を検出できるものであれば良い。好ましくはチオール基と共有結合するための官能基を有している標識物質である。チオール基と共有結合する官能基としては、アルキルハライド、アリールハライド、マレイミド又はアジリジンなどが挙げられる。好ましくは、アルキルハライド基である。
【0016】
また、チオール基に結合する標識物質は、蛍光標識物質であっても酵素標識物質であってもよい。蛍光標識物質に用いられる蛍光物質としては、フルオレセイン、クマリン、エオシン、フェナントロリン、ピレン、ローダミンなどが挙げられる。そのうち、フルオレセインが好ましい。具体的な蛍光標識物質としては、ヨードアセチル−FITC(フルオレセインイソチオシアネート)、5−(ブロモメチル)フルオレセイン、フルオレセイン−5−マレイミド、5−ヨードアセトアミドフルオレセイン(5−IAF)、6−ヨードアセトアミドフルオレセイン(6−IAF)、4−ブロモメチル−7−メトキシクマリン、エオシン−5−マレイミド、エオシン−5−ヨードアセトアミド、N−(1,10−フェナントロリン−5−イル)ブロモアセトアミド、1−ピレンブチリルクロリド、N−(1−ピレンエチル)ヨードアセトアミド、N−(1−ピレンメチル)ヨードアセトアミド(PMIA アミド)、1−ピレンメチルヨードアセテート(PMIA エステル)、ローダミンレッドC2マレンイミドなどが挙げられる。このうち、5−ヨードアセトアミドフルオレセインが好ましい。
標識物質として蛍光標識物質を用いる場合、まず目的物質と蛍光標識物質とを結合させる。次に蛍光物質を特定の波長で励起させて、蛍光を検出する。例えば蛍光物質がフルオレセインの場合、フルオレセインに488nmの波長を照射して励起させ、蛍光画像解析装置で検出する。これにより、目的物質を検出することができる。
【0017】
酵素標識物質に用いられる酵素としては、βガラクトシダーゼ、アルカリホスファターゼ、グルコースオキシダーゼ及びペルオキシダーゼなどが挙げられる。そのうち、ペルオキシダーゼが好ましい。
標識物質として酵素標識物質を用いる場合、まず目的物質と酵素標識物質とを結合させる。次に酵素標識物質で標識された目的物質に、酵素との反応によって発光が生じるような試薬を加える。次に試薬と酵素とを反応させて、発光を生じさせ検出する。これにより、目的物質を検出することができる。例えば酵素としてペルオキシダーゼを用いる場合、試薬としてはECL−プラス(アマシャム・バイオサイエンス社)が挙げられる。なお、試薬は使用する酵素に合わせて適宜選択することができる。
【0018】
本実施形態の、アミノ基に結合する保護物質の存在下で、目的物質とチオール基に結合する標識物質との反応では、標識物質が目的物質のチオール基に結合する反応を阻害せず、標識物質とアミノ基との意図しない結合反応よりも保護物質が十分に目的物質のアミノ基に結合できるpHである必要がある。また、目的物質が生体物質である場合、生体物質の構造変化等を防ぐためには、pHは中性付近が好ましい。特に目的物質がタンパク質である場合、実験内容により、pHによるタンパク質の変性を防ぐ必要がある。そのため、標識物質及び保護物質と目的物質との反応は、中性付近で行われる必要がある。より具体的には、pHは6.5〜8.5で反応させることが好ましい。さらに好ましくはpH7.0〜7.5である。上記pHの範囲で反応が行われる標識物質としては、5−ヨードアセトアミドフルオレセイン、テトラメチルローダミンヨードアセトアミド、テキサスレッドマレイミドなどが挙げられる。また上記pHの範囲で反応が行われる保護物質としては、N−ヒドロキシスクシンイミジルエステル、イソチオシアネートなどが挙げられる。
この反応では前記pHの範囲で緩衝能を有する緩衝液を用いることができる。具体的にはトリス緩衝液やモルフォリンプロパンスルホン酸(MOPS)緩衝液などが挙げられる。またこの緩衝液には、タンパク質分解酵素阻害剤を添加してもよい。例えば、エチレンジアミン四酢酸(EDTA)やジメチルスルホキシド(DMSO)などが挙げられる。
【0019】
さらにこの反応は、通常10分〜2時間でチオール基標識反応を行うことができる。この反応で用いられる標識物質及び保護物質の量は、目的物質の量に応じて添加する。例えば目的物質としてヒストンH1タンパク質、標識物質として5−ヨードアセトアミドフルオレセイン、保護物質としてN−ヒドロキシスクシンイミジルエステルを用いる場合、目的物質のタンパク質1当量に対して、標識物質は50〜500当量、保護物質は100〜2000当量が添加される。
そしてこの反応は、遊離のチオール、例えばβ−メルカプトエタノール(β−ME)、ジチオスレイトール(DTT)、N−アセチルシステインなどが添加されて停止される。
【0020】
本発明の一実施形態である、チオール基標識用試薬は、チオール基に結合する標識物質で目的物質を標識する試薬であって、アミノ基に結合する保護物質と、チオール基に結合する標識物質とを含有する溶液を含むことを特徴とする。
【0021】
本実施形態のチオール基標識試薬のpHとしては、前述と同様のpHでよい。またこの溶液には、前述の緩衝液を用いることができる。この緩衝液にも同様にタンパク質分解酵素阻害剤を添加することができる。
【0022】
本発明の一実施形態である、サイクリン依存性キナーゼの活性測定方法は、試料中のサイクリン依存性キナーゼの酵素活性により、アデノシン5’−O−(3−チオトリホスフェート)を用いて、サイクリン依存性キナーゼの基質タンパク質にチオール基を導入する工程と、アミノ基に結合する保護物質の存在下で、チオール基が導入された基質タンパク質と、チオール基に結合する標識物質とを反応させる工程と、標識物質で標識された基質タンパク質を検出する工程と、検出工程で得られた検出結果に基づいて、サイクリン依存性キナーゼの活性を測定する工程とを含む。
【0023】
本実施形態で用いられる試料は、生体細胞からサイクリン依存性キナーゼの活性を測定するために調製された試料であることが好ましい。生体細胞は、組織サンプル(バイオプシーサンプルや外科切除サンプル等)のようなヒトを含む動物由来の細胞を用いるのが好ましい。
サイクリン依存性キナーゼ(以下CDKという)は、細胞質中に存在しており、核内のサイクリンと結合する。そして、サイクリン依存性キナーゼとサイクリンとの複合体(以下、活性型CDKという)を形成し、活性化状態となる。よって活性測定の対象となるCDKは細胞の内部に含まれている。このため測定するための試料を調製するときには、細胞膜及び核膜を破壊し、CDKを試料中に遊離させた状態で存在させることが好ましい。つまりCDKと基質タンパク質との反応を行う前に、生体細胞に対して可溶化処理を行うことが好ましい。
【0024】
可溶化処理は、生体細胞に可溶化処理用の緩衝液(以下細胞可溶化液とする)を添加して行うことが好ましい。この緩衝液は前述と同様のものを用いることができる。細胞可溶化液には、界面活性剤、タンパク質分解酵素阻害剤や脱リン酸化酵素阻害剤などを含有させることができる。具体的な可溶化処理の方法としては、細胞可溶化液を細胞に添加し、ワーリングブレンダーによる粉砕処理、シリンジによる吸引排出処理又は超音波処理を行う。これにより、生体細胞に対して可溶化処理を行うことができる。
【0025】
界面活性剤は、細胞膜及び核膜を破壊して細胞内物質を取り出すために用いられる。ただし、活性型CDKを分解させない程度の界面活性を有するものが用いられる。例えば、ノニデットP−40、TritonX−100、デオキシコール酸又はCHAPSなどが挙げられる。界面活性剤濃度は、1w/v%以下が好ましい。
【0026】
タンパク質分解酵素阻害剤は、破壊された細胞膜や核膜などの細胞内物質が混在するとき、タンパク質であるCDKやサイクリン分子が破壊されるのを防ぐために用いられる。例えば、EDTA、EGTAのようなメタロプロテアーゼ阻害剤、PMSF、トリプシンインヒビター、キモトリプシンのようなセリンプロテアーゼ阻害剤又はヨードアセトアミド、E−64のようなシステインプロテアーゼ阻害剤などが挙げられる。また、プロテアーゼ阻害剤カクテル(シグマ社)のようなそれらタンパク質分解酵素阻害剤を予め混合した市販品も挙げられる。
【0027】
脱リン酸化酵素阻害剤は、細胞に含まれる脱リン酸化酵素が、測定対象の酵素の活性を低下させることを防ぐ目的で用いられる。例えば、セリン/スレオニン脱リン酸化酵素阻害剤(フッ化ナトリウムなど)、チロシン脱リン酸化酵素阻害剤(オルトバナジン酸ナトリウムなど)などが挙げられる。溶解緩衝液にはこれらの脱リン酸化酵素阻害剤を単独又は混合して用いることができる。
【0028】
本実施形態のCDKとは、具体的には、CDK1、CDK2、CDK3、CDK4、CDK5、CDK6、CDK7及びCDK8等が例示される。
【0029】
可溶化処理を行った細胞から測定目的の活性型CDKを抽出する方法として、例えば免疫沈降法がある。免疫沈降法では、目的の各種CDK1〜8のいずれか一つに特異性を有する抗CDK抗体が用いられる。
【0030】
より詳細には、所定量のタンパク質を含む細胞可溶化液に、測定目的の活性型CDKに対応する抗CDK抗体と、その抗CDK抗体を捕捉するための材料としてプロテインA、プロテインGまたは抗ウサギIgG抗体をコートしたセファロースビーズとの懸濁液を0〜10℃で1〜2時間反応させる。これらビーズは不溶性なので、ビーズに結合した抗CDK抗体とCDKの複合体は不溶性となり沈降する。このビーズを回収することで測定目的の活性型CDKを抽出することができる。
【0031】
本実施形態で用いられる基質タンパク質は、活性測定の対象となる酵素の基質となるものであれば特に限定されない。例えば、活性測定の対象となる酵素がCDK1又はCDK2である場合、基質タンパク質としては、ヒストンH1又は網膜芽細胞腫タンパク質(Retinoblastoma Protein:以下Rbとする)を用いることが好ましい。また、酵素がCDK4又はCDK6である場合は、基質タンパク質としてRbを用いることが好ましい。この基質タンパク質は、硫黄原子を含まないアミノ酸(システイン及びメチオニン以外のアミノ酸)から構成されるタンパク質が好ましい。Rbのようなシステイン残基を含むタンパク質は、システイン残基をアラニンなどの硫黄原子を含まないアミノ酸に置換して用いることが好ましい。基質中のシステイン又はメチオニン残基を、硫黄原子を含まないアミノ酸に置換する方法としては、PCR法や部分点突然変異法などの公知の方法を用いて行うことができる。
【0032】
本実施形態においてCDKの基質タンパク質にチオール基を導入する工程は、活性型CDKの存在下で、CDKの基質タンパク質とATP−γSとを反応させることにより行われる。通常、活性型CDKの存在下では、以下の(化1)に示すように、ATP由来のモノリン酸基が、基質タンパク質のセリン又はスレオニン残基に導入される。本実施形態では、ATPの代わりにATP−γSを用いている。よって、活性型CDKの存在下で、基質タンパク質のセリン又はスレオニン残基にATP−γS由来のチオリン酸基が導入される。これにより、基質タンパク質にチオール基を導入することができる。
【0033】
【化1】

【0034】
本実施形態の保護物質の存在下で、チオール基が導入された基質タンパク質と、標識物質とを反応させる際の反応は、前述のpHと同様でよい。またこの反応において、前述の緩衝液を用いることができる。この緩衝液にも同様にタンパク質分解酵素阻害剤などを添加することができる。
さらにこの反応は、10分〜2時間でチオール基標識反応を行うことができる。この反応で用いられる標識物質及び保護物質の量は、前述と同様の量を添加すればよい。またこの反応は遊離のチオールを添加することで停止される。
【0035】
標識された基質タンパク質を検出する方法としては、蛍光標識物質からの蛍光を検出する方法や、酵素との反応により生成した蛍光物質からの蛍光を検出する方法が挙げられる。具体的な方法については前述に記載の方法と同様である。これにより、目的物質である基質タンパク質を検出することができる。
【0036】
本実施形態の活性の測定は、蛍光標識物質又は反応によって生成した蛍光物質の量を測定し、予め作製した検量線にあてはめて、活性型CDKの活性値が算出される。
予め作製する検量線は、チオール基を導入した既知量の基質タンパク質を用いて作製するのが好ましい。また蛍光標識物質又は酵素との反応に対する挙動が、チオール基を導入した基質タンパク質と同様であることが知られているビオチン化アクチン等が代わりに用いられてもよい。その際、活性型CDKの活性値はビオチン化アクチン等の量から換算される必要がある。
【実施例】
【0037】
本実施例では、チオール基標識方法及び試薬を用いたサイクリン依存性キナーゼの活性測定方法について説明する。
【0038】
実施例(チオール基標識方法を用いたCDK2の活性測定)
〔活性測定用試料の調製〕
50mL遠沈管に、細胞数が1×108から1×109であるK562(白血病由来の培養細胞)を加えた。ここに細胞可溶化液(0.1w/v%NP−40(界面活性剤ノニデットP−40)、50mMのトリス緩衝液(pH7.4)、5mM EDTA、50mMのフッ化ナトリウム、1mMのオルトバナジン酸ナトリウム及び1×プロテアーゼ阻害剤カクテル(Roche社)を含む)を、2×107個の細胞数に対し1mLの割合で加えた。
次に、ピペッティングにより細胞を可溶化し、2mLのエッペンドルフチューブに2mLずつ分注した。これらのチューブを遠心分離(4℃、15000rpm、5分間)にかけ、上清を回収し、これを測定用試料とした。
なお、この測定用試料中に含まれる全タンパク質量をDCタンパク質キット(Bio−Rad社)で測定した。
【0039】
〔測定試料中のCDK2の捕捉〕
96穴フィルタープレートの親水性PVDFメンブレン(ミリポア社)の各ウェルに、免疫沈降用緩衝液(0.1w/v%NP−40及び50mMトリス緩衝液(pH7.4)を含む)を70μL加えた。
ここに抗CDK2抗体を8μgとプロテインAをコートした50v/v%セファロースビーズ(GEヘルスケア社)を30μL加えた。これにより、セファロースビーズと抗CDK2抗体とを結合させた。
次に、測定用試料を、ウェル内の全タンパク質の濃度が23μg/150μLとなるように調節して、ウェル内に加えた。そして前記プレートを4℃で2時間振盪した。これにより、測定試料中のCDK2と、抗CDK2抗体とを反応させた。
反応後、ウェル内のビーズを、ビーズ洗浄液A(1w/v% NP−40及び50mMトリス緩衝液(pH7.4)を含む)で二回洗浄した。次にビーズ洗浄液B(300mM NaCl及び50mM トリス緩衝液(pH7.4)を含む)で一回洗浄した。そしてビーズ洗浄液C(50mMトリス緩衝液(pH7.4)を含む)で一回洗浄した。
【0040】
〔チオール基の導入〕
ウェル内のビーズに、CDKの基質溶液(10μgヒストンH1(カルビオケム社)、2mM ATP−γS(カルビオケム社)、54mM トリス緩衝液(pH=7.4)、20mM 塩化マグネシウム、0.1% TritonX−100を含む)を加えた。基質溶液は、ウェルに収容した混合液の総量が50μLとなるように調節して加えた。これを37℃で30分間振盪してキナーゼ反応を行い、ヒストンH1にチオール基を導入した。キナーゼ反応後、遠心分離(2000rpm、5分間)を行い、上清を回収した。
【0041】
〔蛍光標識試薬の調製〕
蛍光標識試薬A及びBを調製した。蛍光標識試薬Aは、287mM トリス緩衝液(pH7.4)、1.03mM 5−ヨードアセトアミドフルオロセイン(以下5−IAFという)、4.8mM EDTA、4.3%DMSOを含む溶液に、N−ヒドロキシスクシンイミドエステルの濃度がそれぞれ1、10、40mMとなるように添加したものである。
蛍光標識試薬Bは、287mM MOPS−NaOH(pH7.4)、1.03mM 5−IAF、4.8mM EDTA、4.3%DMSOを含む溶液に、N−ヒドロキシスクシンイミドエステルの濃度がそれぞれ1、10mMとなるように添加したものである。
【0042】
なお、バックグラウンド測定用として、抗CDK2抗体の代わりに、ウサギIgG抗体を用いて同様の操作を行った。これにより、セファロースビーズとウサギIgG抗体とを結合させた。
【0043】
〔蛍光標識反応〕
チオール基を導入したヒストンH1を含む、上記回収した上清に、蛍光標識試薬A又はBを加え、遮光条件下で25℃、20分間振盪した。これにより、ヒストンH1に導入されたチオール基の硫黄原子に、5−IAFを結合させた。標識反応後、5−IAFとチオール基との結合反応を停止するために、N−アセチルシステインを加えた。
次に、反応停止後の試料を48μL(5−IAFが結合した基質タンパク質1.76μgを含む)採取した。ここにトリス緩衝生理食塩水(25mMトリス緩衝液(pH=7.4)、150mM NaClを含む)を180μL加えて希釈した。
希釈したサンプル200μLを、96穴フィルタープレートの疎水性PVDFメンブレン(ミリポア社製)の各ウェルにブロッティングした。
このメンブレンを200μLのメンブレン洗浄液(25mMトリス緩衝液(pH=7.4)、150mM NaClを含む)で2回洗浄した。洗浄後、メンブレンの各ウェルにバックグラウンド低減用のブロッキング溶液(4w/v% BSA、25mMトリス緩衝液(pH=7.4)及び150mM NaClを含む)を加えた。
その後、蛍光プレートリーダーInfiniteF−200(テカン社製)を用いて、フィルタープレートの蛍光強度を測定した。蛍光強度は蛍光カウント値(単位はCNT)として表される。
【0044】
比較例
比較例では、蛍光標識試薬A又はBにおいて、N−スクシンイミジルエステルを加えない試薬を用いた以外は実施例と同様にして蛍光強度の測定を行った。
【0045】
結果
実施例及び比較例において測定された蛍光強度のグラフを図1(蛍光標識試薬A)及び図2(蛍光標識試薬B)に示す。バックグラウンド値は、IgG抗体を用いて測定した蛍光強度である。CDK2活性値は、抗CDK2抗体を用いて測定した蛍光強度からバックグラウンド値を差し引いた値である。またS/N比(シグナル/ノイズ比)は、CDK2活性値をバックグラウンド値で除した値である。
なおグラフは、比較例で測定された蛍光強度の蛍光カウント値を100%としたときの相対値で示す。
【0046】
図1及び図2より、蛍光標識試薬A及びBのいずれにおいても、NHSを加えたとき(実施例)は、NHSを加えなかったとき(比較例)よりも、バックグラウンドが低減していることを確認できた。またNHSを加えたときでも、CDK2の活性値が低下することはなかった。
そして、NHSを加えたときはNHSを加えなかったときよりも、S/N比が向上していることが確認できた。
以上より、実施例の方法によって、従来よりも特異的にチオール基を標識でき、正確にチオール基が導入されたヒストンH1タンパク質を定量できる。
【図面の簡単な説明】
【0047】
【図1】実施例及び比較例においてトリス緩衝液を用いて測定された蛍光強度のグラフである。
【図2】実施例及び比較例においてMOPS緩衝液を用いて測定された蛍光強度のグラフである。
【特許請求の範囲】
【請求項1】
アミノ基に結合する保護物質の存在下で、目的物質とチオール基に結合する標識物質とを反応させることを特徴とする、チオール基標識方法。
【請求項2】
前記目的物質がアミノ酸、ペプチド、タンパク質、核酸、Sオリゴ、又はペプチド核酸である、請求項1に記載の方法。
【請求項3】
前記保護物質がアミノ基と共有結合するための官能基を有する請求項1又は2のいずれかに記載の方法。
【請求項4】
アミノ基と共有結合する官能基が、スクシンイミド又はイソチオシアネートである、請求項3に記載の方法。
【請求項5】
前記保護物質が、N−ヒドロキシスクシンイミジルエステルである、請求項1〜4のいずれかに記載の方法。
【請求項6】
前記標識物質が、チオール基と共有結合するための官能基を有する、請求項1〜5のいずれかに記載の方法。
【請求項7】
チオール基と共有結合する官能基が、アルキルハライド、アリールハライド、マレイミド又はアジリジンである、請求項6に記載の方法。
【請求項8】
前記標識物質が、5−ヨードアセトアミドフルオレセインである、請求項1〜7のいずれかに記載の方法。
【請求項9】
チオール基に結合する標識物質が、蛍光標識物質又は酵素標識物質である、請求項1〜8のいずれかに記載の方法。
【請求項10】
前記反応がpH6.5〜8.5で行われる、請求項1〜9のいずれかに記載の方法。
【請求項11】
チオール基に結合する標識物質で目的物質を標識する試薬であって、
アミノ基に結合する保護物質と、チオール基に結合する標識物質とを含有する溶液を含むことを特徴とする、チオール基標識用試薬。
【請求項12】
前記溶液のpHが6.5〜8.5である、請求項11に記載の試薬。
【請求項13】
前記保護物質が、N−ヒドロキシスクシンイミジルエステルである、請求項11又は12のいずれかに記載の試薬。
【請求項14】
前記標識物質が、5−ヨードアセトアミドフルオレセインである、請求項11〜13のいずれかに記載の試薬。
【請求項15】
試料中のサイクリン依存性キナーゼの酵素活性により、アデノシン5’−O−(3−チオトリホスフェート)を用いて、サイクリン依存性キナーゼの基質タンパク質にチオール基を導入する工程と、
アミノ基に結合する保護物質の存在下で、チオール基が導入された基質タンパク質と、チオール基に結合する標識物質とを反応させる工程と、
標識物質で標識された基質タンパク質を検出する工程と、
検出工程で得られた検出結果に基づいて、サイクリン依存性キナーゼの活性を測定する工程とを含む、サイクリン依存性キナーゼの活性測定方法。
【請求項16】
前記保護物質が、N−ヒドロキシスクシンイミジルエステルである、請求項15に記載の方法。
【請求項17】
前記標識物質が、5−ヨードアセトアミドフルオレセインである、請求項15又は16のいずれかに記載の方法。
【請求項18】
反応工程が、pH6.5〜8.5で行われる、請求項15〜17のいずれかに記載の方法。
【請求項1】
アミノ基に結合する保護物質の存在下で、目的物質とチオール基に結合する標識物質とを反応させることを特徴とする、チオール基標識方法。
【請求項2】
前記目的物質がアミノ酸、ペプチド、タンパク質、核酸、Sオリゴ、又はペプチド核酸である、請求項1に記載の方法。
【請求項3】
前記保護物質がアミノ基と共有結合するための官能基を有する請求項1又は2のいずれかに記載の方法。
【請求項4】
アミノ基と共有結合する官能基が、スクシンイミド又はイソチオシアネートである、請求項3に記載の方法。
【請求項5】
前記保護物質が、N−ヒドロキシスクシンイミジルエステルである、請求項1〜4のいずれかに記載の方法。
【請求項6】
前記標識物質が、チオール基と共有結合するための官能基を有する、請求項1〜5のいずれかに記載の方法。
【請求項7】
チオール基と共有結合する官能基が、アルキルハライド、アリールハライド、マレイミド又はアジリジンである、請求項6に記載の方法。
【請求項8】
前記標識物質が、5−ヨードアセトアミドフルオレセインである、請求項1〜7のいずれかに記載の方法。
【請求項9】
チオール基に結合する標識物質が、蛍光標識物質又は酵素標識物質である、請求項1〜8のいずれかに記載の方法。
【請求項10】
前記反応がpH6.5〜8.5で行われる、請求項1〜9のいずれかに記載の方法。
【請求項11】
チオール基に結合する標識物質で目的物質を標識する試薬であって、
アミノ基に結合する保護物質と、チオール基に結合する標識物質とを含有する溶液を含むことを特徴とする、チオール基標識用試薬。
【請求項12】
前記溶液のpHが6.5〜8.5である、請求項11に記載の試薬。
【請求項13】
前記保護物質が、N−ヒドロキシスクシンイミジルエステルである、請求項11又は12のいずれかに記載の試薬。
【請求項14】
前記標識物質が、5−ヨードアセトアミドフルオレセインである、請求項11〜13のいずれかに記載の試薬。
【請求項15】
試料中のサイクリン依存性キナーゼの酵素活性により、アデノシン5’−O−(3−チオトリホスフェート)を用いて、サイクリン依存性キナーゼの基質タンパク質にチオール基を導入する工程と、
アミノ基に結合する保護物質の存在下で、チオール基が導入された基質タンパク質と、チオール基に結合する標識物質とを反応させる工程と、
標識物質で標識された基質タンパク質を検出する工程と、
検出工程で得られた検出結果に基づいて、サイクリン依存性キナーゼの活性を測定する工程とを含む、サイクリン依存性キナーゼの活性測定方法。
【請求項16】
前記保護物質が、N−ヒドロキシスクシンイミジルエステルである、請求項15に記載の方法。
【請求項17】
前記標識物質が、5−ヨードアセトアミドフルオレセインである、請求項15又は16のいずれかに記載の方法。
【請求項18】
反応工程が、pH6.5〜8.5で行われる、請求項15〜17のいずれかに記載の方法。
【図1】


【図2】




【図2】


【公開番号】特開2010−51289(P2010−51289A)
【公開日】平成22年3月11日(2010.3.11)
【国際特許分類】
【出願番号】特願2008−222624(P2008−222624)
【出願日】平成20年8月29日(2008.8.29)
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
【公開日】平成22年3月11日(2010.3.11)
【国際特許分類】
【出願日】平成20年8月29日(2008.8.29)
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
[ Back to top ]

