チロシン脱リン酸化酵素のペプチド基質およびチロシン脱リン酸化酵素の阻害作用を有するペプチド
【課題】本発明は、チロシンの脱リン酸化酵素SHP2の新規基質を提供すること、そして当該基質を用いたSHP2酵素活性を変動させる物質のスクリーニング方法を提供することを課題とする。さらに本発明は、SHP2の新規阻害剤を提供することを課題とする
【解決手段】チロシンキナーゼ受容体Ephファミリー分子のリン酸化チロシンを含む部分ペプチドが、SHP2の酵素学的反応において基質として作用し得る。当該リン酸化チロシンを含むペプチドを用いたSHP2酵素活性を変動させる物質のスクリーニング方法による。また、Ephファミリー分子のチロシンを含む部分ペプチドにおいて、チロシンをリン酸以外のもので修飾したペプチドが、SHP2酵素活性の阻害作用を有することによる。
【解決手段】チロシンキナーゼ受容体Ephファミリー分子のリン酸化チロシンを含む部分ペプチドが、SHP2の酵素学的反応において基質として作用し得る。当該リン酸化チロシンを含むペプチドを用いたSHP2酵素活性を変動させる物質のスクリーニング方法による。また、Ephファミリー分子のチロシンを含む部分ペプチドにおいて、チロシンをリン酸以外のもので修飾したペプチドが、SHP2酵素活性の阻害作用を有することによる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、チロシンキナーゼ受容体Ephファミリー分子の部分ペプチドからなるチロシン脱リン酸化酵素SHP2のペプチド基質、当該ペプチド基質を用いたSHP2酵素活性測定方法、当該基質を用いたSHP2酵素活性を変動させる物質のスクリーニング方法、およびこれらの方法に用いるためのキットに関する。また本発明は、チロシンキナーゼ受容体Ephファミリー分子の部分アミノ酸配列からなるペプチド、当該ペプチドを有効成分とするチロシン脱リン酸化酵素SHP2阻害剤、当該ペプチドを有効成分とする医薬組成物に関する。
【背景技術】
【0002】
リン酸化セリン、スレオニンまたはチロシンの脱リン酸化酵素は、一般に情報伝達を抑制する機能を有しているが、このうちチロシン脱リン酸化酵素SHP2(protein tyrosine phsophatase non-receptor type 11:PTPN11)は情報伝達を促進させるユニークな機能が知られている。
【0003】
SHP2は、種々の疾患に関連していることが予想されている。ヘリコバクターピロリ菌による細胞増殖時の低分子量GTP結合タンパク質Rasの活性化と癌化にSHP2が重要な役割を担っていると予想されている(非特許文献1,2)。また、先天性心疾患を有するヌーナン症候群の原因としてSHP2の変異(優勢変異により脱リン酸化酵素活性が増加する変異)が同定されている(非特許文献3,4)。
【0004】
いずれの病態においてもSHP2の生体内基質が同定されておらず、病態解明が進まない状況である。SHP2が何らかの機構を介してRasを活性化すると考えられているが、SHP2がいかにしてRasの活性化を起こすのかは明らかにされていない。SHP2の基質候補として、細胞接着班キナーゼ(focal adhesin kinase, FAK)、Sprouty(Ras−MAPK(Mitogen-activated protein kinase)の抑制分子)あるいは血小板由来増殖因子受容体(PDGF受容体)が挙げられてきたが(非特許文献5,6,7)、いずれもSHP2のRas−MAPKの活性化を論理的に十分説明できるものでない。また、SHP2の酵素活性測定の基質としては、Srcペプチドが用いられている(特許文献1)。SHP2生体内基質が判明すれば、SHP2機能を阻害する薬剤等の同定が可能となるため、SHP2基質の解明は重要な課題である。
【0005】
チロシンキナーゼ受容体であるEphは、細胞膜表面に存在するephrinのレセプターおよびリガンドとして機能する。Ephファミリー分子は、結合するephrinリガンドへの親和性に基づいて定義され、A群及びB群に大別されている(A群:A1〜A8、A10、B群:B1〜B4、B6)。Ephは、軸索経路の探索、接着融合や集合(神経管閉鎖、血管新生など)といった胚発生上の重要なプロセス調節に寄与していることが知られている。また、一部の癌発生、種々の炎症性疾患との関係も指摘されている。
【0006】
EphAのエピトープペプチドが、免疫応答の増強に用いられ得ることが開示されている(特許文献2)。また、EphB2のペプチドが炎症細胞の化学遊走調節剤として用いられ、血管形成に関連することが開示されている(特許文献3)。また、Ephの部分ペプチドが、タンパク質チロシン脱リン酸化酵素PTPROの基質となることが報告されている(非特許文献8)。
【特許文献1】特開2006−158247
【特許文献2】特表2007−527225
【特許文献3】特表2008−514618
【非特許文献1】Hatakeyama, M. (2004) Nat.Rev.Cancer 4, 688-694
【非特許文献2】Mohi, M. G. and Neel, B. G. (2007) Curr.Opin.Genet.Dev. 17, 23-30
【非特許文献3】Maheshwari, M., Belmont, J., Fernbach, S., Ho, T., Molinari, L., Yakub, I., Yu, F., Combes, A., Towbin, J., Craigen, W. J., and Gibbs, R. (2002) Hum.Mutat. 20, 298-304
【非特許文献4】Nakamura, T., Colberlt, M., Krenz M., Molkentin, J. D., Hahn, H. S., Dorn, G. W., and Robbins, J.(2007) J. Clin. Invest 117, 2123-2132
【非特許文献5】Hanafusa, H., Torii, S., Yasunaga, T., and Nishida, E. (2002) Nat.Cell Biol. 4, 850-858
【非特許文献6】Tsutsumi, R., Takahashi, A., Azuma, T., Higashi, H., and Hatakeyama, M. (2006) Mol.Cell Biol. 26, 261-276
【非特許文献7】Nakata S, Fujita N, Kitagawa Y, Okamoto R, Ogita H, Takai Y., (2007) J Biol Chem. 282(52), 37815-25
【非特許文献8】Shintani T, Ihara M, Sakuta H, Takahashi H, Watakabe I, Noda M., (2006) Nat Neurosci. 9(6), 761-9
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明は、チロシンの脱リン酸化酵素SHP2の新規基質を提供すること、当該基質を用いたSHP2酵素活性を変動させる物質のスクリーニング方法を提供することを課題とする。さらに本発明は、SHP2の新規阻害剤を提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは上記課題を解決するために鋭意検討を重ね、チロシンキナーゼ受容体Ephファミリー分子のリン酸化チロシンを含む部分ペプチドが、SHP2の酵素学的反応において基質として作用すること、当該リン酸化チロシンを含むペプチドを用いてSHP2酵素活性を変動させる物質のスクリーニング方法を行い得ることを見出し、本発明を完成した。また、Ephファミリー分子のチロシンを含む部分ペプチドにおいて、チロシンをリン酸以外のもので修飾することにより、当該ペプチドがSHP2の阻害剤として作用することを見出し、本発明を完成した。
【0009】
すなわち、本発明は以下よりなる。
1.一般式(I):Tyr−Glu−X6―Pro(配列番号1)で表されるアミノ酸配列を少なくとも含むチロシンキナーゼ受容体Ephファミリー分子の部分アミノ酸配列からなるペプチド又はその塩:
式中、X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
チロシン(Tyr)の水酸基が以下の群より選択されるいずれか1の置換基により、修飾されている;スルホ基、バナジン酸基、炭酸基、ハロゲニド基、亜燐酸基、クロム酸基、シュウ酸基、酢酸基、硝酸基、ヘキサン酸基、セバシン酸基、モリブデン酸基、タングステン酸基、シアノ基、ハロゲン原子、カルバモイル基、メルカプト基、炭素数1〜6個のアルキルチオ基、炭素数1〜6個のアルカンスルフィニル基、炭素数1〜6個のアルカンスルホニル基、複素環基、炭素数3〜8個のシクロアルキル基、アミノ基、アミノアリル基、ピリジル基、ピラジル基、ピラジニル基、ピリダジニル基、イミダゾリル基、ピラゾリル基、ピペリジル基、ピペラジニル基、モルホリニル基、アミジノ基、グアニジノ基、カルボキシル基、または、テトラゾリル基、あるいは、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていない炭素数1〜6個のアルキル基、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていないアリール基、または、上記の何れかに記載の置換基もしくは水酸基で置換されたアラルキル基。
2.下記の一般式(II)で表されるアミノ酸配列を含むチロシンキナーゼ受容体Ephファミリー分子の部分アミノ酸配列からなるペプチド又はその塩:
X1−X2−X3−X4−X5―Tyr−Glu−X6―Pro―X7(配列番号2)
式中、X1はバリン、イソロイシン、アラニンから選択されるいずれか1のアミノ酸残基であり、
X2はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X3はプロリンまたはロイシンのいずれかのアミノ酸残基であり、
X4はグルタミン、ヒスチジン、フェニルアラニン、アスパラギン酸、グルタミン酸、セリンから選択されるいずれか1のアミノ酸残基であり、
X5はアラニンまたはスレオニンのいずれかのアミノ酸残基であり、
X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X7はアラニン、アスパラギン、スレオニン、セリン、グリシン、システインから選択されるいずれか1のアミノ酸残基であり、
チロシン(Tyr)の水酸基が以下の群より選択されるいずれか1の置換基により、修飾されている;スルホ基、バナジン酸基、炭酸基、ハロゲニド基、亜燐酸基、クロム酸基、シュウ酸基、酢酸基、硝酸基、ヘキサン酸基、セバシン酸基、モリブデン酸基、タングステン酸基、シアノ基、ハロゲン原子、カルバモイル基、メルカプト基、炭素数1〜6個のアルキルチオ基、炭素数1〜6個のアルカンスルフィニル基、炭素数1〜6個のアルカンスルホニル基、複素環基、炭素数3〜8個のシクロアルキル基、アミノ基、アミノアリル基、ピリジル基、ピラジル基、ピラジニル基、ピリダジニル基、イミダゾリル基、ピラゾリル基、ピペリジル基、ピペラジニル基、モルホリニル基、アミジノ基、グアニジノ基、カルボキシル基、または、テトラゾリル基、あるいは、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていない炭素数1〜6個のアルキル基、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていないアリール基、または、上記の何れかに記載の置換基もしくは水酸基で置換されたアラルキル基。
3.前項1または2に記載のペプチドまたはその塩を有効成分とする、チロシン脱リン酸化酵素SHP2阻害剤。
4.前項1または2に記載のペプチドまたはその塩を有効成分とする、チロシン脱リン酸化酵素SHP2の作用増強により誘発または促進される疾患の治療または予防剤。
5.前項1または2に記載のペプチドまたはその塩を有効成分とする、医薬組成物。
6.一般式(I):Tyr−Glu−X6―Pro(配列番号1)で表されるアミノ酸配列を含むチロシンキナーゼ受容体Ephファミリー分子の部分ペプチドからなる、チロシン脱リン酸化酵素SHP2のペプチド基質:
式中、X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
チロシン(Tyr)がリン酸化されている。
7.下記一般式(II)で表されるアミノ酸配列を含むチロシンキナーゼ受容体Ephファミリー分子の部分ペプチドからなる、チロシン脱リン酸化酵素SHP2のペプチド基質:
X1−X2−X3−X4−X5―Tyr−Glu−X6―Pro―X7(配列番号2)
式中、
X1はバリン、イソロイシン、アラニンから選択されるいずれか1のアミノ酸残基であり、
X2はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X3はプロリンまたはロイシンのいずれかのアミノ酸残基であり、
X4はグルタミン、ヒスチジン、フェニルアラニン、アスパラギン酸、グルタミン酸、セリンから選択されるいずれか1のアミノ酸残基であり、
X5はアラニンまたはスレオニンのいずれかのアミノ酸残基であり、
X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X7はアラニン、アスパラギン、スレオニン、セリン、グリシン、システインから選択されるいずれか1のアミノ酸残基であり、
チロシン(Tyr)がリン酸化されている。
8.チロシン脱リン酸化酵素SHP2を含み得る試料と、前項6または7に記載のペプチド基質とを接触させることを含む、SHP2酵素活性の測定方法。
9.前項6または7に記載のペプチド基質および反応バッファーを含む、SHP2酵素活性を測定するためのキット。
10.被験者由来の検体からチロシン脱リン酸化酵素SHP2を含む画分を調製する工程;
前記画分と、前項6または7に記載のペプチド基質とを接触させて、SHP2酵素活性を測定する工程;
測定された酵素活性の値を基準値と比較する工程;
を含む、被験者由来の検体についてのSHP2酵素活性の検査方法。
11.チロシン脱リン酸化酵素SHP2と、前項6または7に記載のペプチド基質とを、被検物質の存在下で接触させてSHP2酵素活性を測定する工程;
被検物質の存在下でのSHP2酵素活性が、前記被検物質の非存在下でのSHP2酵素活性と比較して、変化した場合に当該被検物質を選択する工程;
を含む、SHP2酵素活性を変動させる物質のスクリーニング方法。
12.チロシン脱リン酸化酵素SHP2、前項6または7に記載のペプチド基質、および反応バッファーを含む、SHP2酵素活性を変動させる物質のスクリーニングキット。
【発明の効果】
【0010】
本発明のペプチド基質により、SHP2酵素活性を特異的に測定することが可能となった。また、本発明のペプチド基質を用いたスクリーニング方法により、SHP2酵素活性の促進剤もしくは阻害剤を選択することができる。
また、チロシンがリン酸以外のもので修飾された本発明のペプチド(以下、「修飾ペプチド」とも称する)により、SHP2酵素活性を有効に阻害することが可能となり、SHP2酵素活性が増強されることに起因して誘発または促進される疾患の病態が緩和されるものと期待される。
【発明を実施するための最良の形態】
【0011】
チロシン脱リン酸化酵素SHP2は、Srcタンパク質チロシンキナーゼにおいて同定された約100アミノ酸からなる保存領域Srcホモロジードメイン2(SH2ドメイン)を2つと、触媒作用を有する脱リン酸化酵素ドメインを有する。これらの2つのSH2ドメインは、SHP2脱リン酸化酵素の制御において、異なる機能を有している。アミノ末端側のSH2ドメインは制御および補充ドメインとして働き、脱リン酸化酵素ドメインと相互作用することにより自己阻害効果を生み出す。すなわち、アミノ末端側のSH2ドメインが脱リン酸化酵素ドメインと相互作用することにより、SHP2は不活性型となる。カルボキシル末端側のSH2ドメインはシグナルの変換に必要な分子間相互作用のために、他のタンパク質を補充する作用を有する。
【0012】
野生型のSHP2は、アミノ末端SH2ドメインが脱リン酸化酵素ドメインと相互作用しており、折畳まれた状態であり、不活性型で存在する。かかるアミノ末端のSH2ドメインが、血小板由来増殖因子受容体(platelet-derived growth factor receptor:PDGFR)、インスリン受容体基質(Insulin receptor substrate:IRS)、繊維芽細胞増殖因子受容体基質(fibroblast growth factor receptor substrate:FRS)、Gab蛋白などに結合することにより、折畳み構造が解消され、活性型になる。SHP2の恒常的活性化型の変異体(例えば、SHP2 D61Y(配列番号11))は、折り畳まれずに存在すると考えられ、アミノ末端側のSH2ドメインに、何らかのタンパク質が結合しなくても、高い酵素活性を示すと考えられている。
【0013】
チロシンキナーゼ受容体であるEphファミリー分子は、A群及びB群に大別されている(A群:A1〜A8、B群:B1〜B4、B6)。EphA1はGenBank Accession番号NP_005223.3に示されており、EphA2はGenBank Accession番号NP_004422.2、EphA3はGenBank Accession番号NP_005224.2、EphA4はGenBank Accession番号NP_004429.1、EphA5はGenBank Accession番号NP_004430.3、EphA6はGenBank Accession番号NP_001073917.2、EphA7はGenBank Accession番号NP_004431.1、EphA8はGenBank Accession番号NP_065387.1、EphB1はGenBank Accession番号NP_004432.1、EphB2はGenBank Accession番号NP_004433.2、EphB3はGenBank Accession番号NP_004434.2、EphB4はGenBank Accession番号NP_004435.3、EphB5は、GenBank Accession番号NP_001004387.1、EphB6は、GenBank Accession番号NP_004436.1に示されている。
【0014】
Ephファミリー分子に保存されている細胞膜近傍の2つのリン酸化チロシン(EphA2における588番目と、594番目のリン酸化チロシン)をそれぞれ含むペプチドについて、SHP2の基質となり得るかどうかについて解析を行ったところ、カルボキシ末端側の594番目のリン酸化チロシンを含むペプチドがSHP2の基質となることが判明した。
【0015】
(SHP2酵素のペプチド基質)
EphA2における594番目のリン酸化チロシンを含むペプチドが、SHP2の基質として酵素学的反応に使用可能である。かかるペプチドは、一般式(I):Tyr−Glu−X6―Pro(配列番号1)で表わされるアミノ酸配列を含むペプチドであり、好ましくは、一般式(II):X1−X2−X3−X4−X5―Tyr−Glu−X6―Pro―X(配列番号2)で表わされるアミノ酸配列を含むペプチドである。
式中、X1はバリン、イソロイシン、アラニンから選択されるいずれか1のアミノ酸残基であり、
X2はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X3はプロリンまたはロイシンのいずれかのアミノ酸残基であり、
X4はグルタミン、ヒスチジン、フェニルアラニン、アスパラギン酸、グルタミン酸、セリンから選択されるいずれか1のアミノ酸残基であり、
X5はアラニンまたはスレオニンのいずれかのアミノ酸残基であり、
X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X7はアラニン、アスパラギン、スレオニン、セリン、グリシン、システインから選択されるいずれか1のアミノ酸残基である。
一般式(II)のアミノ酸配列は、EphA2のアミノ酸配列の589〜598番目に相当するものであり、一般式(I)のアミノ酸配列は、Eph2のアミノ酸配列の594〜597番目に相当する。一般式(I)および(II)中のチロシン(Tyr)はEphA2のアミノ酸配列において594番目に相当する。また、当該チロシンはリン酸化されていることが必要である。ペプチドのアミノ末端にはアミノ保護基が付加されていてもよい。なお、一般式(II)のアミノ酸配列は、EphA1のアミノ酸配列の600〜609番目に相当し、EphA3およびEphA4のアミノ酸配列の597〜606番目、EphA5のアミノ酸配列の629〜638番目、EphA6のアミノ酸配列の701〜710番目、EphA7およびEphA8のアミノ酸配列の609〜618番目、EphB1のアミノ酸配列の595〜604番目、EphB2のアミノ酸配列の597〜606番目、EphB3のアミノ酸配列の609〜618番目、EphB4のアミノ酸配列の591〜600番目、EphB6のアミノ酸配列の631〜640番目に相当する。
【0016】
本発明のペプチド基質は、4個〜30個、好ましくは6個〜25個、さらに好ましくは、8個〜12個のアミノ酸からなる。
【0017】
好ましくは、一般式(I)および(II)において、X1はバリン、イソロイシン、アラニンから選択されるいずれか1のアミノ酸残基であり、
X2はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X3はプロリンであるアミノ酸残基であり、
X4はヒスチジン、フェニルアラニン、アスパラギン酸、グルタミン酸、セリンから選択されるいずれか1のアミノ酸残基であり、
X5はスレオニンであるアミノ酸残基であり、
X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X7はアスパラギン、スレオニン、セリン、グリシン、システインから選択されるいずれか1のアミノ酸残基である。
【0018】
さらに好ましくは、一般式(I)および(II)において、X1はバリンであり、X2はアスパラギン酸であり、X3はプロリンであり、X4はヒスチジンであり、X5はスレオニンであり、X6はアスパラギン酸であり、X7はアスパラギンである。
【0019】
本発明のペプチド基質は、自体公知のペプチド合成法により製造することができる。ペプチドの合成法としては、例えば固相合成法、液相合成法の何れによって行ってもよく、即ち、ペプチドを構成しうる部分ペプチド鎖もしくはアミノ酸と残余部分とを縮合させ、生成物が保護基を有する場合には保護基を脱離させることにより目的のペプチドを製造することができる。
例えば、ペプチド基質はFmoc固相合成法により、連続フロー方式の自動合成機を用いて化学合成することができる。アミノ酸は、側鎖が保護基により保護された誘導体を使用し、固相担体上でペプチド鎖の伸長を行う。酸性条件下にて、脱保護・切り出しを行い、粗ペプチドを回収する。
【0020】
このようにして得られたペプチドは、通常の精製方法、例えば溶媒抽出;蒸留;カラムクロマトグラフィー;液体クロマトグラフィー;再結晶等を組み合わせて単離精製することができる。
例えば、逆相HPLCを用いて、粗ペプチドの分離・精製を行うことができる。逆相カラムは、ODSカラム(スペルコ社製:C18)を使用して、移動相は水/アセトニトリル系(TFA添加、0.1%)を使用することができる。精製を行ったペプチドは、凍結乾燥して保存することができる(白色粉末、もしくはオイル状)。なお、逆相HPLCにて純度を測定可能であり、TOF−MASSにて分子量測定が可能であり、電子天秤により重量測定して、品質管理が可能である。
また、上記方法で得られたペプチドが遊離体である場合には公知の方法によって適当な塩に変換可能であり、逆に塩で得られた場合には、公知の方法によって遊離体に変換することも可能である。
Sigma−Aldrich社などに合成を委託してペプチドを得ることも可能である。
【0021】
(SHP2酵素活性の測定方法)
上記ペプチド基質と、チロシン脱リン酸化酵素SHP2を含み得る試料とを接触させることにより、SHP2酵素活性を測定することが可能である。
【0022】
チロシン脱リン酸化酵素SHP2を含み得る試料とは、SHP2を含む可能性があればいかなる試料でもよく、例えば、ヒトの血液や体液から調製した画分や、遺伝子組換え技術などで作製したタンパク質を回収した溶液などを含む。
反応バッファーは適宜使用可能であるが、反応バッファーのpHは6.5〜8.5であることが好ましく、7〜8であることがさらに好ましい。反応バッファーとして、例えば、最終濃度で10mM Tris(pH7.4)、5mM DTTを含む溶液を用いることができる。所望により、反応バッファーには、その他の成分、例えばSHP2のアミノ末端側のSH2ドメインに結合するタンパク質からなるSHP2の活性化剤を混合することも可能である。かかる活性化剤としては、IRSpY1172(IRS−1の1172番目のチロシンがリン酸化されたもの)などが挙げられる。IRSpY1172は、Pluskeyら(J Biol Chem. 1995 Feb 17;270(7):2897-900:「IRS-1 pY1172」)に記載の方法により調製することができる。
【0023】
当該試料とペプチド基質を、前記反応バッファー中で所定の時間、反応させる。反応条件は適宜決定することができるが、室温で、15分〜1時間反応させればよい。反応終了後、反応液中に遊離したリン酸を自体公知の方法により測定する。例えば、遊離リン酸を測定する方法にはモリブデン法や、マラカイトグリーン(例えば、BIOMOL GREENTM(BIOMOL社製))を使用する方法がある。マラカイトグリーンを使用した場合は、波長620nmの吸収を測定すればよい。試料についての測定値を、標準(酵素活性が判明している試料)についての測定値と比較することにより、試料中の酵素活性を算出することができる。
【0024】
また、ペプチド基質を含む試薬が本発明の範囲に包含される。さらに、本発明のペプチド基質と、反応バッファー等の必要な試薬を含むものを、SHP2酵素活性測定用キットとして提供することもできる。キット中、ペプチド基質とバッファーは別個の容器に入った状態で提供されてもよいし、2以上の試薬を混合した状態で提供されてもよい。
【0025】
(SHP2酵素活性の検査方法)
上記SHP2酵素活性の測定方法を用いて、被験者の生体内でのSHP2酵素活性を予測し、疾患との関連性を評価することが可能である。
かかるSHP2酵素活性の検査方法には、被験者由来の検体からチロシン脱リン酸化酵素SHP2を含む画分を調製する工程;前記画分とペプチド基質とを接触させ、SHP2酵素活性を測定する工程;前記測定結果を基準値と比較する工程;が含まれる。
【0026】
検体とは、哺乳類等から採取され、例えば、血液、血清、糞便、尿、精液、喀痰、唾液、鼻汁、脳脊髄液、涙等の各種体液、又は、脳、結腸、尿生殖器、肺、腎臓、造血組織、乳房、胸腺、精巣、 卵巣、子宮組織等の各種組織、あるいはこれらに含まれる細胞群が挙げられる。検体からSHP2を含むと予測される画分を調製し、これを本発明の検査方法に使用する。当該画分の調製方法は、自体公知の方法を使用すればよい。
【0027】
前記画分とペプチド基質とを接触させSHP2酵素活性を測定し、前記測定結果を基準値と比較することにより、被験者生体内でのSHP2の酵素活性の状態を予測することができる。基準値とは、SHP2酵素活性と疾患とを関連付ける値であり、検体の採取された被験者が疾患と関連があるかないかを判断するために使用される数値もしくは数値範囲である。例えば、基準値とは、SHP2の酵素活性に関連する疾患を有さない健常者におけるSHP2酵素活性レベルの数値範囲であり、予め設定されていてもよい。
【0028】
(SHP2酵素活性を変動させる物質のスクリーニング方法)
SHP2ペプチド基質を用いて、SHP2の酵素活性を変動させる物質をスクリーニングすることが可能である。具体的には、チロシン脱リン酸化酵素SHP2とペプチド基質とを、被検物質の存在下で接触させてSHP2酵素活性を測定する工程;前記被検物質の非存在下でのSHP2酵素活性と比較して、被検物質の有無によりSHP2酵素活性が変化した場合に当該被検物質を選択する工程;を含む方法である。
SHP2酵素活性を変動させる物質とは、SHP2酵素活性を促進もしくは阻害する作用を有する物質である。被検物質の存在下でのSHP2酵素活性が、被検物質の非存在下でのSHP2酵素活性より低下した場合は、当該被検物質を阻害剤として選択することができる。逆に、被検物質の存在下でのSHP2酵素活性が、被検物質の非存在下でのSHP2酵素活性より上昇した場合は、当該被検物質を促進剤として選択することができる。
【0029】
本スクリーニング方法において、SHP2は野生型SHP2、変異型SHP2を適宜用いることが可能である。SHP2は、自体公知の遺伝子工学的な手法を用いて作製することが可能である。ヒトSHP2の塩基配列はGenBankのAccession No.NM_002834(アミノ酸配列は、GenBankのAccession No.NP_002825)に示されている。また、市販のSHP2を使用することも可能である(例えば、SignalChem社:PTPN11 (SHP2), Active:カタログNo.P38-21G、exalpha社:Recombinant SHP-2 (224.529)/PTPN11 Active Enzyme:カタログNo.X1663E)。変異型SHP2は、後述する実施例2に記載のものを使用することができる。
【0030】
さらに本発明は、スクリーニング方法に用いるためのスクリーニングキットにも関する。当該キットには、ペプチド基質、SHP2タンパク質、反応バッファー等の試薬を含み、これらの試薬は別個の容器に入って提供されてもよいし、2以上の試薬を適宜混合した状態で提供されてもよい。
【0031】
本スクリーニング方法もしくはスクリーニングキットを用いて選択される物質はSHP2の酵素活性を変動させる物質であり、SHP2酵素活性に関連する疾患の治療剤もしくは予防剤として使用することができる。かかる疾患の例として、胃癌、ヌーナン症候群、肥満関連疾患、白血病、レパード症候群などが挙げられる。本スクリーニング方法またはスクリーニングキットにより選択され得る物質として、以下に記載するSHP2酵素活性の阻害作用を有する修飾ペプチドが例示される。
【0032】
(修飾ペプチド)
EphA2における594番目のチロシンを含み、当該チロシンの水酸基がリン酸以外の基により修飾されているEphの部分ペプチド(以下、「修飾ペプチド」とも称する)が、SHP2の阻害剤として作用する。かかるペプチドは、一般式(I)Tyr−Glu−X6―Pro(配列番号1)で表わされるアミノ酸配列を含むペプチドであり、好ましくは、一般式(II):X1−X2−X3−X4−X5―Tyr−Glu−X6―Pro―X(配列番号2)で表わされるアミノ酸配列を含むペプチドである。
式中、X1はバリン、イソロイシン、アラニンから選択されるいずれか1のアミノ酸残基であり、
X2はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X3はプロリンまたはロイシンのいずれかのアミノ酸残基であり、
X4はグルタミン、ヒスチジン、フェニルアラニン、アスパラギン酸、グルタミン酸、セリンから選択されるいずれか1のアミノ酸残基であり、
X5はアラニンまたはスレオニンのいずれかのアミノ酸残基であり、
X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X7はアラニン、アスパラギン、スレオニン、セリン、グリシン、システインから選択されるいずれか1のアミノ酸残基である。
【0033】
また、当該ペプチドにおいて、チロシン(Tyr)の水酸基が以下の群より選択されるいずれか1の置換基により、修飾されていることが必要である;スルホ基、バナジン酸基、炭酸基、ハロゲニド基、亜燐酸基、クロム酸基、シュウ酸基、酢酸基、硝酸基、ヘキサン酸基、セバシン酸基、モリブデン酸基、タングステン酸基、シアノ基、ハロゲン原子、カルバモイル基、メルカプト基、炭素数1〜6個のアルキルチオ基、炭素数1〜6個のアルカンスルフィニル基、炭素数1〜6個のアルカンスルホニル基、複素環基、炭素数3〜8個のシクロアルキル基、アミノ基、アミノアリル基、ピリジル基、ピラジル基、ピラジニル基、ピリダジニル基、イミダゾリル基、ピラゾリル基、ピペリジル基、ピペラジニル基、モルホリニル基、アミジノ基、グアニジノ基、カルボキシル基、または、テトラゾリル基、あるいは、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていない炭素数1〜6個のアルキル基、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていないアリール基、または、上記の何れかに記載の置換基もしくは水酸基で置換されたアラルキル基。
好ましくは、チロシンの水酸基は、スルホ基もしくはバナジン酸基により修飾されており、さらに好ましくは、スルホ基により修飾されている。
【0034】
一般式(II)のアミノ酸配列は、EphA2のアミノ酸配列の589〜598番目に相当するものであり、一般式(I)のアミノ酸配列は、Eph2のアミノ酸配列の594〜597番目に相当する。一般式(I)および(II)中のチロシン(Tyr)はEphA2のアミノ酸配列において594番目に相当する。また、当該チロシンはリン酸化されていることが必要である。ペプチドのアミノ末端にはアミノ保護基が付加されていてもよい。なお、一般式(II)のアミノ酸配列は、EphA1のアミノ酸配列の600〜609番目に相当し、EphA3およびEphA4のアミノ酸配列の597〜606番目、EphA5のアミノ酸配列の629〜638番目、EphA6のアミノ酸配列の701〜710番目、EphA7およびEphA8のアミノ酸配列の609〜618番目、EphB1のアミノ酸配列の595〜604番目、EphB2のアミノ酸配列の597〜606番目、EphB3のアミノ酸配列の609〜618番目、EphB4のアミノ酸配列の591〜600番目、EphB6のアミノ酸配列の631〜640番目に相当する。
【0035】
本発明の修飾ペプチドは、4個〜30個、好ましくは6個〜25個、さらに好ましくは、8個〜12個のアミノ酸からなる。
【0036】
好ましくは、一般式Iにおいて、X1はバリン、イソロイシン、アラニンから選択されるいずれか1のアミノ酸残基であり、
X2はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X3はプロリンであるアミノ酸残基であり、
X4はヒスチジン、フェニルアラニン、アスパラギン酸、グルタミン酸、セリンから選択されるいずれか1のアミノ酸残基であり、
X5はスレオニンであるアミノ酸残基であり、
X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X7はアスパラギン、スレオニン、セリン、グリシン、システインから選択されるいずれか1のアミノ酸残基である。
【0037】
さらに好ましくは、一般式Iにおいて、X1はバリンであり、X2はアスパラギン酸であり、X3はプロリンであり、X4はヒスチジンであり、X5はスレオニンであり、X6はアスパラギン酸であり、X7はアスパラギンである。
【0038】
本発明の修飾ペプチドは、自体公知のペプチド合成法により製造することができる。ペプチドの合成法としては、例えば固相合成法、液相合成法の何れによって行ってもよく、即ち、ペプチドを構成しうる部分ペプチド鎖もしくはアミノ酸と残余部分とを縮合させ、生成物が保護基を有する場合には保護基を脱離させることにより目的のペプチドを製造することができる。
例えば、本発明の修飾ペプチドはFmoc固相合成法により、連続フロー方式の自動合成機を用いて化学合成することができる。アミノ酸は、側鎖が保護基により保護された誘導体を使用し、固相担体上でペプチド鎖の伸長を行う。酸性条件下にて、脱保護・切り出しを行い、粗ペプチドを回収する。
【0039】
このようにして得られたペプチドは、通常の精製方法、例えば溶媒抽出;蒸留;カラムクロマトグラフィー;液体クロマトグラフィー;再結晶等を組み合わせて単離精製することができる。
例えば、逆相HPLCを用いて、粗ペプチドの分離・精製を行うことができる。逆相カラムは、ODSカラム(スペルコ社製:C18)を使用して、移動相は水/アセトニトリル系(TFA添加、0.1%)を使用することができる。精製を行ったペプチドは、凍結乾燥して、保存することができる(白色粉末、もしくはオイル状)。なお、逆相HPLCにて純度を測定可能であり、TOF−MASSにて分子量測定が可能であり、電子天秤により重量測定して、品質管理が可能である。
また、上記方法で得られたペプチドが遊離体である場合には公知の方法によって適当な塩に変換可能であり、逆に塩で得られた場合には、公知の方法によって遊離体に変換することも可能である。
Sigma−Aldrich社などに合成を委託してペプチドを得ることも可能である。
【0040】
本発明の修飾ペプチドまたはその塩は、SHP2阻害剤として作用する。本発明の修飾ペプチドまたはその塩は、SHP2の酵素活性が増強することにより誘発または促進される疾患の治療剤または予防剤として使用することができる。当該疾患として、胃癌もしくはヌーナン症候群、白血病などが挙げられる。
【0041】
本発明の修飾ペプチドまたはその塩を医薬組成物として用いる場合には、通常、それ自体公知の薬理学的に許容される担体、賦形剤、希釈剤、増量剤、崩壊剤、安定剤、保存剤、緩衝剤、乳化剤、芳香剤、着色剤、甘味剤、粘稠剤、矯味剤、溶解補助剤、その他の添加剤、具体的には水、植物油、エタノール又はベンジルアルコールのようなアルコール、ポリエチレングリコール、グリセロールトリアゼテートゼラチン、ラクトース、デンプン等のような炭水化物、ステアリン酸マグネシウム、タルク、ワセリン等と混合して錠剤、カプセル剤、エリキシル剤、マイクロカプセル剤、注射剤、液剤、懸濁剤等の形態により経口又は非経口的に投与することができる。
また、本発明の修飾ペプチドは、ヒト用医薬としての使用は勿論、他の哺乳動物用医薬としても使用可能である。投与量は疾患の種類及び程度、投与するペプチド並びに投与経路、患者の年齢、性別、体重等により変わりうるが、注射剤の形での投与の場合、通常、成人1日当たり、約0.1〜30mgを投与するのが好ましい。また、本発明のペプチドは上記各種対象疾患の予防、治療の為に単独で投与する以外に、該疾患の予防、治療に有用な別の薬剤と併用することもできる。
【実施例】
【0042】
以下、実施例により本発明を説明するが、本発明はこれらに限定されるものではない。
【0043】
(実施例1)ペプチド基質の調製
ペプチド基質の候補であるJX1およびJX2(それぞれY(Tyr)がリン酸化されている)を、Sigma−aldrich社に委託して合成し、作製した。本ペプチドを1mMの濃度になるように水に溶かし、−80℃に保存した。
JX1:PLKTYVDPHT(配列番号3)
JX2:VDPHTYEDPN(配列番号4)
【0044】
(実施例2)SHP2酵素の調製
MycタグをC末端に付加した下記(a)〜(e)の各種SHP2酵素を発現するプラスミドをlipofectamine2000(Invitrogen社)を用いたトランスフェクションによりMDCK細胞に導入した。40時間培養後に細胞を溶解し、protein A−セファロースおよび抗myc抗体を用いた免疫沈降法により各種SHP2を調製した。酵素は4℃にて保存した。
(a)SHP2 T468M(配列番号5):レパード症候群の患者で検出される変異体。酵素活性が低い。
(b)SHP2 C/S(C459S)(配列番号7):不活性型。酵素活性なし。基質との複合体形成能有り。ただし(c)SHP2 DMより複合体形成能は弱い。
(c)SHP2 DM(2箇所の置換がある。D425A/C459S)(配列番号9):不活性型。酵素活性なし。基質との複合体形成能有り。
(d)SHP2 D61Y(配列番号11):活性化型の変異体。高い酵素活性を示す。白血病の患者で検出される。
(e)SHP2 wt(配列番号13):野生型。
【0045】
(実施例3)酵素活性の測定
96ウェルプレート1ウェルあたり10μlの基質(最終濃度0.25mM)、20μlの反応バッファー(最終濃度10mM Tris pH7.4、5mM DTT)および10μlの酵素(最終濃度100ng/ml)を加え、室温にて30分間、反応させる。その後マラカイトグリーンを等量加え、遊離したリン酸とマラカイトグリーンの反応によって生じる波長620nmの吸収をプレートリーダーにて測定した。基質としてJX1またはJX2、酵素として野生型SHP2を使用した。IRSpY1172(IRS−1の1172番目のチロシンがリン酸化されたもの)を、野生型酵素の活性化剤として使用した。
【0046】
その結果を図1に示す。JX2がSHP2の特異的な基質となることが判明した。
【0047】
(実施例4)酵素活性の測定
実施例3と同様の方法により、基質としてJX2を用い、酵素として(a)〜(e)のSHP2を用いて、IRSpY1172の存在下、もしくは非存在下で酵素活性を測定した。
【0048】
その結果を図2に示す。SHP2の野生型およびSHP2 D61Y(高い酵素活性を示す)では酵素活性が認められた。一方、不活性型の変異型(SHP2 T468M、SHP2 C/S、SHP2 DM)では酵素活性が認められなかった。
【0049】
(実施例5)修飾ペプチドの調製
JX2−Sペプチド(Y(Tyr)にスルホ基が付加されている)を、Sigma−aldrich社に委託して合成し、作製した。本ペプチドを1mMの濃度になるように水に溶かし、−80℃に保存した。
JX2−S:VDPHTYEDPN(配列番号15)
【0050】
(実施例6)酵素活性の測定
SHP2D61YとJX2−S(0,30,100,300μM)とTBSを混合して、10分間、室温でインキュベートした。その後、基質としてJX2(200μM)を添加して、30分間、室温でインキュベートした。その後、等量のBIOMOL GREENTMを添加して10分間、室温でインキュベートし、波長620nmの吸収を測定した。
【0051】
その結果を、図3に示す。JX2−Sペプチドの量が増加するにつれて、酵素活性が阻害された。
【0052】
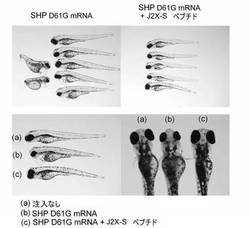
(実施例7)ゼブラフィッシュにおける実験
Jopling Cらの方法(PLoS Genet. 2007 Dec;3(12):e225)に従って、ゼブラフィッシュの受精卵にヒトSHP2 mRNA変異体(SHP2 D61G mRNA)(配列番号25)をマイクロインジェクションし、個体発生過程における心臓の形態変化を観察した。また、JX2−Sペプチドを、SHP2 D61G mRNAの注入と同時に受精卵に注入した。
なお、SHP2 D61Gは、ヌーナン症候群で検出される弱い活性化型である。
【0053】
その結果、SHP2 D61G mRNAのみを注入した場合は、ゼブラフィッシュに心臓の異常、目が小さいなどの病態が発症していたが、JX2−Sペプチドの投与によりこれらの病態が抑えられることがわかった。
なお、SHP2 D61Y(強い活性化型)のmRNAを注入した場合は、心臓が形成される前に胚発生が異常を示し、ゼブラフィッシュ全体が正常な形態ではなくなった(データは示さず)。
【産業上の利用可能性】
【0054】
上記説明したとおり、本発明のEphの部分ペプチドからなるペプチド基質は、SHP2酵素の特異的に作用する。かかる基質をSHP2酵素活性に関連する疾患についての簡便な検査方法、SHP2酵素活性の阻害剤もしくは促進剤のスクリーニング方法に用いることが可能である。スクリーニング方法により得られたSHP2阻害剤もしくは促進剤は、SHP2酵素活性に関連する疾患の予防剤もしくは治療剤として使用され得、有用である。また、本発明の修飾ペプチドは、生体内でSHP2酵素の活性を阻害して、SHP2酵素活性の上昇により発症すると考えられる症状を抑制する。かかる修飾ペプチドは、SHP2酵素活性の上昇により発症する病態の治療剤として使用することが期待され、有用である。
【図面の簡単な説明】
【0055】
【図1】ペプチド基質のSHP2酵素に対する特異性に関する結果を示す。(実施例3)
【図2】ペプチド基質の機能を確認した結果を示す。(実施例4)
【図3】修飾ペプチドのSHP2阻害作用を確認した結果を示す。(実施例6)
【図4】修飾ペプチドのゼブラフィッシュ生体内での作用を確認した結果を示す。(実施例7)
【図5】Ephファミリー分子の部分アミノ酸配列についてのアライメントを示す図である。
【技術分野】
【0001】
本発明は、チロシンキナーゼ受容体Ephファミリー分子の部分ペプチドからなるチロシン脱リン酸化酵素SHP2のペプチド基質、当該ペプチド基質を用いたSHP2酵素活性測定方法、当該基質を用いたSHP2酵素活性を変動させる物質のスクリーニング方法、およびこれらの方法に用いるためのキットに関する。また本発明は、チロシンキナーゼ受容体Ephファミリー分子の部分アミノ酸配列からなるペプチド、当該ペプチドを有効成分とするチロシン脱リン酸化酵素SHP2阻害剤、当該ペプチドを有効成分とする医薬組成物に関する。
【背景技術】
【0002】
リン酸化セリン、スレオニンまたはチロシンの脱リン酸化酵素は、一般に情報伝達を抑制する機能を有しているが、このうちチロシン脱リン酸化酵素SHP2(protein tyrosine phsophatase non-receptor type 11:PTPN11)は情報伝達を促進させるユニークな機能が知られている。
【0003】
SHP2は、種々の疾患に関連していることが予想されている。ヘリコバクターピロリ菌による細胞増殖時の低分子量GTP結合タンパク質Rasの活性化と癌化にSHP2が重要な役割を担っていると予想されている(非特許文献1,2)。また、先天性心疾患を有するヌーナン症候群の原因としてSHP2の変異(優勢変異により脱リン酸化酵素活性が増加する変異)が同定されている(非特許文献3,4)。
【0004】
いずれの病態においてもSHP2の生体内基質が同定されておらず、病態解明が進まない状況である。SHP2が何らかの機構を介してRasを活性化すると考えられているが、SHP2がいかにしてRasの活性化を起こすのかは明らかにされていない。SHP2の基質候補として、細胞接着班キナーゼ(focal adhesin kinase, FAK)、Sprouty(Ras−MAPK(Mitogen-activated protein kinase)の抑制分子)あるいは血小板由来増殖因子受容体(PDGF受容体)が挙げられてきたが(非特許文献5,6,7)、いずれもSHP2のRas−MAPKの活性化を論理的に十分説明できるものでない。また、SHP2の酵素活性測定の基質としては、Srcペプチドが用いられている(特許文献1)。SHP2生体内基質が判明すれば、SHP2機能を阻害する薬剤等の同定が可能となるため、SHP2基質の解明は重要な課題である。
【0005】
チロシンキナーゼ受容体であるEphは、細胞膜表面に存在するephrinのレセプターおよびリガンドとして機能する。Ephファミリー分子は、結合するephrinリガンドへの親和性に基づいて定義され、A群及びB群に大別されている(A群:A1〜A8、A10、B群:B1〜B4、B6)。Ephは、軸索経路の探索、接着融合や集合(神経管閉鎖、血管新生など)といった胚発生上の重要なプロセス調節に寄与していることが知られている。また、一部の癌発生、種々の炎症性疾患との関係も指摘されている。
【0006】
EphAのエピトープペプチドが、免疫応答の増強に用いられ得ることが開示されている(特許文献2)。また、EphB2のペプチドが炎症細胞の化学遊走調節剤として用いられ、血管形成に関連することが開示されている(特許文献3)。また、Ephの部分ペプチドが、タンパク質チロシン脱リン酸化酵素PTPROの基質となることが報告されている(非特許文献8)。
【特許文献1】特開2006−158247
【特許文献2】特表2007−527225
【特許文献3】特表2008−514618
【非特許文献1】Hatakeyama, M. (2004) Nat.Rev.Cancer 4, 688-694
【非特許文献2】Mohi, M. G. and Neel, B. G. (2007) Curr.Opin.Genet.Dev. 17, 23-30
【非特許文献3】Maheshwari, M., Belmont, J., Fernbach, S., Ho, T., Molinari, L., Yakub, I., Yu, F., Combes, A., Towbin, J., Craigen, W. J., and Gibbs, R. (2002) Hum.Mutat. 20, 298-304
【非特許文献4】Nakamura, T., Colberlt, M., Krenz M., Molkentin, J. D., Hahn, H. S., Dorn, G. W., and Robbins, J.(2007) J. Clin. Invest 117, 2123-2132
【非特許文献5】Hanafusa, H., Torii, S., Yasunaga, T., and Nishida, E. (2002) Nat.Cell Biol. 4, 850-858
【非特許文献6】Tsutsumi, R., Takahashi, A., Azuma, T., Higashi, H., and Hatakeyama, M. (2006) Mol.Cell Biol. 26, 261-276
【非特許文献7】Nakata S, Fujita N, Kitagawa Y, Okamoto R, Ogita H, Takai Y., (2007) J Biol Chem. 282(52), 37815-25
【非特許文献8】Shintani T, Ihara M, Sakuta H, Takahashi H, Watakabe I, Noda M., (2006) Nat Neurosci. 9(6), 761-9
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明は、チロシンの脱リン酸化酵素SHP2の新規基質を提供すること、当該基質を用いたSHP2酵素活性を変動させる物質のスクリーニング方法を提供することを課題とする。さらに本発明は、SHP2の新規阻害剤を提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは上記課題を解決するために鋭意検討を重ね、チロシンキナーゼ受容体Ephファミリー分子のリン酸化チロシンを含む部分ペプチドが、SHP2の酵素学的反応において基質として作用すること、当該リン酸化チロシンを含むペプチドを用いてSHP2酵素活性を変動させる物質のスクリーニング方法を行い得ることを見出し、本発明を完成した。また、Ephファミリー分子のチロシンを含む部分ペプチドにおいて、チロシンをリン酸以外のもので修飾することにより、当該ペプチドがSHP2の阻害剤として作用することを見出し、本発明を完成した。
【0009】
すなわち、本発明は以下よりなる。
1.一般式(I):Tyr−Glu−X6―Pro(配列番号1)で表されるアミノ酸配列を少なくとも含むチロシンキナーゼ受容体Ephファミリー分子の部分アミノ酸配列からなるペプチド又はその塩:
式中、X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
チロシン(Tyr)の水酸基が以下の群より選択されるいずれか1の置換基により、修飾されている;スルホ基、バナジン酸基、炭酸基、ハロゲニド基、亜燐酸基、クロム酸基、シュウ酸基、酢酸基、硝酸基、ヘキサン酸基、セバシン酸基、モリブデン酸基、タングステン酸基、シアノ基、ハロゲン原子、カルバモイル基、メルカプト基、炭素数1〜6個のアルキルチオ基、炭素数1〜6個のアルカンスルフィニル基、炭素数1〜6個のアルカンスルホニル基、複素環基、炭素数3〜8個のシクロアルキル基、アミノ基、アミノアリル基、ピリジル基、ピラジル基、ピラジニル基、ピリダジニル基、イミダゾリル基、ピラゾリル基、ピペリジル基、ピペラジニル基、モルホリニル基、アミジノ基、グアニジノ基、カルボキシル基、または、テトラゾリル基、あるいは、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていない炭素数1〜6個のアルキル基、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていないアリール基、または、上記の何れかに記載の置換基もしくは水酸基で置換されたアラルキル基。
2.下記の一般式(II)で表されるアミノ酸配列を含むチロシンキナーゼ受容体Ephファミリー分子の部分アミノ酸配列からなるペプチド又はその塩:
X1−X2−X3−X4−X5―Tyr−Glu−X6―Pro―X7(配列番号2)
式中、X1はバリン、イソロイシン、アラニンから選択されるいずれか1のアミノ酸残基であり、
X2はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X3はプロリンまたはロイシンのいずれかのアミノ酸残基であり、
X4はグルタミン、ヒスチジン、フェニルアラニン、アスパラギン酸、グルタミン酸、セリンから選択されるいずれか1のアミノ酸残基であり、
X5はアラニンまたはスレオニンのいずれかのアミノ酸残基であり、
X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X7はアラニン、アスパラギン、スレオニン、セリン、グリシン、システインから選択されるいずれか1のアミノ酸残基であり、
チロシン(Tyr)の水酸基が以下の群より選択されるいずれか1の置換基により、修飾されている;スルホ基、バナジン酸基、炭酸基、ハロゲニド基、亜燐酸基、クロム酸基、シュウ酸基、酢酸基、硝酸基、ヘキサン酸基、セバシン酸基、モリブデン酸基、タングステン酸基、シアノ基、ハロゲン原子、カルバモイル基、メルカプト基、炭素数1〜6個のアルキルチオ基、炭素数1〜6個のアルカンスルフィニル基、炭素数1〜6個のアルカンスルホニル基、複素環基、炭素数3〜8個のシクロアルキル基、アミノ基、アミノアリル基、ピリジル基、ピラジル基、ピラジニル基、ピリダジニル基、イミダゾリル基、ピラゾリル基、ピペリジル基、ピペラジニル基、モルホリニル基、アミジノ基、グアニジノ基、カルボキシル基、または、テトラゾリル基、あるいは、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていない炭素数1〜6個のアルキル基、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていないアリール基、または、上記の何れかに記載の置換基もしくは水酸基で置換されたアラルキル基。
3.前項1または2に記載のペプチドまたはその塩を有効成分とする、チロシン脱リン酸化酵素SHP2阻害剤。
4.前項1または2に記載のペプチドまたはその塩を有効成分とする、チロシン脱リン酸化酵素SHP2の作用増強により誘発または促進される疾患の治療または予防剤。
5.前項1または2に記載のペプチドまたはその塩を有効成分とする、医薬組成物。
6.一般式(I):Tyr−Glu−X6―Pro(配列番号1)で表されるアミノ酸配列を含むチロシンキナーゼ受容体Ephファミリー分子の部分ペプチドからなる、チロシン脱リン酸化酵素SHP2のペプチド基質:
式中、X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
チロシン(Tyr)がリン酸化されている。
7.下記一般式(II)で表されるアミノ酸配列を含むチロシンキナーゼ受容体Ephファミリー分子の部分ペプチドからなる、チロシン脱リン酸化酵素SHP2のペプチド基質:
X1−X2−X3−X4−X5―Tyr−Glu−X6―Pro―X7(配列番号2)
式中、
X1はバリン、イソロイシン、アラニンから選択されるいずれか1のアミノ酸残基であり、
X2はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X3はプロリンまたはロイシンのいずれかのアミノ酸残基であり、
X4はグルタミン、ヒスチジン、フェニルアラニン、アスパラギン酸、グルタミン酸、セリンから選択されるいずれか1のアミノ酸残基であり、
X5はアラニンまたはスレオニンのいずれかのアミノ酸残基であり、
X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X7はアラニン、アスパラギン、スレオニン、セリン、グリシン、システインから選択されるいずれか1のアミノ酸残基であり、
チロシン(Tyr)がリン酸化されている。
8.チロシン脱リン酸化酵素SHP2を含み得る試料と、前項6または7に記載のペプチド基質とを接触させることを含む、SHP2酵素活性の測定方法。
9.前項6または7に記載のペプチド基質および反応バッファーを含む、SHP2酵素活性を測定するためのキット。
10.被験者由来の検体からチロシン脱リン酸化酵素SHP2を含む画分を調製する工程;
前記画分と、前項6または7に記載のペプチド基質とを接触させて、SHP2酵素活性を測定する工程;
測定された酵素活性の値を基準値と比較する工程;
を含む、被験者由来の検体についてのSHP2酵素活性の検査方法。
11.チロシン脱リン酸化酵素SHP2と、前項6または7に記載のペプチド基質とを、被検物質の存在下で接触させてSHP2酵素活性を測定する工程;
被検物質の存在下でのSHP2酵素活性が、前記被検物質の非存在下でのSHP2酵素活性と比較して、変化した場合に当該被検物質を選択する工程;
を含む、SHP2酵素活性を変動させる物質のスクリーニング方法。
12.チロシン脱リン酸化酵素SHP2、前項6または7に記載のペプチド基質、および反応バッファーを含む、SHP2酵素活性を変動させる物質のスクリーニングキット。
【発明の効果】
【0010】
本発明のペプチド基質により、SHP2酵素活性を特異的に測定することが可能となった。また、本発明のペプチド基質を用いたスクリーニング方法により、SHP2酵素活性の促進剤もしくは阻害剤を選択することができる。
また、チロシンがリン酸以外のもので修飾された本発明のペプチド(以下、「修飾ペプチド」とも称する)により、SHP2酵素活性を有効に阻害することが可能となり、SHP2酵素活性が増強されることに起因して誘発または促進される疾患の病態が緩和されるものと期待される。
【発明を実施するための最良の形態】
【0011】
チロシン脱リン酸化酵素SHP2は、Srcタンパク質チロシンキナーゼにおいて同定された約100アミノ酸からなる保存領域Srcホモロジードメイン2(SH2ドメイン)を2つと、触媒作用を有する脱リン酸化酵素ドメインを有する。これらの2つのSH2ドメインは、SHP2脱リン酸化酵素の制御において、異なる機能を有している。アミノ末端側のSH2ドメインは制御および補充ドメインとして働き、脱リン酸化酵素ドメインと相互作用することにより自己阻害効果を生み出す。すなわち、アミノ末端側のSH2ドメインが脱リン酸化酵素ドメインと相互作用することにより、SHP2は不活性型となる。カルボキシル末端側のSH2ドメインはシグナルの変換に必要な分子間相互作用のために、他のタンパク質を補充する作用を有する。
【0012】
野生型のSHP2は、アミノ末端SH2ドメインが脱リン酸化酵素ドメインと相互作用しており、折畳まれた状態であり、不活性型で存在する。かかるアミノ末端のSH2ドメインが、血小板由来増殖因子受容体(platelet-derived growth factor receptor:PDGFR)、インスリン受容体基質(Insulin receptor substrate:IRS)、繊維芽細胞増殖因子受容体基質(fibroblast growth factor receptor substrate:FRS)、Gab蛋白などに結合することにより、折畳み構造が解消され、活性型になる。SHP2の恒常的活性化型の変異体(例えば、SHP2 D61Y(配列番号11))は、折り畳まれずに存在すると考えられ、アミノ末端側のSH2ドメインに、何らかのタンパク質が結合しなくても、高い酵素活性を示すと考えられている。
【0013】
チロシンキナーゼ受容体であるEphファミリー分子は、A群及びB群に大別されている(A群:A1〜A8、B群:B1〜B4、B6)。EphA1はGenBank Accession番号NP_005223.3に示されており、EphA2はGenBank Accession番号NP_004422.2、EphA3はGenBank Accession番号NP_005224.2、EphA4はGenBank Accession番号NP_004429.1、EphA5はGenBank Accession番号NP_004430.3、EphA6はGenBank Accession番号NP_001073917.2、EphA7はGenBank Accession番号NP_004431.1、EphA8はGenBank Accession番号NP_065387.1、EphB1はGenBank Accession番号NP_004432.1、EphB2はGenBank Accession番号NP_004433.2、EphB3はGenBank Accession番号NP_004434.2、EphB4はGenBank Accession番号NP_004435.3、EphB5は、GenBank Accession番号NP_001004387.1、EphB6は、GenBank Accession番号NP_004436.1に示されている。
【0014】
Ephファミリー分子に保存されている細胞膜近傍の2つのリン酸化チロシン(EphA2における588番目と、594番目のリン酸化チロシン)をそれぞれ含むペプチドについて、SHP2の基質となり得るかどうかについて解析を行ったところ、カルボキシ末端側の594番目のリン酸化チロシンを含むペプチドがSHP2の基質となることが判明した。
【0015】
(SHP2酵素のペプチド基質)
EphA2における594番目のリン酸化チロシンを含むペプチドが、SHP2の基質として酵素学的反応に使用可能である。かかるペプチドは、一般式(I):Tyr−Glu−X6―Pro(配列番号1)で表わされるアミノ酸配列を含むペプチドであり、好ましくは、一般式(II):X1−X2−X3−X4−X5―Tyr−Glu−X6―Pro―X(配列番号2)で表わされるアミノ酸配列を含むペプチドである。
式中、X1はバリン、イソロイシン、アラニンから選択されるいずれか1のアミノ酸残基であり、
X2はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X3はプロリンまたはロイシンのいずれかのアミノ酸残基であり、
X4はグルタミン、ヒスチジン、フェニルアラニン、アスパラギン酸、グルタミン酸、セリンから選択されるいずれか1のアミノ酸残基であり、
X5はアラニンまたはスレオニンのいずれかのアミノ酸残基であり、
X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X7はアラニン、アスパラギン、スレオニン、セリン、グリシン、システインから選択されるいずれか1のアミノ酸残基である。
一般式(II)のアミノ酸配列は、EphA2のアミノ酸配列の589〜598番目に相当するものであり、一般式(I)のアミノ酸配列は、Eph2のアミノ酸配列の594〜597番目に相当する。一般式(I)および(II)中のチロシン(Tyr)はEphA2のアミノ酸配列において594番目に相当する。また、当該チロシンはリン酸化されていることが必要である。ペプチドのアミノ末端にはアミノ保護基が付加されていてもよい。なお、一般式(II)のアミノ酸配列は、EphA1のアミノ酸配列の600〜609番目に相当し、EphA3およびEphA4のアミノ酸配列の597〜606番目、EphA5のアミノ酸配列の629〜638番目、EphA6のアミノ酸配列の701〜710番目、EphA7およびEphA8のアミノ酸配列の609〜618番目、EphB1のアミノ酸配列の595〜604番目、EphB2のアミノ酸配列の597〜606番目、EphB3のアミノ酸配列の609〜618番目、EphB4のアミノ酸配列の591〜600番目、EphB6のアミノ酸配列の631〜640番目に相当する。
【0016】
本発明のペプチド基質は、4個〜30個、好ましくは6個〜25個、さらに好ましくは、8個〜12個のアミノ酸からなる。
【0017】
好ましくは、一般式(I)および(II)において、X1はバリン、イソロイシン、アラニンから選択されるいずれか1のアミノ酸残基であり、
X2はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X3はプロリンであるアミノ酸残基であり、
X4はヒスチジン、フェニルアラニン、アスパラギン酸、グルタミン酸、セリンから選択されるいずれか1のアミノ酸残基であり、
X5はスレオニンであるアミノ酸残基であり、
X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X7はアスパラギン、スレオニン、セリン、グリシン、システインから選択されるいずれか1のアミノ酸残基である。
【0018】
さらに好ましくは、一般式(I)および(II)において、X1はバリンであり、X2はアスパラギン酸であり、X3はプロリンであり、X4はヒスチジンであり、X5はスレオニンであり、X6はアスパラギン酸であり、X7はアスパラギンである。
【0019】
本発明のペプチド基質は、自体公知のペプチド合成法により製造することができる。ペプチドの合成法としては、例えば固相合成法、液相合成法の何れによって行ってもよく、即ち、ペプチドを構成しうる部分ペプチド鎖もしくはアミノ酸と残余部分とを縮合させ、生成物が保護基を有する場合には保護基を脱離させることにより目的のペプチドを製造することができる。
例えば、ペプチド基質はFmoc固相合成法により、連続フロー方式の自動合成機を用いて化学合成することができる。アミノ酸は、側鎖が保護基により保護された誘導体を使用し、固相担体上でペプチド鎖の伸長を行う。酸性条件下にて、脱保護・切り出しを行い、粗ペプチドを回収する。
【0020】
このようにして得られたペプチドは、通常の精製方法、例えば溶媒抽出;蒸留;カラムクロマトグラフィー;液体クロマトグラフィー;再結晶等を組み合わせて単離精製することができる。
例えば、逆相HPLCを用いて、粗ペプチドの分離・精製を行うことができる。逆相カラムは、ODSカラム(スペルコ社製:C18)を使用して、移動相は水/アセトニトリル系(TFA添加、0.1%)を使用することができる。精製を行ったペプチドは、凍結乾燥して保存することができる(白色粉末、もしくはオイル状)。なお、逆相HPLCにて純度を測定可能であり、TOF−MASSにて分子量測定が可能であり、電子天秤により重量測定して、品質管理が可能である。
また、上記方法で得られたペプチドが遊離体である場合には公知の方法によって適当な塩に変換可能であり、逆に塩で得られた場合には、公知の方法によって遊離体に変換することも可能である。
Sigma−Aldrich社などに合成を委託してペプチドを得ることも可能である。
【0021】
(SHP2酵素活性の測定方法)
上記ペプチド基質と、チロシン脱リン酸化酵素SHP2を含み得る試料とを接触させることにより、SHP2酵素活性を測定することが可能である。
【0022】
チロシン脱リン酸化酵素SHP2を含み得る試料とは、SHP2を含む可能性があればいかなる試料でもよく、例えば、ヒトの血液や体液から調製した画分や、遺伝子組換え技術などで作製したタンパク質を回収した溶液などを含む。
反応バッファーは適宜使用可能であるが、反応バッファーのpHは6.5〜8.5であることが好ましく、7〜8であることがさらに好ましい。反応バッファーとして、例えば、最終濃度で10mM Tris(pH7.4)、5mM DTTを含む溶液を用いることができる。所望により、反応バッファーには、その他の成分、例えばSHP2のアミノ末端側のSH2ドメインに結合するタンパク質からなるSHP2の活性化剤を混合することも可能である。かかる活性化剤としては、IRSpY1172(IRS−1の1172番目のチロシンがリン酸化されたもの)などが挙げられる。IRSpY1172は、Pluskeyら(J Biol Chem. 1995 Feb 17;270(7):2897-900:「IRS-1 pY1172」)に記載の方法により調製することができる。
【0023】
当該試料とペプチド基質を、前記反応バッファー中で所定の時間、反応させる。反応条件は適宜決定することができるが、室温で、15分〜1時間反応させればよい。反応終了後、反応液中に遊離したリン酸を自体公知の方法により測定する。例えば、遊離リン酸を測定する方法にはモリブデン法や、マラカイトグリーン(例えば、BIOMOL GREENTM(BIOMOL社製))を使用する方法がある。マラカイトグリーンを使用した場合は、波長620nmの吸収を測定すればよい。試料についての測定値を、標準(酵素活性が判明している試料)についての測定値と比較することにより、試料中の酵素活性を算出することができる。
【0024】
また、ペプチド基質を含む試薬が本発明の範囲に包含される。さらに、本発明のペプチド基質と、反応バッファー等の必要な試薬を含むものを、SHP2酵素活性測定用キットとして提供することもできる。キット中、ペプチド基質とバッファーは別個の容器に入った状態で提供されてもよいし、2以上の試薬を混合した状態で提供されてもよい。
【0025】
(SHP2酵素活性の検査方法)
上記SHP2酵素活性の測定方法を用いて、被験者の生体内でのSHP2酵素活性を予測し、疾患との関連性を評価することが可能である。
かかるSHP2酵素活性の検査方法には、被験者由来の検体からチロシン脱リン酸化酵素SHP2を含む画分を調製する工程;前記画分とペプチド基質とを接触させ、SHP2酵素活性を測定する工程;前記測定結果を基準値と比較する工程;が含まれる。
【0026】
検体とは、哺乳類等から採取され、例えば、血液、血清、糞便、尿、精液、喀痰、唾液、鼻汁、脳脊髄液、涙等の各種体液、又は、脳、結腸、尿生殖器、肺、腎臓、造血組織、乳房、胸腺、精巣、 卵巣、子宮組織等の各種組織、あるいはこれらに含まれる細胞群が挙げられる。検体からSHP2を含むと予測される画分を調製し、これを本発明の検査方法に使用する。当該画分の調製方法は、自体公知の方法を使用すればよい。
【0027】
前記画分とペプチド基質とを接触させSHP2酵素活性を測定し、前記測定結果を基準値と比較することにより、被験者生体内でのSHP2の酵素活性の状態を予測することができる。基準値とは、SHP2酵素活性と疾患とを関連付ける値であり、検体の採取された被験者が疾患と関連があるかないかを判断するために使用される数値もしくは数値範囲である。例えば、基準値とは、SHP2の酵素活性に関連する疾患を有さない健常者におけるSHP2酵素活性レベルの数値範囲であり、予め設定されていてもよい。
【0028】
(SHP2酵素活性を変動させる物質のスクリーニング方法)
SHP2ペプチド基質を用いて、SHP2の酵素活性を変動させる物質をスクリーニングすることが可能である。具体的には、チロシン脱リン酸化酵素SHP2とペプチド基質とを、被検物質の存在下で接触させてSHP2酵素活性を測定する工程;前記被検物質の非存在下でのSHP2酵素活性と比較して、被検物質の有無によりSHP2酵素活性が変化した場合に当該被検物質を選択する工程;を含む方法である。
SHP2酵素活性を変動させる物質とは、SHP2酵素活性を促進もしくは阻害する作用を有する物質である。被検物質の存在下でのSHP2酵素活性が、被検物質の非存在下でのSHP2酵素活性より低下した場合は、当該被検物質を阻害剤として選択することができる。逆に、被検物質の存在下でのSHP2酵素活性が、被検物質の非存在下でのSHP2酵素活性より上昇した場合は、当該被検物質を促進剤として選択することができる。
【0029】
本スクリーニング方法において、SHP2は野生型SHP2、変異型SHP2を適宜用いることが可能である。SHP2は、自体公知の遺伝子工学的な手法を用いて作製することが可能である。ヒトSHP2の塩基配列はGenBankのAccession No.NM_002834(アミノ酸配列は、GenBankのAccession No.NP_002825)に示されている。また、市販のSHP2を使用することも可能である(例えば、SignalChem社:PTPN11 (SHP2), Active:カタログNo.P38-21G、exalpha社:Recombinant SHP-2 (224.529)/PTPN11 Active Enzyme:カタログNo.X1663E)。変異型SHP2は、後述する実施例2に記載のものを使用することができる。
【0030】
さらに本発明は、スクリーニング方法に用いるためのスクリーニングキットにも関する。当該キットには、ペプチド基質、SHP2タンパク質、反応バッファー等の試薬を含み、これらの試薬は別個の容器に入って提供されてもよいし、2以上の試薬を適宜混合した状態で提供されてもよい。
【0031】
本スクリーニング方法もしくはスクリーニングキットを用いて選択される物質はSHP2の酵素活性を変動させる物質であり、SHP2酵素活性に関連する疾患の治療剤もしくは予防剤として使用することができる。かかる疾患の例として、胃癌、ヌーナン症候群、肥満関連疾患、白血病、レパード症候群などが挙げられる。本スクリーニング方法またはスクリーニングキットにより選択され得る物質として、以下に記載するSHP2酵素活性の阻害作用を有する修飾ペプチドが例示される。
【0032】
(修飾ペプチド)
EphA2における594番目のチロシンを含み、当該チロシンの水酸基がリン酸以外の基により修飾されているEphの部分ペプチド(以下、「修飾ペプチド」とも称する)が、SHP2の阻害剤として作用する。かかるペプチドは、一般式(I)Tyr−Glu−X6―Pro(配列番号1)で表わされるアミノ酸配列を含むペプチドであり、好ましくは、一般式(II):X1−X2−X3−X4−X5―Tyr−Glu−X6―Pro―X(配列番号2)で表わされるアミノ酸配列を含むペプチドである。
式中、X1はバリン、イソロイシン、アラニンから選択されるいずれか1のアミノ酸残基であり、
X2はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X3はプロリンまたはロイシンのいずれかのアミノ酸残基であり、
X4はグルタミン、ヒスチジン、フェニルアラニン、アスパラギン酸、グルタミン酸、セリンから選択されるいずれか1のアミノ酸残基であり、
X5はアラニンまたはスレオニンのいずれかのアミノ酸残基であり、
X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X7はアラニン、アスパラギン、スレオニン、セリン、グリシン、システインから選択されるいずれか1のアミノ酸残基である。
【0033】
また、当該ペプチドにおいて、チロシン(Tyr)の水酸基が以下の群より選択されるいずれか1の置換基により、修飾されていることが必要である;スルホ基、バナジン酸基、炭酸基、ハロゲニド基、亜燐酸基、クロム酸基、シュウ酸基、酢酸基、硝酸基、ヘキサン酸基、セバシン酸基、モリブデン酸基、タングステン酸基、シアノ基、ハロゲン原子、カルバモイル基、メルカプト基、炭素数1〜6個のアルキルチオ基、炭素数1〜6個のアルカンスルフィニル基、炭素数1〜6個のアルカンスルホニル基、複素環基、炭素数3〜8個のシクロアルキル基、アミノ基、アミノアリル基、ピリジル基、ピラジル基、ピラジニル基、ピリダジニル基、イミダゾリル基、ピラゾリル基、ピペリジル基、ピペラジニル基、モルホリニル基、アミジノ基、グアニジノ基、カルボキシル基、または、テトラゾリル基、あるいは、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていない炭素数1〜6個のアルキル基、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていないアリール基、または、上記の何れかに記載の置換基もしくは水酸基で置換されたアラルキル基。
好ましくは、チロシンの水酸基は、スルホ基もしくはバナジン酸基により修飾されており、さらに好ましくは、スルホ基により修飾されている。
【0034】
一般式(II)のアミノ酸配列は、EphA2のアミノ酸配列の589〜598番目に相当するものであり、一般式(I)のアミノ酸配列は、Eph2のアミノ酸配列の594〜597番目に相当する。一般式(I)および(II)中のチロシン(Tyr)はEphA2のアミノ酸配列において594番目に相当する。また、当該チロシンはリン酸化されていることが必要である。ペプチドのアミノ末端にはアミノ保護基が付加されていてもよい。なお、一般式(II)のアミノ酸配列は、EphA1のアミノ酸配列の600〜609番目に相当し、EphA3およびEphA4のアミノ酸配列の597〜606番目、EphA5のアミノ酸配列の629〜638番目、EphA6のアミノ酸配列の701〜710番目、EphA7およびEphA8のアミノ酸配列の609〜618番目、EphB1のアミノ酸配列の595〜604番目、EphB2のアミノ酸配列の597〜606番目、EphB3のアミノ酸配列の609〜618番目、EphB4のアミノ酸配列の591〜600番目、EphB6のアミノ酸配列の631〜640番目に相当する。
【0035】
本発明の修飾ペプチドは、4個〜30個、好ましくは6個〜25個、さらに好ましくは、8個〜12個のアミノ酸からなる。
【0036】
好ましくは、一般式Iにおいて、X1はバリン、イソロイシン、アラニンから選択されるいずれか1のアミノ酸残基であり、
X2はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X3はプロリンであるアミノ酸残基であり、
X4はヒスチジン、フェニルアラニン、アスパラギン酸、グルタミン酸、セリンから選択されるいずれか1のアミノ酸残基であり、
X5はスレオニンであるアミノ酸残基であり、
X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X7はアスパラギン、スレオニン、セリン、グリシン、システインから選択されるいずれか1のアミノ酸残基である。
【0037】
さらに好ましくは、一般式Iにおいて、X1はバリンであり、X2はアスパラギン酸であり、X3はプロリンであり、X4はヒスチジンであり、X5はスレオニンであり、X6はアスパラギン酸であり、X7はアスパラギンである。
【0038】
本発明の修飾ペプチドは、自体公知のペプチド合成法により製造することができる。ペプチドの合成法としては、例えば固相合成法、液相合成法の何れによって行ってもよく、即ち、ペプチドを構成しうる部分ペプチド鎖もしくはアミノ酸と残余部分とを縮合させ、生成物が保護基を有する場合には保護基を脱離させることにより目的のペプチドを製造することができる。
例えば、本発明の修飾ペプチドはFmoc固相合成法により、連続フロー方式の自動合成機を用いて化学合成することができる。アミノ酸は、側鎖が保護基により保護された誘導体を使用し、固相担体上でペプチド鎖の伸長を行う。酸性条件下にて、脱保護・切り出しを行い、粗ペプチドを回収する。
【0039】
このようにして得られたペプチドは、通常の精製方法、例えば溶媒抽出;蒸留;カラムクロマトグラフィー;液体クロマトグラフィー;再結晶等を組み合わせて単離精製することができる。
例えば、逆相HPLCを用いて、粗ペプチドの分離・精製を行うことができる。逆相カラムは、ODSカラム(スペルコ社製:C18)を使用して、移動相は水/アセトニトリル系(TFA添加、0.1%)を使用することができる。精製を行ったペプチドは、凍結乾燥して、保存することができる(白色粉末、もしくはオイル状)。なお、逆相HPLCにて純度を測定可能であり、TOF−MASSにて分子量測定が可能であり、電子天秤により重量測定して、品質管理が可能である。
また、上記方法で得られたペプチドが遊離体である場合には公知の方法によって適当な塩に変換可能であり、逆に塩で得られた場合には、公知の方法によって遊離体に変換することも可能である。
Sigma−Aldrich社などに合成を委託してペプチドを得ることも可能である。
【0040】
本発明の修飾ペプチドまたはその塩は、SHP2阻害剤として作用する。本発明の修飾ペプチドまたはその塩は、SHP2の酵素活性が増強することにより誘発または促進される疾患の治療剤または予防剤として使用することができる。当該疾患として、胃癌もしくはヌーナン症候群、白血病などが挙げられる。
【0041】
本発明の修飾ペプチドまたはその塩を医薬組成物として用いる場合には、通常、それ自体公知の薬理学的に許容される担体、賦形剤、希釈剤、増量剤、崩壊剤、安定剤、保存剤、緩衝剤、乳化剤、芳香剤、着色剤、甘味剤、粘稠剤、矯味剤、溶解補助剤、その他の添加剤、具体的には水、植物油、エタノール又はベンジルアルコールのようなアルコール、ポリエチレングリコール、グリセロールトリアゼテートゼラチン、ラクトース、デンプン等のような炭水化物、ステアリン酸マグネシウム、タルク、ワセリン等と混合して錠剤、カプセル剤、エリキシル剤、マイクロカプセル剤、注射剤、液剤、懸濁剤等の形態により経口又は非経口的に投与することができる。
また、本発明の修飾ペプチドは、ヒト用医薬としての使用は勿論、他の哺乳動物用医薬としても使用可能である。投与量は疾患の種類及び程度、投与するペプチド並びに投与経路、患者の年齢、性別、体重等により変わりうるが、注射剤の形での投与の場合、通常、成人1日当たり、約0.1〜30mgを投与するのが好ましい。また、本発明のペプチドは上記各種対象疾患の予防、治療の為に単独で投与する以外に、該疾患の予防、治療に有用な別の薬剤と併用することもできる。
【実施例】
【0042】
以下、実施例により本発明を説明するが、本発明はこれらに限定されるものではない。
【0043】
(実施例1)ペプチド基質の調製
ペプチド基質の候補であるJX1およびJX2(それぞれY(Tyr)がリン酸化されている)を、Sigma−aldrich社に委託して合成し、作製した。本ペプチドを1mMの濃度になるように水に溶かし、−80℃に保存した。
JX1:PLKTYVDPHT(配列番号3)
JX2:VDPHTYEDPN(配列番号4)
【0044】
(実施例2)SHP2酵素の調製
MycタグをC末端に付加した下記(a)〜(e)の各種SHP2酵素を発現するプラスミドをlipofectamine2000(Invitrogen社)を用いたトランスフェクションによりMDCK細胞に導入した。40時間培養後に細胞を溶解し、protein A−セファロースおよび抗myc抗体を用いた免疫沈降法により各種SHP2を調製した。酵素は4℃にて保存した。
(a)SHP2 T468M(配列番号5):レパード症候群の患者で検出される変異体。酵素活性が低い。
(b)SHP2 C/S(C459S)(配列番号7):不活性型。酵素活性なし。基質との複合体形成能有り。ただし(c)SHP2 DMより複合体形成能は弱い。
(c)SHP2 DM(2箇所の置換がある。D425A/C459S)(配列番号9):不活性型。酵素活性なし。基質との複合体形成能有り。
(d)SHP2 D61Y(配列番号11):活性化型の変異体。高い酵素活性を示す。白血病の患者で検出される。
(e)SHP2 wt(配列番号13):野生型。
【0045】
(実施例3)酵素活性の測定
96ウェルプレート1ウェルあたり10μlの基質(最終濃度0.25mM)、20μlの反応バッファー(最終濃度10mM Tris pH7.4、5mM DTT)および10μlの酵素(最終濃度100ng/ml)を加え、室温にて30分間、反応させる。その後マラカイトグリーンを等量加え、遊離したリン酸とマラカイトグリーンの反応によって生じる波長620nmの吸収をプレートリーダーにて測定した。基質としてJX1またはJX2、酵素として野生型SHP2を使用した。IRSpY1172(IRS−1の1172番目のチロシンがリン酸化されたもの)を、野生型酵素の活性化剤として使用した。
【0046】
その結果を図1に示す。JX2がSHP2の特異的な基質となることが判明した。
【0047】
(実施例4)酵素活性の測定
実施例3と同様の方法により、基質としてJX2を用い、酵素として(a)〜(e)のSHP2を用いて、IRSpY1172の存在下、もしくは非存在下で酵素活性を測定した。
【0048】
その結果を図2に示す。SHP2の野生型およびSHP2 D61Y(高い酵素活性を示す)では酵素活性が認められた。一方、不活性型の変異型(SHP2 T468M、SHP2 C/S、SHP2 DM)では酵素活性が認められなかった。
【0049】
(実施例5)修飾ペプチドの調製
JX2−Sペプチド(Y(Tyr)にスルホ基が付加されている)を、Sigma−aldrich社に委託して合成し、作製した。本ペプチドを1mMの濃度になるように水に溶かし、−80℃に保存した。
JX2−S:VDPHTYEDPN(配列番号15)
【0050】
(実施例6)酵素活性の測定
SHP2D61YとJX2−S(0,30,100,300μM)とTBSを混合して、10分間、室温でインキュベートした。その後、基質としてJX2(200μM)を添加して、30分間、室温でインキュベートした。その後、等量のBIOMOL GREENTMを添加して10分間、室温でインキュベートし、波長620nmの吸収を測定した。
【0051】
その結果を、図3に示す。JX2−Sペプチドの量が増加するにつれて、酵素活性が阻害された。
【0052】
(実施例7)ゼブラフィッシュにおける実験
Jopling Cらの方法(PLoS Genet. 2007 Dec;3(12):e225)に従って、ゼブラフィッシュの受精卵にヒトSHP2 mRNA変異体(SHP2 D61G mRNA)(配列番号25)をマイクロインジェクションし、個体発生過程における心臓の形態変化を観察した。また、JX2−Sペプチドを、SHP2 D61G mRNAの注入と同時に受精卵に注入した。
なお、SHP2 D61Gは、ヌーナン症候群で検出される弱い活性化型である。
【0053】
その結果、SHP2 D61G mRNAのみを注入した場合は、ゼブラフィッシュに心臓の異常、目が小さいなどの病態が発症していたが、JX2−Sペプチドの投与によりこれらの病態が抑えられることがわかった。
なお、SHP2 D61Y(強い活性化型)のmRNAを注入した場合は、心臓が形成される前に胚発生が異常を示し、ゼブラフィッシュ全体が正常な形態ではなくなった(データは示さず)。
【産業上の利用可能性】
【0054】
上記説明したとおり、本発明のEphの部分ペプチドからなるペプチド基質は、SHP2酵素の特異的に作用する。かかる基質をSHP2酵素活性に関連する疾患についての簡便な検査方法、SHP2酵素活性の阻害剤もしくは促進剤のスクリーニング方法に用いることが可能である。スクリーニング方法により得られたSHP2阻害剤もしくは促進剤は、SHP2酵素活性に関連する疾患の予防剤もしくは治療剤として使用され得、有用である。また、本発明の修飾ペプチドは、生体内でSHP2酵素の活性を阻害して、SHP2酵素活性の上昇により発症すると考えられる症状を抑制する。かかる修飾ペプチドは、SHP2酵素活性の上昇により発症する病態の治療剤として使用することが期待され、有用である。
【図面の簡単な説明】
【0055】
【図1】ペプチド基質のSHP2酵素に対する特異性に関する結果を示す。(実施例3)
【図2】ペプチド基質の機能を確認した結果を示す。(実施例4)
【図3】修飾ペプチドのSHP2阻害作用を確認した結果を示す。(実施例6)
【図4】修飾ペプチドのゼブラフィッシュ生体内での作用を確認した結果を示す。(実施例7)
【図5】Ephファミリー分子の部分アミノ酸配列についてのアライメントを示す図である。
【特許請求の範囲】
【請求項1】
一般式(I) Tyr−Glu−X6―Pro(配列番号1)で表されるアミノ酸配列を少なくとも含むチロシンキナーゼ受容体Ephファミリー分子の部分アミノ酸配列からなるペプチド又はその塩:
式中、X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
チロシン(Tyr)の水酸基が以下の群より選択されるいずれか1の置換基により、修飾されている;スルホ基、バナジン酸基、炭酸基、ハロゲニド基、亜燐酸基、クロム酸基、シュウ酸基、酢酸基、硝酸基、ヘキサン酸基、セバシン酸基、モリブデン酸基、タングステン酸基、シアノ基、ハロゲン原子、カルバモイル基、メルカプト基、炭素数1〜6個のアルキルチオ基、炭素数1〜6個のアルカンスルフィニル基、炭素数1〜6個のアルカンスルホニル基、複素環基、炭素数3〜8個のシクロアルキル基、アミノ基、アミノアリル基、ピリジル基、ピラジル基、ピラジニル基、ピリダジニル基、イミダゾリル基、ピラゾリル基、ピペリジル基、ピペラジニル基、モルホリニル基、アミジノ基、グアニジノ基、カルボキシル基、または、テトラゾリル基、あるいは、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていない炭素数1〜6個のアルキル基、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていないアリール基、または、上記の何れかに記載の置換基もしくは水酸基で置換されたアラルキル基。
【請求項2】
下記の一般式(II)で表されるアミノ酸配列を含むチロシンキナーゼ受容体Ephファミリー分子の部分アミノ酸配列からなるペプチド又はその塩:
一般式(II) X1−X2−X3−X4−X5―Tyr−Glu−X6―Pro―X7(配列番号2)
式中、X1はバリン、イソロイシン、アラニンから選択されるいずれか1のアミノ酸残基であり、
X2はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X3はプロリンまたはロイシンのいずれかのアミノ酸残基であり、
X4はグルタミン、ヒスチジン、フェニルアラニン、アスパラギン酸、グルタミン酸、セリンから選択されるいずれか1のアミノ酸残基であり、
X5はアラニンまたはスレオニンのいずれかのアミノ酸残基であり、
X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X7はアラニン、アスパラギン、スレオニン、セリン、グリシン、システインから選択されるいずれか1のアミノ酸残基であり、
チロシン(Tyr)の水酸基が以下の群より選択されるいずれか1の置換基により、修飾されている;スルホ基、バナジン酸基、炭酸基、ハロゲニド基、亜燐酸基、クロム酸基、シュウ酸基、酢酸基、硝酸基、ヘキサン酸基、セバシン酸基、モリブデン酸基、タングステン酸基、シアノ基、ハロゲン原子、カルバモイル基、メルカプト基、炭素数1〜6個のアルキルチオ基、炭素数1〜6個のアルカンスルフィニル基、炭素数1〜6個のアルカンスルホニル基、複素環基、炭素数3〜8個のシクロアルキル基、アミノ基、アミノアリル基、ピリジル基、ピラジル基、ピラジニル基、ピリダジニル基、イミダゾリル基、ピラゾリル基、ピペリジル基、ピペラジニル基、モルホリニル基、アミジノ基、グアニジノ基、カルボキシル基、または、テトラゾリル基、あるいは、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていない炭素数1〜6個のアルキル基、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていないアリール基、または、上記の何れかに記載の置換基もしくは水酸基で置換されたアラルキル基。
【請求項3】
請求項1または2に記載のペプチドまたはその塩を有効成分とする、チロシン脱リン酸化酵素SHP2阻害剤。
【請求項4】
請求項1または2に記載のペプチドまたはその塩を有効成分とする、チロシン脱リン酸化酵素SHP2の作用増強により誘発または促進される疾患の治療または予防剤。
【請求項5】
請求項1または2に記載のペプチドまたはその塩を有効成分とする、医薬組成物。
【請求項6】
一般式(I) Tyr−Glu−X6―Pro(配列番号1)で表されるアミノ酸配列を含むチロシンキナーゼ受容体Ephファミリー分子の部分ペプチドからなる、チロシン脱リン酸化酵素SHP2のペプチド基質:
式中、X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
チロシン(Tyr)がリン酸化されている。
【請求項7】
下記一般式(II)で表されるアミノ酸配列を含むチロシンキナーゼ受容体Ephファミリー分子の部分ペプチドからなる、チロシン脱リン酸化酵素SHP2のペプチド基質:
一般式(II) X1−X2−X3−X4−X5―Tyr−Glu−X6―Pro―X7(配列番号2)
式中、
X1はバリン、イソロイシン、アラニンから選択されるいずれか1のアミノ酸残基であり、
X2はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X3はプロリンまたはロイシンのいずれかのアミノ酸残基であり、
X4はグルタミン、ヒスチジン、フェニルアラニン、アスパラギン酸、グルタミン酸、セリンから選択されるいずれか1のアミノ酸残基であり、
X5はアラニンまたはスレオニンのいずれかのアミノ酸残基であり、
X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X7はアラニン、アスパラギン、スレオニン、セリン、グリシン、システインから選択されるいずれか1のアミノ酸残基であり、
チロシン(Tyr)がリン酸化されている。
【請求項8】
チロシン脱リン酸化酵素SHP2を含み得る試料と、請求項6または7に記載のペプチド基質とを接触させることを含む、SHP2酵素活性の測定方法。
【請求項9】
請求項6または7に記載のペプチド基質および反応バッファーを含む、SHP2酵素活性を測定するためのキット。
【請求項10】
被験者由来の検体からチロシン脱リン酸化酵素SHP2を含む画分を調製する工程;
前記画分と、請求項6または7に記載のペプチド基質とを接触させて、SHP2酵素活性を測定する工程;
測定された酵素活性の値を基準値と比較する工程;
を含む、被験者由来の検体についてのSHP2酵素活性の検査方法。
【請求項11】
チロシン脱リン酸化酵素SHP2と、請求項6または7に記載のペプチド基質とを、被検物質の存在下で接触させてSHP2酵素活性を測定する工程;
被検物質の存在下でのSHP2酵素活性が、前記被検物質の非存在下でのSHP2酵素活性と比較して、変化した場合に当該被検物質を選択する工程;
を含む、SHP2酵素活性を変動させる物質のスクリーニング方法。
【請求項12】
チロシン脱リン酸化酵素SHP2、請求項6または7に記載のペプチド基質、および反応バッファーを含む、SHP2酵素活性を変動させる物質のスクリーニングキット。
【請求項1】
一般式(I) Tyr−Glu−X6―Pro(配列番号1)で表されるアミノ酸配列を少なくとも含むチロシンキナーゼ受容体Ephファミリー分子の部分アミノ酸配列からなるペプチド又はその塩:
式中、X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
チロシン(Tyr)の水酸基が以下の群より選択されるいずれか1の置換基により、修飾されている;スルホ基、バナジン酸基、炭酸基、ハロゲニド基、亜燐酸基、クロム酸基、シュウ酸基、酢酸基、硝酸基、ヘキサン酸基、セバシン酸基、モリブデン酸基、タングステン酸基、シアノ基、ハロゲン原子、カルバモイル基、メルカプト基、炭素数1〜6個のアルキルチオ基、炭素数1〜6個のアルカンスルフィニル基、炭素数1〜6個のアルカンスルホニル基、複素環基、炭素数3〜8個のシクロアルキル基、アミノ基、アミノアリル基、ピリジル基、ピラジル基、ピラジニル基、ピリダジニル基、イミダゾリル基、ピラゾリル基、ピペリジル基、ピペラジニル基、モルホリニル基、アミジノ基、グアニジノ基、カルボキシル基、または、テトラゾリル基、あるいは、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていない炭素数1〜6個のアルキル基、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていないアリール基、または、上記の何れかに記載の置換基もしくは水酸基で置換されたアラルキル基。
【請求項2】
下記の一般式(II)で表されるアミノ酸配列を含むチロシンキナーゼ受容体Ephファミリー分子の部分アミノ酸配列からなるペプチド又はその塩:
一般式(II) X1−X2−X3−X4−X5―Tyr−Glu−X6―Pro―X7(配列番号2)
式中、X1はバリン、イソロイシン、アラニンから選択されるいずれか1のアミノ酸残基であり、
X2はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X3はプロリンまたはロイシンのいずれかのアミノ酸残基であり、
X4はグルタミン、ヒスチジン、フェニルアラニン、アスパラギン酸、グルタミン酸、セリンから選択されるいずれか1のアミノ酸残基であり、
X5はアラニンまたはスレオニンのいずれかのアミノ酸残基であり、
X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X7はアラニン、アスパラギン、スレオニン、セリン、グリシン、システインから選択されるいずれか1のアミノ酸残基であり、
チロシン(Tyr)の水酸基が以下の群より選択されるいずれか1の置換基により、修飾されている;スルホ基、バナジン酸基、炭酸基、ハロゲニド基、亜燐酸基、クロム酸基、シュウ酸基、酢酸基、硝酸基、ヘキサン酸基、セバシン酸基、モリブデン酸基、タングステン酸基、シアノ基、ハロゲン原子、カルバモイル基、メルカプト基、炭素数1〜6個のアルキルチオ基、炭素数1〜6個のアルカンスルフィニル基、炭素数1〜6個のアルカンスルホニル基、複素環基、炭素数3〜8個のシクロアルキル基、アミノ基、アミノアリル基、ピリジル基、ピラジル基、ピラジニル基、ピリダジニル基、イミダゾリル基、ピラゾリル基、ピペリジル基、ピペラジニル基、モルホリニル基、アミジノ基、グアニジノ基、カルボキシル基、または、テトラゾリル基、あるいは、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていない炭素数1〜6個のアルキル基、上記の何れかに記載の置換基もしくは水酸基で置換された、もしくは置換されていないアリール基、または、上記の何れかに記載の置換基もしくは水酸基で置換されたアラルキル基。
【請求項3】
請求項1または2に記載のペプチドまたはその塩を有効成分とする、チロシン脱リン酸化酵素SHP2阻害剤。
【請求項4】
請求項1または2に記載のペプチドまたはその塩を有効成分とする、チロシン脱リン酸化酵素SHP2の作用増強により誘発または促進される疾患の治療または予防剤。
【請求項5】
請求項1または2に記載のペプチドまたはその塩を有効成分とする、医薬組成物。
【請求項6】
一般式(I) Tyr−Glu−X6―Pro(配列番号1)で表されるアミノ酸配列を含むチロシンキナーゼ受容体Ephファミリー分子の部分ペプチドからなる、チロシン脱リン酸化酵素SHP2のペプチド基質:
式中、X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
チロシン(Tyr)がリン酸化されている。
【請求項7】
下記一般式(II)で表されるアミノ酸配列を含むチロシンキナーゼ受容体Ephファミリー分子の部分ペプチドからなる、チロシン脱リン酸化酵素SHP2のペプチド基質:
一般式(II) X1−X2−X3−X4−X5―Tyr−Glu−X6―Pro―X7(配列番号2)
式中、
X1はバリン、イソロイシン、アラニンから選択されるいずれか1のアミノ酸残基であり、
X2はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X3はプロリンまたはロイシンのいずれかのアミノ酸残基であり、
X4はグルタミン、ヒスチジン、フェニルアラニン、アスパラギン酸、グルタミン酸、セリンから選択されるいずれか1のアミノ酸残基であり、
X5はアラニンまたはスレオニンのいずれかのアミノ酸残基であり、
X6はアスパラギン酸またはグルタミン酸のいずれかのアミノ酸残基であり、
X7はアラニン、アスパラギン、スレオニン、セリン、グリシン、システインから選択されるいずれか1のアミノ酸残基であり、
チロシン(Tyr)がリン酸化されている。
【請求項8】
チロシン脱リン酸化酵素SHP2を含み得る試料と、請求項6または7に記載のペプチド基質とを接触させることを含む、SHP2酵素活性の測定方法。
【請求項9】
請求項6または7に記載のペプチド基質および反応バッファーを含む、SHP2酵素活性を測定するためのキット。
【請求項10】
被験者由来の検体からチロシン脱リン酸化酵素SHP2を含む画分を調製する工程;
前記画分と、請求項6または7に記載のペプチド基質とを接触させて、SHP2酵素活性を測定する工程;
測定された酵素活性の値を基準値と比較する工程;
を含む、被験者由来の検体についてのSHP2酵素活性の検査方法。
【請求項11】
チロシン脱リン酸化酵素SHP2と、請求項6または7に記載のペプチド基質とを、被検物質の存在下で接触させてSHP2酵素活性を測定する工程;
被検物質の存在下でのSHP2酵素活性が、前記被検物質の非存在下でのSHP2酵素活性と比較して、変化した場合に当該被検物質を選択する工程;
を含む、SHP2酵素活性を変動させる物質のスクリーニング方法。
【請求項12】
チロシン脱リン酸化酵素SHP2、請求項6または7に記載のペプチド基質、および反応バッファーを含む、SHP2酵素活性を変動させる物質のスクリーニングキット。
【図2】


【図1】


【図3】


【図4】


【図5】




【図1】


【図3】


【図4】


【図5】


【公開番号】特開2010−43026(P2010−43026A)
【公開日】平成22年2月25日(2010.2.25)
【国際特許分類】
【出願番号】特願2008−208374(P2008−208374)
【出願日】平成20年8月13日(2008.8.13)
【出願人】(803000056)財団法人ヒューマンサイエンス振興財団 (341)
【Fターム(参考)】
【公開日】平成22年2月25日(2010.2.25)
【国際特許分類】
【出願日】平成20年8月13日(2008.8.13)
【出願人】(803000056)財団法人ヒューマンサイエンス振興財団 (341)
【Fターム(参考)】
[ Back to top ]

