テストステロンを投与するための皮膚パッチおよび方法。
【課題】アンドロゲン療法、またはエストロゲン−アンドロゲン組み合わせ療法に利用可能な調剤形態は、なお多くの問題を残している。特に、これらの物理療法のいずれも、血清テストステロンの日内変動を正常な生理学的範囲内にとどめることを達成できていない。
【解決手段】本発明により、テストステロン置換療法を該療法が必要な女性に提供する方法であって、健康な若い成人女性におけるテストステロンの内因性血液レベルに実質的に一致するテストステロンの血液レベルを該女性に提供する量で、テストステロンを該女性に経皮的に投与する工程を包含する方法が提供される。
【解決手段】本発明により、テストステロン置換療法を該療法が必要な女性に提供する方法であって、健康な若い成人女性におけるテストステロンの内因性血液レベルに実質的に一致するテストステロンの血液レベルを該女性に提供する量で、テストステロンを該女性に経皮的に投与する工程を包含する方法が提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、経皮薬剤送達の分野に関する。より特定すれば、テストステロンを単独であるいは必要に応じてエストロゲンと組み合わせて女性へ経皮的に投与するための皮膚パッチおよび方法に関する。
【背景技術】
【0002】
エストロゲンは、一般に、閉経期後の症状および骨粗しょう症のホルモン補充療法において用いられている。しかし、多くの女性は、エストロゲン単独療法の後、症状を経験し続ける。閉経期後の女性の肉体的および情動の幸福感に対するアンドロゲンの有益な効果が、つい最近認識されてきている。いくつかの臨床研究が、エストロゲン−アンドロゲンの組み合わせ療法の基礎を確立した。McGill大学における一連の二重盲実験法により管理された研究において、エストロゲン−アンドロゲン組み合わせ療法の患者は、エストロゲン置換療法(ERT)単独の患者よりも日々の幸福感、エネルギーレベル、および睡眠の質について高水準のスコアを記録していたことが注目された。著者らはまた、性機能に対するエストロゲン−アンドロゲン療法の有益な効果、および脂質に関して有害な影響のないことを報告した。
【0003】
エストロゲンは単独でいくらかの女性を助け得るが、アンドロゲン類は失われた性衝動の回復を助けることにおいて選択されるホルモンである。文献中のいくつかの報告は、性機能に対するアンドロゲン療法の有益な効果を確立している。このことは、若くて外科的に閉経期後となった女性において特に重要であり、彼女らは、非経口的にアンドロゲンを、単独またはエストロゲンと組み合わせて用いて治療された場合、エストロゲン単独または偽薬を用いた場合と比べて、性行動(要求または喚起)の動機増進が観察された。骨粗しょう症の予防に対して、ERTにアンドロゲンを添加することの正当性もまた、文献において見い出される。
【発明の概要】
【発明が解決しようとする課題】
【0004】
ERT養生法にアンドロゲンを添加する利益が十分認識されている一方、アンドロゲン療法、またはエストロゲン−アンドロゲン組み合わせ療法に利用可能な調剤形態は、なお多くの問題を残している。特に、これらの物理療法のいずれも、血清テストステロンの日内変動を正常な生理学的範囲内にとどめることを達成できていない。臨床用途に最も利用可能なアンドロゲンは、代表的には、天然(native)のテストステロンではなく、通常合成アンドロゲンが用いられる(例えば肝臓毒性があることが知られているメチルテストステロン)。天然のテストステロンは、体内挿入が可能なペレットとして利用可能である;しかし、このシステムは、侵入投与を必要とし、そして安定な生理学的ホルモン状態を生成しない。テストステロンプロピオネートおよび長く作用するテストステロンエナンテート(testosterone enanthate)のような注射可能なテストステロンエステルは、ホルモンレベルが生理学的範囲を著しく超えて変動する。現在のアンドロゲン補充用製品が生理学的にかけはなれた性質をもっていることが、これらの使用により頻繁に見られる過剰のアンドロゲン効果の徴候および症状の原因となっている。これらは、男性化の症状、例えば、多毛症、男性型禿頭症、声の低音化、および陰核巨大症;排卵および月経機能の障害;座瘡および油肌(oily skin);ならびに胸圧痛(breast tenderness)、体液の停滞(fluid retention)、過敏症および抑鬱症が含まれる。これらの問題は、現在市場に出ているエストロゲン−アンドロゲン製品にも存在する。エストロゲンを併用しても、またはしなくても、テストステロンおよびその代謝産物の生理学的レベルを提供する物理療法は、現行のアンドロゲン補充製品に比べ顕著な治療的利益を有する。
【0005】
多くの論文および特許が、テストステロンの経皮投与について示唆または報告している。一般に、これらの刊行物は、男性性機能不全、貧血、および男性骨粗しょう症のような状態を治療するために、テストステロン療法を男性に提供することに焦点を当てていた。この文献のほとんどは、透過促進を何らかの形かで行わない場合には、テストステロンは実用的なフラックス(flux)レベルで非陰嚢皮膚を通過しないと結論している。最も最近の米国特許第5,152,997号には、実用的フラックスレベルを提供する条件(皮膚パッチにおいてテストステロンのほぼ飽和濃度;皮膚浸透促進剤の同時投与)下で非陰嚢皮膚を通してテストステロンを男性に経皮投与することが記載されている。しかしこの文献は、テストステロンまたはテストステロン/エストロゲンの組み合わせによる補充療法を女性に適用するという課題については、事実上記載していない。
【課題を解決するための手段】
【0006】
本発明により、テストステロン置換療法を該療法が必要な女性に提供する方法であって、健康な若い成人女性におけるテストステロンの内因性血液レベルに実質的に一致するテストステロンの血液レベルを該女性に提供する量で、テストステロンを該女性に経皮的に投与する工程を包含する方法が提供される。
【0007】
1つの実施形態では、上記量が50〜500μg/日の範囲である方法が提供される。
【0008】
また、本発明により、テストステロン置換療法を該療法が必要な女性に経皮的に提供するための皮膚パッチであって、(a)バッキング層;および(b)ポリマー性キャリアー中にテストステロンの溶液を含有するマトリックス層であって、該マトリックス層が該療法を提供するために充分な一日毎の用量のテストステロンを供給するマトリックス層の積層化化合物を含む、皮膚パッチが提供される。
【0009】
1つの実施形態では、上記ポリマー性キャリアーが感圧性接着剤であり、そして上記パッチが50〜500μgテストステロン/日を供給する皮膚パッチである。
【0010】
さらに、本発明により、テストステロンとエストロゲンとを組み合わせた置換療法を該療法が必要な女性に提供する方法であって、テストステロンとエストロゲンとを、健康な若い成人女性におけるテストステロンおよびエストロゲンの内因性血液レベルに実質的に一致するテストステロンおよびエストロゲンの血液レベルを該女性に提供するそれぞれの量で、該女性に経皮的に同時投与する方法が提供される。
【0011】
1つの実施形態では、上記テストステロンの量が50〜500μg/日であり、そして上記エストロゲンが17β−エストラジオールであり、そして上記エストロゲンの量が25〜200μg/日である方法が提供される。
【0012】
そして、本発明により、テストステロンおよびエストロゲン置換療法を該療法が必要な女性に経皮的に提供するための皮膚パッチであって、(a)バッキング層;(b)テストステロン−および−エストロゲンを含有する層であって、該女性の皮膚と拡散的連絡があるように適合されそして該女性の皮膚を通して治療的に効果量のテストステロンおよびエストロゲンを伝達するように適合される層を含む皮膚パッチが提供される。
【0013】
1つの実施形態では、上記テストステロンの量が50〜500μg/日であり、そして上記エストロゲンが17β−エストラジオールであり、そして上記エストロゲンの量が25〜200μg/日であるパッチが提供される。
【0014】
本発明の1つの局面は、テストステロン補充療法をこのような療法が必要な女性に提供する方法である。この方法は、健康な若い成人女性におけるテストステロンの内因性血液レベルに実質的に一致するテストステロンの血液レベルに到達できるような量で、その女性にテストステロンを経皮的に投与することから成る療法である。
【0015】
本発明の他の局面は、テストステロン置換療法をこのような療法が必要な女性に経皮的に提供するための皮膚パッチである。この皮膚パッチは、以下の積層した複合体を含む:
(a) バッキング層;および
(b) 高分子キャリアー中にテストステロンの溶液を含有するマトリックス層であって、上記療法を可能にするために充分な一日当たりの用量のテストステロンを供給するマトリックス層。
【0016】
本発明のさらに他の局面は、テストステロンとエストロゲンとを組み合わせた置換療法をこのような療法が必要な女性に提供する方法である。この方法は、テストステロンとエストロゲンとを、健康な若い成人女性におけるテストステロンおよびエストロゲンの内因性血液レベルに実質的に一致するテストステロンおよびエストロゲンの血液レベルを上記女性に提供するそれぞれの量で、該女性に経皮的に同時投与する。
本発明のまた別の局面は、テストステロンおよびエストロゲン補充療法をこのような療法が必要な女性に経皮的に提供するための皮膚パッチである。この皮膚パッチは、以下を含む:
(a) バッキング層;
(b) 上記女性の皮膚と拡散的連絡があるように適合されそして該女性の皮膚を通して治療的に効果量のテストステロンおよびエストロゲンを伝達するように適合される、テストステロン−および−エストロゲンを含有する層。
【発明の効果】
【0017】
本発明により、テストステロンを単独であるいは必要に応じてエストロゲンと組み合わせて女性へ経皮的に投与するための皮膚パッチおよび方法が提供される。
【図面の簡単な説明】
【0018】
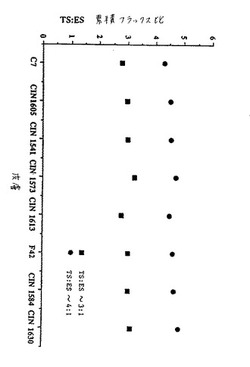
【図1】図1は、上記の実施例2に記載されるデータのグラフである。
【発明を実施するための形態】
【0019】
本明細書において使用される用語「エストロゲン」は、17β−エストラジオール;そのエステル、例えば、エストラジオール−3,17−ジアセテート、エストラジオール−3−アセテート、エストラジオール−17−アセテート、エストラジオール−3,17−ジバレレート(estradiol−3,17−divalerate)、エストラジオール−3−バレレート、エストラジオール−17−バレレート、および対応するピバレート、プロピオネート、シピオネート(cypionate)、ベンゾエートなどのエステル;エチニル(ethiny)エストラジオール、エストロン、および他のエストロゲン様ステロイド、ならびに経皮投与に適切であるそれら誘導体を意味する。同様に、用語「テストステロン」は、テストステロンならびに薬学的に許容可能なその誘導体、例えば、テストステロンのエナンテート(enanthate)、プロピオネート、およびシピオネートエステルを意味する。
【0020】
本明細書において使用される用語「テストステロン補充療法(testosterone replacement therapy)」は、健康な若い成人女性によって正常に生産される筈のテストステロンの全部または一部に相当する量を女性に経皮的に投与することを意味する。この点については、健康な成人女性では、約50%のテストステロンが、卵巣および副腎のそれぞれで生産される。従って、多くの例では、この療法は、両方の卵巣摘出を受けた女性、アンドロゲン生産が減少した閉経後の女性、および副腎アンドロゲン生産が減少した女性(例えば、アジソン病)に提供される。この後者のグループは
また、副腎アンドロゲン生産を副次的に抑制し得る、高用量のコルチコステロイド療法を受ける女性を包含する。
【0021】
本明細書において使用される用語「フラックス」は、 MerrittおよびCooper(J Controlled Release (1984)1:161)の方法により測定されるような、ホルモンが皮膚を横切って移動する速度を意味する。
【0022】
本明細書において使用される用語「内因性血清レベル(endogenous
serum level)」は、健康な若い成人女性に正常に見られるテストステロンまたはエストラジオールのそれぞれの血清レベルを意味する。テストステロンの場合には、この値は、約15〜80ng/dlであり;一方、エストラジオールについては、約25〜200pg/mLである。テストステロンまたはエストラジオールの誘導体の場合には、それぞれ天然ホルモンに匹敵するアンドロゲン活性またはエストロゲン活性を提供する量を意味する。用語「実質的に一致する」は、テストステロンおよびエストラジオールのいずれの場合も容認される標準偏差が、≧100%であることを意味する。
【0023】
用語「拡散的連通(diffusional communication)」は、本発明のパッチを女性の皮膚/粘膜の上に置く場合に、テストステロンおよび必要に応じてエストロゲンがパッチのホルモン含有成分から装着者の皮膚/粘膜に移動し得る、直接的または間接的な拡散経路が存在することを意味する。
【0024】
補充療法を女性に提供するに通常必要とされるテストステロンの一日当たりの用量は、50〜500μg/日、より通常には100〜300μg/日の範囲である。同様に、17β−エストラジオールの一日当たりの用量は、通常、25〜200μg/日、より通常には50〜100μg/日の範囲である。従って、拡散面積が5〜30cm2の範囲のパ
ッチについては、テストステロンのフラックスは、1.7〜100μg/cm2/日、よ
り通常には3.3〜60μg/cm2/日の範囲である。一方、エストラジオールのフラ
ックスは、通常、0.8〜40μg/cm2/日、より通常には1.7〜20μg/cm2/日である。
【0025】
上記のような一日当たりの用量のテストステロンおよび必要に応じてエストラジオールを投与するために用いられるパッチは、マトリックスタイプまたはコンテナタイプが使用できる。マトリックスタイプのパッチでは、単数または複数のホルモンは、他の添加剤(例えば、浸透促進剤、可塑剤、粘度減少剤など)と共に固体または半固体高分子キャリアーに均一にブレンドされる。コンテナタイプのデバイスでは、ホルモンは、典型的には、液体または半固体ビヒクルに溶解または懸濁され、そしてバッキングと、その下にあってホルモン透過性の膜との間の袋(pouch)または空間内に閉じ込められる。マトリックスおよびコンテナタイプのパッチの両方の一般的構造および製造法は、当該分野では周知である。
【0026】
本発明のテストステロンまたはテストステロン/エストロゲンを投与するための好適なパッチは、テストステロン/エストロゲンについて非透過性であり、そしてパッチ表面または上面を規定する閉塞性バッキングならびにホルモン、高分子キャリアー、および1つまたはそれ以上の皮膚浸透促進剤の均一ブレンドからなる固体または半固体マトリックス層を含むマトリックスタイプのパッチである。
【0027】
高分子キャリアーの化学的特性は特に決定的要素ではない。むしろ、キャリアー中のホルモンの拡散係数およびキャリアー中のホルモンの溶解度が重要である。このことに関して、キャリアー中のホルモンの拡散係数は、通常、10-4cm2/秒と10-12cm2/秒
との間、より通常には10-5cm2/秒と10-8cm2/秒との間である。同様に、キャリアー内のホルモンの溶解度は、通常、1〜200mg/cm3、より通常には10〜10
0mg/cm3の範囲である。キャリアー中のテストステロンおよび必要に応じてエスト
ロゲンの量は、予定装着時間中ずっと、必要とされる一日当たりの用量のホルモンを提供するに充分である。ホルモンは、結晶化を回避するために、キャリアー内にホルモンの飽和濃度未満で存在することが望ましい。パッチは、典型的に、1〜14日間、より通常には1〜7日間装着されるように計画されている。従って、キャリアー中のテストステロンの量は、通常、0.1〜30mgの間、より通常には1〜10mgの間であり、そしてエストロゲンを共存させる場合には、その量は、通常、0.1mgと10mgとの間、より通常には0.5mgと5mgとの間である。マトリックス層の厚さは、通常、0.01〜1mm、より通常には0.025〜0.25mmである。皮膚と拡散的接触をしているパッチの面積は、通常、1cm2と150cm2との間、より通常には5cm2と40cm2との間である。高分子キャリアーは、接着性であっても非接着性であってもよい。それが感圧性接着剤である場合、マトリックス層の底面は、パッチを皮膚に貼り付けるために使用できる。感圧性接着剤でない場合は、下層の接着層、周端接着層、接着性オーバーレイ、またはストラップのような他の手段が、パッチを皮膚に貼るために使用できる。
【0028】
キャリアーとして用いられ得る特定のポリマーの例には、ポリアクリレート、ポリメタクリレート、天然および合成ゴム、シリコーンゴムおよびエラストマー、ポリオレフィン、ビニルコポリマー、ウレタン、ナイロン、ポリエステル、ポリエーテルなどがあるが、これらに限定されない。
【0029】
マトリックスに含まれる単数または複数の皮膚浸透促進剤は、ホルモンの皮膚フラックスのレベルを高める。使用できる皮膚浸透促進剤の例には、米国特許第5,122,383号および同第5,152,997号に記載および参照されているものがあるが、これらに限定されない。皮膚浸透促進剤に関するこれらの開示は、参考として援用している。促進剤は、通常、マトリックスの1〜20重量%、より通常にはマトリックスの5〜15重量%を構成する。
【0030】
本発明のパッチは、経皮的薬剤送達デバイスの分野において用いられる従来技術により製造され得る。例えば、ホルモン、キャリアー、および促進剤は、所望の比率で混合されて、均一な混合物を形成し、キャスト成型するか、あるいはリリースライナー層(release liner layer)への積層によって、バッキング層に塗布する。
【0031】
以下の実施例により本発明をさらに説明する。これらの実施例は、どんな形でも本発明を限定するものではない。別に示さない限り百分率および比率は重量基準である。
【実施例】
【0032】
(実施例1)
テストステロン(TS)をUpjohn Companyから入手した。ソルビタンモノオレエート(sorbitan monooleate)(Arlacel 80)をICI Americasから入手した。ポリアクリレート接着剤(Durotak 80−1196)をNational Starch and Chemical Companyから入手した。リリースライナー(release liner)(ポリエステル、S242M)をRelease
Technologies,Inc.から、そしてポリエチレンバッキングフィルム(Cotran 9720)を3M Corporationから入手した。
【0033】
接着剤の固体含量を、少量の接着剤溶液を予め計量したアルミニウムの皿に載せて計量することにより決定した。溶媒を70℃に保持した対流式オーブン内で一晩乾燥することにより蒸発させ、そして固型接着剤含有量%を乾燥接着剤の重量を基に決定した。
【0034】
既知量の接着剤溶液をガラス瓶に入れて計量した。接着剤溶液の重量および接着剤の固体含量%から溶液中の接着剤の量を計算した。適切な量のテストステロンおよびソルビタンモノオレエートを、得られる乾燥フィルム組成物中の接着剤、テストステロン、およびソルビタンモノオレエートの重量比が83:2:15になるように、接着剤溶液に添加した。次いで、このガラス瓶にきつく蓋をしてパラフィルムでシールし、そして全ての内容物が完全に溶解して溶液が視覚的に透明になるまで一晩回転させた。
【0035】
次いで、約8mlの接着剤/テストステロン/ソルビタンモノオレエート混合物をリリースライナー上に分散させ、そして250ミクロンのギャップのキャスティングナイフでキャスト成型した。この成型物を対流式オーブン中で15分、70℃で乾燥させ約60ミクロンの厚さの乾燥フィルムを生成した。次いで、バッキングフィルムを、ゴムローラーを用いてこの接着剤フィルム上に積層した。このマトリックス積層体を用いてインビトロ皮膚フラックス研究を行った。
【0036】
同様の積層体を、別のエンハンサー(グリセリルモノオレエート(glyceryl monooleate)、メチルラウレート(methyl laurate)、アスコルビルステアレート(ascorbyl stearate)、およびアスコルビルパルミテート(ascorbyl palmitate))を用いエンハンサーの量を変えて(5〜15重量%)、あるいはエンハンサ15%の存在下でTS含有量を変えて作製した。
【0037】
インビトロ皮膚フラックス研究を、MerrittおよびCooper(前出)の一般的な方法により、改変したFranzの拡散セル(diffusion
cell)を用いて行った。熱で分離したヒトの表皮膜を方形小片に切断した。マトリックスも同様の方形小片に切断した。リリースライナーを剥がして廃棄した後、マトリックスを表皮膜の角質層表面に積層した。次いで、皮膚−マトリックスサンドイッチを拡散セルに導入するために小片に切断した。皮膚マトリックスサンドイッチの各片を拡散セルのドナー区画とレシーバー区画との間に装着した。表皮側はレシーバー区画に面しており、その場所に固定した。次いで、レシーバー区画を0.02%のアジ化ナトリウム溶液で満たした。この媒体中のテストステロンの溶解度は、実験の間シンクの状態を確実にするために適切である。次いでそのセルを、皮膚の表面温度を32±1℃に維持するように較正された循環水浴中に置いた。
【0038】
所定の間隔でレシーバー区画の全内容物をTS定量のために回収し、そしてこのレシーバー区画を、皮膚/溶液界面に気泡が入らないように注意しながら、新鮮なレセプター媒体で再度満たした。任意の時間tにおける単位面積当たりのTSの累積浸透量(Qt、μ
g/cm2)は、以下のように決定した:
【0039】
【数1】

【0040】
ここで、 Cnは対応する採取時間におけるレシーバーサンプル中の薬剤の濃度(μg/
ml)であり、Vはレシーバーチャンバー(〜6.3cm3)中の流体の体積であり、そ
してAはセルの拡散面積(0.64cm2)である。Qt対tプロットに最も適合する直線の傾きは定常状態のフラックス(Jss、μg/cm2/h)を示す;時間軸上のこの直線
の切片は誘導時間(tL、h)を示す。
【0041】
逆相HPLCを用いて、インビトロ由来のサンプル中のTS濃度を測定した。HPLCの方法を以下にまとめる
移動相:47/53%(v/v)アセトニトリル/H2O
流速:1.0Ml/分
カラム:Partisphere C18、10cm(Whatman)
注入容量:50μL
波長:245nm
保持時間:4.5〜4.8分
分析時間:6分
これらの研究から週に2回(すなわち−3−4日おきに)装着するテストステロンパッチのプロトタイプを設計した。プロトタイプのパッチのマトリックス処方物はDurotak 80−1196(83%)/TS(2%)/Arlacel 80(15%)である。マトリックスのコーティング重量は91±9.1mg;大きさは15cm2、そして
毎日の用量は約150μg/日である。
【0042】
(実施例2)
エストラジオール(ES)をDiosynth,Inc.より入手した。他の材料は実施例1と同じ手段で入手した。
【0043】
実施例1の研究を基にしてTSとESを同時に投与する2つのパッチを作製した。一方は、TS:ESフラックスが4:1であり、他方は3:1のフラックス比を有するように設計した。4:1パッチのマトリックス組成物は、Durotak 80−1196(80.5%)/Arlacel 80(15%)/ES(1.5%)/TS(3%)であった。3:1パッチのマトリックス組成物は、Durotak 80−1196(81.5%)/Arlacel 80(15%)/ES(1.5%)/TS(2%)であった。他のパッチ成分は実施例1と同じであった。
【0044】
フラックス研究をこれらのパッチについて実施例1のように行った。図は、これらの研究のデータのプロットである。特に、この図は、8個の皮膚サンプルのそれぞれに対するTS:ESフラックス比を示している。これらの研究を基にして、〜150μg/日TSおよび50μg/日ESを送達することを目標とする、3:1比の10〜20cm2のパ
ッチを開発した。
【0045】
(実施例3)
実施例1(TMTDSと称する)および実施例2(ETMTDSと称する)(どちらのプロトタイプも表面積は15cm2であった)に記載したパッチの臨床研究を行った。こ
の研究は、このパッチを96時間装着した閉経後の女性のテストステロンおよびエストラジオールの血清中の濃度を評価するために設計された。研究の詳細は以下の通りである:
(a)被検体集団)
年齢範囲36歳〜61歳の12人の健康な女性が参加した。全員が左右の卵巣摘出および子宮摘出を受けていた。
【0046】
(b)処置スケジュール)
各被験者は2回の処置期間を含む釣り合いのとれたランダムな交差順序(balanced randomized crossover sequence)で処置を受けた。各処置期間では1パッチを96時間装着させた。2週間のウォッシュアウト期間により各期間の開始を隔てた。パッチはウエストラインの下の臀部の上部外側四半部の両側に交互に装着された。
【0047】
(c)血液サンプル)
サンプルを各処置期間の各パッチ適用の前、間および後に入手した。適用前のサンプルを内在性ホルモン生成に関する概日性の変動のパターンを決定するために用いた。それらを−24、−22、−20、−18、−16、−12および−1時間に得た。パッチ装着中はサンプルを2、4、6、8、12、24、36、48、60、72、84、および96時間に得た。投与後のサンプルは、98、100、108、および120時間に得た。サンプルをテストステロン(T)、エストラジオール(E2)、ジヒドロテストステロン(DHT)、ジヒドロエピアンドロステンジオン(DHEA)、およびエストロン(E1)含量について分析した。
【0048】
(d)血清中のホルモンレベル)
(1.TMTDS)
テストステロンの血清濃度は、系の適用後定常的に増加し、そして8〜12時間以内に安定期に達した。たとえ平均(SD)、すなわちTについて補正されていないCmaxが3
5.5 ng/dl(範囲;16−53 ng/dl)であっても、血清濃度は、24時間と96時間との間の投与間隔にわたって有意に異ならなかった。エストラジオールおよびエストロンの平均(SD)Cmaxはそれぞれ7.5 pg/mlおよび27.0 pg
/mlであった。これらの値は平均のベースライン値(エストラジオールは3.0、そしてエストロンは19.2)とはわずかに異なり、そして外因性テストステロンの最終代謝産物を反映し得るがおそらく有意な量ではない。DHTは、テストステロンの主要な代謝産物であり、装着期間の間にゆっくり増加し、そして7.8 ng/dlの平均(SD)Cmax(範囲:4−11 ng/dl)に到達した。投与間隔の間のDHT濃度は、T濃
度と同様にかなり狭い安定期で残存した。TMTDSを装着している期間の間に、DHEA濃度は134−1091ng/dlの範囲であった。 DHEA濃度に関連する概日性のパターンは、TMTDSからのテストステロンの外因性送達によって乱されなかった。TMTDS装着期間中に測定された各ホルモンの平均(SD)濃度を下記の表1に作表した。
【0049】
【表1】

【0050】
(2.ETMTDS)
テストステロンおよびエストラジオールの血清濃度は、適用直後に上昇しそして12−24時間以内に安定期に達した。Tの補正されていない血清濃度の平均(SD)ピークは、33.7ng/dl(範囲:11−64ng/dl)であったのに対し、エストラジオールのCmaxは42.9pg/ml(範囲:21−70ng/ml)であった。Tおよび
E2の主要な代謝産物は、DHTおよびエストロンであり、それぞれ7.3ng/dlおよび36.8pg/mlの平均Cmaxを有していた。T、E2、DHT、およびE1の濃
度は、全て24−96時間にかけて狭い範囲に維持された。TMTDSパッチの場合のように、DHEA血清濃度をそれらの特徴的な概日性パターン(範囲:259−771)に維持され、外因性の性ホルモンの送達によって影響を受けないようである。ETMTDS装着期間の間に測定された各ホルモンの平均(SD)濃度を下記の表2に示す。
【0051】
【表2】

【0052】
(e.結論)
TMTDSおよびETMTDSは、閉経後卵巣摘出された女性のこの集団によってよく許容された。研究の間に報告された皮膚または全身の有意な不都合な影響はなかった。テストステロンおよびエストラジオールのどちらもこれらの処方物からよく吸収され、そして得られる両ホルモンの血清濃度は、提案された投与間隔にわたって持続的にインビトロの評価から予想されるレベルに近づく。
【0053】
TMTDSは、主なアンドロゲン代謝産物であるDHTの過剰な生産をすることなく、循環するテストステロン濃度を、ETMTDSが行ったように25−30ng/dlの範囲に高めた。
【0054】
ETMTDSからのエストラジオールの送達は、25−30pg/mlの範囲の循環するエストラジオールの平均増分の増加を提供した。
【0055】
上記の本発明の実施態様の改変は医薬分野の当業者には自明であり、ホルモン補充治療、経皮薬剤送達、および関連技術は以下の請求の範囲内であることを意図する。
【技術分野】
【0001】
本発明は、経皮薬剤送達の分野に関する。より特定すれば、テストステロンを単独であるいは必要に応じてエストロゲンと組み合わせて女性へ経皮的に投与するための皮膚パッチおよび方法に関する。
【背景技術】
【0002】
エストロゲンは、一般に、閉経期後の症状および骨粗しょう症のホルモン補充療法において用いられている。しかし、多くの女性は、エストロゲン単独療法の後、症状を経験し続ける。閉経期後の女性の肉体的および情動の幸福感に対するアンドロゲンの有益な効果が、つい最近認識されてきている。いくつかの臨床研究が、エストロゲン−アンドロゲンの組み合わせ療法の基礎を確立した。McGill大学における一連の二重盲実験法により管理された研究において、エストロゲン−アンドロゲン組み合わせ療法の患者は、エストロゲン置換療法(ERT)単独の患者よりも日々の幸福感、エネルギーレベル、および睡眠の質について高水準のスコアを記録していたことが注目された。著者らはまた、性機能に対するエストロゲン−アンドロゲン療法の有益な効果、および脂質に関して有害な影響のないことを報告した。
【0003】
エストロゲンは単独でいくらかの女性を助け得るが、アンドロゲン類は失われた性衝動の回復を助けることにおいて選択されるホルモンである。文献中のいくつかの報告は、性機能に対するアンドロゲン療法の有益な効果を確立している。このことは、若くて外科的に閉経期後となった女性において特に重要であり、彼女らは、非経口的にアンドロゲンを、単独またはエストロゲンと組み合わせて用いて治療された場合、エストロゲン単独または偽薬を用いた場合と比べて、性行動(要求または喚起)の動機増進が観察された。骨粗しょう症の予防に対して、ERTにアンドロゲンを添加することの正当性もまた、文献において見い出される。
【発明の概要】
【発明が解決しようとする課題】
【0004】
ERT養生法にアンドロゲンを添加する利益が十分認識されている一方、アンドロゲン療法、またはエストロゲン−アンドロゲン組み合わせ療法に利用可能な調剤形態は、なお多くの問題を残している。特に、これらの物理療法のいずれも、血清テストステロンの日内変動を正常な生理学的範囲内にとどめることを達成できていない。臨床用途に最も利用可能なアンドロゲンは、代表的には、天然(native)のテストステロンではなく、通常合成アンドロゲンが用いられる(例えば肝臓毒性があることが知られているメチルテストステロン)。天然のテストステロンは、体内挿入が可能なペレットとして利用可能である;しかし、このシステムは、侵入投与を必要とし、そして安定な生理学的ホルモン状態を生成しない。テストステロンプロピオネートおよび長く作用するテストステロンエナンテート(testosterone enanthate)のような注射可能なテストステロンエステルは、ホルモンレベルが生理学的範囲を著しく超えて変動する。現在のアンドロゲン補充用製品が生理学的にかけはなれた性質をもっていることが、これらの使用により頻繁に見られる過剰のアンドロゲン効果の徴候および症状の原因となっている。これらは、男性化の症状、例えば、多毛症、男性型禿頭症、声の低音化、および陰核巨大症;排卵および月経機能の障害;座瘡および油肌(oily skin);ならびに胸圧痛(breast tenderness)、体液の停滞(fluid retention)、過敏症および抑鬱症が含まれる。これらの問題は、現在市場に出ているエストロゲン−アンドロゲン製品にも存在する。エストロゲンを併用しても、またはしなくても、テストステロンおよびその代謝産物の生理学的レベルを提供する物理療法は、現行のアンドロゲン補充製品に比べ顕著な治療的利益を有する。
【0005】
多くの論文および特許が、テストステロンの経皮投与について示唆または報告している。一般に、これらの刊行物は、男性性機能不全、貧血、および男性骨粗しょう症のような状態を治療するために、テストステロン療法を男性に提供することに焦点を当てていた。この文献のほとんどは、透過促進を何らかの形かで行わない場合には、テストステロンは実用的なフラックス(flux)レベルで非陰嚢皮膚を通過しないと結論している。最も最近の米国特許第5,152,997号には、実用的フラックスレベルを提供する条件(皮膚パッチにおいてテストステロンのほぼ飽和濃度;皮膚浸透促進剤の同時投与)下で非陰嚢皮膚を通してテストステロンを男性に経皮投与することが記載されている。しかしこの文献は、テストステロンまたはテストステロン/エストロゲンの組み合わせによる補充療法を女性に適用するという課題については、事実上記載していない。
【課題を解決するための手段】
【0006】
本発明により、テストステロン置換療法を該療法が必要な女性に提供する方法であって、健康な若い成人女性におけるテストステロンの内因性血液レベルに実質的に一致するテストステロンの血液レベルを該女性に提供する量で、テストステロンを該女性に経皮的に投与する工程を包含する方法が提供される。
【0007】
1つの実施形態では、上記量が50〜500μg/日の範囲である方法が提供される。
【0008】
また、本発明により、テストステロン置換療法を該療法が必要な女性に経皮的に提供するための皮膚パッチであって、(a)バッキング層;および(b)ポリマー性キャリアー中にテストステロンの溶液を含有するマトリックス層であって、該マトリックス層が該療法を提供するために充分な一日毎の用量のテストステロンを供給するマトリックス層の積層化化合物を含む、皮膚パッチが提供される。
【0009】
1つの実施形態では、上記ポリマー性キャリアーが感圧性接着剤であり、そして上記パッチが50〜500μgテストステロン/日を供給する皮膚パッチである。
【0010】
さらに、本発明により、テストステロンとエストロゲンとを組み合わせた置換療法を該療法が必要な女性に提供する方法であって、テストステロンとエストロゲンとを、健康な若い成人女性におけるテストステロンおよびエストロゲンの内因性血液レベルに実質的に一致するテストステロンおよびエストロゲンの血液レベルを該女性に提供するそれぞれの量で、該女性に経皮的に同時投与する方法が提供される。
【0011】
1つの実施形態では、上記テストステロンの量が50〜500μg/日であり、そして上記エストロゲンが17β−エストラジオールであり、そして上記エストロゲンの量が25〜200μg/日である方法が提供される。
【0012】
そして、本発明により、テストステロンおよびエストロゲン置換療法を該療法が必要な女性に経皮的に提供するための皮膚パッチであって、(a)バッキング層;(b)テストステロン−および−エストロゲンを含有する層であって、該女性の皮膚と拡散的連絡があるように適合されそして該女性の皮膚を通して治療的に効果量のテストステロンおよびエストロゲンを伝達するように適合される層を含む皮膚パッチが提供される。
【0013】
1つの実施形態では、上記テストステロンの量が50〜500μg/日であり、そして上記エストロゲンが17β−エストラジオールであり、そして上記エストロゲンの量が25〜200μg/日であるパッチが提供される。
【0014】
本発明の1つの局面は、テストステロン補充療法をこのような療法が必要な女性に提供する方法である。この方法は、健康な若い成人女性におけるテストステロンの内因性血液レベルに実質的に一致するテストステロンの血液レベルに到達できるような量で、その女性にテストステロンを経皮的に投与することから成る療法である。
【0015】
本発明の他の局面は、テストステロン置換療法をこのような療法が必要な女性に経皮的に提供するための皮膚パッチである。この皮膚パッチは、以下の積層した複合体を含む:
(a) バッキング層;および
(b) 高分子キャリアー中にテストステロンの溶液を含有するマトリックス層であって、上記療法を可能にするために充分な一日当たりの用量のテストステロンを供給するマトリックス層。
【0016】
本発明のさらに他の局面は、テストステロンとエストロゲンとを組み合わせた置換療法をこのような療法が必要な女性に提供する方法である。この方法は、テストステロンとエストロゲンとを、健康な若い成人女性におけるテストステロンおよびエストロゲンの内因性血液レベルに実質的に一致するテストステロンおよびエストロゲンの血液レベルを上記女性に提供するそれぞれの量で、該女性に経皮的に同時投与する。
本発明のまた別の局面は、テストステロンおよびエストロゲン補充療法をこのような療法が必要な女性に経皮的に提供するための皮膚パッチである。この皮膚パッチは、以下を含む:
(a) バッキング層;
(b) 上記女性の皮膚と拡散的連絡があるように適合されそして該女性の皮膚を通して治療的に効果量のテストステロンおよびエストロゲンを伝達するように適合される、テストステロン−および−エストロゲンを含有する層。
【発明の効果】
【0017】
本発明により、テストステロンを単独であるいは必要に応じてエストロゲンと組み合わせて女性へ経皮的に投与するための皮膚パッチおよび方法が提供される。
【図面の簡単な説明】
【0018】
【図1】図1は、上記の実施例2に記載されるデータのグラフである。
【発明を実施するための形態】
【0019】
本明細書において使用される用語「エストロゲン」は、17β−エストラジオール;そのエステル、例えば、エストラジオール−3,17−ジアセテート、エストラジオール−3−アセテート、エストラジオール−17−アセテート、エストラジオール−3,17−ジバレレート(estradiol−3,17−divalerate)、エストラジオール−3−バレレート、エストラジオール−17−バレレート、および対応するピバレート、プロピオネート、シピオネート(cypionate)、ベンゾエートなどのエステル;エチニル(ethiny)エストラジオール、エストロン、および他のエストロゲン様ステロイド、ならびに経皮投与に適切であるそれら誘導体を意味する。同様に、用語「テストステロン」は、テストステロンならびに薬学的に許容可能なその誘導体、例えば、テストステロンのエナンテート(enanthate)、プロピオネート、およびシピオネートエステルを意味する。
【0020】
本明細書において使用される用語「テストステロン補充療法(testosterone replacement therapy)」は、健康な若い成人女性によって正常に生産される筈のテストステロンの全部または一部に相当する量を女性に経皮的に投与することを意味する。この点については、健康な成人女性では、約50%のテストステロンが、卵巣および副腎のそれぞれで生産される。従って、多くの例では、この療法は、両方の卵巣摘出を受けた女性、アンドロゲン生産が減少した閉経後の女性、および副腎アンドロゲン生産が減少した女性(例えば、アジソン病)に提供される。この後者のグループは
また、副腎アンドロゲン生産を副次的に抑制し得る、高用量のコルチコステロイド療法を受ける女性を包含する。
【0021】
本明細書において使用される用語「フラックス」は、 MerrittおよびCooper(J Controlled Release (1984)1:161)の方法により測定されるような、ホルモンが皮膚を横切って移動する速度を意味する。
【0022】
本明細書において使用される用語「内因性血清レベル(endogenous
serum level)」は、健康な若い成人女性に正常に見られるテストステロンまたはエストラジオールのそれぞれの血清レベルを意味する。テストステロンの場合には、この値は、約15〜80ng/dlであり;一方、エストラジオールについては、約25〜200pg/mLである。テストステロンまたはエストラジオールの誘導体の場合には、それぞれ天然ホルモンに匹敵するアンドロゲン活性またはエストロゲン活性を提供する量を意味する。用語「実質的に一致する」は、テストステロンおよびエストラジオールのいずれの場合も容認される標準偏差が、≧100%であることを意味する。
【0023】
用語「拡散的連通(diffusional communication)」は、本発明のパッチを女性の皮膚/粘膜の上に置く場合に、テストステロンおよび必要に応じてエストロゲンがパッチのホルモン含有成分から装着者の皮膚/粘膜に移動し得る、直接的または間接的な拡散経路が存在することを意味する。
【0024】
補充療法を女性に提供するに通常必要とされるテストステロンの一日当たりの用量は、50〜500μg/日、より通常には100〜300μg/日の範囲である。同様に、17β−エストラジオールの一日当たりの用量は、通常、25〜200μg/日、より通常には50〜100μg/日の範囲である。従って、拡散面積が5〜30cm2の範囲のパ
ッチについては、テストステロンのフラックスは、1.7〜100μg/cm2/日、よ
り通常には3.3〜60μg/cm2/日の範囲である。一方、エストラジオールのフラ
ックスは、通常、0.8〜40μg/cm2/日、より通常には1.7〜20μg/cm2/日である。
【0025】
上記のような一日当たりの用量のテストステロンおよび必要に応じてエストラジオールを投与するために用いられるパッチは、マトリックスタイプまたはコンテナタイプが使用できる。マトリックスタイプのパッチでは、単数または複数のホルモンは、他の添加剤(例えば、浸透促進剤、可塑剤、粘度減少剤など)と共に固体または半固体高分子キャリアーに均一にブレンドされる。コンテナタイプのデバイスでは、ホルモンは、典型的には、液体または半固体ビヒクルに溶解または懸濁され、そしてバッキングと、その下にあってホルモン透過性の膜との間の袋(pouch)または空間内に閉じ込められる。マトリックスおよびコンテナタイプのパッチの両方の一般的構造および製造法は、当該分野では周知である。
【0026】
本発明のテストステロンまたはテストステロン/エストロゲンを投与するための好適なパッチは、テストステロン/エストロゲンについて非透過性であり、そしてパッチ表面または上面を規定する閉塞性バッキングならびにホルモン、高分子キャリアー、および1つまたはそれ以上の皮膚浸透促進剤の均一ブレンドからなる固体または半固体マトリックス層を含むマトリックスタイプのパッチである。
【0027】
高分子キャリアーの化学的特性は特に決定的要素ではない。むしろ、キャリアー中のホルモンの拡散係数およびキャリアー中のホルモンの溶解度が重要である。このことに関して、キャリアー中のホルモンの拡散係数は、通常、10-4cm2/秒と10-12cm2/秒
との間、より通常には10-5cm2/秒と10-8cm2/秒との間である。同様に、キャリアー内のホルモンの溶解度は、通常、1〜200mg/cm3、より通常には10〜10
0mg/cm3の範囲である。キャリアー中のテストステロンおよび必要に応じてエスト
ロゲンの量は、予定装着時間中ずっと、必要とされる一日当たりの用量のホルモンを提供するに充分である。ホルモンは、結晶化を回避するために、キャリアー内にホルモンの飽和濃度未満で存在することが望ましい。パッチは、典型的に、1〜14日間、より通常には1〜7日間装着されるように計画されている。従って、キャリアー中のテストステロンの量は、通常、0.1〜30mgの間、より通常には1〜10mgの間であり、そしてエストロゲンを共存させる場合には、その量は、通常、0.1mgと10mgとの間、より通常には0.5mgと5mgとの間である。マトリックス層の厚さは、通常、0.01〜1mm、より通常には0.025〜0.25mmである。皮膚と拡散的接触をしているパッチの面積は、通常、1cm2と150cm2との間、より通常には5cm2と40cm2との間である。高分子キャリアーは、接着性であっても非接着性であってもよい。それが感圧性接着剤である場合、マトリックス層の底面は、パッチを皮膚に貼り付けるために使用できる。感圧性接着剤でない場合は、下層の接着層、周端接着層、接着性オーバーレイ、またはストラップのような他の手段が、パッチを皮膚に貼るために使用できる。
【0028】
キャリアーとして用いられ得る特定のポリマーの例には、ポリアクリレート、ポリメタクリレート、天然および合成ゴム、シリコーンゴムおよびエラストマー、ポリオレフィン、ビニルコポリマー、ウレタン、ナイロン、ポリエステル、ポリエーテルなどがあるが、これらに限定されない。
【0029】
マトリックスに含まれる単数または複数の皮膚浸透促進剤は、ホルモンの皮膚フラックスのレベルを高める。使用できる皮膚浸透促進剤の例には、米国特許第5,122,383号および同第5,152,997号に記載および参照されているものがあるが、これらに限定されない。皮膚浸透促進剤に関するこれらの開示は、参考として援用している。促進剤は、通常、マトリックスの1〜20重量%、より通常にはマトリックスの5〜15重量%を構成する。
【0030】
本発明のパッチは、経皮的薬剤送達デバイスの分野において用いられる従来技術により製造され得る。例えば、ホルモン、キャリアー、および促進剤は、所望の比率で混合されて、均一な混合物を形成し、キャスト成型するか、あるいはリリースライナー層(release liner layer)への積層によって、バッキング層に塗布する。
【0031】
以下の実施例により本発明をさらに説明する。これらの実施例は、どんな形でも本発明を限定するものではない。別に示さない限り百分率および比率は重量基準である。
【実施例】
【0032】
(実施例1)
テストステロン(TS)をUpjohn Companyから入手した。ソルビタンモノオレエート(sorbitan monooleate)(Arlacel 80)をICI Americasから入手した。ポリアクリレート接着剤(Durotak 80−1196)をNational Starch and Chemical Companyから入手した。リリースライナー(release liner)(ポリエステル、S242M)をRelease
Technologies,Inc.から、そしてポリエチレンバッキングフィルム(Cotran 9720)を3M Corporationから入手した。
【0033】
接着剤の固体含量を、少量の接着剤溶液を予め計量したアルミニウムの皿に載せて計量することにより決定した。溶媒を70℃に保持した対流式オーブン内で一晩乾燥することにより蒸発させ、そして固型接着剤含有量%を乾燥接着剤の重量を基に決定した。
【0034】
既知量の接着剤溶液をガラス瓶に入れて計量した。接着剤溶液の重量および接着剤の固体含量%から溶液中の接着剤の量を計算した。適切な量のテストステロンおよびソルビタンモノオレエートを、得られる乾燥フィルム組成物中の接着剤、テストステロン、およびソルビタンモノオレエートの重量比が83:2:15になるように、接着剤溶液に添加した。次いで、このガラス瓶にきつく蓋をしてパラフィルムでシールし、そして全ての内容物が完全に溶解して溶液が視覚的に透明になるまで一晩回転させた。
【0035】
次いで、約8mlの接着剤/テストステロン/ソルビタンモノオレエート混合物をリリースライナー上に分散させ、そして250ミクロンのギャップのキャスティングナイフでキャスト成型した。この成型物を対流式オーブン中で15分、70℃で乾燥させ約60ミクロンの厚さの乾燥フィルムを生成した。次いで、バッキングフィルムを、ゴムローラーを用いてこの接着剤フィルム上に積層した。このマトリックス積層体を用いてインビトロ皮膚フラックス研究を行った。
【0036】
同様の積層体を、別のエンハンサー(グリセリルモノオレエート(glyceryl monooleate)、メチルラウレート(methyl laurate)、アスコルビルステアレート(ascorbyl stearate)、およびアスコルビルパルミテート(ascorbyl palmitate))を用いエンハンサーの量を変えて(5〜15重量%)、あるいはエンハンサ15%の存在下でTS含有量を変えて作製した。
【0037】
インビトロ皮膚フラックス研究を、MerrittおよびCooper(前出)の一般的な方法により、改変したFranzの拡散セル(diffusion
cell)を用いて行った。熱で分離したヒトの表皮膜を方形小片に切断した。マトリックスも同様の方形小片に切断した。リリースライナーを剥がして廃棄した後、マトリックスを表皮膜の角質層表面に積層した。次いで、皮膚−マトリックスサンドイッチを拡散セルに導入するために小片に切断した。皮膚マトリックスサンドイッチの各片を拡散セルのドナー区画とレシーバー区画との間に装着した。表皮側はレシーバー区画に面しており、その場所に固定した。次いで、レシーバー区画を0.02%のアジ化ナトリウム溶液で満たした。この媒体中のテストステロンの溶解度は、実験の間シンクの状態を確実にするために適切である。次いでそのセルを、皮膚の表面温度を32±1℃に維持するように較正された循環水浴中に置いた。
【0038】
所定の間隔でレシーバー区画の全内容物をTS定量のために回収し、そしてこのレシーバー区画を、皮膚/溶液界面に気泡が入らないように注意しながら、新鮮なレセプター媒体で再度満たした。任意の時間tにおける単位面積当たりのTSの累積浸透量(Qt、μ
g/cm2)は、以下のように決定した:
【0039】
【数1】

【0040】
ここで、 Cnは対応する採取時間におけるレシーバーサンプル中の薬剤の濃度(μg/
ml)であり、Vはレシーバーチャンバー(〜6.3cm3)中の流体の体積であり、そ
してAはセルの拡散面積(0.64cm2)である。Qt対tプロットに最も適合する直線の傾きは定常状態のフラックス(Jss、μg/cm2/h)を示す;時間軸上のこの直線
の切片は誘導時間(tL、h)を示す。
【0041】
逆相HPLCを用いて、インビトロ由来のサンプル中のTS濃度を測定した。HPLCの方法を以下にまとめる
移動相:47/53%(v/v)アセトニトリル/H2O
流速:1.0Ml/分
カラム:Partisphere C18、10cm(Whatman)
注入容量:50μL
波長:245nm
保持時間:4.5〜4.8分
分析時間:6分
これらの研究から週に2回(すなわち−3−4日おきに)装着するテストステロンパッチのプロトタイプを設計した。プロトタイプのパッチのマトリックス処方物はDurotak 80−1196(83%)/TS(2%)/Arlacel 80(15%)である。マトリックスのコーティング重量は91±9.1mg;大きさは15cm2、そして
毎日の用量は約150μg/日である。
【0042】
(実施例2)
エストラジオール(ES)をDiosynth,Inc.より入手した。他の材料は実施例1と同じ手段で入手した。
【0043】
実施例1の研究を基にしてTSとESを同時に投与する2つのパッチを作製した。一方は、TS:ESフラックスが4:1であり、他方は3:1のフラックス比を有するように設計した。4:1パッチのマトリックス組成物は、Durotak 80−1196(80.5%)/Arlacel 80(15%)/ES(1.5%)/TS(3%)であった。3:1パッチのマトリックス組成物は、Durotak 80−1196(81.5%)/Arlacel 80(15%)/ES(1.5%)/TS(2%)であった。他のパッチ成分は実施例1と同じであった。
【0044】
フラックス研究をこれらのパッチについて実施例1のように行った。図は、これらの研究のデータのプロットである。特に、この図は、8個の皮膚サンプルのそれぞれに対するTS:ESフラックス比を示している。これらの研究を基にして、〜150μg/日TSおよび50μg/日ESを送達することを目標とする、3:1比の10〜20cm2のパ
ッチを開発した。
【0045】
(実施例3)
実施例1(TMTDSと称する)および実施例2(ETMTDSと称する)(どちらのプロトタイプも表面積は15cm2であった)に記載したパッチの臨床研究を行った。こ
の研究は、このパッチを96時間装着した閉経後の女性のテストステロンおよびエストラジオールの血清中の濃度を評価するために設計された。研究の詳細は以下の通りである:
(a)被検体集団)
年齢範囲36歳〜61歳の12人の健康な女性が参加した。全員が左右の卵巣摘出および子宮摘出を受けていた。
【0046】
(b)処置スケジュール)
各被験者は2回の処置期間を含む釣り合いのとれたランダムな交差順序(balanced randomized crossover sequence)で処置を受けた。各処置期間では1パッチを96時間装着させた。2週間のウォッシュアウト期間により各期間の開始を隔てた。パッチはウエストラインの下の臀部の上部外側四半部の両側に交互に装着された。
【0047】
(c)血液サンプル)
サンプルを各処置期間の各パッチ適用の前、間および後に入手した。適用前のサンプルを内在性ホルモン生成に関する概日性の変動のパターンを決定するために用いた。それらを−24、−22、−20、−18、−16、−12および−1時間に得た。パッチ装着中はサンプルを2、4、6、8、12、24、36、48、60、72、84、および96時間に得た。投与後のサンプルは、98、100、108、および120時間に得た。サンプルをテストステロン(T)、エストラジオール(E2)、ジヒドロテストステロン(DHT)、ジヒドロエピアンドロステンジオン(DHEA)、およびエストロン(E1)含量について分析した。
【0048】
(d)血清中のホルモンレベル)
(1.TMTDS)
テストステロンの血清濃度は、系の適用後定常的に増加し、そして8〜12時間以内に安定期に達した。たとえ平均(SD)、すなわちTについて補正されていないCmaxが3
5.5 ng/dl(範囲;16−53 ng/dl)であっても、血清濃度は、24時間と96時間との間の投与間隔にわたって有意に異ならなかった。エストラジオールおよびエストロンの平均(SD)Cmaxはそれぞれ7.5 pg/mlおよび27.0 pg
/mlであった。これらの値は平均のベースライン値(エストラジオールは3.0、そしてエストロンは19.2)とはわずかに異なり、そして外因性テストステロンの最終代謝産物を反映し得るがおそらく有意な量ではない。DHTは、テストステロンの主要な代謝産物であり、装着期間の間にゆっくり増加し、そして7.8 ng/dlの平均(SD)Cmax(範囲:4−11 ng/dl)に到達した。投与間隔の間のDHT濃度は、T濃
度と同様にかなり狭い安定期で残存した。TMTDSを装着している期間の間に、DHEA濃度は134−1091ng/dlの範囲であった。 DHEA濃度に関連する概日性のパターンは、TMTDSからのテストステロンの外因性送達によって乱されなかった。TMTDS装着期間中に測定された各ホルモンの平均(SD)濃度を下記の表1に作表した。
【0049】
【表1】

【0050】
(2.ETMTDS)
テストステロンおよびエストラジオールの血清濃度は、適用直後に上昇しそして12−24時間以内に安定期に達した。Tの補正されていない血清濃度の平均(SD)ピークは、33.7ng/dl(範囲:11−64ng/dl)であったのに対し、エストラジオールのCmaxは42.9pg/ml(範囲:21−70ng/ml)であった。Tおよび
E2の主要な代謝産物は、DHTおよびエストロンであり、それぞれ7.3ng/dlおよび36.8pg/mlの平均Cmaxを有していた。T、E2、DHT、およびE1の濃
度は、全て24−96時間にかけて狭い範囲に維持された。TMTDSパッチの場合のように、DHEA血清濃度をそれらの特徴的な概日性パターン(範囲:259−771)に維持され、外因性の性ホルモンの送達によって影響を受けないようである。ETMTDS装着期間の間に測定された各ホルモンの平均(SD)濃度を下記の表2に示す。
【0051】
【表2】

【0052】
(e.結論)
TMTDSおよびETMTDSは、閉経後卵巣摘出された女性のこの集団によってよく許容された。研究の間に報告された皮膚または全身の有意な不都合な影響はなかった。テストステロンおよびエストラジオールのどちらもこれらの処方物からよく吸収され、そして得られる両ホルモンの血清濃度は、提案された投与間隔にわたって持続的にインビトロの評価から予想されるレベルに近づく。
【0053】
TMTDSは、主なアンドロゲン代謝産物であるDHTの過剰な生産をすることなく、循環するテストステロン濃度を、ETMTDSが行ったように25−30ng/dlの範囲に高めた。
【0054】
ETMTDSからのエストラジオールの送達は、25−30pg/mlの範囲の循環するエストラジオールの平均増分の増加を提供した。
【0055】
上記の本発明の実施態様の改変は医薬分野の当業者には自明であり、ホルモン補充治療、経皮薬剤送達、および関連技術は以下の請求の範囲内であることを意図する。
【特許請求の範囲】
【請求項1】
明細書に記載の発明。
【請求項1】
明細書に記載の発明。
【図1】




【公開番号】特開2009−185074(P2009−185074A)
【公開日】平成21年8月20日(2009.8.20)
【国際特許分類】
【出願番号】特願2009−125890(P2009−125890)
【出願日】平成21年5月25日(2009.5.25)
【分割の表示】特願2005−174407(P2005−174407)の分割
【原出願日】平成6年7月27日(1994.7.27)
【出願人】(500058936)ワトソン ファーマシューティカルズ, インコーポレイテッド (8)
【Fターム(参考)】
【公開日】平成21年8月20日(2009.8.20)
【国際特許分類】
【出願日】平成21年5月25日(2009.5.25)
【分割の表示】特願2005−174407(P2005−174407)の分割
【原出願日】平成6年7月27日(1994.7.27)
【出願人】(500058936)ワトソン ファーマシューティカルズ, インコーポレイテッド (8)
【Fターム(参考)】
[ Back to top ]

