テトラヒドロキナゾリン−4(3H)−オン関連、及びテトラヒドロピリド[2,3−D]ピリミジン−4(3H)−オン関連化合物、組成物、及びそれらの使用方法
式(I)を有する化合物を提供し、式中、変数A1、A2、A3、A4、R1、R2、R3、R4、Q、及びLを本明細書中に記載する。本主題化合物は、炎症及び免疫の、状態及び疾患に有用である。また、本主題化合物を用いる組成物及び治療方法を提供する。例として、本主題方法は、多発性硬化症、関節リウマチ、乾癬、及び炎症性腸疾患などの炎症及び免疫の、障害及び疾患に有用である。
【発明の詳細な説明】
【技術分野】
【0001】
(1. 関連出願の相互参照)
この出願は、2004年6月28日に出願された米国仮出願第60/583,823号の利益を主張し、その開示は、その全体が、引用により本明細書中に取り込まれるものとする。
【0002】
(2. 発明の分野)
本発明は、CXCR3受容体の新規調節物質、該新規化合物を含む組成物、及び例として、関節リウマチ、多発性硬化症、炎症性腸疾患、乾癬、及びアテローム性動脈硬化などの自己免疫病理だけでなく、例えば喘息及びアレルギー疾患などの炎症及び免疫調節の、障害及び疾患の治療における、それらの使用方法に関する。
【背景技術】
【0003】
(3. 発明の背景)
ケモカインは、マクロファージ、T細胞、好酸球、好塩基球、好中球を炎症部位に誘引するための、幅広い種類の細胞により放出される走化性サイトカインである (Schallの論文、Cytokine, 3:165-183 (1991); Schallらの論文、Curr. Opin. Immunol., 6:865-873 (1994); 及び Murphyの論文、Rev. Immun., 12:593-633 (1994))中で概説されている)。走化性を促進することに加えて、ケモカインは、細胞形状の変化、細胞内遊離カルシウムイオン([Ca2+])iの一時的上昇、顆粒エキソサイトーシス、インテグリンの上昇、白血球活性化に関連した生物活性脂質(ロイコトリエンなど)の形成、及び呼吸バーストなどの、他の変化を選択的に応答細胞において誘導できる。従って、該ケモカインは、該炎症応答の初期トリガーであり、炎症メディエータの放出、感染、又は炎症の部位へ走化性、及び血管外遊走を起こす。
【0004】
最初の2つのシステインが1つのアミノ酸により分離されている (C-X-C)か、隣接している(C-C)か、欠損しているシステイン対を有する(C)か、3個のアミノ酸により分離されている(CX3C)かに依存して、4種類のケモカイン、CXC(α)、CC(β)、C(γ)、及びCX3C(δ)がある。インターロイキン-8 (IL-8)、メラノーマ成長刺激活性タンパク質(MGSA)、及びストローマ細胞由来因子1(SDF-1)などのα-ケモカインは、主として、好中球、及びリンパ球に対する走化性活性を有する一方、RANTES、MIP-lα、MIP-1β、単球走化性タンパク質-1(MCP-1)、MCP-2、MCP-3、及びエオタキシンなどのβ-ケモカインは、マクロファージ、T細胞、好酸球、及び好塩基球に対する走化性活性を有する(Dengらの論文、Nature, 381:661-666 (1996))。該Cケモカインであるリンホカインは、リンパ球に特異性を示し(Kelnerらの論文、Science, 266:1395-1399 (1994))、該CX3Cケモカインであるフラクタルカインは、リンパ球、及び単球に特異性を示す(Bazanらの論文、Nature, 385:640-644 (1997))。
【0005】
ケモカインは、"ケモカイン受容体"と称される、Gタンパク質結合7回膜貫通領域タンパク質(Horukの論文、Trends Pharm. Sci., 15:159-165 (1994)中で概説されている)のファミリーに属する特定の細胞表面受容体と結合する。それらの同族のリガンドに結合すると、ケモカイン受容体は、関連したヘテロ三量体G タンパク質を介して細胞内シグナルを伝達し、細胞内カルシウム濃度の急激な上昇をもたらす。少なくとも12個の、β-ケモカインに結合する、又は応答するヒトケモカイン受容体があり、下記の特有の様式を有する: CCR1 (又は"CKR-1"、又は"CC-CKR-1") MIP-lα、MIP-1β、MCP-3、RANTES (Ben-Barruchらの論文、J. Biol. Chem., 270:22123-22128 (1995); Neoteらの論文、Cell, 72:415-425 (1993)); CCR2A、及びCCR2B (又は"CKR-2A"/"CKR-2A"、又は"CC-CKR-2A"/"CC-CKR2A") MCP-1、MCP-3、MCP-4; CCR3 (又は"CKR-3"、又は"CC-CKR-3") エオタキシン、RANTES、MCP (Ponathらの論文、J. Exp. Med., 183:2437-2448 (1996)); CCR4 (又は"CKR-4"、又は"CC-CKR-4") TARC、MDC (Imaiらの論文、J Biol. Chem., 273:1764-1768 (1998)); CCR5 (又は"CKR-5"、又は"CC-CKR-5") MIP-lα、 RANTES、MIP-1β (Sansonらの論文、Biochemistry, 35:3362-3367 (1996)); CCR6 MIP-3アルファ (Greavesらの論文、J. Exp. Med., 186:837-844 (1997)); CCR7 MIP-3ベータ、及び6Cカイン (Campbellらの論文、J Cell Biol., 141:1053-1059(1998)); CCR8 I-309、HHV8 vMIP-I、HHV-8 vMIP-II、MCV vMCC-I (Dairaghiらの論文、J. Biol. Chem., 274:21569-21574 (1999)); CCR9 TECK (Zaballosらの論文、J. Inmunol., 162:5671-5675 (1999))、D6 MIP-1ベータ、RANTES、及びMCP-3 (Nibbsらの論文、J. Biol. Chem., 272:32078-32083 (1997))、及びダフィー式血液型抗原RANTES、MCP-1 (Chaudhunらの論文、J. Biol. Chem., 269:7835-7838 (1994))がある。
【0006】
CCR1、CCR2、CCR2A、CCR2B、CCR3、CCR4、CCR5、CCR6、CCR7、CCR8、CCR9、CXCR1、CXCR2、CXCR3、CXCR4、CXCR5、CX3CR1、及びXCR1などのケモカイン受容体は、関節リウマチ、及びアテローム性動脈硬化などの自己免疫病理だけでなく、喘息、及びアレルギー疾患などの炎症及び免疫調節の、障害及び疾患の重要な仲介物質として関与している。
【0007】
該CXCR3ケモカイン受容体は、主としてT細胞中で発現され、その機能的な活性を、細胞質カルシウム上昇、又は走化性により測定することができる。該受容体は、以前にGPR9、又はCKR-L2と称された。その染色体上の位置は、ケモカイン受容体の中では異常で、Xq13に位置している。選択的、かつ高親和性があると同定されているリガンドは、CXC ケモカインであるIP10、MIG、及びITACである。
【0008】
CXCR3の高度に選択的な発現は、不適切なT細胞の輸送を中断する介入の理想的な標的になる。そのような介入の臨床的適応は、多発性硬化症、関節リウマチ、及びI型糖尿病などのT細胞介在自己免疫疾患においてである。不適切なT細胞浸潤は、真の自己免疫障害ではないが、乾癬、及び他の病理的な皮膚炎症状態でも起こる。この点において、ケラチノサイトにおけるIP-10 発現のアップレジュレーションは、皮膚の免疫病理に共通の特徴である。CXCR3の阻害は、臓器移植における拒絶を減少させるのに有益であり得る。特定の腫瘍、特にB細胞悪性腫瘍の一部におけるCXCR3の異所性発現は、CXCR3の選択的阻害剤が腫瘍の免疫治療、特に転移の減衰に価値があり得ることを示唆する。
【発明の開示】
【発明が解決しようとする課題】
【0009】
CXCR3の臨床的重要性を考慮すると、CXCR3機能を調節する化合物を新治療薬の開発に用いることができる。本明細書において、そのような化合物を提供する。
【課題を解決するための手段】
【0010】
(4. 本発明の要約)
本発明は、関節リウマチ、多発性硬化症などの自己免疫病理だけでなく、喘息、乾癬、炎症性腸疾患、及びアレルギー疾患などの特定の炎症及び免疫調節の、障害及び疾患の治療又は予防に有用な化合物を提供する。
【0011】
一態様において、本明細書中に提供された化合物は、下記一般式(I)を有する:
【化1】

(式中、Qは-C(O)-、-CH2CO-、-CH2SO-、及び-CH2S02-からなる群から選択された一要素であり;
Lは結合、又は(C1-C5)アルキレンであり;
Al、A2、及びA3は、独立に、C(R')(R")、及びC(O)からなる群から選択され;
A4がC(R')(R")、又はN(R''')であり;
各R'、及びR"は、独立に、水素原子、ハロゲン、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、フルオロ(C1-C4)アルキル(ここで、1個以上のフッ素原子が、1個以上の炭素原子上に置換することができる)、アリール、ヘテロアリール、アリール(C1-C8)アルキル、及びヘテロアリール(C1-C8)アルキルからなる群から選択され、任意に、隣接した炭素原子上のR'、及びR"基を組合せて、5員、又は6員縮合環を形成することができ、かつ同一の炭素原子に結合されたR' 、及びR"基を組合せて、3〜8員スピロ環を形成することができ;
R'''は、水素原子、(C1-C8)アルキル、及び(C2-C8)ヘテロアルキルからなる群から選択され;
R1はヘテロアリール、又はアリールであり;
R2は水素原子、ハロゲン、(C1-C10)アルキル、(C2-C10)ヘテロアルキル、ヘテロ(C1-C10)シクロアルキル、(C1-C10)アルキルアリール、及び(C2-C10)ヘテロアルキルアリールからなる群から選択され、任意に、R2をLと組合せて、N、O、及びSからなる群から選択された1〜3個のヘテロ原子を含む、5員環、6員環、7員環、又は8員環を形成することができ;
R3は非存在であるか、或いは-H、-CHR6R7、-S(0)mR5、-S(0)mN(R8)R9、-S(0)mN(R8)CH2R6、-N(R8)SO2R5、-N(R8)CH2R10、並びに下記式の基の群から選択された一要素であり:
【0012】
【化2】

、又は、任意に、R3をR2と組合せて、N、 O、及びSからなる群から選択された1〜3個のヘテロ原子を含む、4員環、5員環、6員環、7員環、又は8員環を形成することができ;
R5は、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、アリール、及びヘテロアリールからなる群から選択され;
R6、及びR7は、独立に、水素原子、(C1-C8)アルキル、又は(C2-C8)ヘテロアルキルであり;
R8は、水素原子、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、ヘテロアリール、又はアリールであり;
R9は(C1-C8)アルキルであり;
R10はアリールであり;
ZはCH、又はNであり;
Xは結合、(C1-C6)アルキレン、又は(C1-C6)ヘテロアルキレンであり;
Yは(C1-C6)アルキレンであり;
下付文字mは、0、1、又は2であり; かつ
R4は、(C1-C20)アルキル、(C2-C20)ヘテロアルキル、ヘテロアリール、アリール、ヘテロアリール(C1-C6)アルキル、ヘテロアリール(C2-C6)ヘテロアルキル、アリール(C1-C6)アルキル、及びアリール(C2-C6)ヘテロアルキルからなる群から選択された一要素である。特定の実施態様において、Al、A2、及びA3がCH2であり、Rlが4-(2,2,2-トリフルオロエトキシ)フェニルであり、R2がメチルであり、R3が3-ピコリルであり、かつQがC(O)であり、-Q-R4がまとめて下記式の基であり、
【0013】
【化3】

かつLが-CH2-であるとき、A4はNH以外である)。
【0014】
本発明の化合物は、その医薬として許容し得る塩、溶媒和物、又はそれらのプロドラッグを含む。
別の態様において、本発明は、式(I)の化合物、及び医薬として許容し得る賦形剤、又は担体を含む医薬組成物を提供する。
さらなる態様において、本発明は、炎症又は免疫の、状態又は障害の、治療又は予防が必要な対象に、治療上効果的な量の式(I)の化合物を投与することを含む、そのような状態又は障害の、治療又は予防の方法を提供する。本発明の方法に好ましい対象は、ヒトなどの哺乳類を含む。
【0015】
また、本発明は、ケモカイン受容体CXCR3により介在された状態、又は障害の治療又は予防が必要な対象に、治療上効果的な量の式(I)の化合物を投与することを含む、そのような状態又は障害の、治療又は予防の方法を提供する。
また、本発明は、細胞を式(I)の化合物と接触させることを含む、CXCR3の調節の方法を提供する。
さらに、本発明は、CXCR3タンパク質を式(I)の化合物と接触させることを含む、CXCR3の調節の方法を提供する。
その上、本発明は、式(I)の化合物の製造方法を提供する。
【発明を実施するための最良の形態】
【0016】
(6. 本発明の詳細な説明)
(6.1 定義)
"アルキル"という用語は、単独で、又は別の置換基の一部として、他に明記しない限り、直鎖又は分岐鎖、又は環状炭化水素基、又はそれの組合せを意味する。それは、完全に飽和、単価、又は多価不飽和であり得て、かつ指定された炭素原子数(すなわち、C1-C10は、1〜10個の炭素原子を意味する)を有する、二価又は多価基を含むことができる。飽和炭化水素基の例は、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、t-ブチル、イソブチル、sec-ブチル、シクロヘキシル、(シクロヘキシル)メチル、シクロプロピルメチルなどの官能基、n-ペンチル、n-へキシル、n-へプチル、n-オクチルなどの同族体及び異性体を含む。不飽和アルキル基は、1個以上の二重結合、又は三重結合を有するものである。不飽和アルキル基の例は、ビニル、2-プロペニル、クロチル、2-イソペンテニル、2-(ブタジエニル)、2,4-ペンタジエニル、3-(1,4-ペンタジエニル)、エチニル、1-及び3-プロピニル、3-ブチニル、及び高級同族体及び異性体を含む。
【0017】
"アルキレン"という用語は、単独で、又は別の置換基の一部として、-CH2CH2CH2CH2-により例示されるとおり、アルカンに由来する二価基を意味し、さらに、"ヘテロアルキレン"として下記に記載された官能基を含む。通常、アルキル(又はアルキレン)基は1〜24個の炭素原子を有することができるが、本発明においては、10個以下の炭素原子を有するそのような基が好ましい。"低級アルキル"、又は"低級アルキレン"は、一般に8個以下の炭素原子を有する、より短鎖のアルキル基又はアルキレン基である。
【0018】
"アルコキシ"、"アルキルアミノ"、及び"アルキルチオ" (又はチオアルコキシ)という用語は従来の意味で用いられ、各々、分子の残りに、酸素原子、アミノ基、又は硫黄原子を介して結合されたアルキル基のことをいう。同様に、ジアルキルアミノという用語は、同一、又は相違し得る、2つの結合したアルキル基を有するアミノ基のことをいう。
【0019】
"ヘテロアルキル"という用語は、単独で、又は別の用語と組合せて、他に明記しない限り、明記された数の炭素原子、及びO、N、Si、及びSからなる群から選択された1〜3個のヘテロ原子を含む、安定した直鎖又は分岐鎖、又は環状炭化水素基、又はそれの組合せのことをいう。ここで、任意に、該窒素原子、及び硫黄原子を酸化でき、かつ任意に、該窒素へテロ原子を四級化することができる。該へテロ原子O、N、及びSは、該ヘテロアルキル基の任意の内側の部位に位置させることができる。該へテロ原子Siは、該アルキル基が該分子の残りに結合されている位置などの、該へテロアルキル基の任意の部位に位置させることができる。例を挙げると、-CH2-CH2-O-CH3、-CH2-CH2-NH-CH3、-CH2-CH2-N(CH3-)-CH3、-CH2-S-CH2-CH3、-CH2-CH2、-S(0)-CH3、-CH2-CH2-S(0)2-CH3、-CH=CH-O-CH3、-Si(CH3)3、-CH2-CH=N-OCH3、及び-CH=CH-N(CH3)-CH3などがある。例えば、-CH2-NH-OCH3、及び-CH2-O-Si(CH3)3のように、2個のヘテロ原子まで連続することができる。ヘテロアルキル基をさすのに(C2-C8)などの接頭語が用いられる場合、炭素原子の数(この例では、2〜8)は、ヘテロ原子を同様に含むものとする。例えば、C2ヘテロアルキル基は、-CH2OH (1個の炭素原子、及び炭素原子に置き換えられている1個のヘテロ原子)、及び-CH2SHなどを含むものとする。"ヘテロアルキレン"という用語は、単独で、又は別の置換基の一部として、-CH2-CH2-S-CH2CH2-、及び-CH2-S-CH2-CH2-NH-CH2-により例示されるとおり、ヘテロアルキルに由来する二価基を意味する。ヘテロアルキレン基に関しては、ヘテロ原子も鎖端のいずれか、又は両方を占めることができる(例として、アルキレンオキシ、アルキレンジオキシ、アルキレンアミノ、アルキレンジアミノ、及びそのようなもの)。さらに、アルキレン、及びヘテロアルキレン結合基に関しては、該結合基の方向を含意しない。
【0020】
"シクロアルキル"、及び"ヘテロシクロアルキル"という用語は、単独で、又は他の用語と組合せて、他に明記しない限り、各々、"アルキル"、及び"ヘテロアルキル"の環状種を示す。さらに、ヘテロシクロアルキルに関しては、ヘテロ原子が、複素環が該分子の残りに結合している部位を占めることができる。シクロアルキルの例には、シクロペンチル、シクロへキシル、1-シクロヘキセニル、3-シクロヘキセニル、シクロヘプチルなどがある。ヘテロシクロアルキルの例には、1-(1,2,5,6-テトラヒドロピリジル)、1-ピペリジニル、2-ピペリジニル、3-ピペリジニル、4-モルホリニル、3-モルホリニル、テトラヒドロフラン-2-イル、テトラヒドロフラン-3-イル、テトラヒドロチエン-2-イル、テトラヒドロチエン-3-イル、1-ピペラジニル、2-ピペラジニルなどがある。
【0021】
"ハロ"、又は"ハロゲン"という用語は、単独で、又は別の置換基の一部として、他に明記しない限り、フッ素、塩素、臭素、又はヨウ素原子のことを意味する。さらに、"ハロアルキル"などの用語は、モノハロアルキル、及びポリハロアルキルを含むものとする。例を挙げると、"ハロ(C1-C4)アルキル"という用語は、トリフルオロメチル、2,2,2-トリフルオロエチル、4-クロロブチル、3-ブロモプロピルなどを含むものとする。
【0022】
"アリール"という用語は、他に明記しなければ、多価不飽和の、一般的に芳香族炭化水素置換基のことを意味し、単環、又は共に縮合している、又は共有結合している(3環までの)多環であり得る。"ヘテロアリール" という用語は、N、 O、及びSから選択された0〜4個のヘテロ原子を含む、アリール基(又は環)をさし、任意に、該窒素原子、及び硫黄原子は酸化され、かつ任意に、該窒素へテロ原子は四級化されている。ヘテロアリール基を、ヘテロ原子を介して、該分子の残りに結合することができる。アリール、及びヘテロアリール基の限定されない例として、フェニル、1-ナフチル、2-ナフチル、4-ビフェニル、1-ピロリル、2-ピロリル、3-ピロリル、3-ピラゾリル、2-イミダゾリル、4-イミダゾリル、ピラジニル、2-オキサゾリル、4-オキサゾリル、2-フェニル-4-オキサゾリル、5-オキサゾリル、3-イソオキサゾリル、4-イソオキサゾリル、5-イソオキサゾリル、2-チアゾリル、4-チアゾリル、5-チアゾリル、2-フリル、3-フリル、2-チエニル、3-チエニル、2-ピリジル、3-ピリジル、4-ピリジル、2-ピリミジル、4-ピリミジル、5-ベンゾチアゾリル、プリニル、2-ベンズイミダゾリル、5-インドリル、1-イソキノリル、5-イソキノリル、2-キノキサリニル、5-キノキサリニル、3-キノリル、及び6-キノリルなどがある。先に記載されたアリール、及びヘテロアリール環系の各々の置換基は、下記に記載された許容し得る置換基の群から選択される。
【0023】
簡略のため、"アリール"という用語は、他の用語と組合せ用いられる場合(アリールオキシ、アリールチオキシ、アリールアルキルなど)、先に記載のとおりアリール環、及びヘテロアリール環の両方を含む。従って、"アリールアルキル" という用語は、アリール基が、アルキル基(例えば、ベンジル、フェネチル、ピリジルメチルなど)に結合している基を含むものとし、炭素原子(メチレン基など)が酸素原子などに置換されているアルキル基(例えばフェノキシメチル、2-ピリジルオキシメチル、3-(1-ナフチルオキシ)プロピルなど)などがある。
先の用語 (例えば"アルキル"、"ヘテロアルキル"、"アリール"、及び"ヘテロアリール")の各々は、示された基の置換型と非置換型の両方を含むものとする。各種類の基の好ましい置換基を下記に提供する。
【0024】
アルキル基及びヘテロアルキル基(アルキレン、アルケニル、ヘテロアルキレン、ヘテロアルケニル、アルキニル、シクロアルキル、ヘテロシクロアルキル、シクロアルケニル、及びヘテロシクロアルケニルとよくいわれる基など)の置換基は、mがそのような基の炭素原子の総数であるとき、0から(2m+1)までの数の、-OR'、=0、=NR'、=N-OR'、-NR'R”、-SR'、-ハロゲン、-SiR'R”R'''、-OC(0) R'、-C(0)R'、-CO2R'、-CONR'R”、-OC(0)NR'R”、-NR”C(0)R'、-NR'C(0)NR”R'''、-NR”C(0)2R'、-NH-C(NH2)=NH、-NR'C(NH2)=NH、-NH-C(NH2)=NR'、-S(0)R'、-S(0)2R'、-S(0)2NR'R”、-CN、及び-NO2から選択された様々な群であり得る。 R'、R”、及びR'''は、各々独立に、H、非置換(C1-C8)アルキル、及びヘテロアルキル、非置換アリール、1〜3個のハロゲンで置換されているアリール、アルコキシ、又はチオアルコキシ基、又はアリール-(C1-C4)アルキル基をさす。R'、及びR”が同一の窒素原子に結合している場合、それらを該窒素原子と組合せて、5員環、6員環、又は7員環を形成できる。例として、-NR'R”は、1-ピロリジニル、及び4-モルホリニルを含むものとする。先の置換基の考察から、同業者は、広い意味における"アルキル"という用語が、ハロアルキル(例えば-CF3、及び-CH2CF3)、及びアシル(例えば-C(0)CH3、-C(0)CF3、-C(0) CH2OCH3など)などの官能基を含むものとすることを理解するであろう。好ましくは、該アルキル基は0〜3個の置換基、さらに好ましくは、他に明記しなければ、0、 1、又は2個の置換基を有することができる。
【0025】
同様に、該アリール、及びヘテロアリール基の置換基は多様であり、0〜芳香環系の空いている結合手の総数までの数の、-ハロゲン、-OR'、-OC(0)R'、-NR'R”、-SR'、-R'、-CN、-NO2、-CO2R'、-CONR'R”、-C(0)R',-OC(0)NR'R”、-N R”C(0)R'、-NR”C(0)2R'、-NR'-C(0)NR”R'''、-NH-C(NH2)=NH、-NR'C(NH2)=NH、-NH-C(NH2)=NR'、-S(0)R'、-S(0)2R'、-S(0)2NR'R”、-N3、-CH(Ph)2、ペルフルオロ(C1-C4)アルコキシ、及びペルフルオロ(C1-C4)アルキルから選択され;かつR'、R”、及びR'''は、独立に、H、(C1-C8)アルキル、及びヘテロアルキル、非置換アリール及びヘテロアリール、(非置換アリール)-(C1-C4)アルキル、及び(非置換アリール)オキシ-(C1-C4)アルキルから選択される。
【0026】
任意に、アリール環又はヘテロアリール環の隣接した原子上の2個の置換基を、式-T-C(0)-(CH2)q_U-の置換基に置き換えることができる(式中、T、及びUは、独立に、-NH-、-O-、-CH2_、又は一重結合であり、かつqは、O〜2の整数である。)。代わりに、任意に、該アリール環、又はヘテロアリール環の隣接した原子上の2個の置換基を、式-A-(CH2)r_B-の置換基に置き換えることができる(式中、A、及びBは、独立に、-CH2_、-O-、-NH-、-S-、-S(O)-、-S(0)2_、-S(0)2NR'-、又は一重結合であり、かつrは、1〜3の整数である。)。任意に、そのように形成された新しい環の1個の一重結合を、二重結合に置き換えることができる。代わりに、任意に、該アリール環、又はヘテロアリール環の隣接した原子上の2個の置換基を、式-(CH2)s-X-(CH2)t-の置換基に置き換えることができる(式中、s、及びtは、独立に、O〜3の整数であり、かつXは、-O-、-NR'-、-S-、-S(O)-、-S(0)2-、又は-S(0)2NR'-である。)。-NR'-、及び-S(0)2NR'-における置換基R'は、水素原子、又は非置換(C1-C6)アルキルから選択される。
【0027】
本明細書で使われる"ヘテロ原子"という用語は、酸素(O)、窒素(N)、硫黄(S)、及びケイ素(Si)を含むものとする。
本明細書で使われる"Me"という略語は、メチル、又はその基(すなわち、-CH3)であるとし、"Et"という略語は、エチル、又はその基であるとし、かつ"Ph"という略語は、フェニル、又はその基であるとする。
【0028】
"医薬として許容し得る塩"という用語は、本明細書に記載された化合物上に見い出された特定の置換基によって、比較的無毒性の酸又は塩基で調製される、
該化合物の塩を含むものとする。本発明の化合物が比較的酸性の官能基を含む場合は、そのような化合物の中性型を、そのまま、又は適切な不活性溶媒中で、十分な量の所望される塩基と接触させることにより、塩基添加塩を得ることができる。医薬として許容し得る塩基添加塩の例には、ナトリウム塩、カリウム塩、カルシウム塩、アンモニウム塩、有機アミノ塩、又はマグネシウム塩、又は同様の塩などがある。本発明の化合物が比較的塩基性の官能基を含む場合は、そのような化合物の中性型を、そのまま、又は適切な不活性溶媒中で、十分な量の所望される酸と接触させることにより、酸添加塩を得ることができる。医薬として許容し得る酸添加塩の例には、塩酸、臭化水素酸、硝酸、炭酸、一水素炭酸、リン酸、一水素リン酸、二水素リン酸、硫酸、一水素硫酸、ヨウ化水素酸、又は亜リン酸などの無機酸由来のものと同様に、酢酸、プロピオン酸、イソ酪酸、マレイン酸、マロン酸、安息香酸、コハク酸、スベリン酸、フマル酸、マンデル酸、フタル酸、ベンゼンスルホン酸、p-トリルスルホン酸、クエン酸、酒石酸、メタンスルホン酸などの比較的無毒性の有機酸由来の塩などがある。また、アルギン酸などのアミノ酸の塩、及びグルクロン酸、又はガラクツノリ酸(galactunoric acid)などの有機酸塩を含む (Bergeらの論文、(1977) J. Pharm. Sci. 66:1-19などを参照されたい。)。本発明のある特定の化合物は、該化合物を塩基添加塩又は酸添加塩のいずれかに変換することを可能にする、塩基性及び酸性の両官能基を含む。
【0029】
該化合物の中性型を、該塩を塩基又は酸と接触させること、かつ従来の方法で該親化合物を単離させることにより、再生することができる。該化合物の原型は、極性溶媒における溶解度など特定の物理的性質において、各種の塩の形態とは異なるが、それ以外は、該塩は、本発明の目的に関して化合物の原型と同等である。
【0030】
塩の形態に加えて、本発明は、プロドラッグの形態である化合物を提供する。本明細書中に記載された活性化合物のプロドラッグは、不活性化合物であり、生理条件下で容易に化学変化を受け、本発明の活性化合物を提供する。さらに、プロドラッグを、生体外環境において、化学的、又は生化学的な方法により、本発明の活性化合物に変換することができる。例えば、経皮貼布貯留層中に適切な酵素又は化学試薬と置いた場合、プロドラッグを、ゆっくりと本発明の活性化合物に変換することができる。プロドラッグがよく有用であるのは、場合によっては、該活性化合物より投与しやすいためである。例えば、それらは経口投与により生物学的に利用できるが、該活性化合物はそうではない。また、プロドラッグは、該活性化合物より、医薬組成物中で改善された溶解度を有することができる。該プロドラッグの加水分解又は酸化的活性化に依存するものなどの、幅広い種類のプロドラッグ誘導体が、当技術分野において知られている。限定されないプロドラッグの例は、エステル(該"プロドラッグ")として投与されるが、その後その活性実体であるカルボン酸へ代謝的に加水分解される、本発明の化合物である。さらなる例には、本発明の活性化合物のぺプチジル誘導体などがある。
【0031】
本発明の特定の化合物は、水和物の形態を含む溶媒和形態だけでなく、非溶媒和形態で存在できる。一般に、該溶媒和形態は非溶媒和形態と同等であり、本発明の範囲内に含まれるものとする。本発明の特定の化合物は、複数の結晶性形態、又は非晶性形態で存在できる。一般に、全ての物理的形態は、本発明により意図された使用に関して同等であり、本発明の範囲内に含まれるものとする。
本発明の特定の化合物は、不斉炭素原子(光学中心)又は二重結合;ラセミ化合物、エナンチオマー、ジアステレオマー、幾何異性体を有し、個々の異性体は、全て、本発明の範囲内であるものとする。
【0032】
本明細書で使われ、かつ他に明記しなければ、"立体異性体"、又は"立体異性的に純粋な"という用語は、実質上、その化合物の他の異性体を含まない、化合物の1つの立体異性体のことを意味する。例として、1個のキラル中心を有する立体異性的に純粋な化合物は、実質上、該化合物の反対のエナンチオマーを含まない。2個のキラル中心を有する、立体異性的に純粋な化合物は、実質上、該化合物の他のジアステレオマーを含まない。典型的な立体異性的に純粋な化合物は、約80重量%を超える該化合物の1つの立体異性体、及び約20重量%未満の該化合物の他の立体異性体を含み、より好ましくは、約90重量%を超える該化合物の1つの立体異性体、及約10重量%未満の該化合物の他の立体異性体、さらにより好ましくは、約95重量%を超える該化合物の1つの立体異性体、及び約5重量%未満の該化合物の他の立体異性体、最も好ましくは、約97重量%を超える該化合物の1つの立体異性体、及び約3重量%未満の該化合物の他の立体異性体を含む。構造の立体化学、又は構造の一部が、例えば太線又は破線で示されていなければ、該構造、又は該構造の一部は、そのすべての立体異性体を含むものと解釈されることになると留意すべきである。
【0033】
本発明の様々な化合物は、1個以上のキラル中心を含み、エナンチオマーのラセミ混合物、ジアステレオマーの混合物、又は鏡像異性的又は光学的に純粋な化合物として存在することができる。本発明は、そのような化合物の立体異性的に純粋な形態の使用と同様に、それらの形態の混合物の使用を含む。例として、本発明の特定の化合物の等量、又は不等量のエナンチオマーを含む混合物を、本発明の方法、及び組成物において用いることができる。これらの異性体を、非対称的に合成、或いはキラルカラム又はキラル分割剤などの標準技術を用いて分離することができる。例えばJacques, J.らの著書、「エナンチオマー、ラセミ化合物、及び光学分割」(Wiley-Interscience, New York, 1981);Wilen, S. H.らの論文、Tetrahedron 33:2725 (1977);Eliel, E. L.らの著書、「炭素化合物の立体化学」(McGraw-Hill, NY, 1962);及びWilen, S. H.の著書「分割剤、及び光学分割の表」268ページ (E.L. Eliel編、Univ. of Notre Dame Press, Notre Dame, IN, 1972)を参照されたい。
【0034】
また、本発明の化合物は、そのような化合物を構成する1個以上の原子において、原子の同位体の不自然な割合を含むことができる。例として、該化合物を、例えばトリチウム(3H)、ヨウ素-125(125I)、又は炭素-14(14C)などの放射性同位体で放射標識することができる。放射性標識された化合物は、癌治療薬などの治療薬として、結合測定試薬などの研究試薬として、かつインビボ造影剤などの診断薬として有用である。本発明の化合物の全ての同位体変異体は、放射性の有無に関わらず、本発明の範囲内に含まれるものとする。
【0035】
本明細書で使われる"活性がある"という用語は、阻害など、CXCR3機能を調節するのに効果的であることを意味する。
【0036】
本明細書で使われる"治療する"、"治療すること"、又は"治療"という用語は、疾患、及び/又はその付随する症状を軽減する、又は無効にする方法のことをいう。本明細書で使われる"予防する"、"予防すること"、又は"予防"という用語は、対象が疾患に罹るのを妨げる方法のことをいう。
【0037】
(6.2 本発明の実施態様)
本発明は、ケモカイン受容体活性の調節、特にCXCR3の調節に有用である化合物、組成物、及び方法を対象にする。本発明の化合物は、例えば炎症及び免疫調節の障害の治療に有用であり、調剤された医薬品として、ヒトなどの対象に、直接投与することができる。また、本発明の化合物は、CXCR3アンタゴニストなどCXCR3機能を調節する化合物、及び生理条件下でCXCR3機能を調節する1個以上の化合物に変換される化合物を同定、及び/又は設計するのに有用である。
【0038】
本発明の化合物は、ヒトCXCR3タンパク質など、哺乳動物CXCR3タンパク質の少なくとも1個の機能、又は特徴を阻害するものである。そのような機能を阻害する化合物の能力を、結合測定法(リガンド結合、又はアゴニスト結合など)、シグナリング測定法(哺乳動物Gタンパク質の活性化、細胞質遊離カルシウム濃度の急速かつ一時的な増加の誘導など)、及び/又は細胞応答機能(走化性の刺激、エクソサイトーシス、又は白血球による炎症メディエータの放出の促進など)において示すことができる。典型的な測定法は、下記の実施例、及び米国特許出願公開第2002/0169159 Al号、及び第2003/0055054 Al号に記載されており、それらの内容は、その全体が、引用により各々本明細書中に取り込まれるものとする。
【0039】
(6.3 化合物)
本発明は、CXCR3のアンタゴニストとして有用であり、炎症又は免疫の、状態又は障害の、治療又は予防に特定の効用がある化合物を提供する。
一態様において、本発明は下記式(I)を有する化合物を提供する:
【化4】

【0040】
(式中、Al、A2、A3、A4、R1、R2、R3、R4、Q、及びLを下記に定義している)。先の式において提供された化合物は、他に明記示さない限り、その医薬として許容し得る塩、溶媒和物、又はそれらのプロドラッグを含む。
Qは、-C(O)-、-CH2CO-、-CH2SO-、及び-CH2SO2-からなる群から選択された一要素である。
【0041】
特定の実施態様において、Qは-C(O)-、又は-CH2-である。
いくつかの実施態様において、Qは-C(O)-である。
Lは結合、又は(C1-C5)アルキレンである。
いくつかの実施態様において、Lは-CH2-、又は-CH2CH2-である。
【0042】
Al、A2、及びA3は、独立に、C(R')(R”)、及びC(O)からなる群から選択される。
A4は、C(R')(R”)、又はN(R''')である。
いくつかの実施態様において、A4はN(R''')である。
他の実施態様において、A4は C(R')(R”)である。
特定の実施態様において、Al、A2、及びA3はC(R')(R”)である。
【0043】
各R'、及びR”は、独立に、水素原子、ハロゲン、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、フルオロ(C1-C4)アルキル、アリール、ヘテロアリール、アリール(C1-C8)アルキル、及びヘテロアリール(C1-C8)アルキルからなる群から選択され、任意に、隣接した炭素原子上のR'、及びR"基を組合せて、5員、又は6員縮合環を形成することができ、かつ同一の炭素原子に結合されたR' 、及びR"基を組合せて、3〜8員スピロ環を形成することができる。
【0044】
R'''は、水素原子、(C1-C8)アルキル、及び(C2-C8)ヘテロアルキルからなる群から選択される。
R1はヘテロアリール、又はアリールである。
いくつかの実施態様において、R1は非置換、又はメタ又はパラ置換フェニルであり、該置換基がハロゲン、シアノ、(C1-C8)アルキル、(C1-C8)ハロアルキル、オキシ(C1-C8)アルキル、又はオキシ(C1-C8)ハロアルキルである。
【0045】
特定の実施態様において、R1がパラシアノフェニルである。
R2は、水素原子、ハロゲン、(C1-C10)アルキル、(C2-C10)ヘテロアルキル、ヘテロ(C1-C10)シクロアルキル、(C1-C10)アルキルアリール、及び(C2-C10)ヘテロアルキルアリールからなる群から選択され、任意に、R2をLと組合せて、N、O、及びSからなる群から選択された1〜3個のヘテロ原子を含む、5員環、6員環、7員環、又は8員環を形成することができる。
【0046】
特定の実施態様において、R2は:
【化5】

の基の群から選択された一要素である。
【0047】
R3は非存在であるか、或いは-H、-CHR6R7、-S(0)mR5、-S(0)mN(R8)R9、-S(0)mN(R8)CH2R6、-N(R8)SO2R5、-N(R8)CH2R10、並びに下記式の基の群から選択された一要素である:
【化6】

。任意に、R3をR2と組合せて、N、 O、及びSからなる群から選択された1〜3個のヘテロ原子を含む、4員環、5員環、6員環、7員環、又は8員環を形成することができる。
【0048】
いくつかの実施態様において、R3は-H、-SO2CH3、-SO2CH2CH3、並びに下記式の基の群から選択された一要素である:
【化7】

。
【0049】
いくつかの実施態様において、L-R3はまとめて下記式の基である:
【化8】

。
【0050】
R5は、(C1-C8)アルキル、(C2-C8)へテロアルキル、アリール、及びヘテロアリールからなる群から選択される。
R6、及びR7は、独立に、水素原子、(C1-C8)アルキル、又は(C2-C8)ヘテロアルキルである。
R8は、水素原子、(C1-C8)アルキル、(C2-C8)へテロアルキル、ヘテロアリール、又はアリールである。
【0051】
R9は(C1-C8)アルキルである。
R10はアリールである。
ZはCH、又はNである。
Xは結合、(C1-C6)アルキレン、又は(C1-C6)ヘテロアルキレンである。
Yは(C1-C6)アルキレンである。
下付文字mは、0、1、又は2である。
R4は、(C1-C20)アルキル、(C2-C20)ヘテロアルキル、ヘテロアリール、アリール、ヘテロアリール(C1-C6)アルキル、ヘテロアリール(C2-C6)ヘテロアルキル、アリール(C1-C6)アルキル、及びアリール(C2-C6)ヘテロアルキルからなる群から選択された一要素である。
【0052】
いくつかの実施態様において、-Q-R4は下記式の基である:
【化9】

。
【0053】
式Iの特定の実施態様において、Al、A2、及びA3がCH2であり、Rlが4-(2,2,2-トリフルオロエトキシ)フェニルであり、R2がメチルであり、R3が3-ピコリルであり、かつQがC(O)であり、-Q-R4がまとめて下記式の基であり、かつLが-CH2-であるとき、A4はNH以外である:
【化10】

。
【0054】
特定の実施態様において、本発明は、下記式(II)を有する化合物を提供する:
【化11】

(式中、R1、R2、R3、R4、R'''、Q、及び Lは先のとおり定義され、かつ各Raは、独立に、ハロゲン、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、フルオロ(C1-C4)アルキル、アリール、ヘテロアリール、アリール(C1-C8)アルキル、及びヘテロアリール(C1-C8)アルキルからなる群から選択され、任意に、隣接した炭素原子上のRa基を組合せて、5員、又は6員縮合環を形成することができ、かつ同一炭素原子に結合したRa基を組合せて、3〜8員スピロ環を形成することができ;かつ下付文字kは、0、1、2、3、又は4である。)。
【0055】
いくつかの実施態様において、R'''が-CH3、-CH2CH3、又は-C(O)CH3である。
いくつかの実施態様において、kは0である。
特定の実施態様において、該化合物は下記式(III)を有する:
【化12】

(式中、R2、R3、R4、R'''、Q、及びLは、先のとおり定義され、かつR11は、水素原子、(C1-C8)アルキル、及び(C2-C8)ヘテロアルキルからなる群から選択される。)。
【0056】
式Iの実施態様群において、該化合物は下記式(IV)を有する:
【化13】

(式中、R1、R2、R3、R4、R'、R"、Q、及びLは、先のとおり定義される。)。
【0057】
いくつかの実施態様において、R'、及びR"は、共に水素原子、又は共にアルキルである。
いくつかの実施態様において、R'、及びR"は、共に水素原子、又は共にメチルである。
いくつかの実施態様において、R'、及びR"は、独立に、水素原子、又はメチルである。
式Iの実施態様群において、該化合物は下記式(V)を有する:
【化14】

(式中、R1、R2、R3、R4、Q、及び Lは先のとおり定義され、かつ各Raは、独立に、ハロゲン、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、フルオロ(C1-C4)アルキル、アリール、ヘテロアリール、アリール(C1-C8)アルキル、及びヘテロアリール(C1-C8)アルキルからなる群から選択されるか、或いは任意に、隣接した炭素原子上のRa基を組合せて、5員、又は6員縮合環を形成することができ、かつ同一炭素原子に結合したRa基を組合せて、3〜8員スピロ環を形成することができ、かつ下付文字kは、0、1、2、3、又は4である。)。
【0058】
いくつかの実施態様において、該化合物は下記式(VI)を有する:
【化15】

(式中、R2、R3、R4、Ra、下付文字p、Q、及び Lは先のとおり定義され、かつR11は、水素原子、(C1-C8)アルキル、及び(C2-C8)ヘテロアルキルからなる群から選択される。)。
【0059】
本明細書中に提供された化合物が、立体異性体で存在することは、容易に理解される。特定の実施態様において、先の式の化合物は、ラセミ化合物である。他の実施態様において、式(I)、(II)、(III)、(IV)、(V)、又は(VI)の化合物は、(S)エナンチオマーと(R)エナンチオマーの混合物を含む。
【0060】
特定の実施態様において、化合物はエナンチオマーである。特定の実施態様において、本発明は、下記式(Ia)を有する化合物を提供する:
【化16】

(式中、A1、A2、A3、A4、R1、R2、R3、R4、Q、及び Lは、先に式Iで定義のとおりである。)。
【0061】
他の実施態様において、該化合物は下記式(Ib)を有する:
【化17】

(式中、A1、A2、A3、A4、R1、R2、R3、R4、Q、及び Lは、先に式Iで定義のとおりである。)。
特定の他の実施態様において、本発明は、化合物(Ia)、及び(Ib)のラセミ混合物を提供する。
【0062】
特定の実施態様において、本発明は、下記式(IIa)を有する化合物を提供する:
【化18】

(式中、R1、R2、R3、R4、R'''、Q、L、Ra、及び下付文字kは、先に式IIに定義のとおりである。)。
他の実施態様において、該化合物は下記式(IIb)を有する:
【化19】

(式中、R1、R2、R3、R4、R'''、Q、L、Ra、及び下付文字kは、先に式IIに定義のとおりである。)。
【0063】
特定の他の実施態様において、本発明は、化合物IIa、及びIIbのラセミ混合物を提供する。
特定の実施態様において、本発明は、下記式(IIIa)を有する化合物を提供する:
【化20】

(式中、R2、R3、R4、R'''、Q、L、及びR11は、先に式IIIに定義のとおりである。)。
【0064】
他の実施態様において、該化合物は下記式(IIIb)を有する:
【化21】

(式中、R2、R3、R4、R'''、Q、L、及びR11は、先に式IIIに定義のとおりである。)。
【0065】
特定の他の実施態様において、本発明は、化合物IIIa及びIIIbのラセミ混合物を提供する。
特定の実施態様において、本発明は、下記式(IVa)を有する化合物を提供する:
【化22】

(式中、R2、R3、R4、R'、R”、Q、及びLは、先に式IVに定義のとおりである。)。
【0066】
他の実施態様において、該化合物は下記式(IVb)を有する:
【化23】

(式中、R2、R3、R4、R'、R”、Q、及びLは、先に式IVに定義のとおりである。)。
特定の他の実施態様において、本発明は、化合物IVa、及びIVbのラセミ混合物を提供する。
【0067】
特定の実施態様において、本発明は、下記式(Va)を有する化合物を提供する:
【化24】

(式中、R1、R2、R3、R4、Ra、下付文字p、Q、及びLは、先に式Vに定義のとおりである。)。
【0068】
他の実施態様において、該化合物は下記式(Vb)を有する:
【化25】

(式中、R1、R2、R3、R4、Ra、下付文字p、Q、及びLは、先に式Vに定義のとおりである。)。
【0069】
特定の他の実施態様において、本発明は、化合物Va、及びVbのラセミ混合物を提供する。
特定の実施態様において、本発明の化合物は固体形態である。例として、いくつかの実施態様において、本発明の化合物は結晶性形態である。いくつかの実施態様において、該化合物は非晶性形態である。
特定の実施態様において、本発明の化合物は、少なくとも80%、少なくとも90%、少なくとも92%、少なくとも95%、少なくとも97%、又は少なくとも98%の純度を有する結晶性形態である。
【0070】
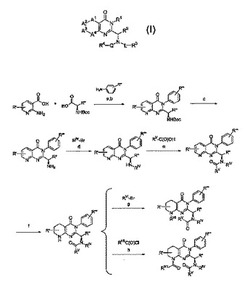
(6.4 該化合物の製造)
第7項の実施例、及び図1〜9は、本明細書中に提供された化合物への様々な合成経路を提供する。適切な出発材料の合成は、当業者に知られている、又は明らかな技術により製造できるか、或いは該出発材料は市販されていることがある。例として、そのような材料を、米国特許出願第2002/0160159 Al号、及び第 2003/0055054 Al号、及び国際公開第WO 02/83143号の方法に従って製造することができ、それらの内容は、その全体が、引用により各々本明細書中に取り込まれるものとする。当業者は、置換基をヘテロ環骨格の製造前、製造中、又は製造後に付加、或いは変更できること、及び条件(例として、温度、溶媒など)の調整ができることを認識するであろう。さらに、当業者は、特定の化合物の製造に保護基が必要であり得ることを認識するであろうし、かつ該選択された保護基に適合するそれらの条件を認識しているであろう。
本明細書中に記載された典型的な方法及び実施例は、本発明を例証し、その範囲を限定するものではないと解釈されるべきである。
【0071】
(6.5 組成物)
他の態様において、本発明は、ヒト及び動物におけるケモカイン受容体活性を調節する医薬組成物を提供する。該組成物は、本発明の化合物を、医薬として許容し得る担体、又は希釈剤と共に含む。
【0072】
本明細書で様々な形で使われる"調節"、すなわちケモカイン受容体活性の調節とは、特定のケモカイン受容体、好ましくはCXCR3受容体に関連する活性の、拮抗作用(antagonism)、受容体活性化作用(agonism)、部分的な拮抗作用、及び/又は部分的な受容体活性化作用を含むものとする。本明細書で使われる"組成物"という用語は、直接的に、又は間接的に、特定の量での特定の成分の組合せに由来する任意の製品だけでなく、特定の成分(かつ、表示されているならば、特定の量で)からなる製品を含むものとする。"医薬として許容し得る"とは、担体、希釈剤、又は賦形剤が、該製剤の他の成分と適合性があるはずであり、かつそれらの受け手に有害でないことを意味する。
【0073】
本発明の化合物の投与用の医薬組成物を、都合よく、単位剤形で提示でき、かつ薬学の分野でよく知られた方法のいずれかにより製造できる。全ての方法は、該活性成分を1個以上の補助成分で構成される担体と結合させる工程を含む。一般に、該活性成分を均一かつ密接に、液体担体、又は細かく分割された固体担体、又は両方に結合させること、及びその後、必要ならば、該製品を所望される剤形に成形することにより、医薬組成物を製造する。該医薬組成物には、疾患の過程、又は状態に所望される効果をもたらすのに十分な量の該化合物を含む。
【0074】
該活性成分を含む医薬組成物は、錠剤、トローチ剤、ドロップ剤(lozenges)、水性又は油性懸濁剤、分散性粉末又は分散性顆粒、乳剤、硬カプセル剤又は軟カプセル剤、シロップ剤、又はエリキシル剤などの、経口用に適した形態であり得る。経口用を目的とした組成物を、医薬組成物の製造の分野で知られた任意の方法に従って製造でき、かつそのような組成物は、甘味料、着香料、着色料、及び保存料からなる群から選択された1つ以上の薬剤を含み、医薬として上品で、口当たりがいい製剤を提供することができる。錠剤は、該活性成分を、錠剤の製造に適している無毒性の医薬として許容し得る賦形剤との混合剤中に含む。これらの賦形剤は、炭酸カルシウム、炭酸ナトリウム、乳糖、リン酸カルシウム、又はリン酸ナトリウムなどの不活性希釈剤;コーンスターチ、又はアルギン酸などの造粒剤及び崩壊剤;澱粉、ゼラチン、又はアカシアなどの結合剤;ステアリン酸マグネシウム、ステアリン酸、又は滑石などの滑沢剤などであり得る。該錠剤は、コーティングされていなくてもよいし、或いはそれらを公知の技術によりコーティングし、胃腸管における崩壊、及び吸収を遅らせることができ、それにより長期間にわたる持続性作用を提供する。例として、モノステアリン酸グリセリン、又はジステアリン酸グリセリンなどの時間遅延材料を使用することができる。また、それらを米国特許第4,256,108号、第4,166,452号、及び4,265,874号に記載された技術によりコーティングし、制御放出用の浸透圧性の治療錠剤を形成できる。
【0075】
また、経口用製剤を、該活性成分が炭酸カルシウム、リン酸カルシウム、又はカオリンなどの不活性固体希釈剤と混合している、硬ゼラチンカプセル剤として、又は該活性成分が水、あるいはピーナッツ油、液体パラフィン、又はオリーブ油などの油性媒体と混合している、軟ゼラチンカプセル剤として提示することができる。
【0076】
水溶性懸濁剤は、該活性成分を、水溶性懸濁剤の製造に適した賦形剤との混合剤中に含む。そのような賦形剤は、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシプロピルメチルセルロース、アルギン酸ナトリウム、ポリビニル-ピロリドン、トラガカントガム、及びアカシアガムなどの懸濁化剤などの懸濁剤であり;分散剤又は湿潤剤は、レシチンなどの天然リン脂質、ステアリン酸ポリオキシ-エチレンなどのアルキレン酸化物の脂肪酸との縮合生成物、又はヘプタデカエチレンオキシセタノールなどのエチレン酸化物の長鎖脂肪族アルコールとの縮合生成物、又はポリオキシエチレンソルビトールモノオレイン酸などの、エチレン酸化物の脂肪酸及びヘキシトール由来の部分エステルとの縮合生成物、又はポリエチレンソルビタンモノオレイン酸などの、エチレン酸化物の脂肪酸及びヘキシトール無水物由来の部分エステルとの縮合生成物などである。また、水性懸濁剤は、エチル、又はn-プロピル、p-ヒドロキシ安息香酸などの1つ以上の保存料、1つ以上の着色料、1つ以上の着香料、スクロース、又はサッカリンなどの1つ以上の甘味料を含むことができる。
【0077】
油性懸濁剤は、該活性成分を、ラッカセイ油、オリーブ油、ゴマ油、又はココナツ油などの植物油、又は液体パラフィンなどの鉱物油に懸濁することにより、製剤することができる。油性懸濁剤は、蜜ろう、固形パラフィン、又はセチルアルコールなどの増粘剤を含むことができる。上記のもののような甘味料、及び着香料を加え、口当たりのいい経口製剤を提供できる。これらの組成物を、アスコルビン酸などの抗酸化剤の添加により保存できる。
【0078】
水の添加による水性懸濁剤の製造に適した分散性粉末剤及び分散性顆粒剤は、該活性成分を、分散剤又は湿潤剤、懸濁化剤及び1つ以上の保存料との混合剤中に提供する。適切な分散剤又は湿潤剤、及び懸濁化剤は、既に先に記載されたものにより例示される。また、甘味料、着香料、及び着色料などのさらなる賦形剤が存在し得る。
【0079】
また、本発明の医薬組成物は、水中油型乳剤の形態であり得る。該油相は、オリーブ油、ラッカセイ油などの植物油、又は液体パラフィンなどの鉱物油、又はそれらの混合物であり得る。適切な乳化剤は、アカシアゴム、又はトラガカントガムなどの天然ゴム、大豆、レシチンなどの天然リン脂質、モノオレイン酸ソルビタンなどの、脂肪酸、及びヘキシトール無水物由来のエステル、又は部分的エステル、及びポリオキシエチレンモノオレイン酸ソルビタンなどの、該部分エステルのエチレンオキシドとの縮合生成物であり得る。また、該乳剤は、甘味料、及び着香料を含む。
【0080】
シロップ剤及びエリキシル剤を、グリセロール、プロピレングリコール、ソルビトール、又はスクロースなどの甘味料と製剤することができる。また、そのような製剤は、粘滑剤、保存料、及び着香料、及び着色料を含むことができる。
【0081】
該医薬組成物は、注入可能な、無菌水溶性懸濁剤又は無菌油性懸濁剤の形態であり得る。この懸濁液は、先に記載されている適切な分散剤又は湿潤剤、及び懸濁化剤を用いて、公知の技術に従って製剤することができる。また、無菌注射剤製剤は、1,3-ブタンジオールにおける溶液など、無毒性で非経口的に許容し得る希釈剤又は溶媒における、注入可能な無菌溶液又は懸濁剤であり得る。使用できる、許容し得る媒体及び溶媒の中には、水、リンガー溶液、及び等張塩化ナトリウム溶液がある。さらに、通常、溶媒、又は懸濁化剤として無菌固定油を使用する。この目的に関して、合成モノグリセリド又はジグリセリドなどの任意の無菌固定油を使用できる。さらに、オレイン酸などの脂肪酸は、注射剤の製造において使用される。
【0082】
また、本発明の化合物は、該薬剤の直腸投与のために、坐薬の形態で投与できる。これらの組成物は、該薬剤を、常温では固体であるが直腸温では液体であり、従って直腸腔で融解し、該活性化合物を放出する、適切な非刺激性賦形剤と混合することにより製造できる。そのような材料には、ココアバター、ポリエチレングリコールがあるが、それらに限定されない。
【0083】
局所使用には、本発明の化合物を含む、クリーム剤、軟膏、ゼリー剤、液剤、又は懸濁剤を使用する。また、本明細書中で使われる局所使用とは、洗口剤、及びうがい薬の使用を含むものとする。
さらに、本発明の医薬組成物、及び方法は、本明細書中に記したとおり、他の治療上効果的な化合物を含むことができ、通常、先に記載された病理状態の治療又は予防に適用される。
【0084】
(6.6 使用方法)
また別の態様において、本発明はCXCR3を介在した状態又は疾患を有する対象に、治療上効果的な量の本発明の化合物又は組成物を投与することにより、そのような状態、又は疾患を治療する方法を提供する。本明細書中で、該"対象"には、霊長類(ヒトなど)、ウシ、ヒツジ、ヤギ、ウマ、ブタ、イヌ、ネコ、ウサギ、ラット、マウスなどの哺乳動物などの動物が含まれると定義するが、それらに限定されない
【0085】
本明細書で使われる"CXCR3を介在した状態又は疾患"という句、及び関連した句、及び用語とは、通常より少ない、又は多いなどの、不適切なCXCR3活性を特徴とする状態のことをいう。不適切なCXCR3活性は、通常CXCR3を発現しない細胞におけるCXCR3発現、(炎症及び免疫調節の、障害及び疾患などをもたらす)CXCR3発現の増加、又は(特定の癌、及び血管由来かつ血管性関連の障害などをもたらす)CXCR3発現の減少の結果として起こり得る。また、不適切なCXCR3機能活性は、通常CXCケモカインを分泌しない細胞によるケモカイン分泌、(炎症及び免疫調節の、障害及び疾患などをもたらす)ケモカイン発現の増加、又はケモカイン発現の減少の結果として起こり得る。CXCR3を介在した状態又は疾患は、不適切なCXCR3機能活性により、完全に、又は部分的に介在され得る。しかしながら、CXCR3を介在した状態又は疾患は、CXCR3の調節がその根底となる状態又は疾患にいくらかの効果をもたらすもののうちの1つである(例えば、CXCR3アンタゴニストは、少なくとも一部の患者において、患者の健康にいくらかの改善をもたらす。)。
【0086】
"治療上効果的な量" という用語は、研究者、獣医、医師、又は他の臨床医により求められている、組織、系、動物、又はヒトの生物学的又は医学的応答を引き出すことができ、又は治療される疾患の1つ以上の症状の進行を予防するか、又は症状をある程度軽減するのに十分である、主題化合物の量を意味する。
【0087】
炎症、感染、及び癌に関連した疾患及び状態を、本化合物及び組成物で治療することができる。一群の実施態様において、ヒト、又は他の種の慢性疾患などの疾患又は状態を、CXCR3機能の阻害剤で治療できる。これらの疾患又は状態には、(1)全身性アナフィラキシー又は過敏性応答、薬物アレルギー、虫さされアレルギー、及び食物アレルギーなどの炎症、又はアレルギー疾患;クローン病、潰瘍性大腸炎、回腸炎、及び腸炎などの炎症性腸疾患;膣炎;皮膚炎、湿疹、アトピー性皮膚炎、アレルギー性接触皮膚炎、じんま疹などの乾癬及び炎症性皮膚病;血管炎;脊椎関節症;強皮症;アレルギー性鼻炎、過敏性肺疾患などの喘息及び呼吸器系アレルギー疾患などがある、(2)関節炎(リウマチ性、及び乾癬性)、多発性硬化症、全身性エリテマトーデス、1型糖尿病、糸球体腎炎などの自己免疫性疾患、(3)移植片拒絶(同種移植片拒絶、及び移植片対宿主病を含む)、及びそれらに関連した状態、及び(4)アテローム性動脈硬化、筋炎、神経変性疾患(アルツハイマー病など)、脳炎、髄膜炎、肝炎、腎炎、敗血症、サルコイドーシス、結膜炎、耳炎、慢性閉塞性肺疾患、洞炎、及びベーチェット症候群などの、好ましくない炎症性応答が阻害されるべきである他の疾患などがあるがある。別の群の実施態様において、疾患又は状態を、CXCR3機能のアゴニストで治療する。CXCR3アゴニストで治療されるべき疾患の例には、血管形成、又は血管新生が役割を果たす疾患(腫瘍性疾患、網膜症、黄斑変性症)、感染症、及び免疫抑制疾患などがある。
【0088】
好ましくは、本発明は、神経変性疾患(アルツハイマー病など)、多発性硬化症、全身性エリテマトーデス、関節リウマチ、アテローム性動脈硬化、脳炎、髄膜炎、肝炎、腎炎、敗血症、サルコイドーシス、乾癬、湿疹、じんま疹、1型糖尿病、喘息、結膜炎、耳炎、アレルギー性鼻炎、慢性閉塞性肺疾患、洞炎、皮膚炎、炎症性腸疾患、潰瘍性大腸炎、クローン病、ベーチェット症候群、痛風、癌、ウイルス感染(HIVなど)、細菌感染、及び臓器移植状態、又は皮膚移植状態から選択された疾患又は状態の、治療又は予防を対象にする。"臓器移植状態"という用語は、骨髄移植状態、及び固形臓器(腎臓、肝臓、肺、心臓、膵臓、又はその組合せなど)移植状態を含むものとする。
【0089】
本化合物、及び組成物で治療できる疾患又は状態には、先に記載のとおり、一般に(1)炎症性、又はアレルギー性疾患、(2)自己免疫疾患、(3)移植片拒絶、及び(4)好ましくない炎症性応答が阻害されるべきである他の疾患に付随した疾患などがある。 例として、バルーン血管形成などの処置後の再狭窄は、一般的にアテローム性動脈硬化を伴い、本化合物、及び組成物で治療できる。
【0090】
治療されるべき疾患、及び対象の状態に応じて、本発明の化合物を、経口、非経口(筋肉内、腹腔内、静脈内、ICV、嚢内注射又は注入、皮下注射、又はインプラントなど)、吸入スプレー、経鼻、膣、直腸、舌下、又は局所の投与経路により投与でき、各投与経路に適切な、従来の無毒性の医薬として許容し得る担体、アジュバント剤、及び媒体を含む、適切な用量単位製剤に、単独で、又は共に製剤することができる。
【0091】
ケモカイン受容体調節を必要とする状態の治療、及び予防において、一般に、適切な投与量レベルは、1日当たり、kg患者の体重当たり、約0.001〜100 mgであり得て、単回投与、又は複数回投与で投与できる。好ましくは、該投与量レベルは、1日当たり約0.01〜約25 mg/kg、さらに好ましくは、1日当たり約0.05〜約10 mg/kgであり得る。適切な投与量レベルは、1日当たり約0.01〜25 mg/kg、1日当たり約0.05〜10 mg/kg、又は1日当たり約0.1〜5 mg/kgであり得る。この範囲内で、該投与量は、1日当たり0.005〜0.05、0.05〜0.5、又は0.5〜5.0 mg/kgであり得る。経口投与に関して、好ましくは、該化合物を、1.0〜1000ミリグラムの活性成分を含有する錠剤の形態で提供し、特に、治療されるべき患者に対症的な投与量調整として、1.0、5.0、10.0、15.0、20.0、25.0、50.0、75.0、100.0、150.0、200.0、250.0、300.0、400.0、500.0、600.0、750.0、800.0、900.0、及び1000.0ミリグラムの活性成分である。該化合物を、1日当たり1〜4回の、好ましくは1日当たり1回、又は2回の投与計画で投与できる。
【0092】
しかし、当然のことながら、任意の特定な患者に関する具体的な服用レベル、及び投与頻度は、多様であり得て、様々な要因に依存し得る。例として、使用された具体的な化合物の活性、その化合物の代謝安定性及び作用の長さ、年齢、体重、一般的な健康、性別、食習慣、投与形態及び投与時間、排出速度、薬剤の組合せ、該特定の状態の程度、及び宿主が受けている治療などがある。
【0093】
本発明の化合物を、関連した効用を有する他の化合物と組合せて、関節リウマチ、及びアテローム性動脈硬化などの自己免疫病理、及び先に記載された病理だけでなく、喘息及びアレルギー疾患などの炎症及び免疫の、障害及び疾患を治療又は予防できる。多くの場合、本発明の化合物、及び代わりの、又は第二の治療薬を含む組成物は、投与したときに、相加効果、又は相乗効果を有する。
【0094】
例として、炎症の治療又は予防において、本化合物を、オピエートアゴニストなどの抗炎症剤又は鎮痛薬、5-リポキシゲナーゼの阻害剤などのリポキシゲナーゼ阻害剤、シクロオキシゲナーゼ-2阻害剤などのシクロオキシゲナーゼの阻害剤、インターロイキン-1阻害剤などのインターロイキン阻害剤、NMDAアンタゴニスト、一酸化窒素の阻害剤又は一酸化窒素の合成の阻害剤、非ステロイド性抗炎症薬、又はサイトカイン抑制抗炎症薬と併用して、又は組合せて用いることができる。例を挙げると、アセトアミノフェン、アスピリン、コデイン、ファンタニル、イブプロフェン、インドメタシン、ケトロラク、モルヒネ、ナプロキセン、フェナセチン、ピロキシカム、ステロイド性鎮痛剤、スフェンタニル、スンリンダク(sunlindac)、テニダプ(tenidap)、及びそのようなものと共に用いることができる。同様に、この即効性の化合物を、鎮痛剤;カフェイン、H2-アンタゴニスト、シメチコン、水酸化アルミニウム、又は水酸化マグネシウムなどの増強剤;フェニレフリン、フェニルプロパノールアミン、プソイドフェドリン、オキシメタゾリン、エピネフリン、ナファゾリン、キシロメタゾリン、プロピルヘキセドリン、又はレボ-デソキシエフェドリンなどの充血除去剤;コデイン、ヒドロコドン、カラミフェン、カルベタペンタン、又はデキストロメトルファンなどの鎮咳剤;利尿薬;鎮静性、又は非鎮静性抗ヒスタミン剤と共に投与することができる。同様に、本発明の化合物は、本発明の化合物が有用である疾患又は状態の治療/予防/抑制、又は改善に用いられる、他の薬剤と組合せることができる。そのような他の薬剤を、それらに一般的に用いられる経路、及び量で、本発明の化合物と同時に、又は連続的に投与できる。本発明の化合物が1つ以上の他の薬剤と同時に用いられる場合は、本発明の化合物に加えてそのような他の薬剤を含む、医薬組成物が好ましい。従って、本発明の医薬組成物には、本発明の化合物に加えて、1つ以上の他の活性成分も含むものなどがある。本発明の化合物と、個別に、又は同一医薬組成物中のいずれかで投与される、本発明の化合物と組合せることができる他の活性成分の例には、下記群などがあるが、それらに限定されない:(a)VLA-4アンタゴニスト;(b)べクロメタゾン、メチルプレドニゾロン、ベタメタゾン、プレドニゾン、デキサメタゾン、及びヒドロコルチゾンなどのステロイド;(c)シクロスポリン(シクロスポリンA 、Sandimmune(商標)、Neoral(商標))、タクロリムス(FK-506、Prograf(商標))、ラパマイシン(シロリムス、Rapamune(商標))、及び他のFK-506型免疫抑制剤、及びミコフェノール酸モフェチル(CellCept(商標))などのミコフェノール酸塩などの免疫抑制剤;(d)ブロモフェニラミン、クロルフェニラミン、デクスクロルフェニラミン、トリプロリジン、クレマスチン、ジフェンヒドラミン、ジフェニルピラリン、トリペレナミン、ヒドロキシジン、メトジラジン、プロメタジン、トリメプラジン、アザタジン、シプロヘプタジン、アンタゾリン、フェニラミン、ピリラミン、アステミゾール、テルフェナジン、ロラタジン、セチリジン、フェキソフェナジン、デスカルボエトキシロラタジンなどの抗ヒスタミン剤(H1-ヒスタミンアンタゴニスト);(e)β2アゴニスト(テルブタリン、メタプロテレノール、フェノテロール、イソエタリン、アルブテロール、ビトルテロール、及びピルブテロール)、テオフィリン、クロモリンナトリウム、アトロピン、臭化イプラトロピウム、ロイコトリエンアンタゴニスト(ザフィルルカスト、モンテルカスト、プランルカスト、イラルカスト、ポビルカスト、SKB-106,203)、ロイコトリエン生合成阻害剤(ジレウトン、BAY-1005)などの非ステロイド系抗喘息薬;(f)プロピオン酸誘導体(アルミノプロフェン、ベノキサプロフェン、ブクロクス酸、カルプロフェン、フェンブフェン、フェノプロフェン、フルプロフェン、フルルビプロフェン、イブプロフェン、インドプロフェン、ケトプロフェン、ミロプロフェン、ナプロキセン、オキサプロジン、ピルプロフェン、プラノプロフェン、スプロフェン、チアプロフェン酸、及びチオキサプロフェン)、酢酸誘導体(インドメタシン、アセメタシン、アルクロフェナク、クリダナク、ジクロフェナク、フェンクロフェナク、フェンクロズ酸、フェンチアザク、フロフェナク、イブフェナク、イソキセパク、オキソピナク(oxpinac)、スリンダク、チオピナク、トルメチン、ジドメタシン、及びゾメピラク)、フェナム酸誘導体(フルフェナム酸、メクロフェナム酸、メフェナム酸、ニフルム酸、及びトルフェナム酸)、ビフェニルカルボン酸誘導体(ジフルニサル、及びフルフェニサール)、オキシカム類(イソキシカム、ピロキシカム、スドキシカム、及びテノキシカム)、サリチル酸塩類(アセチルサリチル酸、スルファサラジン)、及びピラゾロン類(アパゾン、ベンズピペリロン、フェプラゾン、モフェブタゾン、オキシフェンブタゾン、フェニルブタゾン)などの非ステロイド性抗炎症薬(NSAID);(g)セレコキシブ(Celebrex(商標))、及びロフェコキシブ(Vioxx(商標))などのシクロオキシゲナーゼ-2(COX-2)阻害剤;(h)ホスフォジエステラーゼIV 型(PDE-IV)の阻害剤;(i)オーラノフィン、及びオーロチオグルコースなどの金化合物;(j)ホスフォジエステラーゼIV 型(PDE-IV)の阻害剤;(k)ケモカイン受容体、特にCCR1、CCR2、CCR3、CCR5、CCR6、CCR8、及びCCR10の、他のアンタゴニスト;(l)HMG-CoA還元酵素阻害剤(ロバスタチン、シンバスタチン、及びプラバスタチン、フルバスタチン、アトルバスタチン、及び他のスタチン類)、抑制剤(コレスチラミン、及びコレスチポル)、ニコチン酸、フェノフィブリン酸誘導体(ゲムフィブロジル、クロフィブラート、フェノフィブラート、及びベンザフィブラート)、及びプロブコールなどのコレステロール降下薬;(m)インスリン、スルホニル尿素類、ビグアミド類(メトホルミン)、α-グルコシダーゼ阻害剤類 (アカルボース)、及びグリタゾン類 (トログリタゾン、及ピオグリタン)などの抗糖尿病薬;(n)インターフェロンベータの製剤(インターフェロンβ-lα、インターフェロンβ-lβ);(o)エタネルセプト (Enbrel(商標));(p)オルソクローン(OKT3)、ダクリズマブ(Zenapax(商標))、インフリキシマブ (Remicade(商標))、バシリキシマブ(Simulect(商標))、及び抗CD40リガンド抗体(MRP-1など)などの抗体治療;及び (q)5-アミノサリチル酸及びそのプロドラッグ、ヒドロキシクロロキン、D-ペニシラミン、アザチオプレン、及び6-メルカプトプリンなどの代謝拮抗剤、及び 細胞毒性の癌化学療法薬などの他の化合物である。第二の活性成分に対する本発明の化合物の重量比は、多様であり得て、各成分の効果的な用量に依存し得る。一般に、各々の効果的な用量を用いることができる。従って、例として、本発明の化合物をNSAID と組合せる場合、該NSAID に対する本発明の化合物の重量比は、一般に、約1000:1〜約1:1000、好ましくは約200:1〜約1:200の範囲であり得る。本発明の化合物と他の活性成分の組合せも、一般に、先に記載の範囲内であり得るが、その都度、各活性成分の効果的な用量が用いられるべきである。
【0095】
本発明の範囲内の免疫抑制剤には、さらに、レフルノミド;RAD001;ERL080;FTY720;CTLA-4;オルソクローン(OKT3)、ダクリズマブ(Zenapax(商標))、及びバシリキシマブ(Simulect(商標))などの抗体治療;及びサイモグロブリンなどの抗胸腺細胞などがあるが、それらに限定されない。
【0096】
特に好ましい実施態様において、本方法は、本発明の化合物を単独で、又はベタセロン、アボネックス、アザチオプレン(Imurek(商標)、Imuran(商標))、カポキソン(capoxone)、プレドニゾロン、及びシクロホスファミドから選択された第二の治療薬と組合せて用いて、多発性硬化症の治療又は予防を対象にする。組合せて用いる場合、施術者が該治療薬の組合せを投与でき、又は投与を連続的にし得る。
【0097】
さらに他の特に好ましい実施態様において、本方法は、本発明の化合物を単独で、又はメトトレキサート、スルファサラジン、ヒドロキシクロロキン、シクロスポリンA、D-ペニシラミン、インフリキシマブ (Remicade(商標))、エタネルセプト (Enbrel(商標))、オーラノフィン、及びオーロチオグルコースからなる群から選択された第二の治療薬と組合せて投与する、関節リウマチの治療又は予防を対象にする。
【0098】
さらに他の特に好ましい実施態様において、本方法は、本発明の化合物を単独で、又はシクロスポリンA、FK-506、ラパマイシン、ミコフェノール酸塩、プレドニゾロン、アザチオプレン、シクロホスファミド、及び抗リンパ球グロブリンからなる群から選択された第二の治療薬と組合せて用いる、臓器移植状態の治療又は予防を対象にする。
【実施例】
【0099】
(7. 実施例)
下記に用いられた試薬、及び溶媒は、Aldrich Chemical社(Milwaukee、Wis.、米国)などの業務用供給元から入手できる。1H-NMRスペクトルをBruker 500 MHZ NMR分光計上に記録した。有意なピークを順に表にする:プロトンの数、多重度(s, 一重線; d, 二重線; t, 三重線; q, 四重線; m, 多重線; br s, 広域一重線)、及びヘルツ(Hz) における結合定数である。エレクトロスプレーイオン化(ESI)質量分析を、試料送達にHP1 100 HPLCを用いながら、Hewlett-Packard 1100 MSD エレクトロスプレー質量分析計上で行った。質量分析の結果を、質量電荷比として記録する。各化合物をメタノール中に0.1 mg/mLで溶解し、1マイクロリットルを送達溶媒と共に質量分析計に注入し、100〜1500ダルトンを読み取った。各化合物を、1%酢酸含有1:1アセトニトリル/水を該送達溶媒として用い、ポジティブESI モードで分析できる。また、各化合物を、アセトニトリル/水中2 mM NH4OAc溶液を該送達溶媒として用い、ネガティブESI モードで分析できる。
【0100】
【表1】

【0101】
(7.1 実施例1)
【化26】

【0102】
化合物A1を、国際公開第WO 02/83143号、スキーム9、91ページに概説のとおり、第3工程において、4-(2,2,2-トリフルオロエトキシ)アニリンをp-フェネチジンの代わりに用いて合成した。化合物A3を、スキームAに示すとおり、化合物A1から2工程で合成した。
【0103】
(R)-2-[1-(2-エタンスルホニル-エチルアミノ)-エチル]-3-[4-(2,2,2-トリフルオロエトキシ)-フェニル]-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物A2)。
10 mL メタノール中2.18g 化合物A1(5.98 mmol、1.00等量)と687μL エチルビニルスルホン(6.58 mmol、1.10等量) の混合物を、50℃の油浴中で一晩撹拌し、その後真空で濃縮した。該生成物A2 を、さらなる精製をせずに、次の工程に用いた。MS(ESI+) m/z=485.1 [M+H]+。
【0104】
(R)-N-(2-エタンスルホニル-エチル)-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(1-{4-オキソ-3-[4-(2,2,2-トリフルオロ-エトキシ)-フェニル]-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル}-エチル)-アセトアミド (化合物A3)。
該酸クロライドである(4-フルオロ-3-トリフルオロメチル-フェニル)アセチルクロライドを、15 mL ジクロロメタン中に溶解された2.06g (4-フルオロ-3-トリフルオロメチル-フェニル)酢酸(9.27 mmol、1.70等量)、及び0.81 mL 塩化オキサリル(9.27 mmol、1.70等量)の氷冷溶液に、数滴のDMFを加え、製造した。ガス発生が続き、該反応物を常温に平衡化し、ガス発生が終わるまで2時間撹拌した。この溶液を、アセトン-ドライアイス浴で冷却された、20 mLジクロロメタン中に溶解された2.6g A2 (5.37 mmol、1.00等量)及び2.24 mL トリエチルアミン(16.1 mmol、3.00等量)の溶液に、15分間にかけて滴下した。該結果として得られた混合液を、低温で20分間撹拌し、その後、重炭酸ナトリウム飽和水溶液中に注いだ。該有機層を塩水で洗浄し、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮し、ガラス状固形物を得た。該生成物を、ヘキサン中50%酢酸エチル溶液から100%酢酸エチルの勾配で溶出し、シリカゲル上のクロマトグラフィーにより精製した。その後、該クロマトグラフィーの産物をメチルtert-ブチルエーテルから再結晶し、化合物A3を無色結晶、融点=157〜159℃として得た。1H NMR (400 MHz; CDCl3; T=300 K) {S-cis:S-trans アミド回転異性体の混合物の比は、約2.3:1} δ 1.20 (t, J=7.6 Hz, 3H)、1.46 (t, J=7.2 Hz, 6.5H)、1.46 (d, J=7.2 Hz, 6.5H)、2.48 (d, J=16 Hz, 1H)、2.92 (ddd, J=2.8, 7.6, 16.0 Hz, 2H)、2.94 (d, J=16 Hz, 1H)、3.13 (ddd, J=3.6, 7.2, 14.8 Hz, 4.6H)、3.22 (dd, J=6.8, 6.8 Hz, 2H)、3.50 (ddd, J=5.2, 10.6, 13.3 Hz, 2.3H)、3.67 (ddd, J=8.0, 8.0, 13.3 Hz, 1H)、3.84 (s, 4.6H)、3.90 (ddd, J=4.8, 10, 14.8 Hz, 2.3H)、4.02 (ddd, J=8.0, 8.0, 13.3 Hz, 1H)、4.06-4.27 (m, 4.6H)、4.42 (qt, J=8 Hz, 6.6H)、5.01 (qt, J=6.8 Hz, 1H)、5.16 (qt. J=7.2 Hz, 2.3H)、7.09-7.19 (m, lOH)、7.21-7.28 (m, 5H)、7.33-7.50 (m, 8.9H)、7.53 (dd, J=4.6, 9.1 Hz, 1H)、7.63-7.68 (m, 2.3H)、8.58 (dd, J=2.0, 8.0 Hz, 2.3H)、8.61 (dd, J=2.0, 8.0 Hz, 1H)、8.96 (dd, J=2.0, 4.4 Hz, 2.3H)、9.06 (dd, J=2.0, 4.8 Hz, 1H) ppm。 MS(ESI+) m/z=688.9 [M+H]+。理論値: 52.33% C、3.95% H、19.31% F、8.14% N。測定値: 52.29% C、3.97% H、19.40% F、8.12% N。
【0105】
(R)-N-(2-エタンスルホニル-エチル)-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(1-{4-オキソ-3-[4-(2,2,2-トリフルオロ-エトキシ)-フェニル]-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル}-エチル)-アセトアミド (化合物1)。
2 mLメタノール中化合物A3(58 mg、0.084 mmol)と10%炭素担持パラジウム(18 mg、0.017 mmol)の混合物を、常温、水素バルーン下で20時間撹拌させた。終了時に、該混合物をセライトの短いカラムを介してろ過し、該ろ液を真空で濃縮し、かつ乾燥させ、61 mgの化合物1を得た。1H NMR: cis/trans アミド回転異性体の混合物の比は、約3:1 (400 MHz, CDCl3; T=25℃) δ最大 7.00-7.47 (m, 7H)、5.31 (br s, 1H)、4.71 (q, J=6.62 Hz, 1H)、4.36 (m, 2H)、 3.89-4.02 (m, 1H)、3.69-3.76 (m, 1H)、3.36-3.44 (m, 3H)、2.91-3.04 (m, 3H)、2.51-2.66 (m, 2H)、1.87-1.92 (m, 2H)、1.37-1.43 (m, 4H)、1.33 (d, J=6.7 Hz, 3H)、及びδ最小 5.15 (q, J=7.04 Hz, 1H)、4.77 (br s, 1H)、1.28 (d, J=7.08 Hz, 3H)。MS (ESI+) 693 [M+H]+。
【0106】
(7.2 実施例2)
【化27】

【0107】
(R)-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(2-メタンスルホニル-エチル)-N-(1-{4-オキソ-3-[4-(2,2,2-トリフルオロ-エトキシ)-フェニル]-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル}-エチル)-アセトアミド (化合物B2)。
化合物B2を、先に記載された A3の合成順序に従い、第一工程において、メチルビニルスルホンをエチビニルスルホンの代わりに用い、A1 から2工程で合成した。1H NMR: cis/transアミド回転異性体の混合物の比は、約2.0:1 (400 MHz; CDCl3; T=298 K) δ最大 8.98 (dd, J=4.46, 1.78 Hz, 1H)、8.62 (dd, 7.69, 1.78 Hz, 1H)、7.66 (dd, J=9.71, 3.33 Hz, 1H)、7.10-7.46 (m, 7 H)、 5.14 (q, J=7.26 Hz, 1H)、4.41 (q, J=7.94 Hz, 2H)、3.64-4.24 (m, 5H)、 3.10 (s, 3H)、2.47 (m, 1H)、1.46 (d, J=7.2 Hz, 3H)、及びδ最小 9.06 (m, 1H), 8.63 (不明瞭のdd, J=7.28, 1.63 Hz, 1H)、5.01 (q, J=6.64 Hz, 1H), 2.83 (s, 3H)、1.58 (d, J=6.71 Hz, 3H) ppm。MS (ESI+) 675 [M+H]+。
【0108】
(R)-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(2-メタンスルホニル-エチル)-N-(1-{4-(オキソ-3-[4-(2,2,2-トリフルオロ-エトキシ)-フェニル]-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル}-エチル)-アセトアミド (化合物2)。
化合物2 を、化合物1と同じ合成手順に従い、B2から合成した。1H NMR: cis/transアミド回転異性体の混合物の比は、約3:1 (400 MHz, CDCl3; T=25℃)δ最大 7.00-7.48 (m, 7H)、5.30 (br s, 1H)、4.73 (q, J=6.85 Hz, 1H)、4.38 (m, 2H)、3.90-3.95 (m, 1H)、3.73-3.76 (m, 1H)、3.36-3.44 (m, 3H)、2.91-3.03 (m, 5H)、2.53-2.64 (m, 3H)、1.86-1.93 (m, 2H)、1.34 (d, J=6.78 Hz, 3H)、及びδ最小 5.22 (m, 1H)、1.29 (d, J=7.16 Hz, 3H)。MS (ESI+) 679 [M+H]+。
【0109】
(7.3 実施例3)
【化28】

中間体C3を、スキームCに示すとおり、市販のC1から2段階で合成した。
【0110】
2,5-ジメチル-2H-ピラゾール-3-イル)-メタノール(化合物C2)。
水素化アルミニウムリチウム(テトラヒドロフラン中1.0 M、1.78 mL)溶液を、テトラヒドロフラン中市販のエチル1,3-ジメチル-lH-ピラゾール-5-カルボン酸塩 (化合物C1、300 mg、1.78 mmol) の溶液に、常温で、5分間かけて加えた。該反応物を一晩撹拌した。連続して、水(67 μL)、15%水酸化ナトリウム水溶液(202 μL)、水(67 μL)を加えた。該結果として得られた固形物をろ過し、真空で乾燥させ、その後クロマトグラフィー(ジクロロメタン中3%〜7%メタノール溶液)により精製し、175 mgの無色固形物、化合物C2を得た。
【0111】
5-ブロモメチル-1,3-ジメチル-lH-ピラゾール(化合物C3)。
ジクロロメタン中臭素(229 mg、1.44 mmol)溶液を、氷水浴で冷却してあるジクロロメタン中トリフェニルホスフィン(376 mg、1.44 mmol)の溶液に加えた。該反応物を10分間撹拌し、その後化合物C2 (170 mg、1.34 mmol)を一度に全て加え、該混合物を、2時間かけて、常温に平衡化した。該反応物を水で急冷し、その後、該水層をジクロロメタン(2 X 25 mL)で抽出した。該組合せた有機層を、10%チオ硫酸ナトリウム水溶液、その後、塩水で洗浄した。該有機層を硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮した。クロマトグラフィー(1:1 ヘキサン:酢酸エチル)により精製し、195 mgの無色固形物、化合物C3を得た。1H NMR (400 MHz; CDCl3; T=298 K): δ6.07 ppm (s, 1H)、4.44 (s, 2H)、3.83 (s, 3H)、2.23 (s, 3H) ppm。
【0112】
【化29】

【0113】
化合物D1は、先に国際公開第WO 02/83143号、スキーム9、91ページに記載されている。化合物3を、スキームDに示すとおり、化合物D1から5工程で合成した。
(R)-({1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-カルバミン酸tert-ブチルエステル (化合物D2)。
化合物D1 (370 mg、0.90 mmol)をメタノール中に溶解し、窒素で15分間脱気した。パラジウム(活性炭の10%重量、190 mg)を加え、その後、該系をバルーンで水素雰囲気下に置いた。該反応物を常温で一晩撹拌し、その後、Celiteを介してろ過し、かつ真空で濃縮した。クロマトグラフィー(ジクロロメタン中5%メタノール溶液)で精製し、387mgの無色固形物、化合物D2を得た。
【0114】
(R)-{1-[8-アセチル-3-(4-エトキシ-フェニル)-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-カルバミン酸tert-ブチルエステル (化合物D3)。
化合物D2 (263 mg、0.63 mmol)、及びN,N-ジイソプロピルエチルアミン(111 μL, 0.63 mmol)を無水酢酸(10 mL)に溶解し、80℃まで加熱した。該反応物を一晩撹拌した。それを重炭酸ナトリウム飽和水溶液で急冷し、その後、ジクロロメタンで抽出した。該有機層を、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄し、その後、硫酸マグネシウム上で乾燥させ、ろ過し、真空で濃縮した。クロマトグラフィー(1:1〜1:2のヘキサン:酢酸エチル)により精製し、168 mgの化合物D3を回収した。
【0115】
(R)-8-アセチル-2-(1-アミノ-エチル)-3-(4-エトキシ-フェニル)-5,6,7,8-テトラヒドロ-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物D4)。
化合物D3 (268 mg、0.59 mmol)を1:1 トリフルオロ酢酸:ジクロロメタン(10 mL)中に溶解した。該反応物を、常温で30分間撹拌した。該溶媒を真空で除去し、その後、10%水酸化アンモニウム水溶液を、水性pH=9 まで加えた。該水層をジクロロメタンで3回抽出し、その後、該組合せた有機層を、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。それを、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮し、170 mgの化合物D4を回収した。MS (MH+): 357.1。 1H NMR (400 MHz; CDCl3; T=298 K): δ7.13 (ddd, 2H, J=18.9, 1.4, 1.1 Hz)、7.02 (ddd, 2H, J=9.0, 1.2, 0.8 Hz)、4.09 (dq, 2H, J=6.9, 1.2 Hz)、 3.98-3.80 (ddq, 2H, J=62.6, 5.3, 1.0 Hz)、3.73 (dd, 1H, J=6.6, 1.2 Hz)、 2.60 (s, 3H)、1.92 (m, 2H)、1.82 (広域s, 2H)、1.45 (ddd, 3H, J=8.3, 6.1, 1.3 Hz)、1.28-1.21 (m, 5H) ppm。
【0116】
(R)-8-アセチル-2-{1-[(2,5-ジメチル-2H-ピラゾール-3-イルメチル)-アミノ]-エチル}-3-(4-エトキシ-フェニル)-5,6,7,8-テトラヒドロ-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物D5)。
化合物D4(70 mg、0.20 mmol)、化合物C3(37 mg、0.20 mmol)、及び炭酸カリウム (30 mg、0.22 mmol)を、ジメチルホルムアミド中で、常温で一晩で撹拌した。該反応混合物を、4:1 エーテル:ジクロロメタンと水の間で分配した。該有機層を、水、及び塩水で洗浄した。それを、硫酸マグネシウム上で乾燥させ、ろ過し、その後、真空で濃縮した。クロマトグラフィー(ジクロロメタン中0.1%水酸化アンモニウム含有2%〜5%メタノール溶液)により精製し、55 mgの化合物D5を得た。
【0117】
(R)-N-{1-[8-アセチル-3-(4-エトキシ-フェニル)-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-N-(2,5-ジメチル-2H-ピラゾール-3-イルメチル)-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物3)。
4-フルオロ-3-トリフルオロメチルフェニル酢酸 (45 mg、0.20 mmol)をジクロロメタン中に溶解し、0℃まで冷却した。塩化オキサリル(18 μL、0.20 mmol)を加えて、その後5分後に、ジメチルホルムアミド(1.6 μL、0.02 mmol)を加えた。 該反応物を0℃で30分間、及び常温で1時間撹拌した。該溶液を、-78℃で、ジクロロメタン中化合物D5(55 mg、0.12 mmol)とトリエチルアミン(50 μL、0.36 mmol)の混合物にゆっくり加えた。これを30分間撹拌し、その後、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。それを、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮した。逆相HPLCにより精製し、49 mgの無色固形物、化合物3を得た。MS (MH+): 669.1。1H NMR (500 MHz; CDCl3; T=298 K): δ7.47-7.02 (m, 7H)、5.74-5.42 (m, 1H)、5.30-5.04 (m, 1H)、4.63-4.31 (m, 2H)、4.09-3.86 (m, 3H)、3.75-3.59 (m, 3H)、2.81-2.60 (m, 1H)、2.60-2.43 (m, 5H)、2.18 (m, 3H)、1.93 (広域s, 2H)、1.46 (t, 3H, J=6.7 Hz)、1.30 (t, 3H, J=7.7 Hz) ppm。
【0118】
(7.4 実施例4)
【化30】

【0119】
化合物E1の合成は、国際公開第WO 02/83143号、スキーム9、91ページに記載されている。化合物4を、スキームEに示すとおり、化合物E1から5工程で合成した。
(R)-3-(4-エトキシ-フェニル)-2-[1-(3-(オキソ-ブチルアミノ)-エチル]-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物E2)。
先に記載された化合物E1(1.94 g、6.25 mmol)、及びメチルビニルケトン(520 μL、6.25 mmol)をメタノール中に溶解し、60℃で3時間撹拌した。該メタノールを真空で除去した。クロマトグラフィー (ジクロロメタン中3%〜8%メタノール溶液)により精製し、1.38 gの化合物E2を回収した。
【0120】
(R)-N-{1-[3-(4-エトキシ-フェニル)-4-オキソ-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(3-(オキソ-ブチル)-アセトアミド (化合物E3)。
4-フルオロ-3-トリフルオロメチルフェニル酢酸 (707 mg、3.18 mmol)をジクロロメタン中に溶解し、0℃まで冷却した。塩化オキサリル(278 μL、3.18 mmol)を加えて、その後5分後に、ジメチルホルムアミド(24.7 μL、0.32 mmol)を加えた。該反応物を0℃で30分間、及び常温で1時間撹拌した。該溶液を、-78℃で、ジクロロメタン中化合物E2 (713 mg、1.87 mmol)とトリエチルアミン(784 μL、5.62 mmol)の混合物にゆっくり加えた。該反応物を30分間撹拌し、その後、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。それを、硫酸マグネシウム上で乾燥させ、ろ過し、真空で濃縮した。カラム(ジクロロメタン中2%〜10%メタノール溶液)により精製し、859 mgの化合物E3を得た。
【0121】
(R)-N-(3-シクロブチルアミノ-ブチル)-N-{1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物E4)。
化合物E3 (67 mg、0.11 mmol)、シクロブチルアミン (14.7 μL、0.17 mmol)、及びトリアセトキシ水素化ホウ素ナトリウム(73 mg、0.34 mmol)を、ジクロロエタン中で、常温で3時間撹拌した。該反応混合物をジクロロメタンで希釈し、その後、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。それを、硫酸マグネシウム上で乾燥させ、ろ過し、真空で濃縮した。クロマトグラフィー(ジクロロメタン中0.1%水酸化アンモニウム含有4%〜10%メタノール溶液)により精製し、31 mgの化合物E4を回収した。
【0122】
(R)-N-[3-(シクロブチル-メチル-アミノ)-ブチル]-N-{1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物E5)。
化合物E4 (31 mg、0.048 mmol)、ホルムアルデヒド(37%水溶液、5.4 μL、0.073 mmol)、及びトリアセトキシ水素化ホウ素ナトリウム(31 mg、0.15 mmol)をジクロロエタン中で、常温で45分間撹拌した。該反応混合物をジクロロメタンで希釈し、その後、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。それを、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮した。33 mgの化合物E5を回収した。
【0123】
(R)-N-[3-(シクロブチル-メチル-アミノ)-ブチル]-N-{1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物4)。
化合物E5(33 mg、0.048 mmol)をメタノール中に溶解し、窒素で5分間脱気した。パラジウム(Cの10%重量、33 mg)を加え、その後、該反応物をバルーンで水素雰囲気下に置いた。それを常温で2時間撹拌し、その後、Celiteを介してろ過し、かつ真空で濃縮した。逆相HPLCにより精製し、16 mgの無色固形物、化合物4を得た。MS (MH+): 658.3。1H NMR (400 MHz; CDCl3, T=298 K): δ 7.40 (m, 1H)、7.14 (m, 4H)、6.89 (dd, 2H, J=8.7, 22.9 Hz)、5.21 (m, 1H)、4.81 (m, 1H)、4.02 (dd, 2H, J=15.9, 9.9 Hz)、3.57 (d, 1H, J=9.6 Hz)、3.39 (m, 2H)、3.21 (m, 2H)、3.03 (m, 1H)、2.76 (d, 1H, J=14.8 Hz)、2.56 (m, 2H)、 2.20 (dd, 1H, J=25.0, 15.8 Hz)、1.97 (d, 3H, J=11.2 Hz)、1.88 (s, 3H)、 1.74 (m, 3H)、1.64 (m, 3H)、1.40 (d, 4H, J=10.8 Hz)、1.30 (d, 6H, J=18.8 Hz) ppm。
【0124】
(7.5 実施例5)
【化31】

化合物5を、スキームFに示すとおり、先に記載された化合物E1から3工程で合成した。
【0125】
(R)-3-(4-エトキシ-フェニル)-2-[1-(1-イソプロピル-ピペリジン-4-イルアミノ)-エチル]-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物F1)
化合物E1(1.13 g、3.64 mmol)、1-イソプロピル-4-ピペリドン(812 μL、5.46 mmol)、及びトリアセトキシ水素化ホウ素ナトリウム(2.26 g、10.7 mmol)をジクロロエタン中で、常温で6時間撹拌した。該反応混合物をジクロロメタンで希釈し、その後、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。それを、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮した。1.58 gの化合物F1を回収した。MS(MH+): 436.5。1H NMR(500 MHz; CDCl3; T=298 K): δ 9.01 (dd, 1H, J=4.6, 1.9 Hz)、8.62 (dd, 1H, J=7.9, 2.0 Hz)、7.45 (dd, 1H, J=7.9, 4.6 Hz)、7.14 (d, 2H, J=9.9 Hz)、7.08 (dd, 2H, J=5.3, 2.8 Hz)、 4.13 (q, 2H, J=7.0 Hz)、3.64 (q, 1H, J=6.5 Hz)、2.82 (m, 2H)、2.75 (広域s, 1H)、2.36 (広域s, 1H)、2.18 (広域s, 3H)、1.71 (広域d, 2H), 1.49 (dt, 4H, J=7.0, 2.5 Hz)、1.32 (dd, 5H, J=19.0, 12.6 Hz)、1.05 (d, 6H, J=6.1 Hz) ppm。
【0126】
(R)-N-{1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(1-イソプロピル-ピペリジン-4-イル)アセトアミド (化合物F2)
4-フルオロ-3-トリフルオロメチルフェニル酢酸(1.35 g、6.09 mmol)をジクロロメタン中に溶解し、0℃まで冷却した。塩化オキサリル(531 μL、6.09 mmol)を加えて、その後5分後に、ジメチルホルムアミド(47.1 μL、0.61 mmol)を加えた。該反応物を0℃で30分間、その後、常温で1時間撹拌した。該溶液を、-78℃で、ジクロロメタン中化合物F1(1.56 g、3.58 mmol)とトリエチルアミン(1.50 mL, 10.7 mmol)の混合物にゆっくり加えた。それを30分間撹拌し、その後、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。該反応物を、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮した。カラム(ジクロロメタン中0.1%水酸化アンモニウム含有5%〜7%メタノール溶液)により精製し、1.27 gの化合物F2を得た。
【0127】
(R)-N-{1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(l-イソプロピル-ピペリジン-4-イル)-アセトアミド (化合物5)。
化合物F2(665 mg、1.09 mmol)をメタノール中に溶解し、窒素で5分間脱気した。パラジウム(Cの10%重量、665 mg)を加え、その後、該反応物をバルーンで水素雰囲気下に置いた。該反応物を常温で一晩撹拌し、その後、Celiteを介してろ過し、かつ真空で濃縮した。逆相HPLCにより精製し、280 mgの無色固形物、化合物5を得た。MS (MH+): 644.5。1H NMR (400 MHz; CDCl3; T=298 K): δ7.10 (m, 7H)、5.08 (広域s, 1H)、4.70 (dd, 1H, J=11.2, 5.0 Hz)、4.01 (五重線, 2H, 6.8 Hz)、3.67 (広域s, 1H)、3.42 (s, 3H)、3.14 (広域s, 3H)、2.67 (広域 m, 3H)、2.55 (t, 3H, J=6.2 Hz)、2.29 (広域s, 2H)、1.90 (dd, 3H, J=5.6, 2.5 Hz)、1.39 (t, 6H, J=6.9 Hz)、1.25 (d, 6H, 6.4 Hz) ppm。
【0128】
(7.6 実施例6)
【化32】

実施例6を、スキームGに示すとおり、化合物D2から4段階で合成した。
【0129】
(R)-{l-[3-(4-エトキシ-フェニル)-8-メチル-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-カルバミン酸tert-ブチルエステル (化合物G1)。
DMF中、124 mg 化合物D2(0.30 mmol、1.00等量)と489 mg 炭酸セシウム(1.50 mmol、5.00等量)と93 μLヨードメタン(1.50 mmol、5.00等量)の混合物を、栓付バイアル内で、90℃で24時間加熱した。該反応混合物を水に注ぎ、該水層を、3 x 20 mL 3:1 ジエチルエーテル:ジクロロメタンで抽出した。該組合せた有機抽出物を3 x 20 mL 水、その後、20 mL 塩水で洗浄し、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮し、ガラス状黄色固形物を得た。該生成物G1を逆相HPLCにより精製した。
【0130】
(R)-2-(1-アミノ-エチル)-3-(4-エトキシ-フェニル)-8-メチル-5,6,7,8-テトラヒドロ-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物G2)
氷浴により冷却された2 mL ジクロロメタンに溶解した110 mg 化合物G1 (0.26 mmol、1.00等量)の溶液に、4 mL トリフルオロ酢酸を一度に全て加えた。該反応物を、常温に平衡化した。40分後、該反応物を真空で濃縮し、該濃縮物を、各々25 mLのジクロロメタンと重炭酸ナトリウム飽和水溶液の間で分配した。該水性分離物を、25 mL ジクロロメタンで再び抽出した。組合せた有機抽出物を、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮し、化合物G4を淡黄色のガラス状固形物、83 mgとして得た。該生成物を、さらなる精製をせずに次の工程に用いた。
【0131】
(R)-2-{1-[(2,5-ジメチル-2H-ピラゾール-3-イルメチル)-アミノ]-エチル}-3-(4-エトキシ-フェニル)-8-メチル-5,6,7,8-テトラヒドロ-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物G3)。
DMF中、83 mg 化合物G2(0.25 mmol、1.00等量)と48 mg 5-ブロモメチル-1,3-ジメチル-lH-ピラゾール(化合物C3)(0.25 mmol、1.00等量)と38 mg 炭酸カリウム(0.28 mmol、1.10等量)の混合物を、常温で44時間撹拌し、その後、各々20 mLの水と3:1 ジエチルエーテル:ジクロロメタンの間で分配した。該分離された水層を、2 x 20 mL 3:1 ジエチルエーテル:ジクロロメタンで抽出した。該組合せた有機抽出物を、3 x 20 mL 水、及び20 mL 塩水で洗浄した。該有機分離物を硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮し、黄色ガラス状固形物を得た。該生成物を、ジクロロメタン中4%メタノール溶液で溶出し、シリカゲル上でカラムクロマトグラフィーにより精製した。精製された生成物G3をオフホワイト色の固形物、73 mgとして単離した。
【0132】
(R)-N-(2,5-ジメチル-2H-ピラゾール-3-イルメチル)-N-{1-[3-(4-エトキシ-フェニル)-8-メチル-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物6)。
酸クロライドである(4-フルオロ-3-トリフルオロメチル-フェニル)アセチルクロライドを、2 mL ジクロロメタン中に溶解された63 mg(4-フルオロ-3-トリフルオロメチル-フェニル)酢酸 (0.28 mmol、1.70等量)、及び24 μL塩化オキサリル(0.28 mmol、1.70等量)の氷冷溶液に、1滴のDMFを加え、製造した。ガス発生が続き、該反応物を常温に平衡化し、ガス発生が終わるまで2時間撹拌した。この溶液を、アセトン-ドライアイス浴で冷却された2 mLジクロロメタン中に溶解された、73 mg 化合物G3(0.17 mmol、1.00等量)、及び81 μL トリエチルアミン(0.59 mmol、3.50等量)の溶液に、5分間かけて滴下した。該結果として得られた混合液を、低温で20分間撹拌し、その後、重炭酸ナトリウム飽和水溶液中に注いだ。該有機層を塩水で洗浄し、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮し、ガラス状固形物を得た。該生成物を、ジクロロメタン中4%メタノール溶液で溶出し、シリカゲル上のクロマトグラフィーにより精製した。精製された生成物、化合物6を、無色固形物として単離した。1H NMR (500 MHz; CDCl3; T=300 K) {S-cis:S-trans アミド回転異性体の混合物の比は、約1.3:1} δ 1.20-1.50 (m, 18.7H)、1.70-1.87 (m, 1.7H)、1.87-2.00 (m, 5.8H)、2.12-2.28 (m, 8.7H)、2.47-2.69 (m, 6.3H)、2.90 (d, J=16.5 Hz, 1H)、2.96 (s, 4H)、3.21 (s, 3H)、3.28-3.43 (m, 5H)、3.62 (dd, J=17.5, 17.5 Hz, 3.3H)、3.69-3.83 (m, 8.3H)、3.98-4.12 (m, 5.5H)、4.33 (d, J=15.9 Hz, 1H)、4.52-4.67 (m, 2.5H)、4.79 (d, J=18.6, 1.3H)、4.84-4.93 (m, 1H)、5.33-5.40 (m, 1.3H)、5.55 (s, 1H)、5.81 (s, 1.3H)、6.87-7.23 (m, 14.3H)、7.30-7.38 (m, 2.5H)、 7.44 (d, J=8.3 Hz, 1.7H) ppm。MS(ESI+) m/z=641.0 [M+H]+。
【0133】
(7.7 実施例7)
【化33】

【0134】
化合物7を、スキームHに示すとおり、公知の化合物である2-(オキソ-シクロヘキサンカルボン酸(4-エトキシ-フェニル)-アミド (化合物H1)から7工程で合成した。
【0135】
2-(オキソ-シクロヘキサンカルボン酸(4-エトキシ-フェニル)-アミド (化合物H2)。
51 mLのジクロロメタン中、化合物H1(2.93 g、20.6 mmol)とp-フェネチジン(2.92 mL、22.67 mmol)とEDC(5.91 g、30.9 mmol)とHOBT (1.58 g、10.3 mmol)、及び3.6 mLのNMMの混合物を、常温で2日間撹拌させた。終了時に、該混合物を濃縮し、30 mLの2N 塩酸水溶液を加えた。該得られた混合物を、酢酸エチル (30 mL x 3)で抽出した。該組合せた抽出物を、水、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。10%、及び20%酢酸エチル/ヘキサンを溶離液として連続的に用い、該物質をシリカゲルカラム上のクロマトグラフィーにより精製し、2.91 gの生成物、化合物H2を得た。1H NMR (400 MHz, CDCl3) δ: 9.16 (s, 1H)、7.43 (d, J=8.87 Hz, 2H)、6.83 (d, J=8.87 Hz, 2H)、4.00 (m, 2H)、3.30 (dd, J=10.5, 5.57 Hz, 1H)、1.72-2.57 (m, 8H)、1.39 (dd, J=7.0, 7.0 Hz, 3H)。MS (ESI+) 284 [M+Na]+、262 [M+H]+。
【0136】
2-アミノ-シクロヘキス-l-エンカルボン酸(4-エトキシ-フェニル)-アミド (化合物H3)。
化合物H2(1.52 g、5.81 mmol)、及び30 mLの28%アンモニア水溶液の混合物を、16時間還流した。その後、該混合物を常温まで冷却し、ジクロロメタン (40 mL x 3)で抽出した。該組合せた抽出物を、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。30%酢酸エチル/ヘキサンを溶離液として用い、該生成物をカラムクロマトグラフィーにより精製し、1.46 gの化合物H3を得た。1H NMR (400 MHz, CDCl3) δ: 7.35 (d, J=6.94 Hz, 2H)、6.93 (br s, 1H)、6.85 (d, J=6.94 Hz, 2H)、6.39 (br s, 1H)、4.0 (m, 2H)、2.21-2.34 (m, 4H)、1.66-1.74 (m, 4H)、1.39 (dd, J=7.0, 7.0 Hz, 3H)。
【0137】
(R)-{1-[2-(4-エトキシ-フェニルカルバモイル)-シクロヘキス-l-エニルカルバモイル]-エチル}カルバミン酸tert-ブチルエステル (化合物H4)。
30 mLの塩化メチレン中、2-アミノ-シクロヘキス-1-エンカルボン酸(4-エトキシ-フェニル)-アミド(1.46 g、5.60 mmol)とN-Boc-D-アラニン(1.06 g、5.60 mmol)、EDC (1.60 g、8.4 mmol)とHOBT (151 mg、1.12 mmol)と1.0 mLのN-メチルモルホリンの混合物を、常温で28時間撹拌させた。終了時に、該混合物を濃縮し、30 mLの重炭酸ナトリウム飽和水溶液を加えた。該得られた混合物を、酢酸エチル (30 mL x 3)で抽出した。該組合せた抽出物を、水、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。30%酢酸エチル/ヘキサンを溶離液として連続的に用い、該物質をシリカゲルカラム上のクロマトグラフィーにより精製し、1.53 gの生成物、化合物H4を得た。1H NMR (400 MHz, CDCl3) δ: 12.95 (s, 1H)、7.36 (d, J=8.86 Hz, 2H)、7.25 (br s, 1H), 8.87 (d, J=8.95 Hz, 2H)、5.23 (br s, 1H)、4.13 (br s, 1H)、4.02 (q, J=7.0 Hz, 2H)、3.01 (br s, 2H)、2.37 (br s, 2H)、1.70 (m, 4H)、1.43 (s, 9H)、1.41 (dd, J=7.0, 7.0 Hz, 3H)、1.40 (不明瞭のd, J=7.07 Hz, 3H)。MS (ESI+) 432 [M+H]+。
【0138】
(R)-{1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-キナゾリン-2-イル]-エチル}-カルバミン酸tert-ブチルエステル (化合物H5)。
2 mLのピリジン中、化合物H4 (100 mg、0.231 mmol)と亜リン酸トリフェニル (182 μL、0.695 mmol)の混合物を、24時間かけて、100℃まで加熱した。終了時に、該混合物を濃縮し、15 mLの重炭酸ナトリウム飽和水溶液を加えた。該得られた混合物を、酢酸エチル (30 x 3)で抽出した。該組合せた抽出物を、水、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。該生成物を、逆相HPLC により精製し、52 mgの生成物、化合物H5を得た。1H NMR(400 MHz, CDCl3) δ: 7.19 (D, J=7.85 HZ, 1H)、7.10 (dd, J=8.63, 2.58 Hz, 1H)、 6.97-7.04 m, 2H)、5.55 (br s, 1H)、4.47 (br s, 1H)、4.07 (m, 2H)、2.63 (dd, J=6.21, 5.81 Hz, 2H)、2.50 (dd, J=6.17, 6.01 Hz, 2H)、1.73-1.82 (m, 4H)、1.44 (不明瞭のdd, J=7.0, 7.0 Hz, 3H)、1.42 (s, 9H)、1.19 (d, J=6.66 Hz, 3H) ppm。(ESI+) 414 [M+H]+。
【0139】
(R)-2-(1-アミノ-エチル)-3-(4-エトキシ-フェニル)-5,6,7,8-テトラヒドロ-3H-キナゾリン-4-オン (化合物H6)。
1.0 mLのTFAを、0℃で、5 mLの塩化メチレン中化合物H5 (52 mg、0.225 mmol)の溶液にゆっくり加えた。該得られた混合物を、常温で、2 時間撹拌させた。終了時に、50 mLの重炭酸ナトリウム飽和水溶液を加え、さらに固体重炭酸ナトリウムを、該混合物が弱塩基性になるまで加えた。該得られた混合物を、塩化メチレン(35 mL x 3)で抽出した。該組合せた抽出物を、重炭酸ナトリウム飽和水溶液 (50 mL x 2)、及び水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。該残渣を乾燥させ、29 mgの生成物、化合物H6を得た。1H NMR (400 MHz, CDCl3) δ: 7.07-7.11 (m, 2H)、7.00 (dd, J=6.98, 2.02 Hz, 2H)、4.07 (q, J=6.98 Hz, 2H)、 3.66 (q, J=6.41 Hz, 1H)、2.64 (dd, J=6.21, 5.96 Hz, 2H)、2.51 (dd, J=6.21, 6.0 Hz, 2H)、1.74-1.85 (m, 6H)、1.45 (dd, J=6.97, 6.97 Hz, 3H)、1.21 (d, J=6.56 Hz, 3H)。MS (ESI+) 314 [M+H]+。
【0140】
(R)-3-(4-エトキシ-フェニル)-2-[1-(2-メタンスルホニル-エチルアミノ)-エチル]-5,6,7,8-テトラヒドロ-3H-キナゾリン-4-オン (化合物H7)。
2 mLのメタノール中、化合物H6(29 mg、0.092 mmol)とメチルビニルスルホン(11 μL、0.12 mmol)の混合物を、常温で3日間撹拌させた。該反応物をHPLCにより測定した。終了時に、該混合物を濃縮し、かつ乾燥させ、39 mgの生成物、化合物H7を得て、さらに精製せずに次の工程に用いた。1H NMR (400 MHz, CDCl3) δ: 6.99-7.08 (m, 4H)、4.08 (q, J=6.99Hz, 2H)、3.38 (q, J=6.57 Hz, lH)、3.03-3.07 (m, 2H)、2.95 (s, 3H)、2.62 (dd, J=6.16, 5.91 Hz, 2H)、2.50 (dd, J=6.16, 5.92 Hz, 2H)、1.75-1.84 (m, 4H)、1.45 (dd, J=6.96, 6.96 Hz, 3H)、1.16 (d, J=6.59 Hz, 3H)。MS (ESI+) 420 [M+H]+。
【0141】
(R)-N-{1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-キナゾリン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(2-メタンスルホニル-エチル)-アセトアミド (化合物7)。
3 mLの塩化メチレン中、化合物H7(39 mg、0.092 mmol)と4-フルオロ-3-トリフルオロメチルフェニル酢酸(41 mg、0.184 mmol)とEDC (53 g、0.276 mmol)とHOBT (14 mg、0.092 mmol)と38 μLのNMMとの混合物を、常温で3日間撹拌させた。終了時に、該混合物を濃縮し、15 mlの水を加えた。該得られた混合物を、酢酸エチル(30 mL x 3)で抽出した。該組合せた抽出物を、水、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。該物質をHPLCにより精製し、28 mgの生成物、化合物7を得た。1H NMR (400 MHz): cis/transアミド回転異性体の混合物の比は、約3:1 (CDCl3, T=25℃)δ最大 6.98-7.48 (m, 7H)、4.87 (q, J=6.84 Hz, 1H)、 4.02-4.08 (m, 2H)、3.88 (m, 1H)、3.67 (m, 1H)、3.30 (m, 2H)、2.92 (s, 3H)、2.88 (m, 1H)、2.68-2.74 (m, 2H)、2.40-2.53 (m. 3H)。1.76-1.84 (m, 4H)、1.43 (不明瞭のt, J=6.82 Hz, 3H)、1.42 (不明瞭のd, J=6.64 Hz, 3H)、及びδ最小 5.07 (q, J=7.2 Hz, 1H)、2.96 (s, 3H)、1.36 (d, J=7.2 Hz, 3H)。MS (ESI+) 624 [M+H]+。
【0142】
(7.8 実施例8)
【化34】

【0143】
化合物8を、スキームIに示すとおり、公知の化合物I1から8工程で合成した。
【0144】
4,4-ジメチル-2-(オキソ-シクロヘキサンカルボン酸(4-エトキシ-フェニル)アミド (化合物I2)。
32 mLのクロロホルム中、化合物I1と4-(5,5-ジメチル-シクロへキス-1-エニル)-モルホリン/4-(3,3 ジメチル-シクロへキス-l-エニル)-モルホリン(3:1)と(1.28 g、6.55 mmoL)と4-エトキシフェニルイソシアナート(1.20 g、7.20 mmoL)の混合物を、常温で20時間撹拌させた。終了時に、50 mLのジクロロメタンを加えた。該結果として得られた溶液を、水で2回、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。2.04 gの化合物I2を得て、精製せずに次の工程に用いた。MS (ESI+) 290 [M+H]+。
【0145】
2-アミノ-4,4-ジメチル-シクロヘキシ-1-エンカルボン酸(4-エトキシ-フェニル) アミド (化合物I3)。
20 mLのエタノール中化合物I2 (2.04 g、7.05 mmoL)の溶液を、連続5日間の2時間かけて、無水アンモニアで飽和させた。その後、該混合物を濃縮し、かつ乾燥させ、1.98 gの生成物、化合物I3を得た。1H NMR (400 MHz、CDCl3) δ: 7.35 (dd, J=5.2, 0.8 Hz, 2H)、6.94 (br s, 1H)、6.82 (d, J=5.2 Hz, 2H)、 6.37 (br s, 2H)、3.98 (m, 2H)、2.30 (dd, J=5.2, 4.8 Hz, 2H)、1.98 (s, 2H)、1.49 (dd, J=5.6, 5.2 Hz, 2H)、1.38 (dd, J=5.6, 5.6 Hz, 3H)、0.96 (s, 3H)、0.95 (s, 3H)。
【0146】
(R)-{1-[2-(4-エトキシ-フェニルカルバモイル)-5,5-ジメチル-シクロヘキス-1- エニルカルバモイル]-エチル}-カルバミン酸tert-ブチルエステル (化合物I4)。
39 mLのジクロロメタン中、化合物I3 (1.02 g、3.53 mmol)とN-Boc-D-アラニン (803 mg、42.4 mmol)とEDC (1.01 g、5.29 mmol)とHOBT (542 mg、3.53 mmol)と822 μLのNMMの混合物を、常温で28時間撹拌させた。終了時に、該混合物を濃縮し、30 mLの重炭酸ナトリウム飽和水溶液を加えた。該得られた混合物を、酢酸エチル(30 mL x 3)で抽出した。該組合せた抽出物を、水、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。該物質を、20%、及び30%酢酸エチル/ヘキサンを溶離液として連続的に用い、シリカゲルカラム上のクロマトグラフィーにより精製し、1.06 gの生成物、化合物I4を得た。1H NMR (400 MHz, CDCl3) δ: 13.0 (s, 1H)、7.36 (d, J=8.8 Hz, 2H)、7.33 (br s, 1H)、6.85 (d, J=8.92 Hz, 2H)、5.30 (br s, 1H)、4.11 (br s, 1H)、3.99 (q, J=6.96 Hz, 2H)、2.79 (s, 2H)、2.36 (br s, 2H)、1.46 (m, 2H)、1.41 (s, 9H)、1.39 (dd, J=7.0, 7.0 Hz, 3H)、0.97 (s, 3H)、0.96 (s, 3H)。MS (ESI+) 482 [M+Na]+。
【0147】
(R)-{1-[3-(4-エトキシ-フェニル)-7,7-ジメチル-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロキナゾリン-2-イル]-エチル}-カルバミン酸tert-ブチルエステル (化合物I5)。
11 mLのピリジン中、化合物I4(500 mg、1.09 mmol)と亜リン酸トリフェニル(857 μL、3.27 mmol)の混合物を、45時間かけて115℃まで加熱した。終了時に、該混合物を濃縮し、20 mLの重炭酸ナトリウム飽和水溶液を加えた。該得られた混合物を、酢酸エチル(30 x 3)で抽出した。該組合せた抽出物を、水、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。該生成物を、10%、20%、及び40%酢酸エチル/ヘキサンを溶離液として連続的に用い、カラムクロマトグラフィーにより精製し、387 mgの生成物、化合物I5を得た。1H NMR (400 MHz, CDCl3) δ: 6.97-7.21 (m, 4H)、5.29 (br s, 1H)、4.46 (br s, 1H)、4.06 (q, J=6.95 Hz, 2H)、2.53 (dd, J=6.5, 5.4 Hz, 2H)、 2.42 (s, 2H)、1.51 (dd, J=6.5, 6.5 Hz, 2H)、1.43 (不明瞭のdd, J=7.0, 7.0 Hz, 3H)、1.40 (s, 9H)、1.18 (d, J=6.7 Hz, 3H)、1.02 (s, 3H)、1.00 (s, 3H)。MS (ESI+) 442 [M+H]+。
【0148】
(R)-2-(1-アミノ-エチル)-3-(4-エトキシ-フェニル)-7,7-ジメチル-5,6,7,8-テトラヒドロ-3H-キナゾリン-4-オン (化合物I6)。
1.5 mLのTFAを、0℃で、7 mLのジクロロメタン中化合物I5(320 mg、0.724 mmol)の溶液にゆっくり加えた。該得られた混合物を、常温で2時間撹拌させた。終了時に、50 mLの重炭酸ナトリウム飽和水溶液を加え、さらに固体重炭酸ナトリウムを、該混合物が弱塩基性になるまで加えた。該得られた混合物を、塩化メチレン(35 mL x 3)で抽出した。該組合せた抽出物を、重炭酸ナトリウム飽和水溶液(50 mL x 2)、及び水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。該残渣を乾燥させ、268 mgの生成物、化合物H6を得て、それをさらなる精製をせずに用いた。MS (ESI+) 342 [M+H]+。
【0149】
(R)-3-(4-エトキシ-フェニル)-2-[1-(2-メタンスルホニル-エチルアミノ)-エチル]-7,7-ジメチル-5,6,7,8-テトラヒドロ-3H-キナゾリン-4-オン (化合物I7)。
2 mLのメタノール中、化合物I6(92 mg、0.269 mmol)とエチルビニルスルホン(42 mg、0.350 mmol)の混合物を、常温で3日間撹拌させた。該反応物をHPLCにより測定した。終了時に、該混合物を濃縮し、かつ乾燥し、145 mgの生成物、化合物I7を得て、それを精製せずに次の工程に用いた。1H NMR (400 MHz, CDCl3) δ: 6.99-7.09 (m, 4H)、4.08 (q, J=6.99 Hz, 2H)、3.39 (q, J=6.6 Hz, 1H)、3.07 (m, 2H)、2.54 (dd, J=6.60, 6.41 Hz, 2H)、2.42 (s, 2H)、1.53 (dd, J=6.54, 6.51 Hz, 2H)、1.45 (dd, J=7.0, 7.0 Hz, 3H)、1.37 (t, J=6.72 Hz, 3H)、1.17 (d, J=6.61 Hz, 3H)、1.03 (s, 3H)、1.02 (s, 3H)。 MS (ESI+) 462 [M+H]+。
【0150】
(R)-N-(2-エタンスルホニル-エチル)-N-{1-[3-(4-エトキシ-フェニル)-7,7-ジメチル-4-オキソ-3,4,5,6,7,8-ヘキサヒドロ-キナゾリン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物8)。
化合物8を、化合物7に関して先に記載された同じ合成手順に従い、合成した。化合物8の1H NMR: cis/transアミド回転異性体の混合物の比は、約3:1 (400 MHz, CDCl3; T=25℃) δ最大 6.97-7.48 (m, 7H)、4.84 (q, J=6.81 Hz, 1H)、4.01-4.07 (m, 2H)、3.82 (m, 1H)、3.65 (m, 1H)、3.25 (m, 1H)、2.97 (q, J=7.83 Hz, 2H)、2.87 (ABd, JAB=16.3 Hz, 1H)、2.74 (m, 1H)、2.43-2.59 (m, 4H)、2.39 (ABd, JAB=16.3 Hz, 1H)、1.49-1.56 (m, 2H)、1.41 (不明瞭のdd, J=7.04, 7.04 Hz, 3H)、1.40 (不明瞭のd, J=4.75 Hz, 3H)、1.36 (dd, J=7.45, 7.45 Hz, 3H)、1.05 (s, 3H)、1.02 (s, 3H)、及びδ最小 5.17 (m, 1H)、1.30 (d, J=7.16 Hz, 3H)、0.99 (s, 3H)、0.97 (s, 3H)。MS (ESI+) 666 [M+H]+。
【0151】
(7.9 実施例9)
【化35】

化合物9を、例として、先のスキームに示すとおり、化合物5から合成できる。
【0152】
(7.10 実施例10)
【化36】

化合物10を、例として、先のスキームに示すとおり、化合物5から合成できる。
【0153】
【表2】

【0154】
(7.11 実施例11〜16)
【化37】

中間体化合物J2、及びJ3を、スキームJに示すとおり、先に記載された化合物A1から、各々2、及び3工程で合成した。
【0155】
(R)-2-{1-[(テトラヒドロ-チオピラン-4-イルメチル)-アミノ]-エチル}-3-[4-(2,2,2-トリフルオロ-エトキシ)-フェニル]-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物J1)。
先に記載された化合物A1(159 mg、0.44 mmol)、テトラヒドロチオピラニル-4-カルボキサルデヒド(70 μL、0.53 mmol)、及びトリアセトキシ水素化ホウ素ナトリウム(277 mg、1.32 mmol)を、1,2-ジクロロエタン中で、常温で1時間撹拌した。該反応混合物をジクロロメタンで希釈し、その後、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。該有機層を、無水硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮し、208 mgの化合物J1を得て、精製せずに先に進んだ。
【0156】
(R)-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(1-{4-オキソ-3-[4-(2,2,2-トリフルオロ-エトキシ)-フェニル]-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル}-エチル)-N-(テトラヒドロ-チオピラン-4-イルメチル)-アセトアミド (化合物J2)。
化合物4-フルオロ-3-トリフルオロメチルフェニル酢酸 (164 mg、0.74 mmol)をジクロロメタン中に溶解し、0℃まで冷却した。塩化オキサリル(64 μL、0.74 mmol)を加え、その後5分後に、N,N-ジメチルホルムアミド(5.7 μL、0.07 mmol)を加えた。該反応物を0℃で30分間、及び常温で1時間撹拌した。該溶液を、-78℃で、ジクロロメタン中、化合物J1(208 mg、0.43 mmol)とトリエチルアミン(182 μL、1.30 mmol)の混合物にゆっくり加えた。該混合物を30分間撹拌し、その後、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。該有機抽出物を、無水硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮した。該結果として得られた生成物を、クロマトグラフィー(ジクロロメタン中0.1%水酸化アンモニウム含有2%メタノール溶液)により精製し、265 mgの化合物J2を得た。
【0157】
(R)-N-(l,l-ジオキソ-ヘキサヒドロ-lλ6-チオピラン-4-イルメチル)-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(1-{4-オキソ-3-[4-(2,2,2-トリフルオロ-エトキシ)-フェニル]-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル}-エチル)-アセトアミド (化合物J3)。
化合物4(265 mg、0.39 mmol)をジクロロメタン中に溶解し、0℃まで冷却した。この溶液に、3-クロロペルオキシ安息香酸(77%、174 mg、0.78 mmol)を加え、該混合物を、一晩常温に平衡化した。該反応物を、10%チオ硫酸ナトリウム水溶液で2回、及び塩水で1回洗浄した。その後、該有機層を無水硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮した。該生成物を、クロマトグラフィー(ジクロロメタン中0.1%水酸化アンモニウム含有3%メタノール溶液)により精製し、136 mgの化合物5を回収した。MS (MH+): 688.2。1H NMR (500 MHz; CDCl3; T=298 K): δ 8.30 (t, 1H, J=7.9 Hz)、7.86 (m, 1H)、7.69-7.35 (m, 4H)、7.25 (m, 2H)、7.13 (m, 3H)、5.23-4.93 (dq, 1H, J=7.2, 143 Hz)、4.43 (五重線, 2H, J=8.0 Hz)、4.22-3.58 (m, 2H)、3.26 (m, 1H)、3.06-2.97 (m, 3H)、1.55 (d, 2H, J=6.7 Hz)、1.43 (dt, 3H, J=7.6, 2.0 Hz)、1.32 (t, 3H, J=7.5 Hz) ppm。
【0158】
【化38】

中間体化合物K1を、先に記載された化合物E1から2工程で合成した。
【0159】
(R)-N-(2-ベンゼンスルホニル-エチル)-N-{1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物K1)。
化合物K1を、A3の合成順序に従い、第一工程において、フェニルビニルスルホンをエチルビニルスルホンの代わりに用い、E1から2工程で合成した。1H NMR: cis/transアミド回転異性体の混合物の比は、約2.0:1 (400 MHz, CDCl3; T=25℃) δ最大 8.98 (dd, J=4.63, 1.94 Hz, 1H)、8.61 (d, J=7.97, 1.80 Hz, 1H)、7.98 (d, J=7.43 Hz, 1H)、7.01-7.75 (m, 12H)、5.14 (q, J=7.20 Hz, 1H)、4.07 (m, 2H)、2.86-3.90 (m, 6H)、1.45 (不明瞭のt, J=6.93 Hz, 3H)、 1.34 (d, J=7.23 Hz, 3H)、及びδ最小 9.09 (dd, J=4.3, 1.84 Hz, 1H)、8.64 (dd, J=7.88, 1.87 Hz, 1H)、1.54 (d, J=6.73 Hz, 3H)、1.44 (不明瞭のt, 1=6.74 Hz, 3H)。MS (ESI+) 683 [M+H]+。
【0160】
【化39】

中間体化合物L2、及びL3を、先に記載されたE1から、各々2、及び3工程で合成した。
【0161】
(R)-3-(4-エトキシ-フェニル)-2-{1-[(テトラヒドロ-チオピラン-4-イルメチル)-アミノ]エチル}-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物L1)。
9 mLの1,2-ジクロロエタン中、化合物E1(531 mg、1.71 mmol)とテトラヒドロ-チオピラン-4-カルバルデヒド(234 mg、1.79 mmol)の混合物に、常温で、1.09 g (5.13 mmol)のトリアセトキシ水素化ホウ素ナトリウムを加えた。該得られた混合物を、常温で3時間撹拌させた。終了時に、25 mLの重炭酸ナトリウム飽和水溶液を加え、該得られた混合物を、ジクロロメタン(30 mL x 3)で抽出した。該組合せた抽出物を、水、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ真空で濃縮した。該残渣を真空下で乾燥させ、550 mgの所望された生成物L1を得て、さらなる精製をせずに、L1を次の工程で用いた。MS (ESI+) 425 [M+H]+。
【0162】
(R)-N-{1-[3-(4-エトキシ-フェニル)-4-オキソ-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(テトラヒドロ-チオピラン-4-イルメチル)-アセトアミド (化合物L2)。
13 mLのジクロロメタン中、化合物 L1 (550 mg、1.29 mmol)と4-フルオロ-3-トリフルオロメチルフェニル酢酸 (374 mg、1.68 mmol)とEDC (371 mg、1.93 mmol)とHOBT (198 mg、1.29 mmol)と 300 μL(2.58 mmol)のNMMとの混合物を、常温で3日間撹拌させた。終了時に、該混合物を濃縮し、15 mLの水を加えた。該得られた混合物を、酢酸エチル (30 mL x 3)で抽出した。該組合せた抽出物を、水、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。該物質を、50%、及び80%の酢酸エチル/ヘキサンを溶離液として連続的に用い、シリカゲルカラム上のクロマトグラフィーにより精製し、531 mgの生成物、化合物L2を得た。cis/transアミド回転異性体の比が、約2:1の混合物の1H NMR (400 MHz, CDCl3; T=25℃) δ最大 8.96 (dd, J=4.58, 2.01 Hz, 1H)、 8.56 (dd, J=7.87, 2.02 Hz, 1H)、7.0-7.55 (m, 8H)、5.16 (q, J=7.21 Hz, 1H)、4.05 (q, J=6.92 Hz, 2H)、1.44 (不明瞭のd, J=7.19 Hz, 3H)、1.43 (不明瞭のt, J=6.96 Hz, 3H)、及びδ最小 9.06 (dd, J=4.56, 1.96 Hz, 1H)、 8.63 (dd, J=7.90, 1.96 Hz, 1H)、5.02 (q, J=6.81 Hz, 1H)、1.58 (d, J=6.74 Hz, 3H)。MS (ESI+) 629 [M+H]+。
【0163】
(R)-N-(l,l-ジオキソ-ヘキサヒドロ-lλ6-チオピラン-4-イルメチル)-N-{1-[3-(4-エトキシ-フェニル)-4-オキソ-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物L3)。
8 mLのジクロロメタン中化合物L2 (531 mg, 0.845 mmol)の溶液に、379 mg (1.69 mmol)の3-クロロペルオキシ安息香酸(77%)をゆっくりと加えた。該得られた混合物を、3時間常温で撹拌させた。終了時に、30 mLの飽和チオ硫酸ナトリウム水溶液を加え、該得られた混合物を、ジクロロメタン(40 mL x 3)で抽出した。該組合せた抽出物を、飽和チオ硫酸ナトリウム水溶液、及び水で洗浄し、無水硫酸マグネシウム上で乾燥させ、かつ真空で濃縮した。該生成物を、50%、及び100%酢酸エチル/ヘキサンを溶離液として連続的に用い、カラムクロマトグラフィーにより精製し、484 mgの化合物L3を得た。1H NMR: cis/transアミド回転異性体の混合物の比は、約4:1 (400 MHz, CDCl3; T=25℃)δ最大 3.60 (d, J=3.60 Hz, 1H)、8.85 (d, J=6.64 Hz, 1H)、7.04-7.68 (m, 8H)、5.13 (q, J=7.29 Hz, 1H)、4.10 (q, J=6.97 Hz, 2H)、3.90 (ABd, JAB=16.3 Hz, 1H)、3.59-3.75 (m, 3H)、2.85-3.17 (m, 4H)、1.80-2.35 (m, 5H)、1.46 (J=6.95 Hz, 3H)、1.43 (d, J=7.43 Hz, 3H)、及びδ最小 9.10 (m, 1H)、8.78 (m, 1H)、1.59 (d, J=6.74 Hz, 3H)。MS (ESI+) 661 [M+H]+。
【0164】
【化40】

【0165】
(R)-N-(2-エタンスルホニル-エチル)-N-{1-[3-(4-エトキシ-フェニル)-4-オキソ-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物M1)。
化合物M1を、化合物A3の合成順序に従い、化合物E1から2工程で合成した。化合物M1の1H NMR: cis/transアミド回転異性体の混合物の比は、約1.2:1 (400 MHz, CDCl3; T=25℃) δ最大 8.94 (dd, J=4.60, 2.00Hz, 1H)、8.58 (dd, J=7.87, 1.99 Hz, 1H)、7.02-7.55 (m, 8H)、5.21 (m, 1H)、3.82-4.19 (m, 5H)、 3.48 (m, 1H)、3.09-3.21 (m, 2H)、2.88-2.93 (m, 2H)、1.41-1.47 (m, 9H)、及びδ最小 9.05 (dd, J=4.60, 2.02 Hz, 1H)、8.63 (dd, J=7.89, 1.98 Hz, 1H)、5.05 (m, 1H)、3.66 (m, 1H)、2.43 (ABd, JAB=16.3 Hz, 1H)、1.58 (d, J=6.89 Hz, 3H)、1.22 (t, J=7.45 Hz, 3H)。MS (ESI+) 635 [M+H]+。
【0166】
化合物11〜16を、化合物4〜9を、常温水素下で例えばパラジウム担持炭素と接触させることなどにより、各々化合物J2、J3、K1、L2、L3、及びM1から合成する。終了時に、該混合物をろ過し、濃縮し、かつ乾燥させ、化合物11〜16を得た。
【0167】
(7.12 実施例17〜22)
【表3】

【0168】
(7.13 実施例23〜27)
【表4】

【0169】
図8、及び図9は、実施例23〜27に提供された置換5, 6, 7, 8-テトラヒドロ-7,7-ジメチルキナゾリン-4-(3H)-オンの合成の、一般的な合成スキームを示す。
【0170】
(7.14 実施例28〜37)
【表5】

【0171】
(7.15 実施例38〜47)
【表6】

【0172】
(7.16 実施例48〜54)
【表7】

【0173】
(7.17 実施例49〜53)
【表8】

【0174】
【化41】

【0175】
化合物49を、スキームNに示すとおり、化合物N1から合成できる。例として、ピリジン-3-カルバルデヒドを、-10℃で、ジクロロエタン中化合物N1溶液に加え、続いてトリアセトキシ水素化ホウ素ナトリウムである。該混合物を、1.5時間、その温度に保ち、ゆっくり常温まで暖め、かつ一晩撹拌する。該溶液を、ジクロロメタンで希釈し、重炭酸ナトリウム飽和水溶液、水、塩水により洗浄する。乾燥し、化合物N2を得ることができる。EDCを、DMF中で化合物N2と4-フルオロ-3-トリフルオロメチルフェニル酢酸とHOBtとNMMとの混合物に加える。該混合物を、常温で一晩撹拌し、酢酸エチルで希釈できる。該溶液を、重炭酸ナトリウム飽和水溶液、水、及び塩水で洗浄し、乾燥させ、濃縮した。化合物49を、該残渣からクロマトグラフィーにより精製できる。
【0176】
(7.18 実施例54〜58)
【表9】

【0177】
(7.19 実施例59〜63)
【表10】

【0178】
(7.20 実施例64〜66)
【表11】

【0179】
【化42】

【0180】
実施例64を、化合物49から、ジクロロエタン中化合物49の溶液にトリフルオロ酢酸を加え、その後、1.5時間かけて60℃に加熱することにより製造できる。該溶媒を蒸発させ、該残渣を酢酸エチルに溶解し、重炭酸ナトリウム飽和水溶液、水、塩水で洗浄し、乾燥させる。
【0181】
(7.21 実施例67〜69)
【表12】

【0182】
(7.22 実施例70〜77)
実施例70〜77を、先に記載された実施例の合成に従い、わずかな改良を加えて製造した。
【0183】
【表13】


【0184】
(7.23 CXCR3結合測定法、及び移動測定法)
CXCR3結合測定法:下記の実施例は、国際公開第WO 02/083143号の実施例12に記載のとおり、本発明の化合物を評価するのに用いることができるCXCR3結合測定法を示す。
【0185】
他に記載しない限り、該測定法用の全ての試薬は、業務用供給元(Sigma-Aldrich社、St. Louis、MO、米国など)から入手できる。試験化合物を、DMSO中で、目的とする最終測定濃度の40倍である濃度に希釈する;5 μLを、 (Greiner社などの)96ウェル平底ポリプロピレンプレートの各ウェルに移す。CXC3を発現している細胞 (国際公開第WO 02/083143号を参照)を、mL当たり5百万細胞に、測定緩衝液(4℃で保存された25 mM Hepes、80 mM NaCl、1 mM CaCl2、5 mM MgC12、0.2%ウシ血清アルブミン、pH 7.1)に懸濁する;100 μLのこの細胞懸濁液を、希釈された試験化合物を含有する96ウェルプレートの各ウェルに移す。(Amersham社、PE Life Sciences社などの業務用供給元から購入された)125Iで標識されたケモカインを、測定緩衝液中で、約60 pMの濃度に希釈する;100 μLのこのケモカイン溶液を、化合物、及び細胞懸濁液を含有する、96ウェルプレートの各ウェルに移す。該プレートを(E&K Scientific社などの)市販のホイルプレートシールで密封でき、2〜4時間、緩やかに振盪しながら4℃で保存した。インキュベート期間の終わりに、該測定プレートの内容物を、0.3%ポリエチレンイミン(Sigma社)含有溶液に浸け予めコーティングされているGF/Bフィルタープレート(Packard社)に、セルハーベスター(Packard社)を用いて移し、洗浄緩衝液(常温で保存された、25 mM Hepes、500 mM NaCl、1 mM CaCl2、5 mM MgCl2、pH 7.1)で2回洗浄できる。該フィルタープレートは、底部をプレートシール(Packard社)で密封し、50 μLの Microscint-20シンチレーション液(Packard社)を各ウェルに加え、該プレートの上部を透明プラスチック(TopSeal A、Packard社)で密閉する。該プレートを、Packard TopCountなどのシンチレーションカウンターで測定する。非特異的結合を測定するために、標識されていない"コールドの"ケモカインを含有する4つのウェルを、各96ウェルプレート上に含めることができる。最大結合を測定するために、5 μLの DMSO、100 μLの細胞懸濁液、及び100 μLの125Iで標識されたケモカイン溶液を含有する4つのウェルを、各96ウェルプレート上に含めることができる。データを市販のソフトウェア(Microsoft社のExcel、GraphPad Software社のPrismなど)を用いて分析できる。
CXCR3血漿移動測定法:下記の実施例は、本発明の化合物を評価するのに用いることができる、CXCR3血漿移動測定法を提供する。
【0186】
ヒト末梢血単核細胞(PBMC)を、(ハイブリドーマ細胞株OKT3(ATCC CRL-8001)由来のAB溶液により精製された)OKT3及びIL-2(Peprotech社、Rocky Hill、 NJ、米国)で活性化し、14日目に、活性化されたPBMCを、1 ng/mL CMFDA中で、組織培養インキュベーター内で、37℃で>1.5時間インキュベートし、細胞にクロロメチルフルオレセイン二酢酸(CMFDA)(Molecular Probes社) を取り込ませる。細胞が取り込んでいる間、該試験化合物を、DMSO中で、目的とする最終測定濃度の100倍である濃度に希釈できる。次に、ヒト血漿(EDTA、薬物フリー、Biological Specialty社)中100 ng/mLのヒトITAC (Peprotech社)を調製する。試験化合物を該ヒトITAC調製物に加える。細胞を、予め暖めた(37℃)0.5%BSA含有RPMI(Invitrogen社)培地中で、1回洗浄し、ヒト血漿中で5百万細胞/mlに再懸濁する。該試験化合物を該PBMCに加える。ウェル当たり30 μLのITAC/化合物混合物を下のチェンバーに加え、ITAC/化合物ウェルの上部に不透過性膜を置き、かつ50 μLのPBMC/化合物混合物を該ウェルに加えて、96ウェル走化性移動プレート(NeuroProbe社)を組立てた。該プレートを覆い、加湿された組織培養インキュベーター内で2.5時間インキュベートできる。該試験プレートの標準として用いるべきである、CMFDAを取り込んだ細胞の標準曲線を作成できる。移動プレートを分解し、475 nm 吸光度、517 nm 発光に設定し、蛍光プレートリーダーで読み取る。該標準曲線を用い、かつ移動している細胞の割合を計算して、該蛍光測定値を細胞数に変換できる。
【0187】
他の測定法を用い、CXCR3ケモカイン受容体活性を調節する化合物を同定でき、例として、結合測定法 (Wengらの論文 (1998) J. Biol. Chem. 273:18288-18291、Campbellらの論文 (1998) J. Cell Biol. 141:1053-1059、 Endresらの論文 (1999) J. Exp. Med. 189:1993-1998、及びNgらの論文(1999) J. Med. Chem. 42:4680-4694などを参照)、カルシウム流出測定法(Wangらの論文 (2000) Mol. Pharm 57:1190-1198、及びRabinらの論文 (1999) J. Immunol. 162:3840-3850を参照)、及び走化性測定法(Albanesiらの論文(2000) J. Immunol. 165:1395-1402、及びLoetscherらの論文 (1998) Eur. J. Immunol. 28:3696 3705などを参照)、及び当業者に知られている他の測定法がある。
【0188】
個々の印刷物又は特許出願が、具体的かつ個別に示されて、引用により組み込まれるように、この明細書に引用された全ての出版物、特許、及び特許出願は、引用により、本明細書中に取り込まれる。先の発明は、理解を明瞭にする目的で、例示及び実施例としていくらか詳細に記載されているものの、添付の請求項の精神又は範囲から離れることなく、本発明の内容に照らして、それらに特定の変更、及び改良を行うことができることは、当業者には容易に明らかである。
【図面の簡単な説明】
【0189】
【図1】図1は、本発明の化合物の製造用の一般的な合成スキームを示す。
【0190】
【図2】図2は、本発明の化合物の製造用の一般的な合成スキームを示す。
【0191】
【図3】図3は、本発明の化合物の製造用の一般的な合成スキームを示す。
【0192】
【図4】図4は、本発明の化合物の製造用の一般的な合成スキームを示す。
【0193】
【図5】図5は、本発明の化合物の製造用の一般的な合成スキームを示す。
【0194】
【図6】図6は、本発明の化合物の製造用の一般的な合成スキームを示す。
【0195】
【図7】図7は、本発明の化合物の製造用の一般的な合成スキームを示す。
【0196】
【図8】図8は、本発明の化合物の製造用の一般的な合成スキームを示す。
【0197】
【図9】図9は、本発明の化合物の製造用の一般的な合成スキームを示す。
【技術分野】
【0001】
(1. 関連出願の相互参照)
この出願は、2004年6月28日に出願された米国仮出願第60/583,823号の利益を主張し、その開示は、その全体が、引用により本明細書中に取り込まれるものとする。
【0002】
(2. 発明の分野)
本発明は、CXCR3受容体の新規調節物質、該新規化合物を含む組成物、及び例として、関節リウマチ、多発性硬化症、炎症性腸疾患、乾癬、及びアテローム性動脈硬化などの自己免疫病理だけでなく、例えば喘息及びアレルギー疾患などの炎症及び免疫調節の、障害及び疾患の治療における、それらの使用方法に関する。
【背景技術】
【0003】
(3. 発明の背景)
ケモカインは、マクロファージ、T細胞、好酸球、好塩基球、好中球を炎症部位に誘引するための、幅広い種類の細胞により放出される走化性サイトカインである (Schallの論文、Cytokine, 3:165-183 (1991); Schallらの論文、Curr. Opin. Immunol., 6:865-873 (1994); 及び Murphyの論文、Rev. Immun., 12:593-633 (1994))中で概説されている)。走化性を促進することに加えて、ケモカインは、細胞形状の変化、細胞内遊離カルシウムイオン([Ca2+])iの一時的上昇、顆粒エキソサイトーシス、インテグリンの上昇、白血球活性化に関連した生物活性脂質(ロイコトリエンなど)の形成、及び呼吸バーストなどの、他の変化を選択的に応答細胞において誘導できる。従って、該ケモカインは、該炎症応答の初期トリガーであり、炎症メディエータの放出、感染、又は炎症の部位へ走化性、及び血管外遊走を起こす。
【0004】
最初の2つのシステインが1つのアミノ酸により分離されている (C-X-C)か、隣接している(C-C)か、欠損しているシステイン対を有する(C)か、3個のアミノ酸により分離されている(CX3C)かに依存して、4種類のケモカイン、CXC(α)、CC(β)、C(γ)、及びCX3C(δ)がある。インターロイキン-8 (IL-8)、メラノーマ成長刺激活性タンパク質(MGSA)、及びストローマ細胞由来因子1(SDF-1)などのα-ケモカインは、主として、好中球、及びリンパ球に対する走化性活性を有する一方、RANTES、MIP-lα、MIP-1β、単球走化性タンパク質-1(MCP-1)、MCP-2、MCP-3、及びエオタキシンなどのβ-ケモカインは、マクロファージ、T細胞、好酸球、及び好塩基球に対する走化性活性を有する(Dengらの論文、Nature, 381:661-666 (1996))。該Cケモカインであるリンホカインは、リンパ球に特異性を示し(Kelnerらの論文、Science, 266:1395-1399 (1994))、該CX3Cケモカインであるフラクタルカインは、リンパ球、及び単球に特異性を示す(Bazanらの論文、Nature, 385:640-644 (1997))。
【0005】
ケモカインは、"ケモカイン受容体"と称される、Gタンパク質結合7回膜貫通領域タンパク質(Horukの論文、Trends Pharm. Sci., 15:159-165 (1994)中で概説されている)のファミリーに属する特定の細胞表面受容体と結合する。それらの同族のリガンドに結合すると、ケモカイン受容体は、関連したヘテロ三量体G タンパク質を介して細胞内シグナルを伝達し、細胞内カルシウム濃度の急激な上昇をもたらす。少なくとも12個の、β-ケモカインに結合する、又は応答するヒトケモカイン受容体があり、下記の特有の様式を有する: CCR1 (又は"CKR-1"、又は"CC-CKR-1") MIP-lα、MIP-1β、MCP-3、RANTES (Ben-Barruchらの論文、J. Biol. Chem., 270:22123-22128 (1995); Neoteらの論文、Cell, 72:415-425 (1993)); CCR2A、及びCCR2B (又は"CKR-2A"/"CKR-2A"、又は"CC-CKR-2A"/"CC-CKR2A") MCP-1、MCP-3、MCP-4; CCR3 (又は"CKR-3"、又は"CC-CKR-3") エオタキシン、RANTES、MCP (Ponathらの論文、J. Exp. Med., 183:2437-2448 (1996)); CCR4 (又は"CKR-4"、又は"CC-CKR-4") TARC、MDC (Imaiらの論文、J Biol. Chem., 273:1764-1768 (1998)); CCR5 (又は"CKR-5"、又は"CC-CKR-5") MIP-lα、 RANTES、MIP-1β (Sansonらの論文、Biochemistry, 35:3362-3367 (1996)); CCR6 MIP-3アルファ (Greavesらの論文、J. Exp. Med., 186:837-844 (1997)); CCR7 MIP-3ベータ、及び6Cカイン (Campbellらの論文、J Cell Biol., 141:1053-1059(1998)); CCR8 I-309、HHV8 vMIP-I、HHV-8 vMIP-II、MCV vMCC-I (Dairaghiらの論文、J. Biol. Chem., 274:21569-21574 (1999)); CCR9 TECK (Zaballosらの論文、J. Inmunol., 162:5671-5675 (1999))、D6 MIP-1ベータ、RANTES、及びMCP-3 (Nibbsらの論文、J. Biol. Chem., 272:32078-32083 (1997))、及びダフィー式血液型抗原RANTES、MCP-1 (Chaudhunらの論文、J. Biol. Chem., 269:7835-7838 (1994))がある。
【0006】
CCR1、CCR2、CCR2A、CCR2B、CCR3、CCR4、CCR5、CCR6、CCR7、CCR8、CCR9、CXCR1、CXCR2、CXCR3、CXCR4、CXCR5、CX3CR1、及びXCR1などのケモカイン受容体は、関節リウマチ、及びアテローム性動脈硬化などの自己免疫病理だけでなく、喘息、及びアレルギー疾患などの炎症及び免疫調節の、障害及び疾患の重要な仲介物質として関与している。
【0007】
該CXCR3ケモカイン受容体は、主としてT細胞中で発現され、その機能的な活性を、細胞質カルシウム上昇、又は走化性により測定することができる。該受容体は、以前にGPR9、又はCKR-L2と称された。その染色体上の位置は、ケモカイン受容体の中では異常で、Xq13に位置している。選択的、かつ高親和性があると同定されているリガンドは、CXC ケモカインであるIP10、MIG、及びITACである。
【0008】
CXCR3の高度に選択的な発現は、不適切なT細胞の輸送を中断する介入の理想的な標的になる。そのような介入の臨床的適応は、多発性硬化症、関節リウマチ、及びI型糖尿病などのT細胞介在自己免疫疾患においてである。不適切なT細胞浸潤は、真の自己免疫障害ではないが、乾癬、及び他の病理的な皮膚炎症状態でも起こる。この点において、ケラチノサイトにおけるIP-10 発現のアップレジュレーションは、皮膚の免疫病理に共通の特徴である。CXCR3の阻害は、臓器移植における拒絶を減少させるのに有益であり得る。特定の腫瘍、特にB細胞悪性腫瘍の一部におけるCXCR3の異所性発現は、CXCR3の選択的阻害剤が腫瘍の免疫治療、特に転移の減衰に価値があり得ることを示唆する。
【発明の開示】
【発明が解決しようとする課題】
【0009】
CXCR3の臨床的重要性を考慮すると、CXCR3機能を調節する化合物を新治療薬の開発に用いることができる。本明細書において、そのような化合物を提供する。
【課題を解決するための手段】
【0010】
(4. 本発明の要約)
本発明は、関節リウマチ、多発性硬化症などの自己免疫病理だけでなく、喘息、乾癬、炎症性腸疾患、及びアレルギー疾患などの特定の炎症及び免疫調節の、障害及び疾患の治療又は予防に有用な化合物を提供する。
【0011】
一態様において、本明細書中に提供された化合物は、下記一般式(I)を有する:
【化1】

(式中、Qは-C(O)-、-CH2CO-、-CH2SO-、及び-CH2S02-からなる群から選択された一要素であり;
Lは結合、又は(C1-C5)アルキレンであり;
Al、A2、及びA3は、独立に、C(R')(R")、及びC(O)からなる群から選択され;
A4がC(R')(R")、又はN(R''')であり;
各R'、及びR"は、独立に、水素原子、ハロゲン、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、フルオロ(C1-C4)アルキル(ここで、1個以上のフッ素原子が、1個以上の炭素原子上に置換することができる)、アリール、ヘテロアリール、アリール(C1-C8)アルキル、及びヘテロアリール(C1-C8)アルキルからなる群から選択され、任意に、隣接した炭素原子上のR'、及びR"基を組合せて、5員、又は6員縮合環を形成することができ、かつ同一の炭素原子に結合されたR' 、及びR"基を組合せて、3〜8員スピロ環を形成することができ;
R'''は、水素原子、(C1-C8)アルキル、及び(C2-C8)ヘテロアルキルからなる群から選択され;
R1はヘテロアリール、又はアリールであり;
R2は水素原子、ハロゲン、(C1-C10)アルキル、(C2-C10)ヘテロアルキル、ヘテロ(C1-C10)シクロアルキル、(C1-C10)アルキルアリール、及び(C2-C10)ヘテロアルキルアリールからなる群から選択され、任意に、R2をLと組合せて、N、O、及びSからなる群から選択された1〜3個のヘテロ原子を含む、5員環、6員環、7員環、又は8員環を形成することができ;
R3は非存在であるか、或いは-H、-CHR6R7、-S(0)mR5、-S(0)mN(R8)R9、-S(0)mN(R8)CH2R6、-N(R8)SO2R5、-N(R8)CH2R10、並びに下記式の基の群から選択された一要素であり:
【0012】
【化2】

、又は、任意に、R3をR2と組合せて、N、 O、及びSからなる群から選択された1〜3個のヘテロ原子を含む、4員環、5員環、6員環、7員環、又は8員環を形成することができ;
R5は、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、アリール、及びヘテロアリールからなる群から選択され;
R6、及びR7は、独立に、水素原子、(C1-C8)アルキル、又は(C2-C8)ヘテロアルキルであり;
R8は、水素原子、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、ヘテロアリール、又はアリールであり;
R9は(C1-C8)アルキルであり;
R10はアリールであり;
ZはCH、又はNであり;
Xは結合、(C1-C6)アルキレン、又は(C1-C6)ヘテロアルキレンであり;
Yは(C1-C6)アルキレンであり;
下付文字mは、0、1、又は2であり; かつ
R4は、(C1-C20)アルキル、(C2-C20)ヘテロアルキル、ヘテロアリール、アリール、ヘテロアリール(C1-C6)アルキル、ヘテロアリール(C2-C6)ヘテロアルキル、アリール(C1-C6)アルキル、及びアリール(C2-C6)ヘテロアルキルからなる群から選択された一要素である。特定の実施態様において、Al、A2、及びA3がCH2であり、Rlが4-(2,2,2-トリフルオロエトキシ)フェニルであり、R2がメチルであり、R3が3-ピコリルであり、かつQがC(O)であり、-Q-R4がまとめて下記式の基であり、
【0013】
【化3】

かつLが-CH2-であるとき、A4はNH以外である)。
【0014】
本発明の化合物は、その医薬として許容し得る塩、溶媒和物、又はそれらのプロドラッグを含む。
別の態様において、本発明は、式(I)の化合物、及び医薬として許容し得る賦形剤、又は担体を含む医薬組成物を提供する。
さらなる態様において、本発明は、炎症又は免疫の、状態又は障害の、治療又は予防が必要な対象に、治療上効果的な量の式(I)の化合物を投与することを含む、そのような状態又は障害の、治療又は予防の方法を提供する。本発明の方法に好ましい対象は、ヒトなどの哺乳類を含む。
【0015】
また、本発明は、ケモカイン受容体CXCR3により介在された状態、又は障害の治療又は予防が必要な対象に、治療上効果的な量の式(I)の化合物を投与することを含む、そのような状態又は障害の、治療又は予防の方法を提供する。
また、本発明は、細胞を式(I)の化合物と接触させることを含む、CXCR3の調節の方法を提供する。
さらに、本発明は、CXCR3タンパク質を式(I)の化合物と接触させることを含む、CXCR3の調節の方法を提供する。
その上、本発明は、式(I)の化合物の製造方法を提供する。
【発明を実施するための最良の形態】
【0016】
(6. 本発明の詳細な説明)
(6.1 定義)
"アルキル"という用語は、単独で、又は別の置換基の一部として、他に明記しない限り、直鎖又は分岐鎖、又は環状炭化水素基、又はそれの組合せを意味する。それは、完全に飽和、単価、又は多価不飽和であり得て、かつ指定された炭素原子数(すなわち、C1-C10は、1〜10個の炭素原子を意味する)を有する、二価又は多価基を含むことができる。飽和炭化水素基の例は、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、t-ブチル、イソブチル、sec-ブチル、シクロヘキシル、(シクロヘキシル)メチル、シクロプロピルメチルなどの官能基、n-ペンチル、n-へキシル、n-へプチル、n-オクチルなどの同族体及び異性体を含む。不飽和アルキル基は、1個以上の二重結合、又は三重結合を有するものである。不飽和アルキル基の例は、ビニル、2-プロペニル、クロチル、2-イソペンテニル、2-(ブタジエニル)、2,4-ペンタジエニル、3-(1,4-ペンタジエニル)、エチニル、1-及び3-プロピニル、3-ブチニル、及び高級同族体及び異性体を含む。
【0017】
"アルキレン"という用語は、単独で、又は別の置換基の一部として、-CH2CH2CH2CH2-により例示されるとおり、アルカンに由来する二価基を意味し、さらに、"ヘテロアルキレン"として下記に記載された官能基を含む。通常、アルキル(又はアルキレン)基は1〜24個の炭素原子を有することができるが、本発明においては、10個以下の炭素原子を有するそのような基が好ましい。"低級アルキル"、又は"低級アルキレン"は、一般に8個以下の炭素原子を有する、より短鎖のアルキル基又はアルキレン基である。
【0018】
"アルコキシ"、"アルキルアミノ"、及び"アルキルチオ" (又はチオアルコキシ)という用語は従来の意味で用いられ、各々、分子の残りに、酸素原子、アミノ基、又は硫黄原子を介して結合されたアルキル基のことをいう。同様に、ジアルキルアミノという用語は、同一、又は相違し得る、2つの結合したアルキル基を有するアミノ基のことをいう。
【0019】
"ヘテロアルキル"という用語は、単独で、又は別の用語と組合せて、他に明記しない限り、明記された数の炭素原子、及びO、N、Si、及びSからなる群から選択された1〜3個のヘテロ原子を含む、安定した直鎖又は分岐鎖、又は環状炭化水素基、又はそれの組合せのことをいう。ここで、任意に、該窒素原子、及び硫黄原子を酸化でき、かつ任意に、該窒素へテロ原子を四級化することができる。該へテロ原子O、N、及びSは、該ヘテロアルキル基の任意の内側の部位に位置させることができる。該へテロ原子Siは、該アルキル基が該分子の残りに結合されている位置などの、該へテロアルキル基の任意の部位に位置させることができる。例を挙げると、-CH2-CH2-O-CH3、-CH2-CH2-NH-CH3、-CH2-CH2-N(CH3-)-CH3、-CH2-S-CH2-CH3、-CH2-CH2、-S(0)-CH3、-CH2-CH2-S(0)2-CH3、-CH=CH-O-CH3、-Si(CH3)3、-CH2-CH=N-OCH3、及び-CH=CH-N(CH3)-CH3などがある。例えば、-CH2-NH-OCH3、及び-CH2-O-Si(CH3)3のように、2個のヘテロ原子まで連続することができる。ヘテロアルキル基をさすのに(C2-C8)などの接頭語が用いられる場合、炭素原子の数(この例では、2〜8)は、ヘテロ原子を同様に含むものとする。例えば、C2ヘテロアルキル基は、-CH2OH (1個の炭素原子、及び炭素原子に置き換えられている1個のヘテロ原子)、及び-CH2SHなどを含むものとする。"ヘテロアルキレン"という用語は、単独で、又は別の置換基の一部として、-CH2-CH2-S-CH2CH2-、及び-CH2-S-CH2-CH2-NH-CH2-により例示されるとおり、ヘテロアルキルに由来する二価基を意味する。ヘテロアルキレン基に関しては、ヘテロ原子も鎖端のいずれか、又は両方を占めることができる(例として、アルキレンオキシ、アルキレンジオキシ、アルキレンアミノ、アルキレンジアミノ、及びそのようなもの)。さらに、アルキレン、及びヘテロアルキレン結合基に関しては、該結合基の方向を含意しない。
【0020】
"シクロアルキル"、及び"ヘテロシクロアルキル"という用語は、単独で、又は他の用語と組合せて、他に明記しない限り、各々、"アルキル"、及び"ヘテロアルキル"の環状種を示す。さらに、ヘテロシクロアルキルに関しては、ヘテロ原子が、複素環が該分子の残りに結合している部位を占めることができる。シクロアルキルの例には、シクロペンチル、シクロへキシル、1-シクロヘキセニル、3-シクロヘキセニル、シクロヘプチルなどがある。ヘテロシクロアルキルの例には、1-(1,2,5,6-テトラヒドロピリジル)、1-ピペリジニル、2-ピペリジニル、3-ピペリジニル、4-モルホリニル、3-モルホリニル、テトラヒドロフラン-2-イル、テトラヒドロフラン-3-イル、テトラヒドロチエン-2-イル、テトラヒドロチエン-3-イル、1-ピペラジニル、2-ピペラジニルなどがある。
【0021】
"ハロ"、又は"ハロゲン"という用語は、単独で、又は別の置換基の一部として、他に明記しない限り、フッ素、塩素、臭素、又はヨウ素原子のことを意味する。さらに、"ハロアルキル"などの用語は、モノハロアルキル、及びポリハロアルキルを含むものとする。例を挙げると、"ハロ(C1-C4)アルキル"という用語は、トリフルオロメチル、2,2,2-トリフルオロエチル、4-クロロブチル、3-ブロモプロピルなどを含むものとする。
【0022】
"アリール"という用語は、他に明記しなければ、多価不飽和の、一般的に芳香族炭化水素置換基のことを意味し、単環、又は共に縮合している、又は共有結合している(3環までの)多環であり得る。"ヘテロアリール" という用語は、N、 O、及びSから選択された0〜4個のヘテロ原子を含む、アリール基(又は環)をさし、任意に、該窒素原子、及び硫黄原子は酸化され、かつ任意に、該窒素へテロ原子は四級化されている。ヘテロアリール基を、ヘテロ原子を介して、該分子の残りに結合することができる。アリール、及びヘテロアリール基の限定されない例として、フェニル、1-ナフチル、2-ナフチル、4-ビフェニル、1-ピロリル、2-ピロリル、3-ピロリル、3-ピラゾリル、2-イミダゾリル、4-イミダゾリル、ピラジニル、2-オキサゾリル、4-オキサゾリル、2-フェニル-4-オキサゾリル、5-オキサゾリル、3-イソオキサゾリル、4-イソオキサゾリル、5-イソオキサゾリル、2-チアゾリル、4-チアゾリル、5-チアゾリル、2-フリル、3-フリル、2-チエニル、3-チエニル、2-ピリジル、3-ピリジル、4-ピリジル、2-ピリミジル、4-ピリミジル、5-ベンゾチアゾリル、プリニル、2-ベンズイミダゾリル、5-インドリル、1-イソキノリル、5-イソキノリル、2-キノキサリニル、5-キノキサリニル、3-キノリル、及び6-キノリルなどがある。先に記載されたアリール、及びヘテロアリール環系の各々の置換基は、下記に記載された許容し得る置換基の群から選択される。
【0023】
簡略のため、"アリール"という用語は、他の用語と組合せ用いられる場合(アリールオキシ、アリールチオキシ、アリールアルキルなど)、先に記載のとおりアリール環、及びヘテロアリール環の両方を含む。従って、"アリールアルキル" という用語は、アリール基が、アルキル基(例えば、ベンジル、フェネチル、ピリジルメチルなど)に結合している基を含むものとし、炭素原子(メチレン基など)が酸素原子などに置換されているアルキル基(例えばフェノキシメチル、2-ピリジルオキシメチル、3-(1-ナフチルオキシ)プロピルなど)などがある。
先の用語 (例えば"アルキル"、"ヘテロアルキル"、"アリール"、及び"ヘテロアリール")の各々は、示された基の置換型と非置換型の両方を含むものとする。各種類の基の好ましい置換基を下記に提供する。
【0024】
アルキル基及びヘテロアルキル基(アルキレン、アルケニル、ヘテロアルキレン、ヘテロアルケニル、アルキニル、シクロアルキル、ヘテロシクロアルキル、シクロアルケニル、及びヘテロシクロアルケニルとよくいわれる基など)の置換基は、mがそのような基の炭素原子の総数であるとき、0から(2m+1)までの数の、-OR'、=0、=NR'、=N-OR'、-NR'R”、-SR'、-ハロゲン、-SiR'R”R'''、-OC(0) R'、-C(0)R'、-CO2R'、-CONR'R”、-OC(0)NR'R”、-NR”C(0)R'、-NR'C(0)NR”R'''、-NR”C(0)2R'、-NH-C(NH2)=NH、-NR'C(NH2)=NH、-NH-C(NH2)=NR'、-S(0)R'、-S(0)2R'、-S(0)2NR'R”、-CN、及び-NO2から選択された様々な群であり得る。 R'、R”、及びR'''は、各々独立に、H、非置換(C1-C8)アルキル、及びヘテロアルキル、非置換アリール、1〜3個のハロゲンで置換されているアリール、アルコキシ、又はチオアルコキシ基、又はアリール-(C1-C4)アルキル基をさす。R'、及びR”が同一の窒素原子に結合している場合、それらを該窒素原子と組合せて、5員環、6員環、又は7員環を形成できる。例として、-NR'R”は、1-ピロリジニル、及び4-モルホリニルを含むものとする。先の置換基の考察から、同業者は、広い意味における"アルキル"という用語が、ハロアルキル(例えば-CF3、及び-CH2CF3)、及びアシル(例えば-C(0)CH3、-C(0)CF3、-C(0) CH2OCH3など)などの官能基を含むものとすることを理解するであろう。好ましくは、該アルキル基は0〜3個の置換基、さらに好ましくは、他に明記しなければ、0、 1、又は2個の置換基を有することができる。
【0025】
同様に、該アリール、及びヘテロアリール基の置換基は多様であり、0〜芳香環系の空いている結合手の総数までの数の、-ハロゲン、-OR'、-OC(0)R'、-NR'R”、-SR'、-R'、-CN、-NO2、-CO2R'、-CONR'R”、-C(0)R',-OC(0)NR'R”、-N R”C(0)R'、-NR”C(0)2R'、-NR'-C(0)NR”R'''、-NH-C(NH2)=NH、-NR'C(NH2)=NH、-NH-C(NH2)=NR'、-S(0)R'、-S(0)2R'、-S(0)2NR'R”、-N3、-CH(Ph)2、ペルフルオロ(C1-C4)アルコキシ、及びペルフルオロ(C1-C4)アルキルから選択され;かつR'、R”、及びR'''は、独立に、H、(C1-C8)アルキル、及びヘテロアルキル、非置換アリール及びヘテロアリール、(非置換アリール)-(C1-C4)アルキル、及び(非置換アリール)オキシ-(C1-C4)アルキルから選択される。
【0026】
任意に、アリール環又はヘテロアリール環の隣接した原子上の2個の置換基を、式-T-C(0)-(CH2)q_U-の置換基に置き換えることができる(式中、T、及びUは、独立に、-NH-、-O-、-CH2_、又は一重結合であり、かつqは、O〜2の整数である。)。代わりに、任意に、該アリール環、又はヘテロアリール環の隣接した原子上の2個の置換基を、式-A-(CH2)r_B-の置換基に置き換えることができる(式中、A、及びBは、独立に、-CH2_、-O-、-NH-、-S-、-S(O)-、-S(0)2_、-S(0)2NR'-、又は一重結合であり、かつrは、1〜3の整数である。)。任意に、そのように形成された新しい環の1個の一重結合を、二重結合に置き換えることができる。代わりに、任意に、該アリール環、又はヘテロアリール環の隣接した原子上の2個の置換基を、式-(CH2)s-X-(CH2)t-の置換基に置き換えることができる(式中、s、及びtは、独立に、O〜3の整数であり、かつXは、-O-、-NR'-、-S-、-S(O)-、-S(0)2-、又は-S(0)2NR'-である。)。-NR'-、及び-S(0)2NR'-における置換基R'は、水素原子、又は非置換(C1-C6)アルキルから選択される。
【0027】
本明細書で使われる"ヘテロ原子"という用語は、酸素(O)、窒素(N)、硫黄(S)、及びケイ素(Si)を含むものとする。
本明細書で使われる"Me"という略語は、メチル、又はその基(すなわち、-CH3)であるとし、"Et"という略語は、エチル、又はその基であるとし、かつ"Ph"という略語は、フェニル、又はその基であるとする。
【0028】
"医薬として許容し得る塩"という用語は、本明細書に記載された化合物上に見い出された特定の置換基によって、比較的無毒性の酸又は塩基で調製される、
該化合物の塩を含むものとする。本発明の化合物が比較的酸性の官能基を含む場合は、そのような化合物の中性型を、そのまま、又は適切な不活性溶媒中で、十分な量の所望される塩基と接触させることにより、塩基添加塩を得ることができる。医薬として許容し得る塩基添加塩の例には、ナトリウム塩、カリウム塩、カルシウム塩、アンモニウム塩、有機アミノ塩、又はマグネシウム塩、又は同様の塩などがある。本発明の化合物が比較的塩基性の官能基を含む場合は、そのような化合物の中性型を、そのまま、又は適切な不活性溶媒中で、十分な量の所望される酸と接触させることにより、酸添加塩を得ることができる。医薬として許容し得る酸添加塩の例には、塩酸、臭化水素酸、硝酸、炭酸、一水素炭酸、リン酸、一水素リン酸、二水素リン酸、硫酸、一水素硫酸、ヨウ化水素酸、又は亜リン酸などの無機酸由来のものと同様に、酢酸、プロピオン酸、イソ酪酸、マレイン酸、マロン酸、安息香酸、コハク酸、スベリン酸、フマル酸、マンデル酸、フタル酸、ベンゼンスルホン酸、p-トリルスルホン酸、クエン酸、酒石酸、メタンスルホン酸などの比較的無毒性の有機酸由来の塩などがある。また、アルギン酸などのアミノ酸の塩、及びグルクロン酸、又はガラクツノリ酸(galactunoric acid)などの有機酸塩を含む (Bergeらの論文、(1977) J. Pharm. Sci. 66:1-19などを参照されたい。)。本発明のある特定の化合物は、該化合物を塩基添加塩又は酸添加塩のいずれかに変換することを可能にする、塩基性及び酸性の両官能基を含む。
【0029】
該化合物の中性型を、該塩を塩基又は酸と接触させること、かつ従来の方法で該親化合物を単離させることにより、再生することができる。該化合物の原型は、極性溶媒における溶解度など特定の物理的性質において、各種の塩の形態とは異なるが、それ以外は、該塩は、本発明の目的に関して化合物の原型と同等である。
【0030】
塩の形態に加えて、本発明は、プロドラッグの形態である化合物を提供する。本明細書中に記載された活性化合物のプロドラッグは、不活性化合物であり、生理条件下で容易に化学変化を受け、本発明の活性化合物を提供する。さらに、プロドラッグを、生体外環境において、化学的、又は生化学的な方法により、本発明の活性化合物に変換することができる。例えば、経皮貼布貯留層中に適切な酵素又は化学試薬と置いた場合、プロドラッグを、ゆっくりと本発明の活性化合物に変換することができる。プロドラッグがよく有用であるのは、場合によっては、該活性化合物より投与しやすいためである。例えば、それらは経口投与により生物学的に利用できるが、該活性化合物はそうではない。また、プロドラッグは、該活性化合物より、医薬組成物中で改善された溶解度を有することができる。該プロドラッグの加水分解又は酸化的活性化に依存するものなどの、幅広い種類のプロドラッグ誘導体が、当技術分野において知られている。限定されないプロドラッグの例は、エステル(該"プロドラッグ")として投与されるが、その後その活性実体であるカルボン酸へ代謝的に加水分解される、本発明の化合物である。さらなる例には、本発明の活性化合物のぺプチジル誘導体などがある。
【0031】
本発明の特定の化合物は、水和物の形態を含む溶媒和形態だけでなく、非溶媒和形態で存在できる。一般に、該溶媒和形態は非溶媒和形態と同等であり、本発明の範囲内に含まれるものとする。本発明の特定の化合物は、複数の結晶性形態、又は非晶性形態で存在できる。一般に、全ての物理的形態は、本発明により意図された使用に関して同等であり、本発明の範囲内に含まれるものとする。
本発明の特定の化合物は、不斉炭素原子(光学中心)又は二重結合;ラセミ化合物、エナンチオマー、ジアステレオマー、幾何異性体を有し、個々の異性体は、全て、本発明の範囲内であるものとする。
【0032】
本明細書で使われ、かつ他に明記しなければ、"立体異性体"、又は"立体異性的に純粋な"という用語は、実質上、その化合物の他の異性体を含まない、化合物の1つの立体異性体のことを意味する。例として、1個のキラル中心を有する立体異性的に純粋な化合物は、実質上、該化合物の反対のエナンチオマーを含まない。2個のキラル中心を有する、立体異性的に純粋な化合物は、実質上、該化合物の他のジアステレオマーを含まない。典型的な立体異性的に純粋な化合物は、約80重量%を超える該化合物の1つの立体異性体、及び約20重量%未満の該化合物の他の立体異性体を含み、より好ましくは、約90重量%を超える該化合物の1つの立体異性体、及約10重量%未満の該化合物の他の立体異性体、さらにより好ましくは、約95重量%を超える該化合物の1つの立体異性体、及び約5重量%未満の該化合物の他の立体異性体、最も好ましくは、約97重量%を超える該化合物の1つの立体異性体、及び約3重量%未満の該化合物の他の立体異性体を含む。構造の立体化学、又は構造の一部が、例えば太線又は破線で示されていなければ、該構造、又は該構造の一部は、そのすべての立体異性体を含むものと解釈されることになると留意すべきである。
【0033】
本発明の様々な化合物は、1個以上のキラル中心を含み、エナンチオマーのラセミ混合物、ジアステレオマーの混合物、又は鏡像異性的又は光学的に純粋な化合物として存在することができる。本発明は、そのような化合物の立体異性的に純粋な形態の使用と同様に、それらの形態の混合物の使用を含む。例として、本発明の特定の化合物の等量、又は不等量のエナンチオマーを含む混合物を、本発明の方法、及び組成物において用いることができる。これらの異性体を、非対称的に合成、或いはキラルカラム又はキラル分割剤などの標準技術を用いて分離することができる。例えばJacques, J.らの著書、「エナンチオマー、ラセミ化合物、及び光学分割」(Wiley-Interscience, New York, 1981);Wilen, S. H.らの論文、Tetrahedron 33:2725 (1977);Eliel, E. L.らの著書、「炭素化合物の立体化学」(McGraw-Hill, NY, 1962);及びWilen, S. H.の著書「分割剤、及び光学分割の表」268ページ (E.L. Eliel編、Univ. of Notre Dame Press, Notre Dame, IN, 1972)を参照されたい。
【0034】
また、本発明の化合物は、そのような化合物を構成する1個以上の原子において、原子の同位体の不自然な割合を含むことができる。例として、該化合物を、例えばトリチウム(3H)、ヨウ素-125(125I)、又は炭素-14(14C)などの放射性同位体で放射標識することができる。放射性標識された化合物は、癌治療薬などの治療薬として、結合測定試薬などの研究試薬として、かつインビボ造影剤などの診断薬として有用である。本発明の化合物の全ての同位体変異体は、放射性の有無に関わらず、本発明の範囲内に含まれるものとする。
【0035】
本明細書で使われる"活性がある"という用語は、阻害など、CXCR3機能を調節するのに効果的であることを意味する。
【0036】
本明細書で使われる"治療する"、"治療すること"、又は"治療"という用語は、疾患、及び/又はその付随する症状を軽減する、又は無効にする方法のことをいう。本明細書で使われる"予防する"、"予防すること"、又は"予防"という用語は、対象が疾患に罹るのを妨げる方法のことをいう。
【0037】
(6.2 本発明の実施態様)
本発明は、ケモカイン受容体活性の調節、特にCXCR3の調節に有用である化合物、組成物、及び方法を対象にする。本発明の化合物は、例えば炎症及び免疫調節の障害の治療に有用であり、調剤された医薬品として、ヒトなどの対象に、直接投与することができる。また、本発明の化合物は、CXCR3アンタゴニストなどCXCR3機能を調節する化合物、及び生理条件下でCXCR3機能を調節する1個以上の化合物に変換される化合物を同定、及び/又は設計するのに有用である。
【0038】
本発明の化合物は、ヒトCXCR3タンパク質など、哺乳動物CXCR3タンパク質の少なくとも1個の機能、又は特徴を阻害するものである。そのような機能を阻害する化合物の能力を、結合測定法(リガンド結合、又はアゴニスト結合など)、シグナリング測定法(哺乳動物Gタンパク質の活性化、細胞質遊離カルシウム濃度の急速かつ一時的な増加の誘導など)、及び/又は細胞応答機能(走化性の刺激、エクソサイトーシス、又は白血球による炎症メディエータの放出の促進など)において示すことができる。典型的な測定法は、下記の実施例、及び米国特許出願公開第2002/0169159 Al号、及び第2003/0055054 Al号に記載されており、それらの内容は、その全体が、引用により各々本明細書中に取り込まれるものとする。
【0039】
(6.3 化合物)
本発明は、CXCR3のアンタゴニストとして有用であり、炎症又は免疫の、状態又は障害の、治療又は予防に特定の効用がある化合物を提供する。
一態様において、本発明は下記式(I)を有する化合物を提供する:
【化4】

【0040】
(式中、Al、A2、A3、A4、R1、R2、R3、R4、Q、及びLを下記に定義している)。先の式において提供された化合物は、他に明記示さない限り、その医薬として許容し得る塩、溶媒和物、又はそれらのプロドラッグを含む。
Qは、-C(O)-、-CH2CO-、-CH2SO-、及び-CH2SO2-からなる群から選択された一要素である。
【0041】
特定の実施態様において、Qは-C(O)-、又は-CH2-である。
いくつかの実施態様において、Qは-C(O)-である。
Lは結合、又は(C1-C5)アルキレンである。
いくつかの実施態様において、Lは-CH2-、又は-CH2CH2-である。
【0042】
Al、A2、及びA3は、独立に、C(R')(R”)、及びC(O)からなる群から選択される。
A4は、C(R')(R”)、又はN(R''')である。
いくつかの実施態様において、A4はN(R''')である。
他の実施態様において、A4は C(R')(R”)である。
特定の実施態様において、Al、A2、及びA3はC(R')(R”)である。
【0043】
各R'、及びR”は、独立に、水素原子、ハロゲン、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、フルオロ(C1-C4)アルキル、アリール、ヘテロアリール、アリール(C1-C8)アルキル、及びヘテロアリール(C1-C8)アルキルからなる群から選択され、任意に、隣接した炭素原子上のR'、及びR"基を組合せて、5員、又は6員縮合環を形成することができ、かつ同一の炭素原子に結合されたR' 、及びR"基を組合せて、3〜8員スピロ環を形成することができる。
【0044】
R'''は、水素原子、(C1-C8)アルキル、及び(C2-C8)ヘテロアルキルからなる群から選択される。
R1はヘテロアリール、又はアリールである。
いくつかの実施態様において、R1は非置換、又はメタ又はパラ置換フェニルであり、該置換基がハロゲン、シアノ、(C1-C8)アルキル、(C1-C8)ハロアルキル、オキシ(C1-C8)アルキル、又はオキシ(C1-C8)ハロアルキルである。
【0045】
特定の実施態様において、R1がパラシアノフェニルである。
R2は、水素原子、ハロゲン、(C1-C10)アルキル、(C2-C10)ヘテロアルキル、ヘテロ(C1-C10)シクロアルキル、(C1-C10)アルキルアリール、及び(C2-C10)ヘテロアルキルアリールからなる群から選択され、任意に、R2をLと組合せて、N、O、及びSからなる群から選択された1〜3個のヘテロ原子を含む、5員環、6員環、7員環、又は8員環を形成することができる。
【0046】
特定の実施態様において、R2は:
【化5】

の基の群から選択された一要素である。
【0047】
R3は非存在であるか、或いは-H、-CHR6R7、-S(0)mR5、-S(0)mN(R8)R9、-S(0)mN(R8)CH2R6、-N(R8)SO2R5、-N(R8)CH2R10、並びに下記式の基の群から選択された一要素である:
【化6】

。任意に、R3をR2と組合せて、N、 O、及びSからなる群から選択された1〜3個のヘテロ原子を含む、4員環、5員環、6員環、7員環、又は8員環を形成することができる。
【0048】
いくつかの実施態様において、R3は-H、-SO2CH3、-SO2CH2CH3、並びに下記式の基の群から選択された一要素である:
【化7】

。
【0049】
いくつかの実施態様において、L-R3はまとめて下記式の基である:
【化8】

。
【0050】
R5は、(C1-C8)アルキル、(C2-C8)へテロアルキル、アリール、及びヘテロアリールからなる群から選択される。
R6、及びR7は、独立に、水素原子、(C1-C8)アルキル、又は(C2-C8)ヘテロアルキルである。
R8は、水素原子、(C1-C8)アルキル、(C2-C8)へテロアルキル、ヘテロアリール、又はアリールである。
【0051】
R9は(C1-C8)アルキルである。
R10はアリールである。
ZはCH、又はNである。
Xは結合、(C1-C6)アルキレン、又は(C1-C6)ヘテロアルキレンである。
Yは(C1-C6)アルキレンである。
下付文字mは、0、1、又は2である。
R4は、(C1-C20)アルキル、(C2-C20)ヘテロアルキル、ヘテロアリール、アリール、ヘテロアリール(C1-C6)アルキル、ヘテロアリール(C2-C6)ヘテロアルキル、アリール(C1-C6)アルキル、及びアリール(C2-C6)ヘテロアルキルからなる群から選択された一要素である。
【0052】
いくつかの実施態様において、-Q-R4は下記式の基である:
【化9】

。
【0053】
式Iの特定の実施態様において、Al、A2、及びA3がCH2であり、Rlが4-(2,2,2-トリフルオロエトキシ)フェニルであり、R2がメチルであり、R3が3-ピコリルであり、かつQがC(O)であり、-Q-R4がまとめて下記式の基であり、かつLが-CH2-であるとき、A4はNH以外である:
【化10】

。
【0054】
特定の実施態様において、本発明は、下記式(II)を有する化合物を提供する:
【化11】

(式中、R1、R2、R3、R4、R'''、Q、及び Lは先のとおり定義され、かつ各Raは、独立に、ハロゲン、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、フルオロ(C1-C4)アルキル、アリール、ヘテロアリール、アリール(C1-C8)アルキル、及びヘテロアリール(C1-C8)アルキルからなる群から選択され、任意に、隣接した炭素原子上のRa基を組合せて、5員、又は6員縮合環を形成することができ、かつ同一炭素原子に結合したRa基を組合せて、3〜8員スピロ環を形成することができ;かつ下付文字kは、0、1、2、3、又は4である。)。
【0055】
いくつかの実施態様において、R'''が-CH3、-CH2CH3、又は-C(O)CH3である。
いくつかの実施態様において、kは0である。
特定の実施態様において、該化合物は下記式(III)を有する:
【化12】

(式中、R2、R3、R4、R'''、Q、及びLは、先のとおり定義され、かつR11は、水素原子、(C1-C8)アルキル、及び(C2-C8)ヘテロアルキルからなる群から選択される。)。
【0056】
式Iの実施態様群において、該化合物は下記式(IV)を有する:
【化13】

(式中、R1、R2、R3、R4、R'、R"、Q、及びLは、先のとおり定義される。)。
【0057】
いくつかの実施態様において、R'、及びR"は、共に水素原子、又は共にアルキルである。
いくつかの実施態様において、R'、及びR"は、共に水素原子、又は共にメチルである。
いくつかの実施態様において、R'、及びR"は、独立に、水素原子、又はメチルである。
式Iの実施態様群において、該化合物は下記式(V)を有する:
【化14】

(式中、R1、R2、R3、R4、Q、及び Lは先のとおり定義され、かつ各Raは、独立に、ハロゲン、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、フルオロ(C1-C4)アルキル、アリール、ヘテロアリール、アリール(C1-C8)アルキル、及びヘテロアリール(C1-C8)アルキルからなる群から選択されるか、或いは任意に、隣接した炭素原子上のRa基を組合せて、5員、又は6員縮合環を形成することができ、かつ同一炭素原子に結合したRa基を組合せて、3〜8員スピロ環を形成することができ、かつ下付文字kは、0、1、2、3、又は4である。)。
【0058】
いくつかの実施態様において、該化合物は下記式(VI)を有する:
【化15】

(式中、R2、R3、R4、Ra、下付文字p、Q、及び Lは先のとおり定義され、かつR11は、水素原子、(C1-C8)アルキル、及び(C2-C8)ヘテロアルキルからなる群から選択される。)。
【0059】
本明細書中に提供された化合物が、立体異性体で存在することは、容易に理解される。特定の実施態様において、先の式の化合物は、ラセミ化合物である。他の実施態様において、式(I)、(II)、(III)、(IV)、(V)、又は(VI)の化合物は、(S)エナンチオマーと(R)エナンチオマーの混合物を含む。
【0060】
特定の実施態様において、化合物はエナンチオマーである。特定の実施態様において、本発明は、下記式(Ia)を有する化合物を提供する:
【化16】

(式中、A1、A2、A3、A4、R1、R2、R3、R4、Q、及び Lは、先に式Iで定義のとおりである。)。
【0061】
他の実施態様において、該化合物は下記式(Ib)を有する:
【化17】

(式中、A1、A2、A3、A4、R1、R2、R3、R4、Q、及び Lは、先に式Iで定義のとおりである。)。
特定の他の実施態様において、本発明は、化合物(Ia)、及び(Ib)のラセミ混合物を提供する。
【0062】
特定の実施態様において、本発明は、下記式(IIa)を有する化合物を提供する:
【化18】

(式中、R1、R2、R3、R4、R'''、Q、L、Ra、及び下付文字kは、先に式IIに定義のとおりである。)。
他の実施態様において、該化合物は下記式(IIb)を有する:
【化19】

(式中、R1、R2、R3、R4、R'''、Q、L、Ra、及び下付文字kは、先に式IIに定義のとおりである。)。
【0063】
特定の他の実施態様において、本発明は、化合物IIa、及びIIbのラセミ混合物を提供する。
特定の実施態様において、本発明は、下記式(IIIa)を有する化合物を提供する:
【化20】

(式中、R2、R3、R4、R'''、Q、L、及びR11は、先に式IIIに定義のとおりである。)。
【0064】
他の実施態様において、該化合物は下記式(IIIb)を有する:
【化21】

(式中、R2、R3、R4、R'''、Q、L、及びR11は、先に式IIIに定義のとおりである。)。
【0065】
特定の他の実施態様において、本発明は、化合物IIIa及びIIIbのラセミ混合物を提供する。
特定の実施態様において、本発明は、下記式(IVa)を有する化合物を提供する:
【化22】

(式中、R2、R3、R4、R'、R”、Q、及びLは、先に式IVに定義のとおりである。)。
【0066】
他の実施態様において、該化合物は下記式(IVb)を有する:
【化23】

(式中、R2、R3、R4、R'、R”、Q、及びLは、先に式IVに定義のとおりである。)。
特定の他の実施態様において、本発明は、化合物IVa、及びIVbのラセミ混合物を提供する。
【0067】
特定の実施態様において、本発明は、下記式(Va)を有する化合物を提供する:
【化24】

(式中、R1、R2、R3、R4、Ra、下付文字p、Q、及びLは、先に式Vに定義のとおりである。)。
【0068】
他の実施態様において、該化合物は下記式(Vb)を有する:
【化25】

(式中、R1、R2、R3、R4、Ra、下付文字p、Q、及びLは、先に式Vに定義のとおりである。)。
【0069】
特定の他の実施態様において、本発明は、化合物Va、及びVbのラセミ混合物を提供する。
特定の実施態様において、本発明の化合物は固体形態である。例として、いくつかの実施態様において、本発明の化合物は結晶性形態である。いくつかの実施態様において、該化合物は非晶性形態である。
特定の実施態様において、本発明の化合物は、少なくとも80%、少なくとも90%、少なくとも92%、少なくとも95%、少なくとも97%、又は少なくとも98%の純度を有する結晶性形態である。
【0070】
(6.4 該化合物の製造)
第7項の実施例、及び図1〜9は、本明細書中に提供された化合物への様々な合成経路を提供する。適切な出発材料の合成は、当業者に知られている、又は明らかな技術により製造できるか、或いは該出発材料は市販されていることがある。例として、そのような材料を、米国特許出願第2002/0160159 Al号、及び第 2003/0055054 Al号、及び国際公開第WO 02/83143号の方法に従って製造することができ、それらの内容は、その全体が、引用により各々本明細書中に取り込まれるものとする。当業者は、置換基をヘテロ環骨格の製造前、製造中、又は製造後に付加、或いは変更できること、及び条件(例として、温度、溶媒など)の調整ができることを認識するであろう。さらに、当業者は、特定の化合物の製造に保護基が必要であり得ることを認識するであろうし、かつ該選択された保護基に適合するそれらの条件を認識しているであろう。
本明細書中に記載された典型的な方法及び実施例は、本発明を例証し、その範囲を限定するものではないと解釈されるべきである。
【0071】
(6.5 組成物)
他の態様において、本発明は、ヒト及び動物におけるケモカイン受容体活性を調節する医薬組成物を提供する。該組成物は、本発明の化合物を、医薬として許容し得る担体、又は希釈剤と共に含む。
【0072】
本明細書で様々な形で使われる"調節"、すなわちケモカイン受容体活性の調節とは、特定のケモカイン受容体、好ましくはCXCR3受容体に関連する活性の、拮抗作用(antagonism)、受容体活性化作用(agonism)、部分的な拮抗作用、及び/又は部分的な受容体活性化作用を含むものとする。本明細書で使われる"組成物"という用語は、直接的に、又は間接的に、特定の量での特定の成分の組合せに由来する任意の製品だけでなく、特定の成分(かつ、表示されているならば、特定の量で)からなる製品を含むものとする。"医薬として許容し得る"とは、担体、希釈剤、又は賦形剤が、該製剤の他の成分と適合性があるはずであり、かつそれらの受け手に有害でないことを意味する。
【0073】
本発明の化合物の投与用の医薬組成物を、都合よく、単位剤形で提示でき、かつ薬学の分野でよく知られた方法のいずれかにより製造できる。全ての方法は、該活性成分を1個以上の補助成分で構成される担体と結合させる工程を含む。一般に、該活性成分を均一かつ密接に、液体担体、又は細かく分割された固体担体、又は両方に結合させること、及びその後、必要ならば、該製品を所望される剤形に成形することにより、医薬組成物を製造する。該医薬組成物には、疾患の過程、又は状態に所望される効果をもたらすのに十分な量の該化合物を含む。
【0074】
該活性成分を含む医薬組成物は、錠剤、トローチ剤、ドロップ剤(lozenges)、水性又は油性懸濁剤、分散性粉末又は分散性顆粒、乳剤、硬カプセル剤又は軟カプセル剤、シロップ剤、又はエリキシル剤などの、経口用に適した形態であり得る。経口用を目的とした組成物を、医薬組成物の製造の分野で知られた任意の方法に従って製造でき、かつそのような組成物は、甘味料、着香料、着色料、及び保存料からなる群から選択された1つ以上の薬剤を含み、医薬として上品で、口当たりがいい製剤を提供することができる。錠剤は、該活性成分を、錠剤の製造に適している無毒性の医薬として許容し得る賦形剤との混合剤中に含む。これらの賦形剤は、炭酸カルシウム、炭酸ナトリウム、乳糖、リン酸カルシウム、又はリン酸ナトリウムなどの不活性希釈剤;コーンスターチ、又はアルギン酸などの造粒剤及び崩壊剤;澱粉、ゼラチン、又はアカシアなどの結合剤;ステアリン酸マグネシウム、ステアリン酸、又は滑石などの滑沢剤などであり得る。該錠剤は、コーティングされていなくてもよいし、或いはそれらを公知の技術によりコーティングし、胃腸管における崩壊、及び吸収を遅らせることができ、それにより長期間にわたる持続性作用を提供する。例として、モノステアリン酸グリセリン、又はジステアリン酸グリセリンなどの時間遅延材料を使用することができる。また、それらを米国特許第4,256,108号、第4,166,452号、及び4,265,874号に記載された技術によりコーティングし、制御放出用の浸透圧性の治療錠剤を形成できる。
【0075】
また、経口用製剤を、該活性成分が炭酸カルシウム、リン酸カルシウム、又はカオリンなどの不活性固体希釈剤と混合している、硬ゼラチンカプセル剤として、又は該活性成分が水、あるいはピーナッツ油、液体パラフィン、又はオリーブ油などの油性媒体と混合している、軟ゼラチンカプセル剤として提示することができる。
【0076】
水溶性懸濁剤は、該活性成分を、水溶性懸濁剤の製造に適した賦形剤との混合剤中に含む。そのような賦形剤は、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシプロピルメチルセルロース、アルギン酸ナトリウム、ポリビニル-ピロリドン、トラガカントガム、及びアカシアガムなどの懸濁化剤などの懸濁剤であり;分散剤又は湿潤剤は、レシチンなどの天然リン脂質、ステアリン酸ポリオキシ-エチレンなどのアルキレン酸化物の脂肪酸との縮合生成物、又はヘプタデカエチレンオキシセタノールなどのエチレン酸化物の長鎖脂肪族アルコールとの縮合生成物、又はポリオキシエチレンソルビトールモノオレイン酸などの、エチレン酸化物の脂肪酸及びヘキシトール由来の部分エステルとの縮合生成物、又はポリエチレンソルビタンモノオレイン酸などの、エチレン酸化物の脂肪酸及びヘキシトール無水物由来の部分エステルとの縮合生成物などである。また、水性懸濁剤は、エチル、又はn-プロピル、p-ヒドロキシ安息香酸などの1つ以上の保存料、1つ以上の着色料、1つ以上の着香料、スクロース、又はサッカリンなどの1つ以上の甘味料を含むことができる。
【0077】
油性懸濁剤は、該活性成分を、ラッカセイ油、オリーブ油、ゴマ油、又はココナツ油などの植物油、又は液体パラフィンなどの鉱物油に懸濁することにより、製剤することができる。油性懸濁剤は、蜜ろう、固形パラフィン、又はセチルアルコールなどの増粘剤を含むことができる。上記のもののような甘味料、及び着香料を加え、口当たりのいい経口製剤を提供できる。これらの組成物を、アスコルビン酸などの抗酸化剤の添加により保存できる。
【0078】
水の添加による水性懸濁剤の製造に適した分散性粉末剤及び分散性顆粒剤は、該活性成分を、分散剤又は湿潤剤、懸濁化剤及び1つ以上の保存料との混合剤中に提供する。適切な分散剤又は湿潤剤、及び懸濁化剤は、既に先に記載されたものにより例示される。また、甘味料、着香料、及び着色料などのさらなる賦形剤が存在し得る。
【0079】
また、本発明の医薬組成物は、水中油型乳剤の形態であり得る。該油相は、オリーブ油、ラッカセイ油などの植物油、又は液体パラフィンなどの鉱物油、又はそれらの混合物であり得る。適切な乳化剤は、アカシアゴム、又はトラガカントガムなどの天然ゴム、大豆、レシチンなどの天然リン脂質、モノオレイン酸ソルビタンなどの、脂肪酸、及びヘキシトール無水物由来のエステル、又は部分的エステル、及びポリオキシエチレンモノオレイン酸ソルビタンなどの、該部分エステルのエチレンオキシドとの縮合生成物であり得る。また、該乳剤は、甘味料、及び着香料を含む。
【0080】
シロップ剤及びエリキシル剤を、グリセロール、プロピレングリコール、ソルビトール、又はスクロースなどの甘味料と製剤することができる。また、そのような製剤は、粘滑剤、保存料、及び着香料、及び着色料を含むことができる。
【0081】
該医薬組成物は、注入可能な、無菌水溶性懸濁剤又は無菌油性懸濁剤の形態であり得る。この懸濁液は、先に記載されている適切な分散剤又は湿潤剤、及び懸濁化剤を用いて、公知の技術に従って製剤することができる。また、無菌注射剤製剤は、1,3-ブタンジオールにおける溶液など、無毒性で非経口的に許容し得る希釈剤又は溶媒における、注入可能な無菌溶液又は懸濁剤であり得る。使用できる、許容し得る媒体及び溶媒の中には、水、リンガー溶液、及び等張塩化ナトリウム溶液がある。さらに、通常、溶媒、又は懸濁化剤として無菌固定油を使用する。この目的に関して、合成モノグリセリド又はジグリセリドなどの任意の無菌固定油を使用できる。さらに、オレイン酸などの脂肪酸は、注射剤の製造において使用される。
【0082】
また、本発明の化合物は、該薬剤の直腸投与のために、坐薬の形態で投与できる。これらの組成物は、該薬剤を、常温では固体であるが直腸温では液体であり、従って直腸腔で融解し、該活性化合物を放出する、適切な非刺激性賦形剤と混合することにより製造できる。そのような材料には、ココアバター、ポリエチレングリコールがあるが、それらに限定されない。
【0083】
局所使用には、本発明の化合物を含む、クリーム剤、軟膏、ゼリー剤、液剤、又は懸濁剤を使用する。また、本明細書中で使われる局所使用とは、洗口剤、及びうがい薬の使用を含むものとする。
さらに、本発明の医薬組成物、及び方法は、本明細書中に記したとおり、他の治療上効果的な化合物を含むことができ、通常、先に記載された病理状態の治療又は予防に適用される。
【0084】
(6.6 使用方法)
また別の態様において、本発明はCXCR3を介在した状態又は疾患を有する対象に、治療上効果的な量の本発明の化合物又は組成物を投与することにより、そのような状態、又は疾患を治療する方法を提供する。本明細書中で、該"対象"には、霊長類(ヒトなど)、ウシ、ヒツジ、ヤギ、ウマ、ブタ、イヌ、ネコ、ウサギ、ラット、マウスなどの哺乳動物などの動物が含まれると定義するが、それらに限定されない
【0085】
本明細書で使われる"CXCR3を介在した状態又は疾患"という句、及び関連した句、及び用語とは、通常より少ない、又は多いなどの、不適切なCXCR3活性を特徴とする状態のことをいう。不適切なCXCR3活性は、通常CXCR3を発現しない細胞におけるCXCR3発現、(炎症及び免疫調節の、障害及び疾患などをもたらす)CXCR3発現の増加、又は(特定の癌、及び血管由来かつ血管性関連の障害などをもたらす)CXCR3発現の減少の結果として起こり得る。また、不適切なCXCR3機能活性は、通常CXCケモカインを分泌しない細胞によるケモカイン分泌、(炎症及び免疫調節の、障害及び疾患などをもたらす)ケモカイン発現の増加、又はケモカイン発現の減少の結果として起こり得る。CXCR3を介在した状態又は疾患は、不適切なCXCR3機能活性により、完全に、又は部分的に介在され得る。しかしながら、CXCR3を介在した状態又は疾患は、CXCR3の調節がその根底となる状態又は疾患にいくらかの効果をもたらすもののうちの1つである(例えば、CXCR3アンタゴニストは、少なくとも一部の患者において、患者の健康にいくらかの改善をもたらす。)。
【0086】
"治療上効果的な量" という用語は、研究者、獣医、医師、又は他の臨床医により求められている、組織、系、動物、又はヒトの生物学的又は医学的応答を引き出すことができ、又は治療される疾患の1つ以上の症状の進行を予防するか、又は症状をある程度軽減するのに十分である、主題化合物の量を意味する。
【0087】
炎症、感染、及び癌に関連した疾患及び状態を、本化合物及び組成物で治療することができる。一群の実施態様において、ヒト、又は他の種の慢性疾患などの疾患又は状態を、CXCR3機能の阻害剤で治療できる。これらの疾患又は状態には、(1)全身性アナフィラキシー又は過敏性応答、薬物アレルギー、虫さされアレルギー、及び食物アレルギーなどの炎症、又はアレルギー疾患;クローン病、潰瘍性大腸炎、回腸炎、及び腸炎などの炎症性腸疾患;膣炎;皮膚炎、湿疹、アトピー性皮膚炎、アレルギー性接触皮膚炎、じんま疹などの乾癬及び炎症性皮膚病;血管炎;脊椎関節症;強皮症;アレルギー性鼻炎、過敏性肺疾患などの喘息及び呼吸器系アレルギー疾患などがある、(2)関節炎(リウマチ性、及び乾癬性)、多発性硬化症、全身性エリテマトーデス、1型糖尿病、糸球体腎炎などの自己免疫性疾患、(3)移植片拒絶(同種移植片拒絶、及び移植片対宿主病を含む)、及びそれらに関連した状態、及び(4)アテローム性動脈硬化、筋炎、神経変性疾患(アルツハイマー病など)、脳炎、髄膜炎、肝炎、腎炎、敗血症、サルコイドーシス、結膜炎、耳炎、慢性閉塞性肺疾患、洞炎、及びベーチェット症候群などの、好ましくない炎症性応答が阻害されるべきである他の疾患などがあるがある。別の群の実施態様において、疾患又は状態を、CXCR3機能のアゴニストで治療する。CXCR3アゴニストで治療されるべき疾患の例には、血管形成、又は血管新生が役割を果たす疾患(腫瘍性疾患、網膜症、黄斑変性症)、感染症、及び免疫抑制疾患などがある。
【0088】
好ましくは、本発明は、神経変性疾患(アルツハイマー病など)、多発性硬化症、全身性エリテマトーデス、関節リウマチ、アテローム性動脈硬化、脳炎、髄膜炎、肝炎、腎炎、敗血症、サルコイドーシス、乾癬、湿疹、じんま疹、1型糖尿病、喘息、結膜炎、耳炎、アレルギー性鼻炎、慢性閉塞性肺疾患、洞炎、皮膚炎、炎症性腸疾患、潰瘍性大腸炎、クローン病、ベーチェット症候群、痛風、癌、ウイルス感染(HIVなど)、細菌感染、及び臓器移植状態、又は皮膚移植状態から選択された疾患又は状態の、治療又は予防を対象にする。"臓器移植状態"という用語は、骨髄移植状態、及び固形臓器(腎臓、肝臓、肺、心臓、膵臓、又はその組合せなど)移植状態を含むものとする。
【0089】
本化合物、及び組成物で治療できる疾患又は状態には、先に記載のとおり、一般に(1)炎症性、又はアレルギー性疾患、(2)自己免疫疾患、(3)移植片拒絶、及び(4)好ましくない炎症性応答が阻害されるべきである他の疾患に付随した疾患などがある。 例として、バルーン血管形成などの処置後の再狭窄は、一般的にアテローム性動脈硬化を伴い、本化合物、及び組成物で治療できる。
【0090】
治療されるべき疾患、及び対象の状態に応じて、本発明の化合物を、経口、非経口(筋肉内、腹腔内、静脈内、ICV、嚢内注射又は注入、皮下注射、又はインプラントなど)、吸入スプレー、経鼻、膣、直腸、舌下、又は局所の投与経路により投与でき、各投与経路に適切な、従来の無毒性の医薬として許容し得る担体、アジュバント剤、及び媒体を含む、適切な用量単位製剤に、単独で、又は共に製剤することができる。
【0091】
ケモカイン受容体調節を必要とする状態の治療、及び予防において、一般に、適切な投与量レベルは、1日当たり、kg患者の体重当たり、約0.001〜100 mgであり得て、単回投与、又は複数回投与で投与できる。好ましくは、該投与量レベルは、1日当たり約0.01〜約25 mg/kg、さらに好ましくは、1日当たり約0.05〜約10 mg/kgであり得る。適切な投与量レベルは、1日当たり約0.01〜25 mg/kg、1日当たり約0.05〜10 mg/kg、又は1日当たり約0.1〜5 mg/kgであり得る。この範囲内で、該投与量は、1日当たり0.005〜0.05、0.05〜0.5、又は0.5〜5.0 mg/kgであり得る。経口投与に関して、好ましくは、該化合物を、1.0〜1000ミリグラムの活性成分を含有する錠剤の形態で提供し、特に、治療されるべき患者に対症的な投与量調整として、1.0、5.0、10.0、15.0、20.0、25.0、50.0、75.0、100.0、150.0、200.0、250.0、300.0、400.0、500.0、600.0、750.0、800.0、900.0、及び1000.0ミリグラムの活性成分である。該化合物を、1日当たり1〜4回の、好ましくは1日当たり1回、又は2回の投与計画で投与できる。
【0092】
しかし、当然のことながら、任意の特定な患者に関する具体的な服用レベル、及び投与頻度は、多様であり得て、様々な要因に依存し得る。例として、使用された具体的な化合物の活性、その化合物の代謝安定性及び作用の長さ、年齢、体重、一般的な健康、性別、食習慣、投与形態及び投与時間、排出速度、薬剤の組合せ、該特定の状態の程度、及び宿主が受けている治療などがある。
【0093】
本発明の化合物を、関連した効用を有する他の化合物と組合せて、関節リウマチ、及びアテローム性動脈硬化などの自己免疫病理、及び先に記載された病理だけでなく、喘息及びアレルギー疾患などの炎症及び免疫の、障害及び疾患を治療又は予防できる。多くの場合、本発明の化合物、及び代わりの、又は第二の治療薬を含む組成物は、投与したときに、相加効果、又は相乗効果を有する。
【0094】
例として、炎症の治療又は予防において、本化合物を、オピエートアゴニストなどの抗炎症剤又は鎮痛薬、5-リポキシゲナーゼの阻害剤などのリポキシゲナーゼ阻害剤、シクロオキシゲナーゼ-2阻害剤などのシクロオキシゲナーゼの阻害剤、インターロイキン-1阻害剤などのインターロイキン阻害剤、NMDAアンタゴニスト、一酸化窒素の阻害剤又は一酸化窒素の合成の阻害剤、非ステロイド性抗炎症薬、又はサイトカイン抑制抗炎症薬と併用して、又は組合せて用いることができる。例を挙げると、アセトアミノフェン、アスピリン、コデイン、ファンタニル、イブプロフェン、インドメタシン、ケトロラク、モルヒネ、ナプロキセン、フェナセチン、ピロキシカム、ステロイド性鎮痛剤、スフェンタニル、スンリンダク(sunlindac)、テニダプ(tenidap)、及びそのようなものと共に用いることができる。同様に、この即効性の化合物を、鎮痛剤;カフェイン、H2-アンタゴニスト、シメチコン、水酸化アルミニウム、又は水酸化マグネシウムなどの増強剤;フェニレフリン、フェニルプロパノールアミン、プソイドフェドリン、オキシメタゾリン、エピネフリン、ナファゾリン、キシロメタゾリン、プロピルヘキセドリン、又はレボ-デソキシエフェドリンなどの充血除去剤;コデイン、ヒドロコドン、カラミフェン、カルベタペンタン、又はデキストロメトルファンなどの鎮咳剤;利尿薬;鎮静性、又は非鎮静性抗ヒスタミン剤と共に投与することができる。同様に、本発明の化合物は、本発明の化合物が有用である疾患又は状態の治療/予防/抑制、又は改善に用いられる、他の薬剤と組合せることができる。そのような他の薬剤を、それらに一般的に用いられる経路、及び量で、本発明の化合物と同時に、又は連続的に投与できる。本発明の化合物が1つ以上の他の薬剤と同時に用いられる場合は、本発明の化合物に加えてそのような他の薬剤を含む、医薬組成物が好ましい。従って、本発明の医薬組成物には、本発明の化合物に加えて、1つ以上の他の活性成分も含むものなどがある。本発明の化合物と、個別に、又は同一医薬組成物中のいずれかで投与される、本発明の化合物と組合せることができる他の活性成分の例には、下記群などがあるが、それらに限定されない:(a)VLA-4アンタゴニスト;(b)べクロメタゾン、メチルプレドニゾロン、ベタメタゾン、プレドニゾン、デキサメタゾン、及びヒドロコルチゾンなどのステロイド;(c)シクロスポリン(シクロスポリンA 、Sandimmune(商標)、Neoral(商標))、タクロリムス(FK-506、Prograf(商標))、ラパマイシン(シロリムス、Rapamune(商標))、及び他のFK-506型免疫抑制剤、及びミコフェノール酸モフェチル(CellCept(商標))などのミコフェノール酸塩などの免疫抑制剤;(d)ブロモフェニラミン、クロルフェニラミン、デクスクロルフェニラミン、トリプロリジン、クレマスチン、ジフェンヒドラミン、ジフェニルピラリン、トリペレナミン、ヒドロキシジン、メトジラジン、プロメタジン、トリメプラジン、アザタジン、シプロヘプタジン、アンタゾリン、フェニラミン、ピリラミン、アステミゾール、テルフェナジン、ロラタジン、セチリジン、フェキソフェナジン、デスカルボエトキシロラタジンなどの抗ヒスタミン剤(H1-ヒスタミンアンタゴニスト);(e)β2アゴニスト(テルブタリン、メタプロテレノール、フェノテロール、イソエタリン、アルブテロール、ビトルテロール、及びピルブテロール)、テオフィリン、クロモリンナトリウム、アトロピン、臭化イプラトロピウム、ロイコトリエンアンタゴニスト(ザフィルルカスト、モンテルカスト、プランルカスト、イラルカスト、ポビルカスト、SKB-106,203)、ロイコトリエン生合成阻害剤(ジレウトン、BAY-1005)などの非ステロイド系抗喘息薬;(f)プロピオン酸誘導体(アルミノプロフェン、ベノキサプロフェン、ブクロクス酸、カルプロフェン、フェンブフェン、フェノプロフェン、フルプロフェン、フルルビプロフェン、イブプロフェン、インドプロフェン、ケトプロフェン、ミロプロフェン、ナプロキセン、オキサプロジン、ピルプロフェン、プラノプロフェン、スプロフェン、チアプロフェン酸、及びチオキサプロフェン)、酢酸誘導体(インドメタシン、アセメタシン、アルクロフェナク、クリダナク、ジクロフェナク、フェンクロフェナク、フェンクロズ酸、フェンチアザク、フロフェナク、イブフェナク、イソキセパク、オキソピナク(oxpinac)、スリンダク、チオピナク、トルメチン、ジドメタシン、及びゾメピラク)、フェナム酸誘導体(フルフェナム酸、メクロフェナム酸、メフェナム酸、ニフルム酸、及びトルフェナム酸)、ビフェニルカルボン酸誘導体(ジフルニサル、及びフルフェニサール)、オキシカム類(イソキシカム、ピロキシカム、スドキシカム、及びテノキシカム)、サリチル酸塩類(アセチルサリチル酸、スルファサラジン)、及びピラゾロン類(アパゾン、ベンズピペリロン、フェプラゾン、モフェブタゾン、オキシフェンブタゾン、フェニルブタゾン)などの非ステロイド性抗炎症薬(NSAID);(g)セレコキシブ(Celebrex(商標))、及びロフェコキシブ(Vioxx(商標))などのシクロオキシゲナーゼ-2(COX-2)阻害剤;(h)ホスフォジエステラーゼIV 型(PDE-IV)の阻害剤;(i)オーラノフィン、及びオーロチオグルコースなどの金化合物;(j)ホスフォジエステラーゼIV 型(PDE-IV)の阻害剤;(k)ケモカイン受容体、特にCCR1、CCR2、CCR3、CCR5、CCR6、CCR8、及びCCR10の、他のアンタゴニスト;(l)HMG-CoA還元酵素阻害剤(ロバスタチン、シンバスタチン、及びプラバスタチン、フルバスタチン、アトルバスタチン、及び他のスタチン類)、抑制剤(コレスチラミン、及びコレスチポル)、ニコチン酸、フェノフィブリン酸誘導体(ゲムフィブロジル、クロフィブラート、フェノフィブラート、及びベンザフィブラート)、及びプロブコールなどのコレステロール降下薬;(m)インスリン、スルホニル尿素類、ビグアミド類(メトホルミン)、α-グルコシダーゼ阻害剤類 (アカルボース)、及びグリタゾン類 (トログリタゾン、及ピオグリタン)などの抗糖尿病薬;(n)インターフェロンベータの製剤(インターフェロンβ-lα、インターフェロンβ-lβ);(o)エタネルセプト (Enbrel(商標));(p)オルソクローン(OKT3)、ダクリズマブ(Zenapax(商標))、インフリキシマブ (Remicade(商標))、バシリキシマブ(Simulect(商標))、及び抗CD40リガンド抗体(MRP-1など)などの抗体治療;及び (q)5-アミノサリチル酸及びそのプロドラッグ、ヒドロキシクロロキン、D-ペニシラミン、アザチオプレン、及び6-メルカプトプリンなどの代謝拮抗剤、及び 細胞毒性の癌化学療法薬などの他の化合物である。第二の活性成分に対する本発明の化合物の重量比は、多様であり得て、各成分の効果的な用量に依存し得る。一般に、各々の効果的な用量を用いることができる。従って、例として、本発明の化合物をNSAID と組合せる場合、該NSAID に対する本発明の化合物の重量比は、一般に、約1000:1〜約1:1000、好ましくは約200:1〜約1:200の範囲であり得る。本発明の化合物と他の活性成分の組合せも、一般に、先に記載の範囲内であり得るが、その都度、各活性成分の効果的な用量が用いられるべきである。
【0095】
本発明の範囲内の免疫抑制剤には、さらに、レフルノミド;RAD001;ERL080;FTY720;CTLA-4;オルソクローン(OKT3)、ダクリズマブ(Zenapax(商標))、及びバシリキシマブ(Simulect(商標))などの抗体治療;及びサイモグロブリンなどの抗胸腺細胞などがあるが、それらに限定されない。
【0096】
特に好ましい実施態様において、本方法は、本発明の化合物を単独で、又はベタセロン、アボネックス、アザチオプレン(Imurek(商標)、Imuran(商標))、カポキソン(capoxone)、プレドニゾロン、及びシクロホスファミドから選択された第二の治療薬と組合せて用いて、多発性硬化症の治療又は予防を対象にする。組合せて用いる場合、施術者が該治療薬の組合せを投与でき、又は投与を連続的にし得る。
【0097】
さらに他の特に好ましい実施態様において、本方法は、本発明の化合物を単独で、又はメトトレキサート、スルファサラジン、ヒドロキシクロロキン、シクロスポリンA、D-ペニシラミン、インフリキシマブ (Remicade(商標))、エタネルセプト (Enbrel(商標))、オーラノフィン、及びオーロチオグルコースからなる群から選択された第二の治療薬と組合せて投与する、関節リウマチの治療又は予防を対象にする。
【0098】
さらに他の特に好ましい実施態様において、本方法は、本発明の化合物を単独で、又はシクロスポリンA、FK-506、ラパマイシン、ミコフェノール酸塩、プレドニゾロン、アザチオプレン、シクロホスファミド、及び抗リンパ球グロブリンからなる群から選択された第二の治療薬と組合せて用いる、臓器移植状態の治療又は予防を対象にする。
【実施例】
【0099】
(7. 実施例)
下記に用いられた試薬、及び溶媒は、Aldrich Chemical社(Milwaukee、Wis.、米国)などの業務用供給元から入手できる。1H-NMRスペクトルをBruker 500 MHZ NMR分光計上に記録した。有意なピークを順に表にする:プロトンの数、多重度(s, 一重線; d, 二重線; t, 三重線; q, 四重線; m, 多重線; br s, 広域一重線)、及びヘルツ(Hz) における結合定数である。エレクトロスプレーイオン化(ESI)質量分析を、試料送達にHP1 100 HPLCを用いながら、Hewlett-Packard 1100 MSD エレクトロスプレー質量分析計上で行った。質量分析の結果を、質量電荷比として記録する。各化合物をメタノール中に0.1 mg/mLで溶解し、1マイクロリットルを送達溶媒と共に質量分析計に注入し、100〜1500ダルトンを読み取った。各化合物を、1%酢酸含有1:1アセトニトリル/水を該送達溶媒として用い、ポジティブESI モードで分析できる。また、各化合物を、アセトニトリル/水中2 mM NH4OAc溶液を該送達溶媒として用い、ネガティブESI モードで分析できる。
【0100】
【表1】

【0101】
(7.1 実施例1)
【化26】

【0102】
化合物A1を、国際公開第WO 02/83143号、スキーム9、91ページに概説のとおり、第3工程において、4-(2,2,2-トリフルオロエトキシ)アニリンをp-フェネチジンの代わりに用いて合成した。化合物A3を、スキームAに示すとおり、化合物A1から2工程で合成した。
【0103】
(R)-2-[1-(2-エタンスルホニル-エチルアミノ)-エチル]-3-[4-(2,2,2-トリフルオロエトキシ)-フェニル]-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物A2)。
10 mL メタノール中2.18g 化合物A1(5.98 mmol、1.00等量)と687μL エチルビニルスルホン(6.58 mmol、1.10等量) の混合物を、50℃の油浴中で一晩撹拌し、その後真空で濃縮した。該生成物A2 を、さらなる精製をせずに、次の工程に用いた。MS(ESI+) m/z=485.1 [M+H]+。
【0104】
(R)-N-(2-エタンスルホニル-エチル)-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(1-{4-オキソ-3-[4-(2,2,2-トリフルオロ-エトキシ)-フェニル]-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル}-エチル)-アセトアミド (化合物A3)。
該酸クロライドである(4-フルオロ-3-トリフルオロメチル-フェニル)アセチルクロライドを、15 mL ジクロロメタン中に溶解された2.06g (4-フルオロ-3-トリフルオロメチル-フェニル)酢酸(9.27 mmol、1.70等量)、及び0.81 mL 塩化オキサリル(9.27 mmol、1.70等量)の氷冷溶液に、数滴のDMFを加え、製造した。ガス発生が続き、該反応物を常温に平衡化し、ガス発生が終わるまで2時間撹拌した。この溶液を、アセトン-ドライアイス浴で冷却された、20 mLジクロロメタン中に溶解された2.6g A2 (5.37 mmol、1.00等量)及び2.24 mL トリエチルアミン(16.1 mmol、3.00等量)の溶液に、15分間にかけて滴下した。該結果として得られた混合液を、低温で20分間撹拌し、その後、重炭酸ナトリウム飽和水溶液中に注いだ。該有機層を塩水で洗浄し、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮し、ガラス状固形物を得た。該生成物を、ヘキサン中50%酢酸エチル溶液から100%酢酸エチルの勾配で溶出し、シリカゲル上のクロマトグラフィーにより精製した。その後、該クロマトグラフィーの産物をメチルtert-ブチルエーテルから再結晶し、化合物A3を無色結晶、融点=157〜159℃として得た。1H NMR (400 MHz; CDCl3; T=300 K) {S-cis:S-trans アミド回転異性体の混合物の比は、約2.3:1} δ 1.20 (t, J=7.6 Hz, 3H)、1.46 (t, J=7.2 Hz, 6.5H)、1.46 (d, J=7.2 Hz, 6.5H)、2.48 (d, J=16 Hz, 1H)、2.92 (ddd, J=2.8, 7.6, 16.0 Hz, 2H)、2.94 (d, J=16 Hz, 1H)、3.13 (ddd, J=3.6, 7.2, 14.8 Hz, 4.6H)、3.22 (dd, J=6.8, 6.8 Hz, 2H)、3.50 (ddd, J=5.2, 10.6, 13.3 Hz, 2.3H)、3.67 (ddd, J=8.0, 8.0, 13.3 Hz, 1H)、3.84 (s, 4.6H)、3.90 (ddd, J=4.8, 10, 14.8 Hz, 2.3H)、4.02 (ddd, J=8.0, 8.0, 13.3 Hz, 1H)、4.06-4.27 (m, 4.6H)、4.42 (qt, J=8 Hz, 6.6H)、5.01 (qt, J=6.8 Hz, 1H)、5.16 (qt. J=7.2 Hz, 2.3H)、7.09-7.19 (m, lOH)、7.21-7.28 (m, 5H)、7.33-7.50 (m, 8.9H)、7.53 (dd, J=4.6, 9.1 Hz, 1H)、7.63-7.68 (m, 2.3H)、8.58 (dd, J=2.0, 8.0 Hz, 2.3H)、8.61 (dd, J=2.0, 8.0 Hz, 1H)、8.96 (dd, J=2.0, 4.4 Hz, 2.3H)、9.06 (dd, J=2.0, 4.8 Hz, 1H) ppm。 MS(ESI+) m/z=688.9 [M+H]+。理論値: 52.33% C、3.95% H、19.31% F、8.14% N。測定値: 52.29% C、3.97% H、19.40% F、8.12% N。
【0105】
(R)-N-(2-エタンスルホニル-エチル)-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(1-{4-オキソ-3-[4-(2,2,2-トリフルオロ-エトキシ)-フェニル]-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル}-エチル)-アセトアミド (化合物1)。
2 mLメタノール中化合物A3(58 mg、0.084 mmol)と10%炭素担持パラジウム(18 mg、0.017 mmol)の混合物を、常温、水素バルーン下で20時間撹拌させた。終了時に、該混合物をセライトの短いカラムを介してろ過し、該ろ液を真空で濃縮し、かつ乾燥させ、61 mgの化合物1を得た。1H NMR: cis/trans アミド回転異性体の混合物の比は、約3:1 (400 MHz, CDCl3; T=25℃) δ最大 7.00-7.47 (m, 7H)、5.31 (br s, 1H)、4.71 (q, J=6.62 Hz, 1H)、4.36 (m, 2H)、 3.89-4.02 (m, 1H)、3.69-3.76 (m, 1H)、3.36-3.44 (m, 3H)、2.91-3.04 (m, 3H)、2.51-2.66 (m, 2H)、1.87-1.92 (m, 2H)、1.37-1.43 (m, 4H)、1.33 (d, J=6.7 Hz, 3H)、及びδ最小 5.15 (q, J=7.04 Hz, 1H)、4.77 (br s, 1H)、1.28 (d, J=7.08 Hz, 3H)。MS (ESI+) 693 [M+H]+。
【0106】
(7.2 実施例2)
【化27】

【0107】
(R)-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(2-メタンスルホニル-エチル)-N-(1-{4-オキソ-3-[4-(2,2,2-トリフルオロ-エトキシ)-フェニル]-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル}-エチル)-アセトアミド (化合物B2)。
化合物B2を、先に記載された A3の合成順序に従い、第一工程において、メチルビニルスルホンをエチビニルスルホンの代わりに用い、A1 から2工程で合成した。1H NMR: cis/transアミド回転異性体の混合物の比は、約2.0:1 (400 MHz; CDCl3; T=298 K) δ最大 8.98 (dd, J=4.46, 1.78 Hz, 1H)、8.62 (dd, 7.69, 1.78 Hz, 1H)、7.66 (dd, J=9.71, 3.33 Hz, 1H)、7.10-7.46 (m, 7 H)、 5.14 (q, J=7.26 Hz, 1H)、4.41 (q, J=7.94 Hz, 2H)、3.64-4.24 (m, 5H)、 3.10 (s, 3H)、2.47 (m, 1H)、1.46 (d, J=7.2 Hz, 3H)、及びδ最小 9.06 (m, 1H), 8.63 (不明瞭のdd, J=7.28, 1.63 Hz, 1H)、5.01 (q, J=6.64 Hz, 1H), 2.83 (s, 3H)、1.58 (d, J=6.71 Hz, 3H) ppm。MS (ESI+) 675 [M+H]+。
【0108】
(R)-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(2-メタンスルホニル-エチル)-N-(1-{4-(オキソ-3-[4-(2,2,2-トリフルオロ-エトキシ)-フェニル]-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル}-エチル)-アセトアミド (化合物2)。
化合物2 を、化合物1と同じ合成手順に従い、B2から合成した。1H NMR: cis/transアミド回転異性体の混合物の比は、約3:1 (400 MHz, CDCl3; T=25℃)δ最大 7.00-7.48 (m, 7H)、5.30 (br s, 1H)、4.73 (q, J=6.85 Hz, 1H)、4.38 (m, 2H)、3.90-3.95 (m, 1H)、3.73-3.76 (m, 1H)、3.36-3.44 (m, 3H)、2.91-3.03 (m, 5H)、2.53-2.64 (m, 3H)、1.86-1.93 (m, 2H)、1.34 (d, J=6.78 Hz, 3H)、及びδ最小 5.22 (m, 1H)、1.29 (d, J=7.16 Hz, 3H)。MS (ESI+) 679 [M+H]+。
【0109】
(7.3 実施例3)
【化28】

中間体C3を、スキームCに示すとおり、市販のC1から2段階で合成した。
【0110】
2,5-ジメチル-2H-ピラゾール-3-イル)-メタノール(化合物C2)。
水素化アルミニウムリチウム(テトラヒドロフラン中1.0 M、1.78 mL)溶液を、テトラヒドロフラン中市販のエチル1,3-ジメチル-lH-ピラゾール-5-カルボン酸塩 (化合物C1、300 mg、1.78 mmol) の溶液に、常温で、5分間かけて加えた。該反応物を一晩撹拌した。連続して、水(67 μL)、15%水酸化ナトリウム水溶液(202 μL)、水(67 μL)を加えた。該結果として得られた固形物をろ過し、真空で乾燥させ、その後クロマトグラフィー(ジクロロメタン中3%〜7%メタノール溶液)により精製し、175 mgの無色固形物、化合物C2を得た。
【0111】
5-ブロモメチル-1,3-ジメチル-lH-ピラゾール(化合物C3)。
ジクロロメタン中臭素(229 mg、1.44 mmol)溶液を、氷水浴で冷却してあるジクロロメタン中トリフェニルホスフィン(376 mg、1.44 mmol)の溶液に加えた。該反応物を10分間撹拌し、その後化合物C2 (170 mg、1.34 mmol)を一度に全て加え、該混合物を、2時間かけて、常温に平衡化した。該反応物を水で急冷し、その後、該水層をジクロロメタン(2 X 25 mL)で抽出した。該組合せた有機層を、10%チオ硫酸ナトリウム水溶液、その後、塩水で洗浄した。該有機層を硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮した。クロマトグラフィー(1:1 ヘキサン:酢酸エチル)により精製し、195 mgの無色固形物、化合物C3を得た。1H NMR (400 MHz; CDCl3; T=298 K): δ6.07 ppm (s, 1H)、4.44 (s, 2H)、3.83 (s, 3H)、2.23 (s, 3H) ppm。
【0112】
【化29】

【0113】
化合物D1は、先に国際公開第WO 02/83143号、スキーム9、91ページに記載されている。化合物3を、スキームDに示すとおり、化合物D1から5工程で合成した。
(R)-({1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-カルバミン酸tert-ブチルエステル (化合物D2)。
化合物D1 (370 mg、0.90 mmol)をメタノール中に溶解し、窒素で15分間脱気した。パラジウム(活性炭の10%重量、190 mg)を加え、その後、該系をバルーンで水素雰囲気下に置いた。該反応物を常温で一晩撹拌し、その後、Celiteを介してろ過し、かつ真空で濃縮した。クロマトグラフィー(ジクロロメタン中5%メタノール溶液)で精製し、387mgの無色固形物、化合物D2を得た。
【0114】
(R)-{1-[8-アセチル-3-(4-エトキシ-フェニル)-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-カルバミン酸tert-ブチルエステル (化合物D3)。
化合物D2 (263 mg、0.63 mmol)、及びN,N-ジイソプロピルエチルアミン(111 μL, 0.63 mmol)を無水酢酸(10 mL)に溶解し、80℃まで加熱した。該反応物を一晩撹拌した。それを重炭酸ナトリウム飽和水溶液で急冷し、その後、ジクロロメタンで抽出した。該有機層を、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄し、その後、硫酸マグネシウム上で乾燥させ、ろ過し、真空で濃縮した。クロマトグラフィー(1:1〜1:2のヘキサン:酢酸エチル)により精製し、168 mgの化合物D3を回収した。
【0115】
(R)-8-アセチル-2-(1-アミノ-エチル)-3-(4-エトキシ-フェニル)-5,6,7,8-テトラヒドロ-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物D4)。
化合物D3 (268 mg、0.59 mmol)を1:1 トリフルオロ酢酸:ジクロロメタン(10 mL)中に溶解した。該反応物を、常温で30分間撹拌した。該溶媒を真空で除去し、その後、10%水酸化アンモニウム水溶液を、水性pH=9 まで加えた。該水層をジクロロメタンで3回抽出し、その後、該組合せた有機層を、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。それを、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮し、170 mgの化合物D4を回収した。MS (MH+): 357.1。 1H NMR (400 MHz; CDCl3; T=298 K): δ7.13 (ddd, 2H, J=18.9, 1.4, 1.1 Hz)、7.02 (ddd, 2H, J=9.0, 1.2, 0.8 Hz)、4.09 (dq, 2H, J=6.9, 1.2 Hz)、 3.98-3.80 (ddq, 2H, J=62.6, 5.3, 1.0 Hz)、3.73 (dd, 1H, J=6.6, 1.2 Hz)、 2.60 (s, 3H)、1.92 (m, 2H)、1.82 (広域s, 2H)、1.45 (ddd, 3H, J=8.3, 6.1, 1.3 Hz)、1.28-1.21 (m, 5H) ppm。
【0116】
(R)-8-アセチル-2-{1-[(2,5-ジメチル-2H-ピラゾール-3-イルメチル)-アミノ]-エチル}-3-(4-エトキシ-フェニル)-5,6,7,8-テトラヒドロ-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物D5)。
化合物D4(70 mg、0.20 mmol)、化合物C3(37 mg、0.20 mmol)、及び炭酸カリウム (30 mg、0.22 mmol)を、ジメチルホルムアミド中で、常温で一晩で撹拌した。該反応混合物を、4:1 エーテル:ジクロロメタンと水の間で分配した。該有機層を、水、及び塩水で洗浄した。それを、硫酸マグネシウム上で乾燥させ、ろ過し、その後、真空で濃縮した。クロマトグラフィー(ジクロロメタン中0.1%水酸化アンモニウム含有2%〜5%メタノール溶液)により精製し、55 mgの化合物D5を得た。
【0117】
(R)-N-{1-[8-アセチル-3-(4-エトキシ-フェニル)-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-N-(2,5-ジメチル-2H-ピラゾール-3-イルメチル)-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物3)。
4-フルオロ-3-トリフルオロメチルフェニル酢酸 (45 mg、0.20 mmol)をジクロロメタン中に溶解し、0℃まで冷却した。塩化オキサリル(18 μL、0.20 mmol)を加えて、その後5分後に、ジメチルホルムアミド(1.6 μL、0.02 mmol)を加えた。 該反応物を0℃で30分間、及び常温で1時間撹拌した。該溶液を、-78℃で、ジクロロメタン中化合物D5(55 mg、0.12 mmol)とトリエチルアミン(50 μL、0.36 mmol)の混合物にゆっくり加えた。これを30分間撹拌し、その後、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。それを、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮した。逆相HPLCにより精製し、49 mgの無色固形物、化合物3を得た。MS (MH+): 669.1。1H NMR (500 MHz; CDCl3; T=298 K): δ7.47-7.02 (m, 7H)、5.74-5.42 (m, 1H)、5.30-5.04 (m, 1H)、4.63-4.31 (m, 2H)、4.09-3.86 (m, 3H)、3.75-3.59 (m, 3H)、2.81-2.60 (m, 1H)、2.60-2.43 (m, 5H)、2.18 (m, 3H)、1.93 (広域s, 2H)、1.46 (t, 3H, J=6.7 Hz)、1.30 (t, 3H, J=7.7 Hz) ppm。
【0118】
(7.4 実施例4)
【化30】

【0119】
化合物E1の合成は、国際公開第WO 02/83143号、スキーム9、91ページに記載されている。化合物4を、スキームEに示すとおり、化合物E1から5工程で合成した。
(R)-3-(4-エトキシ-フェニル)-2-[1-(3-(オキソ-ブチルアミノ)-エチル]-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物E2)。
先に記載された化合物E1(1.94 g、6.25 mmol)、及びメチルビニルケトン(520 μL、6.25 mmol)をメタノール中に溶解し、60℃で3時間撹拌した。該メタノールを真空で除去した。クロマトグラフィー (ジクロロメタン中3%〜8%メタノール溶液)により精製し、1.38 gの化合物E2を回収した。
【0120】
(R)-N-{1-[3-(4-エトキシ-フェニル)-4-オキソ-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(3-(オキソ-ブチル)-アセトアミド (化合物E3)。
4-フルオロ-3-トリフルオロメチルフェニル酢酸 (707 mg、3.18 mmol)をジクロロメタン中に溶解し、0℃まで冷却した。塩化オキサリル(278 μL、3.18 mmol)を加えて、その後5分後に、ジメチルホルムアミド(24.7 μL、0.32 mmol)を加えた。該反応物を0℃で30分間、及び常温で1時間撹拌した。該溶液を、-78℃で、ジクロロメタン中化合物E2 (713 mg、1.87 mmol)とトリエチルアミン(784 μL、5.62 mmol)の混合物にゆっくり加えた。該反応物を30分間撹拌し、その後、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。それを、硫酸マグネシウム上で乾燥させ、ろ過し、真空で濃縮した。カラム(ジクロロメタン中2%〜10%メタノール溶液)により精製し、859 mgの化合物E3を得た。
【0121】
(R)-N-(3-シクロブチルアミノ-ブチル)-N-{1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物E4)。
化合物E3 (67 mg、0.11 mmol)、シクロブチルアミン (14.7 μL、0.17 mmol)、及びトリアセトキシ水素化ホウ素ナトリウム(73 mg、0.34 mmol)を、ジクロロエタン中で、常温で3時間撹拌した。該反応混合物をジクロロメタンで希釈し、その後、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。それを、硫酸マグネシウム上で乾燥させ、ろ過し、真空で濃縮した。クロマトグラフィー(ジクロロメタン中0.1%水酸化アンモニウム含有4%〜10%メタノール溶液)により精製し、31 mgの化合物E4を回収した。
【0122】
(R)-N-[3-(シクロブチル-メチル-アミノ)-ブチル]-N-{1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物E5)。
化合物E4 (31 mg、0.048 mmol)、ホルムアルデヒド(37%水溶液、5.4 μL、0.073 mmol)、及びトリアセトキシ水素化ホウ素ナトリウム(31 mg、0.15 mmol)をジクロロエタン中で、常温で45分間撹拌した。該反応混合物をジクロロメタンで希釈し、その後、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。それを、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮した。33 mgの化合物E5を回収した。
【0123】
(R)-N-[3-(シクロブチル-メチル-アミノ)-ブチル]-N-{1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物4)。
化合物E5(33 mg、0.048 mmol)をメタノール中に溶解し、窒素で5分間脱気した。パラジウム(Cの10%重量、33 mg)を加え、その後、該反応物をバルーンで水素雰囲気下に置いた。それを常温で2時間撹拌し、その後、Celiteを介してろ過し、かつ真空で濃縮した。逆相HPLCにより精製し、16 mgの無色固形物、化合物4を得た。MS (MH+): 658.3。1H NMR (400 MHz; CDCl3, T=298 K): δ 7.40 (m, 1H)、7.14 (m, 4H)、6.89 (dd, 2H, J=8.7, 22.9 Hz)、5.21 (m, 1H)、4.81 (m, 1H)、4.02 (dd, 2H, J=15.9, 9.9 Hz)、3.57 (d, 1H, J=9.6 Hz)、3.39 (m, 2H)、3.21 (m, 2H)、3.03 (m, 1H)、2.76 (d, 1H, J=14.8 Hz)、2.56 (m, 2H)、 2.20 (dd, 1H, J=25.0, 15.8 Hz)、1.97 (d, 3H, J=11.2 Hz)、1.88 (s, 3H)、 1.74 (m, 3H)、1.64 (m, 3H)、1.40 (d, 4H, J=10.8 Hz)、1.30 (d, 6H, J=18.8 Hz) ppm。
【0124】
(7.5 実施例5)
【化31】

化合物5を、スキームFに示すとおり、先に記載された化合物E1から3工程で合成した。
【0125】
(R)-3-(4-エトキシ-フェニル)-2-[1-(1-イソプロピル-ピペリジン-4-イルアミノ)-エチル]-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物F1)
化合物E1(1.13 g、3.64 mmol)、1-イソプロピル-4-ピペリドン(812 μL、5.46 mmol)、及びトリアセトキシ水素化ホウ素ナトリウム(2.26 g、10.7 mmol)をジクロロエタン中で、常温で6時間撹拌した。該反応混合物をジクロロメタンで希釈し、その後、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。それを、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮した。1.58 gの化合物F1を回収した。MS(MH+): 436.5。1H NMR(500 MHz; CDCl3; T=298 K): δ 9.01 (dd, 1H, J=4.6, 1.9 Hz)、8.62 (dd, 1H, J=7.9, 2.0 Hz)、7.45 (dd, 1H, J=7.9, 4.6 Hz)、7.14 (d, 2H, J=9.9 Hz)、7.08 (dd, 2H, J=5.3, 2.8 Hz)、 4.13 (q, 2H, J=7.0 Hz)、3.64 (q, 1H, J=6.5 Hz)、2.82 (m, 2H)、2.75 (広域s, 1H)、2.36 (広域s, 1H)、2.18 (広域s, 3H)、1.71 (広域d, 2H), 1.49 (dt, 4H, J=7.0, 2.5 Hz)、1.32 (dd, 5H, J=19.0, 12.6 Hz)、1.05 (d, 6H, J=6.1 Hz) ppm。
【0126】
(R)-N-{1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(1-イソプロピル-ピペリジン-4-イル)アセトアミド (化合物F2)
4-フルオロ-3-トリフルオロメチルフェニル酢酸(1.35 g、6.09 mmol)をジクロロメタン中に溶解し、0℃まで冷却した。塩化オキサリル(531 μL、6.09 mmol)を加えて、その後5分後に、ジメチルホルムアミド(47.1 μL、0.61 mmol)を加えた。該反応物を0℃で30分間、その後、常温で1時間撹拌した。該溶液を、-78℃で、ジクロロメタン中化合物F1(1.56 g、3.58 mmol)とトリエチルアミン(1.50 mL, 10.7 mmol)の混合物にゆっくり加えた。それを30分間撹拌し、その後、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。該反応物を、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮した。カラム(ジクロロメタン中0.1%水酸化アンモニウム含有5%〜7%メタノール溶液)により精製し、1.27 gの化合物F2を得た。
【0127】
(R)-N-{1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(l-イソプロピル-ピペリジン-4-イル)-アセトアミド (化合物5)。
化合物F2(665 mg、1.09 mmol)をメタノール中に溶解し、窒素で5分間脱気した。パラジウム(Cの10%重量、665 mg)を加え、その後、該反応物をバルーンで水素雰囲気下に置いた。該反応物を常温で一晩撹拌し、その後、Celiteを介してろ過し、かつ真空で濃縮した。逆相HPLCにより精製し、280 mgの無色固形物、化合物5を得た。MS (MH+): 644.5。1H NMR (400 MHz; CDCl3; T=298 K): δ7.10 (m, 7H)、5.08 (広域s, 1H)、4.70 (dd, 1H, J=11.2, 5.0 Hz)、4.01 (五重線, 2H, 6.8 Hz)、3.67 (広域s, 1H)、3.42 (s, 3H)、3.14 (広域s, 3H)、2.67 (広域 m, 3H)、2.55 (t, 3H, J=6.2 Hz)、2.29 (広域s, 2H)、1.90 (dd, 3H, J=5.6, 2.5 Hz)、1.39 (t, 6H, J=6.9 Hz)、1.25 (d, 6H, 6.4 Hz) ppm。
【0128】
(7.6 実施例6)
【化32】

実施例6を、スキームGに示すとおり、化合物D2から4段階で合成した。
【0129】
(R)-{l-[3-(4-エトキシ-フェニル)-8-メチル-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-カルバミン酸tert-ブチルエステル (化合物G1)。
DMF中、124 mg 化合物D2(0.30 mmol、1.00等量)と489 mg 炭酸セシウム(1.50 mmol、5.00等量)と93 μLヨードメタン(1.50 mmol、5.00等量)の混合物を、栓付バイアル内で、90℃で24時間加熱した。該反応混合物を水に注ぎ、該水層を、3 x 20 mL 3:1 ジエチルエーテル:ジクロロメタンで抽出した。該組合せた有機抽出物を3 x 20 mL 水、その後、20 mL 塩水で洗浄し、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮し、ガラス状黄色固形物を得た。該生成物G1を逆相HPLCにより精製した。
【0130】
(R)-2-(1-アミノ-エチル)-3-(4-エトキシ-フェニル)-8-メチル-5,6,7,8-テトラヒドロ-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物G2)
氷浴により冷却された2 mL ジクロロメタンに溶解した110 mg 化合物G1 (0.26 mmol、1.00等量)の溶液に、4 mL トリフルオロ酢酸を一度に全て加えた。該反応物を、常温に平衡化した。40分後、該反応物を真空で濃縮し、該濃縮物を、各々25 mLのジクロロメタンと重炭酸ナトリウム飽和水溶液の間で分配した。該水性分離物を、25 mL ジクロロメタンで再び抽出した。組合せた有機抽出物を、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮し、化合物G4を淡黄色のガラス状固形物、83 mgとして得た。該生成物を、さらなる精製をせずに次の工程に用いた。
【0131】
(R)-2-{1-[(2,5-ジメチル-2H-ピラゾール-3-イルメチル)-アミノ]-エチル}-3-(4-エトキシ-フェニル)-8-メチル-5,6,7,8-テトラヒドロ-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物G3)。
DMF中、83 mg 化合物G2(0.25 mmol、1.00等量)と48 mg 5-ブロモメチル-1,3-ジメチル-lH-ピラゾール(化合物C3)(0.25 mmol、1.00等量)と38 mg 炭酸カリウム(0.28 mmol、1.10等量)の混合物を、常温で44時間撹拌し、その後、各々20 mLの水と3:1 ジエチルエーテル:ジクロロメタンの間で分配した。該分離された水層を、2 x 20 mL 3:1 ジエチルエーテル:ジクロロメタンで抽出した。該組合せた有機抽出物を、3 x 20 mL 水、及び20 mL 塩水で洗浄した。該有機分離物を硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮し、黄色ガラス状固形物を得た。該生成物を、ジクロロメタン中4%メタノール溶液で溶出し、シリカゲル上でカラムクロマトグラフィーにより精製した。精製された生成物G3をオフホワイト色の固形物、73 mgとして単離した。
【0132】
(R)-N-(2,5-ジメチル-2H-ピラゾール-3-イルメチル)-N-{1-[3-(4-エトキシ-フェニル)-8-メチル-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物6)。
酸クロライドである(4-フルオロ-3-トリフルオロメチル-フェニル)アセチルクロライドを、2 mL ジクロロメタン中に溶解された63 mg(4-フルオロ-3-トリフルオロメチル-フェニル)酢酸 (0.28 mmol、1.70等量)、及び24 μL塩化オキサリル(0.28 mmol、1.70等量)の氷冷溶液に、1滴のDMFを加え、製造した。ガス発生が続き、該反応物を常温に平衡化し、ガス発生が終わるまで2時間撹拌した。この溶液を、アセトン-ドライアイス浴で冷却された2 mLジクロロメタン中に溶解された、73 mg 化合物G3(0.17 mmol、1.00等量)、及び81 μL トリエチルアミン(0.59 mmol、3.50等量)の溶液に、5分間かけて滴下した。該結果として得られた混合液を、低温で20分間撹拌し、その後、重炭酸ナトリウム飽和水溶液中に注いだ。該有機層を塩水で洗浄し、硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮し、ガラス状固形物を得た。該生成物を、ジクロロメタン中4%メタノール溶液で溶出し、シリカゲル上のクロマトグラフィーにより精製した。精製された生成物、化合物6を、無色固形物として単離した。1H NMR (500 MHz; CDCl3; T=300 K) {S-cis:S-trans アミド回転異性体の混合物の比は、約1.3:1} δ 1.20-1.50 (m, 18.7H)、1.70-1.87 (m, 1.7H)、1.87-2.00 (m, 5.8H)、2.12-2.28 (m, 8.7H)、2.47-2.69 (m, 6.3H)、2.90 (d, J=16.5 Hz, 1H)、2.96 (s, 4H)、3.21 (s, 3H)、3.28-3.43 (m, 5H)、3.62 (dd, J=17.5, 17.5 Hz, 3.3H)、3.69-3.83 (m, 8.3H)、3.98-4.12 (m, 5.5H)、4.33 (d, J=15.9 Hz, 1H)、4.52-4.67 (m, 2.5H)、4.79 (d, J=18.6, 1.3H)、4.84-4.93 (m, 1H)、5.33-5.40 (m, 1.3H)、5.55 (s, 1H)、5.81 (s, 1.3H)、6.87-7.23 (m, 14.3H)、7.30-7.38 (m, 2.5H)、 7.44 (d, J=8.3 Hz, 1.7H) ppm。MS(ESI+) m/z=641.0 [M+H]+。
【0133】
(7.7 実施例7)
【化33】

【0134】
化合物7を、スキームHに示すとおり、公知の化合物である2-(オキソ-シクロヘキサンカルボン酸(4-エトキシ-フェニル)-アミド (化合物H1)から7工程で合成した。
【0135】
2-(オキソ-シクロヘキサンカルボン酸(4-エトキシ-フェニル)-アミド (化合物H2)。
51 mLのジクロロメタン中、化合物H1(2.93 g、20.6 mmol)とp-フェネチジン(2.92 mL、22.67 mmol)とEDC(5.91 g、30.9 mmol)とHOBT (1.58 g、10.3 mmol)、及び3.6 mLのNMMの混合物を、常温で2日間撹拌させた。終了時に、該混合物を濃縮し、30 mLの2N 塩酸水溶液を加えた。該得られた混合物を、酢酸エチル (30 mL x 3)で抽出した。該組合せた抽出物を、水、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。10%、及び20%酢酸エチル/ヘキサンを溶離液として連続的に用い、該物質をシリカゲルカラム上のクロマトグラフィーにより精製し、2.91 gの生成物、化合物H2を得た。1H NMR (400 MHz, CDCl3) δ: 9.16 (s, 1H)、7.43 (d, J=8.87 Hz, 2H)、6.83 (d, J=8.87 Hz, 2H)、4.00 (m, 2H)、3.30 (dd, J=10.5, 5.57 Hz, 1H)、1.72-2.57 (m, 8H)、1.39 (dd, J=7.0, 7.0 Hz, 3H)。MS (ESI+) 284 [M+Na]+、262 [M+H]+。
【0136】
2-アミノ-シクロヘキス-l-エンカルボン酸(4-エトキシ-フェニル)-アミド (化合物H3)。
化合物H2(1.52 g、5.81 mmol)、及び30 mLの28%アンモニア水溶液の混合物を、16時間還流した。その後、該混合物を常温まで冷却し、ジクロロメタン (40 mL x 3)で抽出した。該組合せた抽出物を、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。30%酢酸エチル/ヘキサンを溶離液として用い、該生成物をカラムクロマトグラフィーにより精製し、1.46 gの化合物H3を得た。1H NMR (400 MHz, CDCl3) δ: 7.35 (d, J=6.94 Hz, 2H)、6.93 (br s, 1H)、6.85 (d, J=6.94 Hz, 2H)、6.39 (br s, 1H)、4.0 (m, 2H)、2.21-2.34 (m, 4H)、1.66-1.74 (m, 4H)、1.39 (dd, J=7.0, 7.0 Hz, 3H)。
【0137】
(R)-{1-[2-(4-エトキシ-フェニルカルバモイル)-シクロヘキス-l-エニルカルバモイル]-エチル}カルバミン酸tert-ブチルエステル (化合物H4)。
30 mLの塩化メチレン中、2-アミノ-シクロヘキス-1-エンカルボン酸(4-エトキシ-フェニル)-アミド(1.46 g、5.60 mmol)とN-Boc-D-アラニン(1.06 g、5.60 mmol)、EDC (1.60 g、8.4 mmol)とHOBT (151 mg、1.12 mmol)と1.0 mLのN-メチルモルホリンの混合物を、常温で28時間撹拌させた。終了時に、該混合物を濃縮し、30 mLの重炭酸ナトリウム飽和水溶液を加えた。該得られた混合物を、酢酸エチル (30 mL x 3)で抽出した。該組合せた抽出物を、水、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。30%酢酸エチル/ヘキサンを溶離液として連続的に用い、該物質をシリカゲルカラム上のクロマトグラフィーにより精製し、1.53 gの生成物、化合物H4を得た。1H NMR (400 MHz, CDCl3) δ: 12.95 (s, 1H)、7.36 (d, J=8.86 Hz, 2H)、7.25 (br s, 1H), 8.87 (d, J=8.95 Hz, 2H)、5.23 (br s, 1H)、4.13 (br s, 1H)、4.02 (q, J=7.0 Hz, 2H)、3.01 (br s, 2H)、2.37 (br s, 2H)、1.70 (m, 4H)、1.43 (s, 9H)、1.41 (dd, J=7.0, 7.0 Hz, 3H)、1.40 (不明瞭のd, J=7.07 Hz, 3H)。MS (ESI+) 432 [M+H]+。
【0138】
(R)-{1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-キナゾリン-2-イル]-エチル}-カルバミン酸tert-ブチルエステル (化合物H5)。
2 mLのピリジン中、化合物H4 (100 mg、0.231 mmol)と亜リン酸トリフェニル (182 μL、0.695 mmol)の混合物を、24時間かけて、100℃まで加熱した。終了時に、該混合物を濃縮し、15 mLの重炭酸ナトリウム飽和水溶液を加えた。該得られた混合物を、酢酸エチル (30 x 3)で抽出した。該組合せた抽出物を、水、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。該生成物を、逆相HPLC により精製し、52 mgの生成物、化合物H5を得た。1H NMR(400 MHz, CDCl3) δ: 7.19 (D, J=7.85 HZ, 1H)、7.10 (dd, J=8.63, 2.58 Hz, 1H)、 6.97-7.04 m, 2H)、5.55 (br s, 1H)、4.47 (br s, 1H)、4.07 (m, 2H)、2.63 (dd, J=6.21, 5.81 Hz, 2H)、2.50 (dd, J=6.17, 6.01 Hz, 2H)、1.73-1.82 (m, 4H)、1.44 (不明瞭のdd, J=7.0, 7.0 Hz, 3H)、1.42 (s, 9H)、1.19 (d, J=6.66 Hz, 3H) ppm。(ESI+) 414 [M+H]+。
【0139】
(R)-2-(1-アミノ-エチル)-3-(4-エトキシ-フェニル)-5,6,7,8-テトラヒドロ-3H-キナゾリン-4-オン (化合物H6)。
1.0 mLのTFAを、0℃で、5 mLの塩化メチレン中化合物H5 (52 mg、0.225 mmol)の溶液にゆっくり加えた。該得られた混合物を、常温で、2 時間撹拌させた。終了時に、50 mLの重炭酸ナトリウム飽和水溶液を加え、さらに固体重炭酸ナトリウムを、該混合物が弱塩基性になるまで加えた。該得られた混合物を、塩化メチレン(35 mL x 3)で抽出した。該組合せた抽出物を、重炭酸ナトリウム飽和水溶液 (50 mL x 2)、及び水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。該残渣を乾燥させ、29 mgの生成物、化合物H6を得た。1H NMR (400 MHz, CDCl3) δ: 7.07-7.11 (m, 2H)、7.00 (dd, J=6.98, 2.02 Hz, 2H)、4.07 (q, J=6.98 Hz, 2H)、 3.66 (q, J=6.41 Hz, 1H)、2.64 (dd, J=6.21, 5.96 Hz, 2H)、2.51 (dd, J=6.21, 6.0 Hz, 2H)、1.74-1.85 (m, 6H)、1.45 (dd, J=6.97, 6.97 Hz, 3H)、1.21 (d, J=6.56 Hz, 3H)。MS (ESI+) 314 [M+H]+。
【0140】
(R)-3-(4-エトキシ-フェニル)-2-[1-(2-メタンスルホニル-エチルアミノ)-エチル]-5,6,7,8-テトラヒドロ-3H-キナゾリン-4-オン (化合物H7)。
2 mLのメタノール中、化合物H6(29 mg、0.092 mmol)とメチルビニルスルホン(11 μL、0.12 mmol)の混合物を、常温で3日間撹拌させた。該反応物をHPLCにより測定した。終了時に、該混合物を濃縮し、かつ乾燥させ、39 mgの生成物、化合物H7を得て、さらに精製せずに次の工程に用いた。1H NMR (400 MHz, CDCl3) δ: 6.99-7.08 (m, 4H)、4.08 (q, J=6.99Hz, 2H)、3.38 (q, J=6.57 Hz, lH)、3.03-3.07 (m, 2H)、2.95 (s, 3H)、2.62 (dd, J=6.16, 5.91 Hz, 2H)、2.50 (dd, J=6.16, 5.92 Hz, 2H)、1.75-1.84 (m, 4H)、1.45 (dd, J=6.96, 6.96 Hz, 3H)、1.16 (d, J=6.59 Hz, 3H)。MS (ESI+) 420 [M+H]+。
【0141】
(R)-N-{1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロ-キナゾリン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(2-メタンスルホニル-エチル)-アセトアミド (化合物7)。
3 mLの塩化メチレン中、化合物H7(39 mg、0.092 mmol)と4-フルオロ-3-トリフルオロメチルフェニル酢酸(41 mg、0.184 mmol)とEDC (53 g、0.276 mmol)とHOBT (14 mg、0.092 mmol)と38 μLのNMMとの混合物を、常温で3日間撹拌させた。終了時に、該混合物を濃縮し、15 mlの水を加えた。該得られた混合物を、酢酸エチル(30 mL x 3)で抽出した。該組合せた抽出物を、水、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。該物質をHPLCにより精製し、28 mgの生成物、化合物7を得た。1H NMR (400 MHz): cis/transアミド回転異性体の混合物の比は、約3:1 (CDCl3, T=25℃)δ最大 6.98-7.48 (m, 7H)、4.87 (q, J=6.84 Hz, 1H)、 4.02-4.08 (m, 2H)、3.88 (m, 1H)、3.67 (m, 1H)、3.30 (m, 2H)、2.92 (s, 3H)、2.88 (m, 1H)、2.68-2.74 (m, 2H)、2.40-2.53 (m. 3H)。1.76-1.84 (m, 4H)、1.43 (不明瞭のt, J=6.82 Hz, 3H)、1.42 (不明瞭のd, J=6.64 Hz, 3H)、及びδ最小 5.07 (q, J=7.2 Hz, 1H)、2.96 (s, 3H)、1.36 (d, J=7.2 Hz, 3H)。MS (ESI+) 624 [M+H]+。
【0142】
(7.8 実施例8)
【化34】

【0143】
化合物8を、スキームIに示すとおり、公知の化合物I1から8工程で合成した。
【0144】
4,4-ジメチル-2-(オキソ-シクロヘキサンカルボン酸(4-エトキシ-フェニル)アミド (化合物I2)。
32 mLのクロロホルム中、化合物I1と4-(5,5-ジメチル-シクロへキス-1-エニル)-モルホリン/4-(3,3 ジメチル-シクロへキス-l-エニル)-モルホリン(3:1)と(1.28 g、6.55 mmoL)と4-エトキシフェニルイソシアナート(1.20 g、7.20 mmoL)の混合物を、常温で20時間撹拌させた。終了時に、50 mLのジクロロメタンを加えた。該結果として得られた溶液を、水で2回、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。2.04 gの化合物I2を得て、精製せずに次の工程に用いた。MS (ESI+) 290 [M+H]+。
【0145】
2-アミノ-4,4-ジメチル-シクロヘキシ-1-エンカルボン酸(4-エトキシ-フェニル) アミド (化合物I3)。
20 mLのエタノール中化合物I2 (2.04 g、7.05 mmoL)の溶液を、連続5日間の2時間かけて、無水アンモニアで飽和させた。その後、該混合物を濃縮し、かつ乾燥させ、1.98 gの生成物、化合物I3を得た。1H NMR (400 MHz、CDCl3) δ: 7.35 (dd, J=5.2, 0.8 Hz, 2H)、6.94 (br s, 1H)、6.82 (d, J=5.2 Hz, 2H)、 6.37 (br s, 2H)、3.98 (m, 2H)、2.30 (dd, J=5.2, 4.8 Hz, 2H)、1.98 (s, 2H)、1.49 (dd, J=5.6, 5.2 Hz, 2H)、1.38 (dd, J=5.6, 5.6 Hz, 3H)、0.96 (s, 3H)、0.95 (s, 3H)。
【0146】
(R)-{1-[2-(4-エトキシ-フェニルカルバモイル)-5,5-ジメチル-シクロヘキス-1- エニルカルバモイル]-エチル}-カルバミン酸tert-ブチルエステル (化合物I4)。
39 mLのジクロロメタン中、化合物I3 (1.02 g、3.53 mmol)とN-Boc-D-アラニン (803 mg、42.4 mmol)とEDC (1.01 g、5.29 mmol)とHOBT (542 mg、3.53 mmol)と822 μLのNMMの混合物を、常温で28時間撹拌させた。終了時に、該混合物を濃縮し、30 mLの重炭酸ナトリウム飽和水溶液を加えた。該得られた混合物を、酢酸エチル(30 mL x 3)で抽出した。該組合せた抽出物を、水、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。該物質を、20%、及び30%酢酸エチル/ヘキサンを溶離液として連続的に用い、シリカゲルカラム上のクロマトグラフィーにより精製し、1.06 gの生成物、化合物I4を得た。1H NMR (400 MHz, CDCl3) δ: 13.0 (s, 1H)、7.36 (d, J=8.8 Hz, 2H)、7.33 (br s, 1H)、6.85 (d, J=8.92 Hz, 2H)、5.30 (br s, 1H)、4.11 (br s, 1H)、3.99 (q, J=6.96 Hz, 2H)、2.79 (s, 2H)、2.36 (br s, 2H)、1.46 (m, 2H)、1.41 (s, 9H)、1.39 (dd, J=7.0, 7.0 Hz, 3H)、0.97 (s, 3H)、0.96 (s, 3H)。MS (ESI+) 482 [M+Na]+。
【0147】
(R)-{1-[3-(4-エトキシ-フェニル)-7,7-ジメチル-4-(オキソ-3,4,5,6,7,8-ヘキサヒドロキナゾリン-2-イル]-エチル}-カルバミン酸tert-ブチルエステル (化合物I5)。
11 mLのピリジン中、化合物I4(500 mg、1.09 mmol)と亜リン酸トリフェニル(857 μL、3.27 mmol)の混合物を、45時間かけて115℃まで加熱した。終了時に、該混合物を濃縮し、20 mLの重炭酸ナトリウム飽和水溶液を加えた。該得られた混合物を、酢酸エチル(30 x 3)で抽出した。該組合せた抽出物を、水、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。該生成物を、10%、20%、及び40%酢酸エチル/ヘキサンを溶離液として連続的に用い、カラムクロマトグラフィーにより精製し、387 mgの生成物、化合物I5を得た。1H NMR (400 MHz, CDCl3) δ: 6.97-7.21 (m, 4H)、5.29 (br s, 1H)、4.46 (br s, 1H)、4.06 (q, J=6.95 Hz, 2H)、2.53 (dd, J=6.5, 5.4 Hz, 2H)、 2.42 (s, 2H)、1.51 (dd, J=6.5, 6.5 Hz, 2H)、1.43 (不明瞭のdd, J=7.0, 7.0 Hz, 3H)、1.40 (s, 9H)、1.18 (d, J=6.7 Hz, 3H)、1.02 (s, 3H)、1.00 (s, 3H)。MS (ESI+) 442 [M+H]+。
【0148】
(R)-2-(1-アミノ-エチル)-3-(4-エトキシ-フェニル)-7,7-ジメチル-5,6,7,8-テトラヒドロ-3H-キナゾリン-4-オン (化合物I6)。
1.5 mLのTFAを、0℃で、7 mLのジクロロメタン中化合物I5(320 mg、0.724 mmol)の溶液にゆっくり加えた。該得られた混合物を、常温で2時間撹拌させた。終了時に、50 mLの重炭酸ナトリウム飽和水溶液を加え、さらに固体重炭酸ナトリウムを、該混合物が弱塩基性になるまで加えた。該得られた混合物を、塩化メチレン(35 mL x 3)で抽出した。該組合せた抽出物を、重炭酸ナトリウム飽和水溶液(50 mL x 2)、及び水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。該残渣を乾燥させ、268 mgの生成物、化合物H6を得て、それをさらなる精製をせずに用いた。MS (ESI+) 342 [M+H]+。
【0149】
(R)-3-(4-エトキシ-フェニル)-2-[1-(2-メタンスルホニル-エチルアミノ)-エチル]-7,7-ジメチル-5,6,7,8-テトラヒドロ-3H-キナゾリン-4-オン (化合物I7)。
2 mLのメタノール中、化合物I6(92 mg、0.269 mmol)とエチルビニルスルホン(42 mg、0.350 mmol)の混合物を、常温で3日間撹拌させた。該反応物をHPLCにより測定した。終了時に、該混合物を濃縮し、かつ乾燥し、145 mgの生成物、化合物I7を得て、それを精製せずに次の工程に用いた。1H NMR (400 MHz, CDCl3) δ: 6.99-7.09 (m, 4H)、4.08 (q, J=6.99 Hz, 2H)、3.39 (q, J=6.6 Hz, 1H)、3.07 (m, 2H)、2.54 (dd, J=6.60, 6.41 Hz, 2H)、2.42 (s, 2H)、1.53 (dd, J=6.54, 6.51 Hz, 2H)、1.45 (dd, J=7.0, 7.0 Hz, 3H)、1.37 (t, J=6.72 Hz, 3H)、1.17 (d, J=6.61 Hz, 3H)、1.03 (s, 3H)、1.02 (s, 3H)。 MS (ESI+) 462 [M+H]+。
【0150】
(R)-N-(2-エタンスルホニル-エチル)-N-{1-[3-(4-エトキシ-フェニル)-7,7-ジメチル-4-オキソ-3,4,5,6,7,8-ヘキサヒドロ-キナゾリン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物8)。
化合物8を、化合物7に関して先に記載された同じ合成手順に従い、合成した。化合物8の1H NMR: cis/transアミド回転異性体の混合物の比は、約3:1 (400 MHz, CDCl3; T=25℃) δ最大 6.97-7.48 (m, 7H)、4.84 (q, J=6.81 Hz, 1H)、4.01-4.07 (m, 2H)、3.82 (m, 1H)、3.65 (m, 1H)、3.25 (m, 1H)、2.97 (q, J=7.83 Hz, 2H)、2.87 (ABd, JAB=16.3 Hz, 1H)、2.74 (m, 1H)、2.43-2.59 (m, 4H)、2.39 (ABd, JAB=16.3 Hz, 1H)、1.49-1.56 (m, 2H)、1.41 (不明瞭のdd, J=7.04, 7.04 Hz, 3H)、1.40 (不明瞭のd, J=4.75 Hz, 3H)、1.36 (dd, J=7.45, 7.45 Hz, 3H)、1.05 (s, 3H)、1.02 (s, 3H)、及びδ最小 5.17 (m, 1H)、1.30 (d, J=7.16 Hz, 3H)、0.99 (s, 3H)、0.97 (s, 3H)。MS (ESI+) 666 [M+H]+。
【0151】
(7.9 実施例9)
【化35】

化合物9を、例として、先のスキームに示すとおり、化合物5から合成できる。
【0152】
(7.10 実施例10)
【化36】

化合物10を、例として、先のスキームに示すとおり、化合物5から合成できる。
【0153】
【表2】

【0154】
(7.11 実施例11〜16)
【化37】

中間体化合物J2、及びJ3を、スキームJに示すとおり、先に記載された化合物A1から、各々2、及び3工程で合成した。
【0155】
(R)-2-{1-[(テトラヒドロ-チオピラン-4-イルメチル)-アミノ]-エチル}-3-[4-(2,2,2-トリフルオロ-エトキシ)-フェニル]-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物J1)。
先に記載された化合物A1(159 mg、0.44 mmol)、テトラヒドロチオピラニル-4-カルボキサルデヒド(70 μL、0.53 mmol)、及びトリアセトキシ水素化ホウ素ナトリウム(277 mg、1.32 mmol)を、1,2-ジクロロエタン中で、常温で1時間撹拌した。該反応混合物をジクロロメタンで希釈し、その後、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。該有機層を、無水硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮し、208 mgの化合物J1を得て、精製せずに先に進んだ。
【0156】
(R)-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(1-{4-オキソ-3-[4-(2,2,2-トリフルオロ-エトキシ)-フェニル]-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル}-エチル)-N-(テトラヒドロ-チオピラン-4-イルメチル)-アセトアミド (化合物J2)。
化合物4-フルオロ-3-トリフルオロメチルフェニル酢酸 (164 mg、0.74 mmol)をジクロロメタン中に溶解し、0℃まで冷却した。塩化オキサリル(64 μL、0.74 mmol)を加え、その後5分後に、N,N-ジメチルホルムアミド(5.7 μL、0.07 mmol)を加えた。該反応物を0℃で30分間、及び常温で1時間撹拌した。該溶液を、-78℃で、ジクロロメタン中、化合物J1(208 mg、0.43 mmol)とトリエチルアミン(182 μL、1.30 mmol)の混合物にゆっくり加えた。該混合物を30分間撹拌し、その後、重炭酸ナトリウム飽和水溶液、及び塩水で洗浄した。該有機抽出物を、無水硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮した。該結果として得られた生成物を、クロマトグラフィー(ジクロロメタン中0.1%水酸化アンモニウム含有2%メタノール溶液)により精製し、265 mgの化合物J2を得た。
【0157】
(R)-N-(l,l-ジオキソ-ヘキサヒドロ-lλ6-チオピラン-4-イルメチル)-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(1-{4-オキソ-3-[4-(2,2,2-トリフルオロ-エトキシ)-フェニル]-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル}-エチル)-アセトアミド (化合物J3)。
化合物4(265 mg、0.39 mmol)をジクロロメタン中に溶解し、0℃まで冷却した。この溶液に、3-クロロペルオキシ安息香酸(77%、174 mg、0.78 mmol)を加え、該混合物を、一晩常温に平衡化した。該反応物を、10%チオ硫酸ナトリウム水溶液で2回、及び塩水で1回洗浄した。その後、該有機層を無水硫酸マグネシウム上で乾燥させ、ろ過し、かつ真空で濃縮した。該生成物を、クロマトグラフィー(ジクロロメタン中0.1%水酸化アンモニウム含有3%メタノール溶液)により精製し、136 mgの化合物5を回収した。MS (MH+): 688.2。1H NMR (500 MHz; CDCl3; T=298 K): δ 8.30 (t, 1H, J=7.9 Hz)、7.86 (m, 1H)、7.69-7.35 (m, 4H)、7.25 (m, 2H)、7.13 (m, 3H)、5.23-4.93 (dq, 1H, J=7.2, 143 Hz)、4.43 (五重線, 2H, J=8.0 Hz)、4.22-3.58 (m, 2H)、3.26 (m, 1H)、3.06-2.97 (m, 3H)、1.55 (d, 2H, J=6.7 Hz)、1.43 (dt, 3H, J=7.6, 2.0 Hz)、1.32 (t, 3H, J=7.5 Hz) ppm。
【0158】
【化38】

中間体化合物K1を、先に記載された化合物E1から2工程で合成した。
【0159】
(R)-N-(2-ベンゼンスルホニル-エチル)-N-{1-[3-(4-エトキシ-フェニル)-4-(オキソ-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物K1)。
化合物K1を、A3の合成順序に従い、第一工程において、フェニルビニルスルホンをエチルビニルスルホンの代わりに用い、E1から2工程で合成した。1H NMR: cis/transアミド回転異性体の混合物の比は、約2.0:1 (400 MHz, CDCl3; T=25℃) δ最大 8.98 (dd, J=4.63, 1.94 Hz, 1H)、8.61 (d, J=7.97, 1.80 Hz, 1H)、7.98 (d, J=7.43 Hz, 1H)、7.01-7.75 (m, 12H)、5.14 (q, J=7.20 Hz, 1H)、4.07 (m, 2H)、2.86-3.90 (m, 6H)、1.45 (不明瞭のt, J=6.93 Hz, 3H)、 1.34 (d, J=7.23 Hz, 3H)、及びδ最小 9.09 (dd, J=4.3, 1.84 Hz, 1H)、8.64 (dd, J=7.88, 1.87 Hz, 1H)、1.54 (d, J=6.73 Hz, 3H)、1.44 (不明瞭のt, 1=6.74 Hz, 3H)。MS (ESI+) 683 [M+H]+。
【0160】
【化39】

中間体化合物L2、及びL3を、先に記載されたE1から、各々2、及び3工程で合成した。
【0161】
(R)-3-(4-エトキシ-フェニル)-2-{1-[(テトラヒドロ-チオピラン-4-イルメチル)-アミノ]エチル}-3H-ピリド[2,3-d]ピリミジン-4-オン (化合物L1)。
9 mLの1,2-ジクロロエタン中、化合物E1(531 mg、1.71 mmol)とテトラヒドロ-チオピラン-4-カルバルデヒド(234 mg、1.79 mmol)の混合物に、常温で、1.09 g (5.13 mmol)のトリアセトキシ水素化ホウ素ナトリウムを加えた。該得られた混合物を、常温で3時間撹拌させた。終了時に、25 mLの重炭酸ナトリウム飽和水溶液を加え、該得られた混合物を、ジクロロメタン(30 mL x 3)で抽出した。該組合せた抽出物を、水、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ真空で濃縮した。該残渣を真空下で乾燥させ、550 mgの所望された生成物L1を得て、さらなる精製をせずに、L1を次の工程で用いた。MS (ESI+) 425 [M+H]+。
【0162】
(R)-N-{1-[3-(4-エトキシ-フェニル)-4-オキソ-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-N-(テトラヒドロ-チオピラン-4-イルメチル)-アセトアミド (化合物L2)。
13 mLのジクロロメタン中、化合物 L1 (550 mg、1.29 mmol)と4-フルオロ-3-トリフルオロメチルフェニル酢酸 (374 mg、1.68 mmol)とEDC (371 mg、1.93 mmol)とHOBT (198 mg、1.29 mmol)と 300 μL(2.58 mmol)のNMMとの混合物を、常温で3日間撹拌させた。終了時に、該混合物を濃縮し、15 mLの水を加えた。該得られた混合物を、酢酸エチル (30 mL x 3)で抽出した。該組合せた抽出物を、水、及び塩水で洗浄し、無水硫酸ナトリウム上で乾燥させ、かつ濃縮した。該物質を、50%、及び80%の酢酸エチル/ヘキサンを溶離液として連続的に用い、シリカゲルカラム上のクロマトグラフィーにより精製し、531 mgの生成物、化合物L2を得た。cis/transアミド回転異性体の比が、約2:1の混合物の1H NMR (400 MHz, CDCl3; T=25℃) δ最大 8.96 (dd, J=4.58, 2.01 Hz, 1H)、 8.56 (dd, J=7.87, 2.02 Hz, 1H)、7.0-7.55 (m, 8H)、5.16 (q, J=7.21 Hz, 1H)、4.05 (q, J=6.92 Hz, 2H)、1.44 (不明瞭のd, J=7.19 Hz, 3H)、1.43 (不明瞭のt, J=6.96 Hz, 3H)、及びδ最小 9.06 (dd, J=4.56, 1.96 Hz, 1H)、 8.63 (dd, J=7.90, 1.96 Hz, 1H)、5.02 (q, J=6.81 Hz, 1H)、1.58 (d, J=6.74 Hz, 3H)。MS (ESI+) 629 [M+H]+。
【0163】
(R)-N-(l,l-ジオキソ-ヘキサヒドロ-lλ6-チオピラン-4-イルメチル)-N-{1-[3-(4-エトキシ-フェニル)-4-オキソ-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物L3)。
8 mLのジクロロメタン中化合物L2 (531 mg, 0.845 mmol)の溶液に、379 mg (1.69 mmol)の3-クロロペルオキシ安息香酸(77%)をゆっくりと加えた。該得られた混合物を、3時間常温で撹拌させた。終了時に、30 mLの飽和チオ硫酸ナトリウム水溶液を加え、該得られた混合物を、ジクロロメタン(40 mL x 3)で抽出した。該組合せた抽出物を、飽和チオ硫酸ナトリウム水溶液、及び水で洗浄し、無水硫酸マグネシウム上で乾燥させ、かつ真空で濃縮した。該生成物を、50%、及び100%酢酸エチル/ヘキサンを溶離液として連続的に用い、カラムクロマトグラフィーにより精製し、484 mgの化合物L3を得た。1H NMR: cis/transアミド回転異性体の混合物の比は、約4:1 (400 MHz, CDCl3; T=25℃)δ最大 3.60 (d, J=3.60 Hz, 1H)、8.85 (d, J=6.64 Hz, 1H)、7.04-7.68 (m, 8H)、5.13 (q, J=7.29 Hz, 1H)、4.10 (q, J=6.97 Hz, 2H)、3.90 (ABd, JAB=16.3 Hz, 1H)、3.59-3.75 (m, 3H)、2.85-3.17 (m, 4H)、1.80-2.35 (m, 5H)、1.46 (J=6.95 Hz, 3H)、1.43 (d, J=7.43 Hz, 3H)、及びδ最小 9.10 (m, 1H)、8.78 (m, 1H)、1.59 (d, J=6.74 Hz, 3H)。MS (ESI+) 661 [M+H]+。
【0164】
【化40】

【0165】
(R)-N-(2-エタンスルホニル-エチル)-N-{1-[3-(4-エトキシ-フェニル)-4-オキソ-3,4-ジヒドロ-ピリド[2,3-d]ピリミジン-2-イル]-エチル}-2-(4-フルオロ-3-トリフルオロメチル-フェニル)-アセトアミド (化合物M1)。
化合物M1を、化合物A3の合成順序に従い、化合物E1から2工程で合成した。化合物M1の1H NMR: cis/transアミド回転異性体の混合物の比は、約1.2:1 (400 MHz, CDCl3; T=25℃) δ最大 8.94 (dd, J=4.60, 2.00Hz, 1H)、8.58 (dd, J=7.87, 1.99 Hz, 1H)、7.02-7.55 (m, 8H)、5.21 (m, 1H)、3.82-4.19 (m, 5H)、 3.48 (m, 1H)、3.09-3.21 (m, 2H)、2.88-2.93 (m, 2H)、1.41-1.47 (m, 9H)、及びδ最小 9.05 (dd, J=4.60, 2.02 Hz, 1H)、8.63 (dd, J=7.89, 1.98 Hz, 1H)、5.05 (m, 1H)、3.66 (m, 1H)、2.43 (ABd, JAB=16.3 Hz, 1H)、1.58 (d, J=6.89 Hz, 3H)、1.22 (t, J=7.45 Hz, 3H)。MS (ESI+) 635 [M+H]+。
【0166】
化合物11〜16を、化合物4〜9を、常温水素下で例えばパラジウム担持炭素と接触させることなどにより、各々化合物J2、J3、K1、L2、L3、及びM1から合成する。終了時に、該混合物をろ過し、濃縮し、かつ乾燥させ、化合物11〜16を得た。
【0167】
(7.12 実施例17〜22)
【表3】

【0168】
(7.13 実施例23〜27)
【表4】

【0169】
図8、及び図9は、実施例23〜27に提供された置換5, 6, 7, 8-テトラヒドロ-7,7-ジメチルキナゾリン-4-(3H)-オンの合成の、一般的な合成スキームを示す。
【0170】
(7.14 実施例28〜37)
【表5】

【0171】
(7.15 実施例38〜47)
【表6】

【0172】
(7.16 実施例48〜54)
【表7】

【0173】
(7.17 実施例49〜53)
【表8】

【0174】
【化41】

【0175】
化合物49を、スキームNに示すとおり、化合物N1から合成できる。例として、ピリジン-3-カルバルデヒドを、-10℃で、ジクロロエタン中化合物N1溶液に加え、続いてトリアセトキシ水素化ホウ素ナトリウムである。該混合物を、1.5時間、その温度に保ち、ゆっくり常温まで暖め、かつ一晩撹拌する。該溶液を、ジクロロメタンで希釈し、重炭酸ナトリウム飽和水溶液、水、塩水により洗浄する。乾燥し、化合物N2を得ることができる。EDCを、DMF中で化合物N2と4-フルオロ-3-トリフルオロメチルフェニル酢酸とHOBtとNMMとの混合物に加える。該混合物を、常温で一晩撹拌し、酢酸エチルで希釈できる。該溶液を、重炭酸ナトリウム飽和水溶液、水、及び塩水で洗浄し、乾燥させ、濃縮した。化合物49を、該残渣からクロマトグラフィーにより精製できる。
【0176】
(7.18 実施例54〜58)
【表9】

【0177】
(7.19 実施例59〜63)
【表10】

【0178】
(7.20 実施例64〜66)
【表11】

【0179】
【化42】

【0180】
実施例64を、化合物49から、ジクロロエタン中化合物49の溶液にトリフルオロ酢酸を加え、その後、1.5時間かけて60℃に加熱することにより製造できる。該溶媒を蒸発させ、該残渣を酢酸エチルに溶解し、重炭酸ナトリウム飽和水溶液、水、塩水で洗浄し、乾燥させる。
【0181】
(7.21 実施例67〜69)
【表12】

【0182】
(7.22 実施例70〜77)
実施例70〜77を、先に記載された実施例の合成に従い、わずかな改良を加えて製造した。
【0183】
【表13】


【0184】
(7.23 CXCR3結合測定法、及び移動測定法)
CXCR3結合測定法:下記の実施例は、国際公開第WO 02/083143号の実施例12に記載のとおり、本発明の化合物を評価するのに用いることができるCXCR3結合測定法を示す。
【0185】
他に記載しない限り、該測定法用の全ての試薬は、業務用供給元(Sigma-Aldrich社、St. Louis、MO、米国など)から入手できる。試験化合物を、DMSO中で、目的とする最終測定濃度の40倍である濃度に希釈する;5 μLを、 (Greiner社などの)96ウェル平底ポリプロピレンプレートの各ウェルに移す。CXC3を発現している細胞 (国際公開第WO 02/083143号を参照)を、mL当たり5百万細胞に、測定緩衝液(4℃で保存された25 mM Hepes、80 mM NaCl、1 mM CaCl2、5 mM MgC12、0.2%ウシ血清アルブミン、pH 7.1)に懸濁する;100 μLのこの細胞懸濁液を、希釈された試験化合物を含有する96ウェルプレートの各ウェルに移す。(Amersham社、PE Life Sciences社などの業務用供給元から購入された)125Iで標識されたケモカインを、測定緩衝液中で、約60 pMの濃度に希釈する;100 μLのこのケモカイン溶液を、化合物、及び細胞懸濁液を含有する、96ウェルプレートの各ウェルに移す。該プレートを(E&K Scientific社などの)市販のホイルプレートシールで密封でき、2〜4時間、緩やかに振盪しながら4℃で保存した。インキュベート期間の終わりに、該測定プレートの内容物を、0.3%ポリエチレンイミン(Sigma社)含有溶液に浸け予めコーティングされているGF/Bフィルタープレート(Packard社)に、セルハーベスター(Packard社)を用いて移し、洗浄緩衝液(常温で保存された、25 mM Hepes、500 mM NaCl、1 mM CaCl2、5 mM MgCl2、pH 7.1)で2回洗浄できる。該フィルタープレートは、底部をプレートシール(Packard社)で密封し、50 μLの Microscint-20シンチレーション液(Packard社)を各ウェルに加え、該プレートの上部を透明プラスチック(TopSeal A、Packard社)で密閉する。該プレートを、Packard TopCountなどのシンチレーションカウンターで測定する。非特異的結合を測定するために、標識されていない"コールドの"ケモカインを含有する4つのウェルを、各96ウェルプレート上に含めることができる。最大結合を測定するために、5 μLの DMSO、100 μLの細胞懸濁液、及び100 μLの125Iで標識されたケモカイン溶液を含有する4つのウェルを、各96ウェルプレート上に含めることができる。データを市販のソフトウェア(Microsoft社のExcel、GraphPad Software社のPrismなど)を用いて分析できる。
CXCR3血漿移動測定法:下記の実施例は、本発明の化合物を評価するのに用いることができる、CXCR3血漿移動測定法を提供する。
【0186】
ヒト末梢血単核細胞(PBMC)を、(ハイブリドーマ細胞株OKT3(ATCC CRL-8001)由来のAB溶液により精製された)OKT3及びIL-2(Peprotech社、Rocky Hill、 NJ、米国)で活性化し、14日目に、活性化されたPBMCを、1 ng/mL CMFDA中で、組織培養インキュベーター内で、37℃で>1.5時間インキュベートし、細胞にクロロメチルフルオレセイン二酢酸(CMFDA)(Molecular Probes社) を取り込ませる。細胞が取り込んでいる間、該試験化合物を、DMSO中で、目的とする最終測定濃度の100倍である濃度に希釈できる。次に、ヒト血漿(EDTA、薬物フリー、Biological Specialty社)中100 ng/mLのヒトITAC (Peprotech社)を調製する。試験化合物を該ヒトITAC調製物に加える。細胞を、予め暖めた(37℃)0.5%BSA含有RPMI(Invitrogen社)培地中で、1回洗浄し、ヒト血漿中で5百万細胞/mlに再懸濁する。該試験化合物を該PBMCに加える。ウェル当たり30 μLのITAC/化合物混合物を下のチェンバーに加え、ITAC/化合物ウェルの上部に不透過性膜を置き、かつ50 μLのPBMC/化合物混合物を該ウェルに加えて、96ウェル走化性移動プレート(NeuroProbe社)を組立てた。該プレートを覆い、加湿された組織培養インキュベーター内で2.5時間インキュベートできる。該試験プレートの標準として用いるべきである、CMFDAを取り込んだ細胞の標準曲線を作成できる。移動プレートを分解し、475 nm 吸光度、517 nm 発光に設定し、蛍光プレートリーダーで読み取る。該標準曲線を用い、かつ移動している細胞の割合を計算して、該蛍光測定値を細胞数に変換できる。
【0187】
他の測定法を用い、CXCR3ケモカイン受容体活性を調節する化合物を同定でき、例として、結合測定法 (Wengらの論文 (1998) J. Biol. Chem. 273:18288-18291、Campbellらの論文 (1998) J. Cell Biol. 141:1053-1059、 Endresらの論文 (1999) J. Exp. Med. 189:1993-1998、及びNgらの論文(1999) J. Med. Chem. 42:4680-4694などを参照)、カルシウム流出測定法(Wangらの論文 (2000) Mol. Pharm 57:1190-1198、及びRabinらの論文 (1999) J. Immunol. 162:3840-3850を参照)、及び走化性測定法(Albanesiらの論文(2000) J. Immunol. 165:1395-1402、及びLoetscherらの論文 (1998) Eur. J. Immunol. 28:3696 3705などを参照)、及び当業者に知られている他の測定法がある。
【0188】
個々の印刷物又は特許出願が、具体的かつ個別に示されて、引用により組み込まれるように、この明細書に引用された全ての出版物、特許、及び特許出願は、引用により、本明細書中に取り込まれる。先の発明は、理解を明瞭にする目的で、例示及び実施例としていくらか詳細に記載されているものの、添付の請求項の精神又は範囲から離れることなく、本発明の内容に照らして、それらに特定の変更、及び改良を行うことができることは、当業者には容易に明らかである。
【図面の簡単な説明】
【0189】
【図1】図1は、本発明の化合物の製造用の一般的な合成スキームを示す。
【0190】
【図2】図2は、本発明の化合物の製造用の一般的な合成スキームを示す。
【0191】
【図3】図3は、本発明の化合物の製造用の一般的な合成スキームを示す。
【0192】
【図4】図4は、本発明の化合物の製造用の一般的な合成スキームを示す。
【0193】
【図5】図5は、本発明の化合物の製造用の一般的な合成スキームを示す。
【0194】
【図6】図6は、本発明の化合物の製造用の一般的な合成スキームを示す。
【0195】
【図7】図7は、本発明の化合物の製造用の一般的な合成スキームを示す。
【0196】
【図8】図8は、本発明の化合物の製造用の一般的な合成スキームを示す。
【0197】
【図9】図9は、本発明の化合物の製造用の一般的な合成スキームを示す。
【特許請求の範囲】
【請求項1】
下記式(I)を有する化合物、又はその医薬として許容し得る塩、又はそれらのプロドラッグ:
【化1】

(式中、Qは-C(O)-、-CH2CO-、-CH2SO-、及び-CH2S02-からなる群から選択された一要素であり;
Lは結合、又は(C1-C5)アルキレンであり;
Al、A2、及びA3は、独立に、C(R')(R")、及びC(O)からなる群から選択され;
A4がC(R')(R")、又はN(R''')であり;
各R'、及びR"は、独立に、水素原子、ハロゲン、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、フルオロ(C1-C4)アルキル、アリール、ヘテロアリール、アリール(C1-C8)アルキル、及びヘテロアリール(C1-C8)アルキルからなる群から選択され、任意に、隣接した炭素原子上のR'、及びR"基を組合せて、5員、又は6員縮合環を形成することができ、かつ同一の炭素原子に結合されたR' 、及びR"基を組合せて、3〜8員スピロ環を形成することができ;
R'''は、水素原子、(C1-C8)アルキル、及び(C2-C8)ヘテロアルキルからなる群から選択され;
R1はヘテロアリール、又はアリールであり;
R2は水素原子、ハロゲン、(C1-C10)アルキル、(C2-C10)ヘテロアルキル、ヘテロ(C1-C10)シクロアルキル、(C1-C10)アルキルアリール、及び(C2-C10)ヘテロアルキルアリールからなる群から選択され、任意に、R2をLと組合せて、N、O、及びSからなる群から選択された1〜3個のヘテロ原子を含む、5員環、6員環、7員環、又は8員環を形成することができ;
R3は非存在であるか、或いは-H、-CHR6R7、-S(0)mR5、-S(0)mN(R8)R9、-S(0)mN(R8)CH2R6、-N(R8)SO2R5、-N(R8)CH2R10、並びに下記式の基の群からなる群から選択された一要素であり:
【化2】

(式中、R5は、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、アリール、及びヘテロアリールからなる群から選択され;
R6、及びR7は、独立に、水素原子、(C1-C8)アルキル、又は(C2-C8)ヘテロアルキルであり;
R9は(C1-C8)アルキルであり;
R10はアリールであり;
ZはCH、又はNであり;
Xは結合、(C1-C6)アルキレン、又は(C1-C6)ヘテロアルキレンであり;
Yは(C1-C6)アルキレンであり;
下付文字mは、0、1、又は2である。)、かつ
任意に、R3をR2と組合せて、N、 O、及びSからなる群から選択された1〜3個のヘテロ原子を含む、4員環、5員環、6員環、7員環、又は8員環を形成することができ; かつ
R4は、(C1-C20)アルキル、(C2-C20)ヘテロアルキル、ヘテロアリール、アリール、ヘテロアリール(C1-C6)アルキル、ヘテロアリール(C2-C6)ヘテロアルキル、アリール(C1-C6)アルキル、及びアリール(C2-C6)ヘテロアルキルからなる群から選択された一要素である;
但し、Al、A2、及びA3がCH2であり、Rlが4-(2,2,2-トリフルオロエトキシ)フェニルであり、R2がメチルであり、R3が3-ピコリルであり、かつQがC(O)であり、-Q-R4がまとめて下記式の基であり、かつLが-CH2-であるとき、A4はNH以外である:
【化3】

。)。
【請求項2】
Rlがパラ-シアノフェニルである、請求項1記載の化合物。
【請求項3】
下記式(Ia)を有する請求項1記載の化合物、又はその医薬として許容し得る塩、又はそれらのプロドラッグ:
【化4】

。
【請求項4】
A4がN(R''')である、請求項3記載の化合物。
【請求項5】
Al、A2、及びA3がC(R')(R")である、請求項3記載の化合物。
【請求項6】
下記式(II)を有する請求項3記載の化合物、又はその医薬として許容し得る塩、又はプロドラッグ:
【化5】

(式中、各Raは、独立に、ハロゲン、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、フルオロ(C1-C4)アルキル、アリール、ヘテロアリール、アリール(C1-C8)アルキルからなる群から選択され、任意に、隣接した炭素原子上のRa基を組合せて、5員、又は6員縮合環を形成することができ、かつ同一炭素原子に結合したRa基を組合せて、3〜8員スピロ環を形成することができ;かつ
下付文字kは、0、1、2、3、又は4である。)。
【請求項7】
R'''が-CH3、-CH2CH3、又は-C(O)CH3である、請求項6記載の化合物。
【請求項8】
kが0である、請求項6記載の化合物。
【請求項9】
下記式(III)を有する請求項6記載の化合物、又はその医薬として許容し得る塩、又はそれらのプロドラッグ:
【化6】

(式中、R11は、水素原子、(C1-C8)アルキル、及び(C2-C8)ヘテロアルキルからなる群から選択される。)。
【請求項10】
A4がC(R')(R")である、請求項3記載の化合物。
【請求項11】
Al、A2、及びA3がC(R')(R")である、請求項10記載の化合物。
【請求項12】
下記式(IV)を有する請求項11記載の化合物、又はその医薬として許容し得る塩、又はそれらのプロドラッグ:
【化7】

。
【請求項13】
下記式(V)を有する請求項11記載の化合物、又はその医薬として許容し得る塩、又はそれらのプロドラッグ:
【化8】

(式中、各Raは、独立に、ハロゲン、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、フルオロ(C1-C4)アルキル、アリール、ヘテロアリール、アリール(C1-C8)アルキル、及びヘテロアリール(C1-C8)アルキルからなる群から選択され、任意に、隣接した炭素上のRa基を組合せて、5員、又は6員縮合環を形成することができ、かつ同一炭素原子に結合されたRa基を組合せて、3〜8員スピロ環を形成することができ;かつ下付き文字pは、0、1、2、3、又は4である。)。
【請求項14】
下記式(VI)を有する請求項13記載の化合物、又はその医薬として許容し得る塩、又はそれらのプロドラッグ:
【化9】

(式中、R11は水素原子、(C1-C8)アルキル、及び(C2-C8)ヘテロアルキルからなる群から選択される。)。
【請求項15】
R3が-H、-SO2CH3、-SO2CH2CH3、並びに下記式の基の群から選択された一要素である、請求項14記載の化合物:
【化10】

。
【請求項16】
L-R3がまとめて下記式である、請求項4、又は10記載の化合物:
【化11】

。
【請求項17】
R1が非置換、又はメタ、又はパラ置換フェニルであり、該置換基がハロゲン、(C1-C8)アルキル、(C1-C8)ハロアルキル、オキシ(C1-C8)アルキル、又はオキシ(C1-C8)ハロアルキルである、請求項4、又は10記載の化合物。
【請求項18】
R1がメタ、又はパラ置換フェニルであり、該置換基がシアノである、請求項4、又は10記載の化合物。
【請求項19】
R2が-CH3、-CH2CH3、-CH2CH2NH2、並びに下記式の基の群からなる群から選択された一要素である、請求項4、又は10記載の化合物:
【化12】

。
【請求項20】
Qが-C(O)-である、請求項4、又は10記載の化合物。
【請求項21】
Lが結合、-CH2-、又は-CH2CH2-である、請求項4、又は10記載の化合物。
【請求項22】
-Q-R4が下記式の基の群である、請求項4、又は10記載の化合物:
【化13】

。
【請求項23】
請求項1の化合物及び医薬として許容し得る担体、希釈剤又は賦形剤を含む医薬組成物。
【請求項24】
治療が必要な対象に、治療上効果的な量の請求項1記載の化合物を投与することを含む、対象の炎症又は免疫の、状態又は疾患を治療する方法、
【請求項25】
前記炎症又は免疫の、状態又は疾患が、神経変性疾患、多発性硬化症、全身性エリテマトーデス、関節リウマチ、アテローム性動脈硬化、脳炎、髄膜炎、肝炎、腎炎、敗血症、サルコイドーシス、乾癬、湿疹、じんま疹、1型糖尿病、喘息、結膜炎、耳炎、アレルギー性鼻炎、慢性閉塞性肺疾患、洞炎、皮膚炎、炎症性腸疾患、潰瘍性大腸炎、クローン病、ベーチェット症候群、痛風、癌、ウイルス感染、細菌感染、臓器移植状態、皮膚移植状態、及び移植片対宿主病からなる群から選択される、請求項24記載の方法。
【請求項26】
前記化合物を第二の治療薬と組合せて投与し、該第二の治療薬が、神経変性疾患、多発性硬化症、全身性エリテマトーデス、関節リウマチ、アテローム性動脈硬化、脳炎、髄膜炎、肝炎、腎炎、敗血症、サルコイドーシス、乾癬、湿疹、じんま疹、1型糖尿病、喘息、結膜炎、耳炎、アレルギー性鼻炎、慢性閉塞性肺疾患、洞炎、皮膚炎、炎症性腸疾患、潰瘍性大腸炎、クローン病、ベーチェット症候群、痛風、癌、ウイルス感染、細菌感染、臓器移植状態、皮膚移植状態、及び移植片対宿主病の治療に有効である、請求項25記載の方法。
【請求項27】
前記炎症又は免疫の、状態又は疾患が、多発性硬化症、関節リウマチ、乾癬、喘息、炎症性腸疾患、臓器移植状態、及び皮膚移植状態からなる群から選択される、請求項25記載の方法。
【請求項28】
前記化合物がCXCR3を調節する、請求項25記載の方法。
【請求項29】
細胞を請求項1記載の化合物と接触させることを含む、前記細胞のCXCR3機能を調節する方法。
【請求項30】
CXCR3タンパク質を請求項1記載の化合物と接触させることを含む、CXCR3機能の調節の方法。
【請求項1】
下記式(I)を有する化合物、又はその医薬として許容し得る塩、又はそれらのプロドラッグ:
【化1】

(式中、Qは-C(O)-、-CH2CO-、-CH2SO-、及び-CH2S02-からなる群から選択された一要素であり;
Lは結合、又は(C1-C5)アルキレンであり;
Al、A2、及びA3は、独立に、C(R')(R")、及びC(O)からなる群から選択され;
A4がC(R')(R")、又はN(R''')であり;
各R'、及びR"は、独立に、水素原子、ハロゲン、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、フルオロ(C1-C4)アルキル、アリール、ヘテロアリール、アリール(C1-C8)アルキル、及びヘテロアリール(C1-C8)アルキルからなる群から選択され、任意に、隣接した炭素原子上のR'、及びR"基を組合せて、5員、又は6員縮合環を形成することができ、かつ同一の炭素原子に結合されたR' 、及びR"基を組合せて、3〜8員スピロ環を形成することができ;
R'''は、水素原子、(C1-C8)アルキル、及び(C2-C8)ヘテロアルキルからなる群から選択され;
R1はヘテロアリール、又はアリールであり;
R2は水素原子、ハロゲン、(C1-C10)アルキル、(C2-C10)ヘテロアルキル、ヘテロ(C1-C10)シクロアルキル、(C1-C10)アルキルアリール、及び(C2-C10)ヘテロアルキルアリールからなる群から選択され、任意に、R2をLと組合せて、N、O、及びSからなる群から選択された1〜3個のヘテロ原子を含む、5員環、6員環、7員環、又は8員環を形成することができ;
R3は非存在であるか、或いは-H、-CHR6R7、-S(0)mR5、-S(0)mN(R8)R9、-S(0)mN(R8)CH2R6、-N(R8)SO2R5、-N(R8)CH2R10、並びに下記式の基の群からなる群から選択された一要素であり:
【化2】

(式中、R5は、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、アリール、及びヘテロアリールからなる群から選択され;
R6、及びR7は、独立に、水素原子、(C1-C8)アルキル、又は(C2-C8)ヘテロアルキルであり;
R9は(C1-C8)アルキルであり;
R10はアリールであり;
ZはCH、又はNであり;
Xは結合、(C1-C6)アルキレン、又は(C1-C6)ヘテロアルキレンであり;
Yは(C1-C6)アルキレンであり;
下付文字mは、0、1、又は2である。)、かつ
任意に、R3をR2と組合せて、N、 O、及びSからなる群から選択された1〜3個のヘテロ原子を含む、4員環、5員環、6員環、7員環、又は8員環を形成することができ; かつ
R4は、(C1-C20)アルキル、(C2-C20)ヘテロアルキル、ヘテロアリール、アリール、ヘテロアリール(C1-C6)アルキル、ヘテロアリール(C2-C6)ヘテロアルキル、アリール(C1-C6)アルキル、及びアリール(C2-C6)ヘテロアルキルからなる群から選択された一要素である;
但し、Al、A2、及びA3がCH2であり、Rlが4-(2,2,2-トリフルオロエトキシ)フェニルであり、R2がメチルであり、R3が3-ピコリルであり、かつQがC(O)であり、-Q-R4がまとめて下記式の基であり、かつLが-CH2-であるとき、A4はNH以外である:
【化3】

。)。
【請求項2】
Rlがパラ-シアノフェニルである、請求項1記載の化合物。
【請求項3】
下記式(Ia)を有する請求項1記載の化合物、又はその医薬として許容し得る塩、又はそれらのプロドラッグ:
【化4】

。
【請求項4】
A4がN(R''')である、請求項3記載の化合物。
【請求項5】
Al、A2、及びA3がC(R')(R")である、請求項3記載の化合物。
【請求項6】
下記式(II)を有する請求項3記載の化合物、又はその医薬として許容し得る塩、又はプロドラッグ:
【化5】

(式中、各Raは、独立に、ハロゲン、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、フルオロ(C1-C4)アルキル、アリール、ヘテロアリール、アリール(C1-C8)アルキルからなる群から選択され、任意に、隣接した炭素原子上のRa基を組合せて、5員、又は6員縮合環を形成することができ、かつ同一炭素原子に結合したRa基を組合せて、3〜8員スピロ環を形成することができ;かつ
下付文字kは、0、1、2、3、又は4である。)。
【請求項7】
R'''が-CH3、-CH2CH3、又は-C(O)CH3である、請求項6記載の化合物。
【請求項8】
kが0である、請求項6記載の化合物。
【請求項9】
下記式(III)を有する請求項6記載の化合物、又はその医薬として許容し得る塩、又はそれらのプロドラッグ:
【化6】

(式中、R11は、水素原子、(C1-C8)アルキル、及び(C2-C8)ヘテロアルキルからなる群から選択される。)。
【請求項10】
A4がC(R')(R")である、請求項3記載の化合物。
【請求項11】
Al、A2、及びA3がC(R')(R")である、請求項10記載の化合物。
【請求項12】
下記式(IV)を有する請求項11記載の化合物、又はその医薬として許容し得る塩、又はそれらのプロドラッグ:
【化7】

。
【請求項13】
下記式(V)を有する請求項11記載の化合物、又はその医薬として許容し得る塩、又はそれらのプロドラッグ:
【化8】

(式中、各Raは、独立に、ハロゲン、(C1-C8)アルキル、(C2-C8)ヘテロアルキル、フルオロ(C1-C4)アルキル、アリール、ヘテロアリール、アリール(C1-C8)アルキル、及びヘテロアリール(C1-C8)アルキルからなる群から選択され、任意に、隣接した炭素上のRa基を組合せて、5員、又は6員縮合環を形成することができ、かつ同一炭素原子に結合されたRa基を組合せて、3〜8員スピロ環を形成することができ;かつ下付き文字pは、0、1、2、3、又は4である。)。
【請求項14】
下記式(VI)を有する請求項13記載の化合物、又はその医薬として許容し得る塩、又はそれらのプロドラッグ:
【化9】

(式中、R11は水素原子、(C1-C8)アルキル、及び(C2-C8)ヘテロアルキルからなる群から選択される。)。
【請求項15】
R3が-H、-SO2CH3、-SO2CH2CH3、並びに下記式の基の群から選択された一要素である、請求項14記載の化合物:
【化10】

。
【請求項16】
L-R3がまとめて下記式である、請求項4、又は10記載の化合物:
【化11】

。
【請求項17】
R1が非置換、又はメタ、又はパラ置換フェニルであり、該置換基がハロゲン、(C1-C8)アルキル、(C1-C8)ハロアルキル、オキシ(C1-C8)アルキル、又はオキシ(C1-C8)ハロアルキルである、請求項4、又は10記載の化合物。
【請求項18】
R1がメタ、又はパラ置換フェニルであり、該置換基がシアノである、請求項4、又は10記載の化合物。
【請求項19】
R2が-CH3、-CH2CH3、-CH2CH2NH2、並びに下記式の基の群からなる群から選択された一要素である、請求項4、又は10記載の化合物:
【化12】

。
【請求項20】
Qが-C(O)-である、請求項4、又は10記載の化合物。
【請求項21】
Lが結合、-CH2-、又は-CH2CH2-である、請求項4、又は10記載の化合物。
【請求項22】
-Q-R4が下記式の基の群である、請求項4、又は10記載の化合物:
【化13】

。
【請求項23】
請求項1の化合物及び医薬として許容し得る担体、希釈剤又は賦形剤を含む医薬組成物。
【請求項24】
治療が必要な対象に、治療上効果的な量の請求項1記載の化合物を投与することを含む、対象の炎症又は免疫の、状態又は疾患を治療する方法、
【請求項25】
前記炎症又は免疫の、状態又は疾患が、神経変性疾患、多発性硬化症、全身性エリテマトーデス、関節リウマチ、アテローム性動脈硬化、脳炎、髄膜炎、肝炎、腎炎、敗血症、サルコイドーシス、乾癬、湿疹、じんま疹、1型糖尿病、喘息、結膜炎、耳炎、アレルギー性鼻炎、慢性閉塞性肺疾患、洞炎、皮膚炎、炎症性腸疾患、潰瘍性大腸炎、クローン病、ベーチェット症候群、痛風、癌、ウイルス感染、細菌感染、臓器移植状態、皮膚移植状態、及び移植片対宿主病からなる群から選択される、請求項24記載の方法。
【請求項26】
前記化合物を第二の治療薬と組合せて投与し、該第二の治療薬が、神経変性疾患、多発性硬化症、全身性エリテマトーデス、関節リウマチ、アテローム性動脈硬化、脳炎、髄膜炎、肝炎、腎炎、敗血症、サルコイドーシス、乾癬、湿疹、じんま疹、1型糖尿病、喘息、結膜炎、耳炎、アレルギー性鼻炎、慢性閉塞性肺疾患、洞炎、皮膚炎、炎症性腸疾患、潰瘍性大腸炎、クローン病、ベーチェット症候群、痛風、癌、ウイルス感染、細菌感染、臓器移植状態、皮膚移植状態、及び移植片対宿主病の治療に有効である、請求項25記載の方法。
【請求項27】
前記炎症又は免疫の、状態又は疾患が、多発性硬化症、関節リウマチ、乾癬、喘息、炎症性腸疾患、臓器移植状態、及び皮膚移植状態からなる群から選択される、請求項25記載の方法。
【請求項28】
前記化合物がCXCR3を調節する、請求項25記載の方法。
【請求項29】
細胞を請求項1記載の化合物と接触させることを含む、前記細胞のCXCR3機能を調節する方法。
【請求項30】
CXCR3タンパク質を請求項1記載の化合物と接触させることを含む、CXCR3機能の調節の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公表番号】特表2008−504304(P2008−504304A)
【公表日】平成20年2月14日(2008.2.14)
【国際特許分類】
【出願番号】特願2007−518382(P2007−518382)
【出願日】平成17年6月28日(2005.6.28)
【国際出願番号】PCT/US2005/023275
【国際公開番号】WO2006/004925
【国際公開日】平成18年1月12日(2006.1.12)
【出願人】(506214851)アムジェン エスエフ エルエルシー (3)
【Fターム(参考)】
【公表日】平成20年2月14日(2008.2.14)
【国際特許分類】
【出願日】平成17年6月28日(2005.6.28)
【国際出願番号】PCT/US2005/023275
【国際公開番号】WO2006/004925
【国際公開日】平成18年1月12日(2006.1.12)
【出願人】(506214851)アムジェン エスエフ エルエルシー (3)
【Fターム(参考)】
[ Back to top ]

