テルペン合成酵素遺伝子のスクリーニング方法
【課題】既知/未知問わず、テルペン類を生物生産できるようにするためには、その合成酵素の遺伝子を取得する必要がある。また、その生物生産系の構築のためには、酵素活性の高いテルペン合成酵素変異体のスクリーニング方法が必要である。
【解決手段】テルペン合成酵素の「基質消費能」に基づき、テルペン合成酵素をスクリーニングする方法を提供する。具体的には、テルペン酵素群と同じ基質を原料とする種々の色素の生合成経路を細胞内に構築し、これらの細胞にテルペン合成酵素の遺伝子を導入して色素合成経路から原料を奪うことにより、細胞あたりの色素合成量が減少することを指標にした、テルペン合成酵素のスクリーニング方法を提供する。また、本発明の方法により得られたファルネシル二リン酸合成酵素変異体及びその遺伝子を提供する。
【解決手段】テルペン合成酵素の「基質消費能」に基づき、テルペン合成酵素をスクリーニングする方法を提供する。具体的には、テルペン酵素群と同じ基質を原料とする種々の色素の生合成経路を細胞内に構築し、これらの細胞にテルペン合成酵素の遺伝子を導入して色素合成経路から原料を奪うことにより、細胞あたりの色素合成量が減少することを指標にした、テルペン合成酵素のスクリーニング方法を提供する。また、本発明の方法により得られたファルネシル二リン酸合成酵素変異体及びその遺伝子を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、テルペン合成酵素遺伝子のスクリーニング方法に関する。
【背景技術】
【0002】
テルペンは最初精油に含まれるC10H16の分子式をもつ炭化水素のことであったが、テルペンと呼ばれる対象が拡大し、現在では(C5H8)nの組成の炭化水素及びそれから導かれる含酸素/含窒素化合物並びに不飽和度を異にする物も意味するようになった。拡張された範囲のものをテルペノイドと称する場合も多い。上記分子式のnの数が2のものをモノテルペン、3をセスキテルペン、4をジテルペン、6をトリテルペン、8をテトラテルペン、および多数のものをポリテルペンと称する。自然界には既知/未知を含めて百万超のテルペンがあると言われている。これら全てのテルペン化合物はイソペンテニル二リン酸(以下、IPP)という共通の前駆体からテルペン合成経路を介して合成される。IPPは、アセチルCoAを出発物とするメバロン酸経路や、ピルビン酸を出発物とする非メバロン酸経路を経て合成される(非特許文献1,2)。これら経路で合成されたIPPおよびその構造異性体であるジメチルアリル二リン酸 (以下、DMAPP) にプレニルトランフェラーゼが作用することにより、ゲラニル二リン酸、ファルネシル二リン酸、ゲラニルゲラニル二リン酸などの鎖状アルコール二リン酸エステルが生成される。これらの生成物を基質としてテルペン合成酵素の作用によりテルペンが合成されるが、これらの酵素は鎖状のテルペンを与えるほか、閉環、ヒドリドやアルキル基転位、水やアミンの付加、脱水素、酸素官能基導入、脱炭酸反応を行い、多種多様な骨格を持つテルペンを生成する。
【0003】
テルペンの中には、香料、防虫剤、アロマオイルとしての工業価値を有するものに加え、抗菌/免疫賦活/精神安定/抗マラリアなど、様々な薬理活性を有するものが多いがその殆どが未知である。
【0004】
テルペンにはさまざまな生理機能があることから、その合成酵素遺伝子の探索が盛んである。しかし、テルペン生合成に係わる合成酵素をコードする遺伝子の全てを網羅的に取得する方法は提案されていない。
現在のところ、既知のテルペン合成酵素遺伝子と有意なホモロジーをもつ遺伝子をゲノムデータベースからテルペン合成酵素遺伝子であると推定し、それらの活性をひとつひとつLC-MSやGC-MSを用いて同定し認定するという手法がとられている(非特許文献3)。
【0005】
さらにテルペン化合物の殆どは無色であり、その合成酵素の活性は、色の濃淡などで直接判定するハイスループットスクリーニングが実施できなかった。
つまり、自然界には、膨大なテルペン化合物があり、その合成酵素遺伝子も膨大であり、未知のテルペンも莫大に存在する。しかしながら、テルペン合成酵素を網羅的に一挙取得することは不可能であり、とくに未知のテルペン分子をつくる合成酵素の機能は、簡単に同定することはできない。
また、既知のテルペン合成酵素遺伝子とホモロジーが低い遺伝子は、そもそもテルペン合成酵素遺伝子と推定されないため、従来のホモロジーに基づいたスクリーニングでは探し漏らしてしまう事情がある。
【0006】
一方、テルペン合成酵素遺伝子の多くは植物由来であるため、大腸菌や酵母などの宿主では発現量が低く、発現する酵素の安定性や活性も低い。つまりコドン利用(codon usage)の非最適化、翻訳後修飾の欠如、会合パートナーの不在などによって、本来の活性を発揮できない場合が多い。また、テルペン合成酵素は、酵素活性が高くないものが多い。これらが、テルペン合成酵素の生物・大量生産系の構築の大きな足かせとなっている。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Goldstein, J.L. et al.; Nature 343,425-430(1990)
【非特許文献2】Hunter, W.N.; J Biol Chem 282,21573-21577(2007)
【非特許文献3】Mijts, B.N. et al.; Chem Biol 12,453-460(2005)
【発明の概要】
【発明が解決しようとする課題】
【0008】
自然界の既知および未知のテルペンを生物生産できるようにするためには、まず、その合成酵素の遺伝子を取得する必要があり、そのスクリーニング方法の開発が必要である。また、テルペンの生物・大量生産系の構築のためには、宿主により発現される酵素の活性を大きく改良することが必要であり、酵素活性の高いテルペン合成酵素変異体のスクリーニング方法の開発が必要である。
【0009】
すなわち、本発明の課題は、テルペン合成酵素遺伝子の一般的な、そして組織的なスクリーニング方法、および、酵素活性の高いテルペン合成酵素変異体取得のための一般的な手法を提供することである。
【課題を解決するための手段】
【0010】
本発明者らは上記課題を解決すべく鋭意研究を行い、百万を超えるほどあるといわれるテルペン化合物もすべてイソペンテニル二リン酸という共通の前駆体からテルペン合成経路を介して合成される点に着目した。そして、合成されたテルペン(プロダクト)を指標にするのではなく、得ようとするテルペン合成酵素の「基質消費能」に基づき、テルペン合成酵素をスクリーニングする方法、および、酵素活性の高いテルペン合成酵素変異体をスクリーニングする方法を開発した。
【0011】
具体的には、テルペン合成酵素群の基質と同じ基質を原料とする、種々の色素の生合成経路を細胞内に構築する。これらの細胞にテルペン合成酵素遺伝子を導入すると、基質の一部を色素合成経路から奪うため、細胞あたりの色素合成量が減少する。結果、細胞色の退色としてテルペン合成酵素の活性が可視化される。すなわち、より薄い色を示す細胞に導入した被検遺伝子を選択することにより、テルペン合成酵素を同定することができる。
【0012】
すなわち、本発明は、以下からなる。
1.被検遺伝子を色素合成可能な細胞に導入し、色素合成量の低下を検出することを特徴とする、テルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
2.色素合成量の低下が、色素合成に関与する酵素の基質がテルペン合成酵素により消費されることによる色素合成量の低下である、前項1に記載のテルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
3.細胞が大腸菌または酵母である前項1または2に記載のテルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
4.色素合成可能な細胞が色素合成に関与する酵素遺伝子またはその変異体により形質転換された細胞である前項1〜3のいずれか一に記載のテルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
5.色素合成に関与する酵素遺伝子がジアポフィトエン合成酵素(CrtM)遺伝子、デヒドロスクアレン不飽和化酵素(CrtN)遺伝子、ゲラニルゲラニル二リン酸合成酵素(CrtE)遺伝子、フィトエン合成酵素(CrtB)遺伝子、フィトエン脱水素酵素(CrtI)遺伝子及びゲラニル二リン酸合成酵素(GPS)遺伝子から選ばれる少なくとも1つまたはその変異体である前項4に記載のテルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
6.前項1〜5のいずれか一に記載のスクリーニング方法に使用する、色素合成に関与する酵素の遺伝子またはその変異体により形質転換された色素合成可能細胞。
7.ジアポフィトエン合成酵素(CrtM)遺伝子若しくはその変異体、および/またはデヒドロスクアレン不飽和化酵素(CrtN)遺伝子若しくはその変異体により形質転換された色素合成可能細胞。
8.ゲラニル二リン酸合成酵素(GPS)遺伝子またはその変異体によりさらに形質転換された前項7に記載の色素合成可能細胞。
9.フィトエン合成酵素(CrtB)遺伝子若しくはその変異体、および/またはフィトエン脱水素酵素(CrtI)遺伝子若しくはその変異体により形質転換された色素合成可能細胞。
10.ゲラニルゲラニル二リン酸合成酵素(CrtE)遺伝子またはその変異体によりさらに形質転換された前項9に記載の色素合成可能細胞。
11.前項6〜10のいずれか一に記載の色素合成可能細胞を含むテルペン合成酵素遺伝子またはその変異体のスクリーニング用キット。
12.配列番号2に示すデヒドロスクアレン不飽和化酵素(CrtN)変異体をコードする遺伝子。
13.ファルネシル二リン酸合成酵素変異体FDSY81Aの121番目のアミノ酸のスレオニン、および/または、157番目のアミノ酸のバリンが変異したことを特徴とするファルネシル二リン酸合成酵素変異体。
14.121番目のアミノ酸スレオニンがアラニンもしくはセリンに変異し、および/または、157番目のアミノ酸のバリンがアラニンに変異したことを特徴とする前項13に記載のファルネシル二リン酸合成酵素変異体。
15.前項13又は14に記載のファルネシル二リン酸合成酵素変異体をコードする遺伝子。
【発明の効果】
【0013】
本発明は、生産物であるテルペンの種類、つまりテルペンの構造にかかわらず、また、配列未知の検体群(ライブラリ)からの配列による絞り込みに頼らず、テルペン合成酵素遺伝子のスクリーニングを可能とし、該酵素を網羅的に一挙取得する方法を提供できる。
本発明によれば、既知/未知問わず、あらゆるテルペン合成酵素の活性を、その生産物の種類に関わらず、基質消費能に基づいて可視化できる。さらに本発明により、視認可能な色素の利用による色スクリーニングが可能となり、多数の検体を対象としたハイスループット・スクリーニングが可能になる。
【0014】
本発明はまた、共導入する色素合成経路の種類を選択することによって、1)ファルネシル二リン酸(以下、C15PP)を原料とするセスキテルペン/トリテルペン合成酵素の探索、2)ゲラニルゲラニル二リン酸(以下、C20PP)を原料とするジテルペン/テトラテルペン合成酵素の探索、3)ゲラニル二リン酸(以下、C10PP)を原料とするモノテルペンの合成酵素の探索をそれぞれ独立に行うことができ、それぞれの酵素の最適化や変異を入れた酵素変異体のスクリーニングなど、更に細かなスクリーニング対応を可能にする。
加えるに、従来の構造(配列)の類似性からのアプローチ(たとえば非特許文献1、非特許文献3)とは異なり、機能面からのアプローチに基づく方法であることに特徴がある。つまり、本発明に係るスクリーニング方法は酵素活性に基づく手法なので、配列ホモロジーの低いテルペン合成酵素遺伝子も漏れることなく取得できる。
【0015】
本発明に係るスクリーニング方法では、宿主細胞、例えば大腸菌などの中で、より活性の高いテルペン合成酵素をコードする遺伝子が、高いスコアを示す。したがって、本発明に係るスクリーニング方法により、より活性の高い酵素をコードする遺伝子、つまり価値あるテルペン合成酵素を取得することができる。
例えば、既知のテルペン合成酵素遺伝子の変異体を大量に作成し、該変異体をトランスフェクションした宿主を使用して、酵素活性の高い、酵素の安定性の高い、又は発現量の高い変異体をスクリーニングできる。
【図面の簡単な説明】
【0016】
【図1】図1はテルペン合成経路を示した図である。
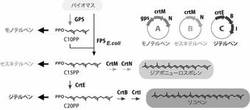
【図2】図2は3種類のテルペン合成活性の可視化機構を示した図である。CrtM/CrtNを発現する大腸菌(B)で、テルペンの合成酵素の遺伝子を共発現させると、黄色色素の合成経路から基質(C15PP)を奪うため、細胞色は白くなりテルペン合成活性を可視化できる。同様に、C20PPを消費するジテルペン合成遺伝子の発現は、CrtE/CrtB/CrtIを発現する大腸菌(C)の色をピンク色から白化するため、テルペン合成活性を可視化できる。C10PPを消費するモノテルペン合成遺伝子の発現は、GPS/CrtM/CrtN発現株(A)の色を黄から白にするため、テルペン合成活性を可視化できる。
【図3】図3はスクアレン合成酵素の活性を色素合成細胞を使用して測定した結果を示した図である。スクアレン合成酵素(図中、Sqswtと表示)およびその不活性変異体(図中、SqsY171Sと表示)を、CrtMおよびCrtNを発現する大腸菌(b)またはCrtM、CrtNおよびイソペンテニル二リン酸イソメラーゼ(idi)を発現する大腸菌(c)に導入し、色素合成量の分析を行った。図中、「null」は、SqswtおよびSqsY171Sを導入していない対照を意味する。大腸菌ペレットを(a)に示す(実施例1)。
【図4】図4はCrtN変異体を用いたC15PPスクリーニング細胞の細胞色の変化を示した図である(実施例2)。
【図5】図5はゲラニオール合成酵素の活性を色素合成細胞を使用して測定した結果を示した図である。CrtMおよびCrtNを発現する大腸菌(b)またはCrtM、CrtNおよびイソペンテニル二リン酸イソメラーゼ(idi)を発現する大腸菌(c)に、ゲラニオール合成酵素(図中、GESFullと表示)およびその不活性変異体(図中、GESc-endと表示)を導入し、色素合成量の分析を行った。図中、「null」は、GESFullおよびGESc-endを導入していない対照を意味する。これらの大腸菌ペレットを(a)に示す(実施例3)。
【図6】図6は、pAC-EBI-idiを導入した大腸菌に、FDSY81Aを親として作製した変異体ライブラリの遺伝子を導入し共発現させた後、寒天培地上に撒布してコロニー形成させた図である(実施例5)。親となるFDSY81A自体が弱いゲラニルファルネシル二リン酸合成酵素(CP25PP)の活性を持つため、うすいピンク色のコロニーを形成する。白いコロニーは、そのゲラニルファルネシル二リン酸合成酵素活性が高い変異体を発現しているクローンである。
【図7】図7は、FDSY81Aとそのアミノ酸置換体のC25PP合成能を示すものである:具体的には、基質選択性を緩めたカロテノイド合成酵素(CrtM)の変異体と大腸菌に共発現系させたときに蓄積されるカロテノイドの骨格スペクトルを表す(実施例5)。
【図8】図8左図は、大腸菌由来のファルネシル二リン酸合成酵素(FDS:ispA)と人工阻害剤との複合体の結晶構造を示し、ゲラニルファルネシル二リン酸(C25PP)合成活性が増強された変異体に見いだされたアミノ酸変異をその構造の上に示したものである。図8右図は、FDS、FDSY81A及びその変異体のC20PP消費活性示す(実施例6)。
【図9】図9は、5-エピアリストロケン合成酵素(TEAS)遺伝子含有ベクター(Ptrc-TEAS)を示す。(実施例7)
【図10】図10はTEASのC15PP消費活性示す。pUC18Nm-TEASをpAC-MNwt(左)あるいはpAC-EBI(右)と共発現し、細胞色および色素合成量を検定した(実施例7)。
【図11】図11はTEAS及びその不活性体のC15PP消費活性示す。pUC18Nm-TEASをpAC-MNwtと共発現し、細胞色および色素合成量を検定した(実施例7)。
【図12】図12はTEAS及びその不活性体のC15PP消費活性示す。pUC18Nm-TEASをpAC-EBIと共発現し、細胞色および色素合成量を検定した(実施例7)。
【図13】図13はタキサジエン合成酵素(TS)のC15PP消費活性示す。pUC18Nm-TSをpAC-MNwtと共発現し、細胞色および色素合成量を検定した(実施例8)。
【図14】図14はタキサジエン合成酵素(TS)のC20PP消費活性示す。pUC18Nm-TS を pAC-EBIと共発現し、細胞色および色素合成量を検定した(実施例8)。
【図15】図15はKafTomライブラリの中から選抜された3つのDNAの(a)C15PPおよび (b)C20PPカロテノイド消費機能を示す。(a)はpAC-MN+、(b)はpAC-EBI+であり、棒グラフはn=4の平均値であり、エラーバーはn=4の標準偏差である(実施例9)。
【発明を実施するための最良の形態】
【0017】
本発明は、テルペン合成酵素(例えば、モノテルペン、セスキテルペン、ジテルペン、セスタテルペン、トリテルペン、テトラテルペン合成酵素等)の探索を行うため、同一の基質(例えば、ゲラニル二リン酸(以下、C10PP)、ファルネシル二リン酸(以下、C15PP)、ゲラニルゲラニル二リン酸(以下、C20PP)等)から色素を合成することができる細胞にテルペン合成酵素遺伝子を導入し発現させて、基質の消費を競合させ、色素合成量の低下を検出することによる、テルペン合成酵素遺伝子のスクリーニング方法に関する。
さらに、本発明は、テルペン合成酵素遺伝子を色素合成可能な細胞に導入し、色素合成量の低下を検出することによる、活性の高いテルペン合成酵素の遺伝子またはその変異体をスクリーニングする方法に関する。
【0018】
「テルペン」は、テルペノイド、イソプレノイドとも呼ばれている。本発明の「テルペン」は広い意味で使用されているテルペンを対象とする。イソプレンを構成単位とする炭化水素で、植物や昆虫、菌類などによって作り出される生体物質である。もともと精油の中から大量に見つかった一群の炭素10個の化合物に与えられた名称であり、そのため炭素10個を基準として体系化されている。テルペンは、メバロン酸経路および非メバロン酸経路から生合成される。なお、これらの経路は生物種により異なっている。
【0019】
「テルペン合成酵素」とは、テルペン合成に関わる酵素である。
テルペンは生体内でメバロン酸またはピルビン酸から生合成される。テルペンの生合成の第一段階はイソプレン単位の生成であり、メバロン酸経路または非メバロン酸(MEP)経路からイソペンテニル二リン酸(IPP)およびジメチルアリル二リン酸(DMAPP)が合成され、この2つがイソプレン単位の起源である2つのC5分子(C5PP)である。
【0020】
テルペンの生合成の第二段階は、ジメチルアリル二リン酸(DMAPP)に次々にイソペンテニル二リン酸(IPP)が付加していくイソプレン単位の結合過程が挙げられ、これによって炭素数が5つずつ増えていく。
最初の段階はジメチルアリルトランストランスフェラーゼ (EC 2.5.1.1) によるIPP とDMAPPからのC10PPの合成で、これはモノテルペン生合成の出発物質となる。
ファルネシル二リン酸合成酵素(ファルネシル二リン酸シンターゼ)はIPPとC10PPを結合させてC15PPを合成する。これはセスキテルペン生合成に利用される。2分子のC15PPが結合するとスクアレンが生成し(スクアレン合成酵素)、コレステロールやフィトステロールといったトリテルペンへと変換されてゆく。
ゲラニルゲラニル二リン酸合成酵素はC15PPとIPPからジテルペンの基本骨格となるC20PPを合成する。さらに、2分子のC20PPが結合するとフィトエンが生成し、テトラテルペンであるカロテノイドの前駆物質となる。
【0021】
テルペンの生合成の第三段階は、種々の骨格の生成である。イソプレン単位結合により合成されたそれぞれの炭素数のテルペンは、種々の骨格生成過程を経て各テルペンが生合成される。この生合成経路にも種々の酵素が関与している。
【0022】
本発明でスクリーニングが可能なテルペン合成酵素は、イソペンテニル二リン酸(IPP)やジメチルアリル二リン酸(DMAPP)から各テルペンまでの合成経路で関与する酵素であり、スクリーニングで用いる細胞が有する色素合成経路に関与する酵素と基質を共通にする。各種生物内に有している天然の酵素であってもよいし、変異体であってもよい。
共通の基質として、例えば、C15PP、C20PP、C10PPなどの鎖状アルコール二リン酸エステルが挙げられる。
【0023】
C15PPを基質とする酵素としては、γ-フムレン合成酵素、ファルネソール合成酵素、アリストロケン合成酵素、β-ファルネセン合成酵素、ノートカトン合成酵素、スクアレン合成酵素等が挙げられる。これらは、C15PPから二リン酸を脱離させ、生じたカルボカチオンに基質自身を攻撃させ、種々の炭化水素化合物(あるいは水酸化化合物)を生成する。スクアレン合成酵素はC15PPを2つhead-to-headで縮合させ、C30骨格をもつ炭化水素スクアレンを合成する。いずれの酵素反応においても、基質も、中間体も、そして生産物も無色透明であるため、それそのものの分析をハイスループットに行うのは困難であるが、本発明の方法を用いれば、スクアレン合成酵素の活性を細胞内で、非破壊的に測定することが可能である。
【0024】
C20PPを基質とする酵素としては、タキサジエン合成酵素、コパリル二リン酸合成酵素、カスベン合成酵素等が挙げられる。ジテルペンの中には生理活性をもつものが数多くあり、その合成酵素の遺伝子探索法は極めて重要である。これらの酵素反応においても、基質、生産物ともに無色透明である。
【0025】
C10PPを基質とする酵素としては、ゲラニオール合成酵素、リモネン合成酵素、メントール合成酵素、ピネン合成酵素、ファルネシル二リン酸合成酵素(FDS)等が挙げられる。これらが触媒する酵素反応においても、基質、生産物ともに無色透明である。
【0026】
本発明における「テルペン合成酵素遺伝子」とは、テルペン合成酵素をコードする遺伝子である。「その変異体」とは、テルペン合成酵素遺伝子のDNAがその一部のヌクレオチドの置換、欠失、付加などにより変異した遺伝子の概念である。自然界で生じた変異でもよいし、人工的になされた変異でもよい。
変異は、発現酵素の酵素活性、発現量又は安定性が高くなる変異が好ましい。また基質特異性を高めるような変異も好ましい。特に、酵素活性を高める変異が好ましい。
変異体のライブラリを作成し、そのライブラリから、その宿主において酵素活性、発現量又は安定性が高い変異体を本発明の方法により、スクリーニングできる。このようにして得た活性が高い酵素として、例えば、中度好熱細菌(Bacillus stearothermophilus)由来のファルネシル二リン酸合成酵素(BstFDS)の変異体であるBstFDSY81A(ゲラニルファルネシル二リン酸合成活性を持つ)(以下FDSY81A)を挙げることができる(Ohnuma, S. et al.; J Biol Chem 271,30748-30754 (1996))。また、さらに酵素活性の高いFDSY81Aの変異体を挙げることができる。
【0027】
本発明における色素合成可能な細胞へ導入される被検遺伝子とは、テルペン合成酵素遺伝子若しくはその変異体を含むと考えられる遺伝子または遺伝子群である。天然の細胞から抽出した遺伝子、作製したライブラリーの遺伝子、化学合成遺伝子、PCR増幅遺伝子など由来は問わない。本発明は発現する酵素の基質消費能を指標とするため、未同定の遺伝子をスクリーニングすることができる。
【0028】
被検遺伝子またはテルペン合成酵素遺伝子若しくはその変異体の、色素合成可能な細胞への導入は、遺伝子組み換え技術で用いられている常法によることができる。例えば、ベクターにスクリーニング対象の遺伝子を組み込み、細胞を形質転換する等である。
【0029】
本発明で用いられる色素は、イソペンテニル二リン酸(IPP)を経由して生合成される色素およびその誘導体であり、色素合成に関与する酵素の基質がテルペン合成酵素の基質と共通する色素であれば制限されない。色素合成量の低下による色の変化の視認性が良い色素が好ましい。例えば、黄色より赤い色素の方が好ましい。色素合成に関与する酵素の変異体により生成された色素も好ましい。
【0030】
テルペンと基質を共有する(奪い合う)色素であれば、本手法は、自然界に知られるその他700超のカロテノイド、あるいは非天然骨格をもつ人工カロテノイド(Umeno, D. et al.; J Bacteriol 186, 1531-1536 (2004))によっても実施可能である。その他、特定のカロテノイド色素と結合することにより青色を呈するタンパク質、たとえばクラスタシアニン(Cianci, M. et al.; Proc Natl Acad Sci U S A 99, 9795-9800 (2002))なども有望である。望ましくは、視認性のよいカロテノイド色素(赤〜赤紫〜青紫)がよい。
本発明でカロテノイドとは、黄色ないし赤色または紫色の水不溶性のポリエン色素であり、炭素数40(C40)、C30、C45、C50のものを含む。C40のカロテノイドは、例えば、リコペン、βカロテン、アスタキサンチン、ルテイン、3,4,3',4'‐テトラデヒドロリコペン、トルレン等が挙げられる。C30(ジアポカロテノイド)としては、例えば、ジアポニューロスポレン、ジアポリコペン、ジアポリコペンジアール、スタフィロキサンチン等が挙げられる。
【0031】
色素合成に関与する酵素は、イソペンテニル二リン酸(IPP)やジメチルアリル二リン酸(DMAPP)から各色素までの合成経路で関与する酵素であり、直接の生成物が色素でない酵素を含む。また、色素合成に関与する酵素はテルペン合成経路で関与する酵素と基質を共通にする。各種生物内に有している天然の酵素であってもよいし、変異体でもよい。色素合成に関与する酵素を変異させることにより、視認性が良い色素を得ることができる。
【0032】
色素合成に関与する酵素遺伝子は、色素合成に関与する酵素をコードする遺伝子であり、「その変異体」とは、色素合成に関与する酵素遺伝子のDNAがその一部のヌクレオチドの置換、欠失、付加などにより変異した遺伝子の概念である。自然界で生じた変異でもよいし、人工的になされた変異でもよい。
変異は、発現される酵素の酵素活性、発現量又は安定性が高くなる変異が好ましい。また、酵素の生成物である色素をより鮮やかな色にする変異が好ましい。鮮やかな色にすることで、色素合成量の低下の検出、測定を容易にすることができる。
【0033】
好適な色素合成に関与する酵素遺伝子として、ジアポフィトエン合成酵素(CrtM)遺伝子、ジアポフィトエン脱水素酵素(CrtN)遺伝子、ゲラニルゲラニル二リン酸合成酵素(CrtE)遺伝子、フィトエン合成酵素(CrtB)遺伝子、フィトエン脱水素酵素(CrtI)遺伝子及びゲラニル二リン酸合成酵素(GPS)遺伝子、およびこれらの変異体を例示できる。細胞は、これら酵素遺伝子およびそれらの変異体から選ばれる少なくとも1つの遺伝子により形質転換される。
ジアポフィトエン合成酵素(CrtM)は、C15PPを基質としてジアポフィトエンを合成する。ジアポフィトエン脱水素酵素(CrtN)は、ジアポフィトエンを基質として、ジアポニューロスポレンを合成する。ゲラニルゲラニル二リン酸合成酵素(CrtE)は、C15PPを基質としてC20PPを合成する。フィトエン合成酵素(CrtB)は、C20PPを基質としてフィトエンを合成する。フィトエン脱水素酵素(CrtI)は、フィトエンを基質として、リコペンを合成する。ゲラニル二リン酸合成酵素(GPS)は、C5PPを基質としてC10PPを合成する。
【0034】
本発明はまた、黄色ブドウ球菌由来のジアポフィトエン不飽和化酵素(CrtN)の変異体およびその遺伝子に関する。野生型のジアポフィトエン不飽和化酵素(CrtN)は黄色の色素ジアポニューロスポレンを主に合成するが(Raisig, A. et al.; Biochim Biophys Acta1533, 164-170 (2001))、CrtN変異体は、赤色のジアポリコペンを合成する。このような改良により、視認性が良くなり、S/N比、定量性、信頼性の全てが飛躍的に向上する。
具体的には、CrtNの209番目のアミノ酸のグルタミン酸をグリシンに、242番目のアスパラギンをセリンに、286番目のメチオニンをバリンに変異したことを特徴とするCrtN変異体(配列番号2)である。このCrtN変異体酵素が、赤色のジアポリコペンを合成する(図4)。
当該CrtN変異体をコードする遺伝子として、例えば配列番号1の配列が挙げられる。黄色ブドウ球菌由来のジアポフィトエン不飽和化酵素(CrtN)遺伝子は黄色ブドウ球菌 S.aureus (ATCC 35556) ゲノムから入手することができ、遺伝子の置換は種々の部位特異的変異法により行うことができる。
【0035】
本発明で用いる、色素合成可能な細胞は、上記色素合成に関与する酵素により色素を生合成することができる細胞であれば制限されない。天然の細胞でも、遺伝子組み換えにより形質転換されている細胞でもよい。遺伝子組み換え細胞は、遺伝子組み換えの操作に簡便な細胞である、大腸菌、枯草菌、酵母などが挙げられる。
【0036】
本発明で用いる好ましい色素合成可能な細胞は、色素合成に関与する酵素遺伝子またはその変異体により形質転換されている細胞である。また、さらにイソペンテニル二リン酸イソメラーゼ(idi)遺伝子により、Idiを細胞に導入し、イソプレノイド経路を強化した細胞が好ましい。
【0037】
好適には、本発明で用いる色素合成可能な細胞は、ジアポフィトエン合成酵素(CrtM)遺伝子若しくはその変異体、および/またはデヒドロスクアレン不飽和化酵素(CrtN)遺伝子若しくはその変異体により形質転換された細胞である。その色素合成可能細胞は、C15PPを基質として、ジアポニューロスポレン(黄色)ジアポリコペン(赤色)等を生成し、細胞が黄色や赤色等になる(図2)。CrtM遺伝子とCrtN遺伝子またはそれらの変異体は、同一のベクターに組み込まれていてもよいし、別のベクターに組み込まれていてもよい。
【0038】
好適な別の実施態様は、CrtM遺伝子若しくはその変異体、および/またはCrtN遺伝子若しくはその変異体に加えさらにゲラニル二リン酸合成酵素(GPS)遺伝子またはその変異体により形質転換された細胞である。その色素合成可能な細胞は、C10PPを基質として、ジアポニューロスポレン(黄色)ジアポリコペン(赤色)等を生成し、細胞が黄色や赤色等になる。CrtM遺伝子、CrtN遺伝子およびGPS遺伝子またはそれらの変異体は、同一のベクターに組み込まれていてもよいし、別のベクターに組み込まれていてもよい。
【0039】
好適な別の実施態様は、フィトエン合成酵素(CrtB)遺伝子若しくはその変異体、および/またはフィトエン脱水素酵素(CrtI)遺伝子若しくはその変異体により形質転換された細胞である。その色素合成可能細胞は、C20PPを基質として、リコペン(赤色)等を生成し、細胞がピンク色等になる。CrtB遺伝子及びCrtI遺伝子またはそれらの変異体は、同一のベクターに組み込まれていてもよいし、別のベクターに組み込まれていてもよい。
【0040】
好適な別の実施態様は、CrtB遺伝子若しくはその変異体、および/またはCrtI遺伝子若しくはその変異体に加えさらにゲラニルゲラニル二リン酸合成酵素(CrtE)遺伝子またはその変異体により形質転換された細胞である。その色素合成可能細胞は、C20PPを基質として、リコペン(赤色)等を生成し、細胞がピンク色等になる。特にC20PPを合成しない宿主(例えば大腸菌)にはCrtE遺伝子の導入が必要になる。CrtB遺伝子、CrtI遺伝子及びCrtE遺伝子またはそれらの変異体は、同一のベクターに組み込まれていてもよいし、別のベクターに組み込まれていてもよい。
【0041】
本発明における「色素合成量の低下」は、細胞における色素生合成の量が低下し、細胞中の色素量が減少することである。試料中にテルペン合成酵素遺伝子が存在し、色素生合成に関与する酵素の基質がテルペン合成酵素により奪われることにより、色素合成量が低下する。すなわち、本発明に係る方法において、被検遺伝子を導入した色素合成可能な細胞における色素合成量を、被検遺伝子を導入していない色素合成可能な細胞における色素合成量と比較し、色素合成量が低下した細胞を選択し、その細胞に導入された被検遺伝子をテルペン合成酵素遺伝子であると決定する。言い換えれば、本発明に係る方法において、色素細胞における色素合成量の低下をもたらす被検遺伝子を選択することにより、テルペン合成酵素遺伝子を得ることができる。
【0042】
色素合成量の低下を検出する方法、又は色素合成量の低下を測定する方法は、視認により実施できる。また、各種測定機器、マイクロプレートリーダー、分光光度計、測色光度計などの各種測定機器により検出できる。
本発明の方法を用いれば、細胞を破壊することなく、テルペン合成酵素の活性を検出又は測定することができる。具体的には、視認によるときは、細胞のコロニーをプレート上に作成し、コロニー色を観察する。視認によるものであれば、0.5-1.0mm直径のコロニーを形成させ、目視により探索する。
スループットをあげる必要があるときは、低倍率拡大鏡などを用い、より小さなコロニーを密集させる手法を用いることができる。また、画像解析ソフトウエアを用いることによって、コロニー色の強弱を定量化したり、コロニーピッカーを用いてスクリーニング全般を半自動化することもできる。
【0043】
本発明は、本発明のスクリーニング方法に使用する色素合成に関与する酵素の遺伝子またはその変異体により形質転換された色素合成可能細胞に関する。
【0044】
色素合成可能細胞として、ジアポフィトエン合成酵素(CrtM)遺伝子およびジアポフィトエン不飽和化酵素(CrtN)遺伝子またはそれらの変異体により形質転換された色素合成可能細胞を例示できる。当該色素合成可能細胞を用いて、CrtMの基質であるC15PPを基質とするテルペン合成酵素の遺伝子を検出し、そして、その酵素活性を測定することができる。また、CrtNの基質であるジアポフィトエンを基質とするテルペン合成酵素遺伝子を検出し、そして、その酵素活性を測定することができる。
当該色素合成可能細胞は、CrtMおよびCrtNまたはそれらの変異体により、ジアポニューロスポレン(黄色)ジアポリコペン(赤)等を生成し、黄色、赤色等の有色になる。被検体中に基質を共通にする酵素の遺伝子が存在すると、酵素が基質を奪い合うことにより、当該宿主における色素合成量が減少し、脱色又は色が薄くなる。
【0045】
色素合成可能細胞としてまた、ジアポフィトエン合成酵素(CrtM)遺伝子、ジアポフィトエン不飽和化酵素(CrtN)遺伝子及びゲラニル二リン酸合成酵素(GPS)遺伝子またはそれらの変異体により形質転換された色素合成可能細胞を例示できる。当該色素合成可能細胞を用いて、C10PPを基質とするテルペン合成遺伝子を検出し、そして、その酵素活性を測定することができる。C10PPが細胞内に蓄積されないような細胞(例えば大腸菌)ではC10PPを基質とするテルペン合成遺伝子が被検体中に存在していても、基質を奪い合うことができないため、色の変化を生じない可能性が高い。そこで、GPS遺伝子を細胞内に導入し、細胞内にC10PPを蓄積せしめ、奪い合わせることにより、C10PPを基質とするテルペン合成酵素遺伝子を検出することが可能になる。C10PPを基質とするテルペン合成酵素遺伝子の存在により、細胞色が脱色又は薄くなる。
【0046】
さらに、色素合成可能細胞として、フィトエン合成酵素(CrtB)遺伝子およびフィトエン脱水素酵素(CrtI)遺伝子またはそれらの変異体により形質転換された色素合成可能細胞を例示できる。
当該色素合成可能細胞を用いて、CrtBの基質であるC20PPを基質とするテルペン合成遺伝子を検出し、そして、その酵素活性を測定することができる。また、CrtIの基質であるフィトエンを基質とするテルペン合成遺伝子を検出し、そして、その酵素活性を測定することができる。
当該色素合成可能細胞は、CrtBおよびCrtIまたはそれらの変異体により、リコペン(赤色)等を生成し赤色等になる。被検体中に基質を共通にする酵素の遺伝子が存在すると、酵素が基質を奪い合うことにより、当該宿主における色素合成量が減少し、脱色又は色が薄くなる。
【0047】
さらにまた、色素合成可能細胞として、フィトエン合成酵素(CrtB)遺伝子、フィトエン脱水素酵素(CrtI)遺伝子及びゲラニルゲラニル二リン酸合成酵素(CrtE)遺伝子またはそれらの変異体により形質転換された色素合成可能細胞を例示できる。当該色素合成可能細胞を用いて、C20PPを基質とするテルペン合成遺伝子を検出し、そして、その酵素活性を測定することができる。C20PPを合成しない細胞(例えば大腸菌)を宿主とする場合は、ゲラニルゲラニル二リン酸合成酵素(CrtE)遺伝子をさらに導入することにより、C20PPを基質とするテルペン合成酵素遺伝子を検出することが可能になる。C20PPを基質とするテルペン合成酵素遺伝子の存在により、細胞色が脱色又は薄くなる。
【0048】
上記色素合成可能細胞は、常法により製造することができる。例えば、色素合成酵素遺伝子を、購入またはPCRなどにより常法により調製し、その遺伝子を宿主に適する発現ベクターに常法により組み込み、目的のベクターを選択し、そのベクターにより宿主細胞を常法により形質転換することにより得られる。色素合成遺伝子を二種類以上組み込むときは、同一の発現ベクターに組み込み形質転換に使用するか、異なるベクターに組み込み共形質転換する。
用いる宿主細胞は、制限されないが、培養時間の短縮やクローニングの容易さを考えれば、大腸菌、枯草菌、酵母などが好ましい。特に大腸菌、酵母が好ましく、好適な大腸菌としては、Escherichia coli XL1-Blueのようなクローニング株、HB101やBL21などの発現株に加え、テルペン前駆体の合成量が豊富な遺伝子ノックアウト株、たとえばJW1750 ΔgdhA (glutamate dehydrogenase欠損)、JW0110 ΔaceE(pyruvate dehydrogenase欠損)(Baba,T. et al.; Mol Syst Biol 2, 2006 0008 (2006))等が挙げられ、好適な酵母としては、標準的な発芽酵母、INVSc1(invitrogen)、YPH499(stratagene)等が挙げられる。
好適なベクターは、特に制限はなく、一般に用いられているベクターでよい。例えば、宿主が大腸菌であるときは、pUC18、pACYC184、などに由来するものが挙げられ、宿主が枯草菌であるときはpUB110、pE194、pC194、pHY300PLK DNAなどが、宿主が酵母であるときは、pRS303、YEp213、TOp2609等が挙げられる。
【0049】
本発明は、また、テルペン合成酵素遺伝子又はその変異体のスクリーニング用キットに関する。
本発明に係るキットは、色素合成可能細胞を含むものであり得る。色素合成可能細胞は、冷凍保存してバイアル内に封入したものが好適である。あるいは、本発明に係るキットは、所望の細胞を色素合成可能細胞に形質転換するための色素合成酵素遺伝子発現ベクターを構成要素として含むものであり得る。
さらに、上記本発明に係るキットは、被検遺伝子用の発現ベクター、クローニング酵素セット、メタゲノムソース、あるいは配列データベースをもとに作製された(候補)遺伝子ライブラリ、マイクロプレート、イソプレノイド経路(テルペン上流経路)の強化された菌株、培地や添加剤などのスクリーニングに有用な物質や器具(画像スキャナや測色光度計、色見本、コロニピッカー)などをキットの構成要素として加えることができる。
【0050】
本発明はさらにまた、本発明に係るスクリーニング方法で取得されたファルネシル二リン酸合成酵素(FDS)の変異体に関する。FDSはC15PP合成酵素であるが、当該変異体はゲラニルファルネシル二リン酸(C25PP)を合成する活性をもつ酵素である。
好ましい変異体は、中度好熱細菌(Bacillus Stearothermophilus)由来のBstFDSのアミノ酸81番チロシン(Y)がアラニン(A)へ置換したFDSY81Aのさらなる変異体である。FDSY81Aの121番のスレオニン(T)が変異した酵素、又は、157番のバリン(V)が変異した酵素を挙げることができる。好ましい121番のスレオニン(T)の変異は、アラニン(A)またはセリン(S)への変異であり、好ましい157番のバリン(V)の変異はアラニン(A)への変異である。
【0051】
テルペノイド群は、モノ(C10)、セスキ(C15)、ジ(C20)、セスタ(C25)、トリ(C30)、テトラ(C40)など骨格によって分類される。セスタテルペンは、真菌や海洋生物に報告が増えつつあるが、その種類は他に比べ少なく、その遺伝子が未知である。更にはC25PPの供給経路を構築した例もなく、生物生産の例はまだ一つもない。
ここで得られた中度好熱細菌(Bacillus Stearothermophilus)由来のFDS変異体は、大腸菌に最も効率よいC25PP供給能力を与えセスタテルペンの細胞生産系の提供に有用である。直鎖C25イソプレノイド膜は、古細菌などの膜主成分として使われているが、その合成遺伝子は未知である。C25PPは高度高熱菌のものがTachibanaらによって報告されているが(Tachibana, A et al; Eur J Biochem 267, 321-328 (2000))、その大腸菌での活性は非常に弱いものであった。これらの変異体によって、C25PPへの効率よい供給経路が初めて得られることとなった。
【0052】
本発明の理解を深めるために、以下の実施例により更に詳細に本発明を説明するが、本発明はこれら実施例に限定されるものではない。
【実施例1】
【0053】
<スクアレン合成酵素のC15PP消費によるCrtM/CrtN色素合成量低下>
スクアレン合成酵素は2つのC15PPをhead-to-headで縮合させ、C30骨格をもつ炭化水素スクアレンを合成する酵素である。基質も、中間体も、そして生産物も無色透明であるため、それらの分析をハイスループットに行うことは困難である。
しかしスクアレン合成酵素の基質と同一の基質に作用して色素合成する大腸菌を使用して、スクアレン合成酵素の活性を大腸菌内で非破壊的に測定することができた。
【0054】
(1)色素合成可能な細胞の調製
CrtM遺伝子とCrtN遺伝子を含む大腸菌発現用プラスミドpAC-MNwtを、常法により大腸菌(Escherichia coli)XL1-Blueに導入し、カロテノイド(ジアポニューロスポレン)合成可能細胞を得た。pAC-MNwtは、黄色ブドウ球菌(Staphylococcus aureus)のゲノムよりCrtMおよびCrtN遺伝子(GEN Bank ID: 1125277および1125276)をPCR増幅し、lacP下流において大腸菌発現用プラスミド(pAmod(Schmidt-Dannert, C. et al.; Nat Biotechnol 18, 750-753(2000)))に組み込み作製した。
また、CrtM遺伝子とCrtN遺伝子およびイソペンテニル二リン酸イソメラーゼ(idi)遺伝子(GEN Bank ID:949020)を含む大腸菌発現用プラスミドpAC-MNwt-idiを、常法により大腸菌(Escherichia coli)XL1-Blueに導入し、より多くのカロテノイド(ジアポニューロスポレン)を合成する細胞を得た。pAC-MNwt-idiは、大腸菌のゲノムからPCR増幅したidiをlacP/Oの制御下に配置したかたちで上記pAC-MNwtに組み込んだ。
【0055】
(2)ヒトスクアレン合成酵素遺伝子の調製
本来膜タンパク質であるスクアレン合成酵素を、大腸菌内で封入体を創らせずに発現させる(可溶性を上げる)ためには、この酵素の膜ドメインを切除することが重要である。そこでヒト由来のスクアレン合成酵素(全長417アミノ酸)のN末端30アミノ酸とC末端47アミノ酸を欠失させた全長340アミノ酸からなるスクアレン合成酵素hSqSwtをコードする遺伝子を得た(Thompson, J.F.et al.; Arch Biochem Biophys 350, 283-290(1998))。
さらに、スクアレン合成酵素hSqSwtの171番目のチロシンをセリンに置換したアミノ酸置換体hSqSY171Sをコードする遺伝子を得た。具体的には、hSqSWTをテンプレートとして、部位特異的変異導入法によりY171のコドンTAC (チロシン:Y)をAGC (セリン:S) に置換したhSqSY171Sをコードする遺伝子を得た。hSqSY171Sは触媒部位を壊した不活性変異体である(Gu,P. et al.; J Biol Chem 273, 12515-12525(1998))。これらを大腸菌発現用プラスミドpUC18Nm(Umeno, D. et al.; J Bacteriol 184,6690-6699 (2002))に挿入し、pUC-hSqSwtおよびpUC-hSqSY171Sを得た。
【0056】
(3)細胞色の観察
pAC-MNwt、あるいはpAC-MNwt-idiを持つ大腸菌XL1-Blueを、pUC-hSqSwt又はpUC-hSqSY171Sで形質転換し、30℃で液体培養してペレット細胞色を比較した。コントロールは pUC18Nmを使用した。
pAC-MNwtを持つ大腸菌XL1-BlueをpUC-hSqSwtで形質転換した細胞の細胞色は対照(pUC18Nm)を導入したものより、有意に黄色が脱色し、薄い黄色となった。pAC-MNwtを持つ大腸菌XL1-BlueをpUC-hSqSY171Sで形質転換した細胞の細胞色は、対照(pUC18Nm)を導入したものと比較して変化がなかった(図3(a))。
【0057】
(4)カロテノイド(ジアポニューロスポレン)合成量の比較
ペレット細胞色の観察と同時に、液体培養におけるカロテノイド合成量(TB培地、2mL)を測定した(pAC-MNwtおよびpAC-MNwt-idi)。結果を図3(b)および図3(c)に示した。
【0058】
野生型のスクアレン合成酵素hSqSwtをCrtMおよびCrtNと共発現させた場合、その色素合成量は、対照に比べ、明らかに少なくなった(図3(b)および(c))。これは、色素合成に使われるはずのC15PPがスクアレン合成に使われたからである。
アミノ酸置換体hSqSY171Sは、触媒部位を壊した不活性変異体である。このような変異体遺伝子の発現は、色素合成には殆ど影響なく、対照と同じレベルであった。
これらより、CrtM-CrtNによって創られる色素は、C15PP消費能力のある酵素の活性によって減少し、それが細胞色の減退として可視化できた。
なお、idi遺伝子の導入によってイソプレノイド経路を強化した場合(図3(c))、細胞のC15PPの実質濃度が上昇し、色素合成量も上がった。より強いテルペン合成酵素活性の検索には、CrtM遺伝子、CrtN遺伝子およびidi遺伝子を導入した細胞を用いるのが好適である。
【実施例2】
【0059】
<CrtN遺伝子変異体;合成色素の改良>
C20PPの消費活性はリコペンの色の退色、すなわち赤から白への明確な色変化を測定するため、正確で迅速なスクリーニングが可能である。これに対し、C15PPの消費活性は、ジアポニューロスポレンの色の退色、すなわち黄から白への退色度によって検出、測定するため、視認性が悪く、擬陽性が頻発するという問題があった。そこで、C15PPを、黄色ではなく鮮やかな赤色の色素に変換する経路を得るべく、CrtN(デヒドロスクアレン不飽和化酵素)にタンパク質工学的な改造を施した。
具体的には、CrtN遺伝子に変異PCR(マンガン法)でランダムな遺伝子変異を導入し、ライブラリ化した。CrtM遺伝子と共に大腸菌用発現プラスミド(pUC)に組み込んで、細胞色が赤くなるものを得た。得られた遺伝子変異体の塩基配列は配列番号1(アミノ酸配列は配列番号2)に示す配列であった。
【0060】
得られた遺伝子変異体を、CrtM遺伝子と共に大腸菌用発現プラスミドpAmodに組み込み、pAC-MN赤変異体を得た。このプラスミドを常法により大腸菌XL1-Blueに導入したところC15PPを、黄色ではなく鮮やかな赤色の色素に変換する経路(図4)を有する細胞を得た。
この改良によって、テルペン合成酵素遺伝子スクリーニング技術における、S/N比、定量性、信頼性の全てが飛躍的に向上した。
【実施例3】
【0061】
<ゲラニオール合成酵素によるCrtM/CrtN色素合成量低下>
ゲラニオール合成酵素(GES)は、モノテルペン合成酵素の一種であり、ゲラニル二リン酸から香料ゲラニオールを合成する。基質も生産物も無色透明である。
スイートバジル由来GES遺伝子(Iijima, Y. et al.; Plant Physiol134,370-379 (2004))、及び、同遺伝子のカルボキシル末端ドメイン(287〜567)あるいはN末端部(計286アミノ酸)欠失体(不活性体)の遺伝子(上記GES遺伝子のC末端部分のみをPCR増幅し、pUCベクターに組み込んだもの)を、大腸菌発現用プラスミド(pUC18Nm)に常法により組み込み、pUC-GESFull及びpUC-GESC-endを得た。
pAC-MNwt 、pAC-MNwt-idiまたはpAC-MN赤変異体をもつ大腸菌XL1-BlueにpUC-GESFullまたはpUC-GESC-endを導入した。
コロニーを形成させたところ、pUC-GESFullを導入したコロニーは、対照(pUC18Nm)を導入したものより、有意に色が薄いコロニーとして観察された。
また、CrtN変異体の遺伝子を含有するプラスミドpAC-MN赤変異体を用いた場合は、その活性の有無の視認性が格段に改良された。
同時に、液体培養(TB 2mL、30℃、48h) の後、カロテノイド成分をアセトン1mLで抽出し、吸収スペクトルから細胞あたりのカロテノイド合成量を算出した。有意な色素合成量の低下が観察された(図5)。
【実施例4】
【0062】
<モノテルペン合成酵素のC10PP消費によるGPS/CrtM/CrtN色素合成量低下>
大腸菌のファルネシル二リン酸合成酵素(FDS)はC10PPを殆どリリースすることなく、C5PPをC15PPに変換してしまう可能性がある。このとき、たとえモノテルペン合成活性(C10PP消費活性)があっても、それが奪うべきC10PPは細胞に蓄積されないので、色変化として検出できないという問題が発生する場合がある。
この問題を解決するため、この内因性のFDSとは別に、上記BstFDSのS82F変異体を作成した。この酵素変異体は、上記BstFDSの82番目のセリンがフェニルアラニンに置換されており、ゲラニル二リン酸合成酵素(GPS)としての機能を示す(特開平11−169178)。大腸菌由来のFDSについて、同様のことが試行され、これが大腸菌内に導入したモノテルペン活性を高めたという報告がある(Reiling, K.K. et al.; Biotechnol Bioeng 87, 200-212 (2004))。
【0063】
BstFDSS82Fを導入した細胞では、C10PPが、C5PP(ジメチルアリル二リン酸)を基質として合成され、C10PPが細胞内に多量に蓄積する。このC10PPは、内因性のFPS(ispA)によってC15PPに変換され、次いでCrtMおよびそれに続くCrtNによって色素が蓄積する。このとき、C10PPを消費するモノテルペン合成酵素があれば、C10PPを経由した前駆体(C15PP)の一部は色素合成に使われなくなるため、細胞色が退色する。
【実施例5】
【0064】
<C25PP(ゲラニルファルネシル二リン酸)合成酵素のスクリーニング/C20PP消費によるCrtE/CrtB/CrtI色素合成量低下>
FDS(ファルネシル二リン酸合成酵素)はジメチルアリル二リン酸とゲラニル二リン酸を結合させてC15PPを合成する酵素である。一方、FDSの81位のアミノ酸チロシンをアラニンに置換したFDSY81AはC15PPではなく、C20PP/C25PPの混合物を与える。プロダクト特異性を更にC25PPに対して高くした変異体を得るために、FDSY81Aを親としたライブラリを作成し、20消費活性(C25PP合成能)に対する機能スクリーニングを行った。
【0065】
(1)C20PPを消費するCrtE/CrtB/CrtI発現大腸菌(色素合成可能細胞)の調製
CrtE遺伝子、CrtB遺伝子、及びCrtI遺伝子及びidi遺伝子を含む大腸菌発現用プラスミドpAC-EBI-idiを調製した。具体的には、土壌細菌(Pantoea ananatis, DSM30080)のゲノムから CrtE, CrtBおよびCrtI遺伝子をPCR増幅し、lacP/O下流において大腸菌用発現プラスミド(pAmod)に組み込み pAC-EBIを得た。このpAC-EBIに大腸菌ゲノムからPCR増幅したidiをlacP/O下流において組み込み 、pAC-EBI-idiを得た。
常法によりpAC-EBI-idiを大腸菌XL1-Blueに導入し、カロテノイド(リコペン)合成可能細胞を得た。なお、大腸菌はC20PPを合成しないため、C15PPからC20PPの合成を触媒するCrtEを導入することが必要である。
【0066】
(2)中度好熱細菌(バチラス属)由来変異FDS遺伝子ライブラリの作成
中度好熱菌(バチラス属)由来のFDS遺伝子について変異体ライブラリを作成した。具体的には、FDSY81A遺伝子(ATCCから入手した精製ゲノムDNA(ATCC 12980D-5)から該当遺伝子をPCR増幅したもの。GENE BankID:13293、文献:Koyama T, et al.,J. Biochem., 133(3), 355-63 (1993) )に変異PCR(マンガン法)(Cadwell, R.C. et al.; PCR Methods Appl 2, 28-33 (1992))で遺伝子変異を導入し、大腸菌用発現プラスミド(pUC18Nm)に組み込み変異体ライブラリ(以下EP-PCRライブラリという。)を得た。
【0067】
(3)ライブラリ遺伝子のCrtE/CrtB/CrtI発現大腸菌への導入とスクリーニング
pAC-EBI-idiを持つXL1-Blueに、これらライブラリの遺伝子を挿入した大腸菌発現用プラスミドpUC18Nm(上述)をトランスフェクションし、37℃でコロニーを形成させた後、室温に静置してコロニー色を観察した(図6)。同時に、液体培養におけるカロテノイド合成量(TB培地,2mL)も測定した。
白いコロニを選択することにより、ゲラニルファルネシル二リン酸合成活性、すなわちC20PPからC25PPを合成する活性をもつC25PP合成酵素変異体を3つ取得した。それらの酵素変異体の配列は、以下のとおりであった。
【0068】
【表1】

2つの変異体は、81番アミノ酸の置換に加え、121番のスレオニン(T)がアラニン(A)またはセリン(S)に変異したものであり、もうひとつは、81番アミノ酸の置換に加え、157番のバリン(V)がアラニン(A)に変異しているFDSであった。
【0069】
(4)スクリーニング前後の遺伝子の解析
1. 上記EP-PCRライブラリを大腸菌に導入し、LBプレート培地にコロニー形成させ、無作為に7つ選んで配列を決定した。
【表2】

【0070】
2.同じライブラリを、pAC-EBIをもつ大腸菌株に導入した。プレート上の白いコロニから変異体DNAを抽出し、その配列を読んだ。
【表3】

【0071】
塩基配列レベルでの遺伝子変異の数は、スクリーニング前には6.9ヌクレオチド変異/geneであったが、スクリーニング後の変異数は、平均3.0変異/geneと下がっていた。また、スクリーニング前の変異体には、non-synonymous変異や構造内部にnon-trivialな(化学的な性質の大きく異なるアミノ酸への置換)が沢山ある一方、スクリーニング後の変異体は殆どの変異が表層に集中していた。
従って、スクリーニング(白コロニーを拾うこと)により、C20PP消費機能を保持した酵素が選択され、機能/構造の保持に対して有害な変異が生じている酵素は除去されることが強く示唆される。なお、スクリーニング後のタンパク質のコア部分に見いだされた4つの変異は全てTrivial mutationsであった。
【表4】

【0072】
(5)新規C25PP合成酵素変異体のC25PP合成能
C20消費活性スコアの上昇がみられた3つのFDS81変異体は、Y81Aに加えてT121AあるいはV157Aの変異を有していた。
そこで、得られた3つのFDS81変異体の遺伝子10-1、50-1、50-2とCrtM26/38遺伝子との共発現を試みた。
CrtMは、C15PP→C30カロテノイド骨格を合成する酵素であるが、F26A/W38A変異を導入した変異体M26/38は、C15, C20, C25までの様々な骨格をもつプレニル2リン酸を基質として、C30, C35, C40, C45, C50と多様な骨格のカロテノイドを生じる。FDSのC25PP合成能が上がっているならば(細胞内のC25/C20比が上がれば)、それを反映して、C50カロテノイドのピーク比も高まると期待された。実際、50-2(残基157に変異)が特に高いC50カロテノイド合成機能を示した。酵素変異体の乾燥菌体重量(DCW)当たりのカロテノイド合成量を図7に示す。
ここで得られた50-2は、大腸菌に効率よいC25PP供給能力を与え、セスタテルペンの細胞生産系の構築に重要であると考えられる。これらの変異体によって、C25PPへの効率よい供給経路が初めて得られることとなった。
【実施例6】
【0073】
<新規C25PP合成酵素変異体の作製、スクリーニング及びC20PP消費能>
3つのアミノ酸置換(Y81A, V157A, T121A)を単独又は組み合わせて7種類の遺伝子変異体を作出し、それらのC20PP消費活性を比較した。
【0074】
1.部位特異的変異導入法(SDM)を用いて、Y81A, V157A, T121A の全ての組み合わせで変異体を作製し、pUC18Nmベクターに組み込んだ。
2.大腸菌(XL1 Blue)にpAC-EBI-idiと共形質転換し、コロニーを形成させた。
3.コロニーから LB(Carb/Cm) 500μLへ植菌して培養した(37℃、16h、n=4)。
4.この培養液 10μLを TB(Carb/Cm) 2mLへ植菌して培養した(30℃、48h)。
5.大腸菌を遠心集菌し、細胞内の脂溶性画分をアセトン1mLで抽出した。
6.抽出液300μLの吸光スペクトルを測定し、極大吸収波長での吸光度から色素量を算出した。
【0075】
野生型のFDSを加えると、リコペン(C40カロテノイド)の合成量が400→600μg/gDCWと50%も向上した。これはC20PPの前駆体であるC15PPを沢山供給できるからである。一方Y81A単独変異体を入れると、その合成量は1/4ほどになった。Y81A単独変異体は、いままでC25PPの供給路として採用してきた変異体である。
T121Aの変異は本研究で新規にみつかったアミノ酸変異である。V157Aの変異は1996年のOhnuma論文でアミノ酸変異として既に報告されているものである。これら単独では、色素合成量(C40カロテノイド合成能)はむしろ上昇した。これはT121A-V157A変異体でも同様であった。
一方、V157A変異又はT121A変異が、Y81Aの変異と組み合わせられると、色素(C40カロテノイド)は細胞内に全く蓄積せず、極めて強力なC20PP消費活性を示した(図8)。
【実施例7】
【0076】
<セスキテルペン合成酵素TEASのスクリーニング>
本実施例では、セスキテルペン合成酵素であるTEASを用いて、本スクリーニング系をセスキテルペン合成酵素活性の可視化に用いることが出来ることを示す。
セスキテルペン合成酵素として、タバコ(Nicotiana tabacum)由来の5-エピアリストロケン合成酵素(TEAS)を用いた。この酵素の主生成物である(+)-5-エピアリストロケンは、タバコのファイトアレキシンであるカプシジオールの前駆体として知られる。TEASは植物由来のセスキテルペンの中で初めて遺伝子が同定された酵素であり、その扱いやすさから、これまで様々な生化学および構造的な研究がなされてきた(Back K and Chappel J, J Biol Chem. 270 (1995) 7375-7381, Back K et al. Arch Biochem Biophys 315 (1994) 527-532, Mathis JR et al. Biochemistry 36(1997) 8340-8348)。
【0077】
(1)TEAS遺伝子の合成とベクターへの組み込み
Mr.Gene(GENEART)に依頼し、Nicotiana tabacum由来のTobacco 5-epi-アリストロケン合成酵素(TEAS)の遺伝子(1,653bps)を大腸菌にコドン最適化し、その上流にTrcプロモータを付したものを全合成した(Ptrc-TEAS)(図9)。Ptrc-TEASにXba IおよびXho I制限酵素処理をおこない、pUC18Nmベクターへ組み込んだ(pUC18Nm-TEAS)。
【0078】
(2)TEASによる色素合成量の低下
1.大腸菌(XL1 Blue)にPtrc-TEASとpAC-MNwtまたはpAC-EBIと共形質転換し、コロニー形成させた。
2.コロニーからLB(Carb/Cm) 500μLへ植菌して培養した(37℃、16h、n=4)。
3.この培養液10μLをTB(Carb/Cm/IPTG 0.1mM)2mLへ植菌して培養した(30℃、pAC-MN:24h培養、pAC-EBI:48h培養)。
4.大腸菌を遠心集菌し、細胞内の脂溶性画分をアセトン1mLで抽出した。
5.抽出液 300μLの吸光スペクトルを測定し、極大吸収波長での吸光度から色素量を算出した。
【0079】
セスキテルペン合成酵素であるTEASは、C15PPの消費活性を示すはずである。その大腸菌活性は非常に低いという報告(0.24μg/L;Martin VJJ et al. Biotechnol Bioeng. 75 (2001) 497-503)があったが、実際に細胞内でC30カロテノイド経路とともに発現させてみると、ほぼ完全に色素合成は抑えられ、その活性は容易に視認できた(図10)。
【0080】
(3)TEASの不活性体と色素合成量
1.PCRを用いた部位特異的変異法を用いて、TEASのD303(GAT)または R443(CGT)をA(GCG)に置換して、pUC18Nm-TEASD303Aおよび pUC18Nm-TEASR443Aを作製した。
2.大腸菌(XL1 Blue)に各種TEASプラスミドとpAC-MNwtまたはpAC-EBIと共形質転換し、コロニー形成させた。
3.コロニーから LB(Carb/Cm)500μLへ植菌して培養した(37℃、16h、n=4)。
4.この培養液 10μLを TB(Carb/Cm/IPTG 0.1 mM)2 mLへ植菌して培養した(30℃、pAC-MN:24h培養、pAC-EBI:48h培養)。
5.大腸菌を遠心集菌し、細胞内の脂溶性画分をアセトン1mLで抽出した。
6.抽出液 300μLの吸光スペクトルを測定し、極大吸収波長での吸光度から色素量を算出した。
【0081】
TEAS変異体は不活性であった(図11、図12)。TEASによる反応の第1ステップは、FPPのリン酸基が脱離して、カルボカチオンを形成することである。このリン酸基脱離反応は、Mg2+がリン酸基と結合することで起きる。TEASのD303はFPPの近傍にMg2+を保持する。R443 は、1)FPP のリン酸基と直接結合、また2)水を介して Mg2+を保持する役割をもつアミノ酸である。これらをAに置換すると、Mg2+とリン酸基が結合できず、TEAS変異体は不活性になったと考えられる。
【実施例8】
【0082】
<タキサジエン合成酵素(TS)のスクリーニング>
本実施例では、ジテルペン合成酵素であるタキサジエン合成酵素(TS)を用いて、本スクリーニング系をジテルペン合成酵素活性の可視化に用いることが出来ることを示す。
C20PP基質消費活性を確認するため、イチイ(Taxus brevifolia)由来のジテルペン環化酵素であるタキサジエン合成酵素(TS)を用いた。タキサジエン合成酵素はタキソール(パクリタキセル)生合成経路の最初の反応を触媒する酵素である。タキソールは抗腫瘍作用を持つことで知られ、近年ではアルツハイマー病等の神経変性疾患治療としても有用であるという報告もある。タキソールの化学合成は極めて収率が悪く(最高0.4%;Walji AM and MacMillan EWC. SYNLETT.10 (2007) 1477-1489)、さらには植物から得られる量も微量でありスケールアップが難しいことから、微生物の代謝工学を用いた生合成が注目されている(Ajikumar PK et al. Science 330 (2010) 70-75, Dejong JM et al.Biotechnol Bioeng. 93 (2006) 212-24)。
【0083】
Mr. Gene(GENEART)に依頼し、N末端を59残基削った Taxus brevifolia由来の タキサジエン合成酵素(TS)の遺伝子を大腸菌にコドン最適化して全合成した(Ptrc-TS)。
Ptrc-TSに Xba Iおよび Xho I制限酵素処理をおこない、pUC18Nmベクターへ組み込んだ(pUC18Nm-TS)。
タキサジエン合成酵素は N末端にplastidへの輸送ペプチド配列がある。その配列を削ることで、大腸菌内でのタキサジエン合成酵素の可溶性が高くなる。
【0084】
1.大腸菌(XL1 Blue)にpUC18Nm-TSとpAC-MNwtまたはpAC-EBIと共形質転換し、コロニー形成させた。
2.コロニーからLB(Carb/Cm)500μLへ植菌して培養した(37℃、16h、n=4)。
3.この培養液10μLをTB(Carb/Cm/IPTG 0.1 mM)2mLへ植菌して培養した(30℃、pAC-MN:24h培養、pAC-EBI:48h培養)。
4.大腸菌を遠心集菌し、細胞内の脂溶性画分をアセトン1 mLで抽出した。
5.抽出液 300μLの吸光スペクトルを測定し、極大吸収波長での吸光度から色素量を算出した。
【0085】
pAC-MNwtと共形質転換した細胞の液体培養のペレットを肉眼で見ると、黄色が若干薄かった(C15消費能、図13)。pAC-EBIと共形質転換した細胞の液体培養のペレットは肉眼でも写真でも色差がはっきりとわかった(C20消費能、図14)。
【実施例9】
【0086】
<トマトcDNAからのテルペン合成酵素遺伝子のスクリーニング>
本発明の方法を未同定のDNAに対して適用した。
1.セスキテルペン合成酵素(kaurene synthase, taxadiene synthase, copalyl synathase)をQuetyにしてかずさDNA研究所のトマトcDNAライブラリ:KaFTom(http://www.pgb.kazusa.or.jp/kaftom/)内をBLAST検索したところ、AK327297、AK324962、AK321354の3つがヒットした。
2.検索にかかった上の3つから、最長 ORFを与える配列に対してPCR増幅し、pUC18Nmに組み込んだ。( )内はそのORFから推定されるポリペプチドのアミノ酸長を示す。
LEFL2026E14(773 aa)AK327297
LEFL1089AH03(551 aa)AK324962
LEFL1023CC09(381 aa)AK321354
3.これらのプラスミドを、大腸菌(XL1 Blue)にpAC-MNまたはpAC-EBIと共形質転換し、コロニー形成させた。
4.コロニーからLB(Carb/Cm)500μLへ植菌して培養した(37℃、16h、n=6)。
5.この培養液10μLをTB(Carb/Cm/IPTG 0.1mM) 2mLへ植菌して培養した(30℃、48h)。
6.大腸菌を遠心集菌し、細胞内の脂溶性画分をアセトン1mLで抽出した。
7.抽出液 300μLの吸光スペクトルを測定し、極大吸収波長での吸光度から蓄積する色素量を算出した。
【0087】
C15Pスクリーニング系において、E14のみが強い活性(カロテノイド色素の蓄積量の減少)を示したが、それ以外については、殆ど活性に変化がなかった。一方、C20PPの消費能スクリーニングにおいては、ごく僅かながら合成量が下がっていた。このことから、このE14 遺伝子は、セスキテルペン合成酵素であることが強く示唆される(図15)。
このE14をQueryにしてBlast検索すると、表のとおりの結果を得た。こうして、本手法による遺伝子探索法としての有効性が示唆された。
【0088】
【表5】

【産業上の利用可能性】
【0089】
本発明は、テルペン合成酵素遺伝子の一般的な、そして組織的探索法を提供する。高活性のテルペン合成酵素変異体の取得を可能とする。
【技術分野】
【0001】
本発明は、テルペン合成酵素遺伝子のスクリーニング方法に関する。
【背景技術】
【0002】
テルペンは最初精油に含まれるC10H16の分子式をもつ炭化水素のことであったが、テルペンと呼ばれる対象が拡大し、現在では(C5H8)nの組成の炭化水素及びそれから導かれる含酸素/含窒素化合物並びに不飽和度を異にする物も意味するようになった。拡張された範囲のものをテルペノイドと称する場合も多い。上記分子式のnの数が2のものをモノテルペン、3をセスキテルペン、4をジテルペン、6をトリテルペン、8をテトラテルペン、および多数のものをポリテルペンと称する。自然界には既知/未知を含めて百万超のテルペンがあると言われている。これら全てのテルペン化合物はイソペンテニル二リン酸(以下、IPP)という共通の前駆体からテルペン合成経路を介して合成される。IPPは、アセチルCoAを出発物とするメバロン酸経路や、ピルビン酸を出発物とする非メバロン酸経路を経て合成される(非特許文献1,2)。これら経路で合成されたIPPおよびその構造異性体であるジメチルアリル二リン酸 (以下、DMAPP) にプレニルトランフェラーゼが作用することにより、ゲラニル二リン酸、ファルネシル二リン酸、ゲラニルゲラニル二リン酸などの鎖状アルコール二リン酸エステルが生成される。これらの生成物を基質としてテルペン合成酵素の作用によりテルペンが合成されるが、これらの酵素は鎖状のテルペンを与えるほか、閉環、ヒドリドやアルキル基転位、水やアミンの付加、脱水素、酸素官能基導入、脱炭酸反応を行い、多種多様な骨格を持つテルペンを生成する。
【0003】
テルペンの中には、香料、防虫剤、アロマオイルとしての工業価値を有するものに加え、抗菌/免疫賦活/精神安定/抗マラリアなど、様々な薬理活性を有するものが多いがその殆どが未知である。
【0004】
テルペンにはさまざまな生理機能があることから、その合成酵素遺伝子の探索が盛んである。しかし、テルペン生合成に係わる合成酵素をコードする遺伝子の全てを網羅的に取得する方法は提案されていない。
現在のところ、既知のテルペン合成酵素遺伝子と有意なホモロジーをもつ遺伝子をゲノムデータベースからテルペン合成酵素遺伝子であると推定し、それらの活性をひとつひとつLC-MSやGC-MSを用いて同定し認定するという手法がとられている(非特許文献3)。
【0005】
さらにテルペン化合物の殆どは無色であり、その合成酵素の活性は、色の濃淡などで直接判定するハイスループットスクリーニングが実施できなかった。
つまり、自然界には、膨大なテルペン化合物があり、その合成酵素遺伝子も膨大であり、未知のテルペンも莫大に存在する。しかしながら、テルペン合成酵素を網羅的に一挙取得することは不可能であり、とくに未知のテルペン分子をつくる合成酵素の機能は、簡単に同定することはできない。
また、既知のテルペン合成酵素遺伝子とホモロジーが低い遺伝子は、そもそもテルペン合成酵素遺伝子と推定されないため、従来のホモロジーに基づいたスクリーニングでは探し漏らしてしまう事情がある。
【0006】
一方、テルペン合成酵素遺伝子の多くは植物由来であるため、大腸菌や酵母などの宿主では発現量が低く、発現する酵素の安定性や活性も低い。つまりコドン利用(codon usage)の非最適化、翻訳後修飾の欠如、会合パートナーの不在などによって、本来の活性を発揮できない場合が多い。また、テルペン合成酵素は、酵素活性が高くないものが多い。これらが、テルペン合成酵素の生物・大量生産系の構築の大きな足かせとなっている。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Goldstein, J.L. et al.; Nature 343,425-430(1990)
【非特許文献2】Hunter, W.N.; J Biol Chem 282,21573-21577(2007)
【非特許文献3】Mijts, B.N. et al.; Chem Biol 12,453-460(2005)
【発明の概要】
【発明が解決しようとする課題】
【0008】
自然界の既知および未知のテルペンを生物生産できるようにするためには、まず、その合成酵素の遺伝子を取得する必要があり、そのスクリーニング方法の開発が必要である。また、テルペンの生物・大量生産系の構築のためには、宿主により発現される酵素の活性を大きく改良することが必要であり、酵素活性の高いテルペン合成酵素変異体のスクリーニング方法の開発が必要である。
【0009】
すなわち、本発明の課題は、テルペン合成酵素遺伝子の一般的な、そして組織的なスクリーニング方法、および、酵素活性の高いテルペン合成酵素変異体取得のための一般的な手法を提供することである。
【課題を解決するための手段】
【0010】
本発明者らは上記課題を解決すべく鋭意研究を行い、百万を超えるほどあるといわれるテルペン化合物もすべてイソペンテニル二リン酸という共通の前駆体からテルペン合成経路を介して合成される点に着目した。そして、合成されたテルペン(プロダクト)を指標にするのではなく、得ようとするテルペン合成酵素の「基質消費能」に基づき、テルペン合成酵素をスクリーニングする方法、および、酵素活性の高いテルペン合成酵素変異体をスクリーニングする方法を開発した。
【0011】
具体的には、テルペン合成酵素群の基質と同じ基質を原料とする、種々の色素の生合成経路を細胞内に構築する。これらの細胞にテルペン合成酵素遺伝子を導入すると、基質の一部を色素合成経路から奪うため、細胞あたりの色素合成量が減少する。結果、細胞色の退色としてテルペン合成酵素の活性が可視化される。すなわち、より薄い色を示す細胞に導入した被検遺伝子を選択することにより、テルペン合成酵素を同定することができる。
【0012】
すなわち、本発明は、以下からなる。
1.被検遺伝子を色素合成可能な細胞に導入し、色素合成量の低下を検出することを特徴とする、テルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
2.色素合成量の低下が、色素合成に関与する酵素の基質がテルペン合成酵素により消費されることによる色素合成量の低下である、前項1に記載のテルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
3.細胞が大腸菌または酵母である前項1または2に記載のテルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
4.色素合成可能な細胞が色素合成に関与する酵素遺伝子またはその変異体により形質転換された細胞である前項1〜3のいずれか一に記載のテルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
5.色素合成に関与する酵素遺伝子がジアポフィトエン合成酵素(CrtM)遺伝子、デヒドロスクアレン不飽和化酵素(CrtN)遺伝子、ゲラニルゲラニル二リン酸合成酵素(CrtE)遺伝子、フィトエン合成酵素(CrtB)遺伝子、フィトエン脱水素酵素(CrtI)遺伝子及びゲラニル二リン酸合成酵素(GPS)遺伝子から選ばれる少なくとも1つまたはその変異体である前項4に記載のテルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
6.前項1〜5のいずれか一に記載のスクリーニング方法に使用する、色素合成に関与する酵素の遺伝子またはその変異体により形質転換された色素合成可能細胞。
7.ジアポフィトエン合成酵素(CrtM)遺伝子若しくはその変異体、および/またはデヒドロスクアレン不飽和化酵素(CrtN)遺伝子若しくはその変異体により形質転換された色素合成可能細胞。
8.ゲラニル二リン酸合成酵素(GPS)遺伝子またはその変異体によりさらに形質転換された前項7に記載の色素合成可能細胞。
9.フィトエン合成酵素(CrtB)遺伝子若しくはその変異体、および/またはフィトエン脱水素酵素(CrtI)遺伝子若しくはその変異体により形質転換された色素合成可能細胞。
10.ゲラニルゲラニル二リン酸合成酵素(CrtE)遺伝子またはその変異体によりさらに形質転換された前項9に記載の色素合成可能細胞。
11.前項6〜10のいずれか一に記載の色素合成可能細胞を含むテルペン合成酵素遺伝子またはその変異体のスクリーニング用キット。
12.配列番号2に示すデヒドロスクアレン不飽和化酵素(CrtN)変異体をコードする遺伝子。
13.ファルネシル二リン酸合成酵素変異体FDSY81Aの121番目のアミノ酸のスレオニン、および/または、157番目のアミノ酸のバリンが変異したことを特徴とするファルネシル二リン酸合成酵素変異体。
14.121番目のアミノ酸スレオニンがアラニンもしくはセリンに変異し、および/または、157番目のアミノ酸のバリンがアラニンに変異したことを特徴とする前項13に記載のファルネシル二リン酸合成酵素変異体。
15.前項13又は14に記載のファルネシル二リン酸合成酵素変異体をコードする遺伝子。
【発明の効果】
【0013】
本発明は、生産物であるテルペンの種類、つまりテルペンの構造にかかわらず、また、配列未知の検体群(ライブラリ)からの配列による絞り込みに頼らず、テルペン合成酵素遺伝子のスクリーニングを可能とし、該酵素を網羅的に一挙取得する方法を提供できる。
本発明によれば、既知/未知問わず、あらゆるテルペン合成酵素の活性を、その生産物の種類に関わらず、基質消費能に基づいて可視化できる。さらに本発明により、視認可能な色素の利用による色スクリーニングが可能となり、多数の検体を対象としたハイスループット・スクリーニングが可能になる。
【0014】
本発明はまた、共導入する色素合成経路の種類を選択することによって、1)ファルネシル二リン酸(以下、C15PP)を原料とするセスキテルペン/トリテルペン合成酵素の探索、2)ゲラニルゲラニル二リン酸(以下、C20PP)を原料とするジテルペン/テトラテルペン合成酵素の探索、3)ゲラニル二リン酸(以下、C10PP)を原料とするモノテルペンの合成酵素の探索をそれぞれ独立に行うことができ、それぞれの酵素の最適化や変異を入れた酵素変異体のスクリーニングなど、更に細かなスクリーニング対応を可能にする。
加えるに、従来の構造(配列)の類似性からのアプローチ(たとえば非特許文献1、非特許文献3)とは異なり、機能面からのアプローチに基づく方法であることに特徴がある。つまり、本発明に係るスクリーニング方法は酵素活性に基づく手法なので、配列ホモロジーの低いテルペン合成酵素遺伝子も漏れることなく取得できる。
【0015】
本発明に係るスクリーニング方法では、宿主細胞、例えば大腸菌などの中で、より活性の高いテルペン合成酵素をコードする遺伝子が、高いスコアを示す。したがって、本発明に係るスクリーニング方法により、より活性の高い酵素をコードする遺伝子、つまり価値あるテルペン合成酵素を取得することができる。
例えば、既知のテルペン合成酵素遺伝子の変異体を大量に作成し、該変異体をトランスフェクションした宿主を使用して、酵素活性の高い、酵素の安定性の高い、又は発現量の高い変異体をスクリーニングできる。
【図面の簡単な説明】
【0016】
【図1】図1はテルペン合成経路を示した図である。
【図2】図2は3種類のテルペン合成活性の可視化機構を示した図である。CrtM/CrtNを発現する大腸菌(B)で、テルペンの合成酵素の遺伝子を共発現させると、黄色色素の合成経路から基質(C15PP)を奪うため、細胞色は白くなりテルペン合成活性を可視化できる。同様に、C20PPを消費するジテルペン合成遺伝子の発現は、CrtE/CrtB/CrtIを発現する大腸菌(C)の色をピンク色から白化するため、テルペン合成活性を可視化できる。C10PPを消費するモノテルペン合成遺伝子の発現は、GPS/CrtM/CrtN発現株(A)の色を黄から白にするため、テルペン合成活性を可視化できる。
【図3】図3はスクアレン合成酵素の活性を色素合成細胞を使用して測定した結果を示した図である。スクアレン合成酵素(図中、Sqswtと表示)およびその不活性変異体(図中、SqsY171Sと表示)を、CrtMおよびCrtNを発現する大腸菌(b)またはCrtM、CrtNおよびイソペンテニル二リン酸イソメラーゼ(idi)を発現する大腸菌(c)に導入し、色素合成量の分析を行った。図中、「null」は、SqswtおよびSqsY171Sを導入していない対照を意味する。大腸菌ペレットを(a)に示す(実施例1)。
【図4】図4はCrtN変異体を用いたC15PPスクリーニング細胞の細胞色の変化を示した図である(実施例2)。
【図5】図5はゲラニオール合成酵素の活性を色素合成細胞を使用して測定した結果を示した図である。CrtMおよびCrtNを発現する大腸菌(b)またはCrtM、CrtNおよびイソペンテニル二リン酸イソメラーゼ(idi)を発現する大腸菌(c)に、ゲラニオール合成酵素(図中、GESFullと表示)およびその不活性変異体(図中、GESc-endと表示)を導入し、色素合成量の分析を行った。図中、「null」は、GESFullおよびGESc-endを導入していない対照を意味する。これらの大腸菌ペレットを(a)に示す(実施例3)。
【図6】図6は、pAC-EBI-idiを導入した大腸菌に、FDSY81Aを親として作製した変異体ライブラリの遺伝子を導入し共発現させた後、寒天培地上に撒布してコロニー形成させた図である(実施例5)。親となるFDSY81A自体が弱いゲラニルファルネシル二リン酸合成酵素(CP25PP)の活性を持つため、うすいピンク色のコロニーを形成する。白いコロニーは、そのゲラニルファルネシル二リン酸合成酵素活性が高い変異体を発現しているクローンである。
【図7】図7は、FDSY81Aとそのアミノ酸置換体のC25PP合成能を示すものである:具体的には、基質選択性を緩めたカロテノイド合成酵素(CrtM)の変異体と大腸菌に共発現系させたときに蓄積されるカロテノイドの骨格スペクトルを表す(実施例5)。
【図8】図8左図は、大腸菌由来のファルネシル二リン酸合成酵素(FDS:ispA)と人工阻害剤との複合体の結晶構造を示し、ゲラニルファルネシル二リン酸(C25PP)合成活性が増強された変異体に見いだされたアミノ酸変異をその構造の上に示したものである。図8右図は、FDS、FDSY81A及びその変異体のC20PP消費活性示す(実施例6)。
【図9】図9は、5-エピアリストロケン合成酵素(TEAS)遺伝子含有ベクター(Ptrc-TEAS)を示す。(実施例7)
【図10】図10はTEASのC15PP消費活性示す。pUC18Nm-TEASをpAC-MNwt(左)あるいはpAC-EBI(右)と共発現し、細胞色および色素合成量を検定した(実施例7)。
【図11】図11はTEAS及びその不活性体のC15PP消費活性示す。pUC18Nm-TEASをpAC-MNwtと共発現し、細胞色および色素合成量を検定した(実施例7)。
【図12】図12はTEAS及びその不活性体のC15PP消費活性示す。pUC18Nm-TEASをpAC-EBIと共発現し、細胞色および色素合成量を検定した(実施例7)。
【図13】図13はタキサジエン合成酵素(TS)のC15PP消費活性示す。pUC18Nm-TSをpAC-MNwtと共発現し、細胞色および色素合成量を検定した(実施例8)。
【図14】図14はタキサジエン合成酵素(TS)のC20PP消費活性示す。pUC18Nm-TS を pAC-EBIと共発現し、細胞色および色素合成量を検定した(実施例8)。
【図15】図15はKafTomライブラリの中から選抜された3つのDNAの(a)C15PPおよび (b)C20PPカロテノイド消費機能を示す。(a)はpAC-MN+、(b)はpAC-EBI+であり、棒グラフはn=4の平均値であり、エラーバーはn=4の標準偏差である(実施例9)。
【発明を実施するための最良の形態】
【0017】
本発明は、テルペン合成酵素(例えば、モノテルペン、セスキテルペン、ジテルペン、セスタテルペン、トリテルペン、テトラテルペン合成酵素等)の探索を行うため、同一の基質(例えば、ゲラニル二リン酸(以下、C10PP)、ファルネシル二リン酸(以下、C15PP)、ゲラニルゲラニル二リン酸(以下、C20PP)等)から色素を合成することができる細胞にテルペン合成酵素遺伝子を導入し発現させて、基質の消費を競合させ、色素合成量の低下を検出することによる、テルペン合成酵素遺伝子のスクリーニング方法に関する。
さらに、本発明は、テルペン合成酵素遺伝子を色素合成可能な細胞に導入し、色素合成量の低下を検出することによる、活性の高いテルペン合成酵素の遺伝子またはその変異体をスクリーニングする方法に関する。
【0018】
「テルペン」は、テルペノイド、イソプレノイドとも呼ばれている。本発明の「テルペン」は広い意味で使用されているテルペンを対象とする。イソプレンを構成単位とする炭化水素で、植物や昆虫、菌類などによって作り出される生体物質である。もともと精油の中から大量に見つかった一群の炭素10個の化合物に与えられた名称であり、そのため炭素10個を基準として体系化されている。テルペンは、メバロン酸経路および非メバロン酸経路から生合成される。なお、これらの経路は生物種により異なっている。
【0019】
「テルペン合成酵素」とは、テルペン合成に関わる酵素である。
テルペンは生体内でメバロン酸またはピルビン酸から生合成される。テルペンの生合成の第一段階はイソプレン単位の生成であり、メバロン酸経路または非メバロン酸(MEP)経路からイソペンテニル二リン酸(IPP)およびジメチルアリル二リン酸(DMAPP)が合成され、この2つがイソプレン単位の起源である2つのC5分子(C5PP)である。
【0020】
テルペンの生合成の第二段階は、ジメチルアリル二リン酸(DMAPP)に次々にイソペンテニル二リン酸(IPP)が付加していくイソプレン単位の結合過程が挙げられ、これによって炭素数が5つずつ増えていく。
最初の段階はジメチルアリルトランストランスフェラーゼ (EC 2.5.1.1) によるIPP とDMAPPからのC10PPの合成で、これはモノテルペン生合成の出発物質となる。
ファルネシル二リン酸合成酵素(ファルネシル二リン酸シンターゼ)はIPPとC10PPを結合させてC15PPを合成する。これはセスキテルペン生合成に利用される。2分子のC15PPが結合するとスクアレンが生成し(スクアレン合成酵素)、コレステロールやフィトステロールといったトリテルペンへと変換されてゆく。
ゲラニルゲラニル二リン酸合成酵素はC15PPとIPPからジテルペンの基本骨格となるC20PPを合成する。さらに、2分子のC20PPが結合するとフィトエンが生成し、テトラテルペンであるカロテノイドの前駆物質となる。
【0021】
テルペンの生合成の第三段階は、種々の骨格の生成である。イソプレン単位結合により合成されたそれぞれの炭素数のテルペンは、種々の骨格生成過程を経て各テルペンが生合成される。この生合成経路にも種々の酵素が関与している。
【0022】
本発明でスクリーニングが可能なテルペン合成酵素は、イソペンテニル二リン酸(IPP)やジメチルアリル二リン酸(DMAPP)から各テルペンまでの合成経路で関与する酵素であり、スクリーニングで用いる細胞が有する色素合成経路に関与する酵素と基質を共通にする。各種生物内に有している天然の酵素であってもよいし、変異体であってもよい。
共通の基質として、例えば、C15PP、C20PP、C10PPなどの鎖状アルコール二リン酸エステルが挙げられる。
【0023】
C15PPを基質とする酵素としては、γ-フムレン合成酵素、ファルネソール合成酵素、アリストロケン合成酵素、β-ファルネセン合成酵素、ノートカトン合成酵素、スクアレン合成酵素等が挙げられる。これらは、C15PPから二リン酸を脱離させ、生じたカルボカチオンに基質自身を攻撃させ、種々の炭化水素化合物(あるいは水酸化化合物)を生成する。スクアレン合成酵素はC15PPを2つhead-to-headで縮合させ、C30骨格をもつ炭化水素スクアレンを合成する。いずれの酵素反応においても、基質も、中間体も、そして生産物も無色透明であるため、それそのものの分析をハイスループットに行うのは困難であるが、本発明の方法を用いれば、スクアレン合成酵素の活性を細胞内で、非破壊的に測定することが可能である。
【0024】
C20PPを基質とする酵素としては、タキサジエン合成酵素、コパリル二リン酸合成酵素、カスベン合成酵素等が挙げられる。ジテルペンの中には生理活性をもつものが数多くあり、その合成酵素の遺伝子探索法は極めて重要である。これらの酵素反応においても、基質、生産物ともに無色透明である。
【0025】
C10PPを基質とする酵素としては、ゲラニオール合成酵素、リモネン合成酵素、メントール合成酵素、ピネン合成酵素、ファルネシル二リン酸合成酵素(FDS)等が挙げられる。これらが触媒する酵素反応においても、基質、生産物ともに無色透明である。
【0026】
本発明における「テルペン合成酵素遺伝子」とは、テルペン合成酵素をコードする遺伝子である。「その変異体」とは、テルペン合成酵素遺伝子のDNAがその一部のヌクレオチドの置換、欠失、付加などにより変異した遺伝子の概念である。自然界で生じた変異でもよいし、人工的になされた変異でもよい。
変異は、発現酵素の酵素活性、発現量又は安定性が高くなる変異が好ましい。また基質特異性を高めるような変異も好ましい。特に、酵素活性を高める変異が好ましい。
変異体のライブラリを作成し、そのライブラリから、その宿主において酵素活性、発現量又は安定性が高い変異体を本発明の方法により、スクリーニングできる。このようにして得た活性が高い酵素として、例えば、中度好熱細菌(Bacillus stearothermophilus)由来のファルネシル二リン酸合成酵素(BstFDS)の変異体であるBstFDSY81A(ゲラニルファルネシル二リン酸合成活性を持つ)(以下FDSY81A)を挙げることができる(Ohnuma, S. et al.; J Biol Chem 271,30748-30754 (1996))。また、さらに酵素活性の高いFDSY81Aの変異体を挙げることができる。
【0027】
本発明における色素合成可能な細胞へ導入される被検遺伝子とは、テルペン合成酵素遺伝子若しくはその変異体を含むと考えられる遺伝子または遺伝子群である。天然の細胞から抽出した遺伝子、作製したライブラリーの遺伝子、化学合成遺伝子、PCR増幅遺伝子など由来は問わない。本発明は発現する酵素の基質消費能を指標とするため、未同定の遺伝子をスクリーニングすることができる。
【0028】
被検遺伝子またはテルペン合成酵素遺伝子若しくはその変異体の、色素合成可能な細胞への導入は、遺伝子組み換え技術で用いられている常法によることができる。例えば、ベクターにスクリーニング対象の遺伝子を組み込み、細胞を形質転換する等である。
【0029】
本発明で用いられる色素は、イソペンテニル二リン酸(IPP)を経由して生合成される色素およびその誘導体であり、色素合成に関与する酵素の基質がテルペン合成酵素の基質と共通する色素であれば制限されない。色素合成量の低下による色の変化の視認性が良い色素が好ましい。例えば、黄色より赤い色素の方が好ましい。色素合成に関与する酵素の変異体により生成された色素も好ましい。
【0030】
テルペンと基質を共有する(奪い合う)色素であれば、本手法は、自然界に知られるその他700超のカロテノイド、あるいは非天然骨格をもつ人工カロテノイド(Umeno, D. et al.; J Bacteriol 186, 1531-1536 (2004))によっても実施可能である。その他、特定のカロテノイド色素と結合することにより青色を呈するタンパク質、たとえばクラスタシアニン(Cianci, M. et al.; Proc Natl Acad Sci U S A 99, 9795-9800 (2002))なども有望である。望ましくは、視認性のよいカロテノイド色素(赤〜赤紫〜青紫)がよい。
本発明でカロテノイドとは、黄色ないし赤色または紫色の水不溶性のポリエン色素であり、炭素数40(C40)、C30、C45、C50のものを含む。C40のカロテノイドは、例えば、リコペン、βカロテン、アスタキサンチン、ルテイン、3,4,3',4'‐テトラデヒドロリコペン、トルレン等が挙げられる。C30(ジアポカロテノイド)としては、例えば、ジアポニューロスポレン、ジアポリコペン、ジアポリコペンジアール、スタフィロキサンチン等が挙げられる。
【0031】
色素合成に関与する酵素は、イソペンテニル二リン酸(IPP)やジメチルアリル二リン酸(DMAPP)から各色素までの合成経路で関与する酵素であり、直接の生成物が色素でない酵素を含む。また、色素合成に関与する酵素はテルペン合成経路で関与する酵素と基質を共通にする。各種生物内に有している天然の酵素であってもよいし、変異体でもよい。色素合成に関与する酵素を変異させることにより、視認性が良い色素を得ることができる。
【0032】
色素合成に関与する酵素遺伝子は、色素合成に関与する酵素をコードする遺伝子であり、「その変異体」とは、色素合成に関与する酵素遺伝子のDNAがその一部のヌクレオチドの置換、欠失、付加などにより変異した遺伝子の概念である。自然界で生じた変異でもよいし、人工的になされた変異でもよい。
変異は、発現される酵素の酵素活性、発現量又は安定性が高くなる変異が好ましい。また、酵素の生成物である色素をより鮮やかな色にする変異が好ましい。鮮やかな色にすることで、色素合成量の低下の検出、測定を容易にすることができる。
【0033】
好適な色素合成に関与する酵素遺伝子として、ジアポフィトエン合成酵素(CrtM)遺伝子、ジアポフィトエン脱水素酵素(CrtN)遺伝子、ゲラニルゲラニル二リン酸合成酵素(CrtE)遺伝子、フィトエン合成酵素(CrtB)遺伝子、フィトエン脱水素酵素(CrtI)遺伝子及びゲラニル二リン酸合成酵素(GPS)遺伝子、およびこれらの変異体を例示できる。細胞は、これら酵素遺伝子およびそれらの変異体から選ばれる少なくとも1つの遺伝子により形質転換される。
ジアポフィトエン合成酵素(CrtM)は、C15PPを基質としてジアポフィトエンを合成する。ジアポフィトエン脱水素酵素(CrtN)は、ジアポフィトエンを基質として、ジアポニューロスポレンを合成する。ゲラニルゲラニル二リン酸合成酵素(CrtE)は、C15PPを基質としてC20PPを合成する。フィトエン合成酵素(CrtB)は、C20PPを基質としてフィトエンを合成する。フィトエン脱水素酵素(CrtI)は、フィトエンを基質として、リコペンを合成する。ゲラニル二リン酸合成酵素(GPS)は、C5PPを基質としてC10PPを合成する。
【0034】
本発明はまた、黄色ブドウ球菌由来のジアポフィトエン不飽和化酵素(CrtN)の変異体およびその遺伝子に関する。野生型のジアポフィトエン不飽和化酵素(CrtN)は黄色の色素ジアポニューロスポレンを主に合成するが(Raisig, A. et al.; Biochim Biophys Acta1533, 164-170 (2001))、CrtN変異体は、赤色のジアポリコペンを合成する。このような改良により、視認性が良くなり、S/N比、定量性、信頼性の全てが飛躍的に向上する。
具体的には、CrtNの209番目のアミノ酸のグルタミン酸をグリシンに、242番目のアスパラギンをセリンに、286番目のメチオニンをバリンに変異したことを特徴とするCrtN変異体(配列番号2)である。このCrtN変異体酵素が、赤色のジアポリコペンを合成する(図4)。
当該CrtN変異体をコードする遺伝子として、例えば配列番号1の配列が挙げられる。黄色ブドウ球菌由来のジアポフィトエン不飽和化酵素(CrtN)遺伝子は黄色ブドウ球菌 S.aureus (ATCC 35556) ゲノムから入手することができ、遺伝子の置換は種々の部位特異的変異法により行うことができる。
【0035】
本発明で用いる、色素合成可能な細胞は、上記色素合成に関与する酵素により色素を生合成することができる細胞であれば制限されない。天然の細胞でも、遺伝子組み換えにより形質転換されている細胞でもよい。遺伝子組み換え細胞は、遺伝子組み換えの操作に簡便な細胞である、大腸菌、枯草菌、酵母などが挙げられる。
【0036】
本発明で用いる好ましい色素合成可能な細胞は、色素合成に関与する酵素遺伝子またはその変異体により形質転換されている細胞である。また、さらにイソペンテニル二リン酸イソメラーゼ(idi)遺伝子により、Idiを細胞に導入し、イソプレノイド経路を強化した細胞が好ましい。
【0037】
好適には、本発明で用いる色素合成可能な細胞は、ジアポフィトエン合成酵素(CrtM)遺伝子若しくはその変異体、および/またはデヒドロスクアレン不飽和化酵素(CrtN)遺伝子若しくはその変異体により形質転換された細胞である。その色素合成可能細胞は、C15PPを基質として、ジアポニューロスポレン(黄色)ジアポリコペン(赤色)等を生成し、細胞が黄色や赤色等になる(図2)。CrtM遺伝子とCrtN遺伝子またはそれらの変異体は、同一のベクターに組み込まれていてもよいし、別のベクターに組み込まれていてもよい。
【0038】
好適な別の実施態様は、CrtM遺伝子若しくはその変異体、および/またはCrtN遺伝子若しくはその変異体に加えさらにゲラニル二リン酸合成酵素(GPS)遺伝子またはその変異体により形質転換された細胞である。その色素合成可能な細胞は、C10PPを基質として、ジアポニューロスポレン(黄色)ジアポリコペン(赤色)等を生成し、細胞が黄色や赤色等になる。CrtM遺伝子、CrtN遺伝子およびGPS遺伝子またはそれらの変異体は、同一のベクターに組み込まれていてもよいし、別のベクターに組み込まれていてもよい。
【0039】
好適な別の実施態様は、フィトエン合成酵素(CrtB)遺伝子若しくはその変異体、および/またはフィトエン脱水素酵素(CrtI)遺伝子若しくはその変異体により形質転換された細胞である。その色素合成可能細胞は、C20PPを基質として、リコペン(赤色)等を生成し、細胞がピンク色等になる。CrtB遺伝子及びCrtI遺伝子またはそれらの変異体は、同一のベクターに組み込まれていてもよいし、別のベクターに組み込まれていてもよい。
【0040】
好適な別の実施態様は、CrtB遺伝子若しくはその変異体、および/またはCrtI遺伝子若しくはその変異体に加えさらにゲラニルゲラニル二リン酸合成酵素(CrtE)遺伝子またはその変異体により形質転換された細胞である。その色素合成可能細胞は、C20PPを基質として、リコペン(赤色)等を生成し、細胞がピンク色等になる。特にC20PPを合成しない宿主(例えば大腸菌)にはCrtE遺伝子の導入が必要になる。CrtB遺伝子、CrtI遺伝子及びCrtE遺伝子またはそれらの変異体は、同一のベクターに組み込まれていてもよいし、別のベクターに組み込まれていてもよい。
【0041】
本発明における「色素合成量の低下」は、細胞における色素生合成の量が低下し、細胞中の色素量が減少することである。試料中にテルペン合成酵素遺伝子が存在し、色素生合成に関与する酵素の基質がテルペン合成酵素により奪われることにより、色素合成量が低下する。すなわち、本発明に係る方法において、被検遺伝子を導入した色素合成可能な細胞における色素合成量を、被検遺伝子を導入していない色素合成可能な細胞における色素合成量と比較し、色素合成量が低下した細胞を選択し、その細胞に導入された被検遺伝子をテルペン合成酵素遺伝子であると決定する。言い換えれば、本発明に係る方法において、色素細胞における色素合成量の低下をもたらす被検遺伝子を選択することにより、テルペン合成酵素遺伝子を得ることができる。
【0042】
色素合成量の低下を検出する方法、又は色素合成量の低下を測定する方法は、視認により実施できる。また、各種測定機器、マイクロプレートリーダー、分光光度計、測色光度計などの各種測定機器により検出できる。
本発明の方法を用いれば、細胞を破壊することなく、テルペン合成酵素の活性を検出又は測定することができる。具体的には、視認によるときは、細胞のコロニーをプレート上に作成し、コロニー色を観察する。視認によるものであれば、0.5-1.0mm直径のコロニーを形成させ、目視により探索する。
スループットをあげる必要があるときは、低倍率拡大鏡などを用い、より小さなコロニーを密集させる手法を用いることができる。また、画像解析ソフトウエアを用いることによって、コロニー色の強弱を定量化したり、コロニーピッカーを用いてスクリーニング全般を半自動化することもできる。
【0043】
本発明は、本発明のスクリーニング方法に使用する色素合成に関与する酵素の遺伝子またはその変異体により形質転換された色素合成可能細胞に関する。
【0044】
色素合成可能細胞として、ジアポフィトエン合成酵素(CrtM)遺伝子およびジアポフィトエン不飽和化酵素(CrtN)遺伝子またはそれらの変異体により形質転換された色素合成可能細胞を例示できる。当該色素合成可能細胞を用いて、CrtMの基質であるC15PPを基質とするテルペン合成酵素の遺伝子を検出し、そして、その酵素活性を測定することができる。また、CrtNの基質であるジアポフィトエンを基質とするテルペン合成酵素遺伝子を検出し、そして、その酵素活性を測定することができる。
当該色素合成可能細胞は、CrtMおよびCrtNまたはそれらの変異体により、ジアポニューロスポレン(黄色)ジアポリコペン(赤)等を生成し、黄色、赤色等の有色になる。被検体中に基質を共通にする酵素の遺伝子が存在すると、酵素が基質を奪い合うことにより、当該宿主における色素合成量が減少し、脱色又は色が薄くなる。
【0045】
色素合成可能細胞としてまた、ジアポフィトエン合成酵素(CrtM)遺伝子、ジアポフィトエン不飽和化酵素(CrtN)遺伝子及びゲラニル二リン酸合成酵素(GPS)遺伝子またはそれらの変異体により形質転換された色素合成可能細胞を例示できる。当該色素合成可能細胞を用いて、C10PPを基質とするテルペン合成遺伝子を検出し、そして、その酵素活性を測定することができる。C10PPが細胞内に蓄積されないような細胞(例えば大腸菌)ではC10PPを基質とするテルペン合成遺伝子が被検体中に存在していても、基質を奪い合うことができないため、色の変化を生じない可能性が高い。そこで、GPS遺伝子を細胞内に導入し、細胞内にC10PPを蓄積せしめ、奪い合わせることにより、C10PPを基質とするテルペン合成酵素遺伝子を検出することが可能になる。C10PPを基質とするテルペン合成酵素遺伝子の存在により、細胞色が脱色又は薄くなる。
【0046】
さらに、色素合成可能細胞として、フィトエン合成酵素(CrtB)遺伝子およびフィトエン脱水素酵素(CrtI)遺伝子またはそれらの変異体により形質転換された色素合成可能細胞を例示できる。
当該色素合成可能細胞を用いて、CrtBの基質であるC20PPを基質とするテルペン合成遺伝子を検出し、そして、その酵素活性を測定することができる。また、CrtIの基質であるフィトエンを基質とするテルペン合成遺伝子を検出し、そして、その酵素活性を測定することができる。
当該色素合成可能細胞は、CrtBおよびCrtIまたはそれらの変異体により、リコペン(赤色)等を生成し赤色等になる。被検体中に基質を共通にする酵素の遺伝子が存在すると、酵素が基質を奪い合うことにより、当該宿主における色素合成量が減少し、脱色又は色が薄くなる。
【0047】
さらにまた、色素合成可能細胞として、フィトエン合成酵素(CrtB)遺伝子、フィトエン脱水素酵素(CrtI)遺伝子及びゲラニルゲラニル二リン酸合成酵素(CrtE)遺伝子またはそれらの変異体により形質転換された色素合成可能細胞を例示できる。当該色素合成可能細胞を用いて、C20PPを基質とするテルペン合成遺伝子を検出し、そして、その酵素活性を測定することができる。C20PPを合成しない細胞(例えば大腸菌)を宿主とする場合は、ゲラニルゲラニル二リン酸合成酵素(CrtE)遺伝子をさらに導入することにより、C20PPを基質とするテルペン合成酵素遺伝子を検出することが可能になる。C20PPを基質とするテルペン合成酵素遺伝子の存在により、細胞色が脱色又は薄くなる。
【0048】
上記色素合成可能細胞は、常法により製造することができる。例えば、色素合成酵素遺伝子を、購入またはPCRなどにより常法により調製し、その遺伝子を宿主に適する発現ベクターに常法により組み込み、目的のベクターを選択し、そのベクターにより宿主細胞を常法により形質転換することにより得られる。色素合成遺伝子を二種類以上組み込むときは、同一の発現ベクターに組み込み形質転換に使用するか、異なるベクターに組み込み共形質転換する。
用いる宿主細胞は、制限されないが、培養時間の短縮やクローニングの容易さを考えれば、大腸菌、枯草菌、酵母などが好ましい。特に大腸菌、酵母が好ましく、好適な大腸菌としては、Escherichia coli XL1-Blueのようなクローニング株、HB101やBL21などの発現株に加え、テルペン前駆体の合成量が豊富な遺伝子ノックアウト株、たとえばJW1750 ΔgdhA (glutamate dehydrogenase欠損)、JW0110 ΔaceE(pyruvate dehydrogenase欠損)(Baba,T. et al.; Mol Syst Biol 2, 2006 0008 (2006))等が挙げられ、好適な酵母としては、標準的な発芽酵母、INVSc1(invitrogen)、YPH499(stratagene)等が挙げられる。
好適なベクターは、特に制限はなく、一般に用いられているベクターでよい。例えば、宿主が大腸菌であるときは、pUC18、pACYC184、などに由来するものが挙げられ、宿主が枯草菌であるときはpUB110、pE194、pC194、pHY300PLK DNAなどが、宿主が酵母であるときは、pRS303、YEp213、TOp2609等が挙げられる。
【0049】
本発明は、また、テルペン合成酵素遺伝子又はその変異体のスクリーニング用キットに関する。
本発明に係るキットは、色素合成可能細胞を含むものであり得る。色素合成可能細胞は、冷凍保存してバイアル内に封入したものが好適である。あるいは、本発明に係るキットは、所望の細胞を色素合成可能細胞に形質転換するための色素合成酵素遺伝子発現ベクターを構成要素として含むものであり得る。
さらに、上記本発明に係るキットは、被検遺伝子用の発現ベクター、クローニング酵素セット、メタゲノムソース、あるいは配列データベースをもとに作製された(候補)遺伝子ライブラリ、マイクロプレート、イソプレノイド経路(テルペン上流経路)の強化された菌株、培地や添加剤などのスクリーニングに有用な物質や器具(画像スキャナや測色光度計、色見本、コロニピッカー)などをキットの構成要素として加えることができる。
【0050】
本発明はさらにまた、本発明に係るスクリーニング方法で取得されたファルネシル二リン酸合成酵素(FDS)の変異体に関する。FDSはC15PP合成酵素であるが、当該変異体はゲラニルファルネシル二リン酸(C25PP)を合成する活性をもつ酵素である。
好ましい変異体は、中度好熱細菌(Bacillus Stearothermophilus)由来のBstFDSのアミノ酸81番チロシン(Y)がアラニン(A)へ置換したFDSY81Aのさらなる変異体である。FDSY81Aの121番のスレオニン(T)が変異した酵素、又は、157番のバリン(V)が変異した酵素を挙げることができる。好ましい121番のスレオニン(T)の変異は、アラニン(A)またはセリン(S)への変異であり、好ましい157番のバリン(V)の変異はアラニン(A)への変異である。
【0051】
テルペノイド群は、モノ(C10)、セスキ(C15)、ジ(C20)、セスタ(C25)、トリ(C30)、テトラ(C40)など骨格によって分類される。セスタテルペンは、真菌や海洋生物に報告が増えつつあるが、その種類は他に比べ少なく、その遺伝子が未知である。更にはC25PPの供給経路を構築した例もなく、生物生産の例はまだ一つもない。
ここで得られた中度好熱細菌(Bacillus Stearothermophilus)由来のFDS変異体は、大腸菌に最も効率よいC25PP供給能力を与えセスタテルペンの細胞生産系の提供に有用である。直鎖C25イソプレノイド膜は、古細菌などの膜主成分として使われているが、その合成遺伝子は未知である。C25PPは高度高熱菌のものがTachibanaらによって報告されているが(Tachibana, A et al; Eur J Biochem 267, 321-328 (2000))、その大腸菌での活性は非常に弱いものであった。これらの変異体によって、C25PPへの効率よい供給経路が初めて得られることとなった。
【0052】
本発明の理解を深めるために、以下の実施例により更に詳細に本発明を説明するが、本発明はこれら実施例に限定されるものではない。
【実施例1】
【0053】
<スクアレン合成酵素のC15PP消費によるCrtM/CrtN色素合成量低下>
スクアレン合成酵素は2つのC15PPをhead-to-headで縮合させ、C30骨格をもつ炭化水素スクアレンを合成する酵素である。基質も、中間体も、そして生産物も無色透明であるため、それらの分析をハイスループットに行うことは困難である。
しかしスクアレン合成酵素の基質と同一の基質に作用して色素合成する大腸菌を使用して、スクアレン合成酵素の活性を大腸菌内で非破壊的に測定することができた。
【0054】
(1)色素合成可能な細胞の調製
CrtM遺伝子とCrtN遺伝子を含む大腸菌発現用プラスミドpAC-MNwtを、常法により大腸菌(Escherichia coli)XL1-Blueに導入し、カロテノイド(ジアポニューロスポレン)合成可能細胞を得た。pAC-MNwtは、黄色ブドウ球菌(Staphylococcus aureus)のゲノムよりCrtMおよびCrtN遺伝子(GEN Bank ID: 1125277および1125276)をPCR増幅し、lacP下流において大腸菌発現用プラスミド(pAmod(Schmidt-Dannert, C. et al.; Nat Biotechnol 18, 750-753(2000)))に組み込み作製した。
また、CrtM遺伝子とCrtN遺伝子およびイソペンテニル二リン酸イソメラーゼ(idi)遺伝子(GEN Bank ID:949020)を含む大腸菌発現用プラスミドpAC-MNwt-idiを、常法により大腸菌(Escherichia coli)XL1-Blueに導入し、より多くのカロテノイド(ジアポニューロスポレン)を合成する細胞を得た。pAC-MNwt-idiは、大腸菌のゲノムからPCR増幅したidiをlacP/Oの制御下に配置したかたちで上記pAC-MNwtに組み込んだ。
【0055】
(2)ヒトスクアレン合成酵素遺伝子の調製
本来膜タンパク質であるスクアレン合成酵素を、大腸菌内で封入体を創らせずに発現させる(可溶性を上げる)ためには、この酵素の膜ドメインを切除することが重要である。そこでヒト由来のスクアレン合成酵素(全長417アミノ酸)のN末端30アミノ酸とC末端47アミノ酸を欠失させた全長340アミノ酸からなるスクアレン合成酵素hSqSwtをコードする遺伝子を得た(Thompson, J.F.et al.; Arch Biochem Biophys 350, 283-290(1998))。
さらに、スクアレン合成酵素hSqSwtの171番目のチロシンをセリンに置換したアミノ酸置換体hSqSY171Sをコードする遺伝子を得た。具体的には、hSqSWTをテンプレートとして、部位特異的変異導入法によりY171のコドンTAC (チロシン:Y)をAGC (セリン:S) に置換したhSqSY171Sをコードする遺伝子を得た。hSqSY171Sは触媒部位を壊した不活性変異体である(Gu,P. et al.; J Biol Chem 273, 12515-12525(1998))。これらを大腸菌発現用プラスミドpUC18Nm(Umeno, D. et al.; J Bacteriol 184,6690-6699 (2002))に挿入し、pUC-hSqSwtおよびpUC-hSqSY171Sを得た。
【0056】
(3)細胞色の観察
pAC-MNwt、あるいはpAC-MNwt-idiを持つ大腸菌XL1-Blueを、pUC-hSqSwt又はpUC-hSqSY171Sで形質転換し、30℃で液体培養してペレット細胞色を比較した。コントロールは pUC18Nmを使用した。
pAC-MNwtを持つ大腸菌XL1-BlueをpUC-hSqSwtで形質転換した細胞の細胞色は対照(pUC18Nm)を導入したものより、有意に黄色が脱色し、薄い黄色となった。pAC-MNwtを持つ大腸菌XL1-BlueをpUC-hSqSY171Sで形質転換した細胞の細胞色は、対照(pUC18Nm)を導入したものと比較して変化がなかった(図3(a))。
【0057】
(4)カロテノイド(ジアポニューロスポレン)合成量の比較
ペレット細胞色の観察と同時に、液体培養におけるカロテノイド合成量(TB培地、2mL)を測定した(pAC-MNwtおよびpAC-MNwt-idi)。結果を図3(b)および図3(c)に示した。
【0058】
野生型のスクアレン合成酵素hSqSwtをCrtMおよびCrtNと共発現させた場合、その色素合成量は、対照に比べ、明らかに少なくなった(図3(b)および(c))。これは、色素合成に使われるはずのC15PPがスクアレン合成に使われたからである。
アミノ酸置換体hSqSY171Sは、触媒部位を壊した不活性変異体である。このような変異体遺伝子の発現は、色素合成には殆ど影響なく、対照と同じレベルであった。
これらより、CrtM-CrtNによって創られる色素は、C15PP消費能力のある酵素の活性によって減少し、それが細胞色の減退として可視化できた。
なお、idi遺伝子の導入によってイソプレノイド経路を強化した場合(図3(c))、細胞のC15PPの実質濃度が上昇し、色素合成量も上がった。より強いテルペン合成酵素活性の検索には、CrtM遺伝子、CrtN遺伝子およびidi遺伝子を導入した細胞を用いるのが好適である。
【実施例2】
【0059】
<CrtN遺伝子変異体;合成色素の改良>
C20PPの消費活性はリコペンの色の退色、すなわち赤から白への明確な色変化を測定するため、正確で迅速なスクリーニングが可能である。これに対し、C15PPの消費活性は、ジアポニューロスポレンの色の退色、すなわち黄から白への退色度によって検出、測定するため、視認性が悪く、擬陽性が頻発するという問題があった。そこで、C15PPを、黄色ではなく鮮やかな赤色の色素に変換する経路を得るべく、CrtN(デヒドロスクアレン不飽和化酵素)にタンパク質工学的な改造を施した。
具体的には、CrtN遺伝子に変異PCR(マンガン法)でランダムな遺伝子変異を導入し、ライブラリ化した。CrtM遺伝子と共に大腸菌用発現プラスミド(pUC)に組み込んで、細胞色が赤くなるものを得た。得られた遺伝子変異体の塩基配列は配列番号1(アミノ酸配列は配列番号2)に示す配列であった。
【0060】
得られた遺伝子変異体を、CrtM遺伝子と共に大腸菌用発現プラスミドpAmodに組み込み、pAC-MN赤変異体を得た。このプラスミドを常法により大腸菌XL1-Blueに導入したところC15PPを、黄色ではなく鮮やかな赤色の色素に変換する経路(図4)を有する細胞を得た。
この改良によって、テルペン合成酵素遺伝子スクリーニング技術における、S/N比、定量性、信頼性の全てが飛躍的に向上した。
【実施例3】
【0061】
<ゲラニオール合成酵素によるCrtM/CrtN色素合成量低下>
ゲラニオール合成酵素(GES)は、モノテルペン合成酵素の一種であり、ゲラニル二リン酸から香料ゲラニオールを合成する。基質も生産物も無色透明である。
スイートバジル由来GES遺伝子(Iijima, Y. et al.; Plant Physiol134,370-379 (2004))、及び、同遺伝子のカルボキシル末端ドメイン(287〜567)あるいはN末端部(計286アミノ酸)欠失体(不活性体)の遺伝子(上記GES遺伝子のC末端部分のみをPCR増幅し、pUCベクターに組み込んだもの)を、大腸菌発現用プラスミド(pUC18Nm)に常法により組み込み、pUC-GESFull及びpUC-GESC-endを得た。
pAC-MNwt 、pAC-MNwt-idiまたはpAC-MN赤変異体をもつ大腸菌XL1-BlueにpUC-GESFullまたはpUC-GESC-endを導入した。
コロニーを形成させたところ、pUC-GESFullを導入したコロニーは、対照(pUC18Nm)を導入したものより、有意に色が薄いコロニーとして観察された。
また、CrtN変異体の遺伝子を含有するプラスミドpAC-MN赤変異体を用いた場合は、その活性の有無の視認性が格段に改良された。
同時に、液体培養(TB 2mL、30℃、48h) の後、カロテノイド成分をアセトン1mLで抽出し、吸収スペクトルから細胞あたりのカロテノイド合成量を算出した。有意な色素合成量の低下が観察された(図5)。
【実施例4】
【0062】
<モノテルペン合成酵素のC10PP消費によるGPS/CrtM/CrtN色素合成量低下>
大腸菌のファルネシル二リン酸合成酵素(FDS)はC10PPを殆どリリースすることなく、C5PPをC15PPに変換してしまう可能性がある。このとき、たとえモノテルペン合成活性(C10PP消費活性)があっても、それが奪うべきC10PPは細胞に蓄積されないので、色変化として検出できないという問題が発生する場合がある。
この問題を解決するため、この内因性のFDSとは別に、上記BstFDSのS82F変異体を作成した。この酵素変異体は、上記BstFDSの82番目のセリンがフェニルアラニンに置換されており、ゲラニル二リン酸合成酵素(GPS)としての機能を示す(特開平11−169178)。大腸菌由来のFDSについて、同様のことが試行され、これが大腸菌内に導入したモノテルペン活性を高めたという報告がある(Reiling, K.K. et al.; Biotechnol Bioeng 87, 200-212 (2004))。
【0063】
BstFDSS82Fを導入した細胞では、C10PPが、C5PP(ジメチルアリル二リン酸)を基質として合成され、C10PPが細胞内に多量に蓄積する。このC10PPは、内因性のFPS(ispA)によってC15PPに変換され、次いでCrtMおよびそれに続くCrtNによって色素が蓄積する。このとき、C10PPを消費するモノテルペン合成酵素があれば、C10PPを経由した前駆体(C15PP)の一部は色素合成に使われなくなるため、細胞色が退色する。
【実施例5】
【0064】
<C25PP(ゲラニルファルネシル二リン酸)合成酵素のスクリーニング/C20PP消費によるCrtE/CrtB/CrtI色素合成量低下>
FDS(ファルネシル二リン酸合成酵素)はジメチルアリル二リン酸とゲラニル二リン酸を結合させてC15PPを合成する酵素である。一方、FDSの81位のアミノ酸チロシンをアラニンに置換したFDSY81AはC15PPではなく、C20PP/C25PPの混合物を与える。プロダクト特異性を更にC25PPに対して高くした変異体を得るために、FDSY81Aを親としたライブラリを作成し、20消費活性(C25PP合成能)に対する機能スクリーニングを行った。
【0065】
(1)C20PPを消費するCrtE/CrtB/CrtI発現大腸菌(色素合成可能細胞)の調製
CrtE遺伝子、CrtB遺伝子、及びCrtI遺伝子及びidi遺伝子を含む大腸菌発現用プラスミドpAC-EBI-idiを調製した。具体的には、土壌細菌(Pantoea ananatis, DSM30080)のゲノムから CrtE, CrtBおよびCrtI遺伝子をPCR増幅し、lacP/O下流において大腸菌用発現プラスミド(pAmod)に組み込み pAC-EBIを得た。このpAC-EBIに大腸菌ゲノムからPCR増幅したidiをlacP/O下流において組み込み 、pAC-EBI-idiを得た。
常法によりpAC-EBI-idiを大腸菌XL1-Blueに導入し、カロテノイド(リコペン)合成可能細胞を得た。なお、大腸菌はC20PPを合成しないため、C15PPからC20PPの合成を触媒するCrtEを導入することが必要である。
【0066】
(2)中度好熱細菌(バチラス属)由来変異FDS遺伝子ライブラリの作成
中度好熱菌(バチラス属)由来のFDS遺伝子について変異体ライブラリを作成した。具体的には、FDSY81A遺伝子(ATCCから入手した精製ゲノムDNA(ATCC 12980D-5)から該当遺伝子をPCR増幅したもの。GENE BankID:13293、文献:Koyama T, et al.,J. Biochem., 133(3), 355-63 (1993) )に変異PCR(マンガン法)(Cadwell, R.C. et al.; PCR Methods Appl 2, 28-33 (1992))で遺伝子変異を導入し、大腸菌用発現プラスミド(pUC18Nm)に組み込み変異体ライブラリ(以下EP-PCRライブラリという。)を得た。
【0067】
(3)ライブラリ遺伝子のCrtE/CrtB/CrtI発現大腸菌への導入とスクリーニング
pAC-EBI-idiを持つXL1-Blueに、これらライブラリの遺伝子を挿入した大腸菌発現用プラスミドpUC18Nm(上述)をトランスフェクションし、37℃でコロニーを形成させた後、室温に静置してコロニー色を観察した(図6)。同時に、液体培養におけるカロテノイド合成量(TB培地,2mL)も測定した。
白いコロニを選択することにより、ゲラニルファルネシル二リン酸合成活性、すなわちC20PPからC25PPを合成する活性をもつC25PP合成酵素変異体を3つ取得した。それらの酵素変異体の配列は、以下のとおりであった。
【0068】
【表1】

2つの変異体は、81番アミノ酸の置換に加え、121番のスレオニン(T)がアラニン(A)またはセリン(S)に変異したものであり、もうひとつは、81番アミノ酸の置換に加え、157番のバリン(V)がアラニン(A)に変異しているFDSであった。
【0069】
(4)スクリーニング前後の遺伝子の解析
1. 上記EP-PCRライブラリを大腸菌に導入し、LBプレート培地にコロニー形成させ、無作為に7つ選んで配列を決定した。
【表2】

【0070】
2.同じライブラリを、pAC-EBIをもつ大腸菌株に導入した。プレート上の白いコロニから変異体DNAを抽出し、その配列を読んだ。
【表3】

【0071】
塩基配列レベルでの遺伝子変異の数は、スクリーニング前には6.9ヌクレオチド変異/geneであったが、スクリーニング後の変異数は、平均3.0変異/geneと下がっていた。また、スクリーニング前の変異体には、non-synonymous変異や構造内部にnon-trivialな(化学的な性質の大きく異なるアミノ酸への置換)が沢山ある一方、スクリーニング後の変異体は殆どの変異が表層に集中していた。
従って、スクリーニング(白コロニーを拾うこと)により、C20PP消費機能を保持した酵素が選択され、機能/構造の保持に対して有害な変異が生じている酵素は除去されることが強く示唆される。なお、スクリーニング後のタンパク質のコア部分に見いだされた4つの変異は全てTrivial mutationsであった。
【表4】

【0072】
(5)新規C25PP合成酵素変異体のC25PP合成能
C20消費活性スコアの上昇がみられた3つのFDS81変異体は、Y81Aに加えてT121AあるいはV157Aの変異を有していた。
そこで、得られた3つのFDS81変異体の遺伝子10-1、50-1、50-2とCrtM26/38遺伝子との共発現を試みた。
CrtMは、C15PP→C30カロテノイド骨格を合成する酵素であるが、F26A/W38A変異を導入した変異体M26/38は、C15, C20, C25までの様々な骨格をもつプレニル2リン酸を基質として、C30, C35, C40, C45, C50と多様な骨格のカロテノイドを生じる。FDSのC25PP合成能が上がっているならば(細胞内のC25/C20比が上がれば)、それを反映して、C50カロテノイドのピーク比も高まると期待された。実際、50-2(残基157に変異)が特に高いC50カロテノイド合成機能を示した。酵素変異体の乾燥菌体重量(DCW)当たりのカロテノイド合成量を図7に示す。
ここで得られた50-2は、大腸菌に効率よいC25PP供給能力を与え、セスタテルペンの細胞生産系の構築に重要であると考えられる。これらの変異体によって、C25PPへの効率よい供給経路が初めて得られることとなった。
【実施例6】
【0073】
<新規C25PP合成酵素変異体の作製、スクリーニング及びC20PP消費能>
3つのアミノ酸置換(Y81A, V157A, T121A)を単独又は組み合わせて7種類の遺伝子変異体を作出し、それらのC20PP消費活性を比較した。
【0074】
1.部位特異的変異導入法(SDM)を用いて、Y81A, V157A, T121A の全ての組み合わせで変異体を作製し、pUC18Nmベクターに組み込んだ。
2.大腸菌(XL1 Blue)にpAC-EBI-idiと共形質転換し、コロニーを形成させた。
3.コロニーから LB(Carb/Cm) 500μLへ植菌して培養した(37℃、16h、n=4)。
4.この培養液 10μLを TB(Carb/Cm) 2mLへ植菌して培養した(30℃、48h)。
5.大腸菌を遠心集菌し、細胞内の脂溶性画分をアセトン1mLで抽出した。
6.抽出液300μLの吸光スペクトルを測定し、極大吸収波長での吸光度から色素量を算出した。
【0075】
野生型のFDSを加えると、リコペン(C40カロテノイド)の合成量が400→600μg/gDCWと50%も向上した。これはC20PPの前駆体であるC15PPを沢山供給できるからである。一方Y81A単独変異体を入れると、その合成量は1/4ほどになった。Y81A単独変異体は、いままでC25PPの供給路として採用してきた変異体である。
T121Aの変異は本研究で新規にみつかったアミノ酸変異である。V157Aの変異は1996年のOhnuma論文でアミノ酸変異として既に報告されているものである。これら単独では、色素合成量(C40カロテノイド合成能)はむしろ上昇した。これはT121A-V157A変異体でも同様であった。
一方、V157A変異又はT121A変異が、Y81Aの変異と組み合わせられると、色素(C40カロテノイド)は細胞内に全く蓄積せず、極めて強力なC20PP消費活性を示した(図8)。
【実施例7】
【0076】
<セスキテルペン合成酵素TEASのスクリーニング>
本実施例では、セスキテルペン合成酵素であるTEASを用いて、本スクリーニング系をセスキテルペン合成酵素活性の可視化に用いることが出来ることを示す。
セスキテルペン合成酵素として、タバコ(Nicotiana tabacum)由来の5-エピアリストロケン合成酵素(TEAS)を用いた。この酵素の主生成物である(+)-5-エピアリストロケンは、タバコのファイトアレキシンであるカプシジオールの前駆体として知られる。TEASは植物由来のセスキテルペンの中で初めて遺伝子が同定された酵素であり、その扱いやすさから、これまで様々な生化学および構造的な研究がなされてきた(Back K and Chappel J, J Biol Chem. 270 (1995) 7375-7381, Back K et al. Arch Biochem Biophys 315 (1994) 527-532, Mathis JR et al. Biochemistry 36(1997) 8340-8348)。
【0077】
(1)TEAS遺伝子の合成とベクターへの組み込み
Mr.Gene(GENEART)に依頼し、Nicotiana tabacum由来のTobacco 5-epi-アリストロケン合成酵素(TEAS)の遺伝子(1,653bps)を大腸菌にコドン最適化し、その上流にTrcプロモータを付したものを全合成した(Ptrc-TEAS)(図9)。Ptrc-TEASにXba IおよびXho I制限酵素処理をおこない、pUC18Nmベクターへ組み込んだ(pUC18Nm-TEAS)。
【0078】
(2)TEASによる色素合成量の低下
1.大腸菌(XL1 Blue)にPtrc-TEASとpAC-MNwtまたはpAC-EBIと共形質転換し、コロニー形成させた。
2.コロニーからLB(Carb/Cm) 500μLへ植菌して培養した(37℃、16h、n=4)。
3.この培養液10μLをTB(Carb/Cm/IPTG 0.1mM)2mLへ植菌して培養した(30℃、pAC-MN:24h培養、pAC-EBI:48h培養)。
4.大腸菌を遠心集菌し、細胞内の脂溶性画分をアセトン1mLで抽出した。
5.抽出液 300μLの吸光スペクトルを測定し、極大吸収波長での吸光度から色素量を算出した。
【0079】
セスキテルペン合成酵素であるTEASは、C15PPの消費活性を示すはずである。その大腸菌活性は非常に低いという報告(0.24μg/L;Martin VJJ et al. Biotechnol Bioeng. 75 (2001) 497-503)があったが、実際に細胞内でC30カロテノイド経路とともに発現させてみると、ほぼ完全に色素合成は抑えられ、その活性は容易に視認できた(図10)。
【0080】
(3)TEASの不活性体と色素合成量
1.PCRを用いた部位特異的変異法を用いて、TEASのD303(GAT)または R443(CGT)をA(GCG)に置換して、pUC18Nm-TEASD303Aおよび pUC18Nm-TEASR443Aを作製した。
2.大腸菌(XL1 Blue)に各種TEASプラスミドとpAC-MNwtまたはpAC-EBIと共形質転換し、コロニー形成させた。
3.コロニーから LB(Carb/Cm)500μLへ植菌して培養した(37℃、16h、n=4)。
4.この培養液 10μLを TB(Carb/Cm/IPTG 0.1 mM)2 mLへ植菌して培養した(30℃、pAC-MN:24h培養、pAC-EBI:48h培養)。
5.大腸菌を遠心集菌し、細胞内の脂溶性画分をアセトン1mLで抽出した。
6.抽出液 300μLの吸光スペクトルを測定し、極大吸収波長での吸光度から色素量を算出した。
【0081】
TEAS変異体は不活性であった(図11、図12)。TEASによる反応の第1ステップは、FPPのリン酸基が脱離して、カルボカチオンを形成することである。このリン酸基脱離反応は、Mg2+がリン酸基と結合することで起きる。TEASのD303はFPPの近傍にMg2+を保持する。R443 は、1)FPP のリン酸基と直接結合、また2)水を介して Mg2+を保持する役割をもつアミノ酸である。これらをAに置換すると、Mg2+とリン酸基が結合できず、TEAS変異体は不活性になったと考えられる。
【実施例8】
【0082】
<タキサジエン合成酵素(TS)のスクリーニング>
本実施例では、ジテルペン合成酵素であるタキサジエン合成酵素(TS)を用いて、本スクリーニング系をジテルペン合成酵素活性の可視化に用いることが出来ることを示す。
C20PP基質消費活性を確認するため、イチイ(Taxus brevifolia)由来のジテルペン環化酵素であるタキサジエン合成酵素(TS)を用いた。タキサジエン合成酵素はタキソール(パクリタキセル)生合成経路の最初の反応を触媒する酵素である。タキソールは抗腫瘍作用を持つことで知られ、近年ではアルツハイマー病等の神経変性疾患治療としても有用であるという報告もある。タキソールの化学合成は極めて収率が悪く(最高0.4%;Walji AM and MacMillan EWC. SYNLETT.10 (2007) 1477-1489)、さらには植物から得られる量も微量でありスケールアップが難しいことから、微生物の代謝工学を用いた生合成が注目されている(Ajikumar PK et al. Science 330 (2010) 70-75, Dejong JM et al.Biotechnol Bioeng. 93 (2006) 212-24)。
【0083】
Mr. Gene(GENEART)に依頼し、N末端を59残基削った Taxus brevifolia由来の タキサジエン合成酵素(TS)の遺伝子を大腸菌にコドン最適化して全合成した(Ptrc-TS)。
Ptrc-TSに Xba Iおよび Xho I制限酵素処理をおこない、pUC18Nmベクターへ組み込んだ(pUC18Nm-TS)。
タキサジエン合成酵素は N末端にplastidへの輸送ペプチド配列がある。その配列を削ることで、大腸菌内でのタキサジエン合成酵素の可溶性が高くなる。
【0084】
1.大腸菌(XL1 Blue)にpUC18Nm-TSとpAC-MNwtまたはpAC-EBIと共形質転換し、コロニー形成させた。
2.コロニーからLB(Carb/Cm)500μLへ植菌して培養した(37℃、16h、n=4)。
3.この培養液10μLをTB(Carb/Cm/IPTG 0.1 mM)2mLへ植菌して培養した(30℃、pAC-MN:24h培養、pAC-EBI:48h培養)。
4.大腸菌を遠心集菌し、細胞内の脂溶性画分をアセトン1 mLで抽出した。
5.抽出液 300μLの吸光スペクトルを測定し、極大吸収波長での吸光度から色素量を算出した。
【0085】
pAC-MNwtと共形質転換した細胞の液体培養のペレットを肉眼で見ると、黄色が若干薄かった(C15消費能、図13)。pAC-EBIと共形質転換した細胞の液体培養のペレットは肉眼でも写真でも色差がはっきりとわかった(C20消費能、図14)。
【実施例9】
【0086】
<トマトcDNAからのテルペン合成酵素遺伝子のスクリーニング>
本発明の方法を未同定のDNAに対して適用した。
1.セスキテルペン合成酵素(kaurene synthase, taxadiene synthase, copalyl synathase)をQuetyにしてかずさDNA研究所のトマトcDNAライブラリ:KaFTom(http://www.pgb.kazusa.or.jp/kaftom/)内をBLAST検索したところ、AK327297、AK324962、AK321354の3つがヒットした。
2.検索にかかった上の3つから、最長 ORFを与える配列に対してPCR増幅し、pUC18Nmに組み込んだ。( )内はそのORFから推定されるポリペプチドのアミノ酸長を示す。
LEFL2026E14(773 aa)AK327297
LEFL1089AH03(551 aa)AK324962
LEFL1023CC09(381 aa)AK321354
3.これらのプラスミドを、大腸菌(XL1 Blue)にpAC-MNまたはpAC-EBIと共形質転換し、コロニー形成させた。
4.コロニーからLB(Carb/Cm)500μLへ植菌して培養した(37℃、16h、n=6)。
5.この培養液10μLをTB(Carb/Cm/IPTG 0.1mM) 2mLへ植菌して培養した(30℃、48h)。
6.大腸菌を遠心集菌し、細胞内の脂溶性画分をアセトン1mLで抽出した。
7.抽出液 300μLの吸光スペクトルを測定し、極大吸収波長での吸光度から蓄積する色素量を算出した。
【0087】
C15Pスクリーニング系において、E14のみが強い活性(カロテノイド色素の蓄積量の減少)を示したが、それ以外については、殆ど活性に変化がなかった。一方、C20PPの消費能スクリーニングにおいては、ごく僅かながら合成量が下がっていた。このことから、このE14 遺伝子は、セスキテルペン合成酵素であることが強く示唆される(図15)。
このE14をQueryにしてBlast検索すると、表のとおりの結果を得た。こうして、本手法による遺伝子探索法としての有効性が示唆された。
【0088】
【表5】

【産業上の利用可能性】
【0089】
本発明は、テルペン合成酵素遺伝子の一般的な、そして組織的探索法を提供する。高活性のテルペン合成酵素変異体の取得を可能とする。
【特許請求の範囲】
【請求項1】
被検遺伝子を色素合成可能な細胞に導入し、色素合成量の低下を検出することを特徴とする、テルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
【請求項2】
色素合成量の低下が、色素合成に関与する酵素の基質がテルペン合成酵素により消費されることによる色素合成量の低下である、請求項1に記載のテルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
【請求項3】
細胞が大腸菌または酵母である請求項1または2に記載のテルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
【請求項4】
色素合成可能な細胞が色素合成に関与する酵素遺伝子またはその変異体により形質転換された細胞である請求項1〜3のいずれか一に記載のテルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
【請求項5】
色素合成に関与する酵素遺伝子がジアポフィトエン合成酵素(CrtM)遺伝子、デヒドロスクアレン不飽和化酵素(CrtN)遺伝子、ゲラニルゲラニル二リン酸合成酵素(CrtE)遺伝子、フィトエン合成酵素(CrtB)遺伝子、フィトエン脱水素酵素(CrtI)遺伝子及びゲラニル二リン酸合成酵素(GPS)遺伝子から選ばれる少なくとも1つまたはその変異体である請求項4に記載のテルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
【請求項6】
請求項1〜5のいずれか一に記載のスクリーニング方法に使用する、色素合成に関与する酵素の遺伝子またはその変異体により形質転換された色素合成可能細胞。
【請求項7】
ジアポフィトエン合成酵素(CrtM)遺伝子若しくはその変異体、および/またはデヒドロスクアレン不飽和化酵素(CrtN)遺伝子若しくはその変異体により形質転換された色素合成可能細胞。
【請求項8】
ゲラニル二リン酸合成酵素(GPS)遺伝子またはその変異体によりさらに形質転換された請求項7に記載の色素合成可能細胞。
【請求項9】
フィトエン合成酵素(CrtB)遺伝子若しくはその変異体、および/またはフィトエン脱水素酵素(CrtI)遺伝子若しくはその変異体により形質転換された色素合成可能細胞。
【請求項10】
ゲラニルゲラニル二リン酸合成酵素(CrtE)遺伝子またはその変異体によりさらに形質転換された請求項9に記載の色素合成可能細胞。
【請求項11】
請求項6〜10のいずれか一に記載の色素合成可能細胞を含むテルペン合成酵素遺伝子またはその変異体のスクリーニング用キット。
【請求項12】
配列番号2に示すデヒドロスクアレン不飽和化酵素(CrtN)変異体をコードする遺伝子。
【請求項13】
ファルネシル二リン酸合成酵素変異体FDSY81Aの121番目のアミノ酸のスレオニン、および/または、157番目のアミノ酸のバリンが変異したことを特徴とするファルネシル二リン酸合成酵素変異体。
【請求項14】
121番目のアミノ酸スレオニンがアラニンもしくはセリンに変異し、および/または、157番目のアミノ酸のバリンがアラニンに変異したことを特徴とする請求項13に記載のファルネシル二リン酸合成酵素変異体。
【請求項15】
請求項13又は14に記載のファルネシル二リン酸合成酵素変異体をコードする遺伝子。
【請求項1】
被検遺伝子を色素合成可能な細胞に導入し、色素合成量の低下を検出することを特徴とする、テルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
【請求項2】
色素合成量の低下が、色素合成に関与する酵素の基質がテルペン合成酵素により消費されることによる色素合成量の低下である、請求項1に記載のテルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
【請求項3】
細胞が大腸菌または酵母である請求項1または2に記載のテルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
【請求項4】
色素合成可能な細胞が色素合成に関与する酵素遺伝子またはその変異体により形質転換された細胞である請求項1〜3のいずれか一に記載のテルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
【請求項5】
色素合成に関与する酵素遺伝子がジアポフィトエン合成酵素(CrtM)遺伝子、デヒドロスクアレン不飽和化酵素(CrtN)遺伝子、ゲラニルゲラニル二リン酸合成酵素(CrtE)遺伝子、フィトエン合成酵素(CrtB)遺伝子、フィトエン脱水素酵素(CrtI)遺伝子及びゲラニル二リン酸合成酵素(GPS)遺伝子から選ばれる少なくとも1つまたはその変異体である請求項4に記載のテルペン合成酵素の遺伝子および/またはその変異体のスクリーニング方法。
【請求項6】
請求項1〜5のいずれか一に記載のスクリーニング方法に使用する、色素合成に関与する酵素の遺伝子またはその変異体により形質転換された色素合成可能細胞。
【請求項7】
ジアポフィトエン合成酵素(CrtM)遺伝子若しくはその変異体、および/またはデヒドロスクアレン不飽和化酵素(CrtN)遺伝子若しくはその変異体により形質転換された色素合成可能細胞。
【請求項8】
ゲラニル二リン酸合成酵素(GPS)遺伝子またはその変異体によりさらに形質転換された請求項7に記載の色素合成可能細胞。
【請求項9】
フィトエン合成酵素(CrtB)遺伝子若しくはその変異体、および/またはフィトエン脱水素酵素(CrtI)遺伝子若しくはその変異体により形質転換された色素合成可能細胞。
【請求項10】
ゲラニルゲラニル二リン酸合成酵素(CrtE)遺伝子またはその変異体によりさらに形質転換された請求項9に記載の色素合成可能細胞。
【請求項11】
請求項6〜10のいずれか一に記載の色素合成可能細胞を含むテルペン合成酵素遺伝子またはその変異体のスクリーニング用キット。
【請求項12】
配列番号2に示すデヒドロスクアレン不飽和化酵素(CrtN)変異体をコードする遺伝子。
【請求項13】
ファルネシル二リン酸合成酵素変異体FDSY81Aの121番目のアミノ酸のスレオニン、および/または、157番目のアミノ酸のバリンが変異したことを特徴とするファルネシル二リン酸合成酵素変異体。
【請求項14】
121番目のアミノ酸スレオニンがアラニンもしくはセリンに変異し、および/または、157番目のアミノ酸のバリンがアラニンに変異したことを特徴とする請求項13に記載のファルネシル二リン酸合成酵素変異体。
【請求項15】
請求項13又は14に記載のファルネシル二リン酸合成酵素変異体をコードする遺伝子。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【公開番号】特開2011−125334(P2011−125334A)
【公開日】平成23年6月30日(2011.6.30)
【国際特許分類】
【出願番号】特願2010−258989(P2010−258989)
【出願日】平成22年11月19日(2010.11.19)
【出願人】(304021831)国立大学法人 千葉大学 (601)
【Fターム(参考)】
【公開日】平成23年6月30日(2011.6.30)
【国際特許分類】
【出願日】平成22年11月19日(2010.11.19)
【出願人】(304021831)国立大学法人 千葉大学 (601)
【Fターム(参考)】
[ Back to top ]

