デコリン遺伝子を含む遺伝子伝達システム及びこれを含む薬剤学的抗腫瘍組成物
本発明は、デコリン(decorin)−エンコーディングヌクレオチド配列を追加的に含み、前記デコリンは、前記目的ヌクレオチド配列の細胞内運搬効率を増加させる作用をすることを特徴とする遺伝子伝達システム、デコリン−エンコーディングヌクレオチド配列を含む組み換えアデノウイルス、これを含む抗腫瘍薬剤学的組成物、及び細胞外基質の過度なる蓄積に係る疾患または状態の治療用薬剤学的組成物に関するものである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、遺伝子伝達システム及び組み換えアデノウイルスに関するものであって、より詳細には、デコリン遺伝子を含む遺伝子伝達システム、組み換えアデノウイルス、前記組み換えアデノウイルスを含む抗腫瘍薬剤学的組成物、改善された組織浸透性を有する薬剤学的組成物、及び細胞外基質の過度なる蓄積に係る疾病または疾患の治療用薬剤学的組成物に関するものである。
【背景技術】
【0002】
アデノウイルス(Adenovirus, Ad)を利用した初期の遺伝子治療は、アデノウイルスの複製に必須的なE1遺伝子の代わりに、治療用遺伝子を挿入して製造した複製不能アデノウイルスを主に利用したが、これらのアデノウイルスは、感染された細胞とその周辺でのみ制限的に抗腫瘍効果を誘導して、臨床的な実用性の面で多い制約があった(Vile RG, Russell SJ, Lemoine NR., Gene Ther, 2000, 7(1):2-8)。これを克服するための一つの方案として、癌細胞でのみ選択的に増殖して癌細胞を殺傷する腫瘍特異的殺傷アデノウイルスであるONYX−015(Ad変異体、dl1520)をMcCormick研究陣が最初に開発した(Bischoff JR, et al., Science, 1996, 274(5286):373-376; Heise C, et al., Nat Med, 1997, 3(6):639-645)。ONYX−015は、E1B 55 kDa遺伝子が部分的に欠損されたアデノウイルスであって、p53が機能的に非活性化された細胞でのみ増殖が可能である。即ち、正常細胞では、ONYX−015アデノウイルスがp53を非活性化することができないため、ウイルスの増殖が抑えられ、細胞殺傷を誘導することができない反面、p53の機能が抑えられている癌細胞では、ウイルスの増殖が活発に起こり、究極的に癌細胞だけを選択的に殺傷するようになる(Chang F, Syrjanen S, Syrjanen K., J Clin Oncol, 1995, 13(4):1009-1022)。
【0003】
最近、頭頸部癌を対象に進行された臨床II/III期の試験結果、腫瘍特異的殺傷アデノウイルスの優れた治療効果が報告された(Kirn D, Hermiston T, McCormick F., Nat Med, 1998, 4(12):1341-1342; Nemunaitis J, et al., Cancer Res, 2000, 60(22):6359-6366; Ganly I, et al., Clin Cancer Res, 2000, 6(3): 798-806)。しかしながら、前記アデノウイルスの投与により、頭頸部腫瘍の成長が部分的に抑制されたものの、完全に消滅されたわけではなく、一定期間が過ぎた後には、腫瘍の成長がさらに速やかに進行された。このような結果は、局所的に腫瘍内投与されたアデノウイルスが一部周辺にのみ拡散されて、腫瘍組織全体に広がらなかったため、抗腫瘍効果が制限的に誘導され、ウイルスに感染されなかった腫瘍細胞が再び速やかに成長したからであると考えられる。最近の研究報告によると、ヌードマウスに形成された人体腫瘍内に投与されたアデノウイルスは、ウイルスの投与後100日が経った場合も、腫瘍内で複製が起こり、腫瘍組織から生きているウイルスが抽出されたが、腫瘍の成長を完全に抑制することはできなかった。以後の研究結果によると、このような低い抗腫瘍効果は、腫瘍組織内に存在する結締組織(connective tissue)と細胞外基質(extracellular matrix)により、ウイルスの拡散が制限的に起こったからであると明かされた。また、アデノウイルスを腫瘍内に投与すると、初期には、生来の(innate)免疫反応により、アデノウイルスが血流から速やかに除去されたが、ウイルス投与後約48週には、アデノウイルスが再び血流から検出されて、これは、腫瘍内で複製されたアデノウイルスが血流に放出されてきたものと推論された。このような一連の結果をまとめてみると、腫瘍特異的殺傷アデノウイルスは、癌細胞内で活発に複製が起こるが、癌細胞間に存在する細胞外基質及び結締組織などのような物理的障壁により、周辺癌細胞に活発に広がることができず、これらのアデノウイルスによる抗腫瘍効果が制限的に誘導されると考えられる。
【0004】
したがって、腫瘍特異的殺傷アデノウイルスを癌治療に効率的に利用するためには、腫瘍特異的殺傷アデノウイルスが強力な細胞殺傷能を誘導することができなければならなく、投与されたアデノウイルスが腫瘍組織全体によく拡散されて、周辺癌細胞を効率的に感染できなければならない。
【0005】
最近、ウイルス性遺伝子伝達体の制限された組織内拡散問題と、これによる低い遺伝子伝達効率を克服するために、いくつかの方案が研究されている。N. Kuriyama研究陣は、コラーゲンとその他の細胞外基質を分解できるコラゲナーゼ/ディスパーゼ(collagenase/dispase)、またはトリプシンのような蛋白質分解酵素(protease)を、アデノウイルスを投与する前に処理することにより、アデノウイルスの遺伝子伝達効率を大きく向上した(Kuriyama N, et al., Hum Gene Ther, 2000, 11(16):2219-2230)。また、同じ概念で、L. Maillard研究陣は、動脈の主要構成成分であるエラスチンを分解できるエラスターゼをラビットのお尻(iliac)動脈に処理することにより、アデノウイルスによる遺伝子伝達効率を約2倍ほど向上させることができた(Maillard, L., et al., Gene Ther, 1998, 5(8):1023-1030)。その他にも、細胞外基質を分解できるヒアルロニダーゼ(hyaluronidase)を利用して、ラットの筋肉におけるアデノ随伴ウイルスによる遺伝子伝達効率を約2〜3倍程度向上できることが報告された(Favre D, et al., Gene Ther, 2000, 7(16):1417-1420)。このような一連の研究を通じて、細胞外基質の構成成分の合成を阻害するかまたが分解を促進して、細胞外基質の構成成分を減少させると、組織内におけるウイルス拡散を増大することができて、その結果、遺伝子伝達効率を向上させることができると期待される。また、皮膚の結合組織の異常増殖により引き起こされるケロイド(keloid)のような線維症疾患においても、細胞外基質の合成を阻害することにより、線維症疾患の生成を抑制し、治療効果を誘導することができると考えられる。
【0006】
本明細書全体にかけて多数の特許文献及び論文が参照されて、その引用は、括弧内に表示されている。引用された特許文献及び論文の開示内容は、その全体が本明細書に参照として取り込まれ、本発明の属する技術分野の水準及び本発明の内容がより明確に説明される。
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明者らは、遺伝子伝達システムの伝達効率、特に、組織内における遺伝子伝達システムの浸透性(あるいは拡散性)を増加させるために鋭意研究した結果、デコリンが遺伝子伝達効率を大きく改善でき、前記デコリンを発現する組み換えアデノウイルスが組織浸透性及び抗腫瘍効果に優れていることを見出し、本発明を完成した。
【0008】
したがって、本発明の目的は、デコリン(decorin)−エンコーディングヌクレオチド配列を含む新規遺伝子伝達システムを提供することにある。
【0009】
本発明の他の目的は、伝達効率の改善された遺伝子伝達方法を提供することにある。
【0010】
本発明のまた他の目的は、腫瘍組織浸透能及び腫瘍細胞アポトーシス能が改善された組み換えアデノウイルスを提供することにある。
【0011】
本発明の他の目的は、上述の組み換えアデノウイルスを含む薬剤学的抗腫瘍組成物を提供することにある。
【0012】
本発明の他の目的は、上述の薬剤学的抗腫瘍組成物を利用した癌の治療方法を提供することにある。
【0013】
本発明の他の目的は、改善された組織浸透性を有する薬剤学的組成物を提供することにある。
【0014】
本発明のまた他の目的は、細胞外基質の過度なる蓄積に係る疾病または疾患の治療用薬剤学的組成物を提供することにある。
【0015】
本発明の他の目的及び利点は、発明の詳細な説明及び請求の範囲により、さらに明確にされる。
【課題を解決するための手段】
【0016】
本発明の一様態によると、本発明は、細胞内に運搬しようとする目的ヌクレオチド配列及びデコリン(decorin)−エンコーディングヌクレオチド配列を含み、前記デコリンは、前記目的ヌクレオチド配列の細胞内運搬効率を増加させる作用をすることを特徴とする遺伝子伝達システムを提供する。
【0017】
本発明者らは、遺伝子伝達システムの伝達効率、特に、組織内における遺伝子伝達システムの浸透性(あるいは、拡散性)を増加させるために鋭意研究した。このような研究の方向は、細胞外基質(ECM)の構成成分の合成を阻害するかまたは分解を促進し、細胞外基質の構成成分を減少させれば、組織内における遺伝子伝達システムの拡散を増大させることができるという仮説に基づいたものである。結局、本発明者らは、デコリンが遺伝子伝達効率を大きく改善できるという驚くべき事実を見出した。
【0018】
本明細書において、用語“デコリン”は、実施例に示されたデコリンだけではなく、本発明で目標とする遺伝子伝達効率を増加させることのできるデコリンのあらゆる擬似体(homologues)を含む。
【0019】
本発明において、遺伝子伝達効率を改善するデコリン(decorin:DCN)は、SLRP(small leucine rich proteoglycan)部類に属するタンパク質であって、10〜12個のロイシンリッチリピート(leucine rich repeat)から構成されており、コア部位は、アーチ(arch)状になっており、細胞外基質に存在する数種の成長因子またはデコリン受容体と結合が容易な構造に形成されている(Krusius T, Ruoslahti E., Proc Natl Acad Sci U S A, 1986, 83(20):7683-7687; Day AA, et al., Biochem J, 1987, 248(3):801-805; Fisher LW, Termine JD, Young MF., J Biol Chem, 1989, 264(8):4571-4576)。デコリンは、腫瘍成長因子(TGF)−βの活性を抑制することにより、コラーゲンの繊維化を防ぎ、細胞外基質の構成(matrix assembly)に関与して、腫瘍細胞の成長を抑制し、腫瘍の形成と成長に天然拮抗剤(antagonist)として作用すると知られている(Iozzo RV., Crit Rev Biochem Mol Biol, 1997, 32(2):141-174; Isaka Y, et al., Nat Med, 1996, 2(4):418-423)。また、デコリンは、成長因子や金属イオンのような細胞外基質の構成成分と反応し、MMP-1(matrix metalloproteinase-1)とMMP-2などの発現を促進して、細胞外基質を分解させる(Yamaguchi Y, Mann DM, Ruoslahti E., Nature, 1990, 346(6281):281-284; Vogel KG, Paulsson M, Heinegard D., Biochem J, 1984, 223(3):587-597; Danielson KG, et al., J Cell Biol, 1997, 136(3):729-743)。
【0020】
本発明の遺伝子伝達システムにおいて、デコリンが遺伝子伝達効率を増加させるメカニズムの一つは、デコリンが、MMP2及びMMP9などのような数種のMMP発現を促進することにより、細胞を囲んでいる細胞外基質成分の大部分を占めているコラーゲンを分解し、 結締組織、ひいては基底膜までも破壊して、細胞外基質の分解を誘導することができるためであると判断されて、このようなメカニズムは、下記の実施例により検証される。
【0021】
したがって、上述のデコリンの作用を参照すると、本発明の遺伝子伝達システムは、細胞外基質により連結された細胞からなる組織内の細胞において、その長所が顕著に現れる。特に、結締組織により堅固に囲まれている腫瘍組織に、本発明の遺伝子伝達システムが適用されると、従来のいかなる遺伝子伝達体よりも改善された伝達効率を示す。
【0022】
本発明の遺伝子伝達システムを製造するために、デコリン−エンコーディングヌクレオチド配列は、適した発現コンストラクト(expression construct)内に存在することが好ましい。前記発現コンストラクトにおいて、デコリン遺伝子は、プロモーターに作動的に結合されることが好ましい。本明細書において、用語“作動的に結合された”は、核酸発現調節配列(例えば、プロモーター、シグナル配列、または転写調節因子結合位置のアレイ)と他の核酸配列との間の機能的な結合を意味し、これにより、前記調節配列は、前記他の核酸配列の転写及び/または解読を調節するようになる。本発明において、デコリン遺伝子に結合されたプロモーターは、好ましくは、動物細胞、より好ましくは、哺乳動物細胞で作動し、デコリン遺伝子の転写を調節することができるものであって、哺乳動物ウイルス由来のプロモーター及び哺乳動物細胞のゲノム由来のプロモーターを含み、例えば、U6プロモーター、H1プロモーター、CMV(Cytomegalo virus)プロモーター、アデノウイルス後期プロモーター、ワクシニアウイルス7.5Kプロモーター、SV40プロモーター、HSVのtkプロモーター、RSVプロモーター、EF1アルファプロモーター、メタロチオネインプロモーター、β−アクチンプロモーター、ヒトIL−2遺伝子のプロモーター、ヒトIFN遺伝子のプロモーター、ヒトIL−4遺伝子のプロモーター、ヒトリンホトキシン遺伝子のプロモーター、ヒトGM−CSF遺伝子のプロモーター、誘導性(inducible)プロモーター、癌細胞特異的プロモーター(例えば、TERTプロモーター、PSAプロモーター、PSMAプロモーター、CEAプロモーター、E2Fプロモーター及びAFPプロモーター)及び組織特異的プロモーター(例えば、アルブミンプロモーター)を含むが、これに限定されるものではない。最も好ましくは、CMVプロモーターまたは癌細胞特異的プロモーターである。癌細胞特異的プロモーターを利用する場合、TERTプロモーターまたはE2Fプロモーターを利用することが好ましい。TERT(telomere reverse transcriptase)プロモーターとして野生型ヒトhTERT(human telomere reverse transcriptase)プロモーターまたは本発明者らにより開発されたm-hTERTを利用できる(see WO 2004/076668)。m-hTERTは、2個のc-Myc結合部位及び5個のSp1結合部位を含むヒトテロメア逆転写酵素プロモーターに、さらに一つ以上(好ましくは1個)のc-Myc結合部位及び一つ以上(好ましくは5個)のSp1結合部位を含む核酸配列が連結されたプロモーターである。m-hTERTの具体的なヌクレオチド配列は、WO 2004/076668に開示されている。E2Fプロモーターは、細胞周期に関与するプロモーターである(Johnson, D.G., Mol. Carcinog. 27: 151-157(2000); Ngwenya, S., and Safe, S., Endocrinology 144:1675-1685; Cam, H., and Dynlacht, D., Cancer Cell 3:311-316(2003))。
【0023】
好ましくは、本発明に利用される発現コンストラクトは、ポリアデニル化配列を含む(例えば、牛成長ホルモンターミネーター及びSV40由来ポリアデニル化配列)。
【0024】
本発明の好ましい具現例によると、本発明に利用されるデコリン−エンコーディングヌクレオチド配列は、“プロモーター−デコリン−エンコーディングヌクレオチド配列−ポリアデニル化配列(Pol A)”の構造を有する。
【0025】
本発明の遺伝子伝達システムにおいて、細胞内に運搬しようとする目的のヌクレオチド配列も、上述のデコリン遺伝子の発現コンストラクトと同一な方法により発現コンストラクトを構築することができる。
【0026】
本発明で細胞内に運搬しようとする目的ヌクレオチド配列は、いかなるヌクレオチド配列でも可能であって、例えば、癌細胞の死滅を誘導して、究極的に腫瘍を退化させる癌治療遺伝子として、腫瘍抑制遺伝子、免疫調節遺伝子[例えば、サイトカイン遺伝子、ケモカイン遺伝子、及び共刺激因子(Costimulatory factor:B7.1とB7.2のようなT細胞活性に必要な補助分子)]、抗原性遺伝子、自殺遺伝子、細胞毒性遺伝子、細胞増殖抑制遺伝子、親−細胞死滅遺伝子、及び抗−新生血管生成遺伝子が含まれるが、これに限定されるものではない。
【0027】
自殺遺伝子は、細胞が外部因子により殺傷され易くなるように誘導する物質を発現するか、細胞に毒性条件を誘発する核酸配列である。このような自殺遺伝子としてよく知られているものは、チミジンキナーゼ(TK)遺伝子である(米国特許第5,631,236号及び第5,601,818号)。TK遺伝子産物を発現する細胞は、ガンシクロビル(gancyclovir)の投与により選択的な死滅に敏感である。腫瘍抑制遺伝子は、腫瘍の形成を抑制するポリペプチドを暗号化する遺伝子を意味する。腫瘍抑制遺伝子は、哺乳動物において自然発生遺伝子であり、この遺伝子の欠失または不活性化は、腫瘍発生に必須前提とされている。腫瘍抑制遺伝子の例としては、APC、DPC4、NF−1、NF−2、MTS1、WT1、BRCA1、BRCA2、VHL、p53、Rb、MMAC−1、MMSC−2、網膜芽細胞腫遺伝子(Lee et al. Nature, 329:642(1987))、大腸腺腫症遺伝子蛋白質(adenomatous polyposis coli protein;米国特許第5,783,666号)、染色体3p21.3に位置した鼻咽喉腫瘍抑制因子遺伝子(Cheng et al. Proc. Nat .Acad. Sci., 95:3042-3047(1998))、欠損された血漿腫瘍(DCC)遺伝子、MTS1、CDK4、VHL、p110Rb、p16、及びp21を含む腫瘍抑制遺伝子のINK4系列の一員及びこれの治療学的に有効な断片(例えば、p56Rb、p94Rbなど)が含まれる。当業者なら、前記例示した遺伝子に限定されず、その他に知られたあらゆる抗腫瘍遺伝子が本発明に使用できるということが分かるだろう。
【0028】
本明細書において、用語“抗原性遺伝子(antigenic gene)”は、ターゲット細胞内で発現されて、免疫システムで認識できる細胞表面抗原性蛋白質を生産するヌクレオチド配列を意味する。このような抗原性遺伝子の例には、癌胎児性抗原(carcinoembryonic antigen, CEA)及びPSA(prostate specific antigen)、AFP(α-feto protein)、p53(WO 94/02167)が含まれる。免疫システムが容易に認識するようにするために、前記抗原性遺伝子をMHC第I型抗原に結合させることができる。
【0029】
本明細書において、用語“細胞毒性遺伝子(Cytotoxic gene)”は、細胞内で発現されて毒性効果を示すヌクレオチド配列を意味する。このような細胞毒性遺伝子の例には、シュードモナス外毒素(exotoxin)、リシン毒素、ジフテリア毒素などをコーディングするヌクレオチド配列が含まれる。
【0030】
本明細書において、用語“細胞増殖抑制遺伝子(cytostatic gene)”は、細胞内で発現されて、細胞周期途中に細胞周期を停止させるヌクレオチド配列を意味する。このような細胞増殖抑制遺伝子の例には、p21、網膜芽細胞腫遺伝子、E2F−Rb融合蛋白質遺伝子、シクリン−従属性キナーゼ抑制因子をコーディングする遺伝子(例えば、p16、p15、p18及びp19)、成長中止特異性ホメオボックス(growth arrest specific homeobox, GAX)遺伝子(WO 97/16459及びWO 96/30385)などがあるが、これに限定されるものではない。
【0031】
また、各種疾患を治療するに有用に使用できる種々の治療遺伝子も、本発明のシステムにより運搬される。例えば、サイトカイン(例えば、インターフェロン−α、−β、−δ、−γ)、インターロイキン(例えば、IL-1、IL-2、IL-4、IL-6、IL-7、IL-10、IL-12、IL-5、IL-18、IL-19、IL-20及びIL-23)、及びコロニー刺激因子(例えば、GM-CSF及びG-CSF)を暗号化する遺伝子、ケモカイングループ(単球走化性蛋白質1(MCP-1)、単球走化性蛋白質2(MCP-2)、単球走化性蛋白質3(MCP-3)、単球走化性蛋白質4(MCP-4)、マクロファージ炎症性蛋白質1α(MIP-1α)、マクロファージ炎症性蛋白質1β(MIP-1β)、マクロファージ炎症性蛋白質1γ(MIP-1γ)、マクロファージ炎症性蛋白質3α(MIP-3α)、マクロファージ炎症性蛋白質3β(MIP-3β)、ケモカイン(ELC)、マクロファージ炎症性蛋白質4(MIP-4)、マクロファージ炎症性蛋白質5(MIP-5)、LD78β、RANTES、SIS−イプシロン(p500)、胸腺活性化調節されるケモカイン(TARC)、エオタキシン、I−309、ヒト蛋白質HCC−1/NCC−2、ヒト蛋白質HCC−3、マウス蛋白質C10など)が含まれる。また、組織プラスミノゲン活性化剤(tPA)またはウロキナーゼを発現する遺伝子及び持続的な血栓効果を提供して、高コレステロール血症を予防するLAL生成遺伝子が含まれる。また、嚢胞性線維症、アデノシンデアミナーゼ欠乏症及びAIDSのようなウイルス、悪性または炎症疾患を治療するための数種のポリヌクレオチドが知られている。
【0032】
本明細書において、用語“親−細胞死滅遺伝子(Pro-apoptotic gene)”は、発現されて、プログラムされた細胞消滅を誘導するヌクレオチド配列を意味する。このような親−細胞死滅遺伝子の例には、p53、アデノウイルスE3−11.6K(Ad2及びAd5由来)またはアデノウイルスE3−10.5K(Ad由来)、アデノウイルスE4遺伝子、Fasリガンド、TNF−α、TRAIL、p53経路遺伝子及びカスパーゼをコーディングする遺伝子が含まれる。
【0033】
本発明の明細書において、用語“抗−新生血管生成遺伝子(anti-angiogenic gene)”は、発現されて、抗−新生血管生成因子を細胞外に放出するヌクレオチド配列を意味する。抗−新生血管生成因子には、アンジオスタチン、Tie 2(PNAS, 1998, 95,8795-800)のような血管内皮成長因子(VEGF)の抑制因子、エンドスタチンなどが含まれる。
【0034】
上述の目的のヌクレオチド配列は、GenBankまたはEMBLのようなDNA配列データバンクから入手できる。
【0035】
本発明の遺伝子伝達システムは、多様な形態に製作することができるが、これは、(i)ネーキッド(naked)組み換えDNA分子、(ii)プラスミド、(iii)ウイルスベクター、及び(iv)前記ネーキッド組み換えDNA分子またはプラスミドを内包するリポソームまたはネオソームの形態に製作することができる。
【0036】
デコリン−エンコーディングヌクレオチド配列は、通常的な遺伝子治療に利用される全ての遺伝子伝達システムに適用できて、好ましくは、プラスミド、アデノウイルス(Lockett LJ, et al., Clin. Cancer Res. 3:2075-2080(1997))、アデノ−関連ウイルス(Adeno-associated viruses: AAV, Lashford LS., et al., Gene Therapy Technologies, Applications and Regulations Ed. A. Meager, 1999)、レトロウイルス(Gunzburg WH, et al., Retroviral vectors. Gene Therapy Technologies, Applications and Regulations Ed. A. Meager, 1999)、レンチウイルス(Wang G. et al., J. Clin. Invest. 104(11):R55-62(1999))、単純ヘルペスウイルス(Chamber R., et al., Proc. Natl. Acad. Sci USA 92:1411-1415(1995))、ワクシニアウイルス(Puhlmann M. et al., Human Gene Therapy 10:649-657(1999))、リポソーム(Methods in Molecular Biology, Vol 199, S.C. Basu and M. Basu (Eds.), Human Press 2002)、またはネオソームに適用できる。最も好ましくは、本発明の遺伝子伝達システムは、デコリンエンコーディングヌクレオチド配列をアデノウイルスに適用して製造される。
【0037】
i.アデノウイルス
アデノウイルスは、中間程度のゲノムサイズ、操作の便宜性、高いタイター、広範囲のターゲット細胞、及び優れた感染性から、遺伝子伝達ベクターとしてよく利用されている。ゲノムの両末端は、100〜200bpのITR(inverted terminal repeat)を含み、これは、DNA複製及びパッケージングに必須的なシスエレメントである。ゲノムのE1領域(E1A及びE1B)は、転写及び宿主細胞遺伝子の転写を調節する蛋白質をコーディングする。E2領域(E2A及びE2B)は、ウイルスDNA複製に関与する蛋白質をコーディングする。
【0038】
現在開発されたアデノウイルスベクターの中で、E1領域の欠如された複製不能アデノウイルスがよく利用されている。一方、E3領域は、通常的なアデノウイルスベクターから除去され、外来遺伝子が挿入される座を提供する(Thimmappaya, B. et al., Cell, 31:543-551(1982); ・ Riordan, J. R. et al., Science, 245:1066-1073(1989))。したがって、本発明のデコリン遺伝子は、欠失されたE1領域(E1A領域及び/またはE1B領域、好ましくは、E1B領域)、またはE3領域に挿入されることが好ましく、より好ましくは、欠失されたE3領域に挿入される。一方、細胞内に運搬しようとする目的ヌクレオチド配列は、欠失されたE1領域(E1A領域及び/またはE1B領域、好ましくは、E1B領域)、またはE3領域に挿入されることが好ましく、より好ましくは、欠失されたE1領域に挿入される。本明細書において、ウイルスゲノム配列と関連して使用される用語、“欠失”は、該当配列が完全に欠失されたものだけではなく、部分的に欠失されたものも含む意味を有する。
【0039】
本発明の最も好ましい具現例によると、本発明のアデノウイルス遺伝子伝達システムは、“プロモーター−目的ヌクレオチド配列−ポリA配列”と“プロモーター−デコリン遺伝子−ポリA配列”とが連結された構造を有して、前記“プロモーター−目的ヌクレオチド配列−ポリA配列”は、欠失されたE1領域(E1A領域及び/またはE1B領域、好ましくは、E1B領域)、またはE3領域、好ましくは、欠失されたE1領域に挿入されたものであり、前記“プロモーター−デコリン遺伝子−ポリA配列”は、欠失されたE1領域(E1A領域及び/またはE1B領域、好ましくは、E1B領域)、またはE3領域、好ましくは、欠失されたE3領域に挿入されたものである。また、“プロモーター−目的ヌクレオチド配列−ポリA配列−IRES−デコリン遺伝子−ポリA配列”のように、目的ヌクレオチドとデコリン遺伝子がIRES(internal ribosome entry site)により連結されたバイシストロン(bicistronic)発現システムによっても発現可能である。
【0040】
また、アデノウイルスは、野生型ゲノムの約105%までパッケージングすることができるため、約2kbを追加的にパッケージングすることができる(Ghosh-Choudhury et al., EMBO J., 6:1733-1739(1987))。したがって、アデノウイルスに挿入される上述の外来配列は、アデノウイルスのゲノムに追加的に結合させることもできる。
【0041】
アデノウイルスは、42個の相異なる血清型及びA〜Fのサブグループを有する。この中で、サブグループCに属するアデノウイルスタイプ2及びタイプ5が、本発明のアデノウイルスベクターを得るための最も好ましい出発物質である。アデノウイルスタイプ2及びタイプ5に対する生化学的及び遺伝的情報は、よく知られている。
【0042】
アデノウイルスにより運搬される外来遺伝子は、エピソームと同一な方式により複製されて、そのため、宿主細胞に対して遺伝的毒性が非常に低い。したがって、本発明のアデノウイルス遺伝子伝達システムを利用した遺伝子治療が非常に安全であると判断される。
【0043】
ii.レトロウイルス
レトロウイルスは、自分の遺伝子を宿主のゲノムに挿入させて、大量の外来遺伝物質を運搬することができ、感染できる細胞のスペクトルが広いため、遺伝子伝達ベクターとしてよく利用されている。
【0044】
レトロウイルスベクターを構築するために、デコリン遺伝子及び運搬しようする目的ヌクレオチド配列は、レトロウイルスの配列の代わりにレトロウイルスゲノムに挿入されて、複製不能のウイルスを生産する。ビリオンを生産するために、gag、pol及びenv遺伝子を含むが、LTR(long terminal repeat)とΨ配列は含まないパッケージング細胞株を構築する(Mann et al., Cell, 33:153-159(1983))。デコリン遺伝子、運搬しようとする目的ヌクレオチド配列、LTR及びΨ配列を含む組み換えプラスミドを前記細胞株に移入すると、Ψ配列は、組み換えプラスミドのRNA転写体の生産を可能にして、この転写体は、ウイルスにパッケージングされて、ウイルスは、培地に排出される(Nicolas and Rubinstein "Retroviral vectors," In: Vectors: A survey of molecular cloning vectors and their uses, Rodriguez and Denhardt (eds.), Stoneham: Butterworth, 494-513(1988))。組み換えレトロウイルスを含有する培地を収集して濃縮し、遺伝子伝達システムに利用する。
【0045】
2世帯レトロウイルスベクターを利用した遺伝子伝達が発表された。Kasaharaら(Science, 266:1373-1376(1994))は、モロニーマウス白血病ウイルス(moloney-murine leukemia virus)の変異体を製造して、ここで、EPO(erythropoietin)配列をエンベロープ部位に挿入して、新しい結合特性を有するキメリック蛋白質(Chimeric proteins)を生産した。本発明の遺伝子伝達システムも、このような2世帯レトロウイルスベクターの構築戦略により製造することができる。
【0046】
iii.AAVベクター
アデノ関連ウイルス(AAV)は、非分裂細胞を感染させることができて、多様な種類の細胞に感染できる能力を有しているため、本発明の遺伝子伝達システムに適している。AAVベクターの製造及び用途に対する詳細な説明は、米国特許第5,139,941号及び第4,797,368号に詳細に開示されている。
【0047】
遺伝子伝達システムとしてのAAVに対する研究は、LaFace et al, Viology, 162:483486(1988), Zhou et al., Exp. Hematol. (NY), 21:928-933(1993), Walsh et al, J. Clin. Invest., 94:1440-1448(1994)、及びFlotte et al., Gene Therapy, 2:29-37(1995)に開示されている。最近、AAVベクターは、嚢胞性線維症の治療剤として臨床Iを施している。
【0048】
典型的に、AAVウイルスは、二つのAAV末端リピートが両側に位置されている目的の遺伝子配列(デコリン遺伝子及び運搬しようとする目的ヌクレオチド配列)を含むプラスミド(McLaughlin et al., J. Virol., 62:1963-1973(1988);及びSamulski et al., J. Virol., 63:3822-3828(1989))及び末端リピートのない野生型AAVコーディング配列を含む発現プラスミド(McCarty et al., J. Virol., 65:2936-2945( 1991))を同時形質転換させて製造される。
【0049】
iv.他のウイルスベクター
他のウイルスベクターも、本発明の遺伝子伝達システムとして利用することができる。ワクシニアウイルス(Puhlmann M. et al., Human Gene Therapy 10:649-657(1999); Ridgeway, "Mammalian expression vectors," In: Vectors: A survey of molecular cloning vectors and their uses. Rodriguez and Denhardt, eds. Stoneham: Butterworth, 467-492(1988); Baichwal and Sugden, "Vectors for gene transfer derived from animal DNA viruses: Transient and stable expression of transferred genes," In: Kucherlapati R, ed. Gene transfer. New York: Plenum Press, 117-148( 1986)及びCoupar et al., Gene, 68:1-10(1988))、レンチウイルス(Wang G. et al., J. Clin. Invest. 104(11):R55-62(1999))、または単純ヘルペスウイルス(Chamber R., et al., Proc. Natl. Acad. Sci USA 92:1411-1415(1995))由来のベクターも、デコリン遺伝子及び運搬しようとする目的ヌクレオチド配列を細胞内に運搬できる運搬システムとして利用することができる。
【0050】
v.リポソーム
リポソームは、水上に分散されたリン脂質により自然に形成される。外来DNA分子をリポソームにより成功的に細胞内に運搬した例は、Nicolau及びSene, Biochim. Biophys. Acta, 721:185-190(1982)、及びNicolau et al., Methods Enzymol., 149:157-176(1987)に開示されている。一方、リポソームを利用した動物細胞の形質転換に最もよく利用される試薬としては、Lipofectamine(Gibco BRL)がある。デコリン遺伝子及び運搬しようとする目的ヌクレオチド配列を内包したリポソームは、エンドサイトーシス、細胞表面への吸着またはプラズマ細胞膜との融合などのメカニズムを通じて細胞と相互作用し、細胞内にデコリン遺伝子及び運搬しようとする目的ヌクレオチド配列を運搬する。
【0051】
本発明の他の様態によると、本発明は、上述の本発明の遺伝子伝達システムを、細胞を含むバイオサンプルに接触させる段階を含む遺伝子伝達方法を提供する。
【0052】
本発明において、遺伝子伝達システムがウイルスベクターに基づいて製作された場合は、前記接触させる段階は、当業界に公知されたウイルス感染方法により行われる。ウイルスベクターを利用した宿主細胞の感染は、上述の引用文献に記載されている。
【0053】
本発明において、遺伝子伝達システムがネーキッド(naked)組み換えDNA分子またはプラスミドの場合は、微細注入法(Capecchi, M.R., Cell, 22:479(1980);及びHarlandとWeintraub, J. Cell Biol. 101:1094-1099(1985))、カルシウムフォスフェート沈殿法(Graham, F.L. et al., Virology, 52:456(1973);及びChenとOkayama, Mol. Cell. Biol. 7:2745-2752(1987))、電気穿孔法(Neumann, E. et al., EMBO J., 1:841(1982);及びTur-Kaspa et al., Mol. Cell Biol., 6:716-718(1986))、リポソーム−媒介形質感染法(Wong, T.K. et al., Gene, 10:87(1980); Nicolau及びSene, Biochim. Biophys. Acta, 721:185-190(1982);及びNicolau et al., Methods Enzymol., 149:157-176(1987))、DEAE−デキストラン処理法(Gopal, Mol. Cell Biol., 5:1188-1190(1985))、及び遺伝子ボンバードメント(Yang et al., Proc. Natl. Acad. Sci., 87:9568-9572(1990))方法により、遺伝子を細胞内に移入させることができる。
【0054】
本発明のまた他の様態によると、本発明は、アデノウイルスのITR(inverted terminal repeat)ヌクレオチド配列及びデコリン−エンコーディングヌクレオチド配列を含み、前記デコリンは、アデノウイルスの腫瘍組織浸透能及び腫瘍細胞アポトーシス能を増大させる作用をすることを特徴とする組み換えアデノウイルスを提供する。
【0055】
本発明の組み換えアデノウイルスは、従来の組み換えアデノウイルスにデコリン−エンコーディングヌクレオチド配列を追加的に結合させ、アデノウイルスの腫瘍組織浸透能及び腫瘍細胞アポトーシス能を増大させて、アデノウイルスによる癌治療効能を大きく増加させる。
【0056】
アデノウイルスゲノムの小さい部分だけがcisで必要であると知られているため(Tooza, J. Molecular biology of DNA Tumor viruses, 2nd ed. Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y.(1981))、アデノウイルスは、大量の外来DNA分子を運搬できる能力があり、これは特に、293のような特定細胞株を利用する場合にそうである。このような側面で、本発明の組み換えアデノウイルスにおいて、デコリン遺伝子以外の他のアデノウイルスの配列は、少なくともITR配列を含む。
【0057】
デコリン遺伝子は、E1領域(E1A領域及び/またはE1B領域、好ましくは、E1B領域)、またはE3領域に挿入されることが好ましく、より好ましくは、E3領域に挿入される。一方、他の外来ヌクレオチド配列(例えば、サイトカイン、免疫−共刺激因子、自殺遺伝子、及び腫瘍抑制遺伝子)も追加的にアデノウイルスに含ませることができて、これは、E1領域(E1A領域及び/またはE1B領域、好ましくは、E1B領域)またはE3領域に挿入されることが好ましく、より好ましくは、E1領域(E1A領域及び/またはE1B領域、好ましくは、E1B領域)に挿入される(参照:図1a及び1b)。本発明の他の変形例によると、デコリン遺伝子は、E4領域に挿入できる。
【0058】
また、アデノウイルスは、野生型ゲノムの約105%までパッケージングすることができるため、約2kbを追加的にパッケージングすることができる。したがって、アデノウイルスに挿入される上述の外来配列は、アデノウイルスのゲノムに追加的に結合させることもできる。
【0059】
本発明の好ましい具現例において、本発明の組み換えアデノウイルスは、非活性化されたE1B 19kDa遺伝子、E1B 55kDa遺伝子、またはE1B 19kDa/E1B 55kDa遺伝子を有して、好ましくは、非活性化されたE1B 19kDa及びE1B 55kDa遺伝子を有する。本明細書において、遺伝子と関連して使用される用語“非活性化”は、その遺伝子の転写及び/または解読が正常的になされず、その遺伝子によりコーディングされる正常的な蛋白質の機能が現れないことを意味する。例えば、非活性化E1B 19kDa遺伝子は、その遺伝子に変異(置換、付加、部分的欠失、または全体的欠失)が発生され、活性のE1B 19kDa蛋白質を生成できない遺伝子である。E1B 19kDa遺伝子が欠如された場合は、細胞アポトーシス能を増加させることができて、E1B 55kDa遺伝子が欠如された場合は、腫瘍細胞特異性を有するようにする(参照:大韓民国特許出願第2002−23760号)。
【0060】
本発明の好ましい具現例によると、本発明の組み換えアデノウイルスは、活性のE1A遺伝子を含む。E1A遺伝子を含む組み換えアデノウイルスは、複製可能な特性を有するようになる。本発明のより好ましい具現例によると、本発明の組み換えアデノウイルスは、非活性化されたE1B 19及び/またはE1B 55遺伝子及び活性のE1A遺伝子を含む。本発明の最も好ましい具現例によると、本発明の組み換えアデノウイルスは、E1B 19及び/またはE1B 55遺伝子が欠失されて、活性のE1A遺伝子を含み、デコリン−エンコーディングヌクレオチド配列は、欠失されたE3領域に挿入される。
【0061】
本発明の好ましい具現例によると、本発明の組み換えアデノウイルスは、非活性化されたE1B遺伝子及び変異された活性のE1A遺伝子を含み、デコリン遺伝子は、欠失されたE3領域に挿入されているものである。ここで、変異された活性のE1A遺伝子は、Rb(retinoblastoma蛋白質)結合部位をコーディングするヌクレオチド配列中で、45番目Glu残基がGlyに置換された変異及び121〜127番目アミノ酸配列が全体的にGlyに置換された変異を有する。腫瘍細胞では、p53蛋白質の変異だけではなく、Rbの突然変異あるいはRb関連信号メカニズムが相当部分損傷されているため、Rbとの結合能が消失されたアデノウイルスは、正常細胞では、Rbの活性によりアデノウイルスの複製が抑制されるが、Rbの機能が抑制された腫瘍細胞では、活発に複製されて、癌細胞を選択的に殺傷することができる。したがって、上述のRb結合部位における変異を含む本発明の組み換えアデノウイルスは、癌細胞特異性が非常に大きく増大される。
【0062】
本発明の最も好ましい具現例によると、本発明の組み換えアデノウイルスは、“ITR−E1A−ΔE1B−プロモーター−デコリン遺伝子−ポリA配列”構造を有して、前記“プロモーター−デコリン遺伝子−ポリA配列”は、欠失されたE3領域に挿入されたものである。
【0063】
本発明の最も好ましい実施例によると、本発明の腫瘍特異的殺傷アデノウイルスは、図1bの遺伝子地図を有する。
【0064】
本発明の組み換えアデノウイルスにおいて、従来の抗腫瘍アデノウイルスの局所的腫瘍浸透力が大きく改善されて、細胞アポトーシス能も大きく改善される。このような効果は、本発明で利用されたデコリンが細胞外基質を効果的に分解して、細胞アポトーシス能を増加させるためであり、最終的に本発明の組み換えアデノウイルスは、大きく改善された腫瘍細胞殺傷能を示す。
【0065】
大部分の腫瘍組織は、癌細胞が単純に群集されているのではなく、血管と正常組織とが絡まっている。特に、癌組織内に存在する結締組織は、硬くて、且つ癌細胞の外部周囲に硬い細胞外基質が形成されているため、ウイルスはもちろん抗癌治療剤が腫瘍に円滑に浸透できず、抗腫瘍効果を十分発揮できない場合が多い。このような問題点は、デコリン遺伝子を含む本発明の組み換えアデノウイルスを利用した場合、成功的に克服される。
【0066】
下記の実施例で証明されたように、デコリンの挿入されたアデノウイルスは、腫瘍球の表面だけではなく、腫瘍球の奥まで活発に拡散される。生体内の癌組織においても、デコリンを発現する本発明のアデノウイルスは、投与部位(injection site, needle track)からさらに遠く且つさらに広く広がっていく。デコリンの発現による遺伝子伝達効率の増加は、肉眼でも容易に確認できるほど、約2〜10倍以上に大きく差があって、既存になされた数々の研究によるコラゲナーゼ/ディスパーゼ、またはトリプシンのような蛋白質分解酵素の前処理、エラスチンを分解できるエラスターゼ、または細胞外基質を分解できるヒアルロニダーゼ(hyaluronidase)による約2〜3倍の遺伝子伝達効率の増大に比べ、著しく優れた遺伝子伝達効率を示す。
【0067】
そして、このようなデコリンの著しい組織内ウイルス拡散増進効果は、腫瘍特異的殺傷アデノウイルスにも適用されて、その結果、抗腫瘍効果を大きく増大させる結果を誘導する。このような抗腫瘍効果の改善は、腫瘍特異的殺傷アデノウイルス(複製可能組み換えアデノウイルス)だけではなく、複製不能組み換えアデノウイルスでも現れる。一方、デコリンによる組み換えアデノウイルスの細胞アポトーシス能の格段の改善は、全く予期できなかった効果である。
【0068】
本発明の他の様態によると、本発明は、(a)上述の本発明の組み換えアデノウイルスの治療学的有効量、及び(b)薬剤学的に許容される担体を含む薬剤学的抗腫瘍組成物を提供する。
【0069】
本発明の他の様態によると、本発明は、上述の本発明の薬剤学的抗腫瘍組成物を動物に投与する段階を含む癌の治療方法を提供する。
【0070】
本発明の薬剤学的組成物に有効成分として含まれる組み換えアデノウイルスは、上述の本発明の組み換えアデノウイルスと同一なものであるため、組み換えアデノウイルスに対する詳細な説明は、本発明の薬剤学的組成物にも同様に適用される。したがって、本明細書の不要な重複記載による過度なる複雑性を避けるために、共通事項は、その記載を省略する。
【0071】
組み換えアデノウイルスを利用した効果的な抗腫瘍効果を誘導するためには、速い速度で成長する癌細胞に比べ、より速いウイルスの増殖と隣接細胞への拡散を通じて、効果的な細胞殺傷効果を誘発することができなければならない。また、アデノウイルスを利用した癌遺伝子治療が成功的になされるためには、高い治療効果と共に、安全性を高めるための方案が開発されなければならない。本発明で開発されたデコリン遺伝子を含む組み換えアデノウイルスは、ウイルス組織内拡散増大と細胞アポトーシス促進を通じて抗腫瘍効果が著しく増大されて、癌細胞特異的に細胞殺傷能を示す。これは、結果的に癌治療に必要なウイルス投与量を減少させることができ、ウイルスによる生体内毒性と免疫反応を大きく減らすことができる。
【0072】
本発明の組成物に含まれる組み換えアデノウイルスは、上述のように、多様な腫瘍細胞に対して殺傷効能を示すため、本発明の薬剤学的組成物は、腫瘍に係る様々な疾病または疾患、例えば、脳癌、胃癌、皮膚癌、肺癌、乳房癌、卵巣癌、肝癌、気管支癌、鼻咽頭癌、喉頭癌、食道癌、膵臓癌、膀胱癌、前立腺癌、大腸癌、結腸癌、及び子宮頸部癌などの治療に利用できる。本明細書において、“治療”は、(i)腫瘍細胞形成の予防;(ii)腫瘍細胞の除去による、腫瘍に係る疾病または疾患の抑制;及び(iii)腫瘍細胞の除去による、腫瘍に係る疾病または疾患の軽減を意味する。したがって、本明細書における用語“治療学的有効量”は、上記した薬理学的効果を達成するに十分な量を意味する。
【0073】
本発明の組成物に含まれる薬剤学的に許容される担体は、製剤時に通常的に利用されるものであって、ラクトース、デキストロース、スクロース、ソルビトール、マンニトール、デンプン、アカシアゴム、リン酸カルシウム、アルギネート、ゼラチン、ケイ酸カルシウム、微細結晶性セルロース、ポリビニルピロリドン、セルロース、水、シロップ、メチルセルロース、メチルヒドロキシベンゾエート、プロピルヒドロキシベンゾエート、滑石、ステアリン酸マグネシウム、及びミネラルオイルなどを含むが、これに限定されるものではない。本発明の薬剤学的組成物は、前記成分の他に、潤滑剤、湿潤剤、甘味剤、香味剤、乳化剤、懸濁剤、保存剤などをさらに含むことができる。
【0074】
本発明の薬剤学的組成物は、非経口投与が好ましく、例えば、静脈内投与、腹腔内投与、筋肉内投与、皮下投与、または、局部投与を利用して投与することができる。卵巣癌で腹腔内に投与する場合及び肝癌で門脈に投与する場合は、注入方法により投与することができて、脳癌、皮膚癌、頭頸部癌及び乳房癌の場合は、腫瘍塊に直接注射して投与することができ、結腸癌の場合は、浣腸で直接注射して投与することができて、膀胱癌の場合は、カテーテル内に直接注射して投与することができる。
【0075】
本発明の薬剤学的組成物の適合した投与量は、製剤化方法、投与方式、患者の年齢、体重、性、疾病症状の程度、飲食、投与時間、投与経路、排泄速度、及び反応感応性のような要因により様々であり、普通に熟練した医者は、目的する治療に効果的な投与量を容易に決定及び処方することができる。一般に、本発明の薬剤学的組成物は、1×105〜1×1015PFU/mlの組み換えアデノウイルスを含み、通常、1×1010PFUを二日に一回、2週間注射する。
【0076】
本発明の薬剤学的組成物は、本発明の属する技術分野で通常の知識を有する者が容易に実施できる方法により、薬剤学的に許容される担体及び/または賦形剤を利用して製剤化することにより、単位容量形態に製造されるか、または多用量容器内に入れて製造する。この際、剤形は、オイルまたは水性媒質中の溶液、懸濁液または乳化液の形態であるか、エリキシル剤、粉末剤、顆粒剤、錠剤またはカプセル剤の形態でもよく、分散剤または安定化剤をさらに含むことができる。
【0077】
本発明の薬剤学的組成物は、単独療法として利用してもよいが、他の通常的な化学療法または放射療法と共に利用してもよく、このような並行療法を実施する場合は、より効果的に癌治療をすることができる。本発明の組成物と共に利用できる化学療法剤は、シスプラチン、カルボプラチン、プロカルバジン、メクロレタミン、シクロホスファミド、イホスファミド、メルファラン、クロラムブシル、ビスルファン、ニトロソウレア、ダクチノマイシン、ダウノルビシン、ドキソルビシン、ブレオマイシン、プリコマイシン(plicomycin)、マイトマイシン、エトポシド、タモキシフェン、タキソール、トランスプラチニウム(transplatinum)、5−フルオロウラシル、ビンクリスチン、ビンブラスチン、及びメトトレキサートなどを含む、本発明の組成物と共に利用できる放射療法は、X−線照射及びγ−線照射などである。
【0078】
本発明の他の様態によると、本発明は、(a)薬物の組織浸透性を改善するためのデコリンタンパク質、及び(b)薬剤学的に許容される担体を含む改善された組織浸透性を有する薬剤学的組成物を提供する。
【0079】
本発明で利用されるデコリンタンパク質は、天然ソース(natural source)から分離されたデコリンタンパク質及び組み換え技術で得られたデコリンタンパク質を含み、細胞外基質分解活性を有する範囲内で、前記タンパク質の断片も含む。
【0080】
本発明の組成物は、薬物が投与される前または薬物と同時に投与することができる。また、本発明の組成物は、薬物を追加的に含むことができる。本発明の薬剤学的組成物は、薬物が適用される生体組織の細胞外基質を分解することにより、薬物の組織浸透性を大きく改善し、薬物の薬理学的効果を増加させる。
【0081】
本発明の薬剤学的組成物において、薬剤学的に許容される担体、投与方法及び製剤化方法などは、上述の抗腫瘍薬剤学的組成物の内容が適用される。特に、本発明の薬剤学的組成物は、非経口投与が好ましいが、例えば、静脈内投与、腹腔内投与、筋肉内投与、皮下投与、経皮投与、または組織内直接投与(例えば、頭頸部癌または乳房癌腫塊内への直接投与)を利用して投与することができる。一般に、本発明の薬剤学的組成物の投与量は、0.0001〜100mg/kgである。
【0082】
本発明の組成物により組織浸透性が改善される前記薬物は、化学薬物及びバイオ薬物(biodrug)を含み、好ましくは、細胞外基質により組織浸透性が問題となる薬物、例えば、上述の癌に対する化学療法剤である。
【0083】
本発明の他の様態によると、本発明は、(a)デコリン−エンコーディングヌクレオチド配列を含む遺伝子伝達システムまたはデコリンタンパク質の治療学的有効量、及び(b)薬剤学的に許容される担体を含む細胞外基質の過度なる蓄積(accumulation)に係る疾患または状態の治療用薬剤学的組成物を提供する。
【0084】
本発明の薬剤学的組成物は、生体組織の細胞外基質を効果的に分解して、細胞外基質の過度なる蓄積または沈着(deposition)が関与する疾病または疾患を治療することができる。本明細書における表現“細胞外基質の過度なる蓄積”は、コラーゲン、ラミニン、フィブロネクチン、及びプロテオグリカンのような細胞外基質成分が、組織または器官機能を損傷し、終局的に線維症疾患を招来する程度に沈着されたことを意味する。
【0085】
本発明の薬剤学的組成物が適用される、細胞外基質の過度なる蓄積に係る疾患または状態は、線維症状態と関連したものであって、斑痕、肝硬変症、肺線維症、糸球体腎炎、成人または急性呼吸困難症、肝線維症、腎線維症、後心筋梗塞線維症、 嚢胞性線維症、線維症癌、静脈閉塞症、または腎間質線維症を含むが、これに限定されるものではない。
【0086】
本発明の薬剤学的組成物が適用される斑痕(scar)は、傷、火傷、または手術により生じた斑痕及びケロイドのような過度な斑痕である。
【0087】
本発明の薬剤学的組成物において、デコリン−エンコーディングヌクレオチド配列を含む遺伝子伝達システムは、上述した本発明の遺伝子伝達システムにより説明される。一方、本発明の薬剤学的組成物で利用されるデコリンタンパク質は、天然ソース(natural source)から分離されたデコリンタンパク質及び組み換え技術により得られたデコリンタンパク質を含み、細胞外基質分解活性を有する範囲内で、前記タンパク質の断片も含む。
【0088】
本発明の薬剤学的組成物において、薬剤学的に許容される担体、投与方法及び製剤化方法などは、上述の抗腫瘍薬剤学的組成物の内容が適用される。特に、本発明の薬剤学的組成物が斑痕の治療のために利用される場合は、経皮投与が最も適しており、軟膏、ゲル、クリーム、液体、スプレー、パッチ、またはローションの剤形で製造することが最も好ましい。一般に、本発明の薬剤学的組成物の1日投与量は、0.001〜100mg/kgである。
【発明を実施するための最良の形態】
【0089】
以下、実施例を通じて本発明をさらに詳細に説明する。これら実施例は、本発明をより具体的に説明するためのものであって、本発明の範囲がこれら実施例に限定されないことは、本発明の属する技術分野で通常の知識を有する者にとって自明なことであろう。
【実施例】
【0090】
[実験材料及び実験方法]
1.対象細胞株及び細胞の培養
本発明の実験に使用された細胞株は、人体脳癌細胞株(U343及びU87MG)、子宮頸部癌細胞株(C33A)、肝癌細胞株(Hep3B)、肺癌細胞株(A549)とマウス黒色腫(B16BL6)のような癌細胞株、人体正常細胞株(CBHEL, MRC5, IMR90及びWI38)及びアデノウイルス初期発現遺伝子であるE1部位が宿主遺伝体内に内在されている293細胞株である。B16BL6を除いた全ての細胞株は、ATCC(American Type Culture Collection; Manassas, VA, USA)から購入し、B16BL6マウス黒色腫細胞株は、大韓民国のヨンセ大学校(Yonsei University)のボクヨンソク教授チームから提供してもらった。
【0091】
B16BL6細胞株を除いた全ての細胞株は、10%の牛胎児血清(Gibco BRL, Grand Island, NY)の含有されたDMEM培地(Gibco BRL)を培養液とし、抗生剤ペニシリン/ストレプトマイシン(Gibco BRL)を添加して、5%CO2の存在下、37℃恒温培養器で培養した。B16BL6細胞株は、10%の牛胎児血清とペニシリン/ストレプトマイシンとを含むRPMI 1640(Gibco BRL)を使用して、5%CO2の存在下、37℃恒温培養器で培養した。
【0092】
2.実験動物
生体内抗腫瘍実験は、6〜8週齢の雄ヌードマウス(BALB/c-nu)とC57BL/6 マウスをCharles River Korea(Seoul, Korea)で購入して行った。動物飼育室の温度は、22±2℃、湿度は、55〜60%に維持して、明暗循環が12時間単位で調節されるようにし、放射線照射で滅菌した固形飼料(Orient, Seoul, Korea)と滅菌された給水を自由に摂取するようにした。
【0093】
3.デコリンを発現するアデノウイルスの製作、生産及び力価算出
(1)複製不能アデノウイルスの製作
LacZ遺伝子を標識遺伝子として発現し且つデコリン遺伝子を発現する、E1とE3遺伝子の消失された複製不能アデノウイルスを製作した。まずvmdl324BstB(Heider, H. et al., Biotechniques, 28(2):260-270(2000))ベクターの消失されたE1部位に標識遺伝子のLacZ遺伝子を挿入し、pdl−LacZウイルスベクターを製作した。このために、まず、LacZを発現するpcDNA−hygro−LacZ(Invitrogen, Carlsbad, CA,米国) プラスミドからCMVプロモーター、LacZ、及びpolA部位をHindIIIとNaeIとで処理し分離した後、これをE1アデノウイルスシャトルベクターであるpΔE1sp1Aに挿入し、pΔE1sp1A/CMV−LacZシャトルベクターを製作した。製作されたpΔE1sp1A/CMV−LacZシャトルベクターをXmnI制限酵素で切断した後、BstBI制限酵素により一本鎖となったアデノウイルスvmdl324BstBと共に大腸菌BJ5183(S.B. Verca, University of Fribourgh, Switzerland)で同時形質転換させて、遺伝子相同組み換えを誘導し、pdl−LacZアデノウイルスを製作した。
【0094】
デコリン遺伝子を発現するアデノウイルスを製作するために、発現ベクターpcDNA3.1にデコリン遺伝子(DCNG) (D.G. Seidler, University Hospital of Munster, ドイツ)を挿入し、pcDNA3.1−DCNG(野生型cDNA形態のデコリン)を製造した。次に、前記野生型デコリンコアタンパク質の6番目ロイシンリッチリピート部位内にあるE180アミノ酸をE180Qで点突然変異させて、コラーゲンとの結合力が野生型に比べ弱化されたデコリン変異体DCNQを製造した後、pcDNA3.1ベクターに挿入し、pcDNA3.1−DCNQ発現ベクターを製造した。そして、デコリンコアタンパク質のE180アミノ酸をE180Kで点突然変異させて、コラーゲンとの結合能が消失されたデコリン変異体DCNKを製造し、これをpcDNA3.1ベクターに挿入して、pcDNA3.1−DCNK発現ベクターを製造した。次に、前記発現ベクターのそれぞれを制限酵素EcoRIとXbaIで処理し、1kb DNA切片を得た後、pCA14ベクター(Microbix, Ontario, Canada)に挿入させて、pCA14−DCNG、pCA14−DCNQ及びpCA14−DCNKベクターを製作した。
【0095】
製作されたpCA14−DCNG、pCA14−DCNQ及びpCA14−DCNKベクターのそれぞれを制限酵素BglIIで処理し、デコリンをCMVプロモーターにより発現できるCMA−DCN−polA発現カセットを切り出して、これをアデノウイルスE3シャトルベクターであるpSP72ΔE3に挿入して、アデノウイルスE3シャトルベクター(pSP72ΔE3-DCNG, pSP72ΔE3-DCNQ及びpSP72ΔE3-DCNK)を製作した。
【0096】
前記製作されたアデノウイルスE3シャトルベクターを制限酵素PvuIまたはXmnIでそれぞれ処理し線形化した後、SpeIを処理して線形化されたPdl−LacZアデノウイルストータルベクターと共に大腸菌BJ5183で同時形質転換させて、遺伝子相同組み換え(homologous recombination)を誘導し、LacZ遺伝子とデコリンとを同時に発現するdl−LacZ−DCNG、dl−LacZ−DCNQ、dl−LacZ−DCNKアデノウイルスをそれぞれ製作した(図1a)。
【0097】
(2)腫瘍特異的殺傷アデノウイルスの製作
デコリン遺伝子を発現する腫瘍特異的殺傷アデノウイルスを製作した。具体的には、上記で製作したアデノウイルスE3シャトルベクターpSP72ΔE3−DCNG、pSP72ΔE3−DCNQ及びpSP72ΔE3−DCNKのそれぞれを制限酵素PvuIまたはXmnIでそれぞれ処理して線形化させた後、制限酵素SpeIを処理して線形化されたpAd−ΔE1Bアデノウイルストータルベクター(E1B 19kDa遺伝子とE1B 55kDa遺伝子とが共に消失された腫瘍特異的殺傷アデノウイルス)と共に大腸菌BJ5183で同時形質転換させて、アデノウイルスベクターAd−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKをそれぞれ製作した(図1a及び図1b)。相同性組み換えされたアデノウイルスベクターを制限酵素HindIIIで処理し、相同性組み換え有無を確認した。相同性組み換えが確認されたプラスミドは、PacI制限酵素で切断した後、293細胞株に形質転換して、アデノウイルスを生産した(図1a及び図1b)。
【0098】
これらのアデノウイルスを293細胞株で増殖させた後、限界希釈法(limiting dilution)またはプラーク分析(plaque assay)を行って、ウイルスの力価を決定し(Hitt, M. et al., Construction and propagation of human adenovirus vectors. Cel biology: a laboratory handbook. New York: Academic Press Inc, 479-490(1994))、CsCl濃度勾配で濃縮して分離した。
【0099】
4.デコリンの発現様相の調査
本発明で製作したアデノウイルスにより誘導されるデコリンの発現様相を調べるために、デコリン遺伝子が挿入された腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)及び対照群としてAd−ΔE1Bアデノウイルスを、それぞれ3MOIで人体肝癌細胞株であるHep3Bに感染させた。感染48時間後、細胞から培地を回収し、SDS−PAGE(Sodium dodecyl sulfate polyacrylamide gel electrophoresis)電気泳動を行った。電気泳動後、ゲルにあるタンパク質をPVDFメンブレインに電気−伝達させた後、デコリン(D.G. Seidler, University Hospital of Munster、ドイツ)及びβ−アクチン(Sigma, St. Louis, MO, USA)を特異的に認知する抗体を一次抗体で結合させて、HRP(horse radish peroxidase)が結合された二次抗体(sc-2004; Santa Cruz Biotech., Santa Cruz, CA)をさらに結合させた後、ECL検出キット(sc-2004; Santa Cruz Biotech)を利用して、デコリンタンパク質の発現様相を究明した。
【0100】
5.遺伝子伝達効率の比較検証
LacZを発現する複製不能アデノウイルスの遺伝子伝達効率を検証するために、数種の人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)と、人体正常細胞株(CBHEL, IMR90及びWI38)とを24−ウェルプレートに分株した後、dl−LacZ、dl−LacZ−DCNG、dl−LacZ−DCNQ及びdl−LacZ−DCNKウイルスを0.1〜100MOI(multiplicity of infection)でそれぞれ感染させた。ウイルス感染二日後、X−Gal試薬(PBS containing 1mg/ml, 5mM K3Fe(CN)6, 5mM K4Fe(CN)6及び2mM MgCl2)で37℃で6時間反応し、X−Gal染色することにより、デコリン遺伝子の発現によるLacZ遺伝子の伝達効率を確認した。
【0101】
6.アデノウイルスの腫瘍球内組織浸透性の検証
約6〜8週齢のヌードマウスの腹壁に人体腫瘍細胞株(U343、U87MG、C33A、及びA549)をそれぞれ1×107個皮下注射した後、腫瘍の大きさが約150〜200mm3程度になった時、腫瘍を摘出した。摘出した腫瘍を約1〜2mm径の切片にして、0.75%アガロースでコーティングされた培養器で、5%牛胎児血清と抗生剤ペニシリン/ストレプトマイシンとが含有されたDMEMを添加して培養した。培養液は、一週間に約1〜2回入れ替えて、1週間以上腫瘍球を培養した。アデノウイルスを感染させる前に、約2mm径の腫瘍球を0.75%アガロースのコーティングされた48ウェルプレートに移した後、5%牛胎児血清を含むDMEM150μlを添加して、1×106、1×107、及び1×108PFU(plaque-forming unit)のアデノウイルスをそれぞれ添加した。アデノウイルスを添加した後三日頃に培地を除去して、腫瘍球を固定溶液に入れて固定させた後、X−gal染色を施した。立体顕微鏡(Olympus optical Co., LTD, Tokyo, Japan)を利用して、X−gal染色された腫瘍球の表面を観察した後、O.C.T.コンパウンド(Sakura Finetec, Torrance, CA)で凍結薄片した後、10μm厚に切断して、ゼラチンのコーティングされたスライドガラス上に付着し光学顕微鏡で観察して、アデノウイルスの腫瘍球内への浸透程度を確認した。また、腫瘍球内のX−gal染色された部分の比率は、MetaMorphプログラム(Meta imaging series, Version 6.1, Universal imaging corporation TM, Downingtown, PA)を利用して算出した。
【0102】
7.アデノウイルスの生体内癌組織浸透性の検証
約6〜8週齢のヌードマウスの腹壁に数種の人体腫瘍細胞株(U343、U87MG、C33A及びHep3B)を皮下注射した後、腫瘍の大きさが約150〜200mm3程度になった時、アデノウイルスdl−LacZ及びdl−LacZ−DCNGをそれぞれ5×107〜5×108PFUの力価で腫瘍内に5回投与した。A549 xenograft modelの場合は、A549細胞株を皮下注射した後、腫瘍の大きさが約150〜200mm3程度になった時、アデノウイルスdl−LacZ、dl−LacZ−DCNG、dl−LacZ−DCNQ及びdl−LacZ−DCNKをそれぞれ5×108PFUの力価で腫瘍内に5回投与した。ウイルス投与後3日頃に腫瘍を摘出して、4%パラホルムアルデヒド(PFA)溶液に入れ、4℃で4〜8時間固定させた後、30%スクロース溶液で12時間程度脱水させた。脱水された組織をO.C.T.コンパウンドで凍結薄片した後、上述の腫瘍球内組織浸透性の検証実験と同様な方法により、X−gal染色を行った。
【0103】
8.細胞病変効果(cytopathic effect, CPE)の分析
デコリンを発現する腫瘍特異的殺傷アデノウイルスの癌細胞殺傷能を検証するために、数種の人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)と、人体正常細胞株(CBHEL, MRC5, IMR90及びWI38)を48−ウェルプレートに分株して、24時間後、Ad−ΔE1、Ad−ΔE1B、Ad−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKなどのアデノウイルスを0.1〜100MOIでそれぞれ処理した。一実験で処理された数種のウイルスの中でいずれか一つのウイルスが、最も低い力価で細胞をほとんどアポトーシスさせた時点で、全ての培地を除去し、0.5%クリスタルバイオレット( in 50%メタノール)で細胞を固定させて染色した後、残存した細胞を分析した。
【0104】
9.プラーク形成分析
デコリン発現によるプラークの大きさの変化を観察するために、6ウェルプレートに3×105個のHep3B細胞株を分株して、翌日アデノウイルスAd−ΔE1B、Ad−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKを1×10-4PFUの力価で処理した。ウイルス感染後約4時間頃に、37℃の2×DMEM(10%牛胎児血清と抗生剤ペニシリン/ストレプトマイシン含み)と42℃の1.4%UltraPureTMアガロース(Invitrogen, Carsbad, CA)とを1:1で混合したアガロース−DMEM溶液を、感染された細胞株上に添加した後培養した。培養後、約4〜16日頃に、プレートに形成されたプラークの大きさを確認し、アガロースオーバーレイ(overlay)上に10%トリクロロ酢酸(trichloroacetic acid)を1ml入れて30分間放置した後、アガロースオーバーレイを除去し、0.5%クリスタルバイオレット(in 50%メタノール)で固定させて染色し、形成されたプラークの個数を算出した。
【0105】
10.フローサイトメトリー分析による細胞アポトーシス観察
デコリンの発現により誘導される細胞アポトーシスを確認するために、人体腫瘍細胞株のU343、U87MG、C33A、Hep3B、及びA549を25T培養器にそれぞれ分株した後、24時間頃にそれぞれのアデノウイルスを0.5〜50MOIでそれぞれ感染させた。陽性対照群としては、細胞アポトーシスを誘導する物質であるカンプトテシン(camptothecin)−11(CPT)を0.1〜1μm処理して、陰性対照群としては、PBSを処理した。48時間、72時間、そして96時間後に感染された細胞を回収し、70%エタノールで4℃で24時間以上固定させた。固定が終わった後、PI(propidium iodide, 50μg/μl)とRNase(ribonuclease)とが混合された溶液500μlを入れて、4℃で15分間反応させた後、フローサイトメトリー分析(FACS analysis)を行った。
【0106】
また、デコリンの発現により誘導される初期細胞アポトーシスを検証するために、上記のような方法により、数種の人体腫瘍細胞株をそれぞれのアデノウイルスでそれぞれ感染させた後、細胞を回収し、ApoAlert V−FITC(fluorescein isothiocyanate)細胞アポトーシス検出キット(CLONTECH, Polo Alto, CA)を利用し、製造会社が提示した方法にしたがって、Annexin V−FITC/PI二重染色(double staining)して、フローサイトメトリー分析を行った。
【0107】
11.TUNEL分析
数種の人体腫瘍細胞株U343(5x104)、U87MG(5x104)、C33A(5x105)、Hep3B(4x105)、及びA549(5x104)をそれぞれ2-ウェルチャンバースライドに分株して、アデノウイルスを0.2〜20MOIで感染させた後、24時間と48時間頃に培地を除去して、ApopTagキット(intergen, Purchase, NY)を用いて、製造会社が提示した方法にしたがってTUNEL(terminal deoxynucleotidyl transferase(TdT)-mediated dUTP nick end labeling)分析を行った。発色有無を確認するために、ペロキシダーゼと結合されたアビジンを使用して、DAB(3,3' diaminobenzine; Dako, Carpinteria, CA)と反応させた後、細胞が褐色に変わるのが肉眼で確認されたら、0.5%メチルグリーンで10分間染色して、顕微鏡で観察した。顕微鏡上で四ヶ所以上の部位をランダムに選定して、全体細胞の中で染色された細胞の比率を算出した。
【0108】
12.生体内抗腫瘍効果と生存率の検証
ヌードマウスに形成された人体癌腫塊の成長に、デコリンを発現するアデノウイルスが及ぼす影響を検証した。具体的には、生後6〜8週のヌードマウス(Charles River Japan Inc.)の腹壁に、皮下に1×107個の人体腫瘍細胞株(U343、U87MG、C33A、Hep3B、及びA549)をそれぞれ100μlのHBSS(Hanks' balanced salt solution, Gibco BRL)に浮遊して皮下注射した。腫瘍が約50〜80mm3程度に成長した時、1×108〜5×108PFUのアデノウイルスをそれぞれ二日間隔で3回腫瘍に直接注射した後、腫瘍の成長と生存率を観察した。陰性対照群としては、PBSを注射した。腫瘍の容積は、バーニヤキャリパスを利用して腫瘍の長軸と短軸を測定した後、次の数学式で算出した。
腫瘍の容積=(短軸mm)2×長軸mm×0.523
【0109】
13.デコリンを発現する複製可能アデノウイルス投与による腫瘍組織の変化観察
ヌードマウスの腹壁に形成されたU343、U87MG、C33A、Hep3B、またはA549腫瘍が約50〜80mm3程度に成長した時、1×108〜5×108PFUのアデノウイルスをそれぞれ3回腫瘍内注射した後、三日後に腫瘍組織を摘出してパラフィンブロックを製作した。陰性対照群としては、PBSを注射した。製作されたパラフィンブロックを3μm厚のスライドに切断した後、これを、キシレン、100%、95%、80%、及び70%エタノール溶液に順に浸してパラフィンを除去(deparafinization)した後、ヘマトキシリンとエオシン(H & E)で染色した。生体内結締組織の構成成分であるコラーゲンの分布を観察するためには、3μm厚のパラフィンブロックスライドをボウイン(bouin)、ヘマトキシリン及びMasson'sトリクロム(biebrich's scarlet acid fuchsin)でそれぞれ染色して観察した。前記染色試薬は、DAKO ARK(Dako, Carpinteria, CA)から購入した。また、同一部位のパラフィンブロックを利用して、アデノウイルスのヘキソン(hexon)部位を検出できる免疫組織化学分析(immunohistochemistry, IHC)を行った。上記のような方法によりスライドのパラフィンを除去した後、アデノウイルスのヘキソン部位と選択的に結合する抗体(MAB 8052 chemicon, Temecula, CA)を一次抗体として、そして、ヤギanti−ラビットIgG−HRP(Sata Cruz Biotechnology)を二次抗体として反応させて、DABを添加し発色させて観察した。
【0110】
腫瘍内の細胞アポトーシスも、同一な部位のパラフィンブロックスライドを利用して観察した。ApopTagキットを利用して、製造会社が提示した方法にしたがってTUNEL分析を行い、ペロキシダーゼと結合されたアビジンを使用してDABと反応させた後、細胞が褐色に変わるのが肉眼で確認されたら、0.5%メチルグリーンで10分間染色し、顕微鏡で観察した。
【0111】
14.ザイモグラフィ(Zymograpy)を利用したMMP発現様相究明
MMP活性変化を観察するために、数種の人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)を75T培養器に分株して、24時間後にPBS、Ad−ΔE1B及びAd−ΔE1B−DCNGアデノウイルスをそれぞれ1〜100MOIで添加し、48時間培養した。その後、牛胎児血清の含まれていないDMEMに入れ替えて、24時間培養した後、培地を回収して濃縮し、濃縮された培地のタンパク質濃度は、タンパク質分析キット(Bio-Rad, Hercules, CA, USA)を利用して定量した後、同量のタンパク質をゼラチン−基質ゲルに電気泳動した。電気泳動した後、ゲルを37℃で18時間ゼラチン溶解(gelatinolysis)反応が起こるようにした後、クマシーブルーで染色して、MMP−2とMMP−9の発現を観察した。また、各実験は、3回以上行って、QuntityOne2.1プログラム(BIO-Rad Laboratories, Hercules, CA)を利用して、バンド厚を比較検証した。
【0112】
15.Spontaneous癌転移モデルを利用したデコリン発現による癌転移能(metastatic potential)変化の検証
デコリンの高発現による癌転移能(metastatic potential)の変化を調べるために、まず、B16BL6細胞(2×105/マウス)を6〜8週齢の雄性C57BL/6マウス(Charles River Korea, Seoul, Korea)の後ろ右足パッドに皮下投与して、一次腫瘍(primary tumor)を形成した。一次腫瘍の大きさが約100〜200mm程度になった時、PBS、Ad−ΔE1B及びAd−ΔE1B−DCNGをそれぞれ二日間隔で腫瘍内に3回投与した。最後の投与後、5日頃にマウスの右足首以下を切断し一次腫瘍を除去した後、20日頃にマウスを全部犠牲させて、肺に転移された腫塊の重量を測定した。
【0113】
16.乳房癌患者から採取した腫瘍組織を利用した、デコリンを発現するアデノウイルスの遺伝子伝達効率及び組織浸透性の検証
乳房癌患者から腫瘍組織及びその周辺の正常組織を採取した後、約1〜2mm径の切片にして、24−ウェルプレート培養器で、5%牛胎児血清と10μM/Lインシュリンと1μM/Lヒドロコルチゾン(hydrocortisone)を含むIMDM(Isocove's Modified Dulbecco's Medium)を添加して、4時間培養した。乳房癌組織が入っている培養器に1×108PFUのdl−LacZ及びdl−LacZ−DCNGアデノウイルスをそれぞれ添加し、5%CO2、37℃恒温器で5日間培養した。培養後、培地を除去して、乳房癌組織を固定溶液に入れて固定させた後、X−gal染色を行い、立体顕微鏡(Olympus optical Co., LTD, Tokyo, Japan)を利用して、X−gal染色された腫瘍球の表面を観察した。
【0114】
17.一次ケロイド細胞における、デコリンを発現するアデノウイルスの遺伝子伝達効率の検証
ケロイド(Keloid)患者の組織から採取した一次ケロイド細胞株(2継代培養)を24−ウェルプレートに分株して、dl−LacZ及びdl−LacZ−DCNGアデノウイルスを0.1〜50MOIの力価でそれぞれ感染させて、5%CO2、37℃恒温器で培養した。ウイルス感染後、48時間頃にX−gal染色を行って、アデノウイルスの遺伝子伝達効率を観察した。
【0115】
18.ケロイド細胞球を利用したスフェロイド(spheroid)モデルを利用した組織浸透性の検証
ケロイド患者の組織から採取した継代培養2世代の一次ケロイド細胞(1×105個)を15mlファルコン(falcon)チューブに入れて、500gで5分間遠心分離し、スフェロイド(spheroid)を作った後、これを24−ウェルプレートに入れて37℃培養器で5日間培養した。その後、ケロイドスフェロイドを0.75%アガロースコーティングされた48−ウェルプレートに移した後、150μlのDMEM培地(5%の牛胎児血清含有)を添加して、1×107PFUのdl−LacZ及びdl−LacZ−DCNGアデノウイルスをそれぞれ培地に添加した。ウイルス感染後3日頃に培地を除去して、ケロイドスフェロイドを固定溶液に入れて固定させた後、X−gal染色を行い、X−gal染色された腫瘍球を立体顕微鏡を利用して表面を観察した。
【0116】
19.ケロイド患者から採取した組織を利用した組織浸透性の検証
ケロイド患者の組織から採取したケロイド組織を約1〜2mm径の切片にして、0.75%アガロースコーティングされた培養器で、5%牛胎児血清の含有されたDMEMと抗生剤ペニシリン/ストレプトマイシンとを添加して培養した。培養液は、一週間に約1〜2回入れ替えて、1週間以上ケロイド組織を培養した。アデノウイルスを感染させる前に、約2mm程度の直径を有するケロイド組織を、0.75%アガロースでコーティングされた48−ウェルプレートに移した後、150μlのDMEM培地(5%の牛胎児血清)を添加して、1×108PFUのdl−LacZ及びdl−LacZ−DCNGアデノウイルスをそれぞれ培地に添加した。ウイルス感染後3日頃に培地を除去して、ケロイド組織を固定溶液に入れて固定させた後、X−gal染色を施した。X−gal染色されたケロイド組織を、立体顕微鏡を利用して表面を観察した後、アデノウイルスのケロイド組織内浸透程度を確認するために、O.C.T.コンパウンドで凍結薄片した後、10μm厚に切断して、ゼラチンのコーティングされたスライド上に付着し、光学顕微鏡で観察した。
【0117】
[実験結果]
1.デコリンを発現するアデノウイルスの製作及びデコリンの発現様相の究明
デコリン遺伝子の発現による組織内浸透力の変化を可視的に観察するために、標識遺伝子としてLacZ遺伝子を発現する複製不能アデノウイルスdl−LacZ−DCNG、dl−LacZ−DCNQ及びdl−LacZ−DCNKを製作した。また、アデノウイルスの組織内拡散及び浸透力を向上させるために、腫瘍特異的殺傷アデノウイルスAd−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKを製作した(図1a及び1b)。 複製不能アデノウイルスdl−LacZは、E1部位が欠失されて、欠失されたE1部位に挿入されたCMVプロモーターの調節下でLacZ遺伝子を発現する;腫瘍特異的殺傷アデノウイルスAd−ΔE1Bは、正常的なE1A遺伝子は含んでいるが、E1B 19kDa及びE1B 55kDa遺伝子が欠失されている。複製不能アデノウイルスdl−LacZ−DCNG、dl−LacZ−DCNQ及びdl−LacZ−DCNKと腫瘍特異的殺傷アデノウイルスAd−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKは、CMVプロモーターの調節下でE3部位に挿入されたデコリン遺伝子を発現する。デコリン遺伝子の点突然変異DCNK及びDCNQは、タイプIコラーゲンフィブリルとデコリンとの結合に非常に重要な作用をする部位を置換したものである。
【0118】
製作されたアデノウイルスにより発現されるデコリンの発現様相を検証するために、人体肝癌細胞株であるHep3Bに腫瘍特異的殺傷アデノウイルスAd−ΔE1B、Ad−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKを3MOIの力価でそれぞれ感染させて、細胞から培地を回収し、ウェスタンブロッテングを行った。その結果、腫瘍特異的殺傷アデノウイルスの陰性対照群であるAd−ΔE1Bアデノウイルスで感染された細胞では、デコリンの発現を観察することができなかった反面、 dl−LacZ−DCNG、dl−LacZ−DCNQ及びdl−LacZ−DCNKアデノウイルスで感染された細胞の全てでは、デコリンの発現を観察することができた(図2)。
【0119】
2.遺伝子伝達効率の比較検証
デコリンを発現して、LacZを発現する複製不能アデノウイルスの遺伝子伝達効率を検証するために、数種の人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)と、人体正常細胞株(CBHEL, IMR90及びWI38)にdl−LacZ、dl−LacZ−DCNG、dl−LacZ−DCNQ及びdl−LacZ−DCNKウイルスを0.1〜100MOIでそれぞれ感染させて、48時間後にX−gal染色法を行って、LacZの発現様相を比較観察した。その結果、本発明で使用された全ての癌細胞株において、dl−LacZ−DCNG感染によるLacZ発現程度が、対照群であるdl−LacZに比べ増加し、デコリンの発現により遺伝子伝達効率が大いに増加することを確認した。ところが、高力価の複製不能ウイルスを処理した場合は、細胞が死滅されることを観察することができて、特に、C33A細胞株を10MOI以上のdl−LacZ−DCNGウイルスで感染させた場合は、全ての細胞が完全に死滅され、デコリンが高発現する時に細胞を死滅することができることが分かった(図3a及び3b)。しかしながら、コラーゲンフィブリルとデコリンとの結合に非常に重要な作用をする部位を置換したDCNK及びDCNQ点突然変異がデコリン遺伝子を発現する場合は、コラーゲンとの結合力が野生型に比べ弱化されたデコリン変異体DCNQを発現するdl−LacZ−DCNQの遺伝子伝達効率が、対照群ウイルスdl−LacZに比べ若干増加した反面、コラーゲンとの結合能が完全に消失されたデコリン変異体DCNKを発現するdl−LacZ−DCNKの遺伝子伝達効率は、dl−LacZの遺伝子伝達効率とほぼ等しいことを観察した。こうような結果から、野生型デコリンの発現により、遺伝子伝達効率が増加することが分かった。これに比べ、正常細胞では、デコリンの発現によるLacZ遺伝子の伝達効率が大いに増加されなかったが、このような結果は、デコリンの癌細胞特異性を意味する。
【0120】
3.腫瘍球を利用したアデノウイルスの生体外癌組織浸透性の検証
アデノウイルスの腫瘍球内への遺伝子伝達効率と組織拡散及び浸透性を調べるために、数種の人体腫瘍細胞株をヌードマウスに皮下注射した後、腫瘍の大きさが約150〜200mm3になった時、腫瘍を摘出した。摘出された腫瘍組織を1〜2mm程度の直径になるように細かく切って培養液に入れた後、1×106、1×107及び1×108PFUのアデノウイルスをそれぞれ培地に添加して、48時間後にX−gal染色を施した。腫瘍球を光学顕微鏡で観察した結果、1×106PFUのdl−LacZ、dl−LacZ−DCNK及びdl−LacZ−DCNQアデノウイルスを投与した場合に比べ、同力価のdl−LacZ−DCNGアデノウイルスを投与した腫瘍球の表面にX−galが濃く染色されたことを観察することができ、1×107PFU以上のアデノウイルスを培地に添加した場合は、全ての腫瘍球の表面全体がX−galで濃く染色されていることを観察した(図4)。また、アデノウイルスの腫瘍球内への浸透程度をより綿密に観察するために、X−gal染色された腫瘍球を凍結薄片して観察した。その結果、1×106、1×107及び1×108PFUのdl−LacZ、dl−LacZ−DCNK及びdl−LacZ−DCNQを投与した癌組織の場合、LacZの発現程度が微弱であり、ウイルスが腫瘍球表面に留まっている反面、同力価のdl−LacZ−DCNGを投与した癌組織におけるLacZ発現度がdl−LacZ、dl−LacZ−DCNK及びdl−LacZ−DCNQの場合より著しく高くて、アデノウイルスが腫瘍球表面に局限されず、腫瘍球の内側部位へウイルスが広がっていくことを確認することができた(図4)。また、本実施例でも、上述の遺伝子伝達効率の比較検証の実施例と同様に、コラーゲンとの結合力が野生型に比べ弱化されたデコリン変異体DCNQを発現するdl−LacZ−DCNQ及びコラーゲンとの結合能が完全に消失されたデコリン変異体DCNKを発現するdl−LacZ−DCNKの組織浸透力が、コラーゲンとの結合力が完全な野生型DCNGを発現するdl−LacZ−DCNGに比べ、大いに弱化されて、弱化された程度は、コラーゲンとの結合力と反比例することが分かった。このような実験結果を通じて、野生型デコリンを発現するdl−LacZ−DCNGアデノウイルスの遺伝子伝達効率及び組織浸透力が、腫瘍球内において、対照群dl−LacZ、dl−LacZ−DCNK及びdl−LacZ−DCNQに比べ、大いに増加されたことが分かった。
【0121】
4.dl−LacZ−DCNGアデノウイルスの生体内癌組織浸透性の検証
生体外腫瘍球を利用した実験結果を通じて確認したdl−LacZ−DCNGアデノウイルスの増加された組織浸透力を、異種移植(xenograft)生体モデルを利用して検証してみた。ヌードマウスの腹壁に形成されたU343、U87MG、C33A及びHep3B腫瘍に、dl−LacZ及びdl−LacZ−DCNGアデノウイルスのそれぞれを1×108〜5×108PFUの力価で腫瘍内に直接注射した後、三日頃に腫瘍を摘出して凍結薄片した後、X−gal染色を施した。その結果、dl−LacZを投与した腫瘍組織の場合は、LacZの発現程度が微弱であり、染色部位がウイルスの投与された組織付近に限定されている反面、dl−LacZ−DCNGを投与した腫瘍組織のLacZ発現度は、dl−LacZを投与した場合に比べ著しく高く、X−galで染色された部位がウイルスの投与された部位に局限されず、広い部位に広がっていることが確認できた(図5)。特に、U87MG及びC33A異種移植の場合は、dl−LacZ−DCNGを投与した時、腫瘍組織全体でLacZが発現されて、濃いブルーに染色されたことを確認することができた。また、dl−LacZ、dl−LacZ−DCNG、dl−LacZ−DCNK及びdl−LacZ−DCNQアデノウイルスを投与したA549腫瘍の場合は、dl−LacZ−DCNGを投与した腫瘍組織の場合のLacZ発現程度及び発現された腫瘍部位が、dl−LacZ、dl−LacZ−DCNK及びdl−LacZ−DCNQを投与した場合に比べ、大いに増大したことを確認することができた。このような実験結果を通じて、生体内でも、腫瘍球を利用した実験と同様に、dl−LacZ−DCNGアデノウイルスの組織内拡散及び浸透性が、デコリンを発現しない対照群アデノウイルスのdl−LacZに比べ、大いに増加したことが分かった。
【0122】
また、GFP(green fluorescence protein)を発現するアデノウイルスであるdl−GFPとdl−GFP−DCNGアデノウイルスをそれぞれヌードマウスの腹壁に形成されたC33A腫瘍に5×108PFUの力価で腫瘍内に直接注射した後、三日頃に腫瘍を摘出して凍結薄片した後、蛍光顕微鏡で観察した結果、dl−GFPを腫瘍内投与した腫瘍組織の場合は、GFPの発現がウイルス投与時に形成されるneedle trackの周辺に沿って制限的に発現された反面、dl−GFP−DCNアデノウイルスを腫瘍内投与した腫瘍組織の場合は、ウイルスが投与された部位に局限されず、広い部位に拡散されて強く発現されることを確認することができた(図19a)。
【0123】
5.デコリンを発現する腫瘍特異的殺傷アデノウイルスの細胞殺傷能の検証
先行の実験から既に確認されたコラーゲンとの結合能を有したデコリンの発現によるアデノウイルスの組織内拡散の増加により、腫瘍特異的殺傷アデノウイルスの細胞殺傷能が増加されるかどうかを調べるために、CPE分析を行った。陰性対照群として複製不能アデノウイルスのdl−LacZ、実験群として腫瘍特異的殺傷アデノウイルスであるAd−ΔE1B、Ad−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKアデノウイルスを、それぞれ0.1〜100MOIで人体腫瘍細胞株(U343、U87MG、C33A、Hep3B、及びA549)と人体正常細胞株(CBHEL, MRC5, IMR90, WI38)をそれぞれ感染させた後、細胞の殺傷程度を比較観察した。図6から分かるように、陰性対照群のdl−LacZで感染された種々の癌細胞では、ウイルスの増殖による細胞殺傷効果が観察されなかったが、Ad−ΔE1B−DCNGで感染された場合は、デコリンを発現しない対照群ウイルスのAd−ΔE1Bに比べ、約10〜20倍程度高い癌細胞殺傷効果が観察された。即ち、Hep3BとU87MG細胞株では、Ad−ΔE1B−DCNGアデノウイルスがAd−ΔE1Bアデノウイルスに比べ約20倍程度高い癌細胞殺傷効果を誘導し、U343、C33A、及びA549細胞株では、約10倍程度高い癌細胞殺傷効果を誘導した。このような実験結果から、デコリンの発現がアデノウイルスの複製能に否定的な影響を及ぼさないばかりか、却ってデコリンの発現により癌細胞特異的殺傷アデノウイルスの細胞殺傷能が増加されることが分かった。また、先行の実施例等と同様に、コラーゲンとの結合能が弱化または消失されたAd−ΔE1B−DCNQ及びAd−ΔE1B−DCNKの癌細胞殺傷能がAd−ΔE1B−DCNGに比べ著しく低くて、その低い程度は、コラーゲンとの結合能と反比例することを確認することができた。しかしながら、正常細胞の場合は、Ad−ΔE1B−DCNGアデノウイルスの細胞殺傷効果が対照群ウイルスのAd−ΔE1Bに比べ増加しなかった。したがって、このような結果から、DCNGの発現による細胞殺傷能増大効果が癌細胞では誘導されたが、正常細胞では誘導されず、癌細胞特異的であることを確認することができた。
【0124】
6.デコリン発現によるプラーク(plaque)形成の比較
デコリンの発現が細胞殺傷と周辺細胞へのウイルス拡散に及ぼす影響を可視化するために、アデノウイルスの増殖と周辺細胞への拡散によるプラークの形成をアガロースの含有された固体培地で比較検証した。Ad−ΔE1B、Ad−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKアデノウイルスをそれぞれHep3B細胞株に感染させて、プラーク形成の進行速度を観察した。図7a及び7bから分かるように、対照群ウイルスのAd−ΔE1B、Ad−ΔE1B−DCNK、またはAd−ΔE1B−DCNQに感染された場合に比べ、Ad−ΔE1B−DCNGで感染されたHep3B細胞株でプラークの形成が速く進行されて、形成されたプラークの大きさも増加したことを観察することができた。即ち、Ad−ΔE1Bアデノウイルスを投与した場合は、ウイルス感染後13〜16日が経ってからプラークの形成を肉眼で確認することができたのに比べ、Ad−ΔE1B−DCNGを感染させた場合は、ウイルス感染後4日頃から、プラークが形成されたことを確認することができた。また、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKのプラーク形成速度がAd−ΔE1B−DCNGに比べ大いに減少したが、その減少された程度は、コラーゲンとの結合能と反比例することを観察した。このような結果は、デコリンとの結合能を有したデコリンを発現するアデノウイルスの増加された細胞殺傷能と、隣接した細胞へのウイルス拡散によりプラークの形成が速く進行されて、また形成されたプラークの大きさが増加したことを意味する。
【0125】
7.デコリンを発現するアデノウイルスによる細胞アポトーシスの誘導
デコリンの発現様相及びこれによる遺伝子伝達効率の変化を調べるために進行された実験(実験結果2)で、高力価の複製不能アデノウイルスのdl−LacZ−DCNGで細胞を感染させた場合、細胞が死滅されて細胞培養プレートの底から離れていくことが観察されたため、デコリンにより細胞殺傷が誘導されるかどうかをより綿密に調べた。これのために、まず、細胞アポトーシスが誘導されるとDNAが無作為的に切片化されて現れるsubG1細胞群の増加率を、PI染色後フローサイトメトリー分析を行って測定した。種々の人体腫瘍細胞株を腫瘍特異的殺傷アデノウイルスAd−ΔE1B、Ad−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKでそれぞれ感染させて、48〜96時間後に細胞を回収してsubG1細胞群の増加を観察した。細胞アポトーシスを誘導する陽性対照群としては、細胞アポトーシス誘導化学物質であるCPTを使用した。対照群のAd−ΔE1Bにより感染されたA549細胞の場合、subG1細胞群が約3.11%であるのに対し、Ad−ΔE1B−DCNGにより感染された場合は、subG1細胞群が約26.52%に大きく増加した。このようなAd−ΔE1B−DCNGアデノウイルス感染によるsubG1細胞群の増加は、他の種類の細胞株(U343、U87MG、C33A、及びHep3B)でも観察された(図8a、表1)。また、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKウイルス感染によるsubG1細胞群の増加は、Ad−ΔE1B−DCNGに比べ減少したが、その減少程度は、コラーゲンとの結合能が低いほどさらに大きいことを、先行の実施例等の結果と同様に、確認することができた。
【0126】
そして、複製不能アデノウイルスであるdl−LacZまたはdl−LacZ−DCNGでそれぞれ感染させて48〜96時間後に細胞を回収してsubG1細胞群の増加を観察した。腫瘍特異的殺傷アデノウイルスによるsubG1細胞群の増加を観察した上記結果と同様に、対照群のdl−LacZアデノウイルスを感染させた場合より、dl−LacZ−DCNGアデノウイルスで感染させた場合にsubG1細胞群が大きく増加することを観察することができた(図8b、表2)。
【0127】
【表1】

【0128】
【表2】

【0129】
また、細胞アポトーシスに及ぼすデコリンの影響をさらに綿密に観察するために、腫瘍特異的殺傷アデノウイルスによる細胞アポトーシスの進行程度をAnnexin V−FITCとPIで二重染色して確認した。Annexin V−FITCは、細胞アポトーシス初期に細胞膜外に流出されてきたフォスファチジルセリン(phosphatidylserine: PS)を検出することができる反面、PIは、細胞死後期に細胞膜の破壊によりPIが細胞内に入って、核内にあるクロマチン(chromatin)と結合することにより、細胞壊死(necrosis)の特徴を確認することができる。したがって、Annexin V−FITC-/PI-は、健康な細胞を意味して、 Annexin V−FITC+/PI-は、初期細胞アポトーシスが起こった細胞、そしてPI+細胞は、細胞壊死が起こった細胞を意味する。細胞アポトーシスを誘導する陽性対照群として利用されたCPTを処理したU343細胞株の場合、約32.15%(Annexin V−FITC+/PI-)の細胞が細胞アポトーシスに進行されて、Ad−ΔE1B及びAd−ΔE1B−DCNGにより感染された場合は、それぞれ24.15%及び44.85%の細胞で細胞アポトーシスが誘導されて、Ad−ΔE1B−DCNGアデノウイルスによる細胞アポトーシス頻度がAd−ΔE1Bアデノウイルスに比べ大きく増加したことを観察した(図9a)。その他にも、U87MG、C33A、Hep3B、及びA549細胞株でも、対照群のAd−ΔE1Bアデノウイルスに比べ、デコリンを発現するアデノウイルスにより遥かに高い頻度で細胞アポトーシスが誘導されることを確認することができた。また、細胞死を総括的に測定できる細胞アポトーシス及び細胞壊死頻度を全部合わせた場合(Annexin V−FITC+/PI-+PI+)でも、Ad−ΔE1B−DCNGアデノウイルスにより誘導された細胞死頻度がAd−ΔE1Bアデノウイルスに比べ著しく増加した。以上のような結果から、腫瘍特異的殺傷アデノウイルスの対照群Ad−ΔE1Bアデノウイルスにより感染された場合より、Ad−ΔE1B−DCNGアデノウイルスに感染された場合に細胞アポトーシスが著しく高い頻度で進行され、結果的に細胞死が増加することを確認することができた。そして、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKウイルス感染により誘導される細胞アポトーシス頻度が、Ad−ΔE1B−DCNGにより誘導される細胞アポトーシス頻度に比べ減少したが、その減少程度は、コラーゲンとの結合能が低いほどさらに大きいことを確認することができた。
【0130】
また、デコリンを発現する複製不能アデノウイルスによる細胞アポトーシス誘導を調べるために、U343、U87MG、C33A、Hep3B、A549細胞に、PBS、CPT、dl−LacZまたはdl−LacZ−DCNGを処理した後、細胞アポトーシス進行程度をAnnexin V−FITCとPIで二重染色して確認した。図9bから分かるように、CPTを処理したU343細胞株の場合、約19.41%(Annexin V−FITC+/PI-)の細胞が初期細胞アポトーシスに進行されて、dl−LacZにより感染された場合は、3.93%の細胞だけが細胞アポトーシスに進行され、PBSのみを処理した陰性対照群と同様に非常に低い比率の細胞のみが細胞アポトーシスに進行された。その反面、dl−LacZ−DCNGにより感染されたU343細胞株の場合は、約13.18%の細胞が細胞アポトーシスに進行され、dl−LacZ−DCNG複製不能アデノウイルスによる細胞アポトーシス頻度が、対照群複製不能アデノウイルスのdl−LacZに比べ、大きく増加したことを観察した。この他にも、U87MG、C33A、Hep3B及びA549細胞株においても、対照群のdl−LacZアデノウイルスに比べ、デコリンを発現する複製不能アデノウイルスのdl−LacZ−DCNGにより遥かに高い頻度で細胞アポトーシスが誘導されることを確認することができた。このような結果がら、コラーゲンとの結合能を有したデコリンを発現する腫瘍特異的殺傷アデノウイルスだけではなく、複製不能アデノウイルスにより感染された場合も、細胞アポトーシス誘導が著しく増加され得ることを確認することができた。
【0131】
初期細胞内アポトーシスの特徴であるDNA切片化を確認できるまた他の分析方法のTUNEL分析も行った。図10aと表3から分かるように、陽性対照群として使用されたCPTを処理した全ての細胞株の場合は、ほとんどの細胞が濃い褐色に染色され、細胞アポトーシスが活発に進行されていることを確認した。U343細胞株をAd−ΔE1Bアデノウイルスで感染させた場合、約32.5±12.5%の細胞が褐色に淡く染色された反面、Ad−ΔE1B−DCNGアデノウイルスで感染させた場合は、約69.7±5.40%の細胞が濃い褐色に染色され、Ad−ΔE1B−DCNGアデノウイルスが遥かに高い頻度で細胞アポトーシスを誘導することが分かった(表3)。このようなデコリン発現による細胞アポトーシス頻度の増加現象は、他の細胞株(U87MG, C33A, Hep3B及びA549)でもほぼ等しい傾向で観察されて、また、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKウイルス感染により誘導されるDNA切片化頻度が、Ad−ΔE1B−DCNGにより誘導されるDNA切片化頻度に比べ大いに減少し、その減少程度がコラーゲンとの結合能に反比例することを観察した。本実施例で確認されたコラーゲンとの結合能に比例したデコリンの作用は、先行の実施例等において、全て同様な結果として検証されたため、以後進行された実施例では、コラーゲンとの結合能の最も高い野生型デコリンを発現するアデノウイルスのみを利用して進行した。
【0132】
【表3】

【0133】
また、複製不能アデノウイルスdl−LacZ及びdl−LacZ−DCNGでそれぞれ感染させて、48〜96時間後に細胞を回収し、TUNEL分析を行った。腫瘍特異的殺傷アデノウイルスによる細胞アポトーシス進行程度を観察した上記の結果と同様に、対照群のdl−LacZアデノウイルスを感染させた場合より、dl−LacZ−DCNGアデノウイルスで感染させた場合、遥かに高い頻度で細胞アポトーシスを誘導することを観察することができた(図10b及び表3)。
【0134】
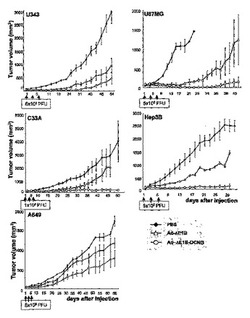
8.デコリンを発現する腫瘍特異的殺傷アデノウイルスの生体内抗腫瘍効果の検証
野性型デコリンを発現するAd−ΔE1B−DCNGアデノウイルスの生体内抗腫瘍効果を検証するために、種々の人体腫瘍細胞株をヌードマウスに接種した後、形成された腫瘍に1×108〜5×108PFUのAd−ΔE1B及びAd−ΔE1B−DCNGアデノウイルスのそれぞれを、陰性対照群のPBSと共に二日間隔で3回腫瘍内投与した後、腫瘍の成長を観察した。人体脳腫瘍U87MGの場合、PBSを投与された時は、ウイルス投与後19日頃に腫瘍の大きさが約1089.22mm3で、腫瘍が急激に成長した反面、腫瘍特異的殺傷アデノウイルスのAd−ΔE1BまたはAd−ΔE1B−DCNGを投与された時は、それぞれ115.70mm3及び11.87mm3で、腫瘍の成長が顕著に遅延されることを観察することができた(図11a)。即ち、Ad−ΔE1B及びAd−ΔE1B−DCNGアデノウイルスを投与された腫瘍の方が、PBSを投与された場合に比べ、明らかな抗腫瘍効果を示した。
【0135】
また、ウイルスの投与後25日頃には、PBSを投与した9匹のマウスが全部死んでしまい、それ以上腫瘍の成長を測定することができなかった反面(図11b)、Ad−ΔE1B及びAd−ΔE1B−DCNGアデノウイルスを投与した後33日頃には、腫瘍の大きさがそれぞれ399.68mm3及び23.38mm3であって、デコリンを発現するアデノウイルスによる抗腫瘍効果が、対照群のAd−ΔE1Bアデノウイルスに比べ、さらに優れており且つさらに長く持続されることを確認した。特に、Ad−ΔE1B−DCNGアデノウイルスを投与した場合、ウイルス投与後19日頃に7匹のマウスの中で4匹から、そして41日頃には6匹から、腫瘍が完全になくなって、60日が経っても腫瘍の再成長は観察されなかった(図11b)。このようなAd−ΔE1B−DCNGの卓越な抗腫瘍効果が他の人体腫瘍モデルでも適用できるかを調べるために、U343、C33A、Hep3B、及びA549異種移植(xenograft)で、前記の方法と同一な方法により抗腫瘍効果を検証した。図11aから分かるように、陰性対照群のPBSを投与した群に比べ、腫瘍特異的殺傷アデノウイルスのAd−ΔE1B及びAd−ΔE1B−DCNGを投与した群で明らかな抗腫瘍効果が観察されて、デコリンを発現するAd−ΔE1B−DCNGアデノウイルスを投与された場合、腫瘍の大きさが、Ad−ΔE1Bを投与された場合に比べ著しく減少し、デコリン発現による明らかな抗腫瘍効果を観察することができた。
【0136】
また、デコリンを発現するアデノウイルスを腫瘍に投与時、マウスの生存率を比較した。C33A異種移植モデルにおいてAd−ΔE1B−DCNGを投与時(C33Aに対しては1×108 PFU投与、U343, U87MG, Hep3B及びA549に対しては5×108 PFU投与)、80日経過後、100%のマウスが生存した反面、Ad−ΔE1Bを投与した場合、同じ期間にただ50%のマウスのみが生存した(マウスの死;腫瘍大きさ>C33Aに対して2000mm3)ことが分かった(図11b)。Ad−ΔE1B−DCNGの生存率増加は、他のU343、U87MG、Hep3B及びA549異種移植モデルでも同様な結果を示した。このような結果を通じて、Ad−ΔE1B−DCNGウイルスが、生体モデルにおいて、優れた抗腫瘍効果及び生存率増大効果を示すことが分かった。
【0137】
9.デコリンを発現する複製可能アデノウイルス投与による腫瘍の変化観察
数種の癌細胞株(U343, U87MG, C33A, Hep3B及びA549)をヌードマウスの腹壁皮下に接種した後、形成された腫瘍にAd−ΔE1B及びAd−ΔE1B−DCNGアデノウイルスを陰性対照群のPBSと共に3回腫瘍内注射した後、三日後に腫瘍組織を摘出してヘマトキシリンとエオシンでH&E染色し、組織の状態を検証した。図12a〜12eから分かるように、Ad−ΔE1Bアデノウイルスを投与した腫瘍の場合は、腫塊の中心部位から自然に発生する細胞壊死と、ウイルスが投与された腫塊の縁の局所的部位でのみ細胞壊死が進行された反面、Ad−ΔE1B−DCNGアデノウイルスを投与した腫瘍の場合は、腫塊の中心部位だけではなく、ウイルスが投与された腫瘍の縁まで、さらに広い部位で細胞壊死が非常に活発に進行されることを確認した。また、腫瘍組織内における癌細胞特異的殺傷アデノウイルスの複製様相を検証するために、アデノウイルスのヘキソン部位と選択的に結合する抗体を利用して、IHCを行った。図12a〜12eから分かるように、Ad−ΔE1Bを投与した場合に比べ、Ad−ΔE1B−DCNGを投与した腫瘍の場合に腫瘍のさらに広い部位からアデノウイルスを検出することができて、細胞アポトーシスを確認できるTUNEL分析を行った場合も、アデノウイルスが検出された部位と同じ部位で細胞アポトーシスが活発に進行されることを確認することができた。以上の結果をまとめてみると、Ad−ΔE1B−DCNGアデノウイルスが投与された腫塊部位でウイルスの複製が活発に起こって且つさらに広い部位に広がっていくことができ、その結果、細胞アポトーシス及び細胞壊死が非常に活発に且つ広範囲で誘導されることが分かった。
【0138】
10.マッソン・トリクローム(Masson's trichrome)染色を利用した腫瘍内コラーゲン分布の検証
人体脳癌細胞株U343をヌードマウスに接種した後、形成された腫瘍にAd−ΔE1B及びAd−ΔE1B−DCNGアデノウイルスを3回腫瘍内注射した後、三日後に腫瘍組織を摘出しマッソン・トリクロームで染色して、青色に染色される細胞外基質の主成分のコラーゲンの分布を観察した。その結果、Ad−ΔE1Bアデノウイルスを投与したU343腫瘍の場合は、腫瘍内部において、青色染色が腫瘍細胞の間で多く観察された反面、Ad−ΔE1B−DCNGアデノウイルスを投与した場合は、腫瘍内部では青色がほとんど観察されず、腫瘍の周囲を囲んでいる正常組織でのみコラーゲンカプセルのような形態を観察することができた(図13のAパネル)。このような結果から、癌細胞特異的殺傷アデノウイルスのAd−ΔE1B−DCNGによるデコリンの発現が癌細胞特異的に誘導されて、癌組織内部のコラーゲンの発現のみを阻害し、周辺の正常組織のコラーゲンの発現様相には、影響を及ぼさないことが分かった。
【0139】
そして、人体脳癌細胞株のU87MGをヌードマウスに接種した後、形成されたAd−ΔE1B−DCNGアデノウイルスを腫瘍内注射した後、マッソン・トリクロームで染色した場合は、対照群ウイルスのAd−ΔE1Bアデノウイルスを投与した場合と同様に、コラーゲンの発現が非常に低くて、青色に染色された部位がほとんど観察されなかった(図13のBパネル)。このような結果から、腫瘍組織内のコラーゲン発現が低い場合は、デコリンの高発現により、コラーゲンの発現様相が変化されないことが分かった。
【0140】
11.ザイモグラフィ(Zymograpy)を利用したMMP発現様相の究明
デコリンの発現による細胞外基質の減少が、MMP発現により誘導されるものであるかを確認するために、MMP−2とMMP−9の活性をザイモグラフィにより検証した(図14)。数種の細胞株(U343, U87MG, C33A, Hep3B及びA549)を様々な力価のアデノウイルス(Ad-ΔE1B及びAd-ΔE1B-DCNG)で感染させて、培地を回収し、MMP−2とMMP−9の発現を観察した結果、PBS及びAd−ΔE1B対照群に比べ、Ad−ΔE1B−DCNGアデノウイルスにより感染された場合に、MMP−2とMMP−9の活性が大きく増加した。このようなMMP−2とMMP−9の活性増加現象は、実験に使用された5種類の人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)でほぼ等しく観察された。前記結果から、デコリンの発現により、MMP−2とMMP−9の活性が増加されたことが分かった。
【0141】
12.Spontaneous癌転移モデルを利用した、デコリン発現による癌転移能(metastatic potential)の変化検証
デコリンは、細胞外基質の構成成分と反応し、MMP−1とMMP−2などの発現を促進して細胞外基質を分解すると知られており、MMP−2の場合は、本研究の実験結果11でも確認された。したがって、デコリンの高発現による癌転移能(metastatic potential)の変化を、spontaneous癌転移モデルを利用して調べてみた。まず、B16BL6細胞をC57BL/6マウスの右後ろ足の裏に皮下投与した後、腫瘍の大きさが約100〜200mm程度に成長した時、PBS、Ad−ΔE1B、及びAd−ΔE1B−DCNGを二日間隔で3回腫瘍内投与した。最後の投与後5日頃にマウスの右足首以下を切断して、一次腫瘍を除去した後、20日頃にマウスを全部犠牲させて、肺に転移された腫塊の重量を測定した。図15から分かるように、Ad−ΔE1B及びAd−ΔE1B−DCNGを投与されたマウスの肺に転移された腫塊の平均重量は、それぞれ200±140mg及び130±160mgであって、PBSを投与された対照群マウスの肺に転移された腫塊の平均重量の250±140mgに比べ、著しく低いことが確認できた。さらに、PBSを投与された6匹のマウスの全部から肺転移が酷く起こったのに対し、Ad−ΔE1BまたはAd−ΔE1B−DCNGを投与された6匹のマウスの場合は、それぞれ1匹と2匹のマウスで癌転移が完全に抑制されたことを観察した。このような結果から、デコリンの発現により、対照群ウイルスに比べ、癌転移がさらに活発に抑制されることが確認できた。
【0142】
13.乳房癌患者から採取した腫瘍組織を利用した、デコリンを発現するアデノウイルスの遺伝子伝達効率及び組織浸透性の検証
先行の各種実験結果から確認された、デコリンを発現するアデノウイルスの向上された遺伝子伝達効率及び組織浸透性が、一次人体腫瘍組織でも確認できるかどうかを調べるために、実際の乳房癌患者から採取した癌組織及びその周辺の正常組織を約1〜2mm径の切片にして、0.75%アガロースでコーティングされた培養器で培養した後、1×108PFUのdl−LacZ及びdl−LacZ−DCNGアデノウイルスをそれぞれ添加した。ウイルス添加後、約5日後にX−gal染色を行った結果、対照群ウイルスのdl−LacZを感染させた場合に比べ、dl−LacZ−DCNGアデノウイルスを感染させた場合の癌組織表面にX−galが濃く染色されたことを観察することができた(図16)。これとは対照的に、正常組織の場合は、dl−LacZまたはdl−LacZ−DCNGアデノウイルスを添加した全ての一次正常組織において、X−gal染色がほとんど起こらなかった。
【0143】
また、GFPを発現するアデノウイルスのdl−GFPとdl−GFP−DCNGアデノウイルスをそれぞれ乳房癌患者から摘出した乳房癌組織球(<1cm3)を、12−ウェルプレートに腫瘍組織球を入れて、インシュリン(10μmol)とヒドロコルチゾン(1μmol)とを含有した5%IMDM培地を添加した後、1×107PFUのアデノウイルスをそれぞれ培地に添加した。ウイルス添加後、5日頃に蛍光顕微鏡で腫瘍球を観察した結果、対照群ウイルスのdl−GFPを培地内に投与した場合は、腫瘍球の表面でのみ制限的にGFPの発現が観察された反面、デコリンを発現するアデノウイルスのdl−GFP−DCNが投与された培地で培養された腫瘍球の場合は、腫瘍球の大部分の組織からGFPが強く発現されることを観察することができた(図19b)。
【0144】
14.一次ケロイド細胞における、デコリンを発現するアデノウイルスの遺伝子伝達効率の検証
ケロイドは、細胞外基質の過度なる形成により現れる疾患であって、デコリンの細胞外基質分解能を利用してケロイド疾患を治療できるかどうかを調べるために、まず、ケロイド患者の組織から採取した一次ケロイド細胞株に、dl−LacZ及びdl−LacZ−DCNGアデノウイルスを0.1〜50MOIの力価でそれぞれ感染させて、二日後にX−gal染色を施して観察した結果、dl−LacZ−DCNG感染によるLacZ発現程度が、対照群のdl−LacZに比べ増加し、デコリンの発現により、ケロイド細胞への遺伝子伝達効率が大きく増加することを確認した(図17)。
【0145】
15.ケロイドスフェロイドモデルを利用した遺伝子伝達効率の検証
デコリン発現によるアデノウイルスのケロイド組織における遺伝子伝達の増加を調べるために、ケロイド患者の組織から採取した継代培養2世代の一次ケロイド細胞を利用して製作されたケロイドスフェロイドを、1×107PFUのdl−LacZ及びdl−LacZ−DCNGアデノウイルスでそれぞれ感染させた後、X−gal染色を施して組織表面を光学顕微鏡で観察した。その結果、対照群ウイルスのdl−LacZを投与した場合に比べ、野生型デコリンを発現するdl−LacZ−DCNGアデノウイルスを投与したケロイドスフェロイドの表面にX−galが非常に濃く染色されることを観察した(図18のパネルA)。
【0146】
16.ケロイド患者から採取した組織を利用した組織浸透性の検証
ケロイド細胞から構成されたケロイドスフェロイドを利用した先行の実施例を通じて確認したdl−LacZ−DCNGアデノウイルスの増加された遺伝子伝達効率が、実際のケロイド患者から採取したケロイド組織でも現れるのかを調べるために、ケロイド患者の組織から採取したケロイド組織を1×108PFUのdl−LacZ及びdl−LacZ−DCNGアデノウイルスでそれぞれ感染させて、X−gal染色を施した後、まず、ケロイド組織の表面を観察した。その結果、dl−LacZを投与したケロイド組織の場合は、LacZの発現程度が非常に微弱である反面、dl−LacZ−DCNGを投与したケロイド組織の表面は、X−galが濃く染色されたことを観察した(図18のパネルB)。また、アデノウイルスのケロイド組織内浸透程度を確認するために、O.C.T.コンパウンドで凍結薄片した後、光学顕微鏡で観察した結果、dl−LacZを投与したケロイド組織の場合は、表面と同様に、ケロイド組織の内部もほとんど染色されなかった反面、dl−LacZ−DCNGを投与した腫瘍組織のLacZ発現度は、dl−LacZを投与した場合に比べ著しく高く、X−galで染色された部位が、ウイルスの投与された部位に局限されず、広い部位に広がっていることを確認することができた(図18のパネルB)。このような結果から、細胞外基質の分解を誘導できるデコリンを発現するアデノウイルスを利用する場合、ケロイド組織における遺伝子伝達効率が著しく増大されるだけではなく、細胞外基質の分解により、ケロイド疾患治療剤として利用することができることを確認した。
【0147】
以上、本発明の望ましい具現例を詳細に記述したが、当業界の通常の知識を有する者にとって、このような具体的な記述はただ望ましい具現例に過ぎなく、これに本発明の範囲が限定されないことは明らかである。従って、本発明の実質的な範囲は、添付の請求項とその等価物により定義されると言える。
【図面の簡単な説明】
【0148】
【図1a】本発明のデコリン発現複製不能アデノウイルス(dl-LacZ, dl-LacZ-DCNG, dl-LacZ-DCNQ及びdl-LacZ-DCNK)と腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)のベクターマップである。ITRは、inverted terminal repeat配列、Ψは、パッケージシグナル配列、LacZは、lac Z配列、IXは蛋白質IX遺伝子、CMVは、CMVプロモーター、そして、Pol Aは、ポリA配列を示す。DCNGは、野生型デコリン遺伝子、DCNQは、野生型デコリンコア蛋白質の6番目ロイシンリッチリピート部位内にあるE180アミノ酸をE180Qで点突然変異させた変異遺伝子、そしてDCNKは、野生型デコリンコア蛋白質のE180アミノ酸をE180Kで点突然変異させた変異遺伝子を示す。
【図1b】本発明の具体的な一実施例に該当する腫瘍特異的殺傷アデノウイルスAd-ΔE1B-DCNGのより具体的なベクターマップである。
【図2】本発明のデコリン発現腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)を感染させた腫瘍細胞株Hep3Bがデコリンを発現することを確認したウェスタンブロット分析結果である。
【図3a】本発明のデコリン発現複製不能アデノウイルス(dl-lacZ-DCNG, dl-lacZ-DCNQ及びdl-lacZ-DCNK)を感染させた人体腫瘍細胞株(図3a)及び人体正常細胞株(図3b)におけるデコリン遺伝子伝達効率を検証したX-gal染色写真である。
【図3b】本発明のデコリン発現複製不能アデノウイルス(dl-lacZ-DCNG, dl-lacZ-DCNQ及びdl-lacZ-DCNK)を感染させた人体腫瘍細胞株(図3a)及び人体正常細胞株(図3b)におけるデコリン遺伝子伝達効率を検証したX-gal染色写真である。
【図4】本発明の複製不能アデノウイルス(dl-lacZ, dl-lacZ-DCNG, dl-lacZ-DCNQ及びdl-lacZ-DCNK)を生体外(in vitro)感染させた腫瘍球(U343, U87MG, C33A及びA549)へのウイルス浸透性を検証したX-gal染色写真である。左側パネルは、X-gal染色された腫瘍球の光学顕微鏡写真(倍率:38×)であり、右側パネルは、X-gal染色された腫瘍球の凍結薄片光学顕微鏡写真(倍率: 40×)である。
【図5】本発明の複製不能アデノウイルス(dl-lacZ, dl-lacZ-DCNG)を生体内(in vivo)感染させた腫瘍球(U343, U87MG, C33A, Hep3B及びA549)へのウイルス浸透性を検証したLacZ染色写真である。
【図6】本発明の腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)を感染させた人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)及び人体正常細胞株(CBHEL, IMR90, MRC5及びW138)における癌細胞特異的殺傷能を検証した細胞病変効果(cytopathic effect, CPE)分析結果である。
【図7a】本発明の腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)を感染させた人体腫瘍細胞株HeP3Bにおけるプラーク形成程度を示したプレート写真(図7a)及びこれのプラーク数を概数してプラーク形成速度を示したグラフ(図7b)である。
【図7b】本発明の腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)を感染させた人体腫瘍細胞株HeP3Bにおけるプラーク形成程度を示したプレート写真(図7a)及びこれのプラーク数を概数してプラーク形成速度を示したグラフ(図7b)である。
【図8a】本発明のアデノウイルスを感染させた人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)における細胞アポトーシス程度を確認したPI染色後のフローサイトメトリー分析結果である。図8aは、腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)であり、図8bは、複製不能アデノウイルス(dl-lacZ, dl-lacZ-DCNG)の結果であって、フローサイトメトリー分析結果にある数字は、subG1細胞群の比率を示す。
【図8b】本発明のアデノウイルスを感染させた人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)における細胞アポトーシス程度を確認したPI染色後のフローサイトメトリー分析結果である。図8aは、腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)であり、図8bは、複製不能アデノウイルス(dl-lacZ, dl-lacZ-DCNG)の結果であって、フローサイトメトリー分析結果にある数字は、subG1細胞群の比率を示す。
【図9a】本発明のアデノウイルスを感染させた人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)における細胞アポトーシスと細胞壊死の程度を同時に確認したAnnexin V-PI染色及びフローサイトメトリー分析結果である。図9aは、腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)であり、図9bは、複製不能アデノウイルス(dl-lacZ, dl-lacZ-DCNG)の結果であって、各フローサイトメトリー分析結果において、Annexin V+/PI-の比率は、太いイタリック体で右側下に表示した。横座標は、Annexin V数値であり、縦座標は、PI数値である。
【図9b】本発明のアデノウイルスを感染させた人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)における細胞アポトーシスと細胞壊死の程度を同時に確認したAnnexin V-PI染色及びフローサイトメトリー分析結果である。図9aは、腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)であり、図9bは、複製不能アデノウイルス(dl-lacZ, dl-lacZ-DCNG)の結果であって、各フローサイトメトリー分析結果において、Annexin V+/PI-の比率は、太いイタリック体で右側下に表示した。横座標は、Annexin V数値であり、縦座標は、PI数値である。
【図10a】本発明のアデノウイルスを感染させた人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)における細胞アポトーシス程度を確認したTUNEL分析結果である。10aは、腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)であり、図10bは、複製不能アデノウイルス(dl-lacZ, dl-lacZ-DCNG)の結果であって、DNA鎖の分節化は、褐色で染色されている。
【図10b】本発明のアデノウイルスを感染させた人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)における細胞アポトーシス程度を確認したTUNEL分析結果である。10aは、腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)であり、図10bは、複製不能アデノウイルス(dl-lacZ, dl-lacZ-DCNG)の結果であって、DNA鎖の分節化は、褐色で染色されている。
【図11a】腫瘍(U343, U87MG, C33A, Hep3B及びA549)が誘導されたマウスに感染させた本発明の腫瘍特異的殺傷アデノウイルスAd-ΔE1B-DCNGによる腫瘍の大きさ変化を示したグラフ(図11a)及びマウスの生存率を示したグラフ(図11b)である。
【図11b】腫瘍(U343, U87MG, C33A, Hep3B及びA549)が誘導されたマウスに感染させた本発明の腫瘍特異的殺傷アデノウイルスAd-ΔE1B-DCNGによる腫瘍の大きさ変化を示したグラフ(図11a)及びマウスの生存率を示したグラフ(図11b)である。
【図12a】腫瘍C33Aが誘導されたマウスに感染させた本発明の腫瘍特異的殺傷アデノウイルスAd-ΔE1B-DCNGによるU343腫瘍の変化を観察したH&E染色結果、IHC (immunohistochemical)染色結果及び細胞アポトーシスされた細胞をTUNEL分析した結果である。
【図12b】腫瘍C33Aが誘導されたマウスに感染させた本発明の腫瘍特異的殺傷アデノウイルスAd-ΔE1B-DCNGによるU87MG腫瘍の変化を観察したH&E染色結果、IHC (immunohistochemical)染色結果及び細胞アポトーシスされた細胞をTUNEL分析した結果である。
【図12c】腫瘍C33Aが誘導されたマウスに感染させた本発明の腫瘍特異的殺傷アデノウイルスAd-ΔE1B-DCNGによるC33A腫瘍の変化を観察したH&E染色結果、IHC (immunohistochemical)染色結果及び細胞アポトーシスされた細胞をTUNEL分析した結果である。
【図12d】腫瘍C33Aが誘導されたマウスに感染させた本発明の腫瘍特異的殺傷アデノウイルスAd-ΔE1B-DCNGによるHep3B腫瘍の変化を観察したH&E染色結果、IHC (immunohistochemical)染色結果及び細胞アポトーシスされた細胞をTUNEL分析した結果である。
【図12e】腫瘍C33Aが誘導されたマウスに感染させた本発明の腫瘍特異的殺傷アデノウイルスAd-ΔE1B-DCNGによるA549腫瘍の変化を観察したH&E染色結果、IHC (immunohistochemical)染色結果及び細胞アポトーシスされた細胞をTUNEL分析した結果である。
【図13】腫瘍U343(パネルA)及びU87MG(パネルB)が誘導されたマウスに感染させた腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG)による腫瘍の細胞外組織にあるコラーゲン分布を確認したMasson's trichrome染色結果である。
【図14】人体腫瘍細胞U343, U87MG, C33A, Hep3B及びA549に感染させた腫瘍特異的殺傷アデノウイルスAd-ΔE1BまたはAd-ΔE1B-DCNGによるMMP発現様相を確認したゼラチンザイモグラフィ電気泳動結果を数値化したグラフである。
【図15】B16BL6 Spontaneous癌転移モデルを利用して、癌転移に対するデコリン発現の影響を検証した結果(上パネル)及び肺転移された腫塊の重量を数値化したグラフ(下パネル)である。
【図16】乳房癌患者から採取した腫瘍組織及びその周辺の正常組織にデコリン発現複製不能アデノウイルス(dl-LacZ-DCNG)を投与した後の遺伝子伝達効率及び組織浸透性をX-gal染色で確認した写真である。
【図17】デコリン発現複製不能アデノウイルス(dl-LacZ-DCNG)を処理した一次ケロイド細胞における遺伝子伝達効率を検証したX-gal染色写真である。
【図18】ケロイドスフェロイド(spheroid)モデルを利用して、デコリン発現複製不能アデノウイルス(dl-LacZ-DCNG)の遺伝子伝達効率を検証したケロイド細胞球のX-gal染色写真(Aパネル)及びケロイド組織を利用してデコリン発現複製不能アデノウイルス(dl-LacZ-DCNG)の組織浸透性を検証したX-gal染色写真(Bパネル)である。
【図19a】本発明の複製不能アデノウイルス(dl-GFPとdl-GFP-DCNG)を生体内(in vivo)感染させた腫瘍球(C33A)内へのウイルス浸透性を検証した蛍光顕微鏡写真である(x10)。
【図19b】乳房癌患者から採取した腫瘍組織にdl-GFPまたはdl-GFP-DCNGを投与した後の遺伝子伝達効率及び組織浸透性を確認した蛍光顕微鏡写真である(x 40)。
【技術分野】
【0001】
本発明は、遺伝子伝達システム及び組み換えアデノウイルスに関するものであって、より詳細には、デコリン遺伝子を含む遺伝子伝達システム、組み換えアデノウイルス、前記組み換えアデノウイルスを含む抗腫瘍薬剤学的組成物、改善された組織浸透性を有する薬剤学的組成物、及び細胞外基質の過度なる蓄積に係る疾病または疾患の治療用薬剤学的組成物に関するものである。
【背景技術】
【0002】
アデノウイルス(Adenovirus, Ad)を利用した初期の遺伝子治療は、アデノウイルスの複製に必須的なE1遺伝子の代わりに、治療用遺伝子を挿入して製造した複製不能アデノウイルスを主に利用したが、これらのアデノウイルスは、感染された細胞とその周辺でのみ制限的に抗腫瘍効果を誘導して、臨床的な実用性の面で多い制約があった(Vile RG, Russell SJ, Lemoine NR., Gene Ther, 2000, 7(1):2-8)。これを克服するための一つの方案として、癌細胞でのみ選択的に増殖して癌細胞を殺傷する腫瘍特異的殺傷アデノウイルスであるONYX−015(Ad変異体、dl1520)をMcCormick研究陣が最初に開発した(Bischoff JR, et al., Science, 1996, 274(5286):373-376; Heise C, et al., Nat Med, 1997, 3(6):639-645)。ONYX−015は、E1B 55 kDa遺伝子が部分的に欠損されたアデノウイルスであって、p53が機能的に非活性化された細胞でのみ増殖が可能である。即ち、正常細胞では、ONYX−015アデノウイルスがp53を非活性化することができないため、ウイルスの増殖が抑えられ、細胞殺傷を誘導することができない反面、p53の機能が抑えられている癌細胞では、ウイルスの増殖が活発に起こり、究極的に癌細胞だけを選択的に殺傷するようになる(Chang F, Syrjanen S, Syrjanen K., J Clin Oncol, 1995, 13(4):1009-1022)。
【0003】
最近、頭頸部癌を対象に進行された臨床II/III期の試験結果、腫瘍特異的殺傷アデノウイルスの優れた治療効果が報告された(Kirn D, Hermiston T, McCormick F., Nat Med, 1998, 4(12):1341-1342; Nemunaitis J, et al., Cancer Res, 2000, 60(22):6359-6366; Ganly I, et al., Clin Cancer Res, 2000, 6(3): 798-806)。しかしながら、前記アデノウイルスの投与により、頭頸部腫瘍の成長が部分的に抑制されたものの、完全に消滅されたわけではなく、一定期間が過ぎた後には、腫瘍の成長がさらに速やかに進行された。このような結果は、局所的に腫瘍内投与されたアデノウイルスが一部周辺にのみ拡散されて、腫瘍組織全体に広がらなかったため、抗腫瘍効果が制限的に誘導され、ウイルスに感染されなかった腫瘍細胞が再び速やかに成長したからであると考えられる。最近の研究報告によると、ヌードマウスに形成された人体腫瘍内に投与されたアデノウイルスは、ウイルスの投与後100日が経った場合も、腫瘍内で複製が起こり、腫瘍組織から生きているウイルスが抽出されたが、腫瘍の成長を完全に抑制することはできなかった。以後の研究結果によると、このような低い抗腫瘍効果は、腫瘍組織内に存在する結締組織(connective tissue)と細胞外基質(extracellular matrix)により、ウイルスの拡散が制限的に起こったからであると明かされた。また、アデノウイルスを腫瘍内に投与すると、初期には、生来の(innate)免疫反応により、アデノウイルスが血流から速やかに除去されたが、ウイルス投与後約48週には、アデノウイルスが再び血流から検出されて、これは、腫瘍内で複製されたアデノウイルスが血流に放出されてきたものと推論された。このような一連の結果をまとめてみると、腫瘍特異的殺傷アデノウイルスは、癌細胞内で活発に複製が起こるが、癌細胞間に存在する細胞外基質及び結締組織などのような物理的障壁により、周辺癌細胞に活発に広がることができず、これらのアデノウイルスによる抗腫瘍効果が制限的に誘導されると考えられる。
【0004】
したがって、腫瘍特異的殺傷アデノウイルスを癌治療に効率的に利用するためには、腫瘍特異的殺傷アデノウイルスが強力な細胞殺傷能を誘導することができなければならなく、投与されたアデノウイルスが腫瘍組織全体によく拡散されて、周辺癌細胞を効率的に感染できなければならない。
【0005】
最近、ウイルス性遺伝子伝達体の制限された組織内拡散問題と、これによる低い遺伝子伝達効率を克服するために、いくつかの方案が研究されている。N. Kuriyama研究陣は、コラーゲンとその他の細胞外基質を分解できるコラゲナーゼ/ディスパーゼ(collagenase/dispase)、またはトリプシンのような蛋白質分解酵素(protease)を、アデノウイルスを投与する前に処理することにより、アデノウイルスの遺伝子伝達効率を大きく向上した(Kuriyama N, et al., Hum Gene Ther, 2000, 11(16):2219-2230)。また、同じ概念で、L. Maillard研究陣は、動脈の主要構成成分であるエラスチンを分解できるエラスターゼをラビットのお尻(iliac)動脈に処理することにより、アデノウイルスによる遺伝子伝達効率を約2倍ほど向上させることができた(Maillard, L., et al., Gene Ther, 1998, 5(8):1023-1030)。その他にも、細胞外基質を分解できるヒアルロニダーゼ(hyaluronidase)を利用して、ラットの筋肉におけるアデノ随伴ウイルスによる遺伝子伝達効率を約2〜3倍程度向上できることが報告された(Favre D, et al., Gene Ther, 2000, 7(16):1417-1420)。このような一連の研究を通じて、細胞外基質の構成成分の合成を阻害するかまたが分解を促進して、細胞外基質の構成成分を減少させると、組織内におけるウイルス拡散を増大することができて、その結果、遺伝子伝達効率を向上させることができると期待される。また、皮膚の結合組織の異常増殖により引き起こされるケロイド(keloid)のような線維症疾患においても、細胞外基質の合成を阻害することにより、線維症疾患の生成を抑制し、治療効果を誘導することができると考えられる。
【0006】
本明細書全体にかけて多数の特許文献及び論文が参照されて、その引用は、括弧内に表示されている。引用された特許文献及び論文の開示内容は、その全体が本明細書に参照として取り込まれ、本発明の属する技術分野の水準及び本発明の内容がより明確に説明される。
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明者らは、遺伝子伝達システムの伝達効率、特に、組織内における遺伝子伝達システムの浸透性(あるいは拡散性)を増加させるために鋭意研究した結果、デコリンが遺伝子伝達効率を大きく改善でき、前記デコリンを発現する組み換えアデノウイルスが組織浸透性及び抗腫瘍効果に優れていることを見出し、本発明を完成した。
【0008】
したがって、本発明の目的は、デコリン(decorin)−エンコーディングヌクレオチド配列を含む新規遺伝子伝達システムを提供することにある。
【0009】
本発明の他の目的は、伝達効率の改善された遺伝子伝達方法を提供することにある。
【0010】
本発明のまた他の目的は、腫瘍組織浸透能及び腫瘍細胞アポトーシス能が改善された組み換えアデノウイルスを提供することにある。
【0011】
本発明の他の目的は、上述の組み換えアデノウイルスを含む薬剤学的抗腫瘍組成物を提供することにある。
【0012】
本発明の他の目的は、上述の薬剤学的抗腫瘍組成物を利用した癌の治療方法を提供することにある。
【0013】
本発明の他の目的は、改善された組織浸透性を有する薬剤学的組成物を提供することにある。
【0014】
本発明のまた他の目的は、細胞外基質の過度なる蓄積に係る疾病または疾患の治療用薬剤学的組成物を提供することにある。
【0015】
本発明の他の目的及び利点は、発明の詳細な説明及び請求の範囲により、さらに明確にされる。
【課題を解決するための手段】
【0016】
本発明の一様態によると、本発明は、細胞内に運搬しようとする目的ヌクレオチド配列及びデコリン(decorin)−エンコーディングヌクレオチド配列を含み、前記デコリンは、前記目的ヌクレオチド配列の細胞内運搬効率を増加させる作用をすることを特徴とする遺伝子伝達システムを提供する。
【0017】
本発明者らは、遺伝子伝達システムの伝達効率、特に、組織内における遺伝子伝達システムの浸透性(あるいは、拡散性)を増加させるために鋭意研究した。このような研究の方向は、細胞外基質(ECM)の構成成分の合成を阻害するかまたは分解を促進し、細胞外基質の構成成分を減少させれば、組織内における遺伝子伝達システムの拡散を増大させることができるという仮説に基づいたものである。結局、本発明者らは、デコリンが遺伝子伝達効率を大きく改善できるという驚くべき事実を見出した。
【0018】
本明細書において、用語“デコリン”は、実施例に示されたデコリンだけではなく、本発明で目標とする遺伝子伝達効率を増加させることのできるデコリンのあらゆる擬似体(homologues)を含む。
【0019】
本発明において、遺伝子伝達効率を改善するデコリン(decorin:DCN)は、SLRP(small leucine rich proteoglycan)部類に属するタンパク質であって、10〜12個のロイシンリッチリピート(leucine rich repeat)から構成されており、コア部位は、アーチ(arch)状になっており、細胞外基質に存在する数種の成長因子またはデコリン受容体と結合が容易な構造に形成されている(Krusius T, Ruoslahti E., Proc Natl Acad Sci U S A, 1986, 83(20):7683-7687; Day AA, et al., Biochem J, 1987, 248(3):801-805; Fisher LW, Termine JD, Young MF., J Biol Chem, 1989, 264(8):4571-4576)。デコリンは、腫瘍成長因子(TGF)−βの活性を抑制することにより、コラーゲンの繊維化を防ぎ、細胞外基質の構成(matrix assembly)に関与して、腫瘍細胞の成長を抑制し、腫瘍の形成と成長に天然拮抗剤(antagonist)として作用すると知られている(Iozzo RV., Crit Rev Biochem Mol Biol, 1997, 32(2):141-174; Isaka Y, et al., Nat Med, 1996, 2(4):418-423)。また、デコリンは、成長因子や金属イオンのような細胞外基質の構成成分と反応し、MMP-1(matrix metalloproteinase-1)とMMP-2などの発現を促進して、細胞外基質を分解させる(Yamaguchi Y, Mann DM, Ruoslahti E., Nature, 1990, 346(6281):281-284; Vogel KG, Paulsson M, Heinegard D., Biochem J, 1984, 223(3):587-597; Danielson KG, et al., J Cell Biol, 1997, 136(3):729-743)。
【0020】
本発明の遺伝子伝達システムにおいて、デコリンが遺伝子伝達効率を増加させるメカニズムの一つは、デコリンが、MMP2及びMMP9などのような数種のMMP発現を促進することにより、細胞を囲んでいる細胞外基質成分の大部分を占めているコラーゲンを分解し、 結締組織、ひいては基底膜までも破壊して、細胞外基質の分解を誘導することができるためであると判断されて、このようなメカニズムは、下記の実施例により検証される。
【0021】
したがって、上述のデコリンの作用を参照すると、本発明の遺伝子伝達システムは、細胞外基質により連結された細胞からなる組織内の細胞において、その長所が顕著に現れる。特に、結締組織により堅固に囲まれている腫瘍組織に、本発明の遺伝子伝達システムが適用されると、従来のいかなる遺伝子伝達体よりも改善された伝達効率を示す。
【0022】
本発明の遺伝子伝達システムを製造するために、デコリン−エンコーディングヌクレオチド配列は、適した発現コンストラクト(expression construct)内に存在することが好ましい。前記発現コンストラクトにおいて、デコリン遺伝子は、プロモーターに作動的に結合されることが好ましい。本明細書において、用語“作動的に結合された”は、核酸発現調節配列(例えば、プロモーター、シグナル配列、または転写調節因子結合位置のアレイ)と他の核酸配列との間の機能的な結合を意味し、これにより、前記調節配列は、前記他の核酸配列の転写及び/または解読を調節するようになる。本発明において、デコリン遺伝子に結合されたプロモーターは、好ましくは、動物細胞、より好ましくは、哺乳動物細胞で作動し、デコリン遺伝子の転写を調節することができるものであって、哺乳動物ウイルス由来のプロモーター及び哺乳動物細胞のゲノム由来のプロモーターを含み、例えば、U6プロモーター、H1プロモーター、CMV(Cytomegalo virus)プロモーター、アデノウイルス後期プロモーター、ワクシニアウイルス7.5Kプロモーター、SV40プロモーター、HSVのtkプロモーター、RSVプロモーター、EF1アルファプロモーター、メタロチオネインプロモーター、β−アクチンプロモーター、ヒトIL−2遺伝子のプロモーター、ヒトIFN遺伝子のプロモーター、ヒトIL−4遺伝子のプロモーター、ヒトリンホトキシン遺伝子のプロモーター、ヒトGM−CSF遺伝子のプロモーター、誘導性(inducible)プロモーター、癌細胞特異的プロモーター(例えば、TERTプロモーター、PSAプロモーター、PSMAプロモーター、CEAプロモーター、E2Fプロモーター及びAFPプロモーター)及び組織特異的プロモーター(例えば、アルブミンプロモーター)を含むが、これに限定されるものではない。最も好ましくは、CMVプロモーターまたは癌細胞特異的プロモーターである。癌細胞特異的プロモーターを利用する場合、TERTプロモーターまたはE2Fプロモーターを利用することが好ましい。TERT(telomere reverse transcriptase)プロモーターとして野生型ヒトhTERT(human telomere reverse transcriptase)プロモーターまたは本発明者らにより開発されたm-hTERTを利用できる(see WO 2004/076668)。m-hTERTは、2個のc-Myc結合部位及び5個のSp1結合部位を含むヒトテロメア逆転写酵素プロモーターに、さらに一つ以上(好ましくは1個)のc-Myc結合部位及び一つ以上(好ましくは5個)のSp1結合部位を含む核酸配列が連結されたプロモーターである。m-hTERTの具体的なヌクレオチド配列は、WO 2004/076668に開示されている。E2Fプロモーターは、細胞周期に関与するプロモーターである(Johnson, D.G., Mol. Carcinog. 27: 151-157(2000); Ngwenya, S., and Safe, S., Endocrinology 144:1675-1685; Cam, H., and Dynlacht, D., Cancer Cell 3:311-316(2003))。
【0023】
好ましくは、本発明に利用される発現コンストラクトは、ポリアデニル化配列を含む(例えば、牛成長ホルモンターミネーター及びSV40由来ポリアデニル化配列)。
【0024】
本発明の好ましい具現例によると、本発明に利用されるデコリン−エンコーディングヌクレオチド配列は、“プロモーター−デコリン−エンコーディングヌクレオチド配列−ポリアデニル化配列(Pol A)”の構造を有する。
【0025】
本発明の遺伝子伝達システムにおいて、細胞内に運搬しようとする目的のヌクレオチド配列も、上述のデコリン遺伝子の発現コンストラクトと同一な方法により発現コンストラクトを構築することができる。
【0026】
本発明で細胞内に運搬しようとする目的ヌクレオチド配列は、いかなるヌクレオチド配列でも可能であって、例えば、癌細胞の死滅を誘導して、究極的に腫瘍を退化させる癌治療遺伝子として、腫瘍抑制遺伝子、免疫調節遺伝子[例えば、サイトカイン遺伝子、ケモカイン遺伝子、及び共刺激因子(Costimulatory factor:B7.1とB7.2のようなT細胞活性に必要な補助分子)]、抗原性遺伝子、自殺遺伝子、細胞毒性遺伝子、細胞増殖抑制遺伝子、親−細胞死滅遺伝子、及び抗−新生血管生成遺伝子が含まれるが、これに限定されるものではない。
【0027】
自殺遺伝子は、細胞が外部因子により殺傷され易くなるように誘導する物質を発現するか、細胞に毒性条件を誘発する核酸配列である。このような自殺遺伝子としてよく知られているものは、チミジンキナーゼ(TK)遺伝子である(米国特許第5,631,236号及び第5,601,818号)。TK遺伝子産物を発現する細胞は、ガンシクロビル(gancyclovir)の投与により選択的な死滅に敏感である。腫瘍抑制遺伝子は、腫瘍の形成を抑制するポリペプチドを暗号化する遺伝子を意味する。腫瘍抑制遺伝子は、哺乳動物において自然発生遺伝子であり、この遺伝子の欠失または不活性化は、腫瘍発生に必須前提とされている。腫瘍抑制遺伝子の例としては、APC、DPC4、NF−1、NF−2、MTS1、WT1、BRCA1、BRCA2、VHL、p53、Rb、MMAC−1、MMSC−2、網膜芽細胞腫遺伝子(Lee et al. Nature, 329:642(1987))、大腸腺腫症遺伝子蛋白質(adenomatous polyposis coli protein;米国特許第5,783,666号)、染色体3p21.3に位置した鼻咽喉腫瘍抑制因子遺伝子(Cheng et al. Proc. Nat .Acad. Sci., 95:3042-3047(1998))、欠損された血漿腫瘍(DCC)遺伝子、MTS1、CDK4、VHL、p110Rb、p16、及びp21を含む腫瘍抑制遺伝子のINK4系列の一員及びこれの治療学的に有効な断片(例えば、p56Rb、p94Rbなど)が含まれる。当業者なら、前記例示した遺伝子に限定されず、その他に知られたあらゆる抗腫瘍遺伝子が本発明に使用できるということが分かるだろう。
【0028】
本明細書において、用語“抗原性遺伝子(antigenic gene)”は、ターゲット細胞内で発現されて、免疫システムで認識できる細胞表面抗原性蛋白質を生産するヌクレオチド配列を意味する。このような抗原性遺伝子の例には、癌胎児性抗原(carcinoembryonic antigen, CEA)及びPSA(prostate specific antigen)、AFP(α-feto protein)、p53(WO 94/02167)が含まれる。免疫システムが容易に認識するようにするために、前記抗原性遺伝子をMHC第I型抗原に結合させることができる。
【0029】
本明細書において、用語“細胞毒性遺伝子(Cytotoxic gene)”は、細胞内で発現されて毒性効果を示すヌクレオチド配列を意味する。このような細胞毒性遺伝子の例には、シュードモナス外毒素(exotoxin)、リシン毒素、ジフテリア毒素などをコーディングするヌクレオチド配列が含まれる。
【0030】
本明細書において、用語“細胞増殖抑制遺伝子(cytostatic gene)”は、細胞内で発現されて、細胞周期途中に細胞周期を停止させるヌクレオチド配列を意味する。このような細胞増殖抑制遺伝子の例には、p21、網膜芽細胞腫遺伝子、E2F−Rb融合蛋白質遺伝子、シクリン−従属性キナーゼ抑制因子をコーディングする遺伝子(例えば、p16、p15、p18及びp19)、成長中止特異性ホメオボックス(growth arrest specific homeobox, GAX)遺伝子(WO 97/16459及びWO 96/30385)などがあるが、これに限定されるものではない。
【0031】
また、各種疾患を治療するに有用に使用できる種々の治療遺伝子も、本発明のシステムにより運搬される。例えば、サイトカイン(例えば、インターフェロン−α、−β、−δ、−γ)、インターロイキン(例えば、IL-1、IL-2、IL-4、IL-6、IL-7、IL-10、IL-12、IL-5、IL-18、IL-19、IL-20及びIL-23)、及びコロニー刺激因子(例えば、GM-CSF及びG-CSF)を暗号化する遺伝子、ケモカイングループ(単球走化性蛋白質1(MCP-1)、単球走化性蛋白質2(MCP-2)、単球走化性蛋白質3(MCP-3)、単球走化性蛋白質4(MCP-4)、マクロファージ炎症性蛋白質1α(MIP-1α)、マクロファージ炎症性蛋白質1β(MIP-1β)、マクロファージ炎症性蛋白質1γ(MIP-1γ)、マクロファージ炎症性蛋白質3α(MIP-3α)、マクロファージ炎症性蛋白質3β(MIP-3β)、ケモカイン(ELC)、マクロファージ炎症性蛋白質4(MIP-4)、マクロファージ炎症性蛋白質5(MIP-5)、LD78β、RANTES、SIS−イプシロン(p500)、胸腺活性化調節されるケモカイン(TARC)、エオタキシン、I−309、ヒト蛋白質HCC−1/NCC−2、ヒト蛋白質HCC−3、マウス蛋白質C10など)が含まれる。また、組織プラスミノゲン活性化剤(tPA)またはウロキナーゼを発現する遺伝子及び持続的な血栓効果を提供して、高コレステロール血症を予防するLAL生成遺伝子が含まれる。また、嚢胞性線維症、アデノシンデアミナーゼ欠乏症及びAIDSのようなウイルス、悪性または炎症疾患を治療するための数種のポリヌクレオチドが知られている。
【0032】
本明細書において、用語“親−細胞死滅遺伝子(Pro-apoptotic gene)”は、発現されて、プログラムされた細胞消滅を誘導するヌクレオチド配列を意味する。このような親−細胞死滅遺伝子の例には、p53、アデノウイルスE3−11.6K(Ad2及びAd5由来)またはアデノウイルスE3−10.5K(Ad由来)、アデノウイルスE4遺伝子、Fasリガンド、TNF−α、TRAIL、p53経路遺伝子及びカスパーゼをコーディングする遺伝子が含まれる。
【0033】
本発明の明細書において、用語“抗−新生血管生成遺伝子(anti-angiogenic gene)”は、発現されて、抗−新生血管生成因子を細胞外に放出するヌクレオチド配列を意味する。抗−新生血管生成因子には、アンジオスタチン、Tie 2(PNAS, 1998, 95,8795-800)のような血管内皮成長因子(VEGF)の抑制因子、エンドスタチンなどが含まれる。
【0034】
上述の目的のヌクレオチド配列は、GenBankまたはEMBLのようなDNA配列データバンクから入手できる。
【0035】
本発明の遺伝子伝達システムは、多様な形態に製作することができるが、これは、(i)ネーキッド(naked)組み換えDNA分子、(ii)プラスミド、(iii)ウイルスベクター、及び(iv)前記ネーキッド組み換えDNA分子またはプラスミドを内包するリポソームまたはネオソームの形態に製作することができる。
【0036】
デコリン−エンコーディングヌクレオチド配列は、通常的な遺伝子治療に利用される全ての遺伝子伝達システムに適用できて、好ましくは、プラスミド、アデノウイルス(Lockett LJ, et al., Clin. Cancer Res. 3:2075-2080(1997))、アデノ−関連ウイルス(Adeno-associated viruses: AAV, Lashford LS., et al., Gene Therapy Technologies, Applications and Regulations Ed. A. Meager, 1999)、レトロウイルス(Gunzburg WH, et al., Retroviral vectors. Gene Therapy Technologies, Applications and Regulations Ed. A. Meager, 1999)、レンチウイルス(Wang G. et al., J. Clin. Invest. 104(11):R55-62(1999))、単純ヘルペスウイルス(Chamber R., et al., Proc. Natl. Acad. Sci USA 92:1411-1415(1995))、ワクシニアウイルス(Puhlmann M. et al., Human Gene Therapy 10:649-657(1999))、リポソーム(Methods in Molecular Biology, Vol 199, S.C. Basu and M. Basu (Eds.), Human Press 2002)、またはネオソームに適用できる。最も好ましくは、本発明の遺伝子伝達システムは、デコリンエンコーディングヌクレオチド配列をアデノウイルスに適用して製造される。
【0037】
i.アデノウイルス
アデノウイルスは、中間程度のゲノムサイズ、操作の便宜性、高いタイター、広範囲のターゲット細胞、及び優れた感染性から、遺伝子伝達ベクターとしてよく利用されている。ゲノムの両末端は、100〜200bpのITR(inverted terminal repeat)を含み、これは、DNA複製及びパッケージングに必須的なシスエレメントである。ゲノムのE1領域(E1A及びE1B)は、転写及び宿主細胞遺伝子の転写を調節する蛋白質をコーディングする。E2領域(E2A及びE2B)は、ウイルスDNA複製に関与する蛋白質をコーディングする。
【0038】
現在開発されたアデノウイルスベクターの中で、E1領域の欠如された複製不能アデノウイルスがよく利用されている。一方、E3領域は、通常的なアデノウイルスベクターから除去され、外来遺伝子が挿入される座を提供する(Thimmappaya, B. et al., Cell, 31:543-551(1982); ・ Riordan, J. R. et al., Science, 245:1066-1073(1989))。したがって、本発明のデコリン遺伝子は、欠失されたE1領域(E1A領域及び/またはE1B領域、好ましくは、E1B領域)、またはE3領域に挿入されることが好ましく、より好ましくは、欠失されたE3領域に挿入される。一方、細胞内に運搬しようとする目的ヌクレオチド配列は、欠失されたE1領域(E1A領域及び/またはE1B領域、好ましくは、E1B領域)、またはE3領域に挿入されることが好ましく、より好ましくは、欠失されたE1領域に挿入される。本明細書において、ウイルスゲノム配列と関連して使用される用語、“欠失”は、該当配列が完全に欠失されたものだけではなく、部分的に欠失されたものも含む意味を有する。
【0039】
本発明の最も好ましい具現例によると、本発明のアデノウイルス遺伝子伝達システムは、“プロモーター−目的ヌクレオチド配列−ポリA配列”と“プロモーター−デコリン遺伝子−ポリA配列”とが連結された構造を有して、前記“プロモーター−目的ヌクレオチド配列−ポリA配列”は、欠失されたE1領域(E1A領域及び/またはE1B領域、好ましくは、E1B領域)、またはE3領域、好ましくは、欠失されたE1領域に挿入されたものであり、前記“プロモーター−デコリン遺伝子−ポリA配列”は、欠失されたE1領域(E1A領域及び/またはE1B領域、好ましくは、E1B領域)、またはE3領域、好ましくは、欠失されたE3領域に挿入されたものである。また、“プロモーター−目的ヌクレオチド配列−ポリA配列−IRES−デコリン遺伝子−ポリA配列”のように、目的ヌクレオチドとデコリン遺伝子がIRES(internal ribosome entry site)により連結されたバイシストロン(bicistronic)発現システムによっても発現可能である。
【0040】
また、アデノウイルスは、野生型ゲノムの約105%までパッケージングすることができるため、約2kbを追加的にパッケージングすることができる(Ghosh-Choudhury et al., EMBO J., 6:1733-1739(1987))。したがって、アデノウイルスに挿入される上述の外来配列は、アデノウイルスのゲノムに追加的に結合させることもできる。
【0041】
アデノウイルスは、42個の相異なる血清型及びA〜Fのサブグループを有する。この中で、サブグループCに属するアデノウイルスタイプ2及びタイプ5が、本発明のアデノウイルスベクターを得るための最も好ましい出発物質である。アデノウイルスタイプ2及びタイプ5に対する生化学的及び遺伝的情報は、よく知られている。
【0042】
アデノウイルスにより運搬される外来遺伝子は、エピソームと同一な方式により複製されて、そのため、宿主細胞に対して遺伝的毒性が非常に低い。したがって、本発明のアデノウイルス遺伝子伝達システムを利用した遺伝子治療が非常に安全であると判断される。
【0043】
ii.レトロウイルス
レトロウイルスは、自分の遺伝子を宿主のゲノムに挿入させて、大量の外来遺伝物質を運搬することができ、感染できる細胞のスペクトルが広いため、遺伝子伝達ベクターとしてよく利用されている。
【0044】
レトロウイルスベクターを構築するために、デコリン遺伝子及び運搬しようする目的ヌクレオチド配列は、レトロウイルスの配列の代わりにレトロウイルスゲノムに挿入されて、複製不能のウイルスを生産する。ビリオンを生産するために、gag、pol及びenv遺伝子を含むが、LTR(long terminal repeat)とΨ配列は含まないパッケージング細胞株を構築する(Mann et al., Cell, 33:153-159(1983))。デコリン遺伝子、運搬しようとする目的ヌクレオチド配列、LTR及びΨ配列を含む組み換えプラスミドを前記細胞株に移入すると、Ψ配列は、組み換えプラスミドのRNA転写体の生産を可能にして、この転写体は、ウイルスにパッケージングされて、ウイルスは、培地に排出される(Nicolas and Rubinstein "Retroviral vectors," In: Vectors: A survey of molecular cloning vectors and their uses, Rodriguez and Denhardt (eds.), Stoneham: Butterworth, 494-513(1988))。組み換えレトロウイルスを含有する培地を収集して濃縮し、遺伝子伝達システムに利用する。
【0045】
2世帯レトロウイルスベクターを利用した遺伝子伝達が発表された。Kasaharaら(Science, 266:1373-1376(1994))は、モロニーマウス白血病ウイルス(moloney-murine leukemia virus)の変異体を製造して、ここで、EPO(erythropoietin)配列をエンベロープ部位に挿入して、新しい結合特性を有するキメリック蛋白質(Chimeric proteins)を生産した。本発明の遺伝子伝達システムも、このような2世帯レトロウイルスベクターの構築戦略により製造することができる。
【0046】
iii.AAVベクター
アデノ関連ウイルス(AAV)は、非分裂細胞を感染させることができて、多様な種類の細胞に感染できる能力を有しているため、本発明の遺伝子伝達システムに適している。AAVベクターの製造及び用途に対する詳細な説明は、米国特許第5,139,941号及び第4,797,368号に詳細に開示されている。
【0047】
遺伝子伝達システムとしてのAAVに対する研究は、LaFace et al, Viology, 162:483486(1988), Zhou et al., Exp. Hematol. (NY), 21:928-933(1993), Walsh et al, J. Clin. Invest., 94:1440-1448(1994)、及びFlotte et al., Gene Therapy, 2:29-37(1995)に開示されている。最近、AAVベクターは、嚢胞性線維症の治療剤として臨床Iを施している。
【0048】
典型的に、AAVウイルスは、二つのAAV末端リピートが両側に位置されている目的の遺伝子配列(デコリン遺伝子及び運搬しようとする目的ヌクレオチド配列)を含むプラスミド(McLaughlin et al., J. Virol., 62:1963-1973(1988);及びSamulski et al., J. Virol., 63:3822-3828(1989))及び末端リピートのない野生型AAVコーディング配列を含む発現プラスミド(McCarty et al., J. Virol., 65:2936-2945( 1991))を同時形質転換させて製造される。
【0049】
iv.他のウイルスベクター
他のウイルスベクターも、本発明の遺伝子伝達システムとして利用することができる。ワクシニアウイルス(Puhlmann M. et al., Human Gene Therapy 10:649-657(1999); Ridgeway, "Mammalian expression vectors," In: Vectors: A survey of molecular cloning vectors and their uses. Rodriguez and Denhardt, eds. Stoneham: Butterworth, 467-492(1988); Baichwal and Sugden, "Vectors for gene transfer derived from animal DNA viruses: Transient and stable expression of transferred genes," In: Kucherlapati R, ed. Gene transfer. New York: Plenum Press, 117-148( 1986)及びCoupar et al., Gene, 68:1-10(1988))、レンチウイルス(Wang G. et al., J. Clin. Invest. 104(11):R55-62(1999))、または単純ヘルペスウイルス(Chamber R., et al., Proc. Natl. Acad. Sci USA 92:1411-1415(1995))由来のベクターも、デコリン遺伝子及び運搬しようとする目的ヌクレオチド配列を細胞内に運搬できる運搬システムとして利用することができる。
【0050】
v.リポソーム
リポソームは、水上に分散されたリン脂質により自然に形成される。外来DNA分子をリポソームにより成功的に細胞内に運搬した例は、Nicolau及びSene, Biochim. Biophys. Acta, 721:185-190(1982)、及びNicolau et al., Methods Enzymol., 149:157-176(1987)に開示されている。一方、リポソームを利用した動物細胞の形質転換に最もよく利用される試薬としては、Lipofectamine(Gibco BRL)がある。デコリン遺伝子及び運搬しようとする目的ヌクレオチド配列を内包したリポソームは、エンドサイトーシス、細胞表面への吸着またはプラズマ細胞膜との融合などのメカニズムを通じて細胞と相互作用し、細胞内にデコリン遺伝子及び運搬しようとする目的ヌクレオチド配列を運搬する。
【0051】
本発明の他の様態によると、本発明は、上述の本発明の遺伝子伝達システムを、細胞を含むバイオサンプルに接触させる段階を含む遺伝子伝達方法を提供する。
【0052】
本発明において、遺伝子伝達システムがウイルスベクターに基づいて製作された場合は、前記接触させる段階は、当業界に公知されたウイルス感染方法により行われる。ウイルスベクターを利用した宿主細胞の感染は、上述の引用文献に記載されている。
【0053】
本発明において、遺伝子伝達システムがネーキッド(naked)組み換えDNA分子またはプラスミドの場合は、微細注入法(Capecchi, M.R., Cell, 22:479(1980);及びHarlandとWeintraub, J. Cell Biol. 101:1094-1099(1985))、カルシウムフォスフェート沈殿法(Graham, F.L. et al., Virology, 52:456(1973);及びChenとOkayama, Mol. Cell. Biol. 7:2745-2752(1987))、電気穿孔法(Neumann, E. et al., EMBO J., 1:841(1982);及びTur-Kaspa et al., Mol. Cell Biol., 6:716-718(1986))、リポソーム−媒介形質感染法(Wong, T.K. et al., Gene, 10:87(1980); Nicolau及びSene, Biochim. Biophys. Acta, 721:185-190(1982);及びNicolau et al., Methods Enzymol., 149:157-176(1987))、DEAE−デキストラン処理法(Gopal, Mol. Cell Biol., 5:1188-1190(1985))、及び遺伝子ボンバードメント(Yang et al., Proc. Natl. Acad. Sci., 87:9568-9572(1990))方法により、遺伝子を細胞内に移入させることができる。
【0054】
本発明のまた他の様態によると、本発明は、アデノウイルスのITR(inverted terminal repeat)ヌクレオチド配列及びデコリン−エンコーディングヌクレオチド配列を含み、前記デコリンは、アデノウイルスの腫瘍組織浸透能及び腫瘍細胞アポトーシス能を増大させる作用をすることを特徴とする組み換えアデノウイルスを提供する。
【0055】
本発明の組み換えアデノウイルスは、従来の組み換えアデノウイルスにデコリン−エンコーディングヌクレオチド配列を追加的に結合させ、アデノウイルスの腫瘍組織浸透能及び腫瘍細胞アポトーシス能を増大させて、アデノウイルスによる癌治療効能を大きく増加させる。
【0056】
アデノウイルスゲノムの小さい部分だけがcisで必要であると知られているため(Tooza, J. Molecular biology of DNA Tumor viruses, 2nd ed. Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y.(1981))、アデノウイルスは、大量の外来DNA分子を運搬できる能力があり、これは特に、293のような特定細胞株を利用する場合にそうである。このような側面で、本発明の組み換えアデノウイルスにおいて、デコリン遺伝子以外の他のアデノウイルスの配列は、少なくともITR配列を含む。
【0057】
デコリン遺伝子は、E1領域(E1A領域及び/またはE1B領域、好ましくは、E1B領域)、またはE3領域に挿入されることが好ましく、より好ましくは、E3領域に挿入される。一方、他の外来ヌクレオチド配列(例えば、サイトカイン、免疫−共刺激因子、自殺遺伝子、及び腫瘍抑制遺伝子)も追加的にアデノウイルスに含ませることができて、これは、E1領域(E1A領域及び/またはE1B領域、好ましくは、E1B領域)またはE3領域に挿入されることが好ましく、より好ましくは、E1領域(E1A領域及び/またはE1B領域、好ましくは、E1B領域)に挿入される(参照:図1a及び1b)。本発明の他の変形例によると、デコリン遺伝子は、E4領域に挿入できる。
【0058】
また、アデノウイルスは、野生型ゲノムの約105%までパッケージングすることができるため、約2kbを追加的にパッケージングすることができる。したがって、アデノウイルスに挿入される上述の外来配列は、アデノウイルスのゲノムに追加的に結合させることもできる。
【0059】
本発明の好ましい具現例において、本発明の組み換えアデノウイルスは、非活性化されたE1B 19kDa遺伝子、E1B 55kDa遺伝子、またはE1B 19kDa/E1B 55kDa遺伝子を有して、好ましくは、非活性化されたE1B 19kDa及びE1B 55kDa遺伝子を有する。本明細書において、遺伝子と関連して使用される用語“非活性化”は、その遺伝子の転写及び/または解読が正常的になされず、その遺伝子によりコーディングされる正常的な蛋白質の機能が現れないことを意味する。例えば、非活性化E1B 19kDa遺伝子は、その遺伝子に変異(置換、付加、部分的欠失、または全体的欠失)が発生され、活性のE1B 19kDa蛋白質を生成できない遺伝子である。E1B 19kDa遺伝子が欠如された場合は、細胞アポトーシス能を増加させることができて、E1B 55kDa遺伝子が欠如された場合は、腫瘍細胞特異性を有するようにする(参照:大韓民国特許出願第2002−23760号)。
【0060】
本発明の好ましい具現例によると、本発明の組み換えアデノウイルスは、活性のE1A遺伝子を含む。E1A遺伝子を含む組み換えアデノウイルスは、複製可能な特性を有するようになる。本発明のより好ましい具現例によると、本発明の組み換えアデノウイルスは、非活性化されたE1B 19及び/またはE1B 55遺伝子及び活性のE1A遺伝子を含む。本発明の最も好ましい具現例によると、本発明の組み換えアデノウイルスは、E1B 19及び/またはE1B 55遺伝子が欠失されて、活性のE1A遺伝子を含み、デコリン−エンコーディングヌクレオチド配列は、欠失されたE3領域に挿入される。
【0061】
本発明の好ましい具現例によると、本発明の組み換えアデノウイルスは、非活性化されたE1B遺伝子及び変異された活性のE1A遺伝子を含み、デコリン遺伝子は、欠失されたE3領域に挿入されているものである。ここで、変異された活性のE1A遺伝子は、Rb(retinoblastoma蛋白質)結合部位をコーディングするヌクレオチド配列中で、45番目Glu残基がGlyに置換された変異及び121〜127番目アミノ酸配列が全体的にGlyに置換された変異を有する。腫瘍細胞では、p53蛋白質の変異だけではなく、Rbの突然変異あるいはRb関連信号メカニズムが相当部分損傷されているため、Rbとの結合能が消失されたアデノウイルスは、正常細胞では、Rbの活性によりアデノウイルスの複製が抑制されるが、Rbの機能が抑制された腫瘍細胞では、活発に複製されて、癌細胞を選択的に殺傷することができる。したがって、上述のRb結合部位における変異を含む本発明の組み換えアデノウイルスは、癌細胞特異性が非常に大きく増大される。
【0062】
本発明の最も好ましい具現例によると、本発明の組み換えアデノウイルスは、“ITR−E1A−ΔE1B−プロモーター−デコリン遺伝子−ポリA配列”構造を有して、前記“プロモーター−デコリン遺伝子−ポリA配列”は、欠失されたE3領域に挿入されたものである。
【0063】
本発明の最も好ましい実施例によると、本発明の腫瘍特異的殺傷アデノウイルスは、図1bの遺伝子地図を有する。
【0064】
本発明の組み換えアデノウイルスにおいて、従来の抗腫瘍アデノウイルスの局所的腫瘍浸透力が大きく改善されて、細胞アポトーシス能も大きく改善される。このような効果は、本発明で利用されたデコリンが細胞外基質を効果的に分解して、細胞アポトーシス能を増加させるためであり、最終的に本発明の組み換えアデノウイルスは、大きく改善された腫瘍細胞殺傷能を示す。
【0065】
大部分の腫瘍組織は、癌細胞が単純に群集されているのではなく、血管と正常組織とが絡まっている。特に、癌組織内に存在する結締組織は、硬くて、且つ癌細胞の外部周囲に硬い細胞外基質が形成されているため、ウイルスはもちろん抗癌治療剤が腫瘍に円滑に浸透できず、抗腫瘍効果を十分発揮できない場合が多い。このような問題点は、デコリン遺伝子を含む本発明の組み換えアデノウイルスを利用した場合、成功的に克服される。
【0066】
下記の実施例で証明されたように、デコリンの挿入されたアデノウイルスは、腫瘍球の表面だけではなく、腫瘍球の奥まで活発に拡散される。生体内の癌組織においても、デコリンを発現する本発明のアデノウイルスは、投与部位(injection site, needle track)からさらに遠く且つさらに広く広がっていく。デコリンの発現による遺伝子伝達効率の増加は、肉眼でも容易に確認できるほど、約2〜10倍以上に大きく差があって、既存になされた数々の研究によるコラゲナーゼ/ディスパーゼ、またはトリプシンのような蛋白質分解酵素の前処理、エラスチンを分解できるエラスターゼ、または細胞外基質を分解できるヒアルロニダーゼ(hyaluronidase)による約2〜3倍の遺伝子伝達効率の増大に比べ、著しく優れた遺伝子伝達効率を示す。
【0067】
そして、このようなデコリンの著しい組織内ウイルス拡散増進効果は、腫瘍特異的殺傷アデノウイルスにも適用されて、その結果、抗腫瘍効果を大きく増大させる結果を誘導する。このような抗腫瘍効果の改善は、腫瘍特異的殺傷アデノウイルス(複製可能組み換えアデノウイルス)だけではなく、複製不能組み換えアデノウイルスでも現れる。一方、デコリンによる組み換えアデノウイルスの細胞アポトーシス能の格段の改善は、全く予期できなかった効果である。
【0068】
本発明の他の様態によると、本発明は、(a)上述の本発明の組み換えアデノウイルスの治療学的有効量、及び(b)薬剤学的に許容される担体を含む薬剤学的抗腫瘍組成物を提供する。
【0069】
本発明の他の様態によると、本発明は、上述の本発明の薬剤学的抗腫瘍組成物を動物に投与する段階を含む癌の治療方法を提供する。
【0070】
本発明の薬剤学的組成物に有効成分として含まれる組み換えアデノウイルスは、上述の本発明の組み換えアデノウイルスと同一なものであるため、組み換えアデノウイルスに対する詳細な説明は、本発明の薬剤学的組成物にも同様に適用される。したがって、本明細書の不要な重複記載による過度なる複雑性を避けるために、共通事項は、その記載を省略する。
【0071】
組み換えアデノウイルスを利用した効果的な抗腫瘍効果を誘導するためには、速い速度で成長する癌細胞に比べ、より速いウイルスの増殖と隣接細胞への拡散を通じて、効果的な細胞殺傷効果を誘発することができなければならない。また、アデノウイルスを利用した癌遺伝子治療が成功的になされるためには、高い治療効果と共に、安全性を高めるための方案が開発されなければならない。本発明で開発されたデコリン遺伝子を含む組み換えアデノウイルスは、ウイルス組織内拡散増大と細胞アポトーシス促進を通じて抗腫瘍効果が著しく増大されて、癌細胞特異的に細胞殺傷能を示す。これは、結果的に癌治療に必要なウイルス投与量を減少させることができ、ウイルスによる生体内毒性と免疫反応を大きく減らすことができる。
【0072】
本発明の組成物に含まれる組み換えアデノウイルスは、上述のように、多様な腫瘍細胞に対して殺傷効能を示すため、本発明の薬剤学的組成物は、腫瘍に係る様々な疾病または疾患、例えば、脳癌、胃癌、皮膚癌、肺癌、乳房癌、卵巣癌、肝癌、気管支癌、鼻咽頭癌、喉頭癌、食道癌、膵臓癌、膀胱癌、前立腺癌、大腸癌、結腸癌、及び子宮頸部癌などの治療に利用できる。本明細書において、“治療”は、(i)腫瘍細胞形成の予防;(ii)腫瘍細胞の除去による、腫瘍に係る疾病または疾患の抑制;及び(iii)腫瘍細胞の除去による、腫瘍に係る疾病または疾患の軽減を意味する。したがって、本明細書における用語“治療学的有効量”は、上記した薬理学的効果を達成するに十分な量を意味する。
【0073】
本発明の組成物に含まれる薬剤学的に許容される担体は、製剤時に通常的に利用されるものであって、ラクトース、デキストロース、スクロース、ソルビトール、マンニトール、デンプン、アカシアゴム、リン酸カルシウム、アルギネート、ゼラチン、ケイ酸カルシウム、微細結晶性セルロース、ポリビニルピロリドン、セルロース、水、シロップ、メチルセルロース、メチルヒドロキシベンゾエート、プロピルヒドロキシベンゾエート、滑石、ステアリン酸マグネシウム、及びミネラルオイルなどを含むが、これに限定されるものではない。本発明の薬剤学的組成物は、前記成分の他に、潤滑剤、湿潤剤、甘味剤、香味剤、乳化剤、懸濁剤、保存剤などをさらに含むことができる。
【0074】
本発明の薬剤学的組成物は、非経口投与が好ましく、例えば、静脈内投与、腹腔内投与、筋肉内投与、皮下投与、または、局部投与を利用して投与することができる。卵巣癌で腹腔内に投与する場合及び肝癌で門脈に投与する場合は、注入方法により投与することができて、脳癌、皮膚癌、頭頸部癌及び乳房癌の場合は、腫瘍塊に直接注射して投与することができ、結腸癌の場合は、浣腸で直接注射して投与することができて、膀胱癌の場合は、カテーテル内に直接注射して投与することができる。
【0075】
本発明の薬剤学的組成物の適合した投与量は、製剤化方法、投与方式、患者の年齢、体重、性、疾病症状の程度、飲食、投与時間、投与経路、排泄速度、及び反応感応性のような要因により様々であり、普通に熟練した医者は、目的する治療に効果的な投与量を容易に決定及び処方することができる。一般に、本発明の薬剤学的組成物は、1×105〜1×1015PFU/mlの組み換えアデノウイルスを含み、通常、1×1010PFUを二日に一回、2週間注射する。
【0076】
本発明の薬剤学的組成物は、本発明の属する技術分野で通常の知識を有する者が容易に実施できる方法により、薬剤学的に許容される担体及び/または賦形剤を利用して製剤化することにより、単位容量形態に製造されるか、または多用量容器内に入れて製造する。この際、剤形は、オイルまたは水性媒質中の溶液、懸濁液または乳化液の形態であるか、エリキシル剤、粉末剤、顆粒剤、錠剤またはカプセル剤の形態でもよく、分散剤または安定化剤をさらに含むことができる。
【0077】
本発明の薬剤学的組成物は、単独療法として利用してもよいが、他の通常的な化学療法または放射療法と共に利用してもよく、このような並行療法を実施する場合は、より効果的に癌治療をすることができる。本発明の組成物と共に利用できる化学療法剤は、シスプラチン、カルボプラチン、プロカルバジン、メクロレタミン、シクロホスファミド、イホスファミド、メルファラン、クロラムブシル、ビスルファン、ニトロソウレア、ダクチノマイシン、ダウノルビシン、ドキソルビシン、ブレオマイシン、プリコマイシン(plicomycin)、マイトマイシン、エトポシド、タモキシフェン、タキソール、トランスプラチニウム(transplatinum)、5−フルオロウラシル、ビンクリスチン、ビンブラスチン、及びメトトレキサートなどを含む、本発明の組成物と共に利用できる放射療法は、X−線照射及びγ−線照射などである。
【0078】
本発明の他の様態によると、本発明は、(a)薬物の組織浸透性を改善するためのデコリンタンパク質、及び(b)薬剤学的に許容される担体を含む改善された組織浸透性を有する薬剤学的組成物を提供する。
【0079】
本発明で利用されるデコリンタンパク質は、天然ソース(natural source)から分離されたデコリンタンパク質及び組み換え技術で得られたデコリンタンパク質を含み、細胞外基質分解活性を有する範囲内で、前記タンパク質の断片も含む。
【0080】
本発明の組成物は、薬物が投与される前または薬物と同時に投与することができる。また、本発明の組成物は、薬物を追加的に含むことができる。本発明の薬剤学的組成物は、薬物が適用される生体組織の細胞外基質を分解することにより、薬物の組織浸透性を大きく改善し、薬物の薬理学的効果を増加させる。
【0081】
本発明の薬剤学的組成物において、薬剤学的に許容される担体、投与方法及び製剤化方法などは、上述の抗腫瘍薬剤学的組成物の内容が適用される。特に、本発明の薬剤学的組成物は、非経口投与が好ましいが、例えば、静脈内投与、腹腔内投与、筋肉内投与、皮下投与、経皮投与、または組織内直接投与(例えば、頭頸部癌または乳房癌腫塊内への直接投与)を利用して投与することができる。一般に、本発明の薬剤学的組成物の投与量は、0.0001〜100mg/kgである。
【0082】
本発明の組成物により組織浸透性が改善される前記薬物は、化学薬物及びバイオ薬物(biodrug)を含み、好ましくは、細胞外基質により組織浸透性が問題となる薬物、例えば、上述の癌に対する化学療法剤である。
【0083】
本発明の他の様態によると、本発明は、(a)デコリン−エンコーディングヌクレオチド配列を含む遺伝子伝達システムまたはデコリンタンパク質の治療学的有効量、及び(b)薬剤学的に許容される担体を含む細胞外基質の過度なる蓄積(accumulation)に係る疾患または状態の治療用薬剤学的組成物を提供する。
【0084】
本発明の薬剤学的組成物は、生体組織の細胞外基質を効果的に分解して、細胞外基質の過度なる蓄積または沈着(deposition)が関与する疾病または疾患を治療することができる。本明細書における表現“細胞外基質の過度なる蓄積”は、コラーゲン、ラミニン、フィブロネクチン、及びプロテオグリカンのような細胞外基質成分が、組織または器官機能を損傷し、終局的に線維症疾患を招来する程度に沈着されたことを意味する。
【0085】
本発明の薬剤学的組成物が適用される、細胞外基質の過度なる蓄積に係る疾患または状態は、線維症状態と関連したものであって、斑痕、肝硬変症、肺線維症、糸球体腎炎、成人または急性呼吸困難症、肝線維症、腎線維症、後心筋梗塞線維症、 嚢胞性線維症、線維症癌、静脈閉塞症、または腎間質線維症を含むが、これに限定されるものではない。
【0086】
本発明の薬剤学的組成物が適用される斑痕(scar)は、傷、火傷、または手術により生じた斑痕及びケロイドのような過度な斑痕である。
【0087】
本発明の薬剤学的組成物において、デコリン−エンコーディングヌクレオチド配列を含む遺伝子伝達システムは、上述した本発明の遺伝子伝達システムにより説明される。一方、本発明の薬剤学的組成物で利用されるデコリンタンパク質は、天然ソース(natural source)から分離されたデコリンタンパク質及び組み換え技術により得られたデコリンタンパク質を含み、細胞外基質分解活性を有する範囲内で、前記タンパク質の断片も含む。
【0088】
本発明の薬剤学的組成物において、薬剤学的に許容される担体、投与方法及び製剤化方法などは、上述の抗腫瘍薬剤学的組成物の内容が適用される。特に、本発明の薬剤学的組成物が斑痕の治療のために利用される場合は、経皮投与が最も適しており、軟膏、ゲル、クリーム、液体、スプレー、パッチ、またはローションの剤形で製造することが最も好ましい。一般に、本発明の薬剤学的組成物の1日投与量は、0.001〜100mg/kgである。
【発明を実施するための最良の形態】
【0089】
以下、実施例を通じて本発明をさらに詳細に説明する。これら実施例は、本発明をより具体的に説明するためのものであって、本発明の範囲がこれら実施例に限定されないことは、本発明の属する技術分野で通常の知識を有する者にとって自明なことであろう。
【実施例】
【0090】
[実験材料及び実験方法]
1.対象細胞株及び細胞の培養
本発明の実験に使用された細胞株は、人体脳癌細胞株(U343及びU87MG)、子宮頸部癌細胞株(C33A)、肝癌細胞株(Hep3B)、肺癌細胞株(A549)とマウス黒色腫(B16BL6)のような癌細胞株、人体正常細胞株(CBHEL, MRC5, IMR90及びWI38)及びアデノウイルス初期発現遺伝子であるE1部位が宿主遺伝体内に内在されている293細胞株である。B16BL6を除いた全ての細胞株は、ATCC(American Type Culture Collection; Manassas, VA, USA)から購入し、B16BL6マウス黒色腫細胞株は、大韓民国のヨンセ大学校(Yonsei University)のボクヨンソク教授チームから提供してもらった。
【0091】
B16BL6細胞株を除いた全ての細胞株は、10%の牛胎児血清(Gibco BRL, Grand Island, NY)の含有されたDMEM培地(Gibco BRL)を培養液とし、抗生剤ペニシリン/ストレプトマイシン(Gibco BRL)を添加して、5%CO2の存在下、37℃恒温培養器で培養した。B16BL6細胞株は、10%の牛胎児血清とペニシリン/ストレプトマイシンとを含むRPMI 1640(Gibco BRL)を使用して、5%CO2の存在下、37℃恒温培養器で培養した。
【0092】
2.実験動物
生体内抗腫瘍実験は、6〜8週齢の雄ヌードマウス(BALB/c-nu)とC57BL/6 マウスをCharles River Korea(Seoul, Korea)で購入して行った。動物飼育室の温度は、22±2℃、湿度は、55〜60%に維持して、明暗循環が12時間単位で調節されるようにし、放射線照射で滅菌した固形飼料(Orient, Seoul, Korea)と滅菌された給水を自由に摂取するようにした。
【0093】
3.デコリンを発現するアデノウイルスの製作、生産及び力価算出
(1)複製不能アデノウイルスの製作
LacZ遺伝子を標識遺伝子として発現し且つデコリン遺伝子を発現する、E1とE3遺伝子の消失された複製不能アデノウイルスを製作した。まずvmdl324BstB(Heider, H. et al., Biotechniques, 28(2):260-270(2000))ベクターの消失されたE1部位に標識遺伝子のLacZ遺伝子を挿入し、pdl−LacZウイルスベクターを製作した。このために、まず、LacZを発現するpcDNA−hygro−LacZ(Invitrogen, Carlsbad, CA,米国) プラスミドからCMVプロモーター、LacZ、及びpolA部位をHindIIIとNaeIとで処理し分離した後、これをE1アデノウイルスシャトルベクターであるpΔE1sp1Aに挿入し、pΔE1sp1A/CMV−LacZシャトルベクターを製作した。製作されたpΔE1sp1A/CMV−LacZシャトルベクターをXmnI制限酵素で切断した後、BstBI制限酵素により一本鎖となったアデノウイルスvmdl324BstBと共に大腸菌BJ5183(S.B. Verca, University of Fribourgh, Switzerland)で同時形質転換させて、遺伝子相同組み換えを誘導し、pdl−LacZアデノウイルスを製作した。
【0094】
デコリン遺伝子を発現するアデノウイルスを製作するために、発現ベクターpcDNA3.1にデコリン遺伝子(DCNG) (D.G. Seidler, University Hospital of Munster, ドイツ)を挿入し、pcDNA3.1−DCNG(野生型cDNA形態のデコリン)を製造した。次に、前記野生型デコリンコアタンパク質の6番目ロイシンリッチリピート部位内にあるE180アミノ酸をE180Qで点突然変異させて、コラーゲンとの結合力が野生型に比べ弱化されたデコリン変異体DCNQを製造した後、pcDNA3.1ベクターに挿入し、pcDNA3.1−DCNQ発現ベクターを製造した。そして、デコリンコアタンパク質のE180アミノ酸をE180Kで点突然変異させて、コラーゲンとの結合能が消失されたデコリン変異体DCNKを製造し、これをpcDNA3.1ベクターに挿入して、pcDNA3.1−DCNK発現ベクターを製造した。次に、前記発現ベクターのそれぞれを制限酵素EcoRIとXbaIで処理し、1kb DNA切片を得た後、pCA14ベクター(Microbix, Ontario, Canada)に挿入させて、pCA14−DCNG、pCA14−DCNQ及びpCA14−DCNKベクターを製作した。
【0095】
製作されたpCA14−DCNG、pCA14−DCNQ及びpCA14−DCNKベクターのそれぞれを制限酵素BglIIで処理し、デコリンをCMVプロモーターにより発現できるCMA−DCN−polA発現カセットを切り出して、これをアデノウイルスE3シャトルベクターであるpSP72ΔE3に挿入して、アデノウイルスE3シャトルベクター(pSP72ΔE3-DCNG, pSP72ΔE3-DCNQ及びpSP72ΔE3-DCNK)を製作した。
【0096】
前記製作されたアデノウイルスE3シャトルベクターを制限酵素PvuIまたはXmnIでそれぞれ処理し線形化した後、SpeIを処理して線形化されたPdl−LacZアデノウイルストータルベクターと共に大腸菌BJ5183で同時形質転換させて、遺伝子相同組み換え(homologous recombination)を誘導し、LacZ遺伝子とデコリンとを同時に発現するdl−LacZ−DCNG、dl−LacZ−DCNQ、dl−LacZ−DCNKアデノウイルスをそれぞれ製作した(図1a)。
【0097】
(2)腫瘍特異的殺傷アデノウイルスの製作
デコリン遺伝子を発現する腫瘍特異的殺傷アデノウイルスを製作した。具体的には、上記で製作したアデノウイルスE3シャトルベクターpSP72ΔE3−DCNG、pSP72ΔE3−DCNQ及びpSP72ΔE3−DCNKのそれぞれを制限酵素PvuIまたはXmnIでそれぞれ処理して線形化させた後、制限酵素SpeIを処理して線形化されたpAd−ΔE1Bアデノウイルストータルベクター(E1B 19kDa遺伝子とE1B 55kDa遺伝子とが共に消失された腫瘍特異的殺傷アデノウイルス)と共に大腸菌BJ5183で同時形質転換させて、アデノウイルスベクターAd−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKをそれぞれ製作した(図1a及び図1b)。相同性組み換えされたアデノウイルスベクターを制限酵素HindIIIで処理し、相同性組み換え有無を確認した。相同性組み換えが確認されたプラスミドは、PacI制限酵素で切断した後、293細胞株に形質転換して、アデノウイルスを生産した(図1a及び図1b)。
【0098】
これらのアデノウイルスを293細胞株で増殖させた後、限界希釈法(limiting dilution)またはプラーク分析(plaque assay)を行って、ウイルスの力価を決定し(Hitt, M. et al., Construction and propagation of human adenovirus vectors. Cel biology: a laboratory handbook. New York: Academic Press Inc, 479-490(1994))、CsCl濃度勾配で濃縮して分離した。
【0099】
4.デコリンの発現様相の調査
本発明で製作したアデノウイルスにより誘導されるデコリンの発現様相を調べるために、デコリン遺伝子が挿入された腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)及び対照群としてAd−ΔE1Bアデノウイルスを、それぞれ3MOIで人体肝癌細胞株であるHep3Bに感染させた。感染48時間後、細胞から培地を回収し、SDS−PAGE(Sodium dodecyl sulfate polyacrylamide gel electrophoresis)電気泳動を行った。電気泳動後、ゲルにあるタンパク質をPVDFメンブレインに電気−伝達させた後、デコリン(D.G. Seidler, University Hospital of Munster、ドイツ)及びβ−アクチン(Sigma, St. Louis, MO, USA)を特異的に認知する抗体を一次抗体で結合させて、HRP(horse radish peroxidase)が結合された二次抗体(sc-2004; Santa Cruz Biotech., Santa Cruz, CA)をさらに結合させた後、ECL検出キット(sc-2004; Santa Cruz Biotech)を利用して、デコリンタンパク質の発現様相を究明した。
【0100】
5.遺伝子伝達効率の比較検証
LacZを発現する複製不能アデノウイルスの遺伝子伝達効率を検証するために、数種の人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)と、人体正常細胞株(CBHEL, IMR90及びWI38)とを24−ウェルプレートに分株した後、dl−LacZ、dl−LacZ−DCNG、dl−LacZ−DCNQ及びdl−LacZ−DCNKウイルスを0.1〜100MOI(multiplicity of infection)でそれぞれ感染させた。ウイルス感染二日後、X−Gal試薬(PBS containing 1mg/ml, 5mM K3Fe(CN)6, 5mM K4Fe(CN)6及び2mM MgCl2)で37℃で6時間反応し、X−Gal染色することにより、デコリン遺伝子の発現によるLacZ遺伝子の伝達効率を確認した。
【0101】
6.アデノウイルスの腫瘍球内組織浸透性の検証
約6〜8週齢のヌードマウスの腹壁に人体腫瘍細胞株(U343、U87MG、C33A、及びA549)をそれぞれ1×107個皮下注射した後、腫瘍の大きさが約150〜200mm3程度になった時、腫瘍を摘出した。摘出した腫瘍を約1〜2mm径の切片にして、0.75%アガロースでコーティングされた培養器で、5%牛胎児血清と抗生剤ペニシリン/ストレプトマイシンとが含有されたDMEMを添加して培養した。培養液は、一週間に約1〜2回入れ替えて、1週間以上腫瘍球を培養した。アデノウイルスを感染させる前に、約2mm径の腫瘍球を0.75%アガロースのコーティングされた48ウェルプレートに移した後、5%牛胎児血清を含むDMEM150μlを添加して、1×106、1×107、及び1×108PFU(plaque-forming unit)のアデノウイルスをそれぞれ添加した。アデノウイルスを添加した後三日頃に培地を除去して、腫瘍球を固定溶液に入れて固定させた後、X−gal染色を施した。立体顕微鏡(Olympus optical Co., LTD, Tokyo, Japan)を利用して、X−gal染色された腫瘍球の表面を観察した後、O.C.T.コンパウンド(Sakura Finetec, Torrance, CA)で凍結薄片した後、10μm厚に切断して、ゼラチンのコーティングされたスライドガラス上に付着し光学顕微鏡で観察して、アデノウイルスの腫瘍球内への浸透程度を確認した。また、腫瘍球内のX−gal染色された部分の比率は、MetaMorphプログラム(Meta imaging series, Version 6.1, Universal imaging corporation TM, Downingtown, PA)を利用して算出した。
【0102】
7.アデノウイルスの生体内癌組織浸透性の検証
約6〜8週齢のヌードマウスの腹壁に数種の人体腫瘍細胞株(U343、U87MG、C33A及びHep3B)を皮下注射した後、腫瘍の大きさが約150〜200mm3程度になった時、アデノウイルスdl−LacZ及びdl−LacZ−DCNGをそれぞれ5×107〜5×108PFUの力価で腫瘍内に5回投与した。A549 xenograft modelの場合は、A549細胞株を皮下注射した後、腫瘍の大きさが約150〜200mm3程度になった時、アデノウイルスdl−LacZ、dl−LacZ−DCNG、dl−LacZ−DCNQ及びdl−LacZ−DCNKをそれぞれ5×108PFUの力価で腫瘍内に5回投与した。ウイルス投与後3日頃に腫瘍を摘出して、4%パラホルムアルデヒド(PFA)溶液に入れ、4℃で4〜8時間固定させた後、30%スクロース溶液で12時間程度脱水させた。脱水された組織をO.C.T.コンパウンドで凍結薄片した後、上述の腫瘍球内組織浸透性の検証実験と同様な方法により、X−gal染色を行った。
【0103】
8.細胞病変効果(cytopathic effect, CPE)の分析
デコリンを発現する腫瘍特異的殺傷アデノウイルスの癌細胞殺傷能を検証するために、数種の人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)と、人体正常細胞株(CBHEL, MRC5, IMR90及びWI38)を48−ウェルプレートに分株して、24時間後、Ad−ΔE1、Ad−ΔE1B、Ad−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKなどのアデノウイルスを0.1〜100MOIでそれぞれ処理した。一実験で処理された数種のウイルスの中でいずれか一つのウイルスが、最も低い力価で細胞をほとんどアポトーシスさせた時点で、全ての培地を除去し、0.5%クリスタルバイオレット( in 50%メタノール)で細胞を固定させて染色した後、残存した細胞を分析した。
【0104】
9.プラーク形成分析
デコリン発現によるプラークの大きさの変化を観察するために、6ウェルプレートに3×105個のHep3B細胞株を分株して、翌日アデノウイルスAd−ΔE1B、Ad−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKを1×10-4PFUの力価で処理した。ウイルス感染後約4時間頃に、37℃の2×DMEM(10%牛胎児血清と抗生剤ペニシリン/ストレプトマイシン含み)と42℃の1.4%UltraPureTMアガロース(Invitrogen, Carsbad, CA)とを1:1で混合したアガロース−DMEM溶液を、感染された細胞株上に添加した後培養した。培養後、約4〜16日頃に、プレートに形成されたプラークの大きさを確認し、アガロースオーバーレイ(overlay)上に10%トリクロロ酢酸(trichloroacetic acid)を1ml入れて30分間放置した後、アガロースオーバーレイを除去し、0.5%クリスタルバイオレット(in 50%メタノール)で固定させて染色し、形成されたプラークの個数を算出した。
【0105】
10.フローサイトメトリー分析による細胞アポトーシス観察
デコリンの発現により誘導される細胞アポトーシスを確認するために、人体腫瘍細胞株のU343、U87MG、C33A、Hep3B、及びA549を25T培養器にそれぞれ分株した後、24時間頃にそれぞれのアデノウイルスを0.5〜50MOIでそれぞれ感染させた。陽性対照群としては、細胞アポトーシスを誘導する物質であるカンプトテシン(camptothecin)−11(CPT)を0.1〜1μm処理して、陰性対照群としては、PBSを処理した。48時間、72時間、そして96時間後に感染された細胞を回収し、70%エタノールで4℃で24時間以上固定させた。固定が終わった後、PI(propidium iodide, 50μg/μl)とRNase(ribonuclease)とが混合された溶液500μlを入れて、4℃で15分間反応させた後、フローサイトメトリー分析(FACS analysis)を行った。
【0106】
また、デコリンの発現により誘導される初期細胞アポトーシスを検証するために、上記のような方法により、数種の人体腫瘍細胞株をそれぞれのアデノウイルスでそれぞれ感染させた後、細胞を回収し、ApoAlert V−FITC(fluorescein isothiocyanate)細胞アポトーシス検出キット(CLONTECH, Polo Alto, CA)を利用し、製造会社が提示した方法にしたがって、Annexin V−FITC/PI二重染色(double staining)して、フローサイトメトリー分析を行った。
【0107】
11.TUNEL分析
数種の人体腫瘍細胞株U343(5x104)、U87MG(5x104)、C33A(5x105)、Hep3B(4x105)、及びA549(5x104)をそれぞれ2-ウェルチャンバースライドに分株して、アデノウイルスを0.2〜20MOIで感染させた後、24時間と48時間頃に培地を除去して、ApopTagキット(intergen, Purchase, NY)を用いて、製造会社が提示した方法にしたがってTUNEL(terminal deoxynucleotidyl transferase(TdT)-mediated dUTP nick end labeling)分析を行った。発色有無を確認するために、ペロキシダーゼと結合されたアビジンを使用して、DAB(3,3' diaminobenzine; Dako, Carpinteria, CA)と反応させた後、細胞が褐色に変わるのが肉眼で確認されたら、0.5%メチルグリーンで10分間染色して、顕微鏡で観察した。顕微鏡上で四ヶ所以上の部位をランダムに選定して、全体細胞の中で染色された細胞の比率を算出した。
【0108】
12.生体内抗腫瘍効果と生存率の検証
ヌードマウスに形成された人体癌腫塊の成長に、デコリンを発現するアデノウイルスが及ぼす影響を検証した。具体的には、生後6〜8週のヌードマウス(Charles River Japan Inc.)の腹壁に、皮下に1×107個の人体腫瘍細胞株(U343、U87MG、C33A、Hep3B、及びA549)をそれぞれ100μlのHBSS(Hanks' balanced salt solution, Gibco BRL)に浮遊して皮下注射した。腫瘍が約50〜80mm3程度に成長した時、1×108〜5×108PFUのアデノウイルスをそれぞれ二日間隔で3回腫瘍に直接注射した後、腫瘍の成長と生存率を観察した。陰性対照群としては、PBSを注射した。腫瘍の容積は、バーニヤキャリパスを利用して腫瘍の長軸と短軸を測定した後、次の数学式で算出した。
腫瘍の容積=(短軸mm)2×長軸mm×0.523
【0109】
13.デコリンを発現する複製可能アデノウイルス投与による腫瘍組織の変化観察
ヌードマウスの腹壁に形成されたU343、U87MG、C33A、Hep3B、またはA549腫瘍が約50〜80mm3程度に成長した時、1×108〜5×108PFUのアデノウイルスをそれぞれ3回腫瘍内注射した後、三日後に腫瘍組織を摘出してパラフィンブロックを製作した。陰性対照群としては、PBSを注射した。製作されたパラフィンブロックを3μm厚のスライドに切断した後、これを、キシレン、100%、95%、80%、及び70%エタノール溶液に順に浸してパラフィンを除去(deparafinization)した後、ヘマトキシリンとエオシン(H & E)で染色した。生体内結締組織の構成成分であるコラーゲンの分布を観察するためには、3μm厚のパラフィンブロックスライドをボウイン(bouin)、ヘマトキシリン及びMasson'sトリクロム(biebrich's scarlet acid fuchsin)でそれぞれ染色して観察した。前記染色試薬は、DAKO ARK(Dako, Carpinteria, CA)から購入した。また、同一部位のパラフィンブロックを利用して、アデノウイルスのヘキソン(hexon)部位を検出できる免疫組織化学分析(immunohistochemistry, IHC)を行った。上記のような方法によりスライドのパラフィンを除去した後、アデノウイルスのヘキソン部位と選択的に結合する抗体(MAB 8052 chemicon, Temecula, CA)を一次抗体として、そして、ヤギanti−ラビットIgG−HRP(Sata Cruz Biotechnology)を二次抗体として反応させて、DABを添加し発色させて観察した。
【0110】
腫瘍内の細胞アポトーシスも、同一な部位のパラフィンブロックスライドを利用して観察した。ApopTagキットを利用して、製造会社が提示した方法にしたがってTUNEL分析を行い、ペロキシダーゼと結合されたアビジンを使用してDABと反応させた後、細胞が褐色に変わるのが肉眼で確認されたら、0.5%メチルグリーンで10分間染色し、顕微鏡で観察した。
【0111】
14.ザイモグラフィ(Zymograpy)を利用したMMP発現様相究明
MMP活性変化を観察するために、数種の人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)を75T培養器に分株して、24時間後にPBS、Ad−ΔE1B及びAd−ΔE1B−DCNGアデノウイルスをそれぞれ1〜100MOIで添加し、48時間培養した。その後、牛胎児血清の含まれていないDMEMに入れ替えて、24時間培養した後、培地を回収して濃縮し、濃縮された培地のタンパク質濃度は、タンパク質分析キット(Bio-Rad, Hercules, CA, USA)を利用して定量した後、同量のタンパク質をゼラチン−基質ゲルに電気泳動した。電気泳動した後、ゲルを37℃で18時間ゼラチン溶解(gelatinolysis)反応が起こるようにした後、クマシーブルーで染色して、MMP−2とMMP−9の発現を観察した。また、各実験は、3回以上行って、QuntityOne2.1プログラム(BIO-Rad Laboratories, Hercules, CA)を利用して、バンド厚を比較検証した。
【0112】
15.Spontaneous癌転移モデルを利用したデコリン発現による癌転移能(metastatic potential)変化の検証
デコリンの高発現による癌転移能(metastatic potential)の変化を調べるために、まず、B16BL6細胞(2×105/マウス)を6〜8週齢の雄性C57BL/6マウス(Charles River Korea, Seoul, Korea)の後ろ右足パッドに皮下投与して、一次腫瘍(primary tumor)を形成した。一次腫瘍の大きさが約100〜200mm程度になった時、PBS、Ad−ΔE1B及びAd−ΔE1B−DCNGをそれぞれ二日間隔で腫瘍内に3回投与した。最後の投与後、5日頃にマウスの右足首以下を切断し一次腫瘍を除去した後、20日頃にマウスを全部犠牲させて、肺に転移された腫塊の重量を測定した。
【0113】
16.乳房癌患者から採取した腫瘍組織を利用した、デコリンを発現するアデノウイルスの遺伝子伝達効率及び組織浸透性の検証
乳房癌患者から腫瘍組織及びその周辺の正常組織を採取した後、約1〜2mm径の切片にして、24−ウェルプレート培養器で、5%牛胎児血清と10μM/Lインシュリンと1μM/Lヒドロコルチゾン(hydrocortisone)を含むIMDM(Isocove's Modified Dulbecco's Medium)を添加して、4時間培養した。乳房癌組織が入っている培養器に1×108PFUのdl−LacZ及びdl−LacZ−DCNGアデノウイルスをそれぞれ添加し、5%CO2、37℃恒温器で5日間培養した。培養後、培地を除去して、乳房癌組織を固定溶液に入れて固定させた後、X−gal染色を行い、立体顕微鏡(Olympus optical Co., LTD, Tokyo, Japan)を利用して、X−gal染色された腫瘍球の表面を観察した。
【0114】
17.一次ケロイド細胞における、デコリンを発現するアデノウイルスの遺伝子伝達効率の検証
ケロイド(Keloid)患者の組織から採取した一次ケロイド細胞株(2継代培養)を24−ウェルプレートに分株して、dl−LacZ及びdl−LacZ−DCNGアデノウイルスを0.1〜50MOIの力価でそれぞれ感染させて、5%CO2、37℃恒温器で培養した。ウイルス感染後、48時間頃にX−gal染色を行って、アデノウイルスの遺伝子伝達効率を観察した。
【0115】
18.ケロイド細胞球を利用したスフェロイド(spheroid)モデルを利用した組織浸透性の検証
ケロイド患者の組織から採取した継代培養2世代の一次ケロイド細胞(1×105個)を15mlファルコン(falcon)チューブに入れて、500gで5分間遠心分離し、スフェロイド(spheroid)を作った後、これを24−ウェルプレートに入れて37℃培養器で5日間培養した。その後、ケロイドスフェロイドを0.75%アガロースコーティングされた48−ウェルプレートに移した後、150μlのDMEM培地(5%の牛胎児血清含有)を添加して、1×107PFUのdl−LacZ及びdl−LacZ−DCNGアデノウイルスをそれぞれ培地に添加した。ウイルス感染後3日頃に培地を除去して、ケロイドスフェロイドを固定溶液に入れて固定させた後、X−gal染色を行い、X−gal染色された腫瘍球を立体顕微鏡を利用して表面を観察した。
【0116】
19.ケロイド患者から採取した組織を利用した組織浸透性の検証
ケロイド患者の組織から採取したケロイド組織を約1〜2mm径の切片にして、0.75%アガロースコーティングされた培養器で、5%牛胎児血清の含有されたDMEMと抗生剤ペニシリン/ストレプトマイシンとを添加して培養した。培養液は、一週間に約1〜2回入れ替えて、1週間以上ケロイド組織を培養した。アデノウイルスを感染させる前に、約2mm程度の直径を有するケロイド組織を、0.75%アガロースでコーティングされた48−ウェルプレートに移した後、150μlのDMEM培地(5%の牛胎児血清)を添加して、1×108PFUのdl−LacZ及びdl−LacZ−DCNGアデノウイルスをそれぞれ培地に添加した。ウイルス感染後3日頃に培地を除去して、ケロイド組織を固定溶液に入れて固定させた後、X−gal染色を施した。X−gal染色されたケロイド組織を、立体顕微鏡を利用して表面を観察した後、アデノウイルスのケロイド組織内浸透程度を確認するために、O.C.T.コンパウンドで凍結薄片した後、10μm厚に切断して、ゼラチンのコーティングされたスライド上に付着し、光学顕微鏡で観察した。
【0117】
[実験結果]
1.デコリンを発現するアデノウイルスの製作及びデコリンの発現様相の究明
デコリン遺伝子の発現による組織内浸透力の変化を可視的に観察するために、標識遺伝子としてLacZ遺伝子を発現する複製不能アデノウイルスdl−LacZ−DCNG、dl−LacZ−DCNQ及びdl−LacZ−DCNKを製作した。また、アデノウイルスの組織内拡散及び浸透力を向上させるために、腫瘍特異的殺傷アデノウイルスAd−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKを製作した(図1a及び1b)。 複製不能アデノウイルスdl−LacZは、E1部位が欠失されて、欠失されたE1部位に挿入されたCMVプロモーターの調節下でLacZ遺伝子を発現する;腫瘍特異的殺傷アデノウイルスAd−ΔE1Bは、正常的なE1A遺伝子は含んでいるが、E1B 19kDa及びE1B 55kDa遺伝子が欠失されている。複製不能アデノウイルスdl−LacZ−DCNG、dl−LacZ−DCNQ及びdl−LacZ−DCNKと腫瘍特異的殺傷アデノウイルスAd−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKは、CMVプロモーターの調節下でE3部位に挿入されたデコリン遺伝子を発現する。デコリン遺伝子の点突然変異DCNK及びDCNQは、タイプIコラーゲンフィブリルとデコリンとの結合に非常に重要な作用をする部位を置換したものである。
【0118】
製作されたアデノウイルスにより発現されるデコリンの発現様相を検証するために、人体肝癌細胞株であるHep3Bに腫瘍特異的殺傷アデノウイルスAd−ΔE1B、Ad−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKを3MOIの力価でそれぞれ感染させて、細胞から培地を回収し、ウェスタンブロッテングを行った。その結果、腫瘍特異的殺傷アデノウイルスの陰性対照群であるAd−ΔE1Bアデノウイルスで感染された細胞では、デコリンの発現を観察することができなかった反面、 dl−LacZ−DCNG、dl−LacZ−DCNQ及びdl−LacZ−DCNKアデノウイルスで感染された細胞の全てでは、デコリンの発現を観察することができた(図2)。
【0119】
2.遺伝子伝達効率の比較検証
デコリンを発現して、LacZを発現する複製不能アデノウイルスの遺伝子伝達効率を検証するために、数種の人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)と、人体正常細胞株(CBHEL, IMR90及びWI38)にdl−LacZ、dl−LacZ−DCNG、dl−LacZ−DCNQ及びdl−LacZ−DCNKウイルスを0.1〜100MOIでそれぞれ感染させて、48時間後にX−gal染色法を行って、LacZの発現様相を比較観察した。その結果、本発明で使用された全ての癌細胞株において、dl−LacZ−DCNG感染によるLacZ発現程度が、対照群であるdl−LacZに比べ増加し、デコリンの発現により遺伝子伝達効率が大いに増加することを確認した。ところが、高力価の複製不能ウイルスを処理した場合は、細胞が死滅されることを観察することができて、特に、C33A細胞株を10MOI以上のdl−LacZ−DCNGウイルスで感染させた場合は、全ての細胞が完全に死滅され、デコリンが高発現する時に細胞を死滅することができることが分かった(図3a及び3b)。しかしながら、コラーゲンフィブリルとデコリンとの結合に非常に重要な作用をする部位を置換したDCNK及びDCNQ点突然変異がデコリン遺伝子を発現する場合は、コラーゲンとの結合力が野生型に比べ弱化されたデコリン変異体DCNQを発現するdl−LacZ−DCNQの遺伝子伝達効率が、対照群ウイルスdl−LacZに比べ若干増加した反面、コラーゲンとの結合能が完全に消失されたデコリン変異体DCNKを発現するdl−LacZ−DCNKの遺伝子伝達効率は、dl−LacZの遺伝子伝達効率とほぼ等しいことを観察した。こうような結果から、野生型デコリンの発現により、遺伝子伝達効率が増加することが分かった。これに比べ、正常細胞では、デコリンの発現によるLacZ遺伝子の伝達効率が大いに増加されなかったが、このような結果は、デコリンの癌細胞特異性を意味する。
【0120】
3.腫瘍球を利用したアデノウイルスの生体外癌組織浸透性の検証
アデノウイルスの腫瘍球内への遺伝子伝達効率と組織拡散及び浸透性を調べるために、数種の人体腫瘍細胞株をヌードマウスに皮下注射した後、腫瘍の大きさが約150〜200mm3になった時、腫瘍を摘出した。摘出された腫瘍組織を1〜2mm程度の直径になるように細かく切って培養液に入れた後、1×106、1×107及び1×108PFUのアデノウイルスをそれぞれ培地に添加して、48時間後にX−gal染色を施した。腫瘍球を光学顕微鏡で観察した結果、1×106PFUのdl−LacZ、dl−LacZ−DCNK及びdl−LacZ−DCNQアデノウイルスを投与した場合に比べ、同力価のdl−LacZ−DCNGアデノウイルスを投与した腫瘍球の表面にX−galが濃く染色されたことを観察することができ、1×107PFU以上のアデノウイルスを培地に添加した場合は、全ての腫瘍球の表面全体がX−galで濃く染色されていることを観察した(図4)。また、アデノウイルスの腫瘍球内への浸透程度をより綿密に観察するために、X−gal染色された腫瘍球を凍結薄片して観察した。その結果、1×106、1×107及び1×108PFUのdl−LacZ、dl−LacZ−DCNK及びdl−LacZ−DCNQを投与した癌組織の場合、LacZの発現程度が微弱であり、ウイルスが腫瘍球表面に留まっている反面、同力価のdl−LacZ−DCNGを投与した癌組織におけるLacZ発現度がdl−LacZ、dl−LacZ−DCNK及びdl−LacZ−DCNQの場合より著しく高くて、アデノウイルスが腫瘍球表面に局限されず、腫瘍球の内側部位へウイルスが広がっていくことを確認することができた(図4)。また、本実施例でも、上述の遺伝子伝達効率の比較検証の実施例と同様に、コラーゲンとの結合力が野生型に比べ弱化されたデコリン変異体DCNQを発現するdl−LacZ−DCNQ及びコラーゲンとの結合能が完全に消失されたデコリン変異体DCNKを発現するdl−LacZ−DCNKの組織浸透力が、コラーゲンとの結合力が完全な野生型DCNGを発現するdl−LacZ−DCNGに比べ、大いに弱化されて、弱化された程度は、コラーゲンとの結合力と反比例することが分かった。このような実験結果を通じて、野生型デコリンを発現するdl−LacZ−DCNGアデノウイルスの遺伝子伝達効率及び組織浸透力が、腫瘍球内において、対照群dl−LacZ、dl−LacZ−DCNK及びdl−LacZ−DCNQに比べ、大いに増加されたことが分かった。
【0121】
4.dl−LacZ−DCNGアデノウイルスの生体内癌組織浸透性の検証
生体外腫瘍球を利用した実験結果を通じて確認したdl−LacZ−DCNGアデノウイルスの増加された組織浸透力を、異種移植(xenograft)生体モデルを利用して検証してみた。ヌードマウスの腹壁に形成されたU343、U87MG、C33A及びHep3B腫瘍に、dl−LacZ及びdl−LacZ−DCNGアデノウイルスのそれぞれを1×108〜5×108PFUの力価で腫瘍内に直接注射した後、三日頃に腫瘍を摘出して凍結薄片した後、X−gal染色を施した。その結果、dl−LacZを投与した腫瘍組織の場合は、LacZの発現程度が微弱であり、染色部位がウイルスの投与された組織付近に限定されている反面、dl−LacZ−DCNGを投与した腫瘍組織のLacZ発現度は、dl−LacZを投与した場合に比べ著しく高く、X−galで染色された部位がウイルスの投与された部位に局限されず、広い部位に広がっていることが確認できた(図5)。特に、U87MG及びC33A異種移植の場合は、dl−LacZ−DCNGを投与した時、腫瘍組織全体でLacZが発現されて、濃いブルーに染色されたことを確認することができた。また、dl−LacZ、dl−LacZ−DCNG、dl−LacZ−DCNK及びdl−LacZ−DCNQアデノウイルスを投与したA549腫瘍の場合は、dl−LacZ−DCNGを投与した腫瘍組織の場合のLacZ発現程度及び発現された腫瘍部位が、dl−LacZ、dl−LacZ−DCNK及びdl−LacZ−DCNQを投与した場合に比べ、大いに増大したことを確認することができた。このような実験結果を通じて、生体内でも、腫瘍球を利用した実験と同様に、dl−LacZ−DCNGアデノウイルスの組織内拡散及び浸透性が、デコリンを発現しない対照群アデノウイルスのdl−LacZに比べ、大いに増加したことが分かった。
【0122】
また、GFP(green fluorescence protein)を発現するアデノウイルスであるdl−GFPとdl−GFP−DCNGアデノウイルスをそれぞれヌードマウスの腹壁に形成されたC33A腫瘍に5×108PFUの力価で腫瘍内に直接注射した後、三日頃に腫瘍を摘出して凍結薄片した後、蛍光顕微鏡で観察した結果、dl−GFPを腫瘍内投与した腫瘍組織の場合は、GFPの発現がウイルス投与時に形成されるneedle trackの周辺に沿って制限的に発現された反面、dl−GFP−DCNアデノウイルスを腫瘍内投与した腫瘍組織の場合は、ウイルスが投与された部位に局限されず、広い部位に拡散されて強く発現されることを確認することができた(図19a)。
【0123】
5.デコリンを発現する腫瘍特異的殺傷アデノウイルスの細胞殺傷能の検証
先行の実験から既に確認されたコラーゲンとの結合能を有したデコリンの発現によるアデノウイルスの組織内拡散の増加により、腫瘍特異的殺傷アデノウイルスの細胞殺傷能が増加されるかどうかを調べるために、CPE分析を行った。陰性対照群として複製不能アデノウイルスのdl−LacZ、実験群として腫瘍特異的殺傷アデノウイルスであるAd−ΔE1B、Ad−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKアデノウイルスを、それぞれ0.1〜100MOIで人体腫瘍細胞株(U343、U87MG、C33A、Hep3B、及びA549)と人体正常細胞株(CBHEL, MRC5, IMR90, WI38)をそれぞれ感染させた後、細胞の殺傷程度を比較観察した。図6から分かるように、陰性対照群のdl−LacZで感染された種々の癌細胞では、ウイルスの増殖による細胞殺傷効果が観察されなかったが、Ad−ΔE1B−DCNGで感染された場合は、デコリンを発現しない対照群ウイルスのAd−ΔE1Bに比べ、約10〜20倍程度高い癌細胞殺傷効果が観察された。即ち、Hep3BとU87MG細胞株では、Ad−ΔE1B−DCNGアデノウイルスがAd−ΔE1Bアデノウイルスに比べ約20倍程度高い癌細胞殺傷効果を誘導し、U343、C33A、及びA549細胞株では、約10倍程度高い癌細胞殺傷効果を誘導した。このような実験結果から、デコリンの発現がアデノウイルスの複製能に否定的な影響を及ぼさないばかりか、却ってデコリンの発現により癌細胞特異的殺傷アデノウイルスの細胞殺傷能が増加されることが分かった。また、先行の実施例等と同様に、コラーゲンとの結合能が弱化または消失されたAd−ΔE1B−DCNQ及びAd−ΔE1B−DCNKの癌細胞殺傷能がAd−ΔE1B−DCNGに比べ著しく低くて、その低い程度は、コラーゲンとの結合能と反比例することを確認することができた。しかしながら、正常細胞の場合は、Ad−ΔE1B−DCNGアデノウイルスの細胞殺傷効果が対照群ウイルスのAd−ΔE1Bに比べ増加しなかった。したがって、このような結果から、DCNGの発現による細胞殺傷能増大効果が癌細胞では誘導されたが、正常細胞では誘導されず、癌細胞特異的であることを確認することができた。
【0124】
6.デコリン発現によるプラーク(plaque)形成の比較
デコリンの発現が細胞殺傷と周辺細胞へのウイルス拡散に及ぼす影響を可視化するために、アデノウイルスの増殖と周辺細胞への拡散によるプラークの形成をアガロースの含有された固体培地で比較検証した。Ad−ΔE1B、Ad−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKアデノウイルスをそれぞれHep3B細胞株に感染させて、プラーク形成の進行速度を観察した。図7a及び7bから分かるように、対照群ウイルスのAd−ΔE1B、Ad−ΔE1B−DCNK、またはAd−ΔE1B−DCNQに感染された場合に比べ、Ad−ΔE1B−DCNGで感染されたHep3B細胞株でプラークの形成が速く進行されて、形成されたプラークの大きさも増加したことを観察することができた。即ち、Ad−ΔE1Bアデノウイルスを投与した場合は、ウイルス感染後13〜16日が経ってからプラークの形成を肉眼で確認することができたのに比べ、Ad−ΔE1B−DCNGを感染させた場合は、ウイルス感染後4日頃から、プラークが形成されたことを確認することができた。また、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKのプラーク形成速度がAd−ΔE1B−DCNGに比べ大いに減少したが、その減少された程度は、コラーゲンとの結合能と反比例することを観察した。このような結果は、デコリンとの結合能を有したデコリンを発現するアデノウイルスの増加された細胞殺傷能と、隣接した細胞へのウイルス拡散によりプラークの形成が速く進行されて、また形成されたプラークの大きさが増加したことを意味する。
【0125】
7.デコリンを発現するアデノウイルスによる細胞アポトーシスの誘導
デコリンの発現様相及びこれによる遺伝子伝達効率の変化を調べるために進行された実験(実験結果2)で、高力価の複製不能アデノウイルスのdl−LacZ−DCNGで細胞を感染させた場合、細胞が死滅されて細胞培養プレートの底から離れていくことが観察されたため、デコリンにより細胞殺傷が誘導されるかどうかをより綿密に調べた。これのために、まず、細胞アポトーシスが誘導されるとDNAが無作為的に切片化されて現れるsubG1細胞群の増加率を、PI染色後フローサイトメトリー分析を行って測定した。種々の人体腫瘍細胞株を腫瘍特異的殺傷アデノウイルスAd−ΔE1B、Ad−ΔE1B−DCNG、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKでそれぞれ感染させて、48〜96時間後に細胞を回収してsubG1細胞群の増加を観察した。細胞アポトーシスを誘導する陽性対照群としては、細胞アポトーシス誘導化学物質であるCPTを使用した。対照群のAd−ΔE1Bにより感染されたA549細胞の場合、subG1細胞群が約3.11%であるのに対し、Ad−ΔE1B−DCNGにより感染された場合は、subG1細胞群が約26.52%に大きく増加した。このようなAd−ΔE1B−DCNGアデノウイルス感染によるsubG1細胞群の増加は、他の種類の細胞株(U343、U87MG、C33A、及びHep3B)でも観察された(図8a、表1)。また、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKウイルス感染によるsubG1細胞群の増加は、Ad−ΔE1B−DCNGに比べ減少したが、その減少程度は、コラーゲンとの結合能が低いほどさらに大きいことを、先行の実施例等の結果と同様に、確認することができた。
【0126】
そして、複製不能アデノウイルスであるdl−LacZまたはdl−LacZ−DCNGでそれぞれ感染させて48〜96時間後に細胞を回収してsubG1細胞群の増加を観察した。腫瘍特異的殺傷アデノウイルスによるsubG1細胞群の増加を観察した上記結果と同様に、対照群のdl−LacZアデノウイルスを感染させた場合より、dl−LacZ−DCNGアデノウイルスで感染させた場合にsubG1細胞群が大きく増加することを観察することができた(図8b、表2)。
【0127】
【表1】

【0128】
【表2】

【0129】
また、細胞アポトーシスに及ぼすデコリンの影響をさらに綿密に観察するために、腫瘍特異的殺傷アデノウイルスによる細胞アポトーシスの進行程度をAnnexin V−FITCとPIで二重染色して確認した。Annexin V−FITCは、細胞アポトーシス初期に細胞膜外に流出されてきたフォスファチジルセリン(phosphatidylserine: PS)を検出することができる反面、PIは、細胞死後期に細胞膜の破壊によりPIが細胞内に入って、核内にあるクロマチン(chromatin)と結合することにより、細胞壊死(necrosis)の特徴を確認することができる。したがって、Annexin V−FITC-/PI-は、健康な細胞を意味して、 Annexin V−FITC+/PI-は、初期細胞アポトーシスが起こった細胞、そしてPI+細胞は、細胞壊死が起こった細胞を意味する。細胞アポトーシスを誘導する陽性対照群として利用されたCPTを処理したU343細胞株の場合、約32.15%(Annexin V−FITC+/PI-)の細胞が細胞アポトーシスに進行されて、Ad−ΔE1B及びAd−ΔE1B−DCNGにより感染された場合は、それぞれ24.15%及び44.85%の細胞で細胞アポトーシスが誘導されて、Ad−ΔE1B−DCNGアデノウイルスによる細胞アポトーシス頻度がAd−ΔE1Bアデノウイルスに比べ大きく増加したことを観察した(図9a)。その他にも、U87MG、C33A、Hep3B、及びA549細胞株でも、対照群のAd−ΔE1Bアデノウイルスに比べ、デコリンを発現するアデノウイルスにより遥かに高い頻度で細胞アポトーシスが誘導されることを確認することができた。また、細胞死を総括的に測定できる細胞アポトーシス及び細胞壊死頻度を全部合わせた場合(Annexin V−FITC+/PI-+PI+)でも、Ad−ΔE1B−DCNGアデノウイルスにより誘導された細胞死頻度がAd−ΔE1Bアデノウイルスに比べ著しく増加した。以上のような結果から、腫瘍特異的殺傷アデノウイルスの対照群Ad−ΔE1Bアデノウイルスにより感染された場合より、Ad−ΔE1B−DCNGアデノウイルスに感染された場合に細胞アポトーシスが著しく高い頻度で進行され、結果的に細胞死が増加することを確認することができた。そして、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKウイルス感染により誘導される細胞アポトーシス頻度が、Ad−ΔE1B−DCNGにより誘導される細胞アポトーシス頻度に比べ減少したが、その減少程度は、コラーゲンとの結合能が低いほどさらに大きいことを確認することができた。
【0130】
また、デコリンを発現する複製不能アデノウイルスによる細胞アポトーシス誘導を調べるために、U343、U87MG、C33A、Hep3B、A549細胞に、PBS、CPT、dl−LacZまたはdl−LacZ−DCNGを処理した後、細胞アポトーシス進行程度をAnnexin V−FITCとPIで二重染色して確認した。図9bから分かるように、CPTを処理したU343細胞株の場合、約19.41%(Annexin V−FITC+/PI-)の細胞が初期細胞アポトーシスに進行されて、dl−LacZにより感染された場合は、3.93%の細胞だけが細胞アポトーシスに進行され、PBSのみを処理した陰性対照群と同様に非常に低い比率の細胞のみが細胞アポトーシスに進行された。その反面、dl−LacZ−DCNGにより感染されたU343細胞株の場合は、約13.18%の細胞が細胞アポトーシスに進行され、dl−LacZ−DCNG複製不能アデノウイルスによる細胞アポトーシス頻度が、対照群複製不能アデノウイルスのdl−LacZに比べ、大きく増加したことを観察した。この他にも、U87MG、C33A、Hep3B及びA549細胞株においても、対照群のdl−LacZアデノウイルスに比べ、デコリンを発現する複製不能アデノウイルスのdl−LacZ−DCNGにより遥かに高い頻度で細胞アポトーシスが誘導されることを確認することができた。このような結果がら、コラーゲンとの結合能を有したデコリンを発現する腫瘍特異的殺傷アデノウイルスだけではなく、複製不能アデノウイルスにより感染された場合も、細胞アポトーシス誘導が著しく増加され得ることを確認することができた。
【0131】
初期細胞内アポトーシスの特徴であるDNA切片化を確認できるまた他の分析方法のTUNEL分析も行った。図10aと表3から分かるように、陽性対照群として使用されたCPTを処理した全ての細胞株の場合は、ほとんどの細胞が濃い褐色に染色され、細胞アポトーシスが活発に進行されていることを確認した。U343細胞株をAd−ΔE1Bアデノウイルスで感染させた場合、約32.5±12.5%の細胞が褐色に淡く染色された反面、Ad−ΔE1B−DCNGアデノウイルスで感染させた場合は、約69.7±5.40%の細胞が濃い褐色に染色され、Ad−ΔE1B−DCNGアデノウイルスが遥かに高い頻度で細胞アポトーシスを誘導することが分かった(表3)。このようなデコリン発現による細胞アポトーシス頻度の増加現象は、他の細胞株(U87MG, C33A, Hep3B及びA549)でもほぼ等しい傾向で観察されて、また、Ad−ΔE1B−DCNQ及びAd−ΔE1B−DCNKウイルス感染により誘導されるDNA切片化頻度が、Ad−ΔE1B−DCNGにより誘導されるDNA切片化頻度に比べ大いに減少し、その減少程度がコラーゲンとの結合能に反比例することを観察した。本実施例で確認されたコラーゲンとの結合能に比例したデコリンの作用は、先行の実施例等において、全て同様な結果として検証されたため、以後進行された実施例では、コラーゲンとの結合能の最も高い野生型デコリンを発現するアデノウイルスのみを利用して進行した。
【0132】
【表3】

【0133】
また、複製不能アデノウイルスdl−LacZ及びdl−LacZ−DCNGでそれぞれ感染させて、48〜96時間後に細胞を回収し、TUNEL分析を行った。腫瘍特異的殺傷アデノウイルスによる細胞アポトーシス進行程度を観察した上記の結果と同様に、対照群のdl−LacZアデノウイルスを感染させた場合より、dl−LacZ−DCNGアデノウイルスで感染させた場合、遥かに高い頻度で細胞アポトーシスを誘導することを観察することができた(図10b及び表3)。
【0134】
8.デコリンを発現する腫瘍特異的殺傷アデノウイルスの生体内抗腫瘍効果の検証
野性型デコリンを発現するAd−ΔE1B−DCNGアデノウイルスの生体内抗腫瘍効果を検証するために、種々の人体腫瘍細胞株をヌードマウスに接種した後、形成された腫瘍に1×108〜5×108PFUのAd−ΔE1B及びAd−ΔE1B−DCNGアデノウイルスのそれぞれを、陰性対照群のPBSと共に二日間隔で3回腫瘍内投与した後、腫瘍の成長を観察した。人体脳腫瘍U87MGの場合、PBSを投与された時は、ウイルス投与後19日頃に腫瘍の大きさが約1089.22mm3で、腫瘍が急激に成長した反面、腫瘍特異的殺傷アデノウイルスのAd−ΔE1BまたはAd−ΔE1B−DCNGを投与された時は、それぞれ115.70mm3及び11.87mm3で、腫瘍の成長が顕著に遅延されることを観察することができた(図11a)。即ち、Ad−ΔE1B及びAd−ΔE1B−DCNGアデノウイルスを投与された腫瘍の方が、PBSを投与された場合に比べ、明らかな抗腫瘍効果を示した。
【0135】
また、ウイルスの投与後25日頃には、PBSを投与した9匹のマウスが全部死んでしまい、それ以上腫瘍の成長を測定することができなかった反面(図11b)、Ad−ΔE1B及びAd−ΔE1B−DCNGアデノウイルスを投与した後33日頃には、腫瘍の大きさがそれぞれ399.68mm3及び23.38mm3であって、デコリンを発現するアデノウイルスによる抗腫瘍効果が、対照群のAd−ΔE1Bアデノウイルスに比べ、さらに優れており且つさらに長く持続されることを確認した。特に、Ad−ΔE1B−DCNGアデノウイルスを投与した場合、ウイルス投与後19日頃に7匹のマウスの中で4匹から、そして41日頃には6匹から、腫瘍が完全になくなって、60日が経っても腫瘍の再成長は観察されなかった(図11b)。このようなAd−ΔE1B−DCNGの卓越な抗腫瘍効果が他の人体腫瘍モデルでも適用できるかを調べるために、U343、C33A、Hep3B、及びA549異種移植(xenograft)で、前記の方法と同一な方法により抗腫瘍効果を検証した。図11aから分かるように、陰性対照群のPBSを投与した群に比べ、腫瘍特異的殺傷アデノウイルスのAd−ΔE1B及びAd−ΔE1B−DCNGを投与した群で明らかな抗腫瘍効果が観察されて、デコリンを発現するAd−ΔE1B−DCNGアデノウイルスを投与された場合、腫瘍の大きさが、Ad−ΔE1Bを投与された場合に比べ著しく減少し、デコリン発現による明らかな抗腫瘍効果を観察することができた。
【0136】
また、デコリンを発現するアデノウイルスを腫瘍に投与時、マウスの生存率を比較した。C33A異種移植モデルにおいてAd−ΔE1B−DCNGを投与時(C33Aに対しては1×108 PFU投与、U343, U87MG, Hep3B及びA549に対しては5×108 PFU投与)、80日経過後、100%のマウスが生存した反面、Ad−ΔE1Bを投与した場合、同じ期間にただ50%のマウスのみが生存した(マウスの死;腫瘍大きさ>C33Aに対して2000mm3)ことが分かった(図11b)。Ad−ΔE1B−DCNGの生存率増加は、他のU343、U87MG、Hep3B及びA549異種移植モデルでも同様な結果を示した。このような結果を通じて、Ad−ΔE1B−DCNGウイルスが、生体モデルにおいて、優れた抗腫瘍効果及び生存率増大効果を示すことが分かった。
【0137】
9.デコリンを発現する複製可能アデノウイルス投与による腫瘍の変化観察
数種の癌細胞株(U343, U87MG, C33A, Hep3B及びA549)をヌードマウスの腹壁皮下に接種した後、形成された腫瘍にAd−ΔE1B及びAd−ΔE1B−DCNGアデノウイルスを陰性対照群のPBSと共に3回腫瘍内注射した後、三日後に腫瘍組織を摘出してヘマトキシリンとエオシンでH&E染色し、組織の状態を検証した。図12a〜12eから分かるように、Ad−ΔE1Bアデノウイルスを投与した腫瘍の場合は、腫塊の中心部位から自然に発生する細胞壊死と、ウイルスが投与された腫塊の縁の局所的部位でのみ細胞壊死が進行された反面、Ad−ΔE1B−DCNGアデノウイルスを投与した腫瘍の場合は、腫塊の中心部位だけではなく、ウイルスが投与された腫瘍の縁まで、さらに広い部位で細胞壊死が非常に活発に進行されることを確認した。また、腫瘍組織内における癌細胞特異的殺傷アデノウイルスの複製様相を検証するために、アデノウイルスのヘキソン部位と選択的に結合する抗体を利用して、IHCを行った。図12a〜12eから分かるように、Ad−ΔE1Bを投与した場合に比べ、Ad−ΔE1B−DCNGを投与した腫瘍の場合に腫瘍のさらに広い部位からアデノウイルスを検出することができて、細胞アポトーシスを確認できるTUNEL分析を行った場合も、アデノウイルスが検出された部位と同じ部位で細胞アポトーシスが活発に進行されることを確認することができた。以上の結果をまとめてみると、Ad−ΔE1B−DCNGアデノウイルスが投与された腫塊部位でウイルスの複製が活発に起こって且つさらに広い部位に広がっていくことができ、その結果、細胞アポトーシス及び細胞壊死が非常に活発に且つ広範囲で誘導されることが分かった。
【0138】
10.マッソン・トリクローム(Masson's trichrome)染色を利用した腫瘍内コラーゲン分布の検証
人体脳癌細胞株U343をヌードマウスに接種した後、形成された腫瘍にAd−ΔE1B及びAd−ΔE1B−DCNGアデノウイルスを3回腫瘍内注射した後、三日後に腫瘍組織を摘出しマッソン・トリクロームで染色して、青色に染色される細胞外基質の主成分のコラーゲンの分布を観察した。その結果、Ad−ΔE1Bアデノウイルスを投与したU343腫瘍の場合は、腫瘍内部において、青色染色が腫瘍細胞の間で多く観察された反面、Ad−ΔE1B−DCNGアデノウイルスを投与した場合は、腫瘍内部では青色がほとんど観察されず、腫瘍の周囲を囲んでいる正常組織でのみコラーゲンカプセルのような形態を観察することができた(図13のAパネル)。このような結果から、癌細胞特異的殺傷アデノウイルスのAd−ΔE1B−DCNGによるデコリンの発現が癌細胞特異的に誘導されて、癌組織内部のコラーゲンの発現のみを阻害し、周辺の正常組織のコラーゲンの発現様相には、影響を及ぼさないことが分かった。
【0139】
そして、人体脳癌細胞株のU87MGをヌードマウスに接種した後、形成されたAd−ΔE1B−DCNGアデノウイルスを腫瘍内注射した後、マッソン・トリクロームで染色した場合は、対照群ウイルスのAd−ΔE1Bアデノウイルスを投与した場合と同様に、コラーゲンの発現が非常に低くて、青色に染色された部位がほとんど観察されなかった(図13のBパネル)。このような結果から、腫瘍組織内のコラーゲン発現が低い場合は、デコリンの高発現により、コラーゲンの発現様相が変化されないことが分かった。
【0140】
11.ザイモグラフィ(Zymograpy)を利用したMMP発現様相の究明
デコリンの発現による細胞外基質の減少が、MMP発現により誘導されるものであるかを確認するために、MMP−2とMMP−9の活性をザイモグラフィにより検証した(図14)。数種の細胞株(U343, U87MG, C33A, Hep3B及びA549)を様々な力価のアデノウイルス(Ad-ΔE1B及びAd-ΔE1B-DCNG)で感染させて、培地を回収し、MMP−2とMMP−9の発現を観察した結果、PBS及びAd−ΔE1B対照群に比べ、Ad−ΔE1B−DCNGアデノウイルスにより感染された場合に、MMP−2とMMP−9の活性が大きく増加した。このようなMMP−2とMMP−9の活性増加現象は、実験に使用された5種類の人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)でほぼ等しく観察された。前記結果から、デコリンの発現により、MMP−2とMMP−9の活性が増加されたことが分かった。
【0141】
12.Spontaneous癌転移モデルを利用した、デコリン発現による癌転移能(metastatic potential)の変化検証
デコリンは、細胞外基質の構成成分と反応し、MMP−1とMMP−2などの発現を促進して細胞外基質を分解すると知られており、MMP−2の場合は、本研究の実験結果11でも確認された。したがって、デコリンの高発現による癌転移能(metastatic potential)の変化を、spontaneous癌転移モデルを利用して調べてみた。まず、B16BL6細胞をC57BL/6マウスの右後ろ足の裏に皮下投与した後、腫瘍の大きさが約100〜200mm程度に成長した時、PBS、Ad−ΔE1B、及びAd−ΔE1B−DCNGを二日間隔で3回腫瘍内投与した。最後の投与後5日頃にマウスの右足首以下を切断して、一次腫瘍を除去した後、20日頃にマウスを全部犠牲させて、肺に転移された腫塊の重量を測定した。図15から分かるように、Ad−ΔE1B及びAd−ΔE1B−DCNGを投与されたマウスの肺に転移された腫塊の平均重量は、それぞれ200±140mg及び130±160mgであって、PBSを投与された対照群マウスの肺に転移された腫塊の平均重量の250±140mgに比べ、著しく低いことが確認できた。さらに、PBSを投与された6匹のマウスの全部から肺転移が酷く起こったのに対し、Ad−ΔE1BまたはAd−ΔE1B−DCNGを投与された6匹のマウスの場合は、それぞれ1匹と2匹のマウスで癌転移が完全に抑制されたことを観察した。このような結果から、デコリンの発現により、対照群ウイルスに比べ、癌転移がさらに活発に抑制されることが確認できた。
【0142】
13.乳房癌患者から採取した腫瘍組織を利用した、デコリンを発現するアデノウイルスの遺伝子伝達効率及び組織浸透性の検証
先行の各種実験結果から確認された、デコリンを発現するアデノウイルスの向上された遺伝子伝達効率及び組織浸透性が、一次人体腫瘍組織でも確認できるかどうかを調べるために、実際の乳房癌患者から採取した癌組織及びその周辺の正常組織を約1〜2mm径の切片にして、0.75%アガロースでコーティングされた培養器で培養した後、1×108PFUのdl−LacZ及びdl−LacZ−DCNGアデノウイルスをそれぞれ添加した。ウイルス添加後、約5日後にX−gal染色を行った結果、対照群ウイルスのdl−LacZを感染させた場合に比べ、dl−LacZ−DCNGアデノウイルスを感染させた場合の癌組織表面にX−galが濃く染色されたことを観察することができた(図16)。これとは対照的に、正常組織の場合は、dl−LacZまたはdl−LacZ−DCNGアデノウイルスを添加した全ての一次正常組織において、X−gal染色がほとんど起こらなかった。
【0143】
また、GFPを発現するアデノウイルスのdl−GFPとdl−GFP−DCNGアデノウイルスをそれぞれ乳房癌患者から摘出した乳房癌組織球(<1cm3)を、12−ウェルプレートに腫瘍組織球を入れて、インシュリン(10μmol)とヒドロコルチゾン(1μmol)とを含有した5%IMDM培地を添加した後、1×107PFUのアデノウイルスをそれぞれ培地に添加した。ウイルス添加後、5日頃に蛍光顕微鏡で腫瘍球を観察した結果、対照群ウイルスのdl−GFPを培地内に投与した場合は、腫瘍球の表面でのみ制限的にGFPの発現が観察された反面、デコリンを発現するアデノウイルスのdl−GFP−DCNが投与された培地で培養された腫瘍球の場合は、腫瘍球の大部分の組織からGFPが強く発現されることを観察することができた(図19b)。
【0144】
14.一次ケロイド細胞における、デコリンを発現するアデノウイルスの遺伝子伝達効率の検証
ケロイドは、細胞外基質の過度なる形成により現れる疾患であって、デコリンの細胞外基質分解能を利用してケロイド疾患を治療できるかどうかを調べるために、まず、ケロイド患者の組織から採取した一次ケロイド細胞株に、dl−LacZ及びdl−LacZ−DCNGアデノウイルスを0.1〜50MOIの力価でそれぞれ感染させて、二日後にX−gal染色を施して観察した結果、dl−LacZ−DCNG感染によるLacZ発現程度が、対照群のdl−LacZに比べ増加し、デコリンの発現により、ケロイド細胞への遺伝子伝達効率が大きく増加することを確認した(図17)。
【0145】
15.ケロイドスフェロイドモデルを利用した遺伝子伝達効率の検証
デコリン発現によるアデノウイルスのケロイド組織における遺伝子伝達の増加を調べるために、ケロイド患者の組織から採取した継代培養2世代の一次ケロイド細胞を利用して製作されたケロイドスフェロイドを、1×107PFUのdl−LacZ及びdl−LacZ−DCNGアデノウイルスでそれぞれ感染させた後、X−gal染色を施して組織表面を光学顕微鏡で観察した。その結果、対照群ウイルスのdl−LacZを投与した場合に比べ、野生型デコリンを発現するdl−LacZ−DCNGアデノウイルスを投与したケロイドスフェロイドの表面にX−galが非常に濃く染色されることを観察した(図18のパネルA)。
【0146】
16.ケロイド患者から採取した組織を利用した組織浸透性の検証
ケロイド細胞から構成されたケロイドスフェロイドを利用した先行の実施例を通じて確認したdl−LacZ−DCNGアデノウイルスの増加された遺伝子伝達効率が、実際のケロイド患者から採取したケロイド組織でも現れるのかを調べるために、ケロイド患者の組織から採取したケロイド組織を1×108PFUのdl−LacZ及びdl−LacZ−DCNGアデノウイルスでそれぞれ感染させて、X−gal染色を施した後、まず、ケロイド組織の表面を観察した。その結果、dl−LacZを投与したケロイド組織の場合は、LacZの発現程度が非常に微弱である反面、dl−LacZ−DCNGを投与したケロイド組織の表面は、X−galが濃く染色されたことを観察した(図18のパネルB)。また、アデノウイルスのケロイド組織内浸透程度を確認するために、O.C.T.コンパウンドで凍結薄片した後、光学顕微鏡で観察した結果、dl−LacZを投与したケロイド組織の場合は、表面と同様に、ケロイド組織の内部もほとんど染色されなかった反面、dl−LacZ−DCNGを投与した腫瘍組織のLacZ発現度は、dl−LacZを投与した場合に比べ著しく高く、X−galで染色された部位が、ウイルスの投与された部位に局限されず、広い部位に広がっていることを確認することができた(図18のパネルB)。このような結果から、細胞外基質の分解を誘導できるデコリンを発現するアデノウイルスを利用する場合、ケロイド組織における遺伝子伝達効率が著しく増大されるだけではなく、細胞外基質の分解により、ケロイド疾患治療剤として利用することができることを確認した。
【0147】
以上、本発明の望ましい具現例を詳細に記述したが、当業界の通常の知識を有する者にとって、このような具体的な記述はただ望ましい具現例に過ぎなく、これに本発明の範囲が限定されないことは明らかである。従って、本発明の実質的な範囲は、添付の請求項とその等価物により定義されると言える。
【図面の簡単な説明】
【0148】
【図1a】本発明のデコリン発現複製不能アデノウイルス(dl-LacZ, dl-LacZ-DCNG, dl-LacZ-DCNQ及びdl-LacZ-DCNK)と腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)のベクターマップである。ITRは、inverted terminal repeat配列、Ψは、パッケージシグナル配列、LacZは、lac Z配列、IXは蛋白質IX遺伝子、CMVは、CMVプロモーター、そして、Pol Aは、ポリA配列を示す。DCNGは、野生型デコリン遺伝子、DCNQは、野生型デコリンコア蛋白質の6番目ロイシンリッチリピート部位内にあるE180アミノ酸をE180Qで点突然変異させた変異遺伝子、そしてDCNKは、野生型デコリンコア蛋白質のE180アミノ酸をE180Kで点突然変異させた変異遺伝子を示す。
【図1b】本発明の具体的な一実施例に該当する腫瘍特異的殺傷アデノウイルスAd-ΔE1B-DCNGのより具体的なベクターマップである。
【図2】本発明のデコリン発現腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)を感染させた腫瘍細胞株Hep3Bがデコリンを発現することを確認したウェスタンブロット分析結果である。
【図3a】本発明のデコリン発現複製不能アデノウイルス(dl-lacZ-DCNG, dl-lacZ-DCNQ及びdl-lacZ-DCNK)を感染させた人体腫瘍細胞株(図3a)及び人体正常細胞株(図3b)におけるデコリン遺伝子伝達効率を検証したX-gal染色写真である。
【図3b】本発明のデコリン発現複製不能アデノウイルス(dl-lacZ-DCNG, dl-lacZ-DCNQ及びdl-lacZ-DCNK)を感染させた人体腫瘍細胞株(図3a)及び人体正常細胞株(図3b)におけるデコリン遺伝子伝達効率を検証したX-gal染色写真である。
【図4】本発明の複製不能アデノウイルス(dl-lacZ, dl-lacZ-DCNG, dl-lacZ-DCNQ及びdl-lacZ-DCNK)を生体外(in vitro)感染させた腫瘍球(U343, U87MG, C33A及びA549)へのウイルス浸透性を検証したX-gal染色写真である。左側パネルは、X-gal染色された腫瘍球の光学顕微鏡写真(倍率:38×)であり、右側パネルは、X-gal染色された腫瘍球の凍結薄片光学顕微鏡写真(倍率: 40×)である。
【図5】本発明の複製不能アデノウイルス(dl-lacZ, dl-lacZ-DCNG)を生体内(in vivo)感染させた腫瘍球(U343, U87MG, C33A, Hep3B及びA549)へのウイルス浸透性を検証したLacZ染色写真である。
【図6】本発明の腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)を感染させた人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)及び人体正常細胞株(CBHEL, IMR90, MRC5及びW138)における癌細胞特異的殺傷能を検証した細胞病変効果(cytopathic effect, CPE)分析結果である。
【図7a】本発明の腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)を感染させた人体腫瘍細胞株HeP3Bにおけるプラーク形成程度を示したプレート写真(図7a)及びこれのプラーク数を概数してプラーク形成速度を示したグラフ(図7b)である。
【図7b】本発明の腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)を感染させた人体腫瘍細胞株HeP3Bにおけるプラーク形成程度を示したプレート写真(図7a)及びこれのプラーク数を概数してプラーク形成速度を示したグラフ(図7b)である。
【図8a】本発明のアデノウイルスを感染させた人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)における細胞アポトーシス程度を確認したPI染色後のフローサイトメトリー分析結果である。図8aは、腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)であり、図8bは、複製不能アデノウイルス(dl-lacZ, dl-lacZ-DCNG)の結果であって、フローサイトメトリー分析結果にある数字は、subG1細胞群の比率を示す。
【図8b】本発明のアデノウイルスを感染させた人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)における細胞アポトーシス程度を確認したPI染色後のフローサイトメトリー分析結果である。図8aは、腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)であり、図8bは、複製不能アデノウイルス(dl-lacZ, dl-lacZ-DCNG)の結果であって、フローサイトメトリー分析結果にある数字は、subG1細胞群の比率を示す。
【図9a】本発明のアデノウイルスを感染させた人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)における細胞アポトーシスと細胞壊死の程度を同時に確認したAnnexin V-PI染色及びフローサイトメトリー分析結果である。図9aは、腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)であり、図9bは、複製不能アデノウイルス(dl-lacZ, dl-lacZ-DCNG)の結果であって、各フローサイトメトリー分析結果において、Annexin V+/PI-の比率は、太いイタリック体で右側下に表示した。横座標は、Annexin V数値であり、縦座標は、PI数値である。
【図9b】本発明のアデノウイルスを感染させた人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)における細胞アポトーシスと細胞壊死の程度を同時に確認したAnnexin V-PI染色及びフローサイトメトリー分析結果である。図9aは、腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)であり、図9bは、複製不能アデノウイルス(dl-lacZ, dl-lacZ-DCNG)の結果であって、各フローサイトメトリー分析結果において、Annexin V+/PI-の比率は、太いイタリック体で右側下に表示した。横座標は、Annexin V数値であり、縦座標は、PI数値である。
【図10a】本発明のアデノウイルスを感染させた人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)における細胞アポトーシス程度を確認したTUNEL分析結果である。10aは、腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)であり、図10bは、複製不能アデノウイルス(dl-lacZ, dl-lacZ-DCNG)の結果であって、DNA鎖の分節化は、褐色で染色されている。
【図10b】本発明のアデノウイルスを感染させた人体腫瘍細胞株(U343, U87MG, C33A, Hep3B及びA549)における細胞アポトーシス程度を確認したTUNEL分析結果である。10aは、腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG, Ad-ΔE1B-DCNQ及びAd-ΔE1B-DCNK)であり、図10bは、複製不能アデノウイルス(dl-lacZ, dl-lacZ-DCNG)の結果であって、DNA鎖の分節化は、褐色で染色されている。
【図11a】腫瘍(U343, U87MG, C33A, Hep3B及びA549)が誘導されたマウスに感染させた本発明の腫瘍特異的殺傷アデノウイルスAd-ΔE1B-DCNGによる腫瘍の大きさ変化を示したグラフ(図11a)及びマウスの生存率を示したグラフ(図11b)である。
【図11b】腫瘍(U343, U87MG, C33A, Hep3B及びA549)が誘導されたマウスに感染させた本発明の腫瘍特異的殺傷アデノウイルスAd-ΔE1B-DCNGによる腫瘍の大きさ変化を示したグラフ(図11a)及びマウスの生存率を示したグラフ(図11b)である。
【図12a】腫瘍C33Aが誘導されたマウスに感染させた本発明の腫瘍特異的殺傷アデノウイルスAd-ΔE1B-DCNGによるU343腫瘍の変化を観察したH&E染色結果、IHC (immunohistochemical)染色結果及び細胞アポトーシスされた細胞をTUNEL分析した結果である。
【図12b】腫瘍C33Aが誘導されたマウスに感染させた本発明の腫瘍特異的殺傷アデノウイルスAd-ΔE1B-DCNGによるU87MG腫瘍の変化を観察したH&E染色結果、IHC (immunohistochemical)染色結果及び細胞アポトーシスされた細胞をTUNEL分析した結果である。
【図12c】腫瘍C33Aが誘導されたマウスに感染させた本発明の腫瘍特異的殺傷アデノウイルスAd-ΔE1B-DCNGによるC33A腫瘍の変化を観察したH&E染色結果、IHC (immunohistochemical)染色結果及び細胞アポトーシスされた細胞をTUNEL分析した結果である。
【図12d】腫瘍C33Aが誘導されたマウスに感染させた本発明の腫瘍特異的殺傷アデノウイルスAd-ΔE1B-DCNGによるHep3B腫瘍の変化を観察したH&E染色結果、IHC (immunohistochemical)染色結果及び細胞アポトーシスされた細胞をTUNEL分析した結果である。
【図12e】腫瘍C33Aが誘導されたマウスに感染させた本発明の腫瘍特異的殺傷アデノウイルスAd-ΔE1B-DCNGによるA549腫瘍の変化を観察したH&E染色結果、IHC (immunohistochemical)染色結果及び細胞アポトーシスされた細胞をTUNEL分析した結果である。
【図13】腫瘍U343(パネルA)及びU87MG(パネルB)が誘導されたマウスに感染させた腫瘍特異的殺傷アデノウイルス(Ad-ΔE1B, Ad-ΔE1B-DCNG)による腫瘍の細胞外組織にあるコラーゲン分布を確認したMasson's trichrome染色結果である。
【図14】人体腫瘍細胞U343, U87MG, C33A, Hep3B及びA549に感染させた腫瘍特異的殺傷アデノウイルスAd-ΔE1BまたはAd-ΔE1B-DCNGによるMMP発現様相を確認したゼラチンザイモグラフィ電気泳動結果を数値化したグラフである。
【図15】B16BL6 Spontaneous癌転移モデルを利用して、癌転移に対するデコリン発現の影響を検証した結果(上パネル)及び肺転移された腫塊の重量を数値化したグラフ(下パネル)である。
【図16】乳房癌患者から採取した腫瘍組織及びその周辺の正常組織にデコリン発現複製不能アデノウイルス(dl-LacZ-DCNG)を投与した後の遺伝子伝達効率及び組織浸透性をX-gal染色で確認した写真である。
【図17】デコリン発現複製不能アデノウイルス(dl-LacZ-DCNG)を処理した一次ケロイド細胞における遺伝子伝達効率を検証したX-gal染色写真である。
【図18】ケロイドスフェロイド(spheroid)モデルを利用して、デコリン発現複製不能アデノウイルス(dl-LacZ-DCNG)の遺伝子伝達効率を検証したケロイド細胞球のX-gal染色写真(Aパネル)及びケロイド組織を利用してデコリン発現複製不能アデノウイルス(dl-LacZ-DCNG)の組織浸透性を検証したX-gal染色写真(Bパネル)である。
【図19a】本発明の複製不能アデノウイルス(dl-GFPとdl-GFP-DCNG)を生体内(in vivo)感染させた腫瘍球(C33A)内へのウイルス浸透性を検証した蛍光顕微鏡写真である(x10)。
【図19b】乳房癌患者から採取した腫瘍組織にdl-GFPまたはdl-GFP-DCNGを投与した後の遺伝子伝達効率及び組織浸透性を確認した蛍光顕微鏡写真である(x 40)。
【特許請求の範囲】
【請求項1】
細胞内に運搬しようとする目的ヌクレオチド配列及びデコリン(decorin)−エンコーディングヌクレオチド配列を含み、前記デコリンは、前記目的ヌクレオチド配列の細胞内運搬効率を増加させる作用をすることを特徴とする遺伝子伝達システム。
【請求項2】
前記細胞は、細胞外基質により連結された細胞からなる組織内の細胞であることを特徴とする請求項1に記載の遺伝子伝達システム。
【請求項3】
前記組織は、腫瘍組織であることを特徴とする請求項2に記載の遺伝子伝達システム。
【請求項4】
前記遺伝子伝達システムは、プラスミド、組み換えアデノウイルス、アデノ−関連ウイルス(Adeno-associated viruses: AAV)、レトロウイルス、レンチウイルス、単純ヘルペスウイルス、ワクシニアウイルス、リポソーム、またはネオソーム(neosome)であることを特徴とする請求項1に記載の遺伝子伝達システム。
【請求項5】
前記遺伝子伝達システムは、組み換えアデノウイルスであることを特徴とする請求項4に記載の遺伝子伝達システム。
【請求項6】
前記組み換えアデノウイルスは、E3領域が欠失されたものであって、前記デコリン−エンコーディングヌクレオチド配列は、E3領域の位置に挿入されたことを特徴とする請求項5に記載の遺伝子伝達システム。
【請求項7】
請求項1〜6に記載の遺伝子伝達システムを、細胞を含むバイオサンプル(biosample)に接触させる段階を含むことを特徴とする遺伝子伝達方法。
【請求項8】
アデノウイルスのITR(inverted terminal repeat)ヌクレオチド配列及びデコリン−エンコーディングヌクレオチド配列を含み、前記デコリンは、アデノウイルスの腫瘍組織浸透能及び腫瘍細胞アポトーシス能を増大させる作用をすることを特徴とする組み換えアデノウイルス。
【請求項9】
前記組み換えアデノウイルスは、E3遺伝子領域が欠失されたものであって、前記デコリン−エンコーディングヌクレオチド配列は、前記E3遺伝子領域の位置に挿入されたことを特徴とする請求項8に記載の組み換えアデノウイルス。
【請求項10】
前記組み換えアデノウイルスは、非活性化されたE1B遺伝子、E1B55遺伝子、またはE1B遺伝子/E1B 55遺伝子を有することを特徴とする請求項8に記載の組み換えアデノウイルス。
【請求項11】
前記組み換えアデノウイルスは、活性のE1A遺伝子を含むことを特徴とする請求項8に記載の組み換えアデノウイルス。
【請求項12】
(a)請求項8〜11のいずれか一つの項に記載の組み換えアデノウイルスの治療学的有効量、及び(b)薬剤学的に許容される担体を含むことを特徴とする薬剤学的抗腫瘍組成物。
【請求項13】
請求項12に記載の薬剤学的組成物を動物に投与する段階を含むことを特徴とする癌の治療方法。
【請求項14】
(a)薬物の組織浸透性を改善するためのデコリンタンパク質、及び(b)薬剤学的に許容される担体を含む、改善された組織浸透性を有する薬剤学的組成物。
【請求項15】
(a)デコリン−エンコーディングヌクレオチド配列を含む遺伝子伝達システムまたはデコリンタンパク質の治療学的有効量、及び(b)薬剤学的に許容される担体を含む、細胞外基質の過度なる蓄積に係る疾患または状態の治療用薬剤学的組成物。
【請求項16】
前記細胞外基質の過度なる蓄積に係る疾病または疾患は、斑痕、肝硬変症、肺線維症、糸球体腎炎、成人または急性呼吸困難症、肝線維症、腎線維症、後心筋梗塞線維症、 嚢胞性線維症、線維症癌、静脈閉塞症、または腎間質線維症であることを特徴とする請求項15に記載の薬剤学的組成物。
【請求項1】
細胞内に運搬しようとする目的ヌクレオチド配列及びデコリン(decorin)−エンコーディングヌクレオチド配列を含み、前記デコリンは、前記目的ヌクレオチド配列の細胞内運搬効率を増加させる作用をすることを特徴とする遺伝子伝達システム。
【請求項2】
前記細胞は、細胞外基質により連結された細胞からなる組織内の細胞であることを特徴とする請求項1に記載の遺伝子伝達システム。
【請求項3】
前記組織は、腫瘍組織であることを特徴とする請求項2に記載の遺伝子伝達システム。
【請求項4】
前記遺伝子伝達システムは、プラスミド、組み換えアデノウイルス、アデノ−関連ウイルス(Adeno-associated viruses: AAV)、レトロウイルス、レンチウイルス、単純ヘルペスウイルス、ワクシニアウイルス、リポソーム、またはネオソーム(neosome)であることを特徴とする請求項1に記載の遺伝子伝達システム。
【請求項5】
前記遺伝子伝達システムは、組み換えアデノウイルスであることを特徴とする請求項4に記載の遺伝子伝達システム。
【請求項6】
前記組み換えアデノウイルスは、E3領域が欠失されたものであって、前記デコリン−エンコーディングヌクレオチド配列は、E3領域の位置に挿入されたことを特徴とする請求項5に記載の遺伝子伝達システム。
【請求項7】
請求項1〜6に記載の遺伝子伝達システムを、細胞を含むバイオサンプル(biosample)に接触させる段階を含むことを特徴とする遺伝子伝達方法。
【請求項8】
アデノウイルスのITR(inverted terminal repeat)ヌクレオチド配列及びデコリン−エンコーディングヌクレオチド配列を含み、前記デコリンは、アデノウイルスの腫瘍組織浸透能及び腫瘍細胞アポトーシス能を増大させる作用をすることを特徴とする組み換えアデノウイルス。
【請求項9】
前記組み換えアデノウイルスは、E3遺伝子領域が欠失されたものであって、前記デコリン−エンコーディングヌクレオチド配列は、前記E3遺伝子領域の位置に挿入されたことを特徴とする請求項8に記載の組み換えアデノウイルス。
【請求項10】
前記組み換えアデノウイルスは、非活性化されたE1B遺伝子、E1B55遺伝子、またはE1B遺伝子/E1B 55遺伝子を有することを特徴とする請求項8に記載の組み換えアデノウイルス。
【請求項11】
前記組み換えアデノウイルスは、活性のE1A遺伝子を含むことを特徴とする請求項8に記載の組み換えアデノウイルス。
【請求項12】
(a)請求項8〜11のいずれか一つの項に記載の組み換えアデノウイルスの治療学的有効量、及び(b)薬剤学的に許容される担体を含むことを特徴とする薬剤学的抗腫瘍組成物。
【請求項13】
請求項12に記載の薬剤学的組成物を動物に投与する段階を含むことを特徴とする癌の治療方法。
【請求項14】
(a)薬物の組織浸透性を改善するためのデコリンタンパク質、及び(b)薬剤学的に許容される担体を含む、改善された組織浸透性を有する薬剤学的組成物。
【請求項15】
(a)デコリン−エンコーディングヌクレオチド配列を含む遺伝子伝達システムまたはデコリンタンパク質の治療学的有効量、及び(b)薬剤学的に許容される担体を含む、細胞外基質の過度なる蓄積に係る疾患または状態の治療用薬剤学的組成物。
【請求項16】
前記細胞外基質の過度なる蓄積に係る疾病または疾患は、斑痕、肝硬変症、肺線維症、糸球体腎炎、成人または急性呼吸困難症、肝線維症、腎線維症、後心筋梗塞線維症、 嚢胞性線維症、線維症癌、静脈閉塞症、または腎間質線維症であることを特徴とする請求項15に記載の薬剤学的組成物。
【図1a】


【図1b】


【図2】


【図3a】


【図3b】


【図4】


【図5】


【図6】


【図7a】


【図7b】


【図8a】


【図8b】


【図9a】


【図9b】


【図10a】


【図10b】


【図11a】


【図11b】


【図12a】


【図12b】


【図12c】


【図12d】


【図12e】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19a】


【図19b】




【図1b】


【図2】


【図3a】


【図3b】


【図4】


【図5】


【図6】


【図7a】


【図7b】


【図8a】


【図8b】


【図9a】


【図9b】


【図10a】


【図10b】


【図11a】


【図11b】


【図12a】


【図12b】


【図12c】


【図12d】


【図12e】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19a】


【図19b】


【公表番号】特表2008−531010(P2008−531010A)
【公表日】平成20年8月14日(2008.8.14)
【国際特許分類】
【出願番号】特願2007−556977(P2007−556977)
【出願日】平成18年2月24日(2006.2.24)
【国際出願番号】PCT/KR2006/000657
【国際公開番号】WO2006/091045
【国際公開日】平成18年8月31日(2006.8.31)
【出願人】(507283193)インダストリー−ユニバーシティ コオペレーション ファウンデーション ヨンセイ ユニバーシティ (2)
【氏名又は名称原語表記】INDUSTRY−UNIVERSITY COOPERATION FOUNDATION YONSEI UNIVERSITY
【出願人】(308006335)
【氏名又は名称原語表記】YUN,Chaoe−Ok
【出願人】(308006346)
【氏名又は名称原語表記】KIM,Joo−Hyun
【Fターム(参考)】
【公表日】平成20年8月14日(2008.8.14)
【国際特許分類】
【出願日】平成18年2月24日(2006.2.24)
【国際出願番号】PCT/KR2006/000657
【国際公開番号】WO2006/091045
【国際公開日】平成18年8月31日(2006.8.31)
【出願人】(507283193)インダストリー−ユニバーシティ コオペレーション ファウンデーション ヨンセイ ユニバーシティ (2)
【氏名又は名称原語表記】INDUSTRY−UNIVERSITY COOPERATION FOUNDATION YONSEI UNIVERSITY
【出願人】(308006335)

【氏名又は名称原語表記】YUN,Chaoe−Ok
【出願人】(308006346)

【氏名又は名称原語表記】KIM,Joo−Hyun
【Fターム(参考)】
[ Back to top ]

