デンドリマー及びこれを用いた有機発光素子
【課題】デンドリマーを利用した有機発光素子の提供。
【解決手段】コア・ユニット、ブリッジ・ユニット及びデンドロン・ユニットを含むデンドリマーであって、前記デンドロン・ユニットが、下記化学式1で表示される一価のフルオレン系作用基を含むデンドリマー。

・・・(化学式1)
【解決手段】コア・ユニット、ブリッジ・ユニット及びデンドロン・ユニットを含むデンドリマーであって、前記デンドロン・ユニットが、下記化学式1で表示される一価のフルオレン系作用基を含むデンドリマー。

・・・(化学式1)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、デンドリマー及びこれを用いた有機発光素子に関する。
【背景技術】
【0002】
一般的な有機発光素子は、基板上部にアノードが形成されており、このアノード上部に、正孔輸送層、発光層、電子輸送層及びカソードが順次に形成されている構造を有している。ここで、正孔輸送層、発光層及び電子輸送層は、有機化合物からなる有機薄膜である。
【0003】
有機発光素子は、蛍光またはリン光の有機膜に電流を流せば、電子と正孔とが有機膜で結合しつつ光が発生する現象を利用した自発光型兄ディスプレイであり、軽量化、簡素な部品、簡単な製作工程、高画質及び高色純度の具現可能、低消費電力消耗、及び動映像の完壁具現のような多様な長所によって、現在活発な研究が行われている。このような有機発光素子において、アノードとカソードとの間には、有機発光層以外に、正孔注入層及び正孔輸送層のような正孔関連層、及び電子輸送層及び電子注入層のような電子関連層を何層か具備することができる。
【0004】
現在、有機発光素子の製作方式は、蒸着方式と湿式方式とに大別される。蒸着方式に使われる有機材料は、工程特定上、一般的に分子量1,000以下の材料に限定される。フルオレン系を含んだ低分子化合物を利用して、蒸着工程で作られた有機発光素子は、その有機発光特性が向上すると周知されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】韓国特許出願公開第2005−0097670号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかし、かような蒸着用低分子材料(フルオレン系を含む)を利用して、湿式工程によって有機発光素子を製作するとき、さまざまな問題点が発生する。代表的なものとして、膜を形成した後、乾燥過程で発生する結晶化現象である。いったん結晶化現象が発生すれば、発生地点がシードになって、その面積が拡大され、この部分は、素子において暗点(dark spot)として残る。かような現象を防止するためには、サイズの大きい置換体や結晶化があまり起こらない置換体を導入するか、あるいは材料自体の分子量を数千まで大きくし、分子間の整列あるいは配列を最大限防止しなければならない。材料の分子量自体を大きくする方策として、デンドリマーあるいは高分子重合体を考慮することができる。
【0007】
高分子重合体は、その合成方法及び精製方法が困難であり、何よりも分子量の分布を有する混合物であるために、発光特性を決定づけるエネルギー準位、熱特性のようなその物性調節が困難である。これに対して、デンドリマーは、合成方法や精製方法が高分子に比べて相対的に容易であり、単一化合物であるから、分子構造の調節が容易であり、有機発光特性に影響を与えるさまざまな物理的特性の調節が可能である。
【0008】
このために、新規のデンドリマーを利用した有機発光素子の開発が必要である。そこで、本発明は、上記問題に鑑みてなされたものであり、本発明の目的とするところは、優秀な電気的安定性、高い電荷輸送能及び高い発光能を有することが可能な、新規かつ改良されたデンドリマー及びこれを用いた有機発光素子を提供することにある。
【課題を解決するための手段】
【0009】
上記課題を解決するために、本発明のある観点によれば、コア・ユニット、ブリッジ・ユニット及びデンドロン・ユニットを含み、前記コア・ユニットは、置換または非置換のC1−C50脂肪族炭化水素、置換または非置換のC5−C50芳香族炭化水素、及び置換または非置換のC3−C50ヘテロ芳香族炭化水素からなる群から選択される三価あるいは四価の作用基を含み、前記ブリッジ・ユニットは、置換または非置換のC5−C50芳香族炭化水素、及び置換または非置換のC3−C50ヘテロ芳香族炭化水素からなる群から選択される二価あるいは三価の作用基を含み、前記デンドロン・ユニットは、下記化学式1で表示される一価のフルオレン系作用基を含むデンドリマーが提供される。
【0010】
【化1】

・・・(化学式1)
前記化学式1で、Zは、単一結合、または、
【0011】
【化2】



【0012】
からなる群から選択され、Ar1及びAr2は互いに独立して、単一結合、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択され、X1及びX2は互いに独立して、窒素(N)、ホウ素(B)及びリン(P)からなる群から選択され、X’は、酸素(O)、硫黄(S)、SO2及びCH2からなる群から選択され、Y1、Y2、Y3、Y4、Y5及びY6は互いに独立して、単一結合、置換または非置換のC1−C50アルキレン基、置換または非置換のC2−C50アルケニレン基、置換または非置換のC2−C50アルキニレン基、置換または非置換のC3−C50シクロアルキレン基、置換または非置換のC1−C50アルコキシレン基、置換または非置換のC5−C50アリーレン基、及び置換または非置換のC3−C50ヘテロアリーレン基からなる群から選択され、R1、R2、R3、R4及びR5は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、カルボン酸基、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択され、R’及びR”は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、カルボン酸基、置換または非置換のC1−C50アルキル基、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択され、R1、R2、R3、R4、R5、R’及びR”で、互いに隣接した2個以上は、結合して飽和環または不飽和環を形成することができ、*は、Ar1、Z及びフルオレン基のうちいずれか一つが、ブリッジ・ユニットと結合するサイトである。
【0013】
前記デンドリマーの数平均分子量は、1,000〜300,000でありうる。
【0014】
前記デンドリマーは、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択される表面ユニットを、前記デンドロン・ユニットの末端位置にさらに含むことができる。
【0015】
本発明の他の側面によって、1対の電極と、それらの間に介在された有機膜と、を含み、前記有機膜が前述のデンドリマーを含む有機発光素子が提供される。
【発明の効果】
【0016】
本発明による新規のデンドリマーは、電気的な安定性、電荷輸送能及び発光能にすぐれ、有機溶媒に溶解されて正孔注入層または正孔輸送層を形成することによって、容易に有機発光素子を製造することができる。
【0017】
本発明による前記新規のデンドリマーを利用して製造された有機発光素子は、発光効率及び輝度が優秀である。
【図面の簡単な説明】
【0018】
【図1】一具現例による有機発光素子の構造を示した図面である。
【発明を実施するための形態】
【0019】
以下に添付図面を参照しながら、本発明の好適な実施の形態について詳細に説明する。なお、本明細書及び図面において、実質的に同一の機能構成を有する構成要素については、同一の符号を付することにより重複説明を省略する。
【0020】
本発明の一側面によるデンドリマーは、コア・ユニット、ブリッジ・ユニット及びデンドロン・ユニットを含み、前記コア・ユニットは、飽和された置換または非置換のC1−C50脂肪族炭化水素、置換または非置換のC5−C50芳香族炭化水素、及び置換または非置換のC3−C50ヘテロ芳香族炭化水素からなる群から選択される三価あるいは四価の作用基を含み、前記ブリッジ・ユニットは、置換または非置換のC5−C50芳香族炭化水素、及び置換または非置換のC3−C50ヘテロ芳香族炭化水素からなる群から選択される二価あるいは三価の作用基を含み、前記デンドロン・ユニットは、下記化学式1で表示される一価のフルオレン系作用基を含むことができる:
【0021】
【化3】

・・・(化学式1)
【0022】
前記化学式1で、Zは、単一結合、または、
【0023】
【化4】



【0024】
からなる群から選択されうる。ただし、Zがブリッジ・ユニットと結合する場合、Zは、二価の酸化状態を有するものでありうる。以下、Zがブリッジ・ユニットと結合する場合には、二価の酸化状態を有するものと考慮する。
【0025】
デンドリマー(dendrimer)とは、コア・ユニットから樹枝状の一定の単位構造が規則的に反復されて伸びてくる構造の物質を意味する。デンドリマーは、全体球形構造の中心に位置するコア・ユニット、コアを中心に一定に反復されて伸びていく単位構造であるブリッジ・ユニット、及び前記ブリッジ・ユニットと連結され、コア・ユニットの反対側に位置したデンドロン(dendron)・ユニットを含む。
【0026】
一具現例によるデンドリマーは、三価あるいは四価の酸化状態を有するコア・ユニットが、全体球形構造の中心に位置しており、前記コア・ユニットにブリッジ・ユニットが追加されつつ、世代(generation)が増加し、ブリッジ・ユニットと連結される末端に、デンドロン・ユニットが位置している。
【0027】
前記デンドロン・ユニットは、化学式1で表示される一価のフルオレン系作用基を含むことができる。
【0028】
化学式1で、Ar1及びAr2は互いに独立して、単一結合、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択されうる。ただし、Ar1がブリッジ・ユニットと結合する場合、Ar1は、二価の酸化状態を有し、C5−C50アリーレン基、及び置換または非置換のC3−C50ヘテロアリーレン基からなる群から選択されうる。以下、Ar1がブリッジ・ユニットと結合する場合には、二価の酸化状態を有するものと考慮する。
【0029】
Ar1及びAr2は互いに独立して、単一結合、フェニル基、ハロフェニル基、シアノフェニル基、フェノキシフェニル基、C1−C15アルキルフェニル基、ジ(C1−C15アルキル)フェニル基、C1−C15アルコキシフェニル基、ジ(C1−C15アルコキシ)フェニル基、C5−C15アリールフェニル基、ジ(C5−C15アリール)フェニル基、ナフチル基、ハロナフチル基、シアノナフチル基、フェノキシナフチル基、C1−C15アルキルナフチル基、ジ(C1−C15アルキル)ナフチル基、C1−C15アルコキシナフチル基、ジ(C1−C15アルコキシ)ナフチル基、C5−C15アリールナフチル基、ジ(C5−C15アリール)ナフチル基、アントリル基、ハロアントリル基、シアノアントリル基、フェノキシアントリル基、C1−C15アルキルアントリル基、ジ(C1−C15アルキル)アントリル基、C1−C15アルコキシアントリル基、ジ(C1−C15アルコキシ)アントリル基、C5−C15アリールアントリル基、ジ(C5−C15アリール)アントリル基、フェナントリル基、ハロフェナントリル基、シアノフェナントリル基、フェノキシフェナントリル基、C1−C15アルキルフェナントリル基、ジ(C1−C15アルキル)フェナントリル基、C1−C15アルコキシフェナントリル基、ジ(C1−C15アルコキシ)フェナントリル基、C5−C15アリールフェナントリル基、ジ(C5−C15アリール)フェナントリル基、フルオレニル基、ハロフルオレニル基、シアノフルオレニル基、フェノキシフルオレニル基、C1−C15アルキルフルオレニル基、ジ(C1−C15アルキル)フルオレニル基、C1−C15アルコキシフルオレニル基、ジ(C1−C15アルコキシ)フルオレニル基、C5−C15アリールフルオレニル基、ジ(C5−C15アリール)フルオレニル基、ピリジル基、ハロピリジル基、シアノピリジル基、フェノキシピリジル基、C1−C15アルキルピリジル基、ジ(C1−C15アルキル)ピリジル基、C1−C15アルコキシピリジル基、ジ(C1−C15アルコキシ)ピリジル基、C5−C15アリールピリジル基、ジ(C5−C15アリール)ピリジル基、ピレニル基、ハロピレニル基、シアノピレニル基、フェノキシピレニル基、C1−C15アルキルピレニル基、ジ(C1−C15アルキル)ピレニル基、C1−C15アルコキシピレニル基、ジ(C1−C15アルコキシ)ピレニル基、C5−C15アリールピレニル基、ジ(C5−C15アリール)ピレニル基、フェナントロリニル基、ハロフェナントロリニル基、シアノフェナントロリニル基、フェノキシフェナントロリニル基、C1−C15アルキルフェナントロリニル基、ジ(C1−C15アルキル)フェナントロリニル基、C1−C15アルコキシフェナントロリニル基、ジ(C1−C15アルコキシ)フェナントロリニル基、C5−C15アリールフェナントロリニル基、ジ(C5−C15アリール)フェナントロリニル基、キノリニル基、ハロキノリニル基、シアノキノリニル基、フェノキシキノリニル基、C1−C15アルキルキノリニル基、ジ(C1−C15アルキル)キノリニル基、C1−C15アルコキシキノリニル基、ジ(C1−C15アルコキシ)キノリニル基、C5−C15アリールキノリニル基、ジ(C5−C15アリール)キノリニル基、カルバゾリル基、ハロカルバゾリル基、シアノカルバゾリル基、フェノキシカルバゾリル基、C1−C15アルキルカルバゾリル基、ジ(C1−C15アルキル)カルバゾリル基、C1−C15アルコキシカルバゾリル基、ジ(C1−C15アルコキシカルバゾリル基)、C5−C15アリールカルバゾリル基及びジ(C5−C15アリール)カルバゾリル基からなる群から選択されうるが、これらに限定されるものではない。
【0030】
例えば、Ar1及びAr2は互いに独立して、単一結合、フェニル基、ハロフェニル基、シアノフェニル基、ビフェニル基、ジメチルフルオレニル基、カルバゾリル基またはジフェニルカルバゾリル基でありうる。
【0031】
化学式1で、X1及びX2は互いに独立して、窒素(N)、ホウ素(B)及びリン(P)からなる群から選択されうる。例えば、X1及びX2は、いずれも窒素(N)でありうる。
【0032】
また、X’は、酸素(O)、硫黄(S)、SO2及びCH2からなる群から選択されうる。例えばX’は、硫黄(S)でありうる。
【0033】
化学式1で、Y1〜Y6は互いに独立して、単一結合、置換または非置換のC1−C50アルキレン基、置換または非置換のC2−C50アルケニレン基、置換または非置換のC2−C50アルキニレン基、置換または非置換のC3−C50シクロアルキレン基、置換または非置換のC1−C50アルコキシレン基、置換または非置換のC5−C50アリーレン基、及び置換または非置換のC3−C50ヘテロアリーレン基からなる群から選択されうる。
【0034】
Y1〜Y6は互いに独立して、単一結合、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、フェニル基、メチルフェニル基、エチルフェニル基、o−,m−及びp−フルオロフェニル基、ジクロロフェニル基、シアノフェニル基、ジシアノフェニル基、トリフルオロメトキシフェニル基、ビフェニル基、ハロビフェニル基、シアノビフェニル基、メチルビフェニル基、エチルビフェニル基、メトキシビフェニル基、エトキシビフェニル基からなる群から選択されうる。
【0035】
例えば、Y1〜Y6は互いに独立して、単一結合、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、フェニル基またはジフェニル基でありうる。
【0036】
化学式1で、R1〜R5は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、カルボン酸基、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択され、R’及びR”は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、カルボン酸基、置換または非置換のC1−C50アルキル基、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択され、R1、R2、R3、R4、R5、R’及びR”で、互いに隣接した2個以上は、結合して飽和環または不飽和環を形成することができる。
【0037】
R1、R2、R3、R4、R5、R’及びR”は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、フェニル基、メチルフェニル基、エチルフェニル基、o−,m−及びp−フルオロフェニル基、ジクロロフェニル基、シアノフェニル基、ジシアノフェニル基、トリフルオロメトキシフェニル基、ビフェニル基、ハロビフェニル基、シアノビフェニル基、メチルビフェニル基、エチルビフェニル基、メトキシビフェニル基、エトキシビフェニル基からなる群から選択されうる。
【0038】
例えば、R1、R2、R3、R4、R5、R’及びR”は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、フェニル基またはビフェニル基でありうる。
【0039】
化学式1で、*は、Ar1、Z及びフルオレン基のうちいずれか一つが、ブリッジ・ユニットと結合するサイトを意味する。例えば*は、化学式1のAr1がブリッジ・ユニットと結合するサイトであったり、Zがブリッジ・ユニットと結合するサイトであったり、またはフルオレン基がブリッジ・ユニットと結合するサイトでありうる。
【0040】
前記化学式1で表示される一価のフルオレン系作用基は、1個以上のフルオレン構造と、1個のフェノチアジン構造を有することができ、有機発光素子の有機膜に使われうる。
【0041】
フェノチアジン基は、X’の選択(O、S、SO2またはCH2)によって、発光層として、あるいは正孔輸送材料としてのバンドギャップ調節が容易である。従って、フェノチアジン基を含む化合物は、有機発光素子内で優秀な電気的特性を示し、発光輝度及び長寿命に有利である。また、化合物内のアミン基に連結されたカルバゾール基は、正孔の注入及び輸送に有利であり、電気的安定性の側面で有利である。フルオレン基は、一重項転移を円滑にする。従って、フルオレン基を含む化合物を、有機発光素子の発光層として使用すれば、蛍光強度を向上させて高い発光輝度を示し、蛍光ドーパントまたはリン光ドーパントのホスト材料として使用すれば、ドーパントへのエネルギー転移量を増加させ、高い発光輝度を示すことになる。また、フルオレン基は、R1及びR2の選択によって、溶媒に対する溶解度を調節でき、湿式工程でさらに有利である。
【0042】
例えば、デンドロン・ユニットは、下記化学式で表示された作用基のうちから選択されるものを含むことができる。
【0043】
【化5】

【0044】
【化6】

【0045】
【化7】

【0046】
【化8】

【0047】
前記化学式で、*は、ブリッジ・ユニットとの結合サイトを意味する。
【0048】
一具現例によるデンドリマーは、前記デンドロン・ユニットとの連結部品に、世代を増加させることができるブリッジ・ユニットが位置している。
【0049】
前記ブリッジ・ユニットは、二価あるいは三価の酸化状態を有し、その結合サイトは、隣接するコア・ユニットまたはデンドロン・ユニットと結合することができ、ブリッジ・ユニットがいくつか連続して連結された構造である場合には、ブリッジ・ユニットとも結合することができる。
【0050】
ブリッジ・ユニットは、互いに隣接するユニットを連結することができる二価あるいは三価の連結基であるならば、特別に制限されるものではないが、フルオレン系作用基を含むデンドロン・ユニットと反応する過程で、所望しない副反応が起こらないように選択することができ、最終生成物の安定性側面で、O及びSを含むことができる。
【0051】
ブリッジ・ユニットは、置換または非置換のC5−C50芳香族炭化水素、及び置換または非置換のC3−C50ヘテロ芳香族炭化水素からなる群から選択される二価あるいは三価の作用基を含むことができ、具体的には、一部水素原子が酸素原子または窒素原子で置換され、カルバゾール基を含むC3−C50ヘテロ芳香族炭化水素でありうる。
【0052】
例えば、ブリッジ・ユニットは、下記化学式で表示される作用基のうちから選択されるものを含むことができる:
【0053】
【化9】

【0054】
【化10】

【0055】
【化11】

【0056】
【化12】

【0057】
前記化学式で、**は、隣接ユニットとの結合サイトを意味する。**は、コア・ユニットとの結合サイトであったり、デンドロン・ユニットとの結合サイトであったり、またはブリッジ・ユニットとの結合サイトでありうる。**がブリッジ・ユニットとの結合サイトである場合、ブリッジ・ユニットが連続して連結している場合を示す。
【0058】
一具現例によるデンドリマーは、全体球形構造の中心に、前記ブリッジ・ユニットと連結されるコア・ユニットが位置している。
【0059】
前記コア・ユニットは、三価あるいは四価の酸化状態を有し、その結合サイトは、いずれもブリッジ・ユニットと結合することができる。
【0060】
コア・ユニットは、置換または非置換のC1−C50脂肪族炭化水素、置換または非置換のC5−C50芳香族炭化水素、及び置換または非置換のC3−C50ヘテロ芳香族炭化水素からなる群から選択される三価あるいは四価の作用基を含むことができる。
【0061】
例えば、コア・ユニットは、下記化学式で表示される作用基のうちから選択されるものを含むことができる:
【0062】
【化13】

【0063】
【化14】

【0064】
【化15】

【0065】
前記化学式で、***は、ブリッジ・ユニットとの結合サイトを意味する。
【0066】
前記コア・ユニット、前記ブリッジ・ユニット及び前記デンドロン・ユニットを含むデンドリマーの数平均分子量は、1,000〜300,000でありうる。
【0067】
デンドリマーの分枝化度は、コア・ユニット、ブリッジ・ユニット及びデンドロン・ユニットの総数に対するコア・ユニットとデンドロン・ユニットとの総数の比を意味する。例えば、もし分枝化度が0であるならば、コア・ユニットとデンドロン・ユニットとが全く存在せずに、ブリッジ・ユニットのみ存在する線形分子を意味し、分枝化度が1であるならば、ブリッジ・ユニットが存在せず、デンドロン・ユニットも存在しなくなる。分枝化度は、核磁気共鳴(NMR)スペクトルで、それぞれコア・ユニット、ブリッジ・ユニット及びデンドロン・ユニットに関連したピークの積分値比から計算可能である。前記デンドリマーの分枝化度は、反応温度、反応時間、溶媒条件などによって変化しうる。
【0068】
一具現例によるデンドリマーは、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択される表面ユニットをさらに含むことができる。
【0069】
例えば、前記デンドリマーは、下記化学式1’で表示されるフルオレン系作用基に連結された表面ユニットをさらに含むことができる:
【0070】
【化16】

・・・(化学式1’)
【0071】
前記化学式1’で、Zは、単一結合、または、
【0072】
【化17】



【0073】
からなる群から選択され、Ar1、Ar2、X1、X2、Y1、Y2、Y3、Y4、Y5、Y6、R1、R2、R3、R4、R5、R’及びR”についての説明は、本明細書の化学式1について説明したところを参照する。ここで、*及び****のうちいずれか一つは、ブリッジ・ユニットとの結合サイトを意味し、残りの一つは、表面ユニットとの結合サイトを意味する。
【0074】
表面ユニットは、デンドロン・ユニットに独立して連結されつつ、末端(表面)に位置するユニットであり、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択されうる。
【0075】
例えば、表面ユニットは、フェニル基、ハロフェニル基、シアノフェニル基、ビフェニル基、ジメチルフルオレニル基、カルバゾリル基またはジフェニルカルバゾリル基でありうる。
【0076】
以下、コア・ユニット、ブリッジ・ユニット及び前記化学式1で表現される作用基を含むデンドロン・ユニットを含むデンドリマーの詳細な例として、下記デンドリマー1〜5で表示される化合物を挙げることができる。しかし、前記デンドリマーが、それらの化合物に限定されるものではない。
【0077】
【化18】

・・・(デンドリマー1)
【0078】
【化19】

・・・(デンドリマー2)
【0079】
【化20】

・・・(デンドリマー3)
【0080】
【化21】

・・・(デンドリマー4)
【0081】
【化22】

・・・(デンドリマー5)
【0082】
本明細書で、非置換のC1−C50アルキル基は、線形及び分枝型であり、その非制限的な例としては、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、ペンチル基、iso−アミル基、ヘキシル基、ヘプチル基、オクチル基、ノナニル基、ドデシル基などを挙げることができる。前記C1−C50アルキル基のうち一つ以上の水素原子は、重水素原子、ハロゲン原子、シアノ基、アミノ基、アミジノ基、ニトロ基、ヒドロキシル基、ヒドラジニル基、ヒドラゾニル基、カルボン酸基やその塩、スルホン酸基やその塩、リン酸やその塩、C1−C30アルキル基、C1−C30アルコキシ基、C2−C30アルケニル基、C2−C30アルキニル基、C5−C20アリール基、C3−C20ヘテロアリール基、−N(Q1)(Q2)、及び−Si(Q3)(Q4)(Q5)で置換可能である。ここで、Q1〜Q5は、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、アミジノ基、ニトロ基、ヒドロキシル基、ヒドラジニル基、ヒドラゾニル基、カルボン酸基やその塩、スルホン酸基やその塩、リン酸やその塩、C1−C30アルキル基、C1−C30アルコキシ基、C2−C30アルケニル基、C2−C30アルキニル基、C5−C20アリール基、またはC3−C20ヘテロアリール基でありうる。
【0083】
本明細書で、非置換のC2−C50アルケニル基は、前記非置換のC2−C50アルキル基の中間か最末端に、一つ以上の炭素二重結合を含有しているものを意味する。その非制限的な例としては、エテニル基、プロフェニル基、ブテニル基などがある。それら非置換のC2−C50アルケニル基のうち少なくとも一つ以上の水素原子は、前述の置換されたC1−C50アルキル基の場合と同一の置換基で置換可能である。
【0084】
本明細書で、非置換のC2−C50アルキニル基は、前記定義されたようなC2−C50アルキル基の中間か最末端に、一つ以上の炭素三重結合を含有しているものを意味する。その非制限的な例としては、アセチレン基、プロピレン基、フェニルアセチレン基、ナフチルアセチレン基、イソプロピルアセチレン基、t−ブチルアセチレン基、ジフェニルアセチレン基などがある。それらアルキニル基のうち少なくとも一つ以上の水素原子は、前述の置換されたC1−C50アルキル基の場合と同一の置換基で置換可能である。
【0085】
本明細書で、非置換のC3−C50シクロアルキル基は、C3−C50環状のアルキル基を意味し、前記シクロアルキル基のうち一つ以上の水素原子は、前述のC1−C50アルキル基の置換基と同一の置換基で置換可能である。
【0086】
本明細書で、非置換のC1−C50アルコキシ基は、−OA(ここで、Aは、前述のような非置換のC1−C50アルキル基である)の構造を有する基を意味し、その非制限的な例としては、メトキシ基、エトキシ基、プロポキシ基、イソプロピルオキシ基、ブトキシ基、ペントキシ基などを挙げることができる。それらアルコキシ基のうち少なくとも一つ以上の水素原子は、前述のC1−C50アルキル基の場合と同一の置換基で置換可能である。
【0087】
本明細書で、非置換のC5−C50アリール基は、一つ以上の環を含む炭素環芳香族系を意味し、二つ以上の環を有する場合、互いに融合されたり、単一結合などを介して連結されうる。アリール基という用語は、フェニル基、ナフチル基、アントラセニル基のような芳香族系を含む。また、前記アリール基のうち一つ以上の水素原子は、前述のC1−C50アルキル基の置換基と同一の置換基で置換可能である。置換または非置換のC5−C30アリール基の例としては、フェニル基、C1−C10アルキルフェニル基(例えば、エチルフェニル基)、ハロフェニル基(例えば、o−,m−及びp−フルオロフェニル基、ジクロロフェニル基)、シアノフェニル基、ジシアノフェニル基、トリフルオロメトキシフェニル基、ビフェニル基、ハロビフェニル基、シアノビフェニル基、C1−C10アルキルビフェニル基、C1−C10アルコキシビフェニル基、o−,m−及びp−トリル基、o−,m−及びp−クメニル基、メシチル基、フェノキシフェニル基、(α,α−ジメチルベンゼン)フェニル基、(N,N”−ジメチル)アミノフェニル基、(N,N’−ジフェニル)アミノフェニル基、ペンタレニル基、インデニル基、ナフチル基、ハロナフチル基(例えば、フルオロナフチル基)、C1−C10アルキルナフチル基(例えば、メチルナフチル基)、C1−C10アルコキシナフチル基(例えば、メトキシナフチル基)、シアノナフチル基、アントラセニル基、アズレニル基、ヘプタレニル基、アセナフチレニル基、フェナレニル基、フルオレニル基、アントラキノリル基、メチルアントリル基、フェナントリル基、トリフェニレン基、ピレニル基、クリセニル基、エチル−クリセニル基、ピセニル基、ペリレニル基、クロロペリレニル基、ペンタフェニル基、ペンタセニル基、テトラフェニレニル基、ヘキサフェニル基、ヘキサセニル基、ルビセニル基、コロネリル基、トリナフチレニル基、ヘプタフェニル基、ヘプタセニル基、ピラントレニル基及びオバレニル基などを挙げることができる。
【0088】
本明細書で、非置換のC3−C50ヘテロアリール基は、N、O、PまたはSのうちから選択された1,2または3個のヘテロ原子を含み、2個以上の環を有する場合、それらは互いに融合されたり単一結合などを介して連結されうる。非置換のC3−C50ヘテロアリール基の例としては、ピラゾリル基、イミダゾリル基、オキサゾリル基、チアゾリル基、トリアゾリル基、テトラゾリル基、オキサジアゾリル基、ピリジニル基、ピリダジニル基、ピリミジニル基、トリアジニル基、カルバゾリル基、インドリル基、キノリニル基、イソキノリニル基などを挙げることができる。また、前記ヘテロアリール基のうち一つ以上の水素原子は、前述のC1−C50アルキル基の置換基と同一の置換基で置換可能である。
【0089】
本明細書で、非置換のC1−C50脂肪族炭化水素形態の作用基は、C1−C50直鎖状または分岐鎖状のアルキル基であり、その非制限的な例としては、メチル基、エチル基、n−プロピル基、i−プロピル基、n−ブチル基、s−ブチル基、i−ブチル基、t−ブチル基、ペンチル基、ヘキシル基、ヘプチル基、オクチル基、ノニル基、デカニル基などを挙げることができる。前記C1−C50脂肪族炭化水素形態の作用基のうち一つ以上の水素原子は、重水素原子、ハロゲン原子、シアノ基、アミノ基、アミジノ基、ニトロ基、ヒドロキシル基、ヒドラジニル基、ヒドラゾニル基、カルボン酸基やその塩、スルホン酸基やその塩、リン酸やその塩、C1−C30アルキル基、C1−C30アルコキシ基、C2−C30アルケニル基またはC2−C30アルキニル基でありうる。
【0090】
本明細書で、非置換のC5−C50芳香族炭化水素形態の作用基は、前述のC5−C50アリール基と同一であり、前述のC1−C50アルキル基の置換基と同一の置換基で置換可能である。
【0091】
本明細書で、非置換のC3−C50ヘテロ芳香族炭化水素形態の作用基は、前述のC3−C50ヘテロアリール基と同一であり、前述のC1−C50アルキル基の置換基と同一の置換基で置換可能である。
【0092】
本明細書で、互いに隣接した2個以上の置換基が、互いに結合して形成した飽和環または不飽和環は、一つ以上の芳香族環及び/または一つ以上の非芳香族環が互いに融合された2個以上の環を含んだ置換基を指すものであり、アリール基またはヘテロアリール基の例のうち一部以上がこれに該当しうる。
【0093】
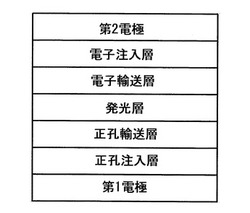
本発明の他の側面による有機発光素子は、第1電極と、前記第1電極に対向した第2電極と、前記第1電極と前記第2電極との間に介在された有機膜と、を具備し、前記有機膜は、前述のような化学式1のデンドロン・ユニットを含有するデンドリマーを含む。
【0094】
以下、一具現例による前記デンドリマーを含む有機発光素子について説明する。
【0095】
図1は、一具現例による有機発光素子の構造を示す断面図である。
【0096】
まず、基板上部に、大きい仕事関数を有するアノード電極用物質を、蒸着法またはスパッタリング法によって形成し、アノードとして使用する。ここで、基板としては、一般的な有機発光素子で使われる基板を使用するが、機械的強度、熱的安定性、透明性、表面平滑性、取扱容易性及び防水性にすぐれる有機基板、または透明プラスチック基板が望ましい。そして、アノード電極用物質としては、透明であって伝導性にすぐれる酸化インジウムスズ(ITO)、酸化インジウム亜鉛(IZO)、酸化スズ(SnO2)、酸化亜鉛(ZnO)などを使用する。
【0097】
その後、前記アノード電極の上部に、正孔注入層(EIL)物質を、真空蒸着法、スピンコーティング法、キャスト法、LB(Langmuir−Blodgett)法のような方法によって形成することができるが、均一な膜質を得やすく、またピン正孔(pin hole)が発生し難いというような点で、真空蒸着法によって形成することが望ましい。真空蒸着法によって正孔注入層を形成する場合、その蒸着条件は、正孔注入層の材料として使用する化合物、目的とする正孔注入層の構造及び熱的特性などによって異なるが、一般的に蒸着温度50〜500℃、真空度10−8〜10−3torr、蒸着速度0.01〜100Å/sec、膜厚は、通常10Å〜5μm範囲で適切に選択することが望ましい。前記正孔注入層物質としては、特別に制限されるものではなく、米国特許第4,356,429号明細書に開示された銅フタロシアニンのようなフタロシアニン化合物;スターバスト型アミン誘導体類である(4,4−トリ(N−カルバゾリル)トリフェニルアミン)(TCTA)、4,4’,4”−トリス(3−メチルフェニルフェニルアミノ)トリフェニルアミン(m−MTDATA)、1,3,5−トリス[4−(3−メチルフェニルフェニルアミノ)フェニル]ベンゼン(m−MTDAPB)(Advanced Material,6,p.677(1994))などを正孔注入層として使用することができる。
【0098】
次に、前記正孔注入層の上部に、正孔輸送層(ETL)物質を、真空蒸着法、スピンコーティング法、キャスト法、LB法のような方法によって形成することができるが、均一な膜質を得やすく、またピン正孔が発生い難いというような点で、真空蒸着法によって形成することができる。真空蒸着法によって正孔輸送層を形成する場合、その蒸着条件は、使用する化合物によって異なるが、一般的に正孔注入層の形成とほぼ同じ条件範囲で選択される。前記正孔輸送層物質は、特別に制限されるものではなく、化学式1のデンドロン・ユニットを含むデンドリマー化合物を使用したり、正孔輸送層に使われている公知の物質のうちから任意のものを選択して使用することができる。例えば、N−フェニルカルバゾール、ポリビニルカルバゾールのようなカルバゾール誘導体;N,N’−ビス(3−メチルフェニル)−N,N’−ジフェニル−[1,1−ビフェニル]−4,4’−ジアミン(TPD)、N,N’−ジ(ナフタレン−1−イル)−N,N’−ジフェニルベンジジン(α−NPD)などの芳香族縮合環を有する一般的なアミン誘導体などが使われる。正孔輸送層の厚みは、約50Å〜1,000Å、例えば100Å〜600Åでありうる。前記正孔輸送層の厚みが、前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な正孔輸送特性を得ることができる。
【0099】
前記正孔輸送層の上部に、発光層(EML)物質を、真空蒸着法、スピンコーティング法、キャスト法、LB法のような方法によって形成することができるが、均一な膜質を得やすく、またピン正孔が発生し難いというような点で、真空蒸着法によって形成することが望ましい。真空蒸着法によって発光層を形成する場合、その蒸着条件は、使用する化合物によって異なるが、一般的に正孔注入層の形成とほぼ同じ条件範囲で選択される。発光層材料は、特別に制限されるものではなく、化学式1のデンドロン・ユニットを含むデンドリマー化合物を単独として使用したり、またはホストとして使用することができる。
【0100】
前記化学式1のデンドロン・ユニットを含むデンドリマー化合物を発光ホストとして使用する場合、リン光ドーパントまたは蛍光ドーパントをともに使用して発光層を形成することができる。このとき、蛍光ドーパントとしては、出光社から購入可能なIDE102またはIDE105を使用することができ、リン光ドーパントとしては、緑色リン光ドーパントであるIr(ppy)3(ppy=フェニルピリジン)、Ir(ppy)2(acac)、Ir(mpyp)3、10−(2−ベンゾチアゾリル)−2,3,6,7−テトラヒドロ−1,1,7,7−テトラメチル−1H,5H,11H−(1)ベンゾピロピラノ(6,7−8−i,j)キノリジン−11−オン(C545T)などを使用することができ、青色リン光ドーパントとしては、F2Irpic、(F2ppy)2Ir(tmd)、Ir(dfppz)3、ter−フルオレン、4,4’−ビス(4−ジフェニルアミノスチリル)ビフェニル(DPAVBi)、2,5,8,11−テトラ−t−ブチルペリレン(TBP)などを使用でき、赤色リン光ドーパントとしては、PtOEP、Ir(piq)3、Btp2Ir(acac)、4−(ジシアノメチレン)−2−t−ブチル−6−(1,1,7,7−テトラメチルジュロリジル−9−エニル)−4H−ピラン(DCJTB)、UDC社のRD61などを使用できるが、これらに限定されるものではない。
【0101】
【化23】

【0102】
【化24】

C545T
【0103】
【化25】

【0104】
【化26】

DPAVBi
【0105】
【化27】

TBP
【0106】
【化28】

【0107】
ドーパントのドーピング濃度は、特別に制限されるものではないが、ホスト100重量部対比でドーパントの濃度は、0.01〜15重量部であることが望ましい。もしドーパントの含有量が0.01重量部未満である場合には、ドーパント量が十分ではなくして発色が正しく行われず、15重量部を超える場合には、濃度消光現象によって効率が急激に低下して望ましくない。発光層にリン光ドーパントと共に使用する場合には、三重項励起子または正孔が、電子輸送層に拡散する現象を防止するために、正孔抑制材料(HBL)をさらに、真空蒸着法またはスピンコーティング法によって積層させることができる。このとき、使用できる正孔抑制物質は、特別に制限されるものではなく、正孔抑制材料として使われている公知のものから任意のものを選択して利用することができる。例えば、オキサジアゾール誘導体、トリアゾール誘導体、フェナントロリン誘導体、または本明細書に参照として統合された特開平11−329734(A1)に記載されている正孔抑制材料などを挙げることができ、代表的なものとして、下記構造式のビス(2−メチル−8−キノリノラト)−(p−フェニルフェノラート)−アルミニウム(BAlq)、フェナントロリン系化合物(例:UDC社の2,9−ジメチル−4,7−ジフェニル−1,10−フェナントロリン(BCP))などが使われる。
【0108】
【化29】

【0109】
発光層の厚みは、約100Å〜1,000Å、例えば200Å〜600Åでありうる。発光層の厚みが、前記範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な発光特性を得ることができる。
【0110】
発光層がリン光ドーパントを含む場合、発光層に正孔抑制材料を入れるような目的で、三重項励起子または正孔が、電子輸送層に拡散する現象を防止するために、前記正孔抑制材料を含む正孔阻止層(HBL)を、発光層の上部に形成することもできる(図1には図示せず)。
【0111】
前記発光層の上部に、電子輸送層(ETL)が、真空蒸着法、またはスピンコーティング法、キャスト法などの方法で形成され、例えば真空蒸着法によって形成されうる。この電子輸送層材料は、電子注入電極から注入された電子を安定して輸送する機能を行うものであり、特別に制限されるものではなく、キノリン誘導体、特にトリス(8−キノリノラト)アルミニウム(Alq3)を使用することができる。また、電子輸送層の上部に、カソードから電子の注入を容易にする機能を有する物質である電子注入層(EIL)が積層され、それは、特別に材料を制限するものではない。電子注入層としては、LiF、NaCl、CsF、Li2O、BaOなどの物質を利用することができる。電子輸送層の厚みは、約100Å〜1,000Å、例えば100Å〜500Åでありうる。前記電子輸送層の厚みが、前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な電子輸送特性を得ることができる。
【0112】
前記正孔阻止層(HBL)、電子輸送層(ETL)、電子注入層(EIL)の蒸着条件は、使用する化合物によって異なるが、一般的に正孔注入層の形成とほぼ同じ条件範囲で選択される。
【0113】
最後に、電子注入層の上部に、カソード形成用金属を、真空蒸着法やスパッタリング法などの方法によって形成し、カソードとして使用する。ここで、カソード形成用金属としては、小さい仕事関数を有する金属、合金、電気伝導性化合物及びそれらの混合物を使用することができる。具体的な例としては、リチウム(Li)、マグネシウム(Mg)、アルミニウム(Al)、アルミニウム−リチウム(Al−Li)、カルシウム(Ca)、マグネシウム−インジウム(Mg−In)、マグネシウム−銀(Mg−Ag)などを挙げることができる。また、前面発光素子を得るために、ITO、IZOを使用した透過型カソードを使用することもできる。
【0114】
このように製造された有機発光素子は、図1に図示されたアノード、正孔注入層(HIL)、正孔輸送層(HTL)、発光層(EML)、電子輸送層(ETL)、電子注入層(EIL)、カソードの構造の有機発光素子だけではなく、多様な構造の有機発光素子の構造が可能であり、必要によって、1層または2層の中間層をさらに形成することも可能である。正孔注入層(HIL)、電子注入層(EIL)、正孔阻止層(HBL)などは、必ずしも必要なものではないが、それらの層を形成することによって、発光効率を向上させることができる。
【0115】
以下、1個以上のフルオレン基と、1個以上のフェノチアジン基とを側鎖として有し、化学式1を含むデンドリマーの合成例及び実施例を具体的に例示するが、これらに限定されるものではない。前記デンドリマーは、発光特性及び正孔伝達特性にすぐれる発光材料であり、青色発光材料、並びに緑色、赤色のリン光ホスト材料及び蛍光ホスト材料として有用であり、正孔輸送材料としても使用可能である。
【0116】
(合成例1)
(デンドリマー2の合成)
【化30】

【0117】
10H−フェノキサジン18.3g(100.0mmole)、ブロモエタン21.6g(200.0mmole)、Et3N 12.0g(120.0mmole)(600mL テトラヒドロフラン(THF)中)の混合物を、窒素雰囲気60℃で12時間撹拌した。反応物に水200mLを加え、酢酸エチル500mLで2回抽出した。有機層を乾燥、濾過、濃縮させて、カラムクロマトグラフィを利用し、化合物C−1を薄黄色液体として得た(18.2g、86%)。化合物の構造は、HR−MS(high resolution mass spectrometry)を利用して確認した(calc.;211.0997、found;211.0986)。
【0118】
化合物C−1(21.1g、100.0mmole)、ヨウ素13.4g(50.3mmole)、過ヨウ素酸2.2g(10.0mmole)に、85%酢酸400mLを加えた後、80℃で4時間加熱した。反応混合物をすぐに冷水500mLに注いで十分にかき混ぜた後でフィルタリングした。こされた固相を冷水で数回洗浄した後、さらにエチルエーテル400mLに溶かし、乾燥、濾過、濃縮させた後、カラムクロマトグラフィを利用して、化合物C−2をクリーム色固体として得た(25.2g、75.1%)。化合物の構造は、HRMSを利用して確認した(calc.;33.9964、found;336.9952)。
【0119】
化合物C−2(10.1g、30.0mmole)、化合物C−3(10.1g、39.0mmole)、NaOtBu 4.3g(45.0mmole)、Pd2(dba)3 1.4g(1.5mmole)、PtBu3(0.30g、1.5mmole)の混合物に、トルエン100mLを加え、窒素雰囲気、90℃で6時間加熱した。反応混合物を室温に冷やした後で水30mLを加え、塩化メチレン200mLで2回抽出した。有機層を乾燥、濾過、濃縮させて、カラムクロマトグラフィを利用し、化合物C−4を薄黄色固体として得た(8.38g、62%)。化合物の構造は、HRMSを利用して確認した(calc.;467。1998、found;467.1987)。
【0120】
化合物C−4(14.0g、30.0mmole)、化合物C−5(15.6g、39.0mmole)、NaOtBu 4.3g(45.0mmole)、Pd2(dba)3 1.4g(1.5mmole)、PtBu3(0.30g、1.5mmole)の混合物に、トルエン100mLを加え、窒素雰囲気、90℃で6時間加熱した。反応混合物を室温に冷やした後で水30mLを加え、塩化メチレン200mLで2回抽出した。有機層を乾燥、濾過、濃縮させて、カラムクロマトグラフィを利用し、化合物C−6を薄黄色固体として得た(17.1g、77%)。化合物の構造は、HRMSを利用して確認した(calc.;737.2042、found;737.2032)。
【0121】
化合物C−6(22.1g、30.0mmole)、ビス(ピナコラト)ジボロン(9.1g、36.0mmole)、Pd(dppf)Cl2(1.2g、0.05mole%)、KOtBu(3.5g、36.0mmole)の混合物に、トルエン100mLを加え、窒素雰囲気、90℃で6時間加熱した。反応混合物を室温に冷やした後で水50mLを加え、塩化メチレン300mLで2回抽出した。有機層を乾燥、濾過、濃縮させて、カラムクロマトグラフィを利用し、化合物C−7をクリーム色固体として得た(13.2g、56%)。化合物の構造は、HRMSを利用して確認した(calc.;785.3789、found;785.3774)。
【0122】
化合物C−8(1.56g、2.0mmole)、化合物C−7(12.7g、14.0mmole)、Pd(PPh3)4(0.69g、5mol%)、NaOH(4.8g、120mmole)(30mLのH2O中)に、THF100mLを加え、窒素雰囲気、70℃で36時間加熱した。反応混合物を室温に冷やした後で水50mLを加え、塩化メチレン300mLで2回抽出した。有機層を乾燥、濾過、濃縮させて、カラムクロマトグラフィと再結晶とを利用し、デンドリマー2をクリーム色固体として得た(2.97g、35%)。化合物の構造は、NMR(nuclear magnetic resonance)を利用して確認した。
【0123】
1H−NMR(CDCl3、400MHz)δ(ppm);1.24(t、18H)、1.87(s、36H)、3.32(q、12H)、6.87−7.96(m、162H)
【0124】
(合成例2)
(デンドリマー3の合成)
【0125】
【化31】

【0126】
デンドリマー2の合成法と同じ方法で、化合物C−7(3.9g、5.0mmole)と化合物C−9(0.54g、1.0mmole)とを利用し、デンドリマー3をクリーム色固体として得た(1.27g、56%)。化合物の構造は、NMRを利用して確認した。
【0127】
1H−NMR(CDCl3、400MHz)δ(ppm);1.28(t、9H)、1.77(s、18H)、3.23(q、6H)、6.87−7.96(m、90H)
【0128】
(合成例3)
(デンドリマー4の合成)
【化32】

【0129】
臭素(11.2mL、32.0g、220mmole)(80mLのCH2Cl2中)溶液を、−30℃でカルバゾール(16.7g、100.0mmole)(300mLのCH2Cl2中)溶液に30分にわたって滴加し、0℃で5時間撹拌した。反応混合物に、10%NaHCO3水溶液200mLを加え、塩化メチレン300mLで2回抽出した。有機層を乾燥、濾過、濃縮させて、カラムクロマトグラフィを利用し、化合物C−9を白色固体として得た(21.1g、65%)。化合物の構造は、HRMSを利用して確認した(calc.;322.8945、found;322.8945)。
【0130】
化合物C−9(16.5g、50.0mmole)、4−ヨードフェノール(44.0g、200.0mmole)、CuI(0.48g、0.05mole%)、18−C−6(商品名)(0.66g、0.05mole%)(400mLのDMF中)溶液を、130℃で12時間撹拌した。
【0131】
反応混合物に室温で塩化メチレン400mLを加え、水500mLで3回洗浄した。有機層を乾燥、濾過、濃縮させて、カラムクロマトグラフィを利用し、化合物C−10をクリーム色固体として得た(12.1g、58%)。化合物の構造は、HRMSを利用して確認した(calc.;414.9270、found;414.9270)。
【0132】
化合物C−4の合成法と同じ方法で、化合物C−11(20.9g、100.0mmole)と化合物C−2(33.7g、100.0mmole)とを利用し、化合物12を薄黄色固体として得た(32.6g、78%)。化合物の構造は、HRMSを利用して確認した(calc.;418.2045、found;418.2032)。
【0133】
化合物C−6の合成法と同じ方法で、化合物C−10(8.4g、20.0mmole)と化合物C−12(18.4g、44.0mmole)とを利用し、化合物C−13を薄黄色固体として得た(13.5g、62%)。化合物の構造は、HRMSを利用して確認した(calc.;1091.4774、found;1091.4762)。
【0134】
化合物C−13(10.9g、10.0mmole)、ペンタエリトリトールテトラブロマイド(770mg、2.0mmole)、95%NaH(480mg、20.0mmole)の混合物にTHF 80mLを加え、室温で1時間撹拌した後、50℃で6時間加熱した。反応混合物を室温に冷やした後で水30mLを加え、塩化メチレン100mLで2回抽出した。有機層を乾燥、濾過、濃縮させて、カラムクロマトグラフィと再結晶とを利用し、デンドリマー4をクリーム色固体として得た(3.20g、46%)。化合物の構造は、NMRを利用して確認した。
【0135】
1H−NMR(CDCl3、400MHz)δ(ppm);1.15(t、24H)、1.82(s、48H)、3.22(q、16H)、3.45(s、8H)、6.47−7.88(m、152H)
【0136】
(合成例4)
【化33】

【0137】
デンドリマー4の合成法と同じ方法で、化合物C−13(5.5g、5.0mmole)と化合物C−14(0.35g、1.0mmole)とを利用し、デンドリマー5をクリーム色固体として得た(1.88g、55%)。化合物の構造は、NMRを利用して確認した。
【0138】
1H−NMR(CDCl3、400MHz)δ(ppm);1.18(t、18H)、1.82(s、36H)、3.33(q、12H)、5.53(s、6H)、6.87−7.96(m、117H)
【0139】
(実施例1)
アノードは、コーニング(Corning)15Ω/cm2(1,200Å)ITOガラス基板を、50mmx50mmx0.7mmサイズに切り、イソプロピルアルコールと純水との中でそれぞれ5分間超音波洗浄した後、30分間紫外線を照射してオゾンに露出させて洗浄し、真空蒸着装置にこのガラス基板を設けた。
【0140】
前記基板上部に、ポリエチレンジヒドロキシチオフェン(PEDOT)/PSS(ポリ(スチレンスルホン酸))(H.C.Starck社製)水溶液をスピンコーティングし、40nm厚の正孔注入層を形成した。次に、前記正孔注入層上に、デンドリマー2を80nm厚の正孔輸送層としてスピンコーティングして形成した。次に、前記正孔輸送層の上部に、公知の緑色蛍光ホストであるlq3と、公知の緑色蛍光ドーパントであるC545Tを、重量比98:2で同時蒸着し、300Å厚に発光層を形成した。
【0141】
次に、前記発光層の上部に、電子輸送層としてAlq3を、300Å厚に蒸着した後、前記電子輸送層の上部に、電子注入層としてハロゲン化アルカリ金属であるLiFを10Å厚に蒸着し、Alを3,000Å(カソード電極)厚に真空蒸着し、LiF/Al電極を形成することによって、有機発光素子を製造した。
【0142】
この素子は、電流密度50mA/cm2で駆動電圧5.23V、発光輝度8,774cd/m2の高輝度を示し、色座標は、(0.315,0.682)であり、発光効率は、17.11cd/Aであった。
【0143】
(実施例2)
前記正孔輸送層の形成時、前記デンドリマー2の代わりに、デンドリマー3を利用したことを除いては、実施例1と同一に行って有機発光素子を製作した。
【0144】
この素子は、電流密度50mA/cm2で駆動電圧5.67V、発光輝度8,445cd/m2の高輝度を示し、色座標は、(0.310,0.643)であり、発光効率は、16.89cd/Aであった。
【0145】
(実施例3)
前記正孔輸送層の形成時、前記デンドリマー2の代わりに、デンドリマー4を利用したことを除いては、実施例1と同一に行って有機発光素子を製作した。
【0146】
この素子は、電流密度50mA/cm2で駆動電圧5.52V、発光輝度8,623cd/m2の高輝度を示し、色座標は、(0.301,0.665)であり、発光効率は、17.24cd/Aであった。
【0147】
(実施例4)
前記正孔輸送層の形成時、前記デンドリマー2の代わりに、デンドリマー5を利用したことを除いては、実施例1と同一に行って有機発光素子を製作した。
【0148】
この素子は、電流密度50mA/cm2で駆動電圧5.24V、発光輝度8,551cd/m2の高輝度を示し、色座標は、(0.301,0.663)であり、発光効率は、17.10cd/Aであった。
【0149】
(実施例5)
正孔注入層(PEDOT/PSS)上部に、正孔輸送層の代わりに、デンドリマー2を公知の緑色蛍光ドーパントであるC545Tと、重量比98:2で混合した後、30nm厚の発光層をスピンコーティングして形成した。次に、前記発光層の上部に、電子輸送層として、Alq3を300Å厚に蒸着した後、前記電子輸送層の上部に、電子注入層として、ハロゲン化アルカリ金属であるLiFを10Å厚に蒸着し、Alを3,000Å(カソード電極)厚に真空蒸着し、LiF/Al電極を形成することによって、有機発光素子を製造した。
【0150】
この素子は、電流密度50mA/cm2で駆動電圧6.25V、発光輝度7,725cd/m2の高輝度を示し、色座標は、(0.320,0.643)であり、発光効率は、15.45cd/Aであった。
【0151】
(比較例1)
正孔輸送層を形成しないことを除いては、実施例1と同一に行って有機発光素子を製作した。
【0152】
この素子は、電流密度50mA/cm2で駆動電圧7.55V、発光輝度6,002cd/m2を示し、色座標は、(0.319,0.652)とほぼ同一であり、発光効率は、12.0cd/Aであった。
【0153】
前記有機発光素子の色座標、輝度、発光効率などを測定し、下記表1に示した。
【0154】
【表1】

【0155】
実施例1〜5の有機発光素子は、比較例1の有機発光素子に比べて、駆動電圧が1V以上低くなり、効率が大幅に向上した優秀なI−V−L特性を示した。特に、寿命改善効果が卓越しており、実施例1〜4の場合は、比較例1対比で、が100%以上向上するという結果を示した。また、デンドリマー化合物を発光層材料として有機発光素子に使用した結果、駆動電圧が低くなって効率が向上するという特性を与え、寿命は、同等なレベルの結果となった。
【0156】
以上、添付図面を参照しながら本発明の好適な実施形態について詳細に説明したが、本発明はかかる例に限定されない。本発明の属する技術の分野における通常の知識を有する者であれば、特許請求の範囲に記載された技術的思想の範疇内において、各種の変更例または修正例に想到し得ることは明らかであり、これらについても、当然に本発明の技術的範囲に属するものと了解される。
【符号の説明】
【0157】
【技術分野】
【0001】
本発明は、デンドリマー及びこれを用いた有機発光素子に関する。
【背景技術】
【0002】
一般的な有機発光素子は、基板上部にアノードが形成されており、このアノード上部に、正孔輸送層、発光層、電子輸送層及びカソードが順次に形成されている構造を有している。ここで、正孔輸送層、発光層及び電子輸送層は、有機化合物からなる有機薄膜である。
【0003】
有機発光素子は、蛍光またはリン光の有機膜に電流を流せば、電子と正孔とが有機膜で結合しつつ光が発生する現象を利用した自発光型兄ディスプレイであり、軽量化、簡素な部品、簡単な製作工程、高画質及び高色純度の具現可能、低消費電力消耗、及び動映像の完壁具現のような多様な長所によって、現在活発な研究が行われている。このような有機発光素子において、アノードとカソードとの間には、有機発光層以外に、正孔注入層及び正孔輸送層のような正孔関連層、及び電子輸送層及び電子注入層のような電子関連層を何層か具備することができる。
【0004】
現在、有機発光素子の製作方式は、蒸着方式と湿式方式とに大別される。蒸着方式に使われる有機材料は、工程特定上、一般的に分子量1,000以下の材料に限定される。フルオレン系を含んだ低分子化合物を利用して、蒸着工程で作られた有機発光素子は、その有機発光特性が向上すると周知されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】韓国特許出願公開第2005−0097670号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかし、かような蒸着用低分子材料(フルオレン系を含む)を利用して、湿式工程によって有機発光素子を製作するとき、さまざまな問題点が発生する。代表的なものとして、膜を形成した後、乾燥過程で発生する結晶化現象である。いったん結晶化現象が発生すれば、発生地点がシードになって、その面積が拡大され、この部分は、素子において暗点(dark spot)として残る。かような現象を防止するためには、サイズの大きい置換体や結晶化があまり起こらない置換体を導入するか、あるいは材料自体の分子量を数千まで大きくし、分子間の整列あるいは配列を最大限防止しなければならない。材料の分子量自体を大きくする方策として、デンドリマーあるいは高分子重合体を考慮することができる。
【0007】
高分子重合体は、その合成方法及び精製方法が困難であり、何よりも分子量の分布を有する混合物であるために、発光特性を決定づけるエネルギー準位、熱特性のようなその物性調節が困難である。これに対して、デンドリマーは、合成方法や精製方法が高分子に比べて相対的に容易であり、単一化合物であるから、分子構造の調節が容易であり、有機発光特性に影響を与えるさまざまな物理的特性の調節が可能である。
【0008】
このために、新規のデンドリマーを利用した有機発光素子の開発が必要である。そこで、本発明は、上記問題に鑑みてなされたものであり、本発明の目的とするところは、優秀な電気的安定性、高い電荷輸送能及び高い発光能を有することが可能な、新規かつ改良されたデンドリマー及びこれを用いた有機発光素子を提供することにある。
【課題を解決するための手段】
【0009】
上記課題を解決するために、本発明のある観点によれば、コア・ユニット、ブリッジ・ユニット及びデンドロン・ユニットを含み、前記コア・ユニットは、置換または非置換のC1−C50脂肪族炭化水素、置換または非置換のC5−C50芳香族炭化水素、及び置換または非置換のC3−C50ヘテロ芳香族炭化水素からなる群から選択される三価あるいは四価の作用基を含み、前記ブリッジ・ユニットは、置換または非置換のC5−C50芳香族炭化水素、及び置換または非置換のC3−C50ヘテロ芳香族炭化水素からなる群から選択される二価あるいは三価の作用基を含み、前記デンドロン・ユニットは、下記化学式1で表示される一価のフルオレン系作用基を含むデンドリマーが提供される。
【0010】
【化1】

・・・(化学式1)
前記化学式1で、Zは、単一結合、または、
【0011】
【化2】



【0012】
からなる群から選択され、Ar1及びAr2は互いに独立して、単一結合、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択され、X1及びX2は互いに独立して、窒素(N)、ホウ素(B)及びリン(P)からなる群から選択され、X’は、酸素(O)、硫黄(S)、SO2及びCH2からなる群から選択され、Y1、Y2、Y3、Y4、Y5及びY6は互いに独立して、単一結合、置換または非置換のC1−C50アルキレン基、置換または非置換のC2−C50アルケニレン基、置換または非置換のC2−C50アルキニレン基、置換または非置換のC3−C50シクロアルキレン基、置換または非置換のC1−C50アルコキシレン基、置換または非置換のC5−C50アリーレン基、及び置換または非置換のC3−C50ヘテロアリーレン基からなる群から選択され、R1、R2、R3、R4及びR5は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、カルボン酸基、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択され、R’及びR”は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、カルボン酸基、置換または非置換のC1−C50アルキル基、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択され、R1、R2、R3、R4、R5、R’及びR”で、互いに隣接した2個以上は、結合して飽和環または不飽和環を形成することができ、*は、Ar1、Z及びフルオレン基のうちいずれか一つが、ブリッジ・ユニットと結合するサイトである。
【0013】
前記デンドリマーの数平均分子量は、1,000〜300,000でありうる。
【0014】
前記デンドリマーは、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択される表面ユニットを、前記デンドロン・ユニットの末端位置にさらに含むことができる。
【0015】
本発明の他の側面によって、1対の電極と、それらの間に介在された有機膜と、を含み、前記有機膜が前述のデンドリマーを含む有機発光素子が提供される。
【発明の効果】
【0016】
本発明による新規のデンドリマーは、電気的な安定性、電荷輸送能及び発光能にすぐれ、有機溶媒に溶解されて正孔注入層または正孔輸送層を形成することによって、容易に有機発光素子を製造することができる。
【0017】
本発明による前記新規のデンドリマーを利用して製造された有機発光素子は、発光効率及び輝度が優秀である。
【図面の簡単な説明】
【0018】
【図1】一具現例による有機発光素子の構造を示した図面である。
【発明を実施するための形態】
【0019】
以下に添付図面を参照しながら、本発明の好適な実施の形態について詳細に説明する。なお、本明細書及び図面において、実質的に同一の機能構成を有する構成要素については、同一の符号を付することにより重複説明を省略する。
【0020】
本発明の一側面によるデンドリマーは、コア・ユニット、ブリッジ・ユニット及びデンドロン・ユニットを含み、前記コア・ユニットは、飽和された置換または非置換のC1−C50脂肪族炭化水素、置換または非置換のC5−C50芳香族炭化水素、及び置換または非置換のC3−C50ヘテロ芳香族炭化水素からなる群から選択される三価あるいは四価の作用基を含み、前記ブリッジ・ユニットは、置換または非置換のC5−C50芳香族炭化水素、及び置換または非置換のC3−C50ヘテロ芳香族炭化水素からなる群から選択される二価あるいは三価の作用基を含み、前記デンドロン・ユニットは、下記化学式1で表示される一価のフルオレン系作用基を含むことができる:
【0021】
【化3】

・・・(化学式1)
【0022】
前記化学式1で、Zは、単一結合、または、
【0023】
【化4】



【0024】
からなる群から選択されうる。ただし、Zがブリッジ・ユニットと結合する場合、Zは、二価の酸化状態を有するものでありうる。以下、Zがブリッジ・ユニットと結合する場合には、二価の酸化状態を有するものと考慮する。
【0025】
デンドリマー(dendrimer)とは、コア・ユニットから樹枝状の一定の単位構造が規則的に反復されて伸びてくる構造の物質を意味する。デンドリマーは、全体球形構造の中心に位置するコア・ユニット、コアを中心に一定に反復されて伸びていく単位構造であるブリッジ・ユニット、及び前記ブリッジ・ユニットと連結され、コア・ユニットの反対側に位置したデンドロン(dendron)・ユニットを含む。
【0026】
一具現例によるデンドリマーは、三価あるいは四価の酸化状態を有するコア・ユニットが、全体球形構造の中心に位置しており、前記コア・ユニットにブリッジ・ユニットが追加されつつ、世代(generation)が増加し、ブリッジ・ユニットと連結される末端に、デンドロン・ユニットが位置している。
【0027】
前記デンドロン・ユニットは、化学式1で表示される一価のフルオレン系作用基を含むことができる。
【0028】
化学式1で、Ar1及びAr2は互いに独立して、単一結合、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択されうる。ただし、Ar1がブリッジ・ユニットと結合する場合、Ar1は、二価の酸化状態を有し、C5−C50アリーレン基、及び置換または非置換のC3−C50ヘテロアリーレン基からなる群から選択されうる。以下、Ar1がブリッジ・ユニットと結合する場合には、二価の酸化状態を有するものと考慮する。
【0029】
Ar1及びAr2は互いに独立して、単一結合、フェニル基、ハロフェニル基、シアノフェニル基、フェノキシフェニル基、C1−C15アルキルフェニル基、ジ(C1−C15アルキル)フェニル基、C1−C15アルコキシフェニル基、ジ(C1−C15アルコキシ)フェニル基、C5−C15アリールフェニル基、ジ(C5−C15アリール)フェニル基、ナフチル基、ハロナフチル基、シアノナフチル基、フェノキシナフチル基、C1−C15アルキルナフチル基、ジ(C1−C15アルキル)ナフチル基、C1−C15アルコキシナフチル基、ジ(C1−C15アルコキシ)ナフチル基、C5−C15アリールナフチル基、ジ(C5−C15アリール)ナフチル基、アントリル基、ハロアントリル基、シアノアントリル基、フェノキシアントリル基、C1−C15アルキルアントリル基、ジ(C1−C15アルキル)アントリル基、C1−C15アルコキシアントリル基、ジ(C1−C15アルコキシ)アントリル基、C5−C15アリールアントリル基、ジ(C5−C15アリール)アントリル基、フェナントリル基、ハロフェナントリル基、シアノフェナントリル基、フェノキシフェナントリル基、C1−C15アルキルフェナントリル基、ジ(C1−C15アルキル)フェナントリル基、C1−C15アルコキシフェナントリル基、ジ(C1−C15アルコキシ)フェナントリル基、C5−C15アリールフェナントリル基、ジ(C5−C15アリール)フェナントリル基、フルオレニル基、ハロフルオレニル基、シアノフルオレニル基、フェノキシフルオレニル基、C1−C15アルキルフルオレニル基、ジ(C1−C15アルキル)フルオレニル基、C1−C15アルコキシフルオレニル基、ジ(C1−C15アルコキシ)フルオレニル基、C5−C15アリールフルオレニル基、ジ(C5−C15アリール)フルオレニル基、ピリジル基、ハロピリジル基、シアノピリジル基、フェノキシピリジル基、C1−C15アルキルピリジル基、ジ(C1−C15アルキル)ピリジル基、C1−C15アルコキシピリジル基、ジ(C1−C15アルコキシ)ピリジル基、C5−C15アリールピリジル基、ジ(C5−C15アリール)ピリジル基、ピレニル基、ハロピレニル基、シアノピレニル基、フェノキシピレニル基、C1−C15アルキルピレニル基、ジ(C1−C15アルキル)ピレニル基、C1−C15アルコキシピレニル基、ジ(C1−C15アルコキシ)ピレニル基、C5−C15アリールピレニル基、ジ(C5−C15アリール)ピレニル基、フェナントロリニル基、ハロフェナントロリニル基、シアノフェナントロリニル基、フェノキシフェナントロリニル基、C1−C15アルキルフェナントロリニル基、ジ(C1−C15アルキル)フェナントロリニル基、C1−C15アルコキシフェナントロリニル基、ジ(C1−C15アルコキシ)フェナントロリニル基、C5−C15アリールフェナントロリニル基、ジ(C5−C15アリール)フェナントロリニル基、キノリニル基、ハロキノリニル基、シアノキノリニル基、フェノキシキノリニル基、C1−C15アルキルキノリニル基、ジ(C1−C15アルキル)キノリニル基、C1−C15アルコキシキノリニル基、ジ(C1−C15アルコキシ)キノリニル基、C5−C15アリールキノリニル基、ジ(C5−C15アリール)キノリニル基、カルバゾリル基、ハロカルバゾリル基、シアノカルバゾリル基、フェノキシカルバゾリル基、C1−C15アルキルカルバゾリル基、ジ(C1−C15アルキル)カルバゾリル基、C1−C15アルコキシカルバゾリル基、ジ(C1−C15アルコキシカルバゾリル基)、C5−C15アリールカルバゾリル基及びジ(C5−C15アリール)カルバゾリル基からなる群から選択されうるが、これらに限定されるものではない。
【0030】
例えば、Ar1及びAr2は互いに独立して、単一結合、フェニル基、ハロフェニル基、シアノフェニル基、ビフェニル基、ジメチルフルオレニル基、カルバゾリル基またはジフェニルカルバゾリル基でありうる。
【0031】
化学式1で、X1及びX2は互いに独立して、窒素(N)、ホウ素(B)及びリン(P)からなる群から選択されうる。例えば、X1及びX2は、いずれも窒素(N)でありうる。
【0032】
また、X’は、酸素(O)、硫黄(S)、SO2及びCH2からなる群から選択されうる。例えばX’は、硫黄(S)でありうる。
【0033】
化学式1で、Y1〜Y6は互いに独立して、単一結合、置換または非置換のC1−C50アルキレン基、置換または非置換のC2−C50アルケニレン基、置換または非置換のC2−C50アルキニレン基、置換または非置換のC3−C50シクロアルキレン基、置換または非置換のC1−C50アルコキシレン基、置換または非置換のC5−C50アリーレン基、及び置換または非置換のC3−C50ヘテロアリーレン基からなる群から選択されうる。
【0034】
Y1〜Y6は互いに独立して、単一結合、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、フェニル基、メチルフェニル基、エチルフェニル基、o−,m−及びp−フルオロフェニル基、ジクロロフェニル基、シアノフェニル基、ジシアノフェニル基、トリフルオロメトキシフェニル基、ビフェニル基、ハロビフェニル基、シアノビフェニル基、メチルビフェニル基、エチルビフェニル基、メトキシビフェニル基、エトキシビフェニル基からなる群から選択されうる。
【0035】
例えば、Y1〜Y6は互いに独立して、単一結合、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、フェニル基またはジフェニル基でありうる。
【0036】
化学式1で、R1〜R5は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、カルボン酸基、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択され、R’及びR”は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、カルボン酸基、置換または非置換のC1−C50アルキル基、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択され、R1、R2、R3、R4、R5、R’及びR”で、互いに隣接した2個以上は、結合して飽和環または不飽和環を形成することができる。
【0037】
R1、R2、R3、R4、R5、R’及びR”は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、フェニル基、メチルフェニル基、エチルフェニル基、o−,m−及びp−フルオロフェニル基、ジクロロフェニル基、シアノフェニル基、ジシアノフェニル基、トリフルオロメトキシフェニル基、ビフェニル基、ハロビフェニル基、シアノビフェニル基、メチルビフェニル基、エチルビフェニル基、メトキシビフェニル基、エトキシビフェニル基からなる群から選択されうる。
【0038】
例えば、R1、R2、R3、R4、R5、R’及びR”は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、フェニル基またはビフェニル基でありうる。
【0039】
化学式1で、*は、Ar1、Z及びフルオレン基のうちいずれか一つが、ブリッジ・ユニットと結合するサイトを意味する。例えば*は、化学式1のAr1がブリッジ・ユニットと結合するサイトであったり、Zがブリッジ・ユニットと結合するサイトであったり、またはフルオレン基がブリッジ・ユニットと結合するサイトでありうる。
【0040】
前記化学式1で表示される一価のフルオレン系作用基は、1個以上のフルオレン構造と、1個のフェノチアジン構造を有することができ、有機発光素子の有機膜に使われうる。
【0041】
フェノチアジン基は、X’の選択(O、S、SO2またはCH2)によって、発光層として、あるいは正孔輸送材料としてのバンドギャップ調節が容易である。従って、フェノチアジン基を含む化合物は、有機発光素子内で優秀な電気的特性を示し、発光輝度及び長寿命に有利である。また、化合物内のアミン基に連結されたカルバゾール基は、正孔の注入及び輸送に有利であり、電気的安定性の側面で有利である。フルオレン基は、一重項転移を円滑にする。従って、フルオレン基を含む化合物を、有機発光素子の発光層として使用すれば、蛍光強度を向上させて高い発光輝度を示し、蛍光ドーパントまたはリン光ドーパントのホスト材料として使用すれば、ドーパントへのエネルギー転移量を増加させ、高い発光輝度を示すことになる。また、フルオレン基は、R1及びR2の選択によって、溶媒に対する溶解度を調節でき、湿式工程でさらに有利である。
【0042】
例えば、デンドロン・ユニットは、下記化学式で表示された作用基のうちから選択されるものを含むことができる。
【0043】
【化5】

【0044】
【化6】

【0045】
【化7】

【0046】
【化8】

【0047】
前記化学式で、*は、ブリッジ・ユニットとの結合サイトを意味する。
【0048】
一具現例によるデンドリマーは、前記デンドロン・ユニットとの連結部品に、世代を増加させることができるブリッジ・ユニットが位置している。
【0049】
前記ブリッジ・ユニットは、二価あるいは三価の酸化状態を有し、その結合サイトは、隣接するコア・ユニットまたはデンドロン・ユニットと結合することができ、ブリッジ・ユニットがいくつか連続して連結された構造である場合には、ブリッジ・ユニットとも結合することができる。
【0050】
ブリッジ・ユニットは、互いに隣接するユニットを連結することができる二価あるいは三価の連結基であるならば、特別に制限されるものではないが、フルオレン系作用基を含むデンドロン・ユニットと反応する過程で、所望しない副反応が起こらないように選択することができ、最終生成物の安定性側面で、O及びSを含むことができる。
【0051】
ブリッジ・ユニットは、置換または非置換のC5−C50芳香族炭化水素、及び置換または非置換のC3−C50ヘテロ芳香族炭化水素からなる群から選択される二価あるいは三価の作用基を含むことができ、具体的には、一部水素原子が酸素原子または窒素原子で置換され、カルバゾール基を含むC3−C50ヘテロ芳香族炭化水素でありうる。
【0052】
例えば、ブリッジ・ユニットは、下記化学式で表示される作用基のうちから選択されるものを含むことができる:
【0053】
【化9】

【0054】
【化10】

【0055】
【化11】

【0056】
【化12】

【0057】
前記化学式で、**は、隣接ユニットとの結合サイトを意味する。**は、コア・ユニットとの結合サイトであったり、デンドロン・ユニットとの結合サイトであったり、またはブリッジ・ユニットとの結合サイトでありうる。**がブリッジ・ユニットとの結合サイトである場合、ブリッジ・ユニットが連続して連結している場合を示す。
【0058】
一具現例によるデンドリマーは、全体球形構造の中心に、前記ブリッジ・ユニットと連結されるコア・ユニットが位置している。
【0059】
前記コア・ユニットは、三価あるいは四価の酸化状態を有し、その結合サイトは、いずれもブリッジ・ユニットと結合することができる。
【0060】
コア・ユニットは、置換または非置換のC1−C50脂肪族炭化水素、置換または非置換のC5−C50芳香族炭化水素、及び置換または非置換のC3−C50ヘテロ芳香族炭化水素からなる群から選択される三価あるいは四価の作用基を含むことができる。
【0061】
例えば、コア・ユニットは、下記化学式で表示される作用基のうちから選択されるものを含むことができる:
【0062】
【化13】

【0063】
【化14】

【0064】
【化15】

【0065】
前記化学式で、***は、ブリッジ・ユニットとの結合サイトを意味する。
【0066】
前記コア・ユニット、前記ブリッジ・ユニット及び前記デンドロン・ユニットを含むデンドリマーの数平均分子量は、1,000〜300,000でありうる。
【0067】
デンドリマーの分枝化度は、コア・ユニット、ブリッジ・ユニット及びデンドロン・ユニットの総数に対するコア・ユニットとデンドロン・ユニットとの総数の比を意味する。例えば、もし分枝化度が0であるならば、コア・ユニットとデンドロン・ユニットとが全く存在せずに、ブリッジ・ユニットのみ存在する線形分子を意味し、分枝化度が1であるならば、ブリッジ・ユニットが存在せず、デンドロン・ユニットも存在しなくなる。分枝化度は、核磁気共鳴(NMR)スペクトルで、それぞれコア・ユニット、ブリッジ・ユニット及びデンドロン・ユニットに関連したピークの積分値比から計算可能である。前記デンドリマーの分枝化度は、反応温度、反応時間、溶媒条件などによって変化しうる。
【0068】
一具現例によるデンドリマーは、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択される表面ユニットをさらに含むことができる。
【0069】
例えば、前記デンドリマーは、下記化学式1’で表示されるフルオレン系作用基に連結された表面ユニットをさらに含むことができる:
【0070】
【化16】

・・・(化学式1’)
【0071】
前記化学式1’で、Zは、単一結合、または、
【0072】
【化17】



【0073】
からなる群から選択され、Ar1、Ar2、X1、X2、Y1、Y2、Y3、Y4、Y5、Y6、R1、R2、R3、R4、R5、R’及びR”についての説明は、本明細書の化学式1について説明したところを参照する。ここで、*及び****のうちいずれか一つは、ブリッジ・ユニットとの結合サイトを意味し、残りの一つは、表面ユニットとの結合サイトを意味する。
【0074】
表面ユニットは、デンドロン・ユニットに独立して連結されつつ、末端(表面)に位置するユニットであり、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択されうる。
【0075】
例えば、表面ユニットは、フェニル基、ハロフェニル基、シアノフェニル基、ビフェニル基、ジメチルフルオレニル基、カルバゾリル基またはジフェニルカルバゾリル基でありうる。
【0076】
以下、コア・ユニット、ブリッジ・ユニット及び前記化学式1で表現される作用基を含むデンドロン・ユニットを含むデンドリマーの詳細な例として、下記デンドリマー1〜5で表示される化合物を挙げることができる。しかし、前記デンドリマーが、それらの化合物に限定されるものではない。
【0077】
【化18】

・・・(デンドリマー1)
【0078】
【化19】

・・・(デンドリマー2)
【0079】
【化20】

・・・(デンドリマー3)
【0080】
【化21】

・・・(デンドリマー4)
【0081】
【化22】

・・・(デンドリマー5)
【0082】
本明細書で、非置換のC1−C50アルキル基は、線形及び分枝型であり、その非制限的な例としては、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、ペンチル基、iso−アミル基、ヘキシル基、ヘプチル基、オクチル基、ノナニル基、ドデシル基などを挙げることができる。前記C1−C50アルキル基のうち一つ以上の水素原子は、重水素原子、ハロゲン原子、シアノ基、アミノ基、アミジノ基、ニトロ基、ヒドロキシル基、ヒドラジニル基、ヒドラゾニル基、カルボン酸基やその塩、スルホン酸基やその塩、リン酸やその塩、C1−C30アルキル基、C1−C30アルコキシ基、C2−C30アルケニル基、C2−C30アルキニル基、C5−C20アリール基、C3−C20ヘテロアリール基、−N(Q1)(Q2)、及び−Si(Q3)(Q4)(Q5)で置換可能である。ここで、Q1〜Q5は、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、アミジノ基、ニトロ基、ヒドロキシル基、ヒドラジニル基、ヒドラゾニル基、カルボン酸基やその塩、スルホン酸基やその塩、リン酸やその塩、C1−C30アルキル基、C1−C30アルコキシ基、C2−C30アルケニル基、C2−C30アルキニル基、C5−C20アリール基、またはC3−C20ヘテロアリール基でありうる。
【0083】
本明細書で、非置換のC2−C50アルケニル基は、前記非置換のC2−C50アルキル基の中間か最末端に、一つ以上の炭素二重結合を含有しているものを意味する。その非制限的な例としては、エテニル基、プロフェニル基、ブテニル基などがある。それら非置換のC2−C50アルケニル基のうち少なくとも一つ以上の水素原子は、前述の置換されたC1−C50アルキル基の場合と同一の置換基で置換可能である。
【0084】
本明細書で、非置換のC2−C50アルキニル基は、前記定義されたようなC2−C50アルキル基の中間か最末端に、一つ以上の炭素三重結合を含有しているものを意味する。その非制限的な例としては、アセチレン基、プロピレン基、フェニルアセチレン基、ナフチルアセチレン基、イソプロピルアセチレン基、t−ブチルアセチレン基、ジフェニルアセチレン基などがある。それらアルキニル基のうち少なくとも一つ以上の水素原子は、前述の置換されたC1−C50アルキル基の場合と同一の置換基で置換可能である。
【0085】
本明細書で、非置換のC3−C50シクロアルキル基は、C3−C50環状のアルキル基を意味し、前記シクロアルキル基のうち一つ以上の水素原子は、前述のC1−C50アルキル基の置換基と同一の置換基で置換可能である。
【0086】
本明細書で、非置換のC1−C50アルコキシ基は、−OA(ここで、Aは、前述のような非置換のC1−C50アルキル基である)の構造を有する基を意味し、その非制限的な例としては、メトキシ基、エトキシ基、プロポキシ基、イソプロピルオキシ基、ブトキシ基、ペントキシ基などを挙げることができる。それらアルコキシ基のうち少なくとも一つ以上の水素原子は、前述のC1−C50アルキル基の場合と同一の置換基で置換可能である。
【0087】
本明細書で、非置換のC5−C50アリール基は、一つ以上の環を含む炭素環芳香族系を意味し、二つ以上の環を有する場合、互いに融合されたり、単一結合などを介して連結されうる。アリール基という用語は、フェニル基、ナフチル基、アントラセニル基のような芳香族系を含む。また、前記アリール基のうち一つ以上の水素原子は、前述のC1−C50アルキル基の置換基と同一の置換基で置換可能である。置換または非置換のC5−C30アリール基の例としては、フェニル基、C1−C10アルキルフェニル基(例えば、エチルフェニル基)、ハロフェニル基(例えば、o−,m−及びp−フルオロフェニル基、ジクロロフェニル基)、シアノフェニル基、ジシアノフェニル基、トリフルオロメトキシフェニル基、ビフェニル基、ハロビフェニル基、シアノビフェニル基、C1−C10アルキルビフェニル基、C1−C10アルコキシビフェニル基、o−,m−及びp−トリル基、o−,m−及びp−クメニル基、メシチル基、フェノキシフェニル基、(α,α−ジメチルベンゼン)フェニル基、(N,N”−ジメチル)アミノフェニル基、(N,N’−ジフェニル)アミノフェニル基、ペンタレニル基、インデニル基、ナフチル基、ハロナフチル基(例えば、フルオロナフチル基)、C1−C10アルキルナフチル基(例えば、メチルナフチル基)、C1−C10アルコキシナフチル基(例えば、メトキシナフチル基)、シアノナフチル基、アントラセニル基、アズレニル基、ヘプタレニル基、アセナフチレニル基、フェナレニル基、フルオレニル基、アントラキノリル基、メチルアントリル基、フェナントリル基、トリフェニレン基、ピレニル基、クリセニル基、エチル−クリセニル基、ピセニル基、ペリレニル基、クロロペリレニル基、ペンタフェニル基、ペンタセニル基、テトラフェニレニル基、ヘキサフェニル基、ヘキサセニル基、ルビセニル基、コロネリル基、トリナフチレニル基、ヘプタフェニル基、ヘプタセニル基、ピラントレニル基及びオバレニル基などを挙げることができる。
【0088】
本明細書で、非置換のC3−C50ヘテロアリール基は、N、O、PまたはSのうちから選択された1,2または3個のヘテロ原子を含み、2個以上の環を有する場合、それらは互いに融合されたり単一結合などを介して連結されうる。非置換のC3−C50ヘテロアリール基の例としては、ピラゾリル基、イミダゾリル基、オキサゾリル基、チアゾリル基、トリアゾリル基、テトラゾリル基、オキサジアゾリル基、ピリジニル基、ピリダジニル基、ピリミジニル基、トリアジニル基、カルバゾリル基、インドリル基、キノリニル基、イソキノリニル基などを挙げることができる。また、前記ヘテロアリール基のうち一つ以上の水素原子は、前述のC1−C50アルキル基の置換基と同一の置換基で置換可能である。
【0089】
本明細書で、非置換のC1−C50脂肪族炭化水素形態の作用基は、C1−C50直鎖状または分岐鎖状のアルキル基であり、その非制限的な例としては、メチル基、エチル基、n−プロピル基、i−プロピル基、n−ブチル基、s−ブチル基、i−ブチル基、t−ブチル基、ペンチル基、ヘキシル基、ヘプチル基、オクチル基、ノニル基、デカニル基などを挙げることができる。前記C1−C50脂肪族炭化水素形態の作用基のうち一つ以上の水素原子は、重水素原子、ハロゲン原子、シアノ基、アミノ基、アミジノ基、ニトロ基、ヒドロキシル基、ヒドラジニル基、ヒドラゾニル基、カルボン酸基やその塩、スルホン酸基やその塩、リン酸やその塩、C1−C30アルキル基、C1−C30アルコキシ基、C2−C30アルケニル基またはC2−C30アルキニル基でありうる。
【0090】
本明細書で、非置換のC5−C50芳香族炭化水素形態の作用基は、前述のC5−C50アリール基と同一であり、前述のC1−C50アルキル基の置換基と同一の置換基で置換可能である。
【0091】
本明細書で、非置換のC3−C50ヘテロ芳香族炭化水素形態の作用基は、前述のC3−C50ヘテロアリール基と同一であり、前述のC1−C50アルキル基の置換基と同一の置換基で置換可能である。
【0092】
本明細書で、互いに隣接した2個以上の置換基が、互いに結合して形成した飽和環または不飽和環は、一つ以上の芳香族環及び/または一つ以上の非芳香族環が互いに融合された2個以上の環を含んだ置換基を指すものであり、アリール基またはヘテロアリール基の例のうち一部以上がこれに該当しうる。
【0093】
本発明の他の側面による有機発光素子は、第1電極と、前記第1電極に対向した第2電極と、前記第1電極と前記第2電極との間に介在された有機膜と、を具備し、前記有機膜は、前述のような化学式1のデンドロン・ユニットを含有するデンドリマーを含む。
【0094】
以下、一具現例による前記デンドリマーを含む有機発光素子について説明する。
【0095】
図1は、一具現例による有機発光素子の構造を示す断面図である。
【0096】
まず、基板上部に、大きい仕事関数を有するアノード電極用物質を、蒸着法またはスパッタリング法によって形成し、アノードとして使用する。ここで、基板としては、一般的な有機発光素子で使われる基板を使用するが、機械的強度、熱的安定性、透明性、表面平滑性、取扱容易性及び防水性にすぐれる有機基板、または透明プラスチック基板が望ましい。そして、アノード電極用物質としては、透明であって伝導性にすぐれる酸化インジウムスズ(ITO)、酸化インジウム亜鉛(IZO)、酸化スズ(SnO2)、酸化亜鉛(ZnO)などを使用する。
【0097】
その後、前記アノード電極の上部に、正孔注入層(EIL)物質を、真空蒸着法、スピンコーティング法、キャスト法、LB(Langmuir−Blodgett)法のような方法によって形成することができるが、均一な膜質を得やすく、またピン正孔(pin hole)が発生し難いというような点で、真空蒸着法によって形成することが望ましい。真空蒸着法によって正孔注入層を形成する場合、その蒸着条件は、正孔注入層の材料として使用する化合物、目的とする正孔注入層の構造及び熱的特性などによって異なるが、一般的に蒸着温度50〜500℃、真空度10−8〜10−3torr、蒸着速度0.01〜100Å/sec、膜厚は、通常10Å〜5μm範囲で適切に選択することが望ましい。前記正孔注入層物質としては、特別に制限されるものではなく、米国特許第4,356,429号明細書に開示された銅フタロシアニンのようなフタロシアニン化合物;スターバスト型アミン誘導体類である(4,4−トリ(N−カルバゾリル)トリフェニルアミン)(TCTA)、4,4’,4”−トリス(3−メチルフェニルフェニルアミノ)トリフェニルアミン(m−MTDATA)、1,3,5−トリス[4−(3−メチルフェニルフェニルアミノ)フェニル]ベンゼン(m−MTDAPB)(Advanced Material,6,p.677(1994))などを正孔注入層として使用することができる。
【0098】
次に、前記正孔注入層の上部に、正孔輸送層(ETL)物質を、真空蒸着法、スピンコーティング法、キャスト法、LB法のような方法によって形成することができるが、均一な膜質を得やすく、またピン正孔が発生い難いというような点で、真空蒸着法によって形成することができる。真空蒸着法によって正孔輸送層を形成する場合、その蒸着条件は、使用する化合物によって異なるが、一般的に正孔注入層の形成とほぼ同じ条件範囲で選択される。前記正孔輸送層物質は、特別に制限されるものではなく、化学式1のデンドロン・ユニットを含むデンドリマー化合物を使用したり、正孔輸送層に使われている公知の物質のうちから任意のものを選択して使用することができる。例えば、N−フェニルカルバゾール、ポリビニルカルバゾールのようなカルバゾール誘導体;N,N’−ビス(3−メチルフェニル)−N,N’−ジフェニル−[1,1−ビフェニル]−4,4’−ジアミン(TPD)、N,N’−ジ(ナフタレン−1−イル)−N,N’−ジフェニルベンジジン(α−NPD)などの芳香族縮合環を有する一般的なアミン誘導体などが使われる。正孔輸送層の厚みは、約50Å〜1,000Å、例えば100Å〜600Åでありうる。前記正孔輸送層の厚みが、前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な正孔輸送特性を得ることができる。
【0099】
前記正孔輸送層の上部に、発光層(EML)物質を、真空蒸着法、スピンコーティング法、キャスト法、LB法のような方法によって形成することができるが、均一な膜質を得やすく、またピン正孔が発生し難いというような点で、真空蒸着法によって形成することが望ましい。真空蒸着法によって発光層を形成する場合、その蒸着条件は、使用する化合物によって異なるが、一般的に正孔注入層の形成とほぼ同じ条件範囲で選択される。発光層材料は、特別に制限されるものではなく、化学式1のデンドロン・ユニットを含むデンドリマー化合物を単独として使用したり、またはホストとして使用することができる。
【0100】
前記化学式1のデンドロン・ユニットを含むデンドリマー化合物を発光ホストとして使用する場合、リン光ドーパントまたは蛍光ドーパントをともに使用して発光層を形成することができる。このとき、蛍光ドーパントとしては、出光社から購入可能なIDE102またはIDE105を使用することができ、リン光ドーパントとしては、緑色リン光ドーパントであるIr(ppy)3(ppy=フェニルピリジン)、Ir(ppy)2(acac)、Ir(mpyp)3、10−(2−ベンゾチアゾリル)−2,3,6,7−テトラヒドロ−1,1,7,7−テトラメチル−1H,5H,11H−(1)ベンゾピロピラノ(6,7−8−i,j)キノリジン−11−オン(C545T)などを使用することができ、青色リン光ドーパントとしては、F2Irpic、(F2ppy)2Ir(tmd)、Ir(dfppz)3、ter−フルオレン、4,4’−ビス(4−ジフェニルアミノスチリル)ビフェニル(DPAVBi)、2,5,8,11−テトラ−t−ブチルペリレン(TBP)などを使用でき、赤色リン光ドーパントとしては、PtOEP、Ir(piq)3、Btp2Ir(acac)、4−(ジシアノメチレン)−2−t−ブチル−6−(1,1,7,7−テトラメチルジュロリジル−9−エニル)−4H−ピラン(DCJTB)、UDC社のRD61などを使用できるが、これらに限定されるものではない。
【0101】
【化23】

【0102】
【化24】

C545T
【0103】
【化25】

【0104】
【化26】

DPAVBi
【0105】
【化27】

TBP
【0106】
【化28】

【0107】
ドーパントのドーピング濃度は、特別に制限されるものではないが、ホスト100重量部対比でドーパントの濃度は、0.01〜15重量部であることが望ましい。もしドーパントの含有量が0.01重量部未満である場合には、ドーパント量が十分ではなくして発色が正しく行われず、15重量部を超える場合には、濃度消光現象によって効率が急激に低下して望ましくない。発光層にリン光ドーパントと共に使用する場合には、三重項励起子または正孔が、電子輸送層に拡散する現象を防止するために、正孔抑制材料(HBL)をさらに、真空蒸着法またはスピンコーティング法によって積層させることができる。このとき、使用できる正孔抑制物質は、特別に制限されるものではなく、正孔抑制材料として使われている公知のものから任意のものを選択して利用することができる。例えば、オキサジアゾール誘導体、トリアゾール誘導体、フェナントロリン誘導体、または本明細書に参照として統合された特開平11−329734(A1)に記載されている正孔抑制材料などを挙げることができ、代表的なものとして、下記構造式のビス(2−メチル−8−キノリノラト)−(p−フェニルフェノラート)−アルミニウム(BAlq)、フェナントロリン系化合物(例:UDC社の2,9−ジメチル−4,7−ジフェニル−1,10−フェナントロリン(BCP))などが使われる。
【0108】
【化29】

【0109】
発光層の厚みは、約100Å〜1,000Å、例えば200Å〜600Åでありうる。発光層の厚みが、前記範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な発光特性を得ることができる。
【0110】
発光層がリン光ドーパントを含む場合、発光層に正孔抑制材料を入れるような目的で、三重項励起子または正孔が、電子輸送層に拡散する現象を防止するために、前記正孔抑制材料を含む正孔阻止層(HBL)を、発光層の上部に形成することもできる(図1には図示せず)。
【0111】
前記発光層の上部に、電子輸送層(ETL)が、真空蒸着法、またはスピンコーティング法、キャスト法などの方法で形成され、例えば真空蒸着法によって形成されうる。この電子輸送層材料は、電子注入電極から注入された電子を安定して輸送する機能を行うものであり、特別に制限されるものではなく、キノリン誘導体、特にトリス(8−キノリノラト)アルミニウム(Alq3)を使用することができる。また、電子輸送層の上部に、カソードから電子の注入を容易にする機能を有する物質である電子注入層(EIL)が積層され、それは、特別に材料を制限するものではない。電子注入層としては、LiF、NaCl、CsF、Li2O、BaOなどの物質を利用することができる。電子輸送層の厚みは、約100Å〜1,000Å、例えば100Å〜500Åでありうる。前記電子輸送層の厚みが、前述のような範囲を満足する場合、実質的な駆動電圧の上昇なしに、優秀な電子輸送特性を得ることができる。
【0112】
前記正孔阻止層(HBL)、電子輸送層(ETL)、電子注入層(EIL)の蒸着条件は、使用する化合物によって異なるが、一般的に正孔注入層の形成とほぼ同じ条件範囲で選択される。
【0113】
最後に、電子注入層の上部に、カソード形成用金属を、真空蒸着法やスパッタリング法などの方法によって形成し、カソードとして使用する。ここで、カソード形成用金属としては、小さい仕事関数を有する金属、合金、電気伝導性化合物及びそれらの混合物を使用することができる。具体的な例としては、リチウム(Li)、マグネシウム(Mg)、アルミニウム(Al)、アルミニウム−リチウム(Al−Li)、カルシウム(Ca)、マグネシウム−インジウム(Mg−In)、マグネシウム−銀(Mg−Ag)などを挙げることができる。また、前面発光素子を得るために、ITO、IZOを使用した透過型カソードを使用することもできる。
【0114】
このように製造された有機発光素子は、図1に図示されたアノード、正孔注入層(HIL)、正孔輸送層(HTL)、発光層(EML)、電子輸送層(ETL)、電子注入層(EIL)、カソードの構造の有機発光素子だけではなく、多様な構造の有機発光素子の構造が可能であり、必要によって、1層または2層の中間層をさらに形成することも可能である。正孔注入層(HIL)、電子注入層(EIL)、正孔阻止層(HBL)などは、必ずしも必要なものではないが、それらの層を形成することによって、発光効率を向上させることができる。
【0115】
以下、1個以上のフルオレン基と、1個以上のフェノチアジン基とを側鎖として有し、化学式1を含むデンドリマーの合成例及び実施例を具体的に例示するが、これらに限定されるものではない。前記デンドリマーは、発光特性及び正孔伝達特性にすぐれる発光材料であり、青色発光材料、並びに緑色、赤色のリン光ホスト材料及び蛍光ホスト材料として有用であり、正孔輸送材料としても使用可能である。
【0116】
(合成例1)
(デンドリマー2の合成)
【化30】

【0117】
10H−フェノキサジン18.3g(100.0mmole)、ブロモエタン21.6g(200.0mmole)、Et3N 12.0g(120.0mmole)(600mL テトラヒドロフラン(THF)中)の混合物を、窒素雰囲気60℃で12時間撹拌した。反応物に水200mLを加え、酢酸エチル500mLで2回抽出した。有機層を乾燥、濾過、濃縮させて、カラムクロマトグラフィを利用し、化合物C−1を薄黄色液体として得た(18.2g、86%)。化合物の構造は、HR−MS(high resolution mass spectrometry)を利用して確認した(calc.;211.0997、found;211.0986)。
【0118】
化合物C−1(21.1g、100.0mmole)、ヨウ素13.4g(50.3mmole)、過ヨウ素酸2.2g(10.0mmole)に、85%酢酸400mLを加えた後、80℃で4時間加熱した。反応混合物をすぐに冷水500mLに注いで十分にかき混ぜた後でフィルタリングした。こされた固相を冷水で数回洗浄した後、さらにエチルエーテル400mLに溶かし、乾燥、濾過、濃縮させた後、カラムクロマトグラフィを利用して、化合物C−2をクリーム色固体として得た(25.2g、75.1%)。化合物の構造は、HRMSを利用して確認した(calc.;33.9964、found;336.9952)。
【0119】
化合物C−2(10.1g、30.0mmole)、化合物C−3(10.1g、39.0mmole)、NaOtBu 4.3g(45.0mmole)、Pd2(dba)3 1.4g(1.5mmole)、PtBu3(0.30g、1.5mmole)の混合物に、トルエン100mLを加え、窒素雰囲気、90℃で6時間加熱した。反応混合物を室温に冷やした後で水30mLを加え、塩化メチレン200mLで2回抽出した。有機層を乾燥、濾過、濃縮させて、カラムクロマトグラフィを利用し、化合物C−4を薄黄色固体として得た(8.38g、62%)。化合物の構造は、HRMSを利用して確認した(calc.;467。1998、found;467.1987)。
【0120】
化合物C−4(14.0g、30.0mmole)、化合物C−5(15.6g、39.0mmole)、NaOtBu 4.3g(45.0mmole)、Pd2(dba)3 1.4g(1.5mmole)、PtBu3(0.30g、1.5mmole)の混合物に、トルエン100mLを加え、窒素雰囲気、90℃で6時間加熱した。反応混合物を室温に冷やした後で水30mLを加え、塩化メチレン200mLで2回抽出した。有機層を乾燥、濾過、濃縮させて、カラムクロマトグラフィを利用し、化合物C−6を薄黄色固体として得た(17.1g、77%)。化合物の構造は、HRMSを利用して確認した(calc.;737.2042、found;737.2032)。
【0121】
化合物C−6(22.1g、30.0mmole)、ビス(ピナコラト)ジボロン(9.1g、36.0mmole)、Pd(dppf)Cl2(1.2g、0.05mole%)、KOtBu(3.5g、36.0mmole)の混合物に、トルエン100mLを加え、窒素雰囲気、90℃で6時間加熱した。反応混合物を室温に冷やした後で水50mLを加え、塩化メチレン300mLで2回抽出した。有機層を乾燥、濾過、濃縮させて、カラムクロマトグラフィを利用し、化合物C−7をクリーム色固体として得た(13.2g、56%)。化合物の構造は、HRMSを利用して確認した(calc.;785.3789、found;785.3774)。
【0122】
化合物C−8(1.56g、2.0mmole)、化合物C−7(12.7g、14.0mmole)、Pd(PPh3)4(0.69g、5mol%)、NaOH(4.8g、120mmole)(30mLのH2O中)に、THF100mLを加え、窒素雰囲気、70℃で36時間加熱した。反応混合物を室温に冷やした後で水50mLを加え、塩化メチレン300mLで2回抽出した。有機層を乾燥、濾過、濃縮させて、カラムクロマトグラフィと再結晶とを利用し、デンドリマー2をクリーム色固体として得た(2.97g、35%)。化合物の構造は、NMR(nuclear magnetic resonance)を利用して確認した。
【0123】
1H−NMR(CDCl3、400MHz)δ(ppm);1.24(t、18H)、1.87(s、36H)、3.32(q、12H)、6.87−7.96(m、162H)
【0124】
(合成例2)
(デンドリマー3の合成)
【0125】
【化31】

【0126】
デンドリマー2の合成法と同じ方法で、化合物C−7(3.9g、5.0mmole)と化合物C−9(0.54g、1.0mmole)とを利用し、デンドリマー3をクリーム色固体として得た(1.27g、56%)。化合物の構造は、NMRを利用して確認した。
【0127】
1H−NMR(CDCl3、400MHz)δ(ppm);1.28(t、9H)、1.77(s、18H)、3.23(q、6H)、6.87−7.96(m、90H)
【0128】
(合成例3)
(デンドリマー4の合成)
【化32】

【0129】
臭素(11.2mL、32.0g、220mmole)(80mLのCH2Cl2中)溶液を、−30℃でカルバゾール(16.7g、100.0mmole)(300mLのCH2Cl2中)溶液に30分にわたって滴加し、0℃で5時間撹拌した。反応混合物に、10%NaHCO3水溶液200mLを加え、塩化メチレン300mLで2回抽出した。有機層を乾燥、濾過、濃縮させて、カラムクロマトグラフィを利用し、化合物C−9を白色固体として得た(21.1g、65%)。化合物の構造は、HRMSを利用して確認した(calc.;322.8945、found;322.8945)。
【0130】
化合物C−9(16.5g、50.0mmole)、4−ヨードフェノール(44.0g、200.0mmole)、CuI(0.48g、0.05mole%)、18−C−6(商品名)(0.66g、0.05mole%)(400mLのDMF中)溶液を、130℃で12時間撹拌した。
【0131】
反応混合物に室温で塩化メチレン400mLを加え、水500mLで3回洗浄した。有機層を乾燥、濾過、濃縮させて、カラムクロマトグラフィを利用し、化合物C−10をクリーム色固体として得た(12.1g、58%)。化合物の構造は、HRMSを利用して確認した(calc.;414.9270、found;414.9270)。
【0132】
化合物C−4の合成法と同じ方法で、化合物C−11(20.9g、100.0mmole)と化合物C−2(33.7g、100.0mmole)とを利用し、化合物12を薄黄色固体として得た(32.6g、78%)。化合物の構造は、HRMSを利用して確認した(calc.;418.2045、found;418.2032)。
【0133】
化合物C−6の合成法と同じ方法で、化合物C−10(8.4g、20.0mmole)と化合物C−12(18.4g、44.0mmole)とを利用し、化合物C−13を薄黄色固体として得た(13.5g、62%)。化合物の構造は、HRMSを利用して確認した(calc.;1091.4774、found;1091.4762)。
【0134】
化合物C−13(10.9g、10.0mmole)、ペンタエリトリトールテトラブロマイド(770mg、2.0mmole)、95%NaH(480mg、20.0mmole)の混合物にTHF 80mLを加え、室温で1時間撹拌した後、50℃で6時間加熱した。反応混合物を室温に冷やした後で水30mLを加え、塩化メチレン100mLで2回抽出した。有機層を乾燥、濾過、濃縮させて、カラムクロマトグラフィと再結晶とを利用し、デンドリマー4をクリーム色固体として得た(3.20g、46%)。化合物の構造は、NMRを利用して確認した。
【0135】
1H−NMR(CDCl3、400MHz)δ(ppm);1.15(t、24H)、1.82(s、48H)、3.22(q、16H)、3.45(s、8H)、6.47−7.88(m、152H)
【0136】
(合成例4)
【化33】

【0137】
デンドリマー4の合成法と同じ方法で、化合物C−13(5.5g、5.0mmole)と化合物C−14(0.35g、1.0mmole)とを利用し、デンドリマー5をクリーム色固体として得た(1.88g、55%)。化合物の構造は、NMRを利用して確認した。
【0138】
1H−NMR(CDCl3、400MHz)δ(ppm);1.18(t、18H)、1.82(s、36H)、3.33(q、12H)、5.53(s、6H)、6.87−7.96(m、117H)
【0139】
(実施例1)
アノードは、コーニング(Corning)15Ω/cm2(1,200Å)ITOガラス基板を、50mmx50mmx0.7mmサイズに切り、イソプロピルアルコールと純水との中でそれぞれ5分間超音波洗浄した後、30分間紫外線を照射してオゾンに露出させて洗浄し、真空蒸着装置にこのガラス基板を設けた。
【0140】
前記基板上部に、ポリエチレンジヒドロキシチオフェン(PEDOT)/PSS(ポリ(スチレンスルホン酸))(H.C.Starck社製)水溶液をスピンコーティングし、40nm厚の正孔注入層を形成した。次に、前記正孔注入層上に、デンドリマー2を80nm厚の正孔輸送層としてスピンコーティングして形成した。次に、前記正孔輸送層の上部に、公知の緑色蛍光ホストであるlq3と、公知の緑色蛍光ドーパントであるC545Tを、重量比98:2で同時蒸着し、300Å厚に発光層を形成した。
【0141】
次に、前記発光層の上部に、電子輸送層としてAlq3を、300Å厚に蒸着した後、前記電子輸送層の上部に、電子注入層としてハロゲン化アルカリ金属であるLiFを10Å厚に蒸着し、Alを3,000Å(カソード電極)厚に真空蒸着し、LiF/Al電極を形成することによって、有機発光素子を製造した。
【0142】
この素子は、電流密度50mA/cm2で駆動電圧5.23V、発光輝度8,774cd/m2の高輝度を示し、色座標は、(0.315,0.682)であり、発光効率は、17.11cd/Aであった。
【0143】
(実施例2)
前記正孔輸送層の形成時、前記デンドリマー2の代わりに、デンドリマー3を利用したことを除いては、実施例1と同一に行って有機発光素子を製作した。
【0144】
この素子は、電流密度50mA/cm2で駆動電圧5.67V、発光輝度8,445cd/m2の高輝度を示し、色座標は、(0.310,0.643)であり、発光効率は、16.89cd/Aであった。
【0145】
(実施例3)
前記正孔輸送層の形成時、前記デンドリマー2の代わりに、デンドリマー4を利用したことを除いては、実施例1と同一に行って有機発光素子を製作した。
【0146】
この素子は、電流密度50mA/cm2で駆動電圧5.52V、発光輝度8,623cd/m2の高輝度を示し、色座標は、(0.301,0.665)であり、発光効率は、17.24cd/Aであった。
【0147】
(実施例4)
前記正孔輸送層の形成時、前記デンドリマー2の代わりに、デンドリマー5を利用したことを除いては、実施例1と同一に行って有機発光素子を製作した。
【0148】
この素子は、電流密度50mA/cm2で駆動電圧5.24V、発光輝度8,551cd/m2の高輝度を示し、色座標は、(0.301,0.663)であり、発光効率は、17.10cd/Aであった。
【0149】
(実施例5)
正孔注入層(PEDOT/PSS)上部に、正孔輸送層の代わりに、デンドリマー2を公知の緑色蛍光ドーパントであるC545Tと、重量比98:2で混合した後、30nm厚の発光層をスピンコーティングして形成した。次に、前記発光層の上部に、電子輸送層として、Alq3を300Å厚に蒸着した後、前記電子輸送層の上部に、電子注入層として、ハロゲン化アルカリ金属であるLiFを10Å厚に蒸着し、Alを3,000Å(カソード電極)厚に真空蒸着し、LiF/Al電極を形成することによって、有機発光素子を製造した。
【0150】
この素子は、電流密度50mA/cm2で駆動電圧6.25V、発光輝度7,725cd/m2の高輝度を示し、色座標は、(0.320,0.643)であり、発光効率は、15.45cd/Aであった。
【0151】
(比較例1)
正孔輸送層を形成しないことを除いては、実施例1と同一に行って有機発光素子を製作した。
【0152】
この素子は、電流密度50mA/cm2で駆動電圧7.55V、発光輝度6,002cd/m2を示し、色座標は、(0.319,0.652)とほぼ同一であり、発光効率は、12.0cd/Aであった。
【0153】
前記有機発光素子の色座標、輝度、発光効率などを測定し、下記表1に示した。
【0154】
【表1】

【0155】
実施例1〜5の有機発光素子は、比較例1の有機発光素子に比べて、駆動電圧が1V以上低くなり、効率が大幅に向上した優秀なI−V−L特性を示した。特に、寿命改善効果が卓越しており、実施例1〜4の場合は、比較例1対比で、が100%以上向上するという結果を示した。また、デンドリマー化合物を発光層材料として有機発光素子に使用した結果、駆動電圧が低くなって効率が向上するという特性を与え、寿命は、同等なレベルの結果となった。
【0156】
以上、添付図面を参照しながら本発明の好適な実施形態について詳細に説明したが、本発明はかかる例に限定されない。本発明の属する技術の分野における通常の知識を有する者であれば、特許請求の範囲に記載された技術的思想の範疇内において、各種の変更例または修正例に想到し得ることは明らかであり、これらについても、当然に本発明の技術的範囲に属するものと了解される。
【符号の説明】
【0157】
【特許請求の範囲】
【請求項1】
コア・ユニット、ブリッジ・ユニット及びデンドロン・ユニットを含むデンドリマーであって、
前記コア・ユニットが、置換または非置換のC1−C50脂肪族炭化水素、置換または非置換のC5−C50芳香族炭化水素、及び置換または非置換のC3−C50ヘテロ芳香族炭化水素からなる群から選択される三価あるいは四価の作用基を含み、
前記ブリッジ・ユニットが、置換または非置換のC5−C50芳香族炭化水素、及び置換または非置換のC3−C50ヘテロ芳香族炭化水素からなる群から選択される二価あるいは三価の作用基を含み、
前記デンドロン・ユニットが、下記化学式1で表示される一価のフルオレン系作用基を含むデンドリマー。
【化1】

・・・(化学式1)
前記化学式1で、Zは、単一結合、または、
【化2】



からなる群から選択され、
Ar1及びAr2は互いに独立して、単一結合、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択され、
X1及びX2は互いに独立して、窒素(N)、ホウ素(B)及びリン(P)からなる群から選択され、X’は、酸素(O)、硫黄(S)、SO2及びCH2からなる群から選択され、
Y1、Y2、Y3、Y4、Y5及びY6は互いに独立して、単一結合、置換または非置換のC1−C50アルキレン基、置換または非置換のC2−C50アルケニレン基、置換または非置換のC2−C50アルキニレン基、置換または非置換のC3−C50シクロアルキレン基、置換または非置換のC1−C50アルコキシレン基、置換または非置換のC5−C50アリーレン基、及び置換または非置換のC3−C50ヘテロアリーレン基からなる群から選択され、
R1、R2、R3、R4及びR5は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、カルボン酸基、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択され、R’及びR”は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシ基、カルボン酸基、置換または非置換のC1−C50アルキル基、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択され、R1、R2、R3、R4、R5、R’及びR”で、互いに隣接した2個以上は、結合して飽和環または不飽和環を形成することができ、
*は、Ar1、Z及びフルオレン基のうちいずれか一つが、ブリッジ・ユニットと結合するサイトである。
【請求項2】
前記Ar1及びAr2は互いに独立して、単一結合、フェニル基、ハロフェニル基、シアノフェニル基、フェノキシフェニル基、C1−C15アルキルフェニル基、ジ(C1−C15アルキル)フェニル基、C1−C15アルコキシフェニル基、ジ(C1−C15アルコキシ)フェニル基、C5−C15アリールフェニル基、ジ(C5−C15アリール)フェニル基、ナフチル基、ハロナフチル基、シアノナフチル基、フェノキシナフチル基、C1−C15アルキルナフチル基、ジ(C1−C15アルキル)ナフチル基、C1−C15アルコキシナフチル基、ジ(C1−C15アルコキシ)ナフチル基、C5−C15アリールナフチル基、ジ(C5−C15アリール)ナフチル基、アントリル基、ハロアントリル基、シアノアントリル基、フェノキシアントリル基、C1−C15アルキルアントリル基、ジ(C1−C15アルキル)アントリル基、C1−C15アルコキシアントリル基、ジ(C1−C15アルコキシ)アントリル基、C5−C15アリールアントリル基、ジ(C5−C15アリール)アントリル基、フェナントリル基、ハロフェナントリル基、シアノフェナントリル基、フェノキシフェナントリル基、C1−C15アルキルフェナントリル基、ジ(C1−C15アルキル)フェナントリル基、C1−C15アルコキシフェナントリル基、ジ(C1−C15アルコキシ)フェナントリル基、C5−C15アリールフェナントリル基、ジ(C5−C15アリール)フェナントリル基、フルオレニル基、ハロフルオレニル基、シアノフルオレニル基、フェノキシフルオレニル基、C1−C15アルキルフルオレニル基、ジ(C1−C15アルキル)フルオレニル基、C1−C15アルコキシフルオレニル基、ジ(C1−C15アルコキシ)フルオレニル基、C5−C15アリールフルオレニル基、ジ(C5−C15アリール)フルオレニル基、ピリジル基、ハロピリジル基、シアノピリジル基、フェノキシピリジル基、C1−C15アルキルピリジル基、ジ(C1−C15アルキル)ピリジル基、C1−C15アルコキシピリジル基、ジ(C1−C15アルコキシ)ピリジル基、C5−C15アリールピリジル基、ジ(C5−C15アリール)ピリジル基、ピレニル基、ハロピレニル基、シアノピレニル基、フェノキシピレニル基、C1−C15アルキルピレニル基、ジ(C1−C15アルキル)ピレニル基、C1−C15アルコキシピレニル基、ジ(C1−C15アルコキシ)ピレニル基、C5−C15アリールピレニル基、ジ(C5−C15アリール)ピレニル基、フェナントロリニル基、ハロフェナントロリニル基、シアノフェナントロリニル基、フェノキシフェナントロリニル基、C1−C15アルキルフェナントロリニル基、ジ(C1−C15アルキル)フェナントロリニル基、C1−C15アルコキシフェナントロリニル基、ジ(C1−C15アルコキシ)フェナントロリニル基、C5−C15アリールフェナントロリニル基、ジ(C5−C15アリール)フェナントロリニル基、キノリニル基、ハロキノリニル基、シアノキノリニル基、フェノキシキノリニル基、C1−C15アルキルキノリニル基、ジ(C1−C15アルキル)キノリニル基、C1−C15アルコキシキノリニル基、ジ(C1−C15アルコキシ)キノリニル基、C5−C15アリールキノリニル基、ジ(C5−C15アリール)キノリニル基、カルバゾリル基、ハロカルバゾリル基、シアノカルバゾリル基、フェノキシカルバゾリル基、C1−C15アルキルカルバゾリル基、ジ(C1−C15アルキル)カルバゾリル基、C1−C15アルコキシカルバゾリル基、ジ(C1−C15アルコキシカルバゾリル基)、C5−C15アリールカルバゾリル基及びジ(C5−C15アリール)カルバゾリル基からなる群から選択されることを特徴とする請求項1に記載のデンドリマー。
【請求項3】
前記Ar1及びAr2は互いに独立して、単一結合、フェニル基、ハロフェニル基、シアノフェニル基、ビフェニル基、ジメチルフルオレニル基、カルバゾリル基及びジフェニルカルバゾリル基からなる群から選択されることを特徴とする請求項1に記載のデンドリマー。
【請求項4】
前記X1及びX2は、窒素(N)であることを特徴とする請求項1に記載のデンドリマー。
【請求項5】
前記Y1、Y2、Y3、Y4、Y5及びY6は互いに独立して、単一結合、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、フェニル基、メチルフェニル基、エチルフェニル基、o−,m−及びp−フルオロフェニル基、ジクロロフェニル基、シアノフェニル基、ジシアノフェニル基、トリフルオロメトキシフェニル基、ビフェニル基、ハロビフェニル基、シアノビフェニル基、メチルビフェニル基、エチルビフェニル基、メトキシビフェニル基及びエトキシビフェニル基からなる群から選択されることを特徴とする請求項1に記載のデンドリマー。
【請求項6】
前記Y1、Y2、Y3、Y4、Y5及びY6は互いに独立して、単一結合、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、フェニル基及びジフェニル基からなる群から選択されることを特徴とする請求項1に記載のデンドリマー。
【請求項7】
前記R1、R2、R3、R4、R5、R’及びR”は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、フェニル基、メチルフェニル基、エチルフェニル基、o−,m−及びp−フルオロフェニル基、ジクロロフェニル基、シアノフェニル基、ジシアノフェニル基、トリフルオロメトキシフェニル基、ビフェニル基、ハロビフェニル基、シアノビフェニル基、メチルビフェニル基、エチルビフェニル基、メトキシビフェニル基及びエトキシビフェニル基からなる群から選択されることを特徴とする請求項1に記載のデンドリマー。
【請求項8】
前記R1、R2、R3、R4、R5、R’及びR”は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、フェニル基及びビフェニル基からなる群から選択されることを特徴とする請求項1に記載のデンドリマー。
【請求項9】
前記フルオレン系作用基が、下記化学式2〜5で表示される作用基のうちから選択されることを特徴とする請求項1に記載のデンドリマー。
【化3】

・・・(化学式2)
【化4】

・・・(化学式3)
【化5】

・・・(化学式4)
【化6】

・・・(化学式5)
前記化学式で、*は、ブリッジ・ユニットとの結合サイトである。
【請求項10】
前記ブリッジ・ユニットが、下記化学式6〜9で表示される作用基のうちから選択される作用基を含むことを特徴とする請求項1に記載のデンドリマー。
【化7】

・・・(化学式6)
【化8】

・・・(化学式7)
【化9】

・・・(化学式8)
【化10】

・・・(化学式9)
前記化学式で、**は、隣接ユニットとの結合サイトである。
【請求項11】
前記コア・ユニットが、下記化学式10〜12で表示される作用基のうちから選択される作用基を含むことを特徴とする請求項1に記載のデンドリマー。
【化11】

・・・(化学式10)
【化12】

・・・(化学式11)
【化13】

・・・(化学式12)
前記化学式で、***は、ブリッジ・ユニットとの結合サイトである。
【請求項12】
前記デンドリマーの数平均分子量が、1,000〜300,000であることを特徴とする請求項1に記載のデンドリマー。
【請求項13】
前記デンドリマーが、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択される表面ユニットを、前記デンドロン・ユニットの末端位置にさらに含むことを特徴とする請求項1に記載のデンドリマー。
【請求項14】
前記デンドリマーが、下記デンドリマー1〜5で表示される化合物のうちから選択され、数平均分子量が1,000〜30,000であることを特徴とする請求項1に記載のデンドリマー。
【化14】

・・・(デンドリマー1)
【化15】

・・・(デンドリマー2)
【化16】

・・・(デンドリマー3)
【化17】

・・・(デンドリマー4)
【化18】

。
・・・(デンドリマー5)
【請求項15】
1対の電極と、それらの間に介在された有機膜と、を含む有機発光素子において、前記有機膜が、請求項1〜請求項14のうち、いずれか1項に記載のデンドリマーを含むことを特徴とする有機発光素子。
【請求項16】
前記有機膜が、発光層、正孔注入層及び正孔輸送層のうちから選択された一つ以上であることを特徴とする請求項15に記載の有機発光素子。
【請求項17】
前記有機膜が、発光層であることを特徴とする請求項15に記載の有機発光素子。
【請求項18】
前記デンドリマーが、緑色ドーパントまたは赤色ドーパントのホストとして使われることを特徴とする請求項15に記載の有機発光素子。
【請求項1】
コア・ユニット、ブリッジ・ユニット及びデンドロン・ユニットを含むデンドリマーであって、
前記コア・ユニットが、置換または非置換のC1−C50脂肪族炭化水素、置換または非置換のC5−C50芳香族炭化水素、及び置換または非置換のC3−C50ヘテロ芳香族炭化水素からなる群から選択される三価あるいは四価の作用基を含み、
前記ブリッジ・ユニットが、置換または非置換のC5−C50芳香族炭化水素、及び置換または非置換のC3−C50ヘテロ芳香族炭化水素からなる群から選択される二価あるいは三価の作用基を含み、
前記デンドロン・ユニットが、下記化学式1で表示される一価のフルオレン系作用基を含むデンドリマー。
【化1】

・・・(化学式1)
前記化学式1で、Zは、単一結合、または、
【化2】



からなる群から選択され、
Ar1及びAr2は互いに独立して、単一結合、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択され、
X1及びX2は互いに独立して、窒素(N)、ホウ素(B)及びリン(P)からなる群から選択され、X’は、酸素(O)、硫黄(S)、SO2及びCH2からなる群から選択され、
Y1、Y2、Y3、Y4、Y5及びY6は互いに独立して、単一結合、置換または非置換のC1−C50アルキレン基、置換または非置換のC2−C50アルケニレン基、置換または非置換のC2−C50アルキニレン基、置換または非置換のC3−C50シクロアルキレン基、置換または非置換のC1−C50アルコキシレン基、置換または非置換のC5−C50アリーレン基、及び置換または非置換のC3−C50ヘテロアリーレン基からなる群から選択され、
R1、R2、R3、R4及びR5は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシル基、カルボン酸基、置換または非置換のC1−C50アルキル基、置換または非置換のC2−C50アルケニル基、置換または非置換のC2−C50アルキニル基、置換または非置換のC3−C50シクロアルキル基、置換または非置換のC1−C50アルコキシ基、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択され、R’及びR”は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、ニトロ基、ヒドロキシ基、カルボン酸基、置換または非置換のC1−C50アルキル基、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択され、R1、R2、R3、R4、R5、R’及びR”で、互いに隣接した2個以上は、結合して飽和環または不飽和環を形成することができ、
*は、Ar1、Z及びフルオレン基のうちいずれか一つが、ブリッジ・ユニットと結合するサイトである。
【請求項2】
前記Ar1及びAr2は互いに独立して、単一結合、フェニル基、ハロフェニル基、シアノフェニル基、フェノキシフェニル基、C1−C15アルキルフェニル基、ジ(C1−C15アルキル)フェニル基、C1−C15アルコキシフェニル基、ジ(C1−C15アルコキシ)フェニル基、C5−C15アリールフェニル基、ジ(C5−C15アリール)フェニル基、ナフチル基、ハロナフチル基、シアノナフチル基、フェノキシナフチル基、C1−C15アルキルナフチル基、ジ(C1−C15アルキル)ナフチル基、C1−C15アルコキシナフチル基、ジ(C1−C15アルコキシ)ナフチル基、C5−C15アリールナフチル基、ジ(C5−C15アリール)ナフチル基、アントリル基、ハロアントリル基、シアノアントリル基、フェノキシアントリル基、C1−C15アルキルアントリル基、ジ(C1−C15アルキル)アントリル基、C1−C15アルコキシアントリル基、ジ(C1−C15アルコキシ)アントリル基、C5−C15アリールアントリル基、ジ(C5−C15アリール)アントリル基、フェナントリル基、ハロフェナントリル基、シアノフェナントリル基、フェノキシフェナントリル基、C1−C15アルキルフェナントリル基、ジ(C1−C15アルキル)フェナントリル基、C1−C15アルコキシフェナントリル基、ジ(C1−C15アルコキシ)フェナントリル基、C5−C15アリールフェナントリル基、ジ(C5−C15アリール)フェナントリル基、フルオレニル基、ハロフルオレニル基、シアノフルオレニル基、フェノキシフルオレニル基、C1−C15アルキルフルオレニル基、ジ(C1−C15アルキル)フルオレニル基、C1−C15アルコキシフルオレニル基、ジ(C1−C15アルコキシ)フルオレニル基、C5−C15アリールフルオレニル基、ジ(C5−C15アリール)フルオレニル基、ピリジル基、ハロピリジル基、シアノピリジル基、フェノキシピリジル基、C1−C15アルキルピリジル基、ジ(C1−C15アルキル)ピリジル基、C1−C15アルコキシピリジル基、ジ(C1−C15アルコキシ)ピリジル基、C5−C15アリールピリジル基、ジ(C5−C15アリール)ピリジル基、ピレニル基、ハロピレニル基、シアノピレニル基、フェノキシピレニル基、C1−C15アルキルピレニル基、ジ(C1−C15アルキル)ピレニル基、C1−C15アルコキシピレニル基、ジ(C1−C15アルコキシ)ピレニル基、C5−C15アリールピレニル基、ジ(C5−C15アリール)ピレニル基、フェナントロリニル基、ハロフェナントロリニル基、シアノフェナントロリニル基、フェノキシフェナントロリニル基、C1−C15アルキルフェナントロリニル基、ジ(C1−C15アルキル)フェナントロリニル基、C1−C15アルコキシフェナントロリニル基、ジ(C1−C15アルコキシ)フェナントロリニル基、C5−C15アリールフェナントロリニル基、ジ(C5−C15アリール)フェナントロリニル基、キノリニル基、ハロキノリニル基、シアノキノリニル基、フェノキシキノリニル基、C1−C15アルキルキノリニル基、ジ(C1−C15アルキル)キノリニル基、C1−C15アルコキシキノリニル基、ジ(C1−C15アルコキシ)キノリニル基、C5−C15アリールキノリニル基、ジ(C5−C15アリール)キノリニル基、カルバゾリル基、ハロカルバゾリル基、シアノカルバゾリル基、フェノキシカルバゾリル基、C1−C15アルキルカルバゾリル基、ジ(C1−C15アルキル)カルバゾリル基、C1−C15アルコキシカルバゾリル基、ジ(C1−C15アルコキシカルバゾリル基)、C5−C15アリールカルバゾリル基及びジ(C5−C15アリール)カルバゾリル基からなる群から選択されることを特徴とする請求項1に記載のデンドリマー。
【請求項3】
前記Ar1及びAr2は互いに独立して、単一結合、フェニル基、ハロフェニル基、シアノフェニル基、ビフェニル基、ジメチルフルオレニル基、カルバゾリル基及びジフェニルカルバゾリル基からなる群から選択されることを特徴とする請求項1に記載のデンドリマー。
【請求項4】
前記X1及びX2は、窒素(N)であることを特徴とする請求項1に記載のデンドリマー。
【請求項5】
前記Y1、Y2、Y3、Y4、Y5及びY6は互いに独立して、単一結合、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、フェニル基、メチルフェニル基、エチルフェニル基、o−,m−及びp−フルオロフェニル基、ジクロロフェニル基、シアノフェニル基、ジシアノフェニル基、トリフルオロメトキシフェニル基、ビフェニル基、ハロビフェニル基、シアノビフェニル基、メチルビフェニル基、エチルビフェニル基、メトキシビフェニル基及びエトキシビフェニル基からなる群から選択されることを特徴とする請求項1に記載のデンドリマー。
【請求項6】
前記Y1、Y2、Y3、Y4、Y5及びY6は互いに独立して、単一結合、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、フェニル基及びジフェニル基からなる群から選択されることを特徴とする請求項1に記載のデンドリマー。
【請求項7】
前記R1、R2、R3、R4、R5、R’及びR”は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、フェニル基、メチルフェニル基、エチルフェニル基、o−,m−及びp−フルオロフェニル基、ジクロロフェニル基、シアノフェニル基、ジシアノフェニル基、トリフルオロメトキシフェニル基、ビフェニル基、ハロビフェニル基、シアノビフェニル基、メチルビフェニル基、エチルビフェニル基、メトキシビフェニル基及びエトキシビフェニル基からなる群から選択されることを特徴とする請求項1に記載のデンドリマー。
【請求項8】
前記R1、R2、R3、R4、R5、R’及びR”は互いに独立して、水素原子、重水素原子、ハロゲン原子、シアノ基、アミノ基、メチル基、エチル基、プロピル基、イソブチル基、sec−ブチル基、フェニル基及びビフェニル基からなる群から選択されることを特徴とする請求項1に記載のデンドリマー。
【請求項9】
前記フルオレン系作用基が、下記化学式2〜5で表示される作用基のうちから選択されることを特徴とする請求項1に記載のデンドリマー。
【化3】

・・・(化学式2)
【化4】

・・・(化学式3)
【化5】

・・・(化学式4)
【化6】

・・・(化学式5)
前記化学式で、*は、ブリッジ・ユニットとの結合サイトである。
【請求項10】
前記ブリッジ・ユニットが、下記化学式6〜9で表示される作用基のうちから選択される作用基を含むことを特徴とする請求項1に記載のデンドリマー。
【化7】

・・・(化学式6)
【化8】

・・・(化学式7)
【化9】

・・・(化学式8)
【化10】

・・・(化学式9)
前記化学式で、**は、隣接ユニットとの結合サイトである。
【請求項11】
前記コア・ユニットが、下記化学式10〜12で表示される作用基のうちから選択される作用基を含むことを特徴とする請求項1に記載のデンドリマー。
【化11】

・・・(化学式10)
【化12】

・・・(化学式11)
【化13】

・・・(化学式12)
前記化学式で、***は、ブリッジ・ユニットとの結合サイトである。
【請求項12】
前記デンドリマーの数平均分子量が、1,000〜300,000であることを特徴とする請求項1に記載のデンドリマー。
【請求項13】
前記デンドリマーが、置換または非置換のC5−C50アリール基、及び置換または非置換のC3−C50ヘテロアリール基からなる群から選択される表面ユニットを、前記デンドロン・ユニットの末端位置にさらに含むことを特徴とする請求項1に記載のデンドリマー。
【請求項14】
前記デンドリマーが、下記デンドリマー1〜5で表示される化合物のうちから選択され、数平均分子量が1,000〜30,000であることを特徴とする請求項1に記載のデンドリマー。
【化14】

・・・(デンドリマー1)
【化15】

・・・(デンドリマー2)
【化16】

・・・(デンドリマー3)
【化17】

・・・(デンドリマー4)
【化18】

。
・・・(デンドリマー5)
【請求項15】
1対の電極と、それらの間に介在された有機膜と、を含む有機発光素子において、前記有機膜が、請求項1〜請求項14のうち、いずれか1項に記載のデンドリマーを含むことを特徴とする有機発光素子。
【請求項16】
前記有機膜が、発光層、正孔注入層及び正孔輸送層のうちから選択された一つ以上であることを特徴とする請求項15に記載の有機発光素子。
【請求項17】
前記有機膜が、発光層であることを特徴とする請求項15に記載の有機発光素子。
【請求項18】
前記デンドリマーが、緑色ドーパントまたは赤色ドーパントのホストとして使われることを特徴とする請求項15に記載の有機発光素子。
【図1】




【公開番号】特開2012−21156(P2012−21156A)
【公開日】平成24年2月2日(2012.2.2)
【国際特許分類】
【出願番号】特願2011−154844(P2011−154844)
【出願日】平成23年7月13日(2011.7.13)
【出願人】(308040351)三星モバイルディスプレイ株式會社 (764)
【氏名又は名称原語表記】Samsung Mobile Display Co., Ltd.
【住所又は居所原語表記】San #24 Nongseo−Dong,Giheung−Gu,Yongin−City,Gyeonggi−Do 446−711 Republic of KOREA
【Fターム(参考)】
【公開日】平成24年2月2日(2012.2.2)
【国際特許分類】
【出願日】平成23年7月13日(2011.7.13)
【出願人】(308040351)三星モバイルディスプレイ株式會社 (764)
【氏名又は名称原語表記】Samsung Mobile Display Co., Ltd.
【住所又は居所原語表記】San #24 Nongseo−Dong,Giheung−Gu,Yongin−City,Gyeonggi−Do 446−711 Republic of KOREA
【Fターム(参考)】
[ Back to top ]

