デンドリマー被覆磁気微粒子並びにその製造方法及び用途
【課題】デンドリマーで被覆された磁気微粒子であって、核酸等の目的物質を吸着した後の凝集が起きにくいデンドリマー被覆磁気微粒子並びにその製造方法及びそれを用いた核酸の回収又は精製方法を提供すること。
【解決手段】デンドリマー被覆磁気微粒子は、磁気微粒子と、この磁気微粒子の表面を被覆する脂質二重層と、この脂質二重層を構成する外層に結合されたデンドリマーとを具備する。このデンドリマー被覆磁気微粒子であってデンドリマーが正電荷を帯びている微粒子を、核酸含有溶液と接触させ、該核酸を前記デンドリマーに吸着させ、核酸を吸着させた微粒子を、磁気を用いて収集することにより、溶液中の核酸を回収することができる。
【解決手段】デンドリマー被覆磁気微粒子は、磁気微粒子と、この磁気微粒子の表面を被覆する脂質二重層と、この脂質二重層を構成する外層に結合されたデンドリマーとを具備する。このデンドリマー被覆磁気微粒子であってデンドリマーが正電荷を帯びている微粒子を、核酸含有溶液と接触させ、該核酸を前記デンドリマーに吸着させ、核酸を吸着させた微粒子を、磁気を用いて収集することにより、溶液中の核酸を回収することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、デンドリマー被覆磁気微粒子並びにその製造方法及び核酸の回収又は精製に適用するその用途に関する。
【背景技術】
【0002】
古くから用いられてきた核酸抽出方法では、フェノールやクロロフォルムといった有毒な有機溶剤を使用するフェノール抽出が代表的である。近年、これに代わる手法として、シリカ微粒子やシリカメンブレンフィルタなどのシリカ担体の表面に核酸を高濃度のカオトロピック塩(塩酸グアニジン、グアニジンチオシアネート等)を含む溶液中で選択的に吸着させる方法が用いられるようになってきた(非特許文献1参照)。この原理により、危険な有機溶媒を用いることなく、効率的に核酸を精製することが可能となった。中でも、シリカコーティングした磁気微粒子を用い、カオトロピック反応により核酸の吸着、脱離を行うBoom法が多く用いられている(非特許文献2参照)。また、同様の原理に基づく技術で、ポリエチレングリコール(PEG)存在下において、カルボキシル基で修飾された磁気微粒子に核酸が選択的に結合する現象を利用したsolid-phase reversible immobilization(SPRI) 法が開発されている(非特許文献3参照)。これらの磁気微粒子を利用した核酸精製法は、遠心、ろ過、沈殿などの操作を必要としないため、簡単・迅速に高純度核酸抽出・精製が可能である。
【0003】
しかしながら、Boom法は、核酸吸着工程において、刺激性、毒性を有するカオトロピック塩を高濃度条件において使用することが必須であるため、高濃度の塩が洗浄工程を経た後も残存し、続いて行われる遺伝子増幅やDNAの酵素切断など酵素を用いる反応に悪影響を及ぼす可能性がある。更に、核酸が結合した磁気微粒子を洗浄する操作では、70%エタノールが使用されるが、このエタノールも同様の悪影響を及ぼすことが指摘されている。特に、マイクロチップデバイスのように、非常に微量な反応容量で核酸をハンドリングする必要がある場合には、その混入の危険性が高い。SPRI法でも、核酸吸着工程で用いられる高濃度塩(NaCl)の残存や洗浄工程におけるエタノールの混入による悪影響はやはり問題となっている。
【0004】
これらの問題点に対し、核酸を固定化させる固相表面と核酸との電荷相互作用を利用した核酸の単離方法が公表されている(特許文献1,2及び非特許文献4参照)。また、この単離方法とほぼ同様の原理(Charge-Switch technology)に基づくDNA抽出キットが市販されている。これらの方法は、生体サンプル中の核酸をあるpH条件下で活性化固相と接触せしめ、負電荷を持つ核酸を、固相表面に導入されたキトサンなどの正に帯電した極性基と静電的に結合させた後、溶液のpHを変化させて固相表面の電荷を正から負に切り替えることにより、固相表面から核酸を容易に脱離させる方法である。これらの方法は、カオトロピック塩や高濃度塩、エタノールを使用しないため、安全性や核酸抽出後に続く反応への悪影響少なさの点で優れている。このような磁気微粒子を用いた電荷による核酸の精製手法は、マイクロデバイスへの応用にも期待がもたれている。微小流路内での応用に際して、分散性の高さと磁気応答性の良さが重要になる。それらを満たす手法が、非特許文献5において示されている。単磁区構造を有するため、ナノサイズでありながら磁気応答性の良い磁気細菌微粒子をコアとし、核酸を結合させるためにポリアミドアミンデンドリマーを微粒子表面に形成している。デンドリマーの樹状構造により高密度に表面アミノ基を固定化することが可能であり、加えて、微粒子どうしは表面電荷の反発から高い分散性を有することが明らかにされている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】国際公開第99/29703号
【特許文献2】特開2004-521881号公報
【特許文献3】特開2005-176613号公報
【特許文献4】特開2005-75993号公報
【特許文献5】特開2004-150797号公報
【特許文献6】特開2009-65849号公報
【特許文献7】特開2006-280277号公報
【非特許文献】
【0006】
【非特許文献1】Vogelstein B., Gillespie D., Proc.Natl.Acad.Sci.USA, 1979, Vol.76, p615-619
【非特許文献2】Boom R., Sol CJ., Salimans MM., Jansen CL., Wertheim-van Dillen PM., van der Noordaa J., J. Clinmicrobiol., 1990, Vol.28., p495-503
【非特許文献3】Hawkins TL., O'Connor-Morin T., Roy A., Santillan C., Nucleic Acids Res., 1994, Vol.22, p4543-4544
【非特許文献4】Weidong Cao et al., Anal. Chem., 2006, Vol.78 No.20, p7222-7228
【非特許文献5】Yoza. B et al., J Biosci. Bioeng. 2003, Vol.95 No.1, p21-26
【発明の概要】
【発明が解決しようとする課題】
【0007】
非特許文献5では表面上のポリアミンデンドリマーが核酸の吸着と粒子の凝集防止という二つの機能を兼ねており、どちらも表面の正電荷により行われている。そのため、核酸の吸着を行うと、表面の正電荷がキャンセルされてしまい、磁気微粒子どうしの凝集も引き起こす。この凝集は、磁気微粒子の回収が容易になるという利点もあるものの、洗浄や核酸の脱離といった工程においては効率が悪くなるため欠点でもある。
【0008】
従って、本発明の目的は、デンドリマーで被覆された磁気微粒子であって、核酸等の目的物質を吸着した後の凝集が起きにくいデンドリマー被覆磁気微粒子並びにその製造方法及びそれを用いた核酸の回収又は精製方法を提供することである。
【課題を解決するための手段】
【0009】
本願発明者らは、鋭意研究の結果、磁気微粒子の表面と、デンドリマーの間に脂質二重層を介在させることにより、核酸等の目的物質を結合した後の磁気微粒子間の平均距離が大きくなり、それによって磁気微粒子同士の凝集が起きにくくなることを見出し、本発明を完成した。
【0010】
すなわち、本発明は、磁気微粒子と、該磁気微粒子の表面を被覆する脂質二重層と、該脂質二重層を構成する外層に結合されたデンドリマーとを具備する、デンドリマー被覆磁気微粒子を提供する。
【0011】
また、本発明は、上記本発明のデンドリマー被覆磁気微粒子の製造方法であって、
(1) 表面に官能基を有する磁気微粒子を準備する工程と、
(2) 疎水性部分と、前記官能基と反応して結合する官能基を持つ親水性部分とを有する第1の両親媒性脂質を前記磁気微粒子上の前記官能基と反応させることにより、該第1の両親媒性脂質を、その疎水性部分が外側になるように前記磁気微粒子の表面に結合させる工程と、
(3) 疎水性部分と、デンドリマーの基端部分にある官能基と反応して結合する官能基を持つ親水性部分とを有する第2の両親媒性脂質を、前記(2)工程後の微粒子と水系媒体中で接触させて自己組織化により前記脂質二重層の外層を形成する工程と、
(4) (3)工程後の微粒子と、前記デンドリマーを反応させて該デンドリマーの基端部分にある上記官能基を、前記第2の両親媒性脂質の前記官能基と結合させる工程とを含む、
デンドリマー被覆磁気微粒子の製造方法を提供する。
【0012】
さらに、本発明は、上記本発明のデンドリマー被覆磁気微粒子の製造方法であって、
(1) 表面に官能基を有する磁気微粒子を準備する工程と、
(2) 疎水性部分と、前記官能基と反応して結合する官能基を持つ親水性部分とを有する第1の両親媒性脂質を前記磁気微粒子上の前記官能基と反応させることにより、該第1の両親媒性脂質を、その疎水性部分が外側になるように前記磁気微粒子の表面に結合させる工程と、
(3) 疎水性部分と、デンドリマーの基端部分にある官能基と反応して結合する官能基を持つ親水性部分とを有する第2の両親媒性脂質と、前記デンドリマーを反応させて該デンドリマーの基端部分にある上記官能基を、前記第2の両親媒性脂質の前記官能基と結合させる工程と、
(4) (3)工程で得られたデンドリマー結合脂質を前記(2)工程後の微粒子と水系媒体中で接触させ、自己組織化により、デンドリマーが結合された前記脂質二重層の外層を形成する工程とを含む、
デンドリマー被覆磁気微粒子の製造方法を提供する。
【0013】
さらに、本発明は、(1)上記本発明のデンドリマー被覆磁気微粒子であって前記デンドリマーが正電荷を帯びている微粒子を、核酸含有溶液と接触させ、該核酸を前記デンドリマーに吸着させる工程と、
(2) 核酸を吸着させた微粒子を、磁気を用いて収集する工程と、
を含む、溶液中の核酸の回収方法を提供する。
【0014】
さらに、本発明は、上記本発明の回収方法により核酸を回収する工程と、次いで該核酸を前記微粒子から脱離させる工程とを含む、溶液中の核酸の精製方法を提供する。
【発明の効果】
【0015】
本発明のデンドリマー被覆磁気微粒子は、磁気微粒子表面とデンドリマーの間に脂質二重層が介在しているので、これを用いて核酸等の回収を行った場合、磁気微粒子間の平均距離が、脂質二重層を介さない公知の磁気微粒子を用いた場合に比べて大きくなり、このため凝集が起きにくくなる。従って、目的物質を結合した後の磁気微粒子の洗浄や、目的物質の脱離工程を効率良く行うことができる。特に、マイクロデバイス内で目的物質の回収又は精製を行う場合等には、磁気微粒子の凝集が起きにくいことは有利である。また、本発明の製造方法では、厚みのある脂質二重層を自己組織化により形成するので、粒径が大きなデンドリマー被覆磁気微粒子を簡便に製造することができる。
【図面の簡単な説明】
【0016】
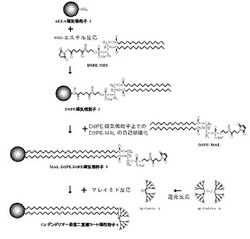
【図1】本発明の実施例で採用した、本発明のデンドリマー被覆磁気微粒子の製造方法の1例の反応スキームを示す図である。
【図2】本発明の実施例で製造した、本発明のデンドリマー被覆磁気微粒子の、レーザーゼータ電位計により測定した粒径と粒度分布を、公知の微粒子と比較して示す図である。
【発明を実施するための形態】
【0017】
上記のとおり、本発明のデンドリマー被覆磁気微粒子は、磁気微粒子と、該磁気微粒子の表面を被覆する脂質二重層と、該脂質二重層を構成する外層に結合されたデンドリマーとを含む。
【0018】
磁気微粒子としては、磁力により収集可能な磁性を帯びた粒子であって、後述する両親媒性脂質と共有結合可能な官能基を付与することが可能な粒子であれば特に限定されず、磁性細菌由来の磁気微粒子、金属又はプラスチック製の磁気微粒子や磁気ビーズ等を挙げることができる。磁気微粒子の直径は、特に限定されないが、50〜100nm程度が好ましい。これらのうち、磁性細菌由来の磁気微粒子が、単磁区構造を有するため、ナノサイズでありながら磁気応答性が良いので好ましい。磁性細菌は、その菌体内に直径約50〜100nmのマグネタイトの微粒子が10〜20個ほど連なったマグネトソームを保持していることが知られており、このマグネタイト微粒子を本発明において好適に利用することができる。磁性細菌としては、Magnetospirillum magneticum AMB-1及びMGT-1、Magnetospirillum gryphiswaldense MSR-1並びにAquaspirillum magnetotacticum MS-1等が知られている。なお、磁性細菌由来の磁気微粒子を固定化担体とするアミノ基含有デンドリマー(後述)を用いて核酸の回収、精製を行う方法は既に本願発明者らにより発明され、公知となっている(例えば特許文献6等)。
【0019】
前記磁気微粒子の表面は、脂質二重層により被覆されている。脂質二重層は、1分子中に疎水性部分と親水性部分を有する両親媒性脂質が水系媒体中で親水性部分を外側に向けて2層を構成することにより形成されるものである。脂質二重層自体は、生体膜の主たる構成要素等として周知のものであり、また、脂質二重層を構成する両親媒性脂質は、生体膜を構成するものとしてだけではなく、ドラッグデリバリーシステム等に広く用いられているリポソームの構成要素としても周知のものである。
【0020】
本発明において用いられる脂質二重層としては、水系媒体中で、自己組織化(すなわち、混合するだけで自動的に二重層が形成される)が可能な両親媒性脂質から形成されるものであれば特に限定されず、生体膜等を構成している周知の両親媒性脂質から基本的に構成されるものを好ましく用いることができる。このような両親媒性脂質としては、親水性部分にリン酸エステルを有するリン脂質が好ましく、中でも、ホスファチジルエタノールアミンのような、ホスファチジル基を有するグリセロリン脂質が好ましい。疎水性部分は、長鎖アルキル基(炭素数は、通常、12〜30程度、好ましくは15〜24程度)が最も好ましいが、脂質二重層の自己組織化を妨げない範囲で、長鎖アルキル基は他の置換基で置換されていてもよい。グリセロリン脂質の場合、長鎖アルキル基の数は、1分子中に2個が好ましい。
【0021】
脂質二重層を構成する内層(磁気微粒子側の層)が前記磁気微粒子の表面に共有結合により結合され、前記脂質二重層を構成する外層(後述するデンドリマーが結合される側の層)が前記デンドリマーと共有結合されていることが、粒子構造の安定性の観点及び製造効率の観点から好ましい。このため、脂質二重層を構成する両親媒性脂質は、基本的に上記のものでよいが、それぞれ他の官能基と化学結合可能な官能基を有していることが好ましい。これらについては、後述の製造方法の説明において説明する。
【0022】
脂質二重層の外層には、デンドリマーが結合されている。デンドリマーは、樹状ポリマーであり、ポリマーに所望の官能基を持たせることにより、担体の単位面積当たりに固定化できる所望の官能基の数を大幅に増加させることができる優れた性質を有するものであり、広く研究されている。後述のとおり、本発明の微粒子を用いて核酸を回収、精製するためには、デンドリマーが正に帯電していることが好ましく、アミノ基を有するものが好ましく、特にポリ(アミドアミン)(PAMAM)デンドリマーが好ましい。PAMAMデンドリマー自体は周知であり(例えば、非特許文献5)、通常、アルキルジアミン(シスタミンのように、一部の炭素原子がイオウ原子に置き換わっているものも用いられる)のコア(炭素数は通常2〜12程度)と三級アミンの分岐構造から成る。PAMAMデンドリマーは、各種コアを用いた各種世代(コアから第何番目の分岐にあたるかを世代といい、分岐を成長させる反応のサイクル数により制御される)のものが市販されており、本発明では、このような市販のPAMAMデンドリマーを好ましく用いることができる。また、本願発明者らは、既に、磁気微粒子の表面にPAMAMデンドリマーを固定化した、デンドリマー固定化磁気微粒子を発明し、これを用いて核酸やタンパク質を抽出する方法を発明し、出願している(特許文献5)。PAMAMデンドリマーの場合、分岐の末端に存在する、単位面積当たりのアミノ基の数が第6世代で最も多くなることがわかっている(非特許文献5)ので、第6世代のデンドリマーを用いることが最も好ましいが、他の世代のデンドリマーを用いることも可能である。
【0023】
デンドリマーは、上記した脂質二重層の外層と共有結合により結合していることが好ましい。このため、デンドリマーを構成するコアとしては、シスタミン(1,6-ヘキサンジアミンの3位と4位の炭素原子がイオウ原子に置き換わっているもの)等のS-S結合を含むものが好ましい。この場合、S-S結合を切断することにより生じるチオール基を利用して、両親媒性脂質の親水性部分に結合することが可能になるので好都合である。なお、シスタミンをコアとする第6世代のPAMAMデンドリマーも市販されているので、市販品を好ましく用いることができる。
【0024】
次に、本発明のデンドリマー被覆磁気微粒子の製造方法について説明する。
【0025】
まず、表面に官能基を有する磁気微粒子を準備する。この工程自体は公知であり、例えば特許文献7に記載されている。磁気微粒子としては、上記の通りであり、磁性細菌由来の磁気微粒子が好ましい。磁性細菌由来の磁気微粒子は、表面に細菌由来の脂質二重膜を有するが、これにデンドリマーを共有結合させることは難しいので、細菌由来の脂質二重膜は、1%ドデシル硫酸ナトリウム(SDS)等の界面活性剤や、有機溶媒、強アルカリ等を作用させることにより除去することが好ましい。
【0026】
磁気微粒子の表面の官能基は、第1の両親媒性脂質の親水部分の置換基と結合可能な官能基であればよく、特にアミノ基が好都合である。磁性細菌由来の磁気微粒子へのアミノ基の付与は、微粒子の表面を、公知のアミノシランカップリング剤やアミノシリル化剤でアミノシラン処理することにより行うことができる。アミノシランカップリング剤の好ましい例としては、3-[2-(2-アミノエチル)-エチルアミノ]-プロピルトリメトキシシラン(AEEA)等のアミノ基含有シラン誘導体を挙げることができる。上記アミノシランカップリング剤により粒子表面にアミノシラン処理を施す際には、粒子に存在するヒドロキシル基を表面に露出させることが好ましい。例えば、粒子として磁性細菌由来の磁気微粒子を採択した場合、該表面をアミノシラン処理するためには粒子表面に存在する細菌由来の脂質二重膜を除去することによって表面のヒドロキシル基を活性化させ、アミノシリル化反応、アミノシランカップリング反応を促進することができる。具体的な反応条件の1例は下記実施例に詳細に記載されている。
【0027】
続く第2工程では、疎水性部分と、前記官能基と反応して結合する官能基を持つ親水性部分とを有する第1の両親媒性脂質を前記磁気微粒子上の前記官能基、好ましくはアミノ基と反応させることにより、該第1の両親媒性脂質を、その疎水性部分が外側になるように前記磁気微粒子の表面に結合させる。第1の両親媒性脂質の親水性部分に存在する、磁気微粒子表面のアミノ基と結合する官能基の好ましい例としては、ヒドロキシスクシンイミジル(NHS)エステル基やスルホヒドロキシルスクシンイミジル(Sulfo-NHS)エステル基、イミドエステル基、アルデヒド基、イソチオシアネート基等を挙げることができるがこれらに限定されるものではない。本発明で好適に用いることができる、ホスファチジルエタノールアミンのような、ホスファチジル基を有するグリセロリン脂質の親水性部分にヒドロキシスクシンイミジル(NHS)エステル基を付加した、N-(スクシンイミジル-グルタリル)-L-α-ホスファチジルエタノールアミン,ジステアロイル(DSPE-NHS)等の、NHSエステル基を有するグリセロリン脂質は種々市販されているので、これらの市販品を好適に用いることができる。
【0028】
アミノ基を有する磁気微粒子と、NHSエステル基を有するリン脂質との反応は、例えばDMSOのような有機溶媒中で、通常、10℃〜40℃の温度下、好ましくは室温下で、通常、15分〜60分程度、好ましくは20分〜40分程度の反応時間で行うことができる。この際、磁気微粒子の凝集を防ぐために、反応液を超音波分散処理することが好ましい。反応時の磁気微粒子の濃度は、通常、0.2mg/ml〜1.0mg/ml程度、好ましくは0.4mg/ml〜0.6mg/ml程度であり、NHSエステル基を有するリン脂質の濃度は、通常、0.5mM〜2mM程度、好ましくは0.8mM〜1.2mM程度である。
【0029】
続く第3工程では、疎水性部分と、デンドリマーの基端部分(デンドリマーの最初の分岐よりも根本の部分)にある官能基と反応して結合する官能基を持つ親水性部分とを有する第2の両親媒性脂質を、前記第2工程後の微粒子と水系媒体中で接触させて自己組織化により前記脂質二重層の外層を形成する。第2の両親媒性脂質は、基本的に上記した通りであるが、その親水性部分は、デンドリマーと結合できる官能基を有しているものを採用する。デンドリマーとしては、上記のとおり、S-S結合を有するシスタミン等をコアに用いたPAMAMデンドリマーが好ましく、この場合には、デンドリマーのSH基が遊離するので、SH基と反応するマレイミド基等の官能基を有するものが好ましい。ホスファチジルエタノールアミンのような、ホスファチジル基を有するグリセロリン脂質の親水性部分にマレイミド基を付加した、N-(3-マレイミド-1-オキシプロピル)-L-α-ホスファチジルエタノールアミン,ジステアロイル等の、マレイミド基を有するグリセロリン脂質は種々市販されているので、これらの市販品を好適に用いることができる。
【0030】
第3工程における自己組織化反応は、上記第2工程により、脂質二重層の内層が結合した磁気微粒子と第2の両親媒性磁気微粒子とを、リン酸緩衝液(PBS)のような水系緩衝液中で加熱下混合し、この混合物を、この混合物よりも低温な、好ましくは室温の、PBSのような水系緩衝液に注入することにより行うことができる。加熱下の混合工程における磁気微粒子の濃度は、通常、0.2mg/ml〜1.0mg/ml程度、好ましくは0.4mg/ml〜0.6mg/ml程度であり、マレイミド基を有するリン脂質の濃度は、通常、0.5mM〜2mM程度、好ましくは0.8mM〜1.2mM程度である。また、加熱温度は、通常、50℃〜80℃程度、好ましくは60℃〜70℃程度であり、混合時間は、通常2分〜10分、好ましくは4分〜6分程度である。加熱下の混合工程中は、反応液を超音波分散処理することが好ましい。注入する水系媒体は、加熱下混合物に比べて十分な量であることが好ましく、通常、体積基準で、8倍〜12倍程度である。注入後、通常、30分〜60分程度、好ましくは40分〜50分程度、反応溶液を静置することにより、疎水性相互作用により、磁気微粒子上に結合されている第1の両親媒性脂質から成る内層と、第2の両親媒性脂質から成る外層とが、互いの疎水性部分を接して積層され、脂質二重層が形成される。
【0031】
続く第4工程では、上記第3工程後の微粒子と、前記デンドリマーとを反応させて該デンドリマーの基端部分にある官能基を、前記第2の両親媒性脂質の前記官能基と結合させる。上記のとおり、本発明で用いるデンドリマーとしては、コアにS-S結合を有するPAMAMデンドリマーが好ましく、このようなデンドリマーを、ジチオスレイトールのような還元剤で処理することにより、コアのS-S結合が切断されて基端部に遊離のSH基を持つデンドリマーが得られる。生じた遊離のSH基を、上記した、第2の両親媒性脂質の親水性部に存在する、好ましくはマレイミド基のような官能基と結合させる。マレイミド基とSH基の反応は、好ましくは、超音波分散処理下で磁気微粒子とデンドリマーをPBSのような水系緩衝液中で混合することにより行うことができる。反応温度は通常、10℃〜40℃、好ましくは室温下で行うことができる。反応時間は、通常、30分〜2時間、好ましくは40分〜80分程度である。反応時の磁気微粒子の濃度は、通常、0.2mg/ml〜1.0mg/ml程度、好ましくは0.4mg/ml〜0.6mg/ml程度であり、デンドリマーの濃度は、通常、0.001mM〜0.02mM、好ましくは0.005mM〜0.015mM程度である。
【0032】
この第4工程により、デンドリマーが脂質二重層の外層に結合され、本発明のデンドリマー被覆磁気微粒子が得られる。得られた磁気微粒子は、PBSのような水系緩衝液で洗浄してから使用することが好ましい。
【0033】
上記した製造方法では、第3工程で脂質二重層の外層を積層し、次に第4工程で外層にデンドリマーを結合したが、第3工程で外層を形成する第2の両親媒性脂質にデンドリマーを結合させ、最後の第4工程で、第2の両親媒性脂質とデンドリマーとの結合物を反応させて、自己組織化により脂質二重層を形成してもよい。この場合、第2の両親媒性脂質とデンドリマーとの反応は、10℃〜40℃、好ましくは室温下で行うことができる。反応時間は、通常、30分〜2時間、好ましくは40分〜80分程度である。反応時の第2の両親媒性脂質の濃度は、通常、0.5mM〜2.0mM程度、好ましくは0.8mM〜1.2mM程度であり、デンドリマーの濃度は、通常、0.001mM〜0.02mM、好ましくは0.005mM〜0.015mM程度である。また、第4工程の自己組織化工程は、上記した製造方法における第3工程の自己組織化工程と同様な条件で行うことができる。
【0034】
本発明のデンドリマー被覆磁気微粒子は、特許文献5や特許文献6等に記載されている公知のデンドリマー被覆磁気微粒子と全く同様にして、核酸やタンパク質の回収や精製に利用することができる。デンドリマーが、好ましくはアミノ基等を有することにより水中で正電荷を帯びている場合、DNAやRNAのような核酸は水中で負電荷を帯びているので、両者の間の静電的な相互作用を利用して核酸を磁気微粒子上に吸着することができる。すなわち、本発明の磁気微粒子を、核酸含有溶液と接触させ、該核酸を前記デンドリマーに吸着させ、次いで、核酸を吸着させた微粒子を、磁気を用いて収集することにより、溶液中の核酸を回収することができる。核酸含有溶液としては、例えば、培養細胞、動物由来の細胞又は組織(血液、血清、バフィーコート、体液、リンパ球等)、植物由来の細胞又は組織、あるいは細菌、真菌、ウィルス等、種々の生物を対象とした材料を含む溶液がいずれも使用可能である。核酸含有溶液と接触させる磁気微粒子の量は、予想される核酸の濃度や、回収目的とする核酸量等に応じて適宜設定できるが、通常、0.1mg/ml〜1.0mg/ml程度である。吸着反応は室温下でよく、時間は、通常、30秒〜5分程度である。また、磁気微粒子を、マイクロデバイスのマイクロ流路内に配置して核酸を吸着することも可能である。
【0035】
核酸を吸着した磁気微粒子は、常法により、磁力を用いて収集される。
【0036】
収集した磁気微粒子に吸着されている核酸を脱離することにより、核酸を精製することができる。脱離の方法も、特許文献5や特許文献6に記載されている通り公知であり、熱処理、界面活性剤処理、リン酸基を含む脱離剤による処理等により行うことができる。ここで、熱処理の条件は、通常、70℃〜90℃程度で10分〜30分程度でよい。界面活性剤としては、ドデシル硫酸ナトリウム、Triton X-100(商品名)、Tween20(商品名)等を用いることができ、使用時の濃度は、通常、0.01重量%〜1重量%程度である。また、リン酸基を含む脱離剤としては、ADP等のデオキシリボヌクレオシド二リン酸やATP等のデオキシリボヌクレオシド三リン酸等を用いることができ、使用時の濃度は、通常、1.0mM〜500mM程度であり、エタノールのような低濃度の有機溶媒を共存させることも好ましい。
【0037】
磁気微粒子から脱離した核酸は、所望の目的に用いることができ、もちろん、PCR等の核酸増幅法に供して増幅することができる。この場合、上記した脱離工程は、PCRの反応液中で行い、核酸が脱離した磁気微粒子の存在下で核酸増幅法を行うことも可能である。このように、核酸の使用場所で脱離を行う場合も、本発明の精製方法に該当する。
【実施例】
【0038】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0039】
実施例1 磁気微粒子の製造
図1に示す反応スキームに従い、本発明のデンドリマー被覆磁気微粒子を製造した。なお、図1中の「MAL-DSPE-DSPE磁気微粒子3」及び「G6デンドリマー−脂質二重層コート磁性粒子6」の第1の両親媒性脂質の親水性部分は、簡便のため図示が省略されている。
【0040】
まず、表面に脂質が修飾された磁気微粒子の調製を行った。磁性細菌(菌Magnetospirillum magneticum AMB-1)を従来公知の手順に従って分離・調製した後、磁気微粒子(平均粒径80nm)の表面の脂質二重膜の除去を行うことにより得た(Biotechnology and Bioengineering; Volume 94, Issue 5 , Pages 862 868 (2006)参照)。脂質二重膜の除去は、1%SDS溶液で除去した。蒸留水を用いて3回洗浄後、Ammonium peroxide溶液 (H20 : H2O2 : NH3 = 5 : 1 : 1) 20 ml を添加し、超音波による分散後、10分間静置することで磁気微粒子表面のヒドロキシル基の活性化を行った。脱水メタノールで3回洗浄を行った磁気微粒子を、2%AEEAのエタノール溶液を超音波分散させながら10分間反応させた。反応後の磁気微粒子をメタノールで3回洗浄した。DMFで1回洗浄した後、DMF中において120 ℃で30分間処理することで、シランカップリングの安定化を行うことでAEEA磁気微粒子1を作製した。
【0041】
第1の両親媒性脂質として、AEEA磁気微粒子表面に存在するアミノ基と反応性のあるヒドロキシスクシンイミジル(NHS)エステル基を有するN-(スクシンイミジル-グルタリル)-L-α-ホスファチジルエタノールアミン,ジステアロイル (DSPE-NHS、市販品)を用いた。DMSOにより1mMに調製したDSPE-NHS溶液をAEEA磁気微粒子濃度が0.5 mg/ml となるように加え、室温で30 分間超音波分散処理を行うことで、DSPE磁気微粒子 2を作製した。
【0042】
PBSを用いて1 mMに調製したN-(3-マレイミド-1-オキシプロピル)-L-α-ホスファチジルエタノールアミン,ジステアロイル,(DSPE-MAL、市販品) をDSPE修飾磁気微粒子濃度が0.5 mg/mlとなるように加え、超音波分散をしながら65℃に加熱後、10 mlのPBS (pH 7.4, 室温, 超音波分散) に注入した。疎水性相互作用により、粒子上のDSPEに対し、DSPE-MALをセルフアセンブルさせたMAL-DSPE-DSPE修飾磁気微粒子 3を調製した。
【0043】
次に、微粒子に結合させるデンドロンの調製を行った。0.5 mM G6 デンドリマー(PAMAMデンドリマー、シスタミンコア、第6世代) 4のメタノール溶液100 μlに対し、PBSで0.5 mMに調製したDTTを400 μl加えた。その後、攪拌しながら室温で12 時間インキュベーションすることでシスタミンコアを還元し、G6 デンドロン 5とした。シスタミンコアが開裂することで、チオール基が反応可能な状態となる。
【0044】
MAL-DSPE-DSPE修飾磁気微粒子に対して、PBSを用いて調製したG6 デンドロン溶液を加え、室温で60 分間超音波分散処理を行った。粒子上のマレイミド基とデンドロンのチオールの反応により、脂質二重層を介してデンドロンが修飾される。PBSを用いて洗浄後、回収した粒子をG6 デンドリマー脂質二重層コート磁性粒子 6とした。
【0045】
実施例2
実施例1で作製した磁気微粒子、及び脂質二重層を形成しないことを以外は、実施例1と同様なデンドリマー被覆磁気微粒子(特許文献6)の透過電子顕微鏡写真を撮った。その結果、実施例1の方法により作製された磁気微粒子において、脂質二重層の形成による構造が確認された。TEM像から各粒子の膜厚を計測したところ、脂質二重層無の粒子Aは約6.5 nm、脂質二重層有の粒子Bは約11.0 nmであった。G6 デンドロンを半球体状と見なした場合、高さは3.35 nm (Tomalia et al. 2003)、粒子Aにおいて架橋剤として用いたGMBSの分子長は0.73 nm (Thermo Scientific)、脂質二重層の厚さは約5〜10 nmである。以上より、G6デンドリマー脂質二重層コート磁性粒子は想定どおりに作製できていることが示唆された。
【0046】
DNAの回収能、脱離能について評価した。具体的には、次のようにして行った。作製した粒子10μgに対して、10mMのTris-HCl緩衝液(pH 7.5)で1000ng/40μlに調製したλDNA溶液を加え、超音波分散後、1分間室温で静置することで粒子上にλDNAを吸着させた。粒子を遠心回収(20400g, 5分間)後の上清中に含まれるλDNA量をインターカレーターであるPicogreenを用いて定量することで、粒子上に吸着したλDNA量を算出した。次に、λDNAを吸着させた粒子を10mMのTris-HCl緩衝液で3回洗浄した後に、1M リン酸緩衝液(pH 7.0)を40μl添加し、超音波分散後、80℃の恒温層で20分間静置することで粒子からλDNAを脱利した。粒子を遠心回収(20400g, 5分間)後、上清中のλDNA量をPicogreenを用いて定量することで粒子から脱離したλDNA量を算出した。その結果、10μgのデンドリマー被覆磁気微粒子を用いて約150ngのλDNAを回収することが可能であった。また、その回収率(λDNA脱離量/λDNA吸着量)は約96%であった。
【0047】
上記結果から明らかなように、本発明の磁気微粒子を用いた場合のDNAの回収能、脱離能は、公知の磁気微粒子と同程度であり、脂質二重層を形成することによる回収能、脱離能の低下は見られなかった。
【0048】
さらに、微粒子の分散性を調べるために、レーザーゼータ電位計を用いて、超音波分後の各種粒子と粒径分布を比較した。結果を図2に示す。
【0049】
図2に示されるように、脂質二重層を設けた本発明のデンドリマー被覆磁気微粒子の方が、脂質二重層を設けない公知のデンドリマー被覆磁気微粒子よりも見かけの粒径が小さくなっており、粒子の分散性がより高いことが示された。
【技術分野】
【0001】
本発明は、デンドリマー被覆磁気微粒子並びにその製造方法及び核酸の回収又は精製に適用するその用途に関する。
【背景技術】
【0002】
古くから用いられてきた核酸抽出方法では、フェノールやクロロフォルムといった有毒な有機溶剤を使用するフェノール抽出が代表的である。近年、これに代わる手法として、シリカ微粒子やシリカメンブレンフィルタなどのシリカ担体の表面に核酸を高濃度のカオトロピック塩(塩酸グアニジン、グアニジンチオシアネート等)を含む溶液中で選択的に吸着させる方法が用いられるようになってきた(非特許文献1参照)。この原理により、危険な有機溶媒を用いることなく、効率的に核酸を精製することが可能となった。中でも、シリカコーティングした磁気微粒子を用い、カオトロピック反応により核酸の吸着、脱離を行うBoom法が多く用いられている(非特許文献2参照)。また、同様の原理に基づく技術で、ポリエチレングリコール(PEG)存在下において、カルボキシル基で修飾された磁気微粒子に核酸が選択的に結合する現象を利用したsolid-phase reversible immobilization(SPRI) 法が開発されている(非特許文献3参照)。これらの磁気微粒子を利用した核酸精製法は、遠心、ろ過、沈殿などの操作を必要としないため、簡単・迅速に高純度核酸抽出・精製が可能である。
【0003】
しかしながら、Boom法は、核酸吸着工程において、刺激性、毒性を有するカオトロピック塩を高濃度条件において使用することが必須であるため、高濃度の塩が洗浄工程を経た後も残存し、続いて行われる遺伝子増幅やDNAの酵素切断など酵素を用いる反応に悪影響を及ぼす可能性がある。更に、核酸が結合した磁気微粒子を洗浄する操作では、70%エタノールが使用されるが、このエタノールも同様の悪影響を及ぼすことが指摘されている。特に、マイクロチップデバイスのように、非常に微量な反応容量で核酸をハンドリングする必要がある場合には、その混入の危険性が高い。SPRI法でも、核酸吸着工程で用いられる高濃度塩(NaCl)の残存や洗浄工程におけるエタノールの混入による悪影響はやはり問題となっている。
【0004】
これらの問題点に対し、核酸を固定化させる固相表面と核酸との電荷相互作用を利用した核酸の単離方法が公表されている(特許文献1,2及び非特許文献4参照)。また、この単離方法とほぼ同様の原理(Charge-Switch technology)に基づくDNA抽出キットが市販されている。これらの方法は、生体サンプル中の核酸をあるpH条件下で活性化固相と接触せしめ、負電荷を持つ核酸を、固相表面に導入されたキトサンなどの正に帯電した極性基と静電的に結合させた後、溶液のpHを変化させて固相表面の電荷を正から負に切り替えることにより、固相表面から核酸を容易に脱離させる方法である。これらの方法は、カオトロピック塩や高濃度塩、エタノールを使用しないため、安全性や核酸抽出後に続く反応への悪影響少なさの点で優れている。このような磁気微粒子を用いた電荷による核酸の精製手法は、マイクロデバイスへの応用にも期待がもたれている。微小流路内での応用に際して、分散性の高さと磁気応答性の良さが重要になる。それらを満たす手法が、非特許文献5において示されている。単磁区構造を有するため、ナノサイズでありながら磁気応答性の良い磁気細菌微粒子をコアとし、核酸を結合させるためにポリアミドアミンデンドリマーを微粒子表面に形成している。デンドリマーの樹状構造により高密度に表面アミノ基を固定化することが可能であり、加えて、微粒子どうしは表面電荷の反発から高い分散性を有することが明らかにされている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】国際公開第99/29703号
【特許文献2】特開2004-521881号公報
【特許文献3】特開2005-176613号公報
【特許文献4】特開2005-75993号公報
【特許文献5】特開2004-150797号公報
【特許文献6】特開2009-65849号公報
【特許文献7】特開2006-280277号公報
【非特許文献】
【0006】
【非特許文献1】Vogelstein B., Gillespie D., Proc.Natl.Acad.Sci.USA, 1979, Vol.76, p615-619
【非特許文献2】Boom R., Sol CJ., Salimans MM., Jansen CL., Wertheim-van Dillen PM., van der Noordaa J., J. Clinmicrobiol., 1990, Vol.28., p495-503
【非特許文献3】Hawkins TL., O'Connor-Morin T., Roy A., Santillan C., Nucleic Acids Res., 1994, Vol.22, p4543-4544
【非特許文献4】Weidong Cao et al., Anal. Chem., 2006, Vol.78 No.20, p7222-7228
【非特許文献5】Yoza. B et al., J Biosci. Bioeng. 2003, Vol.95 No.1, p21-26
【発明の概要】
【発明が解決しようとする課題】
【0007】
非特許文献5では表面上のポリアミンデンドリマーが核酸の吸着と粒子の凝集防止という二つの機能を兼ねており、どちらも表面の正電荷により行われている。そのため、核酸の吸着を行うと、表面の正電荷がキャンセルされてしまい、磁気微粒子どうしの凝集も引き起こす。この凝集は、磁気微粒子の回収が容易になるという利点もあるものの、洗浄や核酸の脱離といった工程においては効率が悪くなるため欠点でもある。
【0008】
従って、本発明の目的は、デンドリマーで被覆された磁気微粒子であって、核酸等の目的物質を吸着した後の凝集が起きにくいデンドリマー被覆磁気微粒子並びにその製造方法及びそれを用いた核酸の回収又は精製方法を提供することである。
【課題を解決するための手段】
【0009】
本願発明者らは、鋭意研究の結果、磁気微粒子の表面と、デンドリマーの間に脂質二重層を介在させることにより、核酸等の目的物質を結合した後の磁気微粒子間の平均距離が大きくなり、それによって磁気微粒子同士の凝集が起きにくくなることを見出し、本発明を完成した。
【0010】
すなわち、本発明は、磁気微粒子と、該磁気微粒子の表面を被覆する脂質二重層と、該脂質二重層を構成する外層に結合されたデンドリマーとを具備する、デンドリマー被覆磁気微粒子を提供する。
【0011】
また、本発明は、上記本発明のデンドリマー被覆磁気微粒子の製造方法であって、
(1) 表面に官能基を有する磁気微粒子を準備する工程と、
(2) 疎水性部分と、前記官能基と反応して結合する官能基を持つ親水性部分とを有する第1の両親媒性脂質を前記磁気微粒子上の前記官能基と反応させることにより、該第1の両親媒性脂質を、その疎水性部分が外側になるように前記磁気微粒子の表面に結合させる工程と、
(3) 疎水性部分と、デンドリマーの基端部分にある官能基と反応して結合する官能基を持つ親水性部分とを有する第2の両親媒性脂質を、前記(2)工程後の微粒子と水系媒体中で接触させて自己組織化により前記脂質二重層の外層を形成する工程と、
(4) (3)工程後の微粒子と、前記デンドリマーを反応させて該デンドリマーの基端部分にある上記官能基を、前記第2の両親媒性脂質の前記官能基と結合させる工程とを含む、
デンドリマー被覆磁気微粒子の製造方法を提供する。
【0012】
さらに、本発明は、上記本発明のデンドリマー被覆磁気微粒子の製造方法であって、
(1) 表面に官能基を有する磁気微粒子を準備する工程と、
(2) 疎水性部分と、前記官能基と反応して結合する官能基を持つ親水性部分とを有する第1の両親媒性脂質を前記磁気微粒子上の前記官能基と反応させることにより、該第1の両親媒性脂質を、その疎水性部分が外側になるように前記磁気微粒子の表面に結合させる工程と、
(3) 疎水性部分と、デンドリマーの基端部分にある官能基と反応して結合する官能基を持つ親水性部分とを有する第2の両親媒性脂質と、前記デンドリマーを反応させて該デンドリマーの基端部分にある上記官能基を、前記第2の両親媒性脂質の前記官能基と結合させる工程と、
(4) (3)工程で得られたデンドリマー結合脂質を前記(2)工程後の微粒子と水系媒体中で接触させ、自己組織化により、デンドリマーが結合された前記脂質二重層の外層を形成する工程とを含む、
デンドリマー被覆磁気微粒子の製造方法を提供する。
【0013】
さらに、本発明は、(1)上記本発明のデンドリマー被覆磁気微粒子であって前記デンドリマーが正電荷を帯びている微粒子を、核酸含有溶液と接触させ、該核酸を前記デンドリマーに吸着させる工程と、
(2) 核酸を吸着させた微粒子を、磁気を用いて収集する工程と、
を含む、溶液中の核酸の回収方法を提供する。
【0014】
さらに、本発明は、上記本発明の回収方法により核酸を回収する工程と、次いで該核酸を前記微粒子から脱離させる工程とを含む、溶液中の核酸の精製方法を提供する。
【発明の効果】
【0015】
本発明のデンドリマー被覆磁気微粒子は、磁気微粒子表面とデンドリマーの間に脂質二重層が介在しているので、これを用いて核酸等の回収を行った場合、磁気微粒子間の平均距離が、脂質二重層を介さない公知の磁気微粒子を用いた場合に比べて大きくなり、このため凝集が起きにくくなる。従って、目的物質を結合した後の磁気微粒子の洗浄や、目的物質の脱離工程を効率良く行うことができる。特に、マイクロデバイス内で目的物質の回収又は精製を行う場合等には、磁気微粒子の凝集が起きにくいことは有利である。また、本発明の製造方法では、厚みのある脂質二重層を自己組織化により形成するので、粒径が大きなデンドリマー被覆磁気微粒子を簡便に製造することができる。
【図面の簡単な説明】
【0016】
【図1】本発明の実施例で採用した、本発明のデンドリマー被覆磁気微粒子の製造方法の1例の反応スキームを示す図である。
【図2】本発明の実施例で製造した、本発明のデンドリマー被覆磁気微粒子の、レーザーゼータ電位計により測定した粒径と粒度分布を、公知の微粒子と比較して示す図である。
【発明を実施するための形態】
【0017】
上記のとおり、本発明のデンドリマー被覆磁気微粒子は、磁気微粒子と、該磁気微粒子の表面を被覆する脂質二重層と、該脂質二重層を構成する外層に結合されたデンドリマーとを含む。
【0018】
磁気微粒子としては、磁力により収集可能な磁性を帯びた粒子であって、後述する両親媒性脂質と共有結合可能な官能基を付与することが可能な粒子であれば特に限定されず、磁性細菌由来の磁気微粒子、金属又はプラスチック製の磁気微粒子や磁気ビーズ等を挙げることができる。磁気微粒子の直径は、特に限定されないが、50〜100nm程度が好ましい。これらのうち、磁性細菌由来の磁気微粒子が、単磁区構造を有するため、ナノサイズでありながら磁気応答性が良いので好ましい。磁性細菌は、その菌体内に直径約50〜100nmのマグネタイトの微粒子が10〜20個ほど連なったマグネトソームを保持していることが知られており、このマグネタイト微粒子を本発明において好適に利用することができる。磁性細菌としては、Magnetospirillum magneticum AMB-1及びMGT-1、Magnetospirillum gryphiswaldense MSR-1並びにAquaspirillum magnetotacticum MS-1等が知られている。なお、磁性細菌由来の磁気微粒子を固定化担体とするアミノ基含有デンドリマー(後述)を用いて核酸の回収、精製を行う方法は既に本願発明者らにより発明され、公知となっている(例えば特許文献6等)。
【0019】
前記磁気微粒子の表面は、脂質二重層により被覆されている。脂質二重層は、1分子中に疎水性部分と親水性部分を有する両親媒性脂質が水系媒体中で親水性部分を外側に向けて2層を構成することにより形成されるものである。脂質二重層自体は、生体膜の主たる構成要素等として周知のものであり、また、脂質二重層を構成する両親媒性脂質は、生体膜を構成するものとしてだけではなく、ドラッグデリバリーシステム等に広く用いられているリポソームの構成要素としても周知のものである。
【0020】
本発明において用いられる脂質二重層としては、水系媒体中で、自己組織化(すなわち、混合するだけで自動的に二重層が形成される)が可能な両親媒性脂質から形成されるものであれば特に限定されず、生体膜等を構成している周知の両親媒性脂質から基本的に構成されるものを好ましく用いることができる。このような両親媒性脂質としては、親水性部分にリン酸エステルを有するリン脂質が好ましく、中でも、ホスファチジルエタノールアミンのような、ホスファチジル基を有するグリセロリン脂質が好ましい。疎水性部分は、長鎖アルキル基(炭素数は、通常、12〜30程度、好ましくは15〜24程度)が最も好ましいが、脂質二重層の自己組織化を妨げない範囲で、長鎖アルキル基は他の置換基で置換されていてもよい。グリセロリン脂質の場合、長鎖アルキル基の数は、1分子中に2個が好ましい。
【0021】
脂質二重層を構成する内層(磁気微粒子側の層)が前記磁気微粒子の表面に共有結合により結合され、前記脂質二重層を構成する外層(後述するデンドリマーが結合される側の層)が前記デンドリマーと共有結合されていることが、粒子構造の安定性の観点及び製造効率の観点から好ましい。このため、脂質二重層を構成する両親媒性脂質は、基本的に上記のものでよいが、それぞれ他の官能基と化学結合可能な官能基を有していることが好ましい。これらについては、後述の製造方法の説明において説明する。
【0022】
脂質二重層の外層には、デンドリマーが結合されている。デンドリマーは、樹状ポリマーであり、ポリマーに所望の官能基を持たせることにより、担体の単位面積当たりに固定化できる所望の官能基の数を大幅に増加させることができる優れた性質を有するものであり、広く研究されている。後述のとおり、本発明の微粒子を用いて核酸を回収、精製するためには、デンドリマーが正に帯電していることが好ましく、アミノ基を有するものが好ましく、特にポリ(アミドアミン)(PAMAM)デンドリマーが好ましい。PAMAMデンドリマー自体は周知であり(例えば、非特許文献5)、通常、アルキルジアミン(シスタミンのように、一部の炭素原子がイオウ原子に置き換わっているものも用いられる)のコア(炭素数は通常2〜12程度)と三級アミンの分岐構造から成る。PAMAMデンドリマーは、各種コアを用いた各種世代(コアから第何番目の分岐にあたるかを世代といい、分岐を成長させる反応のサイクル数により制御される)のものが市販されており、本発明では、このような市販のPAMAMデンドリマーを好ましく用いることができる。また、本願発明者らは、既に、磁気微粒子の表面にPAMAMデンドリマーを固定化した、デンドリマー固定化磁気微粒子を発明し、これを用いて核酸やタンパク質を抽出する方法を発明し、出願している(特許文献5)。PAMAMデンドリマーの場合、分岐の末端に存在する、単位面積当たりのアミノ基の数が第6世代で最も多くなることがわかっている(非特許文献5)ので、第6世代のデンドリマーを用いることが最も好ましいが、他の世代のデンドリマーを用いることも可能である。
【0023】
デンドリマーは、上記した脂質二重層の外層と共有結合により結合していることが好ましい。このため、デンドリマーを構成するコアとしては、シスタミン(1,6-ヘキサンジアミンの3位と4位の炭素原子がイオウ原子に置き換わっているもの)等のS-S結合を含むものが好ましい。この場合、S-S結合を切断することにより生じるチオール基を利用して、両親媒性脂質の親水性部分に結合することが可能になるので好都合である。なお、シスタミンをコアとする第6世代のPAMAMデンドリマーも市販されているので、市販品を好ましく用いることができる。
【0024】
次に、本発明のデンドリマー被覆磁気微粒子の製造方法について説明する。
【0025】
まず、表面に官能基を有する磁気微粒子を準備する。この工程自体は公知であり、例えば特許文献7に記載されている。磁気微粒子としては、上記の通りであり、磁性細菌由来の磁気微粒子が好ましい。磁性細菌由来の磁気微粒子は、表面に細菌由来の脂質二重膜を有するが、これにデンドリマーを共有結合させることは難しいので、細菌由来の脂質二重膜は、1%ドデシル硫酸ナトリウム(SDS)等の界面活性剤や、有機溶媒、強アルカリ等を作用させることにより除去することが好ましい。
【0026】
磁気微粒子の表面の官能基は、第1の両親媒性脂質の親水部分の置換基と結合可能な官能基であればよく、特にアミノ基が好都合である。磁性細菌由来の磁気微粒子へのアミノ基の付与は、微粒子の表面を、公知のアミノシランカップリング剤やアミノシリル化剤でアミノシラン処理することにより行うことができる。アミノシランカップリング剤の好ましい例としては、3-[2-(2-アミノエチル)-エチルアミノ]-プロピルトリメトキシシラン(AEEA)等のアミノ基含有シラン誘導体を挙げることができる。上記アミノシランカップリング剤により粒子表面にアミノシラン処理を施す際には、粒子に存在するヒドロキシル基を表面に露出させることが好ましい。例えば、粒子として磁性細菌由来の磁気微粒子を採択した場合、該表面をアミノシラン処理するためには粒子表面に存在する細菌由来の脂質二重膜を除去することによって表面のヒドロキシル基を活性化させ、アミノシリル化反応、アミノシランカップリング反応を促進することができる。具体的な反応条件の1例は下記実施例に詳細に記載されている。
【0027】
続く第2工程では、疎水性部分と、前記官能基と反応して結合する官能基を持つ親水性部分とを有する第1の両親媒性脂質を前記磁気微粒子上の前記官能基、好ましくはアミノ基と反応させることにより、該第1の両親媒性脂質を、その疎水性部分が外側になるように前記磁気微粒子の表面に結合させる。第1の両親媒性脂質の親水性部分に存在する、磁気微粒子表面のアミノ基と結合する官能基の好ましい例としては、ヒドロキシスクシンイミジル(NHS)エステル基やスルホヒドロキシルスクシンイミジル(Sulfo-NHS)エステル基、イミドエステル基、アルデヒド基、イソチオシアネート基等を挙げることができるがこれらに限定されるものではない。本発明で好適に用いることができる、ホスファチジルエタノールアミンのような、ホスファチジル基を有するグリセロリン脂質の親水性部分にヒドロキシスクシンイミジル(NHS)エステル基を付加した、N-(スクシンイミジル-グルタリル)-L-α-ホスファチジルエタノールアミン,ジステアロイル(DSPE-NHS)等の、NHSエステル基を有するグリセロリン脂質は種々市販されているので、これらの市販品を好適に用いることができる。
【0028】
アミノ基を有する磁気微粒子と、NHSエステル基を有するリン脂質との反応は、例えばDMSOのような有機溶媒中で、通常、10℃〜40℃の温度下、好ましくは室温下で、通常、15分〜60分程度、好ましくは20分〜40分程度の反応時間で行うことができる。この際、磁気微粒子の凝集を防ぐために、反応液を超音波分散処理することが好ましい。反応時の磁気微粒子の濃度は、通常、0.2mg/ml〜1.0mg/ml程度、好ましくは0.4mg/ml〜0.6mg/ml程度であり、NHSエステル基を有するリン脂質の濃度は、通常、0.5mM〜2mM程度、好ましくは0.8mM〜1.2mM程度である。
【0029】
続く第3工程では、疎水性部分と、デンドリマーの基端部分(デンドリマーの最初の分岐よりも根本の部分)にある官能基と反応して結合する官能基を持つ親水性部分とを有する第2の両親媒性脂質を、前記第2工程後の微粒子と水系媒体中で接触させて自己組織化により前記脂質二重層の外層を形成する。第2の両親媒性脂質は、基本的に上記した通りであるが、その親水性部分は、デンドリマーと結合できる官能基を有しているものを採用する。デンドリマーとしては、上記のとおり、S-S結合を有するシスタミン等をコアに用いたPAMAMデンドリマーが好ましく、この場合には、デンドリマーのSH基が遊離するので、SH基と反応するマレイミド基等の官能基を有するものが好ましい。ホスファチジルエタノールアミンのような、ホスファチジル基を有するグリセロリン脂質の親水性部分にマレイミド基を付加した、N-(3-マレイミド-1-オキシプロピル)-L-α-ホスファチジルエタノールアミン,ジステアロイル等の、マレイミド基を有するグリセロリン脂質は種々市販されているので、これらの市販品を好適に用いることができる。
【0030】
第3工程における自己組織化反応は、上記第2工程により、脂質二重層の内層が結合した磁気微粒子と第2の両親媒性磁気微粒子とを、リン酸緩衝液(PBS)のような水系緩衝液中で加熱下混合し、この混合物を、この混合物よりも低温な、好ましくは室温の、PBSのような水系緩衝液に注入することにより行うことができる。加熱下の混合工程における磁気微粒子の濃度は、通常、0.2mg/ml〜1.0mg/ml程度、好ましくは0.4mg/ml〜0.6mg/ml程度であり、マレイミド基を有するリン脂質の濃度は、通常、0.5mM〜2mM程度、好ましくは0.8mM〜1.2mM程度である。また、加熱温度は、通常、50℃〜80℃程度、好ましくは60℃〜70℃程度であり、混合時間は、通常2分〜10分、好ましくは4分〜6分程度である。加熱下の混合工程中は、反応液を超音波分散処理することが好ましい。注入する水系媒体は、加熱下混合物に比べて十分な量であることが好ましく、通常、体積基準で、8倍〜12倍程度である。注入後、通常、30分〜60分程度、好ましくは40分〜50分程度、反応溶液を静置することにより、疎水性相互作用により、磁気微粒子上に結合されている第1の両親媒性脂質から成る内層と、第2の両親媒性脂質から成る外層とが、互いの疎水性部分を接して積層され、脂質二重層が形成される。
【0031】
続く第4工程では、上記第3工程後の微粒子と、前記デンドリマーとを反応させて該デンドリマーの基端部分にある官能基を、前記第2の両親媒性脂質の前記官能基と結合させる。上記のとおり、本発明で用いるデンドリマーとしては、コアにS-S結合を有するPAMAMデンドリマーが好ましく、このようなデンドリマーを、ジチオスレイトールのような還元剤で処理することにより、コアのS-S結合が切断されて基端部に遊離のSH基を持つデンドリマーが得られる。生じた遊離のSH基を、上記した、第2の両親媒性脂質の親水性部に存在する、好ましくはマレイミド基のような官能基と結合させる。マレイミド基とSH基の反応は、好ましくは、超音波分散処理下で磁気微粒子とデンドリマーをPBSのような水系緩衝液中で混合することにより行うことができる。反応温度は通常、10℃〜40℃、好ましくは室温下で行うことができる。反応時間は、通常、30分〜2時間、好ましくは40分〜80分程度である。反応時の磁気微粒子の濃度は、通常、0.2mg/ml〜1.0mg/ml程度、好ましくは0.4mg/ml〜0.6mg/ml程度であり、デンドリマーの濃度は、通常、0.001mM〜0.02mM、好ましくは0.005mM〜0.015mM程度である。
【0032】
この第4工程により、デンドリマーが脂質二重層の外層に結合され、本発明のデンドリマー被覆磁気微粒子が得られる。得られた磁気微粒子は、PBSのような水系緩衝液で洗浄してから使用することが好ましい。
【0033】
上記した製造方法では、第3工程で脂質二重層の外層を積層し、次に第4工程で外層にデンドリマーを結合したが、第3工程で外層を形成する第2の両親媒性脂質にデンドリマーを結合させ、最後の第4工程で、第2の両親媒性脂質とデンドリマーとの結合物を反応させて、自己組織化により脂質二重層を形成してもよい。この場合、第2の両親媒性脂質とデンドリマーとの反応は、10℃〜40℃、好ましくは室温下で行うことができる。反応時間は、通常、30分〜2時間、好ましくは40分〜80分程度である。反応時の第2の両親媒性脂質の濃度は、通常、0.5mM〜2.0mM程度、好ましくは0.8mM〜1.2mM程度であり、デンドリマーの濃度は、通常、0.001mM〜0.02mM、好ましくは0.005mM〜0.015mM程度である。また、第4工程の自己組織化工程は、上記した製造方法における第3工程の自己組織化工程と同様な条件で行うことができる。
【0034】
本発明のデンドリマー被覆磁気微粒子は、特許文献5や特許文献6等に記載されている公知のデンドリマー被覆磁気微粒子と全く同様にして、核酸やタンパク質の回収や精製に利用することができる。デンドリマーが、好ましくはアミノ基等を有することにより水中で正電荷を帯びている場合、DNAやRNAのような核酸は水中で負電荷を帯びているので、両者の間の静電的な相互作用を利用して核酸を磁気微粒子上に吸着することができる。すなわち、本発明の磁気微粒子を、核酸含有溶液と接触させ、該核酸を前記デンドリマーに吸着させ、次いで、核酸を吸着させた微粒子を、磁気を用いて収集することにより、溶液中の核酸を回収することができる。核酸含有溶液としては、例えば、培養細胞、動物由来の細胞又は組織(血液、血清、バフィーコート、体液、リンパ球等)、植物由来の細胞又は組織、あるいは細菌、真菌、ウィルス等、種々の生物を対象とした材料を含む溶液がいずれも使用可能である。核酸含有溶液と接触させる磁気微粒子の量は、予想される核酸の濃度や、回収目的とする核酸量等に応じて適宜設定できるが、通常、0.1mg/ml〜1.0mg/ml程度である。吸着反応は室温下でよく、時間は、通常、30秒〜5分程度である。また、磁気微粒子を、マイクロデバイスのマイクロ流路内に配置して核酸を吸着することも可能である。
【0035】
核酸を吸着した磁気微粒子は、常法により、磁力を用いて収集される。
【0036】
収集した磁気微粒子に吸着されている核酸を脱離することにより、核酸を精製することができる。脱離の方法も、特許文献5や特許文献6に記載されている通り公知であり、熱処理、界面活性剤処理、リン酸基を含む脱離剤による処理等により行うことができる。ここで、熱処理の条件は、通常、70℃〜90℃程度で10分〜30分程度でよい。界面活性剤としては、ドデシル硫酸ナトリウム、Triton X-100(商品名)、Tween20(商品名)等を用いることができ、使用時の濃度は、通常、0.01重量%〜1重量%程度である。また、リン酸基を含む脱離剤としては、ADP等のデオキシリボヌクレオシド二リン酸やATP等のデオキシリボヌクレオシド三リン酸等を用いることができ、使用時の濃度は、通常、1.0mM〜500mM程度であり、エタノールのような低濃度の有機溶媒を共存させることも好ましい。
【0037】
磁気微粒子から脱離した核酸は、所望の目的に用いることができ、もちろん、PCR等の核酸増幅法に供して増幅することができる。この場合、上記した脱離工程は、PCRの反応液中で行い、核酸が脱離した磁気微粒子の存在下で核酸増幅法を行うことも可能である。このように、核酸の使用場所で脱離を行う場合も、本発明の精製方法に該当する。
【実施例】
【0038】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0039】
実施例1 磁気微粒子の製造
図1に示す反応スキームに従い、本発明のデンドリマー被覆磁気微粒子を製造した。なお、図1中の「MAL-DSPE-DSPE磁気微粒子3」及び「G6デンドリマー−脂質二重層コート磁性粒子6」の第1の両親媒性脂質の親水性部分は、簡便のため図示が省略されている。
【0040】
まず、表面に脂質が修飾された磁気微粒子の調製を行った。磁性細菌(菌Magnetospirillum magneticum AMB-1)を従来公知の手順に従って分離・調製した後、磁気微粒子(平均粒径80nm)の表面の脂質二重膜の除去を行うことにより得た(Biotechnology and Bioengineering; Volume 94, Issue 5 , Pages 862 868 (2006)参照)。脂質二重膜の除去は、1%SDS溶液で除去した。蒸留水を用いて3回洗浄後、Ammonium peroxide溶液 (H20 : H2O2 : NH3 = 5 : 1 : 1) 20 ml を添加し、超音波による分散後、10分間静置することで磁気微粒子表面のヒドロキシル基の活性化を行った。脱水メタノールで3回洗浄を行った磁気微粒子を、2%AEEAのエタノール溶液を超音波分散させながら10分間反応させた。反応後の磁気微粒子をメタノールで3回洗浄した。DMFで1回洗浄した後、DMF中において120 ℃で30分間処理することで、シランカップリングの安定化を行うことでAEEA磁気微粒子1を作製した。
【0041】
第1の両親媒性脂質として、AEEA磁気微粒子表面に存在するアミノ基と反応性のあるヒドロキシスクシンイミジル(NHS)エステル基を有するN-(スクシンイミジル-グルタリル)-L-α-ホスファチジルエタノールアミン,ジステアロイル (DSPE-NHS、市販品)を用いた。DMSOにより1mMに調製したDSPE-NHS溶液をAEEA磁気微粒子濃度が0.5 mg/ml となるように加え、室温で30 分間超音波分散処理を行うことで、DSPE磁気微粒子 2を作製した。
【0042】
PBSを用いて1 mMに調製したN-(3-マレイミド-1-オキシプロピル)-L-α-ホスファチジルエタノールアミン,ジステアロイル,(DSPE-MAL、市販品) をDSPE修飾磁気微粒子濃度が0.5 mg/mlとなるように加え、超音波分散をしながら65℃に加熱後、10 mlのPBS (pH 7.4, 室温, 超音波分散) に注入した。疎水性相互作用により、粒子上のDSPEに対し、DSPE-MALをセルフアセンブルさせたMAL-DSPE-DSPE修飾磁気微粒子 3を調製した。
【0043】
次に、微粒子に結合させるデンドロンの調製を行った。0.5 mM G6 デンドリマー(PAMAMデンドリマー、シスタミンコア、第6世代) 4のメタノール溶液100 μlに対し、PBSで0.5 mMに調製したDTTを400 μl加えた。その後、攪拌しながら室温で12 時間インキュベーションすることでシスタミンコアを還元し、G6 デンドロン 5とした。シスタミンコアが開裂することで、チオール基が反応可能な状態となる。
【0044】
MAL-DSPE-DSPE修飾磁気微粒子に対して、PBSを用いて調製したG6 デンドロン溶液を加え、室温で60 分間超音波分散処理を行った。粒子上のマレイミド基とデンドロンのチオールの反応により、脂質二重層を介してデンドロンが修飾される。PBSを用いて洗浄後、回収した粒子をG6 デンドリマー脂質二重層コート磁性粒子 6とした。
【0045】
実施例2
実施例1で作製した磁気微粒子、及び脂質二重層を形成しないことを以外は、実施例1と同様なデンドリマー被覆磁気微粒子(特許文献6)の透過電子顕微鏡写真を撮った。その結果、実施例1の方法により作製された磁気微粒子において、脂質二重層の形成による構造が確認された。TEM像から各粒子の膜厚を計測したところ、脂質二重層無の粒子Aは約6.5 nm、脂質二重層有の粒子Bは約11.0 nmであった。G6 デンドロンを半球体状と見なした場合、高さは3.35 nm (Tomalia et al. 2003)、粒子Aにおいて架橋剤として用いたGMBSの分子長は0.73 nm (Thermo Scientific)、脂質二重層の厚さは約5〜10 nmである。以上より、G6デンドリマー脂質二重層コート磁性粒子は想定どおりに作製できていることが示唆された。
【0046】
DNAの回収能、脱離能について評価した。具体的には、次のようにして行った。作製した粒子10μgに対して、10mMのTris-HCl緩衝液(pH 7.5)で1000ng/40μlに調製したλDNA溶液を加え、超音波分散後、1分間室温で静置することで粒子上にλDNAを吸着させた。粒子を遠心回収(20400g, 5分間)後の上清中に含まれるλDNA量をインターカレーターであるPicogreenを用いて定量することで、粒子上に吸着したλDNA量を算出した。次に、λDNAを吸着させた粒子を10mMのTris-HCl緩衝液で3回洗浄した後に、1M リン酸緩衝液(pH 7.0)を40μl添加し、超音波分散後、80℃の恒温層で20分間静置することで粒子からλDNAを脱利した。粒子を遠心回収(20400g, 5分間)後、上清中のλDNA量をPicogreenを用いて定量することで粒子から脱離したλDNA量を算出した。その結果、10μgのデンドリマー被覆磁気微粒子を用いて約150ngのλDNAを回収することが可能であった。また、その回収率(λDNA脱離量/λDNA吸着量)は約96%であった。
【0047】
上記結果から明らかなように、本発明の磁気微粒子を用いた場合のDNAの回収能、脱離能は、公知の磁気微粒子と同程度であり、脂質二重層を形成することによる回収能、脱離能の低下は見られなかった。
【0048】
さらに、微粒子の分散性を調べるために、レーザーゼータ電位計を用いて、超音波分後の各種粒子と粒径分布を比較した。結果を図2に示す。
【0049】
図2に示されるように、脂質二重層を設けた本発明のデンドリマー被覆磁気微粒子の方が、脂質二重層を設けない公知のデンドリマー被覆磁気微粒子よりも見かけの粒径が小さくなっており、粒子の分散性がより高いことが示された。
【特許請求の範囲】
【請求項1】
磁気微粒子と、該磁気微粒子の表面を被覆する脂質二重層と、該脂質二重層を構成する外層に結合されたデンドリマーとを具備する、デンドリマー被覆磁気微粒子。
【請求項2】
前記デンドリマーが正電荷を帯びている請求項1記載の微粒子。
【請求項3】
前記デンドリマーがアミノ基を有する請求項2記載の微粒子。
【請求項4】
前記脂質二重層を構成する内層が前記磁気微粒子の表面に共有結合により結合され、前記脂質二重層を構成する外層が前記デンドリマーと共有結合されている請求項1〜3のいずれか1項に記載の微粒子。
【請求項5】
請求項1〜4のいずれか1項に記載のデンドリマー被覆磁気微粒子の製造方法であって、
(1) 表面に官能基を有する磁気微粒子を準備する工程と、
(2) 疎水性部分と、前記官能基と反応して結合する官能基を持つ親水性部分とを有する第1の両親媒性脂質を前記磁気微粒子上の前記官能基と反応させることにより、該第1の両親媒性脂質を、その疎水性部分が外側になるように前記磁気微粒子の表面に結合させる工程と、
(3) 疎水性部分と、デンドリマーの基端部分にある官能基と反応して結合する官能基を持つ親水性部分とを有する第2の両親媒性脂質を、前記(2)工程後の微粒子と水系媒体中で接触させて自己組織化により前記脂質二重層の外層を形成する工程と、
(4) (3)工程後の微粒子と、前記デンドリマーを反応させて該デンドリマーの基端部分にある上記官能基を、前記第2の両親媒性脂質の前記官能基と結合させる工程とを含む、
デンドリマー被覆磁気微粒子の製造方法。
【請求項6】
請求項1〜4のいずれか1項に記載のデンドリマー被覆磁気微粒子の製造方法であって、
(1) 表面に官能基を有する磁気微粒子を準備する工程と、
(2) 疎水性部分と、前記官能基と反応して結合する官能基を持つ親水性部分とを有する第1の両親媒性脂質を前記磁気微粒子上の前記官能基と反応させることにより、該第1の両親媒性脂質を、その疎水性部分が外側になるように前記磁気微粒子の表面に結合させる工程と、
(3) 疎水性部分と、デンドリマーの基端部分にある官能基と反応して結合する官能基を持つ親水性部分とを有する第2の両親媒性脂質と、前記デンドリマーを反応させて該デンドリマーの基端部分にある上記官能基を、前記第2の両親媒性脂質の前記官能基と結合させる工程と、
(4) (3)工程で得られたデンドリマー結合脂質を前記(2)工程後の微粒子と水系媒体中で接触させ、自己組織化により、デンドリマーが結合された前記脂質二重層の外層を形成する工程とを含む、
デンドリマー被覆磁気微粒子の製造方法。
【請求項7】
(1) 請求項1〜4のいずれか1項に記載のデンドリマー被覆磁気微粒子であって前記デンドリマーが正電荷を帯びている微粒子を、核酸含有溶液と接触させ、該核酸を前記デンドリマーに吸着させる工程と、
(2) 核酸を吸着させた微粒子を、磁気を用いて収集する工程と、
を含む、溶液中の核酸の回収方法。
【請求項8】
請求項7記載の方法により核酸を回収する工程と、次いで該核酸を前記微粒子から脱離させる工程とを含む、溶液中の核酸の精製方法。
【請求項1】
磁気微粒子と、該磁気微粒子の表面を被覆する脂質二重層と、該脂質二重層を構成する外層に結合されたデンドリマーとを具備する、デンドリマー被覆磁気微粒子。
【請求項2】
前記デンドリマーが正電荷を帯びている請求項1記載の微粒子。
【請求項3】
前記デンドリマーがアミノ基を有する請求項2記載の微粒子。
【請求項4】
前記脂質二重層を構成する内層が前記磁気微粒子の表面に共有結合により結合され、前記脂質二重層を構成する外層が前記デンドリマーと共有結合されている請求項1〜3のいずれか1項に記載の微粒子。
【請求項5】
請求項1〜4のいずれか1項に記載のデンドリマー被覆磁気微粒子の製造方法であって、
(1) 表面に官能基を有する磁気微粒子を準備する工程と、
(2) 疎水性部分と、前記官能基と反応して結合する官能基を持つ親水性部分とを有する第1の両親媒性脂質を前記磁気微粒子上の前記官能基と反応させることにより、該第1の両親媒性脂質を、その疎水性部分が外側になるように前記磁気微粒子の表面に結合させる工程と、
(3) 疎水性部分と、デンドリマーの基端部分にある官能基と反応して結合する官能基を持つ親水性部分とを有する第2の両親媒性脂質を、前記(2)工程後の微粒子と水系媒体中で接触させて自己組織化により前記脂質二重層の外層を形成する工程と、
(4) (3)工程後の微粒子と、前記デンドリマーを反応させて該デンドリマーの基端部分にある上記官能基を、前記第2の両親媒性脂質の前記官能基と結合させる工程とを含む、
デンドリマー被覆磁気微粒子の製造方法。
【請求項6】
請求項1〜4のいずれか1項に記載のデンドリマー被覆磁気微粒子の製造方法であって、
(1) 表面に官能基を有する磁気微粒子を準備する工程と、
(2) 疎水性部分と、前記官能基と反応して結合する官能基を持つ親水性部分とを有する第1の両親媒性脂質を前記磁気微粒子上の前記官能基と反応させることにより、該第1の両親媒性脂質を、その疎水性部分が外側になるように前記磁気微粒子の表面に結合させる工程と、
(3) 疎水性部分と、デンドリマーの基端部分にある官能基と反応して結合する官能基を持つ親水性部分とを有する第2の両親媒性脂質と、前記デンドリマーを反応させて該デンドリマーの基端部分にある上記官能基を、前記第2の両親媒性脂質の前記官能基と結合させる工程と、
(4) (3)工程で得られたデンドリマー結合脂質を前記(2)工程後の微粒子と水系媒体中で接触させ、自己組織化により、デンドリマーが結合された前記脂質二重層の外層を形成する工程とを含む、
デンドリマー被覆磁気微粒子の製造方法。
【請求項7】
(1) 請求項1〜4のいずれか1項に記載のデンドリマー被覆磁気微粒子であって前記デンドリマーが正電荷を帯びている微粒子を、核酸含有溶液と接触させ、該核酸を前記デンドリマーに吸着させる工程と、
(2) 核酸を吸着させた微粒子を、磁気を用いて収集する工程と、
を含む、溶液中の核酸の回収方法。
【請求項8】
請求項7記載の方法により核酸を回収する工程と、次いで該核酸を前記微粒子から脱離させる工程とを含む、溶液中の核酸の精製方法。
【図1】


【図2】




【図2】


【公開番号】特開2011−57813(P2011−57813A)
【公開日】平成23年3月24日(2011.3.24)
【国際特許分類】
【出願番号】特願2009−207802(P2009−207802)
【出願日】平成21年9月9日(2009.9.9)
【出願人】(504132881)国立大学法人東京農工大学 (595)
【出願人】(000006507)横河電機株式会社 (4,443)
【Fターム(参考)】
【公開日】平成23年3月24日(2011.3.24)
【国際特許分類】
【出願日】平成21年9月9日(2009.9.9)
【出願人】(504132881)国立大学法人東京農工大学 (595)
【出願人】(000006507)横河電機株式会社 (4,443)
【Fターム(参考)】
[ Back to top ]

