データ収集プロセスの間の、データおよび関係するメタデータの資格付与
臨床試験に関係するメタデータを処理するシステムおよび方法を記述する。1つの態様では、コンピューティングデバイスは、埋め込まれているメタデータを有する収集データを受け取る。デバイスは、埋め込まれているメタデータを抽出し、埋め込まれているメタデータの特性を決定するために、データベースにアクセスする。その後、デバイスは、プロトコルルールにアクセスする。プロトコルルールは、所定の臨床試験のための、1組のデータの収集要件および手順である。デバイスは、埋め込まれているメタデータの特性をプロトコルルールと比較することによって、埋め込まれているメタデータのコンプライアンスを確認する。その後、デバイスは、収集データの、コンプライアンスまたはノンコンプライアンスを報告する。
【発明の詳細な説明】
【優先権主張】
【0001】
本出願は、2008年11月18日に出願された、米国仮特許出願番号61/115,774に対して優先権を主張する。この特許出願の内容は、その全体が参照によりここに組み込まれている。
【背景】
【0002】
米国では、食品医薬品局のような規制機関によって、新しい薬剤、医療的処置、および/または医療機器を認可してもらうためには、臨床試験が必要であることが多い。
【0003】
臨床試験は、薬剤、医療的処置、および/または医療機器を、プラシーボ、他の医療的処置、および/または医療機器と、それぞれ比較するテストである。臨床試験は、特定の医学的条件に対する、代替的な処置と標準的な医療的処置との比較であることもある。臨床試験は、1つの病院またはクリニックにいる1人の研究者から、いくつかの大陸に何百人の参加研究者がいる国際的な多施設研究まで、大きさがかなり異なることがある。テストされる被験者の数は、少人数のグループから何千もの個人に及ぶことがある。このような大量のデータの、獲得や、妥当性検証や、処理には、注意深い記録管理、および、異なるグループ間の協働が必要である。
【0004】
人への、新しい薬剤、医療的処置、および/または医療機器の安全性および有効性は、臨床試験プロトコル中に詳細に記述されている、明確に規定されたテスト手順にしたがって証明されなければならない。臨床試験プロトコルは、臨床試験の、目的や、計画や、方法論や、統計的考察や、機関を記述している文書である。臨床試験プロトコルは、試験が実施されている、背景および理由を示していることもある。臨床試験プロトコルは、研究プラン、実行する活動、収集するために必要とされるデータ、手順等を含む。研究プランは、被験者の健康を守るとともに、特定のリサーチの質問に回答するように設計され得る。臨床試験プロトコルは、数ある中でも、どのタイプの人々が試験に参加するか;テストのスケジュール、テストの、手順、薬剤、投薬;および/または研究の長さを記述していることがある。他の臨床試験パラメータも含まれていてもよい。臨床試験の間、健康をモニタしたり、受けた処置の安全性および有効性を判断したりするリサーチスタッフによって、研究の被験者は定期的に見られている。
【0005】
倫理委員会による、臨床試験プロトコルの承認後、臨床試験のために、臨床試験の検査員が、臨床現場および被験者を募集することがある。臨床試験のスタッフは、臨床試験プロトコルにしたがって臨床試験を実施するようにトレーニングを受けることがある。臨床試験プロトコルの記述にしたがって、必要な手順を開始し、臨床データを、発生させ、記憶させ、妥当性検証できる。
【0006】
異なる国々のような、遠隔地および/またはさまざまな位置でテストプロトコルが実行された場合、臨床データを取り扱ったり、モニタしたり、および/または妥当性検証したりすることが難しいことがある。その上、臨床試験は、他のさまざまな障害にあうことがある。例えば、臨床試験の間に収集されるデータが、一貫して収集されないことがある;データの完全性が、システム中のいくつかの場所で損なわれることがある;データ収集が、不注意で変わることがある;機器が、置き換えられることがある;および/または、データ収集の間、コンプライアンス手順にしたがわないことがある。
【0007】
臨床試験が世界規模で実施されるとき、臨床試験の間に遭遇する問題が拡大することがある。世界中の数カ国におけるいくつかの位置でのデータ収集を連係させることは、組織的課題および管理的課題を引き起こすことがある。異なる国々における、異なる、規制、施行、標準規格は、臨床試験プロトコルに適合させるデータの収集を複雑にする。
【0008】
世界的な臨床試験の間に遭遇する問題にもかかわらず、世界的な臨床試験は、従来の臨床試験と比較して、利益が増える。グローバルな臨床試験は、特定の臨床試験に対して利用可能な、患者や、医療スタッフや、設備の数を大幅に拡大させる。世界的な臨床試験は、向上したスピードまたは効率、コスト節約、および/または、より多様な被験者のプールを可能にする。
【0009】
既知のシステムでは、臨床データ生成と、臨床試験プロトコルとの間には直接的な関連性はない。これらのシステムでは、臨床データを生成させる技術者も、医療データのエンドユーザのいずれも、臨床データ生成および臨床試験プロトコル要件によって課せられている制約を認識することが必要である。さらに、臨床データを生成させる技術者も、医療データのエンドユーザのいずれも、臨床データ生成および臨床試験プロトコル要件によって課せられている制約に関してトレーニングを受ける必要がある。以下のこのような長い時間期間にわたる手順にしたがうことは、エラーが共通する、労的および時間的消費タスクである。さらに、収集されたデータは、十分に詳述されておらず、収集条件の証拠は不十分であり、またはそうでなければ、後の解析の際の使用のために受け入れられないものかもしれない。臨床試験の間に収集されたデータは、データ収集条件の妥当性を検証できる証拠を含んでいる必要がある。
【0010】
データ収集を追跡しようとする、政府の規制者による現在の試みは、一般的に、高度でない。例えば、2008年10月付けで、小売業者は、米国で販売する生鮮食品や食肉や家禽や魚介類すべてに対する原産地をラベル付けするように法律によって要求された。しかしながら、原産地に関するデータを収集するための、または、原産地に関するデータに資格を与えるための、高度な方法または電子的な方法は存在しない。事実、米国の食品医薬品局は、原産地を追跡するために、生鮮食品上のステッカーを使用する。食料品の小売店は、バーコードスキャナや、ほぼすべてのパッケージ化された製品用の関連技術を持っているが、信頼性が高くない、または、検証性が高くない、そして不正変更を受けるかもしれないステッカーのようなベーシックなデバイスを、食料品の小売店は、生鮮食品に対して依然として使用している。
【0011】
大半は、臨床試験を含むデータ収集の試みで、類似した問題が存在する。例えば、米国における食品医薬品局は、臨床試験データの収集の際に使用する器具を査察して、使用のために認可された機器が、データ収集のために使用されている実際の機器であることを確認する。これは、規制機関による十分な監督を必要とする。このタイプの情報は、データ収集手順なしに追跡することは難しく、不正変更されることがある。
【概要】
【0012】
したがって、本発明のいくつかの実施形態の別の目的は、臨床試験活動、データの資格付与および確認の自動化を可能にする有益な特徴を持つ方法および/またはシステムを提供することであり、結果的に、臨床試験結果の将来の客観的評価を生じさせて、臨床試験結果の将来の客観的評価を可能にする。本発明のいくつかの実施形態の別の目的は、埋め込まれているデータの使用を通してデータの妥当性を検証することである。
【0013】
実施形態は、臨床試験に関係するデータを処理するコンピューティングデバイスによって実現される方法を含んでいてもよい。方法は、埋め込まれているメタデータを有する収集データを受け取ることと;埋め込まれているメタデータを抽出することと;埋め込まれているメタデータの特性を決定するために、データベースにアクセスすることと;プロトコルルールにアクセスすることと;埋め込まれているメタデータの特性をプロトコルルールと比較することによって、埋め込まれているメタデータのコンプライアンスを確認することと;リアルタイムで、リアルタイムに近い間隔または他の時間間隔で、収集データの、コンプライアンスまたはノンコンプライアンスを報告することとを含み、プロトコルルールは、1組のデータ収集の要件および手順を含む。
【0014】
詳細な説明で以下でさらに記述する概念の選択を、簡略化した形態で紹介するために、この概要を提供する。この概要は、主張する主題事項の、主要な特徴または実質的な特徴を識別することを意図しておらず、また、主張する主題事項の範囲を決定する際の補助として使用することも意図していない。本発明の付加的な特徴、利点、実施形態を記述しており、本発明の付加的な特徴、利点、実施形態は、以下の詳細な説明、図面、特許請求の範囲の考察から明らかである。さらに、本発明の前述の概要および以下の詳細な説明の双方とも、例示であり、主張した本発明の範囲を限定せずに、さらなる説明を提供することを意図していることを理解すべきである。
【図面の簡単な説明】
【0015】
本発明のさらなる理解を提供するために含まれ、そして、この明細書の一部に組み込まれ、この明細書の一部を構成している添付図面は、本発明の原理を説明するための機能をしている詳細な説明とともに本発明を説明したものである。
【図1】図1は、コンプライアンスのモニタリングのための例示的な方法およびシステムのフローチャートである。
【図2】図2は、臨床試験または他のデータ収集の提案をレビューするための例示的な方法およびシステムのフローチャートである。
【図3】図3は、臨床試験を実行するための例示的な方法およびシステムのフローチャートである。
【図4】図4は、データの妥当性の検証のための例示的な方法およびシステムのフローチャートである。
【詳細な説明】
【0016】
臨床試験または他のデータの獲得プロセスの管理を促進するために、コンタクトの最初の時点でデータに資格が与えられる。臨床試験は、明細書中で記述する方法およびシステムの使用の単なる例である。コンピュータプロセッサ、ハードウェア、およびソフトウェアは、ここで記述したような方法およびシステムを実行するように構成されていてもよい。ここで記述した方法は、コンピュータ読み取り可能記憶媒体および/またはコンピュータ化されたメモリ中に記憶されていてもよい。
【0017】
臨床試験の間に収集される臨床データのそれぞれは、メタデータによって特徴付けられていることが好ましい。先に示したように、臨床試験のために収集されるデータは、臨床試験プロトコルにしたがっていなければならない。検査員によって設計される臨床試験プロトコルは、以下:(1)収集用データ、すなわち、妥当性検証のための値および/または要件、(2)機器の要件および仕様、(3)スタッフの要件および資格証明書、(4)実行する介入、および(5)エンドポイント、すなわち、時間、結果、および/または有害事象および/またはのうちの、いずれか、または、すべてを含んでいてもよい。他のタイプのデータも可能であってもよい。メタデータが、臨床試験プロトコルに適合させるための方法およびシステムを促進してもよい。
【0018】
メタデータは、臨床試験データ自体が臨床試験プロトコルにしたがっているか否かを臨床データのエンドユーザが決定できるようにする。例えば、承認された機器を使用して測定値が取得され、機器が適切に較正され手入れされ、タスクに対して認証されているスタッフが作業を行い、適切な間隔で測定値が取得された場合のみに、測定値を使用してもよい。特定の臨床試験プロトコル次第では、他の要件が必要かもしれない。メタデータは、臨床データのエンドユーザによるアクセスのために、この必要な情報を記憶していてもよい。
【0019】
メタデータは、例えば、ソース、時間、日付、位置、患者、機器、医療専門家、測定単位、臨床試験等に関する情報であってもよいが、これらに限定されない。情報源へのデータリンクによって、データの信頼度が向上するかもしれない。日付についてのメタデータは、値および/または妥当性を含んでいてもよい。スタッフについてのメタデータは、名前、役割、妥当性、資格証明書、および/または証明書更新の期日を含んでいてもよい。被験者についてのメタデータは、一意的な識別子、識別コード、バーコード、および/またはバイオメトリックのような、名前、ならびに/あるいは、妥当性を含んでいてもよい。
【0020】
機器についてのメタデータは、例えば、機器の名前や、製造業者や、モデルや、データエントリの方法、すなわち、自動化、半自動化、手動でのデータエントリの方法や、妥当性や、精度や、最後の較正の日付や、いつが再較正の期日かや、サービス記録や、機器を動作する技術者や、技術者の証明書等を含んでいてもよい。さらなる例として、患者の血圧測定は、いつ血圧測定値が得られたかや、どのデバイスを使用して血圧測定が行われたかや、どのスタッフが機器を使用したか、に向けられているメタデータを含んでいてもよい。メタデータは、血圧測定の加圧帯機器に関する、より特有の情報も含んでいてもよい。この情報には、例えば、製造業者、モデル、シリアル番号、較正記録、サービス記録、および/または機器を使用するためにトレーニングを受けるスタッフのようなものがある。実際の情報をメタデータ中に記憶する代替案として、データのエンドユーザに実際の情報を参照させる、実際のデータに対するポインタをメタデータ中に記憶させてもよい。実際の情報は、データベース中に、または、他のコンピュータ読み取り可能媒体中に記憶させてもよい。
【0021】
メタデータは、インフォームドコンセントに関する情報を含んでいてもよい。インフォームドコンセントは法律上の条件であり、これにより、事実の正しい認識および理解とアクションの影響とに基づいて、人が同意を与えたということができる。個人は、同意するときに、関連した事実を、そして、例えば、知的障害でない、または、精神障害でない、そして判断力の低下がないといった自身の推理能力も、所有している必要がある。妥当性検証の間に使用するために、インフォームドコンセントに関する情報は、臨床試験データとともに記憶されるので、臨床試験におけるインフォームドコンセント情報は、臨床試験データの妥当性検証を支援できる。インフォームドコンセントが法的に強制できるように、インフォームドコンセントに関する情報の記憶を記憶させてもよい。国際的に使用される1つ以上の標準規格に適合するように、インフォームドコンセントに関する情報の記憶を記憶させてもよい。メタデータが不正変更されにくいように、メタデータを臨床データとともに記憶させてもよい。
【0022】
メタデータは、指紋、顔画像認識、網膜の画像化等のような、バイオメトリック情報をさらに組み込んでいてもよいが、バイオメトリック情報は、これらに限定されない。バイオメトリック情報は、患者の存在および他の情報を確認するのに有用である。バイオメトリック情報は、不正変更の防止がされていることもある。
【0023】
臨床試験からのメタデータを使用して、臨床試験データの妥当性を検証してもよい。臨床試験メタデータとともに妥当性メタデータを含むことが、信頼性のある、標準化されたデータを可能にし、臨床試験管理を促進するかもしれない。臨床データは、リアルタイムで、および/または、リモートアクセスを通して、モニタされて妥当性検証されてもよい。データ処理の効率の良さ、および、ペーパーワークの減少のために、臨床試験のモニタリングに費やす時間を減らすことができる。臨床試験データに対するメタデータを使用する方法およびシステムは、適応臨床試験も可能にする。適応臨床試験は、有益な結果を促進するために、情報が入手可能になると、適応臨床試験を調整できる点で有益である。例えば、以前の投薬量から見出された結果に基づいて、薬剤の投薬を調整してもよい。この調整は、臨床試験の終了より前にデータの顕著な動向を取り扱うことによって、新しい臨床試験を要求せずに臨床試験の有効性を高めることができる。データの同時収集および資格付与は、リアルタイムで情報を入手することを可能にする。
【0024】
方法およびシステムは、標準化されたメタデータフォーマットを提供してもよい。標準化されたフォーマットは、多様なオペレーティングプラットフォームによる、メタデータの使用を可能にする。標準化されたインターフェースは、多くの異なるエンドユーザアプリケーションによる使用を可能にする。データ解析は、実施段階に組み込んでもよい。
【0025】
臨床試験の際にデータの妥当性を確認するための、例示的な方法およびシステムを提供してもよい。スタートアップ段階において、プロトコルが作られてもよく、データベースが作成されてもよい。データベースは、スタッフ、機器、測定値、介入、および/または被験者、に対するサブデータベースを含んでいてもよい。臨床試験の、または、他のデータの収集プロセスが進行すると、証明書の更新要件にしたがった、連続的なチェックがあってもよい。データベースは、定期的に、または、周期的に更新してもよい。事前の測定イベントの間に、提案された測定値、被験者、スタッフ、現場、日付、機器等を、プロトコルベースルールエンジンと照合して、すべての要素が適合しているか否かを決定してもよい。プロトコルベースルールエンジンは、提案された要素が受け入れられるか否か、または、拒否されるか否かを決定してもよい。提案された要素が受け入れられた場合に、測定を行ってもよい。事後測定手順として、データ妥当性ルールエンジンにより、要素を再検証してもよい。測定値が受け入れられるか否かを、または、拒否されるか否かを、データ妥当性ルールエンジンが決定してもよい。
【0026】
介入は、患者に対して取られる、医療または治療のアクションである。事前介入イベントの間に、提案される介入、被験者、スタッフ、現場、日付、機器等を、プロトコルベースルールエンジンと照合してもよい。介入が進行するか否か、または、介入が中止されるか否かを、プロトコルベースルールエンジンが決定してもよい。提案された介入が進行する場合、事後介入解析は、プロトコルベースルールエンジンによる再検証を含んでいてもよい。その後、介入情報が記録されてもよい。
【0027】
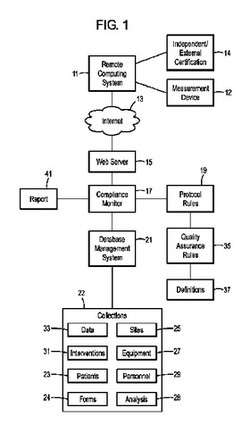
図1は、コンプライアンスモニタリングのための例示的な方法およびシステムを図示している。検査員は、データを収集するために、リモートコンピュータシステム11を遠く離れた場所で動作させてもよい。測定デバイス12は、情報をリモートコンピュータシステム11に提供してもよい。リモートコンピュータシステム11は、独立および/または外部資格証明システム14からの入力も受け入れてもよい。独立および/または外部資格証明システム14は、時間を証明するためのタイムスタンプ、電子署名証明書、国際標準規格機構および他の標準規格設定機構の証明書、計器識別子、位置を確認するためのグローバルポジショニング情報、同一性を確認するためのバイオメトリック証明書、可視的な証拠を生成させる画像記録デバイス等を含んでいてもよい。リモートコンピュータシステム11は、インターネット13または他のネットワークのようなネットワークを通して、ウェブサーバ15にアクセスしてもよい。リモートコンピュータシステム11は、リモートコンピュータシステム11において使用可能なブラウザからウェブサーバ15にアクセスしてもよい。ウェブサーバ15は、コンプライアンスモニタまたはルールエンジン17と通信していてもよい。コンプライアンスモニタ17は、自動化されていてもよく、有体的コンピュータ記憶媒体中に記憶されていてもよい。臨床試験ルールおよびプロトコル19は、コンプライアンスモニタ17に入力されていてもよい。プロトコルルール19は、品質保証ルール35を含んでいてもよい。さらには、品質保証ルール35は、定義37を含んでいてもよい。コンプライアンスモニタ17は、データベース21/データベース管理システムと通信していてもよい。データベース21は、1つ以上の関係データベースあってもよい。
【0028】
データベース21は、被験者に関連する、1つ以上の収集物22中でカテゴリー化されている情報を含んでいてもよく、この情報は、患者23、フォーム24、現場25、機器27、解析28、スタッフ29、介入31、および/または臨床データ33を含んでいてもよいが、これらに限定されない。データベース21は、データベース管理システムおよびアドミニストレータによって管理されてもよい。データベース21は、単一のデータベースおよび/または一連の関連データベースであってもよい。サブデータベースまたは収集物は、機器情報およびサービス情報を含んでいてもよい。このデータベースは、一意的な機器/サービス識別子、機器/サービスの名前、モデル、シリアル番号、精度のレーティング、および/または証明書要件を含んでいてもよい。証明書要件には、サービス記録および/または証明書更新記録のようなものがある。別のサブデータベースは、スタッフのデータベースであってもよい。このデータベースは、一意的なスタッフの識別子や、名前や、連絡先や、資格証明書および/または証明書更新記録のような、識別子によって資格が与えられる測定値や、ならびに/あるいは、資格証明書および/または証明書更新記録のような、識別子によって資格が与えられる介入を含んでいてもよい。さらなる別のサブデータベースは、被験者のデータベースであってもよい。このデータベースは、一意的な被験者の識別子、名前、性別、誕生日、バイオメトリック識別子、および/または識別子によるサイトアフィリエイトを含んでいてもよい。別のサブデータベースは、現場のデータベースであってもよい。このデータベースは、一意的な現場の識別子、位置、連絡先、物理設備要件、識別子により登録された被験者、識別子によって利用可能な機器、識別子による空いているスタッフ、識別子による利用可能な介入を含んでいてもよい。付加的なサブデータベースは、測定データベースであってもよい。このデータベースは、一意的な測定の識別子、名前、識別子によって許可された機器、識別子によって資格が与えられたスタッフ、測定される最小/最大頻度、(おそらくは目盛上の)値、および/または(おそらくは目盛上の)必要とされる妥当性を含んでいてもよい。別のサブデータベースは、介入の識別子であってもよい。このデータベースは、一意的な介入の識別子、名前、識別子によって必要とされる機器、識別子によって資格が与えられたスタッフ、および/または実行される最小/最大頻度を含んでいてもよい。データベースは、さまざまなフォーム、ならびに解析方法および解析結果も含んでいてもよい。
【0029】
コンプライアンスモニタ17は、報告41も発生および/または出力してもよい。臨床試験データの、コンプライアンスまたはノンコンプライアンスの通知も検査員に対して与えてもよい。
【0030】
データ収集の間、コンプライアンスモニタ17は、臨床試験に関連するデータの収集を促進してもよい。測定デバイス12によって取られた測定値を入力するように、リモートユーザが提案してもよい。測定値は、実験値または臨床観測値であってもよいが、これらに限定されない。提案されるエントリの測定値は、使用される機器、潜在的観測者、および/または患者情報のような、メタデータ情報を含んでいてもよいが、これらに限定されない。コンプライアンスモニタ17は、プロトコルルール19を使用して、メタデータ情報が臨床試験品質保証ルール35にしたがっているか否かを決定してもよい。メタデータ情報が、臨床試験品質保証ルール35にしたがっている場合に、データを収集するようにリモートユーザに知らせてもよい。そうでない場合、測定値を入力するメタデータ情報/提案が、臨床試験品質保証ルール35にしたがっていないことをリモートユーザに知らせる。データが収集された後、データは、データベース43にエントリするために、リモートユーザによって提出されてもよい。データベース43への、データの実際のエントリより前に、既存のデータベースエントリと他の妥当性チェックとに対して、データ自体の妥当性を検証してもよい。成功した場合、データおよび関係するメタデータをデータベース43に入力してもよい。不成功であった場合には、データおよび関係するメタデータを訂正する機会が提供されてもよい。訂正されたデータおよび関係するメタデータが受け入れ可能であった場合に、データおよび関係するメタデータはデータベース中に入力されてもよい。おそらく、データ収集活動の完了のときに、最近のデータ収集または前のデータ収集を考慮に入れたプロトコル仕様の結果として、コンプライアンスモニタがユーザと被験者に、次のスケジューリングされた、データ収集活動または介入活動に関して知らせてもよい。
【0031】
介入を記録するときに、臨床試験に関連するデータの収集を促進するために、コンプライアンスモニタ17も使用してもよい。リモートユーザは、例えば、投薬または処置を施すといった介入を実行するように提案してもよい。介入は、これに限定されるものではない。介入を実行するための提案は、機器、スタッフ、および/または患者のような、メタデータ情報を含んでいてもよいが、これらに限定されるものではない。コンプライアンスモニタ17はプロトコルルール19を使用して、介入が適切か否かや、メタデータ情報が、提案された介入に関連する品質保証ルール35にしたがっている否かを決定してもよい。メタデータ情報が、臨床試験品質保証ルール35にしたがっている場合、介入を実行するようにリモートユーザに知らせてもよい。そうでない場合には、介入を実行しないようにリモートユーザに知らせる。その後、リモートユーザは、介入が行われたか、または介入が行われなかったこと示してもよい。介入の完了のときに、コンプライアンスモニタがユーザと被験者に、次のスケジューリングされたデータ収集または介入活動に関して知らせてもよい。
【0032】
図2は、臨床試験または他のデータ収集の提案をレビューするための例示的な方法およびシステムを図示している。参加するための臨床試験の提案51が示される。臨床試験の提案51は、対応するメタデータ55を有する、さまざまなタイプの要求されたデータ53を含んでいてもよい。メタデータ55は、例えば、機器の識別子、検査員の識別子、スタッフ識別子、データおよび/または被験者を含んでいてもよい。臨床試験の提案51は、インターネット57を通して、ウェブサーバ59に提出してもよい。ウェブサーバ59は、コンプライアンスモニタ61と通信してもよい。臨床試験の提案が適合するか否か63を、コンプライアンスモニタ61が決定してもよい。メタデータ55が有効か否かを、コンプライアンスモニタ61が決定してもよい。例えば、機器データおよび/またはスタッフデータが、要求された基準に一致しているか否かを、コンプライアンスモニタ61が決定してもよい。臨床試験の提案が適合しなかった場合、臨床試験の提案は拒否される65。臨床試験の提案のデベロッパに通知を送ってもよい。臨床試験の提案が適合した場合、データを収集する要請67を臨床試験のデベロッパに送ってもよい。要請67はデータ収集活動を開始するための、および/または、データ提出を開始するための承認を含んでいてもよい。
【0033】
図3は、臨床試験81を実行するための例示的な方法およびシステムを図示している。臨床試験81は、検査員83によって開始されてもよい。検査員は、測定値をデータ源から収集および/または処理してもよい。規制者85は、検査員83に対する、ルールや、要件や、手順を決定してもよい。研究プロトコルおよびデータプロトコルは、治験審査委員会または他のタイプの規制機関のような規制者85によって管理されてもよい。治験審査委員会および/または独立倫理委員会は、被験者の権利および福利を保護するように主張する目的で、人間に関係する生物医学的行動に関するリサーチを承認したり、モニタしたり、レビューしたりするように公的に指定されている団体である。治験審査委員会は、人間の被験者に対して実施されるリサーチに対して、科学的な、倫理的な、規制的なクリティカルな監督機能を果たしている。
【0034】
臨床試験81は、研究プロトコル87によって特徴付けられてもよい。研究プロトコル87は、さまざまなタイプのデータおよび関係ルールを記録してもよい。例えば、可能性あるデータは、スケジュールルール91を持つスケジュール89、現場ルール95を持つ現場93、フォームルール99を持つフォーム97、検査員ルール103を持つ検査員101、患者ルール107を持つ患者105、および/またはデータルール111を持つデータ109を含んでいてもよい。他のタイプのデータおよび関係するルールも可能である。X−プロトコルまたは他の類似したタイプのライブラリ113は、研究プロトコル87で使用するためのルールを生成および/または記憶してもよい。研究プロトコル87内のデータ上で、メタ解析115を実行してもよい。
【0035】
図4は、データの妥当性検証のための例示的な方法およびシステムを図示している。臨床試験121が、臨床データ123を収集する。臨床試験121は、妥当性検証プロトコルに基づいて、臨床データ123に対する管理上のデータ125も収集してもよい。臨床試験121からのデータは、記録および/または処理より前に、妥当性検証標準サーバ127を通過してもよい。管理上のデータ125は、リモート妥当性検証ツール129に渡されてもよい。リモート妥当性検証ツール129は、妥当性検証ルール131および/または妥当性検証モニタ133を、管理上のデータ125に適用してもよい。妥当性検証ルール131は、ルールエンジン135によって管理されてもよい。妥当性検証モニタ133は、監視エンジン137によって管理されてもよい。ルールエンジン135および/または監視エンジン137は、コンプライアンスモニタ139と通信していてもよい。コンプライアンスモニタ139は、データ解析と報告141を可能にしてもよい。臨床試験121からのデータは、メタデータの埋め込みによって変形され、妥当性検証ルール131および/または妥当性検証モニタ133によって後続処理されてもよい。さらに、データは、データ解析および報告141によって変形されてもよい。
【0036】
例示目的のためだけに、データ収集プロセスの間に、データおよび関係するメタデータに資格を与えるためのシステムおよび方法の、先述した例示的な実施形態を示した。本発明は、多くの異なる形態の実施形態によって達成されているが、本開示は、例示として考えられるべきであり、記述したシステムおよび方法を、ここで説明および記述した特定の実施形態に限定することを意図しないことを理解すべきである。本記述の精神から逸脱することなく、多数のバリエーションが、当業者によってなされてもよい。さらに、上記で明確に述べられていなくても、1つの実施形態に関連して記述した特徴は、他の実施形態と併せて使用してもよい。本発明の範囲は、添付した特許請求の範囲と、特許請求の範囲の均等物とによって評価されるであろう。要約書およびタイトルが、特許請求の範囲の範囲を限定すると解釈すべきでなく、要約書およびタイトルの目的は、関係当局とともに不特定多数の人々が、記述したシステムおよび方法の一般的な性質を迅速に判断できるようにするものであると解釈すべきである。後続する特許請求の範囲において、「ミーンズ」という用語が使用されていない限り、ここで記載した特徴もエレメントも、35U.S.C.112条第6パラグラフの条文にしたがった、ミーンズプラスファンクションの限定であると解釈すべきではない。
【優先権主張】
【0001】
本出願は、2008年11月18日に出願された、米国仮特許出願番号61/115,774に対して優先権を主張する。この特許出願の内容は、その全体が参照によりここに組み込まれている。
【背景】
【0002】
米国では、食品医薬品局のような規制機関によって、新しい薬剤、医療的処置、および/または医療機器を認可してもらうためには、臨床試験が必要であることが多い。
【0003】
臨床試験は、薬剤、医療的処置、および/または医療機器を、プラシーボ、他の医療的処置、および/または医療機器と、それぞれ比較するテストである。臨床試験は、特定の医学的条件に対する、代替的な処置と標準的な医療的処置との比較であることもある。臨床試験は、1つの病院またはクリニックにいる1人の研究者から、いくつかの大陸に何百人の参加研究者がいる国際的な多施設研究まで、大きさがかなり異なることがある。テストされる被験者の数は、少人数のグループから何千もの個人に及ぶことがある。このような大量のデータの、獲得や、妥当性検証や、処理には、注意深い記録管理、および、異なるグループ間の協働が必要である。
【0004】
人への、新しい薬剤、医療的処置、および/または医療機器の安全性および有効性は、臨床試験プロトコル中に詳細に記述されている、明確に規定されたテスト手順にしたがって証明されなければならない。臨床試験プロトコルは、臨床試験の、目的や、計画や、方法論や、統計的考察や、機関を記述している文書である。臨床試験プロトコルは、試験が実施されている、背景および理由を示していることもある。臨床試験プロトコルは、研究プラン、実行する活動、収集するために必要とされるデータ、手順等を含む。研究プランは、被験者の健康を守るとともに、特定のリサーチの質問に回答するように設計され得る。臨床試験プロトコルは、数ある中でも、どのタイプの人々が試験に参加するか;テストのスケジュール、テストの、手順、薬剤、投薬;および/または研究の長さを記述していることがある。他の臨床試験パラメータも含まれていてもよい。臨床試験の間、健康をモニタしたり、受けた処置の安全性および有効性を判断したりするリサーチスタッフによって、研究の被験者は定期的に見られている。
【0005】
倫理委員会による、臨床試験プロトコルの承認後、臨床試験のために、臨床試験の検査員が、臨床現場および被験者を募集することがある。臨床試験のスタッフは、臨床試験プロトコルにしたがって臨床試験を実施するようにトレーニングを受けることがある。臨床試験プロトコルの記述にしたがって、必要な手順を開始し、臨床データを、発生させ、記憶させ、妥当性検証できる。
【0006】
異なる国々のような、遠隔地および/またはさまざまな位置でテストプロトコルが実行された場合、臨床データを取り扱ったり、モニタしたり、および/または妥当性検証したりすることが難しいことがある。その上、臨床試験は、他のさまざまな障害にあうことがある。例えば、臨床試験の間に収集されるデータが、一貫して収集されないことがある;データの完全性が、システム中のいくつかの場所で損なわれることがある;データ収集が、不注意で変わることがある;機器が、置き換えられることがある;および/または、データ収集の間、コンプライアンス手順にしたがわないことがある。
【0007】
臨床試験が世界規模で実施されるとき、臨床試験の間に遭遇する問題が拡大することがある。世界中の数カ国におけるいくつかの位置でのデータ収集を連係させることは、組織的課題および管理的課題を引き起こすことがある。異なる国々における、異なる、規制、施行、標準規格は、臨床試験プロトコルに適合させるデータの収集を複雑にする。
【0008】
世界的な臨床試験の間に遭遇する問題にもかかわらず、世界的な臨床試験は、従来の臨床試験と比較して、利益が増える。グローバルな臨床試験は、特定の臨床試験に対して利用可能な、患者や、医療スタッフや、設備の数を大幅に拡大させる。世界的な臨床試験は、向上したスピードまたは効率、コスト節約、および/または、より多様な被験者のプールを可能にする。
【0009】
既知のシステムでは、臨床データ生成と、臨床試験プロトコルとの間には直接的な関連性はない。これらのシステムでは、臨床データを生成させる技術者も、医療データのエンドユーザのいずれも、臨床データ生成および臨床試験プロトコル要件によって課せられている制約を認識することが必要である。さらに、臨床データを生成させる技術者も、医療データのエンドユーザのいずれも、臨床データ生成および臨床試験プロトコル要件によって課せられている制約に関してトレーニングを受ける必要がある。以下のこのような長い時間期間にわたる手順にしたがうことは、エラーが共通する、労的および時間的消費タスクである。さらに、収集されたデータは、十分に詳述されておらず、収集条件の証拠は不十分であり、またはそうでなければ、後の解析の際の使用のために受け入れられないものかもしれない。臨床試験の間に収集されたデータは、データ収集条件の妥当性を検証できる証拠を含んでいる必要がある。
【0010】
データ収集を追跡しようとする、政府の規制者による現在の試みは、一般的に、高度でない。例えば、2008年10月付けで、小売業者は、米国で販売する生鮮食品や食肉や家禽や魚介類すべてに対する原産地をラベル付けするように法律によって要求された。しかしながら、原産地に関するデータを収集するための、または、原産地に関するデータに資格を与えるための、高度な方法または電子的な方法は存在しない。事実、米国の食品医薬品局は、原産地を追跡するために、生鮮食品上のステッカーを使用する。食料品の小売店は、バーコードスキャナや、ほぼすべてのパッケージ化された製品用の関連技術を持っているが、信頼性が高くない、または、検証性が高くない、そして不正変更を受けるかもしれないステッカーのようなベーシックなデバイスを、食料品の小売店は、生鮮食品に対して依然として使用している。
【0011】
大半は、臨床試験を含むデータ収集の試みで、類似した問題が存在する。例えば、米国における食品医薬品局は、臨床試験データの収集の際に使用する器具を査察して、使用のために認可された機器が、データ収集のために使用されている実際の機器であることを確認する。これは、規制機関による十分な監督を必要とする。このタイプの情報は、データ収集手順なしに追跡することは難しく、不正変更されることがある。
【概要】
【0012】
したがって、本発明のいくつかの実施形態の別の目的は、臨床試験活動、データの資格付与および確認の自動化を可能にする有益な特徴を持つ方法および/またはシステムを提供することであり、結果的に、臨床試験結果の将来の客観的評価を生じさせて、臨床試験結果の将来の客観的評価を可能にする。本発明のいくつかの実施形態の別の目的は、埋め込まれているデータの使用を通してデータの妥当性を検証することである。
【0013】
実施形態は、臨床試験に関係するデータを処理するコンピューティングデバイスによって実現される方法を含んでいてもよい。方法は、埋め込まれているメタデータを有する収集データを受け取ることと;埋め込まれているメタデータを抽出することと;埋め込まれているメタデータの特性を決定するために、データベースにアクセスすることと;プロトコルルールにアクセスすることと;埋め込まれているメタデータの特性をプロトコルルールと比較することによって、埋め込まれているメタデータのコンプライアンスを確認することと;リアルタイムで、リアルタイムに近い間隔または他の時間間隔で、収集データの、コンプライアンスまたはノンコンプライアンスを報告することとを含み、プロトコルルールは、1組のデータ収集の要件および手順を含む。
【0014】
詳細な説明で以下でさらに記述する概念の選択を、簡略化した形態で紹介するために、この概要を提供する。この概要は、主張する主題事項の、主要な特徴または実質的な特徴を識別することを意図しておらず、また、主張する主題事項の範囲を決定する際の補助として使用することも意図していない。本発明の付加的な特徴、利点、実施形態を記述しており、本発明の付加的な特徴、利点、実施形態は、以下の詳細な説明、図面、特許請求の範囲の考察から明らかである。さらに、本発明の前述の概要および以下の詳細な説明の双方とも、例示であり、主張した本発明の範囲を限定せずに、さらなる説明を提供することを意図していることを理解すべきである。
【図面の簡単な説明】
【0015】
本発明のさらなる理解を提供するために含まれ、そして、この明細書の一部に組み込まれ、この明細書の一部を構成している添付図面は、本発明の原理を説明するための機能をしている詳細な説明とともに本発明を説明したものである。
【図1】図1は、コンプライアンスのモニタリングのための例示的な方法およびシステムのフローチャートである。
【図2】図2は、臨床試験または他のデータ収集の提案をレビューするための例示的な方法およびシステムのフローチャートである。
【図3】図3は、臨床試験を実行するための例示的な方法およびシステムのフローチャートである。
【図4】図4は、データの妥当性の検証のための例示的な方法およびシステムのフローチャートである。
【詳細な説明】
【0016】
臨床試験または他のデータの獲得プロセスの管理を促進するために、コンタクトの最初の時点でデータに資格が与えられる。臨床試験は、明細書中で記述する方法およびシステムの使用の単なる例である。コンピュータプロセッサ、ハードウェア、およびソフトウェアは、ここで記述したような方法およびシステムを実行するように構成されていてもよい。ここで記述した方法は、コンピュータ読み取り可能記憶媒体および/またはコンピュータ化されたメモリ中に記憶されていてもよい。
【0017】
臨床試験の間に収集される臨床データのそれぞれは、メタデータによって特徴付けられていることが好ましい。先に示したように、臨床試験のために収集されるデータは、臨床試験プロトコルにしたがっていなければならない。検査員によって設計される臨床試験プロトコルは、以下:(1)収集用データ、すなわち、妥当性検証のための値および/または要件、(2)機器の要件および仕様、(3)スタッフの要件および資格証明書、(4)実行する介入、および(5)エンドポイント、すなわち、時間、結果、および/または有害事象および/またはのうちの、いずれか、または、すべてを含んでいてもよい。他のタイプのデータも可能であってもよい。メタデータが、臨床試験プロトコルに適合させるための方法およびシステムを促進してもよい。
【0018】
メタデータは、臨床試験データ自体が臨床試験プロトコルにしたがっているか否かを臨床データのエンドユーザが決定できるようにする。例えば、承認された機器を使用して測定値が取得され、機器が適切に較正され手入れされ、タスクに対して認証されているスタッフが作業を行い、適切な間隔で測定値が取得された場合のみに、測定値を使用してもよい。特定の臨床試験プロトコル次第では、他の要件が必要かもしれない。メタデータは、臨床データのエンドユーザによるアクセスのために、この必要な情報を記憶していてもよい。
【0019】
メタデータは、例えば、ソース、時間、日付、位置、患者、機器、医療専門家、測定単位、臨床試験等に関する情報であってもよいが、これらに限定されない。情報源へのデータリンクによって、データの信頼度が向上するかもしれない。日付についてのメタデータは、値および/または妥当性を含んでいてもよい。スタッフについてのメタデータは、名前、役割、妥当性、資格証明書、および/または証明書更新の期日を含んでいてもよい。被験者についてのメタデータは、一意的な識別子、識別コード、バーコード、および/またはバイオメトリックのような、名前、ならびに/あるいは、妥当性を含んでいてもよい。
【0020】
機器についてのメタデータは、例えば、機器の名前や、製造業者や、モデルや、データエントリの方法、すなわち、自動化、半自動化、手動でのデータエントリの方法や、妥当性や、精度や、最後の較正の日付や、いつが再較正の期日かや、サービス記録や、機器を動作する技術者や、技術者の証明書等を含んでいてもよい。さらなる例として、患者の血圧測定は、いつ血圧測定値が得られたかや、どのデバイスを使用して血圧測定が行われたかや、どのスタッフが機器を使用したか、に向けられているメタデータを含んでいてもよい。メタデータは、血圧測定の加圧帯機器に関する、より特有の情報も含んでいてもよい。この情報には、例えば、製造業者、モデル、シリアル番号、較正記録、サービス記録、および/または機器を使用するためにトレーニングを受けるスタッフのようなものがある。実際の情報をメタデータ中に記憶する代替案として、データのエンドユーザに実際の情報を参照させる、実際のデータに対するポインタをメタデータ中に記憶させてもよい。実際の情報は、データベース中に、または、他のコンピュータ読み取り可能媒体中に記憶させてもよい。
【0021】
メタデータは、インフォームドコンセントに関する情報を含んでいてもよい。インフォームドコンセントは法律上の条件であり、これにより、事実の正しい認識および理解とアクションの影響とに基づいて、人が同意を与えたということができる。個人は、同意するときに、関連した事実を、そして、例えば、知的障害でない、または、精神障害でない、そして判断力の低下がないといった自身の推理能力も、所有している必要がある。妥当性検証の間に使用するために、インフォームドコンセントに関する情報は、臨床試験データとともに記憶されるので、臨床試験におけるインフォームドコンセント情報は、臨床試験データの妥当性検証を支援できる。インフォームドコンセントが法的に強制できるように、インフォームドコンセントに関する情報の記憶を記憶させてもよい。国際的に使用される1つ以上の標準規格に適合するように、インフォームドコンセントに関する情報の記憶を記憶させてもよい。メタデータが不正変更されにくいように、メタデータを臨床データとともに記憶させてもよい。
【0022】
メタデータは、指紋、顔画像認識、網膜の画像化等のような、バイオメトリック情報をさらに組み込んでいてもよいが、バイオメトリック情報は、これらに限定されない。バイオメトリック情報は、患者の存在および他の情報を確認するのに有用である。バイオメトリック情報は、不正変更の防止がされていることもある。
【0023】
臨床試験からのメタデータを使用して、臨床試験データの妥当性を検証してもよい。臨床試験メタデータとともに妥当性メタデータを含むことが、信頼性のある、標準化されたデータを可能にし、臨床試験管理を促進するかもしれない。臨床データは、リアルタイムで、および/または、リモートアクセスを通して、モニタされて妥当性検証されてもよい。データ処理の効率の良さ、および、ペーパーワークの減少のために、臨床試験のモニタリングに費やす時間を減らすことができる。臨床試験データに対するメタデータを使用する方法およびシステムは、適応臨床試験も可能にする。適応臨床試験は、有益な結果を促進するために、情報が入手可能になると、適応臨床試験を調整できる点で有益である。例えば、以前の投薬量から見出された結果に基づいて、薬剤の投薬を調整してもよい。この調整は、臨床試験の終了より前にデータの顕著な動向を取り扱うことによって、新しい臨床試験を要求せずに臨床試験の有効性を高めることができる。データの同時収集および資格付与は、リアルタイムで情報を入手することを可能にする。
【0024】
方法およびシステムは、標準化されたメタデータフォーマットを提供してもよい。標準化されたフォーマットは、多様なオペレーティングプラットフォームによる、メタデータの使用を可能にする。標準化されたインターフェースは、多くの異なるエンドユーザアプリケーションによる使用を可能にする。データ解析は、実施段階に組み込んでもよい。
【0025】
臨床試験の際にデータの妥当性を確認するための、例示的な方法およびシステムを提供してもよい。スタートアップ段階において、プロトコルが作られてもよく、データベースが作成されてもよい。データベースは、スタッフ、機器、測定値、介入、および/または被験者、に対するサブデータベースを含んでいてもよい。臨床試験の、または、他のデータの収集プロセスが進行すると、証明書の更新要件にしたがった、連続的なチェックがあってもよい。データベースは、定期的に、または、周期的に更新してもよい。事前の測定イベントの間に、提案された測定値、被験者、スタッフ、現場、日付、機器等を、プロトコルベースルールエンジンと照合して、すべての要素が適合しているか否かを決定してもよい。プロトコルベースルールエンジンは、提案された要素が受け入れられるか否か、または、拒否されるか否かを決定してもよい。提案された要素が受け入れられた場合に、測定を行ってもよい。事後測定手順として、データ妥当性ルールエンジンにより、要素を再検証してもよい。測定値が受け入れられるか否かを、または、拒否されるか否かを、データ妥当性ルールエンジンが決定してもよい。
【0026】
介入は、患者に対して取られる、医療または治療のアクションである。事前介入イベントの間に、提案される介入、被験者、スタッフ、現場、日付、機器等を、プロトコルベースルールエンジンと照合してもよい。介入が進行するか否か、または、介入が中止されるか否かを、プロトコルベースルールエンジンが決定してもよい。提案された介入が進行する場合、事後介入解析は、プロトコルベースルールエンジンによる再検証を含んでいてもよい。その後、介入情報が記録されてもよい。
【0027】
図1は、コンプライアンスモニタリングのための例示的な方法およびシステムを図示している。検査員は、データを収集するために、リモートコンピュータシステム11を遠く離れた場所で動作させてもよい。測定デバイス12は、情報をリモートコンピュータシステム11に提供してもよい。リモートコンピュータシステム11は、独立および/または外部資格証明システム14からの入力も受け入れてもよい。独立および/または外部資格証明システム14は、時間を証明するためのタイムスタンプ、電子署名証明書、国際標準規格機構および他の標準規格設定機構の証明書、計器識別子、位置を確認するためのグローバルポジショニング情報、同一性を確認するためのバイオメトリック証明書、可視的な証拠を生成させる画像記録デバイス等を含んでいてもよい。リモートコンピュータシステム11は、インターネット13または他のネットワークのようなネットワークを通して、ウェブサーバ15にアクセスしてもよい。リモートコンピュータシステム11は、リモートコンピュータシステム11において使用可能なブラウザからウェブサーバ15にアクセスしてもよい。ウェブサーバ15は、コンプライアンスモニタまたはルールエンジン17と通信していてもよい。コンプライアンスモニタ17は、自動化されていてもよく、有体的コンピュータ記憶媒体中に記憶されていてもよい。臨床試験ルールおよびプロトコル19は、コンプライアンスモニタ17に入力されていてもよい。プロトコルルール19は、品質保証ルール35を含んでいてもよい。さらには、品質保証ルール35は、定義37を含んでいてもよい。コンプライアンスモニタ17は、データベース21/データベース管理システムと通信していてもよい。データベース21は、1つ以上の関係データベースあってもよい。
【0028】
データベース21は、被験者に関連する、1つ以上の収集物22中でカテゴリー化されている情報を含んでいてもよく、この情報は、患者23、フォーム24、現場25、機器27、解析28、スタッフ29、介入31、および/または臨床データ33を含んでいてもよいが、これらに限定されない。データベース21は、データベース管理システムおよびアドミニストレータによって管理されてもよい。データベース21は、単一のデータベースおよび/または一連の関連データベースであってもよい。サブデータベースまたは収集物は、機器情報およびサービス情報を含んでいてもよい。このデータベースは、一意的な機器/サービス識別子、機器/サービスの名前、モデル、シリアル番号、精度のレーティング、および/または証明書要件を含んでいてもよい。証明書要件には、サービス記録および/または証明書更新記録のようなものがある。別のサブデータベースは、スタッフのデータベースであってもよい。このデータベースは、一意的なスタッフの識別子や、名前や、連絡先や、資格証明書および/または証明書更新記録のような、識別子によって資格が与えられる測定値や、ならびに/あるいは、資格証明書および/または証明書更新記録のような、識別子によって資格が与えられる介入を含んでいてもよい。さらなる別のサブデータベースは、被験者のデータベースであってもよい。このデータベースは、一意的な被験者の識別子、名前、性別、誕生日、バイオメトリック識別子、および/または識別子によるサイトアフィリエイトを含んでいてもよい。別のサブデータベースは、現場のデータベースであってもよい。このデータベースは、一意的な現場の識別子、位置、連絡先、物理設備要件、識別子により登録された被験者、識別子によって利用可能な機器、識別子による空いているスタッフ、識別子による利用可能な介入を含んでいてもよい。付加的なサブデータベースは、測定データベースであってもよい。このデータベースは、一意的な測定の識別子、名前、識別子によって許可された機器、識別子によって資格が与えられたスタッフ、測定される最小/最大頻度、(おそらくは目盛上の)値、および/または(おそらくは目盛上の)必要とされる妥当性を含んでいてもよい。別のサブデータベースは、介入の識別子であってもよい。このデータベースは、一意的な介入の識別子、名前、識別子によって必要とされる機器、識別子によって資格が与えられたスタッフ、および/または実行される最小/最大頻度を含んでいてもよい。データベースは、さまざまなフォーム、ならびに解析方法および解析結果も含んでいてもよい。
【0029】
コンプライアンスモニタ17は、報告41も発生および/または出力してもよい。臨床試験データの、コンプライアンスまたはノンコンプライアンスの通知も検査員に対して与えてもよい。
【0030】
データ収集の間、コンプライアンスモニタ17は、臨床試験に関連するデータの収集を促進してもよい。測定デバイス12によって取られた測定値を入力するように、リモートユーザが提案してもよい。測定値は、実験値または臨床観測値であってもよいが、これらに限定されない。提案されるエントリの測定値は、使用される機器、潜在的観測者、および/または患者情報のような、メタデータ情報を含んでいてもよいが、これらに限定されない。コンプライアンスモニタ17は、プロトコルルール19を使用して、メタデータ情報が臨床試験品質保証ルール35にしたがっているか否かを決定してもよい。メタデータ情報が、臨床試験品質保証ルール35にしたがっている場合に、データを収集するようにリモートユーザに知らせてもよい。そうでない場合、測定値を入力するメタデータ情報/提案が、臨床試験品質保証ルール35にしたがっていないことをリモートユーザに知らせる。データが収集された後、データは、データベース43にエントリするために、リモートユーザによって提出されてもよい。データベース43への、データの実際のエントリより前に、既存のデータベースエントリと他の妥当性チェックとに対して、データ自体の妥当性を検証してもよい。成功した場合、データおよび関係するメタデータをデータベース43に入力してもよい。不成功であった場合には、データおよび関係するメタデータを訂正する機会が提供されてもよい。訂正されたデータおよび関係するメタデータが受け入れ可能であった場合に、データおよび関係するメタデータはデータベース中に入力されてもよい。おそらく、データ収集活動の完了のときに、最近のデータ収集または前のデータ収集を考慮に入れたプロトコル仕様の結果として、コンプライアンスモニタがユーザと被験者に、次のスケジューリングされた、データ収集活動または介入活動に関して知らせてもよい。
【0031】
介入を記録するときに、臨床試験に関連するデータの収集を促進するために、コンプライアンスモニタ17も使用してもよい。リモートユーザは、例えば、投薬または処置を施すといった介入を実行するように提案してもよい。介入は、これに限定されるものではない。介入を実行するための提案は、機器、スタッフ、および/または患者のような、メタデータ情報を含んでいてもよいが、これらに限定されるものではない。コンプライアンスモニタ17はプロトコルルール19を使用して、介入が適切か否かや、メタデータ情報が、提案された介入に関連する品質保証ルール35にしたがっている否かを決定してもよい。メタデータ情報が、臨床試験品質保証ルール35にしたがっている場合、介入を実行するようにリモートユーザに知らせてもよい。そうでない場合には、介入を実行しないようにリモートユーザに知らせる。その後、リモートユーザは、介入が行われたか、または介入が行われなかったこと示してもよい。介入の完了のときに、コンプライアンスモニタがユーザと被験者に、次のスケジューリングされたデータ収集または介入活動に関して知らせてもよい。
【0032】
図2は、臨床試験または他のデータ収集の提案をレビューするための例示的な方法およびシステムを図示している。参加するための臨床試験の提案51が示される。臨床試験の提案51は、対応するメタデータ55を有する、さまざまなタイプの要求されたデータ53を含んでいてもよい。メタデータ55は、例えば、機器の識別子、検査員の識別子、スタッフ識別子、データおよび/または被験者を含んでいてもよい。臨床試験の提案51は、インターネット57を通して、ウェブサーバ59に提出してもよい。ウェブサーバ59は、コンプライアンスモニタ61と通信してもよい。臨床試験の提案が適合するか否か63を、コンプライアンスモニタ61が決定してもよい。メタデータ55が有効か否かを、コンプライアンスモニタ61が決定してもよい。例えば、機器データおよび/またはスタッフデータが、要求された基準に一致しているか否かを、コンプライアンスモニタ61が決定してもよい。臨床試験の提案が適合しなかった場合、臨床試験の提案は拒否される65。臨床試験の提案のデベロッパに通知を送ってもよい。臨床試験の提案が適合した場合、データを収集する要請67を臨床試験のデベロッパに送ってもよい。要請67はデータ収集活動を開始するための、および/または、データ提出を開始するための承認を含んでいてもよい。
【0033】
図3は、臨床試験81を実行するための例示的な方法およびシステムを図示している。臨床試験81は、検査員83によって開始されてもよい。検査員は、測定値をデータ源から収集および/または処理してもよい。規制者85は、検査員83に対する、ルールや、要件や、手順を決定してもよい。研究プロトコルおよびデータプロトコルは、治験審査委員会または他のタイプの規制機関のような規制者85によって管理されてもよい。治験審査委員会および/または独立倫理委員会は、被験者の権利および福利を保護するように主張する目的で、人間に関係する生物医学的行動に関するリサーチを承認したり、モニタしたり、レビューしたりするように公的に指定されている団体である。治験審査委員会は、人間の被験者に対して実施されるリサーチに対して、科学的な、倫理的な、規制的なクリティカルな監督機能を果たしている。
【0034】
臨床試験81は、研究プロトコル87によって特徴付けられてもよい。研究プロトコル87は、さまざまなタイプのデータおよび関係ルールを記録してもよい。例えば、可能性あるデータは、スケジュールルール91を持つスケジュール89、現場ルール95を持つ現場93、フォームルール99を持つフォーム97、検査員ルール103を持つ検査員101、患者ルール107を持つ患者105、および/またはデータルール111を持つデータ109を含んでいてもよい。他のタイプのデータおよび関係するルールも可能である。X−プロトコルまたは他の類似したタイプのライブラリ113は、研究プロトコル87で使用するためのルールを生成および/または記憶してもよい。研究プロトコル87内のデータ上で、メタ解析115を実行してもよい。
【0035】
図4は、データの妥当性検証のための例示的な方法およびシステムを図示している。臨床試験121が、臨床データ123を収集する。臨床試験121は、妥当性検証プロトコルに基づいて、臨床データ123に対する管理上のデータ125も収集してもよい。臨床試験121からのデータは、記録および/または処理より前に、妥当性検証標準サーバ127を通過してもよい。管理上のデータ125は、リモート妥当性検証ツール129に渡されてもよい。リモート妥当性検証ツール129は、妥当性検証ルール131および/または妥当性検証モニタ133を、管理上のデータ125に適用してもよい。妥当性検証ルール131は、ルールエンジン135によって管理されてもよい。妥当性検証モニタ133は、監視エンジン137によって管理されてもよい。ルールエンジン135および/または監視エンジン137は、コンプライアンスモニタ139と通信していてもよい。コンプライアンスモニタ139は、データ解析と報告141を可能にしてもよい。臨床試験121からのデータは、メタデータの埋め込みによって変形され、妥当性検証ルール131および/または妥当性検証モニタ133によって後続処理されてもよい。さらに、データは、データ解析および報告141によって変形されてもよい。
【0036】
例示目的のためだけに、データ収集プロセスの間に、データおよび関係するメタデータに資格を与えるためのシステムおよび方法の、先述した例示的な実施形態を示した。本発明は、多くの異なる形態の実施形態によって達成されているが、本開示は、例示として考えられるべきであり、記述したシステムおよび方法を、ここで説明および記述した特定の実施形態に限定することを意図しないことを理解すべきである。本記述の精神から逸脱することなく、多数のバリエーションが、当業者によってなされてもよい。さらに、上記で明確に述べられていなくても、1つの実施形態に関連して記述した特徴は、他の実施形態と併せて使用してもよい。本発明の範囲は、添付した特許請求の範囲と、特許請求の範囲の均等物とによって評価されるであろう。要約書およびタイトルが、特許請求の範囲の範囲を限定すると解釈すべきでなく、要約書およびタイトルの目的は、関係当局とともに不特定多数の人々が、記述したシステムおよび方法の一般的な性質を迅速に判断できるようにするものであると解釈すべきである。後続する特許請求の範囲において、「ミーンズ」という用語が使用されていない限り、ここで記載した特徴もエレメントも、35U.S.C.112条第6パラグラフの条文にしたがった、ミーンズプラスファンクションの限定であると解釈すべきではない。
【特許請求の範囲】
【請求項1】
臨床試験に関係するメタデータを処理するコンピューティングデバイスによって実現される方法において、
埋め込まれているメタデータを有する、前記臨床試験から収集データを受け取ることと、
前記埋め込まれているメタデータを抽出することと、
前記埋め込まれているメタデータの特性を決定するために、データベースにアクセスすることと、
プロトコルルールにアクセスすることと、
前記埋め込まれているメタデータの特性を前記プロトコルルールと比較することによって、前記埋め込まれているメタデータのコンプライアンスを確認することと、
前記収集データの、前記コンプライアンスまたはノンコンプライアンスを報告することとを含み、
前記プロトコルルールは、1組の、臨床試験の要件および手順を含む方法。
【請求項2】
前記データベースは、それぞれの特性に対する一連のサブデータベースをさらに含む請求項1記載の方法。
【請求項3】
前記プロトコルルールは、品質保証ルールと定義とをさらに含む請求項1記載の方法。
【請求項4】
前記収集データは、リモートクライアントコンピュータから受け取られる請求項1記載の方法。
【請求項5】
前記方法は、前記臨床試験における前記プロトコルルールでコンプライアンスのレベルを上げる請求項1記載の方法。
【請求項6】
前記メタデータは、現場と、文書と、スタッフと、機器と、患者と、介入とについての情報を含む請求項1記載の方法。
【請求項7】
前記メタデータは、インフォームドコンセント情報を含む請求項1記載の方法。
【請求項8】
前記メタデータは、標準インターフェースフォーマットを有する請求項1記載の方法。
【請求項9】
前記臨床試験は、治験審査委員会によって監督される請求項1記載の方法。
【請求項10】
前記収集データをリアルタイムでモニタすることをさらに含む請求項1記載の方法。
【請求項11】
前記臨床試験の間中、前記収集データをモニタすることをさらに含む請求項1記載の方法。
【請求項12】
前記収集データを受け取るより前に、臨床試験プロセスの提案のコンプライアンスを決定することをさらに含む請求項1記載の方法。
【請求項13】
コンプライアンスまたはノンコンプライアンスの通知を検査員に提供することをさらに含む請求項1記載の方法。
【請求項14】
臨床試験に関係するメタデータを処理するデータ処理システムにおいて、
プロセッサとメモリとを備えているデータ処理デバイスを具備し、
前記データ処理デバイスは、
クライアントコンピュータからデータを受け取り、
前記データは、臨床データと、管理上のデータとを含み、
前記管理上のデータは、メタデータとして前記臨床データ内に埋め込まれており、
前記管理上のデータを抽出し、
前記管理上のデータのコンプライアンスを臨床試験データ獲得プロトコルで決定し、
前記管理上のデータの、前記コンプライアンスまたはノンコンプライアンスを報告するデータ処理システム。
【請求項15】
前記管理上のデータの特性に関連する情報を記憶するデータベースをさらに具備する請求項14記載のデータ処理システム。
【請求項16】
前記データ処理デバイスは、前記管理上のデータのコンプライアンスを前記臨床データ獲得プロトコルで決定するために、前記データベースにアクセスする請求項15記載のデータ処理システム。
【請求項17】
前記データベースは、前記管理上のデータのそれぞれの特性に対する一連のサブデータベースである請求項15記載のデータ処理システム。
【請求項18】
プロセスによって実行可能なコンピュータプログラム命令を含むコンピュータ読み取り可能データ記憶媒体において、
前記コンピュータプログラム命令は、プロセッサによって実行されるときに、
臨床試験データを受け入れることと、
前記臨床試験データの獲得に関する手順情報を受け入れることと、
前記手続情報を、メタデータ中の前記臨床試験データに埋め込むことと、
記憶させるために、組み合わされた手順情報と臨床試験データとを単一のデータとしてデータベースに送ることとを含むステップを実現し、
前記メタデータは、前記組み合わされた手続情報と臨床試験データとを受け取るシステムがアクセス可能になるようにエンコードされ、
前記メタデータは、前記手順情報の特性をプロトコルルールと比較することによって、コンプライアンスを確認するために使用されるコンピュータ読み取り可能データ記憶媒体。
【請求項19】
前記組み合わされた手順情報と臨床試験データとをコンプライアンスモニタに送ることをさらに含む請求項18記載の方法。
【請求項20】
前記メタデータは、前記コンプライアンスモニタにおいてデコードされる請求項19記載の方法。
【請求項1】
臨床試験に関係するメタデータを処理するコンピューティングデバイスによって実現される方法において、
埋め込まれているメタデータを有する、前記臨床試験から収集データを受け取ることと、
前記埋め込まれているメタデータを抽出することと、
前記埋め込まれているメタデータの特性を決定するために、データベースにアクセスすることと、
プロトコルルールにアクセスすることと、
前記埋め込まれているメタデータの特性を前記プロトコルルールと比較することによって、前記埋め込まれているメタデータのコンプライアンスを確認することと、
前記収集データの、前記コンプライアンスまたはノンコンプライアンスを報告することとを含み、
前記プロトコルルールは、1組の、臨床試験の要件および手順を含む方法。
【請求項2】
前記データベースは、それぞれの特性に対する一連のサブデータベースをさらに含む請求項1記載の方法。
【請求項3】
前記プロトコルルールは、品質保証ルールと定義とをさらに含む請求項1記載の方法。
【請求項4】
前記収集データは、リモートクライアントコンピュータから受け取られる請求項1記載の方法。
【請求項5】
前記方法は、前記臨床試験における前記プロトコルルールでコンプライアンスのレベルを上げる請求項1記載の方法。
【請求項6】
前記メタデータは、現場と、文書と、スタッフと、機器と、患者と、介入とについての情報を含む請求項1記載の方法。
【請求項7】
前記メタデータは、インフォームドコンセント情報を含む請求項1記載の方法。
【請求項8】
前記メタデータは、標準インターフェースフォーマットを有する請求項1記載の方法。
【請求項9】
前記臨床試験は、治験審査委員会によって監督される請求項1記載の方法。
【請求項10】
前記収集データをリアルタイムでモニタすることをさらに含む請求項1記載の方法。
【請求項11】
前記臨床試験の間中、前記収集データをモニタすることをさらに含む請求項1記載の方法。
【請求項12】
前記収集データを受け取るより前に、臨床試験プロセスの提案のコンプライアンスを決定することをさらに含む請求項1記載の方法。
【請求項13】
コンプライアンスまたはノンコンプライアンスの通知を検査員に提供することをさらに含む請求項1記載の方法。
【請求項14】
臨床試験に関係するメタデータを処理するデータ処理システムにおいて、
プロセッサとメモリとを備えているデータ処理デバイスを具備し、
前記データ処理デバイスは、
クライアントコンピュータからデータを受け取り、
前記データは、臨床データと、管理上のデータとを含み、
前記管理上のデータは、メタデータとして前記臨床データ内に埋め込まれており、
前記管理上のデータを抽出し、
前記管理上のデータのコンプライアンスを臨床試験データ獲得プロトコルで決定し、
前記管理上のデータの、前記コンプライアンスまたはノンコンプライアンスを報告するデータ処理システム。
【請求項15】
前記管理上のデータの特性に関連する情報を記憶するデータベースをさらに具備する請求項14記載のデータ処理システム。
【請求項16】
前記データ処理デバイスは、前記管理上のデータのコンプライアンスを前記臨床データ獲得プロトコルで決定するために、前記データベースにアクセスする請求項15記載のデータ処理システム。
【請求項17】
前記データベースは、前記管理上のデータのそれぞれの特性に対する一連のサブデータベースである請求項15記載のデータ処理システム。
【請求項18】
プロセスによって実行可能なコンピュータプログラム命令を含むコンピュータ読み取り可能データ記憶媒体において、
前記コンピュータプログラム命令は、プロセッサによって実行されるときに、
臨床試験データを受け入れることと、
前記臨床試験データの獲得に関する手順情報を受け入れることと、
前記手続情報を、メタデータ中の前記臨床試験データに埋め込むことと、
記憶させるために、組み合わされた手順情報と臨床試験データとを単一のデータとしてデータベースに送ることとを含むステップを実現し、
前記メタデータは、前記組み合わされた手続情報と臨床試験データとを受け取るシステムがアクセス可能になるようにエンコードされ、
前記メタデータは、前記手順情報の特性をプロトコルルールと比較することによって、コンプライアンスを確認するために使用されるコンピュータ読み取り可能データ記憶媒体。
【請求項19】
前記組み合わされた手順情報と臨床試験データとをコンプライアンスモニタに送ることをさらに含む請求項18記載の方法。
【請求項20】
前記メタデータは、前記コンプライアンスモニタにおいてデコードされる請求項19記載の方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公表番号】特表2012−509542(P2012−509542A)
【公表日】平成24年4月19日(2012.4.19)
【国際特許分類】
【出願番号】特願2011−537575(P2011−537575)
【出願日】平成21年11月18日(2009.11.18)
【国際出願番号】PCT/US2009/064943
【国際公開番号】WO2010/059691
【国際公開日】平成22年5月27日(2010.5.27)
【出願人】(509214975)ダタシ,エルエルシー (2)
【Fターム(参考)】
【公表日】平成24年4月19日(2012.4.19)
【国際特許分類】
【出願日】平成21年11月18日(2009.11.18)
【国際出願番号】PCT/US2009/064943
【国際公開番号】WO2010/059691
【国際公開日】平成22年5月27日(2010.5.27)
【出願人】(509214975)ダタシ,エルエルシー (2)
【Fターム(参考)】
[ Back to top ]

