トランスジェニック光合成微生物およびフォトバイオリアクター
本明細書において、炭水化物、例えば二糖を蓄積するように操作されたトランスジェニック細菌が提供される。光合成微生物に栄養素および水分を提供するのに適した非ゼラチン質の固体培養担体ならびに前記培養担体の表面の少なくとも一部をおおう物理的バリアを含む、光合成微生物を培養するためのフォトバイオリアクターもまた提供される。フォトバイオリアクターを組み込んだ、光合成微生物の大規模連続培養のための装置および使用方法が開示されている。本発明のフォトバイオリアクターを用いる、光合成微生物からの発酵性糖の生産方法もまた開示されている。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願の相互参照
本願は、米国仮特許出願第61/085,797号(出願日:2008年8月1日)および米国仮特許出願第61/018,798号(出願日:2008年1月3日)に基づく優先権を主張する(そのそれぞれは、参照により本願に組み込まれる)。
【0002】
コンピュータ読み取り可能な形式で提出された資料の参照による組み込み
本開示の一部である配列表は、本発明のヌクレオチドおよび/またはアミノ酸配列を含むコンピュータ読み取り可能な形式および書面での配列表を含む。コンピュータ読み取り可能な形式で記録された配列表情報は、書面での配列表と同一である。配列表の対象物は、参照によりその全体が本願に組み込まれる。
【0003】
技術分野
本発明は、一般に、トランスジェニック微生物ならびにその培養方法および培養装置に関する。
【背景技術】
【0004】
世界のエネルギー必要量の増加に取り組むために、化石燃料の使用の効率的で環境上適正な代替物が求められている。エタノールまたはバイオディーゼルなどの代替燃料は、植物バイオマスから生産できる。例えば、エタノール生産に用いられている現行プロセスの重要成分は発酵性糖と呼ばれている。ほとんどの場合、発酵性糖はスクロース、グルコースまたは高果糖コーンシロップの形態である。このようなバイオマスの生産のために現在栽培されている植物は、コーン、サトウキビ、ダイズ、カノーラ、ジャトロファなどを含む。しかしながら、発酵性糖の生産のために使用される植物バイオマスの多くは、大規模なエネルギー集約型の前処理を必要とする。さらにまた、このような植物バイオマスの使用は、土壌消耗、腐食および食料供給品の転用を引き起こす恐れがある。
【0005】
シアノバクテリアの一部は、スクロースリン酸シンターゼおよびスクロースリン酸ホスファターゼの作用によってスクロースを生産することが知られ、これはもっぱら浸透圧保護剤として研究されてきた。耐塩性に関して、シアノバクテリアを3つのグループに分けることができる。低い耐性(700mM未満)を有する株は、スクロース(例えばシネココッカス・エロンガタス(Synechococcus elongatus)PCC 7942の場合)またはトレハロースとして知られる他の二糖のいずれかを合成する[Blumwald et al., Proc Natl Acd Sci USA (1983) 80:2599-2602 and Reed et al., FEMS Microbiol Rev (1986) 39:51-56]。中程度の耐塩性(0.7〜1.8mM)を有する株、例えばシネコシスチス(Synechocystis)種PCC 6803によりグルコシルグリセロールが生産される。高い耐塩性(〜2.5M)は、グリシンベタインまたはグルタミン酸ベタインのいずれかの蓄積の結果により生じる。しかしながら、Miaoら [FEMS Microbiol Lett (2003) 218:71-77]は、agp遺伝子の欠失によりグルコシルグリセロール生合成が阻害されるとき、シネコシスチス種PCC 6803は、その浸透圧保護剤としてスクロースを生産することを測定した。同様に、乾燥耐性シアノバクテリアは、マトリックス水ストレスに応じてスクロースおよびトレハロースを生産する[Hershkovitz et al., Appl Environ Microbiol (1991) 57:645-648]。
【0006】
シネコシスチス種PCC 6803(ATCC 27184)およびシネココッカス・エロンガタスPCC 7942(ATCC 33912)は比較的よく研究されており、入手可能な遺伝子ツールがあり、それらのゲノム配列は既知である(例えば、Koksharova, O. A. and・Wolk, C. P. 2002. Appl Microbiol Biotechnol 58, 123-137; Ikeuchi1, M. and Satoshi Tabata, S. 2001. Photosynthesis Research 70, 73-83; Golden, S. S., Brusslan, J. and Haselkorn, R. 1987. Methods in Enzymology 153, 215-231; Friedberg, D. 1988. Methods in Enzymology 167, 736-747; Kaneko, T. et al. 1996. DNA Research 3, 109-136 を参照のこと)。
【0007】
光合成微生物、例えば、スピルリナ・マキシマム(Spirulina maximum)、スピルリナ・プラテンシス(Spirulina platensis)、ドナリエラ・サリナ(Dunaliella salina)、ボトリオコックス・ブラウニイ(Botrycoccus braunii)、クロレラ・ブルガリス(Chlorella vulgaris)、クロレラ・ピレノイドーサ(Chlorella pyrenoidosa)、セレナストルム・カプリコミュータム(Serenastrum capricomutum)、セネデスムス・クアドリカウダ(Scenedesmus auadricauda)、ポルフィリディウム・クルエンタム(Porphyridium cruentum)、セネデスムス・アクタス(Scenedesmus acutus)、ドナリエラ(Dunaliella)種、セネデスムス・オブリカス(Scenedesmus obliquus)、アナベノプシス(Anabaenopsis)、アウロシラ(Aulosira)、キリンドロスペルムム(Cylindrospermum)、セネコッカス(Scenecoccus)種、セネシスティス(Scenecosystis)種およびトリポスリックス(Tolypothrix)の商業培養は、精製化学製品、医薬品、化粧品用顔料、脂肪酸、抗酸化剤、予防効果を有するタンパク質、増殖因子、抗生物質、ビタミンおよび多糖の生産を含む多数の用途に好ましい。藻類のバイオマスはまた、低用量で動物食品における抗生物質レベルの低下にまたはその代替として有用であることもでき、タンパク源として有用であることもできる。さらにまた、乾燥形態とは対照的に、湿潤形態で提供される藻類のバイオマスは、燃料の生産のために、培養または熱プロセスによって液化することができる。従って、このような生物の培養効率を上げる能力に大変興味が持たれる。
【0008】
一般に、現行の光合成バイオリアクターは、バイオマスを生産するために、液相系における微生物の培養を必要とする。この系は、通例、開放型池型リアクターまたは密閉型タンク型リアクターである。しかしながら、密閉型バイオリアクターは、一般的には多くの点で池型リアクターよりも改善されていると考えられている。重要なことに、密閉系は、環境汚染に対するバリアを提供している。さらに、この系は、液体培地の温度およびガス含有量の良好な調節を可能にする。
【0009】
それにもかかわらず、密閉型フォトバイオリアクターの使用は、光合成微生物の光要求性により限定される傾向がある(すなわち、化学線は、光合成微生物が二酸化炭素を固定して有機分子にするために必要なエネルギーを提供する)。従って、光合成微生物の十分な照射は、強固な必要条件である。それにもかかわらず、液相フォトバイオリアクターにおける細胞密度が増加するに従って、培地に達する光の能力は減少し、このことは、一般的には達成される細胞密度を限定する。さらに、微生物の好ましくない沈降を防ぐために、一般に、エネルギーの投入を必要とするプロセスである、液体培地のある種の撹拌を必要とする。
【0010】
液相系における微生物に光をもたらす方法を発明するために、多数の試みがなされている。例えば、ある系は、透明な管を通して液体培地を循環させることを含む。他の試みは、放射線吸収を調節するために、培地内に光源を置くか、または培地に反射粒子を導入することを含む。これらの努力にもかかわらず、より高い細胞密度で液相系において微生物を培養する能力における顕著な増加はいまだに達成されていない。
【0011】
前述の光要求性に加えて、液相フォトバイオリアクターの使用は、光合成のための十分な二酸化炭素を光合成微生物に供給することが負担となってきた。一般的には、これらの系は一般に、培地に溶存している二酸化炭素濃度を増加させるための、ある種のさらなる通気システムを組み込んでいる。通気の必要性を排除することにより、この系は著しく簡略化され、それにより操業費が抑えられると考えられる。
【0012】
液相フォトバイオリアクターもまた、連続生産の常法には適切ではない傾向がある。一般に、大容量の液体の移動は複雑で厄介である。さらにまた、液相系は、通例循環、撹拌、通気などの仕組みを必要とするため、一般に、多数の小さな培養装置よりも、1個かまたは数個の大きな培養装置を操作するほうが、より簡単でより費用対効果が高い。従って、現在行われている方法は、比較的大規模なバッチの処理を含む(すなわち、光合成微生物のバッチを培養し、次いで得られる全バイオマスを収穫する)。
【0013】
従って、当該技術分野において、光合成バイオリアクター設計における進歩が強く求められている。大容量の水または他の液体培地を用いず、十分な光および二酸化炭素を供給する前述の特別な手段を用いずに、合理的な費用で、比較的高密度の光合成微生物を効率的に培養し、収穫できる新しいタイプの光合成バイオリアクターを提供することは、当該技術分野での実質的進歩を意味し、産業および消費者が等しく利益を受けることになると考えられる。
【発明の概要】
【0014】
本明細書において、炭水化物、例えば二糖を蓄積するように操作されたトランスジェニック細菌が提供される。光合成微生物に栄養素および水分を提供するのに適した非ゼラチン質の固体培養担体ならびに前記培養担体の表面の少なくとも一部をおおう物理的バリアを含む、光合成微生物を培養するためのフォトバイオリアクターもまた提供される。フォトバイオリアクターを組み込んだ、光合成微生物の大規模連続培養のための装置および使用方法が開示されている。本発明のフォトバイオリアクターを用いる、光合成微生物からの発酵性糖の生産方法もまた開示されている。
【0015】
一側面は、光合成微生物を培養するためのフォトバイオリアクターを提供する。フォトバイオリアクターは、その表面の少なくとも一部の上にある光合成微生物に栄養素および水分を提供するのに適した非ゼラチン質の固体培養担体であって、前記表面の一部が非水平に向けられるとき、光合成微生物がそれに付着するのを可能にする形状(topography)を有する前記固体培養担体;ならびに、少なくとも前記培養担体の表面の一部をおおう物理的バリアであって、前記培養担体の表面の一部への接種、このような光合成微生物の培養に適した環境の形成および維持ならびにこのような培養した光合成微生物の収穫を可能にするように構成された前記物理的バリアを含む。
【0016】
いくつかの実施形態において、フォトバイオリアクターは、前記培養担体の表面の一部の上にある光合成微生物を含む。いくつかの実施形態において、フォトバイオリアクターは、以下でより詳しく説明するが、二糖を蓄積するように操作された細胞であって、固体培養担体に付着した前記細胞をさらに含む。いくつかの実施形態において、前記培養担体の表面の一部は、1リットル相当量当たり乾燥バイオマス少なくとも約50グラムの密度で光合成微生物を培養できる。
【0017】
いくつかの実施形態において、培養担体は柔軟性(flexible)である。いくつかの実施形態において、培養担体は1以上の硬質材料を含む。いくつかの実施形態において、フォトバイオリアクターの培養担体は、少なくとも2つの層、すなわち第2層に隣接した第1層を含み、ここで少なくとも2つの層の材料は同一材料または異なる材料である。いくつかの実施形態において、第1層は高表面積の増殖材料を含み、第2層は透過型材料を含む。いくつかの実施形態において、フォトバイオリアクターの培養担体は、可撓的に連結された硬質部分であって、1以上の硬質材料で構成される前記硬質部分を含む。いくつかの実施形態において、フォトバイオリアクターは1つの培養担体を含む。いくつかの実施形態において、フォトバイオリアクターは複数の培養担体を含む。
【0018】
いくつかの実施形態において、培養担体は布を含む。いくつかの実施形態において、布は天然繊維、改質天然繊維、合成繊維またはそれらの組み合わせで構成される。いくつかの実施形態において、布は織物、編物、フェルト、架橋繊維ポリマーのメッシュまたはそれらの組み合わせである。いくつかの実施形態において、天然繊維は、綿、羊毛、アサ、木繊維、他のセルロース系繊維およびそれらの組み合わせからなる群から選択される。いくつかの実施形態において、改質天然繊維は、ニトロセルロース、セルロースアセタート、セルローススルホナート、架橋デンプンおよびそれらの組み合わせからなる群から選択される。いくつかの実施形態において、合成繊維はポリエステル、ポリアクリラート、ポリアミン、ポリアミド、ポリスルホンおよびそれらの組み合わせからなる群から選択される。
【0019】
いくつかの実施形態において、培養担体は吸水性ポリマー(moisuture absorbent polymer)でコーティングされる。いくつかの実施形態において、布、布の繊維または両方は吸水性ポリマーでコーティングされる。いくつかの実施形態において、吸水性ポリマーは寒天、ポリアクリラート、ポリアミド、ポリアミン、ポリエチレングリコール、修飾デンプンおよびそれらの組み合わせからなる群から選択される。
【0020】
いくつかの実施形態において、フォトバイオリアクターの物理的バリアは、固体微粒子および液体に対して少なくとも実質的に不透過性であるが、前記培養担体の表面の一部に隣接する空間を往復するガスまたは蒸気の移動を妨げないばかりでなく、前記培養担体の表面の一部の化学線照射も妨げない。いくつかの実施形態において、湿らせた培養担体が十分な水分を保持するように、物理的バリアは水蒸気に対して十分に不透過性であり、それにより培養中に光合成微生物は適切に水和されたままである。いくつかの実施形態において、バリアは、光合成微生物の培養の少なくとも一部分において、培養担体およびその培養担体上の任意の光合成微生物を密閉し、かつ、取り外し可能(releasably)にシールされるように構成される。いくつかの実施形態において、物理的バリアは柔軟性である。いくつかの実施形態において、物理的バリアは、固体微粒子、液体、ガスおよび蒸気に対して少なくとも実質的に不透過性である第1の部分ならびに、ガスおよび蒸気に対して透過性であるが、固体微粒子および液体に対して少なくとも実質的に不透過性である第2の部分をさらに含む。いくつかの実施形態において、バリアの第2の部分は、少なくとも約5ガーレー秒から約10,000ガーレー秒以下までのガスまたは蒸気交換速度を有する。いくつかの実施形態において、バリアの第2の部分は、オレフィン繊維もしくはポリエチレン繊維材料、ポリテトラフルオロエチレン濾過媒体、セルロース系フィルター材料、ファイバーグラスフィルター材料、ポリエステルフィルター材料、ポリアクリラートフィルター材料、ポリスルホン膜またはナイロン膜を含む選択膜を含む。いくつかの実施形態において、第1の部分は化学線に対して少なくとも実質的に透過性であり、第2の部分は化学線に対して少なくとも実質的に透過性ではなく、第1および第2の部分の、互いに対する配置および少なくとも前記培養担体の表面の一部に対する配置は光合成微生物による光合成を維持するために十分な量の化学線およびガスが交換されるようなものである。
【0021】
いくつかの実施形態において、フォトバイオリアクターは、培養担体と物理的バリアとの間に位置する化学線源をさらに含む。いくつかの実施形態において、物理的バリアは、培養担体と化学線源との間にあり、このような化学線に対し十分に透明であり、培養中に光合成微生物による光合成を可能にするために十分にガス透過性である。
【0022】
いくつかの実施形態において、フォトバイオリアクターは、培養担体上、培養担体内または培養担体上および培養担体内に水、栄養素、またはそれらの組み合わせをさらに含む。いくつかの実施形態において、フォトバイオリアクターは、フォトバイオリアクターを構造物へ取り付けるための1以上の取り付け部分をさらに含む。いくつかの実施形態において、フォトバイオリアクターは、流体供給システム、栄養供給システム、ガス供給システムおよび微生物供給システムの少なくとも1つをさらに含む
【0023】
他の側面は、光合成微生物を培養するための装置を提供する。前記装置は、前述の少なくとも1つのフォトバイオリアクターおよび少なくとも1つのフォトバイオリアクターの少なくとも1つの培養担体が非水平に向いた少なくとも1つのフォトバイオリアクターが取り付けられる構造物を含む。いくつかの実施形態において、少なくとも1つのフォトバイオリアクターは構造物から吊り下げられる。いくつかの実施形態において、構造物は物理的バリアによって実質的におおわれる。いくつかの実施形態において、構造物は、コンベヤシステムの経路に沿って少なくとも1つの培養担体を運搬することができるようにコンベヤシステムまたはその構成要素を含む。いくつかの実施形態において、装置は、以下の1つ、2つまたは3つ:各培養担体をコンベヤシステムの経路に沿って運搬しながら光合成微生物を接種できる接種ステーション;各培養担体をコンベヤシステムの経路に沿って運搬しながら、接種された各培養担体上の光合成微生物を培養するための培養ステーション;および培養した光合成微生物の少なくとも一部を各培養担体から収穫するために培養担体が運ばれる収穫ステーションをさらに含む。いくつかの実施形態において、接種ステーションおよび収穫ステーションは、実質的に互いに隣接しているかまたは実質的に同延である。いくつかの実施形態において、装置は、各培養担体上の光合成微生物による発酵性糖の合成を誘導するための誘導ステーションをさらに含む。いくつかの実施形態において、装置は、流体供給システム、栄養供給システム、ガス供給システムまたは微生物供給システムの少なくとも1つをさらに含む。いくつかの実施形態において、装置は、固体培養担体上に付着した光合成微生物をさらに含む。いくつかの実施形態において、装置は、以下でより詳しく説明するが、二糖を蓄積するように操作された細胞であって、固体培養担体に付着した前記細胞をさらに含む。
【0024】
他の側面は、二糖を蓄積するように操作されたトランスジェニック光合成微生物細胞を提供する。トランスジェニック光合成微生物細胞は、転写の5’から3’の方向に作動可能に連結された構成要素として:光合成微生物細胞において機能するプロモーター;二糖リン酸シンターゼおよび二糖リン酸ホスファターゼからなる群から選択される、二糖生合成活性を有するポリペプチドをコードするヌクレオチド配列を含むポリヌクレオチド;ならびに転写終結配列;を含み、ここで前記トランスジェニック光合成微生物細胞は、前記DNA構築物を含まない光合成微生物細胞と比較して増加したレベルの二糖を蓄積する。
【0025】
いくつかの実施形態において、トランスジェニック光合成微生物細胞は、二糖リン酸シンターゼ活性を有するポリペプチドをコードする第1ヌクレオチド配列および二糖リン酸ホスファターゼ活性を有するポリペプチドをコードする第2ヌクレオチド配列を含むポリヌクレオチドを含む。いくつかの実施形態において、二糖リン酸シンターゼ活性および二糖リン酸ホスファターゼ活性を有するポリペプチドをコードするヌクレオチド配列を含むポリヌクレオチドを含む。いくつかの実施形態において、二糖リン酸シンターゼ活性を有するポリペプチドをコードする第1ヌクレオチド配列;二糖リン酸ホスファターゼ活性を有するポリペプチドをコードする第2ヌクレオチド配列;ならびに二糖リン酸シンターゼ活性および二糖リン酸ホスファターゼ活性を有するポリペプチドをコードする第3ヌクレオチド配列を含む。
【0026】
いくつかの実施形態において、トランスジェニック光合成微生物細胞のポリヌクレオチドは、(a)スクロースリン酸シンターゼおよびスクロースリン酸ホスファターゼ(ASF)活性を有する配列番号2またはそれに95%同一の配列;スクロースリン酸シンターゼ(SPS)活性を有する配列番号4またはそれに95%同一の配列;スクロースリン酸ホスファターゼ(SPP)活性を有する配列番号6またはそれに95%同一の配列;トレハロースリン酸シンターゼ(TPS)活性を有する配列番号77またはそれに95%同一の配列;トレハロースリン酸ホスファターゼ(TPP)活性を有する配列番号79またはそれに95%同一の配列;グルコシルグリセロールリン酸シンターゼ(GPS)活性を有する配列番号81またはそれに95%同一の配列;グルコシルグリセロールリン酸ホスファターゼ(GPP)活性を有する配列番号83またはそれに95%同一の配列;マンノシルフルクトースリン酸シンターゼ(MPS)活性を有する配列番号85またはそれに95%同一の配列;およびマンノシルフルクトースリン酸ホスファターゼ(MPP)活性を有する配列番号87またはそれに95%同一の配列;からなる群から選択されるポリペプチドをコードするヌクレオチド配列を含むポリヌクレオチド、
(b)スクロースリン酸シンターゼ/スクロースリン酸ホスファターゼ(ASF)活性をコードする配列番号1またはそれに95%同一の配列;スクロースリン酸シンターゼ(SPS)活性をコードする配列番号3またはそれに95%同一の配列;スクロースリン酸ホスファターゼ(SPP)活性をコードする配列番号5またはそれに95%同一の配列;トレハロースリン酸シンターゼ(TPS)活性をコードする配列番号76またはそれに95%同一の配列;トレハロースリン酸ホスファターゼ(TPP)活性をコードする配列番号78またはそれに95%同一の配列;グルコシルグリセロールリン酸シンターゼ(GPS)活性をコードする配列番号80またはそれに95%同一の配列;グルコシルグリセロールリン酸ホスファターゼ(GPP)活性をコードする配列番号82またはそれに95%同一の配列;マンノシルフルクトースリン酸シンターゼ(MPS)活性をコードする配列番号84またはそれに95%同一の配列;およびマンノシルフルクトースリン酸ホスファターゼ(MPP)活性をコードする配列番号86またはそれに95%同一の配列;を含む単離されたポリヌクレオチド;(c)単離されたポリヌクレオチドがASF活性を有するポリペプチドをコードする配列番号1;単離されたポリヌクレオチドがSPS活性を有するポリペプチドをコードする配列番号3;単離されたポリヌクレオチドがSPP活性を有するポリペプチドをコードする配列番号5;単離されたポリヌクレオチドがTPS活性を有するポリペプチドをコードする配列番号76;単離されたポリヌクレオチドがTPP活性を有するポリペプチドをコードする配列番号78;単離されたポリヌクレオチドがGPS活性を有するポリペプチドをコードする配列番号80;単離されたポリヌクレオチドがGPP活性を有するポリペプチドをコードする配列番号82;単離されたポリヌクレオチドがMPS活性を有するポリペプチドをコードする配列番号84;単離されたポリヌクレオチドがMPP活性を有するポリペプチドをコードする配列番号86;からなる群から選択される核酸配列とストリンジェントな条件下でハイブリダイズする単離されたポリヌクレオチドであって、前記ストリンジェントな条件が6X SSC(0.9M塩化ナトリウムおよび0.09Mクエン酸ナトリウム)を含む溶液中65℃でのインキュベーションを含む前記単離されたポリヌクレオチド;ならびに(d)(a)、(b)または(c)のポリヌクレオチド配列に相補的な単離されたポリヌクレオチドからなる群から選択される。
【0027】
いくつかの実施形態において、蓄積された二糖モノマーは細胞にとって内因性である。いくつかの実施形態において、蓄積された二糖のモノマー(単数または複数)は細胞にとって外因性であり、細胞にこのようなモノマー(単数または複数)の発現が操作される。
【0028】
いくつかの実施形態において、細胞は、光合成細菌であるシアノバクテリア細胞;または緑藻である。いくつかの実施形態において、細胞はシアノバクテリア細胞である。いくつかの実施形態において、細胞は、シネココッカス(Synechococcus)およびシネコシスチスからなる群から選択されるシアノバクテリアである。
【0029】
いくつかの実施形態において、プロモーターは誘導性プロモーターである。いくつかの実施形態において、プロモーターは、温度、pH、代謝物、光、浸透圧剤、重金属および抗生物質からなる群から選択される誘導剤で誘導できる。いくつかの実施形態において、プロモーターは、carB、nirA、psbAII、dnaK、kaiAおよびλPRからなる群から選択される。
【0030】
いくつかの実施形態において、細胞のDNA構築物は、配列番号19(asfをコードするpLybAL11);配列番号20(asfをコードするpLybAL12);配列番号44(asfをコードするpLybAL15);配列番号45(asfをコードするpLybAL16);配列番号46(asfをコードするpLybAL17);配列番号47(asfをコードするpLybAL18);配列番号48(asfをコードするpLybAL19);配列番号49(asfをコードするpLybAL21);配列番号50(asfをコードするpLybAL22);配列番号51(asfをコードするpLybAL13f);配列番号52(asfをコードするpLyAL13r);配列番号53(asfをコードするpLybAL14f);配列番号54(asfをコードするpLybAL14r);配列番号65(asfをコードするpLybAL7f);配列番号69(asfをコードするpLybAL8f);配列番号118(tpsおよびtppをコードするpLybAL23);配列番号121(tpsおよびtppをコードするpLybAL28);配列番号122(tpsおよびtppをコードするpLybAL29);配列番号123(tpsおよびtppをコードするpLybAL30);配列番号124(tpsおよびtppをコードするpLybAL31);配列番号125(tpsおよびtppをコードするpLybAL36);配列番号126(tpsおよびtppをコードするpLybAL37);配列番号130(tpsおよびtppをコードするpLybAL24);ならびに配列番号133(tpsおよびtppをコードするpLybAL33)からなる群から選択されるヌクレオチド配列を含む。
【0031】
いくつかの実施形態において、細胞は、1分当たり乾燥バイオマス1グラム当たり二糖を少なくとも約0.1マイクログラム蓄積する。いくつかの実施形態において、細胞は、1分当たり乾燥バイオマス1グラム当たり二糖を少なくとも約0.1マイクログラムから最大1分当たり乾燥バイオマス1グラム当たり二糖を約10マイクログラムまで蓄積する。
【0032】
いくつかの実施形態において、配列番号70、配列番号72および配列番号74またはそれらに対する少なくとも95%の同一性およびインベルターゼ活性もしくはスクラーゼフェリドキシン(sucraseferridoxin)活性を有するそれらのヌクレオチドバリアントからなる群から選択されるヌクレオチド配列を細胞は含まない。いくつかの実施形態において、配列番号71、配列番号73および配列番号75またはそれらに対する少なくとも95%の同一性およびインベルターゼ活性もしくはスクラーゼフェリドキシン活性を有するそれらのポリペプチドバリアントからなる群から選択されるポリペプチド配列を細胞は発現しない。いくつかの実施形態において、配列番号70、配列番号72および配列番号74またはそれらに対する少なくとも95%の同一性およびインベルターゼ活性もしくはスクラーゼフェリドキシン活性を有するそれらのヌクレオチドバリアントからなる群から選択されるヌクレオチド配列に特異的な低分子干渉RNAを細胞は発現する。
【0033】
いくつかの実施形態において、細胞は、活性ポリンポリペプチドをコードする配列番号94またはそれに95%同一の配列を含む単離されたポリヌクレオチド;配列番号95またはそれに95%同一の配列を含みポリン活性を有するポリペプチドをコードする単離されたポリヌクレオチド;または配列番号91(ポリンをコードするpLybAL32)を含む単離されたポリヌクレオチド;をさらに含み、ここで蓄積された二糖はスクロースであり、細胞はポリンを発現し、発現されたポリンは、蓄積されたスクロースを細胞から分泌させる。
【0034】
他の側面は、人工DNA構築物を提供する。いくつかの実施形態において、人工DNA構築物は、配列番号19(asfをコードするpLybAL11);配列番号20(asfをコードするpLybAL12);配列番号44(asfをコードするpLybAL15);配列番号45(asfをコードするpLybAL16);配列番号46(asfをコードするpLybAL17);配列番号47(asfをコードするpLybAL18);配列番号48(asfをコードするpLybAL19);配列番号49(asfをコードするpLybAL21);配列番号50(asfをコードするpLybAL22);配列番号51(asfをコードするpLybAL13f);配列番号52(asfをコードするpLyAL13r);配列番号53(asfをコードするpLybAL14f);配列番号54(asfをコードするpLybAL14r);配列番号65(asfをコードするpLybAL7f);配列番号69(asfをコードするpLybAL8f);配列番号118(tpsおよびtppをコードするpLybAL23);配列番号121(tpsおよびtppをコードするpLybAL28);配列番号122(tpsおよびtppをコードするpLybAL29);配列番号123(tpsおよびtppをコードするpLybAL30);配列番号124(tpsおよびtppをコードするpLybAL31);配列番号125(tpsおよびtppをコードするpLybAL36);配列番号126(tpsおよびtppをコードするpLybAL37);配列番号130(tpsおよびtppをコードするpLybAL24);配列番号133(tpsおよびtppをコードするpLybAL33);配列番号91(ポリンをコードするpLybAL32);配列番号102(SS-UPPをコードするpLybAL3f);配列番号103(SE-UPPをコードするpLybAL5f);配列番号106(SE-UPPをコードするpLybAL4f);配列番号107(SE-UPPをコードするpLybAL9f);配列番号109(SE-UPPをコードするpLybAL6fb);配列番号110(SE-UPPをコードするpLybAL10fb);および配列番号91(ポリンをコードするpLybAL32)からなる群から選択される少なくとも1つの配列を含む。
【0035】
他の側面は、光合成微生物の培養方法を提供する。光合成微生物の培養方法は、前述のフォトバイオリアクターまたは装置のいずれかを用いることができる。前記方法は、培養担体に光合成微生物を接種し;接種された培養担体で光合成微生物を培養し;培養担体から培養した光合成微生物の少なくとも一部を収穫することを含む。いくつかの実施形態において、前記方法は、物理的バリアがシールされている間、光合成微生物の培養の全部または実質的な部分が行われるように、培養担体の接種後にフォトバイオリアクターの物理的バリアをシールすることをさらに含む。いくつかの実施形態において、物理的バリアは取り外し可能にシールされている。いくつかの実施形態において、前記方法は、接種ステーション、培養ステーションおよび収穫ステーションに各培養担体を運搬することをさらに含む。いくつかの実施形態において、前記方法は、培養担体に流体を供給すること;培養担体に栄養素を供給すること;または培養担体にガスを供給することの少なくとも1つをさらに含む。いくつかの実施形態において、光合成微生物は、1リットル相当量当たり乾燥バイオマス少なくとも約50グラムの密度まで培養される。いくつかの実施形態において、光合成微生物は、前述のように、二糖を蓄積するように操作されたトランスジェニック光合成微生物を含む。
【0036】
他の側面は、発酵性糖の生産方法を提供する。発酵性糖の生産方法は、前述のフォトバイオリアクターまたは装置のいずれかを使用することができる。発酵性糖の生産方法は、発酵性糖を蓄積できる光合成微生物を培養担体に接種し;接種された培養担体で光合成微生物を培養し;蓄積された発酵性糖を単離することを含む。いくつかの実施形態において、発酵性糖は光合成微生物内に蓄積する。いくつかの実施形態において、蓄積された発酵性糖の単離は、培養担体からの、培養した光合成微生物の少なくとも一部を収穫し;収穫物からの発酵性糖を回収することを含む。いくつかの実施形態において、蓄積された発酵性糖は、光合成微生物から分泌され、培養培地から単離される。いくつかの実施形態において、蓄積された発酵性糖の単離は、培養培地からの蓄積された発酵性糖の単離を含む。いくつかの実施形態において、前記方法は、物理的バリアがシールされている間、光合成微生物の培養の全部または実質的な部分が行われるように、培養担体の接種後にフォトバイオリアクターの物理的バリアを取り外し可能にシールすることをさらに含む。いくつかの実施形態において、前記方法は、培養担体に流体を供給すること;培養担体に栄養素を供給すること;または培養担体にガスを供給することの少なくとも1つをさらに含む。いくつかの実施形態において、前記方法は、接種ステーション、培養ステーションおよび収穫ステーションの少なくとも1つに各培養担体を運搬することをさらに含む。
【0037】
いくつかの実施形態において、前記方法は、光合成微生物による発酵性糖の合成の誘導をさらに含む。いくつかの実施形態において、発酵性糖の合成の誘導は、温度、pH、代謝物、光、浸透圧剤、重金属および抗生物質からなる群から選択される誘導剤に光合成微生物を暴露することを含む。いくつかの実施形態において、発酵性糖の合成の誘導は、光合成微生物を塩化合物で処理することを含む。いくつかの実施形態において、塩化合物は塩化ナトリウムである。いくつかの実施形態において、塩化合物は約0.01mM〜1.5Mまたは約0.2〜0.9Mの濃度で添加される。いくつかの実施形態において、誘導剤はエアゾールスプレーによって増殖表面に塗布される。いくつかの実施形態において、光合成微生物は、1リットル相当量当たり乾燥バイオマス少なくとも約50グラムの密度まで培養される。いくつかの実施形態において、発酵性糖は、グルコース、フルクトース、スクロース、トレハロース、グルコシルグリセロールおよびマンノシルフルクトースからなる群から選択される少なくとも1つの糖を含む。いくつかの実施形態において、発酵性糖はスクロースおよびトレハロースからなる群から選択される少なくとも1つの糖を含む。
【0038】
いくつかの実施形態において、光合成微生物は天然に存在する光合成微生物を含む。いくつかの実施形態において、光合成微生物は遺伝子改変光合成微生物を含む。いくつかの実施形態において、光合成微生物はシアノバクテリアを含む。いくつかの実施形態において、光合成微生物は、シネココッカスまたはシネコシスチスからなる群から選択されるシアノバクテリアを含む。いくつかの実施形態において、光合成微生物は、前述のように、二糖を蓄積するように操作されたトランスジェニック光合成微生物を含む。
【0039】
下文において、他の対象および特徴が部分的に明らかにされ、部分的に指摘される。
【図面の簡単な説明】
【0040】
下記の図面が単に例示を目的としたものであることは、当業者には明らかであろう。これらの図面は、本教示の範囲をなんら限定するものではない。
【0041】
【図1】固体培養担体、透明な外部保護バリア層、選択パネル、再シール可能なクロージャーおよび装置を吊り下げるための支持要素を含む、本発明のフォトバイオリアクターの正面図である。
【図2】固体培養担体、透明な外部保護バリア層、選択パネル、再シール可能なクロージャーおよび装置を吊り下げるための支持要素を含む、本発明のフォトバイオリアクターの側面図である。
【図3】フォトバイオリアクター農場を構成するための、共通の接種および収穫センターから放射状に外に広げられた複数の閉ループコンベヤシステムに沿った本発明の複数のフォトバイオリアクターまたは培養担体の配置を示す図である。
【図4】シアノバクテリアにおけるスクロースの光合成生産を示すイラストである。
【図5】シネコシスチス種PCC 6803(Ssp6803)スクロースリン酸シンターゼ(SPS)およびスクロースリン酸ホスファターゼ(SPP)タンパク質とシネココッカス・エロンガタスPCC 7942(Selo7942)活性融合SPS/SPP(ASF)とのポリペプチド配列のアラインメントである。Ssp6803は、SPSおよびSPP活性をコードする別々の遺伝子を含む。シネコシスチス種PCC 6803からのSPSタンパク質は、活性部位残基の多くが保存されていないので、おそらく不活性なSPPドメインを含む。カノニカルHAD加水分解酵素の活性部位残基をアラインメントの上部に示し、保存されたアミノ酸には下線を施し、保存されていない残基には二重下線を施した。シネコシスチス種PCC 6803SPSの不活性なSPPドメイン内の8つのアミノ酸挿入はイタリック体で印刷されている。方法論に関するさらなる詳細は、実施例4に示されている。
【図6】pLybAL11の概略図である。pLybAL11はシアノバクテリアDNAのライブラリーの構築およびプロモーター配列の選択を可能にする。プロモーターを含有しないasf遺伝子は、二方向性ターミネーターの後ろにあり、マルチクローニング部位(MCS)によって分離されている。oriVは、大部分のグラム陰性微生物におけるプラスミドの複製を可能にする。oriTは、pRK2013ヘルパープラスミドの助けにより、選択されたシアノバクテリア(または他の微生物)への大腸菌からのプラスミドの接合伝達を可能にする。大腸菌における選択のために、β-ラクタマーゼ遺伝子(bla)が存在している。シアノバクテリアゲノムDNAをMCSにクローニングすることによって、大腸菌内でDNAライブラリーを構築することができる。次いで、接合または直接形質転換によって、シアノバクテリアにプラスミドライブラリーを導入することができる。次いで、クロラムフェニコールアセチルトランスフェラーゼ遺伝子(cat)の発現によるクロラムフェニコールに関する選択によって、活性プロモーターを単離することができる。クロラムフェニコールアセチルトランスフェラーゼ活性に関するアッセイおよびスクロース生産の直接試験の両方によってプロモーターの強度を評価することができる。方法論に関するさらなる詳細は、実施例5に示されている。
【図7】pLybAL12の概略図である。pLybAL12は、asf発現を亢進するための、あらかじめ選択したプロモーターの能力の分析を可能にする。pLybAL12とpLybAL11の間の唯一の差異は、クロラムフェニコールアセチルトランスフェラーゼ遺伝子(cat)の前の活性プロモーターの存在である。PCRによって増幅されたシアノバクテリア染色体DNAから単離された特定のDNA配列をMCSにクローニングすることができる。大腸菌における選択のために、クロラムフェニコールおよびアンピシリンの両方を使用することができる。次いで、接合または直接形質転換によって、プラスミドライブラリーをシアノバクテリアに導入することができる。次いで、クロラムフェニコールアセチルトランスフェラーゼ遺伝子(cat)の発現によるクロラムフェニコールに関する選択によって、プラスミドを含むシアノバクテリアを単離することができる。クロラムフェニコールアセチルトランスフェラーゼ活性に関するアッセイおよびスクロース生産の直接試験の両方によってプロモーターの強度を評価することができる。方法論に関するさらなる詳細は、実施例5に示されている。
【図8】シアノバクテリアプロモーターライブラリーの構築を示すイラストである。方法論に関するさらなる詳細は、実施例8に示されている。
【図9】pSMART-LCKanを示す概略図である。方法論に関するさらなる詳細は、実施例8に示されている。
【図10】シネココッカス・エロンガタスPCC 7942asf内の可能なプロモーターを示す配列表である。シネココッカス・エロンガタスPCC 7942からのasf遺伝子を含む増幅されたPCR産物が示されている。これは、クロラムフェニコール耐性マーカーの上流にクローニングされた。スクロースリン酸シンターゼおよびスクロースリン酸ホスファターゼポリペプチド活性をコードするasf領域は、それぞれ一重下線および二重下線が施されている。全DNA配列領域はイタリック体で示され、上にラベルされている。StartおよびStopは、それぞれ開始コドンおよび終止コドンを示す。SDはシャイン・ダルガノ配列を示す。推定上のプロモーターの-35および-10領域は、グレーで強調表示されている。方法論に関するさらなる詳細は実施例8に示されている。
【図11】シアノバクテリアゲノムにおける遺伝子のマーカーレス欠失のための2ステッププロトコルを示す概略図である。この戦略は、使用されているシアノバクテリア株がそのupp遺伝子を欠失してしまっていることを仮定している。スクロース生合成遺伝子挿入の間に、upp遺伝子は欠失してしまっていると考えられる。欠失の標的とされた目的とする遺伝子を同定しなければならない。出発株は5-フルオロウラシルに耐性を示すが、カナマイシンに感受性を示す。カナマイシン耐性マーカーおよび活性uppを含むカセットの挿入によって遺伝子は完全にまたは部分的に欠失しており、その株はカナマイシンに耐性を示すようになるが、5-フルオロウラシルに感受性を示すようになる。次いで、uppおよびカナマイシン耐性マーカーを除去することができ、株は再度5-フルオロウラシルに耐性を示すようになるが、カナマイシンには感受性になる。方法論に関するさらなる詳細は、実施例12に示されている。
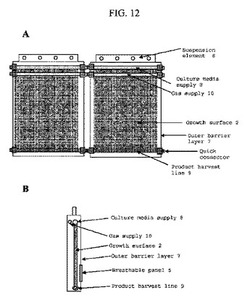
【図12】フォトバイオリアクター実施形態の概略図である。図12Aは正面図を示し、図12Bは側面図を示す。フォトバイオリアクターは、吊り下げ要素(6);培地供給(8);ガス供給(10);増殖表面(2);外部バリア層(7);クイックコネクタ;および産物収穫ライン(9)を含む。
【図13】1つの材料フォーマット(図13A)およびハイブリッド材料フォーマット(図13B)における増殖表面の概略図である。
【発明を実施するための形態】
【0042】
発明の詳細な説明
本願は、発酵性糖蓄積光合成微生物、固相フォトリアクター装置およびそれぞれを用いる方法に関する。
【0043】
発酵性糖蓄積光合成微生物においては、一般に光合成微生物に利用されず、従って培養したバイオマス中に蓄積されることができる二糖(例えば、スクロース、トレハロース)を生産することが好ましいと考えられる。いくつかの実施形態において、光合成微生物は、通常浸透圧ストレス経路に従って生産される二糖(例えば、スクロースまたはトレハロース)を合成するように遺伝子操作され、それにより、浸透圧ストレスの非存在下またはレベル低下において前記二糖が生産される。高等植物と比較して、光合成微生物の増殖は効率がよく、環境影響が少ないので、現行のバイオ燃料製造慣行と比較して、前記方法は持続可能性において重要な改良を提示する。好都合には、前述の二糖合成方法は、本発明のフォトバイオリアクター(単数または複数)内で行われるのに適合されてきた。
【0044】
本明細書記載のフォトバイオリアクターは固体培養担体を用いる。好都合には、少なくとも一部分において、適切な光暴露を提供する困難さは軽減されている。フォトバイオリアクターにおける前述の固体培養担体を用いることにより、工業規模液相バイオリアクターの細胞密度を超える細胞密度(例えば、1リットル相当量当たり乾燥バイオマス200グラムを超える細胞密度)で光合成微生物を培養および増殖させることができる。さらに、本明細書記載のフォトバイオリアクターの種々の実施形態は、従来の工業規模液相フォトバイオリアクターと比較してより少ないエネルギーでより簡単に運転できる。
【0045】
本明細書記載のフォトバイオリアクターの実施形態は、従来の液相フォトバイオリアクターと比較してさらなる利点を提供する。例えば、液体系は、一般的には、光合成微生物の増殖および光合成を維持するために、光合成微生物に適切な濃度/量の二酸化炭素を供給するための特別な装置を必要とする。対照的に、固体培養担体上で微生物を増殖させることによって、比較的簡単で金がかからない方法、例えば周囲の空気への暴露を用いて二酸化炭素を提供できる。さらなる二酸化炭素が所望される場合、例えば、培養担体の周囲の、またはそれに接触している大気(例えば、空気)に二酸化炭素を加えることにより容易に二酸化炭素を供給できる。他の利益は移動の容易さである。液相フォトバイオリアクターは、池(完全に不動である)またはかさのあるタンクまたは管の集合体である可能性がある。対照的に、種々の実施形態において、フォトバイオリアクターは平らで柔軟性であり、それによりそれまたはその多くを積み重ねる、巻き上げる、折りたたむ、および/または類似の方法で形成されて比較的容易に移動することができる。種々の実施形態において、フォトバイオリアクターはシステムから吊り下げられるように形成されることができ、それによりある場所から他の場所へフォトバイオリアクターの1以上のを容易に運送することが可能になる。この移動しやすさは、多数のフォトバイオリアクターの連続式での効率的な取り扱いおよび処理方法を工業規模で可能にするために利用することができる。
【0046】
本願の一側面は、光合成微生物による発酵性糖供給原料の生産方法に関する。好ましくは、発酵性糖は発酵性二糖である。発酵性二糖の例は、限定するものではないが、スクロースおよびトレハロースを含む。発酵性糖は、一般に光合成微生物に利用されない二糖であることができる。例えば、トレハロースは、シアノバクテリアに一般に利用されず、従って、内因性代謝経路による実質的分解を受けずに、培養したバイオマス中に蓄積されることができる。発酵性糖は、光合成微生物に一般に利用される二糖であることができる。一次エネルギー源として用いられない二糖に関しては、内因性代謝経路の存在下であっても、多くの場合、二糖は十分な濃度まで蓄積されることができる。内因性分解経路が標的発酵性糖に特異的な場合、このような活性を低下させるかまたは除去するために光合成微生物を操作することができる。例えば、スクロースを蓄積するように操作されたシアノバクテリアは、スクロースインベルターゼ活性を低下させるかまたは除去するためにさらに操作されることができる。種々の実施形態において、浸透圧またはマトリックス水ストレスに応じて発酵性二糖を合成する光合成微生物株を用いることができる。他の実施形態において、浸透圧ストレスの非存在下またはレベル低下において、発酵性二糖を蓄積するように操作された光合成微生物トランスジェニック株がある。好都合には、前述の発酵性二糖合成方法は、本明細書記載のフォトバイオリアクターなしでも行われるように適合させることができる。
【0047】
高等植物と比較して、光合成微生物の増殖は効率がよく、環境影響が少ないので、現行のバイオ燃料製造慣行と比較して、本明細書記載の組成物、装置および方法は、持続可能性において重要な改良を提示する。
【0048】
光合成微生物
本明細書において、二糖を蓄積するように遺伝子操作された光合成微生物が提供される。光合成微生物は、例えば、シアノバクテリアなどの天然光合成微生物であることもでき、人工光合成細菌などの操作された光合成微生物であることもできる。蓄積された二糖の例は、限定するものではないが、スクロース、トレハロース、グルコシルグリセロールおよびマンノシルフルクトースを含む。種々の実施形態において、所望の二糖の蓄積をもたらすために、宿主光合成微生物(例えば、シアノバクテリア)において、対応するリン酸化モノマーからの所望の二糖の生産に関与するタンパク質(単数または複数)をコードする1以上の遺伝子が操作される。いくつかの実施形態において、二糖を蓄積させるために、宿主光合成微生物の内因性経路が操作される。例えば、シアノバクテリアにおける浸透圧スクロース経路は、浸透圧ストレスの非存在下でスクロースを蓄積するように操作されることができる。いくつかの実施形態において、二糖を蓄積させるために、シアノバクテリアにおける外因性二糖経路が操作される。例えば、大腸菌(E.coli)由来の浸透圧トレハロース経路は、シアノバクテリアにおいてトレハロースを蓄積するように操作されることができる。
【0049】
シンターゼおよびホスファターゼ
所望の二糖に対するシンターゼ活性およびホスファターゼ活性を有するように光合成微生物を形質転換することができる。例えば、シアノバクテリアは、スクロースリン酸シンターゼ活性およびスクロースリン酸ホスファターゼ活性を有するように操作されることができる。他の例として、シアノバクテリアは、トレハロースリン酸シンターゼ活性およびトレハロースリン酸ホスファターゼ活性を有するように操作されることができる。他の例として、シアノバクテリアは、グルコシルグリセロールリン酸シンターゼ活性およびグルコシルグリセロールリン酸ホスファターゼ活性を有するように操作されることができる。他の例として、シアノバクテリアは、マンノシルフルクトースリン酸シンターゼ活性およびマンノシルフルクトースリン酸ホスファターゼ活性を有するように操作されることができる。これらの活性は、他の光合成微生物においても同様に操作されることができると考えられる。
【0050】
シンターゼ活性およびホスファターゼ活性は、シンターゼ活性を有するポリペプチドをコードする1つの遺伝子およびホスファターゼ活性を有するポリペプチドをコードするもう1つの遺伝子の各遺伝子を用いて、またはシンターゼ活性およびホスファターゼ活性の両方をコードする1つの遺伝子を用いて光合成微生物に操作されることができる。例えば、シンターゼ活性およびホスファターゼ活性は融合ポリペプチドに存在することができる。
【0051】
所望の二糖の糖モノマーは、光合成微生物にとって内因性であることもでき、外因性であることもできる。所望の二糖の糖モノマーが内因性である場合、光合成微生物は増加したレベルのこのようなモノマーを生産するように操作されることができる。所望の二糖の糖モノマーが外因性である場合、光合成微生物はこのような外因性モノマーを生産するように操作されることができる。
【0052】
光合成微生物は、ある発生状態の後に、あるいはその様に誘導された後に所望の二糖を継続的に合成し蓄積するように操作されることができる。二糖合成の誘導は、本明細書でさらに詳細に述べるように、コードされるシンターゼおよびホスファターゼと関連する誘導性プロモーターおよび誘導剤の作用に従うことができる。
【0053】
いくつかの実施形態において、本明細書記載の形質転換シアノバクテリアは、1分当たり乾燥バイオマス1グラム当たり二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース)少なくとも約0.1マイクログラムを蓄積することができる。いくつかの実施形態において、形質転換シアノバクテリアは、1分当たり乾燥バイオマス1グラム当たり二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース)少なくとも約0.1から最大約10マイクログラムまでを蓄積することができる。例えば、形質転換シアノバクテリアは、1分当たり乾燥バイオマス1グラム当たり少なくとも約0.2、少なくとも約0.3、少なくとも約0.4、少なくとも約0.5、少なくとも約0.6、少なくとも約0.7、少なくとも約0.8または少なくとも約0.9マイクログラムの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース)を蓄積することができる。他の実施形態において、種々の形質転換光合成微生物は、同様な量の二糖を蓄積する。
【0054】
種々の実施形態は、上記の所定の範囲の値で二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース)を蓄積すると考えられる。例えば、一部の形質転換シアノバクテリアは、1分当たり乾燥バイオマス1グラム当たり少なくとも約0.1から最大約0.9マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);1分当たり乾燥バイオマス1グラム当たり少なくとも約0.1から最大約0.8マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);1分当たり乾燥バイオマス1グラム当たり少なくとも約0.1から最大約0.7マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);などを蓄積することができる。同様に、一部の形質転換シアノバクテリアは、1分当たり乾燥バイオマス1グラム当たり少なくとも約0.2から最大約1.0マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);1分当たり乾燥バイオマス1グラム当たり少なくとも約0.3から最大約1.0マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);1分当たり乾燥バイオマス1グラム当たり少なくとも約0.4から最大約1.0マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);1分当たり乾燥バイオマス1グラム当たり少なくとも約0.5から最大約1.0マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);1分当たり乾燥バイオマス1グラム当たり少なくとも約0.6から最大約1.0マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);1分当たり乾燥バイオマス1グラム当たり少なくとも約0.7から最大約1.0マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);1分当たり乾燥バイオマス1グラム当たり少なくとも約0.8から最大約1.0マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);または1分当たり乾燥バイオマス1グラム当たり少なくとも約0.9から最大約1.0マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース)を蓄積することができる。宿主細胞における糖蓄積のアッセイ方法は当業者に公知である(例えば、実施例10参照)。
【0055】
宿主
二糖を蓄積するように遺伝子操作された宿主は、任意の光合成微生物であることができる。光合成微生物は、例えば、シアノバクテリアなどの天然光合成微生物であることもでき、人工光合成細菌などの操作された光合成微生物であることもできる。天然光合成微生物であるか、または操作して光合成微生物にすることができる典型的な微生物は、限定するものではないが、細菌;真菌;古細菌;原生生物;微小植物、例えば緑藻;ならびに動物、例えばプランクトン、プラナリアおよびアメーバを含む。天然に存在する光合成微生物の例は、限定するものではないが、スピルリナ・マキシマム、スピルリナ・プラテンシス、ドナリエラ・サリナ、ボトリオコックス・ブラウニイ、クロレラ・ブルガリス、クロレラ・ピレノイドーサ、セレナストルム・カプリコミュータム、セネデスムス・クアドリカウダ、ポルフィリディウム・クルエンタム、セネデスムス・アクタス、ドナリエラ種、セネデスムス・オブリカス、アナベノプシス、アウロシラ、キリンドロスペルムム、シネコッカス(Synechoccus)種、シネコシスチス種および/またはトリポスリックスを含む。
【0056】
好ましくは、宿主光合成微生物はシアノバクテリアである。シアノバクテリア、別名藍藻は幅広い酸素発生型光合成独立栄養生物である。宿主シアノバクテリアは、藍色植物門(Cyanophyta)由来の任意の光合成微生物であることができる。宿主シアノバクテリアは、単細胞形態を有することもできるし、コロニー形態(例えば、フィラメント、シートまたはボール)を有することもできる。好ましくは、宿主シアノバクテリアは単細胞シアノバクテリアである。二糖を蓄積するように操作されることができるシアノバクテリアの例は、限定するものではないが、シネコシスチス、シネココッカス、サーモシネココッカス(Thermosynechococcus)、ノストック(Nostoc)、プロクロロコッカス(Prochlorococcu)、ミクロシスティス(Microcystis)、アナベナ(Anabaena)、スピルリナ(Spirulina)およびグロエオバクター(Gloeobacter)属を含む。好ましくは、宿主シアノバクテリアはシネコシスチス種またはシネココッカス種である。より好ましくは、宿主シアノバクテリアはシネココッカス・エロンガタスPCC 7942(ATCC33912)および/またはシネコシスチス種PCC 6803(ATCC27184)である。
【0057】
スクロース
光合成微生物、例えばシアノバクテリアにおけるスクロースの生合成は、順次に作用するスクロースリン酸シンターゼ(sps)およびスクロースリン酸ホスファターゼ(spp)の2つの酵素活性の触媒作用によって達成できる(例えば、図4参照)。このよう活性は、浸透圧およびマトリックス水ストレスに対する順応としてシアノバクテリアの一部に存在する(例えば、Lunn, J. E. 2002. Plant Physiol 128, 1490-1500)。スクロースが蓄積されるように、これらの活性の一方または両方をシアノバクテリアに操作することができる。
【0058】
スクロースを蓄積するように光合成微生物を操作するための特に興味がある遺伝子は、シネココッカス・エロンガタスPCC 7942からの活性融合SPS/SPP(asf)遺伝子である。asfは、spsおよびsppの両方の生合成機能を有する(例えば、実施例4)。いくつかの実施形態において、ASFをコードするヌクレオチド配列がその天然供給源(例えば、シネココッカス・エロンガタスPCC 7942)からクローニングされ、宿主シアノバクテリアに挿入される(例えば、実施例4〜9参照)。いくつかの実施形態において、形質転換宿主光合成微生物は、配列番号1のasfポリヌクレオチドを含む。いくつかの実施形態において、光合成微生物は配列番号2のポリペプチドをコードするヌクレオチド配列asfで形質転換される。さらなる実施形態において、形質転換宿主光合成微生物は、配列番号1に対して少なくとも約80%の配列同一性を有するヌクレオチド配列または、spsおよびspp活性を有し、配列番号2に対して少なくとも約80%の配列同一性を有するポリペプチドをコードするヌクレオチド配列を含む。例として、シアノバクテリアなどの形質転換宿主光合成微生物は、配列番号1に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するヌクレオチド配列であって、その形質転換宿主がASF、SPSおよび/もしくはSPP活性ならびに/またはスクロースの蓄積を示す前記ヌクレオチド配列を含むことができる。例として、形質転換宿主光合成微生物は、配列番号2に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がASF、SPSおよび/もしくはSPP活性ならびに/またはスクロースの蓄積を示す前記ヌクレオチド配列を含むことができる。他の例として、形質転換宿主光合成微生物は、配列番号1に対してストリンジェントな条件下で配列番号1の全長にわたってハイブリダイズし、活性融合SPS/SPP(ASF)ポリペプチドをコードするヌクレオチド配列を含むことができる。さらなる例として、形質転換宿主光合成微生物は、上記配列のいずれかに対する相補鎖を含むことができる。
【0059】
いくつかの実施形態において、スクロースリン酸シンターゼ(sps)(例えば、sps遺伝子をコードする配列番号3およびSPSポリペプチドをコードする配列番号4参照)またはそのホモログが、形質転換光合成微生物において発現されるかまたは過剰発現されるように操作される。例えば、光合成微生物は、スクロースリン酸シンターゼを発現するように、配列番号3の配列を有するヌクレオチドで形質転換されることができる。他の例として、光合成微生物は、スクロースリン酸シンターゼを有するポリペプチドをコードする配列番号3に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の同一性パーセントを有するヌクレオチドで形質転換されることができる。他の例として、形質転換宿主光合成微生物は、配列番号4に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がSPS活性および/またはスクロースの蓄積を示す前記ヌクレオチド配列を含むことができる。
【0060】
いくつかの実施形態において、スクロースリン酸ホスファターゼ(spp)(例えば、spp遺伝子をコードする配列番号5およびSPPポリペプチドをコードする配列番号6を参照のこと)またはそのホモログが、形質転換光合成微生物において発現されるかまたは過剰発現されるように操作される。例えば、シアノバクテリアなどの光合成微生物は、スクロースリン酸ホスファターゼを発現するように、配列番号5の配列を有するヌクレオチドで形質転換されることができる。他の例として、光合成微生物は、スクロースリン酸ホスファターゼ活性を有するポリペプチドをコードする配列番号5に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%同一性パーセントを有するヌクレオチドで形質転換されることができる。他の例として、形質転換宿主光合成微生物は、配列番号6に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がSPP活性および/またはスクロースの蓄積を示す前記ヌクレオチド配列を含むことができる。
【0061】
いくつかの実施形態において、光合成微生物はASF、SPS、および/またはSPPの1以上を発現するように操作される。例えば、シアノバクテリアなどの光合成微生物は、ASFおよびSPS;ASFおよびSPP;SPSおよびSPP;またはASF、SPSおよびSPPを発現するように操作されることができる。
【0062】
トレハロース
トレハロースの生合成は、順次に作用するトレハロースリン酸シンターゼ(tps)およびトレハロースリン酸ホスファターゼ(tpp)の2つの酵素活性の触媒作用により達成できる。光合成微生物において、トレハロースが蓄積されるように、これらの活性の一方または両方が操作されることができる。トレハロースの生合成は、シアノバクテリアなどの一部の光合成微生物においては天然に生じない。
【0063】
いくつかの実施形態において、トレハロースリン酸シンターゼ(tps)(例えば、tps遺伝子をコードする配列番号76およびTPSポリペプチドをコードする配列番号77を参照のこと)またはそのホモログが、形質転換光合成微生物において発現されるかまたは過剰発現されるように操作される。例えば、シアノバクテリアなどの光合成微生物は、トレハロースリン酸シンターゼを発現するように、配列番号76の配列を有するヌクレオチドで形質転換されることができる。他の例として、光合成微生物は、トレハロースリン酸シンターゼを有するポリペプチドをコードする配列番号76に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の同一性パーセントを有するヌクレオチドで形質転換されることができる。他の例として、形質転換宿主光合成微生物は、配列番号77に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がTPS活性および/またはトレハロースの蓄積を示す前記ヌクレオチド配列を含むことができる。
【0064】
いくつかの実施形態において、トレハロースリン酸ホスファターゼ(tpp)(例えば、tpp遺伝子をコードする配列番号78およびTPPポリペプチドをコードする配列番号79を参照のこと)またはそのホモログが操作され、形質転換光合成微生物において発現されるかまたは過剰発現される。例えば、シアノバクテリアなどの光合成微生物は、トレハロースリン酸ホスファターゼを発現するように、配列番号78の配列を有するヌクレオチドで形質転換されることができる。他の例として、光合成微生物は、トレハロースリン酸ホスファターゼ活性を有するポリペプチドをコードする配列番号78に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の同一性パーセントを有するヌクレオチドで形質転換されることができる。他の例として、形質転換宿主光合成微生物は、配列番号79に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がTPP活性および/またはトレハロースの蓄積を示す前記ヌクレオチド配列を含むことができる。
【0065】
グルコシルグリセロール
いくつかの実施形態において、グルコシルグリセロールリン酸シンターゼ(gps)(例えば、gps遺伝子をコードする配列番号80およびGPSポリペプチドをコードする配列番号81を参照のこと)またはそのホモログが、形質転換光合成微生物において発現されるかまたは過剰発現されるように操作される。例えば、シアノバクテリアなどの光合成微生物は、グルコシルグリセロールリン酸シンターゼを発現するように、配列番号80の配列を有するヌクレオチドで形質転換されることができる。他の例として、光合成微生物は、グルコシルグリセロールリン酸シンターゼを有するポリペプチドをコードする配列番号80に対して、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%同一性パーセントを有するヌクレオチドで形質転換されることができる。他の例として、形質転換宿主光合成微生物は、配列番号81に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がGPS活性および/またはグルコシルグリセロールの蓄積を示す前記ヌクレオチド配列を含むことができる。
【0066】
いくつかの実施形態において、グルコシルグリセロールリン酸ホスファターゼ(gpp)(例えば、gpp遺伝子をコードする配列番号82およびGPPポリペプチドをコードする配列番号83を参照のこと)またはそのホモログが、形質転換光合成微生物において発現されるかまたは過剰発現されるように操作される。例えば、シアノバクテリアなどの光合成微生物は、グルコシルグリセロールリン酸ホスファターゼを発現するように、配列番号82の配列を有するヌクレオチドで形質転換されることができる。他の例として、光合成微生物は、グルコシルグリセロールリン酸ホスファターゼ活性を有するポリペプチドをコードする配列番号82に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%同一性パーセントを有するヌクレオチドで形質転換されることができる。他の例として、形質転換宿主光合成微生物は、配列番号83に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がGPP活性および/またはグルコシルグリセロールの蓄積を示す前記ヌクレオチド配列を含むことができる。
【0067】
マンノシルフルクトース
いくつかの実施形態において、マンノシルフルクトースリン酸シンターゼ(mps)(例えば、mps遺伝子をコードする配列番号84およびMPSポリペプチドをコードする配列番号85を参照のこと)またはそのホモログが、形質転換光合成微生物において発現されるかまたは過剰発現されるように操作される。例えば、シアノバクテリアなどの光合成微生物は、マンノシルフルクトースリン酸シンターゼを発現するように、配列番号84の配列を有するヌクレオチドで形質転換されることができる。他の例として、光合成微生物は、マンノシルフルクトースリン酸シンターゼを有するポリペプチドをコードする配列番号84に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の同一性パーセントを有するヌクレオチドで形質転換されることができる。他の例として、形質転換宿主光合成微生物は、配列番号85に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がMPS活性および/またはマンノシルフルクトースの蓄積を示す前記ヌクレオチド配列を含むことができる。
【0068】
いくつかの実施形態において、マンノシルフルクトースリン酸ホスファターゼ(mpp)(例えば、mpp遺伝子をコードする配列番号86およびMPPポリペプチドをコードする配列番号87を参照のこと)またはそのホモログが、形質転換光合成微生物において発現されるかまたは過剰発現されるように操作される。例えば、シアノバクテリアなどの光合成微生物は、マンノシルフルクトースリン酸ホスファターゼを発現するように、配列番号86の配列を有するヌクレオチドで形質転換されることができる。他の例として、光合成微生物は、マンノシルフルクトースリン酸ホスファターゼ活性を有するポリペプチドをコードする配列番号86に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%同一性パーセントを有するヌクレオチドで形質転換されることができる。他の例として、形質転換宿主光合成微生物は、配列番号87に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がMPP活性および/またはマンノシルフルクトースの蓄積を示す前記ヌクレオチド配列を含むことができる。
【0069】
分子工学
バリアントヌクレオチドの設計、作成および試験ならびに、asf配列に対する上記の所望される同一性パーセントを有し、発現タンパク質の所望される活性および/または糖蓄積表現型を保持する、バリアントヌクレオチドによりコードされるポリペプチドは、当業者の技術の範囲内である。例えば、進化分子工学(directed evolution)および変異体の迅速な単離は、限定するものではないが、Link et al. (2007) Nature Reviews 5(9), 680-688; Sanger et al. (1991) Gene 97(1), 119-123; Ghadessy et al. (2001) Proc Natl Acad Sci USA 98(8) 4552-4557を含む参考文献に記載されている方法に従うことができる。このように、当業者は、例えば本明細書記載の参照配列に対して少なくとも95〜99%の同一性を有する多数のヌクレオチド(例えば、asf、sps、spp、tps、tpp、gps、gpp、mps、もしくはmpp)および/またはポリペプチド(例えば、ASF、SPS、SPP、TPS、TPP、GPS、GPP、MPSもしくはMPP)バリアントを作成し、当該技術分野でルーチンな方法に従って、二糖蓄積を含む表現型に関してこれらをスクリーニングすることができる。一般に、所望される活性が保持される限りは、任意の位置で同類置換を行うことができる。
【0070】
ヌクレオチドおよび/またはアミノ酸配列の同一性パーセント(%)は、2つの配列がアラインメントされるとき、参照配列と比較して、候補配列におけるヌクレオチドまたはアミノ酸残基と同一なヌクレオチドまたはアミノ酸残基の百分率として理解される。同一性パーセントを決定するために、配列をアラインメントし、必要に応じてギャップを挿入して最大配列同一性パーセントを得る。同一性パーセントを決定するための配列のアラインメント手順は当業者に公知である。多くの場合、配列をアラインメントするために、BLAST、BLAST2、ALIGN2またはMegalign(DNASTAR)ソフトウェアなどの公表されているコンピュータソフトウェアが用いられる。当業者は、比較される配列の完全長に関する最大アラインメントを得るために必要な任意のアルゴリズムを含む、アラインメントを測定するための適切なパラメータを決定することができる。配列がアラインメントされる場合、所定の配列Bへの、との、またはに対する所定の配列Aの配列同一性パーセント(所定の配列Bへの、との、またはに対して特定の配列同一性パーセントを有するまたは含む所定の配列Aと言い換えることもできる)は、以下で算出できる:
配列同一性パーセント=X/Y100
(式中、Xは、AとBとの、配列のアラインメントプログラムまたはアルゴリズムのアラインメントにより一致としてスコアされる残基数であり、YはBにおける残基総数である)。配列Aの長さが配列Bの長さと等しくない場合、Bに対するAの配列同一性パーセントは、Aに対するBの配列同一性パーセントとは等しくない。
【0071】
“高ストリンジェントなハイブリダイゼーション条件”は、6X SSC緩衝液(すなわち、0.9M塩化ナトリウムおよび0.09Mクエン酸ナトリウム)における65℃でのハイブリダイゼーションと定義される。これらの条件が与えられれば、2つの配列間の二本鎖DNAの融解温度(Tm)を算出することにより、所定の配列の組がハイブリダイズするかどうかについて決定できる。特定の二本鎖が、6X SSCの塩条件下で65℃よりも低い融解温度を有する場合、これらの2つの配列はハイブリダイズしない。他方では、同じ塩条件下で融解温度が65℃より上の場合、これらの配列はハイブリダイズする。一般に、任意のハイブリダイズしたDNA:DNA配列の融解温度は、次式:
Tm=81.5℃+16.6(log10[Na+])+0.41(G/C含量分数)-0.63(%ホルムアミド)-(600/l)
を用いて決定できる。さらにまた、DNA:DNAハイブリッドのTmは、ヌクレオチドの同一性が1%減少するごとに1〜1.5℃減少する(例えば、Sambrook and Russel, 2006 を参照のこと)。
【0072】
宿主細胞は、当業者に公知の種々の標準法を用いて形質転換されることができる(例えば、Sambrook and Russel (2006) Condensed Protocols from Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, ISBN-10: 0879697717; Ausubel et al. (2002) Short Protocols in Molecular Biology, 5th ed., Current Protocols, ISBN-10: 0471250929; Sambrook and Russel (2001) Molecular Cloning: A Laboratory Manual, 3d ed., Cold Spring Harbor Laboratory Press, ISBN-10: 0879695773; Elhai, J. and Wolk, C. P. 1988. Methods in Enzymology 167, 747-754 を参照のこと)。このような技術は、限定するものではないが、ウイルス感染、リン酸カルシウムトランスフェクション、リポソーム媒介トランスフェクション、マイクロプロジェクタイル送達、受容体媒介性取り込み、細胞融合、エレクトロポレーションなどを含む。トランスフェクトされた細胞を選択し、増殖させて、宿主細胞ゲノムに安定に組み込まれた発現ベクターを含む組換え宿主細胞を得ることができる。
【0073】
プロモーター
上記したヌクレオチド配列(例えば、asf、sps、spp、tps、tpp、mps、mpp、gps、gpp)の1以上は、宿主光合成微生物において機能しうるプロモーターに作動可能に連結されることができる。宿主がシアノバクテリアの場合、プロモーターは、シアノバクテリアおよび細菌(大腸菌など)の両方において効率的に機能しうることが好ましい。プロモーターの選択により、種々の条件下で所望の遺伝子産物を発現させることが可能になる。
【0074】
プロモーターは、ベクター構築物が挿入されるシアノバクテリアなどの光合成微生物宿主細胞において最適の機能を発揮するように選択されることができる。プロモーターは、その制御的特徴に基づいて選択されることもできる。このような特徴の例は、転写活性および誘導能の増強を含む。
【0075】
プロモーターは、誘導性プロモーターであることができる。例えば、プロモーターは、温度、pH、ホルモン、代謝物(例えば、ラクトース、マンニトールおよびアミノ酸)、光(例えば、波長特異的)、浸透ポテンシャル(例えば、塩誘導)、重金属または抗生物質によって誘導されることができる。多数の標準的誘導性プロモーターが当業者に公知であろう。
【0076】
いくつかの実施形態において、プロモーターは温度誘導性プロモーターである。例えば、λプロモーターは、シアノバクテリアにおいて機能しうる温度誘導性プロモーターである。驚くべきことに、λプロモーターは、大腸菌内で用いられるときとは異なる温度で機能する。大腸菌内では、λプロモーターは42℃において最も活性が高く、これはシアノバクテリアの通常の生存範囲以上の温度である。一般に、大腸菌内で、λプロモーターは、約30℃から35℃までで約5%〜10%の発現増加をしめし、約37℃においては約20%発現増加を示すが;約37℃から42℃までで約100%の発現増加を示す。シアノバクテリアにおいては、λプロモーターはおよそ30℃〜35℃で最も活性が高く、これはシアノバクテリアの理想的な増殖温度範囲であり、大腸菌内でのλプロモーターの最適発現よりもずっと低い範囲である。従って、λプロモーターは、シアノバクテリアにおいて二糖生合成活性の効果的な発現を提供する。
【0077】
プラスミドに挿入されることができるプロモーターの例は、限定するものではないが、carB、nirA、psbAII、dnaK、kaiAおよびλPRを含む(例えば、実施例6参照)。いくつかの実施形態において、プロモーターは、シアノバクテリアおよび大腸菌の両方において効率的に機能しうる。いくつかの実施形態において、asfコード領域は、前記コード領域を含むプロモーターを含む(例えば、実施例8参照)。例えば、asfコード領域は、asfのSPPドメインの前にプロモーターを含むことができる(例えば、図10参照)。このような内部プロモーターは、asfコード領域の開始部位でのプロモーターの有り無しで存在しうる。
【0078】
用語"キメラ"は、2以上の異なるポリヌクレオチド分子の部分の融合の産物を指すものと解される。"キメラプロモーター"は、既知のプロモーターまたは他のポリヌクレオチド分子の操作により製造されるプロモーターを指すものと解される。このようなキメラプロモーターは、例えば、第1プロモーターからの異種エンハンサードメインを、それ自身の部分的または完全な調節因子を有する第2プロモーターと融合させることにより、1以上のプロモーターまたは調節因子からの、遺伝子発現を付与または調節できるエンハンサードメインを結合することができる。従って、作動可能に連結されたポリヌクレオチド配列の発現を調節するための、本明細書に開示された方法によるキメラプロモーターの設計、構築および使用は本発明に含まれる。
【0079】
多くの方法によって、新規キメラプロモーターを設計することもできるし、操作することもできる。例えば、キメラプロモーターは、第1プロモーターからのエンハンサードメインを第2プロモーターに融合することにより製造できる。得られたキメラプロモーターは、第1または第2プロモーターに対して新規な発現特性を有することができる。新規キメラプロモーターは、第1プロモーターからのエンハンサードメインが、第2プロモーターに対して5’末端部位、3’末端部位または任意の内部位置で融合されるように構築されることができる。
【0080】
構築物
前述の転写可能なポリヌクレオチド分子配列のいずれも構築物で提供できる。本発明の構築物は、一般に、二糖生合成のための、転写可能なポリヌクレオチド分子に作動可能に連結された、シアノバクテリアなどの宿主光合成微生物におけるプロモーター配列(例えば、asf、sps、spp、tps、tpp、mps、mpp、gps、gpp)、例えば配列番号1、3、5、76、78、80、82、84および86ならびに上記のようなそれらのバリアントを含む。
【0081】
典型的なプロモーターは上述した。1以上のさらなるプロモーターもまた組換え構築物で提供できる。これらのプロモーターは、前述の転写可能なポリヌクレオチド分子配列のいずれかに作動可能に連結されることができる。
【0082】
用語"構築物"は、任意の供給源由来の、ゲノム組み込みまたは自律複製できる、1以上のポリヌクレオチド分子が機能的に連結された、すなわち作動可能に連結されたポリヌクレオチド分子を含む任意の組換えポリヌクレオチド分子、例えばプラスミド、コスミド、ウイルス、自律的に複製するポリヌクレオチド分子、ファージまたは線状もしくは環状の一本鎖もしくは二本鎖のDNAもしくはRNAポリヌクレオチド分子を指すものと解される。用語"ベクター"または"ベクター構築物"は、形質転換、すなわちシアノバクテリアなどの宿主光合成微生物への異種DNA導入の目的で使用できる任意の組換えポリヌクレオチド構築物を指すものと解される。
【0083】
さらに、構築物は、限定するものではないが、目的とする遺伝子の非翻訳領域からのさらなるポリヌクレオチド分子を含むことができる。これらのさらなるポリヌクレオチド分子は、構築物に存在する他の配列に対して天然または異種の供給源由来であることができる。
【0084】
プラスミド
いくつかの実施形態において、シアノバクテリアなどの宿主光合成微生物は、プラスミドベースの発現系で形質転換される(例えば、実施例5参照)。好ましくは、目的とする遺伝子をコードするプラスミドは、プロモーター、例えば上記のプロモーターの1以上を含む。プラスミドベースの形質転換については、大腸菌およびシアノバクテリアに両方において機能しうる広い宿主域のプラスミドが好ましく、それらは、よく理解された急速に増殖する便利な系(大腸菌)で働き、最終宿主(シアノバクテリア)に効率的に導入されることができる利点を提供する。いくつかの実施形態において、プラスミドベースの形質転換および染色体組み込みは組み合わせて用いられる。ここでは、遺伝子バリアントの設計および試験のためにプラスミドプロトコルが用いられ、次に、同定されたバリアントの染色体組み込みが行われる。
【0085】
本明細書記載のアプローチに従って開発された宿主株は、当該技術分野で公知の多くの手段で評価できる(例えば、Studier (2005) Protein Expr Purif. 41(1), 207-234; Gellissen, ed. (2005) Production of Recombinant Proteins: Novel Microbial and Eukaryotic Expression Systems, Wiley-VCH, ISBN-10: 3527310363; Baneyx (2004) Protein Expression Technologies, Taylor & Francis, ISBN-10: 0954523253 を参照のこと)。
【0086】
本明細書において、sps、sppおよび/またはasfをコードするプラスミド構築物のためのヌクレオチド配列が提供される。sps、sppおよび/またはasfをコードするプラスミド構築物の例は、限定するものではないが、pLybAL11(配列番号19)(例えば、図6参照)およびpLybAL12(配列番号20)(例えば、図7参照)を含む。本明細書において、tpsおよびtppをコードするプラスミド構築物のためのヌクレオチド配列もまた提供される。tpsおよびtppをコードするプラスミド構築物の例は、限定するものではないが、pLybAL23(配列番号118)を含む。グルコシルグリセロールおよびマンノシルフルクトースなどの他の二糖の蓄積に必要な生合成遺伝子のための同様な構築物を作成できることは、当業者には明らかであろう。
【0087】
いくつかの実施形態において、形質転換宿主光合成微生物は、pLybAL11(配列番号19)またはpLybAL12(配列番号20)を含む。いくつかの実施形態において、形質転換宿主光合成微生物はpLybAL23(配列番号118)を含む。例えば、形質転換シアノバクテリアは、pLybAL11(配列番号19)、pLybAL12(配列番号20)またはpLybAL23(配列番号118)を含むことができる。
【0088】
二糖生合成遺伝子(単数または複数)を含むプラスミド構築物は、プロモーターを含むこともできる。プラスミド構築物の例は、sps、sppおよび/またはasfを含み、プロモーターは、限定するものではないが、pLybAL7f(配列番号65);pLybAL8f(カナマイシン耐性を含む)(配列番号69);pLybAL13f(配列番号51)、pLyAL13r(配列番号52)、pLybAL14f(配列番号53)、pLybAL14r(配列番号54)、pLybAL15(配列番号44)、pLybAL16(配列番号45)、pLybAL17(配列番号46)、pLybAL18(配列番号47)、pLybAL19(配列番号48)、pLybAL21(配列番号49)およびpLybAL22(配列番号50)を含む。プラスミド構築物の例は、tpsおよびtppを含み、プロモーターは、限定するものではないが、pLybAL23(配列番号118)、pLybAL28(配列番号121)、pLybAL29(配列番号122)およびpLybAL30(配列番号123)を含む。グルコシルグリセロールおよびマンノシルフルクトースなどの他の二糖の蓄積に必要な、同様なプロモーターを含む生合成遺伝子のための構築物を作成できることは、当業者には明らかであろう。
【0089】
いくつかの実施形態において、形質転換宿主シアノバクテリアは、pLybAL7f(配列番号65);pLybAL8f(配列番号69);pLybAL13f(配列番号51)、pLyAL13r(配列番号52)、pLybAL14f(配列番号53)、pLybAL14r(配列番号54)、pLybAL15(配列番号44)、pLybAL16(配列番号45)、pLybAL17(配列番号46)、pLybAL18(配列番号47)、pLybAL19(配列番号48)、pLybAL21(配列番号49)およびpLybAL22(配列番号50)を含む。いくつかの実施形態において、形質転換宿主シアノバクテリアは、pLybAL28(配列番号121)、pLybAL29(配列番号122)、pLybAL30(配列番号123)およびpLybAL23(配列番号118)を含む。
【0090】
糖分泌
種々の実施形態において、形質転換二糖蓄積光合成微生物は、蓄積された二糖を細胞内からその増殖環境に分泌することができる。二糖の分泌は、二糖を蓄積するように形質転換した光合成微生物の固有の結果であることもできるし、光合成微生物は分泌するするようにさらに操作されることもできる。例えば、トレハロースを蓄積するように形質転換されたいくつかのシアノバクテリアは、本来細胞からトレハロースを分泌する。(例えば、実施例19〜20参照)。他の例として、スクロースを蓄積するように形質転換されたシアノバクテリアは、細胞からスクロースを分泌するようにさらに操作されることができる(例えば、実施例16参照)。
【0091】
シアノバクテリアなどの宿主光合成微生物は、二糖を分泌するようにさらに操作されることができる。いくつかの実施形態において、形質転換宿主光合成微生物は、操作されて、蓄積された二糖に特異的なポリンを発現する。例えば、スクロースを蓄積するように操作されたシアノバクテリアは、スクロースポリンを発現するように操作されることができる(例えば、実施例16参照)。一実施形態において、形質転換二糖蓄積シアノバクテリアは、配列番号94などのscrY核酸を含む。一実施形態において、形質転換二糖蓄積シアノバクテリアは、配列番号95などのscrYポリペプチドをコードする核酸を含む。一実施形態において、形質転換二糖蓄積シアノバクテリアは、pLybAL32(配列番号91)などのscrYを含むプラスミドを含む。他の光合成微生物または他の標的二糖に、同様なアプローチを適用できることが考えられる。
【0092】
糖分解の調節
いくつかの実施形態において、シアノバクテリアなどの宿主光合成微生物は、分解活性の調節により二糖の生産が改善されるようにさらに操作される(例えば、実施例14参照)。いくつかの実施形態において、形質転換光合成微生物において、インベルターゼホモログはダウンレギュレートされるかまたは除去されることができる。例えば、シネコシスチス種PCC 6803(ヌクレオチド配列配列番号70;ポリペプチド配列配列番号71)からのインベルターゼホモログは、形質転換シアノバクテリアにおいてダウンレギュレートされるかまたは除去されることができる。他の例として、シネココッカス・エロンガタスPCC 7942(ヌクレオチド配列配列番号72;ポリペプチド配列配列番号73)からのインベルターゼホモログは、形質転換シアノバクテリアにおいてダウンレギュレートされるか除去されることができる。いくつかの実施形態において、スクラーゼフェレドキシン様タンパク質は、形質転換シアノバクテリアにおいてダウンレギュレートされるかまたは除去されることができる。例えば、シネコシスチス種PCC 6803からのスクラーゼフェレドキシン様タンパク質(ヌクレオチド配列配列番号74;ポリペプチド配列配列番号75)(Machray G.C. et al. 1994. FEBS Lett 354, 123-127)は、形質転換シアノバクテリアにおいて、ダウンレギュレートされるかまたは除去されることができる。これらの遺伝子は、例えば、図11(例えば、実施例12〜13参照)に記載のマーカーレス欠失プロトコルを用いて欠失させることができる。シアノバクテリアにおいて、他の二糖が蓄積されるように操作される同様なアプローチを用いることができる。
【0093】
上記の遺伝子のダウンレギュレーションまたはサイレンシングの他の方法は当該技術分野で公知である。例えば、二糖分解活性は、アンチセンスオリゴヌクレオチド、タンパク質アプタマー、ヌクレオチドアプタマーおよびRNA干渉(RNAi)によりダウンレギュレートされるかまたは除去されることができる(例えば、低分子干渉RNA(siRNA)、短いヘアピンRNA(shRNA)およびマイクロRNA(miRNA)(例えば、Fanning and Symonds (2006) Handb Exp Pharmacol. 173, 289-303G(ハンマーヘッド型リボザイムおよび低分子ヘアピン型RNAを記載); Helene, C., et al. (1992) Ann. N.Y. Acad. Sci. 660, 27-36; Maher (1992) Bioassays 14(12): 807-15(デオキシリボヌクレオチド配列のターゲッティングを記載);Lee et al. (2006) Curr Opin Chem Biol. 10, 1-8(アプタマーを記載); Reynolds et al. (2004) Nature Biotechnology 22(3), 326 - 330(RNAiを記載); Pushparaj and Melendez (2006) Clinical and Experimental Pharmocology and Physiology 33(5-6), 504-510(RNAiを記載); Dillon et al. (2005) Annual Review of Physiology 67, 147-173(RNAiを記載); Dykxhoorn and Lieberman (2005) Annual Review of Medicine 56, 401-423(RNAiを記載)を参照のこと)。RNAi分子は、種々の供給元から市販されている(例えば,Ambion社(テキサス州);Sigma Aldrich社(ミズーリ州);Invitrogen社)。種々のアルゴリズムを用いるいくつかのsiRNA分子設計プログラムが当業者に公知である(例えば、Cenixアルゴリズム(Ambion社);BLOCK-iT(登録商標)RNAi Designer(Invitrogen社);siRNA Whitehead Institute Design Tools(Bioinofrmatics & Research Computing社)。最適のsiRNA配列を限定するのに影響のある形質は、siRNAの末端におけるG/C含量、siRNAの特定の内部ドメインのTm、siRNAの長さ、CDS(コード領域)内の標的配列の位置および3'オーバーハングのヌクレオチド含量を含む。
【0094】
いくつかの実施形態において、宿主光合成微生物は、細胞からの二糖分泌を促進するようにさらに操作されることができる。例えば、シアノバクテリアは、細胞からのスクロース分泌を促進するようにさらに操作されることができる(例えば、実施例15〜16参照)。低い浸透圧環境においては、スクロースは、高塩環境から低塩環境に移行するとき、一部の微生物により浸透圧保護剤が処理されるように、自動的に細胞から削除されることができる(Schleyer, M., Schmidt, R. and Bakker, E. P. 1993. Arch Microbiol 160, 424-43; Koo, S. P., Higgins, C. F. and Booth, I. R. 1991. J Gen Microbiol 137, 2617-2625; Lamark, T., Styrvold, O. B. and Strgim, A. R. 1992. FEMS Microbiol. Lett 96, 149-154)。スクロースポリンは、形質転換シアノバクテリアにおいて発現されるように操作されることができる(例えば、実施例16参照)。これらの遺伝子をクローニングし、前述の技術に従ってシアノバクテリアを形質転換することができる。このようなアプローチは他の光合成微生物に適用することができる。
【0095】
いくつかの実施形態において、宿主光合成微生物は、宿主の染色体への安定な組み込みで形質転換される。例えば、宿主シアノバクテリアは、宿主の染色体への安定な組み込みで形質転換されることができる(例えば、実施例11〜13参照)。染色体組み込みによって、プラスミドベースの遺伝子発現において時々生じる除去のリスクを冒さないで、標的遺伝子(単数または複数)を微生物に組み込むことが可能になる。染色体組み込みは、標的遺伝子を維持するための抗生物質の必要性を低下させるかまたは除去することもできる。
【0096】
好ましくは、染色体組み込みの戦略は、染色体上のいわゆるupp遺伝子座への遺伝子挿入を標的とする(例えば、実施例11〜13参照)。この部位は、ピリミジン生合成におけるスカベンジャー酵素である酵素ウラシルホスホリボシルトランスフェラーゼ(UPRTase)をコードする。この戦略を用いることにより、非組み込み型微生物を除去できる5-フルオロウラシル(5-FU)による候補選択が可能になる。分離方法は、一般にシアノバクテリア系において用いられる。なぜなら、これらの微生物は、それらの染色体の複数コピーを含むからである(例えば、シネコシスチス種PCC 6803については最大12、シネココッカス・エロンガタスPCC 7942については最大16)。この戦略は、シアノバクテリアにとって特に魅力的である。なぜなら、このアプローチは、分離成功のために選択圧および安定な組み込みに依存する旧来の分離技術の使用を避けることができるからである。スクリーニング剤としての5-FUの使用は、より効率的であることができる。なぜなら、それは、1つの活性upp遺伝子を含む微生物であっても、増殖を阻害できるからである。このように、旧来の技術に必要とされるプロセスと比較して、より少ない世代サイクルで、完全に組み込まれた候補を迅速に選択することができる。
【0097】
固相光合成バイオリアクター
本明細書において、光合成微生物の増殖のための固相培養担体を含む、光合成微生物を培養するためのフォトバイオリアクターが提供される。固相培養担体または固体培養担体または固体担体などは、一般に、液体でもガスでもない培養担体を意味すると解される。担体自体は固体であるが、担体構造物は、それが液体(例えば、増殖培地)、ガスまたは両方を吸収するように選択されることができる。特定の好ましい実施形態において、以下にさらに詳細に説明するように、固体担体は、培養中微生物が使用するための水分を吸収することができる。
【0098】
本明細書記載のフォトバイオリアクター(単数または複数)の種々の実施形態は、光合成微生物の増殖を維持することができる。フォトバイオリアクター中で増殖する光合成微生物は、例えば、シアノバクテリアなどの天然光合成微生物であることもでき、人工光合成細菌などの、操作された光合成微生物であることもできる。天然光合成微生物であるか、または操作されて光合成微生物になることができる典型的な微生物は、限定するものではないが、細菌;真菌;古細菌;原生生物;微小植物、例えば緑藻;ならびに動物、例えばプランクトン、プラナリアおよびアメーバを含む。天然に存在する光合成微生物の例は、限定するものではないが、スピルリナ・マキシマム、スピルリナ・プラテンシス、ドナリエラ・サリナ、ボトリオコックス・ブラウニイ、クロレラ・ブルガリス、クロレラ・ピレノイドーサ、セレナストルム・カプリコミュータム、セネデスムス・クアドリカウダ、ポルフィリディウム・クルエンタム、セネデスムス・アクタス、ドナリエラ種、セネデスムス・オブリカス、アナベノプシス、アウロシラ、キリンドロスペルムム、シネコッカス種、シネコシスチス種および/またはトリポスリックスを含む。
【0099】
好ましくは、バイオリアクターは、前述のように、二糖を蓄積するように形質転換されたシアノバクテリアの接種、増殖、および/または収穫を維持するように構成される。
【0100】
以下にさらに詳細に説明するように、フォトバイオリアクターは開放系であることもできるし、閉鎖系であることもできる。種々の実施形態において、フォトバイオリアクターは、固相培養担体、保護バリア層および吊り下げ要素を含む。フォトバイオリアクターのいくつかの実施形態は、ガス、流体、栄養素、および/または光合成微生物の供給および/または除去のためのシステムを含むことができる。供給システムは、例えば標準的な配管設備であることができる。種々のラインのどれも、クイックコネクト配管設備を含むことができる。フォトバイオリアクターは、例えば、二酸化炭素または通常の大気を供給できるガス供給ラインを備えることができる。フォトバイオリアクターは流体供給ラインを備えることができる。好ましくは、流体供給ラインは、流体(例えば、水)を固相培養担体へ運搬するトリクルシステムまたは滴下システムに接続する。フォトバイオリアクターは、栄養供給ラインを備えることができる。光合成微生物の増殖および維持のための栄養組成物の配合物は、当業者に公知である。いくつかの実施形態において、栄養および流体供給ラインは、例えば流体ベースの栄養混合物を供給するために結合することができる。いくつかの実施形態において、流体供給ラインまたは栄養供給ラインは、液体培地を増殖表面に分配するためのスプレー装置であることができる。このようなスプレー装置においては、フォトバイオリアクターは、例えば外層(バリア層など)と固相培養担体との間にスプレー装置を収納するのに十分な大きさを有する。通例、栄養素は水ベース組成物で供給される。水分および栄養レベルの独立制御を提供するために、異なる水供給ライン(単数または複数)および栄養供給ライン(単数または複数)を提供するのが有利な場合がある。フォトバイオリアクターは、光合成微生物および/または液体懸濁/可溶性産物の回収を提供するための産物収穫ラインを備えることができる。フォトバイオリアクターは、光合成微生物の接種を提供するための接種ラインを備えることができる。いくつかの実施形態において、流体、栄養、および/または接種ラインを結合することができる。
【0101】
固相フォトバイオリアクターの一実施形態は、図1(正面図)および図2(側面図)に示されている。これらの実施形態において、固相培養担体2は保護バリア7によって密閉されている。図2は、固体培養担体が保護バリア7を含む保護バリア層3の間にあることを示している。固体培養担体2は、光合成微生物が培養される表面を提供する。保護バリア7を構成する保護バリア層3は、光合成微生物の増殖を維持するための固体培養担体2の表面に化学線を到達させるために透明である。再シール可能なクロージャー4により、保護バリア7が取り外し可能にシールされることが可能になる。ガスおよび蒸気の交換は、保護バリア7に組み込まれている材料である選択パネル5を介して行われる。フォトバイオリアクター1は、垂直または非水平配向を可能にする支持要素6によって吊り下げられることができる。
【0102】
固相フォトバイオリアクターの他の実施形態を、図12A(正面図)および図12B(側面図)に示す。表面および/または配管の手入れおよび潜在的汚染の最小化に役立つことができるセグメント形式でリアクター1を設計できる。各セグメントは、種々の供給および産物収穫ラインの配管(例えば、クイックコネクト型配管)を介してリアクターに接続することができる。リアクターは、吊り下げ要素6、例えばリアクター1を空間につるし、各セグメントの迅速な手入れを助けるレールによって支えられることができる。外部保護バリア7は、増殖表面2上の光合成を促進する一方で環境汚染および蒸発による水分損失を防ぐ光透過を可能にする透明な材料であることができる。増殖表面2は、水分を保持し、栄養素を供給し、産物を取り除き、および/または光合成微生物の高密度増殖を可能にする材料で構成されることができる。液体培地による表面からの連続フィード/産物収穫を提供する配管により増殖表面2を手入れすることができる。培地管8は、液体が表面2へ染み出る多孔質ホースであることができ、これは重力により増殖表面2を浸透することができる。液体は、リアクター1からの移動のために産物および過剰の液体培地を回収するための収穫管9によってリアクターの底部で収穫することができる。二酸化炭素および空気などのガスは、ガス分散管10によりリアクターに供給できる。ガス供給管10は陽圧環境を提供でき、制御された効率的な方式で増殖に必要なガスを供給することが期待される。ガス供給ライン10は、流入ガス流を加湿することにより、水分損失を最小にするのを助けることもできる。リアクターからの過剰のガスは、ガスの通過が可能であるが、環境汚染を最小化するかまたは除去するための多孔性材料である通気性パネル5(逆側、図示せず)によって排出することができる。供給ライン10によって供給される流入ガスの濾過を通じて、リアクター1の陽圧配置によって汚染が最小化されることが期待される。陽圧はまた、ガス流の内側から外側への経路を提供することによって環境からの汚染を防ぐことができる。
【0103】
図12Bに示す実施形態において、リアクター1の外観が増殖表面に対して1つの配向で示されている。リアクター1から過剰のガスが逃げるのを可能にする通気性パネル5は、増殖表面2を横切ってガスが移動するための経路を提供するために装置の底部の近くに位置することができる。バリア表面7の底部での通気性パネル5の設置はまた、空気に比較して高いその密度から生じる二酸化炭素の分離および蓄積の可能性を最小化または予防する。通気性パネル5の寸法は、培養表面2上の最適の増殖に必要なガス流速に基づいて決定できる。
【0104】
固相培養担体
本明細書記載のフォトバイオリアクターの固相培養担体は、その表面上および/または表面内部で光合成微生物が増殖できる表面を提供する。好ましくは、固相培養担体は、増殖を促進および維持するために、微生物への水分および/または栄養素の提供および/または保持を提供または促進する材料を含む。本発明の実施形態は、培養できる光合成微生物の型または株に限定されない。細胞増殖に望ましい水分量および栄養素の組成物量は、光合成微生物の型または株およびそれが増殖される用途によって異なることは当業者には明らかであろう。光合成微生物の増殖に有害な効果を有する恐れがある材料(またはこれらの材料内または材料上に含まれる物質)は、一般に避けられる。
【0105】
光合成微生物の1つもしくは複数の型または株を培養するために、1つのフォトバイオリアクターを用いることができる。さらにまた、固体培養担体は、培養サイクルの間の滅菌の有り無しで、1つの培養サイクルまたは複数の培養サイクルに適するような材料(単数または複数)を含むことができる。さらにまた、フォトバイオリアクターは、1つのまたは複数の固体担体上で、微生物の1つの型もしくは株または微生物の複数の型もしくは株を培養するように構成されることができる。いくつかの実施形態において、純粋培養の代わりに、種々の光合成微生物の群落または光合成および非光合成微生物の群落を、1つの培養担体上で同時に一緒に増殖させることができる。1つのフォトバイオリアクターはまた、複数の培養担体を含むこともできる。従って、他の実施形態において、1つの保護バリア内の複数の培養担体により、1以上の型または株の光合成微生物を同時に培養することができる。
【0106】
固体培養担体は、好ましくは、比較的多孔性の材料を含む。比較的多孔性の材料は、一般に、増加した表面積を有し、比較的非多孔性の材料よりもより水分を保持するおよび/または吸収することができる。テクスチャ加工のまたはトポグラフィックな表面(単数または複数)を有する固体培養担体もまた好ましい。テクスチャ加工のまたはトポグラフィックな表面は、比較的非テクスチャ加工のまたはなめらかな表面と比較して細胞密度を増強させることができる。担体材料および表面形状の選択は、一般的には、担体への微生物の付着を増加させるように選択されるが、微生物の除去または収穫を妨げないように、微生物があまりきつく付着しないことが一般に望ましい。いくつかの実施形態において、固体培養担体は、微生物の付着および増殖に適した材料を含む。いくつかの実施形態において、固体培養担体は、生物膜形成を低下または除去する材料を含む。
【0107】
本明細書記載のフォトバイオリアクターの固相担体は、当該技術分野で用いられてきた固体担体とは異なると考えられる(例えば、微生物の増殖のために最も一般に用いられる固相担体は寒天である)。寒天は、一般にペトリ皿などの硬質形に注型され、その中でその物理的完全性が維持されるように使用される。なぜなら、寒天は、最小レベルの応力、歪またはその両方を受けるとき、破裂または断裂する傾向があるからである。対照的に、培養担体の種々の実施形態は、十分に丈夫で耐久性があるため、フォトバイオリアクターに用いても、より丈夫で耐久性がある“フレーム”を必要とせずにその物理的完全性を維持することができる。別の言い方をすれば、先行技術は、複合材料が形成されるように、実質的により丈夫で、より耐久性がある材料(例えば、ペトリ皿)と接触した弱い寒天担体の十分な部分を必要とした。従って、フォトバイオリアクターの種々の実施形態の固相担体は、本質的に微生物の培養に適し、十分に丈夫で耐久性がある。
【0108】
固相担体の他の望ましい物理的特性および/または運転パラメータを以下に示す。例えば、担体は、比較的平たく硬質である(プレートのような)こともでき、例えば、ヒンジ、ばね、ワイヤ、糸などによって可撓的に連結された複数の平たく硬質の断片からなることもできる。適切な硬質材料は、限定するものではないが、種々の金属、ポリマー、セラミックスおよびそれらの複合材料を含む。硬質材料は、好ましくは、それに対する光合成微生物の付着を増加させる表面トポグラフィーを有する。さらにまた、硬質材料は、光合成微生物へ水分および/または栄養素を供給する能力を増すために、所望のレベルの多孔性で形成されることができる。さらにまた、硬質材料は、吸収性または高吸水性ポリマー配合物でコーティングされることができる(下記参照)。あるいは、担体は、本質的に布などの柔軟性の材料からなることができる。固相担体に使用する布は、限定するものではないが、場合により吸収性または高吸水性ポリマー配合物でコーティングされた綿、ポリエステルおよび/または綿ポリエステルブレンドを含む。貯蔵、移動または取り扱いのために、培養担体を折り重ねる、撚り合わせる、掛ける、または巻くことが可能になるため、培養担体の柔軟性は極めて有利であることができる。
【0109】
さらに、固相培養担体は、好ましくは、一般的にはオートクレーブ滅菌の間に遭遇する高温(例えば、約120℃以上)で構造的に安定であり、寒天のように溶融しない。従って、一実施形態において、培養担体をオートクレーブ処理で滅菌し、次いでそれを本発明の保護バリア内に入れることができる。他の実施形態において、培養担体を保護バリア内に入れ、次いで全フォトバイオリアクターをオートクレーブ処理することができる。オートクレーブ処理は滅菌のための1方法ではあるが、任意の他の適切な滅菌方法を用いうることは、当業者には明らかであろう。
【0110】
本発明の固体培養担体は、光合成微生物の増殖を維持するのに任意の適切な材料を含むかまたはそれからできていることができる。例えば、担体は、天然材料、改質天然材料、合成材料、またはそれらの任意の組み合わせから構成されることができる。天然材料は、限定するものではないが、綿、羊毛、加工した織り植物繊維および天然多糖(例えば、寒天、デンプン、セルロース誘導体)を含むことができる。改質天然材料は、限定するものではないが、ニトロセルロースまたはセルロースエステルなどの化学修飾した植物繊維に加えて、ポリエステルまたはポリアミド繊維を重ね織りまたはブレンドした天然繊維を含むことができる。合成材料は、限定するものではないが、ナイロン、ファイバーグラス、ポリシロキサン、ポリエステル、ポリオレフィン、ポリアミド、コポリエステルポリエチレン、ポリアクリレートまたはポリスルホナートで構成される繊維を含むことができる。固体培養担体材料のさらなる例は、ワイヤーメッシュ、ポリウレタンフォーム、ポリエチレンフォーム、ガラス状炭素発泡体、ポリエステル/ポリエチレンフォーム、ポリイミドフォーム、ポリイソシアナートフォーム、ポリスチレンフォームおよびポリエーテルフォームまたはそれらの組み合わせを含む。
【0111】
種々の実施形態において、固体培養担体は布である。限定するものではないが、繊維またはポリマーを織る、編む、フェルト化するまたは架橋するなどの方法によって布を形成することができる。布の構築は、ゆるいまたは目の粗いものであることができる。あるいは、布の構築は目のつんだものであることができる。とは言っても、顕著なテクスチャー、表面積、トポグラフィックな変動性、および/または粗さを有する布は、培養担体への光合成微生物の機械的結合または付着をよりもたらすことができ、従って、特に、微生物を担体に接種するプロセスならびに/または微生物を増殖および/または収穫するプロセスの間にフォトバイオリアクターが処理される、移動されるまたはそれ以外の方法で移動される実施形態において好ましい場合がある。好ましくは、大部分の適用において、担体への微生物の付着は、収穫運転中に部生物の除去を過度に妨げないようにそれほど強くないようにすべきである。さらにまた、微生物が使用するための水分および/または栄養素を保持する布の能力は、一般に、疎水性、親水性の繊維またはこのような繊維の混合物を選択することにより調節できる。これらの特性は、表面で増殖する微生物に利用可能なように、水分および/またはそれに溶解している栄養素が固体担体に保持されるおよび/または移動されることを可能にする。
【0112】
培養担体の特性、特に水分および/または栄養の保持は、光合成微生物の増殖を増加させるように選択された材料で担体をコーティングすることにより増加させることができる。例えば、培養担体は寒天でコーティングされることもできるし、修飾セルロースエステル、アクリラートまたはアクリラート/ポリアミンコポリマーブレンドなどの高吸水性ポリマーでコーティングされることもできる。これらのコーティング剤は、一般的には、水中において、その乾燥重量の10〜100倍を超えて吸収および保持することができる。いくつかの実施形態において、これらの材料は、イオンを含む培地成分の存在下で、その高吸収性特性を保持するように配合される。コーティング剤は、培養担体の表面をコーティングすることもできるし、布が用いられている場合はその繊維をコーティングすることもできるし、あるいはその両方をコーティングすることもできる。一実施形態において、培養担体として役立つテリークロスのスワッチが寒天でコーティングされる。固体培養担体がそのようにコーティングされる場合、培養担体の“表面”は、これに光合成微生物が付着したときのコーティングの表面を含む。培養担体を薄く、曲げやすく軽く保つためには、コーティングは、好ましくは、例えば約100ミクロン以下の薄さである。しかしながら、所望の適用または選択される固体培養担体およびコーティング剤の組み合わせに応じて、より薄いコーティングを用いることもできる。
【0113】
固相培養担体は複合層状構造物であることができる。固相培養担体は、隣接するように配置された少なくとも2つの層を含むことができる。固相培養担体の複数の層は、結合、縫い合わせ、接着、圧縮または任意の他の適切な手段などでつなぐことができる。異なった層は、それぞれ独立して、上記のいくつかの材料の中から選択されることができる。例えば、固相培養担体は、合成発泡体の第2材料層に結合した布の第1材料層を含むことができる。他の例において、固相培養担体は、同一または異なる密度の合成発泡体の第2材料層に結合した合成発泡体の第1材料層を含むことができる。好ましくは、固相培養担体は、少なくとも、高表面積の増殖材料で構成される第1層および透過型材料で構成される第2層を含む複合層状構造物である。
【0114】
水分、栄養素および付着面を供給することに加えて、培養担体は化学線を捕捉するための表面を提供できる。従って、いくつかの実施形態において、固体培養担体の寸法はシート状である。すなわち、担体の深さは、担体の長さおよび幅に対して小さい。一実施形態において、培養担体は、保護バリアのフィルム状層間のシート状層である。このような平らなバイオリアクターは、フラットパネル状にして吊り下げられることができる。他の実施形態において、培養担体は、フォトバイオリアクターの外部バリアにより密閉されたカーテンのように吊り下げられる。寒天などの旧来の固相担体の薄いシートは、引き裂かれやすく、そのように吊り下げられることができないと考えられる。従って、吊り下げられるとき、液体で浸された場合であっても、固体培養担体がその完全性が維持できることが好ましい。
【0115】
本明細書に記載のように、テリークロスタイプ組織を有する布は、適切な固体担体を提供できる(例えば、実施例1参照)。他の天然、修飾天然および合成材料もまた許容されることは、当業者には明らかであろう。テリークロスは、本発明の固体担体において望ましいと考えられる属性の多くを提供する。例えば、テリークロスは柔軟性であり、通常条件下(例えば、温度)、非破壊手法(例えば、曲げ、折りたたみ、ひねりまたはローリング)に従って取り扱うとき、破れる、裂ける、破断する、または割れる傾向を有さない。同様に、テリークロスは、一般的には、適度に引っ張られたとき(液体で浸されているときであっても)、破れる、裂ける、または破断する傾向を有さない。さらに、テリークロスは、多くの繊維ループで構成されているため、高度にテクスチャ加工がおこなわれている。これにより、微生物が付着するための高表面積量が提供され、それによって、任意の所定のサイズの担体上で増殖できる微生物量が増す。さらにまた、綿テリークロスは、一般的には、自身の重量の少なくとも約3倍を吸収し、それにより、担体表面上で増殖する微生物に利用可能なように、布担体に水分および水分に溶解した任意の栄養素が保持されることが可能になる。従って、種々の実施形態は、薄いかまたは寸法がシート状であり、吊り下げられるとき、自身の湿重量を支えることができ、柔軟性で、曲げやすく、吸収性で、高度にテクスチャ加工の、またはそれらの任意の組み合わせの固体培養担体を提供する。
【0116】
上記の担体は、繰り返して使用でき、好ましくは、多くの適用において繰り返して使用され、より好ましくは、構造的に堅固であり、単回使用後に処置された微生物の増殖を維持する適切な表面を提供する限り繰り返して使用され、それによって運転費および廃棄物を減らすことができる。とは言うものの、小有機分子または治療用タンパク質およびペプチドなどの医薬品の製造に有用な組換え光合成微生物の培養などの、単回使用担体が望ましい特定の適用が存在しうる。このような単回使用担体の費用を抑えるために、そしてこのような単回使用担体が再使用されない事実を考慮して、このような担体はそれほど耐久性がある必要はなく、従って、金がかからず、耐久性が低い方法および/または材料を用いて製造または構築されることができる。例えば、ペーパータオルの紙繊維と同様な紙繊維で構成される担体が適切な場合がある。
【0117】
固相培養担体のいくつかの実施形態を図13に示す。図13Aで示される固相培養担体材料は、微生物の増殖、水分および栄養素への接近、微生物付着部位ならびに/または培養産物の除去のための持続可能な表面を提供できる1つの材料を示す。この材料は、表面と微生物との間の、栄養素、水分および産物を交換する液体浸透および平衡拡散を可能にする。この構造形態のレンダリングは、高表面積材料であるが、これは寸法および形状に関して最適化できる。図13Bに示す固相培養担体材料は、それぞれが増殖表面のために特定の機能を有する複数の材料で構成されるハイブリッド材料である。基層は、栄養素および水分の供給に加えて、材料を通してパーコレートする産物の除去を効率的に可能にする多孔性材料であることができる。基材は、増殖表面のための物理的担体を提供することもできる。外層(単数または複数)は、基層に取り付けられることが期待され、微生物の付着部位を提供するために最適化されることができる。表面積および培養した微生物との親和性に関して、表層は表面増殖環境をより調節することができる。
【0118】
保護バリア
本明細書記載のフォトバイオリアクターは、汚染および/または水分損失から固体培養担体および増殖表面を保護するバリアを含むことができる。同時に、フォトバイオリアクターは、光合成微生物に到達する化学線(太陽光または人工光のいずれか)および二酸化炭素を提供する。種々の実施形態において、フォトバイオリアクターは、光合成微生物の培養のための少なくとも1つの固体担体および保護バリアを含む。
【0119】
物理的取り扱いおよび/または汚染からの保護
汚染を防ぐために、物理的保護バリアは、固体培養担体を少なくとも部分的に覆うことができる。特定の実施形態において、物理的バリアは培養担体を密閉することができる。保護バリアは、少なくとも一部分において、フォトバイオリアクター内の担体および/または大気からの、フォトバイオリアクター外の大気への水分の損失を調節することもできる。所望の本発明の実施形態に応じて複数のタイプの材料のいずれかで保護バリアが構築されることができることは、当業者には明らかであろう。
【0120】
保護バリアは、培養担体を完全に密閉することができる。保護バリアが永続的にシールされる場合、内部の培養担体に接近するためには、バリアは破ったり、切断したり、裂いたりしなければならない。従って、いくつかの実施形態において、培養担体および微生物が増殖している表面へ、保護バリアを介して接近される。
【0121】
好ましい実施形態において、保護バリアは取り外し可能にシールされる。取り外し可能なシールは、限定するものではないが、Ziploc(登録商標)保存用バッグ(SC Johnson社)において見られるようなジッパータイプのクロージャー、hook-and-loop型のファスナー(例えば、Velcro USA社)、ツイストタイ、ジップタイ、スナップ、クリップ、感圧接着剤裏打ち面およびあらゆる分野で承認されているそれらの均等物を含む、多くのクロージャータイプのいずれかであることができる。しかしながら、完全なシールは必ずしも必要ではなく、外部バリアを完全にシールしないで、培養担体への接近を容易にしたほうが、寄り効率的な場合がある。
【0122】
フォトバイオリアクターは、保護バリア内に1つの培養担体または複数の培養担体を含むことができる。いくつかの実施形態において、1つの保護バリア内に1つの培養担体が密閉されている。例えば、プラスチックバッグは、その中に1つの固体培養担体が密閉されている保護バリアを形成することができる(例えば、図1参照)。他の実施形態において、1つの保護バリアは、複数の固体培養担体を密閉することができる。例えば、温室タイプの構造物は、その中に複数の固体培養担体が密閉されている保護バリアを形成することができる。
【0123】
化学線の透過
フォトバイオリアクターは、太陽光または人工光のいずれかで、光合成微生物への化学線の透過を提供できる。しかし、本発明の保護バリアは、必ずしも光に対して透明である必要はない。もしも光合成微生物の増殖のためにその中で十分な光源が提供されれば、いくつかの実施形態は、非透明な保護バリア内に密閉された培養担体を含むことができる。例えば、光源として太陽光を用いるための透明なバリアを提供することが、望ましく、より簡単で、より経済的であるなどが考えられる。
【0124】
好ましい実施形態は、限定するものではないが、ガラスまたは透明なもしくは一般に可視光を透過するポリマー、例えばポリエチレン、アクリルポリマー、ポリエチレンテレフタレート、ポリスチレン、ポリテトラフルオロエチレンもしくはそれらのコポリマーまたはそれらの組み合わせのいずれかのタイプなどの材料を含む透明なバリアを提供する。透明なバリアは、耐久性があり、裂ける、破れる、割れる、擦り切れる、細断される、または他のこのような物理的損害を受ける傾向を有さない材料から選択されることができる。透明なバリア材料は、オートクレーブ滅菌または他の温度極値への暴露に耐えるその能力に関して選択されることができる。さらにまた、透明なバリア材料は、退色または劣化せずに、日光または他の放射線への長期の暴露に耐えるように選択されることができる。光酸化に抵抗する特定のコーティングまたは配合物は、特に有用であることができることは、当業者には明らかであろう。さらに、本発明のフォトバイオリアクター内の熱の蓄積を低下させるおよび/または別なふうに調節するように、赤外反射コーティングまたは吸収コーティングを選択することができる。
【0125】
透明なバリア材料の厚さは、スケールの機械的特性に応じて変化することは、当業者には明らかであろう。例えば、透明なバリア材料は、厚さ約10ミルの工業用/海用プラスチックのものであることもでき、およそ厚さ2ミルの家庭用プラスチックバッグに用いられるタイプのものであることもできる。一実施形態において、透明なバリア材料は薄く、柔軟性である。例えば、透明なバリア材料は約10ミル未満のものであることができる。
【0126】
いくつかの実施形態において、バリアは、薄く柔軟性である固体培養担体の両面をおおう保護層またはフィルムを形成する。この実施形態の組み立てられたフォトバイオリアクターは柔軟性であり、貯蔵、移動、運搬または取り扱いのために、曲げる、回転させる、折り重ねる、撚り合わせるなどのことができる。他の実施形態において、透明なバリア材料は硬質である。例えば、バリアはガラス温室であることができる。たいがいは、温室ガラスの厚さは、好ましくは、建築慣行と合致するが、それを変更することも可能である。このような実施形態のフォトバイオリアクターは、実際的には固定されていると考えられるが、1つの透明な保護バリアの範囲内で、複数の固体担体を取り扱う、移動する、運ぶなどすることができるだろう。
【0127】
光合成微生物の増殖のための十分な光を提供するように保護バリアが選択されることができるが、必ずしもすべてのバリアが透明である必要はない。従って、いくつかの実施形態において、バリアの一部、例えば1以上の縁は非透明な材料でできている。非透明な材料は、限定するものではないが、ポリエチレン繊維材料(Tyvek(登録商標))、ポリテトラフルオロエチレン濾過媒体、セルロース系フィルター材料、ファイバーグラスフィルター材料、ポリエステルフィルター材料およびポリアクリラートフィルター材料ならびにそれらの組み合わせを含む材料で構成されることができる。耐久性に関して非透明な材料を選択することができる。このような実施形態において、バリアの透明な部分は、さらに、耐久性がある非透明な部分によって、破れる、裂ける、擦り切れる、細断されるなどから保護されると考えられる。一実施形態において、非透明な部分は、取り付け部位または取り付け部分(例えば、孔、ループ、フック、グロメットもしくは他の分野での等価装置、開口部またはくぼみ)および/または構造物にフォトバイオリアクターを固定する仕組みをさらに含むことによってフォトバイオリアクターを吊り下げるための取り付け構造物および/または補強材を提供するまたは含む。このような任意の取り付け部位などが非透明な部分内もしくは上に位置する必要はないが、それらは、バリアの非透明な部分内もしくは上、バリアの透明な部分内もしくは上、またはバリアの非透明な部分および透明な部分内もしくは上に含まれることができる。取り付け構造物はまた、固体培養担体内もしくは上に含まれることもできるし、それを貫通することもできる。
【0128】
いくつかの実施形態において、装置は識別できる前側および後側を有する。この装置の前側は、光源に面することを意味し、従って前側にあるバリアの部分は好ましくは透明であり、一方、光源に面していない側の保護バリアの部分は、必ずしも透明ではない。
【0129】
ガス交換の提供
光合成の間、光合成微生物は二酸化炭素を消費して酸素を放出する。本明細書記載のフォトバイオリアクターは、所望の量の光合成が行われるのに十分な二酸化炭素を供給できる。フォトバイオリアクター内部に二酸化炭素を供給する1つの方法は、フォトバイオリアクターの内部の空気と周囲の空気との間で直接ガス交換させることである。このシステムが周囲の大気に開放されるように、例えば、孔、通気孔、窓または他のこのような開口部を保護バリアに提供できる。
【0130】
しかしながら、このような開放形状は、光合成微生物の汚染が心配される場合、望ましくない可能性がある。このような心配に取り組むために、保護バリアは、その中に密閉された固体担体(単数または複数)を外気から完全にシールすることができる。このような実施形態において、所望の濃度の二酸化炭素は、囲い内にそれを導入することにより維持できる。例えば、圧縮二酸化炭素のタンクからの配管または管により、フォトバイオリアクター内に密閉された空気に二酸化炭素を混合させることが可能になることは、当業者には明らかであろう。さらに、工場、工業プラント、発電所などからの排気を光合成微生物の二酸化炭素供給源として利用することができ、従って二酸化炭素排出量を減らすことができる。一実施形態において、ガス供給ラインにより、増殖表面局部に二酸化炭素を提供することができる。
【0131】
大気中の二酸化炭素を利用するために、ガス透過性の選択的バリアを提供することが、望ましく、より簡単で、より経済的であるなどが考えられる。従って、いくつかのフォトバイオリアクター実施形態は、保護バリア内に密閉された環境と周囲の空気との間のガスおよび蒸気交換を可能にするにもかかわらず、なお汚染に対するシールされた物理的バリアを提供する選択的バリアを提供する。このようなバリアは、少なくとも部分的にガス/蒸気透過性であることができ(例えば、従来の織物よりもずっと透過性は低く、プラスチックフィルムよりも高く、および/またはコーティングされた紙と同様である)、従って二酸化炭素および酸素などのガスの交換は可能であるが、さらに少なくとも部分的に、かつ好ましくは、固形物および液体に対して不透過性であると考えられる。いくつかの実施形態において、フォトバイオリアクターは、増殖表面付近の領域において上昇した二酸化炭素濃度を維持するために、半透性バリア層およびガス供給ラインを含むことができる。
【0132】
いくつかの実施形態において、選択的バリアは、約10マイクロメートル以下の平均孔径または直径および、少なくとも約5から約10,000ガーレー秒以下までのガス交換速度を有することができる(ガーレー秒またはガーレーは、所定の圧力差で1.0平方インチの所定の材料を100立方センチメートルのガスが通過するのに必要な秒数を記載する単位である)。従って、ガス交換を可能にすることに加えて、選択的バリアは、密閉システムからの水分の損失を防ぐことができる。
【0133】
保護バリアの選択的バリア部分は、スパンボンドオレフィンバリアなどの、任意の適切なポリマーベース材料で構成されることができる。種々の特性を有するスパンボンドオレフィンバリア(微細ポリエチレン繊維)は、Tyvek(登録商標)の商標名でDuPont社から容易に入手できる。このような材料は、物理的特性のその組み合わせの故に特に有利である。すなわち、これらの材料は、水などの液体の透過に抵抗する傾向があるが、それでもなお十分に高度のガス/蒸気透過性を有し;これらの材料は比較的丈夫で、水分をほとんど吸収せず、引き裂き抵抗力があり、著しい弾性を有し、高度に柔軟性である。MIT屈曲試験機(TAPPI法T-423)で試験するとき、スパンボンドオレフィンは20,000サイクルを超えることができる。さらに、スパンボンドオレフィンは大部分の酸、塩基および塩に不活性であるが、濃硝酸または過硫酸ナトリウムなどの酸化物質に対する長期の暴露は、強度の少しの低下の原因となる。スパンボンドオレフィンバリアは、一定温度、0〜100%相対湿度でシート寸法が0.01%未満の変化を示すことから、優れた寸法安定性を有する。特定の製品は、直接食品に接触する用途のためのアメリカ合衆国連邦規則集の規定21(21CFR177.1520)の必要条件を満たしている。スパンボンドオレフィンバリアはまた、優れたカビおよび糸状菌抵抗性を示し、中性のpHを有している。しかしながら、残念なことに、そのUV抵抗性は特に優れていない。とは言うものの、通例少なくとも1〜3ヶ月の有用な屋外寿命を予想することができる。さらに、そのUV抵抗性は、不透明なコーティングを用いるか、ポリマー繊維にUV阻害薬を含むことにより改善することができる。さらに、今日までに製造されたスパンボンドオレフィンは不透明であるため、このような材料を含む保護バリアの部分は、好ましくは、光合成微生物の培養を障害するように位置するおよび/または広すぎることがない。
【0134】
特に、スパンボンドオレフィンは、“硬質”および“軟質”構造物で製造されることができる。“硬質”面接合品であるタイプ10は、なめらかで堅い無指向性紙様形状である。タイプ14および16は、“軟質”点接合品であり、型押し模様を有し、布切れのような柔軟性の担体を提供する。例えば、バリアに耐久性および通気性が所望される場合、タイプ14スタイル(またはその等価物)を使用できる。タイプ16スタイルは、5〜20ミル(0.13〜0.51mm)の孔の穴あきであり、タイプ14スタイルと比較して非常に高い空気および水分の透過性、さらなる柔軟性ならびにより大きな可撓性およびドレープを有するが、低い引き裂き強度およびバリア特性という犠牲を払っている。従って、選択的バリアの特定の特性は、スパンボンドオレフィン製品の1以上のタイプを選択することによりカスタマイズすることができる。
【0135】
選択的ポリマーバリアの他の例は、限定するものではないが、ナイロン、ポリスルホン、ポリテトラフルオロエチレン、セルロース、ファイバーグラス、ポリエステルおよびポリアクリラートの膜およびフィルター材料ならびにそれらの組み合わせを含む。
【0136】
光合成微生物の増殖にとって十分に選択的なバリアを提供するためには、保護バリアの全体がガス透過性である必要はない。適切なガス交換を可能にするのに十分な保護バリアの一部のみが、ガス透過性である必要がある。一実施形態において、選択的部分は保護バリアのパネルである(例えば、図1参照)。微生物の培養を過度に妨げることなく、特定の適用のための所望の量のガス交換を達成するために、担体表面の領域に関する選択パネルのサイズおよび配置は変更することができる。ガス透過性選択材料で構成される外部バリアの領域の百分率は、材料のガス透過速度に左右されることは、当業者には明らかであろう。実際、ガス透過性部分は、それを通しての水蒸気の移動もまた可能なので、種々の実施形態において、保護バリアのガス透過性部分のサイズは、酸素および二酸化炭素の十分な移動を可能にすると同時に、水分の損失を最小化するように選択される。
【0137】
吊り下げおよび運搬システム
本明細書記載のフォトバイオリアクターは、例えば、取り扱いおよび運搬システムに組み込むことにより、大規模生産および/または収穫のために構成されることができる。図3は、多数のフォトバイオリアクターを連続工程で取り扱うための、フォトバイオリアクター農場の典型的な設計を上から見た図を示す。フォトバイオリアクターまたは培養パネル(個別には示さず)は、コンベヤシステム8に取り付けられている。コンベヤシステム8は、その経路に沿って培養パネルを移動させる。複数のコンベヤシステムは、中央に位置する接種および収穫センター9に集まる。このように、処理(例えば、採取および/または接種)可能な場合は、培養パネルを接種および収穫センター9に移動させ、次いで、接種後、バイオマスの培養期間中には、センターからパネルを離れさせる。次いで、収穫前の培養期間の後半に、センターに向けてパネルを移動させ、最終的に、バイオマスの成熟と共に収穫のためにセンターに戻される。次いで、このサイクルが繰り返される。さらなる処理のために、パイプライン10を通して収穫したバイオマスを移動させることができる。さらなるコンベヤシステムまたはさらなる接種および収穫センターを付け加えてバイオマス生産専用の隊列を形成させることにより、フォトバイオリアクター農場の能力を上げることができる。
【0138】
フォトバイオリアクターの吊り下げ
光合成微生物に光を供給するためのフォトバイオリアクターの好ましい実施形態は、培養担体が薄いシート状である実施形態である。水平に向けられる場合、床面積の効率的利用は低下する傾向にあり、従って、本発明の特定の実施形態において、培養担体は非水平に向けられ、好ましくは実質的に垂直に向けられ、より好ましくは垂直に向けられる。それにもかかわらず、十分な量の化学線が微生物に到達できる限りは、培養担体は、本質的に任意の向きに向けられることができる。従って、フォトバイオリアクターが、保護バリアが固体担体の周りに密接に結びつけられたフィルムまたは層を形成するタイプのものである場合、全フォトバイオリアクターの好ましい配向は垂直であるが、任意の配向が許容される。明確にするために、前述の配向(例えば、垂直、水平、実質的に垂直、非水平など)は、培養担体の下部の床または地面に対してであり、床または地面が水平であると仮定している。
【0139】
培養担体または全フォトバイオリアクターを所望の配向に向けるかまたは吊り下げるために、種々の構造物、組み立て台、スタンド、ラックなどを使用できる。特に、培養担体および/または保護バリアは、固体培養担体および/またはフォトバイオリアクターを吊り下げることができる、ロープ、ライン、フック、ケーブル、トラック、レール、鎖、棚板、ポール、管、組み立て台、スタンド、梁または任意の他のこのような構造物から吊り下げられることもできるし、これらに取り付けられることもできる。複数の培養担体および/またはフォトバイオリアクターは、物干し用ロープからぶら下がっているシートのような共通の構造物から吊り下げられることができる。培養担体(単数または複数)および/またはフォトバイオリアクター(単数または複数)は、静的に吊り下げられることもできるし、その移動を可能にする方式で吊り下げられることもできる。孔、ループ、フックなどの位置は、好ましくは、培養担体および/またはフォトバイオリアクターの重量を実質的に均等に分配する。
【0140】
フォトバイオリアクターまたは培養担体の吊り下げは、特に垂直配向においては、空間効率が良く、取り扱い上の利点を提供できる。しかしながら、本発明のバイオリアクターまたは培養担体は、吊り下げられる必要はない。例えば、本発明の特定の実施形態において、培養担体は十分に硬質であり、非水平に、垂直にまたは実質的に垂直に向けられる場合(例えば、表面にまたはその上にその基部を固定または配置することにより;一実施形態において、担体は硬質プレート、パネル、グリッドなどのようなものである)、培養担体はその重量を支えることができ、その様に向けられ続ける。他の実施形態において、保護バリアは温室などのように独立型であり、複数の培養担体が吊り下げられるおよび/またはその中で独立している。
【0141】
フォトバイオリアクターおよび/または培養担体の吊り下げ、特に垂直配向における吊り下げは、空間効率がよく、取り扱い上の利点を提供できる。しかしながら、本発明のバイオリアクターまたは培養担体は吊り下げられる必要はない。例えば、本発明の特定の実施形態において、培養担体は十分に硬質であり、非水平に、垂直にまたは実質的に垂直に向けられる場合(例えば、表面にまたはその上にその基部を固定または配置することにより;一実施形態において、担体は硬質プレート、パネル、グリッドなどのようなものである)、培養担体はその重量を支えることができ、その様に向けられ続ける。他の実施形態において、保護バリアは温室などのように独立型であり、複数の培養担体が吊り下げられるおよび/またはその中で独立している。
【0142】
運搬
本明細書において、フォトバイオリアクター、フォトバイオリアクターの保護バリア内の培養担体またはそれらのいくつかの組み合わせをある場所から他の場所に運搬するためのシステムもまた記載されている。フォトバイオリアクターおよび/または培養担体を移動する能力は、種々の理由から有利であることができる。例えば、それは、光を受け取るためのそれらの位置(単数または複数)を最適化し、所望の温度またはガス含有量することを可能にすることができる。複数のフォトバイオリアクターまたは培養担体を、離散ステップ、例えば接種、培養、誘導および/または収穫にかける場合に、移動性は特に有利であることができる。なぜなら、定着したフォトバイオリアクターまたは培養担体に必要な材料および装置を移動させる代わりに、連続式プロセスでいくつかの割り当てられた場所にフォトバイオリアクターまたは培養担体を移動させることがより効率的と考えられる。
【0143】
このように、培養担体単独または保護バリアに密閉された培養担体のいずれであろうと、増殖表面は、接種後でさえ運ばれることができる。産業上の利用に頻繁に使用される多数のタイプのコンベヤシステムは、当業者には明らかであろう。運搬システムは、それが1以上のフォトバイオリアクターまたは培養担体を移動させることができる限り、特定のタイプに限定されない。フォトバイオリアクターまたは培養担体とコンベヤシステムとの間の取り付けのタイプは、用いられる運搬システムのタイプによって異なり、培養担体および/または保護バリアの一部である任意の取り付け部位と協同して働くように選択されることは、当業者には明らかであろう。1以上のモーター(例えば、鎖および歯車の働きにより)によって、機械化された方式で培養担体(単数または複数)またはフォトバイオリアクター(単数または複数)が運ばれることが考えられるが、ヒトの行動によってそれらが運ばれることも可能である(例えば、レールに取り付けられた吊り下げられたバイオリアクターを、レールに沿って滑らせるベアリング機構にそって単に押すことにより)。
【0144】
フォトバイオリアクター(単数または複数)および/または培養担体(単数または複数)を吊り下げるコンベヤシステムは、特に垂直配向においては空間効率がよく、取り扱い上の利点を提供できる。しかしながら、コンベヤシステムはフォトバイオリアクター(単数または複数)または培養担体(単数または複数)を吊り下げることに依存する必要はない。例えば、フォトバイオリアクターは、例えばローラーコンベヤ上を滑らすなど、コンベヤシステムの上部に沿って移動させることができる。一実施形態において、コンベヤシステムは、保護バリア内に密閉された培養担体を含むフォトバイオリアクターを移動させることができる。あるいは、フォトバイオリアクターの保護バリアは、複数の培養担体を移動させる1以上のコンベヤシステムを保護する大きな囲いであることができる。
【0145】
フォトバイオリアクター農場
大規模用途のためには、十分なサイズの1つの培養担体を構築することは、実際的ではない場合がある。従って、フォトバイオリアクター“農場”で光合成微生物を培養するための、2つまたはいくつかまたは数十または数百または数千またはそれ以上の培養担体の使用が提供される。これらの培養担体は、すべて1つの保護バリア内にある、すなわち1つのフォトバイオリアクターを含むこともできるし、複数の培養担体は複数のフォトバイオリアクターの一部であることもできる。いずれの場合においても、取り扱いおよび処理を容易にし効率的にするために、複数のフォトバイオリアクターまたは培養担体をフォトバイオリアクター農場内で組織化することは有益であることができる。太陽などの光源から捕捉されるエネルギー量を最大化するためにそれらの配置を組織化することもまた有益であることができる。このような組織化は、例えば、限定するものではないが、列、縦列、同心円、格子、中心点から放射状に外に広げることなどの規則的なやり方で多数のフォトバイオリアクターまたは培養担体を配置することからなることができる。
【0146】
種々の実施形態において、農場は、一般の構造物、例えばトラック、レール、鎖、ラインなどから吊り下げられる複数のフォトバイオリアクターまたは培養担体を含む。さらなる実施形態において、構造物はコンベヤシステムの一部であり、フォトバイオリアクターまたは培養担体は、コンベヤシステムの経路に沿ってある場所から他の場所へ移動する。
【0147】
フォトバイオリアクター農場は、多数のフォトバイオリアクターまたは培養担体を取り扱う複数のコンベヤシステムの1つまたは配列を含むことができる。このような配列は、2つまたはいくつかまたは数十または数百または数千またはそれ以上のフォトバイオリアクターまたは培養担体を取り扱う、2つまたはいくつかまたは数十または数百または数千またはそれ以上のコンベヤシステムを含むように拡大することができる。コンベヤシステム(単数または複数)に加えて、フォトバイオリアクター農場は、光合成微生物の接種、培養、誘導および/または収穫などのステップを行うための所定の所定の領域、ステーションまたはセンターを含むことができる。このようなセンターは、特定のステップを行うための専門装置の場所であることができる。コンベヤシステムの経路は、特定のステップが行われるこのようなセンターへフォトバイオリアクターまたは培養担体をもたらすことができる。次いで、フォトバイオリアクターまたは培養担体は、順番における次の領域またはセンターに移動されることができる。コンベヤシステムに沿った異なるフォトバイオリアクターまたは培養担体は、経路に沿った異なるセンター位置することができ、従って異なるステップに同時にかけることができる。一実施形態において、コンベヤシステムの経路はループである。フォトバイオリアクターまたは培養担体は、ひとたび培養プロセスにおけるステップの1ラウンドを完了すれば、そのプロセスを繰り返すことができる。ユニットの一部が損害を受けたり、最終的に交替を必要とする場合もあるが、本質的に、同じフォトバイオリアクターまたは固体培養担体のセットを繰り返し用いることができる。
【0148】
他の実施形態において、同じかまたはほぼ同じ場所で培養および収穫を行うことができる。この場所を接種および収穫センターと呼ぶ(例えば、図3参照)。フォトバイオリアクターおよび/または固体培養担体の接種は、接種および収穫センターで行われる。コンベヤシステムは、フォトバイオリアクターまたは培養担体を次に接種および収穫センターから移動させるループを形成する。次いで、フォトバイオリアクターまたは培養担体は、所望の量の細胞増殖に十分な時間、コンベヤシステムの経路に沿って移動する。次いで、コンベヤシステムは、収穫のためにフォトバイオリアクターまたは培養担体を接種および収穫センターに戻させる。複数のコンベヤシステムは、それから放射上に広がる共通の接種および収穫センターを共有できる。さらに高い能力を必要とする場合、フォトバイオリアクター農場は、複数のコンベヤシステムからのフォトバイオリアクターまたは培養担体を取り扱う複数の接種および収穫センターを含むことができる。能率の増加を実現できるとはいえ、接種および収穫の場所は、同じまたはほぼ同じ場所である必要はない。
【0149】
フォトバイオリアクターの使用方法
光合成微生物の培養
本明細書記載の固相フォトバイオリアクターは、光合成微生物を培養するために使用することができる。固相フォトバイオリアクターにおいて増殖できる光合成微生物は、限定するものではないが、シアノバクテリアなどの天然光合成微生物または人工光合成細菌などの操作された光合成微生物を含む。天然光合成微生物であるか、または操作して光合成微生物にすることができる典型的な微生物は、限定するものではないが、細菌;真菌;古細菌;原生生物;微小植物、例えば緑藻;ならびに動物、例えばプランクトン、プラナリアおよびアメーバを含む。バイオリアクターにおいて増殖できる天然に存在する光合成微生物の例は、限定するものではないが、スピルリナ・マキシマム、スピルリナ・プラテンシス、ドナリエラ・サリナ、ボトリオコックス・ブラウニイ、クロレラ・ブルガリス、クロレラ・ピレノイドーサ、セレナストルム・カプリコミュータム、セネデスムス・クアドリカウダ、ポルフィリディウム・クルエンタム、セネデスムス・アクタス、ドナリエラ種、セネデスムス・オブリカス、アナベノプシス、アウロシラ、キリンドロスペルムム、シネコッカス種、シネコシスチス種、および/またはトリポスリックスを含む。
【0150】
好ましくは、固相フォトバイオリアクターにおいて増殖する光合成微生物はシアノバクテリアを含む。バイオリアクターにおいて増殖するシアノバクテリアは、藍色植物門からの任意の光合成微生物であることができる。バイオリアクターにおいて増殖するシアノバクテリアは、単細胞形態を有することもできるし、コロニー形態(例えば、フィラメント、シートまたはボール)を有することもできる。好ましくは、バイオリアクターにおいて増殖するシアノバクテリアは単細胞シアノバクテリアである。バイオリアクターにおいて増殖できるシアノバクテリアの例は、限定するものではないが、シネコシスチス、シネココッカス、サーモシネココッカス、ノストック、プロクロロコッカス、ミクロシスティス、アナベナ、スピルリナおよびグロエオバクター属を含む。好ましくは、バイオリアクターにおいて増殖するシアノバクテリアは、シネコシスチス種またはシネココッカス種(例えば、シネココッカス・エロンガタスPCC 7942(ATCC33912)および/またはシネコシスチス種PCC 6803(ATCC27184))である。より好ましくは、バイオリアクターにおいて増殖する光合成微生物は、本明細書に記載の二糖を蓄積するように操作されたトランスジェニック光合成微生物である。
【0151】
フォトバイオリアクターの固体培養担体は、光合成微生物を接種することに加えて、水分および、限定するものではないが、栄養素、塩、緩衝液、金属、窒素、リン酸、硫黄などを含む他の成分の添加を行うことができる。次いで、保護バリア内の培養担体を含むフォトバイオリアクターは、取り外し可能にシールされることができる。シールされたフォトバイオリアクターは、例えば、照射および温度の調節を可能にする位置および方式で吊り下げることによって配置されることができる。配置は静的であることもできるし、1日にわたって太陽の放射線への最大暴露を確実にするために、フォトバイオリアクターを移動させることもできる。光合成微生物は、所望の時間、培養することができる。時間の長さは、微生物のタイプおよび所望の細胞増殖密度に従って変化することは、当業者には明らかであろう。例えば、シアノバクテリアの特定の株に関しては、約4〜約7日間の範囲内の培養期間によって、1リットル相当量当たり乾燥バイオマス約50〜約250グラムの範囲内の細胞収量をもたらすことができる。培養期間後、取り外し可能なシールを開けることができ、光合成微生物を収穫することができる。
【0152】
本明細書において、“1リットル相当量当たりの乾燥バイオマスのグラム数”は、培養表面上で増殖するバイオマス層の平均深さ(例えば、約150ミクロン)を算出し、その値に培養表面の長さおよび幅をかけ合わせることによって決定される単位である。この計算は体積を与える。次いで、培養表面から収穫したバイオマスの重量は、体積と関連づけられ、“1リットル相当量当たりの乾燥バイオマスのグラム数”として表すことができる。
【0153】
連続培養法
例えばアセンブリラインの様に、もし光合成微生物の培養プロセスが連続で行われれば、より高い効率が実現できるであろう。一度に大量のバイオマスを取り扱う装置および能力を必要とし、それによりバッチ間で遊休させる代わりに、連続システムは、より少ない全能力しか必要とせず、連続作業によってより効率的にその能力を用いると考えられる。培養をより小さくより多数の構成要素に分割することにより、空間的に連続した配置に構成要素を組織化することができる。次いで、全生産プロセスの異なる離散ステップを同時に行うことができる。培養構成要素をプロセスステップにかけた後、構成要素をプロセスの前方に移動させ、一方でそのステップにおいて他の構成要素と交替させる。従って、最終産物の生産は、大量バッチの成熟に限定されず、各構成要素がアセンブリライン様プロセスを完了するにつれて定期的に行うことができる。さらにまた、1ラウンドのプロセスの完了後に、構成要素は、直ちにプロセスをやり直すことができ、それが繰り返される。
【0154】
より具体的には、連続培養は、連続的に光合成微生物を培養するための運搬可能なフォトバイオリアクターまたは培養担体の使用方法に関する。連続または連続工程は、フォトバイオリアクターまたは固体培養担体を、培養プロセスのあるステップから他のステップに進行させることができる空間的関係として理解される。あるいは、1つの大型構造担体を連続工程に用いることが可能である。具体的には、担体は、巡回路(例えば、好ましくは垂直に配置されたコンベヤベルトのような)に沿って移動する様に作られた材料(例えば、テリークロス織物)のループであることができる。複数のフォトバイオリアクターまたは固体培養担体がそのプロセスを順次に繰り返し完了するにつれて、バイオマス生産が定期的に達成されうることが最終結果である。このタイプのプロセスは、大規模であるが、回数が少ないバッチでのバイオマス生産と比較して、効率の高い大規模用途において機会を与える。
【0155】
好ましい実施形態において、連続した空間的関係はコンベヤシステムの経路に沿っている。運転方法はアセンブリラインに類似している。このようなコンベヤシステムは、いくつかの方法で運転することができる。例えば、コンベヤシステムは、フォトバイオリアクターまたは培養担体をある場所から他の場所へ移動させる間、中断なしに運転することができる。このような実施形態において、フォトバイオリアクターまたは培養担体が動いている間に接種、収穫などが行われる。あるいは、実施されるステップを可能にするためにコンベヤシステムを停止させ、次いで次のステップの場所へのフォトバイオリアクターまたは培養担体の移動を再開させることができる。さらにまた、コンベヤシステムは中断なしに運転でき、フォトバイオリアクターまたは培養担体は、処理のためにコンベヤシステムの移動からはずし、次いで運搬の流れの中に再び入れるために再装着することができる。この一般テーマの他の入れ替えもまた可能であることは、当業者には明らかであろう。
【0156】
連続培養法の一実施形態において、コンベヤシステムに沿って、1つの場所で複数のフォトバイオリアクターが接種される。次いで、コンベヤシステムによって、光合成微生物の培養が行われる領域にフォトバイオリアクターが移動される。運搬のこの部分において、増殖および光合成を促進するための最適の照射を可能にするようにフォトバイオリアクターの位置を合わせることができる。次いで、光合成微生物を収穫できる場所にフォトバイオリアクターが到着する。次いで、このプロセスを再開するために、コンベヤシステムの経路に沿ってフォトバイオリアクターを接種地点に戻すことができる。効率を改善するために、フォトバイオリアクターが接種場所を離れ、収穫場所に到着する間の時間は、光合成微生物の所望の量の増殖が起こるのにかかる時間と一致するようにすることができる。このプロセスのステップは接種、培養および収穫に限定されない。さらなるステップは、所望産物を合成させるための細胞の誘導または滅菌を含むことができる。上記の実施形態は、運搬可能なフォトバイオリアクターシステムを説明しているが、複数の固体培養担体を運搬し処理する同じタイプの連続培養を、1つの保護バリア内で行うことができることは明らかであろう。
【0157】
発酵性糖の生産方法
光合成微生物をより効率的に増殖させる能力から利益を得る技術の1つは、エタノールまたはバイオディーゼルなどの代替燃料のためのバイオマスの生産である。コーン、サトウキビ、ダイズ、カノーラ、ジャトロファなどの、バイオマスを生産するために現在栽培されている植物と比較して、シアノバクテリアなどの光合成微生物は、はるかに速い速度でバイオマスを生産し、これによりはるかに大きな生産性をもたらすことができる。さらに、微生物による二糖の直接生産により、発酵性糖を生産するために植物バイオマスを用いる大規模なエネルギー集約型の前処理の多くを避けられる。さらにまた、植物の代わりに光合成独立栄養微生物を使用することにより、土壌消耗、腐食および食料供給品の転用を引き起こすことなく、高収量の発酵性糖をもたらすことができる。炭素供給源(CO2)およびエネルギー(光)が環境から供給され、はるかに低コストで生産できるため、他の微生物と比較して、光合成独立栄養微生物が好ましい。さらに、光合成独立栄養微生物は、産業プロセスからの二酸化炭素排出量を消費するために利用することができ、従って、環境に対するさらなる利点を提供する。
【0158】
光合成微生物からの大量の発酵性糖の生産に対する1つの障害は、光合成微生物が、一般に、生産した炭水化物を蓄積するよりもむしろ消費するからである。スクロースまたはトレハロースなどのいくつかの糖は、光合成微生物により一次炭素源として利用されないが、緩慢な同化機構が存在する。再加工機構にも関わらず、このような物質は代謝されずに蓄積されることができる。微生物を適切に操作すれば、同化機構を不活性化することができ、それにより高収量の糖の生産が可能になる。
【0159】
本明細書において、発酵性糖、特に二糖の光合成微生物による生産方法が提供される。発酵性糖の例は、限定するものではないが、スクロース、トレハロース、グルコシルグリセロールおよびマンノシルフルクトースを含む。好ましくは、発酵性糖はスクロースまたはトレハロースである。本方法は、生産の費用対効果を改善するために連続的に行うのに適応することができる。
【0160】
本方法の種々の実施形態は、発酵性糖を合成できる光合成微生物を用いて実施できる。いくつかの実施形態は、発酵供給原料の生産のために浸透圧およびマトリックス水保護の天然現象を利用し、制御する。一実施形態において、発酵性糖の合成は誘導性である。他の実施形態において、発酵性糖の合成は、遺伝子操作により改変されて構成的に生産されることができる。
【0161】
発酵性糖生産性光合成微生物は、好ましくはシアノバクテリアである。いくつかの実施形態において、シアノバクテリアは、内因性誘導経路によって二糖を蓄積する。いくつかの実施形態において、トランスジェニックシアノバクテリアは、操作された外因性経路によって二糖を蓄積する。内因性および外因性経路共に、上記でさらに詳細に説明されている。
【0162】
好ましくは、トランスジェニック光合成微生物は、上記のトランスジェニック光合成微生物の1以上である。
【0163】
限定するものではないが、二糖を蓄積できるシアノバクテリア株の2例として、シネココッカス・エロンガタスPCC 7942およびシネコシスチス種PCC 6803がある。天然に存在するシネココッカス・エロンガタスPCC 7942は、その許容限界である約700mMまでの塩濃度に暴露することによりスクロースを合成する。agp遺伝子の欠失によりグルコシルグリセロールの生合成がブロックされるとき、シネコシスチス種PCC 6803は、900mMにほぼ等しいその許容限界までの塩濃度に暴露することにより、その浸透圧保護剤としてスクロースを生産する。いくつかの実施形態において、塩誘導は、エアゾール化した生理食塩水を培養表面に直接に塗布することにより達成できる。このプロセスの1つの利点は、その品種の増殖時間に応じて増殖表面に沿って制御可能に塗布することができ、それによって、バイオマスの蓄積およびスクロースなどの二糖の生産のバランスが保たれることである。
【0164】
発酵性糖を生産するために、固体培地上で、または液体もしくはゲル培地内で光合成微生物を培養できる。光合成微生物の培養および増殖は当該分野で公知である。従って、特記しない限り、光合成微生物の培養および増殖は、このような既知のプロセスに従って実施することができる。例えば、二糖を蓄積するように操作されたトランスジェニックシアノバクテリアは、液体培地内で培養し増殖させることができる。蓄積された糖は、細胞から放出される場合、このような液体培地から単離されることができる。蓄積された糖は、液体培地から収穫した光合成微生物から単離されることができる。一実施形態において、上記のように、トレハロースを蓄積するように操作されたトランスジェニックシアノバクテリアは液体培地内で培養され増殖される。トランスジェニックシアノバクテリアから分泌されるトレハロースは、液体培地から直接に単離されることができる。一実施形態において、上記のように、スクロースを蓄積するように操作されたトランスジェニックシアノバクテリアは、液体培地内で培養され増殖される。スクロースは、液体培地かた収穫した操作されたシアノバクテリアから直接に単離されることができる。一実施形態において、上記のように、スクロースを蓄積し分泌するように操作されたトランスジェニックシアノバクテリアは、液体培地内で培養され増殖される。トランスジェニックシアノバクテリアから分泌されるスクロースは、液体培地から直接に単離されることができる。
【0165】
好ましくは、光合成微生物は、誘導の前に、1リットル相当量当たり乾燥バイオマス少なくとも約50グラムの比較的高い細胞密度まで培養される。このような比較的高い細胞密度は、本明細書記載の固相フォトバイオリアクターを用いて達成できる。次いで、溶液伝導率により測定される、培地における水の活性を変えるのに有効である適切な塩化合物の所定の濃度で蓄積されたバイオマスを処理することにより、二糖(例えば、スクロース)の生産を開始/誘導できる。さらに好ましい実施形態において、塩化ナトリウムが用いられる塩である。適切な反応期間(例えば、少なくとも約1時間から約48時間以下まで)後に、生産されたスクロースを単離し回収するために、スクロースを蓄積した細胞を収穫し処理することができる。一般的には、適切な反応期間は、少なくとも約5時間から約24時間以下までの範囲内である。より一般的には、適切な反応期間は、少なくとも約10時間から約20時間以下までの範囲内である。
【0166】
一実施形態において、合成される二糖(例えば、スクロース、トレハロース、グルコシルグリセロール、マンノシルフルクトース)の大部分は、細胞内に蓄積される。他の実施形態において、二糖は細胞によって分泌され、次いでこれはフォトバイオリアクターから回収することができる。二糖が細胞内に存在するかまたは分泌されるかにかかわらず、限定するものではないが、培養表面に塗布される水性スプレー洗浄を含む任意の適切な収穫プロセスを用いて二糖を得ることができる。二糖を単離し回収するために、細胞および/または二糖を含む洗浄液を収穫し処理することができる。
【0167】
本発明を詳細に説明してきたが、添付の特許請求の範囲において定義された本発明の範囲を逸脱することなく、修飾、変更および等価な実施形態が可能であることは明らかであろう。さらにまた、当然のことながら、本開示におけるすべての例は、限定するものではない例として提供される。
【0168】
限定するものではない以下の実施例は、本発明をさらに詳細に説明するために提供される。以下の実施例において開示された技術は、本発明の実施において十分に機能すると本発明者が見出したアプローチを示すものであり、従ってその実施のための方式の例を構成すると考えることができることは、当業者には明らかであろう。しかしながら、本開示を考慮すれば、本発明の精神および範囲から逸脱することなく、開示された特定の実施形態において多くの変更を行うことができ、なお同様で類似した結果が得られることは当業者には明らかであろう。
【実施例1】
【0169】
固相フォトバイオリアクター
Ziploc(登録商標)の再シール可能なクロージャーを有する2ミルポリエチレンバリア層で構成される静的な原型装置を構築した。60平方センチメートルの通気性パネルを1つの表面に組み込み、225平方センチメートルの綿織物培養担体表面を内部に入れた。この装置を70容量%の水性エタノールで処理することによって滅菌し、次いで、無菌濾過した空気流を用い、50℃で装置を乾燥した。滅菌BG-11培地30mlを培養担体上に吸収させ、次いで、エアゾールアプリケーターを用いて、シネココッカス・エロンガタスPCC 7942の前培養物を増殖表面に接種した。接種の前に、6℃で2日間、BG-11培地中で前培養物を増殖させた。33℃に維持され、白色蛍光ランプを用いて300マイクロアインシュタインで照射されているインキュベーションチャンバーにフォトバイオリアクターを入れた。2日後、リアクターは微生物の活発な増殖を示し、さらに2日間、増殖を継続させ、その後リアクターをインキュベーターからはずし、増殖表面を脱イオン水を洗浄した。蒸発によって水を除去し、乾燥重量254mgのバイオマスを得た。
【実施例2】
【0170】
光合成微生物によるスクロースの生産
以下は、フォトバイオリアクターと組み合わせた光合成微生物によるスクロースの生産方法を例示するための予言的実施例である。約15〜40℃の温度、約60〜300マイクロアインシュタインの照射下、約0.2〜15容量%の二酸化炭素濃度で、シネコシスチス種PCC 6803または操作されたシネコシスチス種のいずれかを用いて、おおよそ4〜7日間、少なくとも1つのフォトバイオリアクター、例えば実施例1または実施例3に記載されているような本発明のフォトバイオリアクターを運転することができる。最初の培養期間後に、エアゾールスプレーを用いて、約0.01〜1.5M、より好ましくは約0.2〜0.9Mの濃度範囲の水性塩溶液で増殖表面を処理できる。スクロースを生産させるために、おおよそさらに1日間から2日間培養を続けさせることができる。次いで、脱イオン水で表面を洗浄することによって、増殖表面を収穫することができる。他の実施形態において、洗浄水は滅菌新鮮培養培地であり、洗浄の厳密さは、約70〜90%の細胞塊が収穫される程度である。次いで、培養担体上に残っているバイオマスを、次のサイクルとして増殖を続けさせる。この培養の収量は、用いられる増殖表面材料および微生物に応じて、乾燥バイオマス約200〜600mgであることが期待される。
【実施例3】
【0171】
吸水性ポリマーでコーティングされた固体培養担体
BG-11培地に分散させた滅菌1.5重量パーセント寒天の加熱溶液で材料の滅菌乾燥表面をディップコーティングにより、実施例1に記載のタイプの静的なフォトバイオリアクターの増殖表面を調製した。コーティングされた増殖表面を冷却し硬化させ、次いで表面を滅菌保護バリアに挿入してフォトバイオリアクター装置を作成し、実施例1に記載の前培養で培養されているシネココッカス種を接種した。本質的に実施例1に記載されているようにして培養および収穫を行った。
【実施例4】
【0172】
asf遺伝子標的
スクロースリン酸シンターゼ(sps)およびスクロースリン酸ホスファターゼ(spp)活性の調節を通して、シアノバクテリアにおけるスクロースの生合成を研究した。浸透圧およびマトリックス水ストレスへの順応のために、このような活性は多くのシアノバクテリアに既に存在している(例えば、Lunn, J. E. 2002. Plant Physiol 128, 1490-1500 を参照のこと)。
【0173】
Lunn, J. E. (2002. Plant Physiol 128, 1490-1500)は、シネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942を含むいくつかの微生物のspsおよびspp遺伝子のゲノム構造を解析した。Lunnは、シネコシスチス種PCC 6803(配列番号3)のスクロースリン酸シンターゼ(SPS)が、不活性なスクロースリン酸ホスファターゼ(SPP様)ドメインおよび別個のSPP活性を有することを提案した。SPP様ドメインはsppと高レベルの同一性を有するが、ハロ酸デハロゲナーゼ(HAD)スーパーファミリーの保存された活性部位残基の多くを欠失している。シネココッカス・エロンガタスPCC 7942に関する研究はいまだになされていないが、Lunnは、両方の活性が1つの酵素に含まれていることを提案した。これらの酵素のアラインメントを図5に示す。
【0174】
シネココッカス・エロンガタスPCC 7942ゲノムの研究により、染色体の他の部分では別個のsps遺伝子が明らかにならなかった。同義遺伝子発現の必要性を避けるために、シネココッカス・エロンガタスPCC 7942酵素(配列番号2)を用いた。PCC 7942からの遺伝子はspsと呼ばれているが、SPSおよびSPP活性の両方を有する1つの融合酵素であるため、活性融合SPS/SPP(配列番号1)の代わりにasfと名づけられた(別個のSPP酵素の可能な発現に関するさらなる情報については下記を参照のこと)。
【0175】
シネココッカス・エロンガタスPCC 7942のasf遺伝子産物(配列番号2)の発現には2つのアプローチがある。
【0176】
第1アプローチは、広宿主域ベクターpMMB67EH上に構築されたプラスミドベースの発現系である(Furste, J. P., Pansegrau, W., Frank, R., Blocker, H., Scholz, P., Bagdasarian, M. and Lanka, E. 1986. Gene 48, 119-131)。プラスミドpMMB67EHはRSF1010の誘導体であり、これは大部分のグラム陰性微生物において複製され、一部のグラム陽性微生物においてさえも複製されるため、大腸菌、シネコシスチス種PCC 6803、シネココッカス・エロンガタスPCC 7942および種々の他のシアノバクテリア内でのスクロース生産のプラスミドベースの解析が可能である(Kreps, S., Ferino, F., Mosrin, C., Gerits, J., Mergeay, M. and Thuriaux, P. 1990. Mol Gen Genet 221, 129-133; Marraccini, P., Bulteau, S., Cassier-Chauvat, C., Mermet-Bouvier, P. and Chauvat, F. 1993. Plant Molecular Biology 23, 905-909; Gormley, E. P. and Davies, J. 1991. J Bacteriology 173, 6705-8)。
【0177】
第2アプローチは、upp(ウラシルホスホリボシルトランスフェラーゼ)遺伝子座でのシネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942の染色体への安定な組み込みである。upp遺伝子座は、下記の理由で選択した。
【実施例5】
【0178】
プラスミドベースの発現
asf遺伝子産物、pLybAL11(例えば、図6;配列番号19参照)およびpLybAL12(例えば、図7;配列番号20参照)のプラスミドベースの発現のために、2つのプラスミドを設計した。所定のプロモーターからの発現のためにプラスミドpLybAL12を構築し、無作為に選択されたプロモーターからの発現のためにpLybAL11を構築した。
【0179】
2つのプラスミドを以下のように構築した。鋳型として全細胞を用い、オリゴヌクレオチド5'-AGACTACAATTGGGGCGTTTTCTGTGAG-3'(MfeI制限エンドヌクレアーゼ部位はヌクレオチド位置7〜12である)(配列番号7)および5'-CTTACGTGCCGATCAACGTCTCATTCTGAAAAGGTTAAGCGATCGCCTC-3'(配列番号8)を用いるPCRによりシネココッカス・エロンガタスPCC 7942からのasf遺伝子を増幅し、配列番号1の産物を得た。
【0180】
上流プロモーターの有り無しでの、クロラムフェニコールアセチルトランスフェラーゼをコードする遺伝子(cat)をpBeloBAC11(GenBankアクセッション番号U51113)から増幅した。
【0181】
プロモーターを欠くcat遺伝子は、オリゴヌクレオチド5'-TTATCGCGATCGTCAGGAGCTAAGGAAGCTAAAATGGAG-3'(配列番号9)および5'-CGACCAATTCACGTGTTTGACAGCTTATC-3'(配列番号10)(PvuIおよびPmlI制限エンドヌクレアーゼ部位は、それぞれヌクレオチド位置4〜9および10〜15である)を用いるPCRによってpBeloBAC11から増幅し、配列番号11の産物を得た。
【0182】
プロモーターを含むcat遺伝子は、オリゴヌクレオチド5'-TTTTGGCGATCGTGAGACGTTGATCGGCACGTAAG-3'(配列番号12)および5'-CGACCAATTCACGTGTTTGACAGCTTATC-3'(配列番号13)(PvuIおよびPmlI制限エンドヌクレアーゼ部位は、それぞれヌクレオチド位置7〜12および10〜15である)を用いるPCRによってpBeloBAC11から増幅し、配列番号14の産物を得た。
【0183】
cat遺伝子を含むPCR産物をPvuIで消化し、T4 DNAポリメラーゼで末端を平滑化した。次いでこれらを、個別にasf PCR産物に連結した。得られた産物をアガロースゲル電気泳動で精製し、MfeIおよびPmlIで消化し、次いで、EcoRIおよびHpaIで消化したpMMB67EHの6.6Kbpの産物にT4 DNAリガーゼで連結した。ケミカルコンピテントNEB5α(New England Biolabs社;マサチューセッツ州イプスウィッチ)を連結産物で形質転換し、100μg/mlアンピシリンを添加したLB寒天上37℃で選択した。選択された候補をミニプレップのために100μg/mlアンピシリンを添加したLB中37℃で増殖させ、制限エンドヌクレアーゼ消化物で分析し、次いでオリゴヌクレオチド5'-GCTTCTGCGTTCTGATTTAATCTGTATCAG-3'(配列番号15)、5'-TATCACTTATTCAGGCGTAGCAACCAG-3'(配列番号16)、5'-GTCGTTAGTGACATCGACAACACACTG-3'(配列番号17)、および5'-GATCGCGATACTGATCGAGATAGGTC-3'(配列番号18)を用いる配列分析によって確認した。さらなる研究のために、候補番号5のpLybAL11(pLybAL11-5)(配列番号19)および候補番号1のpLybAL12(pLybAL12-1)(配列番号20)を選択した。
【0184】
ミニプレップ中のプラスミド収量に基づけば、大腸菌株NEB Turbo(New England Biolabs社;マサチューセッツ州イプスウィッチ)内で増殖させるとき、これらのプラスミドのコピー数は著しく低下していると思われるため、これらのプラスミドのための宿主株の選択における重要性が示唆される。
【実施例6】
【0185】
プロモーター挿入
pLybAL12-5への挿入のために、6つのプロモーターを選択した。カルバモイルリン酸シンターゼをコードするシネコシスチス種PCC 6803 carBの推定プロモーター(遺伝子pyrRのすぐ上流に存在すると考えられ、それらはオペロンとして共転写されると考えられる)を選択した。なぜなら、ピリミジンおよびアルギニン生合成の両方におけるその役割により丈夫であると考えられるからである。シネコシスチス種PCC 6803(Aichi, M., Takatani, N. and Omata, T. 2001. J Bacteriol. 183, 5840-5847)およびシネココッカス・エロンガタスPCC 7942(Maeda, S-I. et al. 1998. J Bacteriol 180, 4080-4088)の両方からの硝酸レダクターゼ(nirA)プロモーターを、窒素供給源により制御されるそれらの能力のために選択した。シネココッカス・エロンガタスPCC 7942からの光化学系II D1タンパク質(psbAII)のための丈夫な明期プロモーター(Golden, S. S., Brusslan, J. and Haselkorn, R. 1986. EMBO Journal 5, 2789-2798)およびシネコシスチス種PCC 6803からの2つの暗期プロモーター[dnaK (Aoki, S., Kondo, T. and Ishiura M. 1995. J Bacteriol 177, 5606-11)およびkaiA(Kucho, K-I. et al. 2005. J Bacteriol 187, 2190-2199)]もまた、調節型シアノバクテリア由来プロモーターとして選択した。最後に、シアノバクテリアにおいて活性であることが示されているλPR温度調節型プロモーターを選択した(Ferino, F. and Chauvat, F. 1989. Gene 84, 257-66; Mermet-Bouvier, P. and Chauvat, F. 1994. Current Microbiology 28, 145-148)。
【0186】
以下のオリゴヌクレオチドを用いて、鋳型として全細胞を用いるPCRによってプロモーターを増幅し、示されている産物を得た。クローニングに組み込まれている制限エンドヌクレアーゼ部位は、配列中に示されている。
【0187】
それぞれがヌクレオチド位置7〜12に制限エンドヌクレアーゼ部位を有するオリゴヌクレオチド5'-CGGTGTGCATGCCGTTATTGATGGAATG-3'(配列番号21)および5'-TCACTAGGTACCTAAATTACCTGGGAAGCCAG-3'(配列番号22)を用いるPCRによって、シネコシスチス種PCC 6803 pyrR(SphI/KpnI)(配列番号23)を全細胞から増幅した。
【0188】
それぞれがヌクレオチド位置7〜12に制限エンドヌクレアーゼ部位を有するオリゴヌクレオチド5'-CCCAAGGCATGCAGGAAAACAAGCTCAGAATGCTG-3'(配列番号24)および5'-TTTATTGGTACCAACGCTTCAAGCCAGATAACAGTAGAGATC-3'(配列番号25)を用いるPCRによって、シネコシスチス種PCC 6803 nirA(SphI/KpnI)(配列番号26)を全細胞から増幅した。
【0189】
オリゴヌクレオチド5'-ATCTTTGCGTTCCGTGACGGCTACTG-3'(配列番号27)および5'-GCAGATGGTACCGGTCAGCAGAGTG-3'(ヌクレオチド位置7〜12に制限エンドヌクレアーゼ部位を有する)(配列番号28)を用いるPCRによって、シネココッカス・エロンガタスPCC 7942 psbAII(SphI/KpnI)(配列番号29)を全細胞から増幅した。
【0190】
それぞれがヌクレオチド位置7〜12に制限エンドヌクレアーゼ部位を有するオリゴヌクレオチド5'-CAGCCAGCATGCATAAATTTCTGTTTTGACCAAACCATCC-3'(配列番号30)および5'-GTGGCTGGTACCATGGATTCATCTGCCTACAAAG-3'(配列番号31)を用いるPCRによって、シネココッカス・エロンガタスPCC 7942 nirA(SphI/KpnI)(配列番号32)を全細胞から増幅した。
【0191】
それぞれがヌクレオチド位置7〜12に制限エンドヌクレアーゼ部位を有するオリゴヌクレオチド5'-GTGCATTCTAGATGGCTACGAGGGCAGACAGTAAG-3'(配列番号33)および5'-TTCTGTGGTACCATATGGATCCTCCTTCTTAAGATGCAACCATTATCACC-3'(配列番号34)を用いるPCRによって、λPR(XbaI/KpnI)(配列番号35)を全細胞から増幅した。
【0192】
それぞれがヌクレオチド位置7〜12に制限エンドヌクレアーゼ部位を有するオリゴヌクレオチド5'-GCCCCAGCATGCACCAGTAAACATAAATCTC-3'(配列番号36)および5'-ATTGGTGGTACCGAGGTCAATCCCAACAAC-3'(配列番号37)を用いるによって、シネコシスチス種PCC 6803 dnaK(SphI/KpnI)(配列番号38)を全細胞から増幅した。
【0193】
それぞれがヌクレオチド位置7〜12に制限エンドヌクレアーゼ部位を有するオリゴヌクレオチド5'-GCCAGAGCATGCAAAGCTCACTAACTGG-3'(配列番号39)および5'-GGAAAAGGTACCTGAGTCTATGGGCAACGTG-3'(配列番号40)を用いるPCRによって、シネコシスチス種PCC 6803 kiaA(SphI/KpnI)(配列番号41)を全細胞から増幅した。
【0194】
増幅後、PCR産物を上記で示されている制限エンドヌクレアーゼで消化し、ゲル精製し、同様に消化したpLybAL12-1に連結して、それぞれプラスミドpLybAL15(配列番号44)、pLybAL16(配列番号45)、pLybAL17(配列番号46)、pLybAL18(配列番号47)、pLybAL19(配列番号48)、pLybAL21(配列番号49)、およびpLybAL21(配列番号50)を得た。エレクトロコンピテントNEB5α(New England Biolabs社;マサチューセッツ州イプスウィッチ)を連結産物で形質転換し、100μg/mlアンピシリン、34μg/mlクロラムフェニコールおよび5%スクロースを添加したLB寒天上、30℃で選択した。選択された候補をミニプレップのために100μg/mlアンピシリン34μg/mlクロラムフェニコールおよび5%スクロースを添加したLB中30℃で増殖させ、制限エンドヌクレアーゼ消化物で分析し、次いでオリゴヌクレオチド5'-GCTTCTGCGTTCTGATTTAATCTGTATCAG-3'(配列番号42)および5'-ATGGGTCTGAATGTGCAGAATGTAGAG-3'(配列番号43)を用いる配列分析によって確認した。プラスミドpLybAL15(配列番号44)、pLybAL16(配列番号45)、pLybAL17(配列番号46)、pLybAL18(配列番号47)、pLybAL19(配列番号48)、pLybAL21(配列番号49)およびpLybAL21(配列番号50)のそれぞれに対し、候補6および7(pLybAL15-6およびpLybAL15-7)、2(pLybAL16-2)、4および5(pLybAL17-4およびpLybAL17-5)、1および2(pLybAL18-1およびpLybAL18-2)、1および2(pLybAL19-1およびpLybAL19-2)、3および5(pLybAL21-3およびpLybAL21-5)ならびに4および8(pLybAL22-4およびpLybAL22-8)を選択した。
【0195】
スクロースおよび両抗生物質を添加したLB上でのこれらのプラスミドの選択および増殖は、クローンを得るためには大変重要であった。始めは、アンピシリンのみを添加したLB上で選択を行ったが、プロモーターを含むプラスミドは単離できなかった。単離物は、ベクターのみの再連結反応物であるか、または異なるサイズでクロラムフェニコールの存在下で増殖する能力を欠くものであった。細胞内スクロースが生産され、スクロース生産を防ぐ欠失をもたらす細胞に対する浸透圧ショックが生じたと考えられる。それに続く実験により、ひとたび単離されれば、プラスミドは、おそらくは結果として生じる浸透圧ストレス装置および/またはスクロース消費酵素の誘導により、スクロースの非存在下で安定であることができることを示している。
【実施例7】
【0196】
シネコシスチスおよびシネココッカスの形質転換
プロモーターを含有するプラスミド、pLybAL15(配列番号44)、pLybAL16(配列番号45)、pLybAL17(配列番号46)、pLybAL18(配列番号47)、pLybAL19(配列番号48)、pLybAL21(配列番号49)およびpLybAL21(配列番号50)に加えて、プロモーターを含有しないpLybAL12-1ベクター(配列番号20)(実施例5〜6参照)を、特記しない限り、Elhai,J.and Wolk,C.P.1988.Methods in Enzymology167,747-754に基づいて行う三親接合によって、シネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942の両方に挿入した。
【0197】
30℃で増殖させた、カーゴ株(導入されたプラスミドを含むNEB5α)の終夜培養物に加えて、ヘルパープラスミドpRK2013(ATCC37159)を含むHB101の終夜培養物を遠心分離でペレット化し、LBで2回洗浄し、次いで元の容量の10分の1のLBに再懸濁した。おおよそ0.5のOD730への一定の照度下で、微量元素をNitsch微量元素(Nitsch, J. P. and Nitsch, C. 1956. American Journal of Botany 43, 839-851)に置き換えた以外はBG11と同じであるBG11-Aを用いて、30℃で各シアノバクテリアを増殖させた。細胞を遠心分離でペレット化し、BG11-Aで2回洗浄し、7.5倍高い濃度でBG11-Aに再懸濁した。10-5まで、BG11-Aでシアノバクテリアの一連の10倍希釈液を調製した。各希釈液において、シアノバクテリア100μlを、大腸菌のカーゴ株およびヘルパー株のそれぞれ50μlと混合した。次いで、各混合物150μlを、5%LBを添加したBG11-A寒天(1.5%)プレート上にプレーティングした。一定の照度下、26〜28℃で16〜24時間、プレートをインキュベートした。各プレート上の寒天(およそ30ml)を移動させ、100Xクロラムフェニコール溶液300μlを加えた。クロラムフェニコールの最終濃度は、シネコシスチス種PCC 6803に関して25μg/mlであり、シネココッカス・エロンガタスPCC 7942に関しては7.5μg/mlであった。インキュベーションを8〜12日間続けた。接合伝達株の各コロニーを、再度、適切な量のクロラムフェニコールを添加したBG11-A上に再ストリークすることにより汚染した大腸菌を精製除去して単離されたコロニーを得た。
【実施例8】
【0198】
pLybAL11-5におけるプロモーターライブラリー
以下の実施例により、pLybAL11-5(配列番号19)を用いる、プロモーター選択のためのシアノバクテリアDNAのライブラリーの構築を説明する(実施例5参照)。Wilson, K. (1997. Preparation of Genomic DNA from Bacteria. In Current Protocols in Molecular Biology. John Wiley and Sons Vol. 1, pp. 2.4.1-2.4.5)の染色体DNAの単離プロトコルの、改変されたスケールアップバージョンを用いたが、主な違いは、ずっと長いインキュベーション時間およびSDSをサルコシルで置き換えたことであった。単離されたDNAは、pLybAL11-5のBamHI部位への挿入のための部分Sau3AI消化のために十分な品質を有していた。図8に示すように、フラグメントのあるものはプロモーターを有し、他はプロモーターを有さないと考えられる。
【0199】
ライブラリー構築のプロセス中に、asf遺伝子内の可能なプロモーターが見出された。プロモーターとして機能するためには、クローニングベクター、プラスミドpLybAL11-5(配列番号19)は、プロモーターがasf遺伝子の前に挿入されたときにのみ、クロラムフェニコールに耐性を示すはずである。なぜならこのマーカーは、その通常のプロモーターを欠き、asfの上流のプロモーターは含まれないからである。しかしながら、構築されるやいなや、このプラスミドにより付与されるクロラムフェニコール耐性を大腸菌内で試験した。pLybAL11-5を含むNEB5αを、34μg/mlクロラムフェニコールを添加したLB寒天(1.5%)上37℃で培養したとき、増殖が観察された。しかしながら、34μg/mlクロラムフェニコールを加えた液体LB培地で培養したとき、皆無かそれに近い増殖が観察された。pLybAL12-1(配列番号20)を含むNEB5αは、クロラムフェニコールの存在下、固体および液体LB培地の両方で増殖する。
【0200】
asf遺伝子の上流であるが、転写ターミネーターの下流であるプロモーターが欠失したものがないか確かめるために、pLybAL11を作成するためにpMMB67EHに挿入したインサートを、Lucigen大腸菌株(E. cloni 10G)コンピテント細胞を含むLucigen’s CloneSmartキットを用いるLucigen社(ウィスコンシン州ミドルトン)のpSMART-LCKan平滑末端クローニングベクターにクローニングした(例えば、図9参照)。これが平滑末端化クローニングであったため、インサートはいずれかの方向でプラスミドに連結することが可能であり、pLybAL13f(配列番号51)およびpLyAL13r(配列番号52)が作成された。このベクターは、クローニング部位をターミネーターで囲うことによって、ベクターからの読み通し転写を除去するように特に設計されている。対照として、pLybAL12を構築するために用いたインサートもまたこのベクターに挿入し、pLybAL14f(配列番号53)およびpLybAL14r(配列番号54)を作成した。これらのプラスミドはアガロースゲル上で適切なサイズと思われたが、クローンの完全性を確認されるためのDNA配列決定によりインサートは確認されなかった。しかしながら、pLybAL13およびpLybAL14を含むE.cloni 10Gに関して同様な結果が見られ(fまたはr方向のいずれかに連結されたクローニングされたDNAで)、またpLybAL11(配列番号19)およびpLybAL12(配列番号20)をそれぞれ含むNEB5αに関しても見られた。このことは、このプロモーターの活性が大腸菌内では弱いことを示している。
【0201】
多くの大腸菌プロモーターは、シアノバクテリアでは機能しないし、逆もまた同様である。このプロモーター活性が、シネコシスチス種PCC 6803またはシネココッカス・エロンガタスPCC 7942では観察されない可能性がある。この事を確認するために、前述のように、接合によって、両方の微生物にpLybAL11-5(配列番号19)を挿入した。クロラムフェニコール(シネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942に対して、それぞれ、25μg/mlおよび7.5μg/ml)を添加したBG11-A寒天(1.5%)上で増殖が観察された。
【0202】
クロラムフェニコールを添加した液体BG11-A上で、pLybAL11-5(配列番号19)を含むこれらの微生物の増殖を試験した。この活性は大変弱く、多重コピープラスミドで存在する場合のみ観察される可能性がある。これは大腸菌での場合であって、シアノバクテリアではそうではないと思われる。RSF1010は、比較的低コピーのプラスミドであり、大腸菌内で12コピーのみを有する(Frey, J., Bagdasarian, M. M. and Bagdasarian, M. 1992). Gene 113,101-106)。急速な分裂を行っている大腸菌は、多くてその染色体を2コピー有し、従って少なくとも6倍のコピー数増加を有する。このプラスミドに関するシアノバクテリアにおける同等のコピー数は同様である。シネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942の、それぞれ10〜12および16の染色体コピー数は類似している(Labarre, J., Chauvat, F. and Thuriaux, P. 1989. J Bacteriol 171, 3449-57)。上記の結果は、シアノバクテリアのasf遺伝子内のプロモーターの存在を示唆している。
【0203】
図10は、asf遺伝子内のプロモーター(単数または複数)の可能な位置を示している。転写開始領域は、Curtis, S. E. [1994. The transcription apparatus and the regulation of transcription initiation. In The Molecular Biology of Cyanobacteria. Bryant, D. A. (ed). Kluwer Academic Publishers pp. 613-699] に記載されている。翻訳開始領域は、Sazuka, T. and Ohara, O. (1996. DNA Research 3, 225-232)によって定義されている。
【0204】
既知のSPS酵素に対するアラインメントおよびただ2コドン上流の終止コドンの存在に基づいて、asf遺伝子の翻訳開始はGTG開始コドンで開始されると予想される。ATG開始コドンが最も一般的とはいえ、GTGおよびTTGはあまり一般的ではないがまれではない。アデニンヌクレオチドが、好ましくは開始コドンの第1ヌクレオチド9〜12bp離れた16S rRNAの3'末端に相補的な典型的な大腸菌様シャイン・ダルガノ配列(GGAGまたはGAGG)もまた、少し長めのスペースではあるが存在する。この配列は、SazukaおよびOharaによって研究された遺伝子の約半分において見出されている。あまり最適ではないスペースはまれではないが、多くの場合発現のレベル低下をもたらす。シャイン・ダルガノ配列の上流であってMfeI部位の下流には、プロモーターを組み込むためには配列が少なすぎる。部分プロモーターが組み込まれることは可能ではあるが、プロモーターの残りは3つのプラスミド(pLybAL11-5(配列番号19);pLybAL13f(配列番号51);およびpLybAL13r(配列番号52))のすべてのベクター配列により産生されなけらばならず、それはありそうもない。
【0205】
従って、プロモーター活性はasf遺伝子内に位置すると考えられる。プロモーターがasf遺伝子内にあるとすれば、1つの可能な位置がasfのSPPドメインの前である。これは、シネコシスチス種PCC 6803からのものと同様な四次構造であるシネココッカス・エロンガタスPCC 7942のスクロース生合成酵素を与える。各微生物は、SPPと翻訳的に融合されたSPSドメインまたはSPP様ドメインおよび、互いに相互作用できる(できない)別個のSPPの2つのタンパク質を有すると考えられる。
【0206】
第1に、asfのSPPドメインが別々に翻訳されうるかどうか決定した。図10および表1に示すように、シャイン・ダルガノ配列に先行するSPPドメインのすぐ上流のTTG開始コドンが存在する。
【表1】

【0207】
開始コドンの周囲の領域は、天然開始コドンとほぼ同様に、SazukaおよびOharaによって決定された72シアノバクテリア遺伝子のコンセンサスと一致する。プロモーターが大腸菌内で活性であると考えられることから、大腸菌プロモーターに関して確立されたルールに基づいてシアノバクテリアプロモーターを決定する一方で、典型的な-35および-10領域を調べた。図10に見られるように、2つの可能なプロモーターが同定された。asfの他の部分でのさらなるプロモーター(単数または複数)の可能性は残っている。
【実施例9】
【0208】
大腸菌からのプラスミドのシアノバクテリアへの導入
シアノバクテリアへのpMMB67EHベースプラスミドの導入のために接合を用いた。これらの微生物の形質転換のためのプロトコルは存在するが(Zang, X., Liu, B., Liu, S., Arunakumara, K. K. I. U. and Zhang, X. 2007. Journal of Microbiology 45, 241-245; Golden, S. S. and Sherman, L. A.1984. Journal of Bacteriology 158, 36-42)、天然形質転換を用いるシネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942へこれらのプラスミドを挿入するこのようなアプローチは不成功に終わった。
【0209】
シアノバクテリアにおけるプラスミドの存在は確認した。オリゴヌクレオチド5'-AGACTACAATTGGGGCGTTTTCTGTGAG-3'(配列番号7)および5'-GGTGGTTGTGTTTGACAGCTTATC-3'(配列番号55)を用いて、asf/cat遺伝子組み合わせのPCRによってプラスミドの存在に関して接合伝達株を分析し、3.1kbの産物を得た。さらに、プラスミドを単離し、分析した。クロラムフェニコール(前述の濃度で)を添加したBG11-A中で増殖させた細胞培養物を遠心分離でペレット化し、TEに再懸濁し、熱処理し、Promega Wizard SV Plusミニプレップキットでミニプレップした。しかしながら収率が低いので、直接のプラスミド分析は困難である。それとして、単離されたDNAを大腸菌NEB5αに形質転換し、Promega Wizard SV Plusミニプレップキットを用いて再単離し、制限エンドヌクレアーゼ分析にかけた。
【実施例10】
【0210】
スクロース生産アッセイおよび分析
スクロース蓄積に関して、pLybAL19またはpLybAL17を用いるシネココッカス形質転換をアッセイした(実施例7参照)。BioVision社(カリフォルニア州マウンテンビュー)のスクロースアッセイキットを用いてスクロースを用いて測定する。4時間の誘導期間(pLybAL17(配列番号46)に関する、50マイクロアインシュタインから180マイクロアインシュタインへの光の増強およびpLybAL19(配列番号48)に関する、26℃から39℃への温度の上昇)後にアッセイを行った。細胞内に存在するバックグラウンドのグルコースに関してデータを補正した。
【0211】
pLybAL19(配列番号48)で形質転換したシネココッカスは、乾燥バイオマス1mg当たり0.78ナノモルのスクロースを蓄積したという結果が得られた。pLybAL17(配列番号46)で形質転換したシネココッカスは、乾燥バイオマス1mg当たり0.95ナノモルのスクロースを蓄積したという結果も得られた。
【0212】
大腸菌、シネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942におけるプラスミドベースのスクロース生産のさらなる分析を行った。細菌はスクロースを消費できるので、検出は困難な可能性がある。そのようなものとして、抑制条件下で細胞を増殖させ、誘導後直ちにアッセイした。pyrRプロモーターは、ウラシルを含む増殖により抑制され、ウラシルを欠く培地に移すことにより誘導されることができる。nirAプロモーターは、窒素源としてアンモニウムイオンを含む増殖により抑制され、窒素源として硝酸塩を含む培地に移すことにより誘導されることができる。psbAIIプロモーターは、微光から高照度へ移行させることができる。暗期プロモーターは、明から暗へ移行させることができる。そしてλPRプロモーターは、低温(25℃)から高温(39℃)へ移行させることができる。
【実施例11】
【0213】
安定な染色体組み込みによる発現
スクロース生合成遺伝子の挿入は、10-16染色体の不完全分離をもたらす細胞増殖への悪影響を引き起こす恐れがある。抗生物質耐性マーカーに関する通常の選択を用いても、マーカーのさらなるコピーを有することは、抗生物質の存在下で生き残る細胞の能力に劇的な影響を与えない。従って、陰性表現型に直面する場合、抗生物質選択を用いても、染色体の完全分離を達成することは困難な恐れがある。
【0214】
大部分の生物において、upp遺伝子(ウラシルホスホリボシルトランスフェラーゼをコードする)の欠失は、さもなければ毒性の5-フルオロウラシルに対して耐性をもたらす。完全耐性を得るためには、upp遺伝子のすべてのコピーが欠失されなければならない。従って、シネコシスチス種PCC 6803(配列番号56)およびシネココッカス・エロンガタスPCC 7942(配列番号58)のupp遺伝子座への組み込みは、5-フルオロウラシル耐性をもたらし、陰性表現型の存在下であっても、完全分離の正の選択を可能にする。
【実施例12】
【0215】
upp/カナマイシン耐性カセット
upp/カナマイシン耐性カセットを用いるゲノム操作のための一般的戦略の概略を図11に示す。遺伝子の欠失が示されているが、この戦略は、“置換”ステップにおいて挿入および変異に容易に改変できる。
【0216】
upp/カナマイシン耐性カセットを構築した。製造業者のプロトコルに従って、平滑末端クローニングベクターpCC1および大腸菌株EPI300を用いて、Epicentre Bioechnologies CopyControlクローニングキットでカセットを構築した。オリゴヌクレオチド5'-AAGAAGCAAGACAGCGTGTAGCTGCTCTGACTG-3'(配列番号60)および5'-TCCCGGGATTTGGTACCTTATTTTGTTCCAAACATGCGGTCACCCGCATC-3'(ヌクレオチド位置2〜7および12〜17に制限エンドヌクレアーゼ部位を有する)(配列番号61)を持ちいて、全細胞からバチルス・ズブチリス(Bacillus subtilis)168からのupp遺伝子を増幅して配列番号62の産物を得た。
【0217】
PCR産物をpCC1にクローニングし、Epicentre Biotechnologies社のプロトコルの記載に従って、クロラムフェニコールを添加したLB上でインサートを含むものを選択した。制限エンドヌクレアーゼ消化物によって、lacZに対して順方向をスクリーニングして、pLybAL7f(配列番号65)を得た。インサートの正確な配列を、候補3および8(pLybAL7-3およびpLybAL7-8)に関して、オリゴヌクレオチド5'-GTAATACGACTCACTATAGGGC-3'(配列番号63)および5'-CACACAGGAAACAGCTATGACCAT-3'(配列番号64)を用いるDNA配列決定によって確認した。
【0218】
LybradynベクターpLybAA1[そもそもはpACYC177に由来する(Rose,R.E.1988.Nucleic Acids Res.16、356]からのカナマイシン耐性マーカーを、オリゴヌクレオチド5'-GTCAGTGCACTGCTCTGCCAGTGTTACAACC-3'(ヌクレオチド位置5〜10でApaLI制限エンドヌクレアーゼ部位を有する)(配列番号66)および5'-CTCAGTGGCGCCAAAACTCACGTTAAGGGATTTTGGTC-3'(配列番号67)(ヌクレオチド位置7〜12でNarI制限エンドヌクレアーゼ部位を有する)を用いて増幅し、配列番号68の産物を得た。
【0219】
PCR産物をApaLIおよびNarIで消化し、同様に消化したpLybAL7fに連結して、pLybAL8f(配列番号69)を得た。50μg/mlネオマイシンを添加したLB上で適切なプラスミドを選択し、制限エンドヌクレアーゼ消化で試験した。
【実施例13】
【0220】
UPP欠失
スクロース、トレハロース、グルコシルグリセロールおよびマンノシルフルクトースを含む糖の発現のための染色体インサートの分離を強いる1つの戦略は、染色体からのuppの欠失を利用して、5-フルオロウラシルへの耐性を導くことである。このことは、多くの微生物(大腸菌および枯草菌など)において確立されているが、シネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942などのシアノバクテリアに関しては、以前は確立されていなかった。
【0221】
試験により、これらの微生物のそれぞれの増殖が、1μg/mlの5-フルオロウラシルにより完全に抑制されることが示された。シネコシスチス種PCC 6803の増殖は0.5μg/mlの5-フルオロウラシルによって完全に抑制され、0.1μg/mlの5-フルオロウラシルまで感受性を示した。
【0222】
オリゴヌクレオチドSspupp-F(配列番号96)およびSspupp-R(配列番号97)を用いて、両方のシネコシスチス種PCC 6803のupp遺伝子および周囲の配列を増幅した。オリゴヌクレオチドSeloupp-F(配列番号98)およびSeloupp-R(配列番号99)を用いて、シネココッカス・エロンガタスPCC 7942のupp遺伝子および周囲の配列を増幅した。次いで、PCR産物(シネコシスチス種PCC 6803のupp、配列番号100;シネココッカス・エロンガタスPCC 7942のupp、配列番号101)を、製造業者の使用説明書により、Epicentre Biotechnologies社(ウィスコンシン州マディソン)平滑クローニングベクターpCC1にクローニングした。
【0223】
PCR産物(配列番号100または配列番号101)は、pCC1にいずれかの方向で連結することができるが、lacプロモーターに対して順方向を選択し、それぞれ、pLybAL3f(配列番号102)(シネコシスチス種PCC 6803のuppを含む)およびpLybAL5f(配列番号103)(シネココッカス・エロンガタスPCC 7942のuppを含む)を得た。オリゴヌクレオチドT7long(配列番号104)およびM13rev(配列番号105)を用いてインサートを配列決定した。シネコシスチス種PCC 6803のuppのヌクレオチド配列は配列番号111で表され、ポリペプチド配列は配列番号112で表される。シネココッカス・エロンガタスPCC 7942のuppのヌクレオチド配列は配列番号113で表され、ポリペプチド配列は配列番号114で表される。
【0224】
pLybAL3f(配列番号102)からBlpIおよびApaLIフラグメントを除去し、T4 DNAポリメラーゼで平滑末端化し、次いでT4 DNAリガーゼで再環状化して、プラスミドpLybAL4f(配列番号106)を作成した。次いで、pLybAL4fをAvrIIおよびSgfIで消化することによって、シネコシスチス種PCC 6803のupp遺伝子の一部を欠失させ、T4 DNAポリメラーゼで平滑末端化し、次いでT4 DNAリガーゼで再環状化して、pLybAL9f(配列番号107)を作成した。シアノバクテリアDNAを含むSacI/SphIフラグメント(配列番号108)をpLybAL9f(配列番号107)から切除し、同様に消化したpARO180(配列は完全には知られていない; Parke, D. 1990. Construction of mobilizable vectors derived from plasmids RP4, pUC18 and pUC19. Gene 93:135-137; ATCC 77123)に連結し、pLybAL25を作成した。pLybAL5fからSapIおよびApaLIフラグメントを除去し、T4 DNAポリメラーゼで平滑末端化し、次いでT4 DNAリガーゼで再環状化して、プラスミドpLybAL6fb(配列番号109)を作成した。次いで、BssHIIおよびBsaIでpLybAL6fbを消化することによってシネココッカス・エロンガタスPCC 7942のupp遺伝子の一部を欠失させ、T4 DNAポリメラーゼで平滑末端化し、次いでT4 DNAリガーゼで再環状化してpLybAL10fb(配列番号110)を作成した。pLybAL10fbからシアノバクテリアDNAを含むSacI/SphIフラグメント(配列番号138)を切除し、同様に消化したpARO180に連結してpLybAL26を作成した。
【0225】
プラスミドpLybAL25およびpLybAL26を大腸菌S17-1(ATCC47055)に挿入した。プラスミドpLybAL25およびpLybAL26は、二親接合によってシネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942に導入される予定である。これらのプラスミドはシアノバクテリア内で複製されないため、自殺ベクターとして機能し、染色体に乗り換え、染色体のコピーの1つにあるuppを欠失させるだろう。過剰の5-フルオロウラシルへの早期暴露による最適化されたプロトコルにより、細胞を致死させることなく分離の高速化が可能になると考えられる。
【実施例14】
【0226】
スクロース分解酵素の修飾
asfで形質転換されたシアノバクテリアが、スクロース分解活性の調節によってスクロース生産が改善されるように、さらに操作される。
【0227】
本発明者らは、シネコシスチス種PCC 6803(ヌクレオチド配列配列番号70;ポリペプチド配列配列番号71)およびシネココッカス・エロンガタスPCC 7942(ヌクレオチド配列配列番号72;ポリペプチド配列配列番号73)の両方において、インベルターゼホモログをコードする遺伝子を同定した。シネコシスチス種PCC 6803はまた、スクラーゼフェレドキシン様タンパク質(ヌクレオチド配列配列番号74;ポリペプチド配列配列番号75)(Machray G.C. et al. 1994. FEBS Lett 354, 123-127)をコードする。
【0228】
これらの遺伝子は、図11に示すマーカーレス欠失プロトコルを用いて欠失される。
【実施例15】
【0229】
スクロース分解酵素の修飾
asfで形質転換されたシアノバクテリアが、細胞からのスクロース分泌を促進するようにさらに操作される。
【0230】
高塩環境から低塩環境へ移行するときに一部の微生物によって浸透圧保護剤が処理されるのと同様に、低い浸透圧環境においては、スクロースは細胞から自動的に削除される可能性がある(Schleyer, M., Schmidt, R. and Bakker, E. P. 1993. Arch Microbiol 160, 424-43; Koo, S. P., Higgins, C. F. and Booth, I. R. 1991. J Gen Microbiol 137, 2617-2625; Lamark, T., Styrvold, O. B. and Strgim, A. R. 1992. FEMS Microbiol. Lett 96, 149-154)。シアノバクテリアの操作によってこのようなプロセスを促進させることができる。
【0231】
asfで形質転換されたシアノバクテリアが、スクロース透過酵素、例えば大腸菌およびサルモネラによって用いられているスクロース透過酵素または特定のシアノバクテリアの窒素固定包嚢へのスクロースの輸送におけるスクロース透過酵素を発現するようにさらに操作される(Jahreis K. et al. 2002. J Bacteriol 184, 5307-5316; Cumino, A. C. 2007. Plant Physiol 143, 1385-97)。これらの遺伝子をクローニングし、前述の技術に従ってシアノバクテリアを形質転換する。
【実施例16】
【0232】
ポリンで形質転換したシアノバクテリアによるスクロース分泌
シネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942からのスクロース分泌は、スクロースポリンでの形質転換によって促進させることができる。
【0233】
エンテロバクター・サカザキ(Enterobacter sakazakii)(ATCC BAA-894)からのスクロースポリンをコードする遺伝子(scrY)を、シネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942における発現のためにクローニングした。この遺伝子の機能は、その配列およびその近傍の配列から推測されている。エンテロバクター・サカザキscrYは、オリゴヌクレオチドEsscrYBamHI-F(配列番号88)およびEsscrYSacI-R(配列番号89)を用いるPCRによって染色体DNAから増幅した。PCR産物(配列番号90)をBamHIおよびSacIで消化し、同様に消化したpLybAL19に連結し、NEB5αにクローニングし、pLybAL32(配列番号91)を作成した。次いで、オリゴヌクレオチドEsscrYmidseq-F(配列番号92)およびEsscrYmidseq-R(配列番号93)を用いてscrY遺伝子(核酸配列番号94;ポリペプチド配列、配列番号95)を配列決定した。宿主に導入されたとき、この構築物は、遺伝子scrYおよび温度誘導性プロモーターの調節下に有るasfの同時発現を可能にする。このプラスミドは、三親接合によって(前述のように)シネコシスチス種PCC 6803に導入された。スクロース分泌における有効性に関して、形質転換されたシネコシスチス種PCC 6803が試験される。シネココッカス・エロンガタスPCC 7942の同様な形質転換および試験が次に行われる。
【実施例17】
【0234】
トレハロース蓄積シアノバクテリアの作成
大腸菌からのトレハロースリン酸シンターゼおよびトレハロースリン酸ホスファターゼをコードするトレハロース生合成遺伝子(それぞれotsAおよびotsB)は、2遺伝子オペロン、otsBA(配列番号115)において見出される。オリゴヌクレオチドEcotsBA-F(配列番号116)およびEcotsBA-R(配列番号117)を用いる大腸菌K12ゲノムDNAのPCR増幅によってこのオペロンをクローニングした。このPCR産物をAflIIおよびNheIで消化し、pLybAL19(配列番号48)にクローニングし、asf遺伝子の大部分を置換した。新規プラスミド、pLybAL23(配列番号118)は、温度誘導性λPRプロモーターの調節下に有るトレハロース生合成遺伝子を含んでいる。オリゴヌクレオチドEcotsBAmidseq-F(配列番号119)およびEcotsBAmidseq-R(配列番号120)を用いてこの遺伝子を配列決定し、その完全性を確認した。次いで、AflII(T4 DNAポリメラーゼで平滑末端化した)/otsBAオペロンを含むpLybAL23のNheIフラグメントをpLybAL15、pLybAL17、pLybAL21およびpLybAL22に連結し、SacI(T4 DNAポリメラーゼで平滑末端化した)およびNheIで消化し、それぞれpLybAL28(配列番号121)、pLybAL29(配列番号122)、pLybAL30(配列番号123)、およびpLybAL31(配列番号124)を作成することによって、otsBAオペロンの発現をpyrR、psbAII、dnaKおよびkiaAプロモーターの調節下においた(前述のように)。
【0235】
プラスミドpLybAL28(配列番号121)、pLybAL29(配列番号122)、pLybAL30(配列番号123)およびpLybAL31(配列番号124)のそれぞれを、三親接合(前述のように)によってシネコシスチス種PCC 6803に挿入した。
【0236】
それぞれpLybAL36(配列番号125)およびpLybAL37(配列番号126)を作成することにより、他のプロモーターに関して記載したもの同様にして、pLybAL23からのotsBAオペロンの発現を、pLybAL16およびpLybAL18におけるシネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942nirAプロモーター(前述のように)の調節下においた。
【実施例18】
【0237】
トレハロースアッセイ
バイオマスを、必要に応じて遠心分離により培養液を分離し、0.2ミクロンフィルターを用いる濾過により清澄化した培養液から残留バイオマスを除去した。減圧下で蒸発させることにより培養液を濃縮して残渣を得た。濃縮した培養液を脱イオン水1mlに溶解し、次いで、トレハロースアッセイにおいて溶液10マイクロリットルをサンプリングした。遠心分離によって回収したバイオマスを計量皿に移し、100℃に加熱して残った水分を除去した。乾燥バイオマスの重さを量り、次いで試料100mgを脱イオン水1mlに溶解した。次いでこの混合物を粉砕し、固形物を遠心分離で除去した。清澄化した上清試料10マイクロリットルを脱イオン水で100倍に希釈し、希釈サンプル10マイクロリットルをトレハロースに関して試験した。
【0238】
トレハロースアッセイには、Biovision社から入手可能な市販のスクロースアッセイキットの改変手順を用いた。標準プロトコルの改変は、キットに付属しているインベルターゼ酵素溶液のためのトレハラーゼを置き換えることであった。このキットは、トレハロースをトレハラーゼで加水分解してグルコースを放出させることを含む。グルコースはグルコースオキシダーゼで酸化されて過酸化水素を生じ、これは呈色指示薬の存在下でペルオキシダーゼの作用によって検出される。570nmにおけるその特性吸収によって呈色指示薬を定量的に測定し、もとから試料中に存在したグルコースの濃度を得る。
【0239】
Gutierrez C, Ardourel M, Bremer E, Middendorf A, Boos W, Ehmann U.Mol Gen Genet. 1989 Jun;217(2-3):347-54 の記載と同様な方法に従って、プラスミドに操作し、大腸菌宿主を形質転換した組換え大腸菌treA遺伝子からトレハラーゼ(トレハラーゼポリペプチド配列番号135をコードするtreA核酸配列番号134)を製造した。treAによりコードされるペリプラズムのトレハラーゼを大腸菌K12からクローニングした。treA PCR産物(配列番号127)をAflII/XbaIで消化し、次いで同様に消化したpLybCB6(強力な大腸菌trpプロモーターの構成的バージョンを含む登録商標プラスミド)に連結し、pLybAL24(配列番号130)を作成した。オリゴヌクレオチドEctreAmidseq-FおよびEctreAmidseq-Rで配列決定することによりインサートの完全性を分析した。
【0240】
トレハラーゼのC末端His6タグ付きバージョンを構築した。オリゴヌクレオチドEctreA-F2(配列番号131)およびEctreA-R2(配列番号132)を用いるPCRで遺伝子を増幅した。次いでPCR産物(配列番号136)をAflII/XbaIで消化し、次いで同様に消化したpLybAL24に連結してpLybAL33(配列番号133)を作成した。
【0241】
ペリプラズムのトレハラーゼの強力な構成発現は細胞に有害であり、37℃で強い増殖欠損を引き起こす。これは、30℃で細胞を増殖させることにより顕著に軽減させることができる。
【0242】
カナマイシンを含む2xYT培地中で増殖させた大腸菌BW25113内で、プラスミドpLYBAL24(配列番号130)上のタンパク質を発現させた。ペリプラズムへのタンパク質の輸送を可能にするシグナルペプチドを含むタンパク質を、Trpプロモーターを用いて構成的に産生させた。発酵およびバイオマスの収穫後、洗浄し、再懸濁した細胞ペレットを2%v/vジクロロメタン/50mMトリス緩衝液(pH8)で処理することによる選択的ペリプラズム放出によって酵素を精製した。遠心分離によって細胞の破片から溶解物を分離し、10,000ダルトンの膜を備えたAmicon社のウルトラフィルターを用いる濃縮によってさらに処理した。濃縮された溶解物をアッセイに直接に用いることもでき、酵素(配列番号137)のC末端に操作された6Xポリヒスチジンタグを用いる金属イオンアフィニティークロマトグラフィーによって酵素をさらに精製することもできる。
【実施例19】
【0243】
トレハロースの固相生産
15cm x 15cmを有する増殖表面として使用される布層(DuPont社Sontara)に、培地/水分リザーバー(Foamex社Aquazone)として使用される担体フォームで構成される、固体複合布で覆われる親水性フォームを結合させた。70%エタノール水溶液に浸すことにより複合材料を滅菌し、次いで複合材料の頂部に溶液を供給するために垂直にされた垂直バイオリアクターにつるした。重力によって溶液を増殖複合材料表面に浸透させた。0.2ml/分の流速で滅菌脱イオン水を1リットル通過させることによって滅菌増殖表面から残留エタノールを除去した。0.2ml/分で、複合材料を通して10マイクログラム/mlのクロラムフェニコールを含むBG11A増殖培地0.5リットルを流すことによって、増殖表面を培地で平衡化した。
【0244】
平衡化した滅菌増殖表面に、プラスミドpLYBAL23によって形質転換したシネコシスチス種PCC 6803の4日間前培養物10mlを表面に注ぐことにより接種した。30分間のインキュベーション後に垂直位置にリアクターを向け、発酵を開始させた。白色LEDアレイからの80マイクロアインシュタインの光でリアクターを照射した。バイオリアクターに取り付けられた抵抗加熱装置によって温度を28℃に維持した。リアクターには、0.2L/分で0.2ミクロンのろ過空気で連続的にパージし、増殖複合材料のフォーム層を通して、6時間毎に30分間0.2ml/分の速度でポンプおよび重力浸透によって新鮮培地を供給した。リアクターを連続的に4〜7日間運転し、その間に、複合材料の増殖表面は、シアノバクテリアの密集した芝生で覆われた。最初の培養期間後にバイオリアクターの温度を40℃に上げ、この温度にさらに24時間維持した。高温期間中、使用済の培養液を回収し、トレハロース測定のために処理した。発酵運転の完了時に、トレハロースアッセイのために処理することができる脱イオン水で増殖表面をすすぐことによりバイオマスを回収した。
【0245】
固体表面に増殖するバイオマス中に生産され保持されるトレハロースの量は、温度誘導後にバイオリアクターから回収されるバイオマス全乾燥重量の最大2.5重量%までであった。温度誘導後の培地から、乾燥バイオマス相当量の0.8重量%のトレハロースを回収した。
【実施例20】
【0246】
トレハロース生産液相
Bioflowリアクター中で、10マイクログラム/mlの濃度までクロラムフェニコールを添加した滅菌BG11A培地1リットルを調製した。次いで、プラスミドpLYBAL23で形質転換したシネコシスチス種PCC 6803の4日間前培養物を5容量%リアクターに接種した。リアクターを28℃、300RPM、0.2L/分の0.2ミクロンろ過空気パージで運転し、蛍光電球アレイを用いて80マイクロアインシュタインの光で照射した。培養を4〜7日間維持し、次いで試料200mlを取り出し、処理およびトレハロースアッセイを行った。次いで発酵温度を24時間40℃に上げた。次いで試料200mlをバイオリアクターから取り出し、処理およびトレハロースアッセイを行った。
【0247】
温度誘導後、乾燥バイオマスは最大3重量%までのトレハロースを産生したが、使用済の培養液は、バイオマスに対して0.3重量%トレハロース相当量を含んでいた。
【0248】
引用文献
本願においては、すべての公報、特許、特許出願および他の引用文献は、あたかも個別の公報、特許、特許出願または他の引用文献が、個別具体的に示されて参照によりその全体が組み込まれるのと同じ様に、その全体が参照により本願に組み込まれる。本願における引用文献の引用は、これが本発明の先行技術であるという承認ではない。
【技術分野】
【0001】
関連出願の相互参照
本願は、米国仮特許出願第61/085,797号(出願日:2008年8月1日)および米国仮特許出願第61/018,798号(出願日:2008年1月3日)に基づく優先権を主張する(そのそれぞれは、参照により本願に組み込まれる)。
【0002】
コンピュータ読み取り可能な形式で提出された資料の参照による組み込み
本開示の一部である配列表は、本発明のヌクレオチドおよび/またはアミノ酸配列を含むコンピュータ読み取り可能な形式および書面での配列表を含む。コンピュータ読み取り可能な形式で記録された配列表情報は、書面での配列表と同一である。配列表の対象物は、参照によりその全体が本願に組み込まれる。
【0003】
技術分野
本発明は、一般に、トランスジェニック微生物ならびにその培養方法および培養装置に関する。
【背景技術】
【0004】
世界のエネルギー必要量の増加に取り組むために、化石燃料の使用の効率的で環境上適正な代替物が求められている。エタノールまたはバイオディーゼルなどの代替燃料は、植物バイオマスから生産できる。例えば、エタノール生産に用いられている現行プロセスの重要成分は発酵性糖と呼ばれている。ほとんどの場合、発酵性糖はスクロース、グルコースまたは高果糖コーンシロップの形態である。このようなバイオマスの生産のために現在栽培されている植物は、コーン、サトウキビ、ダイズ、カノーラ、ジャトロファなどを含む。しかしながら、発酵性糖の生産のために使用される植物バイオマスの多くは、大規模なエネルギー集約型の前処理を必要とする。さらにまた、このような植物バイオマスの使用は、土壌消耗、腐食および食料供給品の転用を引き起こす恐れがある。
【0005】
シアノバクテリアの一部は、スクロースリン酸シンターゼおよびスクロースリン酸ホスファターゼの作用によってスクロースを生産することが知られ、これはもっぱら浸透圧保護剤として研究されてきた。耐塩性に関して、シアノバクテリアを3つのグループに分けることができる。低い耐性(700mM未満)を有する株は、スクロース(例えばシネココッカス・エロンガタス(Synechococcus elongatus)PCC 7942の場合)またはトレハロースとして知られる他の二糖のいずれかを合成する[Blumwald et al., Proc Natl Acd Sci USA (1983) 80:2599-2602 and Reed et al., FEMS Microbiol Rev (1986) 39:51-56]。中程度の耐塩性(0.7〜1.8mM)を有する株、例えばシネコシスチス(Synechocystis)種PCC 6803によりグルコシルグリセロールが生産される。高い耐塩性(〜2.5M)は、グリシンベタインまたはグルタミン酸ベタインのいずれかの蓄積の結果により生じる。しかしながら、Miaoら [FEMS Microbiol Lett (2003) 218:71-77]は、agp遺伝子の欠失によりグルコシルグリセロール生合成が阻害されるとき、シネコシスチス種PCC 6803は、その浸透圧保護剤としてスクロースを生産することを測定した。同様に、乾燥耐性シアノバクテリアは、マトリックス水ストレスに応じてスクロースおよびトレハロースを生産する[Hershkovitz et al., Appl Environ Microbiol (1991) 57:645-648]。
【0006】
シネコシスチス種PCC 6803(ATCC 27184)およびシネココッカス・エロンガタスPCC 7942(ATCC 33912)は比較的よく研究されており、入手可能な遺伝子ツールがあり、それらのゲノム配列は既知である(例えば、Koksharova, O. A. and・Wolk, C. P. 2002. Appl Microbiol Biotechnol 58, 123-137; Ikeuchi1, M. and Satoshi Tabata, S. 2001. Photosynthesis Research 70, 73-83; Golden, S. S., Brusslan, J. and Haselkorn, R. 1987. Methods in Enzymology 153, 215-231; Friedberg, D. 1988. Methods in Enzymology 167, 736-747; Kaneko, T. et al. 1996. DNA Research 3, 109-136 を参照のこと)。
【0007】
光合成微生物、例えば、スピルリナ・マキシマム(Spirulina maximum)、スピルリナ・プラテンシス(Spirulina platensis)、ドナリエラ・サリナ(Dunaliella salina)、ボトリオコックス・ブラウニイ(Botrycoccus braunii)、クロレラ・ブルガリス(Chlorella vulgaris)、クロレラ・ピレノイドーサ(Chlorella pyrenoidosa)、セレナストルム・カプリコミュータム(Serenastrum capricomutum)、セネデスムス・クアドリカウダ(Scenedesmus auadricauda)、ポルフィリディウム・クルエンタム(Porphyridium cruentum)、セネデスムス・アクタス(Scenedesmus acutus)、ドナリエラ(Dunaliella)種、セネデスムス・オブリカス(Scenedesmus obliquus)、アナベノプシス(Anabaenopsis)、アウロシラ(Aulosira)、キリンドロスペルムム(Cylindrospermum)、セネコッカス(Scenecoccus)種、セネシスティス(Scenecosystis)種およびトリポスリックス(Tolypothrix)の商業培養は、精製化学製品、医薬品、化粧品用顔料、脂肪酸、抗酸化剤、予防効果を有するタンパク質、増殖因子、抗生物質、ビタミンおよび多糖の生産を含む多数の用途に好ましい。藻類のバイオマスはまた、低用量で動物食品における抗生物質レベルの低下にまたはその代替として有用であることもでき、タンパク源として有用であることもできる。さらにまた、乾燥形態とは対照的に、湿潤形態で提供される藻類のバイオマスは、燃料の生産のために、培養または熱プロセスによって液化することができる。従って、このような生物の培養効率を上げる能力に大変興味が持たれる。
【0008】
一般に、現行の光合成バイオリアクターは、バイオマスを生産するために、液相系における微生物の培養を必要とする。この系は、通例、開放型池型リアクターまたは密閉型タンク型リアクターである。しかしながら、密閉型バイオリアクターは、一般的には多くの点で池型リアクターよりも改善されていると考えられている。重要なことに、密閉系は、環境汚染に対するバリアを提供している。さらに、この系は、液体培地の温度およびガス含有量の良好な調節を可能にする。
【0009】
それにもかかわらず、密閉型フォトバイオリアクターの使用は、光合成微生物の光要求性により限定される傾向がある(すなわち、化学線は、光合成微生物が二酸化炭素を固定して有機分子にするために必要なエネルギーを提供する)。従って、光合成微生物の十分な照射は、強固な必要条件である。それにもかかわらず、液相フォトバイオリアクターにおける細胞密度が増加するに従って、培地に達する光の能力は減少し、このことは、一般的には達成される細胞密度を限定する。さらに、微生物の好ましくない沈降を防ぐために、一般に、エネルギーの投入を必要とするプロセスである、液体培地のある種の撹拌を必要とする。
【0010】
液相系における微生物に光をもたらす方法を発明するために、多数の試みがなされている。例えば、ある系は、透明な管を通して液体培地を循環させることを含む。他の試みは、放射線吸収を調節するために、培地内に光源を置くか、または培地に反射粒子を導入することを含む。これらの努力にもかかわらず、より高い細胞密度で液相系において微生物を培養する能力における顕著な増加はいまだに達成されていない。
【0011】
前述の光要求性に加えて、液相フォトバイオリアクターの使用は、光合成のための十分な二酸化炭素を光合成微生物に供給することが負担となってきた。一般的には、これらの系は一般に、培地に溶存している二酸化炭素濃度を増加させるための、ある種のさらなる通気システムを組み込んでいる。通気の必要性を排除することにより、この系は著しく簡略化され、それにより操業費が抑えられると考えられる。
【0012】
液相フォトバイオリアクターもまた、連続生産の常法には適切ではない傾向がある。一般に、大容量の液体の移動は複雑で厄介である。さらにまた、液相系は、通例循環、撹拌、通気などの仕組みを必要とするため、一般に、多数の小さな培養装置よりも、1個かまたは数個の大きな培養装置を操作するほうが、より簡単でより費用対効果が高い。従って、現在行われている方法は、比較的大規模なバッチの処理を含む(すなわち、光合成微生物のバッチを培養し、次いで得られる全バイオマスを収穫する)。
【0013】
従って、当該技術分野において、光合成バイオリアクター設計における進歩が強く求められている。大容量の水または他の液体培地を用いず、十分な光および二酸化炭素を供給する前述の特別な手段を用いずに、合理的な費用で、比較的高密度の光合成微生物を効率的に培養し、収穫できる新しいタイプの光合成バイオリアクターを提供することは、当該技術分野での実質的進歩を意味し、産業および消費者が等しく利益を受けることになると考えられる。
【発明の概要】
【0014】
本明細書において、炭水化物、例えば二糖を蓄積するように操作されたトランスジェニック細菌が提供される。光合成微生物に栄養素および水分を提供するのに適した非ゼラチン質の固体培養担体ならびに前記培養担体の表面の少なくとも一部をおおう物理的バリアを含む、光合成微生物を培養するためのフォトバイオリアクターもまた提供される。フォトバイオリアクターを組み込んだ、光合成微生物の大規模連続培養のための装置および使用方法が開示されている。本発明のフォトバイオリアクターを用いる、光合成微生物からの発酵性糖の生産方法もまた開示されている。
【0015】
一側面は、光合成微生物を培養するためのフォトバイオリアクターを提供する。フォトバイオリアクターは、その表面の少なくとも一部の上にある光合成微生物に栄養素および水分を提供するのに適した非ゼラチン質の固体培養担体であって、前記表面の一部が非水平に向けられるとき、光合成微生物がそれに付着するのを可能にする形状(topography)を有する前記固体培養担体;ならびに、少なくとも前記培養担体の表面の一部をおおう物理的バリアであって、前記培養担体の表面の一部への接種、このような光合成微生物の培養に適した環境の形成および維持ならびにこのような培養した光合成微生物の収穫を可能にするように構成された前記物理的バリアを含む。
【0016】
いくつかの実施形態において、フォトバイオリアクターは、前記培養担体の表面の一部の上にある光合成微生物を含む。いくつかの実施形態において、フォトバイオリアクターは、以下でより詳しく説明するが、二糖を蓄積するように操作された細胞であって、固体培養担体に付着した前記細胞をさらに含む。いくつかの実施形態において、前記培養担体の表面の一部は、1リットル相当量当たり乾燥バイオマス少なくとも約50グラムの密度で光合成微生物を培養できる。
【0017】
いくつかの実施形態において、培養担体は柔軟性(flexible)である。いくつかの実施形態において、培養担体は1以上の硬質材料を含む。いくつかの実施形態において、フォトバイオリアクターの培養担体は、少なくとも2つの層、すなわち第2層に隣接した第1層を含み、ここで少なくとも2つの層の材料は同一材料または異なる材料である。いくつかの実施形態において、第1層は高表面積の増殖材料を含み、第2層は透過型材料を含む。いくつかの実施形態において、フォトバイオリアクターの培養担体は、可撓的に連結された硬質部分であって、1以上の硬質材料で構成される前記硬質部分を含む。いくつかの実施形態において、フォトバイオリアクターは1つの培養担体を含む。いくつかの実施形態において、フォトバイオリアクターは複数の培養担体を含む。
【0018】
いくつかの実施形態において、培養担体は布を含む。いくつかの実施形態において、布は天然繊維、改質天然繊維、合成繊維またはそれらの組み合わせで構成される。いくつかの実施形態において、布は織物、編物、フェルト、架橋繊維ポリマーのメッシュまたはそれらの組み合わせである。いくつかの実施形態において、天然繊維は、綿、羊毛、アサ、木繊維、他のセルロース系繊維およびそれらの組み合わせからなる群から選択される。いくつかの実施形態において、改質天然繊維は、ニトロセルロース、セルロースアセタート、セルローススルホナート、架橋デンプンおよびそれらの組み合わせからなる群から選択される。いくつかの実施形態において、合成繊維はポリエステル、ポリアクリラート、ポリアミン、ポリアミド、ポリスルホンおよびそれらの組み合わせからなる群から選択される。
【0019】
いくつかの実施形態において、培養担体は吸水性ポリマー(moisuture absorbent polymer)でコーティングされる。いくつかの実施形態において、布、布の繊維または両方は吸水性ポリマーでコーティングされる。いくつかの実施形態において、吸水性ポリマーは寒天、ポリアクリラート、ポリアミド、ポリアミン、ポリエチレングリコール、修飾デンプンおよびそれらの組み合わせからなる群から選択される。
【0020】
いくつかの実施形態において、フォトバイオリアクターの物理的バリアは、固体微粒子および液体に対して少なくとも実質的に不透過性であるが、前記培養担体の表面の一部に隣接する空間を往復するガスまたは蒸気の移動を妨げないばかりでなく、前記培養担体の表面の一部の化学線照射も妨げない。いくつかの実施形態において、湿らせた培養担体が十分な水分を保持するように、物理的バリアは水蒸気に対して十分に不透過性であり、それにより培養中に光合成微生物は適切に水和されたままである。いくつかの実施形態において、バリアは、光合成微生物の培養の少なくとも一部分において、培養担体およびその培養担体上の任意の光合成微生物を密閉し、かつ、取り外し可能(releasably)にシールされるように構成される。いくつかの実施形態において、物理的バリアは柔軟性である。いくつかの実施形態において、物理的バリアは、固体微粒子、液体、ガスおよび蒸気に対して少なくとも実質的に不透過性である第1の部分ならびに、ガスおよび蒸気に対して透過性であるが、固体微粒子および液体に対して少なくとも実質的に不透過性である第2の部分をさらに含む。いくつかの実施形態において、バリアの第2の部分は、少なくとも約5ガーレー秒から約10,000ガーレー秒以下までのガスまたは蒸気交換速度を有する。いくつかの実施形態において、バリアの第2の部分は、オレフィン繊維もしくはポリエチレン繊維材料、ポリテトラフルオロエチレン濾過媒体、セルロース系フィルター材料、ファイバーグラスフィルター材料、ポリエステルフィルター材料、ポリアクリラートフィルター材料、ポリスルホン膜またはナイロン膜を含む選択膜を含む。いくつかの実施形態において、第1の部分は化学線に対して少なくとも実質的に透過性であり、第2の部分は化学線に対して少なくとも実質的に透過性ではなく、第1および第2の部分の、互いに対する配置および少なくとも前記培養担体の表面の一部に対する配置は光合成微生物による光合成を維持するために十分な量の化学線およびガスが交換されるようなものである。
【0021】
いくつかの実施形態において、フォトバイオリアクターは、培養担体と物理的バリアとの間に位置する化学線源をさらに含む。いくつかの実施形態において、物理的バリアは、培養担体と化学線源との間にあり、このような化学線に対し十分に透明であり、培養中に光合成微生物による光合成を可能にするために十分にガス透過性である。
【0022】
いくつかの実施形態において、フォトバイオリアクターは、培養担体上、培養担体内または培養担体上および培養担体内に水、栄養素、またはそれらの組み合わせをさらに含む。いくつかの実施形態において、フォトバイオリアクターは、フォトバイオリアクターを構造物へ取り付けるための1以上の取り付け部分をさらに含む。いくつかの実施形態において、フォトバイオリアクターは、流体供給システム、栄養供給システム、ガス供給システムおよび微生物供給システムの少なくとも1つをさらに含む
【0023】
他の側面は、光合成微生物を培養するための装置を提供する。前記装置は、前述の少なくとも1つのフォトバイオリアクターおよび少なくとも1つのフォトバイオリアクターの少なくとも1つの培養担体が非水平に向いた少なくとも1つのフォトバイオリアクターが取り付けられる構造物を含む。いくつかの実施形態において、少なくとも1つのフォトバイオリアクターは構造物から吊り下げられる。いくつかの実施形態において、構造物は物理的バリアによって実質的におおわれる。いくつかの実施形態において、構造物は、コンベヤシステムの経路に沿って少なくとも1つの培養担体を運搬することができるようにコンベヤシステムまたはその構成要素を含む。いくつかの実施形態において、装置は、以下の1つ、2つまたは3つ:各培養担体をコンベヤシステムの経路に沿って運搬しながら光合成微生物を接種できる接種ステーション;各培養担体をコンベヤシステムの経路に沿って運搬しながら、接種された各培養担体上の光合成微生物を培養するための培養ステーション;および培養した光合成微生物の少なくとも一部を各培養担体から収穫するために培養担体が運ばれる収穫ステーションをさらに含む。いくつかの実施形態において、接種ステーションおよび収穫ステーションは、実質的に互いに隣接しているかまたは実質的に同延である。いくつかの実施形態において、装置は、各培養担体上の光合成微生物による発酵性糖の合成を誘導するための誘導ステーションをさらに含む。いくつかの実施形態において、装置は、流体供給システム、栄養供給システム、ガス供給システムまたは微生物供給システムの少なくとも1つをさらに含む。いくつかの実施形態において、装置は、固体培養担体上に付着した光合成微生物をさらに含む。いくつかの実施形態において、装置は、以下でより詳しく説明するが、二糖を蓄積するように操作された細胞であって、固体培養担体に付着した前記細胞をさらに含む。
【0024】
他の側面は、二糖を蓄積するように操作されたトランスジェニック光合成微生物細胞を提供する。トランスジェニック光合成微生物細胞は、転写の5’から3’の方向に作動可能に連結された構成要素として:光合成微生物細胞において機能するプロモーター;二糖リン酸シンターゼおよび二糖リン酸ホスファターゼからなる群から選択される、二糖生合成活性を有するポリペプチドをコードするヌクレオチド配列を含むポリヌクレオチド;ならびに転写終結配列;を含み、ここで前記トランスジェニック光合成微生物細胞は、前記DNA構築物を含まない光合成微生物細胞と比較して増加したレベルの二糖を蓄積する。
【0025】
いくつかの実施形態において、トランスジェニック光合成微生物細胞は、二糖リン酸シンターゼ活性を有するポリペプチドをコードする第1ヌクレオチド配列および二糖リン酸ホスファターゼ活性を有するポリペプチドをコードする第2ヌクレオチド配列を含むポリヌクレオチドを含む。いくつかの実施形態において、二糖リン酸シンターゼ活性および二糖リン酸ホスファターゼ活性を有するポリペプチドをコードするヌクレオチド配列を含むポリヌクレオチドを含む。いくつかの実施形態において、二糖リン酸シンターゼ活性を有するポリペプチドをコードする第1ヌクレオチド配列;二糖リン酸ホスファターゼ活性を有するポリペプチドをコードする第2ヌクレオチド配列;ならびに二糖リン酸シンターゼ活性および二糖リン酸ホスファターゼ活性を有するポリペプチドをコードする第3ヌクレオチド配列を含む。
【0026】
いくつかの実施形態において、トランスジェニック光合成微生物細胞のポリヌクレオチドは、(a)スクロースリン酸シンターゼおよびスクロースリン酸ホスファターゼ(ASF)活性を有する配列番号2またはそれに95%同一の配列;スクロースリン酸シンターゼ(SPS)活性を有する配列番号4またはそれに95%同一の配列;スクロースリン酸ホスファターゼ(SPP)活性を有する配列番号6またはそれに95%同一の配列;トレハロースリン酸シンターゼ(TPS)活性を有する配列番号77またはそれに95%同一の配列;トレハロースリン酸ホスファターゼ(TPP)活性を有する配列番号79またはそれに95%同一の配列;グルコシルグリセロールリン酸シンターゼ(GPS)活性を有する配列番号81またはそれに95%同一の配列;グルコシルグリセロールリン酸ホスファターゼ(GPP)活性を有する配列番号83またはそれに95%同一の配列;マンノシルフルクトースリン酸シンターゼ(MPS)活性を有する配列番号85またはそれに95%同一の配列;およびマンノシルフルクトースリン酸ホスファターゼ(MPP)活性を有する配列番号87またはそれに95%同一の配列;からなる群から選択されるポリペプチドをコードするヌクレオチド配列を含むポリヌクレオチド、
(b)スクロースリン酸シンターゼ/スクロースリン酸ホスファターゼ(ASF)活性をコードする配列番号1またはそれに95%同一の配列;スクロースリン酸シンターゼ(SPS)活性をコードする配列番号3またはそれに95%同一の配列;スクロースリン酸ホスファターゼ(SPP)活性をコードする配列番号5またはそれに95%同一の配列;トレハロースリン酸シンターゼ(TPS)活性をコードする配列番号76またはそれに95%同一の配列;トレハロースリン酸ホスファターゼ(TPP)活性をコードする配列番号78またはそれに95%同一の配列;グルコシルグリセロールリン酸シンターゼ(GPS)活性をコードする配列番号80またはそれに95%同一の配列;グルコシルグリセロールリン酸ホスファターゼ(GPP)活性をコードする配列番号82またはそれに95%同一の配列;マンノシルフルクトースリン酸シンターゼ(MPS)活性をコードする配列番号84またはそれに95%同一の配列;およびマンノシルフルクトースリン酸ホスファターゼ(MPP)活性をコードする配列番号86またはそれに95%同一の配列;を含む単離されたポリヌクレオチド;(c)単離されたポリヌクレオチドがASF活性を有するポリペプチドをコードする配列番号1;単離されたポリヌクレオチドがSPS活性を有するポリペプチドをコードする配列番号3;単離されたポリヌクレオチドがSPP活性を有するポリペプチドをコードする配列番号5;単離されたポリヌクレオチドがTPS活性を有するポリペプチドをコードする配列番号76;単離されたポリヌクレオチドがTPP活性を有するポリペプチドをコードする配列番号78;単離されたポリヌクレオチドがGPS活性を有するポリペプチドをコードする配列番号80;単離されたポリヌクレオチドがGPP活性を有するポリペプチドをコードする配列番号82;単離されたポリヌクレオチドがMPS活性を有するポリペプチドをコードする配列番号84;単離されたポリヌクレオチドがMPP活性を有するポリペプチドをコードする配列番号86;からなる群から選択される核酸配列とストリンジェントな条件下でハイブリダイズする単離されたポリヌクレオチドであって、前記ストリンジェントな条件が6X SSC(0.9M塩化ナトリウムおよび0.09Mクエン酸ナトリウム)を含む溶液中65℃でのインキュベーションを含む前記単離されたポリヌクレオチド;ならびに(d)(a)、(b)または(c)のポリヌクレオチド配列に相補的な単離されたポリヌクレオチドからなる群から選択される。
【0027】
いくつかの実施形態において、蓄積された二糖モノマーは細胞にとって内因性である。いくつかの実施形態において、蓄積された二糖のモノマー(単数または複数)は細胞にとって外因性であり、細胞にこのようなモノマー(単数または複数)の発現が操作される。
【0028】
いくつかの実施形態において、細胞は、光合成細菌であるシアノバクテリア細胞;または緑藻である。いくつかの実施形態において、細胞はシアノバクテリア細胞である。いくつかの実施形態において、細胞は、シネココッカス(Synechococcus)およびシネコシスチスからなる群から選択されるシアノバクテリアである。
【0029】
いくつかの実施形態において、プロモーターは誘導性プロモーターである。いくつかの実施形態において、プロモーターは、温度、pH、代謝物、光、浸透圧剤、重金属および抗生物質からなる群から選択される誘導剤で誘導できる。いくつかの実施形態において、プロモーターは、carB、nirA、psbAII、dnaK、kaiAおよびλPRからなる群から選択される。
【0030】
いくつかの実施形態において、細胞のDNA構築物は、配列番号19(asfをコードするpLybAL11);配列番号20(asfをコードするpLybAL12);配列番号44(asfをコードするpLybAL15);配列番号45(asfをコードするpLybAL16);配列番号46(asfをコードするpLybAL17);配列番号47(asfをコードするpLybAL18);配列番号48(asfをコードするpLybAL19);配列番号49(asfをコードするpLybAL21);配列番号50(asfをコードするpLybAL22);配列番号51(asfをコードするpLybAL13f);配列番号52(asfをコードするpLyAL13r);配列番号53(asfをコードするpLybAL14f);配列番号54(asfをコードするpLybAL14r);配列番号65(asfをコードするpLybAL7f);配列番号69(asfをコードするpLybAL8f);配列番号118(tpsおよびtppをコードするpLybAL23);配列番号121(tpsおよびtppをコードするpLybAL28);配列番号122(tpsおよびtppをコードするpLybAL29);配列番号123(tpsおよびtppをコードするpLybAL30);配列番号124(tpsおよびtppをコードするpLybAL31);配列番号125(tpsおよびtppをコードするpLybAL36);配列番号126(tpsおよびtppをコードするpLybAL37);配列番号130(tpsおよびtppをコードするpLybAL24);ならびに配列番号133(tpsおよびtppをコードするpLybAL33)からなる群から選択されるヌクレオチド配列を含む。
【0031】
いくつかの実施形態において、細胞は、1分当たり乾燥バイオマス1グラム当たり二糖を少なくとも約0.1マイクログラム蓄積する。いくつかの実施形態において、細胞は、1分当たり乾燥バイオマス1グラム当たり二糖を少なくとも約0.1マイクログラムから最大1分当たり乾燥バイオマス1グラム当たり二糖を約10マイクログラムまで蓄積する。
【0032】
いくつかの実施形態において、配列番号70、配列番号72および配列番号74またはそれらに対する少なくとも95%の同一性およびインベルターゼ活性もしくはスクラーゼフェリドキシン(sucraseferridoxin)活性を有するそれらのヌクレオチドバリアントからなる群から選択されるヌクレオチド配列を細胞は含まない。いくつかの実施形態において、配列番号71、配列番号73および配列番号75またはそれらに対する少なくとも95%の同一性およびインベルターゼ活性もしくはスクラーゼフェリドキシン活性を有するそれらのポリペプチドバリアントからなる群から選択されるポリペプチド配列を細胞は発現しない。いくつかの実施形態において、配列番号70、配列番号72および配列番号74またはそれらに対する少なくとも95%の同一性およびインベルターゼ活性もしくはスクラーゼフェリドキシン活性を有するそれらのヌクレオチドバリアントからなる群から選択されるヌクレオチド配列に特異的な低分子干渉RNAを細胞は発現する。
【0033】
いくつかの実施形態において、細胞は、活性ポリンポリペプチドをコードする配列番号94またはそれに95%同一の配列を含む単離されたポリヌクレオチド;配列番号95またはそれに95%同一の配列を含みポリン活性を有するポリペプチドをコードする単離されたポリヌクレオチド;または配列番号91(ポリンをコードするpLybAL32)を含む単離されたポリヌクレオチド;をさらに含み、ここで蓄積された二糖はスクロースであり、細胞はポリンを発現し、発現されたポリンは、蓄積されたスクロースを細胞から分泌させる。
【0034】
他の側面は、人工DNA構築物を提供する。いくつかの実施形態において、人工DNA構築物は、配列番号19(asfをコードするpLybAL11);配列番号20(asfをコードするpLybAL12);配列番号44(asfをコードするpLybAL15);配列番号45(asfをコードするpLybAL16);配列番号46(asfをコードするpLybAL17);配列番号47(asfをコードするpLybAL18);配列番号48(asfをコードするpLybAL19);配列番号49(asfをコードするpLybAL21);配列番号50(asfをコードするpLybAL22);配列番号51(asfをコードするpLybAL13f);配列番号52(asfをコードするpLyAL13r);配列番号53(asfをコードするpLybAL14f);配列番号54(asfをコードするpLybAL14r);配列番号65(asfをコードするpLybAL7f);配列番号69(asfをコードするpLybAL8f);配列番号118(tpsおよびtppをコードするpLybAL23);配列番号121(tpsおよびtppをコードするpLybAL28);配列番号122(tpsおよびtppをコードするpLybAL29);配列番号123(tpsおよびtppをコードするpLybAL30);配列番号124(tpsおよびtppをコードするpLybAL31);配列番号125(tpsおよびtppをコードするpLybAL36);配列番号126(tpsおよびtppをコードするpLybAL37);配列番号130(tpsおよびtppをコードするpLybAL24);配列番号133(tpsおよびtppをコードするpLybAL33);配列番号91(ポリンをコードするpLybAL32);配列番号102(SS-UPPをコードするpLybAL3f);配列番号103(SE-UPPをコードするpLybAL5f);配列番号106(SE-UPPをコードするpLybAL4f);配列番号107(SE-UPPをコードするpLybAL9f);配列番号109(SE-UPPをコードするpLybAL6fb);配列番号110(SE-UPPをコードするpLybAL10fb);および配列番号91(ポリンをコードするpLybAL32)からなる群から選択される少なくとも1つの配列を含む。
【0035】
他の側面は、光合成微生物の培養方法を提供する。光合成微生物の培養方法は、前述のフォトバイオリアクターまたは装置のいずれかを用いることができる。前記方法は、培養担体に光合成微生物を接種し;接種された培養担体で光合成微生物を培養し;培養担体から培養した光合成微生物の少なくとも一部を収穫することを含む。いくつかの実施形態において、前記方法は、物理的バリアがシールされている間、光合成微生物の培養の全部または実質的な部分が行われるように、培養担体の接種後にフォトバイオリアクターの物理的バリアをシールすることをさらに含む。いくつかの実施形態において、物理的バリアは取り外し可能にシールされている。いくつかの実施形態において、前記方法は、接種ステーション、培養ステーションおよび収穫ステーションに各培養担体を運搬することをさらに含む。いくつかの実施形態において、前記方法は、培養担体に流体を供給すること;培養担体に栄養素を供給すること;または培養担体にガスを供給することの少なくとも1つをさらに含む。いくつかの実施形態において、光合成微生物は、1リットル相当量当たり乾燥バイオマス少なくとも約50グラムの密度まで培養される。いくつかの実施形態において、光合成微生物は、前述のように、二糖を蓄積するように操作されたトランスジェニック光合成微生物を含む。
【0036】
他の側面は、発酵性糖の生産方法を提供する。発酵性糖の生産方法は、前述のフォトバイオリアクターまたは装置のいずれかを使用することができる。発酵性糖の生産方法は、発酵性糖を蓄積できる光合成微生物を培養担体に接種し;接種された培養担体で光合成微生物を培養し;蓄積された発酵性糖を単離することを含む。いくつかの実施形態において、発酵性糖は光合成微生物内に蓄積する。いくつかの実施形態において、蓄積された発酵性糖の単離は、培養担体からの、培養した光合成微生物の少なくとも一部を収穫し;収穫物からの発酵性糖を回収することを含む。いくつかの実施形態において、蓄積された発酵性糖は、光合成微生物から分泌され、培養培地から単離される。いくつかの実施形態において、蓄積された発酵性糖の単離は、培養培地からの蓄積された発酵性糖の単離を含む。いくつかの実施形態において、前記方法は、物理的バリアがシールされている間、光合成微生物の培養の全部または実質的な部分が行われるように、培養担体の接種後にフォトバイオリアクターの物理的バリアを取り外し可能にシールすることをさらに含む。いくつかの実施形態において、前記方法は、培養担体に流体を供給すること;培養担体に栄養素を供給すること;または培養担体にガスを供給することの少なくとも1つをさらに含む。いくつかの実施形態において、前記方法は、接種ステーション、培養ステーションおよび収穫ステーションの少なくとも1つに各培養担体を運搬することをさらに含む。
【0037】
いくつかの実施形態において、前記方法は、光合成微生物による発酵性糖の合成の誘導をさらに含む。いくつかの実施形態において、発酵性糖の合成の誘導は、温度、pH、代謝物、光、浸透圧剤、重金属および抗生物質からなる群から選択される誘導剤に光合成微生物を暴露することを含む。いくつかの実施形態において、発酵性糖の合成の誘導は、光合成微生物を塩化合物で処理することを含む。いくつかの実施形態において、塩化合物は塩化ナトリウムである。いくつかの実施形態において、塩化合物は約0.01mM〜1.5Mまたは約0.2〜0.9Mの濃度で添加される。いくつかの実施形態において、誘導剤はエアゾールスプレーによって増殖表面に塗布される。いくつかの実施形態において、光合成微生物は、1リットル相当量当たり乾燥バイオマス少なくとも約50グラムの密度まで培養される。いくつかの実施形態において、発酵性糖は、グルコース、フルクトース、スクロース、トレハロース、グルコシルグリセロールおよびマンノシルフルクトースからなる群から選択される少なくとも1つの糖を含む。いくつかの実施形態において、発酵性糖はスクロースおよびトレハロースからなる群から選択される少なくとも1つの糖を含む。
【0038】
いくつかの実施形態において、光合成微生物は天然に存在する光合成微生物を含む。いくつかの実施形態において、光合成微生物は遺伝子改変光合成微生物を含む。いくつかの実施形態において、光合成微生物はシアノバクテリアを含む。いくつかの実施形態において、光合成微生物は、シネココッカスまたはシネコシスチスからなる群から選択されるシアノバクテリアを含む。いくつかの実施形態において、光合成微生物は、前述のように、二糖を蓄積するように操作されたトランスジェニック光合成微生物を含む。
【0039】
下文において、他の対象および特徴が部分的に明らかにされ、部分的に指摘される。
【図面の簡単な説明】
【0040】
下記の図面が単に例示を目的としたものであることは、当業者には明らかであろう。これらの図面は、本教示の範囲をなんら限定するものではない。
【0041】
【図1】固体培養担体、透明な外部保護バリア層、選択パネル、再シール可能なクロージャーおよび装置を吊り下げるための支持要素を含む、本発明のフォトバイオリアクターの正面図である。
【図2】固体培養担体、透明な外部保護バリア層、選択パネル、再シール可能なクロージャーおよび装置を吊り下げるための支持要素を含む、本発明のフォトバイオリアクターの側面図である。
【図3】フォトバイオリアクター農場を構成するための、共通の接種および収穫センターから放射状に外に広げられた複数の閉ループコンベヤシステムに沿った本発明の複数のフォトバイオリアクターまたは培養担体の配置を示す図である。
【図4】シアノバクテリアにおけるスクロースの光合成生産を示すイラストである。
【図5】シネコシスチス種PCC 6803(Ssp6803)スクロースリン酸シンターゼ(SPS)およびスクロースリン酸ホスファターゼ(SPP)タンパク質とシネココッカス・エロンガタスPCC 7942(Selo7942)活性融合SPS/SPP(ASF)とのポリペプチド配列のアラインメントである。Ssp6803は、SPSおよびSPP活性をコードする別々の遺伝子を含む。シネコシスチス種PCC 6803からのSPSタンパク質は、活性部位残基の多くが保存されていないので、おそらく不活性なSPPドメインを含む。カノニカルHAD加水分解酵素の活性部位残基をアラインメントの上部に示し、保存されたアミノ酸には下線を施し、保存されていない残基には二重下線を施した。シネコシスチス種PCC 6803SPSの不活性なSPPドメイン内の8つのアミノ酸挿入はイタリック体で印刷されている。方法論に関するさらなる詳細は、実施例4に示されている。
【図6】pLybAL11の概略図である。pLybAL11はシアノバクテリアDNAのライブラリーの構築およびプロモーター配列の選択を可能にする。プロモーターを含有しないasf遺伝子は、二方向性ターミネーターの後ろにあり、マルチクローニング部位(MCS)によって分離されている。oriVは、大部分のグラム陰性微生物におけるプラスミドの複製を可能にする。oriTは、pRK2013ヘルパープラスミドの助けにより、選択されたシアノバクテリア(または他の微生物)への大腸菌からのプラスミドの接合伝達を可能にする。大腸菌における選択のために、β-ラクタマーゼ遺伝子(bla)が存在している。シアノバクテリアゲノムDNAをMCSにクローニングすることによって、大腸菌内でDNAライブラリーを構築することができる。次いで、接合または直接形質転換によって、シアノバクテリアにプラスミドライブラリーを導入することができる。次いで、クロラムフェニコールアセチルトランスフェラーゼ遺伝子(cat)の発現によるクロラムフェニコールに関する選択によって、活性プロモーターを単離することができる。クロラムフェニコールアセチルトランスフェラーゼ活性に関するアッセイおよびスクロース生産の直接試験の両方によってプロモーターの強度を評価することができる。方法論に関するさらなる詳細は、実施例5に示されている。
【図7】pLybAL12の概略図である。pLybAL12は、asf発現を亢進するための、あらかじめ選択したプロモーターの能力の分析を可能にする。pLybAL12とpLybAL11の間の唯一の差異は、クロラムフェニコールアセチルトランスフェラーゼ遺伝子(cat)の前の活性プロモーターの存在である。PCRによって増幅されたシアノバクテリア染色体DNAから単離された特定のDNA配列をMCSにクローニングすることができる。大腸菌における選択のために、クロラムフェニコールおよびアンピシリンの両方を使用することができる。次いで、接合または直接形質転換によって、プラスミドライブラリーをシアノバクテリアに導入することができる。次いで、クロラムフェニコールアセチルトランスフェラーゼ遺伝子(cat)の発現によるクロラムフェニコールに関する選択によって、プラスミドを含むシアノバクテリアを単離することができる。クロラムフェニコールアセチルトランスフェラーゼ活性に関するアッセイおよびスクロース生産の直接試験の両方によってプロモーターの強度を評価することができる。方法論に関するさらなる詳細は、実施例5に示されている。
【図8】シアノバクテリアプロモーターライブラリーの構築を示すイラストである。方法論に関するさらなる詳細は、実施例8に示されている。
【図9】pSMART-LCKanを示す概略図である。方法論に関するさらなる詳細は、実施例8に示されている。
【図10】シネココッカス・エロンガタスPCC 7942asf内の可能なプロモーターを示す配列表である。シネココッカス・エロンガタスPCC 7942からのasf遺伝子を含む増幅されたPCR産物が示されている。これは、クロラムフェニコール耐性マーカーの上流にクローニングされた。スクロースリン酸シンターゼおよびスクロースリン酸ホスファターゼポリペプチド活性をコードするasf領域は、それぞれ一重下線および二重下線が施されている。全DNA配列領域はイタリック体で示され、上にラベルされている。StartおよびStopは、それぞれ開始コドンおよび終止コドンを示す。SDはシャイン・ダルガノ配列を示す。推定上のプロモーターの-35および-10領域は、グレーで強調表示されている。方法論に関するさらなる詳細は実施例8に示されている。
【図11】シアノバクテリアゲノムにおける遺伝子のマーカーレス欠失のための2ステッププロトコルを示す概略図である。この戦略は、使用されているシアノバクテリア株がそのupp遺伝子を欠失してしまっていることを仮定している。スクロース生合成遺伝子挿入の間に、upp遺伝子は欠失してしまっていると考えられる。欠失の標的とされた目的とする遺伝子を同定しなければならない。出発株は5-フルオロウラシルに耐性を示すが、カナマイシンに感受性を示す。カナマイシン耐性マーカーおよび活性uppを含むカセットの挿入によって遺伝子は完全にまたは部分的に欠失しており、その株はカナマイシンに耐性を示すようになるが、5-フルオロウラシルに感受性を示すようになる。次いで、uppおよびカナマイシン耐性マーカーを除去することができ、株は再度5-フルオロウラシルに耐性を示すようになるが、カナマイシンには感受性になる。方法論に関するさらなる詳細は、実施例12に示されている。
【図12】フォトバイオリアクター実施形態の概略図である。図12Aは正面図を示し、図12Bは側面図を示す。フォトバイオリアクターは、吊り下げ要素(6);培地供給(8);ガス供給(10);増殖表面(2);外部バリア層(7);クイックコネクタ;および産物収穫ライン(9)を含む。
【図13】1つの材料フォーマット(図13A)およびハイブリッド材料フォーマット(図13B)における増殖表面の概略図である。
【発明を実施するための形態】
【0042】
発明の詳細な説明
本願は、発酵性糖蓄積光合成微生物、固相フォトリアクター装置およびそれぞれを用いる方法に関する。
【0043】
発酵性糖蓄積光合成微生物においては、一般に光合成微生物に利用されず、従って培養したバイオマス中に蓄積されることができる二糖(例えば、スクロース、トレハロース)を生産することが好ましいと考えられる。いくつかの実施形態において、光合成微生物は、通常浸透圧ストレス経路に従って生産される二糖(例えば、スクロースまたはトレハロース)を合成するように遺伝子操作され、それにより、浸透圧ストレスの非存在下またはレベル低下において前記二糖が生産される。高等植物と比較して、光合成微生物の増殖は効率がよく、環境影響が少ないので、現行のバイオ燃料製造慣行と比較して、前記方法は持続可能性において重要な改良を提示する。好都合には、前述の二糖合成方法は、本発明のフォトバイオリアクター(単数または複数)内で行われるのに適合されてきた。
【0044】
本明細書記載のフォトバイオリアクターは固体培養担体を用いる。好都合には、少なくとも一部分において、適切な光暴露を提供する困難さは軽減されている。フォトバイオリアクターにおける前述の固体培養担体を用いることにより、工業規模液相バイオリアクターの細胞密度を超える細胞密度(例えば、1リットル相当量当たり乾燥バイオマス200グラムを超える細胞密度)で光合成微生物を培養および増殖させることができる。さらに、本明細書記載のフォトバイオリアクターの種々の実施形態は、従来の工業規模液相フォトバイオリアクターと比較してより少ないエネルギーでより簡単に運転できる。
【0045】
本明細書記載のフォトバイオリアクターの実施形態は、従来の液相フォトバイオリアクターと比較してさらなる利点を提供する。例えば、液体系は、一般的には、光合成微生物の増殖および光合成を維持するために、光合成微生物に適切な濃度/量の二酸化炭素を供給するための特別な装置を必要とする。対照的に、固体培養担体上で微生物を増殖させることによって、比較的簡単で金がかからない方法、例えば周囲の空気への暴露を用いて二酸化炭素を提供できる。さらなる二酸化炭素が所望される場合、例えば、培養担体の周囲の、またはそれに接触している大気(例えば、空気)に二酸化炭素を加えることにより容易に二酸化炭素を供給できる。他の利益は移動の容易さである。液相フォトバイオリアクターは、池(完全に不動である)またはかさのあるタンクまたは管の集合体である可能性がある。対照的に、種々の実施形態において、フォトバイオリアクターは平らで柔軟性であり、それによりそれまたはその多くを積み重ねる、巻き上げる、折りたたむ、および/または類似の方法で形成されて比較的容易に移動することができる。種々の実施形態において、フォトバイオリアクターはシステムから吊り下げられるように形成されることができ、それによりある場所から他の場所へフォトバイオリアクターの1以上のを容易に運送することが可能になる。この移動しやすさは、多数のフォトバイオリアクターの連続式での効率的な取り扱いおよび処理方法を工業規模で可能にするために利用することができる。
【0046】
本願の一側面は、光合成微生物による発酵性糖供給原料の生産方法に関する。好ましくは、発酵性糖は発酵性二糖である。発酵性二糖の例は、限定するものではないが、スクロースおよびトレハロースを含む。発酵性糖は、一般に光合成微生物に利用されない二糖であることができる。例えば、トレハロースは、シアノバクテリアに一般に利用されず、従って、内因性代謝経路による実質的分解を受けずに、培養したバイオマス中に蓄積されることができる。発酵性糖は、光合成微生物に一般に利用される二糖であることができる。一次エネルギー源として用いられない二糖に関しては、内因性代謝経路の存在下であっても、多くの場合、二糖は十分な濃度まで蓄積されることができる。内因性分解経路が標的発酵性糖に特異的な場合、このような活性を低下させるかまたは除去するために光合成微生物を操作することができる。例えば、スクロースを蓄積するように操作されたシアノバクテリアは、スクロースインベルターゼ活性を低下させるかまたは除去するためにさらに操作されることができる。種々の実施形態において、浸透圧またはマトリックス水ストレスに応じて発酵性二糖を合成する光合成微生物株を用いることができる。他の実施形態において、浸透圧ストレスの非存在下またはレベル低下において、発酵性二糖を蓄積するように操作された光合成微生物トランスジェニック株がある。好都合には、前述の発酵性二糖合成方法は、本明細書記載のフォトバイオリアクターなしでも行われるように適合させることができる。
【0047】
高等植物と比較して、光合成微生物の増殖は効率がよく、環境影響が少ないので、現行のバイオ燃料製造慣行と比較して、本明細書記載の組成物、装置および方法は、持続可能性において重要な改良を提示する。
【0048】
光合成微生物
本明細書において、二糖を蓄積するように遺伝子操作された光合成微生物が提供される。光合成微生物は、例えば、シアノバクテリアなどの天然光合成微生物であることもでき、人工光合成細菌などの操作された光合成微生物であることもできる。蓄積された二糖の例は、限定するものではないが、スクロース、トレハロース、グルコシルグリセロールおよびマンノシルフルクトースを含む。種々の実施形態において、所望の二糖の蓄積をもたらすために、宿主光合成微生物(例えば、シアノバクテリア)において、対応するリン酸化モノマーからの所望の二糖の生産に関与するタンパク質(単数または複数)をコードする1以上の遺伝子が操作される。いくつかの実施形態において、二糖を蓄積させるために、宿主光合成微生物の内因性経路が操作される。例えば、シアノバクテリアにおける浸透圧スクロース経路は、浸透圧ストレスの非存在下でスクロースを蓄積するように操作されることができる。いくつかの実施形態において、二糖を蓄積させるために、シアノバクテリアにおける外因性二糖経路が操作される。例えば、大腸菌(E.coli)由来の浸透圧トレハロース経路は、シアノバクテリアにおいてトレハロースを蓄積するように操作されることができる。
【0049】
シンターゼおよびホスファターゼ
所望の二糖に対するシンターゼ活性およびホスファターゼ活性を有するように光合成微生物を形質転換することができる。例えば、シアノバクテリアは、スクロースリン酸シンターゼ活性およびスクロースリン酸ホスファターゼ活性を有するように操作されることができる。他の例として、シアノバクテリアは、トレハロースリン酸シンターゼ活性およびトレハロースリン酸ホスファターゼ活性を有するように操作されることができる。他の例として、シアノバクテリアは、グルコシルグリセロールリン酸シンターゼ活性およびグルコシルグリセロールリン酸ホスファターゼ活性を有するように操作されることができる。他の例として、シアノバクテリアは、マンノシルフルクトースリン酸シンターゼ活性およびマンノシルフルクトースリン酸ホスファターゼ活性を有するように操作されることができる。これらの活性は、他の光合成微生物においても同様に操作されることができると考えられる。
【0050】
シンターゼ活性およびホスファターゼ活性は、シンターゼ活性を有するポリペプチドをコードする1つの遺伝子およびホスファターゼ活性を有するポリペプチドをコードするもう1つの遺伝子の各遺伝子を用いて、またはシンターゼ活性およびホスファターゼ活性の両方をコードする1つの遺伝子を用いて光合成微生物に操作されることができる。例えば、シンターゼ活性およびホスファターゼ活性は融合ポリペプチドに存在することができる。
【0051】
所望の二糖の糖モノマーは、光合成微生物にとって内因性であることもでき、外因性であることもできる。所望の二糖の糖モノマーが内因性である場合、光合成微生物は増加したレベルのこのようなモノマーを生産するように操作されることができる。所望の二糖の糖モノマーが外因性である場合、光合成微生物はこのような外因性モノマーを生産するように操作されることができる。
【0052】
光合成微生物は、ある発生状態の後に、あるいはその様に誘導された後に所望の二糖を継続的に合成し蓄積するように操作されることができる。二糖合成の誘導は、本明細書でさらに詳細に述べるように、コードされるシンターゼおよびホスファターゼと関連する誘導性プロモーターおよび誘導剤の作用に従うことができる。
【0053】
いくつかの実施形態において、本明細書記載の形質転換シアノバクテリアは、1分当たり乾燥バイオマス1グラム当たり二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース)少なくとも約0.1マイクログラムを蓄積することができる。いくつかの実施形態において、形質転換シアノバクテリアは、1分当たり乾燥バイオマス1グラム当たり二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース)少なくとも約0.1から最大約10マイクログラムまでを蓄積することができる。例えば、形質転換シアノバクテリアは、1分当たり乾燥バイオマス1グラム当たり少なくとも約0.2、少なくとも約0.3、少なくとも約0.4、少なくとも約0.5、少なくとも約0.6、少なくとも約0.7、少なくとも約0.8または少なくとも約0.9マイクログラムの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース)を蓄積することができる。他の実施形態において、種々の形質転換光合成微生物は、同様な量の二糖を蓄積する。
【0054】
種々の実施形態は、上記の所定の範囲の値で二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース)を蓄積すると考えられる。例えば、一部の形質転換シアノバクテリアは、1分当たり乾燥バイオマス1グラム当たり少なくとも約0.1から最大約0.9マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);1分当たり乾燥バイオマス1グラム当たり少なくとも約0.1から最大約0.8マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);1分当たり乾燥バイオマス1グラム当たり少なくとも約0.1から最大約0.7マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);などを蓄積することができる。同様に、一部の形質転換シアノバクテリアは、1分当たり乾燥バイオマス1グラム当たり少なくとも約0.2から最大約1.0マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);1分当たり乾燥バイオマス1グラム当たり少なくとも約0.3から最大約1.0マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);1分当たり乾燥バイオマス1グラム当たり少なくとも約0.4から最大約1.0マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);1分当たり乾燥バイオマス1グラム当たり少なくとも約0.5から最大約1.0マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);1分当たり乾燥バイオマス1グラム当たり少なくとも約0.6から最大約1.0マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);1分当たり乾燥バイオマス1グラム当たり少なくとも約0.7から最大約1.0マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);1分当たり乾燥バイオマス1グラム当たり少なくとも約0.8から最大約1.0マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース);または1分当たり乾燥バイオマス1グラム当たり少なくとも約0.9から最大約1.0マイクログラムまでの二糖(例えば、スクロース、トレハロース、グルコシルグリセロールまたはマンノシルフルクトース)を蓄積することができる。宿主細胞における糖蓄積のアッセイ方法は当業者に公知である(例えば、実施例10参照)。
【0055】
宿主
二糖を蓄積するように遺伝子操作された宿主は、任意の光合成微生物であることができる。光合成微生物は、例えば、シアノバクテリアなどの天然光合成微生物であることもでき、人工光合成細菌などの操作された光合成微生物であることもできる。天然光合成微生物であるか、または操作して光合成微生物にすることができる典型的な微生物は、限定するものではないが、細菌;真菌;古細菌;原生生物;微小植物、例えば緑藻;ならびに動物、例えばプランクトン、プラナリアおよびアメーバを含む。天然に存在する光合成微生物の例は、限定するものではないが、スピルリナ・マキシマム、スピルリナ・プラテンシス、ドナリエラ・サリナ、ボトリオコックス・ブラウニイ、クロレラ・ブルガリス、クロレラ・ピレノイドーサ、セレナストルム・カプリコミュータム、セネデスムス・クアドリカウダ、ポルフィリディウム・クルエンタム、セネデスムス・アクタス、ドナリエラ種、セネデスムス・オブリカス、アナベノプシス、アウロシラ、キリンドロスペルムム、シネコッカス(Synechoccus)種、シネコシスチス種および/またはトリポスリックスを含む。
【0056】
好ましくは、宿主光合成微生物はシアノバクテリアである。シアノバクテリア、別名藍藻は幅広い酸素発生型光合成独立栄養生物である。宿主シアノバクテリアは、藍色植物門(Cyanophyta)由来の任意の光合成微生物であることができる。宿主シアノバクテリアは、単細胞形態を有することもできるし、コロニー形態(例えば、フィラメント、シートまたはボール)を有することもできる。好ましくは、宿主シアノバクテリアは単細胞シアノバクテリアである。二糖を蓄積するように操作されることができるシアノバクテリアの例は、限定するものではないが、シネコシスチス、シネココッカス、サーモシネココッカス(Thermosynechococcus)、ノストック(Nostoc)、プロクロロコッカス(Prochlorococcu)、ミクロシスティス(Microcystis)、アナベナ(Anabaena)、スピルリナ(Spirulina)およびグロエオバクター(Gloeobacter)属を含む。好ましくは、宿主シアノバクテリアはシネコシスチス種またはシネココッカス種である。より好ましくは、宿主シアノバクテリアはシネココッカス・エロンガタスPCC 7942(ATCC33912)および/またはシネコシスチス種PCC 6803(ATCC27184)である。
【0057】
スクロース
光合成微生物、例えばシアノバクテリアにおけるスクロースの生合成は、順次に作用するスクロースリン酸シンターゼ(sps)およびスクロースリン酸ホスファターゼ(spp)の2つの酵素活性の触媒作用によって達成できる(例えば、図4参照)。このよう活性は、浸透圧およびマトリックス水ストレスに対する順応としてシアノバクテリアの一部に存在する(例えば、Lunn, J. E. 2002. Plant Physiol 128, 1490-1500)。スクロースが蓄積されるように、これらの活性の一方または両方をシアノバクテリアに操作することができる。
【0058】
スクロースを蓄積するように光合成微生物を操作するための特に興味がある遺伝子は、シネココッカス・エロンガタスPCC 7942からの活性融合SPS/SPP(asf)遺伝子である。asfは、spsおよびsppの両方の生合成機能を有する(例えば、実施例4)。いくつかの実施形態において、ASFをコードするヌクレオチド配列がその天然供給源(例えば、シネココッカス・エロンガタスPCC 7942)からクローニングされ、宿主シアノバクテリアに挿入される(例えば、実施例4〜9参照)。いくつかの実施形態において、形質転換宿主光合成微生物は、配列番号1のasfポリヌクレオチドを含む。いくつかの実施形態において、光合成微生物は配列番号2のポリペプチドをコードするヌクレオチド配列asfで形質転換される。さらなる実施形態において、形質転換宿主光合成微生物は、配列番号1に対して少なくとも約80%の配列同一性を有するヌクレオチド配列または、spsおよびspp活性を有し、配列番号2に対して少なくとも約80%の配列同一性を有するポリペプチドをコードするヌクレオチド配列を含む。例として、シアノバクテリアなどの形質転換宿主光合成微生物は、配列番号1に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するヌクレオチド配列であって、その形質転換宿主がASF、SPSおよび/もしくはSPP活性ならびに/またはスクロースの蓄積を示す前記ヌクレオチド配列を含むことができる。例として、形質転換宿主光合成微生物は、配列番号2に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がASF、SPSおよび/もしくはSPP活性ならびに/またはスクロースの蓄積を示す前記ヌクレオチド配列を含むことができる。他の例として、形質転換宿主光合成微生物は、配列番号1に対してストリンジェントな条件下で配列番号1の全長にわたってハイブリダイズし、活性融合SPS/SPP(ASF)ポリペプチドをコードするヌクレオチド配列を含むことができる。さらなる例として、形質転換宿主光合成微生物は、上記配列のいずれかに対する相補鎖を含むことができる。
【0059】
いくつかの実施形態において、スクロースリン酸シンターゼ(sps)(例えば、sps遺伝子をコードする配列番号3およびSPSポリペプチドをコードする配列番号4参照)またはそのホモログが、形質転換光合成微生物において発現されるかまたは過剰発現されるように操作される。例えば、光合成微生物は、スクロースリン酸シンターゼを発現するように、配列番号3の配列を有するヌクレオチドで形質転換されることができる。他の例として、光合成微生物は、スクロースリン酸シンターゼを有するポリペプチドをコードする配列番号3に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の同一性パーセントを有するヌクレオチドで形質転換されることができる。他の例として、形質転換宿主光合成微生物は、配列番号4に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がSPS活性および/またはスクロースの蓄積を示す前記ヌクレオチド配列を含むことができる。
【0060】
いくつかの実施形態において、スクロースリン酸ホスファターゼ(spp)(例えば、spp遺伝子をコードする配列番号5およびSPPポリペプチドをコードする配列番号6を参照のこと)またはそのホモログが、形質転換光合成微生物において発現されるかまたは過剰発現されるように操作される。例えば、シアノバクテリアなどの光合成微生物は、スクロースリン酸ホスファターゼを発現するように、配列番号5の配列を有するヌクレオチドで形質転換されることができる。他の例として、光合成微生物は、スクロースリン酸ホスファターゼ活性を有するポリペプチドをコードする配列番号5に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%同一性パーセントを有するヌクレオチドで形質転換されることができる。他の例として、形質転換宿主光合成微生物は、配列番号6に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がSPP活性および/またはスクロースの蓄積を示す前記ヌクレオチド配列を含むことができる。
【0061】
いくつかの実施形態において、光合成微生物はASF、SPS、および/またはSPPの1以上を発現するように操作される。例えば、シアノバクテリアなどの光合成微生物は、ASFおよびSPS;ASFおよびSPP;SPSおよびSPP;またはASF、SPSおよびSPPを発現するように操作されることができる。
【0062】
トレハロース
トレハロースの生合成は、順次に作用するトレハロースリン酸シンターゼ(tps)およびトレハロースリン酸ホスファターゼ(tpp)の2つの酵素活性の触媒作用により達成できる。光合成微生物において、トレハロースが蓄積されるように、これらの活性の一方または両方が操作されることができる。トレハロースの生合成は、シアノバクテリアなどの一部の光合成微生物においては天然に生じない。
【0063】
いくつかの実施形態において、トレハロースリン酸シンターゼ(tps)(例えば、tps遺伝子をコードする配列番号76およびTPSポリペプチドをコードする配列番号77を参照のこと)またはそのホモログが、形質転換光合成微生物において発現されるかまたは過剰発現されるように操作される。例えば、シアノバクテリアなどの光合成微生物は、トレハロースリン酸シンターゼを発現するように、配列番号76の配列を有するヌクレオチドで形質転換されることができる。他の例として、光合成微生物は、トレハロースリン酸シンターゼを有するポリペプチドをコードする配列番号76に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の同一性パーセントを有するヌクレオチドで形質転換されることができる。他の例として、形質転換宿主光合成微生物は、配列番号77に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がTPS活性および/またはトレハロースの蓄積を示す前記ヌクレオチド配列を含むことができる。
【0064】
いくつかの実施形態において、トレハロースリン酸ホスファターゼ(tpp)(例えば、tpp遺伝子をコードする配列番号78およびTPPポリペプチドをコードする配列番号79を参照のこと)またはそのホモログが操作され、形質転換光合成微生物において発現されるかまたは過剰発現される。例えば、シアノバクテリアなどの光合成微生物は、トレハロースリン酸ホスファターゼを発現するように、配列番号78の配列を有するヌクレオチドで形質転換されることができる。他の例として、光合成微生物は、トレハロースリン酸ホスファターゼ活性を有するポリペプチドをコードする配列番号78に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の同一性パーセントを有するヌクレオチドで形質転換されることができる。他の例として、形質転換宿主光合成微生物は、配列番号79に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がTPP活性および/またはトレハロースの蓄積を示す前記ヌクレオチド配列を含むことができる。
【0065】
グルコシルグリセロール
いくつかの実施形態において、グルコシルグリセロールリン酸シンターゼ(gps)(例えば、gps遺伝子をコードする配列番号80およびGPSポリペプチドをコードする配列番号81を参照のこと)またはそのホモログが、形質転換光合成微生物において発現されるかまたは過剰発現されるように操作される。例えば、シアノバクテリアなどの光合成微生物は、グルコシルグリセロールリン酸シンターゼを発現するように、配列番号80の配列を有するヌクレオチドで形質転換されることができる。他の例として、光合成微生物は、グルコシルグリセロールリン酸シンターゼを有するポリペプチドをコードする配列番号80に対して、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%同一性パーセントを有するヌクレオチドで形質転換されることができる。他の例として、形質転換宿主光合成微生物は、配列番号81に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がGPS活性および/またはグルコシルグリセロールの蓄積を示す前記ヌクレオチド配列を含むことができる。
【0066】
いくつかの実施形態において、グルコシルグリセロールリン酸ホスファターゼ(gpp)(例えば、gpp遺伝子をコードする配列番号82およびGPPポリペプチドをコードする配列番号83を参照のこと)またはそのホモログが、形質転換光合成微生物において発現されるかまたは過剰発現されるように操作される。例えば、シアノバクテリアなどの光合成微生物は、グルコシルグリセロールリン酸ホスファターゼを発現するように、配列番号82の配列を有するヌクレオチドで形質転換されることができる。他の例として、光合成微生物は、グルコシルグリセロールリン酸ホスファターゼ活性を有するポリペプチドをコードする配列番号82に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%同一性パーセントを有するヌクレオチドで形質転換されることができる。他の例として、形質転換宿主光合成微生物は、配列番号83に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がGPP活性および/またはグルコシルグリセロールの蓄積を示す前記ヌクレオチド配列を含むことができる。
【0067】
マンノシルフルクトース
いくつかの実施形態において、マンノシルフルクトースリン酸シンターゼ(mps)(例えば、mps遺伝子をコードする配列番号84およびMPSポリペプチドをコードする配列番号85を参照のこと)またはそのホモログが、形質転換光合成微生物において発現されるかまたは過剰発現されるように操作される。例えば、シアノバクテリアなどの光合成微生物は、マンノシルフルクトースリン酸シンターゼを発現するように、配列番号84の配列を有するヌクレオチドで形質転換されることができる。他の例として、光合成微生物は、マンノシルフルクトースリン酸シンターゼを有するポリペプチドをコードする配列番号84に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の同一性パーセントを有するヌクレオチドで形質転換されることができる。他の例として、形質転換宿主光合成微生物は、配列番号85に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がMPS活性および/またはマンノシルフルクトースの蓄積を示す前記ヌクレオチド配列を含むことができる。
【0068】
いくつかの実施形態において、マンノシルフルクトースリン酸ホスファターゼ(mpp)(例えば、mpp遺伝子をコードする配列番号86およびMPPポリペプチドをコードする配列番号87を参照のこと)またはそのホモログが、形質転換光合成微生物において発現されるかまたは過剰発現されるように操作される。例えば、シアノバクテリアなどの光合成微生物は、マンノシルフルクトースリン酸ホスファターゼを発現するように、配列番号86の配列を有するヌクレオチドで形質転換されることができる。他の例として、光合成微生物は、マンノシルフルクトースリン酸ホスファターゼ活性を有するポリペプチドをコードする配列番号86に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%同一性パーセントを有するヌクレオチドで形質転換されることができる。他の例として、形質転換宿主光合成微生物は、配列番号87に対して少なくとも約85%、少なくとも約90%、少なくとも約95%または少なくとも約99%の配列同一性を有するポリペプチドをコードするヌクレオチド配列であって、その形質転換宿主がMPP活性および/またはマンノシルフルクトースの蓄積を示す前記ヌクレオチド配列を含むことができる。
【0069】
分子工学
バリアントヌクレオチドの設計、作成および試験ならびに、asf配列に対する上記の所望される同一性パーセントを有し、発現タンパク質の所望される活性および/または糖蓄積表現型を保持する、バリアントヌクレオチドによりコードされるポリペプチドは、当業者の技術の範囲内である。例えば、進化分子工学(directed evolution)および変異体の迅速な単離は、限定するものではないが、Link et al. (2007) Nature Reviews 5(9), 680-688; Sanger et al. (1991) Gene 97(1), 119-123; Ghadessy et al. (2001) Proc Natl Acad Sci USA 98(8) 4552-4557を含む参考文献に記載されている方法に従うことができる。このように、当業者は、例えば本明細書記載の参照配列に対して少なくとも95〜99%の同一性を有する多数のヌクレオチド(例えば、asf、sps、spp、tps、tpp、gps、gpp、mps、もしくはmpp)および/またはポリペプチド(例えば、ASF、SPS、SPP、TPS、TPP、GPS、GPP、MPSもしくはMPP)バリアントを作成し、当該技術分野でルーチンな方法に従って、二糖蓄積を含む表現型に関してこれらをスクリーニングすることができる。一般に、所望される活性が保持される限りは、任意の位置で同類置換を行うことができる。
【0070】
ヌクレオチドおよび/またはアミノ酸配列の同一性パーセント(%)は、2つの配列がアラインメントされるとき、参照配列と比較して、候補配列におけるヌクレオチドまたはアミノ酸残基と同一なヌクレオチドまたはアミノ酸残基の百分率として理解される。同一性パーセントを決定するために、配列をアラインメントし、必要に応じてギャップを挿入して最大配列同一性パーセントを得る。同一性パーセントを決定するための配列のアラインメント手順は当業者に公知である。多くの場合、配列をアラインメントするために、BLAST、BLAST2、ALIGN2またはMegalign(DNASTAR)ソフトウェアなどの公表されているコンピュータソフトウェアが用いられる。当業者は、比較される配列の完全長に関する最大アラインメントを得るために必要な任意のアルゴリズムを含む、アラインメントを測定するための適切なパラメータを決定することができる。配列がアラインメントされる場合、所定の配列Bへの、との、またはに対する所定の配列Aの配列同一性パーセント(所定の配列Bへの、との、またはに対して特定の配列同一性パーセントを有するまたは含む所定の配列Aと言い換えることもできる)は、以下で算出できる:
配列同一性パーセント=X/Y100
(式中、Xは、AとBとの、配列のアラインメントプログラムまたはアルゴリズムのアラインメントにより一致としてスコアされる残基数であり、YはBにおける残基総数である)。配列Aの長さが配列Bの長さと等しくない場合、Bに対するAの配列同一性パーセントは、Aに対するBの配列同一性パーセントとは等しくない。
【0071】
“高ストリンジェントなハイブリダイゼーション条件”は、6X SSC緩衝液(すなわち、0.9M塩化ナトリウムおよび0.09Mクエン酸ナトリウム)における65℃でのハイブリダイゼーションと定義される。これらの条件が与えられれば、2つの配列間の二本鎖DNAの融解温度(Tm)を算出することにより、所定の配列の組がハイブリダイズするかどうかについて決定できる。特定の二本鎖が、6X SSCの塩条件下で65℃よりも低い融解温度を有する場合、これらの2つの配列はハイブリダイズしない。他方では、同じ塩条件下で融解温度が65℃より上の場合、これらの配列はハイブリダイズする。一般に、任意のハイブリダイズしたDNA:DNA配列の融解温度は、次式:
Tm=81.5℃+16.6(log10[Na+])+0.41(G/C含量分数)-0.63(%ホルムアミド)-(600/l)
を用いて決定できる。さらにまた、DNA:DNAハイブリッドのTmは、ヌクレオチドの同一性が1%減少するごとに1〜1.5℃減少する(例えば、Sambrook and Russel, 2006 を参照のこと)。
【0072】
宿主細胞は、当業者に公知の種々の標準法を用いて形質転換されることができる(例えば、Sambrook and Russel (2006) Condensed Protocols from Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, ISBN-10: 0879697717; Ausubel et al. (2002) Short Protocols in Molecular Biology, 5th ed., Current Protocols, ISBN-10: 0471250929; Sambrook and Russel (2001) Molecular Cloning: A Laboratory Manual, 3d ed., Cold Spring Harbor Laboratory Press, ISBN-10: 0879695773; Elhai, J. and Wolk, C. P. 1988. Methods in Enzymology 167, 747-754 を参照のこと)。このような技術は、限定するものではないが、ウイルス感染、リン酸カルシウムトランスフェクション、リポソーム媒介トランスフェクション、マイクロプロジェクタイル送達、受容体媒介性取り込み、細胞融合、エレクトロポレーションなどを含む。トランスフェクトされた細胞を選択し、増殖させて、宿主細胞ゲノムに安定に組み込まれた発現ベクターを含む組換え宿主細胞を得ることができる。
【0073】
プロモーター
上記したヌクレオチド配列(例えば、asf、sps、spp、tps、tpp、mps、mpp、gps、gpp)の1以上は、宿主光合成微生物において機能しうるプロモーターに作動可能に連結されることができる。宿主がシアノバクテリアの場合、プロモーターは、シアノバクテリアおよび細菌(大腸菌など)の両方において効率的に機能しうることが好ましい。プロモーターの選択により、種々の条件下で所望の遺伝子産物を発現させることが可能になる。
【0074】
プロモーターは、ベクター構築物が挿入されるシアノバクテリアなどの光合成微生物宿主細胞において最適の機能を発揮するように選択されることができる。プロモーターは、その制御的特徴に基づいて選択されることもできる。このような特徴の例は、転写活性および誘導能の増強を含む。
【0075】
プロモーターは、誘導性プロモーターであることができる。例えば、プロモーターは、温度、pH、ホルモン、代謝物(例えば、ラクトース、マンニトールおよびアミノ酸)、光(例えば、波長特異的)、浸透ポテンシャル(例えば、塩誘導)、重金属または抗生物質によって誘導されることができる。多数の標準的誘導性プロモーターが当業者に公知であろう。
【0076】
いくつかの実施形態において、プロモーターは温度誘導性プロモーターである。例えば、λプロモーターは、シアノバクテリアにおいて機能しうる温度誘導性プロモーターである。驚くべきことに、λプロモーターは、大腸菌内で用いられるときとは異なる温度で機能する。大腸菌内では、λプロモーターは42℃において最も活性が高く、これはシアノバクテリアの通常の生存範囲以上の温度である。一般に、大腸菌内で、λプロモーターは、約30℃から35℃までで約5%〜10%の発現増加をしめし、約37℃においては約20%発現増加を示すが;約37℃から42℃までで約100%の発現増加を示す。シアノバクテリアにおいては、λプロモーターはおよそ30℃〜35℃で最も活性が高く、これはシアノバクテリアの理想的な増殖温度範囲であり、大腸菌内でのλプロモーターの最適発現よりもずっと低い範囲である。従って、λプロモーターは、シアノバクテリアにおいて二糖生合成活性の効果的な発現を提供する。
【0077】
プラスミドに挿入されることができるプロモーターの例は、限定するものではないが、carB、nirA、psbAII、dnaK、kaiAおよびλPRを含む(例えば、実施例6参照)。いくつかの実施形態において、プロモーターは、シアノバクテリアおよび大腸菌の両方において効率的に機能しうる。いくつかの実施形態において、asfコード領域は、前記コード領域を含むプロモーターを含む(例えば、実施例8参照)。例えば、asfコード領域は、asfのSPPドメインの前にプロモーターを含むことができる(例えば、図10参照)。このような内部プロモーターは、asfコード領域の開始部位でのプロモーターの有り無しで存在しうる。
【0078】
用語"キメラ"は、2以上の異なるポリヌクレオチド分子の部分の融合の産物を指すものと解される。"キメラプロモーター"は、既知のプロモーターまたは他のポリヌクレオチド分子の操作により製造されるプロモーターを指すものと解される。このようなキメラプロモーターは、例えば、第1プロモーターからの異種エンハンサードメインを、それ自身の部分的または完全な調節因子を有する第2プロモーターと融合させることにより、1以上のプロモーターまたは調節因子からの、遺伝子発現を付与または調節できるエンハンサードメインを結合することができる。従って、作動可能に連結されたポリヌクレオチド配列の発現を調節するための、本明細書に開示された方法によるキメラプロモーターの設計、構築および使用は本発明に含まれる。
【0079】
多くの方法によって、新規キメラプロモーターを設計することもできるし、操作することもできる。例えば、キメラプロモーターは、第1プロモーターからのエンハンサードメインを第2プロモーターに融合することにより製造できる。得られたキメラプロモーターは、第1または第2プロモーターに対して新規な発現特性を有することができる。新規キメラプロモーターは、第1プロモーターからのエンハンサードメインが、第2プロモーターに対して5’末端部位、3’末端部位または任意の内部位置で融合されるように構築されることができる。
【0080】
構築物
前述の転写可能なポリヌクレオチド分子配列のいずれも構築物で提供できる。本発明の構築物は、一般に、二糖生合成のための、転写可能なポリヌクレオチド分子に作動可能に連結された、シアノバクテリアなどの宿主光合成微生物におけるプロモーター配列(例えば、asf、sps、spp、tps、tpp、mps、mpp、gps、gpp)、例えば配列番号1、3、5、76、78、80、82、84および86ならびに上記のようなそれらのバリアントを含む。
【0081】
典型的なプロモーターは上述した。1以上のさらなるプロモーターもまた組換え構築物で提供できる。これらのプロモーターは、前述の転写可能なポリヌクレオチド分子配列のいずれかに作動可能に連結されることができる。
【0082】
用語"構築物"は、任意の供給源由来の、ゲノム組み込みまたは自律複製できる、1以上のポリヌクレオチド分子が機能的に連結された、すなわち作動可能に連結されたポリヌクレオチド分子を含む任意の組換えポリヌクレオチド分子、例えばプラスミド、コスミド、ウイルス、自律的に複製するポリヌクレオチド分子、ファージまたは線状もしくは環状の一本鎖もしくは二本鎖のDNAもしくはRNAポリヌクレオチド分子を指すものと解される。用語"ベクター"または"ベクター構築物"は、形質転換、すなわちシアノバクテリアなどの宿主光合成微生物への異種DNA導入の目的で使用できる任意の組換えポリヌクレオチド構築物を指すものと解される。
【0083】
さらに、構築物は、限定するものではないが、目的とする遺伝子の非翻訳領域からのさらなるポリヌクレオチド分子を含むことができる。これらのさらなるポリヌクレオチド分子は、構築物に存在する他の配列に対して天然または異種の供給源由来であることができる。
【0084】
プラスミド
いくつかの実施形態において、シアノバクテリアなどの宿主光合成微生物は、プラスミドベースの発現系で形質転換される(例えば、実施例5参照)。好ましくは、目的とする遺伝子をコードするプラスミドは、プロモーター、例えば上記のプロモーターの1以上を含む。プラスミドベースの形質転換については、大腸菌およびシアノバクテリアに両方において機能しうる広い宿主域のプラスミドが好ましく、それらは、よく理解された急速に増殖する便利な系(大腸菌)で働き、最終宿主(シアノバクテリア)に効率的に導入されることができる利点を提供する。いくつかの実施形態において、プラスミドベースの形質転換および染色体組み込みは組み合わせて用いられる。ここでは、遺伝子バリアントの設計および試験のためにプラスミドプロトコルが用いられ、次に、同定されたバリアントの染色体組み込みが行われる。
【0085】
本明細書記載のアプローチに従って開発された宿主株は、当該技術分野で公知の多くの手段で評価できる(例えば、Studier (2005) Protein Expr Purif. 41(1), 207-234; Gellissen, ed. (2005) Production of Recombinant Proteins: Novel Microbial and Eukaryotic Expression Systems, Wiley-VCH, ISBN-10: 3527310363; Baneyx (2004) Protein Expression Technologies, Taylor & Francis, ISBN-10: 0954523253 を参照のこと)。
【0086】
本明細書において、sps、sppおよび/またはasfをコードするプラスミド構築物のためのヌクレオチド配列が提供される。sps、sppおよび/またはasfをコードするプラスミド構築物の例は、限定するものではないが、pLybAL11(配列番号19)(例えば、図6参照)およびpLybAL12(配列番号20)(例えば、図7参照)を含む。本明細書において、tpsおよびtppをコードするプラスミド構築物のためのヌクレオチド配列もまた提供される。tpsおよびtppをコードするプラスミド構築物の例は、限定するものではないが、pLybAL23(配列番号118)を含む。グルコシルグリセロールおよびマンノシルフルクトースなどの他の二糖の蓄積に必要な生合成遺伝子のための同様な構築物を作成できることは、当業者には明らかであろう。
【0087】
いくつかの実施形態において、形質転換宿主光合成微生物は、pLybAL11(配列番号19)またはpLybAL12(配列番号20)を含む。いくつかの実施形態において、形質転換宿主光合成微生物はpLybAL23(配列番号118)を含む。例えば、形質転換シアノバクテリアは、pLybAL11(配列番号19)、pLybAL12(配列番号20)またはpLybAL23(配列番号118)を含むことができる。
【0088】
二糖生合成遺伝子(単数または複数)を含むプラスミド構築物は、プロモーターを含むこともできる。プラスミド構築物の例は、sps、sppおよび/またはasfを含み、プロモーターは、限定するものではないが、pLybAL7f(配列番号65);pLybAL8f(カナマイシン耐性を含む)(配列番号69);pLybAL13f(配列番号51)、pLyAL13r(配列番号52)、pLybAL14f(配列番号53)、pLybAL14r(配列番号54)、pLybAL15(配列番号44)、pLybAL16(配列番号45)、pLybAL17(配列番号46)、pLybAL18(配列番号47)、pLybAL19(配列番号48)、pLybAL21(配列番号49)およびpLybAL22(配列番号50)を含む。プラスミド構築物の例は、tpsおよびtppを含み、プロモーターは、限定するものではないが、pLybAL23(配列番号118)、pLybAL28(配列番号121)、pLybAL29(配列番号122)およびpLybAL30(配列番号123)を含む。グルコシルグリセロールおよびマンノシルフルクトースなどの他の二糖の蓄積に必要な、同様なプロモーターを含む生合成遺伝子のための構築物を作成できることは、当業者には明らかであろう。
【0089】
いくつかの実施形態において、形質転換宿主シアノバクテリアは、pLybAL7f(配列番号65);pLybAL8f(配列番号69);pLybAL13f(配列番号51)、pLyAL13r(配列番号52)、pLybAL14f(配列番号53)、pLybAL14r(配列番号54)、pLybAL15(配列番号44)、pLybAL16(配列番号45)、pLybAL17(配列番号46)、pLybAL18(配列番号47)、pLybAL19(配列番号48)、pLybAL21(配列番号49)およびpLybAL22(配列番号50)を含む。いくつかの実施形態において、形質転換宿主シアノバクテリアは、pLybAL28(配列番号121)、pLybAL29(配列番号122)、pLybAL30(配列番号123)およびpLybAL23(配列番号118)を含む。
【0090】
糖分泌
種々の実施形態において、形質転換二糖蓄積光合成微生物は、蓄積された二糖を細胞内からその増殖環境に分泌することができる。二糖の分泌は、二糖を蓄積するように形質転換した光合成微生物の固有の結果であることもできるし、光合成微生物は分泌するするようにさらに操作されることもできる。例えば、トレハロースを蓄積するように形質転換されたいくつかのシアノバクテリアは、本来細胞からトレハロースを分泌する。(例えば、実施例19〜20参照)。他の例として、スクロースを蓄積するように形質転換されたシアノバクテリアは、細胞からスクロースを分泌するようにさらに操作されることができる(例えば、実施例16参照)。
【0091】
シアノバクテリアなどの宿主光合成微生物は、二糖を分泌するようにさらに操作されることができる。いくつかの実施形態において、形質転換宿主光合成微生物は、操作されて、蓄積された二糖に特異的なポリンを発現する。例えば、スクロースを蓄積するように操作されたシアノバクテリアは、スクロースポリンを発現するように操作されることができる(例えば、実施例16参照)。一実施形態において、形質転換二糖蓄積シアノバクテリアは、配列番号94などのscrY核酸を含む。一実施形態において、形質転換二糖蓄積シアノバクテリアは、配列番号95などのscrYポリペプチドをコードする核酸を含む。一実施形態において、形質転換二糖蓄積シアノバクテリアは、pLybAL32(配列番号91)などのscrYを含むプラスミドを含む。他の光合成微生物または他の標的二糖に、同様なアプローチを適用できることが考えられる。
【0092】
糖分解の調節
いくつかの実施形態において、シアノバクテリアなどの宿主光合成微生物は、分解活性の調節により二糖の生産が改善されるようにさらに操作される(例えば、実施例14参照)。いくつかの実施形態において、形質転換光合成微生物において、インベルターゼホモログはダウンレギュレートされるかまたは除去されることができる。例えば、シネコシスチス種PCC 6803(ヌクレオチド配列配列番号70;ポリペプチド配列配列番号71)からのインベルターゼホモログは、形質転換シアノバクテリアにおいてダウンレギュレートされるかまたは除去されることができる。他の例として、シネココッカス・エロンガタスPCC 7942(ヌクレオチド配列配列番号72;ポリペプチド配列配列番号73)からのインベルターゼホモログは、形質転換シアノバクテリアにおいてダウンレギュレートされるか除去されることができる。いくつかの実施形態において、スクラーゼフェレドキシン様タンパク質は、形質転換シアノバクテリアにおいてダウンレギュレートされるかまたは除去されることができる。例えば、シネコシスチス種PCC 6803からのスクラーゼフェレドキシン様タンパク質(ヌクレオチド配列配列番号74;ポリペプチド配列配列番号75)(Machray G.C. et al. 1994. FEBS Lett 354, 123-127)は、形質転換シアノバクテリアにおいて、ダウンレギュレートされるかまたは除去されることができる。これらの遺伝子は、例えば、図11(例えば、実施例12〜13参照)に記載のマーカーレス欠失プロトコルを用いて欠失させることができる。シアノバクテリアにおいて、他の二糖が蓄積されるように操作される同様なアプローチを用いることができる。
【0093】
上記の遺伝子のダウンレギュレーションまたはサイレンシングの他の方法は当該技術分野で公知である。例えば、二糖分解活性は、アンチセンスオリゴヌクレオチド、タンパク質アプタマー、ヌクレオチドアプタマーおよびRNA干渉(RNAi)によりダウンレギュレートされるかまたは除去されることができる(例えば、低分子干渉RNA(siRNA)、短いヘアピンRNA(shRNA)およびマイクロRNA(miRNA)(例えば、Fanning and Symonds (2006) Handb Exp Pharmacol. 173, 289-303G(ハンマーヘッド型リボザイムおよび低分子ヘアピン型RNAを記載); Helene, C., et al. (1992) Ann. N.Y. Acad. Sci. 660, 27-36; Maher (1992) Bioassays 14(12): 807-15(デオキシリボヌクレオチド配列のターゲッティングを記載);Lee et al. (2006) Curr Opin Chem Biol. 10, 1-8(アプタマーを記載); Reynolds et al. (2004) Nature Biotechnology 22(3), 326 - 330(RNAiを記載); Pushparaj and Melendez (2006) Clinical and Experimental Pharmocology and Physiology 33(5-6), 504-510(RNAiを記載); Dillon et al. (2005) Annual Review of Physiology 67, 147-173(RNAiを記載); Dykxhoorn and Lieberman (2005) Annual Review of Medicine 56, 401-423(RNAiを記載)を参照のこと)。RNAi分子は、種々の供給元から市販されている(例えば,Ambion社(テキサス州);Sigma Aldrich社(ミズーリ州);Invitrogen社)。種々のアルゴリズムを用いるいくつかのsiRNA分子設計プログラムが当業者に公知である(例えば、Cenixアルゴリズム(Ambion社);BLOCK-iT(登録商標)RNAi Designer(Invitrogen社);siRNA Whitehead Institute Design Tools(Bioinofrmatics & Research Computing社)。最適のsiRNA配列を限定するのに影響のある形質は、siRNAの末端におけるG/C含量、siRNAの特定の内部ドメインのTm、siRNAの長さ、CDS(コード領域)内の標的配列の位置および3'オーバーハングのヌクレオチド含量を含む。
【0094】
いくつかの実施形態において、宿主光合成微生物は、細胞からの二糖分泌を促進するようにさらに操作されることができる。例えば、シアノバクテリアは、細胞からのスクロース分泌を促進するようにさらに操作されることができる(例えば、実施例15〜16参照)。低い浸透圧環境においては、スクロースは、高塩環境から低塩環境に移行するとき、一部の微生物により浸透圧保護剤が処理されるように、自動的に細胞から削除されることができる(Schleyer, M., Schmidt, R. and Bakker, E. P. 1993. Arch Microbiol 160, 424-43; Koo, S. P., Higgins, C. F. and Booth, I. R. 1991. J Gen Microbiol 137, 2617-2625; Lamark, T., Styrvold, O. B. and Strgim, A. R. 1992. FEMS Microbiol. Lett 96, 149-154)。スクロースポリンは、形質転換シアノバクテリアにおいて発現されるように操作されることができる(例えば、実施例16参照)。これらの遺伝子をクローニングし、前述の技術に従ってシアノバクテリアを形質転換することができる。このようなアプローチは他の光合成微生物に適用することができる。
【0095】
いくつかの実施形態において、宿主光合成微生物は、宿主の染色体への安定な組み込みで形質転換される。例えば、宿主シアノバクテリアは、宿主の染色体への安定な組み込みで形質転換されることができる(例えば、実施例11〜13参照)。染色体組み込みによって、プラスミドベースの遺伝子発現において時々生じる除去のリスクを冒さないで、標的遺伝子(単数または複数)を微生物に組み込むことが可能になる。染色体組み込みは、標的遺伝子を維持するための抗生物質の必要性を低下させるかまたは除去することもできる。
【0096】
好ましくは、染色体組み込みの戦略は、染色体上のいわゆるupp遺伝子座への遺伝子挿入を標的とする(例えば、実施例11〜13参照)。この部位は、ピリミジン生合成におけるスカベンジャー酵素である酵素ウラシルホスホリボシルトランスフェラーゼ(UPRTase)をコードする。この戦略を用いることにより、非組み込み型微生物を除去できる5-フルオロウラシル(5-FU)による候補選択が可能になる。分離方法は、一般にシアノバクテリア系において用いられる。なぜなら、これらの微生物は、それらの染色体の複数コピーを含むからである(例えば、シネコシスチス種PCC 6803については最大12、シネココッカス・エロンガタスPCC 7942については最大16)。この戦略は、シアノバクテリアにとって特に魅力的である。なぜなら、このアプローチは、分離成功のために選択圧および安定な組み込みに依存する旧来の分離技術の使用を避けることができるからである。スクリーニング剤としての5-FUの使用は、より効率的であることができる。なぜなら、それは、1つの活性upp遺伝子を含む微生物であっても、増殖を阻害できるからである。このように、旧来の技術に必要とされるプロセスと比較して、より少ない世代サイクルで、完全に組み込まれた候補を迅速に選択することができる。
【0097】
固相光合成バイオリアクター
本明細書において、光合成微生物の増殖のための固相培養担体を含む、光合成微生物を培養するためのフォトバイオリアクターが提供される。固相培養担体または固体培養担体または固体担体などは、一般に、液体でもガスでもない培養担体を意味すると解される。担体自体は固体であるが、担体構造物は、それが液体(例えば、増殖培地)、ガスまたは両方を吸収するように選択されることができる。特定の好ましい実施形態において、以下にさらに詳細に説明するように、固体担体は、培養中微生物が使用するための水分を吸収することができる。
【0098】
本明細書記載のフォトバイオリアクター(単数または複数)の種々の実施形態は、光合成微生物の増殖を維持することができる。フォトバイオリアクター中で増殖する光合成微生物は、例えば、シアノバクテリアなどの天然光合成微生物であることもでき、人工光合成細菌などの、操作された光合成微生物であることもできる。天然光合成微生物であるか、または操作されて光合成微生物になることができる典型的な微生物は、限定するものではないが、細菌;真菌;古細菌;原生生物;微小植物、例えば緑藻;ならびに動物、例えばプランクトン、プラナリアおよびアメーバを含む。天然に存在する光合成微生物の例は、限定するものではないが、スピルリナ・マキシマム、スピルリナ・プラテンシス、ドナリエラ・サリナ、ボトリオコックス・ブラウニイ、クロレラ・ブルガリス、クロレラ・ピレノイドーサ、セレナストルム・カプリコミュータム、セネデスムス・クアドリカウダ、ポルフィリディウム・クルエンタム、セネデスムス・アクタス、ドナリエラ種、セネデスムス・オブリカス、アナベノプシス、アウロシラ、キリンドロスペルムム、シネコッカス種、シネコシスチス種および/またはトリポスリックスを含む。
【0099】
好ましくは、バイオリアクターは、前述のように、二糖を蓄積するように形質転換されたシアノバクテリアの接種、増殖、および/または収穫を維持するように構成される。
【0100】
以下にさらに詳細に説明するように、フォトバイオリアクターは開放系であることもできるし、閉鎖系であることもできる。種々の実施形態において、フォトバイオリアクターは、固相培養担体、保護バリア層および吊り下げ要素を含む。フォトバイオリアクターのいくつかの実施形態は、ガス、流体、栄養素、および/または光合成微生物の供給および/または除去のためのシステムを含むことができる。供給システムは、例えば標準的な配管設備であることができる。種々のラインのどれも、クイックコネクト配管設備を含むことができる。フォトバイオリアクターは、例えば、二酸化炭素または通常の大気を供給できるガス供給ラインを備えることができる。フォトバイオリアクターは流体供給ラインを備えることができる。好ましくは、流体供給ラインは、流体(例えば、水)を固相培養担体へ運搬するトリクルシステムまたは滴下システムに接続する。フォトバイオリアクターは、栄養供給ラインを備えることができる。光合成微生物の増殖および維持のための栄養組成物の配合物は、当業者に公知である。いくつかの実施形態において、栄養および流体供給ラインは、例えば流体ベースの栄養混合物を供給するために結合することができる。いくつかの実施形態において、流体供給ラインまたは栄養供給ラインは、液体培地を増殖表面に分配するためのスプレー装置であることができる。このようなスプレー装置においては、フォトバイオリアクターは、例えば外層(バリア層など)と固相培養担体との間にスプレー装置を収納するのに十分な大きさを有する。通例、栄養素は水ベース組成物で供給される。水分および栄養レベルの独立制御を提供するために、異なる水供給ライン(単数または複数)および栄養供給ライン(単数または複数)を提供するのが有利な場合がある。フォトバイオリアクターは、光合成微生物および/または液体懸濁/可溶性産物の回収を提供するための産物収穫ラインを備えることができる。フォトバイオリアクターは、光合成微生物の接種を提供するための接種ラインを備えることができる。いくつかの実施形態において、流体、栄養、および/または接種ラインを結合することができる。
【0101】
固相フォトバイオリアクターの一実施形態は、図1(正面図)および図2(側面図)に示されている。これらの実施形態において、固相培養担体2は保護バリア7によって密閉されている。図2は、固体培養担体が保護バリア7を含む保護バリア層3の間にあることを示している。固体培養担体2は、光合成微生物が培養される表面を提供する。保護バリア7を構成する保護バリア層3は、光合成微生物の増殖を維持するための固体培養担体2の表面に化学線を到達させるために透明である。再シール可能なクロージャー4により、保護バリア7が取り外し可能にシールされることが可能になる。ガスおよび蒸気の交換は、保護バリア7に組み込まれている材料である選択パネル5を介して行われる。フォトバイオリアクター1は、垂直または非水平配向を可能にする支持要素6によって吊り下げられることができる。
【0102】
固相フォトバイオリアクターの他の実施形態を、図12A(正面図)および図12B(側面図)に示す。表面および/または配管の手入れおよび潜在的汚染の最小化に役立つことができるセグメント形式でリアクター1を設計できる。各セグメントは、種々の供給および産物収穫ラインの配管(例えば、クイックコネクト型配管)を介してリアクターに接続することができる。リアクターは、吊り下げ要素6、例えばリアクター1を空間につるし、各セグメントの迅速な手入れを助けるレールによって支えられることができる。外部保護バリア7は、増殖表面2上の光合成を促進する一方で環境汚染および蒸発による水分損失を防ぐ光透過を可能にする透明な材料であることができる。増殖表面2は、水分を保持し、栄養素を供給し、産物を取り除き、および/または光合成微生物の高密度増殖を可能にする材料で構成されることができる。液体培地による表面からの連続フィード/産物収穫を提供する配管により増殖表面2を手入れすることができる。培地管8は、液体が表面2へ染み出る多孔質ホースであることができ、これは重力により増殖表面2を浸透することができる。液体は、リアクター1からの移動のために産物および過剰の液体培地を回収するための収穫管9によってリアクターの底部で収穫することができる。二酸化炭素および空気などのガスは、ガス分散管10によりリアクターに供給できる。ガス供給管10は陽圧環境を提供でき、制御された効率的な方式で増殖に必要なガスを供給することが期待される。ガス供給ライン10は、流入ガス流を加湿することにより、水分損失を最小にするのを助けることもできる。リアクターからの過剰のガスは、ガスの通過が可能であるが、環境汚染を最小化するかまたは除去するための多孔性材料である通気性パネル5(逆側、図示せず)によって排出することができる。供給ライン10によって供給される流入ガスの濾過を通じて、リアクター1の陽圧配置によって汚染が最小化されることが期待される。陽圧はまた、ガス流の内側から外側への経路を提供することによって環境からの汚染を防ぐことができる。
【0103】
図12Bに示す実施形態において、リアクター1の外観が増殖表面に対して1つの配向で示されている。リアクター1から過剰のガスが逃げるのを可能にする通気性パネル5は、増殖表面2を横切ってガスが移動するための経路を提供するために装置の底部の近くに位置することができる。バリア表面7の底部での通気性パネル5の設置はまた、空気に比較して高いその密度から生じる二酸化炭素の分離および蓄積の可能性を最小化または予防する。通気性パネル5の寸法は、培養表面2上の最適の増殖に必要なガス流速に基づいて決定できる。
【0104】
固相培養担体
本明細書記載のフォトバイオリアクターの固相培養担体は、その表面上および/または表面内部で光合成微生物が増殖できる表面を提供する。好ましくは、固相培養担体は、増殖を促進および維持するために、微生物への水分および/または栄養素の提供および/または保持を提供または促進する材料を含む。本発明の実施形態は、培養できる光合成微生物の型または株に限定されない。細胞増殖に望ましい水分量および栄養素の組成物量は、光合成微生物の型または株およびそれが増殖される用途によって異なることは当業者には明らかであろう。光合成微生物の増殖に有害な効果を有する恐れがある材料(またはこれらの材料内または材料上に含まれる物質)は、一般に避けられる。
【0105】
光合成微生物の1つもしくは複数の型または株を培養するために、1つのフォトバイオリアクターを用いることができる。さらにまた、固体培養担体は、培養サイクルの間の滅菌の有り無しで、1つの培養サイクルまたは複数の培養サイクルに適するような材料(単数または複数)を含むことができる。さらにまた、フォトバイオリアクターは、1つのまたは複数の固体担体上で、微生物の1つの型もしくは株または微生物の複数の型もしくは株を培養するように構成されることができる。いくつかの実施形態において、純粋培養の代わりに、種々の光合成微生物の群落または光合成および非光合成微生物の群落を、1つの培養担体上で同時に一緒に増殖させることができる。1つのフォトバイオリアクターはまた、複数の培養担体を含むこともできる。従って、他の実施形態において、1つの保護バリア内の複数の培養担体により、1以上の型または株の光合成微生物を同時に培養することができる。
【0106】
固体培養担体は、好ましくは、比較的多孔性の材料を含む。比較的多孔性の材料は、一般に、増加した表面積を有し、比較的非多孔性の材料よりもより水分を保持するおよび/または吸収することができる。テクスチャ加工のまたはトポグラフィックな表面(単数または複数)を有する固体培養担体もまた好ましい。テクスチャ加工のまたはトポグラフィックな表面は、比較的非テクスチャ加工のまたはなめらかな表面と比較して細胞密度を増強させることができる。担体材料および表面形状の選択は、一般的には、担体への微生物の付着を増加させるように選択されるが、微生物の除去または収穫を妨げないように、微生物があまりきつく付着しないことが一般に望ましい。いくつかの実施形態において、固体培養担体は、微生物の付着および増殖に適した材料を含む。いくつかの実施形態において、固体培養担体は、生物膜形成を低下または除去する材料を含む。
【0107】
本明細書記載のフォトバイオリアクターの固相担体は、当該技術分野で用いられてきた固体担体とは異なると考えられる(例えば、微生物の増殖のために最も一般に用いられる固相担体は寒天である)。寒天は、一般にペトリ皿などの硬質形に注型され、その中でその物理的完全性が維持されるように使用される。なぜなら、寒天は、最小レベルの応力、歪またはその両方を受けるとき、破裂または断裂する傾向があるからである。対照的に、培養担体の種々の実施形態は、十分に丈夫で耐久性があるため、フォトバイオリアクターに用いても、より丈夫で耐久性がある“フレーム”を必要とせずにその物理的完全性を維持することができる。別の言い方をすれば、先行技術は、複合材料が形成されるように、実質的により丈夫で、より耐久性がある材料(例えば、ペトリ皿)と接触した弱い寒天担体の十分な部分を必要とした。従って、フォトバイオリアクターの種々の実施形態の固相担体は、本質的に微生物の培養に適し、十分に丈夫で耐久性がある。
【0108】
固相担体の他の望ましい物理的特性および/または運転パラメータを以下に示す。例えば、担体は、比較的平たく硬質である(プレートのような)こともでき、例えば、ヒンジ、ばね、ワイヤ、糸などによって可撓的に連結された複数の平たく硬質の断片からなることもできる。適切な硬質材料は、限定するものではないが、種々の金属、ポリマー、セラミックスおよびそれらの複合材料を含む。硬質材料は、好ましくは、それに対する光合成微生物の付着を増加させる表面トポグラフィーを有する。さらにまた、硬質材料は、光合成微生物へ水分および/または栄養素を供給する能力を増すために、所望のレベルの多孔性で形成されることができる。さらにまた、硬質材料は、吸収性または高吸水性ポリマー配合物でコーティングされることができる(下記参照)。あるいは、担体は、本質的に布などの柔軟性の材料からなることができる。固相担体に使用する布は、限定するものではないが、場合により吸収性または高吸水性ポリマー配合物でコーティングされた綿、ポリエステルおよび/または綿ポリエステルブレンドを含む。貯蔵、移動または取り扱いのために、培養担体を折り重ねる、撚り合わせる、掛ける、または巻くことが可能になるため、培養担体の柔軟性は極めて有利であることができる。
【0109】
さらに、固相培養担体は、好ましくは、一般的にはオートクレーブ滅菌の間に遭遇する高温(例えば、約120℃以上)で構造的に安定であり、寒天のように溶融しない。従って、一実施形態において、培養担体をオートクレーブ処理で滅菌し、次いでそれを本発明の保護バリア内に入れることができる。他の実施形態において、培養担体を保護バリア内に入れ、次いで全フォトバイオリアクターをオートクレーブ処理することができる。オートクレーブ処理は滅菌のための1方法ではあるが、任意の他の適切な滅菌方法を用いうることは、当業者には明らかであろう。
【0110】
本発明の固体培養担体は、光合成微生物の増殖を維持するのに任意の適切な材料を含むかまたはそれからできていることができる。例えば、担体は、天然材料、改質天然材料、合成材料、またはそれらの任意の組み合わせから構成されることができる。天然材料は、限定するものではないが、綿、羊毛、加工した織り植物繊維および天然多糖(例えば、寒天、デンプン、セルロース誘導体)を含むことができる。改質天然材料は、限定するものではないが、ニトロセルロースまたはセルロースエステルなどの化学修飾した植物繊維に加えて、ポリエステルまたはポリアミド繊維を重ね織りまたはブレンドした天然繊維を含むことができる。合成材料は、限定するものではないが、ナイロン、ファイバーグラス、ポリシロキサン、ポリエステル、ポリオレフィン、ポリアミド、コポリエステルポリエチレン、ポリアクリレートまたはポリスルホナートで構成される繊維を含むことができる。固体培養担体材料のさらなる例は、ワイヤーメッシュ、ポリウレタンフォーム、ポリエチレンフォーム、ガラス状炭素発泡体、ポリエステル/ポリエチレンフォーム、ポリイミドフォーム、ポリイソシアナートフォーム、ポリスチレンフォームおよびポリエーテルフォームまたはそれらの組み合わせを含む。
【0111】
種々の実施形態において、固体培養担体は布である。限定するものではないが、繊維またはポリマーを織る、編む、フェルト化するまたは架橋するなどの方法によって布を形成することができる。布の構築は、ゆるいまたは目の粗いものであることができる。あるいは、布の構築は目のつんだものであることができる。とは言っても、顕著なテクスチャー、表面積、トポグラフィックな変動性、および/または粗さを有する布は、培養担体への光合成微生物の機械的結合または付着をよりもたらすことができ、従って、特に、微生物を担体に接種するプロセスならびに/または微生物を増殖および/または収穫するプロセスの間にフォトバイオリアクターが処理される、移動されるまたはそれ以外の方法で移動される実施形態において好ましい場合がある。好ましくは、大部分の適用において、担体への微生物の付着は、収穫運転中に部生物の除去を過度に妨げないようにそれほど強くないようにすべきである。さらにまた、微生物が使用するための水分および/または栄養素を保持する布の能力は、一般に、疎水性、親水性の繊維またはこのような繊維の混合物を選択することにより調節できる。これらの特性は、表面で増殖する微生物に利用可能なように、水分および/またはそれに溶解している栄養素が固体担体に保持されるおよび/または移動されることを可能にする。
【0112】
培養担体の特性、特に水分および/または栄養の保持は、光合成微生物の増殖を増加させるように選択された材料で担体をコーティングすることにより増加させることができる。例えば、培養担体は寒天でコーティングされることもできるし、修飾セルロースエステル、アクリラートまたはアクリラート/ポリアミンコポリマーブレンドなどの高吸水性ポリマーでコーティングされることもできる。これらのコーティング剤は、一般的には、水中において、その乾燥重量の10〜100倍を超えて吸収および保持することができる。いくつかの実施形態において、これらの材料は、イオンを含む培地成分の存在下で、その高吸収性特性を保持するように配合される。コーティング剤は、培養担体の表面をコーティングすることもできるし、布が用いられている場合はその繊維をコーティングすることもできるし、あるいはその両方をコーティングすることもできる。一実施形態において、培養担体として役立つテリークロスのスワッチが寒天でコーティングされる。固体培養担体がそのようにコーティングされる場合、培養担体の“表面”は、これに光合成微生物が付着したときのコーティングの表面を含む。培養担体を薄く、曲げやすく軽く保つためには、コーティングは、好ましくは、例えば約100ミクロン以下の薄さである。しかしながら、所望の適用または選択される固体培養担体およびコーティング剤の組み合わせに応じて、より薄いコーティングを用いることもできる。
【0113】
固相培養担体は複合層状構造物であることができる。固相培養担体は、隣接するように配置された少なくとも2つの層を含むことができる。固相培養担体の複数の層は、結合、縫い合わせ、接着、圧縮または任意の他の適切な手段などでつなぐことができる。異なった層は、それぞれ独立して、上記のいくつかの材料の中から選択されることができる。例えば、固相培養担体は、合成発泡体の第2材料層に結合した布の第1材料層を含むことができる。他の例において、固相培養担体は、同一または異なる密度の合成発泡体の第2材料層に結合した合成発泡体の第1材料層を含むことができる。好ましくは、固相培養担体は、少なくとも、高表面積の増殖材料で構成される第1層および透過型材料で構成される第2層を含む複合層状構造物である。
【0114】
水分、栄養素および付着面を供給することに加えて、培養担体は化学線を捕捉するための表面を提供できる。従って、いくつかの実施形態において、固体培養担体の寸法はシート状である。すなわち、担体の深さは、担体の長さおよび幅に対して小さい。一実施形態において、培養担体は、保護バリアのフィルム状層間のシート状層である。このような平らなバイオリアクターは、フラットパネル状にして吊り下げられることができる。他の実施形態において、培養担体は、フォトバイオリアクターの外部バリアにより密閉されたカーテンのように吊り下げられる。寒天などの旧来の固相担体の薄いシートは、引き裂かれやすく、そのように吊り下げられることができないと考えられる。従って、吊り下げられるとき、液体で浸された場合であっても、固体培養担体がその完全性が維持できることが好ましい。
【0115】
本明細書に記載のように、テリークロスタイプ組織を有する布は、適切な固体担体を提供できる(例えば、実施例1参照)。他の天然、修飾天然および合成材料もまた許容されることは、当業者には明らかであろう。テリークロスは、本発明の固体担体において望ましいと考えられる属性の多くを提供する。例えば、テリークロスは柔軟性であり、通常条件下(例えば、温度)、非破壊手法(例えば、曲げ、折りたたみ、ひねりまたはローリング)に従って取り扱うとき、破れる、裂ける、破断する、または割れる傾向を有さない。同様に、テリークロスは、一般的には、適度に引っ張られたとき(液体で浸されているときであっても)、破れる、裂ける、または破断する傾向を有さない。さらに、テリークロスは、多くの繊維ループで構成されているため、高度にテクスチャ加工がおこなわれている。これにより、微生物が付着するための高表面積量が提供され、それによって、任意の所定のサイズの担体上で増殖できる微生物量が増す。さらにまた、綿テリークロスは、一般的には、自身の重量の少なくとも約3倍を吸収し、それにより、担体表面上で増殖する微生物に利用可能なように、布担体に水分および水分に溶解した任意の栄養素が保持されることが可能になる。従って、種々の実施形態は、薄いかまたは寸法がシート状であり、吊り下げられるとき、自身の湿重量を支えることができ、柔軟性で、曲げやすく、吸収性で、高度にテクスチャ加工の、またはそれらの任意の組み合わせの固体培養担体を提供する。
【0116】
上記の担体は、繰り返して使用でき、好ましくは、多くの適用において繰り返して使用され、より好ましくは、構造的に堅固であり、単回使用後に処置された微生物の増殖を維持する適切な表面を提供する限り繰り返して使用され、それによって運転費および廃棄物を減らすことができる。とは言うものの、小有機分子または治療用タンパク質およびペプチドなどの医薬品の製造に有用な組換え光合成微生物の培養などの、単回使用担体が望ましい特定の適用が存在しうる。このような単回使用担体の費用を抑えるために、そしてこのような単回使用担体が再使用されない事実を考慮して、このような担体はそれほど耐久性がある必要はなく、従って、金がかからず、耐久性が低い方法および/または材料を用いて製造または構築されることができる。例えば、ペーパータオルの紙繊維と同様な紙繊維で構成される担体が適切な場合がある。
【0117】
固相培養担体のいくつかの実施形態を図13に示す。図13Aで示される固相培養担体材料は、微生物の増殖、水分および栄養素への接近、微生物付着部位ならびに/または培養産物の除去のための持続可能な表面を提供できる1つの材料を示す。この材料は、表面と微生物との間の、栄養素、水分および産物を交換する液体浸透および平衡拡散を可能にする。この構造形態のレンダリングは、高表面積材料であるが、これは寸法および形状に関して最適化できる。図13Bに示す固相培養担体材料は、それぞれが増殖表面のために特定の機能を有する複数の材料で構成されるハイブリッド材料である。基層は、栄養素および水分の供給に加えて、材料を通してパーコレートする産物の除去を効率的に可能にする多孔性材料であることができる。基材は、増殖表面のための物理的担体を提供することもできる。外層(単数または複数)は、基層に取り付けられることが期待され、微生物の付着部位を提供するために最適化されることができる。表面積および培養した微生物との親和性に関して、表層は表面増殖環境をより調節することができる。
【0118】
保護バリア
本明細書記載のフォトバイオリアクターは、汚染および/または水分損失から固体培養担体および増殖表面を保護するバリアを含むことができる。同時に、フォトバイオリアクターは、光合成微生物に到達する化学線(太陽光または人工光のいずれか)および二酸化炭素を提供する。種々の実施形態において、フォトバイオリアクターは、光合成微生物の培養のための少なくとも1つの固体担体および保護バリアを含む。
【0119】
物理的取り扱いおよび/または汚染からの保護
汚染を防ぐために、物理的保護バリアは、固体培養担体を少なくとも部分的に覆うことができる。特定の実施形態において、物理的バリアは培養担体を密閉することができる。保護バリアは、少なくとも一部分において、フォトバイオリアクター内の担体および/または大気からの、フォトバイオリアクター外の大気への水分の損失を調節することもできる。所望の本発明の実施形態に応じて複数のタイプの材料のいずれかで保護バリアが構築されることができることは、当業者には明らかであろう。
【0120】
保護バリアは、培養担体を完全に密閉することができる。保護バリアが永続的にシールされる場合、内部の培養担体に接近するためには、バリアは破ったり、切断したり、裂いたりしなければならない。従って、いくつかの実施形態において、培養担体および微生物が増殖している表面へ、保護バリアを介して接近される。
【0121】
好ましい実施形態において、保護バリアは取り外し可能にシールされる。取り外し可能なシールは、限定するものではないが、Ziploc(登録商標)保存用バッグ(SC Johnson社)において見られるようなジッパータイプのクロージャー、hook-and-loop型のファスナー(例えば、Velcro USA社)、ツイストタイ、ジップタイ、スナップ、クリップ、感圧接着剤裏打ち面およびあらゆる分野で承認されているそれらの均等物を含む、多くのクロージャータイプのいずれかであることができる。しかしながら、完全なシールは必ずしも必要ではなく、外部バリアを完全にシールしないで、培養担体への接近を容易にしたほうが、寄り効率的な場合がある。
【0122】
フォトバイオリアクターは、保護バリア内に1つの培養担体または複数の培養担体を含むことができる。いくつかの実施形態において、1つの保護バリア内に1つの培養担体が密閉されている。例えば、プラスチックバッグは、その中に1つの固体培養担体が密閉されている保護バリアを形成することができる(例えば、図1参照)。他の実施形態において、1つの保護バリアは、複数の固体培養担体を密閉することができる。例えば、温室タイプの構造物は、その中に複数の固体培養担体が密閉されている保護バリアを形成することができる。
【0123】
化学線の透過
フォトバイオリアクターは、太陽光または人工光のいずれかで、光合成微生物への化学線の透過を提供できる。しかし、本発明の保護バリアは、必ずしも光に対して透明である必要はない。もしも光合成微生物の増殖のためにその中で十分な光源が提供されれば、いくつかの実施形態は、非透明な保護バリア内に密閉された培養担体を含むことができる。例えば、光源として太陽光を用いるための透明なバリアを提供することが、望ましく、より簡単で、より経済的であるなどが考えられる。
【0124】
好ましい実施形態は、限定するものではないが、ガラスまたは透明なもしくは一般に可視光を透過するポリマー、例えばポリエチレン、アクリルポリマー、ポリエチレンテレフタレート、ポリスチレン、ポリテトラフルオロエチレンもしくはそれらのコポリマーまたはそれらの組み合わせのいずれかのタイプなどの材料を含む透明なバリアを提供する。透明なバリアは、耐久性があり、裂ける、破れる、割れる、擦り切れる、細断される、または他のこのような物理的損害を受ける傾向を有さない材料から選択されることができる。透明なバリア材料は、オートクレーブ滅菌または他の温度極値への暴露に耐えるその能力に関して選択されることができる。さらにまた、透明なバリア材料は、退色または劣化せずに、日光または他の放射線への長期の暴露に耐えるように選択されることができる。光酸化に抵抗する特定のコーティングまたは配合物は、特に有用であることができることは、当業者には明らかであろう。さらに、本発明のフォトバイオリアクター内の熱の蓄積を低下させるおよび/または別なふうに調節するように、赤外反射コーティングまたは吸収コーティングを選択することができる。
【0125】
透明なバリア材料の厚さは、スケールの機械的特性に応じて変化することは、当業者には明らかであろう。例えば、透明なバリア材料は、厚さ約10ミルの工業用/海用プラスチックのものであることもでき、およそ厚さ2ミルの家庭用プラスチックバッグに用いられるタイプのものであることもできる。一実施形態において、透明なバリア材料は薄く、柔軟性である。例えば、透明なバリア材料は約10ミル未満のものであることができる。
【0126】
いくつかの実施形態において、バリアは、薄く柔軟性である固体培養担体の両面をおおう保護層またはフィルムを形成する。この実施形態の組み立てられたフォトバイオリアクターは柔軟性であり、貯蔵、移動、運搬または取り扱いのために、曲げる、回転させる、折り重ねる、撚り合わせるなどのことができる。他の実施形態において、透明なバリア材料は硬質である。例えば、バリアはガラス温室であることができる。たいがいは、温室ガラスの厚さは、好ましくは、建築慣行と合致するが、それを変更することも可能である。このような実施形態のフォトバイオリアクターは、実際的には固定されていると考えられるが、1つの透明な保護バリアの範囲内で、複数の固体担体を取り扱う、移動する、運ぶなどすることができるだろう。
【0127】
光合成微生物の増殖のための十分な光を提供するように保護バリアが選択されることができるが、必ずしもすべてのバリアが透明である必要はない。従って、いくつかの実施形態において、バリアの一部、例えば1以上の縁は非透明な材料でできている。非透明な材料は、限定するものではないが、ポリエチレン繊維材料(Tyvek(登録商標))、ポリテトラフルオロエチレン濾過媒体、セルロース系フィルター材料、ファイバーグラスフィルター材料、ポリエステルフィルター材料およびポリアクリラートフィルター材料ならびにそれらの組み合わせを含む材料で構成されることができる。耐久性に関して非透明な材料を選択することができる。このような実施形態において、バリアの透明な部分は、さらに、耐久性がある非透明な部分によって、破れる、裂ける、擦り切れる、細断されるなどから保護されると考えられる。一実施形態において、非透明な部分は、取り付け部位または取り付け部分(例えば、孔、ループ、フック、グロメットもしくは他の分野での等価装置、開口部またはくぼみ)および/または構造物にフォトバイオリアクターを固定する仕組みをさらに含むことによってフォトバイオリアクターを吊り下げるための取り付け構造物および/または補強材を提供するまたは含む。このような任意の取り付け部位などが非透明な部分内もしくは上に位置する必要はないが、それらは、バリアの非透明な部分内もしくは上、バリアの透明な部分内もしくは上、またはバリアの非透明な部分および透明な部分内もしくは上に含まれることができる。取り付け構造物はまた、固体培養担体内もしくは上に含まれることもできるし、それを貫通することもできる。
【0128】
いくつかの実施形態において、装置は識別できる前側および後側を有する。この装置の前側は、光源に面することを意味し、従って前側にあるバリアの部分は好ましくは透明であり、一方、光源に面していない側の保護バリアの部分は、必ずしも透明ではない。
【0129】
ガス交換の提供
光合成の間、光合成微生物は二酸化炭素を消費して酸素を放出する。本明細書記載のフォトバイオリアクターは、所望の量の光合成が行われるのに十分な二酸化炭素を供給できる。フォトバイオリアクター内部に二酸化炭素を供給する1つの方法は、フォトバイオリアクターの内部の空気と周囲の空気との間で直接ガス交換させることである。このシステムが周囲の大気に開放されるように、例えば、孔、通気孔、窓または他のこのような開口部を保護バリアに提供できる。
【0130】
しかしながら、このような開放形状は、光合成微生物の汚染が心配される場合、望ましくない可能性がある。このような心配に取り組むために、保護バリアは、その中に密閉された固体担体(単数または複数)を外気から完全にシールすることができる。このような実施形態において、所望の濃度の二酸化炭素は、囲い内にそれを導入することにより維持できる。例えば、圧縮二酸化炭素のタンクからの配管または管により、フォトバイオリアクター内に密閉された空気に二酸化炭素を混合させることが可能になることは、当業者には明らかであろう。さらに、工場、工業プラント、発電所などからの排気を光合成微生物の二酸化炭素供給源として利用することができ、従って二酸化炭素排出量を減らすことができる。一実施形態において、ガス供給ラインにより、増殖表面局部に二酸化炭素を提供することができる。
【0131】
大気中の二酸化炭素を利用するために、ガス透過性の選択的バリアを提供することが、望ましく、より簡単で、より経済的であるなどが考えられる。従って、いくつかのフォトバイオリアクター実施形態は、保護バリア内に密閉された環境と周囲の空気との間のガスおよび蒸気交換を可能にするにもかかわらず、なお汚染に対するシールされた物理的バリアを提供する選択的バリアを提供する。このようなバリアは、少なくとも部分的にガス/蒸気透過性であることができ(例えば、従来の織物よりもずっと透過性は低く、プラスチックフィルムよりも高く、および/またはコーティングされた紙と同様である)、従って二酸化炭素および酸素などのガスの交換は可能であるが、さらに少なくとも部分的に、かつ好ましくは、固形物および液体に対して不透過性であると考えられる。いくつかの実施形態において、フォトバイオリアクターは、増殖表面付近の領域において上昇した二酸化炭素濃度を維持するために、半透性バリア層およびガス供給ラインを含むことができる。
【0132】
いくつかの実施形態において、選択的バリアは、約10マイクロメートル以下の平均孔径または直径および、少なくとも約5から約10,000ガーレー秒以下までのガス交換速度を有することができる(ガーレー秒またはガーレーは、所定の圧力差で1.0平方インチの所定の材料を100立方センチメートルのガスが通過するのに必要な秒数を記載する単位である)。従って、ガス交換を可能にすることに加えて、選択的バリアは、密閉システムからの水分の損失を防ぐことができる。
【0133】
保護バリアの選択的バリア部分は、スパンボンドオレフィンバリアなどの、任意の適切なポリマーベース材料で構成されることができる。種々の特性を有するスパンボンドオレフィンバリア(微細ポリエチレン繊維)は、Tyvek(登録商標)の商標名でDuPont社から容易に入手できる。このような材料は、物理的特性のその組み合わせの故に特に有利である。すなわち、これらの材料は、水などの液体の透過に抵抗する傾向があるが、それでもなお十分に高度のガス/蒸気透過性を有し;これらの材料は比較的丈夫で、水分をほとんど吸収せず、引き裂き抵抗力があり、著しい弾性を有し、高度に柔軟性である。MIT屈曲試験機(TAPPI法T-423)で試験するとき、スパンボンドオレフィンは20,000サイクルを超えることができる。さらに、スパンボンドオレフィンは大部分の酸、塩基および塩に不活性であるが、濃硝酸または過硫酸ナトリウムなどの酸化物質に対する長期の暴露は、強度の少しの低下の原因となる。スパンボンドオレフィンバリアは、一定温度、0〜100%相対湿度でシート寸法が0.01%未満の変化を示すことから、優れた寸法安定性を有する。特定の製品は、直接食品に接触する用途のためのアメリカ合衆国連邦規則集の規定21(21CFR177.1520)の必要条件を満たしている。スパンボンドオレフィンバリアはまた、優れたカビおよび糸状菌抵抗性を示し、中性のpHを有している。しかしながら、残念なことに、そのUV抵抗性は特に優れていない。とは言うものの、通例少なくとも1〜3ヶ月の有用な屋外寿命を予想することができる。さらに、そのUV抵抗性は、不透明なコーティングを用いるか、ポリマー繊維にUV阻害薬を含むことにより改善することができる。さらに、今日までに製造されたスパンボンドオレフィンは不透明であるため、このような材料を含む保護バリアの部分は、好ましくは、光合成微生物の培養を障害するように位置するおよび/または広すぎることがない。
【0134】
特に、スパンボンドオレフィンは、“硬質”および“軟質”構造物で製造されることができる。“硬質”面接合品であるタイプ10は、なめらかで堅い無指向性紙様形状である。タイプ14および16は、“軟質”点接合品であり、型押し模様を有し、布切れのような柔軟性の担体を提供する。例えば、バリアに耐久性および通気性が所望される場合、タイプ14スタイル(またはその等価物)を使用できる。タイプ16スタイルは、5〜20ミル(0.13〜0.51mm)の孔の穴あきであり、タイプ14スタイルと比較して非常に高い空気および水分の透過性、さらなる柔軟性ならびにより大きな可撓性およびドレープを有するが、低い引き裂き強度およびバリア特性という犠牲を払っている。従って、選択的バリアの特定の特性は、スパンボンドオレフィン製品の1以上のタイプを選択することによりカスタマイズすることができる。
【0135】
選択的ポリマーバリアの他の例は、限定するものではないが、ナイロン、ポリスルホン、ポリテトラフルオロエチレン、セルロース、ファイバーグラス、ポリエステルおよびポリアクリラートの膜およびフィルター材料ならびにそれらの組み合わせを含む。
【0136】
光合成微生物の増殖にとって十分に選択的なバリアを提供するためには、保護バリアの全体がガス透過性である必要はない。適切なガス交換を可能にするのに十分な保護バリアの一部のみが、ガス透過性である必要がある。一実施形態において、選択的部分は保護バリアのパネルである(例えば、図1参照)。微生物の培養を過度に妨げることなく、特定の適用のための所望の量のガス交換を達成するために、担体表面の領域に関する選択パネルのサイズおよび配置は変更することができる。ガス透過性選択材料で構成される外部バリアの領域の百分率は、材料のガス透過速度に左右されることは、当業者には明らかであろう。実際、ガス透過性部分は、それを通しての水蒸気の移動もまた可能なので、種々の実施形態において、保護バリアのガス透過性部分のサイズは、酸素および二酸化炭素の十分な移動を可能にすると同時に、水分の損失を最小化するように選択される。
【0137】
吊り下げおよび運搬システム
本明細書記載のフォトバイオリアクターは、例えば、取り扱いおよび運搬システムに組み込むことにより、大規模生産および/または収穫のために構成されることができる。図3は、多数のフォトバイオリアクターを連続工程で取り扱うための、フォトバイオリアクター農場の典型的な設計を上から見た図を示す。フォトバイオリアクターまたは培養パネル(個別には示さず)は、コンベヤシステム8に取り付けられている。コンベヤシステム8は、その経路に沿って培養パネルを移動させる。複数のコンベヤシステムは、中央に位置する接種および収穫センター9に集まる。このように、処理(例えば、採取および/または接種)可能な場合は、培養パネルを接種および収穫センター9に移動させ、次いで、接種後、バイオマスの培養期間中には、センターからパネルを離れさせる。次いで、収穫前の培養期間の後半に、センターに向けてパネルを移動させ、最終的に、バイオマスの成熟と共に収穫のためにセンターに戻される。次いで、このサイクルが繰り返される。さらなる処理のために、パイプライン10を通して収穫したバイオマスを移動させることができる。さらなるコンベヤシステムまたはさらなる接種および収穫センターを付け加えてバイオマス生産専用の隊列を形成させることにより、フォトバイオリアクター農場の能力を上げることができる。
【0138】
フォトバイオリアクターの吊り下げ
光合成微生物に光を供給するためのフォトバイオリアクターの好ましい実施形態は、培養担体が薄いシート状である実施形態である。水平に向けられる場合、床面積の効率的利用は低下する傾向にあり、従って、本発明の特定の実施形態において、培養担体は非水平に向けられ、好ましくは実質的に垂直に向けられ、より好ましくは垂直に向けられる。それにもかかわらず、十分な量の化学線が微生物に到達できる限りは、培養担体は、本質的に任意の向きに向けられることができる。従って、フォトバイオリアクターが、保護バリアが固体担体の周りに密接に結びつけられたフィルムまたは層を形成するタイプのものである場合、全フォトバイオリアクターの好ましい配向は垂直であるが、任意の配向が許容される。明確にするために、前述の配向(例えば、垂直、水平、実質的に垂直、非水平など)は、培養担体の下部の床または地面に対してであり、床または地面が水平であると仮定している。
【0139】
培養担体または全フォトバイオリアクターを所望の配向に向けるかまたは吊り下げるために、種々の構造物、組み立て台、スタンド、ラックなどを使用できる。特に、培養担体および/または保護バリアは、固体培養担体および/またはフォトバイオリアクターを吊り下げることができる、ロープ、ライン、フック、ケーブル、トラック、レール、鎖、棚板、ポール、管、組み立て台、スタンド、梁または任意の他のこのような構造物から吊り下げられることもできるし、これらに取り付けられることもできる。複数の培養担体および/またはフォトバイオリアクターは、物干し用ロープからぶら下がっているシートのような共通の構造物から吊り下げられることができる。培養担体(単数または複数)および/またはフォトバイオリアクター(単数または複数)は、静的に吊り下げられることもできるし、その移動を可能にする方式で吊り下げられることもできる。孔、ループ、フックなどの位置は、好ましくは、培養担体および/またはフォトバイオリアクターの重量を実質的に均等に分配する。
【0140】
フォトバイオリアクターまたは培養担体の吊り下げは、特に垂直配向においては、空間効率が良く、取り扱い上の利点を提供できる。しかしながら、本発明のバイオリアクターまたは培養担体は、吊り下げられる必要はない。例えば、本発明の特定の実施形態において、培養担体は十分に硬質であり、非水平に、垂直にまたは実質的に垂直に向けられる場合(例えば、表面にまたはその上にその基部を固定または配置することにより;一実施形態において、担体は硬質プレート、パネル、グリッドなどのようなものである)、培養担体はその重量を支えることができ、その様に向けられ続ける。他の実施形態において、保護バリアは温室などのように独立型であり、複数の培養担体が吊り下げられるおよび/またはその中で独立している。
【0141】
フォトバイオリアクターおよび/または培養担体の吊り下げ、特に垂直配向における吊り下げは、空間効率がよく、取り扱い上の利点を提供できる。しかしながら、本発明のバイオリアクターまたは培養担体は吊り下げられる必要はない。例えば、本発明の特定の実施形態において、培養担体は十分に硬質であり、非水平に、垂直にまたは実質的に垂直に向けられる場合(例えば、表面にまたはその上にその基部を固定または配置することにより;一実施形態において、担体は硬質プレート、パネル、グリッドなどのようなものである)、培養担体はその重量を支えることができ、その様に向けられ続ける。他の実施形態において、保護バリアは温室などのように独立型であり、複数の培養担体が吊り下げられるおよび/またはその中で独立している。
【0142】
運搬
本明細書において、フォトバイオリアクター、フォトバイオリアクターの保護バリア内の培養担体またはそれらのいくつかの組み合わせをある場所から他の場所に運搬するためのシステムもまた記載されている。フォトバイオリアクターおよび/または培養担体を移動する能力は、種々の理由から有利であることができる。例えば、それは、光を受け取るためのそれらの位置(単数または複数)を最適化し、所望の温度またはガス含有量することを可能にすることができる。複数のフォトバイオリアクターまたは培養担体を、離散ステップ、例えば接種、培養、誘導および/または収穫にかける場合に、移動性は特に有利であることができる。なぜなら、定着したフォトバイオリアクターまたは培養担体に必要な材料および装置を移動させる代わりに、連続式プロセスでいくつかの割り当てられた場所にフォトバイオリアクターまたは培養担体を移動させることがより効率的と考えられる。
【0143】
このように、培養担体単独または保護バリアに密閉された培養担体のいずれであろうと、増殖表面は、接種後でさえ運ばれることができる。産業上の利用に頻繁に使用される多数のタイプのコンベヤシステムは、当業者には明らかであろう。運搬システムは、それが1以上のフォトバイオリアクターまたは培養担体を移動させることができる限り、特定のタイプに限定されない。フォトバイオリアクターまたは培養担体とコンベヤシステムとの間の取り付けのタイプは、用いられる運搬システムのタイプによって異なり、培養担体および/または保護バリアの一部である任意の取り付け部位と協同して働くように選択されることは、当業者には明らかであろう。1以上のモーター(例えば、鎖および歯車の働きにより)によって、機械化された方式で培養担体(単数または複数)またはフォトバイオリアクター(単数または複数)が運ばれることが考えられるが、ヒトの行動によってそれらが運ばれることも可能である(例えば、レールに取り付けられた吊り下げられたバイオリアクターを、レールに沿って滑らせるベアリング機構にそって単に押すことにより)。
【0144】
フォトバイオリアクター(単数または複数)および/または培養担体(単数または複数)を吊り下げるコンベヤシステムは、特に垂直配向においては空間効率がよく、取り扱い上の利点を提供できる。しかしながら、コンベヤシステムはフォトバイオリアクター(単数または複数)または培養担体(単数または複数)を吊り下げることに依存する必要はない。例えば、フォトバイオリアクターは、例えばローラーコンベヤ上を滑らすなど、コンベヤシステムの上部に沿って移動させることができる。一実施形態において、コンベヤシステムは、保護バリア内に密閉された培養担体を含むフォトバイオリアクターを移動させることができる。あるいは、フォトバイオリアクターの保護バリアは、複数の培養担体を移動させる1以上のコンベヤシステムを保護する大きな囲いであることができる。
【0145】
フォトバイオリアクター農場
大規模用途のためには、十分なサイズの1つの培養担体を構築することは、実際的ではない場合がある。従って、フォトバイオリアクター“農場”で光合成微生物を培養するための、2つまたはいくつかまたは数十または数百または数千またはそれ以上の培養担体の使用が提供される。これらの培養担体は、すべて1つの保護バリア内にある、すなわち1つのフォトバイオリアクターを含むこともできるし、複数の培養担体は複数のフォトバイオリアクターの一部であることもできる。いずれの場合においても、取り扱いおよび処理を容易にし効率的にするために、複数のフォトバイオリアクターまたは培養担体をフォトバイオリアクター農場内で組織化することは有益であることができる。太陽などの光源から捕捉されるエネルギー量を最大化するためにそれらの配置を組織化することもまた有益であることができる。このような組織化は、例えば、限定するものではないが、列、縦列、同心円、格子、中心点から放射状に外に広げることなどの規則的なやり方で多数のフォトバイオリアクターまたは培養担体を配置することからなることができる。
【0146】
種々の実施形態において、農場は、一般の構造物、例えばトラック、レール、鎖、ラインなどから吊り下げられる複数のフォトバイオリアクターまたは培養担体を含む。さらなる実施形態において、構造物はコンベヤシステムの一部であり、フォトバイオリアクターまたは培養担体は、コンベヤシステムの経路に沿ってある場所から他の場所へ移動する。
【0147】
フォトバイオリアクター農場は、多数のフォトバイオリアクターまたは培養担体を取り扱う複数のコンベヤシステムの1つまたは配列を含むことができる。このような配列は、2つまたはいくつかまたは数十または数百または数千またはそれ以上のフォトバイオリアクターまたは培養担体を取り扱う、2つまたはいくつかまたは数十または数百または数千またはそれ以上のコンベヤシステムを含むように拡大することができる。コンベヤシステム(単数または複数)に加えて、フォトバイオリアクター農場は、光合成微生物の接種、培養、誘導および/または収穫などのステップを行うための所定の所定の領域、ステーションまたはセンターを含むことができる。このようなセンターは、特定のステップを行うための専門装置の場所であることができる。コンベヤシステムの経路は、特定のステップが行われるこのようなセンターへフォトバイオリアクターまたは培養担体をもたらすことができる。次いで、フォトバイオリアクターまたは培養担体は、順番における次の領域またはセンターに移動されることができる。コンベヤシステムに沿った異なるフォトバイオリアクターまたは培養担体は、経路に沿った異なるセンター位置することができ、従って異なるステップに同時にかけることができる。一実施形態において、コンベヤシステムの経路はループである。フォトバイオリアクターまたは培養担体は、ひとたび培養プロセスにおけるステップの1ラウンドを完了すれば、そのプロセスを繰り返すことができる。ユニットの一部が損害を受けたり、最終的に交替を必要とする場合もあるが、本質的に、同じフォトバイオリアクターまたは固体培養担体のセットを繰り返し用いることができる。
【0148】
他の実施形態において、同じかまたはほぼ同じ場所で培養および収穫を行うことができる。この場所を接種および収穫センターと呼ぶ(例えば、図3参照)。フォトバイオリアクターおよび/または固体培養担体の接種は、接種および収穫センターで行われる。コンベヤシステムは、フォトバイオリアクターまたは培養担体を次に接種および収穫センターから移動させるループを形成する。次いで、フォトバイオリアクターまたは培養担体は、所望の量の細胞増殖に十分な時間、コンベヤシステムの経路に沿って移動する。次いで、コンベヤシステムは、収穫のためにフォトバイオリアクターまたは培養担体を接種および収穫センターに戻させる。複数のコンベヤシステムは、それから放射上に広がる共通の接種および収穫センターを共有できる。さらに高い能力を必要とする場合、フォトバイオリアクター農場は、複数のコンベヤシステムからのフォトバイオリアクターまたは培養担体を取り扱う複数の接種および収穫センターを含むことができる。能率の増加を実現できるとはいえ、接種および収穫の場所は、同じまたはほぼ同じ場所である必要はない。
【0149】
フォトバイオリアクターの使用方法
光合成微生物の培養
本明細書記載の固相フォトバイオリアクターは、光合成微生物を培養するために使用することができる。固相フォトバイオリアクターにおいて増殖できる光合成微生物は、限定するものではないが、シアノバクテリアなどの天然光合成微生物または人工光合成細菌などの操作された光合成微生物を含む。天然光合成微生物であるか、または操作して光合成微生物にすることができる典型的な微生物は、限定するものではないが、細菌;真菌;古細菌;原生生物;微小植物、例えば緑藻;ならびに動物、例えばプランクトン、プラナリアおよびアメーバを含む。バイオリアクターにおいて増殖できる天然に存在する光合成微生物の例は、限定するものではないが、スピルリナ・マキシマム、スピルリナ・プラテンシス、ドナリエラ・サリナ、ボトリオコックス・ブラウニイ、クロレラ・ブルガリス、クロレラ・ピレノイドーサ、セレナストルム・カプリコミュータム、セネデスムス・クアドリカウダ、ポルフィリディウム・クルエンタム、セネデスムス・アクタス、ドナリエラ種、セネデスムス・オブリカス、アナベノプシス、アウロシラ、キリンドロスペルムム、シネコッカス種、シネコシスチス種、および/またはトリポスリックスを含む。
【0150】
好ましくは、固相フォトバイオリアクターにおいて増殖する光合成微生物はシアノバクテリアを含む。バイオリアクターにおいて増殖するシアノバクテリアは、藍色植物門からの任意の光合成微生物であることができる。バイオリアクターにおいて増殖するシアノバクテリアは、単細胞形態を有することもできるし、コロニー形態(例えば、フィラメント、シートまたはボール)を有することもできる。好ましくは、バイオリアクターにおいて増殖するシアノバクテリアは単細胞シアノバクテリアである。バイオリアクターにおいて増殖できるシアノバクテリアの例は、限定するものではないが、シネコシスチス、シネココッカス、サーモシネココッカス、ノストック、プロクロロコッカス、ミクロシスティス、アナベナ、スピルリナおよびグロエオバクター属を含む。好ましくは、バイオリアクターにおいて増殖するシアノバクテリアは、シネコシスチス種またはシネココッカス種(例えば、シネココッカス・エロンガタスPCC 7942(ATCC33912)および/またはシネコシスチス種PCC 6803(ATCC27184))である。より好ましくは、バイオリアクターにおいて増殖する光合成微生物は、本明細書に記載の二糖を蓄積するように操作されたトランスジェニック光合成微生物である。
【0151】
フォトバイオリアクターの固体培養担体は、光合成微生物を接種することに加えて、水分および、限定するものではないが、栄養素、塩、緩衝液、金属、窒素、リン酸、硫黄などを含む他の成分の添加を行うことができる。次いで、保護バリア内の培養担体を含むフォトバイオリアクターは、取り外し可能にシールされることができる。シールされたフォトバイオリアクターは、例えば、照射および温度の調節を可能にする位置および方式で吊り下げることによって配置されることができる。配置は静的であることもできるし、1日にわたって太陽の放射線への最大暴露を確実にするために、フォトバイオリアクターを移動させることもできる。光合成微生物は、所望の時間、培養することができる。時間の長さは、微生物のタイプおよび所望の細胞増殖密度に従って変化することは、当業者には明らかであろう。例えば、シアノバクテリアの特定の株に関しては、約4〜約7日間の範囲内の培養期間によって、1リットル相当量当たり乾燥バイオマス約50〜約250グラムの範囲内の細胞収量をもたらすことができる。培養期間後、取り外し可能なシールを開けることができ、光合成微生物を収穫することができる。
【0152】
本明細書において、“1リットル相当量当たりの乾燥バイオマスのグラム数”は、培養表面上で増殖するバイオマス層の平均深さ(例えば、約150ミクロン)を算出し、その値に培養表面の長さおよび幅をかけ合わせることによって決定される単位である。この計算は体積を与える。次いで、培養表面から収穫したバイオマスの重量は、体積と関連づけられ、“1リットル相当量当たりの乾燥バイオマスのグラム数”として表すことができる。
【0153】
連続培養法
例えばアセンブリラインの様に、もし光合成微生物の培養プロセスが連続で行われれば、より高い効率が実現できるであろう。一度に大量のバイオマスを取り扱う装置および能力を必要とし、それによりバッチ間で遊休させる代わりに、連続システムは、より少ない全能力しか必要とせず、連続作業によってより効率的にその能力を用いると考えられる。培養をより小さくより多数の構成要素に分割することにより、空間的に連続した配置に構成要素を組織化することができる。次いで、全生産プロセスの異なる離散ステップを同時に行うことができる。培養構成要素をプロセスステップにかけた後、構成要素をプロセスの前方に移動させ、一方でそのステップにおいて他の構成要素と交替させる。従って、最終産物の生産は、大量バッチの成熟に限定されず、各構成要素がアセンブリライン様プロセスを完了するにつれて定期的に行うことができる。さらにまた、1ラウンドのプロセスの完了後に、構成要素は、直ちにプロセスをやり直すことができ、それが繰り返される。
【0154】
より具体的には、連続培養は、連続的に光合成微生物を培養するための運搬可能なフォトバイオリアクターまたは培養担体の使用方法に関する。連続または連続工程は、フォトバイオリアクターまたは固体培養担体を、培養プロセスのあるステップから他のステップに進行させることができる空間的関係として理解される。あるいは、1つの大型構造担体を連続工程に用いることが可能である。具体的には、担体は、巡回路(例えば、好ましくは垂直に配置されたコンベヤベルトのような)に沿って移動する様に作られた材料(例えば、テリークロス織物)のループであることができる。複数のフォトバイオリアクターまたは固体培養担体がそのプロセスを順次に繰り返し完了するにつれて、バイオマス生産が定期的に達成されうることが最終結果である。このタイプのプロセスは、大規模であるが、回数が少ないバッチでのバイオマス生産と比較して、効率の高い大規模用途において機会を与える。
【0155】
好ましい実施形態において、連続した空間的関係はコンベヤシステムの経路に沿っている。運転方法はアセンブリラインに類似している。このようなコンベヤシステムは、いくつかの方法で運転することができる。例えば、コンベヤシステムは、フォトバイオリアクターまたは培養担体をある場所から他の場所へ移動させる間、中断なしに運転することができる。このような実施形態において、フォトバイオリアクターまたは培養担体が動いている間に接種、収穫などが行われる。あるいは、実施されるステップを可能にするためにコンベヤシステムを停止させ、次いで次のステップの場所へのフォトバイオリアクターまたは培養担体の移動を再開させることができる。さらにまた、コンベヤシステムは中断なしに運転でき、フォトバイオリアクターまたは培養担体は、処理のためにコンベヤシステムの移動からはずし、次いで運搬の流れの中に再び入れるために再装着することができる。この一般テーマの他の入れ替えもまた可能であることは、当業者には明らかであろう。
【0156】
連続培養法の一実施形態において、コンベヤシステムに沿って、1つの場所で複数のフォトバイオリアクターが接種される。次いで、コンベヤシステムによって、光合成微生物の培養が行われる領域にフォトバイオリアクターが移動される。運搬のこの部分において、増殖および光合成を促進するための最適の照射を可能にするようにフォトバイオリアクターの位置を合わせることができる。次いで、光合成微生物を収穫できる場所にフォトバイオリアクターが到着する。次いで、このプロセスを再開するために、コンベヤシステムの経路に沿ってフォトバイオリアクターを接種地点に戻すことができる。効率を改善するために、フォトバイオリアクターが接種場所を離れ、収穫場所に到着する間の時間は、光合成微生物の所望の量の増殖が起こるのにかかる時間と一致するようにすることができる。このプロセスのステップは接種、培養および収穫に限定されない。さらなるステップは、所望産物を合成させるための細胞の誘導または滅菌を含むことができる。上記の実施形態は、運搬可能なフォトバイオリアクターシステムを説明しているが、複数の固体培養担体を運搬し処理する同じタイプの連続培養を、1つの保護バリア内で行うことができることは明らかであろう。
【0157】
発酵性糖の生産方法
光合成微生物をより効率的に増殖させる能力から利益を得る技術の1つは、エタノールまたはバイオディーゼルなどの代替燃料のためのバイオマスの生産である。コーン、サトウキビ、ダイズ、カノーラ、ジャトロファなどの、バイオマスを生産するために現在栽培されている植物と比較して、シアノバクテリアなどの光合成微生物は、はるかに速い速度でバイオマスを生産し、これによりはるかに大きな生産性をもたらすことができる。さらに、微生物による二糖の直接生産により、発酵性糖を生産するために植物バイオマスを用いる大規模なエネルギー集約型の前処理の多くを避けられる。さらにまた、植物の代わりに光合成独立栄養微生物を使用することにより、土壌消耗、腐食および食料供給品の転用を引き起こすことなく、高収量の発酵性糖をもたらすことができる。炭素供給源(CO2)およびエネルギー(光)が環境から供給され、はるかに低コストで生産できるため、他の微生物と比較して、光合成独立栄養微生物が好ましい。さらに、光合成独立栄養微生物は、産業プロセスからの二酸化炭素排出量を消費するために利用することができ、従って、環境に対するさらなる利点を提供する。
【0158】
光合成微生物からの大量の発酵性糖の生産に対する1つの障害は、光合成微生物が、一般に、生産した炭水化物を蓄積するよりもむしろ消費するからである。スクロースまたはトレハロースなどのいくつかの糖は、光合成微生物により一次炭素源として利用されないが、緩慢な同化機構が存在する。再加工機構にも関わらず、このような物質は代謝されずに蓄積されることができる。微生物を適切に操作すれば、同化機構を不活性化することができ、それにより高収量の糖の生産が可能になる。
【0159】
本明細書において、発酵性糖、特に二糖の光合成微生物による生産方法が提供される。発酵性糖の例は、限定するものではないが、スクロース、トレハロース、グルコシルグリセロールおよびマンノシルフルクトースを含む。好ましくは、発酵性糖はスクロースまたはトレハロースである。本方法は、生産の費用対効果を改善するために連続的に行うのに適応することができる。
【0160】
本方法の種々の実施形態は、発酵性糖を合成できる光合成微生物を用いて実施できる。いくつかの実施形態は、発酵供給原料の生産のために浸透圧およびマトリックス水保護の天然現象を利用し、制御する。一実施形態において、発酵性糖の合成は誘導性である。他の実施形態において、発酵性糖の合成は、遺伝子操作により改変されて構成的に生産されることができる。
【0161】
発酵性糖生産性光合成微生物は、好ましくはシアノバクテリアである。いくつかの実施形態において、シアノバクテリアは、内因性誘導経路によって二糖を蓄積する。いくつかの実施形態において、トランスジェニックシアノバクテリアは、操作された外因性経路によって二糖を蓄積する。内因性および外因性経路共に、上記でさらに詳細に説明されている。
【0162】
好ましくは、トランスジェニック光合成微生物は、上記のトランスジェニック光合成微生物の1以上である。
【0163】
限定するものではないが、二糖を蓄積できるシアノバクテリア株の2例として、シネココッカス・エロンガタスPCC 7942およびシネコシスチス種PCC 6803がある。天然に存在するシネココッカス・エロンガタスPCC 7942は、その許容限界である約700mMまでの塩濃度に暴露することによりスクロースを合成する。agp遺伝子の欠失によりグルコシルグリセロールの生合成がブロックされるとき、シネコシスチス種PCC 6803は、900mMにほぼ等しいその許容限界までの塩濃度に暴露することにより、その浸透圧保護剤としてスクロースを生産する。いくつかの実施形態において、塩誘導は、エアゾール化した生理食塩水を培養表面に直接に塗布することにより達成できる。このプロセスの1つの利点は、その品種の増殖時間に応じて増殖表面に沿って制御可能に塗布することができ、それによって、バイオマスの蓄積およびスクロースなどの二糖の生産のバランスが保たれることである。
【0164】
発酵性糖を生産するために、固体培地上で、または液体もしくはゲル培地内で光合成微生物を培養できる。光合成微生物の培養および増殖は当該分野で公知である。従って、特記しない限り、光合成微生物の培養および増殖は、このような既知のプロセスに従って実施することができる。例えば、二糖を蓄積するように操作されたトランスジェニックシアノバクテリアは、液体培地内で培養し増殖させることができる。蓄積された糖は、細胞から放出される場合、このような液体培地から単離されることができる。蓄積された糖は、液体培地から収穫した光合成微生物から単離されることができる。一実施形態において、上記のように、トレハロースを蓄積するように操作されたトランスジェニックシアノバクテリアは液体培地内で培養され増殖される。トランスジェニックシアノバクテリアから分泌されるトレハロースは、液体培地から直接に単離されることができる。一実施形態において、上記のように、スクロースを蓄積するように操作されたトランスジェニックシアノバクテリアは、液体培地内で培養され増殖される。スクロースは、液体培地かた収穫した操作されたシアノバクテリアから直接に単離されることができる。一実施形態において、上記のように、スクロースを蓄積し分泌するように操作されたトランスジェニックシアノバクテリアは、液体培地内で培養され増殖される。トランスジェニックシアノバクテリアから分泌されるスクロースは、液体培地から直接に単離されることができる。
【0165】
好ましくは、光合成微生物は、誘導の前に、1リットル相当量当たり乾燥バイオマス少なくとも約50グラムの比較的高い細胞密度まで培養される。このような比較的高い細胞密度は、本明細書記載の固相フォトバイオリアクターを用いて達成できる。次いで、溶液伝導率により測定される、培地における水の活性を変えるのに有効である適切な塩化合物の所定の濃度で蓄積されたバイオマスを処理することにより、二糖(例えば、スクロース)の生産を開始/誘導できる。さらに好ましい実施形態において、塩化ナトリウムが用いられる塩である。適切な反応期間(例えば、少なくとも約1時間から約48時間以下まで)後に、生産されたスクロースを単離し回収するために、スクロースを蓄積した細胞を収穫し処理することができる。一般的には、適切な反応期間は、少なくとも約5時間から約24時間以下までの範囲内である。より一般的には、適切な反応期間は、少なくとも約10時間から約20時間以下までの範囲内である。
【0166】
一実施形態において、合成される二糖(例えば、スクロース、トレハロース、グルコシルグリセロール、マンノシルフルクトース)の大部分は、細胞内に蓄積される。他の実施形態において、二糖は細胞によって分泌され、次いでこれはフォトバイオリアクターから回収することができる。二糖が細胞内に存在するかまたは分泌されるかにかかわらず、限定するものではないが、培養表面に塗布される水性スプレー洗浄を含む任意の適切な収穫プロセスを用いて二糖を得ることができる。二糖を単離し回収するために、細胞および/または二糖を含む洗浄液を収穫し処理することができる。
【0167】
本発明を詳細に説明してきたが、添付の特許請求の範囲において定義された本発明の範囲を逸脱することなく、修飾、変更および等価な実施形態が可能であることは明らかであろう。さらにまた、当然のことながら、本開示におけるすべての例は、限定するものではない例として提供される。
【0168】
限定するものではない以下の実施例は、本発明をさらに詳細に説明するために提供される。以下の実施例において開示された技術は、本発明の実施において十分に機能すると本発明者が見出したアプローチを示すものであり、従ってその実施のための方式の例を構成すると考えることができることは、当業者には明らかであろう。しかしながら、本開示を考慮すれば、本発明の精神および範囲から逸脱することなく、開示された特定の実施形態において多くの変更を行うことができ、なお同様で類似した結果が得られることは当業者には明らかであろう。
【実施例1】
【0169】
固相フォトバイオリアクター
Ziploc(登録商標)の再シール可能なクロージャーを有する2ミルポリエチレンバリア層で構成される静的な原型装置を構築した。60平方センチメートルの通気性パネルを1つの表面に組み込み、225平方センチメートルの綿織物培養担体表面を内部に入れた。この装置を70容量%の水性エタノールで処理することによって滅菌し、次いで、無菌濾過した空気流を用い、50℃で装置を乾燥した。滅菌BG-11培地30mlを培養担体上に吸収させ、次いで、エアゾールアプリケーターを用いて、シネココッカス・エロンガタスPCC 7942の前培養物を増殖表面に接種した。接種の前に、6℃で2日間、BG-11培地中で前培養物を増殖させた。33℃に維持され、白色蛍光ランプを用いて300マイクロアインシュタインで照射されているインキュベーションチャンバーにフォトバイオリアクターを入れた。2日後、リアクターは微生物の活発な増殖を示し、さらに2日間、増殖を継続させ、その後リアクターをインキュベーターからはずし、増殖表面を脱イオン水を洗浄した。蒸発によって水を除去し、乾燥重量254mgのバイオマスを得た。
【実施例2】
【0170】
光合成微生物によるスクロースの生産
以下は、フォトバイオリアクターと組み合わせた光合成微生物によるスクロースの生産方法を例示するための予言的実施例である。約15〜40℃の温度、約60〜300マイクロアインシュタインの照射下、約0.2〜15容量%の二酸化炭素濃度で、シネコシスチス種PCC 6803または操作されたシネコシスチス種のいずれかを用いて、おおよそ4〜7日間、少なくとも1つのフォトバイオリアクター、例えば実施例1または実施例3に記載されているような本発明のフォトバイオリアクターを運転することができる。最初の培養期間後に、エアゾールスプレーを用いて、約0.01〜1.5M、より好ましくは約0.2〜0.9Mの濃度範囲の水性塩溶液で増殖表面を処理できる。スクロースを生産させるために、おおよそさらに1日間から2日間培養を続けさせることができる。次いで、脱イオン水で表面を洗浄することによって、増殖表面を収穫することができる。他の実施形態において、洗浄水は滅菌新鮮培養培地であり、洗浄の厳密さは、約70〜90%の細胞塊が収穫される程度である。次いで、培養担体上に残っているバイオマスを、次のサイクルとして増殖を続けさせる。この培養の収量は、用いられる増殖表面材料および微生物に応じて、乾燥バイオマス約200〜600mgであることが期待される。
【実施例3】
【0171】
吸水性ポリマーでコーティングされた固体培養担体
BG-11培地に分散させた滅菌1.5重量パーセント寒天の加熱溶液で材料の滅菌乾燥表面をディップコーティングにより、実施例1に記載のタイプの静的なフォトバイオリアクターの増殖表面を調製した。コーティングされた増殖表面を冷却し硬化させ、次いで表面を滅菌保護バリアに挿入してフォトバイオリアクター装置を作成し、実施例1に記載の前培養で培養されているシネココッカス種を接種した。本質的に実施例1に記載されているようにして培養および収穫を行った。
【実施例4】
【0172】
asf遺伝子標的
スクロースリン酸シンターゼ(sps)およびスクロースリン酸ホスファターゼ(spp)活性の調節を通して、シアノバクテリアにおけるスクロースの生合成を研究した。浸透圧およびマトリックス水ストレスへの順応のために、このような活性は多くのシアノバクテリアに既に存在している(例えば、Lunn, J. E. 2002. Plant Physiol 128, 1490-1500 を参照のこと)。
【0173】
Lunn, J. E. (2002. Plant Physiol 128, 1490-1500)は、シネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942を含むいくつかの微生物のspsおよびspp遺伝子のゲノム構造を解析した。Lunnは、シネコシスチス種PCC 6803(配列番号3)のスクロースリン酸シンターゼ(SPS)が、不活性なスクロースリン酸ホスファターゼ(SPP様)ドメインおよび別個のSPP活性を有することを提案した。SPP様ドメインはsppと高レベルの同一性を有するが、ハロ酸デハロゲナーゼ(HAD)スーパーファミリーの保存された活性部位残基の多くを欠失している。シネココッカス・エロンガタスPCC 7942に関する研究はいまだになされていないが、Lunnは、両方の活性が1つの酵素に含まれていることを提案した。これらの酵素のアラインメントを図5に示す。
【0174】
シネココッカス・エロンガタスPCC 7942ゲノムの研究により、染色体の他の部分では別個のsps遺伝子が明らかにならなかった。同義遺伝子発現の必要性を避けるために、シネココッカス・エロンガタスPCC 7942酵素(配列番号2)を用いた。PCC 7942からの遺伝子はspsと呼ばれているが、SPSおよびSPP活性の両方を有する1つの融合酵素であるため、活性融合SPS/SPP(配列番号1)の代わりにasfと名づけられた(別個のSPP酵素の可能な発現に関するさらなる情報については下記を参照のこと)。
【0175】
シネココッカス・エロンガタスPCC 7942のasf遺伝子産物(配列番号2)の発現には2つのアプローチがある。
【0176】
第1アプローチは、広宿主域ベクターpMMB67EH上に構築されたプラスミドベースの発現系である(Furste, J. P., Pansegrau, W., Frank, R., Blocker, H., Scholz, P., Bagdasarian, M. and Lanka, E. 1986. Gene 48, 119-131)。プラスミドpMMB67EHはRSF1010の誘導体であり、これは大部分のグラム陰性微生物において複製され、一部のグラム陽性微生物においてさえも複製されるため、大腸菌、シネコシスチス種PCC 6803、シネココッカス・エロンガタスPCC 7942および種々の他のシアノバクテリア内でのスクロース生産のプラスミドベースの解析が可能である(Kreps, S., Ferino, F., Mosrin, C., Gerits, J., Mergeay, M. and Thuriaux, P. 1990. Mol Gen Genet 221, 129-133; Marraccini, P., Bulteau, S., Cassier-Chauvat, C., Mermet-Bouvier, P. and Chauvat, F. 1993. Plant Molecular Biology 23, 905-909; Gormley, E. P. and Davies, J. 1991. J Bacteriology 173, 6705-8)。
【0177】
第2アプローチは、upp(ウラシルホスホリボシルトランスフェラーゼ)遺伝子座でのシネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942の染色体への安定な組み込みである。upp遺伝子座は、下記の理由で選択した。
【実施例5】
【0178】
プラスミドベースの発現
asf遺伝子産物、pLybAL11(例えば、図6;配列番号19参照)およびpLybAL12(例えば、図7;配列番号20参照)のプラスミドベースの発現のために、2つのプラスミドを設計した。所定のプロモーターからの発現のためにプラスミドpLybAL12を構築し、無作為に選択されたプロモーターからの発現のためにpLybAL11を構築した。
【0179】
2つのプラスミドを以下のように構築した。鋳型として全細胞を用い、オリゴヌクレオチド5'-AGACTACAATTGGGGCGTTTTCTGTGAG-3'(MfeI制限エンドヌクレアーゼ部位はヌクレオチド位置7〜12である)(配列番号7)および5'-CTTACGTGCCGATCAACGTCTCATTCTGAAAAGGTTAAGCGATCGCCTC-3'(配列番号8)を用いるPCRによりシネココッカス・エロンガタスPCC 7942からのasf遺伝子を増幅し、配列番号1の産物を得た。
【0180】
上流プロモーターの有り無しでの、クロラムフェニコールアセチルトランスフェラーゼをコードする遺伝子(cat)をpBeloBAC11(GenBankアクセッション番号U51113)から増幅した。
【0181】
プロモーターを欠くcat遺伝子は、オリゴヌクレオチド5'-TTATCGCGATCGTCAGGAGCTAAGGAAGCTAAAATGGAG-3'(配列番号9)および5'-CGACCAATTCACGTGTTTGACAGCTTATC-3'(配列番号10)(PvuIおよびPmlI制限エンドヌクレアーゼ部位は、それぞれヌクレオチド位置4〜9および10〜15である)を用いるPCRによってpBeloBAC11から増幅し、配列番号11の産物を得た。
【0182】
プロモーターを含むcat遺伝子は、オリゴヌクレオチド5'-TTTTGGCGATCGTGAGACGTTGATCGGCACGTAAG-3'(配列番号12)および5'-CGACCAATTCACGTGTTTGACAGCTTATC-3'(配列番号13)(PvuIおよびPmlI制限エンドヌクレアーゼ部位は、それぞれヌクレオチド位置7〜12および10〜15である)を用いるPCRによってpBeloBAC11から増幅し、配列番号14の産物を得た。
【0183】
cat遺伝子を含むPCR産物をPvuIで消化し、T4 DNAポリメラーゼで末端を平滑化した。次いでこれらを、個別にasf PCR産物に連結した。得られた産物をアガロースゲル電気泳動で精製し、MfeIおよびPmlIで消化し、次いで、EcoRIおよびHpaIで消化したpMMB67EHの6.6Kbpの産物にT4 DNAリガーゼで連結した。ケミカルコンピテントNEB5α(New England Biolabs社;マサチューセッツ州イプスウィッチ)を連結産物で形質転換し、100μg/mlアンピシリンを添加したLB寒天上37℃で選択した。選択された候補をミニプレップのために100μg/mlアンピシリンを添加したLB中37℃で増殖させ、制限エンドヌクレアーゼ消化物で分析し、次いでオリゴヌクレオチド5'-GCTTCTGCGTTCTGATTTAATCTGTATCAG-3'(配列番号15)、5'-TATCACTTATTCAGGCGTAGCAACCAG-3'(配列番号16)、5'-GTCGTTAGTGACATCGACAACACACTG-3'(配列番号17)、および5'-GATCGCGATACTGATCGAGATAGGTC-3'(配列番号18)を用いる配列分析によって確認した。さらなる研究のために、候補番号5のpLybAL11(pLybAL11-5)(配列番号19)および候補番号1のpLybAL12(pLybAL12-1)(配列番号20)を選択した。
【0184】
ミニプレップ中のプラスミド収量に基づけば、大腸菌株NEB Turbo(New England Biolabs社;マサチューセッツ州イプスウィッチ)内で増殖させるとき、これらのプラスミドのコピー数は著しく低下していると思われるため、これらのプラスミドのための宿主株の選択における重要性が示唆される。
【実施例6】
【0185】
プロモーター挿入
pLybAL12-5への挿入のために、6つのプロモーターを選択した。カルバモイルリン酸シンターゼをコードするシネコシスチス種PCC 6803 carBの推定プロモーター(遺伝子pyrRのすぐ上流に存在すると考えられ、それらはオペロンとして共転写されると考えられる)を選択した。なぜなら、ピリミジンおよびアルギニン生合成の両方におけるその役割により丈夫であると考えられるからである。シネコシスチス種PCC 6803(Aichi, M., Takatani, N. and Omata, T. 2001. J Bacteriol. 183, 5840-5847)およびシネココッカス・エロンガタスPCC 7942(Maeda, S-I. et al. 1998. J Bacteriol 180, 4080-4088)の両方からの硝酸レダクターゼ(nirA)プロモーターを、窒素供給源により制御されるそれらの能力のために選択した。シネココッカス・エロンガタスPCC 7942からの光化学系II D1タンパク質(psbAII)のための丈夫な明期プロモーター(Golden, S. S., Brusslan, J. and Haselkorn, R. 1986. EMBO Journal 5, 2789-2798)およびシネコシスチス種PCC 6803からの2つの暗期プロモーター[dnaK (Aoki, S., Kondo, T. and Ishiura M. 1995. J Bacteriol 177, 5606-11)およびkaiA(Kucho, K-I. et al. 2005. J Bacteriol 187, 2190-2199)]もまた、調節型シアノバクテリア由来プロモーターとして選択した。最後に、シアノバクテリアにおいて活性であることが示されているλPR温度調節型プロモーターを選択した(Ferino, F. and Chauvat, F. 1989. Gene 84, 257-66; Mermet-Bouvier, P. and Chauvat, F. 1994. Current Microbiology 28, 145-148)。
【0186】
以下のオリゴヌクレオチドを用いて、鋳型として全細胞を用いるPCRによってプロモーターを増幅し、示されている産物を得た。クローニングに組み込まれている制限エンドヌクレアーゼ部位は、配列中に示されている。
【0187】
それぞれがヌクレオチド位置7〜12に制限エンドヌクレアーゼ部位を有するオリゴヌクレオチド5'-CGGTGTGCATGCCGTTATTGATGGAATG-3'(配列番号21)および5'-TCACTAGGTACCTAAATTACCTGGGAAGCCAG-3'(配列番号22)を用いるPCRによって、シネコシスチス種PCC 6803 pyrR(SphI/KpnI)(配列番号23)を全細胞から増幅した。
【0188】
それぞれがヌクレオチド位置7〜12に制限エンドヌクレアーゼ部位を有するオリゴヌクレオチド5'-CCCAAGGCATGCAGGAAAACAAGCTCAGAATGCTG-3'(配列番号24)および5'-TTTATTGGTACCAACGCTTCAAGCCAGATAACAGTAGAGATC-3'(配列番号25)を用いるPCRによって、シネコシスチス種PCC 6803 nirA(SphI/KpnI)(配列番号26)を全細胞から増幅した。
【0189】
オリゴヌクレオチド5'-ATCTTTGCGTTCCGTGACGGCTACTG-3'(配列番号27)および5'-GCAGATGGTACCGGTCAGCAGAGTG-3'(ヌクレオチド位置7〜12に制限エンドヌクレアーゼ部位を有する)(配列番号28)を用いるPCRによって、シネココッカス・エロンガタスPCC 7942 psbAII(SphI/KpnI)(配列番号29)を全細胞から増幅した。
【0190】
それぞれがヌクレオチド位置7〜12に制限エンドヌクレアーゼ部位を有するオリゴヌクレオチド5'-CAGCCAGCATGCATAAATTTCTGTTTTGACCAAACCATCC-3'(配列番号30)および5'-GTGGCTGGTACCATGGATTCATCTGCCTACAAAG-3'(配列番号31)を用いるPCRによって、シネココッカス・エロンガタスPCC 7942 nirA(SphI/KpnI)(配列番号32)を全細胞から増幅した。
【0191】
それぞれがヌクレオチド位置7〜12に制限エンドヌクレアーゼ部位を有するオリゴヌクレオチド5'-GTGCATTCTAGATGGCTACGAGGGCAGACAGTAAG-3'(配列番号33)および5'-TTCTGTGGTACCATATGGATCCTCCTTCTTAAGATGCAACCATTATCACC-3'(配列番号34)を用いるPCRによって、λPR(XbaI/KpnI)(配列番号35)を全細胞から増幅した。
【0192】
それぞれがヌクレオチド位置7〜12に制限エンドヌクレアーゼ部位を有するオリゴヌクレオチド5'-GCCCCAGCATGCACCAGTAAACATAAATCTC-3'(配列番号36)および5'-ATTGGTGGTACCGAGGTCAATCCCAACAAC-3'(配列番号37)を用いるによって、シネコシスチス種PCC 6803 dnaK(SphI/KpnI)(配列番号38)を全細胞から増幅した。
【0193】
それぞれがヌクレオチド位置7〜12に制限エンドヌクレアーゼ部位を有するオリゴヌクレオチド5'-GCCAGAGCATGCAAAGCTCACTAACTGG-3'(配列番号39)および5'-GGAAAAGGTACCTGAGTCTATGGGCAACGTG-3'(配列番号40)を用いるPCRによって、シネコシスチス種PCC 6803 kiaA(SphI/KpnI)(配列番号41)を全細胞から増幅した。
【0194】
増幅後、PCR産物を上記で示されている制限エンドヌクレアーゼで消化し、ゲル精製し、同様に消化したpLybAL12-1に連結して、それぞれプラスミドpLybAL15(配列番号44)、pLybAL16(配列番号45)、pLybAL17(配列番号46)、pLybAL18(配列番号47)、pLybAL19(配列番号48)、pLybAL21(配列番号49)、およびpLybAL21(配列番号50)を得た。エレクトロコンピテントNEB5α(New England Biolabs社;マサチューセッツ州イプスウィッチ)を連結産物で形質転換し、100μg/mlアンピシリン、34μg/mlクロラムフェニコールおよび5%スクロースを添加したLB寒天上、30℃で選択した。選択された候補をミニプレップのために100μg/mlアンピシリン34μg/mlクロラムフェニコールおよび5%スクロースを添加したLB中30℃で増殖させ、制限エンドヌクレアーゼ消化物で分析し、次いでオリゴヌクレオチド5'-GCTTCTGCGTTCTGATTTAATCTGTATCAG-3'(配列番号42)および5'-ATGGGTCTGAATGTGCAGAATGTAGAG-3'(配列番号43)を用いる配列分析によって確認した。プラスミドpLybAL15(配列番号44)、pLybAL16(配列番号45)、pLybAL17(配列番号46)、pLybAL18(配列番号47)、pLybAL19(配列番号48)、pLybAL21(配列番号49)およびpLybAL21(配列番号50)のそれぞれに対し、候補6および7(pLybAL15-6およびpLybAL15-7)、2(pLybAL16-2)、4および5(pLybAL17-4およびpLybAL17-5)、1および2(pLybAL18-1およびpLybAL18-2)、1および2(pLybAL19-1およびpLybAL19-2)、3および5(pLybAL21-3およびpLybAL21-5)ならびに4および8(pLybAL22-4およびpLybAL22-8)を選択した。
【0195】
スクロースおよび両抗生物質を添加したLB上でのこれらのプラスミドの選択および増殖は、クローンを得るためには大変重要であった。始めは、アンピシリンのみを添加したLB上で選択を行ったが、プロモーターを含むプラスミドは単離できなかった。単離物は、ベクターのみの再連結反応物であるか、または異なるサイズでクロラムフェニコールの存在下で増殖する能力を欠くものであった。細胞内スクロースが生産され、スクロース生産を防ぐ欠失をもたらす細胞に対する浸透圧ショックが生じたと考えられる。それに続く実験により、ひとたび単離されれば、プラスミドは、おそらくは結果として生じる浸透圧ストレス装置および/またはスクロース消費酵素の誘導により、スクロースの非存在下で安定であることができることを示している。
【実施例7】
【0196】
シネコシスチスおよびシネココッカスの形質転換
プロモーターを含有するプラスミド、pLybAL15(配列番号44)、pLybAL16(配列番号45)、pLybAL17(配列番号46)、pLybAL18(配列番号47)、pLybAL19(配列番号48)、pLybAL21(配列番号49)およびpLybAL21(配列番号50)に加えて、プロモーターを含有しないpLybAL12-1ベクター(配列番号20)(実施例5〜6参照)を、特記しない限り、Elhai,J.and Wolk,C.P.1988.Methods in Enzymology167,747-754に基づいて行う三親接合によって、シネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942の両方に挿入した。
【0197】
30℃で増殖させた、カーゴ株(導入されたプラスミドを含むNEB5α)の終夜培養物に加えて、ヘルパープラスミドpRK2013(ATCC37159)を含むHB101の終夜培養物を遠心分離でペレット化し、LBで2回洗浄し、次いで元の容量の10分の1のLBに再懸濁した。おおよそ0.5のOD730への一定の照度下で、微量元素をNitsch微量元素(Nitsch, J. P. and Nitsch, C. 1956. American Journal of Botany 43, 839-851)に置き換えた以外はBG11と同じであるBG11-Aを用いて、30℃で各シアノバクテリアを増殖させた。細胞を遠心分離でペレット化し、BG11-Aで2回洗浄し、7.5倍高い濃度でBG11-Aに再懸濁した。10-5まで、BG11-Aでシアノバクテリアの一連の10倍希釈液を調製した。各希釈液において、シアノバクテリア100μlを、大腸菌のカーゴ株およびヘルパー株のそれぞれ50μlと混合した。次いで、各混合物150μlを、5%LBを添加したBG11-A寒天(1.5%)プレート上にプレーティングした。一定の照度下、26〜28℃で16〜24時間、プレートをインキュベートした。各プレート上の寒天(およそ30ml)を移動させ、100Xクロラムフェニコール溶液300μlを加えた。クロラムフェニコールの最終濃度は、シネコシスチス種PCC 6803に関して25μg/mlであり、シネココッカス・エロンガタスPCC 7942に関しては7.5μg/mlであった。インキュベーションを8〜12日間続けた。接合伝達株の各コロニーを、再度、適切な量のクロラムフェニコールを添加したBG11-A上に再ストリークすることにより汚染した大腸菌を精製除去して単離されたコロニーを得た。
【実施例8】
【0198】
pLybAL11-5におけるプロモーターライブラリー
以下の実施例により、pLybAL11-5(配列番号19)を用いる、プロモーター選択のためのシアノバクテリアDNAのライブラリーの構築を説明する(実施例5参照)。Wilson, K. (1997. Preparation of Genomic DNA from Bacteria. In Current Protocols in Molecular Biology. John Wiley and Sons Vol. 1, pp. 2.4.1-2.4.5)の染色体DNAの単離プロトコルの、改変されたスケールアップバージョンを用いたが、主な違いは、ずっと長いインキュベーション時間およびSDSをサルコシルで置き換えたことであった。単離されたDNAは、pLybAL11-5のBamHI部位への挿入のための部分Sau3AI消化のために十分な品質を有していた。図8に示すように、フラグメントのあるものはプロモーターを有し、他はプロモーターを有さないと考えられる。
【0199】
ライブラリー構築のプロセス中に、asf遺伝子内の可能なプロモーターが見出された。プロモーターとして機能するためには、クローニングベクター、プラスミドpLybAL11-5(配列番号19)は、プロモーターがasf遺伝子の前に挿入されたときにのみ、クロラムフェニコールに耐性を示すはずである。なぜならこのマーカーは、その通常のプロモーターを欠き、asfの上流のプロモーターは含まれないからである。しかしながら、構築されるやいなや、このプラスミドにより付与されるクロラムフェニコール耐性を大腸菌内で試験した。pLybAL11-5を含むNEB5αを、34μg/mlクロラムフェニコールを添加したLB寒天(1.5%)上37℃で培養したとき、増殖が観察された。しかしながら、34μg/mlクロラムフェニコールを加えた液体LB培地で培養したとき、皆無かそれに近い増殖が観察された。pLybAL12-1(配列番号20)を含むNEB5αは、クロラムフェニコールの存在下、固体および液体LB培地の両方で増殖する。
【0200】
asf遺伝子の上流であるが、転写ターミネーターの下流であるプロモーターが欠失したものがないか確かめるために、pLybAL11を作成するためにpMMB67EHに挿入したインサートを、Lucigen大腸菌株(E. cloni 10G)コンピテント細胞を含むLucigen’s CloneSmartキットを用いるLucigen社(ウィスコンシン州ミドルトン)のpSMART-LCKan平滑末端クローニングベクターにクローニングした(例えば、図9参照)。これが平滑末端化クローニングであったため、インサートはいずれかの方向でプラスミドに連結することが可能であり、pLybAL13f(配列番号51)およびpLyAL13r(配列番号52)が作成された。このベクターは、クローニング部位をターミネーターで囲うことによって、ベクターからの読み通し転写を除去するように特に設計されている。対照として、pLybAL12を構築するために用いたインサートもまたこのベクターに挿入し、pLybAL14f(配列番号53)およびpLybAL14r(配列番号54)を作成した。これらのプラスミドはアガロースゲル上で適切なサイズと思われたが、クローンの完全性を確認されるためのDNA配列決定によりインサートは確認されなかった。しかしながら、pLybAL13およびpLybAL14を含むE.cloni 10Gに関して同様な結果が見られ(fまたはr方向のいずれかに連結されたクローニングされたDNAで)、またpLybAL11(配列番号19)およびpLybAL12(配列番号20)をそれぞれ含むNEB5αに関しても見られた。このことは、このプロモーターの活性が大腸菌内では弱いことを示している。
【0201】
多くの大腸菌プロモーターは、シアノバクテリアでは機能しないし、逆もまた同様である。このプロモーター活性が、シネコシスチス種PCC 6803またはシネココッカス・エロンガタスPCC 7942では観察されない可能性がある。この事を確認するために、前述のように、接合によって、両方の微生物にpLybAL11-5(配列番号19)を挿入した。クロラムフェニコール(シネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942に対して、それぞれ、25μg/mlおよび7.5μg/ml)を添加したBG11-A寒天(1.5%)上で増殖が観察された。
【0202】
クロラムフェニコールを添加した液体BG11-A上で、pLybAL11-5(配列番号19)を含むこれらの微生物の増殖を試験した。この活性は大変弱く、多重コピープラスミドで存在する場合のみ観察される可能性がある。これは大腸菌での場合であって、シアノバクテリアではそうではないと思われる。RSF1010は、比較的低コピーのプラスミドであり、大腸菌内で12コピーのみを有する(Frey, J., Bagdasarian, M. M. and Bagdasarian, M. 1992). Gene 113,101-106)。急速な分裂を行っている大腸菌は、多くてその染色体を2コピー有し、従って少なくとも6倍のコピー数増加を有する。このプラスミドに関するシアノバクテリアにおける同等のコピー数は同様である。シネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942の、それぞれ10〜12および16の染色体コピー数は類似している(Labarre, J., Chauvat, F. and Thuriaux, P. 1989. J Bacteriol 171, 3449-57)。上記の結果は、シアノバクテリアのasf遺伝子内のプロモーターの存在を示唆している。
【0203】
図10は、asf遺伝子内のプロモーター(単数または複数)の可能な位置を示している。転写開始領域は、Curtis, S. E. [1994. The transcription apparatus and the regulation of transcription initiation. In The Molecular Biology of Cyanobacteria. Bryant, D. A. (ed). Kluwer Academic Publishers pp. 613-699] に記載されている。翻訳開始領域は、Sazuka, T. and Ohara, O. (1996. DNA Research 3, 225-232)によって定義されている。
【0204】
既知のSPS酵素に対するアラインメントおよびただ2コドン上流の終止コドンの存在に基づいて、asf遺伝子の翻訳開始はGTG開始コドンで開始されると予想される。ATG開始コドンが最も一般的とはいえ、GTGおよびTTGはあまり一般的ではないがまれではない。アデニンヌクレオチドが、好ましくは開始コドンの第1ヌクレオチド9〜12bp離れた16S rRNAの3'末端に相補的な典型的な大腸菌様シャイン・ダルガノ配列(GGAGまたはGAGG)もまた、少し長めのスペースではあるが存在する。この配列は、SazukaおよびOharaによって研究された遺伝子の約半分において見出されている。あまり最適ではないスペースはまれではないが、多くの場合発現のレベル低下をもたらす。シャイン・ダルガノ配列の上流であってMfeI部位の下流には、プロモーターを組み込むためには配列が少なすぎる。部分プロモーターが組み込まれることは可能ではあるが、プロモーターの残りは3つのプラスミド(pLybAL11-5(配列番号19);pLybAL13f(配列番号51);およびpLybAL13r(配列番号52))のすべてのベクター配列により産生されなけらばならず、それはありそうもない。
【0205】
従って、プロモーター活性はasf遺伝子内に位置すると考えられる。プロモーターがasf遺伝子内にあるとすれば、1つの可能な位置がasfのSPPドメインの前である。これは、シネコシスチス種PCC 6803からのものと同様な四次構造であるシネココッカス・エロンガタスPCC 7942のスクロース生合成酵素を与える。各微生物は、SPPと翻訳的に融合されたSPSドメインまたはSPP様ドメインおよび、互いに相互作用できる(できない)別個のSPPの2つのタンパク質を有すると考えられる。
【0206】
第1に、asfのSPPドメインが別々に翻訳されうるかどうか決定した。図10および表1に示すように、シャイン・ダルガノ配列に先行するSPPドメインのすぐ上流のTTG開始コドンが存在する。
【表1】

【0207】
開始コドンの周囲の領域は、天然開始コドンとほぼ同様に、SazukaおよびOharaによって決定された72シアノバクテリア遺伝子のコンセンサスと一致する。プロモーターが大腸菌内で活性であると考えられることから、大腸菌プロモーターに関して確立されたルールに基づいてシアノバクテリアプロモーターを決定する一方で、典型的な-35および-10領域を調べた。図10に見られるように、2つの可能なプロモーターが同定された。asfの他の部分でのさらなるプロモーター(単数または複数)の可能性は残っている。
【実施例9】
【0208】
大腸菌からのプラスミドのシアノバクテリアへの導入
シアノバクテリアへのpMMB67EHベースプラスミドの導入のために接合を用いた。これらの微生物の形質転換のためのプロトコルは存在するが(Zang, X., Liu, B., Liu, S., Arunakumara, K. K. I. U. and Zhang, X. 2007. Journal of Microbiology 45, 241-245; Golden, S. S. and Sherman, L. A.1984. Journal of Bacteriology 158, 36-42)、天然形質転換を用いるシネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942へこれらのプラスミドを挿入するこのようなアプローチは不成功に終わった。
【0209】
シアノバクテリアにおけるプラスミドの存在は確認した。オリゴヌクレオチド5'-AGACTACAATTGGGGCGTTTTCTGTGAG-3'(配列番号7)および5'-GGTGGTTGTGTTTGACAGCTTATC-3'(配列番号55)を用いて、asf/cat遺伝子組み合わせのPCRによってプラスミドの存在に関して接合伝達株を分析し、3.1kbの産物を得た。さらに、プラスミドを単離し、分析した。クロラムフェニコール(前述の濃度で)を添加したBG11-A中で増殖させた細胞培養物を遠心分離でペレット化し、TEに再懸濁し、熱処理し、Promega Wizard SV Plusミニプレップキットでミニプレップした。しかしながら収率が低いので、直接のプラスミド分析は困難である。それとして、単離されたDNAを大腸菌NEB5αに形質転換し、Promega Wizard SV Plusミニプレップキットを用いて再単離し、制限エンドヌクレアーゼ分析にかけた。
【実施例10】
【0210】
スクロース生産アッセイおよび分析
スクロース蓄積に関して、pLybAL19またはpLybAL17を用いるシネココッカス形質転換をアッセイした(実施例7参照)。BioVision社(カリフォルニア州マウンテンビュー)のスクロースアッセイキットを用いてスクロースを用いて測定する。4時間の誘導期間(pLybAL17(配列番号46)に関する、50マイクロアインシュタインから180マイクロアインシュタインへの光の増強およびpLybAL19(配列番号48)に関する、26℃から39℃への温度の上昇)後にアッセイを行った。細胞内に存在するバックグラウンドのグルコースに関してデータを補正した。
【0211】
pLybAL19(配列番号48)で形質転換したシネココッカスは、乾燥バイオマス1mg当たり0.78ナノモルのスクロースを蓄積したという結果が得られた。pLybAL17(配列番号46)で形質転換したシネココッカスは、乾燥バイオマス1mg当たり0.95ナノモルのスクロースを蓄積したという結果も得られた。
【0212】
大腸菌、シネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942におけるプラスミドベースのスクロース生産のさらなる分析を行った。細菌はスクロースを消費できるので、検出は困難な可能性がある。そのようなものとして、抑制条件下で細胞を増殖させ、誘導後直ちにアッセイした。pyrRプロモーターは、ウラシルを含む増殖により抑制され、ウラシルを欠く培地に移すことにより誘導されることができる。nirAプロモーターは、窒素源としてアンモニウムイオンを含む増殖により抑制され、窒素源として硝酸塩を含む培地に移すことにより誘導されることができる。psbAIIプロモーターは、微光から高照度へ移行させることができる。暗期プロモーターは、明から暗へ移行させることができる。そしてλPRプロモーターは、低温(25℃)から高温(39℃)へ移行させることができる。
【実施例11】
【0213】
安定な染色体組み込みによる発現
スクロース生合成遺伝子の挿入は、10-16染色体の不完全分離をもたらす細胞増殖への悪影響を引き起こす恐れがある。抗生物質耐性マーカーに関する通常の選択を用いても、マーカーのさらなるコピーを有することは、抗生物質の存在下で生き残る細胞の能力に劇的な影響を与えない。従って、陰性表現型に直面する場合、抗生物質選択を用いても、染色体の完全分離を達成することは困難な恐れがある。
【0214】
大部分の生物において、upp遺伝子(ウラシルホスホリボシルトランスフェラーゼをコードする)の欠失は、さもなければ毒性の5-フルオロウラシルに対して耐性をもたらす。完全耐性を得るためには、upp遺伝子のすべてのコピーが欠失されなければならない。従って、シネコシスチス種PCC 6803(配列番号56)およびシネココッカス・エロンガタスPCC 7942(配列番号58)のupp遺伝子座への組み込みは、5-フルオロウラシル耐性をもたらし、陰性表現型の存在下であっても、完全分離の正の選択を可能にする。
【実施例12】
【0215】
upp/カナマイシン耐性カセット
upp/カナマイシン耐性カセットを用いるゲノム操作のための一般的戦略の概略を図11に示す。遺伝子の欠失が示されているが、この戦略は、“置換”ステップにおいて挿入および変異に容易に改変できる。
【0216】
upp/カナマイシン耐性カセットを構築した。製造業者のプロトコルに従って、平滑末端クローニングベクターpCC1および大腸菌株EPI300を用いて、Epicentre Bioechnologies CopyControlクローニングキットでカセットを構築した。オリゴヌクレオチド5'-AAGAAGCAAGACAGCGTGTAGCTGCTCTGACTG-3'(配列番号60)および5'-TCCCGGGATTTGGTACCTTATTTTGTTCCAAACATGCGGTCACCCGCATC-3'(ヌクレオチド位置2〜7および12〜17に制限エンドヌクレアーゼ部位を有する)(配列番号61)を持ちいて、全細胞からバチルス・ズブチリス(Bacillus subtilis)168からのupp遺伝子を増幅して配列番号62の産物を得た。
【0217】
PCR産物をpCC1にクローニングし、Epicentre Biotechnologies社のプロトコルの記載に従って、クロラムフェニコールを添加したLB上でインサートを含むものを選択した。制限エンドヌクレアーゼ消化物によって、lacZに対して順方向をスクリーニングして、pLybAL7f(配列番号65)を得た。インサートの正確な配列を、候補3および8(pLybAL7-3およびpLybAL7-8)に関して、オリゴヌクレオチド5'-GTAATACGACTCACTATAGGGC-3'(配列番号63)および5'-CACACAGGAAACAGCTATGACCAT-3'(配列番号64)を用いるDNA配列決定によって確認した。
【0218】
LybradynベクターpLybAA1[そもそもはpACYC177に由来する(Rose,R.E.1988.Nucleic Acids Res.16、356]からのカナマイシン耐性マーカーを、オリゴヌクレオチド5'-GTCAGTGCACTGCTCTGCCAGTGTTACAACC-3'(ヌクレオチド位置5〜10でApaLI制限エンドヌクレアーゼ部位を有する)(配列番号66)および5'-CTCAGTGGCGCCAAAACTCACGTTAAGGGATTTTGGTC-3'(配列番号67)(ヌクレオチド位置7〜12でNarI制限エンドヌクレアーゼ部位を有する)を用いて増幅し、配列番号68の産物を得た。
【0219】
PCR産物をApaLIおよびNarIで消化し、同様に消化したpLybAL7fに連結して、pLybAL8f(配列番号69)を得た。50μg/mlネオマイシンを添加したLB上で適切なプラスミドを選択し、制限エンドヌクレアーゼ消化で試験した。
【実施例13】
【0220】
UPP欠失
スクロース、トレハロース、グルコシルグリセロールおよびマンノシルフルクトースを含む糖の発現のための染色体インサートの分離を強いる1つの戦略は、染色体からのuppの欠失を利用して、5-フルオロウラシルへの耐性を導くことである。このことは、多くの微生物(大腸菌および枯草菌など)において確立されているが、シネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942などのシアノバクテリアに関しては、以前は確立されていなかった。
【0221】
試験により、これらの微生物のそれぞれの増殖が、1μg/mlの5-フルオロウラシルにより完全に抑制されることが示された。シネコシスチス種PCC 6803の増殖は0.5μg/mlの5-フルオロウラシルによって完全に抑制され、0.1μg/mlの5-フルオロウラシルまで感受性を示した。
【0222】
オリゴヌクレオチドSspupp-F(配列番号96)およびSspupp-R(配列番号97)を用いて、両方のシネコシスチス種PCC 6803のupp遺伝子および周囲の配列を増幅した。オリゴヌクレオチドSeloupp-F(配列番号98)およびSeloupp-R(配列番号99)を用いて、シネココッカス・エロンガタスPCC 7942のupp遺伝子および周囲の配列を増幅した。次いで、PCR産物(シネコシスチス種PCC 6803のupp、配列番号100;シネココッカス・エロンガタスPCC 7942のupp、配列番号101)を、製造業者の使用説明書により、Epicentre Biotechnologies社(ウィスコンシン州マディソン)平滑クローニングベクターpCC1にクローニングした。
【0223】
PCR産物(配列番号100または配列番号101)は、pCC1にいずれかの方向で連結することができるが、lacプロモーターに対して順方向を選択し、それぞれ、pLybAL3f(配列番号102)(シネコシスチス種PCC 6803のuppを含む)およびpLybAL5f(配列番号103)(シネココッカス・エロンガタスPCC 7942のuppを含む)を得た。オリゴヌクレオチドT7long(配列番号104)およびM13rev(配列番号105)を用いてインサートを配列決定した。シネコシスチス種PCC 6803のuppのヌクレオチド配列は配列番号111で表され、ポリペプチド配列は配列番号112で表される。シネココッカス・エロンガタスPCC 7942のuppのヌクレオチド配列は配列番号113で表され、ポリペプチド配列は配列番号114で表される。
【0224】
pLybAL3f(配列番号102)からBlpIおよびApaLIフラグメントを除去し、T4 DNAポリメラーゼで平滑末端化し、次いでT4 DNAリガーゼで再環状化して、プラスミドpLybAL4f(配列番号106)を作成した。次いで、pLybAL4fをAvrIIおよびSgfIで消化することによって、シネコシスチス種PCC 6803のupp遺伝子の一部を欠失させ、T4 DNAポリメラーゼで平滑末端化し、次いでT4 DNAリガーゼで再環状化して、pLybAL9f(配列番号107)を作成した。シアノバクテリアDNAを含むSacI/SphIフラグメント(配列番号108)をpLybAL9f(配列番号107)から切除し、同様に消化したpARO180(配列は完全には知られていない; Parke, D. 1990. Construction of mobilizable vectors derived from plasmids RP4, pUC18 and pUC19. Gene 93:135-137; ATCC 77123)に連結し、pLybAL25を作成した。pLybAL5fからSapIおよびApaLIフラグメントを除去し、T4 DNAポリメラーゼで平滑末端化し、次いでT4 DNAリガーゼで再環状化して、プラスミドpLybAL6fb(配列番号109)を作成した。次いで、BssHIIおよびBsaIでpLybAL6fbを消化することによってシネココッカス・エロンガタスPCC 7942のupp遺伝子の一部を欠失させ、T4 DNAポリメラーゼで平滑末端化し、次いでT4 DNAリガーゼで再環状化してpLybAL10fb(配列番号110)を作成した。pLybAL10fbからシアノバクテリアDNAを含むSacI/SphIフラグメント(配列番号138)を切除し、同様に消化したpARO180に連結してpLybAL26を作成した。
【0225】
プラスミドpLybAL25およびpLybAL26を大腸菌S17-1(ATCC47055)に挿入した。プラスミドpLybAL25およびpLybAL26は、二親接合によってシネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942に導入される予定である。これらのプラスミドはシアノバクテリア内で複製されないため、自殺ベクターとして機能し、染色体に乗り換え、染色体のコピーの1つにあるuppを欠失させるだろう。過剰の5-フルオロウラシルへの早期暴露による最適化されたプロトコルにより、細胞を致死させることなく分離の高速化が可能になると考えられる。
【実施例14】
【0226】
スクロース分解酵素の修飾
asfで形質転換されたシアノバクテリアが、スクロース分解活性の調節によってスクロース生産が改善されるように、さらに操作される。
【0227】
本発明者らは、シネコシスチス種PCC 6803(ヌクレオチド配列配列番号70;ポリペプチド配列配列番号71)およびシネココッカス・エロンガタスPCC 7942(ヌクレオチド配列配列番号72;ポリペプチド配列配列番号73)の両方において、インベルターゼホモログをコードする遺伝子を同定した。シネコシスチス種PCC 6803はまた、スクラーゼフェレドキシン様タンパク質(ヌクレオチド配列配列番号74;ポリペプチド配列配列番号75)(Machray G.C. et al. 1994. FEBS Lett 354, 123-127)をコードする。
【0228】
これらの遺伝子は、図11に示すマーカーレス欠失プロトコルを用いて欠失される。
【実施例15】
【0229】
スクロース分解酵素の修飾
asfで形質転換されたシアノバクテリアが、細胞からのスクロース分泌を促進するようにさらに操作される。
【0230】
高塩環境から低塩環境へ移行するときに一部の微生物によって浸透圧保護剤が処理されるのと同様に、低い浸透圧環境においては、スクロースは細胞から自動的に削除される可能性がある(Schleyer, M., Schmidt, R. and Bakker, E. P. 1993. Arch Microbiol 160, 424-43; Koo, S. P., Higgins, C. F. and Booth, I. R. 1991. J Gen Microbiol 137, 2617-2625; Lamark, T., Styrvold, O. B. and Strgim, A. R. 1992. FEMS Microbiol. Lett 96, 149-154)。シアノバクテリアの操作によってこのようなプロセスを促進させることができる。
【0231】
asfで形質転換されたシアノバクテリアが、スクロース透過酵素、例えば大腸菌およびサルモネラによって用いられているスクロース透過酵素または特定のシアノバクテリアの窒素固定包嚢へのスクロースの輸送におけるスクロース透過酵素を発現するようにさらに操作される(Jahreis K. et al. 2002. J Bacteriol 184, 5307-5316; Cumino, A. C. 2007. Plant Physiol 143, 1385-97)。これらの遺伝子をクローニングし、前述の技術に従ってシアノバクテリアを形質転換する。
【実施例16】
【0232】
ポリンで形質転換したシアノバクテリアによるスクロース分泌
シネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942からのスクロース分泌は、スクロースポリンでの形質転換によって促進させることができる。
【0233】
エンテロバクター・サカザキ(Enterobacter sakazakii)(ATCC BAA-894)からのスクロースポリンをコードする遺伝子(scrY)を、シネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942における発現のためにクローニングした。この遺伝子の機能は、その配列およびその近傍の配列から推測されている。エンテロバクター・サカザキscrYは、オリゴヌクレオチドEsscrYBamHI-F(配列番号88)およびEsscrYSacI-R(配列番号89)を用いるPCRによって染色体DNAから増幅した。PCR産物(配列番号90)をBamHIおよびSacIで消化し、同様に消化したpLybAL19に連結し、NEB5αにクローニングし、pLybAL32(配列番号91)を作成した。次いで、オリゴヌクレオチドEsscrYmidseq-F(配列番号92)およびEsscrYmidseq-R(配列番号93)を用いてscrY遺伝子(核酸配列番号94;ポリペプチド配列、配列番号95)を配列決定した。宿主に導入されたとき、この構築物は、遺伝子scrYおよび温度誘導性プロモーターの調節下に有るasfの同時発現を可能にする。このプラスミドは、三親接合によって(前述のように)シネコシスチス種PCC 6803に導入された。スクロース分泌における有効性に関して、形質転換されたシネコシスチス種PCC 6803が試験される。シネココッカス・エロンガタスPCC 7942の同様な形質転換および試験が次に行われる。
【実施例17】
【0234】
トレハロース蓄積シアノバクテリアの作成
大腸菌からのトレハロースリン酸シンターゼおよびトレハロースリン酸ホスファターゼをコードするトレハロース生合成遺伝子(それぞれotsAおよびotsB)は、2遺伝子オペロン、otsBA(配列番号115)において見出される。オリゴヌクレオチドEcotsBA-F(配列番号116)およびEcotsBA-R(配列番号117)を用いる大腸菌K12ゲノムDNAのPCR増幅によってこのオペロンをクローニングした。このPCR産物をAflIIおよびNheIで消化し、pLybAL19(配列番号48)にクローニングし、asf遺伝子の大部分を置換した。新規プラスミド、pLybAL23(配列番号118)は、温度誘導性λPRプロモーターの調節下に有るトレハロース生合成遺伝子を含んでいる。オリゴヌクレオチドEcotsBAmidseq-F(配列番号119)およびEcotsBAmidseq-R(配列番号120)を用いてこの遺伝子を配列決定し、その完全性を確認した。次いで、AflII(T4 DNAポリメラーゼで平滑末端化した)/otsBAオペロンを含むpLybAL23のNheIフラグメントをpLybAL15、pLybAL17、pLybAL21およびpLybAL22に連結し、SacI(T4 DNAポリメラーゼで平滑末端化した)およびNheIで消化し、それぞれpLybAL28(配列番号121)、pLybAL29(配列番号122)、pLybAL30(配列番号123)、およびpLybAL31(配列番号124)を作成することによって、otsBAオペロンの発現をpyrR、psbAII、dnaKおよびkiaAプロモーターの調節下においた(前述のように)。
【0235】
プラスミドpLybAL28(配列番号121)、pLybAL29(配列番号122)、pLybAL30(配列番号123)およびpLybAL31(配列番号124)のそれぞれを、三親接合(前述のように)によってシネコシスチス種PCC 6803に挿入した。
【0236】
それぞれpLybAL36(配列番号125)およびpLybAL37(配列番号126)を作成することにより、他のプロモーターに関して記載したもの同様にして、pLybAL23からのotsBAオペロンの発現を、pLybAL16およびpLybAL18におけるシネコシスチス種PCC 6803およびシネココッカス・エロンガタスPCC 7942nirAプロモーター(前述のように)の調節下においた。
【実施例18】
【0237】
トレハロースアッセイ
バイオマスを、必要に応じて遠心分離により培養液を分離し、0.2ミクロンフィルターを用いる濾過により清澄化した培養液から残留バイオマスを除去した。減圧下で蒸発させることにより培養液を濃縮して残渣を得た。濃縮した培養液を脱イオン水1mlに溶解し、次いで、トレハロースアッセイにおいて溶液10マイクロリットルをサンプリングした。遠心分離によって回収したバイオマスを計量皿に移し、100℃に加熱して残った水分を除去した。乾燥バイオマスの重さを量り、次いで試料100mgを脱イオン水1mlに溶解した。次いでこの混合物を粉砕し、固形物を遠心分離で除去した。清澄化した上清試料10マイクロリットルを脱イオン水で100倍に希釈し、希釈サンプル10マイクロリットルをトレハロースに関して試験した。
【0238】
トレハロースアッセイには、Biovision社から入手可能な市販のスクロースアッセイキットの改変手順を用いた。標準プロトコルの改変は、キットに付属しているインベルターゼ酵素溶液のためのトレハラーゼを置き換えることであった。このキットは、トレハロースをトレハラーゼで加水分解してグルコースを放出させることを含む。グルコースはグルコースオキシダーゼで酸化されて過酸化水素を生じ、これは呈色指示薬の存在下でペルオキシダーゼの作用によって検出される。570nmにおけるその特性吸収によって呈色指示薬を定量的に測定し、もとから試料中に存在したグルコースの濃度を得る。
【0239】
Gutierrez C, Ardourel M, Bremer E, Middendorf A, Boos W, Ehmann U.Mol Gen Genet. 1989 Jun;217(2-3):347-54 の記載と同様な方法に従って、プラスミドに操作し、大腸菌宿主を形質転換した組換え大腸菌treA遺伝子からトレハラーゼ(トレハラーゼポリペプチド配列番号135をコードするtreA核酸配列番号134)を製造した。treAによりコードされるペリプラズムのトレハラーゼを大腸菌K12からクローニングした。treA PCR産物(配列番号127)をAflII/XbaIで消化し、次いで同様に消化したpLybCB6(強力な大腸菌trpプロモーターの構成的バージョンを含む登録商標プラスミド)に連結し、pLybAL24(配列番号130)を作成した。オリゴヌクレオチドEctreAmidseq-FおよびEctreAmidseq-Rで配列決定することによりインサートの完全性を分析した。
【0240】
トレハラーゼのC末端His6タグ付きバージョンを構築した。オリゴヌクレオチドEctreA-F2(配列番号131)およびEctreA-R2(配列番号132)を用いるPCRで遺伝子を増幅した。次いでPCR産物(配列番号136)をAflII/XbaIで消化し、次いで同様に消化したpLybAL24に連結してpLybAL33(配列番号133)を作成した。
【0241】
ペリプラズムのトレハラーゼの強力な構成発現は細胞に有害であり、37℃で強い増殖欠損を引き起こす。これは、30℃で細胞を増殖させることにより顕著に軽減させることができる。
【0242】
カナマイシンを含む2xYT培地中で増殖させた大腸菌BW25113内で、プラスミドpLYBAL24(配列番号130)上のタンパク質を発現させた。ペリプラズムへのタンパク質の輸送を可能にするシグナルペプチドを含むタンパク質を、Trpプロモーターを用いて構成的に産生させた。発酵およびバイオマスの収穫後、洗浄し、再懸濁した細胞ペレットを2%v/vジクロロメタン/50mMトリス緩衝液(pH8)で処理することによる選択的ペリプラズム放出によって酵素を精製した。遠心分離によって細胞の破片から溶解物を分離し、10,000ダルトンの膜を備えたAmicon社のウルトラフィルターを用いる濃縮によってさらに処理した。濃縮された溶解物をアッセイに直接に用いることもでき、酵素(配列番号137)のC末端に操作された6Xポリヒスチジンタグを用いる金属イオンアフィニティークロマトグラフィーによって酵素をさらに精製することもできる。
【実施例19】
【0243】
トレハロースの固相生産
15cm x 15cmを有する増殖表面として使用される布層(DuPont社Sontara)に、培地/水分リザーバー(Foamex社Aquazone)として使用される担体フォームで構成される、固体複合布で覆われる親水性フォームを結合させた。70%エタノール水溶液に浸すことにより複合材料を滅菌し、次いで複合材料の頂部に溶液を供給するために垂直にされた垂直バイオリアクターにつるした。重力によって溶液を増殖複合材料表面に浸透させた。0.2ml/分の流速で滅菌脱イオン水を1リットル通過させることによって滅菌増殖表面から残留エタノールを除去した。0.2ml/分で、複合材料を通して10マイクログラム/mlのクロラムフェニコールを含むBG11A増殖培地0.5リットルを流すことによって、増殖表面を培地で平衡化した。
【0244】
平衡化した滅菌増殖表面に、プラスミドpLYBAL23によって形質転換したシネコシスチス種PCC 6803の4日間前培養物10mlを表面に注ぐことにより接種した。30分間のインキュベーション後に垂直位置にリアクターを向け、発酵を開始させた。白色LEDアレイからの80マイクロアインシュタインの光でリアクターを照射した。バイオリアクターに取り付けられた抵抗加熱装置によって温度を28℃に維持した。リアクターには、0.2L/分で0.2ミクロンのろ過空気で連続的にパージし、増殖複合材料のフォーム層を通して、6時間毎に30分間0.2ml/分の速度でポンプおよび重力浸透によって新鮮培地を供給した。リアクターを連続的に4〜7日間運転し、その間に、複合材料の増殖表面は、シアノバクテリアの密集した芝生で覆われた。最初の培養期間後にバイオリアクターの温度を40℃に上げ、この温度にさらに24時間維持した。高温期間中、使用済の培養液を回収し、トレハロース測定のために処理した。発酵運転の完了時に、トレハロースアッセイのために処理することができる脱イオン水で増殖表面をすすぐことによりバイオマスを回収した。
【0245】
固体表面に増殖するバイオマス中に生産され保持されるトレハロースの量は、温度誘導後にバイオリアクターから回収されるバイオマス全乾燥重量の最大2.5重量%までであった。温度誘導後の培地から、乾燥バイオマス相当量の0.8重量%のトレハロースを回収した。
【実施例20】
【0246】
トレハロース生産液相
Bioflowリアクター中で、10マイクログラム/mlの濃度までクロラムフェニコールを添加した滅菌BG11A培地1リットルを調製した。次いで、プラスミドpLYBAL23で形質転換したシネコシスチス種PCC 6803の4日間前培養物を5容量%リアクターに接種した。リアクターを28℃、300RPM、0.2L/分の0.2ミクロンろ過空気パージで運転し、蛍光電球アレイを用いて80マイクロアインシュタインの光で照射した。培養を4〜7日間維持し、次いで試料200mlを取り出し、処理およびトレハロースアッセイを行った。次いで発酵温度を24時間40℃に上げた。次いで試料200mlをバイオリアクターから取り出し、処理およびトレハロースアッセイを行った。
【0247】
温度誘導後、乾燥バイオマスは最大3重量%までのトレハロースを産生したが、使用済の培養液は、バイオマスに対して0.3重量%トレハロース相当量を含んでいた。
【0248】
引用文献
本願においては、すべての公報、特許、特許出願および他の引用文献は、あたかも個別の公報、特許、特許出願または他の引用文献が、個別具体的に示されて参照によりその全体が組み込まれるのと同じ様に、その全体が参照により本願に組み込まれる。本願における引用文献の引用は、これが本発明の先行技術であるという承認ではない。
【特許請求の範囲】
【請求項1】
光合成微生物を培養するためのフォトバイオリアクターにおいて、
その表面の少なくとも一部の上にある光合成微生物に栄養素および水分を提供するのに適した非ゼラチン質の固体培養担体であって、前記表面の一部が非水平に向けられるとき、光合成微生物がそれに付着するのを可能にする形状を有する前記固体培養担体;ならびに
少なくとも前記培養担体の表面の一部をおおう物理的バリアであって、前記培養担体の表面の一部への接種、このような光合成微生物の培養に適した環境の形成および維持ならびにこのような培養した光合成微生物の収穫を可能にするように構成された前記物理的バリア
を含む前記フォトバイオリアクター。
【請求項2】
前記培養担体の表面の一部の上にある付着した光合成微生物をさらに含む、請求項1記載のフォトバイオリアクター。
【請求項3】
前記培養担体の表面の一部が、1リットル相当量当たり乾燥バイオマス少なくとも約50グラムの密度で光合成微生物を培養できる、請求項1または請求項2記載のフォトバイオリアクター。
【請求項4】
培養担体が柔軟性である、請求項1〜3のいずれかに記載のフォトバイオリアクター。
【請求項5】
培養担体が1以上の硬質材料を含む、請求項1〜3のいずれかに記載にフォトバイオリアクター。
【請求項6】
培養担体が少なくとも2つの層、すなわち第2層に隣接した第1層を含み、ここで少なくとも2つの層の材料が同一材料または異なる材料である、請求項1〜5のいずれか1つに記載のフォトバイオリアクター。
【請求項7】
第1層が高表面積の増殖材料を含み、第2層が透過型材料を含む、請求項6記載のフォトバイオリアクター。
【請求項8】
培養担体が、可撓的に連結された硬質部分であって、1以上の硬質材料で構成される前記硬質部分を含む、請求項1〜7のいずれか1つに記載のフォトバイオリアクター。
【請求項9】
物理的バリアが、固体微粒子および液体に対して少なくとも実質的に不透過性であるが、前記培養担体の表面の一部に隣接する空間を往復するガスまたは蒸気の移動を妨げないばかりでなく、前記培養担体の表面の一部の化学線照射も妨げない、請求項1〜8のいずれかに記載のフォトバイオリアクター。
【請求項10】
培養担体と物理的バリアとの間に位置する化学線源をさらに含む、請求項1〜9のいずれか1つに記載のフォトバイオリアクター。
【請求項11】
物理的バリアが、培養担体と化学線源との間にあり、このような化学線に対し十分に透明であり、培養中に光合成微生物による光合成を可能にするために十分にガス透過性である、請求項1〜9のいずれかに記載のフォトバイオリアクター。
【請求項12】
湿らせた培養担体が十分な水分を保持するように、物理的バリアが水蒸気に対して十分に不透過性であり、それにより培養中に光合成微生物が適切に水和されたままである、請求項1〜11のいずれかに記載のフォトバイオリアクター。
【請求項13】
バリアが、光合成微生物の培養の少なくとも一部分において、培養担体およびその培養担体上の任意の光合成微生物を密閉し、かつ、取り外し可能にシールされるように構成される、請求項1〜12のいずれかに記載のフォトバイオリアクター。
【請求項14】
フォトバイオリアクターが1つの培養担体を含む、請求項1〜13のいずれかに記載のフォトバイオリアクター。
【請求項15】
フォトバイオリアクターが複数の培養担体を含む、請求項1〜13のいずれかに記載のフォトバイオリアクター。
【請求項16】
物理的バリアが柔軟性である、請求項1〜15のいずれか1つに記載のフォトバイオリアクター。
【請求項17】
物理的バリアが、固体微粒子、液体、ガスおよび蒸気に対して少なくとも実質的に不透過性である第1の部分ならびに、ガスおよび蒸気に対して透過性であるが、固体微粒子および液体に対して少なくとも実質的に不透過性である第2の部分をさらに含む、請求項1〜16のいずれか1つに記載のフォトバイオリアクター。
【請求項18】
バリアの第2の部分が、少なくとも約5ガーレー秒から約10,000ガーレー秒以下までのガスまたは蒸気交換速度を有する、請求項17記載のフォトバイオリアクター。
【請求項19】
バリアの第2の部分が、オレフィン繊維もしくはポリエチレン繊維材料、ポリテトラフルオロエチレン濾過媒体、セルロース系フィルター材料、ファイバーグラスフィルター材料、ポリエステルフィルター材料、ポリアクリラートフィルター材料、ポリスルホン膜またはナイロン膜を含む選択膜を含む、請求項17記載のフォトバイオリアクター。
【請求項20】
第1の部分が化学線に対して少なくとも実質的に透過性であり、第2の部分が化学線に対して少なくとも実質的に透過性ではなく、第1および第2の部分の、互いに対する配置および少なくとも前記培養担体の表面の一部に対する配置が光合成微生物による光合成を維持するために十分な量の化学線およびガスが交換されるようなものである、請求項17〜19のいずれか1つに記載のフォトバイオリアクター。
【請求項21】
培養担体が布を含む、請求項1〜20のいずれか1つに記載のフォトバイオリアクター。
【請求項22】
布が天然繊維、改質天然繊維、合成繊維またはそれらの組み合わせで構成される、請求項21記載のフォトバイオリアクター。
【請求項23】
布が織物、編物、フェルト、架橋繊維ポリマーのメッシュまたはそれらの組み合わせである、請求項21記載のフォトバイオリアクター。
【請求項24】
天然繊維が綿、羊毛、アサ、木繊維、他のセルロース系繊維およびそれらの組み合わせからなる群から選択され;
改質天然繊維がニトロセルロース、セルロースアセタート、セルローススルホナート、架橋デンプンおよびそれらの組み合わせからなる群から選択され;
合成繊維がポリエステル、ポリアクリラート、ポリアミン、ポリアミド、ポリスルホンおよびそれらの組み合わせからなる群から選択される、
請求項22記載のフォトバイオリアクター。
【請求項25】
培養担体が吸水性ポリマーでコーティングされる、請求項1〜24のいずれかに記載のフォトバイオリアクター。
【請求項26】
布、布の繊維または両方が吸水性ポリマーでコーティングされる、請求項21〜25のいずれかに記載のフォトバイオリアクター。
【請求項27】
前記吸水性ポリマーが寒天、ポリアクリラート、ポリアミド、ポリアミン、ポリエチレングリコール、修飾デンプンおよびそれらの組み合わせからなる群から選択される、請求項25〜26のいずれか1つに記載のフォトバイオリアクター。
【請求項28】
培養担体上、培養担体内または培養担体上および培養担体内に水、栄養素、またはそれらの組み合わせをさらに含む、請求項1〜27のいずれかに記載のフォトバイオリアクター。
【請求項29】
フォトバイオリアクターを構造物へ取り付けるための1以上の取り付け部分をさらに含む、請求項1〜28のいずれかに記載のフォトバイオリアクター。
【請求項30】
固体培養担体が、培養担体を取り付けるための1以上の取り付け部分をさらに含む、請求項1〜29のいずれかに記載のフォトバイオリアクター。
【請求項31】
流体供給システム、栄養供給システム、ガス供給システムおよび微生物供給システムの少なくとも1つをさらに含む、請求項1〜30のいずれか1つに記載のフォトバイオリアクター。
【請求項32】
請求項42〜55のいずれか1つに記載の細胞であって、固体培養担体に付着した前記細胞をさらに含む、請求項1〜31のいずれか1つに記載のフォトバイオリアクター。
【請求項33】
請求項1〜32のいずれかに記載の少なくとも1つのフォトバイオリアクター;および
少なくとも1つのフォトバイオリアクターの少なくとも1つの培養担体が非水平に向いた少なくとも1つのフォトバイオリアクターが取り付けられる構造物
を含む、光合成微生物を培養するための装置。
【請求項34】
少なくとも1つのフォトバイオリアクターが構造物から吊り下げられる、請求項33記載の装置。
【請求項35】
構造物が物理的バリアによって実質的におおわれる、請求項33〜34のいずれか1つに記載の装置。
【請求項36】
構造物が、コンベヤシステムの経路に沿って少なくとも1つの培養担体を運搬することができるようにコンベヤシステムまたはその構成要素を含む、請求項33〜35のいずれか1つに記載の装置。
【請求項37】
各培養担体をコンベヤシステムの経路に沿って運搬しながら光合成微生物を接種できる接種ステーション;
各培養担体をコンベヤシステムの経路に沿って運搬しながら、接種された各培養担体上の光合成微生物を培養するための培養ステーション;および
培養した光合成微生物の少なくとも一部を各培養担体から収穫するために培養担体が運ばれる収穫ステーション
をさらに含む、請求項36記載の装置。
【請求項38】
接種ステーションおよび収穫ステーションが、実質的に互いに隣接しているかまたは実質的に同延である、請求項37記載の装置。
【請求項39】
各培養担体上の光合成微生物による発酵性糖の合成を誘導するための誘導ステーションをさらに含む、請求項33〜38のいずれか1つに記載の装置。
【請求項40】
流体供給システム、栄養供給システム、ガス供給システムまたは微生物供給システムの少なくとも1つをさらに含む、請求項33〜39のいずれか1つに記載の装置。
【請求項41】
請求項42〜55のいずれか1つに記載の細胞であって、固体培養担体に付着した前記細胞をさらに含む、請求項33〜40のいずれかに記載の装置。
【請求項42】
転写の5’から3’の方向に作動可能に連結された構成要素として:
光合成微生物細胞において機能するプロモーター;
二糖リン酸シンターゼおよび二糖リン酸ホスファターゼからなる群から選択される、二糖生合成活性を有するポリペプチドをコードするヌクレオチド配列を含むポリヌクレオチド;ならびに
転写終結配列;
を含む人工DNA構築物を含むトランスジェニック光合成微生物細胞であって、前記DNA構築物を含まない光合成微生物細胞と比較して増加したレベルの二糖を蓄積する前記トランスジェニック光合成微生物細胞。
【請求項43】
(i)二糖リン酸シンターゼ活性を有するポリペプチドをコードする第1ヌクレオチド配列および二糖リン酸ホスファターゼ活性を有するポリペプチドをコードする第2ヌクレオチド配列を含むポリヌクレオチドまたは(ii)二糖リン酸シンターゼ活性および二糖リン酸ホスファターゼ活性を有するポリペプチドをコードするヌクレオチド配列を含むポリヌクレオチドを含む、請求項42記載の細胞。
【請求項44】
二糖生合成活性を有するポリペプチドをコードするヌクレオチド配列を含むポリヌクレオチドが:
(a)スクロースリン酸シンターゼおよびスクロースリン酸ホスファターゼ(ASF)活性を有する配列番号2またはそれに95%同一の配列;
スクロースリン酸シンターゼ(SPS)活性を有する配列番号4またはそれに95%同一の配列;
スクロースリン酸ホスファターゼ(SPP)活性を有する配列番号6またはそれに95%同一の配列;
トレハロースリン酸シンターゼ(TPS)活性を有する配列番号77またはそれに95%同一の配列;
トレハロースリン酸ホスファターゼ(TPP)活性を有する配列番号79またはそれに95%同一の配列;
グルコシルグリセロールリン酸シンターゼ(GPS)活性を有する配列番号81またはそれに95%同一の配列;
グルコシルグリセロールリン酸ホスファターゼ(GPP)活性を有する配列番号83またはそれに95%同一の配列;
マンノシルフルクトースリン酸シンターゼ(MPS)活性を有する配列番号85またはそれに95%同一の配列;および
マンノシルフルクトースリン酸ホスファターゼ(MPP)活性を有する配列番号87またはそれに95%同一の配列;
からなる群から選択されるポリペプチドをコードするヌクレオチド配列を含むポリヌクレオチド、
(b)スクロースリン酸シンターゼ/スクロースリン酸ホスファターゼ(ASF)活性をコードする配列番号1またはそれに95%同一の配列;
スクロースリン酸シンターゼ(SPS)活性をコードする配列番号3またはそれに95%同一の配列;
スクロースリン酸ホスファターゼ(SPP)活性をコードする配列番号5またはそれに95%同一の配列;
トレハロースリン酸シンターゼ(TPS)活性をコードする配列番号76またはそれに95%同一の配列;
トレハロースリン酸ホスファターゼ(TPP)活性をコードする配列番号78またはそれに95%同一の配列;
グルコシルグリセロールリン酸シンターゼ(GPS)活性をコードする配列番号80またはそれに95%同一の配列;
グルコシルグリセロールリン酸ホスファターゼ(GPP)活性をコードする配列番号82またはそれに95%同一の配列;
マンノシルフルクトースリン酸シンターゼ(MPS)活性をコードする配列番号84またはそれに95%同一の配列;および
マンノシルフルクトースリン酸ホスファターゼ(MPP)活性をコードする配列番号86またはそれに95%同一の配列;
を含む単離されたポリヌクレオチド;
(c)単離されたポリヌクレオチドがASF活性を有するポリペプチドをコードする配列番号1;
単離されたポリヌクレオチドがSPS活性を有するポリペプチドをコードする配列番号3;
単離されたポリヌクレオチドがSPP活性を有するポリペプチドをコードする配列番号5;
単離されたポリヌクレオチドがTPS活性を有するポリペプチドをコードする配列番号76;
単離されたポリヌクレオチドがTPP活性を有するポリペプチドをコードする配列番号78;
単離されたポリヌクレオチドがGPS活性を有するポリペプチドをコードする配列番号80;
単離されたポリヌクレオチドがGPP活性を有するポリペプチドをコードする配列番号82;
単離されたポリヌクレオチドがMPS活性を有するポリペプチドをコードする配列番号84;
単離されたポリヌクレオチドがMPP活性を有するポリペプチドをコードする配列番号86;
からなる群から選択される核酸配列とストリンジェントな条件下でハイブリダイズする単離されたポリヌクレオチドであって、前記ストリンジェントな条件が6X SSC(0.9M塩化ナトリウムおよび0.09Mクエン酸ナトリウム)を含む溶液中65℃でのインキュベーションを含む前記単離されたポリヌクレオチド;ならびに
(d)(a)、(b)または(c)のポリヌクレオチド配列に相補的な単離されたポリヌクレオチド
からなる群から選択される、請求項42〜43のいずれか1つに記載の細胞。
【請求項45】
蓄積された二糖モノマーが細胞にとって内因性である、請求項42〜44のいずれか1つに記載の細胞。
【請求項46】
細胞が、光合成細菌であるシアノバクテリア細胞;または緑藻である、請求項42〜45のいずれか1つに記載の細胞。
【請求項47】
細胞がシアノバクテリア細胞である、請求項42〜46のいずれか1つに記載の細胞。
【請求項48】
細胞がシネココッカスおよびシネコシスチスからなる群から選択されるシアノバクテリアである、請求項42〜47のいずれか1つに記載の細胞。
【請求項49】
プロモーターが誘導性プロモーターである、請求項42〜48のいずれか1つに記載の細胞。
【請求項50】
プロモーターがcarB、nirA、psbAII、dnaK、kaiAおよびλPRからなる群から選択される、請求項42〜49のいずれか1つに記載の細胞。
【請求項51】
DNA構築物が、配列番号19(asfをコードするpLybAL11);配列番号20(asfをコードするpLybAL12);配列番号44(asfをコードするpLybAL15);配列番号45(asfをコードするpLybAL16);配列番号46(asfをコードするpLybAL17);配列番号47(asfをコードするpLybAL18);配列番号48(asfをコードするpLybAL19);配列番号49(asfをコードするpLybAL21);配列番号50(asfをコードするpLybAL22);配列番号51(asfをコードするpLybAL13f);配列番号52(asfをコードするpLyAL13r);配列番号53(asfをコードするpLybAL14f);配列番号54(asfをコードするpLybAL14r);配列番号65(asfをコードするpLybAL7f);配列番号69(asfをコードするpLybAL8f);配列番号118(tpsおよびtppをコードするpLybAL23);配列番号121(tpsおよびtppをコードするpLybAL28);配列番号122(tpsおよびtppをコードするpLybAL29);配列番号123(tpsおよびtppをコードするpLybAL30);配列番号124(tpsおよびtppをコードするpLybAL31);配列番号125(tpsおよびtppをコードするpLybAL36);配列番号126(tpsおよびtppをコードするpLybAL37);配列番号130(tpsおよびtppをコードするpLybAL24);ならびに配列番号133(tpsおよびtppをコードするpLybAL33)からなる群から選択されるヌクレオチド配列を含む、請求項42〜50のいずれか1つに記載の細胞。
【請求項52】
細胞が、1分当たり乾燥バイオマス1グラム当たり二糖を少なくとも約0.1マイクログラム蓄積する、請求項42〜51のいずれかに記載の細胞。
【請求項53】
細胞が、1分当たり乾燥バイオマス1グラム当たり二糖を少なくとも約0.1マイクログラムから最大1分当たり乾燥バイオマス1グラム当たり二糖を約10マイクログラムまで蓄積する、請求項42〜52のいずれか1つに記載の細胞。
【請求項54】
以下:
配列番号70、配列番号72および配列番号74またはそれらに対する少なくとも95%の同一性およびインベルターゼ活性もしくはスクラーゼフェリドキシン活性を有するそれらのヌクレオチドバリアントからなる群から選択されるヌクレオチド配列を細胞が含まない;
配列番号71、配列番号73および配列番号75またはそれらに対する少なくとも95%の同一性およびインベルターゼ活性もしくはスクラーゼフェリドキシン活性を有するそれらのポリペプチドバリアントからなる群から選択されるポリペプチド配列を細胞が発現しない;または
配列番号70、配列番号72および配列番号74またはそれらに対する少なくとも95%の同一性およびインベルターゼ活性もしくはスクラーゼフェリドキシン活性を有するそれらのヌクレオチドバリアントからなる群から選択されるヌクレオチド配列に特異的な低分子干渉RNAを細胞が発現する
の少なくとも1つを満足させる、請求項42〜53のいずれかに記載の細胞。
【請求項55】
活性ポリンポリペプチドをコードする配列番号94またはそれに95%同一の配列を含む単離されたポリヌクレオチド;
配列番号95またはそれに95%同一の配列を含みポリン活性を有するポリペプチドをコードする単離されたポリヌクレオチド;または
配列番号91(ポリンをコードするpLybAL32)を含む単離されたポリヌクレオチド;
をさらに含む請求項42〜54のいずれか1つに記載の細胞であって、蓄積された二糖がスクロースであり、細胞がポリンを発現し、発現されたポリンが、蓄積されたスクロースを細胞から分泌させる前記細胞。
【請求項56】
配列番号19(asfをコードするpLybAL11);配列番号20(asfをコードするpLybAL12);配列番号44(asfをコードするpLybAL15);配列番号45(asfをコードするpLybAL16);配列番号46(asfをコードするpLybAL17);配列番号47(asfをコードするpLybAL18);配列番号48(asfをコードするpLybAL19);配列番号49(asfをコードするpLybAL21);配列番号50(asfをコードするpLybAL22);配列番号51(asfをコードするpLybAL13f);配列番号52(asfをコードするpLyAL13r);配列番号53(asfをコードするpLybAL14f);配列番号54(asfをコードするpLybAL14r);配列番号65(asfをコードするpLybAL7f);配列番号69(asfをコードするpLybAL8f);配列番号118(tpsおよびtppをコードするpLybAL23);配列番号121(tpsおよびtppをコードするpLybAL28);配列番号122(tpsおよびtppをコードするpLybAL29);配列番号123(tpsおよびtppをコードするpLybAL30);配列番号124(tpsおよびtppをコードするpLybAL31);配列番号125(tpsおよびtppをコードするpLybAL36);配列番号126(tpsおよびtppをコードするpLybAL37);配列番号130(tpsおよびtppをコードするpLybAL24);配列番号133(tpsおよびtppをコードするpLybAL33);配列番号91(ポリンをコードするpLybAL32);配列番号102(SS-UPPをコードするpLybAL3f);配列番号103(SE-UPPをコードするpLybAL5f);配列番号106(SE-UPPをコードするpLybAL4f);配列番号107(SE-UPPをコードするpLybAL9f);配列番号109(SE-UPPをコードするpLybAL6fb);配列番号110(SE-UPPをコードするpLybAL10fb);および配列番号91(ポリンをコードするpLybAL32)からなる群から選択される少なくとも1つの配列を含む人工DNA構築物。
【請求項57】
請求項1〜41のいずれかに記載のフォトバイオリアクターまたは装置を用いる光合成微生物の培養方法であって、
培養担体に光合成微生物を接種し;
接種された培養担体で光合成微生物を培養し;
培養担体から培養した光合成微生物の少なくとも一部を収穫すること
を含む前記方法。
【請求項58】
物理的バリアがシールされている間、光合成微生物の培養の全部または実質的な部分が行われるように、培養担体の接種後にフォトバイオリアクターの物理的バリアをシールすることをさらに含む請求項57記載の方法。
【請求項59】
物理的バリアが取り外し可能にシールされている、請求項58記載の方法。
【請求項60】
接種ステーション、培養ステーションおよび収穫ステーションに各培養担体を運搬することをさらに含む、請求項57〜59のいずれか1つに記載の方法。
【請求項61】
培養担体に流体を供給すること;培養担体に栄養素を供給すること;または培養担体にガスを供給することの少なくとも1つをさらに含む、請求項57〜60のいずれか1つに記載の方法。
【請求項62】
光合成微生物が、1リットル相当量当たり乾燥バイオマス少なくとも約50グラムの密度まで培養される、請求項57〜61のいずれかに記載の方法。
【請求項63】
光合成微生物が、請求項42〜55のいずれか1つに記載の細胞を含む、請求項57〜62のいずれか1つに記載の方法。
【請求項64】
請求項1〜41記載のいずれかに記載のフォトバイオリアクターまたは装置を用いる発酵性糖の生産方法であって、
発酵性糖を蓄積できる光合成微生物を培養担体に接種し;
接種された培養担体で光合成微生物を培養し;
蓄積された発酵性糖を単離すること
を含む前記方法。
【請求項65】
発酵性糖が光合成微生物内に蓄積する、請求項64記載の方法。
【請求項66】
蓄積された発酵性糖の単離が、
培養担体からの、培養した光合成微生物の少なくとも一部を収穫し;
収穫物からの発酵性糖を回収すること
を含む請求項64〜65のいずれか1つに記載の方法。
【請求項67】
蓄積された発酵性糖が、光合成微生物から分泌され、培養培地から単離される、請求項64〜66のいずれかに記載の方法。
【請求項68】
蓄積された発酵性糖の単離が、培養培地からの蓄積された発酵性糖の単離を含む、請求項64〜67のいずれかに記載の方法。
【請求項69】
物理的バリアがシールされている間、光合成微生物の培養の全部または実質的な部分が行われるように、培養担体の接種後にフォトバイオリアクターの物理的バリアを取り外し可能にシールすることをさらに含む、請求項64〜68のいずれか1つに記載の方法。
【請求項70】
培養担体に流体を供給すること;培養担体に栄養素を供給すること;または培養担体にガスを供給することの少なくとも1つをさらに含む、請求項64〜69のいずれか1つに記載の方法。
【請求項71】
培養担体を接種ステーション、培養ステーションおよび収穫ステーションの少なくとも1つに運搬することをさらに含む、請求項64〜70のいずれか1つに記載の方法。
【請求項72】
光合成微生物による発酵性糖の合成の誘導をさらに含む、請求項64〜71のいずれか1つに記載の方法。
【請求項73】
発酵性糖の合成の誘導が、温度、pH、代謝物、光、浸透圧剤、重金属および抗生物質からなる群から選択される誘導剤に光合成微生物を暴露することを含む、請求項72記載の方法。
【請求項74】
発酵性糖の合成の誘導が、光合成微生物を塩化合物で処理することを含む、請求項72〜73のいずれか1つに記載の方法。
【請求項75】
塩化合物が塩化ナトリウムである、請求項74記載の方法。
【請求項76】
塩化合物が約0.01mM〜1.5Mまたは約0.2〜0.9Mの濃度で添加される、請求項74〜75のいずれか1つに記載の方法。
【請求項77】
エアゾールスプレーによって増殖表面に誘導剤が塗布される、請求項73〜76のいずれか1つに記載の方法。
【請求項78】
光合成微生物が、1リットル相当量当たり乾燥バイオマス少なくとも約50グラムの密度まで培養される、請求項64〜77のいずれかに記載の方法。
【請求項79】
発酵性糖が、グルコース、フルクトース、スクロース、トレハロース、グルコシルグリセロールおよびマンノシルフルクトースからなる群から選択される少なくとも1つの糖を含む、請求項64〜78のいずれかに記載の方法。
【請求項80】
発酵性糖が、スクロースおよびトレハロースからなる群から選択される少なくとも1つの糖を含む、請求項64〜79のいずれか1つに記載の方法。
【請求項81】
光合成微生物が天然に存在する光合成微生物を含む、請求項64〜81のいずれか1つに記載の方法。
【請求項82】
光合成微生物が遺伝子改変光合成微生物を含む、請求項64〜81のいずれか1つに記載の方法。
【請求項83】
光合成微生物がシアノバクテリアを含む、請求項64〜82のいずれかに記載の方法。
【請求項84】
光合成微生物がシネココッカスまたはシネコシスチスからなる群から選択されるシアノバクテリアを含む、請求項64〜83のいずれか1つに記載の方法。
【請求項85】
光合成微生物が請求項42〜52のいずれか1つに記載の細胞を含む、請求項64〜84のいずれか1つに記載の方法。
【請求項1】
光合成微生物を培養するためのフォトバイオリアクターにおいて、
その表面の少なくとも一部の上にある光合成微生物に栄養素および水分を提供するのに適した非ゼラチン質の固体培養担体であって、前記表面の一部が非水平に向けられるとき、光合成微生物がそれに付着するのを可能にする形状を有する前記固体培養担体;ならびに
少なくとも前記培養担体の表面の一部をおおう物理的バリアであって、前記培養担体の表面の一部への接種、このような光合成微生物の培養に適した環境の形成および維持ならびにこのような培養した光合成微生物の収穫を可能にするように構成された前記物理的バリア
を含む前記フォトバイオリアクター。
【請求項2】
前記培養担体の表面の一部の上にある付着した光合成微生物をさらに含む、請求項1記載のフォトバイオリアクター。
【請求項3】
前記培養担体の表面の一部が、1リットル相当量当たり乾燥バイオマス少なくとも約50グラムの密度で光合成微生物を培養できる、請求項1または請求項2記載のフォトバイオリアクター。
【請求項4】
培養担体が柔軟性である、請求項1〜3のいずれかに記載のフォトバイオリアクター。
【請求項5】
培養担体が1以上の硬質材料を含む、請求項1〜3のいずれかに記載にフォトバイオリアクター。
【請求項6】
培養担体が少なくとも2つの層、すなわち第2層に隣接した第1層を含み、ここで少なくとも2つの層の材料が同一材料または異なる材料である、請求項1〜5のいずれか1つに記載のフォトバイオリアクター。
【請求項7】
第1層が高表面積の増殖材料を含み、第2層が透過型材料を含む、請求項6記載のフォトバイオリアクター。
【請求項8】
培養担体が、可撓的に連結された硬質部分であって、1以上の硬質材料で構成される前記硬質部分を含む、請求項1〜7のいずれか1つに記載のフォトバイオリアクター。
【請求項9】
物理的バリアが、固体微粒子および液体に対して少なくとも実質的に不透過性であるが、前記培養担体の表面の一部に隣接する空間を往復するガスまたは蒸気の移動を妨げないばかりでなく、前記培養担体の表面の一部の化学線照射も妨げない、請求項1〜8のいずれかに記載のフォトバイオリアクター。
【請求項10】
培養担体と物理的バリアとの間に位置する化学線源をさらに含む、請求項1〜9のいずれか1つに記載のフォトバイオリアクター。
【請求項11】
物理的バリアが、培養担体と化学線源との間にあり、このような化学線に対し十分に透明であり、培養中に光合成微生物による光合成を可能にするために十分にガス透過性である、請求項1〜9のいずれかに記載のフォトバイオリアクター。
【請求項12】
湿らせた培養担体が十分な水分を保持するように、物理的バリアが水蒸気に対して十分に不透過性であり、それにより培養中に光合成微生物が適切に水和されたままである、請求項1〜11のいずれかに記載のフォトバイオリアクター。
【請求項13】
バリアが、光合成微生物の培養の少なくとも一部分において、培養担体およびその培養担体上の任意の光合成微生物を密閉し、かつ、取り外し可能にシールされるように構成される、請求項1〜12のいずれかに記載のフォトバイオリアクター。
【請求項14】
フォトバイオリアクターが1つの培養担体を含む、請求項1〜13のいずれかに記載のフォトバイオリアクター。
【請求項15】
フォトバイオリアクターが複数の培養担体を含む、請求項1〜13のいずれかに記載のフォトバイオリアクター。
【請求項16】
物理的バリアが柔軟性である、請求項1〜15のいずれか1つに記載のフォトバイオリアクター。
【請求項17】
物理的バリアが、固体微粒子、液体、ガスおよび蒸気に対して少なくとも実質的に不透過性である第1の部分ならびに、ガスおよび蒸気に対して透過性であるが、固体微粒子および液体に対して少なくとも実質的に不透過性である第2の部分をさらに含む、請求項1〜16のいずれか1つに記載のフォトバイオリアクター。
【請求項18】
バリアの第2の部分が、少なくとも約5ガーレー秒から約10,000ガーレー秒以下までのガスまたは蒸気交換速度を有する、請求項17記載のフォトバイオリアクター。
【請求項19】
バリアの第2の部分が、オレフィン繊維もしくはポリエチレン繊維材料、ポリテトラフルオロエチレン濾過媒体、セルロース系フィルター材料、ファイバーグラスフィルター材料、ポリエステルフィルター材料、ポリアクリラートフィルター材料、ポリスルホン膜またはナイロン膜を含む選択膜を含む、請求項17記載のフォトバイオリアクター。
【請求項20】
第1の部分が化学線に対して少なくとも実質的に透過性であり、第2の部分が化学線に対して少なくとも実質的に透過性ではなく、第1および第2の部分の、互いに対する配置および少なくとも前記培養担体の表面の一部に対する配置が光合成微生物による光合成を維持するために十分な量の化学線およびガスが交換されるようなものである、請求項17〜19のいずれか1つに記載のフォトバイオリアクター。
【請求項21】
培養担体が布を含む、請求項1〜20のいずれか1つに記載のフォトバイオリアクター。
【請求項22】
布が天然繊維、改質天然繊維、合成繊維またはそれらの組み合わせで構成される、請求項21記載のフォトバイオリアクター。
【請求項23】
布が織物、編物、フェルト、架橋繊維ポリマーのメッシュまたはそれらの組み合わせである、請求項21記載のフォトバイオリアクター。
【請求項24】
天然繊維が綿、羊毛、アサ、木繊維、他のセルロース系繊維およびそれらの組み合わせからなる群から選択され;
改質天然繊維がニトロセルロース、セルロースアセタート、セルローススルホナート、架橋デンプンおよびそれらの組み合わせからなる群から選択され;
合成繊維がポリエステル、ポリアクリラート、ポリアミン、ポリアミド、ポリスルホンおよびそれらの組み合わせからなる群から選択される、
請求項22記載のフォトバイオリアクター。
【請求項25】
培養担体が吸水性ポリマーでコーティングされる、請求項1〜24のいずれかに記載のフォトバイオリアクター。
【請求項26】
布、布の繊維または両方が吸水性ポリマーでコーティングされる、請求項21〜25のいずれかに記載のフォトバイオリアクター。
【請求項27】
前記吸水性ポリマーが寒天、ポリアクリラート、ポリアミド、ポリアミン、ポリエチレングリコール、修飾デンプンおよびそれらの組み合わせからなる群から選択される、請求項25〜26のいずれか1つに記載のフォトバイオリアクター。
【請求項28】
培養担体上、培養担体内または培養担体上および培養担体内に水、栄養素、またはそれらの組み合わせをさらに含む、請求項1〜27のいずれかに記載のフォトバイオリアクター。
【請求項29】
フォトバイオリアクターを構造物へ取り付けるための1以上の取り付け部分をさらに含む、請求項1〜28のいずれかに記載のフォトバイオリアクター。
【請求項30】
固体培養担体が、培養担体を取り付けるための1以上の取り付け部分をさらに含む、請求項1〜29のいずれかに記載のフォトバイオリアクター。
【請求項31】
流体供給システム、栄養供給システム、ガス供給システムおよび微生物供給システムの少なくとも1つをさらに含む、請求項1〜30のいずれか1つに記載のフォトバイオリアクター。
【請求項32】
請求項42〜55のいずれか1つに記載の細胞であって、固体培養担体に付着した前記細胞をさらに含む、請求項1〜31のいずれか1つに記載のフォトバイオリアクター。
【請求項33】
請求項1〜32のいずれかに記載の少なくとも1つのフォトバイオリアクター;および
少なくとも1つのフォトバイオリアクターの少なくとも1つの培養担体が非水平に向いた少なくとも1つのフォトバイオリアクターが取り付けられる構造物
を含む、光合成微生物を培養するための装置。
【請求項34】
少なくとも1つのフォトバイオリアクターが構造物から吊り下げられる、請求項33記載の装置。
【請求項35】
構造物が物理的バリアによって実質的におおわれる、請求項33〜34のいずれか1つに記載の装置。
【請求項36】
構造物が、コンベヤシステムの経路に沿って少なくとも1つの培養担体を運搬することができるようにコンベヤシステムまたはその構成要素を含む、請求項33〜35のいずれか1つに記載の装置。
【請求項37】
各培養担体をコンベヤシステムの経路に沿って運搬しながら光合成微生物を接種できる接種ステーション;
各培養担体をコンベヤシステムの経路に沿って運搬しながら、接種された各培養担体上の光合成微生物を培養するための培養ステーション;および
培養した光合成微生物の少なくとも一部を各培養担体から収穫するために培養担体が運ばれる収穫ステーション
をさらに含む、請求項36記載の装置。
【請求項38】
接種ステーションおよび収穫ステーションが、実質的に互いに隣接しているかまたは実質的に同延である、請求項37記載の装置。
【請求項39】
各培養担体上の光合成微生物による発酵性糖の合成を誘導するための誘導ステーションをさらに含む、請求項33〜38のいずれか1つに記載の装置。
【請求項40】
流体供給システム、栄養供給システム、ガス供給システムまたは微生物供給システムの少なくとも1つをさらに含む、請求項33〜39のいずれか1つに記載の装置。
【請求項41】
請求項42〜55のいずれか1つに記載の細胞であって、固体培養担体に付着した前記細胞をさらに含む、請求項33〜40のいずれかに記載の装置。
【請求項42】
転写の5’から3’の方向に作動可能に連結された構成要素として:
光合成微生物細胞において機能するプロモーター;
二糖リン酸シンターゼおよび二糖リン酸ホスファターゼからなる群から選択される、二糖生合成活性を有するポリペプチドをコードするヌクレオチド配列を含むポリヌクレオチド;ならびに
転写終結配列;
を含む人工DNA構築物を含むトランスジェニック光合成微生物細胞であって、前記DNA構築物を含まない光合成微生物細胞と比較して増加したレベルの二糖を蓄積する前記トランスジェニック光合成微生物細胞。
【請求項43】
(i)二糖リン酸シンターゼ活性を有するポリペプチドをコードする第1ヌクレオチド配列および二糖リン酸ホスファターゼ活性を有するポリペプチドをコードする第2ヌクレオチド配列を含むポリヌクレオチドまたは(ii)二糖リン酸シンターゼ活性および二糖リン酸ホスファターゼ活性を有するポリペプチドをコードするヌクレオチド配列を含むポリヌクレオチドを含む、請求項42記載の細胞。
【請求項44】
二糖生合成活性を有するポリペプチドをコードするヌクレオチド配列を含むポリヌクレオチドが:
(a)スクロースリン酸シンターゼおよびスクロースリン酸ホスファターゼ(ASF)活性を有する配列番号2またはそれに95%同一の配列;
スクロースリン酸シンターゼ(SPS)活性を有する配列番号4またはそれに95%同一の配列;
スクロースリン酸ホスファターゼ(SPP)活性を有する配列番号6またはそれに95%同一の配列;
トレハロースリン酸シンターゼ(TPS)活性を有する配列番号77またはそれに95%同一の配列;
トレハロースリン酸ホスファターゼ(TPP)活性を有する配列番号79またはそれに95%同一の配列;
グルコシルグリセロールリン酸シンターゼ(GPS)活性を有する配列番号81またはそれに95%同一の配列;
グルコシルグリセロールリン酸ホスファターゼ(GPP)活性を有する配列番号83またはそれに95%同一の配列;
マンノシルフルクトースリン酸シンターゼ(MPS)活性を有する配列番号85またはそれに95%同一の配列;および
マンノシルフルクトースリン酸ホスファターゼ(MPP)活性を有する配列番号87またはそれに95%同一の配列;
からなる群から選択されるポリペプチドをコードするヌクレオチド配列を含むポリヌクレオチド、
(b)スクロースリン酸シンターゼ/スクロースリン酸ホスファターゼ(ASF)活性をコードする配列番号1またはそれに95%同一の配列;
スクロースリン酸シンターゼ(SPS)活性をコードする配列番号3またはそれに95%同一の配列;
スクロースリン酸ホスファターゼ(SPP)活性をコードする配列番号5またはそれに95%同一の配列;
トレハロースリン酸シンターゼ(TPS)活性をコードする配列番号76またはそれに95%同一の配列;
トレハロースリン酸ホスファターゼ(TPP)活性をコードする配列番号78またはそれに95%同一の配列;
グルコシルグリセロールリン酸シンターゼ(GPS)活性をコードする配列番号80またはそれに95%同一の配列;
グルコシルグリセロールリン酸ホスファターゼ(GPP)活性をコードする配列番号82またはそれに95%同一の配列;
マンノシルフルクトースリン酸シンターゼ(MPS)活性をコードする配列番号84またはそれに95%同一の配列;および
マンノシルフルクトースリン酸ホスファターゼ(MPP)活性をコードする配列番号86またはそれに95%同一の配列;
を含む単離されたポリヌクレオチド;
(c)単離されたポリヌクレオチドがASF活性を有するポリペプチドをコードする配列番号1;
単離されたポリヌクレオチドがSPS活性を有するポリペプチドをコードする配列番号3;
単離されたポリヌクレオチドがSPP活性を有するポリペプチドをコードする配列番号5;
単離されたポリヌクレオチドがTPS活性を有するポリペプチドをコードする配列番号76;
単離されたポリヌクレオチドがTPP活性を有するポリペプチドをコードする配列番号78;
単離されたポリヌクレオチドがGPS活性を有するポリペプチドをコードする配列番号80;
単離されたポリヌクレオチドがGPP活性を有するポリペプチドをコードする配列番号82;
単離されたポリヌクレオチドがMPS活性を有するポリペプチドをコードする配列番号84;
単離されたポリヌクレオチドがMPP活性を有するポリペプチドをコードする配列番号86;
からなる群から選択される核酸配列とストリンジェントな条件下でハイブリダイズする単離されたポリヌクレオチドであって、前記ストリンジェントな条件が6X SSC(0.9M塩化ナトリウムおよび0.09Mクエン酸ナトリウム)を含む溶液中65℃でのインキュベーションを含む前記単離されたポリヌクレオチド;ならびに
(d)(a)、(b)または(c)のポリヌクレオチド配列に相補的な単離されたポリヌクレオチド
からなる群から選択される、請求項42〜43のいずれか1つに記載の細胞。
【請求項45】
蓄積された二糖モノマーが細胞にとって内因性である、請求項42〜44のいずれか1つに記載の細胞。
【請求項46】
細胞が、光合成細菌であるシアノバクテリア細胞;または緑藻である、請求項42〜45のいずれか1つに記載の細胞。
【請求項47】
細胞がシアノバクテリア細胞である、請求項42〜46のいずれか1つに記載の細胞。
【請求項48】
細胞がシネココッカスおよびシネコシスチスからなる群から選択されるシアノバクテリアである、請求項42〜47のいずれか1つに記載の細胞。
【請求項49】
プロモーターが誘導性プロモーターである、請求項42〜48のいずれか1つに記載の細胞。
【請求項50】
プロモーターがcarB、nirA、psbAII、dnaK、kaiAおよびλPRからなる群から選択される、請求項42〜49のいずれか1つに記載の細胞。
【請求項51】
DNA構築物が、配列番号19(asfをコードするpLybAL11);配列番号20(asfをコードするpLybAL12);配列番号44(asfをコードするpLybAL15);配列番号45(asfをコードするpLybAL16);配列番号46(asfをコードするpLybAL17);配列番号47(asfをコードするpLybAL18);配列番号48(asfをコードするpLybAL19);配列番号49(asfをコードするpLybAL21);配列番号50(asfをコードするpLybAL22);配列番号51(asfをコードするpLybAL13f);配列番号52(asfをコードするpLyAL13r);配列番号53(asfをコードするpLybAL14f);配列番号54(asfをコードするpLybAL14r);配列番号65(asfをコードするpLybAL7f);配列番号69(asfをコードするpLybAL8f);配列番号118(tpsおよびtppをコードするpLybAL23);配列番号121(tpsおよびtppをコードするpLybAL28);配列番号122(tpsおよびtppをコードするpLybAL29);配列番号123(tpsおよびtppをコードするpLybAL30);配列番号124(tpsおよびtppをコードするpLybAL31);配列番号125(tpsおよびtppをコードするpLybAL36);配列番号126(tpsおよびtppをコードするpLybAL37);配列番号130(tpsおよびtppをコードするpLybAL24);ならびに配列番号133(tpsおよびtppをコードするpLybAL33)からなる群から選択されるヌクレオチド配列を含む、請求項42〜50のいずれか1つに記載の細胞。
【請求項52】
細胞が、1分当たり乾燥バイオマス1グラム当たり二糖を少なくとも約0.1マイクログラム蓄積する、請求項42〜51のいずれかに記載の細胞。
【請求項53】
細胞が、1分当たり乾燥バイオマス1グラム当たり二糖を少なくとも約0.1マイクログラムから最大1分当たり乾燥バイオマス1グラム当たり二糖を約10マイクログラムまで蓄積する、請求項42〜52のいずれか1つに記載の細胞。
【請求項54】
以下:
配列番号70、配列番号72および配列番号74またはそれらに対する少なくとも95%の同一性およびインベルターゼ活性もしくはスクラーゼフェリドキシン活性を有するそれらのヌクレオチドバリアントからなる群から選択されるヌクレオチド配列を細胞が含まない;
配列番号71、配列番号73および配列番号75またはそれらに対する少なくとも95%の同一性およびインベルターゼ活性もしくはスクラーゼフェリドキシン活性を有するそれらのポリペプチドバリアントからなる群から選択されるポリペプチド配列を細胞が発現しない;または
配列番号70、配列番号72および配列番号74またはそれらに対する少なくとも95%の同一性およびインベルターゼ活性もしくはスクラーゼフェリドキシン活性を有するそれらのヌクレオチドバリアントからなる群から選択されるヌクレオチド配列に特異的な低分子干渉RNAを細胞が発現する
の少なくとも1つを満足させる、請求項42〜53のいずれかに記載の細胞。
【請求項55】
活性ポリンポリペプチドをコードする配列番号94またはそれに95%同一の配列を含む単離されたポリヌクレオチド;
配列番号95またはそれに95%同一の配列を含みポリン活性を有するポリペプチドをコードする単離されたポリヌクレオチド;または
配列番号91(ポリンをコードするpLybAL32)を含む単離されたポリヌクレオチド;
をさらに含む請求項42〜54のいずれか1つに記載の細胞であって、蓄積された二糖がスクロースであり、細胞がポリンを発現し、発現されたポリンが、蓄積されたスクロースを細胞から分泌させる前記細胞。
【請求項56】
配列番号19(asfをコードするpLybAL11);配列番号20(asfをコードするpLybAL12);配列番号44(asfをコードするpLybAL15);配列番号45(asfをコードするpLybAL16);配列番号46(asfをコードするpLybAL17);配列番号47(asfをコードするpLybAL18);配列番号48(asfをコードするpLybAL19);配列番号49(asfをコードするpLybAL21);配列番号50(asfをコードするpLybAL22);配列番号51(asfをコードするpLybAL13f);配列番号52(asfをコードするpLyAL13r);配列番号53(asfをコードするpLybAL14f);配列番号54(asfをコードするpLybAL14r);配列番号65(asfをコードするpLybAL7f);配列番号69(asfをコードするpLybAL8f);配列番号118(tpsおよびtppをコードするpLybAL23);配列番号121(tpsおよびtppをコードするpLybAL28);配列番号122(tpsおよびtppをコードするpLybAL29);配列番号123(tpsおよびtppをコードするpLybAL30);配列番号124(tpsおよびtppをコードするpLybAL31);配列番号125(tpsおよびtppをコードするpLybAL36);配列番号126(tpsおよびtppをコードするpLybAL37);配列番号130(tpsおよびtppをコードするpLybAL24);配列番号133(tpsおよびtppをコードするpLybAL33);配列番号91(ポリンをコードするpLybAL32);配列番号102(SS-UPPをコードするpLybAL3f);配列番号103(SE-UPPをコードするpLybAL5f);配列番号106(SE-UPPをコードするpLybAL4f);配列番号107(SE-UPPをコードするpLybAL9f);配列番号109(SE-UPPをコードするpLybAL6fb);配列番号110(SE-UPPをコードするpLybAL10fb);および配列番号91(ポリンをコードするpLybAL32)からなる群から選択される少なくとも1つの配列を含む人工DNA構築物。
【請求項57】
請求項1〜41のいずれかに記載のフォトバイオリアクターまたは装置を用いる光合成微生物の培養方法であって、
培養担体に光合成微生物を接種し;
接種された培養担体で光合成微生物を培養し;
培養担体から培養した光合成微生物の少なくとも一部を収穫すること
を含む前記方法。
【請求項58】
物理的バリアがシールされている間、光合成微生物の培養の全部または実質的な部分が行われるように、培養担体の接種後にフォトバイオリアクターの物理的バリアをシールすることをさらに含む請求項57記載の方法。
【請求項59】
物理的バリアが取り外し可能にシールされている、請求項58記載の方法。
【請求項60】
接種ステーション、培養ステーションおよび収穫ステーションに各培養担体を運搬することをさらに含む、請求項57〜59のいずれか1つに記載の方法。
【請求項61】
培養担体に流体を供給すること;培養担体に栄養素を供給すること;または培養担体にガスを供給することの少なくとも1つをさらに含む、請求項57〜60のいずれか1つに記載の方法。
【請求項62】
光合成微生物が、1リットル相当量当たり乾燥バイオマス少なくとも約50グラムの密度まで培養される、請求項57〜61のいずれかに記載の方法。
【請求項63】
光合成微生物が、請求項42〜55のいずれか1つに記載の細胞を含む、請求項57〜62のいずれか1つに記載の方法。
【請求項64】
請求項1〜41記載のいずれかに記載のフォトバイオリアクターまたは装置を用いる発酵性糖の生産方法であって、
発酵性糖を蓄積できる光合成微生物を培養担体に接種し;
接種された培養担体で光合成微生物を培養し;
蓄積された発酵性糖を単離すること
を含む前記方法。
【請求項65】
発酵性糖が光合成微生物内に蓄積する、請求項64記載の方法。
【請求項66】
蓄積された発酵性糖の単離が、
培養担体からの、培養した光合成微生物の少なくとも一部を収穫し;
収穫物からの発酵性糖を回収すること
を含む請求項64〜65のいずれか1つに記載の方法。
【請求項67】
蓄積された発酵性糖が、光合成微生物から分泌され、培養培地から単離される、請求項64〜66のいずれかに記載の方法。
【請求項68】
蓄積された発酵性糖の単離が、培養培地からの蓄積された発酵性糖の単離を含む、請求項64〜67のいずれかに記載の方法。
【請求項69】
物理的バリアがシールされている間、光合成微生物の培養の全部または実質的な部分が行われるように、培養担体の接種後にフォトバイオリアクターの物理的バリアを取り外し可能にシールすることをさらに含む、請求項64〜68のいずれか1つに記載の方法。
【請求項70】
培養担体に流体を供給すること;培養担体に栄養素を供給すること;または培養担体にガスを供給することの少なくとも1つをさらに含む、請求項64〜69のいずれか1つに記載の方法。
【請求項71】
培養担体を接種ステーション、培養ステーションおよび収穫ステーションの少なくとも1つに運搬することをさらに含む、請求項64〜70のいずれか1つに記載の方法。
【請求項72】
光合成微生物による発酵性糖の合成の誘導をさらに含む、請求項64〜71のいずれか1つに記載の方法。
【請求項73】
発酵性糖の合成の誘導が、温度、pH、代謝物、光、浸透圧剤、重金属および抗生物質からなる群から選択される誘導剤に光合成微生物を暴露することを含む、請求項72記載の方法。
【請求項74】
発酵性糖の合成の誘導が、光合成微生物を塩化合物で処理することを含む、請求項72〜73のいずれか1つに記載の方法。
【請求項75】
塩化合物が塩化ナトリウムである、請求項74記載の方法。
【請求項76】
塩化合物が約0.01mM〜1.5Mまたは約0.2〜0.9Mの濃度で添加される、請求項74〜75のいずれか1つに記載の方法。
【請求項77】
エアゾールスプレーによって増殖表面に誘導剤が塗布される、請求項73〜76のいずれか1つに記載の方法。
【請求項78】
光合成微生物が、1リットル相当量当たり乾燥バイオマス少なくとも約50グラムの密度まで培養される、請求項64〜77のいずれかに記載の方法。
【請求項79】
発酵性糖が、グルコース、フルクトース、スクロース、トレハロース、グルコシルグリセロールおよびマンノシルフルクトースからなる群から選択される少なくとも1つの糖を含む、請求項64〜78のいずれかに記載の方法。
【請求項80】
発酵性糖が、スクロースおよびトレハロースからなる群から選択される少なくとも1つの糖を含む、請求項64〜79のいずれか1つに記載の方法。
【請求項81】
光合成微生物が天然に存在する光合成微生物を含む、請求項64〜81のいずれか1つに記載の方法。
【請求項82】
光合成微生物が遺伝子改変光合成微生物を含む、請求項64〜81のいずれか1つに記載の方法。
【請求項83】
光合成微生物がシアノバクテリアを含む、請求項64〜82のいずれかに記載の方法。
【請求項84】
光合成微生物がシネココッカスまたはシネコシスチスからなる群から選択されるシアノバクテリアを含む、請求項64〜83のいずれか1つに記載の方法。
【請求項85】
光合成微生物が請求項42〜52のいずれか1つに記載の細胞を含む、請求項64〜84のいずれか1つに記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公表番号】特表2011−509085(P2011−509085A)
【公表日】平成23年3月24日(2011.3.24)
【国際特許分類】
【出願番号】特願2010−541587(P2010−541587)
【出願日】平成21年1月5日(2009.1.5)
【国際出願番号】PCT/US2009/030162
【国際公開番号】WO2009/089185
【国際公開日】平成21年7月16日(2009.7.16)
【出願人】(510184553)プロテロ インコーポレイテッド (1)
【Fターム(参考)】
【公表日】平成23年3月24日(2011.3.24)
【国際特許分類】
【出願日】平成21年1月5日(2009.1.5)
【国際出願番号】PCT/US2009/030162
【国際公開番号】WO2009/089185
【国際公開日】平成21年7月16日(2009.7.16)
【出願人】(510184553)プロテロ インコーポレイテッド (1)
【Fターム(参考)】
[ Back to top ]

