トロンビン基質およびサンプル中の生体活性トロンビンのレベルを測定するためのアッセイ
トロンビンの基質およびサンプル中の生体活性トロンビンのレベルを測定するためのアッセイが開示されている。本発明の基質は一般式A−X−Z−A’を有し、ここでAとA’の一方がルミネッセンスキレート(例えばランタニドキレート)を含む。AとA’の他方が結合対の第1のパートナー(例えばビオチン)と場合によってはスペーサーを含む。Xは、トリペプチドまたはテトラペプチド(例えば、X’−Phe−Aze−Arg、X’−Phe−Pip−Arg、およびX’−Phe−Pro−Arg;ここでX’は、存在しないか又はLys、Ahx、Ile、およびValから選ばれる)を形成する。Zはリンカー(例えばジアミンリンカー)を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、トロンビンの新規基質、およびサンプル中の生体活性トロンビンのレベルを測定するためのアッセイに関する。
【背景技術】
【0002】
トロンビンは、プロトロンビン上の2つの部位の、活性化第X(Xa)因子による酵素切断によってもたらされる。
トロンビンは、フィブリノゲンを活性型に転化させ、これが集合してフィブリンとなる。トロンビンはさらに、第XI因子、第V因子、および第VIII因子を活性化する。こうした正のフィードバックがトロンビンの生成を促進する。
【0003】
第XIII因子はさらに、トロンビンによって活性化される。第XIIIa因子は、リシンとフィブリン中のグルタミン残基との間の共有結合の形成を触媒するトランスグルタミナーゼである。共有結合により、フィブリン塊の安定性が高まる。
【0004】
凝固カスケードにおける活性に加えて、トロンビンはさらに、血小板上のプロテアーゼ活性化受容体の活性化によって血小板活性化を促進する。
臨床業務において、プロトロンビン時間(PT)(すなわち、血液が凝固するのに要する時間)の測定は、活性化部分トロンボプラスチン時間(APTT)と活性化凝固時間(ACT)に関して、凝固経路の異常を調べるのに、および抗凝固療法をモニターするのに広く使用されている。
【0005】
血液凝固試験の結果を標準化するために、国際標準化比(INR)が考案されている。組織因子の各メーカーは、メーカーが製造する全ての組織因子に対してISI(国際感度指数)を与えている。ISI値は、組織因子の特定のバッチと国際的に標準化されたサンプルとの間の比較を示す。INRは、患者のプロトロンビン時間と対照標準サンプルのプロトロンビン時間との比に、使用されるトロンボプラスチン試薬のISI値を乗じて得られる値である。
INR=(PTtest/PTnormal)ISI
PTの測定に対して利用可能なアッセイが2種ある。
【0006】
1つ目のアッセイは凝固(coagulometric)アッセイであり、フィブリノゲンからフィブリンへの転化による血塊形成のエンドポイントに基づいている。しかしながら、アッセイの結果は変わりやすく、特に、患者におけるフィブリノゲン/フィブリン転化の障害によって影響される。もう1つのアッセイは非凝固アッセイであり、トロンビン切断に適した合成基質の使用に基づいている。後者のアッセイの結果は変動がより少なく、フィブリノゲンのレベルによって影響されない。
【0007】
米国特許第4,061,625号は、
式:
D−Phe−環状イミノ酸−Arg−pNA
[式中、環状イミノ酸は、2−アゼチジンカルボン酸、プロリン、および2−ピペリジンカルボン酸から選ばれ、pNAはp−ニトロアニリドである]
の発色性トロンビン基質を開示している。該基質は、トロンビンの定量的測定に、あるいはトロンビンが形成、阻害、もしくは消費される反応の研究に、あるいはこのような反応に影響を及ぼすかもしくは関与する因子の測定(例えば、抗トロンビン、プロトロンビン、およびヘパリンの測定)に適していると記載されている。
【0008】
発色性基質が使用されるとき、反応は約405nmにて検出される。この波長では、全血自体が紫外線の吸収を起こすために、全血は分析することができない。したがって発色性基質は、使用されるサンプルタイプが全血であるときには適切ではない。
【0009】
イムノアッセイやDNAハイブリダイゼーションアッセイにおいては、ランタニドキレート等のキレートを使用する時間分解ルミネッセンス分光法が、ここ数年にわたって利用されている。全血の吸収特性により、このキレート検出技術は、発色性基質の場合と比較して、サンプルが全血であるときに適している。なぜなら、この技術を使用すると、615nm(この波長では、全血の吸収は少ない)での吸光度を測定することができるからである。
【0010】
このようなキレートは、時間分解蛍光分析(TRF)への応用に適した改良された蛍光ランタニドキレートを開示している米国特許第7,018,851B1号において記載されている。これらのキレートは、特異的バイオアフィニティベースの結合アッセイ(例えばイムノアッセイ)において使用されている。
【0011】
TRFは、高い感度と広いダイナミックレンジを必要とするアッセイに対して極めて適切な検出技術である。従来の蛍光検出を使用するイムノアッセイ法においては、例えば、サンプルの生物学的成分からの光散乱によって引き起こされる高い非特異的バックグラウンドは、アッセイの感度にとって深刻な制約となる。
【0012】
蛍光ランタニドキレートは、検出原理が、こうしたキレートの捕捉とキレートの検出をベースとするイムノアッセイにおいて従来から使用されている。これとは対照的に、蛍光ランタニドキレートは、検出原理が、キレート担体の切断およびアッセイにおいて残留している捕捉された(切断していない)担体の検出をベースとする酵素アッセイには使用されていない。
【0013】
このようなシステムの重要な特徴は、一方では安定であって、他方ではトロンビンによって特異的に切断可能であるような担体を提供することである。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】米国特許第4,061,625号
【特許文献2】米国特許第7,018,851B1号
【発明の概要】
【発明が解決しようとする課題】
【0015】
したがって、トロンビンによって特異的に切断可能であって、長い寿命を有する(このため、全血での検出が容易になり、障害はより少なくなる)本質的に安定なルミネッセンス成分を含む酵素基質が求められている。
【0016】
さらに、実施するのが速やかで、単純かつ簡単であり、ばらつきが小さく、簡単に自動化することができ、そして低コストであるようなアッセイが求められている。
驚くべきことに、トロンビンによって特異的に切断可能であるペプチドとルミネッセンスキレートとを、ある特定のリンカーを介して結びつけることによって、サンプルタイプが全血であるときに使用することができる、長い寿命を有する安定な基質が得られる、ということが見出された。
【課題を解決するための手段】
【0017】
第1の側面では、本発明は、
一般式:
A−X−Z−A’
[式中、AとA’の一方が、ルミネッセンスキレートを含み、そして
AとA’の他方が、場合によってはスペーサーを含み、ペプチド結合を介して基質の残りの部分に連結されている、結合対の第1のパートナーを含み;
Xは、X’−Phe−Aze−Arg、X’−Phe−Pip−Arg、およびX’−Phe−Pro−Argから選ばれるトリ−ペプチドもしくはテトラ−ペプチドを形成し、
ここで、X’は、存在しないか又はLys、Ahx、Ile、およびValから選ばれ;
ZはNH−R−Z’であり、
ここで、Rは、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、C1−6アルキレンオキシ−カルボニル、C1−6アルキレン−アリーレン、C1−6アルキレンオキシ−アリーレン、C1−6アルキレン−NH、C1−6アルキレンオキシ−NH、C1−6アルキレン−NHCO、C1−6アルキレンオキシ−NHCO、C1−6アルキレン−CONH、C1−6アルキレンオキシ−CONH、C1−6アルキレン−COS、C1−6アルキレンオキシ−COS、C1−6アルキレン−CONH−C1−6アルキレン−アリーレン、アリーレン、アリーレン−C1−6アルキレン、アリーレン−C1−6アルキレンオキシ、R1a−アリーレン−(NHCO−R2)b、R3c−アリーレン−(CONH−R4)d、(R5−CONH)e−アリーレン−R6f、および(R7−NHCO)g−アリーレン−R8hからなる群から選ばれ、ここで、それぞれの場合における各R1、R2、R3、R4、R5、R6、R7、およびR8は、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、アリーレン、またはアリーレン−C1−6アルキレンから独立して選ばれ、a、b、c、d、e、f、g、およびhのそれぞれが、0〜6の整数から独立して選ばれ、
ここで、アリーレンは、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、もしくはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、もしくはトリ置換されてもよいフェニレン、ビフェニレン、またはナフチレンであって、
Z’は、N、S、およびカルボニルのうちの1つを含み、
ここで、Z’がNを含むとき、Z’は、チオウレア(−NH−CS−NH−)、アミノアセトアミド(−NH−CO−CH2−NH−)、アミド(−NH−CO−)、メチルアミド(−NCH3−CO−)、または置換−トリアジン−ジアミン(−NH−(R9C3N3)−NH−)から選択され、
Z’がSを含むとき、Z’は、チオエーテル(−S−)、チオアセトアミド(−S−CH2−CO−NH−)、ジスルフィド(−S−S−)、(−S−CO−CH2−NH−)、または(−S−(R9C3N3)−NH−)から選択され、あるいは
Z’がカルボニルを含むとき、Z’は、アミド(−CO−NH−、−CO−NCH3−)またはエステル(−CO−O−)から選ばれ、
R9は、水素、ハロゲン、C1−6アルキル、C1−6チオアルキル、C1−6アルコキシ、C1−6チオアルコキシ、アリールオキシ、およびアミノからなる群から選ばれ、アルキル基、チオアルキル基、アルコキシ基、チオアルコキシ基、またはアリールオキシ基は、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、またはトリ置換されてもよく、アミノ基は、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換またはジ置換されてもよい]
を有する、トロンビンの基質に好適である。
【0018】
本発明の文脈においては、C1−6アルキル基は、1〜6個の炭素原子で構成される直鎖基または分岐鎖基を意味しており、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、t−ブチル、ペンチル、およびヘキシル等があるが、これらに限定されない。好ましいのは、メチル基、エチル基、プロピル基、およびイソプロピル基である。
【0019】
本発明の文脈においては、C1−6アルキレン基は、1〜6個の炭素原子で構成される直鎖基または分岐鎖基を意味しており、メチレン、エチレン、プロピレン、イソプロピレン、ブチレン、イソブチレン、t−ブチレン、ペンチレン、およびヘキシレン等があるが、これらに限定されない。好ましいのは、メチレン基、エチレン基、およびプロピレン基である。
【0020】
本発明の文脈においては、C1−6アルコキシ基は、酸素原子に連結した1〜6個の炭素原子で構成される直鎖基または分岐鎖基を意味しており、メトキシ、エトキシ、プロポキシ、イソプロポキシ、ブトキシ、イソブトキシ、t−ブトキシ、ペントキシ、およびヘキソキシ等があるが、これらに限定されない。好ましいのは、メトキシ基、エトキシ基、およびプロポキシ基である。
【0021】
本発明の文脈においては、C1−6アルキレンオキシ基は、酸素原子に連結した1〜6個の炭素原子で構成される直鎖基または分岐鎖基を意味しており、メチレンオキシ、エチレンオキシ、プロピレンオキシ、イソプロピレンオキシ、ブチレンオキシ、イソブチレンオキシ、t−ブチレンオキシ、ペンチレンオキシ、およびヘキシレンオキシ等があるが、これらに限定されない。好ましいのは、メチレンオキシ基、エチレンオキシ基、およびプロピレンオキシ基である。
【0022】
本発明の文脈におけるアミノ酸残基は、従来の3文字略語を有する。したがってAhxは2−アミノヘキサン酸(ノルロイシン)を表わし、Alaはアラニンを表わし、Argはアルギニンを表わし、Asnはアスパラギンを表わし、Aspはアスパラギン酸を表わし、Azeは、アゼチジン−2−カルボン酸を表わし、Cysはシステインを表わし、Glnはグルタミンを表わし、Gluはグルタミン酸を表わし、Glyはグリシンを表わし、Hisはヒスチジンを表わし、Ileはイソロイシンを表わし、Leuはロイシンを表わし、Lysはリシンを表わし、Metはメチオニンを表わし、Pheはフェニルアラニンを表わし、Pipはピペリジン−2−カルボン酸を表わし、Proはプロリンを表わし、Serはセリンを表わし、Thrはトレオニンを表わし、Trpはトリプトファンを表わし、Tyrはチロシンを表わし、そしてValはバリンを表わす。
【0023】
本発明の文脈においては、ハロゲンは、フルオロ、クロロ、ブロモ、またはヨードを表わす。
本発明の基質は、切断された基質を非切断/非損傷(intact)の基質から分離するために、固定化マトリックスに付着させることができるものでなければならない。したがって本発明の基質は、結合対の第1のパートナーによって終結されていて、つまり、結合対の第2のパートナーに結合する。該結合対のこの第2のパートナーが、固定化マトリックス上に固定化される。
【0024】
本発明の基質は、優れた特異性を有するトロンビンによって速やかに切断することができる。その中央部は、トリもしくはテトラペプチドを単位とする小さなペプチドであり、Arg−部分とZ−部分との間に位置する切断可能結合においてトロンビンによって切断される。
【0025】
本発明の基質は、サンプルが血漿であるときに使用することができ、サンプルが全血であるときに適しているので特に有利である。なぜなら本発明の基質は、使用されているキレート技術により、615nmにて検出することができるからである。
【図面の簡単な説明】
【0026】
【図1】図1は、事前に基質を固定化しない1ステップアッセイ法の概略図を示す。
【図2】図2は、事前に基質を固定化する1ステップアッセイ法の概略図を示す。
【図3】図3は、2ステップアッセイ法の概略図を示す。
【図4】図4は、本発明の基質であるS1V6cの合成の反応スキームを示す。
【図5】図5は、本発明の他の基質であるS1V12aの合成の反応スキームを示す。
【図6】図6は、本発明の基質であるS1V6cとS1V9bの標準的な曲線を示す。
【発明を実施するための形態】
【0027】
本発明の1つの実施態様では、基質は、X’が存在せず、PheがD−Pheであり、そしてArgがL−Argである、という基質である。
本発明の1つの実施態様では、XはD−Phe−L−2−Aze−L−ArgまたはD−Phe−L−2−Pip−L−Argである。
【0028】
これらの基質は、速い切断速度論をもたらすことが示されており、および/または、トロンビンに対して高度に特異的である。
本発明の1つの実施態様では、Z’がNであり、Rがアリーレン、C1−6アルキレン−アリーレン、またはR1a−アリーレン−(NHCO−R2)bであって、R1とR2が上記したとおりであり、aとbが0、1、または2である。
【0029】
したがって、切断可能な結合におけるZが芳香族部分を含む場合の基質は、極めて良好で速い切断速度論をもたらすことが示されている。
本発明の1つの実施態様では、Z’が6−置換−1,3,5−トリアジン−2,4−ジアミン(NH−(R9C3N3)−NH)結合または(S−(R9C3N3)−NH)結合であって、R9が、クロロ、フルオロ、エトキシ、2−メトキシエトキトシ、2−シアノエトキシ、2,2,2−トリフルオロエトキシ、チオフェノキシ、およびエトキシカルボニルチオメトキシからなる群から選ばれる。
【0030】
本発明の実施態様に従った基質は、トロンビンに対して特に特異的である。
本発明の1つの実施態様では、ルミネッセンスキレートは蛍光ランタニドキレートである。例えば米国特許第7,018,851B2号に開示されているように、適切な波長での高い吸収率;同じリガンド構造における幾つかの別個のUV吸収部;UV吸収部からランタニドイオンへの効果的なエネルギー伝達;熱力学的安定性と高い速度論的安定性をつくりだすための強固なキレート部分;および、結合試剤として使用するキレート化合物の効果的なカップリングを、その結合特性を損なうことなく可能にする官能基;をもたらすこのようなルミネッセンスランタニドキレートは、本発明に対して極めて適している。
【0031】
本発明の好ましい実施態様では、前記ランタニドキレートAまたはA’は、
【0032】
【化1】

【0033】
と
【0034】
【化2】

【0035】
から選ばれる。
このようなキレートはさらに、例えば、ピリジン、ビピリジン、ターピリジン、もしくはフェノール化合物の誘導体をエネルギー媒介基として、そしてポリカルボン酸をキレート部分として構成される安定なキレートを含んでよい。さらに、種々のジカルボン酸塩誘導体、大環状クリプテート、カリックスアレーン、DTPAカルボスチリル124コンジュゲート、および大環状シッフ塩基が特許出願および/または特許に開示されている。
【0036】
本発明の1つの実施態様では、結合対は、第1のパートナーとしてのビオチンと第2のパートナーとしてのストレプトアビジン(ビオチン/ストレプトアビジン)、ビオチン/アビジン、ビオチン/ビオチン受容体ペプチド、およびストレプトアビジン誘導体/受容体ペプチドから選ばれる。
【0037】
結合対の上記リストは限定的なものであり、本発明の基質を固定化マトリックスに固定化することができる全ての結合対を含む。市販の結合対の例としては、Strep−tag、Sterep−tagII/Strep−Tactin、またはビオチン/ビオチン受容体ペプチドなどがあるが、これらに限定されない。
【0038】
好ましい実施態様では、前記第1のパートナーはビオチンである。
好ましい実施態様では、前記第2のパートナーはストレプトアビジンである。
固定化マトリックスは、当業者には公知であり、マイクロウェルやマイクロ粒子(例えば、ポリスチレンやポリプロピレン等のプラスチック材料で造られたビーズ、あるいはガラスで造られたビーズ)などがある。
【0039】
本発明の1つの実施態様では、結合対の前記第1のパートナーが、スペーサーを介して基質の残部に連結される。立体的な理由から特に有用であるスペーサーを利用することで、基質の溶解性が改良される。したがってスペーサーの役割は、トロンビン酵素に課される立体障害を減ずるように、基質のペプチド/リンカー/キレート部分を溶解させることである。
【0040】
本発明の1つの実施態様では、スペーサーは、式NH−R10−CONH−R11−CO−(NH−R12−NH)iで表わされ、ここでR10、R11、およびR12のそれぞれは、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、アリーレン、またはアリーレン−C1−6アルキレンから独立して選ばれ、ここで、アリーレンは、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、もしくはトリ置換されてもよいフェニレン、ビフェニレン、またはナフチレンであり、iは0〜6の整数である。
【0041】
本発明の1つの実施態様では、R10、R11、およびR12は、同一もしくは異なった、直鎖C1−6アルキレン、アリーレン、またはアリーレン−C1−6アルキレンであり、iは0または1である。
【0042】
これとは別に、スペーサーはW−merペプチドであって、Wは1〜40の整数である。
好ましい実施態様では、本発明の基質は、
【0043】
【化3】

【0044】
【化4】

【0045】
【化5】

【0046】
【化6】

【0047】
【化7】

【0048】
【化8】

【0049】
【化9】

【0050】
【化10】

【0051】
【化11】

【0052】
から選ばれる。
本発明の基質は、実施するのが速やかで、単純かつ簡単で、ばらつきが小さく、簡単に自動化することができ、そして低コストであるようなアッセイにおいて使用することができる。
【0053】
本発明の基質は、先行技術のアッセイと比較して、速やかで正確なアッセイをもたらすので、本発明のアッセイは、吸光度が任意に定めた特定の値に達するのに必要とする時間を測定する必要がない。代わりに、先行技術のアッセイと比較してアッセイ時間をより短い時間に固定することができ、時間分解ルミノメトリーを使用してルミネッセンスシグナルを測定することができる。好ましい実施態様では、前記ルミノメトリーはフルオロメトリーである。こうしたより短い時間でも、より正確な結果が得られる。エンドポイントは、標準サンプルにおいて、基質分子の約80%が、アクチベータが存在下にてトロンビンによって切断される、という状態に達するのに必要な時間を表わすことができる。
【0054】
これとは別に、エンドポイントはさらに、標準サンプルにおいて、トロンビンによる切断反応の定常状態に達するのに必要な時間を表わすことができる。
したがって第2の側面においては、本発明は、テストサンプル中の生体活性トロンビンのレベルを測定するための1ステップアッセイ法に関し、該アッセイ法は、
a)本発明の基質、アクチベータ、および該テストサンプルを、連続して、同時に、または実質的に同時に混合する工程;
b)得られる反応混合物を、トロンビン切断されたキレート含有基質フラグメントを放出するようインキュベートし、結合パートナー含有基質フラグメントとトロンビン切断されない非損傷基質を固定化マトリックス上に固定化する工程;
c)固定化されずトロンビン切断されたキレート含有基質フラグメントと、固定化されずトロンビン切断されない基質が存在する場合は、これらを洗い落とす工程;
d)固定化された非損傷基質からのルミネッセンス発光のレベルを測定する工程;および
e)トロンビン非含有の標準サンプルと比較したときの、ルミネッセンス発光の強度の減少から、トロンビン活性を算出する工程;
を含む。
【0055】
したがって、固定化されないトロンビン切断されたキレート含有基質フラグメントと、固定化されないトロンビン切断されない基質(後者は、固定化マトリックスの結合容量が基質分子の量より低いときに存在する)とを洗い落とすことによって、トロンビン非含有の標準サンプルからのルミネッセンスと比較したときの、サンプルにおけるルミネッセンス発光の減少(切断パーセント)を、サンプルにおけるトロンビン活性と直接相関づけることが可能となる。
【0056】
これとは別に、基質は、マイクロウェルやマイクロ粒子等の固定化マトリックスの表面上に固定化される。全血や血漿等のテストサンプルを、アクチベータとともに固定化マトリックスに、連続して、同時に、あるいは実質的に同時に加える。得られる反応混合物を、トロンビンが基質に対して作用できるようにインキュベートし、これによりトロンビン切断されたキレート含有基質フラグメントを放出させ、結合パートナー含有基質フラグメントとトロンビン切断されない非損傷基質を、引き続き固定化マトリックス上に残存させる。
【0057】
使用するアクチベータのアイデンティティは、決定しようとするパラメーターPR、APTT、またはACTに依存する。使用するアクチベータの例としては、トロンボプラスチン、部分トロンボプラスチン試薬(例えばリン脂質)、およびコンタクトアクチベータ(例えば、シリカ、カオリン、セライト、エラグ酸等)などがあるが、これらに限定されない。
【0058】
未知サンプル中の生体活性トロンビン(すなわち、いかなる阻害剤(例えば抗トロンビン)にも結合しておらず、したがってタンパク質分解作用において活性であるトロンビン)の量は、生体活性トロンビンの標準曲線から、その切断パーセント(全ルミネッセンス強度に対するルミネッセンス強度の減少)によって決定することができる。その後、生体活性トロンビンのレベルは、標準サンプルの群(n≧20)からの生体活性トロンビンと、未知サンプルからの生体活性トロンビンとの比として表示することができる。この比は、使用されるアクチベータがトロンボプラスチンである場合は、プロトロンビン時間比(PR)に等しく、使用されるアクチベータが部分トロンボプラスチン試薬(例えばリン脂質)とコンタクトアクチベータ(例えば、シリカ、カオリン、セライト、エラグ酸等)である場合は、活性化部分トロンボプラスチン時間(APTT)比に等しく、あるいは、使用されるアクチベータがコンタクトアクチベータであって、使用されるサンプルタイプが天然の全血である場合は、活性化凝固時間(ACT)比に等しい。
【0059】
本発明の1つの実施態様では、テストサンプルとアクチベータの添加は、固定化マトリックスへの基質の添加と同時に、または実質的に同時に行われる。
事前に基質を固定化しない1ステップアッセイ法を、図1に概略的に示す。図1については詳細に後述する。
【0060】
1ステップアッセイ法は、固定化マトリックス上に固定化されたときに当該基質がそれほど切断可能ではないが、液相においてはトロンビンによって切断可能であるときに(すなわち、液相における基質の切断速度論が、結合パートナーの結合速度論より速やかであるか、あるいは少なくとも同等程度に速やかであるときに)、特に有用である。したがって、基質分子とトロンビン分子との間の切断反応と、固定化結合パートナー分子と切断された非損傷基質分子との間の結合反応の両方が、次のインキュベーション工程時に起こる。
【0061】
本発明の他の実施態様では、テストサンプルの添加は、固定化マトリックスに基質を固定化させた後に行われる。事前に基質を固定化する1ステップアッセイ法を、図2に概略的に示す。図2については詳細に後述する。
【0062】
このようなアッセイは、単純さ、速さ、およびロバスト性等の多くの利点を有する。しかしながら、この実施態様のための必須条件であると考えられる条件は、基質が固定化マトリックス上に固定化されたときに、基質が切断可能でなければならない、ということである。
【0063】
その後、固定化されずトロンビン切断されたキレート含有基質フラグメントを洗い落とす。固定化された非損傷基質のルミネッセンス発光を測定し、トロンビン非含有の標準サンプルのルミネッセンスと比較する。サンプルにおけるルミネッセンス強度の減少のパーセント(切断パーセント)は、サンプルにおけるトロンビン活性と直接的に相関する。
【0064】
本発明の第3の側面は、テストサンプル中の生体活性トロンビンのレベルを測定するための2ステップアッセイ法に関し、該アッセイ法は、
a)該サンプルとアクチベータを、液相中にて本発明の基質に加える工程;
b)得られる反応混合物を、トロンビン切断されたキレート含有基質フラグメントを放出するようインキュベートする工程;
c)反応混合物を固定化マトリックスに加える工程;
d)固定化されないトロンビン切断されたキレート含有基質フラグメントと、固定化されないトロンビン切断されない基質が存在する場合は、これらを洗い落とす工程;
e)固定化された非損傷基質からのルミネッセンス発光のレベルを測定する工程;および
f)トロンビン非含有の標準サンプルと比較したときの、ルミネッセンス発光の強度の減少から、トロンビン活性を算出する工程;
を含む。
【0065】
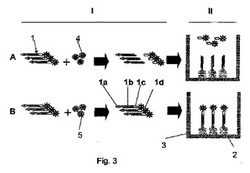
2ステップアッセイは、当該基質が液相においてのみ機能するときに有利に使用することができる。2ステップアッセイを図3に概略的に示す。図3については詳細に後述する。
【0066】
本実施態様では、テストサンプル(例えば、血漿や全血)、アクチベータ、および基質を含む反応混合物を液相中にて反応させる。引き続き、該反応混合物の一部または全部を固定化マトリックスに移し、そこでトロンビン切断された基質フラグメントとトロンビン切断されない非損傷トロンビンの固定化が行われる。トロンビン切断されたキレート含有基質フラグメントと固定化されないトロンビン切断されない基質を洗い落とした後、固定化非損傷基質からのルミネッセンスのレベルを上記のように測定する。
【0067】
1ステップアッセイと2ステップアッセイのどちらのタイプのアッセイを選択するかは、主として、基質、アクチベータ、およびサンプルの固定化マトリックスへ同時に添加を行うことがどの程度困難であるかによって決まる。同時添加が困難であるときは、2ステップアッセイを使用するのが好ましい。同時添加が困難でないときは、1ステップアッセイを使用することができる。さらに、2ステップアッセイは、基質の溶解性が許す限り、利用する基質の量がかなり多くてよいという、1ステップアッセイを凌ぐ利点を有する。
【0068】
本発明の第4の側面は、サンプル中の生体活性トロンビンのレベルを測定するために、本発明の基質を使用することを提供する。したがって本発明の基質は、トロンビンの優れた特異性を示し、トロンビンによって速やかに切断することができる。したがって、実施するのが簡単で、自動化することができ、そして短時間で信頼性の高い結果をもたらすアッセイにおいて該基質を使用することが可能となる。
【0069】
第5の側面では、本発明は、
a)上記のようなルミネッセンス基質;および
b)固体固定化マトリックス;
を含む、サンプル中の生体活性トロンビンのレベルを測定するためのテストキットを提供する。
【0070】
本発明の基質が、トロンビンの場合に特異的に採用されるとしても、異なった酵素の場合にも同様に適用することができる。したがって本出願人は、トリ−もしくはテトラ−ペプチド(X)と本発明のリンカー(Z)との結合を、同様に他の酵素によって簡単に切断することができる、ということを実際に示した。
【0071】
したがって本発明の基質は、基質の小さな修飾によって(具体的にはペプチドを選択することによって)所望の用途に応用することができる。
例えば、活性型および不活性型のFII、FV、FVII、FVIII、FIX、FX、FXI、およびFXII、ならびに、活性型および不活性型の、これらのフラグメントと、C1、C2、C3、C4、C5、C6、C7、C8、およびC9の組み合わせ等の、種々の凝固因子を測定することができる。ミエロペルオキシダーゼ(MPO)、アラニンアミノトランスフェラーゼ(ALAT)、アスパルテートアミノトランスフェラーゼ(ASAT)、カスパーゼ−1、およびグルタチオンペルオキシダーゼ−1(GPx−1)等の酵素も測定することができる。
【0072】
したがって第6の側面では、本発明は、
一般式:
A−X−Z−A’
[式中、AとA’の一方が、ルミネッセンスキレートを含み、そして
AとA’の他方が、場合によってはスペーサーを含みペプチド結合を介して基質の残りの部分に連結されている、結合対の第1のパートナーを含み;
Xは、トリ−ペプチドもしくはテトラ−ペプチドを形成し;
Zは、NH−R−Z’であり、
ここで、Rは、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、C1−6アルキレンオキシ−カルボニル、C1−6アルキレン−アリーレン、C1−6アルキレンオキシ−アリーレン、C1−6アルキレン−NH、C1−6アルキレンオキシ−NH、C1−6アルキレン−NHCO、C1−6アルキレンオキシ−NHCO、C1−6アルキレン−CONH、C1−6アルキレンオキシ−CONH、C1−6アルキレン−COS、C1−6アルキレンオキシ−COS、C1−6アルキレン−CONH−C1−6アルキレン−アリーレン、アリーレン、アリーレン−C1−6アルキレン、アリーレン−C1−6アルキレンオキシ、R1a−アリーレン−(NHCO−R2)b、R3c−アリーレン−(CONH−R4)d、(R5−CONH)e−アリーレン−R6f、および(R7−NHCO)g−アリーレン−R8hからなる群から選ばれ、ここで、それぞれの場合における各R1、R2、R3、R4、R5、R6、R7、およびR8は、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、アリーレン、またはアリーレン−C1−6アルキレンから独立して選ばれ、a、b、c、d、e、f、g、およびhのそれぞれが、0〜6の整数から独立して選ばれ、
ここで、アリーレンは、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、もしくはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、もしくはトリ置換されてもよいフェニレン、ビフェニレン、またはナフチレンであって、
Z’は、N、S、およびカルボニルのうちの1つを含み、
ここで、Z’がNを含むとき、Z’は、チオウレア(−NH−CS−NH−)、アミノアセトアミド(−NH−CO−CH2−NH−)、アミド(−NH−CO−)、メチルアミド(−NCH3−CO−)、または置換−トリアジン−ジアミン(−NH−(R9C3N3)−NH−)から選択され、
Z’がSを含むとき、Z’は、チオエーテル(−S−)、チオアセトアミド(−S−CH2−CO−NH−)、ジスルフィド(−S−S−)、(−S−CO−CH2−NH−)、または(−S−(R9C3N3)−NH−)から選択され、あるいは
Z’がカルボニルを含むとき、Z’は、アミド(−CO−NH−、−CO−NCH3−)またはエステル(−CO−O−)から選ばれ、
R9は、水素、ハロゲン、C1−6アルキル、C1−6チオアルキル、C1−6アルコキシ、C1−6チオアルコキシ、アリールオキシ、およびアミノからなる群から選ばれ、アルキル基、チオアルキル基、アルコキシ基、チオアルコキシ基、またはアリールオキシ基は、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、またはトリ置換されてもよく、アミノ基は、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換またはジ置換されてもよい]
を有する酵素基質を提供する。
【0073】
以下に、図面を参照しつつ本発明を開示する。
事前に基質を固定化しない1ステップアッセイを図1に示す。使用される基質1は、本発明によれば、4つの部分((1a、1b、1c、および1d)(A−X−Z−A’))を含む。1aは結合対の第1のパートナーを表わし、また1aは場合によってはスペーサーを含み、1bはトリペプチドもしくはテトラペプチドを表わし、1cはリンカーを表わし、そして1dはルミネッセンスキレートを表わす。2は、固定化マトリックス3の表面に結合する結合対の第2のパートナーを表わす。4は、テストサンプル中のトロンビンの存在を表わし(Aは、高レベルのトロンビンを含有する、Bは、低レベルのトロンビンを含有する)、5はトロンビン非含有のテストサンプル(C)を表わす。
【0074】
高レベルのトロンビンを示すAにおいては、基質1がテストサンプル4と反応する。この結果、基質の切断が起こる。切断された基質は2つの部分(第1の部分(1a、1b)と第2の部分(1c、1d))を含む。基質の第1の部分(1a、1b)は固定化マトリックスに固定化されるが、第2の部分(1c、1d)は洗い落とされる。次いで、固定化された非損傷基質(1a、1b)からのルミネッセンス発光を測定し、トロンビン非含有サンプル5(C)のルミネッセンスと比較する。洗浄工程と測定工程は図1には示されていない。
【0075】
図1はさらに、低トロンビンレベル場合(Bに示す)とトロンビンレベルゼロ(Cに示す)の1ステップアッセイを示す。Cは対照標準として使用される。
図2は、上記のような1ステップアッセイを示すが、ここではテストサンプル4または5の添加が、本発明の基質1を固定化マトリックス3に固定化した後に行われる。
【0076】
図3は2ステップアッセイを示す。のステップIは、基質1がテストサンプル4(トロンビン含有(A))またはテストサンプル5(トロンビン非含有(B))と反応することを示している。この結果、トロンビン切断された基質が生成するか(A)、また非損傷の基質が生成する(B)。ステップIIでは、該反応混合物の一部または全部が固定化マトリックスに移動され、そこでトロンビン切断された基質フラグメント(1a、1b)の固定化(A)と、トロンビン切断されない非損傷トロンビン基質(1a、1b、1c、および1d)の固定化(B)が起こる。トロンビン切断されたキレート含有基質フラグメント(1c、1d)を洗い落とした後、固定化された非損傷基質1からのルミネッセンス発光を、1ステップアッセイの場合と同様に測定する。洗浄工程と測定工程は図3には示されていない。
【0077】
したがって(A)の場合は、低レベルのキレート(ルミネッセンス/蛍光)が測定され、このことは高レベルのトロンビンが存在することを示している。(B)の場合は対照的に、高レベルのキレート(ルミネッセンス/蛍光)が測定され、このことはトロンビンが存在しないことを示している。
【実施例】
【0078】
以下に実施例を挙げて本発明をさらに詳細に説明するが、これら特定の実施例によって本発明が限定されることはない。
以下の実施例に対しては、下記のような材料と計測機器を使用した。
【0079】
材料
ピアース社からのスルホ−NHS−LC−LC−ビオチン、アクロス社からのp−フェニレンジアミン、アルドリッチ社からの(7−アザベンゾトリアゾール−1−イルオキシ)トリピロリジノホスホニウムヘキサフルオロホスフェート(PyAOP)、およびフルカ社からのN−エチルジイソプロピルアミン(DIPEA)。トリフルオロ酢酸(TFA)はRiedel−de−Haenから購入し、酢酸トリエチルアンモニウム緩衝液(TFAA)はフルカ社から購入した。使用したアセトニトリル(MeCN)は、J.T.BakerからのHPLCグレード品であった。DMFは、Lab−Scanから購入し、モレキュラーシーブ(4Å)上で乾燥した。使用した他の薬品は全て、分析グレード品であった。
【0080】
H−Phe(D)−Pip−ArgはKJ Ross−Petersen ApSから購入した。N−末端ビオチン化長鎖ペプチドベースのD−phe−L−Aze−Arg−OH(例えば、ビオチン−(Ser−(Gly)2)7D−phe−L−Aze−Arg−OH)はインビトロジェン社から購入した。イノビンはデイド・ベーリング社(シーメンス社)から購入した。ウシ血清アルブミン(BSA)はシグマ社から購入した。
【0081】
9−デンテートユーロピウム−キレート(2,2’,2”,2’’’−{[2−(4−イソチオシアナートフェニル)−エチルアミノ]−ビス(メチレン)ビス{4−{[4−(α−ガラクトピラノキシ)フェニル]エチニル}−ピリジン−6,2−ジイル}ビス(メチレンニトリロ)}テトラキス(アセタート)ユーロピウム(III))、洗浄液、およびストレプトアビジンで被覆された単一カップは、インノトラック・ダイアグノスティクス社(フィンランド)から購入した。
【0082】
低蛍光12ウェルのマキシソープマイクロタイトレーションストリップと単一マキシソープマイクロタイトレーションウェル(紫外線クエンチ)はヌンク社(デンマーク)から購入した。
【0083】
計測機器
質量分析(MS)は、α−シアノ−4−ヒドロキシケイ皮酸をマトリックスとして使用して、パーセプティブバイオシステムズ社からのVoyager DE−PRO(MALDI TOF)により操作した。アッセイが手操作で行われるときは、Wallac Oy社、パーキンエルマーライフサンエンス社からの1420マルチラベルカウンター(ビクター)を使用して時間分解蛍光を615nmにて測定したが、アッセイが半自動で行われるときは、インノトラック・ダイアグノスティクス社からのAioイムノアナライザーを使用して時間分解蛍光を615nmにて測定した。
【0084】
実施例1
S1V6cの合成
S1V6cの合成は、図4に示すように、H−Phe(D)−Pip−Arg−OHを含むトリペプチドの使用からスタートして3つの工程を含む。まず、直鎖状のスペーサーを有するビオチン基を、トリペプチドのN−末端α−アミノ基に結合させた。次いで、ジアミンリンカー(すなわち4−フェニレンジアミン)を、トリペプチドのC−末端カルボキシル基にカップリングさせた。最後に、9−デンテートユーロピウムキレートを、導入されたリンカー分子の芳香族アミノ基とコンジュゲートさせた。
【0085】
合成手順
i)ビオチン化
H−Phe(D)−Pip−Arg−OH(5.0mg、11.6μmol)をPBS緩衝液(pH7.0、1ml)中に溶解した。スルホ−NHS−LC−LC−ビオチン(12.0mg、17.3μmol)を加え、混合物を室温で一晩撹拌した。反応混合物をHPLCで精製した。収量:5.5mg(54%)。MS:実測値885.67、計算値885.15。
【0086】
ii)ジアミンリンカーのカップリング
i)のビオチン化生成物(2.4mg、2.7μmol)を乾燥DMF(0.5ml)中に溶解した。4−フェニレンジアミン(1.2mg、10.84μmol)、PyAOP(1.7mg、3.3μmol)、およびDIPEA(0.6μl、3.3μmol)を加え、混合物を室温で一晩撹拌した。DMFを蒸発除去し、反応混合物を、HPLCカラム(Thermo ODS Hipersil、サイズ:150×10mm)により精製した。A(0.1%TFA)とB(MeCN)を使用して20分にて5%Bから50%Bまで変えて得られる直線的勾配を使用して、2.5ml/分の流量にて溶出した。
【0087】
収量は2.4g(92%)であった。MSの実測値(975.83)は、MSの計算値(975.28)とよく一致した。
iii)標識化
ii)から生成物(2.0mg、2.1μmol)を50mMの炭酸塩緩衝液(pH9.8、0.5ml)中に溶解した。9−デンテートユーロピウム−キレート(2,2’,2”,2’’’−{[2−(4−イソチオシアナートフェニル)−エチルアミノ]−ビス(メチレン)ビス{4−{[4−(α−ガラクトピラノキシ)フェニル]エチニル}−ピリジン−6,2−ジイル}ビス(メチレンニトリロ)}テトラキス(アセタート)ユーロピウム(III))(3.3mg、2.5μmol)を加え、反応混合物を室温で一晩撹拌した。反応混合物を、HPLCカラム(Phenomenex C18、サイズ:250×10mm)により精製した。A(20mM TEAA)とB(20mM TEAA+50%MeCN)を使用して30分にて5%Bから100%Bまで変えて得られる直線的勾配を使用して、3ml/分の流量にて溶出した。収量は1.3mg(27%)であった。
【0088】
実施例2
S1V12aの合成
S1V12aの合成は、出発物質がアミノ酸で造られたスペーサー基とビオチン基を既に有するので、2工程のみを含む(図5を参照)。同じジアミンリンカー(すなわち4−フェニレンジアミン)をトリペプチドのC−末端カルボキシル基にカップリングさせた後、9−デンテートユーロピウムキレートを、導入されたジアミンリンカー分子の芳香族アミノ基とコンジュゲートさせた。S1V12aの合成に対して使用した実験条件は、S1V6cの合成のための関連工程において使用した条件と同じであった。
【0089】
実施例3
その後のトロンビン測定において使用する3つの異なった参照基準曲線を作成した。
基準曲線Aは、200nMの濃度でのS1V6cを表わし、基準曲線Bは、10nMの濃度でのS1V9bを表わし、基準曲線Cは、25mMの濃度でのS1V9bを表わす。基質は、実施例1に記載の条件に従って作製した。
【0090】
組み換えトロンボプラスチン(イノビン)をアクチベータとして使用した。アッセイ緩衝液は従来のHEPES緩衝液であった。
0〜11.9IU/mlのトロンビン標準濃度を適用した。
【0091】
アッセイは、2ステップアッセイとして行った。工程Iにおいては、基準濃度を有するトロンビンを、異なったトロンビン濃度にて、アクチベータおよび基質とともにアッセイ緩衝液に加えた。試薬を十分に混合し、37℃で数分インキュベートした。
【0092】
工程IIにおいては、反応混合物の一部をマイクロウェルに移し、そこで捕捉を行った。基質をマイクロウェルに、37℃にて約3分にわたって固定化/捕捉してから、洗浄と乾燥を行った。捕捉されなかった基質ならびにキレートを含有する切断基質を洗い落とし、次いでマイクロウェルを乾燥した。最後に、乾燥したマイクロウェルからの蛍光カウント数を、蛍光カウンターを使用して測定した。
【0093】
検出された蛍光カウント数を、トロンビンを含有しない対照標準サンプルと比較し、基準曲線を作成するために、対照標準(トロンビン非含有)と比較してシグナルの減少を算出した。
【0094】
図6に示す結果は、S1V6cとS1V9bの濃度を増大させると、シグナルの減少が大きくなるということを示している。このことは、S1V6c基質とS1V9b基質が共に、トロンビンに対して極めて有効な基質であるということを示している。S1V9bは、S1V6cと比較して、より低いトロンビン濃度ではシグナルの減少がより大きくなる。しかしながらそれでも、どちらの基質も極めて適切なトロンビン基質であり、したがってどちらの基質も、サンプル中のトロンビンのレベルを測定するのに使用することができる。
【0095】
実施例4
全血での測定に対しては、全血ヘマトクリット値の補正を施すことを条件として、実施例3における基準曲線を適用することができる。検体としての二人の健康な女性からの全血サンプルと血漿サンプルを、本発明に従ってトロンビンに関して試験した。
【0096】
一人の検体からの血漿サンプルの4回の個別の測定は、87.7%±0.5%という対照標準シグナルと比較して検出シグナルの減少を示した。もう一人の検体に対しては、減少は91.5%±0.1%であった。
【0097】
全血サンプルの場合も、ほぼ同等の結果が得られた(それぞれ、一人の検体に対しては80.7%±0.9%、もう一人の検体に対しては86.3%±0.2%)。
これらの結果は、本発明の基質とアッセイが全血サンプルと血漿サンプル中のトロンビンを測定できること、および本発明の基質とアッセイの不変性を示している。
【符号の説明】
【0098】
1 基質
1a 結合対の第1のパートナー
1b トリペプチドまたはテトラペプチド
1c リンカー
1d ルミネッセンスキレート
2 結合対の第2のパートナー
3 固定化マトリックス
4 トロンビンを含有するテストサンプル
5 トロンビン非含有のテストサンプル
A 高レベルのトロンビンを含有するテストサンプル
B 低レベルのトロンビンを含有するテストサンプル
C トロンビン非含有のテストサンプル
【技術分野】
【0001】
本発明は、トロンビンの新規基質、およびサンプル中の生体活性トロンビンのレベルを測定するためのアッセイに関する。
【背景技術】
【0002】
トロンビンは、プロトロンビン上の2つの部位の、活性化第X(Xa)因子による酵素切断によってもたらされる。
トロンビンは、フィブリノゲンを活性型に転化させ、これが集合してフィブリンとなる。トロンビンはさらに、第XI因子、第V因子、および第VIII因子を活性化する。こうした正のフィードバックがトロンビンの生成を促進する。
【0003】
第XIII因子はさらに、トロンビンによって活性化される。第XIIIa因子は、リシンとフィブリン中のグルタミン残基との間の共有結合の形成を触媒するトランスグルタミナーゼである。共有結合により、フィブリン塊の安定性が高まる。
【0004】
凝固カスケードにおける活性に加えて、トロンビンはさらに、血小板上のプロテアーゼ活性化受容体の活性化によって血小板活性化を促進する。
臨床業務において、プロトロンビン時間(PT)(すなわち、血液が凝固するのに要する時間)の測定は、活性化部分トロンボプラスチン時間(APTT)と活性化凝固時間(ACT)に関して、凝固経路の異常を調べるのに、および抗凝固療法をモニターするのに広く使用されている。
【0005】
血液凝固試験の結果を標準化するために、国際標準化比(INR)が考案されている。組織因子の各メーカーは、メーカーが製造する全ての組織因子に対してISI(国際感度指数)を与えている。ISI値は、組織因子の特定のバッチと国際的に標準化されたサンプルとの間の比較を示す。INRは、患者のプロトロンビン時間と対照標準サンプルのプロトロンビン時間との比に、使用されるトロンボプラスチン試薬のISI値を乗じて得られる値である。
INR=(PTtest/PTnormal)ISI
PTの測定に対して利用可能なアッセイが2種ある。
【0006】
1つ目のアッセイは凝固(coagulometric)アッセイであり、フィブリノゲンからフィブリンへの転化による血塊形成のエンドポイントに基づいている。しかしながら、アッセイの結果は変わりやすく、特に、患者におけるフィブリノゲン/フィブリン転化の障害によって影響される。もう1つのアッセイは非凝固アッセイであり、トロンビン切断に適した合成基質の使用に基づいている。後者のアッセイの結果は変動がより少なく、フィブリノゲンのレベルによって影響されない。
【0007】
米国特許第4,061,625号は、
式:
D−Phe−環状イミノ酸−Arg−pNA
[式中、環状イミノ酸は、2−アゼチジンカルボン酸、プロリン、および2−ピペリジンカルボン酸から選ばれ、pNAはp−ニトロアニリドである]
の発色性トロンビン基質を開示している。該基質は、トロンビンの定量的測定に、あるいはトロンビンが形成、阻害、もしくは消費される反応の研究に、あるいはこのような反応に影響を及ぼすかもしくは関与する因子の測定(例えば、抗トロンビン、プロトロンビン、およびヘパリンの測定)に適していると記載されている。
【0008】
発色性基質が使用されるとき、反応は約405nmにて検出される。この波長では、全血自体が紫外線の吸収を起こすために、全血は分析することができない。したがって発色性基質は、使用されるサンプルタイプが全血であるときには適切ではない。
【0009】
イムノアッセイやDNAハイブリダイゼーションアッセイにおいては、ランタニドキレート等のキレートを使用する時間分解ルミネッセンス分光法が、ここ数年にわたって利用されている。全血の吸収特性により、このキレート検出技術は、発色性基質の場合と比較して、サンプルが全血であるときに適している。なぜなら、この技術を使用すると、615nm(この波長では、全血の吸収は少ない)での吸光度を測定することができるからである。
【0010】
このようなキレートは、時間分解蛍光分析(TRF)への応用に適した改良された蛍光ランタニドキレートを開示している米国特許第7,018,851B1号において記載されている。これらのキレートは、特異的バイオアフィニティベースの結合アッセイ(例えばイムノアッセイ)において使用されている。
【0011】
TRFは、高い感度と広いダイナミックレンジを必要とするアッセイに対して極めて適切な検出技術である。従来の蛍光検出を使用するイムノアッセイ法においては、例えば、サンプルの生物学的成分からの光散乱によって引き起こされる高い非特異的バックグラウンドは、アッセイの感度にとって深刻な制約となる。
【0012】
蛍光ランタニドキレートは、検出原理が、こうしたキレートの捕捉とキレートの検出をベースとするイムノアッセイにおいて従来から使用されている。これとは対照的に、蛍光ランタニドキレートは、検出原理が、キレート担体の切断およびアッセイにおいて残留している捕捉された(切断していない)担体の検出をベースとする酵素アッセイには使用されていない。
【0013】
このようなシステムの重要な特徴は、一方では安定であって、他方ではトロンビンによって特異的に切断可能であるような担体を提供することである。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】米国特許第4,061,625号
【特許文献2】米国特許第7,018,851B1号
【発明の概要】
【発明が解決しようとする課題】
【0015】
したがって、トロンビンによって特異的に切断可能であって、長い寿命を有する(このため、全血での検出が容易になり、障害はより少なくなる)本質的に安定なルミネッセンス成分を含む酵素基質が求められている。
【0016】
さらに、実施するのが速やかで、単純かつ簡単であり、ばらつきが小さく、簡単に自動化することができ、そして低コストであるようなアッセイが求められている。
驚くべきことに、トロンビンによって特異的に切断可能であるペプチドとルミネッセンスキレートとを、ある特定のリンカーを介して結びつけることによって、サンプルタイプが全血であるときに使用することができる、長い寿命を有する安定な基質が得られる、ということが見出された。
【課題を解決するための手段】
【0017】
第1の側面では、本発明は、
一般式:
A−X−Z−A’
[式中、AとA’の一方が、ルミネッセンスキレートを含み、そして
AとA’の他方が、場合によってはスペーサーを含み、ペプチド結合を介して基質の残りの部分に連結されている、結合対の第1のパートナーを含み;
Xは、X’−Phe−Aze−Arg、X’−Phe−Pip−Arg、およびX’−Phe−Pro−Argから選ばれるトリ−ペプチドもしくはテトラ−ペプチドを形成し、
ここで、X’は、存在しないか又はLys、Ahx、Ile、およびValから選ばれ;
ZはNH−R−Z’であり、
ここで、Rは、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、C1−6アルキレンオキシ−カルボニル、C1−6アルキレン−アリーレン、C1−6アルキレンオキシ−アリーレン、C1−6アルキレン−NH、C1−6アルキレンオキシ−NH、C1−6アルキレン−NHCO、C1−6アルキレンオキシ−NHCO、C1−6アルキレン−CONH、C1−6アルキレンオキシ−CONH、C1−6アルキレン−COS、C1−6アルキレンオキシ−COS、C1−6アルキレン−CONH−C1−6アルキレン−アリーレン、アリーレン、アリーレン−C1−6アルキレン、アリーレン−C1−6アルキレンオキシ、R1a−アリーレン−(NHCO−R2)b、R3c−アリーレン−(CONH−R4)d、(R5−CONH)e−アリーレン−R6f、および(R7−NHCO)g−アリーレン−R8hからなる群から選ばれ、ここで、それぞれの場合における各R1、R2、R3、R4、R5、R6、R7、およびR8は、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、アリーレン、またはアリーレン−C1−6アルキレンから独立して選ばれ、a、b、c、d、e、f、g、およびhのそれぞれが、0〜6の整数から独立して選ばれ、
ここで、アリーレンは、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、もしくはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、もしくはトリ置換されてもよいフェニレン、ビフェニレン、またはナフチレンであって、
Z’は、N、S、およびカルボニルのうちの1つを含み、
ここで、Z’がNを含むとき、Z’は、チオウレア(−NH−CS−NH−)、アミノアセトアミド(−NH−CO−CH2−NH−)、アミド(−NH−CO−)、メチルアミド(−NCH3−CO−)、または置換−トリアジン−ジアミン(−NH−(R9C3N3)−NH−)から選択され、
Z’がSを含むとき、Z’は、チオエーテル(−S−)、チオアセトアミド(−S−CH2−CO−NH−)、ジスルフィド(−S−S−)、(−S−CO−CH2−NH−)、または(−S−(R9C3N3)−NH−)から選択され、あるいは
Z’がカルボニルを含むとき、Z’は、アミド(−CO−NH−、−CO−NCH3−)またはエステル(−CO−O−)から選ばれ、
R9は、水素、ハロゲン、C1−6アルキル、C1−6チオアルキル、C1−6アルコキシ、C1−6チオアルコキシ、アリールオキシ、およびアミノからなる群から選ばれ、アルキル基、チオアルキル基、アルコキシ基、チオアルコキシ基、またはアリールオキシ基は、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、またはトリ置換されてもよく、アミノ基は、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換またはジ置換されてもよい]
を有する、トロンビンの基質に好適である。
【0018】
本発明の文脈においては、C1−6アルキル基は、1〜6個の炭素原子で構成される直鎖基または分岐鎖基を意味しており、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、t−ブチル、ペンチル、およびヘキシル等があるが、これらに限定されない。好ましいのは、メチル基、エチル基、プロピル基、およびイソプロピル基である。
【0019】
本発明の文脈においては、C1−6アルキレン基は、1〜6個の炭素原子で構成される直鎖基または分岐鎖基を意味しており、メチレン、エチレン、プロピレン、イソプロピレン、ブチレン、イソブチレン、t−ブチレン、ペンチレン、およびヘキシレン等があるが、これらに限定されない。好ましいのは、メチレン基、エチレン基、およびプロピレン基である。
【0020】
本発明の文脈においては、C1−6アルコキシ基は、酸素原子に連結した1〜6個の炭素原子で構成される直鎖基または分岐鎖基を意味しており、メトキシ、エトキシ、プロポキシ、イソプロポキシ、ブトキシ、イソブトキシ、t−ブトキシ、ペントキシ、およびヘキソキシ等があるが、これらに限定されない。好ましいのは、メトキシ基、エトキシ基、およびプロポキシ基である。
【0021】
本発明の文脈においては、C1−6アルキレンオキシ基は、酸素原子に連結した1〜6個の炭素原子で構成される直鎖基または分岐鎖基を意味しており、メチレンオキシ、エチレンオキシ、プロピレンオキシ、イソプロピレンオキシ、ブチレンオキシ、イソブチレンオキシ、t−ブチレンオキシ、ペンチレンオキシ、およびヘキシレンオキシ等があるが、これらに限定されない。好ましいのは、メチレンオキシ基、エチレンオキシ基、およびプロピレンオキシ基である。
【0022】
本発明の文脈におけるアミノ酸残基は、従来の3文字略語を有する。したがってAhxは2−アミノヘキサン酸(ノルロイシン)を表わし、Alaはアラニンを表わし、Argはアルギニンを表わし、Asnはアスパラギンを表わし、Aspはアスパラギン酸を表わし、Azeは、アゼチジン−2−カルボン酸を表わし、Cysはシステインを表わし、Glnはグルタミンを表わし、Gluはグルタミン酸を表わし、Glyはグリシンを表わし、Hisはヒスチジンを表わし、Ileはイソロイシンを表わし、Leuはロイシンを表わし、Lysはリシンを表わし、Metはメチオニンを表わし、Pheはフェニルアラニンを表わし、Pipはピペリジン−2−カルボン酸を表わし、Proはプロリンを表わし、Serはセリンを表わし、Thrはトレオニンを表わし、Trpはトリプトファンを表わし、Tyrはチロシンを表わし、そしてValはバリンを表わす。
【0023】
本発明の文脈においては、ハロゲンは、フルオロ、クロロ、ブロモ、またはヨードを表わす。
本発明の基質は、切断された基質を非切断/非損傷(intact)の基質から分離するために、固定化マトリックスに付着させることができるものでなければならない。したがって本発明の基質は、結合対の第1のパートナーによって終結されていて、つまり、結合対の第2のパートナーに結合する。該結合対のこの第2のパートナーが、固定化マトリックス上に固定化される。
【0024】
本発明の基質は、優れた特異性を有するトロンビンによって速やかに切断することができる。その中央部は、トリもしくはテトラペプチドを単位とする小さなペプチドであり、Arg−部分とZ−部分との間に位置する切断可能結合においてトロンビンによって切断される。
【0025】
本発明の基質は、サンプルが血漿であるときに使用することができ、サンプルが全血であるときに適しているので特に有利である。なぜなら本発明の基質は、使用されているキレート技術により、615nmにて検出することができるからである。
【図面の簡単な説明】
【0026】
【図1】図1は、事前に基質を固定化しない1ステップアッセイ法の概略図を示す。
【図2】図2は、事前に基質を固定化する1ステップアッセイ法の概略図を示す。
【図3】図3は、2ステップアッセイ法の概略図を示す。
【図4】図4は、本発明の基質であるS1V6cの合成の反応スキームを示す。
【図5】図5は、本発明の他の基質であるS1V12aの合成の反応スキームを示す。
【図6】図6は、本発明の基質であるS1V6cとS1V9bの標準的な曲線を示す。
【発明を実施するための形態】
【0027】
本発明の1つの実施態様では、基質は、X’が存在せず、PheがD−Pheであり、そしてArgがL−Argである、という基質である。
本発明の1つの実施態様では、XはD−Phe−L−2−Aze−L−ArgまたはD−Phe−L−2−Pip−L−Argである。
【0028】
これらの基質は、速い切断速度論をもたらすことが示されており、および/または、トロンビンに対して高度に特異的である。
本発明の1つの実施態様では、Z’がNであり、Rがアリーレン、C1−6アルキレン−アリーレン、またはR1a−アリーレン−(NHCO−R2)bであって、R1とR2が上記したとおりであり、aとbが0、1、または2である。
【0029】
したがって、切断可能な結合におけるZが芳香族部分を含む場合の基質は、極めて良好で速い切断速度論をもたらすことが示されている。
本発明の1つの実施態様では、Z’が6−置換−1,3,5−トリアジン−2,4−ジアミン(NH−(R9C3N3)−NH)結合または(S−(R9C3N3)−NH)結合であって、R9が、クロロ、フルオロ、エトキシ、2−メトキシエトキトシ、2−シアノエトキシ、2,2,2−トリフルオロエトキシ、チオフェノキシ、およびエトキシカルボニルチオメトキシからなる群から選ばれる。
【0030】
本発明の実施態様に従った基質は、トロンビンに対して特に特異的である。
本発明の1つの実施態様では、ルミネッセンスキレートは蛍光ランタニドキレートである。例えば米国特許第7,018,851B2号に開示されているように、適切な波長での高い吸収率;同じリガンド構造における幾つかの別個のUV吸収部;UV吸収部からランタニドイオンへの効果的なエネルギー伝達;熱力学的安定性と高い速度論的安定性をつくりだすための強固なキレート部分;および、結合試剤として使用するキレート化合物の効果的なカップリングを、その結合特性を損なうことなく可能にする官能基;をもたらすこのようなルミネッセンスランタニドキレートは、本発明に対して極めて適している。
【0031】
本発明の好ましい実施態様では、前記ランタニドキレートAまたはA’は、
【0032】
【化1】

【0033】
と
【0034】
【化2】

【0035】
から選ばれる。
このようなキレートはさらに、例えば、ピリジン、ビピリジン、ターピリジン、もしくはフェノール化合物の誘導体をエネルギー媒介基として、そしてポリカルボン酸をキレート部分として構成される安定なキレートを含んでよい。さらに、種々のジカルボン酸塩誘導体、大環状クリプテート、カリックスアレーン、DTPAカルボスチリル124コンジュゲート、および大環状シッフ塩基が特許出願および/または特許に開示されている。
【0036】
本発明の1つの実施態様では、結合対は、第1のパートナーとしてのビオチンと第2のパートナーとしてのストレプトアビジン(ビオチン/ストレプトアビジン)、ビオチン/アビジン、ビオチン/ビオチン受容体ペプチド、およびストレプトアビジン誘導体/受容体ペプチドから選ばれる。
【0037】
結合対の上記リストは限定的なものであり、本発明の基質を固定化マトリックスに固定化することができる全ての結合対を含む。市販の結合対の例としては、Strep−tag、Sterep−tagII/Strep−Tactin、またはビオチン/ビオチン受容体ペプチドなどがあるが、これらに限定されない。
【0038】
好ましい実施態様では、前記第1のパートナーはビオチンである。
好ましい実施態様では、前記第2のパートナーはストレプトアビジンである。
固定化マトリックスは、当業者には公知であり、マイクロウェルやマイクロ粒子(例えば、ポリスチレンやポリプロピレン等のプラスチック材料で造られたビーズ、あるいはガラスで造られたビーズ)などがある。
【0039】
本発明の1つの実施態様では、結合対の前記第1のパートナーが、スペーサーを介して基質の残部に連結される。立体的な理由から特に有用であるスペーサーを利用することで、基質の溶解性が改良される。したがってスペーサーの役割は、トロンビン酵素に課される立体障害を減ずるように、基質のペプチド/リンカー/キレート部分を溶解させることである。
【0040】
本発明の1つの実施態様では、スペーサーは、式NH−R10−CONH−R11−CO−(NH−R12−NH)iで表わされ、ここでR10、R11、およびR12のそれぞれは、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、アリーレン、またはアリーレン−C1−6アルキレンから独立して選ばれ、ここで、アリーレンは、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、もしくはトリ置換されてもよいフェニレン、ビフェニレン、またはナフチレンであり、iは0〜6の整数である。
【0041】
本発明の1つの実施態様では、R10、R11、およびR12は、同一もしくは異なった、直鎖C1−6アルキレン、アリーレン、またはアリーレン−C1−6アルキレンであり、iは0または1である。
【0042】
これとは別に、スペーサーはW−merペプチドであって、Wは1〜40の整数である。
好ましい実施態様では、本発明の基質は、
【0043】
【化3】

【0044】
【化4】

【0045】
【化5】

【0046】
【化6】

【0047】
【化7】

【0048】
【化8】

【0049】
【化9】

【0050】
【化10】

【0051】
【化11】

【0052】
から選ばれる。
本発明の基質は、実施するのが速やかで、単純かつ簡単で、ばらつきが小さく、簡単に自動化することができ、そして低コストであるようなアッセイにおいて使用することができる。
【0053】
本発明の基質は、先行技術のアッセイと比較して、速やかで正確なアッセイをもたらすので、本発明のアッセイは、吸光度が任意に定めた特定の値に達するのに必要とする時間を測定する必要がない。代わりに、先行技術のアッセイと比較してアッセイ時間をより短い時間に固定することができ、時間分解ルミノメトリーを使用してルミネッセンスシグナルを測定することができる。好ましい実施態様では、前記ルミノメトリーはフルオロメトリーである。こうしたより短い時間でも、より正確な結果が得られる。エンドポイントは、標準サンプルにおいて、基質分子の約80%が、アクチベータが存在下にてトロンビンによって切断される、という状態に達するのに必要な時間を表わすことができる。
【0054】
これとは別に、エンドポイントはさらに、標準サンプルにおいて、トロンビンによる切断反応の定常状態に達するのに必要な時間を表わすことができる。
したがって第2の側面においては、本発明は、テストサンプル中の生体活性トロンビンのレベルを測定するための1ステップアッセイ法に関し、該アッセイ法は、
a)本発明の基質、アクチベータ、および該テストサンプルを、連続して、同時に、または実質的に同時に混合する工程;
b)得られる反応混合物を、トロンビン切断されたキレート含有基質フラグメントを放出するようインキュベートし、結合パートナー含有基質フラグメントとトロンビン切断されない非損傷基質を固定化マトリックス上に固定化する工程;
c)固定化されずトロンビン切断されたキレート含有基質フラグメントと、固定化されずトロンビン切断されない基質が存在する場合は、これらを洗い落とす工程;
d)固定化された非損傷基質からのルミネッセンス発光のレベルを測定する工程;および
e)トロンビン非含有の標準サンプルと比較したときの、ルミネッセンス発光の強度の減少から、トロンビン活性を算出する工程;
を含む。
【0055】
したがって、固定化されないトロンビン切断されたキレート含有基質フラグメントと、固定化されないトロンビン切断されない基質(後者は、固定化マトリックスの結合容量が基質分子の量より低いときに存在する)とを洗い落とすことによって、トロンビン非含有の標準サンプルからのルミネッセンスと比較したときの、サンプルにおけるルミネッセンス発光の減少(切断パーセント)を、サンプルにおけるトロンビン活性と直接相関づけることが可能となる。
【0056】
これとは別に、基質は、マイクロウェルやマイクロ粒子等の固定化マトリックスの表面上に固定化される。全血や血漿等のテストサンプルを、アクチベータとともに固定化マトリックスに、連続して、同時に、あるいは実質的に同時に加える。得られる反応混合物を、トロンビンが基質に対して作用できるようにインキュベートし、これによりトロンビン切断されたキレート含有基質フラグメントを放出させ、結合パートナー含有基質フラグメントとトロンビン切断されない非損傷基質を、引き続き固定化マトリックス上に残存させる。
【0057】
使用するアクチベータのアイデンティティは、決定しようとするパラメーターPR、APTT、またはACTに依存する。使用するアクチベータの例としては、トロンボプラスチン、部分トロンボプラスチン試薬(例えばリン脂質)、およびコンタクトアクチベータ(例えば、シリカ、カオリン、セライト、エラグ酸等)などがあるが、これらに限定されない。
【0058】
未知サンプル中の生体活性トロンビン(すなわち、いかなる阻害剤(例えば抗トロンビン)にも結合しておらず、したがってタンパク質分解作用において活性であるトロンビン)の量は、生体活性トロンビンの標準曲線から、その切断パーセント(全ルミネッセンス強度に対するルミネッセンス強度の減少)によって決定することができる。その後、生体活性トロンビンのレベルは、標準サンプルの群(n≧20)からの生体活性トロンビンと、未知サンプルからの生体活性トロンビンとの比として表示することができる。この比は、使用されるアクチベータがトロンボプラスチンである場合は、プロトロンビン時間比(PR)に等しく、使用されるアクチベータが部分トロンボプラスチン試薬(例えばリン脂質)とコンタクトアクチベータ(例えば、シリカ、カオリン、セライト、エラグ酸等)である場合は、活性化部分トロンボプラスチン時間(APTT)比に等しく、あるいは、使用されるアクチベータがコンタクトアクチベータであって、使用されるサンプルタイプが天然の全血である場合は、活性化凝固時間(ACT)比に等しい。
【0059】
本発明の1つの実施態様では、テストサンプルとアクチベータの添加は、固定化マトリックスへの基質の添加と同時に、または実質的に同時に行われる。
事前に基質を固定化しない1ステップアッセイ法を、図1に概略的に示す。図1については詳細に後述する。
【0060】
1ステップアッセイ法は、固定化マトリックス上に固定化されたときに当該基質がそれほど切断可能ではないが、液相においてはトロンビンによって切断可能であるときに(すなわち、液相における基質の切断速度論が、結合パートナーの結合速度論より速やかであるか、あるいは少なくとも同等程度に速やかであるときに)、特に有用である。したがって、基質分子とトロンビン分子との間の切断反応と、固定化結合パートナー分子と切断された非損傷基質分子との間の結合反応の両方が、次のインキュベーション工程時に起こる。
【0061】
本発明の他の実施態様では、テストサンプルの添加は、固定化マトリックスに基質を固定化させた後に行われる。事前に基質を固定化する1ステップアッセイ法を、図2に概略的に示す。図2については詳細に後述する。
【0062】
このようなアッセイは、単純さ、速さ、およびロバスト性等の多くの利点を有する。しかしながら、この実施態様のための必須条件であると考えられる条件は、基質が固定化マトリックス上に固定化されたときに、基質が切断可能でなければならない、ということである。
【0063】
その後、固定化されずトロンビン切断されたキレート含有基質フラグメントを洗い落とす。固定化された非損傷基質のルミネッセンス発光を測定し、トロンビン非含有の標準サンプルのルミネッセンスと比較する。サンプルにおけるルミネッセンス強度の減少のパーセント(切断パーセント)は、サンプルにおけるトロンビン活性と直接的に相関する。
【0064】
本発明の第3の側面は、テストサンプル中の生体活性トロンビンのレベルを測定するための2ステップアッセイ法に関し、該アッセイ法は、
a)該サンプルとアクチベータを、液相中にて本発明の基質に加える工程;
b)得られる反応混合物を、トロンビン切断されたキレート含有基質フラグメントを放出するようインキュベートする工程;
c)反応混合物を固定化マトリックスに加える工程;
d)固定化されないトロンビン切断されたキレート含有基質フラグメントと、固定化されないトロンビン切断されない基質が存在する場合は、これらを洗い落とす工程;
e)固定化された非損傷基質からのルミネッセンス発光のレベルを測定する工程;および
f)トロンビン非含有の標準サンプルと比較したときの、ルミネッセンス発光の強度の減少から、トロンビン活性を算出する工程;
を含む。
【0065】
2ステップアッセイは、当該基質が液相においてのみ機能するときに有利に使用することができる。2ステップアッセイを図3に概略的に示す。図3については詳細に後述する。
【0066】
本実施態様では、テストサンプル(例えば、血漿や全血)、アクチベータ、および基質を含む反応混合物を液相中にて反応させる。引き続き、該反応混合物の一部または全部を固定化マトリックスに移し、そこでトロンビン切断された基質フラグメントとトロンビン切断されない非損傷トロンビンの固定化が行われる。トロンビン切断されたキレート含有基質フラグメントと固定化されないトロンビン切断されない基質を洗い落とした後、固定化非損傷基質からのルミネッセンスのレベルを上記のように測定する。
【0067】
1ステップアッセイと2ステップアッセイのどちらのタイプのアッセイを選択するかは、主として、基質、アクチベータ、およびサンプルの固定化マトリックスへ同時に添加を行うことがどの程度困難であるかによって決まる。同時添加が困難であるときは、2ステップアッセイを使用するのが好ましい。同時添加が困難でないときは、1ステップアッセイを使用することができる。さらに、2ステップアッセイは、基質の溶解性が許す限り、利用する基質の量がかなり多くてよいという、1ステップアッセイを凌ぐ利点を有する。
【0068】
本発明の第4の側面は、サンプル中の生体活性トロンビンのレベルを測定するために、本発明の基質を使用することを提供する。したがって本発明の基質は、トロンビンの優れた特異性を示し、トロンビンによって速やかに切断することができる。したがって、実施するのが簡単で、自動化することができ、そして短時間で信頼性の高い結果をもたらすアッセイにおいて該基質を使用することが可能となる。
【0069】
第5の側面では、本発明は、
a)上記のようなルミネッセンス基質;および
b)固体固定化マトリックス;
を含む、サンプル中の生体活性トロンビンのレベルを測定するためのテストキットを提供する。
【0070】
本発明の基質が、トロンビンの場合に特異的に採用されるとしても、異なった酵素の場合にも同様に適用することができる。したがって本出願人は、トリ−もしくはテトラ−ペプチド(X)と本発明のリンカー(Z)との結合を、同様に他の酵素によって簡単に切断することができる、ということを実際に示した。
【0071】
したがって本発明の基質は、基質の小さな修飾によって(具体的にはペプチドを選択することによって)所望の用途に応用することができる。
例えば、活性型および不活性型のFII、FV、FVII、FVIII、FIX、FX、FXI、およびFXII、ならびに、活性型および不活性型の、これらのフラグメントと、C1、C2、C3、C4、C5、C6、C7、C8、およびC9の組み合わせ等の、種々の凝固因子を測定することができる。ミエロペルオキシダーゼ(MPO)、アラニンアミノトランスフェラーゼ(ALAT)、アスパルテートアミノトランスフェラーゼ(ASAT)、カスパーゼ−1、およびグルタチオンペルオキシダーゼ−1(GPx−1)等の酵素も測定することができる。
【0072】
したがって第6の側面では、本発明は、
一般式:
A−X−Z−A’
[式中、AとA’の一方が、ルミネッセンスキレートを含み、そして
AとA’の他方が、場合によってはスペーサーを含みペプチド結合を介して基質の残りの部分に連結されている、結合対の第1のパートナーを含み;
Xは、トリ−ペプチドもしくはテトラ−ペプチドを形成し;
Zは、NH−R−Z’であり、
ここで、Rは、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、C1−6アルキレンオキシ−カルボニル、C1−6アルキレン−アリーレン、C1−6アルキレンオキシ−アリーレン、C1−6アルキレン−NH、C1−6アルキレンオキシ−NH、C1−6アルキレン−NHCO、C1−6アルキレンオキシ−NHCO、C1−6アルキレン−CONH、C1−6アルキレンオキシ−CONH、C1−6アルキレン−COS、C1−6アルキレンオキシ−COS、C1−6アルキレン−CONH−C1−6アルキレン−アリーレン、アリーレン、アリーレン−C1−6アルキレン、アリーレン−C1−6アルキレンオキシ、R1a−アリーレン−(NHCO−R2)b、R3c−アリーレン−(CONH−R4)d、(R5−CONH)e−アリーレン−R6f、および(R7−NHCO)g−アリーレン−R8hからなる群から選ばれ、ここで、それぞれの場合における各R1、R2、R3、R4、R5、R6、R7、およびR8は、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、アリーレン、またはアリーレン−C1−6アルキレンから独立して選ばれ、a、b、c、d、e、f、g、およびhのそれぞれが、0〜6の整数から独立して選ばれ、
ここで、アリーレンは、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、もしくはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、もしくはトリ置換されてもよいフェニレン、ビフェニレン、またはナフチレンであって、
Z’は、N、S、およびカルボニルのうちの1つを含み、
ここで、Z’がNを含むとき、Z’は、チオウレア(−NH−CS−NH−)、アミノアセトアミド(−NH−CO−CH2−NH−)、アミド(−NH−CO−)、メチルアミド(−NCH3−CO−)、または置換−トリアジン−ジアミン(−NH−(R9C3N3)−NH−)から選択され、
Z’がSを含むとき、Z’は、チオエーテル(−S−)、チオアセトアミド(−S−CH2−CO−NH−)、ジスルフィド(−S−S−)、(−S−CO−CH2−NH−)、または(−S−(R9C3N3)−NH−)から選択され、あるいは
Z’がカルボニルを含むとき、Z’は、アミド(−CO−NH−、−CO−NCH3−)またはエステル(−CO−O−)から選ばれ、
R9は、水素、ハロゲン、C1−6アルキル、C1−6チオアルキル、C1−6アルコキシ、C1−6チオアルコキシ、アリールオキシ、およびアミノからなる群から選ばれ、アルキル基、チオアルキル基、アルコキシ基、チオアルコキシ基、またはアリールオキシ基は、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、またはトリ置換されてもよく、アミノ基は、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換またはジ置換されてもよい]
を有する酵素基質を提供する。
【0073】
以下に、図面を参照しつつ本発明を開示する。
事前に基質を固定化しない1ステップアッセイを図1に示す。使用される基質1は、本発明によれば、4つの部分((1a、1b、1c、および1d)(A−X−Z−A’))を含む。1aは結合対の第1のパートナーを表わし、また1aは場合によってはスペーサーを含み、1bはトリペプチドもしくはテトラペプチドを表わし、1cはリンカーを表わし、そして1dはルミネッセンスキレートを表わす。2は、固定化マトリックス3の表面に結合する結合対の第2のパートナーを表わす。4は、テストサンプル中のトロンビンの存在を表わし(Aは、高レベルのトロンビンを含有する、Bは、低レベルのトロンビンを含有する)、5はトロンビン非含有のテストサンプル(C)を表わす。
【0074】
高レベルのトロンビンを示すAにおいては、基質1がテストサンプル4と反応する。この結果、基質の切断が起こる。切断された基質は2つの部分(第1の部分(1a、1b)と第2の部分(1c、1d))を含む。基質の第1の部分(1a、1b)は固定化マトリックスに固定化されるが、第2の部分(1c、1d)は洗い落とされる。次いで、固定化された非損傷基質(1a、1b)からのルミネッセンス発光を測定し、トロンビン非含有サンプル5(C)のルミネッセンスと比較する。洗浄工程と測定工程は図1には示されていない。
【0075】
図1はさらに、低トロンビンレベル場合(Bに示す)とトロンビンレベルゼロ(Cに示す)の1ステップアッセイを示す。Cは対照標準として使用される。
図2は、上記のような1ステップアッセイを示すが、ここではテストサンプル4または5の添加が、本発明の基質1を固定化マトリックス3に固定化した後に行われる。
【0076】
図3は2ステップアッセイを示す。のステップIは、基質1がテストサンプル4(トロンビン含有(A))またはテストサンプル5(トロンビン非含有(B))と反応することを示している。この結果、トロンビン切断された基質が生成するか(A)、また非損傷の基質が生成する(B)。ステップIIでは、該反応混合物の一部または全部が固定化マトリックスに移動され、そこでトロンビン切断された基質フラグメント(1a、1b)の固定化(A)と、トロンビン切断されない非損傷トロンビン基質(1a、1b、1c、および1d)の固定化(B)が起こる。トロンビン切断されたキレート含有基質フラグメント(1c、1d)を洗い落とした後、固定化された非損傷基質1からのルミネッセンス発光を、1ステップアッセイの場合と同様に測定する。洗浄工程と測定工程は図3には示されていない。
【0077】
したがって(A)の場合は、低レベルのキレート(ルミネッセンス/蛍光)が測定され、このことは高レベルのトロンビンが存在することを示している。(B)の場合は対照的に、高レベルのキレート(ルミネッセンス/蛍光)が測定され、このことはトロンビンが存在しないことを示している。
【実施例】
【0078】
以下に実施例を挙げて本発明をさらに詳細に説明するが、これら特定の実施例によって本発明が限定されることはない。
以下の実施例に対しては、下記のような材料と計測機器を使用した。
【0079】
材料
ピアース社からのスルホ−NHS−LC−LC−ビオチン、アクロス社からのp−フェニレンジアミン、アルドリッチ社からの(7−アザベンゾトリアゾール−1−イルオキシ)トリピロリジノホスホニウムヘキサフルオロホスフェート(PyAOP)、およびフルカ社からのN−エチルジイソプロピルアミン(DIPEA)。トリフルオロ酢酸(TFA)はRiedel−de−Haenから購入し、酢酸トリエチルアンモニウム緩衝液(TFAA)はフルカ社から購入した。使用したアセトニトリル(MeCN)は、J.T.BakerからのHPLCグレード品であった。DMFは、Lab−Scanから購入し、モレキュラーシーブ(4Å)上で乾燥した。使用した他の薬品は全て、分析グレード品であった。
【0080】
H−Phe(D)−Pip−ArgはKJ Ross−Petersen ApSから購入した。N−末端ビオチン化長鎖ペプチドベースのD−phe−L−Aze−Arg−OH(例えば、ビオチン−(Ser−(Gly)2)7D−phe−L−Aze−Arg−OH)はインビトロジェン社から購入した。イノビンはデイド・ベーリング社(シーメンス社)から購入した。ウシ血清アルブミン(BSA)はシグマ社から購入した。
【0081】
9−デンテートユーロピウム−キレート(2,2’,2”,2’’’−{[2−(4−イソチオシアナートフェニル)−エチルアミノ]−ビス(メチレン)ビス{4−{[4−(α−ガラクトピラノキシ)フェニル]エチニル}−ピリジン−6,2−ジイル}ビス(メチレンニトリロ)}テトラキス(アセタート)ユーロピウム(III))、洗浄液、およびストレプトアビジンで被覆された単一カップは、インノトラック・ダイアグノスティクス社(フィンランド)から購入した。
【0082】
低蛍光12ウェルのマキシソープマイクロタイトレーションストリップと単一マキシソープマイクロタイトレーションウェル(紫外線クエンチ)はヌンク社(デンマーク)から購入した。
【0083】
計測機器
質量分析(MS)は、α−シアノ−4−ヒドロキシケイ皮酸をマトリックスとして使用して、パーセプティブバイオシステムズ社からのVoyager DE−PRO(MALDI TOF)により操作した。アッセイが手操作で行われるときは、Wallac Oy社、パーキンエルマーライフサンエンス社からの1420マルチラベルカウンター(ビクター)を使用して時間分解蛍光を615nmにて測定したが、アッセイが半自動で行われるときは、インノトラック・ダイアグノスティクス社からのAioイムノアナライザーを使用して時間分解蛍光を615nmにて測定した。
【0084】
実施例1
S1V6cの合成
S1V6cの合成は、図4に示すように、H−Phe(D)−Pip−Arg−OHを含むトリペプチドの使用からスタートして3つの工程を含む。まず、直鎖状のスペーサーを有するビオチン基を、トリペプチドのN−末端α−アミノ基に結合させた。次いで、ジアミンリンカー(すなわち4−フェニレンジアミン)を、トリペプチドのC−末端カルボキシル基にカップリングさせた。最後に、9−デンテートユーロピウムキレートを、導入されたリンカー分子の芳香族アミノ基とコンジュゲートさせた。
【0085】
合成手順
i)ビオチン化
H−Phe(D)−Pip−Arg−OH(5.0mg、11.6μmol)をPBS緩衝液(pH7.0、1ml)中に溶解した。スルホ−NHS−LC−LC−ビオチン(12.0mg、17.3μmol)を加え、混合物を室温で一晩撹拌した。反応混合物をHPLCで精製した。収量:5.5mg(54%)。MS:実測値885.67、計算値885.15。
【0086】
ii)ジアミンリンカーのカップリング
i)のビオチン化生成物(2.4mg、2.7μmol)を乾燥DMF(0.5ml)中に溶解した。4−フェニレンジアミン(1.2mg、10.84μmol)、PyAOP(1.7mg、3.3μmol)、およびDIPEA(0.6μl、3.3μmol)を加え、混合物を室温で一晩撹拌した。DMFを蒸発除去し、反応混合物を、HPLCカラム(Thermo ODS Hipersil、サイズ:150×10mm)により精製した。A(0.1%TFA)とB(MeCN)を使用して20分にて5%Bから50%Bまで変えて得られる直線的勾配を使用して、2.5ml/分の流量にて溶出した。
【0087】
収量は2.4g(92%)であった。MSの実測値(975.83)は、MSの計算値(975.28)とよく一致した。
iii)標識化
ii)から生成物(2.0mg、2.1μmol)を50mMの炭酸塩緩衝液(pH9.8、0.5ml)中に溶解した。9−デンテートユーロピウム−キレート(2,2’,2”,2’’’−{[2−(4−イソチオシアナートフェニル)−エチルアミノ]−ビス(メチレン)ビス{4−{[4−(α−ガラクトピラノキシ)フェニル]エチニル}−ピリジン−6,2−ジイル}ビス(メチレンニトリロ)}テトラキス(アセタート)ユーロピウム(III))(3.3mg、2.5μmol)を加え、反応混合物を室温で一晩撹拌した。反応混合物を、HPLCカラム(Phenomenex C18、サイズ:250×10mm)により精製した。A(20mM TEAA)とB(20mM TEAA+50%MeCN)を使用して30分にて5%Bから100%Bまで変えて得られる直線的勾配を使用して、3ml/分の流量にて溶出した。収量は1.3mg(27%)であった。
【0088】
実施例2
S1V12aの合成
S1V12aの合成は、出発物質がアミノ酸で造られたスペーサー基とビオチン基を既に有するので、2工程のみを含む(図5を参照)。同じジアミンリンカー(すなわち4−フェニレンジアミン)をトリペプチドのC−末端カルボキシル基にカップリングさせた後、9−デンテートユーロピウムキレートを、導入されたジアミンリンカー分子の芳香族アミノ基とコンジュゲートさせた。S1V12aの合成に対して使用した実験条件は、S1V6cの合成のための関連工程において使用した条件と同じであった。
【0089】
実施例3
その後のトロンビン測定において使用する3つの異なった参照基準曲線を作成した。
基準曲線Aは、200nMの濃度でのS1V6cを表わし、基準曲線Bは、10nMの濃度でのS1V9bを表わし、基準曲線Cは、25mMの濃度でのS1V9bを表わす。基質は、実施例1に記載の条件に従って作製した。
【0090】
組み換えトロンボプラスチン(イノビン)をアクチベータとして使用した。アッセイ緩衝液は従来のHEPES緩衝液であった。
0〜11.9IU/mlのトロンビン標準濃度を適用した。
【0091】
アッセイは、2ステップアッセイとして行った。工程Iにおいては、基準濃度を有するトロンビンを、異なったトロンビン濃度にて、アクチベータおよび基質とともにアッセイ緩衝液に加えた。試薬を十分に混合し、37℃で数分インキュベートした。
【0092】
工程IIにおいては、反応混合物の一部をマイクロウェルに移し、そこで捕捉を行った。基質をマイクロウェルに、37℃にて約3分にわたって固定化/捕捉してから、洗浄と乾燥を行った。捕捉されなかった基質ならびにキレートを含有する切断基質を洗い落とし、次いでマイクロウェルを乾燥した。最後に、乾燥したマイクロウェルからの蛍光カウント数を、蛍光カウンターを使用して測定した。
【0093】
検出された蛍光カウント数を、トロンビンを含有しない対照標準サンプルと比較し、基準曲線を作成するために、対照標準(トロンビン非含有)と比較してシグナルの減少を算出した。
【0094】
図6に示す結果は、S1V6cとS1V9bの濃度を増大させると、シグナルの減少が大きくなるということを示している。このことは、S1V6c基質とS1V9b基質が共に、トロンビンに対して極めて有効な基質であるということを示している。S1V9bは、S1V6cと比較して、より低いトロンビン濃度ではシグナルの減少がより大きくなる。しかしながらそれでも、どちらの基質も極めて適切なトロンビン基質であり、したがってどちらの基質も、サンプル中のトロンビンのレベルを測定するのに使用することができる。
【0095】
実施例4
全血での測定に対しては、全血ヘマトクリット値の補正を施すことを条件として、実施例3における基準曲線を適用することができる。検体としての二人の健康な女性からの全血サンプルと血漿サンプルを、本発明に従ってトロンビンに関して試験した。
【0096】
一人の検体からの血漿サンプルの4回の個別の測定は、87.7%±0.5%という対照標準シグナルと比較して検出シグナルの減少を示した。もう一人の検体に対しては、減少は91.5%±0.1%であった。
【0097】
全血サンプルの場合も、ほぼ同等の結果が得られた(それぞれ、一人の検体に対しては80.7%±0.9%、もう一人の検体に対しては86.3%±0.2%)。
これらの結果は、本発明の基質とアッセイが全血サンプルと血漿サンプル中のトロンビンを測定できること、および本発明の基質とアッセイの不変性を示している。
【符号の説明】
【0098】
1 基質
1a 結合対の第1のパートナー
1b トリペプチドまたはテトラペプチド
1c リンカー
1d ルミネッセンスキレート
2 結合対の第2のパートナー
3 固定化マトリックス
4 トロンビンを含有するテストサンプル
5 トロンビン非含有のテストサンプル
A 高レベルのトロンビンを含有するテストサンプル
B 低レベルのトロンビンを含有するテストサンプル
C トロンビン非含有のテストサンプル
【特許請求の範囲】
【請求項1】
トロンビンの基質であって、
一般式:
A−X−Z−A’
[式中、
AとA’の一方が、ルミネッセンスキレートを含み、そして
AとA’の他方が、場合によってはスペーサーを含みペプチド結合を介して基質の残りの部分に連結されている、結合対の第1のパートナーを含み;
Xは、X’−Phe−Aze−Arg、X’−Phe−Pip−Arg、およびX’−Phe−Pro−Argから選ばれるトリ−ペプチドもしくはテトラ−ペプチドを形成し、
ここで、X’は、存在しないか又はLys、Ahx、Ile、およびValから選ばれ;
Zは、NH−R−Z’であり、
ここで、Rは、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、C1−6アルキレンオキシ−カルボニル、C1−6アルキレン−アリーレン、C1−6アルキレンオキシ−アリーレン、C1−6アルキレン−NH、C1−6アルキレンオキシ−NH、C1−6アルキレン−NHCO、C1−6アルキレンオキシ−NHCO、C1−6アルキレン−CONH、C1−6アルキレンオキシ−CONH、C1−6アルキレン−COS、C1−6アルキレンオキシ−COS、C1−6アルキレン−CONH−C1−6アルキレン−アリーレン、アリーレン、アリーレン−C1−6アルキレン、アリーレン−C1−6アルキレンオキシ、R1a−アリーレン−(NHCO−R2)b、R3c−アリーレン−(CONH−R4)d、(R5−CONH)e−アリーレン−R6f、および(R7−NHCO)g−アリーレン−R8hからなる群から選ばれ、ここで、それぞれの場合における各R1、R2、R3、R4、R5、R6、R7、およびR8は、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、アリーレン、またはアリーレン−C1−6アルキレンから独立して選ばれ、a、b、c、d、e、f、g、およびhのそれぞれが、0〜6の整数から独立して選ばれ、
ここで、アリーレンは、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、もしくはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、もしくはトリ置換されてもよいフェニレン、ビフェニレン、またはナフチレンであって、
Z’は、N、S、およびカルボニルのうちの1つを含み、
ここで、Z’がNを含むとき、Z’は、チオウレア(−NH−CS−NH−)、アミノアセトアミド(−NH−CO−CH2−NH−)、アミド(−NH−CO−)、メチルアミド(−NCH3−CO−)、または置換−トリアジン−ジアミン(−NH−(R9C3N3)−NH−)から選択され、
Z’がSを含むとき、Z’は、チオエーテル(−S−)、チオアセトアミド(−S−CH2−CO−NH−)、ジスルフィド(−S−S−)、(−S−CO−CH2−NH−)、または(−S−(R9C3N3)−NH−)から選択され、あるいは
Z’がカルボニルを含むとき、Z’は、アミド(−CO−NH−、−CO−NCH3−)またはエステル(−CO−O−)から選ばれ、
ここで、R9は、水素、ハロゲン、C1−6アルキル、C1−6チオアルキル、C1−6アルコキシ、C1−6チオアルコキシ、アリールオキシ、およびアミノからなる群から選ばれ、アルキル基、チオアルキル基、アルコキシ基、チオアルコキシ基、またはアリールオキシ基は、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、またはトリ置換されてもよく、アミノ基は、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換またはジ置換されてもよい]
を有する、上記基質。
【請求項2】
Xが、D−Phe−L−2−Aze−L−ArgまたはD−Phe−L−2−Pip−L−Argである、請求項1に記載の基質。
【請求項3】
Z’がNであり、Rがアリーレン、C1−6アルキレン−アリーレン、またはR1a−アリーレン−(NHCO−R2)bであって、aとbが0、1、または2である、請求項1または2に記載の基質。
【請求項4】
前記ルミネッセンスキレートが、蛍光ランタニドキレートである、請求項1〜3のいずれかに記載の基質。
【請求項5】
前記ランタニドキレートが、
【化1】

と
【化2】

から選ばれる、請求項4に記載の基質。
【請求項6】
前記結合対の第1のパートナーが、ビオチン/ストレプトアビジン、ビオチン/アビジン、ビオチン/ビオチン受容体ペプチド、およびストレプトアビジン誘導体/受容体ペプチドから選ばれる結合対のパートナーである、請求項1〜5のいずれかに記載の基質。
【請求項7】
前記結合対の第1のパートナーが、式NH−R10−CONH−R11−CO−(NH−R12−NH)i[式中、R10、R11、およびR12のそれぞれは、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、アリーレン、またはアリーレン−C1−6アルキレンから独立して選ばれ、アリーレンは、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、もしくはトリ置換されてもよいフェニレン、ビフェニレン、またはナフチレンであり、iは0〜6の整数である]のスペーサー、あるいはW−merペプチドであって、Wが1〜40の整数であるスペーサーを介して基質の残部に連結されることを特徴とする、請求項1〜6のいずれかに記載の基質。
【請求項8】
R10、R11、およびR12が、同一もしくは異なった、直鎖C1−6アルキレン、アリーレン、またはアリーレン−C1−6アルキレンであり、iが0または1である、請求項7に記載の基質。
【請求項9】
S1V6(a、b、c)、S1V8、S1V9(a、b)、およびS1V12(a、b、c):
【化3】

【化4】

【化5】

【化6】

【化7】

【化8】

【化9】

【化10】

【化11】

から選ばれる、請求項1〜8のいずれかに記載の基質。
【請求項10】
テストサンプル中の生体活性トロンビンのレベルを測定するための1ステップアッセイ法であって、
a)請求項1〜9のいずれかに記載の基質、アクチベータ、およびテストサンプルを、連続して、同時に、または実質的に同時に混合する工程;
b)得られる反応混合物を、トロンビン切断されたキレート含有基質フラグメントを放出するようインキュベートし、結合パートナー含有基質フラグメントとトロンビン切断されない非損傷基質を固定化マトリックス上に固定化する工程;
c)固定化されずトロンビン切断されたキレート含有基質フラグメントと、固定化されずトロンビン切断されない基質が存在する場合は、これらを洗い落とす工程;
d)固定化された非損傷基質からのルミネッセンス発光のレベルを測定する工程;および
e)トロンビン非含有の標準サンプルと比較したときの、ルミネッセンス発光の強度の減少から、トロンビン活性を算出する工程;
を含む、上記アッセイ法。
【請求項11】
前記サンプルとアクチベータの添加が、固定化マトリックスへの基質の添加と同時に、もしくは実質的に同時に行われる、請求項10に記載のアッセイ法。
【請求項12】
前記サンプルとアクチベータの添加が、固定化マトリックスへの基質の固定化後に行われる、請求項10に記載のアッセイ法。
【請求項13】
テストサンプル中の生体活性トロンビンのレベルを測定するための2ステップアッセイ法であって、
a)テストサンプルとアクチベータを、液相中にて、請求項1〜9のいずれかに記載の基質に加える工程;
b)得られる反応混合物を、トロンビン切断されたキレート含有基質フラグメントを放出するようインキュベートする工程;
c)反応混合物を固定化マトリックスに加える工程;
d)固定化されずトロンビン切断されたキレート含有基質フラグメントと、固定化されずトロンビン切断されない基質が存在する場合は、これらを洗い落とす工程;
e)固定化された非損傷基質からのルミネッセンス発光のレベルを測定する工程;および
f)トロンビン非含有の標準サンプルと比較したときの、ルミネッセンス発光の強度の減少から、トロンビン活性を算出する工程;
を含む、上記アッセイ法。
【請求項14】
前記アクチベータが、トロンボプラスチン試薬、部分トロンボプラスチン試薬、およびコンタクトアクチベータからなる群から選ばれる、請求項10〜13のいずれかに記載のアッセイ法。
【請求項15】
前記部分トロンボプラスチン試薬がリン脂質を含み、前記コンタクトアクチベータが、シリカ、カオリン、セライト、エラグ酸を含む、請求項14に記載のアッセイ法。
【請求項16】
サンプル中の生体活性トロンビンのレベルを測定するための、請求項1〜9のいずれかに記載の基質の使用。
【請求項17】
a)請求項1〜9のいずれかに記載の発光基質;および
b)固体の固定化マトリックス;
を含む、サンプル中の生体活性トロンビンのレベルを測定するためのテストキット。
【請求項18】
酵素の基質であって、
一般式:
A−X−Z−A’
[式中、
AとA’の一方が、ルミネッセンスキレートを含み、そして
AとA’の他方が、場合によってはスペーサーを含みペプチド結合を介して基質の残りの部分に連結されている、結合対の第1のパートナーを含み;
Xは、トリ−ペプチドもしくはテトラ−ペプチドを形成し;
Zは、NH−R−Z’であり、
ここで、Rは、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、C1−6アルキレンオキシ−カルボニル、C1−6アルキレン−アリーレン、C1−6アルキレンオキシ−アリーレン、C1−6アルキレン−NH、C1−6アルキレンオキシ−NH、C1−6アルキレン−NHCO、C1−6アルキレンオキシ−NHCO、C1−6アルキレン−CONH、C1−6アルキレンオキシ−CONH、C1−6アルキレン−COS、C1−6アルキレンオキシ−COS、C1−6アルキレン−CONH−C1−6アルキレン−アリーレン、アリーレン、アリーレン−C1−6アルキレン、アリーレン−C1−6アルキレンオキシ、R1a−アリーレン−(NHCO−R2)b、R3c−アリーレン−(CONH−R4)d、(R5−CONH)e−アリーレン−R6f、および(R7−NHCO)g−アリーレン−R8hからなる群から選ばれ、ここでそれぞれの場合における各R1、R2、R3、R4、R5、R6、R7、およびR8は、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、アリーレン、またはアリーレン−C1−6アルキレンから独立して選ばれ、a、b、c、d、e、f、g、およびhのそれぞれが、0〜6の整数から独立して選ばれ、
ここで、アリーレンは、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、もしくはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、もしくはトリ置換されてもよいフェニレン、ビフェニレン、またはナフチレンであって、
Z’は、N、S、およびカルボニルのうちの1つを含み、
ここで、Z’がNを含むとき、Z’は、チオウレア(−NH−CS−NH−)、アミノアセトアミド(−NH−CO−CH2−NH−)、アミド(−NH−CO−)、メチルアミド(−NCH3−CO−)、または置換−トリアジン−ジアミン(−NH−(R9C3N3)−NH−)から選択され、Z’がSを含むとき、Z’は、チオエーテル(−S−)、チオアセトアミド(−S−CH2−CO−NH−)、ジスルフィド(−S−S−)、(−S−CO−CH2−NH−)、または(−S−(R9C3N3)−NH−)から選択され、あるいは
Z’がカルボニルを含むとき、Z’は、アミド(−CO−NH−、−CO−NCH3−)またはエステル(−CO−O−)から選ばれ、
ここで、R9は、水素、ハロゲン、C1−6アルキル、C1−6チオアルキル、C1−6アルコキシ、C1−6チオアルコキシ、アリールオキシ、およびアミノからなる群から選ばれ、アルキル基、チオアルキル基、アルコキシ基、チオアルコキシ基、またはアリールオキシ基は、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、またはトリ置換されてもよく、アミノ基は、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換またはジ置換されてもよい]
を有する、上記基質。
【請求項1】
トロンビンの基質であって、
一般式:
A−X−Z−A’
[式中、
AとA’の一方が、ルミネッセンスキレートを含み、そして
AとA’の他方が、場合によってはスペーサーを含みペプチド結合を介して基質の残りの部分に連結されている、結合対の第1のパートナーを含み;
Xは、X’−Phe−Aze−Arg、X’−Phe−Pip−Arg、およびX’−Phe−Pro−Argから選ばれるトリ−ペプチドもしくはテトラ−ペプチドを形成し、
ここで、X’は、存在しないか又はLys、Ahx、Ile、およびValから選ばれ;
Zは、NH−R−Z’であり、
ここで、Rは、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、C1−6アルキレンオキシ−カルボニル、C1−6アルキレン−アリーレン、C1−6アルキレンオキシ−アリーレン、C1−6アルキレン−NH、C1−6アルキレンオキシ−NH、C1−6アルキレン−NHCO、C1−6アルキレンオキシ−NHCO、C1−6アルキレン−CONH、C1−6アルキレンオキシ−CONH、C1−6アルキレン−COS、C1−6アルキレンオキシ−COS、C1−6アルキレン−CONH−C1−6アルキレン−アリーレン、アリーレン、アリーレン−C1−6アルキレン、アリーレン−C1−6アルキレンオキシ、R1a−アリーレン−(NHCO−R2)b、R3c−アリーレン−(CONH−R4)d、(R5−CONH)e−アリーレン−R6f、および(R7−NHCO)g−アリーレン−R8hからなる群から選ばれ、ここで、それぞれの場合における各R1、R2、R3、R4、R5、R6、R7、およびR8は、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、アリーレン、またはアリーレン−C1−6アルキレンから独立して選ばれ、a、b、c、d、e、f、g、およびhのそれぞれが、0〜6の整数から独立して選ばれ、
ここで、アリーレンは、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、もしくはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、もしくはトリ置換されてもよいフェニレン、ビフェニレン、またはナフチレンであって、
Z’は、N、S、およびカルボニルのうちの1つを含み、
ここで、Z’がNを含むとき、Z’は、チオウレア(−NH−CS−NH−)、アミノアセトアミド(−NH−CO−CH2−NH−)、アミド(−NH−CO−)、メチルアミド(−NCH3−CO−)、または置換−トリアジン−ジアミン(−NH−(R9C3N3)−NH−)から選択され、
Z’がSを含むとき、Z’は、チオエーテル(−S−)、チオアセトアミド(−S−CH2−CO−NH−)、ジスルフィド(−S−S−)、(−S−CO−CH2−NH−)、または(−S−(R9C3N3)−NH−)から選択され、あるいは
Z’がカルボニルを含むとき、Z’は、アミド(−CO−NH−、−CO−NCH3−)またはエステル(−CO−O−)から選ばれ、
ここで、R9は、水素、ハロゲン、C1−6アルキル、C1−6チオアルキル、C1−6アルコキシ、C1−6チオアルコキシ、アリールオキシ、およびアミノからなる群から選ばれ、アルキル基、チオアルキル基、アルコキシ基、チオアルコキシ基、またはアリールオキシ基は、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、またはトリ置換されてもよく、アミノ基は、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換またはジ置換されてもよい]
を有する、上記基質。
【請求項2】
Xが、D−Phe−L−2−Aze−L−ArgまたはD−Phe−L−2−Pip−L−Argである、請求項1に記載の基質。
【請求項3】
Z’がNであり、Rがアリーレン、C1−6アルキレン−アリーレン、またはR1a−アリーレン−(NHCO−R2)bであって、aとbが0、1、または2である、請求項1または2に記載の基質。
【請求項4】
前記ルミネッセンスキレートが、蛍光ランタニドキレートである、請求項1〜3のいずれかに記載の基質。
【請求項5】
前記ランタニドキレートが、
【化1】

と
【化2】

から選ばれる、請求項4に記載の基質。
【請求項6】
前記結合対の第1のパートナーが、ビオチン/ストレプトアビジン、ビオチン/アビジン、ビオチン/ビオチン受容体ペプチド、およびストレプトアビジン誘導体/受容体ペプチドから選ばれる結合対のパートナーである、請求項1〜5のいずれかに記載の基質。
【請求項7】
前記結合対の第1のパートナーが、式NH−R10−CONH−R11−CO−(NH−R12−NH)i[式中、R10、R11、およびR12のそれぞれは、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、アリーレン、またはアリーレン−C1−6アルキレンから独立して選ばれ、アリーレンは、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、もしくはトリ置換されてもよいフェニレン、ビフェニレン、またはナフチレンであり、iは0〜6の整数である]のスペーサー、あるいはW−merペプチドであって、Wが1〜40の整数であるスペーサーを介して基質の残部に連結されることを特徴とする、請求項1〜6のいずれかに記載の基質。
【請求項8】
R10、R11、およびR12が、同一もしくは異なった、直鎖C1−6アルキレン、アリーレン、またはアリーレン−C1−6アルキレンであり、iが0または1である、請求項7に記載の基質。
【請求項9】
S1V6(a、b、c)、S1V8、S1V9(a、b)、およびS1V12(a、b、c):
【化3】

【化4】

【化5】

【化6】

【化7】

【化8】

【化9】

【化10】

【化11】

から選ばれる、請求項1〜8のいずれかに記載の基質。
【請求項10】
テストサンプル中の生体活性トロンビンのレベルを測定するための1ステップアッセイ法であって、
a)請求項1〜9のいずれかに記載の基質、アクチベータ、およびテストサンプルを、連続して、同時に、または実質的に同時に混合する工程;
b)得られる反応混合物を、トロンビン切断されたキレート含有基質フラグメントを放出するようインキュベートし、結合パートナー含有基質フラグメントとトロンビン切断されない非損傷基質を固定化マトリックス上に固定化する工程;
c)固定化されずトロンビン切断されたキレート含有基質フラグメントと、固定化されずトロンビン切断されない基質が存在する場合は、これらを洗い落とす工程;
d)固定化された非損傷基質からのルミネッセンス発光のレベルを測定する工程;および
e)トロンビン非含有の標準サンプルと比較したときの、ルミネッセンス発光の強度の減少から、トロンビン活性を算出する工程;
を含む、上記アッセイ法。
【請求項11】
前記サンプルとアクチベータの添加が、固定化マトリックスへの基質の添加と同時に、もしくは実質的に同時に行われる、請求項10に記載のアッセイ法。
【請求項12】
前記サンプルとアクチベータの添加が、固定化マトリックスへの基質の固定化後に行われる、請求項10に記載のアッセイ法。
【請求項13】
テストサンプル中の生体活性トロンビンのレベルを測定するための2ステップアッセイ法であって、
a)テストサンプルとアクチベータを、液相中にて、請求項1〜9のいずれかに記載の基質に加える工程;
b)得られる反応混合物を、トロンビン切断されたキレート含有基質フラグメントを放出するようインキュベートする工程;
c)反応混合物を固定化マトリックスに加える工程;
d)固定化されずトロンビン切断されたキレート含有基質フラグメントと、固定化されずトロンビン切断されない基質が存在する場合は、これらを洗い落とす工程;
e)固定化された非損傷基質からのルミネッセンス発光のレベルを測定する工程;および
f)トロンビン非含有の標準サンプルと比較したときの、ルミネッセンス発光の強度の減少から、トロンビン活性を算出する工程;
を含む、上記アッセイ法。
【請求項14】
前記アクチベータが、トロンボプラスチン試薬、部分トロンボプラスチン試薬、およびコンタクトアクチベータからなる群から選ばれる、請求項10〜13のいずれかに記載のアッセイ法。
【請求項15】
前記部分トロンボプラスチン試薬がリン脂質を含み、前記コンタクトアクチベータが、シリカ、カオリン、セライト、エラグ酸を含む、請求項14に記載のアッセイ法。
【請求項16】
サンプル中の生体活性トロンビンのレベルを測定するための、請求項1〜9のいずれかに記載の基質の使用。
【請求項17】
a)請求項1〜9のいずれかに記載の発光基質;および
b)固体の固定化マトリックス;
を含む、サンプル中の生体活性トロンビンのレベルを測定するためのテストキット。
【請求項18】
酵素の基質であって、
一般式:
A−X−Z−A’
[式中、
AとA’の一方が、ルミネッセンスキレートを含み、そして
AとA’の他方が、場合によってはスペーサーを含みペプチド結合を介して基質の残りの部分に連結されている、結合対の第1のパートナーを含み;
Xは、トリ−ペプチドもしくはテトラ−ペプチドを形成し;
Zは、NH−R−Z’であり、
ここで、Rは、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、C1−6アルキレンオキシ−カルボニル、C1−6アルキレン−アリーレン、C1−6アルキレンオキシ−アリーレン、C1−6アルキレン−NH、C1−6アルキレンオキシ−NH、C1−6アルキレン−NHCO、C1−6アルキレンオキシ−NHCO、C1−6アルキレン−CONH、C1−6アルキレンオキシ−CONH、C1−6アルキレン−COS、C1−6アルキレンオキシ−COS、C1−6アルキレン−CONH−C1−6アルキレン−アリーレン、アリーレン、アリーレン−C1−6アルキレン、アリーレン−C1−6アルキレンオキシ、R1a−アリーレン−(NHCO−R2)b、R3c−アリーレン−(CONH−R4)d、(R5−CONH)e−アリーレン−R6f、および(R7−NHCO)g−アリーレン−R8hからなる群から選ばれ、ここでそれぞれの場合における各R1、R2、R3、R4、R5、R6、R7、およびR8は、C1−6アルキレン、C1−6アルキレンオキシ、C1−6チオアルキレン、C1−6チオアルキレンオキシ、カルボニル−C1−6アルキレン、カルボニル−C1−6アルキレンオキシ、C1−6アルキレン−カルボニル、アリーレン、またはアリーレン−C1−6アルキレンから独立して選ばれ、a、b、c、d、e、f、g、およびhのそれぞれが、0〜6の整数から独立して選ばれ、
ここで、アリーレンは、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、もしくはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、もしくはトリ置換されてもよいフェニレン、ビフェニレン、またはナフチレンであって、
Z’は、N、S、およびカルボニルのうちの1つを含み、
ここで、Z’がNを含むとき、Z’は、チオウレア(−NH−CS−NH−)、アミノアセトアミド(−NH−CO−CH2−NH−)、アミド(−NH−CO−)、メチルアミド(−NCH3−CO−)、または置換−トリアジン−ジアミン(−NH−(R9C3N3)−NH−)から選択され、Z’がSを含むとき、Z’は、チオエーテル(−S−)、チオアセトアミド(−S−CH2−CO−NH−)、ジスルフィド(−S−S−)、(−S−CO−CH2−NH−)、または(−S−(R9C3N3)−NH−)から選択され、あるいは
Z’がカルボニルを含むとき、Z’は、アミド(−CO−NH−、−CO−NCH3−)またはエステル(−CO−O−)から選ばれ、
ここで、R9は、水素、ハロゲン、C1−6アルキル、C1−6チオアルキル、C1−6アルコキシ、C1−6チオアルコキシ、アリールオキシ、およびアミノからなる群から選ばれ、アルキル基、チオアルキル基、アルコキシ基、チオアルコキシ基、またはアリールオキシ基は、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換、ジ置換、またはトリ置換されてもよく、アミノ基は、ハロゲン、OH、SH、CN、NO2、C1−6アルキル、C1−6アルコキシ、またはC1−6アルコキシカルボニルから選ばれる1つ以上の置換基でモノ置換またはジ置換されてもよい]
を有する、上記基質。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2011−527889(P2011−527889A)
【公表日】平成23年11月10日(2011.11.10)
【国際特許分類】
【出願番号】特願2011−517751(P2011−517751)
【出願日】平成21年7月10日(2009.7.10)
【国際出願番号】PCT/DK2009/000169
【国際公開番号】WO2010/006605
【国際公開日】平成22年1月21日(2010.1.21)
【出願人】(500554782)ラジオメーター・メディカル・アー・ペー・エス (20)
【Fターム(参考)】
【公表日】平成23年11月10日(2011.11.10)
【国際特許分類】
【出願日】平成21年7月10日(2009.7.10)
【国際出願番号】PCT/DK2009/000169
【国際公開番号】WO2010/006605
【国際公開日】平成22年1月21日(2010.1.21)
【出願人】(500554782)ラジオメーター・メディカル・アー・ペー・エス (20)
【Fターム(参考)】
[ Back to top ]

