ドコサヘキサエン酸およびドコサヘキサエン酸を含む化合物
【課題】DHA含有食用単細胞オイルを提供する。
【解決手段】渦鞭毛虫、好ましくはクリプテコディニウムコニーを供給源とすることにより、トリグリセリドを含む食用単細胞オイルであって、DHAがオイルの少なくとも20%を占める食用単細胞オイル、より好ましくは、少なくとも70%のトリグリセリドを含み、DHAがトリグリセリドの少なくとも30%を占める、食用単細胞オイルが提供される。
【解決手段】渦鞭毛虫、好ましくはクリプテコディニウムコニーを供給源とすることにより、トリグリセリドを含む食用単細胞オイルであって、DHAがオイルの少なくとも20%を占める食用単細胞オイル、より好ましくは、少なくとも70%のトリグリセリドを含み、DHAがトリグリセリドの少なくとも30%を占める、食用単細胞オイルが提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はドコサへキサエン酸(DHA)を含有する食用単細胞オイルに関する。本発明は、また、本オイルを含有する製品に関する。
【背景技術】
【0002】
DHAはオメガ−3−脂肪酸で脳灰白質中の最も多量の長鎖多不飽和脂肪酸(PUFA)である。オメガ−3−脂肪酸は一般に冠状動脈心疾患の発現低下に有益であることが知られている(非特許文献1)。しかし、オメガ−3−脂肪酸の代謝はよく知られていない。従って、正確な臨床用量と有効性は未知である。
【0003】
冷水海魚はDHAを含むオメガ−3−脂肪酸の供給源であることが知られている。特許文献1はC22オメガ−3−脂肪酸供給源として大型ニシン(menhaden)やニシン(herrinng)等から採れる魚油の利用を開示している。実際、魚油はオメガ−3−脂肪酸の主な商品化用供給源である。しかし、魚油はPCB等の環境汚染物質の混入により人間の消費には使用できないことが多い。
【0004】
食品用にDHA含有魚油を回収することに関しては問題もある。このようなオイルには脂肪酸の酸化生成物に関連する魚臭といやな味があることが多い。この過酸化物の味と毒性が本オイルのベビーフードや乳幼児用調合乳等の食用組成物への使用を満足できないものにしている。
【0005】
海中微生物もDHAを含有することが知られている。特に、種々の渦(双)鞭毛虫類がDHAを含有することが知られている。Harringtonらは、8つの光合成、および1つの有機栄養海中渦鞭毛虫の脂肪酸含有量を特性づけ、渦鞭毛虫がドコサヘキサエン酸の一次生産者群であり、この化合物の海中食物運鎖にかなりの量で寄与していると結論づけている(非特許文献2)。
【0006】
DHA含有の食用オイルを産生する渦鞭毛虫類の培養は成功していない。渦鞭毛虫類は概して非常に成長が遅く剪断力感受性が高い(非特許文献3)。従来技術は培養槽のごくわずかな振動でさえ培養物の成長を減じると開示している。しかし、商品化用産生では増殖を最大化するための適当な酸素添加反応を達成するためにはこのような振動が必要である。
【0007】
DHAは上述したように脳と網膜中の最も多量の長鎖PUFAであるので、乳幼児の脳と視覚の適正な発達に不可欠であると考えられている。哺乳類では食物中のリノール酸からDHAを生合成する代謝経路があるが、この経路は生物エネルギー学的に不利であり(非特許文献4)、哺乳類は魚類同様DHAのほとんどを食物から得ていると考えられている。乳幼児の場合、最も適当な供給源は母乳である。実際、DHAは母乳中最も多量のC20オメガ−3−PUFAである。しかし、一般にDHAは乳幼児用調合乳には含まれていない。特許文献1はオメガ−3−脂肪酸含有の乳幼児用調合乳を開示している。しかし、そこで利用されている脂肪酸は卵あるいは魚(Talapia)油から得たもので、前述した好ましくない特性がある。さらに、魚油は一般に他のオメガ−3−脂肪酸であるエイコサペンタエン酸(EPA)を含み、これは持続性抗凝血作用と乳幼児のアラキドン酸濃度抑制のため乳幼児用調合乳に望ましくない成分である。これは乳幼児の体重増加率の減少と関連がある(非特許文献5)。実際、母乳中EPA濃度は非常に低い(DHAの4分の1以下)。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】合衆国特許第 4,670,285号
【非特許文献】
【0009】
【非特許文献1】Lands,Fish and Human Health(1986)Academic Press
【非特許文献2】The Polyunsaturated Fatty Acids of Marine Dinoflagellates(海中渦鞭毛虫類の多不飽和脂肪酸)、J.Protozoal,17:213−219(1970)
【非特許文献3】Guillardら、Dinoflagellates,(1984),Academic Press
【非特許文献4】Crawford,P.A0CS.Short Course in Poly−unsaturated Fatty Acids and Eicosanoids,pp.270−295(1987)
【非特許文献5】Carlesonら、INFORM 1:306
【発明の概要】
【発明が解決しようとする課題】
【0010】
従って、本発明の1つの目的はDHA含有単細胞食用オイルを提供することである。本オイルは他の多不飽和脂肪酸(PUFA)を有意量、すなわち全脂肪酸量の約2%以上含まないことが好ましい。概して、本発明の目的は単細胞オイルを商品化可能な収率で産生することである。本オイルはここで「デザイナー」オイルとして特徴づけるが、抽出後に、乳幼児用調合乳、ベビーフード、栄養補助食品および医薬品に使用できる。
【0011】
加えて、オメガ−3−脂肪酸の代謝経路をさらによく理解することが望ましい。これについては同位体標識DHAが非常に有用と考えられる。しかし、今日まで十分量の同位体標識DHAを産生する方法は知られていない。従って、このような研究を行うに十分な量の同位体標識DHAを提供することも、本発明の目的である。
【課題を解決するための手段】
【0012】
本発明は微生物、特に渦鞭毛虫類の発酵槽での培養と、この微生物がDHAを高率で含有する単細胞オイルを有意量産生するよう誘導することを含む、前記オイルの回収に関する。ここで用いる「単細胞オイル」は単細胞有機体の脂質産生物をさす。本発明は、少なくとも約20重量%のDHAを含有する単細胞オイルを多量に産生できる変異有機体も含み、またDHA含有単細胞オイルも含む。
【0013】
本発明はDHA含有食用オイルを高水準で得る経済的な方法を提供する。加えて、本法は高細胞濃度の渦鞭毛虫の商品化用培養も可能にする。
本発明による方法で産生した食用オイルにはいやな味や魚臭がなく従来の供給源から得たDHA含有オイルによくみられる環境汚染物質も含まない。従って、本発明はさらに本発明のオイルを含有する食品も含む。
【図面の簡単な説明】
【0014】
【図1】図1は、種々の栄養物を添加したC.cohniiの経時的バイオマス累積のグラフである。
【図2】図2は、種々の栄養物を添加したC.cohniiの経時的バイオマス累積のグラフである。
【図3】図3は、種々の栄養物を添加したC.cohniiの経時的バイオマス累積のグラフである。
【発明を実施するための形態】
【0015】
本発明に従い、DHA含有単細胞オイル産生能のある微生物をこのような微生物の増殖を支持できる栄養液に入れ発酵槽で培養する。単細胞オイルはDHAを少なくとも約20重量パーセント含むことが望ましい。
【0016】
DHA含有食用単細胞オイル産生能のある微生物はすべて本発明に用いることができる。たとえば、光合成珪藻類を用いることができる。好ましい微生物はCrypthecodinium sp.を含む海中渦鞭毛虫類である。特に好ましいしものは Crypthecodinium cohniiであり、これは増殖に還元炭素源を要する偏性有機栄養生物である。C.cohniiが好ましい理由は、十分量(全PUFA量の約1%以上)存在するPUFAがDHAのみであるという脂肪酸プロフィールを有するからである。この有機体の標本は、MK8840と称し、Rockville,Maryland の American Type Culture Collection に寄託されており、受け入れ番号40750号である。ここで用いられる微生物、あるいは微生物の特異型には、野生株、変異株あるいは組換え型を含む。DHA含有オイルを高水準で産生する微生物はすべて本発明の範囲内と考えられる。本発明の特徴の1つは渦鞭毛虫類等の微生物の食用オイル産生能力の認識と、それに伴うこのようなオイルの信頼できる経済的な供給源の維持の問題の解決である。従って、野性型微生物とDHA含有単細胞オイルを産生するよう設計された組換え微生物は本発明の一面である。このような組換え微生物には、同じ基質で、同じ野性型微生物が産生する量と比べて、単細胞オイル中のDHA量が多くなるように、あるいは総オイル量が多くなるように、あるいはその両方を意図して設計されたものが含まれる。また、さらに費用効果のすぐれた基質を効率よく用いて匹適する野性型と同量のDHA含有単細胞オイルを産生するよう設計された微生物も含まれる。
【0017】
一般に、当該技術分野の専門家は C.cohnii が発酵槽内培養に適する有機体であると考えようとしなかった。従前の研究者は C.cohnii を首尾よく培養するには極めて複雑な栄養混合物が必要であると説明してきた。Goldら、Protozoal,13:255−257(1966);Guillard ら、in"Dinoflagellates",Academic Press(1984);Hendersonら、Phytochemistry 27:1679−1683(1988)。これに対して、本発明はグルコースと酵母エキスを含む簡単な培地でDHA産生微生物の培養をなしとげる。これらの成分を海水等の溶液に用いて経済的に有意な増殖速度と細胞濃度が得られる。たとえば、3〜5日の発酵期間で、C.cohnii細胞濃度は少なくとも溶液1lあたりバイオマス10gで、一般には20から約40g/lに達しうる。このような濃度はこれまで到達されえなかった。
【0018】
培養はすべての適当な発酵槽で行えるが、撹拌槽発酵槽(Stirred tank fermentor;STF)かエアリフト発酵槽(ALF)で有機体と増殖することが好ましく、いずれのタイプも当該技術分野専門家既知である。STFを選んだ場合は、Rushton型高効率タービンかピッチドブレードあるいはマリンインペラーを用いて撹拌する。撹拌と散布が微生物への酸素供給をくり返す。バイオマスの増加につれて、酸素要求量が増えるので、通常撹拌速度を上げる。翅端速度は約500cm/秒以下に、好ましくは約300cm/秒以下に保つことが望ましい。大きな翅端速度にも剪断をうけることなく耐えうる微生物株の選択は当該技術分野の範囲内である。このような株の使用は本発明に明らかに含まれる。
【0019】
上述したように、海水は栄養溶液として認容できる培養基である。海水は自然のものでも、濾過したものでも、人工的に混合したものでもよく、いずれも水道水で希釈して塩度を通常の1/2から1/4に減じたり、2倍に濃縮してもよい。好ましい例は、Instant Ocean(登録商標)(IO)ブランドの人工海水である。C.Cohniiは海水微生物であるが、塩度0でもいくらかの増殖が観察されている。低塩度でもよく増殖する変異体の使用は本発明に特に包含されている。微量元素を添加してもよく、これは低塩度で必要となることがある。しかし、このような微量元素は当該技術専門家既知であり概して海水や水道水中に存在する。選択した微生物が、C.cohnii等の有機栄養生物である場合は炭素源を添加する。海水培養基を発酵槽に入れた後、栄養分と微生物の種を加える前に培養基入り発酵槽を滅菌し冷却する。(栄養分を海水と一緒に滅菌してもよいが、この滅菌方法では有効グルコースの減損をきたすことがある。)栄養分と微生物は同時に加えても順々に加えてもよい。
【0020】
有効種濃度は当該技術専門家により決定される。STFを用いる場合、発酵開始時に1lあたり約0.05〜1.0g乾燥重量当量の添加が好ましい。これは約106細胞/mlである。従って30lの発酵槽では、生存能力のある細胞を1lあたり20g乾燥重量の濃度で含む種付け培養基1〜3lを添加する。
【0021】
酸素濃度は少なくとも空気飽和濃度の約10%のD.0.に維持することが好ましい。DHA生合成には酸素が必要であるので、DHAの収率を上げるには空気飽和濃度の約10〜50%のD.0.濃度が必要である。翅端撹拌速度150〜200cm/秒と給気速度1VVM(1分あたりの空気体積/発酵槽体積)の組み合わせによりバイオマス濃度約25g乾燥重量/培養物1lで約20〜30%のD.0.濃度が提供できる。細胞濃度が高ければより高いD.0.濃度が必要となるが、これは02散布による給気速度の増加が発酵槽の空気圧の上昇で達成できる。
【0022】
認容できる炭素源は当該技術分野専門家既知である。たとえば、炭素はグルコースの形で C.cohniiに供給できる。他の有機栄養生物は他の還元炭素源を用いることができるが、これは当該技術専門家により容易に決定され、独立栄養生物は二酸化炭素を利用する。C.cohniiは他のもっと複雑な還元炭素源でも増殖する。一般には、グルコース約10〜50g/lで発酵を開始する。発酵中必要に応じてグルコースを追加する。あるいは、グルコース約50〜150g/l、好ましくは50〜100gを最初に加えて、以降の追加回数を少なくすることもできる。他の有機体に供給する炭素源の量は当該技術分野専門家により容易に決定される。
【0023】
還元炭素源に加えて、酵母エキス(YE)等の窒素源を培養基に供給する。市販の酵母エキスが認容される。たとえば、DIFCOやMARCORブランドの酵母エキスを使用できる。酵母エキスは微量元素も含む有機窒素源である。他の有機窒素源は当該技術専門家により容易に決定できる。しかし、このような化合物は概して酵母エキスより高価である。尿素や硝酸塩で増殖可能な変異体の使用は本発明の範囲内である。一般にYE約6〜12g/lで発酵を開始する。必要に応じてさらにYEを追加してもよい。一般的な発酵は全工程でYE約8〜15g/lを要する。従って、その量のYEを最初に加えて以降の追加の必要を減らすことができる。正確な量は当該技術専門家により決定できる。一般に、グルコースとYEの比は約2:1から約15:1である。
【0024】
培養はどのような生命維持温度でも行える。一般にC.cohniiは約15℃から34℃の範囲で増殖する。温度を約20〜30℃に保つことが好ましい。高温で増殖する株は倍増時間が短く発酵時間を減じられるので好ましい。他の微生物の適正温度範囲は当該技術専門家によって容易に決定される。
【0025】
培養は広いpH範囲、一般にはpH約5.0 から9.0で遂行される。増殖期には約6.0から約7.0のpH範囲を用いることが好ましい。接種前にはKOHやNaOH等の塩基を用いて培養基pHを調整する。発酵の後期には、培養基はアルカリ性になる傾向がある。必要であれば、増殖期中のアルカリ性を修正するために無機酸のpH調節剤を用いてもよい。渦鞭毛虫での単細胞オイルの産生は定常期の賦課(たとえば窒素枯渇やpH上昇)によって誘発される。YE欠乏は、利用できるグルコースが残存しているのに培養基がYEを使い果すようにYE供給量を制限することに起因する。本発明は、単細胞オイルの効率のよい産生を促進するものが、炭素源の窒素源に対する比であることを認めている。例としてグルコースとYEを用いると、好ましい炭素源と窒素源の比は、YE1に対してグルコース約10〜15である。他の炭素源と窒素源における同様の比は当該技術専門家により算出できる。
【0026】
オイル産生誘発後、培養物をさらに24時間増殖させる。この油合成期間中、DHA含有単細胞オイルが合成され可視のオイル滴が現れる。当該技術専門家は、加えたYE量に基づく細胞バイオマスの期待値に達するに要する発酵時間を容易に算出できる。その時間が経過したら、培養物をさらに24時間増殖させてから採収する。一般に、C.cohniiを単細胞オイルを産生するに足る時間、通常約60分から約90分、培養するが、この時間は変動する。
【0027】
野生型 C.cohniiを用いて、結果として生じるバイオマスの約15〜30%が抽出可能なオイルから成る。株の選択によりこの比率を上げることができ、このような選択は本発明の範囲内である。本オイルは、一般に次の脂肪酸組成を有するトリグリセリドを約70%以上含むことが好ましい。
15〜20%ミリスチン酸(C14:0)
20〜25%パルミチン酸(C16:0)
10〜15%オレイン酸(C18:0)
30〜40%DHA(C22:6)
0〜10%その他(ホスファチジルコリン等の極性脂質を含む他のオイル成分もDHAに含まれることがある)
粗オイルの特性は黄澄色で室温で液体である。本オイルはDHAを少なくとも約20重量%含むことが望ましく、約35重量%以上含むことが最も望ましい。
【0028】
有機体は当該技術分野専門家既知の従来法である遠心分離,凝集,濾過等で採収し、すぐに加工処理するが、後の加工処理用に乾燥させる。いずれの場合も、オイルは有効量の溶媒で容易に抽出できる。適当な溶媒は当該技術専門家により決定される。しかし、好ましい溶媒には精製へキサンと臨界超過CO2等の臨界超過液体が含まれる。
【0029】
臨界超過液体を用いた抽出法は当該技術分野専門家既知で、McHuglらの Supercritical F1uid Extraction,Butterworth,1986.に記載されている。抽出溶媒がへキサンである場合は、乾燥バイオマスに対するへキサンの適当な割合は、乾燥バイオマス1kgあたりへキサン約4lである。へキサンとバイオマスを撹拌反応槽に入れ約20〜50℃の温度で約2時間混合することが好ましい。混合後、バイオマスを濾過しオイルを含むへキサンから分離する。あるいは、湿性バイオマスペースト(固形分30〜35%)をエタノール、イソプロパノールあるいはへキサン/イソプロパノール混合物等のより極性の高い溶媒で直接抽出できる。残澄バイオマス、すなわち C.cohnii等の微生物の単細胞食用オイル抽出後のバイオマスは動物の飼料として使用できるがこれは約35〜40%のタンパク質、8〜10%の灰分、45〜50%の炭水化物を含む。タンパク質含有率が高くDHA濃度も高いことから、バイオマスペースト全体を水産養殖(例、エビ,カキ,魚)飼料として使用できる。
【0030】
その後、当該技術分野専門家既知の蒸留方法でオイルから溶媒を除去する。従来の油料種子加工装置が濾過、分離および蒸留の遂行に適している。個々の適用において、当該技術分野専門家既知の追加加工行程が必要であれば行ってよい。この行程も従来の植物性オイル加工に含まれるものと類似しており、DHAに富む極性脂質分画の分離を可能にする。
【0031】
本発明の方法により、DHAの代謝経路の研究を可能にする量の標識DHAを含む同位体標識単細胞オイルを簡単に得ることができる。還元炭素基質として13C−グルコースか14C−グルコースを供給すると標識DHAが得られる。
【0032】
本発明は、本発明のDHA含有単細胞オイルを含む乳幼児用調合乳、ベビーフード、栄養補助食品等の食品も含む。当該技術専門家はDHA含有乳幼児用調合乳が望ましいと認めてはきたが、従来技術の乳幼児用調合乳は魚油からとったDHAを含んでおり、それに付随するいやな味と特殊感覚器に印象を与える特性があった。さらに、乳幼児用調合乳に魚油を添加すると、抗凝血作用がありアラキドン酸生合成の減少におそらく関与しているオメガ−3−脂肪酸であるエイコサペンタエン酸(EPA)も添加される。このような作用は乳幼児用調合乳やベビーフードに望ましくなく、ここで記述した単細胞オイルには有意な量のEPAは含まれていない。本発明の単細胞オイルを含有する乳幼児用調合乳等の食品には魚油の持つ不快な特殊感覚器に印象を与える特性がない。従って食品は乳幼児にも成人にもより容易に認容される。本発明の乳幼児用調合乳は0.05重量%のDHA含有単細胞オイルを含むことが好ましい。さらに固形分の多い本発明のベビーフードは、約0.5重量%のDHA含有単細胞オイルを含むことが好ましい。いずれの場合でも、オイルが少なくとも約35%のDHAを含むことが最も好ましい。
【0033】
本発明はDHA含有単細胞オイルを含む医薬品を含む。本製品は少なくとも約35%のDHAを含むことが好ましい。このような医薬品の例としては乳幼児や成人への完全非経口栄養(TPN)の供給に適したものがある。さらに、単細胞オイルを含有する栄養補助食品も含まれる。このような栄養補助食品は前記オイルをカプセルに入れたゼラチンカプセル形態で妊婦や授乳中の婦人に適することが好ましい。これは特に菜食主義者で食事から十分量のDHAを摂れないような女性に適する。
【0034】
本発明はDHA含有単細胞オイルも含む。本単細胞オイルは少なくとも約20重量%のDHAを含むことが好ましい。本オイルは少なくとも約35重量%のDHAを含むことが最も好ましい。
本発明を全般的に記述してきたが、次に特定実施例を引用するがこれに限られるものではない。
【実施例】
【0035】
実施例1
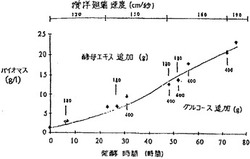
作業容量30lのSTFに濃度2分の1の人工海水を入れた。IO6lを水道水18lと化合した。培養基の入った発酵槽を滅菌し28℃まで冷却した。濃縮YE(455g/l)400ml、グルコースシロップ(400g/l)900mlおよび約2×107細胞/mlあるいはバイオマス20g/l(最終濃度は約7×106細胞/mlあるいはバイオマス約700mg/lになる)含有する種発酵槽からの接種物1lを培養基に加えた。撹拌は翅端速度120cm/秒に設定し給気は1VVM(30l/分)に設定した。30時間後にグルコースシロップ(900ml)を追加し、さらに次の42時間の間に4.2lを追加した。従って計6lのグルコースシロップを加えた。6時間後に濃縮YE溶液(400ml)を加え次の48時間の間にさらに1.2l追加し、計2.0l加えた。D.0.20%以上に維持するため24時間後に翅端速度を150cm/秒に、48時間後には160cm/秒に上げた。72時間後には翅端速度を200cm/秒に上げ、最後投入グルコースが細胞オイルに転化するに十分な時間をおいて培養物を増殖させた。培養条件を図1にグラフで示す。その後細胞球粒を保持して遠心分離により培養物を採収した。採収した細胞球粒を凍結乾燥して水分含有量約4%とした。へキサン(2.8l)を乾燥バイオマスに加えガラスケトルに入れ50℃で1.5時間撹拌した。回転蒸発装置を用いてへキサンを除去し、粗DHA含有オイル約175gを産生した。
【0036】
実施例2
作業容量350lのSTFにI.O.(登録商標)4.3kgと水道水230lを化合して作った濃度2分の1の人工海水培養基を入れた。培養基を入れた発酵槽を滅菌し28℃まで冷却した。濃縮YE(400g/l)6.8l、グルコースシロップ(400g/l)12.5lおよび種発酵槽(106 細胞/mlあるいはバイオマス濃度約1.3g/l)からの C.cohnii接種物30lを培養基に加えた。撹拌は翅端速度73cm/秒に設定し給気は1VVM(280l/分)に設定した。約44時間後にグルコースシロップ(12l)を追加し次の32時間の間にさらに43lを加えた。従って、計67.5lのグルコースシロップを加えた。グルコース添加と細胞増殖を図2にグラフで表す。
D.0.を20%以上に維持するため、44時間後に指枠麹端速度を175cm/秒に上げ、55時間後には225cm/秒に上げた。76時間後には翅端速度を150cm/秒に下げて、最終投入グルコースが細胞オイルに転化するに十分な時間をおいて培養物を増殖させた。その後培養物を採収した。採収した細胞を乾燥し水分含有量約4%とした。へキサンを乾燥バイオマスに加えてガラスケトルに入れ25℃で2時間撹拌した。回転蒸発装置を用いてへキサンを除去し、粗DHA含有オイル約700gを産生した。
【0037】
実施例3
作業容量30lのSTFにI.O.(登録商標)565gと水道水15lを化合して作った正規濃度の人工海水を入れた。培養基を入れた発酵槽を滅菌し28℃に冷却した。濃縮YE(400g/l)400ml、グルコースシロップ(400g/l)1.9l、および種発酵槽(106細胞/lあるいはバイオマス約20g/l)からの C.cohnii接種物1lを培養基に加えた。撹拌は翅端速度80cm/秒に設定し給気は1VVM(20l/分)に設定した。94時間後にグルコースシロップ(1.5l)を追加し116時間後にさらに1.1l追加した。従って、計4.5lのグルコースシロップを加えた。
D.0.を 20%以上に維持するため、52時間後に撹拌翅端速度を160cm/秒に上げた。66時間後に、定常期を導入したがこれを成しとげるために4N KOHでPHを7.0にスパイクし撹拌翅端速度は行程中さらには上げなかった。図3に示すように、最終投入グルコースが細胞オイルに転化するに十分な時間をおいて培養物を増殖させた。その後培養物を採収した。採収した細胞を乾燥し水分含有量約4%とした。乾燥バイオマスにへキサンを加えガラスケトルに入れ50℃で1.5時間撹拌した。回転蒸発装置を用いてへキサンを除去し、粗DHA含有オイル約65g産生した。
【技術分野】
【0001】
本発明はドコサへキサエン酸(DHA)を含有する食用単細胞オイルに関する。本発明は、また、本オイルを含有する製品に関する。
【背景技術】
【0002】
DHAはオメガ−3−脂肪酸で脳灰白質中の最も多量の長鎖多不飽和脂肪酸(PUFA)である。オメガ−3−脂肪酸は一般に冠状動脈心疾患の発現低下に有益であることが知られている(非特許文献1)。しかし、オメガ−3−脂肪酸の代謝はよく知られていない。従って、正確な臨床用量と有効性は未知である。
【0003】
冷水海魚はDHAを含むオメガ−3−脂肪酸の供給源であることが知られている。特許文献1はC22オメガ−3−脂肪酸供給源として大型ニシン(menhaden)やニシン(herrinng)等から採れる魚油の利用を開示している。実際、魚油はオメガ−3−脂肪酸の主な商品化用供給源である。しかし、魚油はPCB等の環境汚染物質の混入により人間の消費には使用できないことが多い。
【0004】
食品用にDHA含有魚油を回収することに関しては問題もある。このようなオイルには脂肪酸の酸化生成物に関連する魚臭といやな味があることが多い。この過酸化物の味と毒性が本オイルのベビーフードや乳幼児用調合乳等の食用組成物への使用を満足できないものにしている。
【0005】
海中微生物もDHAを含有することが知られている。特に、種々の渦(双)鞭毛虫類がDHAを含有することが知られている。Harringtonらは、8つの光合成、および1つの有機栄養海中渦鞭毛虫の脂肪酸含有量を特性づけ、渦鞭毛虫がドコサヘキサエン酸の一次生産者群であり、この化合物の海中食物運鎖にかなりの量で寄与していると結論づけている(非特許文献2)。
【0006】
DHA含有の食用オイルを産生する渦鞭毛虫類の培養は成功していない。渦鞭毛虫類は概して非常に成長が遅く剪断力感受性が高い(非特許文献3)。従来技術は培養槽のごくわずかな振動でさえ培養物の成長を減じると開示している。しかし、商品化用産生では増殖を最大化するための適当な酸素添加反応を達成するためにはこのような振動が必要である。
【0007】
DHAは上述したように脳と網膜中の最も多量の長鎖PUFAであるので、乳幼児の脳と視覚の適正な発達に不可欠であると考えられている。哺乳類では食物中のリノール酸からDHAを生合成する代謝経路があるが、この経路は生物エネルギー学的に不利であり(非特許文献4)、哺乳類は魚類同様DHAのほとんどを食物から得ていると考えられている。乳幼児の場合、最も適当な供給源は母乳である。実際、DHAは母乳中最も多量のC20オメガ−3−PUFAである。しかし、一般にDHAは乳幼児用調合乳には含まれていない。特許文献1はオメガ−3−脂肪酸含有の乳幼児用調合乳を開示している。しかし、そこで利用されている脂肪酸は卵あるいは魚(Talapia)油から得たもので、前述した好ましくない特性がある。さらに、魚油は一般に他のオメガ−3−脂肪酸であるエイコサペンタエン酸(EPA)を含み、これは持続性抗凝血作用と乳幼児のアラキドン酸濃度抑制のため乳幼児用調合乳に望ましくない成分である。これは乳幼児の体重増加率の減少と関連がある(非特許文献5)。実際、母乳中EPA濃度は非常に低い(DHAの4分の1以下)。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】合衆国特許第 4,670,285号
【非特許文献】
【0009】
【非特許文献1】Lands,Fish and Human Health(1986)Academic Press
【非特許文献2】The Polyunsaturated Fatty Acids of Marine Dinoflagellates(海中渦鞭毛虫類の多不飽和脂肪酸)、J.Protozoal,17:213−219(1970)
【非特許文献3】Guillardら、Dinoflagellates,(1984),Academic Press
【非特許文献4】Crawford,P.A0CS.Short Course in Poly−unsaturated Fatty Acids and Eicosanoids,pp.270−295(1987)
【非特許文献5】Carlesonら、INFORM 1:306
【発明の概要】
【発明が解決しようとする課題】
【0010】
従って、本発明の1つの目的はDHA含有単細胞食用オイルを提供することである。本オイルは他の多不飽和脂肪酸(PUFA)を有意量、すなわち全脂肪酸量の約2%以上含まないことが好ましい。概して、本発明の目的は単細胞オイルを商品化可能な収率で産生することである。本オイルはここで「デザイナー」オイルとして特徴づけるが、抽出後に、乳幼児用調合乳、ベビーフード、栄養補助食品および医薬品に使用できる。
【0011】
加えて、オメガ−3−脂肪酸の代謝経路をさらによく理解することが望ましい。これについては同位体標識DHAが非常に有用と考えられる。しかし、今日まで十分量の同位体標識DHAを産生する方法は知られていない。従って、このような研究を行うに十分な量の同位体標識DHAを提供することも、本発明の目的である。
【課題を解決するための手段】
【0012】
本発明は微生物、特に渦鞭毛虫類の発酵槽での培養と、この微生物がDHAを高率で含有する単細胞オイルを有意量産生するよう誘導することを含む、前記オイルの回収に関する。ここで用いる「単細胞オイル」は単細胞有機体の脂質産生物をさす。本発明は、少なくとも約20重量%のDHAを含有する単細胞オイルを多量に産生できる変異有機体も含み、またDHA含有単細胞オイルも含む。
【0013】
本発明はDHA含有食用オイルを高水準で得る経済的な方法を提供する。加えて、本法は高細胞濃度の渦鞭毛虫の商品化用培養も可能にする。
本発明による方法で産生した食用オイルにはいやな味や魚臭がなく従来の供給源から得たDHA含有オイルによくみられる環境汚染物質も含まない。従って、本発明はさらに本発明のオイルを含有する食品も含む。
【図面の簡単な説明】
【0014】
【図1】図1は、種々の栄養物を添加したC.cohniiの経時的バイオマス累積のグラフである。
【図2】図2は、種々の栄養物を添加したC.cohniiの経時的バイオマス累積のグラフである。
【図3】図3は、種々の栄養物を添加したC.cohniiの経時的バイオマス累積のグラフである。
【発明を実施するための形態】
【0015】
本発明に従い、DHA含有単細胞オイル産生能のある微生物をこのような微生物の増殖を支持できる栄養液に入れ発酵槽で培養する。単細胞オイルはDHAを少なくとも約20重量パーセント含むことが望ましい。
【0016】
DHA含有食用単細胞オイル産生能のある微生物はすべて本発明に用いることができる。たとえば、光合成珪藻類を用いることができる。好ましい微生物はCrypthecodinium sp.を含む海中渦鞭毛虫類である。特に好ましいしものは Crypthecodinium cohniiであり、これは増殖に還元炭素源を要する偏性有機栄養生物である。C.cohniiが好ましい理由は、十分量(全PUFA量の約1%以上)存在するPUFAがDHAのみであるという脂肪酸プロフィールを有するからである。この有機体の標本は、MK8840と称し、Rockville,Maryland の American Type Culture Collection に寄託されており、受け入れ番号40750号である。ここで用いられる微生物、あるいは微生物の特異型には、野生株、変異株あるいは組換え型を含む。DHA含有オイルを高水準で産生する微生物はすべて本発明の範囲内と考えられる。本発明の特徴の1つは渦鞭毛虫類等の微生物の食用オイル産生能力の認識と、それに伴うこのようなオイルの信頼できる経済的な供給源の維持の問題の解決である。従って、野性型微生物とDHA含有単細胞オイルを産生するよう設計された組換え微生物は本発明の一面である。このような組換え微生物には、同じ基質で、同じ野性型微生物が産生する量と比べて、単細胞オイル中のDHA量が多くなるように、あるいは総オイル量が多くなるように、あるいはその両方を意図して設計されたものが含まれる。また、さらに費用効果のすぐれた基質を効率よく用いて匹適する野性型と同量のDHA含有単細胞オイルを産生するよう設計された微生物も含まれる。
【0017】
一般に、当該技術分野の専門家は C.cohnii が発酵槽内培養に適する有機体であると考えようとしなかった。従前の研究者は C.cohnii を首尾よく培養するには極めて複雑な栄養混合物が必要であると説明してきた。Goldら、Protozoal,13:255−257(1966);Guillard ら、in"Dinoflagellates",Academic Press(1984);Hendersonら、Phytochemistry 27:1679−1683(1988)。これに対して、本発明はグルコースと酵母エキスを含む簡単な培地でDHA産生微生物の培養をなしとげる。これらの成分を海水等の溶液に用いて経済的に有意な増殖速度と細胞濃度が得られる。たとえば、3〜5日の発酵期間で、C.cohnii細胞濃度は少なくとも溶液1lあたりバイオマス10gで、一般には20から約40g/lに達しうる。このような濃度はこれまで到達されえなかった。
【0018】
培養はすべての適当な発酵槽で行えるが、撹拌槽発酵槽(Stirred tank fermentor;STF)かエアリフト発酵槽(ALF)で有機体と増殖することが好ましく、いずれのタイプも当該技術分野専門家既知である。STFを選んだ場合は、Rushton型高効率タービンかピッチドブレードあるいはマリンインペラーを用いて撹拌する。撹拌と散布が微生物への酸素供給をくり返す。バイオマスの増加につれて、酸素要求量が増えるので、通常撹拌速度を上げる。翅端速度は約500cm/秒以下に、好ましくは約300cm/秒以下に保つことが望ましい。大きな翅端速度にも剪断をうけることなく耐えうる微生物株の選択は当該技術分野の範囲内である。このような株の使用は本発明に明らかに含まれる。
【0019】
上述したように、海水は栄養溶液として認容できる培養基である。海水は自然のものでも、濾過したものでも、人工的に混合したものでもよく、いずれも水道水で希釈して塩度を通常の1/2から1/4に減じたり、2倍に濃縮してもよい。好ましい例は、Instant Ocean(登録商標)(IO)ブランドの人工海水である。C.Cohniiは海水微生物であるが、塩度0でもいくらかの増殖が観察されている。低塩度でもよく増殖する変異体の使用は本発明に特に包含されている。微量元素を添加してもよく、これは低塩度で必要となることがある。しかし、このような微量元素は当該技術専門家既知であり概して海水や水道水中に存在する。選択した微生物が、C.cohnii等の有機栄養生物である場合は炭素源を添加する。海水培養基を発酵槽に入れた後、栄養分と微生物の種を加える前に培養基入り発酵槽を滅菌し冷却する。(栄養分を海水と一緒に滅菌してもよいが、この滅菌方法では有効グルコースの減損をきたすことがある。)栄養分と微生物は同時に加えても順々に加えてもよい。
【0020】
有効種濃度は当該技術専門家により決定される。STFを用いる場合、発酵開始時に1lあたり約0.05〜1.0g乾燥重量当量の添加が好ましい。これは約106細胞/mlである。従って30lの発酵槽では、生存能力のある細胞を1lあたり20g乾燥重量の濃度で含む種付け培養基1〜3lを添加する。
【0021】
酸素濃度は少なくとも空気飽和濃度の約10%のD.0.に維持することが好ましい。DHA生合成には酸素が必要であるので、DHAの収率を上げるには空気飽和濃度の約10〜50%のD.0.濃度が必要である。翅端撹拌速度150〜200cm/秒と給気速度1VVM(1分あたりの空気体積/発酵槽体積)の組み合わせによりバイオマス濃度約25g乾燥重量/培養物1lで約20〜30%のD.0.濃度が提供できる。細胞濃度が高ければより高いD.0.濃度が必要となるが、これは02散布による給気速度の増加が発酵槽の空気圧の上昇で達成できる。
【0022】
認容できる炭素源は当該技術分野専門家既知である。たとえば、炭素はグルコースの形で C.cohniiに供給できる。他の有機栄養生物は他の還元炭素源を用いることができるが、これは当該技術専門家により容易に決定され、独立栄養生物は二酸化炭素を利用する。C.cohniiは他のもっと複雑な還元炭素源でも増殖する。一般には、グルコース約10〜50g/lで発酵を開始する。発酵中必要に応じてグルコースを追加する。あるいは、グルコース約50〜150g/l、好ましくは50〜100gを最初に加えて、以降の追加回数を少なくすることもできる。他の有機体に供給する炭素源の量は当該技術分野専門家により容易に決定される。
【0023】
還元炭素源に加えて、酵母エキス(YE)等の窒素源を培養基に供給する。市販の酵母エキスが認容される。たとえば、DIFCOやMARCORブランドの酵母エキスを使用できる。酵母エキスは微量元素も含む有機窒素源である。他の有機窒素源は当該技術専門家により容易に決定できる。しかし、このような化合物は概して酵母エキスより高価である。尿素や硝酸塩で増殖可能な変異体の使用は本発明の範囲内である。一般にYE約6〜12g/lで発酵を開始する。必要に応じてさらにYEを追加してもよい。一般的な発酵は全工程でYE約8〜15g/lを要する。従って、その量のYEを最初に加えて以降の追加の必要を減らすことができる。正確な量は当該技術専門家により決定できる。一般に、グルコースとYEの比は約2:1から約15:1である。
【0024】
培養はどのような生命維持温度でも行える。一般にC.cohniiは約15℃から34℃の範囲で増殖する。温度を約20〜30℃に保つことが好ましい。高温で増殖する株は倍増時間が短く発酵時間を減じられるので好ましい。他の微生物の適正温度範囲は当該技術専門家によって容易に決定される。
【0025】
培養は広いpH範囲、一般にはpH約5.0 から9.0で遂行される。増殖期には約6.0から約7.0のpH範囲を用いることが好ましい。接種前にはKOHやNaOH等の塩基を用いて培養基pHを調整する。発酵の後期には、培養基はアルカリ性になる傾向がある。必要であれば、増殖期中のアルカリ性を修正するために無機酸のpH調節剤を用いてもよい。渦鞭毛虫での単細胞オイルの産生は定常期の賦課(たとえば窒素枯渇やpH上昇)によって誘発される。YE欠乏は、利用できるグルコースが残存しているのに培養基がYEを使い果すようにYE供給量を制限することに起因する。本発明は、単細胞オイルの効率のよい産生を促進するものが、炭素源の窒素源に対する比であることを認めている。例としてグルコースとYEを用いると、好ましい炭素源と窒素源の比は、YE1に対してグルコース約10〜15である。他の炭素源と窒素源における同様の比は当該技術専門家により算出できる。
【0026】
オイル産生誘発後、培養物をさらに24時間増殖させる。この油合成期間中、DHA含有単細胞オイルが合成され可視のオイル滴が現れる。当該技術専門家は、加えたYE量に基づく細胞バイオマスの期待値に達するに要する発酵時間を容易に算出できる。その時間が経過したら、培養物をさらに24時間増殖させてから採収する。一般に、C.cohniiを単細胞オイルを産生するに足る時間、通常約60分から約90分、培養するが、この時間は変動する。
【0027】
野生型 C.cohniiを用いて、結果として生じるバイオマスの約15〜30%が抽出可能なオイルから成る。株の選択によりこの比率を上げることができ、このような選択は本発明の範囲内である。本オイルは、一般に次の脂肪酸組成を有するトリグリセリドを約70%以上含むことが好ましい。
15〜20%ミリスチン酸(C14:0)
20〜25%パルミチン酸(C16:0)
10〜15%オレイン酸(C18:0)
30〜40%DHA(C22:6)
0〜10%その他(ホスファチジルコリン等の極性脂質を含む他のオイル成分もDHAに含まれることがある)
粗オイルの特性は黄澄色で室温で液体である。本オイルはDHAを少なくとも約20重量%含むことが望ましく、約35重量%以上含むことが最も望ましい。
【0028】
有機体は当該技術分野専門家既知の従来法である遠心分離,凝集,濾過等で採収し、すぐに加工処理するが、後の加工処理用に乾燥させる。いずれの場合も、オイルは有効量の溶媒で容易に抽出できる。適当な溶媒は当該技術専門家により決定される。しかし、好ましい溶媒には精製へキサンと臨界超過CO2等の臨界超過液体が含まれる。
【0029】
臨界超過液体を用いた抽出法は当該技術分野専門家既知で、McHuglらの Supercritical F1uid Extraction,Butterworth,1986.に記載されている。抽出溶媒がへキサンである場合は、乾燥バイオマスに対するへキサンの適当な割合は、乾燥バイオマス1kgあたりへキサン約4lである。へキサンとバイオマスを撹拌反応槽に入れ約20〜50℃の温度で約2時間混合することが好ましい。混合後、バイオマスを濾過しオイルを含むへキサンから分離する。あるいは、湿性バイオマスペースト(固形分30〜35%)をエタノール、イソプロパノールあるいはへキサン/イソプロパノール混合物等のより極性の高い溶媒で直接抽出できる。残澄バイオマス、すなわち C.cohnii等の微生物の単細胞食用オイル抽出後のバイオマスは動物の飼料として使用できるがこれは約35〜40%のタンパク質、8〜10%の灰分、45〜50%の炭水化物を含む。タンパク質含有率が高くDHA濃度も高いことから、バイオマスペースト全体を水産養殖(例、エビ,カキ,魚)飼料として使用できる。
【0030】
その後、当該技術分野専門家既知の蒸留方法でオイルから溶媒を除去する。従来の油料種子加工装置が濾過、分離および蒸留の遂行に適している。個々の適用において、当該技術分野専門家既知の追加加工行程が必要であれば行ってよい。この行程も従来の植物性オイル加工に含まれるものと類似しており、DHAに富む極性脂質分画の分離を可能にする。
【0031】
本発明の方法により、DHAの代謝経路の研究を可能にする量の標識DHAを含む同位体標識単細胞オイルを簡単に得ることができる。還元炭素基質として13C−グルコースか14C−グルコースを供給すると標識DHAが得られる。
【0032】
本発明は、本発明のDHA含有単細胞オイルを含む乳幼児用調合乳、ベビーフード、栄養補助食品等の食品も含む。当該技術専門家はDHA含有乳幼児用調合乳が望ましいと認めてはきたが、従来技術の乳幼児用調合乳は魚油からとったDHAを含んでおり、それに付随するいやな味と特殊感覚器に印象を与える特性があった。さらに、乳幼児用調合乳に魚油を添加すると、抗凝血作用がありアラキドン酸生合成の減少におそらく関与しているオメガ−3−脂肪酸であるエイコサペンタエン酸(EPA)も添加される。このような作用は乳幼児用調合乳やベビーフードに望ましくなく、ここで記述した単細胞オイルには有意な量のEPAは含まれていない。本発明の単細胞オイルを含有する乳幼児用調合乳等の食品には魚油の持つ不快な特殊感覚器に印象を与える特性がない。従って食品は乳幼児にも成人にもより容易に認容される。本発明の乳幼児用調合乳は0.05重量%のDHA含有単細胞オイルを含むことが好ましい。さらに固形分の多い本発明のベビーフードは、約0.5重量%のDHA含有単細胞オイルを含むことが好ましい。いずれの場合でも、オイルが少なくとも約35%のDHAを含むことが最も好ましい。
【0033】
本発明はDHA含有単細胞オイルを含む医薬品を含む。本製品は少なくとも約35%のDHAを含むことが好ましい。このような医薬品の例としては乳幼児や成人への完全非経口栄養(TPN)の供給に適したものがある。さらに、単細胞オイルを含有する栄養補助食品も含まれる。このような栄養補助食品は前記オイルをカプセルに入れたゼラチンカプセル形態で妊婦や授乳中の婦人に適することが好ましい。これは特に菜食主義者で食事から十分量のDHAを摂れないような女性に適する。
【0034】
本発明はDHA含有単細胞オイルも含む。本単細胞オイルは少なくとも約20重量%のDHAを含むことが好ましい。本オイルは少なくとも約35重量%のDHAを含むことが最も好ましい。
本発明を全般的に記述してきたが、次に特定実施例を引用するがこれに限られるものではない。
【実施例】
【0035】
実施例1
作業容量30lのSTFに濃度2分の1の人工海水を入れた。IO6lを水道水18lと化合した。培養基の入った発酵槽を滅菌し28℃まで冷却した。濃縮YE(455g/l)400ml、グルコースシロップ(400g/l)900mlおよび約2×107細胞/mlあるいはバイオマス20g/l(最終濃度は約7×106細胞/mlあるいはバイオマス約700mg/lになる)含有する種発酵槽からの接種物1lを培養基に加えた。撹拌は翅端速度120cm/秒に設定し給気は1VVM(30l/分)に設定した。30時間後にグルコースシロップ(900ml)を追加し、さらに次の42時間の間に4.2lを追加した。従って計6lのグルコースシロップを加えた。6時間後に濃縮YE溶液(400ml)を加え次の48時間の間にさらに1.2l追加し、計2.0l加えた。D.0.20%以上に維持するため24時間後に翅端速度を150cm/秒に、48時間後には160cm/秒に上げた。72時間後には翅端速度を200cm/秒に上げ、最後投入グルコースが細胞オイルに転化するに十分な時間をおいて培養物を増殖させた。培養条件を図1にグラフで示す。その後細胞球粒を保持して遠心分離により培養物を採収した。採収した細胞球粒を凍結乾燥して水分含有量約4%とした。へキサン(2.8l)を乾燥バイオマスに加えガラスケトルに入れ50℃で1.5時間撹拌した。回転蒸発装置を用いてへキサンを除去し、粗DHA含有オイル約175gを産生した。
【0036】
実施例2
作業容量350lのSTFにI.O.(登録商標)4.3kgと水道水230lを化合して作った濃度2分の1の人工海水培養基を入れた。培養基を入れた発酵槽を滅菌し28℃まで冷却した。濃縮YE(400g/l)6.8l、グルコースシロップ(400g/l)12.5lおよび種発酵槽(106 細胞/mlあるいはバイオマス濃度約1.3g/l)からの C.cohnii接種物30lを培養基に加えた。撹拌は翅端速度73cm/秒に設定し給気は1VVM(280l/分)に設定した。約44時間後にグルコースシロップ(12l)を追加し次の32時間の間にさらに43lを加えた。従って、計67.5lのグルコースシロップを加えた。グルコース添加と細胞増殖を図2にグラフで表す。
D.0.を20%以上に維持するため、44時間後に指枠麹端速度を175cm/秒に上げ、55時間後には225cm/秒に上げた。76時間後には翅端速度を150cm/秒に下げて、最終投入グルコースが細胞オイルに転化するに十分な時間をおいて培養物を増殖させた。その後培養物を採収した。採収した細胞を乾燥し水分含有量約4%とした。へキサンを乾燥バイオマスに加えてガラスケトルに入れ25℃で2時間撹拌した。回転蒸発装置を用いてへキサンを除去し、粗DHA含有オイル約700gを産生した。
【0037】
実施例3
作業容量30lのSTFにI.O.(登録商標)565gと水道水15lを化合して作った正規濃度の人工海水を入れた。培養基を入れた発酵槽を滅菌し28℃に冷却した。濃縮YE(400g/l)400ml、グルコースシロップ(400g/l)1.9l、および種発酵槽(106細胞/lあるいはバイオマス約20g/l)からの C.cohnii接種物1lを培養基に加えた。撹拌は翅端速度80cm/秒に設定し給気は1VVM(20l/分)に設定した。94時間後にグルコースシロップ(1.5l)を追加し116時間後にさらに1.1l追加した。従って、計4.5lのグルコースシロップを加えた。
D.0.を 20%以上に維持するため、52時間後に撹拌翅端速度を160cm/秒に上げた。66時間後に、定常期を導入したがこれを成しとげるために4N KOHでPHを7.0にスパイクし撹拌翅端速度は行程中さらには上げなかった。図3に示すように、最終投入グルコースが細胞オイルに転化するに十分な時間をおいて培養物を増殖させた。その後培養物を採収した。採収した細胞を乾燥し水分含有量約4%とした。乾燥バイオマスにへキサンを加えガラスケトルに入れ50℃で1.5時間撹拌した。回転蒸発装置を用いてへキサンを除去し、粗DHA含有オイル約65g産生した。
【特許請求の範囲】
【請求項1】
ドコサヘキサエン酸(DHA)が少なくとも20重量%を占め、そしてトリグリセリドを70%より多く含む、C. cohniiのバイオマスから抽出された粗食用単細胞オイル。
【請求項2】
ヘキサン抽出によりC. cohniiのバイオマスから得ることができる、請求項1項記載の粗オイル。
【請求項3】
DHAがオイルの少なくとも35重量%を占める、請求項1または2記載の粗オイル。
【請求項4】
エイコサペンタエン酸(EPA)を有意な量含まない、請求項1または2記載の粗オイル。
【請求項5】
請求項1または2記載の粗オイルを追加の加工工程に供することにより得られた食用単細胞オイルを含む幼児用製剤。
【請求項6】
請求項1または2記載の粗オイルを追加の加工工程に供することにより得られた食用単細胞オイルを含む幼児用食品。
【請求項7】
請求項1または2記載の粗オイルを追加の加工工程に供することにより得られた食用単細胞オイルを含む食品。
【請求項8】
請求項1または2記載の粗オイルを追加の加工工程に供することにより得られた食用単細胞オイルを含む医薬品。
【請求項9】
完全非経口栄養(TPN)を供給するように適合された、請求項21記載の医薬品。
【請求項10】
請求項1または2項記載の粗オイルを追加の加工工程に供することにより得られた食用単細胞オイルを含む栄養補助剤。
【請求項11】
栄養補助剤がオイルを封入したゼラチンカプセルの形態である、請求項10記載の栄養補助剤。
【請求項12】
請求項1記載の粗食用単細胞オイルを含む渦鞭毛虫バイオマスを生産するための方法であって、上記オイルを生産することができる微生物を通気性発酵槽中の栄養溶液中において培養することにより、栄養溶液のリットルあたり少なくとも約10グラムのバイオマスの細胞密度を達成し、そして上記バイオマスを回収することによるが、但し、微生物が渦鞭毛虫であり、そして定常期の賦課により該微生物を誘発して栄養溶液リットルあたり少なくとも約1.5グラムの濃度の単細胞オイルを生産する、方法。
【請求項13】
(a)約106細胞/ml(0.5−1.0g乾燥重量/リットル)のC.cohniiを、約1/4から1/2の塩度の人工海水、1−8%グルコースおよび0.4−0.8%酵母エキスを含む栄養溶液を初期に含む発酵槽に添加し;
(b)C.cohniiを15℃から34℃の温度および5.0から9.0のpHで培養し;
(c)グルコースと酵母エキスを約56時間かけて漸次栄養溶液に添加し;
(d)さらにグルコースを約16時間かけて栄養溶液に添加して、C.cohniiがオイルを生産するのを誘発し;
(e)培養中を通して溶解酸素含有量を空気飽和レベルの少なくとも約20%に維持するように、発酵槽を撹拌および通気し;そして
(f)約60時間から約90時間後にC.cohniiを回収する
ことからなる、請求項12記載の方法。
【請求項14】
請求項12または13に従い生産されたバイオマスを含む動物用飼料。
【請求項15】
請求項12または13に従い生産されたバイオマスを含む水産養殖用飼料。
【請求項16】
請求項1ないし4の何れか1項記載の食用単細胞オイルを含む動物用飼料。
【請求項17】
請求項1ないし4の何れか1項記載の食用単細胞オイルを含む水産養殖用飼料。
【請求項1】
ドコサヘキサエン酸(DHA)が少なくとも20重量%を占め、そしてトリグリセリドを70%より多く含む、C. cohniiのバイオマスから抽出された粗食用単細胞オイル。
【請求項2】
ヘキサン抽出によりC. cohniiのバイオマスから得ることができる、請求項1項記載の粗オイル。
【請求項3】
DHAがオイルの少なくとも35重量%を占める、請求項1または2記載の粗オイル。
【請求項4】
エイコサペンタエン酸(EPA)を有意な量含まない、請求項1または2記載の粗オイル。
【請求項5】
請求項1または2記載の粗オイルを追加の加工工程に供することにより得られた食用単細胞オイルを含む幼児用製剤。
【請求項6】
請求項1または2記載の粗オイルを追加の加工工程に供することにより得られた食用単細胞オイルを含む幼児用食品。
【請求項7】
請求項1または2記載の粗オイルを追加の加工工程に供することにより得られた食用単細胞オイルを含む食品。
【請求項8】
請求項1または2記載の粗オイルを追加の加工工程に供することにより得られた食用単細胞オイルを含む医薬品。
【請求項9】
完全非経口栄養(TPN)を供給するように適合された、請求項21記載の医薬品。
【請求項10】
請求項1または2項記載の粗オイルを追加の加工工程に供することにより得られた食用単細胞オイルを含む栄養補助剤。
【請求項11】
栄養補助剤がオイルを封入したゼラチンカプセルの形態である、請求項10記載の栄養補助剤。
【請求項12】
請求項1記載の粗食用単細胞オイルを含む渦鞭毛虫バイオマスを生産するための方法であって、上記オイルを生産することができる微生物を通気性発酵槽中の栄養溶液中において培養することにより、栄養溶液のリットルあたり少なくとも約10グラムのバイオマスの細胞密度を達成し、そして上記バイオマスを回収することによるが、但し、微生物が渦鞭毛虫であり、そして定常期の賦課により該微生物を誘発して栄養溶液リットルあたり少なくとも約1.5グラムの濃度の単細胞オイルを生産する、方法。
【請求項13】
(a)約106細胞/ml(0.5−1.0g乾燥重量/リットル)のC.cohniiを、約1/4から1/2の塩度の人工海水、1−8%グルコースおよび0.4−0.8%酵母エキスを含む栄養溶液を初期に含む発酵槽に添加し;
(b)C.cohniiを15℃から34℃の温度および5.0から9.0のpHで培養し;
(c)グルコースと酵母エキスを約56時間かけて漸次栄養溶液に添加し;
(d)さらにグルコースを約16時間かけて栄養溶液に添加して、C.cohniiがオイルを生産するのを誘発し;
(e)培養中を通して溶解酸素含有量を空気飽和レベルの少なくとも約20%に維持するように、発酵槽を撹拌および通気し;そして
(f)約60時間から約90時間後にC.cohniiを回収する
ことからなる、請求項12記載の方法。
【請求項14】
請求項12または13に従い生産されたバイオマスを含む動物用飼料。
【請求項15】
請求項12または13に従い生産されたバイオマスを含む水産養殖用飼料。
【請求項16】
請求項1ないし4の何れか1項記載の食用単細胞オイルを含む動物用飼料。
【請求項17】
請求項1ないし4の何れか1項記載の食用単細胞オイルを含む水産養殖用飼料。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2010−220627(P2010−220627A)
【公開日】平成22年10月7日(2010.10.7)
【国際特許分類】
【出願番号】特願2010−134939(P2010−134939)
【出願日】平成22年6月14日(2010.6.14)
【分割の表示】特願2009−23286(P2009−23286)の分割
【原出願日】平成3年2月4日(1991.2.4)
【出願人】(508004410)マーテック バイオサイエンシーズ コーポレーション (26)
【Fターム(参考)】
【公開日】平成22年10月7日(2010.10.7)
【国際特許分類】
【出願日】平成22年6月14日(2010.6.14)
【分割の表示】特願2009−23286(P2009−23286)の分割
【原出願日】平成3年2月4日(1991.2.4)
【出願人】(508004410)マーテック バイオサイエンシーズ コーポレーション (26)
【Fターム(参考)】
[ Back to top ]

