ドコサヘキサエン酸およびルテインを含有する乳児用製剤
【課題】乳児における網膜の健康および視覚の発達を促進するための乳児用製剤および対応使用方法の提供。
【解決手段】該製剤は卵リン脂質を含有せず、ドコサヘキサエン酸およびそのまま摂取される形態に基づき少なくとも約50mcg/リットルのルテインを含む、脂肪、タンパク質、炭水化物、ビタミンおよびミネラルを含み、ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比は約1:2から約10:1である。該製剤は早期産児における未熟児網膜症のリスクの軽減にも特に有用。
【解決手段】該製剤は卵リン脂質を含有せず、ドコサヘキサエン酸およびそのまま摂取される形態に基づき少なくとも約50mcg/リットルのルテインを含む、脂肪、タンパク質、炭水化物、ビタミンおよびミネラルを含み、ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比は約1:2から約10:1である。該製剤は早期産児における未熟児網膜症のリスクの軽減にも特に有用。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、乳児における網膜の健康および視覚の発達を促進するための、ドコサヘキサエン酸およびルテインの選択された組合せを含有する乳児用製剤(infant formula)に関する。
【背景技術】
【0002】
乳児用製剤は、出生後の早い時期における補助的な又は唯一の栄養源を供給するために今日一般に使用されている。これらの製剤は、タンパク質、炭水化物、脂肪、ビタミン、ミネラルおよび他の栄養素を含有する。それらは、粉末、そのまま摂取される液体、および液体濃縮物として商業的に入手可能である。
【0003】
多数の乳児用製剤は、人乳の代用となる特性をもたらすが、それらは尚も、人乳において見出されるのと同じ高レベルの栄養を供給するものではない。したがって、過去数年にわたる乳児用製剤に関する研究努力の多くは、人乳の天然構成成分を更に深く理解すること、そしてそれに応じて又は少なくとも現在の利用可能な技術で可能な程度で乳児製剤を改良することに向けられている。
【0004】
例えばアラキドン酸およびドコサヘキサエン酸が人乳において同定されており、ついで合成乳児用製剤に添加されている。これらの脂肪酸は乳児における脳および視覚の発達を支え、現在、Similac(登録商標)Advance(登録商標)乳児用製剤、Isomil(登録商標)Advance(登録商標)乳児用製剤およびSimilac(登録商標)Special Care(登録商標)Advance(登録商標)乳児用製剤(これらはすべて、Ross Products Division,Abbott Laboratories,Columbus,Ohio,USAから入手可能である)のような商業的に入手可能な製剤中に見出される。
【0005】
ルテインも人乳において同定されている。それは現在、単離された成分としては乳児用製剤に添加されないが、ルテインは、そのような製剤を製造するために一般に使用される天然油のいくつかにおける固有成分として乳児用製剤中に低濃度で見出されうる。ルテインは、たまたま眼の網膜内にも濃縮される抗酸化剤である。食用ルテインは眼の健康上の利益を個体にもらたすことが一般に公知であり、そのような利益は、人乳または補助乳児用製剤のいずれかからルテインを摂取する乳児にも拡張されうると考えられる。
【0006】
現在、ルテインとドコサヘキサエン酸との組合せが乳児における網膜の健康および視覚の発達において特に重要でありうると考えられている。どちらの物質も人乳中に存在し、共に、その他の点では健常な対象の網膜内に濃縮されることが公知である。多不飽和脂肪酸としてのドコサヘキサエン酸(DHA)は、眼内の酸化および分解による損傷を非常に受けやすく、一方、ルテインは公知の抗酸化物質である。ルテインを乳児製剤に加えることにより、それは網膜内に濃縮されるばかりでなく、網膜DHAの酸化分解をも軽減して、更には乳児における網膜の健康および視覚の発達を促進しうる。
【0007】
しかし、乳児用製剤からのルテインの相対バイオアベイラビリティはより低いため、母乳栄養児において見られるのと同じ血漿中ルテイン濃度を得るためには、乳児用製剤中のルテイン濃度は、人乳中で見られるルテイン濃度より遥かに高くなければならないことが、本発明において見出された。今日の乳児用製剤は典型的には約20mcg/リットル未満のルテインを含有し、そのほとんどは添加油脂に固有に由来するものであるが、専ら母乳栄養の乳児で見られる血漿中ルテイン濃度の2倍の濃度を得るためには、そのようなルテイン濃度は約50mcg/リットル超、好ましくは約100mcg/リットルから約200mcg/リットルでなければならないことが、本発明において見出された。
【0008】
したがって、本発明において、前記のとおりのルテインとDHAとの組合せを含有する乳児用製剤は、人乳において一般に見られるものより高い比(ルテイン対DHA)で製剤化されるべきであることも判明した。本発明においては、ルテイン(mcg)対DHA(mg)のこれらの重量比は約1:2から約10:1の範囲であるべきである。
【発明の概要】
【0009】
発明の概要
本発明は、ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比が約1:2から約10:1である、ドコサヘキサエン酸および少なくとも約50mcg/リットルのルテインを含む、脂肪、タンパク質、炭水化物、ビタミンおよびミネラルを含む乳児用製剤に関する。本発明はまた、乳児における未熟児網膜症のリスクを軽減すること、および乳児の眼への過剰な自然光または人工光の損傷効果に対して保護することを含む、乳児における網膜の健康および視覚の発達を促進するための、該製剤の使用方法に関する。
【0010】
人乳自体が典型的にせいぜい約30mcg/リットルのルテインを含有する場合であっても、母乳栄養児で見られるのと同じ血漿中ルテイン濃度を乳児用製剤から得たいならば、該乳児用製剤は少なくとも50mcg/リットルのルテイン濃度で製造されるべきであることが見出された。したがって、該乳児用製剤におけるルテイン(mcg)対DHA(mg)の重量比は約1:2から約10:1の範囲であるべきであることも見出された。ルテインとドコサヘキサエン酸との組合せは、それぞれの十分な量が本明細書に記載のとおりに該乳児用製剤へと設計されれば、乳児における網膜の健康および視覚の発達を促進するのに特に有用であると考えられる。
【図面の簡単な説明】
【0011】
【図1】図1は、人乳(HM)または種々の濃度のルテインを含有する乳児用製剤[CTRLは14.6mcg/リットルのルテインを含有する(ルテインは添加されておらず、すべてのルテインは成分に固有のものである);L1は32.6mcg/リットルのルテインを含有する(約18mcg/リットルの添加ルテインを含有し、残りは固有のものである);L2は52.6mcg/リットルのルテインを含有する(約38mcg/リットルの添加ルテインを含有し、残りは固有のものである)]を摂取した乳児群におけるルテイン摂取量(mcg/日)および対応する血漿中ルテイン濃度(mcg/dl)のグラフである。
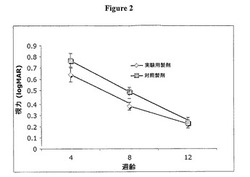
【図2】図2は、4、8および12週齢のサルにおいてスイープ(sweep)視覚誘発電位(logMAR)により測定した視力を示すグラフである。12週間の給餌期間中に、DHAおよび添加ルテイン(n=8)または添加ルテインの非存在下のDHA(n=8)を含有する乳児製剤を該サルに給餌する。
【0012】
発明の詳細な説明
本発明の乳児用製剤は、脂肪、タンパク質、炭水化物、ミネラルおよびビタミンを含み、ルテインとドコサヘキサエン酸との新規組合せを含む。本発明の乳児用製剤および対応方法のこれらの及び他の必須要素または限定を以下に詳細に説明する。
【0013】
本明細書中で用いる「乳児」なる語は約1歳以下の個体を意味し、0から約4月齢の乳児、約4から約8月齢の乳児、約8から約12月齢の乳児、出生時に2,500グラム未満の低出生体重児、および妊娠期約37週未満、典型的には妊娠期約26週から約34週で出生した早期産児を含む。
【0014】
本明細書中で用いる「乳児用製剤」なる語は、十分な量で与えられた場合に唯一の栄養源として潜在的に働くのに十分なタンパク質、炭水化物、脂肪、ビタミンおよびミネラルを含有するよう乳児用に設計された、卵リン脂質を含有しない栄養組成物を意味する。
【0015】
本明細書中で用いる「そのまま摂取される」なる語は、特に示さない限り、還元粉末、希釈濃縮物および加工液を含む、乳児への投与に適した液体形態の乳児用製剤を意味する。
【0016】
本明細書中で用いる、「mcg/リットル」または「mg/リットル」のいずれかで表される全ての濃度は、特に示さない限り、そのまま摂取される製剤または摂取製剤に基づいて計算された本発明の乳児用製剤における成分濃度を意味する。
【0017】
本明細書中で用いる全てのパーセント、部および比は、特に示さない限り、全組成物の重量に対するものである。挙げられている成分に関する全てのそのような重量は活性レベルに基づくものであり、したがって、特に示さない限り、商業的に入手可能なものに含まれうる溶媒または副産物を含まない。
【0018】
本発明の単数の特性または限定に対する全ての言及は、特に示さない限り、あるいは該言及がなされている状況により矛盾すると明らかに示唆される場合を除き、対応する複数の特性または限定を含むものとし、その逆も成立する。
【0019】
本明細書中で用いる方法またはプロセス工程の全ての組合せは、特に示さない限り、あるいは言及されている組合せがなされる状況により矛盾すると明らかに示唆される場合を除き、任意の順序で実施されうる。
【0020】
本発明の乳児用製剤は、本明細書に記載のいずれの随意的な又は選択された必須成分または特徴をも実質的に含有しないことも可能であるが、この場合、残りの製剤が、本明細書に記載されている必要な成分または特徴の全てを尚も含有していなければならない。この場合、「実質的に含有しない」なる語は、選択された組成物が該随意的成分を機能量未満、典型的には0.1重量%未満しか含有しないこと(そのような随意的成分を0重量%含有することも含む)を意味する。
【0021】
本発明の乳児用製剤および対応方法は、本明細書に記載の本発明の必須の要素および限定ならびに本明細書に記載の又は栄養製剤用途において有用な任意の追加的または随意的な成分、要素または限定を含む、またはそれらからなる、またはそれらから実質的になる。
【0022】
ルテイン
本発明の乳児用製剤はルテインを含み、その濃度は少なくともルテイン約50mcg/リットルでなければならない。乳児用製剤において使用されることが公知であるか又は乳児用製剤における使用に適しており、該製剤中のその他の選択された成分に適合性である限り、任意のルテイン源が本発明における使用に適しており、ここで、該製剤におけるルテイン(mcg/リットル)対ドコサヘキサエン酸(mg/リットル)の重量比は約1:2から約10:1の範囲である。
【0023】
本発明の乳児用製剤中のルテイン濃度は、そのまま摂取される製剤に基づいて計算した場合、約50から約1150mcg/リットル、例えば、約75から約230mcg/リットル、また、例えば、約100から約200mcg/リットルの範囲である。本明細書に記載の全てのルテイン濃度および比は、特に示さない限り、遊離ルテインに基づいて計算されている。
【0024】
また、該乳児用製剤中のルテインの量は、ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比が約1:2から約10:1、例えば、約1.5:1から約9:1、また、例えば、約1.7:1から約5:1の範囲となるよう選択されなければならない。
【0025】
本明細書中で用いる「ルテイン」なる語は、特に示さない限り、遊離ルテイン、ルテインエステル、ルテイン塩、または本明細書中に記載または示唆されている他のルテイン誘導体もしくは関連構造体の1以上を意味する。本発明の乳児用製剤における使用に適したルテインまたはルテイン源には、遊離ルテイン、ならびにそのエステル、塩または他の誘導体もしくは関連構造体、例えば、式:
【0026】
【化1】

に適合するものが含まれる。前記式はルテインおよび関連誘導体または構造体の一般構造を含む。例えば遊離ルテインは、R1およびR2が共に水素である該式に対応し、そのシスおよびトランス異性体ならびにその塩、例えばナトリウム塩、カリウム塩を包含する。
【0027】
本発明の乳児用製剤における使用に適したルテインエステルには、R1およびR2が、同一または異なって、栄養学的に許容される一価塩、水素、またはカルボン酸のアシル残基である、前記式の任意のルテインエステルが含まれる。ただし、この場合、R1またはR2の少なくとも1つはカルボン酸のアシル残基である。適当なルテインエステルには、シスおよびトランス異性体の両方も含まれる。R1およびR2部分は飽和または不飽和のC1−C22脂肪カルボン酸であり、その非限定的な具体例には、ギ酸、酢酸、プロピオン酸、酪酸、吉草酸、カプロン酸、カプリル酸、カプリン酸、ラウリル酸、ミリスチン酸、パルミチン酸、ステアリン酸およびオレイン酸が含まれる。
【0028】
本発明において使用するルテインには、乳児用製剤などの経口栄養剤において使用されることが公知である又はそのような使用のための許容される入手源である任意の天然または合成源が含まれる。ルテイン源は、個々の成分として、または総合ビタミンプレミックス、混合カロテノイドプレミックス、純粋なルテイン源および該乳児用製剤中の他の油脂成分からの固有のルテインのようなルテイン源を含む、他の物質または源との任意の組合せとして提供されうる。本明細書中に記載されているルテイン濃度および比は、添加された又は固有のルテイン源に基づいて計算されたものである。本発明の乳児用製剤は、好ましくは、全ルテインの重量に対して少なくとも約25重量%、より好ましくは約50重量%から約95重量%を添加ルテインとして含み、その残りは、添加油脂に伴う固有のルテインである。
【0029】
本明細書中で使用するためのいくつかの適当なルテイン源の非限定的な具体例には、Kemin Foods,Des Moines,Iowa,USAから入手可能なFloraGLO(登録商標)Crystalline Lutein、およびCognis,Cincinnati,Ohio,USAから供給されるXangold(登録商標)ルテインエステルが含まれる。
【0030】
本発明の乳児用製剤には、マリーゴルドの花(タゲテス・エレクタ(Tagetes erecta))からの精製結晶抽出物における遊離ルテインおよびゼアキサンチンの単一の源の組合せを含む好ましい実施形態が含まれ、この場合、該遊離ルテインは該組合せの85重量%から95重量%に相当し、該ゼアキサンチンは該組合せの約5重量%から約15重量%に相当する。好ましいルテイン−ゼアキサンチンの組合せはKemin Foods,Des Moines,Iowa,USAからFloraGLO(登録商標)のブランドで入手可能である。
【0031】
ドコヘキサエン酸(DHA)
本発明の乳児用製剤は、メチル末端から3番目の炭素から始まる6個の二重結合を伴う炭素数22の鎖長を有する有機カルボン酸(22:6 n−3)であるドコサヘキサエン酸を含む。乳児用製剤において使用されることが公知であり、該製剤中のその他の選択された成分に適合性である限り、任意のドコサヘキサエン酸源が本発明における使用に適している。
【0032】
本発明の乳児用製剤中のドコサヘキサエン酸濃度は、ルテイン対ドコサヘキサエン酸の得られる重量比が本明細書に記載の範囲内となるよう選択されなければならない。そのような濃度は、最も典型的には、そのまま摂取される製剤に基づいて計算した場合、約36から360mg/リットル、例えば、約50から約144mg/リットル、また、約72から約130mg/リットルの範囲である。
【0033】
ドコサヘキサエン酸は、遊離脂肪酸として、またはそうでなければ乳児への投与に際して若しくは該投与後にそのような遊離脂肪酸の源を与えうる化合物もしくは物質(例えば、ドコサヘキサエン酸の非卵リン脂質およびグリセリドエステル(モノ−、ジ−、トリ−))として、該乳児製剤に添加されうる。多不飽和脂肪酸およびその源は米国特許第6,080,787号(Carlsonら)および米国特許第6,495,599号(Auestadら)(それらの記載を参照により本明細書に組み入れることとする)に記載されている。適当なドコサヘキサエン酸源のいくつかの非限定的な具体例には、魚油、藻類油他の単細胞油およびそれらの組合せが含まれる。
【0034】
本発明の乳児用製剤は更に、本明細書に記載のドコサヘキサエン酸に加えて、他の長鎖多不飽和脂肪酸、例えばアラキドン酸(20:4 n−6)、エイコサペンタエン酸、すなわちEPA(20:5 n−3)、リノール酸(18:2 n−6)、γ−リノレン酸、すなわちGLA(18:3 n−6)、α−リノレン酸(18:3 n−3)、ジホモ−γ−リノレン酸、すなわちDHGLA(20:3 n−6)、α−リノレン酸(18:3 n−3)、ステアリドン酸(18:4 n−3)およびそれらの組合せを含みうる。そのような随意的な長鎖多不飽和脂肪酸は同様に、遊離脂肪酸として、またはそうでなければ乳児への投与に際して若しくは該投与後にそのような遊離脂肪酸の源を与えうる化合物もしくは物質(例えば、ドコサヘキサエン酸の非卵リン脂質およびグリセリドエステル(モノ−、ジ−、トリ−))として、乳児用製剤中に製剤化されうる。
【0035】
他の栄養素
本発明の乳児用製剤は脂肪、タンパク質、炭水化物、ミネラルおよびビタミンを含み、これらの全ては、種類および量において、意図される乳児集団の食事要求を満たすように選択される。
【0036】
炭水化物、脂肪、タンパク質、ミネラルおよびビタミンの多種多様な源およびタイプが公知であり、本発明の乳児用製剤において使用されうる。ただし、そのような栄養素は、選択された製剤における添加成分に適合しうるものであり、それ以外の点で乳児用製剤における使用に適したものでなければならない。
【0037】
本発明の乳児用製剤における使用に適した炭水化物は、単純体または複合体、ラクトース含有体またはラクトース非含有体、あるいはそれらの組合せであることが可能であり、それらの非限定的な具体例には、加水分解された、無傷の、天然で及び/又は化学的に修飾されたコーンスターチ、マルトデキストリン、グルコース重合体、スクロース、コーンシロップ、コーンシロップソリッド、コメまたはジャガイモ由来炭水化物、グルコース、フルクトース、ラクトース、高フルクトースコーンシロップおよび消化されにくいオリゴ糖、例えばフルクトオリゴ糖(FOS)、ガラクトオリゴ糖(GOS)ならびにそれらの組合せが含まれる。
【0038】
本発明の乳児用製剤における使用に適したタンパク質は、加水分解された、部分加水分解された及び加水分解されていない又は無傷のタンパク質またはタンパク質源を包含し、任意の公知の又は適当な源、例えば乳(例えば、カゼイン、ホエー)、動物(例えば、肉、魚)、穀類(例えば、コメ、トウモロコシ)、野菜(例えば、ダイズ)またはそれらの組合せに由来するものでありうる。
【0039】
本発明において使用するタンパク質は、乳児用製剤において使用されることが公知の又は乳児用製剤における使用に適している遊離アミノ酸をも含むことが可能であり、あるいはそのような遊離アミノ酸により完全に又は部分的に置換されることが可能である。該アミノ酸の非限定的な具体例には、アラニン、アルギニン、アスパラギン、カルニチン、アスパラギン酸、シスチン、グルタミン酸、グルタミン、グリシン、ヒスチジン、イソロイシン、ロイシン、リシン、メチオニン、フェニルアラニン、プロリン、セリン、タウリン、トレオニン、トリプトファン、タウリン、チロシン、バリンおよびそれらの組合せが含まれる。これらのアミノ酸は、最も典型的には、それらのL形態で使用されるが、栄養的に等価である場合には対応D異性体も使用されうる。ラセミ混合物または異性体混合物も使用されうる。
【0040】
本発明の乳児用製剤における使用に適した脂肪には、ココナッツ油、ダイズ油、トウモロコシ油、オリーブ油、サフラワー油、高オレイン酸サフラワー油、藻類油、MCT油(中鎖トリグリセリド)、ヒマワリ油、高オレイン酸ヒマワリ油、パーム油、パーム核油、パームオレイン、カノラ油、水産油脂、綿実油およびそれらの組合せが含まれる。
【0041】
本発明の乳児用製剤における使用に適したビタミンおよび同様の他の成分には、ビタミンA、ビタミンD、ビタミンE、ビタミンK、チアミン、リボフラビン、ピリドキシン、ビタミンB12、ナイアシン、葉酸、パントテン酸、ビオチン、ビタミンC、コリン、イノシトール、それらの塩および誘導体ならびにそれらの組合せが含まれる。
【0042】
本発明の乳児用製剤における使用に適したミネラルには、カルシウム、リン、マグネシウム、鉄、亜鉛、マンガン、銅、クロム、ヨウ素、ナトリウム、カリウム、クロリド(塩化物)およびそれらの組合せが含まれる。
【0043】
該乳児用製剤は、好ましくは、対象となる消費者または使用者の集団のための関連乳児用製剤指針(その一例は、Infant Formula Act,21 U.S.C. Section 350(a)である。)に従った栄養素を含む。
【0044】
本発明の乳児用製剤には、以下の表に示す炭水化物、脂肪およびタンパク質濃度を含有する実施形態も含まれる。
【0045】
【表1】

【0046】
本発明の乳児用製剤には、製剤の100kcal当たりに以下のうちの1以上を含む実施形態が含まれる:ビタミンA(約250から約750 IU)、ビタミンD(約40から約100 IU)、ビタミンK(約4mcg以上)、ビタミンE(少なくとも約0.3 IU)、ビタミンC(少なくとも約8mg)、チアミン(少なくとも約8g)、ビタミンB12(少なくとも約0.15g)、ナイアシン(少なくとも約250g)、葉酸(少なくとも約4g)、パントテン酸(少なくとも約300g)、ビオチン(少なくとも約1.5g)、コリン(少なくとも約7mg)およびイノシトール(少なくとも約4mg)。
【0047】
本発明の乳児用製剤には、製剤の100kcal当たりに以下のうちの1以上を含む実施形態も含まれる:カルシウム(少なくとも約50mg)、リン(少なくとも約25mg)、マグネシウム(少なくとも約6mg)、鉄(少なくとも約0.15mg)、ヨウ素(少なくとも約5g)、亜鉛(少なくとも約0.5mg)、銅(少なくとも約60g)、マンガン(少なくとも約5g)、ナトリウム(約20から約60mg)、カリウム(約80から約200mg)およびクロリド(約55から約150mg)。
【0048】
随意的成分
本発明の乳児用製剤は更に、該組成物の物理的、化学的、美的または加工特性を修飾しうる又は対象乳児集団において使用された場合に医薬的または追加的栄養成分として働きうる他の随意的成分を含みうる。多数のそのような随意的成分が公知であるか、または栄養製品における使用に適しており、本発明の乳児用製剤においても使用されうる。ただし、そのような随意的物質は、本明細書に記載されている必須物質に適合しうるものでり、それ以外の点で乳児製剤における使用に適したものでなければならない。
【0049】
そのような随意的成分の非限定的な具体例には、保存剤、追加的抗酸化剤、乳化剤、バッファー、着色剤、香味剤、ヌクレオチドおよびヌクレオシド、プロバイオティックス、プレバイオティックス、ラクトフェリンおよび関連誘導体、増粘剤および安定剤などが含まれる。
【0050】
製品形態
本発明の乳児用製剤は、乳児における使用に適した任意の製品形態、還元可能な粉末、そのまま摂取される液体および希釈可能な液体濃縮物として製造されることが可能であり、これらの製品形態は全て、栄養および乳児製剤の分野においてよく知られている。
【0051】
本発明の乳児製剤は、意図される乳児集団に適した任意のカロリー密度を有することが可能であり、あるいは粉末実施形態の還元に際して又は液体濃縮物実施形態の希釈に際してそのような密度を与えうる。本発明の製剤のための最も一般的なカロリー密度は、一般には少なくとも約18kca1/fl oz(609kcal/リットル)、より典型的には約20kcal/fl oz(675から680kcal/リットル)から約25kcal/fl oz(820kcal/リットル)、より一層典型的には約20kcal/fl oz(675から680kcal/リットル)から約24kcal/fl oz(800から810kcal/リットル)である。一般には、早期産の低出生体重児においては22から30kcal/fl oz、最も典型的には約22から24kcal/fl ozの製剤がより一般に使用され、正期産児においては20から21kcal/fl oz(675から680から700kcal/リットル)の製剤がより頻繁に使用される。低出生体重の早期産児では、より高いカロリー供給を用いることが可能であり、そのような供給は典型的には約27kcal/fl oz(90から95kcal/リットル)から約30kcal/fl oz(1000から1015kcal/リットル)である。
【0052】
本発明の粉末実施形態の場合、そのような粉末は、典型的には、流動可能または実質的に流動可能な粒子組成物、あるいは少なくとも、スプーンまたは同様の他の装置で容易にすくって量り取られうる粒子状組成物の形態であり、この場合、該組成物は、意図される使用者により、適当な水性流体(典型的には水)で容易に還元されて、即座の経口または経腸使用のための液体栄養製剤を形成しうる。この場合、「即座」の使用は、一般には約48時間以内、最も典型的には約24時間以内、好ましくは還元直後を意味する。これらの粉末実施形態には、噴霧乾燥された、凝集した、乾燥混合された、または他の公知もしくは有効な粒子状形態が含まれうる。1食分に適した体積を与えるのに必要な栄養粉末の量は様々となりうる。
【0053】
本発明の乳児用製剤は、1回または複数回使用のための容器に入れられ、密封され、ついで外界条件下で約36ヵ月まで又はそれ以上、より典型的には約12から約24ヶ月間保存されうる。複数回使用のための容器の場合、これらのパッケージは最終使用者により開かれ、ついで反復使用のために覆われうる。ただし、その覆われたパッケージはついで、外界条件下(例えば、極端な温度を避ける)で保存され、内容物は約1ヶ月以内に使用される。
【0054】
網膜の健康および視覚の発達
本発明はまた、乳児における網膜の健康および視覚の発達を促進するために該製剤を投与する方法に関する。この特定の方法においては、該乳児製剤は、唯一の栄養源、主要な栄養源または補助的な栄養源として正期産児または早期産児に投与され、この場合、該製剤は、ドコサヘキサエン酸および少なくとも約50mcg/リットルのルテインを含む、脂肪、タンパク質、炭水化物、ビタミンおよびミネラルを含み、ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比は約1:2から約10:1である。そのような方法は、本明細書中に記載または示唆されている任意の製剤実施形態に適用されうる。
【0055】
したがって、この特定の方法は、記載されている利益をもたらすルテインの有効量、例えば約7から約300mcg/kg/日、例えば約14から約220mcg/kg/日、また、例えば約22から約150mcg/kg/日(乳児の体重1kg当たりのルテイン)を乳児に与えるべきであり、この場合、ルテイン対ドコサヘキサエン酸の重量比は、本明細書に記載されている比の範囲内に維持される。
【0056】
眼および視覚の発達は出生後の最初の1年の間に急速に生じる。出生時には、乳児は、おそらく25から30cm離れた、高コントラストの物体しか見ることができない。次の6ヵ月の間に、乳児の網膜は、細かい詳細を見て識別するのに十分な程度にまで発達する。そして乳児の視覚が発達するにつれて(それらのほとんどは最初の1年間に生じるであろう)、乳児は、新たに発達した視覚により今や可能となった視覚刺激により学習する能力を更に高める。乳児にとっては、ついでこの視覚学習が、特に出生後の最初の2から3年の間に、脳および認知の発達において中心的な役割を果たす。
【0057】
乳児における網膜の健康および視覚の発達を促進することにより、本発明の乳児製剤は、可能な限り早く視覚的に学習する能力を子供が発達させるのを助け、眼の発達中の網膜による早期の視覚刺激に関連した脳および認知の発達を子供が潜在的に加速させるのを助けうる。したがって、本発明の乳児製剤は乳児における視覚の発達の促進に有用であり、したがって、早期の視覚刺激による、関連した認知および脳の発達のような二次的な利益の促進に有用である。
【0058】
本発明のこの特定の方法は、早期産児において正常視覚の発達を加速させるのを助けて、彼らの対応正期産児により定められる発達有意段階に追いつくために必要な時間を減少させるのに特に有用でありうる。
【0059】
未熟児網膜症
本発明の乳児用製剤は、未熟児網膜症のリスクを軽減するために早期産児に投与された場合に特に有用である。そのような方法においては、該製剤は、唯一の栄養源、主要な栄養源または補助的な栄養源として投与され、この場合、該製剤は、ドコサヘキサエン酸および少なくとも約50mcg/リットルのルテインを含む、脂肪、タンパク質、炭水化物、ビタミンおよびミネラルを含み、ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比は約1:2から約10:1である。そのような方法は、本明細書中に記載または示唆されている任意の製剤実施形態に適用されうる。
【0060】
未熟児網膜症は、早期産児をしばしば冒す病態であり、おそらくは高い酸素圧に続発性の酸化ストレスの結果としての眼の網膜血管の発達異常により最も一般的に特徴づけられる。この病態は、視覚に対する最小限度の影響を伴って又は視覚に対する影響を全く伴わずに血管が若干冒されるものから、失明を招く部分的または完全な網膜剥離まで、様々な度合で生じうる。これまでのところ、適当な症例に対する療法はレーザー治療、冷凍治療などであった。
【0061】
したがって、この特定の方法は、記載されている利益をもたらすルテインの有効量、例えば約7から約300mcg/kg/日、例えば約14から約220mcg/kg/日、また、例えば約22から約150mcg/kg/日(乳児の体重1kg当たりのルテイン)を乳児に与えるべきであり、この場合、ルテイン対ドコサヘキサエン酸の重量比は、本明細書に記載されている比の範囲内に維持される。
【0062】
製造方法
本発明の乳児用製剤は、乳児用製剤または同様の他の製剤を製造し製剤化するのに適した任意の公知または有効な技術により製造されうる。それらの変更は、所望の乳児用製剤のための選択された製品形態、成分の組合せ、パッケージング(包装)および容器の選択などのような変数に左右されうる。任意の与えられた製剤に関するそのような技術および変法は、乳児用栄養製剤または製造の分野の当業者により容易に決定され、適用される
したがって、以下に記載され例示される製剤を含む本発明の乳児用製剤は、種々の公知または有効な製剤化または製造方法のいずれかにより製造されうる。これらの方法は、最も典型的には、炭水化物、タンパク質、脂質、安定剤または他の製剤化補助剤、ビタミン、ミネラルまたはそれらの組合せを含有する水性スラリーの初期形成を含む。該スラリーを乳化し、低温殺菌し、ホモジナイズし、冷却する。更なる加工の前、途中または後に、得られたエマルションに種々の他の溶液、混合物または他の物質を添加することが可能である。ついでこのエマルションを更に希釈し、加熱処理し、パッケージングして、そのまま摂取される又は濃縮された液体を得ることが可能であり、あるいはそれを加熱処理し、ついで加工し、還元可能な粉末(例えば、噴霧乾燥物、乾燥混合物、凝集物)としてパッケージングすることが可能である。
【0063】
栄養製剤を製造するための他の適当な方法は、例えば米国特許第6,365,218号(Borschelら)、米国特許第6,589,576号(Borschelら)、米国特許第6,306,908号(Carlsonら)、米国特許出願20030118703 A1(Nguyenら)(それらの記載を参照により本明細書に組み入れることとする)に記載されている。
【0064】
実験
この実験の目的は、DHAまたは添加ルテインを伴うDHAのいずれかを含む乳児用製剤が給餌された動物における視力の変化を評価することである。16頭のサルに、出生後の最初の12週の間に、2つの定められた乳児用製剤の1つを給餌する。一方は対照製剤、すなわち、Abbott Laboratories,Columbus Ohioから入手可能なSimilac(登録商標)Advance(登録商標)乳児用製剤であり、もう一方は、Similac(登録商標)Advance(登録商標)乳児用製剤を基礎製剤として含み、ルテインを含むカロテノイドがそれに添加された実験用製剤である。該製剤は以下のものを含む。
【0065】
【表2】

【0066】
該基礎製剤(Similac(登録商標)Advance(登録商標)乳児用製剤)は水、脱脂乳、ラクトース、高オレイン酸サフラワー油、ダイズ油、ココナッツ油、ホエータンパク質濃縮物、シー・コーニイ(C.cohnii)油、エム・アルピナ(M.alpina)油、クエン酸ナトリウム、炭酸カルシウム、アスコルビン酸、モノ−およびジグリセリド、ダイズレシチン、カラゲナン、塩化カリウム、塩化マグネシウム、塩化ナトリウム、硫酸第一鉄、塩化コリン、酒石酸水素コリン、タウリン、m−イノシトール、d−アルファ−トコフェリルアセタート、L−カルニチン、硫酸亜鉛、ナイアシンアミド、パントテン酸カルシウム、リボフラビン、ビタミンAパルミタート、硫酸第二銅、塩酸チアミン、塩酸ピリドキシン、ベータ−カロテン、葉酸、硫酸マンガン、フィロキノン、ビオチン、セレン酸ナトリウム、ビタミンD3、シアノコバラミンおよびヌクレオチド(アデノシン5’−一リン酸、シチジン5’−一リン酸、グアノシン5’−一リン酸二ナトリウム、ウリジン5’−一リン酸二ナトリウム)を含有する。
【0067】
該サルを、出生後から12週齢まで実験用製剤(n=8)または対照製剤(n=8)の投与を受けるように無作為化する。該動物にはそれらの母親からの母乳を与えない。出生時に乳児と母親とを分離する。該研究中、乳児により潜在的に経験される光誘発性酸化ストレスを模擬するために、該サルを、太陽光に特徴的な強度およびスペクトルを有する光に1日12時間さらす。該研究中、血漿中ルテイン濃度およびスイープ(sweep)視覚誘発電位(VEP)を含むいくつかのパラメーターに関して該サルを評価する。
【0068】
血漿中ルテイン
ルテイン、リコペンおよびベータ−カロテンの血漿中濃度は、出生時(0週齢)には、該対照製剤を与えたサルと該実験用製剤を与えたサルとの間で有意な差はない。血漿中ルテイン濃度は、4週齢(p<0.001)、8週齢(p<0.001)および12週齢(p<0.001)では、該実験用製剤を与えたサルにおいては、該対照製剤を与えたサルの場合より有意に高い。同様に、血漿中リコペン濃度は、4週齢(p<0.001)、8週齢(p<0.001)および12週齢(p<0.001)で、実験群においては、対照群の場合より有意に高い。血漿中ベータ−カロテン濃度は、4週齢(p=0.005)および8週齢(p=0.010)では、実験群製剤群において、対照製剤群の場合より有意に高いが、12週齢(p<0.001)ではそうではない。
【0069】
視力
該サルを、4、8および12週齢において、視力の変化に関して評価する。視力は、乳児における視覚誘発電位を測定するための当技術分野でよく知られた方法であるスイープ視覚誘発電位(VEP)により測定する。視力は、視皮質からの測定可能な応答を誘発する最小空間周波数高コントラスト格子を決定することにより測定する。一次皮質視覚野からのVEPを、水溶性電極ペーストで頭皮上に配置された小さな銀円盤EEG電極を使用して記録する。該乳児は実験者のひざにかかえられながら、黒および白の位相反転格子を表示するビデオモニターを凝視する。必要に応じて、小さなぶら下がり玩具を使用して、該乳児の注意を該スクリーンの中央に引きつける。各「スイープ(sweep)」中、格子の空間周波数を、数秒の記録時間中に被験者の視力閾値の上から下へ段階的に減少させる。刺激反転速度に関連した応答を反映する、VEP応答の第2調波の振幅を、空間周波数の関数としてプロットして、被験者の視力閾値を決定する(Neuringer M,Jeffrey BG:Visual development:neural basis and new assessment methods.J Pediatr 2003;143:S87−S95)。
【0070】
該研究からのVEPスコアを図1のグラフに要約する。VEP(logMAR)スコアが低ければ低いほど、良好な視力を示す。全てのサルに関して12週間の試験期間中にVEPスコアは減少した(すなわち、視力は改善された)が、予想どおり、8週の時点でのVEPスコアは、実験群(添加ルテイン+DHA製剤)においては、対照群(添加ルテインを伴わないDHA製剤)の場合より驚くほど低かった(4週間、p=0.412など)。
【0071】
該データは、8週齢における該実験製剤を与えた乳児サルにおける加速された発達(特に、VEP値により測定された視力において)を示唆している。該データをヒト乳児に外挿する場合、4、8および12週齢のサルにおける眼の発達はそれぞれ4、8および12月齢のヒト乳児における眼の発達に対応する。したがって、該データは、ヒト乳児においても、該実験製剤が、約4から約12月齢において視力を改善することを示唆している。
【実施例】
【0072】
以下の実施例は本発明の範囲内の特定の実施形態を表し、それらのそれぞれは専ら例示目的で記載されており、本発明を限定するものとして解釈されるべきではない。本発明の精神および範囲から逸脱することなく、それらの多数の変更が可能である。特に示さない限り、すべての例示されている量は、該組成物の全重量に基づく重量パーセントである。
【0073】
実施例1.1から1.3
以下は、乳に基づくそのまま摂取される本発明の乳児用製剤の実施例であり、該製剤の使用および製造方法を含む。各バッチの製剤成分を以下の表に示す。
【0074】
【表3】


【0075】
例示されている製剤は、少なくとも3つの別々のスラリーを調製し、ついでこれらを一緒に混合し、加熱処理し、標準化し、パッケージングし、滅菌することにより製造することが可能である。まず、ラクトースを65から71℃の水に溶解し、ついで塩化マグネシウム、クエン酸カリウム、塩化カリウム、塩化コリンおよびクエン酸を加えることにより、炭水化物−ミネラルスラリーを調製する。得られたスラリーを、後にその他の調製スラリーと混合するまで、55から65℃で8時間以下の時間にわたり攪拌しながら維持する。
【0076】
高オレイン酸サフラワー油、ダイズ油およびココナッツ油を55から60℃で一緒にし、ついでビタミンADEKプレミックス、モノ−およびジグリセリド、レシチン、カラゲナン、ビタミンA、ARA油ならびにDHA油を加えることにより、タンパク質−脂肪スラリーを調製する。ついでホエータンパク質および炭酸カルシウムを加える。得られたタンパク質−油スラリーを、後にその他の形成スラリーと混合するまで、40から43℃で2時間以下の時間にわたり適度に攪拌しながら維持する。
【0077】
ついで該炭水化物−ミネラルスラリーを水および脱脂乾燥乳と一緒にし、10分間攪拌する。ついで該タンパク質−油スラリーを加え、得られた混合物を少なくとも10分間攪拌する。ついでルテインおよびベータ−カロテンを該混合物に加え、少なくとも15分間攪拌する。得られた混合物のpHを1N 水酸化カリウム6.68から6.75に調節する。
【0078】
1分以上かつ2時間以下の時間待った後、得られた混合物を71から82℃に加熱し、真空下で脱気し、第1段(single stage)ホモジナイザーで900から1100psigで乳化し、ついで99から110℃に加熱し、ついで再び146℃に約5秒間加熱する。該加熱混合物をフラッシュクーラーに通過させて温度を99から110℃に低下させ、ついでプレートクーラーに通過させて温度を更に71から76℃に低下させる。ついで該冷却混合物を3900から4100/400から600psigでホモジナイズし、ついで74から80℃で16秒間維持し、ついで1から7℃に冷却する。微生物学的および分析試験のためにサンプルを採取する。該混合物を攪拌下で維持する。
【0079】
水溶性ビタミン(WSV)溶液およびアスコルビン酸溶液を別々に調製し、該加工混合スラリーに加える。該ビタミン溶液は、以下の成分を攪拌下で9.4kgの水に加えることにより調製する:クエン酸カリウム、硫酸第一鉄、WSVプレミックス、L−カルニチン、リボフラビンおよびヌクレオチド−コリンプレミックス。該アスコルビン酸溶液は、クエン酸カリウムおよびアスコルビン酸を、該成分を溶解するのに十分な量の水に加えることにより調製する。ついで該ビタミンおよびアスコルビン酸溶液を該混合物に加え、該混合物のpHを45% 水酸化カリウム溶液で7から10に調節する。
【0080】
該品質管理試験の分析結果に基づき、攪拌しながら適当な量の水を該バッチに加えて所望の全固体を得る。製品のpHは、最適な製品安定性が得られるよう調節されうる。ついで、完成した製品を適当な容器内に配置し、最終滅菌に付す。
【0081】
出生後の最初の6から12ヶ月間、各乳児に7から300μg/kg/日のルテインを供給するために、得られた製剤を唯一の栄養源として乳児に与える。本明細書に記載のとおり、該製剤は網膜の健康および視覚の発達の改善をもたらす。
【0082】
実施例2.1から2.3
以下は、ダイズに基づく本発明の粉末乳児用製剤の実施例であり、該製剤の使用および製造方法を含む。各バッチの製剤成分を以下の表に示す。
【0083】
【表4】

【0084】
例示されている粉末の製造における第1工程は油混合物の調製である。ダイズ油、ココナッツ油および高オレイン酸サフラワー油を適当な容器またはタンク内で60から65℃で、攪拌しながら一緒にする。該タンクにアスコルビルパルミタートおよび混合トコフェロール、ついで脂溶性ビタミンプレミックスを、全て攪拌しながら加える。ベータ−カロテン(BASF,Mount Olive,New Jersey)およびルテイン(Kemin,Des Moines,Iowa)を該油混合物に加え、十分に分散するまで攪拌する。ついでダイズタンパク質単離物およびメチオニンを該油混合物に加え、得られた混合物を攪拌し、後に製造プロセスにおいて使用するまで54.0から60℃で維持する。
【0085】
ついで炭水化物−ミネラルスラリーを調製する。60から65℃の水に塩化カリウム、塩化ナトリウム、塩化マグネシウムおよびヨウ化カリウム、ついでリン酸二カルシウムおよびリン酸三カルシウムを、全て攪拌しながら加える。ついでコーンシロップを、攪拌しながら加え、該スラリーを、後に製造プロセスにおいて使用するまで54から60℃で維持する。
【0086】
該炭水化物−ミネラルスラリーを該油混合物に加える。必要に応じて追加的な水を加える。ARAおよびDHA油を該混合物に加える。得られた混合物のpHを、KOH溶液を使用して6.75から6.85に調節する。ついで、調節された混合物を攪拌下、54から60℃で少なくとも15分間維持する。
【0087】
ついで、得られた混合物を74から79℃に加熱し、真空下で脱気し、0から2.76Mpaの第1段ホモジナイザーで乳化し、6.2から7.6Mpaおよび2.1から3.4Mpaの第2段ホモジナイザーに通過させる。そのホモジナイズされた混合物を73から79℃で16秒間維持し、ついで1から7℃に冷却する。微生物学的および分析試験のためにサンプルを採取する。該混合物を攪拌下で維持する。
【0088】
該混合物のカルシウムレベルを、それが仕様から逸脱している場合に調節するのに使用するための炭酸カルシウム溶液を、調製することが可能である。
【0089】
微量ミネラルおよびタウリンと共に水溶性ビタミンプレミックスを含有するビタミンストック溶液を調製する。クエン酸カリウムおよび硫酸第一鉄を37から66℃の水に加える。ついで該ビタミンプレミックスを加え、該混合物を攪拌する。塩化コリンおよびカルニチンを加え、ついでこのビタミン混合物の必要量をバッチに加える。
【0090】
アスコルビン酸溶液を調製し、少なくとも10分にわたり攪拌しながら該バッチにゆっくり加える。ついで該バッチを74から79℃に予備加熱する。ついで直接蒸気注入を用いて該バッチを107から111℃で5秒間維持する。ついで該バッチを71から82℃に冷却した後、噴霧乾燥器へ送り出し、流動可能な粉末へと乾燥させる。ついで該バッチを適当な容器内にパッケージングし、酸素2.0%未満の頭隙にて密封する。
【0091】
例示されている粉末を、676kcal/リットルのカロリー密度に、水で還元する。出生後の最初の6から12ヶ月間、7から300μg/kg/日のルテインを供給するために、得られた液体製剤を唯一の栄養源として乳児に与える。本明細書に記載のとおり、該製剤は網膜の健康および視覚の発達の改善をもたらす。
【0092】
実施例3.1から3.3
以下は、乳に基づく本発明の粉末乳児用製剤の実施例であり、該製剤の使用および製造方法を含む。各バッチの製剤成分を以下の表に示す。
【0093】
【表5】


【0094】
この粉末製剤は、少なくとも2つのスラリーを調製し、ついでこれらを一緒に混合し、加熱処理し、標準化し、噴霧乾燥し、パッケージングすることにより製造する。まず、ラクトースを66から76℃の水に溶解することにより、炭水化物−ミネラルスラリーを調製する(45から50% 固体)。ついでコーンシロップを加え、溶解させ、ついで塩化マグネシウム、クエン酸カリウム、塩化ナトリウム、塩化コリンおよびクエン酸ナトリウムを、全て攪拌しながら加える。得られた炭水化物−ミネラルスラリーを、後に製造プロセスにおいて使用するまで、攪拌下、54から60℃で維持する。
【0095】
高オレイン酸サフラワー油、ココナッツ油、ダイズ油およびMCT油を40.5から49℃で一緒にし、ついでアスコルビルパルミタート、混合トコフェロール、ビタミンAパルミタートおよびビタミンADEKプレミックスを、全て攪拌しながら加えることにより、タンパク質−脂肪スラリーを調製する。ついでルテイン(Kemin,Des Moines,Iowa)を、攪拌しながら加える。ついで該スラリーにホエータンパク質濃縮物、ついで炭酸カルシウムおよび三塩基性リン酸カルシウムを、全て攪拌しながら加える。完成したタンパク質−脂肪スラリーを、その他の調製スラリーと混合するまで、適度な攪拌下、54から60℃でせいぜい12時間維持する。
【0096】
該炭水化物−ミネラルスラリーを、約50%固体の最終混合スラリーを与えるのに十分な量の水が加えられたタンクへ移す。ついで脱脂乾燥乳を該混合物に加え、可溶化する。ついで該タンパク質−脂肪スラリーを加え、該全混合スラリーを少なくとも15分間攪拌する。得られた混合物を60から65℃で維持する。該混合物pHを1N KOHで6.7から6.9に調節する。
【0097】
1分以上かつ2時間以下の時間待った後、得られた混合物を71から79℃に加熱し、真空下で脱気し、2.75から4.1Mpaで乳化し、ついで直接蒸気注入を用いて115から127℃に約5秒間加熱する。ついで該加熱混合物を87から99℃にフラッシュ冷却し、9.7から11.0/2.75から4.1Mpaでホモジナイズする。ついで、そのホモジナイズされたスラリーを1.6から7.2℃に冷却する。微生物学的および分析試験のためにサンプルを採取する。該混合物を攪拌下で維持する。
【0098】
以下の成分を必要量の水に攪拌下で加えることにより、ビタミン−微量ミネラル溶液を調製する:クエン酸カリウム、硫酸第一鉄、カルニチン、ビタミンおよび微量ミネラルプレミックス、イノシトールならびにヌクレオチドおよび酒石酸水素コリンプレミックス。ついで該ビタミン−微量ミネラル溶液を、そのホモジナイズされたスラリーに攪拌下で加える。
【0099】
クエン酸カリウムおよびアスコルビン酸を水に攪拌しながら加え、ついで該水性混合物をそのホモジナイズされたスラリーに攪拌下で加えることにより、アスコルビン酸溶液を調製する。
【0100】
該産物を65.5から77℃に予備加熱する。ついで該産物を82から90.5℃で5秒間維持した後、71から82℃にフラッシュ冷却し、噴霧乾燥器へ送り出す。該産物を噴霧乾燥して所望の自由流動性粉末を得る。製品の安定性および香味を最大にするために、得られた粉末を窒素下でパッケージングする。
【0101】
例示されている粉末を、676kcal/リットルのカロリー密度に、水で還元する。出生後の最初の6から12ヶ月間、7から300μg/kg/日のルテインを供給するために、得られた液体製剤を唯一の栄養源として乳児に与える。本明細書に記載のとおり、該製剤は網膜の健康および視覚の発達の改善をもたらす。
【0102】
実施例4.1から4.3
以下は本発明の濃縮人乳強化液の実施例であり、該製剤の使用および製造方法を含む。各バッチの製剤成分を以下の表に示す。
【0103】
【表6】

【0104】
本発明の濃縮人乳強化実施形態を形成させるために、前記表に挙げた成分を一緒にし、加工する。そのような実施形態を製造するための1つの方法を以下に記載する。
【0105】
特定されている量のココナッツ油、MCT油、ダイズ油、DHA油およびAA油を、全て攪拌しながら、32から37℃に加熱することにより、初期中間体混合物を調製する。ダイズレシチン乳化剤を該加熱混合物に攪拌しながら加え、溶解させる。ついでビタミンA、DおよびK、天然ビタミンEならびにルテインをその生成しつつある混合物に攪拌しながら加える。乳タンパク質単離物(25.8kg)ならびに特定されている量の超微小化リン酸三カルシウムおよび炭酸カルシウムを該混合物に加える。得られた中間体混合物を、後記の水性タンパク質混合物に加えるまで、適度な攪拌下、26から48℃で6時間以下の時間にわたり維持する。
【0106】
ついで、573kgの成分水を48から60℃で加熱し、ついで攪拌しながらそれに乳タンパク質単離物(38.8kg)および特定されている量のホエータンパク質濃縮物を加えることにより、水性タンパク質混合物を調製する。ついで、攪拌しながら、前記の全中間体混合物を該水性タンパク質混合物に加える。ついで、得られた混合物に以下の成分を以下の順序で加える:クエン酸カリウム、リン酸二カリウム、リン酸一カリウム、リン酸マグネシウム、塩化ナトリウム、塩化カリウム、ヨウ化カリウムおよびスクロース。5分間もの後、該混合物pHを、1N KOH溶液を使用して6.60から6.80に調節し、ついで更なる加工まで、2時間以下の時間にわたり51から60℃で維持する。
【0107】
ついで、pHが調節された該混合物を、100から500psig(約0.7MPa〜約3.4MPa)の第2段ホモジナイゼーションを伴う又は伴わない1000から4000psigの1以上の直列ホモジナイザーを使用してホモジナイズし、ついでHTST(高温短時間、74℃で16秒間)またはUHTST(超高温短時間、132から154℃で5から15秒間)のプロセスを用いる加熱処理に付す。UHTSTまたはHTSTの選択は、通常、該製剤中の成分のそれぞれの生物負荷(bioburden)の精査に基づいてなされる。適当な加熱処理の後、該バッチをプレートクーラー内で1.0から5.0℃に冷却し、ついで冷凍保持タンクに移し、ここにおいて、それを分析試験に付し、ついで、アスコルビン酸溶液ならびに水溶性ビタミンおよび微量ミネラル溶液(これらは全て、前記の冷凍バッチに加える前に別々に調製される)の添加を含む、最終的な製品の仕様への標準化に付す。
【0108】
該アスコルビン酸溶液は、特定されている量のアスコルビン酸を11.1kgの1N KOH溶液に攪拌しながら加えることにより調製する。該水溶性ビタミンおよび微量ミネラル溶液は、25.2kgの成分水を37℃から48℃に加熱することにより調製する。該水溶性ビタミンおよび微量ミネラルは、m−イノシトール、タウリン、ナイアシンアミド、硫酸亜鉛、パントテン酸カルシウム、硫酸第一鉄、硫酸第二鉄、リボフラビン、塩酸チアミン、塩酸ピリドキシン、葉酸、硫酸マンガン、ビオチン、セレン酸ナトリウムおよびシアノコバラミンを含有するプレミックスとして該水に添加する。前記のとおり、ついで両方の溶液を該冷凍バッチに、全て攪拌しながら加える。ついで、バッチ標準化の一部として、適量の成分希釈水を該バッチに加えて、31%の目標全固体レベルとなるようにし、pHを1N KOHで7.1に調節する。該バッチを、5mlの産物を含有する適当な大きさの容器内に充填する。
【0109】
例示されている人乳強化濃縮物を人乳と一緒にする(5mlの濃縮物および20から25mlの人乳)。ついで、7から300μg/kg/日のルテインを供給するために、該強化人乳を早期産児に与える。本明細書に記載のとおり、該製剤は、未熟児網膜症のリスクの軽減を含む、網膜の健康および視覚の発達の改善をもたらす。
【0110】
実施例5.1から5.3
この実施例は、本発明のそのまま摂取される早期産児用製剤の実施形態を例示する。この製剤は、ルテイン濃度が増加していること及びそれに伴いルテイン対ドコサヘキサエン酸の比が増加していること以外は、Abbott Laboratories,Columbus,Ohioから入手可能な早期産児用製剤である、早期産児用鉄製剤を伴うSimilac(登録商標)Special Care(登録商標)Advance(登録商標)に類似している。
【0111】
該早期産児用製剤は、脱脂乳、コーンシロップ固体、ラクトース、中鎖トリグリセリド、ホエータンパク質濃縮物、ダイズ油、ココナッツ油、シー・コーニイ(C.cohnii)油(ドコサヘキサエン酸源)、エム・アルピナ(M.alpina)油(アラキドン酸源)、リン酸カルシウム、炭酸カルシウム、クエン酸カリウム、アスコルビン酸、塩化マグネシウム、ダイズレシチン、モノ−およびジグリセリド、m−イノシトール、クエン酸ナトリウム、カラゲナン、硫酸第一鉄、酒石酸水素コリン、タウリン、塩化コリン、ナイアシンアミド、d−アルファ−トコフェリルアセタート、L−カルニチン、硫酸亜鉛、塩化カリウム、二塩基性リン酸カリウム、パントテン酸カルシウム、硫酸第二銅、ビタミンAパルミタート、リボフラビン、塩酸塩化チアミン、塩酸ピリドキシン、葉酸、ベータ−カロテン、硫酸マンガン、ビオチン、フィロキノン、セレン酸ナトリウム、ビタミンD3、シアノコバラミンおよびヌクレオチド(シチジン5’−一リン酸、グアノシン5’−一リン酸二ナトリウム、ウリジン5’−一リン酸二ナトリウム、アデノシン5’−一リン酸)を含む。
【0112】
以下の栄養プロファイルを得るために、前記成分を通常の方法により一緒に製剤化する。
【0113】
【表7】

【0114】
例示されている、そのまま摂取される製剤(812kcal/リットルのカロリー密度)を、1日当たり7から300mcg/kgのルテインを供給するために乳児に投与する。投与された製剤は、本明細書に記載のとおり、眼の健康を改善し、未熟児網膜症のリスクを軽減するために早期産児に適用された場合に特に有用であり、自然光または人工光(特に胆管光)から眼を保護するのを助ける。
【0115】
実験
母乳栄養児における血漿中ルテイン濃度と製剤摂取乳児における血漿中ルテイン濃度とを比較するために、研究を行う。後者には、32.6mcg/リットル(L1)、52.6mcg/リットル(L2)または14.6mcg/リットル(CTRL)のルテイン濃度により特徴づけられる3つの製剤のうちの1つを与えた。該研究群および得られた血漿中ルテイン濃度を以下の表に要約する。
【0116】
【表8】

【0117】
血漿中ルテイン濃度(研究の第56日におけるもの)を該研究における一次変数として使用する。一次比較は、L2製剤群とCTRL製剤群との間の血漿中ルテイン濃度における相違である。二次比較は、製剤群(CTRL、L1、L2)間の血漿中ルテイン濃度における相違および製剤群と人乳群との間の相違を含むものであった。合計85名(CTRL,n=18;L1,n=22;L2,n=19;HM,n=26)の乳児からの第56日の血漿中ルテイン濃度をこれらの分析において使用し、結果を以下の表に平均±SEMとして示す。
【0118】
L2製剤群の乳児は、L1およびCTRL製剤群の乳児より有意に高い(p<0.05)血漿中ルテイン濃度を有する。L1製剤群とCTRL製剤群との間では血漿中ルテインは異ならない。人乳群は、CTRL(p<0.0001)、L1(p<0.0001)およびL2(p=0.0052)製剤群より高い血漿中ルテイン濃度を有する。血漿中ルテイン濃度はルテイン摂取量と有意に相関している(r=0.436,p=0.0014)。ルテイン摂取および該研究からの血漿応答も図1に要約する。
【0119】
該研究からのデータは、乳児用製剤からのルテインのバイオアベイラビリティが人乳からのものより驚くほど低いことを示している(図1を参照されたい)。したがって、人乳の摂取により得られるものに類似した、乳児における血漿中ルテイン濃度を、乳児用製剤により得るためには、少なくとも約50mcg/リットル、好ましくは100mcg/リットルから約200mcg/リットルのルテインを含有するよう乳児用製剤を製剤化しなければならない。
【技術分野】
【0001】
本発明は、乳児における網膜の健康および視覚の発達を促進するための、ドコサヘキサエン酸およびルテインの選択された組合せを含有する乳児用製剤(infant formula)に関する。
【背景技術】
【0002】
乳児用製剤は、出生後の早い時期における補助的な又は唯一の栄養源を供給するために今日一般に使用されている。これらの製剤は、タンパク質、炭水化物、脂肪、ビタミン、ミネラルおよび他の栄養素を含有する。それらは、粉末、そのまま摂取される液体、および液体濃縮物として商業的に入手可能である。
【0003】
多数の乳児用製剤は、人乳の代用となる特性をもたらすが、それらは尚も、人乳において見出されるのと同じ高レベルの栄養を供給するものではない。したがって、過去数年にわたる乳児用製剤に関する研究努力の多くは、人乳の天然構成成分を更に深く理解すること、そしてそれに応じて又は少なくとも現在の利用可能な技術で可能な程度で乳児製剤を改良することに向けられている。
【0004】
例えばアラキドン酸およびドコサヘキサエン酸が人乳において同定されており、ついで合成乳児用製剤に添加されている。これらの脂肪酸は乳児における脳および視覚の発達を支え、現在、Similac(登録商標)Advance(登録商標)乳児用製剤、Isomil(登録商標)Advance(登録商標)乳児用製剤およびSimilac(登録商標)Special Care(登録商標)Advance(登録商標)乳児用製剤(これらはすべて、Ross Products Division,Abbott Laboratories,Columbus,Ohio,USAから入手可能である)のような商業的に入手可能な製剤中に見出される。
【0005】
ルテインも人乳において同定されている。それは現在、単離された成分としては乳児用製剤に添加されないが、ルテインは、そのような製剤を製造するために一般に使用される天然油のいくつかにおける固有成分として乳児用製剤中に低濃度で見出されうる。ルテインは、たまたま眼の網膜内にも濃縮される抗酸化剤である。食用ルテインは眼の健康上の利益を個体にもらたすことが一般に公知であり、そのような利益は、人乳または補助乳児用製剤のいずれかからルテインを摂取する乳児にも拡張されうると考えられる。
【0006】
現在、ルテインとドコサヘキサエン酸との組合せが乳児における網膜の健康および視覚の発達において特に重要でありうると考えられている。どちらの物質も人乳中に存在し、共に、その他の点では健常な対象の網膜内に濃縮されることが公知である。多不飽和脂肪酸としてのドコサヘキサエン酸(DHA)は、眼内の酸化および分解による損傷を非常に受けやすく、一方、ルテインは公知の抗酸化物質である。ルテインを乳児製剤に加えることにより、それは網膜内に濃縮されるばかりでなく、網膜DHAの酸化分解をも軽減して、更には乳児における網膜の健康および視覚の発達を促進しうる。
【0007】
しかし、乳児用製剤からのルテインの相対バイオアベイラビリティはより低いため、母乳栄養児において見られるのと同じ血漿中ルテイン濃度を得るためには、乳児用製剤中のルテイン濃度は、人乳中で見られるルテイン濃度より遥かに高くなければならないことが、本発明において見出された。今日の乳児用製剤は典型的には約20mcg/リットル未満のルテインを含有し、そのほとんどは添加油脂に固有に由来するものであるが、専ら母乳栄養の乳児で見られる血漿中ルテイン濃度の2倍の濃度を得るためには、そのようなルテイン濃度は約50mcg/リットル超、好ましくは約100mcg/リットルから約200mcg/リットルでなければならないことが、本発明において見出された。
【0008】
したがって、本発明において、前記のとおりのルテインとDHAとの組合せを含有する乳児用製剤は、人乳において一般に見られるものより高い比(ルテイン対DHA)で製剤化されるべきであることも判明した。本発明においては、ルテイン(mcg)対DHA(mg)のこれらの重量比は約1:2から約10:1の範囲であるべきである。
【発明の概要】
【0009】
発明の概要
本発明は、ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比が約1:2から約10:1である、ドコサヘキサエン酸および少なくとも約50mcg/リットルのルテインを含む、脂肪、タンパク質、炭水化物、ビタミンおよびミネラルを含む乳児用製剤に関する。本発明はまた、乳児における未熟児網膜症のリスクを軽減すること、および乳児の眼への過剰な自然光または人工光の損傷効果に対して保護することを含む、乳児における網膜の健康および視覚の発達を促進するための、該製剤の使用方法に関する。
【0010】
人乳自体が典型的にせいぜい約30mcg/リットルのルテインを含有する場合であっても、母乳栄養児で見られるのと同じ血漿中ルテイン濃度を乳児用製剤から得たいならば、該乳児用製剤は少なくとも50mcg/リットルのルテイン濃度で製造されるべきであることが見出された。したがって、該乳児用製剤におけるルテイン(mcg)対DHA(mg)の重量比は約1:2から約10:1の範囲であるべきであることも見出された。ルテインとドコサヘキサエン酸との組合せは、それぞれの十分な量が本明細書に記載のとおりに該乳児用製剤へと設計されれば、乳児における網膜の健康および視覚の発達を促進するのに特に有用であると考えられる。
【図面の簡単な説明】
【0011】
【図1】図1は、人乳(HM)または種々の濃度のルテインを含有する乳児用製剤[CTRLは14.6mcg/リットルのルテインを含有する(ルテインは添加されておらず、すべてのルテインは成分に固有のものである);L1は32.6mcg/リットルのルテインを含有する(約18mcg/リットルの添加ルテインを含有し、残りは固有のものである);L2は52.6mcg/リットルのルテインを含有する(約38mcg/リットルの添加ルテインを含有し、残りは固有のものである)]を摂取した乳児群におけるルテイン摂取量(mcg/日)および対応する血漿中ルテイン濃度(mcg/dl)のグラフである。
【図2】図2は、4、8および12週齢のサルにおいてスイープ(sweep)視覚誘発電位(logMAR)により測定した視力を示すグラフである。12週間の給餌期間中に、DHAおよび添加ルテイン(n=8)または添加ルテインの非存在下のDHA(n=8)を含有する乳児製剤を該サルに給餌する。
【0012】
発明の詳細な説明
本発明の乳児用製剤は、脂肪、タンパク質、炭水化物、ミネラルおよびビタミンを含み、ルテインとドコサヘキサエン酸との新規組合せを含む。本発明の乳児用製剤および対応方法のこれらの及び他の必須要素または限定を以下に詳細に説明する。
【0013】
本明細書中で用いる「乳児」なる語は約1歳以下の個体を意味し、0から約4月齢の乳児、約4から約8月齢の乳児、約8から約12月齢の乳児、出生時に2,500グラム未満の低出生体重児、および妊娠期約37週未満、典型的には妊娠期約26週から約34週で出生した早期産児を含む。
【0014】
本明細書中で用いる「乳児用製剤」なる語は、十分な量で与えられた場合に唯一の栄養源として潜在的に働くのに十分なタンパク質、炭水化物、脂肪、ビタミンおよびミネラルを含有するよう乳児用に設計された、卵リン脂質を含有しない栄養組成物を意味する。
【0015】
本明細書中で用いる「そのまま摂取される」なる語は、特に示さない限り、還元粉末、希釈濃縮物および加工液を含む、乳児への投与に適した液体形態の乳児用製剤を意味する。
【0016】
本明細書中で用いる、「mcg/リットル」または「mg/リットル」のいずれかで表される全ての濃度は、特に示さない限り、そのまま摂取される製剤または摂取製剤に基づいて計算された本発明の乳児用製剤における成分濃度を意味する。
【0017】
本明細書中で用いる全てのパーセント、部および比は、特に示さない限り、全組成物の重量に対するものである。挙げられている成分に関する全てのそのような重量は活性レベルに基づくものであり、したがって、特に示さない限り、商業的に入手可能なものに含まれうる溶媒または副産物を含まない。
【0018】
本発明の単数の特性または限定に対する全ての言及は、特に示さない限り、あるいは該言及がなされている状況により矛盾すると明らかに示唆される場合を除き、対応する複数の特性または限定を含むものとし、その逆も成立する。
【0019】
本明細書中で用いる方法またはプロセス工程の全ての組合せは、特に示さない限り、あるいは言及されている組合せがなされる状況により矛盾すると明らかに示唆される場合を除き、任意の順序で実施されうる。
【0020】
本発明の乳児用製剤は、本明細書に記載のいずれの随意的な又は選択された必須成分または特徴をも実質的に含有しないことも可能であるが、この場合、残りの製剤が、本明細書に記載されている必要な成分または特徴の全てを尚も含有していなければならない。この場合、「実質的に含有しない」なる語は、選択された組成物が該随意的成分を機能量未満、典型的には0.1重量%未満しか含有しないこと(そのような随意的成分を0重量%含有することも含む)を意味する。
【0021】
本発明の乳児用製剤および対応方法は、本明細書に記載の本発明の必須の要素および限定ならびに本明細書に記載の又は栄養製剤用途において有用な任意の追加的または随意的な成分、要素または限定を含む、またはそれらからなる、またはそれらから実質的になる。
【0022】
ルテイン
本発明の乳児用製剤はルテインを含み、その濃度は少なくともルテイン約50mcg/リットルでなければならない。乳児用製剤において使用されることが公知であるか又は乳児用製剤における使用に適しており、該製剤中のその他の選択された成分に適合性である限り、任意のルテイン源が本発明における使用に適しており、ここで、該製剤におけるルテイン(mcg/リットル)対ドコサヘキサエン酸(mg/リットル)の重量比は約1:2から約10:1の範囲である。
【0023】
本発明の乳児用製剤中のルテイン濃度は、そのまま摂取される製剤に基づいて計算した場合、約50から約1150mcg/リットル、例えば、約75から約230mcg/リットル、また、例えば、約100から約200mcg/リットルの範囲である。本明細書に記載の全てのルテイン濃度および比は、特に示さない限り、遊離ルテインに基づいて計算されている。
【0024】
また、該乳児用製剤中のルテインの量は、ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比が約1:2から約10:1、例えば、約1.5:1から約9:1、また、例えば、約1.7:1から約5:1の範囲となるよう選択されなければならない。
【0025】
本明細書中で用いる「ルテイン」なる語は、特に示さない限り、遊離ルテイン、ルテインエステル、ルテイン塩、または本明細書中に記載または示唆されている他のルテイン誘導体もしくは関連構造体の1以上を意味する。本発明の乳児用製剤における使用に適したルテインまたはルテイン源には、遊離ルテイン、ならびにそのエステル、塩または他の誘導体もしくは関連構造体、例えば、式:
【0026】
【化1】

に適合するものが含まれる。前記式はルテインおよび関連誘導体または構造体の一般構造を含む。例えば遊離ルテインは、R1およびR2が共に水素である該式に対応し、そのシスおよびトランス異性体ならびにその塩、例えばナトリウム塩、カリウム塩を包含する。
【0027】
本発明の乳児用製剤における使用に適したルテインエステルには、R1およびR2が、同一または異なって、栄養学的に許容される一価塩、水素、またはカルボン酸のアシル残基である、前記式の任意のルテインエステルが含まれる。ただし、この場合、R1またはR2の少なくとも1つはカルボン酸のアシル残基である。適当なルテインエステルには、シスおよびトランス異性体の両方も含まれる。R1およびR2部分は飽和または不飽和のC1−C22脂肪カルボン酸であり、その非限定的な具体例には、ギ酸、酢酸、プロピオン酸、酪酸、吉草酸、カプロン酸、カプリル酸、カプリン酸、ラウリル酸、ミリスチン酸、パルミチン酸、ステアリン酸およびオレイン酸が含まれる。
【0028】
本発明において使用するルテインには、乳児用製剤などの経口栄養剤において使用されることが公知である又はそのような使用のための許容される入手源である任意の天然または合成源が含まれる。ルテイン源は、個々の成分として、または総合ビタミンプレミックス、混合カロテノイドプレミックス、純粋なルテイン源および該乳児用製剤中の他の油脂成分からの固有のルテインのようなルテイン源を含む、他の物質または源との任意の組合せとして提供されうる。本明細書中に記載されているルテイン濃度および比は、添加された又は固有のルテイン源に基づいて計算されたものである。本発明の乳児用製剤は、好ましくは、全ルテインの重量に対して少なくとも約25重量%、より好ましくは約50重量%から約95重量%を添加ルテインとして含み、その残りは、添加油脂に伴う固有のルテインである。
【0029】
本明細書中で使用するためのいくつかの適当なルテイン源の非限定的な具体例には、Kemin Foods,Des Moines,Iowa,USAから入手可能なFloraGLO(登録商標)Crystalline Lutein、およびCognis,Cincinnati,Ohio,USAから供給されるXangold(登録商標)ルテインエステルが含まれる。
【0030】
本発明の乳児用製剤には、マリーゴルドの花(タゲテス・エレクタ(Tagetes erecta))からの精製結晶抽出物における遊離ルテインおよびゼアキサンチンの単一の源の組合せを含む好ましい実施形態が含まれ、この場合、該遊離ルテインは該組合せの85重量%から95重量%に相当し、該ゼアキサンチンは該組合せの約5重量%から約15重量%に相当する。好ましいルテイン−ゼアキサンチンの組合せはKemin Foods,Des Moines,Iowa,USAからFloraGLO(登録商標)のブランドで入手可能である。
【0031】
ドコヘキサエン酸(DHA)
本発明の乳児用製剤は、メチル末端から3番目の炭素から始まる6個の二重結合を伴う炭素数22の鎖長を有する有機カルボン酸(22:6 n−3)であるドコサヘキサエン酸を含む。乳児用製剤において使用されることが公知であり、該製剤中のその他の選択された成分に適合性である限り、任意のドコサヘキサエン酸源が本発明における使用に適している。
【0032】
本発明の乳児用製剤中のドコサヘキサエン酸濃度は、ルテイン対ドコサヘキサエン酸の得られる重量比が本明細書に記載の範囲内となるよう選択されなければならない。そのような濃度は、最も典型的には、そのまま摂取される製剤に基づいて計算した場合、約36から360mg/リットル、例えば、約50から約144mg/リットル、また、約72から約130mg/リットルの範囲である。
【0033】
ドコサヘキサエン酸は、遊離脂肪酸として、またはそうでなければ乳児への投与に際して若しくは該投与後にそのような遊離脂肪酸の源を与えうる化合物もしくは物質(例えば、ドコサヘキサエン酸の非卵リン脂質およびグリセリドエステル(モノ−、ジ−、トリ−))として、該乳児製剤に添加されうる。多不飽和脂肪酸およびその源は米国特許第6,080,787号(Carlsonら)および米国特許第6,495,599号(Auestadら)(それらの記載を参照により本明細書に組み入れることとする)に記載されている。適当なドコサヘキサエン酸源のいくつかの非限定的な具体例には、魚油、藻類油他の単細胞油およびそれらの組合せが含まれる。
【0034】
本発明の乳児用製剤は更に、本明細書に記載のドコサヘキサエン酸に加えて、他の長鎖多不飽和脂肪酸、例えばアラキドン酸(20:4 n−6)、エイコサペンタエン酸、すなわちEPA(20:5 n−3)、リノール酸(18:2 n−6)、γ−リノレン酸、すなわちGLA(18:3 n−6)、α−リノレン酸(18:3 n−3)、ジホモ−γ−リノレン酸、すなわちDHGLA(20:3 n−6)、α−リノレン酸(18:3 n−3)、ステアリドン酸(18:4 n−3)およびそれらの組合せを含みうる。そのような随意的な長鎖多不飽和脂肪酸は同様に、遊離脂肪酸として、またはそうでなければ乳児への投与に際して若しくは該投与後にそのような遊離脂肪酸の源を与えうる化合物もしくは物質(例えば、ドコサヘキサエン酸の非卵リン脂質およびグリセリドエステル(モノ−、ジ−、トリ−))として、乳児用製剤中に製剤化されうる。
【0035】
他の栄養素
本発明の乳児用製剤は脂肪、タンパク質、炭水化物、ミネラルおよびビタミンを含み、これらの全ては、種類および量において、意図される乳児集団の食事要求を満たすように選択される。
【0036】
炭水化物、脂肪、タンパク質、ミネラルおよびビタミンの多種多様な源およびタイプが公知であり、本発明の乳児用製剤において使用されうる。ただし、そのような栄養素は、選択された製剤における添加成分に適合しうるものであり、それ以外の点で乳児用製剤における使用に適したものでなければならない。
【0037】
本発明の乳児用製剤における使用に適した炭水化物は、単純体または複合体、ラクトース含有体またはラクトース非含有体、あるいはそれらの組合せであることが可能であり、それらの非限定的な具体例には、加水分解された、無傷の、天然で及び/又は化学的に修飾されたコーンスターチ、マルトデキストリン、グルコース重合体、スクロース、コーンシロップ、コーンシロップソリッド、コメまたはジャガイモ由来炭水化物、グルコース、フルクトース、ラクトース、高フルクトースコーンシロップおよび消化されにくいオリゴ糖、例えばフルクトオリゴ糖(FOS)、ガラクトオリゴ糖(GOS)ならびにそれらの組合せが含まれる。
【0038】
本発明の乳児用製剤における使用に適したタンパク質は、加水分解された、部分加水分解された及び加水分解されていない又は無傷のタンパク質またはタンパク質源を包含し、任意の公知の又は適当な源、例えば乳(例えば、カゼイン、ホエー)、動物(例えば、肉、魚)、穀類(例えば、コメ、トウモロコシ)、野菜(例えば、ダイズ)またはそれらの組合せに由来するものでありうる。
【0039】
本発明において使用するタンパク質は、乳児用製剤において使用されることが公知の又は乳児用製剤における使用に適している遊離アミノ酸をも含むことが可能であり、あるいはそのような遊離アミノ酸により完全に又は部分的に置換されることが可能である。該アミノ酸の非限定的な具体例には、アラニン、アルギニン、アスパラギン、カルニチン、アスパラギン酸、シスチン、グルタミン酸、グルタミン、グリシン、ヒスチジン、イソロイシン、ロイシン、リシン、メチオニン、フェニルアラニン、プロリン、セリン、タウリン、トレオニン、トリプトファン、タウリン、チロシン、バリンおよびそれらの組合せが含まれる。これらのアミノ酸は、最も典型的には、それらのL形態で使用されるが、栄養的に等価である場合には対応D異性体も使用されうる。ラセミ混合物または異性体混合物も使用されうる。
【0040】
本発明の乳児用製剤における使用に適した脂肪には、ココナッツ油、ダイズ油、トウモロコシ油、オリーブ油、サフラワー油、高オレイン酸サフラワー油、藻類油、MCT油(中鎖トリグリセリド)、ヒマワリ油、高オレイン酸ヒマワリ油、パーム油、パーム核油、パームオレイン、カノラ油、水産油脂、綿実油およびそれらの組合せが含まれる。
【0041】
本発明の乳児用製剤における使用に適したビタミンおよび同様の他の成分には、ビタミンA、ビタミンD、ビタミンE、ビタミンK、チアミン、リボフラビン、ピリドキシン、ビタミンB12、ナイアシン、葉酸、パントテン酸、ビオチン、ビタミンC、コリン、イノシトール、それらの塩および誘導体ならびにそれらの組合せが含まれる。
【0042】
本発明の乳児用製剤における使用に適したミネラルには、カルシウム、リン、マグネシウム、鉄、亜鉛、マンガン、銅、クロム、ヨウ素、ナトリウム、カリウム、クロリド(塩化物)およびそれらの組合せが含まれる。
【0043】
該乳児用製剤は、好ましくは、対象となる消費者または使用者の集団のための関連乳児用製剤指針(その一例は、Infant Formula Act,21 U.S.C. Section 350(a)である。)に従った栄養素を含む。
【0044】
本発明の乳児用製剤には、以下の表に示す炭水化物、脂肪およびタンパク質濃度を含有する実施形態も含まれる。
【0045】
【表1】

【0046】
本発明の乳児用製剤には、製剤の100kcal当たりに以下のうちの1以上を含む実施形態が含まれる:ビタミンA(約250から約750 IU)、ビタミンD(約40から約100 IU)、ビタミンK(約4mcg以上)、ビタミンE(少なくとも約0.3 IU)、ビタミンC(少なくとも約8mg)、チアミン(少なくとも約8g)、ビタミンB12(少なくとも約0.15g)、ナイアシン(少なくとも約250g)、葉酸(少なくとも約4g)、パントテン酸(少なくとも約300g)、ビオチン(少なくとも約1.5g)、コリン(少なくとも約7mg)およびイノシトール(少なくとも約4mg)。
【0047】
本発明の乳児用製剤には、製剤の100kcal当たりに以下のうちの1以上を含む実施形態も含まれる:カルシウム(少なくとも約50mg)、リン(少なくとも約25mg)、マグネシウム(少なくとも約6mg)、鉄(少なくとも約0.15mg)、ヨウ素(少なくとも約5g)、亜鉛(少なくとも約0.5mg)、銅(少なくとも約60g)、マンガン(少なくとも約5g)、ナトリウム(約20から約60mg)、カリウム(約80から約200mg)およびクロリド(約55から約150mg)。
【0048】
随意的成分
本発明の乳児用製剤は更に、該組成物の物理的、化学的、美的または加工特性を修飾しうる又は対象乳児集団において使用された場合に医薬的または追加的栄養成分として働きうる他の随意的成分を含みうる。多数のそのような随意的成分が公知であるか、または栄養製品における使用に適しており、本発明の乳児用製剤においても使用されうる。ただし、そのような随意的物質は、本明細書に記載されている必須物質に適合しうるものでり、それ以外の点で乳児製剤における使用に適したものでなければならない。
【0049】
そのような随意的成分の非限定的な具体例には、保存剤、追加的抗酸化剤、乳化剤、バッファー、着色剤、香味剤、ヌクレオチドおよびヌクレオシド、プロバイオティックス、プレバイオティックス、ラクトフェリンおよび関連誘導体、増粘剤および安定剤などが含まれる。
【0050】
製品形態
本発明の乳児用製剤は、乳児における使用に適した任意の製品形態、還元可能な粉末、そのまま摂取される液体および希釈可能な液体濃縮物として製造されることが可能であり、これらの製品形態は全て、栄養および乳児製剤の分野においてよく知られている。
【0051】
本発明の乳児製剤は、意図される乳児集団に適した任意のカロリー密度を有することが可能であり、あるいは粉末実施形態の還元に際して又は液体濃縮物実施形態の希釈に際してそのような密度を与えうる。本発明の製剤のための最も一般的なカロリー密度は、一般には少なくとも約18kca1/fl oz(609kcal/リットル)、より典型的には約20kcal/fl oz(675から680kcal/リットル)から約25kcal/fl oz(820kcal/リットル)、より一層典型的には約20kcal/fl oz(675から680kcal/リットル)から約24kcal/fl oz(800から810kcal/リットル)である。一般には、早期産の低出生体重児においては22から30kcal/fl oz、最も典型的には約22から24kcal/fl ozの製剤がより一般に使用され、正期産児においては20から21kcal/fl oz(675から680から700kcal/リットル)の製剤がより頻繁に使用される。低出生体重の早期産児では、より高いカロリー供給を用いることが可能であり、そのような供給は典型的には約27kcal/fl oz(90から95kcal/リットル)から約30kcal/fl oz(1000から1015kcal/リットル)である。
【0052】
本発明の粉末実施形態の場合、そのような粉末は、典型的には、流動可能または実質的に流動可能な粒子組成物、あるいは少なくとも、スプーンまたは同様の他の装置で容易にすくって量り取られうる粒子状組成物の形態であり、この場合、該組成物は、意図される使用者により、適当な水性流体(典型的には水)で容易に還元されて、即座の経口または経腸使用のための液体栄養製剤を形成しうる。この場合、「即座」の使用は、一般には約48時間以内、最も典型的には約24時間以内、好ましくは還元直後を意味する。これらの粉末実施形態には、噴霧乾燥された、凝集した、乾燥混合された、または他の公知もしくは有効な粒子状形態が含まれうる。1食分に適した体積を与えるのに必要な栄養粉末の量は様々となりうる。
【0053】
本発明の乳児用製剤は、1回または複数回使用のための容器に入れられ、密封され、ついで外界条件下で約36ヵ月まで又はそれ以上、より典型的には約12から約24ヶ月間保存されうる。複数回使用のための容器の場合、これらのパッケージは最終使用者により開かれ、ついで反復使用のために覆われうる。ただし、その覆われたパッケージはついで、外界条件下(例えば、極端な温度を避ける)で保存され、内容物は約1ヶ月以内に使用される。
【0054】
網膜の健康および視覚の発達
本発明はまた、乳児における網膜の健康および視覚の発達を促進するために該製剤を投与する方法に関する。この特定の方法においては、該乳児製剤は、唯一の栄養源、主要な栄養源または補助的な栄養源として正期産児または早期産児に投与され、この場合、該製剤は、ドコサヘキサエン酸および少なくとも約50mcg/リットルのルテインを含む、脂肪、タンパク質、炭水化物、ビタミンおよびミネラルを含み、ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比は約1:2から約10:1である。そのような方法は、本明細書中に記載または示唆されている任意の製剤実施形態に適用されうる。
【0055】
したがって、この特定の方法は、記載されている利益をもたらすルテインの有効量、例えば約7から約300mcg/kg/日、例えば約14から約220mcg/kg/日、また、例えば約22から約150mcg/kg/日(乳児の体重1kg当たりのルテイン)を乳児に与えるべきであり、この場合、ルテイン対ドコサヘキサエン酸の重量比は、本明細書に記載されている比の範囲内に維持される。
【0056】
眼および視覚の発達は出生後の最初の1年の間に急速に生じる。出生時には、乳児は、おそらく25から30cm離れた、高コントラストの物体しか見ることができない。次の6ヵ月の間に、乳児の網膜は、細かい詳細を見て識別するのに十分な程度にまで発達する。そして乳児の視覚が発達するにつれて(それらのほとんどは最初の1年間に生じるであろう)、乳児は、新たに発達した視覚により今や可能となった視覚刺激により学習する能力を更に高める。乳児にとっては、ついでこの視覚学習が、特に出生後の最初の2から3年の間に、脳および認知の発達において中心的な役割を果たす。
【0057】
乳児における網膜の健康および視覚の発達を促進することにより、本発明の乳児製剤は、可能な限り早く視覚的に学習する能力を子供が発達させるのを助け、眼の発達中の網膜による早期の視覚刺激に関連した脳および認知の発達を子供が潜在的に加速させるのを助けうる。したがって、本発明の乳児製剤は乳児における視覚の発達の促進に有用であり、したがって、早期の視覚刺激による、関連した認知および脳の発達のような二次的な利益の促進に有用である。
【0058】
本発明のこの特定の方法は、早期産児において正常視覚の発達を加速させるのを助けて、彼らの対応正期産児により定められる発達有意段階に追いつくために必要な時間を減少させるのに特に有用でありうる。
【0059】
未熟児網膜症
本発明の乳児用製剤は、未熟児網膜症のリスクを軽減するために早期産児に投与された場合に特に有用である。そのような方法においては、該製剤は、唯一の栄養源、主要な栄養源または補助的な栄養源として投与され、この場合、該製剤は、ドコサヘキサエン酸および少なくとも約50mcg/リットルのルテインを含む、脂肪、タンパク質、炭水化物、ビタミンおよびミネラルを含み、ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比は約1:2から約10:1である。そのような方法は、本明細書中に記載または示唆されている任意の製剤実施形態に適用されうる。
【0060】
未熟児網膜症は、早期産児をしばしば冒す病態であり、おそらくは高い酸素圧に続発性の酸化ストレスの結果としての眼の網膜血管の発達異常により最も一般的に特徴づけられる。この病態は、視覚に対する最小限度の影響を伴って又は視覚に対する影響を全く伴わずに血管が若干冒されるものから、失明を招く部分的または完全な網膜剥離まで、様々な度合で生じうる。これまでのところ、適当な症例に対する療法はレーザー治療、冷凍治療などであった。
【0061】
したがって、この特定の方法は、記載されている利益をもたらすルテインの有効量、例えば約7から約300mcg/kg/日、例えば約14から約220mcg/kg/日、また、例えば約22から約150mcg/kg/日(乳児の体重1kg当たりのルテイン)を乳児に与えるべきであり、この場合、ルテイン対ドコサヘキサエン酸の重量比は、本明細書に記載されている比の範囲内に維持される。
【0062】
製造方法
本発明の乳児用製剤は、乳児用製剤または同様の他の製剤を製造し製剤化するのに適した任意の公知または有効な技術により製造されうる。それらの変更は、所望の乳児用製剤のための選択された製品形態、成分の組合せ、パッケージング(包装)および容器の選択などのような変数に左右されうる。任意の与えられた製剤に関するそのような技術および変法は、乳児用栄養製剤または製造の分野の当業者により容易に決定され、適用される
したがって、以下に記載され例示される製剤を含む本発明の乳児用製剤は、種々の公知または有効な製剤化または製造方法のいずれかにより製造されうる。これらの方法は、最も典型的には、炭水化物、タンパク質、脂質、安定剤または他の製剤化補助剤、ビタミン、ミネラルまたはそれらの組合せを含有する水性スラリーの初期形成を含む。該スラリーを乳化し、低温殺菌し、ホモジナイズし、冷却する。更なる加工の前、途中または後に、得られたエマルションに種々の他の溶液、混合物または他の物質を添加することが可能である。ついでこのエマルションを更に希釈し、加熱処理し、パッケージングして、そのまま摂取される又は濃縮された液体を得ることが可能であり、あるいはそれを加熱処理し、ついで加工し、還元可能な粉末(例えば、噴霧乾燥物、乾燥混合物、凝集物)としてパッケージングすることが可能である。
【0063】
栄養製剤を製造するための他の適当な方法は、例えば米国特許第6,365,218号(Borschelら)、米国特許第6,589,576号(Borschelら)、米国特許第6,306,908号(Carlsonら)、米国特許出願20030118703 A1(Nguyenら)(それらの記載を参照により本明細書に組み入れることとする)に記載されている。
【0064】
実験
この実験の目的は、DHAまたは添加ルテインを伴うDHAのいずれかを含む乳児用製剤が給餌された動物における視力の変化を評価することである。16頭のサルに、出生後の最初の12週の間に、2つの定められた乳児用製剤の1つを給餌する。一方は対照製剤、すなわち、Abbott Laboratories,Columbus Ohioから入手可能なSimilac(登録商標)Advance(登録商標)乳児用製剤であり、もう一方は、Similac(登録商標)Advance(登録商標)乳児用製剤を基礎製剤として含み、ルテインを含むカロテノイドがそれに添加された実験用製剤である。該製剤は以下のものを含む。
【0065】
【表2】

【0066】
該基礎製剤(Similac(登録商標)Advance(登録商標)乳児用製剤)は水、脱脂乳、ラクトース、高オレイン酸サフラワー油、ダイズ油、ココナッツ油、ホエータンパク質濃縮物、シー・コーニイ(C.cohnii)油、エム・アルピナ(M.alpina)油、クエン酸ナトリウム、炭酸カルシウム、アスコルビン酸、モノ−およびジグリセリド、ダイズレシチン、カラゲナン、塩化カリウム、塩化マグネシウム、塩化ナトリウム、硫酸第一鉄、塩化コリン、酒石酸水素コリン、タウリン、m−イノシトール、d−アルファ−トコフェリルアセタート、L−カルニチン、硫酸亜鉛、ナイアシンアミド、パントテン酸カルシウム、リボフラビン、ビタミンAパルミタート、硫酸第二銅、塩酸チアミン、塩酸ピリドキシン、ベータ−カロテン、葉酸、硫酸マンガン、フィロキノン、ビオチン、セレン酸ナトリウム、ビタミンD3、シアノコバラミンおよびヌクレオチド(アデノシン5’−一リン酸、シチジン5’−一リン酸、グアノシン5’−一リン酸二ナトリウム、ウリジン5’−一リン酸二ナトリウム)を含有する。
【0067】
該サルを、出生後から12週齢まで実験用製剤(n=8)または対照製剤(n=8)の投与を受けるように無作為化する。該動物にはそれらの母親からの母乳を与えない。出生時に乳児と母親とを分離する。該研究中、乳児により潜在的に経験される光誘発性酸化ストレスを模擬するために、該サルを、太陽光に特徴的な強度およびスペクトルを有する光に1日12時間さらす。該研究中、血漿中ルテイン濃度およびスイープ(sweep)視覚誘発電位(VEP)を含むいくつかのパラメーターに関して該サルを評価する。
【0068】
血漿中ルテイン
ルテイン、リコペンおよびベータ−カロテンの血漿中濃度は、出生時(0週齢)には、該対照製剤を与えたサルと該実験用製剤を与えたサルとの間で有意な差はない。血漿中ルテイン濃度は、4週齢(p<0.001)、8週齢(p<0.001)および12週齢(p<0.001)では、該実験用製剤を与えたサルにおいては、該対照製剤を与えたサルの場合より有意に高い。同様に、血漿中リコペン濃度は、4週齢(p<0.001)、8週齢(p<0.001)および12週齢(p<0.001)で、実験群においては、対照群の場合より有意に高い。血漿中ベータ−カロテン濃度は、4週齢(p=0.005)および8週齢(p=0.010)では、実験群製剤群において、対照製剤群の場合より有意に高いが、12週齢(p<0.001)ではそうではない。
【0069】
視力
該サルを、4、8および12週齢において、視力の変化に関して評価する。視力は、乳児における視覚誘発電位を測定するための当技術分野でよく知られた方法であるスイープ視覚誘発電位(VEP)により測定する。視力は、視皮質からの測定可能な応答を誘発する最小空間周波数高コントラスト格子を決定することにより測定する。一次皮質視覚野からのVEPを、水溶性電極ペーストで頭皮上に配置された小さな銀円盤EEG電極を使用して記録する。該乳児は実験者のひざにかかえられながら、黒および白の位相反転格子を表示するビデオモニターを凝視する。必要に応じて、小さなぶら下がり玩具を使用して、該乳児の注意を該スクリーンの中央に引きつける。各「スイープ(sweep)」中、格子の空間周波数を、数秒の記録時間中に被験者の視力閾値の上から下へ段階的に減少させる。刺激反転速度に関連した応答を反映する、VEP応答の第2調波の振幅を、空間周波数の関数としてプロットして、被験者の視力閾値を決定する(Neuringer M,Jeffrey BG:Visual development:neural basis and new assessment methods.J Pediatr 2003;143:S87−S95)。
【0070】
該研究からのVEPスコアを図1のグラフに要約する。VEP(logMAR)スコアが低ければ低いほど、良好な視力を示す。全てのサルに関して12週間の試験期間中にVEPスコアは減少した(すなわち、視力は改善された)が、予想どおり、8週の時点でのVEPスコアは、実験群(添加ルテイン+DHA製剤)においては、対照群(添加ルテインを伴わないDHA製剤)の場合より驚くほど低かった(4週間、p=0.412など)。
【0071】
該データは、8週齢における該実験製剤を与えた乳児サルにおける加速された発達(特に、VEP値により測定された視力において)を示唆している。該データをヒト乳児に外挿する場合、4、8および12週齢のサルにおける眼の発達はそれぞれ4、8および12月齢のヒト乳児における眼の発達に対応する。したがって、該データは、ヒト乳児においても、該実験製剤が、約4から約12月齢において視力を改善することを示唆している。
【実施例】
【0072】
以下の実施例は本発明の範囲内の特定の実施形態を表し、それらのそれぞれは専ら例示目的で記載されており、本発明を限定するものとして解釈されるべきではない。本発明の精神および範囲から逸脱することなく、それらの多数の変更が可能である。特に示さない限り、すべての例示されている量は、該組成物の全重量に基づく重量パーセントである。
【0073】
実施例1.1から1.3
以下は、乳に基づくそのまま摂取される本発明の乳児用製剤の実施例であり、該製剤の使用および製造方法を含む。各バッチの製剤成分を以下の表に示す。
【0074】
【表3】


【0075】
例示されている製剤は、少なくとも3つの別々のスラリーを調製し、ついでこれらを一緒に混合し、加熱処理し、標準化し、パッケージングし、滅菌することにより製造することが可能である。まず、ラクトースを65から71℃の水に溶解し、ついで塩化マグネシウム、クエン酸カリウム、塩化カリウム、塩化コリンおよびクエン酸を加えることにより、炭水化物−ミネラルスラリーを調製する。得られたスラリーを、後にその他の調製スラリーと混合するまで、55から65℃で8時間以下の時間にわたり攪拌しながら維持する。
【0076】
高オレイン酸サフラワー油、ダイズ油およびココナッツ油を55から60℃で一緒にし、ついでビタミンADEKプレミックス、モノ−およびジグリセリド、レシチン、カラゲナン、ビタミンA、ARA油ならびにDHA油を加えることにより、タンパク質−脂肪スラリーを調製する。ついでホエータンパク質および炭酸カルシウムを加える。得られたタンパク質−油スラリーを、後にその他の形成スラリーと混合するまで、40から43℃で2時間以下の時間にわたり適度に攪拌しながら維持する。
【0077】
ついで該炭水化物−ミネラルスラリーを水および脱脂乾燥乳と一緒にし、10分間攪拌する。ついで該タンパク質−油スラリーを加え、得られた混合物を少なくとも10分間攪拌する。ついでルテインおよびベータ−カロテンを該混合物に加え、少なくとも15分間攪拌する。得られた混合物のpHを1N 水酸化カリウム6.68から6.75に調節する。
【0078】
1分以上かつ2時間以下の時間待った後、得られた混合物を71から82℃に加熱し、真空下で脱気し、第1段(single stage)ホモジナイザーで900から1100psigで乳化し、ついで99から110℃に加熱し、ついで再び146℃に約5秒間加熱する。該加熱混合物をフラッシュクーラーに通過させて温度を99から110℃に低下させ、ついでプレートクーラーに通過させて温度を更に71から76℃に低下させる。ついで該冷却混合物を3900から4100/400から600psigでホモジナイズし、ついで74から80℃で16秒間維持し、ついで1から7℃に冷却する。微生物学的および分析試験のためにサンプルを採取する。該混合物を攪拌下で維持する。
【0079】
水溶性ビタミン(WSV)溶液およびアスコルビン酸溶液を別々に調製し、該加工混合スラリーに加える。該ビタミン溶液は、以下の成分を攪拌下で9.4kgの水に加えることにより調製する:クエン酸カリウム、硫酸第一鉄、WSVプレミックス、L−カルニチン、リボフラビンおよびヌクレオチド−コリンプレミックス。該アスコルビン酸溶液は、クエン酸カリウムおよびアスコルビン酸を、該成分を溶解するのに十分な量の水に加えることにより調製する。ついで該ビタミンおよびアスコルビン酸溶液を該混合物に加え、該混合物のpHを45% 水酸化カリウム溶液で7から10に調節する。
【0080】
該品質管理試験の分析結果に基づき、攪拌しながら適当な量の水を該バッチに加えて所望の全固体を得る。製品のpHは、最適な製品安定性が得られるよう調節されうる。ついで、完成した製品を適当な容器内に配置し、最終滅菌に付す。
【0081】
出生後の最初の6から12ヶ月間、各乳児に7から300μg/kg/日のルテインを供給するために、得られた製剤を唯一の栄養源として乳児に与える。本明細書に記載のとおり、該製剤は網膜の健康および視覚の発達の改善をもたらす。
【0082】
実施例2.1から2.3
以下は、ダイズに基づく本発明の粉末乳児用製剤の実施例であり、該製剤の使用および製造方法を含む。各バッチの製剤成分を以下の表に示す。
【0083】
【表4】

【0084】
例示されている粉末の製造における第1工程は油混合物の調製である。ダイズ油、ココナッツ油および高オレイン酸サフラワー油を適当な容器またはタンク内で60から65℃で、攪拌しながら一緒にする。該タンクにアスコルビルパルミタートおよび混合トコフェロール、ついで脂溶性ビタミンプレミックスを、全て攪拌しながら加える。ベータ−カロテン(BASF,Mount Olive,New Jersey)およびルテイン(Kemin,Des Moines,Iowa)を該油混合物に加え、十分に分散するまで攪拌する。ついでダイズタンパク質単離物およびメチオニンを該油混合物に加え、得られた混合物を攪拌し、後に製造プロセスにおいて使用するまで54.0から60℃で維持する。
【0085】
ついで炭水化物−ミネラルスラリーを調製する。60から65℃の水に塩化カリウム、塩化ナトリウム、塩化マグネシウムおよびヨウ化カリウム、ついでリン酸二カルシウムおよびリン酸三カルシウムを、全て攪拌しながら加える。ついでコーンシロップを、攪拌しながら加え、該スラリーを、後に製造プロセスにおいて使用するまで54から60℃で維持する。
【0086】
該炭水化物−ミネラルスラリーを該油混合物に加える。必要に応じて追加的な水を加える。ARAおよびDHA油を該混合物に加える。得られた混合物のpHを、KOH溶液を使用して6.75から6.85に調節する。ついで、調節された混合物を攪拌下、54から60℃で少なくとも15分間維持する。
【0087】
ついで、得られた混合物を74から79℃に加熱し、真空下で脱気し、0から2.76Mpaの第1段ホモジナイザーで乳化し、6.2から7.6Mpaおよび2.1から3.4Mpaの第2段ホモジナイザーに通過させる。そのホモジナイズされた混合物を73から79℃で16秒間維持し、ついで1から7℃に冷却する。微生物学的および分析試験のためにサンプルを採取する。該混合物を攪拌下で維持する。
【0088】
該混合物のカルシウムレベルを、それが仕様から逸脱している場合に調節するのに使用するための炭酸カルシウム溶液を、調製することが可能である。
【0089】
微量ミネラルおよびタウリンと共に水溶性ビタミンプレミックスを含有するビタミンストック溶液を調製する。クエン酸カリウムおよび硫酸第一鉄を37から66℃の水に加える。ついで該ビタミンプレミックスを加え、該混合物を攪拌する。塩化コリンおよびカルニチンを加え、ついでこのビタミン混合物の必要量をバッチに加える。
【0090】
アスコルビン酸溶液を調製し、少なくとも10分にわたり攪拌しながら該バッチにゆっくり加える。ついで該バッチを74から79℃に予備加熱する。ついで直接蒸気注入を用いて該バッチを107から111℃で5秒間維持する。ついで該バッチを71から82℃に冷却した後、噴霧乾燥器へ送り出し、流動可能な粉末へと乾燥させる。ついで該バッチを適当な容器内にパッケージングし、酸素2.0%未満の頭隙にて密封する。
【0091】
例示されている粉末を、676kcal/リットルのカロリー密度に、水で還元する。出生後の最初の6から12ヶ月間、7から300μg/kg/日のルテインを供給するために、得られた液体製剤を唯一の栄養源として乳児に与える。本明細書に記載のとおり、該製剤は網膜の健康および視覚の発達の改善をもたらす。
【0092】
実施例3.1から3.3
以下は、乳に基づく本発明の粉末乳児用製剤の実施例であり、該製剤の使用および製造方法を含む。各バッチの製剤成分を以下の表に示す。
【0093】
【表5】


【0094】
この粉末製剤は、少なくとも2つのスラリーを調製し、ついでこれらを一緒に混合し、加熱処理し、標準化し、噴霧乾燥し、パッケージングすることにより製造する。まず、ラクトースを66から76℃の水に溶解することにより、炭水化物−ミネラルスラリーを調製する(45から50% 固体)。ついでコーンシロップを加え、溶解させ、ついで塩化マグネシウム、クエン酸カリウム、塩化ナトリウム、塩化コリンおよびクエン酸ナトリウムを、全て攪拌しながら加える。得られた炭水化物−ミネラルスラリーを、後に製造プロセスにおいて使用するまで、攪拌下、54から60℃で維持する。
【0095】
高オレイン酸サフラワー油、ココナッツ油、ダイズ油およびMCT油を40.5から49℃で一緒にし、ついでアスコルビルパルミタート、混合トコフェロール、ビタミンAパルミタートおよびビタミンADEKプレミックスを、全て攪拌しながら加えることにより、タンパク質−脂肪スラリーを調製する。ついでルテイン(Kemin,Des Moines,Iowa)を、攪拌しながら加える。ついで該スラリーにホエータンパク質濃縮物、ついで炭酸カルシウムおよび三塩基性リン酸カルシウムを、全て攪拌しながら加える。完成したタンパク質−脂肪スラリーを、その他の調製スラリーと混合するまで、適度な攪拌下、54から60℃でせいぜい12時間維持する。
【0096】
該炭水化物−ミネラルスラリーを、約50%固体の最終混合スラリーを与えるのに十分な量の水が加えられたタンクへ移す。ついで脱脂乾燥乳を該混合物に加え、可溶化する。ついで該タンパク質−脂肪スラリーを加え、該全混合スラリーを少なくとも15分間攪拌する。得られた混合物を60から65℃で維持する。該混合物pHを1N KOHで6.7から6.9に調節する。
【0097】
1分以上かつ2時間以下の時間待った後、得られた混合物を71から79℃に加熱し、真空下で脱気し、2.75から4.1Mpaで乳化し、ついで直接蒸気注入を用いて115から127℃に約5秒間加熱する。ついで該加熱混合物を87から99℃にフラッシュ冷却し、9.7から11.0/2.75から4.1Mpaでホモジナイズする。ついで、そのホモジナイズされたスラリーを1.6から7.2℃に冷却する。微生物学的および分析試験のためにサンプルを採取する。該混合物を攪拌下で維持する。
【0098】
以下の成分を必要量の水に攪拌下で加えることにより、ビタミン−微量ミネラル溶液を調製する:クエン酸カリウム、硫酸第一鉄、カルニチン、ビタミンおよび微量ミネラルプレミックス、イノシトールならびにヌクレオチドおよび酒石酸水素コリンプレミックス。ついで該ビタミン−微量ミネラル溶液を、そのホモジナイズされたスラリーに攪拌下で加える。
【0099】
クエン酸カリウムおよびアスコルビン酸を水に攪拌しながら加え、ついで該水性混合物をそのホモジナイズされたスラリーに攪拌下で加えることにより、アスコルビン酸溶液を調製する。
【0100】
該産物を65.5から77℃に予備加熱する。ついで該産物を82から90.5℃で5秒間維持した後、71から82℃にフラッシュ冷却し、噴霧乾燥器へ送り出す。該産物を噴霧乾燥して所望の自由流動性粉末を得る。製品の安定性および香味を最大にするために、得られた粉末を窒素下でパッケージングする。
【0101】
例示されている粉末を、676kcal/リットルのカロリー密度に、水で還元する。出生後の最初の6から12ヶ月間、7から300μg/kg/日のルテインを供給するために、得られた液体製剤を唯一の栄養源として乳児に与える。本明細書に記載のとおり、該製剤は網膜の健康および視覚の発達の改善をもたらす。
【0102】
実施例4.1から4.3
以下は本発明の濃縮人乳強化液の実施例であり、該製剤の使用および製造方法を含む。各バッチの製剤成分を以下の表に示す。
【0103】
【表6】

【0104】
本発明の濃縮人乳強化実施形態を形成させるために、前記表に挙げた成分を一緒にし、加工する。そのような実施形態を製造するための1つの方法を以下に記載する。
【0105】
特定されている量のココナッツ油、MCT油、ダイズ油、DHA油およびAA油を、全て攪拌しながら、32から37℃に加熱することにより、初期中間体混合物を調製する。ダイズレシチン乳化剤を該加熱混合物に攪拌しながら加え、溶解させる。ついでビタミンA、DおよびK、天然ビタミンEならびにルテインをその生成しつつある混合物に攪拌しながら加える。乳タンパク質単離物(25.8kg)ならびに特定されている量の超微小化リン酸三カルシウムおよび炭酸カルシウムを該混合物に加える。得られた中間体混合物を、後記の水性タンパク質混合物に加えるまで、適度な攪拌下、26から48℃で6時間以下の時間にわたり維持する。
【0106】
ついで、573kgの成分水を48から60℃で加熱し、ついで攪拌しながらそれに乳タンパク質単離物(38.8kg)および特定されている量のホエータンパク質濃縮物を加えることにより、水性タンパク質混合物を調製する。ついで、攪拌しながら、前記の全中間体混合物を該水性タンパク質混合物に加える。ついで、得られた混合物に以下の成分を以下の順序で加える:クエン酸カリウム、リン酸二カリウム、リン酸一カリウム、リン酸マグネシウム、塩化ナトリウム、塩化カリウム、ヨウ化カリウムおよびスクロース。5分間もの後、該混合物pHを、1N KOH溶液を使用して6.60から6.80に調節し、ついで更なる加工まで、2時間以下の時間にわたり51から60℃で維持する。
【0107】
ついで、pHが調節された該混合物を、100から500psig(約0.7MPa〜約3.4MPa)の第2段ホモジナイゼーションを伴う又は伴わない1000から4000psigの1以上の直列ホモジナイザーを使用してホモジナイズし、ついでHTST(高温短時間、74℃で16秒間)またはUHTST(超高温短時間、132から154℃で5から15秒間)のプロセスを用いる加熱処理に付す。UHTSTまたはHTSTの選択は、通常、該製剤中の成分のそれぞれの生物負荷(bioburden)の精査に基づいてなされる。適当な加熱処理の後、該バッチをプレートクーラー内で1.0から5.0℃に冷却し、ついで冷凍保持タンクに移し、ここにおいて、それを分析試験に付し、ついで、アスコルビン酸溶液ならびに水溶性ビタミンおよび微量ミネラル溶液(これらは全て、前記の冷凍バッチに加える前に別々に調製される)の添加を含む、最終的な製品の仕様への標準化に付す。
【0108】
該アスコルビン酸溶液は、特定されている量のアスコルビン酸を11.1kgの1N KOH溶液に攪拌しながら加えることにより調製する。該水溶性ビタミンおよび微量ミネラル溶液は、25.2kgの成分水を37℃から48℃に加熱することにより調製する。該水溶性ビタミンおよび微量ミネラルは、m−イノシトール、タウリン、ナイアシンアミド、硫酸亜鉛、パントテン酸カルシウム、硫酸第一鉄、硫酸第二鉄、リボフラビン、塩酸チアミン、塩酸ピリドキシン、葉酸、硫酸マンガン、ビオチン、セレン酸ナトリウムおよびシアノコバラミンを含有するプレミックスとして該水に添加する。前記のとおり、ついで両方の溶液を該冷凍バッチに、全て攪拌しながら加える。ついで、バッチ標準化の一部として、適量の成分希釈水を該バッチに加えて、31%の目標全固体レベルとなるようにし、pHを1N KOHで7.1に調節する。該バッチを、5mlの産物を含有する適当な大きさの容器内に充填する。
【0109】
例示されている人乳強化濃縮物を人乳と一緒にする(5mlの濃縮物および20から25mlの人乳)。ついで、7から300μg/kg/日のルテインを供給するために、該強化人乳を早期産児に与える。本明細書に記載のとおり、該製剤は、未熟児網膜症のリスクの軽減を含む、網膜の健康および視覚の発達の改善をもたらす。
【0110】
実施例5.1から5.3
この実施例は、本発明のそのまま摂取される早期産児用製剤の実施形態を例示する。この製剤は、ルテイン濃度が増加していること及びそれに伴いルテイン対ドコサヘキサエン酸の比が増加していること以外は、Abbott Laboratories,Columbus,Ohioから入手可能な早期産児用製剤である、早期産児用鉄製剤を伴うSimilac(登録商標)Special Care(登録商標)Advance(登録商標)に類似している。
【0111】
該早期産児用製剤は、脱脂乳、コーンシロップ固体、ラクトース、中鎖トリグリセリド、ホエータンパク質濃縮物、ダイズ油、ココナッツ油、シー・コーニイ(C.cohnii)油(ドコサヘキサエン酸源)、エム・アルピナ(M.alpina)油(アラキドン酸源)、リン酸カルシウム、炭酸カルシウム、クエン酸カリウム、アスコルビン酸、塩化マグネシウム、ダイズレシチン、モノ−およびジグリセリド、m−イノシトール、クエン酸ナトリウム、カラゲナン、硫酸第一鉄、酒石酸水素コリン、タウリン、塩化コリン、ナイアシンアミド、d−アルファ−トコフェリルアセタート、L−カルニチン、硫酸亜鉛、塩化カリウム、二塩基性リン酸カリウム、パントテン酸カルシウム、硫酸第二銅、ビタミンAパルミタート、リボフラビン、塩酸塩化チアミン、塩酸ピリドキシン、葉酸、ベータ−カロテン、硫酸マンガン、ビオチン、フィロキノン、セレン酸ナトリウム、ビタミンD3、シアノコバラミンおよびヌクレオチド(シチジン5’−一リン酸、グアノシン5’−一リン酸二ナトリウム、ウリジン5’−一リン酸二ナトリウム、アデノシン5’−一リン酸)を含む。
【0112】
以下の栄養プロファイルを得るために、前記成分を通常の方法により一緒に製剤化する。
【0113】
【表7】

【0114】
例示されている、そのまま摂取される製剤(812kcal/リットルのカロリー密度)を、1日当たり7から300mcg/kgのルテインを供給するために乳児に投与する。投与された製剤は、本明細書に記載のとおり、眼の健康を改善し、未熟児網膜症のリスクを軽減するために早期産児に適用された場合に特に有用であり、自然光または人工光(特に胆管光)から眼を保護するのを助ける。
【0115】
実験
母乳栄養児における血漿中ルテイン濃度と製剤摂取乳児における血漿中ルテイン濃度とを比較するために、研究を行う。後者には、32.6mcg/リットル(L1)、52.6mcg/リットル(L2)または14.6mcg/リットル(CTRL)のルテイン濃度により特徴づけられる3つの製剤のうちの1つを与えた。該研究群および得られた血漿中ルテイン濃度を以下の表に要約する。
【0116】
【表8】

【0117】
血漿中ルテイン濃度(研究の第56日におけるもの)を該研究における一次変数として使用する。一次比較は、L2製剤群とCTRL製剤群との間の血漿中ルテイン濃度における相違である。二次比較は、製剤群(CTRL、L1、L2)間の血漿中ルテイン濃度における相違および製剤群と人乳群との間の相違を含むものであった。合計85名(CTRL,n=18;L1,n=22;L2,n=19;HM,n=26)の乳児からの第56日の血漿中ルテイン濃度をこれらの分析において使用し、結果を以下の表に平均±SEMとして示す。
【0118】
L2製剤群の乳児は、L1およびCTRL製剤群の乳児より有意に高い(p<0.05)血漿中ルテイン濃度を有する。L1製剤群とCTRL製剤群との間では血漿中ルテインは異ならない。人乳群は、CTRL(p<0.0001)、L1(p<0.0001)およびL2(p=0.0052)製剤群より高い血漿中ルテイン濃度を有する。血漿中ルテイン濃度はルテイン摂取量と有意に相関している(r=0.436,p=0.0014)。ルテイン摂取および該研究からの血漿応答も図1に要約する。
【0119】
該研究からのデータは、乳児用製剤からのルテインのバイオアベイラビリティが人乳からのものより驚くほど低いことを示している(図1を参照されたい)。したがって、人乳の摂取により得られるものに類似した、乳児における血漿中ルテイン濃度を、乳児用製剤により得るためには、少なくとも約50mcg/リットル、好ましくは100mcg/リットルから約200mcg/リットルのルテインを含有するよう乳児用製剤を製剤化しなければならない。
【特許請求の範囲】
【請求項1】
ドコサヘキサエン酸、およびそのまま摂取される形態に基づき少なくとも約50mcg/リットルのルテインを含む、脂肪、タンパク質、炭水化物、ビタミンおよびミネラルを含んでなる乳児用製剤であって、ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比が約1:2から約10:1であり、該製剤が卵リン脂質を含有しない、乳児用製剤。
【請求項2】
組成物が約50から約1150mcg/リットルの添加ルテインを含む、請求項1の乳児用製剤。
【請求項3】
製剤が約100から約200mcg/リットルのルテインを含む、請求項1の乳児用製剤。
【請求項4】
製剤が約100から約200mcg/リットルのルテインを含む、請求項1の乳児用製剤。
【請求項5】
ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比が約1.5:1から約10:1である、請求項1の乳児用製剤。
【請求項6】
ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比が約2:1から約5:1である、請求項1の乳児用製剤。
【請求項7】
製剤が約20から30kcal/流体オンスのカロリー密度を有する、請求項1の乳児用製剤。
【請求項8】
製剤が単一源からの遊離ルテインとゼアキサンチンとの組合せを含み、該源がタゲテス・エレクタ(Tagetes erecta)の結晶抽出物であり、該遊離ルテインが該組合せの85重量%から95重量%に相当し、該遊離ゼアキサンチンが該組合せの約5重量%から約15重量%に相当する、請求項1の乳児用製剤。
【請求項9】
製剤が粉末である、請求項1の乳児用製剤。
【請求項10】
製剤が液体である、請求項1の乳児用製剤。
【請求項11】
ルテインが少なくとも25重量%の添加ルテインを含む、請求項1の乳児用製剤。
【請求項12】
そのまま摂取される形態に基づき、
(a)約54から約108gm/リットルの炭水化物、
(b)約20から約54gm/リットルの脂肪、
(c)約7から約24gm/リットルのタンパク質、
(d)約100から約200mcg/リットルのルテイン、および
(e)ドコサヘキサエン酸
を含んでなる乳児用製剤であって、ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比が約2:1から約5:1であり、該製剤が卵リン脂質を含有しない、乳児用製剤。
【請求項13】
製剤が単一源からの遊離ルテインとゼアキサンチンとの組合せを含み、該源がタゲテス・エレクタ(Tagetes erecta)の結晶抽出物であり、該遊離ルテインが該組合せの85重量%から95重量%に相当し、該遊離ゼアキサンチンが該組合せの約5重量%から約15重量%に相当する、請求項12の乳児用製剤。
【請求項14】
早期産児における未熟児網膜症のリスクを軽減するための方法であって、未熟児網膜症のリスクの軽減を要する早期産児に請求項1記載の製剤を投与して約7から約300mcg/kg/日のルテインを該乳児に供給することを含んでなる方法。
【請求項15】
早期産児における未熟児網膜症のリスクを軽減するための方法であって、未熟児網膜症のリスクの軽減を要する早期産児に請求項1記載の製剤を投与して約14から約220mcg/kg/日のルテインを該乳児に供給することを含んでなる方法。
【請求項16】
乳児における網膜の健康および視覚の発達を促進するための方法であって、網膜の健康および視覚の発達の促進を要する乳児に請求項1記載の製剤を投与して約7から約300mcg/kg/日のルテインを該乳児に供給することを含んでなる方法。
【請求項17】
乳児における網膜の健康および視覚の発達を促進するための方法であって、網膜の健康および視覚の発達の促進を要する乳児に請求項1記載の製剤を投与して約7から約300mcg/kg/日のルテインを該乳児に供給することを含んでなる方法。
【請求項1】
ドコサヘキサエン酸、およびそのまま摂取される形態に基づき少なくとも約50mcg/リットルのルテインを含む、脂肪、タンパク質、炭水化物、ビタミンおよびミネラルを含んでなる乳児用製剤であって、ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比が約1:2から約10:1であり、該製剤が卵リン脂質を含有しない、乳児用製剤。
【請求項2】
組成物が約50から約1150mcg/リットルの添加ルテインを含む、請求項1の乳児用製剤。
【請求項3】
製剤が約100から約200mcg/リットルのルテインを含む、請求項1の乳児用製剤。
【請求項4】
製剤が約100から約200mcg/リットルのルテインを含む、請求項1の乳児用製剤。
【請求項5】
ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比が約1.5:1から約10:1である、請求項1の乳児用製剤。
【請求項6】
ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比が約2:1から約5:1である、請求項1の乳児用製剤。
【請求項7】
製剤が約20から30kcal/流体オンスのカロリー密度を有する、請求項1の乳児用製剤。
【請求項8】
製剤が単一源からの遊離ルテインとゼアキサンチンとの組合せを含み、該源がタゲテス・エレクタ(Tagetes erecta)の結晶抽出物であり、該遊離ルテインが該組合せの85重量%から95重量%に相当し、該遊離ゼアキサンチンが該組合せの約5重量%から約15重量%に相当する、請求項1の乳児用製剤。
【請求項9】
製剤が粉末である、請求項1の乳児用製剤。
【請求項10】
製剤が液体である、請求項1の乳児用製剤。
【請求項11】
ルテインが少なくとも25重量%の添加ルテインを含む、請求項1の乳児用製剤。
【請求項12】
そのまま摂取される形態に基づき、
(a)約54から約108gm/リットルの炭水化物、
(b)約20から約54gm/リットルの脂肪、
(c)約7から約24gm/リットルのタンパク質、
(d)約100から約200mcg/リットルのルテイン、および
(e)ドコサヘキサエン酸
を含んでなる乳児用製剤であって、ルテイン(mcg)対ドコサヘキサエン酸(mg)の重量比が約2:1から約5:1であり、該製剤が卵リン脂質を含有しない、乳児用製剤。
【請求項13】
製剤が単一源からの遊離ルテインとゼアキサンチンとの組合せを含み、該源がタゲテス・エレクタ(Tagetes erecta)の結晶抽出物であり、該遊離ルテインが該組合せの85重量%から95重量%に相当し、該遊離ゼアキサンチンが該組合せの約5重量%から約15重量%に相当する、請求項12の乳児用製剤。
【請求項14】
早期産児における未熟児網膜症のリスクを軽減するための方法であって、未熟児網膜症のリスクの軽減を要する早期産児に請求項1記載の製剤を投与して約7から約300mcg/kg/日のルテインを該乳児に供給することを含んでなる方法。
【請求項15】
早期産児における未熟児網膜症のリスクを軽減するための方法であって、未熟児網膜症のリスクの軽減を要する早期産児に請求項1記載の製剤を投与して約14から約220mcg/kg/日のルテインを該乳児に供給することを含んでなる方法。
【請求項16】
乳児における網膜の健康および視覚の発達を促進するための方法であって、網膜の健康および視覚の発達の促進を要する乳児に請求項1記載の製剤を投与して約7から約300mcg/kg/日のルテインを該乳児に供給することを含んでなる方法。
【請求項17】
乳児における網膜の健康および視覚の発達を促進するための方法であって、網膜の健康および視覚の発達の促進を要する乳児に請求項1記載の製剤を投与して約7から約300mcg/kg/日のルテインを該乳児に供給することを含んでなる方法。
【図1】


【図2】




【図2】


【公開番号】特開2012−131802(P2012−131802A)
【公開日】平成24年7月12日(2012.7.12)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−22860(P2012−22860)
【出願日】平成24年2月6日(2012.2.6)
【分割の表示】特願2008−537844(P2008−537844)の分割
【原出願日】平成18年10月23日(2006.10.23)
【出願人】(391008788)アボット・ラボラトリーズ (650)
【氏名又は名称原語表記】ABBOTT LABORATORIES
【Fターム(参考)】
【公開日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願番号】特願2012−22860(P2012−22860)
【出願日】平成24年2月6日(2012.2.6)
【分割の表示】特願2008−537844(P2008−537844)の分割
【原出願日】平成18年10月23日(2006.10.23)
【出願人】(391008788)アボット・ラボラトリーズ (650)
【氏名又は名称原語表記】ABBOTT LABORATORIES
【Fターム(参考)】
[ Back to top ]

