ドセタキセル耐性または感受性の測定方法
【課題】タキソイドファミリー分子に対する患者の応答を、対照と比較した特異的遺伝子マーカーの増減を測定することで予測またはモニタリングする方法の開発。
【解決手段】タキソイドファミリー分子に対する患者の応答を、特定の遺伝子マーカーの核酸またはタンパク質レベルを測定し、試験試料において測定された遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する感受性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするための方法の提供、およびこれらのレベルを対照または参照マーカーと比較することで予測またはモニタリングするキット。
【解決手段】タキソイドファミリー分子に対する患者の応答を、特定の遺伝子マーカーの核酸またはタンパク質レベルを測定し、試験試料において測定された遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する感受性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするための方法の提供、およびこれらのレベルを対照または参照マーカーと比較することで予測またはモニタリングするキット。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、タキソイドファミリー分子に対する患者の応答を、対照と比較した特異的遺伝子マーカーの増減を測定することで予測またはモニタリングすることができる、新規の、有用な、これまで知られていない方法に関する。本発明はまた、タキソイドファミリー分子に対する患者の応答を、特定の遺伝子マーカーの核酸またはタンパク質レベルを測定すること、およびこれらのレベルを対照または参照マーカーと比較することで予測またはモニタリングするキットも提供する。
【背景技術】
【0002】
ドセタキセルは、乳癌、肺癌および卵巣癌の治療に幅広く使用されている抗有糸分裂剤であり、これほどではないが頭頚部癌、胃癌および前立腺癌を治療するのに使用されている(Hong、Oncology 16:9頁、2002年)。ドセタキセルは、ベータ−チューブリンに結合し、アルファ−およびベータ−チューブリンへテロダイマーの解離を抑制して微小管動態を阻害することで腫瘍増殖を抑制する(RingelおよびHorwitz、J Natl Cancer Inst 83:288頁、1991年)。ドセタキセルおよび関連するタキサンであるパクリタキセルの抗腫瘍活性は、紡錘体の微小管を標的とすることにより生じ、染色体の整列および分離を抑制し、細胞周期の進行を阻害し、アポトーシス経路を活性化する(Wangら、Cancer 88:2619頁、2000年)。パクリタキセルのプロアポトーシス活性は、p53/p21waf1/Cip1、raf/rasおよびマイトジェン活性化プロテインキナーゼ(MAPK)を伴う細胞シグナル伝達事象を介して、Bcl−2のリン酸化および不活性化に関連している(Wangら、Cancer 88:2619頁、2000年)。ドセタキセルは、パクリタキセルより強力な抗癌剤であるが、この細胞毒性に関わる経路は、パクリタキセルほど明確になっていない(Katsumata、Br J Cancer 89:S9頁、2003年)。ドセタキセル誘導アポトーシスは、Bcl−2リン酸化およびカスパーゼ−3活性化を伴うメカニズムを介して、任意の細胞系で観察されている(Kolfschotenら、Biochem Pharmacol 63:733頁、2002年)。異なる培養系においてタキサン誘導細胞殺傷を調節する他のタンパク質には、HeLa細胞のAurora−A(Anandら、Cancer Cell 3:51頁、2003年)、乳癌細胞のHER−2(Tanabeら、Int J Oncol 22:875頁、2003年)、膠芽腫細胞のp21waf1/Cip1(Liら、J Biol Chem 277:11352頁、2002年)および卵巣癌細胞のJNK/MKK1(Leeら、J Biol Chem 273:28253頁、1998年)が挙げられる。
【発明の概要】
【発明が解決しようとする課題】
【0003】
この分野には、ドセタキセル耐性を媒介する、薬剤の標的になり得るタンパク質を同定することで、創薬にこれらを利用して、タンパク質のインビボでの機能を抑制し、抗腫瘍剤化学療法に細胞を感作させる可能性のある試薬(低分子、siRNAなど)を同定できるようにする必要が依然として残っている。この分野にはまた、どの患者が、抗腫瘍ドセタキセル薬に基づく化学療法に応答するか否かを、化学療法による治療の前に確信をもって予測できるアッセイを行う必要も残っている。出願者は、本明細書で、ドセタキセルに対する耐性および/または感受性を予測できる新規アッセイを説明し、癌における薬剤耐性を抑制する新規療法を開発するためのスクリーニングアッセイを提供する。
【課題を解決するための手段】
【0004】
本発明により、タキソイドファミリー分子に対する患者の応答を、患者および対照にお
ける特異的遺伝子マーカーの活性化および/または発現レベルを比較することでモニタリングおよび/または予測する、新規で有用な方法が提供される。
【0005】
1つの実施形態では、本発明は、
a)患者の癌領域から試験試料を得る工程と、
b)対照試料を得る工程と、
c)1種またはそれ以上の遺伝子マーカーのレベルを測定する工程と、
d)試験試料および対照試料における前記1種またはそれ以上の遺伝子マーカーの測定レベルを比較する工程と
を含み、対照試料と比較した場合の、試験試料において測定された前記1種またはそれ以上の遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する耐性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするための方法を提供する。
【0006】
本発明のこの態様では、特定の遺伝子マーカーとして以下が挙げられる。
BubR1,Homo sapiens similar to protein kinase(BUBR1)mRNA,complete cds(BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列)(GenBank受託番号:AF046079)、
Mad2,Homo sapiens mRNA for MAD2 protein(Mad2、ホモサピエンスmRNA、MAD2タンパク質対応)(GenBank受託番号:AJ000186)、
Mps1,Homo sapiens TTK protein kinase(TTK),mRNA(Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA)(GenBank受託番号:NM_003318)、
GEFT for Rac1/CDC42,Homo sapiens RAC/CDC42 exchange factor(GEFT),transcript variant 2,mRNA(GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA)(GenBank受託番号:NM_133483)、
Bub1,Homo sapiens BUB1 budding uninhibited by benzimidazoles 1 homolog(yeast)(BUB1),mRNA(Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻害されず(酵母)(BUB1)、mRNA)(GenBank受託番号:NM_004336)、
hSepharase,Homo sapiens extra spindle poles like 1(S.cerevisiae)(ESPL1),mRNA(hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESPL1)、mRNA)(GenBank受託番号:NM_012291)、
CamKIId,Homo sapiens calcium/calmodulin−dependent protein kinase(CaM kinase)II delta(CAMK2D),transcript variant 3,mRNA(CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA)(GenBank受託番号:NM_001221)、
CDK6,Homo sapiens cyclin−dependent kinase 6(CDK6),mRNA(CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA)(GenBank受託番号:NM_001259)、および
GRB2,Homo sapiens growth factor recepto
r−bound protein 2(GRB2),transcript variant 1,mRNA(GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA)(GenBank受託番号:NM_002086)
【0007】
別の実施形態では、本発明は、
a)患者の癌領域から試験試料を得る工程と、
b)対照試料を得る工程と、
c)1種またはそれ以上の遺伝子マーカーのレベルを測定する工程と、
d)試験試料および対照試料における前記1種またはそれ以上の遺伝子マーカーの測定レベルを比較する工程と
を含み、対照試料と比較した場合の、試験試料において測定された前記1種またはそれ以上の遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する感受性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするための方法に関する。
【0008】
本発明のこの特定の態様では、1種またはそれ以上の遺伝子マーカーは、以下からなる群から選択することができる。
P21(Waf1),Homo sapiens cyclin−dependent
kinase inhibitor 1A(p21,Cip1)(CDKN1A),transcript variant 1,mRNA(P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA)(GenBank受託番号:NM_000389)、
Pim−1,Homo sapiens pim−1 oncogene(PIM1),mRNA(Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA)(GenBank受託番号:NM_002648)、
GBP−1,Homo sapiens guanylate binding protein 1,interferon−inducible,67kDa(GBP1),mRNA(GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導性、67kDa(GBP1)、mRNA)(GenBank受託番号:NM_002053)、
RXRA,Homo sapiens retinoid X receptor,alpha(RXRA),mRNA(RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA)(GenBank受託番号:NM_002957)、
SPF45,Homo sapiens RNA binding motif protein 17(RBM17),mRNA(SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA)(GenBank受託番号:NM_032905)、
Hec1,Homo sapiens kinetochore associated 2(KNTC2),mRNA(Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA)(GenBank受託番号:NM_006101)、
Raf1,Human mRNA for raf oncogene(Raf1、ヒトmRNA、raf発癌遺伝子対応)(GenBank受託番号:X03484)、
Aurora A,Homo sapiens aurora−related kinase 1(ARK1)mRNA,complete cds(Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列)(GenBank受託番号:AF008551)、
TACC3,Homo sapiens transforming,acidic coiled−coil containing protein 3(TACC3),mRNA(TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA)(GenBank受託番号:NM_006342)、
RelB,Homo sapiens v−rel reticuloendotheliosis viral oncogene homolog B,nuclear factor of kappa light polypeptide gene enhancer in B−cells 3(avian)(RELB),mRNA(RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA)(GenBank受託番号:NM_006509)、
PRKCD,Homo sapiens protein kinase C,delta(PRKCD),transcript variant 1,mRNA(PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA)(GenBank受託番号:NM_006254)、
BRAF35,Homo sapiens high−mobility group
20B(HMG20B),mRNA(BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA)(GenBank受託番号:NM_006339)、
HSPA1L,Homo sapiens heat shock 70kDa protein 1A(HSPA1A),mRNA(HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA)(GenBank受託番号:NM_005345)、
STK11,Homo sapiens serine/threonine kinase 11(Peutz−Jeghers syndrome)(STK11),mRNA(STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツジェガース症候群)(STK11)、mRNA)(GenBank受託番号:NM_000455)、および
MKK3,Homo sapiens MAP kinase kinase 3(MKK3)mRNA,complete cds(MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列)(GenBank受託番号:L36719)。
【0009】
さらなる実施形態では、本発明は、
a)患者の癌領域から試験試料を得る工程と、
b)BubR1,Homo sapiens similar to protein
kinase(BUBR1)mRNA,complete cds(BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列)(GenBank受託番号:AF046079)、
Mad2,Homo sapiens mRNA for MAD2 protein(Mad2、ホモサピエンスmRNA、MAD2タンパク質対応)(GenBank受託番号:AJ000186)、
Mps1,Homo sapiens TTK protein kinase(TTK),mRNA(Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA)(GenBank受託番号:NM_003318)、
GEFT for Rac1/CDC42,Homo sapiens RAC/CDC42 exchange factor(GEFT),transcript variant 2,mRNA(GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA)(GenBank受託番号:NM_133483)、
Bub1,Homo sapiens BUB1 budding uninhibited by benzimidazoles 1 homolog(yeast)(BUB1),mRNA(Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻害されず(酵母)(BUB1)、mRNA)(GenBank受託番
号:NM_004336)、
hSepharase,Homo sapiens extra spindle poles like 1(S.cerevisiae)(ESPL1),mRNA(hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESPL1)、mRNA)(GenBank受託番号:NM_012291)、
CamKIId,Homo sapiens calcium/calmodulin−dependent protein kinase(CaM kinase)II delta(CAMK2D),transcript variant 3,mRNA(CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA)(GenBank受託番号:NM_001221)、
CDK6,Homo sapiens cyclin−dependent kinase 6(CDK6),mRNA(CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA)(GenBank受託番号:NM_001259)、および
GRB2,Homo sapiens growth factor receptor−bound protein 2(GRB2),transcript variant 1,mRNA(GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA)(GenBank受託番号:NM_002086)からなる群から選択される1種またはそれ以上の遺伝子マーカーのレベルを測定する工程と、
c)GAPDH,Homo sapiens glyceraldehyde−3−phosphate dehydrogenase(GAPD),mRNA(GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA)(GenBank受託番号:NM_002046)、および
RPS9,Homo sapiens cDNA clone IMAGE:6647283、partial cds(RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列)(GenBank受託番号:BC071941)
からなる群から選択される1種またはそれ以上の参照遺伝子マーカーのレベルを測定する工程と、
d)試験試料における前記1種またはそれ以上の遺伝子マーカーおよび前記1種またはそれ以上の参照遺伝子マーカーの測定レベルを比較する工程と
を含み、
前記1種またはそれ以上の参照遺伝子マーカーレベルと比較した場合の、前記1種またはそれ以上の遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する耐性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするための方法に関する。
【0010】
本発明のさらなる実施形態は、
a)患者の癌領域から試験試料を得る工程と、
b)P21(Waf1),Homo sapiens cyclin−dependent kinase inhibitor 1A(p21,Cip1)(CDKN1A),transcript variant 1,mRNA(P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA)(GenBank受託番号:NM_000389)、
Pim−1,Homo sapiens pim−1 oncogene(PIM1),mRNA(Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA)(GenBank受託番号:NM_002648)、
GBP−1,Homo sapiens guanylate binding protein 1,interferon−inducible,67kDa(GBP1)
,mRNA(GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導性、67kDa(GBP1)、mRNA)(GenBank受託番号:NM_002053)、
RXRA,Homo sapiens retinoid X receptor,alpha(RXRA),mRNA(RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA)(GenBank受託番号:NM_002957)、
SPF45,Homo sapiens RNA binding motif protein 17(RBM17),mRNA(SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA)(GenBank受託番号:NM_032905)、
Hec1,Homo sapiens kinetochore associated 2(KNTC2),mRNA(Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA)(GenBank受託番号:NM_006101)、
Raf1,Human mRNA for raf oncogene(Raf1、ヒトmRNA、raf発癌遺伝子対応)(GenBank受託番号:X03484)、
Aurora A,Homo sapiens aurora−related kinase 1(ARK1)mRNA,complete cds(Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列)(GenBank受託番号:AF008551)、
TACC3,Homo sapiens transforming,acidic coiled−coil containing protein 3(TACC3),mRNA(TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA)(GenBank受託番号:NM_006342)、
RelB,Homo sapiens v−rel reticuloendotheliosis viral oncogene homolog B,nuclear factor of kappa light polypeptide gene enhancer in B−cells 3(avian)(RELB),mRNA(RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA)(GenBank受託番号:NM_006509)、
PRKCD,Homo sapiens protein kinase C,delta(PRKCD),transcript variant 1,mRNA(PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA)(GenBank受託番号:NM_006254)、
BRAF35,Homo sapiens high−mobility group
20B(HMG20B),mRNA(BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA)(GenBank受託番号:NM_006339)、
HSPA1L,Homo sapiens heat shock 70kDa protein 1A(HSPA1A),mRNA(HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA)(GenBank受託番号:NM_005345)、
STK11,Homo sapiens serine/threonine kinase 11(Peutz−Jeghers syndrome)(STK11),mRNA(STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツジェガース症候群)(STK11)、mRNA)(GenBank受託番号:NM_000455)、および
MKK3,Homo sapiens MAP kinase kinase 3(MKK3)mRNA,complete cds(MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列)(GenBank受託番号:L36719)
からなる群から選択される1種またはそれ以上の遺伝子マーカーのレベルを測定する工程と、
c)GAPDH,Homo sapiens glyceraldehyde−3−phosphate dehydrogenase(GAPD),mRNA(GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA)(GenBank受託番号:NM_002046)、および
RPS9,Homo sapiens cDNA clone IMAGE:6647283、partial cds(RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列)(GenBank受託番号:BC071941)
からなる群から選択される1種またはそれ以上の参照遺伝子マーカーのレベルを測定する工程と、
d)試験試料における前記1種またはそれ以上の遺伝子マーカーおよび前記1種またはそれ以上の参照遺伝子マーカーの測定レベルを比較する工程と
を含み、
前記1種またはそれ以上の参照遺伝子マーカーレベルと比較した場合の、前記1種またはそれ以上の遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する感受性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするための方法に関する。
【0011】
本発明は、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするための方法に関する。この、本発明のさらなる実施形態には、タキソイドファミリー分子であるパクリタキセル、ドセタキセルXRP9881およびXRP6258が含まれる。
【0012】
本発明で説明される遺伝子マーカーは、以下でさらに詳細に説明される様々な方法により、RNA、DNAまたはタンパク質のレベルを測定することで評価することができる。本発明の他の実施形態は、タキソイドファミリー分子に対する患者の応答を予測またはモニタリングするためのキットに関する。
【0013】
本発明の上記態様および他の態様、特徴、および利点は、添付図面と併せて以下の詳細な説明からさらに理解されるであろう。
【図面の簡単な説明】
【0014】
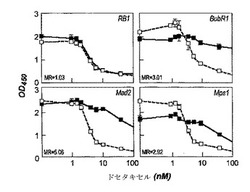
【図1】ダウンレギュレーションによりドセタキセル耐性をもたらす遺伝子の特性を示す図である。ドセタキセルは、対照siRNA(白い四角)に比べ、RB1、BubR1、Mad2およびMps1のsiRNA(黒い四角)をトランスフェクトされたHCT116細胞に対し用量反応曲線を描いた。RB1は、スクリーニングでスコア化されなかったsiRNAの一例であった。細胞の生存は、WST−1添加後、吸光度450nMで測定した。最小比(MR)は、40nMドセタキセルにおける対照に対する遺伝子のWST−1値である。
【図2】対照shRNA(白い四角)と比較した、BubR1およびMps1のshRNA(黒い四角)の用量反応曲線を示す図である。
【図3】BubR1およびMps1のshRNAをそれぞれ含有する細胞におけるBubR1およびMps1のmRNAレベルに関するTaqManリアルタイムPCR分析を示す図である。
【図4】ドセタキセル処理の有無による、Mad2、BubR1およびMps1のsiRNAをトランスフェクトされたHCT116細胞に関する、細胞の生存および形態を示す図である。トランスフェクション24時間後、細胞は未処理のまま(−ドセタキセル)または200nMドセタキセルで処理(+ドセタキセル)され、処理16時間後および72時間後の生細胞を視覚化するためカルセイン−AMで染色した。
【図5】ドセタキセル処理後、Mad2、BubR1およびMps1および対照のsiRNAをトランスフェクトされたHCT116細胞に関する、有糸分裂指数を示す図である。トランスフェクション24時間後、細胞を、200nMドセタキセルで16時間および72時間処理し、処理した。有糸分裂細胞は、リン酸化ヒストンH3抗体により検出され、ここでは細胞核上の赤い点状染色として示された(有糸分裂指数キット、Cellomics)。核は、ヘキスト染料により青色に染色された。
【図6】Mps1、BubR1およびMad2のsiRNAをそれぞれトランスフェクトされたHCT116細胞におけるMps1、BubR1およびMad2のmRNAに関するTaqManリアルタイムPCR分析を示す図である。
【図7】3つの有糸分裂チェックポイント遺伝子siRNAをトランスフェクトされたHCT116細胞の細胞周期分析を示す図である。Mps1、BubR1およびMad2のsiRNAをトランスフェクション後、細胞を未処理(−ドセタキセル)とするかまたは200nMドセタキセルで24時間処理(+ドセタキセル)した。ドセタキセル添加72時間後、細胞を収集し、細胞周期を分析した。ピークを上回る数は、2N、4N、8N、16Nまたは32NなどのDNA量を示している。
【図8】安定したノックダウン細胞株によるコロニー形成細胞生存アッセイを示す図である。BubR1またはベクター対照のshRNAを含有するHCT116細胞を、10cm皿に播種し、5nMドセタキセル中で10日間維持した。コロニーは、PBSで洗浄し、クリスタルバイオレットで染色した。
【図9】ダウンレギュレーションによりドセタキセル感受性の増加をもたらす遺伝子のいくつかの用量反応曲線を示す図である。ドセタキセルは、対照siRNA(白い四角)に比べ、RB1、Pim−1、p21、Aurora AおよびTACC3のsiRNA(黒い四角)をトランスフェクトしたHCT116細胞に対し用量反応曲線を描いた。最小比(MR)は、40nMドセタキセル濃度における対照のWST−1読み出し値に対する遺伝子のWST−1読み出し値の比である。IC50(IR)比は、対照のIC50に対する遺伝子のIC50の比である。
【図10】ベクター対照(白い四角)と比較した、Aurora AのshRNA(黒い四角)の用量反応曲線を示す図である。
【図11】Aurora AのshRNAを含有する細胞におけるAurora AのmRNAレベルに関するTaqManリアルタイムPCR分析を示す図である。
【図12】対照siRNA(白い四角)と比較した、Pim−1およびTACC3のsiRNA(黒い四角)をトランスフェクトしたHCT116細胞の増殖の差を示す図である。Pim−1、TACC3および対照siRNAをトランスフェクション後様々な時点で、6ウェルプレートに残存している細胞数。
【図13】siRNAトランスフェクション後、Pim−1およびTACC3のmRNAレベルに関するTaqMan分析を示す図である。
【図14】Pim−1およびBubR1のsiRNAをトランスフェクトしたHCT116細胞における活性カスパーゼ−3レベルを示す図である。活性カスパーゼ−3レベルは、活性カスパーゼ−3Beadmatesキット(Upstate)による蛍光強度として示された。3つのドセタキセル濃度、0、5および40nM、および3つの時点であるドセタキセル添加後24、48および72時間が調べられた。
【図15】Pim−1およびBubR1のsiRNAをトランスフェクトしたHCT116細胞におけるAKTリン酸化レベルを示す図である。リン酸化AKTレベルおよび全AKTレベルの比は、ビーズベースのアッセイ(Biosource)により定量された。トランスフェクション24時間後、細胞は未処理のままとするか、または5および40nMドセタキセルで処理した。ドセタキセル処理48時間後、細胞溶解物を分析した。リン酸化レベルは、全AKT(t−AKT)に対するリン酸化AKT(p−AKT)の比として算出した。
【図16】トランスフェクション48時間後のPim−1およびBubR1レベルの低下を示すウェスタンブロットの図である。
【発明を実施するための最良の形態】
【0015】
本発明は、被験対象がタキソイドファミリーの薬剤に耐性であるかまたは感受性であるかを予測することができる遺伝子マーカーの、出願者による同定に広く基づいている。細胞ベースのRNA干渉(RNAi)スクリーニングにより、出願者は、ドセタキセルに対する薬剤耐性または感受性が、特定の遺伝子マーカーと関連があることを認めた。
【0016】
本明細書および特許請求の範囲を通じて、数多くの用語および語句が使用されていることが注目される。これらの用語および語句の定義は、以下の通りである。
【0017】
本明細書では、「予後」という用語は、薬剤耐性の他、再発、転移、および腫瘍性疾患を含め、癌に起因する死または進行の予測または見込みを言う。
【0018】
本明細書では、「予測」という用語は、患者がある薬剤または一連の薬剤に対し、好ましいまたは好ましくない応答を示す見込みを言う。また、患者が、原発腫瘍の外科的除去および/または化学療法後、癌が再発することなく一定の期間生存するかどうかなどの応答の程度も言う。本発明により想定される予測方法は、任意の特定の患者に対し、最も適切な治療法、特にタキソイドファミリーの化学療法薬を選択することにより治療決定を行うために、臨床的に用いることができる。本発明の予測方法は、患者が、所与の薬剤または薬剤併用による化学療法、および/または放射線療法などの治療法に良好に応答する見込みがあるかどうか、または化学療法もしくは他の治療法を中止した後に患者から長期生存する見込みがあるかどうかを予測する上で貴重なツールとなる。
【0019】
本明細書では、「腫瘍」という用語は、悪性または良性にかかわらず、すべての新生細胞の成長および増殖、およびすべての前癌性および癌性の細胞ならびに組織のことを言う。
【0020】
本明細書では、「癌」および「癌性」という用語は、一般に未制御な細胞の成長を特徴とする、哺乳類における生理的状態を言う。癌の例としては、以下が挙げられるが、これらに限定されない。乳癌、結腸癌、肺癌、前立腺癌、肝細胞癌、胃癌、膵臓癌、子宮頸癌および卵巣癌、肝臓癌、膀胱癌、尿管癌、癌腫、メラノーマ、膠芽細胞腫および髄芽腫を含む脳癌、胆道癌、絨毛腫、食道癌、胃癌、急性リンパ性および骨髄性白血病を含む血液腫瘍、多発性骨腫、AIDS関連白血病および成人T細胞白血病リンパ腫、ボーエン病およびページェット病を含む上皮内腫瘍、ホジキン病およびリンパ球性リンパ腫を含むリンパ腫、神経芽腫、扁平上皮癌を含む口腔癌、平滑筋肉腫、横紋筋肉腫、脂肪肉腫、線維肉腫、および骨肉腫を含む肉腫、メラノーマ、カポジ肉腫、基底細胞癌、および扁平上皮癌を含む皮膚癌、精上皮腫、非精上皮腫(奇形腫、絨毛腫)、間質腫瘍、および生殖細胞腫瘍などの生殖腫瘍を含む睾丸癌、甲状腺癌(thyroid adenocarcinoma)および髄様癌を含む甲状腺癌(thyroid cancer)、腺癌およびウイルムス腫瘍を含む腎臓癌。
【0021】
本明細書では、「患者」という用語は、好ましくはヒトを言うが、ヒト以外の霊長類、ウシ、ウマ、ブタ、ヒツジ、ヤギ、イヌ、ネコまたはげっ歯類を含めてもよい。好ましくは、対象は、癌であることが疑われる、または癌もしくは例えば、癌の家族歴があるなど癌を発症するハイリスク群にあると診断されたヒトである。本発明の好ましい実施形態では、癌は、乳癌である。癌であることが疑われる対象を特定する方法には、指診、生検、対象の家族の病歴、対象の病歴、またはマンモグラフィー、磁気共鳴分光法、もしくは陽電子放出断層撮影法などのいくつかの画像技術を挙げることができる。癌の診断方法および癌診断の臨床特性は、医術における当業者に公知である。
【0022】
本明細書では、「試料」とは、関連医術の当業者に公知の方法を用いて得られた組織のことである。生検などの方法には、グロスアポーショニングオブアマス(gross apportioning of a mass)、マイクロダイセクション、レーザーベースのマイクロダイセクション、または他の当業者に公知の細胞分離法が含まれる。罹患組織の生検材料には、多様な細胞型、および使用される診断方法の多様な感受性があるため、分析に必要な試料サイズは、1、10、50、100、200、300、500、1000、5000、10,000〜50,000個またはこれを上回る細胞となり得る。適切な試料サイズは、細胞組成および生検条件に基づき決定することができ、この決定に関する標準的な調製工程、および次いで発明で使用するための核酸の単離は、当業者に公知である。例えば、生検からの試料は、増幅を伴わないRNA発現の評価には十分であり得る。反対に、小さな生検範囲における適切な細胞数の欠如は、核酸分子の解像度を高めるため、RNA変換および/もしくは増幅方法または他の方法の使用が必要となり得る。限られた生検材料の使用を可能にするような方法は、当業者に公知である。いくつかの例としては、直接RNA増幅、RNAのcDNAへの逆転写、cDNA増幅、または放射線標識された核酸の生成が挙げられるが、これらに限定されない。
【0023】
本明細書では、試料に関する「試験」という用語は、身体の癌領域またはある病期の癌もしくは癌の特性を発現している身体の領域から採取された試料を言う。
【0024】
本明細書では、試料に関する「対照」という用語は、比較目的で使用される試料を言う。好ましくは、これらの試料は、遺伝子発現に影響を及ぼすであろういずれかの疾患もしくは状態のいずれかの徴候、特に、該試料を基準として使用する疾患に関するいずれかの徴候を、該試料が示さない、または該試料が、遺伝子発現に影響を及ぼすであろういずれかの疾患もしくは状態を有すると考えられるという意味での「対照」である。あるいは、疾患または状態の様々な病期は、比較することができ、このような場合、「対照」試料とは、該疾患または状態の早期に相当すると理解されてよい。例えば、対照試料は、非癌性ではあるが同等の身体領域から採取することができる。さらに、対照試料は、同一対象由来の比較可能領域、または第1対象に実質的に類似した第2対象(同一のまたは類似の種、年齢、体重、性別等)由来の身体非癌領域であってよい。最後に、対照試料は、タキソイドファミリー分子を用いた治療によく応答する第2対象の癌領域由来であることもできる。
【0025】
「核酸分子」とは、リボヌクレオシド(アデノシン、グアノシン、ウリジン、もしくはシチジン;「RNA分子」)またはデオキシリボヌクレオシド(デオキシアデノシン、デオキシグアノシン、デオキシチミジン、もしくはデオキシシチジン;「DNA分子」)のリン酸エステル多量体、または一本鎖型、もしくは二本鎖ヘリックスの、ホスホロチオエートおよびチオエステルといった、これらのいずれかのリン酸エステルアナログを言う。二本鎖のDNA−DNA、DNA−RNAおよびRNA−RNAヘリックスは、可能である。核酸分子、および特にDNAまたはRNA分子という用語は、分子の一次構造および二次構造を言うに過ぎず、いずれか特定の三次形態に限定するものではない。したがって、この用語には、特に線状または環状DNA分子(例えば、制限断片)、プラスミド、および染色体で見られる二本鎖DNAが含まれる。特定の二本鎖DNA分子の構造を考察する際、配列は、DNAの非転写ストランド(すなわち、mRNAに相同な配列を有するストランド)に沿って5’から3’方向の配列のみを生成する通常の慣例に従い、本明細書では説明され得る。「組換えDNA分子」とは、分子的生物学的操作を受けたDNA分子のことである。
【0026】
本明細書では、特定のタンパク質をコードする、単離された核酸分子の「部分」という用語は、ペプチドまたはポリペプチドをコードする、十分な数の連続した核酸を含む単離
された核酸分子の一部または断片を言う。本来、単離された核酸分子の「部分」とは、1つのヌクレオチドより大きく、以下のペプチドまたはポリペプチドの定義に記載されているように、多数のアミノ酸残基を含有するタンパク質にコードされたペプチドまたはポリペプチドのことである。
【0027】
本明細書では、「ペプチド」という用語は、ペプチド結合により共有結合された2つまたはこれ以上のアミノ酸を言う。特定の実施形態では、ペプチドは、少なくとも10個、好ましくは少なくとも20個、より好ましくは少なくとも30個、さらにより好ましくは少なくとも40個、および最も好ましくは50個またはこれ以上のアミノ酸を含む。
【0028】
本明細書では、「ポリペプチド」という用語は、複数の連続したアミノ酸からなる線状ポリマーを言う。特に、ポリペプチドは、100kDを超える分子量を有することができる。
【0029】
本明細書では、「遺伝子マーカー」という用語は、試料中の測定されたRNA、DNAまたはタンパク質レベルが、タキソイドファミリーの薬剤に被験対象が耐性であるかまたは感受性であるかを予測するのに役立つ、生理学的組成物を言う。さらに、遺伝子マーカーは、特定のタンパク質をコードすることができ、または活性が、身体試料中の遺伝子マーカーレベルに関連しているタンパク質の「代理」マーカーの役目をすることができる。この関係は、順相関であり得る。この場合、タンパク質活性レベルの低下は、遺伝子マーカーレベルの低下に相当する。または、該関係は、逆相関であり得る。この場合、タンパク質活性レベルの低下は、遺伝子マーカーレベルの上昇に相当する。このような生理学的組成物には、ほんの数例を挙げると、細胞(例えば、前駆幹細胞)タンパク質、ポリペプチド、DNA、RNA、炭水化物、または脂肪酸があるが、これらの限定されるものではまったくない。本発明の特定の実施形態では、特定の遺伝子マーカーの測定レベルは、被験対象が、タキソイドファミリーの薬剤に耐性であるかまたは感受性であるかを予測することができる。このような遺伝子マーカーの例としては、以下が挙げられるが、これらに限定されるものではまったくない。
【0030】
BubR1,Homo sapiens similar to protein kinase(BUBR1)mRNA,complete cds(BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列)(GenBank受託番号:AF046079)、
Mad2,Homo sapiens mRNA for MAD2 protein(Mad2、ホモサピエンスmRNA、MAD2タンパク質対応)(GenBank受託番号:AJ000186)、
Mps1,Homo sapiens TTK protein kinase(TTK),mRNA(Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA)(GenBank受託番号:NM_003318)、
GEFT for Rac1/CDC42,Homo sapiens RAC/CDC42 exchange factor(GEFT),transcript variant 2,mRNA(GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA)(GenBank受託番号:NM_133483)、
Bub1,Homo sapiens BUB1 budding uninhibited by benzimidazoles 1 homolog(yeast)(BUB1),mRNA(Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻害されず(酵母)(BUB1)、mRNA)(GenBank受託番号:NM_004336)、
hSepharase,Homo sapiens extra spindle p
oles like 1(S.cerevisiae)(ESPL1),mRNA(hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESPL1)、mRNA)(GenBank受託番号:NM_012291)、
CamKIId,Homo sapiens calcium/calmodulin−dependent protein kinase(CaM kinase)II delta(CAMK2D),transcript variant 3,mRNA(CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA)(GenBank受託番号:NM_001221)、
CDK6,Homo sapiens cyclin−dependent kinase 6(CDK6),mRNA(CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA)(GenBank受託番号:NM_001259)、および
GRB2,Homo sapiens growth factor receptor−bound protein 2(GRB2),transcript variant 1,mRNA(GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA)(GenBank受託番号:NM_002086)
P21(Waf1),Homo sapiens cyclin−dependent
kinase inhibitor 1A(p21,Cip1)(CDKN1A),transcript variant 1,mRNA(P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA)(GenBank受託番号:NM_000389)、
Pim−1,Homo sapiens pim−1 oncogene(PIM1),mRNA(Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA)(GenBank受託番号:NM_002648)、
GBP−1,Homo sapiens guanylate binding protein 1,interferon−inducible,67kDa(GBP1),mRNA(GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導性、67kDa(GBP1)、mRNA)(GenBank受託番号:NM_002053)、
RXRA,Homo sapiens retinoid X receptor,alpha(RXRA),mRNA(RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA)(GenBank受託番号:NM_002957)、
SPF45,Homo sapiens RNA binding motif protein 17(RBM17),mRNA(SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA)(GenBank受託番号:NM_032905)、
Hec1,Homo sapiens kinetochore associated 2(KNTC2),mRNA(Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA)(GenBank受託番号:NM_006101)、
Raf1,Human mRNA for raf oncogene(Raf1、ヒトmRNA、raf発癌遺伝子対応)(GenBank受託番号:X03484)、
Aurora A,Homo sapiens aurora−related kinase 1(ARK1)mRNA,complete cds(Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列)(GenBank受託番号:AF008551)、
TACC3,Homo sapiens transforming,acidic coiled−coil containing protein 3(TACC3),mRNA(TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA)(GenBank受託番号:NM_006342)、
RelB,Homo sapiens v−rel reticuloendotheliosis viral oncogene homolog B,nuclear factor of kappa light polypeptide gene enhancer in B−cells 3(avian)(RELB),mRNA(RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA)(GenBank受託番号:NM_006509)、
PRKCD,Homo sapiens protein kinase C,delta(PRKCD),transcript variant 1,mRNA(PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA)(GenBank受託番号:NM_006254)、
BRAF35,Homo sapiens high−mobility group
20B(HMG20B),mRNA(BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA)(GenBank受託番号:NM_006339)、
HSPA1L,Homo sapiens heat shock 70kDa protein 1A(HSPA1A),mRNA(HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA)(GenBank受託番号:NM_005345)、
STK11,Homo sapiens serine/threonine kinase 11(Peutz−Jeghers syndrome)(STK11),mRNA(STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツジェガース症候群)(STK11)、mRNA)(GenBank受託番号:NM_000455)、および
MKK3,Homo sapiens MAP kinase kinase 3(MKK3)mRNA,complete cds(MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列)(GenBank受託番号:L36719)
【0031】
本明細書では、「参照遺伝子マーカー」という用語は、測定されたRNA、DNAまたはタンパク質レベルが、タキソイドファミリーの薬剤への曝露前、曝露中、曝露後で変化しないままである生理学的組成物を言う。「参照遺伝子マーカー」は、ハウスキーピング遺伝子と呼ばれている。これらは、例えば、癌など特定の疾患で検討されている系における比較的不変の発現レベルに基づき、選択される遺伝子である。ハウスキーピング遺伝子は、発現結果を標準化するのに使用される。このような遺伝子マーカーの例としては、以下が挙げられるが、これらに限定されるものではまったくない。
GAPDH,Homo sapiens glyceraldehyde−3−phosphate dehydrogenase(GAPD),mRNA(GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA)(GenBank受託番号:NM_002046)、および
RPS9,Homo sapiens cDNA clone IMAGE:6647283、partial cds(RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列)(GenBank受託番号:BC071941)
【0032】
本明細書では、「タキソイドファミリー分子」という用語は、タキサンファミリーに属する化学療法化合物の1つのクラスを言う。タキソイドファミリーの具体的なメンバーには、パクリタキセル(タキソール)、ドセタキセル(タキソテール)およびこれらのアナログ(すなわち、XRP9881およびXRP6258;OjimaおよびGeney、Curr Opin Investig Drugs 4:737頁、2004年参照)が挙げられるが、これらに限定されない。分子のこのクラスは、ベータ−チューブリン結
合剤であり、ドセタキセルに類似した微小管の重合型を安定させるため、本明細書に記載されたバイオマーカーの臨床的発現は、これら薬剤と類似の反応状態を反映することが予測される。
【0033】
本明細書では、「分子」、「化合物」または「物質」という用語は、現在知られている、または後に発見されるいずれかの組成物を言う。本明細書で適用となる化合物または物質の例には、有機化合物(例えば、人工、天然および光学活性の)、ペプチド(人工、天然、および光学活性の、すなわち、Dアミノ酸またはLアミノ酸)、炭水化物、核酸分子などがある。
【0034】
本明細書では、「ハイブリダイゼーションのストリンジェンシー」または「ストリンジェントな条件下のハイブリダイゼーション」とは、当業者により容易に定量可能な条件を言い、一般には、プローブの長さ、洗浄温度、および塩分濃度に依存する経験的計算のことである。一般に、プローブが長いほど、適切なアニールには高温を要し、プローブが短いほど、低温を要する。ハイブリダイゼーションは一般に、相補鎖が、これらの溶解温度を下回る環境で存在する場合の、変性DNAの再アニール能に依存する。プローブとハイブリダイゼーション可能な配列との間の所望のホモロジー程度が高いほど、使用され得る相対温度は上昇する。その結果、相対温度が高いほど、反応条件はより厳密になり、相対温度が低いほど、反応条件は厳密でなくなる傾向になるであろう。ハイブリダイゼーション反応のストリンジェンシーに関するさらなる詳細および説明は、Ausubelら、Current Protocols in Molecular Biology、Wiley Interscience Publishers、(1995年)を参照されたい。
【0035】
本明細書では、「ストリンジェントな条件」または「高ストリンジェンシー条件」とは、以下のようなパラメータを言う:(1)例えば0.015M塩化ナトリウム/0.0015Mクエン酸ナトリウム/0.1%ドデシル硫酸ナトリウムを50℃で洗浄するため、低イオン強度および高温を用いるパラメータ;(2)ハイブリダイゼーション中に、例えば、0.1%ウシ血清アルブミン/0.1%フィコール/0.1%ポリビニルピロリドン/50mMリン酸ナトリウム緩衝液を含む50%(v/v)ホルムアミドなどのホルムアミドといった変性剤を、pH6.5にて750mM塩化ナトリウム、75mMクエン酸ナトリウムと共に42℃で用いるパラメータ;または(3)50%ホルムアミド、5×SSC(0.75M Nacl、0.075Mクエン酸ナトリウム)、50mMリン酸ナトリウム(pH6.8)、0.1%ピロリン酸ナトリウム、5×デンハルト溶液、超音波破砕されたサケ精子DNA(50.mu.g/ml)、0.1%SDS、および10%硫酸デキストランを42℃で用いる溶液中で一晩ハイブリダイゼーションし、0.2×SSC(塩化ナトリウム/クエン酸ナトリウム)中で42℃にて10分間洗浄した後、EDTAを含有する0.1×SSCからなる高ストリンジェンシー洗浄を55℃で10分間行うパラメータ。中程度にストリンジェントな条件は、Sambrookら、Molecular Cloning、A Laboratory Manual、New York、Cold Spring Harbor Press、1989年に記載されているように同定することができ、洗浄液および上述のものほどストリンジェントでないハイブリダイゼーション条件(例えば、温度、イオン強度および%SDS)の使用を含む。中程度にストリンジェントな条件の例は、20%ホルムアミド、5×SSC(150mM NaCl、15mMクエン酸三ナトリウム)、50mMリン酸ナトリウム(pH7.6)、5×デンハルト溶液、10%硫酸デキストラン、および20mg/ml変性剪断されたサケ精子DNAを含む溶液中で37℃にて一晩インキュベーションした後、1×SSC中で約37〜50℃にてフィルターを洗浄することである。当業者であれば、プローブの長さ等など要素を調整するため必要に応じて温度、イオン強度等を調整する方法がわかるであろう。核酸をハイブリダイズするための適切なストリンジェンシーは、核酸の長さおよび相補性の程度、当技術分野で公知の変数に依存している。2つのヌクレオチド配列間の類似性または相同性の程度が高いほど、これらの配列を有する核酸をハイブリダイズするためのTm値は高くなる。核酸ハイブリダイゼーションの相対的安定性(高いTmに相当)は、以下の順で低下する:RNA:RNA、DNA:RNA、DNA:DNA。好ましくは、ハイブリダイズ可能な核酸の最小の長さは、少なくとも約12ヌクレオチド、好ましくは少なくとも約16ヌクレオチド、より好ましくは長さは、少なくとも約24ヌクレオチド、最も好ましくは少なくとも36ヌクレオチドである。
【0036】
本明細書では、「標識」または「検出可能な標識」とは、「標識された」抗体、オリゴヌクレオチドまたは他の有機分子を生成するため、抗体、オリゴヌクレオチドまたは他の有機分子に直接的または間接的に結合された、検出可能な標識化合物または組成物を言う。標識は、これ自体(例えば、放射性同位元素または蛍光標識)により検出することができ、または、酵素標識の場合には、検出可能な基質化合物または組成物の化学変換を触媒することができる。
【0037】
本明細書では、「直接標識」とは、自然状態では、肉眼で、または光学フィルターおよび/もしくは応用刺激(例えば、蛍光を促すための紫外線)の助けにより、容易に可視可能な、実体を言う。例としては、着色標識、金属ゾル粒子、染料ゾル粒子、染色されたラテックスまたはリポソームに封入された色素が挙げられる(米国特許第4,313,734号、米国特許第4,373,932号、WO88/08534、EP−A0 280 559、EP−A0 281 327、米国特許第4,703,017号により記載されている)が、これらに限定されない。他の直接標識には、ラジオヌクレオチド、放射線不透過性物質、蛍光部分または発光部分がある。
【0038】
本明細書では、「間接標識」とは、本発明により使用することもできる酵素を言う。イムノアッセイに結合される酵素の様々な種類は、当技術分野で公知の、例えば、アルカリホスファターゼおよび西洋ワサビペルオキシダーゼ、リゾチーム、グルコース−6−リン酸デヒドロゲナーゼ、乳酸脱水素酵素、ウレアーゼであり、これらおよびその他の物は、Eva Engvall in Enzyme Immunoassay ELISA and EMIT in Methods in Enzymology、70:419〜439頁(1980年)および米国特許第4,857,453号に詳細に説明されている。
【0039】
本明細書では、「キット」という用語は、1種またはそれ以上の容器、および該容器上のまたは該容器に関連したラベルまたは添付文書を含む製品を言う。好ましい実施形態では、容器は、検出可能な標識された抗体、検出可能な標識された抗体断片または検出可能な標識されたオリゴヌクレオチドを含有することができる。別の実施形態では、容器は、身体試料から全RNAを得、該全RNAを逆転写してcDNAを得、一方または両方のプライマーが検出可能な標識された1組のプライマーを用いて、該cDNAをポリメラーゼ連鎖反応にかけるための手段を提供する。キットの別の容器には、例えば、希釈剤および緩衝剤、対照抗体、オリゴペプチドまたは小さな有機分子を含有するものが含まれてよい。ラベルまたは添付文書は、組成物の説明の他、保存指示およびインビトロ使用または診断的使用目的の指示を提供することができる。
【0040】
さらに、本発明により、当業者には従来型の分子生物学、微生物学、および組換えDNAの技法が使用することができる。このような技術は、文献で十分に説明されている。例えば、Sambrook、Fritsch & Maniatis、Molecular
Cloning:A Laboratory Manual、第2版(1989年)、Cold Spring Harbor Laboratory Press、Cold
Spring Harbor、New York(本明細書では「Sambrookら、1989年」);DNA Cloning:A Practical Approach,IおよびII巻(D.N.Glover編、1985年);Oligonucleotide Synthesis(MJ Gait編、1984年);Nucleic Acid Hybridization[B.D.Hames & S.J.Higgins編(1985年)];Transcription And Translation[B.D.Hames & S.J.Higgins編(1984年)];Animal Cell Culture[R.I.Freshney編、(1986年)];Immobilized Cells And Enzymes[IRL Press、(1986年)];B.Perbal、A Practical Guide To Molecular Cloning(1984年);F.M.Ausubelら(編)、Current Protocols in Molecular Biology、John Wiley & Sons,Inc.(1994年)を参照されたい。
【0041】
一般に、RNAi技術は、合成のまたはベクターにより生成された二本鎖RNAを用いて、相同な配列を含有するmRNAの分解を誘発する(McManusおよびSharp、Nat Rev Genet 3:737頁、2002年)。RNAiスクリーニングは、シノラブディスエレガンス(Caenorhabditis elegans)(Simmerら、PloS Biol 1:E12頁、2003年)、ショウジョウバエ(Lumら、Science 299:2039頁、2003年)および哺乳類細胞(Aza−Blancら、Mol Cell 12:627頁、2003年)など多くの生物における遺伝子機能を解明するために使用されている。
【0042】
本発明では、HCT116結腸癌細胞は、ほとんどがキナーゼファミリーメンバーを含む、101種の癌関連遺伝子に対するsiRNAをスクリーニングするために使用され、ドセタキセルの死滅効果は、高分解能の用量反応曲線により定量した。このアプローチを用いて、出願者は、BubR1、Bub1、Mad2、Mps1およびGEFT Rac/CDCを含む、9種類の遺伝子の過少発現が、ドセタキセルによる死滅を阻害することができるのに対し、Pim1、p21、TACC3およびAurora−Aを含む、15種類の他の遺伝子の過少発現は、ドセタキセル誘導細胞死を促進することができることを明らかにした。
【0043】
故に、本発明は、ドセタキセルを服用している、または服用を検討している個人が、該薬剤に耐性となるかまたは感受性となるかを特定するのに使用することができる診断方法およびキットにまで広範に及ぶ。
【0044】
出願者は、薬剤耐性が、BubR1、Bub1、Mad2、Msp1およびGEFT Rac/CDCを含む、幅広いチェックポイント遺伝子の欠損に関連していることにより、ドセタキセルに対する薬剤耐性を観察した。
【0045】
ドセタキセル感受性の増加は、GBP−1、STK11、RXRA、Hec1、SPF45、Raf1、RELB、MKK3、PRKCD、HSPA1A、BRAF35、Aurora−A、Pim−1、TACC3およびp2lwaf1/Cip1を含む、いくつかの遺伝子のいずれか1つの欠損に相当し、これらの遺伝子に対する阻害剤は、ドセタキセル療法に対する有益な補助剤として働くことができる。
【0046】
有糸分裂チェックポイント遺伝子は、姉妹染色体の動原体が、紡錘体に適切に接着され、赤道で整列されるまで、Cdc20−APC(後期促進複合体)の阻害により有糸分裂後期を遅延させるための二重安全機構(failsafe mechanism)の役目をする(Zhouら、J Cell Sci 115:3547頁、2002年)ため、細胞が、DNAの正確な相補体を伴って有糸分裂を確実に終了し、別の細胞周期に確実に入ることを可能にする。微小管阻害剤の存在下では、有糸分裂から出た細胞は、もはやこれらの染色体を適切に分離することができず、一般的にはすぐに、またはいくつかの細胞周期後にアポトーシスを引き起こす(TaylorおよびMcKeon、Cell 89:727頁、1997年)。微小管阻害剤とBubR1などの有糸分裂チェックポイント遺伝子欠損との組合せは、細胞が、アポトーシスを引き起こすことなく有糸分裂の停止を逃れ、染色体安定性(CIN)および異数性をもたらすことを可能にする(Shinら、Cancer Cell 4:483頁、2003年)。最近では、薬剤耐性データは、微小管阻害剤パクリタキセルが、BubR1およびMad2をダウンレギュレートされたMCF−7細胞を治療するのに使用された際に得られた(Sudoら、Cancer Res 64:2502頁、2004年)。
【0047】
Pim−1遺伝子は、関連キナーゼの小さなファミリーに属するセリン/スレオニンキナーゼをコードしている。Pim−1の機能は、増殖、分化、アポトーシス、腫瘍形成、低酸素症、血管形成および有糸分裂に関連している(Wangら、Biochim Biophys Acta 1593:45頁、2002年)。顕微鏡画像データは、AKT低リン酸化データおよびカスパーゼ3活性測定値の上昇と共に、Pim−1ダウンレギュレーションが、細胞生存を媒介するAKTシグナル伝達を不活化することにより、ドセタキセル誘導アポトーシスを増強することを示している。Pim−1およびp21は、HCT116細胞の感作において、ドセタキセルにきわめて類似した特性を有する。これは、p21が、Pim−1のリン酸化基質であることを示す複数の報告と一致する(Wangら、Biochim Biophys Acta 1593:45頁、2002年)。Pim−1ダウンレギュレーションは、ドセタキセル非存在下でいくつかのアポトーシスを誘発するが、薬剤存在下でより効果的であったのに対し、形質転換酸性コイルドコイルタンパク質TACC3のダウンレギュレーションは、ドセタキセル非存在下で細胞死を誘発せず、RNAiだけでは細胞増殖に影響しないことを示した。これらの結果は、異なるタンパク質の枯渇は、ドセタキセルに対し細胞を感作させるための異なる機序を惹起することができることを示唆している。
【0048】
したがって、本発明の1つの態様では、表IおよびIIに記載された1種またはそれ以上の遺伝子の活性化、およびこれらの遺伝子のタンパク質レベルは、治療処置方法を選択し、選択された治療方法の有効性をモニターするために利用することができる。
【0049】
特定の実施形態では、化学療法の過程において、表IおよびIIに示された1種またはそれ以上の遺伝子の活性化レベルをモニターして、患者に対する化学療法の有効性を評価し予測する方法が提供される。腫瘍(例えば、乳腺腫瘍、結腸腫瘍、非小細胞肺腫瘍、および胃腫瘍)からの生検、または未診断癌患者もしくは現在治療を行っている患者からの腫瘍生検の短期培養は、表IおよびIIに記載された遺伝子またはこれらのサブセットの、遺伝子活性化レベルもしくはタンパク質レベルを評価するためのDNA(Hafnerら、Arch Pathol Lab Med 127:1221頁、2003年;Rodriguezら、Clin Cancer Res 10:5785頁、2004年)、メッセンジャーRNA(Changら、Lancet 362:340頁、2003年)および/またはタンパク質(Espinaら、J Immunol Methods 290:121頁、2004年)を単離するために処理される。遺伝子転写およびタンパク質発現プロファイリングは、可能性のある治療戦略に対する患者の応答の診断、予測に実用性を有し、患者の治療応答をモニターするための有用なツールになることができる。
【0050】
本発明により、RNAは、当技術分野で一般に使用される入手可能な方法のいずれかを用いて、腫瘍試料から単離することができる(Ullmannら、J Biomol Screen 9:95頁、2004年;Badieeら、BMC Biotechnol
3:23頁、2003年)。被験対象由来の1種またはそれ以上の細胞を得て、RNA
を、これらの細胞から単離する。例えば、末梢血白血球(PBL)細胞は、対象から得られることができ、または細胞試料を得て、該試料を所望の細胞型に濃縮することも可能である。細胞は、所望の細胞型上にある特定のエピトープに結合する抗体を用いた細胞分離など、様々な技法を用いて細胞混合物から分離することができる。所望の細胞が、固形組織内にある場合、特定の細胞は、例えば、マイクロダイセクションまたはレーザーキャプチャーマイクロダイセクション(LCM)により切断することができる(Bonnerら、Science 278:1481頁、1997年;Fendら、Am J Path 154:61頁、1999年)。RNAは、様々な方法、例えば、チオシアン酸グアニジウム溶解に続くCsCl遠心分離により、組織または細胞試料から抽出することができる(Chirgwinら、Biochemistry 18:5294頁、1979年)。単一細胞由来のRNAは、単一細胞由来のcDNAライブラリの製造方法に記載されているように得られることができる(Dulac、Curr Top Dev Biol.36:245頁、1998年)。RNA試料は、さらに特定の種に関して濃縮することができる。1つの実施形態では、例えば、ポリ(A)+RNAは、RNA試料から単離することができる。特に、ポリ−Tオリゴヌクレオチドは、固体担体に固定化させ、mRNAの親和性リガンドとして働くことができる。このためキットは、例えば、MessageMakerキット(Life Technologies、グランドアイランド、NY)などが市販されている。濃縮は、例えば、プライマー特異的cDNA合成、またはcDNA合成に基づく複数回の線形増幅およびテンプレート特異的インビトロ転写により、実現することができる(Wangら、Proc Natl Acad Sci USA 86:9717頁、1989年;Dulacら、上記参照)。
【0051】
例えば、PCR、リガーゼ連鎖反応(LCR)(WuおよびWallace、Genomics 4:560頁、1989年)、自律配列複製法(self−sustained sequence replication)(SSR)、(Guatelliら、Proc Natl Acad Sci USA 87:1874頁、1990年)、核酸配列ベースの増幅法(NASBA)および転写増幅法(Kwohら、Proc Natl Acad Sci USA 86:1173頁、1989年)を含む、様々な増幅方法が、本発明の方法に使用するのに適している。PCR技術の方法は、当技術分野に公知である(例えば、PCR Technology:Principles and Applications for DNA Amplification(H.A.Erlich編、Freeman Press、N.Y.、N.Y.、1992年)、PCR Protocols:A Guide to Methods and Applications(Innisら編、Academic Press、San Diego、Calif.、1990年)参照)。
【0052】
RNAは、当業者に公知のいずれかの方法、例えば、アフィメトリックス社製のもののようなマイクロアレイにより検出するために標識することができる。RNAは、シアニン−3またはシアニン−5(Perkin Elmer MPS544001KT)などの色素による直接RNA標識といった、一般に使用されている方法のいずれかを用いて、ハイブリダイゼーションにより標識し、検出する。さらなる方法には、シアニン−3またはシアニン−5(Badiee A、2003年)、フルオレセインもしくはアレクサ色素(Molecular Probes)、または他のフルオロフォアで標識された核酸による逆転写により行われる、直接cDNA標識がある。さらに、FairPlay(商標)/アミノアリル標識(Stratagene カタログ番号:252002)、3DNAデンドリマー標識(Genisphere Inc)または酵素的シグナル増幅(MICROMAX TSA、Perkin Elmer)などの間接cDNA標識を利用することができる。あるいは、RNAは、酵素、フルオレセイン、放射性または発光する方法により検出されるRNAプローブを用いて定量することができる。
【0053】
本発明の1つの態様では、RNAを、腫瘍試料から得、Taqman技術を、遺伝子マーカーの検出に使用する。プライマーは、表IおよびIIに指定された特定のRNAまたはこれらのサブセットを検出するために作成され、逆転写酵素により増幅される。逆転写により増幅された特定断片の検出は、ゲル電気泳動、ポリマー電気泳動、直接DNAシークエンシング、光検出、フルオレセインシグナルの消失、酵素反応、または相補的RNAへのハイブリダイゼーションによる検出により実現される。
【0054】
本発明の別の態様では、リアルタイムPCRを利用して、オリゴヌクレオチドを検出する。腫瘍試料から得たmRNAは、cDNAへ逆翻訳される。プライマーは、ポリメラーゼ連鎖反応技術を用いて、表IおよびIIに指定された特定のRNAまたはこれらのサブセットを増幅するために作成される。mRNAレベルの検出は、ゲル電気泳動および臭化エチジウムもしくはCYBRグリーン染色により、またはポリメラーゼにより放出される、フルオロフォア標識された配列特異的プローブからの蛍光強度を測定することで実現される。
【0055】
本発明のさらなる態様では、ノーザンブロッティング技術を利用する。RNAを、腫瘍試料から得、次いでゲル電気泳動により分離し、膜に移す。RNA量は、P32などの放射性同位元素で標識されたプローブを用いたハイブリダイゼーション、または酵素ベースの発色もしくは発光アッセイにより定量する。
【0056】
本発明のさらに別の態様では、遺伝子量は、転写レベルの代理指標として使用することができる。表IおよびIIの転写物またはこれらのサブセットの遺伝子量を、定量的に測定し、腫瘍がドセタキセル療法に対し応答性となるか否かを評価することができる(Rodriguezら、Clin Cancer Res 10:5785頁、2004年)。この評価は、ネオアジュバント(術前の治療)療法の前に行うことができ、患者が応答者に分類されれば、患者をドセタキセルで治療し、患者が非応答者に分類されれば、別の化学療法剤を投与することができる。
【0057】
DNAは、患者の腫瘍生検から抽出し、当業者により行われているような方法を用いて汚染物質を除去するために精製する。腫瘍DNAにおける遺伝子量の定量に使用される方法には、定量的PCR、ゲノムDNAチップ、in situハイブリダイゼーションまたはサザンブロットがある(Hafnerら、Arch Pathol Lab Med
127:1221頁、2003年;Rodriguezら、Clin Cancer Res 10:5785頁、2004年)が、これらに限定されない。したがって、これらの方法は、表IおよびIIにおける1種またはそれ以上の遺伝子のコピー数を定量するのに使用することができ、対照試料または参照マーカーと比較することができる。
【0058】
本発明のさらに別の態様では、タンパク質レベルを、転写レベルの代理測定値として使用する。タンパク質レベルは、転写レベルの抑制または上昇に相当することが明らかにされている。したがって、本発明は、表IおよびIIの転写物にコードされたポリペプチド産物に相当するタンパク質のレベルを測定する技法を包含する。タンパク質を検出し、ドセタキセルに対する予測的応答マーカーとして使用する。タンパク質検出方法は、当技術分野で公知である。例えば、イムノアッセイは、抗体を用いて標的タンパク質の発現を検出する方法である。
【0059】
特定の実施形態では、表IおよびIIに列挙された1種またはそれ以上の遺伝子のタンパク質産物を検出するために、イムノアッセイを使用する。さらに、表IおよびIIに列挙されたタンパク質のいずれか1種に対する抗体は、いくつかの他の検出方法で使用することができる。これらの検出方法には、以下が挙げられるが、これらに限定されない:ウェスタンブロット、ELISAアッセイ、サンドイッチELISA。あるいは、抗体を使用
しない他のアッセイが考えられ、表IおよびIIの転写物(例えば、アプタマー)にコードされたタンパク質を認識するDNAオリゴヌクレオチドまたはポリペプチドを利用するアプローチが挙げられる。タンパク質分解切断後にペプチド断片の正確な分子量を定量して、ポリペプチドの組成を判定する生物学的試料の質量分析もまた、使用することができる。
【0060】
本発明はさらに、酵素、フルオロフォアを含む適切な標識を包含する(例えば、フルオレセインイソチオシアネート(FITC)、フィコエリトリン(PE)、テキサスレッド(TR)、ローダミン、遊離またはキレート化ランタニド系列の塩、クロモフォア、放射性同位元素、キレート剤、色素、コロイド金、ラテックス粒子、リガンド(例えば、ビチオン)、および化学発光剤)。
【0061】
本発明の別の態様では、使用される放射性標識は、3H、14C、32P、35S、36Cl、51Cr、57Co,58Co,59Fe、90Y、125I、131I、および186Reなどのアイソトープであってよい。放射能レベルの定量化は、現在既知の利用可能な計数方法を介して行うことができる。反対に、放射線不透過性物質の使用を用いてもよい。標識が酵素である実施形態では、検出は、当技術分野で公知の、現在利用されている熱量測定法、分光光度法、蛍光分光光度法、アンペロメトリック法またはガス定量法のいずれかにより実現することができる。
【0062】
本発明のさらなる態様は、抗体または抗体断片などのペプチド結合剤の使用である。抗体には、従来方法により製造されるポリクローナルおよびモノクローナル抗体がある。抗体分子のごく小さな部分であるパラトープは、このエピトープへの抗体の結合に関与している(一般には、Clark,W.R(1986年)、The Experimental Foundations of Modem Immunology、Wiley & Sons,Inc.、New York;Roitt,L(1991年)、Esse
ntial Immunology、第7版、Blackwell Scientific Publications、Oxford参照)。例えば、pFc’およびFc領域は、補体カスケードのエフェクターであるが、抗原結合に関与しない。pFc’領域が、酵素により切断された抗体、またはpFc’領域なしで生成され、F(ab’)2フラグメントと称される抗体は、無処置の抗体の2つの抗原結合部位を保持する。したがって、本発明の1つの実施形態は、F(ab’)2フラグメントなどの検出可能な標識された抗体フラグメントを利用する。同様に、Fc領域が、酵素により切断された抗体、またはFc領域なしで生成され、Fabフラグメントと称される抗体は、無処置の抗体分子の抗原結合部位の1つを保持する。Fabフラグメントは、共有結合抗体軽鎖および抗体重鎖を意味するFdの一部から成る。Fdフラグメントは、抗体特異性の主要な決定因子であり(単一のFdフラグメントは、抗体特異性を変更することなく、10種類の異なる軽鎖に関連することができる)、Fdフラグメントは、単独でエピトープ結合能を保持することができる。
【0063】
当技術分野で公知の通り、抗体の抗原結合部分には、抗原のエピトープと直接相互作用する相補性決定領域(CDR)、およびパラトープの3次構造を維持するフレームワーク領域(FR)がある(一般的には、Clark、1986年;Roitt、1991年参照)。IgG免疫グロブリンの重鎖Fdフラグメントおよび軽鎖フラグメントのどちらにも、3つの相補性決定領域(CDR1〜CDR3)によりそれぞれ隔てられる4つのフレームワーク領域(FR1〜FR4)がある。CDR、および特にCDR3領域、およびより特別には重鎖CDR3は、大部分が抗体特異性に関与している。哺乳類抗体の非CDR領域は、オリジナル抗体のエピトープ特異性を保持しつつ、同種または異種特異的抗体の類似の領域と置換することができることは、現在当技術分野でよく知られている。これは、非ヒトCDRが、ヒトFRおよび/またはFc/pFc’領域に共有結合されて機能的抗体を生成する「ヒト化」抗体の開発および使用において最も明白に示されている(米国特許第4,816,567号、第5,225,539号、第5,585,089号、第5,693,762号および第5,859,205号参照)。
【0064】
完全なヒトモノクローナル抗体も、ヒト免疫グロブリン重鎖および軽鎖遺伝子座の大部分のトランスジェニックマウスを免疫することで製造することができる。これらのマウス(例えば、XenoMouse(Abgenix)、HuMAbマウス(Medarex/GenPharm))を免疫化後、モノクローナル抗体は、標準的ハイブリドーマ技術により製造することができる。これらのモノクローナル抗体は、ヒト免疫グロブリンアミノ酸配列を有するため、ヒトに投与された場合にヒト抗マウス抗体(HAMA)反応を惹起することはないであろう。
【0065】
したがって、本発明はまた、F(ab’)2、FvおよびFdフラグメント;Fcおよび/またはFRおよび/またはCDR1および/またはCDR2および/または軽鎖CDR3領域が、ヒトまたは非ヒト相同配列で置換されたキメラ抗体;FRおよび/またはCDR1および/またはCDR2および/または軽鎖CDR3領域が、ヒトまたは非ヒト相同配列で置換されたキメラF(ab’)2フラグメント抗体;FRおよび/またはCDR1および/またはCDR2および/または軽鎖CDR3領域が、ヒトまたは非ヒト相同配列で置換されたキメラFabフラグメント抗体;ならびにFRおよび/またはCDR1および/またはCDR2領域が、ヒトまたは非ヒト相同配列で置換されたキメラFdフラグメント抗体も包含することは、当業者には容易に明らかである。本発明にはまた、いわゆる一本鎖抗体も含まれる。
【0066】
本発明は、本発明の見本として提供される以下の実施例を参照することで、より理解することができるが、これに限定されない。実施例は、本発明の好ましい実施形態を十分に説明するために示される。しかし、これらは、本発明の幅広い範囲を限定するものとして解釈されるべきではまったくない。
【実施例】
【0067】
〔実施例1〕
siRNAスクリーニング
ドセタキセル処理に対し細胞をより耐性または感受性にする遺伝子を同定するため、用量反応曲線を作成するための様々なドセタキセル濃度を用いて、HCT116細胞中において101種類の遺伝子に対するsiRNAをスクリーニングした。ヒト結腸癌細胞株HCTT116は、ATCCから入手し、100単位/mlペニシリン、100μg/mlストレプトマイシン、4mM L−グルタミンおよび10%胎児ウシ血清を補充したMcCoy 5A中で、37℃にて95%CO2および5%O2で培養した。siRNAのリストは、遺伝子発現プロファイリング実験(Changら、Lancet 362:362頁、2003年)で検出されたようなドセタキセル耐性乳腺腫瘍において過剰発現されたものを含む、癌関連遺伝子で構成された。さらなる基準は、標的が創薬に適していることであった。全体的なスキームを以下にまとめた。第1日目、HCT116細胞を、96ウェルフォーマットでウェルあたり5,000細胞にてプレーティングし、翌日、遺伝子あたり3〜4siRNAプールでトランスフェクトした。使用したsiRNAの代表的試料を、表IおよびIIに示した。リポフェクタミン2000(インビトロゲン)を用いて、siRNA(Dharmacon)を96ウェルプレートのHCT116細胞にトランスフェクトした。第3日目、siRNAを除去し、ドセタキセルを、0〜40nMの濃度で添加した。第6日目、細胞の生存を、WST−1アッセイにより定量した。これは、生存細胞に存在するミトコンドリアのデヒドロゲナーゼ活性をモニターするアッセイである。デヒドロゲナーゼ活性は、テトラゾリウム塩WST−1の開裂をもたらし、フォルマザンを形成する。アッセイ当日、培地を96ウェルプレートから除去した。WST−1試薬(Roche)を、McCoy 5A培地で10倍に希釈し、100ulを各ウェルに添加した。プレートを次いで、40〜80分間、37℃にてインキュベートした後、SpectroMax(Molecular Devices)で450nmにて読み取った。WST−1値は、実験siRNAの対照siRNAに対する比を計数して階層的にクラスター化し、下記の表IIIに示したように、合計15遺伝子を感受性を付与するもの、9遺伝子を耐性を付与するものとして特徴づけた。感受性および耐性集団を、さらに別の群に分けた:1)siRNA効果が、低濃度ドセタキセル(1〜6nM)で観察され、IC50がシフトした群、または2)主な効果は、高濃度(>6nM)で観察され、IC50のシフトがより小さかった群。
【0068】
Mad2、BubR1およびMps1のsiRNAに比べ、Grb2、CDK6、セファラーゼ、およびカルシウム/カルモジュリン依存性プロテインキナーゼIIデルタ(CamKIID)を標識するsiRNAは、より低濃度(1〜6nM)のドセタキセルでより顕著な効果を示し、IC50に特徴的なシフトが見られた。全体に、このサブグループは、有糸分裂チェックポイント遺伝子より弱い耐性を示し、CamKIIDのsiRNAは、対照細胞に対し2倍となる、最も高い保護レベルを示した。これらのデータは、4つの有糸分裂チェックポイント遺伝子は、いくつかの他の遺伝子と共に様々な程度でドセタキセル耐性を増加させることができることを示した。図1のデータは、siRNAをトランスフェクトされた後、様々な濃度のドセタキセルに曝露された細胞の、いくつかの特徴的な用量反応曲線を示している。BubR1、Bub1、Mad2、およびMsp1(Bub1のデータは不図示)を含む、4つの有糸分裂チェックポイント遺伝子の他、Rac/Cdc42のグアニンヌクレオチド交換因子(GEFT)に対するsiRNAは、効果が高ドセタキセル濃度(6>nM)でより顕著となり、有意なドセタキセル耐性を示した。最大の耐性レベルを示したのは、Mad2であり、細胞の生存が、細胞をトランスフェクトされた対照siRNAに比べて5倍に増加していた。siRNAの大半は、スクリーニングでスコア化されず、ここでは本発明者は、代表例としてヒト網膜芽細胞腫1(PB1)を示している。
【0069】
以上のことから、これらの結果は、遺伝子発現のダウンレギュレーションが、ドセタキセル処理から細胞をいかに感作または保護し、濃度に応じて、様々な作用機序をいかに惹起してドセタキセルによる細胞死を調節するかの洞察を、siRNAスクリーニングが提供できることを示している。
【0070】
【表1】

【0071】
【表2】

【0072】
【表3】

【0073】
〔実施例2〕
ドセタキセル耐性の増加を付与するsiRNAサブセットの交差検定
siRNAスクリーニングアプローチの短所となる可能性があるのは、siRNAが、部分的に同一の転写物にアニールする、またはマイクロRNA(miRNA)の翻訳阻害を起こすことができるため、標的特異的な作用と非特異的(部位外の(off−site))作用との区別が困難になる点である(Jacksonら、Nat Biotechn
ol 21:635頁、2003年)。第2配列を伴う独立のアプローチを用いて耐性を確認するため、ショートヘアピン(sh)RNAをコードするDNAオリゴヌクレオチドを有しているレトロウイルスベクターに、HCT116細胞を感染させて、BubR1およびMps1用の安定したノックダウン細胞株を生成した。shRNAは、siRNAよりも異なる配列を含有しており、オープンリーディングフレームの明確な領域を標的する。レトロウイルスパッケージング細胞株GP2−293は、Clontechから入手した。細胞は、100単位/mlペニシリン、100μg/mlストレプトマイシン、4mM L−グルタミンおよび10%胎児ウシ血清を補充したDMEMで維持した。ウイルスは、GP2−293細胞を一過性トランスフェクトして生成した。合計3.6×106細胞を、トランスフェクション24時間前に10cm皿に播種した。培地は、トランスフェクション4時間前に、10%FBS(抗生物質を含まない)を含有するDMEMと交換した。細胞は、6μgベクターDNA、6μgエンベローププラスミドVSV−G(Clontech)および72μlリポフェクタミン−2000をトランスフェクトした。培地は、14〜16時間後に交換した。ウイルス上清を24時間後に回収し、0.45μMフィルターを介して濾過し、8μg/mlポリブレンの存在下で、M.O.I5でHCT116を感染させるために用いた。感染後48時間目に、細胞を、0.5μg/mlピューロマイシン中で7日間、またはバックグラウンド細胞が死滅するまで選択した。BubR1およびMps1ノックダウン細胞株で作成された用量反応曲線は、ここでも、高いドセタキセル濃度でより顕著であった耐性の増大を示した(図2)。これは、siRNA一過性トランスフェクションで得られた結果と類似していた。shRNAがmRNAレベルを低下させるかどうかを調べるため、本発明者は、リアルタイムPCRを用いて内因性転写物を検出し、RNAレベルが、ベクター対照安定株に比べBubR1およびMps1安定ノックダウン細胞株で減少していることを確認した(図3)。
【0074】
細胞を溶解し、RNAを、RNAqueous−96(Ambion)を用いて抽出した。Taqman(商標)プローブおよびフォワードプライマーおよびリバースプライマーは、Primer Express(商標)ソフトウェア(PE Applied Biosystems、UK)によりデザインした。プローブおよびプライマー配列のBLAST検索は、試験中の特定の遺伝子以外の他の配列とは有意な同一性が見られないことを明らかにした。リアルタイムPCRには、マスターTaqMan(商標)ミックス20μlを、各ウェル用に作製した。内訳は、4.825μlRNアーゼフリーを含まない水、12.5μl 2×ユニバーサルPCRマスターミックスおよび0.625μl 40×MultiscribeTMおよびRNase Inhibitor Mix(Applied BioSystems)、0.9μlフォワードおよびリバースプライマー(100μM)、0.25ulプローブ(100μM)である。各ウェルに、5ul試料RNA(約1ng/μl)を添加した。プレートは、TaqMan(商標)ABI Prism 7700 Sequence Detector(商標)(Perkin−Elmer、UK)で分析した。循環パラメータは、30分間48℃、10分間95℃、15秒間95℃を40サイクル、および1分間60℃であった。試験遺伝子のmRNA値は、標準曲線から推定し、残留率(percent remaining)で表した。
【0075】
〔実施例3〕
Mad2、BubR1およびMps1のダウンレギュレーションは、異数性の発生と共に、有糸分裂停止を回避することでドセタキセル誘導死から細胞を保護する
WST−1アッセイで定量した通り、ドセタキセル存在下の有糸分裂チェックポイント遺伝子の欠損は、耐性を示す細胞生存の増加と相関していた(図1)。WST−1測定法の妥当性をさらに試験するため、細胞学的実験を行い、細胞の形態および生存能力を調べた(図4)。細胞は、共焦点顕微鏡法および、代謝的に活性な細胞の指標として働く細胞内エステラーゼにより、緑色蛍光に変換される生体染色色素であるカルセイン−AMを用いて追跡した。図4は、ドセタキセル添加後16時間目に、Mad2、BubR1および
、(程度は低いものの)Mps1のsiRNAをトランスフェクトした細胞は、時期尚早に有糸分裂を終わらせ、平板な細胞形態と一致する明らかな間期の状態に入っていたのに対し、対照siRNAをトランスフェクトした細胞の大半が、集合した細胞形態を伴う有糸分裂で停止していた。扁平な細胞の表現型は、以前に他の微小管阻害剤で記述されており、有糸分裂停止から出て、実際には有糸分裂を終了させることなく明らかな間期状態へ入る細胞の能力を言う(Kungら、Proc Natl Acad Sci 87:9553頁、1990年;LanniおよびJacks、Mol Cell Biol 18:1055頁、1998年)。処理後72時間目、Mad2、BubR1またはMps1のsiRNAダウンレギュレート細胞に関する最も顕著な観察は、ドセタキセル処理により事実上除去されたsiRNA対照トランスフェクト細胞に比べ、より多くの細胞が存在し、およびこれらのサイズがきわめて大きかった点であった。ドセタキセル非存在下では、有糸分裂チェックポイントダウンレギュレート細胞は、2つの異なる時点において対照細胞と類似しているように見え、72時間目の細胞数の増加は、細胞が、siRNA存在下で活発に成長していることを示唆した。
【0076】
有糸分裂チェックポイントを障害された細胞は、コルセミド、ノコダゾールおよびパクリタキセルなどの微小管阻害剤による処理後は、有糸分裂停止を迂回し、時期尚早に有糸分裂を終了させることができる(TaylorおよびMcKeon、Cell 89:727頁、1997年;Shinら、Cancer Cell 4:483頁、2003年;Masudaら、Am J Pathol 163:1109頁、2003年;Sudoら、Cancer Res 64:2502頁、2004年)。ドセタキセル処理したHCT116細胞が、3つの特異的チェックポイント遺伝子Mad2、BubR1またはMps1を抑制後、有糸分裂を時期尚早に終了させるかどうかを判定するため、本発明者は、トランスフェクト細胞の有糸分裂指標を測定した。そこで、siRNAをトランスフェクトされたMad2、BubR1またはMps1細胞を、未処理(0)またはドセタキセル処理後8、16、24、36、48および72時間目で回収し、次いで、固定化し、有糸分裂指標であるヒストンH3のリン酸化を検出するポリクローナル抗体(Mitotic Index Kit、Cellomics)によりインキュベートした。すべての時点を図5にグラフで示した。有糸分裂指標のピークは、処理後16時間目および24時間目であり、全例で有糸分裂停止があったことを示している。有糸分裂指標は、対照siRNAをトランスフェクトされた細胞で最も高値に達したのに対し、Mad2およびBubR1のsiRNAをトランスフェクトした細胞は、有糸分裂指標の有意な低下を示した。Mps1のsiRNA効果は、Mad2、BubR1ほど重度ではなかった。これらの結果は、有糸分裂チェックポイントを障害された細胞は、ドセタキセルにより誘発された有糸分裂停止を迂回すること、BubR1のsiRNAは、最も有効であり、次いでMad2およびMps1となることを明らかに示すものである。
【0077】
有糸分裂指標の変化が、ノックダウン効率における大きな差と一致していた可能性を除外するため、本発明者は、リアルタイムPCRを用いて有糸分裂チェックポイント転写レベルを測定した。図6に示された実験は、mRNAレベルが、Mad2、BubR1およびMps1のsiRNAトランスフェクト細胞では同等レベルにまで低下したことを示している。これは、有糸分裂指標の差が、遺伝子機能をより大きく反映していたことを示唆するものである。
【0078】
顕微鏡データから、きわめて大きな細胞は、異常なDNA量を保有できることが明らかになった。これらの有糸分裂チェックポイント障害細胞は、ドセタキセル誘導細胞周期停止を抑制し、S期に再進入して異数性細胞を産生することが可能かどうかをさらに調査するため、本発明者は、FACS分析を行いDNA量を測定した。Mps1、BubR1、Mad2および対照のsiRNAをトランスフェクトされた細胞を、ドセタキセル非存在下または存在下で増殖し、固定化し、ヨウ化物プロピルで染色し、FACSにより分析し
た。ドセタキセル添加後、いくつかの異なる時点でデータを回収し(データ不図示)、72時間時点のヒストグラムを図7に示した。ドセタキセル添加後72時間目、Mps1、BubR1、Mad2のsiRNAトランスフェクションは、8N、16Nで細胞蓄積を引き起こしており、BubR1の場合は32NのDNA量であった。対照siRNAを用いるだけで、ドセタキセル存在下で8Nの細胞集団を検出したが、8Nの数は、有糸分裂チェックポイントをダウンレギュレートされた細胞でより高かった。ドセタキセル添加後の早い時点では(データ不図示)、対照細胞の大半が4Nで停止していたのに対し、Mps1、BubR1およびMad2のsiRNAをトランスフェクトされた細胞は、4Nから8Nへ進行していた。これらの結果は、有糸分裂チェックポイント遺伝子のノックダウンは、野生型細胞細胞に比べ、細胞がより迅速に異常なDNAレベルを蓄積し、倍数性のより高い閾値を交差できるようにすることを示している。本発明者の結果は、有糸分裂指標の制御、これまで明らかにされなかった微小管阻害剤ドセタキセルによる細胞周期の進行における、Mad2、BubR1およびMps1の役割を示すものである。
【0079】
〔実施例4〕
BubR1をダウンレギュレートされた細胞におけるドセタキセル耐性コロニーの形成
抗微小管剤を併用したBubR1の過少発現が、異数性細胞のチェックポイントおよびアポトーシスの活性化と関連したBubR1の異数性、ならびに回復と関連があったことを考えると、BubR1のアポトーシス機能は、染色体忠実度の制御にとって重要であるように思われる(Shinら、Cancer Cell 4:483頁、2003年)。永続的な有糸分裂チェックポイント遺伝子のダウンレギュレーションは、細胞の、増殖能の増大による増殖を可能にするかどうかを判定するため、BubR1およびMps1の安定ノックダウン細胞株(図4)の、ドセタキセルの連続存在下で増殖しコロニーを構築する能力について試験した。Mad2安定ノックダウン細胞株は、Mad2の障害が、細胞にとって致死的であったため(Michelら、Proc Natl Acad Sci
101:4459頁、2004年)作製することができなかった。BubR1、Mps1および対照shRNAの安定ノックダウン細胞株は、5nMドセタキセルに10日間曝した後、クリスタルバイオレットで染色した。図8は、BubR1ノックダウン細胞株は、対照細胞株に比べ、より多くの大きなコロニーを発生したことを示している。Mps1ノックダウン細胞株は、5nMドセタキセル存在下でコロニーを成長させることができなかった。プレートを17日間にわたりインキュベートした場合、対照プレートではコロニーが観察されたが、BubR1ノックダウン細胞株に比べ、数はより少なかった。これらの結果は、BubR1の低レベルを、化学療法剤ドセタキセル存在下の細胞成長の進行と関連づけるものであるが、Mps1を関連づけるものではない。
【0080】
〔実施例5〕
ドセタキセル感受性の増加を付与するsiRNAの交差検定
ドセタキセル誘導死滅から細胞を保護するsiRNAの同定に加えて、スクリーニングは死滅に対し細胞を感作させるsiRNAを同定した。表IIIでは、Pim−1、p21waf1/Cip1、GBP−1、RXRA、Hecl,SPF45、Raf1は、IC50のシフトはごく小さいが、高ドセタキセル濃度(>6nM)で顕著な死滅を示したsiRNA群を表している。発癌性セリン/スレオニンキナーゼPim−1および細胞周期阻害剤p21waf1/Cip1のsiRNA用量反応曲線は、きわめて類似していた(図9)。これは、シグナル伝達経路における重複するまたは協調的な役割を反映している可能性があり、過去の報告は、p21waf1/Cip1が、Pim−1の基質であることを明らかにしている(Wan
gら、Biochim Biophys Acta 1593:45頁、2002年)。さらに興味深いのは、前立腺上皮細胞のPim−1過剰発現に関するデータであり、これは、有糸分裂チェックポイント干渉および遺伝的不安定性につながるものである(Rohら、Cancer Res 63:8079頁、2003年)。これらの結果は、反対の発現レベルと同等の表現型を示す、Mad2、BubR1およびMps1過少発現データ
と一致していた(図1参照)。ドセタキセル感受性を付与する別のsiRNAは、Hec1であった。
【0081】
表IIIでは、TACC3、RELB、Aurora−A、PRKCD(PKC)、HS
PA1A、およびBRAF35は、IC50のシフトが特徴的な、低ドセタキセル濃度(1〜6nM)で感受性を増大させるsiRNA群を表している。Aurora−Aは、有糸分裂開始時に機能し、これまで、中心体成熟および紡錘体集合に関与するとされてきたセリン/スレオニンキナーゼである(Meraldiら、Curr Opin Genet Dev 14:29頁、2004年で再検討された)。最も興味深いのは、HeLa細胞のAurora−A過剰発現が、パクリタキセルから細胞を保護することを示した公表データであり、Aurora−A過少発現が、ドセタキセル死滅力を増大させた本発明者の結果と一致していた(Anandら、Cancer Cell 3:51頁、2003年)。確かに、生存の25%減少を示したAurora−Aに関しては、これはIC50のわずかな減少であったが、この結果は、HCT116細胞でAurora−Aの安定ノックダウンを生じているshRNAを、レトロウイルス送達することで正確に再現された(図9を図10および11と比較のこと)。
【0082】
〔実施例6〕
Pim1はドセタキセル非存在下でHCT116増殖を阻害する
スクリーニングからの陽性結果を評価するためには、ドセタキセル非存在下で細胞の生存に影響するsiRNAと、ドセタキセルと協調して死滅力を増大する働きをするものとを区別することが重要であった。これらの可能性を区別するため、本発明者は、トリパンブルー排除法を用いてsiRNAトランスフェクションが増殖に与える影響を試験し、トランスフェクション後24、48、72時間目に、6ウェルプレートの生細胞数を判定するため、細胞を計数した。本発明者の結果は、Pim−1のsiRNAはHCT116細胞の成長を阻害するのに対し、TACCのsiRNAは、成長に影響しない(図12、ノックダウンを定量した図13)が、siRNAは両方ともドセタキセル誘導細胞死を増大させた(図9)。
【0083】
〔実施例7〕
Live/Deadアッセイを用いた耐性および感受性遺伝子サブセットの検証
ドセタキセル感受性および耐性を付与するsiRNAを視覚的に比較するため、顕微鏡撮像を用いて生細胞対死細胞の比を測定した。ここでは、生細胞を緑色に染色するカルセイン−AMを、および死細胞の核酸を赤く染色するヨウ化プロピジウム(PI)を用いた。ドセタキセル添加後(72時間目)、siRNAをトランスフェクトしたBubR1細胞は、生細胞数が最大となったのに対し、siRNAをトランスフェクトしたPim−1およびTACC3は、死細胞数が最大となり、対照細胞はこの中間であった(データ不図示)。BubR1のsiRNA単独では、72時間まで細胞死は増加したが、細胞は最終的にドセタキセルに対し更に耐性となった。Pim−1のsiRNA単独では、24時間まで細胞死を誘発したのに対し、TACC3のsiRNAは、細胞死を引き起こさなかった。これらの結果は、BubR1ダウンレギュレーションは、細胞の生存および薬剤耐性と関連があるのに対し、Pim−1およびTACC3ダウンレギュレーションは、細胞死および薬剤感受性と関連があることを示した。Pim−1およびTACC3はいずれも、ドセタキセル存在下で死滅が増加したが、このアッセイは、相加効果と協調的死滅とを区別することができなかった。
【0084】
〔実施例8〕
ドセタキセル誘導カスパーゼ3活性はBubR1ダウンレギュレーションにより低下し、Pim−1ダウンレギュレーションで増大した
ドセタキセルは、アポトーシスの誘発を介して細胞死を引き起こす(Kimら、Int
J Mo1 Med 11:799頁、2003年)。Pim−1およびBubR1のsiRNAが、ドセタキセル存在下および非存在下でアポトーシス標準経路を調節することができるかどうかを判定するため、本発明者は、HCT116細胞における活性化カスパーゼ3レベルを試験した(バイオプレックスアッセイ(bioplex assay)により)(図14)。40nMドセタキセル添加48時間後、カスパーゼ3活性を対照細胞で誘導し、Pim−1をダウンレギュレートして誘導をさらに増大させ、BubR1をダウンレギュレートして減少させた(中段および下段パネル)。ドセタキセル非存在下では、Pim−1のダウンレギュレーションは、24時間目にカスパーゼ3活性のわずかな増加をもたらしたが、カスパーゼ3活性は、48および72時間目までに対照レベルに戻っていた(上段パネル)。これは、他のアポトーシス機構が活性化されて、WST−1およびLIVE/DEADアッセイにより72時間目に観察された死滅の増大を維持したことを示している。ドセタキセル非存在下におけるBubR1のダウンレギュレーションは、カスパーゼ3活性のきわめてわずかな増加をもたらした。これは、BubR1ノックダウンが当初、LIVE/DEADアッセイで72時間目に細胞死を引き起こした所見と一致していた。これらの結果はさらに、Pim−1およびBubR1が、カスパーゼ3活性の調節を介したドセタキセル死滅エフェクターであることを示唆した。
【0085】
〔実施例9〕
ドセタキセル誘導Pim−1関連感受性およびBubR1関連耐性に関与するシグナル伝達経路
Pim−1に起因する活性は、細胞死につながるシグナル伝達イベントを阻害する一方、細胞生存を促進するシグナル伝達イベントを促す上で中心的な役割を果たしていることを示唆した。Pim−1ノックダウンに関連した細胞死の増大に関する分子基盤を明らかにするため、本発明者は、細胞生存に関与する鍵となる細胞経路、AKTの活性化状態を調べた。HCT116は、4×105細胞/ウェルで6ウェルプレートに播種し、翌日、リポフェクタミン2000(インビトロゲン)により16nMにてsiRNAをトランスフェクトした。24時間後、細胞を5および40nMドセタキセルで処理するか未処理とした。ドセタキセル添加後24、48および72時間目に、氷冷した溶解緩衝液(50mM HEPES緩衝液(PH7.4)、1%NP40、2.5mM EDTA、100mMフッ化ナトリウム、10mM PPLナトリウム、プロテーアーゼ阻害剤カクテルタブレット(Roche)、2mMオルトバナジウム酸ナトリウム)で細胞を溶解し、12,000gで10分間遠心分離した。溶解物は、次いでDCタンパク質アッセイ(BioRad)により全タンパク質レベルを定量化した。活性化カスパーゼ3レベルは、活性化カスパーゼ3Beadmatesキット(アップステート)およびルミネックス100(商標)システムを用いて、メーカーにより指示されたプロトコールで判定した。総合およびリン酸化AKTレベルは、トータルAKT抗体ビーズキットおよびリン酸特異的AKTS473抗体ビーズキット(Biosource)およびルミネックス100(商標)システムを用いて、メーカーにより指示されたプロトコールで判定した。
【0086】
図15に示された実験は、Pim−1ダウンレギュレーションが、対照に比べてベースラインのAKTリン酸化を減少させ、この効果は、ドセタキセル濃度の上昇に伴い有意に倍加したことを示している。対して、BubR1ダウンレギュレーションは、ベースラインのAKTリン酸化を増加させ、この効果は、ドセタキセルの高くはなく低い濃度で強調された。これは、代替シグナル伝達経路の変化が、高用量で活性化される可能性があることを示している。
【0087】
本発明者は、Pim−1およびBubR1に対する抗体を用いてウェスタンブロット分析を行い、48時間時点のタンパク質レベルを測定した。同量のタンパク質を、NuPAGE Novex Bis−Trisゲル(インビトロゲン)に添加した。Pim−1に対する抗体(サンタクルスバイオテクノロジー)、BubR1に対する抗体(BDバイオ
サイエンス)およびα−チューブリンに対する抗体(シグマ)は、メーカーの指示通りに使用した。第2抗体は、HRP(BioRad)に結合させ、ECLウェスタンブロット検出システム(Amhersham Biosciences)で検出した後、ハイパーフィルムECL(Amhersham Biosciences)に曝露した。図16に示された実験は、Pim−1およびBubR1のタンパク質レベルが、対照に比べて低下したことを示しており、タンパク質レベルの低下は、機能的変化(図15)に対応していたことを示している。これらのデータは、Pim−1タンパク質レベルのダウンレギュレーションは、細胞をアポトーシスへ押しやるため、AKTのリン酸化および活性化を阻害することができることを示唆している。Pim−1は、プロサバイバル経路(pro−survival pathway)の活性化により細胞の生存を媒介しているように思われる。
【0088】
本発明は、本明細書に記載された特定の実施形態により範囲を限定されない。実際、本明細書に記載されたものに加え、本発明の様々な変更が可能であることは、先述の説明および添付図面から当業者には明らかであろう。このような変更は、添付の特許請求の範囲にあるものである。
【0089】
本明細書で引用されている文献はすべて、参照により全体が組み込まれている。
Anand S, Penrhyn-Lowe S, Venkitaraman AR. (2003) AURORA-A amplification overrides the mitotic spindle assembly checkpoint, inducing resistance to Taxol. Cancer Cell. 3:51-62.
Aza-Blanc P, Cooper CL, Wagner K, Batalov S, Deveraux QL, Cooke MP. (2003) Identification of modulators of TRAIL-induced apoptosis via RNAi-based phenotypic screening. Mol Cell. 12:627-37.
Chang JC, Wooten EC, Tsimelzon A, Hilsenbeck SG, Gutierrez MC, Elledge R, Mohsin S, Osborne CK, Chamness GC, Allred DC, O'Connell P. (2003) Gene expression profiling for the prediction of therapeutic response to docetaxel in patients with breast cancer. Lancet. 362:362-9.
Hong, WK (2002) The current status of docetaxel in solid tumors. Oncology 16:9-15.
Jackson AL, Bartz SR, Schelter J, Kobayashi SV, Burchard J, Mao M, Li B, Cavet
G, Linsley PS. (2003) Expression profiling reveals off-target gene regulation by RNAi. Nat Biotechnol. 21:635-7.
Katsumata N. (2003) Docetaxel: an alternative taxane in ovarian cancer. Br J Cancer. 89 Suppl 3:S9-S15.
Kim R, Tanabe K, Uchida Y, Emi M, Toge T. (2003) Effect of Bcl-2 antisense oligonucleotide on drug-sensitivity in association with apoptosis in undifferentiated thyroid carcinoma. Int J Mol Med. 11:799-804.
Kolfschoten GM, Hulscher TM, Duyndam MC, Pinedo HM, Boven E. (2002) Variation in the kinetics of caspase-3 activation, Bcl-2 phosphorylation and apoptotic morphology in unselected human ovarian cancer cell lines as a response to docetaxel. Biochem Pharmacol. 63:733-43.
Kung AL, Sherwood SW, Schimke RT. (1990) Cell line-specific differences in the
control of cell cycle progression in the absence of mitosis. Proc Natl Acad Sci
U S A. 87:9553-7.
Lanni JS, Jacks T. (1998) Characterization of the p53-dependent postmitotic checkpoint following spindle disruption. Mol Cell Biol. 18:1055-64.
Lee LF, Li G, Templeton DJ, Ting JP. (1998) Paclitaxel (Taxol)-induced gene expression and cell death are both mediated by the activation of c-Jun NH2-terminal kinase (JNK/SAPK). J Biol Chem. 273:28253-60.
Li Y, Dowbenko D, Lasky LA. (2002) AKT/PKB phosphorylation of p21Cip/WAF1 enhances protein stability of p21Cip/WAF1 and promotes cell survival. J Biol Chem. 277:11352-61.
Lum L, Yao S, Mozer B, Rovescalli A, Von Kessler D, Nirenberg M, Beachy PA. (2003) Identification of Hedgehog pathway components by RNAi in Drosophila cultured cells. Science. 299:2039-45.
Masuda A, Maeno K, Nakagawa T, Saito H, Takahashi T. (2003) Association between mitotic spindle checkpoint impairment and susceptibility to the induction of apoptosis by anti-microtubule agents in human lung cancers. Am J Pathol. 163:1109-16.
McManus MT, Sharp PA. (2002) Gene silencing in mammals by small interfering RNAs. Nat Rev Genet. 3:737-47.
Meraldi P, Honda R, Nigg EA. (2004) Aurora kinases link chromosome segregation
and cell division to cancer susceptibility. Curr Opin Genet Dev. 14:29-36.
Michel L, Diaz-Rodriguez E, Narayan G, Hernando E, Murty VV, Benezra R. (2004)
Complete loss of the tumor suppressor MAD2 causes premature cyclin B degradation and mitotic failure in human somatic cells. Proc Natl Acad Sci U S A. 101:4459-64.
Ojima, I. and Geney, R. 109881 Aventis (2004) Curr Opin Investig Drugs 4:737-40.
Ringel I, Horwitz SB. (1991) Studies with RP 56976 (taxotere): a semisynthetic
analogue of taxol. J Natl Cancer Inst. 83:288-91.
Roh M, Gary B, Song C, Said-Al-Naief N, Tousson A, Kraft A, Eltoum IE, Abdulkadir SA. (2003) Overexpression of the oncogenic kinase Pim-1 leads to genomic instability. Cancer Res. 63:8079-84.
Shin HJ, Baek KH, Jeon AH, Park MT, Lee SJ, Kang CM, Lee HS, Yoo SH, Chung DH,
Sung YC, McKeon F, Lee CW. (2003) Dual roles of human BubR1, a mitotic checkpoint kinase, in the monitoring of chromosomal instability. Cancer Cell. 4:483-97.
Simmer F, Moorman C, Van Der Linden AM, Kuijk E, Van Den Berghe PV, Kamath R, Fraser AG, Ahringer J, Plasterk RH. (2003) Genome-Wide RNAi of C. elegans Using the Hypersensitive rrf-3 Strain Reveals Novel Gene Functions. PLoS Biol. 1:E12.
Sudo T, Nitta M, Saya H, Ueno NT. (2004) Dependence of paclitaxel sensitivity on a functional spindle assembly checkpoint. Cancer Res. 64:2502-8.
Tanabe K, Kim R, Inoue H, Emi M, Uchida Y, Toge T. (2003) Antisense Bcl-2 and HER-2 oligonucleotide treatment of breast cancer cells enhances their sensitivity to anticancer drugs. Int J Oncol. 22:875-81.
Taylor SS, McKeon F. (1997) Kinetochore localization of murine Bub1 is required for normal mitotic timing and checkpoint response to spindle damage.Cell. 89:727-35.
Wang TH, Wang HS, Soong YK (2000) Paclitaxel-induced cell death: where the cell cycle and apoptosis come together. Cancer. 88:2619-28.
Wang Z, Bhattacharya N, Mixter PF, Wei W, Sedivy J, Magnuson NS. (2002) Phosphorylation of the cell cycle inhibitor p21Cip1/WAF1 by Pim-1 kinase. Biochim Biophys Acta. 1593:45-55.
Zhou J, Yao J, Joshi HC. (2002) Attachment and tension in the spindle assembly
checkpoint. J Cell Sci. 115:3547-55.
【技術分野】
【0001】
本発明は、タキソイドファミリー分子に対する患者の応答を、対照と比較した特異的遺伝子マーカーの増減を測定することで予測またはモニタリングすることができる、新規の、有用な、これまで知られていない方法に関する。本発明はまた、タキソイドファミリー分子に対する患者の応答を、特定の遺伝子マーカーの核酸またはタンパク質レベルを測定すること、およびこれらのレベルを対照または参照マーカーと比較することで予測またはモニタリングするキットも提供する。
【背景技術】
【0002】
ドセタキセルは、乳癌、肺癌および卵巣癌の治療に幅広く使用されている抗有糸分裂剤であり、これほどではないが頭頚部癌、胃癌および前立腺癌を治療するのに使用されている(Hong、Oncology 16:9頁、2002年)。ドセタキセルは、ベータ−チューブリンに結合し、アルファ−およびベータ−チューブリンへテロダイマーの解離を抑制して微小管動態を阻害することで腫瘍増殖を抑制する(RingelおよびHorwitz、J Natl Cancer Inst 83:288頁、1991年)。ドセタキセルおよび関連するタキサンであるパクリタキセルの抗腫瘍活性は、紡錘体の微小管を標的とすることにより生じ、染色体の整列および分離を抑制し、細胞周期の進行を阻害し、アポトーシス経路を活性化する(Wangら、Cancer 88:2619頁、2000年)。パクリタキセルのプロアポトーシス活性は、p53/p21waf1/Cip1、raf/rasおよびマイトジェン活性化プロテインキナーゼ(MAPK)を伴う細胞シグナル伝達事象を介して、Bcl−2のリン酸化および不活性化に関連している(Wangら、Cancer 88:2619頁、2000年)。ドセタキセルは、パクリタキセルより強力な抗癌剤であるが、この細胞毒性に関わる経路は、パクリタキセルほど明確になっていない(Katsumata、Br J Cancer 89:S9頁、2003年)。ドセタキセル誘導アポトーシスは、Bcl−2リン酸化およびカスパーゼ−3活性化を伴うメカニズムを介して、任意の細胞系で観察されている(Kolfschotenら、Biochem Pharmacol 63:733頁、2002年)。異なる培養系においてタキサン誘導細胞殺傷を調節する他のタンパク質には、HeLa細胞のAurora−A(Anandら、Cancer Cell 3:51頁、2003年)、乳癌細胞のHER−2(Tanabeら、Int J Oncol 22:875頁、2003年)、膠芽腫細胞のp21waf1/Cip1(Liら、J Biol Chem 277:11352頁、2002年)および卵巣癌細胞のJNK/MKK1(Leeら、J Biol Chem 273:28253頁、1998年)が挙げられる。
【発明の概要】
【発明が解決しようとする課題】
【0003】
この分野には、ドセタキセル耐性を媒介する、薬剤の標的になり得るタンパク質を同定することで、創薬にこれらを利用して、タンパク質のインビボでの機能を抑制し、抗腫瘍剤化学療法に細胞を感作させる可能性のある試薬(低分子、siRNAなど)を同定できるようにする必要が依然として残っている。この分野にはまた、どの患者が、抗腫瘍ドセタキセル薬に基づく化学療法に応答するか否かを、化学療法による治療の前に確信をもって予測できるアッセイを行う必要も残っている。出願者は、本明細書で、ドセタキセルに対する耐性および/または感受性を予測できる新規アッセイを説明し、癌における薬剤耐性を抑制する新規療法を開発するためのスクリーニングアッセイを提供する。
【課題を解決するための手段】
【0004】
本発明により、タキソイドファミリー分子に対する患者の応答を、患者および対照にお
ける特異的遺伝子マーカーの活性化および/または発現レベルを比較することでモニタリングおよび/または予測する、新規で有用な方法が提供される。
【0005】
1つの実施形態では、本発明は、
a)患者の癌領域から試験試料を得る工程と、
b)対照試料を得る工程と、
c)1種またはそれ以上の遺伝子マーカーのレベルを測定する工程と、
d)試験試料および対照試料における前記1種またはそれ以上の遺伝子マーカーの測定レベルを比較する工程と
を含み、対照試料と比較した場合の、試験試料において測定された前記1種またはそれ以上の遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する耐性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするための方法を提供する。
【0006】
本発明のこの態様では、特定の遺伝子マーカーとして以下が挙げられる。
BubR1,Homo sapiens similar to protein kinase(BUBR1)mRNA,complete cds(BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列)(GenBank受託番号:AF046079)、
Mad2,Homo sapiens mRNA for MAD2 protein(Mad2、ホモサピエンスmRNA、MAD2タンパク質対応)(GenBank受託番号:AJ000186)、
Mps1,Homo sapiens TTK protein kinase(TTK),mRNA(Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA)(GenBank受託番号:NM_003318)、
GEFT for Rac1/CDC42,Homo sapiens RAC/CDC42 exchange factor(GEFT),transcript variant 2,mRNA(GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA)(GenBank受託番号:NM_133483)、
Bub1,Homo sapiens BUB1 budding uninhibited by benzimidazoles 1 homolog(yeast)(BUB1),mRNA(Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻害されず(酵母)(BUB1)、mRNA)(GenBank受託番号:NM_004336)、
hSepharase,Homo sapiens extra spindle poles like 1(S.cerevisiae)(ESPL1),mRNA(hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESPL1)、mRNA)(GenBank受託番号:NM_012291)、
CamKIId,Homo sapiens calcium/calmodulin−dependent protein kinase(CaM kinase)II delta(CAMK2D),transcript variant 3,mRNA(CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA)(GenBank受託番号:NM_001221)、
CDK6,Homo sapiens cyclin−dependent kinase 6(CDK6),mRNA(CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA)(GenBank受託番号:NM_001259)、および
GRB2,Homo sapiens growth factor recepto
r−bound protein 2(GRB2),transcript variant 1,mRNA(GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA)(GenBank受託番号:NM_002086)
【0007】
別の実施形態では、本発明は、
a)患者の癌領域から試験試料を得る工程と、
b)対照試料を得る工程と、
c)1種またはそれ以上の遺伝子マーカーのレベルを測定する工程と、
d)試験試料および対照試料における前記1種またはそれ以上の遺伝子マーカーの測定レベルを比較する工程と
を含み、対照試料と比較した場合の、試験試料において測定された前記1種またはそれ以上の遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する感受性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするための方法に関する。
【0008】
本発明のこの特定の態様では、1種またはそれ以上の遺伝子マーカーは、以下からなる群から選択することができる。
P21(Waf1),Homo sapiens cyclin−dependent
kinase inhibitor 1A(p21,Cip1)(CDKN1A),transcript variant 1,mRNA(P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA)(GenBank受託番号:NM_000389)、
Pim−1,Homo sapiens pim−1 oncogene(PIM1),mRNA(Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA)(GenBank受託番号:NM_002648)、
GBP−1,Homo sapiens guanylate binding protein 1,interferon−inducible,67kDa(GBP1),mRNA(GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導性、67kDa(GBP1)、mRNA)(GenBank受託番号:NM_002053)、
RXRA,Homo sapiens retinoid X receptor,alpha(RXRA),mRNA(RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA)(GenBank受託番号:NM_002957)、
SPF45,Homo sapiens RNA binding motif protein 17(RBM17),mRNA(SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA)(GenBank受託番号:NM_032905)、
Hec1,Homo sapiens kinetochore associated 2(KNTC2),mRNA(Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA)(GenBank受託番号:NM_006101)、
Raf1,Human mRNA for raf oncogene(Raf1、ヒトmRNA、raf発癌遺伝子対応)(GenBank受託番号:X03484)、
Aurora A,Homo sapiens aurora−related kinase 1(ARK1)mRNA,complete cds(Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列)(GenBank受託番号:AF008551)、
TACC3,Homo sapiens transforming,acidic coiled−coil containing protein 3(TACC3),mRNA(TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA)(GenBank受託番号:NM_006342)、
RelB,Homo sapiens v−rel reticuloendotheliosis viral oncogene homolog B,nuclear factor of kappa light polypeptide gene enhancer in B−cells 3(avian)(RELB),mRNA(RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA)(GenBank受託番号:NM_006509)、
PRKCD,Homo sapiens protein kinase C,delta(PRKCD),transcript variant 1,mRNA(PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA)(GenBank受託番号:NM_006254)、
BRAF35,Homo sapiens high−mobility group
20B(HMG20B),mRNA(BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA)(GenBank受託番号:NM_006339)、
HSPA1L,Homo sapiens heat shock 70kDa protein 1A(HSPA1A),mRNA(HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA)(GenBank受託番号:NM_005345)、
STK11,Homo sapiens serine/threonine kinase 11(Peutz−Jeghers syndrome)(STK11),mRNA(STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツジェガース症候群)(STK11)、mRNA)(GenBank受託番号:NM_000455)、および
MKK3,Homo sapiens MAP kinase kinase 3(MKK3)mRNA,complete cds(MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列)(GenBank受託番号:L36719)。
【0009】
さらなる実施形態では、本発明は、
a)患者の癌領域から試験試料を得る工程と、
b)BubR1,Homo sapiens similar to protein
kinase(BUBR1)mRNA,complete cds(BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列)(GenBank受託番号:AF046079)、
Mad2,Homo sapiens mRNA for MAD2 protein(Mad2、ホモサピエンスmRNA、MAD2タンパク質対応)(GenBank受託番号:AJ000186)、
Mps1,Homo sapiens TTK protein kinase(TTK),mRNA(Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA)(GenBank受託番号:NM_003318)、
GEFT for Rac1/CDC42,Homo sapiens RAC/CDC42 exchange factor(GEFT),transcript variant 2,mRNA(GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA)(GenBank受託番号:NM_133483)、
Bub1,Homo sapiens BUB1 budding uninhibited by benzimidazoles 1 homolog(yeast)(BUB1),mRNA(Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻害されず(酵母)(BUB1)、mRNA)(GenBank受託番
号:NM_004336)、
hSepharase,Homo sapiens extra spindle poles like 1(S.cerevisiae)(ESPL1),mRNA(hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESPL1)、mRNA)(GenBank受託番号:NM_012291)、
CamKIId,Homo sapiens calcium/calmodulin−dependent protein kinase(CaM kinase)II delta(CAMK2D),transcript variant 3,mRNA(CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA)(GenBank受託番号:NM_001221)、
CDK6,Homo sapiens cyclin−dependent kinase 6(CDK6),mRNA(CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA)(GenBank受託番号:NM_001259)、および
GRB2,Homo sapiens growth factor receptor−bound protein 2(GRB2),transcript variant 1,mRNA(GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA)(GenBank受託番号:NM_002086)からなる群から選択される1種またはそれ以上の遺伝子マーカーのレベルを測定する工程と、
c)GAPDH,Homo sapiens glyceraldehyde−3−phosphate dehydrogenase(GAPD),mRNA(GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA)(GenBank受託番号:NM_002046)、および
RPS9,Homo sapiens cDNA clone IMAGE:6647283、partial cds(RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列)(GenBank受託番号:BC071941)
からなる群から選択される1種またはそれ以上の参照遺伝子マーカーのレベルを測定する工程と、
d)試験試料における前記1種またはそれ以上の遺伝子マーカーおよび前記1種またはそれ以上の参照遺伝子マーカーの測定レベルを比較する工程と
を含み、
前記1種またはそれ以上の参照遺伝子マーカーレベルと比較した場合の、前記1種またはそれ以上の遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する耐性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするための方法に関する。
【0010】
本発明のさらなる実施形態は、
a)患者の癌領域から試験試料を得る工程と、
b)P21(Waf1),Homo sapiens cyclin−dependent kinase inhibitor 1A(p21,Cip1)(CDKN1A),transcript variant 1,mRNA(P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA)(GenBank受託番号:NM_000389)、
Pim−1,Homo sapiens pim−1 oncogene(PIM1),mRNA(Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA)(GenBank受託番号:NM_002648)、
GBP−1,Homo sapiens guanylate binding protein 1,interferon−inducible,67kDa(GBP1)
,mRNA(GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導性、67kDa(GBP1)、mRNA)(GenBank受託番号:NM_002053)、
RXRA,Homo sapiens retinoid X receptor,alpha(RXRA),mRNA(RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA)(GenBank受託番号:NM_002957)、
SPF45,Homo sapiens RNA binding motif protein 17(RBM17),mRNA(SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA)(GenBank受託番号:NM_032905)、
Hec1,Homo sapiens kinetochore associated 2(KNTC2),mRNA(Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA)(GenBank受託番号:NM_006101)、
Raf1,Human mRNA for raf oncogene(Raf1、ヒトmRNA、raf発癌遺伝子対応)(GenBank受託番号:X03484)、
Aurora A,Homo sapiens aurora−related kinase 1(ARK1)mRNA,complete cds(Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列)(GenBank受託番号:AF008551)、
TACC3,Homo sapiens transforming,acidic coiled−coil containing protein 3(TACC3),mRNA(TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA)(GenBank受託番号:NM_006342)、
RelB,Homo sapiens v−rel reticuloendotheliosis viral oncogene homolog B,nuclear factor of kappa light polypeptide gene enhancer in B−cells 3(avian)(RELB),mRNA(RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA)(GenBank受託番号:NM_006509)、
PRKCD,Homo sapiens protein kinase C,delta(PRKCD),transcript variant 1,mRNA(PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA)(GenBank受託番号:NM_006254)、
BRAF35,Homo sapiens high−mobility group
20B(HMG20B),mRNA(BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA)(GenBank受託番号:NM_006339)、
HSPA1L,Homo sapiens heat shock 70kDa protein 1A(HSPA1A),mRNA(HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA)(GenBank受託番号:NM_005345)、
STK11,Homo sapiens serine/threonine kinase 11(Peutz−Jeghers syndrome)(STK11),mRNA(STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツジェガース症候群)(STK11)、mRNA)(GenBank受託番号:NM_000455)、および
MKK3,Homo sapiens MAP kinase kinase 3(MKK3)mRNA,complete cds(MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列)(GenBank受託番号:L36719)
からなる群から選択される1種またはそれ以上の遺伝子マーカーのレベルを測定する工程と、
c)GAPDH,Homo sapiens glyceraldehyde−3−phosphate dehydrogenase(GAPD),mRNA(GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA)(GenBank受託番号:NM_002046)、および
RPS9,Homo sapiens cDNA clone IMAGE:6647283、partial cds(RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列)(GenBank受託番号:BC071941)
からなる群から選択される1種またはそれ以上の参照遺伝子マーカーのレベルを測定する工程と、
d)試験試料における前記1種またはそれ以上の遺伝子マーカーおよび前記1種またはそれ以上の参照遺伝子マーカーの測定レベルを比較する工程と
を含み、
前記1種またはそれ以上の参照遺伝子マーカーレベルと比較した場合の、前記1種またはそれ以上の遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する感受性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするための方法に関する。
【0011】
本発明は、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするための方法に関する。この、本発明のさらなる実施形態には、タキソイドファミリー分子であるパクリタキセル、ドセタキセルXRP9881およびXRP6258が含まれる。
【0012】
本発明で説明される遺伝子マーカーは、以下でさらに詳細に説明される様々な方法により、RNA、DNAまたはタンパク質のレベルを測定することで評価することができる。本発明の他の実施形態は、タキソイドファミリー分子に対する患者の応答を予測またはモニタリングするためのキットに関する。
【0013】
本発明の上記態様および他の態様、特徴、および利点は、添付図面と併せて以下の詳細な説明からさらに理解されるであろう。
【図面の簡単な説明】
【0014】
【図1】ダウンレギュレーションによりドセタキセル耐性をもたらす遺伝子の特性を示す図である。ドセタキセルは、対照siRNA(白い四角)に比べ、RB1、BubR1、Mad2およびMps1のsiRNA(黒い四角)をトランスフェクトされたHCT116細胞に対し用量反応曲線を描いた。RB1は、スクリーニングでスコア化されなかったsiRNAの一例であった。細胞の生存は、WST−1添加後、吸光度450nMで測定した。最小比(MR)は、40nMドセタキセルにおける対照に対する遺伝子のWST−1値である。
【図2】対照shRNA(白い四角)と比較した、BubR1およびMps1のshRNA(黒い四角)の用量反応曲線を示す図である。
【図3】BubR1およびMps1のshRNAをそれぞれ含有する細胞におけるBubR1およびMps1のmRNAレベルに関するTaqManリアルタイムPCR分析を示す図である。
【図4】ドセタキセル処理の有無による、Mad2、BubR1およびMps1のsiRNAをトランスフェクトされたHCT116細胞に関する、細胞の生存および形態を示す図である。トランスフェクション24時間後、細胞は未処理のまま(−ドセタキセル)または200nMドセタキセルで処理(+ドセタキセル)され、処理16時間後および72時間後の生細胞を視覚化するためカルセイン−AMで染色した。
【図5】ドセタキセル処理後、Mad2、BubR1およびMps1および対照のsiRNAをトランスフェクトされたHCT116細胞に関する、有糸分裂指数を示す図である。トランスフェクション24時間後、細胞を、200nMドセタキセルで16時間および72時間処理し、処理した。有糸分裂細胞は、リン酸化ヒストンH3抗体により検出され、ここでは細胞核上の赤い点状染色として示された(有糸分裂指数キット、Cellomics)。核は、ヘキスト染料により青色に染色された。
【図6】Mps1、BubR1およびMad2のsiRNAをそれぞれトランスフェクトされたHCT116細胞におけるMps1、BubR1およびMad2のmRNAに関するTaqManリアルタイムPCR分析を示す図である。
【図7】3つの有糸分裂チェックポイント遺伝子siRNAをトランスフェクトされたHCT116細胞の細胞周期分析を示す図である。Mps1、BubR1およびMad2のsiRNAをトランスフェクション後、細胞を未処理(−ドセタキセル)とするかまたは200nMドセタキセルで24時間処理(+ドセタキセル)した。ドセタキセル添加72時間後、細胞を収集し、細胞周期を分析した。ピークを上回る数は、2N、4N、8N、16Nまたは32NなどのDNA量を示している。
【図8】安定したノックダウン細胞株によるコロニー形成細胞生存アッセイを示す図である。BubR1またはベクター対照のshRNAを含有するHCT116細胞を、10cm皿に播種し、5nMドセタキセル中で10日間維持した。コロニーは、PBSで洗浄し、クリスタルバイオレットで染色した。
【図9】ダウンレギュレーションによりドセタキセル感受性の増加をもたらす遺伝子のいくつかの用量反応曲線を示す図である。ドセタキセルは、対照siRNA(白い四角)に比べ、RB1、Pim−1、p21、Aurora AおよびTACC3のsiRNA(黒い四角)をトランスフェクトしたHCT116細胞に対し用量反応曲線を描いた。最小比(MR)は、40nMドセタキセル濃度における対照のWST−1読み出し値に対する遺伝子のWST−1読み出し値の比である。IC50(IR)比は、対照のIC50に対する遺伝子のIC50の比である。
【図10】ベクター対照(白い四角)と比較した、Aurora AのshRNA(黒い四角)の用量反応曲線を示す図である。
【図11】Aurora AのshRNAを含有する細胞におけるAurora AのmRNAレベルに関するTaqManリアルタイムPCR分析を示す図である。
【図12】対照siRNA(白い四角)と比較した、Pim−1およびTACC3のsiRNA(黒い四角)をトランスフェクトしたHCT116細胞の増殖の差を示す図である。Pim−1、TACC3および対照siRNAをトランスフェクション後様々な時点で、6ウェルプレートに残存している細胞数。
【図13】siRNAトランスフェクション後、Pim−1およびTACC3のmRNAレベルに関するTaqMan分析を示す図である。
【図14】Pim−1およびBubR1のsiRNAをトランスフェクトしたHCT116細胞における活性カスパーゼ−3レベルを示す図である。活性カスパーゼ−3レベルは、活性カスパーゼ−3Beadmatesキット(Upstate)による蛍光強度として示された。3つのドセタキセル濃度、0、5および40nM、および3つの時点であるドセタキセル添加後24、48および72時間が調べられた。
【図15】Pim−1およびBubR1のsiRNAをトランスフェクトしたHCT116細胞におけるAKTリン酸化レベルを示す図である。リン酸化AKTレベルおよび全AKTレベルの比は、ビーズベースのアッセイ(Biosource)により定量された。トランスフェクション24時間後、細胞は未処理のままとするか、または5および40nMドセタキセルで処理した。ドセタキセル処理48時間後、細胞溶解物を分析した。リン酸化レベルは、全AKT(t−AKT)に対するリン酸化AKT(p−AKT)の比として算出した。
【図16】トランスフェクション48時間後のPim−1およびBubR1レベルの低下を示すウェスタンブロットの図である。
【発明を実施するための最良の形態】
【0015】
本発明は、被験対象がタキソイドファミリーの薬剤に耐性であるかまたは感受性であるかを予測することができる遺伝子マーカーの、出願者による同定に広く基づいている。細胞ベースのRNA干渉(RNAi)スクリーニングにより、出願者は、ドセタキセルに対する薬剤耐性または感受性が、特定の遺伝子マーカーと関連があることを認めた。
【0016】
本明細書および特許請求の範囲を通じて、数多くの用語および語句が使用されていることが注目される。これらの用語および語句の定義は、以下の通りである。
【0017】
本明細書では、「予後」という用語は、薬剤耐性の他、再発、転移、および腫瘍性疾患を含め、癌に起因する死または進行の予測または見込みを言う。
【0018】
本明細書では、「予測」という用語は、患者がある薬剤または一連の薬剤に対し、好ましいまたは好ましくない応答を示す見込みを言う。また、患者が、原発腫瘍の外科的除去および/または化学療法後、癌が再発することなく一定の期間生存するかどうかなどの応答の程度も言う。本発明により想定される予測方法は、任意の特定の患者に対し、最も適切な治療法、特にタキソイドファミリーの化学療法薬を選択することにより治療決定を行うために、臨床的に用いることができる。本発明の予測方法は、患者が、所与の薬剤または薬剤併用による化学療法、および/または放射線療法などの治療法に良好に応答する見込みがあるかどうか、または化学療法もしくは他の治療法を中止した後に患者から長期生存する見込みがあるかどうかを予測する上で貴重なツールとなる。
【0019】
本明細書では、「腫瘍」という用語は、悪性または良性にかかわらず、すべての新生細胞の成長および増殖、およびすべての前癌性および癌性の細胞ならびに組織のことを言う。
【0020】
本明細書では、「癌」および「癌性」という用語は、一般に未制御な細胞の成長を特徴とする、哺乳類における生理的状態を言う。癌の例としては、以下が挙げられるが、これらに限定されない。乳癌、結腸癌、肺癌、前立腺癌、肝細胞癌、胃癌、膵臓癌、子宮頸癌および卵巣癌、肝臓癌、膀胱癌、尿管癌、癌腫、メラノーマ、膠芽細胞腫および髄芽腫を含む脳癌、胆道癌、絨毛腫、食道癌、胃癌、急性リンパ性および骨髄性白血病を含む血液腫瘍、多発性骨腫、AIDS関連白血病および成人T細胞白血病リンパ腫、ボーエン病およびページェット病を含む上皮内腫瘍、ホジキン病およびリンパ球性リンパ腫を含むリンパ腫、神経芽腫、扁平上皮癌を含む口腔癌、平滑筋肉腫、横紋筋肉腫、脂肪肉腫、線維肉腫、および骨肉腫を含む肉腫、メラノーマ、カポジ肉腫、基底細胞癌、および扁平上皮癌を含む皮膚癌、精上皮腫、非精上皮腫(奇形腫、絨毛腫)、間質腫瘍、および生殖細胞腫瘍などの生殖腫瘍を含む睾丸癌、甲状腺癌(thyroid adenocarcinoma)および髄様癌を含む甲状腺癌(thyroid cancer)、腺癌およびウイルムス腫瘍を含む腎臓癌。
【0021】
本明細書では、「患者」という用語は、好ましくはヒトを言うが、ヒト以外の霊長類、ウシ、ウマ、ブタ、ヒツジ、ヤギ、イヌ、ネコまたはげっ歯類を含めてもよい。好ましくは、対象は、癌であることが疑われる、または癌もしくは例えば、癌の家族歴があるなど癌を発症するハイリスク群にあると診断されたヒトである。本発明の好ましい実施形態では、癌は、乳癌である。癌であることが疑われる対象を特定する方法には、指診、生検、対象の家族の病歴、対象の病歴、またはマンモグラフィー、磁気共鳴分光法、もしくは陽電子放出断層撮影法などのいくつかの画像技術を挙げることができる。癌の診断方法および癌診断の臨床特性は、医術における当業者に公知である。
【0022】
本明細書では、「試料」とは、関連医術の当業者に公知の方法を用いて得られた組織のことである。生検などの方法には、グロスアポーショニングオブアマス(gross apportioning of a mass)、マイクロダイセクション、レーザーベースのマイクロダイセクション、または他の当業者に公知の細胞分離法が含まれる。罹患組織の生検材料には、多様な細胞型、および使用される診断方法の多様な感受性があるため、分析に必要な試料サイズは、1、10、50、100、200、300、500、1000、5000、10,000〜50,000個またはこれを上回る細胞となり得る。適切な試料サイズは、細胞組成および生検条件に基づき決定することができ、この決定に関する標準的な調製工程、および次いで発明で使用するための核酸の単離は、当業者に公知である。例えば、生検からの試料は、増幅を伴わないRNA発現の評価には十分であり得る。反対に、小さな生検範囲における適切な細胞数の欠如は、核酸分子の解像度を高めるため、RNA変換および/もしくは増幅方法または他の方法の使用が必要となり得る。限られた生検材料の使用を可能にするような方法は、当業者に公知である。いくつかの例としては、直接RNA増幅、RNAのcDNAへの逆転写、cDNA増幅、または放射線標識された核酸の生成が挙げられるが、これらに限定されない。
【0023】
本明細書では、試料に関する「試験」という用語は、身体の癌領域またはある病期の癌もしくは癌の特性を発現している身体の領域から採取された試料を言う。
【0024】
本明細書では、試料に関する「対照」という用語は、比較目的で使用される試料を言う。好ましくは、これらの試料は、遺伝子発現に影響を及ぼすであろういずれかの疾患もしくは状態のいずれかの徴候、特に、該試料を基準として使用する疾患に関するいずれかの徴候を、該試料が示さない、または該試料が、遺伝子発現に影響を及ぼすであろういずれかの疾患もしくは状態を有すると考えられるという意味での「対照」である。あるいは、疾患または状態の様々な病期は、比較することができ、このような場合、「対照」試料とは、該疾患または状態の早期に相当すると理解されてよい。例えば、対照試料は、非癌性ではあるが同等の身体領域から採取することができる。さらに、対照試料は、同一対象由来の比較可能領域、または第1対象に実質的に類似した第2対象(同一のまたは類似の種、年齢、体重、性別等)由来の身体非癌領域であってよい。最後に、対照試料は、タキソイドファミリー分子を用いた治療によく応答する第2対象の癌領域由来であることもできる。
【0025】
「核酸分子」とは、リボヌクレオシド(アデノシン、グアノシン、ウリジン、もしくはシチジン;「RNA分子」)またはデオキシリボヌクレオシド(デオキシアデノシン、デオキシグアノシン、デオキシチミジン、もしくはデオキシシチジン;「DNA分子」)のリン酸エステル多量体、または一本鎖型、もしくは二本鎖ヘリックスの、ホスホロチオエートおよびチオエステルといった、これらのいずれかのリン酸エステルアナログを言う。二本鎖のDNA−DNA、DNA−RNAおよびRNA−RNAヘリックスは、可能である。核酸分子、および特にDNAまたはRNA分子という用語は、分子の一次構造および二次構造を言うに過ぎず、いずれか特定の三次形態に限定するものではない。したがって、この用語には、特に線状または環状DNA分子(例えば、制限断片)、プラスミド、および染色体で見られる二本鎖DNAが含まれる。特定の二本鎖DNA分子の構造を考察する際、配列は、DNAの非転写ストランド(すなわち、mRNAに相同な配列を有するストランド)に沿って5’から3’方向の配列のみを生成する通常の慣例に従い、本明細書では説明され得る。「組換えDNA分子」とは、分子的生物学的操作を受けたDNA分子のことである。
【0026】
本明細書では、特定のタンパク質をコードする、単離された核酸分子の「部分」という用語は、ペプチドまたはポリペプチドをコードする、十分な数の連続した核酸を含む単離
された核酸分子の一部または断片を言う。本来、単離された核酸分子の「部分」とは、1つのヌクレオチドより大きく、以下のペプチドまたはポリペプチドの定義に記載されているように、多数のアミノ酸残基を含有するタンパク質にコードされたペプチドまたはポリペプチドのことである。
【0027】
本明細書では、「ペプチド」という用語は、ペプチド結合により共有結合された2つまたはこれ以上のアミノ酸を言う。特定の実施形態では、ペプチドは、少なくとも10個、好ましくは少なくとも20個、より好ましくは少なくとも30個、さらにより好ましくは少なくとも40個、および最も好ましくは50個またはこれ以上のアミノ酸を含む。
【0028】
本明細書では、「ポリペプチド」という用語は、複数の連続したアミノ酸からなる線状ポリマーを言う。特に、ポリペプチドは、100kDを超える分子量を有することができる。
【0029】
本明細書では、「遺伝子マーカー」という用語は、試料中の測定されたRNA、DNAまたはタンパク質レベルが、タキソイドファミリーの薬剤に被験対象が耐性であるかまたは感受性であるかを予測するのに役立つ、生理学的組成物を言う。さらに、遺伝子マーカーは、特定のタンパク質をコードすることができ、または活性が、身体試料中の遺伝子マーカーレベルに関連しているタンパク質の「代理」マーカーの役目をすることができる。この関係は、順相関であり得る。この場合、タンパク質活性レベルの低下は、遺伝子マーカーレベルの低下に相当する。または、該関係は、逆相関であり得る。この場合、タンパク質活性レベルの低下は、遺伝子マーカーレベルの上昇に相当する。このような生理学的組成物には、ほんの数例を挙げると、細胞(例えば、前駆幹細胞)タンパク質、ポリペプチド、DNA、RNA、炭水化物、または脂肪酸があるが、これらの限定されるものではまったくない。本発明の特定の実施形態では、特定の遺伝子マーカーの測定レベルは、被験対象が、タキソイドファミリーの薬剤に耐性であるかまたは感受性であるかを予測することができる。このような遺伝子マーカーの例としては、以下が挙げられるが、これらに限定されるものではまったくない。
【0030】
BubR1,Homo sapiens similar to protein kinase(BUBR1)mRNA,complete cds(BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列)(GenBank受託番号:AF046079)、
Mad2,Homo sapiens mRNA for MAD2 protein(Mad2、ホモサピエンスmRNA、MAD2タンパク質対応)(GenBank受託番号:AJ000186)、
Mps1,Homo sapiens TTK protein kinase(TTK),mRNA(Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA)(GenBank受託番号:NM_003318)、
GEFT for Rac1/CDC42,Homo sapiens RAC/CDC42 exchange factor(GEFT),transcript variant 2,mRNA(GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA)(GenBank受託番号:NM_133483)、
Bub1,Homo sapiens BUB1 budding uninhibited by benzimidazoles 1 homolog(yeast)(BUB1),mRNA(Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻害されず(酵母)(BUB1)、mRNA)(GenBank受託番号:NM_004336)、
hSepharase,Homo sapiens extra spindle p
oles like 1(S.cerevisiae)(ESPL1),mRNA(hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESPL1)、mRNA)(GenBank受託番号:NM_012291)、
CamKIId,Homo sapiens calcium/calmodulin−dependent protein kinase(CaM kinase)II delta(CAMK2D),transcript variant 3,mRNA(CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA)(GenBank受託番号:NM_001221)、
CDK6,Homo sapiens cyclin−dependent kinase 6(CDK6),mRNA(CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA)(GenBank受託番号:NM_001259)、および
GRB2,Homo sapiens growth factor receptor−bound protein 2(GRB2),transcript variant 1,mRNA(GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA)(GenBank受託番号:NM_002086)
P21(Waf1),Homo sapiens cyclin−dependent
kinase inhibitor 1A(p21,Cip1)(CDKN1A),transcript variant 1,mRNA(P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA)(GenBank受託番号:NM_000389)、
Pim−1,Homo sapiens pim−1 oncogene(PIM1),mRNA(Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA)(GenBank受託番号:NM_002648)、
GBP−1,Homo sapiens guanylate binding protein 1,interferon−inducible,67kDa(GBP1),mRNA(GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導性、67kDa(GBP1)、mRNA)(GenBank受託番号:NM_002053)、
RXRA,Homo sapiens retinoid X receptor,alpha(RXRA),mRNA(RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA)(GenBank受託番号:NM_002957)、
SPF45,Homo sapiens RNA binding motif protein 17(RBM17),mRNA(SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA)(GenBank受託番号:NM_032905)、
Hec1,Homo sapiens kinetochore associated 2(KNTC2),mRNA(Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA)(GenBank受託番号:NM_006101)、
Raf1,Human mRNA for raf oncogene(Raf1、ヒトmRNA、raf発癌遺伝子対応)(GenBank受託番号:X03484)、
Aurora A,Homo sapiens aurora−related kinase 1(ARK1)mRNA,complete cds(Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列)(GenBank受託番号:AF008551)、
TACC3,Homo sapiens transforming,acidic coiled−coil containing protein 3(TACC3),mRNA(TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA)(GenBank受託番号:NM_006342)、
RelB,Homo sapiens v−rel reticuloendotheliosis viral oncogene homolog B,nuclear factor of kappa light polypeptide gene enhancer in B−cells 3(avian)(RELB),mRNA(RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA)(GenBank受託番号:NM_006509)、
PRKCD,Homo sapiens protein kinase C,delta(PRKCD),transcript variant 1,mRNA(PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA)(GenBank受託番号:NM_006254)、
BRAF35,Homo sapiens high−mobility group
20B(HMG20B),mRNA(BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA)(GenBank受託番号:NM_006339)、
HSPA1L,Homo sapiens heat shock 70kDa protein 1A(HSPA1A),mRNA(HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA)(GenBank受託番号:NM_005345)、
STK11,Homo sapiens serine/threonine kinase 11(Peutz−Jeghers syndrome)(STK11),mRNA(STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツジェガース症候群)(STK11)、mRNA)(GenBank受託番号:NM_000455)、および
MKK3,Homo sapiens MAP kinase kinase 3(MKK3)mRNA,complete cds(MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列)(GenBank受託番号:L36719)
【0031】
本明細書では、「参照遺伝子マーカー」という用語は、測定されたRNA、DNAまたはタンパク質レベルが、タキソイドファミリーの薬剤への曝露前、曝露中、曝露後で変化しないままである生理学的組成物を言う。「参照遺伝子マーカー」は、ハウスキーピング遺伝子と呼ばれている。これらは、例えば、癌など特定の疾患で検討されている系における比較的不変の発現レベルに基づき、選択される遺伝子である。ハウスキーピング遺伝子は、発現結果を標準化するのに使用される。このような遺伝子マーカーの例としては、以下が挙げられるが、これらに限定されるものではまったくない。
GAPDH,Homo sapiens glyceraldehyde−3−phosphate dehydrogenase(GAPD),mRNA(GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA)(GenBank受託番号:NM_002046)、および
RPS9,Homo sapiens cDNA clone IMAGE:6647283、partial cds(RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列)(GenBank受託番号:BC071941)
【0032】
本明細書では、「タキソイドファミリー分子」という用語は、タキサンファミリーに属する化学療法化合物の1つのクラスを言う。タキソイドファミリーの具体的なメンバーには、パクリタキセル(タキソール)、ドセタキセル(タキソテール)およびこれらのアナログ(すなわち、XRP9881およびXRP6258;OjimaおよびGeney、Curr Opin Investig Drugs 4:737頁、2004年参照)が挙げられるが、これらに限定されない。分子のこのクラスは、ベータ−チューブリン結
合剤であり、ドセタキセルに類似した微小管の重合型を安定させるため、本明細書に記載されたバイオマーカーの臨床的発現は、これら薬剤と類似の反応状態を反映することが予測される。
【0033】
本明細書では、「分子」、「化合物」または「物質」という用語は、現在知られている、または後に発見されるいずれかの組成物を言う。本明細書で適用となる化合物または物質の例には、有機化合物(例えば、人工、天然および光学活性の)、ペプチド(人工、天然、および光学活性の、すなわち、Dアミノ酸またはLアミノ酸)、炭水化物、核酸分子などがある。
【0034】
本明細書では、「ハイブリダイゼーションのストリンジェンシー」または「ストリンジェントな条件下のハイブリダイゼーション」とは、当業者により容易に定量可能な条件を言い、一般には、プローブの長さ、洗浄温度、および塩分濃度に依存する経験的計算のことである。一般に、プローブが長いほど、適切なアニールには高温を要し、プローブが短いほど、低温を要する。ハイブリダイゼーションは一般に、相補鎖が、これらの溶解温度を下回る環境で存在する場合の、変性DNAの再アニール能に依存する。プローブとハイブリダイゼーション可能な配列との間の所望のホモロジー程度が高いほど、使用され得る相対温度は上昇する。その結果、相対温度が高いほど、反応条件はより厳密になり、相対温度が低いほど、反応条件は厳密でなくなる傾向になるであろう。ハイブリダイゼーション反応のストリンジェンシーに関するさらなる詳細および説明は、Ausubelら、Current Protocols in Molecular Biology、Wiley Interscience Publishers、(1995年)を参照されたい。
【0035】
本明細書では、「ストリンジェントな条件」または「高ストリンジェンシー条件」とは、以下のようなパラメータを言う:(1)例えば0.015M塩化ナトリウム/0.0015Mクエン酸ナトリウム/0.1%ドデシル硫酸ナトリウムを50℃で洗浄するため、低イオン強度および高温を用いるパラメータ;(2)ハイブリダイゼーション中に、例えば、0.1%ウシ血清アルブミン/0.1%フィコール/0.1%ポリビニルピロリドン/50mMリン酸ナトリウム緩衝液を含む50%(v/v)ホルムアミドなどのホルムアミドといった変性剤を、pH6.5にて750mM塩化ナトリウム、75mMクエン酸ナトリウムと共に42℃で用いるパラメータ;または(3)50%ホルムアミド、5×SSC(0.75M Nacl、0.075Mクエン酸ナトリウム)、50mMリン酸ナトリウム(pH6.8)、0.1%ピロリン酸ナトリウム、5×デンハルト溶液、超音波破砕されたサケ精子DNA(50.mu.g/ml)、0.1%SDS、および10%硫酸デキストランを42℃で用いる溶液中で一晩ハイブリダイゼーションし、0.2×SSC(塩化ナトリウム/クエン酸ナトリウム)中で42℃にて10分間洗浄した後、EDTAを含有する0.1×SSCからなる高ストリンジェンシー洗浄を55℃で10分間行うパラメータ。中程度にストリンジェントな条件は、Sambrookら、Molecular Cloning、A Laboratory Manual、New York、Cold Spring Harbor Press、1989年に記載されているように同定することができ、洗浄液および上述のものほどストリンジェントでないハイブリダイゼーション条件(例えば、温度、イオン強度および%SDS)の使用を含む。中程度にストリンジェントな条件の例は、20%ホルムアミド、5×SSC(150mM NaCl、15mMクエン酸三ナトリウム)、50mMリン酸ナトリウム(pH7.6)、5×デンハルト溶液、10%硫酸デキストラン、および20mg/ml変性剪断されたサケ精子DNAを含む溶液中で37℃にて一晩インキュベーションした後、1×SSC中で約37〜50℃にてフィルターを洗浄することである。当業者であれば、プローブの長さ等など要素を調整するため必要に応じて温度、イオン強度等を調整する方法がわかるであろう。核酸をハイブリダイズするための適切なストリンジェンシーは、核酸の長さおよび相補性の程度、当技術分野で公知の変数に依存している。2つのヌクレオチド配列間の類似性または相同性の程度が高いほど、これらの配列を有する核酸をハイブリダイズするためのTm値は高くなる。核酸ハイブリダイゼーションの相対的安定性(高いTmに相当)は、以下の順で低下する:RNA:RNA、DNA:RNA、DNA:DNA。好ましくは、ハイブリダイズ可能な核酸の最小の長さは、少なくとも約12ヌクレオチド、好ましくは少なくとも約16ヌクレオチド、より好ましくは長さは、少なくとも約24ヌクレオチド、最も好ましくは少なくとも36ヌクレオチドである。
【0036】
本明細書では、「標識」または「検出可能な標識」とは、「標識された」抗体、オリゴヌクレオチドまたは他の有機分子を生成するため、抗体、オリゴヌクレオチドまたは他の有機分子に直接的または間接的に結合された、検出可能な標識化合物または組成物を言う。標識は、これ自体(例えば、放射性同位元素または蛍光標識)により検出することができ、または、酵素標識の場合には、検出可能な基質化合物または組成物の化学変換を触媒することができる。
【0037】
本明細書では、「直接標識」とは、自然状態では、肉眼で、または光学フィルターおよび/もしくは応用刺激(例えば、蛍光を促すための紫外線)の助けにより、容易に可視可能な、実体を言う。例としては、着色標識、金属ゾル粒子、染料ゾル粒子、染色されたラテックスまたはリポソームに封入された色素が挙げられる(米国特許第4,313,734号、米国特許第4,373,932号、WO88/08534、EP−A0 280 559、EP−A0 281 327、米国特許第4,703,017号により記載されている)が、これらに限定されない。他の直接標識には、ラジオヌクレオチド、放射線不透過性物質、蛍光部分または発光部分がある。
【0038】
本明細書では、「間接標識」とは、本発明により使用することもできる酵素を言う。イムノアッセイに結合される酵素の様々な種類は、当技術分野で公知の、例えば、アルカリホスファターゼおよび西洋ワサビペルオキシダーゼ、リゾチーム、グルコース−6−リン酸デヒドロゲナーゼ、乳酸脱水素酵素、ウレアーゼであり、これらおよびその他の物は、Eva Engvall in Enzyme Immunoassay ELISA and EMIT in Methods in Enzymology、70:419〜439頁(1980年)および米国特許第4,857,453号に詳細に説明されている。
【0039】
本明細書では、「キット」という用語は、1種またはそれ以上の容器、および該容器上のまたは該容器に関連したラベルまたは添付文書を含む製品を言う。好ましい実施形態では、容器は、検出可能な標識された抗体、検出可能な標識された抗体断片または検出可能な標識されたオリゴヌクレオチドを含有することができる。別の実施形態では、容器は、身体試料から全RNAを得、該全RNAを逆転写してcDNAを得、一方または両方のプライマーが検出可能な標識された1組のプライマーを用いて、該cDNAをポリメラーゼ連鎖反応にかけるための手段を提供する。キットの別の容器には、例えば、希釈剤および緩衝剤、対照抗体、オリゴペプチドまたは小さな有機分子を含有するものが含まれてよい。ラベルまたは添付文書は、組成物の説明の他、保存指示およびインビトロ使用または診断的使用目的の指示を提供することができる。
【0040】
さらに、本発明により、当業者には従来型の分子生物学、微生物学、および組換えDNAの技法が使用することができる。このような技術は、文献で十分に説明されている。例えば、Sambrook、Fritsch & Maniatis、Molecular
Cloning:A Laboratory Manual、第2版(1989年)、Cold Spring Harbor Laboratory Press、Cold
Spring Harbor、New York(本明細書では「Sambrookら、1989年」);DNA Cloning:A Practical Approach,IおよびII巻(D.N.Glover編、1985年);Oligonucleotide Synthesis(MJ Gait編、1984年);Nucleic Acid Hybridization[B.D.Hames & S.J.Higgins編(1985年)];Transcription And Translation[B.D.Hames & S.J.Higgins編(1984年)];Animal Cell Culture[R.I.Freshney編、(1986年)];Immobilized Cells And Enzymes[IRL Press、(1986年)];B.Perbal、A Practical Guide To Molecular Cloning(1984年);F.M.Ausubelら(編)、Current Protocols in Molecular Biology、John Wiley & Sons,Inc.(1994年)を参照されたい。
【0041】
一般に、RNAi技術は、合成のまたはベクターにより生成された二本鎖RNAを用いて、相同な配列を含有するmRNAの分解を誘発する(McManusおよびSharp、Nat Rev Genet 3:737頁、2002年)。RNAiスクリーニングは、シノラブディスエレガンス(Caenorhabditis elegans)(Simmerら、PloS Biol 1:E12頁、2003年)、ショウジョウバエ(Lumら、Science 299:2039頁、2003年)および哺乳類細胞(Aza−Blancら、Mol Cell 12:627頁、2003年)など多くの生物における遺伝子機能を解明するために使用されている。
【0042】
本発明では、HCT116結腸癌細胞は、ほとんどがキナーゼファミリーメンバーを含む、101種の癌関連遺伝子に対するsiRNAをスクリーニングするために使用され、ドセタキセルの死滅効果は、高分解能の用量反応曲線により定量した。このアプローチを用いて、出願者は、BubR1、Bub1、Mad2、Mps1およびGEFT Rac/CDCを含む、9種類の遺伝子の過少発現が、ドセタキセルによる死滅を阻害することができるのに対し、Pim1、p21、TACC3およびAurora−Aを含む、15種類の他の遺伝子の過少発現は、ドセタキセル誘導細胞死を促進することができることを明らかにした。
【0043】
故に、本発明は、ドセタキセルを服用している、または服用を検討している個人が、該薬剤に耐性となるかまたは感受性となるかを特定するのに使用することができる診断方法およびキットにまで広範に及ぶ。
【0044】
出願者は、薬剤耐性が、BubR1、Bub1、Mad2、Msp1およびGEFT Rac/CDCを含む、幅広いチェックポイント遺伝子の欠損に関連していることにより、ドセタキセルに対する薬剤耐性を観察した。
【0045】
ドセタキセル感受性の増加は、GBP−1、STK11、RXRA、Hec1、SPF45、Raf1、RELB、MKK3、PRKCD、HSPA1A、BRAF35、Aurora−A、Pim−1、TACC3およびp2lwaf1/Cip1を含む、いくつかの遺伝子のいずれか1つの欠損に相当し、これらの遺伝子に対する阻害剤は、ドセタキセル療法に対する有益な補助剤として働くことができる。
【0046】
有糸分裂チェックポイント遺伝子は、姉妹染色体の動原体が、紡錘体に適切に接着され、赤道で整列されるまで、Cdc20−APC(後期促進複合体)の阻害により有糸分裂後期を遅延させるための二重安全機構(failsafe mechanism)の役目をする(Zhouら、J Cell Sci 115:3547頁、2002年)ため、細胞が、DNAの正確な相補体を伴って有糸分裂を確実に終了し、別の細胞周期に確実に入ることを可能にする。微小管阻害剤の存在下では、有糸分裂から出た細胞は、もはやこれらの染色体を適切に分離することができず、一般的にはすぐに、またはいくつかの細胞周期後にアポトーシスを引き起こす(TaylorおよびMcKeon、Cell 89:727頁、1997年)。微小管阻害剤とBubR1などの有糸分裂チェックポイント遺伝子欠損との組合せは、細胞が、アポトーシスを引き起こすことなく有糸分裂の停止を逃れ、染色体安定性(CIN)および異数性をもたらすことを可能にする(Shinら、Cancer Cell 4:483頁、2003年)。最近では、薬剤耐性データは、微小管阻害剤パクリタキセルが、BubR1およびMad2をダウンレギュレートされたMCF−7細胞を治療するのに使用された際に得られた(Sudoら、Cancer Res 64:2502頁、2004年)。
【0047】
Pim−1遺伝子は、関連キナーゼの小さなファミリーに属するセリン/スレオニンキナーゼをコードしている。Pim−1の機能は、増殖、分化、アポトーシス、腫瘍形成、低酸素症、血管形成および有糸分裂に関連している(Wangら、Biochim Biophys Acta 1593:45頁、2002年)。顕微鏡画像データは、AKT低リン酸化データおよびカスパーゼ3活性測定値の上昇と共に、Pim−1ダウンレギュレーションが、細胞生存を媒介するAKTシグナル伝達を不活化することにより、ドセタキセル誘導アポトーシスを増強することを示している。Pim−1およびp21は、HCT116細胞の感作において、ドセタキセルにきわめて類似した特性を有する。これは、p21が、Pim−1のリン酸化基質であることを示す複数の報告と一致する(Wangら、Biochim Biophys Acta 1593:45頁、2002年)。Pim−1ダウンレギュレーションは、ドセタキセル非存在下でいくつかのアポトーシスを誘発するが、薬剤存在下でより効果的であったのに対し、形質転換酸性コイルドコイルタンパク質TACC3のダウンレギュレーションは、ドセタキセル非存在下で細胞死を誘発せず、RNAiだけでは細胞増殖に影響しないことを示した。これらの結果は、異なるタンパク質の枯渇は、ドセタキセルに対し細胞を感作させるための異なる機序を惹起することができることを示唆している。
【0048】
したがって、本発明の1つの態様では、表IおよびIIに記載された1種またはそれ以上の遺伝子の活性化、およびこれらの遺伝子のタンパク質レベルは、治療処置方法を選択し、選択された治療方法の有効性をモニターするために利用することができる。
【0049】
特定の実施形態では、化学療法の過程において、表IおよびIIに示された1種またはそれ以上の遺伝子の活性化レベルをモニターして、患者に対する化学療法の有効性を評価し予測する方法が提供される。腫瘍(例えば、乳腺腫瘍、結腸腫瘍、非小細胞肺腫瘍、および胃腫瘍)からの生検、または未診断癌患者もしくは現在治療を行っている患者からの腫瘍生検の短期培養は、表IおよびIIに記載された遺伝子またはこれらのサブセットの、遺伝子活性化レベルもしくはタンパク質レベルを評価するためのDNA(Hafnerら、Arch Pathol Lab Med 127:1221頁、2003年;Rodriguezら、Clin Cancer Res 10:5785頁、2004年)、メッセンジャーRNA(Changら、Lancet 362:340頁、2003年)および/またはタンパク質(Espinaら、J Immunol Methods 290:121頁、2004年)を単離するために処理される。遺伝子転写およびタンパク質発現プロファイリングは、可能性のある治療戦略に対する患者の応答の診断、予測に実用性を有し、患者の治療応答をモニターするための有用なツールになることができる。
【0050】
本発明により、RNAは、当技術分野で一般に使用される入手可能な方法のいずれかを用いて、腫瘍試料から単離することができる(Ullmannら、J Biomol Screen 9:95頁、2004年;Badieeら、BMC Biotechnol
3:23頁、2003年)。被験対象由来の1種またはそれ以上の細胞を得て、RNA
を、これらの細胞から単離する。例えば、末梢血白血球(PBL)細胞は、対象から得られることができ、または細胞試料を得て、該試料を所望の細胞型に濃縮することも可能である。細胞は、所望の細胞型上にある特定のエピトープに結合する抗体を用いた細胞分離など、様々な技法を用いて細胞混合物から分離することができる。所望の細胞が、固形組織内にある場合、特定の細胞は、例えば、マイクロダイセクションまたはレーザーキャプチャーマイクロダイセクション(LCM)により切断することができる(Bonnerら、Science 278:1481頁、1997年;Fendら、Am J Path 154:61頁、1999年)。RNAは、様々な方法、例えば、チオシアン酸グアニジウム溶解に続くCsCl遠心分離により、組織または細胞試料から抽出することができる(Chirgwinら、Biochemistry 18:5294頁、1979年)。単一細胞由来のRNAは、単一細胞由来のcDNAライブラリの製造方法に記載されているように得られることができる(Dulac、Curr Top Dev Biol.36:245頁、1998年)。RNA試料は、さらに特定の種に関して濃縮することができる。1つの実施形態では、例えば、ポリ(A)+RNAは、RNA試料から単離することができる。特に、ポリ−Tオリゴヌクレオチドは、固体担体に固定化させ、mRNAの親和性リガンドとして働くことができる。このためキットは、例えば、MessageMakerキット(Life Technologies、グランドアイランド、NY)などが市販されている。濃縮は、例えば、プライマー特異的cDNA合成、またはcDNA合成に基づく複数回の線形増幅およびテンプレート特異的インビトロ転写により、実現することができる(Wangら、Proc Natl Acad Sci USA 86:9717頁、1989年;Dulacら、上記参照)。
【0051】
例えば、PCR、リガーゼ連鎖反応(LCR)(WuおよびWallace、Genomics 4:560頁、1989年)、自律配列複製法(self−sustained sequence replication)(SSR)、(Guatelliら、Proc Natl Acad Sci USA 87:1874頁、1990年)、核酸配列ベースの増幅法(NASBA)および転写増幅法(Kwohら、Proc Natl Acad Sci USA 86:1173頁、1989年)を含む、様々な増幅方法が、本発明の方法に使用するのに適している。PCR技術の方法は、当技術分野に公知である(例えば、PCR Technology:Principles and Applications for DNA Amplification(H.A.Erlich編、Freeman Press、N.Y.、N.Y.、1992年)、PCR Protocols:A Guide to Methods and Applications(Innisら編、Academic Press、San Diego、Calif.、1990年)参照)。
【0052】
RNAは、当業者に公知のいずれかの方法、例えば、アフィメトリックス社製のもののようなマイクロアレイにより検出するために標識することができる。RNAは、シアニン−3またはシアニン−5(Perkin Elmer MPS544001KT)などの色素による直接RNA標識といった、一般に使用されている方法のいずれかを用いて、ハイブリダイゼーションにより標識し、検出する。さらなる方法には、シアニン−3またはシアニン−5(Badiee A、2003年)、フルオレセインもしくはアレクサ色素(Molecular Probes)、または他のフルオロフォアで標識された核酸による逆転写により行われる、直接cDNA標識がある。さらに、FairPlay(商標)/アミノアリル標識(Stratagene カタログ番号:252002)、3DNAデンドリマー標識(Genisphere Inc)または酵素的シグナル増幅(MICROMAX TSA、Perkin Elmer)などの間接cDNA標識を利用することができる。あるいは、RNAは、酵素、フルオレセイン、放射性または発光する方法により検出されるRNAプローブを用いて定量することができる。
【0053】
本発明の1つの態様では、RNAを、腫瘍試料から得、Taqman技術を、遺伝子マーカーの検出に使用する。プライマーは、表IおよびIIに指定された特定のRNAまたはこれらのサブセットを検出するために作成され、逆転写酵素により増幅される。逆転写により増幅された特定断片の検出は、ゲル電気泳動、ポリマー電気泳動、直接DNAシークエンシング、光検出、フルオレセインシグナルの消失、酵素反応、または相補的RNAへのハイブリダイゼーションによる検出により実現される。
【0054】
本発明の別の態様では、リアルタイムPCRを利用して、オリゴヌクレオチドを検出する。腫瘍試料から得たmRNAは、cDNAへ逆翻訳される。プライマーは、ポリメラーゼ連鎖反応技術を用いて、表IおよびIIに指定された特定のRNAまたはこれらのサブセットを増幅するために作成される。mRNAレベルの検出は、ゲル電気泳動および臭化エチジウムもしくはCYBRグリーン染色により、またはポリメラーゼにより放出される、フルオロフォア標識された配列特異的プローブからの蛍光強度を測定することで実現される。
【0055】
本発明のさらなる態様では、ノーザンブロッティング技術を利用する。RNAを、腫瘍試料から得、次いでゲル電気泳動により分離し、膜に移す。RNA量は、P32などの放射性同位元素で標識されたプローブを用いたハイブリダイゼーション、または酵素ベースの発色もしくは発光アッセイにより定量する。
【0056】
本発明のさらに別の態様では、遺伝子量は、転写レベルの代理指標として使用することができる。表IおよびIIの転写物またはこれらのサブセットの遺伝子量を、定量的に測定し、腫瘍がドセタキセル療法に対し応答性となるか否かを評価することができる(Rodriguezら、Clin Cancer Res 10:5785頁、2004年)。この評価は、ネオアジュバント(術前の治療)療法の前に行うことができ、患者が応答者に分類されれば、患者をドセタキセルで治療し、患者が非応答者に分類されれば、別の化学療法剤を投与することができる。
【0057】
DNAは、患者の腫瘍生検から抽出し、当業者により行われているような方法を用いて汚染物質を除去するために精製する。腫瘍DNAにおける遺伝子量の定量に使用される方法には、定量的PCR、ゲノムDNAチップ、in situハイブリダイゼーションまたはサザンブロットがある(Hafnerら、Arch Pathol Lab Med
127:1221頁、2003年;Rodriguezら、Clin Cancer Res 10:5785頁、2004年)が、これらに限定されない。したがって、これらの方法は、表IおよびIIにおける1種またはそれ以上の遺伝子のコピー数を定量するのに使用することができ、対照試料または参照マーカーと比較することができる。
【0058】
本発明のさらに別の態様では、タンパク質レベルを、転写レベルの代理測定値として使用する。タンパク質レベルは、転写レベルの抑制または上昇に相当することが明らかにされている。したがって、本発明は、表IおよびIIの転写物にコードされたポリペプチド産物に相当するタンパク質のレベルを測定する技法を包含する。タンパク質を検出し、ドセタキセルに対する予測的応答マーカーとして使用する。タンパク質検出方法は、当技術分野で公知である。例えば、イムノアッセイは、抗体を用いて標的タンパク質の発現を検出する方法である。
【0059】
特定の実施形態では、表IおよびIIに列挙された1種またはそれ以上の遺伝子のタンパク質産物を検出するために、イムノアッセイを使用する。さらに、表IおよびIIに列挙されたタンパク質のいずれか1種に対する抗体は、いくつかの他の検出方法で使用することができる。これらの検出方法には、以下が挙げられるが、これらに限定されない:ウェスタンブロット、ELISAアッセイ、サンドイッチELISA。あるいは、抗体を使用
しない他のアッセイが考えられ、表IおよびIIの転写物(例えば、アプタマー)にコードされたタンパク質を認識するDNAオリゴヌクレオチドまたはポリペプチドを利用するアプローチが挙げられる。タンパク質分解切断後にペプチド断片の正確な分子量を定量して、ポリペプチドの組成を判定する生物学的試料の質量分析もまた、使用することができる。
【0060】
本発明はさらに、酵素、フルオロフォアを含む適切な標識を包含する(例えば、フルオレセインイソチオシアネート(FITC)、フィコエリトリン(PE)、テキサスレッド(TR)、ローダミン、遊離またはキレート化ランタニド系列の塩、クロモフォア、放射性同位元素、キレート剤、色素、コロイド金、ラテックス粒子、リガンド(例えば、ビチオン)、および化学発光剤)。
【0061】
本発明の別の態様では、使用される放射性標識は、3H、14C、32P、35S、36Cl、51Cr、57Co,58Co,59Fe、90Y、125I、131I、および186Reなどのアイソトープであってよい。放射能レベルの定量化は、現在既知の利用可能な計数方法を介して行うことができる。反対に、放射線不透過性物質の使用を用いてもよい。標識が酵素である実施形態では、検出は、当技術分野で公知の、現在利用されている熱量測定法、分光光度法、蛍光分光光度法、アンペロメトリック法またはガス定量法のいずれかにより実現することができる。
【0062】
本発明のさらなる態様は、抗体または抗体断片などのペプチド結合剤の使用である。抗体には、従来方法により製造されるポリクローナルおよびモノクローナル抗体がある。抗体分子のごく小さな部分であるパラトープは、このエピトープへの抗体の結合に関与している(一般には、Clark,W.R(1986年)、The Experimental Foundations of Modem Immunology、Wiley & Sons,Inc.、New York;Roitt,L(1991年)、Esse
ntial Immunology、第7版、Blackwell Scientific Publications、Oxford参照)。例えば、pFc’およびFc領域は、補体カスケードのエフェクターであるが、抗原結合に関与しない。pFc’領域が、酵素により切断された抗体、またはpFc’領域なしで生成され、F(ab’)2フラグメントと称される抗体は、無処置の抗体の2つの抗原結合部位を保持する。したがって、本発明の1つの実施形態は、F(ab’)2フラグメントなどの検出可能な標識された抗体フラグメントを利用する。同様に、Fc領域が、酵素により切断された抗体、またはFc領域なしで生成され、Fabフラグメントと称される抗体は、無処置の抗体分子の抗原結合部位の1つを保持する。Fabフラグメントは、共有結合抗体軽鎖および抗体重鎖を意味するFdの一部から成る。Fdフラグメントは、抗体特異性の主要な決定因子であり(単一のFdフラグメントは、抗体特異性を変更することなく、10種類の異なる軽鎖に関連することができる)、Fdフラグメントは、単独でエピトープ結合能を保持することができる。
【0063】
当技術分野で公知の通り、抗体の抗原結合部分には、抗原のエピトープと直接相互作用する相補性決定領域(CDR)、およびパラトープの3次構造を維持するフレームワーク領域(FR)がある(一般的には、Clark、1986年;Roitt、1991年参照)。IgG免疫グロブリンの重鎖Fdフラグメントおよび軽鎖フラグメントのどちらにも、3つの相補性決定領域(CDR1〜CDR3)によりそれぞれ隔てられる4つのフレームワーク領域(FR1〜FR4)がある。CDR、および特にCDR3領域、およびより特別には重鎖CDR3は、大部分が抗体特異性に関与している。哺乳類抗体の非CDR領域は、オリジナル抗体のエピトープ特異性を保持しつつ、同種または異種特異的抗体の類似の領域と置換することができることは、現在当技術分野でよく知られている。これは、非ヒトCDRが、ヒトFRおよび/またはFc/pFc’領域に共有結合されて機能的抗体を生成する「ヒト化」抗体の開発および使用において最も明白に示されている(米国特許第4,816,567号、第5,225,539号、第5,585,089号、第5,693,762号および第5,859,205号参照)。
【0064】
完全なヒトモノクローナル抗体も、ヒト免疫グロブリン重鎖および軽鎖遺伝子座の大部分のトランスジェニックマウスを免疫することで製造することができる。これらのマウス(例えば、XenoMouse(Abgenix)、HuMAbマウス(Medarex/GenPharm))を免疫化後、モノクローナル抗体は、標準的ハイブリドーマ技術により製造することができる。これらのモノクローナル抗体は、ヒト免疫グロブリンアミノ酸配列を有するため、ヒトに投与された場合にヒト抗マウス抗体(HAMA)反応を惹起することはないであろう。
【0065】
したがって、本発明はまた、F(ab’)2、FvおよびFdフラグメント;Fcおよび/またはFRおよび/またはCDR1および/またはCDR2および/または軽鎖CDR3領域が、ヒトまたは非ヒト相同配列で置換されたキメラ抗体;FRおよび/またはCDR1および/またはCDR2および/または軽鎖CDR3領域が、ヒトまたは非ヒト相同配列で置換されたキメラF(ab’)2フラグメント抗体;FRおよび/またはCDR1および/またはCDR2および/または軽鎖CDR3領域が、ヒトまたは非ヒト相同配列で置換されたキメラFabフラグメント抗体;ならびにFRおよび/またはCDR1および/またはCDR2領域が、ヒトまたは非ヒト相同配列で置換されたキメラFdフラグメント抗体も包含することは、当業者には容易に明らかである。本発明にはまた、いわゆる一本鎖抗体も含まれる。
【0066】
本発明は、本発明の見本として提供される以下の実施例を参照することで、より理解することができるが、これに限定されない。実施例は、本発明の好ましい実施形態を十分に説明するために示される。しかし、これらは、本発明の幅広い範囲を限定するものとして解釈されるべきではまったくない。
【実施例】
【0067】
〔実施例1〕
siRNAスクリーニング
ドセタキセル処理に対し細胞をより耐性または感受性にする遺伝子を同定するため、用量反応曲線を作成するための様々なドセタキセル濃度を用いて、HCT116細胞中において101種類の遺伝子に対するsiRNAをスクリーニングした。ヒト結腸癌細胞株HCTT116は、ATCCから入手し、100単位/mlペニシリン、100μg/mlストレプトマイシン、4mM L−グルタミンおよび10%胎児ウシ血清を補充したMcCoy 5A中で、37℃にて95%CO2および5%O2で培養した。siRNAのリストは、遺伝子発現プロファイリング実験(Changら、Lancet 362:362頁、2003年)で検出されたようなドセタキセル耐性乳腺腫瘍において過剰発現されたものを含む、癌関連遺伝子で構成された。さらなる基準は、標的が創薬に適していることであった。全体的なスキームを以下にまとめた。第1日目、HCT116細胞を、96ウェルフォーマットでウェルあたり5,000細胞にてプレーティングし、翌日、遺伝子あたり3〜4siRNAプールでトランスフェクトした。使用したsiRNAの代表的試料を、表IおよびIIに示した。リポフェクタミン2000(インビトロゲン)を用いて、siRNA(Dharmacon)を96ウェルプレートのHCT116細胞にトランスフェクトした。第3日目、siRNAを除去し、ドセタキセルを、0〜40nMの濃度で添加した。第6日目、細胞の生存を、WST−1アッセイにより定量した。これは、生存細胞に存在するミトコンドリアのデヒドロゲナーゼ活性をモニターするアッセイである。デヒドロゲナーゼ活性は、テトラゾリウム塩WST−1の開裂をもたらし、フォルマザンを形成する。アッセイ当日、培地を96ウェルプレートから除去した。WST−1試薬(Roche)を、McCoy 5A培地で10倍に希釈し、100ulを各ウェルに添加した。プレートを次いで、40〜80分間、37℃にてインキュベートした後、SpectroMax(Molecular Devices)で450nmにて読み取った。WST−1値は、実験siRNAの対照siRNAに対する比を計数して階層的にクラスター化し、下記の表IIIに示したように、合計15遺伝子を感受性を付与するもの、9遺伝子を耐性を付与するものとして特徴づけた。感受性および耐性集団を、さらに別の群に分けた:1)siRNA効果が、低濃度ドセタキセル(1〜6nM)で観察され、IC50がシフトした群、または2)主な効果は、高濃度(>6nM)で観察され、IC50のシフトがより小さかった群。
【0068】
Mad2、BubR1およびMps1のsiRNAに比べ、Grb2、CDK6、セファラーゼ、およびカルシウム/カルモジュリン依存性プロテインキナーゼIIデルタ(CamKIID)を標識するsiRNAは、より低濃度(1〜6nM)のドセタキセルでより顕著な効果を示し、IC50に特徴的なシフトが見られた。全体に、このサブグループは、有糸分裂チェックポイント遺伝子より弱い耐性を示し、CamKIIDのsiRNAは、対照細胞に対し2倍となる、最も高い保護レベルを示した。これらのデータは、4つの有糸分裂チェックポイント遺伝子は、いくつかの他の遺伝子と共に様々な程度でドセタキセル耐性を増加させることができることを示した。図1のデータは、siRNAをトランスフェクトされた後、様々な濃度のドセタキセルに曝露された細胞の、いくつかの特徴的な用量反応曲線を示している。BubR1、Bub1、Mad2、およびMsp1(Bub1のデータは不図示)を含む、4つの有糸分裂チェックポイント遺伝子の他、Rac/Cdc42のグアニンヌクレオチド交換因子(GEFT)に対するsiRNAは、効果が高ドセタキセル濃度(6>nM)でより顕著となり、有意なドセタキセル耐性を示した。最大の耐性レベルを示したのは、Mad2であり、細胞の生存が、細胞をトランスフェクトされた対照siRNAに比べて5倍に増加していた。siRNAの大半は、スクリーニングでスコア化されず、ここでは本発明者は、代表例としてヒト網膜芽細胞腫1(PB1)を示している。
【0069】
以上のことから、これらの結果は、遺伝子発現のダウンレギュレーションが、ドセタキセル処理から細胞をいかに感作または保護し、濃度に応じて、様々な作用機序をいかに惹起してドセタキセルによる細胞死を調節するかの洞察を、siRNAスクリーニングが提供できることを示している。
【0070】
【表1】

【0071】
【表2】

【0072】
【表3】

【0073】
〔実施例2〕
ドセタキセル耐性の増加を付与するsiRNAサブセットの交差検定
siRNAスクリーニングアプローチの短所となる可能性があるのは、siRNAが、部分的に同一の転写物にアニールする、またはマイクロRNA(miRNA)の翻訳阻害を起こすことができるため、標的特異的な作用と非特異的(部位外の(off−site))作用との区別が困難になる点である(Jacksonら、Nat Biotechn
ol 21:635頁、2003年)。第2配列を伴う独立のアプローチを用いて耐性を確認するため、ショートヘアピン(sh)RNAをコードするDNAオリゴヌクレオチドを有しているレトロウイルスベクターに、HCT116細胞を感染させて、BubR1およびMps1用の安定したノックダウン細胞株を生成した。shRNAは、siRNAよりも異なる配列を含有しており、オープンリーディングフレームの明確な領域を標的する。レトロウイルスパッケージング細胞株GP2−293は、Clontechから入手した。細胞は、100単位/mlペニシリン、100μg/mlストレプトマイシン、4mM L−グルタミンおよび10%胎児ウシ血清を補充したDMEMで維持した。ウイルスは、GP2−293細胞を一過性トランスフェクトして生成した。合計3.6×106細胞を、トランスフェクション24時間前に10cm皿に播種した。培地は、トランスフェクション4時間前に、10%FBS(抗生物質を含まない)を含有するDMEMと交換した。細胞は、6μgベクターDNA、6μgエンベローププラスミドVSV−G(Clontech)および72μlリポフェクタミン−2000をトランスフェクトした。培地は、14〜16時間後に交換した。ウイルス上清を24時間後に回収し、0.45μMフィルターを介して濾過し、8μg/mlポリブレンの存在下で、M.O.I5でHCT116を感染させるために用いた。感染後48時間目に、細胞を、0.5μg/mlピューロマイシン中で7日間、またはバックグラウンド細胞が死滅するまで選択した。BubR1およびMps1ノックダウン細胞株で作成された用量反応曲線は、ここでも、高いドセタキセル濃度でより顕著であった耐性の増大を示した(図2)。これは、siRNA一過性トランスフェクションで得られた結果と類似していた。shRNAがmRNAレベルを低下させるかどうかを調べるため、本発明者は、リアルタイムPCRを用いて内因性転写物を検出し、RNAレベルが、ベクター対照安定株に比べBubR1およびMps1安定ノックダウン細胞株で減少していることを確認した(図3)。
【0074】
細胞を溶解し、RNAを、RNAqueous−96(Ambion)を用いて抽出した。Taqman(商標)プローブおよびフォワードプライマーおよびリバースプライマーは、Primer Express(商標)ソフトウェア(PE Applied Biosystems、UK)によりデザインした。プローブおよびプライマー配列のBLAST検索は、試験中の特定の遺伝子以外の他の配列とは有意な同一性が見られないことを明らかにした。リアルタイムPCRには、マスターTaqMan(商標)ミックス20μlを、各ウェル用に作製した。内訳は、4.825μlRNアーゼフリーを含まない水、12.5μl 2×ユニバーサルPCRマスターミックスおよび0.625μl 40×MultiscribeTMおよびRNase Inhibitor Mix(Applied BioSystems)、0.9μlフォワードおよびリバースプライマー(100μM)、0.25ulプローブ(100μM)である。各ウェルに、5ul試料RNA(約1ng/μl)を添加した。プレートは、TaqMan(商標)ABI Prism 7700 Sequence Detector(商標)(Perkin−Elmer、UK)で分析した。循環パラメータは、30分間48℃、10分間95℃、15秒間95℃を40サイクル、および1分間60℃であった。試験遺伝子のmRNA値は、標準曲線から推定し、残留率(percent remaining)で表した。
【0075】
〔実施例3〕
Mad2、BubR1およびMps1のダウンレギュレーションは、異数性の発生と共に、有糸分裂停止を回避することでドセタキセル誘導死から細胞を保護する
WST−1アッセイで定量した通り、ドセタキセル存在下の有糸分裂チェックポイント遺伝子の欠損は、耐性を示す細胞生存の増加と相関していた(図1)。WST−1測定法の妥当性をさらに試験するため、細胞学的実験を行い、細胞の形態および生存能力を調べた(図4)。細胞は、共焦点顕微鏡法および、代謝的に活性な細胞の指標として働く細胞内エステラーゼにより、緑色蛍光に変換される生体染色色素であるカルセイン−AMを用いて追跡した。図4は、ドセタキセル添加後16時間目に、Mad2、BubR1および
、(程度は低いものの)Mps1のsiRNAをトランスフェクトした細胞は、時期尚早に有糸分裂を終わらせ、平板な細胞形態と一致する明らかな間期の状態に入っていたのに対し、対照siRNAをトランスフェクトした細胞の大半が、集合した細胞形態を伴う有糸分裂で停止していた。扁平な細胞の表現型は、以前に他の微小管阻害剤で記述されており、有糸分裂停止から出て、実際には有糸分裂を終了させることなく明らかな間期状態へ入る細胞の能力を言う(Kungら、Proc Natl Acad Sci 87:9553頁、1990年;LanniおよびJacks、Mol Cell Biol 18:1055頁、1998年)。処理後72時間目、Mad2、BubR1またはMps1のsiRNAダウンレギュレート細胞に関する最も顕著な観察は、ドセタキセル処理により事実上除去されたsiRNA対照トランスフェクト細胞に比べ、より多くの細胞が存在し、およびこれらのサイズがきわめて大きかった点であった。ドセタキセル非存在下では、有糸分裂チェックポイントダウンレギュレート細胞は、2つの異なる時点において対照細胞と類似しているように見え、72時間目の細胞数の増加は、細胞が、siRNA存在下で活発に成長していることを示唆した。
【0076】
有糸分裂チェックポイントを障害された細胞は、コルセミド、ノコダゾールおよびパクリタキセルなどの微小管阻害剤による処理後は、有糸分裂停止を迂回し、時期尚早に有糸分裂を終了させることができる(TaylorおよびMcKeon、Cell 89:727頁、1997年;Shinら、Cancer Cell 4:483頁、2003年;Masudaら、Am J Pathol 163:1109頁、2003年;Sudoら、Cancer Res 64:2502頁、2004年)。ドセタキセル処理したHCT116細胞が、3つの特異的チェックポイント遺伝子Mad2、BubR1またはMps1を抑制後、有糸分裂を時期尚早に終了させるかどうかを判定するため、本発明者は、トランスフェクト細胞の有糸分裂指標を測定した。そこで、siRNAをトランスフェクトされたMad2、BubR1またはMps1細胞を、未処理(0)またはドセタキセル処理後8、16、24、36、48および72時間目で回収し、次いで、固定化し、有糸分裂指標であるヒストンH3のリン酸化を検出するポリクローナル抗体(Mitotic Index Kit、Cellomics)によりインキュベートした。すべての時点を図5にグラフで示した。有糸分裂指標のピークは、処理後16時間目および24時間目であり、全例で有糸分裂停止があったことを示している。有糸分裂指標は、対照siRNAをトランスフェクトされた細胞で最も高値に達したのに対し、Mad2およびBubR1のsiRNAをトランスフェクトした細胞は、有糸分裂指標の有意な低下を示した。Mps1のsiRNA効果は、Mad2、BubR1ほど重度ではなかった。これらの結果は、有糸分裂チェックポイントを障害された細胞は、ドセタキセルにより誘発された有糸分裂停止を迂回すること、BubR1のsiRNAは、最も有効であり、次いでMad2およびMps1となることを明らかに示すものである。
【0077】
有糸分裂指標の変化が、ノックダウン効率における大きな差と一致していた可能性を除外するため、本発明者は、リアルタイムPCRを用いて有糸分裂チェックポイント転写レベルを測定した。図6に示された実験は、mRNAレベルが、Mad2、BubR1およびMps1のsiRNAトランスフェクト細胞では同等レベルにまで低下したことを示している。これは、有糸分裂指標の差が、遺伝子機能をより大きく反映していたことを示唆するものである。
【0078】
顕微鏡データから、きわめて大きな細胞は、異常なDNA量を保有できることが明らかになった。これらの有糸分裂チェックポイント障害細胞は、ドセタキセル誘導細胞周期停止を抑制し、S期に再進入して異数性細胞を産生することが可能かどうかをさらに調査するため、本発明者は、FACS分析を行いDNA量を測定した。Mps1、BubR1、Mad2および対照のsiRNAをトランスフェクトされた細胞を、ドセタキセル非存在下または存在下で増殖し、固定化し、ヨウ化物プロピルで染色し、FACSにより分析し
た。ドセタキセル添加後、いくつかの異なる時点でデータを回収し(データ不図示)、72時間時点のヒストグラムを図7に示した。ドセタキセル添加後72時間目、Mps1、BubR1、Mad2のsiRNAトランスフェクションは、8N、16Nで細胞蓄積を引き起こしており、BubR1の場合は32NのDNA量であった。対照siRNAを用いるだけで、ドセタキセル存在下で8Nの細胞集団を検出したが、8Nの数は、有糸分裂チェックポイントをダウンレギュレートされた細胞でより高かった。ドセタキセル添加後の早い時点では(データ不図示)、対照細胞の大半が4Nで停止していたのに対し、Mps1、BubR1およびMad2のsiRNAをトランスフェクトされた細胞は、4Nから8Nへ進行していた。これらの結果は、有糸分裂チェックポイント遺伝子のノックダウンは、野生型細胞細胞に比べ、細胞がより迅速に異常なDNAレベルを蓄積し、倍数性のより高い閾値を交差できるようにすることを示している。本発明者の結果は、有糸分裂指標の制御、これまで明らかにされなかった微小管阻害剤ドセタキセルによる細胞周期の進行における、Mad2、BubR1およびMps1の役割を示すものである。
【0079】
〔実施例4〕
BubR1をダウンレギュレートされた細胞におけるドセタキセル耐性コロニーの形成
抗微小管剤を併用したBubR1の過少発現が、異数性細胞のチェックポイントおよびアポトーシスの活性化と関連したBubR1の異数性、ならびに回復と関連があったことを考えると、BubR1のアポトーシス機能は、染色体忠実度の制御にとって重要であるように思われる(Shinら、Cancer Cell 4:483頁、2003年)。永続的な有糸分裂チェックポイント遺伝子のダウンレギュレーションは、細胞の、増殖能の増大による増殖を可能にするかどうかを判定するため、BubR1およびMps1の安定ノックダウン細胞株(図4)の、ドセタキセルの連続存在下で増殖しコロニーを構築する能力について試験した。Mad2安定ノックダウン細胞株は、Mad2の障害が、細胞にとって致死的であったため(Michelら、Proc Natl Acad Sci
101:4459頁、2004年)作製することができなかった。BubR1、Mps1および対照shRNAの安定ノックダウン細胞株は、5nMドセタキセルに10日間曝した後、クリスタルバイオレットで染色した。図8は、BubR1ノックダウン細胞株は、対照細胞株に比べ、より多くの大きなコロニーを発生したことを示している。Mps1ノックダウン細胞株は、5nMドセタキセル存在下でコロニーを成長させることができなかった。プレートを17日間にわたりインキュベートした場合、対照プレートではコロニーが観察されたが、BubR1ノックダウン細胞株に比べ、数はより少なかった。これらの結果は、BubR1の低レベルを、化学療法剤ドセタキセル存在下の細胞成長の進行と関連づけるものであるが、Mps1を関連づけるものではない。
【0080】
〔実施例5〕
ドセタキセル感受性の増加を付与するsiRNAの交差検定
ドセタキセル誘導死滅から細胞を保護するsiRNAの同定に加えて、スクリーニングは死滅に対し細胞を感作させるsiRNAを同定した。表IIIでは、Pim−1、p21waf1/Cip1、GBP−1、RXRA、Hecl,SPF45、Raf1は、IC50のシフトはごく小さいが、高ドセタキセル濃度(>6nM)で顕著な死滅を示したsiRNA群を表している。発癌性セリン/スレオニンキナーゼPim−1および細胞周期阻害剤p21waf1/Cip1のsiRNA用量反応曲線は、きわめて類似していた(図9)。これは、シグナル伝達経路における重複するまたは協調的な役割を反映している可能性があり、過去の報告は、p21waf1/Cip1が、Pim−1の基質であることを明らかにしている(Wan
gら、Biochim Biophys Acta 1593:45頁、2002年)。さらに興味深いのは、前立腺上皮細胞のPim−1過剰発現に関するデータであり、これは、有糸分裂チェックポイント干渉および遺伝的不安定性につながるものである(Rohら、Cancer Res 63:8079頁、2003年)。これらの結果は、反対の発現レベルと同等の表現型を示す、Mad2、BubR1およびMps1過少発現データ
と一致していた(図1参照)。ドセタキセル感受性を付与する別のsiRNAは、Hec1であった。
【0081】
表IIIでは、TACC3、RELB、Aurora−A、PRKCD(PKC)、HS
PA1A、およびBRAF35は、IC50のシフトが特徴的な、低ドセタキセル濃度(1〜6nM)で感受性を増大させるsiRNA群を表している。Aurora−Aは、有糸分裂開始時に機能し、これまで、中心体成熟および紡錘体集合に関与するとされてきたセリン/スレオニンキナーゼである(Meraldiら、Curr Opin Genet Dev 14:29頁、2004年で再検討された)。最も興味深いのは、HeLa細胞のAurora−A過剰発現が、パクリタキセルから細胞を保護することを示した公表データであり、Aurora−A過少発現が、ドセタキセル死滅力を増大させた本発明者の結果と一致していた(Anandら、Cancer Cell 3:51頁、2003年)。確かに、生存の25%減少を示したAurora−Aに関しては、これはIC50のわずかな減少であったが、この結果は、HCT116細胞でAurora−Aの安定ノックダウンを生じているshRNAを、レトロウイルス送達することで正確に再現された(図9を図10および11と比較のこと)。
【0082】
〔実施例6〕
Pim1はドセタキセル非存在下でHCT116増殖を阻害する
スクリーニングからの陽性結果を評価するためには、ドセタキセル非存在下で細胞の生存に影響するsiRNAと、ドセタキセルと協調して死滅力を増大する働きをするものとを区別することが重要であった。これらの可能性を区別するため、本発明者は、トリパンブルー排除法を用いてsiRNAトランスフェクションが増殖に与える影響を試験し、トランスフェクション後24、48、72時間目に、6ウェルプレートの生細胞数を判定するため、細胞を計数した。本発明者の結果は、Pim−1のsiRNAはHCT116細胞の成長を阻害するのに対し、TACCのsiRNAは、成長に影響しない(図12、ノックダウンを定量した図13)が、siRNAは両方ともドセタキセル誘導細胞死を増大させた(図9)。
【0083】
〔実施例7〕
Live/Deadアッセイを用いた耐性および感受性遺伝子サブセットの検証
ドセタキセル感受性および耐性を付与するsiRNAを視覚的に比較するため、顕微鏡撮像を用いて生細胞対死細胞の比を測定した。ここでは、生細胞を緑色に染色するカルセイン−AMを、および死細胞の核酸を赤く染色するヨウ化プロピジウム(PI)を用いた。ドセタキセル添加後(72時間目)、siRNAをトランスフェクトしたBubR1細胞は、生細胞数が最大となったのに対し、siRNAをトランスフェクトしたPim−1およびTACC3は、死細胞数が最大となり、対照細胞はこの中間であった(データ不図示)。BubR1のsiRNA単独では、72時間まで細胞死は増加したが、細胞は最終的にドセタキセルに対し更に耐性となった。Pim−1のsiRNA単独では、24時間まで細胞死を誘発したのに対し、TACC3のsiRNAは、細胞死を引き起こさなかった。これらの結果は、BubR1ダウンレギュレーションは、細胞の生存および薬剤耐性と関連があるのに対し、Pim−1およびTACC3ダウンレギュレーションは、細胞死および薬剤感受性と関連があることを示した。Pim−1およびTACC3はいずれも、ドセタキセル存在下で死滅が増加したが、このアッセイは、相加効果と協調的死滅とを区別することができなかった。
【0084】
〔実施例8〕
ドセタキセル誘導カスパーゼ3活性はBubR1ダウンレギュレーションにより低下し、Pim−1ダウンレギュレーションで増大した
ドセタキセルは、アポトーシスの誘発を介して細胞死を引き起こす(Kimら、Int
J Mo1 Med 11:799頁、2003年)。Pim−1およびBubR1のsiRNAが、ドセタキセル存在下および非存在下でアポトーシス標準経路を調節することができるかどうかを判定するため、本発明者は、HCT116細胞における活性化カスパーゼ3レベルを試験した(バイオプレックスアッセイ(bioplex assay)により)(図14)。40nMドセタキセル添加48時間後、カスパーゼ3活性を対照細胞で誘導し、Pim−1をダウンレギュレートして誘導をさらに増大させ、BubR1をダウンレギュレートして減少させた(中段および下段パネル)。ドセタキセル非存在下では、Pim−1のダウンレギュレーションは、24時間目にカスパーゼ3活性のわずかな増加をもたらしたが、カスパーゼ3活性は、48および72時間目までに対照レベルに戻っていた(上段パネル)。これは、他のアポトーシス機構が活性化されて、WST−1およびLIVE/DEADアッセイにより72時間目に観察された死滅の増大を維持したことを示している。ドセタキセル非存在下におけるBubR1のダウンレギュレーションは、カスパーゼ3活性のきわめてわずかな増加をもたらした。これは、BubR1ノックダウンが当初、LIVE/DEADアッセイで72時間目に細胞死を引き起こした所見と一致していた。これらの結果はさらに、Pim−1およびBubR1が、カスパーゼ3活性の調節を介したドセタキセル死滅エフェクターであることを示唆した。
【0085】
〔実施例9〕
ドセタキセル誘導Pim−1関連感受性およびBubR1関連耐性に関与するシグナル伝達経路
Pim−1に起因する活性は、細胞死につながるシグナル伝達イベントを阻害する一方、細胞生存を促進するシグナル伝達イベントを促す上で中心的な役割を果たしていることを示唆した。Pim−1ノックダウンに関連した細胞死の増大に関する分子基盤を明らかにするため、本発明者は、細胞生存に関与する鍵となる細胞経路、AKTの活性化状態を調べた。HCT116は、4×105細胞/ウェルで6ウェルプレートに播種し、翌日、リポフェクタミン2000(インビトロゲン)により16nMにてsiRNAをトランスフェクトした。24時間後、細胞を5および40nMドセタキセルで処理するか未処理とした。ドセタキセル添加後24、48および72時間目に、氷冷した溶解緩衝液(50mM HEPES緩衝液(PH7.4)、1%NP40、2.5mM EDTA、100mMフッ化ナトリウム、10mM PPLナトリウム、プロテーアーゼ阻害剤カクテルタブレット(Roche)、2mMオルトバナジウム酸ナトリウム)で細胞を溶解し、12,000gで10分間遠心分離した。溶解物は、次いでDCタンパク質アッセイ(BioRad)により全タンパク質レベルを定量化した。活性化カスパーゼ3レベルは、活性化カスパーゼ3Beadmatesキット(アップステート)およびルミネックス100(商標)システムを用いて、メーカーにより指示されたプロトコールで判定した。総合およびリン酸化AKTレベルは、トータルAKT抗体ビーズキットおよびリン酸特異的AKTS473抗体ビーズキット(Biosource)およびルミネックス100(商標)システムを用いて、メーカーにより指示されたプロトコールで判定した。
【0086】
図15に示された実験は、Pim−1ダウンレギュレーションが、対照に比べてベースラインのAKTリン酸化を減少させ、この効果は、ドセタキセル濃度の上昇に伴い有意に倍加したことを示している。対して、BubR1ダウンレギュレーションは、ベースラインのAKTリン酸化を増加させ、この効果は、ドセタキセルの高くはなく低い濃度で強調された。これは、代替シグナル伝達経路の変化が、高用量で活性化される可能性があることを示している。
【0087】
本発明者は、Pim−1およびBubR1に対する抗体を用いてウェスタンブロット分析を行い、48時間時点のタンパク質レベルを測定した。同量のタンパク質を、NuPAGE Novex Bis−Trisゲル(インビトロゲン)に添加した。Pim−1に対する抗体(サンタクルスバイオテクノロジー)、BubR1に対する抗体(BDバイオ
サイエンス)およびα−チューブリンに対する抗体(シグマ)は、メーカーの指示通りに使用した。第2抗体は、HRP(BioRad)に結合させ、ECLウェスタンブロット検出システム(Amhersham Biosciences)で検出した後、ハイパーフィルムECL(Amhersham Biosciences)に曝露した。図16に示された実験は、Pim−1およびBubR1のタンパク質レベルが、対照に比べて低下したことを示しており、タンパク質レベルの低下は、機能的変化(図15)に対応していたことを示している。これらのデータは、Pim−1タンパク質レベルのダウンレギュレーションは、細胞をアポトーシスへ押しやるため、AKTのリン酸化および活性化を阻害することができることを示唆している。Pim−1は、プロサバイバル経路(pro−survival pathway)の活性化により細胞の生存を媒介しているように思われる。
【0088】
本発明は、本明細書に記載された特定の実施形態により範囲を限定されない。実際、本明細書に記載されたものに加え、本発明の様々な変更が可能であることは、先述の説明および添付図面から当業者には明らかであろう。このような変更は、添付の特許請求の範囲にあるものである。
【0089】
本明細書で引用されている文献はすべて、参照により全体が組み込まれている。
Anand S, Penrhyn-Lowe S, Venkitaraman AR. (2003) AURORA-A amplification overrides the mitotic spindle assembly checkpoint, inducing resistance to Taxol. Cancer Cell. 3:51-62.
Aza-Blanc P, Cooper CL, Wagner K, Batalov S, Deveraux QL, Cooke MP. (2003) Identification of modulators of TRAIL-induced apoptosis via RNAi-based phenotypic screening. Mol Cell. 12:627-37.
Chang JC, Wooten EC, Tsimelzon A, Hilsenbeck SG, Gutierrez MC, Elledge R, Mohsin S, Osborne CK, Chamness GC, Allred DC, O'Connell P. (2003) Gene expression profiling for the prediction of therapeutic response to docetaxel in patients with breast cancer. Lancet. 362:362-9.
Hong, WK (2002) The current status of docetaxel in solid tumors. Oncology 16:9-15.
Jackson AL, Bartz SR, Schelter J, Kobayashi SV, Burchard J, Mao M, Li B, Cavet
G, Linsley PS. (2003) Expression profiling reveals off-target gene regulation by RNAi. Nat Biotechnol. 21:635-7.
Katsumata N. (2003) Docetaxel: an alternative taxane in ovarian cancer. Br J Cancer. 89 Suppl 3:S9-S15.
Kim R, Tanabe K, Uchida Y, Emi M, Toge T. (2003) Effect of Bcl-2 antisense oligonucleotide on drug-sensitivity in association with apoptosis in undifferentiated thyroid carcinoma. Int J Mol Med. 11:799-804.
Kolfschoten GM, Hulscher TM, Duyndam MC, Pinedo HM, Boven E. (2002) Variation in the kinetics of caspase-3 activation, Bcl-2 phosphorylation and apoptotic morphology in unselected human ovarian cancer cell lines as a response to docetaxel. Biochem Pharmacol. 63:733-43.
Kung AL, Sherwood SW, Schimke RT. (1990) Cell line-specific differences in the
control of cell cycle progression in the absence of mitosis. Proc Natl Acad Sci
U S A. 87:9553-7.
Lanni JS, Jacks T. (1998) Characterization of the p53-dependent postmitotic checkpoint following spindle disruption. Mol Cell Biol. 18:1055-64.
Lee LF, Li G, Templeton DJ, Ting JP. (1998) Paclitaxel (Taxol)-induced gene expression and cell death are both mediated by the activation of c-Jun NH2-terminal kinase (JNK/SAPK). J Biol Chem. 273:28253-60.
Li Y, Dowbenko D, Lasky LA. (2002) AKT/PKB phosphorylation of p21Cip/WAF1 enhances protein stability of p21Cip/WAF1 and promotes cell survival. J Biol Chem. 277:11352-61.
Lum L, Yao S, Mozer B, Rovescalli A, Von Kessler D, Nirenberg M, Beachy PA. (2003) Identification of Hedgehog pathway components by RNAi in Drosophila cultured cells. Science. 299:2039-45.
Masuda A, Maeno K, Nakagawa T, Saito H, Takahashi T. (2003) Association between mitotic spindle checkpoint impairment and susceptibility to the induction of apoptosis by anti-microtubule agents in human lung cancers. Am J Pathol. 163:1109-16.
McManus MT, Sharp PA. (2002) Gene silencing in mammals by small interfering RNAs. Nat Rev Genet. 3:737-47.
Meraldi P, Honda R, Nigg EA. (2004) Aurora kinases link chromosome segregation
and cell division to cancer susceptibility. Curr Opin Genet Dev. 14:29-36.
Michel L, Diaz-Rodriguez E, Narayan G, Hernando E, Murty VV, Benezra R. (2004)
Complete loss of the tumor suppressor MAD2 causes premature cyclin B degradation and mitotic failure in human somatic cells. Proc Natl Acad Sci U S A. 101:4459-64.
Ojima, I. and Geney, R. 109881 Aventis (2004) Curr Opin Investig Drugs 4:737-40.
Ringel I, Horwitz SB. (1991) Studies with RP 56976 (taxotere): a semisynthetic
analogue of taxol. J Natl Cancer Inst. 83:288-91.
Roh M, Gary B, Song C, Said-Al-Naief N, Tousson A, Kraft A, Eltoum IE, Abdulkadir SA. (2003) Overexpression of the oncogenic kinase Pim-1 leads to genomic instability. Cancer Res. 63:8079-84.
Shin HJ, Baek KH, Jeon AH, Park MT, Lee SJ, Kang CM, Lee HS, Yoo SH, Chung DH,
Sung YC, McKeon F, Lee CW. (2003) Dual roles of human BubR1, a mitotic checkpoint kinase, in the monitoring of chromosomal instability. Cancer Cell. 4:483-97.
Simmer F, Moorman C, Van Der Linden AM, Kuijk E, Van Den Berghe PV, Kamath R, Fraser AG, Ahringer J, Plasterk RH. (2003) Genome-Wide RNAi of C. elegans Using the Hypersensitive rrf-3 Strain Reveals Novel Gene Functions. PLoS Biol. 1:E12.
Sudo T, Nitta M, Saya H, Ueno NT. (2004) Dependence of paclitaxel sensitivity on a functional spindle assembly checkpoint. Cancer Res. 64:2502-8.
Tanabe K, Kim R, Inoue H, Emi M, Uchida Y, Toge T. (2003) Antisense Bcl-2 and HER-2 oligonucleotide treatment of breast cancer cells enhances their sensitivity to anticancer drugs. Int J Oncol. 22:875-81.
Taylor SS, McKeon F. (1997) Kinetochore localization of murine Bub1 is required for normal mitotic timing and checkpoint response to spindle damage.Cell. 89:727-35.
Wang TH, Wang HS, Soong YK (2000) Paclitaxel-induced cell death: where the cell cycle and apoptosis come together. Cancer. 88:2619-28.
Wang Z, Bhattacharya N, Mixter PF, Wei W, Sedivy J, Magnuson NS. (2002) Phosphorylation of the cell cycle inhibitor p21Cip1/WAF1 by Pim-1 kinase. Biochim Biophys Acta. 1593:45-55.
Zhou J, Yao J, Joshi HC. (2002) Attachment and tension in the spindle assembly
checkpoint. J Cell Sci. 115:3547-55.
【特許請求の範囲】
【請求項1】
a)患者の癌領域から試験試料を得る工程、
b)対照試料を得る工程、
c)1種またはそれ以上の遺伝子マーカーのレベルを測定する工程、および
d)試験試料および対照試料における上記1種またはそれ以上の遺伝子マーカーの測定レベルを比較する工程
を含み、対照試料と比較した場合の、試験試料において測定された上記1種またはそれ以上の遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する耐性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングする方法。
【請求項2】
1種またはそれ以上の遺伝子マーカーが、
BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列(GenBank受託番号:AF046079)、
Mad2、ホモサピエンスmRNA、MAD2タンパク質対応(GenBank受託番号:AJ000186)、
Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA(GenBank受託番号:NM_003318)、
GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA(GenBank受託番号:NM_133483)、
Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻害されず(酵母)(BUB1)、mRNA(GenBank受託番号:NM_004336)、
hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESPL1)、mRNA(GenBank受託番号:NM_012291)、
CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA(GenBank受託番号:NM_001221)、
CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA(GenBank受託番号:NM_001259)、および
GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA(GenBank受託番号:NM_002086)
からなる群から選択される、請求項1に記載の方法。
【請求項3】
タキソイドファミリーの分子が、パクリタキセル、ドセタキセルXRP9881およびXRP6258からなる群から選択される、請求項1に記載の方法。
【請求項4】
1種またはそれ以上の遺伝子マーカーのレベルが、mRNA、DNAまたはタンパク質により測定される、請求項1に記載の方法。
【請求項5】
mRNAが、in situハイブリダイゼーション、逆転写ポリメラーゼ連鎖反応、核酸ハイブリダイゼーション、電気泳動、ノーザンブロッティングおよび質量分析からなる群から選択される方法を用いて測定される、請求項4に記載の方法。
【請求項6】
DNAが、定量的ポリメラーゼ連鎖反応、ゲノムDNAチップ、in situハイブリダイゼーション、電気泳動、サザンブロッティングおよび質量分析からなる群から選択される方法を用いて測定される、請求項4に記載の方法。
【請求項7】
タンパク質が、イムノアッセイ、ウェスタンブロット、ELISA、および質量分析からなる群から選択される方法を用いて測定される、請求項4に記載の方法。
【請求項8】
a)患者の癌領域から試験試料を得る工程、
b)対照試料を得る工程、
c)1種またはそれ以上の遺伝子マーカーのレベルを測定する工程、および
d)試験試料および対照試料における上記1種またはそれ以上の遺伝子マーカーの測定レベルを比較する工程
を含み、対照試料と比較した場合の、試験試料において測定された上記1種またはそれ以上の遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する感受性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングする方法。
【請求項9】
1種またはそれ以上の遺伝子マーカーが、
P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA(GenBank受託番号:NM_000389)、
Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA(GenBank受託番号:NM_002648)、
GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導性、67kDa(GBP1)、mRNA(GenBank受託番号:NM_002053)、
RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA(GenBank受託番号:NM_002957)、
SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA(GenBank受託番号:NM_032905)、
Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA(GenBank受託番号:NM_006101)、
Raf1、ヒトmRNA、raf発癌遺伝子対応(GenBank受託番号:X03484)、
Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列(GenBank受託番号:AF008551)、
TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA(GenBank受託番号:NM_006342)、
RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA(GenBank受託番号:NM_006509)、
PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA(GenBank受託番号:NM_006254)、
BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA(GenBank受託番号:NM_006339)、
HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA(GenBank受託番号:NM_005345)、
STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツ−ジェガース症候群)(STK11)、mRNA(GenBank受託番号:NM_000455)、および
MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列(GenBank受託番号:L36719)
からなる群から選択される、請求項8に記載の方法。
【請求項10】
タキソイドファミリーの分子が、パクリタキセル、ドセタキセルXRP9881およびXRP6258からなる群から選択される、請求項8に記載の方法。
【請求項11】
1種またはそれ以上の遺伝子マーカーのレベルが、mRNA、DNAまたはタンパク質により測定される、請求項8に記載の方法。
【請求項12】
mRNAが、in situハイブリダイゼーション、逆転写ポリメラーゼ連鎖反応、核酸ハイブリダイゼーション、電気泳動、ノーザンブロッティングおよび質量分析からなる群から選択される方法を用いて測定される、請求項11に記載の方法。
【請求項13】
DNAが、定量的ポリメラーゼ連鎖反応、ゲノムDNAチップ、in situハイブリダイゼーション、電気泳動、サザンブロッティングおよび質量分析からなる群から選択される方法を用いて測定される、請求項11に記載の方法。
【請求項14】
タンパク質が、イムノアッセイ、ウェスタンブロット、ELISA、および質量分析からなる群から選択される方法を用いて測定される、請求項11に記載の方法。
【請求項15】
BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列(GenBank受託番号:AF046079)、
Mad2、ホモサピエンスmRNA、MAD2タンパク質対応(GenBank受託番号:AJ000186)、
Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA(GenBank受託番号:NM_003318)、
GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA(GenBank受託番号:NM_133483)、
Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻害されず(酵母)(BUB1)、mRNA(GenBank受託番号:NM_004336)、
hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESPL1)、mRNA(GenBank受託番号:NM_012291)、
CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA(GenBank受託番号:NM_001221)、
CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA(GenBank受託番号:NM_001259)、および
GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA(GenBank受託番号:NM_002086)
からなる群から選択される上記1種またはそれ以上の遺伝子マーカーに対し、ストリンジェントな条件下でハイブリダイズすることが可能な核酸を含む、検出可能な標識化抗体、検出可能な標識化抗体断片または検出可能な標識化オリゴヌクレオチドを含む、請求項1に記載の方法により、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするためのキット。
【請求項16】
P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA(GenBank受託番号:NM_000389)、
Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA(GenBank受託番号:NM_002648)、
GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導
性、67kDa(GBP1)、mRNA(GenBank受託番号:NM_002053)、
RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA(GenBank受託番号:NM_002957)、
SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA(GenBank受託番号:NM_032905)、
Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA(GenBank受託番号:NM_006101)、
Raf1、ヒトmRNA、raf発癌遺伝子対応(GenBank受託番号:X03484)、
Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列(GenBank受託番号:AF008551)、
TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA(GenBank受託番号:NM_006342)、
RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA(GenBank受託番号:NM_006509)、
PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA(GenBank受託番号:NM_006254)、
BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA(GenBank受託番号:NM_006339)、
HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA(GenBank受託番号:NM_005345)、
STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツ−ジェガース症候群)(STK11)、mRNA(GenBank受託番号:NM_000455)、および
MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列(GenBank受託番号:L36719)
からなる群から選択される上記1種またはそれ以上の遺伝子マーカーに対し、ストリンジェントな条件下でハイブリダイズすることが可能な核酸を含む、検出可能な標識化抗体、検出可能な標識化抗体断片または検出可能な標識化オリゴヌクレオチドを含む、請求項8に記載の方法により、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするためのキット。
【請求項17】
a)身体試料から全RNAを得る手段、
b)全RNAを逆転写してcDNAを得る手段、および
c)一方または両方のプライマーが、検出可能に標識され、両方のプライマーが、
BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列(GenBank受託番号:AF046079)、
Mad2、ホモサピエンスmRNA、MAD2タンパク質対応(GenBank受託番号:AJ000186)、
Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA(GenBank受託番号:NM_003318)、
GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA(GenBank受託番号:NM_133483)、
Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻害されず(酵母)(BUB1)、mRNA(GenBank受託番号:NM_004336)、
hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESP
L1)、mRNA(GenBank受託番号:NM_012291)、
CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA(GenBank受託番号:NM_001221)、
CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA(GenBank受託番号:NM_001259)、および
GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA(GenBank受託番号:NM_002086)
からなる群から選択される1種またはそれ以上の遺伝子マーカーのヌクレオチド配列に由来する、1組のプライマーを用いて上記cDNAをポリメラーゼ連鎖反応にかける手段
を含む、請求項1に記載の方法により、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするためのキット。
【請求項18】
a)身体試料から全RNAを得る手段、
b)全RNAを逆転写してcDNAを得る手段、および
c)一方または両方のプライマーが、検出可能に標識され、両方のプライマーが、
P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA(GenBank受託番号:NM_000389)、
Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA(GenBank受託番号:NM_002648)、
GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導性、67kDa(GBP1)、mRNA(GenBank受託番号:NM_002053)、
RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA(GenBank受託番号:NM_002957)、
SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA(GenBank受託番号:NM_032905)、
Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA(GenBank受託番号:NM_006101)、
Raf1、ヒトmRNA、raf発癌遺伝子対応(GenBank受託番号:X03484)、
Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列(GenBank受託番号:AF008551)、
TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA(GenBank受託番号:NM_006342)、
RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA(GenBank受託番号:NM_006509)、
PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA(GenBank受託番号:NM_006254)、
BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA(GenBank受託番号:NM_006339)、
HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA(GenBank受託番号:NM_005345)、
STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツ−ジェガース症候群)(STK11)、mRNA(GenBank受託番号:NM_000455)、および
MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列(GenBank受託番号:L36719)
からなる群から選択される1種またはそれ以上の遺伝子マーカーのヌクレオチド配列に由来する、1組のプライマーを用いて上記cDNAをポリメラーゼ連鎖反応にかける手段
を含む、請求項8に記載の方法により、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするためのキット。
【請求項19】
検出可能な標識が、酵素、放射性同位元素、または蛍光する化学物質、化学発光分子、放射線不透過性物質、リポソーム、およびハプテン分子からなる群から選択される、請求項15〜18のいずれか1項に記載の検出可能な標識。
【請求項20】
a)患者の癌領域から試験試料を得る工程、
b)BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列(GenBank受託番号:AF046079)、
Mad2、ホモサピエンスmRNA、MAD2タンパク質対応(GenBank受託番号:AJ000186)、
Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA(GenBank受託番号:NM_003318)、
GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA(GenBank受託番号:NM_133483)、
Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻害されず(酵母)(BUB1)、mRNA(GenBank受託番号:NM_004336)、
hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESPL1)、mRNA(GenBank受託番号:NM_012291)、
CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA(GenBank受託番号:NM_001221)、
CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA(GenBank受託番号:NM_001259)、および
GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA(GenBank受託番号:NM_002086)
からなる群から選択される1種またはそれ以上の遺伝子マーカーのレベルを測定する工程、
c)GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA(GenBank受託番号:NM_002046)、および
RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列(GenBank受託番号:BC071941)
からなる群から選択される1種またはそれ以上の参照遺伝子マーカーのレベルを測定する工程、
d)試験試料における上記1種またはそれ以上の遺伝子マーカーおよび上記1種またはそれ以上の参照遺伝子マーカーの測定レベルを比較する工程
を含み、上記1種またはそれ以上の参照遺伝子マーカーレベルと比較した場合の、上記1種またはそれ以上の遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する耐性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングする方法。
【請求項21】
a)患者の癌領域から試験試料を得る工程、
b)P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA(GenBank受託番号:NM_000389)、
Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA(GenBank受託番号:NM_002648)、
GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導性、67kDa(GBP1)、mRNA(GenBank受託番号:NM_002053)、
RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA(GenBank受託番号:NM_002957)、
SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA(GenBank受託番号:NM_032905)、
Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA(GenBank受託番号:NM_006101)、
Raf1、ヒトmRNA、raf発癌遺伝子対応(GenBank受託番号:X03484)、
Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列(GenBankアクセッション番号:AF008551)、
TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA(GenBank受託番号:NM_006342)、
RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA(GenBank受託番号:NM_006509)、
PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA(GenBank受託番号:NM_006254)、
BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA(GenBank受託番号:NM_006339)、
HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA(GenBank受託番号:NM_005345)、
STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツ−ジェガース症候群)(STK11)、mRNA(GenBank受託番号:NM_000455)、および
MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列(GenBank受託番号:L36719)
からなる群から選択される1種またはそれ以上の遺伝子マーカーのレベルを測定する工程、
c)GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA(GenBank受託番号:NM_002046)、および
RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列(GenBank受託番号:BC071941)
からなる群から選択される1種またはそれ以上の参照遺伝子マーカーのレベルを測定する工程、
d)試験試料における上記1種またはそれ以上の遺伝子マーカーおよび上記1種またはそれ以上の参照遺伝子マーカーの測定レベルを比較する工程
を含み、上記1種またはそれ以上の参照遺伝子マーカーレベルと比較した場合の、上記1種またはそれ以上の遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する感受性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングする方法。
【請求項22】
タキソイドファミリーの分子が、パクリタキセル、ドセタキセルXRP9881およびXRP6258からなる群から選択される、請求項20または21に記載の方法。
【請求項23】
1種またはそれ以上の遺伝子マーカーのレベルが、mRNA、DNAまたはタンパク質
により測定される、請求項20または21に記載の方法。
【請求項24】
mRNAが、in situハイブリダイゼーション、逆転写ポリメラーゼ連鎖反応、核酸ハイブリダイゼーション、電気泳動、ノーザンブロッティングおよび質量分析からなる群から選択される方法を用いて測定される、請求項23に記載の方法。
【請求項25】
DNAが、定量的ポリメラーゼ連鎖反応、ゲノムDNAチップ、in situハイブリダイゼーション、電気泳動、サザンブロッティングおよび質量分析からなる群から選択される方法を用いて測定される、請求項23に記載の方法。
【請求項26】
タンパク質が、イムノアッセイ、ウェスタンブロット、ELISA、および質量分析からなる群から選択される方法を用いて測定される、請求項23に記載の方法。
【請求項27】
BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列(GenBank受託番号:AF046079)、
Mad2、ホモサピエンスmRNA、MAD2タンパク質対応(GenBank受託番号:AJ000186)、
Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA(GenBank受託番号:NM_003318)、
GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA(GenBank受託番号:NM_133483)、
Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻害されず(酵母)(BUB1)、mRNA(GenBank受託番号:NM_004336)、
hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESPL1)、mRNA(GenBank受託番号:NM_012291)、
CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA(GenBank受託番号:NM_001221)、
CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA(GenBank受託番号:NM_001259)、
GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA(GenBank受託番号:NM_002086)
GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA(GenBank受託番号:NM_002046)、および
RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列(GenBank受託番号:BC071941)
からなる群から選択される上記1種またはそれ以上の遺伝子マーカーおよび上記1種またはそれ以上の参照遺伝子マーカーに対し、ストリンジェントな条件下でハイブリダイズすることが可能な核酸を含む、検出可能な標識化抗体、検出可能な標識化抗体断片または検出可能な標識化オリゴヌクレオチドを含む、請求項20に記載の方法により、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするためのキット。
【請求項28】
P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA(GenBank受託番号:NM_000389)、
Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA(GenBank受託番号:NM_002648)、
GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導
性、67kDa(GBP1)、mRNA(GenBank受託番号:NM_002053)、
RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA(GenBank受託番号:NM_002957)、
SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA(GenBank受託番号:NM_032905)、
Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA(GenBank受託番号:NM_006101)、
Raf1、ヒトmRNA、raf発癌遺伝子対応(GenBank受託番号:X03484)、
Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列(GenBank受託番号:AF008551)、
TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA(GenBank受託番号:NM_006342)、
RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA(GenBank受託番号:NM_006509)、
PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA(GenBank受託番号:NM_006254)、
BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA(GenBank受託番号:NM_006339)、
HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA(GenBank受託番号:NM_005345)、
STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツ−ジェガース症候群)(STK11)、mRNA(GenBank受託番号:NM_000455)、
MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列(GenBank受託番号:L36719)
GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA(GenBank受託番号:NM_002046)、および
RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列(GenBank受託番号:BC071941)
からなる群から選択される上記1種またはそれ以上の遺伝子マーカーおよび上記1種またはそれ以上の参照遺伝子マーカーに対し、ストリンジェントな条件下でハイブリダイズすることが可能な核酸を含む、検出可能な標識化抗体、検出可能な標識化抗体断片または検出可能な標識化オリゴヌクレオチドを含む、請求項21に記載の方法により、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするためのキット。
【請求項29】
a)身体試料から全RNAを得る手段、
b)全RNAを逆転写してcDNAを得る手段、および
c)一方または両方のプライマーが、検出可能に標識され、両方のプライマーが、
BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列(GenBank受託番号:AF046079)、
Mad2、ホモサピエンスmRNA、MAD2タンパク質対応(GenBank受託番号:AJ000186)、
Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA(GenBank受託番号:NM_003318)、
GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA(GenBank受託番号:NM_133483)、
Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻
害されず(酵母)(BUB1)、mRNA(GenBank受託番号:NM_004336)、
hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESPL1)、mRNA(GenBank受託番号:NM_012291)、
CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA(GenBank受託番号:NM_001221)、
CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA(GenBank受託番号:NM_001259)、
GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA(GenBank受託番号:NM_002086)、
GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA(GenBank受託番号:NM_002046)、および
RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列(GenBank受託番号:BC071941)
からなる群から選択される1種またはそれ以上の遺伝子マーカーのヌクレオチド配列に由来する、1組のプライマーを用いてcDNAをポリメラーゼ連鎖反応にかける手段
を含む、請求項20に記載の方法により、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするためのキット。
【請求項30】
a)身体試料から全RNAを得る手段、
b)全RNAを逆転写してcDNAを得る手段、および
c)一方または両方のプライマーが、検出可能に標識され、両方のプライマーが、
P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA(GenBank受託番号:NM_000389)、
Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA(GenBank受託番号:NM_002648)、
GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導性、67kDa(GBP1)、mRNA(GenBank受託番号:NM_002053)、
RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA(GenBank受託番号:NM_002957)、
SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA(GenBank受託番号:NM_032905)、
Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA(GenBank受託番号:NM_006101)、
Raf1、ヒトmRNA、raf発癌遺伝子対応(GenBank受託番号:X03484)、
Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列(GenBank受託番号:AF008551)、
TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA(GenBank受託番号:NM_006342)、
RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA(GenBank受託番号:NM_006509)、
PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA(GenBank受託番号:NM_006254)、
BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA(GenBank受託番号:NM_006339)、
HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA(GenBank受託番号:NM_005345)、
STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツ−ジェガース症候群)(STK11)、mRNA(GenBank受託番号:NM_000455)、
MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列(GenBank受託番号:L36719),
GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA(GenBank受託番号:NM_002046)、および
RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列(GenBank受託番号:BC071941)
からなる群から選択される1種またはそれ以上の遺伝子マーカーのヌクレオチド配列に由来する、1組のプライマーを用いてcDNAをポリメラーゼ連鎖反応にかける手段
を含む、請求項19に記載の方法により、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするためのキット。
【請求項31】
検出可能な標識が、酵素、放射性同位元素、または蛍光する化学物質、化学発光分子、放射線不透過性物質、リポソーム、およびハプテン分子を含む、請求項24〜27のいずれか1項に記載の検出可能な標識。
【請求項1】
a)患者の癌領域から試験試料を得る工程、
b)対照試料を得る工程、
c)1種またはそれ以上の遺伝子マーカーのレベルを測定する工程、および
d)試験試料および対照試料における上記1種またはそれ以上の遺伝子マーカーの測定レベルを比較する工程
を含み、対照試料と比較した場合の、試験試料において測定された上記1種またはそれ以上の遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する耐性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングする方法。
【請求項2】
1種またはそれ以上の遺伝子マーカーが、
BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列(GenBank受託番号:AF046079)、
Mad2、ホモサピエンスmRNA、MAD2タンパク質対応(GenBank受託番号:AJ000186)、
Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA(GenBank受託番号:NM_003318)、
GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA(GenBank受託番号:NM_133483)、
Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻害されず(酵母)(BUB1)、mRNA(GenBank受託番号:NM_004336)、
hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESPL1)、mRNA(GenBank受託番号:NM_012291)、
CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA(GenBank受託番号:NM_001221)、
CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA(GenBank受託番号:NM_001259)、および
GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA(GenBank受託番号:NM_002086)
からなる群から選択される、請求項1に記載の方法。
【請求項3】
タキソイドファミリーの分子が、パクリタキセル、ドセタキセルXRP9881およびXRP6258からなる群から選択される、請求項1に記載の方法。
【請求項4】
1種またはそれ以上の遺伝子マーカーのレベルが、mRNA、DNAまたはタンパク質により測定される、請求項1に記載の方法。
【請求項5】
mRNAが、in situハイブリダイゼーション、逆転写ポリメラーゼ連鎖反応、核酸ハイブリダイゼーション、電気泳動、ノーザンブロッティングおよび質量分析からなる群から選択される方法を用いて測定される、請求項4に記載の方法。
【請求項6】
DNAが、定量的ポリメラーゼ連鎖反応、ゲノムDNAチップ、in situハイブリダイゼーション、電気泳動、サザンブロッティングおよび質量分析からなる群から選択される方法を用いて測定される、請求項4に記載の方法。
【請求項7】
タンパク質が、イムノアッセイ、ウェスタンブロット、ELISA、および質量分析からなる群から選択される方法を用いて測定される、請求項4に記載の方法。
【請求項8】
a)患者の癌領域から試験試料を得る工程、
b)対照試料を得る工程、
c)1種またはそれ以上の遺伝子マーカーのレベルを測定する工程、および
d)試験試料および対照試料における上記1種またはそれ以上の遺伝子マーカーの測定レベルを比較する工程
を含み、対照試料と比較した場合の、試験試料において測定された上記1種またはそれ以上の遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する感受性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングする方法。
【請求項9】
1種またはそれ以上の遺伝子マーカーが、
P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA(GenBank受託番号:NM_000389)、
Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA(GenBank受託番号:NM_002648)、
GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導性、67kDa(GBP1)、mRNA(GenBank受託番号:NM_002053)、
RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA(GenBank受託番号:NM_002957)、
SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA(GenBank受託番号:NM_032905)、
Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA(GenBank受託番号:NM_006101)、
Raf1、ヒトmRNA、raf発癌遺伝子対応(GenBank受託番号:X03484)、
Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列(GenBank受託番号:AF008551)、
TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA(GenBank受託番号:NM_006342)、
RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA(GenBank受託番号:NM_006509)、
PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA(GenBank受託番号:NM_006254)、
BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA(GenBank受託番号:NM_006339)、
HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA(GenBank受託番号:NM_005345)、
STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツ−ジェガース症候群)(STK11)、mRNA(GenBank受託番号:NM_000455)、および
MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列(GenBank受託番号:L36719)
からなる群から選択される、請求項8に記載の方法。
【請求項10】
タキソイドファミリーの分子が、パクリタキセル、ドセタキセルXRP9881およびXRP6258からなる群から選択される、請求項8に記載の方法。
【請求項11】
1種またはそれ以上の遺伝子マーカーのレベルが、mRNA、DNAまたはタンパク質により測定される、請求項8に記載の方法。
【請求項12】
mRNAが、in situハイブリダイゼーション、逆転写ポリメラーゼ連鎖反応、核酸ハイブリダイゼーション、電気泳動、ノーザンブロッティングおよび質量分析からなる群から選択される方法を用いて測定される、請求項11に記載の方法。
【請求項13】
DNAが、定量的ポリメラーゼ連鎖反応、ゲノムDNAチップ、in situハイブリダイゼーション、電気泳動、サザンブロッティングおよび質量分析からなる群から選択される方法を用いて測定される、請求項11に記載の方法。
【請求項14】
タンパク質が、イムノアッセイ、ウェスタンブロット、ELISA、および質量分析からなる群から選択される方法を用いて測定される、請求項11に記載の方法。
【請求項15】
BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列(GenBank受託番号:AF046079)、
Mad2、ホモサピエンスmRNA、MAD2タンパク質対応(GenBank受託番号:AJ000186)、
Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA(GenBank受託番号:NM_003318)、
GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA(GenBank受託番号:NM_133483)、
Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻害されず(酵母)(BUB1)、mRNA(GenBank受託番号:NM_004336)、
hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESPL1)、mRNA(GenBank受託番号:NM_012291)、
CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA(GenBank受託番号:NM_001221)、
CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA(GenBank受託番号:NM_001259)、および
GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA(GenBank受託番号:NM_002086)
からなる群から選択される上記1種またはそれ以上の遺伝子マーカーに対し、ストリンジェントな条件下でハイブリダイズすることが可能な核酸を含む、検出可能な標識化抗体、検出可能な標識化抗体断片または検出可能な標識化オリゴヌクレオチドを含む、請求項1に記載の方法により、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするためのキット。
【請求項16】
P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA(GenBank受託番号:NM_000389)、
Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA(GenBank受託番号:NM_002648)、
GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導
性、67kDa(GBP1)、mRNA(GenBank受託番号:NM_002053)、
RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA(GenBank受託番号:NM_002957)、
SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA(GenBank受託番号:NM_032905)、
Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA(GenBank受託番号:NM_006101)、
Raf1、ヒトmRNA、raf発癌遺伝子対応(GenBank受託番号:X03484)、
Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列(GenBank受託番号:AF008551)、
TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA(GenBank受託番号:NM_006342)、
RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA(GenBank受託番号:NM_006509)、
PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA(GenBank受託番号:NM_006254)、
BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA(GenBank受託番号:NM_006339)、
HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA(GenBank受託番号:NM_005345)、
STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツ−ジェガース症候群)(STK11)、mRNA(GenBank受託番号:NM_000455)、および
MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列(GenBank受託番号:L36719)
からなる群から選択される上記1種またはそれ以上の遺伝子マーカーに対し、ストリンジェントな条件下でハイブリダイズすることが可能な核酸を含む、検出可能な標識化抗体、検出可能な標識化抗体断片または検出可能な標識化オリゴヌクレオチドを含む、請求項8に記載の方法により、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするためのキット。
【請求項17】
a)身体試料から全RNAを得る手段、
b)全RNAを逆転写してcDNAを得る手段、および
c)一方または両方のプライマーが、検出可能に標識され、両方のプライマーが、
BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列(GenBank受託番号:AF046079)、
Mad2、ホモサピエンスmRNA、MAD2タンパク質対応(GenBank受託番号:AJ000186)、
Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA(GenBank受託番号:NM_003318)、
GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA(GenBank受託番号:NM_133483)、
Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻害されず(酵母)(BUB1)、mRNA(GenBank受託番号:NM_004336)、
hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESP
L1)、mRNA(GenBank受託番号:NM_012291)、
CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA(GenBank受託番号:NM_001221)、
CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA(GenBank受託番号:NM_001259)、および
GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA(GenBank受託番号:NM_002086)
からなる群から選択される1種またはそれ以上の遺伝子マーカーのヌクレオチド配列に由来する、1組のプライマーを用いて上記cDNAをポリメラーゼ連鎖反応にかける手段
を含む、請求項1に記載の方法により、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするためのキット。
【請求項18】
a)身体試料から全RNAを得る手段、
b)全RNAを逆転写してcDNAを得る手段、および
c)一方または両方のプライマーが、検出可能に標識され、両方のプライマーが、
P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA(GenBank受託番号:NM_000389)、
Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA(GenBank受託番号:NM_002648)、
GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導性、67kDa(GBP1)、mRNA(GenBank受託番号:NM_002053)、
RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA(GenBank受託番号:NM_002957)、
SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA(GenBank受託番号:NM_032905)、
Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA(GenBank受託番号:NM_006101)、
Raf1、ヒトmRNA、raf発癌遺伝子対応(GenBank受託番号:X03484)、
Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列(GenBank受託番号:AF008551)、
TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA(GenBank受託番号:NM_006342)、
RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA(GenBank受託番号:NM_006509)、
PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA(GenBank受託番号:NM_006254)、
BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA(GenBank受託番号:NM_006339)、
HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA(GenBank受託番号:NM_005345)、
STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツ−ジェガース症候群)(STK11)、mRNA(GenBank受託番号:NM_000455)、および
MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列(GenBank受託番号:L36719)
からなる群から選択される1種またはそれ以上の遺伝子マーカーのヌクレオチド配列に由来する、1組のプライマーを用いて上記cDNAをポリメラーゼ連鎖反応にかける手段
を含む、請求項8に記載の方法により、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするためのキット。
【請求項19】
検出可能な標識が、酵素、放射性同位元素、または蛍光する化学物質、化学発光分子、放射線不透過性物質、リポソーム、およびハプテン分子からなる群から選択される、請求項15〜18のいずれか1項に記載の検出可能な標識。
【請求項20】
a)患者の癌領域から試験試料を得る工程、
b)BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列(GenBank受託番号:AF046079)、
Mad2、ホモサピエンスmRNA、MAD2タンパク質対応(GenBank受託番号:AJ000186)、
Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA(GenBank受託番号:NM_003318)、
GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA(GenBank受託番号:NM_133483)、
Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻害されず(酵母)(BUB1)、mRNA(GenBank受託番号:NM_004336)、
hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESPL1)、mRNA(GenBank受託番号:NM_012291)、
CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA(GenBank受託番号:NM_001221)、
CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA(GenBank受託番号:NM_001259)、および
GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA(GenBank受託番号:NM_002086)
からなる群から選択される1種またはそれ以上の遺伝子マーカーのレベルを測定する工程、
c)GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA(GenBank受託番号:NM_002046)、および
RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列(GenBank受託番号:BC071941)
からなる群から選択される1種またはそれ以上の参照遺伝子マーカーのレベルを測定する工程、
d)試験試料における上記1種またはそれ以上の遺伝子マーカーおよび上記1種またはそれ以上の参照遺伝子マーカーの測定レベルを比較する工程
を含み、上記1種またはそれ以上の参照遺伝子マーカーレベルと比較した場合の、上記1種またはそれ以上の遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する耐性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングする方法。
【請求項21】
a)患者の癌領域から試験試料を得る工程、
b)P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA(GenBank受託番号:NM_000389)、
Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA(GenBank受託番号:NM_002648)、
GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導性、67kDa(GBP1)、mRNA(GenBank受託番号:NM_002053)、
RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA(GenBank受託番号:NM_002957)、
SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA(GenBank受託番号:NM_032905)、
Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA(GenBank受託番号:NM_006101)、
Raf1、ヒトmRNA、raf発癌遺伝子対応(GenBank受託番号:X03484)、
Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列(GenBankアクセッション番号:AF008551)、
TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA(GenBank受託番号:NM_006342)、
RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA(GenBank受託番号:NM_006509)、
PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA(GenBank受託番号:NM_006254)、
BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA(GenBank受託番号:NM_006339)、
HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA(GenBank受託番号:NM_005345)、
STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツ−ジェガース症候群)(STK11)、mRNA(GenBank受託番号:NM_000455)、および
MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列(GenBank受託番号:L36719)
からなる群から選択される1種またはそれ以上の遺伝子マーカーのレベルを測定する工程、
c)GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA(GenBank受託番号:NM_002046)、および
RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列(GenBank受託番号:BC071941)
からなる群から選択される1種またはそれ以上の参照遺伝子マーカーのレベルを測定する工程、
d)試験試料における上記1種またはそれ以上の遺伝子マーカーおよび上記1種またはそれ以上の参照遺伝子マーカーの測定レベルを比較する工程
を含み、上記1種またはそれ以上の参照遺伝子マーカーレベルと比較した場合の、上記1種またはそれ以上の遺伝子マーカーレベルの低下が、タキソイドファミリー分子に対する感受性の増加を表す、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングする方法。
【請求項22】
タキソイドファミリーの分子が、パクリタキセル、ドセタキセルXRP9881およびXRP6258からなる群から選択される、請求項20または21に記載の方法。
【請求項23】
1種またはそれ以上の遺伝子マーカーのレベルが、mRNA、DNAまたはタンパク質
により測定される、請求項20または21に記載の方法。
【請求項24】
mRNAが、in situハイブリダイゼーション、逆転写ポリメラーゼ連鎖反応、核酸ハイブリダイゼーション、電気泳動、ノーザンブロッティングおよび質量分析からなる群から選択される方法を用いて測定される、請求項23に記載の方法。
【請求項25】
DNAが、定量的ポリメラーゼ連鎖反応、ゲノムDNAチップ、in situハイブリダイゼーション、電気泳動、サザンブロッティングおよび質量分析からなる群から選択される方法を用いて測定される、請求項23に記載の方法。
【請求項26】
タンパク質が、イムノアッセイ、ウェスタンブロット、ELISA、および質量分析からなる群から選択される方法を用いて測定される、請求項23に記載の方法。
【請求項27】
BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列(GenBank受託番号:AF046079)、
Mad2、ホモサピエンスmRNA、MAD2タンパク質対応(GenBank受託番号:AJ000186)、
Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA(GenBank受託番号:NM_003318)、
GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA(GenBank受託番号:NM_133483)、
Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻害されず(酵母)(BUB1)、mRNA(GenBank受託番号:NM_004336)、
hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESPL1)、mRNA(GenBank受託番号:NM_012291)、
CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA(GenBank受託番号:NM_001221)、
CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA(GenBank受託番号:NM_001259)、
GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA(GenBank受託番号:NM_002086)
GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA(GenBank受託番号:NM_002046)、および
RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列(GenBank受託番号:BC071941)
からなる群から選択される上記1種またはそれ以上の遺伝子マーカーおよび上記1種またはそれ以上の参照遺伝子マーカーに対し、ストリンジェントな条件下でハイブリダイズすることが可能な核酸を含む、検出可能な標識化抗体、検出可能な標識化抗体断片または検出可能な標識化オリゴヌクレオチドを含む、請求項20に記載の方法により、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするためのキット。
【請求項28】
P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA(GenBank受託番号:NM_000389)、
Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA(GenBank受託番号:NM_002648)、
GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導
性、67kDa(GBP1)、mRNA(GenBank受託番号:NM_002053)、
RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA(GenBank受託番号:NM_002957)、
SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA(GenBank受託番号:NM_032905)、
Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA(GenBank受託番号:NM_006101)、
Raf1、ヒトmRNA、raf発癌遺伝子対応(GenBank受託番号:X03484)、
Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列(GenBank受託番号:AF008551)、
TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA(GenBank受託番号:NM_006342)、
RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA(GenBank受託番号:NM_006509)、
PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA(GenBank受託番号:NM_006254)、
BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA(GenBank受託番号:NM_006339)、
HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA(GenBank受託番号:NM_005345)、
STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツ−ジェガース症候群)(STK11)、mRNA(GenBank受託番号:NM_000455)、
MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列(GenBank受託番号:L36719)
GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA(GenBank受託番号:NM_002046)、および
RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列(GenBank受託番号:BC071941)
からなる群から選択される上記1種またはそれ以上の遺伝子マーカーおよび上記1種またはそれ以上の参照遺伝子マーカーに対し、ストリンジェントな条件下でハイブリダイズすることが可能な核酸を含む、検出可能な標識化抗体、検出可能な標識化抗体断片または検出可能な標識化オリゴヌクレオチドを含む、請求項21に記載の方法により、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするためのキット。
【請求項29】
a)身体試料から全RNAを得る手段、
b)全RNAを逆転写してcDNAを得る手段、および
c)一方または両方のプライマーが、検出可能に標識され、両方のプライマーが、
BubR1、ホモサピエンス、プロテインキナーゼ(BUBR1)に類似、mRNA、完全配列(GenBank受託番号:AF046079)、
Mad2、ホモサピエンスmRNA、MAD2タンパク質対応(GenBank受託番号:AJ000186)、
Mps1、ホモサピエンスTTKプロテインキナーゼ(TTK)、mRNA(GenBank受託番号:NM_003318)、
GEFT、Rac1/CDC42対応、ホモサピエンスRAC/CDC42交換因子(GEFT)、転写変異体2、mRNA(GenBank受託番号:NM_133483)、
Bub1、ホモサピエンスBUB1、出芽はベンゾイミダゾール1ホモログによって阻
害されず(酵母)(BUB1)、mRNA(GenBank受託番号:NM_004336)、
hセファラーゼ、ホモサピエンス、余分紡錘体極類似1(S.セレヴィシエ)(ESPL1)、mRNA(GenBank受託番号:NM_012291)、
CamKIId、ホモサピエンス、カルシウム/カルモジュリン依存症プロテインキナーゼ(CaMキナーゼ)IIδ(CAMK2D)、転写変異体3、mRNA(GenBank受託番号:NM_001221)、
CDK6、ホモサピエンス、サイクリン依存性キナーゼ6(CDK6)、mRNA(GenBank受託番号:NM_001259)、
GRB2、ホモサピエンス、成長因子受容体結合プロテイン2(GRB2)、転写変異体1、mRNA(GenBank受託番号:NM_002086)、
GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA(GenBank受託番号:NM_002046)、および
RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列(GenBank受託番号:BC071941)
からなる群から選択される1種またはそれ以上の遺伝子マーカーのヌクレオチド配列に由来する、1組のプライマーを用いてcDNAをポリメラーゼ連鎖反応にかける手段
を含む、請求項20に記載の方法により、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするためのキット。
【請求項30】
a)身体試料から全RNAを得る手段、
b)全RNAを逆転写してcDNAを得る手段、および
c)一方または両方のプライマーが、検出可能に標識され、両方のプライマーが、
P21(Waf1)、ホモサピエンス、サイクリン依存症キナーゼ阻害因子1A(p21,Cip1)(CDKN1A)、転写変異体1、mRNA(GenBank受託番号:NM_000389)、
Pim−1、ホモサピエンス、pim−1発癌遺伝子(PIM1)、mRNA(GenBank受託番号:NM_002648)、
GBP−1、ホモサピエンス、グアニレート結合プロテイン1、インターフェロン誘導性、67kDa(GBP1)、mRNA(GenBank受託番号:NM_002053)、
RXRA、ホモサピエンス、レチノイドX受容体、α(RXRA)、mRNA(GenBank受託番号:NM_002957)、
SPF45、ホモサピエンス、RNA結合モチーフプロテイン17(RBM17)、mRNA(GenBank受託番号:NM_032905)、
Hec1、ホモサピエンス、動原体結合2(KNTC2)、mRNA(GenBank受託番号:NM_006101)、
Raf1、ヒトmRNA、raf発癌遺伝子対応(GenBank受託番号:X03484)、
Aurora A、ホモサピエンス、オーロラ関連キナーゼ1(ARK1)mRNA、完全配列(GenBank受託番号:AF008551)、
TACC3、ホモサピエンス、形質転換性酸性コイルドコイル含有プロテイン3(TACC3)、mRNA(GenBank受託番号:NM_006342)、
RelB、ホモサピエンス、ウイルス関連細網内皮症ウイルス発癌遺伝子ホモログB、B細胞内κ軽鎖ポリペプチド遺伝子エンハンサーの核因子3(鳥類)(RELB)、mRNA(GenBank受託番号:NM_006509)、
PRKCD、ホモサピエンス、プロテインキナーゼC、δ(PRKCD)、転写変異体1、mRNA(GenBank受託番号:NM_006254)、
BRAF35、ホモサピエンス、高移動度グループ20B(HMG20B)、mRNA(GenBank受託番号:NM_006339)、
HSPA1L、ホモサピエンス、熱ショック70kDaプロテイン1A(HSPA1A)、mRNA(GenBank受託番号:NM_005345)、
STK11、ホモサピエンス、セリン/トレオニンキナーゼ11(ポイツ−ジェガース症候群)(STK11)、mRNA(GenBank受託番号:NM_000455)、
MKK3、ホモサピエンス、MAPキナーゼキナーゼ3(MKK3)mRNA、完全配列(GenBank受託番号:L36719),
GAPDH、ホモサピエンス、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ(GAPD)、mRNA(GenBank受託番号:NM_002046)、および
RPS9、ホモサピエンス、cDNAクローンIMAGE:6647283、部分配列(GenBank受託番号:BC071941)
からなる群から選択される1種またはそれ以上の遺伝子マーカーのヌクレオチド配列に由来する、1組のプライマーを用いてcDNAをポリメラーゼ連鎖反応にかける手段
を含む、請求項19に記載の方法により、タキソイドファミリー分子に対する癌患者の応答を予測またはモニタリングするためのキット。
【請求項31】
検出可能な標識が、酵素、放射性同位元素、または蛍光する化学物質、化学発光分子、放射線不透過性物質、リポソーム、およびハプテン分子を含む、請求項24〜27のいずれか1項に記載の検出可能な標識。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2012−100666(P2012−100666A)
【公開日】平成24年5月31日(2012.5.31)
【国際特許分類】
【出願番号】特願2011−273355(P2011−273355)
【出願日】平成23年12月14日(2011.12.14)
【分割の表示】特願2007−545523(P2007−545523)の分割
【原出願日】平成17年12月1日(2005.12.1)
【出願人】(500137976)アベンティス・ファーマスーティカルズ・インコーポレイテツド (76)
【Fターム(参考)】
【公開日】平成24年5月31日(2012.5.31)
【国際特許分類】
【出願日】平成23年12月14日(2011.12.14)
【分割の表示】特願2007−545523(P2007−545523)の分割
【原出願日】平成17年12月1日(2005.12.1)
【出願人】(500137976)アベンティス・ファーマスーティカルズ・インコーポレイテツド (76)
【Fターム(参考)】
[ Back to top ]

