ドーパミン放出に対するウリジンの効果
【課題】ドーパミン放出の減少を特徴とする病気の治療法を提供する。
【解決手段】本発明は、ドーパミン及び他の神経伝達物質の分泌を増加させる方法、及び、ドーパミン及び他の神経伝達物質の減少を伴う病気(例えば、パーキンソン病)を治療する又は前記病気の発生率を減少させる方法であって、患者にウリジン又はそのソースを投与するステップを含む方法を提供する。また、本発明は、パーキンソン病を治療する又はパーキンソン病の発生率を減少させるための組成物であって、ウリジン、ウリジン1リン酸、又はそのソースを含有する組成物を提供する。
【解決手段】本発明は、ドーパミン及び他の神経伝達物質の分泌を増加させる方法、及び、ドーパミン及び他の神経伝達物質の減少を伴う病気(例えば、パーキンソン病)を治療する又は前記病気の発生率を減少させる方法であって、患者にウリジン又はそのソースを投与するステップを含む方法を提供する。また、本発明は、パーキンソン病を治療する又はパーキンソン病の発生率を減少させるための組成物であって、ウリジン、ウリジン1リン酸、又はそのソースを含有する組成物を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ドーパミン及び他の神経伝達物質の分泌を増加させる方法、及び、ドーパミン及び他の神経伝達物質の減少を伴う病気(例えば、パーキンソン病)を治療する又は前記病気の発生率を減少させる方法であって、患者にウリジン又はそのソースを投与するステップを含む方法を提供する。また、本発明は、パーキンソン病を治療する又はパーキンソン病の発生率を減少させるための組成物であって、ウリジン、ウリジン1リン酸、又はそのソースを含有する組成物を提供する。
【0002】
本発明は、米国国立衛生研究所により認可された認可番号MH28783の下で米国政府の支援によって、全部又は一部が成された。米国政府は、本発明に対する一定の権利を有し得る。
【0003】
(関連出願の相互参照)
本出願は、2004年5月13日に出願された米国特許仮出願第60/570、444号(その全ては、この参照により本発明に含まれるものとする)の優先権を主張するものである。
【背景技術】
【0004】
パーキンソン病(Parkinson's disease:PD)は、高齢者によく起こる、身体に障害を引き起こす病気であり、米国における60歳以上の人口の約1%に影響を及ぼす。パーキンソン病は、線条体からのドーパミン放出の減少と関連しており、脳内におけるドーパミン/アセチルコリンの深刻な不均衡をもたらす。ドーパミンは、脳内で、神経細胞のシナプス間隙における神経伝達物質として作用し、細胞間の信号伝達を担う。
【0005】
パーキンソン病は、いくつかある症状の中で特に、筋肉の硬直、粗大振戦、及び体位の変形を特徴とする進行性変性疾患である。最も一般的な治療方法は、生じた化学的不均衡を、アセチルコリン生成を減少させることにより及び/又はドーパミン濃度を増加させることにより改善することを試みるが、生じた新しいバランスの結果による副作用が伴う。その内のあるPDの治療方法は、ドーパミン放出を促進するためのドーパミン前駆体(例えば、L−DOPA)の投与と、それによる後シナプス受容体の刺激を含む。しかしながら、L−DOPAは体内での半減期が短いので、結局はL−DOPAの作用は散発的及び予測不可能となるため、運動機能、運動障害及び精神的副作用にばらつきをもたらす。
【0006】
したがって、ドーパミン放出の減少を特徴とする病態の治療法が求められている。また、症状の発現を遅延させる、及び/又は、前記病気の病徴発現を緩和する或いは遅延させる治療法が望まれている。
【発明の概要】
【課題を解決するための手段】
【0007】
本発明は、ドーパミン及び他の神経伝達物質の分泌を増加させる方法、及び、ドーパミン及び他の神経伝達物質の減少を伴う病気(例えば、パーキンソン病)を治療する又は前記病気の発生率を減少させる方法であって、患者にウリジン又はそのソースを投与するステップを含む方法を提供する。また、本発明は、パーキンソン病を治療する又はパーキンソン病の発生率を減少させるための組成物であって、ウリジン、ウリジン1リン酸、又はそのソースを含有する組成物を提供する。
【0008】
ある実施形態では、本発明は、神経細胞からのドーパミン放出を促進又は増大させる方法であって、前記神経細胞にウリジン又はそのソースを接触させるステップを含み、前記接触は前記神経細胞からのドーパミン放出を促進又は増大させ、それによって、前記神経細胞からのドーパミン放出を促進又は増大させるようにした方法を提供する。
【0009】
他の実施形態では、本発明は、パーキンソン病の治療方法であって、患者にウリジン又はそのソースを投与するステップを含み、前記ウリジン又はそのソースの投与は前記患者の脳内における神経細胞のドーパミン濃度を促進又は増大させ、それによって、パーキンソン病を治療するようにした方法を提供する。
【0010】
他の実施形態では、本発明は、パーキンソン病の発生率を減少させる方法であって、患者にウリジン又はそのソースを投与するステップを含み、前記ウリジン又はそのソースの投与は前記患者の脳内における神経細胞のドーパミン濃度を促進又は増大させ、それによって、パーキンソン病の発生率を減少させるようにした方法を提供する。
【0011】
他の実施形態では、本発明は、パーキンソン病を治療する又はパーキンソン病の発生率を減少させるための組成物であって、神経細胞からのドーパミン放出を促進又は増大させるのに十分な量のウリジン又はそのソースを含有する組成物を提供する。
【図面の簡単な説明】
【0012】
【図1】ウリジン投与ラット(四角の内側)及び対照ラット(四角の外側)の脳内のカリウムによる刺激に対応しての、脱分極前、脱分極中又は脱分極後における、UMP投与のドーパミン、5−HT、及びドーパミン代謝産物の放出に対しての効果を示す図である。DOPAC(A)、ドーパミン(B)、5−HAA(C)、HVA(D)、及び5−HT(E)が示されている。エラーバーは、反復刺激の違いを示している。
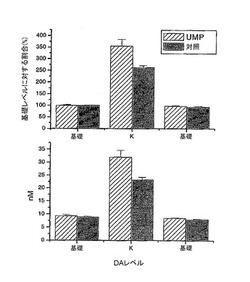
【図2】ウリジン投与ラット及び対照ラットにおけるDA放出の平均値を示しており(各グループ6匹である)、基準値放出(A)基準レベルの増大又はドーパミン全体濃度(B)を表している。ドーパミン放出は、放出前、放出中(K)、及びカリウムによる局所脱分極後に測定される。
【発明を実施するための形態】
【0013】
本発明は、ドーパミン及び他の神経伝達物質の分泌を増加させる方法、及び、ドーパミン及び他の神経伝達物質の減少を伴う病気(例えば、パーキンソン病)を治療する又は前記病気の発生率を減少させる方法であって、患者にウリジン又はそのソースを投与するステップを含む方法を提供する。また、本発明は、パーキンソン病を治療する又はパーキンソン病の発生率を減少させるための組成物であって、ウリジン、ウリジン1リン酸、又はそのソースを含有する組成物を提供する。
【0014】
ある実施形態では、本発明は、神経細胞からのドーパミン放出を促進又は増大させる方法であって、前記神経細胞にウリジン又はそのソースを接触させるステップを含み、前記接触は前記神経細胞からのドーパミン放出を促進又は増大させ、それによって、前記神経細胞からのドーパミン放出を促進又は増大させるようにした方法を提供する。
【0015】
他の実施形態では、本発明は、パーキンソン病の治療方法であって、患者にウリジン又はそのソースを投与するステップを含み、前記ウリジン又はそのソースの投与は前記患者の脳内における神経細胞のドーパミン濃度を促進又は増大させ、それによって、パーキンソン病を治療するようにした方法を提供する。
【0016】
他の実施形態では、本発明は、パーキンソン病の発生率を減少させる方法であって、患者にウリジン又はそのソースを投与するステップを含み、前記ウリジン又はそのソースの投与は前記患者の脳内における神経細胞のドーパミン濃度を促進又は増大させ、それによって、パーキンソン病の発生率を減少させるようにした方法を提供する。
【0017】
ウリジン又はウリジンソースは、ある実施形態では、神経細胞のドーパミン、5−HT、又はドーパミン代謝産物の濃度を促進又は増大させるのに十分な量で投与される。
【0018】
他の実施形態では、本発明に係る方法は、神経細胞からの5−HTの放出を促進又は増大させるのに利用される。他の実施形態では、本発明に係る方法は、神経細胞からのセロトニンの放出を促進又は増大させるのに利用される。他の実施形態では、本発明に係る方法は、神経細胞からのアセチルコリンの放出を促進又は増大させるのに利用される。他の実施形態では、本発明に係る方法は、神経細胞からのGABAの放出を促進又は増大させるのに利用される。他の実施形態では、本発明に係る方法は、神経細胞からのグルタミン酸塩の放出を促進又は増大させるのに利用される。他の実施形態では、本発明に係る方法は、神経細胞からのアデノシンの放出を促進又は増大させるのに利用される。各々の可能性は、本発明の別個の実施形態に相当する。
【0019】
他の実施形態では、上記した神経伝達物質又は代謝産物の1つの放出の促進及び増大は、基礎レベルに対しての、神経細胞によって放出される前記化合物の相対的増加を意味する。他の実施形態では、ドーパミン放出の促進及び増大は、濃度又は量の相対的増加を意味する。他の実施形態では、ドーパミン放出の促進及び増大は、黒質線条体ECF内に放出されるドーパミンの割合の増大を意味する。黒質(脳幹)の神経組織は、脳の線条体領域に突出する。
【0020】
本発明に示すように、ウリジン1リン酸を豊富に含む食餌を摂取したラットでは、ドーパミン放出は著しく促進された。また、UMPを含む食餌を摂取した場合も、セロトニン遊離が促進される。
【0021】
ある実施形態では、本発明に係る方法における、放出の「促進」又は「増大」は、神経細胞からシナプス末端への神経調節物質(5−ヒドロキシトリプタミン(セロトニン)、アセチルコリン、及びγアミノ酪酸(gamma−aminobutyric acid:GABA))の放出の促進又は増大を意味する。他の実施形態では、ニューロン膜を横切るCa2+濃度の変化の結果として、外因性の興奮性アミノ酸(例えば、グルタミン酸塩及びアスパラギン酸塩)が放出される。他の実施形態では、食餌から得られるウリジンは、シナプス末端と直接的にアクセスする外因性アミノ酸として、血流に入り、脳血管関門を通過し、UTPに変換される(その後、一部はCTPに変換される)。
【0022】
ある実施形態では、ここに例示するように、ドーパミン、5−HT、又はドーパミン代謝産物の放出は、右線条体に埋め込んだカニューレから採取したサンプルを微小透析(microdialysis)することによって、インビボで測定される。他の実施形態では、前記方法は、ドーパミンジヒドロキシフェニール酢酸(dopamine dihydroxyphenylacetic acid:DOPAC)、ホモバニリン酸(homovanillic acid:HVA)、セロトニン、又は5−ハイドロキシインドール酢酸(5−hydroxyindole acetic acid:5−HIAA)の放出を測定するのに利用される。他の実施形態では、サンプルは、高速液体クロマトグラフィー(High−Pressure Liquid Chromatography:HPLC)、又は当該技術分野では公知の他の方法によって分析される。他の実施形態では、神経伝達物質の濃度は、それぞれの酸化電位でのファラデー電流を、炭素繊維電極で測定することによって分析される。他の実施形態では、神経伝達物質の濃度は、当該技術分野では公知の他の方法によって分析される。各々の可能性は、本発明の別個の実施形態に相当する。
【0023】
他の実施形態では、本発明は、パーキンソン病を治療する又はパーキンソン病の発生率を減少させるための組成物であって、神経細胞からのドーパミン放出を促進又は増大させるのに十分な量のウリジン又はそのソースを含有する組成物を提供する。
【0024】
他の実施形態では、本発明に係る方法及び組成物は、パーキンソン病の症状を治療する又は発生率を低下させるのに利用される。ある実施形態では、パーキンソン病の症状の緩和は、適切なパーキンソン病統一スケール(United Parkinson's disease Rating Scale:UPDRS)レベルの基準からの変化を点数にすることにより評価される。前記変化は、レベルにおける放出と累積との間で示すことができ、パート1:精神機能/行動/気分、パート2:日常生活動作、パート3:運動能力検査、パート4:レボドパ合併症における変化を含んでいる。
【0025】
ある実施形態では、パーキンソン病の症状は、筋肉の硬直である。他の実施形態では、前記症状は、粗大振戦である。他の実施形態では、前記症状は、体位の変形である。他の実施形態では、前記症状は、筋強剛である。他の実施形態では、前記症状は、動作緩慢である。他の実施形態では、前記症状は、バランス障害である。他の実施形態では、前記症状は、当該技術分野では公知の、パーキンソン病の他の症状である。各々の可能性は、本発明の別個の実施形態に相当する。
【0026】
ある実施形態では、本発明に係る方法における「神経細胞に接触させる」は、神経細胞をウリジン又はウリジンソースに直接的にさらすことを意味する。他の実施形態では、本発明に係る方法における「神経細胞に接触させる」は、神経細胞をウリジン又はウリジンソースに間接的にさらすことを意味する。他の実施形態では、ウリジン又はウリジンソースとの接触は、例えば食餌又は静脈注射による、神経細胞への間接的な提供によって行われる。他の実施形態では、「神経細胞に接触させる」は、例えば注射などの当該技術分野では公知の他の手段によって行われる、神経細胞をウリジン又はウリジンソースと直接的に接触させることを含む。各々の可能性は、本発明の別個の実施形態に相当する。
【0027】
本発明に係る方法及び組成物のある実施形態では、ウリジン又はそのソース(例えばUMP)は、約550〜700mgの用量で患者に投与される。他の実施形態では、ウリジン又はそのソース(例えばUMP)は、約625mgの用量で患者に投与される。本発明に係る方法及び組成物のある実施形態では、ウリジン又はそのソース(例えばUMP)は、約100〜4000mg/日の用量で患者に投与される。他の実施形態では、ウリジン又はそのソース(例えばUMP)は、約200〜800mg/日の用量で患者に投与される。
【0028】
他の実施形態では、投与されたウリジン又はウリジンソースの用量は、「ウリジン当量(uridine equivalent)」という用語で表される。「ウリジン当量」は、ある実施形態では、代謝された際に、特定の量(例えば1モル)のウリジンを生成する化合物の量である。したがって、ある実施形態では、ウリジン又はウリジンソースは、約350〜500ミリグラムのウリジンに相当する用量で患者に投与される。
【0029】
本発明に係る方法の他の実施形態では、ウリジン又はウリジンソースは、約40〜4000mg/Kgの用量で患者に投与される。他の実施形態では、用量は、約40〜140mg/Kgである。他の実施形態では、用量は、約140〜240mg/Kgである。他の実施形態では、用量は、約240〜340mg/Kgである。他の実施形態では、用量は、約340〜440mg/Kgである。他の実施形態では、用量は、約440〜540mg/Kgである。他の実施形態では、用量は、約540〜640mg/Kgである。他の実施形態では、用量は、約640〜750mg/Kgである。他の実施形態では、用量は、約750〜1000mg/Kgである。他の実施形態では、用量は、約1000〜1250mg/Kgである。他の実施形態では、用量は、約1250〜1500mg/Kgである。他の実施形態では、用量は、約1500〜1750mg/Kgである。他の実施形態では、用量は、約1750〜2000mg/Kgである。他の実施形態では、用量は、約2000〜2500mg/Kgである。他の実施形態では、用量は、約2500〜3000mg/Kgである。他の実施形態では、用量は、約3000〜4000mg/Kgである。
【0030】
他の実施形態では、ウリジン又はウリジンソースは、1〜300グラムの1日量で患者に投与される。他の実施形態では、1日量は、1〜25グラムである。他の実施形態では、1日量は、25〜50グラムである。他の実施形態では、1日量は、25〜100グラムである。他の実施形態では、1日量は、25〜75グラムである。他の実施形態では、1日量は、50〜100グラムである。他の実施形態では、1日量は、100〜150グラムである。他の実施形態では、1日量は、50〜150グラムである。他の実施形態では、1日量は、25〜150グラムである。他の実施形態では、1日量は、75〜150グラムである。他の実施形態では、1日量は、150〜200グラムである。他の実施形態では、1日量は、125〜200グラムである。他の実施形態では、1日量は、125〜250グラムである。他の実施形態では、1日量は、200〜250グラムである。他の実施形態では、1日量は、250〜300グラムである。上記の1日量の各々の可能性は、本発明の別個の実施形態に相当する。
【0031】
ある実施形態では、本発明は、ドーパミン濃度を増加させることによって緩和される疾患及び病態を治療又は予防する方法であって、患者にウリジン又はそのソースを含む組成物を投与するステップを含み、前記ウリジン又はそのソースの投与は前記患者のドーパミン放出レベルを促進又は増大させ、それによって患者の神経系疾患を治療又は予防するようにした方法を提供する。ある実施形態では、神経細胞のドーパミン放出の促進又は増大は、疾患及び病態の症状を緩和する。
【0032】
ある実施形態では、前記疾患又は病態は、神経変性疾患である。ある実施形態では、前記疾患又は病態は、神経系疾患である。他の実施形態では、前記疾患又は病態は、アルツハイマー病(Alzheimer’s Disease:AD)である。他の実施形態では、前記疾患又は病態はレビー小体型痴呆(Dementia With Lewy Bodies:DLB)である。他の実施形態では、前記疾患又は病態は、多発梗塞性痴呆である。他の実施形態では、前記疾患又は病態は、注意欠陥過活動性障害(Attention Deficit Hyperactivity Disorder:ADHD)である。他の実施形態では、前記疾患又は病態は、脚不穏症(Restless Legs:RL)である。他の実施形態では、前記疾患又は病態は、加齢に伴う震えである。他の実施形態では、前記疾患又は病態は、統合失調症である。他の実施形態では、前記疾患又は病態は、ナルコレプシーにおける睡眠障害である。
【0033】
他の実施形態では、前記疾患又は病態は、ナルコプレシーである。他の実施形態では、前記疾患又は病態は、高齢又は血管疾患に関連する認知障害である。他の実施形態では、前記疾患又は病態は高プロラクチン血症である。ある実施形態では、前記疾患は慢性である。他の実施形態では、前記疾患は急性である。各々の可能性は、本発明の別個の実施形態に相当する。
【0034】
他の実施形態では、前記組成物、及び、本発明に係る方法での前記組成物の使用は、例えば、下垂体部腫瘍の患者、又はプロラクチンレベルを上昇させるための薬物を使用している患者における、過度に高濃度のプロラクチンホルモンを低減させるのに利用される。ドーパミンは、プロラクチン分泌の抑制剤として、下垂体に作用する。他の実施形態では、本発明に係る方法及び組成物は、高齢又は血管障害に関連する障害を有する人々において、認識能力又は動作開始を向上させるのに利用される。各々の可能性は、本発明の別個の実施形態に相当する。
【0035】
他の実施形態では、前記病気又は病態は、睡眠障害、高濃度のホルモンプロラクチン、又は認識能力の欠如をもたらす。他の実施形態では、前記睡眠障害、高濃度のホルモンプロラクチン、又は認識能力の欠如は、高齢又は血管疾患の結果として生じる。各々の可能性は、本発明の別個の実施形態に相当する。
【0036】
ある実施形態では、本発明に係る方法は、神経系疾患の症状を緩和するのに利用される。ある実施形態では、前記症状は震えである。ある実施形態では、前記症状は歩行不安定である。ある実施形態では、前記症状は視覚障害である。ある実施形態では、前記症状は嚥下困難である。ある実施形態では、前記症状は口の乾燥である。ある実施形態では、前記症状は尿の貯留である。ある実施形態では、前記症状は前屈姿勢である。ある実施形態では、前記症状は意識障害である。ある実施形態では、前記症状は情動不安である。ある実施形態では、前記症状は集中力欠如である。ある実施形態では、前記症状は活動過剰である。ある実施形態では、前記症状は憂うつである。ある実施形態では、前記症状は不眠症である。ある実施形態では、前記症状は幻覚である。ある実施形態では、前記症状はチックである。ある実施形態では、前記症状は発生障害である。ある実施形態では、前記症状はけいれんである。ある実施形態では、前記症状は失禁である。ある実施形態では、前記症状はインポテンスである。ある実施形態では、前記症状は勃起障害である。ある実施形態では、前記症状は協調性の欠如である。各々の可能性は、本発明の別個の実施形態に相当する。
【0037】
ある実施形態では、本発明に係る方法によって治療される神経系疾患は慢性疾患であり、ウリジン又はウリジンソースを含有する組成物の投与により、ドーパミン放出を促進又は増大させる。ある実施形態では、ウリジン又はウリジンソースを含有する組成物は、前記病気の全期間に渡って投与される。他の実施形態では、前記ウリジン又はウリジンソース、或いは本発明に係る組成物は、前記病気の症状期に投与される。他の実施形態では、前記ウリジン又はウリジンソースは、或いは本発明に係る組成物は、前記病気を予防するための前治療として投与される。他の実施形態では、前記ウリジン又はウリジンソース、或いは本発明に係る組成物は、前記病気の再発を予防するための後治療として投与される。各々の可能性は、本発明の別個の実施形態に相当する。
【0038】
他の実施形態では、本発明に係るウリジン又はウリジンソースは、周期的に投与される。ある実施形態では、「周期的に投与される」は、ウリジン又はウリジンソース、或いは本発明に係る組成物を一定の期間で投与するステップ、投与を中断するステップ、及び、ウリジン又はウリジンソース、或いは本発明に係る組成物を第2の期間で再投与するステップを意味する。他の実施形態では、前記ステップは、繰り返される、及び症状の重症度に依存している。本発明のこの形態によれば、及びある実施形態では、パーキンソン病統一スケール(United Parkinson’s disease Rating Scale:UPDRS)」における重症度IIIの症状は、本発明に係る方法による治療を必要とする。
【0039】
他の実施形態では、本発明に係る神経系疾患を治療又は予防する方法は、急性病を対象としたものである。ある実施形態では、ウリジン又はウリジンソースを含有する組成物は単回投与される。他の実施形態では、前記投与は前記病気の急性期の存続期間を対象としたものである。他の実施形態では、前記投与は、前記病気の存続期間、及び病気後の処置期間のためのものである(前記病気が急性であろうと慢性であろうと)。各々の可能性は、本発明の別個の実施形態に相当する。
【0040】
ある実施形態では、前記ウリジン又はウリジンソースの投与は、神経系疾患の再発を予防又は治療する役割を果たす。他の実施形態では、前記ウリジン又はウリジンソースの投与は、神経系疾患の発症を遅らせる役割を果たす。他の実施形態では、前記ウリジン又はウリジンソースの投与は、神経系疾患の重症度を低下させる役割を果たす。各々の可能性は、本発明の別個の実施形態に相当する。
【0041】
他の実施形態では、本発明は、神経系疾患を治療するための組成物であって、神経細胞からのドーパミン放出を促進又は増大させるのに十分な量のウリジン又はウリジンソースを含有する組成物を提供する。当然のことながら、本発明に係る組成物のいずれかは、本発明に係る方法に使用することができる。
【0042】
本発明に係る方法の他の実施形態では、前記組成物は、約2〜12週間の期間で投与される。他の実施形態では、前記組成物は、約5〜7週間の期間で投与される。他の実施形態では、前記組成物は、約4〜9週間の期間で投与される。他の実施形態では、前記組成物は、約2〜12週間の期間で投与される。他の実施形態では、前記組成物は、約2〜3週間の期間で投与される。他の実施形態では、前記組成物は、約3〜4週間の期間で投与される。他の実施形態では、前記組成物は、約4〜5週間の期間で投与される。他の実施形態では、前記組成物は、約5〜6週間の期間で投与される。他の実施形態では、前記組成物は、約6〜7週間の期間で投与される。他の実施形態では、前記組成物は、約7〜8週間の期間で投与される。他の実施形態では、前記組成物は、約8〜9週間の期間で投与される。他の実施形態では、前記組成物は、約9〜10週間の期間で投与される。他の実施形態では、前記組成物は、約10〜12週間の期間で投与される。他の実施形態では、前記組成物は、約5〜7週間の期間で投与される。他の実施形態では、前記組成物の投与期間は、上記の組み合わせである。
【0043】
他の実施形態では、前記組成物は、栄養補給剤を含んでいる。ある実施形態では、前記組成物は、コリンソースを含んでいる。他の実施形態では、前記組成物は、ビタミンを含んでいる。他の実施形態では、前記組成物は、当該技術分野では公知の他の栄養補給剤を含んでいる。各々の可能性は、本発明の別個の実施形態に相当する。
【0044】
「ウリジンソース(uridine source)」、「コリンソース(choline source)」という用語は、ある実施形態では、体内で消化される、又はコリンを生成するための酵素反応によって変換される、食事由来の前駆物質を意味する。さまざまな他の実施形態では、「コリンソース」は、合成的に製造したコリン、食事由来の直接的に得られたコリン、又は酵素的に製造したコリン、或いはそれらの組み合わせであり、薬学的に許容される塩及びキレートを含有する。各々の可能性は、本発明の別個の実施形態に相当する。
【0045】
ある実施形態では、本発明に係る方法及び組成物のウリジンソースは、ウリジン1リン酸(uridine monophosphate:UMP)である。他の実施形態では、前記ウリジンソースは、ウリジン2リン酸(uridine diphosphate:UDP)である。他の実施形態では、前記ウリジンソースは、ウリジン三リン酸(uridine triphosphate:UTP)である。他の実施形態では、前記ウリジンソースは、ウラシルである。他の実施形態では、前記ウリジンソースは、UDP−グルコースである。他の実施形態では、前記ウリジンソースは、UDP−ガラクトースである。他の実施形態では、前記ウリジンソースは、UDP−グルクロン酸である。他の実施形態では、前記ウリジンソースは、5−ブロモ−2−デオキシ−ウリジン(BrdU)である。他の実施形態では、前記ウリジンソースは、ジヒドロウリジンである。他の実施形態では、前記ウリジンソースは、オロチジン−5´‐リン酸である。他の実施形態では、前記ウリジン又はウリジンソースは、様々なソースから精製、変換又は合成される。他の実施形態では、ウリジンソースは、当該技術分野では公知の他のウリジンソースである。各々の可能性は、本発明の別個の実施形態に相当する。
【0046】
様々な実施形態では、本発明に係る方法及び組成物のコリンソースは、レシチン、ホスファチジルコリン、アセチルコリン、アルファ・グリセロホスホリルコリン、又はシチコリンである。ある実施形態では、前記シチコリンは、シチジン−5´−ジホスホコリンである。各々の可能性は、本発明の別個の実施形態に相当する。
【0047】
他の実施形態では、前記組成物は、ビタミン又はマイクロ素子を含有する。様々な実施形態では、前記ビタミンは、チアミン(Bl)、リボフラビン(B2)、ナイアシン(B3)、パントテン酸(B5)、ピリドキシン(B6)、コバラミン(B12)、葉酸、レチノール(A)、トコフェロール(E)、アスコルビン酸(C)、カルシフェロール(D)、又はフィロキノン(K1)である。他の実施形態では、前記マイクロ素子は、亜鉛(Zinc)、鉄、銅、マンガン、カルシウム、コバルト、リン、ヨウ素、マグネシウム、セレン、クロム、モリブデン、ホウ素、ニッケル、又はバナジウムである。他の実施形態では、前記組成物は、上記したビタミンの1つの薬学的に許容されるキレートを含有する。各々の可能性は、本発明の別個の実施形態に相当する。
【0048】
他の実施形態では、前記組成物は、抗酸化物質、繊維、ハーブ(例えば、イチョウ、朝鮮人参)、又は他の栄養補給剤をさらに含有し得る。1つ又はいくつかの成分の選択は、製剤設計、消費者、及びエンドユーザーの嗜好の問題である。本発明に係る栄養補給剤に添加されるこれらの成分の量は当業者には公知であり、子供及び大人に投与可能な添加量のガイドラインは、RDA及び食事摂取基準(Dietary Reference Intake:DRI)により提供されている。
【0049】
当然のことながら、本発明に係る方法で使用する組成物は、ここに列挙した任意の成分の、任意の組み合わせを含有することができる。各々の可能性は、本発明の別個の実施形態に相当する。
【0050】
他の実施形態では、前記組成物は、タンパク質源を含む。ある実施形態では、タンパク質としては、乳漿タンパク質、乳漿タンパク質濃縮物、乳漿粉末、卵、大豆タンパク質、大豆タンパク質分離物、カゼイン塩(例えば、カゼイン酸ナトリウム、カゼイン酸カルシウム・ナトリウム、カゼイン酸カルシウム、又はカゼイン酸カリウム)、動物性タンパク質、植物性タンパク質、又はそれらの混合物がある。
【0051】
他の実施形態では、前記栄養製剤は、人間又は動物の消化に適した任意の形態を取り得る。他の実施形態では、前記組成物は、人間の食用又は動物の飼料用の液体中に、懸濁可能、分散可能、又は乳化可能な粉末状混合物である。前記液体は、ある実施形態では、例えば、水、コーヒ、お茶、又はジュースなどの水を含んでいる液体である。そのような目的のために、前記組成物は、ある実施形態では、栄養必要量の一部又は全部を所定の期間覆うためのパッケージの中にパックされている。他の実施形態では、本発明は、栄養補助食品の形態の栄養製剤を提供する。
【0052】
他の実施形態では、前記栄養製剤は、機能性食品又は飲料である。すなわち、医療効果又は薬学的効果をもたらすために本発明に係る組成物が追加された、容易に得られる、食用又は飲用に適する物資である。したがって、本発明は、機能性食品の成分としての使用される、本発明に係る組成物を提供する。機能性食品及び飲料は、ある実施形態では、日常用品(例えば、ヨーグルト及びヨーグルト・アイスクリーム)、ジュース(オレンジジュース又はトマトジュースなど)、市販されている飲用の液体、スプレッド製品(例えば、マーガリン、植物又はプラント抽出油)、穀物製品(例えば、一般的な朝食用シリアル製品)、栄養バー、ビスケット、パン、スープ(トマトスープなど)、肉製品(ハンバーガーなど)、肉代用製品、及び植物製品から成る群より選択される。他の実施形態では、本発明に係る栄養製剤は、既製の液体の形態、粉末状の形態、トローチの形態、又は固形組成(栄養バー、フルーツバー、クッキー、ケーキ、パン、又はマフィン)の形態であり得る。各々の可能性は、本発明の別個の実施形態に相当する。
【0053】
他の実施形態では、前記組成物は、即時放出用に作成される。他の実施形態では、前記組成物は、制御又は持続放出用に作成される。各々の可能性は、本発明の別個の実施形態に相当する。
【0054】
「制御放出」という用語は、様々な実施形態では、摂取又は放出が遅延、パルス又は持続される製剤を意味する。他の実施形態では、制御放出組成物は、移植又はマイクロカプセル化送達システムを含む。他の実施形態では、エチレン酢酸ビニール、ポリ酸無水物、ポリグリコール酸、コラーゲン、ポリオルトエステル、又はポリ乳酸などの、生分解性又は生体適合性ポリマーが、そのような製剤に使用される。そのような製剤の作成方法は、当該技術分野では公知である。各々の可能性は、本発明の別個の実施形態に相当する。
【0055】
他の実施形態では、「持続放出」という用語は、前記組成物を所定の期間(少なくとも0.0005〜21日、他の実施形態では、少なくとも1〜120日)放出するようにデザインされた投与形態を意味する。長期間に渡る放出も、本発明に係る投与形態では、「持続放出」だと見なされる。全身投与のための持続放出形態も、局所投与のための場合と同様に、本発明の実施に用いることができると考えられる。各々の可能性は、本発明の別個の実施形態に相当する。
【0056】
他の実施形態では、前記組成物は、さらに、繊維源、安定剤、乳化剤、香味料、又はそれらの組み合わせ含む。他の実施形態では、前記繊維源は、高メトキシルペクチン、低メトキシルペクチン、メラニン、リグニン、セルロース、ヘミセルロース、ルテイン、又はそれらの組み合わせである。
【0057】
他の実施形態では、前記安定剤は、ラクトース、微結晶性セルロース、ヒドロキシメチル・セルロース、でんぷん、もちトウモロコシ(waxy maize)、キサンタン、カラギナン、ペクチン、グアー、アラビアゴム、こんにゃく、トラガカント・ゴム、アルギン酸プロピレングリコール、又はそれらの組み合わせである。
【0058】
他の実施形態では、乳化剤は、レシチン、ステアロイル乳酸ナトリウム(sodium stearoyl lactylate:ssl)、ソルビタン脂肪酸エステル、ポリオキシエチレン・ソルビタン脂肪酸エステル、モノグリセリル、ジグリセリル、ポリオキシエチレン脂肪酸エステル、ポリオキシエチレン・アルコール、卵黄、酵素調整卵黄、又はそれらの組み合わせである。
【0059】
他の実施形態では、香味料、着色剤、香辛料、ナッツ又はそれらの組み合わせが、生成物に組み込まれる。香味料としては、フレーバー抽出物、精油、チョコレート香味料(例えば、カフェインを含まないココア或いはチョコレートや、人工チョコレート(イナゴマメなど))、ピーナッツバター香味料、クッキーの小片、クリスプライス(crisp rice)、バニラ、又はその他の市販の香味料を用いることができる。香味料は、ミックストコフェロール(mixed tocopherol)で保護することができる。使用可能な香味料の例としては、純粋アニス抽出物、イミテーション・バナナ抽出物、イミテーション・サクランボ抽出物、チョコレート抽出物、純粋レモン抽出物、純粋オレンジ抽出物、純粋ペパーミント抽出物、イミテーション・ラム抽出物、イミテーション・イチゴ抽出物、純粋バニラ抽出物、精油(例えば、香油、ベイ油、ベルガモット油、セダー油、サクランボ油、くるみ油、桂皮油、丁子油、又はペパーミント油)、ピーナッツバター、チョコレート香味料、バニラクッキークラム、バタースコッチ、及びタフィーなどがある(ただし、これらに限定されるものではない)。他の実施形態では、前記組成物は、ベリー又は他の果実フレーバーを含む。他の実施形態では、前記組成物をバーとして作成する場合は、前記組成物は、例えばヨーグルトによってさらにコーティングされる。
【0060】
他の実施形態では、前記組成物は、人口甘味料を含む。ある実施形態では、前記人口甘味料は、サッカリド、チクロ、アスパルタミン、アスパルテーム、アセスルファムK、ソルビトール、又はそれらの組み合わせである。
【0061】
他の実施形態では、前記組成物は、保存料を含む。ある実施形態では、前記保存料は、ソルビン酸カリウム、ソルビン酸ナトリウム、安息香酸カリウム、安息香酸ナトリウム、EDTAカルシウム2ナトリウムである。
【0062】
本発明に係る方法の他の実施形態では、前記組成物は、経口投与される。他の実施形態では、前記組成物は、経直腸、局所的、口腔(例えば舌下)、鼻腔内、エアロゾル化によって、又は非経口(例えば、皮下、筋肉内、皮内、経皮、又は静脈内)投与される。各々の可能性は、本発明の別個の実施形態に相当する。
【0063】
本発明の他の実施形態では、ウリジンを含有している前記組成物は、錠剤、カプセル、ジェルキャップ、懸濁液、乳濁液、パッチ、軟膏、注射剤の形態、又は当該技術分野では公知の他の送達手段である。ある実施形態では、前記組成物は、ガム、キャンデー、飲料、冷凍の砂糖菓子、又はバーなどの食品の形態を取ることができる。前記組成物は、1日に1回又は複数回の投与用に製剤することができる。
【0064】
上記の各添加物、賦形剤などは、本発明の別個の実施形態に相当する。
【0065】
他の実施形態では、本発明に係る方法は、パーキンソン病治療薬の投与をさらに含む。ある実施形態では、追加される薬剤はレボドパである。他の実施形態では、追加される薬剤はカルビドパである。他の実施形態では、追加される薬剤は塩酸プラミペキソールである。他の実施形態では、追加される薬剤は塩酸ロピニロールである。他の実施形態では、追加される薬剤はトルカポン・ブロモクリプチンである。他の実施形態では、追加される薬剤はペルゴリドである。他の実施形態では、追加される薬剤は塩酸セレギリンである。他の実施形態では、追加される薬剤はアポモルヒネである。他の実施形態では、追加される薬剤は、当該技術分野では公知の他のパーキンソン病治療薬である。各々の可能性は、本発明の別個の実施形態に相当する。
【0066】
他の実施形態では、本発明に係る方法は、パーキンソン病治療法の実施をさらに含む。ある実施形態では、前記パーキンソン病治療法は、「Activa Tremor Control Therapy」である。ある実施形態では、前記パーキンソン病治療法は、ブタ胎児のドーパミン作動性神経細胞又はセルトリ細胞の移植である。他の実施形態では、前記パーキンソン病治療法は、同種ヒト網膜色素上皮細胞の移植である。他の実施形態では、前記パーキンソン病治療法は、当該技術分野では公知の他の治療法である。各々の可能性は、本発明の別個の実施形態に相当する。
【実施例】
【0067】
神経細胞の脱分極中又は脱分極後における、経口投与されたUMPが神経伝達物質の放出に及ぼす影響。
【0068】
<材料及び方法>
【0069】
(ラット)
更年期モデルの飼育ラットに、ウリジン5´−モノリン酸(uridine5’−monophosphate:UMP)(2.5%,w/w)を最終濃度では500mg/kg/日で追加した又は追加しなかった通常の食餌(Harlan Tech Lad、Madison、WI)を、6週間に渡って摂取させた。
【0070】
(微小透析)
対照ラット及び治療したラットの右線条体に直接的に埋め込んだカニューレを用いて、微小透析を行なった。カニューレは1日目に埋め込み、サンプルは3日目及び4日目に採取した。微小透析液(22.5マイクロリットル。15分以上採取した)について、ドーパミン(dopamine:DA)、3,4−ジヒドロキシフェニール酢酸(3、4−dihydroxyphenylacetic acid:DOPAC)、ホモバニリン酸(homovanillic acid:HVA)、5−ヒドロキシトリプタミン(5−hydroxy−tryptamine:5−HT)、及び5−ハイドロキシインドール酢酸(5−hydroxyindole acetic acid:5−HIAA)の分析を行った。100nmの塩化カリウム(KCl)溶液の局所適用による神経細胞膜の脱分極前及び脱分極後に採取したサンプルに対して、神経伝達物質濃度の実時間測定を行った。その後、動物を屠殺し、線条体、海馬及び側頭皮質について、DA、DOPAC、HVA、5HT、5HIAA、DNA、タンパク質、及びホスファチジルコリン(phosphatidyl choline:PC)の成分を分析した。
【0071】
(ドーパミン及び代謝産物の分析)
ESA微小透析細胞(ESA Microdialysis Cell、model 5014B、ESA、North Chelmsford、MA)、及びESA Coulochem II 5100A 検出器(El=−175mV;E2=+325mV;Eguard=350mV)を使用して、透析液及び組織サンプル中のDA及び代謝産物を測定した。移動相(MD−TM、ESA)は、75mM NaH2PO4、1.7mM 1−オクタンスルホン酸、100?l/L トリエチルアミン、25 ?MEDTA、10% アセトニトリル、pH 3.0から成る。流速は、0.4mL/分であった。カラム(ESA MD 150、3x150mm、3?m、120Å)は、40℃のカラムオーブンに置かれた。サンプルは、Alltech580オ−トサンプラ〔Alltech、Deerfield、IL〕によってHPLCに注入され、分析中は冷却トレイによって4℃に保たれた。データは、Alltech AllChrom(登録商標)データシステムによって採取され、AllChrom plus(登録商標)ソフトウエアによって分析された。1回の注入によって、透析液中の低いDA濃度及び高い代謝産物濃度データを取ることを可能にすべく、サンプルの分離中及び検出中に検出利得(detection gain)を変更可能な時系列プログラムを使用した。
【0072】
(神経伝達物質濃度の実時間測定)
カニューレを通じて挿入された炭素繊維電極を使用して、各々の酸化電位でのファラデー電流を測定することにより、神経伝達物質濃度を実時間で分析した。
【0073】
<結果>
【0074】
ドーパミン放出がウリジン投与の影響を受けるがどうかを判断するために、神経細胞の脱分極中又は脱分極後の両方における、食餌中にUMPが追加された動物についてのドーパミン生成を分析した。図1A〜Eは、反復刺激を与えた、1匹のウリジン投与ラットと、1匹の対照ラットの放出特性を示す。UMP投与は、脱分極中又は脱分極後の両方において、DA(B)及び5−HT(E)の放出を促進した。DOPAC(A)、5−HIAA(C)、及びHVA(D)は、UMP摂取動物では低い基準レベルを示し、刺激中では見られないが、刺激後は、DA及び5−HTよりも小さい幅ではあるが、放出は増大する。UMPは、線条体におけるDA及び5−HTの全体レベルに対しては影響を与えないが、線条体及び線条体細胞外液〔extracellular fluid:ECF〕におけるDOPAC、5−HIAA、及びHVAの線条体の全体レベルはわずかに低下する。
【0075】
図2は、6匹のウリジン投与ラットと、6匹の対照ラットにおけるDA放出の平均値を示しており、DAの総量(下側の図面)と、基礎レベルのパーセンテージ(上側の図面)との両方を示している。
【0076】
結論として、UMP投与は、脱分極中における線条体からのDA及び5−HT放出量を促進し、DA代謝産物の線条体の全体レベルを減少させる。したがって、ウリジン及びその代謝産物又は誘導体の投与は、DA放出の減少を特徴とする病気(例えば、パーキンソン病)を治療するのに効果的な方法である。
【技術分野】
【0001】
本発明は、ドーパミン及び他の神経伝達物質の分泌を増加させる方法、及び、ドーパミン及び他の神経伝達物質の減少を伴う病気(例えば、パーキンソン病)を治療する又は前記病気の発生率を減少させる方法であって、患者にウリジン又はそのソースを投与するステップを含む方法を提供する。また、本発明は、パーキンソン病を治療する又はパーキンソン病の発生率を減少させるための組成物であって、ウリジン、ウリジン1リン酸、又はそのソースを含有する組成物を提供する。
【0002】
本発明は、米国国立衛生研究所により認可された認可番号MH28783の下で米国政府の支援によって、全部又は一部が成された。米国政府は、本発明に対する一定の権利を有し得る。
【0003】
(関連出願の相互参照)
本出願は、2004年5月13日に出願された米国特許仮出願第60/570、444号(その全ては、この参照により本発明に含まれるものとする)の優先権を主張するものである。
【背景技術】
【0004】
パーキンソン病(Parkinson's disease:PD)は、高齢者によく起こる、身体に障害を引き起こす病気であり、米国における60歳以上の人口の約1%に影響を及ぼす。パーキンソン病は、線条体からのドーパミン放出の減少と関連しており、脳内におけるドーパミン/アセチルコリンの深刻な不均衡をもたらす。ドーパミンは、脳内で、神経細胞のシナプス間隙における神経伝達物質として作用し、細胞間の信号伝達を担う。
【0005】
パーキンソン病は、いくつかある症状の中で特に、筋肉の硬直、粗大振戦、及び体位の変形を特徴とする進行性変性疾患である。最も一般的な治療方法は、生じた化学的不均衡を、アセチルコリン生成を減少させることにより及び/又はドーパミン濃度を増加させることにより改善することを試みるが、生じた新しいバランスの結果による副作用が伴う。その内のあるPDの治療方法は、ドーパミン放出を促進するためのドーパミン前駆体(例えば、L−DOPA)の投与と、それによる後シナプス受容体の刺激を含む。しかしながら、L−DOPAは体内での半減期が短いので、結局はL−DOPAの作用は散発的及び予測不可能となるため、運動機能、運動障害及び精神的副作用にばらつきをもたらす。
【0006】
したがって、ドーパミン放出の減少を特徴とする病態の治療法が求められている。また、症状の発現を遅延させる、及び/又は、前記病気の病徴発現を緩和する或いは遅延させる治療法が望まれている。
【発明の概要】
【課題を解決するための手段】
【0007】
本発明は、ドーパミン及び他の神経伝達物質の分泌を増加させる方法、及び、ドーパミン及び他の神経伝達物質の減少を伴う病気(例えば、パーキンソン病)を治療する又は前記病気の発生率を減少させる方法であって、患者にウリジン又はそのソースを投与するステップを含む方法を提供する。また、本発明は、パーキンソン病を治療する又はパーキンソン病の発生率を減少させるための組成物であって、ウリジン、ウリジン1リン酸、又はそのソースを含有する組成物を提供する。
【0008】
ある実施形態では、本発明は、神経細胞からのドーパミン放出を促進又は増大させる方法であって、前記神経細胞にウリジン又はそのソースを接触させるステップを含み、前記接触は前記神経細胞からのドーパミン放出を促進又は増大させ、それによって、前記神経細胞からのドーパミン放出を促進又は増大させるようにした方法を提供する。
【0009】
他の実施形態では、本発明は、パーキンソン病の治療方法であって、患者にウリジン又はそのソースを投与するステップを含み、前記ウリジン又はそのソースの投与は前記患者の脳内における神経細胞のドーパミン濃度を促進又は増大させ、それによって、パーキンソン病を治療するようにした方法を提供する。
【0010】
他の実施形態では、本発明は、パーキンソン病の発生率を減少させる方法であって、患者にウリジン又はそのソースを投与するステップを含み、前記ウリジン又はそのソースの投与は前記患者の脳内における神経細胞のドーパミン濃度を促進又は増大させ、それによって、パーキンソン病の発生率を減少させるようにした方法を提供する。
【0011】
他の実施形態では、本発明は、パーキンソン病を治療する又はパーキンソン病の発生率を減少させるための組成物であって、神経細胞からのドーパミン放出を促進又は増大させるのに十分な量のウリジン又はそのソースを含有する組成物を提供する。
【図面の簡単な説明】
【0012】
【図1】ウリジン投与ラット(四角の内側)及び対照ラット(四角の外側)の脳内のカリウムによる刺激に対応しての、脱分極前、脱分極中又は脱分極後における、UMP投与のドーパミン、5−HT、及びドーパミン代謝産物の放出に対しての効果を示す図である。DOPAC(A)、ドーパミン(B)、5−HAA(C)、HVA(D)、及び5−HT(E)が示されている。エラーバーは、反復刺激の違いを示している。
【図2】ウリジン投与ラット及び対照ラットにおけるDA放出の平均値を示しており(各グループ6匹である)、基準値放出(A)基準レベルの増大又はドーパミン全体濃度(B)を表している。ドーパミン放出は、放出前、放出中(K)、及びカリウムによる局所脱分極後に測定される。
【発明を実施するための形態】
【0013】
本発明は、ドーパミン及び他の神経伝達物質の分泌を増加させる方法、及び、ドーパミン及び他の神経伝達物質の減少を伴う病気(例えば、パーキンソン病)を治療する又は前記病気の発生率を減少させる方法であって、患者にウリジン又はそのソースを投与するステップを含む方法を提供する。また、本発明は、パーキンソン病を治療する又はパーキンソン病の発生率を減少させるための組成物であって、ウリジン、ウリジン1リン酸、又はそのソースを含有する組成物を提供する。
【0014】
ある実施形態では、本発明は、神経細胞からのドーパミン放出を促進又は増大させる方法であって、前記神経細胞にウリジン又はそのソースを接触させるステップを含み、前記接触は前記神経細胞からのドーパミン放出を促進又は増大させ、それによって、前記神経細胞からのドーパミン放出を促進又は増大させるようにした方法を提供する。
【0015】
他の実施形態では、本発明は、パーキンソン病の治療方法であって、患者にウリジン又はそのソースを投与するステップを含み、前記ウリジン又はそのソースの投与は前記患者の脳内における神経細胞のドーパミン濃度を促進又は増大させ、それによって、パーキンソン病を治療するようにした方法を提供する。
【0016】
他の実施形態では、本発明は、パーキンソン病の発生率を減少させる方法であって、患者にウリジン又はそのソースを投与するステップを含み、前記ウリジン又はそのソースの投与は前記患者の脳内における神経細胞のドーパミン濃度を促進又は増大させ、それによって、パーキンソン病の発生率を減少させるようにした方法を提供する。
【0017】
ウリジン又はウリジンソースは、ある実施形態では、神経細胞のドーパミン、5−HT、又はドーパミン代謝産物の濃度を促進又は増大させるのに十分な量で投与される。
【0018】
他の実施形態では、本発明に係る方法は、神経細胞からの5−HTの放出を促進又は増大させるのに利用される。他の実施形態では、本発明に係る方法は、神経細胞からのセロトニンの放出を促進又は増大させるのに利用される。他の実施形態では、本発明に係る方法は、神経細胞からのアセチルコリンの放出を促進又は増大させるのに利用される。他の実施形態では、本発明に係る方法は、神経細胞からのGABAの放出を促進又は増大させるのに利用される。他の実施形態では、本発明に係る方法は、神経細胞からのグルタミン酸塩の放出を促進又は増大させるのに利用される。他の実施形態では、本発明に係る方法は、神経細胞からのアデノシンの放出を促進又は増大させるのに利用される。各々の可能性は、本発明の別個の実施形態に相当する。
【0019】
他の実施形態では、上記した神経伝達物質又は代謝産物の1つの放出の促進及び増大は、基礎レベルに対しての、神経細胞によって放出される前記化合物の相対的増加を意味する。他の実施形態では、ドーパミン放出の促進及び増大は、濃度又は量の相対的増加を意味する。他の実施形態では、ドーパミン放出の促進及び増大は、黒質線条体ECF内に放出されるドーパミンの割合の増大を意味する。黒質(脳幹)の神経組織は、脳の線条体領域に突出する。
【0020】
本発明に示すように、ウリジン1リン酸を豊富に含む食餌を摂取したラットでは、ドーパミン放出は著しく促進された。また、UMPを含む食餌を摂取した場合も、セロトニン遊離が促進される。
【0021】
ある実施形態では、本発明に係る方法における、放出の「促進」又は「増大」は、神経細胞からシナプス末端への神経調節物質(5−ヒドロキシトリプタミン(セロトニン)、アセチルコリン、及びγアミノ酪酸(gamma−aminobutyric acid:GABA))の放出の促進又は増大を意味する。他の実施形態では、ニューロン膜を横切るCa2+濃度の変化の結果として、外因性の興奮性アミノ酸(例えば、グルタミン酸塩及びアスパラギン酸塩)が放出される。他の実施形態では、食餌から得られるウリジンは、シナプス末端と直接的にアクセスする外因性アミノ酸として、血流に入り、脳血管関門を通過し、UTPに変換される(その後、一部はCTPに変換される)。
【0022】
ある実施形態では、ここに例示するように、ドーパミン、5−HT、又はドーパミン代謝産物の放出は、右線条体に埋め込んだカニューレから採取したサンプルを微小透析(microdialysis)することによって、インビボで測定される。他の実施形態では、前記方法は、ドーパミンジヒドロキシフェニール酢酸(dopamine dihydroxyphenylacetic acid:DOPAC)、ホモバニリン酸(homovanillic acid:HVA)、セロトニン、又は5−ハイドロキシインドール酢酸(5−hydroxyindole acetic acid:5−HIAA)の放出を測定するのに利用される。他の実施形態では、サンプルは、高速液体クロマトグラフィー(High−Pressure Liquid Chromatography:HPLC)、又は当該技術分野では公知の他の方法によって分析される。他の実施形態では、神経伝達物質の濃度は、それぞれの酸化電位でのファラデー電流を、炭素繊維電極で測定することによって分析される。他の実施形態では、神経伝達物質の濃度は、当該技術分野では公知の他の方法によって分析される。各々の可能性は、本発明の別個の実施形態に相当する。
【0023】
他の実施形態では、本発明は、パーキンソン病を治療する又はパーキンソン病の発生率を減少させるための組成物であって、神経細胞からのドーパミン放出を促進又は増大させるのに十分な量のウリジン又はそのソースを含有する組成物を提供する。
【0024】
他の実施形態では、本発明に係る方法及び組成物は、パーキンソン病の症状を治療する又は発生率を低下させるのに利用される。ある実施形態では、パーキンソン病の症状の緩和は、適切なパーキンソン病統一スケール(United Parkinson's disease Rating Scale:UPDRS)レベルの基準からの変化を点数にすることにより評価される。前記変化は、レベルにおける放出と累積との間で示すことができ、パート1:精神機能/行動/気分、パート2:日常生活動作、パート3:運動能力検査、パート4:レボドパ合併症における変化を含んでいる。
【0025】
ある実施形態では、パーキンソン病の症状は、筋肉の硬直である。他の実施形態では、前記症状は、粗大振戦である。他の実施形態では、前記症状は、体位の変形である。他の実施形態では、前記症状は、筋強剛である。他の実施形態では、前記症状は、動作緩慢である。他の実施形態では、前記症状は、バランス障害である。他の実施形態では、前記症状は、当該技術分野では公知の、パーキンソン病の他の症状である。各々の可能性は、本発明の別個の実施形態に相当する。
【0026】
ある実施形態では、本発明に係る方法における「神経細胞に接触させる」は、神経細胞をウリジン又はウリジンソースに直接的にさらすことを意味する。他の実施形態では、本発明に係る方法における「神経細胞に接触させる」は、神経細胞をウリジン又はウリジンソースに間接的にさらすことを意味する。他の実施形態では、ウリジン又はウリジンソースとの接触は、例えば食餌又は静脈注射による、神経細胞への間接的な提供によって行われる。他の実施形態では、「神経細胞に接触させる」は、例えば注射などの当該技術分野では公知の他の手段によって行われる、神経細胞をウリジン又はウリジンソースと直接的に接触させることを含む。各々の可能性は、本発明の別個の実施形態に相当する。
【0027】
本発明に係る方法及び組成物のある実施形態では、ウリジン又はそのソース(例えばUMP)は、約550〜700mgの用量で患者に投与される。他の実施形態では、ウリジン又はそのソース(例えばUMP)は、約625mgの用量で患者に投与される。本発明に係る方法及び組成物のある実施形態では、ウリジン又はそのソース(例えばUMP)は、約100〜4000mg/日の用量で患者に投与される。他の実施形態では、ウリジン又はそのソース(例えばUMP)は、約200〜800mg/日の用量で患者に投与される。
【0028】
他の実施形態では、投与されたウリジン又はウリジンソースの用量は、「ウリジン当量(uridine equivalent)」という用語で表される。「ウリジン当量」は、ある実施形態では、代謝された際に、特定の量(例えば1モル)のウリジンを生成する化合物の量である。したがって、ある実施形態では、ウリジン又はウリジンソースは、約350〜500ミリグラムのウリジンに相当する用量で患者に投与される。
【0029】
本発明に係る方法の他の実施形態では、ウリジン又はウリジンソースは、約40〜4000mg/Kgの用量で患者に投与される。他の実施形態では、用量は、約40〜140mg/Kgである。他の実施形態では、用量は、約140〜240mg/Kgである。他の実施形態では、用量は、約240〜340mg/Kgである。他の実施形態では、用量は、約340〜440mg/Kgである。他の実施形態では、用量は、約440〜540mg/Kgである。他の実施形態では、用量は、約540〜640mg/Kgである。他の実施形態では、用量は、約640〜750mg/Kgである。他の実施形態では、用量は、約750〜1000mg/Kgである。他の実施形態では、用量は、約1000〜1250mg/Kgである。他の実施形態では、用量は、約1250〜1500mg/Kgである。他の実施形態では、用量は、約1500〜1750mg/Kgである。他の実施形態では、用量は、約1750〜2000mg/Kgである。他の実施形態では、用量は、約2000〜2500mg/Kgである。他の実施形態では、用量は、約2500〜3000mg/Kgである。他の実施形態では、用量は、約3000〜4000mg/Kgである。
【0030】
他の実施形態では、ウリジン又はウリジンソースは、1〜300グラムの1日量で患者に投与される。他の実施形態では、1日量は、1〜25グラムである。他の実施形態では、1日量は、25〜50グラムである。他の実施形態では、1日量は、25〜100グラムである。他の実施形態では、1日量は、25〜75グラムである。他の実施形態では、1日量は、50〜100グラムである。他の実施形態では、1日量は、100〜150グラムである。他の実施形態では、1日量は、50〜150グラムである。他の実施形態では、1日量は、25〜150グラムである。他の実施形態では、1日量は、75〜150グラムである。他の実施形態では、1日量は、150〜200グラムである。他の実施形態では、1日量は、125〜200グラムである。他の実施形態では、1日量は、125〜250グラムである。他の実施形態では、1日量は、200〜250グラムである。他の実施形態では、1日量は、250〜300グラムである。上記の1日量の各々の可能性は、本発明の別個の実施形態に相当する。
【0031】
ある実施形態では、本発明は、ドーパミン濃度を増加させることによって緩和される疾患及び病態を治療又は予防する方法であって、患者にウリジン又はそのソースを含む組成物を投与するステップを含み、前記ウリジン又はそのソースの投与は前記患者のドーパミン放出レベルを促進又は増大させ、それによって患者の神経系疾患を治療又は予防するようにした方法を提供する。ある実施形態では、神経細胞のドーパミン放出の促進又は増大は、疾患及び病態の症状を緩和する。
【0032】
ある実施形態では、前記疾患又は病態は、神経変性疾患である。ある実施形態では、前記疾患又は病態は、神経系疾患である。他の実施形態では、前記疾患又は病態は、アルツハイマー病(Alzheimer’s Disease:AD)である。他の実施形態では、前記疾患又は病態はレビー小体型痴呆(Dementia With Lewy Bodies:DLB)である。他の実施形態では、前記疾患又は病態は、多発梗塞性痴呆である。他の実施形態では、前記疾患又は病態は、注意欠陥過活動性障害(Attention Deficit Hyperactivity Disorder:ADHD)である。他の実施形態では、前記疾患又は病態は、脚不穏症(Restless Legs:RL)である。他の実施形態では、前記疾患又は病態は、加齢に伴う震えである。他の実施形態では、前記疾患又は病態は、統合失調症である。他の実施形態では、前記疾患又は病態は、ナルコレプシーにおける睡眠障害である。
【0033】
他の実施形態では、前記疾患又は病態は、ナルコプレシーである。他の実施形態では、前記疾患又は病態は、高齢又は血管疾患に関連する認知障害である。他の実施形態では、前記疾患又は病態は高プロラクチン血症である。ある実施形態では、前記疾患は慢性である。他の実施形態では、前記疾患は急性である。各々の可能性は、本発明の別個の実施形態に相当する。
【0034】
他の実施形態では、前記組成物、及び、本発明に係る方法での前記組成物の使用は、例えば、下垂体部腫瘍の患者、又はプロラクチンレベルを上昇させるための薬物を使用している患者における、過度に高濃度のプロラクチンホルモンを低減させるのに利用される。ドーパミンは、プロラクチン分泌の抑制剤として、下垂体に作用する。他の実施形態では、本発明に係る方法及び組成物は、高齢又は血管障害に関連する障害を有する人々において、認識能力又は動作開始を向上させるのに利用される。各々の可能性は、本発明の別個の実施形態に相当する。
【0035】
他の実施形態では、前記病気又は病態は、睡眠障害、高濃度のホルモンプロラクチン、又は認識能力の欠如をもたらす。他の実施形態では、前記睡眠障害、高濃度のホルモンプロラクチン、又は認識能力の欠如は、高齢又は血管疾患の結果として生じる。各々の可能性は、本発明の別個の実施形態に相当する。
【0036】
ある実施形態では、本発明に係る方法は、神経系疾患の症状を緩和するのに利用される。ある実施形態では、前記症状は震えである。ある実施形態では、前記症状は歩行不安定である。ある実施形態では、前記症状は視覚障害である。ある実施形態では、前記症状は嚥下困難である。ある実施形態では、前記症状は口の乾燥である。ある実施形態では、前記症状は尿の貯留である。ある実施形態では、前記症状は前屈姿勢である。ある実施形態では、前記症状は意識障害である。ある実施形態では、前記症状は情動不安である。ある実施形態では、前記症状は集中力欠如である。ある実施形態では、前記症状は活動過剰である。ある実施形態では、前記症状は憂うつである。ある実施形態では、前記症状は不眠症である。ある実施形態では、前記症状は幻覚である。ある実施形態では、前記症状はチックである。ある実施形態では、前記症状は発生障害である。ある実施形態では、前記症状はけいれんである。ある実施形態では、前記症状は失禁である。ある実施形態では、前記症状はインポテンスである。ある実施形態では、前記症状は勃起障害である。ある実施形態では、前記症状は協調性の欠如である。各々の可能性は、本発明の別個の実施形態に相当する。
【0037】
ある実施形態では、本発明に係る方法によって治療される神経系疾患は慢性疾患であり、ウリジン又はウリジンソースを含有する組成物の投与により、ドーパミン放出を促進又は増大させる。ある実施形態では、ウリジン又はウリジンソースを含有する組成物は、前記病気の全期間に渡って投与される。他の実施形態では、前記ウリジン又はウリジンソース、或いは本発明に係る組成物は、前記病気の症状期に投与される。他の実施形態では、前記ウリジン又はウリジンソースは、或いは本発明に係る組成物は、前記病気を予防するための前治療として投与される。他の実施形態では、前記ウリジン又はウリジンソース、或いは本発明に係る組成物は、前記病気の再発を予防するための後治療として投与される。各々の可能性は、本発明の別個の実施形態に相当する。
【0038】
他の実施形態では、本発明に係るウリジン又はウリジンソースは、周期的に投与される。ある実施形態では、「周期的に投与される」は、ウリジン又はウリジンソース、或いは本発明に係る組成物を一定の期間で投与するステップ、投与を中断するステップ、及び、ウリジン又はウリジンソース、或いは本発明に係る組成物を第2の期間で再投与するステップを意味する。他の実施形態では、前記ステップは、繰り返される、及び症状の重症度に依存している。本発明のこの形態によれば、及びある実施形態では、パーキンソン病統一スケール(United Parkinson’s disease Rating Scale:UPDRS)」における重症度IIIの症状は、本発明に係る方法による治療を必要とする。
【0039】
他の実施形態では、本発明に係る神経系疾患を治療又は予防する方法は、急性病を対象としたものである。ある実施形態では、ウリジン又はウリジンソースを含有する組成物は単回投与される。他の実施形態では、前記投与は前記病気の急性期の存続期間を対象としたものである。他の実施形態では、前記投与は、前記病気の存続期間、及び病気後の処置期間のためのものである(前記病気が急性であろうと慢性であろうと)。各々の可能性は、本発明の別個の実施形態に相当する。
【0040】
ある実施形態では、前記ウリジン又はウリジンソースの投与は、神経系疾患の再発を予防又は治療する役割を果たす。他の実施形態では、前記ウリジン又はウリジンソースの投与は、神経系疾患の発症を遅らせる役割を果たす。他の実施形態では、前記ウリジン又はウリジンソースの投与は、神経系疾患の重症度を低下させる役割を果たす。各々の可能性は、本発明の別個の実施形態に相当する。
【0041】
他の実施形態では、本発明は、神経系疾患を治療するための組成物であって、神経細胞からのドーパミン放出を促進又は増大させるのに十分な量のウリジン又はウリジンソースを含有する組成物を提供する。当然のことながら、本発明に係る組成物のいずれかは、本発明に係る方法に使用することができる。
【0042】
本発明に係る方法の他の実施形態では、前記組成物は、約2〜12週間の期間で投与される。他の実施形態では、前記組成物は、約5〜7週間の期間で投与される。他の実施形態では、前記組成物は、約4〜9週間の期間で投与される。他の実施形態では、前記組成物は、約2〜12週間の期間で投与される。他の実施形態では、前記組成物は、約2〜3週間の期間で投与される。他の実施形態では、前記組成物は、約3〜4週間の期間で投与される。他の実施形態では、前記組成物は、約4〜5週間の期間で投与される。他の実施形態では、前記組成物は、約5〜6週間の期間で投与される。他の実施形態では、前記組成物は、約6〜7週間の期間で投与される。他の実施形態では、前記組成物は、約7〜8週間の期間で投与される。他の実施形態では、前記組成物は、約8〜9週間の期間で投与される。他の実施形態では、前記組成物は、約9〜10週間の期間で投与される。他の実施形態では、前記組成物は、約10〜12週間の期間で投与される。他の実施形態では、前記組成物は、約5〜7週間の期間で投与される。他の実施形態では、前記組成物の投与期間は、上記の組み合わせである。
【0043】
他の実施形態では、前記組成物は、栄養補給剤を含んでいる。ある実施形態では、前記組成物は、コリンソースを含んでいる。他の実施形態では、前記組成物は、ビタミンを含んでいる。他の実施形態では、前記組成物は、当該技術分野では公知の他の栄養補給剤を含んでいる。各々の可能性は、本発明の別個の実施形態に相当する。
【0044】
「ウリジンソース(uridine source)」、「コリンソース(choline source)」という用語は、ある実施形態では、体内で消化される、又はコリンを生成するための酵素反応によって変換される、食事由来の前駆物質を意味する。さまざまな他の実施形態では、「コリンソース」は、合成的に製造したコリン、食事由来の直接的に得られたコリン、又は酵素的に製造したコリン、或いはそれらの組み合わせであり、薬学的に許容される塩及びキレートを含有する。各々の可能性は、本発明の別個の実施形態に相当する。
【0045】
ある実施形態では、本発明に係る方法及び組成物のウリジンソースは、ウリジン1リン酸(uridine monophosphate:UMP)である。他の実施形態では、前記ウリジンソースは、ウリジン2リン酸(uridine diphosphate:UDP)である。他の実施形態では、前記ウリジンソースは、ウリジン三リン酸(uridine triphosphate:UTP)である。他の実施形態では、前記ウリジンソースは、ウラシルである。他の実施形態では、前記ウリジンソースは、UDP−グルコースである。他の実施形態では、前記ウリジンソースは、UDP−ガラクトースである。他の実施形態では、前記ウリジンソースは、UDP−グルクロン酸である。他の実施形態では、前記ウリジンソースは、5−ブロモ−2−デオキシ−ウリジン(BrdU)である。他の実施形態では、前記ウリジンソースは、ジヒドロウリジンである。他の実施形態では、前記ウリジンソースは、オロチジン−5´‐リン酸である。他の実施形態では、前記ウリジン又はウリジンソースは、様々なソースから精製、変換又は合成される。他の実施形態では、ウリジンソースは、当該技術分野では公知の他のウリジンソースである。各々の可能性は、本発明の別個の実施形態に相当する。
【0046】
様々な実施形態では、本発明に係る方法及び組成物のコリンソースは、レシチン、ホスファチジルコリン、アセチルコリン、アルファ・グリセロホスホリルコリン、又はシチコリンである。ある実施形態では、前記シチコリンは、シチジン−5´−ジホスホコリンである。各々の可能性は、本発明の別個の実施形態に相当する。
【0047】
他の実施形態では、前記組成物は、ビタミン又はマイクロ素子を含有する。様々な実施形態では、前記ビタミンは、チアミン(Bl)、リボフラビン(B2)、ナイアシン(B3)、パントテン酸(B5)、ピリドキシン(B6)、コバラミン(B12)、葉酸、レチノール(A)、トコフェロール(E)、アスコルビン酸(C)、カルシフェロール(D)、又はフィロキノン(K1)である。他の実施形態では、前記マイクロ素子は、亜鉛(Zinc)、鉄、銅、マンガン、カルシウム、コバルト、リン、ヨウ素、マグネシウム、セレン、クロム、モリブデン、ホウ素、ニッケル、又はバナジウムである。他の実施形態では、前記組成物は、上記したビタミンの1つの薬学的に許容されるキレートを含有する。各々の可能性は、本発明の別個の実施形態に相当する。
【0048】
他の実施形態では、前記組成物は、抗酸化物質、繊維、ハーブ(例えば、イチョウ、朝鮮人参)、又は他の栄養補給剤をさらに含有し得る。1つ又はいくつかの成分の選択は、製剤設計、消費者、及びエンドユーザーの嗜好の問題である。本発明に係る栄養補給剤に添加されるこれらの成分の量は当業者には公知であり、子供及び大人に投与可能な添加量のガイドラインは、RDA及び食事摂取基準(Dietary Reference Intake:DRI)により提供されている。
【0049】
当然のことながら、本発明に係る方法で使用する組成物は、ここに列挙した任意の成分の、任意の組み合わせを含有することができる。各々の可能性は、本発明の別個の実施形態に相当する。
【0050】
他の実施形態では、前記組成物は、タンパク質源を含む。ある実施形態では、タンパク質としては、乳漿タンパク質、乳漿タンパク質濃縮物、乳漿粉末、卵、大豆タンパク質、大豆タンパク質分離物、カゼイン塩(例えば、カゼイン酸ナトリウム、カゼイン酸カルシウム・ナトリウム、カゼイン酸カルシウム、又はカゼイン酸カリウム)、動物性タンパク質、植物性タンパク質、又はそれらの混合物がある。
【0051】
他の実施形態では、前記栄養製剤は、人間又は動物の消化に適した任意の形態を取り得る。他の実施形態では、前記組成物は、人間の食用又は動物の飼料用の液体中に、懸濁可能、分散可能、又は乳化可能な粉末状混合物である。前記液体は、ある実施形態では、例えば、水、コーヒ、お茶、又はジュースなどの水を含んでいる液体である。そのような目的のために、前記組成物は、ある実施形態では、栄養必要量の一部又は全部を所定の期間覆うためのパッケージの中にパックされている。他の実施形態では、本発明は、栄養補助食品の形態の栄養製剤を提供する。
【0052】
他の実施形態では、前記栄養製剤は、機能性食品又は飲料である。すなわち、医療効果又は薬学的効果をもたらすために本発明に係る組成物が追加された、容易に得られる、食用又は飲用に適する物資である。したがって、本発明は、機能性食品の成分としての使用される、本発明に係る組成物を提供する。機能性食品及び飲料は、ある実施形態では、日常用品(例えば、ヨーグルト及びヨーグルト・アイスクリーム)、ジュース(オレンジジュース又はトマトジュースなど)、市販されている飲用の液体、スプレッド製品(例えば、マーガリン、植物又はプラント抽出油)、穀物製品(例えば、一般的な朝食用シリアル製品)、栄養バー、ビスケット、パン、スープ(トマトスープなど)、肉製品(ハンバーガーなど)、肉代用製品、及び植物製品から成る群より選択される。他の実施形態では、本発明に係る栄養製剤は、既製の液体の形態、粉末状の形態、トローチの形態、又は固形組成(栄養バー、フルーツバー、クッキー、ケーキ、パン、又はマフィン)の形態であり得る。各々の可能性は、本発明の別個の実施形態に相当する。
【0053】
他の実施形態では、前記組成物は、即時放出用に作成される。他の実施形態では、前記組成物は、制御又は持続放出用に作成される。各々の可能性は、本発明の別個の実施形態に相当する。
【0054】
「制御放出」という用語は、様々な実施形態では、摂取又は放出が遅延、パルス又は持続される製剤を意味する。他の実施形態では、制御放出組成物は、移植又はマイクロカプセル化送達システムを含む。他の実施形態では、エチレン酢酸ビニール、ポリ酸無水物、ポリグリコール酸、コラーゲン、ポリオルトエステル、又はポリ乳酸などの、生分解性又は生体適合性ポリマーが、そのような製剤に使用される。そのような製剤の作成方法は、当該技術分野では公知である。各々の可能性は、本発明の別個の実施形態に相当する。
【0055】
他の実施形態では、「持続放出」という用語は、前記組成物を所定の期間(少なくとも0.0005〜21日、他の実施形態では、少なくとも1〜120日)放出するようにデザインされた投与形態を意味する。長期間に渡る放出も、本発明に係る投与形態では、「持続放出」だと見なされる。全身投与のための持続放出形態も、局所投与のための場合と同様に、本発明の実施に用いることができると考えられる。各々の可能性は、本発明の別個の実施形態に相当する。
【0056】
他の実施形態では、前記組成物は、さらに、繊維源、安定剤、乳化剤、香味料、又はそれらの組み合わせ含む。他の実施形態では、前記繊維源は、高メトキシルペクチン、低メトキシルペクチン、メラニン、リグニン、セルロース、ヘミセルロース、ルテイン、又はそれらの組み合わせである。
【0057】
他の実施形態では、前記安定剤は、ラクトース、微結晶性セルロース、ヒドロキシメチル・セルロース、でんぷん、もちトウモロコシ(waxy maize)、キサンタン、カラギナン、ペクチン、グアー、アラビアゴム、こんにゃく、トラガカント・ゴム、アルギン酸プロピレングリコール、又はそれらの組み合わせである。
【0058】
他の実施形態では、乳化剤は、レシチン、ステアロイル乳酸ナトリウム(sodium stearoyl lactylate:ssl)、ソルビタン脂肪酸エステル、ポリオキシエチレン・ソルビタン脂肪酸エステル、モノグリセリル、ジグリセリル、ポリオキシエチレン脂肪酸エステル、ポリオキシエチレン・アルコール、卵黄、酵素調整卵黄、又はそれらの組み合わせである。
【0059】
他の実施形態では、香味料、着色剤、香辛料、ナッツ又はそれらの組み合わせが、生成物に組み込まれる。香味料としては、フレーバー抽出物、精油、チョコレート香味料(例えば、カフェインを含まないココア或いはチョコレートや、人工チョコレート(イナゴマメなど))、ピーナッツバター香味料、クッキーの小片、クリスプライス(crisp rice)、バニラ、又はその他の市販の香味料を用いることができる。香味料は、ミックストコフェロール(mixed tocopherol)で保護することができる。使用可能な香味料の例としては、純粋アニス抽出物、イミテーション・バナナ抽出物、イミテーション・サクランボ抽出物、チョコレート抽出物、純粋レモン抽出物、純粋オレンジ抽出物、純粋ペパーミント抽出物、イミテーション・ラム抽出物、イミテーション・イチゴ抽出物、純粋バニラ抽出物、精油(例えば、香油、ベイ油、ベルガモット油、セダー油、サクランボ油、くるみ油、桂皮油、丁子油、又はペパーミント油)、ピーナッツバター、チョコレート香味料、バニラクッキークラム、バタースコッチ、及びタフィーなどがある(ただし、これらに限定されるものではない)。他の実施形態では、前記組成物は、ベリー又は他の果実フレーバーを含む。他の実施形態では、前記組成物をバーとして作成する場合は、前記組成物は、例えばヨーグルトによってさらにコーティングされる。
【0060】
他の実施形態では、前記組成物は、人口甘味料を含む。ある実施形態では、前記人口甘味料は、サッカリド、チクロ、アスパルタミン、アスパルテーム、アセスルファムK、ソルビトール、又はそれらの組み合わせである。
【0061】
他の実施形態では、前記組成物は、保存料を含む。ある実施形態では、前記保存料は、ソルビン酸カリウム、ソルビン酸ナトリウム、安息香酸カリウム、安息香酸ナトリウム、EDTAカルシウム2ナトリウムである。
【0062】
本発明に係る方法の他の実施形態では、前記組成物は、経口投与される。他の実施形態では、前記組成物は、経直腸、局所的、口腔(例えば舌下)、鼻腔内、エアロゾル化によって、又は非経口(例えば、皮下、筋肉内、皮内、経皮、又は静脈内)投与される。各々の可能性は、本発明の別個の実施形態に相当する。
【0063】
本発明の他の実施形態では、ウリジンを含有している前記組成物は、錠剤、カプセル、ジェルキャップ、懸濁液、乳濁液、パッチ、軟膏、注射剤の形態、又は当該技術分野では公知の他の送達手段である。ある実施形態では、前記組成物は、ガム、キャンデー、飲料、冷凍の砂糖菓子、又はバーなどの食品の形態を取ることができる。前記組成物は、1日に1回又は複数回の投与用に製剤することができる。
【0064】
上記の各添加物、賦形剤などは、本発明の別個の実施形態に相当する。
【0065】
他の実施形態では、本発明に係る方法は、パーキンソン病治療薬の投与をさらに含む。ある実施形態では、追加される薬剤はレボドパである。他の実施形態では、追加される薬剤はカルビドパである。他の実施形態では、追加される薬剤は塩酸プラミペキソールである。他の実施形態では、追加される薬剤は塩酸ロピニロールである。他の実施形態では、追加される薬剤はトルカポン・ブロモクリプチンである。他の実施形態では、追加される薬剤はペルゴリドである。他の実施形態では、追加される薬剤は塩酸セレギリンである。他の実施形態では、追加される薬剤はアポモルヒネである。他の実施形態では、追加される薬剤は、当該技術分野では公知の他のパーキンソン病治療薬である。各々の可能性は、本発明の別個の実施形態に相当する。
【0066】
他の実施形態では、本発明に係る方法は、パーキンソン病治療法の実施をさらに含む。ある実施形態では、前記パーキンソン病治療法は、「Activa Tremor Control Therapy」である。ある実施形態では、前記パーキンソン病治療法は、ブタ胎児のドーパミン作動性神経細胞又はセルトリ細胞の移植である。他の実施形態では、前記パーキンソン病治療法は、同種ヒト網膜色素上皮細胞の移植である。他の実施形態では、前記パーキンソン病治療法は、当該技術分野では公知の他の治療法である。各々の可能性は、本発明の別個の実施形態に相当する。
【実施例】
【0067】
神経細胞の脱分極中又は脱分極後における、経口投与されたUMPが神経伝達物質の放出に及ぼす影響。
【0068】
<材料及び方法>
【0069】
(ラット)
更年期モデルの飼育ラットに、ウリジン5´−モノリン酸(uridine5’−monophosphate:UMP)(2.5%,w/w)を最終濃度では500mg/kg/日で追加した又は追加しなかった通常の食餌(Harlan Tech Lad、Madison、WI)を、6週間に渡って摂取させた。
【0070】
(微小透析)
対照ラット及び治療したラットの右線条体に直接的に埋め込んだカニューレを用いて、微小透析を行なった。カニューレは1日目に埋め込み、サンプルは3日目及び4日目に採取した。微小透析液(22.5マイクロリットル。15分以上採取した)について、ドーパミン(dopamine:DA)、3,4−ジヒドロキシフェニール酢酸(3、4−dihydroxyphenylacetic acid:DOPAC)、ホモバニリン酸(homovanillic acid:HVA)、5−ヒドロキシトリプタミン(5−hydroxy−tryptamine:5−HT)、及び5−ハイドロキシインドール酢酸(5−hydroxyindole acetic acid:5−HIAA)の分析を行った。100nmの塩化カリウム(KCl)溶液の局所適用による神経細胞膜の脱分極前及び脱分極後に採取したサンプルに対して、神経伝達物質濃度の実時間測定を行った。その後、動物を屠殺し、線条体、海馬及び側頭皮質について、DA、DOPAC、HVA、5HT、5HIAA、DNA、タンパク質、及びホスファチジルコリン(phosphatidyl choline:PC)の成分を分析した。
【0071】
(ドーパミン及び代謝産物の分析)
ESA微小透析細胞(ESA Microdialysis Cell、model 5014B、ESA、North Chelmsford、MA)、及びESA Coulochem II 5100A 検出器(El=−175mV;E2=+325mV;Eguard=350mV)を使用して、透析液及び組織サンプル中のDA及び代謝産物を測定した。移動相(MD−TM、ESA)は、75mM NaH2PO4、1.7mM 1−オクタンスルホン酸、100?l/L トリエチルアミン、25 ?MEDTA、10% アセトニトリル、pH 3.0から成る。流速は、0.4mL/分であった。カラム(ESA MD 150、3x150mm、3?m、120Å)は、40℃のカラムオーブンに置かれた。サンプルは、Alltech580オ−トサンプラ〔Alltech、Deerfield、IL〕によってHPLCに注入され、分析中は冷却トレイによって4℃に保たれた。データは、Alltech AllChrom(登録商標)データシステムによって採取され、AllChrom plus(登録商標)ソフトウエアによって分析された。1回の注入によって、透析液中の低いDA濃度及び高い代謝産物濃度データを取ることを可能にすべく、サンプルの分離中及び検出中に検出利得(detection gain)を変更可能な時系列プログラムを使用した。
【0072】
(神経伝達物質濃度の実時間測定)
カニューレを通じて挿入された炭素繊維電極を使用して、各々の酸化電位でのファラデー電流を測定することにより、神経伝達物質濃度を実時間で分析した。
【0073】
<結果>
【0074】
ドーパミン放出がウリジン投与の影響を受けるがどうかを判断するために、神経細胞の脱分極中又は脱分極後の両方における、食餌中にUMPが追加された動物についてのドーパミン生成を分析した。図1A〜Eは、反復刺激を与えた、1匹のウリジン投与ラットと、1匹の対照ラットの放出特性を示す。UMP投与は、脱分極中又は脱分極後の両方において、DA(B)及び5−HT(E)の放出を促進した。DOPAC(A)、5−HIAA(C)、及びHVA(D)は、UMP摂取動物では低い基準レベルを示し、刺激中では見られないが、刺激後は、DA及び5−HTよりも小さい幅ではあるが、放出は増大する。UMPは、線条体におけるDA及び5−HTの全体レベルに対しては影響を与えないが、線条体及び線条体細胞外液〔extracellular fluid:ECF〕におけるDOPAC、5−HIAA、及びHVAの線条体の全体レベルはわずかに低下する。
【0075】
図2は、6匹のウリジン投与ラットと、6匹の対照ラットにおけるDA放出の平均値を示しており、DAの総量(下側の図面)と、基礎レベルのパーセンテージ(上側の図面)との両方を示している。
【0076】
結論として、UMP投与は、脱分極中における線条体からのDA及び5−HT放出量を促進し、DA代謝産物の線条体の全体レベルを減少させる。したがって、ウリジン及びその代謝産物又は誘導体の投与は、DA放出の減少を特徴とする病気(例えば、パーキンソン病)を治療するのに効果的な方法である。
【特許請求の範囲】
【請求項1】
神経細胞からのドーパミン放出を促進又は増大させる方法であって、
前記神経細胞に、ウリジン、ウリジン1リン酸、又はそのソースを接触させるステップ
を含み、
前記接触は、神経細胞からのドーパミン放出を促進又は増大させ、
それによって、神経細胞からのドーパミン放出を促進又は増大させるようにした方法。
【請求項2】
請求項1に記載の方法であって、
前記ウリジン、ウリジン1リン酸、又はそのソースは、前記神経細胞からの、5−ヒド
ロキシトリプタミン、セロトニン、アセチルコリン、GABA、グルタミン酸、アデノシ
ン、又はそれらの組み合わせの放出を促進又は増大させることを特徴とする方法。
【請求項3】
請求項1に記載の方法であって、
前記組成物は、経口投与されることを特徴とする方法。
【請求項4】
請求項1に記載の方法であって、
前記組成物は、栄養補給剤と共に又は栄養補給剤の一部として投与されることを特徴と
する方法。
【請求項5】
請求項4に記載の方法であって、
前記栄養補給剤は、コリン又はコリンソースを含むことを特徴とする方法。
【請求項6】
請求項5に記載の方法であって、
前記コリンソースは、レシチン、ホスファチジルコリン、アセチルコリン、シチコリン
、又はアルファ・グリセロホスホリルコリンであることを特徴とする方法。
【請求項7】
請求項4に記載の方法であって、
前記栄養補給剤は、ビタミンを含むことを特徴とする方法。
【請求項8】
パーキンソン病の治療方法であって、
患者に、ウリジン、ウリジン1リン酸、又はそのソースを投与するステップを含み、
前記ウリジン又はそのソースの投与は、神経細胞のドーパミン濃度、又は前記患者の脳
内のシナプスへのドーパミン放出を促進又は増大させ、
それによって、患者のパーキンソン病を治療するようにした方法。
【請求項9】
請求項8に記載の方法であって、
前記ウリジン、ウリジン1リン酸、又はそのソースは、前記神経細胞からの、5−ヒド
ロキシトリプタミン、セロトニン、アセチルコリン、GABA、グルタミン酸、アデノシ
ン、又はそれらの組み合わせの放出を促進又は増大させることを特徴とする方法。
【請求項10】
請求項8に記載の方法であって、
前記組成物は、経口投与されることを特徴とする方法。
【請求項11】
請求項8に記載の方法であって、
前記組成物は、栄養補給剤と共に又は栄養補給剤の一部として投与されることを特徴と
する方法。
【請求項12】
請求項11に記載の方法であって、
前記栄養補給剤は、コリン又はコリンソースを含むことを特徴とする方法。
【請求項13】
請求項12に記載の方法であって、
前記コリンソースは、レシチン、ホスファチジルコリン、アセチルコリン、シチコリン
、又はアルファ・グリセロホスホリルコリンであることを特徴とする方法。
【請求項14】
請求項11に記載の方法であって、
前記栄養補給剤は、ビタミンを含むことを特徴とする方法。
【請求項15】
パーキンソン病の発生率を減少させる方法であって、
患者に、ウリジン、ウリジン1リン酸、又はそのソースを投与するステップを含み、
前記ウリジン又はそのソースの投与は、神経細胞のドーパミン濃度、又は前記患者の脳
内のシナプスへのドーパミン放出を促進又は増大させ、
それによって、患者のパーキンソン病の発生率を減少させるようにした方法。
【請求項16】
請求項15に記載の方法であって、
前記ウリジン、ウリジン1リン酸、又はそのソースは、前記神経細胞からの、5−ヒド
ロキシトリプタミン、セロトニン、アセチルコリン、GABA、グルタミン酸、アデノシ
ン、又はそれらの組み合わせの放出を促進又は増大させることを特徴とする方法。
【請求項17】
請求項15に記載の方法であって、
前記組成物は、経口投与されることを特徴とする方法。
【請求項18】
請求項15に記載の方法であって、
前記組成物は、栄養補給剤と共に又は栄養補給剤の一部として投与されることを特徴と
する方法。
【請求項19】
請求項18に記載の方法であって、
前記栄養補給剤は、コリン又はコリンソースを含むことを特徴とする方法。
【請求項20】
請求項19に記載の方法であって、
前記コリンソースは、レシチン、ホスファチジルコリン、アセチルコリン、シチコリン
、又はアルファ・グリセロホスホリルコリンであることを特徴とする方法。
【請求項21】
請求項18に記載の方法であって、
前記栄養補給剤は、ビタミンを含むことを特徴とする方法。
【請求項22】
パーキンソン病を治療する又はパーキンソン病の発生率を減少させるための組成物であ
って、
患者の神経細胞からのドーパミン放出を促進又は増大させるのに十分な量の、ウリジン
、ウリジン1リン酸、又はそのソースを含むことを特徴とする組成物。
【請求項23】
請求項22に記載の組成物であって、
前記ソースは、ウリジン1リン酸であることを特徴とする組成物。
【請求項24】
請求項22に記載の組成物であって、
経口投与用に製剤されたことを特徴とする組成物。
【請求項25】
請求項22に記載の組成物であって、
制御又は持続放出用に製剤されたことを特徴とする組成物。
【請求項26】
請求項22に記載の組成物であって、
栄養補給剤をさらに含むことを特徴とする組成物。
【請求項27】
請求項26に記載の組成物であって、
前記栄養補給剤は、コリン又はコリンソースを含むことを特徴とする組成物。
【請求項28】
請求項27に記載の組成物であって、
前記コリンソースは、レシチン、ホスファチジルコリン、アセチルコリン、シチコリン
、又はアルファ・グリセロホスホリルコリンであることを特徴とする組成物。
【請求項29】
請求項28に記載の組成物であって、
前記シチコリンは、シチジン−5´−ジホスホコリンであることを特徴とする組成物。
【請求項30】
請求項28に記載の組成物であって、
前記栄養補給剤は、ビタミンを含むことを特徴とする組成物。
【請求項1】
神経細胞からのドーパミン放出を促進又は増大させる方法であって、
前記神経細胞に、ウリジン、ウリジン1リン酸、又はそのソースを接触させるステップ
を含み、
前記接触は、神経細胞からのドーパミン放出を促進又は増大させ、
それによって、神経細胞からのドーパミン放出を促進又は増大させるようにした方法。
【請求項2】
請求項1に記載の方法であって、
前記ウリジン、ウリジン1リン酸、又はそのソースは、前記神経細胞からの、5−ヒド
ロキシトリプタミン、セロトニン、アセチルコリン、GABA、グルタミン酸、アデノシ
ン、又はそれらの組み合わせの放出を促進又は増大させることを特徴とする方法。
【請求項3】
請求項1に記載の方法であって、
前記組成物は、経口投与されることを特徴とする方法。
【請求項4】
請求項1に記載の方法であって、
前記組成物は、栄養補給剤と共に又は栄養補給剤の一部として投与されることを特徴と
する方法。
【請求項5】
請求項4に記載の方法であって、
前記栄養補給剤は、コリン又はコリンソースを含むことを特徴とする方法。
【請求項6】
請求項5に記載の方法であって、
前記コリンソースは、レシチン、ホスファチジルコリン、アセチルコリン、シチコリン
、又はアルファ・グリセロホスホリルコリンであることを特徴とする方法。
【請求項7】
請求項4に記載の方法であって、
前記栄養補給剤は、ビタミンを含むことを特徴とする方法。
【請求項8】
パーキンソン病の治療方法であって、
患者に、ウリジン、ウリジン1リン酸、又はそのソースを投与するステップを含み、
前記ウリジン又はそのソースの投与は、神経細胞のドーパミン濃度、又は前記患者の脳
内のシナプスへのドーパミン放出を促進又は増大させ、
それによって、患者のパーキンソン病を治療するようにした方法。
【請求項9】
請求項8に記載の方法であって、
前記ウリジン、ウリジン1リン酸、又はそのソースは、前記神経細胞からの、5−ヒド
ロキシトリプタミン、セロトニン、アセチルコリン、GABA、グルタミン酸、アデノシ
ン、又はそれらの組み合わせの放出を促進又は増大させることを特徴とする方法。
【請求項10】
請求項8に記載の方法であって、
前記組成物は、経口投与されることを特徴とする方法。
【請求項11】
請求項8に記載の方法であって、
前記組成物は、栄養補給剤と共に又は栄養補給剤の一部として投与されることを特徴と
する方法。
【請求項12】
請求項11に記載の方法であって、
前記栄養補給剤は、コリン又はコリンソースを含むことを特徴とする方法。
【請求項13】
請求項12に記載の方法であって、
前記コリンソースは、レシチン、ホスファチジルコリン、アセチルコリン、シチコリン
、又はアルファ・グリセロホスホリルコリンであることを特徴とする方法。
【請求項14】
請求項11に記載の方法であって、
前記栄養補給剤は、ビタミンを含むことを特徴とする方法。
【請求項15】
パーキンソン病の発生率を減少させる方法であって、
患者に、ウリジン、ウリジン1リン酸、又はそのソースを投与するステップを含み、
前記ウリジン又はそのソースの投与は、神経細胞のドーパミン濃度、又は前記患者の脳
内のシナプスへのドーパミン放出を促進又は増大させ、
それによって、患者のパーキンソン病の発生率を減少させるようにした方法。
【請求項16】
請求項15に記載の方法であって、
前記ウリジン、ウリジン1リン酸、又はそのソースは、前記神経細胞からの、5−ヒド
ロキシトリプタミン、セロトニン、アセチルコリン、GABA、グルタミン酸、アデノシ
ン、又はそれらの組み合わせの放出を促進又は増大させることを特徴とする方法。
【請求項17】
請求項15に記載の方法であって、
前記組成物は、経口投与されることを特徴とする方法。
【請求項18】
請求項15に記載の方法であって、
前記組成物は、栄養補給剤と共に又は栄養補給剤の一部として投与されることを特徴と
する方法。
【請求項19】
請求項18に記載の方法であって、
前記栄養補給剤は、コリン又はコリンソースを含むことを特徴とする方法。
【請求項20】
請求項19に記載の方法であって、
前記コリンソースは、レシチン、ホスファチジルコリン、アセチルコリン、シチコリン
、又はアルファ・グリセロホスホリルコリンであることを特徴とする方法。
【請求項21】
請求項18に記載の方法であって、
前記栄養補給剤は、ビタミンを含むことを特徴とする方法。
【請求項22】
パーキンソン病を治療する又はパーキンソン病の発生率を減少させるための組成物であ
って、
患者の神経細胞からのドーパミン放出を促進又は増大させるのに十分な量の、ウリジン
、ウリジン1リン酸、又はそのソースを含むことを特徴とする組成物。
【請求項23】
請求項22に記載の組成物であって、
前記ソースは、ウリジン1リン酸であることを特徴とする組成物。
【請求項24】
請求項22に記載の組成物であって、
経口投与用に製剤されたことを特徴とする組成物。
【請求項25】
請求項22に記載の組成物であって、
制御又は持続放出用に製剤されたことを特徴とする組成物。
【請求項26】
請求項22に記載の組成物であって、
栄養補給剤をさらに含むことを特徴とする組成物。
【請求項27】
請求項26に記載の組成物であって、
前記栄養補給剤は、コリン又はコリンソースを含むことを特徴とする組成物。
【請求項28】
請求項27に記載の組成物であって、
前記コリンソースは、レシチン、ホスファチジルコリン、アセチルコリン、シチコリン
、又はアルファ・グリセロホスホリルコリンであることを特徴とする組成物。
【請求項29】
請求項28に記載の組成物であって、
前記シチコリンは、シチジン−5´−ジホスホコリンであることを特徴とする組成物。
【請求項30】
請求項28に記載の組成物であって、
前記栄養補給剤は、ビタミンを含むことを特徴とする組成物。
【図1】


【図2】




【図2】


【公開番号】特開2012−144575(P2012−144575A)
【公開日】平成24年8月2日(2012.8.2)
【国際特許分類】
【出願番号】特願2012−103465(P2012−103465)
【出願日】平成24年4月27日(2012.4.27)
【分割の表示】特願2007−513306(P2007−513306)の分割
【原出願日】平成17年5月11日(2005.5.11)
【出願人】(596060697)マサチューセッツ インスティテュート オブ テクノロジー (233)
【Fターム(参考)】
【公開日】平成24年8月2日(2012.8.2)
【国際特許分類】
【出願日】平成24年4月27日(2012.4.27)
【分割の表示】特願2007−513306(P2007−513306)の分割
【原出願日】平成17年5月11日(2005.5.11)
【出願人】(596060697)マサチューセッツ インスティテュート オブ テクノロジー (233)
【Fターム(参考)】
[ Back to top ]

