ナチュラルキラーT細胞のリガンドと抗原を積載したB細胞を媒介とするワクチン
【課題】ナチュラルキラーT細胞リガンドと、糖脂質の一種であるアルファガラクトシルセラミドを媒介にした、B細胞を含む免疫予防及び治療用ワクチンを提供する。
【解決手段】B細胞が樹状細胞に比べて取得が容易で既存の樹状細胞ワクチンと比較して類似水準の細胞毒性Tリンパ球反応を誘導するだけでなく、皮下癌及び転移癌の予防及び治療効果があるので、抗癌免疫治療剤に使用することができる。
【解決手段】B細胞が樹状細胞に比べて取得が容易で既存の樹状細胞ワクチンと比較して類似水準の細胞毒性Tリンパ球反応を誘導するだけでなく、皮下癌及び転移癌の予防及び治療効果があるので、抗癌免疫治療剤に使用することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ナチュラルキラーT細胞のリガンドと抗原を積載したB細胞を含む免疫予防及び治療用ワクチンに関するもので、より詳細には、ナチュラルキラーT細胞リガンドと同時に糖脂質の一種であるアルファガラクトシルセラミドを媒介にしたB細胞を含む免疫予防及び治療用ワクチンに関するものである。
【背景技術】
【0002】
人体では、抗原提示細胞によって腫瘍細胞の抗原が効率的に提示されないので、それに対する免疫反応が効果的に誘導されない。癌治療ワクチンは、癌細胞に特異的に作用する免疫機序を人為的に活性化させて(抗原提示細胞導入等)力強い免疫反応を誘発して癌細胞を破壊する新しい概念の治療用ワクチンである。
【0003】
使用可能なワクチンの接近方法として使用されるものの中で、樹状細胞(dendritic cells、DC)のような抗原提示細胞(antigen-presenting cell、APC)を使用した細胞ワクチンは、効果的なT細胞免疫を生成させるのに確実な方法として知られている(Rosenberg,S.A.等,Nat.Med.,2004年,第10巻,909-915頁)。特に、樹状細胞ワクチンは、抗原特異的な効果T細胞(Antigen-specific effector T cell)と記憶T細胞(memory T cell)を効率的に誘導することが知られていて、多くの臨床試験で抗癌治療に適用されている(Rosenberg,S.A.等,Nat.Med.,2004年,第10巻,909-915頁)。このような樹状細胞(DC)は、抗原を収容して抗原をそれに相応するT細胞に提示する場所であるリンパ器官(lymphoid organ)に移動する能力があるので、免疫治療のための理想的な抗原提示細胞であると言える。さらに重要なことは、樹状細胞は、T細胞に強い共刺激(co-stimulation)を提供する(Figdor,C.G.等,Nat, Med.,2004年,第10巻,475-480頁;及びBanchereau,J. 等,Cell,2001年,第106巻,271-274頁)。樹状細胞ワクチンを使用した接近法が、実験的にも臨床試験でよく確立されているにもかかわらず、血液とリンパ組職に樹状細胞が少数で血液中の単核細胞から体外に(ex vivo)増殖させにくいという点は、ワクチンとして広く使用される障害になっている(Schultze,J.L.等,Trends Immunol.,2004年,第25巻,659-664頁)。
【0004】
一方、B細胞はリンパ組職や血液に多量に存在して体外で容易に増殖されることができるため、細胞ワクチンのための樹状細胞の効率的な代替剤になるのみならず(Schultze,J.L.等,Trends Immunol.,2004年,第25巻,659-664頁;von Bergwelt-Baildon、M.S.等,Blood,2002年,第99巻,3319-3325頁;及びSchultze,J.L.等,J.Clin.Invest.,19974年,第100巻,2757-2757頁) 非経口投与後にリンパ器官に移動するようになる。
【0005】
このような長所にもかかわらずB細胞は、弱い免疫原性のため抗原提示細胞ワクチンとしては広く使用されなかった。実際にB細胞がCD4+とCD8+T細胞の自己免疫寛容(tolerance)を直接的に誘導する。これは共刺激(costimulation)が欠如したからであるという証拠があり(Bennett,S.R.等,J.Exp.Med.,19984年,第188巻,1977-1983頁;及びEynon,E.E.等,J.Exp.Med.,1992年,第175巻,131-138頁)、共刺激は、抗原特異的なT細胞が活性化するためにT細胞が認識することができる抗原とともに要求される二番目信号を言う。しかし、活性化したB細胞がCD4+T細胞とCD8+T細胞全てを刺激することができるということは(von Bergwelt-Baildon,M.S.等,Blood,2002年,第99巻,3319-3325頁;Schultze,J.L.等,J.Clin.Invest.,1997年,第100巻,2757-2765頁;Lapointe,R.等,Cancer Res.,2003年,第63巻,2836-2843頁;及びHeit,A.等,J.Immunol.,2004年,第172巻,1501-1507頁)適切な刺激によって活性化したB細胞が抗原特異的なT細胞免疫を誘導する免疫原性を有した抗原提示細胞として作用することができるということを示唆する。
【0006】
不変性ナチュラルキラーT(iNKT)細胞が多くの免疫反応及び免疫病理現象を総括する中枢的な役割を担当するということは、よく知られている。マウスの全体リンパ球の中で1%未満存在すると言っても、ナチュラルキラーT細胞は、自己抗原及び外来抗原に対する反応を管理して自己免疫または免疫反応を誘導するかどうかを決定する(Kronenberg,M.,Annu.Rev.Immunol.,2005年,第23巻,877-900頁;及びPark,S.H.&Bendelac,A.,Nature,2000年,第406巻,788-792頁)。また、この細胞は、癌、糖尿及び免疫反応が起きない部位(immune-privileged site)で免疫反応を抑制する機能を有すると報告された(Sonoda,K.H.,等,J.Exp.Med.,1999年,第190巻,1215-1226頁)。
【0007】
一方、リガンドで活性化した不変性ナチュラルキラーT細胞は、樹状細胞だけではなくT、B及びナチュラルキラー細胞の活性化を誘導する。不変性ナチュラルキラーT細胞のリガンドであるアルファガラクトシルセラミド(αGalCer)を注入すると、ナチュラルキラー細胞とT細胞を通じて抗癌免疫を起こす(Moodycliffe,A.M.,等,Nat.Immunol.,2000年,第1巻,521-525頁)。
【0008】
アルファガラクトシルセラミド(a-galactosylceramide、αGalCer)は、元々海綿動物から抽出された糖脂質(glycolipid)で、Vα14+T細胞受容体(TCR)を有しているナチュラルキラー T(Natural Killer T)細胞のリガンドで、抗原提示細胞(antigen presenting cell,APC)にあるCD1d分子によって提示されることが知られている(Kawano等,Science,1997年,第278巻,1626頁)。ナチュラルキラーT細胞が活性化すると、多量のIFN-γ及びIL-4を生産する。これは、特定疾病または感染に対する免疫反応を調節することができる(Chen等,J.Immunol.,1997年,第159巻,2240頁;Wilson等,Proc.Natl.Acad.Sci.U.S.A.,2003年,第100巻,10913頁)。
【0009】
タンパク質抗原とアルファガラクトシルセラミドを一緒に投与したマウスでは、細胞毒性T細胞反応を含んだ細胞性免疫反応(cell-mediated immunity)及び体液性免疫反応(humoral-mediated immunity)が起きる(Hermans,I.F.,等,J.Immunol,2003年,第171巻,5140-5147頁;及びStober,D.等,J.Immunol.,2003年,第170巻,2540-2548頁)。さらに、最近の研究でアルファガラクトシルセラミドを積載した樹状細胞は、自然型のアルファガラクトシルセラミドに比べて長く持続するナチュラルキラーT細胞反応を生成させることが示されて、ナチュラルキラーT細胞リガンドの免疫増強効果は、専門的な抗原提示細胞(professional APC)を標的にすることにより増加させることができることを示唆している。
【0010】
以上のことに鑑みて、本発明者等は、ナチュラルキラーT細胞リガンドをB細胞に積載してこの細胞の自己免疫寛容性を免疫原性に変化させることにより、B細胞のMHC分子によって提示される抗原に対して活発な免疫反応を生成することができることを確認し、それを検証するためにアルファガラクトシルセラミド(αGalCer)とペプチドが積載されたB細胞及びアルファガラクトシルセラミド(αGalCer)と癌抗原を発現するアデノウイルスで形質転換されたB細胞が抗原特異的な免疫反応と抗癌効果を示すことを確認することによって、本発明を完成した。
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明の目的は、ナチュラルキラーT細胞リガンド、特にアルファガラクトシルセラミドと抗原を積載したB細胞によって活性化したナチュラルキラーT細胞を通じて、B細胞の免疫寛容性を免疫原性に変化させることにより、抗原を提示するB細胞を通じて抗原特異的な免疫反応を誘導することができる免疫予防及び治療用ワクチンを提供するものである。
【課題を解決するための手段】
【0012】
本発明は、ナチュラルキラーT細胞のリガンドと抗原を積載したB細胞を含む免疫予防/治療用ワクチン及び抗癌用ワクチンを提供する。
【0013】
また、本発明は、ナチュラルキラーT細胞のリガンドを積載して癌抗原を発現するB細胞を媒介にする抗癌用ワクチンを提供する。
【0014】
また、本発明は、アルファガラクトシルセラミドを積載したB細胞を媒介にするナチュラルキラーT細胞活性化剤を提供する。
【0015】
同時に、本発明は、癌抗原を発現するB細胞を含む細胞毒性反応誘導剤を提供する。
【0016】
以下、本発明を詳しく説明する。
【0017】
本発明は、ナチュラルキラーT細胞のリガンドを積載したB細胞または、ナチュラルキラーT細胞のリガンドと抗原を積載したB細胞を含む、免疫予防/治療用ワクチン及び抗癌用ワクチンを提供する。
【0018】
前記のナチュラルキラーT細胞のリガンドは、スピンゴモナス属(Sphingomonas spp.)由来のアルファガラクトロノシルセラミド(alpha-galacturonosylceramide)とアルファグルクロノシルセラマイド(alpha-glucuronosylceramide,Mattner,J.等,Nature,2005年,第434巻,525頁;Kinjo,Y.等,Nature,2005年,第434巻,520頁)。M.ツバクロシス(M.tuberculosis)由来のホスファチジリノシトルテトラマンノサイド(phosphatidylinositoltetramannoside,Fischer,K.等,PNAS,2004年,第101巻,10685頁)。
【0019】
自家抗原であるイソグロボトリヘキソシルセラミド(isoglobotrihexosylceramide,Zhou,D.等,Science,2004年,第306巻,1786頁)とガングリオサイドGD3(ganglioside GD3,Wu,D.Y.等,J.Exp.Med.,2003年,第198巻,173頁)、ホスファチジルコリン(phosphatidylcholine,J.Immunol.,2005年,第175巻,977頁)、ベータガラクトシルセラミド(beta-galactosylceramide,betαGalCer,Ortaldo JR等,J.Immunol.,第172巻,943頁)、Leishmania表面糖結合リポホスホグリカン(lipophosphoglycan)とグリコイノシトールホスホリピド(glycoinositol phospholipids,J.Exp.Med.,2004年,第200巻,895頁)、アルファガラクトシルセラミドの類似体のベータアノマガラクトシルセラミド等(beta-anomeric GalCer)とアルファアノマガラクトシルセラミド等(alpha-anomeric GalCer;J.Immunol.,2004年,第173巻,3693頁)、アルファガラクトシルセラミドの変異体(J.Am.Chem.Soc.,2004年,第126巻,13602頁)及びバクテリア脂質抗原、例えばノカルデアファルシニカ(Nocardia falcinica)由来のグルコースモノマイコレート(glucose monomycolate,Moody,D.B.等,J.Exp.Med.,2000年,第192巻,965頁)を含む。
【0020】
すでに、アルファガラクトシルセラミドが積載された樹状細胞(dendritic cell、DC)が、不変性ナチュラルキラーT(iNKT)細胞を活性化させるということは公知の事実なので(van der Vliet HJ,等,J Immunol Methods.,2001年,第1;247(1-2)巻,61-72頁)、本発明者等は、アルファガラクトシルセラミドを積載したB細胞が前記の樹状細胞と類似の効果を示すかどうかを確認した。
【0021】
マウスからCD19を発現するB細胞(図1)と樹状細胞を分離して、アルファガラクトシルセラミド及びナチュラルキラーT細胞ハイブリドーマとともに培養した後、培養液内のIL-2濃度を測定した結果、アルファガラクトシルセラミドを積載した樹状細胞(DC/αGalCer)とB細胞(B/αGalCer)の両方が、ナチュラルキラーT細胞ハイブリドーマを刺激してIL-2を生成した(図30参照)。したがって、B/αGalCer及びDC/αGalCerの両方が、体外で不変性ナチュラルキラーT細胞を活性化させることができることを確認した。
【0022】
B/αGalCer及びDC/αGalCer投与が体内で免疫細胞を活性化させることができるかどうかを確認するために、C57BL/6マウスから取得したB細胞とDCを使用して製造したB/αGalCerまたはDC/αGalCerを同種のマウスに静脈注射して、エリスポット(ELISPOT)を通じてIL-4及びIFN-γレベルを測定した。詳細には、野生型C57BL/6またはJα281-/-マウスにビヒクル、αGalCer、αGalCerを積載したB細胞または、αGalCerを積載した樹状細胞を静脈注射した。一週間後、脾臓細胞を摘出して単一細胞を作製した後にエリスポット用プレートに入れて、ビヒクルまたはαGalCerを入れて刺激した。以後は、製造社(IL-4 ELISPOT kit,IFN-γ ELISPOTキット,R&Dシステム)のマニュアルによってIL-4とIFN-γを生成する細胞を測定するためのエリスポット試験を実施した。
【0023】
その結果、B/αGalCer及びDC/αGalCerグループ全てで、IL-4及びIFN-γを生成する細胞を顕著に多く誘導した(図2)。しかし、不変性ナチュラルキラーT細胞が欠如したJα281-/-マウスの場合には、正常マウスと異なり前記のようなサイトカインを生成する細胞が誘導されない。これは、IFN-γとIL-4を生成する細胞が、不変性ナチュラルキラーT細胞に依存的に誘導されるということを示唆する(図2参照)。
【0024】
本発明者等は、B/αGalCerを体内で投与した時に誘導されるナチュラルキラーT細胞の活性化によってB細胞がどんな影響を受けるのかを調べるために、アルファガラクトシルセラミドを積載したB細胞をCFSEで標識して静脈で免疫化されないマウス(naive mouse)に移入して、24時間または48時間後に脾臓細胞の免疫細胞中でCFSE+細胞上の補助刺激分子をフローサイトメーターで分析した。その結果、CD80はどんな変化もなかったが、CD86は高いレベルで発現が誘導され(図3参照)CD40及びMHC class II分子も弱く増加した。すなわち、B/αGalCerを体内に投与すると、24時間または48時間後にB細胞が活性化することを確認した。
【0025】
本発明者等は、アルファガラクトシルセラミドとMHC I分子に結合する抗原のエピトープペプチドをB細胞に一緒に積載することで、ペプチド特異的なCD8+T細胞を刺激して抗原特異的な細胞分解を起こすことができるかどうか調べた。そのために、CFSEで標識されたOVA特異的なCD8+T細胞をマウスに移植した後、B細胞単独、B/αGalCer、ビヒクル+ペプチドを添加したB細胞(B/pep)またはαGalCer+ペプチドを添加したB細胞(B/αGalCer/pep)を静脈注射して、脾臓とリンパ節から取得したリンパ球からCD8+T細胞反応を測定した。その結果、B細胞単独またはB/αGalCerを投与した群では、OVA特異的なCD8+T細胞の分裂がほとんど誘導されず、B/pepを投与した群では相当に多いCD8+T細胞の分裂を誘導し、B/αGalCer/pepを投与した群では細胞の顕著な分裂が現れ、分裂した細胞の40%以上がIL-2を生成し、90%以上がIFN-γを生成し、そのレベルがB/pep群に比べて非常に高かった(図4参照)。前記結果は、B細胞にアルファガラクトシルセラミドとペプチドを一緒に積載することで、CD8+T細胞をずっと高いレベルで活性化させることができることを示す。
【0026】
本発明者等は、マウスにB細胞単独、B/αGalCer、B/pepまたはB/αGalCer/pepを各々静脈投与した後、細胞毒性免疫反応を誘導することができるかどうかを調べるために、細胞毒性Tリンパ球活性を測定した。その結果、B/αGalCer/pepを投与した群でのみ、ペプチドが積載された標的を完全に破壊し(図5)、ペプチドに対するIFN-γを生成するCD8+T細胞が顕著に増加することを観察した(図6、左側)。また、同一抗原で体外で再刺激した場合、B細胞単独またはB/αGalCerを投与したマウスの場合には、正常に免疫反応が誘導されてペプチド特異的なIFN-γを生産するCD8+T細胞を誘導した一方(図6、右側)、B/pepを投与したマウスはIFN-γを生産するCD8+T細胞の増加が見られず、B/αGalCer/pepを投与したマウスはB細胞単独またはB/αGalCerを投与した群に比べて非常に多いペプチドに反応するCD8+T細胞を形成した。
【0027】
本発明者等は、B細胞を媒介にするワクチンの細胞毒性効果を樹状細胞ワクチンの細胞毒性効果と比べるために、細胞毒性Tリンパ球分析を使用して、完全に標的を溶解するのに必要な最小限の細胞数を測定した。その結果、樹状細胞の広い表面積を考慮する時、B/αGalCer/pep投与群は、DC/αGalCer/pep投与群と類似の効率で体内で細胞毒性を起こすことを確認した。これと共に、体内細胞毒性の効果がDC/pepとDC/αGalCer/pep投与群が類似していたが、これはαGalCerを樹状細胞に積載することが、ペプチドを積載した樹状細胞のワクチン効率を増加させないということを意味する。
【0028】
本発明者等は、細胞毒性Tリンパ球反応を誘導するのに関与する免疫細胞の種類を確認するために、各々の免疫細胞を除去する抗体を投与した後、B/αGalCer/pepで免疫化した。その結果、CD4+T細胞またはNK1.1細胞除去が、細胞毒性Tリンパ球反応誘導を阻害しない一方、CD8+T細胞を除去すると標的細胞の破壊が起きなかった(図9)。
【0029】
本発明者等は、ペプチドを積載したB細胞が抗原提示細胞として機能するのか、そうでなければB細胞が運んだペプチドを樹状細胞が回収して細胞毒性Tリンパ球反応を誘導するのかを調べた。そのために、OVAのCTLエピトープペプチドをMHC Iに積載することができるが、H-2K領域の突然変異によってCD8+T細胞がMHC I-ペプチド複合体を認識することができないbm-1マウスから取得したB細胞を使用した結果、前記細胞は、αGalCerと反応してナチュラルキラーT細胞の活性化を刺激することを確認した。また、野生型のB細胞から準備したB/αGalCer/pepを野生型マウスに注射すると、体内でOVA特異的な細胞毒性が完璧に生成されるが、bm-1マウスのB細胞から準備したB/αGalCer/pepを野生型マウスに注射すると、OVA特異的な細胞毒性活性を生成することができないので、B細胞が抗原提示細胞として機能することを確認した(図11)。
【0030】
続いて、本発明者等は、αGalCerとペプチドを個別に投与した場合、そして一緒に投与した場合に、細胞毒性Tリンパ球を形成することができるかどうかを調査した。その結果、B/αGalCerとB/pepを一緒に投与したマウスでは、体内細胞毒性が全く誘導されないことを確認した(図12)。これは、ペプチドとαGalCerが同一なB細胞によって提示されることが、OVA特異的な細胞毒性を生成するのに必須であることを示す。
【0031】
本発明者等は、B/αGalCer/pepのワクチン投与が、抗癌免疫を誘導するかどうか調査した。まず、予防的抗癌免疫活性を試験するために、B細胞単独、B/αGalCer、B/pep、B/αGalCer/pep、DC/pep、またはDC/αGalCer/pepワクチンを投与してOVAを形質導入した黒色腫を皮下に移植した。その結果、B/αGalCerを投与したマウスでは癌を形成した一方、B/αGalCer/pep、DC/pep、またはDC/αGalCer/pepを投与したマウスでは癌が成長しなかった(図13参照)。続いて、最初に癌を移植してから70日になる時点で、生存したマウスに癌細胞を再び移植した結果、癌の成長が現れなかったが、これは、B/αGalCer/pepワクチン投与によって前記癌に対する記憶免疫反応を確立したことを示唆する(図14参照)。
【0032】
次に、B/αGalCer/pepワクチンを投与することで、すでに存在している癌を除去することができるかどうか調べたが、DC/pep、DC/αGalCer/pepまたはB/αGalCer/pepワクチンを投与したマウスは、完璧に癌の成長を減少させることを観察した(図15及び図16参照)。
【0033】
本発明者等は、B細胞を媒介にするワクチン投与が、実際に癌抗原に適用され得るかどうかを調べるために、Her-2/neuモデルを使用した結果、αGalCer及びHer-2/neu63-71を提示するB細胞を投与したマウス群で、体内Her-2/neuに対する細胞毒性が有意な水準で示されることを確認した(図17参照)。また、Her-2/neuを発現する癌細胞をマウスに注入した後、B細胞ワクチンを投与した結果、B/αGalCerまたはB/pepワクチン投与した場合には、B細胞単独投与群と比べて生存期間が若干延長されることが確認され(図18参照)、αGalCerとHer-2/neu63-71を積載したB細胞を投与したマウスは、全体の実験期間の間生存することを観察した。また、癌を有したマウスをB細胞ワクチンまたは樹状細胞ワクチンで免疫化すると、αGalCerとHer-2/neu63-71を積載したB細胞投与群は、樹状細胞ワクチンと類似の水準でHer-2/neuを発現する癌細胞の成長を抑制することを確認することができた(図19参照)。
【0034】
したがって、本発明のB細胞を媒介にするワクチン投与は、抗癌免疫の予防効果及び治療効果において樹状細胞を基盤にするワクチン程度に効率的であることを立証した。
【0035】
また、本発明は、ナチュラルキラーT細胞のリガンドを積載して抗原を発現するB細胞を含む免疫予防及び治療用ワクチン及び抗癌用ワクチンを提供する。
【0036】
ペプチドを積載した細胞ワクチンに比べてウイルスを媒介として全体抗原を導入した細胞ワクチンは、主組織適合性複合体の一倍体型に限らず、すべての人に適用可能であり、多くの抗原決定基に特異的な免疫反応を誘導することができる。特に、体液性免疫反応と細胞性免疫反応を同時に誘導することができるという長所がある。腫瘍関連抗原であるHer-2/neuを標的にしてHer-2/neuの細胞外領域及び細胞膜領域を発現する遺伝子を有したアデノウイルス(AdHM)でB細胞を感染させた結果、B細胞がアルファガラクトシルセラミドを提示するにおいても、特別な影響を及ぼさないことを確認した(図21参照)。また、免疫化して1週間過ぎた時点で、BとB/αGalCerで免疫化されたマウス群では、標的細胞の分解を観察することができなかった一方、B/AdHMとB/AdHM/αGalCerで免疫化されたマウス群では、細胞毒性T細胞反応を確認することができた(図22及び図24参照)。
【0037】
アルファガラクトシルセラミド(αGalCer)が積載されたアデノウイルスで形質導入されたB細胞(B/AdHM/αGalCer)は、アデノウイルスで導入したB細胞(B/AdHM)に比べて、細胞毒性T細胞反応が多少高く長期間持続する傾向性を見せるが、有意な水準の差が現れないことから、細胞毒性T細胞反応を誘導するのにおいてペプチドを積載したB細胞ワクチンとは異なり、アルファガラクトシルセラミドの積載が決定的な役割を担当しないことを示している。しかし、アルファガラクトシルセラミドが積載されたB細胞ワクチンをマウスに投与すると、形質導入だけされたB細胞ワクチン投与群とは異なり、体内でNKT細胞を刺激して結果的にナチュラルキラー細胞を活性化させることを確認した(図25参照)。
【0038】
本発明者等は、B細胞ワクチンが細胞毒性T細胞を誘導する効率性を測定するために、完全な細胞毒性T細胞を誘導する水準以下で細胞ワクチンを投与した時に誘導される標的細胞の溶解程度を比較した。その結果、アデノウイルスで形質導入されたB細胞(B/AdHM)の場合、全体細胞数の約20%程度だけが抗原提示細胞で機能することを勘案すると、抗原をアデノウイルスで導入したB細胞ワクチンは、ペプチドが積載されたB細胞ワクチンに比べて多数のB細胞投与が必要であるにもかかわらず、効率的に抗原特異的な細胞毒性T細胞反応を誘導することができると判断される。また、少数のB細胞が投与された時、アルファガラクトシルセラミドの積載でNKTの助けを受ける場合、標的細胞を溶解するのに多少有利であることを確認した。
【0039】
前記で癌抗原発現のためにB細胞に導入するウイルスは、アデノウイルス、レトロウイルス、ワクシニアウイルス、ポックスウイルス(Pox virus)、シンドビスウイルス等が可能だが、これに限定されない。ウイルスを使用した方法以外にも、抗原遺伝子伝達で適用可能なものは、1)DNAをリポソーム(liposome)に結合させて形質導入して酵素分解からDNAを保護したりエンドソーム(endosome)で吸収するようにする方法、2)DNAにタンパク質で構成された分子コンジュゲート(molecular conjugate)や合成リガンドを結合して細胞でDNAの伝達効率を高める方法[例:アシアログリコプロテイン(Asialoglycoprotein)、トランスフェリン(transferrin)、ポリマーIgA(polymeric IgA)]、3)PTD(Protein transduction domain)を使用した新しいDNA伝達システムで、細胞でDNAの伝達効率を高めることで、抗原遺伝子を伝達する方法[例:Mph-1]、4)前記方法以外にも、ペプチドを使用したり抗原タンパク質をB細胞に適用することで、B細胞が抗原を提示するようにできる。
【0040】
また、本発明は、アルファガラクトシルセラミドが積載されたB細胞を媒介にするナチュラルキラーT細胞活性化剤を提供する。
【0041】
前記と同様に、本発明のアルファガラクトシルセラミドが積載されたB細胞は、樹状細胞と同じく生体外でナチュラルキラーT細胞ハイブリドーマを刺激してIL-2を生成し(図30参照)、生体内でも不変性ナチュラルキラーT細胞を活性化して結果的に免疫細胞の活性を誘導した(図2参照)。したがって、本発明のアルファガラクトシルセラミドが積載されたB細胞は、既存の樹状細胞と同じくナチュラルキラーT細胞活性化剤として使用することができる。
【0042】
併せて、本発明は、癌抗原を発現するB細胞を含む細胞毒性反応誘導剤を提供する。
【0043】
アデノウイルスで形質導入されたB細胞ワクチンは、細胞性免疫反応を誘導するためにペプチドを積載したB細胞ワクチンとは異なり、細胞性免疫反応及び体液性免疫反応を同時に誘導することができるという長所がある。AdHMで形質導入されたB細胞ワクチンが、Her-2/neu特異的な抗体を誘導することができるかどうかを調べるために、マウスをB/AdHM及びB/AdHM/αGalCerで各々免疫化させた後、血清中の抗-Her-2/neu抗体の力価を測定した結果、B/AdHM及びB/AdHM/αGalCerの二つの集団全てで、長い間抗-Her-2/neu抗体が高い力価で維持されることが観察され(図27参照)、B細胞(B)及びB/αGalCerと異なりB/AdHM及びB/AdHM/αGalCerワクチン投与集団では、全て体液性免疫反応が生成されることを確認した(図28参照)。
【0044】
本発明者等は、マウスをB細胞ワクチンで免疫化した後、7日目にHer-2/neuを発現するマウス癌細胞(TAUF)を静脈注射して生存率を測定した結果、B細胞だけ投与を受けたマウス群に比べて、アルファガラクトシルセラミドを積載したB細胞(B/αGalCer)の投与を受けたマウス群で、生存期間が多少延長され、癌抗原を発現するアデノウイルスで形質導入されたB細胞ワクチンで免疫化されたマウスで、すぐれた抗癌予防効果を確認することができた(図29参照)。したがって、アルファガラクトシルセラミドを積載してアデノウイルスで形質導入されたB細胞ワクチンに誘導された免疫反応が、効果的に癌を予防するということが分かった。
【0045】
次に、B細胞ワクチンの治療効果を確認するために、BALB/cマウスを、B、B/αGalCer、B/AdHM、B/AdHM/αGalCerに各々免疫化した後、癌細胞(TAUF)を尾静脈に注射して肺癌を誘導した結果、B細胞だけ単独で投与を受けたマウス群が一番短い生存期間を示し、B/αGalCerワクチン投与群もこれに似た傾向が観察された。B/AdHMワクチンで免疫化されたマウス群は、B、B/αGalCer投与群に比べて生存期間が延長されたが、完璧に癌の生成を抑制することはできなかった。一方、B/AdHM/αGalCer投与群は、他の投与群に比べて生存期間が有意的に増加した。したがって、B、B/αGalCerまたはB/AdHMの免疫化で誘導される抗癌効果に比べて優れた効果を示すことを確認した(図29参照)。
【0046】
本発明のワクチンは、ナチュラルキラーT細胞のリガンドとB細胞に追加で同一または類似の機能を示す有効成分を1種以上含むことができる。前記ワクチンは、投与のために前記記載した有効成分以外に追加で薬剤学的で許容可能な担体を1種以上含んで製造することができる。薬剤学的に許容可能な担体は、食塩水、リンゲル液、緩衝食塩水、デキストロース溶液、マルトデキストリン溶液、グリセロール、エチルアルコール及びこれら成分中の1成分以上を混合して使用することができ、必要によって抗酸化剤、緩衝液、整菌剤等、他の通常の添加剤成分を添加することができる。また希釈剤、分散剤、界面活性剤、結合剤及び潤滑剤を付加的に添加して、水溶液、懸濁液、乳濁液等のような注射用剤形等に製剤化することができる。一歩進んで、当分野の適正な方法でまたはレミントン(Remington's Pharmaceutical Science(最近版)、Mack Publishing Company、Easton PA)に開示されている方法を使用して、各疾患によってまたは成分によって好ましく製剤化できる。
【0047】
本発明のワクチンは、非経口で投与することができ、非経口投与は、皮下注射、静脈注射、筋肉内注射または胸部内注射注入方式による。非経口投与用剤形に製剤化するためには、本発明のナチュラルキラーT細胞のリガンドを積載したB細胞、ナチュラルキラーT細胞のリガンドとペプチドを積載したB細胞または癌抗原を発現するウイルスで感染されたB細胞は、安定剤または緩衝剤とともに混合して、溶液または懸濁液に製造して、それをアンプルまたはバイアルの単位投与型に製剤化する(既存の樹状細胞の形質導入に適用されるウイルスベクターの基準を参照)。
【0048】
ワクチンは、患者において免疫反応を刺激するのに効果的な量で投与することができる。例えば、ワクチンは、ヒトに一回ないし数回で投与することができ、投与量は細胞数が1×103個/kg〜1×109/kg個、好ましくは1×104個/kg〜1×108個/kgである。アルファガラクトシルセラミドを積載したB細胞ワクチンを製作する場合、B細胞1×106〜1×107個/ml当たりアルファガラクトシルセラミド1〜2μg/mlが入った培地を使用して培養する。アルファガラクトシルセラミドとペプチドを積載したB細胞ワクチンを製作する場合、B細胞1×106〜1×107個/ml当たりアルファガラクトシルセラミド1〜2μg/mlが入った培地を使用して、ペプチドはB細胞1×106〜1×107個/mlを1〜10μg/mlペプチドが含まれた培地で培養して細胞に積載させる。
【0049】
アルファガラクトシルセラミドは、げっ歯類及び猿で毒性を誘導しないものとみられている(Nakata等,Cancer Res.,1998年,第58巻,1202-1207頁)。2200μg/KgのαGalCerが注入されたマウスでも、副作用は報告されていない(Giaccone等、Clin.Cancer Res.,2002年,第8巻,3702頁)。進行中の臨床試験でも、αGalCerの全身投与によって軽微な頭痛のような副作用が一部報告されたが(Mie Nieda等,Blood,2004年,第103巻,383-389頁;Giaccone等,Clin.Cancer Res.,2002年,第8巻,3702頁)、パラセタモール(paracetamol)の投与によって予防することができ、これら対象においても微弱な全身的副作用が必ず現れるのではない(Giaccone等、Clin.Cancer Res.,2000年,第8巻,3702頁)。本発明でも、αGalCerは、用量制限毒性(dose-limiting toxicity)(50-4800μg/m2)を惹起しないで、用量増加実験(dose escalation study)でも耐性を示し、αGalCerは安全な物質であると判断される。
【0050】
前記でペプチドは、ウイルス、バクテリア、菌類、寄生虫及び癌由来の抗原ペプチドが含まれ、ウイルスを媒介にして発現が誘導された抗原は、ウイルス、バクテリア、菌類、寄生虫及び癌由来の抗原が含まれる。
【0051】
「抗原」は、宿主の体内に入って来た時、宿主の免疫系によって認識されて免疫反応を起こすことができるすべての物質(例えば、タンパク質、ペプチド、癌細胞、糖蛋白質、糖脂質、生ウイルス、死ウイルス、DNA等)を意味する。抗原はまた、精製されたまたは精製されない形態で提供することができ、精製された形態で提供されることが好ましい。本発明は、病原体のタンパク質、組換えタンパク質、ペプチド、多糖類、糖蛋白質、脂質多糖類及びDNA分子(ポリヌクレオチド)、癌細胞、生ウイルス、死ウイルスを含む抗原にも適用することができる。
【0052】
下記の抗原リストは、実施例の癌抗原の代わりをして免疫反応を誘導する手段として提供でき、これに制限されるものではない:インフルエンザウイルス(influenza virus)抗原(haemagglutinin及びneuraminidase抗原)、百日咳菌(Bordetella pertussis)抗原(pertussis toxin、filamentous haemagglutinin、pertactin)、ヒトパピロマウイルス(human papilloma virus、HPV)抗原(glycoprotein)、ヘリコバクテリアピロリ(Helicobacterpylori)抗原(capsula polysaccharides of serogrupA,B,C,Y及びW-135)、破傷風菌抗原(tetanus toxoid)、ジフテリア菌(diphtheria)抗原(diphtheria toxoid)、肺炎菌(pneumococcal)抗原(Streptococcus pnemoniae type 3 capsular polysaccharide)、結核菌(tuberculosis)抗原、ヒト免疫欠乏ウイルス(human immunodeficiency virus、HIV)抗原(GP-120、GP-160,p18,Tat,Gag,Pol,Env)、コレラ(cholera)抗原(cholera toxin B subunit)、葡萄状球菌(staphylococcal)抗原(staphylococcal enterotoxin B)、赤痢菌(shigella)抗原(shigella polysaccharides)、小水疱性口内炎ウイルス(vesicular stomatitis virus)抗原(vesicular stomatitis virus glycoprotein)、サイトメガロウイルス(cytomegalovirus,CMV)抗原、肝炎ウイルス(hepatitis)抗原(hepatitis A(HAV),B(HBV),C(HCV),D(HDV)及びG(HGV)抗原)(core antigen and surface antigen)、呼吸器多核体ウイルス(respiratory synctytial virus、RSV)抗原、ヘルペスシンプレックス(herpes simplex)抗原またはその組み合わせ(例、ジフテリア、百日咳菌及び破傷風菌、DPT)、ボレリア(Borrelia sp.)抗原(例、OspA、OspB、OspC antigen)、カンジダ(Candida albicans)抗原(例、MP65)、プラスモジウム(Plasmodium)抗原(例、CS プロテイン)。
【0053】
癌抗原は、正常な遺伝子の体細胞変異の結果生成されて、癌細胞の遺伝的不安定性に起因する産物である癌特異抗原(tumor-specific antigen)と癌抗原の大部分を占めて癌細胞で発現が増加する抗原で、発生段階で一時的に発現されたり特定組職にだけ発現されるタンパク質で、正常に体内に存在する自家抗原である癌共有抗原が含まれる。癌特異抗原の例としては、HPV E6/E7等の癌ウイルスによる癌抗原があり、癌共有抗原の例としては、gp100、チロシナーゼ(tyrosinase)、TRP-1(tyrosinase-related protein-1)、TRP-2(tyrosinase-related protein-2)、MAGE、MUC-1、CEA(arcinoembryonic antigen)、p53、アルファ-フェトプロテイン(alpha-fetoprotein)及びHer-2/neu等がある(Rosenberg SA.,Nature,2001年,第17;411(6835)巻,380-4頁)。
【図面の簡単な説明】
【0054】
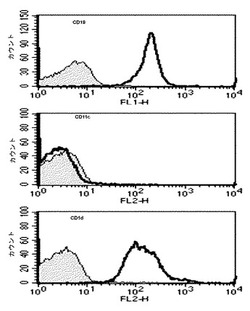
【図1】アルファガラクトシルセラミド(αGalCer)が積載されたB細胞及びナチュラルキラーT細胞(iNKT)間での両方向活性化を示す図である。CD11c+細胞を除去した後、マウスの脾臓からB細胞を純粋分離した後、フローサイトメーターでCD19、CD11c及びCD1dの発現を測定した結果を示したグラフである。
【図2】アルファガラクトシルセラミド(αGalCer)が積載されたB細胞及びナチュラルキラーT細胞(iNKT)間での両方向活性化を示す図である。C57BL/6野生型またはJα281-/-マウスにビヒクル単独、αGalCer、αGalCerが積載されたB細胞(B/αGalCer)または樹状細胞(DC/αGalCer)を投与した後、IL-4またはIFN-γを生成する細胞の数をELISPOTで分析した結果を示したグラフである。
【図3】アルファガラクトシルセラミド(αGalCer)が積載されたB細胞及びナチュラルキラーT細胞(iNKT)間での両方向活性化を示す図である。ビヒクルまたはαGalCerが積載されたB細胞をCFSEで標識してC57BL/6マウスに投与した後、脾臓細胞から分離したCFSE+細胞を分析した結果を示したグラフである。
【図4】ペプチド(OVA257-264)とαGalCerが一緒に積載されたB細胞によるペプチド特異的なCD8+T細胞の活性化を示した図である。CFSEで標識されたOVA257-264に特異的なCD8+T細胞(OT-IT細胞)をC57BL/6マウスに移植した後、ビヒクル単独、B/αGalCer、B/pep、またはB/αGalCer/pepを投与した後、OT-IT細胞の分裂とサイトカイン生成をフローサイトメーターで測定した結果を示したグラフである。
【図5】ペプチド(OVA257-264)とαGalCerが一緒に積載されたB細胞によるペプチド特異的なCD8+T細胞の活性化を示した図である。C57BL/6マウスにB細胞単独、B/αGalCer、B/pepまたはB/αGalCer/pepを投与した後、1週、3週、または5週後にCFSEで標識された同種の標的を注入して生体内の細胞毒性Tリンパ球活性を測定した結果を示したグラフである。CFSEhigh:ペプチドが積載された標的群CFSElow:ペプチドが積載されない対照群。
【図6】ペプチド(OVA257-264)とαGalCerが一緒に積載されたB細胞によるペプチド特異的なCD8+T細胞の活性化を示した図である。生体内にB細胞ワクチンを投与して7日後にマウスの脾臓細胞を分離して、IFN-γを生成するCD8+T細胞の反応を測定したもの(左側)と、それを体外でOVA257-264を積載した同種の脾臓細胞に再刺激した場合に現れるIFN-γを生成するCD8+T細胞の数を測定した(右側)グラフである。
【図7】B細胞を媒介にする細胞ワクチン及び樹状細胞(DC)を媒介にする細胞ワクチンとの細胞毒性Tリンパ球形成における効率性比較を示した図である。OVA257-264ペプチドが積載されたB/αGalCer/pep及びDC/αGalCer/pepを順次に希釈してマウスに投与して以後、OVA257-264ペプチドに対する生体内細胞毒性Tリンパ球活性を測定したグラフである。
【図8】B細胞を媒介にする細胞ワクチン及び樹状細胞(DC)を媒介にする細胞ワクチンとの細胞毒性Tリンパ球形成における効率性比較を示した図である。OVA257-264ペプチドとビヒクルが積載されたB/ビヒクル/pep及びDC/ビヒクル/pepを前記のような方法で投与することで誘導される、OVA257-264ペプチドに対する生体内細胞毒性Tリンパ球活性を示したグラフである。
【図9】B細胞を媒介にするワクチンによって細胞毒性Tリンパ球反応を誘導するのに関与する免疫細胞の種類を示した図である。αGalCerとOVA257-264ペプチドが一緒に積載されたB細胞を投与する前または後に、特定免疫細胞を除去する抗体を注入した後、OVA257-264ペプチドに対する生体内細胞毒性Tリンパ球活性を示したグラフである。
【図10】B細胞を媒介にするワクチンによって細胞毒性Tリンパ球反応を誘導するのに関与する免疫細胞の種類を示した図である。野生型、Jα281-/-、またはMHC classII-/-マウスにαGalCerとOVA257-264ペプチドが一緒に積載されたB細胞を投与した後、OVA257-264ペプチドに対する生体の外細胞毒性を標準51Cr放出分析を実施して示したグラフである。
【図11】αGalCerとOVA257-264ペプチドが一緒に積載されたB細胞が、CD8+T細胞に直接的な抗原提示細胞として作用するということを示した図である。野生型またはbm-1マウスから分離したB細胞にαGalCerとOVA257-264ペプチドを一緒に積載した後、各々野生型マウスに投与した後、OVA257-264ペプチドに対する生体内細胞毒性を測定した結果を示したグラフである。
【図12】αGalCerとOVA257-264ペプチドが一緒に積載されたB細胞が、CD8+T細胞に直接的な抗原提示細胞として作用するということを示した図である。αGalCerとOVA257-264ペプチドが一緒に積載されたB細胞またはOVA257-264ペプチドが積載されたB細胞とαGalCerが積載されたB細胞を使用して、各々C57BL/6マウスを免疫化した後、誘導されるOVA257-264ペプチドに対する生体内細胞毒性を示したグラフである。
【図13】B細胞を媒介にするワクチンが、OVAを発現するB16黒色腫瘍に対する予防的及び治療的抗癌免疫活性を提供するということを示した図である。C57BL/6マウスをB細胞単独、B/αGalCer、B/pep、B/αGalCer/pep、DC/pep、またはDC/αGalCer/pepで免疫化させた後、7日後にMO-5癌細胞を前記マウス皮下に移植してマウスの腫瘍大きさを測定した結果を示したグラフである。
【図14】B細胞を媒介にするワクチンが、OVAを発現するB16黒色腫瘍に対する予防的及び治療的抗癌免疫活性を提供するということを示した図である。図13で腫瘍が生成されないマウスに最初の腫瘍を移植してから70日後、MO-5細胞(2×105個)を再移植して腫瘍大きさを測定して示したグラフである。
【図15】B細胞を媒介にするワクチンが、OVAを発現するB16黒色腫瘍に対する予防的及び治療的抗癌免疫活性を提供するということを示した図である。C57BL/6マウスにMO-5癌細胞(2×105個)を皮下に移植して、1日後と9日後にB細胞単独、B/αGalCer、B/pep、B/αGalCer/pep、DC/pep、またはDC/αGalCer/pepで各々免疫化してマウスの腫瘍大きさを測定した結果を示したグラフである。*、p<0.05:「B細胞単独」対照群(図13、図15及び図16)または週齢が補正されたワクチン投与を受けないマウス群(図14)との有意的な差を示す。
【図16】B細胞を媒介にするワクチンが、OVAを発現するB16黒色腫瘍に対する予防的及び治療的抗癌免疫活性を提供するということを示した図である。C57BL/6マウスにMO-5癌細胞(2×105個)を皮下に移植して、1日後と9日後にB細胞単独、B/αGalCer、B/pep、B/αGalCer/pep、DC/pep、またはDC/αGalCer/pepで各々免疫化してマウスの腫瘍大きさを測定した結果を示したグラフである。*、p<0.05:「B細胞単独」対照群(図13、図15及び図16)または週齢が補正されたワクチン投与を受けないマウス群(図14)との有意的な差を示す。
【図17】B細胞を媒介にするワクチンが、実際癌抗原であるHer-2/neuを発現する腫瘍で抗癌免疫反応を誘導するということを示した結果である。B細胞単独、αGalCerが積載されたB細胞、Her-2/neu63-71(hP63)が積載されたB細胞、αGalCerとhP63が一緒に積載されたB細胞、hP63が積載された樹状細胞、αGalCerとhP63が一緒に積載された樹状細胞を、各々BALB/cマウスに免疫化させた後、誘導される生体内細胞毒性を示したグラフである。
【図18】B細胞を媒介にするワクチンが、実際癌抗原であるHer-2/neuを発現する腫瘍で抗癌免疫反応を誘導するということを示した結果である。前記のような方法でCT-26-Her2/neuを尾静脈(図18)または皮下(図19)に移植した後、前記B細胞または樹状細胞(DC)で免疫化させた後、マウスの生存率(図18)または腫瘍の大きさ(図19)を測定した結果を示したグラフである。
【図19】B細胞を媒介にするワクチンが、実際癌抗原であるHer-2/neuを発現する腫瘍で抗癌免疫反応を誘導するということを示した結果である。前記のような方法でCT-26-Her2/neuを尾静脈(図18)または皮下(図19)に移植した後、前記B細胞または樹状細胞(DC)で免疫化させた後、マウスの生存率(図18)または腫瘍の大きさ(図19)を測定した結果を示したグラフである。
【図20】B細胞にウイルスで全体抗原を形質導入する方法を、B細胞ワクチンに適用することができるかどうかを確認した図である。腫瘍関連抗原であるHer-2/neuの細胞外領域と細胞膜領域を発現することができるアデノウイルス(AdHM)を、B細胞に感染させた後、B細胞表面に発現されるHer-2/neuを測定して示したグラフである。
【図21】B細胞にウイルスで全体抗原を形質導入する方法を、B細胞ワクチンに適用することができるかどうかを確認した図である。AdHMで形質転換されたB細胞がαGalCerを積載してDN32.D3細胞を活性化することができることを示した実験で、B細胞、αGalCerを積載したB細胞、AdHMで形質転換されたB細胞、そしてAdHMで形質転換してαGalCerを積載したB細胞とDN32.D3細胞を一緒に培養した培養上層液のIL-2をエライザ(ELISA)で測定して示したグラフである。
【図22】腫瘍関連抗原であるHer-2/neuで形質導入されたB細胞がマウスで効果的に細胞毒性免疫反応を誘導するかどうかを示した図である。BALB/cマウスの脾臓細胞から分離したB細胞にアデノウイルスで形質導入された細胞(B/AdHM)、追加的にαGalCerを積載した細胞(B/AdHM/αGalCer)、B細胞単独及びB/αGalCerで各々免疫化させた後、細胞毒性T細胞の抗原決定ペプチドを積載した標的細胞を移植した後、体内で誘導された抗原特異的な細胞毒性Tリンパ球反応を測定して示したグラフである。
【図23】腫瘍関連抗原であるHer-2/neuで形質導入されたB細胞がマウスで効果的に細胞毒性免疫反応を誘導するかどうかを示した図である。B/AdHM及びB/AdHM/αGalCerワクチンで各々マウスを免疫化させた後、細胞毒性T細胞反応が長期間持続することを示したグラフである。
【図24】腫瘍関連抗原であるHer-2/neuで形質導入されたB細胞がマウスで効果的に細胞毒性免疫反応を誘導するかどうかを示した図である。B/AdHM及びB/AdHM/αGalCerワクチンで各々マウスを免疫化させた後、体外で細胞毒性T細胞ペプチドで刺激した時または刺激しなかった時、CD8+T細胞のIFN-γの生成を測定結果を示したグラフである。対照群:ワクチン投与を受けていないマウス群。
【図25】アデノウイルスで形質導入されたB細胞(B/AdHM及び B/AdHM/αGalCer)ワクチンによってナチュラルキラー(NK)細胞の活性化が誘導されて、細胞毒性T細胞が効率的に作用することを示した図である。ナチュラルキラー細胞の活性化を示したグラフである。
【図26】アデノウイルスで形質導入されたB細胞(B/AdHM及び B/AdHM/αGalCer)ワクチンによってナチュラルキラー(NK)細胞の活性化が誘導されて、細胞毒性T細胞が効率的に作用することを示した図である。ワクチン集団間で細胞毒性T細胞を誘導する効率性を測定するために、細胞ワクチンの濃度によって誘導される標的細胞の溶解度を示したグラフである。
【図27】AdHMで形質導入されたB細胞(B/AdHM及びB/AdHM/αGalCer)ワクチンが、Her-2/neuに特異的な抗体誘導を示す結果である。BALB/cマウスにB/AdHM及びB/AdHM/αGalCerで各々免疫化させた後、血清内の抗Her-2/neu抗体がHer-2/neuを表面に発現するマウス癌細胞であるTAUF細胞に結合する程度で、抗-Her-2/neu抗体の力価を測定した結果を示したグラフである。
【図28】AdHMで形質導入されたB細胞(B/AdHM及びB/AdHM/αGalCer)ワクチンが、Her-2/neuに特異的な抗体誘導を示す結果である。各群での体液性免疫反応を示したグラフである。
【図29】アデノウイルスで形質導入されたB細胞ワクチンの抗癌活性を示したもので、Her-2/neuを発現するマウス癌細胞を投与して肺癌を誘導したマウスを、B細胞ワクチンで免疫化させた結果を示したグラフである。
【図30】ナチュラルキラーT細胞の活性化指標であるIL-2を生成するにおいて、αGalCer濃度によってαGalCerを積載したB細胞が、ナチュラルキラーT細胞を活性化させてIL-2生成を誘導する程度及び、細胞数にしたがってαGalCerを積載したBまたは樹状細胞(DC)がナチュラルキラーT細胞を活性化する程度を示した図である。
【図31】生体内にCD4+、CD8+、またはNK1.1細胞を除去することができる抗体を投与して、特定免疫細胞が除去される現象を示したグラフである。
【図32】生体内にCD4+、CD8+、またはNK1.1細胞を除去することができる抗体を投与して、特定免疫細胞が除去される現象を示したグラフである。
【図33】生体内にCD4+、CD8+、またはNK1.1細胞を除去することができる抗体を投与して、特定免疫細胞が除去される現象を示したグラフである。
【図34】生体内にCD4+、CD8+、またはNK1.1細胞を除去することができる抗体を投与して、特定免疫細胞が除去される現象を示したグラフである。
【図35】生体内にCD4+、CD8+、またはNK1.1細胞を除去することができる抗体を投与して、特定免疫細胞が除去される現象を示したグラフである。
【図36】胸線腫(EG-7)に対するB細胞を媒介にする細胞ワクチンの抗癌免疫活性を示した図である。*、p<0.001:B細胞単独処理された群との統計的な有意性。
【発明を実施するための形態】
【0055】
以下、本発明を実施例によって詳しく説明する。
但し、下記の実施例は本発明を例示するだけのものであって、本発明の内容が下記の実施例に限定されるものではない。
【実施例】
【0056】
<実施例1>アルファガラクトシルセラミドを積載したB細胞及びナチュラルキラーT細胞間での両方向活性化
<1-1>B細胞と樹状細胞のナチュラルキラーT細胞活性化効果の比較
アルファガラクトシルセラミド(Kim,S.,等,Synthesis,2004年,847頁)が積載された樹状細胞(dendritic cell、DC)が、不変性ナチュラルキラーT(iNKT)細胞を活性化させるということは公知の事実なので、本発明ではまず、このようなアルファガラクトシルセラミドが積載されたB細胞が前記の樹状細胞と類似の効果を示すかどうか確認して見た。
【0057】
本発明では、6-10週齢のメスのC57BL/6とBALB/cを使用した。OT-I及びC57BL/6bm1(bm1)マウスは、ジャクソン研究所(The Jackson Laboratory)から購入し、Jα281-/-マウス及び MHC II-/-マウスは、各々ソウル大学校ジョン・ドヒョン教授(Kim JH等,Am J Pathol.,2005年,第167(5)巻,1231-41頁)と高麗大学校パク・セホ教授(Park,S.H.,等,J.Exp.Med.,2001年,第193巻,893頁)から提供を受けた。すべてのマウスは、ソウル大学校薬学研究所動物センターの特定病原体がない条件(specific pathogen-free condition)下で保存した。また、抗体等は、GK1.5(抗-CD4:ATCC number:TIB-207)、2.43(抗-CD8;ATCC number:TIB-210)及びPK136(抗-NK1.1;ATCC number:HB-191)ハイブリドーマから取得し、生体内で各々に対するリンパ球を除去するためにマウス当り150μgずつを腹腔に投与した。
【0058】
詳細には、各々のマウスからB細胞を純粋分離するために、マウスから脾臓を摘出した後、均質化(homogenization)して、脾臓細胞から抗-CD11cマイクロビーズ(Miltenyibiotec)でCD11c+細胞を除去した後、抗B220マイクロビーズ(Miltenyibiotec)を使用してB220+細胞を分離した。前記細胞等は、99%以上がCD19を発現する純粋に分離されたB細胞である(図1参照)。
【0059】
脾臓から樹状細胞を分離するために、マウスから摘出された脾臓をコラゲナーゼ(collagenase)D(1mg/ml、ロシュ)及びDNase I(50μg/ml、シグマアルドリッチ)を含んだ7mlの培地を使用して37℃で30分間反応させた後、EDTA(最終濃度10mM、pH7.2)を添加して5分間さらに反応させた。15.5%Accudenz密度勾配(Accurate Chemical & Scientific社)を使用して脾臓から分離した細胞から樹状細胞を分離した。
【0060】
前記のように分離した細胞(B細胞または樹状細胞)は、準備したアルファガラクトシルセラミド(1μg/ml)または溶媒(0.5%ポリソルベート)とともに二酸化炭素培養器で14時間培養した後、ナチュラルキラーT細胞ハイブリドーマ(DN32.D3)(Claire Forestier等,The Journal of Immunology,2003年,第171巻,4096頁)とともに24時間培養した。以後、培養液からナチュラルキラーT細胞ハイブリドーマの活性化指標であるIL-2濃度をサンドイッチエライザ法で測定した。
【0061】
その結果、アルファガラクトシルセラミドを積載した樹状細胞(DC/αGalCer)は、DN32.D3を刺激してIL-2を生成した。これと類似に、アルファガラクトシルセラミドを積載したB細胞(B/αGalCer)も、効率的にDN32.D3を刺激してIL-2を生成した。ハイブリドーマと抗原提示細胞を高い割合で混合したB細胞群で生成されるIL-2レベルは、樹状細胞群で生成されるIL-2の量と等しかったが、低い割合で混合した時は樹状細胞群のIL-2量より少なく現れた(図30参照)。
【0062】
<1-2>ナチュラルキラーT細胞依存的免疫反応活性化確認
本発明では、C57BL/6マウスから取得したB細胞と、DCを使用して製造したB/αGalCerまたはDC/αGalCerを同種のマウスに静脈注射して、エリスポット(ELISPOT)を通じてIL-4及びIFN-γレベルを測定した。詳細には、野生型C57BL/6またはJα281-/-マウスにビヒクル、αGalCer、αGalCerを積載したB細胞またはαGalCerを積載した樹状細胞を静脈注射した。一週間後、脾臓細胞を摘出して単一細胞に作った後にエリスポット用プレートに入れて、ビヒクルまたはαGalCerを入れて6時間培養して刺激した。以後は、製造社(IL-4ELISPOTキット、IFN-γ ELISPOTキット全てR&Dシステム)のマニュアルによって、IL-4とIFN-γを生成する細胞を測定するためのエリスポット試験を実施した。
【0063】
その結果、B/αGalCer及びDC/αGalCerグループ全てで、IL-4及びIFN-γを生成する細胞を顕著に多く誘導した(図2)。しかし、不変性ナチュラルキラーT細胞が欠如したJα281-/-マウスの場合には、正常マウスとは異なり前記のようなサイトカインを生成する細胞が誘導されない。これは、IFN-γとIL-4を生成する細胞が、不変性ナチュラルキラーT細胞依存的に誘導されるということを示唆する(図2参照)。
【0064】
<1-3>ナチュラルキラーT細胞活性化によるB細胞活性化確認
本発明者等は、B細胞を注射すると生体内でどんな変化が起きるのかを調べるために、CFSE(Carboxyfluorescein Succinimidyl Ester)が標識されたB/αGalCerを静脈投与した後、CFSE+細胞で共刺激分子を分析した。詳細には、C57BL/6の脾臓及びリンパ節から単一細胞を取得した後、抗CD11cマイクロビード(Miltenyibiotec)を使用して脾臓及びリンパ器官から分離したリンパ球の中でCD11c+細胞を除去して、抗B220マイクロビード(Miltenyibiotec)を使用してB細胞を分離した後、その細胞を10μMのCFSEで標識して同種マウスの尾静脈にした。CFSE標識は、RPMI培地に適切な濃度でCFSE(Molecular Probe)を希釈して、37℃で15分間培養して標識した後、RPMI培地で3回洗浄して残余のCFSEを除去する方法で実施した。標識してから24時間後と48時間後、前記マウスのリンパ節や脾臓から分離したCFSE+細胞の共刺激分子をフローサイトメーター(flow cytometry)で分析した。
【0065】
その結果、24時間以内にCD80はなんの変化もなかったが、CD86は高いレベルで発現が誘導され、CD40及びMHC IIの発現も弱く増加することを観察することができた(図3)。注射後48時間が経過した後にもCD80の増加は観察されなかったが、その他は24時間のレベルと大部分類似だった。すなわち、24時間以内にB/αGalCerによって活性化したナチュラルキラーT細胞によって投与されたB細胞も活性化になる現象を確認することができた。
【0066】
前記実施例<1-1>、<1-2>と<1-3>の結果によって、B/αGalCer及びDC/αGalCerの全てでナチュラルキラーT細胞を活性化させることができ、B細胞はアルファガラクトシルセラミドを提示受けたナチュラルキラーT細胞によって活性化されるので、前記活性化は両方向で成り立つという事実を確認した。
【0067】
<実施例2>ペプチド及びαGalCerがともに積載されたB細胞によるペプチドに特異的なCD8+T細胞の活性化促進
本発明者等は、アルファガラクトシルセラミド(αGalCer)とMHC IペプチドをB細胞に一緒に積載することで、ペプチドに特異的なCD8+T細胞を刺激してOVA特異的な細胞毒性を起こすことができるかどうかを調べた。
【0068】
そのために、まずCFSEで標識されたOVA特異的なCD8T細胞(OT-I)を、C57BL/6マウスの尾静脈に移植(adoptive transfer)して、一日後にビヒクルを含んだ培地で培養したB細胞(B細胞)、αGalCerを積載したB細胞(B/aGarCer)、OVA257-264ペプチドを積載したB細胞(B/pep)そして、αGalCerとOVA257-264ペプチドを積載したB細胞(B/aGarCer/pep)を静脈注射した。48時間後に脾臓から単一細胞を得た後にOT-I細胞の分裂を観察した。別に、1μMのOVA257-264ペプチドと1μL/mLのGolgiPlμgで4時間培養した後、IL-2とIFN-γを生成するOT-I細胞をCytoperm/Cytofixキット(BD Pharmingen)を使用して細胞内サイトカイン染色法で試験した。
【0069】
その結果、B細胞単独またはB/αGalCerを投与した群では、OVA特異的なCD8+T細胞すなわち、OT-I細胞の分裂がほとんど誘導されなかった。特に、B/αGalCerを投与した群では、弱いながらもOT-I細胞の分裂を示したが(図7、1.2±0.5%vs.5.4±1.8%)、これは抗原非特異的な変化であると思われる。一方、B/pepを投与した群では、相当に多いOT-I細胞の分裂を誘導した。しかし、生体外で同一ペプチドで再刺激すると、このような細胞の極少数だけがIL-2を生成し(<4%)相対的に少ないIFN-γを生成した(38%)。これとは対照的に、B/αGalCer/pepを投与した群では、OT-I細胞の顕著な分裂が現れ、分裂した細胞の40%以上がIL-2を生成して、90%以上がIFN-γを生成し、そのレベルはB/pep群に比べて顕著に高かった(図4)。
【0070】
前記結果は、B/pepとアルファガラクトシルセラミドを一緒に積載することで、CD8+T細胞をずっと高いレベルで活性化させることができることを示している。
【0071】
<実施例3>B/αGalCer/pepによる持続性を有した細胞毒性T細胞反応の誘導及び免疫寛容の克服
<1-1>B/αGalCer/peptideによる持続的細胞毒性T細胞反応の誘導
本発明者等は、C57BL/6マウスにB細胞単独、B/αGalCer、B/pepまたはB/αGalCer/pepを各々静脈投与した後、生体内の細胞毒性Tリンパ球活性を測定して、B細胞ワクチンが細胞毒性免疫反応を誘導することができるかどうかを調べた。また、B細胞ワクチンによって誘導された細胞毒性免疫反応が、持続的に維持されるかどうかを調べた。詳細には、C57BL/6マウスを各々、B単独、B/αGalCer、B/pep及びB/αGalCer/pepで免疫化した後に、1週間、3週間、5週間後に生体内細胞毒性試験(in vivo CTL assay)を実施した。まず、同種の免疫化されていないマウスの脾臓単一細胞を二つのグループに分けた後、一グループはOVA257-264ペプチドを積載した後、20μMのCFSEで標識し(CFSEhigh)、他のグループはペプチド積載なしに2μMのCFSEで標識して対照細胞にした(CFSElow)。前記二つのグループの細胞を同量ずつ混合して免疫化したマウスに注射した後、一日後に脾臓単一細胞を摘出してCFSEhighとCFSElow細胞集団をフローサイトメーターを通じて測定した。ここで、CFSEhighの割合が低いほど細胞毒性免疫反応が大きいことを意味する。
【0072】
その結果、B/αGalCer/pepを投与した群でのみ、ペプチドが積載された標的を完全に破壊し、特異的に一回のワクチン接種以後、5週まで完璧に細胞毒性を示した。一方、B/αGalCerまたはB/pepを投与したマウス群の全てが、ペプチド特異的な細胞毒性T細胞反応が全く誘導されなかった。ただ、B/αGalCer/pepを投与した群でのみ、ペプチドに対するIFN-γを生成するCD8+T細胞が顕著に増加することを観察した(図6、左側)。
【0073】
<1-2>B/αGalCer/pepによる免疫寛容の克服確認
一般的に抗原のみを投与した場合には、免疫寛容が誘導されるので本発明者等は、αGalCerをペプチッドと一緒にB細胞に積載した時、抗原のみを投与して誘導される免疫寛容を乗り越えることができるかどうかを調べた。詳細には、前記実施例3の<1-1>と同様にC57BL/6マウスを免疫化して一週間後に脾臓単一細胞を摘出した後、OVAが積載された脾臓単一細胞で一週間刺激した。刺激された脾臓単一細胞に対して、IFN-γを生成するCD8+T細胞を前記の細胞内サイトカイン染色法で試験した。
【0074】
その結果、B細胞単独またはB/αGalCerを投与したマウスの場合には、正常に免疫反応が誘導されてペプチド特異的なIFN-γを生産するCD8+T細胞を誘導した一方(図6、右側)、B/pepを投与したマウスはIFN-γを生産するCD8+T細胞の増加が現れなかった。これはマウスがペプチドに対して「免疫寛容」を示したものとみられる。
【0075】
これとは対照的に、B/αGalCer/pepを投与したマウスは、B細胞単独またはB/αGalCerを投与した群に比べてペプチドに反応するCD8+T細胞を顕著に多く形成した。ここで、B単独またはB/αGalCerを投与したマウスの場合には、抗原が投与されたことがないから抗原特異的な免疫反応が誘導されないマウスで、OVAが積載された脾臓単一細胞の試験管内再刺激が最初の免疫反応である。一方、B/αGalCer/pepを投与したマウスの場合には、マウスにすでに抗原が投与されたのでOVAが積載された脾臓単一細胞の試験管内再刺激は再反応(recall response)になる。結論的に、B/αGalCer/pepは、免疫寛容を克服して免疫原性を示して、力強い再反応を示すことを確認した。
【0076】
<実施例4>樹状細胞ワクチンと類似の効能のB細胞ワクチンの細胞毒性Tリンパ球の生成を誘導確認
本発明者等は、B細胞を媒介にするワクチンの細胞毒性効果を樹状細胞ワクチンの細胞毒性効果と比較した。
【0077】
そのために、生体内細胞毒性Tリンパ球分析を使用して、完全に標的を溶解するのに必要な最小限の細胞数を測定してみた。詳細には、B細胞または樹状細胞を各々αGalCerまたはビヒクルとともに16時間乃至18時間培養した後、OVA257-264ペプチド1μg/mlで1時間培養した。その次に、細胞を順次に希釈して同種のマウスに静脈注射してから一週間後に、生体内細胞毒性Tリンパ球分析を実施した。すなわち前記実施例と同様に、ペプチドが適用された標的細胞はCFSEhighで標識して、ペプチドが適用されない対照細胞はCFSElowで標識してマウスに同量注入した後、一程時間が経ってマウスの脾臓細胞をフローサイトメーターで分析してCFSElow:CFSEhigh割合を算出して抗原特異的な標的細胞の溶解を測定した。
【0078】
その結果、DC/αGalCer/pep投与群は16000個の細胞だけでも完全に標的細胞の溶解を起こし、B/αGalCer/pep投与群では80000個の細胞で完全にペプチド特異的な溶解が起きた。前記のDC/αGalCer/pepと同数(16000個)のB/αGalCer/pepを投与すると体内で中間程度の細胞毒性を起こすことを観察した(図7)。しかし、樹状細胞の表面積がB細胞に比べてずっと大きいという点を考慮すると、B/αGalCer/pepはDC/αGalCer/pep程度効果的に体内で細胞毒性を起こすと言える。また、DC/pepは、OVA特異的に効率的な細胞毒性を起こした一方、B/pepを投与すると細胞の数字とは無関係に細胞毒性を誘導しなかった(図8)。特に、重要なことは、体内細胞毒性の傾向性がDC/pepとDC/αGalCer/pep投与群が相当に類似しているということであるが、これは、αGalCerを樹状細胞に積載することが、ペプチドを積載した樹状細胞のワクチン効率を増加させないということを意味する。
【0079】
<実施例5>B/αGalCer/pepの細胞毒性Tリンパ球形成時の必要条件確認
本発明者等は、細胞毒性Tリンパ球反応を誘導するのに関与する免疫細胞の種類を確認するために、C57BL/6マウスにB/αGalCer/pepを投与する4日前または4日後に各々の免疫細胞を除去するための抗体(抗CD4除去抗体:GK1.5、抗CD8除去抗体:2.43、抗NK1.1除去抗体:PK136)を注射した後、体内細胞毒性Tリンパ球分析を実施した。
【0080】
その結果、免疫細胞除去の時期とは無関係に(B/αGalCer/pep投与の前後全て)CD4+T細胞またはNK1.1細胞除去が、細胞毒性Tリンパ球反応誘導を阻害しなかった(図9)。一方、CD8+T細胞を除去すると標的細胞の破壊が起きなかった。前記結果と類似にMHC II-/-(CD4+T細胞欠如)マウスは、正常に細胞毒性Tリンパ球反応が誘導された一方、Jα281-/-(ナチュラルキラーT細胞欠如)マウスは誘導されないことを確認した(図10)。
【0081】
<実施例6>B細胞の抗原提示及び細胞毒性Tリンパ球の誘導確認
本発明者等は、ペプチドを積載したB細胞が抗原提示細胞として機能するのか、あるいはペプチドの運搬体としてのみ作用するのか、すなわち、B細胞が運んだペプチドを樹状細胞が回収して細胞毒性Tリンパ球反応を誘導するのかを調べた。そのために、OVAペプチドをMHC Iに積載することができるが、H-2K領域の突然変異によってCD8+T細胞がMHC I-ペプチド複合体を認識することができないbm-1マウスを使用した(Norbury,C.C.等,Science,2004年,第304巻,1318-1321頁)。このようなbm-1から取得したB細胞は、正常にCD1dを発現していて、αGalCerと反応してナチュラルキラーT細胞の活性化を刺激するという点で、bm-1のB細胞とナチュラルキラーT細胞との相互作用においては何らの問題がないことが分かる。
【0082】
もう一度、野生型のB細胞から準備したB/αGalCer/pepを野生型マウスに注射すると、体内でOVA特異的な細胞毒性が完璧に生成されることを確認することができた。これとは異なり、bm-1マウスのB細胞から準備したB/αGalCer/pepを野生型マウスに注射すると、野生型のマウスは、OVA特異的な細胞毒性活性を生成することができないことが分かった。このような結果は、受容マウスの樹状細胞または他の専門的な抗原提示細胞が細胞毒性Tリンパ球を形成するのに寄与しないことを示す(図11)。
【0083】
続いて、本発明者等は、αGalCerとペプチドを個別的に投与した場合と、ともに投与した場合に、細胞毒性Tリンパ球を形成することができるのかを調査した。C57BL/6マウスにB/αGalCer+B/pepまたはB/αGalCer/pep単独で静脈注射した後、体内細胞毒性Tリンパ球分析を実施した。
【0084】
その結果、B/αGalCer+B/pepを投与したマウスでは、体内細胞毒性が全く誘導されないことを確認した(図12)。このような結果は、ペプチドとαGalCerが同一B細胞に積載されることがOVA特異的な細胞毒性を生成するのにおいて必須であることを示唆している。
【0085】
<実施例7>B/αGalCer/pepの抗癌効果確認
<7-1>OVAモデルを使用した生体内実験
本発明者等は、B/αGalCer/pepのワクチン投与が抗癌免疫を誘導するのかどうかを調査した。まず、予防的抗癌免疫活性を試験するためにB細胞単独、B/αGalCer、B/pep、B/αGalCer/pep、DC/pep、またはDC/αGalCer/pepワクチンを1回投与した後、OVAを形質導入したB16黒色腫(MO-5)(Dr.Kenneth Rock,University of Massachusetts:Falo,L.D.,等,Nat.Med.1995年,第1巻,649頁)を皮下に移植した。その結果、B/αGalCerを投与したマウスでは、癌の成長が多少遅延する傾向性を見せたが、最終的には癌を形成した一方(図13)、B/αGalCer/pep、DC/pep、またはDC/αGalCer/pepを投与したマウスでは、癌が成長しなかった。
【0086】
続いて、このようなマウスが長期間抗癌活性を維持することができるかどうかを確認するために、最初に癌を移植してから70日になる時点で生存したマウスにMO-5癌細胞を再び皮下に移植した。その結果、このようなマウスでは癌の成長が現れなかった(図14)。これは、B/αGalCer/pepワクチン投与で前記癌に対する記憶免疫反応を確立したことを示唆する。OVAを形質導入すた胸腺種(EG-7)を使用して遂行した場合にも、前記と一致する結果を得ることができた(図36)。
【0087】
次には、B/αGalCer/pepワクチンを投与することですでに存在している癌を除去することができるかどうかを調べた。そのために本発明者等は、下記のような二つの治療モデルを提示した。すなわち、マウスに癌を皮下移植してからi)1日後または、ii)9日後に癌が促進される時期にワクチンを投与した。
【0088】
その結果、1日モデルでは、DC/pepまたはDC/αGalCer/pepワクチンを投与した場合にほとんど完璧に癌の成長を抑制した。特に、B/αGalCer/pepワクチンを投与したマウスも完璧に癌の成長を減少させることを観察した(図15)。9日モデルでは、いかなるワクチン投与群でも成長する癌を完璧に減少させることができなかった。このような結果は、おそらくB16黒色腫が非常に活発な成長特性を有しているためであると判断される。これとは異なり、B/αGalCer/pepワクチンを投与したマウスの場合には、B細胞単独投与群及びB/αGalCer、B/pep投与群に比べて癌の成長が減少することが示され、DC/pepまたはDC/αGalCer/pepワクチン投与群と類似に現れることを確認した(図16)。
【0089】
<7-2>Her-2/neuモデルを使用した生体内実験
本発明者等は、B細胞を媒介にするワクチン投与が実際に癌抗原に適用することができるかどうかを調べるために、特性がよく解明されていて細胞毒性Tリンパ球抗原決定基(epitope)が知られているHer-2/neuを発現する癌細胞であるTAUF(Penichet ML等,Lab Anim Sci.,1999年,第49巻,179-88頁)で、前記実施例<7-1>と同じ実験を実施した。その結果、本発明者等は、もう一度、αGalCer及びHer-2/neu63-71ペプチドを提示するB細胞を投与したマウス群で体内Her-2/neuに対する細胞毒性が意味ある水準で現れることを確認した(図17)。
【0090】
また、前記モデルでの抗癌活性を分析するために、Her-2/neuを発現する癌細胞(TAUF)をBALB/cマウスの静脈または皮下に注射した後、αGalCerとHer-2/neu63-71を積載したB細胞ワクチンを投与した結果、静脈に癌を注入してB/αGalCerまたはB/pepワクチン投与した場合には、B細胞単独投与群と比べて生存期間が若干延長されることを確認した(図18)。これとは対照的に、B/αGalCer/pepを投与したすべてのマウスは、全体実験期間の間生存することを観察し、そのように生存したマウスにHer-2/neuを発現する癌細胞(TAUF)を再び注入しても抑制効果が現れることを確認することができた。また、皮下癌成長モデルでも、類似な結果を観察することができた(図19)。
【0091】
したがって、本発明のB細胞を媒介にするワクチン投与は、抗癌免疫の予防効果及び治療効果において、樹状細胞を基盤にするワクチン程度に効率的であることを立証した。
【0092】
<実施例8>抗原を発現するウイルスベクターを使用したタンパク質導入
ペプチドを積載した細胞ワクチンは、臨床的に使用する場合、個人の主組織適合性複合体(major histocompatibilty complex、MHC)の一倍体型に制限的にペプチドが使用されるので普遍的に使用することができず、単一抗原決定基(epitope)のみを提示する短所を有している。一方、ウイルスを媒介にして全体抗原を導入するようになれば、主組織適合性複合体の一倍体型に限らないですべての人に適用可能であり、多くの抗原決定基に特異的な免疫反応すなわち、特に体液性免疫反応と細胞性免疫反応を同時に誘導することができる。これを根拠にして、B細胞にウイルスで全体抗原を形質導入した後、免疫反応を効果的に誘導することができるかどうかを確認してみた。まず、腫瘍関連抗原であるHer-2/neuの細胞外領域及び細胞膜領域(Her-2/ne extracellular domain+transmembrane domain:HM)を発現する遺伝子を有したアデノウイルス(AdHM)を製作してマウス癌モデルに適用した。
【0093】
詳細には、BALB/cマウスの脾臓細胞から分離したB細胞をHer-2/neuの細胞外領域及び細胞膜領域を発現するアデノウイルス(AdHM、バイロメド)100 MOIで血清を添加しない培地で90分間37℃の培養器で感染させた後、血清を補充して総8時間、24時間、及び48時間各々培養した後、PEで標識された抗-Her-2/neu抗体(BD biosciences #340552)で染色してフローサイトメトリーを実施した後、Her-2/neuが表面に発現される程度(B細胞に対するアデノウイルス形質導入効率、全体B細胞中のPE+細胞の割合)を測定した。
【0094】
その結果、8時間、24時間及び48時間、B細胞をアデノウイルスとともに培養した時、すべての培養条件で約20%以上の効率を示すことを確認した(図20)。すなわち、B細胞をAdHMと8時間以上培養すると、十分にAdHMによって形質導入されたB細胞表面にHer-2/neuを発現することができるということが分かる。また、B細胞でのHer-2/neu発現は、ウイルスで形質導入した後、アルファガラクトシルセラミドとともに培養しても変わらなかったし、B細胞がアルファガラクトシルセラミドを提示するにおいても何の影響も及ぼさないことを確認した(図21)。このような結果は、前記で言及したように、B細胞のCD1d分子によってDN32.D3細胞にアルファガラクトシルセラミドが提示されると、活性化したDN32.D3細胞はIL-2を分泌するようになって、培養液に含まれたこのようなIL-2濃度を測定することで、B細胞がアルファガラクトシルセラミドを提示することができることを間接的に確認した。
【0095】
<実施例9>アデノウイルスで形質導入されたB細胞によって誘導される細胞毒性T細胞反応確認
BALB/cマウスの脾臓細胞から分離したB細胞を、Her-2/neuの細胞外領域と細胞膜領域を発現するアデノウイルス(AdHM)100M.O.I.で血清を添加しない培地で60分間37゜Cの培養器で感染させた。以後、血清が補充された培地を添加して総24時間培養して、B/AdHM細胞を製作した。また、AdHMで形質転換されたB細胞を1〜2μg/mlのαGalCerを添加した血清が補充された培地で23時間培養して、αGalCerを積載したB細胞(B/AdHM/αGalCer)を製作した。製作が完了したB細胞は、RPMI培地で3回以上洗浄して自由型のアデノウイルス及びαGalCerを除去して実験に使用した。
【0096】
本発明者等は、前記Her-2/neuの細胞外領域と細胞膜領域を発現するアデノウイルス(AdHM)で形質導入されたB細胞が、マウスで細胞毒性免疫反応を誘導することができるかどうか調査するために、マウスに静脈注射でB細胞ワクチンを投与した。B細胞単独(B)及びアルファガラクトシルセラミドだけ積載したB細胞(B/αGalCer)を投与したマウスを陰性対照群に使用し、AdHMで形質導入されたB細胞(B/AdHM)及び、AdHMで形質導入されたアルファガラクトシルセラミドを積載したB細胞(B/AdHM/αGalCer)が誘導するHer-2/neu特異的な細胞毒性T細胞反応を測定した。免疫化した後、細胞毒性T細胞の抗原決定基ペプチド(Her-2/neu63-71、エニゼン)を積載した標的細胞を注入して体内で起きる標的細胞の分解を確認した。
【0097】
その結果、免疫化して1週間が過ぎた時点で、BとB/αGalCerで免疫化されたマウス群では標的細胞の分解を観察することができなかった。一方、B/AdHMとB/AdHM/αGalCerで免疫化されたマウス群では細胞毒性T細胞反応を確認することができた(図22)。アデノウイルスで形質導入されたB細胞は、活性化するのでナチュラルキラーT細胞の助けもなしに体内で細胞毒性T細胞を効果的に誘導することができる抗原提示細胞として機能すると考えられる。B/AdHMとB/AdHM/αGalCerで誘導された細胞毒性T細胞反応は、時間に依存的に漸次減少する傾向を示したが、免疫化以後7週目まで細胞毒性T細胞反応が相当な水準で維持された(図23)。また、免疫化以後1週目に細胞毒性T細胞とともにCD8+T細胞でIFN-γの生成を確認した結果、B細胞のみ投与を受けたマウス群に比べて、B/AdHMとB/AdHM/αGalCerで免疫化されたマウス群で活性化したCD8+T細胞の数が増加していた。特に、このような現象は、B/AdHMに比べてB/AdHM/αGalCer群で多少高く現れた(図24)。
【0098】
<実施例10>αGalCerの積載を通じたナチュラルキラー細胞の活性化誘導及びアデノウイルスで形質導入されたB細胞ワクチンの効果増進確認
<10-1>αGalCerを積載したB細胞を通じたナチュラルキラー細胞の活性化誘導確認
活性化したナチュラルキラー細胞集団は、IFN-γを生産するナチュラルキラー細胞に基づいて計算した。簡略に説明すると、マウスの脾臓から分離したB細胞を1μg/mlのゴルジプラグ(GolgiPlug)下で5時間培養して、その細胞を固定及び透過させた後に抗-マウスIFN-γ:APC、CD3:PE、及びCD49b:FITC抗体(全てBiolegend)で各々染色した。ナチュラルキラー細胞は、CD3を発現しないで、ナチュラルキラー細胞の標式であるCD49bを発現する細胞集団にした。
【0099】
アルファガラクトシルセラミド(αGalCer)が積載されてアデノウイルスで形質導入されたB細胞(B/AdHM/αGalCer)は、アデノウイルスで形質導入したB細胞(B/AdHM)に比べて細胞毒性T細胞反応が多少高く長期間持続する傾向性を見せるが、留意するに値する水準の差が現れないことからして、細胞毒性T細胞反応を誘導するにおいてペプチドを積載したB細胞ワクチンとは異なり、アルファガラクトシルセラミドの積載が決定的な役目を担当しないものとみられる。しかし、アルファガラクトシルセラミドが積載されたB細胞ワクチンをマウスに投与すると、形質導入だけされたB細胞ワクチン投与群とは異なり、体内でナチュラルキラーT細胞を刺激して結果的にナチュラルキラー細胞を活性化させることを確認した(図25)。このようなナチュラルキラー細胞の活性化は、細胞毒性T細胞反応の誘導とともに抗癌効果に寄与することができると考えられる。
【0100】
<10-2>αGalCerの積載を通じたアデノウイルスで形質導入されたB細胞ワクチンの効果増進確認
本発明者等は、B細胞ワクチンが細胞毒性T細胞を誘導する効率性を測定するために、完全な細胞毒性T細胞を誘導する水準以下で細胞ワクチンを投与した時、誘導される標的細胞の溶解程度を比較した。そのために、陽性対照群にはアルファガラクトシルセラミドを積載して細胞毒性T細胞抗原決定基ペプチドを積載したB細胞(B/αGalCer/pep)を使用し、各々のB細胞ワクチンを免疫化した後、1週間後にB/AdHMとB/AdHM/αGalCer投与で誘導される細胞毒性T細胞誘導効率性を測定した(図26)。B/αGalCer/pepの場合、大部分のB細胞が抗原を提示できるようにペプチドが適用されたものと推定されるが、前記で言及したようにアデノウイルスで形質導入されたB細胞の場合、全体の約20%程度だけが抗原提示細胞に機能すると考えられる。これを勘案すると、抗原をアデノウイルスで導入されたB細胞ワクチンは、ペプチドが積載されたB細胞ワクチンに比べて多数のB細胞投与が必要であるにもかかわらず、効率的に抗原特異的な細胞毒性T細胞反応を誘導することができると判断される。また、少数のB細胞が投与された時、アルファガラクトシルセラミドの積載でナチュラルキラーT細胞の助けを借りる場合、標的細胞を溶解するのに多少有利であることを確認した。
【0101】
<実施例11>抗原特異的な抗体反応を誘導するアデノウイルスで形質導入されたB細胞ワクチン
アデノウイルスで形質導入されたB細胞ワクチンは、細胞性免疫反応を誘導するためにペプチドを積載したB細胞ワクチンとは異なり、細胞性免疫反応及び体液性免疫反応を同時に誘導することができるという長所がある。AdHMで形質導入されたB細胞ワクチンが、Her-2/neu特異的な抗体を誘導することができるかどうかを調べるために、BALB/cマウスにB/AdHM及びB/AdHM/αGalCerで各々免疫化させた後、血清中の抗-Her-2/neu抗体の力価を測定するために、Her-2/neuを細胞表面に発現するマウス癌細胞であるTAUF細胞に結合する程度をフローサイトメトリー(flow cytometry)を通じて確認した。
【0102】
抗体反応を測定するためにB細胞ワクチンで免疫化した後、1、3、5、及び7週目に各々眼窩採血で血液を抽出した。マウスの血液を常温で2時間放置した後、8000rpmで10分間遠心分離して血清を分離した。血清中の抗-Her-2/neu抗体の力価を測定するために、1:50から2倍ずつ緩衝剤(1%FBS、0.09%アジドを含むPBS)で希釈した後、Her-2/neuを発現する癌細胞であるTAUF細胞と4゜Cで60分間培養した。緩衝剤でマウス血清と培養されたTAUF細胞を洗浄した後、FITCで標識されたマウス抗体に結合するヤギ抗体を2次抗体に使用して、TAUF細胞に結合されたマウス抗体を染色した。続いて、フローサイトメーター(FACSCaliber、BD Biosciences社)を使用して、TAUF細胞に結合したマウス抗体の量を測定し、免疫化されないマウスの血液を基準にして、平均蛍光強度が1.8倍以上増加する場合を陽性反応と見なして抗体の力価を算出した。
【0103】
その結果、細胞毒性T細胞を誘導したのと類似に、B/AdHM及びB/AdHM/αGalCerの二集団全てで免疫化した後、7週間以上抗-Her-2/neu抗体が高い力価で維持されることが観察され(図27)、B細胞(B)及びB/αGalCerとは異なり、B/AdHMとB/AdHM/aGarCerワクチン投与集団では全て、体液性免疫反応が生成されることを確認した(図28)。
【0104】
<実施例12>アルファガラクトシルセラミドを積載してアデノウイルスで形質導入したB細胞ワクチンの免疫化を利用した癌の予防及び治療効果確認
Her-2/neu腫瘍モデルでBALB/cマウスの尾静脈に2×105個のTAUF細胞を投与してマウスに腫瘍ができるようにした。以後、腫瘍を有したマウスにB細胞ワクチンで各々免疫化した後、生存率を測定した。
【0105】
本発明では、アデノウイルスで形質転換されたB細胞ワクチンを使用して誘導された細胞性免疫反応及び体液性免疫反応が、窮極的に効果的な抗癌活性を示すかどうかを調査した。Her-2/neuを発現するマウス癌細胞(TAUF)を静脈注射した後、肺癌が誘導されたマウスでB細胞ワクチンの予防及び治療効果を確認した。2×106個のB細胞ワクチンで免疫化して7日後、癌細胞2×105個を静脈注射したマウスの生存率を測定した結果、B細胞だけ投与を受けたマウス群(B)に比べて、アルファガラクトシルセラミドを積載したB細胞の投与を受けたマウス群(B/aGarCer)と癌抗原を発現するアデノウイルスで形質転換されたB細胞(B/AdHM)で免疫化されたマウス群で、生存期間が多少延長されることを観察することができた。アルファガラクトシルセラミドが積載され癌抗原を発現するB細胞ワクチン(B/AdHM/aGarCer)を静脈投与すると、全実験期間の間マウスが生存することが観察され、B/aGarCerやB/AdHMワクチンに比べて B/AdHM/aGarCerワクチンが抗癌効果が高いことが示された(図29の上)。したがって、B細胞ワクチンで誘導された免疫反応が効果的に癌を予防するということが分かった。
【0106】
次では、B細胞ワクチンの治療効果を確認するために、BALB/cマウスを1×106個のB、B/aGarCer、B/AdHM、B/AdHM/aGarCerで各々免疫化した後、3日後に5×104個の癌細胞(TAUF)を尾静脈に注射して肺癌を誘導した。B細胞だけ単独で投与を受けたマウス群が一番短い生存期間を示し、B/aGarCerワクチン投与群もこれに似た傾向が観察された。B/AdHMワクチンで免疫化されたマウス群は、B、B/aGarCer投与群に比べて生存期間が若干延長される効果があった。一方、B/AdHM/aGarCer投与群は、予防モデルで観察したのと類似に他の実験群に比べて生存期間が顕著に増加することからして、B、B/aGarCerまたはB/AdHMの免疫化で誘導される抗癌効果に比べて優れた効果を示すことが分かる(図29の下)。
【0107】
<製剤例>注射液剤の製造方法
本発明の抗癌用ワクチンの注射液剤は、次のような方法で製造した。
アルファガラクトシルセラミド1〜2μg/ml、B細胞5×106個/ml、ペプチド1〜2μg/ml、5'-クロロ-3,2'-ジヒドロキシカルコンまたは5'-クロロ-2,3'-ジヒドロキシカルコン塩酸塩1g、塩化ナトリウム0.6g及びアスコルビン酸0.1gを蒸溜水に溶解させて100mlを作った。前記溶液を瓶に入れて20℃で30分間加熱して滅菌させた。
【産業上の利用可能性】
【0108】
本発明のナチュラルキラーT細胞のリガンド、特に、アルファガラクトシルセラミド(αGalCer)と抗原を積載したB細胞は、既存の樹状細胞ワクチンと比較して類似水準の細胞毒性Tリンパ球反応を誘導するだけでなく、皮下癌及び転移癌の予防及び抑制効果があって、癌抗原を発現するアデノウイルスで形質転換されたB細胞は、抗原特異的な免疫反応を誘導することにより、前記細胞を含むワクチンは、癌予防及び治療剤に使用することができる。併せて、本発明のワクチンは、CD4+T細胞がない場合にも免疫反応を誘導するので、CD4+T細胞の数が顕著に減少して免疫欠乏が現れるHIV患者を免疫化するのにも使用することができる。
【技術分野】
【0001】
本発明は、ナチュラルキラーT細胞のリガンドと抗原を積載したB細胞を含む免疫予防及び治療用ワクチンに関するもので、より詳細には、ナチュラルキラーT細胞リガンドと同時に糖脂質の一種であるアルファガラクトシルセラミドを媒介にしたB細胞を含む免疫予防及び治療用ワクチンに関するものである。
【背景技術】
【0002】
人体では、抗原提示細胞によって腫瘍細胞の抗原が効率的に提示されないので、それに対する免疫反応が効果的に誘導されない。癌治療ワクチンは、癌細胞に特異的に作用する免疫機序を人為的に活性化させて(抗原提示細胞導入等)力強い免疫反応を誘発して癌細胞を破壊する新しい概念の治療用ワクチンである。
【0003】
使用可能なワクチンの接近方法として使用されるものの中で、樹状細胞(dendritic cells、DC)のような抗原提示細胞(antigen-presenting cell、APC)を使用した細胞ワクチンは、効果的なT細胞免疫を生成させるのに確実な方法として知られている(Rosenberg,S.A.等,Nat.Med.,2004年,第10巻,909-915頁)。特に、樹状細胞ワクチンは、抗原特異的な効果T細胞(Antigen-specific effector T cell)と記憶T細胞(memory T cell)を効率的に誘導することが知られていて、多くの臨床試験で抗癌治療に適用されている(Rosenberg,S.A.等,Nat.Med.,2004年,第10巻,909-915頁)。このような樹状細胞(DC)は、抗原を収容して抗原をそれに相応するT細胞に提示する場所であるリンパ器官(lymphoid organ)に移動する能力があるので、免疫治療のための理想的な抗原提示細胞であると言える。さらに重要なことは、樹状細胞は、T細胞に強い共刺激(co-stimulation)を提供する(Figdor,C.G.等,Nat, Med.,2004年,第10巻,475-480頁;及びBanchereau,J. 等,Cell,2001年,第106巻,271-274頁)。樹状細胞ワクチンを使用した接近法が、実験的にも臨床試験でよく確立されているにもかかわらず、血液とリンパ組職に樹状細胞が少数で血液中の単核細胞から体外に(ex vivo)増殖させにくいという点は、ワクチンとして広く使用される障害になっている(Schultze,J.L.等,Trends Immunol.,2004年,第25巻,659-664頁)。
【0004】
一方、B細胞はリンパ組職や血液に多量に存在して体外で容易に増殖されることができるため、細胞ワクチンのための樹状細胞の効率的な代替剤になるのみならず(Schultze,J.L.等,Trends Immunol.,2004年,第25巻,659-664頁;von Bergwelt-Baildon、M.S.等,Blood,2002年,第99巻,3319-3325頁;及びSchultze,J.L.等,J.Clin.Invest.,19974年,第100巻,2757-2757頁) 非経口投与後にリンパ器官に移動するようになる。
【0005】
このような長所にもかかわらずB細胞は、弱い免疫原性のため抗原提示細胞ワクチンとしては広く使用されなかった。実際にB細胞がCD4+とCD8+T細胞の自己免疫寛容(tolerance)を直接的に誘導する。これは共刺激(costimulation)が欠如したからであるという証拠があり(Bennett,S.R.等,J.Exp.Med.,19984年,第188巻,1977-1983頁;及びEynon,E.E.等,J.Exp.Med.,1992年,第175巻,131-138頁)、共刺激は、抗原特異的なT細胞が活性化するためにT細胞が認識することができる抗原とともに要求される二番目信号を言う。しかし、活性化したB細胞がCD4+T細胞とCD8+T細胞全てを刺激することができるということは(von Bergwelt-Baildon,M.S.等,Blood,2002年,第99巻,3319-3325頁;Schultze,J.L.等,J.Clin.Invest.,1997年,第100巻,2757-2765頁;Lapointe,R.等,Cancer Res.,2003年,第63巻,2836-2843頁;及びHeit,A.等,J.Immunol.,2004年,第172巻,1501-1507頁)適切な刺激によって活性化したB細胞が抗原特異的なT細胞免疫を誘導する免疫原性を有した抗原提示細胞として作用することができるということを示唆する。
【0006】
不変性ナチュラルキラーT(iNKT)細胞が多くの免疫反応及び免疫病理現象を総括する中枢的な役割を担当するということは、よく知られている。マウスの全体リンパ球の中で1%未満存在すると言っても、ナチュラルキラーT細胞は、自己抗原及び外来抗原に対する反応を管理して自己免疫または免疫反応を誘導するかどうかを決定する(Kronenberg,M.,Annu.Rev.Immunol.,2005年,第23巻,877-900頁;及びPark,S.H.&Bendelac,A.,Nature,2000年,第406巻,788-792頁)。また、この細胞は、癌、糖尿及び免疫反応が起きない部位(immune-privileged site)で免疫反応を抑制する機能を有すると報告された(Sonoda,K.H.,等,J.Exp.Med.,1999年,第190巻,1215-1226頁)。
【0007】
一方、リガンドで活性化した不変性ナチュラルキラーT細胞は、樹状細胞だけではなくT、B及びナチュラルキラー細胞の活性化を誘導する。不変性ナチュラルキラーT細胞のリガンドであるアルファガラクトシルセラミド(αGalCer)を注入すると、ナチュラルキラー細胞とT細胞を通じて抗癌免疫を起こす(Moodycliffe,A.M.,等,Nat.Immunol.,2000年,第1巻,521-525頁)。
【0008】
アルファガラクトシルセラミド(a-galactosylceramide、αGalCer)は、元々海綿動物から抽出された糖脂質(glycolipid)で、Vα14+T細胞受容体(TCR)を有しているナチュラルキラー T(Natural Killer T)細胞のリガンドで、抗原提示細胞(antigen presenting cell,APC)にあるCD1d分子によって提示されることが知られている(Kawano等,Science,1997年,第278巻,1626頁)。ナチュラルキラーT細胞が活性化すると、多量のIFN-γ及びIL-4を生産する。これは、特定疾病または感染に対する免疫反応を調節することができる(Chen等,J.Immunol.,1997年,第159巻,2240頁;Wilson等,Proc.Natl.Acad.Sci.U.S.A.,2003年,第100巻,10913頁)。
【0009】
タンパク質抗原とアルファガラクトシルセラミドを一緒に投与したマウスでは、細胞毒性T細胞反応を含んだ細胞性免疫反応(cell-mediated immunity)及び体液性免疫反応(humoral-mediated immunity)が起きる(Hermans,I.F.,等,J.Immunol,2003年,第171巻,5140-5147頁;及びStober,D.等,J.Immunol.,2003年,第170巻,2540-2548頁)。さらに、最近の研究でアルファガラクトシルセラミドを積載した樹状細胞は、自然型のアルファガラクトシルセラミドに比べて長く持続するナチュラルキラーT細胞反応を生成させることが示されて、ナチュラルキラーT細胞リガンドの免疫増強効果は、専門的な抗原提示細胞(professional APC)を標的にすることにより増加させることができることを示唆している。
【0010】
以上のことに鑑みて、本発明者等は、ナチュラルキラーT細胞リガンドをB細胞に積載してこの細胞の自己免疫寛容性を免疫原性に変化させることにより、B細胞のMHC分子によって提示される抗原に対して活発な免疫反応を生成することができることを確認し、それを検証するためにアルファガラクトシルセラミド(αGalCer)とペプチドが積載されたB細胞及びアルファガラクトシルセラミド(αGalCer)と癌抗原を発現するアデノウイルスで形質転換されたB細胞が抗原特異的な免疫反応と抗癌効果を示すことを確認することによって、本発明を完成した。
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明の目的は、ナチュラルキラーT細胞リガンド、特にアルファガラクトシルセラミドと抗原を積載したB細胞によって活性化したナチュラルキラーT細胞を通じて、B細胞の免疫寛容性を免疫原性に変化させることにより、抗原を提示するB細胞を通じて抗原特異的な免疫反応を誘導することができる免疫予防及び治療用ワクチンを提供するものである。
【課題を解決するための手段】
【0012】
本発明は、ナチュラルキラーT細胞のリガンドと抗原を積載したB細胞を含む免疫予防/治療用ワクチン及び抗癌用ワクチンを提供する。
【0013】
また、本発明は、ナチュラルキラーT細胞のリガンドを積載して癌抗原を発現するB細胞を媒介にする抗癌用ワクチンを提供する。
【0014】
また、本発明は、アルファガラクトシルセラミドを積載したB細胞を媒介にするナチュラルキラーT細胞活性化剤を提供する。
【0015】
同時に、本発明は、癌抗原を発現するB細胞を含む細胞毒性反応誘導剤を提供する。
【0016】
以下、本発明を詳しく説明する。
【0017】
本発明は、ナチュラルキラーT細胞のリガンドを積載したB細胞または、ナチュラルキラーT細胞のリガンドと抗原を積載したB細胞を含む、免疫予防/治療用ワクチン及び抗癌用ワクチンを提供する。
【0018】
前記のナチュラルキラーT細胞のリガンドは、スピンゴモナス属(Sphingomonas spp.)由来のアルファガラクトロノシルセラミド(alpha-galacturonosylceramide)とアルファグルクロノシルセラマイド(alpha-glucuronosylceramide,Mattner,J.等,Nature,2005年,第434巻,525頁;Kinjo,Y.等,Nature,2005年,第434巻,520頁)。M.ツバクロシス(M.tuberculosis)由来のホスファチジリノシトルテトラマンノサイド(phosphatidylinositoltetramannoside,Fischer,K.等,PNAS,2004年,第101巻,10685頁)。
【0019】
自家抗原であるイソグロボトリヘキソシルセラミド(isoglobotrihexosylceramide,Zhou,D.等,Science,2004年,第306巻,1786頁)とガングリオサイドGD3(ganglioside GD3,Wu,D.Y.等,J.Exp.Med.,2003年,第198巻,173頁)、ホスファチジルコリン(phosphatidylcholine,J.Immunol.,2005年,第175巻,977頁)、ベータガラクトシルセラミド(beta-galactosylceramide,betαGalCer,Ortaldo JR等,J.Immunol.,第172巻,943頁)、Leishmania表面糖結合リポホスホグリカン(lipophosphoglycan)とグリコイノシトールホスホリピド(glycoinositol phospholipids,J.Exp.Med.,2004年,第200巻,895頁)、アルファガラクトシルセラミドの類似体のベータアノマガラクトシルセラミド等(beta-anomeric GalCer)とアルファアノマガラクトシルセラミド等(alpha-anomeric GalCer;J.Immunol.,2004年,第173巻,3693頁)、アルファガラクトシルセラミドの変異体(J.Am.Chem.Soc.,2004年,第126巻,13602頁)及びバクテリア脂質抗原、例えばノカルデアファルシニカ(Nocardia falcinica)由来のグルコースモノマイコレート(glucose monomycolate,Moody,D.B.等,J.Exp.Med.,2000年,第192巻,965頁)を含む。
【0020】
すでに、アルファガラクトシルセラミドが積載された樹状細胞(dendritic cell、DC)が、不変性ナチュラルキラーT(iNKT)細胞を活性化させるということは公知の事実なので(van der Vliet HJ,等,J Immunol Methods.,2001年,第1;247(1-2)巻,61-72頁)、本発明者等は、アルファガラクトシルセラミドを積載したB細胞が前記の樹状細胞と類似の効果を示すかどうかを確認した。
【0021】
マウスからCD19を発現するB細胞(図1)と樹状細胞を分離して、アルファガラクトシルセラミド及びナチュラルキラーT細胞ハイブリドーマとともに培養した後、培養液内のIL-2濃度を測定した結果、アルファガラクトシルセラミドを積載した樹状細胞(DC/αGalCer)とB細胞(B/αGalCer)の両方が、ナチュラルキラーT細胞ハイブリドーマを刺激してIL-2を生成した(図30参照)。したがって、B/αGalCer及びDC/αGalCerの両方が、体外で不変性ナチュラルキラーT細胞を活性化させることができることを確認した。
【0022】
B/αGalCer及びDC/αGalCer投与が体内で免疫細胞を活性化させることができるかどうかを確認するために、C57BL/6マウスから取得したB細胞とDCを使用して製造したB/αGalCerまたはDC/αGalCerを同種のマウスに静脈注射して、エリスポット(ELISPOT)を通じてIL-4及びIFN-γレベルを測定した。詳細には、野生型C57BL/6またはJα281-/-マウスにビヒクル、αGalCer、αGalCerを積載したB細胞または、αGalCerを積載した樹状細胞を静脈注射した。一週間後、脾臓細胞を摘出して単一細胞を作製した後にエリスポット用プレートに入れて、ビヒクルまたはαGalCerを入れて刺激した。以後は、製造社(IL-4 ELISPOT kit,IFN-γ ELISPOTキット,R&Dシステム)のマニュアルによってIL-4とIFN-γを生成する細胞を測定するためのエリスポット試験を実施した。
【0023】
その結果、B/αGalCer及びDC/αGalCerグループ全てで、IL-4及びIFN-γを生成する細胞を顕著に多く誘導した(図2)。しかし、不変性ナチュラルキラーT細胞が欠如したJα281-/-マウスの場合には、正常マウスと異なり前記のようなサイトカインを生成する細胞が誘導されない。これは、IFN-γとIL-4を生成する細胞が、不変性ナチュラルキラーT細胞に依存的に誘導されるということを示唆する(図2参照)。
【0024】
本発明者等は、B/αGalCerを体内で投与した時に誘導されるナチュラルキラーT細胞の活性化によってB細胞がどんな影響を受けるのかを調べるために、アルファガラクトシルセラミドを積載したB細胞をCFSEで標識して静脈で免疫化されないマウス(naive mouse)に移入して、24時間または48時間後に脾臓細胞の免疫細胞中でCFSE+細胞上の補助刺激分子をフローサイトメーターで分析した。その結果、CD80はどんな変化もなかったが、CD86は高いレベルで発現が誘導され(図3参照)CD40及びMHC class II分子も弱く増加した。すなわち、B/αGalCerを体内に投与すると、24時間または48時間後にB細胞が活性化することを確認した。
【0025】
本発明者等は、アルファガラクトシルセラミドとMHC I分子に結合する抗原のエピトープペプチドをB細胞に一緒に積載することで、ペプチド特異的なCD8+T細胞を刺激して抗原特異的な細胞分解を起こすことができるかどうか調べた。そのために、CFSEで標識されたOVA特異的なCD8+T細胞をマウスに移植した後、B細胞単独、B/αGalCer、ビヒクル+ペプチドを添加したB細胞(B/pep)またはαGalCer+ペプチドを添加したB細胞(B/αGalCer/pep)を静脈注射して、脾臓とリンパ節から取得したリンパ球からCD8+T細胞反応を測定した。その結果、B細胞単独またはB/αGalCerを投与した群では、OVA特異的なCD8+T細胞の分裂がほとんど誘導されず、B/pepを投与した群では相当に多いCD8+T細胞の分裂を誘導し、B/αGalCer/pepを投与した群では細胞の顕著な分裂が現れ、分裂した細胞の40%以上がIL-2を生成し、90%以上がIFN-γを生成し、そのレベルがB/pep群に比べて非常に高かった(図4参照)。前記結果は、B細胞にアルファガラクトシルセラミドとペプチドを一緒に積載することで、CD8+T細胞をずっと高いレベルで活性化させることができることを示す。
【0026】
本発明者等は、マウスにB細胞単独、B/αGalCer、B/pepまたはB/αGalCer/pepを各々静脈投与した後、細胞毒性免疫反応を誘導することができるかどうかを調べるために、細胞毒性Tリンパ球活性を測定した。その結果、B/αGalCer/pepを投与した群でのみ、ペプチドが積載された標的を完全に破壊し(図5)、ペプチドに対するIFN-γを生成するCD8+T細胞が顕著に増加することを観察した(図6、左側)。また、同一抗原で体外で再刺激した場合、B細胞単独またはB/αGalCerを投与したマウスの場合には、正常に免疫反応が誘導されてペプチド特異的なIFN-γを生産するCD8+T細胞を誘導した一方(図6、右側)、B/pepを投与したマウスはIFN-γを生産するCD8+T細胞の増加が見られず、B/αGalCer/pepを投与したマウスはB細胞単独またはB/αGalCerを投与した群に比べて非常に多いペプチドに反応するCD8+T細胞を形成した。
【0027】
本発明者等は、B細胞を媒介にするワクチンの細胞毒性効果を樹状細胞ワクチンの細胞毒性効果と比べるために、細胞毒性Tリンパ球分析を使用して、完全に標的を溶解するのに必要な最小限の細胞数を測定した。その結果、樹状細胞の広い表面積を考慮する時、B/αGalCer/pep投与群は、DC/αGalCer/pep投与群と類似の効率で体内で細胞毒性を起こすことを確認した。これと共に、体内細胞毒性の効果がDC/pepとDC/αGalCer/pep投与群が類似していたが、これはαGalCerを樹状細胞に積載することが、ペプチドを積載した樹状細胞のワクチン効率を増加させないということを意味する。
【0028】
本発明者等は、細胞毒性Tリンパ球反応を誘導するのに関与する免疫細胞の種類を確認するために、各々の免疫細胞を除去する抗体を投与した後、B/αGalCer/pepで免疫化した。その結果、CD4+T細胞またはNK1.1細胞除去が、細胞毒性Tリンパ球反応誘導を阻害しない一方、CD8+T細胞を除去すると標的細胞の破壊が起きなかった(図9)。
【0029】
本発明者等は、ペプチドを積載したB細胞が抗原提示細胞として機能するのか、そうでなければB細胞が運んだペプチドを樹状細胞が回収して細胞毒性Tリンパ球反応を誘導するのかを調べた。そのために、OVAのCTLエピトープペプチドをMHC Iに積載することができるが、H-2K領域の突然変異によってCD8+T細胞がMHC I-ペプチド複合体を認識することができないbm-1マウスから取得したB細胞を使用した結果、前記細胞は、αGalCerと反応してナチュラルキラーT細胞の活性化を刺激することを確認した。また、野生型のB細胞から準備したB/αGalCer/pepを野生型マウスに注射すると、体内でOVA特異的な細胞毒性が完璧に生成されるが、bm-1マウスのB細胞から準備したB/αGalCer/pepを野生型マウスに注射すると、OVA特異的な細胞毒性活性を生成することができないので、B細胞が抗原提示細胞として機能することを確認した(図11)。
【0030】
続いて、本発明者等は、αGalCerとペプチドを個別に投与した場合、そして一緒に投与した場合に、細胞毒性Tリンパ球を形成することができるかどうかを調査した。その結果、B/αGalCerとB/pepを一緒に投与したマウスでは、体内細胞毒性が全く誘導されないことを確認した(図12)。これは、ペプチドとαGalCerが同一なB細胞によって提示されることが、OVA特異的な細胞毒性を生成するのに必須であることを示す。
【0031】
本発明者等は、B/αGalCer/pepのワクチン投与が、抗癌免疫を誘導するかどうか調査した。まず、予防的抗癌免疫活性を試験するために、B細胞単独、B/αGalCer、B/pep、B/αGalCer/pep、DC/pep、またはDC/αGalCer/pepワクチンを投与してOVAを形質導入した黒色腫を皮下に移植した。その結果、B/αGalCerを投与したマウスでは癌を形成した一方、B/αGalCer/pep、DC/pep、またはDC/αGalCer/pepを投与したマウスでは癌が成長しなかった(図13参照)。続いて、最初に癌を移植してから70日になる時点で、生存したマウスに癌細胞を再び移植した結果、癌の成長が現れなかったが、これは、B/αGalCer/pepワクチン投与によって前記癌に対する記憶免疫反応を確立したことを示唆する(図14参照)。
【0032】
次に、B/αGalCer/pepワクチンを投与することで、すでに存在している癌を除去することができるかどうか調べたが、DC/pep、DC/αGalCer/pepまたはB/αGalCer/pepワクチンを投与したマウスは、完璧に癌の成長を減少させることを観察した(図15及び図16参照)。
【0033】
本発明者等は、B細胞を媒介にするワクチン投与が、実際に癌抗原に適用され得るかどうかを調べるために、Her-2/neuモデルを使用した結果、αGalCer及びHer-2/neu63-71を提示するB細胞を投与したマウス群で、体内Her-2/neuに対する細胞毒性が有意な水準で示されることを確認した(図17参照)。また、Her-2/neuを発現する癌細胞をマウスに注入した後、B細胞ワクチンを投与した結果、B/αGalCerまたはB/pepワクチン投与した場合には、B細胞単独投与群と比べて生存期間が若干延長されることが確認され(図18参照)、αGalCerとHer-2/neu63-71を積載したB細胞を投与したマウスは、全体の実験期間の間生存することを観察した。また、癌を有したマウスをB細胞ワクチンまたは樹状細胞ワクチンで免疫化すると、αGalCerとHer-2/neu63-71を積載したB細胞投与群は、樹状細胞ワクチンと類似の水準でHer-2/neuを発現する癌細胞の成長を抑制することを確認することができた(図19参照)。
【0034】
したがって、本発明のB細胞を媒介にするワクチン投与は、抗癌免疫の予防効果及び治療効果において樹状細胞を基盤にするワクチン程度に効率的であることを立証した。
【0035】
また、本発明は、ナチュラルキラーT細胞のリガンドを積載して抗原を発現するB細胞を含む免疫予防及び治療用ワクチン及び抗癌用ワクチンを提供する。
【0036】
ペプチドを積載した細胞ワクチンに比べてウイルスを媒介として全体抗原を導入した細胞ワクチンは、主組織適合性複合体の一倍体型に限らず、すべての人に適用可能であり、多くの抗原決定基に特異的な免疫反応を誘導することができる。特に、体液性免疫反応と細胞性免疫反応を同時に誘導することができるという長所がある。腫瘍関連抗原であるHer-2/neuを標的にしてHer-2/neuの細胞外領域及び細胞膜領域を発現する遺伝子を有したアデノウイルス(AdHM)でB細胞を感染させた結果、B細胞がアルファガラクトシルセラミドを提示するにおいても、特別な影響を及ぼさないことを確認した(図21参照)。また、免疫化して1週間過ぎた時点で、BとB/αGalCerで免疫化されたマウス群では、標的細胞の分解を観察することができなかった一方、B/AdHMとB/AdHM/αGalCerで免疫化されたマウス群では、細胞毒性T細胞反応を確認することができた(図22及び図24参照)。
【0037】
アルファガラクトシルセラミド(αGalCer)が積載されたアデノウイルスで形質導入されたB細胞(B/AdHM/αGalCer)は、アデノウイルスで導入したB細胞(B/AdHM)に比べて、細胞毒性T細胞反応が多少高く長期間持続する傾向性を見せるが、有意な水準の差が現れないことから、細胞毒性T細胞反応を誘導するのにおいてペプチドを積載したB細胞ワクチンとは異なり、アルファガラクトシルセラミドの積載が決定的な役割を担当しないことを示している。しかし、アルファガラクトシルセラミドが積載されたB細胞ワクチンをマウスに投与すると、形質導入だけされたB細胞ワクチン投与群とは異なり、体内でNKT細胞を刺激して結果的にナチュラルキラー細胞を活性化させることを確認した(図25参照)。
【0038】
本発明者等は、B細胞ワクチンが細胞毒性T細胞を誘導する効率性を測定するために、完全な細胞毒性T細胞を誘導する水準以下で細胞ワクチンを投与した時に誘導される標的細胞の溶解程度を比較した。その結果、アデノウイルスで形質導入されたB細胞(B/AdHM)の場合、全体細胞数の約20%程度だけが抗原提示細胞で機能することを勘案すると、抗原をアデノウイルスで導入したB細胞ワクチンは、ペプチドが積載されたB細胞ワクチンに比べて多数のB細胞投与が必要であるにもかかわらず、効率的に抗原特異的な細胞毒性T細胞反応を誘導することができると判断される。また、少数のB細胞が投与された時、アルファガラクトシルセラミドの積載でNKTの助けを受ける場合、標的細胞を溶解するのに多少有利であることを確認した。
【0039】
前記で癌抗原発現のためにB細胞に導入するウイルスは、アデノウイルス、レトロウイルス、ワクシニアウイルス、ポックスウイルス(Pox virus)、シンドビスウイルス等が可能だが、これに限定されない。ウイルスを使用した方法以外にも、抗原遺伝子伝達で適用可能なものは、1)DNAをリポソーム(liposome)に結合させて形質導入して酵素分解からDNAを保護したりエンドソーム(endosome)で吸収するようにする方法、2)DNAにタンパク質で構成された分子コンジュゲート(molecular conjugate)や合成リガンドを結合して細胞でDNAの伝達効率を高める方法[例:アシアログリコプロテイン(Asialoglycoprotein)、トランスフェリン(transferrin)、ポリマーIgA(polymeric IgA)]、3)PTD(Protein transduction domain)を使用した新しいDNA伝達システムで、細胞でDNAの伝達効率を高めることで、抗原遺伝子を伝達する方法[例:Mph-1]、4)前記方法以外にも、ペプチドを使用したり抗原タンパク質をB細胞に適用することで、B細胞が抗原を提示するようにできる。
【0040】
また、本発明は、アルファガラクトシルセラミドが積載されたB細胞を媒介にするナチュラルキラーT細胞活性化剤を提供する。
【0041】
前記と同様に、本発明のアルファガラクトシルセラミドが積載されたB細胞は、樹状細胞と同じく生体外でナチュラルキラーT細胞ハイブリドーマを刺激してIL-2を生成し(図30参照)、生体内でも不変性ナチュラルキラーT細胞を活性化して結果的に免疫細胞の活性を誘導した(図2参照)。したがって、本発明のアルファガラクトシルセラミドが積載されたB細胞は、既存の樹状細胞と同じくナチュラルキラーT細胞活性化剤として使用することができる。
【0042】
併せて、本発明は、癌抗原を発現するB細胞を含む細胞毒性反応誘導剤を提供する。
【0043】
アデノウイルスで形質導入されたB細胞ワクチンは、細胞性免疫反応を誘導するためにペプチドを積載したB細胞ワクチンとは異なり、細胞性免疫反応及び体液性免疫反応を同時に誘導することができるという長所がある。AdHMで形質導入されたB細胞ワクチンが、Her-2/neu特異的な抗体を誘導することができるかどうかを調べるために、マウスをB/AdHM及びB/AdHM/αGalCerで各々免疫化させた後、血清中の抗-Her-2/neu抗体の力価を測定した結果、B/AdHM及びB/AdHM/αGalCerの二つの集団全てで、長い間抗-Her-2/neu抗体が高い力価で維持されることが観察され(図27参照)、B細胞(B)及びB/αGalCerと異なりB/AdHM及びB/AdHM/αGalCerワクチン投与集団では、全て体液性免疫反応が生成されることを確認した(図28参照)。
【0044】
本発明者等は、マウスをB細胞ワクチンで免疫化した後、7日目にHer-2/neuを発現するマウス癌細胞(TAUF)を静脈注射して生存率を測定した結果、B細胞だけ投与を受けたマウス群に比べて、アルファガラクトシルセラミドを積載したB細胞(B/αGalCer)の投与を受けたマウス群で、生存期間が多少延長され、癌抗原を発現するアデノウイルスで形質導入されたB細胞ワクチンで免疫化されたマウスで、すぐれた抗癌予防効果を確認することができた(図29参照)。したがって、アルファガラクトシルセラミドを積載してアデノウイルスで形質導入されたB細胞ワクチンに誘導された免疫反応が、効果的に癌を予防するということが分かった。
【0045】
次に、B細胞ワクチンの治療効果を確認するために、BALB/cマウスを、B、B/αGalCer、B/AdHM、B/AdHM/αGalCerに各々免疫化した後、癌細胞(TAUF)を尾静脈に注射して肺癌を誘導した結果、B細胞だけ単独で投与を受けたマウス群が一番短い生存期間を示し、B/αGalCerワクチン投与群もこれに似た傾向が観察された。B/AdHMワクチンで免疫化されたマウス群は、B、B/αGalCer投与群に比べて生存期間が延長されたが、完璧に癌の生成を抑制することはできなかった。一方、B/AdHM/αGalCer投与群は、他の投与群に比べて生存期間が有意的に増加した。したがって、B、B/αGalCerまたはB/AdHMの免疫化で誘導される抗癌効果に比べて優れた効果を示すことを確認した(図29参照)。
【0046】
本発明のワクチンは、ナチュラルキラーT細胞のリガンドとB細胞に追加で同一または類似の機能を示す有効成分を1種以上含むことができる。前記ワクチンは、投与のために前記記載した有効成分以外に追加で薬剤学的で許容可能な担体を1種以上含んで製造することができる。薬剤学的に許容可能な担体は、食塩水、リンゲル液、緩衝食塩水、デキストロース溶液、マルトデキストリン溶液、グリセロール、エチルアルコール及びこれら成分中の1成分以上を混合して使用することができ、必要によって抗酸化剤、緩衝液、整菌剤等、他の通常の添加剤成分を添加することができる。また希釈剤、分散剤、界面活性剤、結合剤及び潤滑剤を付加的に添加して、水溶液、懸濁液、乳濁液等のような注射用剤形等に製剤化することができる。一歩進んで、当分野の適正な方法でまたはレミントン(Remington's Pharmaceutical Science(最近版)、Mack Publishing Company、Easton PA)に開示されている方法を使用して、各疾患によってまたは成分によって好ましく製剤化できる。
【0047】
本発明のワクチンは、非経口で投与することができ、非経口投与は、皮下注射、静脈注射、筋肉内注射または胸部内注射注入方式による。非経口投与用剤形に製剤化するためには、本発明のナチュラルキラーT細胞のリガンドを積載したB細胞、ナチュラルキラーT細胞のリガンドとペプチドを積載したB細胞または癌抗原を発現するウイルスで感染されたB細胞は、安定剤または緩衝剤とともに混合して、溶液または懸濁液に製造して、それをアンプルまたはバイアルの単位投与型に製剤化する(既存の樹状細胞の形質導入に適用されるウイルスベクターの基準を参照)。
【0048】
ワクチンは、患者において免疫反応を刺激するのに効果的な量で投与することができる。例えば、ワクチンは、ヒトに一回ないし数回で投与することができ、投与量は細胞数が1×103個/kg〜1×109/kg個、好ましくは1×104個/kg〜1×108個/kgである。アルファガラクトシルセラミドを積載したB細胞ワクチンを製作する場合、B細胞1×106〜1×107個/ml当たりアルファガラクトシルセラミド1〜2μg/mlが入った培地を使用して培養する。アルファガラクトシルセラミドとペプチドを積載したB細胞ワクチンを製作する場合、B細胞1×106〜1×107個/ml当たりアルファガラクトシルセラミド1〜2μg/mlが入った培地を使用して、ペプチドはB細胞1×106〜1×107個/mlを1〜10μg/mlペプチドが含まれた培地で培養して細胞に積載させる。
【0049】
アルファガラクトシルセラミドは、げっ歯類及び猿で毒性を誘導しないものとみられている(Nakata等,Cancer Res.,1998年,第58巻,1202-1207頁)。2200μg/KgのαGalCerが注入されたマウスでも、副作用は報告されていない(Giaccone等、Clin.Cancer Res.,2002年,第8巻,3702頁)。進行中の臨床試験でも、αGalCerの全身投与によって軽微な頭痛のような副作用が一部報告されたが(Mie Nieda等,Blood,2004年,第103巻,383-389頁;Giaccone等,Clin.Cancer Res.,2002年,第8巻,3702頁)、パラセタモール(paracetamol)の投与によって予防することができ、これら対象においても微弱な全身的副作用が必ず現れるのではない(Giaccone等、Clin.Cancer Res.,2000年,第8巻,3702頁)。本発明でも、αGalCerは、用量制限毒性(dose-limiting toxicity)(50-4800μg/m2)を惹起しないで、用量増加実験(dose escalation study)でも耐性を示し、αGalCerは安全な物質であると判断される。
【0050】
前記でペプチドは、ウイルス、バクテリア、菌類、寄生虫及び癌由来の抗原ペプチドが含まれ、ウイルスを媒介にして発現が誘導された抗原は、ウイルス、バクテリア、菌類、寄生虫及び癌由来の抗原が含まれる。
【0051】
「抗原」は、宿主の体内に入って来た時、宿主の免疫系によって認識されて免疫反応を起こすことができるすべての物質(例えば、タンパク質、ペプチド、癌細胞、糖蛋白質、糖脂質、生ウイルス、死ウイルス、DNA等)を意味する。抗原はまた、精製されたまたは精製されない形態で提供することができ、精製された形態で提供されることが好ましい。本発明は、病原体のタンパク質、組換えタンパク質、ペプチド、多糖類、糖蛋白質、脂質多糖類及びDNA分子(ポリヌクレオチド)、癌細胞、生ウイルス、死ウイルスを含む抗原にも適用することができる。
【0052】
下記の抗原リストは、実施例の癌抗原の代わりをして免疫反応を誘導する手段として提供でき、これに制限されるものではない:インフルエンザウイルス(influenza virus)抗原(haemagglutinin及びneuraminidase抗原)、百日咳菌(Bordetella pertussis)抗原(pertussis toxin、filamentous haemagglutinin、pertactin)、ヒトパピロマウイルス(human papilloma virus、HPV)抗原(glycoprotein)、ヘリコバクテリアピロリ(Helicobacterpylori)抗原(capsula polysaccharides of serogrupA,B,C,Y及びW-135)、破傷風菌抗原(tetanus toxoid)、ジフテリア菌(diphtheria)抗原(diphtheria toxoid)、肺炎菌(pneumococcal)抗原(Streptococcus pnemoniae type 3 capsular polysaccharide)、結核菌(tuberculosis)抗原、ヒト免疫欠乏ウイルス(human immunodeficiency virus、HIV)抗原(GP-120、GP-160,p18,Tat,Gag,Pol,Env)、コレラ(cholera)抗原(cholera toxin B subunit)、葡萄状球菌(staphylococcal)抗原(staphylococcal enterotoxin B)、赤痢菌(shigella)抗原(shigella polysaccharides)、小水疱性口内炎ウイルス(vesicular stomatitis virus)抗原(vesicular stomatitis virus glycoprotein)、サイトメガロウイルス(cytomegalovirus,CMV)抗原、肝炎ウイルス(hepatitis)抗原(hepatitis A(HAV),B(HBV),C(HCV),D(HDV)及びG(HGV)抗原)(core antigen and surface antigen)、呼吸器多核体ウイルス(respiratory synctytial virus、RSV)抗原、ヘルペスシンプレックス(herpes simplex)抗原またはその組み合わせ(例、ジフテリア、百日咳菌及び破傷風菌、DPT)、ボレリア(Borrelia sp.)抗原(例、OspA、OspB、OspC antigen)、カンジダ(Candida albicans)抗原(例、MP65)、プラスモジウム(Plasmodium)抗原(例、CS プロテイン)。
【0053】
癌抗原は、正常な遺伝子の体細胞変異の結果生成されて、癌細胞の遺伝的不安定性に起因する産物である癌特異抗原(tumor-specific antigen)と癌抗原の大部分を占めて癌細胞で発現が増加する抗原で、発生段階で一時的に発現されたり特定組職にだけ発現されるタンパク質で、正常に体内に存在する自家抗原である癌共有抗原が含まれる。癌特異抗原の例としては、HPV E6/E7等の癌ウイルスによる癌抗原があり、癌共有抗原の例としては、gp100、チロシナーゼ(tyrosinase)、TRP-1(tyrosinase-related protein-1)、TRP-2(tyrosinase-related protein-2)、MAGE、MUC-1、CEA(arcinoembryonic antigen)、p53、アルファ-フェトプロテイン(alpha-fetoprotein)及びHer-2/neu等がある(Rosenberg SA.,Nature,2001年,第17;411(6835)巻,380-4頁)。
【図面の簡単な説明】
【0054】
【図1】アルファガラクトシルセラミド(αGalCer)が積載されたB細胞及びナチュラルキラーT細胞(iNKT)間での両方向活性化を示す図である。CD11c+細胞を除去した後、マウスの脾臓からB細胞を純粋分離した後、フローサイトメーターでCD19、CD11c及びCD1dの発現を測定した結果を示したグラフである。
【図2】アルファガラクトシルセラミド(αGalCer)が積載されたB細胞及びナチュラルキラーT細胞(iNKT)間での両方向活性化を示す図である。C57BL/6野生型またはJα281-/-マウスにビヒクル単独、αGalCer、αGalCerが積載されたB細胞(B/αGalCer)または樹状細胞(DC/αGalCer)を投与した後、IL-4またはIFN-γを生成する細胞の数をELISPOTで分析した結果を示したグラフである。
【図3】アルファガラクトシルセラミド(αGalCer)が積載されたB細胞及びナチュラルキラーT細胞(iNKT)間での両方向活性化を示す図である。ビヒクルまたはαGalCerが積載されたB細胞をCFSEで標識してC57BL/6マウスに投与した後、脾臓細胞から分離したCFSE+細胞を分析した結果を示したグラフである。
【図4】ペプチド(OVA257-264)とαGalCerが一緒に積載されたB細胞によるペプチド特異的なCD8+T細胞の活性化を示した図である。CFSEで標識されたOVA257-264に特異的なCD8+T細胞(OT-IT細胞)をC57BL/6マウスに移植した後、ビヒクル単独、B/αGalCer、B/pep、またはB/αGalCer/pepを投与した後、OT-IT細胞の分裂とサイトカイン生成をフローサイトメーターで測定した結果を示したグラフである。
【図5】ペプチド(OVA257-264)とαGalCerが一緒に積載されたB細胞によるペプチド特異的なCD8+T細胞の活性化を示した図である。C57BL/6マウスにB細胞単独、B/αGalCer、B/pepまたはB/αGalCer/pepを投与した後、1週、3週、または5週後にCFSEで標識された同種の標的を注入して生体内の細胞毒性Tリンパ球活性を測定した結果を示したグラフである。CFSEhigh:ペプチドが積載された標的群CFSElow:ペプチドが積載されない対照群。
【図6】ペプチド(OVA257-264)とαGalCerが一緒に積載されたB細胞によるペプチド特異的なCD8+T細胞の活性化を示した図である。生体内にB細胞ワクチンを投与して7日後にマウスの脾臓細胞を分離して、IFN-γを生成するCD8+T細胞の反応を測定したもの(左側)と、それを体外でOVA257-264を積載した同種の脾臓細胞に再刺激した場合に現れるIFN-γを生成するCD8+T細胞の数を測定した(右側)グラフである。
【図7】B細胞を媒介にする細胞ワクチン及び樹状細胞(DC)を媒介にする細胞ワクチンとの細胞毒性Tリンパ球形成における効率性比較を示した図である。OVA257-264ペプチドが積載されたB/αGalCer/pep及びDC/αGalCer/pepを順次に希釈してマウスに投与して以後、OVA257-264ペプチドに対する生体内細胞毒性Tリンパ球活性を測定したグラフである。
【図8】B細胞を媒介にする細胞ワクチン及び樹状細胞(DC)を媒介にする細胞ワクチンとの細胞毒性Tリンパ球形成における効率性比較を示した図である。OVA257-264ペプチドとビヒクルが積載されたB/ビヒクル/pep及びDC/ビヒクル/pepを前記のような方法で投与することで誘導される、OVA257-264ペプチドに対する生体内細胞毒性Tリンパ球活性を示したグラフである。
【図9】B細胞を媒介にするワクチンによって細胞毒性Tリンパ球反応を誘導するのに関与する免疫細胞の種類を示した図である。αGalCerとOVA257-264ペプチドが一緒に積載されたB細胞を投与する前または後に、特定免疫細胞を除去する抗体を注入した後、OVA257-264ペプチドに対する生体内細胞毒性Tリンパ球活性を示したグラフである。
【図10】B細胞を媒介にするワクチンによって細胞毒性Tリンパ球反応を誘導するのに関与する免疫細胞の種類を示した図である。野生型、Jα281-/-、またはMHC classII-/-マウスにαGalCerとOVA257-264ペプチドが一緒に積載されたB細胞を投与した後、OVA257-264ペプチドに対する生体の外細胞毒性を標準51Cr放出分析を実施して示したグラフである。
【図11】αGalCerとOVA257-264ペプチドが一緒に積載されたB細胞が、CD8+T細胞に直接的な抗原提示細胞として作用するということを示した図である。野生型またはbm-1マウスから分離したB細胞にαGalCerとOVA257-264ペプチドを一緒に積載した後、各々野生型マウスに投与した後、OVA257-264ペプチドに対する生体内細胞毒性を測定した結果を示したグラフである。
【図12】αGalCerとOVA257-264ペプチドが一緒に積載されたB細胞が、CD8+T細胞に直接的な抗原提示細胞として作用するということを示した図である。αGalCerとOVA257-264ペプチドが一緒に積載されたB細胞またはOVA257-264ペプチドが積載されたB細胞とαGalCerが積載されたB細胞を使用して、各々C57BL/6マウスを免疫化した後、誘導されるOVA257-264ペプチドに対する生体内細胞毒性を示したグラフである。
【図13】B細胞を媒介にするワクチンが、OVAを発現するB16黒色腫瘍に対する予防的及び治療的抗癌免疫活性を提供するということを示した図である。C57BL/6マウスをB細胞単独、B/αGalCer、B/pep、B/αGalCer/pep、DC/pep、またはDC/αGalCer/pepで免疫化させた後、7日後にMO-5癌細胞を前記マウス皮下に移植してマウスの腫瘍大きさを測定した結果を示したグラフである。
【図14】B細胞を媒介にするワクチンが、OVAを発現するB16黒色腫瘍に対する予防的及び治療的抗癌免疫活性を提供するということを示した図である。図13で腫瘍が生成されないマウスに最初の腫瘍を移植してから70日後、MO-5細胞(2×105個)を再移植して腫瘍大きさを測定して示したグラフである。
【図15】B細胞を媒介にするワクチンが、OVAを発現するB16黒色腫瘍に対する予防的及び治療的抗癌免疫活性を提供するということを示した図である。C57BL/6マウスにMO-5癌細胞(2×105個)を皮下に移植して、1日後と9日後にB細胞単独、B/αGalCer、B/pep、B/αGalCer/pep、DC/pep、またはDC/αGalCer/pepで各々免疫化してマウスの腫瘍大きさを測定した結果を示したグラフである。*、p<0.05:「B細胞単独」対照群(図13、図15及び図16)または週齢が補正されたワクチン投与を受けないマウス群(図14)との有意的な差を示す。
【図16】B細胞を媒介にするワクチンが、OVAを発現するB16黒色腫瘍に対する予防的及び治療的抗癌免疫活性を提供するということを示した図である。C57BL/6マウスにMO-5癌細胞(2×105個)を皮下に移植して、1日後と9日後にB細胞単独、B/αGalCer、B/pep、B/αGalCer/pep、DC/pep、またはDC/αGalCer/pepで各々免疫化してマウスの腫瘍大きさを測定した結果を示したグラフである。*、p<0.05:「B細胞単独」対照群(図13、図15及び図16)または週齢が補正されたワクチン投与を受けないマウス群(図14)との有意的な差を示す。
【図17】B細胞を媒介にするワクチンが、実際癌抗原であるHer-2/neuを発現する腫瘍で抗癌免疫反応を誘導するということを示した結果である。B細胞単独、αGalCerが積載されたB細胞、Her-2/neu63-71(hP63)が積載されたB細胞、αGalCerとhP63が一緒に積載されたB細胞、hP63が積載された樹状細胞、αGalCerとhP63が一緒に積載された樹状細胞を、各々BALB/cマウスに免疫化させた後、誘導される生体内細胞毒性を示したグラフである。
【図18】B細胞を媒介にするワクチンが、実際癌抗原であるHer-2/neuを発現する腫瘍で抗癌免疫反応を誘導するということを示した結果である。前記のような方法でCT-26-Her2/neuを尾静脈(図18)または皮下(図19)に移植した後、前記B細胞または樹状細胞(DC)で免疫化させた後、マウスの生存率(図18)または腫瘍の大きさ(図19)を測定した結果を示したグラフである。
【図19】B細胞を媒介にするワクチンが、実際癌抗原であるHer-2/neuを発現する腫瘍で抗癌免疫反応を誘導するということを示した結果である。前記のような方法でCT-26-Her2/neuを尾静脈(図18)または皮下(図19)に移植した後、前記B細胞または樹状細胞(DC)で免疫化させた後、マウスの生存率(図18)または腫瘍の大きさ(図19)を測定した結果を示したグラフである。
【図20】B細胞にウイルスで全体抗原を形質導入する方法を、B細胞ワクチンに適用することができるかどうかを確認した図である。腫瘍関連抗原であるHer-2/neuの細胞外領域と細胞膜領域を発現することができるアデノウイルス(AdHM)を、B細胞に感染させた後、B細胞表面に発現されるHer-2/neuを測定して示したグラフである。
【図21】B細胞にウイルスで全体抗原を形質導入する方法を、B細胞ワクチンに適用することができるかどうかを確認した図である。AdHMで形質転換されたB細胞がαGalCerを積載してDN32.D3細胞を活性化することができることを示した実験で、B細胞、αGalCerを積載したB細胞、AdHMで形質転換されたB細胞、そしてAdHMで形質転換してαGalCerを積載したB細胞とDN32.D3細胞を一緒に培養した培養上層液のIL-2をエライザ(ELISA)で測定して示したグラフである。
【図22】腫瘍関連抗原であるHer-2/neuで形質導入されたB細胞がマウスで効果的に細胞毒性免疫反応を誘導するかどうかを示した図である。BALB/cマウスの脾臓細胞から分離したB細胞にアデノウイルスで形質導入された細胞(B/AdHM)、追加的にαGalCerを積載した細胞(B/AdHM/αGalCer)、B細胞単独及びB/αGalCerで各々免疫化させた後、細胞毒性T細胞の抗原決定ペプチドを積載した標的細胞を移植した後、体内で誘導された抗原特異的な細胞毒性Tリンパ球反応を測定して示したグラフである。
【図23】腫瘍関連抗原であるHer-2/neuで形質導入されたB細胞がマウスで効果的に細胞毒性免疫反応を誘導するかどうかを示した図である。B/AdHM及びB/AdHM/αGalCerワクチンで各々マウスを免疫化させた後、細胞毒性T細胞反応が長期間持続することを示したグラフである。
【図24】腫瘍関連抗原であるHer-2/neuで形質導入されたB細胞がマウスで効果的に細胞毒性免疫反応を誘導するかどうかを示した図である。B/AdHM及びB/AdHM/αGalCerワクチンで各々マウスを免疫化させた後、体外で細胞毒性T細胞ペプチドで刺激した時または刺激しなかった時、CD8+T細胞のIFN-γの生成を測定結果を示したグラフである。対照群:ワクチン投与を受けていないマウス群。
【図25】アデノウイルスで形質導入されたB細胞(B/AdHM及び B/AdHM/αGalCer)ワクチンによってナチュラルキラー(NK)細胞の活性化が誘導されて、細胞毒性T細胞が効率的に作用することを示した図である。ナチュラルキラー細胞の活性化を示したグラフである。
【図26】アデノウイルスで形質導入されたB細胞(B/AdHM及び B/AdHM/αGalCer)ワクチンによってナチュラルキラー(NK)細胞の活性化が誘導されて、細胞毒性T細胞が効率的に作用することを示した図である。ワクチン集団間で細胞毒性T細胞を誘導する効率性を測定するために、細胞ワクチンの濃度によって誘導される標的細胞の溶解度を示したグラフである。
【図27】AdHMで形質導入されたB細胞(B/AdHM及びB/AdHM/αGalCer)ワクチンが、Her-2/neuに特異的な抗体誘導を示す結果である。BALB/cマウスにB/AdHM及びB/AdHM/αGalCerで各々免疫化させた後、血清内の抗Her-2/neu抗体がHer-2/neuを表面に発現するマウス癌細胞であるTAUF細胞に結合する程度で、抗-Her-2/neu抗体の力価を測定した結果を示したグラフである。
【図28】AdHMで形質導入されたB細胞(B/AdHM及びB/AdHM/αGalCer)ワクチンが、Her-2/neuに特異的な抗体誘導を示す結果である。各群での体液性免疫反応を示したグラフである。
【図29】アデノウイルスで形質導入されたB細胞ワクチンの抗癌活性を示したもので、Her-2/neuを発現するマウス癌細胞を投与して肺癌を誘導したマウスを、B細胞ワクチンで免疫化させた結果を示したグラフである。
【図30】ナチュラルキラーT細胞の活性化指標であるIL-2を生成するにおいて、αGalCer濃度によってαGalCerを積載したB細胞が、ナチュラルキラーT細胞を活性化させてIL-2生成を誘導する程度及び、細胞数にしたがってαGalCerを積載したBまたは樹状細胞(DC)がナチュラルキラーT細胞を活性化する程度を示した図である。
【図31】生体内にCD4+、CD8+、またはNK1.1細胞を除去することができる抗体を投与して、特定免疫細胞が除去される現象を示したグラフである。
【図32】生体内にCD4+、CD8+、またはNK1.1細胞を除去することができる抗体を投与して、特定免疫細胞が除去される現象を示したグラフである。
【図33】生体内にCD4+、CD8+、またはNK1.1細胞を除去することができる抗体を投与して、特定免疫細胞が除去される現象を示したグラフである。
【図34】生体内にCD4+、CD8+、またはNK1.1細胞を除去することができる抗体を投与して、特定免疫細胞が除去される現象を示したグラフである。
【図35】生体内にCD4+、CD8+、またはNK1.1細胞を除去することができる抗体を投与して、特定免疫細胞が除去される現象を示したグラフである。
【図36】胸線腫(EG-7)に対するB細胞を媒介にする細胞ワクチンの抗癌免疫活性を示した図である。*、p<0.001:B細胞単独処理された群との統計的な有意性。
【発明を実施するための形態】
【0055】
以下、本発明を実施例によって詳しく説明する。
但し、下記の実施例は本発明を例示するだけのものであって、本発明の内容が下記の実施例に限定されるものではない。
【実施例】
【0056】
<実施例1>アルファガラクトシルセラミドを積載したB細胞及びナチュラルキラーT細胞間での両方向活性化
<1-1>B細胞と樹状細胞のナチュラルキラーT細胞活性化効果の比較
アルファガラクトシルセラミド(Kim,S.,等,Synthesis,2004年,847頁)が積載された樹状細胞(dendritic cell、DC)が、不変性ナチュラルキラーT(iNKT)細胞を活性化させるということは公知の事実なので、本発明ではまず、このようなアルファガラクトシルセラミドが積載されたB細胞が前記の樹状細胞と類似の効果を示すかどうか確認して見た。
【0057】
本発明では、6-10週齢のメスのC57BL/6とBALB/cを使用した。OT-I及びC57BL/6bm1(bm1)マウスは、ジャクソン研究所(The Jackson Laboratory)から購入し、Jα281-/-マウス及び MHC II-/-マウスは、各々ソウル大学校ジョン・ドヒョン教授(Kim JH等,Am J Pathol.,2005年,第167(5)巻,1231-41頁)と高麗大学校パク・セホ教授(Park,S.H.,等,J.Exp.Med.,2001年,第193巻,893頁)から提供を受けた。すべてのマウスは、ソウル大学校薬学研究所動物センターの特定病原体がない条件(specific pathogen-free condition)下で保存した。また、抗体等は、GK1.5(抗-CD4:ATCC number:TIB-207)、2.43(抗-CD8;ATCC number:TIB-210)及びPK136(抗-NK1.1;ATCC number:HB-191)ハイブリドーマから取得し、生体内で各々に対するリンパ球を除去するためにマウス当り150μgずつを腹腔に投与した。
【0058】
詳細には、各々のマウスからB細胞を純粋分離するために、マウスから脾臓を摘出した後、均質化(homogenization)して、脾臓細胞から抗-CD11cマイクロビーズ(Miltenyibiotec)でCD11c+細胞を除去した後、抗B220マイクロビーズ(Miltenyibiotec)を使用してB220+細胞を分離した。前記細胞等は、99%以上がCD19を発現する純粋に分離されたB細胞である(図1参照)。
【0059】
脾臓から樹状細胞を分離するために、マウスから摘出された脾臓をコラゲナーゼ(collagenase)D(1mg/ml、ロシュ)及びDNase I(50μg/ml、シグマアルドリッチ)を含んだ7mlの培地を使用して37℃で30分間反応させた後、EDTA(最終濃度10mM、pH7.2)を添加して5分間さらに反応させた。15.5%Accudenz密度勾配(Accurate Chemical & Scientific社)を使用して脾臓から分離した細胞から樹状細胞を分離した。
【0060】
前記のように分離した細胞(B細胞または樹状細胞)は、準備したアルファガラクトシルセラミド(1μg/ml)または溶媒(0.5%ポリソルベート)とともに二酸化炭素培養器で14時間培養した後、ナチュラルキラーT細胞ハイブリドーマ(DN32.D3)(Claire Forestier等,The Journal of Immunology,2003年,第171巻,4096頁)とともに24時間培養した。以後、培養液からナチュラルキラーT細胞ハイブリドーマの活性化指標であるIL-2濃度をサンドイッチエライザ法で測定した。
【0061】
その結果、アルファガラクトシルセラミドを積載した樹状細胞(DC/αGalCer)は、DN32.D3を刺激してIL-2を生成した。これと類似に、アルファガラクトシルセラミドを積載したB細胞(B/αGalCer)も、効率的にDN32.D3を刺激してIL-2を生成した。ハイブリドーマと抗原提示細胞を高い割合で混合したB細胞群で生成されるIL-2レベルは、樹状細胞群で生成されるIL-2の量と等しかったが、低い割合で混合した時は樹状細胞群のIL-2量より少なく現れた(図30参照)。
【0062】
<1-2>ナチュラルキラーT細胞依存的免疫反応活性化確認
本発明では、C57BL/6マウスから取得したB細胞と、DCを使用して製造したB/αGalCerまたはDC/αGalCerを同種のマウスに静脈注射して、エリスポット(ELISPOT)を通じてIL-4及びIFN-γレベルを測定した。詳細には、野生型C57BL/6またはJα281-/-マウスにビヒクル、αGalCer、αGalCerを積載したB細胞またはαGalCerを積載した樹状細胞を静脈注射した。一週間後、脾臓細胞を摘出して単一細胞に作った後にエリスポット用プレートに入れて、ビヒクルまたはαGalCerを入れて6時間培養して刺激した。以後は、製造社(IL-4ELISPOTキット、IFN-γ ELISPOTキット全てR&Dシステム)のマニュアルによって、IL-4とIFN-γを生成する細胞を測定するためのエリスポット試験を実施した。
【0063】
その結果、B/αGalCer及びDC/αGalCerグループ全てで、IL-4及びIFN-γを生成する細胞を顕著に多く誘導した(図2)。しかし、不変性ナチュラルキラーT細胞が欠如したJα281-/-マウスの場合には、正常マウスとは異なり前記のようなサイトカインを生成する細胞が誘導されない。これは、IFN-γとIL-4を生成する細胞が、不変性ナチュラルキラーT細胞依存的に誘導されるということを示唆する(図2参照)。
【0064】
<1-3>ナチュラルキラーT細胞活性化によるB細胞活性化確認
本発明者等は、B細胞を注射すると生体内でどんな変化が起きるのかを調べるために、CFSE(Carboxyfluorescein Succinimidyl Ester)が標識されたB/αGalCerを静脈投与した後、CFSE+細胞で共刺激分子を分析した。詳細には、C57BL/6の脾臓及びリンパ節から単一細胞を取得した後、抗CD11cマイクロビード(Miltenyibiotec)を使用して脾臓及びリンパ器官から分離したリンパ球の中でCD11c+細胞を除去して、抗B220マイクロビード(Miltenyibiotec)を使用してB細胞を分離した後、その細胞を10μMのCFSEで標識して同種マウスの尾静脈にした。CFSE標識は、RPMI培地に適切な濃度でCFSE(Molecular Probe)を希釈して、37℃で15分間培養して標識した後、RPMI培地で3回洗浄して残余のCFSEを除去する方法で実施した。標識してから24時間後と48時間後、前記マウスのリンパ節や脾臓から分離したCFSE+細胞の共刺激分子をフローサイトメーター(flow cytometry)で分析した。
【0065】
その結果、24時間以内にCD80はなんの変化もなかったが、CD86は高いレベルで発現が誘導され、CD40及びMHC IIの発現も弱く増加することを観察することができた(図3)。注射後48時間が経過した後にもCD80の増加は観察されなかったが、その他は24時間のレベルと大部分類似だった。すなわち、24時間以内にB/αGalCerによって活性化したナチュラルキラーT細胞によって投与されたB細胞も活性化になる現象を確認することができた。
【0066】
前記実施例<1-1>、<1-2>と<1-3>の結果によって、B/αGalCer及びDC/αGalCerの全てでナチュラルキラーT細胞を活性化させることができ、B細胞はアルファガラクトシルセラミドを提示受けたナチュラルキラーT細胞によって活性化されるので、前記活性化は両方向で成り立つという事実を確認した。
【0067】
<実施例2>ペプチド及びαGalCerがともに積載されたB細胞によるペプチドに特異的なCD8+T細胞の活性化促進
本発明者等は、アルファガラクトシルセラミド(αGalCer)とMHC IペプチドをB細胞に一緒に積載することで、ペプチドに特異的なCD8+T細胞を刺激してOVA特異的な細胞毒性を起こすことができるかどうかを調べた。
【0068】
そのために、まずCFSEで標識されたOVA特異的なCD8T細胞(OT-I)を、C57BL/6マウスの尾静脈に移植(adoptive transfer)して、一日後にビヒクルを含んだ培地で培養したB細胞(B細胞)、αGalCerを積載したB細胞(B/aGarCer)、OVA257-264ペプチドを積載したB細胞(B/pep)そして、αGalCerとOVA257-264ペプチドを積載したB細胞(B/aGarCer/pep)を静脈注射した。48時間後に脾臓から単一細胞を得た後にOT-I細胞の分裂を観察した。別に、1μMのOVA257-264ペプチドと1μL/mLのGolgiPlμgで4時間培養した後、IL-2とIFN-γを生成するOT-I細胞をCytoperm/Cytofixキット(BD Pharmingen)を使用して細胞内サイトカイン染色法で試験した。
【0069】
その結果、B細胞単独またはB/αGalCerを投与した群では、OVA特異的なCD8+T細胞すなわち、OT-I細胞の分裂がほとんど誘導されなかった。特に、B/αGalCerを投与した群では、弱いながらもOT-I細胞の分裂を示したが(図7、1.2±0.5%vs.5.4±1.8%)、これは抗原非特異的な変化であると思われる。一方、B/pepを投与した群では、相当に多いOT-I細胞の分裂を誘導した。しかし、生体外で同一ペプチドで再刺激すると、このような細胞の極少数だけがIL-2を生成し(<4%)相対的に少ないIFN-γを生成した(38%)。これとは対照的に、B/αGalCer/pepを投与した群では、OT-I細胞の顕著な分裂が現れ、分裂した細胞の40%以上がIL-2を生成して、90%以上がIFN-γを生成し、そのレベルはB/pep群に比べて顕著に高かった(図4)。
【0070】
前記結果は、B/pepとアルファガラクトシルセラミドを一緒に積載することで、CD8+T細胞をずっと高いレベルで活性化させることができることを示している。
【0071】
<実施例3>B/αGalCer/pepによる持続性を有した細胞毒性T細胞反応の誘導及び免疫寛容の克服
<1-1>B/αGalCer/peptideによる持続的細胞毒性T細胞反応の誘導
本発明者等は、C57BL/6マウスにB細胞単独、B/αGalCer、B/pepまたはB/αGalCer/pepを各々静脈投与した後、生体内の細胞毒性Tリンパ球活性を測定して、B細胞ワクチンが細胞毒性免疫反応を誘導することができるかどうかを調べた。また、B細胞ワクチンによって誘導された細胞毒性免疫反応が、持続的に維持されるかどうかを調べた。詳細には、C57BL/6マウスを各々、B単独、B/αGalCer、B/pep及びB/αGalCer/pepで免疫化した後に、1週間、3週間、5週間後に生体内細胞毒性試験(in vivo CTL assay)を実施した。まず、同種の免疫化されていないマウスの脾臓単一細胞を二つのグループに分けた後、一グループはOVA257-264ペプチドを積載した後、20μMのCFSEで標識し(CFSEhigh)、他のグループはペプチド積載なしに2μMのCFSEで標識して対照細胞にした(CFSElow)。前記二つのグループの細胞を同量ずつ混合して免疫化したマウスに注射した後、一日後に脾臓単一細胞を摘出してCFSEhighとCFSElow細胞集団をフローサイトメーターを通じて測定した。ここで、CFSEhighの割合が低いほど細胞毒性免疫反応が大きいことを意味する。
【0072】
その結果、B/αGalCer/pepを投与した群でのみ、ペプチドが積載された標的を完全に破壊し、特異的に一回のワクチン接種以後、5週まで完璧に細胞毒性を示した。一方、B/αGalCerまたはB/pepを投与したマウス群の全てが、ペプチド特異的な細胞毒性T細胞反応が全く誘導されなかった。ただ、B/αGalCer/pepを投与した群でのみ、ペプチドに対するIFN-γを生成するCD8+T細胞が顕著に増加することを観察した(図6、左側)。
【0073】
<1-2>B/αGalCer/pepによる免疫寛容の克服確認
一般的に抗原のみを投与した場合には、免疫寛容が誘導されるので本発明者等は、αGalCerをペプチッドと一緒にB細胞に積載した時、抗原のみを投与して誘導される免疫寛容を乗り越えることができるかどうかを調べた。詳細には、前記実施例3の<1-1>と同様にC57BL/6マウスを免疫化して一週間後に脾臓単一細胞を摘出した後、OVAが積載された脾臓単一細胞で一週間刺激した。刺激された脾臓単一細胞に対して、IFN-γを生成するCD8+T細胞を前記の細胞内サイトカイン染色法で試験した。
【0074】
その結果、B細胞単独またはB/αGalCerを投与したマウスの場合には、正常に免疫反応が誘導されてペプチド特異的なIFN-γを生産するCD8+T細胞を誘導した一方(図6、右側)、B/pepを投与したマウスはIFN-γを生産するCD8+T細胞の増加が現れなかった。これはマウスがペプチドに対して「免疫寛容」を示したものとみられる。
【0075】
これとは対照的に、B/αGalCer/pepを投与したマウスは、B細胞単独またはB/αGalCerを投与した群に比べてペプチドに反応するCD8+T細胞を顕著に多く形成した。ここで、B単独またはB/αGalCerを投与したマウスの場合には、抗原が投与されたことがないから抗原特異的な免疫反応が誘導されないマウスで、OVAが積載された脾臓単一細胞の試験管内再刺激が最初の免疫反応である。一方、B/αGalCer/pepを投与したマウスの場合には、マウスにすでに抗原が投与されたのでOVAが積載された脾臓単一細胞の試験管内再刺激は再反応(recall response)になる。結論的に、B/αGalCer/pepは、免疫寛容を克服して免疫原性を示して、力強い再反応を示すことを確認した。
【0076】
<実施例4>樹状細胞ワクチンと類似の効能のB細胞ワクチンの細胞毒性Tリンパ球の生成を誘導確認
本発明者等は、B細胞を媒介にするワクチンの細胞毒性効果を樹状細胞ワクチンの細胞毒性効果と比較した。
【0077】
そのために、生体内細胞毒性Tリンパ球分析を使用して、完全に標的を溶解するのに必要な最小限の細胞数を測定してみた。詳細には、B細胞または樹状細胞を各々αGalCerまたはビヒクルとともに16時間乃至18時間培養した後、OVA257-264ペプチド1μg/mlで1時間培養した。その次に、細胞を順次に希釈して同種のマウスに静脈注射してから一週間後に、生体内細胞毒性Tリンパ球分析を実施した。すなわち前記実施例と同様に、ペプチドが適用された標的細胞はCFSEhighで標識して、ペプチドが適用されない対照細胞はCFSElowで標識してマウスに同量注入した後、一程時間が経ってマウスの脾臓細胞をフローサイトメーターで分析してCFSElow:CFSEhigh割合を算出して抗原特異的な標的細胞の溶解を測定した。
【0078】
その結果、DC/αGalCer/pep投与群は16000個の細胞だけでも完全に標的細胞の溶解を起こし、B/αGalCer/pep投与群では80000個の細胞で完全にペプチド特異的な溶解が起きた。前記のDC/αGalCer/pepと同数(16000個)のB/αGalCer/pepを投与すると体内で中間程度の細胞毒性を起こすことを観察した(図7)。しかし、樹状細胞の表面積がB細胞に比べてずっと大きいという点を考慮すると、B/αGalCer/pepはDC/αGalCer/pep程度効果的に体内で細胞毒性を起こすと言える。また、DC/pepは、OVA特異的に効率的な細胞毒性を起こした一方、B/pepを投与すると細胞の数字とは無関係に細胞毒性を誘導しなかった(図8)。特に、重要なことは、体内細胞毒性の傾向性がDC/pepとDC/αGalCer/pep投与群が相当に類似しているということであるが、これは、αGalCerを樹状細胞に積載することが、ペプチドを積載した樹状細胞のワクチン効率を増加させないということを意味する。
【0079】
<実施例5>B/αGalCer/pepの細胞毒性Tリンパ球形成時の必要条件確認
本発明者等は、細胞毒性Tリンパ球反応を誘導するのに関与する免疫細胞の種類を確認するために、C57BL/6マウスにB/αGalCer/pepを投与する4日前または4日後に各々の免疫細胞を除去するための抗体(抗CD4除去抗体:GK1.5、抗CD8除去抗体:2.43、抗NK1.1除去抗体:PK136)を注射した後、体内細胞毒性Tリンパ球分析を実施した。
【0080】
その結果、免疫細胞除去の時期とは無関係に(B/αGalCer/pep投与の前後全て)CD4+T細胞またはNK1.1細胞除去が、細胞毒性Tリンパ球反応誘導を阻害しなかった(図9)。一方、CD8+T細胞を除去すると標的細胞の破壊が起きなかった。前記結果と類似にMHC II-/-(CD4+T細胞欠如)マウスは、正常に細胞毒性Tリンパ球反応が誘導された一方、Jα281-/-(ナチュラルキラーT細胞欠如)マウスは誘導されないことを確認した(図10)。
【0081】
<実施例6>B細胞の抗原提示及び細胞毒性Tリンパ球の誘導確認
本発明者等は、ペプチドを積載したB細胞が抗原提示細胞として機能するのか、あるいはペプチドの運搬体としてのみ作用するのか、すなわち、B細胞が運んだペプチドを樹状細胞が回収して細胞毒性Tリンパ球反応を誘導するのかを調べた。そのために、OVAペプチドをMHC Iに積載することができるが、H-2K領域の突然変異によってCD8+T細胞がMHC I-ペプチド複合体を認識することができないbm-1マウスを使用した(Norbury,C.C.等,Science,2004年,第304巻,1318-1321頁)。このようなbm-1から取得したB細胞は、正常にCD1dを発現していて、αGalCerと反応してナチュラルキラーT細胞の活性化を刺激するという点で、bm-1のB細胞とナチュラルキラーT細胞との相互作用においては何らの問題がないことが分かる。
【0082】
もう一度、野生型のB細胞から準備したB/αGalCer/pepを野生型マウスに注射すると、体内でOVA特異的な細胞毒性が完璧に生成されることを確認することができた。これとは異なり、bm-1マウスのB細胞から準備したB/αGalCer/pepを野生型マウスに注射すると、野生型のマウスは、OVA特異的な細胞毒性活性を生成することができないことが分かった。このような結果は、受容マウスの樹状細胞または他の専門的な抗原提示細胞が細胞毒性Tリンパ球を形成するのに寄与しないことを示す(図11)。
【0083】
続いて、本発明者等は、αGalCerとペプチドを個別的に投与した場合と、ともに投与した場合に、細胞毒性Tリンパ球を形成することができるのかを調査した。C57BL/6マウスにB/αGalCer+B/pepまたはB/αGalCer/pep単独で静脈注射した後、体内細胞毒性Tリンパ球分析を実施した。
【0084】
その結果、B/αGalCer+B/pepを投与したマウスでは、体内細胞毒性が全く誘導されないことを確認した(図12)。このような結果は、ペプチドとαGalCerが同一B細胞に積載されることがOVA特異的な細胞毒性を生成するのにおいて必須であることを示唆している。
【0085】
<実施例7>B/αGalCer/pepの抗癌効果確認
<7-1>OVAモデルを使用した生体内実験
本発明者等は、B/αGalCer/pepのワクチン投与が抗癌免疫を誘導するのかどうかを調査した。まず、予防的抗癌免疫活性を試験するためにB細胞単独、B/αGalCer、B/pep、B/αGalCer/pep、DC/pep、またはDC/αGalCer/pepワクチンを1回投与した後、OVAを形質導入したB16黒色腫(MO-5)(Dr.Kenneth Rock,University of Massachusetts:Falo,L.D.,等,Nat.Med.1995年,第1巻,649頁)を皮下に移植した。その結果、B/αGalCerを投与したマウスでは、癌の成長が多少遅延する傾向性を見せたが、最終的には癌を形成した一方(図13)、B/αGalCer/pep、DC/pep、またはDC/αGalCer/pepを投与したマウスでは、癌が成長しなかった。
【0086】
続いて、このようなマウスが長期間抗癌活性を維持することができるかどうかを確認するために、最初に癌を移植してから70日になる時点で生存したマウスにMO-5癌細胞を再び皮下に移植した。その結果、このようなマウスでは癌の成長が現れなかった(図14)。これは、B/αGalCer/pepワクチン投与で前記癌に対する記憶免疫反応を確立したことを示唆する。OVAを形質導入すた胸腺種(EG-7)を使用して遂行した場合にも、前記と一致する結果を得ることができた(図36)。
【0087】
次には、B/αGalCer/pepワクチンを投与することですでに存在している癌を除去することができるかどうかを調べた。そのために本発明者等は、下記のような二つの治療モデルを提示した。すなわち、マウスに癌を皮下移植してからi)1日後または、ii)9日後に癌が促進される時期にワクチンを投与した。
【0088】
その結果、1日モデルでは、DC/pepまたはDC/αGalCer/pepワクチンを投与した場合にほとんど完璧に癌の成長を抑制した。特に、B/αGalCer/pepワクチンを投与したマウスも完璧に癌の成長を減少させることを観察した(図15)。9日モデルでは、いかなるワクチン投与群でも成長する癌を完璧に減少させることができなかった。このような結果は、おそらくB16黒色腫が非常に活発な成長特性を有しているためであると判断される。これとは異なり、B/αGalCer/pepワクチンを投与したマウスの場合には、B細胞単独投与群及びB/αGalCer、B/pep投与群に比べて癌の成長が減少することが示され、DC/pepまたはDC/αGalCer/pepワクチン投与群と類似に現れることを確認した(図16)。
【0089】
<7-2>Her-2/neuモデルを使用した生体内実験
本発明者等は、B細胞を媒介にするワクチン投与が実際に癌抗原に適用することができるかどうかを調べるために、特性がよく解明されていて細胞毒性Tリンパ球抗原決定基(epitope)が知られているHer-2/neuを発現する癌細胞であるTAUF(Penichet ML等,Lab Anim Sci.,1999年,第49巻,179-88頁)で、前記実施例<7-1>と同じ実験を実施した。その結果、本発明者等は、もう一度、αGalCer及びHer-2/neu63-71ペプチドを提示するB細胞を投与したマウス群で体内Her-2/neuに対する細胞毒性が意味ある水準で現れることを確認した(図17)。
【0090】
また、前記モデルでの抗癌活性を分析するために、Her-2/neuを発現する癌細胞(TAUF)をBALB/cマウスの静脈または皮下に注射した後、αGalCerとHer-2/neu63-71を積載したB細胞ワクチンを投与した結果、静脈に癌を注入してB/αGalCerまたはB/pepワクチン投与した場合には、B細胞単独投与群と比べて生存期間が若干延長されることを確認した(図18)。これとは対照的に、B/αGalCer/pepを投与したすべてのマウスは、全体実験期間の間生存することを観察し、そのように生存したマウスにHer-2/neuを発現する癌細胞(TAUF)を再び注入しても抑制効果が現れることを確認することができた。また、皮下癌成長モデルでも、類似な結果を観察することができた(図19)。
【0091】
したがって、本発明のB細胞を媒介にするワクチン投与は、抗癌免疫の予防効果及び治療効果において、樹状細胞を基盤にするワクチン程度に効率的であることを立証した。
【0092】
<実施例8>抗原を発現するウイルスベクターを使用したタンパク質導入
ペプチドを積載した細胞ワクチンは、臨床的に使用する場合、個人の主組織適合性複合体(major histocompatibilty complex、MHC)の一倍体型に制限的にペプチドが使用されるので普遍的に使用することができず、単一抗原決定基(epitope)のみを提示する短所を有している。一方、ウイルスを媒介にして全体抗原を導入するようになれば、主組織適合性複合体の一倍体型に限らないですべての人に適用可能であり、多くの抗原決定基に特異的な免疫反応すなわち、特に体液性免疫反応と細胞性免疫反応を同時に誘導することができる。これを根拠にして、B細胞にウイルスで全体抗原を形質導入した後、免疫反応を効果的に誘導することができるかどうかを確認してみた。まず、腫瘍関連抗原であるHer-2/neuの細胞外領域及び細胞膜領域(Her-2/ne extracellular domain+transmembrane domain:HM)を発現する遺伝子を有したアデノウイルス(AdHM)を製作してマウス癌モデルに適用した。
【0093】
詳細には、BALB/cマウスの脾臓細胞から分離したB細胞をHer-2/neuの細胞外領域及び細胞膜領域を発現するアデノウイルス(AdHM、バイロメド)100 MOIで血清を添加しない培地で90分間37℃の培養器で感染させた後、血清を補充して総8時間、24時間、及び48時間各々培養した後、PEで標識された抗-Her-2/neu抗体(BD biosciences #340552)で染色してフローサイトメトリーを実施した後、Her-2/neuが表面に発現される程度(B細胞に対するアデノウイルス形質導入効率、全体B細胞中のPE+細胞の割合)を測定した。
【0094】
その結果、8時間、24時間及び48時間、B細胞をアデノウイルスとともに培養した時、すべての培養条件で約20%以上の効率を示すことを確認した(図20)。すなわち、B細胞をAdHMと8時間以上培養すると、十分にAdHMによって形質導入されたB細胞表面にHer-2/neuを発現することができるということが分かる。また、B細胞でのHer-2/neu発現は、ウイルスで形質導入した後、アルファガラクトシルセラミドとともに培養しても変わらなかったし、B細胞がアルファガラクトシルセラミドを提示するにおいても何の影響も及ぼさないことを確認した(図21)。このような結果は、前記で言及したように、B細胞のCD1d分子によってDN32.D3細胞にアルファガラクトシルセラミドが提示されると、活性化したDN32.D3細胞はIL-2を分泌するようになって、培養液に含まれたこのようなIL-2濃度を測定することで、B細胞がアルファガラクトシルセラミドを提示することができることを間接的に確認した。
【0095】
<実施例9>アデノウイルスで形質導入されたB細胞によって誘導される細胞毒性T細胞反応確認
BALB/cマウスの脾臓細胞から分離したB細胞を、Her-2/neuの細胞外領域と細胞膜領域を発現するアデノウイルス(AdHM)100M.O.I.で血清を添加しない培地で60分間37゜Cの培養器で感染させた。以後、血清が補充された培地を添加して総24時間培養して、B/AdHM細胞を製作した。また、AdHMで形質転換されたB細胞を1〜2μg/mlのαGalCerを添加した血清が補充された培地で23時間培養して、αGalCerを積載したB細胞(B/AdHM/αGalCer)を製作した。製作が完了したB細胞は、RPMI培地で3回以上洗浄して自由型のアデノウイルス及びαGalCerを除去して実験に使用した。
【0096】
本発明者等は、前記Her-2/neuの細胞外領域と細胞膜領域を発現するアデノウイルス(AdHM)で形質導入されたB細胞が、マウスで細胞毒性免疫反応を誘導することができるかどうか調査するために、マウスに静脈注射でB細胞ワクチンを投与した。B細胞単独(B)及びアルファガラクトシルセラミドだけ積載したB細胞(B/αGalCer)を投与したマウスを陰性対照群に使用し、AdHMで形質導入されたB細胞(B/AdHM)及び、AdHMで形質導入されたアルファガラクトシルセラミドを積載したB細胞(B/AdHM/αGalCer)が誘導するHer-2/neu特異的な細胞毒性T細胞反応を測定した。免疫化した後、細胞毒性T細胞の抗原決定基ペプチド(Her-2/neu63-71、エニゼン)を積載した標的細胞を注入して体内で起きる標的細胞の分解を確認した。
【0097】
その結果、免疫化して1週間が過ぎた時点で、BとB/αGalCerで免疫化されたマウス群では標的細胞の分解を観察することができなかった。一方、B/AdHMとB/AdHM/αGalCerで免疫化されたマウス群では細胞毒性T細胞反応を確認することができた(図22)。アデノウイルスで形質導入されたB細胞は、活性化するのでナチュラルキラーT細胞の助けもなしに体内で細胞毒性T細胞を効果的に誘導することができる抗原提示細胞として機能すると考えられる。B/AdHMとB/AdHM/αGalCerで誘導された細胞毒性T細胞反応は、時間に依存的に漸次減少する傾向を示したが、免疫化以後7週目まで細胞毒性T細胞反応が相当な水準で維持された(図23)。また、免疫化以後1週目に細胞毒性T細胞とともにCD8+T細胞でIFN-γの生成を確認した結果、B細胞のみ投与を受けたマウス群に比べて、B/AdHMとB/AdHM/αGalCerで免疫化されたマウス群で活性化したCD8+T細胞の数が増加していた。特に、このような現象は、B/AdHMに比べてB/AdHM/αGalCer群で多少高く現れた(図24)。
【0098】
<実施例10>αGalCerの積載を通じたナチュラルキラー細胞の活性化誘導及びアデノウイルスで形質導入されたB細胞ワクチンの効果増進確認
<10-1>αGalCerを積載したB細胞を通じたナチュラルキラー細胞の活性化誘導確認
活性化したナチュラルキラー細胞集団は、IFN-γを生産するナチュラルキラー細胞に基づいて計算した。簡略に説明すると、マウスの脾臓から分離したB細胞を1μg/mlのゴルジプラグ(GolgiPlug)下で5時間培養して、その細胞を固定及び透過させた後に抗-マウスIFN-γ:APC、CD3:PE、及びCD49b:FITC抗体(全てBiolegend)で各々染色した。ナチュラルキラー細胞は、CD3を発現しないで、ナチュラルキラー細胞の標式であるCD49bを発現する細胞集団にした。
【0099】
アルファガラクトシルセラミド(αGalCer)が積載されてアデノウイルスで形質導入されたB細胞(B/AdHM/αGalCer)は、アデノウイルスで形質導入したB細胞(B/AdHM)に比べて細胞毒性T細胞反応が多少高く長期間持続する傾向性を見せるが、留意するに値する水準の差が現れないことからして、細胞毒性T細胞反応を誘導するにおいてペプチドを積載したB細胞ワクチンとは異なり、アルファガラクトシルセラミドの積載が決定的な役目を担当しないものとみられる。しかし、アルファガラクトシルセラミドが積載されたB細胞ワクチンをマウスに投与すると、形質導入だけされたB細胞ワクチン投与群とは異なり、体内でナチュラルキラーT細胞を刺激して結果的にナチュラルキラー細胞を活性化させることを確認した(図25)。このようなナチュラルキラー細胞の活性化は、細胞毒性T細胞反応の誘導とともに抗癌効果に寄与することができると考えられる。
【0100】
<10-2>αGalCerの積載を通じたアデノウイルスで形質導入されたB細胞ワクチンの効果増進確認
本発明者等は、B細胞ワクチンが細胞毒性T細胞を誘導する効率性を測定するために、完全な細胞毒性T細胞を誘導する水準以下で細胞ワクチンを投与した時、誘導される標的細胞の溶解程度を比較した。そのために、陽性対照群にはアルファガラクトシルセラミドを積載して細胞毒性T細胞抗原決定基ペプチドを積載したB細胞(B/αGalCer/pep)を使用し、各々のB細胞ワクチンを免疫化した後、1週間後にB/AdHMとB/AdHM/αGalCer投与で誘導される細胞毒性T細胞誘導効率性を測定した(図26)。B/αGalCer/pepの場合、大部分のB細胞が抗原を提示できるようにペプチドが適用されたものと推定されるが、前記で言及したようにアデノウイルスで形質導入されたB細胞の場合、全体の約20%程度だけが抗原提示細胞に機能すると考えられる。これを勘案すると、抗原をアデノウイルスで導入されたB細胞ワクチンは、ペプチドが積載されたB細胞ワクチンに比べて多数のB細胞投与が必要であるにもかかわらず、効率的に抗原特異的な細胞毒性T細胞反応を誘導することができると判断される。また、少数のB細胞が投与された時、アルファガラクトシルセラミドの積載でナチュラルキラーT細胞の助けを借りる場合、標的細胞を溶解するのに多少有利であることを確認した。
【0101】
<実施例11>抗原特異的な抗体反応を誘導するアデノウイルスで形質導入されたB細胞ワクチン
アデノウイルスで形質導入されたB細胞ワクチンは、細胞性免疫反応を誘導するためにペプチドを積載したB細胞ワクチンとは異なり、細胞性免疫反応及び体液性免疫反応を同時に誘導することができるという長所がある。AdHMで形質導入されたB細胞ワクチンが、Her-2/neu特異的な抗体を誘導することができるかどうかを調べるために、BALB/cマウスにB/AdHM及びB/AdHM/αGalCerで各々免疫化させた後、血清中の抗-Her-2/neu抗体の力価を測定するために、Her-2/neuを細胞表面に発現するマウス癌細胞であるTAUF細胞に結合する程度をフローサイトメトリー(flow cytometry)を通じて確認した。
【0102】
抗体反応を測定するためにB細胞ワクチンで免疫化した後、1、3、5、及び7週目に各々眼窩採血で血液を抽出した。マウスの血液を常温で2時間放置した後、8000rpmで10分間遠心分離して血清を分離した。血清中の抗-Her-2/neu抗体の力価を測定するために、1:50から2倍ずつ緩衝剤(1%FBS、0.09%アジドを含むPBS)で希釈した後、Her-2/neuを発現する癌細胞であるTAUF細胞と4゜Cで60分間培養した。緩衝剤でマウス血清と培養されたTAUF細胞を洗浄した後、FITCで標識されたマウス抗体に結合するヤギ抗体を2次抗体に使用して、TAUF細胞に結合されたマウス抗体を染色した。続いて、フローサイトメーター(FACSCaliber、BD Biosciences社)を使用して、TAUF細胞に結合したマウス抗体の量を測定し、免疫化されないマウスの血液を基準にして、平均蛍光強度が1.8倍以上増加する場合を陽性反応と見なして抗体の力価を算出した。
【0103】
その結果、細胞毒性T細胞を誘導したのと類似に、B/AdHM及びB/AdHM/αGalCerの二集団全てで免疫化した後、7週間以上抗-Her-2/neu抗体が高い力価で維持されることが観察され(図27)、B細胞(B)及びB/αGalCerとは異なり、B/AdHMとB/AdHM/aGarCerワクチン投与集団では全て、体液性免疫反応が生成されることを確認した(図28)。
【0104】
<実施例12>アルファガラクトシルセラミドを積載してアデノウイルスで形質導入したB細胞ワクチンの免疫化を利用した癌の予防及び治療効果確認
Her-2/neu腫瘍モデルでBALB/cマウスの尾静脈に2×105個のTAUF細胞を投与してマウスに腫瘍ができるようにした。以後、腫瘍を有したマウスにB細胞ワクチンで各々免疫化した後、生存率を測定した。
【0105】
本発明では、アデノウイルスで形質転換されたB細胞ワクチンを使用して誘導された細胞性免疫反応及び体液性免疫反応が、窮極的に効果的な抗癌活性を示すかどうかを調査した。Her-2/neuを発現するマウス癌細胞(TAUF)を静脈注射した後、肺癌が誘導されたマウスでB細胞ワクチンの予防及び治療効果を確認した。2×106個のB細胞ワクチンで免疫化して7日後、癌細胞2×105個を静脈注射したマウスの生存率を測定した結果、B細胞だけ投与を受けたマウス群(B)に比べて、アルファガラクトシルセラミドを積載したB細胞の投与を受けたマウス群(B/aGarCer)と癌抗原を発現するアデノウイルスで形質転換されたB細胞(B/AdHM)で免疫化されたマウス群で、生存期間が多少延長されることを観察することができた。アルファガラクトシルセラミドが積載され癌抗原を発現するB細胞ワクチン(B/AdHM/aGarCer)を静脈投与すると、全実験期間の間マウスが生存することが観察され、B/aGarCerやB/AdHMワクチンに比べて B/AdHM/aGarCerワクチンが抗癌効果が高いことが示された(図29の上)。したがって、B細胞ワクチンで誘導された免疫反応が効果的に癌を予防するということが分かった。
【0106】
次では、B細胞ワクチンの治療効果を確認するために、BALB/cマウスを1×106個のB、B/aGarCer、B/AdHM、B/AdHM/aGarCerで各々免疫化した後、3日後に5×104個の癌細胞(TAUF)を尾静脈に注射して肺癌を誘導した。B細胞だけ単独で投与を受けたマウス群が一番短い生存期間を示し、B/aGarCerワクチン投与群もこれに似た傾向が観察された。B/AdHMワクチンで免疫化されたマウス群は、B、B/aGarCer投与群に比べて生存期間が若干延長される効果があった。一方、B/AdHM/aGarCer投与群は、予防モデルで観察したのと類似に他の実験群に比べて生存期間が顕著に増加することからして、B、B/aGarCerまたはB/AdHMの免疫化で誘導される抗癌効果に比べて優れた効果を示すことが分かる(図29の下)。
【0107】
<製剤例>注射液剤の製造方法
本発明の抗癌用ワクチンの注射液剤は、次のような方法で製造した。
アルファガラクトシルセラミド1〜2μg/ml、B細胞5×106個/ml、ペプチド1〜2μg/ml、5'-クロロ-3,2'-ジヒドロキシカルコンまたは5'-クロロ-2,3'-ジヒドロキシカルコン塩酸塩1g、塩化ナトリウム0.6g及びアスコルビン酸0.1gを蒸溜水に溶解させて100mlを作った。前記溶液を瓶に入れて20℃で30分間加熱して滅菌させた。
【産業上の利用可能性】
【0108】
本発明のナチュラルキラーT細胞のリガンド、特に、アルファガラクトシルセラミド(αGalCer)と抗原を積載したB細胞は、既存の樹状細胞ワクチンと比較して類似水準の細胞毒性Tリンパ球反応を誘導するだけでなく、皮下癌及び転移癌の予防及び抑制効果があって、癌抗原を発現するアデノウイルスで形質転換されたB細胞は、抗原特異的な免疫反応を誘導することにより、前記細胞を含むワクチンは、癌予防及び治療剤に使用することができる。併せて、本発明のワクチンは、CD4+T細胞がない場合にも免疫反応を誘導するので、CD4+T細胞の数が顕著に減少して免疫欠乏が現れるHIV患者を免疫化するのにも使用することができる。
【特許請求の範囲】
【請求項1】
ナチュラルキラーT細胞のリガンドを積載したB細胞、前記リガンドと抗原を積載したB細胞または前記リガンドを積載して抗原を発現するB細胞を含む、免疫治療及び予防用ワクチン。
【請求項2】
ナチュラルキラーT細胞のリガンドが、アルファガラクトロノシルセラミド、アルファグルクロノシルセラマイド、ホスファチジリノシトルテトラマンノサイド、イソグロボトリヘキソシルセラミド、ガングリオサイドGD3、ホスファチジルコリン、ベータガラクトシルセラミド、リポホスホグリカン、グリコイノシトールホスホリピド、アルファガラクトシルセラミドの類似体のベータアノマガラクトシルセラミド及びアルファアノマガラクトシルセラミド、バクテリア脂質抗原及びアルファガラクトシルセラミドの変異体からなる群から選択されることを特徴とする、請求項1に記載の免疫治療及び予防用ワクチン。
【請求項3】
前記抗原が、病原菌(pathogenic bacteria)、ウイルス及び寄生虫を含む病原体(pathogen)由来の抗原または癌抗原であることを特徴とする、請求項1に記載の免疫治療及び予防用ワクチン。
【請求項4】
病原菌由来の抗原が、百日咳菌(Bordetella pertussis)抗原(pertussis toxin、filamentous haemagglutinin、pertactin)、破傷風菌抗原(tetanus toxoid)、ジフテリア菌(diphtheria)抗原(diphtheria toxoid)、ヘリコバクテリアピロリ(Helicobacterpylori)抗原(capsula polysaccharides of serogrup A,B,C,Y及びW-135)、肺炎菌(pneumococcal)抗原(Streptococcus pnemoniae type 3 capsular polysaccharide)、結核菌(tuberculosis)抗原、コレラ(cholera)抗原(cholera toxin B subunit)、葡萄状球菌(staphylococcal)抗原(staphylococcal enterotoxin B)、赤痢菌(shigella)抗原(shigella polysaccharides)、ボレリア(Borrelia sp.)抗原、カンジダ(Candida albicans)抗原及びプラスモジウム(Plasmodium)抗原からなる群から選択されることを特徴とする、請求項3に記載の免疫治療及び予防用ワクチン。
【請求項5】
ウイルス由来の抗原が、インフルエンザウイルス(influenza virus)抗原(haemagglutinin及びneuraminidase抗原)、ヒトパピロマウイルス(human papilloma virus、HPV)抗原(glycoprotein)、小水疱性口内炎ウイルス(vesicular stomatitis virus)抗原(vesicular stomatitis virus glycoprotein)、サイトメガロウイルス(cytomegalovirus、CMV)抗原、肝炎(hepatitis)ウイルス抗原(hepatitis A(HAV),B(HBV),C(HCV),D(HDV)及びG(HGV)抗原)(core antigen and surface antigen)、呼吸器多核体ウイルス(respiratory synctytial virus、RSV)抗原、ヘルペスシンプレックスウイルス(herpes simplex virus)抗原、ヒト免疫欠乏ウイルス(human immunodeficiency virus、HIV)抗原(GP-120,GP-160,p18,Tat,Gag,Pol,Env)及びその組み合わせからなる群から選択されることを特徴とする、請求項3に記載の免疫治療及び予防用ワクチン。
【請求項6】
癌抗原が、HPV E6/E7、gp100、チロシナーゼ(tyrosinase)、チロシナーゼ関連タンパク質-1(TRP-1)、チロシナーゼ関連タンパク質-2(TRP-2)、MAGE、MUC-1、CEA(carcinoembryonic antigen)、p53、アルファ-フェトプロテイン及びHer-2/neuからなる群から選択されることを特徴とする、請求項3に記載の免疫治療及び予防用ワクチン。
【請求項7】
抗原が、ペプチド、脂質多糖類、多糖類、糖蛋白質またはポリヌクレオチドの形態を有することを特徴とする、請求項1に記載の免疫治療及び予防用ワクチン。
【請求項8】
前記抗原の発現が、組換えウイルスによって導入されて発現することを特徴とする、請求項1に記載の免疫治療及び予防用ワクチン。
【請求項9】
前記組換えウイルスが、抗原を発現する遺伝子が導入されたアデノウイルス、レトロウイルス、ワクシニアウイルス、ポックスウイルス、シンドビスウイルスであることを特徴とする、請求項8に記載の免疫治療及び予防用ワクチン。
【請求項10】
アルファガラクトシルセラミドが積載されたB細胞を媒介にするナチュラルキラーT細胞活性化剤。
【請求項11】
アルファガラクトシルセラミドを積載して癌抗原を発現するB細胞を含む細胞毒性反応誘導剤。
【請求項1】
ナチュラルキラーT細胞のリガンドを積載したB細胞、前記リガンドと抗原を積載したB細胞または前記リガンドを積載して抗原を発現するB細胞を含む、免疫治療及び予防用ワクチン。
【請求項2】
ナチュラルキラーT細胞のリガンドが、アルファガラクトロノシルセラミド、アルファグルクロノシルセラマイド、ホスファチジリノシトルテトラマンノサイド、イソグロボトリヘキソシルセラミド、ガングリオサイドGD3、ホスファチジルコリン、ベータガラクトシルセラミド、リポホスホグリカン、グリコイノシトールホスホリピド、アルファガラクトシルセラミドの類似体のベータアノマガラクトシルセラミド及びアルファアノマガラクトシルセラミド、バクテリア脂質抗原及びアルファガラクトシルセラミドの変異体からなる群から選択されることを特徴とする、請求項1に記載の免疫治療及び予防用ワクチン。
【請求項3】
前記抗原が、病原菌(pathogenic bacteria)、ウイルス及び寄生虫を含む病原体(pathogen)由来の抗原または癌抗原であることを特徴とする、請求項1に記載の免疫治療及び予防用ワクチン。
【請求項4】
病原菌由来の抗原が、百日咳菌(Bordetella pertussis)抗原(pertussis toxin、filamentous haemagglutinin、pertactin)、破傷風菌抗原(tetanus toxoid)、ジフテリア菌(diphtheria)抗原(diphtheria toxoid)、ヘリコバクテリアピロリ(Helicobacterpylori)抗原(capsula polysaccharides of serogrup A,B,C,Y及びW-135)、肺炎菌(pneumococcal)抗原(Streptococcus pnemoniae type 3 capsular polysaccharide)、結核菌(tuberculosis)抗原、コレラ(cholera)抗原(cholera toxin B subunit)、葡萄状球菌(staphylococcal)抗原(staphylococcal enterotoxin B)、赤痢菌(shigella)抗原(shigella polysaccharides)、ボレリア(Borrelia sp.)抗原、カンジダ(Candida albicans)抗原及びプラスモジウム(Plasmodium)抗原からなる群から選択されることを特徴とする、請求項3に記載の免疫治療及び予防用ワクチン。
【請求項5】
ウイルス由来の抗原が、インフルエンザウイルス(influenza virus)抗原(haemagglutinin及びneuraminidase抗原)、ヒトパピロマウイルス(human papilloma virus、HPV)抗原(glycoprotein)、小水疱性口内炎ウイルス(vesicular stomatitis virus)抗原(vesicular stomatitis virus glycoprotein)、サイトメガロウイルス(cytomegalovirus、CMV)抗原、肝炎(hepatitis)ウイルス抗原(hepatitis A(HAV),B(HBV),C(HCV),D(HDV)及びG(HGV)抗原)(core antigen and surface antigen)、呼吸器多核体ウイルス(respiratory synctytial virus、RSV)抗原、ヘルペスシンプレックスウイルス(herpes simplex virus)抗原、ヒト免疫欠乏ウイルス(human immunodeficiency virus、HIV)抗原(GP-120,GP-160,p18,Tat,Gag,Pol,Env)及びその組み合わせからなる群から選択されることを特徴とする、請求項3に記載の免疫治療及び予防用ワクチン。
【請求項6】
癌抗原が、HPV E6/E7、gp100、チロシナーゼ(tyrosinase)、チロシナーゼ関連タンパク質-1(TRP-1)、チロシナーゼ関連タンパク質-2(TRP-2)、MAGE、MUC-1、CEA(carcinoembryonic antigen)、p53、アルファ-フェトプロテイン及びHer-2/neuからなる群から選択されることを特徴とする、請求項3に記載の免疫治療及び予防用ワクチン。
【請求項7】
抗原が、ペプチド、脂質多糖類、多糖類、糖蛋白質またはポリヌクレオチドの形態を有することを特徴とする、請求項1に記載の免疫治療及び予防用ワクチン。
【請求項8】
前記抗原の発現が、組換えウイルスによって導入されて発現することを特徴とする、請求項1に記載の免疫治療及び予防用ワクチン。
【請求項9】
前記組換えウイルスが、抗原を発現する遺伝子が導入されたアデノウイルス、レトロウイルス、ワクシニアウイルス、ポックスウイルス、シンドビスウイルスであることを特徴とする、請求項8に記載の免疫治療及び予防用ワクチン。
【請求項10】
アルファガラクトシルセラミドが積載されたB細胞を媒介にするナチュラルキラーT細胞活性化剤。
【請求項11】
アルファガラクトシルセラミドを積載して癌抗原を発現するB細胞を含む細胞毒性反応誘導剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【公開番号】特開2011−102320(P2011−102320A)
【公開日】平成23年5月26日(2011.5.26)
【国際特許分類】
【出願番号】特願2011−7438(P2011−7438)
【出願日】平成23年1月18日(2011.1.18)
【分割の表示】特願2008−513353(P2008−513353)の分割
【原出願日】平成18年4月27日(2006.4.27)
【出願人】(507229272)ソウル ナショナル ユニバーシティー インダストリー ファウンデーション (2)
【Fターム(参考)】
【公開日】平成23年5月26日(2011.5.26)
【国際特許分類】
【出願日】平成23年1月18日(2011.1.18)
【分割の表示】特願2008−513353(P2008−513353)の分割
【原出願日】平成18年4月27日(2006.4.27)
【出願人】(507229272)ソウル ナショナル ユニバーシティー インダストリー ファウンデーション (2)
【Fターム(参考)】
[ Back to top ]

