ナトリウムイオン二次電池用の電極活物質
【課題】 ナトリウムイオン二次電池として高い放電容量を示し、安定して充放電動作できる新しいタイプのナトリウムイオン二次電池に使用できる電極活物質、特に正極活物質を提供し、さらにナトリウムイオン二次電池を構成する正極活物質と負極活物質との最適な組み合わせを提供する。
【解決手段】 ナトリウムイオン二次電池用の電極活物質は、一般式Na3M2(PO4)2F3(MはTi、V、Feのうちいずれかの金属元素)で表されるリン酸塩から成る。
【解決手段】 ナトリウムイオン二次電池用の電極活物質は、一般式Na3M2(PO4)2F3(MはTi、V、Feのうちいずれかの金属元素)で表されるリン酸塩から成る。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、二次電池の技術分野に属し、ナトリウムイオン二次電池を構成する電極活物質、特に正極活物質、およびそれを用いる二次電池に関する。
【背景技術】
【0002】
充放電可能な電池である二次電池としては、高電圧で高エネルギー密度を達成できるリチウムイオン二次電池がこれまでのところ主として使用されているが、近年では大型蓄電池ニーズの高まりによって、より低コストで製造できる二次電池が望まれており、この観点から、リチウムと比較して安価で埋蔵量が豊富なナトリウムを用いたナトリウムイオン二次電池に関心が集まっている。リチウムイオン電池の場合にはリチウムがアルミ等、多くの金属と合金を作るため、負極の基板に高価な銅を使わざるを得なかったがナトリウムはアルミと合金を作らず、銅の代わりに安価なアルミを負極基板に使えることも大きなコスト低減の利点となる。
【0003】
しかし、ナトリウムの理論容量はリチウムの半分以下の1.17 Ah/gしかない上、両者の標準電極電位の差分である0.33 V程、セル電圧も低くなる。また、ナトリウムイオン二次電池では、電解質中の電気伝導を担うナトリウムイオンの体積がリチウムイオンの約2倍にも及ぶことから、ナトリウムイオンが格子内に出入りすることを可能とするインサーションホストの設計がリチウムの場合よりも困難であり、有意な充放電特性をもつ正極活物質が得られ難いという問題がある。さらに、ナトリウムはその表面に不動態被膜が形成され難く、かつリチウムより活性が高いことによる実験設備上の制約もあるという問題もある。
【0004】
ナトリウムイオン二次電池を構成する電極活物質、特に正極活物質は、ナトリウムイオンの供給源とならなくてはならないため、構成元素としてナトリウムを含むナトリウム化合物である必要がある。現在のところ、ナトリウムイオン二次電池用の正極活物質としては、例えば、層状岩塩型構造を有する結晶NaFeO2から成るもの(非特許文献1参照)やナシコン型構造を有する結晶Na3V2(PO4)3から成るもの(非特許文献2参照)等が知られており、開発が盛んに行なわれているが、実用化に耐え得るだけの十分な放電電圧や放電容量は得られていない。
【0005】
一方負極に関しては、リチウムイオン二次電池で一般的に用いられている黒鉛がナトリウムイオン電池に対しては、ほとんど不可逆である。リチウムイオン二次電池と同じレベルの可逆充放電容量が得られるものはイオン体積の大きなナトリウムに特化した炭素間空隙をもったごく一部の特殊なハードカーボンに限られているのが現状である。
【0006】
このように、ナトリウムイオンはリチウムイオンに比べ、約二倍のイオン体積をもち、その性質が大きく異なることから、電極活物質、特に電気伝導を担うイオンの供給源である正極活物質において、リチウムイオン二次電池で使用可能なものをそのままナトリウムイオン二次電池に流用することは一般に困難である。ナトリウムイオン二次電池として十分な特性を有する電極活物質が得られていないこともあり、現在のところ、ナトリウムイオン二次電池に関する報告はリチウムイオン二次電池に比べて非常に少ない。
【0007】
一般に、正極活物質に電気陰性度の高いフッ素を構成元素として含有させることで、電池電圧の向上が期待される。このような正極活物質としては、例えば、Na3FeF6があるが、十分な充放電特性は得られていない(特許文献1参照)。この他、フッ素およびナトリウムを構成元素に含むリン酸塩(例えば、特許文献2および非特許文献3〜6参照)も提案されているが、これらはいずれもリチウムイオン二次電池用正極として用いられていたに過ぎない。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2009−238687号公報
【特許文献2】米国特許6,872,492号公報
【非特許文献】
【0009】
【非特許文献1】S.Okada,Y.Takahashi,T.Kiyabu,T.Doi,J.YamakiandT.Nishida,Abstract of 210th ECS Meeting, B2,#201,(2006).
【非特許文献2】野口良典、小林栄次、L.S.Plashnitsa、土井貴之、岡田重人、山木準一、第49回電池討論会,2E07(2008).
【非特許文献3】J.Barker,M.Y.Saidi and J.L.Swoyer,Electrochem,Solid−State Lett.,6(1)(2003) A1−A4.
【非特許文献4】J.M.Le Meins,M.P.Crosnier−Lopez,A.Hemon−Ribaud, and G.Courbion,J.Solid State Chemistry,148(1999)260−277.
【非特許文献5】R.K.B.Gover,A.Bryan,P Burns,J.Barker,Solid State Ionics,177(2006)1495−1500.
【非特許文献6】Tao Jiang,Gang Chen,Ang Li,Chunzhong Wang,Yingjin Wei, J.Alloys and Compounds,478(2009)604−607
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明の目的は、ナトリウムイオン二次電池として高い放電容量を示し、安定して充放電動作できる新しいタイプのナトリウムイオン二次電池に使用できる電極活物質、特に正極活物質を提供し、さらにナトリウムイオン二次電池を構成する正極活物質と負極活物質との最適な組み合わせを提供することにある。
【課題を解決するための手段】
【0011】
本発明者らは、鋭意研究の結果、実際にナトリウムイオン二次電池として使用可能な電極活物質、特に正極活物質を新たに見出した。さらに、この電極活物質を正極および/または負極に使用することによって、稼動安定性の高いナトリウムイオン二次電池を構築できることを新たに見出した。特に、実用化可能なナトリウムイオン二次電池として機能するための正極活物質と負極との最適な組み合わせを見出した。
【0012】
かくして、本発明に従えば、一般式Na3M2(PO4)2F3(MはTi、V、Feのうちいずれかの金属元素)で表されるリン酸塩から成ることを特徴とするナトリウムイオン二次電池用の電極活物質が提供される。また、本発明に従えば、上記の電極活物質を正極として備えることを特徴とするナトリウムイオン二次電池も提供される。
【図面の簡単な説明】
【0013】
【図1】本発明に係るペレット電極および塗布電極の概略図を示す。
【図2】本発明に係る電極活物質Na3M2(PO4)2F3のXRDパターン結果を示す。
【図3】本発明に係る電極活物質Na3M2(PO4)2F3を正極として、NaTi2(PO4)3負極に対する充放電試験結果を示す。
【図4】本発明に係る電極活物質Na3M2(PO4)2F3を正極として、対称セルおよびカーボン負極に対する充放電試験結果を示す。
【発明を実施するための形態】
【0014】
本発明に係るナトリウムイオン二次電池用の電極活物質は、ナトリウムおよびフッ素を構成元素に含む一般式Na3M2(PO4)2F3(MはTi、V、Feのうちいずれかの金属元素)で表されるリン酸塩から成ることを特徴としている。Mは、放電容量の高さと取扱いの容易性からは一般にV(バナジウム)を使用することが好ましい。
【0015】
ナトリウムおよびフッ素を構成元素に含むリン酸塩Na3M2(PO4)2F3は、公知の手段を使用して製造することができ、例えば、2段階固相焼成等の固相法を使用することができる。固相法は、粉末原料を所定の組成となるように秤量して混合し、その後熱処理によって合成する手法である。この他にもよく知られた気相法を用いて製造することができる。
【0016】
本発明の製造方法の一例として、上記の金属元素Mがバナジウム(V)の場合には、酸化バナジウム(V2O5)とリン酸水素二アンモニウム(NH4)2HPO4を化学量論比1:2の割合で混合し、ペレット状に固め、カーボンが入った坩堝の中にいれて、アルゴン(Ar)、またはアルゴン(Ar)と5%水素混合ガス雰囲気下で固相焼成しVPO4を合成する。これにフッ化ナトリウム(NaF)を2:3の化学量論比で混合して2時間焼成することで、ナトリウムおよびフッ素を構成元素に含むリン酸塩Na3V2(PO4)2F3が得られる。それぞれ、以下の化学反応が起きているものと推察される。
【0017】
(化1)
0.5V2O5+(NH4)2HPO4+C→VPO4+2NH3+1.5H2O+CO (1)
2VPO4+3NaF→Na3V2(PO4)2F3 (2)
【0018】
上記の電極活物質を、ナトリウムイオン二次電池の電極としてそのまま用いてもよいが、電極のレート特性を向上させるために、公知の導電材との複合体を形成させてもよい。
すなわち、本発明に従えば、レート特性を向上させる観点から、上記で得られた電極活物質であるナトリウムおよびフッ素を構成元素に含むリン酸塩Na3M2(PO4)2F3を、不活性ガス雰囲気下で炭素微粒子と共に粉砕・混合することにより、カーボンコートすることができる。該炭素微粒子としては、ファーネスブラック、チャンネルブラック、アセチレンブラック、サーマルブラック等を使用することができるが、電極として使用する際の導電性の高さからアセチレンブラックが好適である。不活性ガスとしては、窒素ガスやアルゴンガス等を用いることができ、例えば、アルゴンガスを用いることができる。
【0019】
カーボンコートの際の粉砕・混合に適用される具体的手段は、特に限定されるものではなく、固形物質の粉砕・混合の目的で従来から用いられている各種の手段が適用可能であるが、好ましいのは、ボールミルであり、そのうち特に、原料を充分に粉砕・混合することができる点から遊星型ボールミル(planetary ball milling)を用いることが好ましい。
【0020】
本発明に従えば、以上のようにして得られた電極活物質Na3M2(PO4)2F3、該電極活物質を含むナトリウムイオン二次電池電極、および該電極を正極および/または負極として組み合わせたナトリウムイオン二次電池が提供される。なお、本発明に係る電極活物質Na3M2(PO4)2F3は、水系の電解液または非水系の電解液のいずれに対しても使用することができる。
【0021】
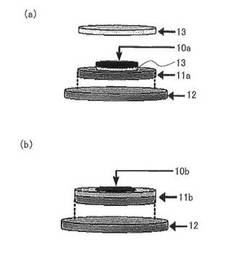
本発明に従う電極を作製する際には、上記の電極活物質を用いるほかは公知の電極の作製方法に従えばよい。例えば、上記活物質の粉末を必要に応じてポリエチレン等の公知の結着材、さらに必要に応じてアセチレンブラック等の公知の導電材と混合した後、得られた混合粉末をステンレス鋼製等の支持体上に圧着成形したり、金属製容器に充填したりすることができる。このような電極の例として、ペレット電極がある。ペレット電極としては、例えば、図1(a)に示すように、ペレット電極10aと、スペーサー11aと、コインセル容器(下蓋)12と、チタン製のチタンメッシュ13とから構成することができる。ペレット電極10aは、例えば、10mmの厚さとすることができる。スペーサー11aは、チタンメッシュ13を載置し、このチタンメッシュ13上にペレット電極10aを載置する。
【0022】
また、例えば、上記混合粉末をトルエン等の有機溶剤と混合して得られたスラリーをアルミニウム、ニッケル、ステンレス、銅等の金属基板上に塗布する等の方法によっても本発明の電極を作製することができる。このような電極の例として、塗布電極がある。塗布電極としては、例えば、図1(b)に示すように、塗布電極10bと、スペーサー11bと、コインセル容器(下蓋)12とから構成することができる。塗布電極10bは、例えば、10mmの電極径とすることができる。スペーサー11bは、上面中央部に塗布電極10bがスポット溶接される。
【0023】
本発明に係る電極活物質Na3M2(PO4)2F3を正極として使用する場合の好ましい態様として、一般式NaX2(PO4)3(XはTi、V、Feのうちいずれかの金属元素)で表されるリン酸塩から成る負極活物質を使用することが挙げられる。このうち本発明に係る電極活物質はより高電位のNa3V2(PO4)2F3を正極とすることが好ましい。また、負極としては上記リン酸塩のうち、より低電位のNaTi2(PO4)3が好ましい。かくして、本発明に従う特に好ましい態様として、Na3V2(PO4)2F3を正極とし、NaTi2(PO4)3を負極とすることにより、電圧特性および充放電特性の優れたナトリウムイオン二次電池が得られる(後述の実施例参照)。本発明に係る電極活物質Na3M2(PO4)2F3を正極とする他の例としては、負極にナトリウム金属や、従来から知られているハードカーボン(好ましいものとして、後述の実施例に示すものが挙げられる)を当然に使用することができるが、これらに限定されるものではない。また、本発明に係る電極活物質Na3M2(PO4)2F3を負極として使用する場合には、同じ電極活物質Na3M2(PO4)2F3を対称セルとして正極に使用することもできるが、これに限定されるものではない。
【0024】
その他の構成要素としては、公知のナトリウムイオン二次電池に使用されるものを構成要素として使用できる。例えば、以下のものが例示できる。
本発明のナトリウムイオン二次電池において、電解液は、ナトリウム塩を主電解質とするものであれば特に限定されない。この主電解質となるナトリウム塩としては、水系電解液の場合には、例えば、NaPF6、NaNO3、NaOH、NaCl、Na2SO4及びNa2S等が挙げられる。これらのナトリウム塩は、各々単独で用いることもできるが、2種以上を組み合わせて使用することもできる。また、非水系電解液の場合には、例えば、電解質NaClO4を、プロピレンカーボネート(PC)電解液として使用することができるが、この他にも、エチレンカーボネート(EC)とジエチルカーボネート(DEC)との混合溶媒に溶解させたものや、エチレンカーボネート(EC)とジメチルカーボネート(DMC)との混合溶媒に溶解させたもの等を電解液として使用することができる。
【0025】
本発明に係るナトリウムイオン二次電池は、セパレータ、電池ケース他、構造材料等の要素についても従来公知の各種材料を使用することができ、特に制限はない。本発明に係るナトリウムイオン二次電池は、上記の電池要素を用いて公知の方法に従って組み立てればよい。この場合、電池形状についても特に制限されることはなく、例えば円筒状、角型、コイン型等種々の形状、サイズを適宜採用することができる。
【0026】
以下に、本発明の特徴をさらに具体的に示すために実施例を記すが、本発明は以下の実施例によって制限されるものではない。
【0027】
(実施例1)
(1)電極活物質Na3M2(PO4)2F3の合成
リン酸塩Na3M2(PO4)2F3(M=Ti、V、Fe)は、2段階固相焼成を用いて合成した。まず各々の金属酸化物[酸化チタン(Ti2O3;純度99.9%以上、アルドリッチ製)、酸化バナジウム(V2O5;純度99%以上、ナカライテスク製)、リン酸第二鉄水和物(FePO4・2H2O;純度99.9%以上、アルドリッチ製)]とリン酸水素二アンモニウム[(NH4)2HPO4;純度99%以上、和光純薬工業株式会社製]とを化学量論比1:2の割合で混ぜ、アルゴンガス雰囲気下で600〜750℃を維持して、15時間固相焼成し、MPO4(M=Ti、V、Fe)を得た。これにフッ化ナトリウム(NaF;純度99%以上、和光純薬工業株式会社製)を2:3の化学量論比で混合し、500〜600℃に維持し、2時間焼成した。得られたNa3M2(PO4)2F3(M=Ti、V、Fe)を、アセチレンブラック(AB;電気化学工業株式会社製)とポリテトラフルオロエチレン(PTFE;ダイキン工業株式会社製)を70:25:5の重量比で混合後、ペレット状に成型したものを電極とした。
【0028】
充放電測定は、電解液に1M NaClO4/PC(富山薬品工業株式会社製)、負極にナトリウム金属(アルドリッチ製)、セパレータ(ポリプロピレン3501;Celgard LLC社製)を用いて作製したコインセルにて行なった。また、Na3V2(PO4)2F3は、対極にNaTi2(PO4)3、Na3V2(PO4)2F3 およびハードカーボンを用いたイオンセル構成にて評価した。
【0029】
(2)XRD測定、およびナトリウム金属負極に対する充放電測定
充放電条件は、充放電電流密度0.2 mA/cm2 一定の定電流モードに設定し室温にて測定を行った。さらに、充放電中の構造変化を明らかにするために、充放電測定後のコインセルは、露点?80℃以下のドライボックス中で解体し、取り出した電極ペレットをPCで洗浄後、気密性セルを用いてXRD測定を行なった。図2は、本発明に係る電極活物質Na3M2(PO4)2F3のXRDパターン結果を示し、図3は、本発明に係る電極活物質Na3M2(PO4)2F3を正極として、NaTi2(PO4)3負極に対する充放電試験結果を示す。
【0030】
XRD測定の結果、図2に示すように、Na3V2(PO4)2F3は、ICDD No.01−089−8485と一致する空間群P42/mnmの正方晶β−Na3V2(PO4)2F3単相が得られた。Na3Ti2(PO4)2F3とNa3Fe2(PO4)2F3もβ−Na3V2(PO4)2F3に類似するXRDプロファイルが得られた。また、ナトリウム金属を対極(負極)に用いて充電、放電を行ったNa3V2(PO4)2F3正極ペレットのXRD測定の結果から、ナトリウムイオンの脱離に伴いa軸、b軸方向への収縮とc 軸方向への伸長が可逆的に起こっていることが明らかとなった。
【0031】
各々のナトリウム金属負極に対するNa3M2(PO4)2F3(M=Ti、V、Fe)の充放電特性を図3(a)に示す。Na3V2(PO4)2F3およびNa3Ti2(PO4)2F3は、4.1V−3.6V、2.8V−2.4Vに各々二段の放電平坦部が、Na3Fe2(PO4)2F3では2.4Vに一段の放電平坦部が見られ、各試料の初回放電容量は、120mAh/g(M=V)、57mAh/g(M=Ti)、27mAh/g(M=Fe)であった。この結果から、特に、正極がNa3V2(PO4)2F3の場合に、120mAh/gという100mAh/gを超える放電容量を示すことがわかった。
【0032】
(実施例3)
Na3V2(PO4)2F3正極とNaTi2(PO4)3負極で構成したナトリウムイオン二次電池
上記最も大きい放電容量を示したNa3V2(PO4)2F3正極に対して、NaTi2(PO4)3を負極に用いて正極:負極のmol比を1:2に調整したナトリウムイオン二次電池を作成した。図3(b)に示すように、この二次電池は正極重量当たり120.4mAh/gという大きな初回放電容量を示し、50サイクル目のサイクル維持率は89.4%と比較的安定した可逆性を示した。この結果から、120mAh/gという大きな放電容量で、且つフラットなサイクルを実現する2Vクラスのナトリウムイオン二次電池が実現できることが示された。
【0033】
(実施例4)
Na3V2(PO4)2F3電極を対称セルで構成したナトリウムイオン二次電池
上記実施例3と同じNa3V2(PO4)2F3電極を正極(シート電極)および負極(ペレット電極)に用いて、対称セルによるナトリウムイオン二次電池を作成した。正極:負極のモル比を1:5に調整した。電解液を1M NaClO4/PC、電流密度を0.2mA/cm2、電圧範囲2.8−0.5Vとして、得られた充放電特性の結果を図4(a)に示す。図4(a)に示すように、本発明に係る電極活物質Na3V2(PO4)2F3は、良好な充放電特性を示すとともに、20サイクルを越えてもサイクル維持率は90%という比較的安定した可逆性を示した。このように、本発明に係る電極活物質Na3V2(PO4)2F3は、負極としても十分な電池特性をもつことが示された。
なお、電気伝導を担う媒体がNaであるため容量限界組成をC8Naと想定し、負極ハードカーボンの理論容量を計算した。
【0034】
(実施例5)
Na3V2(PO4)2F3正極とカーボン負極で構成したナトリウムイオン二次電池
上記実施例3と同じNa3V2(PO4)2F3正極に対して、特開2009−132593に開示の炭素材を1600℃処理した炭素材(以下、C1600)を負極に用いてナトリウムイオン二次電池を作成した。カーボンの理論容量を500mAh/gとして、正極:負極の理論容量比を1:3に調整した。電解液を1M NaClO4/PC、電流密度を0.2mA/cm2、電圧範囲4.3−2.3Vとして、得られた充放電特性の結果を図4(a)に示す。得られた充放電特性の結果を図4(b)に示す。図4(b)に示すように、本発明に係る電極活物質Na3V2(PO4)2F3は、カーボン(C1600)を負極に用いた場合にも4V付近にプラトーをもつ良好な充放電特性を有することが示された。
【0035】
上記実施例3〜5で得られた結果から、Na3V2(PO4)2F3正極に対する負極としては、対称セルや、従来から知られたカーボンを用いる他に、NaTi2(PO4)3を用いても、120mAh/gという大きな放電容量で、フラットなサイクルを有するナトリウムイオン二次電池が得られることが示された。
【符号の説明】
【0036】
10a ペレット電極
10b 塗布電極
11a スペーサー
11b スペーサー
12 コインセル容器(下蓋)
13 チタンメッシュ
【技術分野】
【0001】
本発明は、二次電池の技術分野に属し、ナトリウムイオン二次電池を構成する電極活物質、特に正極活物質、およびそれを用いる二次電池に関する。
【背景技術】
【0002】
充放電可能な電池である二次電池としては、高電圧で高エネルギー密度を達成できるリチウムイオン二次電池がこれまでのところ主として使用されているが、近年では大型蓄電池ニーズの高まりによって、より低コストで製造できる二次電池が望まれており、この観点から、リチウムと比較して安価で埋蔵量が豊富なナトリウムを用いたナトリウムイオン二次電池に関心が集まっている。リチウムイオン電池の場合にはリチウムがアルミ等、多くの金属と合金を作るため、負極の基板に高価な銅を使わざるを得なかったがナトリウムはアルミと合金を作らず、銅の代わりに安価なアルミを負極基板に使えることも大きなコスト低減の利点となる。
【0003】
しかし、ナトリウムの理論容量はリチウムの半分以下の1.17 Ah/gしかない上、両者の標準電極電位の差分である0.33 V程、セル電圧も低くなる。また、ナトリウムイオン二次電池では、電解質中の電気伝導を担うナトリウムイオンの体積がリチウムイオンの約2倍にも及ぶことから、ナトリウムイオンが格子内に出入りすることを可能とするインサーションホストの設計がリチウムの場合よりも困難であり、有意な充放電特性をもつ正極活物質が得られ難いという問題がある。さらに、ナトリウムはその表面に不動態被膜が形成され難く、かつリチウムより活性が高いことによる実験設備上の制約もあるという問題もある。
【0004】
ナトリウムイオン二次電池を構成する電極活物質、特に正極活物質は、ナトリウムイオンの供給源とならなくてはならないため、構成元素としてナトリウムを含むナトリウム化合物である必要がある。現在のところ、ナトリウムイオン二次電池用の正極活物質としては、例えば、層状岩塩型構造を有する結晶NaFeO2から成るもの(非特許文献1参照)やナシコン型構造を有する結晶Na3V2(PO4)3から成るもの(非特許文献2参照)等が知られており、開発が盛んに行なわれているが、実用化に耐え得るだけの十分な放電電圧や放電容量は得られていない。
【0005】
一方負極に関しては、リチウムイオン二次電池で一般的に用いられている黒鉛がナトリウムイオン電池に対しては、ほとんど不可逆である。リチウムイオン二次電池と同じレベルの可逆充放電容量が得られるものはイオン体積の大きなナトリウムに特化した炭素間空隙をもったごく一部の特殊なハードカーボンに限られているのが現状である。
【0006】
このように、ナトリウムイオンはリチウムイオンに比べ、約二倍のイオン体積をもち、その性質が大きく異なることから、電極活物質、特に電気伝導を担うイオンの供給源である正極活物質において、リチウムイオン二次電池で使用可能なものをそのままナトリウムイオン二次電池に流用することは一般に困難である。ナトリウムイオン二次電池として十分な特性を有する電極活物質が得られていないこともあり、現在のところ、ナトリウムイオン二次電池に関する報告はリチウムイオン二次電池に比べて非常に少ない。
【0007】
一般に、正極活物質に電気陰性度の高いフッ素を構成元素として含有させることで、電池電圧の向上が期待される。このような正極活物質としては、例えば、Na3FeF6があるが、十分な充放電特性は得られていない(特許文献1参照)。この他、フッ素およびナトリウムを構成元素に含むリン酸塩(例えば、特許文献2および非特許文献3〜6参照)も提案されているが、これらはいずれもリチウムイオン二次電池用正極として用いられていたに過ぎない。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2009−238687号公報
【特許文献2】米国特許6,872,492号公報
【非特許文献】
【0009】
【非特許文献1】S.Okada,Y.Takahashi,T.Kiyabu,T.Doi,J.YamakiandT.Nishida,Abstract of 210th ECS Meeting, B2,#201,(2006).
【非特許文献2】野口良典、小林栄次、L.S.Plashnitsa、土井貴之、岡田重人、山木準一、第49回電池討論会,2E07(2008).
【非特許文献3】J.Barker,M.Y.Saidi and J.L.Swoyer,Electrochem,Solid−State Lett.,6(1)(2003) A1−A4.
【非特許文献4】J.M.Le Meins,M.P.Crosnier−Lopez,A.Hemon−Ribaud, and G.Courbion,J.Solid State Chemistry,148(1999)260−277.
【非特許文献5】R.K.B.Gover,A.Bryan,P Burns,J.Barker,Solid State Ionics,177(2006)1495−1500.
【非特許文献6】Tao Jiang,Gang Chen,Ang Li,Chunzhong Wang,Yingjin Wei, J.Alloys and Compounds,478(2009)604−607
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明の目的は、ナトリウムイオン二次電池として高い放電容量を示し、安定して充放電動作できる新しいタイプのナトリウムイオン二次電池に使用できる電極活物質、特に正極活物質を提供し、さらにナトリウムイオン二次電池を構成する正極活物質と負極活物質との最適な組み合わせを提供することにある。
【課題を解決するための手段】
【0011】
本発明者らは、鋭意研究の結果、実際にナトリウムイオン二次電池として使用可能な電極活物質、特に正極活物質を新たに見出した。さらに、この電極活物質を正極および/または負極に使用することによって、稼動安定性の高いナトリウムイオン二次電池を構築できることを新たに見出した。特に、実用化可能なナトリウムイオン二次電池として機能するための正極活物質と負極との最適な組み合わせを見出した。
【0012】
かくして、本発明に従えば、一般式Na3M2(PO4)2F3(MはTi、V、Feのうちいずれかの金属元素)で表されるリン酸塩から成ることを特徴とするナトリウムイオン二次電池用の電極活物質が提供される。また、本発明に従えば、上記の電極活物質を正極として備えることを特徴とするナトリウムイオン二次電池も提供される。
【図面の簡単な説明】
【0013】
【図1】本発明に係るペレット電極および塗布電極の概略図を示す。
【図2】本発明に係る電極活物質Na3M2(PO4)2F3のXRDパターン結果を示す。
【図3】本発明に係る電極活物質Na3M2(PO4)2F3を正極として、NaTi2(PO4)3負極に対する充放電試験結果を示す。
【図4】本発明に係る電極活物質Na3M2(PO4)2F3を正極として、対称セルおよびカーボン負極に対する充放電試験結果を示す。
【発明を実施するための形態】
【0014】
本発明に係るナトリウムイオン二次電池用の電極活物質は、ナトリウムおよびフッ素を構成元素に含む一般式Na3M2(PO4)2F3(MはTi、V、Feのうちいずれかの金属元素)で表されるリン酸塩から成ることを特徴としている。Mは、放電容量の高さと取扱いの容易性からは一般にV(バナジウム)を使用することが好ましい。
【0015】
ナトリウムおよびフッ素を構成元素に含むリン酸塩Na3M2(PO4)2F3は、公知の手段を使用して製造することができ、例えば、2段階固相焼成等の固相法を使用することができる。固相法は、粉末原料を所定の組成となるように秤量して混合し、その後熱処理によって合成する手法である。この他にもよく知られた気相法を用いて製造することができる。
【0016】
本発明の製造方法の一例として、上記の金属元素Mがバナジウム(V)の場合には、酸化バナジウム(V2O5)とリン酸水素二アンモニウム(NH4)2HPO4を化学量論比1:2の割合で混合し、ペレット状に固め、カーボンが入った坩堝の中にいれて、アルゴン(Ar)、またはアルゴン(Ar)と5%水素混合ガス雰囲気下で固相焼成しVPO4を合成する。これにフッ化ナトリウム(NaF)を2:3の化学量論比で混合して2時間焼成することで、ナトリウムおよびフッ素を構成元素に含むリン酸塩Na3V2(PO4)2F3が得られる。それぞれ、以下の化学反応が起きているものと推察される。
【0017】
(化1)
0.5V2O5+(NH4)2HPO4+C→VPO4+2NH3+1.5H2O+CO (1)
2VPO4+3NaF→Na3V2(PO4)2F3 (2)
【0018】
上記の電極活物質を、ナトリウムイオン二次電池の電極としてそのまま用いてもよいが、電極のレート特性を向上させるために、公知の導電材との複合体を形成させてもよい。
すなわち、本発明に従えば、レート特性を向上させる観点から、上記で得られた電極活物質であるナトリウムおよびフッ素を構成元素に含むリン酸塩Na3M2(PO4)2F3を、不活性ガス雰囲気下で炭素微粒子と共に粉砕・混合することにより、カーボンコートすることができる。該炭素微粒子としては、ファーネスブラック、チャンネルブラック、アセチレンブラック、サーマルブラック等を使用することができるが、電極として使用する際の導電性の高さからアセチレンブラックが好適である。不活性ガスとしては、窒素ガスやアルゴンガス等を用いることができ、例えば、アルゴンガスを用いることができる。
【0019】
カーボンコートの際の粉砕・混合に適用される具体的手段は、特に限定されるものではなく、固形物質の粉砕・混合の目的で従来から用いられている各種の手段が適用可能であるが、好ましいのは、ボールミルであり、そのうち特に、原料を充分に粉砕・混合することができる点から遊星型ボールミル(planetary ball milling)を用いることが好ましい。
【0020】
本発明に従えば、以上のようにして得られた電極活物質Na3M2(PO4)2F3、該電極活物質を含むナトリウムイオン二次電池電極、および該電極を正極および/または負極として組み合わせたナトリウムイオン二次電池が提供される。なお、本発明に係る電極活物質Na3M2(PO4)2F3は、水系の電解液または非水系の電解液のいずれに対しても使用することができる。
【0021】
本発明に従う電極を作製する際には、上記の電極活物質を用いるほかは公知の電極の作製方法に従えばよい。例えば、上記活物質の粉末を必要に応じてポリエチレン等の公知の結着材、さらに必要に応じてアセチレンブラック等の公知の導電材と混合した後、得られた混合粉末をステンレス鋼製等の支持体上に圧着成形したり、金属製容器に充填したりすることができる。このような電極の例として、ペレット電極がある。ペレット電極としては、例えば、図1(a)に示すように、ペレット電極10aと、スペーサー11aと、コインセル容器(下蓋)12と、チタン製のチタンメッシュ13とから構成することができる。ペレット電極10aは、例えば、10mmの厚さとすることができる。スペーサー11aは、チタンメッシュ13を載置し、このチタンメッシュ13上にペレット電極10aを載置する。
【0022】
また、例えば、上記混合粉末をトルエン等の有機溶剤と混合して得られたスラリーをアルミニウム、ニッケル、ステンレス、銅等の金属基板上に塗布する等の方法によっても本発明の電極を作製することができる。このような電極の例として、塗布電極がある。塗布電極としては、例えば、図1(b)に示すように、塗布電極10bと、スペーサー11bと、コインセル容器(下蓋)12とから構成することができる。塗布電極10bは、例えば、10mmの電極径とすることができる。スペーサー11bは、上面中央部に塗布電極10bがスポット溶接される。
【0023】
本発明に係る電極活物質Na3M2(PO4)2F3を正極として使用する場合の好ましい態様として、一般式NaX2(PO4)3(XはTi、V、Feのうちいずれかの金属元素)で表されるリン酸塩から成る負極活物質を使用することが挙げられる。このうち本発明に係る電極活物質はより高電位のNa3V2(PO4)2F3を正極とすることが好ましい。また、負極としては上記リン酸塩のうち、より低電位のNaTi2(PO4)3が好ましい。かくして、本発明に従う特に好ましい態様として、Na3V2(PO4)2F3を正極とし、NaTi2(PO4)3を負極とすることにより、電圧特性および充放電特性の優れたナトリウムイオン二次電池が得られる(後述の実施例参照)。本発明に係る電極活物質Na3M2(PO4)2F3を正極とする他の例としては、負極にナトリウム金属や、従来から知られているハードカーボン(好ましいものとして、後述の実施例に示すものが挙げられる)を当然に使用することができるが、これらに限定されるものではない。また、本発明に係る電極活物質Na3M2(PO4)2F3を負極として使用する場合には、同じ電極活物質Na3M2(PO4)2F3を対称セルとして正極に使用することもできるが、これに限定されるものではない。
【0024】
その他の構成要素としては、公知のナトリウムイオン二次電池に使用されるものを構成要素として使用できる。例えば、以下のものが例示できる。
本発明のナトリウムイオン二次電池において、電解液は、ナトリウム塩を主電解質とするものであれば特に限定されない。この主電解質となるナトリウム塩としては、水系電解液の場合には、例えば、NaPF6、NaNO3、NaOH、NaCl、Na2SO4及びNa2S等が挙げられる。これらのナトリウム塩は、各々単独で用いることもできるが、2種以上を組み合わせて使用することもできる。また、非水系電解液の場合には、例えば、電解質NaClO4を、プロピレンカーボネート(PC)電解液として使用することができるが、この他にも、エチレンカーボネート(EC)とジエチルカーボネート(DEC)との混合溶媒に溶解させたものや、エチレンカーボネート(EC)とジメチルカーボネート(DMC)との混合溶媒に溶解させたもの等を電解液として使用することができる。
【0025】
本発明に係るナトリウムイオン二次電池は、セパレータ、電池ケース他、構造材料等の要素についても従来公知の各種材料を使用することができ、特に制限はない。本発明に係るナトリウムイオン二次電池は、上記の電池要素を用いて公知の方法に従って組み立てればよい。この場合、電池形状についても特に制限されることはなく、例えば円筒状、角型、コイン型等種々の形状、サイズを適宜採用することができる。
【0026】
以下に、本発明の特徴をさらに具体的に示すために実施例を記すが、本発明は以下の実施例によって制限されるものではない。
【0027】
(実施例1)
(1)電極活物質Na3M2(PO4)2F3の合成
リン酸塩Na3M2(PO4)2F3(M=Ti、V、Fe)は、2段階固相焼成を用いて合成した。まず各々の金属酸化物[酸化チタン(Ti2O3;純度99.9%以上、アルドリッチ製)、酸化バナジウム(V2O5;純度99%以上、ナカライテスク製)、リン酸第二鉄水和物(FePO4・2H2O;純度99.9%以上、アルドリッチ製)]とリン酸水素二アンモニウム[(NH4)2HPO4;純度99%以上、和光純薬工業株式会社製]とを化学量論比1:2の割合で混ぜ、アルゴンガス雰囲気下で600〜750℃を維持して、15時間固相焼成し、MPO4(M=Ti、V、Fe)を得た。これにフッ化ナトリウム(NaF;純度99%以上、和光純薬工業株式会社製)を2:3の化学量論比で混合し、500〜600℃に維持し、2時間焼成した。得られたNa3M2(PO4)2F3(M=Ti、V、Fe)を、アセチレンブラック(AB;電気化学工業株式会社製)とポリテトラフルオロエチレン(PTFE;ダイキン工業株式会社製)を70:25:5の重量比で混合後、ペレット状に成型したものを電極とした。
【0028】
充放電測定は、電解液に1M NaClO4/PC(富山薬品工業株式会社製)、負極にナトリウム金属(アルドリッチ製)、セパレータ(ポリプロピレン3501;Celgard LLC社製)を用いて作製したコインセルにて行なった。また、Na3V2(PO4)2F3は、対極にNaTi2(PO4)3、Na3V2(PO4)2F3 およびハードカーボンを用いたイオンセル構成にて評価した。
【0029】
(2)XRD測定、およびナトリウム金属負極に対する充放電測定
充放電条件は、充放電電流密度0.2 mA/cm2 一定の定電流モードに設定し室温にて測定を行った。さらに、充放電中の構造変化を明らかにするために、充放電測定後のコインセルは、露点?80℃以下のドライボックス中で解体し、取り出した電極ペレットをPCで洗浄後、気密性セルを用いてXRD測定を行なった。図2は、本発明に係る電極活物質Na3M2(PO4)2F3のXRDパターン結果を示し、図3は、本発明に係る電極活物質Na3M2(PO4)2F3を正極として、NaTi2(PO4)3負極に対する充放電試験結果を示す。
【0030】
XRD測定の結果、図2に示すように、Na3V2(PO4)2F3は、ICDD No.01−089−8485と一致する空間群P42/mnmの正方晶β−Na3V2(PO4)2F3単相が得られた。Na3Ti2(PO4)2F3とNa3Fe2(PO4)2F3もβ−Na3V2(PO4)2F3に類似するXRDプロファイルが得られた。また、ナトリウム金属を対極(負極)に用いて充電、放電を行ったNa3V2(PO4)2F3正極ペレットのXRD測定の結果から、ナトリウムイオンの脱離に伴いa軸、b軸方向への収縮とc 軸方向への伸長が可逆的に起こっていることが明らかとなった。
【0031】
各々のナトリウム金属負極に対するNa3M2(PO4)2F3(M=Ti、V、Fe)の充放電特性を図3(a)に示す。Na3V2(PO4)2F3およびNa3Ti2(PO4)2F3は、4.1V−3.6V、2.8V−2.4Vに各々二段の放電平坦部が、Na3Fe2(PO4)2F3では2.4Vに一段の放電平坦部が見られ、各試料の初回放電容量は、120mAh/g(M=V)、57mAh/g(M=Ti)、27mAh/g(M=Fe)であった。この結果から、特に、正極がNa3V2(PO4)2F3の場合に、120mAh/gという100mAh/gを超える放電容量を示すことがわかった。
【0032】
(実施例3)
Na3V2(PO4)2F3正極とNaTi2(PO4)3負極で構成したナトリウムイオン二次電池
上記最も大きい放電容量を示したNa3V2(PO4)2F3正極に対して、NaTi2(PO4)3を負極に用いて正極:負極のmol比を1:2に調整したナトリウムイオン二次電池を作成した。図3(b)に示すように、この二次電池は正極重量当たり120.4mAh/gという大きな初回放電容量を示し、50サイクル目のサイクル維持率は89.4%と比較的安定した可逆性を示した。この結果から、120mAh/gという大きな放電容量で、且つフラットなサイクルを実現する2Vクラスのナトリウムイオン二次電池が実現できることが示された。
【0033】
(実施例4)
Na3V2(PO4)2F3電極を対称セルで構成したナトリウムイオン二次電池
上記実施例3と同じNa3V2(PO4)2F3電極を正極(シート電極)および負極(ペレット電極)に用いて、対称セルによるナトリウムイオン二次電池を作成した。正極:負極のモル比を1:5に調整した。電解液を1M NaClO4/PC、電流密度を0.2mA/cm2、電圧範囲2.8−0.5Vとして、得られた充放電特性の結果を図4(a)に示す。図4(a)に示すように、本発明に係る電極活物質Na3V2(PO4)2F3は、良好な充放電特性を示すとともに、20サイクルを越えてもサイクル維持率は90%という比較的安定した可逆性を示した。このように、本発明に係る電極活物質Na3V2(PO4)2F3は、負極としても十分な電池特性をもつことが示された。
なお、電気伝導を担う媒体がNaであるため容量限界組成をC8Naと想定し、負極ハードカーボンの理論容量を計算した。
【0034】
(実施例5)
Na3V2(PO4)2F3正極とカーボン負極で構成したナトリウムイオン二次電池
上記実施例3と同じNa3V2(PO4)2F3正極に対して、特開2009−132593に開示の炭素材を1600℃処理した炭素材(以下、C1600)を負極に用いてナトリウムイオン二次電池を作成した。カーボンの理論容量を500mAh/gとして、正極:負極の理論容量比を1:3に調整した。電解液を1M NaClO4/PC、電流密度を0.2mA/cm2、電圧範囲4.3−2.3Vとして、得られた充放電特性の結果を図4(a)に示す。得られた充放電特性の結果を図4(b)に示す。図4(b)に示すように、本発明に係る電極活物質Na3V2(PO4)2F3は、カーボン(C1600)を負極に用いた場合にも4V付近にプラトーをもつ良好な充放電特性を有することが示された。
【0035】
上記実施例3〜5で得られた結果から、Na3V2(PO4)2F3正極に対する負極としては、対称セルや、従来から知られたカーボンを用いる他に、NaTi2(PO4)3を用いても、120mAh/gという大きな放電容量で、フラットなサイクルを有するナトリウムイオン二次電池が得られることが示された。
【符号の説明】
【0036】
10a ペレット電極
10b 塗布電極
11a スペーサー
11b スペーサー
12 コインセル容器(下蓋)
13 チタンメッシュ
【特許請求の範囲】
【請求項1】
一般式Na3M2(PO4)2F3(MはTi、V、Feのうちいずれかの金属元素)で表されるリン酸塩から成ることを特徴とするナトリウムイオン二次電池用の電極活物質。
【請求項2】
請求項1に記載の電極活物質からなる正極活物質。
【請求項3】
請求項1または2に記載の電極活物質を備えることを特徴とするナトリウムイオン二次電池。
【請求項4】
請求項1に記載の電極活物質を正極として、一般式NaX2(PO4)3(XはTi、V、Feのうちいずれかの金属元素)で表されるリン酸塩から成る電極活物質を負極として備えることを特徴とするナトリウムイオン二次電池。
【請求項5】
MがVであるリン酸塩Na3V2(PO4)2F3を正極とすることを特徴とする請求項4に記載のナトリウムイオン二次電池。
【請求項6】
XがTiであるリン酸塩NaTi2(PO4)3を負極とすることを特徴とする請求項4または請求項5に記載のナトリウムイオン二次電池。
【請求項1】
一般式Na3M2(PO4)2F3(MはTi、V、Feのうちいずれかの金属元素)で表されるリン酸塩から成ることを特徴とするナトリウムイオン二次電池用の電極活物質。
【請求項2】
請求項1に記載の電極活物質からなる正極活物質。
【請求項3】
請求項1または2に記載の電極活物質を備えることを特徴とするナトリウムイオン二次電池。
【請求項4】
請求項1に記載の電極活物質を正極として、一般式NaX2(PO4)3(XはTi、V、Feのうちいずれかの金属元素)で表されるリン酸塩から成る電極活物質を負極として備えることを特徴とするナトリウムイオン二次電池。
【請求項5】
MがVであるリン酸塩Na3V2(PO4)2F3を正極とすることを特徴とする請求項4に記載のナトリウムイオン二次電池。
【請求項6】
XがTiであるリン酸塩NaTi2(PO4)3を負極とすることを特徴とする請求項4または請求項5に記載のナトリウムイオン二次電池。
【図2】


【図3】


【図4】


【図1】




【図3】


【図4】


【図1】


【公開番号】特開2013−89391(P2013−89391A)
【公開日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願番号】特願2011−227413(P2011−227413)
【出願日】平成23年10月14日(2011.10.14)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成23年度、文部科学省、科学技術試験研究委託事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504145342)国立大学法人九州大学 (960)
【Fターム(参考)】
【公開日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願日】平成23年10月14日(2011.10.14)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成23年度、文部科学省、科学技術試験研究委託事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504145342)国立大学法人九州大学 (960)
【Fターム(参考)】
[ Back to top ]

