ナノスフェアの製造方法、ナノスフェア、これを含有する皮膚外用組成物および化粧料
【課題】 親水性物質もしくは疎水性物質のいずれか一方または両方を内包し、かつ粒径がナノオーダーである高分子微粒子を製造することができる。
【解決手段】 本発明のナノスフェアの製造方法は、親水性物質もしくは疎水性物質のいずれか一方または両方を溶解した溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液に超音波を照射して1次エマルションを生成し、1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成し、2次溶液に超音波を照射して2次エマルションを生成する。
【解決手段】 本発明のナノスフェアの製造方法は、親水性物質もしくは疎水性物質のいずれか一方または両方を溶解した溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液に超音波を照射して1次エマルションを生成し、1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成し、2次溶液に超音波を照射して2次エマルションを生成する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、例えば、タンパク質、核酸、薬物、造影剤等の親水性物質、もしくは、脂質、薬物等の疎水性物質のいずれか一方または両方を内包できるナノスフェアの製造方法、ナノスフェア、これを含有する皮膚外用組成物および化粧料に関する。
【背景技術】
【0002】
一般に病気の治療においては、「必要なときに、必要な量の薬物を、必要な病巣に選択的に送り届ける」ことが理想的であると言われている。従来の飲み薬等は、体内の目的場所(病巣)に到達する過程において、ほとんどの成分が変化してしまい、投与量と比較して、目的場所に到達する量はわずかであるという課題があった。
【0003】
そこで、生分解性ポリマー等で薬物を内包した高分子微粒子を投与することにより、薬物を変化させることなく目的場所に到達させる、所謂ドラッグ・デリバリー・システム(Drug Delivery System:以下単にDDSと称する)が注目を集めている。
【0004】
さらに、生分解性ポリマー等で薬物を内包した高分子微粒子を投与して、所定量の薬物を長時間にわたって放出させることで、患者のQOL(Quality Of Life)を高めることができる薬物徐放型DDSも脚光を浴びている。
【0005】
薬物徐放型DDS製剤に利用される、生分解性ポリマーを用いた高分子微粒子として、粒子径0.1μm程度〜数100μmと幅広い範囲の粒子径の高分子微粒子(マイクロスフェア、またはマイクロパーティクル)が報告されている。例えば、特許文献1には、ポリ乳酸やポリ乳酸共重合体で酢酸リュープロレリンを内包したマイクロスフェアが開示され、かかる酢酸リュープロレリンを内包したマイクロスフェアは皮下注射用製剤として実用化されている。
【0006】
一方、近年では、ホルモンや成長因子等のタンパク質やDNA、RNA等の核酸、生理活性を有する天然抽出物等の水溶性高分子の薬物としての利用が、ますます重要になっている。そこで、水溶性高分子の薬物を内包する高分子微粒子を利用した薬物徐放型DDS製剤が要求されている。
【0007】
特許文献1に記載のポリ乳酸やポリ乳酸共重合体を用いて水溶性高分子を内包する場合、ポリ乳酸やポリ乳酸共重合体(以下、単に疎水性生分解性ポリマーと称する)は疎水性であるため、W/O/W(Water in Oil in Water)エマルション法等が利用される。しかし、疎水性生分解性ポリマーを用いて水溶性高分子を内包するマイクロスフェアを製造すると、マイクロスフェアの内部における水溶性高分子の分布の均一性が低くなり、薬物徐放型DDS製剤とした場合における水溶性高分子の効力持続性(徐放化)が不十分であった。また、水溶性高分子がタンパク質や核酸である場合、マイクロスフェアを製造する過程で、立体構造が維持できなくなったり、変性してしまったりして、失活してしまうこともあった。
【0008】
そこで、生分解性ポリマーとして両親媒性を有するポリ乳酸グラフト化デキストランを用いることにより、W/O/Wエマルション法で、水溶性高分子を内包するマイクロスフェアが製造可能な技術が開示されている(非特許文献1)。非特許文献1に記載のマイクロスフェアは、水溶性高分子としてウシ血清アルブミン(Bovine Serum Albumin:以下、単にBSAと称する)を内包している。かかるマイクロスフェアは、BSAがマイクロスフェアの内部で略均一に分布しており、BSAの高次構造および活性も維持されているため、薬物徐放型DDS製剤として十分な徐放化を達成することが可能となる。
【0009】
しかし、非特許文献1に記載の水溶性高分子を内包する高分子微粒子は、スフェア粒径がマイクロメートルオーダーと大きいため、すなわちマイクロスフェアとなるため、静脈または動脈注射、経皮吸収には適していない。
【0010】
静脈または動脈注射や経皮吸収に適したナノメートルオーダーの高分子微粒子(ナノスフェア)を製造する技術として、O/W(Oil in Water)エマルション法を利用する技術が開示されている。例えば、非特許文献2には、O/Wエマルション法でポリ乳酸グラフト化デキストランを用いてナノスフェアを製造する技術が、非特許文献3には、O/Wエマルション法で両親媒性のブロック共重合体を用いてナノスフェアを製造する技術が開示されている。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開平10−182496号公報
【非特許文献】
【0012】
【非特許文献1】Ouchi T, Saito T, Kontani T, Ohya Y, Macromol Biosci. 2004 Apr 19;4(4):458-463
【非特許文献2】Nouvel C, Raynaud J, Marie E, Dellacherie E, Six JL, Durand A, J Colloid Interface Sci. 2009 Feb 15; 330(2):337-343
【非特許文献3】Ouchi T, Toyohara M, Arimura H, Ohya Y,Biomacromolecules. 2002 Sep-Oct; 3(5):885-888
【発明の概要】
【発明が解決しようとする課題】
【0013】
しかし、上述した非特許文献2および3に記載された、O/Wエマルション法を利用した場合、ナノスフェアを製造できるものの、疎水性物質しか内包できない、すなわち水溶性高分子を内包することができないといった問題点がある。
【0014】
上述したように、水溶性高分子の内包と、高分子微粒子の粒径の微細化との両立を成し得た例はなく、水溶性高分子を内包し、かつ、ナノメートルオーダーの高分子微粒子の開発が望まれている。
【0015】
そこで本発明は、このような課題に鑑み、水溶性高分子等の親水性物質もしくは疎水性物質のいずれか一方または両方を内包し、かつ粒径がナノオーダーである高分子微粒子を製造することができるナノスフェアの製造方法、ナノスフェア、これを含有する皮膚外用組成物および化粧料を提供することを目的とする。
【課題を解決するための手段】
【0016】
本発明の一例であるW/O/Wエマルション法を用いた、ナノスフェアの製造方法は、親水性物質を溶解した水系溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、1次溶液に超音波を照射して1次エマルションを生成する1次エマルション生成ステップと、1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、2次溶液に超音波を照射して2次エマルションを生成する2次エマルション生成ステップと、を含む。当該ナノスフェアは親水性物質を内包する。
【0017】
疎水性ポリマーおよび親水性物質に両親媒性ポリマーを添加した1次溶液に超音波を照射して生成した1次エマルションに親水性ポリマーを添加した2次溶液に、超音波を照射する構成により、凝集を抑制しつつ、親水性物質を内包するW/O/Wエマルションの高分子微粒子をナノメートルオーダーで製造することが可能となる。
【0018】
したがって、両親媒性ポリマー、疎水性ポリマーおよび親水性ポリマーに生分解性ポリマーを用いれば、タンパク質や核酸、生理活性を有する天然抽出物等の水溶性(親水性)高分子の薬物を内包する薬物徐放型DDS製剤等の医薬品や親水性の有効物質を内包する徐放型の化粧料を製造することができる。また、親水性物質を内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0019】
他のW/O/Wエマルション法を用いた、ナノスフェアの製造方法は、親水性物質を溶解した水系溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、1次溶液に超音波を照射して1次エマルションを生成する1次エマルション生成ステップと、1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、2次溶液に超音波を照射して2次エマルションを生成する2次エマルション生成ステップと、を含む。当該ナノスフェアは、親水性物質を内包する。
【0020】
ここでは、両親媒性ポリマーと親水性物質を含む1次溶液に超音波を照射して生成した1次エマルションに親水性ポリマーを添加した2次溶液に、超音波を照射する構成により、凝集を抑制しつつ、親水性物質を内包するW/O/Wエマルションの高分子微粒子をナノメートルオーダーで製造することが可能となる。
【0021】
したがって、両親媒性ポリマーおよび親水性ポリマーに生分解性ポリマーを用いれば、タンパク質や核酸、生理活性を有する天然抽出物等の水溶性(親水性)高分子の薬物を内包する医薬品や親水性の有効物質を内包する徐放型の化粧料を製造することができる。また、親水性物質を内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0022】
さらに他のO/Wエマルション法を用いた、ナノスフェアの製造方法は、疎水性物質を溶解した水非混和性有機溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、1次溶液に、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、2次溶液に超音波を照射してエマルションを生成するエマルション生成ステップと、を含む。当該ナノスフェアは、疎水性物質を内包する。
【0023】
ここでは、疎水性ポリマーおよび疎水性物質に両親媒性ポリマーを添加した1次溶液に親水性ポリマーをさらに添加した2次溶液に、超音波を照射する構成により、凝集を抑制しつつ、疎水性物質を内包する高分子微粒子をナノメートルオーダーで製造することが可能となる。
【0024】
したがって、両親媒性ポリマー、疎水性ポリマーおよび親水性ポリマーに生分解性ポリマーを用いれば、脂質や、生理活性を有する天然抽出物等の疎水性の高分子の薬物を内包する薬物徐放型DDS製剤等の医薬品や疎水性の有効物質を内包する徐放型の化粧料を製造することができる。また、疎水性物質を内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0025】
さらに他のO/Wエマルション法を用いた、ナノスフェアの製造方法は、疎水性物質を溶解した水非混和性有機溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、1次溶液に、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、2次溶液に超音波を照射してエマルションを生成するエマルション生成ステップと、を含む。当該ナノスフェアは、疎水性物質を内包する。
【0026】
ここでは、両親媒性ポリマーと疎水性物質を含む1次溶液に親水性ポリマーをさらに添加した2次溶液に、超音波を照射する構成により、凝集を抑制しつつ、疎水性物質を内包する高分子微粒子をナノメートルオーダーで製造することが可能となる。
【0027】
したがって、両親媒性ポリマーおよび親水性ポリマーに生分解性ポリマーを用いれば、脂質や、生理活性を有する天然抽出物等の疎水性の高分子の薬物を内包する医薬品や疎水性の有効物質を内包する徐放型の化粧料を製造することができる。また、疎水性物質を内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0028】
さらに他のW/O/Wエマルション法を用いた、ナノスフェアの製造方法は、親水性物質を溶解した水系溶媒と、疎水性物質を溶解した水非混和性有機溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、1次溶液に超音波を照射して1次エマルションを生成する1次エマルション生成ステップと、1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、2次溶液に超音波を照射して2次エマルションを生成する2次エマルション生成ステップと、を含む。当該ナノスフェアは、親水性物質および疎水性物質を内包する。
【0029】
疎水性ポリマー、親水性物質および疎水性物質に両親媒性ポリマーを添加した1次溶液に超音波を照射して生成した1次エマルションに親水性ポリマーを添加した2次溶液に、超音波を照射する構成により、凝集を抑制しつつ、親水性物質および疎水性物質を内包する高分子微粒子をナノメートルオーダーで製造することが可能となる。
【0030】
したがって、両親媒性ポリマー、疎水性ポリマーおよび親水性ポリマーに生分解性ポリマーを用いれば、タンパク質や核酸、生理活性を有する天然抽出物等の水溶性(親水性)高分子の薬物、および、脂質や生理活性を有する天然抽出物等の疎水性の高分子を内包する薬物徐放型DDS製剤等の医薬品や、親水性および疎水性の有効物質を内包する徐放型の化粧料を製造することができる。また、親水性物質および疎水性物質を内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0031】
さらに他のW/O/Wエマルション法を用いた、ナノスフェアの製造方法は、親水性物質を溶解した水系溶媒と、疎水性物質を溶解した水非混和性有機溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、1次溶液に超音波を照射して1次エマルションを生成する1次エマルション生成ステップと、1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、2次溶液に超音波を照射して2次エマルションを生成する2次エマルション生成ステップと、を含む。当該ナノスフェアは、親水性物質および疎水性物質を内包する。
【0032】
ここでは、両親媒性ポリマーと親水性物質および疎水性物質を含む1次溶液に超音波を照射して生成した1次エマルションに親水性ポリマーを添加した2次溶液に、超音波を照射する構成により、凝集を抑制しつつ、親水性物質および疎水性物質を内包する高分子微粒子をナノメートルオーダーで製造することが可能となる。
【0033】
したがって、両親媒性ポリマーおよび親水性ポリマーに生分解性ポリマーを用いれば、タンパク質や核酸、生理活性を有する天然抽出物等の水溶性(親水性)高分子の薬物、および、脂質や生理活性を有する天然抽出物等の疎水性の高分子を内包する医薬品や、親水性および疎水性の有効物質を内包する徐放型の化粧料を製造することができる。また、親水性物質および疎水性物質を内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0034】
両親媒性ポリマーは、親水性セグメントと疎水性セグメントとで構成される共重合体であり、親水性セグメントは、電荷を有するアミノ酸を3個以上有するポリペプチド、数平均分子量500〜100000であるポリエチレングリコール、および、多糖、の群から選択される1または複数を含み、疎水性セグメントは、生分解性ポリエステルを含んでもよい。
【0035】
両親媒性ポリマーとして、電荷を有するアミノ酸を3個以上有するポリペプチド、数平均分子量500〜100000であるポリエチレングリコール、および多糖、の群から選択される1または複数と、生分解性ポリエステルとで構成される共重合体を用いることにより、親水性物質もしくは疎水性物質のいずれか一方または両方を内包する生分解性のナノスフェアを製造することができる。
【0036】
ポリペプチドを構成するアミノ酸は、正電荷を有するアミノ酸であるリジン、アルギニンおよびヒスチジンの群および負電荷を有するアミノ酸であるアスパラギン酸およびグルタミン酸の群から選択される1または複数のアミノ酸であってもよい。
【0037】
両親媒性ポリマーを構成するポリペプチドのアミノ酸を、リジン、アルギニン、ヒスチジン、アスパラギン酸、グルタミン酸の群から選択される1または複数のアミノ酸といったタンパク質を構成するアミノ酸とする構成により、医薬品や化粧料を製造する際に、生体適合性を向上させることができる。また、両親媒性ポリマーを構成するポリペプチドのアミノ酸を、タンパク質を構成するアミノ酸とすることにより、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを血中に導入した場合に、マクロファージなどの貪食細胞に異物として捕捉される可能性を低減させることができ、血中の循環時間を延長させることが可能となる。
【0038】
また、両親媒性ポリマーにポリエチレングリコールを含ませる構成により、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを血中に導入した場合に、マクロファージなどの貪食細胞に異物として捕捉される可能性を低減させることができ、血中の循環時間を延長させることが可能となる。
【0039】
両親媒性ポリマーを構成する多糖は、ヒアルロン酸、アミロース、プルラン、コンドロイチン、コンドロイチン硫酸、デキストラン、デキストラン硫酸、デルマタン硫酸、ケラタン硫酸、ヘパラン硫酸、キチン、キトサン、および、βグルカン、の群から選択される1または複数であってもよい。また、両親媒性ポリマーにおける多糖の含有量が1〜50質量%であってもよい。
【0040】
両親媒性ポリマーとして、多糖と、生分解性ポリエステルとで構成される共重合体を用いることにより、親水性物質もしくは疎水性物質のいずれか一方または両方を内包する生分解性のナノスフェアを製造することができる。
【0041】
生分解性ポリエステルの構成単位は、乳酸、グリコール酸、および、アミノ酸、の群から選択される1または複数であってもよい。
【0042】
生分解性ポリエステルを生体由来材料である乳酸やアミノ酸、またはグリコール酸で構成することにより、医薬品や化粧料を製造する際に、生体適合性を向上させることができる。
【0043】
上記ナノスフェアの製造方法を用いて製造されるナノスフェアが提供される。ここで、ナノスフェアは、親水性物質もしくは疎水性物質のいずれか一方または両方として、ステビア発酵エキスまたはスフィンゴミエリンを内包してもよい。
【0044】
上記ナノスフェアの製造方法を用いて製造されたナノスフェアを含有する皮膚外用組成物が提供される。ここで、皮膚外用組成物は、ヒトの皮膚に接触させることにより、皮膚外用組成物に含まれる物質を経皮吸収させるものである。
【0045】
皮膚外用組成物として、上記ナノスフェアの製造方法を用いて製造された親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを含有する構成により、塗り薬等の皮膚外用組成物を皮膚表面の微細な凹凸にナノスフェアを略均一に塗布することができる。また、上述したようにナノスフェアを構成するポリマーに生分解性ポリマーを用いる構成により、ナノスフェアに内包させた親水性物質もしくは疎水性物質のいずれか一方または両方を皮膚表面で好適に徐放させることができ、従来と比較して、皮膚外用組成物の効果を維持しつつ、塗布する回数を減少させることが可能となる。
【0046】
上記皮膚外用組成物に含有されるナノスフェアは、親水性物質もしくは疎水性物質のいずれか一方または両方として、ステビア発酵エキスまたはスフィンゴミエリンを内包してもよい。ステビア発酵エキスおよびスフィンゴミエリンは、保湿効果が高く、荒れ肌を改善したり、かゆみを抑止したり、炎症を抑えたり、抗ヒスタミン作用を有したりする。したがって、ステビア発酵エキスまたはスフィンゴミエリンを内包させたナノスフェアを含有させた皮膚外用組成物とする構成により、皮膚表面の微細な凹凸にステビア発酵エキスまたはスフィンゴミエリンを略均一に行き渡らせることができる。
【0047】
上記ナノスフェアの製造方法を用いて製造されたナノスフェアを含有する化粧料が提供される。ここで、化粧料は、美化、清潔、保護あるいは、防臭を目的として人体を処置するための組成物である。
【0048】
化粧料として、上記ナノスフェアの製造方法を用いて製造された親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを含有する構成により、化粧料を皮膚表面の微細な凹凸にナノスフェアを略均一に塗布することができる。また、上述したようにナノスフェアを構成するポリマーに生分解性ポリマーを用いる構成により、ナノスフェアに内包させた親水性物質もしくは疎水性物質のいずれか一方または両方を皮膚表面で好適に徐放させることができ、従来と比較して化粧料の塗布回数を減らしても同程度の効果を得ることが可能となる。
【0049】
上記化粧料に含有されるナノスフェアは、親水性物質もしくは疎水性物質のいずれか一方または両方として、ステビア発酵エキスまたはスフィンゴミエリンを内包してもよい。ステビア発酵エキスおよびスフィンゴミエリンは、保湿効果が高く、荒れ肌を改善したり、かゆみを抑止したり、炎症を抑えたり、抗ヒスタミン作用を有したりする。したがって、ステビア発酵エキスまたはスフィンゴミエリンを内包させたナノスフェアを含有させた化粧料とする構成により、皮膚表面の微細な凹凸にステビア発酵エキスまたはスフィンゴミエリンを略均一に行き渡らせることができる。
【0050】
上述したナノスフェアの製造方法の技術的思想に基づく構成要素やその説明は、当該ナノスフェア、これを含有する皮膚外用組成物および化粧料にも適用可能である。
【発明の効果】
【0051】
本発明によれば、水溶性高分子等の親水性物質もしくは疎水性物質のいずれか一方または両方を内包し、かつ粒径がナノオーダーである高分子微粒子を製造することが可能となる。
【図面の簡単な説明】
【0052】
【図1】実施形態にかかるナノスフェアの製造方法を説明するための説明図である。
【図2】実施例1にかかるPLys+−b−PLLAの合成方法を説明するための説明図である。
【図3】実施例1にかかるPLys+−b−PLLAのミセル状態における分解性を説明するための説明図である。
【図4】実施例1を説明するための説明図である。
【図5】BSAを内包する生分解性ナノスフェアを、走査型電子顕微鏡で観察した結果を説明するための説明図である。
【図6】実施例における内包率、回収率、収率および内包効率を算出する式を説明するための説明図である。
【図7】実施例2にかかるPEG3K−b−PLLAの合成方法を説明するための説明図である。
【図8】実施例2を説明するための説明図である。
【図9】スフィンゴミエリンを内包する生分解性ナノスフェアを、走査型電子顕微鏡で観察した結果を説明するための説明図である。
【図10】実施例3にかかるDex−g−PLLAの合成方法を説明するための説明図である。
【図11】実施例3にかかるDex−g−PLLAの分解性を説明するための説明図である。
【図12】分解性実験に用いたDex−g−PLLAを説明するための説明図である。
【図13】、実施例3を説明するための説明図である。
【図14】スフィンゴミエリンを内包する生分解性ナノスフェアを、走査型電子顕微鏡で観察した結果を説明するための説明図である。
【図15】実施例4を説明するための説明図である。
【図16】BSAを内包する生分解性ナノスフェアを、走査型電子顕微鏡で観察した結果を説明するための説明図である。
【発明を実施するための形態】
【0053】
以下に添付図面を参照しながら、本発明の好適な実施形態について詳細に説明する。かかる実施形態に示す寸法、材料、その他具体的な数値などは、発明の理解を容易とするための例示にすぎず、特に断る場合を除き、本発明を限定するものではない。なお、本明細書および図面において、実質的に同一の機能、構成を有する要素については、同一の符号を付することにより重複説明を省略し、また本発明に直接関係のない要素は図示を省略する。
【0054】
(実施形態)
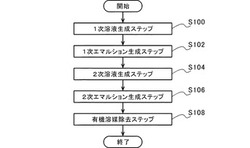
図1は、実施形態にかかるナノスフェアの製造方法を説明するための説明図である。
【0055】
まず、内包する物質を溶解した溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する(S100:1次溶液生成ステップ)。
【0056】
1次溶液生成ステップS100において、内包する物質を親水性物質とする場合、親水性物質を溶解した水系溶媒を、両親媒性ポリマーを溶解した水非混和性有機溶媒と疎水性ポリマーを溶解した水非混和性有機溶媒とに混合し、1次溶液を生成する。
【0057】
また、1次溶液生成ステップS100において、内包する物質を親水性物質および疎水性物質とする場合、親水性物質を溶解した水系溶媒および疎水性物質を溶解した水非混和性有機溶媒を、両親媒性ポリマーを溶解した水非混和性有機溶媒と疎水性ポリマーを溶解した水非混和性有機溶媒とに混合し、1次溶液を生成する。
【0058】
生成した1次溶液に超音波を照射し、逆相エマルション(W/Oエマルション)である1次エマルションを生成する(S102:1次エマルション生成ステップ)。そして、1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する(S104:2次溶液生成ステップ)。生成した2次溶液に超音波を照射して2次エマルションを生成し(S106:2次エマルション生成ステップ)、2次エマルションから水非混和性有機溶媒を除去する(S108:有機溶媒除去ステップ)。
【0059】
また、内包する物質が疎水性物質である場合、1次溶液生成ステップS100において、疎水性物質を溶解した水非混和性有機溶媒を、両親媒性ポリマーを溶解した水非混和性有機溶媒と疎水性ポリマーを溶解した水非混和性有機溶媒とに混合し、1次溶液を生成する。そして、1次エマルション生成ステップS102を省略し、1次溶液に、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する(S104:2次溶液生成ステップ)。生成した2次溶液に超音波を照射してエマルション(O/Wエマルション)を生成し(S106:エマルション生成ステップ(2次エマルション生成ステップ))、エマルションから水非混和性有機溶媒を除去する(S108:有機溶媒除去ステップ)。
【0060】
以下に、各ステップの構成を詳細に説明する。
【0061】
(1次溶液生成ステップS100)
内包する物質を溶解した溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する。
【0062】
[1次溶液生成ステップS100における両親媒性ポリマー1]
1次溶液生成ステップS100における両親媒性ポリマーは、親水性セグメントと疎水性セグメントとで構成される共重合体であり、親水性セグメントは、電荷を有するアミノ酸を3個以上有するポリペプチドまたは数平均分子量500〜100000であるポリエチレングリコールを含み、疎水性セグメントは生分解性ポリエステルを含んで構成される。
【0063】
<両親媒性ポリマーの重合形態>
ポリペプチドを含む両親媒性ポリマーまたはポリエチレングリコールを含む両親媒性ポリマーの重合形態は、好ましくは、電荷を有するアミノ酸を3個以上有するポリペプチドまたは数平均分子量500〜100000であるポリエチレングリコールと、生分解性ポリエステルとの、ランダム共重合体、交互共重合体、ブロック共重合体、グラフト共重合体であり、より好ましくは、ブロック共重合体またはグラフト共重合体であり、さらに好ましくは、ブロック共重合体である。
【0064】
<電荷を有するアミノ酸を3個以上有するポリペプチド>
両親媒性ポリマーを構成するポリペプチドは、正電荷または負電荷を有していればよく、かかるポリペプチドを構成するアミノ酸は、好ましくは、リジン、アルギニン、ヒスチジン、アスパラギン酸、グルタミン酸の群から選択される1または複数のアミノ酸であればよく、より好ましくは、リジン、アルギニンまたはヒスチジンの群から選択される1または複数のアミノ酸であり、さらに好ましくはリジンである。
【0065】
両親媒性ポリマーを構成するポリペプチドのアミノ酸を、タンパク質を構成するアミノ酸とする構成により、かかる両親媒性ポリマーを用いたナノスフェアを利用して薬物徐放型DDS製剤等の医薬品や徐放型の皮膚外用組成物、徐放型の化粧料を製造する際に、生体適合性を向上させることができる。また、両親媒性ポリマーを構成するポリペプチドのアミノ酸を、タンパク質を構成するアミノ酸とすることにより、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを血中に導入した場合に、マクロファージなどの貪食細胞に異物として捕捉される可能性を低減させることができ、血中の循環時間を延長させることが可能となる。
【0066】
<ポリエチレングリコール>
両親媒性ポリマーを構成するポリエチレングリコールの数平均分子量は、特に限定されないが、好ましくは、数平均分子量500〜100000であり、より好ましくは、数平均分子量1000〜50000であり、さらに好ましくは数平均分子量2000〜20000である。
【0067】
両親媒性ポリマーにポリエチレングリコールを含ませる構成により、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを血中に導入した場合に、マクロファージなどの貪食細胞に異物として捕捉される可能性を低減させることができ、血中の循環時間を延長させることが可能となる。
【0068】
<生分解性ポリエステルの構成単位>
生分解性ポリエステルの構成単位は、重合した場合に生分解性ポリエステルとなるものであり、上記ポリペプチドまたはポリエチレングリコールと共重合体を構成できるものであればよく、好ましくは、乳酸(L−乳酸、D−乳酸、DL−乳酸)、グリコール酸(ヒドロキシ酢酸)、アミノ酸、カプロラクトン(α−カプロラクトン、β−カプロラクトン、γ−カプロラクトン、δ−カプロラクトン、ε−カプロラクトン等)、コハク酸とエチレングリコールの混合物、コハク酸とブタンジオール(1,2−ブタンジオール、1,3−ブタンジオール、1,4−ブタンジオール、2,3−ブタンジオール等)の混合物、からなる群のうち、1または複数、またはこれらのオリゴマーであればよく、より好ましくは、乳酸、グリコール酸およびアミノ酸、の群から選択される1または複数であり、さらに好ましくはL−乳酸である。
【0069】
生分解性ポリエステルは、例えば、ポリ乳酸(PLA:Poly Lactic Acid)、ポリグリコール酸(PGA:Poly Glycolic Acid)、ポリ乳酸−グリコール酸共重合体、ポリデプシペプチド(アミノ酸とヒドロキシ酸の共重合体)を用いることができる。
【0070】
生分解性ポリエステルを生体由来材料である乳酸やアミノ酸、またはグリコール酸で構成することにより、医薬品や、皮膚外用組成物、化粧料を製造する際に、生体適合性を向上させることができる。
【0071】
[1次溶液生成ステップS100における両親媒性ポリマー2]
また、1次溶液生成ステップS100における両親媒性ポリマーは、親水性セグメントと疎水性セグメントとで構成される共重合体であり、親水性セグメントは、多糖を含み、疎水性セグメントは生分解性ポリエステルを含んで構成されてもよい。
【0072】
<両親媒性ポリマーの重合形態>
多糖を含む両親媒性ポリマーの重合形態は、多糖と、生分解性ポリエステルとの、ランダム共重合体、交互共重合体、ブロック共重合体、グラフト共重合体であればよく、好ましくは、グラフト共重合体またはブロック共重合体であり、より好ましくは、グラフト共重合体である。また、両親媒性ポリマーは、さらに好ましくは、多糖を主鎖とし、生分解性ポリエステルを側鎖としたグラフト共重合体である。
【0073】
<多糖の含有量>
また、両親媒性ポリマーを構成する多糖の含有量は、特に限定されないが、1〜50質量%であればよく、好ましくは、1〜30質量%であり、さらに好ましくは、4〜25質量%である。
【0074】
両親媒性ポリマーを構成する多糖の含有量をかかる範囲の含有量とする構成により、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを生体内に留置した場合においても、分解に伴う炎症反応等を生じさせない分解速度であり、かつ、生体内で必要とされる期間の経過後には生体内から消失している分解速度に調節することができる。かかる生体内で必要とされる期間とは、好ましくは1ヶ月〜10ヶ月、さらに好ましくは、2ヶ月〜10ヶ月、最も好ましくは2ヶ月〜8ヶ月である。
【0075】
<多糖>
両親媒性ポリマーを構成する多糖は、生体内で安定であればよく、好ましくは、ヒアルロン酸、アミロース、プルラン、コンドロイチン、コンドロイチン硫酸、デキストラン、デキストラン硫酸、デルマタン硫酸、ケラタン硫酸、ヘパラン硫酸、キチン、キトサンおよびβグルカンの群から選択される1または複数であり、より好ましくは、デキストラン、プルランおよびヒアルロン酸の群から選択される1または複数であり、さらに好ましくは、デキストランである。
【0076】
両親媒性ポリマーにおける多糖をデキストランとする構成により、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを安定して血管内に存在させることができる。
【0077】
かかる多糖の重量平均分子量は、特に限定されないが、1000〜100000g/molであればよく、好ましくは、5000〜50000g/molであり、さらに好ましくは、10000〜30000g/molである。
【0078】
両親媒性ポリマーにおける多糖をかかる範囲の数平均分子量である多糖とする構成により、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアが、高い成型性と、柔軟性とを維持しつつ細胞接着性を低下させることができる。
【0079】
<生分解性ポリエステルの構成単位>
生分解性ポリエステルの構成単位は、重合した場合に、生分解性ポリエステルとなるものであり、上記多糖と共重合体を構成できるものであればよく、好ましくは、乳酸(L−乳酸、D−乳酸、DL−乳酸)、グリコール酸(ヒドロキシ酢酸)、アミノ酸、カプロラクトン(α−カプロラクトン、β−カプロラクトン、γ−カプロラクトン、δ−カプロラクトン、ε−カプロラクトン等)、コハク酸とエチレングリコールの混合物、コハク酸とブタンジオール(1,2−ブタンジオール、1,3−ブタンジオール、1,4−ブタンジオール、2,3−ブタンジオール等)の混合物、からなる群のうち、1または複数、またはこれらのオリゴマーであり、より好ましくは、乳酸、グリコール酸およびアミノ酸、の群から選択される1または複数であり、さらに好ましくはL−乳酸である。
【0080】
生分解性ポリエステルは、例えば、ポリ乳酸、ポリグリコール酸、ポリ乳酸−グリコール酸共重合体、ポリデプシペプチドを用いることができる。
【0081】
生分解性ポリエステルを生体由来材料である乳酸やアミノ酸、またはグリコール酸で構成することにより、医薬品や、皮膚外用組成物、化粧料を製造する際に、生体適合性を向上させることができる。
【0082】
上述した多糖と生分解性ポリエステルとの共重合体である両親媒性ポリマーは、好ましくは、主鎖をデキストランとし、側鎖をL−乳酸としたグラフト共重合体である。以下、デキストランを主鎖としL−乳酸を側鎖としたグラフト共重合体である両親媒性ポリマーをDex−g−PLLA(ポリ乳酸グラフト化デキストラン)と称する。
【0083】
上記Dex−g−PLLA1分子における乳酸のグラフト本数は、1〜100本であればよく、好ましくは、1〜50本であり、さらに好ましくは2〜30本である。Dex−g−PLLA1分子における乳酸のグラフト本数を上記範囲の本数とする構成により、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアの細胞接着性を低減させることが可能となる。
【0084】
また、上記Dex−g−PLLAの数平均分子量は、特に限定されないが、1×104〜100×104/molであればよく、好ましくは、5×104〜20×104/molであり、さらに好ましくは、10×104〜13×104/molである。
【0085】
Dex−g−PLLAをかかる範囲の数平均分子量とする構成により、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアが、高い強度と、柔軟性を維持しつつ細胞接着性を低下させることができる。
【0086】
1次溶液生成ステップS100において、上記疎水性ポリマーを溶解した水非混和性有機溶媒を添加せずともよく、内包する物質を溶解した溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成してもよい。
【0087】
<疎水性ポリマー>
疎水性ポリマーの重合形態は、ランダム共重合体、交互共重合体、ブロック共重合体、グラフト共重合体であってもよい。
【0088】
疎水性ポリマーの構成単位は、重合した場合に、疎水性ポリマーとなるものであればよく、好ましくは乳酸(L−乳酸、D−乳酸、DL−乳酸)、グリコール酸(ヒドロキシ酢酸)、アミノ酸、カプロラクトン(α−カプロラクトン、β−カプロラクトン、γ−カプロラクトン、δ−カプロラクトン、ε−カプロラクトン等)、コハク酸とエチレングリコールの混合物、コハク酸とブタンジオール(1,2−ブタンジオール、1,3−ブタンジオール、1,4−ブタンジオール、2,3−ブタンジオール等)の混合物、からなる群のうち、1または複数、またはこれらのオリゴマーであればよく、より好ましくは、乳酸、グリコール酸およびアミノ酸、の群から選択される1または複数であり、さらに好ましくはL−乳酸およびグリコール酸である。
【0089】
疎水性ポリマーは、例えば、ポリ乳酸、ポリグリコール酸、ポリ乳酸−グリコール酸共重合体、ポリデプシペプチドを用いることができる。
【0090】
本実施形態では、疎水性ポリマーとして、L−乳酸とグリコール酸とのランダム共重合体を用い、以下、かかるL−乳酸とグリコール酸とのランダム共重合体による疎水性ポリマーをPLGA(ポリ乳酸−グリコール酸ランダム共重合体)と称する。
【0091】
PLGAの重量平均分子量(Mw)は、特に限定されないが、5000〜75000であるとよい。
【0092】
[1次溶液生成ステップS100における内包する物質]
1次溶液生成ステップS100における内包する物質は、親水性物質もしくは疎水性物質のいずれか一方または両方であってもよく、親水性物質もしくは疎水性物質のいずれか一方または両方としてステビア発酵エキスまたは両親媒性物質であってもよい。また両親媒性物質として、例えば、スフィンゴミエリンを用いることができる。
【0093】
親水性物質と疎水性物質の混合物であるステビア発酵エキスおよび両親媒性物質であるスフィンゴミエリンは、国際公開番号WO2008/126638A1や「ステビア発酵エキスの抗ヒスタミン作用に関する研究」薬理と治療 vol.36 no.8 2008に記載されているように、保湿効果が高く、荒れ肌を改善したり、かゆみを抑止したり、炎症を抑えたり、抗ヒスタミン作用を有したりする。したがって、ステビア発酵エキスまたはスフィンゴミエリンを内包させたナノスフェアを含有させた皮膚外用組成物や化粧料とする構成により、皮膚表面の微細な凹凸にステビア発酵エキスまたはスフィンゴミエリンを略均一に行き渡らせることができる。
【0094】
[1次溶液生成ステップS100における水系溶媒]
1次溶液生成ステップS100における水系溶媒は、水または無機塩類、糖類、有機塩類、アミノ酸等を含む水溶液であり、親水性物質または両親媒性物質の親水セグメントが溶解できれば足りる。
【0095】
[1次溶液生成ステップS100における水非混和性有機溶媒]
1次溶液生成ステップS100における水非混和性有機溶媒は、疎水性ポリマー、両親媒性ポリマーの疎水性セグメント、疎水性物質、または両親媒性物質の疎水性セグメントが可溶であり、かつ両親媒性ポリマーの親水性セグメントが難溶または不溶であるとよいが、両親媒性ポリマーの疎水性セグメントおよび親水性セグメントの両者が難溶または可溶であってもよい。かかる水非混和性有機溶媒の水への溶解度は、10g(水非混和性有機溶媒)/100ml(水)以下であり、好ましくは、1g(水非混和性有機溶媒)/100ml(水)以下であり、さらに好ましくは、0.1g(水非混和性有機溶媒)/100ml(水)以下である。水非混和性有機溶媒は、特に限定されないが、酢酸エチル、酢酸イソプロピル、酢酸ブチル、炭酸ジメチル、炭酸ジエチル、塩化メチレン(ジクロロメタン)、クロロホルム等を好適に利用できる。
【0096】
[1次溶液生成ステップS100における水系溶媒と水非混和性有機溶媒の比]
上記水系溶媒に対する水非混和性有機溶媒の比は、1:1000〜1:1であってもよく、好ましくは、1:100〜1:3、より好ましくは、1:50〜1:10である。ここで、水非混和性有機溶媒の量は、ポリペプチドを含む両親媒性ポリマーまたはポリエチレングリコールを含む両親媒性ポリマーを用いる場合、これらの両親媒性ポリマーを溶解する水非混和性有機溶媒と疎水性ポリマーを溶解する水非混和性有機溶媒の合計の量とし、多糖を含む両親媒性ポリマーを用いる場合、多糖を含む両親媒性ポリマーを溶解する水非混和性有機溶媒の量とする。
【0097】
水非混和性有機溶媒中の両親媒性ポリマーおよび疎水性ポリマーの濃度は、ポリペプチドを含む両親媒性ポリマーまたはポリエチレングリコールを含む両親媒性ポリマーを用いる場合、1〜500mg/mlであればよく、好ましくは、10〜250mg/mlであり、さらに好ましくは50〜100mg/mlである。この場合、両親媒性ポリマーに対する疎水性ポリマーの比は、1:1000〜1:1であればよく、好ましくは、1:100〜1:3、より好ましくは、1:50〜1:5である。
【0098】
また、水非混和性有機溶媒中の両親媒性ポリマーの濃度は、多糖を含む両親媒性ポリマーを用いる場合、1〜500mg/mlであればよく、好ましくは、10〜250mg/mlであり、さらに好ましくは50〜100mg/mlである。
【0099】
(1次エマルション生成ステップS102)
生成した1次溶液に超音波を照射し、逆相エマルション(W/Oエマルション)である1次エマルションを生成する。
【0100】
超音波の照射時間は、0.5〜15分間であればよく、好ましくは、1〜10分間であり、より好ましくは、3〜5分間である。
【0101】
超音波の照射は、バス型ソニケータを用いても、プローブ型ソニケータを用いてもよく、バス型ソニケータおよびプローブ型ソニケータを用いてもよい。
【0102】
また、本実施形態において、生成した1次溶液に超音波を照射することで、逆相エマルションである1次エマルションを生成するが、これに限定されず、マグネチックスターラー等の攪拌装置、タービン型攪拌装置、ホモジナイザー等を用いて1次溶液を攪拌することで1次エマルションを生成してもよい。
【0103】
(2次溶液生成ステップS104)
1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する。
【0104】
[2次溶液生成ステップS104における親水性ポリマー]
親水性ポリマーは、上述した両親媒性ポリマーの疎水性セグメントまたは疎水性ポリマーと、化学結合し、または物理的に吸着するものであるとよい。また、親水性ポリマーは、溶媒中における1次エマルションの凝集を防止したり、凝集を遅延させたりするものであるとよい。なお、親水性ポリマーは、2次溶液生成ステップS104において、両親媒性ポリマーの疎水性セグメントまたは疎水性ポリマーと、化学結合し、または物理的に吸着するものであってもよく、後述する有機溶媒除去ステップS108における、溶媒除去時に両親媒性ポリマーの疎水性セグメントまたは疎水性ポリマーと、化学結合し、または物理的に吸着するものであってもよい。
【0105】
親水性ポリマーは、ポリビニルアルコール、ポリエチレングリコール、ポリペプチド、タンパク質または多糖類の群から選択される1または複数であればよく、好ましくは、ポリビニルアルコールである。
【0106】
また、親水性ポリマーは、ポリビニルアルコール、ポリエチレングリコール、ポリペプチド、タンパク質または多糖類の群から選択される1または複数の類縁体であってもよい。
【0107】
[2次溶液生成ステップS104における水系溶媒]
2次溶液生成ステップS100における水系溶媒は、親水性ポリマーを溶解できればよく、例えば、水または無機塩類、糖類、有機塩類、アミノ酸等を含む水溶液である。
【0108】
水系溶媒中の親水性ポリマーの濃度は、0.1〜500mg/mlであればよく、好ましくは、10〜250mg/mlであり、さらに好ましくは50〜100mg/mlである。
【0109】
また、1次溶液生成ステップS100における1次溶液に対する、2次溶液生成ステップS100における親水性ポリマーを溶解した水系溶媒比は、1:500〜1:10であればよく、好ましくは、1:300〜1:50、さらに好ましくは、1:200〜1:100である。
【0110】
(2次エマルション生成ステップS106)
生成した2次溶液に超音波を照射して2次エマルションを生成する。
【0111】
超音波の照射時間は、0.5〜20分間であればよく、好ましくは、1〜15分間であり、さらに好ましくは、3〜7分間である。
【0112】
超音波の照射は、バス型ソニケータを用いても、プローブ型ソニケータを用いてもよく、バス型ソニケータおよびプローブ型ソニケータを用いてもよい。
【0113】
また、本実施形態において、生成した2次溶液に超音波を照射することで、2次エマルションを生成するが、これに限定されず、マグネチックスターラー等の攪拌装置、タービン型攪拌装置、ホモジナイザー等を用いて2次溶液を攪拌することで2次エマルションを生成してもよい。
【0114】
(有機溶媒除去ステップS108)
2次エマルションから水非混和性有機溶媒を除去する。
【0115】
水非混和性有機溶媒を除去する方法としては、液中乾燥、透析、遠心分離、凍結乾燥、濾過、再沈殿等を利用すればよく、好ましくは、液中乾燥、遠心分離、凍結乾燥を利用する。
【0116】
また、当該有機溶媒除去ステップS108を経た後に、2次エマルション(疎水性物質を内包する場合、エマルション)を、水系溶媒に導入し、さらに水非混和性有機溶媒を除去することにより、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアの水系溶媒分散体としてもよい。
【0117】
以上説明した1次溶液生成ステップS100、1次エマルション生成ステップS102、2次溶液生成ステップS104、2次エマルション生成ステップS106および有機溶媒除去ステップS108により、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアの水系溶媒分散体を得ることができる。なお、両親媒性ポリマー、疎水性ポリマーおよび親水性ポリマーに生分解性ポリマーを用いれば、薬物徐放型DDS製剤等の医薬品や有効物質を内包する徐放型の皮膚外用組成物、有効成分を内包する化粧料に好適な、親水性物質もしくは疎水性物質のいずれか一方または両方を内包する生分解性ナノスフェアの水系溶媒分散体を得ることが可能となる。
【0118】
また、本実施形態により得られた親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアの水系溶媒分散体から、分散媒を除去することにより、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアとすることも可能である。分散媒を除去する方法としては、特に限定されないが、液中乾燥、透析、遠心分離、凍結乾燥、濾過、再沈殿等を利用することができ、好ましくは、液中乾燥、遠心分離、凍結乾燥を利用する。
【0119】
以上説明したように、1次エマルション生成ステップS102において1次エマルションを生成する際に、両親媒性ポリマーを添加する構成により、疎水性ポリマーに親水性物質もしくは疎水性物質のいずれか一方または両方を内包させることができる。また、疎水性ポリマーと、親水性物質もしくは疎水性物質のいずれか一方または両方とに両親媒性ポリマーを添加した1次溶液に上述した条件で超音波を照射して生成した1次エマルションに親水性ポリマーを添加した2次溶液に、上述した条件で超音波を照射する構成により、凝集を抑制しつつ、親水性物質もしくは疎水性物質のいずれか一方または両方を内包する高分子微粒子をナノメートルオーダーで製造することが可能となる。
【0120】
また、1次エマルション生成ステップS102において1次エマルションを生成する際に、両親媒性ポリマーと、親水性物質もしくは疎水性物質のいずれか一方または両方と、を含む1次溶液に上述した条件で超音波を照射して生成した1次エマルションに親水性ポリマーを添加した2次溶液に、上述した条件で超音波を照射する構成により、凝集を抑制しつつ、親水性物質もしくは疎水性物質のいずれか一方または両方を内包する高分子微粒子をナノメートルオーダーで製造することが可能となる。
【0121】
さらに、両親媒性ポリマー、疎水性ポリマーおよび親水性ポリマーに生分解性ポリマーを用いる構成により、タンパク質や核酸、生理活性を有する天然抽出物等の水溶性(親水性)高分子の薬物、および、脂質や、生理活性を有する天然抽出物等の疎水性の高分子の薬物を内包する医薬品や、親水性および疎水性の有効物質を内包する徐放型の化粧料を製造することができる。また、親水性物質もしくは疎水性物質のいずれか一方または両方を内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0122】
皮膚外用組成物として、上記親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアの製造方法を用いて製造された親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを含有する構成により、塗り薬等の皮膚外用組成物を皮膚表面の微細な凹凸にナノスフェアを略均一に塗布することができる。また、上述したようにナノスフェアを構成するポリマーに生分解性ポリマーを用いる構成により、ナノスフェアに内包させた親水性物質もしくは疎水性物質のいずれか一方または両方を皮膚表面で好適に徐放させることができ、従来と比較して、皮膚外用組成物の効果を維持しつつ、塗布する回数を減少させることが可能となる。
【0123】
また、化粧料として、上記親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアの製造方法を用いて製造された親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを含有する構成により、化粧料を皮膚表面の微細な凹凸にナノスフェアを略均一に塗布することができる。また、上述したようにナノスフェアを構成するポリマーに生分解性ポリマーを用いる構成により、ナノスフェアに内包させた親水性物質もしくは疎水性物質のいずれか一方または両方を皮膚表面で好適に徐放させることができ、従来と比較して化粧料の塗布回数を減らしても同程度の効果を得ることが可能となる。
【0124】
例えば、親水性物質と疎水性物質の混合物であるステビア発酵エキスや、親水性物質もしくは疎水性物質のいずれか一方または両方の機能を有する両親媒性物質としてのスフィンゴミエリンを内包させたナノスフェアを含有させた皮膚外用組成物や、化粧料を製造することもできる。
【0125】
ステビア発酵エキスおよびスフィンゴミエリンは、国際公開番号WO2008/126638A1や「ステビア発酵エキスの抗ヒスタミン作用に関する研究」薬理と治療 vol.36 no.8 2008に記載されているように、保湿効果が高く、荒れ肌を改善したり、かゆみを抑止したり、炎症を抑えたり、抗ヒスタミン作用を有したりする。したがって、ステビア発酵エキスまたはスフィンゴミエリンを内包させたナノスフェアを含有させた皮膚外用組成物や化粧料とする構成により、皮膚表面の微細な凹凸にステビア発酵エキスまたはスフィンゴミエリンを略均一に行き渡らせることができる。
【0126】
また本実施形態にかかるステビア発酵エキスもしくはスフィンゴミエリンのいずれか一方または両方を内包させたナノスフェアは、化粧料においては、頭髪用化粧品、整髪料、養毛料、頭皮料、毛髪着色料、洗髪料、ヘアリンス、皮膚用化粧品・化粧水、化粧液、クリーム、乳液、日焼け、日焼け止め、洗浄料、ひげそり、むだ毛そり、フェイシャルリンス、パック、化粧用油、ボディリンス、マッサージ料、仕上用化粧品・ファンデーション、化粧下地、おしろい、口紅、アイメークアップ、頬化粧料、ボディメークアップ、オーデコロン・香水、浴用化粧料、爪化粧料、ボディパウダー等、また、医薬品においては、散剤・細粒剤、顆粒剤、錠剤、カプセル剤、丸剤、桿剤、ペンシル剤、内容液剤、外用液剤、エキス剤、硬膏剤、坐剤、エアゾール、ガス剤、薬品吸着剤、眼科用剤、注射剤、絆創膏剤等幅広く使用可能である。
【0127】
以下に、ある実施例の詳細についてさらに説明する。
【0128】
(実施例1)
本実施例では、両親媒性ポリマーとしてポリリジンとL−乳酸のジブロック共重合体(以下、単に、PLys+−b−PLLAと称する)を、疎水性ポリマーとして、PLGAを、親水性ポリマーとしてポリビニルアルコール(以下、単に、PVAと称する)を、内包する親水性物質としてBSAを用いた。
【0129】
図2は、実施例1にかかるPLys+−b−PLLAの合成方法を説明するための説明図である。
【0130】
図2に示すように、まず、2−aminoethanolのアミノ基をt-ブトキシカルボニル(以下単に、Bocと称する)基で保護した。次に、Boc―aminoethanolの末端水酸基をカリウムナフタレンによりアルコキシド化し、これを開始剤としてラクチドの溶液系アニオン開環重合を行った。最後に、得られたポリマーの末端アミノ基の保護基(Boc基)を25%臭化水素酢酸(25%HBr/AcOH)で除去した後、トリエチルアミン(TEA)を用いて脱塩を行い、目的物であるNH2−PLLAを得た。
【0131】
NH2−PLLAのアミノ基を重合開始点として用い、Lys(Z)−N−カルボキシ無水物(NCA:N-Carboxy Anhydride)との脱炭酸重合を行った。蒸留したクロロホルムにNH2−PLLAを溶解した後、Lys(Z)−NCAを加え、アルゴン気流下、40℃で24時間撹拌した。次に、得られたポリマーを25%臭化水素酢酸で処理することで側鎖保護基であるベンジルオキシカルボニル基(Z基)の脱保護を行い、目的物であるPLys+−b−PLLAを得た。
【0132】
本実施例にかかるPLys+−b−PLLAは、リジンの重合度は16であり、乳酸の重合度は39であった。また、本実施例にかかるPLys+−b−PLLAは両親媒性を有するため水中で自己会合してミセルを形成する。
【0133】
図3は、実施例1にかかるPLys+−b−PLLAのミセル状態における分解性を説明するための説明図である。ここでは、PLys+−b−PLLAのミセルを0.5mg/mlとなるようにリン酸緩衝生理食塩水(PBS:Phosphate Buffered Saline)(pH=7.4、I=0.14)に分散させ、37℃でインキュベートし、1日後、3日後、5日後、7日後のPLys+−b−PLLAを、GPC(Gel Permeation Chromatography)を用いた分子量分布測定を行い分子量の減少について検討した。
【0134】
図3に示すように、1日後においても1%程度しか減少しておらず、3日後においては、1.5%程度、5日後においては、2.5%程度、7日後においては6%程度の減少であった。したがって、両親媒性ポリマーとしてPLys+−b−PLLAを用いた親水性物質もしくは疎水性物質のいずれか一方または両方を内包する生分解性ナノスフェアを生体内に留置した場合に、分解に伴う炎症反応等を起こさない分解速度であり、かつ、生体内で必要とされる期間の経過後には生体内から消失している分解速度に調節することができる。
【0135】
図4は、実施例1を説明するための説明図である。図4に示すように、試験管に、PLys+−b−PLLA20mgおよび重量平均分子量が5000〜75000であるPLGA180mgを入れ、クロロホルム(CHCl3)2.5mlに溶解させた。続いて、親水性物質としてBSA5mgを溶解したPBS100μlを試験管に加え1次溶液を生成した。次に、1次溶液をスパチュラで激しく撹拌しながらプローブ型ソニケータで3分間超音波を照射し、1次エマルションを調製した。本実施例において、プローブ型ソニケータとして、株式会社トミー精工製 UD−200を用い、レベル5〜10に設定して、超音波を照射した。以下、株式会社トミー精工製 UD−200を用いて、レベル5〜10に設定し超音波を照射することを、単にプローブ型ソニケータで超音波を照射すると称する。
【0136】
その後、1次エマルションを、0.1%PVAを含むPBS300mlに加えて2次溶液を調製した。次に、2次溶液にバス型ソニケータで3分間超音波を照射し、90秒間スパチュラで激しく攪拌し、さらに、プローブ型ソニケータで90秒間超音波を照射して2次エマルションを調製した。本実施例において、バス型ソニケータとして、株式会社エスエヌディ製 US−2を用い、レベル5に設定して超音波を照射した。以下、株式会社エスエヌディ製 US−2を用いて、レベル5に設定し超音波を照射することを、単にバス型ソニケータで超音波を照射すると称する。
【0137】
そして、2次エマルションを、0.1%PVAを含むPBS300mlにさらに加え、液中乾燥を行うことにより、クロロホルムを除去した懸濁液を得た。その後、懸濁液を20000rpmで10分間遠心分離し、BSAを内包する生分解性ナノスフェアを含む沈殿を得た。そして、かかる沈殿を超純水で洗浄した。この、遠心分離および洗浄からなる操作を数回繰り返した後、沈殿を凍結乾燥して水を除去することで、BSAを内包する生分解性ナノスフェアを得た。
【0138】
(評価)
BSAを内包する生分解性ナノスフェアの形状および粒径を、走査型電子顕微鏡(SEM:Scanning Electron Microscope)を用いて検討した。走査型電子顕微鏡試料台にカーボン両面テープを貼り付け、その上に凍結乾燥後のBSAを内包する生分解性ナノスフェアを載置し、200Åの金蒸着を行うことにより、走査型電子顕微鏡の試料を作成した。BSAを内包する生分解性ナノスフェア粒径は無作為に選択したBSAを内包する生分解性ナノスフェアの粒径を測定することにより求めた。
【0139】
図5は、BSAを内包する生分解性ナノスフェアを走査型電子顕微鏡で観察した結果を説明するための説明図である。図5に示すように、BSAを内包する生分解性ナノスフェアの粒径は、約150nm〜約800nmであった。また、比較的凝集も抑えられており微粒子表面も、平滑なものが得られた。
【0140】
ナノスフェアの粒径が約150nm〜約800nmと小さいため、親水性物質もしくは疎水性物質のいずれか一方または両方を内包した生分解性ナノスフェアを、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0141】
次に、生分解性ナノスフェアのBSA内包率およびBSAの回収率を測定した。まず、サンプル管を6個用意し、そのうち5個のサンプル管には内包物なしの空の生分解性ナノスフェアを、残りの1個のサンプル管には内包率が未知である、BSAを内包した生分解性ナノスフェアを、それぞれ20mg入れた。
【0142】
空の生分解性ナノスフェアを入れた5個のサンプル管には、それぞれBSAの濃度が0、0.3、0.5、0.7、0.9mg/mlとなるように、BSA含有1N水酸化ナトリウム水溶液を3mlずつ入れ、BSAを内包した生分解性ナノスフェアを入れたサンプル管には、1N水酸化ナトリウム水溶液を3ml入れた。
【0143】
上記6個のサンプル管にキャップをして約2日間スターラーで攪拌した。2日後、溶液が透明になり、生分解性ナノスフェアが分解されたのを目視で確認した後、それぞれの溶液を、ディスポーサブルフィルターを用いて濾過した。BSAの濃度が0mg/mlの空の生分解性ナノスフェアを分解した溶液をバックグラウンドとし、波長290nmの吸光度を測定して、検量線を作成した。そして、BSAを内包した生分解性ナノスフェアを分解した溶液の吸光度を測定し、作成した検量線より、生分解性ナノスフェアに内包されたBSAの定量(内包率の測定)を行った。
【0144】
図6は、実施例における内包率、回収率、収率および内包効率を算出する式を説明するための説明図である。ここで内包率は、得られた単位重量あたりのナノスフェアに対する内包された物質(本実施例では、親水性物質)の重量の比率(%)であり、回収率は、用いられた内包される物質(本実施例では、親水性物質)に対する回収された内包される物質(本実施例では、親水性物質)の比率(%)であり、収率は、ナノスフェアの構成成分として用いられた内包される物質(本実施例では、親水性物質)、両親媒性ポリマー、疎水性ポリマーおよび親水性ポリマーの重量に対する回収されたナノスフェアの重量の比率(%)であり、内包効率は、用いられた内包される物質(本実施例では、親水性物質)と用いられたポリマーの合計との割合に対する、内包される親水性物質もしくは疎水性物質のいずれか一方または両方と回収したナノスフェア中のポリマーとの割合、の比を百分率(%)で示す。
【0145】
図6に示す、内包率を算出する式を用いて、実施例1の生分解性ナノスフェアのBSAの内包率を算出すると、2.9%となった。
【0146】
また、懸濁液を20000rpmで10分間遠心分離した結果、得られた上澄におけるBSAの濃度から、図6に示す、回収率を算出する式を用いて、実施例1におけるBSAの回収率を求めた。その結果、実施例1におけるBSAの回収率は、91.0%となった。
【0147】
BSAの回収率が90%以上と高いことから、医薬品等の高価な物質を内包させる場合であっても、好適に医薬品等の高価な物質を回収することができる。したがって、回収した物質を再利用することができ、薬価の不要な上昇を抑えることが可能となる。
【0148】
(実施例2)
本実施例では、両親媒性ポリマーとして数平均分子量3000のポリエチレングリコールとL−乳酸のジブロック共重合体(以下、単に、PEG3K−b−PLLAと称する)を、疎水性ポリマーとして、PLGAを、親水性ポリマーとしてPVAを、内包する物質は、親水性物質および疎水性物質の機能を備える両親媒性物質としてスフィンゴミエリンを用いた。
【0149】
図7は、実施例2にかかるPEG3K−b−PLLAの合成方法を説明するための説明図である。
【0150】
図7に示すように、まず、L−ラクチド、MeO−PEG3K、2−エチルヘキサン酸スズをそれぞれ秤量し、ナス型フラスコにいれ、攪拌子もいれて減圧乾燥を行った。乾燥後、ナス型フラスコを150℃のoil bathに浸漬して内容物を溶融させ、ナス型フラスコを130℃のoil bathに12時間浸漬することで開環重合反応を行った。反応後,反応物を少量のクロロホルムに溶解させ、大量のエーテルにより再沈殿を行った。これを遠心分離にかけ、沈殿物を減圧乾燥することでPEG3K−b−PLLAを得た。
【0151】
図8は、実施例2を説明するための説明図である。図8に示すように、試験管に、PEG3K−b−PLLA20mgおよび重量平均分子量が5000〜75000であるPLGA180mgを入れ、クロロホルム2.5mlに溶解させた。続いて、スフィンゴミエリン5mgを試験管に加え1次溶液を生成した。次に、1次溶液をスパチュラで激しく撹拌しながらプローブ型ソニケータで3分間超音波を照射し、1次エマルションを調製した。
【0152】
その後、1次エマルションを、0.1%PVAを含むPBS300mlに加えて2次溶液を調製した。次に、2次溶液にバス型ソニケータで3分間超音波を照射し、90秒間スパチュラで激しく攪拌し、さらに、プローブ型ソニケータで90秒間超音波を照射して2次エマルションを調製した。
【0153】
そして、2次エマルションを、0.1%PVAを含むPBS300mlにさらに加え、液中乾燥を行うことにより、クロロホルムを除去した懸濁液を得た。その後、懸濁液を20000rpmで10分間遠心分離し、両親媒性物質としてのスフィンゴミエリンを内包する生分解性ナノスフェアを含む沈殿を得た。そして、かかる沈殿を超純水で洗浄した。この、遠心分離および洗浄からなる操作を数回繰り返した後、沈殿を凍結乾燥して水を除去することで、スフィンゴミエリンを内包する生分解性ナノスフェアを得た。
【0154】
(評価)
スフィンゴミエリンを内包する生分解性ナノスフェアの形状および粒径を、走査型電子顕微鏡を用いて検討した。走査型電子顕微鏡の試料の作成方法は、上述した実施例1の作成方法と同一であるため説明を省略する。
【0155】
図9は、スフィンゴミエリンを内包する生分解性ナノスフェアを、走査型電子顕微鏡で観察した結果を説明するための説明図である。図9に示すように、スフィンゴミエリンを内包する生分解性ナノスフェアの粒径は、比較的凝集も抑えられており微粒子表面も、平滑なものが得られた。
【0156】
また、懸濁液を20000rpmで10分間遠心分離した結果、得られた上澄におけるスフィンゴミエリンの濃度から、図6に示す、収率を算出する式を用いて、実施例2におけるスフィンゴミエリンの収率を求めた。その結果、実施例2におけるスフィンゴミエリンの収率は、53.7%となった。
【0157】
実施例2において、親水性物質だけでなく、親水性物質および疎水性物質の機能を備える両親媒性物質のスフィンゴミエリンを内包したナノスフェアを製造することができた。したがって、親水性物質だけでなく、親水性物質および疎水性物質を内包するナノスフェアを製造することが可能となった。また、スフィンゴミエリンを内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0158】
また、スフィンゴミエリンのセラミドに基づく保湿効果により、スフィンゴミエリンを内包するナノスフェアを含有する皮膚外用組成物または化粧料を製造すれば、皮膚外用組成物または化粧料を皮膚表面の微細な凹凸にナノスフェアを略均一に塗布することができるため、皮膚外用組成物または化粧料が有する保湿効果を満遍なく皮膚に与えることが可能となる。また、上述したようにナノスフェアを構成するポリマーに生分解性ポリマーを用いる構成により、スフィンゴミエリンを皮膚表面で好適に徐放させることができ、従来と比較して皮膚外用組成物または化粧料の塗布回数を減らしても同程度の保湿効果を得ることが可能となる。
【0159】
(実施例3)
本実施例では、両親媒性ポリマーとしてDex−g−PLLAを、親水性ポリマーとしてPVAを、内包する物質は、親水性物質および疎水性物質の混合物としてステビア発酵エキス(stevia ferment extract)を用い、疎水性ポリマーは使用しなかった。
【0160】
図10は、実施例3にかかるDex−g−PLLAの合成方法を説明するための説明図である。
【0161】
図10(a)に示すように、まず、トリメチルシリル(TMS)化デキストラン(TMSDex)を合成した。合成前日にデキストランの減圧乾燥を行った。アルゴンで満たして常圧に戻し、デキストランを取り出した。デキストランをホルムアミドに溶解させ、80℃に加熱し、ヘキサメチルジシラザンを攪拌しながら注いだ。
【0162】
2時間後分液漏斗を用い抽出し、濃縮して、さらに減圧乾燥した。生成物をクロロホルムに溶解させ、メタノールを貧溶媒とした再沈殿を行い精製した。沈殿物は超遠心分離を行い回収し、減圧乾燥した。
【0163】
図10(b)に示すように、まず、合成前日にL−ラクチドと図10(a)で得られたTMSDexの減圧乾燥をそれぞれ行なった。L−ラクチドはクライゼンフラスコに秤量し、常温で直引減圧乾燥した。水酸基をカリウムナフタレンによりアルコキシド化し、これを開始剤としてラクチドの溶液系アニオン開環重合を行った。
【0164】
次に、TMS基の脱保護を行った。TMSDex−g−PLLAを、DMSO(Dimethylsulfoxide)を加えてスターラーで攪拌し溶解した。TMSDex−g−PLLAが完全に溶解したことを確認してからメタノールを加えた。そして、酢酸を加え4時間攪拌した。4時間後、メタノールを貧溶媒とした再沈殿を行ない、超遠心分離を行い、沈殿を回収し、デシケータ内で減圧乾燥した。さらなる精製は糖含有率により、良溶媒にDMSOまたはクロロホルム、貧溶媒にメタノールを用いた再沈殿により行なった。これを数回繰り返し、Dex−g−PLLAを得た。
【0165】
図11は、実施例3にかかるDex−g−PLLAの分解性を説明するための説明図であり、図12は、分解性実験に用いたDex−g−PLLAを説明するための説明図である。ここでは、クロロホルムを用いたキャスト法で作成したDex−g−PLLAフィルムおよびPLLAフィルムの質量を電子天秤で量り、PBSに浸漬して37℃でインキュベートし、1日後、2日後、4日後、7日後、14日後、28日後に取り出し、水分を減圧乾燥により除去した後の質量を測定した。分解前のフィルムの重さと分解後のフィルムの重さから、図11(a)に示す式を用いてフィルムの重量減少率を求めた。また、取り出したサンプルの一部をDMFで溶解し、GPCを用いた分子量分布測定を行い数平均分子量の減少について検討した。分解前のDex−g−PLLAの数平均分子量と分解後のDex−g−PLLAの数平均分子量から、図11(c)に示す式を用いてDex−g−PLLAの分子量減少率を求めた。
【0166】
図11(b)に示すように、PLLAと比較して、Dex−g−PLLAは、フィルムの重量減少率が高い。また、Dex−g−PLLAにおけるL−ラクチドの重合度が低い方が、フィルムの重量減少率が高くなった。
【0167】
また、図11(d)に示すように、PLLAと比較して、Dex−g−PLLAは、分子量減少率が低い。また、Dex−g−PLLAにおける糖含有率が高い方が、分子量減少率が高い。したがって、両親媒性ポリマーとして、Dex−g−PLLAにおけるL−ラクチドの重合度または糖含有率を調節することで、生分解性ナノスフェアを生体内に留置した場合に、分解に伴う炎症反応等を起こさない分解速度であり、かつ、生体内で必要とされる期間の経過後には生体内から消失している生分解速度に調節することができる。
【0168】
図13は、実施例3を説明するための説明図である。図13に示すように、試験管に、Dex−g−PLLAであるG45−12−20またはG80−9−16を、200mgを入れ、クロロホルム(CHCl3)2.4mlに溶解させた。続いて、ステビア発酵エキス5mgを試験管に加え1次溶液を生成した。次に、1次溶液をスパチュラで激しく撹拌しながらバス型ソニケータで5分間超音波を照射し、1次エマルションを調製した。
【0169】
その後、1次エマルションを、0.1%PVAを含むPBS300mlに加えて2次溶液を調製した。次に、2次溶液にプローブ型ソニケータで3分間超音波を照射して2次エマルションを調製した。
【0170】
そして、2次エマルションを、0.1%PVAを含むPBS300mlにさらに加え、液中乾燥を行うことにより、クロロホルムを除去した懸濁液を得た。その後、懸濁液を20000rpmで10分間遠心分離し、ステビア発酵エキスを内包する生分解性ナノスフェアを含む沈殿を得た。そして、かかる沈殿を超純水で洗浄した。この、遠心分離および洗浄からなる操作を数回繰り返した後、沈殿を凍結乾燥して水を除去することで、ステビア発酵エキスを内包する生分解性ナノスフェアを得た。
【0171】
(評価)
ステビア発酵エキスを内包する生分解性ナノスフェアの形状および粒径を、走査型電子顕微鏡を用いて検討した。走査型電子顕微鏡の試料の作成方法は、上述した実施例1の作成方法と同一であるため説明を省略する。
【0172】
図14は、ステビア発酵エキスを内包する生分解性ナノスフェアを、走査型電子顕微鏡で観察した結果を説明するための説明図である。図14に示すように、ステビア発酵エキスを内包する生分解性ナノスフェアの粒径は、比較的凝集も抑えられており微粒子表面も、平滑なものが得られた。
【0173】
また、懸濁液を20000rpmで10分間遠心分離した結果、得られた上澄におけるステビア発酵エキスの濃度から、図6に示す、収率を算出する式を用いて、実施例3におけるステビア発酵エキスの収率を求めた。その結果、実施例3におけるステビア発酵エキスの収率は、G45−12−20で65.8%、G80−9−16で63.7%となった。
【0174】
実施例3において、親水性物質だけでなく、親水性物質および疎水性物質の混合物であるステビア発酵エキスを内包したナノスフェアを製造することができた。したがって、親水性物質だけでなく、親水性物質および疎水性物質の混合物を内包するナノスフェアを製造することが可能となった。また、ステビア発酵エキスを内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0175】
また、ステビア発酵エキスの回収率が60%以上と高いことから、医薬品や、皮膚外用組成物、化粧料、に利用される有効物質等の高価な物質を内包させる場合であっても、好適に有効成分等の高価な物質を回収することができる。したがって、回収した物質を再利用することができ、薬価の不要な上昇を抑えることが可能となる。
【0176】
また、ステビア発酵エキスは、保湿効果が高く、荒れ肌を改善したり、かゆみを抑止したり、炎症を抑えたり、抗ヒスタミン作用を有したりする。したがって、ステビア発酵エキスを内包するナノスフェアを含有する皮膚外用組成物または化粧料を製造すれば、皮膚表面の微細な凹凸にステビア発酵エキスを略均一に行き渡らせることができ、ステビア発酵エキスの保湿効果、荒れ肌改善効果、かゆみ抑止効果、炎症抑止効果および抗ヒスタミン効果を皮膚表面に満遍なく塗布することが可能となる。
【0177】
(実施例4)
本実施例では、両親媒性ポリマーとしてDex−g−PLLAを、疎水性ポリマーとしてEtO−PLLAを、親水性ポリマーとしてPVAを、内包する親水性物質としてBSAを用いた。
【0178】
図15は、実施例4を説明するための説明図である。図15に示すように、試験管に、EtO−PLLAを170mg、Dex−g−PLLAであるG71−13−13(図13(b)参照)を、30mgを入れ、塩化メチレン(CH2Cl2)2.4mlに溶解させた。続いて、BSA5mgを溶解させたPBS100μlを試験管に加え1次溶液を生成した。次に、1次溶液をスパチュラで激しく撹拌しながら、バス型ソニケータで5分間、プローブ型ソニケータで1.5分間超音波を照射し、1次エマルションを調製した。
【0179】
その後、1次エマルション800μlを、0.1%PVAを含むPBS5mlに加えて2次溶液を調製した。次に、2次溶液にプローブ型ソニケータで1.5分間超音波を照射して2次エマルションを調製した。
【0180】
そして、2次エマルションを、0.1%PVAを含むPBS200mlに加え、1時間攪拌し,約40℃で2時間液中乾燥することにより塩化メチレンを除去した懸濁液を得た。その後、懸濁液を20000rpmで10分間遠心分離し、BSAを内包する生分解性ナノスフェアを含む沈殿を得た。かかる沈殿を超純水で洗浄した。この、遠心分離および洗浄からなる操作を数回繰り返した後、沈殿を凍結乾燥して水を除去することで、BSAを内包する生分解性ナノスフェアを得た。
【0181】
(評価)
BSAを内包する生分解性ナノスフェアの形状および粒径を、走査型電子顕微鏡を用いて検討した。走査型電子顕微鏡の試料の作成方法は、上述した実施例1の作成方法と同一であるため説明を省略する。
【0182】
図16は、BSAを内包する生分解性ナノスフェアを、走査型電子顕微鏡で観察した結果を説明するための説明図である。図16に示すように、BSAを内包する生分解性ナノスフェアの粒径は、約400nm〜約600nmであった。また、比較的凝集も抑えられており微粒子表面も、平滑なものが得られた。
【0183】
実施例4におけるナノスフェアの粒径が約400nm〜約600nmと小さいため、親水性物質を内包した生分解性ナノスフェアを、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0184】
次に、生分解性ナノスフェアのBSA内包率およびBSAの回収率を測定した。まず、サンプル管を6個用意し、そのうち5個のサンプル管には内包物なしの空の生分解性ナノスフェアを、残りの1個のサンプル管には内包率が未知である、BSAを内包した生分解性ナノスフェアを、それぞれ20mg入れた。
【0185】
空の生分解性ナノスフェアを入れた5個のサンプル管には、それぞれBSAの濃度が0、0.1、0.15、0.23、0.3mg/mlとなるように、BSA含有1N水酸化ナトリウム水溶液を3mlずつ入れ、BSAを内包した生分解性ナノスフェアを入れたサンプル管には、1N水酸化ナトリウム水溶液を3ml入れた。
【0186】
上記6個のサンプル管にキャップをして約2日間スターラーで攪拌した。2日後、溶液が透明になり、生分解性ナノスフェアが分解されたのを目視で確認した後、それぞれの溶液を、ディスポーサブルフィルターを用いて濾過した。BSAの濃度が0mg/mlの空の生分解性ナノスフェアを分解した溶液をバックグラウンドとし、波長291nmの吸光度を測定して、検量線を作成した。そして、BSAを内包した生分解性ナノスフェアを分解した溶液の吸光度を測定し、作成した検量線より、生分解性ナノスフェアに内包されたBSAの定量(内包率の測定)を行った。
【0187】
図6に示す、内包効率を算出する式を用いて、実施例4の生分解性ナノスフェアのBSAの内包効率を算出すると、52.9%となった。
【0188】
また、懸濁液を20000rpmで10分間遠心分離した結果、得られた上澄におけるBSAの濃度から、図6に示す、回収率を算出する式を用いて、実施例4におけるBSAの回収率を求めた。その結果、実施例4におけるBSAの回収率は、82.7%となった。
【0189】
BSAの回収率が80%以上と高いことから、医薬品や、皮膚外用組成物、化粧料、に利用される有効成分等の高価な物質を内包させる場合であっても、好適に有効成分等の高価な物質を回収することができる。したがって、回収した物質を再利用することができ、薬価の不要な上昇を抑えることが可能となる。
【0190】
以上、添付図面を参照しながら本発明の好適な実施形態について説明したが、本発明はかかる実施形態に限定されないことは言うまでもない。当業者であれば、特許請求の範囲に記載された範疇内において、各種の変更例または修正例に想到し得ることは明らかであり、それらについても当然に本発明の技術的範囲に属するものと了解される。
【0191】
なお、本明細書のナノスフェアの製造方法における各工程は、必ずしもフローチャートとして記載された順序に沿って時系列に処理する必要はなく、並列的あるいはサブルーチンによる処理を含んでもよい。
【産業上の利用可能性】
【0192】
本発明は、例えば、タンパク質、核酸、薬物、造影剤等の親水性物質、もしくは、脂質、薬物等の疎水性物質のいずれか一方または両方を内包できるナノスフェアの製造方法、ナノスフェア、これを含有する皮膚外用組成物および化粧料に利用することができる。
【符号の説明】
【0193】
S100 …1次溶液生成ステップ
S102 …1次エマルション生成ステップ
S104 …2次溶液生成ステップ
S106 …2次エマルション生成ステップ
S108 …有機溶媒除去ステップ
【技術分野】
【0001】
本発明は、例えば、タンパク質、核酸、薬物、造影剤等の親水性物質、もしくは、脂質、薬物等の疎水性物質のいずれか一方または両方を内包できるナノスフェアの製造方法、ナノスフェア、これを含有する皮膚外用組成物および化粧料に関する。
【背景技術】
【0002】
一般に病気の治療においては、「必要なときに、必要な量の薬物を、必要な病巣に選択的に送り届ける」ことが理想的であると言われている。従来の飲み薬等は、体内の目的場所(病巣)に到達する過程において、ほとんどの成分が変化してしまい、投与量と比較して、目的場所に到達する量はわずかであるという課題があった。
【0003】
そこで、生分解性ポリマー等で薬物を内包した高分子微粒子を投与することにより、薬物を変化させることなく目的場所に到達させる、所謂ドラッグ・デリバリー・システム(Drug Delivery System:以下単にDDSと称する)が注目を集めている。
【0004】
さらに、生分解性ポリマー等で薬物を内包した高分子微粒子を投与して、所定量の薬物を長時間にわたって放出させることで、患者のQOL(Quality Of Life)を高めることができる薬物徐放型DDSも脚光を浴びている。
【0005】
薬物徐放型DDS製剤に利用される、生分解性ポリマーを用いた高分子微粒子として、粒子径0.1μm程度〜数100μmと幅広い範囲の粒子径の高分子微粒子(マイクロスフェア、またはマイクロパーティクル)が報告されている。例えば、特許文献1には、ポリ乳酸やポリ乳酸共重合体で酢酸リュープロレリンを内包したマイクロスフェアが開示され、かかる酢酸リュープロレリンを内包したマイクロスフェアは皮下注射用製剤として実用化されている。
【0006】
一方、近年では、ホルモンや成長因子等のタンパク質やDNA、RNA等の核酸、生理活性を有する天然抽出物等の水溶性高分子の薬物としての利用が、ますます重要になっている。そこで、水溶性高分子の薬物を内包する高分子微粒子を利用した薬物徐放型DDS製剤が要求されている。
【0007】
特許文献1に記載のポリ乳酸やポリ乳酸共重合体を用いて水溶性高分子を内包する場合、ポリ乳酸やポリ乳酸共重合体(以下、単に疎水性生分解性ポリマーと称する)は疎水性であるため、W/O/W(Water in Oil in Water)エマルション法等が利用される。しかし、疎水性生分解性ポリマーを用いて水溶性高分子を内包するマイクロスフェアを製造すると、マイクロスフェアの内部における水溶性高分子の分布の均一性が低くなり、薬物徐放型DDS製剤とした場合における水溶性高分子の効力持続性(徐放化)が不十分であった。また、水溶性高分子がタンパク質や核酸である場合、マイクロスフェアを製造する過程で、立体構造が維持できなくなったり、変性してしまったりして、失活してしまうこともあった。
【0008】
そこで、生分解性ポリマーとして両親媒性を有するポリ乳酸グラフト化デキストランを用いることにより、W/O/Wエマルション法で、水溶性高分子を内包するマイクロスフェアが製造可能な技術が開示されている(非特許文献1)。非特許文献1に記載のマイクロスフェアは、水溶性高分子としてウシ血清アルブミン(Bovine Serum Albumin:以下、単にBSAと称する)を内包している。かかるマイクロスフェアは、BSAがマイクロスフェアの内部で略均一に分布しており、BSAの高次構造および活性も維持されているため、薬物徐放型DDS製剤として十分な徐放化を達成することが可能となる。
【0009】
しかし、非特許文献1に記載の水溶性高分子を内包する高分子微粒子は、スフェア粒径がマイクロメートルオーダーと大きいため、すなわちマイクロスフェアとなるため、静脈または動脈注射、経皮吸収には適していない。
【0010】
静脈または動脈注射や経皮吸収に適したナノメートルオーダーの高分子微粒子(ナノスフェア)を製造する技術として、O/W(Oil in Water)エマルション法を利用する技術が開示されている。例えば、非特許文献2には、O/Wエマルション法でポリ乳酸グラフト化デキストランを用いてナノスフェアを製造する技術が、非特許文献3には、O/Wエマルション法で両親媒性のブロック共重合体を用いてナノスフェアを製造する技術が開示されている。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開平10−182496号公報
【非特許文献】
【0012】
【非特許文献1】Ouchi T, Saito T, Kontani T, Ohya Y, Macromol Biosci. 2004 Apr 19;4(4):458-463
【非特許文献2】Nouvel C, Raynaud J, Marie E, Dellacherie E, Six JL, Durand A, J Colloid Interface Sci. 2009 Feb 15; 330(2):337-343
【非特許文献3】Ouchi T, Toyohara M, Arimura H, Ohya Y,Biomacromolecules. 2002 Sep-Oct; 3(5):885-888
【発明の概要】
【発明が解決しようとする課題】
【0013】
しかし、上述した非特許文献2および3に記載された、O/Wエマルション法を利用した場合、ナノスフェアを製造できるものの、疎水性物質しか内包できない、すなわち水溶性高分子を内包することができないといった問題点がある。
【0014】
上述したように、水溶性高分子の内包と、高分子微粒子の粒径の微細化との両立を成し得た例はなく、水溶性高分子を内包し、かつ、ナノメートルオーダーの高分子微粒子の開発が望まれている。
【0015】
そこで本発明は、このような課題に鑑み、水溶性高分子等の親水性物質もしくは疎水性物質のいずれか一方または両方を内包し、かつ粒径がナノオーダーである高分子微粒子を製造することができるナノスフェアの製造方法、ナノスフェア、これを含有する皮膚外用組成物および化粧料を提供することを目的とする。
【課題を解決するための手段】
【0016】
本発明の一例であるW/O/Wエマルション法を用いた、ナノスフェアの製造方法は、親水性物質を溶解した水系溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、1次溶液に超音波を照射して1次エマルションを生成する1次エマルション生成ステップと、1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、2次溶液に超音波を照射して2次エマルションを生成する2次エマルション生成ステップと、を含む。当該ナノスフェアは親水性物質を内包する。
【0017】
疎水性ポリマーおよび親水性物質に両親媒性ポリマーを添加した1次溶液に超音波を照射して生成した1次エマルションに親水性ポリマーを添加した2次溶液に、超音波を照射する構成により、凝集を抑制しつつ、親水性物質を内包するW/O/Wエマルションの高分子微粒子をナノメートルオーダーで製造することが可能となる。
【0018】
したがって、両親媒性ポリマー、疎水性ポリマーおよび親水性ポリマーに生分解性ポリマーを用いれば、タンパク質や核酸、生理活性を有する天然抽出物等の水溶性(親水性)高分子の薬物を内包する薬物徐放型DDS製剤等の医薬品や親水性の有効物質を内包する徐放型の化粧料を製造することができる。また、親水性物質を内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0019】
他のW/O/Wエマルション法を用いた、ナノスフェアの製造方法は、親水性物質を溶解した水系溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、1次溶液に超音波を照射して1次エマルションを生成する1次エマルション生成ステップと、1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、2次溶液に超音波を照射して2次エマルションを生成する2次エマルション生成ステップと、を含む。当該ナノスフェアは、親水性物質を内包する。
【0020】
ここでは、両親媒性ポリマーと親水性物質を含む1次溶液に超音波を照射して生成した1次エマルションに親水性ポリマーを添加した2次溶液に、超音波を照射する構成により、凝集を抑制しつつ、親水性物質を内包するW/O/Wエマルションの高分子微粒子をナノメートルオーダーで製造することが可能となる。
【0021】
したがって、両親媒性ポリマーおよび親水性ポリマーに生分解性ポリマーを用いれば、タンパク質や核酸、生理活性を有する天然抽出物等の水溶性(親水性)高分子の薬物を内包する医薬品や親水性の有効物質を内包する徐放型の化粧料を製造することができる。また、親水性物質を内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0022】
さらに他のO/Wエマルション法を用いた、ナノスフェアの製造方法は、疎水性物質を溶解した水非混和性有機溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、1次溶液に、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、2次溶液に超音波を照射してエマルションを生成するエマルション生成ステップと、を含む。当該ナノスフェアは、疎水性物質を内包する。
【0023】
ここでは、疎水性ポリマーおよび疎水性物質に両親媒性ポリマーを添加した1次溶液に親水性ポリマーをさらに添加した2次溶液に、超音波を照射する構成により、凝集を抑制しつつ、疎水性物質を内包する高分子微粒子をナノメートルオーダーで製造することが可能となる。
【0024】
したがって、両親媒性ポリマー、疎水性ポリマーおよび親水性ポリマーに生分解性ポリマーを用いれば、脂質や、生理活性を有する天然抽出物等の疎水性の高分子の薬物を内包する薬物徐放型DDS製剤等の医薬品や疎水性の有効物質を内包する徐放型の化粧料を製造することができる。また、疎水性物質を内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0025】
さらに他のO/Wエマルション法を用いた、ナノスフェアの製造方法は、疎水性物質を溶解した水非混和性有機溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、1次溶液に、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、2次溶液に超音波を照射してエマルションを生成するエマルション生成ステップと、を含む。当該ナノスフェアは、疎水性物質を内包する。
【0026】
ここでは、両親媒性ポリマーと疎水性物質を含む1次溶液に親水性ポリマーをさらに添加した2次溶液に、超音波を照射する構成により、凝集を抑制しつつ、疎水性物質を内包する高分子微粒子をナノメートルオーダーで製造することが可能となる。
【0027】
したがって、両親媒性ポリマーおよび親水性ポリマーに生分解性ポリマーを用いれば、脂質や、生理活性を有する天然抽出物等の疎水性の高分子の薬物を内包する医薬品や疎水性の有効物質を内包する徐放型の化粧料を製造することができる。また、疎水性物質を内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0028】
さらに他のW/O/Wエマルション法を用いた、ナノスフェアの製造方法は、親水性物質を溶解した水系溶媒と、疎水性物質を溶解した水非混和性有機溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、1次溶液に超音波を照射して1次エマルションを生成する1次エマルション生成ステップと、1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、2次溶液に超音波を照射して2次エマルションを生成する2次エマルション生成ステップと、を含む。当該ナノスフェアは、親水性物質および疎水性物質を内包する。
【0029】
疎水性ポリマー、親水性物質および疎水性物質に両親媒性ポリマーを添加した1次溶液に超音波を照射して生成した1次エマルションに親水性ポリマーを添加した2次溶液に、超音波を照射する構成により、凝集を抑制しつつ、親水性物質および疎水性物質を内包する高分子微粒子をナノメートルオーダーで製造することが可能となる。
【0030】
したがって、両親媒性ポリマー、疎水性ポリマーおよび親水性ポリマーに生分解性ポリマーを用いれば、タンパク質や核酸、生理活性を有する天然抽出物等の水溶性(親水性)高分子の薬物、および、脂質や生理活性を有する天然抽出物等の疎水性の高分子を内包する薬物徐放型DDS製剤等の医薬品や、親水性および疎水性の有効物質を内包する徐放型の化粧料を製造することができる。また、親水性物質および疎水性物質を内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0031】
さらに他のW/O/Wエマルション法を用いた、ナノスフェアの製造方法は、親水性物質を溶解した水系溶媒と、疎水性物質を溶解した水非混和性有機溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、1次溶液に超音波を照射して1次エマルションを生成する1次エマルション生成ステップと、1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、2次溶液に超音波を照射して2次エマルションを生成する2次エマルション生成ステップと、を含む。当該ナノスフェアは、親水性物質および疎水性物質を内包する。
【0032】
ここでは、両親媒性ポリマーと親水性物質および疎水性物質を含む1次溶液に超音波を照射して生成した1次エマルションに親水性ポリマーを添加した2次溶液に、超音波を照射する構成により、凝集を抑制しつつ、親水性物質および疎水性物質を内包する高分子微粒子をナノメートルオーダーで製造することが可能となる。
【0033】
したがって、両親媒性ポリマーおよび親水性ポリマーに生分解性ポリマーを用いれば、タンパク質や核酸、生理活性を有する天然抽出物等の水溶性(親水性)高分子の薬物、および、脂質や生理活性を有する天然抽出物等の疎水性の高分子を内包する医薬品や、親水性および疎水性の有効物質を内包する徐放型の化粧料を製造することができる。また、親水性物質および疎水性物質を内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0034】
両親媒性ポリマーは、親水性セグメントと疎水性セグメントとで構成される共重合体であり、親水性セグメントは、電荷を有するアミノ酸を3個以上有するポリペプチド、数平均分子量500〜100000であるポリエチレングリコール、および、多糖、の群から選択される1または複数を含み、疎水性セグメントは、生分解性ポリエステルを含んでもよい。
【0035】
両親媒性ポリマーとして、電荷を有するアミノ酸を3個以上有するポリペプチド、数平均分子量500〜100000であるポリエチレングリコール、および多糖、の群から選択される1または複数と、生分解性ポリエステルとで構成される共重合体を用いることにより、親水性物質もしくは疎水性物質のいずれか一方または両方を内包する生分解性のナノスフェアを製造することができる。
【0036】
ポリペプチドを構成するアミノ酸は、正電荷を有するアミノ酸であるリジン、アルギニンおよびヒスチジンの群および負電荷を有するアミノ酸であるアスパラギン酸およびグルタミン酸の群から選択される1または複数のアミノ酸であってもよい。
【0037】
両親媒性ポリマーを構成するポリペプチドのアミノ酸を、リジン、アルギニン、ヒスチジン、アスパラギン酸、グルタミン酸の群から選択される1または複数のアミノ酸といったタンパク質を構成するアミノ酸とする構成により、医薬品や化粧料を製造する際に、生体適合性を向上させることができる。また、両親媒性ポリマーを構成するポリペプチドのアミノ酸を、タンパク質を構成するアミノ酸とすることにより、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを血中に導入した場合に、マクロファージなどの貪食細胞に異物として捕捉される可能性を低減させることができ、血中の循環時間を延長させることが可能となる。
【0038】
また、両親媒性ポリマーにポリエチレングリコールを含ませる構成により、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを血中に導入した場合に、マクロファージなどの貪食細胞に異物として捕捉される可能性を低減させることができ、血中の循環時間を延長させることが可能となる。
【0039】
両親媒性ポリマーを構成する多糖は、ヒアルロン酸、アミロース、プルラン、コンドロイチン、コンドロイチン硫酸、デキストラン、デキストラン硫酸、デルマタン硫酸、ケラタン硫酸、ヘパラン硫酸、キチン、キトサン、および、βグルカン、の群から選択される1または複数であってもよい。また、両親媒性ポリマーにおける多糖の含有量が1〜50質量%であってもよい。
【0040】
両親媒性ポリマーとして、多糖と、生分解性ポリエステルとで構成される共重合体を用いることにより、親水性物質もしくは疎水性物質のいずれか一方または両方を内包する生分解性のナノスフェアを製造することができる。
【0041】
生分解性ポリエステルの構成単位は、乳酸、グリコール酸、および、アミノ酸、の群から選択される1または複数であってもよい。
【0042】
生分解性ポリエステルを生体由来材料である乳酸やアミノ酸、またはグリコール酸で構成することにより、医薬品や化粧料を製造する際に、生体適合性を向上させることができる。
【0043】
上記ナノスフェアの製造方法を用いて製造されるナノスフェアが提供される。ここで、ナノスフェアは、親水性物質もしくは疎水性物質のいずれか一方または両方として、ステビア発酵エキスまたはスフィンゴミエリンを内包してもよい。
【0044】
上記ナノスフェアの製造方法を用いて製造されたナノスフェアを含有する皮膚外用組成物が提供される。ここで、皮膚外用組成物は、ヒトの皮膚に接触させることにより、皮膚外用組成物に含まれる物質を経皮吸収させるものである。
【0045】
皮膚外用組成物として、上記ナノスフェアの製造方法を用いて製造された親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを含有する構成により、塗り薬等の皮膚外用組成物を皮膚表面の微細な凹凸にナノスフェアを略均一に塗布することができる。また、上述したようにナノスフェアを構成するポリマーに生分解性ポリマーを用いる構成により、ナノスフェアに内包させた親水性物質もしくは疎水性物質のいずれか一方または両方を皮膚表面で好適に徐放させることができ、従来と比較して、皮膚外用組成物の効果を維持しつつ、塗布する回数を減少させることが可能となる。
【0046】
上記皮膚外用組成物に含有されるナノスフェアは、親水性物質もしくは疎水性物質のいずれか一方または両方として、ステビア発酵エキスまたはスフィンゴミエリンを内包してもよい。ステビア発酵エキスおよびスフィンゴミエリンは、保湿効果が高く、荒れ肌を改善したり、かゆみを抑止したり、炎症を抑えたり、抗ヒスタミン作用を有したりする。したがって、ステビア発酵エキスまたはスフィンゴミエリンを内包させたナノスフェアを含有させた皮膚外用組成物とする構成により、皮膚表面の微細な凹凸にステビア発酵エキスまたはスフィンゴミエリンを略均一に行き渡らせることができる。
【0047】
上記ナノスフェアの製造方法を用いて製造されたナノスフェアを含有する化粧料が提供される。ここで、化粧料は、美化、清潔、保護あるいは、防臭を目的として人体を処置するための組成物である。
【0048】
化粧料として、上記ナノスフェアの製造方法を用いて製造された親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを含有する構成により、化粧料を皮膚表面の微細な凹凸にナノスフェアを略均一に塗布することができる。また、上述したようにナノスフェアを構成するポリマーに生分解性ポリマーを用いる構成により、ナノスフェアに内包させた親水性物質もしくは疎水性物質のいずれか一方または両方を皮膚表面で好適に徐放させることができ、従来と比較して化粧料の塗布回数を減らしても同程度の効果を得ることが可能となる。
【0049】
上記化粧料に含有されるナノスフェアは、親水性物質もしくは疎水性物質のいずれか一方または両方として、ステビア発酵エキスまたはスフィンゴミエリンを内包してもよい。ステビア発酵エキスおよびスフィンゴミエリンは、保湿効果が高く、荒れ肌を改善したり、かゆみを抑止したり、炎症を抑えたり、抗ヒスタミン作用を有したりする。したがって、ステビア発酵エキスまたはスフィンゴミエリンを内包させたナノスフェアを含有させた化粧料とする構成により、皮膚表面の微細な凹凸にステビア発酵エキスまたはスフィンゴミエリンを略均一に行き渡らせることができる。
【0050】
上述したナノスフェアの製造方法の技術的思想に基づく構成要素やその説明は、当該ナノスフェア、これを含有する皮膚外用組成物および化粧料にも適用可能である。
【発明の効果】
【0051】
本発明によれば、水溶性高分子等の親水性物質もしくは疎水性物質のいずれか一方または両方を内包し、かつ粒径がナノオーダーである高分子微粒子を製造することが可能となる。
【図面の簡単な説明】
【0052】
【図1】実施形態にかかるナノスフェアの製造方法を説明するための説明図である。
【図2】実施例1にかかるPLys+−b−PLLAの合成方法を説明するための説明図である。
【図3】実施例1にかかるPLys+−b−PLLAのミセル状態における分解性を説明するための説明図である。
【図4】実施例1を説明するための説明図である。
【図5】BSAを内包する生分解性ナノスフェアを、走査型電子顕微鏡で観察した結果を説明するための説明図である。
【図6】実施例における内包率、回収率、収率および内包効率を算出する式を説明するための説明図である。
【図7】実施例2にかかるPEG3K−b−PLLAの合成方法を説明するための説明図である。
【図8】実施例2を説明するための説明図である。
【図9】スフィンゴミエリンを内包する生分解性ナノスフェアを、走査型電子顕微鏡で観察した結果を説明するための説明図である。
【図10】実施例3にかかるDex−g−PLLAの合成方法を説明するための説明図である。
【図11】実施例3にかかるDex−g−PLLAの分解性を説明するための説明図である。
【図12】分解性実験に用いたDex−g−PLLAを説明するための説明図である。
【図13】、実施例3を説明するための説明図である。
【図14】スフィンゴミエリンを内包する生分解性ナノスフェアを、走査型電子顕微鏡で観察した結果を説明するための説明図である。
【図15】実施例4を説明するための説明図である。
【図16】BSAを内包する生分解性ナノスフェアを、走査型電子顕微鏡で観察した結果を説明するための説明図である。
【発明を実施するための形態】
【0053】
以下に添付図面を参照しながら、本発明の好適な実施形態について詳細に説明する。かかる実施形態に示す寸法、材料、その他具体的な数値などは、発明の理解を容易とするための例示にすぎず、特に断る場合を除き、本発明を限定するものではない。なお、本明細書および図面において、実質的に同一の機能、構成を有する要素については、同一の符号を付することにより重複説明を省略し、また本発明に直接関係のない要素は図示を省略する。
【0054】
(実施形態)
図1は、実施形態にかかるナノスフェアの製造方法を説明するための説明図である。
【0055】
まず、内包する物質を溶解した溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する(S100:1次溶液生成ステップ)。
【0056】
1次溶液生成ステップS100において、内包する物質を親水性物質とする場合、親水性物質を溶解した水系溶媒を、両親媒性ポリマーを溶解した水非混和性有機溶媒と疎水性ポリマーを溶解した水非混和性有機溶媒とに混合し、1次溶液を生成する。
【0057】
また、1次溶液生成ステップS100において、内包する物質を親水性物質および疎水性物質とする場合、親水性物質を溶解した水系溶媒および疎水性物質を溶解した水非混和性有機溶媒を、両親媒性ポリマーを溶解した水非混和性有機溶媒と疎水性ポリマーを溶解した水非混和性有機溶媒とに混合し、1次溶液を生成する。
【0058】
生成した1次溶液に超音波を照射し、逆相エマルション(W/Oエマルション)である1次エマルションを生成する(S102:1次エマルション生成ステップ)。そして、1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する(S104:2次溶液生成ステップ)。生成した2次溶液に超音波を照射して2次エマルションを生成し(S106:2次エマルション生成ステップ)、2次エマルションから水非混和性有機溶媒を除去する(S108:有機溶媒除去ステップ)。
【0059】
また、内包する物質が疎水性物質である場合、1次溶液生成ステップS100において、疎水性物質を溶解した水非混和性有機溶媒を、両親媒性ポリマーを溶解した水非混和性有機溶媒と疎水性ポリマーを溶解した水非混和性有機溶媒とに混合し、1次溶液を生成する。そして、1次エマルション生成ステップS102を省略し、1次溶液に、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する(S104:2次溶液生成ステップ)。生成した2次溶液に超音波を照射してエマルション(O/Wエマルション)を生成し(S106:エマルション生成ステップ(2次エマルション生成ステップ))、エマルションから水非混和性有機溶媒を除去する(S108:有機溶媒除去ステップ)。
【0060】
以下に、各ステップの構成を詳細に説明する。
【0061】
(1次溶液生成ステップS100)
内包する物質を溶解した溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する。
【0062】
[1次溶液生成ステップS100における両親媒性ポリマー1]
1次溶液生成ステップS100における両親媒性ポリマーは、親水性セグメントと疎水性セグメントとで構成される共重合体であり、親水性セグメントは、電荷を有するアミノ酸を3個以上有するポリペプチドまたは数平均分子量500〜100000であるポリエチレングリコールを含み、疎水性セグメントは生分解性ポリエステルを含んで構成される。
【0063】
<両親媒性ポリマーの重合形態>
ポリペプチドを含む両親媒性ポリマーまたはポリエチレングリコールを含む両親媒性ポリマーの重合形態は、好ましくは、電荷を有するアミノ酸を3個以上有するポリペプチドまたは数平均分子量500〜100000であるポリエチレングリコールと、生分解性ポリエステルとの、ランダム共重合体、交互共重合体、ブロック共重合体、グラフト共重合体であり、より好ましくは、ブロック共重合体またはグラフト共重合体であり、さらに好ましくは、ブロック共重合体である。
【0064】
<電荷を有するアミノ酸を3個以上有するポリペプチド>
両親媒性ポリマーを構成するポリペプチドは、正電荷または負電荷を有していればよく、かかるポリペプチドを構成するアミノ酸は、好ましくは、リジン、アルギニン、ヒスチジン、アスパラギン酸、グルタミン酸の群から選択される1または複数のアミノ酸であればよく、より好ましくは、リジン、アルギニンまたはヒスチジンの群から選択される1または複数のアミノ酸であり、さらに好ましくはリジンである。
【0065】
両親媒性ポリマーを構成するポリペプチドのアミノ酸を、タンパク質を構成するアミノ酸とする構成により、かかる両親媒性ポリマーを用いたナノスフェアを利用して薬物徐放型DDS製剤等の医薬品や徐放型の皮膚外用組成物、徐放型の化粧料を製造する際に、生体適合性を向上させることができる。また、両親媒性ポリマーを構成するポリペプチドのアミノ酸を、タンパク質を構成するアミノ酸とすることにより、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを血中に導入した場合に、マクロファージなどの貪食細胞に異物として捕捉される可能性を低減させることができ、血中の循環時間を延長させることが可能となる。
【0066】
<ポリエチレングリコール>
両親媒性ポリマーを構成するポリエチレングリコールの数平均分子量は、特に限定されないが、好ましくは、数平均分子量500〜100000であり、より好ましくは、数平均分子量1000〜50000であり、さらに好ましくは数平均分子量2000〜20000である。
【0067】
両親媒性ポリマーにポリエチレングリコールを含ませる構成により、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを血中に導入した場合に、マクロファージなどの貪食細胞に異物として捕捉される可能性を低減させることができ、血中の循環時間を延長させることが可能となる。
【0068】
<生分解性ポリエステルの構成単位>
生分解性ポリエステルの構成単位は、重合した場合に生分解性ポリエステルとなるものであり、上記ポリペプチドまたはポリエチレングリコールと共重合体を構成できるものであればよく、好ましくは、乳酸(L−乳酸、D−乳酸、DL−乳酸)、グリコール酸(ヒドロキシ酢酸)、アミノ酸、カプロラクトン(α−カプロラクトン、β−カプロラクトン、γ−カプロラクトン、δ−カプロラクトン、ε−カプロラクトン等)、コハク酸とエチレングリコールの混合物、コハク酸とブタンジオール(1,2−ブタンジオール、1,3−ブタンジオール、1,4−ブタンジオール、2,3−ブタンジオール等)の混合物、からなる群のうち、1または複数、またはこれらのオリゴマーであればよく、より好ましくは、乳酸、グリコール酸およびアミノ酸、の群から選択される1または複数であり、さらに好ましくはL−乳酸である。
【0069】
生分解性ポリエステルは、例えば、ポリ乳酸(PLA:Poly Lactic Acid)、ポリグリコール酸(PGA:Poly Glycolic Acid)、ポリ乳酸−グリコール酸共重合体、ポリデプシペプチド(アミノ酸とヒドロキシ酸の共重合体)を用いることができる。
【0070】
生分解性ポリエステルを生体由来材料である乳酸やアミノ酸、またはグリコール酸で構成することにより、医薬品や、皮膚外用組成物、化粧料を製造する際に、生体適合性を向上させることができる。
【0071】
[1次溶液生成ステップS100における両親媒性ポリマー2]
また、1次溶液生成ステップS100における両親媒性ポリマーは、親水性セグメントと疎水性セグメントとで構成される共重合体であり、親水性セグメントは、多糖を含み、疎水性セグメントは生分解性ポリエステルを含んで構成されてもよい。
【0072】
<両親媒性ポリマーの重合形態>
多糖を含む両親媒性ポリマーの重合形態は、多糖と、生分解性ポリエステルとの、ランダム共重合体、交互共重合体、ブロック共重合体、グラフト共重合体であればよく、好ましくは、グラフト共重合体またはブロック共重合体であり、より好ましくは、グラフト共重合体である。また、両親媒性ポリマーは、さらに好ましくは、多糖を主鎖とし、生分解性ポリエステルを側鎖としたグラフト共重合体である。
【0073】
<多糖の含有量>
また、両親媒性ポリマーを構成する多糖の含有量は、特に限定されないが、1〜50質量%であればよく、好ましくは、1〜30質量%であり、さらに好ましくは、4〜25質量%である。
【0074】
両親媒性ポリマーを構成する多糖の含有量をかかる範囲の含有量とする構成により、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを生体内に留置した場合においても、分解に伴う炎症反応等を生じさせない分解速度であり、かつ、生体内で必要とされる期間の経過後には生体内から消失している分解速度に調節することができる。かかる生体内で必要とされる期間とは、好ましくは1ヶ月〜10ヶ月、さらに好ましくは、2ヶ月〜10ヶ月、最も好ましくは2ヶ月〜8ヶ月である。
【0075】
<多糖>
両親媒性ポリマーを構成する多糖は、生体内で安定であればよく、好ましくは、ヒアルロン酸、アミロース、プルラン、コンドロイチン、コンドロイチン硫酸、デキストラン、デキストラン硫酸、デルマタン硫酸、ケラタン硫酸、ヘパラン硫酸、キチン、キトサンおよびβグルカンの群から選択される1または複数であり、より好ましくは、デキストラン、プルランおよびヒアルロン酸の群から選択される1または複数であり、さらに好ましくは、デキストランである。
【0076】
両親媒性ポリマーにおける多糖をデキストランとする構成により、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを安定して血管内に存在させることができる。
【0077】
かかる多糖の重量平均分子量は、特に限定されないが、1000〜100000g/molであればよく、好ましくは、5000〜50000g/molであり、さらに好ましくは、10000〜30000g/molである。
【0078】
両親媒性ポリマーにおける多糖をかかる範囲の数平均分子量である多糖とする構成により、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアが、高い成型性と、柔軟性とを維持しつつ細胞接着性を低下させることができる。
【0079】
<生分解性ポリエステルの構成単位>
生分解性ポリエステルの構成単位は、重合した場合に、生分解性ポリエステルとなるものであり、上記多糖と共重合体を構成できるものであればよく、好ましくは、乳酸(L−乳酸、D−乳酸、DL−乳酸)、グリコール酸(ヒドロキシ酢酸)、アミノ酸、カプロラクトン(α−カプロラクトン、β−カプロラクトン、γ−カプロラクトン、δ−カプロラクトン、ε−カプロラクトン等)、コハク酸とエチレングリコールの混合物、コハク酸とブタンジオール(1,2−ブタンジオール、1,3−ブタンジオール、1,4−ブタンジオール、2,3−ブタンジオール等)の混合物、からなる群のうち、1または複数、またはこれらのオリゴマーであり、より好ましくは、乳酸、グリコール酸およびアミノ酸、の群から選択される1または複数であり、さらに好ましくはL−乳酸である。
【0080】
生分解性ポリエステルは、例えば、ポリ乳酸、ポリグリコール酸、ポリ乳酸−グリコール酸共重合体、ポリデプシペプチドを用いることができる。
【0081】
生分解性ポリエステルを生体由来材料である乳酸やアミノ酸、またはグリコール酸で構成することにより、医薬品や、皮膚外用組成物、化粧料を製造する際に、生体適合性を向上させることができる。
【0082】
上述した多糖と生分解性ポリエステルとの共重合体である両親媒性ポリマーは、好ましくは、主鎖をデキストランとし、側鎖をL−乳酸としたグラフト共重合体である。以下、デキストランを主鎖としL−乳酸を側鎖としたグラフト共重合体である両親媒性ポリマーをDex−g−PLLA(ポリ乳酸グラフト化デキストラン)と称する。
【0083】
上記Dex−g−PLLA1分子における乳酸のグラフト本数は、1〜100本であればよく、好ましくは、1〜50本であり、さらに好ましくは2〜30本である。Dex−g−PLLA1分子における乳酸のグラフト本数を上記範囲の本数とする構成により、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアの細胞接着性を低減させることが可能となる。
【0084】
また、上記Dex−g−PLLAの数平均分子量は、特に限定されないが、1×104〜100×104/molであればよく、好ましくは、5×104〜20×104/molであり、さらに好ましくは、10×104〜13×104/molである。
【0085】
Dex−g−PLLAをかかる範囲の数平均分子量とする構成により、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアが、高い強度と、柔軟性を維持しつつ細胞接着性を低下させることができる。
【0086】
1次溶液生成ステップS100において、上記疎水性ポリマーを溶解した水非混和性有機溶媒を添加せずともよく、内包する物質を溶解した溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成してもよい。
【0087】
<疎水性ポリマー>
疎水性ポリマーの重合形態は、ランダム共重合体、交互共重合体、ブロック共重合体、グラフト共重合体であってもよい。
【0088】
疎水性ポリマーの構成単位は、重合した場合に、疎水性ポリマーとなるものであればよく、好ましくは乳酸(L−乳酸、D−乳酸、DL−乳酸)、グリコール酸(ヒドロキシ酢酸)、アミノ酸、カプロラクトン(α−カプロラクトン、β−カプロラクトン、γ−カプロラクトン、δ−カプロラクトン、ε−カプロラクトン等)、コハク酸とエチレングリコールの混合物、コハク酸とブタンジオール(1,2−ブタンジオール、1,3−ブタンジオール、1,4−ブタンジオール、2,3−ブタンジオール等)の混合物、からなる群のうち、1または複数、またはこれらのオリゴマーであればよく、より好ましくは、乳酸、グリコール酸およびアミノ酸、の群から選択される1または複数であり、さらに好ましくはL−乳酸およびグリコール酸である。
【0089】
疎水性ポリマーは、例えば、ポリ乳酸、ポリグリコール酸、ポリ乳酸−グリコール酸共重合体、ポリデプシペプチドを用いることができる。
【0090】
本実施形態では、疎水性ポリマーとして、L−乳酸とグリコール酸とのランダム共重合体を用い、以下、かかるL−乳酸とグリコール酸とのランダム共重合体による疎水性ポリマーをPLGA(ポリ乳酸−グリコール酸ランダム共重合体)と称する。
【0091】
PLGAの重量平均分子量(Mw)は、特に限定されないが、5000〜75000であるとよい。
【0092】
[1次溶液生成ステップS100における内包する物質]
1次溶液生成ステップS100における内包する物質は、親水性物質もしくは疎水性物質のいずれか一方または両方であってもよく、親水性物質もしくは疎水性物質のいずれか一方または両方としてステビア発酵エキスまたは両親媒性物質であってもよい。また両親媒性物質として、例えば、スフィンゴミエリンを用いることができる。
【0093】
親水性物質と疎水性物質の混合物であるステビア発酵エキスおよび両親媒性物質であるスフィンゴミエリンは、国際公開番号WO2008/126638A1や「ステビア発酵エキスの抗ヒスタミン作用に関する研究」薬理と治療 vol.36 no.8 2008に記載されているように、保湿効果が高く、荒れ肌を改善したり、かゆみを抑止したり、炎症を抑えたり、抗ヒスタミン作用を有したりする。したがって、ステビア発酵エキスまたはスフィンゴミエリンを内包させたナノスフェアを含有させた皮膚外用組成物や化粧料とする構成により、皮膚表面の微細な凹凸にステビア発酵エキスまたはスフィンゴミエリンを略均一に行き渡らせることができる。
【0094】
[1次溶液生成ステップS100における水系溶媒]
1次溶液生成ステップS100における水系溶媒は、水または無機塩類、糖類、有機塩類、アミノ酸等を含む水溶液であり、親水性物質または両親媒性物質の親水セグメントが溶解できれば足りる。
【0095】
[1次溶液生成ステップS100における水非混和性有機溶媒]
1次溶液生成ステップS100における水非混和性有機溶媒は、疎水性ポリマー、両親媒性ポリマーの疎水性セグメント、疎水性物質、または両親媒性物質の疎水性セグメントが可溶であり、かつ両親媒性ポリマーの親水性セグメントが難溶または不溶であるとよいが、両親媒性ポリマーの疎水性セグメントおよび親水性セグメントの両者が難溶または可溶であってもよい。かかる水非混和性有機溶媒の水への溶解度は、10g(水非混和性有機溶媒)/100ml(水)以下であり、好ましくは、1g(水非混和性有機溶媒)/100ml(水)以下であり、さらに好ましくは、0.1g(水非混和性有機溶媒)/100ml(水)以下である。水非混和性有機溶媒は、特に限定されないが、酢酸エチル、酢酸イソプロピル、酢酸ブチル、炭酸ジメチル、炭酸ジエチル、塩化メチレン(ジクロロメタン)、クロロホルム等を好適に利用できる。
【0096】
[1次溶液生成ステップS100における水系溶媒と水非混和性有機溶媒の比]
上記水系溶媒に対する水非混和性有機溶媒の比は、1:1000〜1:1であってもよく、好ましくは、1:100〜1:3、より好ましくは、1:50〜1:10である。ここで、水非混和性有機溶媒の量は、ポリペプチドを含む両親媒性ポリマーまたはポリエチレングリコールを含む両親媒性ポリマーを用いる場合、これらの両親媒性ポリマーを溶解する水非混和性有機溶媒と疎水性ポリマーを溶解する水非混和性有機溶媒の合計の量とし、多糖を含む両親媒性ポリマーを用いる場合、多糖を含む両親媒性ポリマーを溶解する水非混和性有機溶媒の量とする。
【0097】
水非混和性有機溶媒中の両親媒性ポリマーおよび疎水性ポリマーの濃度は、ポリペプチドを含む両親媒性ポリマーまたはポリエチレングリコールを含む両親媒性ポリマーを用いる場合、1〜500mg/mlであればよく、好ましくは、10〜250mg/mlであり、さらに好ましくは50〜100mg/mlである。この場合、両親媒性ポリマーに対する疎水性ポリマーの比は、1:1000〜1:1であればよく、好ましくは、1:100〜1:3、より好ましくは、1:50〜1:5である。
【0098】
また、水非混和性有機溶媒中の両親媒性ポリマーの濃度は、多糖を含む両親媒性ポリマーを用いる場合、1〜500mg/mlであればよく、好ましくは、10〜250mg/mlであり、さらに好ましくは50〜100mg/mlである。
【0099】
(1次エマルション生成ステップS102)
生成した1次溶液に超音波を照射し、逆相エマルション(W/Oエマルション)である1次エマルションを生成する。
【0100】
超音波の照射時間は、0.5〜15分間であればよく、好ましくは、1〜10分間であり、より好ましくは、3〜5分間である。
【0101】
超音波の照射は、バス型ソニケータを用いても、プローブ型ソニケータを用いてもよく、バス型ソニケータおよびプローブ型ソニケータを用いてもよい。
【0102】
また、本実施形態において、生成した1次溶液に超音波を照射することで、逆相エマルションである1次エマルションを生成するが、これに限定されず、マグネチックスターラー等の攪拌装置、タービン型攪拌装置、ホモジナイザー等を用いて1次溶液を攪拌することで1次エマルションを生成してもよい。
【0103】
(2次溶液生成ステップS104)
1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する。
【0104】
[2次溶液生成ステップS104における親水性ポリマー]
親水性ポリマーは、上述した両親媒性ポリマーの疎水性セグメントまたは疎水性ポリマーと、化学結合し、または物理的に吸着するものであるとよい。また、親水性ポリマーは、溶媒中における1次エマルションの凝集を防止したり、凝集を遅延させたりするものであるとよい。なお、親水性ポリマーは、2次溶液生成ステップS104において、両親媒性ポリマーの疎水性セグメントまたは疎水性ポリマーと、化学結合し、または物理的に吸着するものであってもよく、後述する有機溶媒除去ステップS108における、溶媒除去時に両親媒性ポリマーの疎水性セグメントまたは疎水性ポリマーと、化学結合し、または物理的に吸着するものであってもよい。
【0105】
親水性ポリマーは、ポリビニルアルコール、ポリエチレングリコール、ポリペプチド、タンパク質または多糖類の群から選択される1または複数であればよく、好ましくは、ポリビニルアルコールである。
【0106】
また、親水性ポリマーは、ポリビニルアルコール、ポリエチレングリコール、ポリペプチド、タンパク質または多糖類の群から選択される1または複数の類縁体であってもよい。
【0107】
[2次溶液生成ステップS104における水系溶媒]
2次溶液生成ステップS100における水系溶媒は、親水性ポリマーを溶解できればよく、例えば、水または無機塩類、糖類、有機塩類、アミノ酸等を含む水溶液である。
【0108】
水系溶媒中の親水性ポリマーの濃度は、0.1〜500mg/mlであればよく、好ましくは、10〜250mg/mlであり、さらに好ましくは50〜100mg/mlである。
【0109】
また、1次溶液生成ステップS100における1次溶液に対する、2次溶液生成ステップS100における親水性ポリマーを溶解した水系溶媒比は、1:500〜1:10であればよく、好ましくは、1:300〜1:50、さらに好ましくは、1:200〜1:100である。
【0110】
(2次エマルション生成ステップS106)
生成した2次溶液に超音波を照射して2次エマルションを生成する。
【0111】
超音波の照射時間は、0.5〜20分間であればよく、好ましくは、1〜15分間であり、さらに好ましくは、3〜7分間である。
【0112】
超音波の照射は、バス型ソニケータを用いても、プローブ型ソニケータを用いてもよく、バス型ソニケータおよびプローブ型ソニケータを用いてもよい。
【0113】
また、本実施形態において、生成した2次溶液に超音波を照射することで、2次エマルションを生成するが、これに限定されず、マグネチックスターラー等の攪拌装置、タービン型攪拌装置、ホモジナイザー等を用いて2次溶液を攪拌することで2次エマルションを生成してもよい。
【0114】
(有機溶媒除去ステップS108)
2次エマルションから水非混和性有機溶媒を除去する。
【0115】
水非混和性有機溶媒を除去する方法としては、液中乾燥、透析、遠心分離、凍結乾燥、濾過、再沈殿等を利用すればよく、好ましくは、液中乾燥、遠心分離、凍結乾燥を利用する。
【0116】
また、当該有機溶媒除去ステップS108を経た後に、2次エマルション(疎水性物質を内包する場合、エマルション)を、水系溶媒に導入し、さらに水非混和性有機溶媒を除去することにより、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアの水系溶媒分散体としてもよい。
【0117】
以上説明した1次溶液生成ステップS100、1次エマルション生成ステップS102、2次溶液生成ステップS104、2次エマルション生成ステップS106および有機溶媒除去ステップS108により、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアの水系溶媒分散体を得ることができる。なお、両親媒性ポリマー、疎水性ポリマーおよび親水性ポリマーに生分解性ポリマーを用いれば、薬物徐放型DDS製剤等の医薬品や有効物質を内包する徐放型の皮膚外用組成物、有効成分を内包する化粧料に好適な、親水性物質もしくは疎水性物質のいずれか一方または両方を内包する生分解性ナノスフェアの水系溶媒分散体を得ることが可能となる。
【0118】
また、本実施形態により得られた親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアの水系溶媒分散体から、分散媒を除去することにより、親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアとすることも可能である。分散媒を除去する方法としては、特に限定されないが、液中乾燥、透析、遠心分離、凍結乾燥、濾過、再沈殿等を利用することができ、好ましくは、液中乾燥、遠心分離、凍結乾燥を利用する。
【0119】
以上説明したように、1次エマルション生成ステップS102において1次エマルションを生成する際に、両親媒性ポリマーを添加する構成により、疎水性ポリマーに親水性物質もしくは疎水性物質のいずれか一方または両方を内包させることができる。また、疎水性ポリマーと、親水性物質もしくは疎水性物質のいずれか一方または両方とに両親媒性ポリマーを添加した1次溶液に上述した条件で超音波を照射して生成した1次エマルションに親水性ポリマーを添加した2次溶液に、上述した条件で超音波を照射する構成により、凝集を抑制しつつ、親水性物質もしくは疎水性物質のいずれか一方または両方を内包する高分子微粒子をナノメートルオーダーで製造することが可能となる。
【0120】
また、1次エマルション生成ステップS102において1次エマルションを生成する際に、両親媒性ポリマーと、親水性物質もしくは疎水性物質のいずれか一方または両方と、を含む1次溶液に上述した条件で超音波を照射して生成した1次エマルションに親水性ポリマーを添加した2次溶液に、上述した条件で超音波を照射する構成により、凝集を抑制しつつ、親水性物質もしくは疎水性物質のいずれか一方または両方を内包する高分子微粒子をナノメートルオーダーで製造することが可能となる。
【0121】
さらに、両親媒性ポリマー、疎水性ポリマーおよび親水性ポリマーに生分解性ポリマーを用いる構成により、タンパク質や核酸、生理活性を有する天然抽出物等の水溶性(親水性)高分子の薬物、および、脂質や、生理活性を有する天然抽出物等の疎水性の高分子の薬物を内包する医薬品や、親水性および疎水性の有効物質を内包する徐放型の化粧料を製造することができる。また、親水性物質もしくは疎水性物質のいずれか一方または両方を内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0122】
皮膚外用組成物として、上記親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアの製造方法を用いて製造された親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを含有する構成により、塗り薬等の皮膚外用組成物を皮膚表面の微細な凹凸にナノスフェアを略均一に塗布することができる。また、上述したようにナノスフェアを構成するポリマーに生分解性ポリマーを用いる構成により、ナノスフェアに内包させた親水性物質もしくは疎水性物質のいずれか一方または両方を皮膚表面で好適に徐放させることができ、従来と比較して、皮膚外用組成物の効果を維持しつつ、塗布する回数を減少させることが可能となる。
【0123】
また、化粧料として、上記親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアの製造方法を用いて製造された親水性物質もしくは疎水性物質のいずれか一方または両方を内包するナノスフェアを含有する構成により、化粧料を皮膚表面の微細な凹凸にナノスフェアを略均一に塗布することができる。また、上述したようにナノスフェアを構成するポリマーに生分解性ポリマーを用いる構成により、ナノスフェアに内包させた親水性物質もしくは疎水性物質のいずれか一方または両方を皮膚表面で好適に徐放させることができ、従来と比較して化粧料の塗布回数を減らしても同程度の効果を得ることが可能となる。
【0124】
例えば、親水性物質と疎水性物質の混合物であるステビア発酵エキスや、親水性物質もしくは疎水性物質のいずれか一方または両方の機能を有する両親媒性物質としてのスフィンゴミエリンを内包させたナノスフェアを含有させた皮膚外用組成物や、化粧料を製造することもできる。
【0125】
ステビア発酵エキスおよびスフィンゴミエリンは、国際公開番号WO2008/126638A1や「ステビア発酵エキスの抗ヒスタミン作用に関する研究」薬理と治療 vol.36 no.8 2008に記載されているように、保湿効果が高く、荒れ肌を改善したり、かゆみを抑止したり、炎症を抑えたり、抗ヒスタミン作用を有したりする。したがって、ステビア発酵エキスまたはスフィンゴミエリンを内包させたナノスフェアを含有させた皮膚外用組成物や化粧料とする構成により、皮膚表面の微細な凹凸にステビア発酵エキスまたはスフィンゴミエリンを略均一に行き渡らせることができる。
【0126】
また本実施形態にかかるステビア発酵エキスもしくはスフィンゴミエリンのいずれか一方または両方を内包させたナノスフェアは、化粧料においては、頭髪用化粧品、整髪料、養毛料、頭皮料、毛髪着色料、洗髪料、ヘアリンス、皮膚用化粧品・化粧水、化粧液、クリーム、乳液、日焼け、日焼け止め、洗浄料、ひげそり、むだ毛そり、フェイシャルリンス、パック、化粧用油、ボディリンス、マッサージ料、仕上用化粧品・ファンデーション、化粧下地、おしろい、口紅、アイメークアップ、頬化粧料、ボディメークアップ、オーデコロン・香水、浴用化粧料、爪化粧料、ボディパウダー等、また、医薬品においては、散剤・細粒剤、顆粒剤、錠剤、カプセル剤、丸剤、桿剤、ペンシル剤、内容液剤、外用液剤、エキス剤、硬膏剤、坐剤、エアゾール、ガス剤、薬品吸着剤、眼科用剤、注射剤、絆創膏剤等幅広く使用可能である。
【0127】
以下に、ある実施例の詳細についてさらに説明する。
【0128】
(実施例1)
本実施例では、両親媒性ポリマーとしてポリリジンとL−乳酸のジブロック共重合体(以下、単に、PLys+−b−PLLAと称する)を、疎水性ポリマーとして、PLGAを、親水性ポリマーとしてポリビニルアルコール(以下、単に、PVAと称する)を、内包する親水性物質としてBSAを用いた。
【0129】
図2は、実施例1にかかるPLys+−b−PLLAの合成方法を説明するための説明図である。
【0130】
図2に示すように、まず、2−aminoethanolのアミノ基をt-ブトキシカルボニル(以下単に、Bocと称する)基で保護した。次に、Boc―aminoethanolの末端水酸基をカリウムナフタレンによりアルコキシド化し、これを開始剤としてラクチドの溶液系アニオン開環重合を行った。最後に、得られたポリマーの末端アミノ基の保護基(Boc基)を25%臭化水素酢酸(25%HBr/AcOH)で除去した後、トリエチルアミン(TEA)を用いて脱塩を行い、目的物であるNH2−PLLAを得た。
【0131】
NH2−PLLAのアミノ基を重合開始点として用い、Lys(Z)−N−カルボキシ無水物(NCA:N-Carboxy Anhydride)との脱炭酸重合を行った。蒸留したクロロホルムにNH2−PLLAを溶解した後、Lys(Z)−NCAを加え、アルゴン気流下、40℃で24時間撹拌した。次に、得られたポリマーを25%臭化水素酢酸で処理することで側鎖保護基であるベンジルオキシカルボニル基(Z基)の脱保護を行い、目的物であるPLys+−b−PLLAを得た。
【0132】
本実施例にかかるPLys+−b−PLLAは、リジンの重合度は16であり、乳酸の重合度は39であった。また、本実施例にかかるPLys+−b−PLLAは両親媒性を有するため水中で自己会合してミセルを形成する。
【0133】
図3は、実施例1にかかるPLys+−b−PLLAのミセル状態における分解性を説明するための説明図である。ここでは、PLys+−b−PLLAのミセルを0.5mg/mlとなるようにリン酸緩衝生理食塩水(PBS:Phosphate Buffered Saline)(pH=7.4、I=0.14)に分散させ、37℃でインキュベートし、1日後、3日後、5日後、7日後のPLys+−b−PLLAを、GPC(Gel Permeation Chromatography)を用いた分子量分布測定を行い分子量の減少について検討した。
【0134】
図3に示すように、1日後においても1%程度しか減少しておらず、3日後においては、1.5%程度、5日後においては、2.5%程度、7日後においては6%程度の減少であった。したがって、両親媒性ポリマーとしてPLys+−b−PLLAを用いた親水性物質もしくは疎水性物質のいずれか一方または両方を内包する生分解性ナノスフェアを生体内に留置した場合に、分解に伴う炎症反応等を起こさない分解速度であり、かつ、生体内で必要とされる期間の経過後には生体内から消失している分解速度に調節することができる。
【0135】
図4は、実施例1を説明するための説明図である。図4に示すように、試験管に、PLys+−b−PLLA20mgおよび重量平均分子量が5000〜75000であるPLGA180mgを入れ、クロロホルム(CHCl3)2.5mlに溶解させた。続いて、親水性物質としてBSA5mgを溶解したPBS100μlを試験管に加え1次溶液を生成した。次に、1次溶液をスパチュラで激しく撹拌しながらプローブ型ソニケータで3分間超音波を照射し、1次エマルションを調製した。本実施例において、プローブ型ソニケータとして、株式会社トミー精工製 UD−200を用い、レベル5〜10に設定して、超音波を照射した。以下、株式会社トミー精工製 UD−200を用いて、レベル5〜10に設定し超音波を照射することを、単にプローブ型ソニケータで超音波を照射すると称する。
【0136】
その後、1次エマルションを、0.1%PVAを含むPBS300mlに加えて2次溶液を調製した。次に、2次溶液にバス型ソニケータで3分間超音波を照射し、90秒間スパチュラで激しく攪拌し、さらに、プローブ型ソニケータで90秒間超音波を照射して2次エマルションを調製した。本実施例において、バス型ソニケータとして、株式会社エスエヌディ製 US−2を用い、レベル5に設定して超音波を照射した。以下、株式会社エスエヌディ製 US−2を用いて、レベル5に設定し超音波を照射することを、単にバス型ソニケータで超音波を照射すると称する。
【0137】
そして、2次エマルションを、0.1%PVAを含むPBS300mlにさらに加え、液中乾燥を行うことにより、クロロホルムを除去した懸濁液を得た。その後、懸濁液を20000rpmで10分間遠心分離し、BSAを内包する生分解性ナノスフェアを含む沈殿を得た。そして、かかる沈殿を超純水で洗浄した。この、遠心分離および洗浄からなる操作を数回繰り返した後、沈殿を凍結乾燥して水を除去することで、BSAを内包する生分解性ナノスフェアを得た。
【0138】
(評価)
BSAを内包する生分解性ナノスフェアの形状および粒径を、走査型電子顕微鏡(SEM:Scanning Electron Microscope)を用いて検討した。走査型電子顕微鏡試料台にカーボン両面テープを貼り付け、その上に凍結乾燥後のBSAを内包する生分解性ナノスフェアを載置し、200Åの金蒸着を行うことにより、走査型電子顕微鏡の試料を作成した。BSAを内包する生分解性ナノスフェア粒径は無作為に選択したBSAを内包する生分解性ナノスフェアの粒径を測定することにより求めた。
【0139】
図5は、BSAを内包する生分解性ナノスフェアを走査型電子顕微鏡で観察した結果を説明するための説明図である。図5に示すように、BSAを内包する生分解性ナノスフェアの粒径は、約150nm〜約800nmであった。また、比較的凝集も抑えられており微粒子表面も、平滑なものが得られた。
【0140】
ナノスフェアの粒径が約150nm〜約800nmと小さいため、親水性物質もしくは疎水性物質のいずれか一方または両方を内包した生分解性ナノスフェアを、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0141】
次に、生分解性ナノスフェアのBSA内包率およびBSAの回収率を測定した。まず、サンプル管を6個用意し、そのうち5個のサンプル管には内包物なしの空の生分解性ナノスフェアを、残りの1個のサンプル管には内包率が未知である、BSAを内包した生分解性ナノスフェアを、それぞれ20mg入れた。
【0142】
空の生分解性ナノスフェアを入れた5個のサンプル管には、それぞれBSAの濃度が0、0.3、0.5、0.7、0.9mg/mlとなるように、BSA含有1N水酸化ナトリウム水溶液を3mlずつ入れ、BSAを内包した生分解性ナノスフェアを入れたサンプル管には、1N水酸化ナトリウム水溶液を3ml入れた。
【0143】
上記6個のサンプル管にキャップをして約2日間スターラーで攪拌した。2日後、溶液が透明になり、生分解性ナノスフェアが分解されたのを目視で確認した後、それぞれの溶液を、ディスポーサブルフィルターを用いて濾過した。BSAの濃度が0mg/mlの空の生分解性ナノスフェアを分解した溶液をバックグラウンドとし、波長290nmの吸光度を測定して、検量線を作成した。そして、BSAを内包した生分解性ナノスフェアを分解した溶液の吸光度を測定し、作成した検量線より、生分解性ナノスフェアに内包されたBSAの定量(内包率の測定)を行った。
【0144】
図6は、実施例における内包率、回収率、収率および内包効率を算出する式を説明するための説明図である。ここで内包率は、得られた単位重量あたりのナノスフェアに対する内包された物質(本実施例では、親水性物質)の重量の比率(%)であり、回収率は、用いられた内包される物質(本実施例では、親水性物質)に対する回収された内包される物質(本実施例では、親水性物質)の比率(%)であり、収率は、ナノスフェアの構成成分として用いられた内包される物質(本実施例では、親水性物質)、両親媒性ポリマー、疎水性ポリマーおよび親水性ポリマーの重量に対する回収されたナノスフェアの重量の比率(%)であり、内包効率は、用いられた内包される物質(本実施例では、親水性物質)と用いられたポリマーの合計との割合に対する、内包される親水性物質もしくは疎水性物質のいずれか一方または両方と回収したナノスフェア中のポリマーとの割合、の比を百分率(%)で示す。
【0145】
図6に示す、内包率を算出する式を用いて、実施例1の生分解性ナノスフェアのBSAの内包率を算出すると、2.9%となった。
【0146】
また、懸濁液を20000rpmで10分間遠心分離した結果、得られた上澄におけるBSAの濃度から、図6に示す、回収率を算出する式を用いて、実施例1におけるBSAの回収率を求めた。その結果、実施例1におけるBSAの回収率は、91.0%となった。
【0147】
BSAの回収率が90%以上と高いことから、医薬品等の高価な物質を内包させる場合であっても、好適に医薬品等の高価な物質を回収することができる。したがって、回収した物質を再利用することができ、薬価の不要な上昇を抑えることが可能となる。
【0148】
(実施例2)
本実施例では、両親媒性ポリマーとして数平均分子量3000のポリエチレングリコールとL−乳酸のジブロック共重合体(以下、単に、PEG3K−b−PLLAと称する)を、疎水性ポリマーとして、PLGAを、親水性ポリマーとしてPVAを、内包する物質は、親水性物質および疎水性物質の機能を備える両親媒性物質としてスフィンゴミエリンを用いた。
【0149】
図7は、実施例2にかかるPEG3K−b−PLLAの合成方法を説明するための説明図である。
【0150】
図7に示すように、まず、L−ラクチド、MeO−PEG3K、2−エチルヘキサン酸スズをそれぞれ秤量し、ナス型フラスコにいれ、攪拌子もいれて減圧乾燥を行った。乾燥後、ナス型フラスコを150℃のoil bathに浸漬して内容物を溶融させ、ナス型フラスコを130℃のoil bathに12時間浸漬することで開環重合反応を行った。反応後,反応物を少量のクロロホルムに溶解させ、大量のエーテルにより再沈殿を行った。これを遠心分離にかけ、沈殿物を減圧乾燥することでPEG3K−b−PLLAを得た。
【0151】
図8は、実施例2を説明するための説明図である。図8に示すように、試験管に、PEG3K−b−PLLA20mgおよび重量平均分子量が5000〜75000であるPLGA180mgを入れ、クロロホルム2.5mlに溶解させた。続いて、スフィンゴミエリン5mgを試験管に加え1次溶液を生成した。次に、1次溶液をスパチュラで激しく撹拌しながらプローブ型ソニケータで3分間超音波を照射し、1次エマルションを調製した。
【0152】
その後、1次エマルションを、0.1%PVAを含むPBS300mlに加えて2次溶液を調製した。次に、2次溶液にバス型ソニケータで3分間超音波を照射し、90秒間スパチュラで激しく攪拌し、さらに、プローブ型ソニケータで90秒間超音波を照射して2次エマルションを調製した。
【0153】
そして、2次エマルションを、0.1%PVAを含むPBS300mlにさらに加え、液中乾燥を行うことにより、クロロホルムを除去した懸濁液を得た。その後、懸濁液を20000rpmで10分間遠心分離し、両親媒性物質としてのスフィンゴミエリンを内包する生分解性ナノスフェアを含む沈殿を得た。そして、かかる沈殿を超純水で洗浄した。この、遠心分離および洗浄からなる操作を数回繰り返した後、沈殿を凍結乾燥して水を除去することで、スフィンゴミエリンを内包する生分解性ナノスフェアを得た。
【0154】
(評価)
スフィンゴミエリンを内包する生分解性ナノスフェアの形状および粒径を、走査型電子顕微鏡を用いて検討した。走査型電子顕微鏡の試料の作成方法は、上述した実施例1の作成方法と同一であるため説明を省略する。
【0155】
図9は、スフィンゴミエリンを内包する生分解性ナノスフェアを、走査型電子顕微鏡で観察した結果を説明するための説明図である。図9に示すように、スフィンゴミエリンを内包する生分解性ナノスフェアの粒径は、比較的凝集も抑えられており微粒子表面も、平滑なものが得られた。
【0156】
また、懸濁液を20000rpmで10分間遠心分離した結果、得られた上澄におけるスフィンゴミエリンの濃度から、図6に示す、収率を算出する式を用いて、実施例2におけるスフィンゴミエリンの収率を求めた。その結果、実施例2におけるスフィンゴミエリンの収率は、53.7%となった。
【0157】
実施例2において、親水性物質だけでなく、親水性物質および疎水性物質の機能を備える両親媒性物質のスフィンゴミエリンを内包したナノスフェアを製造することができた。したがって、親水性物質だけでなく、親水性物質および疎水性物質を内包するナノスフェアを製造することが可能となった。また、スフィンゴミエリンを内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0158】
また、スフィンゴミエリンのセラミドに基づく保湿効果により、スフィンゴミエリンを内包するナノスフェアを含有する皮膚外用組成物または化粧料を製造すれば、皮膚外用組成物または化粧料を皮膚表面の微細な凹凸にナノスフェアを略均一に塗布することができるため、皮膚外用組成物または化粧料が有する保湿効果を満遍なく皮膚に与えることが可能となる。また、上述したようにナノスフェアを構成するポリマーに生分解性ポリマーを用いる構成により、スフィンゴミエリンを皮膚表面で好適に徐放させることができ、従来と比較して皮膚外用組成物または化粧料の塗布回数を減らしても同程度の保湿効果を得ることが可能となる。
【0159】
(実施例3)
本実施例では、両親媒性ポリマーとしてDex−g−PLLAを、親水性ポリマーとしてPVAを、内包する物質は、親水性物質および疎水性物質の混合物としてステビア発酵エキス(stevia ferment extract)を用い、疎水性ポリマーは使用しなかった。
【0160】
図10は、実施例3にかかるDex−g−PLLAの合成方法を説明するための説明図である。
【0161】
図10(a)に示すように、まず、トリメチルシリル(TMS)化デキストラン(TMSDex)を合成した。合成前日にデキストランの減圧乾燥を行った。アルゴンで満たして常圧に戻し、デキストランを取り出した。デキストランをホルムアミドに溶解させ、80℃に加熱し、ヘキサメチルジシラザンを攪拌しながら注いだ。
【0162】
2時間後分液漏斗を用い抽出し、濃縮して、さらに減圧乾燥した。生成物をクロロホルムに溶解させ、メタノールを貧溶媒とした再沈殿を行い精製した。沈殿物は超遠心分離を行い回収し、減圧乾燥した。
【0163】
図10(b)に示すように、まず、合成前日にL−ラクチドと図10(a)で得られたTMSDexの減圧乾燥をそれぞれ行なった。L−ラクチドはクライゼンフラスコに秤量し、常温で直引減圧乾燥した。水酸基をカリウムナフタレンによりアルコキシド化し、これを開始剤としてラクチドの溶液系アニオン開環重合を行った。
【0164】
次に、TMS基の脱保護を行った。TMSDex−g−PLLAを、DMSO(Dimethylsulfoxide)を加えてスターラーで攪拌し溶解した。TMSDex−g−PLLAが完全に溶解したことを確認してからメタノールを加えた。そして、酢酸を加え4時間攪拌した。4時間後、メタノールを貧溶媒とした再沈殿を行ない、超遠心分離を行い、沈殿を回収し、デシケータ内で減圧乾燥した。さらなる精製は糖含有率により、良溶媒にDMSOまたはクロロホルム、貧溶媒にメタノールを用いた再沈殿により行なった。これを数回繰り返し、Dex−g−PLLAを得た。
【0165】
図11は、実施例3にかかるDex−g−PLLAの分解性を説明するための説明図であり、図12は、分解性実験に用いたDex−g−PLLAを説明するための説明図である。ここでは、クロロホルムを用いたキャスト法で作成したDex−g−PLLAフィルムおよびPLLAフィルムの質量を電子天秤で量り、PBSに浸漬して37℃でインキュベートし、1日後、2日後、4日後、7日後、14日後、28日後に取り出し、水分を減圧乾燥により除去した後の質量を測定した。分解前のフィルムの重さと分解後のフィルムの重さから、図11(a)に示す式を用いてフィルムの重量減少率を求めた。また、取り出したサンプルの一部をDMFで溶解し、GPCを用いた分子量分布測定を行い数平均分子量の減少について検討した。分解前のDex−g−PLLAの数平均分子量と分解後のDex−g−PLLAの数平均分子量から、図11(c)に示す式を用いてDex−g−PLLAの分子量減少率を求めた。
【0166】
図11(b)に示すように、PLLAと比較して、Dex−g−PLLAは、フィルムの重量減少率が高い。また、Dex−g−PLLAにおけるL−ラクチドの重合度が低い方が、フィルムの重量減少率が高くなった。
【0167】
また、図11(d)に示すように、PLLAと比較して、Dex−g−PLLAは、分子量減少率が低い。また、Dex−g−PLLAにおける糖含有率が高い方が、分子量減少率が高い。したがって、両親媒性ポリマーとして、Dex−g−PLLAにおけるL−ラクチドの重合度または糖含有率を調節することで、生分解性ナノスフェアを生体内に留置した場合に、分解に伴う炎症反応等を起こさない分解速度であり、かつ、生体内で必要とされる期間の経過後には生体内から消失している生分解速度に調節することができる。
【0168】
図13は、実施例3を説明するための説明図である。図13に示すように、試験管に、Dex−g−PLLAであるG45−12−20またはG80−9−16を、200mgを入れ、クロロホルム(CHCl3)2.4mlに溶解させた。続いて、ステビア発酵エキス5mgを試験管に加え1次溶液を生成した。次に、1次溶液をスパチュラで激しく撹拌しながらバス型ソニケータで5分間超音波を照射し、1次エマルションを調製した。
【0169】
その後、1次エマルションを、0.1%PVAを含むPBS300mlに加えて2次溶液を調製した。次に、2次溶液にプローブ型ソニケータで3分間超音波を照射して2次エマルションを調製した。
【0170】
そして、2次エマルションを、0.1%PVAを含むPBS300mlにさらに加え、液中乾燥を行うことにより、クロロホルムを除去した懸濁液を得た。その後、懸濁液を20000rpmで10分間遠心分離し、ステビア発酵エキスを内包する生分解性ナノスフェアを含む沈殿を得た。そして、かかる沈殿を超純水で洗浄した。この、遠心分離および洗浄からなる操作を数回繰り返した後、沈殿を凍結乾燥して水を除去することで、ステビア発酵エキスを内包する生分解性ナノスフェアを得た。
【0171】
(評価)
ステビア発酵エキスを内包する生分解性ナノスフェアの形状および粒径を、走査型電子顕微鏡を用いて検討した。走査型電子顕微鏡の試料の作成方法は、上述した実施例1の作成方法と同一であるため説明を省略する。
【0172】
図14は、ステビア発酵エキスを内包する生分解性ナノスフェアを、走査型電子顕微鏡で観察した結果を説明するための説明図である。図14に示すように、ステビア発酵エキスを内包する生分解性ナノスフェアの粒径は、比較的凝集も抑えられており微粒子表面も、平滑なものが得られた。
【0173】
また、懸濁液を20000rpmで10分間遠心分離した結果、得られた上澄におけるステビア発酵エキスの濃度から、図6に示す、収率を算出する式を用いて、実施例3におけるステビア発酵エキスの収率を求めた。その結果、実施例3におけるステビア発酵エキスの収率は、G45−12−20で65.8%、G80−9−16で63.7%となった。
【0174】
実施例3において、親水性物質だけでなく、親水性物質および疎水性物質の混合物であるステビア発酵エキスを内包したナノスフェアを製造することができた。したがって、親水性物質だけでなく、親水性物質および疎水性物質の混合物を内包するナノスフェアを製造することが可能となった。また、ステビア発酵エキスを内包する高分子微粒子は、ナノメートルオーダーであるため、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0175】
また、ステビア発酵エキスの回収率が60%以上と高いことから、医薬品や、皮膚外用組成物、化粧料、に利用される有効物質等の高価な物質を内包させる場合であっても、好適に有効成分等の高価な物質を回収することができる。したがって、回収した物質を再利用することができ、薬価の不要な上昇を抑えることが可能となる。
【0176】
また、ステビア発酵エキスは、保湿効果が高く、荒れ肌を改善したり、かゆみを抑止したり、炎症を抑えたり、抗ヒスタミン作用を有したりする。したがって、ステビア発酵エキスを内包するナノスフェアを含有する皮膚外用組成物または化粧料を製造すれば、皮膚表面の微細な凹凸にステビア発酵エキスを略均一に行き渡らせることができ、ステビア発酵エキスの保湿効果、荒れ肌改善効果、かゆみ抑止効果、炎症抑止効果および抗ヒスタミン効果を皮膚表面に満遍なく塗布することが可能となる。
【0177】
(実施例4)
本実施例では、両親媒性ポリマーとしてDex−g−PLLAを、疎水性ポリマーとしてEtO−PLLAを、親水性ポリマーとしてPVAを、内包する親水性物質としてBSAを用いた。
【0178】
図15は、実施例4を説明するための説明図である。図15に示すように、試験管に、EtO−PLLAを170mg、Dex−g−PLLAであるG71−13−13(図13(b)参照)を、30mgを入れ、塩化メチレン(CH2Cl2)2.4mlに溶解させた。続いて、BSA5mgを溶解させたPBS100μlを試験管に加え1次溶液を生成した。次に、1次溶液をスパチュラで激しく撹拌しながら、バス型ソニケータで5分間、プローブ型ソニケータで1.5分間超音波を照射し、1次エマルションを調製した。
【0179】
その後、1次エマルション800μlを、0.1%PVAを含むPBS5mlに加えて2次溶液を調製した。次に、2次溶液にプローブ型ソニケータで1.5分間超音波を照射して2次エマルションを調製した。
【0180】
そして、2次エマルションを、0.1%PVAを含むPBS200mlに加え、1時間攪拌し,約40℃で2時間液中乾燥することにより塩化メチレンを除去した懸濁液を得た。その後、懸濁液を20000rpmで10分間遠心分離し、BSAを内包する生分解性ナノスフェアを含む沈殿を得た。かかる沈殿を超純水で洗浄した。この、遠心分離および洗浄からなる操作を数回繰り返した後、沈殿を凍結乾燥して水を除去することで、BSAを内包する生分解性ナノスフェアを得た。
【0181】
(評価)
BSAを内包する生分解性ナノスフェアの形状および粒径を、走査型電子顕微鏡を用いて検討した。走査型電子顕微鏡の試料の作成方法は、上述した実施例1の作成方法と同一であるため説明を省略する。
【0182】
図16は、BSAを内包する生分解性ナノスフェアを、走査型電子顕微鏡で観察した結果を説明するための説明図である。図16に示すように、BSAを内包する生分解性ナノスフェアの粒径は、約400nm〜約600nmであった。また、比較的凝集も抑えられており微粒子表面も、平滑なものが得られた。
【0183】
実施例4におけるナノスフェアの粒径が約400nm〜約600nmと小さいため、親水性物質を内包した生分解性ナノスフェアを、静脈または動脈注射用の医薬品、経皮吸収用の医薬品や化粧料等の皮膚外用組成物に利用することができ、薬物の全身投与、患部へのターゲッティングおよび皮膚への浸透が可能となる。
【0184】
次に、生分解性ナノスフェアのBSA内包率およびBSAの回収率を測定した。まず、サンプル管を6個用意し、そのうち5個のサンプル管には内包物なしの空の生分解性ナノスフェアを、残りの1個のサンプル管には内包率が未知である、BSAを内包した生分解性ナノスフェアを、それぞれ20mg入れた。
【0185】
空の生分解性ナノスフェアを入れた5個のサンプル管には、それぞれBSAの濃度が0、0.1、0.15、0.23、0.3mg/mlとなるように、BSA含有1N水酸化ナトリウム水溶液を3mlずつ入れ、BSAを内包した生分解性ナノスフェアを入れたサンプル管には、1N水酸化ナトリウム水溶液を3ml入れた。
【0186】
上記6個のサンプル管にキャップをして約2日間スターラーで攪拌した。2日後、溶液が透明になり、生分解性ナノスフェアが分解されたのを目視で確認した後、それぞれの溶液を、ディスポーサブルフィルターを用いて濾過した。BSAの濃度が0mg/mlの空の生分解性ナノスフェアを分解した溶液をバックグラウンドとし、波長291nmの吸光度を測定して、検量線を作成した。そして、BSAを内包した生分解性ナノスフェアを分解した溶液の吸光度を測定し、作成した検量線より、生分解性ナノスフェアに内包されたBSAの定量(内包率の測定)を行った。
【0187】
図6に示す、内包効率を算出する式を用いて、実施例4の生分解性ナノスフェアのBSAの内包効率を算出すると、52.9%となった。
【0188】
また、懸濁液を20000rpmで10分間遠心分離した結果、得られた上澄におけるBSAの濃度から、図6に示す、回収率を算出する式を用いて、実施例4におけるBSAの回収率を求めた。その結果、実施例4におけるBSAの回収率は、82.7%となった。
【0189】
BSAの回収率が80%以上と高いことから、医薬品や、皮膚外用組成物、化粧料、に利用される有効成分等の高価な物質を内包させる場合であっても、好適に有効成分等の高価な物質を回収することができる。したがって、回収した物質を再利用することができ、薬価の不要な上昇を抑えることが可能となる。
【0190】
以上、添付図面を参照しながら本発明の好適な実施形態について説明したが、本発明はかかる実施形態に限定されないことは言うまでもない。当業者であれば、特許請求の範囲に記載された範疇内において、各種の変更例または修正例に想到し得ることは明らかであり、それらについても当然に本発明の技術的範囲に属するものと了解される。
【0191】
なお、本明細書のナノスフェアの製造方法における各工程は、必ずしもフローチャートとして記載された順序に沿って時系列に処理する必要はなく、並列的あるいはサブルーチンによる処理を含んでもよい。
【産業上の利用可能性】
【0192】
本発明は、例えば、タンパク質、核酸、薬物、造影剤等の親水性物質、もしくは、脂質、薬物等の疎水性物質のいずれか一方または両方を内包できるナノスフェアの製造方法、ナノスフェア、これを含有する皮膚外用組成物および化粧料に利用することができる。
【符号の説明】
【0193】
S100 …1次溶液生成ステップ
S102 …1次エマルション生成ステップ
S104 …2次溶液生成ステップ
S106 …2次エマルション生成ステップ
S108 …有機溶媒除去ステップ
【特許請求の範囲】
【請求項1】
W/O/Wエマルション法を用いた、ナノスフェアの製造方法であって、
親水性物質を溶解した水系溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、
前記1次溶液に超音波を照射して1次エマルションを生成する1次エマルション生成ステップと、
前記1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、
前記2次溶液に超音波を照射して2次エマルションを生成する2次エマルション生成ステップと、
を含み、
前記ナノスフェアは、親水性物質を内包するナノスフェアの製造方法。
【請求項2】
W/O/Wエマルション法を用いた、ナノスフェアの製造方法であって、
親水性物質を溶解した水系溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、
前記1次溶液に超音波を照射して1次エマルションを生成する1次エマルション生成ステップと、
前記1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、
前記2次溶液に超音波を照射して2次エマルションを生成する2次エマルション生成ステップと、
を含み、
前記ナノスフェアは、親水性物質を内包するナノスフェアの製造方法。
【請求項3】
O/Wエマルション法を用いた、ナノスフェアの製造方法であって、
疎水性物質を溶解した水非混和性有機溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、
前記1次溶液に、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、
前記2次溶液に超音波を照射してエマルションを生成するエマルション生成ステップと、
を含み、
前記ナノスフェアは、疎水性物質を内包するナノスフェアの製造方法。
【請求項4】
O/Wエマルション法を用いた、ナノスフェアの製造方法であって、
疎水性物質を溶解した水非混和性有機溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、
前記1次溶液に、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、
前記2次溶液に超音波を照射してエマルションを生成するエマルション生成ステップと、
を含み、
前記ナノスフェアは、疎水性物質を内包するナノスフェアの製造方法。
【請求項5】
W/O/Wエマルション法を用いた、ナノスフェアの製造方法であって、
親水性物質を溶解した水系溶媒と、疎水性物質を溶解した水非混和性有機溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、
前記1次溶液に超音波を照射して1次エマルションを生成する1次エマルション生成ステップと、
前記1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、
前記2次溶液に超音波を照射して2次エマルションを生成する2次エマルション生成ステップと、
を含み、
前記ナノスフェアは、親水性物質および疎水性物質を内包するナノスフェアの製造方法。
【請求項6】
W/O/Wエマルション法を用いた、ナノスフェアの製造方法であって、
親水性物質を溶解した水系溶媒と、疎水性物質を溶解した水非混和性有機溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、
前記1次溶液に超音波を照射して1次エマルションを生成する1次エマルション生成ステップと、
前記1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、
前記2次溶液に超音波を照射して2次エマルションを生成する2次エマルション生成ステップと、
を含み、
前記ナノスフェアは、親水性物質および疎水性物質を内包するナノスフェアの製造方法。
【請求項7】
前記両親媒性ポリマーは、親水性セグメントと疎水性セグメントとで構成される共重合体であり、
前記親水性セグメントは、電荷を有するアミノ酸を3個以上有するポリペプチド、数平均分子量500〜100000であるポリエチレングリコール、および、多糖、の群から選択される1または複数を含み、
前記疎水性セグメントは、生分解性ポリエステルを含む請求項1から6のいずれか1項に記載の方法。
【請求項8】
前記アミノ酸は、正電荷を有するアミノ酸であるリジン、アルギニンおよびヒスチジンの群および負電荷を有するアミノ酸であるアスパラギン酸およびグルタミン酸の群から選択される1または複数のアミノ酸である請求項7に記載の方法。
【請求項9】
前記多糖は、ヒアルロン酸、アミロース、プルラン、コンドロイチン、コンドロイチン硫酸、デキストラン、デキストラン硫酸、デルマタン硫酸、ケラタン硫酸、ヘパラン硫酸、キチン、キトサン、および、βグルカン、の群から選択される1または複数である請求項7に記載の方法。
【請求項10】
前記両親媒性ポリマーにおける前記多糖の含有量が1〜50質量%である請求項7または5に記載の方法。
【請求項11】
前記生分解性ポリエステルの構成単位は、乳酸、グリコール酸、および、アミノ酸、の群から選択される1または複数である請求項7に記載の方法。
【請求項12】
請求項1から11のいずれか1項に記載のナノスフェアの製造方法を用いて製造されたナノスフェア。
【請求項13】
前記親水性物質もしくは疎水性物質のいずれか一方または両方として、ステビア発酵エキスまたはスフィンゴミエリンを内包する請求項12に記載のナノスフェア。
【請求項14】
請求項1から11いずれか1項に記載のナノスフェアの製造方法を用いて製造されたナノスフェアを含有する皮膚外用組成物。
【請求項15】
前記親水性物質もしくは疎水性物質のいずれか一方または両方として、ステビア発酵エキスまたはスフィンゴミエリンを含有する請求項14に記載の皮膚外用組成物。
【請求項16】
請求項1から11いずれか1項に記載のナノスフェアの製造方法を用いて製造されたナノスフェアを含有する化粧料。
【請求項17】
前記親水性物質もしくは疎水性物質のいずれか一方または両方として、ステビア発酵エキスまたはスフィンゴミエリンを含有する請求項16に記載の化粧料。
【請求項1】
W/O/Wエマルション法を用いた、ナノスフェアの製造方法であって、
親水性物質を溶解した水系溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、
前記1次溶液に超音波を照射して1次エマルションを生成する1次エマルション生成ステップと、
前記1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、
前記2次溶液に超音波を照射して2次エマルションを生成する2次エマルション生成ステップと、
を含み、
前記ナノスフェアは、親水性物質を内包するナノスフェアの製造方法。
【請求項2】
W/O/Wエマルション法を用いた、ナノスフェアの製造方法であって、
親水性物質を溶解した水系溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、
前記1次溶液に超音波を照射して1次エマルションを生成する1次エマルション生成ステップと、
前記1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、
前記2次溶液に超音波を照射して2次エマルションを生成する2次エマルション生成ステップと、
を含み、
前記ナノスフェアは、親水性物質を内包するナノスフェアの製造方法。
【請求項3】
O/Wエマルション法を用いた、ナノスフェアの製造方法であって、
疎水性物質を溶解した水非混和性有機溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、
前記1次溶液に、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、
前記2次溶液に超音波を照射してエマルションを生成するエマルション生成ステップと、
を含み、
前記ナノスフェアは、疎水性物質を内包するナノスフェアの製造方法。
【請求項4】
O/Wエマルション法を用いた、ナノスフェアの製造方法であって、
疎水性物質を溶解した水非混和性有機溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、
前記1次溶液に、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、
前記2次溶液に超音波を照射してエマルションを生成するエマルション生成ステップと、
を含み、
前記ナノスフェアは、疎水性物質を内包するナノスフェアの製造方法。
【請求項5】
W/O/Wエマルション法を用いた、ナノスフェアの製造方法であって、
親水性物質を溶解した水系溶媒と、疎水性物質を溶解した水非混和性有機溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒と、疎水性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、
前記1次溶液に超音波を照射して1次エマルションを生成する1次エマルション生成ステップと、
前記1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、
前記2次溶液に超音波を照射して2次エマルションを生成する2次エマルション生成ステップと、
を含み、
前記ナノスフェアは、親水性物質および疎水性物質を内包するナノスフェアの製造方法。
【請求項6】
W/O/Wエマルション法を用いた、ナノスフェアの製造方法であって、
親水性物質を溶解した水系溶媒と、疎水性物質を溶解した水非混和性有機溶媒と、両親媒性ポリマーを溶解した水非混和性有機溶媒とを混合し、1次溶液を生成する1次溶液生成ステップと、
前記1次溶液に超音波を照射して1次エマルションを生成する1次エマルション生成ステップと、
前記1次エマルションに、親水性ポリマーを溶解した水系溶媒を添加し、2次溶液を生成する2次溶液生成ステップと、
前記2次溶液に超音波を照射して2次エマルションを生成する2次エマルション生成ステップと、
を含み、
前記ナノスフェアは、親水性物質および疎水性物質を内包するナノスフェアの製造方法。
【請求項7】
前記両親媒性ポリマーは、親水性セグメントと疎水性セグメントとで構成される共重合体であり、
前記親水性セグメントは、電荷を有するアミノ酸を3個以上有するポリペプチド、数平均分子量500〜100000であるポリエチレングリコール、および、多糖、の群から選択される1または複数を含み、
前記疎水性セグメントは、生分解性ポリエステルを含む請求項1から6のいずれか1項に記載の方法。
【請求項8】
前記アミノ酸は、正電荷を有するアミノ酸であるリジン、アルギニンおよびヒスチジンの群および負電荷を有するアミノ酸であるアスパラギン酸およびグルタミン酸の群から選択される1または複数のアミノ酸である請求項7に記載の方法。
【請求項9】
前記多糖は、ヒアルロン酸、アミロース、プルラン、コンドロイチン、コンドロイチン硫酸、デキストラン、デキストラン硫酸、デルマタン硫酸、ケラタン硫酸、ヘパラン硫酸、キチン、キトサン、および、βグルカン、の群から選択される1または複数である請求項7に記載の方法。
【請求項10】
前記両親媒性ポリマーにおける前記多糖の含有量が1〜50質量%である請求項7または5に記載の方法。
【請求項11】
前記生分解性ポリエステルの構成単位は、乳酸、グリコール酸、および、アミノ酸、の群から選択される1または複数である請求項7に記載の方法。
【請求項12】
請求項1から11のいずれか1項に記載のナノスフェアの製造方法を用いて製造されたナノスフェア。
【請求項13】
前記親水性物質もしくは疎水性物質のいずれか一方または両方として、ステビア発酵エキスまたはスフィンゴミエリンを内包する請求項12に記載のナノスフェア。
【請求項14】
請求項1から11いずれか1項に記載のナノスフェアの製造方法を用いて製造されたナノスフェアを含有する皮膚外用組成物。
【請求項15】
前記親水性物質もしくは疎水性物質のいずれか一方または両方として、ステビア発酵エキスまたはスフィンゴミエリンを含有する請求項14に記載の皮膚外用組成物。
【請求項16】
請求項1から11いずれか1項に記載のナノスフェアの製造方法を用いて製造されたナノスフェアを含有する化粧料。
【請求項17】
前記親水性物質もしくは疎水性物質のいずれか一方または両方として、ステビア発酵エキスまたはスフィンゴミエリンを含有する請求項16に記載の化粧料。
【図1】


【図2】


【図3】


【図4】


【図6】


【図7】


【図8】


【図10】


【図11】


【図12】


【図13】


【図15】


【図5】


【図9】


【図14】


【図16】




【図2】


【図3】


【図4】


【図6】


【図7】


【図8】


【図10】


【図11】


【図12】


【図13】


【図15】


【図5】


【図9】


【図14】


【図16】


【公開番号】特開2011−11144(P2011−11144A)
【公開日】平成23年1月20日(2011.1.20)
【国際特許分類】
【出願番号】特願2009−157496(P2009−157496)
【出願日】平成21年7月2日(2009.7.2)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 発行者名 日本DDS学会 刊行物名 第25回 日本DDS学会 プログラム予稿集 発行年月日 平成21年6月9日
【出願人】(399030060)学校法人 関西大学 (208)
【出願人】(599047125)株式会社シャローム (5)
【Fターム(参考)】
【公開日】平成23年1月20日(2011.1.20)
【国際特許分類】
【出願日】平成21年7月2日(2009.7.2)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 発行者名 日本DDS学会 刊行物名 第25回 日本DDS学会 プログラム予稿集 発行年月日 平成21年6月9日
【出願人】(399030060)学校法人 関西大学 (208)
【出願人】(599047125)株式会社シャローム (5)
【Fターム(参考)】
[ Back to top ]

