ナノセル薬物送達系
【課題】併用療法において、ある因子の前又は後に、もう一つの因子が送達され得る薬物送達系を提供すること。
【解決手段】ナノセルは、異なる作用様式又は異なる薬物動態を有する二つの異なる治療因子の連続的な送達を可能にする。ナノセルは、第一の因子を有するナノコアを、第二の因子を含有している脂質小胞の内部に封入することにより形成される。ナノコアの因子が放出される前に、外側脂質の区画の因子がまず放出され、その効果を発揮することができる。ナノセル送達系は、癌、喘息のような炎症性疾患、慢性関節リウマチのような自己免疫疾患、感染性疾患、及びてんかんのような神経学的疾患のような疾患に罹患した患者への送達のための薬学的組成物へと製剤化され得る。
【解決手段】ナノセルは、異なる作用様式又は異なる薬物動態を有する二つの異なる治療因子の連続的な送達を可能にする。ナノセルは、第一の因子を有するナノコアを、第二の因子を含有している脂質小胞の内部に封入することにより形成される。ナノコアの因子が放出される前に、外側脂質の区画の因子がまず放出され、その効果を発揮することができる。ナノセル送達系は、癌、喘息のような炎症性疾患、慢性関節リウマチのような自己免疫疾患、感染性疾患、及びてんかんのような神経学的疾患のような疾患に罹患した患者への送達のための薬学的組成物へと製剤化され得る。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願)
本出願は、米国特許法第119条(e)項に基づいて、2004年3月2日に出願された「ナノセル薬物送達系」という発明の名称の米国仮出願第USSN60/549,280号からの優先権を主張し、それらは、本明細書中に参考として援用される。
【背景技術】
【0002】
(発明の背景)
合理的な薬物療法のための必要条件は、薬物の効果が予測され得るような、正確な診断、疾患の病態生理学の知識、健常者及び疾患者における基本的な薬物療法学の知識、並びにこれらの関係の適切な予想である(非特許文献1)。ゲノム、プロテオーム、又はグリコームに関して、生物医学的科学においてなされた進歩は、多くの疾患の根底にある分子メカニズムを解明し、シグナル伝達カスケード、トランスクリプトーム、及びグリコームの明らかに変化する複雑なネットワークを関連付けた。ほとんどの病態生理学的状態において、このことは、治療結果をもたらす機能の回復又は欠損についての調節のための効果的な標的を明らかにし得る。しかしながら、疾患組織に、もしくは疾患組織内の空間的に別個の標的細胞にさえ、別の経路が関与している点、又は疾患組織内で起こる時間的事象が、最終表現型として現れる点に、複雑さがある。論理的なストラテジーは、複数のレベルで疾患を標的とすることであり、それは、複数の活性因子又は薬物の併用療法を使用して達成され得る。しかしながら、このことは、多くの場合、あまりにも多い薬物の服用における患者のコンプライアンス、又は薬物動態(吸収、分布、生体内変換、及び排出)並びに薬力学(薬物の生化学的及び生理学的な効果並びにそれらの作用機構)のレベルにおける薬物−薬物相互作用、又は毒物学により制限されるため、ほとんどの条件において最適なストラテジーではない(非特許文献2)。このような相互作用は、活性因子の実際の治療効果を低下させ得るか、又はその毒性を増加させ得、その比率は治療指数として定義される。本発明による上記の制限の解決は、医学及び治療学を確実に革新する。
【0003】
近代医療の限界をより理解するための適切な例は、腫瘍の処置である。米国の全ての人の3分の1が、癌を発症する。米国において、5年生存率は、早期診断及び治療の進歩の結果として、ほぼ50パーセントへと劇的に上昇したが、癌は依然として心疾患に次いで最も多い死因である。アメリカ人の20パーセントが癌で死亡しており、その半分が、肺癌、乳癌、及び結腸直腸癌による。
【0004】
癌を罹患する患者のための有効な処置を計画することは、大きな難題となっている。外科的切除、放射線外部照射療法、及び/又は全身化学療法という現在のレジメンは、ある種の悪性疾患においては部分的に成功しているが、満足な結果を与えない場合もある。脳悪性疾患のようないくつかの悪性疾患において、このレジメンは、1年未満の生存期間の中央値を与える。例えば、切除された悪性神経膠腫の90%は、1年以内に元の腫瘍部位の2センチメートル以内に再発する。
【0005】
全身化学療法の使用は、数種の癌においては有効であるが、結腸癌直腸、食道癌、肝臓癌、膵臓癌及び腎臓癌及び皮膚癌の治療においては、わずかにしか成功していない。これらの型の癌の治療のための全身化学療法による主要な問題は、腫瘍増殖の抑制を達成するために必要とされる全身用量が、高頻度に、受容可能でない全身毒性をもたらすという点である。例えば、連続全身注入によって、腫瘍部位への化学療法因子の送達を改良する試みは、器官指向化(organ−directed)化学療法の進歩をもたらした。しかしながら、抗癌薬の連続注入は、一般に、パルス注入又は短期注入を超える明らかな利益を示していない。現在病院で使用されている抗腫瘍性因子又は化学療法因子には、(a)メクロレタミン、シクロホスファミド、イホスファミド、メルファラン(melphaan)、クロラムブシル、ヘキサメチルメラミン、チオテパ、ブスルファン、カルムスチン、ロムスチン、セムスチン、ストレプトゾシン、ダカルバジン等のようなアルキル化剤;(b)メトトレキサート、5−FU、FudR、シタラビン、6MP、チオグアニン、ペントスタチン等のような代謝拮抗薬;(c)タキソール、ビンブラスチン、ビンクリスチン、エトポシド、テニポシド等のような天然物;(d)ダクチノマイシン、ダウノルビシン、ドキソルビシン、ブレオマイシン、プリカマイシン、マイトマイシンc等のような抗生物質;(e)L−アスパラギナーゼ、ヘパリナーゼ、コンドロイチナーゼ等のような酵素;(f)インターフェロン−α、インターフェロン−γ、腫瘍壊死因子等のようなインターフェロン及びインターロイキン;(g)シスプラチン、カルボプラチン、又はそれらの誘導体のような白金配位錯体;及び(h)ミトキサントロン、ビスクロロエチルニトロソウレア、ヒドロキシ尿素、クロロエチル−シクロヘキシルニトロソウレア、プレドニゾン、ジエチルスチルベストロール、メドロキシプロゲステロン、タモキシフェン、ミトタン、プロカルバジン、アミノグルテチミド、プロゲスチン、アンドロゲン、抗アンドロゲン(antiadrogens)、ロイプロリド等のようなその他の種々の因子が含まれる。
【0006】
抗腫瘍療法の最近の進歩は、腫瘍の発達における重要な段階としての血管形成の同定であった。既存の血管床からの新たな血管の発達である血管形成は、腫瘍の急激な増大及び遠位転移の発達の基礎となる(非特許文献3)。腫瘍は、体積1〜2mm3の段階に達すると、さらなる増殖のための栄養素を必要とする。腫瘍のコアの細胞が死滅し始め、それが、最も近い血管からの内皮細胞の補充をもたらす、増殖因子及び血管形成促進シグナルに富んだ壊死コア(necrotic core)となる。別の連続的な段階において遂行される血管形成は、複数の媒介物質の相互作用により引き起こされる、腫瘍細胞と細胞外マトリックスと内皮細胞との間の空間−時間的相互作用の頂点である(非特許文献4)。この複雑な過程の根底にある事象についての理解、及びいくつかの媒介物質の作用機構の解明は、腫瘍管理のための新規ストラテジーとしての血管形成の治療的ターゲティングという刺激的な可能性を開き、60を超える化合物が臨床的な開発段階にある。
現在、血管形成インヒビターには、直接型及び間接型という二つのクラスが存在する。ビタキシン(vitaxin)、アンジオスタチン、エンドスタチン、コンブレタスタチン(combretastatin)、2−メトキシエストラジオール、アバスチン、カンスタチン(canstatin)等のような直接型の血管形成インヒビターは、内皮細胞の増殖、遊走、もしくは管形成を防止するか、又は腫瘍から分泌された血管形成因子に応答した細胞死を細胞が回避することを可能にする。間接型の血管形成インヒビターは、一般に、血管形成を活性化する腫瘍タンパク質の発現を防止するか、もしくはその活性を阻止するか、又は内皮細胞におけるその受容体の発現を阻止する(非特許文献5)。いずれの場合にも、抗血管形成療法の最終結果は、腫瘍の飢餓をもたらす、増殖中の腫瘍への血管供給の停止である。従って、抗血管形成療法は、腫瘍における低酸素をもたらす(非特許文献6)。この低酸素の状況を克服するために、腫瘍は、増殖因子を産生し始め、これらも、腫瘍がはるかに小さかった際の血管形成効果に類似した血管形成効果を発揮する。臨床上、このことは、抗血管形成療法が中止されるや否やの腫瘍増殖の噴出という結果となる(非特許文献7)。同じ増殖因子は、腫瘍細胞の一部がアポトーシス又は細胞死を受けるのを防止することもできる。さらに、固形腫瘍の領域内の異常又は不活発な血流による腫瘍低酸素は、微小環境により媒介される放射線及び化学療法薬の両方に対する耐性をもたらし得る(非特許文献8)。従って、抗血管形成療法の成功によって、血管依存性がより低い変異腫瘍細胞が、時間の経過とともに選択される可能性もある。このことは、より慣例の形態の化学療法に対する応答の欠損又は減弱した応答をもたらす。このことは、生体内還元性の低酸素細胞の細胞障害性因子と抗血管形成因子との併用使用によって克服され得る(非特許文献9)。癌/腫瘍の処置のための、抗腫瘍性因子又は化学療法因子と抗血管形成薬との併用療法の使用は、複数の特許出願に開示されている(例えば、特許文献1;特許文献2;及び特許文献3;特許文献4;特許文献5及び特許文献6(これらの各々は、本明細書中に参考として援用される);特許文献7;特許文献8;特許文献9;特許文献10(これらの各々は、本明細書中に参考として援用される)を参照のこと)。しかしながら、各因子が所望の最大の効果を提供するような、併用療法を送達するための薬物送達系の必要性が残存している。そのような系は、癌の治療においてのみ有用ではなく、自己免疫疾患(例えば、慢性関節リウマチ)、炎症性疾患(例えば、喘息)、神経学的疾患(例えば、てんかん)、及び眼科学的(ophthamological)疾患(例えば、糖尿病性網膜症)のようなその他の疾患の処置における使用にも見出される。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】米国特許第6,147,060号明細書
【特許文献2】米国特許第6,140,346号明細書
【特許文献3】米国特許第5,856,315号明細書
【特許文献4】米国特許第5,731,325号明細書
【特許文献5】米国特許第5,710,134号明細書
【特許文献6】米国特許第5,574,026号明細書
【特許文献7】米国特許出願公開第2002/0041880号明細書
【特許文献8】米国特許出願公開第2002/0107191号明細書
【特許文献9】米国特許出願公開第2002/0128228号明細書
【特許文献10】米国特許出願公開第2002/0111362号明細書
【非特許文献】
【0008】
【非特許文献1】DiPiroら、編、「Pharmacotherapy−A pathophysiologic approach」、第2版
【非特許文献2】GoodmanおよびGilman、「The Pharmacological Basis of Therapeutics」、第9版
【非特許文献3】Folkman、Nat Med、1995年1月、第1巻、p.27−31
【非特許文献4】GriffoenおよびMolema、Pharmacol.Review、2000年6月、第52巻、p.237−68
【非特許文献5】KerbelおよびFolkman、Nature Reviews Cancer、2002年10月、p.727−739
【非特許文献6】Yu JLら、Science、2002年2月、第295巻、p.1526−1528
【非特許文献7】Boehmら、Nature、1997年11月、第390巻、p.404−407
【非特許文献8】Yuら、Differentiation、2002年12月、第70巻、p.599−609
【非特許文献9】Yu JL、Differentiation、2002年12月、第70巻、p.599−609
【発明の概要】
【課題を解決するための手段】
【0009】
(発明の要旨)
本発明は、併用療法において使用される多くの薬物が、異なるメカニズムを介して、及び/又は異なるタイムスケールで作用するという認識に端を発する。従って、併用療法において、薬物がその標的に到達することができないか、又は適切な時点でその標的に到達しない場合には、薬物の効力の全てではないにしても大部分が失われる。例えば、より慣例的な抗腫瘍性因子及び抗血管形成因子の組み合わせによる癌の処置において、最適には、抗腫瘍性因子を輸送する血流が腫瘍細胞に到達するのを抗血管形成因子が防止する前に、抗腫瘍性因子が腫瘍に到達しその効果を発揮するべきである。抗血管形成因子によって機能性の血管系が停止される前に、抗腫瘍性因子が腫瘍に到達しなければ、患者は、抗腫瘍性因子の利益を受容することなく、その副作用に苦しむことになる。従って、癌においても、その他の多くの疾患においても、異なる時間間隔での複数の因子の送達を可能にする薬物送達系が必要とされている。
【0010】
本発明は、併用療法において、ある因子の前又は後に、もう一つの因子が送達され得る薬物送達系を提供する。その薬物送達系は、バルーン内のバルーンの概念に基づく。薬学的因子を含有しているナノコア(例えば、ナノ粒子、ナノチューブ、ナノワイヤ、量子ドット等)が、もう一つの薬学的因子を含有している脂質小胞、マトリックス、又はシェルに封入され、ナノセルを形成する。ナノセルの外側部分(例えば、脂質小胞、シェル、又はマトリックス)の薬学的因子が、まず放出され、続いて、ナノコアの溶解及び/又は分解により第二の薬学的因子の放出が起こる。本発明のナノセルは、最大直径10nm〜500マイクロメートル、好ましくは最大直径80nm〜50マイクロメートルのサイズの範囲である。
【0011】
例えば、癌の処置においては、抗血管形成因子が、脂質小胞内に負荷され、内側ナノ粒子内の抗腫瘍性因子/化学療法因子の前に放出される。このことは、腫瘍に栄養供給する血管系の崩壊をもたらし、抗腫瘍性因子を負荷されたナノコアが、脱出経路のない腫瘍の内部に捕獲されるようにもする。抗腫瘍性因子は、徐々に放出され、栄養素が欠乏した腫瘍細胞の死滅をもたらす。換言すると、この二重バルーン薬物送達系は、抗腫瘍性因子を腫瘍に負荷し、次いで、腫瘍への血液供給を遮断することを可能にする。この連続的な過程は、毒性の化学療法因子/抗腫瘍性因子の腫瘍内への捕獲をもたらして、腫瘍細胞に対する増加した選択的な毒性を与え、そして、機能的に無血管である腫瘍部位から漏出し得ないために、より少ない薬物が体循環中に存在することになり、より少ない副作用をもたらす。腫瘍に捕獲された細胞障害性化学療法セルが、別のやり方では血管停止に起因する低酸素性の増殖因子リッチ(growth factor−rich)な環境において生存する腫瘍細胞を死滅させるため、この技術は、低酸素警告(hypoxia caveat)をも克服する。
【0012】
内側ナノ粒子(別名ナノコア)は、最大寸法およそ10〜20000nmであり、ポリマーマトリックスに封入された第一の治療因子を含有している。これらのナノコアは、当該分野において公知の、脂質、タンパク質、炭水化物、単純結合体、及びポリマー(例えば、PLGA、ポリエステル、ポリアミド、ポリカーボネート、ポリ(β−アミノエステル)、ポリ尿素、ポリカルバメート、タンパク質等)のような材料、並びに方法(例えば、ダブルエマルジョン、噴霧乾燥、転相等)のいずれかを使用して調製される。薬学的又は診断的な因子は、ナノコアに負荷され得るか、又は共有結合的に結合され得るか、又は静電荷を通して結合され得るか、又はイオン結合的に(electrovalently)に結合され得るか、又はリンカーを通して結合され得る。この結果により、ゆっくりとした、持続性および/又は遅延性のナノコアからの(一つ又は複数の)因子が放出される。好ましくは、因子がナノコアに共有結合的に結合される場合、そのリンカー又は結合は、生理学的条件下で生分解性又は加水分解性であり、例えば、酵素分解に対して感受性である。ナノコアは、実質的に球状のナノ粒子、ナノリポソーム、ナノワイヤ、量子ドット、又はナノチューブであり得る。
【0013】
ナノセルを形成させるためには、脂質相に分配された第二の治療因子を有する脂質により、ナノコアをコーティングする。ナノセルは、第二の治療因子を有する別個のポリマー組成物により、ナノコアをコーティングすることによっても形成され得る。好ましくは、ナノシェル又はナノセル周囲のマトリックスは、それが捕獲する一つ又は複数の因子の速い放出を可能にする組成を含んでいるべきである。従って、ある種の実施形態において、この因子の効果は、ナノコアに負荷された活性因子が治療レベルに達する前に、開始する。従って、第二の治療因子は、ナノコアの外部にあるが、最大直径およそ50〜20000nmのナノセルの脂質膜の内部にある。ナノセルは、粒子を安定化するか、又は粒子の外側にターゲティング剤を添加するため、さらにコーティングされてもよい。
【0014】
二つ以上の薬学的因子が、本発明のナノセルを使用して送達され得る。好ましくは、一つの因子又は因子の組み合わせが、第二の因子又は因子の組み合わせの前に最適に送達される。ある種の実施形態において、因子は作用様式又は標的が異なっていてもよい。例えば、ある種の実施形態において、ナノコアの因子がシグナル伝達経路を阻害することができ、そしてナノセルの外側の区画の因子が、異なる経路又は同一経路内の異なるシグナルに影響を与える。二つの因子は、相乗的に作用してもよい。その他の実施形態において、因子は、薬物動態が異なっていてもよい。例えば、関節炎の処置においては、メトトレキサート又はコルヒチンがナノコアに封入され、かつ抗血管形成因子がナノセルの外側脂質部分に封入される。喘息又は慢性閉塞性肺疾患(COPD)の処置においては、抗炎症性因子(例えば、コルチコステロイド、リポキシゲナーゼインヒビター、肥満細胞安定化剤)が、ナノコアに提供され、気管支拡張剤(例えば、β−アゴニスト)がナノセルの外側の区画に提供される。因子を脳へ送達する場合には、血液脳関門を通過させるため、カオトロピック剤、又は薬物が血液脳関門を通過することを可能にするその他の因子が、粒子の外側部分に提供され、抗発作因子のような神経活性剤がナノコアに提供される。その他の実施形態において、ナノセルは、嚢胞性繊維症を罹患する患者を処置するために使用され得る。例えば、ナノセルは、抗生物質及び抗炎症性因子を送達するために使用され得る。その他の実施形態において、ナノセルは、ワクチンを送達するための媒体として使用され、例えば、抗原がナノコアに負荷され得、そしてアジュバントのような炎症性の因子がナノセルの外側部分に含まれ得る。
【0015】
別の局面において、本発明は、本発明のナノセルを有する薬学的組成物を提供する。これらの組成物は、他の薬学的に受容可能な賦形剤も含み得る。これらの組成物は、錠剤、懸濁物、溶液、カプセル、エマルジョン等の形態であり得る。
【0016】
本発明は、適切な薬学的因子が負荷されたナノセルを、疾患に罹患した患者へ投与することにより、様々な疾患を処置する方法も提供する。これらの方法には、癌、炎症性疾患、眼科学的疾患、神経学的疾患、感染性疾患、及び自己免疫疾患を処置する方法が含まれる。治療的に有効な量の因子を送達し、所望の結果を達成するために必要とされる量の因子が、ナノセルに負荷される。当業者により認識されるように、使用される因子及び用量、並びにナノセル内の賦形剤は、(腎臓及び肝臓の機能を含む)処置を受ける患者、処置される疾患、送達すべき因子の種々の薬理学的及び薬物動態学的な特徴、臨床的環境、投与様式等に依存する。ナノセルは、公知の投与経路を使用して投与され得る。ある種の実施形態において、ナノセルは、非経口的に送達される。その他の実施形態において、ナノセルは、例えば、噴霧器、スピンへラー、又はディスクへラーを使用して、吸入により送達される。
【0017】
インビボ環境に類似した状況で、一緒に又は別々に、抗血管形成因子及び化学療法因子をスクリーニングすることを可能にするアッセイ系を提供することが、本発明のさらなる目的であった。これは、細胞外マトリックス上で増殖する細胞を含み、インビボ条件を正確にシミュレートする。このアッセイにおいて、腫瘍細胞が組織培養プレート上に播種される前に、内皮細胞が播種され、細胞外マトリックス上で増殖させられ得る。腫瘍細胞を検出するため、それらは、緑色蛍光タンパク質(GFP)のような蛍光性の遺伝子産物を発現するようトランスフェクトされる。内皮細胞は、蛍光色素により染色される。本発明のアッセイ法を実施するために必要とされる必要な因子を有するキットも、本発明により提供される。
【0018】
(定義)
「アジュバント」:用語アジュバントとは、免疫応答の非特異的な調節因子である化合物をいう。ある種の好ましい実施形態において、アジュバントは免疫応答を刺激する。任意のアジュバントが、本発明に従って使用され得る。多数のアジュバント化合物が公知であり;多くのそのような化合物の有用な概要が、国立衛生研究所(National Instisutes of Health)により用意されている(Allison Dev.Biol.Stand.92:3−11,1998;Unkelessら、Annu.Rev.Immunol.6:251−281,1998;及びPhillips ら、Vaccine 10:151−158,1992(それらの各々は、本明細書中に参考として援用される)も参照のこと)。
【0019】
「動物」:本明細書中で使用される場合、用語動物とは、ヒト、並びに、例えば、哺乳類、鳥類、爬虫類、両生類、及び魚類を含む非ヒト動物をいう。好ましくは、非ヒト動物は、哺乳類(例えば、げっ歯類、マウス、ラット、ウサギ、サル、イヌ、ネコ、霊長類、又はブタ)である。動物はトランスジェニック動物であってもよい。
【0020】
「抗体」:用語抗体とは、天然であるか、又は完全にもしくは部分的に合成により作製されたか否かにかかわらず、免疫グロブリンをいう。特異的結合能力を維持しているその誘導体も、全て、この用語に含まれる。この用語には、免疫グロブリン結合ドメインと相同な又は概して相同な結合ドメインを有しているあらゆるタンパク質も包含される。これらのタンパク質は、天然起源に由来してもよいし、又は部分的にもしくは完全に合成により作製されてもよい。抗体は、モノクローナルであってもよいし又はポリクローナルであってもよい。抗体は、ヒトクラス:IgG、IgM、IgA、IgD、及びIgEのいずれかを含む任意の免疫グロブリンクラスのメンバーであり得る。しかしながら、IgGクラスの誘導体が、本発明において好ましい。
【0021】
「抗体フラグメント」:用語抗体フラグメントとは、全長未満の抗体のあらゆる誘導体をいう。好ましくは、抗体フラグメントは、全長抗体の特異的結合能力の少なくとも有意な一部分(protion)を保持している。抗体フラグメントの例には、Fab、Fab’、F(ab’)2、scFv、Fv、dsFv二重特異性抗体(diabody)、及びFdフラグメントが含まれるが、これらに制限はされない。抗体フラグメントは、任意の手段によって作製され得る。例えば、抗体フラグメントは、インタクトな抗体の断片化により酵素的もしくは化学的に作製されてもよいし、又は部分抗体配列をコードする遺伝子から組換えにより作製されてもよい。あるいは、抗体フラグメントは、完全に又は部分的に合成により作製され得る。抗体フラグメントは、必要に応じて、単鎖抗体フラグメントであってもよい。あるいは、フラグメントは、例えば、ジスルフィド結合により共に連結された複数の鎖を含んでいてもよい。フラグメントは、必要に応じて、多分子複合体であってもよい。機能性の抗体フラグメントは、代表的には少なくとも約50アミノ酸を含み、より代表的には少なくとも約200アミノ酸を含む。
【0022】
単鎖Fv(scFv)は、ポリペプチドリンカーにより相互に共有結合的に結合された、軽鎖可変部(VL)及び重鎖可変部(VH)のみからなる組換え抗体フラグメントである。VL又はVHのいずれかが、NH2−末端ドメインであり得る。ポリペプチドリンカーは、2個の可変ドメインが重大な立体障害なしに架橋される限り、種々の長さ及び組成を有し得る。代表的には、リンカーは、グリシン残基及びセリン残基と、可溶性のための散在しているいくつかのグルタミン酸残基又はリジン残基との伸長から主として構成される。
【0023】
二重特異性抗体は、scFvの二量体である。二重特異性抗体の成分は、代表的には、大部分のscFvより短いペプチドリンカーを有しており、それらは、二量体として会合しやすい。
【0024】
Fvフラグメントは、非共有結合性の相互作用によりつなぎ合わされた一つのVHドメイン及び一つのVLドメインからなる抗体フラグメントである。用語dsFvとは、VH−VL対を安定化するために操作された分子間ジスルフィド結合を有するFvをいうために本明細書中に使用される。
【0025】
F(ab’)2フラグメントは、pH4.0〜4.5における酵素ペプシンによる消化により免疫グロブリン(代表的にはIgG)から入手されるものと本質的に等しい抗体フラグメントである。このフラグメントは、組換えにより作製されてもよい。
【0026】
Fabフラグメントは、F(ab’)2フラグメント内の二つの重鎖片をつないでいる一つ又は複数のジスルフィド架橋の還元により入手されるものと本質的に等しい抗体フラグメントである。Fab’フラグメントは、組換えにより作製されてもよい。
【0027】
Fabフラグメントは、酵素パパインによる免疫グロブリン(代表的にIgG)の消化により入手されるものと本質的に等しい抗体フラグメントである。Fabフラグメントは、組換えにより作製されてもよい。Fabフラグメントの重鎖セグメントはFd片である。
【0028】
「会合した」:本明細書において記載されるように、二つの要素が相互に「会合した」場合、それらは、直接又は間接の共有結合性又は非共有結合性の相互作用により結合されている。好ましくは、会合は共有結合性である。望ましい非共有結合性の相互作用としては、水素結合、ファンデルワールス相互作用、疎水性相互作用、磁気相互作用、静電相互作用等が挙げられる。
【0029】
「生体適合性」:本明細書中で使用される場合、用語「生体適合性」とは、細胞にとって毒性でない化合物を記載するために意図される。インビトロでの細胞への添加が、30%、20%、10%、5%、又は1%以下の細胞死をもたらし、インビボで炎症又はその他のそのような不要な有害効果を誘導しない場合、その化合物は「生体適合性」である。
【0030】
「生分解性」:本明細書において使用される場合、「生分解性」化合物とは、細胞へ導入された場合に、細胞に対する有意な毒性作用なしに(即ち、細胞の約30%、20%、10%、5%、又は1%未満が死滅する)、細胞が再使用又は処分することができる成分へと細胞機構によって分解されるものである。
【0031】
「有効量」:一般に、活性因子又は微粒子の「有効量」とは、所望の生物学的応答を誘発するのに必要な量をいう。当業者により認識されるように、微粒子の有効量は、所望の生物学的終点、送達すべき因子、封入マトリックスの組成、標的組織等のような要因に依って変動し得る。例えば、送達すべき抗てんかん因子を含有している微粒子の有効量は、発作及び/又は不要な電気活動の重篤度又は頻度の低下をもたらす量である。別の例において、個体の心臓に送達すべき抗不整脈剤を含有している微粒子の有効量は、不要な電気活動の量もしくは頻度の減少、又は心臓不整脈の臨床的徴候(例えば、ECG所見)もしくは症状(例えば、失神エピソード)の減少をもたらす量である。
【0032】
「ナノセル」:本発明によると、用語「ナノセル」とは、マトリックス又はシェルにナノコアが包囲又は封入されている粒子をいう。換言すると、より大きな粒子の内部のより小さな粒子、又はバルーン内のバルーンである。ナノセルは、好ましくは、ある因子をナノコアに有し、異なる因子をナノセルの外側部分に有している。ある種の好ましい実施形態において、ナノセルはリポソーム内のナノコアである。その他の実施形態において、ナノコアは、ポリマー性のマトリックス又はシェル(例えば、多糖マトリックス)により包囲されている。
【0033】
「ナノコア」:本明細書中で使用される場合、用語「ナノコア」とは、ナノセル内のあらゆる粒子をいう。ナノコアは、微粒子、ナノ粒子、量子ドット、ナノデバイス、ナノチューブ、ナノシェル、又はナノセル内に含まれる適切な寸法のその他の組成物であり得る。好ましくは、ナノコアは、ナノセルの外側部分の因子が放出されるより遅く、又はその後に放出されるべき因子を含む。
【0034】
「ペプチド」又は「タンパク質」:本発明によると、「ペプチド」又は「タンパク質」は、ペプチド結合により共に結合された一連の少なくとも3つのアミノ酸を含む。「タンパク質」及び「ペプチド」という用語は、交換可能に使用され得る。ペプチドとは、個々のペプチドをいってもよいし、又はペプチドの集合をいってもよい。本発明のペプチドは、好ましくは、天然アミノ酸のみを含有しているが、非天然のアミノ酸(即ち、自然界には存在しないが、ポリペプチド鎖へ組み込まれ得る化合物)及び/又は当該分野において公知のアミノ酸類似体が、代替として、利用され得る。また、本発明のペプチド内のアミノ酸のうちの一つ以上が、例えば、炭水化物基、リン酸基、ファルネシル基、イソファルネシル基、脂肪酸基、結合、官能化、又はその他の修飾のためのリンカー等のような化学的要素の付加により修飾され得る。好ましい実施形態において、ペプチドの修飾は、ペプチドをより安定なものにする(例えば、より大きなインビボ半減期)。これらの修飾には、ペプチドの環化、D−アミノ酸の取り込み等が含まれ得る。いずれの修飾も、ペプチドの所望の生物学的活性に実質的に干渉するべきでない。
「低分子」:本明細書において使用される場合、用語「低分子」とは、比較的低い分子量を有しており、かつタンパク質、ポリペプチド、又は核酸でない、天然に存在するものであってもよいし、又は(例えば、化学合成を介して)人工的に作出されたものであってもよい有機化合物をいう。代表的には、低分子は、約1500g/mol未満の分子量を有している。また、低分子は、代表的には、複数の炭素−炭素結合を有している。公知の天然に存在する低分子には、ペニシリン、エリスロマイシン、タキソール、シクロスポリン、及びラパマイシンが含まれるが、これらに限定されない。公知の合成低分子には、アンピシリン、メチシリン、スルファメトキサゾール、及びスルホンアミドが含まれるが、これらに限定されない。
例えば、本発明は以下の項目を提供する。
(項目1)
脂質小胞内にナノ粒子を含む粒子であって、該ナノ粒子が第一の因子を含み;そして脂質小胞が第二の因子を含む、粒子。
(項目2)
マトリックス内に封入されたナノ粒子を含む粒子であって、該ナノ粒子が第一の因子を含み;そして該マトリックスが第二の因子を含む、粒子。
(項目3)
前記第一の因子が因子の組み合わせである、項目1または2に記載の粒子。
(項目4)
前記第二の因子が因子の組み合わせである、項目1または2に記載の粒子。
(項目5)
前記因子が、薬学的、診断的、または予防的な因子である、項目1または2に記載の粒子。
(項目6)
前記因子が、薬学的因子である、項目1または2に記載の粒子。
(項目7)
前記第一の因子および前記第二の因子の作用様式が異なる、項目1または2に記載の粒子。
(項目8)
前記第一の因子および前記第二の因子の薬物動態が異なる、項目1または2に記載の粒子。
(項目9)
前記第一の因子および前記第二の因子の細胞標的が異なる、項目1または2に記載の粒子。
(項目10)
前記第一の因子および前記第二の因子の分子標的または細胞標的が異なる、項目1または2に記載の粒子。
(項目11)
前記第一の薬学的因子および前記第二の薬学的因子の各々が、独立して、低分子、ポリヌクレオチド、アンチセンス因子、RNAi、多糖、オリゴ糖、炭水化物、脂質、タンパク質、ペプチド、金属、有機化合物、有機金属化合物、または無機化合物である、項目1または2に記載の粒子。
(項目12)
前記第二の薬学的因子が、前記第一の薬学的因子より迅速に作用する、項目1または2に記載の粒子。
(項目13)
前記第一の薬学的因子が抗腫瘍性因子または細胞障害性因子であり、前記第二の薬学的因子が抗血管形成因子である、項目1または2に記載の粒子。
(項目14)
前記抗腫瘍性因子が、アルキル化剤、代謝拮抗薬、天然物、抗生物質、酵素、ステロイド、および有機金属錯体からなる群より選択される、項目13に記載の粒子。
(項目15)
前記抗腫瘍性因子が、メクロレタミン、シクロホスファミド、イホスファミド、メルファラン、クロラムブシル、ヘキサメチルメラミン、チオテパ、ブスルファン、カルムスチン、ロムスチン、セムスチン、ストレプトゾシン、ダカルバジン、シスプラチン、カルボプラチン、メルファラン、メクロレタミン、ビスクロロエチルニトロソウレア、クロロエチル−シクロヘキシルニトロソウレア、メトトレキサート、5−フルオロウラシル(5FU)、シトシンアラビノシド、6−メルカプトプリン、6−チオグアニン、FudR、ペントスタチン、ヒドロキシ尿素、ドキソルビシン、ブレオマイシン、マイトマイシンC、アクチノマイシン、タキソール、エポチロン、ビンクリスチン、ビンブラスチン、エトポシド、テニポシド、ダクチノマイシン、ダウノルビシン、ドキソルビシン、プリカマイシン、L−アスパラギナーゼ、ヘパリナーゼ、コンドロイチナーゼ、インターフェロンα、インターフェロンβ、インターフェロンγ、腫瘍壊死因子、ミトキサントロン、ビスクロロエチルニトロソウレア、4−ジメチル−エピポドフィロトキシンエチリデン、プレドニゾン、ジエチルスチルベストロール、メドロキシプロゲステロン、タモキシフェン、プロカルバジン、アミノグルテチミド、プロゲスチン、アンドロゲン、抗アンドロゲン、ロイプロリド、プロテアソームインヒビター、PS341、HSP90インヒビター、ゲルダナマイシン、ヒストンデアセチラーゼインヒビター、およびプロテインキナーゼインヒビターからなる群より選択される、項目13に記載の粒子。
(項目16)
前記抗血管形成因子が、血管形成を阻害するために内皮細胞に直接作用する、項目13に記載の粒子。
(項目17)
前記抗血管形成因子が、アンジオスタチン、アバスチン、アレスチン、カンスタチン、コンブレタスタチン、エンドスタチン、NM3、トロンボスポンジン、タムスタチン、2−メトキシエストラジオール、2−メトキシエストラジオールの誘導体、ビタキシン、およびそれらの誘導体からなる群より選択される、項目13に記載の粒子。
(項目18)
前記抗血管形成因子が間接作用型として分類される、項目13に記載の粒子。
(項目19)
前記間接作用型の抗血管形成因子が、EGF受容体チロシンキナーゼインヒビター、VEGF受容体アンタゴニスト、HER−2/neu受容体チロシンキナーゼインヒビター、PDGF受容体アンタゴニスト、MAPK経路のインヒビター、およびPI3K経路のインヒビターからなる群より選択される、項目18に記載の粒子。
(項目20)
前記間接作用型の抗血管形成因子が、イレッサ(Iressa)、ZD6474、タルセバ(Tarceva)、エルビタックス(Erbitux)、PTK787、SU6668、ハーセプチン(Herceptine)、インターフェロン−α、およびSU11248からなる群より選択される、項目18に記載の粒子。
(項目21)
前記第一の因子が抗炎症性因子であり、前記第二の因子が抗血管形成因子である、項目1または2に記載の粒子。
(項目22)
前記抗炎症性因子が、非ステロイド性抗炎症薬、ステロイド、リポキシゲナーゼインヒビター、および肥満細胞安定化剤からなる群より選択される、項目21に記載の粒子。
(項目23)
前記第一の因子が抗炎症性因子であり、前記第二の因子が気管支拡張剤である、項目1または2に記載の粒子。
(項目24)
前記抗炎症性因子が、非ステロイド性抗炎症薬、ステロイド、リポキシゲナーゼインヒビター、および肥満細胞安定化剤からなる群より選択される、項目23に記載の粒子。
(項目25)
前記気管支拡張剤がβ−アドレナリン受容体アゴニストである、項目23に記載の粒子。
(項目26)
前記第一の因子がコルチコステロイドであり、前記第二の因子がβ−アドレナリン受容体アゴニストである、項目23に記載の粒子。
(項目27)
前記第一の因子が疾患修飾抗リウマチ薬(DMARD)であり、前記第二の因子が抗血管形成因子である、項目1または2に記載の粒子。
(項目28)
前記第一の因子が増殖因子であり、前記第二の因子が異なる増殖因子であって、ここで、該増殖因子の空間的/時間的放出がシグナル伝達経路の相乗的な調節をもたらす、項目1または2に記載の粒子。
(項目29)
前記第一の因子がシグナル伝達経路を阻害し、前記第二の因子が異なる経路または同一経路内の異なるシグナル伝達に影響を与える、項目1または2に記載の粒子。
(項目30)
前記第一の因子が神経活性剤であり、前記第二の因子がカオトロピック剤である、項目1または2に記載の粒子。
(項目31)
前記第一の因子が神経活性剤であり、前記第二の因子が血液脳関門をより透過性にする、項目1または2に記載の粒子。
(項目32)
前記第二の因子が、血液脳関門を前記第一の因子に対してより透過性にする、項目30に記載の粒子。
(項目33)
前記マトリックスが、多糖、炭水化物、タンパク質、ポリマー、糖タンパク質、糖脂質、またはそれらの誘導体もしくは組み合わせを含む、項目2に記載の粒子。
(項目34)
前記炭水化物が、ラクトース、グリコサミノグリカン、ショ糖、マルトース、ガラクトース、グルコース、ラムノース、シアル酸、デンプン、セルロース、ならびにそれらの誘導体および組み合わせからなる群より選択される、項目33に記載の粒子。
(項目35)
前記ナノ粒子が、最大寸法5〜10,000nmのサイズの範囲である、項目1または2に記載の粒子。
(項目36)
前記ナノ粒子が、最大寸法10〜800nmのサイズの範囲である、項目1または2に記載の粒子。
(項目37)
前記ナノ粒子が、最大寸法10〜500nmのサイズの範囲である、項目1または2に記載の粒子。
(項目38)
前記ナノ粒子が、最大寸法50〜250nmのサイズの範囲である、項目1または2に記載の粒子。
(項目39)
前記ナノ粒子が、ナノワイヤ、量子ドット、またはナノチューブである、項目1または2に記載の粒子。
(項目40)
前記ナノ粒子が、実質的に固体であり、リポソームではない、項目1または2に記載の粒子。
(項目41)
前記粒子が、最大寸法10nm〜500,000nmのサイズの範囲である、項目1または2に記載の粒子。
(項目42)
前記粒子が、最大寸法50nm〜100マイクロメートルのサイズの範囲である、項目1または2に記載の粒子。
(項目43)
前記粒子が、最大寸法500nm〜50マイクロメートルのサイズの範囲である、項目1または2に記載の粒子。
(項目44)
前記粒子が、最大直径20nm〜1000nmのサイズの範囲である、項目1または2に記載の粒子。
(項目45)
前記粒子が、最大直径50nm〜1000nmのサイズの範囲である、項目1または2に記載の粒子。
(項目46)
前記粒子が、最大直径50nm〜500nmのサイズの範囲である、項目1または2に記載の粒子。
(項目47)
前記ナノ粒子がポリマーを含む、項目1または2に記載の粒子。
(項目48)
前記ポリマーが生体適合性である、項目47に記載の粒子。
(項目49)
前記ポリマーが生分解性である、項目47に記載の粒子。
(項目50)
前記ポリマーが天然ポリマーである、項目47に記載の粒子。
(項目51)
前記ポリマーが合成ポリマーである、項目47に記載の粒子。
(項目52)
前記ポリマーが、ポリエステル、ポリアミド、ポリカーボネート、ポリカルバメート、ポリ尿素、ポリエーテル、ポリチオエーテル、およびポリアミンからなる群より選択される、項目47に記載の粒子。
(項目53)
前記ポリマーがコポリマーである、項目47に記載の粒子。
(項目54)
前記ポリマーが、D,L−ラクチド、D−ラクチド、L−ラクチド、D,L−乳酸、D−乳酸およびL−乳酸、グリコリド、グリコール酸、ε−カプロラクトン、ε−ヒドロキシヘキサン酸、γ−ブチロラクトン、γ−ヒドロキシ酪酸、δ−バレロラクトン、δ−ヒドロキシ吉草酸、ヒドロキシ酪酸、およびリンゴ酸からなる群より選択されるモノマーから合成される、項目47に記載の粒子。
(項目55)
前記ポリマーがポリエチレングリコールである、項目47に記載の粒子。
(項目56)
前記ポリマーが、ポリ(ホスフェート)、ポリ(ホスファイト)、ポリ(ホスホネート)、ポリ(カルボン酸)により修飾されたポリ(ホスホエステル)、ポリ(フェニルネオカルボキシレートホスファイト)、環式シクロアルキレンホスフェート、環式アリーレンホスフェート、ポリヒドロキシクロロプロピルホスフェート−ホスフェート、ジホスフィン酸エステル、ポリ(フェニルホスホネート)、ポリ(テルフタレートホスホネート)、ポリ(アミドカルボン酸)、リン酸の直鎖状飽和ポリエステル、ポリエステルホスホネート、リン含有部分を有するポリアリーレンエステル、またはポリ(ホスホエステル−ウレタン)、ポリ(ホスフェート)、ポリ(ホスファイト)、およびポリ(ホスホネート)からなる群より選択される、項目47に記載の粒子。
(項目57)
前記ポリマーがPLGAである、項目47に記載の粒子。
(項目58)
前記第一の因子が前記ナノ粒子の全体に見出される、項目1または2に記載の粒子。
(項目59)
前記第一の因子が前記ナノ粒子の内部にのみ見出され、前記ナノ粒子の表面には見出されない、項目1または2に記載の粒子。
(項目60)
前記第一の因子がポリマーに共有結合的に結合されている、項目47に記載の粒子。
(項目61)
前記因子がポリエチレングリコールと結合している、項目1または2に記載の粒子。
(項目62)
前記第一の因子が前記ポリマーにイオン結合的に結合されている、項目47に記載の粒子。
(項目63)
前記第一の因子がリンカーを通して前記ポリマーと結合している、項目47に記載の粒子。
(項目64)
前記リンカーが酵素分解に対して感受性である、項目63に記載の粒子。
(項目65)
前記リンカーが前記第一の因子の作用部位において酵素分解に対して感受性である、項目64に記載の粒子。
(項目66)
前記脂質小胞が、ホスホグリセリド;ホスファチジルコリン;ジパルミトイルホスファチジルコリン(DPPC);ジオレイルホスファチジルエタノールアミン(DOPE);ジオレイルオキシプロピルトリエチルアンモニウム(DOTMA);ジオレイルホスファチジルコリン;コレステロール;コレステロールエステル;ジアシルグリセロール;ジアシルグリセロールスクシネート;ジホスファチジルグリセロール(DPPG);ヘキサンデカノール;アシル基がジオレオイル、ジステアロイル、ジパルミトイル、またはジミリストイルであり、ポリエチレングリコールが350〜5000g/molの範囲であるヘキサンデカノール、1,2−ジアシル−sn−グリセロ−3−ホスホエタノールアミン−N−[メトキシ(ポリエチレングリコール)];ジアセチレンリン脂質;脂肪族アルコール;ポリエチレングリコール(PEG);ポリオキシエチレン−9−ラウリルエーテル;表面活性脂肪酸;パルミチン酸;オレイン酸;脂肪酸;脂肪酸アミド;ソルビタントリオレエート(Span85)グリココレート;サーファクチン;ポロキサマー;ソルビタン脂肪酸エステル;ソルビタントリオレエート;レシチン;リゾレシチン;ホスファチジルセリン;ホスファチジルイノシトール;スフィンゴミエリン;ホスファチジルエタノールアミン(ケファリン);カルジオリピン;ホスファチジン酸;セレブロシド;ジセチルホスフェート;ジパルミトイルホスファチジルグリセロール;ステアリルアミン;ドデシルアミン;ヘキサデシル−アミン;パルミチン酸アセチル;グリセロールリシノレエート;ステアリン酸ヘキサデシル;ミリスチン酸イソプロピル;チロキサポール;ポリ(エチレングリコール)5000−ホスファチジルエタノールアミン;リン脂質;官能化リン脂質;1,2−ジオレオイル−sn−グリセロ−3−スクシネート;ホスファチジルイノシトール;ホスファチジルセリン;ホスファチジルグリセロール;リン酸;ジホスファチジルグリセロール;ポリ(エチレングリコール)−ホスファチジルエタノールアミン;ジミリストイルホスファチジルグリセロール;ジオレオイルホスファチジルグリセロール;ジラウロイルホスファチジルグリセロール;ジパルミトイルホスファチジルグリセロール;ジステアロイルホスファチジルグリセロール;ジミリストイルリン酸;ジパルミトイルリン酸;ジミリストイルホスファチジルセリン;ジパルミトイルホスファチジルセリン;ホスファチジルセリン;両性リン脂質;ホスファチジルコリン;ホスファチジルエタノールアミン;スフィンゴミエリン;レシチン;リゾレシチン;リゾホスファチジルエタノールアミン;セレブロシド;ジミリストイルホスファチジルコリン;ジパルミトイルホスファチジルコリン;ジステアロイルホスファチジルコリン;ジエライドイルホスファチジルコリン;ジオレオイルホスファチジルコリン;ジラウロイルホスファチジルコリン;1−ミリストイル−2−パルミトイルホスファチジルコリン;1−パルミトイル−2−ミリストイルホスファチジルコリン;1−パルミトイル−ホスファチジルコリン;1−ステアロイル−2−パルミトイルホスファチジルコリン;ジミリストイルホスファチジルエタノールアミン;ジパルミトイルホスファチジルエタノールアミン;脳スフィンゴミエリン;ジパルミトイルスフィンゴミエリン;ジステアロイルスフィンゴミエリン;カチオン脂質;ステロール;コレステロール;コレステロール誘導体;コレステリルエステル;ビタミンD;植物ステロール;ステロイドホルモン;コレステロール−ホスホコリン、コレステロールポリエチレングリコール;コレステロール−SO4;植物ステロール;シトステロール;カンペステロール;スチグマステロール;およびそれらの混合物からなる群より選択された脂質をさらに含む、項目1に記載の粒子。
(項目67)
1つのナノ粒子が前記粒子に含まれている、項目1または2に記載の粒子。
(項目68)
2つ以上のナノ粒子が前記粒子に含まれている、項目1または2に記載の粒子。
(項目69)
前記粒子がコーティングされている、項目1または2に記載の粒子。
(項目70)
前記粒子がポリエチレングリコールでコーティングされている、項目1または2に記載の粒子。
(項目71)
前記粒子がターゲティング剤をさらに含む、項目1または2に記載の粒子。
(項目72)
前記ターゲティング剤が、抗体、抗体フラグメント、受容体、糖タンパク質、および多糖からなる群より選択される、項目71に記載の粒子。
(項目73)
治療的に有効な量の項目1または2に記載の粒子を含む薬学的組成物。
(項目74)
治療的に受容可能な賦形剤をさらに含む、項目73に記載の薬学的組成物。
(項目75)
脂質小胞内にナノ粒子を含む粒子を調製する方法であって、該方法が、以下の工程:
第一の因子を含むナノ粒子を提供する工程;
脂質を提供する工程;
第二の因子を提供する工程;および
該第二の因子を含有している脂質小胞に該ナノ粒子を封入する工程、
を包含する、方法。
(項目76)
項目75に記載の方法であって、前記ナノ粒子を提供する工程が、以下の工程:
ポリマーを提供する工程;
第一の薬学的因子を提供する工程;および
噴霧乾燥、ダブルエマルジョン技術、または転相技術により該ナノ粒子を調製する工程、
を包含する、方法。
(項目77)
脂質小胞内にナノ粒子を含む粒子を投与する方法であって、
第二の因子が負荷された脂質小胞に封入された第一の因子を有するナノ粒子を含む粒子を調製する工程;および
治療的に有効な量の粒子をその必要のある対象へ投与する工程、
を包含する、方法。
(項目78)
前記二つの因子が、同時に投与されるが、連続的な時間的効果または空間的効果を達成する、項目77に記載の方法。
(項目79)
前記因子が、同時に投与されるが、連続的な時間的効果または空間的効果を達成し、それによって、該因子のうちの少なくとも一つの毒性が低下する、項目77に記載の方法。
(項目80)
前記因子が、同時に投与されるが、連続的な時間的効果または空間的効果を達成し、それによって、該因子のうちの少なくとも一つの効力が増加する、項目77に記載の方法。
(項目81)
作用部位において、前記少なくとも一つの因子の効力が増加し、該因子のうちの少なくとも一つの全身毒性が低下する、項目77に記載の方法。
(項目82)
前記効力の増加が、前記因子のバイオアベイラビリティの増加による、項目80に記載の方法。
(項目83)
前記二つの因子の効果が相乗的である、項目77に記載の方法。
(項目84)
前記因子のうちの少なくとも一つの活性の増強が、病態生理学的条件に内在する異なる段階または事象を標的とする因子によるものである、項目77に記載の方法。
(項目85)
前記因子のうちの少なくとも一つの活性の増強が、作用部位における該因子の局所的なバイオアベイラビリティの増加によるものであり、該局所的なバイオアベイラビリティの増加が、もう一方の因子の活性によるものである、項目77に記載の方法。
(項目86)
前記因子のうちの少なくとも一つの毒性の減少が、もう一方の因子の活性により生じた作用部位における局所的なバイオアベイラビリティの増加によるものである、項目77に記載の方法。
(項目87)
前記因子のうちの少なくとも一つの毒性の減少が、全身的なバイオアベイラビリティの低下によるものであり、該低下が、もう一方の因子の活性によるものである、項目77に記載の方法。
(項目88)
前記投与する工程が、経口的、非経口的、静脈内、吸入、筋肉内、皮下、直腸、くも膜下腔内、鼻、膣、皮内、粘膜、または経皮的に粒子を投与する工程を包含する、項目77に記載の方法。
(項目89)
前記投与する工程が、噴霧器、スピンへラー、またはディスクへラーを使用して吸入により前記粒子を投与する工程を包含する、項目77に記載の方法。
(項目90)
癌を処置する方法であって、該方法が、以下の工程:
項目1、2、13、14、15、16、17、18、19、または20に記載の粒子を提供する工程;および
治療的に有効な量の粒子を癌を罹患する被験体へ投与する工程、
を包含する、方法。
(項目91)
関節炎または強直性脊椎症を処置する方法であって、該方法が、以下の工程:
項目1、2、21、22、または27に記載の粒子を提供する工程;および
治療的に有効な量の粒子を関節炎または強直性脊椎症を罹患する被験体へ投与する工程、
を包含する、方法。
(項目92)
中枢神経系(CNS)の障害を処置する方法であって、該方法が、以下の工程:
項目1、2、30、31、または32に記載の粒子を提供する工程;および
治療的に有効な量の粒子をCNS障害を罹患する被験体へ投与する工程、
を包含する、方法。
(項目93)
前記CNS障害がてんかんであり;そして前記第一の治療因子が抗発作剤である、項目92に記載の方法。
(項目94)
喘息または慢性閉塞性肺疾患(COPD)を処置する方法であって、該方法が、以下の工程:
項目1、2、23、24、25、または26に記載の粒子を提供する工程;および
治療的に有効な量の粒子を喘息を罹患する被験体へ投与する工程、
を包含する、方法。
(項目95)
乾癬を処置する方法であって、該方法が、以下の工程:
項目1、2、21、または22に記載の粒子を提供する工程であって、前記第一の因子が抗乾癬剤であり;そして前記第二の因子が抗血管形成因子である、工程;および
治療的に有効な量の粒子を乾癬を罹患する被験体へ投与する工程、
を包含する、方法。
(項目96)
網膜症を処置する方法であって、該方法が、以下の工程:
項目1または2に記載の粒子を提供する工程であって、前記第一の因子が抗血管形成因子であり、そして前記第二の因子が吸収促進剤である、工程;および
治療的に有効な量の粒子を網膜症を罹患する被験体へ投与する工程、
を包含する、方法。
(項目97)
薬学的因子をアッセイする方法であって、該方法が、以下の工程:
蛍光タンパク質を発現するよう安定的にトランスフェクトされた少なくとも一つの腫瘍細胞を提供する工程;
少なくとも一つの初代内皮細胞を提供する工程;
該腫瘍細胞および内皮細胞が増殖する細胞外マトリックスを提供する工程;
試験化合物を提供する工程;
該試験化合物と、マトリックス上で増殖する細胞とを接触させる工程;および
該蛍光タンパク質の発現の変化を検出する工程、
を包含する、方法。
(項目98)
前記腫瘍細胞が前記マトリックス上に播種される前に、前記内皮細胞が細胞外マトリックス上に播種される、項目97に記載の方法。
(項目99)
前記検出する工程が、生体色素により前記細胞を染色する工程を包含する、項目97に記載の方法。
(項目100)
前記検出する工程が、蛍光色素により前記細胞を染色する工程を包含し、該色素の発光が前記蛍光タンパク質のものとは別である、項目97に記載の方法。
(項目101)
前記色素がヨウ化プロピジウムである、項目99に記載の方法。
(項目102)
前記検出する工程が、エピフルオレセンスもしくは共焦点顕微鏡検、立体解析学、またはマイクロプレートリーダーを使用して、別の色を有する細胞の量を解析および定量する工程を包含する、項目97に記載の方法。
(項目103)
前記細胞外マトリックスがコラーゲンを含む、項目97に記載の方法。
(項目104)
前記細胞外マトリックスがマトリゲルである、項目97に記載の方法。
(項目105)
前記細胞外マトリックスがフィブロネクチンを含む、項目97に記載の方法。
(項目106)
前記細胞外マトリックスがラミニンを含む、項目97に記載の方法。
(項目107)
前記細胞外マトリックスがビトロネクチンを含む、項目97に記載の方法。
(項目108)
前記細胞外マトリックスが合成マトリックスである、項目97に記載の方法。
(項目109)
前記細胞外マトリックスがポリリジンを含む、項目97に記載の方法。
(項目110)
蛍光タンパク質で安定的にトランスフェクトされた腫瘍細胞、内皮細胞、細胞外マトリックスでコーティングされた細胞培養プレート、および標識色素を含む、キット。
【図面の簡単な説明】
【0035】
【図1】図1は、ナノセル粒子の模式図である。ナノセルは、第二の因子を内含している脂質小胞の内部に、第一の因子が負荷されたナノコアを含む。
【図2】図2は、併用療法ストラテジーを示す。ナノセルの遅い薬物動態及び速い薬物動態を達成するため、第一の因子を有するターゲティングされたナノ粒子が、第二の因子を含有している単層脂質小胞と併せて使用される。
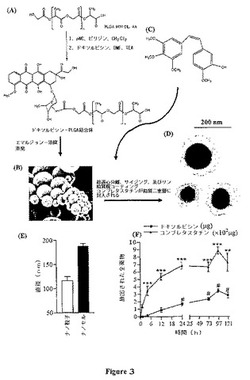
【図3】図3は、コンブレタスタチン−ドキソルビシンナノセルの合成及び特徴決定を示す。(A)ドキソルビシンとPLGA5050との間の結合反応の模式図。(B)エマルジョン−溶媒蒸発技術を使用して合成されたナノ粒子の走査型電子顕微鏡写真(Jeol JSM5600、3700×)は、不均質サイズの球状構造を示す。(C)脂質二重層に封入されるコンブレタスタチンの構造。(D)70nmの厚さに切片化し、2.0%酢酸ウラニル、続いて0.1%クエン酸鉛により染色し、Philips EM410を使用して調査することにより入手された、3個のナノセルの横断面の透過型電子顕微鏡検画像。この技術によると、ナノ粒子(濃いスフェア)は、リン脂質ブロックコポリマーの白い冠により囲まれた核に見える。(E)動的レーザー光散乱を使用したサイジングは、リン脂質コポリマーエンベロープへの封入のため、定義されたサイズのナノ粒子が、超遠心分離の連続的な工程を通して単離され得ることを証明している。(F)コンブレタスタチン及びドキソルビシンの物理化学的な放出速度動態プロファイルは、コンブレタスタチンがまずナノセルから放出され、続いて、遊離のドキソルビシンが放出されることを示している。デキサメタゾンが内部標準として使用された。示されたデータは、n=4の平均値±SEである。エラーバーが可視でないデータ点は、誤差が小さく、プロットに隠れていることを意味する。***P<0.002;#P<0.001(同一の時点におけるコンブレタスタチン濃度に対して)。
【図4】図4は、インビトロの腫瘍血管形成に対するVEGF及びHGFの効果、並びにaVEGF−受容体アンタゴニストであるPTK787の効果を示す。
【図5】図5は、B16/F10黒色腫細胞及びヒト臍静脈内皮細胞の共培養アッセイにおけるVEGFにより誘導される応答に対するドキソルビシン、サリドマイド、及びコンブレタスタチンの効果を示す。
【図6】図6は、B16/F10黒色腫細胞及びヒト臍静脈内皮細胞の共培養アッセイにおけるHGFにより誘導される応答に対するドキソルビシン、サリドマイド、及びコンブレタスタチンの効果を示す。
【図7】図7は、コラーゲン上に蒔かれた場合の、B16/F10黒色腫細胞及びヒト臍静脈内皮細胞の共培養アッセイにおけるVEGFにより誘導される応答に対するドキソルビシン、サリドマイド、及びコンブレタスタチンの効果を示す。
【図8】図8は、コラーゲン上に蒔かれた場合の、B16/F10黒色腫細胞及びヒト臍静脈内皮細胞の共培養アッセイにおけるHGFにより誘導される応答に対するドキソルビシン、サリドマイド、及びコンブレタスタチンの効果を示す。
【図9】図9は、ナノセルからの薬理学的因子の時間的な放出及び活性のバイオアッセイを示す。GFP+黒色腫−内皮細胞共培養物を、3次元マトリゲルマトリックス上で確立した。共培養物を、定義された期間、異なる処理群と共にインキュベートした。細胞をパラホルムアルデヒドで固定し、ヨウ化プロピジウムで染色し、Zeiss LSM510共焦点顕微鏡を使用して分析した。蛍光色素を488nm及び543nmのレーザー線で励起し、512×512ピクセルの解像度で505−530BP及び565−615BPフィルターを使用して画像を補足した。(A)顕微鏡写真は、異なる処理群からのマージ画像を示す。黒色腫細胞は黄色に見え、血管形成中の内皮細胞は赤色である。(B)グラフは、各細胞型によりカバーされた面積の立体解析学的定量化を示す。ナノセル(NC)による処理は、血管系の時間的な迅速な排除をもたらし、その後、遅れて腫瘍細胞の欠損をもたらす。対照的に、リポソーム−コンブレタスタチン(250μg/ml)(L[C])又はドキソルビシン結合ナノ粒子(ND)(20μg/mlのドキソルビシン)で処理された対照群は、それぞれ、血管系又は腫瘍細胞の選択的な欠損をもたらした。30hのNC処理に関する画像は、完全な細胞欠損が大部分の画像において明白であったが、共培養物の排除を強調するため、少数の球状化細胞を示すよう特に選択された。一つの実験において、四つのランダムな画像が、各複製物から捕捉された。データは、三つの独立の実験からの平均値±SEMを表す。(C)濃度−効果曲線は、B16/F10細胞に対する遊離ドキソルビシン及びPLGA結合ドキソルビシンの効果を示す。[Dox]は、遊離薬物として、又はナノセルで、培養物に添加された薬物の濃度を示す。示されたデータは、複製物を用いた二つの独立の実験の平均値±SEである。***P<0.001(ボンフェローニのポストホックテスト(Bonferroni’s post−hoc test)を含むANOVA)。
【図10】図10は、ナノセル療法がB16/F10黒色腫及びルイス肺癌の増殖を阻害することを証明する。3×105個のGFP+BL6/F10又は2.5×105個のルイス肺癌細胞を側腹部に皮下注射することにより、黒色腫及び癌腫をC57/BL6マウスにおいて確立した。(A、B)ナノセル(NC)の効果、対、ドキソルビシン結合ナノ粒子のみを有するナノセルNC[D]、リポソーム−コンブレタスタチン(L[C])、NC[D]+L[C]の同時注射、コンブレタスタチン及びドキソルビシンの両方が封入されている単純リポソーム製剤(L[CD])、並びにより低用量(ld)のNCの効果を示す、切除された腫瘍。対照群は、生理食塩水で処理された。癌腫及び黒色腫(50mm3)を保持しているマウスを6〜8群へと無作為化し、50mg/kgコンブレタスタチン及び500 g/kgドキソルビシンに等しい異なる媒体で隔日に処理した。(C、D)グラフは、癌腫及び黒色腫の最長直径及び最短直径の測定から計算された、異なる処理群における平均(SE)腫瘍体積を示す。(E)グラフは、白血球数に対する異なる処理の効果を示す。最小の毒性が、ナノセル処理群で観察された。ナノセルによる長期的な処理(NClt)は、より短い処理と比較して、付加的な毒性を有していなかった。(F)フルオレセイン色素を用いて製作されたナノセルの分布を、5、10、及び24時間目に、色素のレベルを測定することにより、経時的に定量した。24時間目、他の血管新生組織と比較して癌腫に優先的にナノセルが蓄積していることが明白であり、同時に、血中レベルが降下していた。全てのデータが、時点に依って各群n=3〜5の平均値±SEMである。エラーバーが可視でないデータ点は、誤差が小さく、プロットに隠れていることを意味する。
【図11】図11は、腫瘍血管系及びアポトーシスに対するナノセル処理の効果を示す。ナノセル(NC)、ドキソルビシン結合ナノ粒子のみを有するナノセルNC[D]、リポソーム−コンブレタスタチン(L[C])、NC[D]+L[C]の同時注射、又はコンブレタスタチン及びドキソルビシンの両方が封入されている単純リポソーム製剤(L[CD])で処理されたルイス肺癌を保持している動物から、腫瘍が切除された。対照群は生理食塩水を受容した。処理は、50mg/kgコンブレタスタチン及び500μg/kgドキソルビシンに等しい異なる媒体を使用して、10日間にわたり隔日に投与された。(A)上パネルは、冷メタノールで固定され、血管内皮マーカーであるフォンヴィレブランド因子(vWF)に関して免疫染色された腫瘍の横断面を示す。下パネルは、腫瘍におけるアポトーシスの誘導に対する異なる処理の効果を示す。切片は、10%ホルマリンで固定され、テキサスレッド標識ヌクレオチドを使用したタネル(TUNEL)陽性染色のため加工された。同じ切片を、HIF−1 に対する抗体で同時標識し、FITC標識二次抗体を使用して検出した。タネル染色はアポトーシスの顕著な特徴であるDNA鎖切断を検出するため、NC処理群におけるマージ画像の黄色シグナルは、HIF−1αの核移行を示す。グラフは、腫瘍横断面に標準的な立体解析学技術を適用して計算された(B)腫瘍血管密度、(C)低酸素細胞の割合(%)、及び(D)アポトーシス細胞の割合(%)を示す。全ての画像がZeiss LSM510共焦点顕微鏡を使用して捕捉された。蛍光色素は、488nm及び543nmのレーザー線で励起され、512×512ピクセルの解像度で505−530BP及び565−615BPフィルターを使用して画像が捕捉された。データは各試料からの複数のランダムな画像を用いた、三つの独立の腫瘍試料からの平均値±SEMとして表されている。*P<0.05、**P<0.01、***P<0.001(対照に対して)(ニューマンクール(Newman−Keul’s)のポストホックテストを含むANOVA)。(E)ウエスタンブロットは、HIF1α及びVEGFのレベルに対する異なる処理の効果を示しており、それぞれ(F&G)のグラフにおいてβ−アクチンに対して定量的に規準化される。*P<0.05(他のコンブレタスタチン処理群に対して)。
【図12】図12は、腫瘍増殖に対するリポソームコンブレタスタチン、ナノセルコンブレタスタチン、及び長期ナノセル療法の効果を示す。(A)グラフは、黒色腫を保持しているマウスに投与されたリポソームコンブレタスタチン及び(コンブレタスタチン及びPLGAコアのみを封入して製作された)ナノセルの効果を示す。処理は、腫瘍が50mm3の体積に達した時点で開始し、隔日の5回の投与のため継続した。いずれかの製剤で注射1回につき投与される全コンブレタスタチンは、50mg/kgであった。もう一つの実験においては、腫瘍が50mm3の体積に達した後、黒色腫を保持している動物を、7サイクルのNC療法で処理した。対照動物は、PBS媒体で処理され、17日目に腫瘍サイズが大きくなりすぎたため屠殺された。長期処理群においては、動物の50%が、28日にわたり腫瘍のほぼ完全な退縮を示し、グラフ(B)に示されるように、残りの動物は、未処理の動物と比較して有意に小さい腫瘍体積を有していた。
【図13】図13は、原発性GFP+黒色腫の肺及び肝臓への転移に対するナノセル療法の効果を示す。(A)上パネルは、異なる処理群からの同レベルの肺組織の横断面を示す。(B)パネルは、異なる処理群からの肝臓の同レベルの横断面を示す。ナノセル(NC)、ドキソルビシン結合ナノ粒子NC[D]、リポソーム−コンブレタスタチン(L[C])、NC[D]+L[C]の同時注射、又はドキソルビシン及びコンブレタスタチンが封入されたリポソーム(L[CD])で処理された動物から、器官が切除された。対照群は生理食塩水で処理された。組織は氷上で4%パラホルムアルデヒドで固定され、標準的なH&Eで染色された。画像はZeiss LSM510共焦点顕微鏡を使用して捕捉された。蛍光色素は、488nm及び543nmのレーザー線で励起され、512×512ピクセルの解像度で505−530BP及び565−615BPフィルターを使用して画像が捕捉された。ここに示されたマージ画像は、黄色に見える別個の転移節を示している。グラフは、各視野における転移節の定量化を示す。表されたデータは、n=3からの平均値±SEMである。***P<0.001(対照に対して)(ニューマンクールのポストホックテストを含むANOVA)。
【図14】図14は、ドキソルビシンのPLGA5050との結合に含まれる詳細な合成工程を示す模式図である。
【図15】図15は、喘息治療用に開発されたナノセルの構造及び放出動態プロファイルを示す。電子顕微鏡写真は、マトリックスがラクトースシェルであるこれらのナノセルの外側マトリックスの超微細構造を示す。コルチコステロイド(抗炎症性因子)がナノコア内に捕獲され得、気管支拡張剤がナノコアを包囲するラクトースマトリックスに捕獲される。グラフは、気管支拡張剤(サルブタモール)が数分というタイムスケールでまず放出され、コルチコステロイド(デキサメタゾン)が遅い遷延性の様式で放出されるという事実を証明する。この時間的な放出は、まず、喘息の間に収縮した細気管支が拡張することを可能にし、より深い肺へのナノコアの浸透を可能にするであろう。その後の遅い放出は、急性喘息エピソードの後の慢性炎症を阻止し、サルブタモールの速い放出は、即時型の症状を緩和する。
【発明を実施するための形態】
【0036】
(発明の特定の好ましい実施形態の詳細な説明)
本発明の薬物送達系は、疾患を処置するために複数の因子を投与する場合、第二の因子又は因子のセットが送達される前に、一つの因子又は因子の組み合わせを送達することが有利であり得るという認識から生まれた。本発明の粒子を使用して異なる時点で放出される因子は、異なる作用様式、異なる標的、及び/又は異なる薬物動態プロファイルを有し得る。本発明は、本発明の粒子(ナノセル)、ナノセルを含む薬学的組成物、ナノセル及びその薬学的組成物を調製する方法、並びにナノセル及びその薬学的組成物を使用する方法を包含する。ナノセルは、概念的には、バルーン内のバルーン、又は粒子(例えばリポソーム)内の粒子(例えばナノ粒子)である。
【0037】
一つの実施形態において、ナノセルは、第二の因子又は因子の組み合わせを有する脂質小胞又はマトリックス/シェル外側部分により包囲された、第一の因子又は因子の組み合わせが負荷された内側部分(ナノコア)を含む。外側部分の(一つ又は複数の)因子は、内側ナノコアの(一つ又は複数の)因子の前に放出される。好ましくは、ナノセルは1個のナノコアを含有している。しかしながら、ある種の実施形態において、ナノセルは、1個又は複数個のナノコア、好ましくは1〜100個のナノコア、より好ましくは1〜10個のナノコア、さらに好ましくは1〜3個のナノコアを含有している。別の実施形態において、ナノセルは、外側のシェル又はマトリックスでコーティングされた内側コアを含む粒子である。
【0038】
本発明のナノセルのコアは、マトリックスに封入された少なくとも一つの因子を含む。マトリックスは、好ましくは、生分解性かつ生体適合性のポリマー性のマトリックスである。ナノコアの調製において有用なポリマーには、合成ポリマー及び天然ポリマーが含まれる。本発明において有用なポリマーの例には、ポリエステル、ポリアミド、ポリエーテル、ポリチオエーテル、ポリ尿素、ポリカーボネート、ポリカルバミド、タンパク質、多糖、ポリアリール等が含まれる。ナノコアにおいて有用なポリマーは、100g/mol〜100,000g/mol、好ましくは500g/mol〜80,000g/molの範囲の平均分子量を有している。好ましい実施形態において、ポリマーは、D,L−ラクチド、D−ラクチド、L−ラクチド、D,L−乳酸、D−乳酸、L−乳酸、グリコリド、グリコール酸、ε−カプロラクトン、ε−ヒドロキシヘキサン酸、γ−ブチロラクトン、γ−ヒドロキシ酪酸、δ−バレロラクトン、δ−ヒドロキシ吉草酸、ヒドロキシ酪酸、及びリンゴ酸からなる群より選択されるモノマーから合成されたポリエステルである。より好ましくは、生分解性ポリエステルが、D,L−ラクチド、D−ラクチド、L−ラクチド、D,L−乳酸、D−乳酸、L−乳酸、グリコリド、グリコール酸、ε−カプロラクトン、及びε−ヒドロキシヘキサン酸からなる群より選択されるモノマーから合成される。最も好ましくは、生分解性ポリエステルが、D,L−ラクチド、D−ラクチド、L−ラクチド、D,L−乳酸、D−乳酸、L−乳酸、グリコリド、及びグリコール酸からなる群より選択されるモノマーから合成される。コポリマーも、ナノコアにおいて使用され得る。コポリマーには、ABA型トリブロック(triblock)コポリマー、BAB型トリブロックコポリマー、及びAB型ジブロック(diblock)コポリマーが含まれる。ブロックコポリマーは、疎水性のAブロック(例えば、ポリエステル)及び親水性のBブロックを有し得る(例えば、ポリエチレングリコール)。
【0039】
ナノコアのポリマーは、活性因子の捕獲及び放出動態に基づき選択される。ある種の実施形態において、ナノコア上の活性因子は、ナノコアのポリマーに共有結合的に結合される。送達すべき因子をポリマーマトリックスに共有結合的に結合するため、ポリマーは、当該分野において公知の技術を使用して、化学的に活性化され得る。次いで、活性化されたポリマーは、ポリマーと因子との間に共有結合が形成されることを可能にする適切な条件の下で、因子と混合される。好ましい実施形態において、因子上のチオール、ヒドロキシル基、アミノ基のような求核剤が、ポリマー上の求電子剤(例えば、活性化されたカルボニル基)を攻撃して、共有結合を作出する。
【0040】
他の実施形態において、活性因子は、ファンデルワールス相互作用、疎水性相互作用、水素結合、双極子間相互作用、イオン性相互作用、及びパイスタッキング(pi stacking)のような非共有結合性の相互作用を通してナノコアのマトリックスと会合させられる。
【0041】
ナノコアは、ナノ粒子を調製するための当該分野において公知の任意の方法を使用して調製され得る。そのような方法には、噴霧乾燥、エマルジョン溶媒蒸発、ダブルエマルジョン、及び転相が含まれる。さらに、任意のナノスケールの粒子、マトリックス、又はコアが、ナノセル内のナノコアとして使用され得る。ナノコアは、ナノシェル(本明細書中に参考として援用される米国特許第6,685,986号を参照のこと);ナノワイヤ(本明細書中に参考として援用される米国特許第5,858,862号を参照のこと);ナノ結晶(本明細書中に参考として援用される米国特許第6,114,038号を参照のこと);量子ドット(本明細書中に参考として援用される米国特許第6,326,144号を参照のこと);及びナノチューブ(本明細書中に参考として援用される米国特許第6,528,020号を参照のこと)であり得るが、これらに限定されない。
【0042】
ナノコアは、調製された後、特定のサイズ範囲内のナノコアを回収するため、ろ過、篩過、押し出し、又は超遠心分離により分画され得る。一つの効果的なサイジング法は、選択された均一の孔サイズを有している一連のポリカーボネート膜を通して、ナノコアの水性懸濁物を押し出すことを含み;膜の孔サイズは、その膜を通した押し出しにより作製されるナノコアの最大サイズにほぼ相当するであろう。例えば、本明細書中に参考として援用される米国特許第4,737,323号を参照のこと。もう一つの好ましい方法は、定義されたサイズの画分を単離するための定義されたスピード(例えば、8,000、10,000、12,000、15,000、20,000、22,000、及び25,000rpm)における連続超遠心分離である。ある種の実施形態において、ナノコアは、選択されたサイズ範囲内で、サイズが実質的に均質であるよう調製される。ナノコアは、好ましくは、最大直径10nm〜10,000nmの範囲内である。より好ましくは、ナノコアは、最大直径20〜8,000nm、最も好ましくは、最大直径50〜5,000nmの範囲である。ナノコアは、粒子のサイズを決定するため、動的光散乱及び/又は走査型電子顕微鏡検により分析され得る。ナノコアは、ナノコアへの(一つ又は複数の)因子の負荷に関しても試験され得る。ナノコアには、ナノ粒子のみならず、ナノシェル、ナノワイヤ、量子ドット、及びナノチューブも含まれる。
【0043】
ナノコアは、調製され、場合により特徴決定された後、ナノセルを形成するため、脂質、ポリマー、炭水化物等のような外層でコーティングされる。ナノコアは、当該分野において記載されている任意の方法を使用して、脂質、炭水化物、多糖、タンパク質、ポリマー、糖タンパク質、糖脂質等のような、合成の又は天然に存在する高分子でコーティングされ得る。米国特許第4,235,871号、第4,501,728号、第4,837,028号;PCT出願WO96/14057、New RRC,Liposomes:A
practical approach,IRL Press,Oxford(1990)、33−104頁;Lasic DD,Liposomes from physics to applications,Elsevier Science Publishers BV,Amsterdam,1993;Szokaら、Ann.Rev.Biophys.Bioeng.9:467(1980);Liposomes,Marc J.Ostro,ed.,Marcel Decker,Inc.,New York,1983,Chapter 1;Hopeら、Chem.Phys.Lip.40:89(1986)(これらの各々は、本明細書中に参考として援用される)を含む、脂質小胞を調製する様々な方法が、記載されている。
【0044】
当該分野において既知の界面活性剤及び乳化剤を含む任意の脂質が、本発明のナノセルの作成において使用するのに適している。脂質成分は、異なる脂質分子の混合物であってもよい。これらの脂質は、天然の起源から抽出され精製されてもよいし、又は実験室で合成により調製されてもよい。好ましい実施形態において、脂質は市販されているものである。ナノコアのコーティングにおいて有用な脂質には、天然脂質のみならず、合成脂質も含まれる。脂質は、化学的又は生物学的に改変させられ得る。本発明のナノセルの調製において有用な脂質には、ホスホグリセリド;ホスファチジルコリン;ジパルミトイルホスファチジルコリン(DPPC);ジオレイルホスファチジルエタノールアミン(DOPE);ジオレイルオキシプロピルトリエチルアンモニウム(DOTMA);ジオレイルホスファチジルコリン;コレステロール;コレステロールエステル;ジアシルグリセロール;ジアシルグリセロールスクシネート;ジホスファチジルグリセロール(DPPG);ヘキサンデカノール;ポリエチレングリコール(PEG)のような脂肪族アルコール;ポリオキシエチレン−9−ラウリルエーテル;パルミチン酸又はオレイン酸のような表面活性脂肪酸;脂肪酸;脂肪酸アミド;ソルビタントリオレエート(Span85)グリココレート;サーファクチン;ポロキサマー(poloxomer);ソルビタントリオレエートのようなソルビタン脂肪酸エステル;レシチン;リゾレシチン;ホスファチジルセリン;ホスファチジルイノシトール;スフィンゴミエリン;ホスファチジルエタノールアミン(ケファリン);カルジオリピン;ホスファチジン酸;セレブロシド;ジセチルホスフェート;ジパルミトイルホスファチジルグリセロール;ステアリルアミン;ドデシルアミン;ヘキサデシル−アミン;パルミチン酸アセチル;グリセロールリシノレエート;ステアリン酸ヘキサデシル;ミリスチン酸イソプロピル;チロキサポール;ポリ(エチレングリコール)5000−ホスファチジルエタノールアミン;及びリン脂質が含まれるが、これらに限定されない。脂質は、正の電荷を有していてもよいし、負の電荷を有していてもよいし、又は中性であってもよい。ある種の実施形態において、脂質は脂質の組み合わせである。ナノセルの調製において有用なリン脂質には、負に電荷を有するホスファチジルイノシトール、ホスファチジルセリン、ホスファチジルグリセロール、リン酸(phosphatic acid)、ジホスファチジルグリセロール、ポリ(エチレングリコール)−ホスファチジルエタノールアミン、ジミリストイルホスファチジルグリセロール、ジオレオイルホスファチジルグリセロール、ジラウロイル(dilauryloyl)ホスファチジルグリセロール、ジパルミトイル(dipalmitotyl)ホスファチジルグリセロール、ジステアロイル(distearyloyl)ホスファチジルグリセロール;ジミリストイルリン酸(phosphatic acid)、ジパルミトイルリン酸(phosphatic acid)、ジミリストイルホスファチジル(phosphitadyl)セリン、ジパルミトイルホスファチジルセリン、ホスファチジルセリン、及びそれらの混合物が含まれる。有用な両性リン脂質には、ホスファチジルコリン、ホスファチジルエタノールアミン、スフィンゴミエリン、レシチン、リゾレシチン、リゾホスファチジル(lysophatidyl)エタノールアミン、セレブロシド、ジミリストイルホスファチジルコリン、ジパルミトイル(dipalmitotyl)ホスファチジルコリン、ジステアロイル(distearyloyl)ホスファチジルコリン、ジエライドイルホスファチジルコリン、ジオレオイルホスファチジルコリン、ジラウロイル(dilauryloyl)ホスファチジルコリン、1−ミリストイル−2−パルミトイルホスファチジルコリン、1−パルミトイル−2−ミリストイルホスファチジルコリン、1−パルミトイル−ホスファチジルコリン、1−ステアロイル−2−パルミトイルホスファチジルコリン、ジミリストイルホスファチジルエタノールアミン、ジパルミトイルホスファチジルエタノールアミン、脳スフィンゴミエリン、ジパルミトイルスフィンゴミエリン、ジステアロイルスフィンゴミエリン、及びそれらの混合物が含まれる。両性リン脂質は、正味の電荷がゼロであるイオン化可能基を有するリン脂質を構成する。ある種の実施形態において、脂質はホスファチジルコリンである。
【0045】
コレステロール及びその他のステロールも、脂質小胞の物理的性質を改変させるため、本発明のナノセルの外側脂質部分へ組み込まれ得る。ナノセルへの取り込みのための適切なステロールには、コレステロール、コレステロール誘導体、コレステリルエステル、ビタミンD、植物ステロール、エルゴステロール、ステロイドホルモン、及びそれらの混合物が含まれる。有用なコレステロール誘導体には、コレステロール−ホスホコリン、コレステロールポリエチレングリコール;コレステロール−SO4が含まれ、植物ステロールは、シトステロール、カンペステロール、及びスチグマステロールであり得る。本明細書中に参考として援用される米国特許第4,891,208号に記載されているようなステロールの有機酸誘導体の塩型も、本発明のナノセルにおいて使用され得る。
【0046】
ナノセルの脂質小胞部分は、多層であってもよいし、又は単層であってもよい。ある種の実施形態において、ナノコアは、脂質二重層のような多層脂質膜でコーティングされる。その他の実施形態において、ナノコアは単層脂質膜でコーティングされる。
【0047】
誘導体化された脂質も、ナノセルにおいて使用され得る。誘導体化された脂質の添加は、ナノセルの薬物動態を改変させる。例えば、ターゲティング剤により誘導体化された脂質の添加は、ナノセルが、特定の細胞、腫瘍、組織、器官、又は器官系を標的とすることを可能にし得る。ある種の実施形態において、ナノセルの誘導体化された脂質成分は、ペプチダーゼもしくはエステラーゼ酵素又は還元剤の存在下のような選択的な生理学的条件の下で切断され得る、ペプチド結合、アミド結合、エーテル結合、エステル結合、又はジスルフィド結合のような不安定な脂質−ポリマー結合を含む。ポリマーをリン脂質にカップリングさせるためのそのような結合の使用は、そうでなければRES系による迅速な取り込みを受けるかもしれない、投与後数時間の高い血中レベルの達成を可能にする。例えば本明細書中に参考として援用される米国特許第5,356,633号を参照のこと。ナノセルの薬物動態及び/又はターゲティングは、脂質の組成及び比率の変化に起因する表面電荷の改変によっても修飾され得る。脂質小胞の成分として熱感受性又はpH感受性の脂質(例えば、ジパルミトイル−ホスファチジルコリン:ジステアリルホスファチジルコリン(DPPC:DSPC)に基づく混合物)を組み込むことにより、熱又はpHによる放出特徴がナノセルへと構築され得る。熱又はpHに感受性の脂質の使用は、ナノセルの脂質小胞膜成分の制御された分解を可能にする。
【0048】
さらに、本発明に係るナノセルは、ハプテン、酵素、抗体又は抗体フラグメント、サイトカイン、受容体、及びホルモン(例えば、本明細書中に参考として援用される米国特許第5,527,528号を参照のこと)のような外部と結合した非ポリマー分子、及び脂質製剤に特定の酵素的特性又は表面認識特性を賦与するその他の小さなタンパク質、ポリペプチド、又は非タンパク質分子を含有していてもよい。表面分子を脂質にカップリングさせるための技術は、当該分野において公知である(例えば、本明細書中に参考として援用される米国特許第4,762,915号を参照のこと)。
【0049】
一つの実施形態において、脂質は、薄い脂質フィルムが形成されるよう、適当な有機溶媒又は溶媒系に溶解させられ、真空又は不活性ガスの下で乾燥される。場合により、フィルムは、より容易に水和される粉末様の形態である、より均質の脂質混合物が形成されるよう、第三級ブタノールのような適当な溶媒に再溶解させられ、次いで、凍結乾燥されてもよい。得られたフィルム又は粉末は、ナノコアの水性緩衝懸濁物でカバーされ、撹拌により15〜60分にわたり水和させられる。得られる多層小胞のサイズ分布は、より激しい撹拌条件の下で脂質を水和させることにより、又はデオキシコール酸のような可溶化界面活性剤を添加することにより、より小さいサイズへとシフトし得る。
【0050】
もう一つの実施形態において、ナノコアのコーティングは、親水性ポリマーで誘導体化された脂質を、予め形成された小胞へと拡散させることにより、例えば、ナノセル中の望まれる誘導体化脂質の最終モルパーセントに対応する脂質濃度で、脂質グラフトポリマーから構成されたナノコア/ミセルに、予め形成された小胞を曝すことにより、調製され得る。親水性ポリマーを含有しているナノコアを包囲するマトリックスは、ホモジナイゼーション、脂質領域水和(lipid−field hydration)、又は押し出し技術によっても形成され得る。
【0051】
さらに別の実施形態においては、ナノコアが、まず、疎水性分子を容易に可溶化するポリマーグラフト(polymer−grafted)脂質を含む、リゾホスファチジルコリンのような低CMC界面活性剤に、超音波処理により分散させられる。次いで、得られたナノコアのミセル懸濁物が、適当なモルパーセントのポリマーグラフター(polymer−grafter)脂質又はコレステロールを含有している乾燥脂質試料を再水和するために使用される。次いで、マトリックス/シェル及びナノコア懸濁物が、当該分野において公知の押し出し技術を使用して、ナノセルへと成形される。得られたナノセルは、標準的なカラムクロマトグラフィにより、封入されなかったナノコアから分離される。
【0052】
もう一つの好ましい実施形態において、小胞形成脂質は、脂質フィルムが形成されるよう、適切な有機溶媒又は溶媒系に採取され、真空又は不活性ガスの下で乾燥又は凍結乾燥される。ナノセルの外側チャンバーに組み込まれるべき一つ又は複数の活性因子は、好ましくは、フィルムを形成する脂質に含まれる。脂質溶液中の薬物の濃度は、ナノセルへの最大の薬物捕獲を与えるために、ナノセル中の薬物の最終最大濃度のモル過剰で含まれ得る。乾燥された脂質又は脂質/薬物の水和において使用される水性媒体は、非経口補液のために使用されるような、生理学的に適合性の媒体、好ましくは、発熱性物質が除去された生理食塩水又は5%デキストロース水溶液である。ナノコアは、水和工程の前に、均質に、そしてナノコア中の他の一つ/複数の活性因子の所望の濃度で、この水性媒体に懸濁させられる。溶液は、水溶性鉄キレート化剤のような付加的な溶質成分及び/又は所望の溶質濃度の可溶性の第二の化合物と混合されてもよい。脂質は、(撹拌を使用して)速い条件で、又は(撹拌なしで)遅い条件で水和させられる。脂質は、水和し、サイズ範囲が代表的には約0.5ミクロン〜10ミクロン又はそれ以上である多層小胞の懸濁物を形成する。一般に、小胞のサイズ分布は、振とうしながら、より迅速に脂質フィルムを水和させることにより、より小さなサイズへとシフトし得る。得られる膜二重層の構造は、脂質の疎水性(無極性)「尾部」が二重層の中心へ向かい、親水性(極性)「頭部」が水相へ向かっているようなものである。
【0053】
別の実施形態において、適切な比率で混合された、乾燥小胞形成脂質、因子を含有しているナノコア、及び(ナノセルの外側チャンバーに負荷されるべき)(一つ又は複数の)因子が、必要であれば加温しながら、水混和性の有機溶媒又は溶媒の混合物に溶解させられる。そのような溶媒の例は、エタノール、又は様々な比率のエタノール及びジメチルスルホキシド(DMSO)である。次いで、その混合物は、ナノセルの自発的な形成を引き起こすために、十分な容量の水性受容相に添加される。水性受容相は、全ての脂質を融解状態に維持するため、必要であれば、加温され得る。受容相は迅速にかき回されてもよいし、又は穏和に撹拌されてもよい。その混合物は、小さなオリフィスを通して迅速に射出されるか、又は直接注入される。数分〜数時間のインキュベーションの後、有機溶媒が、減圧、透析、又は透析ろ過により除去されると、ヒトへの投与に適したナノセル懸濁剤が残る。
【0054】
別の実施形態において、適切な量で混合された乾燥小胞形成脂質、ナノセルの外側チャンバーに負荷されるべき一つ/複数の因子、及び因子が負荷されたナノコアが、必要であれば加温しながら、フリーズドライ(凍結乾燥)による除去を可能にするために十分に高い蒸気圧及び凝固点を有する適切な有機溶媒に溶解させられる。そのような溶媒の例は、tert−ブタノール及びベンゼンである。次いで、薬物/脂質/溶媒混合物が凍結され、高真空下に置かれる。凍結のための方法の例には、液体の容器壁との接触を最大限にするため、混合物を含有している容器が旋回又は回転され、その容器が、アルコール又はアセトンのような溶媒と混合された液体窒素又はドライアイスのような冷却された物質の中に置かれる「シェルフリージング(shell−freezing)」が含まれる。そのようにして、薬物/脂質/溶媒混合物の成分の分離なしに、混合物は、急速に凍結させられる。凍結乾燥による溶媒の除去により、ふわふわとした乾燥粉末が生じる。この薬物/脂質粉末は、構成要素の化学分解又は水分の吸収を減少させる条件の下で長期にわたり保管され得る。そのような条件の例には、(アルゴン又は窒素のような)乾燥不活性ガスの雰囲気の下での粉末の密封、及び低温保管が含まれる。材料を投与することが望まれる場合には、生理学的に適合性の水性媒体、好ましくは発熱性物質が除去された生理食塩水又は5%デキストロース水溶液を添加することにより、再生が実施される。一つ又は複数の第二の活性因子が、親水性である場合には、この段階で添加されてもよい。再生が、ナノセルの自発的な形成を引き起し、そのナノセルは、超遠心分離、ろ過、及び篩過を含む本明細書に詳述された方法によりサイズ的に純化され得る。
【0055】
当業者により認識されるように、薬学的、診断的、又は予防的な因子が、本発明の薬物送達系を使用して投与され得る。ナノセルの二つの区画へ負荷される因子は、処置される疾患、患者、臨床的環境、投与様式、及び許可された医師又は薬理学者のような当業者により認識されるその他の要因を含む様々な要因に依存するであろう。
【0056】
ある種の実施形態において、ナノセルの内側部分、ナノコアの因子は、ナノセルの外側部分の因子より遅い放出動態を有している。このように、ナノコアの因子が効果を発揮し始める前に、まず外側部分の因子が放出され、効果を発揮することができる。例えば、癌の治療においては、ナノセルの外側脂質小胞部分に、メトトレキサートのような慣例的な化学療法因子が負荷され、ナノコアに、コンブレタスタチンのような抗血管形成因子が負荷される。まず、メトトレキサートがナノセルから放出され、コンブレタスタチンが腫瘍への血液供給を遮断する前に、腫瘍への血液供給が、細胞障害性因子を腫瘍細胞へと輸送する。このように、抗血管形成因子が腫瘍への血液供給を遮断する前に、細胞障害性因子が、細胞に到着し、その細胞障害性効果を発揮することできる。細胞障害性因子、それに続く抗血管形成剤の連続的送達は、好ましくは、相乗的であり、本発明の系において使用される薬物のより低い用量のため、減少した副作用を可能にする。
【0057】
本発明のナノセルを使用して送達される因子には、治療的、診断的、又は予防的な因子が含まれる。個体に投与される任意の化学化合物が、ナノセルを使用して送達され得る。因子は、低分子、有機金属化合物、核酸、タンパク質、ペプチド、金属、同位体標識された化学化合物、薬物、ワクチン、免疫学的因子等であり得る。
【0058】
好ましい実施形態において、因子は薬学的活性を有する有機化合物である。本発明のもう一つの実施形態において、因子は臨床的に使用されている薬物である。もう一つの実施形態において、因子は、ヒト又はその他の動物における使用のため米国食品医薬品局(U.S.Food&Drug Administration)により承認されているものである。特に好ましい実施形態において、薬物は、抗生物質、抗ウイルス剤、麻酔薬、ステロイド剤、抗炎症性因子、抗腫瘍性因子、抗原、ワクチン、抗体、鬱血除去薬、抗高血圧薬、鎮静薬、産児制限剤、妊娠促進剤、抗コリン作用薬、鎮痛薬、抗うつ薬、抗精神病薬、β−アドレナリン作用遮断薬、利尿薬、心血管作用剤、血管作用剤、非ステロイド性抗炎症剤、栄養剤等である。例えば、本発明のナノセルは、シナプス部位及び神経効果器結合部位において作用する薬物(例えば、アセチルコリン、メタコリン、ピロカルピン、アトロピン、スコポラミン、フィゾスチグミン、スクシニルコリン、エピネフリン、ノルエピネフリン、ドーパミン、ドブタミン、イソプロテレノール、アルブテロール、プロプラノロール、セロトニン);中枢神経系に作用する薬物(例えば、クロナゼパム、ジアゼパム、ロラゼパム、ベンゾカイン、ブピバカイン、リドカイン、テトラカイン、ロピバカイン、アミトリプチリン、フルオキセチン、パロキセチン、バルプロ酸、カルバマゼピン、ブロモクリプチン、モルヒネ、フェンタニル、ナルトレキソン、ナロキソン);炎症性応答を調整する薬物(例えば、アスピリン、インドメタシン、イブプロフェン、ナプロキセン、ステロイド、クロモリンナトリウム、テオフィリン);腎臓及び/又は心血管の機能に影響を与える薬物(例えば、フロセミド、チアジド、アミロライド、スピロノラクトン、カプトプリル、エナラプリル、リシノプリル、ジルチアゼム、ニフェジピン、ベラパミル、ジゴキシン、イソルジル(isordil)、ドブタミン、リドカイン、キニジン、アデノシン、ジギタリス、メバスタチン、ロバスタチン、シンバスタチン、メバロン酸);胃腸機能に影響を与える薬物(例えば、オメプラゾール、スクラルファート);抗生物質(例えば、テトラサイクリン、クリンダマイシン、アンホテリシンB、キニーネ、メチシリン、バンコマイシン、ペニシリンG、アモキシシリン、ゲンタマイシン、エリスロマイシン、シプロフロキサシン、ドキシサイクリン、アシクロビル、ジドブジン(AZT)、ddC、ddI、リバビリン、セファクロル、セファレキシン、ストレプトマイシン、ゲンタマイシン、トブラマイシン、クロラムフェニコール、イソニアジド、フルコナゾール、アマンタジン、インターフェロン);抗癌剤(例えば、シクロホスファミド、メトトレキサート、フルオロウラシル、シタラビン、メルカプトプリン、ビンブラスチン、ビンクリスチン、ドキソルビシン、ブレオマイシン、マイトマイシンC、ヒドロキシ尿素、プレドニゾン、タモキシフェン、シスプラチン、ダカルバジン(decarbazine));免疫調整剤(例えば、インターロイキン、インターフェロン、GM−CSF、TNFα、TNFβ、シクロスポリン、FK506、アザチオプリン、ステロイド);血液及び/又は血液形成器官に作用する薬物(例えば、インターロイキン、G−CSF、GM−CSF、エリスロポエチン、ビタミン、鉄、銅、ビタミンB12、葉酸、ヘパリン、ワルファリン、クマリン);ホルモン(例えば、成長ホルモン(GH)、プロラクチン、黄体化ホルモン、TSH、ACTH、インスリン、FSH、CG、ソマトスタチン、エストロゲン、アンドロゲン、プロゲステロン、性腺刺激ホルモン放出ホルモン(GnRH)、チロキシン、トリヨードサイロニン);ホルモンアンタゴニスト;石灰化及び骨代謝回転に影響を与える因子(例えば、カルシウム、リン酸塩、副甲状腺ホルモン(PTH)、ビタミンD、ビスホスホネート、カルシトニン、フッ化物)、ビタミン(例えば、リボフラビン、ニコチン酸、ピリドキシン、パントテン酸、ビオチン、コリン、イノシトール、カルニチン、ビタミンC、ビタミンA、ビタミンE、ビタミンK)、遺伝子治療因子(例えば、ウイルスベクター、核酸を保持しているリポソーム、DNA−タンパク質結合体、アンチセンス因子);又はターゲティング剤のようなその他の因子等からなる群より選択される一つ以上の化合物を含むよう調製され得る。
【0059】
予防的因子には、ワクチンが含まれる。ワクチンは、単離されたタンパク質又はペプチド、不活化された生物及びウイルス、死んでいる生物及びウイルス、遺伝学的に改変された生物又はウイルス、並びに細胞抽出物を含み得る。予防的因子は、インターロイキン、インターフェロン、サイトカイン、及びコレラ毒素、ミョウバン、フロイントアジュバントのようなアジュバント等と組み合わせられ得る。予防的因子は、細菌、ウイルス、真菌、原生動物、及び寄生動物の抗原を含む。これらの抗原は、完全な死滅させられた生物、ペプチド、タンパク質、糖タンパク質、炭水化物、又はそれらの組み合わせの形態であり得る。
【0060】
因子とは、組み合わせられ、ナノセルのナノコア又は外側脂質部分へ負荷された因子の組み合わせも意味し得る。因子の任意の組み合わせが使用され得る。例えば、薬学的因子が診断的因子と組み合わせられてもよいし、薬学的因子が予防的因子と組み合わせられてもよいし、薬学的因子が他の薬学的因子と組み合わせられてもよいし、診断的因子が予防的因子と組み合わせられてもよいし、診断的因子が他の診断的因子と組み合わせられてもよいし、そして予防的因子が他の予防的因子と組み合わせられてもよい。癌を治療するためのある種の実施形態においては、少なくとも二つの慣例的な化学療法因子が、ナノセルの他の脂質部分へ負荷される。
【0061】
本発明の一つの局面において、ナノセルは、選択されたサイズ範囲の実質的に均質のサイズを有するよう調製される。ナノセルは、特定のサイズの粒子を収集するため、ろ過、篩過、遠心分離、超遠心分離、カラムクロマトグラフィ分取、又は押し出しされ得る。一つの効果的なサイジング法は、選択された均一の孔サイズを有している一連のポリカーボネート膜を通してナノセルの水性懸濁物を押し出すことを含み;膜の孔サイズは、その膜を通した押し出しにより作製されるナノセルの最大サイズにほぼ相当するであろう。例えば、本明細書中に参考として援用される米国特許第4,737,323号を参照のこと。もう一つの好ましい方法は、定義されたサイズの画分を単離するための、定義されたスピードにおける連続超遠心分離によるものである。
【0062】
ナノセル組成物の好ましい使用は、腫瘍療法(固形及び脊髄性の両方)であるが、同じ原理が、その他の異常な血管形成に基づく病理の処置においても具体化される。その他の病理には、関節炎、網膜症、乾癬、固形腫瘍、良性腫瘍、カポジ肉腫、及び血液学的悪性疾患が含まれ得る。これには、前記の薬物が含まれ得;又は、例えば、関節炎の場合には、疾患修飾薬(DMARD)、非ステロイド性抗炎症薬(NSAID)、コルヒチン、メトトレキサート等がナノコアに含まれ、抗血管形成因子が周囲の脂質小胞又はポリマーシェルに含まれ得る。さらに、ナノセルにより達成される二つの無関係な活性因子間の空間−時間的な放出動態及び薬力学的相乗作用は、治療因子のそのような時間的又は空間的な活性が望まれる、その他の病態生理学的状態における使用の可能性を開く。そのような状態の例は喘息であり得、その場合には、鎮攣薬又は弛緩薬がナノシェルの外側部分に負荷され、ステロイド又はNSAIDのような抗炎症性因子が、喘息に関連した遅延型炎症反応に対する遅延型の活性のため、ナノコアに負荷され、ナノセルの外側部分から速く放出された活性因子が、肺胞及び/又は細気管支を弛緩させた後に、その効果を発揮するであろう。同様に、血液脳関門を開く分子がナノセルの外側部分に負荷され得、中枢作用性の神経活性剤がナノコアへ負荷され得、CNSにおける活性因子の構築を増加させ得る。ナノセルは、ワクチンの送達においても、より良好な結果のため使用され得る。例えば、アジュバントのような炎症性因子が、ナノセルの外側部分に負荷され得、抗原がナノコアに負荷され得る。当業者により認識されるように、ナノセル系は、多様な疾患を治療するために使用され得る。
【0063】
(ターゲティング剤)
特定の細胞、細胞の集団、組織、又は器官へと薬物送達デバイスをターゲティングすることが、しばしば望ましいため、ナノセルはターゲティング剤を含むよう修飾されてもよい。特定の細胞へ薬学的組成物を差し向ける多様なターゲティング剤が、当該分野において公知である(例えば、Cottenら、Methods Enzym.217:618,1993を参照のこと;これは本明細書中に参考として援用される)。ターゲティング剤は、ナノセル全体に含まれてもよいし、内側ナノコアにのみ含まれてもよいし、外側の脂質もしくはポリマーシェル部分にのみ含まれてもよいし、又はナノセルの表面にのみ存在してもよい。ターゲティング剤は、タンパク質、ペプチド、炭水化物、糖タンパク質、脂質、低分子、金属等であり得る。ターゲティング剤は、特定の細胞もしくは組織を標的とするために使用されてもよいし、又は粒子のエンドサイトーシスもしくは食作用を促進するために使用されてもよい。ターゲティング剤の例には、以下に限定されないが、抗体、抗体フラグメント、低密度リポタンパク質(LDL)、トランスフェリン、アシアロ糖タンパク質(asialycoproteins)、ヒト免疫不全ウイルス(HIV)のgp120エンベロープタンパク質、炭水化物、受容体リガンド、シアル酸等が含まれる。ターゲティング剤がナノコアに含まれる場合、ターゲティング剤は、ナノ粒子を形成させるために使用される混合物に含まれ得る。ターゲティング剤がナノセルの表面にのみ存在する場合、ターゲティング剤は、標準的な化学的技術を使用して、形成された粒子と(即ち、共有結合性、疎水性、水素結合性、ファンデルワールス性、又はその他の相互作用により)会合させられ得る。
【0064】
(薬学的組成物)
本発明の粒子が調製された後、それらは、薬学的組成物を形成させるため、その他の薬学的賦形剤と組み合わせられ得る。当業者により認識されるように、賦形剤は、下記のような投与経路、送達される因子、因子の送達の時間的経過等に基づき選択され得る。
【0065】
本発明の薬学的組成物、及び本発明に係る使用のための薬学的組成物は、薬学的に受容可能な賦形剤又は担体を含み得る。本明細書において使用されるように、「薬学的に受容可能な担体」という用語は、非毒性の、不活性の、固形、半固形、又は液状の増量剤、希釈剤、封入材料、又は任意の型の製剤化補助剤を意味する。薬学的に受容可能な担体として機能し得る材料のいくつかの例は、ラクトース、グルコース、及びショ糖のような糖;コーンスターチ及びジャガイモデンプンのようなデンプン;セルロース、並びにカルボキシメチルセルロースナトリウム、エチルセルロース、及び酢酸セルロースのようなその誘導体;粉末化されたトラガカントゴム;麦芽;ゼラチン;タルク;カカオ脂及び坐剤用ロウのような賦形剤;落花生油、綿実油のような油;ベニバナ油;ゴマ油;オリーブ油;トウモロコシ油及び大豆油;プロピレングリコールのようなグリコール;オレイン酸エチル及びラウリン酸エチルのようなエステル;寒天;トゥイーン80のような界面活性剤;水酸化マグネシウム及び水酸化アルミニウムのような緩衝剤;アルギン酸;発熱性物質除去水;等張生理食塩水;リンゲル液;エチルアルコール;人工脳脊髄液(CSF)、及びリン酸緩衝溶液、並びにラウリル硫酸ナトリウム及びステアリン酸マグネシウムのようなその他の非毒性の適合性の滑沢剤であり、着色剤、放出剤、コーティング剤、甘味剤、風味芳香剤、保存剤、及び抗酸化剤も、製剤化を行う者の判断により組成物中に存在し得る。本発明の薬学的組成物は、経口的に、直腸に、非経口的に、大槽内に、膣内に、鼻腔内に、腹腔内に、局所的に(粉末、クリーム、軟膏、又は滴剤により)、経皮的に、皮下に、頬に、又は経口もしくは鼻のスプレーとして、ヒト及び/又は動物へ投与され得る。
【0066】
注射可能調製物、例えば、無菌の注射可能な水性又は油性の懸濁物は、適当な分散剤又は湿潤剤及び懸濁化剤を使用して、既知の技術に従って製剤化され得る。無菌の注射可能調製物は、非毒性の非経口的に受容可能な希釈剤又は溶媒による無菌の注射可能な溶液、懸濁物、又はエマルジョン、例えば、1,3−ブタンジオール溶液であってもよい。利用され得る受容可能な媒体及び溶媒には、水、リンゲル液、U.S.P.等張塩化ナトリウム溶液が含まれる。さらに、無菌の固定油が、溶媒又は懸濁化媒体として従来利用されている。この目的のためには、合成のモノグリセリド又はジグリセリドを含む、任意の非刺激性(bland)の固定油が利用され得る。さらに、オレイン酸のような脂肪酸が、注射可能剤の調製において使用される。
【0067】
注射可能製剤は、例えば、細菌保持フィルターによるろ過により、又は、使用前に滅菌水又はその他の無菌の注射可能媒体に溶解又は分散させられ得る、無菌の固形組成物の形態に滅菌剤を組み入れることにより、滅菌され得る。
【0068】
(薬学的組成物をアッセイする方法)
実質−間質軸の介入は、依然として腫瘍療法のための魅力的な目標である。抗血管形成薬を評価するための標準的なアプローチは、血管形成中の重要工程である内皮細胞の増殖、遊走、化学浸潤(chemoinvasion)、又は管形成(tubulogenesis)に対する活性を研究することであった(Senguptaら、Circulation 107(23):2955−61,6月17日,2003)。しかしながら、これらのアッセイは、腫瘍細胞から単離されて、活性化された内皮が研究されるという事実によって制限される。腫瘍内皮が独特の遺伝学的サインを示すことが証明されているため(StCroixら、Science 289(5482):1197−1202,8月18日,2000)、このことは致命的である。さらに、標準的な組織培養技術は、しばしば、空間的配置を促進しない。実際、2−D系において培養された内皮細胞は、細胞と細胞外環境との間の天然の相互作用をシミュレートするために開発された3−Dモデル系とは異なっている。Shekharら(Cancer Res.61(4):1320−26,2月15日,2001)は、新生物発生前の胸部上皮細胞と混合された内皮細胞が、管−肺胞形態形成、血管形成、及び悪性表現型への進行の研究を可能にする、3次元マトリゲルに基づく共培養モデルを開発した。3D共培養系を開発するため、Nehls及びDrenckhahn(Histochem.Cell Biol.104(6):459−66,12月、1995)は、ミクロの担体に基づくフィブリンゲル包埋共培養物を使用し、Duttら(Tissue Eng.9(5):893−908,10月、2003)は、NASAバイオリアクターを使用した。Longoら(Blood 98(13):3717−26、12月15日、2001)は、3−Dコラーゲンマトリックス上で黒色腫細胞と内皮細胞の単層との相互作用を研究した。しかしながら、全てのそのような共培養実験において、標準的な免疫組織細胞化学を使用して、CD31、CD34、CD105、vWF等のような一般に使用される抗体、又はa1−フコシル部分と結合するレクチンを使用して、内皮細胞が標識されているが、これらは、多くのコスト及び時間を要する。さらに、相互作用する細胞パートナーの同時の可視化及び分析のため、複雑さのレベルがさらに増す。
【0069】
本発明は、有限の寿命を有している初代内皮細胞を改変させずに、蛍光性の遺伝子産物(例えば、緑色蛍光タンパク質(GFP))を発現するよう安定的にトランスフェクトされた形質転換腫瘍細胞(例えば、黒色腫細胞)を組み入れることにより、これらの制限を克服する。内皮成分と腫瘍成分とを別個に標識するその後の一工程は、マージされた画像が、内皮細胞とは異なる色で腫瘍細胞を示すため(例えば、腫瘍細胞は緑色で、内皮細胞は赤色で現れる)、容易な可視化及び分析を可能にする。
【0070】
実際、ドキソルビシンとのインキュベーションは、緑色の黒色腫細胞の完全な欠損から明からなように、化学療法効果を発揮した。さらに、より低いバックグラウンドを有する高コントラスト画像の捕捉が、定量化のための立体解析学的分析も容易にし、この工程は容易にコンピュータにより自動化され得る。
【0071】
アッセイ系において使用される細胞系は、蛍光タンパク質を安定的に発現することができるか、又は適切な波長を使用して励起された場合に蛍光を発するよう修飾された形質転換細胞である。好ましくは、細胞は、間葉系起源の腫瘍(肉腫)、又は上皮起源の腫瘍(癌腫)、又は奇形腫からのものであろう。脳の癌、肺癌、胃癌、結腸癌、乳癌、膀胱癌、前立腺癌、卵巣癌、子宮癌、精巣癌、膵臓癌、白血病、リンパ腫、骨癌、筋肉の癌、及び皮膚癌からの細胞が、本発明のアッセイにおいて使用され得る。好ましくは、細胞は、細胞培養ディッシュに付着性のものであろう。内皮細胞は、血管系、例えば、動脈、静脈、又は毛細血管のような微小血管系に由来するべきである。内皮細胞は、先祖細胞又は幹細胞に由来してもよい。ある種の実施形態において、内皮細胞はヒト臍帯に由来する。
【0072】
この研究より以前に報告された全ての共培養実験において、相互作用する細胞成分は、一緒に播種された。しかしながら、病態生理学において、血管形成とは、既存の血管床からの新生血管の出芽として定義される。病態生理学をより正確に模倣するため、本発明は、腫瘍細胞を播種する前に、内皮細胞の原始ネットワークの発達が形成されることを可能にする。このアプローチによって、腫瘍細胞の存在下での血管ネットワークの形成の有意な増加が観察される。この新規のインビトロモデル系は、腫瘍血管形成をより正確にシミュレートし、新規分子の化学療法活性及び抗血管形成活性の同時の検出を可能にする。このアッセイ系は、実質−間質軸の分子的相互作用を精査し、化学療法薬及び抗血管形成薬の戦略的組み合わせ計画の開発を容易にするための独特のツールを提供する。
【0073】
本発明のこれら及びその他の局面は、以下の実施例を考慮することによりさらに認識されるが、実施例は、本発明のある種の特定の実施形態を例示するためのものであって、特許請求の範囲により定義されるような本発明の範囲を制限するためのものではない。
【実施例】
【0074】
(実施例1:ナノセルの合成及び分析)
(A)ドキソルビシンのPLGAとの結合(図3)。50/50のラクチド/グリコリドモル比を有しているポリ乳酸グリコール酸(PLGA)(Medisorb(登録商標)5050 DL 4A)を、Alkermes(Wilmington,OH)から入手した。このポリマーの平均分子量は61kDaであると報告されており、その末端に遊離のヒドロキシル基及びカルボキシル基を有している。塩酸ドキソルビシン、クロロギ酸p−ニトロフェニル(nitrophenyl chloroformate)、及びトリエチルアミンは、Sigma−Aldrich(St.Louis,MO)から入手した。簡単にいえば、1.5gのPLGA 5050 DL 4Aを15mlの塩化メチレンに溶解させ、0℃の氷浴中で維持された溶液に、14mgのクロロギ酸p−ニトロフェニル及び9.4mg(およそ9.6μL)のピリジンを添加することにより活性化した(PLGA:クロロギ酸p−ニトロフェニル:ピリジンの化学量論的モル比=1:2.8:4.7)。反応を窒素雰囲気下で室温で3時間実施した。得られた溶液を塩化メチレンにより希釈し、0.1%HCl及びブラインで洗浄した。有機相を分離し、無水硫酸マグネシウムで乾燥し、ろ過し、次いで、回転式蒸発により、活性化されたPLGAポリマーを得た。活性化されたPLGA(0.4g)を3mLのジメチルホルムアミド(DMF)に溶解させ、窒素雰囲気下で室温で24時間、4mgのドキソルビシン及び2.7mg(およそ4μL)のトリエチルアミンと反応させた(活性化されたPLGA:ドキソルビシン:トリエチルアミンの化学量論的モル比=1:1:4)。最終結合生成物を、冷エーテルの添加により沈殿させ、エーテルで洗浄し、ろ過し、真空下で乾燥した。
【0075】
既知量の結合体を計量し、ジメチルスルホキシド(DMSO)に溶解させた。結合の程度は、480nm(ドキソルビシン吸光度の波長)において溶液の吸光度を測定することにより決定した。DMSO中の一連のドキソルビシン濃度の吸光度の標準曲線を、結合体内のドキソルビシン量を決定するために使用した。結合反応の収率は、およそ90%であった。
【0076】
(B)ナノコアの合成及びナノコアの走査型電子顕微鏡検(図3B)。ナノコアをエマルジョン溶媒蒸発技術を使用して製剤化した。簡単にいえば、50mgのPLGA−DOXを、室温で1時間2.5mLのアセトンに完全に溶解させた。この時点で、0.5mLのメタノールを添加し、全溶液を、組織ホモジナイザーを使用して常にホモジナイズしながら徐々に射出し、その後、1分間、超音波処理(Misonix,Farmingdale,NY)することにより、PVA(0.5g/25mL)の水性溶液へと乳化した。残余のアセトン又はメタノールを蒸発させるため、室温で3時間、急速に混合しながら、エマルジョンをPVAの希薄な水性溶液(0.2g/100mL)へと添加した。ナノコアサイズ画分を、8,000、15,000、20,000、及び22,000RPMにおける超遠心分離により回収した。ナノセルへの封入のためのナノコアを入手するため、最小サイズ画分からのナノコアを、携帯型押し出し機(Avestin,Ottawa,ONT)を使用して100nmの膜を通して押し出した。動的光散乱(Brookhaven Instruments Corp,Holtsville,NY)によっても、SEMによっても、ナノコアをサイジングした(図3B及び3E)。SEM調製のため、ナノコアを72時間凍結乾燥し、その後、少量をカーボングリッドへと吹き付け、金によりコーティングした。65000×の倍率でPhilips EMを使用して、粒子を分析した。凝集を最小限に抑えるため、全てのナノコアを、合成から2時間以内に使用した。
【0077】
周囲のマトリックス/ナノシェルを調製するため、コレステロール(CHOL)、卵ホスファチジルコリン(PC)、及びジステアロイルホスファチジルコリン−ポリエチレングリコール(分子量2000)(DSPE−PEG)を、Avanti Polar Lipids(Birmingham,AL)から入手した。コンブレタスタチンA4は、Tocris Cookson(Ellisville,MO)から入手した。その他の全ての試薬及び溶媒は、分析用等級であった。
【0078】
PC:CHOL:DSPE−PEG(2:1:0.2モル濃度)脂質膜を、丸底フラスコで2mLのクロロホルムに27.5mgの脂質を溶解させることにより調製した。12.5mgのコンブレタスタチンA4を、0.9:1薬物:脂質モル比で、クロロホルム(choloroform)混合物に同時溶解させた。単層脂質/薬物フィルムを作出するため、回転式エバポレーター(roto−evaporator)を使用してクロロホルムを蒸発させた。脂質二重層へのコンブレタスタチンA4の優先的な封入を可能にするため、このフィルムを、65℃で1時間振とうした後、1mLのH2Oに再懸濁させた。得られた懸濁剤を、単層脂質小胞を作出するため、携帯型押し出し機(Avestin,Ottawa,ONT)を使用して、65℃で200nmの膜を通して押し出した。平均小胞サイズを、動的光散乱(Brookhaven Instruments Corp,Holtsville,NY)により決定した。290nmでコンブレタスタチンA4溶出をUVモニタリングしながら、セファデックスG−25(Pharmacia Biotech)を含有しているPD−10カラムに薬物/脂質混合物を通すことにより、封入効率を決定した。
【0079】
上記のようにしてPLGA−DOXナノコアを調製し、100nmの膜を通した押し出しにより、およそ100nmのナノコアをナノセル封入のため選択した。CHOL:PC:DSPE−PEG:コンブレタスタチンナノセルを合成する場合には、250μgのドキソルビシンを含有しているナノコアを、水性脂質再懸濁緩衝液へ添加した。封入効率を決定するため、その混合物をTEMを使用して分析した。ナノコアを72時間凍結乾燥し、その後、少量をカーボングリッドへと吹き付け、金によりコーティングした。それらを、65000×の倍率でPhilips EMを使用して分析した(図3B)。
【0080】
(C)ナノセルの合成及び透過型電子顕微鏡写真(図3C)。試料を、5%ショ糖と共に2.5%グルタルアルデヒド(gluteraldehyde)、3%パラホルムアルデヒドを含む0.1Mカコジル酸ナトリウム緩衝液(pH7.4)で固定し、低温アガロースに包埋し、1%OsO4を含むベロナール−酢酸緩衝液で後固定した。試料を、ブロックで、0.5%酢酸ウラニルを含むベロナール−酢酸緩衝液(pH6.0)により一晩染色した。次いで、脱水し、epon−812樹脂に包埋した。切片を、Leica ultra cut UCTで、ダイヤモンドナイフを使用して70nmの厚さに切断し、2.0%酢酸ウラニル、続いて0.1%クエン酸鉛により染色し、Philips EM410を使用して調査した。動的レーザー光散乱実験も、サイズ範囲が180〜220nmであることを確認した(図3D及び3E)。
【0081】
(D)物理化学的な放出動態研究。濃縮された薬物が負荷されたナノセルを、1mlのPBS又は低酸素細胞溶解物緩衝液に懸濁させ、透析バッグ(分子量カットオフ:10,000、Spectrapor)に密封した。透析バッグを、温和に振とうしながら、37Cの20mlのPBS緩衝液の中でインキュベートした。所定の時間間隔でインキュベーション媒体から一定分量200ulを採取し、分析のための凍結保管した。溶出剤としてアセトニトリル(A)及び水(B)を用いたC18カラム(4.5mm×150mm、Waters)を使用した逆相HPLCにより、放出された薬物を定量した。出発条件は、80%A及び20%Bであり、1ml/分の流速で、15分間の直線勾配により10%A及び90%Bにし、5分間の直線勾配により0%A及び100%Bにし、そして5分間の直線勾配により出発条件へと戻した。標準化された量のデキサメタゾンを、コンブレタスタチン(combretastatain)A4及びドキソルビシンの絶対的定量化のための内部対照として添加した。コンブレタスタチンA4及びデキサメタゾンを、295nmにおける波長モニタリングにより検出し、ドキソルビシンは、480nmにおける波長モニタリングにより検出した。まず大量のコンブレタスタチンがナノセルから放出され、続いてナノコアからのドキソルビシンの遷延性の遅い放出が起こる。放出された遊離ドキソルビシンの量はドキソルビシン−PLGAフラグメントと比較して小さく、そのことから、遊離ドキソルビシン及び活性ドキソルビシン−PLGAフラグメントは細胞障害性効果に寄与するが、ドキソルビシン−PLGAオリゴマーはそれに寄与しないことが強調された(図3F)。
【0082】
(実施例2:新規のインビトロアッセイ系の開発)
プロトコル:系を確立するため、3人のドナーからプールされたヒト臍静脈内皮細胞を、Cambrexから購入し、3〜6の間の継代で使用した。細胞を、20%胎仔ウシ血清(FBS)及びブレットキット(bulletkit)−2が補足された内皮基本培地において増殖させた(Senguptaら、Cancer Res.63(23):8351−59,2003年、12月1日)。腫瘍成分のため、本発明者らは、緑色蛍光タンパク質を発現するよう安定的にトランスフェクトされたB16/F10黒色腫細胞をモデル細胞系として使用した。増強緑色蛍光タンパク質を発現するプラスミド(pEGFP−C2,Clontech)を直鎖化し、リポフェクションによりB16−F10細胞へと導入した(Lipofectamine 2000,Invitrogen)。安定的に組み込まれたB16−F10細胞のクローンを、800μg/ml G418により選択した。G418耐性クローンの緑色蛍光を、フローサイトメトリー及びエピフルオレセンス(epifluorescence)顕微鏡検によりさらに確認した。GFP−B16/F10細胞を、5%FBSが補足されたDMEMにおいて定期的に培養した。無菌カバーガラス(Corning)を、マトリゲル(リン酸緩衝生理食塩水で1:3に希釈されたマウスEnglebreth−Holms肉腫から抽出された細胞外マトリックス;Becton Dickinson)又はコラーゲン(ラット尾部由来のI型、Becton Dickinson)によりコーティングした。同期化されたヒト臍静脈内皮細胞を、トリプシン処理し、1ウェル当たり2×104細胞の密度でカバーガラス上に蒔いた。20%胎仔ウシ血清が補足された内皮基本培地中で24時間、細胞を付着させた。この時点で、1%血清が補足されたEBMに培地を交換し、緑色蛍光タンパク質を発現しているB16/F10細胞を、1ウェル当たり5×103細胞の密度で系へ添加した。共培養物を一晩インキュベートし、その後、異なる処理を培地に添加した。処理後24時間目に、細胞をパラホルムアルデヒド(4%、氷上、20分間)で固定し、ヨウ化プロピジウムにより染色した。アンチフェード(antifade)でカバーガラスをマウントし、LSM510 Zeiss共焦点顕微鏡により分析した。蛍光色素を488nm及び543nmのレーザー線を使用して励起し、放射された光を505/30nm及び565/615のバンドパスフィルターを使用して捕捉した。512×512ピクセルの解像度で画像を捕捉した。内皮細胞又はGFP−BL6/F10細胞によりカバーされた面積の定量化を、224−インターセクションポイントスクエアレティキュラム(intersection point square reticulum)を使用して、面積測定ポイントカウント法(planimetric point−count method)を使用して実施した。データは、細胞によりカバーされた総面積に対する各成分の比率として表された。
【0083】
(インビトロ腫瘍血管形成に対するVEGF及びHGFの効果(図4))
内皮細胞は、マトリゲルに蒔かれてから(1:3希釈)24時間以内に、限られた数の管状ネットワークを形成した。しかしながら、共培養物を確立するための腫瘍細胞の添加は、管形成過程を加速した。GFP+腫瘍細胞は、血管ネットワークにより包囲され統合されたクラスタへと集中していることが可視化された。VEGF及びHGF/SFの両方の添加は、血管ネットワークの有意な増加をもたらした。特定の経路の調節を解明するための系の感受性を確証するため、本発明者らは、VEGF受容体アンタゴニスト、PTK787を使用した。予想通り、VEGFにより誘導される血管形成は、HGF/SFにより誘導される応答に対しては効果がなかった濃度で、PTK787により阻止された(図4)。
【0084】
(VEGF又はHGF/SFにより誘導される応答に対するコンブレタスタチン、サリドマイド、及びドキソルビシンの効果(図5および6))
図5に示されるように、ドキソルビシン(10〜50μM)とのインキュベーションは、濃度依存様式において腫瘍細胞の選択的な排除を発揮した。使用された最も高い濃度(50mM)ですら、VEGFにより誘導される内皮ネットワークに対する効果は明白でなかった。対照的に、サリドマイド及びコンブレタスタチンの両方は、腫瘍細胞に影響を与えることなく、VEGFにより誘導される血管ネットワークの崩壊を発揮した。
【0085】
VEGFにより誘導される共培養実験と同様に、ドキソルビシンは、HGF/SFの存在下で腫瘍細胞死の選択的な誘導を発揮した(図6)。しかしながら、VEGFとは対照的に、HGF/SFは、サリドマイド又はコンブレタスタチンの存在下での内皮細胞ネットワークの排除を防止した(図6)。これらの二つの間接型抗血管形成因子に対する、VEGFにより誘導される血管形成の感受性、及びHGF/SFの防護効果は、二つの増殖因子により誘導される細胞内シグナル伝達のレベルにおける機能的な差を示している。
【0086】
(VEGF又はHGFにより誘導される腫瘍応答に対するコラーゲンマトリックスの効果(図7〜8))
コラーゲンマトリックス上に蒔かれた内皮細胞は、マトリゲル上に蒔かれた場合に形成された管状ネットワークと異なり、平坦な「丸石(cobble−stone)」形態学を呈した。さらに、黒色腫細胞も、接着斑の形成と共に「展延(spreading−out)」形態学を呈し、マトリゲル上で見られたような細胞クラスタを形成しなかった。ドキソルビシンとのインキュベーションは、VEGFで処理された共培養物においても、HGF/SFで処理された共培養物においても、腫瘍細胞死を誘導した(図7、8)。図7に示されるように、コンブレタスタチン及びサリドマイドの両方が、VEGFの血管形成効果を阻害した。興味深いことに、細胞をコラーゲン上に蒔いた場合には、マトリゲル上に蒔かれた細胞において観察されたHGF/SFの防護効果が失われ、サリドマイド及びコンブレタスタチンの両方が内皮細胞欠損を誘導した(図8)。この見解は、抗血管形成療法をスクリーニングする際に細胞外成分を組み入れる必要を強調している。
【0087】
(実施例3:薬物が負荷されたナノセルのインビトロ効力(図9))
無菌カバーガラス(Corning)を、マトリゲル(リン酸緩衝生理食塩水で1:3に希釈されたマウスEnglebreth−Holms肉腫から抽出された細胞外マトリックス;Becton Dickinson)又はコラーゲン(ラット尾部由来のI型、Becton Dickinson)によりコーティングした。同期化されたヒト臍静脈内皮細胞を、トリプシン処理し、1ウェル当たり2×104細胞の密度でカバーガラス上に播種した。細胞を、20%胎仔ウシ血清が補足された内皮基本培地中で24時間付着させた。この時点で、1%血清が補足されたEBMに培地を交換し、緑色蛍光タンパク質を発現しているB16/F10細胞を、1ウェル当たり5×103細胞の密度で系へ添加した。共培養物を一晩インキュベートし、その後、異なる処理を培地に添加した。処理後24時間目に、細胞をパラホルムアルデヒド(4%、氷上、20分間)で固定し、ヨウ化プロピジウムにより染色した。アンチフェードでカバーガラスをマウントし、LSM510
Zeiss共焦点顕微鏡により分析した。蛍光色素を488nm及び543nmのレーザー線を使用して励起し、放射された光を505/30nm及び565/615のバンドパスフィルターを使用して捕捉した。512×512ピクセルの解像度で画像を捕捉した。内皮細胞又はGFP−BL6/F10細胞によりカバーされた面積の定量化を、224−インターセクションポイントスクエアレティキュラムを使用して、面積測定ポイントカウント法を使用して実施した。データは、細胞によりカバーされた総面積に対する各成分の比率として表された。
【0088】
統計図表に示されるように、ドキソルビシンが負荷されたナノコアとのインキュベーションは、血管形成の結果には影響を与えることなく、黄色の黒色腫細胞の選択的な欠損をもたらした。対照的に、周囲の脂質マトリックスに捕獲されたコンブレタスタチンとのインキュベーションは、血管ネットワークの選択的な欠損をもたらし、内皮細胞に対するその選択性が証明された。共培養物をコンブレタスタチン及びドキソルビシンが負荷されたナノセルと共にインキュベートした場合には、まず内皮細胞の迅速な死がもたらされ、続いて、全共培養物の完全な欠損が起こった。これは、病態生理学を精密に模倣したシミュレーションにおいて、周囲マトリックスの活性因子(この場合、コンブレタスタチン)が、ナノコアに結合された活性因子(この実施例の場合、ドキソルビシン)の前に放出されることを証明しており、ナノセルの使用に起因する空間−時間的な効果、及び腫瘍の完全な排除をもたらすために、より優れた効力を強調している。
【0089】
(実施例4:インビボ腫瘍モデル(図10))
雄C57/BL6マウス(20g)に、3×105個のYFP−BL6/F10細胞又は2.5×105個のルイス(Lewis)肺癌細胞を側腹部へ注射した。腫瘍の増殖を、定期的にモニタリングした。腫瘍の体積が50又は150mm3のいずれかに達した時点で、マウスを異なる処理群へと無作為化した。処理は、3〜7回の適用のため隔日に尾静脈から投与された。腫瘍の寸法を毎日測定し、下記式に従って腫瘍体積を計算した:
体積=3.14/6×長さ×幅2
特定の時点で動物を屠殺し(図10及び12参照)、腫瘍を、肉眼的形態学のため写真撮影し、組織病理学的分析のため切除した。白血球数が化学療法薬の効果に対して最も感受性であるため、同時に、1mlの血液を心臓穿刺により採取し、処理レジメンの毒性プロファイルのために分析した。
【0090】
写真は、ナノセル処理群と比較した、マウスにおける黒色腫増殖に対する異なる薬物製剤及び組み合わせの効果を示している。ドキソルビシン−ナノコア及びナノ脂質捕獲コンブレタスタチンによる処理は、いずれも、腫瘍増殖の低下をもたらし、組み合わせられた場合、相加効果を示した。しかしながら、ナノセル製剤で投与された場合、結果は、いずれの比較群よりも有意に優れていた。これは、ナノセルが、血管系の破壊の前に、dox−ナノコアを腫瘍へと送達するという本発明者らの仮説を支持している。
【0091】
グラフは、異なる血球数及びヘモグロビンレベルに対する異なる処理の効果を示す。ナノセル処理群では、最も強力であったという事実にもかかわらず、最小の毒性が観察され、このことは、化学療法因子(ドキソルビシン)が、ナノコアから放出される前に血管が崩壊するため、腫瘍内に捕獲され、より少ない量が体循環へと漏出し得ることを示唆している。
【0092】
(実施例5:腫瘍新生血管系に対する異なる処理の効果(図11))
ナノコア−ドキソルビシン(ND)による処理は、血管系又は血管密度に対しては効果を及ぼさないが(グラフ参照)、ナノ脂質−ミセルコンブレタスタチン(LC)は、血管密度を低下させ、血管系を崩壊させる。ND+LCは相乗的であったが、この群とナノセルを使用して達成されたものとの間に有意な差は存在しなかった。いずれの群においても、LCがNDより早く功奏すると予想されるため、これは予想通りである。
【0093】
(実施例6:腫瘍アポトーシスに対する異なる処理の効果(図12))
アポトーシスを受けている細胞は、TUNEL陽性であるため、赤色に染色される。LC+ND処理群及びナノセル処理群は、腫瘍血管系に対して同じ効果を有していたが、後者が腫瘍においてより大きなアポトーシスを誘導したことは明白である。これは、ナノセル処理群において観察された、より良好な治療結果を説明し、ドキソルビシンが、ナノコアから放出され、LCにより媒介される腫瘍血管の崩壊の結果として腫瘍内に捕獲されるという仮説も支持する。対照的に、LC+ND処理切片は、有意な量のNDが腫瘍間質に侵入する前に血管が崩壊するため、比較的少ないアポトーシスを示す。
【0094】
(実施例7:転移に対する異なる処理の効果(図13))
黒色腫は、その他の器官に加えて、肝臓及び肺へと自然に転移する高悪性度の腫瘍である。本発明者らは、これらの器官における転移節の数を評価することにより、肺(上パネルセット)及び肝臓(下パネルセット)への転移に対する異なる処理条件の効果を評価した。これは、緑色蛍光陽性の節の数を計数することによりなされたが、統計図表においては、核を標識する色素で標識された全細胞からの赤色発光と、緑色蛍光がマージするため、それらは黄色として現れる。示されるように、ナノセルによる処理は、両方の器官への転移を防止した。
【0095】
(実施例8:組織分布研究)
フルオレセイン色素が負荷されたナノセルを合成した。遊離フルオレセインは、セファデックスG25カラムにナノセルを通すことにより除去した。フルオレセイン−ナノセルを、腫瘍を保持しているマウスへ注射した。投与後5、10、及び24時間後に、動物を屠殺した。剖検の間に血清、腫瘍、肝臓、肺、及び脾臓を収集し、メタノールを使用して、これらの組織からフルオレセインを抽出した。各試料におけるフルオレセインの量を蛍光プレートリーダーを使用して検出し、組織重量に対して規準化した。ナノセルは腫瘍に明らかに蓄積しており、その他の臓器系には蓄積していなかった(図10F)。
【0096】
(実施例9:喘息治療用のナノセル)
図15は、喘息治療用に開発されたナノセルの構造及び放出動態プロファイルを示す。電子顕微鏡写真は、生分解性ナノコアがラクトースシェルによりコーティングされているナノセルの超微細構造を示している。コルチコステロイド(抗炎症性因子)がナノコア内に捕獲され、気管支拡張剤がナノコアを包囲するラクトースマトリックスに捕獲されている。グラフは、まず気管支拡張剤(サルブタモール)が数分という時間スケールで放出され、コルチコステロイド(デキサメタゾン)が遅い遷延性の様式で放出されるという事実を証明している。この時間的な放出は、まず、喘息の間に収縮した細気管支が拡張することを可能にし、より深い肺へのナノコアの浸透を可能にする。その後の遅い放出は、急性喘息エピソードの後の慢性炎症を阻止する。
【0097】
(他の実施形態)
以上は、本発明のある種の非限定的な好ましい実施形態の説明である。当業者は、添付の特許請求の範囲において定義されるような本発明の精神又は範囲から逸脱することなく、この説明に対して種々の変化及び改変が実施され得ることを認識する。
【技術分野】
【0001】
(関連出願)
本出願は、米国特許法第119条(e)項に基づいて、2004年3月2日に出願された「ナノセル薬物送達系」という発明の名称の米国仮出願第USSN60/549,280号からの優先権を主張し、それらは、本明細書中に参考として援用される。
【背景技術】
【0002】
(発明の背景)
合理的な薬物療法のための必要条件は、薬物の効果が予測され得るような、正確な診断、疾患の病態生理学の知識、健常者及び疾患者における基本的な薬物療法学の知識、並びにこれらの関係の適切な予想である(非特許文献1)。ゲノム、プロテオーム、又はグリコームに関して、生物医学的科学においてなされた進歩は、多くの疾患の根底にある分子メカニズムを解明し、シグナル伝達カスケード、トランスクリプトーム、及びグリコームの明らかに変化する複雑なネットワークを関連付けた。ほとんどの病態生理学的状態において、このことは、治療結果をもたらす機能の回復又は欠損についての調節のための効果的な標的を明らかにし得る。しかしながら、疾患組織に、もしくは疾患組織内の空間的に別個の標的細胞にさえ、別の経路が関与している点、又は疾患組織内で起こる時間的事象が、最終表現型として現れる点に、複雑さがある。論理的なストラテジーは、複数のレベルで疾患を標的とすることであり、それは、複数の活性因子又は薬物の併用療法を使用して達成され得る。しかしながら、このことは、多くの場合、あまりにも多い薬物の服用における患者のコンプライアンス、又は薬物動態(吸収、分布、生体内変換、及び排出)並びに薬力学(薬物の生化学的及び生理学的な効果並びにそれらの作用機構)のレベルにおける薬物−薬物相互作用、又は毒物学により制限されるため、ほとんどの条件において最適なストラテジーではない(非特許文献2)。このような相互作用は、活性因子の実際の治療効果を低下させ得るか、又はその毒性を増加させ得、その比率は治療指数として定義される。本発明による上記の制限の解決は、医学及び治療学を確実に革新する。
【0003】
近代医療の限界をより理解するための適切な例は、腫瘍の処置である。米国の全ての人の3分の1が、癌を発症する。米国において、5年生存率は、早期診断及び治療の進歩の結果として、ほぼ50パーセントへと劇的に上昇したが、癌は依然として心疾患に次いで最も多い死因である。アメリカ人の20パーセントが癌で死亡しており、その半分が、肺癌、乳癌、及び結腸直腸癌による。
【0004】
癌を罹患する患者のための有効な処置を計画することは、大きな難題となっている。外科的切除、放射線外部照射療法、及び/又は全身化学療法という現在のレジメンは、ある種の悪性疾患においては部分的に成功しているが、満足な結果を与えない場合もある。脳悪性疾患のようないくつかの悪性疾患において、このレジメンは、1年未満の生存期間の中央値を与える。例えば、切除された悪性神経膠腫の90%は、1年以内に元の腫瘍部位の2センチメートル以内に再発する。
【0005】
全身化学療法の使用は、数種の癌においては有効であるが、結腸癌直腸、食道癌、肝臓癌、膵臓癌及び腎臓癌及び皮膚癌の治療においては、わずかにしか成功していない。これらの型の癌の治療のための全身化学療法による主要な問題は、腫瘍増殖の抑制を達成するために必要とされる全身用量が、高頻度に、受容可能でない全身毒性をもたらすという点である。例えば、連続全身注入によって、腫瘍部位への化学療法因子の送達を改良する試みは、器官指向化(organ−directed)化学療法の進歩をもたらした。しかしながら、抗癌薬の連続注入は、一般に、パルス注入又は短期注入を超える明らかな利益を示していない。現在病院で使用されている抗腫瘍性因子又は化学療法因子には、(a)メクロレタミン、シクロホスファミド、イホスファミド、メルファラン(melphaan)、クロラムブシル、ヘキサメチルメラミン、チオテパ、ブスルファン、カルムスチン、ロムスチン、セムスチン、ストレプトゾシン、ダカルバジン等のようなアルキル化剤;(b)メトトレキサート、5−FU、FudR、シタラビン、6MP、チオグアニン、ペントスタチン等のような代謝拮抗薬;(c)タキソール、ビンブラスチン、ビンクリスチン、エトポシド、テニポシド等のような天然物;(d)ダクチノマイシン、ダウノルビシン、ドキソルビシン、ブレオマイシン、プリカマイシン、マイトマイシンc等のような抗生物質;(e)L−アスパラギナーゼ、ヘパリナーゼ、コンドロイチナーゼ等のような酵素;(f)インターフェロン−α、インターフェロン−γ、腫瘍壊死因子等のようなインターフェロン及びインターロイキン;(g)シスプラチン、カルボプラチン、又はそれらの誘導体のような白金配位錯体;及び(h)ミトキサントロン、ビスクロロエチルニトロソウレア、ヒドロキシ尿素、クロロエチル−シクロヘキシルニトロソウレア、プレドニゾン、ジエチルスチルベストロール、メドロキシプロゲステロン、タモキシフェン、ミトタン、プロカルバジン、アミノグルテチミド、プロゲスチン、アンドロゲン、抗アンドロゲン(antiadrogens)、ロイプロリド等のようなその他の種々の因子が含まれる。
【0006】
抗腫瘍療法の最近の進歩は、腫瘍の発達における重要な段階としての血管形成の同定であった。既存の血管床からの新たな血管の発達である血管形成は、腫瘍の急激な増大及び遠位転移の発達の基礎となる(非特許文献3)。腫瘍は、体積1〜2mm3の段階に達すると、さらなる増殖のための栄養素を必要とする。腫瘍のコアの細胞が死滅し始め、それが、最も近い血管からの内皮細胞の補充をもたらす、増殖因子及び血管形成促進シグナルに富んだ壊死コア(necrotic core)となる。別の連続的な段階において遂行される血管形成は、複数の媒介物質の相互作用により引き起こされる、腫瘍細胞と細胞外マトリックスと内皮細胞との間の空間−時間的相互作用の頂点である(非特許文献4)。この複雑な過程の根底にある事象についての理解、及びいくつかの媒介物質の作用機構の解明は、腫瘍管理のための新規ストラテジーとしての血管形成の治療的ターゲティングという刺激的な可能性を開き、60を超える化合物が臨床的な開発段階にある。
現在、血管形成インヒビターには、直接型及び間接型という二つのクラスが存在する。ビタキシン(vitaxin)、アンジオスタチン、エンドスタチン、コンブレタスタチン(combretastatin)、2−メトキシエストラジオール、アバスチン、カンスタチン(canstatin)等のような直接型の血管形成インヒビターは、内皮細胞の増殖、遊走、もしくは管形成を防止するか、又は腫瘍から分泌された血管形成因子に応答した細胞死を細胞が回避することを可能にする。間接型の血管形成インヒビターは、一般に、血管形成を活性化する腫瘍タンパク質の発現を防止するか、もしくはその活性を阻止するか、又は内皮細胞におけるその受容体の発現を阻止する(非特許文献5)。いずれの場合にも、抗血管形成療法の最終結果は、腫瘍の飢餓をもたらす、増殖中の腫瘍への血管供給の停止である。従って、抗血管形成療法は、腫瘍における低酸素をもたらす(非特許文献6)。この低酸素の状況を克服するために、腫瘍は、増殖因子を産生し始め、これらも、腫瘍がはるかに小さかった際の血管形成効果に類似した血管形成効果を発揮する。臨床上、このことは、抗血管形成療法が中止されるや否やの腫瘍増殖の噴出という結果となる(非特許文献7)。同じ増殖因子は、腫瘍細胞の一部がアポトーシス又は細胞死を受けるのを防止することもできる。さらに、固形腫瘍の領域内の異常又は不活発な血流による腫瘍低酸素は、微小環境により媒介される放射線及び化学療法薬の両方に対する耐性をもたらし得る(非特許文献8)。従って、抗血管形成療法の成功によって、血管依存性がより低い変異腫瘍細胞が、時間の経過とともに選択される可能性もある。このことは、より慣例の形態の化学療法に対する応答の欠損又は減弱した応答をもたらす。このことは、生体内還元性の低酸素細胞の細胞障害性因子と抗血管形成因子との併用使用によって克服され得る(非特許文献9)。癌/腫瘍の処置のための、抗腫瘍性因子又は化学療法因子と抗血管形成薬との併用療法の使用は、複数の特許出願に開示されている(例えば、特許文献1;特許文献2;及び特許文献3;特許文献4;特許文献5及び特許文献6(これらの各々は、本明細書中に参考として援用される);特許文献7;特許文献8;特許文献9;特許文献10(これらの各々は、本明細書中に参考として援用される)を参照のこと)。しかしながら、各因子が所望の最大の効果を提供するような、併用療法を送達するための薬物送達系の必要性が残存している。そのような系は、癌の治療においてのみ有用ではなく、自己免疫疾患(例えば、慢性関節リウマチ)、炎症性疾患(例えば、喘息)、神経学的疾患(例えば、てんかん)、及び眼科学的(ophthamological)疾患(例えば、糖尿病性網膜症)のようなその他の疾患の処置における使用にも見出される。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】米国特許第6,147,060号明細書
【特許文献2】米国特許第6,140,346号明細書
【特許文献3】米国特許第5,856,315号明細書
【特許文献4】米国特許第5,731,325号明細書
【特許文献5】米国特許第5,710,134号明細書
【特許文献6】米国特許第5,574,026号明細書
【特許文献7】米国特許出願公開第2002/0041880号明細書
【特許文献8】米国特許出願公開第2002/0107191号明細書
【特許文献9】米国特許出願公開第2002/0128228号明細書
【特許文献10】米国特許出願公開第2002/0111362号明細書
【非特許文献】
【0008】
【非特許文献1】DiPiroら、編、「Pharmacotherapy−A pathophysiologic approach」、第2版
【非特許文献2】GoodmanおよびGilman、「The Pharmacological Basis of Therapeutics」、第9版
【非特許文献3】Folkman、Nat Med、1995年1月、第1巻、p.27−31
【非特許文献4】GriffoenおよびMolema、Pharmacol.Review、2000年6月、第52巻、p.237−68
【非特許文献5】KerbelおよびFolkman、Nature Reviews Cancer、2002年10月、p.727−739
【非特許文献6】Yu JLら、Science、2002年2月、第295巻、p.1526−1528
【非特許文献7】Boehmら、Nature、1997年11月、第390巻、p.404−407
【非特許文献8】Yuら、Differentiation、2002年12月、第70巻、p.599−609
【非特許文献9】Yu JL、Differentiation、2002年12月、第70巻、p.599−609
【発明の概要】
【課題を解決するための手段】
【0009】
(発明の要旨)
本発明は、併用療法において使用される多くの薬物が、異なるメカニズムを介して、及び/又は異なるタイムスケールで作用するという認識に端を発する。従って、併用療法において、薬物がその標的に到達することができないか、又は適切な時点でその標的に到達しない場合には、薬物の効力の全てではないにしても大部分が失われる。例えば、より慣例的な抗腫瘍性因子及び抗血管形成因子の組み合わせによる癌の処置において、最適には、抗腫瘍性因子を輸送する血流が腫瘍細胞に到達するのを抗血管形成因子が防止する前に、抗腫瘍性因子が腫瘍に到達しその効果を発揮するべきである。抗血管形成因子によって機能性の血管系が停止される前に、抗腫瘍性因子が腫瘍に到達しなければ、患者は、抗腫瘍性因子の利益を受容することなく、その副作用に苦しむことになる。従って、癌においても、その他の多くの疾患においても、異なる時間間隔での複数の因子の送達を可能にする薬物送達系が必要とされている。
【0010】
本発明は、併用療法において、ある因子の前又は後に、もう一つの因子が送達され得る薬物送達系を提供する。その薬物送達系は、バルーン内のバルーンの概念に基づく。薬学的因子を含有しているナノコア(例えば、ナノ粒子、ナノチューブ、ナノワイヤ、量子ドット等)が、もう一つの薬学的因子を含有している脂質小胞、マトリックス、又はシェルに封入され、ナノセルを形成する。ナノセルの外側部分(例えば、脂質小胞、シェル、又はマトリックス)の薬学的因子が、まず放出され、続いて、ナノコアの溶解及び/又は分解により第二の薬学的因子の放出が起こる。本発明のナノセルは、最大直径10nm〜500マイクロメートル、好ましくは最大直径80nm〜50マイクロメートルのサイズの範囲である。
【0011】
例えば、癌の処置においては、抗血管形成因子が、脂質小胞内に負荷され、内側ナノ粒子内の抗腫瘍性因子/化学療法因子の前に放出される。このことは、腫瘍に栄養供給する血管系の崩壊をもたらし、抗腫瘍性因子を負荷されたナノコアが、脱出経路のない腫瘍の内部に捕獲されるようにもする。抗腫瘍性因子は、徐々に放出され、栄養素が欠乏した腫瘍細胞の死滅をもたらす。換言すると、この二重バルーン薬物送達系は、抗腫瘍性因子を腫瘍に負荷し、次いで、腫瘍への血液供給を遮断することを可能にする。この連続的な過程は、毒性の化学療法因子/抗腫瘍性因子の腫瘍内への捕獲をもたらして、腫瘍細胞に対する増加した選択的な毒性を与え、そして、機能的に無血管である腫瘍部位から漏出し得ないために、より少ない薬物が体循環中に存在することになり、より少ない副作用をもたらす。腫瘍に捕獲された細胞障害性化学療法セルが、別のやり方では血管停止に起因する低酸素性の増殖因子リッチ(growth factor−rich)な環境において生存する腫瘍細胞を死滅させるため、この技術は、低酸素警告(hypoxia caveat)をも克服する。
【0012】
内側ナノ粒子(別名ナノコア)は、最大寸法およそ10〜20000nmであり、ポリマーマトリックスに封入された第一の治療因子を含有している。これらのナノコアは、当該分野において公知の、脂質、タンパク質、炭水化物、単純結合体、及びポリマー(例えば、PLGA、ポリエステル、ポリアミド、ポリカーボネート、ポリ(β−アミノエステル)、ポリ尿素、ポリカルバメート、タンパク質等)のような材料、並びに方法(例えば、ダブルエマルジョン、噴霧乾燥、転相等)のいずれかを使用して調製される。薬学的又は診断的な因子は、ナノコアに負荷され得るか、又は共有結合的に結合され得るか、又は静電荷を通して結合され得るか、又はイオン結合的に(electrovalently)に結合され得るか、又はリンカーを通して結合され得る。この結果により、ゆっくりとした、持続性および/又は遅延性のナノコアからの(一つ又は複数の)因子が放出される。好ましくは、因子がナノコアに共有結合的に結合される場合、そのリンカー又は結合は、生理学的条件下で生分解性又は加水分解性であり、例えば、酵素分解に対して感受性である。ナノコアは、実質的に球状のナノ粒子、ナノリポソーム、ナノワイヤ、量子ドット、又はナノチューブであり得る。
【0013】
ナノセルを形成させるためには、脂質相に分配された第二の治療因子を有する脂質により、ナノコアをコーティングする。ナノセルは、第二の治療因子を有する別個のポリマー組成物により、ナノコアをコーティングすることによっても形成され得る。好ましくは、ナノシェル又はナノセル周囲のマトリックスは、それが捕獲する一つ又は複数の因子の速い放出を可能にする組成を含んでいるべきである。従って、ある種の実施形態において、この因子の効果は、ナノコアに負荷された活性因子が治療レベルに達する前に、開始する。従って、第二の治療因子は、ナノコアの外部にあるが、最大直径およそ50〜20000nmのナノセルの脂質膜の内部にある。ナノセルは、粒子を安定化するか、又は粒子の外側にターゲティング剤を添加するため、さらにコーティングされてもよい。
【0014】
二つ以上の薬学的因子が、本発明のナノセルを使用して送達され得る。好ましくは、一つの因子又は因子の組み合わせが、第二の因子又は因子の組み合わせの前に最適に送達される。ある種の実施形態において、因子は作用様式又は標的が異なっていてもよい。例えば、ある種の実施形態において、ナノコアの因子がシグナル伝達経路を阻害することができ、そしてナノセルの外側の区画の因子が、異なる経路又は同一経路内の異なるシグナルに影響を与える。二つの因子は、相乗的に作用してもよい。その他の実施形態において、因子は、薬物動態が異なっていてもよい。例えば、関節炎の処置においては、メトトレキサート又はコルヒチンがナノコアに封入され、かつ抗血管形成因子がナノセルの外側脂質部分に封入される。喘息又は慢性閉塞性肺疾患(COPD)の処置においては、抗炎症性因子(例えば、コルチコステロイド、リポキシゲナーゼインヒビター、肥満細胞安定化剤)が、ナノコアに提供され、気管支拡張剤(例えば、β−アゴニスト)がナノセルの外側の区画に提供される。因子を脳へ送達する場合には、血液脳関門を通過させるため、カオトロピック剤、又は薬物が血液脳関門を通過することを可能にするその他の因子が、粒子の外側部分に提供され、抗発作因子のような神経活性剤がナノコアに提供される。その他の実施形態において、ナノセルは、嚢胞性繊維症を罹患する患者を処置するために使用され得る。例えば、ナノセルは、抗生物質及び抗炎症性因子を送達するために使用され得る。その他の実施形態において、ナノセルは、ワクチンを送達するための媒体として使用され、例えば、抗原がナノコアに負荷され得、そしてアジュバントのような炎症性の因子がナノセルの外側部分に含まれ得る。
【0015】
別の局面において、本発明は、本発明のナノセルを有する薬学的組成物を提供する。これらの組成物は、他の薬学的に受容可能な賦形剤も含み得る。これらの組成物は、錠剤、懸濁物、溶液、カプセル、エマルジョン等の形態であり得る。
【0016】
本発明は、適切な薬学的因子が負荷されたナノセルを、疾患に罹患した患者へ投与することにより、様々な疾患を処置する方法も提供する。これらの方法には、癌、炎症性疾患、眼科学的疾患、神経学的疾患、感染性疾患、及び自己免疫疾患を処置する方法が含まれる。治療的に有効な量の因子を送達し、所望の結果を達成するために必要とされる量の因子が、ナノセルに負荷される。当業者により認識されるように、使用される因子及び用量、並びにナノセル内の賦形剤は、(腎臓及び肝臓の機能を含む)処置を受ける患者、処置される疾患、送達すべき因子の種々の薬理学的及び薬物動態学的な特徴、臨床的環境、投与様式等に依存する。ナノセルは、公知の投与経路を使用して投与され得る。ある種の実施形態において、ナノセルは、非経口的に送達される。その他の実施形態において、ナノセルは、例えば、噴霧器、スピンへラー、又はディスクへラーを使用して、吸入により送達される。
【0017】
インビボ環境に類似した状況で、一緒に又は別々に、抗血管形成因子及び化学療法因子をスクリーニングすることを可能にするアッセイ系を提供することが、本発明のさらなる目的であった。これは、細胞外マトリックス上で増殖する細胞を含み、インビボ条件を正確にシミュレートする。このアッセイにおいて、腫瘍細胞が組織培養プレート上に播種される前に、内皮細胞が播種され、細胞外マトリックス上で増殖させられ得る。腫瘍細胞を検出するため、それらは、緑色蛍光タンパク質(GFP)のような蛍光性の遺伝子産物を発現するようトランスフェクトされる。内皮細胞は、蛍光色素により染色される。本発明のアッセイ法を実施するために必要とされる必要な因子を有するキットも、本発明により提供される。
【0018】
(定義)
「アジュバント」:用語アジュバントとは、免疫応答の非特異的な調節因子である化合物をいう。ある種の好ましい実施形態において、アジュバントは免疫応答を刺激する。任意のアジュバントが、本発明に従って使用され得る。多数のアジュバント化合物が公知であり;多くのそのような化合物の有用な概要が、国立衛生研究所(National Instisutes of Health)により用意されている(Allison Dev.Biol.Stand.92:3−11,1998;Unkelessら、Annu.Rev.Immunol.6:251−281,1998;及びPhillips ら、Vaccine 10:151−158,1992(それらの各々は、本明細書中に参考として援用される)も参照のこと)。
【0019】
「動物」:本明細書中で使用される場合、用語動物とは、ヒト、並びに、例えば、哺乳類、鳥類、爬虫類、両生類、及び魚類を含む非ヒト動物をいう。好ましくは、非ヒト動物は、哺乳類(例えば、げっ歯類、マウス、ラット、ウサギ、サル、イヌ、ネコ、霊長類、又はブタ)である。動物はトランスジェニック動物であってもよい。
【0020】
「抗体」:用語抗体とは、天然であるか、又は完全にもしくは部分的に合成により作製されたか否かにかかわらず、免疫グロブリンをいう。特異的結合能力を維持しているその誘導体も、全て、この用語に含まれる。この用語には、免疫グロブリン結合ドメインと相同な又は概して相同な結合ドメインを有しているあらゆるタンパク質も包含される。これらのタンパク質は、天然起源に由来してもよいし、又は部分的にもしくは完全に合成により作製されてもよい。抗体は、モノクローナルであってもよいし又はポリクローナルであってもよい。抗体は、ヒトクラス:IgG、IgM、IgA、IgD、及びIgEのいずれかを含む任意の免疫グロブリンクラスのメンバーであり得る。しかしながら、IgGクラスの誘導体が、本発明において好ましい。
【0021】
「抗体フラグメント」:用語抗体フラグメントとは、全長未満の抗体のあらゆる誘導体をいう。好ましくは、抗体フラグメントは、全長抗体の特異的結合能力の少なくとも有意な一部分(protion)を保持している。抗体フラグメントの例には、Fab、Fab’、F(ab’)2、scFv、Fv、dsFv二重特異性抗体(diabody)、及びFdフラグメントが含まれるが、これらに制限はされない。抗体フラグメントは、任意の手段によって作製され得る。例えば、抗体フラグメントは、インタクトな抗体の断片化により酵素的もしくは化学的に作製されてもよいし、又は部分抗体配列をコードする遺伝子から組換えにより作製されてもよい。あるいは、抗体フラグメントは、完全に又は部分的に合成により作製され得る。抗体フラグメントは、必要に応じて、単鎖抗体フラグメントであってもよい。あるいは、フラグメントは、例えば、ジスルフィド結合により共に連結された複数の鎖を含んでいてもよい。フラグメントは、必要に応じて、多分子複合体であってもよい。機能性の抗体フラグメントは、代表的には少なくとも約50アミノ酸を含み、より代表的には少なくとも約200アミノ酸を含む。
【0022】
単鎖Fv(scFv)は、ポリペプチドリンカーにより相互に共有結合的に結合された、軽鎖可変部(VL)及び重鎖可変部(VH)のみからなる組換え抗体フラグメントである。VL又はVHのいずれかが、NH2−末端ドメインであり得る。ポリペプチドリンカーは、2個の可変ドメインが重大な立体障害なしに架橋される限り、種々の長さ及び組成を有し得る。代表的には、リンカーは、グリシン残基及びセリン残基と、可溶性のための散在しているいくつかのグルタミン酸残基又はリジン残基との伸長から主として構成される。
【0023】
二重特異性抗体は、scFvの二量体である。二重特異性抗体の成分は、代表的には、大部分のscFvより短いペプチドリンカーを有しており、それらは、二量体として会合しやすい。
【0024】
Fvフラグメントは、非共有結合性の相互作用によりつなぎ合わされた一つのVHドメイン及び一つのVLドメインからなる抗体フラグメントである。用語dsFvとは、VH−VL対を安定化するために操作された分子間ジスルフィド結合を有するFvをいうために本明細書中に使用される。
【0025】
F(ab’)2フラグメントは、pH4.0〜4.5における酵素ペプシンによる消化により免疫グロブリン(代表的にはIgG)から入手されるものと本質的に等しい抗体フラグメントである。このフラグメントは、組換えにより作製されてもよい。
【0026】
Fabフラグメントは、F(ab’)2フラグメント内の二つの重鎖片をつないでいる一つ又は複数のジスルフィド架橋の還元により入手されるものと本質的に等しい抗体フラグメントである。Fab’フラグメントは、組換えにより作製されてもよい。
【0027】
Fabフラグメントは、酵素パパインによる免疫グロブリン(代表的にIgG)の消化により入手されるものと本質的に等しい抗体フラグメントである。Fabフラグメントは、組換えにより作製されてもよい。Fabフラグメントの重鎖セグメントはFd片である。
【0028】
「会合した」:本明細書において記載されるように、二つの要素が相互に「会合した」場合、それらは、直接又は間接の共有結合性又は非共有結合性の相互作用により結合されている。好ましくは、会合は共有結合性である。望ましい非共有結合性の相互作用としては、水素結合、ファンデルワールス相互作用、疎水性相互作用、磁気相互作用、静電相互作用等が挙げられる。
【0029】
「生体適合性」:本明細書中で使用される場合、用語「生体適合性」とは、細胞にとって毒性でない化合物を記載するために意図される。インビトロでの細胞への添加が、30%、20%、10%、5%、又は1%以下の細胞死をもたらし、インビボで炎症又はその他のそのような不要な有害効果を誘導しない場合、その化合物は「生体適合性」である。
【0030】
「生分解性」:本明細書において使用される場合、「生分解性」化合物とは、細胞へ導入された場合に、細胞に対する有意な毒性作用なしに(即ち、細胞の約30%、20%、10%、5%、又は1%未満が死滅する)、細胞が再使用又は処分することができる成分へと細胞機構によって分解されるものである。
【0031】
「有効量」:一般に、活性因子又は微粒子の「有効量」とは、所望の生物学的応答を誘発するのに必要な量をいう。当業者により認識されるように、微粒子の有効量は、所望の生物学的終点、送達すべき因子、封入マトリックスの組成、標的組織等のような要因に依って変動し得る。例えば、送達すべき抗てんかん因子を含有している微粒子の有効量は、発作及び/又は不要な電気活動の重篤度又は頻度の低下をもたらす量である。別の例において、個体の心臓に送達すべき抗不整脈剤を含有している微粒子の有効量は、不要な電気活動の量もしくは頻度の減少、又は心臓不整脈の臨床的徴候(例えば、ECG所見)もしくは症状(例えば、失神エピソード)の減少をもたらす量である。
【0032】
「ナノセル」:本発明によると、用語「ナノセル」とは、マトリックス又はシェルにナノコアが包囲又は封入されている粒子をいう。換言すると、より大きな粒子の内部のより小さな粒子、又はバルーン内のバルーンである。ナノセルは、好ましくは、ある因子をナノコアに有し、異なる因子をナノセルの外側部分に有している。ある種の好ましい実施形態において、ナノセルはリポソーム内のナノコアである。その他の実施形態において、ナノコアは、ポリマー性のマトリックス又はシェル(例えば、多糖マトリックス)により包囲されている。
【0033】
「ナノコア」:本明細書中で使用される場合、用語「ナノコア」とは、ナノセル内のあらゆる粒子をいう。ナノコアは、微粒子、ナノ粒子、量子ドット、ナノデバイス、ナノチューブ、ナノシェル、又はナノセル内に含まれる適切な寸法のその他の組成物であり得る。好ましくは、ナノコアは、ナノセルの外側部分の因子が放出されるより遅く、又はその後に放出されるべき因子を含む。
【0034】
「ペプチド」又は「タンパク質」:本発明によると、「ペプチド」又は「タンパク質」は、ペプチド結合により共に結合された一連の少なくとも3つのアミノ酸を含む。「タンパク質」及び「ペプチド」という用語は、交換可能に使用され得る。ペプチドとは、個々のペプチドをいってもよいし、又はペプチドの集合をいってもよい。本発明のペプチドは、好ましくは、天然アミノ酸のみを含有しているが、非天然のアミノ酸(即ち、自然界には存在しないが、ポリペプチド鎖へ組み込まれ得る化合物)及び/又は当該分野において公知のアミノ酸類似体が、代替として、利用され得る。また、本発明のペプチド内のアミノ酸のうちの一つ以上が、例えば、炭水化物基、リン酸基、ファルネシル基、イソファルネシル基、脂肪酸基、結合、官能化、又はその他の修飾のためのリンカー等のような化学的要素の付加により修飾され得る。好ましい実施形態において、ペプチドの修飾は、ペプチドをより安定なものにする(例えば、より大きなインビボ半減期)。これらの修飾には、ペプチドの環化、D−アミノ酸の取り込み等が含まれ得る。いずれの修飾も、ペプチドの所望の生物学的活性に実質的に干渉するべきでない。
「低分子」:本明細書において使用される場合、用語「低分子」とは、比較的低い分子量を有しており、かつタンパク質、ポリペプチド、又は核酸でない、天然に存在するものであってもよいし、又は(例えば、化学合成を介して)人工的に作出されたものであってもよい有機化合物をいう。代表的には、低分子は、約1500g/mol未満の分子量を有している。また、低分子は、代表的には、複数の炭素−炭素結合を有している。公知の天然に存在する低分子には、ペニシリン、エリスロマイシン、タキソール、シクロスポリン、及びラパマイシンが含まれるが、これらに限定されない。公知の合成低分子には、アンピシリン、メチシリン、スルファメトキサゾール、及びスルホンアミドが含まれるが、これらに限定されない。
例えば、本発明は以下の項目を提供する。
(項目1)
脂質小胞内にナノ粒子を含む粒子であって、該ナノ粒子が第一の因子を含み;そして脂質小胞が第二の因子を含む、粒子。
(項目2)
マトリックス内に封入されたナノ粒子を含む粒子であって、該ナノ粒子が第一の因子を含み;そして該マトリックスが第二の因子を含む、粒子。
(項目3)
前記第一の因子が因子の組み合わせである、項目1または2に記載の粒子。
(項目4)
前記第二の因子が因子の組み合わせである、項目1または2に記載の粒子。
(項目5)
前記因子が、薬学的、診断的、または予防的な因子である、項目1または2に記載の粒子。
(項目6)
前記因子が、薬学的因子である、項目1または2に記載の粒子。
(項目7)
前記第一の因子および前記第二の因子の作用様式が異なる、項目1または2に記載の粒子。
(項目8)
前記第一の因子および前記第二の因子の薬物動態が異なる、項目1または2に記載の粒子。
(項目9)
前記第一の因子および前記第二の因子の細胞標的が異なる、項目1または2に記載の粒子。
(項目10)
前記第一の因子および前記第二の因子の分子標的または細胞標的が異なる、項目1または2に記載の粒子。
(項目11)
前記第一の薬学的因子および前記第二の薬学的因子の各々が、独立して、低分子、ポリヌクレオチド、アンチセンス因子、RNAi、多糖、オリゴ糖、炭水化物、脂質、タンパク質、ペプチド、金属、有機化合物、有機金属化合物、または無機化合物である、項目1または2に記載の粒子。
(項目12)
前記第二の薬学的因子が、前記第一の薬学的因子より迅速に作用する、項目1または2に記載の粒子。
(項目13)
前記第一の薬学的因子が抗腫瘍性因子または細胞障害性因子であり、前記第二の薬学的因子が抗血管形成因子である、項目1または2に記載の粒子。
(項目14)
前記抗腫瘍性因子が、アルキル化剤、代謝拮抗薬、天然物、抗生物質、酵素、ステロイド、および有機金属錯体からなる群より選択される、項目13に記載の粒子。
(項目15)
前記抗腫瘍性因子が、メクロレタミン、シクロホスファミド、イホスファミド、メルファラン、クロラムブシル、ヘキサメチルメラミン、チオテパ、ブスルファン、カルムスチン、ロムスチン、セムスチン、ストレプトゾシン、ダカルバジン、シスプラチン、カルボプラチン、メルファラン、メクロレタミン、ビスクロロエチルニトロソウレア、クロロエチル−シクロヘキシルニトロソウレア、メトトレキサート、5−フルオロウラシル(5FU)、シトシンアラビノシド、6−メルカプトプリン、6−チオグアニン、FudR、ペントスタチン、ヒドロキシ尿素、ドキソルビシン、ブレオマイシン、マイトマイシンC、アクチノマイシン、タキソール、エポチロン、ビンクリスチン、ビンブラスチン、エトポシド、テニポシド、ダクチノマイシン、ダウノルビシン、ドキソルビシン、プリカマイシン、L−アスパラギナーゼ、ヘパリナーゼ、コンドロイチナーゼ、インターフェロンα、インターフェロンβ、インターフェロンγ、腫瘍壊死因子、ミトキサントロン、ビスクロロエチルニトロソウレア、4−ジメチル−エピポドフィロトキシンエチリデン、プレドニゾン、ジエチルスチルベストロール、メドロキシプロゲステロン、タモキシフェン、プロカルバジン、アミノグルテチミド、プロゲスチン、アンドロゲン、抗アンドロゲン、ロイプロリド、プロテアソームインヒビター、PS341、HSP90インヒビター、ゲルダナマイシン、ヒストンデアセチラーゼインヒビター、およびプロテインキナーゼインヒビターからなる群より選択される、項目13に記載の粒子。
(項目16)
前記抗血管形成因子が、血管形成を阻害するために内皮細胞に直接作用する、項目13に記載の粒子。
(項目17)
前記抗血管形成因子が、アンジオスタチン、アバスチン、アレスチン、カンスタチン、コンブレタスタチン、エンドスタチン、NM3、トロンボスポンジン、タムスタチン、2−メトキシエストラジオール、2−メトキシエストラジオールの誘導体、ビタキシン、およびそれらの誘導体からなる群より選択される、項目13に記載の粒子。
(項目18)
前記抗血管形成因子が間接作用型として分類される、項目13に記載の粒子。
(項目19)
前記間接作用型の抗血管形成因子が、EGF受容体チロシンキナーゼインヒビター、VEGF受容体アンタゴニスト、HER−2/neu受容体チロシンキナーゼインヒビター、PDGF受容体アンタゴニスト、MAPK経路のインヒビター、およびPI3K経路のインヒビターからなる群より選択される、項目18に記載の粒子。
(項目20)
前記間接作用型の抗血管形成因子が、イレッサ(Iressa)、ZD6474、タルセバ(Tarceva)、エルビタックス(Erbitux)、PTK787、SU6668、ハーセプチン(Herceptine)、インターフェロン−α、およびSU11248からなる群より選択される、項目18に記載の粒子。
(項目21)
前記第一の因子が抗炎症性因子であり、前記第二の因子が抗血管形成因子である、項目1または2に記載の粒子。
(項目22)
前記抗炎症性因子が、非ステロイド性抗炎症薬、ステロイド、リポキシゲナーゼインヒビター、および肥満細胞安定化剤からなる群より選択される、項目21に記載の粒子。
(項目23)
前記第一の因子が抗炎症性因子であり、前記第二の因子が気管支拡張剤である、項目1または2に記載の粒子。
(項目24)
前記抗炎症性因子が、非ステロイド性抗炎症薬、ステロイド、リポキシゲナーゼインヒビター、および肥満細胞安定化剤からなる群より選択される、項目23に記載の粒子。
(項目25)
前記気管支拡張剤がβ−アドレナリン受容体アゴニストである、項目23に記載の粒子。
(項目26)
前記第一の因子がコルチコステロイドであり、前記第二の因子がβ−アドレナリン受容体アゴニストである、項目23に記載の粒子。
(項目27)
前記第一の因子が疾患修飾抗リウマチ薬(DMARD)であり、前記第二の因子が抗血管形成因子である、項目1または2に記載の粒子。
(項目28)
前記第一の因子が増殖因子であり、前記第二の因子が異なる増殖因子であって、ここで、該増殖因子の空間的/時間的放出がシグナル伝達経路の相乗的な調節をもたらす、項目1または2に記載の粒子。
(項目29)
前記第一の因子がシグナル伝達経路を阻害し、前記第二の因子が異なる経路または同一経路内の異なるシグナル伝達に影響を与える、項目1または2に記載の粒子。
(項目30)
前記第一の因子が神経活性剤であり、前記第二の因子がカオトロピック剤である、項目1または2に記載の粒子。
(項目31)
前記第一の因子が神経活性剤であり、前記第二の因子が血液脳関門をより透過性にする、項目1または2に記載の粒子。
(項目32)
前記第二の因子が、血液脳関門を前記第一の因子に対してより透過性にする、項目30に記載の粒子。
(項目33)
前記マトリックスが、多糖、炭水化物、タンパク質、ポリマー、糖タンパク質、糖脂質、またはそれらの誘導体もしくは組み合わせを含む、項目2に記載の粒子。
(項目34)
前記炭水化物が、ラクトース、グリコサミノグリカン、ショ糖、マルトース、ガラクトース、グルコース、ラムノース、シアル酸、デンプン、セルロース、ならびにそれらの誘導体および組み合わせからなる群より選択される、項目33に記載の粒子。
(項目35)
前記ナノ粒子が、最大寸法5〜10,000nmのサイズの範囲である、項目1または2に記載の粒子。
(項目36)
前記ナノ粒子が、最大寸法10〜800nmのサイズの範囲である、項目1または2に記載の粒子。
(項目37)
前記ナノ粒子が、最大寸法10〜500nmのサイズの範囲である、項目1または2に記載の粒子。
(項目38)
前記ナノ粒子が、最大寸法50〜250nmのサイズの範囲である、項目1または2に記載の粒子。
(項目39)
前記ナノ粒子が、ナノワイヤ、量子ドット、またはナノチューブである、項目1または2に記載の粒子。
(項目40)
前記ナノ粒子が、実質的に固体であり、リポソームではない、項目1または2に記載の粒子。
(項目41)
前記粒子が、最大寸法10nm〜500,000nmのサイズの範囲である、項目1または2に記載の粒子。
(項目42)
前記粒子が、最大寸法50nm〜100マイクロメートルのサイズの範囲である、項目1または2に記載の粒子。
(項目43)
前記粒子が、最大寸法500nm〜50マイクロメートルのサイズの範囲である、項目1または2に記載の粒子。
(項目44)
前記粒子が、最大直径20nm〜1000nmのサイズの範囲である、項目1または2に記載の粒子。
(項目45)
前記粒子が、最大直径50nm〜1000nmのサイズの範囲である、項目1または2に記載の粒子。
(項目46)
前記粒子が、最大直径50nm〜500nmのサイズの範囲である、項目1または2に記載の粒子。
(項目47)
前記ナノ粒子がポリマーを含む、項目1または2に記載の粒子。
(項目48)
前記ポリマーが生体適合性である、項目47に記載の粒子。
(項目49)
前記ポリマーが生分解性である、項目47に記載の粒子。
(項目50)
前記ポリマーが天然ポリマーである、項目47に記載の粒子。
(項目51)
前記ポリマーが合成ポリマーである、項目47に記載の粒子。
(項目52)
前記ポリマーが、ポリエステル、ポリアミド、ポリカーボネート、ポリカルバメート、ポリ尿素、ポリエーテル、ポリチオエーテル、およびポリアミンからなる群より選択される、項目47に記載の粒子。
(項目53)
前記ポリマーがコポリマーである、項目47に記載の粒子。
(項目54)
前記ポリマーが、D,L−ラクチド、D−ラクチド、L−ラクチド、D,L−乳酸、D−乳酸およびL−乳酸、グリコリド、グリコール酸、ε−カプロラクトン、ε−ヒドロキシヘキサン酸、γ−ブチロラクトン、γ−ヒドロキシ酪酸、δ−バレロラクトン、δ−ヒドロキシ吉草酸、ヒドロキシ酪酸、およびリンゴ酸からなる群より選択されるモノマーから合成される、項目47に記載の粒子。
(項目55)
前記ポリマーがポリエチレングリコールである、項目47に記載の粒子。
(項目56)
前記ポリマーが、ポリ(ホスフェート)、ポリ(ホスファイト)、ポリ(ホスホネート)、ポリ(カルボン酸)により修飾されたポリ(ホスホエステル)、ポリ(フェニルネオカルボキシレートホスファイト)、環式シクロアルキレンホスフェート、環式アリーレンホスフェート、ポリヒドロキシクロロプロピルホスフェート−ホスフェート、ジホスフィン酸エステル、ポリ(フェニルホスホネート)、ポリ(テルフタレートホスホネート)、ポリ(アミドカルボン酸)、リン酸の直鎖状飽和ポリエステル、ポリエステルホスホネート、リン含有部分を有するポリアリーレンエステル、またはポリ(ホスホエステル−ウレタン)、ポリ(ホスフェート)、ポリ(ホスファイト)、およびポリ(ホスホネート)からなる群より選択される、項目47に記載の粒子。
(項目57)
前記ポリマーがPLGAである、項目47に記載の粒子。
(項目58)
前記第一の因子が前記ナノ粒子の全体に見出される、項目1または2に記載の粒子。
(項目59)
前記第一の因子が前記ナノ粒子の内部にのみ見出され、前記ナノ粒子の表面には見出されない、項目1または2に記載の粒子。
(項目60)
前記第一の因子がポリマーに共有結合的に結合されている、項目47に記載の粒子。
(項目61)
前記因子がポリエチレングリコールと結合している、項目1または2に記載の粒子。
(項目62)
前記第一の因子が前記ポリマーにイオン結合的に結合されている、項目47に記載の粒子。
(項目63)
前記第一の因子がリンカーを通して前記ポリマーと結合している、項目47に記載の粒子。
(項目64)
前記リンカーが酵素分解に対して感受性である、項目63に記載の粒子。
(項目65)
前記リンカーが前記第一の因子の作用部位において酵素分解に対して感受性である、項目64に記載の粒子。
(項目66)
前記脂質小胞が、ホスホグリセリド;ホスファチジルコリン;ジパルミトイルホスファチジルコリン(DPPC);ジオレイルホスファチジルエタノールアミン(DOPE);ジオレイルオキシプロピルトリエチルアンモニウム(DOTMA);ジオレイルホスファチジルコリン;コレステロール;コレステロールエステル;ジアシルグリセロール;ジアシルグリセロールスクシネート;ジホスファチジルグリセロール(DPPG);ヘキサンデカノール;アシル基がジオレオイル、ジステアロイル、ジパルミトイル、またはジミリストイルであり、ポリエチレングリコールが350〜5000g/molの範囲であるヘキサンデカノール、1,2−ジアシル−sn−グリセロ−3−ホスホエタノールアミン−N−[メトキシ(ポリエチレングリコール)];ジアセチレンリン脂質;脂肪族アルコール;ポリエチレングリコール(PEG);ポリオキシエチレン−9−ラウリルエーテル;表面活性脂肪酸;パルミチン酸;オレイン酸;脂肪酸;脂肪酸アミド;ソルビタントリオレエート(Span85)グリココレート;サーファクチン;ポロキサマー;ソルビタン脂肪酸エステル;ソルビタントリオレエート;レシチン;リゾレシチン;ホスファチジルセリン;ホスファチジルイノシトール;スフィンゴミエリン;ホスファチジルエタノールアミン(ケファリン);カルジオリピン;ホスファチジン酸;セレブロシド;ジセチルホスフェート;ジパルミトイルホスファチジルグリセロール;ステアリルアミン;ドデシルアミン;ヘキサデシル−アミン;パルミチン酸アセチル;グリセロールリシノレエート;ステアリン酸ヘキサデシル;ミリスチン酸イソプロピル;チロキサポール;ポリ(エチレングリコール)5000−ホスファチジルエタノールアミン;リン脂質;官能化リン脂質;1,2−ジオレオイル−sn−グリセロ−3−スクシネート;ホスファチジルイノシトール;ホスファチジルセリン;ホスファチジルグリセロール;リン酸;ジホスファチジルグリセロール;ポリ(エチレングリコール)−ホスファチジルエタノールアミン;ジミリストイルホスファチジルグリセロール;ジオレオイルホスファチジルグリセロール;ジラウロイルホスファチジルグリセロール;ジパルミトイルホスファチジルグリセロール;ジステアロイルホスファチジルグリセロール;ジミリストイルリン酸;ジパルミトイルリン酸;ジミリストイルホスファチジルセリン;ジパルミトイルホスファチジルセリン;ホスファチジルセリン;両性リン脂質;ホスファチジルコリン;ホスファチジルエタノールアミン;スフィンゴミエリン;レシチン;リゾレシチン;リゾホスファチジルエタノールアミン;セレブロシド;ジミリストイルホスファチジルコリン;ジパルミトイルホスファチジルコリン;ジステアロイルホスファチジルコリン;ジエライドイルホスファチジルコリン;ジオレオイルホスファチジルコリン;ジラウロイルホスファチジルコリン;1−ミリストイル−2−パルミトイルホスファチジルコリン;1−パルミトイル−2−ミリストイルホスファチジルコリン;1−パルミトイル−ホスファチジルコリン;1−ステアロイル−2−パルミトイルホスファチジルコリン;ジミリストイルホスファチジルエタノールアミン;ジパルミトイルホスファチジルエタノールアミン;脳スフィンゴミエリン;ジパルミトイルスフィンゴミエリン;ジステアロイルスフィンゴミエリン;カチオン脂質;ステロール;コレステロール;コレステロール誘導体;コレステリルエステル;ビタミンD;植物ステロール;ステロイドホルモン;コレステロール−ホスホコリン、コレステロールポリエチレングリコール;コレステロール−SO4;植物ステロール;シトステロール;カンペステロール;スチグマステロール;およびそれらの混合物からなる群より選択された脂質をさらに含む、項目1に記載の粒子。
(項目67)
1つのナノ粒子が前記粒子に含まれている、項目1または2に記載の粒子。
(項目68)
2つ以上のナノ粒子が前記粒子に含まれている、項目1または2に記載の粒子。
(項目69)
前記粒子がコーティングされている、項目1または2に記載の粒子。
(項目70)
前記粒子がポリエチレングリコールでコーティングされている、項目1または2に記載の粒子。
(項目71)
前記粒子がターゲティング剤をさらに含む、項目1または2に記載の粒子。
(項目72)
前記ターゲティング剤が、抗体、抗体フラグメント、受容体、糖タンパク質、および多糖からなる群より選択される、項目71に記載の粒子。
(項目73)
治療的に有効な量の項目1または2に記載の粒子を含む薬学的組成物。
(項目74)
治療的に受容可能な賦形剤をさらに含む、項目73に記載の薬学的組成物。
(項目75)
脂質小胞内にナノ粒子を含む粒子を調製する方法であって、該方法が、以下の工程:
第一の因子を含むナノ粒子を提供する工程;
脂質を提供する工程;
第二の因子を提供する工程;および
該第二の因子を含有している脂質小胞に該ナノ粒子を封入する工程、
を包含する、方法。
(項目76)
項目75に記載の方法であって、前記ナノ粒子を提供する工程が、以下の工程:
ポリマーを提供する工程;
第一の薬学的因子を提供する工程;および
噴霧乾燥、ダブルエマルジョン技術、または転相技術により該ナノ粒子を調製する工程、
を包含する、方法。
(項目77)
脂質小胞内にナノ粒子を含む粒子を投与する方法であって、
第二の因子が負荷された脂質小胞に封入された第一の因子を有するナノ粒子を含む粒子を調製する工程;および
治療的に有効な量の粒子をその必要のある対象へ投与する工程、
を包含する、方法。
(項目78)
前記二つの因子が、同時に投与されるが、連続的な時間的効果または空間的効果を達成する、項目77に記載の方法。
(項目79)
前記因子が、同時に投与されるが、連続的な時間的効果または空間的効果を達成し、それによって、該因子のうちの少なくとも一つの毒性が低下する、項目77に記載の方法。
(項目80)
前記因子が、同時に投与されるが、連続的な時間的効果または空間的効果を達成し、それによって、該因子のうちの少なくとも一つの効力が増加する、項目77に記載の方法。
(項目81)
作用部位において、前記少なくとも一つの因子の効力が増加し、該因子のうちの少なくとも一つの全身毒性が低下する、項目77に記載の方法。
(項目82)
前記効力の増加が、前記因子のバイオアベイラビリティの増加による、項目80に記載の方法。
(項目83)
前記二つの因子の効果が相乗的である、項目77に記載の方法。
(項目84)
前記因子のうちの少なくとも一つの活性の増強が、病態生理学的条件に内在する異なる段階または事象を標的とする因子によるものである、項目77に記載の方法。
(項目85)
前記因子のうちの少なくとも一つの活性の増強が、作用部位における該因子の局所的なバイオアベイラビリティの増加によるものであり、該局所的なバイオアベイラビリティの増加が、もう一方の因子の活性によるものである、項目77に記載の方法。
(項目86)
前記因子のうちの少なくとも一つの毒性の減少が、もう一方の因子の活性により生じた作用部位における局所的なバイオアベイラビリティの増加によるものである、項目77に記載の方法。
(項目87)
前記因子のうちの少なくとも一つの毒性の減少が、全身的なバイオアベイラビリティの低下によるものであり、該低下が、もう一方の因子の活性によるものである、項目77に記載の方法。
(項目88)
前記投与する工程が、経口的、非経口的、静脈内、吸入、筋肉内、皮下、直腸、くも膜下腔内、鼻、膣、皮内、粘膜、または経皮的に粒子を投与する工程を包含する、項目77に記載の方法。
(項目89)
前記投与する工程が、噴霧器、スピンへラー、またはディスクへラーを使用して吸入により前記粒子を投与する工程を包含する、項目77に記載の方法。
(項目90)
癌を処置する方法であって、該方法が、以下の工程:
項目1、2、13、14、15、16、17、18、19、または20に記載の粒子を提供する工程;および
治療的に有効な量の粒子を癌を罹患する被験体へ投与する工程、
を包含する、方法。
(項目91)
関節炎または強直性脊椎症を処置する方法であって、該方法が、以下の工程:
項目1、2、21、22、または27に記載の粒子を提供する工程;および
治療的に有効な量の粒子を関節炎または強直性脊椎症を罹患する被験体へ投与する工程、
を包含する、方法。
(項目92)
中枢神経系(CNS)の障害を処置する方法であって、該方法が、以下の工程:
項目1、2、30、31、または32に記載の粒子を提供する工程;および
治療的に有効な量の粒子をCNS障害を罹患する被験体へ投与する工程、
を包含する、方法。
(項目93)
前記CNS障害がてんかんであり;そして前記第一の治療因子が抗発作剤である、項目92に記載の方法。
(項目94)
喘息または慢性閉塞性肺疾患(COPD)を処置する方法であって、該方法が、以下の工程:
項目1、2、23、24、25、または26に記載の粒子を提供する工程;および
治療的に有効な量の粒子を喘息を罹患する被験体へ投与する工程、
を包含する、方法。
(項目95)
乾癬を処置する方法であって、該方法が、以下の工程:
項目1、2、21、または22に記載の粒子を提供する工程であって、前記第一の因子が抗乾癬剤であり;そして前記第二の因子が抗血管形成因子である、工程;および
治療的に有効な量の粒子を乾癬を罹患する被験体へ投与する工程、
を包含する、方法。
(項目96)
網膜症を処置する方法であって、該方法が、以下の工程:
項目1または2に記載の粒子を提供する工程であって、前記第一の因子が抗血管形成因子であり、そして前記第二の因子が吸収促進剤である、工程;および
治療的に有効な量の粒子を網膜症を罹患する被験体へ投与する工程、
を包含する、方法。
(項目97)
薬学的因子をアッセイする方法であって、該方法が、以下の工程:
蛍光タンパク質を発現するよう安定的にトランスフェクトされた少なくとも一つの腫瘍細胞を提供する工程;
少なくとも一つの初代内皮細胞を提供する工程;
該腫瘍細胞および内皮細胞が増殖する細胞外マトリックスを提供する工程;
試験化合物を提供する工程;
該試験化合物と、マトリックス上で増殖する細胞とを接触させる工程;および
該蛍光タンパク質の発現の変化を検出する工程、
を包含する、方法。
(項目98)
前記腫瘍細胞が前記マトリックス上に播種される前に、前記内皮細胞が細胞外マトリックス上に播種される、項目97に記載の方法。
(項目99)
前記検出する工程が、生体色素により前記細胞を染色する工程を包含する、項目97に記載の方法。
(項目100)
前記検出する工程が、蛍光色素により前記細胞を染色する工程を包含し、該色素の発光が前記蛍光タンパク質のものとは別である、項目97に記載の方法。
(項目101)
前記色素がヨウ化プロピジウムである、項目99に記載の方法。
(項目102)
前記検出する工程が、エピフルオレセンスもしくは共焦点顕微鏡検、立体解析学、またはマイクロプレートリーダーを使用して、別の色を有する細胞の量を解析および定量する工程を包含する、項目97に記載の方法。
(項目103)
前記細胞外マトリックスがコラーゲンを含む、項目97に記載の方法。
(項目104)
前記細胞外マトリックスがマトリゲルである、項目97に記載の方法。
(項目105)
前記細胞外マトリックスがフィブロネクチンを含む、項目97に記載の方法。
(項目106)
前記細胞外マトリックスがラミニンを含む、項目97に記載の方法。
(項目107)
前記細胞外マトリックスがビトロネクチンを含む、項目97に記載の方法。
(項目108)
前記細胞外マトリックスが合成マトリックスである、項目97に記載の方法。
(項目109)
前記細胞外マトリックスがポリリジンを含む、項目97に記載の方法。
(項目110)
蛍光タンパク質で安定的にトランスフェクトされた腫瘍細胞、内皮細胞、細胞外マトリックスでコーティングされた細胞培養プレート、および標識色素を含む、キット。
【図面の簡単な説明】
【0035】
【図1】図1は、ナノセル粒子の模式図である。ナノセルは、第二の因子を内含している脂質小胞の内部に、第一の因子が負荷されたナノコアを含む。
【図2】図2は、併用療法ストラテジーを示す。ナノセルの遅い薬物動態及び速い薬物動態を達成するため、第一の因子を有するターゲティングされたナノ粒子が、第二の因子を含有している単層脂質小胞と併せて使用される。
【図3】図3は、コンブレタスタチン−ドキソルビシンナノセルの合成及び特徴決定を示す。(A)ドキソルビシンとPLGA5050との間の結合反応の模式図。(B)エマルジョン−溶媒蒸発技術を使用して合成されたナノ粒子の走査型電子顕微鏡写真(Jeol JSM5600、3700×)は、不均質サイズの球状構造を示す。(C)脂質二重層に封入されるコンブレタスタチンの構造。(D)70nmの厚さに切片化し、2.0%酢酸ウラニル、続いて0.1%クエン酸鉛により染色し、Philips EM410を使用して調査することにより入手された、3個のナノセルの横断面の透過型電子顕微鏡検画像。この技術によると、ナノ粒子(濃いスフェア)は、リン脂質ブロックコポリマーの白い冠により囲まれた核に見える。(E)動的レーザー光散乱を使用したサイジングは、リン脂質コポリマーエンベロープへの封入のため、定義されたサイズのナノ粒子が、超遠心分離の連続的な工程を通して単離され得ることを証明している。(F)コンブレタスタチン及びドキソルビシンの物理化学的な放出速度動態プロファイルは、コンブレタスタチンがまずナノセルから放出され、続いて、遊離のドキソルビシンが放出されることを示している。デキサメタゾンが内部標準として使用された。示されたデータは、n=4の平均値±SEである。エラーバーが可視でないデータ点は、誤差が小さく、プロットに隠れていることを意味する。***P<0.002;#P<0.001(同一の時点におけるコンブレタスタチン濃度に対して)。
【図4】図4は、インビトロの腫瘍血管形成に対するVEGF及びHGFの効果、並びにaVEGF−受容体アンタゴニストであるPTK787の効果を示す。
【図5】図5は、B16/F10黒色腫細胞及びヒト臍静脈内皮細胞の共培養アッセイにおけるVEGFにより誘導される応答に対するドキソルビシン、サリドマイド、及びコンブレタスタチンの効果を示す。
【図6】図6は、B16/F10黒色腫細胞及びヒト臍静脈内皮細胞の共培養アッセイにおけるHGFにより誘導される応答に対するドキソルビシン、サリドマイド、及びコンブレタスタチンの効果を示す。
【図7】図7は、コラーゲン上に蒔かれた場合の、B16/F10黒色腫細胞及びヒト臍静脈内皮細胞の共培養アッセイにおけるVEGFにより誘導される応答に対するドキソルビシン、サリドマイド、及びコンブレタスタチンの効果を示す。
【図8】図8は、コラーゲン上に蒔かれた場合の、B16/F10黒色腫細胞及びヒト臍静脈内皮細胞の共培養アッセイにおけるHGFにより誘導される応答に対するドキソルビシン、サリドマイド、及びコンブレタスタチンの効果を示す。
【図9】図9は、ナノセルからの薬理学的因子の時間的な放出及び活性のバイオアッセイを示す。GFP+黒色腫−内皮細胞共培養物を、3次元マトリゲルマトリックス上で確立した。共培養物を、定義された期間、異なる処理群と共にインキュベートした。細胞をパラホルムアルデヒドで固定し、ヨウ化プロピジウムで染色し、Zeiss LSM510共焦点顕微鏡を使用して分析した。蛍光色素を488nm及び543nmのレーザー線で励起し、512×512ピクセルの解像度で505−530BP及び565−615BPフィルターを使用して画像を補足した。(A)顕微鏡写真は、異なる処理群からのマージ画像を示す。黒色腫細胞は黄色に見え、血管形成中の内皮細胞は赤色である。(B)グラフは、各細胞型によりカバーされた面積の立体解析学的定量化を示す。ナノセル(NC)による処理は、血管系の時間的な迅速な排除をもたらし、その後、遅れて腫瘍細胞の欠損をもたらす。対照的に、リポソーム−コンブレタスタチン(250μg/ml)(L[C])又はドキソルビシン結合ナノ粒子(ND)(20μg/mlのドキソルビシン)で処理された対照群は、それぞれ、血管系又は腫瘍細胞の選択的な欠損をもたらした。30hのNC処理に関する画像は、完全な細胞欠損が大部分の画像において明白であったが、共培養物の排除を強調するため、少数の球状化細胞を示すよう特に選択された。一つの実験において、四つのランダムな画像が、各複製物から捕捉された。データは、三つの独立の実験からの平均値±SEMを表す。(C)濃度−効果曲線は、B16/F10細胞に対する遊離ドキソルビシン及びPLGA結合ドキソルビシンの効果を示す。[Dox]は、遊離薬物として、又はナノセルで、培養物に添加された薬物の濃度を示す。示されたデータは、複製物を用いた二つの独立の実験の平均値±SEである。***P<0.001(ボンフェローニのポストホックテスト(Bonferroni’s post−hoc test)を含むANOVA)。
【図10】図10は、ナノセル療法がB16/F10黒色腫及びルイス肺癌の増殖を阻害することを証明する。3×105個のGFP+BL6/F10又は2.5×105個のルイス肺癌細胞を側腹部に皮下注射することにより、黒色腫及び癌腫をC57/BL6マウスにおいて確立した。(A、B)ナノセル(NC)の効果、対、ドキソルビシン結合ナノ粒子のみを有するナノセルNC[D]、リポソーム−コンブレタスタチン(L[C])、NC[D]+L[C]の同時注射、コンブレタスタチン及びドキソルビシンの両方が封入されている単純リポソーム製剤(L[CD])、並びにより低用量(ld)のNCの効果を示す、切除された腫瘍。対照群は、生理食塩水で処理された。癌腫及び黒色腫(50mm3)を保持しているマウスを6〜8群へと無作為化し、50mg/kgコンブレタスタチン及び500 g/kgドキソルビシンに等しい異なる媒体で隔日に処理した。(C、D)グラフは、癌腫及び黒色腫の最長直径及び最短直径の測定から計算された、異なる処理群における平均(SE)腫瘍体積を示す。(E)グラフは、白血球数に対する異なる処理の効果を示す。最小の毒性が、ナノセル処理群で観察された。ナノセルによる長期的な処理(NClt)は、より短い処理と比較して、付加的な毒性を有していなかった。(F)フルオレセイン色素を用いて製作されたナノセルの分布を、5、10、及び24時間目に、色素のレベルを測定することにより、経時的に定量した。24時間目、他の血管新生組織と比較して癌腫に優先的にナノセルが蓄積していることが明白であり、同時に、血中レベルが降下していた。全てのデータが、時点に依って各群n=3〜5の平均値±SEMである。エラーバーが可視でないデータ点は、誤差が小さく、プロットに隠れていることを意味する。
【図11】図11は、腫瘍血管系及びアポトーシスに対するナノセル処理の効果を示す。ナノセル(NC)、ドキソルビシン結合ナノ粒子のみを有するナノセルNC[D]、リポソーム−コンブレタスタチン(L[C])、NC[D]+L[C]の同時注射、又はコンブレタスタチン及びドキソルビシンの両方が封入されている単純リポソーム製剤(L[CD])で処理されたルイス肺癌を保持している動物から、腫瘍が切除された。対照群は生理食塩水を受容した。処理は、50mg/kgコンブレタスタチン及び500μg/kgドキソルビシンに等しい異なる媒体を使用して、10日間にわたり隔日に投与された。(A)上パネルは、冷メタノールで固定され、血管内皮マーカーであるフォンヴィレブランド因子(vWF)に関して免疫染色された腫瘍の横断面を示す。下パネルは、腫瘍におけるアポトーシスの誘導に対する異なる処理の効果を示す。切片は、10%ホルマリンで固定され、テキサスレッド標識ヌクレオチドを使用したタネル(TUNEL)陽性染色のため加工された。同じ切片を、HIF−1 に対する抗体で同時標識し、FITC標識二次抗体を使用して検出した。タネル染色はアポトーシスの顕著な特徴であるDNA鎖切断を検出するため、NC処理群におけるマージ画像の黄色シグナルは、HIF−1αの核移行を示す。グラフは、腫瘍横断面に標準的な立体解析学技術を適用して計算された(B)腫瘍血管密度、(C)低酸素細胞の割合(%)、及び(D)アポトーシス細胞の割合(%)を示す。全ての画像がZeiss LSM510共焦点顕微鏡を使用して捕捉された。蛍光色素は、488nm及び543nmのレーザー線で励起され、512×512ピクセルの解像度で505−530BP及び565−615BPフィルターを使用して画像が捕捉された。データは各試料からの複数のランダムな画像を用いた、三つの独立の腫瘍試料からの平均値±SEMとして表されている。*P<0.05、**P<0.01、***P<0.001(対照に対して)(ニューマンクール(Newman−Keul’s)のポストホックテストを含むANOVA)。(E)ウエスタンブロットは、HIF1α及びVEGFのレベルに対する異なる処理の効果を示しており、それぞれ(F&G)のグラフにおいてβ−アクチンに対して定量的に規準化される。*P<0.05(他のコンブレタスタチン処理群に対して)。
【図12】図12は、腫瘍増殖に対するリポソームコンブレタスタチン、ナノセルコンブレタスタチン、及び長期ナノセル療法の効果を示す。(A)グラフは、黒色腫を保持しているマウスに投与されたリポソームコンブレタスタチン及び(コンブレタスタチン及びPLGAコアのみを封入して製作された)ナノセルの効果を示す。処理は、腫瘍が50mm3の体積に達した時点で開始し、隔日の5回の投与のため継続した。いずれかの製剤で注射1回につき投与される全コンブレタスタチンは、50mg/kgであった。もう一つの実験においては、腫瘍が50mm3の体積に達した後、黒色腫を保持している動物を、7サイクルのNC療法で処理した。対照動物は、PBS媒体で処理され、17日目に腫瘍サイズが大きくなりすぎたため屠殺された。長期処理群においては、動物の50%が、28日にわたり腫瘍のほぼ完全な退縮を示し、グラフ(B)に示されるように、残りの動物は、未処理の動物と比較して有意に小さい腫瘍体積を有していた。
【図13】図13は、原発性GFP+黒色腫の肺及び肝臓への転移に対するナノセル療法の効果を示す。(A)上パネルは、異なる処理群からの同レベルの肺組織の横断面を示す。(B)パネルは、異なる処理群からの肝臓の同レベルの横断面を示す。ナノセル(NC)、ドキソルビシン結合ナノ粒子NC[D]、リポソーム−コンブレタスタチン(L[C])、NC[D]+L[C]の同時注射、又はドキソルビシン及びコンブレタスタチンが封入されたリポソーム(L[CD])で処理された動物から、器官が切除された。対照群は生理食塩水で処理された。組織は氷上で4%パラホルムアルデヒドで固定され、標準的なH&Eで染色された。画像はZeiss LSM510共焦点顕微鏡を使用して捕捉された。蛍光色素は、488nm及び543nmのレーザー線で励起され、512×512ピクセルの解像度で505−530BP及び565−615BPフィルターを使用して画像が捕捉された。ここに示されたマージ画像は、黄色に見える別個の転移節を示している。グラフは、各視野における転移節の定量化を示す。表されたデータは、n=3からの平均値±SEMである。***P<0.001(対照に対して)(ニューマンクールのポストホックテストを含むANOVA)。
【図14】図14は、ドキソルビシンのPLGA5050との結合に含まれる詳細な合成工程を示す模式図である。
【図15】図15は、喘息治療用に開発されたナノセルの構造及び放出動態プロファイルを示す。電子顕微鏡写真は、マトリックスがラクトースシェルであるこれらのナノセルの外側マトリックスの超微細構造を示す。コルチコステロイド(抗炎症性因子)がナノコア内に捕獲され得、気管支拡張剤がナノコアを包囲するラクトースマトリックスに捕獲される。グラフは、気管支拡張剤(サルブタモール)が数分というタイムスケールでまず放出され、コルチコステロイド(デキサメタゾン)が遅い遷延性の様式で放出されるという事実を証明する。この時間的な放出は、まず、喘息の間に収縮した細気管支が拡張することを可能にし、より深い肺へのナノコアの浸透を可能にするであろう。その後の遅い放出は、急性喘息エピソードの後の慢性炎症を阻止し、サルブタモールの速い放出は、即時型の症状を緩和する。
【発明を実施するための形態】
【0036】
(発明の特定の好ましい実施形態の詳細な説明)
本発明の薬物送達系は、疾患を処置するために複数の因子を投与する場合、第二の因子又は因子のセットが送達される前に、一つの因子又は因子の組み合わせを送達することが有利であり得るという認識から生まれた。本発明の粒子を使用して異なる時点で放出される因子は、異なる作用様式、異なる標的、及び/又は異なる薬物動態プロファイルを有し得る。本発明は、本発明の粒子(ナノセル)、ナノセルを含む薬学的組成物、ナノセル及びその薬学的組成物を調製する方法、並びにナノセル及びその薬学的組成物を使用する方法を包含する。ナノセルは、概念的には、バルーン内のバルーン、又は粒子(例えばリポソーム)内の粒子(例えばナノ粒子)である。
【0037】
一つの実施形態において、ナノセルは、第二の因子又は因子の組み合わせを有する脂質小胞又はマトリックス/シェル外側部分により包囲された、第一の因子又は因子の組み合わせが負荷された内側部分(ナノコア)を含む。外側部分の(一つ又は複数の)因子は、内側ナノコアの(一つ又は複数の)因子の前に放出される。好ましくは、ナノセルは1個のナノコアを含有している。しかしながら、ある種の実施形態において、ナノセルは、1個又は複数個のナノコア、好ましくは1〜100個のナノコア、より好ましくは1〜10個のナノコア、さらに好ましくは1〜3個のナノコアを含有している。別の実施形態において、ナノセルは、外側のシェル又はマトリックスでコーティングされた内側コアを含む粒子である。
【0038】
本発明のナノセルのコアは、マトリックスに封入された少なくとも一つの因子を含む。マトリックスは、好ましくは、生分解性かつ生体適合性のポリマー性のマトリックスである。ナノコアの調製において有用なポリマーには、合成ポリマー及び天然ポリマーが含まれる。本発明において有用なポリマーの例には、ポリエステル、ポリアミド、ポリエーテル、ポリチオエーテル、ポリ尿素、ポリカーボネート、ポリカルバミド、タンパク質、多糖、ポリアリール等が含まれる。ナノコアにおいて有用なポリマーは、100g/mol〜100,000g/mol、好ましくは500g/mol〜80,000g/molの範囲の平均分子量を有している。好ましい実施形態において、ポリマーは、D,L−ラクチド、D−ラクチド、L−ラクチド、D,L−乳酸、D−乳酸、L−乳酸、グリコリド、グリコール酸、ε−カプロラクトン、ε−ヒドロキシヘキサン酸、γ−ブチロラクトン、γ−ヒドロキシ酪酸、δ−バレロラクトン、δ−ヒドロキシ吉草酸、ヒドロキシ酪酸、及びリンゴ酸からなる群より選択されるモノマーから合成されたポリエステルである。より好ましくは、生分解性ポリエステルが、D,L−ラクチド、D−ラクチド、L−ラクチド、D,L−乳酸、D−乳酸、L−乳酸、グリコリド、グリコール酸、ε−カプロラクトン、及びε−ヒドロキシヘキサン酸からなる群より選択されるモノマーから合成される。最も好ましくは、生分解性ポリエステルが、D,L−ラクチド、D−ラクチド、L−ラクチド、D,L−乳酸、D−乳酸、L−乳酸、グリコリド、及びグリコール酸からなる群より選択されるモノマーから合成される。コポリマーも、ナノコアにおいて使用され得る。コポリマーには、ABA型トリブロック(triblock)コポリマー、BAB型トリブロックコポリマー、及びAB型ジブロック(diblock)コポリマーが含まれる。ブロックコポリマーは、疎水性のAブロック(例えば、ポリエステル)及び親水性のBブロックを有し得る(例えば、ポリエチレングリコール)。
【0039】
ナノコアのポリマーは、活性因子の捕獲及び放出動態に基づき選択される。ある種の実施形態において、ナノコア上の活性因子は、ナノコアのポリマーに共有結合的に結合される。送達すべき因子をポリマーマトリックスに共有結合的に結合するため、ポリマーは、当該分野において公知の技術を使用して、化学的に活性化され得る。次いで、活性化されたポリマーは、ポリマーと因子との間に共有結合が形成されることを可能にする適切な条件の下で、因子と混合される。好ましい実施形態において、因子上のチオール、ヒドロキシル基、アミノ基のような求核剤が、ポリマー上の求電子剤(例えば、活性化されたカルボニル基)を攻撃して、共有結合を作出する。
【0040】
他の実施形態において、活性因子は、ファンデルワールス相互作用、疎水性相互作用、水素結合、双極子間相互作用、イオン性相互作用、及びパイスタッキング(pi stacking)のような非共有結合性の相互作用を通してナノコアのマトリックスと会合させられる。
【0041】
ナノコアは、ナノ粒子を調製するための当該分野において公知の任意の方法を使用して調製され得る。そのような方法には、噴霧乾燥、エマルジョン溶媒蒸発、ダブルエマルジョン、及び転相が含まれる。さらに、任意のナノスケールの粒子、マトリックス、又はコアが、ナノセル内のナノコアとして使用され得る。ナノコアは、ナノシェル(本明細書中に参考として援用される米国特許第6,685,986号を参照のこと);ナノワイヤ(本明細書中に参考として援用される米国特許第5,858,862号を参照のこと);ナノ結晶(本明細書中に参考として援用される米国特許第6,114,038号を参照のこと);量子ドット(本明細書中に参考として援用される米国特許第6,326,144号を参照のこと);及びナノチューブ(本明細書中に参考として援用される米国特許第6,528,020号を参照のこと)であり得るが、これらに限定されない。
【0042】
ナノコアは、調製された後、特定のサイズ範囲内のナノコアを回収するため、ろ過、篩過、押し出し、又は超遠心分離により分画され得る。一つの効果的なサイジング法は、選択された均一の孔サイズを有している一連のポリカーボネート膜を通して、ナノコアの水性懸濁物を押し出すことを含み;膜の孔サイズは、その膜を通した押し出しにより作製されるナノコアの最大サイズにほぼ相当するであろう。例えば、本明細書中に参考として援用される米国特許第4,737,323号を参照のこと。もう一つの好ましい方法は、定義されたサイズの画分を単離するための定義されたスピード(例えば、8,000、10,000、12,000、15,000、20,000、22,000、及び25,000rpm)における連続超遠心分離である。ある種の実施形態において、ナノコアは、選択されたサイズ範囲内で、サイズが実質的に均質であるよう調製される。ナノコアは、好ましくは、最大直径10nm〜10,000nmの範囲内である。より好ましくは、ナノコアは、最大直径20〜8,000nm、最も好ましくは、最大直径50〜5,000nmの範囲である。ナノコアは、粒子のサイズを決定するため、動的光散乱及び/又は走査型電子顕微鏡検により分析され得る。ナノコアは、ナノコアへの(一つ又は複数の)因子の負荷に関しても試験され得る。ナノコアには、ナノ粒子のみならず、ナノシェル、ナノワイヤ、量子ドット、及びナノチューブも含まれる。
【0043】
ナノコアは、調製され、場合により特徴決定された後、ナノセルを形成するため、脂質、ポリマー、炭水化物等のような外層でコーティングされる。ナノコアは、当該分野において記載されている任意の方法を使用して、脂質、炭水化物、多糖、タンパク質、ポリマー、糖タンパク質、糖脂質等のような、合成の又は天然に存在する高分子でコーティングされ得る。米国特許第4,235,871号、第4,501,728号、第4,837,028号;PCT出願WO96/14057、New RRC,Liposomes:A
practical approach,IRL Press,Oxford(1990)、33−104頁;Lasic DD,Liposomes from physics to applications,Elsevier Science Publishers BV,Amsterdam,1993;Szokaら、Ann.Rev.Biophys.Bioeng.9:467(1980);Liposomes,Marc J.Ostro,ed.,Marcel Decker,Inc.,New York,1983,Chapter 1;Hopeら、Chem.Phys.Lip.40:89(1986)(これらの各々は、本明細書中に参考として援用される)を含む、脂質小胞を調製する様々な方法が、記載されている。
【0044】
当該分野において既知の界面活性剤及び乳化剤を含む任意の脂質が、本発明のナノセルの作成において使用するのに適している。脂質成分は、異なる脂質分子の混合物であってもよい。これらの脂質は、天然の起源から抽出され精製されてもよいし、又は実験室で合成により調製されてもよい。好ましい実施形態において、脂質は市販されているものである。ナノコアのコーティングにおいて有用な脂質には、天然脂質のみならず、合成脂質も含まれる。脂質は、化学的又は生物学的に改変させられ得る。本発明のナノセルの調製において有用な脂質には、ホスホグリセリド;ホスファチジルコリン;ジパルミトイルホスファチジルコリン(DPPC);ジオレイルホスファチジルエタノールアミン(DOPE);ジオレイルオキシプロピルトリエチルアンモニウム(DOTMA);ジオレイルホスファチジルコリン;コレステロール;コレステロールエステル;ジアシルグリセロール;ジアシルグリセロールスクシネート;ジホスファチジルグリセロール(DPPG);ヘキサンデカノール;ポリエチレングリコール(PEG)のような脂肪族アルコール;ポリオキシエチレン−9−ラウリルエーテル;パルミチン酸又はオレイン酸のような表面活性脂肪酸;脂肪酸;脂肪酸アミド;ソルビタントリオレエート(Span85)グリココレート;サーファクチン;ポロキサマー(poloxomer);ソルビタントリオレエートのようなソルビタン脂肪酸エステル;レシチン;リゾレシチン;ホスファチジルセリン;ホスファチジルイノシトール;スフィンゴミエリン;ホスファチジルエタノールアミン(ケファリン);カルジオリピン;ホスファチジン酸;セレブロシド;ジセチルホスフェート;ジパルミトイルホスファチジルグリセロール;ステアリルアミン;ドデシルアミン;ヘキサデシル−アミン;パルミチン酸アセチル;グリセロールリシノレエート;ステアリン酸ヘキサデシル;ミリスチン酸イソプロピル;チロキサポール;ポリ(エチレングリコール)5000−ホスファチジルエタノールアミン;及びリン脂質が含まれるが、これらに限定されない。脂質は、正の電荷を有していてもよいし、負の電荷を有していてもよいし、又は中性であってもよい。ある種の実施形態において、脂質は脂質の組み合わせである。ナノセルの調製において有用なリン脂質には、負に電荷を有するホスファチジルイノシトール、ホスファチジルセリン、ホスファチジルグリセロール、リン酸(phosphatic acid)、ジホスファチジルグリセロール、ポリ(エチレングリコール)−ホスファチジルエタノールアミン、ジミリストイルホスファチジルグリセロール、ジオレオイルホスファチジルグリセロール、ジラウロイル(dilauryloyl)ホスファチジルグリセロール、ジパルミトイル(dipalmitotyl)ホスファチジルグリセロール、ジステアロイル(distearyloyl)ホスファチジルグリセロール;ジミリストイルリン酸(phosphatic acid)、ジパルミトイルリン酸(phosphatic acid)、ジミリストイルホスファチジル(phosphitadyl)セリン、ジパルミトイルホスファチジルセリン、ホスファチジルセリン、及びそれらの混合物が含まれる。有用な両性リン脂質には、ホスファチジルコリン、ホスファチジルエタノールアミン、スフィンゴミエリン、レシチン、リゾレシチン、リゾホスファチジル(lysophatidyl)エタノールアミン、セレブロシド、ジミリストイルホスファチジルコリン、ジパルミトイル(dipalmitotyl)ホスファチジルコリン、ジステアロイル(distearyloyl)ホスファチジルコリン、ジエライドイルホスファチジルコリン、ジオレオイルホスファチジルコリン、ジラウロイル(dilauryloyl)ホスファチジルコリン、1−ミリストイル−2−パルミトイルホスファチジルコリン、1−パルミトイル−2−ミリストイルホスファチジルコリン、1−パルミトイル−ホスファチジルコリン、1−ステアロイル−2−パルミトイルホスファチジルコリン、ジミリストイルホスファチジルエタノールアミン、ジパルミトイルホスファチジルエタノールアミン、脳スフィンゴミエリン、ジパルミトイルスフィンゴミエリン、ジステアロイルスフィンゴミエリン、及びそれらの混合物が含まれる。両性リン脂質は、正味の電荷がゼロであるイオン化可能基を有するリン脂質を構成する。ある種の実施形態において、脂質はホスファチジルコリンである。
【0045】
コレステロール及びその他のステロールも、脂質小胞の物理的性質を改変させるため、本発明のナノセルの外側脂質部分へ組み込まれ得る。ナノセルへの取り込みのための適切なステロールには、コレステロール、コレステロール誘導体、コレステリルエステル、ビタミンD、植物ステロール、エルゴステロール、ステロイドホルモン、及びそれらの混合物が含まれる。有用なコレステロール誘導体には、コレステロール−ホスホコリン、コレステロールポリエチレングリコール;コレステロール−SO4が含まれ、植物ステロールは、シトステロール、カンペステロール、及びスチグマステロールであり得る。本明細書中に参考として援用される米国特許第4,891,208号に記載されているようなステロールの有機酸誘導体の塩型も、本発明のナノセルにおいて使用され得る。
【0046】
ナノセルの脂質小胞部分は、多層であってもよいし、又は単層であってもよい。ある種の実施形態において、ナノコアは、脂質二重層のような多層脂質膜でコーティングされる。その他の実施形態において、ナノコアは単層脂質膜でコーティングされる。
【0047】
誘導体化された脂質も、ナノセルにおいて使用され得る。誘導体化された脂質の添加は、ナノセルの薬物動態を改変させる。例えば、ターゲティング剤により誘導体化された脂質の添加は、ナノセルが、特定の細胞、腫瘍、組織、器官、又は器官系を標的とすることを可能にし得る。ある種の実施形態において、ナノセルの誘導体化された脂質成分は、ペプチダーゼもしくはエステラーゼ酵素又は還元剤の存在下のような選択的な生理学的条件の下で切断され得る、ペプチド結合、アミド結合、エーテル結合、エステル結合、又はジスルフィド結合のような不安定な脂質−ポリマー結合を含む。ポリマーをリン脂質にカップリングさせるためのそのような結合の使用は、そうでなければRES系による迅速な取り込みを受けるかもしれない、投与後数時間の高い血中レベルの達成を可能にする。例えば本明細書中に参考として援用される米国特許第5,356,633号を参照のこと。ナノセルの薬物動態及び/又はターゲティングは、脂質の組成及び比率の変化に起因する表面電荷の改変によっても修飾され得る。脂質小胞の成分として熱感受性又はpH感受性の脂質(例えば、ジパルミトイル−ホスファチジルコリン:ジステアリルホスファチジルコリン(DPPC:DSPC)に基づく混合物)を組み込むことにより、熱又はpHによる放出特徴がナノセルへと構築され得る。熱又はpHに感受性の脂質の使用は、ナノセルの脂質小胞膜成分の制御された分解を可能にする。
【0048】
さらに、本発明に係るナノセルは、ハプテン、酵素、抗体又は抗体フラグメント、サイトカイン、受容体、及びホルモン(例えば、本明細書中に参考として援用される米国特許第5,527,528号を参照のこと)のような外部と結合した非ポリマー分子、及び脂質製剤に特定の酵素的特性又は表面認識特性を賦与するその他の小さなタンパク質、ポリペプチド、又は非タンパク質分子を含有していてもよい。表面分子を脂質にカップリングさせるための技術は、当該分野において公知である(例えば、本明細書中に参考として援用される米国特許第4,762,915号を参照のこと)。
【0049】
一つの実施形態において、脂質は、薄い脂質フィルムが形成されるよう、適当な有機溶媒又は溶媒系に溶解させられ、真空又は不活性ガスの下で乾燥される。場合により、フィルムは、より容易に水和される粉末様の形態である、より均質の脂質混合物が形成されるよう、第三級ブタノールのような適当な溶媒に再溶解させられ、次いで、凍結乾燥されてもよい。得られたフィルム又は粉末は、ナノコアの水性緩衝懸濁物でカバーされ、撹拌により15〜60分にわたり水和させられる。得られる多層小胞のサイズ分布は、より激しい撹拌条件の下で脂質を水和させることにより、又はデオキシコール酸のような可溶化界面活性剤を添加することにより、より小さいサイズへとシフトし得る。
【0050】
もう一つの実施形態において、ナノコアのコーティングは、親水性ポリマーで誘導体化された脂質を、予め形成された小胞へと拡散させることにより、例えば、ナノセル中の望まれる誘導体化脂質の最終モルパーセントに対応する脂質濃度で、脂質グラフトポリマーから構成されたナノコア/ミセルに、予め形成された小胞を曝すことにより、調製され得る。親水性ポリマーを含有しているナノコアを包囲するマトリックスは、ホモジナイゼーション、脂質領域水和(lipid−field hydration)、又は押し出し技術によっても形成され得る。
【0051】
さらに別の実施形態においては、ナノコアが、まず、疎水性分子を容易に可溶化するポリマーグラフト(polymer−grafted)脂質を含む、リゾホスファチジルコリンのような低CMC界面活性剤に、超音波処理により分散させられる。次いで、得られたナノコアのミセル懸濁物が、適当なモルパーセントのポリマーグラフター(polymer−grafter)脂質又はコレステロールを含有している乾燥脂質試料を再水和するために使用される。次いで、マトリックス/シェル及びナノコア懸濁物が、当該分野において公知の押し出し技術を使用して、ナノセルへと成形される。得られたナノセルは、標準的なカラムクロマトグラフィにより、封入されなかったナノコアから分離される。
【0052】
もう一つの好ましい実施形態において、小胞形成脂質は、脂質フィルムが形成されるよう、適切な有機溶媒又は溶媒系に採取され、真空又は不活性ガスの下で乾燥又は凍結乾燥される。ナノセルの外側チャンバーに組み込まれるべき一つ又は複数の活性因子は、好ましくは、フィルムを形成する脂質に含まれる。脂質溶液中の薬物の濃度は、ナノセルへの最大の薬物捕獲を与えるために、ナノセル中の薬物の最終最大濃度のモル過剰で含まれ得る。乾燥された脂質又は脂質/薬物の水和において使用される水性媒体は、非経口補液のために使用されるような、生理学的に適合性の媒体、好ましくは、発熱性物質が除去された生理食塩水又は5%デキストロース水溶液である。ナノコアは、水和工程の前に、均質に、そしてナノコア中の他の一つ/複数の活性因子の所望の濃度で、この水性媒体に懸濁させられる。溶液は、水溶性鉄キレート化剤のような付加的な溶質成分及び/又は所望の溶質濃度の可溶性の第二の化合物と混合されてもよい。脂質は、(撹拌を使用して)速い条件で、又は(撹拌なしで)遅い条件で水和させられる。脂質は、水和し、サイズ範囲が代表的には約0.5ミクロン〜10ミクロン又はそれ以上である多層小胞の懸濁物を形成する。一般に、小胞のサイズ分布は、振とうしながら、より迅速に脂質フィルムを水和させることにより、より小さなサイズへとシフトし得る。得られる膜二重層の構造は、脂質の疎水性(無極性)「尾部」が二重層の中心へ向かい、親水性(極性)「頭部」が水相へ向かっているようなものである。
【0053】
別の実施形態において、適切な比率で混合された、乾燥小胞形成脂質、因子を含有しているナノコア、及び(ナノセルの外側チャンバーに負荷されるべき)(一つ又は複数の)因子が、必要であれば加温しながら、水混和性の有機溶媒又は溶媒の混合物に溶解させられる。そのような溶媒の例は、エタノール、又は様々な比率のエタノール及びジメチルスルホキシド(DMSO)である。次いで、その混合物は、ナノセルの自発的な形成を引き起こすために、十分な容量の水性受容相に添加される。水性受容相は、全ての脂質を融解状態に維持するため、必要であれば、加温され得る。受容相は迅速にかき回されてもよいし、又は穏和に撹拌されてもよい。その混合物は、小さなオリフィスを通して迅速に射出されるか、又は直接注入される。数分〜数時間のインキュベーションの後、有機溶媒が、減圧、透析、又は透析ろ過により除去されると、ヒトへの投与に適したナノセル懸濁剤が残る。
【0054】
別の実施形態において、適切な量で混合された乾燥小胞形成脂質、ナノセルの外側チャンバーに負荷されるべき一つ/複数の因子、及び因子が負荷されたナノコアが、必要であれば加温しながら、フリーズドライ(凍結乾燥)による除去を可能にするために十分に高い蒸気圧及び凝固点を有する適切な有機溶媒に溶解させられる。そのような溶媒の例は、tert−ブタノール及びベンゼンである。次いで、薬物/脂質/溶媒混合物が凍結され、高真空下に置かれる。凍結のための方法の例には、液体の容器壁との接触を最大限にするため、混合物を含有している容器が旋回又は回転され、その容器が、アルコール又はアセトンのような溶媒と混合された液体窒素又はドライアイスのような冷却された物質の中に置かれる「シェルフリージング(shell−freezing)」が含まれる。そのようにして、薬物/脂質/溶媒混合物の成分の分離なしに、混合物は、急速に凍結させられる。凍結乾燥による溶媒の除去により、ふわふわとした乾燥粉末が生じる。この薬物/脂質粉末は、構成要素の化学分解又は水分の吸収を減少させる条件の下で長期にわたり保管され得る。そのような条件の例には、(アルゴン又は窒素のような)乾燥不活性ガスの雰囲気の下での粉末の密封、及び低温保管が含まれる。材料を投与することが望まれる場合には、生理学的に適合性の水性媒体、好ましくは発熱性物質が除去された生理食塩水又は5%デキストロース水溶液を添加することにより、再生が実施される。一つ又は複数の第二の活性因子が、親水性である場合には、この段階で添加されてもよい。再生が、ナノセルの自発的な形成を引き起し、そのナノセルは、超遠心分離、ろ過、及び篩過を含む本明細書に詳述された方法によりサイズ的に純化され得る。
【0055】
当業者により認識されるように、薬学的、診断的、又は予防的な因子が、本発明の薬物送達系を使用して投与され得る。ナノセルの二つの区画へ負荷される因子は、処置される疾患、患者、臨床的環境、投与様式、及び許可された医師又は薬理学者のような当業者により認識されるその他の要因を含む様々な要因に依存するであろう。
【0056】
ある種の実施形態において、ナノセルの内側部分、ナノコアの因子は、ナノセルの外側部分の因子より遅い放出動態を有している。このように、ナノコアの因子が効果を発揮し始める前に、まず外側部分の因子が放出され、効果を発揮することができる。例えば、癌の治療においては、ナノセルの外側脂質小胞部分に、メトトレキサートのような慣例的な化学療法因子が負荷され、ナノコアに、コンブレタスタチンのような抗血管形成因子が負荷される。まず、メトトレキサートがナノセルから放出され、コンブレタスタチンが腫瘍への血液供給を遮断する前に、腫瘍への血液供給が、細胞障害性因子を腫瘍細胞へと輸送する。このように、抗血管形成因子が腫瘍への血液供給を遮断する前に、細胞障害性因子が、細胞に到着し、その細胞障害性効果を発揮することできる。細胞障害性因子、それに続く抗血管形成剤の連続的送達は、好ましくは、相乗的であり、本発明の系において使用される薬物のより低い用量のため、減少した副作用を可能にする。
【0057】
本発明のナノセルを使用して送達される因子には、治療的、診断的、又は予防的な因子が含まれる。個体に投与される任意の化学化合物が、ナノセルを使用して送達され得る。因子は、低分子、有機金属化合物、核酸、タンパク質、ペプチド、金属、同位体標識された化学化合物、薬物、ワクチン、免疫学的因子等であり得る。
【0058】
好ましい実施形態において、因子は薬学的活性を有する有機化合物である。本発明のもう一つの実施形態において、因子は臨床的に使用されている薬物である。もう一つの実施形態において、因子は、ヒト又はその他の動物における使用のため米国食品医薬品局(U.S.Food&Drug Administration)により承認されているものである。特に好ましい実施形態において、薬物は、抗生物質、抗ウイルス剤、麻酔薬、ステロイド剤、抗炎症性因子、抗腫瘍性因子、抗原、ワクチン、抗体、鬱血除去薬、抗高血圧薬、鎮静薬、産児制限剤、妊娠促進剤、抗コリン作用薬、鎮痛薬、抗うつ薬、抗精神病薬、β−アドレナリン作用遮断薬、利尿薬、心血管作用剤、血管作用剤、非ステロイド性抗炎症剤、栄養剤等である。例えば、本発明のナノセルは、シナプス部位及び神経効果器結合部位において作用する薬物(例えば、アセチルコリン、メタコリン、ピロカルピン、アトロピン、スコポラミン、フィゾスチグミン、スクシニルコリン、エピネフリン、ノルエピネフリン、ドーパミン、ドブタミン、イソプロテレノール、アルブテロール、プロプラノロール、セロトニン);中枢神経系に作用する薬物(例えば、クロナゼパム、ジアゼパム、ロラゼパム、ベンゾカイン、ブピバカイン、リドカイン、テトラカイン、ロピバカイン、アミトリプチリン、フルオキセチン、パロキセチン、バルプロ酸、カルバマゼピン、ブロモクリプチン、モルヒネ、フェンタニル、ナルトレキソン、ナロキソン);炎症性応答を調整する薬物(例えば、アスピリン、インドメタシン、イブプロフェン、ナプロキセン、ステロイド、クロモリンナトリウム、テオフィリン);腎臓及び/又は心血管の機能に影響を与える薬物(例えば、フロセミド、チアジド、アミロライド、スピロノラクトン、カプトプリル、エナラプリル、リシノプリル、ジルチアゼム、ニフェジピン、ベラパミル、ジゴキシン、イソルジル(isordil)、ドブタミン、リドカイン、キニジン、アデノシン、ジギタリス、メバスタチン、ロバスタチン、シンバスタチン、メバロン酸);胃腸機能に影響を与える薬物(例えば、オメプラゾール、スクラルファート);抗生物質(例えば、テトラサイクリン、クリンダマイシン、アンホテリシンB、キニーネ、メチシリン、バンコマイシン、ペニシリンG、アモキシシリン、ゲンタマイシン、エリスロマイシン、シプロフロキサシン、ドキシサイクリン、アシクロビル、ジドブジン(AZT)、ddC、ddI、リバビリン、セファクロル、セファレキシン、ストレプトマイシン、ゲンタマイシン、トブラマイシン、クロラムフェニコール、イソニアジド、フルコナゾール、アマンタジン、インターフェロン);抗癌剤(例えば、シクロホスファミド、メトトレキサート、フルオロウラシル、シタラビン、メルカプトプリン、ビンブラスチン、ビンクリスチン、ドキソルビシン、ブレオマイシン、マイトマイシンC、ヒドロキシ尿素、プレドニゾン、タモキシフェン、シスプラチン、ダカルバジン(decarbazine));免疫調整剤(例えば、インターロイキン、インターフェロン、GM−CSF、TNFα、TNFβ、シクロスポリン、FK506、アザチオプリン、ステロイド);血液及び/又は血液形成器官に作用する薬物(例えば、インターロイキン、G−CSF、GM−CSF、エリスロポエチン、ビタミン、鉄、銅、ビタミンB12、葉酸、ヘパリン、ワルファリン、クマリン);ホルモン(例えば、成長ホルモン(GH)、プロラクチン、黄体化ホルモン、TSH、ACTH、インスリン、FSH、CG、ソマトスタチン、エストロゲン、アンドロゲン、プロゲステロン、性腺刺激ホルモン放出ホルモン(GnRH)、チロキシン、トリヨードサイロニン);ホルモンアンタゴニスト;石灰化及び骨代謝回転に影響を与える因子(例えば、カルシウム、リン酸塩、副甲状腺ホルモン(PTH)、ビタミンD、ビスホスホネート、カルシトニン、フッ化物)、ビタミン(例えば、リボフラビン、ニコチン酸、ピリドキシン、パントテン酸、ビオチン、コリン、イノシトール、カルニチン、ビタミンC、ビタミンA、ビタミンE、ビタミンK)、遺伝子治療因子(例えば、ウイルスベクター、核酸を保持しているリポソーム、DNA−タンパク質結合体、アンチセンス因子);又はターゲティング剤のようなその他の因子等からなる群より選択される一つ以上の化合物を含むよう調製され得る。
【0059】
予防的因子には、ワクチンが含まれる。ワクチンは、単離されたタンパク質又はペプチド、不活化された生物及びウイルス、死んでいる生物及びウイルス、遺伝学的に改変された生物又はウイルス、並びに細胞抽出物を含み得る。予防的因子は、インターロイキン、インターフェロン、サイトカイン、及びコレラ毒素、ミョウバン、フロイントアジュバントのようなアジュバント等と組み合わせられ得る。予防的因子は、細菌、ウイルス、真菌、原生動物、及び寄生動物の抗原を含む。これらの抗原は、完全な死滅させられた生物、ペプチド、タンパク質、糖タンパク質、炭水化物、又はそれらの組み合わせの形態であり得る。
【0060】
因子とは、組み合わせられ、ナノセルのナノコア又は外側脂質部分へ負荷された因子の組み合わせも意味し得る。因子の任意の組み合わせが使用され得る。例えば、薬学的因子が診断的因子と組み合わせられてもよいし、薬学的因子が予防的因子と組み合わせられてもよいし、薬学的因子が他の薬学的因子と組み合わせられてもよいし、診断的因子が予防的因子と組み合わせられてもよいし、診断的因子が他の診断的因子と組み合わせられてもよいし、そして予防的因子が他の予防的因子と組み合わせられてもよい。癌を治療するためのある種の実施形態においては、少なくとも二つの慣例的な化学療法因子が、ナノセルの他の脂質部分へ負荷される。
【0061】
本発明の一つの局面において、ナノセルは、選択されたサイズ範囲の実質的に均質のサイズを有するよう調製される。ナノセルは、特定のサイズの粒子を収集するため、ろ過、篩過、遠心分離、超遠心分離、カラムクロマトグラフィ分取、又は押し出しされ得る。一つの効果的なサイジング法は、選択された均一の孔サイズを有している一連のポリカーボネート膜を通してナノセルの水性懸濁物を押し出すことを含み;膜の孔サイズは、その膜を通した押し出しにより作製されるナノセルの最大サイズにほぼ相当するであろう。例えば、本明細書中に参考として援用される米国特許第4,737,323号を参照のこと。もう一つの好ましい方法は、定義されたサイズの画分を単離するための、定義されたスピードにおける連続超遠心分離によるものである。
【0062】
ナノセル組成物の好ましい使用は、腫瘍療法(固形及び脊髄性の両方)であるが、同じ原理が、その他の異常な血管形成に基づく病理の処置においても具体化される。その他の病理には、関節炎、網膜症、乾癬、固形腫瘍、良性腫瘍、カポジ肉腫、及び血液学的悪性疾患が含まれ得る。これには、前記の薬物が含まれ得;又は、例えば、関節炎の場合には、疾患修飾薬(DMARD)、非ステロイド性抗炎症薬(NSAID)、コルヒチン、メトトレキサート等がナノコアに含まれ、抗血管形成因子が周囲の脂質小胞又はポリマーシェルに含まれ得る。さらに、ナノセルにより達成される二つの無関係な活性因子間の空間−時間的な放出動態及び薬力学的相乗作用は、治療因子のそのような時間的又は空間的な活性が望まれる、その他の病態生理学的状態における使用の可能性を開く。そのような状態の例は喘息であり得、その場合には、鎮攣薬又は弛緩薬がナノシェルの外側部分に負荷され、ステロイド又はNSAIDのような抗炎症性因子が、喘息に関連した遅延型炎症反応に対する遅延型の活性のため、ナノコアに負荷され、ナノセルの外側部分から速く放出された活性因子が、肺胞及び/又は細気管支を弛緩させた後に、その効果を発揮するであろう。同様に、血液脳関門を開く分子がナノセルの外側部分に負荷され得、中枢作用性の神経活性剤がナノコアへ負荷され得、CNSにおける活性因子の構築を増加させ得る。ナノセルは、ワクチンの送達においても、より良好な結果のため使用され得る。例えば、アジュバントのような炎症性因子が、ナノセルの外側部分に負荷され得、抗原がナノコアに負荷され得る。当業者により認識されるように、ナノセル系は、多様な疾患を治療するために使用され得る。
【0063】
(ターゲティング剤)
特定の細胞、細胞の集団、組織、又は器官へと薬物送達デバイスをターゲティングすることが、しばしば望ましいため、ナノセルはターゲティング剤を含むよう修飾されてもよい。特定の細胞へ薬学的組成物を差し向ける多様なターゲティング剤が、当該分野において公知である(例えば、Cottenら、Methods Enzym.217:618,1993を参照のこと;これは本明細書中に参考として援用される)。ターゲティング剤は、ナノセル全体に含まれてもよいし、内側ナノコアにのみ含まれてもよいし、外側の脂質もしくはポリマーシェル部分にのみ含まれてもよいし、又はナノセルの表面にのみ存在してもよい。ターゲティング剤は、タンパク質、ペプチド、炭水化物、糖タンパク質、脂質、低分子、金属等であり得る。ターゲティング剤は、特定の細胞もしくは組織を標的とするために使用されてもよいし、又は粒子のエンドサイトーシスもしくは食作用を促進するために使用されてもよい。ターゲティング剤の例には、以下に限定されないが、抗体、抗体フラグメント、低密度リポタンパク質(LDL)、トランスフェリン、アシアロ糖タンパク質(asialycoproteins)、ヒト免疫不全ウイルス(HIV)のgp120エンベロープタンパク質、炭水化物、受容体リガンド、シアル酸等が含まれる。ターゲティング剤がナノコアに含まれる場合、ターゲティング剤は、ナノ粒子を形成させるために使用される混合物に含まれ得る。ターゲティング剤がナノセルの表面にのみ存在する場合、ターゲティング剤は、標準的な化学的技術を使用して、形成された粒子と(即ち、共有結合性、疎水性、水素結合性、ファンデルワールス性、又はその他の相互作用により)会合させられ得る。
【0064】
(薬学的組成物)
本発明の粒子が調製された後、それらは、薬学的組成物を形成させるため、その他の薬学的賦形剤と組み合わせられ得る。当業者により認識されるように、賦形剤は、下記のような投与経路、送達される因子、因子の送達の時間的経過等に基づき選択され得る。
【0065】
本発明の薬学的組成物、及び本発明に係る使用のための薬学的組成物は、薬学的に受容可能な賦形剤又は担体を含み得る。本明細書において使用されるように、「薬学的に受容可能な担体」という用語は、非毒性の、不活性の、固形、半固形、又は液状の増量剤、希釈剤、封入材料、又は任意の型の製剤化補助剤を意味する。薬学的に受容可能な担体として機能し得る材料のいくつかの例は、ラクトース、グルコース、及びショ糖のような糖;コーンスターチ及びジャガイモデンプンのようなデンプン;セルロース、並びにカルボキシメチルセルロースナトリウム、エチルセルロース、及び酢酸セルロースのようなその誘導体;粉末化されたトラガカントゴム;麦芽;ゼラチン;タルク;カカオ脂及び坐剤用ロウのような賦形剤;落花生油、綿実油のような油;ベニバナ油;ゴマ油;オリーブ油;トウモロコシ油及び大豆油;プロピレングリコールのようなグリコール;オレイン酸エチル及びラウリン酸エチルのようなエステル;寒天;トゥイーン80のような界面活性剤;水酸化マグネシウム及び水酸化アルミニウムのような緩衝剤;アルギン酸;発熱性物質除去水;等張生理食塩水;リンゲル液;エチルアルコール;人工脳脊髄液(CSF)、及びリン酸緩衝溶液、並びにラウリル硫酸ナトリウム及びステアリン酸マグネシウムのようなその他の非毒性の適合性の滑沢剤であり、着色剤、放出剤、コーティング剤、甘味剤、風味芳香剤、保存剤、及び抗酸化剤も、製剤化を行う者の判断により組成物中に存在し得る。本発明の薬学的組成物は、経口的に、直腸に、非経口的に、大槽内に、膣内に、鼻腔内に、腹腔内に、局所的に(粉末、クリーム、軟膏、又は滴剤により)、経皮的に、皮下に、頬に、又は経口もしくは鼻のスプレーとして、ヒト及び/又は動物へ投与され得る。
【0066】
注射可能調製物、例えば、無菌の注射可能な水性又は油性の懸濁物は、適当な分散剤又は湿潤剤及び懸濁化剤を使用して、既知の技術に従って製剤化され得る。無菌の注射可能調製物は、非毒性の非経口的に受容可能な希釈剤又は溶媒による無菌の注射可能な溶液、懸濁物、又はエマルジョン、例えば、1,3−ブタンジオール溶液であってもよい。利用され得る受容可能な媒体及び溶媒には、水、リンゲル液、U.S.P.等張塩化ナトリウム溶液が含まれる。さらに、無菌の固定油が、溶媒又は懸濁化媒体として従来利用されている。この目的のためには、合成のモノグリセリド又はジグリセリドを含む、任意の非刺激性(bland)の固定油が利用され得る。さらに、オレイン酸のような脂肪酸が、注射可能剤の調製において使用される。
【0067】
注射可能製剤は、例えば、細菌保持フィルターによるろ過により、又は、使用前に滅菌水又はその他の無菌の注射可能媒体に溶解又は分散させられ得る、無菌の固形組成物の形態に滅菌剤を組み入れることにより、滅菌され得る。
【0068】
(薬学的組成物をアッセイする方法)
実質−間質軸の介入は、依然として腫瘍療法のための魅力的な目標である。抗血管形成薬を評価するための標準的なアプローチは、血管形成中の重要工程である内皮細胞の増殖、遊走、化学浸潤(chemoinvasion)、又は管形成(tubulogenesis)に対する活性を研究することであった(Senguptaら、Circulation 107(23):2955−61,6月17日,2003)。しかしながら、これらのアッセイは、腫瘍細胞から単離されて、活性化された内皮が研究されるという事実によって制限される。腫瘍内皮が独特の遺伝学的サインを示すことが証明されているため(StCroixら、Science 289(5482):1197−1202,8月18日,2000)、このことは致命的である。さらに、標準的な組織培養技術は、しばしば、空間的配置を促進しない。実際、2−D系において培養された内皮細胞は、細胞と細胞外環境との間の天然の相互作用をシミュレートするために開発された3−Dモデル系とは異なっている。Shekharら(Cancer Res.61(4):1320−26,2月15日,2001)は、新生物発生前の胸部上皮細胞と混合された内皮細胞が、管−肺胞形態形成、血管形成、及び悪性表現型への進行の研究を可能にする、3次元マトリゲルに基づく共培養モデルを開発した。3D共培養系を開発するため、Nehls及びDrenckhahn(Histochem.Cell Biol.104(6):459−66,12月、1995)は、ミクロの担体に基づくフィブリンゲル包埋共培養物を使用し、Duttら(Tissue Eng.9(5):893−908,10月、2003)は、NASAバイオリアクターを使用した。Longoら(Blood 98(13):3717−26、12月15日、2001)は、3−Dコラーゲンマトリックス上で黒色腫細胞と内皮細胞の単層との相互作用を研究した。しかしながら、全てのそのような共培養実験において、標準的な免疫組織細胞化学を使用して、CD31、CD34、CD105、vWF等のような一般に使用される抗体、又はa1−フコシル部分と結合するレクチンを使用して、内皮細胞が標識されているが、これらは、多くのコスト及び時間を要する。さらに、相互作用する細胞パートナーの同時の可視化及び分析のため、複雑さのレベルがさらに増す。
【0069】
本発明は、有限の寿命を有している初代内皮細胞を改変させずに、蛍光性の遺伝子産物(例えば、緑色蛍光タンパク質(GFP))を発現するよう安定的にトランスフェクトされた形質転換腫瘍細胞(例えば、黒色腫細胞)を組み入れることにより、これらの制限を克服する。内皮成分と腫瘍成分とを別個に標識するその後の一工程は、マージされた画像が、内皮細胞とは異なる色で腫瘍細胞を示すため(例えば、腫瘍細胞は緑色で、内皮細胞は赤色で現れる)、容易な可視化及び分析を可能にする。
【0070】
実際、ドキソルビシンとのインキュベーションは、緑色の黒色腫細胞の完全な欠損から明からなように、化学療法効果を発揮した。さらに、より低いバックグラウンドを有する高コントラスト画像の捕捉が、定量化のための立体解析学的分析も容易にし、この工程は容易にコンピュータにより自動化され得る。
【0071】
アッセイ系において使用される細胞系は、蛍光タンパク質を安定的に発現することができるか、又は適切な波長を使用して励起された場合に蛍光を発するよう修飾された形質転換細胞である。好ましくは、細胞は、間葉系起源の腫瘍(肉腫)、又は上皮起源の腫瘍(癌腫)、又は奇形腫からのものであろう。脳の癌、肺癌、胃癌、結腸癌、乳癌、膀胱癌、前立腺癌、卵巣癌、子宮癌、精巣癌、膵臓癌、白血病、リンパ腫、骨癌、筋肉の癌、及び皮膚癌からの細胞が、本発明のアッセイにおいて使用され得る。好ましくは、細胞は、細胞培養ディッシュに付着性のものであろう。内皮細胞は、血管系、例えば、動脈、静脈、又は毛細血管のような微小血管系に由来するべきである。内皮細胞は、先祖細胞又は幹細胞に由来してもよい。ある種の実施形態において、内皮細胞はヒト臍帯に由来する。
【0072】
この研究より以前に報告された全ての共培養実験において、相互作用する細胞成分は、一緒に播種された。しかしながら、病態生理学において、血管形成とは、既存の血管床からの新生血管の出芽として定義される。病態生理学をより正確に模倣するため、本発明は、腫瘍細胞を播種する前に、内皮細胞の原始ネットワークの発達が形成されることを可能にする。このアプローチによって、腫瘍細胞の存在下での血管ネットワークの形成の有意な増加が観察される。この新規のインビトロモデル系は、腫瘍血管形成をより正確にシミュレートし、新規分子の化学療法活性及び抗血管形成活性の同時の検出を可能にする。このアッセイ系は、実質−間質軸の分子的相互作用を精査し、化学療法薬及び抗血管形成薬の戦略的組み合わせ計画の開発を容易にするための独特のツールを提供する。
【0073】
本発明のこれら及びその他の局面は、以下の実施例を考慮することによりさらに認識されるが、実施例は、本発明のある種の特定の実施形態を例示するためのものであって、特許請求の範囲により定義されるような本発明の範囲を制限するためのものではない。
【実施例】
【0074】
(実施例1:ナノセルの合成及び分析)
(A)ドキソルビシンのPLGAとの結合(図3)。50/50のラクチド/グリコリドモル比を有しているポリ乳酸グリコール酸(PLGA)(Medisorb(登録商標)5050 DL 4A)を、Alkermes(Wilmington,OH)から入手した。このポリマーの平均分子量は61kDaであると報告されており、その末端に遊離のヒドロキシル基及びカルボキシル基を有している。塩酸ドキソルビシン、クロロギ酸p−ニトロフェニル(nitrophenyl chloroformate)、及びトリエチルアミンは、Sigma−Aldrich(St.Louis,MO)から入手した。簡単にいえば、1.5gのPLGA 5050 DL 4Aを15mlの塩化メチレンに溶解させ、0℃の氷浴中で維持された溶液に、14mgのクロロギ酸p−ニトロフェニル及び9.4mg(およそ9.6μL)のピリジンを添加することにより活性化した(PLGA:クロロギ酸p−ニトロフェニル:ピリジンの化学量論的モル比=1:2.8:4.7)。反応を窒素雰囲気下で室温で3時間実施した。得られた溶液を塩化メチレンにより希釈し、0.1%HCl及びブラインで洗浄した。有機相を分離し、無水硫酸マグネシウムで乾燥し、ろ過し、次いで、回転式蒸発により、活性化されたPLGAポリマーを得た。活性化されたPLGA(0.4g)を3mLのジメチルホルムアミド(DMF)に溶解させ、窒素雰囲気下で室温で24時間、4mgのドキソルビシン及び2.7mg(およそ4μL)のトリエチルアミンと反応させた(活性化されたPLGA:ドキソルビシン:トリエチルアミンの化学量論的モル比=1:1:4)。最終結合生成物を、冷エーテルの添加により沈殿させ、エーテルで洗浄し、ろ過し、真空下で乾燥した。
【0075】
既知量の結合体を計量し、ジメチルスルホキシド(DMSO)に溶解させた。結合の程度は、480nm(ドキソルビシン吸光度の波長)において溶液の吸光度を測定することにより決定した。DMSO中の一連のドキソルビシン濃度の吸光度の標準曲線を、結合体内のドキソルビシン量を決定するために使用した。結合反応の収率は、およそ90%であった。
【0076】
(B)ナノコアの合成及びナノコアの走査型電子顕微鏡検(図3B)。ナノコアをエマルジョン溶媒蒸発技術を使用して製剤化した。簡単にいえば、50mgのPLGA−DOXを、室温で1時間2.5mLのアセトンに完全に溶解させた。この時点で、0.5mLのメタノールを添加し、全溶液を、組織ホモジナイザーを使用して常にホモジナイズしながら徐々に射出し、その後、1分間、超音波処理(Misonix,Farmingdale,NY)することにより、PVA(0.5g/25mL)の水性溶液へと乳化した。残余のアセトン又はメタノールを蒸発させるため、室温で3時間、急速に混合しながら、エマルジョンをPVAの希薄な水性溶液(0.2g/100mL)へと添加した。ナノコアサイズ画分を、8,000、15,000、20,000、及び22,000RPMにおける超遠心分離により回収した。ナノセルへの封入のためのナノコアを入手するため、最小サイズ画分からのナノコアを、携帯型押し出し機(Avestin,Ottawa,ONT)を使用して100nmの膜を通して押し出した。動的光散乱(Brookhaven Instruments Corp,Holtsville,NY)によっても、SEMによっても、ナノコアをサイジングした(図3B及び3E)。SEM調製のため、ナノコアを72時間凍結乾燥し、その後、少量をカーボングリッドへと吹き付け、金によりコーティングした。65000×の倍率でPhilips EMを使用して、粒子を分析した。凝集を最小限に抑えるため、全てのナノコアを、合成から2時間以内に使用した。
【0077】
周囲のマトリックス/ナノシェルを調製するため、コレステロール(CHOL)、卵ホスファチジルコリン(PC)、及びジステアロイルホスファチジルコリン−ポリエチレングリコール(分子量2000)(DSPE−PEG)を、Avanti Polar Lipids(Birmingham,AL)から入手した。コンブレタスタチンA4は、Tocris Cookson(Ellisville,MO)から入手した。その他の全ての試薬及び溶媒は、分析用等級であった。
【0078】
PC:CHOL:DSPE−PEG(2:1:0.2モル濃度)脂質膜を、丸底フラスコで2mLのクロロホルムに27.5mgの脂質を溶解させることにより調製した。12.5mgのコンブレタスタチンA4を、0.9:1薬物:脂質モル比で、クロロホルム(choloroform)混合物に同時溶解させた。単層脂質/薬物フィルムを作出するため、回転式エバポレーター(roto−evaporator)を使用してクロロホルムを蒸発させた。脂質二重層へのコンブレタスタチンA4の優先的な封入を可能にするため、このフィルムを、65℃で1時間振とうした後、1mLのH2Oに再懸濁させた。得られた懸濁剤を、単層脂質小胞を作出するため、携帯型押し出し機(Avestin,Ottawa,ONT)を使用して、65℃で200nmの膜を通して押し出した。平均小胞サイズを、動的光散乱(Brookhaven Instruments Corp,Holtsville,NY)により決定した。290nmでコンブレタスタチンA4溶出をUVモニタリングしながら、セファデックスG−25(Pharmacia Biotech)を含有しているPD−10カラムに薬物/脂質混合物を通すことにより、封入効率を決定した。
【0079】
上記のようにしてPLGA−DOXナノコアを調製し、100nmの膜を通した押し出しにより、およそ100nmのナノコアをナノセル封入のため選択した。CHOL:PC:DSPE−PEG:コンブレタスタチンナノセルを合成する場合には、250μgのドキソルビシンを含有しているナノコアを、水性脂質再懸濁緩衝液へ添加した。封入効率を決定するため、その混合物をTEMを使用して分析した。ナノコアを72時間凍結乾燥し、その後、少量をカーボングリッドへと吹き付け、金によりコーティングした。それらを、65000×の倍率でPhilips EMを使用して分析した(図3B)。
【0080】
(C)ナノセルの合成及び透過型電子顕微鏡写真(図3C)。試料を、5%ショ糖と共に2.5%グルタルアルデヒド(gluteraldehyde)、3%パラホルムアルデヒドを含む0.1Mカコジル酸ナトリウム緩衝液(pH7.4)で固定し、低温アガロースに包埋し、1%OsO4を含むベロナール−酢酸緩衝液で後固定した。試料を、ブロックで、0.5%酢酸ウラニルを含むベロナール−酢酸緩衝液(pH6.0)により一晩染色した。次いで、脱水し、epon−812樹脂に包埋した。切片を、Leica ultra cut UCTで、ダイヤモンドナイフを使用して70nmの厚さに切断し、2.0%酢酸ウラニル、続いて0.1%クエン酸鉛により染色し、Philips EM410を使用して調査した。動的レーザー光散乱実験も、サイズ範囲が180〜220nmであることを確認した(図3D及び3E)。
【0081】
(D)物理化学的な放出動態研究。濃縮された薬物が負荷されたナノセルを、1mlのPBS又は低酸素細胞溶解物緩衝液に懸濁させ、透析バッグ(分子量カットオフ:10,000、Spectrapor)に密封した。透析バッグを、温和に振とうしながら、37Cの20mlのPBS緩衝液の中でインキュベートした。所定の時間間隔でインキュベーション媒体から一定分量200ulを採取し、分析のための凍結保管した。溶出剤としてアセトニトリル(A)及び水(B)を用いたC18カラム(4.5mm×150mm、Waters)を使用した逆相HPLCにより、放出された薬物を定量した。出発条件は、80%A及び20%Bであり、1ml/分の流速で、15分間の直線勾配により10%A及び90%Bにし、5分間の直線勾配により0%A及び100%Bにし、そして5分間の直線勾配により出発条件へと戻した。標準化された量のデキサメタゾンを、コンブレタスタチン(combretastatain)A4及びドキソルビシンの絶対的定量化のための内部対照として添加した。コンブレタスタチンA4及びデキサメタゾンを、295nmにおける波長モニタリングにより検出し、ドキソルビシンは、480nmにおける波長モニタリングにより検出した。まず大量のコンブレタスタチンがナノセルから放出され、続いてナノコアからのドキソルビシンの遷延性の遅い放出が起こる。放出された遊離ドキソルビシンの量はドキソルビシン−PLGAフラグメントと比較して小さく、そのことから、遊離ドキソルビシン及び活性ドキソルビシン−PLGAフラグメントは細胞障害性効果に寄与するが、ドキソルビシン−PLGAオリゴマーはそれに寄与しないことが強調された(図3F)。
【0082】
(実施例2:新規のインビトロアッセイ系の開発)
プロトコル:系を確立するため、3人のドナーからプールされたヒト臍静脈内皮細胞を、Cambrexから購入し、3〜6の間の継代で使用した。細胞を、20%胎仔ウシ血清(FBS)及びブレットキット(bulletkit)−2が補足された内皮基本培地において増殖させた(Senguptaら、Cancer Res.63(23):8351−59,2003年、12月1日)。腫瘍成分のため、本発明者らは、緑色蛍光タンパク質を発現するよう安定的にトランスフェクトされたB16/F10黒色腫細胞をモデル細胞系として使用した。増強緑色蛍光タンパク質を発現するプラスミド(pEGFP−C2,Clontech)を直鎖化し、リポフェクションによりB16−F10細胞へと導入した(Lipofectamine 2000,Invitrogen)。安定的に組み込まれたB16−F10細胞のクローンを、800μg/ml G418により選択した。G418耐性クローンの緑色蛍光を、フローサイトメトリー及びエピフルオレセンス(epifluorescence)顕微鏡検によりさらに確認した。GFP−B16/F10細胞を、5%FBSが補足されたDMEMにおいて定期的に培養した。無菌カバーガラス(Corning)を、マトリゲル(リン酸緩衝生理食塩水で1:3に希釈されたマウスEnglebreth−Holms肉腫から抽出された細胞外マトリックス;Becton Dickinson)又はコラーゲン(ラット尾部由来のI型、Becton Dickinson)によりコーティングした。同期化されたヒト臍静脈内皮細胞を、トリプシン処理し、1ウェル当たり2×104細胞の密度でカバーガラス上に蒔いた。20%胎仔ウシ血清が補足された内皮基本培地中で24時間、細胞を付着させた。この時点で、1%血清が補足されたEBMに培地を交換し、緑色蛍光タンパク質を発現しているB16/F10細胞を、1ウェル当たり5×103細胞の密度で系へ添加した。共培養物を一晩インキュベートし、その後、異なる処理を培地に添加した。処理後24時間目に、細胞をパラホルムアルデヒド(4%、氷上、20分間)で固定し、ヨウ化プロピジウムにより染色した。アンチフェード(antifade)でカバーガラスをマウントし、LSM510 Zeiss共焦点顕微鏡により分析した。蛍光色素を488nm及び543nmのレーザー線を使用して励起し、放射された光を505/30nm及び565/615のバンドパスフィルターを使用して捕捉した。512×512ピクセルの解像度で画像を捕捉した。内皮細胞又はGFP−BL6/F10細胞によりカバーされた面積の定量化を、224−インターセクションポイントスクエアレティキュラム(intersection point square reticulum)を使用して、面積測定ポイントカウント法(planimetric point−count method)を使用して実施した。データは、細胞によりカバーされた総面積に対する各成分の比率として表された。
【0083】
(インビトロ腫瘍血管形成に対するVEGF及びHGFの効果(図4))
内皮細胞は、マトリゲルに蒔かれてから(1:3希釈)24時間以内に、限られた数の管状ネットワークを形成した。しかしながら、共培養物を確立するための腫瘍細胞の添加は、管形成過程を加速した。GFP+腫瘍細胞は、血管ネットワークにより包囲され統合されたクラスタへと集中していることが可視化された。VEGF及びHGF/SFの両方の添加は、血管ネットワークの有意な増加をもたらした。特定の経路の調節を解明するための系の感受性を確証するため、本発明者らは、VEGF受容体アンタゴニスト、PTK787を使用した。予想通り、VEGFにより誘導される血管形成は、HGF/SFにより誘導される応答に対しては効果がなかった濃度で、PTK787により阻止された(図4)。
【0084】
(VEGF又はHGF/SFにより誘導される応答に対するコンブレタスタチン、サリドマイド、及びドキソルビシンの効果(図5および6))
図5に示されるように、ドキソルビシン(10〜50μM)とのインキュベーションは、濃度依存様式において腫瘍細胞の選択的な排除を発揮した。使用された最も高い濃度(50mM)ですら、VEGFにより誘導される内皮ネットワークに対する効果は明白でなかった。対照的に、サリドマイド及びコンブレタスタチンの両方は、腫瘍細胞に影響を与えることなく、VEGFにより誘導される血管ネットワークの崩壊を発揮した。
【0085】
VEGFにより誘導される共培養実験と同様に、ドキソルビシンは、HGF/SFの存在下で腫瘍細胞死の選択的な誘導を発揮した(図6)。しかしながら、VEGFとは対照的に、HGF/SFは、サリドマイド又はコンブレタスタチンの存在下での内皮細胞ネットワークの排除を防止した(図6)。これらの二つの間接型抗血管形成因子に対する、VEGFにより誘導される血管形成の感受性、及びHGF/SFの防護効果は、二つの増殖因子により誘導される細胞内シグナル伝達のレベルにおける機能的な差を示している。
【0086】
(VEGF又はHGFにより誘導される腫瘍応答に対するコラーゲンマトリックスの効果(図7〜8))
コラーゲンマトリックス上に蒔かれた内皮細胞は、マトリゲル上に蒔かれた場合に形成された管状ネットワークと異なり、平坦な「丸石(cobble−stone)」形態学を呈した。さらに、黒色腫細胞も、接着斑の形成と共に「展延(spreading−out)」形態学を呈し、マトリゲル上で見られたような細胞クラスタを形成しなかった。ドキソルビシンとのインキュベーションは、VEGFで処理された共培養物においても、HGF/SFで処理された共培養物においても、腫瘍細胞死を誘導した(図7、8)。図7に示されるように、コンブレタスタチン及びサリドマイドの両方が、VEGFの血管形成効果を阻害した。興味深いことに、細胞をコラーゲン上に蒔いた場合には、マトリゲル上に蒔かれた細胞において観察されたHGF/SFの防護効果が失われ、サリドマイド及びコンブレタスタチンの両方が内皮細胞欠損を誘導した(図8)。この見解は、抗血管形成療法をスクリーニングする際に細胞外成分を組み入れる必要を強調している。
【0087】
(実施例3:薬物が負荷されたナノセルのインビトロ効力(図9))
無菌カバーガラス(Corning)を、マトリゲル(リン酸緩衝生理食塩水で1:3に希釈されたマウスEnglebreth−Holms肉腫から抽出された細胞外マトリックス;Becton Dickinson)又はコラーゲン(ラット尾部由来のI型、Becton Dickinson)によりコーティングした。同期化されたヒト臍静脈内皮細胞を、トリプシン処理し、1ウェル当たり2×104細胞の密度でカバーガラス上に播種した。細胞を、20%胎仔ウシ血清が補足された内皮基本培地中で24時間付着させた。この時点で、1%血清が補足されたEBMに培地を交換し、緑色蛍光タンパク質を発現しているB16/F10細胞を、1ウェル当たり5×103細胞の密度で系へ添加した。共培養物を一晩インキュベートし、その後、異なる処理を培地に添加した。処理後24時間目に、細胞をパラホルムアルデヒド(4%、氷上、20分間)で固定し、ヨウ化プロピジウムにより染色した。アンチフェードでカバーガラスをマウントし、LSM510
Zeiss共焦点顕微鏡により分析した。蛍光色素を488nm及び543nmのレーザー線を使用して励起し、放射された光を505/30nm及び565/615のバンドパスフィルターを使用して捕捉した。512×512ピクセルの解像度で画像を捕捉した。内皮細胞又はGFP−BL6/F10細胞によりカバーされた面積の定量化を、224−インターセクションポイントスクエアレティキュラムを使用して、面積測定ポイントカウント法を使用して実施した。データは、細胞によりカバーされた総面積に対する各成分の比率として表された。
【0088】
統計図表に示されるように、ドキソルビシンが負荷されたナノコアとのインキュベーションは、血管形成の結果には影響を与えることなく、黄色の黒色腫細胞の選択的な欠損をもたらした。対照的に、周囲の脂質マトリックスに捕獲されたコンブレタスタチンとのインキュベーションは、血管ネットワークの選択的な欠損をもたらし、内皮細胞に対するその選択性が証明された。共培養物をコンブレタスタチン及びドキソルビシンが負荷されたナノセルと共にインキュベートした場合には、まず内皮細胞の迅速な死がもたらされ、続いて、全共培養物の完全な欠損が起こった。これは、病態生理学を精密に模倣したシミュレーションにおいて、周囲マトリックスの活性因子(この場合、コンブレタスタチン)が、ナノコアに結合された活性因子(この実施例の場合、ドキソルビシン)の前に放出されることを証明しており、ナノセルの使用に起因する空間−時間的な効果、及び腫瘍の完全な排除をもたらすために、より優れた効力を強調している。
【0089】
(実施例4:インビボ腫瘍モデル(図10))
雄C57/BL6マウス(20g)に、3×105個のYFP−BL6/F10細胞又は2.5×105個のルイス(Lewis)肺癌細胞を側腹部へ注射した。腫瘍の増殖を、定期的にモニタリングした。腫瘍の体積が50又は150mm3のいずれかに達した時点で、マウスを異なる処理群へと無作為化した。処理は、3〜7回の適用のため隔日に尾静脈から投与された。腫瘍の寸法を毎日測定し、下記式に従って腫瘍体積を計算した:
体積=3.14/6×長さ×幅2
特定の時点で動物を屠殺し(図10及び12参照)、腫瘍を、肉眼的形態学のため写真撮影し、組織病理学的分析のため切除した。白血球数が化学療法薬の効果に対して最も感受性であるため、同時に、1mlの血液を心臓穿刺により採取し、処理レジメンの毒性プロファイルのために分析した。
【0090】
写真は、ナノセル処理群と比較した、マウスにおける黒色腫増殖に対する異なる薬物製剤及び組み合わせの効果を示している。ドキソルビシン−ナノコア及びナノ脂質捕獲コンブレタスタチンによる処理は、いずれも、腫瘍増殖の低下をもたらし、組み合わせられた場合、相加効果を示した。しかしながら、ナノセル製剤で投与された場合、結果は、いずれの比較群よりも有意に優れていた。これは、ナノセルが、血管系の破壊の前に、dox−ナノコアを腫瘍へと送達するという本発明者らの仮説を支持している。
【0091】
グラフは、異なる血球数及びヘモグロビンレベルに対する異なる処理の効果を示す。ナノセル処理群では、最も強力であったという事実にもかかわらず、最小の毒性が観察され、このことは、化学療法因子(ドキソルビシン)が、ナノコアから放出される前に血管が崩壊するため、腫瘍内に捕獲され、より少ない量が体循環へと漏出し得ることを示唆している。
【0092】
(実施例5:腫瘍新生血管系に対する異なる処理の効果(図11))
ナノコア−ドキソルビシン(ND)による処理は、血管系又は血管密度に対しては効果を及ぼさないが(グラフ参照)、ナノ脂質−ミセルコンブレタスタチン(LC)は、血管密度を低下させ、血管系を崩壊させる。ND+LCは相乗的であったが、この群とナノセルを使用して達成されたものとの間に有意な差は存在しなかった。いずれの群においても、LCがNDより早く功奏すると予想されるため、これは予想通りである。
【0093】
(実施例6:腫瘍アポトーシスに対する異なる処理の効果(図12))
アポトーシスを受けている細胞は、TUNEL陽性であるため、赤色に染色される。LC+ND処理群及びナノセル処理群は、腫瘍血管系に対して同じ効果を有していたが、後者が腫瘍においてより大きなアポトーシスを誘導したことは明白である。これは、ナノセル処理群において観察された、より良好な治療結果を説明し、ドキソルビシンが、ナノコアから放出され、LCにより媒介される腫瘍血管の崩壊の結果として腫瘍内に捕獲されるという仮説も支持する。対照的に、LC+ND処理切片は、有意な量のNDが腫瘍間質に侵入する前に血管が崩壊するため、比較的少ないアポトーシスを示す。
【0094】
(実施例7:転移に対する異なる処理の効果(図13))
黒色腫は、その他の器官に加えて、肝臓及び肺へと自然に転移する高悪性度の腫瘍である。本発明者らは、これらの器官における転移節の数を評価することにより、肺(上パネルセット)及び肝臓(下パネルセット)への転移に対する異なる処理条件の効果を評価した。これは、緑色蛍光陽性の節の数を計数することによりなされたが、統計図表においては、核を標識する色素で標識された全細胞からの赤色発光と、緑色蛍光がマージするため、それらは黄色として現れる。示されるように、ナノセルによる処理は、両方の器官への転移を防止した。
【0095】
(実施例8:組織分布研究)
フルオレセイン色素が負荷されたナノセルを合成した。遊離フルオレセインは、セファデックスG25カラムにナノセルを通すことにより除去した。フルオレセイン−ナノセルを、腫瘍を保持しているマウスへ注射した。投与後5、10、及び24時間後に、動物を屠殺した。剖検の間に血清、腫瘍、肝臓、肺、及び脾臓を収集し、メタノールを使用して、これらの組織からフルオレセインを抽出した。各試料におけるフルオレセインの量を蛍光プレートリーダーを使用して検出し、組織重量に対して規準化した。ナノセルは腫瘍に明らかに蓄積しており、その他の臓器系には蓄積していなかった(図10F)。
【0096】
(実施例9:喘息治療用のナノセル)
図15は、喘息治療用に開発されたナノセルの構造及び放出動態プロファイルを示す。電子顕微鏡写真は、生分解性ナノコアがラクトースシェルによりコーティングされているナノセルの超微細構造を示している。コルチコステロイド(抗炎症性因子)がナノコア内に捕獲され、気管支拡張剤がナノコアを包囲するラクトースマトリックスに捕獲されている。グラフは、まず気管支拡張剤(サルブタモール)が数分という時間スケールで放出され、コルチコステロイド(デキサメタゾン)が遅い遷延性の様式で放出されるという事実を証明している。この時間的な放出は、まず、喘息の間に収縮した細気管支が拡張することを可能にし、より深い肺へのナノコアの浸透を可能にする。その後の遅い放出は、急性喘息エピソードの後の慢性炎症を阻止する。
【0097】
(他の実施形態)
以上は、本発明のある種の非限定的な好ましい実施形態の説明である。当業者は、添付の特許請求の範囲において定義されるような本発明の精神又は範囲から逸脱することなく、この説明に対して種々の変化及び改変が実施され得ることを認識する。
【特許請求の範囲】
【請求項1】
明細書に記載の発明。
【請求項1】
明細書に記載の発明。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【公開番号】特開2011−256207(P2011−256207A)
【公開日】平成23年12月22日(2011.12.22)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−203566(P2011−203566)
【出願日】平成23年9月16日(2011.9.16)
【分割の表示】特願2007−501918(P2007−501918)の分割
【原出願日】平成17年3月2日(2005.3.2)
【出願人】(596060697)マサチューセッツ インスティテュート オブ テクノロジー (233)
【Fターム(参考)】
【公開日】平成23年12月22日(2011.12.22)
【国際特許分類】
【出願番号】特願2011−203566(P2011−203566)
【出願日】平成23年9月16日(2011.9.16)
【分割の表示】特願2007−501918(P2007−501918)の分割
【原出願日】平成17年3月2日(2005.3.2)
【出願人】(596060697)マサチューセッツ インスティテュート オブ テクノロジー (233)
【Fターム(参考)】
[ Back to top ]

