ニゲロースホスホリラーゼ
【課題】ニゲロース加リン酸分解活性を有する酵素の提供。
【解決手段】ニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有する酵素。
【解決手段】ニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有する酵素。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ホスホリラーゼ酵素及びその利用に関する。
【背景技術】
【0002】
ホスホリラーゼは、グリコシド結合を加リン酸分解する酵素の総称である。ホスホリラーゼは、その可逆的な加水分解反応や厳密な反応位置特異性から、特定のオリゴ糖の調製に有用であることが知られている。ホスホリラーゼの反応の可逆性を利用して、様々なオリゴ糖が対応する糖1−リン酸から逆反応を用いて合成されている(非特許文献1〜3及び特許文献1)。単独のホスホリラーゼを用いて、又は2つのホスホリラーゼを組み合わせて用いて、より安価な原料からオリゴ糖を生成することも可能になっている。
【0003】
従来クローニングされている反転型ホスホリラーゼは全て、CAZyデータベース(http://www.cazy.org)中でグリコシドヒドロラーゼ(GH)ファミリー65、94又は112に分類されている。グリコシドヒドロラーゼ(GH)ファミリー65は、α−D−グルコシル結合を加リン酸分解してβ−D−グルコース1−リン酸(β−グルコース1−リン酸;β-G1P)を生成するホスホリラーゼを含有するファミリーである。現在では、トレハロースホスホリラーゼ(EC 2.4.1.64)、コージビオースホスホリラーゼ(EC 2.4.1.230)、マルトースホスホリラーゼ(EC 2.4.1.8)及びトレハロース6−リン酸ホスホリラーゼ(EC 2.4.1.216)が、GH65酵素のメンバーとして知られている。
【0004】
しかしながら、既知のホスホリラーゼの基質特異性のバリエーションはまだ少ない。そのため、ホスホリラーゼを用いたオリゴ糖製造法を適用可能な範囲はなおも限定されている。このため新規な基質特異性を有するホスホリラーゼの取得がなおも望まれている。例えば、グルコース2分子がα−1,3結合したグルコシル二糖であるニゲロースを特異的に加リン酸分解するホスホリラーゼは、ホスホリラーゼを用いたニゲロースの製造に重要であると考えられるが、そのような酵素はこれまで報告されていない。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特公昭63−60998号公報
【非特許文献】
【0006】
【非特許文献1】Kitaoka M., and Hayashi K., (2002), Trends Glycosci. Glycotechnol., 14, p.35-50
【非特許文献2】Luley-Goedl C., and Nidetzky B., (2010) Biotechnol. J., 5, p.1324-1338
【非特許文献3】Murao S., et al., (1985), Agric. Biol. Chem., 49, p.2113-2118
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、ニゲロースに対して特異的な加リン酸分解活性を有する酵素を提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは、上記課題を解決するため鋭意検討を重ねた結果、クロストリディウム・フィトファーメンタンス(Clostridium phytofermentans)から新規な活性、すなわち、ニゲロースを高い特異性で加リン酸分解してβ−グルコース1−リン酸を生成するニゲロースホスホリラーゼ酵素を取得し、本発明を完成するに至った。
【0009】
すなわち、本発明は以下を包含する。
[1] ニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有する酵素。
本酵素は、基質濃度10mMのコージビオース、マルトース及びトレハロースに対する加リン酸分解活性が、基質濃度10mMのニゲロースに対する加リン酸分解活性と比較していずれも5%以下であることが好ましい。
本酵素はまた、
(a)30℃の条件下で至適pHが6.5〜7.5であり、pH5.5〜9.0で安定であり、
(b)pH7.0の条件下で至適温度が40℃であり、15℃〜40℃の範囲で安定であり、
(c)ゲルろ過法で測定した分子量が200kDaであり、
(d)二量体であり、
(e)クロストリディウム・フィトファーメンタンス由来である
酵素であることが好ましい。
本酵素は、以下の(a)又は(b)のタンパク質から構成されることがさらに好ましい。
(a)配列番号2で表されるアミノ酸配列からなるタンパク質、又は
(b)配列番号2で表されるアミノ酸配列において1〜数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有するタンパク質
[2] 上記[1]の酵素を、リン酸存在下でニゲロースと反応させることを含む、ニゲロースの分解方法。
[3] 上記[1]の酵素を、β−グルコース1リン酸、及び単糖若しくはその誘導体と反応させてα−グルコシル結合を生成することを含む、α−グルコシル結合を有する二糖の製造方法。
この方法において用いる単糖又はその誘導体は、グルコース、ガラクトース、キシロース、1,5−アンヒドロ−グルシトール、グルクロン酸、及びα−メチルグルコシドからなる群から選択されることが好ましい。
この方法の特に好ましい態様では、用いる単糖又はその誘導体がグルコースであり、製造されるα−グルコシル結合を有する二糖がニゲロースであってよい。
【発明の効果】
【0010】
本発明によれば、ニゲロースに対する特異的かつ可逆的な加リン酸分解活性を有する酵素ニゲロースホスホリラーゼを提供することができる。
【図面の簡単な説明】
【0011】
【図1】図1は、糖受容体としてのグルコースと糖供与体としてのβ−グルコース1−リン酸から合成された生成物の1H−NMR解析の結果を示す。Bは、コージビオースのNMRスペクトル、Cは、ニゲロースのNMRスペクトルである。Dは、グルコースからの生成物のNMRスペクトルであり、Aは、Dの拡大図である。
【図2】図2は、糖受容体としてのα−メチルグルコシドと糖供与体としてのβ−グルコース1−リン酸から合成された生成物の1H−NMR解析の結果を示す。Aはメチル−3−O−α−グルコピラノシル−α−グルコシドの構造式及びNMRデータ、Bはメチル−2−O−α−グルコピラノシル−α−グルコシドの構造式及びNMRデータを示す。
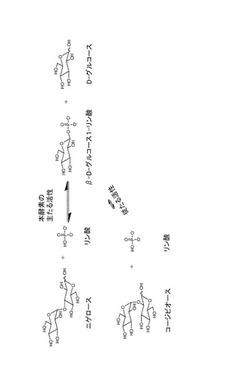
【図3】図3は、ニゲロースホスホリラーゼの可逆的反応の概略図である。
【図4】図4は、ニゲロースホスホリラーゼの温度に対する基本的特性を示す図である。Aは加リン酸分解活性(温度依存性)、Bは温度安定性を示す。
【図5】図5は、ニゲロースホスホリラーゼのpHに対する基本的特性を示す図である。Aは加リン酸分解活性(pH依存性)、Bは合成活性(pH依存性)、CはpH安定性を示す。
【発明を実施するための形態】
【0012】
以下、本発明を詳細に説明する。
1.ニゲロースホスホリラーゼ酵素
本発明者らは、森林土壌に見出された嫌気性中温性セルロース分解性細菌であるクロストリディウム・フィトファーメンタンス(Clostridium phytofermentans)から、本発明に係る新規な活性を有する新規酵素を取得した。本発明はこの知見に基づく。
【0013】
本発明に係る酵素ニゲロースホスホリラーゼは、α−グルコシル二糖(α−グルコシル結合を有する二糖;特に、α−1,3結合含有グルコシル二糖)、とりわけニゲロースを特異的かつ可逆的に加リン酸分解して、グルコースとβ−グルコース1リン酸を生成するという新規な活性を有する。本酵素は、リン酸存在下で加リン酸分解活性を示し、リン酸非存在下では加リン酸分解活性を示さない。
【0014】
本酵素は、ニゲロースに対して高度な基質特異性を示し、一方、他のα−グルコシル二糖に対しては同一反応条件(例えば、反応液中の濃度10mM)でのニゲロースに対する加リン酸分解活性と比較して、加リン酸分解活性をほとんど(例えば5%以下)示さない。具体的には、本酵素は、α−グルコシル二糖であるコージビオースに対して、同一反応条件(例えば、反応液中の濃度10mM)でのニゲロースに対する加リン酸分解活性を100%として比較した場合、5%以下、好ましくは2%以下の加リン酸分解活性しか有しない。本酵素は、α−グルコシル二糖であるマルトース及びトレハロースに対して、同一反応条件(例えば、反応液中の濃度10mM)でのニゲロースに対する加リン酸分解活性を100%として比較した場合、5%以下、好ましくは2%以下、さらに好ましくは検出限界以下(例えば、0.01%以下)の加リン酸分解活性しか有しない。本酵素はさらに、イソマルトース及びスクロースに対して、同一反応条件(例えば、反応液中の濃度10mM)でのニゲロースに対する加リン酸分解活性を100%として比較した場合、5%以下、好ましくは2%以下、さらに好ましくは検出限界以下(例えば、0.01%以下)の加リン酸分解活性しか有しない。本発明において、本発明に係る酵素の「ニゲロースに特異的な加リン酸分解活性」及び「ニゲロースを特異的に加リン酸分解する」との表現は、ニゲロースに対する加リン酸分解活性を100%として比較した場合の相対活性で、ニゲロース以外のほとんどの(好ましくは全ての)α−グルコシル二糖に対しては10%以下、好ましくは5%以下、より好ましくは2%以下の加リン酸分解活性しか、本発明に係る酵素が示さないことを意味する。
【0015】
本発明に係る酵素の加リン酸分解活性は、例えば後述の実施例2に記載の手順に従って測定することができる。例えば、25mM MOPS−NaOH緩衝液(pH7.0)中、10mM ニゲロース等の被験糖類、及び10mM リン酸緩衝液(pH7.0)、並びに実施例1で得た精製酵素を含む、反応液200μLを調製し、30℃で30分インキュベートする。反応時間後、反応液のサンプルを、等量のDMSO(ジメチルスルホキシド)に加え、酵素反応を停止させてサンプル液とする。サンプル液中の生成グルコースは、グルコースオキシダーゼ法により発色させ、505nmでの吸光度を測定して定量すればよい。この条件下で毎分1μmolのグルコースを生成する活性(加リン酸分解活性)を1ユニットと定義することができる。
【0016】
本発明に係る酵素はまた、加リン酸分解の逆反応として、糖供与体としてのβ−グルコース1−リン酸(β−D−グルコース1−リン酸)と糖受容体としてのグルコースから、ニゲロースとリン酸を生成する合成活性も併せて有する。このような合成活性を併せ持つことから、本酵素のようなホスホリラーゼの加リン酸分解反応は「可逆的」であると称される。本発明に係るニゲロースホスホリラーゼの可逆的反応は図3に示されている。
【0017】
さらに、本発明に係る酵素は、糖供与体としてのβ−グルコース1−リン酸と、糖受容体としてのグルコース以外のいくつかの単糖又はその誘導体(好ましくは、グルコース、ガラクトース、キシロース、1,5−アンヒドログルシトール、グルクロン酸、及びα−メチルグルコシド)から、α−グルコシル結合を有する二糖とリン酸を生成する合成活性も有している。
【0018】
本発明に係る酵素は、グルコースとβ−グルコース1−リン酸からニゲロースを生成するが、グルコースとα−グルコース1−リン酸からは二糖を生成せず、α−グルコース1−リン酸を糖供与体とした合成反応を触媒しない。
【0019】
本発明に係る酵素のそのような合成活性もまた、例えば後述の実施例2に記載の手順に従って測定することができる。例えば、25mM MOPS−NaOH緩衝液(pH7.0)中、10mM β−グルコース1−リン酸、及び10mM 糖受容体候補単糖、並びに本発明の酵素を含む、反応液200μLを調製し、30℃で30分インキュベートする。反応時間後、反応液のサンプルを、0.2M 酢酸ナトリウム緩衝液(pH4.0)に加え、酵素反応を停止させてサンプル液とする。25mM 硫酸塩を含有する1% モリブデン酸アンモニウム12.5μLと0.05%硫酸水素カリウムを含有する1%アスコルビン酸12.5μLを、上記サンプル液と混合した。混合液を37℃で1時間インキュベートした後、700nmでの吸光度を測定すればよい。この条件下で毎分1μmolの無機リン酸を生成する活性(合成活性)を1ユニットと定義することができる。
【0020】
本発明に係る酵素は、糖供与体としてβ−グルコース1−リン酸を用いる合成反応において、糖受容体として単糖を用いて二糖を特異的に生成する。その合成反応において、本酵素は、糖受容体として二糖を利用して三糖を合成しないことが好ましい。
【0021】
本発明に係る酵素は、限定するものではないが、クロストリディウム属(Clostridium)細菌由来のものが好ましく、クロストリディウム・フィトファーメンタンス由来のものがさらに好ましい。
【0022】
本発明に係る酵素は、30℃の条件下での至適pHが6.5〜7.5、好ましくは6.5〜7.0、例えば7.0付近である。また、本酵素は、pH5.5〜9.0で安定である。
【0023】
本酵素はまた、pH7.0の条件下での至適温度が40℃であり、少なくとも40℃以下、例えば15℃〜40℃の範囲で安定である。
【0024】
本発明に係る酵素は、好ましくは、2個のサブユニットタンパク質(単量体)から構成される二量体の形態である。本発明に係る酵素は、通常はホモ二量体である。ここで「ホモ二量体」とは、同じサブユニットタンパク質2個から構成される二量体を意味する。
【0025】
本発明に係る酵素の分子量は、限定するものではないが、典型例では、二量体の形態で、ゲルろ過法での分子量測定値が200kDaである。また本酵素の単量体の分子量は、例えばSDS−PAGEでの測定値で90kDaである。なお二量体と単量体の分子量が若干不整合であるのは測定法が異なることに起因しており実験誤差の範囲である。
【0026】
本発明に係る酵素は、典型的には、配列番号2で表されるアミノ酸配列からなるタンパク質から構成されるものでありうる。さらに本発明に係る酵素は、そのタンパク質が(典型的には二量体形態で)ニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有する限り、配列番号2で表されるアミノ酸配列において1〜数個(1〜10個、好ましくは1〜5個、例えば1〜3個)のアミノ酸が欠失、置換又は付加されたアミノ酸配列からなるタンパク質から構成されるものであってもよい。例えば、本発明に係る酵素は、必要に応じて分泌シグナルペプチドや精製用のヒスチジンタグ、標識ペプチド等を含んでもよい。なお本明細書全体において、本発明の酵素タンパク質が、シグナルペプチドや標識ペプチド等を含む場合、それを除去すればニゲロースに対して特異的かつ可逆的に加リン酸分解活性を発揮する場合も、当該タンパク質が「ニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有する」範囲に含まれるものとするが、これは当業者には当然認識されることである。
【0027】
2.ニゲロースホスホリラーゼの調製
本発明に係る酵素ニゲロースホスホリラーゼは、クロストリディウム属(Clostridium)細菌、好ましくはクロストリディウム・フィトファーメンタンスを培養して得られる培養物から、常法に従って回収することができる。
【0028】
本発明に係る酵素ニゲロースホスホリラーゼはまた、そのタンパク質をコードするニゲロースホスホリラーゼ遺伝子を用いて、遺伝子工学に基づく組換え法により常法に従って生産することができる。本発明は、ニゲロースホスホリラーゼ遺伝子も提供する。
【0029】
本発明に係る酵素タンパク質をコードするニゲロースホスホリラーゼ遺伝子は、配列番号2で表されるアミノ酸配列をコードするDNAからなるものであり得る。あるいはこのニゲロースホスホリラーゼ遺伝子は、配列番号2で表されるアミノ酸配列をコードするDNAの誘導体、例えば、配列番号2で表されるアミノ酸配列において1〜数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有するタンパク質をコードするDNAからなるものであってもよい。
【0030】
あるいは本発明に係る酵素タンパク質をコードするニゲロースホスホリラーゼ遺伝子は、配列番号1で表される塩基配列からなるDNAからなるものであってもよい。あるいはその遺伝子は、配列番号1で表される塩基配列に相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有するタンパク質をコードするDNAからなるものであってもよい。ここでストリンジェントな条件とは、塩基配列相同性が高い核酸同士、例えば80%以上、好ましくは90%以上、さらに好ましくは95%以上の配列相同性を有するDNA同士が、いわゆる特異的な核酸ハイブリッドを形成するが、それより相同性が低い核酸同士はハイブリダイズしない条件を指し、その具体的な例としては、ナトリウム塩濃度が好ましくは50〜750mM、より好ましくは300〜750mM、反応温度が好ましくは50℃〜70℃、より好ましくは55〜65℃、ホルムアミド濃度が好ましくは20〜50%、より好ましくは35〜45%でハイブリダイゼーション反応を行う条件を言う。さらにハイブリダイゼーション後のフィルターの洗浄条件が、ナトリウム塩濃度が好ましくは50〜600mM、より好ましくは300〜600mM、温度が好ましくは55〜70℃、より好ましくは60〜65℃での条件である場合も、本発明における「ストリンジェントな条件」に含めることができる。
【0031】
本発明においてDNAは少なくともゲノムDNA、cDNA、修飾塩基を一部に含むDNA等を包含する。本発明において「遺伝子」は、開始コドン及び終止コドンを含まない塩基配列を有する核酸断片であってもよいが、開始コドン及び終止コドンを含むことが好ましい。本発明の「遺伝子」は、非翻訳領域(UTR)の配列などを含んでもよい。
【0032】
本発明に係るニゲロースホスホリラーゼ遺伝子は、クロストリディウム・フィトファーメンタンスから単離して用いてもよいが、他のクロストリディウム属細菌から単離してもよい。本発明に係るニゲロースホスホリラーゼ遺伝子は、複数部位に分けて化学合成したDNA断片をPCR法等で連結することにより作製することもできる。
【0033】
また本発明に係るニゲロースホスホリラーゼ遺伝子は、配列番号1で表される塩基配列を含むDNAに、部位特異的突然変異誘発法等の変異導入法を用いて塩基の欠失、置換、又は付加等の改変を導入することにより作製してもよい。遺伝子に変異を導入するには、Kunkel法、Gapped duplex法等の公知の手法又はこれに準ずる方法を採用することができる。これらの変異導入は、例えば市販の部位特異的突然変異誘発キット(例えばMutan(R)-K、Mutan(R)-Super Express Km、PrimeSTAR(R) Mutagenesis Basal Kit(いずれもTAKARA BIO INC.社製))などを用いて当業者であれば容易に行うことができる。
【0034】
なお、得られたニゲロースホスホリラーゼ遺伝子のDNA配列については、塩基配列決定によりその配列を確認することが好ましい。塩基配列決定はマキサム-ギルバートの化学修飾法、ジデオキシヌクレオチド鎖終結法等の公知手法により行うことができるが、通常は自動塩基配列決定装置(例えばABI社製DNAシークエンサー)を用いて行えばよい。
【0035】
得られたニゲロースホスホリラーゼ遺伝子は、ベクター中にクローニングして組換えベクターを作製することが好ましい。本発明の組換えベクターは、適当なベクターに本発明の遺伝子を連結することにより得ることができる。本発明のベクターは、宿主細胞中で当該遺伝子からニゲロースホスホリラーゼタンパク質を発現させるため、発現ベクターであることがさらに好ましい。ベクターは、宿主中で複製可能なものであれば特に限定されず、例えば、プラスミドDNA、ファージDNA等が挙げられる。例えばプラスミドDNAとしては、大腸菌由来のプラスミド(例えばpET−24a、pET22b(+)、pBR322、pBR325、pUC118、pUC119、pUC18、pUC19、pBluescript、pET100/D−TOPO等)などが挙げられ、ファージDNAとしてはλファージ(Charon4A、Charon21A、EMBL3、EMBL4、λgt10、λgt11、λZAP、λZAPII等)などが挙げられる。発現ベクターには、プロモーター、ターミネーター、リボソーム結合部位などの宿主生物における発現に必要な各種エレメントが含まれることが好ましい。発現ベクターには、プロモーター、ターミネーター、リボソーム結合部位などの宿主生物における発現に必要な各種エレメントが含まれることが好ましい。プロモーターは、その発現ベクターを導入すべき宿主細胞中でその制御下の遺伝子の発現を誘導できる任意のものであってよい。例えば細菌中で発現させるのであれば、T7プロモーター、trcプロモーター、tacプロモーター、lacプロモーター等が使用できる。発現ベクターには、選択マーカー遺伝子、レポーター遺伝子や、ポリリンカー、エンハンサーなどのシスエレメント、スプライシングシグナル、ポリA付加シグナル、精製用のヒスチジンタグ配列等の有用な配列が必要に応じて含まれていてもよい。選択マーカーとしては、例えばジヒドロ葉酸還元酵素遺伝子、アンピシリン耐性遺伝子、ネオマイシン耐性遺伝子、クロラムフェニコール耐性遺伝子(CAT遺伝子)等が挙げられる。
【0036】
本発明に係るニゲロースホスホリラーゼ遺伝子を宿主細胞に導入することにより形質転換体を作製することができる。具体的には、本発明に係るニゲロースホスホリラーゼ遺伝子を含む組換えベクター(好ましくは発現ベクター)を宿主細胞に導入することにより宿主細胞を形質転換することができる。
【0037】
宿主細胞は、原核細胞であっても真核細胞であってもよい。より具体的には、宿主細胞には、大腸菌や枯草菌等の細菌、酵母細胞、昆虫細胞、動物細胞(例えば、哺乳動物細胞)、植物細胞等の任意の細胞(好ましくは培養細胞)が含まれる。本発明においては、例えば本発明のニゲロースホスホリラーゼを生産する目的では、大腸菌(E.coli)やバチルス・スブチルス(Bacillus subtillis)、特に大腸菌(例えば、DH5α株、Rosetta(DE3)LysS株など)を宿主細胞として好適に使用することができる。
【0038】
宿主細胞の形質転換には、一般的に行われている遺伝子導入法、例えば、リン酸カルシウム法、エレクトロポレーション法、リポフェクション法、パーテイクルガン法、ポリエチレングリコール(PEG)法、アグロバクテリウム法、プロトプラスト融合法等を用いればよい。形質転換体の選択は、常法に従って行うことができるが、通常は使用したベクターに組み込まれた選択マーカー遺伝子の機能を利用して行うことができる。
【0039】
得られた形質転換体を常法により培養し、遺伝子発現を誘導することにより、ニゲロースホスホリラーゼを製造することができる。形質転換細胞の培養は、宿主生物の培養に用いられる通常の方法に従って行えばよい。例えば、大腸菌や酵母細胞等の微生物を宿主細胞として得られた形質転換細胞は、宿主微生物が資化し得る炭素源、窒素源、無機塩類等を含有する培地中に接種して培養すればよい。培地は、形質転換細胞の培養を効率的に行える培地であれば、天然培地、合成培地のいずれを用いてもよい。培地には、必要に応じてアンピシリンやテトラサイクリン等の抗生物質を添加してもよい。
【0040】
誘導性プロモーターを含む発現ベクターで形質転換した宿主細胞を培養する場合は、必要に応じてインデューサーを培地に添加してもよい。例えば、Lacプロモーターを用いた発現ベクターで形質転換した宿主細胞を培養するときにはイソプロピル−1−チオ−β−D−ガラクトシド(IPTG)等を、trpプロモーターを用いた発現ベクターで形質転換した宿主細胞を培養するときにはインドールアクリル酸(IAA)等を培地に添加することができる。培養条件は特に限定されないが、好ましくは形質転換に用いる宿主細胞に適した条件下で行われる。
【0041】
ニゲロースホスホリラーゼを取得するため、形質転換細胞の培養後、例えば、宿主細胞の菌体を破砕し、固液分離して得た上清を採取することが好ましい。固液分離した上清中の組換えタンパク質を常法により精製することにより、ニゲロースホスホリラーゼを単離精製することができる。
【0042】
あるいは、無細胞タンパク質翻訳合成系を使用して、ニゲロースホスホリラーゼ遺伝子を含む発現ベクターから、ニゲロースホスホリラーゼを生成させることもできる。
【0043】
3.本発明に係るニゲロースホスホリラーゼを用いた糖類製造
本発明では、上記のとおり作製したニゲロースホスホリラーゼを、糖類の分解や製造に用いることができる。
【0044】
本発明に係る酵素ニゲロースホスホリラーゼは、ニゲロースに特異的な加リン酸分解活性を示す(図3)。
【0045】
この加リン酸分解活性を利用して、本発明では、ニゲロースを特異的に分解し、β−グルコース1−リン酸とグルコースを等モルずつ生成することができる。具体的には、本発明に係るニゲロースホスホリラーゼを、適切な水性媒体(水又は緩衝液など)中、リン酸存在下でニゲロースと共にインキュベートして反応させることで、ニゲロースを分解することができ、その結果、グルコース及びβ−グルコース1リン酸を生成させることができる。本発明は、このようなニゲロースの分解方法も提供する。
【0046】
本発明に係るニゲロースホスホリラーゼは、限定するものではないが、基質となるニゲロース1モルに対して100〜100,000ユニット、好適には1,000〜50,000ユニットの量で反応系に含めることが好ましい。
【0047】
本発明に係るニゲロースホスホリラーゼは、反応系(反応液)中に分散していてもよいし、固相担体等に固定化されていてもよい。
【0048】
反応系に加えるリン酸は、無機リン酸が好ましい。リン酸は、好適な実施形態では、リン酸塩を用いて調製されるリン酸緩衝液の形態で反応系に加えることができる。リン酸塩は、限定するものではないが、例えばリン酸三ナトリウム、リン酸三カリウム、リン酸二水素ナトリウム、リン酸二水素カリウム、リン酸水素カリウム、リン酸水素ナトリウム等が挙げられる。限定するものではないが、ニゲロース1モルに対して0.1〜10モル、好ましくは0.5〜1.5モルとなる量でリン酸が反応系に含まれるようにするのが適当である。
【0049】
反応系のpH条件は、限定するものではないが、通常は5.5〜9.0、好ましくは6.5〜7.5、特に7.0が好適である。反応系の温度条件は、限定するものではないが、40℃以下、例えば15〜40℃、例えば20℃〜40℃、より好ましくは30℃が好適である。
【0050】
反応時間は、限定するものではないが、例えば30℃で1分〜10日間、好ましくは10分〜5日間、例えば20分〜1時間が好適である。
【0051】
加リン酸分解反応が十分に進行した後、反応液の加熱、酸性溶液や有機溶媒の添加等により酵素反応を停止させることができる。加リン酸分解反応の反応後組成物中には、ニゲロースの分解により生成したグルコースとβ−グルコース1−リン酸が含まれる。
【0052】
また本発明では、本発明に係るニゲロースホスホリラーゼを、適切な水性媒体(水又は緩衝液など)中で、糖供与体として機能するβ−グルコース1リン酸、及び糖受容体として機能する単糖又はその誘導体(以下、「単糖等」とも呼ぶ)とインキュベートして反応させ、β−グルコース1リン酸と単糖等との間でα−グルコシル結合(α−グルコシド結合とも呼ばれる)を生成することにより、α−グルコシル結合を有する二糖を効率よく製造することができる。ここでα−グルコシル結合を有する二糖とは、1分子のグルコースに1分子の単糖又はその誘導体がα−グルコシル結合(例えばα−1,3グルコシル結合、α−1,2グルコシル結合)したものをいい、α−グルコシル二糖とも呼ばれる。本発明は、このようなα−グルコシル結合を有する二糖の製造方法も提供する。本方法は、ニゲロースホスホリラーゼの加リン酸分解の逆反応である合成反応に基づく。
【0053】
本方法において、糖受容体として使用し得る単糖の誘導体としては、限定するものではないが、例えば糖アルコール(アルジトールなど)、糖エステル、アルドン酸、ウロン酸、アルダル酸等が挙げられる。糖受容体として使用するのに好適な単糖等の具体例としては、グルコース、ガラクトース、キシロース、1,5−アンヒドログルシトール、グルクロン酸、及びα−メチルグルコシド等が挙げられる。本方法において、グルコースは糖受容体として特に好適に使用できる。
【0054】
本方法において、糖受容体としての単糖等は、限定するものではないが、糖供与体となるβ−グルコース1リン酸1モルに対して1〜10モル、好適には1〜2モルの量で反応系に含めることが好ましい。
【0055】
本発明に係るニゲロースホスホリラーゼは、限定するものではないが、基質となるβ−グルコース1リン酸1モルに対して0.1〜50ユニット、好適には1〜10ユニットの量で反応系に含めることが好ましい。
【0056】
本発明に係るニゲロースホスホリラーゼは、反応系(反応液)中に分散していてもよいし、固相担体等に固定化されていてもよい。
【0057】
反応系のpH条件は、限定するものではないが、通常は5.5〜9.0、好ましくは6.5〜7.5、特に7.0が好適である。反応系の温度条件は、限定するものではないが、40℃以下、例えば15〜40℃、例えば20℃〜40℃、より好ましくは30℃が好適である。
【0058】
反応時間は、限定するものではないが、例えば30℃で1分〜10日間、好ましくは10分〜5日間、例えば10時間〜40時間が好適である。
【0059】
反応時間及び使用酵素量は、限定するものではないが、酵素反応が平衡状態に達するまで増加させることが好ましい。
【0060】
反応後、反応液の加熱、酸性溶液や有機溶媒の添加等により酵素反応を停止させることができる。本酵素による合成反応の反応後組成物中には、グルコース等の単糖とβ−グルコース1−リン酸から合成された二糖が含まれる。
【0061】
例えば、等モルずつの単糖とβ−グルコース1−リン酸を基質とした合成反応の場合、反応液について平衡状態になるまで酵素反応(合成反応)を進めると、反応後組成物中には、出発物質として含めた単糖又はβ−グルコース1−リン酸のおよそ60%がα−グルコシル結合を有する二糖に変換されて含まれることになる。すなわち平衡状態では基質のα−グルコシル結合を有する二糖への転換率はおよそ60%である。ここで生成されるα−グルコシル結合を有する二糖は、主としてα−1,3グルコシル結合を有する二糖であることが好ましいが、副次的にα−1,2グルコシル結合を有する二糖が生成されてもよい。
【0062】
この本発明に係る方法の好ましい一実施形態では、本発明に係るニゲロースホスホリラーゼを、適切な水性媒体(水又は緩衝液など)中で、糖供与体として機能するβ−グルコース1リン酸、及び糖受容体として機能するグルコースとインキュベートして反応させてα−1,3グルコシル結合を生成することにより、ニゲロースを効率よく製造することができる。この場合の反応条件等は上記と同様である。
【0063】
さらに、ニゲロースの製造は、本発明に係るニゲロースホスホリラーゼの反応系と、他のホスホリラーゼ反応系とを組み合わせることによって行うこともできる。すなわち本発明の方法では、ニゲロース以外の二糖を基質とするホスホリラーゼの加リン酸分解反応によりβ−グルコース1リン酸を生成して、それを、本発明に係るニゲロースホスホリラーゼが触媒する二糖合成反応に用いることにより、ニゲロースを製造することができる。本発明は、そのような2つ以上のホスホリラーゼ反応系を組み合わせたニゲロースの製造法も提供する。
【0064】
例えば文献Murao S., Nagano, H., Ogura, S., and Nishio T., (1985), Agric. Biol. Chem., 49, p. 2113-2118や特公昭63−60998には、マルトースホスホリラーゼとトレハロースホスホリラーゼを組み合わせて用いる、マルトースを原料としたトレハロースの製造方法が記載されている。この方法では2種類のホスホリラーゼ(マルトースホスホリラーゼ及びトレハロースホスホリラーゼ)をマルトースと反応させることにより、マルトースが加リン酸分解されて生成されるグルコースとβ−グルコース−1−リン酸からトレハロースが合成される。この方法により、より安価な原料(マルトース)からトレハロースを製造することができる。
【0065】
そこでこの方法と同様にして、リン酸の存在下でβ−グルコース1リン酸を生成する別の1種以上のホスホリラーゼ及びその基質とニゲロースホスホリラーゼ反応系を組み合わせることにより、ニゲロースを製造することが可能である。具体的には、そのような別のホスホリラーゼとその基質を含む水性媒体に、本発明に係るニゲロースホスホリラーゼを加えて反応させることにより、ニゲロースを合成できる。本発明の方法で使用する、リン酸の存在下でβ−グルコース1リン酸を生成する別のホスホリラーゼとしては、例えば、マルトースホスホリラーゼ(基質:マルトース)、トレハロースホスホリラーゼ(基質:トレハロース)、スクロースホスホリラーゼ(基質:スクロース)等が挙げられ、公知のものを使用することができる。このような別のホスホリラーゼとしては、本発明に係る酵素ニゲロースホスホリラーゼのpH条件及び温度条件に適合するものが好ましい。例えばそのようなホスホリラーゼは、30℃の条件下で至適pHが6.5〜7.5、例えば7.0付近であり、pH5.5〜9.0で安定であり、またpH7.0の条件下での至適温度が30℃〜50℃、例えば40℃であり、少なくとも40℃以下、例えば15℃〜40℃の範囲で安定であることが好ましい。
【0066】
本発明に係るニゲロースホスホリラーゼを含む2種以上のホスホリラーゼを用いた上記反応系のpH条件は、限定するものではないが、通常は5.5〜9.0、好ましくは6.5〜7.5、特に7.0が好適である。反応系の温度条件は、限定するものではないが、40℃以下、例えば15〜40℃、例えば20℃〜40℃、より好ましくは30℃が好適である。反応時間は、特に限定するものではなく、15分〜30時間であってよいが、例えば15〜25時間であることも好ましい。
【0067】
この2種以上のホスホリラーゼを用いて得られる反応後組成物中には、ホスホリラーゼ、残存量の基質(単糖等及びβ−グルコース1リン酸)に加えて、生成されたニゲロースが含まれる。
【0068】
ニゲロースを含む反応後組成物は、ニゲロース含有組成物としてそのまま使用してもよいし、そこからニゲロースを分離して使用してもよい。
【0069】
なお本発明において用いるmRNAの調製、cDNAの作製(RT−PCR)、PCR、ライブラリーの作製、ベクター中へのライゲーション、細胞の形質転換、DNA塩基配列決定、プライマーの合成、突然変異誘発、タンパク質の抽出・精製などの分子生物学的・生化学的実験操作は、基本的には通常の実験書の記載に従って行うことができる。そのような実験書としては、例えば、SambrookらのMolecular Cloning, A laboratory manual, 2001, Eds., Sambrook, J. & Russell, DW. Cold Spring Harbor Laboratory Pressを挙げることができる。
【実施例】
【0070】
次に、本発明を実施例により詳しく説明するが、本発明はこれらにより限定されるものではない。
【0071】
(実施例1)
クロストリディウム・フィトファーメンタンス(Clostridium phytofermentans)ISDgTゲノムデータベースに登録されている機能未同定遺伝子CPH1874の配列情報(配列表の配列番号1)に基づき、CPH1874遺伝子のオープンリーディングフレーム(ORF)の5’末端及び3’末端に、フォワードプライマー(5'-gatatacatatgaattggacattaacaaat-3';配列番号3;NdeI部位を含む)及びリバースプライマー(5'-ggtgctcgagcatttcaattttactaatag-3';配列番号4;XhoI部位を含む)をそれぞれ設計した。インスタジーン(バイオラッド社製)を用いて調製したクロストリディウム・フィトファーメンタンスISDg株(アメリカン・タイプ・カルチャー・コレクション(ATCC)(登録商標)からATCC番号700394にて入手可能)のゲノムDNAを鋳型として、このプライマー対を用い、ORF全長をポリメラーゼ連鎖反応(PCR反応)により増幅した。得られた増幅産物を電気泳動したところ、予測断片長2278bpと一致する明瞭なバンドが得られた。
【0072】
増幅したPCR産物を制限酵素NdeI及びXhoIで消化した後、その断片を、同様にNdeI及びXhoIで処理した市販の遺伝子発現用プラスミドpET−24a(ノバジェン社製)に、DNAライゲーションキット(宝酒造株式会社製)を用いて連結した。
【0073】
増幅産物については、自動DNAシークエンサーを用いて塩基配列を決定した。増幅産物が、配列番号1に示す塩基配列を有する目的のCPH1874遺伝子(ORF)を含むことが確認された。
【0074】
このようにしてCPH1874遺伝子をクローン化した遺伝子発現用プラスミドを用いて、Sambrook,J.,Fritsch, E. F. and Maniatis, T. "Molecular Cloning, A Laboratory Manual 第2版”1.74章 Vo1. 1 (1989)に記載された方法に従い、大腸菌(E. coli BL21 (DE3)(ノバジェン社製))を形質転換した。
【0075】
得られた形質転換体を用い、常法に従って該遺伝子の発現及び組換えタンパク質の生産を行った。具体的には、CPH1874遺伝子含有発現プラスミドをE. coli BL21(DE3)に導入した形質転換体を、33μg/mL カナマイシンを添加したルリア−ベルターニ培地(1% トリプトン、0.5% 酵母エキス、1% NaCl;LB培地)中、37℃で、660nmでの吸光度が0.6になるまで増殖させた。遺伝子発現は、0.1mM イソプロピル−β−D−チオガラクトピラノシド(IPTG)の添加により誘導し、25℃で6時間培養を続けた。4000 x gで5分間の遠心分離により培養物中の湿潤細胞を回収し、それを、500mM NaClを含む50mM 3−(N−モルホリノ)プロパンスルホン酸(MOPS)−NaOH緩衝液(pH7.5)(バッファーA)中に懸濁した。細胞懸濁物を超音波処理し、さらに10,000 x gで20分間、遠心分離した。こうして得られた上清から、組換えタンパク質をNi−NTAアガロース(キアゲン社製)を用いたカラムクロマトグラフィーにより精製し、精製酵素標品を得た。
【0076】
(実施例2)
実施例1で得られた精製酵素標品を用い、以下に示す方法によって酵素活性を調べた。
【0077】
なお本願の実施例で用いた、トレハロース(別名:α−D−グルコピラノシル−α−D−グルコピラノシド)、コージビオース(別名:2−O−α−D−グルコピラノシル−D−グルコース)、ニゲロース(別名:3−O−α−D−グルコピラノシル−D−グルコース)、マルトース(別名:4−O−α−D−グルコピラノシル−D−グルコース)一水和物、イソマルトース(別名:6−O−α−D−グルコピラノシル−D−グルコース)、及び1,5−アンヒドロ−D−グルシトールは、Wako Pure Chemicals (Osaka, Japan)から購入して用いた。なお本願実施例で用いた糖は、特に記載しない限りD体である。またMOPSは、3−(N−モルホリノ)プロパンスルホン酸の略語である。
【0078】
25mM MOPS−NaOH緩衝液(pH7.0)中、10mM α−グルコシル二糖(トレハロース、コージビオース、ニゲロース、マルトース、イソマルトース又はスクロース)、及び10mM リン酸緩衝液(pH7.0)、並びに実施例1で得た精製酵素22μg/mLを含む、反応液200μLを調製し、30℃で30分インキュベートした。反応時間後、反応液25μLを、25μLのDMSO(ジメチルスルホキシド)に加え、酵素反応を停止させてサンプル液とした。サンプル液中で酵素反応により生成されたグルコース(より明確には、D−グルコース)を、グルコースオキシダーゼ法(グルコースC−IIテストワコー、和光純薬株式会社製)により定量した。具体的には、100μLのグルコースC−IIテストワコー液(但しリン酸緩衝液を200mM MOPS−NaOH緩衝液(pH7.0)に変更)をサンプル液に加えてインキュベートした後、505nmでの吸光度を測定した。上記条件下に毎分1μmolのグルコースを生成する酵素活性(分解活性)を1ユニットと定義した。
【0079】
その結果、本酵素はニゲロースに対する分解活性が32ユニット/mgであった。また、コージビオースをわずかに(0.5ユニット/mg)分解する活性を示したが、他の二糖に対する分解活性は示さなかった。また、リン酸の非存在下ではニゲロースを分解しなかった。この結果から、本酵素がニゲロース特異的に高い加リン酸分解活性を有することが示された。
【0080】
本酵素は、トレハロース、マルトース及びトレハロース6−リン酸のような、典型的なグリコシドヒドロラーゼファミリー(GH)65酵素の基質に対して加リン酸分解活性を示さず、これまで報告のないニゲロースに対して強い加リン酸分解活性を示すことから、従来の他のGH65酵素とは全く異なる活性を有する酵素であることが判明した。
【0081】
次いで本酵素について、β−グルコース1−リン酸(β−G1P)を糖供与体とし、各種糖を糖受容体(基質)候補とした合成活性を、反応液中のリン酸の増加をLowry−Lopezの方法(Lowry O.H. and Lopez J.A., (1946) J. Biol. Chem., 162, p. 421-428)により測定することにより決定した。25mM MOPS−NaOH緩衝液(pH7.0)中、10mM β−グルコース1−リン酸、及び10mM 糖受容体候補糖、並びに実施例1で得た精製酵素22μg/mLを含む、反応液200μLを調製し、30℃で30分インキュベートした。反応時間後、反応液25μLを、100μLの0.2M 酢酸ナトリウム緩衝液(pH4.0)に加え、酵素反応を停止させてサンプル液とした。25mM 硫酸塩を含有する1% モリブデン酸アンモニウム12.5μLと0.05%硫酸水素カリウムを含有する1%アスコルビン酸12.5μLを、上記サンプル液と混合した。混合液を37℃で1時間インキュベートした後、700nmでの吸光度を測定した。上記条件下に毎分1μmolの無機リン酸を生成する酵素活性(合成活性)を1ユニットと定義した。
【0082】
その結果、本酵素が、糖供与体としてのβ−グルコース1−リン酸の存在下で、グルコース、ガラクトース、キシロース、1,5−アンヒドログルシトール、グルクロン酸、又はα−メチルグルコシドを糖受容体として利用できることが示された。測定された合成活性を表1に示す。
【0083】
【表1】

【0084】
本酵素は表1に示す基質のいずれからも、対応する二糖を生成した。
【0085】
一方、本酵素は、マンノース、アロース、L−アラビノース、リキソース、L−フコース、L−ラムノース、フルクトース、2−デオキシ−グルコース、グルカル、グルコサミン、α−グルコース1−リン酸、β−グルコース1−リン酸、グルコース6−リン酸、メチルβ−グルコース、3−メチル−グルコース、N−アセチル−グルコサミン、N−アセチル−ガラクトサミン、トレハロース、コージビオース、ニゲロース、マルトース、イソマルトース、ソホロース、ラミナリビオース、セロビース、ゲンチオビオース、キシロビオース、ラクトース及びスクロースを糖受容体とした活性は示さなかった。
【0086】
このように本酵素は、表1に示すように、グルコースの誘導体のうち、2,3位に変異が入っておらず1位に大きな置換基が入っていない単糖又はその誘導体を基質として合成活性を生じた。本酵素は、二糖を合成反応における糖受容体として利用してさらに三糖を合成する活性は示さなかった。このことは、本酵素が、加リン酸分解反応の逆反応では二糖を特異的に合成することを示している。
【0087】
なお本酵素は、同様の実験で、グルコースとα−グルコース1−リン酸からは二糖を合成しなかった。
【0088】
したがって本酵素が、糖供与体としてのβ−グルコース1−リン酸と糖受容体としての所定の単糖又はその誘導体から二糖を合成する活性を有することが示された。この合成反応は、加リン酸分解反応の逆反応に当たる。
【0089】
これらの結果から、実施例1で得られた本酵素が、ニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1−リン酸を生成する新規活性を有することが示された。そこで本酵素をニゲロースホスホリラーゼと命名した。
【0090】
(実施例3)
次に、β−グルコース1−リン酸を糖供与体とした本酵素の合成活性により得られる生成物の解析を行った。100mM MOPS−NaOH緩衝液(pH7.0)中、50mM β−グルコース1−リン酸、及び50mM 糖受容体(グルコース、キシロース、1,5−アンヒドログルシトール、ガラクトース、又はα−メチルグルコシド)に、実施例1で得た、ニゲロースに対する特異的かつ可逆的な加リン酸分解活性を有する精製酵素(各糖受容体に対して、それぞれ、22μg/mL、44μg/mL、44μg/mL、44μg/mL、350μg/mLの濃度)を含む、反応液500μLを、30℃で20時間インキュベートした。次いでこの反応液を、アンバーライトMB−3(オルガノ社製)を用いて脱塩した後、蒸留水で平衡化したトヨパールHW−40Fカラム(径2.6cm、長さ32cm;トーソー社製)上で、流速0.5mL/分の、水を溶媒としたゲル濾過クロマトグラフィーにより分離することにより、二糖画分を単離した。生成物を含有する画分を回収し、アンバーライトMB−3を用いて再度脱塩した後、凍結乾燥した。こうして得られた生成物の収量は、表2のとおりであった。
【0091】
【表2】

【0092】
さらに、それぞれの生成物をNMRにより分析した。各生成物の、1D(1H及び13C)及び2D[二重量子相関分光解析(DQF−COSY)、異核種単一量子コヒーレンス(HSQC)、及び異核種多重結合相関(HMBC)]核磁気共鳴(NMR)スペクトルは、Bruker Avance 800又はAvance 500スペクトロメーター(Bruker Biospin社製)を使用し、内部標準として2−メチル−2−プロパノールを用いて、D2O中で取得した。プロトンシグナルはDQF−COSYスペクトルに基づいて割り当てた。13Cシグナルには、プロトンシグナルの割り当てに基づいて、HSQCスペクトルを割り当てた。それぞれの二糖の結合位置は、各HMBCスペクトル中の環内クロスピークを検出することによって決定した。
【0093】
NMR解析の結果、糖受容体としてグルコース、1,5−アンヒドログルシトール、及びガラクトースを用いて得られた生成物は、それぞれ、ニゲロース、3−O−α−グルコピラノシル−1,5−アンヒドログルシトール、及び3−O−α−グルコピラノシル−ガラクトースであることが判明した。このことは、グルコース1−リン酸を糖供与体とした本酵素の合成反応において、α−1,3−グルコシル結合が形成されることを示す。
【0094】
例として、グルコースを糖受容体とした場合の生成物のNMR解析の結果を図1に示す。なお、グルコースを糖受容体として得られた生成物の1H−NMRスペクトル(図1のA及びD)には、ごくわずかな量のコージビオース(1.6%)(図1のB)が検出された。
【0095】
また糖受容体としてキシロースを用いて得られた生成物は、3−O−α−グルコピラノシル−キシロース及び2−O−α−グルコピラノシル−キシロースを63:37の重量比で含有していた。同様に、α−メチルグルコシドを糖受容体として得られた生成物は、メチル−3−O−α−グルコピラノシル−α−グルコシド及びメチル−2−O−α−グルコピラノシル−α−グルコシドを71:29の重量比で含有していた。例として、メチル−α−D−グルコシドを糖受容体とした場合の生成物のNMR解析の結果を図2に示す。
【0096】
このように、本酵素によるβ−グルコース1−リン酸と単糖等からのα−グルコシル二糖の合成反応においては、α−1,3−グルコシル結合を有する二糖が主たる生成物であり、α−1,2−グルコシル結合を有する二糖は従たる(マイナーな)生成物であった。
実施例2〜4により示された、本酵素が触媒する可逆的反応を図3に示す。
【0097】
(実施例4)
本酵素のニゲロース加リン酸分解活性に対する温度の影響を、標準的反応条件で調べた。様々な反応温度で10分間インキュベートした点以外は、実施例2に示す手順に従って反応を実施した。なお温度安定性は、各種温度で酵素(175μg/mL)を10分間インキュベーションした後の残存活性(加リン酸分解活性)として定義した。
【0098】
測定の結果、本酵素ニゲロースホスホリラーゼはpH7.0において、至適温度は40℃であり(図4A)、15℃から40℃まで安定であった(図4B)。
【0099】
また、本酵素のニゲロース加リン酸分解活性及びニゲロース合成活性に対するpHの影響を、標準的反応条件で調べた。
【0100】
まず25mM MOPS−NaOH緩衝液(pH7.0)を、各種pHの100mM 緩衝液(クエン酸ナトリウム(pH3.0−5.5)、4−モルホリン−エタンスルホン酸−NaOH(pH5.5−7.0)、4−(2−ヒドロキシエチル)−1−ピペラジンエタンスルホン酸−NaOH(pH7.0−8.5)、グリシン−NaOH(pH8.5−10.5))に変更する点以外は、実施例2と同様の手順に従って、無機リン酸存在下でのニゲロースに対する加リン酸分解活性と、グルコースとβ−グルコース1−リン酸からのニゲロース合成活性とを測定した。なおpH安定性は、各種pHで30℃にて30分間、酵素(175μg/mL)をインキュベートした後の残存活性(加リン酸分解活性)として定義した。
【0101】
本酵素の30℃における至適pHは、加リン酸分解活性及び合成活性の両方についてpH7.0付近(pH6.5〜7.5)であった(図5A及び図5B)。さらに本酵素は、30℃にて30分の反応条件下で、pH5.5〜9.0の範囲で安定であった(図5C)。
【0102】
さらに実施例2及び3でニゲロース特異的かつ可逆的な加リン酸分解活性が確認された精製酵素標品について、SDS−ポリアクリルアミドゲル電気泳動(SDS−PAGE)、及びSuperose 12 HR10/30カラム(GE Healthcare UK Ltd.)を用いたゲルろ過法により、分子量測定を行った。その結果、本酵素の分子量は、変性条件下にあるSDS−PAGEでは90kDa(キロダルトン)、ゲルろ過法で200kDaと測定された。この結果から、本酵素が、SDS−PAGEによる測定値で90kDaのサブユニットタンパク質(単量体)2個から構成される二量体であること、その二量体の分子量はゲルろ過法による測定値で200kDaであることが示された。これらの測定値は、配列番号2のアミノ酸配列から計算される分子量87.2kDaとよく合致していた。
【産業上の利用可能性】
【0103】
ニゲロースは、食品用素材や医薬品用素材などへの利用が期待される有用なオリゴ糖である。本発明に係る酵素ニゲロースホスホリラーゼを用いることにより、ニゲロースを製造することが可能である。また本発明に係るニゲロースホスホリラーゼを用いれば、β−グルコース1−リン酸を高効率に製造することもできる。
【配列表フリーテキスト】
【0104】
配列番号3〜4:プライマー
【技術分野】
【0001】
本発明は、ホスホリラーゼ酵素及びその利用に関する。
【背景技術】
【0002】
ホスホリラーゼは、グリコシド結合を加リン酸分解する酵素の総称である。ホスホリラーゼは、その可逆的な加水分解反応や厳密な反応位置特異性から、特定のオリゴ糖の調製に有用であることが知られている。ホスホリラーゼの反応の可逆性を利用して、様々なオリゴ糖が対応する糖1−リン酸から逆反応を用いて合成されている(非特許文献1〜3及び特許文献1)。単独のホスホリラーゼを用いて、又は2つのホスホリラーゼを組み合わせて用いて、より安価な原料からオリゴ糖を生成することも可能になっている。
【0003】
従来クローニングされている反転型ホスホリラーゼは全て、CAZyデータベース(http://www.cazy.org)中でグリコシドヒドロラーゼ(GH)ファミリー65、94又は112に分類されている。グリコシドヒドロラーゼ(GH)ファミリー65は、α−D−グルコシル結合を加リン酸分解してβ−D−グルコース1−リン酸(β−グルコース1−リン酸;β-G1P)を生成するホスホリラーゼを含有するファミリーである。現在では、トレハロースホスホリラーゼ(EC 2.4.1.64)、コージビオースホスホリラーゼ(EC 2.4.1.230)、マルトースホスホリラーゼ(EC 2.4.1.8)及びトレハロース6−リン酸ホスホリラーゼ(EC 2.4.1.216)が、GH65酵素のメンバーとして知られている。
【0004】
しかしながら、既知のホスホリラーゼの基質特異性のバリエーションはまだ少ない。そのため、ホスホリラーゼを用いたオリゴ糖製造法を適用可能な範囲はなおも限定されている。このため新規な基質特異性を有するホスホリラーゼの取得がなおも望まれている。例えば、グルコース2分子がα−1,3結合したグルコシル二糖であるニゲロースを特異的に加リン酸分解するホスホリラーゼは、ホスホリラーゼを用いたニゲロースの製造に重要であると考えられるが、そのような酵素はこれまで報告されていない。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特公昭63−60998号公報
【非特許文献】
【0006】
【非特許文献1】Kitaoka M., and Hayashi K., (2002), Trends Glycosci. Glycotechnol., 14, p.35-50
【非特許文献2】Luley-Goedl C., and Nidetzky B., (2010) Biotechnol. J., 5, p.1324-1338
【非特許文献3】Murao S., et al., (1985), Agric. Biol. Chem., 49, p.2113-2118
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、ニゲロースに対して特異的な加リン酸分解活性を有する酵素を提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは、上記課題を解決するため鋭意検討を重ねた結果、クロストリディウム・フィトファーメンタンス(Clostridium phytofermentans)から新規な活性、すなわち、ニゲロースを高い特異性で加リン酸分解してβ−グルコース1−リン酸を生成するニゲロースホスホリラーゼ酵素を取得し、本発明を完成するに至った。
【0009】
すなわち、本発明は以下を包含する。
[1] ニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有する酵素。
本酵素は、基質濃度10mMのコージビオース、マルトース及びトレハロースに対する加リン酸分解活性が、基質濃度10mMのニゲロースに対する加リン酸分解活性と比較していずれも5%以下であることが好ましい。
本酵素はまた、
(a)30℃の条件下で至適pHが6.5〜7.5であり、pH5.5〜9.0で安定であり、
(b)pH7.0の条件下で至適温度が40℃であり、15℃〜40℃の範囲で安定であり、
(c)ゲルろ過法で測定した分子量が200kDaであり、
(d)二量体であり、
(e)クロストリディウム・フィトファーメンタンス由来である
酵素であることが好ましい。
本酵素は、以下の(a)又は(b)のタンパク質から構成されることがさらに好ましい。
(a)配列番号2で表されるアミノ酸配列からなるタンパク質、又は
(b)配列番号2で表されるアミノ酸配列において1〜数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有するタンパク質
[2] 上記[1]の酵素を、リン酸存在下でニゲロースと反応させることを含む、ニゲロースの分解方法。
[3] 上記[1]の酵素を、β−グルコース1リン酸、及び単糖若しくはその誘導体と反応させてα−グルコシル結合を生成することを含む、α−グルコシル結合を有する二糖の製造方法。
この方法において用いる単糖又はその誘導体は、グルコース、ガラクトース、キシロース、1,5−アンヒドロ−グルシトール、グルクロン酸、及びα−メチルグルコシドからなる群から選択されることが好ましい。
この方法の特に好ましい態様では、用いる単糖又はその誘導体がグルコースであり、製造されるα−グルコシル結合を有する二糖がニゲロースであってよい。
【発明の効果】
【0010】
本発明によれば、ニゲロースに対する特異的かつ可逆的な加リン酸分解活性を有する酵素ニゲロースホスホリラーゼを提供することができる。
【図面の簡単な説明】
【0011】
【図1】図1は、糖受容体としてのグルコースと糖供与体としてのβ−グルコース1−リン酸から合成された生成物の1H−NMR解析の結果を示す。Bは、コージビオースのNMRスペクトル、Cは、ニゲロースのNMRスペクトルである。Dは、グルコースからの生成物のNMRスペクトルであり、Aは、Dの拡大図である。
【図2】図2は、糖受容体としてのα−メチルグルコシドと糖供与体としてのβ−グルコース1−リン酸から合成された生成物の1H−NMR解析の結果を示す。Aはメチル−3−O−α−グルコピラノシル−α−グルコシドの構造式及びNMRデータ、Bはメチル−2−O−α−グルコピラノシル−α−グルコシドの構造式及びNMRデータを示す。
【図3】図3は、ニゲロースホスホリラーゼの可逆的反応の概略図である。
【図4】図4は、ニゲロースホスホリラーゼの温度に対する基本的特性を示す図である。Aは加リン酸分解活性(温度依存性)、Bは温度安定性を示す。
【図5】図5は、ニゲロースホスホリラーゼのpHに対する基本的特性を示す図である。Aは加リン酸分解活性(pH依存性)、Bは合成活性(pH依存性)、CはpH安定性を示す。
【発明を実施するための形態】
【0012】
以下、本発明を詳細に説明する。
1.ニゲロースホスホリラーゼ酵素
本発明者らは、森林土壌に見出された嫌気性中温性セルロース分解性細菌であるクロストリディウム・フィトファーメンタンス(Clostridium phytofermentans)から、本発明に係る新規な活性を有する新規酵素を取得した。本発明はこの知見に基づく。
【0013】
本発明に係る酵素ニゲロースホスホリラーゼは、α−グルコシル二糖(α−グルコシル結合を有する二糖;特に、α−1,3結合含有グルコシル二糖)、とりわけニゲロースを特異的かつ可逆的に加リン酸分解して、グルコースとβ−グルコース1リン酸を生成するという新規な活性を有する。本酵素は、リン酸存在下で加リン酸分解活性を示し、リン酸非存在下では加リン酸分解活性を示さない。
【0014】
本酵素は、ニゲロースに対して高度な基質特異性を示し、一方、他のα−グルコシル二糖に対しては同一反応条件(例えば、反応液中の濃度10mM)でのニゲロースに対する加リン酸分解活性と比較して、加リン酸分解活性をほとんど(例えば5%以下)示さない。具体的には、本酵素は、α−グルコシル二糖であるコージビオースに対して、同一反応条件(例えば、反応液中の濃度10mM)でのニゲロースに対する加リン酸分解活性を100%として比較した場合、5%以下、好ましくは2%以下の加リン酸分解活性しか有しない。本酵素は、α−グルコシル二糖であるマルトース及びトレハロースに対して、同一反応条件(例えば、反応液中の濃度10mM)でのニゲロースに対する加リン酸分解活性を100%として比較した場合、5%以下、好ましくは2%以下、さらに好ましくは検出限界以下(例えば、0.01%以下)の加リン酸分解活性しか有しない。本酵素はさらに、イソマルトース及びスクロースに対して、同一反応条件(例えば、反応液中の濃度10mM)でのニゲロースに対する加リン酸分解活性を100%として比較した場合、5%以下、好ましくは2%以下、さらに好ましくは検出限界以下(例えば、0.01%以下)の加リン酸分解活性しか有しない。本発明において、本発明に係る酵素の「ニゲロースに特異的な加リン酸分解活性」及び「ニゲロースを特異的に加リン酸分解する」との表現は、ニゲロースに対する加リン酸分解活性を100%として比較した場合の相対活性で、ニゲロース以外のほとんどの(好ましくは全ての)α−グルコシル二糖に対しては10%以下、好ましくは5%以下、より好ましくは2%以下の加リン酸分解活性しか、本発明に係る酵素が示さないことを意味する。
【0015】
本発明に係る酵素の加リン酸分解活性は、例えば後述の実施例2に記載の手順に従って測定することができる。例えば、25mM MOPS−NaOH緩衝液(pH7.0)中、10mM ニゲロース等の被験糖類、及び10mM リン酸緩衝液(pH7.0)、並びに実施例1で得た精製酵素を含む、反応液200μLを調製し、30℃で30分インキュベートする。反応時間後、反応液のサンプルを、等量のDMSO(ジメチルスルホキシド)に加え、酵素反応を停止させてサンプル液とする。サンプル液中の生成グルコースは、グルコースオキシダーゼ法により発色させ、505nmでの吸光度を測定して定量すればよい。この条件下で毎分1μmolのグルコースを生成する活性(加リン酸分解活性)を1ユニットと定義することができる。
【0016】
本発明に係る酵素はまた、加リン酸分解の逆反応として、糖供与体としてのβ−グルコース1−リン酸(β−D−グルコース1−リン酸)と糖受容体としてのグルコースから、ニゲロースとリン酸を生成する合成活性も併せて有する。このような合成活性を併せ持つことから、本酵素のようなホスホリラーゼの加リン酸分解反応は「可逆的」であると称される。本発明に係るニゲロースホスホリラーゼの可逆的反応は図3に示されている。
【0017】
さらに、本発明に係る酵素は、糖供与体としてのβ−グルコース1−リン酸と、糖受容体としてのグルコース以外のいくつかの単糖又はその誘導体(好ましくは、グルコース、ガラクトース、キシロース、1,5−アンヒドログルシトール、グルクロン酸、及びα−メチルグルコシド)から、α−グルコシル結合を有する二糖とリン酸を生成する合成活性も有している。
【0018】
本発明に係る酵素は、グルコースとβ−グルコース1−リン酸からニゲロースを生成するが、グルコースとα−グルコース1−リン酸からは二糖を生成せず、α−グルコース1−リン酸を糖供与体とした合成反応を触媒しない。
【0019】
本発明に係る酵素のそのような合成活性もまた、例えば後述の実施例2に記載の手順に従って測定することができる。例えば、25mM MOPS−NaOH緩衝液(pH7.0)中、10mM β−グルコース1−リン酸、及び10mM 糖受容体候補単糖、並びに本発明の酵素を含む、反応液200μLを調製し、30℃で30分インキュベートする。反応時間後、反応液のサンプルを、0.2M 酢酸ナトリウム緩衝液(pH4.0)に加え、酵素反応を停止させてサンプル液とする。25mM 硫酸塩を含有する1% モリブデン酸アンモニウム12.5μLと0.05%硫酸水素カリウムを含有する1%アスコルビン酸12.5μLを、上記サンプル液と混合した。混合液を37℃で1時間インキュベートした後、700nmでの吸光度を測定すればよい。この条件下で毎分1μmolの無機リン酸を生成する活性(合成活性)を1ユニットと定義することができる。
【0020】
本発明に係る酵素は、糖供与体としてβ−グルコース1−リン酸を用いる合成反応において、糖受容体として単糖を用いて二糖を特異的に生成する。その合成反応において、本酵素は、糖受容体として二糖を利用して三糖を合成しないことが好ましい。
【0021】
本発明に係る酵素は、限定するものではないが、クロストリディウム属(Clostridium)細菌由来のものが好ましく、クロストリディウム・フィトファーメンタンス由来のものがさらに好ましい。
【0022】
本発明に係る酵素は、30℃の条件下での至適pHが6.5〜7.5、好ましくは6.5〜7.0、例えば7.0付近である。また、本酵素は、pH5.5〜9.0で安定である。
【0023】
本酵素はまた、pH7.0の条件下での至適温度が40℃であり、少なくとも40℃以下、例えば15℃〜40℃の範囲で安定である。
【0024】
本発明に係る酵素は、好ましくは、2個のサブユニットタンパク質(単量体)から構成される二量体の形態である。本発明に係る酵素は、通常はホモ二量体である。ここで「ホモ二量体」とは、同じサブユニットタンパク質2個から構成される二量体を意味する。
【0025】
本発明に係る酵素の分子量は、限定するものではないが、典型例では、二量体の形態で、ゲルろ過法での分子量測定値が200kDaである。また本酵素の単量体の分子量は、例えばSDS−PAGEでの測定値で90kDaである。なお二量体と単量体の分子量が若干不整合であるのは測定法が異なることに起因しており実験誤差の範囲である。
【0026】
本発明に係る酵素は、典型的には、配列番号2で表されるアミノ酸配列からなるタンパク質から構成されるものでありうる。さらに本発明に係る酵素は、そのタンパク質が(典型的には二量体形態で)ニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有する限り、配列番号2で表されるアミノ酸配列において1〜数個(1〜10個、好ましくは1〜5個、例えば1〜3個)のアミノ酸が欠失、置換又は付加されたアミノ酸配列からなるタンパク質から構成されるものであってもよい。例えば、本発明に係る酵素は、必要に応じて分泌シグナルペプチドや精製用のヒスチジンタグ、標識ペプチド等を含んでもよい。なお本明細書全体において、本発明の酵素タンパク質が、シグナルペプチドや標識ペプチド等を含む場合、それを除去すればニゲロースに対して特異的かつ可逆的に加リン酸分解活性を発揮する場合も、当該タンパク質が「ニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有する」範囲に含まれるものとするが、これは当業者には当然認識されることである。
【0027】
2.ニゲロースホスホリラーゼの調製
本発明に係る酵素ニゲロースホスホリラーゼは、クロストリディウム属(Clostridium)細菌、好ましくはクロストリディウム・フィトファーメンタンスを培養して得られる培養物から、常法に従って回収することができる。
【0028】
本発明に係る酵素ニゲロースホスホリラーゼはまた、そのタンパク質をコードするニゲロースホスホリラーゼ遺伝子を用いて、遺伝子工学に基づく組換え法により常法に従って生産することができる。本発明は、ニゲロースホスホリラーゼ遺伝子も提供する。
【0029】
本発明に係る酵素タンパク質をコードするニゲロースホスホリラーゼ遺伝子は、配列番号2で表されるアミノ酸配列をコードするDNAからなるものであり得る。あるいはこのニゲロースホスホリラーゼ遺伝子は、配列番号2で表されるアミノ酸配列をコードするDNAの誘導体、例えば、配列番号2で表されるアミノ酸配列において1〜数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有するタンパク質をコードするDNAからなるものであってもよい。
【0030】
あるいは本発明に係る酵素タンパク質をコードするニゲロースホスホリラーゼ遺伝子は、配列番号1で表される塩基配列からなるDNAからなるものであってもよい。あるいはその遺伝子は、配列番号1で表される塩基配列に相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、かつニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有するタンパク質をコードするDNAからなるものであってもよい。ここでストリンジェントな条件とは、塩基配列相同性が高い核酸同士、例えば80%以上、好ましくは90%以上、さらに好ましくは95%以上の配列相同性を有するDNA同士が、いわゆる特異的な核酸ハイブリッドを形成するが、それより相同性が低い核酸同士はハイブリダイズしない条件を指し、その具体的な例としては、ナトリウム塩濃度が好ましくは50〜750mM、より好ましくは300〜750mM、反応温度が好ましくは50℃〜70℃、より好ましくは55〜65℃、ホルムアミド濃度が好ましくは20〜50%、より好ましくは35〜45%でハイブリダイゼーション反応を行う条件を言う。さらにハイブリダイゼーション後のフィルターの洗浄条件が、ナトリウム塩濃度が好ましくは50〜600mM、より好ましくは300〜600mM、温度が好ましくは55〜70℃、より好ましくは60〜65℃での条件である場合も、本発明における「ストリンジェントな条件」に含めることができる。
【0031】
本発明においてDNAは少なくともゲノムDNA、cDNA、修飾塩基を一部に含むDNA等を包含する。本発明において「遺伝子」は、開始コドン及び終止コドンを含まない塩基配列を有する核酸断片であってもよいが、開始コドン及び終止コドンを含むことが好ましい。本発明の「遺伝子」は、非翻訳領域(UTR)の配列などを含んでもよい。
【0032】
本発明に係るニゲロースホスホリラーゼ遺伝子は、クロストリディウム・フィトファーメンタンスから単離して用いてもよいが、他のクロストリディウム属細菌から単離してもよい。本発明に係るニゲロースホスホリラーゼ遺伝子は、複数部位に分けて化学合成したDNA断片をPCR法等で連結することにより作製することもできる。
【0033】
また本発明に係るニゲロースホスホリラーゼ遺伝子は、配列番号1で表される塩基配列を含むDNAに、部位特異的突然変異誘発法等の変異導入法を用いて塩基の欠失、置換、又は付加等の改変を導入することにより作製してもよい。遺伝子に変異を導入するには、Kunkel法、Gapped duplex法等の公知の手法又はこれに準ずる方法を採用することができる。これらの変異導入は、例えば市販の部位特異的突然変異誘発キット(例えばMutan(R)-K、Mutan(R)-Super Express Km、PrimeSTAR(R) Mutagenesis Basal Kit(いずれもTAKARA BIO INC.社製))などを用いて当業者であれば容易に行うことができる。
【0034】
なお、得られたニゲロースホスホリラーゼ遺伝子のDNA配列については、塩基配列決定によりその配列を確認することが好ましい。塩基配列決定はマキサム-ギルバートの化学修飾法、ジデオキシヌクレオチド鎖終結法等の公知手法により行うことができるが、通常は自動塩基配列決定装置(例えばABI社製DNAシークエンサー)を用いて行えばよい。
【0035】
得られたニゲロースホスホリラーゼ遺伝子は、ベクター中にクローニングして組換えベクターを作製することが好ましい。本発明の組換えベクターは、適当なベクターに本発明の遺伝子を連結することにより得ることができる。本発明のベクターは、宿主細胞中で当該遺伝子からニゲロースホスホリラーゼタンパク質を発現させるため、発現ベクターであることがさらに好ましい。ベクターは、宿主中で複製可能なものであれば特に限定されず、例えば、プラスミドDNA、ファージDNA等が挙げられる。例えばプラスミドDNAとしては、大腸菌由来のプラスミド(例えばpET−24a、pET22b(+)、pBR322、pBR325、pUC118、pUC119、pUC18、pUC19、pBluescript、pET100/D−TOPO等)などが挙げられ、ファージDNAとしてはλファージ(Charon4A、Charon21A、EMBL3、EMBL4、λgt10、λgt11、λZAP、λZAPII等)などが挙げられる。発現ベクターには、プロモーター、ターミネーター、リボソーム結合部位などの宿主生物における発現に必要な各種エレメントが含まれることが好ましい。発現ベクターには、プロモーター、ターミネーター、リボソーム結合部位などの宿主生物における発現に必要な各種エレメントが含まれることが好ましい。プロモーターは、その発現ベクターを導入すべき宿主細胞中でその制御下の遺伝子の発現を誘導できる任意のものであってよい。例えば細菌中で発現させるのであれば、T7プロモーター、trcプロモーター、tacプロモーター、lacプロモーター等が使用できる。発現ベクターには、選択マーカー遺伝子、レポーター遺伝子や、ポリリンカー、エンハンサーなどのシスエレメント、スプライシングシグナル、ポリA付加シグナル、精製用のヒスチジンタグ配列等の有用な配列が必要に応じて含まれていてもよい。選択マーカーとしては、例えばジヒドロ葉酸還元酵素遺伝子、アンピシリン耐性遺伝子、ネオマイシン耐性遺伝子、クロラムフェニコール耐性遺伝子(CAT遺伝子)等が挙げられる。
【0036】
本発明に係るニゲロースホスホリラーゼ遺伝子を宿主細胞に導入することにより形質転換体を作製することができる。具体的には、本発明に係るニゲロースホスホリラーゼ遺伝子を含む組換えベクター(好ましくは発現ベクター)を宿主細胞に導入することにより宿主細胞を形質転換することができる。
【0037】
宿主細胞は、原核細胞であっても真核細胞であってもよい。より具体的には、宿主細胞には、大腸菌や枯草菌等の細菌、酵母細胞、昆虫細胞、動物細胞(例えば、哺乳動物細胞)、植物細胞等の任意の細胞(好ましくは培養細胞)が含まれる。本発明においては、例えば本発明のニゲロースホスホリラーゼを生産する目的では、大腸菌(E.coli)やバチルス・スブチルス(Bacillus subtillis)、特に大腸菌(例えば、DH5α株、Rosetta(DE3)LysS株など)を宿主細胞として好適に使用することができる。
【0038】
宿主細胞の形質転換には、一般的に行われている遺伝子導入法、例えば、リン酸カルシウム法、エレクトロポレーション法、リポフェクション法、パーテイクルガン法、ポリエチレングリコール(PEG)法、アグロバクテリウム法、プロトプラスト融合法等を用いればよい。形質転換体の選択は、常法に従って行うことができるが、通常は使用したベクターに組み込まれた選択マーカー遺伝子の機能を利用して行うことができる。
【0039】
得られた形質転換体を常法により培養し、遺伝子発現を誘導することにより、ニゲロースホスホリラーゼを製造することができる。形質転換細胞の培養は、宿主生物の培養に用いられる通常の方法に従って行えばよい。例えば、大腸菌や酵母細胞等の微生物を宿主細胞として得られた形質転換細胞は、宿主微生物が資化し得る炭素源、窒素源、無機塩類等を含有する培地中に接種して培養すればよい。培地は、形質転換細胞の培養を効率的に行える培地であれば、天然培地、合成培地のいずれを用いてもよい。培地には、必要に応じてアンピシリンやテトラサイクリン等の抗生物質を添加してもよい。
【0040】
誘導性プロモーターを含む発現ベクターで形質転換した宿主細胞を培養する場合は、必要に応じてインデューサーを培地に添加してもよい。例えば、Lacプロモーターを用いた発現ベクターで形質転換した宿主細胞を培養するときにはイソプロピル−1−チオ−β−D−ガラクトシド(IPTG)等を、trpプロモーターを用いた発現ベクターで形質転換した宿主細胞を培養するときにはインドールアクリル酸(IAA)等を培地に添加することができる。培養条件は特に限定されないが、好ましくは形質転換に用いる宿主細胞に適した条件下で行われる。
【0041】
ニゲロースホスホリラーゼを取得するため、形質転換細胞の培養後、例えば、宿主細胞の菌体を破砕し、固液分離して得た上清を採取することが好ましい。固液分離した上清中の組換えタンパク質を常法により精製することにより、ニゲロースホスホリラーゼを単離精製することができる。
【0042】
あるいは、無細胞タンパク質翻訳合成系を使用して、ニゲロースホスホリラーゼ遺伝子を含む発現ベクターから、ニゲロースホスホリラーゼを生成させることもできる。
【0043】
3.本発明に係るニゲロースホスホリラーゼを用いた糖類製造
本発明では、上記のとおり作製したニゲロースホスホリラーゼを、糖類の分解や製造に用いることができる。
【0044】
本発明に係る酵素ニゲロースホスホリラーゼは、ニゲロースに特異的な加リン酸分解活性を示す(図3)。
【0045】
この加リン酸分解活性を利用して、本発明では、ニゲロースを特異的に分解し、β−グルコース1−リン酸とグルコースを等モルずつ生成することができる。具体的には、本発明に係るニゲロースホスホリラーゼを、適切な水性媒体(水又は緩衝液など)中、リン酸存在下でニゲロースと共にインキュベートして反応させることで、ニゲロースを分解することができ、その結果、グルコース及びβ−グルコース1リン酸を生成させることができる。本発明は、このようなニゲロースの分解方法も提供する。
【0046】
本発明に係るニゲロースホスホリラーゼは、限定するものではないが、基質となるニゲロース1モルに対して100〜100,000ユニット、好適には1,000〜50,000ユニットの量で反応系に含めることが好ましい。
【0047】
本発明に係るニゲロースホスホリラーゼは、反応系(反応液)中に分散していてもよいし、固相担体等に固定化されていてもよい。
【0048】
反応系に加えるリン酸は、無機リン酸が好ましい。リン酸は、好適な実施形態では、リン酸塩を用いて調製されるリン酸緩衝液の形態で反応系に加えることができる。リン酸塩は、限定するものではないが、例えばリン酸三ナトリウム、リン酸三カリウム、リン酸二水素ナトリウム、リン酸二水素カリウム、リン酸水素カリウム、リン酸水素ナトリウム等が挙げられる。限定するものではないが、ニゲロース1モルに対して0.1〜10モル、好ましくは0.5〜1.5モルとなる量でリン酸が反応系に含まれるようにするのが適当である。
【0049】
反応系のpH条件は、限定するものではないが、通常は5.5〜9.0、好ましくは6.5〜7.5、特に7.0が好適である。反応系の温度条件は、限定するものではないが、40℃以下、例えば15〜40℃、例えば20℃〜40℃、より好ましくは30℃が好適である。
【0050】
反応時間は、限定するものではないが、例えば30℃で1分〜10日間、好ましくは10分〜5日間、例えば20分〜1時間が好適である。
【0051】
加リン酸分解反応が十分に進行した後、反応液の加熱、酸性溶液や有機溶媒の添加等により酵素反応を停止させることができる。加リン酸分解反応の反応後組成物中には、ニゲロースの分解により生成したグルコースとβ−グルコース1−リン酸が含まれる。
【0052】
また本発明では、本発明に係るニゲロースホスホリラーゼを、適切な水性媒体(水又は緩衝液など)中で、糖供与体として機能するβ−グルコース1リン酸、及び糖受容体として機能する単糖又はその誘導体(以下、「単糖等」とも呼ぶ)とインキュベートして反応させ、β−グルコース1リン酸と単糖等との間でα−グルコシル結合(α−グルコシド結合とも呼ばれる)を生成することにより、α−グルコシル結合を有する二糖を効率よく製造することができる。ここでα−グルコシル結合を有する二糖とは、1分子のグルコースに1分子の単糖又はその誘導体がα−グルコシル結合(例えばα−1,3グルコシル結合、α−1,2グルコシル結合)したものをいい、α−グルコシル二糖とも呼ばれる。本発明は、このようなα−グルコシル結合を有する二糖の製造方法も提供する。本方法は、ニゲロースホスホリラーゼの加リン酸分解の逆反応である合成反応に基づく。
【0053】
本方法において、糖受容体として使用し得る単糖の誘導体としては、限定するものではないが、例えば糖アルコール(アルジトールなど)、糖エステル、アルドン酸、ウロン酸、アルダル酸等が挙げられる。糖受容体として使用するのに好適な単糖等の具体例としては、グルコース、ガラクトース、キシロース、1,5−アンヒドログルシトール、グルクロン酸、及びα−メチルグルコシド等が挙げられる。本方法において、グルコースは糖受容体として特に好適に使用できる。
【0054】
本方法において、糖受容体としての単糖等は、限定するものではないが、糖供与体となるβ−グルコース1リン酸1モルに対して1〜10モル、好適には1〜2モルの量で反応系に含めることが好ましい。
【0055】
本発明に係るニゲロースホスホリラーゼは、限定するものではないが、基質となるβ−グルコース1リン酸1モルに対して0.1〜50ユニット、好適には1〜10ユニットの量で反応系に含めることが好ましい。
【0056】
本発明に係るニゲロースホスホリラーゼは、反応系(反応液)中に分散していてもよいし、固相担体等に固定化されていてもよい。
【0057】
反応系のpH条件は、限定するものではないが、通常は5.5〜9.0、好ましくは6.5〜7.5、特に7.0が好適である。反応系の温度条件は、限定するものではないが、40℃以下、例えば15〜40℃、例えば20℃〜40℃、より好ましくは30℃が好適である。
【0058】
反応時間は、限定するものではないが、例えば30℃で1分〜10日間、好ましくは10分〜5日間、例えば10時間〜40時間が好適である。
【0059】
反応時間及び使用酵素量は、限定するものではないが、酵素反応が平衡状態に達するまで増加させることが好ましい。
【0060】
反応後、反応液の加熱、酸性溶液や有機溶媒の添加等により酵素反応を停止させることができる。本酵素による合成反応の反応後組成物中には、グルコース等の単糖とβ−グルコース1−リン酸から合成された二糖が含まれる。
【0061】
例えば、等モルずつの単糖とβ−グルコース1−リン酸を基質とした合成反応の場合、反応液について平衡状態になるまで酵素反応(合成反応)を進めると、反応後組成物中には、出発物質として含めた単糖又はβ−グルコース1−リン酸のおよそ60%がα−グルコシル結合を有する二糖に変換されて含まれることになる。すなわち平衡状態では基質のα−グルコシル結合を有する二糖への転換率はおよそ60%である。ここで生成されるα−グルコシル結合を有する二糖は、主としてα−1,3グルコシル結合を有する二糖であることが好ましいが、副次的にα−1,2グルコシル結合を有する二糖が生成されてもよい。
【0062】
この本発明に係る方法の好ましい一実施形態では、本発明に係るニゲロースホスホリラーゼを、適切な水性媒体(水又は緩衝液など)中で、糖供与体として機能するβ−グルコース1リン酸、及び糖受容体として機能するグルコースとインキュベートして反応させてα−1,3グルコシル結合を生成することにより、ニゲロースを効率よく製造することができる。この場合の反応条件等は上記と同様である。
【0063】
さらに、ニゲロースの製造は、本発明に係るニゲロースホスホリラーゼの反応系と、他のホスホリラーゼ反応系とを組み合わせることによって行うこともできる。すなわち本発明の方法では、ニゲロース以外の二糖を基質とするホスホリラーゼの加リン酸分解反応によりβ−グルコース1リン酸を生成して、それを、本発明に係るニゲロースホスホリラーゼが触媒する二糖合成反応に用いることにより、ニゲロースを製造することができる。本発明は、そのような2つ以上のホスホリラーゼ反応系を組み合わせたニゲロースの製造法も提供する。
【0064】
例えば文献Murao S., Nagano, H., Ogura, S., and Nishio T., (1985), Agric. Biol. Chem., 49, p. 2113-2118や特公昭63−60998には、マルトースホスホリラーゼとトレハロースホスホリラーゼを組み合わせて用いる、マルトースを原料としたトレハロースの製造方法が記載されている。この方法では2種類のホスホリラーゼ(マルトースホスホリラーゼ及びトレハロースホスホリラーゼ)をマルトースと反応させることにより、マルトースが加リン酸分解されて生成されるグルコースとβ−グルコース−1−リン酸からトレハロースが合成される。この方法により、より安価な原料(マルトース)からトレハロースを製造することができる。
【0065】
そこでこの方法と同様にして、リン酸の存在下でβ−グルコース1リン酸を生成する別の1種以上のホスホリラーゼ及びその基質とニゲロースホスホリラーゼ反応系を組み合わせることにより、ニゲロースを製造することが可能である。具体的には、そのような別のホスホリラーゼとその基質を含む水性媒体に、本発明に係るニゲロースホスホリラーゼを加えて反応させることにより、ニゲロースを合成できる。本発明の方法で使用する、リン酸の存在下でβ−グルコース1リン酸を生成する別のホスホリラーゼとしては、例えば、マルトースホスホリラーゼ(基質:マルトース)、トレハロースホスホリラーゼ(基質:トレハロース)、スクロースホスホリラーゼ(基質:スクロース)等が挙げられ、公知のものを使用することができる。このような別のホスホリラーゼとしては、本発明に係る酵素ニゲロースホスホリラーゼのpH条件及び温度条件に適合するものが好ましい。例えばそのようなホスホリラーゼは、30℃の条件下で至適pHが6.5〜7.5、例えば7.0付近であり、pH5.5〜9.0で安定であり、またpH7.0の条件下での至適温度が30℃〜50℃、例えば40℃であり、少なくとも40℃以下、例えば15℃〜40℃の範囲で安定であることが好ましい。
【0066】
本発明に係るニゲロースホスホリラーゼを含む2種以上のホスホリラーゼを用いた上記反応系のpH条件は、限定するものではないが、通常は5.5〜9.0、好ましくは6.5〜7.5、特に7.0が好適である。反応系の温度条件は、限定するものではないが、40℃以下、例えば15〜40℃、例えば20℃〜40℃、より好ましくは30℃が好適である。反応時間は、特に限定するものではなく、15分〜30時間であってよいが、例えば15〜25時間であることも好ましい。
【0067】
この2種以上のホスホリラーゼを用いて得られる反応後組成物中には、ホスホリラーゼ、残存量の基質(単糖等及びβ−グルコース1リン酸)に加えて、生成されたニゲロースが含まれる。
【0068】
ニゲロースを含む反応後組成物は、ニゲロース含有組成物としてそのまま使用してもよいし、そこからニゲロースを分離して使用してもよい。
【0069】
なお本発明において用いるmRNAの調製、cDNAの作製(RT−PCR)、PCR、ライブラリーの作製、ベクター中へのライゲーション、細胞の形質転換、DNA塩基配列決定、プライマーの合成、突然変異誘発、タンパク質の抽出・精製などの分子生物学的・生化学的実験操作は、基本的には通常の実験書の記載に従って行うことができる。そのような実験書としては、例えば、SambrookらのMolecular Cloning, A laboratory manual, 2001, Eds., Sambrook, J. & Russell, DW. Cold Spring Harbor Laboratory Pressを挙げることができる。
【実施例】
【0070】
次に、本発明を実施例により詳しく説明するが、本発明はこれらにより限定されるものではない。
【0071】
(実施例1)
クロストリディウム・フィトファーメンタンス(Clostridium phytofermentans)ISDgTゲノムデータベースに登録されている機能未同定遺伝子CPH1874の配列情報(配列表の配列番号1)に基づき、CPH1874遺伝子のオープンリーディングフレーム(ORF)の5’末端及び3’末端に、フォワードプライマー(5'-gatatacatatgaattggacattaacaaat-3';配列番号3;NdeI部位を含む)及びリバースプライマー(5'-ggtgctcgagcatttcaattttactaatag-3';配列番号4;XhoI部位を含む)をそれぞれ設計した。インスタジーン(バイオラッド社製)を用いて調製したクロストリディウム・フィトファーメンタンスISDg株(アメリカン・タイプ・カルチャー・コレクション(ATCC)(登録商標)からATCC番号700394にて入手可能)のゲノムDNAを鋳型として、このプライマー対を用い、ORF全長をポリメラーゼ連鎖反応(PCR反応)により増幅した。得られた増幅産物を電気泳動したところ、予測断片長2278bpと一致する明瞭なバンドが得られた。
【0072】
増幅したPCR産物を制限酵素NdeI及びXhoIで消化した後、その断片を、同様にNdeI及びXhoIで処理した市販の遺伝子発現用プラスミドpET−24a(ノバジェン社製)に、DNAライゲーションキット(宝酒造株式会社製)を用いて連結した。
【0073】
増幅産物については、自動DNAシークエンサーを用いて塩基配列を決定した。増幅産物が、配列番号1に示す塩基配列を有する目的のCPH1874遺伝子(ORF)を含むことが確認された。
【0074】
このようにしてCPH1874遺伝子をクローン化した遺伝子発現用プラスミドを用いて、Sambrook,J.,Fritsch, E. F. and Maniatis, T. "Molecular Cloning, A Laboratory Manual 第2版”1.74章 Vo1. 1 (1989)に記載された方法に従い、大腸菌(E. coli BL21 (DE3)(ノバジェン社製))を形質転換した。
【0075】
得られた形質転換体を用い、常法に従って該遺伝子の発現及び組換えタンパク質の生産を行った。具体的には、CPH1874遺伝子含有発現プラスミドをE. coli BL21(DE3)に導入した形質転換体を、33μg/mL カナマイシンを添加したルリア−ベルターニ培地(1% トリプトン、0.5% 酵母エキス、1% NaCl;LB培地)中、37℃で、660nmでの吸光度が0.6になるまで増殖させた。遺伝子発現は、0.1mM イソプロピル−β−D−チオガラクトピラノシド(IPTG)の添加により誘導し、25℃で6時間培養を続けた。4000 x gで5分間の遠心分離により培養物中の湿潤細胞を回収し、それを、500mM NaClを含む50mM 3−(N−モルホリノ)プロパンスルホン酸(MOPS)−NaOH緩衝液(pH7.5)(バッファーA)中に懸濁した。細胞懸濁物を超音波処理し、さらに10,000 x gで20分間、遠心分離した。こうして得られた上清から、組換えタンパク質をNi−NTAアガロース(キアゲン社製)を用いたカラムクロマトグラフィーにより精製し、精製酵素標品を得た。
【0076】
(実施例2)
実施例1で得られた精製酵素標品を用い、以下に示す方法によって酵素活性を調べた。
【0077】
なお本願の実施例で用いた、トレハロース(別名:α−D−グルコピラノシル−α−D−グルコピラノシド)、コージビオース(別名:2−O−α−D−グルコピラノシル−D−グルコース)、ニゲロース(別名:3−O−α−D−グルコピラノシル−D−グルコース)、マルトース(別名:4−O−α−D−グルコピラノシル−D−グルコース)一水和物、イソマルトース(別名:6−O−α−D−グルコピラノシル−D−グルコース)、及び1,5−アンヒドロ−D−グルシトールは、Wako Pure Chemicals (Osaka, Japan)から購入して用いた。なお本願実施例で用いた糖は、特に記載しない限りD体である。またMOPSは、3−(N−モルホリノ)プロパンスルホン酸の略語である。
【0078】
25mM MOPS−NaOH緩衝液(pH7.0)中、10mM α−グルコシル二糖(トレハロース、コージビオース、ニゲロース、マルトース、イソマルトース又はスクロース)、及び10mM リン酸緩衝液(pH7.0)、並びに実施例1で得た精製酵素22μg/mLを含む、反応液200μLを調製し、30℃で30分インキュベートした。反応時間後、反応液25μLを、25μLのDMSO(ジメチルスルホキシド)に加え、酵素反応を停止させてサンプル液とした。サンプル液中で酵素反応により生成されたグルコース(より明確には、D−グルコース)を、グルコースオキシダーゼ法(グルコースC−IIテストワコー、和光純薬株式会社製)により定量した。具体的には、100μLのグルコースC−IIテストワコー液(但しリン酸緩衝液を200mM MOPS−NaOH緩衝液(pH7.0)に変更)をサンプル液に加えてインキュベートした後、505nmでの吸光度を測定した。上記条件下に毎分1μmolのグルコースを生成する酵素活性(分解活性)を1ユニットと定義した。
【0079】
その結果、本酵素はニゲロースに対する分解活性が32ユニット/mgであった。また、コージビオースをわずかに(0.5ユニット/mg)分解する活性を示したが、他の二糖に対する分解活性は示さなかった。また、リン酸の非存在下ではニゲロースを分解しなかった。この結果から、本酵素がニゲロース特異的に高い加リン酸分解活性を有することが示された。
【0080】
本酵素は、トレハロース、マルトース及びトレハロース6−リン酸のような、典型的なグリコシドヒドロラーゼファミリー(GH)65酵素の基質に対して加リン酸分解活性を示さず、これまで報告のないニゲロースに対して強い加リン酸分解活性を示すことから、従来の他のGH65酵素とは全く異なる活性を有する酵素であることが判明した。
【0081】
次いで本酵素について、β−グルコース1−リン酸(β−G1P)を糖供与体とし、各種糖を糖受容体(基質)候補とした合成活性を、反応液中のリン酸の増加をLowry−Lopezの方法(Lowry O.H. and Lopez J.A., (1946) J. Biol. Chem., 162, p. 421-428)により測定することにより決定した。25mM MOPS−NaOH緩衝液(pH7.0)中、10mM β−グルコース1−リン酸、及び10mM 糖受容体候補糖、並びに実施例1で得た精製酵素22μg/mLを含む、反応液200μLを調製し、30℃で30分インキュベートした。反応時間後、反応液25μLを、100μLの0.2M 酢酸ナトリウム緩衝液(pH4.0)に加え、酵素反応を停止させてサンプル液とした。25mM 硫酸塩を含有する1% モリブデン酸アンモニウム12.5μLと0.05%硫酸水素カリウムを含有する1%アスコルビン酸12.5μLを、上記サンプル液と混合した。混合液を37℃で1時間インキュベートした後、700nmでの吸光度を測定した。上記条件下に毎分1μmolの無機リン酸を生成する酵素活性(合成活性)を1ユニットと定義した。
【0082】
その結果、本酵素が、糖供与体としてのβ−グルコース1−リン酸の存在下で、グルコース、ガラクトース、キシロース、1,5−アンヒドログルシトール、グルクロン酸、又はα−メチルグルコシドを糖受容体として利用できることが示された。測定された合成活性を表1に示す。
【0083】
【表1】

【0084】
本酵素は表1に示す基質のいずれからも、対応する二糖を生成した。
【0085】
一方、本酵素は、マンノース、アロース、L−アラビノース、リキソース、L−フコース、L−ラムノース、フルクトース、2−デオキシ−グルコース、グルカル、グルコサミン、α−グルコース1−リン酸、β−グルコース1−リン酸、グルコース6−リン酸、メチルβ−グルコース、3−メチル−グルコース、N−アセチル−グルコサミン、N−アセチル−ガラクトサミン、トレハロース、コージビオース、ニゲロース、マルトース、イソマルトース、ソホロース、ラミナリビオース、セロビース、ゲンチオビオース、キシロビオース、ラクトース及びスクロースを糖受容体とした活性は示さなかった。
【0086】
このように本酵素は、表1に示すように、グルコースの誘導体のうち、2,3位に変異が入っておらず1位に大きな置換基が入っていない単糖又はその誘導体を基質として合成活性を生じた。本酵素は、二糖を合成反応における糖受容体として利用してさらに三糖を合成する活性は示さなかった。このことは、本酵素が、加リン酸分解反応の逆反応では二糖を特異的に合成することを示している。
【0087】
なお本酵素は、同様の実験で、グルコースとα−グルコース1−リン酸からは二糖を合成しなかった。
【0088】
したがって本酵素が、糖供与体としてのβ−グルコース1−リン酸と糖受容体としての所定の単糖又はその誘導体から二糖を合成する活性を有することが示された。この合成反応は、加リン酸分解反応の逆反応に当たる。
【0089】
これらの結果から、実施例1で得られた本酵素が、ニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1−リン酸を生成する新規活性を有することが示された。そこで本酵素をニゲロースホスホリラーゼと命名した。
【0090】
(実施例3)
次に、β−グルコース1−リン酸を糖供与体とした本酵素の合成活性により得られる生成物の解析を行った。100mM MOPS−NaOH緩衝液(pH7.0)中、50mM β−グルコース1−リン酸、及び50mM 糖受容体(グルコース、キシロース、1,5−アンヒドログルシトール、ガラクトース、又はα−メチルグルコシド)に、実施例1で得た、ニゲロースに対する特異的かつ可逆的な加リン酸分解活性を有する精製酵素(各糖受容体に対して、それぞれ、22μg/mL、44μg/mL、44μg/mL、44μg/mL、350μg/mLの濃度)を含む、反応液500μLを、30℃で20時間インキュベートした。次いでこの反応液を、アンバーライトMB−3(オルガノ社製)を用いて脱塩した後、蒸留水で平衡化したトヨパールHW−40Fカラム(径2.6cm、長さ32cm;トーソー社製)上で、流速0.5mL/分の、水を溶媒としたゲル濾過クロマトグラフィーにより分離することにより、二糖画分を単離した。生成物を含有する画分を回収し、アンバーライトMB−3を用いて再度脱塩した後、凍結乾燥した。こうして得られた生成物の収量は、表2のとおりであった。
【0091】
【表2】

【0092】
さらに、それぞれの生成物をNMRにより分析した。各生成物の、1D(1H及び13C)及び2D[二重量子相関分光解析(DQF−COSY)、異核種単一量子コヒーレンス(HSQC)、及び異核種多重結合相関(HMBC)]核磁気共鳴(NMR)スペクトルは、Bruker Avance 800又はAvance 500スペクトロメーター(Bruker Biospin社製)を使用し、内部標準として2−メチル−2−プロパノールを用いて、D2O中で取得した。プロトンシグナルはDQF−COSYスペクトルに基づいて割り当てた。13Cシグナルには、プロトンシグナルの割り当てに基づいて、HSQCスペクトルを割り当てた。それぞれの二糖の結合位置は、各HMBCスペクトル中の環内クロスピークを検出することによって決定した。
【0093】
NMR解析の結果、糖受容体としてグルコース、1,5−アンヒドログルシトール、及びガラクトースを用いて得られた生成物は、それぞれ、ニゲロース、3−O−α−グルコピラノシル−1,5−アンヒドログルシトール、及び3−O−α−グルコピラノシル−ガラクトースであることが判明した。このことは、グルコース1−リン酸を糖供与体とした本酵素の合成反応において、α−1,3−グルコシル結合が形成されることを示す。
【0094】
例として、グルコースを糖受容体とした場合の生成物のNMR解析の結果を図1に示す。なお、グルコースを糖受容体として得られた生成物の1H−NMRスペクトル(図1のA及びD)には、ごくわずかな量のコージビオース(1.6%)(図1のB)が検出された。
【0095】
また糖受容体としてキシロースを用いて得られた生成物は、3−O−α−グルコピラノシル−キシロース及び2−O−α−グルコピラノシル−キシロースを63:37の重量比で含有していた。同様に、α−メチルグルコシドを糖受容体として得られた生成物は、メチル−3−O−α−グルコピラノシル−α−グルコシド及びメチル−2−O−α−グルコピラノシル−α−グルコシドを71:29の重量比で含有していた。例として、メチル−α−D−グルコシドを糖受容体とした場合の生成物のNMR解析の結果を図2に示す。
【0096】
このように、本酵素によるβ−グルコース1−リン酸と単糖等からのα−グルコシル二糖の合成反応においては、α−1,3−グルコシル結合を有する二糖が主たる生成物であり、α−1,2−グルコシル結合を有する二糖は従たる(マイナーな)生成物であった。
実施例2〜4により示された、本酵素が触媒する可逆的反応を図3に示す。
【0097】
(実施例4)
本酵素のニゲロース加リン酸分解活性に対する温度の影響を、標準的反応条件で調べた。様々な反応温度で10分間インキュベートした点以外は、実施例2に示す手順に従って反応を実施した。なお温度安定性は、各種温度で酵素(175μg/mL)を10分間インキュベーションした後の残存活性(加リン酸分解活性)として定義した。
【0098】
測定の結果、本酵素ニゲロースホスホリラーゼはpH7.0において、至適温度は40℃であり(図4A)、15℃から40℃まで安定であった(図4B)。
【0099】
また、本酵素のニゲロース加リン酸分解活性及びニゲロース合成活性に対するpHの影響を、標準的反応条件で調べた。
【0100】
まず25mM MOPS−NaOH緩衝液(pH7.0)を、各種pHの100mM 緩衝液(クエン酸ナトリウム(pH3.0−5.5)、4−モルホリン−エタンスルホン酸−NaOH(pH5.5−7.0)、4−(2−ヒドロキシエチル)−1−ピペラジンエタンスルホン酸−NaOH(pH7.0−8.5)、グリシン−NaOH(pH8.5−10.5))に変更する点以外は、実施例2と同様の手順に従って、無機リン酸存在下でのニゲロースに対する加リン酸分解活性と、グルコースとβ−グルコース1−リン酸からのニゲロース合成活性とを測定した。なおpH安定性は、各種pHで30℃にて30分間、酵素(175μg/mL)をインキュベートした後の残存活性(加リン酸分解活性)として定義した。
【0101】
本酵素の30℃における至適pHは、加リン酸分解活性及び合成活性の両方についてpH7.0付近(pH6.5〜7.5)であった(図5A及び図5B)。さらに本酵素は、30℃にて30分の反応条件下で、pH5.5〜9.0の範囲で安定であった(図5C)。
【0102】
さらに実施例2及び3でニゲロース特異的かつ可逆的な加リン酸分解活性が確認された精製酵素標品について、SDS−ポリアクリルアミドゲル電気泳動(SDS−PAGE)、及びSuperose 12 HR10/30カラム(GE Healthcare UK Ltd.)を用いたゲルろ過法により、分子量測定を行った。その結果、本酵素の分子量は、変性条件下にあるSDS−PAGEでは90kDa(キロダルトン)、ゲルろ過法で200kDaと測定された。この結果から、本酵素が、SDS−PAGEによる測定値で90kDaのサブユニットタンパク質(単量体)2個から構成される二量体であること、その二量体の分子量はゲルろ過法による測定値で200kDaであることが示された。これらの測定値は、配列番号2のアミノ酸配列から計算される分子量87.2kDaとよく合致していた。
【産業上の利用可能性】
【0103】
ニゲロースは、食品用素材や医薬品用素材などへの利用が期待される有用なオリゴ糖である。本発明に係る酵素ニゲロースホスホリラーゼを用いることにより、ニゲロースを製造することが可能である。また本発明に係るニゲロースホスホリラーゼを用いれば、β−グルコース1−リン酸を高効率に製造することもできる。
【配列表フリーテキスト】
【0104】
配列番号3〜4:プライマー
【特許請求の範囲】
【請求項1】
ニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有する酵素。
【請求項2】
基質濃度10mMのコージビオース、マルトース及びトレハロースに対する加リン酸分解活性が、基質濃度10mMのニゲロースに対する加リン酸分解活性と比較していずれも5%以下である、請求項1に記載の酵素。
【請求項3】
(a)30℃の条件下で至適pHが6.5〜7.5であり、pH5.5〜9.0で安定であり、
(b)pH7.0の条件下で至適温度が40℃であり、15℃〜40℃の範囲で安定であり、
(c)ゲルろ過法で測定した分子量が200kDaであり、
(d)二量体であり、
(e)クロストリディウム・フィトファーメンタンス由来である、
請求項1又は2に記載の酵素。
【請求項4】
以下の(a)又は(b)のタンパク質から構成される、請求項1〜3のいずれか1項に記載の酵素。
(a)配列番号2で表されるアミノ酸配列からなるタンパク質、又は
(b)配列番号2で表されるアミノ酸配列において1〜数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有するタンパク質
【請求項5】
請求項1〜4のいずれか1項に記載の酵素を、リン酸存在下でニゲロースと反応させることを含む、ニゲロースの分解方法。
【請求項6】
請求項1〜4のいずれか1項に記載の酵素を、β−グルコース1リン酸、及び単糖若しくはその誘導体と反応させてα−グルコシル結合を生成することを含む、α−グルコシル結合を有する二糖の製造方法。
【請求項7】
単糖若しくはその誘導体がグルコース、ガラクトース、キシロース、1,5−アンヒドロ−グルシトール、グルクロン酸、及びα−メチルグルコシドからなる群から選択される、請求項6に記載の方法。
【請求項8】
単糖若しくはその誘導体がグルコースであり、製造されるα−グルコシル結合を有する二糖がニゲロースである、請求項6又は7に記載の方法。
【請求項1】
ニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有する酵素。
【請求項2】
基質濃度10mMのコージビオース、マルトース及びトレハロースに対する加リン酸分解活性が、基質濃度10mMのニゲロースに対する加リン酸分解活性と比較していずれも5%以下である、請求項1に記載の酵素。
【請求項3】
(a)30℃の条件下で至適pHが6.5〜7.5であり、pH5.5〜9.0で安定であり、
(b)pH7.0の条件下で至適温度が40℃であり、15℃〜40℃の範囲で安定であり、
(c)ゲルろ過法で測定した分子量が200kDaであり、
(d)二量体であり、
(e)クロストリディウム・フィトファーメンタンス由来である、
請求項1又は2に記載の酵素。
【請求項4】
以下の(a)又は(b)のタンパク質から構成される、請求項1〜3のいずれか1項に記載の酵素。
(a)配列番号2で表されるアミノ酸配列からなるタンパク質、又は
(b)配列番号2で表されるアミノ酸配列において1〜数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつニゲロースを特異的かつ可逆的に加リン酸分解してグルコースとβ−グルコース1リン酸を生成する活性を有するタンパク質
【請求項5】
請求項1〜4のいずれか1項に記載の酵素を、リン酸存在下でニゲロースと反応させることを含む、ニゲロースの分解方法。
【請求項6】
請求項1〜4のいずれか1項に記載の酵素を、β−グルコース1リン酸、及び単糖若しくはその誘導体と反応させてα−グルコシル結合を生成することを含む、α−グルコシル結合を有する二糖の製造方法。
【請求項7】
単糖若しくはその誘導体がグルコース、ガラクトース、キシロース、1,5−アンヒドロ−グルシトール、グルクロン酸、及びα−メチルグルコシドからなる群から選択される、請求項6に記載の方法。
【請求項8】
単糖若しくはその誘導体がグルコースであり、製造されるα−グルコシル結合を有する二糖がニゲロースである、請求項6又は7に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2012−254061(P2012−254061A)
【公開日】平成24年12月27日(2012.12.27)
【国際特許分類】
【出願番号】特願2011−130340(P2011−130340)
【出願日】平成23年6月10日(2011.6.10)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成22年度、独立行政法人農業・食品産業技術総合研究機構 生物系特定産業技術研究支援センター「イノベーション創出事業」委託事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(501203344)独立行政法人農業・食品産業技術総合研究機構 (827)
【Fターム(参考)】
【公開日】平成24年12月27日(2012.12.27)
【国際特許分類】
【出願日】平成23年6月10日(2011.6.10)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成22年度、独立行政法人農業・食品産業技術総合研究機構 生物系特定産業技術研究支援センター「イノベーション創出事業」委託事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(501203344)独立行政法人農業・食品産業技術総合研究機構 (827)
【Fターム(参考)】
[ Back to top ]

