ニッケル−リチウム二次電池
【課題】ニッケル−水素二次電池の大きな正極容量とリチウムイオン電池の高い電圧という利点を両方利用することができる、新たな二次電池を提供する。
【解決手段】リチウムイオン電池の負極(例えば:金属リチウム)材料を負極として、また、ニッケル−水素二次電池の正極(NiOOH)材料を正極として用い、正負両極間の負極側に有機電解液2を、また、正極側に水性電解液3をそれぞれ配設し、負極側の有機電解液2と正極側の水溶性電解液3の間に、リチウムイオンのみを通す固体電解質をセパレータ1として配設することによる、ニッケル−水素二次電池の有する大きな正極容量とリチウムイオン電池の有する高い電圧という利点を兼ね備えた、高容量、高電圧を有し、かつ、充放電の繰り返しに対して安定性の優れる、ニッケル−リチウム二次電池。
【解決手段】リチウムイオン電池の負極(例えば:金属リチウム)材料を負極として、また、ニッケル−水素二次電池の正極(NiOOH)材料を正極として用い、正負両極間の負極側に有機電解液2を、また、正極側に水性電解液3をそれぞれ配設し、負極側の有機電解液2と正極側の水溶性電解液3の間に、リチウムイオンのみを通す固体電解質をセパレータ1として配設することによる、ニッケル−水素二次電池の有する大きな正極容量とリチウムイオン電池の有する高い電圧という利点を兼ね備えた、高容量、高電圧を有し、かつ、充放電の繰り返しに対して安定性の優れる、ニッケル−リチウム二次電池。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規な反応を利用したニッケル−リチウム二次電池に関する。
【背景技術】
【0002】
従来より、ニッケル−水素二次電池やリチウムイオン電池について、数多くの研究がなされている(例えば、前者について、非特許文献1、後者について、特許文献1、特許文献2など)。
【0003】
ニッケル−水素二次電池は、約1.35V前後の比較的低い電圧を有するが、正極NiOOHの容量は約298mAh/gと大きい。一方、リチウムイオン電池は、正極の容量は約120mAh/gと小さいが、約4.0Vの高い電圧を有する。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特願2008−202754号
【特許文献2】特開2008−285372号
【非特許文献】
【0005】
【非特許文献1】S.R.Ovshisky, M. A. Fetcenko, J. Ross, Science, Vol.260, (1993), 176-181
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明は、ニッケル−水素二次電池の大きな正極容量とリチウムイオン電池の高い電圧という利点を両方利用することができる、ニッケル−リチウム二次電池を開発することを課題とする。
【課題を解決するための手段】
【0007】
本発明者らは、上記課題を解決するため、リチウムイオン電池の負極(例えば:金属リチウム)材料を負極として用い、ニッケル−水素二次電池の正極(NiOOH)材料を正極として用いる、新型のニッケル−リチウム二次電池を開発した。
【0008】
本発明のニッケル−リチウム二次電池においては、正負両極間の負極側に有機電解液を、また、正極側に水性電解液をそれぞれ配設し、負極側の有機電解液と正極側の水溶性電解液の間に、リチウムイオンのみを通す固体電解質をセパレータとして配設する。
【0009】
すなわち、この出願は以下の発明を提供するものである。
(1)リチウムイオン電池或いはリチウム二次電池の負極材料を負極として用い、ニッケル−水素二次電池の正極材料を正極として用いることを特徴とする、充電可能なニッケル−リチウム二次電池。
(2)リチウム金属或いはリチウムを豊富に含む化合物、負極用の電解液、セパレータ、正極用の電解液およびNiOOH或いはNi(OH)2あるいはNi(OH)3がその順に設けられたニッケル−リチウム二次電池であって、該セパレータがリチウムイオンのみを通す固体電解質を含むことを特徴とする、(1)に記載の充電可能なニッケル−リチウム二次電池。
(3)リチウムイオンのみを通す固体電解質が、Li3N、Garnet-Type型リチウムイオン伝導体、NASICON型リチウムイオン伝導体、β-Fe2(SO4) 型リチウムイオン伝導体、ペロブスカイト型リチウムイオン伝導体、チオLISICON型リチウムイオン伝導体、高分子型リチウムイオン伝導体から選ばれた少なくとも一種であることを特徴とする、(2)に記載の充電可能なニッケル−リチウム二次電池。
(4)負極として、リチウム金属、或いはリチウムが豊富に含む化合物、リチウムカーボン、リチウムシリコン、リチウム錫、窒化リチウムの中の一種類を選んで用い、負極用電解液が有機電解液であることを特徴とする、(2)または(3)に記載の充電可能なニッケル−リチウム二次電池。
(5)正極として、NiOOH或いはNi(OH)2、Ni(OH)3、NiO、Ni2O3の中の一種類を選んで用いることを特徴とする、(1)〜(4)のいずれかに記載のニッケル−リチウム二次電池。
(6)正極用電解液が水性電解液であり、水性電解液はアルカリ性(弱アルカリ性或いは強アルカリ性)であることを特徴とする、(2)〜(5)のいずれかに記載の充電可能なリチウム−ニッケル二次電池。
(7)正極用電解液が弱アルカリ性或いは強アルカリ性水を含むゲルであることを特徴とする、(2)〜(6)のいずれかに記載の充電可能なニッケル−リチウム二次電池。
(8)リチウムイオンのみを通す固体電解質の水性電解液側に、耐強アルカリ性高分子イオン交換膜がつけられていることを特徴とする、(2)〜(7)のいずれかに記載の充電可能なニッケル−リチウム二次電池。
(9)放電と共に、負極の金属リチウムの表面には、Li => Li+ + e-となる酸化(溶解)反応が、正極の側には、NiOOH + H2O + e- => Ni(OH)2 + OH- なる還元反応が生じ、充電と共に、負極の金属リチウムの表面には、Li+ + e- => Li なる還元(析出)反応が、正極電極においては、Ni(OH)2 + OH-=> NiOOH + H2O + e- なる酸化反応が生じることを特徴とする、(1)〜(8)のいずれかに記載の充電可能なニッケル−リチウム二次電池。
【発明の効果】
【0010】
本発明により、ニッケル−水素二次電池の有する大きな正極容量とリチウムイオン電池の有する高い電圧という利点を兼ね備えた、高容量、高電圧を有し、かつ、充放電の繰り返しに対して安定性の優れる、ニッケル−リチウム二次電池が提供される。
【図面の簡単な説明】
【0011】
【図1】本発明のニッケル−リチウム二次電池の全体の構成を示す説明図である。
【図2】実施例で得たニッケル−リチウム二次電池を用いて、0.1A/g, 0.2A/g, 0.5A/g,1.0A/gという電流密度で行った、充放電のプロファイルである。
【図3】実施例で得たニッケル−リチウム二次電池を0.2A/gの電流密度で、50サイクルまで充放電を行った際の、容量、クーロン効率とサイクル回数の関係を示す図である。
【図4】実施例で得たニッケル−リチウム二次電池に対して、開路電圧(OCV)において、10mVの振幅で、1MHzから0.01Hzまで測定したインピーダンス(Impedance)曲線である。
【発明を実施するための形態】
【0012】
本発明のニッケル−リチウム二次電池は、負極、負極用の電解液、セパレータ、正極用の電解液および正極がその順に設けられたニッケル−リチウム二次電池であって、該セパレータがリチウムイオンのみを通す固体電解質を含むことを特徴としている。
【0013】
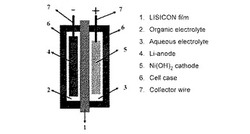
本発明の代表的なニッケル−リチウム二次電池を、図1に示す。
図1において、1は固体電解質セパレータ、2は負極側用の有機電解液、3は正極用の水溶液電解液、4はリチウム金属負極、5は正極、6は外装用缶、7は外部とつなぐリード線、を示す。
【0014】
1の負極を形成する材料としては、リチウム金属、リチウムが豊富に含む化合物、リチウムカーボン、リチウムシリコン、リチウム錫、窒化リチウムなどが挙げられる。この中でも大容量、サイクル安定性の点からみて、金属リチウムが好ましく使用される。
【0015】
負極域の電解液は特に制限はないが、負極として金属リチウムを用いた場合には、電解液として有機電解液を用いる必要がある。
電解液に含有させる電解質としては、電解液中でリチウムイオンを形成するものであれば特に限定されない。例えば、LiPF6 、LiClO4 、LiBF4 、LiAsF6 、LiAlCl4 、LiCF3 SO3 、LiSbF6 等が挙げられる。これら電解質は、単独でもよいが、組み合わせて使用してもよい。
【0016】
また、電解液の溶媒としては、この種の有機溶媒として公知のものがすべて使用できる。例えば、プロピレンカーボネート、テトラヒドロフラン、ジメチルスルホキシド、γ−ブチロラクロン、1,3−ジオキソラン、4−メチル−1,3−ジオキソラン、1,2−ジメトキシエタン、2−メチルテトラヒドロフラン、スルホラン、ジエチルカーボネート、ジメチルホルムアミド、アセトニトリル、ジメチルカーボネート、エチレンカーボネート等が挙げられる。これら有機溶媒は、単独でもよいが、組み合わせて使用してもよい。
【0017】
3は、リチウムイオンのみを透過する固体電解質である。
本発明で用いるリチウムイオンのみを透過する固体電解質としては、たとえば、Li3N、Garnet-Type型リチウムイオン伝導体、 NASICON型リチウムイオン伝導体、β-Fe2(SO4) 型リチウムイオン伝導体、ペロブスカイト型リチウムイオン伝導体、チオLISICON型リチウムイオン伝導体、高分子型リチウムイオン伝導体が使用できる。実施例においては、NASICON型リチウムイオン伝導体を用いたが、広い電位範囲において酸化・還元反応が起こらない固体電解質が特に好ましく、例えば、Garnet-Type型リチウムイオン伝導体などが期待される。
リチウムイオンのみを透過する固体電解質ではなくて、普通のセパレータや、陽イオン一般が透過するイオン交換膜を使うと、リチウムイオンだけでなく、水素イオンなどが透過され、これが負極の金属リチウムと反応し、大量の水素を発生し、電池を構成することができず、本発明の所期の目的を達成することはできない。
【0018】
5の正極としては、NiOOH或いはNi(OH)2、Ni(OH)3、NiO、Ni2O3の中の一種類を選んで用いる。
【0019】
4の正極用の電解液としては、水性電解液、或いはアルカリ性水を含むゲルを用いることができる。
【0020】
つぎに本発明のニッケル−リチウム二次電池における充放電の機構を説明する。この電池においては、負極の金属リチウムは、負極用の有機電解液のみと接触し、正極のNiOOHは正極用の水性電解液のみと接触する。負極用電解液と正極用電解液の間には、リチウムイオンのみを透過する固体電解質が配設されており、充電と放電に伴い、リチウムイオンが当該固体電解質を通して、それぞれ、正極区域から負極区域へ、あるいは、負極区域から正極区域へと移動する。
放電時には、負極の金属リチウムの表面においては、Li => Li+ + e- なる酸化(溶解)反応が、正極の側ではNiOOH + H2O + e- => Ni(OH)2 + OH- なる還元反応が生じ、この際、負極区域溶液のLi+が、固体電解質を通して正極区域へ移動する。
充電時には、負極の金属リチウムの表面においては、Li+ + e- => Li なる還元(析出)反応が、正極の側ではNi(OH)2 + OH-=> NiOOH + H2O + e- なる酸化反応が生じ、この際、正極区域溶液のLi+が、固体電解質を通して負極区域へ移動する。
【実施例】
【0021】
本発明を以下の実施例により更に詳細に説明する。
【0022】
実施例1
図1に示される装置において、1は固体電解質セパレータとして、リチウムイオン固体電解質(NASICON型リチウムイオン伝導体LISICON、厚み0.15mm、イオン伝導率2x10-4 S/cm2 )を、2は負極側用の有機電解液して、1MのLiClO4を溶解した有機電解液(EC/DMC)1.5mlを、3は正極用の電解液として、1MのLiOHと1MのKOHの水溶液を、4はリチウム金属負極、5は正極としてNiOOHを、6は外装用缶、7は外部とつなぐリード線、を用いてニッケル−リチウム二次電池を作製し、充放電試験を行った。
放電と共に、負極の金属リチウムの表面には、Li => Li+ + e-となる溶解反応が、正極の表面には、NiOOH + H2O + e- => Ni(OH)2 + OH-なる還元反応が生じ、充電と共に、負極の金属リチウムの表面には、Li+ + e- => Li なる析出反応が、正極に、Ni(OH)2 + OH-=> NiOOH + H2O + e-なる酸化反応が生じる。
このニッケル−リチウム二次電池の0.1A/g, 0.2A/g, 0.5A/g, 1.0A/gの電流密度での充放電のプロファイルを図2に示す。図2に示すように、OCV(=開路電圧)は3.7V(vs Li/Li+)であり、0.1A/gと0.2A/gの電流密度で充放電した際の正極の容量は約268mAh/gであった。
このニッケル−リチウム二次電池を0.2A/gの電流密度で充放電した際の、50サイクルまでの容量およびクーロン効率とサイクル回数の関係を図3に示す。この電池は、50サイクルまでの充放電において、高い容量およびクーロン効率を安定に保っている。
このニッケル−リチウム二次電池の開路電圧(OCV)において、10mVの振幅で、1MHzから0.01Hzまで測定したインピーダンス(Impedance)曲線を図4に示す。高い周波数から低い周波数まで、二つの半円とそれに続く曲線は、それぞれ、界面抵抗、電荷移動抵抗、酸素拡散抵抗を示している。界面抵抗約160オームはほぼ固体電解質に由来する抵抗である。
【技術分野】
【0001】
本発明は、新規な反応を利用したニッケル−リチウム二次電池に関する。
【背景技術】
【0002】
従来より、ニッケル−水素二次電池やリチウムイオン電池について、数多くの研究がなされている(例えば、前者について、非特許文献1、後者について、特許文献1、特許文献2など)。
【0003】
ニッケル−水素二次電池は、約1.35V前後の比較的低い電圧を有するが、正極NiOOHの容量は約298mAh/gと大きい。一方、リチウムイオン電池は、正極の容量は約120mAh/gと小さいが、約4.0Vの高い電圧を有する。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特願2008−202754号
【特許文献2】特開2008−285372号
【非特許文献】
【0005】
【非特許文献1】S.R.Ovshisky, M. A. Fetcenko, J. Ross, Science, Vol.260, (1993), 176-181
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明は、ニッケル−水素二次電池の大きな正極容量とリチウムイオン電池の高い電圧という利点を両方利用することができる、ニッケル−リチウム二次電池を開発することを課題とする。
【課題を解決するための手段】
【0007】
本発明者らは、上記課題を解決するため、リチウムイオン電池の負極(例えば:金属リチウム)材料を負極として用い、ニッケル−水素二次電池の正極(NiOOH)材料を正極として用いる、新型のニッケル−リチウム二次電池を開発した。
【0008】
本発明のニッケル−リチウム二次電池においては、正負両極間の負極側に有機電解液を、また、正極側に水性電解液をそれぞれ配設し、負極側の有機電解液と正極側の水溶性電解液の間に、リチウムイオンのみを通す固体電解質をセパレータとして配設する。
【0009】
すなわち、この出願は以下の発明を提供するものである。
(1)リチウムイオン電池或いはリチウム二次電池の負極材料を負極として用い、ニッケル−水素二次電池の正極材料を正極として用いることを特徴とする、充電可能なニッケル−リチウム二次電池。
(2)リチウム金属或いはリチウムを豊富に含む化合物、負極用の電解液、セパレータ、正極用の電解液およびNiOOH或いはNi(OH)2あるいはNi(OH)3がその順に設けられたニッケル−リチウム二次電池であって、該セパレータがリチウムイオンのみを通す固体電解質を含むことを特徴とする、(1)に記載の充電可能なニッケル−リチウム二次電池。
(3)リチウムイオンのみを通す固体電解質が、Li3N、Garnet-Type型リチウムイオン伝導体、NASICON型リチウムイオン伝導体、β-Fe2(SO4) 型リチウムイオン伝導体、ペロブスカイト型リチウムイオン伝導体、チオLISICON型リチウムイオン伝導体、高分子型リチウムイオン伝導体から選ばれた少なくとも一種であることを特徴とする、(2)に記載の充電可能なニッケル−リチウム二次電池。
(4)負極として、リチウム金属、或いはリチウムが豊富に含む化合物、リチウムカーボン、リチウムシリコン、リチウム錫、窒化リチウムの中の一種類を選んで用い、負極用電解液が有機電解液であることを特徴とする、(2)または(3)に記載の充電可能なニッケル−リチウム二次電池。
(5)正極として、NiOOH或いはNi(OH)2、Ni(OH)3、NiO、Ni2O3の中の一種類を選んで用いることを特徴とする、(1)〜(4)のいずれかに記載のニッケル−リチウム二次電池。
(6)正極用電解液が水性電解液であり、水性電解液はアルカリ性(弱アルカリ性或いは強アルカリ性)であることを特徴とする、(2)〜(5)のいずれかに記載の充電可能なリチウム−ニッケル二次電池。
(7)正極用電解液が弱アルカリ性或いは強アルカリ性水を含むゲルであることを特徴とする、(2)〜(6)のいずれかに記載の充電可能なニッケル−リチウム二次電池。
(8)リチウムイオンのみを通す固体電解質の水性電解液側に、耐強アルカリ性高分子イオン交換膜がつけられていることを特徴とする、(2)〜(7)のいずれかに記載の充電可能なニッケル−リチウム二次電池。
(9)放電と共に、負極の金属リチウムの表面には、Li => Li+ + e-となる酸化(溶解)反応が、正極の側には、NiOOH + H2O + e- => Ni(OH)2 + OH- なる還元反応が生じ、充電と共に、負極の金属リチウムの表面には、Li+ + e- => Li なる還元(析出)反応が、正極電極においては、Ni(OH)2 + OH-=> NiOOH + H2O + e- なる酸化反応が生じることを特徴とする、(1)〜(8)のいずれかに記載の充電可能なニッケル−リチウム二次電池。
【発明の効果】
【0010】
本発明により、ニッケル−水素二次電池の有する大きな正極容量とリチウムイオン電池の有する高い電圧という利点を兼ね備えた、高容量、高電圧を有し、かつ、充放電の繰り返しに対して安定性の優れる、ニッケル−リチウム二次電池が提供される。
【図面の簡単な説明】
【0011】
【図1】本発明のニッケル−リチウム二次電池の全体の構成を示す説明図である。
【図2】実施例で得たニッケル−リチウム二次電池を用いて、0.1A/g, 0.2A/g, 0.5A/g,1.0A/gという電流密度で行った、充放電のプロファイルである。
【図3】実施例で得たニッケル−リチウム二次電池を0.2A/gの電流密度で、50サイクルまで充放電を行った際の、容量、クーロン効率とサイクル回数の関係を示す図である。
【図4】実施例で得たニッケル−リチウム二次電池に対して、開路電圧(OCV)において、10mVの振幅で、1MHzから0.01Hzまで測定したインピーダンス(Impedance)曲線である。
【発明を実施するための形態】
【0012】
本発明のニッケル−リチウム二次電池は、負極、負極用の電解液、セパレータ、正極用の電解液および正極がその順に設けられたニッケル−リチウム二次電池であって、該セパレータがリチウムイオンのみを通す固体電解質を含むことを特徴としている。
【0013】
本発明の代表的なニッケル−リチウム二次電池を、図1に示す。
図1において、1は固体電解質セパレータ、2は負極側用の有機電解液、3は正極用の水溶液電解液、4はリチウム金属負極、5は正極、6は外装用缶、7は外部とつなぐリード線、を示す。
【0014】
1の負極を形成する材料としては、リチウム金属、リチウムが豊富に含む化合物、リチウムカーボン、リチウムシリコン、リチウム錫、窒化リチウムなどが挙げられる。この中でも大容量、サイクル安定性の点からみて、金属リチウムが好ましく使用される。
【0015】
負極域の電解液は特に制限はないが、負極として金属リチウムを用いた場合には、電解液として有機電解液を用いる必要がある。
電解液に含有させる電解質としては、電解液中でリチウムイオンを形成するものであれば特に限定されない。例えば、LiPF6 、LiClO4 、LiBF4 、LiAsF6 、LiAlCl4 、LiCF3 SO3 、LiSbF6 等が挙げられる。これら電解質は、単独でもよいが、組み合わせて使用してもよい。
【0016】
また、電解液の溶媒としては、この種の有機溶媒として公知のものがすべて使用できる。例えば、プロピレンカーボネート、テトラヒドロフラン、ジメチルスルホキシド、γ−ブチロラクロン、1,3−ジオキソラン、4−メチル−1,3−ジオキソラン、1,2−ジメトキシエタン、2−メチルテトラヒドロフラン、スルホラン、ジエチルカーボネート、ジメチルホルムアミド、アセトニトリル、ジメチルカーボネート、エチレンカーボネート等が挙げられる。これら有機溶媒は、単独でもよいが、組み合わせて使用してもよい。
【0017】
3は、リチウムイオンのみを透過する固体電解質である。
本発明で用いるリチウムイオンのみを透過する固体電解質としては、たとえば、Li3N、Garnet-Type型リチウムイオン伝導体、 NASICON型リチウムイオン伝導体、β-Fe2(SO4) 型リチウムイオン伝導体、ペロブスカイト型リチウムイオン伝導体、チオLISICON型リチウムイオン伝導体、高分子型リチウムイオン伝導体が使用できる。実施例においては、NASICON型リチウムイオン伝導体を用いたが、広い電位範囲において酸化・還元反応が起こらない固体電解質が特に好ましく、例えば、Garnet-Type型リチウムイオン伝導体などが期待される。
リチウムイオンのみを透過する固体電解質ではなくて、普通のセパレータや、陽イオン一般が透過するイオン交換膜を使うと、リチウムイオンだけでなく、水素イオンなどが透過され、これが負極の金属リチウムと反応し、大量の水素を発生し、電池を構成することができず、本発明の所期の目的を達成することはできない。
【0018】
5の正極としては、NiOOH或いはNi(OH)2、Ni(OH)3、NiO、Ni2O3の中の一種類を選んで用いる。
【0019】
4の正極用の電解液としては、水性電解液、或いはアルカリ性水を含むゲルを用いることができる。
【0020】
つぎに本発明のニッケル−リチウム二次電池における充放電の機構を説明する。この電池においては、負極の金属リチウムは、負極用の有機電解液のみと接触し、正極のNiOOHは正極用の水性電解液のみと接触する。負極用電解液と正極用電解液の間には、リチウムイオンのみを透過する固体電解質が配設されており、充電と放電に伴い、リチウムイオンが当該固体電解質を通して、それぞれ、正極区域から負極区域へ、あるいは、負極区域から正極区域へと移動する。
放電時には、負極の金属リチウムの表面においては、Li => Li+ + e- なる酸化(溶解)反応が、正極の側ではNiOOH + H2O + e- => Ni(OH)2 + OH- なる還元反応が生じ、この際、負極区域溶液のLi+が、固体電解質を通して正極区域へ移動する。
充電時には、負極の金属リチウムの表面においては、Li+ + e- => Li なる還元(析出)反応が、正極の側ではNi(OH)2 + OH-=> NiOOH + H2O + e- なる酸化反応が生じ、この際、正極区域溶液のLi+が、固体電解質を通して負極区域へ移動する。
【実施例】
【0021】
本発明を以下の実施例により更に詳細に説明する。
【0022】
実施例1
図1に示される装置において、1は固体電解質セパレータとして、リチウムイオン固体電解質(NASICON型リチウムイオン伝導体LISICON、厚み0.15mm、イオン伝導率2x10-4 S/cm2 )を、2は負極側用の有機電解液して、1MのLiClO4を溶解した有機電解液(EC/DMC)1.5mlを、3は正極用の電解液として、1MのLiOHと1MのKOHの水溶液を、4はリチウム金属負極、5は正極としてNiOOHを、6は外装用缶、7は外部とつなぐリード線、を用いてニッケル−リチウム二次電池を作製し、充放電試験を行った。
放電と共に、負極の金属リチウムの表面には、Li => Li+ + e-となる溶解反応が、正極の表面には、NiOOH + H2O + e- => Ni(OH)2 + OH-なる還元反応が生じ、充電と共に、負極の金属リチウムの表面には、Li+ + e- => Li なる析出反応が、正極に、Ni(OH)2 + OH-=> NiOOH + H2O + e-なる酸化反応が生じる。
このニッケル−リチウム二次電池の0.1A/g, 0.2A/g, 0.5A/g, 1.0A/gの電流密度での充放電のプロファイルを図2に示す。図2に示すように、OCV(=開路電圧)は3.7V(vs Li/Li+)であり、0.1A/gと0.2A/gの電流密度で充放電した際の正極の容量は約268mAh/gであった。
このニッケル−リチウム二次電池を0.2A/gの電流密度で充放電した際の、50サイクルまでの容量およびクーロン効率とサイクル回数の関係を図3に示す。この電池は、50サイクルまでの充放電において、高い容量およびクーロン効率を安定に保っている。
このニッケル−リチウム二次電池の開路電圧(OCV)において、10mVの振幅で、1MHzから0.01Hzまで測定したインピーダンス(Impedance)曲線を図4に示す。高い周波数から低い周波数まで、二つの半円とそれに続く曲線は、それぞれ、界面抵抗、電荷移動抵抗、酸素拡散抵抗を示している。界面抵抗約160オームはほぼ固体電解質に由来する抵抗である。
【特許請求の範囲】
【請求項1】
リチウムイオン電池或いはリチウム二次電池の負極材料を負極として用い、ニッケル−水素二次電池の正極材料を正極として用いることを特徴とする、充電可能なニッケル−リチウム二次電池。
【請求項2】
リチウム金属或いはリチウムを豊富に含む化合物、負極用の電解液、セパレータ、正極用の電解液およびNiOOH或いはNi(OH)2あるいはNi(OH)3がその順に設けられたニッケル−リチウム二次電池であって、該セパレータがリチウムイオンのみを通す固体電解質を含むことを特徴とする、請求項1に記載の充電可能なニッケル−リチウム二次電池。
【請求項3】
リチウムイオンのみを通す固体電解質が、Li3N、Garnet-Type型リチウムイオン伝導体、NASICON型リチウムイオン伝導体、β-Fe2(SO4) 型リチウムイオン伝導体、ペロブスカイト型リチウムイオン伝導体、チオLISICON型リチウムイオン伝導体、高分子型リチウムイオン伝導体から選ばれた少なくとも一種であることを特徴とする、請求項2に記載の充電可能なニッケル−リチウム二次電池。
【請求項4】
負極として、リチウム金属、或いはリチウムを豊富に含む化合物、リチウムカーボン、リチウムシリコン、リチウム錫、窒化リチウムの中の一種類を選んで用い、負極用電解液が有機電解液であることを特徴とする、請求項2または3に記載の充電可能なニッケル−リチウム二次電池。
【請求項5】
正極として、NiOOH或いはNi(OH)2、Ni(OH)3、NiO、Ni2O3の中の一種類を選んで用いることを特徴とする、請求項1〜4のいずれかに記載の充電可能なニッケル−リチウム二次電池。
【請求項6】
正極用電解液が水性電解液であり、水性電解液はアルカリ性(弱アルカリ性或いは強アルカリ性)であることを特徴とする、請求項2〜5のいずれかに記載の充電可能なリチウム−ニッケル二次電池。
【請求項7】
正極用電解液が弱アルカリ性或いは強アルカリ性水を含むゲルであることを特徴とする、請求項2〜6のいずれかに記載の充電可能なニッケル−リチウム二次電池。
【請求項8】
リチウムイオンのみを通す固体電解質の水性電解液側に、耐強アルカリ性高分子イオン交換膜がつけられていることを特徴とする、請求項2〜7のいずれかに記載の充電可能なニッケル−リチウム二次電池。
【請求項9】
放電と共に、負極の金属リチウムの表面には、Li => Li+ + e-となる酸化(溶解)反応が、正極の側には、NiOOH + H2O + e- => Ni(OH)2 + OH- なる還元反応が生じ、充電と共に、負極の金属リチウムの表面には、Li+ + e- => Li なる還元(析出)反応が、正極電極においては、Ni(OH)2 + OH-=> NiOOH + H2O + e- なる酸化反応が生じることを特徴とする、請求項1〜8のいずれかに記載の充電可能なニッケル−リチウム二次電池。
【請求項1】
リチウムイオン電池或いはリチウム二次電池の負極材料を負極として用い、ニッケル−水素二次電池の正極材料を正極として用いることを特徴とする、充電可能なニッケル−リチウム二次電池。
【請求項2】
リチウム金属或いはリチウムを豊富に含む化合物、負極用の電解液、セパレータ、正極用の電解液およびNiOOH或いはNi(OH)2あるいはNi(OH)3がその順に設けられたニッケル−リチウム二次電池であって、該セパレータがリチウムイオンのみを通す固体電解質を含むことを特徴とする、請求項1に記載の充電可能なニッケル−リチウム二次電池。
【請求項3】
リチウムイオンのみを通す固体電解質が、Li3N、Garnet-Type型リチウムイオン伝導体、NASICON型リチウムイオン伝導体、β-Fe2(SO4) 型リチウムイオン伝導体、ペロブスカイト型リチウムイオン伝導体、チオLISICON型リチウムイオン伝導体、高分子型リチウムイオン伝導体から選ばれた少なくとも一種であることを特徴とする、請求項2に記載の充電可能なニッケル−リチウム二次電池。
【請求項4】
負極として、リチウム金属、或いはリチウムを豊富に含む化合物、リチウムカーボン、リチウムシリコン、リチウム錫、窒化リチウムの中の一種類を選んで用い、負極用電解液が有機電解液であることを特徴とする、請求項2または3に記載の充電可能なニッケル−リチウム二次電池。
【請求項5】
正極として、NiOOH或いはNi(OH)2、Ni(OH)3、NiO、Ni2O3の中の一種類を選んで用いることを特徴とする、請求項1〜4のいずれかに記載の充電可能なニッケル−リチウム二次電池。
【請求項6】
正極用電解液が水性電解液であり、水性電解液はアルカリ性(弱アルカリ性或いは強アルカリ性)であることを特徴とする、請求項2〜5のいずれかに記載の充電可能なリチウム−ニッケル二次電池。
【請求項7】
正極用電解液が弱アルカリ性或いは強アルカリ性水を含むゲルであることを特徴とする、請求項2〜6のいずれかに記載の充電可能なニッケル−リチウム二次電池。
【請求項8】
リチウムイオンのみを通す固体電解質の水性電解液側に、耐強アルカリ性高分子イオン交換膜がつけられていることを特徴とする、請求項2〜7のいずれかに記載の充電可能なニッケル−リチウム二次電池。
【請求項9】
放電と共に、負極の金属リチウムの表面には、Li => Li+ + e-となる酸化(溶解)反応が、正極の側には、NiOOH + H2O + e- => Ni(OH)2 + OH- なる還元反応が生じ、充電と共に、負極の金属リチウムの表面には、Li+ + e- => Li なる還元(析出)反応が、正極電極においては、Ni(OH)2 + OH-=> NiOOH + H2O + e- なる酸化反応が生じることを特徴とする、請求項1〜8のいずれかに記載の充電可能なニッケル−リチウム二次電池。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2011−81971(P2011−81971A)
【公開日】平成23年4月21日(2011.4.21)
【国際特許分類】
【出願番号】特願2009−231902(P2009−231902)
【出願日】平成21年10月5日(2009.10.5)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成23年4月21日(2011.4.21)
【国際特許分類】
【出願日】平成21年10月5日(2009.10.5)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

