ニトリル誘導体ならびにそれらの薬学的使用および組成物
ニトリル誘導体、およびニトリル誘導体を含む薬学的組成物が開示される。本薬学的組成物は、式I:(I)の化合物およびそのような化合物の薬学的に許容される塩を含む。そのような化合物の調製のための過程と、そのような化合物の調製において使用される中間物と、過剰増殖性疾患、炎症性疾患、およびウイルスおよび細菌感染の治療、ならびに癌細胞内でのアポトーシスの誘導におけるそのような化合物の使用、もまた開示される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ニトリル誘導体およびニトリル誘導体を含む薬学的組成物に関する。本発明は、そのような化合物の薬学的に許容される塩、そのような化合物を調製するための過程、そのような化合物の調製に使用される中間体、ならびに過剰増殖性疾患、炎症性疾患、およびウイルスおよび細菌感染の治療におけるそのような化合物の使用にも関する。
【背景技術】
【0002】
前述される誘導体およびそれらの薬学的に許容される塩は、AKT阻害、細胞周期過剰増殖の阻害、癌細胞におけるアポトーシスの細胞周期特異的誘導、LTB4活性の阻害、および抗血管形成活性のうちの1つまたは複数の特性を有し、実験動物において、腫瘍の大きさの著しい減少を示す。したがって、これらの化合物は、過剰増殖性疾患、例えば、神経膠腫を含む頭頸部癌、薬物耐性肺癌、ヒトにおけるエストロゲン依存性または非依存性癌、非小細胞肺癌、および結腸癌を含むが、これらに限定されない、哺乳動物における広範な疾患の治療に有用である。エストロゲン依存性癌の非限定例は、乳癌および卵巣癌である。それらのLTB4活性の阻害の結果として、これらの化合物は、炎症性疾患、例えば、アレルギー、喘息、および関節炎等の炎症性疾患の治療に有用であり、それらのAKT阻害およびサイトカイン活性の結果として、これらの化合物は、ウイルスおよび細菌感染の治療にも有用である。現在、前述の疾患に対する新しい治療法を見出すことに大きな関心が寄せられている。
【0003】
置換イソチオ尿素化合物の塩は、Miller et al.,JACS,Vol.62,2099−2103(1940)、Shapiro,et al.,Radiation Research,Vol.7,No.1,22−34(1957)、King et al.,Biochemistry,Vol.17,No.8,1499−1506(1978)、Bauer and Welsh,J.Org.Chem.Vol.26,No.5,1443−1445(1961)、Southan,et al.,Br.J.Pharmacol.,Vol.114,510−516(1995)、およびGerber,et al.,Organic Synthesis,Vol.77,186(2000)において言及されている。
【発明の概要】
【0004】
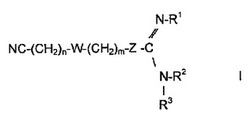
特定の実施形態において、本発明は、ヒトを含むが、これに限定されない哺乳動物において、癌、炎症性疾患、ならびにウイルスおよび細菌感染を含むが、これらに限定されない過剰増殖性疾患を治療するための薬学的組成物に関し、抗過剰増殖性疾患、抗炎症、抗ウイルス、または抗菌有効量の式Iの化合物であって、
【化1】

式中、Zは、硫黄、銅、銀、金、および白金から選択されるか、またはZは、ClO2、BrO2、およびIO2から選択されるハロゲン含有部分であり、
式中、nは、ゼロまたは1〜8の整数であり、mは、ゼロまたは1〜8の整数であり、
R1、R2、およびR3は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、およびC2−C6アルキニルから独立して選択され、アルキル、アルケニル、およびアルキニル基のアルキル部分は、直鎖、分岐、および環状、ならびに直鎖、分岐、および環状のアルキル、アルケニル、およびアルキニル部分の組み合わせであってもよく、基は、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、メトキシ、エトキシ、O−n−プロピル、O−イソプロピル、O−n−ブチル、およびO−t−ブチルから選択される基で置換され得るか、または
R1およびR2は、以下に示されるように、それらが直接結合する窒素、および前記窒素に結合する炭素と一緒に、5員以上の環を形成し、pは、1〜7の整数であり、
【化2】

式中、破線は、任意の二重結合を表すが、但し、そのような二重結合が存在するときには、R3は、非存在であり、二重結合に隣接するCH2基は、2個の水素ではなく1個の水素を有するか、
またはR2およびR3は、以下に示されるように、それらが結合する窒素と一緒に、3員以上の環を形成し、pは、1〜7の整数であり、
【化3】

Wは、非存在であるか、またはWは、
−CH2−、−CH2−CH2−、trans−CH=CH−、cis−CH=CH−、
【化4】

、または−CHR4−CHR5−、trans−CR4=CR5−、cis−CR4=CR5−から選択され、R4およびR5は、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、およびC1−C6アルキルエーテル(C1−C6アルキル−O−とも称される)から独立して選択されるか、または
Wは、二置換部分であり、二置換という用語は、Wが、
(a)以下の式によって示されるように、1、2、もしくは3個の二重結合を有し、飽和または不飽和であり得る、1,2−、1,3−、または1,4−二置換6員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換5員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換4員環、あるいは二重結合を有し、飽和および不飽和であり得る、1,2−二置換3員環であって、二置換環上の置換基は、式IのWに結合する基であり、
【化5】

式中、破線は、任意の二重結合を示す、環と、
(b)以下の式によって示されるように、1、2、もしくは3個の二重結合を有し、飽和または不飽和であり得る、1,2−、1,3−、または1,4−二置換6員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換5員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換4員環、あるいは二重結合を有し、飽和および不飽和であり得る、1,2−二置換3員環であって、二置換環上の置換基は、式IのWに結合する基であり、二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、およびR9を有してもよく、
【化6】

式中、破線は、任意の二重結合を示し、R6、R7、R8、およびR9は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立して選択され、6員環は、飽和であり得るか、または1、2、もしくは3個の二重結合を有してもよく、5員環および4員環は、飽和であり得るか、または1もしくは2個の二重結合を有してもよく、3員環は、飽和であり得るか、または1個の二重結合を有してもよく、Yは、窒素、酸素、または硫黄である、環と、
(c)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、または1,7−二置換飽和および不飽和9員環から選択される環であって、環は、以下に記載される2〜13番目の環から選択され、二置換環上の置換基は、式IのWに結合する基であり、二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、およびR10を有してもよく、
【化7】

式中、破線は、任意の二重結合を示し、
R6、R7、R8、R9、およびR10は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立してから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
(d)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、1,7−、または1,8−二置換飽和および不飽和ナフタレン環から選択される環であって、環は、以下に記載される2〜6番目の環から選択され、二置換環上の置換基は、式IのWに結合する基であり、二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、R10、およびR11を有してもよく、
【化8】

式中、破線は、任意の二重結合を示し、R6、R7、R8、R9、R10、およびR11は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立してから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
(e)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、1,7−、1,8−、1,9−、1,10−、2,5−、3,5−、4,5−、または5,10−二置換飽和および不飽和アントラセン環から選択される環であって、環は、以下に記載される2〜9番目の環から選択され、二置換環上の置換基は、式IのWに結合する基であり、二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、R10、R11、R12、およびR13を有してもよく、
【化9】

式中、破線は、任意の二重結合を示し、
R6、R7、R8、R9、R10、R11、R12、およびR13は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
から成る二置換部分の群から選択される、基(CH2)mおよび(CH2)nにどのように結合するかを示すために使用される、化合物、
またはその薬学的に許容される塩および薬学的に許容される担体を含む。
【0005】
一実施形態において、R1、R2、およびR3は、水素、メチル、エチル、n−プロピル、イソプロピル、シクロプロピル、−CH2−シクロプロピル、n−ブチル、sec−ブチル、イソブチル、tert−ブチル、シクロブチル、−CH2−シクロブチル、n−ペンチル、sec−ペンチル、イソペンチル、tert−ペンチル、シクロペンチル、−CH2−シクロペンチル、n−ヘキシル、sec−ヘキシル、シクロヘキシル、−CH2−シクロヘキシル、エテニル、プロペニル、ブテニル、1−メチル−2−ブテン−1−イル、エチニル、2−プロピニル(プロパルギル)、および1−プロピニルから独立して選択され、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、メトキシ、エトキシ、O−n−プロピル、O−イソプロピル、O−n−ブチル、およびO−t−ブチルから選択される1つまたは複数の置換基を担持し得る。
【0006】
発明の一実施形態において、式Iの化合物は、式II
【化10】

の化合物であり、式中、n、m、W、Z、R1、R2、およびR3は、上記で定義されるとおりであり、Xは、薬学的に許容される酸である。一実施形態において、酸は、HClである。別の実施形態において、酸は、HBrである。
【0007】
発明の一実施形態において、Zは、硫黄、銅、銀、金、または白金である。発明の別の実施形態において、Zは硫黄である。発明の別の実施形態において、Zは銅である。発明の別の実施形態において、Zは金である。発明の別の実施形態において、Zは、上記で定義されるようなハロゲン含有部分である。発明の別の実施形態において、R1、R2、およびR3は、それぞれ水素である。発明の一特定化合物において、Zは銅であり、R1、R2、およびR3は、それぞれ水素であり、mは1であり、nは1であり、WはCH2である。
【0008】
発明の一実施形態において、R4、R5、R6、R7、R8、R9、R10、R11、R12、およびR13は、水素、メチル、エチル、n−プロピル、イソプロピル、シクロプロピル、−CH2−シクロプロピル、ビニル、アリール、n−ブチル、sec−ブチル、イソブチル、tert−ブチル、シクロブチル、−CH2−シクロブチル、n−ペンチル、sec−ペンチル、イソペンチル、tert−ペンチル、シクロペンチル、−CH2−シクロペンチル、n−ヘキシル、sec−ヘキシル、シクロヘキシル、−CH2−シクロヘキシル、エテニル、プロペニル、ブテニル、1−メチル−2−ブテン−1−イル、エチニル、2−プロピニル(プロパルギル)、および1−プロピニルから独立して選択され、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、メトキシ、エトキシ、O−n−プロピル、O−イソプロピル、O−n−ブチル、およびO−t−ブチルから選択される、1つまたは複数の置換基を担持し得る。
【0009】
発明の一実施形態において、Wは、アリールまたはビニルである。
【0010】
本発明の一実施形態は、哺乳動物における癌、炎症性疾患、ならびにウイルスおよび細菌感染を含むが、これらに限定されない過剰増殖性疾患の治療のための薬学的組成物に関し、抗過剰増殖性疾患、抗炎症、抗ウイルス、または抗菌有効量の4−イソチオウレイドブチロニトリル(S−(3−シアノプロピル)イソチオ尿素またはS−(γ−シアノプロピル)イソチオ尿素とも称される)またはその薬学的に許容される塩、および薬学的に許容される担体を含む。特定の実施形態において、組成物は、「Kevetrin」としても知られる、4−イソチオウレイドブチロニトリルの塩酸酸付加塩を含む。この塩は、以下の式を有する。
【化11】

【0011】
別の実施形態において、組成物は、4−イソチオウレイドブチロニトリルの臭化水素酸酸付加塩を含む。
【0012】
別の実施形態において、本発明は、哺乳動物における癌、炎症性疾患、ならびにウイルスおよび細菌感染を含むが、これらに限定されない過剰増殖性疾患の治療のための薬学的組成物に関し、抗過剰増殖性疾患、抗炎症、抗ウイルス、または抗菌有効量のS−(2−シアノエチル)イソチオ尿素、S−(4−シアノブチル)イソチオ尿素、S−(5−シアノペンチル)イソチオ尿素から選択される化合物、またはその薬学的に許容される塩、および薬学的に許容される担体を含む。
【0013】
別の実施形態において、本発明は、哺乳動物における癌、炎症性疾患、ならびにウイルスおよび細菌感染を含むが、これらに限定されない過剰増殖性疾患の治療のための薬学的組成物に関し、抗過剰増殖性疾患、抗炎症、抗ウイルス、または抗菌有効量のS−(4−シアノメチルフェニル)メチルイソチオ尿素塩酸塩、S−2(4−[2−シアノエチル]フェニル)エチルイソチオ尿素メシレート、S−(2−シアノメチルフェニル)メチルイソチオ尿素塩酸塩、S−(6−シアノメチルピリジン−2−イル)メチルイソチオ尿素塩酸塩、S−(3−シアノメチルフェニル)メチルイソチオ尿素塩酸塩、S−(1−シアノメチルナフト−2−イル))メチルイソチオ尿素塩酸塩から選択される化合物、またはその異なる薬学的に許容される塩、および薬学的に許容される担体を含む。別の実施形態において、薬学的組成物は、以下に記載される実施例11で説明されるように調製される化合物から選択される化合物、またはその異なる薬学的に許容される塩、またはその遊離塩基、および薬学的に許容される担体を含む。
【0014】
発明の一実施形態において、薬学的組成物は、S−シアノメチルイソチオ尿素HBrを含まない。発明の別の実施形態において、薬学的組成物は、S−シアノメチルイソチオ尿素HClまたはS−シアノメチルイソチオ尿素HBrを含まない。発明の別の実施形態において、薬学的組成物は、S−シアノメチルイソチオ尿素の薬学的に許容される塩を含まない。発明の別の実施形態において、薬学的組成物は、遊離塩基または塩として、S−シアノメチルイソチオ尿素を含まない。
【0015】
発明の一実施形態において、薬学的組成物は、S−(2−シアノエチル)イソチオ尿素HCl、S−シアノメチルイソチオ尿素HBr、およびS−シアノメチルイソチオ尿素HClを含まない。発明の別の実施形態において、薬学的組成物は、S−(2−シアノエチル)イソチオ尿素HCl、S−(2−シアノエチル)イソチオ尿素HBr、S−シアノメチルイソチオ尿素HCl、またはS−シアノメチルイソチオ尿素HBrを含まない。発明の別の実施形態において、薬学的組成物は、S−(2−シアノエチル)イソチオ尿素、およびS−シアノメチルイソチオ尿素の薬学的に許容される塩を含まない。発明の別の実施形態において、薬学的組成物は、S−(2−シアノエチル)イソチオ尿素を遊離塩基または塩として含まず、S−シアノメチルイソチオ尿素を遊離塩基または塩として含まない。
【0016】
発明の別の実施形態において、薬学的組成物は、S−(シアノメチル)イソチオ尿素HCl、S−(シアノメチル)イソチオ尿素HBr、S−(2−シアノエチル)イソチオ尿素HCl、S−(2−シアノエチル)イソチオ尿素HBr、S−(2−シアノエチル)イソチオ尿素p−トルエンスルホネート、S−(3−シアノプロピル)イソチオ尿素HCl、S−(3−シアノプロピル)イソチオ尿素ピクリン酸、およびS−パラ−シアノベンジルイソチオ尿素HClを含まない。発明の別の実施形態において、薬学的組成物は、S−(3−シアノプロピル)イソチオ尿素またはS−パラ−シアノベンジルイソチオ尿素の臭化水素酸塩も含まない。
【0017】
発明の別の実施形態において、薬学的組成物は、S−(シアノメチル)イソチオ尿素、S−(2−シアノエチル)イソチオ尿素、S−(3−シアノプロピル)イソチオ尿素、またはS−パラ−シアノベンジルイソチオ尿素の薬学的に許容される塩を含まない。発明の別の実施形態において、化合物は、S−(シアノメチル)イソチオ尿素、S−(2−シアノエチル)イソチオ尿素、S−(3−シアノプロピル)イソチオ尿素、およびS−パラ−シアノベンジルイソチオ尿素、およびその薬学的に許容される塩から選択されない。
【0018】
式Iの化合物の薬学的に許容される塩は、その酸付加および塩基塩(二塩を含む)を含む。適切な酸付加塩は、非毒性塩を形成する酸から形成される。例には、酢酸塩、アスパラギン酸塩、安息香酸塩、ベシル酸塩、重炭酸塩/炭酸塩、重硫酸塩/硫酸塩、ホウ酸塩、カンシル酸塩、クエン酸塩、エジシル酸塩、エシル酸塩、ギ酸塩、フマル酸塩、グルセプチン酸塩、グルコン酸塩、グルクロン酸塩、ヘキサフルオロリン酸塩、ヒベンズ酸塩、塩酸塩/塩化物、臭化水素酸塩/臭化物、ヨウ化水素酸塩/ヨウ化物、イセチオン酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マロン酸塩、メシル酸塩、メチル硫酸塩、ナフチル酸塩、2−ナプシル酸塩、ニコチン酸塩、硝酸塩、オロチン酸塩、オキサル酸塩、パルミチン酸塩、パモ酸塩、リン酸塩/リン酸水素/リン酸二水素、サッカラート、ステアリン酸塩、コハク酸塩、酒石酸塩、トシル酸塩、およびトリフルオロ酢酸塩が挙げられる。適切な塩基塩は、非毒性塩を形成する塩基から形成される。例には、アルミニウム、アルギニン、ベンザチン、カルシウム、塩素、ジエチルアミン、ジオラミン、グリシン、リシン、マグネシウム、メグルミン、オラミン、カリウム、ナトリウム、トロメタミン、および亜鉛塩が挙げられる。適切な塩に関する考察は、″Handbook of Pharmaceutical Salts:Properties,Selection,and Use″by Stahl and Wermuth(Wiley−VCH,Weinheim,Germany,2002)を参照されたい。
【0019】
式Iの化合物の薬学的に許容される塩は、式Iの化合物の溶液および所望の酸または塩基を、必要に応じて一緒に混合することによって容易に調製され得る。塩は、溶液から沈殿し、ろ過によって収集され得るか、または溶媒の蒸発によって回収され得る。塩中のイオン化の程度は、完全なイオン化からほぼ非イオン化まで異なり得る。
【0020】
式Iの化合物およびその薬学的に許容される塩(以降、活性化合物とも称される)は、非溶媒および溶媒形態で存在し得る。活性化合物(塩、遊離塩基、遊離酸、および中性化合物の形態のものを含む)は、水和物および他の溶媒を形成し得る。「溶媒和物」とう用語は、本明細書において、発明の化合物、および1つまたは複数の薬学的に許容される溶媒分子、例えば、エタノールを含む、分子複合体を説明するために使用される。「水和物」という用語は、当該溶媒が水である場合に用いられる。薬学的に許容される溶媒は、水和物および他の溶媒を含み、結晶化の溶媒は、同位体置換、例えば、D2O、d6−アセトン、d6−DMSOであり得る。活性化合物は、クラスレートまたは他の複合体として存在し得る。一般に、溶媒、水和等の形態は、非溶媒、非水和/無水等の形態と同等であり、本明細書において請求される化合物、組成物、および用途は、これらの形態、ならびに異性体、結晶、および非晶質形態、ならびに以下に論じられる同位体標識化合物を、本発明の範囲内に包含することが意図される。
【0021】
1つまたは複数の非対称炭素原子を含有する式Iの化合物は、2つ以上の立体異性体として存在し得る。式Iの化合物がアルケニルまたはアルケニレン基、あるいはシクロアルケニル基を含有する場合、幾何cis/trans(またはZ/E)異性体が可能である。化合物が、例えば、ケトまたはオキシム基、あるいは芳香族部分を含有する場合、互変異性異性(「互変異性」)が起こり得る。単一の化合物が、1種類より多くの互変異性を呈し得るということになる。式Iの化合物は、それらが酸付加または塩基塩を形成する場合、異性体としても存在し得、そこでは対イオンは、光学的に活性な、例えば、D−乳酸またはL−リシン、あるいはラセミ、例えば、DL−酒石酸またはDL−アルギニンである。
【0022】
立体異性体の混合物は、当業者に知られている従来技術によって分離され得る。例えば、″Stereochemistry of Organic Compounds″by E.L..Eliel(Wiley,New York,1994)を参照されたい。
【0023】
Cis/trans異性体は、当業者によく知られている従来技術、例えば、クロマトグラフィおよび分別結晶によって分離され得る。
【0024】
一般に、本発明の鏡像異性的に純粋な化合物は、当該技術分野において知られている過程、例えば、適切な光学的に純粋な前駆体からのキラル合成およびラセミ化合物(または塩あるいは誘導体のラセミ化合物)の溶解に従って、調製および単離され得る。例えば、ラセミ化合物(またはラセミ前駆体)は、キラル高圧液体クロマトグラフィ(HPLC)を使用して分離され得る。代替として、ラセミ化合物(またはラセミ前駆体)は、適切な光学的に活性な化合物、例えば、アルコールと反応し得るか、または式Iの化合物が酸性または塩基性部分を含有する場合は、酸または塩基、例えば、酒石酸または1−フェニルエチルアミンと反応し得る。得られるジアステレオ異性体混合物は、クロマトグラフィまたは分別結晶、あるいはそれらの両方によって分離され得、両方のジアステレオ異性体は、当業者によく知られている手段によって、1つまたは複数の対応する純粋な鏡像異性体に変換され得る。
【0025】
本発明のキラル化合物(およびそのキラル前駆体)は、クロマトグラフィ、通常、HPLCを使用して、鏡像異性的に富化された形態で、非対称固定相および移動相を有する樹脂上で取得されてもよく、それは炭化水素、通常、ヘプタンまたはヘキサンから成り、0〜50%のイソプロパノール、通常、2〜20%、および0〜5%のアルキルアミン、通常0.1%のジエチルアミンを含有する。溶出液の濃縮は、富化混合物をもたらす。
【0026】
固体の状態において、本発明の化合物は、結晶または非晶質形態で存在し得る。
【0027】
本発明は、本明細書において請求される式Iの薬学的に許容されるすべての同位体標識化合物を含み、そこでは1つまたは複数の原子が、同一の原子番号を有するが、原子質量または質量番号が、自然界で通常見出される原子質量または質量番号とは異なる原子と置換される。
【0028】
発明の化合物に含有するために適した同位体の例には、水素の同位体、例えば2Hおよび3H、炭素の同位体、例えば11C、13C、および14C、塩素の同位体、例えば36Cl、フッ素のの同位体、例えば18F、ヨウ素の同位体、例えば123Iおよび125I、窒素の同位体、例えば13Nおよび15N、酸素の同位体、例えば15O、17O、および18O、リンの同位体、例えば32P、および硫黄の同位体、例えば、35Sが挙げられる。式Iの特定の同位体的標識化合物、例えば、放射性同位体を組み込むものは、薬物および/または基質組織分布研究において有用である。放射性同位体のトリチウム、すなわち3H、および炭素14、すなわち14Cは、それらの組み込みの容易さ、および検出の容易な手段を考慮すると、この目的で特に有用である。より重い同位体、例えば、ジウテリウム、すなわち2Hによる置換は、優れた代謝安定性、例えば、インビボ半減期の増加または用量要件の減少によって生じる特定の治療利益をもたらし得、したがって、いくつかの状況において好適であり得る。陽電子放出同位体、例えば、11C、18F、15O、および13Nによる置換は、陽電子放出トポグラフィ(PET)研究において、置換基受容体の占有を調べるために有用であり得る。
【0029】
式Iの同位体的標識化合物は、一般に、当業者に知られている従来技術によって、または添付の実施例に記載されるものに類似する過程によって、以前に用いられた非標識試薬の代わりに、適切な同位体的標識試薬を使用して、調製され得る。
【0030】
本発明は、抗過剰増殖有効量の式Iの化合物、またはその薬学的に許容される塩、および薬学的に許容される担体を含む、細胞過剰増殖の治療のための薬学的組成物にも関する。別の実施形態において、本発明は、抗癌有効量の式Iの化合物、またはその薬学的に許容される塩、および薬学的に許容される担体を含む、癌治療のための薬学的組成物に関する。別の実施形態において、本発明は、アポトーシス誘導有効量の式Iの化合物、またはその薬学的に許容される塩、および薬学的に許容される担体を含む、癌治療のための薬学的組成物に関する。他の実施形態において、上述される薬学的組成物から除外される化合物の1つまたは複数は、この段落で参照される薬学的組成物からも同様に除外され得る。
【0031】
本発明は、癌を含むが、それに限定されない細胞過剰増殖の治療のための、抗過剰増殖または抗癌有効量の式Iの化合物、またはその薬学的に許容される塩、および薬学的に許容される担体を含む、用量単位形態の薬学的組成物にも関する。他の実施形態において、上述される薬学的組成物から除外される化合物の1つまたは複数は、前述の薬学的組成物からも同様に除外され得る。
【0032】
本発明は、癌を含むが、それに限定されない細胞過剰増殖の治療のための、抗過剰増殖または抗癌有効量の式Iの化合物、またはその薬学的に許容される塩、および薬学的に許容される担体を含む、非経口薬学的組成物にも関する。医薬品は、所望される量の製品を、滅菌等張液に溶解することによって得ることができ、任意の所望される経路で容易に投与され得る。他の実施形態において、上述薬学的組成物から除外される化合物の1つまたは複数は、前述の薬学的組成物からも同様に除外され得る。
【0033】
本発明は、ヒトを含む哺乳動物において、癌を含むが、これらに限定されない過剰増殖性疾患、炎症性疾患、ならびにウイルスおよび細菌感染を治療する方法にも関し、そのような治療を必要とする患者に、抗過剰増殖性疾患、抗炎症、抗ウイルスまたは抗菌有効量の式Iの化合物、またはその薬学的に許容される塩を投与することを含む。一実施形態において、化合物は、S−(3−シアノプロピル)イソチオ尿素、S−(2−シアノエチル)イソチオ尿素、S−(4−シアノブチル)イソチオ尿素、S−(5−シアノペンチル)イソチオ尿素、S−(4−シアノメチルフェニル)メチルイソチオ尿素、S−2(4−[2−シアノエチル]フェニル)エチルイソチオ尿素、S−(2−シアノメチルフェニル)メチルイソチオ尿素、S−(6−シアノメチルピリジン−2−イル)メチルイソチオ尿素、S−(3−シアノメチルフェニル)メチルイソチオ尿素、およびS−(1−シアノメチルナフト−2−イル))メチルイソチオ尿素、およびその薬学的に許容される塩から選択される。別の実施形態において、化合物は、S−(3−シアノプロピル)イソチオ尿素塩酸塩から選択される。別の実施形態において、化合物は、以下の実施例11に記載されるように調製される化合物、またはその異なる薬学的に許容される塩、またはその遊離塩基から選択される。
【0034】
本発明は、過剰増殖性疾患を治療する方法にも関し、そのような治療を必要とする患者に、抗過剰増殖有効量の式Iの化合物、またはその薬学的に許容される塩を投与することを含む。別の実施形態において、本発明は、癌を治療する方法に関し、そのような治療を必要とする患者に、抗癌有効量の式Iの化合物、またはその薬学的に許容される塩を投与することを含む。別の実施形態において、本発明は、癌を治療する方法に関し、そのような治療を必要とする患者に、アポトーシス誘導有効量の式Iの化合物、またはその薬学的に許容される塩を投与することを含む。他の実施形態において、上述薬学的組成物から除外される化合物の1つまたは複数は、この段落で参照される方法からも同様に除外され得る。
【0035】
本発明は、哺乳動物において、頭頸部癌、非小細胞肺癌、小細胞肺癌、耐性型の肺および任意の女性癌、卵巣癌、乳癌、または結腸癌を治療する方法にも関し、そのような治療を必要とする哺乳動物に、抗癌有効量の式Iの化合物、またはその薬学的に許容される塩を投与することを含む。本発明の一実施形態において、癌は、頭頸部癌、非小細胞肺癌、卵巣癌、および結腸癌から選択される。本発明の一実施形態において、頭部癌は、神経膠腫である。
【0036】
本発明は、アポトーシスの誘導に応答する過剰増殖性疾患の治療を、そのような治療を必要とする哺乳動物において行う方法にも関し、それを必要とする哺乳動物に、個別に、同時に、一斉に、順次、または経時的にずらして、式Iの化合物またはその薬学的に許容される塩である、活性化合物の量、および少なくとも1つの二次化合物または放射線の量を投与することを含み、二次化合物は、化学療法抗癌剤および標的特異的抗癌剤から成る群から選択される抗癌剤であり、活性化合物および当該二次化合物または放射線の量は、治療効果をもたらす。発明の一実施形態において、当該二次化合物は、(i)アルキル化/カルバミル化剤、(ii)白金誘導体、(iii)抗有糸分裂剤/チューブリン阻害剤、(iv)トポイソメラーゼ阻害剤、(v)ピリミジン拮抗薬、(vi)プリン拮抗薬、(vii)葉酸拮抗薬、および(viii)注入放射性物質から成る群から選択される。発明の一実施形態において、当該標的特異的抗癌剤は、(i)キナーゼ阻害剤、(ii)プロテアソーム阻害剤、(iii)ヒストン脱アセチル化阻害剤、(iv)熱衝撃タンパク質90阻害剤、(v)血管標的剤(VAT)抗血管新生薬、およびKDRチロシンキナーゼ阻害剤、(vi)モノクローナル抗体および変異体、およびモノクローナル抗体と抗体フラグメントの複合体、(vii)オリゴヌクレオチド系治療薬、(viii)トール様受容体/TLR9作動薬、TLR7作動薬およびその類似体、またはTLR7/8作動薬およびTLR7/8作動薬としての免疫刺激性RNA、(ix)プロテアーゼ阻害剤、(x)ホルモン治療薬、(xi)ブレオマイシン、(xii)レチノイド、(xiii)DNAメチルトランスフェラーゼ阻害剤、(xiv)アラノシン、(xv)サイトカイン、(xvi)インターフェロン、および(xvii)細胞死受容体作動薬から成る群から選択される。発明の一実施形態において、当該式Iの化合物またはその薬学的に許容される塩は、抗癌有効量の放射線と個別に、同時に、一斉に、順次、または経時的にずらして投与される。本明細書で使用される、用語「有効量」は、それ自体で投与される場合に有効な活性化合物の量、および別の治療剤と併せて投与される場合に有効な活性化合物の量を含むことは、前述から明らかである。
【0037】
本発明の方法によって治療され得る過剰増殖性疾患には、これらに限定されないが、乳房、膀胱、骨、脳、中枢および末梢神経系、結腸、内分泌腺、食道、子宮内膜、生殖細胞、頭頸部、腎臓、肝臓、肺、咽頭および下咽頭、中皮腫、肉腫、卵巣、膵臓、前立腺、肛門、小腸、柔組織、睾丸、胃、皮膚、尿管、膣および外陰の癌、遺伝性癌、網膜芽腫、およびウィルムス腫瘍、白血病、リンパ腫、非ホジキン病、慢性および急性骨髄性白血病、急性リンパ芽球性白血病、ホジキン病、多発性骨髄腫、およびT細胞リンパ腫、骨髄異形成症候群、形質細胞新生組織形成、腫瘍随伴症候群、未知の原発部位の癌、薬物耐性癌、およびAIDS関連悪性腫瘍が挙げられ、疾患は、そのような治療を必要とする哺乳動物に、抗過剰増殖または抗癌有効量の式Iの化合物、またはその薬学的に許容される塩を投与することによって治療される。発明の一実施形態において、過剰増殖性疾患は、頭頸部癌、非小細胞肺癌、小細胞肺癌、耐性型肺癌および任意の女性癌、乳癌、卵巣癌、および結腸癌から成る群から選択される。
【0038】
本発明は、上記で定義されるような式Iの化合物、またはその薬学的に許容される塩であるが、但し、S−(シアノメチル)イソチオ尿素HCl、S−(シアノメチル)イソチオ尿素HBr、S−(2−シアノエチル)イソチオ尿素HCl、S−(2−シアノエチル)イソチオ尿素HBr、S−(2−シアノエチル)イソチオ尿素p−トルエンスルホン酸塩、S−(3−シアノプロピル)イソチオ尿素HCl、S−(3−シアノプロピル)イソチオ尿素 ピクリン酸、およびS−パラ−シアノベンジルイソチオ尿素HClではないことを条件とする、化合物にも関する。本発明の別の実施形態において、化合物は、S−(3−シアノプロピル)イソチオ尿素、またはS−パラ−シアノベンジルイソチオ尿素の臭化水素酸塩でもない。
【0039】
本発明の別の実施形態において、化合物は、S−(シアノメチル)イソチオ尿素、S−(2−シアノエチル)イソチオ尿素、S−(3−シアノプロピル)イソチオ尿素、またはS−パラ−シアノベンジルイソチオ尿素の薬学的に許容される塩ではない。本発明の別の実施形態において、化合物は、S−(シアノメチル)イソチオ尿素、S−(2−シアノエチル)イソチオ尿素、S−(3−シアノプロピル)イソチオ尿素、およびS−パラ−シアノベンジルイソチオ尿素、およびその薬学的に許容される塩から選択されない。
【0040】
S−シアノメチルイソチオ尿素は、カルバムイミドチオ酸,シアノメチルエステルとも称され、S−(2−シアノエチル)イソチオ尿素は、カルバムイミドチオ酸,シアノエチルエステルとも称され、S−(3−シアノプロピル)イソチオ尿素は、カルバムイミドチオ酸,シアノプロピルエステルとも称され、S−パラ−シアノベンジルイソチオ尿素は、カルバムイミドチオ酸,(4−シアノフェニル)メチルエステルとも称されることに留意されたい。
【0041】
本発明の一実施形態において、化合物は、S−(4−シアノブチル)イソチオ尿素、およびS−(5−シアノペンチル)イソチオ尿素、ならびにその薬学的に許容される塩から選択される。本発明の別の実施形態において、化合物は、S−(4−シアノメチルフェニル)メチルイソチオ尿素塩酸塩、S−2(4−[2−シアノエチル]フェニル)エチルイソチオ尿素メシレート、S−(2−シアノメチルフェニル)メチルイソチオ尿素塩酸塩、S−(6−シアノメチルピリジン−2−イル)メチルイソチオ尿素塩酸塩、S−(3−シアノメチルフェニル)メチルイソチオ尿素塩酸塩、S−(1−シアノメチルナフト−2−イル))メチルイソチオ尿素塩酸塩、またはその異なる薬学的に許容される塩から選択される。別の実施形態において、化合物は、以下に記載される実施例11で説明されるように調製される化合物、またはの異なる薬学的に許容される塩、もしくはその遊離塩基から選択される。
【0042】
本発明は、Zが硫黄である、式Iの化合物の塩酸塩付加塩を調製するための過程にも関し、チオ尿素または式
【化12】

のチオ尿素誘導体であって、式中、R1、R2、およびR3は、式Iに関して上
記で定義されるとおりである、チオ尿素誘導体を、式NC−(CH2)n−W−(CH2)mClの適切なニトリル誘導体であって、n、m、およびWは、式Iの化合物に関して上記で定義されるとおりである、ニトリル誘導体と、水または水/アルコール溶媒中、あるいは極性溶媒中、還流温度で反応させて、Zが硫黄である式Iの化合物を得ること、および必要に応じて、遊離塩基または異なる酸付加塩を調製することを含む。発明の一実施形態において、溶媒は、メタノール、エタノール、イソプロパノールから選択されるアルコール、および前述のアルコールの1つまたは複数と水との混合液から選択される。
【0043】
本発明は、式Iの化合物の塩酸付加塩を調製するための過程にも関し、Zは、銅、銀、金、白金、およびClO2、BrO2、およびIO2から選択されるハロゲン含有部分から選択され、式NC−(CH2)n−W−(CH2)mClの化合物であって、n、m、およびWは、式Iの化合物に関して上記で定義されるとおりである、化合物を、それぞれの金属の塩またはハロゲン含有部分の塩と反応させて、中間化合物を形成すること、および次に、中間化合物を、チオ尿素または式
【化13】

のチオ尿素誘導体であって、R1、R2、およびR3は、式Iに関して上記で定義されるとおりである、チオ尿素誘導体と反応させて、Zが銅、銀、金、白金、またはClO2、BrO2、およびIO2から選択されるハロゲン含有部分である、式Iの化合物を得ることであって、中間物の形成および酸付加塩の形成は、水または水/アルコール溶媒または極性溶媒中、還流温度で行われることと、および必要に応じて、遊離塩基または異なる酸付加塩を調製することを含む。発明の一実施形態において、溶媒は、メタノール、エタノール、イソプロパノールから選択されるアルコール、および前述のアルコールの1つまたは複数と水との混合液から選択される。本発明は、式Iの化合物の臭化水素酸酸付加塩、および式Iの化合物のメシレート塩の調製にも関する。臭化水素酸酸付加塩は、上述の過程において、開始物質を含有する臭素を置換することによって調製される。メシレート塩は、上述の過程において、メシレート開始物質を置換することによって調製される。本発明の二塩は、塩を開始物質として使用することによって同様に調製され得る。遊離塩基が2つの塩基中心を有する場合、そのような塩を形成することが可能であり得る。
【図面の簡単な説明】
【0044】
【図1】Kevetrin細胞毒性の時間依存性を示す。ヒト癌細胞を、異なる濃度のKevetrinに、5、10、20、30、あるいは45分間、または1、2、6、24、または120時間曝露した。IC50として表される細胞生存能力を、MTT分析を使用して測定して、Kevetrin曝露の時間に対してプロットした。
【図2】Kevetrinおよびシスプラチンの活性スペクトルを示す。Kevetrinおよびシスプラチンが、表示腫瘍細胞株の生存能力に及ぼす影響を、3倍増時間Kevetrinに連続曝露した後、MTT分析を使用して測定した。表示値は、以下のように計算する:ログ(IC50個別の細胞株−IC50平均)。負の値は、細胞株が、平均よりも感受性が高いことを示すが、正の値は、細胞株が平均よりも耐性が高いことを示す。試験したすべての細胞株の平均IC50は、Kevetrinの場合、4.9x10−7M、シスプラチンの場合、2.1x10−6Mであった。
【図3】Kevetrinに起因するマウスの体重変化を示す。0日目にKevetrin IV100mg/kgまたは200mg/kgのいずれかで処置した後のマウスの動物体重が示される。
【図4】哺乳動物癌におけるKevetrinまたはタキソールの有効性を示す。MDA−MB−231ヒト乳癌を持つマウスを、7、9、および11日目に200mg/kgKevetrinの静脈内注入で処置し、7、9、11、および13日目の22mg/kgタキソールの静脈内注入と比較した。
【図5】結腸癌におけるKevetrinまたは5−FUの有効性を示す。HT−29腫瘍を持つ裸マウスを、7、9、および11日目に、200mg/kgのKevetrinの静脈内注入または5−FUのいずれかで処置した。
【図6】前立腺癌におけるKevetrinまたはシスプラチンの有用性を示す。PC−3腫瘍を有する裸マウスを、7、9、および11日目に200mg/kg Kevetrinの静脈内注入または7日目に10mg/kgのシスプラチンのいずれかで処置した。
【図7】ヒトP−糖タンパク質媒介耐性結腸癌におけるKevetrinまたはタキソールの有効性を示す。HCT−15腫瘍を有する裸マウスを、7、9、および11日目に200mg/kg Kevetrinの静脈内注入または腫瘍後7、9、11、および13日目に22mg/kgタキソールのいずれかで処置した。
【図8】A549多剤耐性ヒト肺癌における7、9、および11日目のKevetrin200mg/kg、および7、9、11、および13日目のタキソール22mg/kgの有効性を示す。
【図9】NCI−H1975多剤耐性ヒト肺癌における7、9、および11日目のKevetrin200mg/kg、および13日目のタキソール22mg/kgの有効性を示す。
【発明を実施するための形態】
【0045】
Zが硫黄である、本発明において有用な化合物は、チオ尿素を、式NC−(CH2)n−W−(CH2)mClの適切なニトリル誘導体と反応させることによって、水中で調製され、式中、n、m、およびWは、式Iの化合物に関して上で定義されるとおりである。等量のチオ尿素およびニトリルを、10倍量の水または水/アルコール溶媒、または極性溶媒に添加し、加熱して、約4時間、大気圧で還流させる。水およびアルコールの混合液を調製するため、または極性溶媒として使用するために適したアルコールの非限定例には、メタノール、エタノール、およびイソプロパノールが挙げられる。反応混合液を蒸発させて、所望の生成物を得る。この生成物は、エタノールまたは別の適切な溶媒、例えば、イソプロパノールまたはメタノール、あるいは前述のアルコールの1つとアセトンとの混合液からの再結晶化によって精製される。結晶物質は、ろ過によって収集され、高真空下で乾燥される。Zが、銅、銀、金、および白金から選択されるか、またはZが、ClO2、BrO2、およびIO2から選択される、ハロゲン含有部分である、式Iの化合物は、同様に調製される。
【0046】
W部分のYが、硫黄、酸素、または窒素である、式Iの化合物は、硫黄、酸素、または窒素が、W部分の環上の所望の位置にある、適切なニトリル誘導体を選択することによって調製される。
【0047】
当業者であれば、関心対象の特定の化合物を形成するために、上述のものから条件を選択する方法、またはそこに修正を行う方法が分かる。
【0048】
患者の疾患および状態に応じて、本明細書で使用される、用語「治療」は、治療、緩和、および予防的治療の1つまたは複数を含み得る。活性化合物は、患者の治療において、放射線と一緒に、または他の抗過剰増殖化合物、例えば、シクロホスファミド、シスプラチン、カルボプラチン、タキソール、およびアービタックス、ならびに他の認可された抗過剰増殖化合物と一緒に、複合または連続的に投与され得る。特定の疾患および患者の状態に応じて、そのような治療は、化合物単独または放射線単独のいずれよりも有効であり得る。抗過剰増殖、抗炎症、抗菌、または抗ウイルス用途の各活性化合物の正確な投与量は、患者のタイプ、治療される疾患状態のタイプ、患者の年齢、および投与経路が挙げられるが、これらに限定されない多数の因子に応じて異なる。
【0049】
ヒト患者に投与する場合、活性化合物の総日量は、投与方法に応じて、体重1kg当り1mg〜300mgの範囲であることが予想される。例えば、経口投与は、体重1kg当り100mg〜300mgの総日量を必要とし得るが、静脈内用量は、体重1kg当り20mg〜200mgだけを必要とし得る。総日量は、単一または分割用量で投与されてもよい。体重約70kgの平均的ヒト対象の場合、用量は、経口投与で約1400mg〜21000mg、静脈内投与で約140mg〜1400mgとなるであろう。医師は、体重がこの範囲外である対象、例えば、幼児および高齢者に対する用量を容易に決定することができるであろう。獣医は、他の哺乳動物に対する用量を容易に決定することができるであろう。
【0050】
一実施形態において、発明は、体重1kg当り200mgの活性化合物を含む、静脈内溶液または懸濁液の投与を含む。上述の治療用途の場合、投与される用量は、当然のことながら、用いられる化合物、投与方法、所望される治療、および示される疾患によって異なる。総日量は、単一または分割用量で投与されてもよい。本発明は、持続放出組成物も包含する。
【0051】
薬学的組成物は、例えば、錠剤、カプセル、丸薬、粉末、持続放出製剤、懸濁液として経口投与に適した形態、滅菌溶液、懸濁液、または乳剤として非経口注入に適した形態、軟膏またはクリームとして局所投与に適した形態、または坐薬として肛門投与に適した形態であり得る。薬学的組成物は、精密用量の単一投与に適した単位用量形態であってもよい。薬学的組成物は、従来の薬学的担体または賦形剤、および活性化合物を含む。さらに、他の医薬剤、担体、アジュバント等を含んでもよい。
【0052】
典型的な非経口投与形態は、滅菌水溶液、例えば、水性プロピレングリコールまたはデキストロース溶液中の活性化合物の溶液または懸濁液を含む。そのような投与形態は、必要に応じて、適切に緩衝され得る。
【0053】
適切な薬学的担体は、不活性希釈剤または充填剤、水、および種々の有機溶媒を含む。薬学的組成物は、必要に応じて、追加の成分、例えば、香味剤、結合剤、賦形剤等を含有し得る。したがって、経口投与の場合、種々の賦形剤、例えば、クエン酸を含有する錠剤は、種々の崩壊剤、例えば、スターチ、アルギニン酸、および特定の複合ケイ酸と一緒に、およびスクロース、ゼラチン、およびアカシア等の結合剤と一緒に用いられてもよい。さらに、ステアリン酸マグネシウム、ラウリル硫酸ナトリウム、およびタルク等の滑沢剤は、錠剤化目的で有用な場合が多い。類似型の固形組成物は、軟および硬ゼラチンカプセルで用いられてもよい。これらの組成物の有用な成分は、ラクトース、乳糖、および高分子量ポリエチレングリコールを含む。水性懸濁液またはエリキシルが、経口投与に所望される場合、そこでの活性化合物は、水、エタノール、プロピレングリコール、グリセリン、またはそれらの組み合わせと一緒に、種々の甘味剤または香味剤、着色物質または染料、および必要に応じて、乳化剤または懸濁剤と組み合わされてもよい。
【0054】
種々の薬学的組成物を特定量の活性化合物で調製する方法は、既知であるか、または当業者に明らかとなるであろう。例えば、Remington′s Pharmaceutical Sciences,Mack Publishing Company,Easter,Pa.,15th Edition(1975)を参照されたい。
【0055】
本明細書に記載される用量範囲は、単なる例証であり、請求される組成物の範囲または実践を限定することを意図しない。例えば、用量は、毒性作用および/または検査値等の臨床効果を含み得る、薬物動態または薬力学的パラメータに基づいて調整されてもよい。したがって、本発明は、熟練者によって決定されるように、患者内用量上昇を包含する。化学療法剤の投与に適した用量およびレジメンを決定することは、関連技術においてよく知られており、本明細書に開示される教示が一旦提供されると、熟練者によって包含されることが理解される。
【0056】
発明の薬学的組成物は、単一単位用量、または複数の単一単位用量として、バルクで調製、包装、または販売されてもよい。本明細書で使用される、「単位用量」は、規定量の活性化合物を含む、個別量の薬学的組成物である。活性化合物の量は、概して、対象に投与される、活性化合物の用量、またはそのような用量の便宜的分数、例えば、そのような用量の1/2または1/3に等しい。
【0057】
発明の薬学的組成物中の活性化合物、薬学的に許容される担体、および任意の追加成分の相対量は、治療される対象が何であるが、その大きさ、および状態に応じて、さらに組成物が投与される経路に応じて異なる。例として、組成物は、0.1%〜100%(w/w)の活性成分を含み得る。
【0058】
活性化合物に加えて、本発明の薬学的組成物は、上述のように、1つまたは複数の追加の治療上有効な化合物をさらに含み得る。
【0059】
本明細書で使用される、薬学的組成物の「非経口投与」は、対象の組織の物理的な切れ目を入れることによって特徴付けられる任意の投与経路、および組織内の切れ目を通しての薬学的組成物の投与を含む。したがって、非経口投与には、非経口投与には、組成物の注入、外科的切開を通る組成物の適用、組織関数非外科的創傷を通る組成物の適用による、薬学的組成物の投与が挙げられるが、これらに限定されない。したがって、活性化合物は、血流、筋肉、または内臓に直接投与され得る。非経口投与に適した手段には、静脈内、動脈内、腹腔内、髄腔内、脳室内、尿道内、胸骨内、頭蓋内、筋肉内、および皮下、および腎透析注入技術が挙げられる。そのような非経口投与に適したデバイスには、針(極微針を含む)、注射器、無針注射器、および注入装置が挙げられる。
【0060】
非経口製剤は、通常、塩、炭水化物、および緩衝剤(好ましくは、pH3〜9)等の賦形剤を含有し得る、水溶液であるが、いくつかの適用の場合、それらは、滅菌非水溶液またはピロゲンを含まない滅菌水等適切な媒体と併せて使用される乾燥形態として、より適切に製剤され得る。
【0061】
滅菌条件下、例えば、凍結乾燥による非経口製剤の調製は、当業者によく知られている標準薬学的技術を使用して、容易に達成され得る。
【0062】
非経口投与に適した薬学的組成物の製剤は、薬学的に許容される担体、例えば、滅菌水または滅菌等張食塩水と組み合わされる、活性成分を含む。そのような製剤は、ボーラス投与または連続投与に適した携帯で、調製、包装、または販売され得る。注入可能な製剤は、単位用量形態、例えば、アンプルまたは保存量を含有する複数回投与容器で調製、包装、または販売され得る。非経口投与のための製剤には、懸濁液、溶液、油性または水性媒体中の乳剤、ペースト、および以下に論じられるような移植可能な持続放出または生分解性製剤が挙げられるが、これらに限定されない。そのような製剤は、懸濁剤、安定剤、または分散剤を含むが、これらに限定されない1つまたは複数の追加成分をさらに含んでもよい。非経口投与用製剤の一実施形態において、活性成分は、再構成成分の非経口投与に先立って、適切な媒体(例えば、ピロゲンを含まない滅菌水)による再構成のために、乾燥(すなわち、粉末または粒状)形態で提供される。
【0063】
薬学的組成物は、滅菌注入可能な水性または油性の懸濁液または溶液の形態で、調製、包装、または販売され得る。懸濁液または溶液は、周知の技術に従って製剤され得、活性成分に加えて、本明細書に記載される分散剤、湿潤剤、または懸濁剤等の追加成分を含んでもよい。そのような滅菌注入可能な製剤は、非毒性の非経口投与可能な希釈剤または溶媒、例えば、水または1,3−ブタンジオール等を使用して調製され得る。他の許容される希釈剤および溶媒には、リンガー溶液、等張性塩化ナトリウム溶液、および固定油、例えば、合成モノ−またはジ−グリセリドが挙げられるが、これらに限定されない。有用な他の非経口投与可能な製剤には、活性成分を、微結晶形態で、リポソーム調製物中、または生分解性ポリマー系化合物として含むものが挙げられる。持続放出または移植用の組成物は、薬学的に許容されるポリマーまたは疎水性物質、例えば、乳剤、イオン交換樹脂、難溶性ポリマー、または難溶性塩を含み得る。
【0064】
活性化合物は、細胞過剰増殖の阻害剤であるか、または癌細胞におけるアポトーシスの細胞周期特異的誘導体であるか、または両方である。したがって、これらの化合物は、過剰増殖疾患および障害、例えば、癌を治療するために有用であり、アポトーシスの誘導に応答性である疾患および障害、例えば、癌を治療するために有用である。細胞周期特異的モードの作用を有することによって、これらの化合物は、DNA複製等の基本細胞過程を標的とするか、またはDNA等の基本細胞分子を干渉する標準化学療法薬と比較して、治療指数が高いはずである。したがって、例えば、本明細書において論じられる活性化合物は、目標とされる癌治療において有用となることが期待される。活性化合物は、血管形成に対しても有効であり得る。
【0065】
本発明の文脈において、過剰増殖および類似する用語は、異常または非調節、あるいは異常および非調節細胞成長、癌等の疾患の特徴を説明するために使用される。細胞増殖の阻害および類似する用語は、本明細書において、化合物が、その化合物と接触されない細胞と比較して、その化合物と接触される細胞の成長を遅延させる、および/または殺傷する能力を示すために使用される。最も好ましくは、この細胞増殖の阻害は、100%であり、すべての細胞の増殖が停止される、および/または細胞がプログラム化細胞死を経ることを意味する。いくつかの実施形態において、接触される細胞は、腫瘍細胞である。腫瘍細胞は、異常細胞増殖のある細胞として定義される。良性腫瘍細胞は、攻撃的な転移腫瘍をインビボで形成することができない細胞の過剰増殖によって説明される。対照的に、悪性腫瘍は、例えば、腫瘍転移を形成することができる、異なる細胞および生化学的異常のある細胞によって説明される。悪性腫瘍細胞の後天的機能異常(「癌の特徴」とも定義される)は、複製能(「過剰増殖」)、成長シグナルの自給、抗成長シグナルに対する非感受性、アポトーシスからの回避、持続的血管形成、組織侵襲、および転移である。
【0066】
アポトーシスの誘導体および類似する用語は、本明細書において、その化合物と接触される細胞においてプログラム化細胞死を実行する、化合物を特定するために使用される。アポトーシスは、接触される細胞内の複雑な生化学的事象、例えば、システイン特異的プロテイナーゼ(「カスパーゼ」)の活性、およびクロマチンのフラグメント化によって定義される。化合物と接触される細胞におけるアポトーシスの誘導は、必ずしも細胞増殖の阻害を伴うとは限らない。好ましくは、細胞増殖の阻害および/またはアポトーシスの誘導は、異常細胞成長(過剰増殖)のある細胞に特異的である。したがって、異常細胞成長のある細胞と比較して、正常な増殖または停止細胞は、化合物の増殖阻害またはアポトーシス誘導活性に対して感受性が低いか、または非感受性でさえある。最後に、細胞毒性は、細胞周期依存または細胞周期独立の様式で、アポトーシス/プログラム化細胞死の誘導を含む、種々の機序によって細胞を殺傷する化合物を特定するために、より一般的な意味で使用される。
【0067】
細胞周期特異的および類似する用語は、本明細書において、化合物を、静止している非分割細胞内ではなく、細胞周期の特定の相を活発に通過する連続的増殖細胞内でのみアポトーシスを誘導するものとして特定するために使用される。連続増殖細胞は、疾患様癌に典型的であり、細胞分割周期のすべての相、つまりG(「ギャップ」)1、S(「DNA合成」)、G2およびM(「有糸分裂」)相によって特徴付けられる。
【0068】
AKT(タンパク質キナーゼB(PKB)としても知られる)、およびその遺伝子族生成物は、セリン/トレオニンタンパク質キナーゼとして特定されている。Testa et al.,Proc.Natl.Acad.Sci.,2001,98,10983−10985、Lawlor et al.,J.Cell Sci.,2001,114,2903−2910、Duan,Circ.Res.,2000,86,15−23。PKBは、細胞増殖、アポトーシス、およびインスリン応答において重要な役割を果たす。したがって、PKBの調節は、腫瘍形成、異常細胞増殖、および糖尿病の治療において感心対象である。本発明の文脈において、過剰増殖および類似する用語は、異常/非調節細胞成長、疾患様癌の特徴を説明するために使用される。
【0069】
PKB分析
PKB活性を評価するためのキナーゼ分析は、活性PKB酵素、PPKB特定基質、およびP33標識ATPを含む。PKB酵素の2つの形態、全長PKBαおよびプレクストリンドメイン(アミノ酸1〜117)が削除された、PKBαのキナーゼドメインを使用する。両方のPKB酵素は、Upstate Cell Signaling Solutions(カタログ番号14〜276および14〜341)から入手することができる。使用されるPKB基質は、Obata et al.,J.Biol.Chem.2000,275,36108−36115に記載されるような合成ペプチド(ARKRERTYSFGHHA)である。リン酸化基質は、ホスホセルロース膜フィルタプレート(Millipore)によって捕捉され、Wallac Microbeta液体シンチレーションカウンタ(Perkin Elmer)によって測定される。
【0070】
細胞中のPKB活性は、PTENヌルヒト乳房主要細胞株MDA−MB−468において分析される。PKB基質FKHRL1、GSK3a/b、およびツベリンのリン酸化状態は、ホスホ特異的抗体(細胞シグナリング技術)を利用する免疫分析によって測定される。
【0071】
PKB阻害が細胞生存能力に及ぼす影響は、MDA−MB−468、MDA−MB−231、U87−MG、LN−229、PC−3、DU145が挙げられるが、これらに限定されない、一連のヒト主要細胞株において測定される。細胞は、通常の成長培地において72時間処理し、細胞生存能力は、Alamar Blue(Biosource,UK)によって測定する。
【0072】
以下の非限定実施例は、活性化合物の調製を説明する。1H核磁気共鳴(NMR、Mercury−300)スペクトルは、提案される構造と一致した。特徴的な化学シフト(δ)は、主要なピークの指定のための従来の省略形(例えば、s単項、d二重項、t三重項、q四重項、m多項、br広範)を使用して、テトラメチルシランから100万分の1ダウンフィールドで示される。質量スペクトル(m/z)は、エレクトロスプレイイオン化(ESI)または大気圧化学イオン化(APCI)のいずれかを使用して、Agilentモデル1100質量分析計で記録した。以下の略語を、一般的な溶媒に対して使用する:CDCl3:デウテロクロロホルム、D6−DMSO:デウテロメチルスルホキシド、CD3OD:デウテロメタノール。
【実施例】
【0073】
実施例1
S−(3−シアノプロピル)イソチオ尿素塩酸塩(Kevetrinとしても知られる)
【化14】

γ−クロロブチロニトリル(5.0g、48.3mmol)およびチオ尿素(4.04g、53.1mmol)を、40mlの水に混合した。混合液を加熱し、3〜4時間還流させた。反応混合液を蒸発させて、20mlのエタノールを添加した後、同様に蒸発させた。これを3回繰り返した。その後、10mlのメタノールおよび30mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、5.44g(30.3mmol、収率62.7%)の生成物を、白い結晶として、融点134〜135℃、97%よりも高い純度で得た。1H NMR(300MHz,d6DMSO)δ1.89(m,2H)、2.63(t,2H、J=7.2Hz)、3.23(t,2H、J=7.2Hz)、3.38(s,3H)。
13C NMR(75MHz)δ15.3,25.0,28.8,119.8,169.7
式: C5H10ClN3S
精密質量: 179.03
分子量: 179.67
m/e: 179.03(100.0%),181.03(32.1%),180.03(7.4%),181.02(4.5%),182.03(2.0%),183.02(1.5%).C,33.42、H,5.61、Cl,19.73、N,23.39、S,17.85
解析計算値: 33.42 5.61 23.39 17.85
実測値: 33.44 5.48 23.40 18.31
【0074】
実施例2
S−(2−シアノエチル)イソチオ尿素塩酸塩
【化15】

3−クロロプロパンニトリル(4.32g、48.3mmol)およびチオ尿素(4.04g、53.1mmol)を40mlの水中で混合した。混合液を加熱し、3〜4時間還流させた。反応混合液を蒸発させて、20mlのエタノールを添加した後、同様に蒸発させた。これを3回繰り返した。その後、10mlのメタノールおよび30mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、S−(2−シアノエチル)イソチオ尿素塩酸塩を得た。
【0075】
実施例3
S−(4−シアノブチル)イソチオ尿素塩酸塩
【化16】

5−クロロペンタンニトリル(5.68g、48.3mmol)およびチオ尿素(4.04g、53.1mmol)を、40mlの水中で混合した。混合液を加熱し、3〜4時間還流させた。反応混合液を蒸発させて、20mlのエタノールを添加した後、同様に蒸発させた。これを3回繰り返した。その後、10mlのメタノールおよび30mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、S−(4−シアノブチル)イソチオ尿素塩酸塩を得た。
【0076】
実施例4
S−(5−シアノペンチル)イソチオ尿素塩酸塩
【化17】

6−クロロヘキサンニトリル(6.36g、48.3mmol)およびチオ尿素(4.04g、53.1mmol)を、40mlの水中で混合した。混合液を加熱し、3〜4時間還流させた。反応混合液を蒸発させて、20mlのエタノールを添加した後、同様に蒸発させた。これを3回繰り返した。その後、10mlのメタノールおよび30mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、S−(5−シアノペンチル)イソチオ尿素塩酸塩を得た。
【0077】
実施例5
S−(4−シアノメチルフェニル)メチルイソチオ尿素塩酸塩
【化18】

4−クロロメチルフェニルアセトニトリル(200mg、1.21mmol)およびチオ尿素(101mg、1.33mmol)を、1mlのメタノール中で混合した。混合液を加熱し、3〜4時間還流させた。反応混合液を蒸発させた。その後、1mlのメタノールおよび4mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、219mg(0.91mmol、収率75%)の生成物を、オフホワイトの結晶として、95%よりも高い純度で得た。1H NMR(300MHz、d6−DMSO)δ4.03(s,2H)、4.50(s,2H)、7.35(d,2H,J=8.23Hz)、7.45(d,2H,J=8.23Hz)、9.22(s,4H)。(M+H)206.00
式: C10H12ClN3S
精密質量: 241.04 (205.07)
分子量: 241.74
m/e:241.04(100.0%)、243.04(36.6%)、242.05(11.0%)、244.04(4.6%)、242.04(1.9%)、245.04(1.5%)
【0078】
実施例6
S−2(4−[2−シアノエチル]フェニル)エチルイソチオ尿素メシレート
【化19】

メシレート(200mg、0.79mmol)およびチオ尿素(66mg、0.87mmol)を、1mlのメタノール中で混合した。混合液を加熱し、3〜4時間還流させた。反応混合液を蒸発させた。その後、1mlのメタノールおよび4mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、203mg(0.62mmol、収率78%)の生成物を、オフホワイトの結晶として、95%よりも高い純度で得た。1H NMR(300MHz,d6−DMSO)δ2.35(s,3H)、2.80(m,2H)、2.85(m,2H)、2.91(t,2H,J=7.4)、3.42(t,3H,J=7.4)、7.24(s,4H)、9.04(s,4H)。(M+H)234.07
式: C13H19N3O3S2
精密質量: 329.09(233.10)
分子量: 329.44
m/e: 329.09(100.0%)、330.09(16.0%)、331.08(9.1%)、331.09(1.9%)、332.09(1.4%)、330.08(1.1%)
【0079】
実施例7
S−(2−シアノメチルフェニル)メチルイソチオ尿素塩酸塩
【化20】

2−クロロメチルフェニルアセトニトリル(200mg、1.21mmol)およびチオ尿素(101mg、1.33mmol)を、1mlのメタノール中で混合した。混合液を加熱し、3〜4時間還流させた。反応混合液を蒸発させた。その後、1mlのメタノールおよび4mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、231mg(0.95mmol、収率79%)の生成物を、オフホワイトの結晶として、95%よりも高い純度で得た。1H NMR(300MHz,d6−DMSO)δ4.14(s,2H)、4.56(s,2H)、7.37(m,2H)、7.45(m,2H)、9.23(s,4H)。(M+H)205.97
式: C10H12ClN3S
精密質量: 241.04(205.07)
分子量: 241.74
m/e: 241.04(100.0%)、243.04(36.6%)、242.05(11.0%)、244.04(4.6%)、242.04(1.9%)、245.04(1.5%)
【0080】
実施例8
S−(6−シアノメチルピリジン−2−イル)メチルイソチオ尿素塩酸塩
【化21】

6−クロロメチル−2−ピリジルアセトニトリル(200mg、1.2mmol)およびチオ尿素(101mg、1.32mmol)を、1mlのメタノール中で混合した。混合液を加熱し、3〜4時間還流させた。反応混合液を蒸発させた。その後、1mlのメタノールおよび4mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、216mg(0.89mmol、収率74%)の生成物を、オフホワイトの結晶として、95%よりも高い純度で得た。1H NMR(300MHz,d6−DMSO)δ4.29(s,2H)、4.64(s,2H)、7.41(d,1H,J=7.78)、7.51(d,1H,J=7.78)、7.91(t,1H,J=7.78)、9.46(s,4H)。(M+H)207.00
式: C9H11ClN4S
精密質量: 242.04(206.06)
分子量: 242.73
m/e: 242.04(100.0%)、244.04(36.7%)、243.04(12.0%)、245.04(3.9%)、246.03(1.5%)
【0081】
実施例9
S−(3−シアノメチルフェニル)メチルイソチオ尿素塩酸塩
【化22】

3−ブロモメチルフェニルアセトニトリル(200mg、0.95mmol)およびチオ尿素(80mg、1.05mmol)を、1mlのメタノール中で混合した。混合液を加熱して、3〜4時間還流させた。反応混合液を蒸発させた。その後、1mlのメタノールおよび4mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、215mg(0.75mmol、収率79%)の生成物を、オフホワイトの結晶として、95%よりも高い純度で得た。1H NMR(300MHz,d6−DMSO)δ4.08(s,2H)、4.53(s,2H)、7.31(m,2H)、7.40(m,2H)、9.25(s,4H)。(M+H)206.00
式: C10H12BrN3S
精密質量: 284.99(205.07)
分子量: 286.19
m/e: 286.99(100.0%)、284.99(98.1%)、287.99(12.7%)、286.00(10.7%)、288.99(4.5%)、285.99(1.9%)
【0082】
実施例10
S−(1−シアノメチルナフト−2−イル))メチルイソチオ尿素塩酸塩
【化23】

2−ブロモメチル−1−ナフチルアセトニトリル(200mg、0.77mmol)およびチオ尿素(64mg、0.85mmol)を、1mlのメタノール中で混合した。混合液を加熱して、3〜4時間還流させた。反応混合液を蒸発させた。その後、1mlのメタノールおよび4mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、215mg(0.64mmol、収率83%)の生成物を、オフホワイトの結晶として、95%よりも高い純度で得た。1H NMR(300MHz,d6−DMSO)δ4.57(s,2H)、4.83(s,2H)、7.63(m,2H)、7.72(m,1H)、8.05(m,2H)、8.2(d,1H,J=8.24)、9.1(s,2H)、9.28(s,2H)。(M+H)256.00。
式: C14H14BrN3S
精密質量: 335.01(255.08)
分子量: 336.25
m/e: 335.01(100.0%)、337.01(97.6%)、336.01(17.1%)、338.01(16.4%)、337.00(4.5%)、339.00(4.4%)、339.01(1.4%)、338.00(1.1%)、337.02(1.1%)
【0083】
実施例11
本発明の化合物の調製を示す、化学反応が以下に表される。示されるように、これらの化合物は、適切なニトリル誘導体をチオ尿素と反応させることによって、実施例1のそれに類似する方法で調製され得る。チオ尿素は、窒素原子上の4個の置換基のうちの1、2、もしくは3個が、水素以外であり、式Iの他の化合物を提供する、誘導体によって置換されてもよい。
【化24】

【化25】

【化26】

【化27】

【化28】

【化29】

【0084】
この実施例で表される反応において、nおよびmは、ゼロであるか、または独立して、1〜8の整数であり、R1、R2、R3、およびR4は、例えば、メチル、エチル、n−プロピル、イソプロピル、シクロプロピル、−CH2−シクロプロピル、ビニル、アリール、n−ブチル、sec−ブチル、イソブチル、tert−ブチル、シクロブチル、−CH2−シクロブチル、n−ペンチル、sec−ペンチル、イソペンチル、tert−ペンチル、シクロペンチル、−CH2−シクロペンチル、n−ヘキシル、sec−ヘキシル、シクロヘキシル、−CH2−シクロヘキシル部分等であり、これらも1つまたは複数の置換基を有し得る。R1、R2、R3、およびR4は、アルケニルおよびアルキニルでもあり得る。アルケニル基には、例えば、エテニル、プロペニル、ブテニル、1−メチル−2−ブテン−1−イル等が挙げられるが、これらに限定されない。代表的なアルキニル基には、エチニル、2−プロピニル(プロパルギル)、および1−プロピニルが挙げられる。
【0085】
上述のとおり調製される塩酸塩は、対応する遊離塩基または他の薬学的に許容される塩に、既知の方法によって変換され得る。他の薬学的に許容される塩は、上記反応のそれぞれにおいて、ニトリルを適切な開始物質(例えば、ニトリルを含有するクロリンではなく、ニトリルを含有するブロミン)を置換することによって、調製されてもよい。
【0086】
実施例12−Kevetrinの有効性研究
化学物質、細胞および培地
Kevetrinは、実施例1に記載されるように合成した。シスプラチン、ビンクリスチン、5−FU、およびタキソールは、Sigma Scientificから購入した。H460およびH522肺癌細胞、HT−29、SW−620、およびColo205、およびHCT−15結腸癌細胞、OvCar−3、およびSKOv−3卵巣癌細胞、DU−145、およびPC−3前立腺癌細胞、ならびにSNB−19およびU−251グリオーマ細胞、HT−1080線維肉腫、およびSW−480結腸癌細胞は、American Type Culture Collection(ATCC)(Rockville,MD)から購入した。A2780卵巣癌細胞およびそれらのシスプラチン耐性変異型A2780/CP1およびA2780/CP2は、社内で生成した。Colon HCT−116結腸癌細胞、それらのp53−/−、およびp21−/−亜株は、Central Research Institute(Salen,Ohio)のGangadharan博士から厚意で提供されたが、染色体3が補充されたHCT−116は、The Rajiv Gandhi Center for Cancer Research(Rohini,Delhi,India)から入手した。特に指示のない限り、媒体および他の試薬は、Becton Dickinsonから購入した。Bio Whittaker製の基礎培養培地(RPMI−1640)は、0.22μm Millex−GVフィルタ装置(Millipore)を通して滅菌した。調製された培地は、小アリコート中、5℃で、暗所保管した。基礎培養培地は、培養培地として使用するために、10%ウシ胎仔血清を補充し(FCS−560で30分間熱不活性化される)、ミトゲン、すなわち、リポ多糖類(LPS、10〜50μg/mL)を添加して、細胞を増殖させた。
【0087】
成長阻害分析
細胞毒性は、Maximum Tolerated Titer(MTT)分析によって決定した。簡潔に述べると、細胞を24ウェル組織培養プレートに、10,000〜15,000細胞/ウェルで播種し、一晩培養した。指数関数的に成長する細胞を、次に、異なる薬物濃度に3〜4世代時間曝露した。細胞生存性は、細胞をMTTテトラゾリウム塩に4 時間、37℃で曝露することによって決定し、ホルマザンの形成は、マイクロプレートリーダによって560nmで測定した。未処理対照と比較した、50%細胞成長を阻害する濃度は、用量の関数として、生存率をプロットする曲線から決定した。すべての値は、それぞれ重複して行われた少なくとも3つの独立実験の平均である。
【0088】
細胞増殖分析
MTT溶液(10μL)を、48時間培養したリンパ球のすべてのウェルに添加し、4時間37℃で培養した。2つの培養セットを調製し、LPSを1つのセットのみに添加した。この期間中、ホルマザン結晶が、各ウェルの底に形成した。消費された媒体を、培養細胞の懸濁液とともにピペットで除去した。次に、酸性化イソプロパノール(無水イソプロパノール中100μLの0.1N HCl)を、すべてのウェルに添加し、完全に混合して、紺青色の結晶を溶解した。数分後、室温で、プレートアナライザを使用して、二波長測定システムによってプレートを読み取った(試験波長540nm、参照波長630nm)。プレートは、酸性化イソプロパノールの添加から1時間以内に読み取った。細胞増殖は、刺激指数として以下のように計算した。
【数1】

【0089】
p53の免疫学的局在決定
細胞の増殖をもたらすタンパク質である、p53の局在を決定するために、免疫細胞化学分析を行った。簡潔に述べると、HCT−116細胞(ATCC)を、ガラススライドに一晩付着させ、イソ毒性濃度のKevetrin(300ng/ml)、またはシスプラチン(11μg/ml)に6時間曝露した。薬物曝露後に、細胞を3.7%ホルムアルデヒドで固定し、0.25% Triton X−100で透過処理し、1% BSA(ウシ血清アルブミン)で遮断した。次に、細胞を1時間、抗p53ポリクローナル抗体(Sc−6243、Santa Cruz Biotechnology,California)、続いて、二次抗ウサギFITC結合抗体(Amersham Life Sciences,U.K.)と共に培養した。カバースリップをVectashieldに載置し(Vector Laboratories Vector,U.K.)、プランApochromat x63対物レンズ(Zeiss)を使用することによって、適切なフィルタおよびレーザー共焦点走査システムLSM510を備える、落射蛍光顕微鏡Axiovert100Mで分析した。
【0090】
ウェスタンブロット分析
ウェスタンブロット分析を行った。全体細胞溶解物を、イソ毒性濃度のKevitren(300ng/ml)、またはシスプラチン(11ng/ml)で6時間処理された細胞から調製した。タンパク質(50μg/レーン)を、4〜12%ポリアクリルアミドSDSゲル上で分離し、PolyScreen膜(Millipore,Bedford,MA)に移した。p53、p21、およびβ−アクチンの存在を、それぞれ抗p53抗体(Sc−6243、Santa Cruz Biotechnology)、抗p21抗体(Sc−3976、Santa Cruz Biotechnology)、および抗アクチン抗体(Sc−1616、Santa Cruz Biotechnology)によって明らかにした後、ペルオキシダーゼ共役二次抗体(Jackson ImmunoResearch,West Grove,PA)で培養し、強化された化学発光(New England Nuclear,Hebron,CT)によって検出した。
【0091】
Kevetrinがヒト腫瘍細胞株の生存能力に及ぼす影響
Kevetrinが、肺、結腸、乳房、卵巣、前立腺の癌、肉腫、神経膠腫、および白血病を含む、10種類の異なるヒト腫瘍細胞の生存能力に及ぼす影響を、上述の細胞増殖分析を使用して決定した。細胞生存能力は、Kevetrinに3倍増期間、連続曝露した後に測定した。Kevetrinの指示濃度は、平均IC50に対応する。結果は、以下に記載される。一般に、Kevetrinは、上皮起源のヒト腫瘍細胞に対して、強力な活性を有する。Kevetrinの細胞毒性作用は、非小細胞肺、結腸、および卵巣癌に対して最も顕著であり、IC50は、11〜68ng/mlの範囲であった。興味深いことに、Kevetrinは、悪性神経膠腫細胞に対しても強力な活性を示した(IC50〜30ng/ml)。
【表1】

【0092】
Kevetrin細胞毒性の時間依存性
曝露時間がKevetrinの細胞毒性作用に及ぼす影響を決定するために、DU−145、HCT−116、またはHT−29癌細胞を、異なる濃度のKevetrinに、5、10、20、30、または45分、あるいは1、2、6、24、または120時間曝露した。長い曝露時間が細胞毒性の増加と関連する、Kevetrinの明白な時間依存の細胞毒性作用が、3つの細胞株すべてに認められた。結果を、図1に示す。時間依存性は、曝露時間が30〜45分以下の場合に特に劇的であった。対照的に、薬物曝露時間を24時間を超えて延長することは、細胞毒性に影響しなかった。
【0093】
Kevetrinおよびシスプラチンの活性スペクトラム
Kevetrinおよびシスプラチンが指示腫瘍株の生存能力に及ぼす影響を、MTT分析を使用して、Kevetrinに3倍増時間、連続曝露した後に測定し、結果を、図2に示す。示される値は、以下のように計算される:ログ(IC50個別の細胞株−IC50平均)。負の値は、細胞株が、平均よりも敏感であることを示すのに対して、正の値は、細胞株が平均よりも耐性があることを示す。試験されたすべての細胞株の平均IC50は、Kevetrinの場合、4.9x10−7M、およびシスプラチンの場合、2.1x10−6Mであった。MTT分析結果を考慮すると、図2の10種類の異なるヒト腫瘍細胞に対するシスプラチンおよびKevetrinの活性スペクトラムの比較は、2つの薬物間の明らかな相違を示す。Kevetrinの活性は、肺、頭頸部、乳房、卵巣、および結腸細胞株に対して、シスプラチンのそれよりも顕著であった。興味深いことに、Kevetrinは、一般に、特定の腫瘍細胞型内で高い異種反応を呈する、シスプラチンとは対照的に、試験された頭頸部、非小細胞肺、卵巣、結腸、および神経膠腫全てに対して活性を示した。Kevetrinとシスプラチンとの間の差異は、3つの頭頸部癌細胞株に対して特に顕著であったが、そこでKevetrinは、すべての細胞株に対して活性を示したが、シスプラチンは、3つの細胞株のうちの1つに対して活性であったことである。驚くべきことに、Kevetrinは、シスプラチンの場合に認められたものとは異なる、アルキル化剤に敏感である、白血病に対して比較的制限された活性を有した。
【0094】
ヒト腫瘍異種移植片を有する裸マウスにおけるKevetrinのインビボ有効性研究
動物および動物ケア
マウスは、12時間/12時間の明暗サイクルで、室温18〜26℃、および比較的高い湿度30〜70%で飼育した。動物の飼料および水は、不断で付与した。この順応期間中、各動物は、少なくとも1日1回、任意の異常または感染性疾患の発症に関して観察された。使用に適していると決定された動物のみをこの研究に割り当てた。本研究での使用に許容されないと考えられるいかなる動物も、同一業者からの類似する年齢および体重の動物と置き換えた。腫瘍質量が、平均、約100mm3に達すると、腫瘍の大きさに従って、無作為化し、グループに分けた。
【0095】
ヒト腫瘍細胞株
MDA−MB−231ヒト乳癌(HTB−26)、HT−29結腸癌(HTB−38)、PC−3前立腺癌(CRL−1435)、HCT−15P−糖タンパク質耐性結腸癌は、American Type Culture Collection(Rockville,MD)から購入した。
【0096】
MDA−MB−231細胞株は、最初に、乳腺腺癌の51歳白人女性の胸水から単離された。これらの細胞は、形態学的に上皮の性質であると考えられる。
【0097】
HT−29細胞株は、最初に、結腸直腸腺癌の44歳白人女性から1964年に単離された。これらの細胞は、形態学的に上皮の性質であると考えられる。
【0098】
PC−3細胞株は、最初に、グレードIV転移性前立腺腺癌の62歳白人男性の骨転移から単離された。これらの細胞は、低い酸ホスファターゼおよびテストステロン−5−アルファ還元酵素活性を呈し、形態学的に上皮の性質であると考えられる。
【0099】
HCT−15親細胞株は、最初に、デュークC型結腸直腸腺癌の男性から単離された。これらの細胞は、形態学的に上皮の性質であると考えられる。
【0100】
A549およびNCI−H1975多剤耐性ヒト肺癌株は、Dana Farber Cancer Institute(Boston,MA)からの寄贈であった。
【0101】
試験システム
細胞は、10%FBS RPMI培地中で培養した。細胞は、本有用性研究に対して、さらなる拡張のために、5代継代で取得した。裸マウス(Nu/Nu)の雄(20〜24g)および雌(19〜22g)の両方を、6〜8週齢で、Charles River Laboratoriesから購入した。これらのマウスは、研究の開始時においてナイーブであり、耳の穿孔によって識別された。マウスは、5日間放置して、新しい環境に順化させた。RPMI:マトリゲル50:50混合中のヒト腫瘍細胞を、各マウスの右脇腹に皮下的に移植した。腫瘍が平均容積100mm3に達したときに、投与を開始した。
【0102】
生存中の観察および測定
任意の悪影響について、マウスを毎日観察した。処置前、処置中の隔日、および処置後に、マウスの体重を測定した。動物の状態が悪化した場合は、その動物のいかなる処置をも中断した。回復しない場合は、動物を犠牲死させた。15%を超える体重喪失を示すいかなる動物も、状態が悪化していると見なした。20%を超える体重喪失を示すいかなる動物も、犠牲死させた。腫瘍部位上に皮膚の持続的潰瘍化を呈するいかなる動物も、犠牲死させた。マウスの腫瘍の大きさの測定値を、処置前、処置中の隔日、および処置後に取った。同一の科学者が、研究を通して、腫瘍測定値の測定を担当した。
【0103】
終末手順
媒体群からの腫瘍が1000mm3に到達すると、すべての群からのすべての動物を、CO2窒息により犠牲死させた。犠牲死時に、腫瘍を除去し、測量した。
【0104】
研究スケジュール
RPMI:マトリゲル50:50混合中の5x106腫瘍細胞を、各裸マウスの右脇腹に皮下的に移植した。腫瘍が平均容積100mm3に到達したときに(通常、移植後14日目までに達した)、投与を開始し、投与は8日間行った。剖検は、治療の終了後、41日目に行った。
【0105】
材料
Kevetrinは、実施例1に記載されるように調製した。周囲温度(または−20℃以下)で保存し、光から保護した。試験動物に投与するために、Kevetrinをリン酸緩衝生理食塩水(PBS)に懸濁させた(滅菌、pH=7.4)。使用する前に、PBSを周囲温度で保存した。各懸濁液を調製した後、−20℃以下で保存し、光から保護した。
【0106】
投与
投与手順は、マウスを無作為化し、グループ分けした日に開始した。以下の段落において論じられるように、腫瘍移植後7、9、および11日目に用量を投与した。各用量は、尾静脈を介して投与した。
【0107】
Kevetrinに起因する体重喪失
Kevetrinを、腫瘍を持つ動物に静脈内注入(IV)した場合、化合物の投与に起因する体重喪失は、許容可能な範囲内であった。7、9、および11日目に静脈内投与された100mg/kgは、体重の6.8%の喪失をもたらし、同一スケジュールで投与された200mg/kgは、9.3%の体重喪失をもたらした。これらの濃度はいずれも、Kevetrinの有用性を確立するために使用され得る。これらの結果を、図3に示す。
【0108】
MDA−MB−231ヒト乳癌における、7、9、11、および13日目の22mg/kg タキソール静脈内注入と比較した、7、9、および11日目の200mg/kg Kevetrin静脈内注入の有用性
動物に、ヒト乳癌MDA−MB−231を皮下的に移植し、スケジュールに従って、化合物を静脈内注入した。Kevetrinを投与した動物は、タキソール治療した動物よりも高い有用性を示した。腫瘍成長は、タキソール治療した動物よりも12日、未治療の対照よりも32日遅延した。結果を、図4に示す。
【0109】
HT−29結腸癌における、7〜12日目の5−FUと比較した、7、9、および11日目の200mg/kg Kevetrin静脈内注入の有用性
動物に、ヒト結腸癌HT−29を皮下的に移植し、スケジュールに従って、化合物を静脈内注入した。Kevetrinを投与した動物は、5−FU治療した動物よりも高い有用性を示した。腫瘍成長は、5−FU治療した動物よりも10日、未治療の対照よりも33日遅延した。結果を、図5に示す。
【0110】
PC−3ヒト前立腺癌における、7日目の10mg/kgシスプラチンと比較した、7、9、および11日目の200mg/kg Kevetrin静脈内注入の有用性
動物に、ヒト前立腺癌PC−3を皮下的に移植した。スケジュールに従って、Kevetrinを静脈内注入し、シスプラチンを腹腔内(IP)注入した。Kevetrinを投与した動物は、シスプラチン治療した動物よりも高い有用性を示した。腫瘍成長は、シスプラチン治療した動物よりも8日、未治療の対照よりも34日遅延した。結果は、図6に示される。
【0111】
P−糖タンパク質媒介耐性を有するHCT−15ヒト結腸癌における、7、9、11、および13日目の22mg/kg タキソールと比較した、7、9、および11日目の200mg/kg Kevetrinの有用性
動物に、P−糖タンパク質耐性細胞モデルである、ヒト結腸癌HCT−15を皮下的に移植し、スケジュールに従って、化合物を静脈内注入した。タキソールは、そのような癌に対してほとんど作用しなかったが、Kevetrinを投与した動物は、動物において有用性を示した。腫瘍成長は、タキソール治療した動物、および未治療の対照よりも15日遅延した。結果を、図7に示す。
【0112】
A549多剤耐性ヒト肺癌における、7、9、11、および13日目の22mg/kg タキソールと比較した、7、9、および11日目の200mg/kg Kevetrin の有用性
動物に、多剤耐性ヒト肺癌を皮下的に移植し、スケジュールに従って、化合物を静脈内注入した。タキソールは、そのような癌に対してほとんど作用しなかったが、Kevetrinを投与した動物は、動物において強力な有用性を示した。腫瘍成長は、未治療の対照よりも26日遅延した。結果を、図8に示す。
【0113】
NClI−H1975多剤耐性ヒト肺癌における、7、9、11、および13日目の22mg/kg タキソールと比較した、7、9、および11日目の200mg/kg Kevetrinの有用性
動物に、別の多剤耐性ヒト肺癌を皮下的に移植し、スケジュールに従って、化合物を静脈内注入した。タキソールは、そのような癌に対してほとんど作用しなかったが、Kevetrinを投与した動物は、動物において強力な有用性を示した。腫瘍成長は、タキソール治療した動物よりも約9日、および未治療の対照よりも約24日遅延した。結果を、図9に示す。
【0114】
書籍および学術論文を含むが、これらに限定されない、本出願において引用されるすべての出版物は、それぞれ参照することによりそれら全体が本明細書に組み込まれる。
【0115】
発明は、開示される実施形態を参照して上述されたが、当業者であれば、詳述される特定の実験が、発明の単なる例証に過ぎないことを容易に理解するであろう。発明の精神から逸脱することなく、種々の修正を行うことができることを理解されたい。したがって、発明は、以下の請求項によってのみ制限される。
【技術分野】
【0001】
本発明は、ニトリル誘導体およびニトリル誘導体を含む薬学的組成物に関する。本発明は、そのような化合物の薬学的に許容される塩、そのような化合物を調製するための過程、そのような化合物の調製に使用される中間体、ならびに過剰増殖性疾患、炎症性疾患、およびウイルスおよび細菌感染の治療におけるそのような化合物の使用にも関する。
【背景技術】
【0002】
前述される誘導体およびそれらの薬学的に許容される塩は、AKT阻害、細胞周期過剰増殖の阻害、癌細胞におけるアポトーシスの細胞周期特異的誘導、LTB4活性の阻害、および抗血管形成活性のうちの1つまたは複数の特性を有し、実験動物において、腫瘍の大きさの著しい減少を示す。したがって、これらの化合物は、過剰増殖性疾患、例えば、神経膠腫を含む頭頸部癌、薬物耐性肺癌、ヒトにおけるエストロゲン依存性または非依存性癌、非小細胞肺癌、および結腸癌を含むが、これらに限定されない、哺乳動物における広範な疾患の治療に有用である。エストロゲン依存性癌の非限定例は、乳癌および卵巣癌である。それらのLTB4活性の阻害の結果として、これらの化合物は、炎症性疾患、例えば、アレルギー、喘息、および関節炎等の炎症性疾患の治療に有用であり、それらのAKT阻害およびサイトカイン活性の結果として、これらの化合物は、ウイルスおよび細菌感染の治療にも有用である。現在、前述の疾患に対する新しい治療法を見出すことに大きな関心が寄せられている。
【0003】
置換イソチオ尿素化合物の塩は、Miller et al.,JACS,Vol.62,2099−2103(1940)、Shapiro,et al.,Radiation Research,Vol.7,No.1,22−34(1957)、King et al.,Biochemistry,Vol.17,No.8,1499−1506(1978)、Bauer and Welsh,J.Org.Chem.Vol.26,No.5,1443−1445(1961)、Southan,et al.,Br.J.Pharmacol.,Vol.114,510−516(1995)、およびGerber,et al.,Organic Synthesis,Vol.77,186(2000)において言及されている。
【発明の概要】
【0004】
特定の実施形態において、本発明は、ヒトを含むが、これに限定されない哺乳動物において、癌、炎症性疾患、ならびにウイルスおよび細菌感染を含むが、これらに限定されない過剰増殖性疾患を治療するための薬学的組成物に関し、抗過剰増殖性疾患、抗炎症、抗ウイルス、または抗菌有効量の式Iの化合物であって、
【化1】

式中、Zは、硫黄、銅、銀、金、および白金から選択されるか、またはZは、ClO2、BrO2、およびIO2から選択されるハロゲン含有部分であり、
式中、nは、ゼロまたは1〜8の整数であり、mは、ゼロまたは1〜8の整数であり、
R1、R2、およびR3は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、およびC2−C6アルキニルから独立して選択され、アルキル、アルケニル、およびアルキニル基のアルキル部分は、直鎖、分岐、および環状、ならびに直鎖、分岐、および環状のアルキル、アルケニル、およびアルキニル部分の組み合わせであってもよく、基は、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、メトキシ、エトキシ、O−n−プロピル、O−イソプロピル、O−n−ブチル、およびO−t−ブチルから選択される基で置換され得るか、または
R1およびR2は、以下に示されるように、それらが直接結合する窒素、および前記窒素に結合する炭素と一緒に、5員以上の環を形成し、pは、1〜7の整数であり、
【化2】

式中、破線は、任意の二重結合を表すが、但し、そのような二重結合が存在するときには、R3は、非存在であり、二重結合に隣接するCH2基は、2個の水素ではなく1個の水素を有するか、
またはR2およびR3は、以下に示されるように、それらが結合する窒素と一緒に、3員以上の環を形成し、pは、1〜7の整数であり、
【化3】

Wは、非存在であるか、またはWは、
−CH2−、−CH2−CH2−、trans−CH=CH−、cis−CH=CH−、
【化4】

、または−CHR4−CHR5−、trans−CR4=CR5−、cis−CR4=CR5−から選択され、R4およびR5は、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、およびC1−C6アルキルエーテル(C1−C6アルキル−O−とも称される)から独立して選択されるか、または
Wは、二置換部分であり、二置換という用語は、Wが、
(a)以下の式によって示されるように、1、2、もしくは3個の二重結合を有し、飽和または不飽和であり得る、1,2−、1,3−、または1,4−二置換6員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換5員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換4員環、あるいは二重結合を有し、飽和および不飽和であり得る、1,2−二置換3員環であって、二置換環上の置換基は、式IのWに結合する基であり、
【化5】

式中、破線は、任意の二重結合を示す、環と、
(b)以下の式によって示されるように、1、2、もしくは3個の二重結合を有し、飽和または不飽和であり得る、1,2−、1,3−、または1,4−二置換6員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換5員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換4員環、あるいは二重結合を有し、飽和および不飽和であり得る、1,2−二置換3員環であって、二置換環上の置換基は、式IのWに結合する基であり、二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、およびR9を有してもよく、
【化6】

式中、破線は、任意の二重結合を示し、R6、R7、R8、およびR9は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立して選択され、6員環は、飽和であり得るか、または1、2、もしくは3個の二重結合を有してもよく、5員環および4員環は、飽和であり得るか、または1もしくは2個の二重結合を有してもよく、3員環は、飽和であり得るか、または1個の二重結合を有してもよく、Yは、窒素、酸素、または硫黄である、環と、
(c)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、または1,7−二置換飽和および不飽和9員環から選択される環であって、環は、以下に記載される2〜13番目の環から選択され、二置換環上の置換基は、式IのWに結合する基であり、二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、およびR10を有してもよく、
【化7】

式中、破線は、任意の二重結合を示し、
R6、R7、R8、R9、およびR10は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立してから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
(d)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、1,7−、または1,8−二置換飽和および不飽和ナフタレン環から選択される環であって、環は、以下に記載される2〜6番目の環から選択され、二置換環上の置換基は、式IのWに結合する基であり、二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、R10、およびR11を有してもよく、
【化8】

式中、破線は、任意の二重結合を示し、R6、R7、R8、R9、R10、およびR11は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立してから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
(e)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、1,7−、1,8−、1,9−、1,10−、2,5−、3,5−、4,5−、または5,10−二置換飽和および不飽和アントラセン環から選択される環であって、環は、以下に記載される2〜9番目の環から選択され、二置換環上の置換基は、式IのWに結合する基であり、二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、R10、R11、R12、およびR13を有してもよく、
【化9】

式中、破線は、任意の二重結合を示し、
R6、R7、R8、R9、R10、R11、R12、およびR13は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
から成る二置換部分の群から選択される、基(CH2)mおよび(CH2)nにどのように結合するかを示すために使用される、化合物、
またはその薬学的に許容される塩および薬学的に許容される担体を含む。
【0005】
一実施形態において、R1、R2、およびR3は、水素、メチル、エチル、n−プロピル、イソプロピル、シクロプロピル、−CH2−シクロプロピル、n−ブチル、sec−ブチル、イソブチル、tert−ブチル、シクロブチル、−CH2−シクロブチル、n−ペンチル、sec−ペンチル、イソペンチル、tert−ペンチル、シクロペンチル、−CH2−シクロペンチル、n−ヘキシル、sec−ヘキシル、シクロヘキシル、−CH2−シクロヘキシル、エテニル、プロペニル、ブテニル、1−メチル−2−ブテン−1−イル、エチニル、2−プロピニル(プロパルギル)、および1−プロピニルから独立して選択され、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、メトキシ、エトキシ、O−n−プロピル、O−イソプロピル、O−n−ブチル、およびO−t−ブチルから選択される1つまたは複数の置換基を担持し得る。
【0006】
発明の一実施形態において、式Iの化合物は、式II
【化10】

の化合物であり、式中、n、m、W、Z、R1、R2、およびR3は、上記で定義されるとおりであり、Xは、薬学的に許容される酸である。一実施形態において、酸は、HClである。別の実施形態において、酸は、HBrである。
【0007】
発明の一実施形態において、Zは、硫黄、銅、銀、金、または白金である。発明の別の実施形態において、Zは硫黄である。発明の別の実施形態において、Zは銅である。発明の別の実施形態において、Zは金である。発明の別の実施形態において、Zは、上記で定義されるようなハロゲン含有部分である。発明の別の実施形態において、R1、R2、およびR3は、それぞれ水素である。発明の一特定化合物において、Zは銅であり、R1、R2、およびR3は、それぞれ水素であり、mは1であり、nは1であり、WはCH2である。
【0008】
発明の一実施形態において、R4、R5、R6、R7、R8、R9、R10、R11、R12、およびR13は、水素、メチル、エチル、n−プロピル、イソプロピル、シクロプロピル、−CH2−シクロプロピル、ビニル、アリール、n−ブチル、sec−ブチル、イソブチル、tert−ブチル、シクロブチル、−CH2−シクロブチル、n−ペンチル、sec−ペンチル、イソペンチル、tert−ペンチル、シクロペンチル、−CH2−シクロペンチル、n−ヘキシル、sec−ヘキシル、シクロヘキシル、−CH2−シクロヘキシル、エテニル、プロペニル、ブテニル、1−メチル−2−ブテン−1−イル、エチニル、2−プロピニル(プロパルギル)、および1−プロピニルから独立して選択され、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、メトキシ、エトキシ、O−n−プロピル、O−イソプロピル、O−n−ブチル、およびO−t−ブチルから選択される、1つまたは複数の置換基を担持し得る。
【0009】
発明の一実施形態において、Wは、アリールまたはビニルである。
【0010】
本発明の一実施形態は、哺乳動物における癌、炎症性疾患、ならびにウイルスおよび細菌感染を含むが、これらに限定されない過剰増殖性疾患の治療のための薬学的組成物に関し、抗過剰増殖性疾患、抗炎症、抗ウイルス、または抗菌有効量の4−イソチオウレイドブチロニトリル(S−(3−シアノプロピル)イソチオ尿素またはS−(γ−シアノプロピル)イソチオ尿素とも称される)またはその薬学的に許容される塩、および薬学的に許容される担体を含む。特定の実施形態において、組成物は、「Kevetrin」としても知られる、4−イソチオウレイドブチロニトリルの塩酸酸付加塩を含む。この塩は、以下の式を有する。
【化11】

【0011】
別の実施形態において、組成物は、4−イソチオウレイドブチロニトリルの臭化水素酸酸付加塩を含む。
【0012】
別の実施形態において、本発明は、哺乳動物における癌、炎症性疾患、ならびにウイルスおよび細菌感染を含むが、これらに限定されない過剰増殖性疾患の治療のための薬学的組成物に関し、抗過剰増殖性疾患、抗炎症、抗ウイルス、または抗菌有効量のS−(2−シアノエチル)イソチオ尿素、S−(4−シアノブチル)イソチオ尿素、S−(5−シアノペンチル)イソチオ尿素から選択される化合物、またはその薬学的に許容される塩、および薬学的に許容される担体を含む。
【0013】
別の実施形態において、本発明は、哺乳動物における癌、炎症性疾患、ならびにウイルスおよび細菌感染を含むが、これらに限定されない過剰増殖性疾患の治療のための薬学的組成物に関し、抗過剰増殖性疾患、抗炎症、抗ウイルス、または抗菌有効量のS−(4−シアノメチルフェニル)メチルイソチオ尿素塩酸塩、S−2(4−[2−シアノエチル]フェニル)エチルイソチオ尿素メシレート、S−(2−シアノメチルフェニル)メチルイソチオ尿素塩酸塩、S−(6−シアノメチルピリジン−2−イル)メチルイソチオ尿素塩酸塩、S−(3−シアノメチルフェニル)メチルイソチオ尿素塩酸塩、S−(1−シアノメチルナフト−2−イル))メチルイソチオ尿素塩酸塩から選択される化合物、またはその異なる薬学的に許容される塩、および薬学的に許容される担体を含む。別の実施形態において、薬学的組成物は、以下に記載される実施例11で説明されるように調製される化合物から選択される化合物、またはその異なる薬学的に許容される塩、またはその遊離塩基、および薬学的に許容される担体を含む。
【0014】
発明の一実施形態において、薬学的組成物は、S−シアノメチルイソチオ尿素HBrを含まない。発明の別の実施形態において、薬学的組成物は、S−シアノメチルイソチオ尿素HClまたはS−シアノメチルイソチオ尿素HBrを含まない。発明の別の実施形態において、薬学的組成物は、S−シアノメチルイソチオ尿素の薬学的に許容される塩を含まない。発明の別の実施形態において、薬学的組成物は、遊離塩基または塩として、S−シアノメチルイソチオ尿素を含まない。
【0015】
発明の一実施形態において、薬学的組成物は、S−(2−シアノエチル)イソチオ尿素HCl、S−シアノメチルイソチオ尿素HBr、およびS−シアノメチルイソチオ尿素HClを含まない。発明の別の実施形態において、薬学的組成物は、S−(2−シアノエチル)イソチオ尿素HCl、S−(2−シアノエチル)イソチオ尿素HBr、S−シアノメチルイソチオ尿素HCl、またはS−シアノメチルイソチオ尿素HBrを含まない。発明の別の実施形態において、薬学的組成物は、S−(2−シアノエチル)イソチオ尿素、およびS−シアノメチルイソチオ尿素の薬学的に許容される塩を含まない。発明の別の実施形態において、薬学的組成物は、S−(2−シアノエチル)イソチオ尿素を遊離塩基または塩として含まず、S−シアノメチルイソチオ尿素を遊離塩基または塩として含まない。
【0016】
発明の別の実施形態において、薬学的組成物は、S−(シアノメチル)イソチオ尿素HCl、S−(シアノメチル)イソチオ尿素HBr、S−(2−シアノエチル)イソチオ尿素HCl、S−(2−シアノエチル)イソチオ尿素HBr、S−(2−シアノエチル)イソチオ尿素p−トルエンスルホネート、S−(3−シアノプロピル)イソチオ尿素HCl、S−(3−シアノプロピル)イソチオ尿素ピクリン酸、およびS−パラ−シアノベンジルイソチオ尿素HClを含まない。発明の別の実施形態において、薬学的組成物は、S−(3−シアノプロピル)イソチオ尿素またはS−パラ−シアノベンジルイソチオ尿素の臭化水素酸塩も含まない。
【0017】
発明の別の実施形態において、薬学的組成物は、S−(シアノメチル)イソチオ尿素、S−(2−シアノエチル)イソチオ尿素、S−(3−シアノプロピル)イソチオ尿素、またはS−パラ−シアノベンジルイソチオ尿素の薬学的に許容される塩を含まない。発明の別の実施形態において、化合物は、S−(シアノメチル)イソチオ尿素、S−(2−シアノエチル)イソチオ尿素、S−(3−シアノプロピル)イソチオ尿素、およびS−パラ−シアノベンジルイソチオ尿素、およびその薬学的に許容される塩から選択されない。
【0018】
式Iの化合物の薬学的に許容される塩は、その酸付加および塩基塩(二塩を含む)を含む。適切な酸付加塩は、非毒性塩を形成する酸から形成される。例には、酢酸塩、アスパラギン酸塩、安息香酸塩、ベシル酸塩、重炭酸塩/炭酸塩、重硫酸塩/硫酸塩、ホウ酸塩、カンシル酸塩、クエン酸塩、エジシル酸塩、エシル酸塩、ギ酸塩、フマル酸塩、グルセプチン酸塩、グルコン酸塩、グルクロン酸塩、ヘキサフルオロリン酸塩、ヒベンズ酸塩、塩酸塩/塩化物、臭化水素酸塩/臭化物、ヨウ化水素酸塩/ヨウ化物、イセチオン酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マロン酸塩、メシル酸塩、メチル硫酸塩、ナフチル酸塩、2−ナプシル酸塩、ニコチン酸塩、硝酸塩、オロチン酸塩、オキサル酸塩、パルミチン酸塩、パモ酸塩、リン酸塩/リン酸水素/リン酸二水素、サッカラート、ステアリン酸塩、コハク酸塩、酒石酸塩、トシル酸塩、およびトリフルオロ酢酸塩が挙げられる。適切な塩基塩は、非毒性塩を形成する塩基から形成される。例には、アルミニウム、アルギニン、ベンザチン、カルシウム、塩素、ジエチルアミン、ジオラミン、グリシン、リシン、マグネシウム、メグルミン、オラミン、カリウム、ナトリウム、トロメタミン、および亜鉛塩が挙げられる。適切な塩に関する考察は、″Handbook of Pharmaceutical Salts:Properties,Selection,and Use″by Stahl and Wermuth(Wiley−VCH,Weinheim,Germany,2002)を参照されたい。
【0019】
式Iの化合物の薬学的に許容される塩は、式Iの化合物の溶液および所望の酸または塩基を、必要に応じて一緒に混合することによって容易に調製され得る。塩は、溶液から沈殿し、ろ過によって収集され得るか、または溶媒の蒸発によって回収され得る。塩中のイオン化の程度は、完全なイオン化からほぼ非イオン化まで異なり得る。
【0020】
式Iの化合物およびその薬学的に許容される塩(以降、活性化合物とも称される)は、非溶媒および溶媒形態で存在し得る。活性化合物(塩、遊離塩基、遊離酸、および中性化合物の形態のものを含む)は、水和物および他の溶媒を形成し得る。「溶媒和物」とう用語は、本明細書において、発明の化合物、および1つまたは複数の薬学的に許容される溶媒分子、例えば、エタノールを含む、分子複合体を説明するために使用される。「水和物」という用語は、当該溶媒が水である場合に用いられる。薬学的に許容される溶媒は、水和物および他の溶媒を含み、結晶化の溶媒は、同位体置換、例えば、D2O、d6−アセトン、d6−DMSOであり得る。活性化合物は、クラスレートまたは他の複合体として存在し得る。一般に、溶媒、水和等の形態は、非溶媒、非水和/無水等の形態と同等であり、本明細書において請求される化合物、組成物、および用途は、これらの形態、ならびに異性体、結晶、および非晶質形態、ならびに以下に論じられる同位体標識化合物を、本発明の範囲内に包含することが意図される。
【0021】
1つまたは複数の非対称炭素原子を含有する式Iの化合物は、2つ以上の立体異性体として存在し得る。式Iの化合物がアルケニルまたはアルケニレン基、あるいはシクロアルケニル基を含有する場合、幾何cis/trans(またはZ/E)異性体が可能である。化合物が、例えば、ケトまたはオキシム基、あるいは芳香族部分を含有する場合、互変異性異性(「互変異性」)が起こり得る。単一の化合物が、1種類より多くの互変異性を呈し得るということになる。式Iの化合物は、それらが酸付加または塩基塩を形成する場合、異性体としても存在し得、そこでは対イオンは、光学的に活性な、例えば、D−乳酸またはL−リシン、あるいはラセミ、例えば、DL−酒石酸またはDL−アルギニンである。
【0022】
立体異性体の混合物は、当業者に知られている従来技術によって分離され得る。例えば、″Stereochemistry of Organic Compounds″by E.L..Eliel(Wiley,New York,1994)を参照されたい。
【0023】
Cis/trans異性体は、当業者によく知られている従来技術、例えば、クロマトグラフィおよび分別結晶によって分離され得る。
【0024】
一般に、本発明の鏡像異性的に純粋な化合物は、当該技術分野において知られている過程、例えば、適切な光学的に純粋な前駆体からのキラル合成およびラセミ化合物(または塩あるいは誘導体のラセミ化合物)の溶解に従って、調製および単離され得る。例えば、ラセミ化合物(またはラセミ前駆体)は、キラル高圧液体クロマトグラフィ(HPLC)を使用して分離され得る。代替として、ラセミ化合物(またはラセミ前駆体)は、適切な光学的に活性な化合物、例えば、アルコールと反応し得るか、または式Iの化合物が酸性または塩基性部分を含有する場合は、酸または塩基、例えば、酒石酸または1−フェニルエチルアミンと反応し得る。得られるジアステレオ異性体混合物は、クロマトグラフィまたは分別結晶、あるいはそれらの両方によって分離され得、両方のジアステレオ異性体は、当業者によく知られている手段によって、1つまたは複数の対応する純粋な鏡像異性体に変換され得る。
【0025】
本発明のキラル化合物(およびそのキラル前駆体)は、クロマトグラフィ、通常、HPLCを使用して、鏡像異性的に富化された形態で、非対称固定相および移動相を有する樹脂上で取得されてもよく、それは炭化水素、通常、ヘプタンまたはヘキサンから成り、0〜50%のイソプロパノール、通常、2〜20%、および0〜5%のアルキルアミン、通常0.1%のジエチルアミンを含有する。溶出液の濃縮は、富化混合物をもたらす。
【0026】
固体の状態において、本発明の化合物は、結晶または非晶質形態で存在し得る。
【0027】
本発明は、本明細書において請求される式Iの薬学的に許容されるすべての同位体標識化合物を含み、そこでは1つまたは複数の原子が、同一の原子番号を有するが、原子質量または質量番号が、自然界で通常見出される原子質量または質量番号とは異なる原子と置換される。
【0028】
発明の化合物に含有するために適した同位体の例には、水素の同位体、例えば2Hおよび3H、炭素の同位体、例えば11C、13C、および14C、塩素の同位体、例えば36Cl、フッ素のの同位体、例えば18F、ヨウ素の同位体、例えば123Iおよび125I、窒素の同位体、例えば13Nおよび15N、酸素の同位体、例えば15O、17O、および18O、リンの同位体、例えば32P、および硫黄の同位体、例えば、35Sが挙げられる。式Iの特定の同位体的標識化合物、例えば、放射性同位体を組み込むものは、薬物および/または基質組織分布研究において有用である。放射性同位体のトリチウム、すなわち3H、および炭素14、すなわち14Cは、それらの組み込みの容易さ、および検出の容易な手段を考慮すると、この目的で特に有用である。より重い同位体、例えば、ジウテリウム、すなわち2Hによる置換は、優れた代謝安定性、例えば、インビボ半減期の増加または用量要件の減少によって生じる特定の治療利益をもたらし得、したがって、いくつかの状況において好適であり得る。陽電子放出同位体、例えば、11C、18F、15O、および13Nによる置換は、陽電子放出トポグラフィ(PET)研究において、置換基受容体の占有を調べるために有用であり得る。
【0029】
式Iの同位体的標識化合物は、一般に、当業者に知られている従来技術によって、または添付の実施例に記載されるものに類似する過程によって、以前に用いられた非標識試薬の代わりに、適切な同位体的標識試薬を使用して、調製され得る。
【0030】
本発明は、抗過剰増殖有効量の式Iの化合物、またはその薬学的に許容される塩、および薬学的に許容される担体を含む、細胞過剰増殖の治療のための薬学的組成物にも関する。別の実施形態において、本発明は、抗癌有効量の式Iの化合物、またはその薬学的に許容される塩、および薬学的に許容される担体を含む、癌治療のための薬学的組成物に関する。別の実施形態において、本発明は、アポトーシス誘導有効量の式Iの化合物、またはその薬学的に許容される塩、および薬学的に許容される担体を含む、癌治療のための薬学的組成物に関する。他の実施形態において、上述される薬学的組成物から除外される化合物の1つまたは複数は、この段落で参照される薬学的組成物からも同様に除外され得る。
【0031】
本発明は、癌を含むが、それに限定されない細胞過剰増殖の治療のための、抗過剰増殖または抗癌有効量の式Iの化合物、またはその薬学的に許容される塩、および薬学的に許容される担体を含む、用量単位形態の薬学的組成物にも関する。他の実施形態において、上述される薬学的組成物から除外される化合物の1つまたは複数は、前述の薬学的組成物からも同様に除外され得る。
【0032】
本発明は、癌を含むが、それに限定されない細胞過剰増殖の治療のための、抗過剰増殖または抗癌有効量の式Iの化合物、またはその薬学的に許容される塩、および薬学的に許容される担体を含む、非経口薬学的組成物にも関する。医薬品は、所望される量の製品を、滅菌等張液に溶解することによって得ることができ、任意の所望される経路で容易に投与され得る。他の実施形態において、上述薬学的組成物から除外される化合物の1つまたは複数は、前述の薬学的組成物からも同様に除外され得る。
【0033】
本発明は、ヒトを含む哺乳動物において、癌を含むが、これらに限定されない過剰増殖性疾患、炎症性疾患、ならびにウイルスおよび細菌感染を治療する方法にも関し、そのような治療を必要とする患者に、抗過剰増殖性疾患、抗炎症、抗ウイルスまたは抗菌有効量の式Iの化合物、またはその薬学的に許容される塩を投与することを含む。一実施形態において、化合物は、S−(3−シアノプロピル)イソチオ尿素、S−(2−シアノエチル)イソチオ尿素、S−(4−シアノブチル)イソチオ尿素、S−(5−シアノペンチル)イソチオ尿素、S−(4−シアノメチルフェニル)メチルイソチオ尿素、S−2(4−[2−シアノエチル]フェニル)エチルイソチオ尿素、S−(2−シアノメチルフェニル)メチルイソチオ尿素、S−(6−シアノメチルピリジン−2−イル)メチルイソチオ尿素、S−(3−シアノメチルフェニル)メチルイソチオ尿素、およびS−(1−シアノメチルナフト−2−イル))メチルイソチオ尿素、およびその薬学的に許容される塩から選択される。別の実施形態において、化合物は、S−(3−シアノプロピル)イソチオ尿素塩酸塩から選択される。別の実施形態において、化合物は、以下の実施例11に記載されるように調製される化合物、またはその異なる薬学的に許容される塩、またはその遊離塩基から選択される。
【0034】
本発明は、過剰増殖性疾患を治療する方法にも関し、そのような治療を必要とする患者に、抗過剰増殖有効量の式Iの化合物、またはその薬学的に許容される塩を投与することを含む。別の実施形態において、本発明は、癌を治療する方法に関し、そのような治療を必要とする患者に、抗癌有効量の式Iの化合物、またはその薬学的に許容される塩を投与することを含む。別の実施形態において、本発明は、癌を治療する方法に関し、そのような治療を必要とする患者に、アポトーシス誘導有効量の式Iの化合物、またはその薬学的に許容される塩を投与することを含む。他の実施形態において、上述薬学的組成物から除外される化合物の1つまたは複数は、この段落で参照される方法からも同様に除外され得る。
【0035】
本発明は、哺乳動物において、頭頸部癌、非小細胞肺癌、小細胞肺癌、耐性型の肺および任意の女性癌、卵巣癌、乳癌、または結腸癌を治療する方法にも関し、そのような治療を必要とする哺乳動物に、抗癌有効量の式Iの化合物、またはその薬学的に許容される塩を投与することを含む。本発明の一実施形態において、癌は、頭頸部癌、非小細胞肺癌、卵巣癌、および結腸癌から選択される。本発明の一実施形態において、頭部癌は、神経膠腫である。
【0036】
本発明は、アポトーシスの誘導に応答する過剰増殖性疾患の治療を、そのような治療を必要とする哺乳動物において行う方法にも関し、それを必要とする哺乳動物に、個別に、同時に、一斉に、順次、または経時的にずらして、式Iの化合物またはその薬学的に許容される塩である、活性化合物の量、および少なくとも1つの二次化合物または放射線の量を投与することを含み、二次化合物は、化学療法抗癌剤および標的特異的抗癌剤から成る群から選択される抗癌剤であり、活性化合物および当該二次化合物または放射線の量は、治療効果をもたらす。発明の一実施形態において、当該二次化合物は、(i)アルキル化/カルバミル化剤、(ii)白金誘導体、(iii)抗有糸分裂剤/チューブリン阻害剤、(iv)トポイソメラーゼ阻害剤、(v)ピリミジン拮抗薬、(vi)プリン拮抗薬、(vii)葉酸拮抗薬、および(viii)注入放射性物質から成る群から選択される。発明の一実施形態において、当該標的特異的抗癌剤は、(i)キナーゼ阻害剤、(ii)プロテアソーム阻害剤、(iii)ヒストン脱アセチル化阻害剤、(iv)熱衝撃タンパク質90阻害剤、(v)血管標的剤(VAT)抗血管新生薬、およびKDRチロシンキナーゼ阻害剤、(vi)モノクローナル抗体および変異体、およびモノクローナル抗体と抗体フラグメントの複合体、(vii)オリゴヌクレオチド系治療薬、(viii)トール様受容体/TLR9作動薬、TLR7作動薬およびその類似体、またはTLR7/8作動薬およびTLR7/8作動薬としての免疫刺激性RNA、(ix)プロテアーゼ阻害剤、(x)ホルモン治療薬、(xi)ブレオマイシン、(xii)レチノイド、(xiii)DNAメチルトランスフェラーゼ阻害剤、(xiv)アラノシン、(xv)サイトカイン、(xvi)インターフェロン、および(xvii)細胞死受容体作動薬から成る群から選択される。発明の一実施形態において、当該式Iの化合物またはその薬学的に許容される塩は、抗癌有効量の放射線と個別に、同時に、一斉に、順次、または経時的にずらして投与される。本明細書で使用される、用語「有効量」は、それ自体で投与される場合に有効な活性化合物の量、および別の治療剤と併せて投与される場合に有効な活性化合物の量を含むことは、前述から明らかである。
【0037】
本発明の方法によって治療され得る過剰増殖性疾患には、これらに限定されないが、乳房、膀胱、骨、脳、中枢および末梢神経系、結腸、内分泌腺、食道、子宮内膜、生殖細胞、頭頸部、腎臓、肝臓、肺、咽頭および下咽頭、中皮腫、肉腫、卵巣、膵臓、前立腺、肛門、小腸、柔組織、睾丸、胃、皮膚、尿管、膣および外陰の癌、遺伝性癌、網膜芽腫、およびウィルムス腫瘍、白血病、リンパ腫、非ホジキン病、慢性および急性骨髄性白血病、急性リンパ芽球性白血病、ホジキン病、多発性骨髄腫、およびT細胞リンパ腫、骨髄異形成症候群、形質細胞新生組織形成、腫瘍随伴症候群、未知の原発部位の癌、薬物耐性癌、およびAIDS関連悪性腫瘍が挙げられ、疾患は、そのような治療を必要とする哺乳動物に、抗過剰増殖または抗癌有効量の式Iの化合物、またはその薬学的に許容される塩を投与することによって治療される。発明の一実施形態において、過剰増殖性疾患は、頭頸部癌、非小細胞肺癌、小細胞肺癌、耐性型肺癌および任意の女性癌、乳癌、卵巣癌、および結腸癌から成る群から選択される。
【0038】
本発明は、上記で定義されるような式Iの化合物、またはその薬学的に許容される塩であるが、但し、S−(シアノメチル)イソチオ尿素HCl、S−(シアノメチル)イソチオ尿素HBr、S−(2−シアノエチル)イソチオ尿素HCl、S−(2−シアノエチル)イソチオ尿素HBr、S−(2−シアノエチル)イソチオ尿素p−トルエンスルホン酸塩、S−(3−シアノプロピル)イソチオ尿素HCl、S−(3−シアノプロピル)イソチオ尿素 ピクリン酸、およびS−パラ−シアノベンジルイソチオ尿素HClではないことを条件とする、化合物にも関する。本発明の別の実施形態において、化合物は、S−(3−シアノプロピル)イソチオ尿素、またはS−パラ−シアノベンジルイソチオ尿素の臭化水素酸塩でもない。
【0039】
本発明の別の実施形態において、化合物は、S−(シアノメチル)イソチオ尿素、S−(2−シアノエチル)イソチオ尿素、S−(3−シアノプロピル)イソチオ尿素、またはS−パラ−シアノベンジルイソチオ尿素の薬学的に許容される塩ではない。本発明の別の実施形態において、化合物は、S−(シアノメチル)イソチオ尿素、S−(2−シアノエチル)イソチオ尿素、S−(3−シアノプロピル)イソチオ尿素、およびS−パラ−シアノベンジルイソチオ尿素、およびその薬学的に許容される塩から選択されない。
【0040】
S−シアノメチルイソチオ尿素は、カルバムイミドチオ酸,シアノメチルエステルとも称され、S−(2−シアノエチル)イソチオ尿素は、カルバムイミドチオ酸,シアノエチルエステルとも称され、S−(3−シアノプロピル)イソチオ尿素は、カルバムイミドチオ酸,シアノプロピルエステルとも称され、S−パラ−シアノベンジルイソチオ尿素は、カルバムイミドチオ酸,(4−シアノフェニル)メチルエステルとも称されることに留意されたい。
【0041】
本発明の一実施形態において、化合物は、S−(4−シアノブチル)イソチオ尿素、およびS−(5−シアノペンチル)イソチオ尿素、ならびにその薬学的に許容される塩から選択される。本発明の別の実施形態において、化合物は、S−(4−シアノメチルフェニル)メチルイソチオ尿素塩酸塩、S−2(4−[2−シアノエチル]フェニル)エチルイソチオ尿素メシレート、S−(2−シアノメチルフェニル)メチルイソチオ尿素塩酸塩、S−(6−シアノメチルピリジン−2−イル)メチルイソチオ尿素塩酸塩、S−(3−シアノメチルフェニル)メチルイソチオ尿素塩酸塩、S−(1−シアノメチルナフト−2−イル))メチルイソチオ尿素塩酸塩、またはその異なる薬学的に許容される塩から選択される。別の実施形態において、化合物は、以下に記載される実施例11で説明されるように調製される化合物、またはの異なる薬学的に許容される塩、もしくはその遊離塩基から選択される。
【0042】
本発明は、Zが硫黄である、式Iの化合物の塩酸塩付加塩を調製するための過程にも関し、チオ尿素または式
【化12】

のチオ尿素誘導体であって、式中、R1、R2、およびR3は、式Iに関して上
記で定義されるとおりである、チオ尿素誘導体を、式NC−(CH2)n−W−(CH2)mClの適切なニトリル誘導体であって、n、m、およびWは、式Iの化合物に関して上記で定義されるとおりである、ニトリル誘導体と、水または水/アルコール溶媒中、あるいは極性溶媒中、還流温度で反応させて、Zが硫黄である式Iの化合物を得ること、および必要に応じて、遊離塩基または異なる酸付加塩を調製することを含む。発明の一実施形態において、溶媒は、メタノール、エタノール、イソプロパノールから選択されるアルコール、および前述のアルコールの1つまたは複数と水との混合液から選択される。
【0043】
本発明は、式Iの化合物の塩酸付加塩を調製するための過程にも関し、Zは、銅、銀、金、白金、およびClO2、BrO2、およびIO2から選択されるハロゲン含有部分から選択され、式NC−(CH2)n−W−(CH2)mClの化合物であって、n、m、およびWは、式Iの化合物に関して上記で定義されるとおりである、化合物を、それぞれの金属の塩またはハロゲン含有部分の塩と反応させて、中間化合物を形成すること、および次に、中間化合物を、チオ尿素または式
【化13】

のチオ尿素誘導体であって、R1、R2、およびR3は、式Iに関して上記で定義されるとおりである、チオ尿素誘導体と反応させて、Zが銅、銀、金、白金、またはClO2、BrO2、およびIO2から選択されるハロゲン含有部分である、式Iの化合物を得ることであって、中間物の形成および酸付加塩の形成は、水または水/アルコール溶媒または極性溶媒中、還流温度で行われることと、および必要に応じて、遊離塩基または異なる酸付加塩を調製することを含む。発明の一実施形態において、溶媒は、メタノール、エタノール、イソプロパノールから選択されるアルコール、および前述のアルコールの1つまたは複数と水との混合液から選択される。本発明は、式Iの化合物の臭化水素酸酸付加塩、および式Iの化合物のメシレート塩の調製にも関する。臭化水素酸酸付加塩は、上述の過程において、開始物質を含有する臭素を置換することによって調製される。メシレート塩は、上述の過程において、メシレート開始物質を置換することによって調製される。本発明の二塩は、塩を開始物質として使用することによって同様に調製され得る。遊離塩基が2つの塩基中心を有する場合、そのような塩を形成することが可能であり得る。
【図面の簡単な説明】
【0044】
【図1】Kevetrin細胞毒性の時間依存性を示す。ヒト癌細胞を、異なる濃度のKevetrinに、5、10、20、30、あるいは45分間、または1、2、6、24、または120時間曝露した。IC50として表される細胞生存能力を、MTT分析を使用して測定して、Kevetrin曝露の時間に対してプロットした。
【図2】Kevetrinおよびシスプラチンの活性スペクトルを示す。Kevetrinおよびシスプラチンが、表示腫瘍細胞株の生存能力に及ぼす影響を、3倍増時間Kevetrinに連続曝露した後、MTT分析を使用して測定した。表示値は、以下のように計算する:ログ(IC50個別の細胞株−IC50平均)。負の値は、細胞株が、平均よりも感受性が高いことを示すが、正の値は、細胞株が平均よりも耐性が高いことを示す。試験したすべての細胞株の平均IC50は、Kevetrinの場合、4.9x10−7M、シスプラチンの場合、2.1x10−6Mであった。
【図3】Kevetrinに起因するマウスの体重変化を示す。0日目にKevetrin IV100mg/kgまたは200mg/kgのいずれかで処置した後のマウスの動物体重が示される。
【図4】哺乳動物癌におけるKevetrinまたはタキソールの有効性を示す。MDA−MB−231ヒト乳癌を持つマウスを、7、9、および11日目に200mg/kgKevetrinの静脈内注入で処置し、7、9、11、および13日目の22mg/kgタキソールの静脈内注入と比較した。
【図5】結腸癌におけるKevetrinまたは5−FUの有効性を示す。HT−29腫瘍を持つ裸マウスを、7、9、および11日目に、200mg/kgのKevetrinの静脈内注入または5−FUのいずれかで処置した。
【図6】前立腺癌におけるKevetrinまたはシスプラチンの有用性を示す。PC−3腫瘍を有する裸マウスを、7、9、および11日目に200mg/kg Kevetrinの静脈内注入または7日目に10mg/kgのシスプラチンのいずれかで処置した。
【図7】ヒトP−糖タンパク質媒介耐性結腸癌におけるKevetrinまたはタキソールの有効性を示す。HCT−15腫瘍を有する裸マウスを、7、9、および11日目に200mg/kg Kevetrinの静脈内注入または腫瘍後7、9、11、および13日目に22mg/kgタキソールのいずれかで処置した。
【図8】A549多剤耐性ヒト肺癌における7、9、および11日目のKevetrin200mg/kg、および7、9、11、および13日目のタキソール22mg/kgの有効性を示す。
【図9】NCI−H1975多剤耐性ヒト肺癌における7、9、および11日目のKevetrin200mg/kg、および13日目のタキソール22mg/kgの有効性を示す。
【発明を実施するための形態】
【0045】
Zが硫黄である、本発明において有用な化合物は、チオ尿素を、式NC−(CH2)n−W−(CH2)mClの適切なニトリル誘導体と反応させることによって、水中で調製され、式中、n、m、およびWは、式Iの化合物に関して上で定義されるとおりである。等量のチオ尿素およびニトリルを、10倍量の水または水/アルコール溶媒、または極性溶媒に添加し、加熱して、約4時間、大気圧で還流させる。水およびアルコールの混合液を調製するため、または極性溶媒として使用するために適したアルコールの非限定例には、メタノール、エタノール、およびイソプロパノールが挙げられる。反応混合液を蒸発させて、所望の生成物を得る。この生成物は、エタノールまたは別の適切な溶媒、例えば、イソプロパノールまたはメタノール、あるいは前述のアルコールの1つとアセトンとの混合液からの再結晶化によって精製される。結晶物質は、ろ過によって収集され、高真空下で乾燥される。Zが、銅、銀、金、および白金から選択されるか、またはZが、ClO2、BrO2、およびIO2から選択される、ハロゲン含有部分である、式Iの化合物は、同様に調製される。
【0046】
W部分のYが、硫黄、酸素、または窒素である、式Iの化合物は、硫黄、酸素、または窒素が、W部分の環上の所望の位置にある、適切なニトリル誘導体を選択することによって調製される。
【0047】
当業者であれば、関心対象の特定の化合物を形成するために、上述のものから条件を選択する方法、またはそこに修正を行う方法が分かる。
【0048】
患者の疾患および状態に応じて、本明細書で使用される、用語「治療」は、治療、緩和、および予防的治療の1つまたは複数を含み得る。活性化合物は、患者の治療において、放射線と一緒に、または他の抗過剰増殖化合物、例えば、シクロホスファミド、シスプラチン、カルボプラチン、タキソール、およびアービタックス、ならびに他の認可された抗過剰増殖化合物と一緒に、複合または連続的に投与され得る。特定の疾患および患者の状態に応じて、そのような治療は、化合物単独または放射線単独のいずれよりも有効であり得る。抗過剰増殖、抗炎症、抗菌、または抗ウイルス用途の各活性化合物の正確な投与量は、患者のタイプ、治療される疾患状態のタイプ、患者の年齢、および投与経路が挙げられるが、これらに限定されない多数の因子に応じて異なる。
【0049】
ヒト患者に投与する場合、活性化合物の総日量は、投与方法に応じて、体重1kg当り1mg〜300mgの範囲であることが予想される。例えば、経口投与は、体重1kg当り100mg〜300mgの総日量を必要とし得るが、静脈内用量は、体重1kg当り20mg〜200mgだけを必要とし得る。総日量は、単一または分割用量で投与されてもよい。体重約70kgの平均的ヒト対象の場合、用量は、経口投与で約1400mg〜21000mg、静脈内投与で約140mg〜1400mgとなるであろう。医師は、体重がこの範囲外である対象、例えば、幼児および高齢者に対する用量を容易に決定することができるであろう。獣医は、他の哺乳動物に対する用量を容易に決定することができるであろう。
【0050】
一実施形態において、発明は、体重1kg当り200mgの活性化合物を含む、静脈内溶液または懸濁液の投与を含む。上述の治療用途の場合、投与される用量は、当然のことながら、用いられる化合物、投与方法、所望される治療、および示される疾患によって異なる。総日量は、単一または分割用量で投与されてもよい。本発明は、持続放出組成物も包含する。
【0051】
薬学的組成物は、例えば、錠剤、カプセル、丸薬、粉末、持続放出製剤、懸濁液として経口投与に適した形態、滅菌溶液、懸濁液、または乳剤として非経口注入に適した形態、軟膏またはクリームとして局所投与に適した形態、または坐薬として肛門投与に適した形態であり得る。薬学的組成物は、精密用量の単一投与に適した単位用量形態であってもよい。薬学的組成物は、従来の薬学的担体または賦形剤、および活性化合物を含む。さらに、他の医薬剤、担体、アジュバント等を含んでもよい。
【0052】
典型的な非経口投与形態は、滅菌水溶液、例えば、水性プロピレングリコールまたはデキストロース溶液中の活性化合物の溶液または懸濁液を含む。そのような投与形態は、必要に応じて、適切に緩衝され得る。
【0053】
適切な薬学的担体は、不活性希釈剤または充填剤、水、および種々の有機溶媒を含む。薬学的組成物は、必要に応じて、追加の成分、例えば、香味剤、結合剤、賦形剤等を含有し得る。したがって、経口投与の場合、種々の賦形剤、例えば、クエン酸を含有する錠剤は、種々の崩壊剤、例えば、スターチ、アルギニン酸、および特定の複合ケイ酸と一緒に、およびスクロース、ゼラチン、およびアカシア等の結合剤と一緒に用いられてもよい。さらに、ステアリン酸マグネシウム、ラウリル硫酸ナトリウム、およびタルク等の滑沢剤は、錠剤化目的で有用な場合が多い。類似型の固形組成物は、軟および硬ゼラチンカプセルで用いられてもよい。これらの組成物の有用な成分は、ラクトース、乳糖、および高分子量ポリエチレングリコールを含む。水性懸濁液またはエリキシルが、経口投与に所望される場合、そこでの活性化合物は、水、エタノール、プロピレングリコール、グリセリン、またはそれらの組み合わせと一緒に、種々の甘味剤または香味剤、着色物質または染料、および必要に応じて、乳化剤または懸濁剤と組み合わされてもよい。
【0054】
種々の薬学的組成物を特定量の活性化合物で調製する方法は、既知であるか、または当業者に明らかとなるであろう。例えば、Remington′s Pharmaceutical Sciences,Mack Publishing Company,Easter,Pa.,15th Edition(1975)を参照されたい。
【0055】
本明細書に記載される用量範囲は、単なる例証であり、請求される組成物の範囲または実践を限定することを意図しない。例えば、用量は、毒性作用および/または検査値等の臨床効果を含み得る、薬物動態または薬力学的パラメータに基づいて調整されてもよい。したがって、本発明は、熟練者によって決定されるように、患者内用量上昇を包含する。化学療法剤の投与に適した用量およびレジメンを決定することは、関連技術においてよく知られており、本明細書に開示される教示が一旦提供されると、熟練者によって包含されることが理解される。
【0056】
発明の薬学的組成物は、単一単位用量、または複数の単一単位用量として、バルクで調製、包装、または販売されてもよい。本明細書で使用される、「単位用量」は、規定量の活性化合物を含む、個別量の薬学的組成物である。活性化合物の量は、概して、対象に投与される、活性化合物の用量、またはそのような用量の便宜的分数、例えば、そのような用量の1/2または1/3に等しい。
【0057】
発明の薬学的組成物中の活性化合物、薬学的に許容される担体、および任意の追加成分の相対量は、治療される対象が何であるが、その大きさ、および状態に応じて、さらに組成物が投与される経路に応じて異なる。例として、組成物は、0.1%〜100%(w/w)の活性成分を含み得る。
【0058】
活性化合物に加えて、本発明の薬学的組成物は、上述のように、1つまたは複数の追加の治療上有効な化合物をさらに含み得る。
【0059】
本明細書で使用される、薬学的組成物の「非経口投与」は、対象の組織の物理的な切れ目を入れることによって特徴付けられる任意の投与経路、および組織内の切れ目を通しての薬学的組成物の投与を含む。したがって、非経口投与には、非経口投与には、組成物の注入、外科的切開を通る組成物の適用、組織関数非外科的創傷を通る組成物の適用による、薬学的組成物の投与が挙げられるが、これらに限定されない。したがって、活性化合物は、血流、筋肉、または内臓に直接投与され得る。非経口投与に適した手段には、静脈内、動脈内、腹腔内、髄腔内、脳室内、尿道内、胸骨内、頭蓋内、筋肉内、および皮下、および腎透析注入技術が挙げられる。そのような非経口投与に適したデバイスには、針(極微針を含む)、注射器、無針注射器、および注入装置が挙げられる。
【0060】
非経口製剤は、通常、塩、炭水化物、および緩衝剤(好ましくは、pH3〜9)等の賦形剤を含有し得る、水溶液であるが、いくつかの適用の場合、それらは、滅菌非水溶液またはピロゲンを含まない滅菌水等適切な媒体と併せて使用される乾燥形態として、より適切に製剤され得る。
【0061】
滅菌条件下、例えば、凍結乾燥による非経口製剤の調製は、当業者によく知られている標準薬学的技術を使用して、容易に達成され得る。
【0062】
非経口投与に適した薬学的組成物の製剤は、薬学的に許容される担体、例えば、滅菌水または滅菌等張食塩水と組み合わされる、活性成分を含む。そのような製剤は、ボーラス投与または連続投与に適した携帯で、調製、包装、または販売され得る。注入可能な製剤は、単位用量形態、例えば、アンプルまたは保存量を含有する複数回投与容器で調製、包装、または販売され得る。非経口投与のための製剤には、懸濁液、溶液、油性または水性媒体中の乳剤、ペースト、および以下に論じられるような移植可能な持続放出または生分解性製剤が挙げられるが、これらに限定されない。そのような製剤は、懸濁剤、安定剤、または分散剤を含むが、これらに限定されない1つまたは複数の追加成分をさらに含んでもよい。非経口投与用製剤の一実施形態において、活性成分は、再構成成分の非経口投与に先立って、適切な媒体(例えば、ピロゲンを含まない滅菌水)による再構成のために、乾燥(すなわち、粉末または粒状)形態で提供される。
【0063】
薬学的組成物は、滅菌注入可能な水性または油性の懸濁液または溶液の形態で、調製、包装、または販売され得る。懸濁液または溶液は、周知の技術に従って製剤され得、活性成分に加えて、本明細書に記載される分散剤、湿潤剤、または懸濁剤等の追加成分を含んでもよい。そのような滅菌注入可能な製剤は、非毒性の非経口投与可能な希釈剤または溶媒、例えば、水または1,3−ブタンジオール等を使用して調製され得る。他の許容される希釈剤および溶媒には、リンガー溶液、等張性塩化ナトリウム溶液、および固定油、例えば、合成モノ−またはジ−グリセリドが挙げられるが、これらに限定されない。有用な他の非経口投与可能な製剤には、活性成分を、微結晶形態で、リポソーム調製物中、または生分解性ポリマー系化合物として含むものが挙げられる。持続放出または移植用の組成物は、薬学的に許容されるポリマーまたは疎水性物質、例えば、乳剤、イオン交換樹脂、難溶性ポリマー、または難溶性塩を含み得る。
【0064】
活性化合物は、細胞過剰増殖の阻害剤であるか、または癌細胞におけるアポトーシスの細胞周期特異的誘導体であるか、または両方である。したがって、これらの化合物は、過剰増殖疾患および障害、例えば、癌を治療するために有用であり、アポトーシスの誘導に応答性である疾患および障害、例えば、癌を治療するために有用である。細胞周期特異的モードの作用を有することによって、これらの化合物は、DNA複製等の基本細胞過程を標的とするか、またはDNA等の基本細胞分子を干渉する標準化学療法薬と比較して、治療指数が高いはずである。したがって、例えば、本明細書において論じられる活性化合物は、目標とされる癌治療において有用となることが期待される。活性化合物は、血管形成に対しても有効であり得る。
【0065】
本発明の文脈において、過剰増殖および類似する用語は、異常または非調節、あるいは異常および非調節細胞成長、癌等の疾患の特徴を説明するために使用される。細胞増殖の阻害および類似する用語は、本明細書において、化合物が、その化合物と接触されない細胞と比較して、その化合物と接触される細胞の成長を遅延させる、および/または殺傷する能力を示すために使用される。最も好ましくは、この細胞増殖の阻害は、100%であり、すべての細胞の増殖が停止される、および/または細胞がプログラム化細胞死を経ることを意味する。いくつかの実施形態において、接触される細胞は、腫瘍細胞である。腫瘍細胞は、異常細胞増殖のある細胞として定義される。良性腫瘍細胞は、攻撃的な転移腫瘍をインビボで形成することができない細胞の過剰増殖によって説明される。対照的に、悪性腫瘍は、例えば、腫瘍転移を形成することができる、異なる細胞および生化学的異常のある細胞によって説明される。悪性腫瘍細胞の後天的機能異常(「癌の特徴」とも定義される)は、複製能(「過剰増殖」)、成長シグナルの自給、抗成長シグナルに対する非感受性、アポトーシスからの回避、持続的血管形成、組織侵襲、および転移である。
【0066】
アポトーシスの誘導体および類似する用語は、本明細書において、その化合物と接触される細胞においてプログラム化細胞死を実行する、化合物を特定するために使用される。アポトーシスは、接触される細胞内の複雑な生化学的事象、例えば、システイン特異的プロテイナーゼ(「カスパーゼ」)の活性、およびクロマチンのフラグメント化によって定義される。化合物と接触される細胞におけるアポトーシスの誘導は、必ずしも細胞増殖の阻害を伴うとは限らない。好ましくは、細胞増殖の阻害および/またはアポトーシスの誘導は、異常細胞成長(過剰増殖)のある細胞に特異的である。したがって、異常細胞成長のある細胞と比較して、正常な増殖または停止細胞は、化合物の増殖阻害またはアポトーシス誘導活性に対して感受性が低いか、または非感受性でさえある。最後に、細胞毒性は、細胞周期依存または細胞周期独立の様式で、アポトーシス/プログラム化細胞死の誘導を含む、種々の機序によって細胞を殺傷する化合物を特定するために、より一般的な意味で使用される。
【0067】
細胞周期特異的および類似する用語は、本明細書において、化合物を、静止している非分割細胞内ではなく、細胞周期の特定の相を活発に通過する連続的増殖細胞内でのみアポトーシスを誘導するものとして特定するために使用される。連続増殖細胞は、疾患様癌に典型的であり、細胞分割周期のすべての相、つまりG(「ギャップ」)1、S(「DNA合成」)、G2およびM(「有糸分裂」)相によって特徴付けられる。
【0068】
AKT(タンパク質キナーゼB(PKB)としても知られる)、およびその遺伝子族生成物は、セリン/トレオニンタンパク質キナーゼとして特定されている。Testa et al.,Proc.Natl.Acad.Sci.,2001,98,10983−10985、Lawlor et al.,J.Cell Sci.,2001,114,2903−2910、Duan,Circ.Res.,2000,86,15−23。PKBは、細胞増殖、アポトーシス、およびインスリン応答において重要な役割を果たす。したがって、PKBの調節は、腫瘍形成、異常細胞増殖、および糖尿病の治療において感心対象である。本発明の文脈において、過剰増殖および類似する用語は、異常/非調節細胞成長、疾患様癌の特徴を説明するために使用される。
【0069】
PKB分析
PKB活性を評価するためのキナーゼ分析は、活性PKB酵素、PPKB特定基質、およびP33標識ATPを含む。PKB酵素の2つの形態、全長PKBαおよびプレクストリンドメイン(アミノ酸1〜117)が削除された、PKBαのキナーゼドメインを使用する。両方のPKB酵素は、Upstate Cell Signaling Solutions(カタログ番号14〜276および14〜341)から入手することができる。使用されるPKB基質は、Obata et al.,J.Biol.Chem.2000,275,36108−36115に記載されるような合成ペプチド(ARKRERTYSFGHHA)である。リン酸化基質は、ホスホセルロース膜フィルタプレート(Millipore)によって捕捉され、Wallac Microbeta液体シンチレーションカウンタ(Perkin Elmer)によって測定される。
【0070】
細胞中のPKB活性は、PTENヌルヒト乳房主要細胞株MDA−MB−468において分析される。PKB基質FKHRL1、GSK3a/b、およびツベリンのリン酸化状態は、ホスホ特異的抗体(細胞シグナリング技術)を利用する免疫分析によって測定される。
【0071】
PKB阻害が細胞生存能力に及ぼす影響は、MDA−MB−468、MDA−MB−231、U87−MG、LN−229、PC−3、DU145が挙げられるが、これらに限定されない、一連のヒト主要細胞株において測定される。細胞は、通常の成長培地において72時間処理し、細胞生存能力は、Alamar Blue(Biosource,UK)によって測定する。
【0072】
以下の非限定実施例は、活性化合物の調製を説明する。1H核磁気共鳴(NMR、Mercury−300)スペクトルは、提案される構造と一致した。特徴的な化学シフト(δ)は、主要なピークの指定のための従来の省略形(例えば、s単項、d二重項、t三重項、q四重項、m多項、br広範)を使用して、テトラメチルシランから100万分の1ダウンフィールドで示される。質量スペクトル(m/z)は、エレクトロスプレイイオン化(ESI)または大気圧化学イオン化(APCI)のいずれかを使用して、Agilentモデル1100質量分析計で記録した。以下の略語を、一般的な溶媒に対して使用する:CDCl3:デウテロクロロホルム、D6−DMSO:デウテロメチルスルホキシド、CD3OD:デウテロメタノール。
【実施例】
【0073】
実施例1
S−(3−シアノプロピル)イソチオ尿素塩酸塩(Kevetrinとしても知られる)
【化14】

γ−クロロブチロニトリル(5.0g、48.3mmol)およびチオ尿素(4.04g、53.1mmol)を、40mlの水に混合した。混合液を加熱し、3〜4時間還流させた。反応混合液を蒸発させて、20mlのエタノールを添加した後、同様に蒸発させた。これを3回繰り返した。その後、10mlのメタノールおよび30mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、5.44g(30.3mmol、収率62.7%)の生成物を、白い結晶として、融点134〜135℃、97%よりも高い純度で得た。1H NMR(300MHz,d6DMSO)δ1.89(m,2H)、2.63(t,2H、J=7.2Hz)、3.23(t,2H、J=7.2Hz)、3.38(s,3H)。
13C NMR(75MHz)δ15.3,25.0,28.8,119.8,169.7
式: C5H10ClN3S
精密質量: 179.03
分子量: 179.67
m/e: 179.03(100.0%),181.03(32.1%),180.03(7.4%),181.02(4.5%),182.03(2.0%),183.02(1.5%).C,33.42、H,5.61、Cl,19.73、N,23.39、S,17.85
解析計算値: 33.42 5.61 23.39 17.85
実測値: 33.44 5.48 23.40 18.31
【0074】
実施例2
S−(2−シアノエチル)イソチオ尿素塩酸塩
【化15】

3−クロロプロパンニトリル(4.32g、48.3mmol)およびチオ尿素(4.04g、53.1mmol)を40mlの水中で混合した。混合液を加熱し、3〜4時間還流させた。反応混合液を蒸発させて、20mlのエタノールを添加した後、同様に蒸発させた。これを3回繰り返した。その後、10mlのメタノールおよび30mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、S−(2−シアノエチル)イソチオ尿素塩酸塩を得た。
【0075】
実施例3
S−(4−シアノブチル)イソチオ尿素塩酸塩
【化16】

5−クロロペンタンニトリル(5.68g、48.3mmol)およびチオ尿素(4.04g、53.1mmol)を、40mlの水中で混合した。混合液を加熱し、3〜4時間還流させた。反応混合液を蒸発させて、20mlのエタノールを添加した後、同様に蒸発させた。これを3回繰り返した。その後、10mlのメタノールおよび30mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、S−(4−シアノブチル)イソチオ尿素塩酸塩を得た。
【0076】
実施例4
S−(5−シアノペンチル)イソチオ尿素塩酸塩
【化17】

6−クロロヘキサンニトリル(6.36g、48.3mmol)およびチオ尿素(4.04g、53.1mmol)を、40mlの水中で混合した。混合液を加熱し、3〜4時間還流させた。反応混合液を蒸発させて、20mlのエタノールを添加した後、同様に蒸発させた。これを3回繰り返した。その後、10mlのメタノールおよび30mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、S−(5−シアノペンチル)イソチオ尿素塩酸塩を得た。
【0077】
実施例5
S−(4−シアノメチルフェニル)メチルイソチオ尿素塩酸塩
【化18】

4−クロロメチルフェニルアセトニトリル(200mg、1.21mmol)およびチオ尿素(101mg、1.33mmol)を、1mlのメタノール中で混合した。混合液を加熱し、3〜4時間還流させた。反応混合液を蒸発させた。その後、1mlのメタノールおよび4mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、219mg(0.91mmol、収率75%)の生成物を、オフホワイトの結晶として、95%よりも高い純度で得た。1H NMR(300MHz、d6−DMSO)δ4.03(s,2H)、4.50(s,2H)、7.35(d,2H,J=8.23Hz)、7.45(d,2H,J=8.23Hz)、9.22(s,4H)。(M+H)206.00
式: C10H12ClN3S
精密質量: 241.04 (205.07)
分子量: 241.74
m/e:241.04(100.0%)、243.04(36.6%)、242.05(11.0%)、244.04(4.6%)、242.04(1.9%)、245.04(1.5%)
【0078】
実施例6
S−2(4−[2−シアノエチル]フェニル)エチルイソチオ尿素メシレート
【化19】

メシレート(200mg、0.79mmol)およびチオ尿素(66mg、0.87mmol)を、1mlのメタノール中で混合した。混合液を加熱し、3〜4時間還流させた。反応混合液を蒸発させた。その後、1mlのメタノールおよび4mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、203mg(0.62mmol、収率78%)の生成物を、オフホワイトの結晶として、95%よりも高い純度で得た。1H NMR(300MHz,d6−DMSO)δ2.35(s,3H)、2.80(m,2H)、2.85(m,2H)、2.91(t,2H,J=7.4)、3.42(t,3H,J=7.4)、7.24(s,4H)、9.04(s,4H)。(M+H)234.07
式: C13H19N3O3S2
精密質量: 329.09(233.10)
分子量: 329.44
m/e: 329.09(100.0%)、330.09(16.0%)、331.08(9.1%)、331.09(1.9%)、332.09(1.4%)、330.08(1.1%)
【0079】
実施例7
S−(2−シアノメチルフェニル)メチルイソチオ尿素塩酸塩
【化20】

2−クロロメチルフェニルアセトニトリル(200mg、1.21mmol)およびチオ尿素(101mg、1.33mmol)を、1mlのメタノール中で混合した。混合液を加熱し、3〜4時間還流させた。反応混合液を蒸発させた。その後、1mlのメタノールおよび4mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、231mg(0.95mmol、収率79%)の生成物を、オフホワイトの結晶として、95%よりも高い純度で得た。1H NMR(300MHz,d6−DMSO)δ4.14(s,2H)、4.56(s,2H)、7.37(m,2H)、7.45(m,2H)、9.23(s,4H)。(M+H)205.97
式: C10H12ClN3S
精密質量: 241.04(205.07)
分子量: 241.74
m/e: 241.04(100.0%)、243.04(36.6%)、242.05(11.0%)、244.04(4.6%)、242.04(1.9%)、245.04(1.5%)
【0080】
実施例8
S−(6−シアノメチルピリジン−2−イル)メチルイソチオ尿素塩酸塩
【化21】

6−クロロメチル−2−ピリジルアセトニトリル(200mg、1.2mmol)およびチオ尿素(101mg、1.32mmol)を、1mlのメタノール中で混合した。混合液を加熱し、3〜4時間還流させた。反応混合液を蒸発させた。その後、1mlのメタノールおよび4mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、216mg(0.89mmol、収率74%)の生成物を、オフホワイトの結晶として、95%よりも高い純度で得た。1H NMR(300MHz,d6−DMSO)δ4.29(s,2H)、4.64(s,2H)、7.41(d,1H,J=7.78)、7.51(d,1H,J=7.78)、7.91(t,1H,J=7.78)、9.46(s,4H)。(M+H)207.00
式: C9H11ClN4S
精密質量: 242.04(206.06)
分子量: 242.73
m/e: 242.04(100.0%)、244.04(36.7%)、243.04(12.0%)、245.04(3.9%)、246.03(1.5%)
【0081】
実施例9
S−(3−シアノメチルフェニル)メチルイソチオ尿素塩酸塩
【化22】

3−ブロモメチルフェニルアセトニトリル(200mg、0.95mmol)およびチオ尿素(80mg、1.05mmol)を、1mlのメタノール中で混合した。混合液を加熱して、3〜4時間還流させた。反応混合液を蒸発させた。その後、1mlのメタノールおよび4mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、215mg(0.75mmol、収率79%)の生成物を、オフホワイトの結晶として、95%よりも高い純度で得た。1H NMR(300MHz,d6−DMSO)δ4.08(s,2H)、4.53(s,2H)、7.31(m,2H)、7.40(m,2H)、9.25(s,4H)。(M+H)206.00
式: C10H12BrN3S
精密質量: 284.99(205.07)
分子量: 286.19
m/e: 286.99(100.0%)、284.99(98.1%)、287.99(12.7%)、286.00(10.7%)、288.99(4.5%)、285.99(1.9%)
【0082】
実施例10
S−(1−シアノメチルナフト−2−イル))メチルイソチオ尿素塩酸塩
【化23】

2−ブロモメチル−1−ナフチルアセトニトリル(200mg、0.77mmol)およびチオ尿素(64mg、0.85mmol)を、1mlのメタノール中で混合した。混合液を加熱して、3〜4時間還流させた。反応混合液を蒸発させた。その後、1mlのメタノールおよび4mlのアセトンを添加し、混合液を1時間攪拌した。結晶物質をろ過し、生成物を高真空下で一晩乾燥させて、215mg(0.64mmol、収率83%)の生成物を、オフホワイトの結晶として、95%よりも高い純度で得た。1H NMR(300MHz,d6−DMSO)δ4.57(s,2H)、4.83(s,2H)、7.63(m,2H)、7.72(m,1H)、8.05(m,2H)、8.2(d,1H,J=8.24)、9.1(s,2H)、9.28(s,2H)。(M+H)256.00。
式: C14H14BrN3S
精密質量: 335.01(255.08)
分子量: 336.25
m/e: 335.01(100.0%)、337.01(97.6%)、336.01(17.1%)、338.01(16.4%)、337.00(4.5%)、339.00(4.4%)、339.01(1.4%)、338.00(1.1%)、337.02(1.1%)
【0083】
実施例11
本発明の化合物の調製を示す、化学反応が以下に表される。示されるように、これらの化合物は、適切なニトリル誘導体をチオ尿素と反応させることによって、実施例1のそれに類似する方法で調製され得る。チオ尿素は、窒素原子上の4個の置換基のうちの1、2、もしくは3個が、水素以外であり、式Iの他の化合物を提供する、誘導体によって置換されてもよい。
【化24】

【化25】

【化26】

【化27】

【化28】

【化29】

【0084】
この実施例で表される反応において、nおよびmは、ゼロであるか、または独立して、1〜8の整数であり、R1、R2、R3、およびR4は、例えば、メチル、エチル、n−プロピル、イソプロピル、シクロプロピル、−CH2−シクロプロピル、ビニル、アリール、n−ブチル、sec−ブチル、イソブチル、tert−ブチル、シクロブチル、−CH2−シクロブチル、n−ペンチル、sec−ペンチル、イソペンチル、tert−ペンチル、シクロペンチル、−CH2−シクロペンチル、n−ヘキシル、sec−ヘキシル、シクロヘキシル、−CH2−シクロヘキシル部分等であり、これらも1つまたは複数の置換基を有し得る。R1、R2、R3、およびR4は、アルケニルおよびアルキニルでもあり得る。アルケニル基には、例えば、エテニル、プロペニル、ブテニル、1−メチル−2−ブテン−1−イル等が挙げられるが、これらに限定されない。代表的なアルキニル基には、エチニル、2−プロピニル(プロパルギル)、および1−プロピニルが挙げられる。
【0085】
上述のとおり調製される塩酸塩は、対応する遊離塩基または他の薬学的に許容される塩に、既知の方法によって変換され得る。他の薬学的に許容される塩は、上記反応のそれぞれにおいて、ニトリルを適切な開始物質(例えば、ニトリルを含有するクロリンではなく、ニトリルを含有するブロミン)を置換することによって、調製されてもよい。
【0086】
実施例12−Kevetrinの有効性研究
化学物質、細胞および培地
Kevetrinは、実施例1に記載されるように合成した。シスプラチン、ビンクリスチン、5−FU、およびタキソールは、Sigma Scientificから購入した。H460およびH522肺癌細胞、HT−29、SW−620、およびColo205、およびHCT−15結腸癌細胞、OvCar−3、およびSKOv−3卵巣癌細胞、DU−145、およびPC−3前立腺癌細胞、ならびにSNB−19およびU−251グリオーマ細胞、HT−1080線維肉腫、およびSW−480結腸癌細胞は、American Type Culture Collection(ATCC)(Rockville,MD)から購入した。A2780卵巣癌細胞およびそれらのシスプラチン耐性変異型A2780/CP1およびA2780/CP2は、社内で生成した。Colon HCT−116結腸癌細胞、それらのp53−/−、およびp21−/−亜株は、Central Research Institute(Salen,Ohio)のGangadharan博士から厚意で提供されたが、染色体3が補充されたHCT−116は、The Rajiv Gandhi Center for Cancer Research(Rohini,Delhi,India)から入手した。特に指示のない限り、媒体および他の試薬は、Becton Dickinsonから購入した。Bio Whittaker製の基礎培養培地(RPMI−1640)は、0.22μm Millex−GVフィルタ装置(Millipore)を通して滅菌した。調製された培地は、小アリコート中、5℃で、暗所保管した。基礎培養培地は、培養培地として使用するために、10%ウシ胎仔血清を補充し(FCS−560で30分間熱不活性化される)、ミトゲン、すなわち、リポ多糖類(LPS、10〜50μg/mL)を添加して、細胞を増殖させた。
【0087】
成長阻害分析
細胞毒性は、Maximum Tolerated Titer(MTT)分析によって決定した。簡潔に述べると、細胞を24ウェル組織培養プレートに、10,000〜15,000細胞/ウェルで播種し、一晩培養した。指数関数的に成長する細胞を、次に、異なる薬物濃度に3〜4世代時間曝露した。細胞生存性は、細胞をMTTテトラゾリウム塩に4 時間、37℃で曝露することによって決定し、ホルマザンの形成は、マイクロプレートリーダによって560nmで測定した。未処理対照と比較した、50%細胞成長を阻害する濃度は、用量の関数として、生存率をプロットする曲線から決定した。すべての値は、それぞれ重複して行われた少なくとも3つの独立実験の平均である。
【0088】
細胞増殖分析
MTT溶液(10μL)を、48時間培養したリンパ球のすべてのウェルに添加し、4時間37℃で培養した。2つの培養セットを調製し、LPSを1つのセットのみに添加した。この期間中、ホルマザン結晶が、各ウェルの底に形成した。消費された媒体を、培養細胞の懸濁液とともにピペットで除去した。次に、酸性化イソプロパノール(無水イソプロパノール中100μLの0.1N HCl)を、すべてのウェルに添加し、完全に混合して、紺青色の結晶を溶解した。数分後、室温で、プレートアナライザを使用して、二波長測定システムによってプレートを読み取った(試験波長540nm、参照波長630nm)。プレートは、酸性化イソプロパノールの添加から1時間以内に読み取った。細胞増殖は、刺激指数として以下のように計算した。
【数1】

【0089】
p53の免疫学的局在決定
細胞の増殖をもたらすタンパク質である、p53の局在を決定するために、免疫細胞化学分析を行った。簡潔に述べると、HCT−116細胞(ATCC)を、ガラススライドに一晩付着させ、イソ毒性濃度のKevetrin(300ng/ml)、またはシスプラチン(11μg/ml)に6時間曝露した。薬物曝露後に、細胞を3.7%ホルムアルデヒドで固定し、0.25% Triton X−100で透過処理し、1% BSA(ウシ血清アルブミン)で遮断した。次に、細胞を1時間、抗p53ポリクローナル抗体(Sc−6243、Santa Cruz Biotechnology,California)、続いて、二次抗ウサギFITC結合抗体(Amersham Life Sciences,U.K.)と共に培養した。カバースリップをVectashieldに載置し(Vector Laboratories Vector,U.K.)、プランApochromat x63対物レンズ(Zeiss)を使用することによって、適切なフィルタおよびレーザー共焦点走査システムLSM510を備える、落射蛍光顕微鏡Axiovert100Mで分析した。
【0090】
ウェスタンブロット分析
ウェスタンブロット分析を行った。全体細胞溶解物を、イソ毒性濃度のKevitren(300ng/ml)、またはシスプラチン(11ng/ml)で6時間処理された細胞から調製した。タンパク質(50μg/レーン)を、4〜12%ポリアクリルアミドSDSゲル上で分離し、PolyScreen膜(Millipore,Bedford,MA)に移した。p53、p21、およびβ−アクチンの存在を、それぞれ抗p53抗体(Sc−6243、Santa Cruz Biotechnology)、抗p21抗体(Sc−3976、Santa Cruz Biotechnology)、および抗アクチン抗体(Sc−1616、Santa Cruz Biotechnology)によって明らかにした後、ペルオキシダーゼ共役二次抗体(Jackson ImmunoResearch,West Grove,PA)で培養し、強化された化学発光(New England Nuclear,Hebron,CT)によって検出した。
【0091】
Kevetrinがヒト腫瘍細胞株の生存能力に及ぼす影響
Kevetrinが、肺、結腸、乳房、卵巣、前立腺の癌、肉腫、神経膠腫、および白血病を含む、10種類の異なるヒト腫瘍細胞の生存能力に及ぼす影響を、上述の細胞増殖分析を使用して決定した。細胞生存能力は、Kevetrinに3倍増期間、連続曝露した後に測定した。Kevetrinの指示濃度は、平均IC50に対応する。結果は、以下に記載される。一般に、Kevetrinは、上皮起源のヒト腫瘍細胞に対して、強力な活性を有する。Kevetrinの細胞毒性作用は、非小細胞肺、結腸、および卵巣癌に対して最も顕著であり、IC50は、11〜68ng/mlの範囲であった。興味深いことに、Kevetrinは、悪性神経膠腫細胞に対しても強力な活性を示した(IC50〜30ng/ml)。
【表1】

【0092】
Kevetrin細胞毒性の時間依存性
曝露時間がKevetrinの細胞毒性作用に及ぼす影響を決定するために、DU−145、HCT−116、またはHT−29癌細胞を、異なる濃度のKevetrinに、5、10、20、30、または45分、あるいは1、2、6、24、または120時間曝露した。長い曝露時間が細胞毒性の増加と関連する、Kevetrinの明白な時間依存の細胞毒性作用が、3つの細胞株すべてに認められた。結果を、図1に示す。時間依存性は、曝露時間が30〜45分以下の場合に特に劇的であった。対照的に、薬物曝露時間を24時間を超えて延長することは、細胞毒性に影響しなかった。
【0093】
Kevetrinおよびシスプラチンの活性スペクトラム
Kevetrinおよびシスプラチンが指示腫瘍株の生存能力に及ぼす影響を、MTT分析を使用して、Kevetrinに3倍増時間、連続曝露した後に測定し、結果を、図2に示す。示される値は、以下のように計算される:ログ(IC50個別の細胞株−IC50平均)。負の値は、細胞株が、平均よりも敏感であることを示すのに対して、正の値は、細胞株が平均よりも耐性があることを示す。試験されたすべての細胞株の平均IC50は、Kevetrinの場合、4.9x10−7M、およびシスプラチンの場合、2.1x10−6Mであった。MTT分析結果を考慮すると、図2の10種類の異なるヒト腫瘍細胞に対するシスプラチンおよびKevetrinの活性スペクトラムの比較は、2つの薬物間の明らかな相違を示す。Kevetrinの活性は、肺、頭頸部、乳房、卵巣、および結腸細胞株に対して、シスプラチンのそれよりも顕著であった。興味深いことに、Kevetrinは、一般に、特定の腫瘍細胞型内で高い異種反応を呈する、シスプラチンとは対照的に、試験された頭頸部、非小細胞肺、卵巣、結腸、および神経膠腫全てに対して活性を示した。Kevetrinとシスプラチンとの間の差異は、3つの頭頸部癌細胞株に対して特に顕著であったが、そこでKevetrinは、すべての細胞株に対して活性を示したが、シスプラチンは、3つの細胞株のうちの1つに対して活性であったことである。驚くべきことに、Kevetrinは、シスプラチンの場合に認められたものとは異なる、アルキル化剤に敏感である、白血病に対して比較的制限された活性を有した。
【0094】
ヒト腫瘍異種移植片を有する裸マウスにおけるKevetrinのインビボ有効性研究
動物および動物ケア
マウスは、12時間/12時間の明暗サイクルで、室温18〜26℃、および比較的高い湿度30〜70%で飼育した。動物の飼料および水は、不断で付与した。この順応期間中、各動物は、少なくとも1日1回、任意の異常または感染性疾患の発症に関して観察された。使用に適していると決定された動物のみをこの研究に割り当てた。本研究での使用に許容されないと考えられるいかなる動物も、同一業者からの類似する年齢および体重の動物と置き換えた。腫瘍質量が、平均、約100mm3に達すると、腫瘍の大きさに従って、無作為化し、グループに分けた。
【0095】
ヒト腫瘍細胞株
MDA−MB−231ヒト乳癌(HTB−26)、HT−29結腸癌(HTB−38)、PC−3前立腺癌(CRL−1435)、HCT−15P−糖タンパク質耐性結腸癌は、American Type Culture Collection(Rockville,MD)から購入した。
【0096】
MDA−MB−231細胞株は、最初に、乳腺腺癌の51歳白人女性の胸水から単離された。これらの細胞は、形態学的に上皮の性質であると考えられる。
【0097】
HT−29細胞株は、最初に、結腸直腸腺癌の44歳白人女性から1964年に単離された。これらの細胞は、形態学的に上皮の性質であると考えられる。
【0098】
PC−3細胞株は、最初に、グレードIV転移性前立腺腺癌の62歳白人男性の骨転移から単離された。これらの細胞は、低い酸ホスファターゼおよびテストステロン−5−アルファ還元酵素活性を呈し、形態学的に上皮の性質であると考えられる。
【0099】
HCT−15親細胞株は、最初に、デュークC型結腸直腸腺癌の男性から単離された。これらの細胞は、形態学的に上皮の性質であると考えられる。
【0100】
A549およびNCI−H1975多剤耐性ヒト肺癌株は、Dana Farber Cancer Institute(Boston,MA)からの寄贈であった。
【0101】
試験システム
細胞は、10%FBS RPMI培地中で培養した。細胞は、本有用性研究に対して、さらなる拡張のために、5代継代で取得した。裸マウス(Nu/Nu)の雄(20〜24g)および雌(19〜22g)の両方を、6〜8週齢で、Charles River Laboratoriesから購入した。これらのマウスは、研究の開始時においてナイーブであり、耳の穿孔によって識別された。マウスは、5日間放置して、新しい環境に順化させた。RPMI:マトリゲル50:50混合中のヒト腫瘍細胞を、各マウスの右脇腹に皮下的に移植した。腫瘍が平均容積100mm3に達したときに、投与を開始した。
【0102】
生存中の観察および測定
任意の悪影響について、マウスを毎日観察した。処置前、処置中の隔日、および処置後に、マウスの体重を測定した。動物の状態が悪化した場合は、その動物のいかなる処置をも中断した。回復しない場合は、動物を犠牲死させた。15%を超える体重喪失を示すいかなる動物も、状態が悪化していると見なした。20%を超える体重喪失を示すいかなる動物も、犠牲死させた。腫瘍部位上に皮膚の持続的潰瘍化を呈するいかなる動物も、犠牲死させた。マウスの腫瘍の大きさの測定値を、処置前、処置中の隔日、および処置後に取った。同一の科学者が、研究を通して、腫瘍測定値の測定を担当した。
【0103】
終末手順
媒体群からの腫瘍が1000mm3に到達すると、すべての群からのすべての動物を、CO2窒息により犠牲死させた。犠牲死時に、腫瘍を除去し、測量した。
【0104】
研究スケジュール
RPMI:マトリゲル50:50混合中の5x106腫瘍細胞を、各裸マウスの右脇腹に皮下的に移植した。腫瘍が平均容積100mm3に到達したときに(通常、移植後14日目までに達した)、投与を開始し、投与は8日間行った。剖検は、治療の終了後、41日目に行った。
【0105】
材料
Kevetrinは、実施例1に記載されるように調製した。周囲温度(または−20℃以下)で保存し、光から保護した。試験動物に投与するために、Kevetrinをリン酸緩衝生理食塩水(PBS)に懸濁させた(滅菌、pH=7.4)。使用する前に、PBSを周囲温度で保存した。各懸濁液を調製した後、−20℃以下で保存し、光から保護した。
【0106】
投与
投与手順は、マウスを無作為化し、グループ分けした日に開始した。以下の段落において論じられるように、腫瘍移植後7、9、および11日目に用量を投与した。各用量は、尾静脈を介して投与した。
【0107】
Kevetrinに起因する体重喪失
Kevetrinを、腫瘍を持つ動物に静脈内注入(IV)した場合、化合物の投与に起因する体重喪失は、許容可能な範囲内であった。7、9、および11日目に静脈内投与された100mg/kgは、体重の6.8%の喪失をもたらし、同一スケジュールで投与された200mg/kgは、9.3%の体重喪失をもたらした。これらの濃度はいずれも、Kevetrinの有用性を確立するために使用され得る。これらの結果を、図3に示す。
【0108】
MDA−MB−231ヒト乳癌における、7、9、11、および13日目の22mg/kg タキソール静脈内注入と比較した、7、9、および11日目の200mg/kg Kevetrin静脈内注入の有用性
動物に、ヒト乳癌MDA−MB−231を皮下的に移植し、スケジュールに従って、化合物を静脈内注入した。Kevetrinを投与した動物は、タキソール治療した動物よりも高い有用性を示した。腫瘍成長は、タキソール治療した動物よりも12日、未治療の対照よりも32日遅延した。結果を、図4に示す。
【0109】
HT−29結腸癌における、7〜12日目の5−FUと比較した、7、9、および11日目の200mg/kg Kevetrin静脈内注入の有用性
動物に、ヒト結腸癌HT−29を皮下的に移植し、スケジュールに従って、化合物を静脈内注入した。Kevetrinを投与した動物は、5−FU治療した動物よりも高い有用性を示した。腫瘍成長は、5−FU治療した動物よりも10日、未治療の対照よりも33日遅延した。結果を、図5に示す。
【0110】
PC−3ヒト前立腺癌における、7日目の10mg/kgシスプラチンと比較した、7、9、および11日目の200mg/kg Kevetrin静脈内注入の有用性
動物に、ヒト前立腺癌PC−3を皮下的に移植した。スケジュールに従って、Kevetrinを静脈内注入し、シスプラチンを腹腔内(IP)注入した。Kevetrinを投与した動物は、シスプラチン治療した動物よりも高い有用性を示した。腫瘍成長は、シスプラチン治療した動物よりも8日、未治療の対照よりも34日遅延した。結果は、図6に示される。
【0111】
P−糖タンパク質媒介耐性を有するHCT−15ヒト結腸癌における、7、9、11、および13日目の22mg/kg タキソールと比較した、7、9、および11日目の200mg/kg Kevetrinの有用性
動物に、P−糖タンパク質耐性細胞モデルである、ヒト結腸癌HCT−15を皮下的に移植し、スケジュールに従って、化合物を静脈内注入した。タキソールは、そのような癌に対してほとんど作用しなかったが、Kevetrinを投与した動物は、動物において有用性を示した。腫瘍成長は、タキソール治療した動物、および未治療の対照よりも15日遅延した。結果を、図7に示す。
【0112】
A549多剤耐性ヒト肺癌における、7、9、11、および13日目の22mg/kg タキソールと比較した、7、9、および11日目の200mg/kg Kevetrin の有用性
動物に、多剤耐性ヒト肺癌を皮下的に移植し、スケジュールに従って、化合物を静脈内注入した。タキソールは、そのような癌に対してほとんど作用しなかったが、Kevetrinを投与した動物は、動物において強力な有用性を示した。腫瘍成長は、未治療の対照よりも26日遅延した。結果を、図8に示す。
【0113】
NClI−H1975多剤耐性ヒト肺癌における、7、9、11、および13日目の22mg/kg タキソールと比較した、7、9、および11日目の200mg/kg Kevetrinの有用性
動物に、別の多剤耐性ヒト肺癌を皮下的に移植し、スケジュールに従って、化合物を静脈内注入した。タキソールは、そのような癌に対してほとんど作用しなかったが、Kevetrinを投与した動物は、動物において強力な有用性を示した。腫瘍成長は、タキソール治療した動物よりも約9日、および未治療の対照よりも約24日遅延した。結果を、図9に示す。
【0114】
書籍および学術論文を含むが、これらに限定されない、本出願において引用されるすべての出版物は、それぞれ参照することによりそれら全体が本明細書に組み込まれる。
【0115】
発明は、開示される実施形態を参照して上述されたが、当業者であれば、詳述される特定の実験が、発明の単なる例証に過ぎないことを容易に理解するであろう。発明の精神から逸脱することなく、種々の修正を行うことができることを理解されたい。したがって、発明は、以下の請求項によってのみ制限される。
【特許請求の範囲】
【請求項1】
哺乳動物において、過剰増殖性疾患、炎症性疾患、ウイルス感染、または細菌感染を治療するための薬学的組成物であって、抗増殖性疾患、抗炎症性、抗ウイルス、または抗菌有効量の式Iの化合物であって、
【化30】

式中、Zは、硫黄、銅、銀、金、および白金から選択されるか、またはZは、ClO2、BrO2、およびIO2から選択されるハロゲン含有部分であり、
式中、nは、ゼロまたは1〜8の整数であり、mは、ゼロまたは1〜8の整数であり、
R1、R2、およびR3は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、およびC2−C6アルキニルから独立して選択され、前記アルキル、アルケニル、およびアルキニル基の前記アルキル部分は、直鎖、分岐、および環状、ならびに直鎖、分岐、および環状のアルキル、アルケニル、およびアルキニル部分の組み合わせであってもよく、前記基は、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、メトキシ、エトキシ、O−n−プロピル、O−イソプロピル、O−n−ブチル、およびO−t−ブチルから選択される基で置換され得るか、または
R1およびR2は、以下に示されるように、それらが直接結合する窒素、および前記窒素に結合する炭素と一緒に、5員以上の環を形成し、pは、1〜7の整数であり、
【化31】

式中、破線は、任意の二重結合を表すが、但し、そのような二重結合が存在するときには、R3は、非存在であり、前記二重結合に隣接するCH2基は、2個の水素ではなく1個の水素を有するか、
またはR2およびR3は、以下に示されるように、それらが結合する窒素と一緒に、3員以上の環を形成し、pは、1〜7の整数であり、
【化32】

Wは、非存在であるか、またはWは、
−CH2−、−CH2−CH2−、trans−CH=CH−、cis−CH=CH−、
【化33】

、または−CHR4−CHR5−、trans−CR4=CR5−、cis−CR4=CR5−から選択され、R4およびR5は、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、およびC1−C6アルキルエーテル(C1−C6アルキル−O−とも称される)から独立して選択されるか、または
Wは、二置換部分であり、二置換という用語は、Wが、
(a)以下の式によって示されるように、1、2、もしくは3個の二重結合を有し、飽和または不飽和であり得る、1,2−、1,3−、または1,4−二置換6員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換5員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換4員環、あるいは二重結合を有し、飽和および不飽和であり得る、1,2−二置換3員環であって、前記二置換環上の置換基は、式IのWに結合する基であり、
【化34】

式中、破線は、任意の二重結合を示す、環と、
(b)以下の式によって示されるように、1、2、もしくは3個の二重結合を有し、飽和または不飽和であり得る、1,2−、1,3−、または1,4−二置換6員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換5員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換4員環、あるいは二重結合を有し、飽和および不飽和であり得る、1,2−二置換3員環であって、前記二置換環上の置換基は、式IのWに結合する基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、およびR9を有してもよく、
【化35】

式中、破線は、任意の二重結合を示し、R6、R7、R8、およびR9は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立して選択され、前記6員環は、飽和であり得るか、または1、2、もしくは3個の二重結合を有してもよく、前記5員環および4員環は、飽和であり得るか、または1もしくは2個の二重結合を有してもよく、前記3員環は、飽和であり得るか、または1個の二重結合を有してもよく、Yは、窒素、酸素、または硫黄である、環と、
(c)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、または1,7−二置換飽和および不飽和9員環から選択される環であって、前記環は、以下に記載される2〜13番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、およびR10を有してもよく、
【化36】

式中、破線は、任意の二重結合を示し、
R6、R7、R8、R9、およびR10は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立してから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
(d)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、1,7−、または1,8−二置換飽和および不飽和ナフタレン環から選択される環であって、前記環は、以下に記載される2〜6番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、R10、およびR11を有してもよく、
【化37】

式中、破線は、任意の二重結合を示し、R6、R7、R8、R9、R10、およびR11は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立してから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
(e)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、1,7−、1,8−、1,9−、1,10−、2,5−、3,5−、4,5−、または5,10−二置換飽和および不飽和アントラセン環から選択される環であって、前記環は、以下に記載される2〜9番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、R10、R11、R12、およびR13を有してもよく、
【化38】

式中、破線は、任意の二重結合を示し、
R6、R7、R8、R9、R10、R11、R12、およびR13は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
から成る二置換部分の群から選択される、基(CH2)mおよび(CH2)nにどのように結合するかを示すために使用される、化合物、
またはその薬学的に許容される塩および薬学的に許容される担体を含む、薬学的組成物。
【請求項2】
Zは、硫黄である、請求項1に記載の薬学的組成物。
【請求項3】
前記式Iの化合物は、式IIの化合物であり、
【化39】

式中、n、m、W、Z、R1、R2、およびR3は、請求項1に定義されるとおりであり、Xは、薬学的に許容される酸である、請求項1または2に記載の薬学的組成物。
【請求項4】
前記薬学的に許容される酸は、HClまたはHBrである、請求項3に記載の薬学的組成物。
【請求項5】
前記組成物は、S−シアノメチルイソチオ尿素HBrを含有しないことを条件とする、請求項1〜4のいずれか1項に記載の薬学的組成物。
【請求項6】
前記化合物は、S−(3−シアノプロピル)イソチオ尿素、またはその薬学的に許容される塩である、請求項1〜4のいずれか1項に記載の薬学的組成物。
【請求項7】
前記化合物は、S−(3−シアノプロピル)イソチオ尿素塩酸塩である、請求項1〜4のいずれか1項に記載の薬学的組成物。
【請求項8】
S−(2−シアノエチル)イソチオ尿素、S−(4−シアノブチル)イソチオ尿素、S−(5−シアノペンチル)イソチオ尿素、S−(4−シアノメチルフェニル)メチルイソチオ尿素、S−2(4−[2−シアノエチル]フェニル)エチルイソチオ尿素、S−(2−シアノメチルフェニル)メチルイソチオ尿素、S−(6−シアノメチルピリジン−2−イル)メチルイソチオ尿素、S−(3−シアノメチルフェニル)メチルイソチオ尿素、S−(1−シアノメチルナフト−2−イル))メチルイソチオ尿素から選択される化合物、ならびにその薬学的に許容される塩および薬学的に許容される担体を含む、請求項1〜4のいずれか1項に記載の薬学的組成物。
【請求項9】
前記過剰増殖性疾患は、細胞過剰増殖であり、前記組成物は、抗過剰増殖有効量の式Iの化合物、またはその薬学的に許容される塩および薬学的に許容される担体を含む、請求項1〜8のいずれか1項に記載の薬学的組成物。
【請求項10】
前記過剰増殖性疾患は、癌であり、前記組成物は、抗癌有効量の式Iの化合物、またはその薬学的に許容される塩および薬学的に許容される担体を含む、請求項1〜8のいずれか1項に記載の薬学的組成物。
【請求項11】
前記過剰増殖性疾患は、癌であり、前記組成物は、アポトーシス誘導有効量の式Iの化合物、またはその薬学的に許容される塩および薬学的に許容される担体を含む、請求項1〜8および10のいずれか1項に記載の薬学的組成物。
【請求項12】
前記組成物は、用量単位形態である、請求項1〜11のいずれか1項に記載の薬学的組成物。
【請求項13】
請求項1〜12のいずれか1項に記載の非経口薬学的組成物。
【請求項14】
前記哺乳動物は、ヒトである、請求項1〜13のいずれか1項に記載の薬学的組成物。
【請求項15】
過剰増殖性疾患、炎症性疾患、ウイルス感染、または細菌感染を治療する方法であって、そのような治療を必要とする患者に、抗過剰増殖性疾患、抗炎症、抗ウイルス、または抗菌有効量の式Iの化合物であって、
【化40】

式中、Zは、硫黄、銅、銀、金、および白金から選択されるか、またはZは、ClO2、BrO2、およびIO2から選択されるハロゲン含有部分であり、
式中、nは、ゼロまたは1〜8の整数であり、mは、ゼロまたは1〜8の整数であり、
R1、R2、およびR3は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、およびC2−C6アルキニルから独立して選択され、前記アルキル、アルケニル、およびアルキニル基の前記アルキル部分は、直鎖、分岐、および環状、ならびに直鎖、分岐、および環状のアルキル、アルケニル、およびアルキニル部分の組み合わせであってもよく、前記基は、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、メトキシ、エトキシ、O−n−プロピル、O−イソプロピル、O−n−ブチル、およびO−t−ブチルから選択される基で置換され得るか、または
R1およびR2は、以下に示されるように、それらが直接結合する窒素、および前記窒素に結合する炭素と一緒に、5員以上の環を形成し、pは、1〜7の整数であり、
【化41】

式中、破線は、任意の二重結合を表すが、但し、そのような二重結合が存在するときには、R3は、非存在であり、二重結合に隣接するCH2基は、2個の水素ではなく1個の水素を有するか、
またはR2およびR3は、以下に示されるように、それらが結合する窒素と一緒に、3員以上の環を形成し、pは、1〜7の整数であり、
【化42】

Wは、非存在であるか、またはWは、
−CH2−、−CH2−CH2−、trans−CH=CH−、cis−CH=CH−、
【化43】

、または−CHR4−CHR5−、trans−CR4=CR5−、cis−CR4=CR5−から選択され、R4およびR5は、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、およびC1−C6アルキルエーテル(C1−C6アルキル−O−とも称される)から独立して選択されるか、または
Wは、二置換部分であり、二置換という用語は、Wが、
(a)以下の式によって示されるように、1、2、もしくは3個の二重結合を有し、飽和または不飽和であり得る、1,2−、1,3−、または1,4−二置換6員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換5員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換4員環、あるいは二重結合を有し、飽和および不飽和であり得る、1,2−二置換3員環であって、前記二置換環上の置換基は、式IのWに結合する基であり、
【化44】

式中、破線は、任意の二重結合を示す、環と、
(b)以下の式によって示されるように、1、2、もしくは3個の二重結合を有し、飽和または不飽和であり得る、1,2−、1,3−、または1,4−二置換6員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換5員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換4員環、あるいは二重結合を有し、飽和および不飽和であり得る、1,2−二置換3員環であって、前記二置換環上の置換基は、式IのWに結合する基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、およびR9を有してもよく、
【化45】

式中、破線は、任意の二重結合を示し、R6、R7、R8、およびR9は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立して選択され、前記6員環は、飽和であり得るか、または1、2、もしくは3個の二重結合を有してもよく、前記5員環および4員環は、飽和であり得るか、または1もしくは2個の二重結合を有してもよく、前記3員環は、飽和であり得るか、または1個の二重結合を有してもよく、Yは、窒素、酸素、または硫黄である、環と、
(c)1個または複数の二重結合を有すし、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、または1,7−二置換飽和および不飽和9員環から選択される環であって、前記環は、以下に記載される2〜13番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、およびR10を有してもよく、
【化46】

式中、破線は、任意の二重結合を示し、
R6、R7、R8、R9、およびR10は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立してから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
(d)1個または複数の二重結合を有すし、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、1,7−、または1,8−二置換飽和および不飽和ナフタレン環から選択される環であって、前記環は、以下に記載される2〜6番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、R10、およびR11を有してもよく、
【化47】

式中、破線は、任意の二重結合を示し、R6、R7、R8、R9、およびR10は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立してから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
(e)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、1,7−、1,8−、1,9−、1,10−、2,5−、3,5−、4,5−、または5,10−二置換飽和および不飽和アントラセン環から選択される環であって、前記環は、以下に記載される2〜9番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、R10、R11、R12、およびR13を有してもよく、
【化48】

式中、破線は、任意の二重結合を示し、
R6、R7、R8、R9、R10、R11、R12、およびR13は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立して選択され、Yは、窒素、酸素、または硫黄である環、
から成る二置換部分の群から選択される、基(CH2)mおよび(CH2)nにどのように結合するかを示すために使用される、化合物、
またはその薬学的に許容される塩を、投与することを含む、方法。
【請求項16】
前記過剰増殖性疾患は、細胞性過剰増殖であり、抗過剰増殖有効量の式Iの化合物、またはその薬学的に許容される塩が投与される、請求項15に記載の方法。
【請求項17】
前記過剰増殖性疾患は、癌であり、抗癌有効量の式Iの化合物、またはその薬学的に許容される塩が投与される、請求項15に記載の方法。
【請求項18】
前記過剰増殖性疾患は、癌であり、アポトーシス誘導有効量の式Iの化合物、またはその薬学的に許容される塩が投与される、請求項15または17に記載の方法。
【請求項19】
前記過剰増殖性疾患は、乳房、膀胱、骨、脳、中枢および末梢神経系、結腸、内分泌腺、食道、子宮内膜、生殖細胞、頭頸部、腎臓、肝臓、肺、咽頭および下咽頭、中皮腫、肉腫、卵巣、膵臓、前立腺、肛門、小腸、柔組織、睾丸、胃、皮膚、尿管、膣および外陰の癌、遺伝性癌、網膜芽腫、およびウィルムス腫瘍、白血病、リンパ腫、非ホジキン病、慢性ならびに急性骨髄性白血病、急性リンパ芽球性白血病、ホジキン病、多発性骨髄腫、およびT細胞リンパ腫、骨髄異形成症候群、形質細胞新生組織形成、腫瘍随伴症候群、未知の原発部位の癌、薬物耐性癌、およびAIDS関連悪性腫瘍から成る群から選択され、前記疾患は、抗過剰増殖性疾患有効量の式Iの化合物、またはその薬学的に許容される塩を、そのような治療を必要とする哺乳類に投与することによって治療される、請求項15に記載の方法。
【請求項20】
前記増殖性疾患は、頭頸部癌、非小細胞肺癌、小細胞肺癌、耐性型の肺癌および任意の女性癌、卵巣癌、および結腸癌から成る群から選択される癌であり、前記疾患は、抗癌有効量の式Iの化合物、またはその薬学的に許容される塩を、そのような治療を必要とする哺乳類に投与することによって治療される、請求項15に記載の方法。
【請求項21】
前記過剰増殖性疾患は、頭頸部癌、非小細胞肺癌、卵巣癌、および結腸癌から成る群から選択される、請求項19に記載の方法。
【請求項22】
前記頭部癌は、神経膠腫である、請求項19に記載の方法。
【請求項23】
前記哺乳類は、ヒトである、請求項15〜22のいずれか1項に記載の方法。
【請求項24】
請求項15に記載の過剰増殖性疾患を治療する方法であって、前記疾患は、哺乳類患者において、アポトーシスの誘導に応答性であり、それを必要とする前記患者に、請求項20に定義される、式Iの化合物であるある量の活性化合物、またはその薬学的に許容される塩と、ある量の少なくとも1つの第2の化合物または放射線とを、個別に、同時に、一斉に、順次、または経時的にずらして投与することを含み、前記第2の化合物は、化学療法抗癌剤および標的特異的抗癌剤から成る群から選択される抗癌剤であり、前記量の前記活性化合物および前記第2の化合物または放射線は、治療効果をもたらす、方法。
【請求項25】
前記第2の化合物は、(i)アルキル化/カルバミル化剤、(ii)白金誘導体、(iii)抗有糸分裂剤/チューブリン阻害剤、(iv)トポイソメラーゼ阻害剤、(v)ピリミジン拮抗薬、(vi)プリン拮抗薬、(vii)葉酸拮抗薬、および(viii)注入放射性物質から成る群から選択される、請求項24に記載の方法。
【請求項26】
前記標的特異的抗癌剤は、(i)キナーゼ阻害剤、(ii)プロテアソーム阻害剤、(iii)ヒストンデアセチラーゼ阻害剤、(iv)熱ショックタンパク質90阻害剤、(v)血管標的剤(VAT)抗血管新生薬およびKDRチロシンキナーゼ阻害剤、(vi)モノクローナル抗体ならびにモノクローナル抗体の変異体および複合体、ならびに抗体フラグメント、(vii)オリゴヌクレオチド系治療薬、(viii)トール様受容体/TLR9作動薬、TLR7作動薬およびその類似体、またはTLR7/8作動薬、ならびにTLR7/8作動薬としての免疫刺激RNA、(ix)プロテアーゼ阻害剤、(x)ホルモン治療薬、(xi)ブレオマイシン、(xii)レチノイド、(xiii)DNAメチルトランスフェラーゼ阻害剤、(xiv)アラノシン、(xv)サイトカイン、(xvi)インターフェロン、および(xvii)細胞死受容体作動薬から成る群から選択される、請求項24に記載の方法。
【請求項27】
前記式Iの化合物または前記その薬学的に許容される塩は、個別に、同時に、一斉に、順次、または経時的にずらして、抗癌有効量の放射線とともに投与される、請求項24に記載の方法
【請求項28】
Zは、硫黄である、請求項15〜27のいずれか1項に記載の方法。
【請求項29】
前記化合物は、S−(3−シアノプロピル)イソチオ尿素またはその薬学的に許容される塩である、請求項15〜28のいずれか1項に記載の方法。
【請求項30】
前記化合物は、S−(3−シアノプロピル)イソチオ尿素塩酸塩である、請求項15〜29のいずれか1項に記載の方法。
【請求項31】
前記化合物は、S−(2−シアノエチル)イソチオ尿素、S−(4−シアノブチル)イソチオ尿素、S−(5−シアノペンチル)イソチオ尿素、S−(4−シアノメチルフェニル)メチルイソチオ尿素、S−2(4−[2−シアノエチル]フェニル)エチルイソチオ尿素、S−(2−シアノメチルフェニル)メチルイソチオ尿素、S−(6−シアノメチルピリジン−2−イル)メチルイソチオ尿素、S−(3−シアノメチルフェニル)メチルイソチオ尿素、S−(1−シアノメチルナフト−2−イル))メチルイソチオ尿素、および前記その薬学的に許容される塩から選択される、請求項15〜28のいずれか1項に記載の方法。
【請求項32】
式Iの化合物であって、
【化49】

式中、Zは、硫黄、銅、銀、金、および白金から選択されるか、またはZは、ClO2、BrO2、およびIO2から選択されるハロゲン含有部分であり、
式中、nは、ゼロまたは1〜8の整数であり、mは、ゼロまたは1〜8の整数であり、
R1、R2、およびR3は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、およびC2−C6アルキニルから独立して選択され、前記アルキル、アルケニル、およびアルキニル基の前記アルキル部分は、直鎖、分岐、および環状、ならびに直鎖、分岐、および環状のアルキル、アルケニル、およびアルキニル部分の組み合わせであってもよく、前記基は、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、メトキシ、エトキシ、O−n−プロピル、O−イソプロピル、O−n−ブチル、およびO−t−ブチルから選択される基で置換され得るか、または
R1およびR2は、以下に示されるように、それらが直接結合する窒素、および前記窒素に結合する炭素と一緒に、5員以上の環を形成し、pは、1〜7の整数であり
【化50】

式中、破線は、任意の二重結合を表すが、但し、そのような二重結合が存在するときには、R3は、非存在であり、二重結合に隣接するCH2基は、2個の水素ではなく1個の水素を有するか、
またはR2およびR3は、以下に示されるように、それらが結合する窒素と一緒に、3員以上の環を形成し、pは、1〜7の整数であり、
【化51】

Wは、非存在であるか、またはWは、
−CH2−、−CH2−CH2−、trans−CH=CH−、cis−CH=CH−、
【化52】

、または−CHR4−CHR5−、trans−CR4=CR5−、cis−CR4=CR5−から選択され、R4およびR5は、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、およびC1−C6アルキルエーテル(C1−C6アルキル−O−とも称される)から独立して選択されるか、または
Wは、二置換部分であり、二置換という用語は、Wが、
(a)以下の式によって示されるように、1、2、もしくは3個の二重結合を有し、飽和または不飽和であり得る、1,2−、1,3−、または1,4−二置換6員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換5員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換4員環、あるいは二重結合を有し、飽和および不飽和であり得る、1,2−二置換3員環であって、前記二置換環上の置換基は、式IのWに結合する基であり、
【化53】

式中、破線は、任意の二重結合を示す、環と、
(b)以下の式によって示されるように、1、2、もしくは3個の二重結合を有し、飽和または不飽和であり得る、1,2−、1,3−、または1,4−二置換6員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換5員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換4員環、あるいは二重結合を有し、飽和および不飽和であり得る、1,2−二置換3員環であって、前記二置換環上の置換基は、式IのWに結合する基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、およびR9を有してもよく、
【化54】

式中、破線は、任意の二重結合を示し、R6、R7、R8、およびR9は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立して選択され、前記6員環は、飽和であり得るか、または1、2、もしくは3個の二重結合を有してもよく、前記5員環および4員環は、飽和であり得るか、または1もしくは2個の二重結合を有してもよく、前記3員環は、飽和であり得るか、または1個の二重結合を有してもよく、Yは、窒素、酸素、または硫黄である、環と、
(c)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、または1,7−二置換飽和および不飽和9員環から選択される環であって、前記環は、以下に記載される2〜13番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、およびR10を有してもよく、
【化55】

式中、破線は、任意の二重結合を示し、
R6、R7、R8、R9、およびR10は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立してから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
(d)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、1,7−、または1,8−二置換飽和および不飽和ナフタレン環から選択される環であって、前記環は、以下に記載される2〜6番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、R10、およびR11を有してもよく、
【化56】

式中、破線は、任意の二重結合を示し、R6、R7、R8、R9、R10、およびR11は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立してから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
(e)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、1,7−、1,8−、1,9−、1,10−、2,5−、3,5−、4,5−、または5,10−二置換飽和および不飽和アントラセン環から選択される環であって、前記環は、以下に記載される2〜9番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、R10、R11、R12、およびR13を有してもよく、
【化57】

式中、破線は、任意の二重結合を示し、
R6、R7、R8、R9、R10、R11、R12、およびR13は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、から成る二置換部分の群から選択される、基(CH2)mおよび(CH2)nにどのように結合するかを示すために使用される、化合物、
またはその薬学的に許容される塩であるが、但し、前記化合物は、S−(シアノメチル)イソチオ尿素HCl、S−(シアノメチル)イソチオ尿素HBr、S−(2−シアノエチル)イソチオ尿素HCl、S−(2−シアノエチル)イソチオ尿素HBr、S−(2−シアノエチル)イソチオ尿素p−トルエンスルホン酸塩、S−(3−シアノプロピル)イソチオ尿素HCl、S−(3−シアノプロピル)イソチオ尿素ピクリン酸塩、またはS−パラ−シアノベンジルイソチオ尿素HClではないことを条件とする、化合物。
【請求項33】
Zは、硫黄である、請求項32に記載の化合物。
【請求項34】
前記化合物は、S−(3−シアノプロピル)イソチオ尿素、またはS−パラ−シアノベンジルイソチオ尿素の臭化水素酸塩ではないことを条件とする、請求項32に記載の化合物。
【請求項35】
前記化合物は、S−(シアノメチル)イソチオ尿素、S−(2−シアノエチル)イソチオ尿素、S−(3−シアノプロピル)イソチオ尿素、またはS−パラ−シアノベンジルイソチオ尿素の薬学的に許容される塩ではないことを条件とする、請求項32に記載の化合物。
【請求項36】
前記化合物は、S−(シアノメチル)イソチオ尿素、S−(2−シアノエチル)イソチオ尿素、S−(3−シアノプロピル)イソチオ尿素、およびS−パラ−シアノベンジルイソチオ尿素、およびその薬学的に許容される塩から選択されないことを条件とする、請求項32に記載の化合物、またはその薬学的に許容される塩。
【請求項37】
S−(4−シアノブチル)イソチオ尿素、S−(5−シアノペンチル)イソチオ尿素、S−(4−シアノメチルフェニル)メチルイソチオ尿素、S−2(4−[2−シアノエチル]フェニル)エチルイソチオ尿素、S−(2−シアノメチルフェニル)メチルイソチオ尿素、S−(6−シアノメチルピリジン−2−イル)メチルイソチオ尿素、S−(3−シアノメチルフェニル)メチルイソチオ尿素、およびS−(1−シアノメチルナフチ−2−イル))メチルイソチオ尿素、およびそれらの薬学的に許容される塩から選択される、請求項32に記載の化合物。
【請求項38】
前記式Iの化合物は、以下の化合物
【化58】

【化59】

【化60】

およびそれらの薬学的に許容される塩から選択され、式中、nおよびmは、ゼロまたは独立して1〜8の整数であり、R1、R2、R3、およびR4は、メチル、エチル、n−プロピル、イソプロピル、シクロプロピル、−CH2−シクロプロピル、ビニル、アリル、n−ブチル、sec−ブチル、イソブチル、tert−ブチル、シクロブチル、−CH2−シクロブチル、n−ペンチル、sec−ペンチル、イソペンチル、tert−ペンチル、シクロペンチル、−CH2−シクロペンチル、n−ヘキシル、sec−ヘキシル、シクロヘキシル、および−CH2−シクロヘキシル部分であり得、これらは請求項35において定義されるような1つまたは複数の置換基を有し得、R1、R2、R3、およびR4はまた、アルケニルおよびアルキニルであってもよく、前記アルケニル基は、エテニル、プロペニル、ブテニル、または1−メチル−2−ブテン−1−イルであり、前記アルキニル基は、エチニル、2−プロピニル(プロパルギル)、または1−プロピニルでもあり得る、請求項32に記載の化合物。
【請求項39】
抗過剰増殖、抗炎症、抗ウイルス、または抗菌有効量の請求項38に記載の化合物、および薬学的に許容される担体を含む、哺乳類において過剰増殖性疾患、炎症性疾患、ウイルス感染、または細菌感染を治療するための、薬学的組成物。
【請求項40】
前記過剰増殖性疾患は、癌であり、前記組成物は、アポトーシス誘導量の前記化合物を含む、請求項39に記載の薬学的組成物。
【請求項41】
哺乳類において過剰増殖性疾患、炎症性疾患、ウイルス感染、または細菌感染を治療する方法であって、そのような治療を必要とする患者に、請求項38に記載の抗過剰増殖、抗炎症、抗ウイルス、または抗菌有効量の化合物を投与することを含む、方法。
【請求項42】
前記過剰増殖性疾患は、癌であり、アポトーシスを誘導する量の化合物が投与される、請求項41に記載の方法。
【請求項1】
哺乳動物において、過剰増殖性疾患、炎症性疾患、ウイルス感染、または細菌感染を治療するための薬学的組成物であって、抗増殖性疾患、抗炎症性、抗ウイルス、または抗菌有効量の式Iの化合物であって、
【化30】

式中、Zは、硫黄、銅、銀、金、および白金から選択されるか、またはZは、ClO2、BrO2、およびIO2から選択されるハロゲン含有部分であり、
式中、nは、ゼロまたは1〜8の整数であり、mは、ゼロまたは1〜8の整数であり、
R1、R2、およびR3は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、およびC2−C6アルキニルから独立して選択され、前記アルキル、アルケニル、およびアルキニル基の前記アルキル部分は、直鎖、分岐、および環状、ならびに直鎖、分岐、および環状のアルキル、アルケニル、およびアルキニル部分の組み合わせであってもよく、前記基は、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、メトキシ、エトキシ、O−n−プロピル、O−イソプロピル、O−n−ブチル、およびO−t−ブチルから選択される基で置換され得るか、または
R1およびR2は、以下に示されるように、それらが直接結合する窒素、および前記窒素に結合する炭素と一緒に、5員以上の環を形成し、pは、1〜7の整数であり、
【化31】

式中、破線は、任意の二重結合を表すが、但し、そのような二重結合が存在するときには、R3は、非存在であり、前記二重結合に隣接するCH2基は、2個の水素ではなく1個の水素を有するか、
またはR2およびR3は、以下に示されるように、それらが結合する窒素と一緒に、3員以上の環を形成し、pは、1〜7の整数であり、
【化32】

Wは、非存在であるか、またはWは、
−CH2−、−CH2−CH2−、trans−CH=CH−、cis−CH=CH−、
【化33】

、または−CHR4−CHR5−、trans−CR4=CR5−、cis−CR4=CR5−から選択され、R4およびR5は、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、およびC1−C6アルキルエーテル(C1−C6アルキル−O−とも称される)から独立して選択されるか、または
Wは、二置換部分であり、二置換という用語は、Wが、
(a)以下の式によって示されるように、1、2、もしくは3個の二重結合を有し、飽和または不飽和であり得る、1,2−、1,3−、または1,4−二置換6員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換5員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換4員環、あるいは二重結合を有し、飽和および不飽和であり得る、1,2−二置換3員環であって、前記二置換環上の置換基は、式IのWに結合する基であり、
【化34】

式中、破線は、任意の二重結合を示す、環と、
(b)以下の式によって示されるように、1、2、もしくは3個の二重結合を有し、飽和または不飽和であり得る、1,2−、1,3−、または1,4−二置換6員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換5員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換4員環、あるいは二重結合を有し、飽和および不飽和であり得る、1,2−二置換3員環であって、前記二置換環上の置換基は、式IのWに結合する基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、およびR9を有してもよく、
【化35】

式中、破線は、任意の二重結合を示し、R6、R7、R8、およびR9は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立して選択され、前記6員環は、飽和であり得るか、または1、2、もしくは3個の二重結合を有してもよく、前記5員環および4員環は、飽和であり得るか、または1もしくは2個の二重結合を有してもよく、前記3員環は、飽和であり得るか、または1個の二重結合を有してもよく、Yは、窒素、酸素、または硫黄である、環と、
(c)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、または1,7−二置換飽和および不飽和9員環から選択される環であって、前記環は、以下に記載される2〜13番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、およびR10を有してもよく、
【化36】

式中、破線は、任意の二重結合を示し、
R6、R7、R8、R9、およびR10は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立してから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
(d)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、1,7−、または1,8−二置換飽和および不飽和ナフタレン環から選択される環であって、前記環は、以下に記載される2〜6番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、R10、およびR11を有してもよく、
【化37】

式中、破線は、任意の二重結合を示し、R6、R7、R8、R9、R10、およびR11は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立してから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
(e)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、1,7−、1,8−、1,9−、1,10−、2,5−、3,5−、4,5−、または5,10−二置換飽和および不飽和アントラセン環から選択される環であって、前記環は、以下に記載される2〜9番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、R10、R11、R12、およびR13を有してもよく、
【化38】

式中、破線は、任意の二重結合を示し、
R6、R7、R8、R9、R10、R11、R12、およびR13は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
から成る二置換部分の群から選択される、基(CH2)mおよび(CH2)nにどのように結合するかを示すために使用される、化合物、
またはその薬学的に許容される塩および薬学的に許容される担体を含む、薬学的組成物。
【請求項2】
Zは、硫黄である、請求項1に記載の薬学的組成物。
【請求項3】
前記式Iの化合物は、式IIの化合物であり、
【化39】

式中、n、m、W、Z、R1、R2、およびR3は、請求項1に定義されるとおりであり、Xは、薬学的に許容される酸である、請求項1または2に記載の薬学的組成物。
【請求項4】
前記薬学的に許容される酸は、HClまたはHBrである、請求項3に記載の薬学的組成物。
【請求項5】
前記組成物は、S−シアノメチルイソチオ尿素HBrを含有しないことを条件とする、請求項1〜4のいずれか1項に記載の薬学的組成物。
【請求項6】
前記化合物は、S−(3−シアノプロピル)イソチオ尿素、またはその薬学的に許容される塩である、請求項1〜4のいずれか1項に記載の薬学的組成物。
【請求項7】
前記化合物は、S−(3−シアノプロピル)イソチオ尿素塩酸塩である、請求項1〜4のいずれか1項に記載の薬学的組成物。
【請求項8】
S−(2−シアノエチル)イソチオ尿素、S−(4−シアノブチル)イソチオ尿素、S−(5−シアノペンチル)イソチオ尿素、S−(4−シアノメチルフェニル)メチルイソチオ尿素、S−2(4−[2−シアノエチル]フェニル)エチルイソチオ尿素、S−(2−シアノメチルフェニル)メチルイソチオ尿素、S−(6−シアノメチルピリジン−2−イル)メチルイソチオ尿素、S−(3−シアノメチルフェニル)メチルイソチオ尿素、S−(1−シアノメチルナフト−2−イル))メチルイソチオ尿素から選択される化合物、ならびにその薬学的に許容される塩および薬学的に許容される担体を含む、請求項1〜4のいずれか1項に記載の薬学的組成物。
【請求項9】
前記過剰増殖性疾患は、細胞過剰増殖であり、前記組成物は、抗過剰増殖有効量の式Iの化合物、またはその薬学的に許容される塩および薬学的に許容される担体を含む、請求項1〜8のいずれか1項に記載の薬学的組成物。
【請求項10】
前記過剰増殖性疾患は、癌であり、前記組成物は、抗癌有効量の式Iの化合物、またはその薬学的に許容される塩および薬学的に許容される担体を含む、請求項1〜8のいずれか1項に記載の薬学的組成物。
【請求項11】
前記過剰増殖性疾患は、癌であり、前記組成物は、アポトーシス誘導有効量の式Iの化合物、またはその薬学的に許容される塩および薬学的に許容される担体を含む、請求項1〜8および10のいずれか1項に記載の薬学的組成物。
【請求項12】
前記組成物は、用量単位形態である、請求項1〜11のいずれか1項に記載の薬学的組成物。
【請求項13】
請求項1〜12のいずれか1項に記載の非経口薬学的組成物。
【請求項14】
前記哺乳動物は、ヒトである、請求項1〜13のいずれか1項に記載の薬学的組成物。
【請求項15】
過剰増殖性疾患、炎症性疾患、ウイルス感染、または細菌感染を治療する方法であって、そのような治療を必要とする患者に、抗過剰増殖性疾患、抗炎症、抗ウイルス、または抗菌有効量の式Iの化合物であって、
【化40】

式中、Zは、硫黄、銅、銀、金、および白金から選択されるか、またはZは、ClO2、BrO2、およびIO2から選択されるハロゲン含有部分であり、
式中、nは、ゼロまたは1〜8の整数であり、mは、ゼロまたは1〜8の整数であり、
R1、R2、およびR3は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、およびC2−C6アルキニルから独立して選択され、前記アルキル、アルケニル、およびアルキニル基の前記アルキル部分は、直鎖、分岐、および環状、ならびに直鎖、分岐、および環状のアルキル、アルケニル、およびアルキニル部分の組み合わせであってもよく、前記基は、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、メトキシ、エトキシ、O−n−プロピル、O−イソプロピル、O−n−ブチル、およびO−t−ブチルから選択される基で置換され得るか、または
R1およびR2は、以下に示されるように、それらが直接結合する窒素、および前記窒素に結合する炭素と一緒に、5員以上の環を形成し、pは、1〜7の整数であり、
【化41】

式中、破線は、任意の二重結合を表すが、但し、そのような二重結合が存在するときには、R3は、非存在であり、二重結合に隣接するCH2基は、2個の水素ではなく1個の水素を有するか、
またはR2およびR3は、以下に示されるように、それらが結合する窒素と一緒に、3員以上の環を形成し、pは、1〜7の整数であり、
【化42】

Wは、非存在であるか、またはWは、
−CH2−、−CH2−CH2−、trans−CH=CH−、cis−CH=CH−、
【化43】

、または−CHR4−CHR5−、trans−CR4=CR5−、cis−CR4=CR5−から選択され、R4およびR5は、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、およびC1−C6アルキルエーテル(C1−C6アルキル−O−とも称される)から独立して選択されるか、または
Wは、二置換部分であり、二置換という用語は、Wが、
(a)以下の式によって示されるように、1、2、もしくは3個の二重結合を有し、飽和または不飽和であり得る、1,2−、1,3−、または1,4−二置換6員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換5員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換4員環、あるいは二重結合を有し、飽和および不飽和であり得る、1,2−二置換3員環であって、前記二置換環上の置換基は、式IのWに結合する基であり、
【化44】

式中、破線は、任意の二重結合を示す、環と、
(b)以下の式によって示されるように、1、2、もしくは3個の二重結合を有し、飽和または不飽和であり得る、1,2−、1,3−、または1,4−二置換6員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換5員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換4員環、あるいは二重結合を有し、飽和および不飽和であり得る、1,2−二置換3員環であって、前記二置換環上の置換基は、式IのWに結合する基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、およびR9を有してもよく、
【化45】

式中、破線は、任意の二重結合を示し、R6、R7、R8、およびR9は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立して選択され、前記6員環は、飽和であり得るか、または1、2、もしくは3個の二重結合を有してもよく、前記5員環および4員環は、飽和であり得るか、または1もしくは2個の二重結合を有してもよく、前記3員環は、飽和であり得るか、または1個の二重結合を有してもよく、Yは、窒素、酸素、または硫黄である、環と、
(c)1個または複数の二重結合を有すし、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、または1,7−二置換飽和および不飽和9員環から選択される環であって、前記環は、以下に記載される2〜13番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、およびR10を有してもよく、
【化46】

式中、破線は、任意の二重結合を示し、
R6、R7、R8、R9、およびR10は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立してから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
(d)1個または複数の二重結合を有すし、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、1,7−、または1,8−二置換飽和および不飽和ナフタレン環から選択される環であって、前記環は、以下に記載される2〜6番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、R10、およびR11を有してもよく、
【化47】

式中、破線は、任意の二重結合を示し、R6、R7、R8、R9、およびR10は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立してから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
(e)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、1,7−、1,8−、1,9−、1,10−、2,5−、3,5−、4,5−、または5,10−二置換飽和および不飽和アントラセン環から選択される環であって、前記環は、以下に記載される2〜9番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、R10、R11、R12、およびR13を有してもよく、
【化48】

式中、破線は、任意の二重結合を示し、
R6、R7、R8、R9、R10、R11、R12、およびR13は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立して選択され、Yは、窒素、酸素、または硫黄である環、
から成る二置換部分の群から選択される、基(CH2)mおよび(CH2)nにどのように結合するかを示すために使用される、化合物、
またはその薬学的に許容される塩を、投与することを含む、方法。
【請求項16】
前記過剰増殖性疾患は、細胞性過剰増殖であり、抗過剰増殖有効量の式Iの化合物、またはその薬学的に許容される塩が投与される、請求項15に記載の方法。
【請求項17】
前記過剰増殖性疾患は、癌であり、抗癌有効量の式Iの化合物、またはその薬学的に許容される塩が投与される、請求項15に記載の方法。
【請求項18】
前記過剰増殖性疾患は、癌であり、アポトーシス誘導有効量の式Iの化合物、またはその薬学的に許容される塩が投与される、請求項15または17に記載の方法。
【請求項19】
前記過剰増殖性疾患は、乳房、膀胱、骨、脳、中枢および末梢神経系、結腸、内分泌腺、食道、子宮内膜、生殖細胞、頭頸部、腎臓、肝臓、肺、咽頭および下咽頭、中皮腫、肉腫、卵巣、膵臓、前立腺、肛門、小腸、柔組織、睾丸、胃、皮膚、尿管、膣および外陰の癌、遺伝性癌、網膜芽腫、およびウィルムス腫瘍、白血病、リンパ腫、非ホジキン病、慢性ならびに急性骨髄性白血病、急性リンパ芽球性白血病、ホジキン病、多発性骨髄腫、およびT細胞リンパ腫、骨髄異形成症候群、形質細胞新生組織形成、腫瘍随伴症候群、未知の原発部位の癌、薬物耐性癌、およびAIDS関連悪性腫瘍から成る群から選択され、前記疾患は、抗過剰増殖性疾患有効量の式Iの化合物、またはその薬学的に許容される塩を、そのような治療を必要とする哺乳類に投与することによって治療される、請求項15に記載の方法。
【請求項20】
前記増殖性疾患は、頭頸部癌、非小細胞肺癌、小細胞肺癌、耐性型の肺癌および任意の女性癌、卵巣癌、および結腸癌から成る群から選択される癌であり、前記疾患は、抗癌有効量の式Iの化合物、またはその薬学的に許容される塩を、そのような治療を必要とする哺乳類に投与することによって治療される、請求項15に記載の方法。
【請求項21】
前記過剰増殖性疾患は、頭頸部癌、非小細胞肺癌、卵巣癌、および結腸癌から成る群から選択される、請求項19に記載の方法。
【請求項22】
前記頭部癌は、神経膠腫である、請求項19に記載の方法。
【請求項23】
前記哺乳類は、ヒトである、請求項15〜22のいずれか1項に記載の方法。
【請求項24】
請求項15に記載の過剰増殖性疾患を治療する方法であって、前記疾患は、哺乳類患者において、アポトーシスの誘導に応答性であり、それを必要とする前記患者に、請求項20に定義される、式Iの化合物であるある量の活性化合物、またはその薬学的に許容される塩と、ある量の少なくとも1つの第2の化合物または放射線とを、個別に、同時に、一斉に、順次、または経時的にずらして投与することを含み、前記第2の化合物は、化学療法抗癌剤および標的特異的抗癌剤から成る群から選択される抗癌剤であり、前記量の前記活性化合物および前記第2の化合物または放射線は、治療効果をもたらす、方法。
【請求項25】
前記第2の化合物は、(i)アルキル化/カルバミル化剤、(ii)白金誘導体、(iii)抗有糸分裂剤/チューブリン阻害剤、(iv)トポイソメラーゼ阻害剤、(v)ピリミジン拮抗薬、(vi)プリン拮抗薬、(vii)葉酸拮抗薬、および(viii)注入放射性物質から成る群から選択される、請求項24に記載の方法。
【請求項26】
前記標的特異的抗癌剤は、(i)キナーゼ阻害剤、(ii)プロテアソーム阻害剤、(iii)ヒストンデアセチラーゼ阻害剤、(iv)熱ショックタンパク質90阻害剤、(v)血管標的剤(VAT)抗血管新生薬およびKDRチロシンキナーゼ阻害剤、(vi)モノクローナル抗体ならびにモノクローナル抗体の変異体および複合体、ならびに抗体フラグメント、(vii)オリゴヌクレオチド系治療薬、(viii)トール様受容体/TLR9作動薬、TLR7作動薬およびその類似体、またはTLR7/8作動薬、ならびにTLR7/8作動薬としての免疫刺激RNA、(ix)プロテアーゼ阻害剤、(x)ホルモン治療薬、(xi)ブレオマイシン、(xii)レチノイド、(xiii)DNAメチルトランスフェラーゼ阻害剤、(xiv)アラノシン、(xv)サイトカイン、(xvi)インターフェロン、および(xvii)細胞死受容体作動薬から成る群から選択される、請求項24に記載の方法。
【請求項27】
前記式Iの化合物または前記その薬学的に許容される塩は、個別に、同時に、一斉に、順次、または経時的にずらして、抗癌有効量の放射線とともに投与される、請求項24に記載の方法
【請求項28】
Zは、硫黄である、請求項15〜27のいずれか1項に記載の方法。
【請求項29】
前記化合物は、S−(3−シアノプロピル)イソチオ尿素またはその薬学的に許容される塩である、請求項15〜28のいずれか1項に記載の方法。
【請求項30】
前記化合物は、S−(3−シアノプロピル)イソチオ尿素塩酸塩である、請求項15〜29のいずれか1項に記載の方法。
【請求項31】
前記化合物は、S−(2−シアノエチル)イソチオ尿素、S−(4−シアノブチル)イソチオ尿素、S−(5−シアノペンチル)イソチオ尿素、S−(4−シアノメチルフェニル)メチルイソチオ尿素、S−2(4−[2−シアノエチル]フェニル)エチルイソチオ尿素、S−(2−シアノメチルフェニル)メチルイソチオ尿素、S−(6−シアノメチルピリジン−2−イル)メチルイソチオ尿素、S−(3−シアノメチルフェニル)メチルイソチオ尿素、S−(1−シアノメチルナフト−2−イル))メチルイソチオ尿素、および前記その薬学的に許容される塩から選択される、請求項15〜28のいずれか1項に記載の方法。
【請求項32】
式Iの化合物であって、
【化49】

式中、Zは、硫黄、銅、銀、金、および白金から選択されるか、またはZは、ClO2、BrO2、およびIO2から選択されるハロゲン含有部分であり、
式中、nは、ゼロまたは1〜8の整数であり、mは、ゼロまたは1〜8の整数であり、
R1、R2、およびR3は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、およびC2−C6アルキニルから独立して選択され、前記アルキル、アルケニル、およびアルキニル基の前記アルキル部分は、直鎖、分岐、および環状、ならびに直鎖、分岐、および環状のアルキル、アルケニル、およびアルキニル部分の組み合わせであってもよく、前記基は、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、メトキシ、エトキシ、O−n−プロピル、O−イソプロピル、O−n−ブチル、およびO−t−ブチルから選択される基で置換され得るか、または
R1およびR2は、以下に示されるように、それらが直接結合する窒素、および前記窒素に結合する炭素と一緒に、5員以上の環を形成し、pは、1〜7の整数であり
【化50】

式中、破線は、任意の二重結合を表すが、但し、そのような二重結合が存在するときには、R3は、非存在であり、二重結合に隣接するCH2基は、2個の水素ではなく1個の水素を有するか、
またはR2およびR3は、以下に示されるように、それらが結合する窒素と一緒に、3員以上の環を形成し、pは、1〜7の整数であり、
【化51】

Wは、非存在であるか、またはWは、
−CH2−、−CH2−CH2−、trans−CH=CH−、cis−CH=CH−、
【化52】

、または−CHR4−CHR5−、trans−CR4=CR5−、cis−CR4=CR5−から選択され、R4およびR5は、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、およびC1−C6アルキルエーテル(C1−C6アルキル−O−とも称される)から独立して選択されるか、または
Wは、二置換部分であり、二置換という用語は、Wが、
(a)以下の式によって示されるように、1、2、もしくは3個の二重結合を有し、飽和または不飽和であり得る、1,2−、1,3−、または1,4−二置換6員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換5員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換4員環、あるいは二重結合を有し、飽和および不飽和であり得る、1,2−二置換3員環であって、前記二置換環上の置換基は、式IのWに結合する基であり、
【化53】

式中、破線は、任意の二重結合を示す、環と、
(b)以下の式によって示されるように、1、2、もしくは3個の二重結合を有し、飽和または不飽和であり得る、1,2−、1,3−、または1,4−二置換6員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換5員環、1もしくは2個の二重結合を有し、飽和または不飽和であり得る、1,2−または1,3−二置換4員環、あるいは二重結合を有し、飽和および不飽和であり得る、1,2−二置換3員環であって、前記二置換環上の置換基は、式IのWに結合する基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、およびR9を有してもよく、
【化54】

式中、破線は、任意の二重結合を示し、R6、R7、R8、およびR9は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立して選択され、前記6員環は、飽和であり得るか、または1、2、もしくは3個の二重結合を有してもよく、前記5員環および4員環は、飽和であり得るか、または1もしくは2個の二重結合を有してもよく、前記3員環は、飽和であり得るか、または1個の二重結合を有してもよく、Yは、窒素、酸素、または硫黄である、環と、
(c)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、または1,7−二置換飽和および不飽和9員環から選択される環であって、前記環は、以下に記載される2〜13番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、およびR10を有してもよく、
【化55】

式中、破線は、任意の二重結合を示し、
R6、R7、R8、R9、およびR10は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立してから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
(d)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、1,7−、または1,8−二置換飽和および不飽和ナフタレン環から選択される環であって、前記環は、以下に記載される2〜6番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、R10、およびR11を有してもよく、
【化56】

式中、破線は、任意の二重結合を示し、R6、R7、R8、R9、R10、およびR11は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立してから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、
(e)1個または複数の二重結合を有し、環位置に、以下に記載される最初の環に示されるように番号を付けた、1,2−、1,3−、1,4−、1,5−、1,6−、1,7−、1,8−、1,9−、1,10−、2,5−、3,5−、4,5−、または5,10−二置換飽和および不飽和アントラセン環から選択される環であって、前記環は、以下に記載される2〜9番目の環から選択され、前記二置換環上の置換基は、式IのWに結合する前記基であり、前記二置換環は、以下の式に示されるように、追加の置換基R6、R7、R8、R9、R10、R11、R12、およびR13を有してもよく、
【化57】

式中、破線は、任意の二重結合を示し、
R6、R7、R8、R9、R10、R11、R12、およびR13は、水素、−CH2−シクロヘキシル、C1−C6アルキル、C2−C6アルケニル、C2−C6アルキニル、またはC1−C6アルキルエーテルから独立して選択され、Yは、窒素、酸素、または硫黄である、環と、から成る二置換部分の群から選択される、基(CH2)mおよび(CH2)nにどのように結合するかを示すために使用される、化合物、
またはその薬学的に許容される塩であるが、但し、前記化合物は、S−(シアノメチル)イソチオ尿素HCl、S−(シアノメチル)イソチオ尿素HBr、S−(2−シアノエチル)イソチオ尿素HCl、S−(2−シアノエチル)イソチオ尿素HBr、S−(2−シアノエチル)イソチオ尿素p−トルエンスルホン酸塩、S−(3−シアノプロピル)イソチオ尿素HCl、S−(3−シアノプロピル)イソチオ尿素ピクリン酸塩、またはS−パラ−シアノベンジルイソチオ尿素HClではないことを条件とする、化合物。
【請求項33】
Zは、硫黄である、請求項32に記載の化合物。
【請求項34】
前記化合物は、S−(3−シアノプロピル)イソチオ尿素、またはS−パラ−シアノベンジルイソチオ尿素の臭化水素酸塩ではないことを条件とする、請求項32に記載の化合物。
【請求項35】
前記化合物は、S−(シアノメチル)イソチオ尿素、S−(2−シアノエチル)イソチオ尿素、S−(3−シアノプロピル)イソチオ尿素、またはS−パラ−シアノベンジルイソチオ尿素の薬学的に許容される塩ではないことを条件とする、請求項32に記載の化合物。
【請求項36】
前記化合物は、S−(シアノメチル)イソチオ尿素、S−(2−シアノエチル)イソチオ尿素、S−(3−シアノプロピル)イソチオ尿素、およびS−パラ−シアノベンジルイソチオ尿素、およびその薬学的に許容される塩から選択されないことを条件とする、請求項32に記載の化合物、またはその薬学的に許容される塩。
【請求項37】
S−(4−シアノブチル)イソチオ尿素、S−(5−シアノペンチル)イソチオ尿素、S−(4−シアノメチルフェニル)メチルイソチオ尿素、S−2(4−[2−シアノエチル]フェニル)エチルイソチオ尿素、S−(2−シアノメチルフェニル)メチルイソチオ尿素、S−(6−シアノメチルピリジン−2−イル)メチルイソチオ尿素、S−(3−シアノメチルフェニル)メチルイソチオ尿素、およびS−(1−シアノメチルナフチ−2−イル))メチルイソチオ尿素、およびそれらの薬学的に許容される塩から選択される、請求項32に記載の化合物。
【請求項38】
前記式Iの化合物は、以下の化合物
【化58】

【化59】

【化60】

およびそれらの薬学的に許容される塩から選択され、式中、nおよびmは、ゼロまたは独立して1〜8の整数であり、R1、R2、R3、およびR4は、メチル、エチル、n−プロピル、イソプロピル、シクロプロピル、−CH2−シクロプロピル、ビニル、アリル、n−ブチル、sec−ブチル、イソブチル、tert−ブチル、シクロブチル、−CH2−シクロブチル、n−ペンチル、sec−ペンチル、イソペンチル、tert−ペンチル、シクロペンチル、−CH2−シクロペンチル、n−ヘキシル、sec−ヘキシル、シクロヘキシル、および−CH2−シクロヘキシル部分であり得、これらは請求項35において定義されるような1つまたは複数の置換基を有し得、R1、R2、R3、およびR4はまた、アルケニルおよびアルキニルであってもよく、前記アルケニル基は、エテニル、プロペニル、ブテニル、または1−メチル−2−ブテン−1−イルであり、前記アルキニル基は、エチニル、2−プロピニル(プロパルギル)、または1−プロピニルでもあり得る、請求項32に記載の化合物。
【請求項39】
抗過剰増殖、抗炎症、抗ウイルス、または抗菌有効量の請求項38に記載の化合物、および薬学的に許容される担体を含む、哺乳類において過剰増殖性疾患、炎症性疾患、ウイルス感染、または細菌感染を治療するための、薬学的組成物。
【請求項40】
前記過剰増殖性疾患は、癌であり、前記組成物は、アポトーシス誘導量の前記化合物を含む、請求項39に記載の薬学的組成物。
【請求項41】
哺乳類において過剰増殖性疾患、炎症性疾患、ウイルス感染、または細菌感染を治療する方法であって、そのような治療を必要とする患者に、請求項38に記載の抗過剰増殖、抗炎症、抗ウイルス、または抗菌有効量の化合物を投与することを含む、方法。
【請求項42】
前記過剰増殖性疾患は、癌であり、アポトーシスを誘導する量の化合物が投与される、請求項41に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公表番号】特表2012−527464(P2012−527464A)
【公表日】平成24年11月8日(2012.11.8)
【国際特許分類】
【出願番号】特願2012−511907(P2012−511907)
【出願日】平成22年5月14日(2010.5.14)
【国際出願番号】PCT/US2010/034838
【国際公開番号】WO2010/135170
【国際公開日】平成22年11月25日(2010.11.25)
【出願人】(511282771)セルセウティックス コーポレイション (1)
【Fターム(参考)】
【公表日】平成24年11月8日(2012.11.8)
【国際特許分類】
【出願日】平成22年5月14日(2010.5.14)
【国際出願番号】PCT/US2010/034838
【国際公開番号】WO2010/135170
【国際公開日】平成22年11月25日(2010.11.25)
【出願人】(511282771)セルセウティックス コーポレイション (1)
【Fターム(参考)】
[ Back to top ]

