ニューキノロン剤誘導体
【課題】腫瘍集積性を高めたニューキノロン剤誘導体を提供する。
【解決手段】ニューキノロン剤のカルボキシル基が、高分子化合物と結合してなる、ニューキノロン剤誘導体。
【解決手段】ニューキノロン剤のカルボキシル基が、高分子化合物と結合してなる、ニューキノロン剤誘導体。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規なニューキノロン剤誘導体に関する。詳細には、音響癌化学療法において使用する音響感受性物質として作用する、新規な構造のニューキノロン剤誘導体に関する。
【背景技術】
【0002】
超音波を使用した癌の治療方法としては、超音波の生体組織に対する加熱作用と非加熱作用の二種類を利用するものに大別される。加熱作用を利用するものとしては、理学療法、温熱療法、加熱凝固療法がある。理学療法は、強度0.1〜3W/cm3の超音波を用いて、疼痛を緩和させる治療法である。温熱療法は、腫瘍を局所的に加温して悪性腫瘍を治療する方法である。また、加熱凝固療法は、患部に大きな超音波エネルギーを集束させ、蛋白質凝固点以上に加熱して、凝固壊死させる治療法である。
【0003】
超音波の非加熱作用としては、機械的作用と化学作用がある。機械的作用は、超音波振動によるもので、この作用を主として用いた治療法に、対外衝撃波砕石術、超音波振動メス、歯石除去術などがある。化学作用とは、微小気泡が超音波の照射を受けて急速に圧壊するときに、物質が化学的に活性化されることにより生じる作用をいう。この超音波の化学作用を利用した癌の治療法として、音響癌化学療法(超音波力学的療法、ソノダイナミックセラピー(SDT))がある。音響癌化学療法とは、悪性腫瘍に対して、音響感受性物質の存在下で、微弱な超音波を照射し、超音波と薬物の相乗効果により治療する方法である。音響癌化学療法における超音波の強度は、超音波診断装置における強度(0.05〜0.3W/cm2)と同程度である。本発明のニューキロン剤誘導体は、該音響感受性物質として作用するものである。以下、音響癌化学療法について説明する。
【0004】
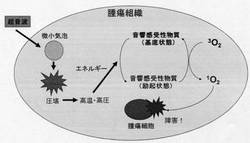
音響癌化学療法の推定メカニズムを図1に示す。体外より超音波を照射すると、腫瘍組織の液体中に微小気泡が生成する。該微小気泡は、断熱膨張・圧縮を繰り返し、やがて圧壊する。この時、数千度・数百気圧の高温・高圧が生じ、ここで生じたエネルギーによって腫瘍組織に取り込まれた音響感受性物質が基底状態から励起状態に活性化される。該音響感受性物質が、励起状態から基底状態に戻るときに溶存酸素から活性酸素を発生させる。生じた活性酸素が腫瘍細胞に障害を与え、腫瘍組織の壊死を引き起こすと考えられている。
【0005】
音響癌化学療法の利点としては、(1)超音波を用いることから低侵襲性であること、(2)超音波を局所的に照射することが可能で、さらに腫瘍集積性の高い音響感受性物質を用いることで、腫瘍選択的に治療できること、(3)超音波や音響感受性物質による副作用が少ないこと、(4)超音波の透過性が高いことから体深部の腫瘍に効果が期待できること、が挙げられる。
【0006】
音響癌化学療法を実現するには、最適な音響感受性物質を開発することが重要である。臨床応用の可能性が高い理想的な音響感受性物質の特性としては、(1)低濃度で高い音響化学効果を示すこと、(2)人体に投与可能であること、(3)腫瘍集積性(腫瘍選択性)が高いこと、が挙げられる。音響感受性物質についてのこれまでの研究としては、梅村らにより、ヘマトポリフィリンが音響感受性物質として用いることができることが報告されている(非特許文献1)。ヘマトポリフィリンは、強い音響化学効果を示し、腫瘍集積性が高い化合物であるが、光毒性という重篤な副作用がある。
【0007】
また、本発明者らは、抗炎症剤として既に臨床使用されているピロキシカムが音響化学的効果を示すことを報告している(非特許文献2)。しかしながら、ピロキシカムは、in vivoにおいては、通常量の4倍以上が局所で必要となる欠点があった。
【0008】
また、本発明者らは、広く臨床に使用されている抗生物質であり、重篤な副作用が少ないニューキノロン剤に着目した。そのうち、ロメフロキサシン(LFLX)、ガチフロキサシン(GFLX)、スパルフロキサシン(SPFX)、シプロフロキサシン(CPFX)の4種類を用いて検討を行い、LFLX、GFLX、SPFXの3種類のニューキノロン剤がin vivoにおいて、音響化学的効果を示すことを明らかにした(非特許文献3、4)。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Yumita N, Nishigaki R, Umemura K and Umemura S: Hematoporphyrin as a sensitizer of cell-damaging effect of ultrasound. Jpn J Cancer Res, 80, 219-222,1989.
【0010】
【非特許文献2】Sakusabe N, Okada K, Sato K, Kamada S, Yoshida Y and Suzuki T: Enhanced sonodynamic antitumor effect of ultrasound in the presence of nonsteroidal anti-inflammatory drugs. Jpn J Cancer Res, 90, 1146-1151, 1999.
【0011】
【非特許文献3】Huang D, Okada K, Komori C, Itoi E and Suzuki T: Enhanced antitumor activity of ultrasonic irradiation in the presence of new quinolone antibiotics in vivo. Cancer Sci, 95, 845-849, 2004.
【0012】
【非特許文献4】Huang D, Okada K, Komori C, Itoi E, Kawamura K and Suzuki T: Ultrastructure of sarcoma 180 cells after ultrasound irradiation in the presence of sparfloxacin. Anticancer Res, 24, 1553-1559, 2004.
【発明の概要】
【発明が解決しようとする課題】
【0013】
しかしながら、上記のニューキノロン剤は腫瘍集積性が乏しいという欠点があった。
そこで、本発明は、腫瘍集積性を高めたニューキノロン剤誘導体を提供することを課題とする。
【課題を解決するための手段】
【0014】
本発明者らは、ニューキノロン剤の腫瘍集積性を高めることを検討した。腫瘍組織の特徴として、毛細血管透過性が亢進していること、リンパ管からの排出が不十分であることが挙げられる。したがって、血中半減期の長い化合物は、正常組織と腫瘍組織に取り込まれた後に、リンパ管からの排泄が不十分な腫瘍組織に次第に集積していくことが予想される。血中半減期を長くする手段の一つとして、化合物の分子量を大きくすることが挙げられる。この目的で汎用される高分子化合物の一つとして、ポリエチレングリコールがある。ポリエチレングリコール(PEG)は、無毒性で、非免疫原性で、生物分解性の水溶性ポリマーである。該PEGの医薬品への応用例としては、ペグイントロンがある。この薬剤は、IFNα−2bを分子量12000のPEGと共有結合したC型慢性肝炎治療薬である。PEG化することで、生体内での滞留時間が延長し、週3回投与を週1回投与とすることが可能となった。
【0015】
本発明者らは、以上の知見を基に、ニューキロン剤をPEG化することにより、その分子量を増大させ、得られるLFLX誘導体の血中半減期を延長させ、腫瘍集積性を高めることについて鋭意研究し、以下の発明を完成させた。
【0016】
第1の本発明は、ニューキノロン剤のカルボキシル基が、高分子化合物と結合してなる、ニューキノロン剤誘導体である。
【0017】
第1の本発明において、高分子化合物の分子量は、1000以上15000以下であることが好ましい。
【0018】
第1の本発明において、高分子化合物は、ポリエチレングリコールであることが好ましい。また、ポリエチレングリコールは、末端にアミノ基を有するメトキシポリエチレングリコールであることが好ましい。
【0019】
第1の本発明において、ニューキノロン剤のアミノ基は、保護基で保護されていることが好ましい。
【0020】
第1の本発明において、ニューキノロン剤は、ロメフロキサシン、ガチフロキサシン、スパルフロキサシンからなる群から選ばれる一種であることが好ましい。
【0021】
第1の本発明において、ニューキノロン剤は、ロメフロキサシンであることが好ましい。
【0022】
第2の本発明は、下記式(1)の構造を備えてなる、ニューキノロン剤誘導体である。
【0023】
【化1】

(式(1)中、Rは、アセチル基、tert−ブトキシカルボニル基、ベンジルオキシカルボニル基から選ばれる保護基である。nは、20〜340の整数である。)
【0024】
第2の本発明において、保護基はアセチル基であることが好ましい。
【0025】
第3の本発明は、第1および第2の本発明のニューキノロン剤誘導体を含有してなる、超音波治療用薬剤である。
【0026】
第4の本発明は、第3の本発明の超音波治療用薬剤を患者に投与する工程、腫瘍部に超音波を照射する工程を備えてなる、腫瘍の治療方法である。
【発明の効果】
【0027】
本発明のニューキノロン剤誘導体は、低濃度で高い音響化学効果を示すものであり、また、臨床に広く使用され、重篤な副作用が少ないニューキノロン剤をベースとしているため、同様に人体への副作用が少ないことが予想され、さらに、C型肝炎治療薬を高分子化して血中半減期を延長したという実績のあるポリエチレングリコールを用いて高分子化していることから、同様に血中半減期を延長することができ、腫瘍選択性が高いことが予想される。これより、本発明のニューキノロン剤誘導体は、音響癌化学療法において用いる音響感受性物質として好適に使用することができる。
【図面の簡単な説明】
【0028】
【図1】音響癌化学療法の推定メカニズムを示す概念図である。
【図2】実施例における腫瘍細胞−薬物混合溶液の調整方法を示す概念図である。
【図3】実施例で使用した超音波装置の概要を示す概念図である。
【図4】混合溶液(200μM)における細胞生存率を比較したグラフである。
【図5】細胞生存率の薬物濃度依存性を示したグラフである。
【図6】(A)はコントロールにおける超音波照射前の腫瘍細胞の電子顕微鏡写真であり、(B)はLP2000(実施例1)における超音波照射前の腫瘍細胞の電子顕微鏡写真であり、(C)はコントロールにおける超音波照射後の腫瘍細胞の電子顕微鏡写真であり、(D)はLP2000(実施例1)における超音波照射後の腫瘍細胞の電子顕微鏡写真である。
【発明を実施するための形態】
【0029】
<ニューキノロン剤誘導体>
本発明の新規な構造のニューキノロン剤誘導体は、ニューキノロン剤のカルボキシル基が、高分子化合物と結合した構造を有している。本発明のニューキノロン剤誘導体は、高分子化されることにより、血中半減期が長くなり、これにより、腫瘍集積性が高められている。
【0030】
(ニューキノロン剤)
ニューキノロン剤は、重篤な副作用が少ない抗生物質として、広く臨床に使用されている化合物である。該ニューキノロン剤のうち、音響化学的効果を示すものであれば、特に限定なく、本発明のニューキノロン剤誘導体の前駆体として用いることができる。ニューキロン剤としては、例えば、ロメフロキサシン(LFLX)、ガチフロキサシン(GFLX)、スパルフロキサシン(SPFX)、シプロフロキサシン(CPLX)が挙げられる。中でも、ロメフロキサシン(LFLX)、ガチフロキサシン(GFLX)、スパルフロキサシン(SPFX)は、本発明者らによって、in vitroにおいて音響化学的効果を示すことが確かめられているので、これらの化合物から選ばれるものを本願発明のニューキノロン剤誘導体の前駆体として用いることが好ましい。また、ニューキノロン剤のカルボキシル基を高分子化する際の合成の容易さの点から、中でも、ロメフロキサシン(LFLX)を前駆体とすることが、特に好ましい。
【0031】
(高分子化合物)
上記したニューキノロン剤のカルボキシル基と結合して、高分子化させる高分子化合物としては、無毒性、非免疫原性、生分解性、水溶性等の性質を備えた高分子化合物であれば、特に限定されず、例えば、ポリエチレングリコール、ポリ乳酸が挙げられる。中でも、IFNα−2bを高分子化してペグイントロンとして、生体内での滞留時間を延長させた実績のある、ポリエチレングリコールを用いることが好ましい。
【0032】
ポリエチレングリコールとしては、所定の分子量を有し、ニューキノロン剤のカルボキシル基と結合して高分子化させることができるものであれば、特に限定されない。ポリエチレングリコールにおける、カルボキシル基と結合する側の末端としては、例えば、水酸基、アミノ基を挙げることができる。水酸基の場合は、エステル結合によりニューキノロン剤と結合し、また、アミノ基の場合は、アミド結合によりニューキノロン剤と結合する。該末端の種類は、ニューキノロン剤の種類により、結合をさせやすいものを選択すればよい。例えば、ニューキノロン剤としてLFLXを用いた場合は、合成上の点から、アミノ基を末端に有する高分子化合物を用いた方が好ましい。
【0033】
また、ポリエチレングリコールにおける、カルボキシル基と結合する側の末端と反対の末端は、ニューキノロン剤との反応において副反応を防ぐ観点から、および、目的物の精製を容易にする観点から、アルコキシ化されていることが好ましい。アルコキシ基としては、例えば、メトキシ基、エトキシ基、プロポキシ基が挙げられる。
【0034】
高分子化合物の分子量は、1000以上15000以下であることが好ましく、1300以上10000以下であることがより好ましく、1500以上8000以下であることがさらに好ましく、1800以上7000以下であることが特に好ましく、1900以上6000以下であることが最も好ましい。高分子化合物の分子量が小さすぎると、ニューキノロン剤誘導体の血中半減期を延長させ、腫瘍集積性を高める効果が劣る虞があり、逆に、高分子化合物の分子量が大きすぎると、ニューキノロン剤誘導体の音響化学効果が劣る虞がある。
【0035】
本発明における、高分子化合物の好ましい形態の一つとして、以下の式(2)で示される末端にアミノ基を持つメトキシポリエチレングリコールを挙げることができる。
【0036】
【化2】

【0037】
式(2)中、nは、20〜340の整数であり、nは好ましくは28〜225の整数であり、より好ましくは32〜180の整数であり、さらに好ましくは39〜157の整数であり、特に好ましくは41〜135の整数である。nが小さすぎると、ニューキノロン剤誘導体の血中半減期を延長させ、腫瘍集積性を高める効果が劣る虞があり、逆に、nが大きすぎると、ニューキノロン剤誘導体の音響化学効果が劣る虞がある。
【0038】
(アミノ基の保護)
ニューキノロン剤のカルボキシル基を高分子化化合物と結合させるに際して、ニューキノロン剤中のアミノ基は、保護しておくことが好ましい。ニューキノロン剤中のアミノ基を保護しておくことによって、有機溶媒への可溶性を増すことができ、副反応を抑えることができる。このような目的を達成できるのであれば、保護基は特に限定されないが、例えば、アセチル基、tert−ブトキシカルボニル基、ベンジルオキシカルボニル基を挙げることができる。中でも、保護基としては、合成の容易さ、および、生体適合性の点から、アセチル基を用いることが好ましい。
【0039】
<ニューキノロン剤誘導体の製造方法>
本発明のニューキノロン剤誘導体は、ニューキノロン剤中のカルボキシル基と、高分子化合物とを結合させて、高分子化することにより製造することができる。例えば、高分子化合物がアミノ基を有している場合は、ニューキノロン剤中のカルボキシル基と反応させアミド結合を形成することにより高分子化することができ、また、高分子化合物が水酸基を有している場合は、ニューキノロン剤中のカルボキシル基と反応させエステル結合を形成することにより高分子化することができる。なお、高分子化に先立って、ニューキノロン剤中のアミド基は、保護基により保護しておくことが好ましい。
【0040】
高分子化合物の好ましい形態の一つとして、上記の式(2)で示される末端にアミノ基を持つメトキシポリエチレングリコールを用い、ニューキノロン剤としてLFLXを用いた場合における、両者の結合反応について、以下、詳細に説明する。ポリエチレングリコール化LFLX誘導体の製造方法の概要を式(3)に示す。
【0041】
【化3】

【0042】
まず、LFLX塩酸塩のアミノ基を、アセチルクロライドによりアセチル化して保護する。得られた化合物にクロロギ酸メチルを反応させて、その後、末端にアミノ基を持つメトキシポリエチレングリコールを反応させて、ポリエチレングリコール化LFLX誘導体が得られる。
【0043】
<音響感受性物質としての用途>
本発明のニューキノロン剤誘導体は、低濃度で高い音響化学効果を示すものであり、また、臨床に広く使用され、重篤な副作用が少ないニューキノロン剤をベースとしているため、同様に人体への副作用が少ないことが予想され、さらに、C型肝炎治療薬を高分子化して血中半減期を延長したという実績のあるポリエチレングリコールを用いて高分子化していることから、同様に血中半減期を延長することができ、腫瘍選択性が高いことが予想できる。これより、本発明のニューキノロン剤誘導体は、音響癌化学療法において用いる音響感受性物質として使用することができる。
【実施例】
【0044】
<PEG化LFLX誘導体の合成>
(実施例1)
撹拌したロメフロキサシン塩酸塩(塩野義製薬社製)のジクロロメタン溶液(30mL)に、トリエチルアミン(和光純薬社製)0.59mL(4.12mmol)、および、アセチルクロライド(和光純薬社製)0.15mL(2.06mmol)を0℃にて加え、室温にて4時間撹拌した。
得られた溶液から、減圧化にて溶媒を除去し、残渣をクロロホルムに溶解させた。このクロロホルム容器を水洗後、硫酸ナトリウムで乾燥させ、溶媒を除去して粗生成物を得た。該粗生成物をカラムクロマトグラフィー(クロロホルム:メタノール=97:3)により精製した(粗生成物:525mg)。これを、クロロホルム−メタノール混合溶媒から再結晶させ、目的物であるアセチル化LFLXを黄色粉末(256mg、63%)として得た。
【0045】
【化4】

【0046】
アセチル化LFLX:
IR(KBr)cm−1:3052,1719,1625.
1H−NMR(270MHz,CDCl3)δ:14.58(1H,s),8.60(1H,s),8.00(1H,dd,J=11.0,2.0Hz),4.48(2H,dd,J=7.0,3.0Hz),3.62−3.70(1H,m),3.38−3.44(2H,m),3.28(2H,d,J=8.0Hz),2.15(2H,q,J=6.5Hz),1.64(3H,s),1.58(3H,t,J=7.0Hz),1.41(3H,dd,J=7.7Hz).
13C−NMR(67.5MHz,CDCl3)δ:176.5,169.6,166.8,153.9,157.5,150.5,134.7,127.5,122.5,109.0,108.6,55.9,54.9,51.4,45.1,42.4,22.2,16.7,15.5.
【0047】
得られたアセチル化LFLX(100mg,0.25mmol)のクロロホルム溶液(5.0mL)を撹拌し、これにトリエチルアミン(和光純薬社製)140μL(1.0mmol)、および、クロロギ酸メチル(和光純薬社製)39μL(0.5mmol)を0℃にて加え、室温にて3時間撹拌した。
【0048】
【化5】

【0049】
上記で得られた反応溶液に、末端にアミノ基を持つメトキシポリエチレングリコール(日本油脂社製、SUNBRIGHT(MEPA−20H)、分子量2000)500mg(0.25mmol)のジクロロメタン溶液(3.0mL)を加え、混合溶液を室温にて2.5時間撹拌した。得られた混合溶液を水洗後、硫酸ナトリウムで乾燥させ、溶媒を除去して粗生成物を得た。この粗生成物を、クロロホルム−メタノール混合溶媒から再結晶させ、目的物であるPEG化LFLX誘導体を白色固体(451mg、76%)として得た。以下、実施例1で得られたPEG化LFLX誘導体をLP2000という。
【0050】
【化6】

【0051】
PEG化LFLX誘導体(LP2000):
IR(KBr)cm−1:1660,1542,1113.
1H−NMR(270MHz,CDCl3)δ:8.64(1H,s),7.98(1H,dd,J=12.0,2.0Hz),4.42(2H,dd,J=7.0,3.0Hz),3.88−3.92(1H,m),3.60−3.70(−OCH2CH2O−,m),3.65(3H,s),3.38(4H,t,J=5.0Hz),3.20−3.22(2H,m),2.15(2H,q,J=6.0Hz),1.74(3H,s),1.72−1.75,(2H,m),1.52(3H,t,J=7.0Hz),1.37(3H,d,J=7.0Hz).
13C−NMR(67.5MHz,CDCl3)δ:174.2,171.9,164.5,156.9,149.5,148.6,130.7,124.4,122.8,111.4,108.6,71.0−69.1(PEG),59.1,55.6,53.7,51.1,50.2,44.7,42.2,29.7,25.4,21.8,16.4,16.2.
【0052】
(実施例2)
末端にアミノ基を持つメトキシポリエチレングリコールとして、分子量5000(日本油脂社製、SUNBRIGHT(MEPA−50H))のものを用いた以外は、実施例1と同様にしてPEG化LFLX誘導体を得た(92%)。以下、実施例2で得られたPEG化LFLX誘導体をLP5000という。
【0053】
(参考例1)
末端にアミノ基を持つメトキシポリエチレングリコールとして、分子量20000(日本油脂社製、SUNBRIGHT(MEPA−20T))のものを用いた以外は、実施例1と同様にしてPEG化LFLX誘導体を得た(58%)。以下、参考例1で得られたPEG化LFLX誘導体をLP20000という。
【0054】
(比較例1)
LFLX(塩野義製薬社製)を、PEG化しないで、そのまま用いた。
【0055】
上記実施例等において、1H−NMRおよび13C−NMRスペクトルは、JEOL FT NMRシステム(EX−270)を用いて、重クロロホルムを溶媒として測定したものである。化学シフトの内部基準物質としては、テトラメチルシラン(TMS)を用いた。
IRスペクトルは、FT−IR410分光光度計を用いて測定した。
末端にアミノ基を持つメトキシポリエチレングリコールの各分子量は、PEGを基準物質としたHPLCにより求めた。
【0056】
<評価方法>
上記実施例1、2および参考例1で合成したPEG化LFLX誘導体および比較例1のLFLXを、音響感受性物質として、腫瘍細胞に対する音響化学効果をin vivoで評価した。
腫瘍細胞としては、マウス肉腫細胞のSarcoma180(東北大学加齢医学研究所医用細胞センターより提供)を用いた。この細胞を、マウスの腹腔内に投与して1週間ほどかけて増殖させた。その後、腹水を採取し、PBSで希釈し、腫瘍細胞液(1.0×106/mL)を調製した。この腫瘍細胞液をそれぞれ0.7mLずつビーカーに取り分けた。実施例1のLP2000を三種類の濃度(20μM、200μM、400μM)のPBS溶液として調整し、それぞれ0.7mLを先の腫瘍細胞液が入ったビーカーに加え、腫瘍細胞−薬物混合溶液を得た。得られた混合溶液の最終的な薬物濃度は、それぞれ、10μM、100μM、200μMとなっている。
【0057】
また、比較対照(コントロール)として、腫瘍細胞液が0.7mL入ったビーカーに、PBSを0.7mL入れたものを用意した。同様の手順で、実施例2および参考例1のLP5000およびLP20000について、比較例1のLPLXについても、それぞれ三種類の濃度の腫瘍細胞−薬物混合溶液(10μM、100μM、200μM)を調整した。実験手順を図2に示す。
【0058】
上記で調整した溶液を用いて、超音波照射装置(信号発生器(FG−350、岩通計測社製)、増幅用アンプ(PA40−2801、サムウェイ社製)、出力計(SX−200、第一電波工業社製))を用いて、音響化学的効果を評価した。使用した超音波装置の概要を図3に示す。上記で調製した溶液をガラスセルの中に入れ、超音波伝達ゲルを用いて、ガラスセルをヒートシンク上に固定し、セルの下から超音波を照射した。照射により発熱し溶液の温度が上昇するため、流水してクーリングした。
【0059】
腫瘍細胞の生死の判定方法として、トリパンブルー色素排除法を用いた。音響化学的効果の判定方法は、下記の生存率を用いて行った。
生存率=超音波照射後の腫瘍細胞の生存数/超音波照射前の腫瘍細胞の生存数×100(%)
【0060】
(混合溶液(200μM)における細胞生存率の比較)
照射強度2W、照射時間30秒で、各溶液(200μM)に超音波を照射し、細胞生存率の比較を行った。結果を図4に示す。各測定は、サンプル数10の平均値として求めた(以下の生存率の測定において同様。)。縦軸が腫瘍細胞の生存率を示す。アスタリスクは、コントロール群と比較して有意差があることを示している。LP2000(実施例1)とLP5000(実施例2)では、コントロール群に比較して有意な生存率の低下が認められた。これに対し、LP20000(参考例1)は、まったく生存率の低下を示さず、コントロールと比較しても生存率が高いことから、超音波単独での抗腫瘍効果を打ち消す結果となった。
【0061】
シャープは、LFLX(比較例1)と比較して有意差があることを示す。LP2000(実施例1)とLP5000(実施例2)では、LFLX(比較例1)と比較して有意な生存率の低下が認められた。これより、PEG化LFLX誘導体の音響化学的効果は、PEGの分子量に依存することが示された。
【0062】
(細胞生存率の薬物濃度依存性)
次に、効果の認められたLP2000(実施例1)とLP5000(実施例2)に対して、照射強度2W、照射時間30秒で、超音波を照射し、音響化学効果の薬物濃度依存性を評価した。結果を図5に示す。LP2000(実施例1)、LP5000(実施例2)ともに、100μMおよび10μMにおいても、コントロールと比較して有意な生存率の低下が認められた。この結果から、LP2000(実施例1)とLP5000(実施例2)は、低濃度においても十分な音響化学的効果を有することが示された。
【0063】
(電子顕微鏡による腫瘍細胞の観察)
走査型電子顕微鏡(JSM−520、日本電子社製)を用いた腫瘍細胞の観察を行った。図6(A)は、コントロールにおける超音波照射前の腫瘍細胞の写真である。細胞の大きさはほぼ一定で丸く、表面には微絨毛が見られた。図6(C)は、コントロールに対して2.0Wで30秒間超音波を照射した後の写真である。形がやや不規則で、微絨毛が消失した細胞が見られた。図6(B)は、LP2000(実施例1)の混合溶液中の超音波照射前の細胞の写真である。コントロールとほぼ同様の形状が観察され、LP2000を混合したのみでは、腫瘍細胞に影響を与えないことが分かった。
【0064】
図6(D)は、LP2000(実施例1)の存在下で、同様の条件にて超音波を照射した後の写真である。ほとんどの細胞は形が不規則で、微絨毛は消失し、縮小して固まっていた。この結果より、超音波のみを照射した場合(コントロール)に比べて、音響感受性物質(LP2000)存在下で、超音波を照射した場合は、音響化学的効果により、腫瘍細胞に大きなダメージを与えることができることが示された。
【0065】
以上、現時点において、もっとも、実践的であり、かつ、好ましいと思われる実施形態に関連して本発明を説明したが、本発明は、本願明細書中に開示された実施形態に限定されるものではなく、請求の範囲および明細書全体から読み取れる発明の要旨或いは思想に反しない範囲で適宜変更可能であり、そのような変更を伴うニューキノロン剤誘導体もまた本発明の技術的範囲に包含されるものとして理解されなければならない。
【技術分野】
【0001】
本発明は、新規なニューキノロン剤誘導体に関する。詳細には、音響癌化学療法において使用する音響感受性物質として作用する、新規な構造のニューキノロン剤誘導体に関する。
【背景技術】
【0002】
超音波を使用した癌の治療方法としては、超音波の生体組織に対する加熱作用と非加熱作用の二種類を利用するものに大別される。加熱作用を利用するものとしては、理学療法、温熱療法、加熱凝固療法がある。理学療法は、強度0.1〜3W/cm3の超音波を用いて、疼痛を緩和させる治療法である。温熱療法は、腫瘍を局所的に加温して悪性腫瘍を治療する方法である。また、加熱凝固療法は、患部に大きな超音波エネルギーを集束させ、蛋白質凝固点以上に加熱して、凝固壊死させる治療法である。
【0003】
超音波の非加熱作用としては、機械的作用と化学作用がある。機械的作用は、超音波振動によるもので、この作用を主として用いた治療法に、対外衝撃波砕石術、超音波振動メス、歯石除去術などがある。化学作用とは、微小気泡が超音波の照射を受けて急速に圧壊するときに、物質が化学的に活性化されることにより生じる作用をいう。この超音波の化学作用を利用した癌の治療法として、音響癌化学療法(超音波力学的療法、ソノダイナミックセラピー(SDT))がある。音響癌化学療法とは、悪性腫瘍に対して、音響感受性物質の存在下で、微弱な超音波を照射し、超音波と薬物の相乗効果により治療する方法である。音響癌化学療法における超音波の強度は、超音波診断装置における強度(0.05〜0.3W/cm2)と同程度である。本発明のニューキロン剤誘導体は、該音響感受性物質として作用するものである。以下、音響癌化学療法について説明する。
【0004】
音響癌化学療法の推定メカニズムを図1に示す。体外より超音波を照射すると、腫瘍組織の液体中に微小気泡が生成する。該微小気泡は、断熱膨張・圧縮を繰り返し、やがて圧壊する。この時、数千度・数百気圧の高温・高圧が生じ、ここで生じたエネルギーによって腫瘍組織に取り込まれた音響感受性物質が基底状態から励起状態に活性化される。該音響感受性物質が、励起状態から基底状態に戻るときに溶存酸素から活性酸素を発生させる。生じた活性酸素が腫瘍細胞に障害を与え、腫瘍組織の壊死を引き起こすと考えられている。
【0005】
音響癌化学療法の利点としては、(1)超音波を用いることから低侵襲性であること、(2)超音波を局所的に照射することが可能で、さらに腫瘍集積性の高い音響感受性物質を用いることで、腫瘍選択的に治療できること、(3)超音波や音響感受性物質による副作用が少ないこと、(4)超音波の透過性が高いことから体深部の腫瘍に効果が期待できること、が挙げられる。
【0006】
音響癌化学療法を実現するには、最適な音響感受性物質を開発することが重要である。臨床応用の可能性が高い理想的な音響感受性物質の特性としては、(1)低濃度で高い音響化学効果を示すこと、(2)人体に投与可能であること、(3)腫瘍集積性(腫瘍選択性)が高いこと、が挙げられる。音響感受性物質についてのこれまでの研究としては、梅村らにより、ヘマトポリフィリンが音響感受性物質として用いることができることが報告されている(非特許文献1)。ヘマトポリフィリンは、強い音響化学効果を示し、腫瘍集積性が高い化合物であるが、光毒性という重篤な副作用がある。
【0007】
また、本発明者らは、抗炎症剤として既に臨床使用されているピロキシカムが音響化学的効果を示すことを報告している(非特許文献2)。しかしながら、ピロキシカムは、in vivoにおいては、通常量の4倍以上が局所で必要となる欠点があった。
【0008】
また、本発明者らは、広く臨床に使用されている抗生物質であり、重篤な副作用が少ないニューキノロン剤に着目した。そのうち、ロメフロキサシン(LFLX)、ガチフロキサシン(GFLX)、スパルフロキサシン(SPFX)、シプロフロキサシン(CPFX)の4種類を用いて検討を行い、LFLX、GFLX、SPFXの3種類のニューキノロン剤がin vivoにおいて、音響化学的効果を示すことを明らかにした(非特許文献3、4)。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Yumita N, Nishigaki R, Umemura K and Umemura S: Hematoporphyrin as a sensitizer of cell-damaging effect of ultrasound. Jpn J Cancer Res, 80, 219-222,1989.
【0010】
【非特許文献2】Sakusabe N, Okada K, Sato K, Kamada S, Yoshida Y and Suzuki T: Enhanced sonodynamic antitumor effect of ultrasound in the presence of nonsteroidal anti-inflammatory drugs. Jpn J Cancer Res, 90, 1146-1151, 1999.
【0011】
【非特許文献3】Huang D, Okada K, Komori C, Itoi E and Suzuki T: Enhanced antitumor activity of ultrasonic irradiation in the presence of new quinolone antibiotics in vivo. Cancer Sci, 95, 845-849, 2004.
【0012】
【非特許文献4】Huang D, Okada K, Komori C, Itoi E, Kawamura K and Suzuki T: Ultrastructure of sarcoma 180 cells after ultrasound irradiation in the presence of sparfloxacin. Anticancer Res, 24, 1553-1559, 2004.
【発明の概要】
【発明が解決しようとする課題】
【0013】
しかしながら、上記のニューキノロン剤は腫瘍集積性が乏しいという欠点があった。
そこで、本発明は、腫瘍集積性を高めたニューキノロン剤誘導体を提供することを課題とする。
【課題を解決するための手段】
【0014】
本発明者らは、ニューキノロン剤の腫瘍集積性を高めることを検討した。腫瘍組織の特徴として、毛細血管透過性が亢進していること、リンパ管からの排出が不十分であることが挙げられる。したがって、血中半減期の長い化合物は、正常組織と腫瘍組織に取り込まれた後に、リンパ管からの排泄が不十分な腫瘍組織に次第に集積していくことが予想される。血中半減期を長くする手段の一つとして、化合物の分子量を大きくすることが挙げられる。この目的で汎用される高分子化合物の一つとして、ポリエチレングリコールがある。ポリエチレングリコール(PEG)は、無毒性で、非免疫原性で、生物分解性の水溶性ポリマーである。該PEGの医薬品への応用例としては、ペグイントロンがある。この薬剤は、IFNα−2bを分子量12000のPEGと共有結合したC型慢性肝炎治療薬である。PEG化することで、生体内での滞留時間が延長し、週3回投与を週1回投与とすることが可能となった。
【0015】
本発明者らは、以上の知見を基に、ニューキロン剤をPEG化することにより、その分子量を増大させ、得られるLFLX誘導体の血中半減期を延長させ、腫瘍集積性を高めることについて鋭意研究し、以下の発明を完成させた。
【0016】
第1の本発明は、ニューキノロン剤のカルボキシル基が、高分子化合物と結合してなる、ニューキノロン剤誘導体である。
【0017】
第1の本発明において、高分子化合物の分子量は、1000以上15000以下であることが好ましい。
【0018】
第1の本発明において、高分子化合物は、ポリエチレングリコールであることが好ましい。また、ポリエチレングリコールは、末端にアミノ基を有するメトキシポリエチレングリコールであることが好ましい。
【0019】
第1の本発明において、ニューキノロン剤のアミノ基は、保護基で保護されていることが好ましい。
【0020】
第1の本発明において、ニューキノロン剤は、ロメフロキサシン、ガチフロキサシン、スパルフロキサシンからなる群から選ばれる一種であることが好ましい。
【0021】
第1の本発明において、ニューキノロン剤は、ロメフロキサシンであることが好ましい。
【0022】
第2の本発明は、下記式(1)の構造を備えてなる、ニューキノロン剤誘導体である。
【0023】
【化1】

(式(1)中、Rは、アセチル基、tert−ブトキシカルボニル基、ベンジルオキシカルボニル基から選ばれる保護基である。nは、20〜340の整数である。)
【0024】
第2の本発明において、保護基はアセチル基であることが好ましい。
【0025】
第3の本発明は、第1および第2の本発明のニューキノロン剤誘導体を含有してなる、超音波治療用薬剤である。
【0026】
第4の本発明は、第3の本発明の超音波治療用薬剤を患者に投与する工程、腫瘍部に超音波を照射する工程を備えてなる、腫瘍の治療方法である。
【発明の効果】
【0027】
本発明のニューキノロン剤誘導体は、低濃度で高い音響化学効果を示すものであり、また、臨床に広く使用され、重篤な副作用が少ないニューキノロン剤をベースとしているため、同様に人体への副作用が少ないことが予想され、さらに、C型肝炎治療薬を高分子化して血中半減期を延長したという実績のあるポリエチレングリコールを用いて高分子化していることから、同様に血中半減期を延長することができ、腫瘍選択性が高いことが予想される。これより、本発明のニューキノロン剤誘導体は、音響癌化学療法において用いる音響感受性物質として好適に使用することができる。
【図面の簡単な説明】
【0028】
【図1】音響癌化学療法の推定メカニズムを示す概念図である。
【図2】実施例における腫瘍細胞−薬物混合溶液の調整方法を示す概念図である。
【図3】実施例で使用した超音波装置の概要を示す概念図である。
【図4】混合溶液(200μM)における細胞生存率を比較したグラフである。
【図5】細胞生存率の薬物濃度依存性を示したグラフである。
【図6】(A)はコントロールにおける超音波照射前の腫瘍細胞の電子顕微鏡写真であり、(B)はLP2000(実施例1)における超音波照射前の腫瘍細胞の電子顕微鏡写真であり、(C)はコントロールにおける超音波照射後の腫瘍細胞の電子顕微鏡写真であり、(D)はLP2000(実施例1)における超音波照射後の腫瘍細胞の電子顕微鏡写真である。
【発明を実施するための形態】
【0029】
<ニューキノロン剤誘導体>
本発明の新規な構造のニューキノロン剤誘導体は、ニューキノロン剤のカルボキシル基が、高分子化合物と結合した構造を有している。本発明のニューキノロン剤誘導体は、高分子化されることにより、血中半減期が長くなり、これにより、腫瘍集積性が高められている。
【0030】
(ニューキノロン剤)
ニューキノロン剤は、重篤な副作用が少ない抗生物質として、広く臨床に使用されている化合物である。該ニューキノロン剤のうち、音響化学的効果を示すものであれば、特に限定なく、本発明のニューキノロン剤誘導体の前駆体として用いることができる。ニューキロン剤としては、例えば、ロメフロキサシン(LFLX)、ガチフロキサシン(GFLX)、スパルフロキサシン(SPFX)、シプロフロキサシン(CPLX)が挙げられる。中でも、ロメフロキサシン(LFLX)、ガチフロキサシン(GFLX)、スパルフロキサシン(SPFX)は、本発明者らによって、in vitroにおいて音響化学的効果を示すことが確かめられているので、これらの化合物から選ばれるものを本願発明のニューキノロン剤誘導体の前駆体として用いることが好ましい。また、ニューキノロン剤のカルボキシル基を高分子化する際の合成の容易さの点から、中でも、ロメフロキサシン(LFLX)を前駆体とすることが、特に好ましい。
【0031】
(高分子化合物)
上記したニューキノロン剤のカルボキシル基と結合して、高分子化させる高分子化合物としては、無毒性、非免疫原性、生分解性、水溶性等の性質を備えた高分子化合物であれば、特に限定されず、例えば、ポリエチレングリコール、ポリ乳酸が挙げられる。中でも、IFNα−2bを高分子化してペグイントロンとして、生体内での滞留時間を延長させた実績のある、ポリエチレングリコールを用いることが好ましい。
【0032】
ポリエチレングリコールとしては、所定の分子量を有し、ニューキノロン剤のカルボキシル基と結合して高分子化させることができるものであれば、特に限定されない。ポリエチレングリコールにおける、カルボキシル基と結合する側の末端としては、例えば、水酸基、アミノ基を挙げることができる。水酸基の場合は、エステル結合によりニューキノロン剤と結合し、また、アミノ基の場合は、アミド結合によりニューキノロン剤と結合する。該末端の種類は、ニューキノロン剤の種類により、結合をさせやすいものを選択すればよい。例えば、ニューキノロン剤としてLFLXを用いた場合は、合成上の点から、アミノ基を末端に有する高分子化合物を用いた方が好ましい。
【0033】
また、ポリエチレングリコールにおける、カルボキシル基と結合する側の末端と反対の末端は、ニューキノロン剤との反応において副反応を防ぐ観点から、および、目的物の精製を容易にする観点から、アルコキシ化されていることが好ましい。アルコキシ基としては、例えば、メトキシ基、エトキシ基、プロポキシ基が挙げられる。
【0034】
高分子化合物の分子量は、1000以上15000以下であることが好ましく、1300以上10000以下であることがより好ましく、1500以上8000以下であることがさらに好ましく、1800以上7000以下であることが特に好ましく、1900以上6000以下であることが最も好ましい。高分子化合物の分子量が小さすぎると、ニューキノロン剤誘導体の血中半減期を延長させ、腫瘍集積性を高める効果が劣る虞があり、逆に、高分子化合物の分子量が大きすぎると、ニューキノロン剤誘導体の音響化学効果が劣る虞がある。
【0035】
本発明における、高分子化合物の好ましい形態の一つとして、以下の式(2)で示される末端にアミノ基を持つメトキシポリエチレングリコールを挙げることができる。
【0036】
【化2】

【0037】
式(2)中、nは、20〜340の整数であり、nは好ましくは28〜225の整数であり、より好ましくは32〜180の整数であり、さらに好ましくは39〜157の整数であり、特に好ましくは41〜135の整数である。nが小さすぎると、ニューキノロン剤誘導体の血中半減期を延長させ、腫瘍集積性を高める効果が劣る虞があり、逆に、nが大きすぎると、ニューキノロン剤誘導体の音響化学効果が劣る虞がある。
【0038】
(アミノ基の保護)
ニューキノロン剤のカルボキシル基を高分子化化合物と結合させるに際して、ニューキノロン剤中のアミノ基は、保護しておくことが好ましい。ニューキノロン剤中のアミノ基を保護しておくことによって、有機溶媒への可溶性を増すことができ、副反応を抑えることができる。このような目的を達成できるのであれば、保護基は特に限定されないが、例えば、アセチル基、tert−ブトキシカルボニル基、ベンジルオキシカルボニル基を挙げることができる。中でも、保護基としては、合成の容易さ、および、生体適合性の点から、アセチル基を用いることが好ましい。
【0039】
<ニューキノロン剤誘導体の製造方法>
本発明のニューキノロン剤誘導体は、ニューキノロン剤中のカルボキシル基と、高分子化合物とを結合させて、高分子化することにより製造することができる。例えば、高分子化合物がアミノ基を有している場合は、ニューキノロン剤中のカルボキシル基と反応させアミド結合を形成することにより高分子化することができ、また、高分子化合物が水酸基を有している場合は、ニューキノロン剤中のカルボキシル基と反応させエステル結合を形成することにより高分子化することができる。なお、高分子化に先立って、ニューキノロン剤中のアミド基は、保護基により保護しておくことが好ましい。
【0040】
高分子化合物の好ましい形態の一つとして、上記の式(2)で示される末端にアミノ基を持つメトキシポリエチレングリコールを用い、ニューキノロン剤としてLFLXを用いた場合における、両者の結合反応について、以下、詳細に説明する。ポリエチレングリコール化LFLX誘導体の製造方法の概要を式(3)に示す。
【0041】
【化3】

【0042】
まず、LFLX塩酸塩のアミノ基を、アセチルクロライドによりアセチル化して保護する。得られた化合物にクロロギ酸メチルを反応させて、その後、末端にアミノ基を持つメトキシポリエチレングリコールを反応させて、ポリエチレングリコール化LFLX誘導体が得られる。
【0043】
<音響感受性物質としての用途>
本発明のニューキノロン剤誘導体は、低濃度で高い音響化学効果を示すものであり、また、臨床に広く使用され、重篤な副作用が少ないニューキノロン剤をベースとしているため、同様に人体への副作用が少ないことが予想され、さらに、C型肝炎治療薬を高分子化して血中半減期を延長したという実績のあるポリエチレングリコールを用いて高分子化していることから、同様に血中半減期を延長することができ、腫瘍選択性が高いことが予想できる。これより、本発明のニューキノロン剤誘導体は、音響癌化学療法において用いる音響感受性物質として使用することができる。
【実施例】
【0044】
<PEG化LFLX誘導体の合成>
(実施例1)
撹拌したロメフロキサシン塩酸塩(塩野義製薬社製)のジクロロメタン溶液(30mL)に、トリエチルアミン(和光純薬社製)0.59mL(4.12mmol)、および、アセチルクロライド(和光純薬社製)0.15mL(2.06mmol)を0℃にて加え、室温にて4時間撹拌した。
得られた溶液から、減圧化にて溶媒を除去し、残渣をクロロホルムに溶解させた。このクロロホルム容器を水洗後、硫酸ナトリウムで乾燥させ、溶媒を除去して粗生成物を得た。該粗生成物をカラムクロマトグラフィー(クロロホルム:メタノール=97:3)により精製した(粗生成物:525mg)。これを、クロロホルム−メタノール混合溶媒から再結晶させ、目的物であるアセチル化LFLXを黄色粉末(256mg、63%)として得た。
【0045】
【化4】

【0046】
アセチル化LFLX:
IR(KBr)cm−1:3052,1719,1625.
1H−NMR(270MHz,CDCl3)δ:14.58(1H,s),8.60(1H,s),8.00(1H,dd,J=11.0,2.0Hz),4.48(2H,dd,J=7.0,3.0Hz),3.62−3.70(1H,m),3.38−3.44(2H,m),3.28(2H,d,J=8.0Hz),2.15(2H,q,J=6.5Hz),1.64(3H,s),1.58(3H,t,J=7.0Hz),1.41(3H,dd,J=7.7Hz).
13C−NMR(67.5MHz,CDCl3)δ:176.5,169.6,166.8,153.9,157.5,150.5,134.7,127.5,122.5,109.0,108.6,55.9,54.9,51.4,45.1,42.4,22.2,16.7,15.5.
【0047】
得られたアセチル化LFLX(100mg,0.25mmol)のクロロホルム溶液(5.0mL)を撹拌し、これにトリエチルアミン(和光純薬社製)140μL(1.0mmol)、および、クロロギ酸メチル(和光純薬社製)39μL(0.5mmol)を0℃にて加え、室温にて3時間撹拌した。
【0048】
【化5】

【0049】
上記で得られた反応溶液に、末端にアミノ基を持つメトキシポリエチレングリコール(日本油脂社製、SUNBRIGHT(MEPA−20H)、分子量2000)500mg(0.25mmol)のジクロロメタン溶液(3.0mL)を加え、混合溶液を室温にて2.5時間撹拌した。得られた混合溶液を水洗後、硫酸ナトリウムで乾燥させ、溶媒を除去して粗生成物を得た。この粗生成物を、クロロホルム−メタノール混合溶媒から再結晶させ、目的物であるPEG化LFLX誘導体を白色固体(451mg、76%)として得た。以下、実施例1で得られたPEG化LFLX誘導体をLP2000という。
【0050】
【化6】

【0051】
PEG化LFLX誘導体(LP2000):
IR(KBr)cm−1:1660,1542,1113.
1H−NMR(270MHz,CDCl3)δ:8.64(1H,s),7.98(1H,dd,J=12.0,2.0Hz),4.42(2H,dd,J=7.0,3.0Hz),3.88−3.92(1H,m),3.60−3.70(−OCH2CH2O−,m),3.65(3H,s),3.38(4H,t,J=5.0Hz),3.20−3.22(2H,m),2.15(2H,q,J=6.0Hz),1.74(3H,s),1.72−1.75,(2H,m),1.52(3H,t,J=7.0Hz),1.37(3H,d,J=7.0Hz).
13C−NMR(67.5MHz,CDCl3)δ:174.2,171.9,164.5,156.9,149.5,148.6,130.7,124.4,122.8,111.4,108.6,71.0−69.1(PEG),59.1,55.6,53.7,51.1,50.2,44.7,42.2,29.7,25.4,21.8,16.4,16.2.
【0052】
(実施例2)
末端にアミノ基を持つメトキシポリエチレングリコールとして、分子量5000(日本油脂社製、SUNBRIGHT(MEPA−50H))のものを用いた以外は、実施例1と同様にしてPEG化LFLX誘導体を得た(92%)。以下、実施例2で得られたPEG化LFLX誘導体をLP5000という。
【0053】
(参考例1)
末端にアミノ基を持つメトキシポリエチレングリコールとして、分子量20000(日本油脂社製、SUNBRIGHT(MEPA−20T))のものを用いた以外は、実施例1と同様にしてPEG化LFLX誘導体を得た(58%)。以下、参考例1で得られたPEG化LFLX誘導体をLP20000という。
【0054】
(比較例1)
LFLX(塩野義製薬社製)を、PEG化しないで、そのまま用いた。
【0055】
上記実施例等において、1H−NMRおよび13C−NMRスペクトルは、JEOL FT NMRシステム(EX−270)を用いて、重クロロホルムを溶媒として測定したものである。化学シフトの内部基準物質としては、テトラメチルシラン(TMS)を用いた。
IRスペクトルは、FT−IR410分光光度計を用いて測定した。
末端にアミノ基を持つメトキシポリエチレングリコールの各分子量は、PEGを基準物質としたHPLCにより求めた。
【0056】
<評価方法>
上記実施例1、2および参考例1で合成したPEG化LFLX誘導体および比較例1のLFLXを、音響感受性物質として、腫瘍細胞に対する音響化学効果をin vivoで評価した。
腫瘍細胞としては、マウス肉腫細胞のSarcoma180(東北大学加齢医学研究所医用細胞センターより提供)を用いた。この細胞を、マウスの腹腔内に投与して1週間ほどかけて増殖させた。その後、腹水を採取し、PBSで希釈し、腫瘍細胞液(1.0×106/mL)を調製した。この腫瘍細胞液をそれぞれ0.7mLずつビーカーに取り分けた。実施例1のLP2000を三種類の濃度(20μM、200μM、400μM)のPBS溶液として調整し、それぞれ0.7mLを先の腫瘍細胞液が入ったビーカーに加え、腫瘍細胞−薬物混合溶液を得た。得られた混合溶液の最終的な薬物濃度は、それぞれ、10μM、100μM、200μMとなっている。
【0057】
また、比較対照(コントロール)として、腫瘍細胞液が0.7mL入ったビーカーに、PBSを0.7mL入れたものを用意した。同様の手順で、実施例2および参考例1のLP5000およびLP20000について、比較例1のLPLXについても、それぞれ三種類の濃度の腫瘍細胞−薬物混合溶液(10μM、100μM、200μM)を調整した。実験手順を図2に示す。
【0058】
上記で調整した溶液を用いて、超音波照射装置(信号発生器(FG−350、岩通計測社製)、増幅用アンプ(PA40−2801、サムウェイ社製)、出力計(SX−200、第一電波工業社製))を用いて、音響化学的効果を評価した。使用した超音波装置の概要を図3に示す。上記で調製した溶液をガラスセルの中に入れ、超音波伝達ゲルを用いて、ガラスセルをヒートシンク上に固定し、セルの下から超音波を照射した。照射により発熱し溶液の温度が上昇するため、流水してクーリングした。
【0059】
腫瘍細胞の生死の判定方法として、トリパンブルー色素排除法を用いた。音響化学的効果の判定方法は、下記の生存率を用いて行った。
生存率=超音波照射後の腫瘍細胞の生存数/超音波照射前の腫瘍細胞の生存数×100(%)
【0060】
(混合溶液(200μM)における細胞生存率の比較)
照射強度2W、照射時間30秒で、各溶液(200μM)に超音波を照射し、細胞生存率の比較を行った。結果を図4に示す。各測定は、サンプル数10の平均値として求めた(以下の生存率の測定において同様。)。縦軸が腫瘍細胞の生存率を示す。アスタリスクは、コントロール群と比較して有意差があることを示している。LP2000(実施例1)とLP5000(実施例2)では、コントロール群に比較して有意な生存率の低下が認められた。これに対し、LP20000(参考例1)は、まったく生存率の低下を示さず、コントロールと比較しても生存率が高いことから、超音波単独での抗腫瘍効果を打ち消す結果となった。
【0061】
シャープは、LFLX(比較例1)と比較して有意差があることを示す。LP2000(実施例1)とLP5000(実施例2)では、LFLX(比較例1)と比較して有意な生存率の低下が認められた。これより、PEG化LFLX誘導体の音響化学的効果は、PEGの分子量に依存することが示された。
【0062】
(細胞生存率の薬物濃度依存性)
次に、効果の認められたLP2000(実施例1)とLP5000(実施例2)に対して、照射強度2W、照射時間30秒で、超音波を照射し、音響化学効果の薬物濃度依存性を評価した。結果を図5に示す。LP2000(実施例1)、LP5000(実施例2)ともに、100μMおよび10μMにおいても、コントロールと比較して有意な生存率の低下が認められた。この結果から、LP2000(実施例1)とLP5000(実施例2)は、低濃度においても十分な音響化学的効果を有することが示された。
【0063】
(電子顕微鏡による腫瘍細胞の観察)
走査型電子顕微鏡(JSM−520、日本電子社製)を用いた腫瘍細胞の観察を行った。図6(A)は、コントロールにおける超音波照射前の腫瘍細胞の写真である。細胞の大きさはほぼ一定で丸く、表面には微絨毛が見られた。図6(C)は、コントロールに対して2.0Wで30秒間超音波を照射した後の写真である。形がやや不規則で、微絨毛が消失した細胞が見られた。図6(B)は、LP2000(実施例1)の混合溶液中の超音波照射前の細胞の写真である。コントロールとほぼ同様の形状が観察され、LP2000を混合したのみでは、腫瘍細胞に影響を与えないことが分かった。
【0064】
図6(D)は、LP2000(実施例1)の存在下で、同様の条件にて超音波を照射した後の写真である。ほとんどの細胞は形が不規則で、微絨毛は消失し、縮小して固まっていた。この結果より、超音波のみを照射した場合(コントロール)に比べて、音響感受性物質(LP2000)存在下で、超音波を照射した場合は、音響化学的効果により、腫瘍細胞に大きなダメージを与えることができることが示された。
【0065】
以上、現時点において、もっとも、実践的であり、かつ、好ましいと思われる実施形態に関連して本発明を説明したが、本発明は、本願明細書中に開示された実施形態に限定されるものではなく、請求の範囲および明細書全体から読み取れる発明の要旨或いは思想に反しない範囲で適宜変更可能であり、そのような変更を伴うニューキノロン剤誘導体もまた本発明の技術的範囲に包含されるものとして理解されなければならない。
【特許請求の範囲】
【請求項1】
ニューキノロン剤のカルボキシル基が、高分子化合物と結合してなる、ニューキノロン剤誘導体。
【請求項2】
高分子化合物の分子量が、1000以上15000以下である、請求項1に記載のニューキノロン剤誘導体。
【請求項3】
前記高分子化合物が、ポリエチレングリコールである、請求項1または2に記載のニューキノロン剤誘導体。
【請求項4】
前記ポリエチレングリコールが、末端にアミノ基を有するメトキシポリエチレングリコールである、請求項3に記載のニューキノロン剤誘導体。
【請求項5】
ニューキノロン剤のアミノ基が、保護基で保護されている、請求項1〜4のいずれかに記載のニューキノロン剤誘導体。
【請求項6】
前記ニューキノロン剤が、ロメフロキサシン、ガチフロキサシン、スパルフロキサシンからなる群から選ばれる一種である、請求項1〜5のいずれかの記載のニューキノロン剤誘導体。
【請求項7】
前記ニューキノロン剤が、ロメフロキサシンである、請求項1〜5のいずれかの記載のニューキノロン剤誘導体。
【請求項8】
下記式(1)の構造を備えてなる、ニューキノロン剤誘導体。
【化1】

(式(1)中、Rは、アセチル基、tert−ブトキシカルボニル基、ベンジルオキシカルボニル基から選ばれる保護基である。nは、20〜340の整数である。)
【請求項9】
前記保護基がアセチル基である、請求項8に記載のニューキノロン剤誘導体。
【請求項10】
請求項1〜9のいずれかに記載のニューキノロン剤誘導体を含有してなる、超音波治療用薬剤。
【請求項11】
請求項10の超音波治療用薬剤を患者に投与する工程、腫瘍部に超音波を照射する工程を備えてなる、腫瘍の治療方法。
【請求項1】
ニューキノロン剤のカルボキシル基が、高分子化合物と結合してなる、ニューキノロン剤誘導体。
【請求項2】
高分子化合物の分子量が、1000以上15000以下である、請求項1に記載のニューキノロン剤誘導体。
【請求項3】
前記高分子化合物が、ポリエチレングリコールである、請求項1または2に記載のニューキノロン剤誘導体。
【請求項4】
前記ポリエチレングリコールが、末端にアミノ基を有するメトキシポリエチレングリコールである、請求項3に記載のニューキノロン剤誘導体。
【請求項5】
ニューキノロン剤のアミノ基が、保護基で保護されている、請求項1〜4のいずれかに記載のニューキノロン剤誘導体。
【請求項6】
前記ニューキノロン剤が、ロメフロキサシン、ガチフロキサシン、スパルフロキサシンからなる群から選ばれる一種である、請求項1〜5のいずれかの記載のニューキノロン剤誘導体。
【請求項7】
前記ニューキノロン剤が、ロメフロキサシンである、請求項1〜5のいずれかの記載のニューキノロン剤誘導体。
【請求項8】
下記式(1)の構造を備えてなる、ニューキノロン剤誘導体。
【化1】

(式(1)中、Rは、アセチル基、tert−ブトキシカルボニル基、ベンジルオキシカルボニル基から選ばれる保護基である。nは、20〜340の整数である。)
【請求項9】
前記保護基がアセチル基である、請求項8に記載のニューキノロン剤誘導体。
【請求項10】
請求項1〜9のいずれかに記載のニューキノロン剤誘導体を含有してなる、超音波治療用薬剤。
【請求項11】
請求項10の超音波治療用薬剤を患者に投与する工程、腫瘍部に超音波を照射する工程を備えてなる、腫瘍の治療方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−6344(P2011−6344A)
【公開日】平成23年1月13日(2011.1.13)
【国際特許分類】
【出願番号】特願2009−150303(P2009−150303)
【出願日】平成21年6月24日(2009.6.24)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成21年1月 International Institute of Anticancer Research発行の「ANTICANCER RESEARCH International Journal of Cancer Research and Treatment(Volume 29,Number 1)」に発表
【出願人】(504409543)国立大学法人秋田大学 (210)
【Fターム(参考)】
【公開日】平成23年1月13日(2011.1.13)
【国際特許分類】
【出願日】平成21年6月24日(2009.6.24)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成21年1月 International Institute of Anticancer Research発行の「ANTICANCER RESEARCH International Journal of Cancer Research and Treatment(Volume 29,Number 1)」に発表
【出願人】(504409543)国立大学法人秋田大学 (210)
【Fターム(参考)】
[ Back to top ]

