ネコブセンチュウpos−1遺伝子、及びその遺伝子発現抑制によるネコブセンチュウ防除方法
【課題】ネコブセンチュウの細胞極性を制御し、ネコブセンチュウの防除方法を提供することを目的とする。
【解決手段】ネコブセンチュウの細胞極性に関わるPOS−1タンパク質を見つけ出し、該タンパク質をコードする遺伝子の発現をRNAiにより抑制することによって、ネコブセンチュウの増殖を阻害する。
【解決手段】ネコブセンチュウの細胞極性に関わるPOS−1タンパク質を見つけ出し、該タンパク質をコードする遺伝子の発現をRNAiにより抑制することによって、ネコブセンチュウの増殖を阻害する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ネコブセンチュウの増殖に必須のpos−1遺伝子に関するものである。さらに、本発明は、ネコブセンチュウpos−1遺伝子の発現を抑制するRNA、ネコブセンチュウpos−1遺伝子の発現を抑制するRNAiプラスミド(以下、RNAiプラスミドという)、RNAiプラスミドを導入したネコブセンチュウ抵抗性植物、及びネコブセンチュウの防除方法に関するものである。
【背景技術】
【0002】
世界的な線虫による農作物の被害は、約8兆円ともいわれ、このうちネコブセンチュウ(Meloidogyne spp.)による被害は、約半分を占め、経済的に最も大きな損失をもたらす。ネコブセンチュウは約80種が知られているが、ネコブセンチュウ害のうち95%はサツマイモネコブセンチュウ(Meloidogyne incognita)、アレナリアネコブセンチュウ(M. arenaria)、キタネコブセンチュウ(M. hapla)、ジャワネコブセンチュウ(M. javanica)の4種によるもので、さらにこれらの被害の90%以上はサツマイモネコブセンチュウによるものと推定されている(非特許文献1)。
【0003】
それぞれの種が広い寄生範囲をもつが、例えば、サツマイモネコブセンチュウの寄生植物は700種以上にもおよび、国内で被害となる作物はきわめて多く、キュウリ、トマト、ニンジン、メロン、サツマイモは普遍的に被害を受ける作物である。また、被害は鳥取県の県特産品であるスイカ・白ネギの栽培にも見受けられ、防除法の確立が切実に望まれている。
【0004】
ネコブセンチュウは、土壌中に生息し、植物の根に寄生して根にコブを作り、養分を吸収しながら繁殖する寄生種である。メスの成虫は、あちこちの根の表面付近にゼリー状の大きな塊を尾端から出し、その中に産卵する(図1)。卵から孵化した幼虫は、土の中を移動し新しい根の組織内に侵入する。そして侵入したセンチュウの排泄する刺激物質により、寄生された植物の根の細胞が異常分裂を起こし、コブが形成される。寄生された植物は、このコブが形成されることによって根の組織が破壊され、水分や養分の吸収が悪くなり、寄生植物の種類や栽培法などによって被害状況は異なるものの、草丈の短小、葉色の減退・しおれ、枯れ上がりといった症状を示し、成長が遅くなったり、収穫量が減少したりする(図2)。
【0005】
さらにまた、ネコブセンチュウの被害は、複合病害が大きいという問題も含んでいる。例えば、ネコブセンチュウとフザリウム菌との関連事例は多数報告されており、これは線虫が病原の媒介役を担うだけでなく、線虫寄生組織が病原体の誘引、侵入、感染、発育、及び発病を促進し、線虫または病原体が単体で働く場合よりはるかに被害が激化する。
【0006】
現在、ネコブセンチュウの防除法としては、表1に示したように、土壌燻蒸剤を利用する防除法、非土壌燻蒸剤を投与する防除法、対抗植物を利用する防除法、及び緑肥作物等の有機物の施用による防除法などがある(非特許文献2)。
【表1】

【0007】
現在最も有効と考えられている防除法は、クロルピクリンなどの土壌燻蒸剤を利用する方法である。また、ネマトリンなど非土壌燻蒸剤を投与する防除法は、他の土壌微生物に影響がない点で優れている。
この他、栽培することによって積極的に線虫密度を減らす働きのある「対抗作物」を利用した防除方法もある。マリーゴールドなどの対抗植物は、一般的に殺線虫性の物質を含み、または分泌して根辺や植物組織内の線虫の発育を阻害したり死亡させる作用を持つ。土壌線虫は連作障害の主原因と考えられており、対抗作物を輪作したり、畑周辺に植えることで、有害線虫の密度を抑制することができる。
【0008】
現在のところ、土壌中のセンチュウ密度が高い場合は主に土壌燻蒸剤を使用し、密度が下がった時に非土壌燻蒸剤で抑えるという方法や、対抗植物等を併用するのが効果的と考えられている。
【0009】
その他、ネコブセンチュウに抵抗性を持った作物の育種も進められており、イチゴ、ラッカセイは線虫抵抗性の品種があり、輪作でも線虫害の軽減が期待できるといわれている。また、わが国ではサツマイモやトマトなどで試験研究が行われ、特にトマトでは一種の野生トマトの抵抗性因子(Mi因子)を導入して、既に幾つかの優れた経済品種が育成され実用に供されている(非特許文献3)。
【0010】
また、ネコブセンチュウ抵抗性作物から耐性遺伝子を単離して、これを導入する遺伝子組換え作物の研究もされている。例えば、特許文献1、及び特許文献2ではネコブセンチュウに耐性を示すMi耐性遺伝子を導入した作物について、また特許文献3でもネコブセンチュウ抵抗性遺伝子を導入した作物について記載されている。
さらにまた、特許文献4では、線虫の食道腺細胞ポリペプチドの合成を阻害する遺伝子組換え作物に関して記載されている。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特表2001−500006号公報
【特許文献2】特開2005−237380号公報
【特許文献3】再表03/080838号公報
【特許文献4】特表2008−515458号公報
【非特許文献】
【0012】
【非特許文献1】線虫の生物学 石橋信義
【非特許文献2】農林水産研究文献解題No.24
【非特許文献3】農林水産研究文献解題No.7
【発明の概要】
【発明が解決しようとする課題】
【0013】
しかしながら、土壌燻蒸剤を利用する防除法は、ネコブセンチュウに対して優れた効果を示す一方、眼、のど、鼻を刺激するなどの催涙性の刺激を有し、環境汚染・労働衛生上の観点から世界的に使用を削減・中止する方向に向かっている。また、拮抗する有益生物も減少させることから、農薬施用以前よりも病害虫が増加するという報告もある。
さらに、非土壌燻蒸剤を投与する防除法は、土壌燻蒸剤に比べ防除効果が弱く、また、対抗植物による防除効果も弱く不安定であり、緑肥作物等の有機物の施用による防除法も、効果は小さい。
【0014】
また、抵抗性品種においても、たとえばラッカセイは、サツマイモネコブセンチュウに対して抵抗性を示しても、キタネコブセンチュウに対して抵抗性がないとの報告や、またトマトのネコブセンチュウ抵抗性の品種は、サツマイモネコブセンチュウやジャワネコブセンチュウにのみ有効で、キタネコブセンチュウには全く無効である(前田速雄:Meloidogyne属3種のネコブセンチュウに対するトマト品種の抵抗性 関東病虫研報 13132−133(1966))との報告がある。
さらにまた、Mi遺伝子は高温条件下では抵抗性が破られやすいとの報告(岡本好一・三井康:トマト抵抗性品種に寄生するサツマイモネコブセンチュウ 日線虫研誌,4,32−36(1971))や、抵抗性品種であっても連作をつづけることによって、その抵抗性を打破して寄生できる個体群が出現するとの報告(農林水産研究情報 平成10年 農業研究センター・病害虫防除部・線虫害研究室「抵抗性トマトを加害するネコブセンチュウ系統の出現要因」)もあり、ネコブセンチュウの有効な防除法とはいえない。
【0015】
さらにまた、ネコブセンチュウ抵抗性遺伝子を導入した遺伝子組換え作物は、対象となる作物や害虫ごとに有効な害虫抵抗性遺伝子組換え作物を作製するのは、経済的、作業的負担が非常に大きく、さらに遺伝子組換え作物を嫌う風潮から、特に日本では、現実的に商品化が難しいという問題がある。また、特許文献4に記載される食道腺細胞分泌ポリペプチドは、植物の根の細胞壁を消化する酵素であるが、この酵素に対応するRNA干渉(以下、RNAiという)の効果は、線虫がいったん根に侵入しなければ起こらないものであり、RNAiの効果が疑問視される。
【0016】
そこで、本発明において解決しようとする課題は、土壌燻蒸等に代わる、低コスト・軽労力ならびに安全かつ環境にやさしい持続的栽培が実現できる斬新かつ有効なネコブセンチュウの種特異的な防除法を開発することである。
【課題を解決するための手段】
【0017】
発明者は、ネコブセンチュウの増殖に必須のpos−1遺伝子を発見し、RNAiにより特異的にネコブセンチュウpos−1遺伝子の発現を抑制し、ネコブセンチュウの増殖を阻害する方法を開発した。
さらに、RNAiによりネコブセンチュウpos−1遺伝子の発現が特異的に抑制されるようRNAiプラスミドが導入された遺伝子組換え作物にネコブセンチュウの幼虫を誘引し、この遺伝子組換え植物の根から侵入させ、幼虫が根の組織を摂食することによって幼虫の体内に二本鎖RNAが取り込まれ、この結果、幼虫の子孫の胚を死滅させるという新たな駆除法を開発した。
【0018】
本発明は、特に、ネコブセンチュウの好む植物を「トラップ植物」として利用する防除方法に特徴を有する。すなわち、ネコブセンチュウの好む植物を、RNAiによりネコブセンチュウpos−1遺伝子の発現が特異的に抑制するよう作製された遺伝子組換え作物として用いて、ネコブセンチュウを故意に遺伝子組換え作物に侵入させるものである。侵入した線虫はRNAi効果により不稔となる。このように「トラップ植物」自体は食用ではなく、「植物農薬」としての働きをする。
また、食用でないことから花芽も花粉も果実も全く必要としないので、花粉の飛散を避けるため、花芽を摘み取る、若しくは遺伝子操作にて花芽を形成させないなどの処理が可能であり、バイオハザードの観点からも問題がない。
【0019】
すなわち、本発明によれば、ネコブセンチュウPOS−1タンパク質又はその変異体をコードする遺伝子であって、(a)配列番号1で表される塩基配列(b)配列番号1で表される塩基配列の1若しくは数個の塩基が欠失・置換若しくは付加された塩基配列(c)配列番号1で表される塩基配列からなるDNA分子に対して相補的な塩基配列からなるDNA分子とストリンジェントな条件下でハイブリダイズする塩基配列のいずれかの塩基配列からなる遺伝子が提供される。本発明にかかる上記塩基配列からなる遺伝子は、ネコブセンチュウのPOS−1タンパク質をコードすることから、この遺伝子の発現を抑制すると、ネコブセンチュウPOS−1タンパク質の発現を制御することが出来る。
【0020】
また、本発明によればネコブセンチュウPOS−1タンパク質又はその変異体をコードする遺伝子の転写産物であって、(d)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列(e)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列の1若しくは数個の塩基が欠失・置換若しくは付加された塩基配列(f)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列からなるRNA分子に対して相補的な塩基配列からなるRNA分子とストリンジェントな条件下でハイブリダイズする塩基配列のいずれかの塩基配列からなるRNAが提供される。
【0021】
また、本発明によれば上記のネコブセンチュウpos−1RNAと、前記ネコブセンチュウpos−1RNAと相補的な塩基配列を含むRNAと、を含む二本鎖のRNAが提供される。
【0022】
また、本発明によれば上記の二本鎖RNAであって、ネコブセンチュウPOS−1タンパク質の発現量を低減させるためのRNAi分子として作用し得る二本鎖RNAが提供される。この二本鎖RNAは、上記のネコブセンチュウpos−1遺伝子の転写産物にRNAi分子として作用し、該遺伝子の発現、すなわち転写又は翻訳を阻害する。前記pos−1遺伝子の転写又は翻訳を阻害すると、ネコブセンチュウPOS−1タンパク質の発現が抑制される。該タンパク質の発現を抑制すれば、ネコブセンチュウの細胞極性が制御される。
【0023】
また、本発明によれば上記のネコブセンチュウpos−1遺伝子をベクターに連結して発現可能に構成されているネコブセンチュウpos−1遺伝子発現ベクター(RNAiプラスミド)が提供される。このRNAiプラスミドは、ネコブセンチュウpos−1遺伝子が発現するように構成されており、このベクターが植物に導入されると、植物細胞内でネコブセンチュウpos−1遺伝子の転写産物の発現が抑制され、ネコブセンチュウPOS−1タンパク質の発現が制御される。
【0024】
また、本発明によればネコブセンチュウに抵抗性を示す植物を生産する方法であって、上記RNAiプラスミドを用いて生産されるネコブセンチュウ抵抗性植物の製造方法が提供される。
【0025】
また、本発明によれば上記の方法によって生産されたネコブセンチュウ抵抗性植物が提供される。このネコブセンチュウ抵抗性植物は、上記RNAiプラスミドが導入された植物であり、ネコブセンチュウpos−1遺伝子の発現を制御する二本鎖RNAが細胞内で合成される。このRNAi作用により、ネコブセンチュウのPOS−1タンパク質の合成が制御される。よってこの構成により、ネコブセンチュウに対する抵抗性を示す植物を作製することができる。
【0026】
また、本発明によれば上記のネコブセンチュウ抵抗性植物をトラップ植物として利用する工程を含む、ネコブセンチュウの防除方法が提供される。このネコブセンチュウ抵抗性植物はネコブセンチュウに抵抗性を示すことから、トラップ植物として他の作物といっしょに栽培することで、この植物にネコブセンチュウを積極的に寄生させ、土壌中のネコブセンチュウの数を減らすことができ、他の作物の被害を抑えることができる。
【発明の効果】
【0027】
本発明によれば、本発明にかかるネコブセンチュウPOS−1タンパク質は、ネコブセンチュウの増殖に必須の細胞極性に寄与するタンパク質であるため、このタンパク質の発現を制御した組換え植物による防除方法は、有益な他の土壌線虫に影響を与えることなく、種特異的にネコブセンチュウの増殖を阻害することができ、大幅に農薬を減らすことが可能となり、低コスト・軽労働ならびに安全かつ環境にやさしい。
また、本発明にかかる組換え植物は「トラップ植物」として利用するため、多くの作物の栽培に利用でき、商品作物栽培中でも裁植が可能であり、花芽を摘み取るなどによりバイオハザードの面でも安心である。
【図面の簡単な説明】
【0028】
【図1】図1はサツマイモネコブセンチュウを示す図である。
【図2】図2はサツマイモネコブセンチュウによる被害を示した図である。矢印で示した部分は、寄生したサツマイモネコブセンチュウによって肥大した根である。
【図3】図3はRNAi作用の説明図である。
【図4】図4はC.elegans POS−1とM.incognita POS−1のアミノ酸配列を比較した図である。
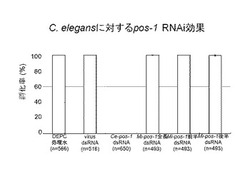
【図5】図5はC.elegansに対するネコブセンチュウpos−1 RNAi効果を示した図である。
【図6】図6はネコブセンチュウに対するC.elegans pos−1 RNAi効果を示した図である。
【図7】図7はネコブセンチュウに対するネコブセンチュウpos−1 RNAi効果を示した図である。
【発明を実施するための形態】
【0029】
<POS−1タンパク質の説明>
本実施の形態は、ネコブセンチュウの増殖に必須のPOS−1タンパク質に関する。また、本実施の形態では、POS−1タンパク質の発現を制御することで、ネコブセンチュの増殖を阻害するものである。
【0030】
C.elegans(Caenorhabditis elegans)では、POS−1(Posterior Segregation)タンパク質は、受精卵が第一分裂を行なう際に後方側(posterior)に分配され、細胞の極性(前後軸形成)に寄与することが知られている。ここで受精卵の後方とは、精子の侵入点であり、精子の侵入が引き金となって前後軸が決定されるといわれている。また、第一分裂は非対称的な不等分裂で、後方の小さい細胞が生殖系列細胞となる。
また、C.elegansでは、胚発生初期に必要な遺伝子発現はほとんど母親(卵子)由来であることがわかっており、POS−1タンパク質の主要な機能は、生殖細胞系列(P細胞系列)に分配蓄積されるapx−1(anterior pharynx excess)遺伝子などの母性mRNAの翻訳制御だといわれている(Tabara H et al.,1999,Ogura K et al.,2003)。すなわち、POS−1タンパク質は標的mRNAと結合することにより、翻訳を阻害すると考えられているが、詳細は分かっていない。
しかしながら胚発生は、細胞分裂を繰り返す細胞分裂期、細胞が分化する形態形成期を経て、孵化へと至ることから、細胞の極性に寄与するPOS−1タンパク質は卵の成熟に必須なタンパク質であり、これが欠損すると胚発生が停止し、重篤な胚性致死が誘起され、卵から幼虫に孵化することができない。
【0031】
これに対して、これまでネコブセンチュウのPOS−1タンパク質については知られておらず、以下で詳細に説明するが、本実施の形態では、初めてネコブセンチュウPOS−1タンパク質の同定に成功し、次いで遺伝子配列の決定に成功したものである。
さらに、本実施の形態では、RNAiによるネコブセンチュウpos−1遺伝子の発現を抑制することで、ネコブセンチュウPOS−1タンパク質の制御に成功し、新たなネコブセンチュウの駆除法を開発したものである。
【0032】
<ネコブセンチュウPOS−1タンパク質及び遺伝子発見の経緯>
図4に示すように、本発明では、C.elegansのPOS−1タンパク質のアミノ酸配列を基に、ネコブセンチュウのデータベース(NemaBase EST)に存在するcDNA配列より推定されるアミノ酸配列を検索し、相同タンパク質を調査した。EST(expressed sequence tag)とは、ある組織において発現しているタンパク質のmRNA配列に由来するcDNA配列を部分的に決定したものをいい、イントロンが除去されたcDNA配列であるという特徴をもつ。検討を重ねた結果、アミノ酸配列の相同性は20%と低いものの、多数の候補の中から配列番号5で表されるタンパク質に注目した。
【0033】
このタンパク質は、図4に示されるように、C.elegansのPOS−1タンパク質のアミノ酸配列との相同性は20%程度と低いものであるが、C−X8−C−X5−C−X3−Hで表される、RNA結合モチーフといわれるジンクフィンガーモチーフを2箇所有していた。このジンクフィンガーモチーフは、C.elegansのPOS−1タンパク質にも含まれており、POS−1タンパク質に共通して保存されていることが分かった。
【0034】
次に上記C.elegansのPOS−1タンパク質と相同性を示すタンパク質をコードするM.incognita cDNAの塩基配列を基にRACE(rapid amplification of cDNA ends)法を行った。
【0035】
<用語の説明>
本明細書において、各種用語の意味は、下記の通り定義するものとする。
【0036】
(1)線虫
線虫は非常に多様性に富み、1億種を超えるともいわれ、地中生活種、淡水生活種、海水生活種、寄生種などがあり、このうち寄生種は約8万種といわれている。
線虫の一種であるC.elegansは、後生動物でありながら体が小さく、細胞数が少なく、しかも培養がたやすいこと等からモデル生物として確立された。自由生活性で、実験室では寒天培地上に生やした大腸菌を餌として飼育される。1998年に多細胞生物として初めて 97Mb の塩基配列読み取りが完了し、6本の染色体上に約 190000 個の遺伝子の存在が予測され、受精卵から成虫に至る全細胞の発生、分化の過程が細胞系譜として明らかになっている。
またRNAiについて最初に報告されたのも、線虫を用いた研究である(A.Fire,S.Xu,M.K.Montgomery,S.A.Kostas,S.E.Driver,C.C.Mello,Nature,391,806(1998)。
【0037】
(2)ネコブセンチュウ
これに対してネコブセンチュウ(Meloidogyne spp.)(図1)は、寄生種である。詳細は前述したが、本発明においてネコブセンチュウとは、例えば、キタネコブセンチュウ、サツマイモネコプセンチュウ、ジャワネコブセンチュウ、及びアレナリアネコブセンチュウなどが挙げられるが、これに限定されない。
【0038】
(3)RACE法
RACE法は、得られたcDNAの情報を基にさらに上流や下流をクローニングする方法で、標的mRNAを鋳型として逆転写反応を行ない、得られたcDNAを基にPCRにより全長cDNAを合成することが出来る(Frohman,M.A.,Dush,M.K.,Martin,G.R.(1988)Proc.Natl.Acad.Sci.USA.,85,8998−9002)。未知領域がmRNAの上流(5’側)にある場合を5’RACE、下流(3’側)にある場合を3’RACEという。
【0039】
3’RACEは、5’末端にアダプター配列の付いたオリゴ(dT)をプライマーにして逆転写反応を行いcDNA(第1鎖)を合成する。できた第1鎖cDNAはすべてアダプター配列が末端に付いた構造をしている。このためクローニングを目的とするcDNAは、未知領域が既知配列とアダプター配列に挟まれた形になる。そこで、既知配列の一部をセンスプライマー(GSP1)としてアダプタープライマーとPCRを行うことによって、両者に挟まれた未知領域を増幅することが可能になる。しかしこの第1段階のPCRでは、用いた二つのプライマーのうち、一方のアダプタープライマーは逆転写反応によって生成された全cDNAに共通に含まれる配列であり、PCRの特異性はGSP1のみに依存している。したがってこの段階で得られる生成物は、非特異的バックグラウンドが極めて多い。そこで、バックグラウンドを軽減する手段としてnested PCRを行う。GSP1の下流の既知領域に、同じく目的のDNAに特異的なセンスプライマーのGSP2をデザインし、GSP2とアダプタープライマーでnested PCRを行いシークエンスして確認する。
【0040】
5’RACEは、上流の未知領域を得るために、既知配列を基に遺伝子特異的なアンチセンスプライマー(GSP1)を合成し、GSP1をプライマーとした逆転写反応を行う。その後、cDNAと2本鎖を作っているmRNAをRNaseHで分解すると、1本鎖のcDNA(第1鎖)が得られる。このDNAは5’末端にGSP1の配列を持ち、3’末端が未知の配列で終わっている。この未知配列をPCRで増幅するには第1鎖cDNAの3’末端にアンカー配列を付加する必要があるので、ターミナルデオキシヌクレオチジルトランスフェラーゼ(TdT)でヌクレオチドホモポリマーをアンカー配列として付加する。アンカー配列を付加した後で、アンカー配列に相補的なヌクレオチドポリマーを3’末端にもつアダプタープライマーと遺伝子特異的なアンチセンスプライマー(GSP2)を用いてnested PCRを行えば、5’上流の未知領域を含むcDNAが増幅される。
【0041】
(4)遺伝子発現
遺伝子発現とは、遺伝子の情報が細胞における構造および機能に変換される過程をいう。具体的には、遺伝情報に基づいてタンパク質が合成されること、又はmRNAの合成をいう。
【0042】
(5)ハイブリダイズ
ハイブリダイズするとは、あるヌクレオチドに対し、別のヌクレオチドが水素結合等を介し、相補的に結合し、比較対照とすべきヌクレオチドには同条件では結合しない状態をいう。必ずしも、他の全てのヌクレオチドに対して特異的である必要は無く、使用目的に応じた特異性を有していればよい。ハイブリダイズの条件は、そのヌクレオチドの使用目的に応じて選択することができる。例えば、PCRに用いるプライマーとしてのヌクレオチドであれば、PCRでのアニーリング時の条件でハイブリダイズするように選択される。
【0043】
(6)ストリンジェントな条件
ストリンジェントな条件とは、ハイブリダイゼイション中にホルムアミド等の変性剤を含む条件、例えば、42℃において50%(v/v)ホルムアミドと0.1%ウシ血清アルブミン/0.1%フィコール/0.1%のポリビニルピロリドン/50mMのpH6.5のリン酸ナトリウムバッファー、及び750mMの塩化ナトリウム、75mMクエン酸ナトリウムを用いるものや、その適宜改変したものが挙げられるが、これに限られない。
【0044】
(7)核酸増幅法
核酸増幅法としては、標的の核酸を増幅させる方法として公知のものならば、何れの方法を用いてもよいが、プライマー及びプライマーセットを用いる方法として、例えば、PCR法、LAMP法あるいは他の核酸の協奏的核酸増幅方法が用いられる。特にRNAを増幅する際には、逆転写酵素によってRNAを鋳型としてcDNAを合成し、それと同時或いはそれに引き続いて、耐熱性DNAポリメラーゼによって標的RNA由来の核酸産物を増幅させるRT−PCR法(Kinetic RT−PCR法など)、RT−LAMP法あるいは他の核酸の協奏的RNA増幅方法が用いられる。
【0045】
更に、RNA増幅法としては、一定温度でRNAのみを増幅する方法として、上記のLAMP法に加え、NASBA法、TMA法、3SR法等を用いることもできる。これらの方法の概略は、標的となるRNAに対してプロモーター配列を含むプライマー、逆転写酵素、および必要に応じてリボヌクレアーゼH(RNaseH)により、プロモーター配列を含む2本鎖DNAを合成し、この2本鎖DNAを鋳型としRNAポリメラーゼによって標的RNA由来の特定核酸配列を含むRNAを生産し、このRNAが引き続きプロモーター配列を含む2本鎖DNA合成の鋳型となる連鎖反応を行うというものである。
【0046】
更に、他の核酸増幅法として、ICAN法を用いることもできる。これらの方法の概略は、標的となるRNAに対して、逆転写酵素によってRNAを鋳型としてcDNAを合成し、それと同時或いはそれに引き続いて、RNA−DNAからなるキメラプライマー、転写酵素により、RNAを含む2本鎖DNAを合成し、その2本鎖DNAにリボヌクレアーゼH(RNaseH)が切れ目を入れることで、標的RNA由来の特定核酸配列を含むDNAを生産する鎖置換連鎖反応を行うというものである。
【0047】
(8)相同性
相同性とは、配列を整列させ、最大のパーセント配列同一性を得るために必要な場合は間隙を導入した上で、目的の塩基と同一である候補配列中の核酸塩基数のパーセントとして定義される。この際に、同一の塩基(チミンとウラシンも同一とみなす)を有するDNAとRNAとは結合特性が非常に近いため、同一の核酸塩基として定義される。相同性を決定する目的のためのアラインメントは、当業者の技量の範囲にある種々の方法、例えば、NCBI(National Center for Biotechnology Information)の提供するblast、blast2seq又はALIGNのような公に入手可能なコンピュータソフトウエアを使用することにより達成可能であるが、blast2seqにおいて標準的な初期パラメーターを用いて計算された値を用いることもできる。
【0048】
(9)相補性
相補性とは、核酸増幅反応条件(塩濃度、オリゴヌクレオチド濃度等の試薬組成および温度)において、所定のDNAまたはRNAおよびそれと完全に相同な核酸に対して、高効率にハイブリダイゼイション可能であることを意味する。
【0049】
以下、本発明の実施の形態について、説明する。
【0050】
<RNAi>
本実施の形態は、ネコブセンチュウpos−1RNAと、前記ネコブセンチュウpos−1RNAと相補的な塩基配列を含むRNAと、を含む二本鎖RNAであって、ネコブセンチュウPOS−1タンパク質の発現を低減させるためのRNAi分子として作用し得る二本鎖RNAである。後述の実施例に示すように、本実施形態における前記二本鎖RNAは、ネコブセンチュウPOS−1タンパク質又はその変異体をコードする遺伝子の転写産物であって、(d)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列(e)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列の1若しくは数個の塩基が欠失・置換若しくは付加された塩基配列(f)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列からなるRNA分子に対して相補的な塩基配列からなるRNA分子とストリンジェントな条件下でハイブリダイズする塩基配列のいずれかの塩基配列からなるRNAと、前記ネコブセンチュウpos−1RNAと相補的な塩基配列を含むRNAと、を含む二本鎖RNAであるので、RNAi作用によりネコブセンチュウpos−1遺伝子の転写または翻訳を阻害するため、ネコブセンチュウPOS−1タンパク質の合成が制御され、ネコブセンチュウの増殖が阻害される。
【0051】
RNAi(RNA interference:RNAi)とは、二本鎖RNA(double−stranded RNA:dsRNA)が引き金となり、そのアンチセンス鎖と相補的な配列を持つmRNAが切断される機構である。本実施形態においてRNAiは、転写後の遺伝子発現の抑制として知られる転写後遺伝子サイレンシング(post−transcriptional gene silencing:PTGS)でもよく、遺伝子からmRNAへの転写そのものを抑制する転写時サイレンシングでもよい。
前者は、外から細胞内に導入されたdsRNAによって、配列特異的に標的mRNAが分解され、結果として標的遺伝子の発現が抑制されるという現象である。図3に示したように、細胞内に取り込まれたdsRNAは、細胞内に導入されると、Dicerと呼ばれるリボヌクレアーゼによって2塩基の3’突出末端をもった21〜23塩基程度の短いdsRNA(small interfering RNA:siRNA)に切断される。このsiRNAは、RISC(RNA−induced silencing complex)と呼ばれるタンパク質複合体に取り込まれ、配列特異的に標的RNAを切断する際のガイド配列として働く。
後者は、遺伝子のプロモーター領域でDNAのメチル化の誘発を介した遺伝子発現抑制システムである。
【0052】
線虫にRNAiを起こすためのdsRNAを導入する方法は、顕微注入法、浸漬法及び摂食法などである。顕微注入法はRNAを線虫体内に注射する方法で、特別な装置及び技術を必要とし、煩雑かつコスト高である。浸漬法は、線虫類をRNA溶液に漬すだけで極めて簡便な方法である。摂食法は、線虫類が2本鎖RNAを合成する組換え微生物を摂取することによりRNAiを誘導する方法である。
本実施の形態においては、上記いずれの方法を用いても良いが、適宜目的に合った方法を選択できる。
【0053】
<ネコブセンチュウpos−1遺伝子発現プラスミド(RNAiプラスミド)>
本実施の形態は、ネコブセンチュウpos−1遺伝子をベクターに連結して発現可能に構成されているRNAiプラスミドである。また、本実施の形態のRNAiプラスミドは、植物細胞に導入され二本鎖RNAを発現する。これを寄生したネコブセンチュウが摂食すると、ネコブセンチュウの体内に取り込まれ、ネコブセンチュウpos−1遺伝子の転写又は翻訳を阻害する。あるいは、上記二本鎖RNAは、ネコブセンチュウの体表から直接取り込まれ、ネコブセンチュウpos−1遺伝子の転写又は翻訳を阻害する。
【0054】
本実施の形態において、RNAi用ベクターに連結する遺伝子は、配列番号1で表される塩基配列、又は配列番号1で表される塩基配列の1若しくは数個の塩基が欠失・置換若しくは付加された塩基配列の全部又はその一部からなるDNAであって、作製されたRNAiプラスミドより産生される二本鎖RNAによりpos−1タンパク質の発現量を低減させるためのRNAi効果を有する遺伝子を用いることができる。また、このような遺伝子は、例えば対象となるRNA領域に対応するcDNAをRT−PCRにより増幅し、Tベクターにサブクローニングすることによって得られる。
一般に、RNAiプラスミドに連結する遺伝子は、発現抑制の対象となる遺伝子の開始コドンの下流50〜100bpを用いることが好ましく、5’および3’の非翻訳領域(UTR)は避けることが好ましい。
【0055】
植物形質転換に用いる組換えベクターは、上記の本実施形態の遺伝子を適当なベクターに導入することにより構築することができる。ここで、ベクターとしては、アグロバクテリウムを介して植物細胞に目的遺伝子を導入することができる、pBI系、pPZP系、pSMA系のベクターなどが好適に用いられるがこれらに限定されるものではない。バイナリーベクターとは大腸菌(Escherichia coli)およびアグロバクテリウムにおいて複製可能なシャトルベクターで、バイナリーベクターを保持するアグロバクテリムを植物細胞に感染させると、ベクター上にあるT−DNA領域と呼ばれているLB配列およびRB配列ではさまれた部分のDNAを植物の核DNAに組み込むことが可能である(EMBO Journal,10(3),697−704(1991))。また、カリフラワーモザイクウイルス(CaMV)、インゲンマメモザイクウイルス(BGMV)、タバコモザイクウイルス(TMV)等の植物ウイルスベクターも用いることができる。
【0056】
バイナリーベクター系プラスミドを用いる場合、上記のバイナリーベクターのT−DNA領域内に、目的遺伝子を含む遺伝子カセットを挿入し、この組換えベクターを大腸菌中で増幅する。次いで、増幅した組換えベクターをアグロバクテリウム・ツメファシエンスの菌株C58、LBA4404、EHA101、EHA105等に、凍結融解法、エレクトロポレーション法等用いて導入し、該アグロバクテリウムを植物細胞の形質転換に用いる。
【0057】
また、上記の方法以外にも、三者接合法(Nucleic Acids Research,12:8711(1984))によって、植物細胞形質転換用アグロバクテリウムを調製することができる。すなわち、目的遺伝子を含むプラスミドを保有する大腸菌、ヘルパープラスミド(例えば、pRK2013等)を保有する大腸菌、およびアグロバクテリウムを混合培養し、リファンピシリンおよびカナマイシンを含む培地上で培養することにより植物細胞形質転換用のアグロバクテリウムを得ることができる。
【0058】
ベクターに目的遺伝子を挿入するには、精製されたDNAを適当な制限酵素で消化し、適当なベクターDNAの制限酵素部位またはマルチクローニングサイトに挿入する方法などが採用される。詳しいベクターの作製方法は、Molecular Cloning:a Laboratory Manual:第2版、Sambrookら、1989,Cold Spring Harbor Laboratory Press.に記載されており、このような方法を用いて作製できる。
【0059】
また、組換えベクターには、目的遺伝子以外にプロモーター配列、エンハンサー配列、ターミネーター配列、ポリA付加シグナル、5’−UTR配列、選抜マーカー遺伝子、レポーター遺伝子、必要に応じて、アグロバクテリウム細菌中で増幅するための複製開始点などを配置することができる。
【0060】
本実施形態に用いられるベクターは、RNAiを引き起こす二本鎖RNA(dsRNA)を発現するベクターであって、RNAiを引き起こすdsRNAをヘアピン型として発現するベクターでもよく、タンデム型として発現するベクターでもよく、これに限定されるものではない。
ヘアピン型は、数塩基以上のリンカー(スペーサー)配列の両端にIR(inverted repeat:逆位反復)となるようにdsRNA形成部分に対応したDNA配列を配置し、植物体内で高発現するプロモーターによりヘアピン型dsRNAを転写し、細胞内でsiRNAを産生するシステムである。
タンデム型は、2つのプロモーターからセンスRNAとアンチセンスRNAが転写され、細胞内でハイブリダイズしてsiRNAを産生するシステムである。
【0061】
<形質転換>
形質転換とは、外因性のDNA配列(例えば、ベクター、組み換えDNA分子)を細胞またはプロトプラストに導入し、その細胞またはプロトプラストの遺伝的性質を変えることをいう。
本実施形態の形質転換植物は、上記の組換えベクターを用いて、対象植物を形質転換することによって作出することができる。形質転換植物を作出する際には、既に報告され、確立されている種々の方法を適宜利用することができ、その好ましい例として、アグロバクテリウム法、PEG−リン酸カルシウム法、エレクトロポレーション法、リポソーム法、パーティクルガン法、マイクロインジェクション法等が挙げられるが、アグロバクテリウム法が好ましい。アグロバクテリウム法を用いる場合は、プロトプラストを用いる場合、培養細胞を用いる場合、組織を用いる場合がある。
【0062】
本実施の形態では、宿主植物として、ネコブセンチュウの好む植物を用いることが好ましい。例えば、これに限定されないが、トマト、サツマイモ、ジャガイモ、キュウリ、ニンジン、スイカ、ネギなどの野菜、トウモロコシ、コムギなどの穀物、エンドウマメなどのマメ科の植物、および他の根、塊茎または種子作物、観賞用植物および針葉樹などである。
【0063】
本実施形態では、これに限定されないが、例えばトマトを用いることがより好ましい。ネコブセンチュウは、トマトに対する嗜好性が高いことから、この作出したネコブセンチュウpos−1遺伝子組換えトマトを他の作物などと一緒に植えておくと、ネコブセンチュウが該遺伝子組換えトマトの根へ積極的に誘導されることとなり、その結果、他の作物への被害が低減されるからである。
【0064】
また本実施の形態では、宿主細胞タイプは、例えば、胚形成組織、カルス組織I、IIおよびIII型、胚軸、成長点、根の組織、師部における発現のための組織における細胞などである
【0065】
<植物再生および繁殖>
本実施の形態では、形質転換後、植物は、当該分野で標準的であるように、例えば、単一の細胞、カルス組織、または葉片から再生され得る。ほとんどすべての植物は、その植物の細胞、組織および器官から全体として再生され得る。利用可能な技術は、Vasilら(1984)Cell Culture and Somatic Cell Genetics of Plants,第I、IIおよびIII巻、Laboratory Procedures and Their Applications(Academic press);およびWeissbachら(1989)Methods for Plant Molecular Biology,Academic Press,1989に概説される。
【0066】
懸濁培養の成長の間、小細胞凝集物(10〜100個の細胞)を、外見上より大きい細胞の塊から形成して、その培養物に分散した外見を与える。固体培地へのこれらの細胞をプレートする際、体細胞胚の発達が誘導され、そしてこれらの胚が成熟され、出芽され、そして繁殖力のある種子を保有する植物へと成長することができる。あるいは、固体培養培地上で成長しているカルス細胞は、体細胞胚を形成するように誘導され、それから繁殖性の種子保有植物が発達し得る。胚形成、再生および植物の繁殖性の特徴は、懸濁培養中で時間の関数として徐々に失われる。懸濁細胞の凍結保存によって、培養物の発育が停止され、そして凍結保存期間の間のこれらの特徴の喪失が妨げられる。
【0067】
次いで、形質転換された植物を成長させて、同じ形質転換された株または異なる株で受粉させてもよく、そして所望の表現性の特徴の発現を有する得られた系統が同定される。所望の表現性の特徴の発現が安定に維持されかつ遺伝されることを確実にするために2つ以上の世代を成長させて、次いで種子を回収して所望の表現性の特徴の発現が達成されていることを確認してもよい。
【0068】
<ネコブセンチュウpos−1遺伝子発現の抑制>
ネコブセンチュウpos−1遺伝子発現の抑制とは、ネコブセンチュウpos−1遺伝子からのタンパク質および/またはmRNAの生成のレベルの減少を意味する。本実施の形態では、抑制の結果は、例えば上記二本鎖RNAを導入したセンチュウの孵化率を調べることによって、または上記二本鎖RNAを導入したセンチュウを植物の根に寄生させた後、根の変化を調べることによって、RNAi効果を直接的に確認できる。また例えば、RNAiプラスミドで形質転換された遺伝子組換え作物にネコブセンチュウを寄生させた後、根の変化を調べることによって確認できる。
より詳細には、2本鎖RNA溶液にネコブセンチュウを漬けて2本鎖RNAを取り込ませた後、次世代のネコブセンチュウの孵化率によって、またはこのネコブセンチュウをトマトの根に感染させ、培養した根の形状を観察することによって、ネコブセンチュウpos−1遺伝子の発現の制御を確認することができる。さらには、ネコブセンチュウの嗜好性の強い作物であるトマトを上記の方法によってRNAiプラスミドで形質転換させ、この遺伝子組換えトマトにネコブセンチュウを寄生させ、生じたネコブを観察することによりネコブ被害指数を算出することができる。ネコブ被害指数は、例えば、以下の表2に基づいて算出することができる。
【表2】

このようなネコブセンチュウの増殖阻害効果は、ポット試験にて検証することができる。
【0069】
<圃場試験>
圃場試験においては、遺伝子組換え作物をフィールドに持ち出す場合、バイオハザードを懸念した制約(安全性の確保)がある。最大の問題は花粉の飛散であると考えられるが、本トラップ植物は根にネコブセンチュウを感染させることが重要であるから、花芽を剪定することにより花粉の飛散を回避できる。この段階では、密閉した圃場試験が可能な研究施設の利用が必要になる。
【0070】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【実施例1】
【0071】
(材料と方法)
(クローニング)
EST配列より取得した、ネコブセンチュウPOS−1タンパク質をコードするcDNA配列を基に、RACE(rapid amplification of cDNA ends)法により全長のcDNAを取得した。具体的には、以下の手順で行った。
(1)EST配列よりネコブセンチュウPOS−1タンパク質をコードするcDNA配列を取得した。このESTの配列は開始メチオニンに対応するAUGが含まれていたが、ストップコドンは含まれていなかったので、次に3’RACEを実施した。
【0072】
(2)3’RACE法
<mRNAの調整>
ネコブセンチュウをトマトに感染させ、大量にネコブを作らせた。このコブを切り出して滅菌水に漬け線虫を放出させ、ベルマン法(濾過)により線虫を分離した。次に、回収した線虫をポッター式ホモジナイザーを用いて破砕し、線虫破砕液を回収した。線虫破砕液から、フェノールとチオシアン酸グアニジンを含むISOGEN(ニッポンジーン社製 No.311−02501)を用いた液相分離法により全RNAを回収し、その後Poly(A)+RNA Isolation kit from Total RNA(ニッポンジーン社製 No.317−05641)を用いて、mRNAを調製した。
具体的には、試料にISOGENを加えて溶解またはホモジナイゼーションした後、クロロホルムを加えて遠心分離し、RNAが存在する水相を採取してイソプロパノールを加えて沈殿させmRNAを回収した。その後、Total RNAからPoly(A)+RNAを抽出するため、Poly(A)+RNAと反応性の高いOligotex−dT30<Super> を用いてPoly(A)+RNAを補足し、その後スピンカラムを用いて迅速に洗浄・溶出し、Poly(A)+RNAを得た。
【0073】
<cDNAの合成と増幅>
TaKaRa RNA PCR Kit(AMV)Ver.3.0(TaKaRa社製 No.RR019A)を用いて、逆転写反応による1st strand cDNA合成を行った後、これを鋳型としてPCRを行った。1回目のPCRではEST配列に基づいて設計したMi−pos1−FW1配列(配列番号6)プライマーとM13 Primer M4(配列番号8)を、その後のPCRではMi−pos1−FW2(配列番号7)プライマーとM13 Primer M4(配列番号8)を用いた。
Mi−pos1−FW1 5’−GCAACAAGTTGGATCCAATC−3’ (配列番号6)
Mi−pos1−FW2 5’−GGAAGGCTTTGCCATTATGC−3’ (配列番号7)
M13 Primer M4 5’−GTTTTCCCAGTCACGAC−3’(配列番号8)
逆転写反応は、42℃で60分の後、95℃で5 分、5℃で5 分で反応させた。また、その後のPCRは、94℃で30秒、55℃で 30秒、72℃ で1分を30サイクル反応させた。 遺伝子増幅装置は、AB社製のThermal Cycler2720を用いた。
【0074】
(3)クローニング
PCR産物をpGEM−Tを用いてTA クローニング(Promega社製 pGEM−T(Easy)Vector Systems)し、形質転換株よりプラスミドを調製し、塩基配列分析により全長のcDNA配列が得られたことを確認した。このcDNAを鋳型として、全長cDNA(配列番号1),前半cDNA(配列番号9),後半cDNA(配列番号10)の増幅を行い、同様にTA cloningを行った。
【実施例2】
【0075】
(二本鎖RNAの調整)
RNA溶液は以下のように調整した。
まず、RNAi用ベクターpPD129.36(cDNAを挿入するマルチクローニングサイトの両端にT7配列が付加したもの:+鎖、−鎖を鋳型とした転写が可能:米国スタンフォード大学Andrew Fire教授より分与)に、実施例1で作製したTAクローンの全長cDNA、前半cDNA、後半cDNAの各々のcDNAを組み込んだ。具体的には、 個々のTAクローンを制限酵素EcoRIで消化し、挿入されたcDNAを取り出し、RNAi用ベクターpPD129.36のEcoRI制限酵素切断部位に導入し、RNAiプラスミドとした。このベクターによる大腸菌の形質転換体を作製し、プラスミド調製を行った。次に、このプラスミドを鋳型としてT7プロモーター配列よりcDNAを増幅(PCR)し, 精製してRNA合成(転写反応)の鋳型とした。PCRの反応条件は、下記のプライマーを用いて、50マイクロリットルスケールで行った。鋳型となるプラスミド0.01ナノグラムを加え、94℃で 30秒、50℃で30秒、72℃ で1分を25サイクル反応させた。遺伝子増幅装置は、AB社製のThermal Cycler2720を用いた。
T7−PCR primer 5’−TAATACGACTCACTATAGGG−3’(配列番号11)
そして、MEG Ascript RNAi Kit(Ambion社 No.AM1626)を用いてAmbion社のプロトコールに従って、上記合成DNAを鋳型に、T7RNAポリメラーゼにより37℃で4時間反応させ、2本鎖RNAを調製した。
【実施例3】
【0076】
(RNAi 浸漬法)
100μlで100匹になるように調製したセンチュウ 1mlを、M9溶液ごと1.5ml Tubeに移した。13,000rpmで2分間遠心し、上澄みを捨てた後、5×Soaking Buffer(表3)2μl、10%resorcinol 1μl、dsRNA溶液 8μl(1μg/μl)加え、優しく混合した。室温で4時間soaking(振とう培養) した。
【表3】

【実施例4】
【0077】
(トマトへの感染)
上記のdsRNA溶液に浸したセンチュウにM9溶液を適量加え、子葉が6枚以上のトマトへ寄生させ、25.5℃に3ヵ月間、静置培養した。その後、丁寧に引き抜いてコブの形状により被害度を判断し、それによって増殖度を観察した。結果は、図6、及び7に示した。
【0078】
(結果)
図5は、実施例3の方法でC.elegansをpos−1遺伝子に対する二本鎖RNA溶液に浸し、その孵化率の結果を示した図である。図5中、コントロールとして、pos−1遺伝子に対する二本鎖RNA溶液の代わりに、DEPC処理水、及びC.elegansをpos−1遺伝子と全く相同性を示さないvirusの二本鎖RNA溶液を使用した。また、Ce−pos−1 dsRNAは、C.elegansのpos−1遺伝子に対する二本鎖RNA溶液を用いたことを示す。さらに、Mi−pos−1全長dsRNA、Mi−pos−1前半dsRNA、及びMi−pos−1後半dsRNAは、それぞれサツマイモネコブセンチュウの全長pos−1遺伝子(配列番号1)、前半pos−1遺伝子(配列番号9)、及び後半pos−1遺伝子(配列番号10)に対する二本鎖RNA溶液を用いたことを示す。また、nは、実験に用いた個体数を示す。
この結果、C.elegansに対しCe−pos−1 dsRNAを用いた場合のみ孵化率が0%で、サツマイモネコブセンチュウのいずれの二本鎖RNA溶液を用いた場合も100%の孵化率を示すという非常に顕著なものであった。すなわち、C.elegansに対しRNAi効果があったのはC.elegans由来の二本鎖RNAだけで、サツマイモネコブセンチュウ由来のdsRNAの影響は全くなく、このRNAi効果は顕著で種特異的であることが示唆された。
【0079】
図6、及び7は、上記の方法により作製されたネコブセンチュウに寄生されたトマトの根を示す。
図6は、上記同様コントロールとして、実施例3のdsRNA溶液の代わりにDEPC処理水に浸したサツマイモネコブセンチュウに、実施例4の方法でトマトの根に寄生させた後の被害の様子である。このネコブ指数は4か3であると認められた。また、C.elegansのpos−1遺伝子に対する二本鎖RNA溶液(Ce−pos−1)に浸したサツマイモネコブセンチュウに寄生されたトマトの根のネコブ指数も4か3であると認められた。
これらの結果から、Ce−pos−1溶液は、サツマイモネコブセンチュウに対して、ネコブ被害を抑える効果がないということがわかった。すなわち、サツマイモネコブセンチュウに対して、C.elegansのpos−1遺伝子に対する二本鎖RNAによるRNAi効果はなかったことが示唆された。
図7は、C.elegansのpos−1遺伝子に対する二本鎖RNA溶液(Ce−pos−1)と、サツマイモネコブセンチュウのpos−1遺伝子に対する二本鎖RNA溶液(Mi−pos−1)に浸したサツマイモネコブセンチュウに寄生されたトマトの根を示す。Ce−pos−1 二本鎖RNA溶液に浸したサツマイモネコブセンチュウに寄生されたトマトの根のネコブ指数は2から4であると認められた。一方、Mi−pos−1 二本鎖RNA溶液に浸したサツマイモネコブセンチュウに寄生されたトマトの根のネコブ指数は1か0であると認められた。
これらの結果から、サツマイモネコブセンチュウに対して、Ce−pos−1 二本鎖RNA溶液にはネコブ被害の抑制がみられないが、Mi−pos−1 二本鎖RNA溶液にはネコブ被害を抑制する著しい効果がみられた。すなわち、サツマイモネコブセンチュウに対して、C.elegansのpos−1遺伝子に対する二本鎖RNAによるRNAiの影響は認められないが、ネコブセンチュウのpos−1遺伝子に対する二本鎖RNAによるRNAi効果は顕著であり、種特異的にサツマイモネコブセンチュウの増殖が抑制されたことが示唆された。
【0080】
以上より、pos−1遺伝子に対する二本鎖RNA溶液の種特異的なRNAi効果は、C.elegansのpos−1遺伝子配列とネコブセンチュウpos−1遺伝子配列の相同性が20%と低いことが原因と考えられる。そうであれば、他の土壌線虫への影響が少ない可能性が高く、実際農作物を育てる上で、非常に有益と考えられる。
【産業上の利用可能性】
【0081】
以上のように、本発明にかかるネコブセンチュウPOS−1タンパク質は、ネコブセンチュウの増殖に必須の細胞極性に寄与するタンパク質であるため、pos−1遺伝子の発現を抑制するRNAiを利用した組換え植物による防除方法は、種特異的にネコブセンチュウの増殖を阻害することができ、大幅に農薬を減らすことが可能であり、低コスト・軽労働ならびに安全かつ環境にやさしい。
また、本発明にかかる組換え植物は「トラップ植物」として利用するため、多くの作物の栽培に利用でき、商品作物栽培中でも裁植が可能であり、花芽を摘み取るなどによりバイオハザ−ドの面でも安心である。
【技術分野】
【0001】
本発明は、ネコブセンチュウの増殖に必須のpos−1遺伝子に関するものである。さらに、本発明は、ネコブセンチュウpos−1遺伝子の発現を抑制するRNA、ネコブセンチュウpos−1遺伝子の発現を抑制するRNAiプラスミド(以下、RNAiプラスミドという)、RNAiプラスミドを導入したネコブセンチュウ抵抗性植物、及びネコブセンチュウの防除方法に関するものである。
【背景技術】
【0002】
世界的な線虫による農作物の被害は、約8兆円ともいわれ、このうちネコブセンチュウ(Meloidogyne spp.)による被害は、約半分を占め、経済的に最も大きな損失をもたらす。ネコブセンチュウは約80種が知られているが、ネコブセンチュウ害のうち95%はサツマイモネコブセンチュウ(Meloidogyne incognita)、アレナリアネコブセンチュウ(M. arenaria)、キタネコブセンチュウ(M. hapla)、ジャワネコブセンチュウ(M. javanica)の4種によるもので、さらにこれらの被害の90%以上はサツマイモネコブセンチュウによるものと推定されている(非特許文献1)。
【0003】
それぞれの種が広い寄生範囲をもつが、例えば、サツマイモネコブセンチュウの寄生植物は700種以上にもおよび、国内で被害となる作物はきわめて多く、キュウリ、トマト、ニンジン、メロン、サツマイモは普遍的に被害を受ける作物である。また、被害は鳥取県の県特産品であるスイカ・白ネギの栽培にも見受けられ、防除法の確立が切実に望まれている。
【0004】
ネコブセンチュウは、土壌中に生息し、植物の根に寄生して根にコブを作り、養分を吸収しながら繁殖する寄生種である。メスの成虫は、あちこちの根の表面付近にゼリー状の大きな塊を尾端から出し、その中に産卵する(図1)。卵から孵化した幼虫は、土の中を移動し新しい根の組織内に侵入する。そして侵入したセンチュウの排泄する刺激物質により、寄生された植物の根の細胞が異常分裂を起こし、コブが形成される。寄生された植物は、このコブが形成されることによって根の組織が破壊され、水分や養分の吸収が悪くなり、寄生植物の種類や栽培法などによって被害状況は異なるものの、草丈の短小、葉色の減退・しおれ、枯れ上がりといった症状を示し、成長が遅くなったり、収穫量が減少したりする(図2)。
【0005】
さらにまた、ネコブセンチュウの被害は、複合病害が大きいという問題も含んでいる。例えば、ネコブセンチュウとフザリウム菌との関連事例は多数報告されており、これは線虫が病原の媒介役を担うだけでなく、線虫寄生組織が病原体の誘引、侵入、感染、発育、及び発病を促進し、線虫または病原体が単体で働く場合よりはるかに被害が激化する。
【0006】
現在、ネコブセンチュウの防除法としては、表1に示したように、土壌燻蒸剤を利用する防除法、非土壌燻蒸剤を投与する防除法、対抗植物を利用する防除法、及び緑肥作物等の有機物の施用による防除法などがある(非特許文献2)。
【表1】

【0007】
現在最も有効と考えられている防除法は、クロルピクリンなどの土壌燻蒸剤を利用する方法である。また、ネマトリンなど非土壌燻蒸剤を投与する防除法は、他の土壌微生物に影響がない点で優れている。
この他、栽培することによって積極的に線虫密度を減らす働きのある「対抗作物」を利用した防除方法もある。マリーゴールドなどの対抗植物は、一般的に殺線虫性の物質を含み、または分泌して根辺や植物組織内の線虫の発育を阻害したり死亡させる作用を持つ。土壌線虫は連作障害の主原因と考えられており、対抗作物を輪作したり、畑周辺に植えることで、有害線虫の密度を抑制することができる。
【0008】
現在のところ、土壌中のセンチュウ密度が高い場合は主に土壌燻蒸剤を使用し、密度が下がった時に非土壌燻蒸剤で抑えるという方法や、対抗植物等を併用するのが効果的と考えられている。
【0009】
その他、ネコブセンチュウに抵抗性を持った作物の育種も進められており、イチゴ、ラッカセイは線虫抵抗性の品種があり、輪作でも線虫害の軽減が期待できるといわれている。また、わが国ではサツマイモやトマトなどで試験研究が行われ、特にトマトでは一種の野生トマトの抵抗性因子(Mi因子)を導入して、既に幾つかの優れた経済品種が育成され実用に供されている(非特許文献3)。
【0010】
また、ネコブセンチュウ抵抗性作物から耐性遺伝子を単離して、これを導入する遺伝子組換え作物の研究もされている。例えば、特許文献1、及び特許文献2ではネコブセンチュウに耐性を示すMi耐性遺伝子を導入した作物について、また特許文献3でもネコブセンチュウ抵抗性遺伝子を導入した作物について記載されている。
さらにまた、特許文献4では、線虫の食道腺細胞ポリペプチドの合成を阻害する遺伝子組換え作物に関して記載されている。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特表2001−500006号公報
【特許文献2】特開2005−237380号公報
【特許文献3】再表03/080838号公報
【特許文献4】特表2008−515458号公報
【非特許文献】
【0012】
【非特許文献1】線虫の生物学 石橋信義
【非特許文献2】農林水産研究文献解題No.24
【非特許文献3】農林水産研究文献解題No.7
【発明の概要】
【発明が解決しようとする課題】
【0013】
しかしながら、土壌燻蒸剤を利用する防除法は、ネコブセンチュウに対して優れた効果を示す一方、眼、のど、鼻を刺激するなどの催涙性の刺激を有し、環境汚染・労働衛生上の観点から世界的に使用を削減・中止する方向に向かっている。また、拮抗する有益生物も減少させることから、農薬施用以前よりも病害虫が増加するという報告もある。
さらに、非土壌燻蒸剤を投与する防除法は、土壌燻蒸剤に比べ防除効果が弱く、また、対抗植物による防除効果も弱く不安定であり、緑肥作物等の有機物の施用による防除法も、効果は小さい。
【0014】
また、抵抗性品種においても、たとえばラッカセイは、サツマイモネコブセンチュウに対して抵抗性を示しても、キタネコブセンチュウに対して抵抗性がないとの報告や、またトマトのネコブセンチュウ抵抗性の品種は、サツマイモネコブセンチュウやジャワネコブセンチュウにのみ有効で、キタネコブセンチュウには全く無効である(前田速雄:Meloidogyne属3種のネコブセンチュウに対するトマト品種の抵抗性 関東病虫研報 13132−133(1966))との報告がある。
さらにまた、Mi遺伝子は高温条件下では抵抗性が破られやすいとの報告(岡本好一・三井康:トマト抵抗性品種に寄生するサツマイモネコブセンチュウ 日線虫研誌,4,32−36(1971))や、抵抗性品種であっても連作をつづけることによって、その抵抗性を打破して寄生できる個体群が出現するとの報告(農林水産研究情報 平成10年 農業研究センター・病害虫防除部・線虫害研究室「抵抗性トマトを加害するネコブセンチュウ系統の出現要因」)もあり、ネコブセンチュウの有効な防除法とはいえない。
【0015】
さらにまた、ネコブセンチュウ抵抗性遺伝子を導入した遺伝子組換え作物は、対象となる作物や害虫ごとに有効な害虫抵抗性遺伝子組換え作物を作製するのは、経済的、作業的負担が非常に大きく、さらに遺伝子組換え作物を嫌う風潮から、特に日本では、現実的に商品化が難しいという問題がある。また、特許文献4に記載される食道腺細胞分泌ポリペプチドは、植物の根の細胞壁を消化する酵素であるが、この酵素に対応するRNA干渉(以下、RNAiという)の効果は、線虫がいったん根に侵入しなければ起こらないものであり、RNAiの効果が疑問視される。
【0016】
そこで、本発明において解決しようとする課題は、土壌燻蒸等に代わる、低コスト・軽労力ならびに安全かつ環境にやさしい持続的栽培が実現できる斬新かつ有効なネコブセンチュウの種特異的な防除法を開発することである。
【課題を解決するための手段】
【0017】
発明者は、ネコブセンチュウの増殖に必須のpos−1遺伝子を発見し、RNAiにより特異的にネコブセンチュウpos−1遺伝子の発現を抑制し、ネコブセンチュウの増殖を阻害する方法を開発した。
さらに、RNAiによりネコブセンチュウpos−1遺伝子の発現が特異的に抑制されるようRNAiプラスミドが導入された遺伝子組換え作物にネコブセンチュウの幼虫を誘引し、この遺伝子組換え植物の根から侵入させ、幼虫が根の組織を摂食することによって幼虫の体内に二本鎖RNAが取り込まれ、この結果、幼虫の子孫の胚を死滅させるという新たな駆除法を開発した。
【0018】
本発明は、特に、ネコブセンチュウの好む植物を「トラップ植物」として利用する防除方法に特徴を有する。すなわち、ネコブセンチュウの好む植物を、RNAiによりネコブセンチュウpos−1遺伝子の発現が特異的に抑制するよう作製された遺伝子組換え作物として用いて、ネコブセンチュウを故意に遺伝子組換え作物に侵入させるものである。侵入した線虫はRNAi効果により不稔となる。このように「トラップ植物」自体は食用ではなく、「植物農薬」としての働きをする。
また、食用でないことから花芽も花粉も果実も全く必要としないので、花粉の飛散を避けるため、花芽を摘み取る、若しくは遺伝子操作にて花芽を形成させないなどの処理が可能であり、バイオハザードの観点からも問題がない。
【0019】
すなわち、本発明によれば、ネコブセンチュウPOS−1タンパク質又はその変異体をコードする遺伝子であって、(a)配列番号1で表される塩基配列(b)配列番号1で表される塩基配列の1若しくは数個の塩基が欠失・置換若しくは付加された塩基配列(c)配列番号1で表される塩基配列からなるDNA分子に対して相補的な塩基配列からなるDNA分子とストリンジェントな条件下でハイブリダイズする塩基配列のいずれかの塩基配列からなる遺伝子が提供される。本発明にかかる上記塩基配列からなる遺伝子は、ネコブセンチュウのPOS−1タンパク質をコードすることから、この遺伝子の発現を抑制すると、ネコブセンチュウPOS−1タンパク質の発現を制御することが出来る。
【0020】
また、本発明によればネコブセンチュウPOS−1タンパク質又はその変異体をコードする遺伝子の転写産物であって、(d)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列(e)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列の1若しくは数個の塩基が欠失・置換若しくは付加された塩基配列(f)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列からなるRNA分子に対して相補的な塩基配列からなるRNA分子とストリンジェントな条件下でハイブリダイズする塩基配列のいずれかの塩基配列からなるRNAが提供される。
【0021】
また、本発明によれば上記のネコブセンチュウpos−1RNAと、前記ネコブセンチュウpos−1RNAと相補的な塩基配列を含むRNAと、を含む二本鎖のRNAが提供される。
【0022】
また、本発明によれば上記の二本鎖RNAであって、ネコブセンチュウPOS−1タンパク質の発現量を低減させるためのRNAi分子として作用し得る二本鎖RNAが提供される。この二本鎖RNAは、上記のネコブセンチュウpos−1遺伝子の転写産物にRNAi分子として作用し、該遺伝子の発現、すなわち転写又は翻訳を阻害する。前記pos−1遺伝子の転写又は翻訳を阻害すると、ネコブセンチュウPOS−1タンパク質の発現が抑制される。該タンパク質の発現を抑制すれば、ネコブセンチュウの細胞極性が制御される。
【0023】
また、本発明によれば上記のネコブセンチュウpos−1遺伝子をベクターに連結して発現可能に構成されているネコブセンチュウpos−1遺伝子発現ベクター(RNAiプラスミド)が提供される。このRNAiプラスミドは、ネコブセンチュウpos−1遺伝子が発現するように構成されており、このベクターが植物に導入されると、植物細胞内でネコブセンチュウpos−1遺伝子の転写産物の発現が抑制され、ネコブセンチュウPOS−1タンパク質の発現が制御される。
【0024】
また、本発明によればネコブセンチュウに抵抗性を示す植物を生産する方法であって、上記RNAiプラスミドを用いて生産されるネコブセンチュウ抵抗性植物の製造方法が提供される。
【0025】
また、本発明によれば上記の方法によって生産されたネコブセンチュウ抵抗性植物が提供される。このネコブセンチュウ抵抗性植物は、上記RNAiプラスミドが導入された植物であり、ネコブセンチュウpos−1遺伝子の発現を制御する二本鎖RNAが細胞内で合成される。このRNAi作用により、ネコブセンチュウのPOS−1タンパク質の合成が制御される。よってこの構成により、ネコブセンチュウに対する抵抗性を示す植物を作製することができる。
【0026】
また、本発明によれば上記のネコブセンチュウ抵抗性植物をトラップ植物として利用する工程を含む、ネコブセンチュウの防除方法が提供される。このネコブセンチュウ抵抗性植物はネコブセンチュウに抵抗性を示すことから、トラップ植物として他の作物といっしょに栽培することで、この植物にネコブセンチュウを積極的に寄生させ、土壌中のネコブセンチュウの数を減らすことができ、他の作物の被害を抑えることができる。
【発明の効果】
【0027】
本発明によれば、本発明にかかるネコブセンチュウPOS−1タンパク質は、ネコブセンチュウの増殖に必須の細胞極性に寄与するタンパク質であるため、このタンパク質の発現を制御した組換え植物による防除方法は、有益な他の土壌線虫に影響を与えることなく、種特異的にネコブセンチュウの増殖を阻害することができ、大幅に農薬を減らすことが可能となり、低コスト・軽労働ならびに安全かつ環境にやさしい。
また、本発明にかかる組換え植物は「トラップ植物」として利用するため、多くの作物の栽培に利用でき、商品作物栽培中でも裁植が可能であり、花芽を摘み取るなどによりバイオハザードの面でも安心である。
【図面の簡単な説明】
【0028】
【図1】図1はサツマイモネコブセンチュウを示す図である。
【図2】図2はサツマイモネコブセンチュウによる被害を示した図である。矢印で示した部分は、寄生したサツマイモネコブセンチュウによって肥大した根である。
【図3】図3はRNAi作用の説明図である。
【図4】図4はC.elegans POS−1とM.incognita POS−1のアミノ酸配列を比較した図である。
【図5】図5はC.elegansに対するネコブセンチュウpos−1 RNAi効果を示した図である。
【図6】図6はネコブセンチュウに対するC.elegans pos−1 RNAi効果を示した図である。
【図7】図7はネコブセンチュウに対するネコブセンチュウpos−1 RNAi効果を示した図である。
【発明を実施するための形態】
【0029】
<POS−1タンパク質の説明>
本実施の形態は、ネコブセンチュウの増殖に必須のPOS−1タンパク質に関する。また、本実施の形態では、POS−1タンパク質の発現を制御することで、ネコブセンチュの増殖を阻害するものである。
【0030】
C.elegans(Caenorhabditis elegans)では、POS−1(Posterior Segregation)タンパク質は、受精卵が第一分裂を行なう際に後方側(posterior)に分配され、細胞の極性(前後軸形成)に寄与することが知られている。ここで受精卵の後方とは、精子の侵入点であり、精子の侵入が引き金となって前後軸が決定されるといわれている。また、第一分裂は非対称的な不等分裂で、後方の小さい細胞が生殖系列細胞となる。
また、C.elegansでは、胚発生初期に必要な遺伝子発現はほとんど母親(卵子)由来であることがわかっており、POS−1タンパク質の主要な機能は、生殖細胞系列(P細胞系列)に分配蓄積されるapx−1(anterior pharynx excess)遺伝子などの母性mRNAの翻訳制御だといわれている(Tabara H et al.,1999,Ogura K et al.,2003)。すなわち、POS−1タンパク質は標的mRNAと結合することにより、翻訳を阻害すると考えられているが、詳細は分かっていない。
しかしながら胚発生は、細胞分裂を繰り返す細胞分裂期、細胞が分化する形態形成期を経て、孵化へと至ることから、細胞の極性に寄与するPOS−1タンパク質は卵の成熟に必須なタンパク質であり、これが欠損すると胚発生が停止し、重篤な胚性致死が誘起され、卵から幼虫に孵化することができない。
【0031】
これに対して、これまでネコブセンチュウのPOS−1タンパク質については知られておらず、以下で詳細に説明するが、本実施の形態では、初めてネコブセンチュウPOS−1タンパク質の同定に成功し、次いで遺伝子配列の決定に成功したものである。
さらに、本実施の形態では、RNAiによるネコブセンチュウpos−1遺伝子の発現を抑制することで、ネコブセンチュウPOS−1タンパク質の制御に成功し、新たなネコブセンチュウの駆除法を開発したものである。
【0032】
<ネコブセンチュウPOS−1タンパク質及び遺伝子発見の経緯>
図4に示すように、本発明では、C.elegansのPOS−1タンパク質のアミノ酸配列を基に、ネコブセンチュウのデータベース(NemaBase EST)に存在するcDNA配列より推定されるアミノ酸配列を検索し、相同タンパク質を調査した。EST(expressed sequence tag)とは、ある組織において発現しているタンパク質のmRNA配列に由来するcDNA配列を部分的に決定したものをいい、イントロンが除去されたcDNA配列であるという特徴をもつ。検討を重ねた結果、アミノ酸配列の相同性は20%と低いものの、多数の候補の中から配列番号5で表されるタンパク質に注目した。
【0033】
このタンパク質は、図4に示されるように、C.elegansのPOS−1タンパク質のアミノ酸配列との相同性は20%程度と低いものであるが、C−X8−C−X5−C−X3−Hで表される、RNA結合モチーフといわれるジンクフィンガーモチーフを2箇所有していた。このジンクフィンガーモチーフは、C.elegansのPOS−1タンパク質にも含まれており、POS−1タンパク質に共通して保存されていることが分かった。
【0034】
次に上記C.elegansのPOS−1タンパク質と相同性を示すタンパク質をコードするM.incognita cDNAの塩基配列を基にRACE(rapid amplification of cDNA ends)法を行った。
【0035】
<用語の説明>
本明細書において、各種用語の意味は、下記の通り定義するものとする。
【0036】
(1)線虫
線虫は非常に多様性に富み、1億種を超えるともいわれ、地中生活種、淡水生活種、海水生活種、寄生種などがあり、このうち寄生種は約8万種といわれている。
線虫の一種であるC.elegansは、後生動物でありながら体が小さく、細胞数が少なく、しかも培養がたやすいこと等からモデル生物として確立された。自由生活性で、実験室では寒天培地上に生やした大腸菌を餌として飼育される。1998年に多細胞生物として初めて 97Mb の塩基配列読み取りが完了し、6本の染色体上に約 190000 個の遺伝子の存在が予測され、受精卵から成虫に至る全細胞の発生、分化の過程が細胞系譜として明らかになっている。
またRNAiについて最初に報告されたのも、線虫を用いた研究である(A.Fire,S.Xu,M.K.Montgomery,S.A.Kostas,S.E.Driver,C.C.Mello,Nature,391,806(1998)。
【0037】
(2)ネコブセンチュウ
これに対してネコブセンチュウ(Meloidogyne spp.)(図1)は、寄生種である。詳細は前述したが、本発明においてネコブセンチュウとは、例えば、キタネコブセンチュウ、サツマイモネコプセンチュウ、ジャワネコブセンチュウ、及びアレナリアネコブセンチュウなどが挙げられるが、これに限定されない。
【0038】
(3)RACE法
RACE法は、得られたcDNAの情報を基にさらに上流や下流をクローニングする方法で、標的mRNAを鋳型として逆転写反応を行ない、得られたcDNAを基にPCRにより全長cDNAを合成することが出来る(Frohman,M.A.,Dush,M.K.,Martin,G.R.(1988)Proc.Natl.Acad.Sci.USA.,85,8998−9002)。未知領域がmRNAの上流(5’側)にある場合を5’RACE、下流(3’側)にある場合を3’RACEという。
【0039】
3’RACEは、5’末端にアダプター配列の付いたオリゴ(dT)をプライマーにして逆転写反応を行いcDNA(第1鎖)を合成する。できた第1鎖cDNAはすべてアダプター配列が末端に付いた構造をしている。このためクローニングを目的とするcDNAは、未知領域が既知配列とアダプター配列に挟まれた形になる。そこで、既知配列の一部をセンスプライマー(GSP1)としてアダプタープライマーとPCRを行うことによって、両者に挟まれた未知領域を増幅することが可能になる。しかしこの第1段階のPCRでは、用いた二つのプライマーのうち、一方のアダプタープライマーは逆転写反応によって生成された全cDNAに共通に含まれる配列であり、PCRの特異性はGSP1のみに依存している。したがってこの段階で得られる生成物は、非特異的バックグラウンドが極めて多い。そこで、バックグラウンドを軽減する手段としてnested PCRを行う。GSP1の下流の既知領域に、同じく目的のDNAに特異的なセンスプライマーのGSP2をデザインし、GSP2とアダプタープライマーでnested PCRを行いシークエンスして確認する。
【0040】
5’RACEは、上流の未知領域を得るために、既知配列を基に遺伝子特異的なアンチセンスプライマー(GSP1)を合成し、GSP1をプライマーとした逆転写反応を行う。その後、cDNAと2本鎖を作っているmRNAをRNaseHで分解すると、1本鎖のcDNA(第1鎖)が得られる。このDNAは5’末端にGSP1の配列を持ち、3’末端が未知の配列で終わっている。この未知配列をPCRで増幅するには第1鎖cDNAの3’末端にアンカー配列を付加する必要があるので、ターミナルデオキシヌクレオチジルトランスフェラーゼ(TdT)でヌクレオチドホモポリマーをアンカー配列として付加する。アンカー配列を付加した後で、アンカー配列に相補的なヌクレオチドポリマーを3’末端にもつアダプタープライマーと遺伝子特異的なアンチセンスプライマー(GSP2)を用いてnested PCRを行えば、5’上流の未知領域を含むcDNAが増幅される。
【0041】
(4)遺伝子発現
遺伝子発現とは、遺伝子の情報が細胞における構造および機能に変換される過程をいう。具体的には、遺伝情報に基づいてタンパク質が合成されること、又はmRNAの合成をいう。
【0042】
(5)ハイブリダイズ
ハイブリダイズするとは、あるヌクレオチドに対し、別のヌクレオチドが水素結合等を介し、相補的に結合し、比較対照とすべきヌクレオチドには同条件では結合しない状態をいう。必ずしも、他の全てのヌクレオチドに対して特異的である必要は無く、使用目的に応じた特異性を有していればよい。ハイブリダイズの条件は、そのヌクレオチドの使用目的に応じて選択することができる。例えば、PCRに用いるプライマーとしてのヌクレオチドであれば、PCRでのアニーリング時の条件でハイブリダイズするように選択される。
【0043】
(6)ストリンジェントな条件
ストリンジェントな条件とは、ハイブリダイゼイション中にホルムアミド等の変性剤を含む条件、例えば、42℃において50%(v/v)ホルムアミドと0.1%ウシ血清アルブミン/0.1%フィコール/0.1%のポリビニルピロリドン/50mMのpH6.5のリン酸ナトリウムバッファー、及び750mMの塩化ナトリウム、75mMクエン酸ナトリウムを用いるものや、その適宜改変したものが挙げられるが、これに限られない。
【0044】
(7)核酸増幅法
核酸増幅法としては、標的の核酸を増幅させる方法として公知のものならば、何れの方法を用いてもよいが、プライマー及びプライマーセットを用いる方法として、例えば、PCR法、LAMP法あるいは他の核酸の協奏的核酸増幅方法が用いられる。特にRNAを増幅する際には、逆転写酵素によってRNAを鋳型としてcDNAを合成し、それと同時或いはそれに引き続いて、耐熱性DNAポリメラーゼによって標的RNA由来の核酸産物を増幅させるRT−PCR法(Kinetic RT−PCR法など)、RT−LAMP法あるいは他の核酸の協奏的RNA増幅方法が用いられる。
【0045】
更に、RNA増幅法としては、一定温度でRNAのみを増幅する方法として、上記のLAMP法に加え、NASBA法、TMA法、3SR法等を用いることもできる。これらの方法の概略は、標的となるRNAに対してプロモーター配列を含むプライマー、逆転写酵素、および必要に応じてリボヌクレアーゼH(RNaseH)により、プロモーター配列を含む2本鎖DNAを合成し、この2本鎖DNAを鋳型としRNAポリメラーゼによって標的RNA由来の特定核酸配列を含むRNAを生産し、このRNAが引き続きプロモーター配列を含む2本鎖DNA合成の鋳型となる連鎖反応を行うというものである。
【0046】
更に、他の核酸増幅法として、ICAN法を用いることもできる。これらの方法の概略は、標的となるRNAに対して、逆転写酵素によってRNAを鋳型としてcDNAを合成し、それと同時或いはそれに引き続いて、RNA−DNAからなるキメラプライマー、転写酵素により、RNAを含む2本鎖DNAを合成し、その2本鎖DNAにリボヌクレアーゼH(RNaseH)が切れ目を入れることで、標的RNA由来の特定核酸配列を含むDNAを生産する鎖置換連鎖反応を行うというものである。
【0047】
(8)相同性
相同性とは、配列を整列させ、最大のパーセント配列同一性を得るために必要な場合は間隙を導入した上で、目的の塩基と同一である候補配列中の核酸塩基数のパーセントとして定義される。この際に、同一の塩基(チミンとウラシンも同一とみなす)を有するDNAとRNAとは結合特性が非常に近いため、同一の核酸塩基として定義される。相同性を決定する目的のためのアラインメントは、当業者の技量の範囲にある種々の方法、例えば、NCBI(National Center for Biotechnology Information)の提供するblast、blast2seq又はALIGNのような公に入手可能なコンピュータソフトウエアを使用することにより達成可能であるが、blast2seqにおいて標準的な初期パラメーターを用いて計算された値を用いることもできる。
【0048】
(9)相補性
相補性とは、核酸増幅反応条件(塩濃度、オリゴヌクレオチド濃度等の試薬組成および温度)において、所定のDNAまたはRNAおよびそれと完全に相同な核酸に対して、高効率にハイブリダイゼイション可能であることを意味する。
【0049】
以下、本発明の実施の形態について、説明する。
【0050】
<RNAi>
本実施の形態は、ネコブセンチュウpos−1RNAと、前記ネコブセンチュウpos−1RNAと相補的な塩基配列を含むRNAと、を含む二本鎖RNAであって、ネコブセンチュウPOS−1タンパク質の発現を低減させるためのRNAi分子として作用し得る二本鎖RNAである。後述の実施例に示すように、本実施形態における前記二本鎖RNAは、ネコブセンチュウPOS−1タンパク質又はその変異体をコードする遺伝子の転写産物であって、(d)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列(e)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列の1若しくは数個の塩基が欠失・置換若しくは付加された塩基配列(f)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列からなるRNA分子に対して相補的な塩基配列からなるRNA分子とストリンジェントな条件下でハイブリダイズする塩基配列のいずれかの塩基配列からなるRNAと、前記ネコブセンチュウpos−1RNAと相補的な塩基配列を含むRNAと、を含む二本鎖RNAであるので、RNAi作用によりネコブセンチュウpos−1遺伝子の転写または翻訳を阻害するため、ネコブセンチュウPOS−1タンパク質の合成が制御され、ネコブセンチュウの増殖が阻害される。
【0051】
RNAi(RNA interference:RNAi)とは、二本鎖RNA(double−stranded RNA:dsRNA)が引き金となり、そのアンチセンス鎖と相補的な配列を持つmRNAが切断される機構である。本実施形態においてRNAiは、転写後の遺伝子発現の抑制として知られる転写後遺伝子サイレンシング(post−transcriptional gene silencing:PTGS)でもよく、遺伝子からmRNAへの転写そのものを抑制する転写時サイレンシングでもよい。
前者は、外から細胞内に導入されたdsRNAによって、配列特異的に標的mRNAが分解され、結果として標的遺伝子の発現が抑制されるという現象である。図3に示したように、細胞内に取り込まれたdsRNAは、細胞内に導入されると、Dicerと呼ばれるリボヌクレアーゼによって2塩基の3’突出末端をもった21〜23塩基程度の短いdsRNA(small interfering RNA:siRNA)に切断される。このsiRNAは、RISC(RNA−induced silencing complex)と呼ばれるタンパク質複合体に取り込まれ、配列特異的に標的RNAを切断する際のガイド配列として働く。
後者は、遺伝子のプロモーター領域でDNAのメチル化の誘発を介した遺伝子発現抑制システムである。
【0052】
線虫にRNAiを起こすためのdsRNAを導入する方法は、顕微注入法、浸漬法及び摂食法などである。顕微注入法はRNAを線虫体内に注射する方法で、特別な装置及び技術を必要とし、煩雑かつコスト高である。浸漬法は、線虫類をRNA溶液に漬すだけで極めて簡便な方法である。摂食法は、線虫類が2本鎖RNAを合成する組換え微生物を摂取することによりRNAiを誘導する方法である。
本実施の形態においては、上記いずれの方法を用いても良いが、適宜目的に合った方法を選択できる。
【0053】
<ネコブセンチュウpos−1遺伝子発現プラスミド(RNAiプラスミド)>
本実施の形態は、ネコブセンチュウpos−1遺伝子をベクターに連結して発現可能に構成されているRNAiプラスミドである。また、本実施の形態のRNAiプラスミドは、植物細胞に導入され二本鎖RNAを発現する。これを寄生したネコブセンチュウが摂食すると、ネコブセンチュウの体内に取り込まれ、ネコブセンチュウpos−1遺伝子の転写又は翻訳を阻害する。あるいは、上記二本鎖RNAは、ネコブセンチュウの体表から直接取り込まれ、ネコブセンチュウpos−1遺伝子の転写又は翻訳を阻害する。
【0054】
本実施の形態において、RNAi用ベクターに連結する遺伝子は、配列番号1で表される塩基配列、又は配列番号1で表される塩基配列の1若しくは数個の塩基が欠失・置換若しくは付加された塩基配列の全部又はその一部からなるDNAであって、作製されたRNAiプラスミドより産生される二本鎖RNAによりpos−1タンパク質の発現量を低減させるためのRNAi効果を有する遺伝子を用いることができる。また、このような遺伝子は、例えば対象となるRNA領域に対応するcDNAをRT−PCRにより増幅し、Tベクターにサブクローニングすることによって得られる。
一般に、RNAiプラスミドに連結する遺伝子は、発現抑制の対象となる遺伝子の開始コドンの下流50〜100bpを用いることが好ましく、5’および3’の非翻訳領域(UTR)は避けることが好ましい。
【0055】
植物形質転換に用いる組換えベクターは、上記の本実施形態の遺伝子を適当なベクターに導入することにより構築することができる。ここで、ベクターとしては、アグロバクテリウムを介して植物細胞に目的遺伝子を導入することができる、pBI系、pPZP系、pSMA系のベクターなどが好適に用いられるがこれらに限定されるものではない。バイナリーベクターとは大腸菌(Escherichia coli)およびアグロバクテリウムにおいて複製可能なシャトルベクターで、バイナリーベクターを保持するアグロバクテリムを植物細胞に感染させると、ベクター上にあるT−DNA領域と呼ばれているLB配列およびRB配列ではさまれた部分のDNAを植物の核DNAに組み込むことが可能である(EMBO Journal,10(3),697−704(1991))。また、カリフラワーモザイクウイルス(CaMV)、インゲンマメモザイクウイルス(BGMV)、タバコモザイクウイルス(TMV)等の植物ウイルスベクターも用いることができる。
【0056】
バイナリーベクター系プラスミドを用いる場合、上記のバイナリーベクターのT−DNA領域内に、目的遺伝子を含む遺伝子カセットを挿入し、この組換えベクターを大腸菌中で増幅する。次いで、増幅した組換えベクターをアグロバクテリウム・ツメファシエンスの菌株C58、LBA4404、EHA101、EHA105等に、凍結融解法、エレクトロポレーション法等用いて導入し、該アグロバクテリウムを植物細胞の形質転換に用いる。
【0057】
また、上記の方法以外にも、三者接合法(Nucleic Acids Research,12:8711(1984))によって、植物細胞形質転換用アグロバクテリウムを調製することができる。すなわち、目的遺伝子を含むプラスミドを保有する大腸菌、ヘルパープラスミド(例えば、pRK2013等)を保有する大腸菌、およびアグロバクテリウムを混合培養し、リファンピシリンおよびカナマイシンを含む培地上で培養することにより植物細胞形質転換用のアグロバクテリウムを得ることができる。
【0058】
ベクターに目的遺伝子を挿入するには、精製されたDNAを適当な制限酵素で消化し、適当なベクターDNAの制限酵素部位またはマルチクローニングサイトに挿入する方法などが採用される。詳しいベクターの作製方法は、Molecular Cloning:a Laboratory Manual:第2版、Sambrookら、1989,Cold Spring Harbor Laboratory Press.に記載されており、このような方法を用いて作製できる。
【0059】
また、組換えベクターには、目的遺伝子以外にプロモーター配列、エンハンサー配列、ターミネーター配列、ポリA付加シグナル、5’−UTR配列、選抜マーカー遺伝子、レポーター遺伝子、必要に応じて、アグロバクテリウム細菌中で増幅するための複製開始点などを配置することができる。
【0060】
本実施形態に用いられるベクターは、RNAiを引き起こす二本鎖RNA(dsRNA)を発現するベクターであって、RNAiを引き起こすdsRNAをヘアピン型として発現するベクターでもよく、タンデム型として発現するベクターでもよく、これに限定されるものではない。
ヘアピン型は、数塩基以上のリンカー(スペーサー)配列の両端にIR(inverted repeat:逆位反復)となるようにdsRNA形成部分に対応したDNA配列を配置し、植物体内で高発現するプロモーターによりヘアピン型dsRNAを転写し、細胞内でsiRNAを産生するシステムである。
タンデム型は、2つのプロモーターからセンスRNAとアンチセンスRNAが転写され、細胞内でハイブリダイズしてsiRNAを産生するシステムである。
【0061】
<形質転換>
形質転換とは、外因性のDNA配列(例えば、ベクター、組み換えDNA分子)を細胞またはプロトプラストに導入し、その細胞またはプロトプラストの遺伝的性質を変えることをいう。
本実施形態の形質転換植物は、上記の組換えベクターを用いて、対象植物を形質転換することによって作出することができる。形質転換植物を作出する際には、既に報告され、確立されている種々の方法を適宜利用することができ、その好ましい例として、アグロバクテリウム法、PEG−リン酸カルシウム法、エレクトロポレーション法、リポソーム法、パーティクルガン法、マイクロインジェクション法等が挙げられるが、アグロバクテリウム法が好ましい。アグロバクテリウム法を用いる場合は、プロトプラストを用いる場合、培養細胞を用いる場合、組織を用いる場合がある。
【0062】
本実施の形態では、宿主植物として、ネコブセンチュウの好む植物を用いることが好ましい。例えば、これに限定されないが、トマト、サツマイモ、ジャガイモ、キュウリ、ニンジン、スイカ、ネギなどの野菜、トウモロコシ、コムギなどの穀物、エンドウマメなどのマメ科の植物、および他の根、塊茎または種子作物、観賞用植物および針葉樹などである。
【0063】
本実施形態では、これに限定されないが、例えばトマトを用いることがより好ましい。ネコブセンチュウは、トマトに対する嗜好性が高いことから、この作出したネコブセンチュウpos−1遺伝子組換えトマトを他の作物などと一緒に植えておくと、ネコブセンチュウが該遺伝子組換えトマトの根へ積極的に誘導されることとなり、その結果、他の作物への被害が低減されるからである。
【0064】
また本実施の形態では、宿主細胞タイプは、例えば、胚形成組織、カルス組織I、IIおよびIII型、胚軸、成長点、根の組織、師部における発現のための組織における細胞などである
【0065】
<植物再生および繁殖>
本実施の形態では、形質転換後、植物は、当該分野で標準的であるように、例えば、単一の細胞、カルス組織、または葉片から再生され得る。ほとんどすべての植物は、その植物の細胞、組織および器官から全体として再生され得る。利用可能な技術は、Vasilら(1984)Cell Culture and Somatic Cell Genetics of Plants,第I、IIおよびIII巻、Laboratory Procedures and Their Applications(Academic press);およびWeissbachら(1989)Methods for Plant Molecular Biology,Academic Press,1989に概説される。
【0066】
懸濁培養の成長の間、小細胞凝集物(10〜100個の細胞)を、外見上より大きい細胞の塊から形成して、その培養物に分散した外見を与える。固体培地へのこれらの細胞をプレートする際、体細胞胚の発達が誘導され、そしてこれらの胚が成熟され、出芽され、そして繁殖力のある種子を保有する植物へと成長することができる。あるいは、固体培養培地上で成長しているカルス細胞は、体細胞胚を形成するように誘導され、それから繁殖性の種子保有植物が発達し得る。胚形成、再生および植物の繁殖性の特徴は、懸濁培養中で時間の関数として徐々に失われる。懸濁細胞の凍結保存によって、培養物の発育が停止され、そして凍結保存期間の間のこれらの特徴の喪失が妨げられる。
【0067】
次いで、形質転換された植物を成長させて、同じ形質転換された株または異なる株で受粉させてもよく、そして所望の表現性の特徴の発現を有する得られた系統が同定される。所望の表現性の特徴の発現が安定に維持されかつ遺伝されることを確実にするために2つ以上の世代を成長させて、次いで種子を回収して所望の表現性の特徴の発現が達成されていることを確認してもよい。
【0068】
<ネコブセンチュウpos−1遺伝子発現の抑制>
ネコブセンチュウpos−1遺伝子発現の抑制とは、ネコブセンチュウpos−1遺伝子からのタンパク質および/またはmRNAの生成のレベルの減少を意味する。本実施の形態では、抑制の結果は、例えば上記二本鎖RNAを導入したセンチュウの孵化率を調べることによって、または上記二本鎖RNAを導入したセンチュウを植物の根に寄生させた後、根の変化を調べることによって、RNAi効果を直接的に確認できる。また例えば、RNAiプラスミドで形質転換された遺伝子組換え作物にネコブセンチュウを寄生させた後、根の変化を調べることによって確認できる。
より詳細には、2本鎖RNA溶液にネコブセンチュウを漬けて2本鎖RNAを取り込ませた後、次世代のネコブセンチュウの孵化率によって、またはこのネコブセンチュウをトマトの根に感染させ、培養した根の形状を観察することによって、ネコブセンチュウpos−1遺伝子の発現の制御を確認することができる。さらには、ネコブセンチュウの嗜好性の強い作物であるトマトを上記の方法によってRNAiプラスミドで形質転換させ、この遺伝子組換えトマトにネコブセンチュウを寄生させ、生じたネコブを観察することによりネコブ被害指数を算出することができる。ネコブ被害指数は、例えば、以下の表2に基づいて算出することができる。
【表2】

このようなネコブセンチュウの増殖阻害効果は、ポット試験にて検証することができる。
【0069】
<圃場試験>
圃場試験においては、遺伝子組換え作物をフィールドに持ち出す場合、バイオハザードを懸念した制約(安全性の確保)がある。最大の問題は花粉の飛散であると考えられるが、本トラップ植物は根にネコブセンチュウを感染させることが重要であるから、花芽を剪定することにより花粉の飛散を回避できる。この段階では、密閉した圃場試験が可能な研究施設の利用が必要になる。
【0070】
以下、本発明を実施例によりさらに説明するが、本発明はこれらに限定されるものではない。
【実施例1】
【0071】
(材料と方法)
(クローニング)
EST配列より取得した、ネコブセンチュウPOS−1タンパク質をコードするcDNA配列を基に、RACE(rapid amplification of cDNA ends)法により全長のcDNAを取得した。具体的には、以下の手順で行った。
(1)EST配列よりネコブセンチュウPOS−1タンパク質をコードするcDNA配列を取得した。このESTの配列は開始メチオニンに対応するAUGが含まれていたが、ストップコドンは含まれていなかったので、次に3’RACEを実施した。
【0072】
(2)3’RACE法
<mRNAの調整>
ネコブセンチュウをトマトに感染させ、大量にネコブを作らせた。このコブを切り出して滅菌水に漬け線虫を放出させ、ベルマン法(濾過)により線虫を分離した。次に、回収した線虫をポッター式ホモジナイザーを用いて破砕し、線虫破砕液を回収した。線虫破砕液から、フェノールとチオシアン酸グアニジンを含むISOGEN(ニッポンジーン社製 No.311−02501)を用いた液相分離法により全RNAを回収し、その後Poly(A)+RNA Isolation kit from Total RNA(ニッポンジーン社製 No.317−05641)を用いて、mRNAを調製した。
具体的には、試料にISOGENを加えて溶解またはホモジナイゼーションした後、クロロホルムを加えて遠心分離し、RNAが存在する水相を採取してイソプロパノールを加えて沈殿させmRNAを回収した。その後、Total RNAからPoly(A)+RNAを抽出するため、Poly(A)+RNAと反応性の高いOligotex−dT30<Super> を用いてPoly(A)+RNAを補足し、その後スピンカラムを用いて迅速に洗浄・溶出し、Poly(A)+RNAを得た。
【0073】
<cDNAの合成と増幅>
TaKaRa RNA PCR Kit(AMV)Ver.3.0(TaKaRa社製 No.RR019A)を用いて、逆転写反応による1st strand cDNA合成を行った後、これを鋳型としてPCRを行った。1回目のPCRではEST配列に基づいて設計したMi−pos1−FW1配列(配列番号6)プライマーとM13 Primer M4(配列番号8)を、その後のPCRではMi−pos1−FW2(配列番号7)プライマーとM13 Primer M4(配列番号8)を用いた。
Mi−pos1−FW1 5’−GCAACAAGTTGGATCCAATC−3’ (配列番号6)
Mi−pos1−FW2 5’−GGAAGGCTTTGCCATTATGC−3’ (配列番号7)
M13 Primer M4 5’−GTTTTCCCAGTCACGAC−3’(配列番号8)
逆転写反応は、42℃で60分の後、95℃で5 分、5℃で5 分で反応させた。また、その後のPCRは、94℃で30秒、55℃で 30秒、72℃ で1分を30サイクル反応させた。 遺伝子増幅装置は、AB社製のThermal Cycler2720を用いた。
【0074】
(3)クローニング
PCR産物をpGEM−Tを用いてTA クローニング(Promega社製 pGEM−T(Easy)Vector Systems)し、形質転換株よりプラスミドを調製し、塩基配列分析により全長のcDNA配列が得られたことを確認した。このcDNAを鋳型として、全長cDNA(配列番号1),前半cDNA(配列番号9),後半cDNA(配列番号10)の増幅を行い、同様にTA cloningを行った。
【実施例2】
【0075】
(二本鎖RNAの調整)
RNA溶液は以下のように調整した。
まず、RNAi用ベクターpPD129.36(cDNAを挿入するマルチクローニングサイトの両端にT7配列が付加したもの:+鎖、−鎖を鋳型とした転写が可能:米国スタンフォード大学Andrew Fire教授より分与)に、実施例1で作製したTAクローンの全長cDNA、前半cDNA、後半cDNAの各々のcDNAを組み込んだ。具体的には、 個々のTAクローンを制限酵素EcoRIで消化し、挿入されたcDNAを取り出し、RNAi用ベクターpPD129.36のEcoRI制限酵素切断部位に導入し、RNAiプラスミドとした。このベクターによる大腸菌の形質転換体を作製し、プラスミド調製を行った。次に、このプラスミドを鋳型としてT7プロモーター配列よりcDNAを増幅(PCR)し, 精製してRNA合成(転写反応)の鋳型とした。PCRの反応条件は、下記のプライマーを用いて、50マイクロリットルスケールで行った。鋳型となるプラスミド0.01ナノグラムを加え、94℃で 30秒、50℃で30秒、72℃ で1分を25サイクル反応させた。遺伝子増幅装置は、AB社製のThermal Cycler2720を用いた。
T7−PCR primer 5’−TAATACGACTCACTATAGGG−3’(配列番号11)
そして、MEG Ascript RNAi Kit(Ambion社 No.AM1626)を用いてAmbion社のプロトコールに従って、上記合成DNAを鋳型に、T7RNAポリメラーゼにより37℃で4時間反応させ、2本鎖RNAを調製した。
【実施例3】
【0076】
(RNAi 浸漬法)
100μlで100匹になるように調製したセンチュウ 1mlを、M9溶液ごと1.5ml Tubeに移した。13,000rpmで2分間遠心し、上澄みを捨てた後、5×Soaking Buffer(表3)2μl、10%resorcinol 1μl、dsRNA溶液 8μl(1μg/μl)加え、優しく混合した。室温で4時間soaking(振とう培養) した。
【表3】

【実施例4】
【0077】
(トマトへの感染)
上記のdsRNA溶液に浸したセンチュウにM9溶液を適量加え、子葉が6枚以上のトマトへ寄生させ、25.5℃に3ヵ月間、静置培養した。その後、丁寧に引き抜いてコブの形状により被害度を判断し、それによって増殖度を観察した。結果は、図6、及び7に示した。
【0078】
(結果)
図5は、実施例3の方法でC.elegansをpos−1遺伝子に対する二本鎖RNA溶液に浸し、その孵化率の結果を示した図である。図5中、コントロールとして、pos−1遺伝子に対する二本鎖RNA溶液の代わりに、DEPC処理水、及びC.elegansをpos−1遺伝子と全く相同性を示さないvirusの二本鎖RNA溶液を使用した。また、Ce−pos−1 dsRNAは、C.elegansのpos−1遺伝子に対する二本鎖RNA溶液を用いたことを示す。さらに、Mi−pos−1全長dsRNA、Mi−pos−1前半dsRNA、及びMi−pos−1後半dsRNAは、それぞれサツマイモネコブセンチュウの全長pos−1遺伝子(配列番号1)、前半pos−1遺伝子(配列番号9)、及び後半pos−1遺伝子(配列番号10)に対する二本鎖RNA溶液を用いたことを示す。また、nは、実験に用いた個体数を示す。
この結果、C.elegansに対しCe−pos−1 dsRNAを用いた場合のみ孵化率が0%で、サツマイモネコブセンチュウのいずれの二本鎖RNA溶液を用いた場合も100%の孵化率を示すという非常に顕著なものであった。すなわち、C.elegansに対しRNAi効果があったのはC.elegans由来の二本鎖RNAだけで、サツマイモネコブセンチュウ由来のdsRNAの影響は全くなく、このRNAi効果は顕著で種特異的であることが示唆された。
【0079】
図6、及び7は、上記の方法により作製されたネコブセンチュウに寄生されたトマトの根を示す。
図6は、上記同様コントロールとして、実施例3のdsRNA溶液の代わりにDEPC処理水に浸したサツマイモネコブセンチュウに、実施例4の方法でトマトの根に寄生させた後の被害の様子である。このネコブ指数は4か3であると認められた。また、C.elegansのpos−1遺伝子に対する二本鎖RNA溶液(Ce−pos−1)に浸したサツマイモネコブセンチュウに寄生されたトマトの根のネコブ指数も4か3であると認められた。
これらの結果から、Ce−pos−1溶液は、サツマイモネコブセンチュウに対して、ネコブ被害を抑える効果がないということがわかった。すなわち、サツマイモネコブセンチュウに対して、C.elegansのpos−1遺伝子に対する二本鎖RNAによるRNAi効果はなかったことが示唆された。
図7は、C.elegansのpos−1遺伝子に対する二本鎖RNA溶液(Ce−pos−1)と、サツマイモネコブセンチュウのpos−1遺伝子に対する二本鎖RNA溶液(Mi−pos−1)に浸したサツマイモネコブセンチュウに寄生されたトマトの根を示す。Ce−pos−1 二本鎖RNA溶液に浸したサツマイモネコブセンチュウに寄生されたトマトの根のネコブ指数は2から4であると認められた。一方、Mi−pos−1 二本鎖RNA溶液に浸したサツマイモネコブセンチュウに寄生されたトマトの根のネコブ指数は1か0であると認められた。
これらの結果から、サツマイモネコブセンチュウに対して、Ce−pos−1 二本鎖RNA溶液にはネコブ被害の抑制がみられないが、Mi−pos−1 二本鎖RNA溶液にはネコブ被害を抑制する著しい効果がみられた。すなわち、サツマイモネコブセンチュウに対して、C.elegansのpos−1遺伝子に対する二本鎖RNAによるRNAiの影響は認められないが、ネコブセンチュウのpos−1遺伝子に対する二本鎖RNAによるRNAi効果は顕著であり、種特異的にサツマイモネコブセンチュウの増殖が抑制されたことが示唆された。
【0080】
以上より、pos−1遺伝子に対する二本鎖RNA溶液の種特異的なRNAi効果は、C.elegansのpos−1遺伝子配列とネコブセンチュウpos−1遺伝子配列の相同性が20%と低いことが原因と考えられる。そうであれば、他の土壌線虫への影響が少ない可能性が高く、実際農作物を育てる上で、非常に有益と考えられる。
【産業上の利用可能性】
【0081】
以上のように、本発明にかかるネコブセンチュウPOS−1タンパク質は、ネコブセンチュウの増殖に必須の細胞極性に寄与するタンパク質であるため、pos−1遺伝子の発現を抑制するRNAiを利用した組換え植物による防除方法は、種特異的にネコブセンチュウの増殖を阻害することができ、大幅に農薬を減らすことが可能であり、低コスト・軽労働ならびに安全かつ環境にやさしい。
また、本発明にかかる組換え植物は「トラップ植物」として利用するため、多くの作物の栽培に利用でき、商品作物栽培中でも裁植が可能であり、花芽を摘み取るなどによりバイオハザ−ドの面でも安心である。
【特許請求の範囲】
【請求項1】
ネコブセンチュウPOS−1タンパク質又はその変異体をコードする遺伝子であって、
(a)配列番号1で表される塩基配列
(b)配列番号1で表される塩基配列の1若しくは数個の塩基が欠失・置換若しくは付加された塩基配列
(c)配列番号1で表される塩基配列からなるDNA分子に対して相補的な塩基配列からなるDNA分子とストリンジェントな条件下でハイブリダイズする塩基配列
のいずれかの塩基配列からなる遺伝子。
【請求項2】
ネコブセンチュウの細胞の極性に寄与するタンパク質をコードする請求項1に記載の遺伝子。
【請求項3】
ネコブセンチュウPOS−1タンパク質又はその変異体をコードする遺伝子の転写産物であって、
(d)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列
(e)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列の1若しくは数個の塩基が欠失・置換若しくは付加された塩基配列
(f)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列からなるRNA分子に対して相補的な塩基配列からなるRNA分子とストリンジェントな条件下でハイブリダイズする塩基配列
のいずれかの塩基配列からなるRNA。
【請求項4】
請求項3に記載のネコブセンチュウpos−1RNAと、
前記ネコブセンチュウpos−1RNAと相補的な塩基配列を含むRNAと、
を含む二本鎖のRNA。
【請求項5】
請求項4に記載の二本鎖RNAであって、ネコブセンチュウPOS−1タンパク質の発現量を低減させるためのRNAi分子として作用し得る二本鎖RNA。
【請求項6】
請求項1又は2のいずれかに記載のネコブセンチュウpos−1遺伝子をベクターに連結して発現可能に構成されているネコブセンチュウpos−1遺伝子発現ベクター。
【請求項7】
請求項1又は2のいずれかに記載のネコブセンチュウpos−1遺伝子の発現によって合成されるネコブセンチュウPOS−1タンパク質であって、細胞の極性に寄与するネコブセンチュウPOS−1タンパク質。
【請求項8】
ネコブセンチュウに抵抗性を示す植物を生産する方法であって、請求項6に記載のネコブセンチュウpos−1遺伝子発現ベクターを用いて生産されるネコブセンチュウ抵抗性植物の製造方法。
【請求項9】
請求項8に記載の方法によって生産されたネコブセンチュウ抵抗性植物。
【請求項10】
請求項9に記載のネコブセンチュウ抵抗性植物をトラップ植物として利用する工程を含む、ネコブセンチュウの防除方法。
【請求項1】
ネコブセンチュウPOS−1タンパク質又はその変異体をコードする遺伝子であって、
(a)配列番号1で表される塩基配列
(b)配列番号1で表される塩基配列の1若しくは数個の塩基が欠失・置換若しくは付加された塩基配列
(c)配列番号1で表される塩基配列からなるDNA分子に対して相補的な塩基配列からなるDNA分子とストリンジェントな条件下でハイブリダイズする塩基配列
のいずれかの塩基配列からなる遺伝子。
【請求項2】
ネコブセンチュウの細胞の極性に寄与するタンパク質をコードする請求項1に記載の遺伝子。
【請求項3】
ネコブセンチュウPOS−1タンパク質又はその変異体をコードする遺伝子の転写産物であって、
(d)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列
(e)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列の1若しくは数個の塩基が欠失・置換若しくは付加された塩基配列
(f)配列番号2、配列番号3又は配列番号4のいずれかで表される塩基配列からなるRNA分子に対して相補的な塩基配列からなるRNA分子とストリンジェントな条件下でハイブリダイズする塩基配列
のいずれかの塩基配列からなるRNA。
【請求項4】
請求項3に記載のネコブセンチュウpos−1RNAと、
前記ネコブセンチュウpos−1RNAと相補的な塩基配列を含むRNAと、
を含む二本鎖のRNA。
【請求項5】
請求項4に記載の二本鎖RNAであって、ネコブセンチュウPOS−1タンパク質の発現量を低減させるためのRNAi分子として作用し得る二本鎖RNA。
【請求項6】
請求項1又は2のいずれかに記載のネコブセンチュウpos−1遺伝子をベクターに連結して発現可能に構成されているネコブセンチュウpos−1遺伝子発現ベクター。
【請求項7】
請求項1又は2のいずれかに記載のネコブセンチュウpos−1遺伝子の発現によって合成されるネコブセンチュウPOS−1タンパク質であって、細胞の極性に寄与するネコブセンチュウPOS−1タンパク質。
【請求項8】
ネコブセンチュウに抵抗性を示す植物を生産する方法であって、請求項6に記載のネコブセンチュウpos−1遺伝子発現ベクターを用いて生産されるネコブセンチュウ抵抗性植物の製造方法。
【請求項9】
請求項8に記載の方法によって生産されたネコブセンチュウ抵抗性植物。
【請求項10】
請求項9に記載のネコブセンチュウ抵抗性植物をトラップ植物として利用する工程を含む、ネコブセンチュウの防除方法。
【図3】


【図4】


【図5】


【図1】


【図2】


【図6】


【図7】




【図4】


【図5】


【図1】


【図2】


【図6】


【図7】


【公開番号】特開2011−83193(P2011−83193A)
【公開日】平成23年4月28日(2011.4.28)
【国際特許分類】
【出願番号】特願2009−236075(P2009−236075)
【出願日】平成21年10月13日(2009.10.13)
【出願人】(504150461)国立大学法人鳥取大学 (271)
【Fターム(参考)】
【公開日】平成23年4月28日(2011.4.28)
【国際特許分類】
【出願日】平成21年10月13日(2009.10.13)
【出願人】(504150461)国立大学法人鳥取大学 (271)
【Fターム(参考)】
[ Back to top ]

