ネフローゼ症候群の検査方法、並びにネフローゼ症候群の予防又は治療薬およびそのスクリーニング方法
【課題】ネフローゼ症候群を予測するための検査方法、およびネフローゼ症候群の予防又は治療薬のスクリーニング方法を提供する。
【解決手段】GLYPICAN-5遺伝子上に存在する塩基の一塩基多型または該塩基と連鎖不平衡にある塩基の一塩基多型を分析し、該分析結果に基づいてネフローゼ症候群を検査する。また、GLYPICAN-5の発現量を変化させる物質を選択することによりネフローゼ症候群の予防又は治療薬のスクリーニングを行う。
【解決手段】GLYPICAN-5遺伝子上に存在する塩基の一塩基多型または該塩基と連鎖不平衡にある塩基の一塩基多型を分析し、該分析結果に基づいてネフローゼ症候群を検査する。また、GLYPICAN-5の発現量を変化させる物質を選択することによりネフローゼ症候群の予防又は治療薬のスクリーニングを行う。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はネフローゼ症候群の検査方法及びそれに使用するプローブやプライマー、並びにネフローゼ症候群を予防又は治療するための医薬およびそのスクリーニング方法に関する。
【背景技術】
【0002】
ネフローゼ症候群は多量の蛋白尿と低蛋白血症等を呈することが知られている。ネフローゼ症候群には微小変化型のもの(minimal change nephritic syndrome: MC)、巣状糸球体硬化症(FSGS)、膜性腎症(MN)、膜性増殖性糸球体腎炎(MPGN)を発症するもの等が含まれる。
【0003】
ネフローゼ症候群においては、糸球体の濾過機能に異常が認められるが、他の腎症と異なり、尿細管には殆ど組織学的な変化が見られず、多くの症例では、急性に発症し、ステロイドや免疫抑制剤の投与により寛解する。再発しやすく、組織型によっては予後不良などの特徴を有する。
【0004】
ネフローゼ症候群においては、尿中に比較的低分子の血清蛋白質が多量に漏出するため、血清中の総蛋白質量およびアルブミン/グロブリン比が低下することが知られている。従って、ネフローゼ症候群の病態判定には、尿中蛋白・血清総蛋白質量及びアルブミン/グロブリン比を測定することが従来から行われている。しかし、ステロイド投与や安静食事療法等の治療により、腎臓糸球体の濾過機能が改善し、尿中への蛋白質の漏出が停止しても、血清総蛋白質量及びアルブミン/グロブリン比は、すぐに著しくは回復しない。それゆえ、これらの測定値にはネフローゼ症候群の治療効果等の病態があまり迅速には反映されず、定量性にも問題があった。そこで、ネフローゼ症候群をより感度よく正確に判定する方法の開発が要望されていた。
従来、先天性ネフローゼ症候群ではNPHS1, NPHS2, ACTN4などの原因遺伝子が同定されているが、実臨床の大多数を占める後天性ネフローゼ症候群では、多因子遺伝要因の関与が考えられており、いまだにほとんどの疾患感受性遺伝子が明らかになっていない。
【0005】
非特許文献1には、GPC5が細胞表面のプロテオグリカンであり、線維芽細胞増殖因子2(FGF-2)のシグナルを増強して中胚葉細胞の増殖に関与すること、そして、GPC5が横紋筋肉腫(Rhabdomyosarcoma)などの腫瘍のターゲット分子として期待できることが記載されている。しかしながらGPC5のネフローゼ症候群における関与については全く知られていない。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Cancer Research 67(1), 57-65, 2007
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、ネフローゼ症候群の発症や進行を正確に予測するための検査方法を提供することを課題とする。本発明はまた、ネフローゼ症候群の予防薬又は治療薬およびそのスクリーニング方法を提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは、ネフローゼ症候群に関連がある一塩基多型(SNP;single nucleotide polymorphism)を同定するため、解析を行った。その結果、GPC5遺伝子上に存在する塩基のSNPまたは該塩基と連鎖不平衡関係にあるSNPがネフローゼ症候群に関連があることを見出した。さらに、GPC5遺伝子の発現を抑制する二本鎖RNAがネフローゼ症候群の発症を抑制し、発症後にも症状を低減させることを見出し、GPC5遺伝子の発現あるいはGPC5の機能を抑制する物質がネフローゼ症候群の予防薬や治療薬として有用であることを見出し、本発明を完成するに至った。
【0009】
すなわち、本発明は以下の通りである。
(1)GPC5遺伝子上に存在する塩基のSNPまたは該塩基と連鎖不平衡にある塩基のSNPを分析し、当該分析結果に基づいてネフローゼ症候群を検査する方法。
(2)前記SNPが、配列番号1の塩基配列の塩基番号101番目の塩基に相当する塩基における多型である、(1)に記載の方法。
(3)配列番号1の塩基配列において、塩基番号101番目の塩基を含む10塩基以上の配列、又はその相補配列を有するネフローゼ症候群検査用プローブ。
(4)配列番号1のいずれかの塩基配列において、塩基番号101番目の塩基を含む領域を増幅することのできるネフローゼ症候群検査用プライマー。
(5)GPC5遺伝子またはGPC5遺伝子のプロモーターに連結されたレポーター遺伝子を発現する細胞に医薬候補物質を添加する工程、GPC5遺伝子またはレポーター遺伝子の発現量を測定する工程、及び前記発現量を低下させる物質を選択する工程を含む、ネフローゼ症候群の予防薬又は治療薬をスクリーニングする方法。
(6)GPC5遺伝子またはGPC5遺伝子産物の発現量を測定する工程を含む、ネフローゼ症候群の検査方法。
(7)GPC5遺伝子発現抑制物質またはGPC5機能抑制物質を含むネフローゼ症候群を予防または治療するための医薬。
(8)GPC5遺伝子発現抑制物質がGlypican-5遺伝子に対する二本鎖RNAである、(7)に記載の医薬。
【発明の効果】
【0010】
本発明の検査方法によればネフローゼ症候群の発症リスクや進行を正確に予測することができるため、蛋白尿をコントロールすることができ、腎障害進行を抑制することができる。これにより、腎機能廃絶により高額医療の代名詞である人工腎臓治療を必要とする患者数を減じることが可能となる。また、二本鎖RNAなどのGPC5遺伝子の発現を阻害する物質は糸球体における蛋白質の透過性を減少させる作用を有しており、ネフローゼ症候群の新規な予防薬または治療薬として有用である。
【図面の簡単な説明】
【0011】
【図1】各genotypeにおけるGPC5遺伝子の発現量を示す図。縦軸は任意ユニットである。
【図2】(A)RT-PCRによるsiRNAのGPC5遺伝子発現抑制の確認(電気泳動写真)。(B)GEC-T細胞を用いた蛋白質透過性評価系の模式図。(C)siRNAの蛋白質透過性に与える影響の評価。controlはsiRNA非添加、negativeはnegative control siRNAの添加、siRNAはGPC5特異的siRNAの添加を示す。縦軸は蛋白質透過濃度を示す。
【図3】GPC5のFGF-2とFGFRの結合を促進する作用に対する、siRNAの効果を示す図。(A)がラット糸球体上皮細胞株、(B)がヒト大腸癌細胞株での結果である。
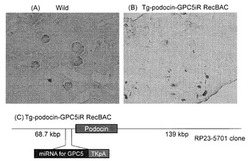
【図4】抗GPC5抗体を用いたマウス腎臓免疫組織染色の写真。(A)野生型マウス、(B)GPC5糸球体特異的ノックダウンマウス。(C)はノックダウンマウス作製に用いたBACコンストラクトを示す。
【図5】野生型マウス(GPC5特異的siRNA投与、非投与)およびGPC5糸球体特異的ノックダウンマウスにおける腎炎誘発刺激(PAN+bFGF)後のアルブミンクレアチニン比(ACR)および尿総蛋白量(uTP)の変動を示す図。
【図6】野生型マウスおよびGPC5糸球体特異的ノックダウンマウスにおける腎炎誘発刺激(PAN+bFGF)後のアルブミン血中のアルブミン(ALB)濃度を示す図。野生型マウスでは10日目の測定後にGPC5特異的siRNAを投与した。
【図7】野生型マウス(GPC5特異的siRNA投与、非投与)およびGPC5糸球体特異的ノックダウンマウスにおける巣状分節状硬化の割合を示す図。
【発明を実施するための形態】
【0012】
<1>SNPに基づく検査方法
本発明の検査方法は、GPC5遺伝子上に存在する塩基のSNPまたは該塩基と連鎖不平衡にある塩基のSNPを分析し、該分析に基づいてネフローゼ症候群を検査する方法(検査データを得る方法)である。ネフローゼ症候群は、蛋白尿(1日蛋白量3.5g以上持続)と低蛋白血症(血清総蛋白量6.0g/100ml以下)を特徴とする疾患であり、MC、FSGS、MN、MPGN、糖尿病性腎症(DMN)などを含むが、本発明の検査法によれば、特に四大組織病変であるMCNS、FSGS、MN、MPGNを正確に検出することができる。なお、本発明において、「検査」とは将来、ネフローゼ症候群になるかどうかを予測するための検査、及びネフローゼ症候群の程度が重症化するかどうかを予測するための検査を含む。
【0013】
GPC5遺伝子としては、ヒトGPC5遺伝子が好ましく、例えば、GenBank Accession No. NC_000013.9の90848929 .. 92317490に登録された配列を有する遺伝子を挙げることができる。ただし、該遺伝子は人種の違いなどによって1又は複数の塩基に置換や欠失等が存在する可能性があるため、上記配列の遺伝子に限定されない。
ネフローゼ症候群に関連するGPC5遺伝子のSNPは特に制限されないが、例えば、イントロン2に存在するrs16946160が挙げられる。rs16946160はNational Center for Biotechnology InformationのdbSNPデータベース(//www.ncbi.nlm.nih.gov/projects/SNP/)の登録番号を示す。
【0014】
rs16946160はGenBank Accession No. NT_009952.14の5293489番目(NC_000013.9の91001814)の塩基におけるグアニン(G)/アデニン(A)の多型を意味し、このアリルがAである場合はネフローゼ症候群になる確率が高い。また、遺伝子型を考慮して解析した場合は、rs16946160がAA>AG>GGの順でネフローゼ症候群になる確率が高い。
なお、rs16946160について、SNP塩基及びその前後100bpの領域を含む合計201bpの長さの配列を、配列番号1に示した(101番目の塩基が多型を有する)。
この塩基に相当する多型を本発明の方法によって解析する。ここで、「相当する」とは、ヒトGPC5遺伝子上の上記配列を有する領域中の該当塩基を意味し、仮に、人種の違いなどによって上記配列がSNP以外の位置で若干変化したとしても、その中の該当塩基を解析することも含む。
【0015】
上記SNPの塩基の種類を調べることによって、ネフローゼ症候群を検査することができる。なお、GPC5遺伝子の配列はセンス鎖を解析してもよいし、アンチセンス鎖を解析してもよい。例えば、rs16946160の場合、センス鎖を解析する場合の多型はA/Gであるが、アンチセンス鎖を解析する場合の多型はT/Cとなる。
また、本発明において解析する塩基は上記SNPに限定されず、上記の塩基と連鎖不平衡関係にある多型を分析してもよい。ここで「上記の塩基と連鎖不平衡にある多型」とは、上記の多型とr2>0.5の関係を満たす塩基をいう。
【0016】
GPC5遺伝子のSNPの解析に用いる試料としては、染色体DNAを含む試料であれば特に制限されないが、例えば、血液、尿等の体液サンプル、細胞、毛髪等の体毛、爪などが挙げられる。SNPの解析にはこれらの試料を直接使用することもできるが、これらの試料から染色体DNAを常法により単離し、これを用いて解析することが好ましい。
【0017】
GPC5遺伝子のSNPの解析は、通常のSNP解析方法によって行うことができる。例えば、シークエンス解析、PCR、ハイブリダイゼーションなどが挙げられるが、これらに限定されない。
【0018】
シークエンスは通常の方法により行うことができる。具体的には、多型を示す塩基の5’側 数十塩基の位置に設定したプライマーを使用してシークエンス反応を行い、その解析結果から、該当する位置がどの種類の塩基であるかを決定することができる。なお、シークエンスを行う場合、あらかじめ多型を含む断片をPCRなどによって増幅しておくことが好ましい。
【0019】
また、PCRによる増幅の有無を調べることによっても解析することができる。例えば、多型を示す塩基を含む領域に対応する配列を有し、かつ、各多型に対応するプライマーをそれぞれ用意する。それぞれのプライマーを使用してPCRを行い、増幅産物の有無によってどのタイプの多型であるかを決定することができる。
【0020】
また、多型を含むDNA断片を増幅し、増幅産物の電気泳動における移動度の違いによってどのタイプの多型であるかを決定することもできる。このような方法としては、例えば、PCR-SSCP(single−strand conformation polymorphism)法(Genomics. 1992 Jan 1; 12(1): 139−146.)が挙げられる。具体的には、まず、GPC5遺伝子の多型部位を含むDNAを増幅し、増幅したDNAを一本鎖DNAに解離させる。次いで、解離させた一本鎖DNAを非変性ゲル上で分離し、分離した一本鎖DNAのゲル上での移動度の違いによってどのタイプの多型であるかを決定することができる。
【0021】
さらに、多型を示す塩基が制限酵素認識配列に含まれる場合は、制限酵素による切断の有無によって解析することもできる(RFLP法)。この場合、まず、DNA試料をPCRで増幅し、それを制限酵素により切断する。次いで、DNA断片を分離し、検出されたDNA断片の大きさによってどのタイプの多型であるかを決定することができる。
【0022】
ハイブリダイゼーションの有無を調べることによって多型の種類を解析することも可能である。すなわち、各塩基に対応するプローブを用意し、いずれのプローブにハイブリダイズするかを調べることによってSNPがいずれの塩基であるかを調べることもできる。
【0023】
<2>ネフローゼ症候群検査用試薬
本発明はまた、ネフローゼ症候群を検査するためのプライマーやプローブなどの検査試薬を提供する。このようなプローブとしては、GPC5遺伝子における上記多型部位を含み、ハイブリダイズの有無によって多型部位の塩基の種類を判定できるプローブが挙げられる。具体的には、配列番号1において塩基配列の101番目の塩基を含む配列、又はその相補配列を有する10塩基以上の長さのプローブが挙げられる。プローブの長さはより好ましくは、15〜35塩基であり、さらに好ましくは20〜35塩基である。このようなプローブとしては、例えば、配列番号10またはその相補配列を含むプローブが例示される。
【0024】
また、プライマーとしては、GPC5遺伝子における上記多型部位を増幅するためのPCRに用いることのできるプライマー、又は上記多型部位を配列解析(シークエンシング)するために用いることのできるプライマーが挙げられる。具体的には、配列番号1の塩基配列の101番目の塩基含む領域を増幅したりシークエンシングしたりすることのできるプライマーが挙げられる。このようなプライマーの長さは10〜50塩基が好ましく、15〜35塩基がより好ましく、20〜35塩基がさらに好ましい。
上記多型部位をシークエンシングするためのプライマーとしては、上記塩基の5’側領
域、好ましくは30〜100塩基上流の配列を有するプライマーや、上記塩基の3’側領域、好ましくは30〜100塩基下流の領域に相補的な配列を有するプライマーが例示される。PCRによる増幅の有無で多型を判定するために用いるプライマーとしては、上記塩基を含む配列を有し、上記塩基を3’側に含むプライマーや、上記塩基を含む配列の相補配列を有し、上記塩基の相補塩基を3’側に含むプライマーなどが例示される。
このようなプライマーとしては、配列番号11の塩基配列を含むプライマーが例示できる。
なお、本発明の検査用試薬はこれらのプライマーやプローブに加えて、PCR用のポリメラーゼやバッファー、ハイブリダイゼーション用試薬などを含むものであってもよい。
【0025】
<3>ネフローゼ症候群の予防薬又は治療薬のスクリーニング方法
本発明者の研究により、rs16946160はイントロンに存在しGPC5の発現量に影響を与えること、およびGPC5遺伝子の発現量がネフローゼ症候群モデルで増加していることが示唆された。以上のことから、GPC5遺伝子の発現を低下させるあるいはGPC5の機能を阻害する物質をスクリーニングすることにより、ネフローゼ症候群の予防薬又は治療薬となりうる候補物質を得ることができる。
すなわち、本発明のスクリーニング方法としては、GPC5遺伝子またはGPC5遺伝子のプロモーターに連結されたレポーター遺伝子を発現する細胞に医薬候補物質を添加する工程、GPC5遺伝子またはレポーター遺伝子の発現量を測定する工程、及び前記発現量を低下させる物質を選択する工程を含む、ネフローゼ症候群の予防薬又は治療薬のスクリーニング方法が挙げられる。
【0026】
GPC5遺伝子を発現する細胞としては、糸球体上皮細胞が好ましく、GEC-T細胞(J Am Soc Nephrol 13:2027-36,2002)などを用いることができる。
【0027】
GPC5遺伝子のプロモーターに連結されたレポーター遺伝子を用いる場合、GPC5遺伝子のプロモーターとしては、該遺伝子の転写開始点の上流約2kbpを含む領域が好ましく、上流約5kbpを含む領域がより好ましい。プロモーターの配列情報はGPC5遺伝子のゲノム配列(NC_000013.9)より入手できる。
レポーター遺伝子としては、ルシフェラーゼ遺伝子、GFP遺伝子、クロラムフェニコールアセチルトランスフェラーゼ遺伝子などが例示できる。これらのレポーター遺伝子をGPC5遺伝子のプロモーターに連結し、これを哺乳類細胞に遺伝子を導入するために用いられるプラスミドに組み込み、リポフェクションなどの通常の方法にて細胞にトランスフェクションする。
上記のようなGPC5遺伝子を発現する細胞、又はレポーター遺伝子が導入された細胞に医薬候補物質を添加し、GPC5遺伝子またはレポーター遺伝子の発現量を測定する。
【0028】
医薬候補物質としては特に制限はなく、例えば、低分子合成化合物であってもよいし、天然物に含まれる化合物であってもよい。また、ペプチドや核酸であってもよい。スクリーニングには個々の被検物質を用いてもよいが、これらの物質を含む化合物ライブラリーを用いてもよい。候補物質の中から、GPC5遺伝子又はレポーター遺伝子の発現量を(非添加時と比べて)低下させるものを選択することにより、ネフローゼ症候群薬の候補物質を得ることができる。
【0029】
GPC5遺伝子の発現量はRT−PCR、定量PCR、ノーザンブロット、ELISA、Western blotting、In situ hybridization、免疫組織染色などの方法により測定することができる。
レポーター遺伝子の発現量はレポーター遺伝子の種類にもよるが、蛍光強度や発光強度、放射能強度などによって測定することができる。
GPC5遺伝子またはレポーター遺伝子の発現量を変化させた物質をネフローゼ症候群治療
薬の候補物質として選択することができる。
【0030】
<4>ネフローゼ症候群治療薬または予防薬
本発明は、GPC5遺伝子発現抑制物質またはGPC5機能抑制物質を含むネフローゼ症候群の治療または予防のための医薬を提供する。
ここで、GPC5遺伝子発現抑制物質としては、GPC5遺伝子発現抑制作用を有する、二本鎖RNA、アンチセンス核酸、低分子化合物などが挙げられる。
GPC5遺伝子発現抑制作用を有する二本鎖RNAとしては、RNA干渉(RNA interference)によりGPC5遺伝子の発現を抑制するGPC5遺伝子に対する二本鎖RNA(GPC5遺伝子の部分配列及びその相補鎖からなる二本鎖RNA)が挙げられる。具体的には、このようなGPC5遺伝子に対する二本鎖RNAを細胞内に導入すると内在性GPC5遺伝子から転写されたmRNAが分解されて、結果としてその細胞でのGPC5の遺伝子発現が特異的に抑制される。この手法は、哺乳動物細胞などにおいても確認されている(Hannon,GJ., Nature (2002) 418,244-251 (review);特表2002−516062号公報;特表平8−506734号公報)。
本発明において用いることができる二本鎖RNA(short-interfering RNA:siRNA)は、GPC5遺伝子のコード領域の塩基配列(例えば配列番号8)のうちの10〜50個の連続する塩基配列、好ましくは15〜35個の連続する塩基配列、より好ましくは19〜27個の連続する塩基配列、さらに好ましくは21〜23個の連続する塩基配列とその相補鎖からなるものである。GPC5遺伝子発現抑制物質として用いることのできるsiRNAとしては配列番号4と5からなるsiRNAが挙げられるが、これに限定されず、GPC5遺伝子の他の領域についても探索アルゴリズムを使って特定して使用することができる。
なお、二本鎖RNAは、2つの別個の鎖から構成される1つの二本鎖RNA分子であってもよいが、1本の鎖がステムループ構造をとることにより形成される二本鎖RNA分子であってもよい。またそれぞれの鎖の3'側に2塩基のオーバーハングを持たせることにより、遺伝子の発現抑制作用を増強することもできる(WO01/75164号パンフレット)。
【0031】
GPC5遺伝子発現抑制作用を有するアンチセンス核酸としては、GPC5遺伝子の塩基配列(例えば配列番号8)の一部に相補的な塩基配列を有するアンチセンスオリゴヌクレオチドが挙げられる。アンチセンスオリゴヌクレオチドはホスホロチオエートなどにより修飾されたものであってもよい。アンチセンスオリゴヌクレオチドの長さは特に制限されないが、15〜40merが好ましく、20〜30merがより好ましい。
【0032】
GPC5遺伝子発現抑制作用を有する低分子化合物は上記のGPC5遺伝子またはGPC5遺伝子のプロモーターに連結されたレポーター遺伝子を発現する細胞を用いたスクリーニング方法によって得ることができる。
GPC5機能抑制物質としては、GPC5に対する抗体やGPC5の部分タンパク質などが挙げられる。GPC5の機能を抑制するかどうかは、GPC5のFGF-2とFGF受容体(FGFR)の相互作用を促進する機能を抑制することなどにより確かめることができる。
【0033】
本発明のネフローゼ症候群治療または予防薬においては、GPC5遺伝子発現抑制物質をそのまま使用してもよいが、好ましくは、GPC5遺伝子発現抑制物質を薬学的に許容される担体に配合して用いる。薬学的に許容される担体としては、液体担体(例えば水、油、生理食塩水、デキストロース水溶液、エタノールなど)、固体担体(例えば、ゼラチン、デンプン、グルコース、ラクトース、スクロース、ステアリン酸ナトリウム、モノステアリン酸グリセロール、ケラチン、コロイド状シリカ、乾燥脱脂乳、グリセロール、水溶性フラーレンなど)が挙げられる。また、通常の医薬組成物に配合される補助剤、防腐剤、安定化剤、濃化剤、潤滑剤、着色剤、湿潤剤、乳化剤、及びpH緩衝剤などのうち適当なものを含有してもよい。
【0034】
本発明のネフローゼ症候群治療または予防薬が上記の二本鎖RNAまたはアンチセンス核酸を有効成分とする場合、これらの核酸分子を標的組織又は細胞に送達するために、ナノカプセル、ミクロスフェア、ビーズ、水中油型エマルジョン、ミセル、混合ミセル及びリポソームなどを送達系として用いることが好ましい。
【0035】
本発明のネフローゼ症候群治療または予防薬の投与方法は特に制限されないが、特に二本鎖RNAまたはアンチセンス核酸を有効成分とする場合は、注射又は送液管を用いた局所投与によって腎臓に投与することが好ましい。または、二本鎖RNAまたはアンチセンス核酸を有効成分とする場合、患者から得られた細胞に二本鎖RNAまたはアンチセンス核酸を導入し、その後、該細胞を患者に投与することによっても送達することができる。二本鎖RNAまたはアンチセンス核酸の細胞への導入は、リン酸カルシウム法、DEAE−デキストラン法、エレクトロポレーション、又はリポフェクションなどにより行うことができる。
【0036】
本発明のネフローゼ症候群治療または予防薬の投与量は、患者の年齢、性別、症状、投与経路、投与頻度、及び剤形などに応じて適宜設定されるが、当技術分野で慣用の方法(例えば疾患モデルを用いる試験)などを行って好適な投与量を設定することができる。例えば、有効成分の量として、0.1 mg/kg体重/日〜50mg/kg/日で投与することができる。
【0037】
<5>発現量に基づく検査方法
本発明はまた、GPC5遺伝子またはGPC5遺伝子産物の発現量を測定する工程を含む、ネフローゼ症候群の検査方法(検査データを得る方法)を提供する。GPC5遺伝子またはGPC5遺伝子産物(GPC5蛋白質)の発現量が健常人などの対照と比べて増加している場合、ネフローゼ症候群に罹患している、またはネフローゼ症候群の危険性が高いと判定することができる。
GPC5遺伝子の発現量は、RT−PCR、ノーザンブロット、マイクロアレイ法などで調べることができる。また、GPC5遺伝子産物の発現量はELISA、ウエスタンブロットなどで調べることができる。抗体は市販の抗体を用いることもできるし、GPC5蛋白質のアミノ酸配列(例えば配列番号9)の一部を抗原として作製された抗体を用いることもできる。GPC5のコード領域の塩基配列としてはGenBank Accession No. NM_004466(配列番号8)が例示され、この配列等を利用して発現解析用プライマーやプローブなどを設計または取得することができる。RT−PCRのプライマーとしては、例えば、配列番号2および3のプライマーセットが例示される。
検査に用いる試料は血液サンプル、あるいは尿サンプルなどが挙げられる。
【実施例】
【0038】
以下、本発明を実施例によりさらに具体的に説明する。但し、本発明はこれらの実施例に限定されない。
【0039】
1.ネフローゼ症候群に相関するSNPの同定
ネフローゼ症候群患者と対照患者
ネフローゼ症候群患者の3つの独立した集団(case 1(N=195)、case 2(N=231)、case 3(N=201))、ネフローゼ症候群患者ではない対照の3つの独立した集団(control 1(N=1546)、control 2(N=1548)、control 3(N=300))を用いてネフローゼ症候群に相関するSNPの探索を行った。case 1、case 2、control 1およびcontrol 2はRIKEN Biobankに登録されたサンプルを使用し、case 3は福島県立医大で収集されたネフローゼ症候群患者サンプルを使用した。control 3は東京大学付属病院が所有する健常人サンプルを使用した。
なお、これらのサンプルの収集については、いずれもインフォームドコンセントが得ら
れている。
case 1〜3は以下の基準で選択した。
(1)蛋白尿:1日蛋白量3.5g以上を持続する
(2)低蛋白血症:血清総蛋白量は6.0g/100ml以下
(低アルブミン血症とした場合は血清アルブミン量3.0g/100ml以下)
control 1、2はネフローゼ症候群以外の疾患、具体的には、2型糖尿病、気管支喘息、心筋梗塞、乳癌、バセドー氏病、脳梗塞、脳動脈瘤、骨粗しょう症、心疾患、不安定狭心症、花粉症、閉塞性動脈硬化症、肺気腫、アトピー性皮膚炎、胃癌または肝硬変の患者である。
case 1〜3とcontrol 1〜3の内訳は表1のとおりである。
【0040】
【表1】

年齢は平均値±標準偏差で示す。N.Aは特定できていないことを示す。etcは原発性ネフローゼゼ症候群のうち4大組織診断以外のもの、secondaryは2次性ネフローゼ症候群を示す。
MC: 微小変化型; FSGS, 巣状分節状糸球体硬化症; MN, 膜性腎症; MPGN; 膜性増殖性糸球体腎炎
【0041】
SNP の解析は直接シークエンス、TaqMan(商標)SNP genotyping assayまたはDigitagIItm assay(Analytical Biochemistry 346(2):281-288)により行った。
まず、case 1とcontrol 1、case 2とcontrol 2を用いてネフローゼ症候群に相関するSNPの探索を試みたところ、case 1とcontrol 1の間、およびcase 2とcontrol 2の間でともに有意であり、疾患感受性アリルの逆転をみない90 個のSNP を得た。
ネフローゼ症候群は、数多くの病態を含むため単にネフローゼ症候群としてまとめてしまうとターゲットとなる病態があいまいになってしまうことが考えられたため、全ネフローゼ症候群の中から原発性ネフローゼ症候群・四大組織病変(微小変化群、巣状糸球体硬化症、膜性腎症、膜性増殖性糸球体腎炎)を抽出し、微小変化群、巣状糸球体硬化症、膜性腎症、膜性増殖性糸球体腎炎の各グループにおけるP 値およびオッズ比(OR)を比較することによりネフローゼの中でもより純粋な病態に関連するSNP を得ることを試みた。
これらのサブグループのうち1グループ以上でP 値が0.01 未満であったSNP は48 個あった。そのうち4 個はタイピングミスであったため、44 個を有意なSNP とした。
【0042】
このように導き出したSNP の中から原発性ネフローゼ症候群・四大組織病変の各々上位10 個のSNP(5 個重複のため全15 個)を選択した。
これらについて、case 3とcontrol 3の間で検討したところ、3 個のSNP で再現性が確認された。
このうちの一つはGPC5遺伝子のイントロン2に存在するSNP(rs16946160)であった。このSNPについて、case 1とcontrol 1(1st panel)、case 2とcontrol 2(2nd panel)
、case 3とcontrol 3(3rd panel)で比較した結果を表2に示す。上段はcase として全ネフローゼ症候群を、下段はcaseとして四大組織病変のみを採用した。
この結果から、rs16946160については、全ネフローゼ症候群:controlでオッズ比が1.273、四大組織病変:controlでオッズ比が1.376を示し、rs16946160のAアレルがネフローゼ症候群の有意なリスクアレルであることが判明した。
【0043】
【表2】

MAF:minor allele frequency、OR:odds ratio
【0044】
rs16946160はイントロン領域にあるため、各genotypeを有する健常人の末梢血より得られたtotal RNA を用いて合成したcDNAに対し、エクソン2と3からイントロン2を挟むPCRにてsplicing variantのスクリーニングを行ったが、各genotypeにおいてsplicingの違いは認められなかった(データは示さず)。
【0045】
GPC5 mRNA発現量の解析
各genotype を有する健常人の末梢血のtotal RNAから合成したcDNA に対し、GPC5についてrealtime PCR を行い、β-actin との比をもってGPC5遺伝子の転写レベルを比較したところ、genotypeA/Aをもつ健常人においてGPC5のmRNAレベルが高い事が示された(図1)。すなわちGPC5遺伝子の発現上昇が、ネフローゼ症候群の発症を促進させる可能性が示唆された。
なお、realtime PCRにおいては、ヒトGPC5増幅用のプライマーとして、配列番号2および3を用い、検出装置としてABI Prism 3700 Real Time PCR System (Applied BioSystems)を用いた。
【0046】
なお、培養糸球体上皮細胞(GEC-T)と培養近位尿細管上皮細胞(mProx)におけるGPC5遺伝子の発現量を比較したところ、GPC5は前者においてに高発現していることがわかった(データは示さず)。さらに、抗GPC5抗体(R&D systems, MAB2607)を用いて免疫組織染色を行ったところ、GPC5の糸球体への集積が認められた(図4A)。
【0047】
細胞系でのGPC5の機能解析
培養ラット糸球体上皮細胞(GEC-T)をGPC5遺伝子に対するsiRNAまたは陰性コントロールsiRNAを添加し(40pmol/ml)、100%コンフルエントになるまで培養しPBSで2 倍希釈し、コラーゲンtype Iでコーティングされたフィルター(日本BD:BioCoat コラーゲン I カ
ルチャーインサート、ポアサイズ0.4μm、1,600,000/cm2)上に播き、37℃で18 時間培養した後、細胞層上下に0.6g/dl のアルブミン濃度差を付けた液相を配し、さらに8 時間後における濃度勾配差をもって、蛋白透過性検討を評価可能な実験系を確立した(図2B)。
なお、GEC-T は既にJAm Soc Nephrol 13:2027-36,2002 において報告されており、arborization を有し、Nephrin 及びVEGF 121 の発現を認め糸球体上皮細胞に特異的なC-3 及び5-1-2 モノクローナル抗体の免染も確認されている。
その結果、siRNA非添加(control)および陰性コントロールsiRNA 添加時と比べて、GPC5遺伝子に対するsiRNAを加えてGPC5遺伝子の発現抑制した場合に蛋白透過性が減少した(図2C)。
ここで、GPC5遺伝子に対するsiRNAとして配列番号4(センス鎖)と配列番号5(アンチセンス鎖)からなる二本鎖RNA(GPC5特異的siRNA)を用いたが、これによってGPC5遺伝子の発現を20%程度まで抑制できることは確認されている(図2A)。
なお、陰性コントロールsiRNAとしては、Stealth RNAi Negative Control Medium GC Duplex #2 (Invitrogen, Carlsbad, CA) を用いた。GPC5特異的siRNAと陰性コントロールsiRNAの添加にはLipofectamine 2000 (Invitrogen, Carlsbad, CA)を使用した。
【0048】
in vivo実験によるGPC5の機能解析
GPC5遺伝子の糸球体特異的ノックダウンマウスを作製した。
具体的には、図4Cに示すように、大腸菌人工染色体(BACクローン)の糸球体特異的遺伝子であるpodocinプロモーターの下流にチミジンキナーゼのポリA配列(TKpA)およびマウスGPC5のmRNA配列(NM_175500.3)の3か所に対するRNAi効果を有するmicro RNA (miR RNA)を発現させるための二本鎖RNA発現配列である
(1−1)TGCTGTTCAGGAGGGCCCTACTGCACGTTTTGGCCACTGACTGACGTGCAGTAGCCCTCCTGAA(配列番号6)
(1−2)CCTGTTCAGGAGGGCTACTGCACGTCAGTCAGTGGCCAAAACGTGCAGTAGGGCCCTCCTGAAC(配列番号7)
(2−1)TGCTGCAAACCTGAAGATCAGGTCCTGTTTTGGCCACTGACTGACAGGACCTGCTTCAGGTTTG(配列番号12)
(2−2)CCTGCAAACCTGAAGCAGGTCCTGTCAGTCAGTGGCCAAAACAGGACCTGATCTTCAGGTTTGC(配列番号13)
(3−1)TGCTGAATTTCTGCCCATTGAGGTGAGTTTTGGCCACTGACTGACTCACCTCAGGGCAGAAATT(配列番号14)
(3−2)CCTGAATTTCTGCCCTGAGGTGAGTCAGTCAGTGGCCAAAACTCACCTCAATGGGCAGAAATTC(配列番号15)
の3組をセルフアニーリングさせたものをクローニングした。常法により得られたBACコンストラクト(Tg-podocin-GPC5iR RecBAC)をマウスのES細胞に導入して糸球体特異的にGPC5遺伝子発現が抑制されたマウス(GPC5糸球体特異的ノックダウンマウス)を作製した。
得られたGPC5糸球体特異的ノックダウンマウスについて、抗GPC5抗体を用いて腎臓の組織染色を行ったところ、糸球体においてGPC5の発現が著しく低下していることが確認できた(図4B)。
【0049】
野生型マウス(BDF1マウス)および上記GPC5糸球体特異的ノックダウンマウスにおいて、ピューロマイシン(PAN)(300 mg/kg 皮下投与)と塩基性線維芽細胞増殖因子(bFGF)投与(250 μg/kg 静脈内投与)を投与することにより、腎炎を誘発した。その結果、図5に示されるように、野生型マウスでは尿中アルブミンクレアチニン比(ACR)および尿総蛋白量(uTP)が上昇したのに対し、GPC5糸球体特異的ノックダウンマウスではこれらの値の上昇がみられなかった。
【0050】
また、野生型マウスに上記GPC5特異的siRNAを(400μg/PBS 0.8 ml 静注)投与し、尿
中アルブミンクレアチニン比(ACR)および尿中蛋白(uTP)の経時変化を調べたところ、siRNA非投与の野生型マウスにおいて腎炎誘発後約10〜12日に見られるACRおよびuTPの大幅な増加は見られず、GPC5特異的siRNAの投与により腎炎の症状が抑制できることがわかった。
【0051】
さらに、野生型マウスおよびGPC5糸球体特異的ノックダウンマウスにおいて、血液を採取し、血液中のアルブミンの量を測定した。その結果、図6に示すように、野生型マウスでは腎炎誘発により血液中のアルブミン(ALB)の量が減少した(腎炎誘発10日後)のに対し、GPC5糸球体特異的ノックダウンマウスでは血液中のALBの量は低下しなかった。野生型マウスについても、腎炎誘発10日後に上記GPC5特異的siRNAを投与したところ、投与から11日後(腎炎誘発21日後)では血液中のALBの量が回復した。
【0052】
また、野生型マウス(GPC5特異的siRNA投与(腎炎誘発後9日目にsiRNA投与)および非投与)、並びにGPC5糸球体特異的ノックダウンマウスにおいて、腎炎誘発後28日後に腎臓を摘出して腎臓の組織染色(PAS染色およびMT染色)を行った。PAS染色とMT染色の結果から糸球体の巣状分節状硬化の程度を算出した。結果を図7に示す。それによると、GPC5糸球体特異的ノックダウンマウスでは糸球体の巣状分節状硬化はほとんど見られなかった。また、GPC5特異的siRNA投与マウスにおいても、非投与マウスと比べて重度(75〜100%)の巣状分節状硬化の割合が減少した。
【0053】
以上の結果から、GPC5遺伝子のSNPをタイピングすることによりネフローゼ症候群発症の可能性を予測できること、およびsiRNAなどのGPC5発現抑制物質を用いることによりネフローゼ症候群の治療及び予防ができることがわかった。
【0054】
なお、本発明者は、GPC5遺伝子産物がFGF-2とFGFRの結合を促進すること、およびGPC5遺伝子の抑制によりp21遺伝子の発現が増加してG0/G1 期の比率が増加し、G2/M 期の比率が有意に抑制されることを確認している。これらのことから、GPC5発現の増加によりFGF シグナル伝達の活性化とp21の抑制を介して、糸球体上皮細胞を増殖相へと移行させ、これが糸球体における障壁機能を形成している糸球体上皮細胞の構築を崩壊へと導き、tight junction を障害して蛋白尿の原因の一つとなることが考えられた。
【0055】
また、FGF-2とFGFRの結合に対するGPC5特異的siRNAの効果を細胞系で調べた。具体的には、ビオチンで標識したbFGFを培養細胞メディウムに加えてFGFRに結合させ、残存したbFGFをピコエリスリン(PE)標識ストレプトアビジンで検出し、FGFの結合能を、陰性コントロールsiRNA(Stealth RNAi Negative Control Medium GC Duplex #2)またはGPC5特異的siRNA存在下で比較した。結果を図3に示す。(A)がラット糸球体上皮細胞株、(B)がヒト大腸癌細胞株での結果である。GPC5特異的siRNAの添加により、FGF-2とFGFRの結合が減少していることがわかる。
なお、GPC5特異的siRNAは配列番号4と5からなるsiRNAを使用した。なお、この配列はヒトとマウスで共通の配列に対するsiRNAでありヒトでも同配列を使用する事が好まれるが、同様にGPC5発現を抑制しうるmiRNAやsiRNAでも同様の効果が期待できる。
これによりヒトにおいてもsiRNAなどのGPC5発現抑制物質を用いることによりネフローゼ症候群の治療及び予防ができることがわかった。
【技術分野】
【0001】
本発明はネフローゼ症候群の検査方法及びそれに使用するプローブやプライマー、並びにネフローゼ症候群を予防又は治療するための医薬およびそのスクリーニング方法に関する。
【背景技術】
【0002】
ネフローゼ症候群は多量の蛋白尿と低蛋白血症等を呈することが知られている。ネフローゼ症候群には微小変化型のもの(minimal change nephritic syndrome: MC)、巣状糸球体硬化症(FSGS)、膜性腎症(MN)、膜性増殖性糸球体腎炎(MPGN)を発症するもの等が含まれる。
【0003】
ネフローゼ症候群においては、糸球体の濾過機能に異常が認められるが、他の腎症と異なり、尿細管には殆ど組織学的な変化が見られず、多くの症例では、急性に発症し、ステロイドや免疫抑制剤の投与により寛解する。再発しやすく、組織型によっては予後不良などの特徴を有する。
【0004】
ネフローゼ症候群においては、尿中に比較的低分子の血清蛋白質が多量に漏出するため、血清中の総蛋白質量およびアルブミン/グロブリン比が低下することが知られている。従って、ネフローゼ症候群の病態判定には、尿中蛋白・血清総蛋白質量及びアルブミン/グロブリン比を測定することが従来から行われている。しかし、ステロイド投与や安静食事療法等の治療により、腎臓糸球体の濾過機能が改善し、尿中への蛋白質の漏出が停止しても、血清総蛋白質量及びアルブミン/グロブリン比は、すぐに著しくは回復しない。それゆえ、これらの測定値にはネフローゼ症候群の治療効果等の病態があまり迅速には反映されず、定量性にも問題があった。そこで、ネフローゼ症候群をより感度よく正確に判定する方法の開発が要望されていた。
従来、先天性ネフローゼ症候群ではNPHS1, NPHS2, ACTN4などの原因遺伝子が同定されているが、実臨床の大多数を占める後天性ネフローゼ症候群では、多因子遺伝要因の関与が考えられており、いまだにほとんどの疾患感受性遺伝子が明らかになっていない。
【0005】
非特許文献1には、GPC5が細胞表面のプロテオグリカンであり、線維芽細胞増殖因子2(FGF-2)のシグナルを増強して中胚葉細胞の増殖に関与すること、そして、GPC5が横紋筋肉腫(Rhabdomyosarcoma)などの腫瘍のターゲット分子として期待できることが記載されている。しかしながらGPC5のネフローゼ症候群における関与については全く知られていない。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Cancer Research 67(1), 57-65, 2007
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は、ネフローゼ症候群の発症や進行を正確に予測するための検査方法を提供することを課題とする。本発明はまた、ネフローゼ症候群の予防薬又は治療薬およびそのスクリーニング方法を提供することを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは、ネフローゼ症候群に関連がある一塩基多型(SNP;single nucleotide polymorphism)を同定するため、解析を行った。その結果、GPC5遺伝子上に存在する塩基のSNPまたは該塩基と連鎖不平衡関係にあるSNPがネフローゼ症候群に関連があることを見出した。さらに、GPC5遺伝子の発現を抑制する二本鎖RNAがネフローゼ症候群の発症を抑制し、発症後にも症状を低減させることを見出し、GPC5遺伝子の発現あるいはGPC5の機能を抑制する物質がネフローゼ症候群の予防薬や治療薬として有用であることを見出し、本発明を完成するに至った。
【0009】
すなわち、本発明は以下の通りである。
(1)GPC5遺伝子上に存在する塩基のSNPまたは該塩基と連鎖不平衡にある塩基のSNPを分析し、当該分析結果に基づいてネフローゼ症候群を検査する方法。
(2)前記SNPが、配列番号1の塩基配列の塩基番号101番目の塩基に相当する塩基における多型である、(1)に記載の方法。
(3)配列番号1の塩基配列において、塩基番号101番目の塩基を含む10塩基以上の配列、又はその相補配列を有するネフローゼ症候群検査用プローブ。
(4)配列番号1のいずれかの塩基配列において、塩基番号101番目の塩基を含む領域を増幅することのできるネフローゼ症候群検査用プライマー。
(5)GPC5遺伝子またはGPC5遺伝子のプロモーターに連結されたレポーター遺伝子を発現する細胞に医薬候補物質を添加する工程、GPC5遺伝子またはレポーター遺伝子の発現量を測定する工程、及び前記発現量を低下させる物質を選択する工程を含む、ネフローゼ症候群の予防薬又は治療薬をスクリーニングする方法。
(6)GPC5遺伝子またはGPC5遺伝子産物の発現量を測定する工程を含む、ネフローゼ症候群の検査方法。
(7)GPC5遺伝子発現抑制物質またはGPC5機能抑制物質を含むネフローゼ症候群を予防または治療するための医薬。
(8)GPC5遺伝子発現抑制物質がGlypican-5遺伝子に対する二本鎖RNAである、(7)に記載の医薬。
【発明の効果】
【0010】
本発明の検査方法によればネフローゼ症候群の発症リスクや進行を正確に予測することができるため、蛋白尿をコントロールすることができ、腎障害進行を抑制することができる。これにより、腎機能廃絶により高額医療の代名詞である人工腎臓治療を必要とする患者数を減じることが可能となる。また、二本鎖RNAなどのGPC5遺伝子の発現を阻害する物質は糸球体における蛋白質の透過性を減少させる作用を有しており、ネフローゼ症候群の新規な予防薬または治療薬として有用である。
【図面の簡単な説明】
【0011】
【図1】各genotypeにおけるGPC5遺伝子の発現量を示す図。縦軸は任意ユニットである。
【図2】(A)RT-PCRによるsiRNAのGPC5遺伝子発現抑制の確認(電気泳動写真)。(B)GEC-T細胞を用いた蛋白質透過性評価系の模式図。(C)siRNAの蛋白質透過性に与える影響の評価。controlはsiRNA非添加、negativeはnegative control siRNAの添加、siRNAはGPC5特異的siRNAの添加を示す。縦軸は蛋白質透過濃度を示す。
【図3】GPC5のFGF-2とFGFRの結合を促進する作用に対する、siRNAの効果を示す図。(A)がラット糸球体上皮細胞株、(B)がヒト大腸癌細胞株での結果である。
【図4】抗GPC5抗体を用いたマウス腎臓免疫組織染色の写真。(A)野生型マウス、(B)GPC5糸球体特異的ノックダウンマウス。(C)はノックダウンマウス作製に用いたBACコンストラクトを示す。
【図5】野生型マウス(GPC5特異的siRNA投与、非投与)およびGPC5糸球体特異的ノックダウンマウスにおける腎炎誘発刺激(PAN+bFGF)後のアルブミンクレアチニン比(ACR)および尿総蛋白量(uTP)の変動を示す図。
【図6】野生型マウスおよびGPC5糸球体特異的ノックダウンマウスにおける腎炎誘発刺激(PAN+bFGF)後のアルブミン血中のアルブミン(ALB)濃度を示す図。野生型マウスでは10日目の測定後にGPC5特異的siRNAを投与した。
【図7】野生型マウス(GPC5特異的siRNA投与、非投与)およびGPC5糸球体特異的ノックダウンマウスにおける巣状分節状硬化の割合を示す図。
【発明を実施するための形態】
【0012】
<1>SNPに基づく検査方法
本発明の検査方法は、GPC5遺伝子上に存在する塩基のSNPまたは該塩基と連鎖不平衡にある塩基のSNPを分析し、該分析に基づいてネフローゼ症候群を検査する方法(検査データを得る方法)である。ネフローゼ症候群は、蛋白尿(1日蛋白量3.5g以上持続)と低蛋白血症(血清総蛋白量6.0g/100ml以下)を特徴とする疾患であり、MC、FSGS、MN、MPGN、糖尿病性腎症(DMN)などを含むが、本発明の検査法によれば、特に四大組織病変であるMCNS、FSGS、MN、MPGNを正確に検出することができる。なお、本発明において、「検査」とは将来、ネフローゼ症候群になるかどうかを予測するための検査、及びネフローゼ症候群の程度が重症化するかどうかを予測するための検査を含む。
【0013】
GPC5遺伝子としては、ヒトGPC5遺伝子が好ましく、例えば、GenBank Accession No. NC_000013.9の90848929 .. 92317490に登録された配列を有する遺伝子を挙げることができる。ただし、該遺伝子は人種の違いなどによって1又は複数の塩基に置換や欠失等が存在する可能性があるため、上記配列の遺伝子に限定されない。
ネフローゼ症候群に関連するGPC5遺伝子のSNPは特に制限されないが、例えば、イントロン2に存在するrs16946160が挙げられる。rs16946160はNational Center for Biotechnology InformationのdbSNPデータベース(//www.ncbi.nlm.nih.gov/projects/SNP/)の登録番号を示す。
【0014】
rs16946160はGenBank Accession No. NT_009952.14の5293489番目(NC_000013.9の91001814)の塩基におけるグアニン(G)/アデニン(A)の多型を意味し、このアリルがAである場合はネフローゼ症候群になる確率が高い。また、遺伝子型を考慮して解析した場合は、rs16946160がAA>AG>GGの順でネフローゼ症候群になる確率が高い。
なお、rs16946160について、SNP塩基及びその前後100bpの領域を含む合計201bpの長さの配列を、配列番号1に示した(101番目の塩基が多型を有する)。
この塩基に相当する多型を本発明の方法によって解析する。ここで、「相当する」とは、ヒトGPC5遺伝子上の上記配列を有する領域中の該当塩基を意味し、仮に、人種の違いなどによって上記配列がSNP以外の位置で若干変化したとしても、その中の該当塩基を解析することも含む。
【0015】
上記SNPの塩基の種類を調べることによって、ネフローゼ症候群を検査することができる。なお、GPC5遺伝子の配列はセンス鎖を解析してもよいし、アンチセンス鎖を解析してもよい。例えば、rs16946160の場合、センス鎖を解析する場合の多型はA/Gであるが、アンチセンス鎖を解析する場合の多型はT/Cとなる。
また、本発明において解析する塩基は上記SNPに限定されず、上記の塩基と連鎖不平衡関係にある多型を分析してもよい。ここで「上記の塩基と連鎖不平衡にある多型」とは、上記の多型とr2>0.5の関係を満たす塩基をいう。
【0016】
GPC5遺伝子のSNPの解析に用いる試料としては、染色体DNAを含む試料であれば特に制限されないが、例えば、血液、尿等の体液サンプル、細胞、毛髪等の体毛、爪などが挙げられる。SNPの解析にはこれらの試料を直接使用することもできるが、これらの試料から染色体DNAを常法により単離し、これを用いて解析することが好ましい。
【0017】
GPC5遺伝子のSNPの解析は、通常のSNP解析方法によって行うことができる。例えば、シークエンス解析、PCR、ハイブリダイゼーションなどが挙げられるが、これらに限定されない。
【0018】
シークエンスは通常の方法により行うことができる。具体的には、多型を示す塩基の5’側 数十塩基の位置に設定したプライマーを使用してシークエンス反応を行い、その解析結果から、該当する位置がどの種類の塩基であるかを決定することができる。なお、シークエンスを行う場合、あらかじめ多型を含む断片をPCRなどによって増幅しておくことが好ましい。
【0019】
また、PCRによる増幅の有無を調べることによっても解析することができる。例えば、多型を示す塩基を含む領域に対応する配列を有し、かつ、各多型に対応するプライマーをそれぞれ用意する。それぞれのプライマーを使用してPCRを行い、増幅産物の有無によってどのタイプの多型であるかを決定することができる。
【0020】
また、多型を含むDNA断片を増幅し、増幅産物の電気泳動における移動度の違いによってどのタイプの多型であるかを決定することもできる。このような方法としては、例えば、PCR-SSCP(single−strand conformation polymorphism)法(Genomics. 1992 Jan 1; 12(1): 139−146.)が挙げられる。具体的には、まず、GPC5遺伝子の多型部位を含むDNAを増幅し、増幅したDNAを一本鎖DNAに解離させる。次いで、解離させた一本鎖DNAを非変性ゲル上で分離し、分離した一本鎖DNAのゲル上での移動度の違いによってどのタイプの多型であるかを決定することができる。
【0021】
さらに、多型を示す塩基が制限酵素認識配列に含まれる場合は、制限酵素による切断の有無によって解析することもできる(RFLP法)。この場合、まず、DNA試料をPCRで増幅し、それを制限酵素により切断する。次いで、DNA断片を分離し、検出されたDNA断片の大きさによってどのタイプの多型であるかを決定することができる。
【0022】
ハイブリダイゼーションの有無を調べることによって多型の種類を解析することも可能である。すなわち、各塩基に対応するプローブを用意し、いずれのプローブにハイブリダイズするかを調べることによってSNPがいずれの塩基であるかを調べることもできる。
【0023】
<2>ネフローゼ症候群検査用試薬
本発明はまた、ネフローゼ症候群を検査するためのプライマーやプローブなどの検査試薬を提供する。このようなプローブとしては、GPC5遺伝子における上記多型部位を含み、ハイブリダイズの有無によって多型部位の塩基の種類を判定できるプローブが挙げられる。具体的には、配列番号1において塩基配列の101番目の塩基を含む配列、又はその相補配列を有する10塩基以上の長さのプローブが挙げられる。プローブの長さはより好ましくは、15〜35塩基であり、さらに好ましくは20〜35塩基である。このようなプローブとしては、例えば、配列番号10またはその相補配列を含むプローブが例示される。
【0024】
また、プライマーとしては、GPC5遺伝子における上記多型部位を増幅するためのPCRに用いることのできるプライマー、又は上記多型部位を配列解析(シークエンシング)するために用いることのできるプライマーが挙げられる。具体的には、配列番号1の塩基配列の101番目の塩基含む領域を増幅したりシークエンシングしたりすることのできるプライマーが挙げられる。このようなプライマーの長さは10〜50塩基が好ましく、15〜35塩基がより好ましく、20〜35塩基がさらに好ましい。
上記多型部位をシークエンシングするためのプライマーとしては、上記塩基の5’側領
域、好ましくは30〜100塩基上流の配列を有するプライマーや、上記塩基の3’側領域、好ましくは30〜100塩基下流の領域に相補的な配列を有するプライマーが例示される。PCRによる増幅の有無で多型を判定するために用いるプライマーとしては、上記塩基を含む配列を有し、上記塩基を3’側に含むプライマーや、上記塩基を含む配列の相補配列を有し、上記塩基の相補塩基を3’側に含むプライマーなどが例示される。
このようなプライマーとしては、配列番号11の塩基配列を含むプライマーが例示できる。
なお、本発明の検査用試薬はこれらのプライマーやプローブに加えて、PCR用のポリメラーゼやバッファー、ハイブリダイゼーション用試薬などを含むものであってもよい。
【0025】
<3>ネフローゼ症候群の予防薬又は治療薬のスクリーニング方法
本発明者の研究により、rs16946160はイントロンに存在しGPC5の発現量に影響を与えること、およびGPC5遺伝子の発現量がネフローゼ症候群モデルで増加していることが示唆された。以上のことから、GPC5遺伝子の発現を低下させるあるいはGPC5の機能を阻害する物質をスクリーニングすることにより、ネフローゼ症候群の予防薬又は治療薬となりうる候補物質を得ることができる。
すなわち、本発明のスクリーニング方法としては、GPC5遺伝子またはGPC5遺伝子のプロモーターに連結されたレポーター遺伝子を発現する細胞に医薬候補物質を添加する工程、GPC5遺伝子またはレポーター遺伝子の発現量を測定する工程、及び前記発現量を低下させる物質を選択する工程を含む、ネフローゼ症候群の予防薬又は治療薬のスクリーニング方法が挙げられる。
【0026】
GPC5遺伝子を発現する細胞としては、糸球体上皮細胞が好ましく、GEC-T細胞(J Am Soc Nephrol 13:2027-36,2002)などを用いることができる。
【0027】
GPC5遺伝子のプロモーターに連結されたレポーター遺伝子を用いる場合、GPC5遺伝子のプロモーターとしては、該遺伝子の転写開始点の上流約2kbpを含む領域が好ましく、上流約5kbpを含む領域がより好ましい。プロモーターの配列情報はGPC5遺伝子のゲノム配列(NC_000013.9)より入手できる。
レポーター遺伝子としては、ルシフェラーゼ遺伝子、GFP遺伝子、クロラムフェニコールアセチルトランスフェラーゼ遺伝子などが例示できる。これらのレポーター遺伝子をGPC5遺伝子のプロモーターに連結し、これを哺乳類細胞に遺伝子を導入するために用いられるプラスミドに組み込み、リポフェクションなどの通常の方法にて細胞にトランスフェクションする。
上記のようなGPC5遺伝子を発現する細胞、又はレポーター遺伝子が導入された細胞に医薬候補物質を添加し、GPC5遺伝子またはレポーター遺伝子の発現量を測定する。
【0028】
医薬候補物質としては特に制限はなく、例えば、低分子合成化合物であってもよいし、天然物に含まれる化合物であってもよい。また、ペプチドや核酸であってもよい。スクリーニングには個々の被検物質を用いてもよいが、これらの物質を含む化合物ライブラリーを用いてもよい。候補物質の中から、GPC5遺伝子又はレポーター遺伝子の発現量を(非添加時と比べて)低下させるものを選択することにより、ネフローゼ症候群薬の候補物質を得ることができる。
【0029】
GPC5遺伝子の発現量はRT−PCR、定量PCR、ノーザンブロット、ELISA、Western blotting、In situ hybridization、免疫組織染色などの方法により測定することができる。
レポーター遺伝子の発現量はレポーター遺伝子の種類にもよるが、蛍光強度や発光強度、放射能強度などによって測定することができる。
GPC5遺伝子またはレポーター遺伝子の発現量を変化させた物質をネフローゼ症候群治療
薬の候補物質として選択することができる。
【0030】
<4>ネフローゼ症候群治療薬または予防薬
本発明は、GPC5遺伝子発現抑制物質またはGPC5機能抑制物質を含むネフローゼ症候群の治療または予防のための医薬を提供する。
ここで、GPC5遺伝子発現抑制物質としては、GPC5遺伝子発現抑制作用を有する、二本鎖RNA、アンチセンス核酸、低分子化合物などが挙げられる。
GPC5遺伝子発現抑制作用を有する二本鎖RNAとしては、RNA干渉(RNA interference)によりGPC5遺伝子の発現を抑制するGPC5遺伝子に対する二本鎖RNA(GPC5遺伝子の部分配列及びその相補鎖からなる二本鎖RNA)が挙げられる。具体的には、このようなGPC5遺伝子に対する二本鎖RNAを細胞内に導入すると内在性GPC5遺伝子から転写されたmRNAが分解されて、結果としてその細胞でのGPC5の遺伝子発現が特異的に抑制される。この手法は、哺乳動物細胞などにおいても確認されている(Hannon,GJ., Nature (2002) 418,244-251 (review);特表2002−516062号公報;特表平8−506734号公報)。
本発明において用いることができる二本鎖RNA(short-interfering RNA:siRNA)は、GPC5遺伝子のコード領域の塩基配列(例えば配列番号8)のうちの10〜50個の連続する塩基配列、好ましくは15〜35個の連続する塩基配列、より好ましくは19〜27個の連続する塩基配列、さらに好ましくは21〜23個の連続する塩基配列とその相補鎖からなるものである。GPC5遺伝子発現抑制物質として用いることのできるsiRNAとしては配列番号4と5からなるsiRNAが挙げられるが、これに限定されず、GPC5遺伝子の他の領域についても探索アルゴリズムを使って特定して使用することができる。
なお、二本鎖RNAは、2つの別個の鎖から構成される1つの二本鎖RNA分子であってもよいが、1本の鎖がステムループ構造をとることにより形成される二本鎖RNA分子であってもよい。またそれぞれの鎖の3'側に2塩基のオーバーハングを持たせることにより、遺伝子の発現抑制作用を増強することもできる(WO01/75164号パンフレット)。
【0031】
GPC5遺伝子発現抑制作用を有するアンチセンス核酸としては、GPC5遺伝子の塩基配列(例えば配列番号8)の一部に相補的な塩基配列を有するアンチセンスオリゴヌクレオチドが挙げられる。アンチセンスオリゴヌクレオチドはホスホロチオエートなどにより修飾されたものであってもよい。アンチセンスオリゴヌクレオチドの長さは特に制限されないが、15〜40merが好ましく、20〜30merがより好ましい。
【0032】
GPC5遺伝子発現抑制作用を有する低分子化合物は上記のGPC5遺伝子またはGPC5遺伝子のプロモーターに連結されたレポーター遺伝子を発現する細胞を用いたスクリーニング方法によって得ることができる。
GPC5機能抑制物質としては、GPC5に対する抗体やGPC5の部分タンパク質などが挙げられる。GPC5の機能を抑制するかどうかは、GPC5のFGF-2とFGF受容体(FGFR)の相互作用を促進する機能を抑制することなどにより確かめることができる。
【0033】
本発明のネフローゼ症候群治療または予防薬においては、GPC5遺伝子発現抑制物質をそのまま使用してもよいが、好ましくは、GPC5遺伝子発現抑制物質を薬学的に許容される担体に配合して用いる。薬学的に許容される担体としては、液体担体(例えば水、油、生理食塩水、デキストロース水溶液、エタノールなど)、固体担体(例えば、ゼラチン、デンプン、グルコース、ラクトース、スクロース、ステアリン酸ナトリウム、モノステアリン酸グリセロール、ケラチン、コロイド状シリカ、乾燥脱脂乳、グリセロール、水溶性フラーレンなど)が挙げられる。また、通常の医薬組成物に配合される補助剤、防腐剤、安定化剤、濃化剤、潤滑剤、着色剤、湿潤剤、乳化剤、及びpH緩衝剤などのうち適当なものを含有してもよい。
【0034】
本発明のネフローゼ症候群治療または予防薬が上記の二本鎖RNAまたはアンチセンス核酸を有効成分とする場合、これらの核酸分子を標的組織又は細胞に送達するために、ナノカプセル、ミクロスフェア、ビーズ、水中油型エマルジョン、ミセル、混合ミセル及びリポソームなどを送達系として用いることが好ましい。
【0035】
本発明のネフローゼ症候群治療または予防薬の投与方法は特に制限されないが、特に二本鎖RNAまたはアンチセンス核酸を有効成分とする場合は、注射又は送液管を用いた局所投与によって腎臓に投与することが好ましい。または、二本鎖RNAまたはアンチセンス核酸を有効成分とする場合、患者から得られた細胞に二本鎖RNAまたはアンチセンス核酸を導入し、その後、該細胞を患者に投与することによっても送達することができる。二本鎖RNAまたはアンチセンス核酸の細胞への導入は、リン酸カルシウム法、DEAE−デキストラン法、エレクトロポレーション、又はリポフェクションなどにより行うことができる。
【0036】
本発明のネフローゼ症候群治療または予防薬の投与量は、患者の年齢、性別、症状、投与経路、投与頻度、及び剤形などに応じて適宜設定されるが、当技術分野で慣用の方法(例えば疾患モデルを用いる試験)などを行って好適な投与量を設定することができる。例えば、有効成分の量として、0.1 mg/kg体重/日〜50mg/kg/日で投与することができる。
【0037】
<5>発現量に基づく検査方法
本発明はまた、GPC5遺伝子またはGPC5遺伝子産物の発現量を測定する工程を含む、ネフローゼ症候群の検査方法(検査データを得る方法)を提供する。GPC5遺伝子またはGPC5遺伝子産物(GPC5蛋白質)の発現量が健常人などの対照と比べて増加している場合、ネフローゼ症候群に罹患している、またはネフローゼ症候群の危険性が高いと判定することができる。
GPC5遺伝子の発現量は、RT−PCR、ノーザンブロット、マイクロアレイ法などで調べることができる。また、GPC5遺伝子産物の発現量はELISA、ウエスタンブロットなどで調べることができる。抗体は市販の抗体を用いることもできるし、GPC5蛋白質のアミノ酸配列(例えば配列番号9)の一部を抗原として作製された抗体を用いることもできる。GPC5のコード領域の塩基配列としてはGenBank Accession No. NM_004466(配列番号8)が例示され、この配列等を利用して発現解析用プライマーやプローブなどを設計または取得することができる。RT−PCRのプライマーとしては、例えば、配列番号2および3のプライマーセットが例示される。
検査に用いる試料は血液サンプル、あるいは尿サンプルなどが挙げられる。
【実施例】
【0038】
以下、本発明を実施例によりさらに具体的に説明する。但し、本発明はこれらの実施例に限定されない。
【0039】
1.ネフローゼ症候群に相関するSNPの同定
ネフローゼ症候群患者と対照患者
ネフローゼ症候群患者の3つの独立した集団(case 1(N=195)、case 2(N=231)、case 3(N=201))、ネフローゼ症候群患者ではない対照の3つの独立した集団(control 1(N=1546)、control 2(N=1548)、control 3(N=300))を用いてネフローゼ症候群に相関するSNPの探索を行った。case 1、case 2、control 1およびcontrol 2はRIKEN Biobankに登録されたサンプルを使用し、case 3は福島県立医大で収集されたネフローゼ症候群患者サンプルを使用した。control 3は東京大学付属病院が所有する健常人サンプルを使用した。
なお、これらのサンプルの収集については、いずれもインフォームドコンセントが得ら
れている。
case 1〜3は以下の基準で選択した。
(1)蛋白尿:1日蛋白量3.5g以上を持続する
(2)低蛋白血症:血清総蛋白量は6.0g/100ml以下
(低アルブミン血症とした場合は血清アルブミン量3.0g/100ml以下)
control 1、2はネフローゼ症候群以外の疾患、具体的には、2型糖尿病、気管支喘息、心筋梗塞、乳癌、バセドー氏病、脳梗塞、脳動脈瘤、骨粗しょう症、心疾患、不安定狭心症、花粉症、閉塞性動脈硬化症、肺気腫、アトピー性皮膚炎、胃癌または肝硬変の患者である。
case 1〜3とcontrol 1〜3の内訳は表1のとおりである。
【0040】
【表1】

年齢は平均値±標準偏差で示す。N.Aは特定できていないことを示す。etcは原発性ネフローゼゼ症候群のうち4大組織診断以外のもの、secondaryは2次性ネフローゼ症候群を示す。
MC: 微小変化型; FSGS, 巣状分節状糸球体硬化症; MN, 膜性腎症; MPGN; 膜性増殖性糸球体腎炎
【0041】
SNP の解析は直接シークエンス、TaqMan(商標)SNP genotyping assayまたはDigitagIItm assay(Analytical Biochemistry 346(2):281-288)により行った。
まず、case 1とcontrol 1、case 2とcontrol 2を用いてネフローゼ症候群に相関するSNPの探索を試みたところ、case 1とcontrol 1の間、およびcase 2とcontrol 2の間でともに有意であり、疾患感受性アリルの逆転をみない90 個のSNP を得た。
ネフローゼ症候群は、数多くの病態を含むため単にネフローゼ症候群としてまとめてしまうとターゲットとなる病態があいまいになってしまうことが考えられたため、全ネフローゼ症候群の中から原発性ネフローゼ症候群・四大組織病変(微小変化群、巣状糸球体硬化症、膜性腎症、膜性増殖性糸球体腎炎)を抽出し、微小変化群、巣状糸球体硬化症、膜性腎症、膜性増殖性糸球体腎炎の各グループにおけるP 値およびオッズ比(OR)を比較することによりネフローゼの中でもより純粋な病態に関連するSNP を得ることを試みた。
これらのサブグループのうち1グループ以上でP 値が0.01 未満であったSNP は48 個あった。そのうち4 個はタイピングミスであったため、44 個を有意なSNP とした。
【0042】
このように導き出したSNP の中から原発性ネフローゼ症候群・四大組織病変の各々上位10 個のSNP(5 個重複のため全15 個)を選択した。
これらについて、case 3とcontrol 3の間で検討したところ、3 個のSNP で再現性が確認された。
このうちの一つはGPC5遺伝子のイントロン2に存在するSNP(rs16946160)であった。このSNPについて、case 1とcontrol 1(1st panel)、case 2とcontrol 2(2nd panel)
、case 3とcontrol 3(3rd panel)で比較した結果を表2に示す。上段はcase として全ネフローゼ症候群を、下段はcaseとして四大組織病変のみを採用した。
この結果から、rs16946160については、全ネフローゼ症候群:controlでオッズ比が1.273、四大組織病変:controlでオッズ比が1.376を示し、rs16946160のAアレルがネフローゼ症候群の有意なリスクアレルであることが判明した。
【0043】
【表2】

MAF:minor allele frequency、OR:odds ratio
【0044】
rs16946160はイントロン領域にあるため、各genotypeを有する健常人の末梢血より得られたtotal RNA を用いて合成したcDNAに対し、エクソン2と3からイントロン2を挟むPCRにてsplicing variantのスクリーニングを行ったが、各genotypeにおいてsplicingの違いは認められなかった(データは示さず)。
【0045】
GPC5 mRNA発現量の解析
各genotype を有する健常人の末梢血のtotal RNAから合成したcDNA に対し、GPC5についてrealtime PCR を行い、β-actin との比をもってGPC5遺伝子の転写レベルを比較したところ、genotypeA/Aをもつ健常人においてGPC5のmRNAレベルが高い事が示された(図1)。すなわちGPC5遺伝子の発現上昇が、ネフローゼ症候群の発症を促進させる可能性が示唆された。
なお、realtime PCRにおいては、ヒトGPC5増幅用のプライマーとして、配列番号2および3を用い、検出装置としてABI Prism 3700 Real Time PCR System (Applied BioSystems)を用いた。
【0046】
なお、培養糸球体上皮細胞(GEC-T)と培養近位尿細管上皮細胞(mProx)におけるGPC5遺伝子の発現量を比較したところ、GPC5は前者においてに高発現していることがわかった(データは示さず)。さらに、抗GPC5抗体(R&D systems, MAB2607)を用いて免疫組織染色を行ったところ、GPC5の糸球体への集積が認められた(図4A)。
【0047】
細胞系でのGPC5の機能解析
培養ラット糸球体上皮細胞(GEC-T)をGPC5遺伝子に対するsiRNAまたは陰性コントロールsiRNAを添加し(40pmol/ml)、100%コンフルエントになるまで培養しPBSで2 倍希釈し、コラーゲンtype Iでコーティングされたフィルター(日本BD:BioCoat コラーゲン I カ
ルチャーインサート、ポアサイズ0.4μm、1,600,000/cm2)上に播き、37℃で18 時間培養した後、細胞層上下に0.6g/dl のアルブミン濃度差を付けた液相を配し、さらに8 時間後における濃度勾配差をもって、蛋白透過性検討を評価可能な実験系を確立した(図2B)。
なお、GEC-T は既にJAm Soc Nephrol 13:2027-36,2002 において報告されており、arborization を有し、Nephrin 及びVEGF 121 の発現を認め糸球体上皮細胞に特異的なC-3 及び5-1-2 モノクローナル抗体の免染も確認されている。
その結果、siRNA非添加(control)および陰性コントロールsiRNA 添加時と比べて、GPC5遺伝子に対するsiRNAを加えてGPC5遺伝子の発現抑制した場合に蛋白透過性が減少した(図2C)。
ここで、GPC5遺伝子に対するsiRNAとして配列番号4(センス鎖)と配列番号5(アンチセンス鎖)からなる二本鎖RNA(GPC5特異的siRNA)を用いたが、これによってGPC5遺伝子の発現を20%程度まで抑制できることは確認されている(図2A)。
なお、陰性コントロールsiRNAとしては、Stealth RNAi Negative Control Medium GC Duplex #2 (Invitrogen, Carlsbad, CA) を用いた。GPC5特異的siRNAと陰性コントロールsiRNAの添加にはLipofectamine 2000 (Invitrogen, Carlsbad, CA)を使用した。
【0048】
in vivo実験によるGPC5の機能解析
GPC5遺伝子の糸球体特異的ノックダウンマウスを作製した。
具体的には、図4Cに示すように、大腸菌人工染色体(BACクローン)の糸球体特異的遺伝子であるpodocinプロモーターの下流にチミジンキナーゼのポリA配列(TKpA)およびマウスGPC5のmRNA配列(NM_175500.3)の3か所に対するRNAi効果を有するmicro RNA (miR RNA)を発現させるための二本鎖RNA発現配列である
(1−1)TGCTGTTCAGGAGGGCCCTACTGCACGTTTTGGCCACTGACTGACGTGCAGTAGCCCTCCTGAA(配列番号6)
(1−2)CCTGTTCAGGAGGGCTACTGCACGTCAGTCAGTGGCCAAAACGTGCAGTAGGGCCCTCCTGAAC(配列番号7)
(2−1)TGCTGCAAACCTGAAGATCAGGTCCTGTTTTGGCCACTGACTGACAGGACCTGCTTCAGGTTTG(配列番号12)
(2−2)CCTGCAAACCTGAAGCAGGTCCTGTCAGTCAGTGGCCAAAACAGGACCTGATCTTCAGGTTTGC(配列番号13)
(3−1)TGCTGAATTTCTGCCCATTGAGGTGAGTTTTGGCCACTGACTGACTCACCTCAGGGCAGAAATT(配列番号14)
(3−2)CCTGAATTTCTGCCCTGAGGTGAGTCAGTCAGTGGCCAAAACTCACCTCAATGGGCAGAAATTC(配列番号15)
の3組をセルフアニーリングさせたものをクローニングした。常法により得られたBACコンストラクト(Tg-podocin-GPC5iR RecBAC)をマウスのES細胞に導入して糸球体特異的にGPC5遺伝子発現が抑制されたマウス(GPC5糸球体特異的ノックダウンマウス)を作製した。
得られたGPC5糸球体特異的ノックダウンマウスについて、抗GPC5抗体を用いて腎臓の組織染色を行ったところ、糸球体においてGPC5の発現が著しく低下していることが確認できた(図4B)。
【0049】
野生型マウス(BDF1マウス)および上記GPC5糸球体特異的ノックダウンマウスにおいて、ピューロマイシン(PAN)(300 mg/kg 皮下投与)と塩基性線維芽細胞増殖因子(bFGF)投与(250 μg/kg 静脈内投与)を投与することにより、腎炎を誘発した。その結果、図5に示されるように、野生型マウスでは尿中アルブミンクレアチニン比(ACR)および尿総蛋白量(uTP)が上昇したのに対し、GPC5糸球体特異的ノックダウンマウスではこれらの値の上昇がみられなかった。
【0050】
また、野生型マウスに上記GPC5特異的siRNAを(400μg/PBS 0.8 ml 静注)投与し、尿
中アルブミンクレアチニン比(ACR)および尿中蛋白(uTP)の経時変化を調べたところ、siRNA非投与の野生型マウスにおいて腎炎誘発後約10〜12日に見られるACRおよびuTPの大幅な増加は見られず、GPC5特異的siRNAの投与により腎炎の症状が抑制できることがわかった。
【0051】
さらに、野生型マウスおよびGPC5糸球体特異的ノックダウンマウスにおいて、血液を採取し、血液中のアルブミンの量を測定した。その結果、図6に示すように、野生型マウスでは腎炎誘発により血液中のアルブミン(ALB)の量が減少した(腎炎誘発10日後)のに対し、GPC5糸球体特異的ノックダウンマウスでは血液中のALBの量は低下しなかった。野生型マウスについても、腎炎誘発10日後に上記GPC5特異的siRNAを投与したところ、投与から11日後(腎炎誘発21日後)では血液中のALBの量が回復した。
【0052】
また、野生型マウス(GPC5特異的siRNA投与(腎炎誘発後9日目にsiRNA投与)および非投与)、並びにGPC5糸球体特異的ノックダウンマウスにおいて、腎炎誘発後28日後に腎臓を摘出して腎臓の組織染色(PAS染色およびMT染色)を行った。PAS染色とMT染色の結果から糸球体の巣状分節状硬化の程度を算出した。結果を図7に示す。それによると、GPC5糸球体特異的ノックダウンマウスでは糸球体の巣状分節状硬化はほとんど見られなかった。また、GPC5特異的siRNA投与マウスにおいても、非投与マウスと比べて重度(75〜100%)の巣状分節状硬化の割合が減少した。
【0053】
以上の結果から、GPC5遺伝子のSNPをタイピングすることによりネフローゼ症候群発症の可能性を予測できること、およびsiRNAなどのGPC5発現抑制物質を用いることによりネフローゼ症候群の治療及び予防ができることがわかった。
【0054】
なお、本発明者は、GPC5遺伝子産物がFGF-2とFGFRの結合を促進すること、およびGPC5遺伝子の抑制によりp21遺伝子の発現が増加してG0/G1 期の比率が増加し、G2/M 期の比率が有意に抑制されることを確認している。これらのことから、GPC5発現の増加によりFGF シグナル伝達の活性化とp21の抑制を介して、糸球体上皮細胞を増殖相へと移行させ、これが糸球体における障壁機能を形成している糸球体上皮細胞の構築を崩壊へと導き、tight junction を障害して蛋白尿の原因の一つとなることが考えられた。
【0055】
また、FGF-2とFGFRの結合に対するGPC5特異的siRNAの効果を細胞系で調べた。具体的には、ビオチンで標識したbFGFを培養細胞メディウムに加えてFGFRに結合させ、残存したbFGFをピコエリスリン(PE)標識ストレプトアビジンで検出し、FGFの結合能を、陰性コントロールsiRNA(Stealth RNAi Negative Control Medium GC Duplex #2)またはGPC5特異的siRNA存在下で比較した。結果を図3に示す。(A)がラット糸球体上皮細胞株、(B)がヒト大腸癌細胞株での結果である。GPC5特異的siRNAの添加により、FGF-2とFGFRの結合が減少していることがわかる。
なお、GPC5特異的siRNAは配列番号4と5からなるsiRNAを使用した。なお、この配列はヒトとマウスで共通の配列に対するsiRNAでありヒトでも同配列を使用する事が好まれるが、同様にGPC5発現を抑制しうるmiRNAやsiRNAでも同様の効果が期待できる。
これによりヒトにおいてもsiRNAなどのGPC5発現抑制物質を用いることによりネフローゼ症候群の治療及び予防ができることがわかった。
【特許請求の範囲】
【請求項1】
Glypican5(GPC5)遺伝子上に存在する塩基の一塩基多型または該塩基と連鎖不平衡にある塩基の一塩基多型を分析し、該分析結果に基づいてネフローゼ症候群を検査する方法。
【請求項2】
前記一塩基多型が、配列番号1の塩基配列の塩基番号101番目の塩基に相当する塩基における多型である、請求項1に記載の方法。
【請求項3】
配列番号1の塩基配列において、塩基番号101番目の塩基を含む10塩基以上の配列、又はその相補配列を有するネフローゼ症候群検査用プローブ。
【請求項4】
配列番号1のいずれかの塩基配列において、塩基番号101番目の塩基を含む領域を増幅することのできるネフローゼ症候群検査用プライマー。
【請求項5】
GPC5遺伝子またはGPC5遺伝子のプロモーターに連結されたレポーター遺伝子を発現する細胞に医薬候補物質を添加する工程、GPC5遺伝子またはレポーター遺伝子の発現量を測定する工程、及び前記発現量を低下させる物質を選択する工程を含む、ネフローゼ症候群の予防薬又は治療薬をスクリーニングする方法。
【請求項6】
GPC5遺伝子またはGPC5遺伝子産物の発現量を測定する工程を含む、ネフローゼ症候群の検査方法。
【請求項7】
GPC5遺伝子発現抑制物質またはGPC5機能抑制物質を含むネフローゼ症候群を予防または治療するための医薬。
【請求項8】
GPC5遺伝子発現抑制物質がGPC5遺伝子に対する二本鎖RNAである、請求項7に記載の医薬。
【請求項1】
Glypican5(GPC5)遺伝子上に存在する塩基の一塩基多型または該塩基と連鎖不平衡にある塩基の一塩基多型を分析し、該分析結果に基づいてネフローゼ症候群を検査する方法。
【請求項2】
前記一塩基多型が、配列番号1の塩基配列の塩基番号101番目の塩基に相当する塩基における多型である、請求項1に記載の方法。
【請求項3】
配列番号1の塩基配列において、塩基番号101番目の塩基を含む10塩基以上の配列、又はその相補配列を有するネフローゼ症候群検査用プローブ。
【請求項4】
配列番号1のいずれかの塩基配列において、塩基番号101番目の塩基を含む領域を増幅することのできるネフローゼ症候群検査用プライマー。
【請求項5】
GPC5遺伝子またはGPC5遺伝子のプロモーターに連結されたレポーター遺伝子を発現する細胞に医薬候補物質を添加する工程、GPC5遺伝子またはレポーター遺伝子の発現量を測定する工程、及び前記発現量を低下させる物質を選択する工程を含む、ネフローゼ症候群の予防薬又は治療薬をスクリーニングする方法。
【請求項6】
GPC5遺伝子またはGPC5遺伝子産物の発現量を測定する工程を含む、ネフローゼ症候群の検査方法。
【請求項7】
GPC5遺伝子発現抑制物質またはGPC5機能抑制物質を含むネフローゼ症候群を予防または治療するための医薬。
【請求項8】
GPC5遺伝子発現抑制物質がGPC5遺伝子に対する二本鎖RNAである、請求項7に記載の医薬。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2012−80777(P2012−80777A)
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願番号】特願2009−10160(P2009−10160)
【出願日】平成21年1月20日(2009.1.20)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成19年度、文部科学省、「科学技術試験研究委託事業(ネフローゼ症候群関連遺伝子研究)」、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【出願人】(503359821)独立行政法人理化学研究所 (1,056)
【出願人】(508067851)一般社団法人徳洲会 (12)
【Fターム(参考)】
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願日】平成21年1月20日(2009.1.20)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成19年度、文部科学省、「科学技術試験研究委託事業(ネフローゼ症候群関連遺伝子研究)」、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【出願人】(503359821)独立行政法人理化学研究所 (1,056)
【出願人】(508067851)一般社団法人徳洲会 (12)
【Fターム(参考)】
[ Back to top ]

