ハイブリッドポリヌクレオチドの作製方法
【課題】従来の煩雑な工程による遺伝子変異導入法に対して、少ない工程でより多様なハイブリッド遺伝子を効率よく作製するための手段を提供する。
【解決手段】微生物細胞内でin vivo相同組換えを用いてハイブリッドポリヌクレオチドを作製する方法において、直鎖状のベクターの両端に元のポリヌクレオチドの一方の末端のみをそれぞれ同じ方向に連結することにより直鎖状遺伝子を形成させ、該遺伝子を相同組換えによって環化することによりハイブリッドポリヌクレオチド得る方法で、二回目以降の組換えに、ハイブリッドポリヌクレオチドの一方の末端が、同じポリヌクレオチド由来のハイブリッドポリヌクレオチドのみを用いて、組換えを起こすハイブリッドポリヌクレオチドの作製方法を用いる。
【解決手段】微生物細胞内でin vivo相同組換えを用いてハイブリッドポリヌクレオチドを作製する方法において、直鎖状のベクターの両端に元のポリヌクレオチドの一方の末端のみをそれぞれ同じ方向に連結することにより直鎖状遺伝子を形成させ、該遺伝子を相同組換えによって環化することによりハイブリッドポリヌクレオチド得る方法で、二回目以降の組換えに、ハイブリッドポリヌクレオチドの一方の末端が、同じポリヌクレオチド由来のハイブリッドポリヌクレオチドのみを用いて、組換えを起こすハイブリッドポリヌクレオチドの作製方法を用いる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、相同組換えを用いた遺伝子組換え方法において、既存の蛋白質をコードする遺伝子に少ない工程で効率的により多くの遺伝子変異を導入する、ハイブリッドポリヌクレオチドの作製方法に関するものである。
【背景技術】
【0002】
既存のタンパク質をコードする遺伝子に遺伝子変異を導入し、新たな機能を持たせることは、古くから行われている。その方法には、PCRを行う際にDNAポリメラーゼがある一定の割合で遺伝子を読み間違う性質を利用したエラープローンPCR(Plymerase Chain Reaction)と呼ばれるものや、変異原性物質や紫外線により細胞を処理し、遺伝子に突然変異を起こす方法がある。
【0003】
また、既存のタンパク質のアミノ酸配列の一部を他の配列と置換し、タンパク質を改良する試みも行われている。その中で共通の祖先分子に由来した、同じタンパク質ファミリーに属する2種類以上のタンパク質の間でハイブリッドを作製する方法が近年開発されている。その方法には、目的のタンパク質をコードする複数の遺伝子(親遺伝子)を断片化し、PCRによりin vitroで遺伝子断片を再結合することで、複数の親遺伝子がランダムに結合した多数のハイブリッド遺伝子を作製することができるSexal PCRやファミリーシャフリングと呼ばれる方法や(例えば、特許文献1参照)、遺伝子の断片化を制限酵素で行うことにより、より効率良くハイブリッド遺伝子を形成させる方法がある(例えば、特許文献2参照)。
【0004】
一方、大腸菌などの微生物内における相同組換えを利用し、in vivoで既存のタンパク質の遺伝子配列の一部を他の配列と置換したハイブリッド遺伝子を作製し、既存のタンパク質に新たな機能を持たせることが試みられている。その方法には、大腸菌におけるRecAタンパク質による相同組換えを利用しハイブリッド遺伝子を作製する方法があり、数多く報告されている。この方法は、ベクター上に相同な2種類の遺伝子を同じ向きにクローン化したプラスミドを作製し、2つの遺伝子間を制限酵素で切断することにより直鎖状遺伝子にし、続いて該直鎖状遺伝子を大腸菌に導入し、RecAタンパク質による相同遺伝子間での相同組換えによって遺伝子を環状化することにより、ハイブリッド遺伝子を得る方法である。この方法では比較的相同性の低い遺伝子間からもハイブリッド遺伝子を作製することができる。また、遺伝子断片を含む環状ベクターを制限酵素で切断するのではなく、予め直鎖状のベクターを作製し、これに遺伝子断片の一方の末端だけを連結することによって直鎖状DNAを作製する方法がある(例えば、特許文献3参照)。この方法では相同組換えする度に遺伝子のクローン化をする必要がなく、また、一度の反応で複数の組み合わせのハイブリッド遺伝子を作製することが可能である。
【0005】
【特許文献1】特表平10−50561号公報
【特許文献2】特開2000−245473号公報
【特許文献3】特開2006−42737号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
これら各種の遺伝子変異導入方及びハイブリッド遺伝子作製法は、いずれも有効な方法であるが、いくつかの改善すべき課題がある。
【0007】
すなわち、エラープローンPCRや、変異原性物質や紫外線による細胞処理は、遺伝子の突然変異か無作為に起こるため、目的タンパク質の機能的な構造が破壊されてしまったり、細胞が死滅してしまう場合がある。既存のin vitroでのファミリーシャフリングでは、何らかの方法で遺伝子の不特定の部位あるいは特定の部位を切断し遺伝子を断片化しなければならないという煩雑な工程が存在する。また、試験管内で、PCRを利用した遺伝子断片の再結合を行うため、制限酵素による断片化であっても、80%以上という比較的高い相同性が要求される。そのため、相同性が高い遺伝子配列のハイブリッドを作製するには有効であるが、相同性が低い遺伝子間でのハイブリッド遺伝子作製には適さない場合がある。一方in vivoでの相同組換えを用いる方法では、一度の反応で一回の相同組換えしか起こらず、得られるハイブリッド遺伝子の種類がファミリーシャフリング法に比べて少ないことや、得られるハイブリッド遺伝子の種類を増やすために二回目、三回目の相同組換えを行う場合、その都度遺伝子のクローン化を行わなければならないという課題がある。
【0008】
また、予め直鎖状のベクターを作製し、これに相同な2種類の遺伝子断片(それぞれ第一のポリヌクレオチド及び第二のポリヌクレオチドとすると)のそれぞれ一方の末端だけを連結することによって直鎖状DNAを作製する方法においても、二度の組換えで得られるポリヌクレオチドは5’末端部分が第一のポリヌクレオチドに由来し、中央部分が第二のポリヌクレオチドに由来し、3’末端部分が第一のポリヌクレオチドに由来したハイブリッドのみであり、これ以上の変異を導入しようとする場合、さらに組換えを行わなければならない。また、二回目以降の組換えを行う場合、直鎖状遺伝子の5’末端部分が第一のポリヌクレオチドに由来するキメラ遺伝子と、3’末端部分が第一のポリヌクレオチドに由来するキメラ遺伝子の両方を調製しなければならず、煩雑である。
【0009】
本発明の目的は、微生物細胞内でのin vivo相同組換えを用いた方法を元にした、少ない工程でより多様なハイブリッド遺伝子を簡便に作製するための手段として、ハイブリッドポリヌクレオチドの作製方法を提供することにある。
【課題を解決するための手段】
【0010】
従来の微生物内での相同組換え法は、2種類の相同な遺伝子をダンデムにクローン化した後、これを制限酵素で切断して直鎖状DNAとし、次いで、該直鎖状DNAを大腸菌内での相同組換えによって環状化した後、それぞれ別に組換えを行った5’末端部分が第一のポリヌクレオチドに由来するキメラ遺伝子と、3’末端部分が第一のポリヌクレオチドに由来するキメラ遺伝子を用いて、2回目以降の組換えを行っていた。
【0011】
本発明者らは、2回目以降の組換えを行う場合に、5’末端部分が第一のポリヌクレオチドに由来するキメラ遺伝子のみを用いることによって、多様なハイブリッド遺伝子を簡便に作製する方法を見出した。
【0012】
すなわち本発明は、従来の相同組換え法のように2回目以降の組換えに5’末端部分が第一のポリヌクレオチドに由来するキメラ遺伝子と、3’末端部分が第一のポリヌクレオチドに由来するキメラ遺伝子の両方を調製する必要がなく、多様なハイブリッド遺伝子を作製することが可能である。
【0013】
従って本発明は、微生物細胞内でのin vivo相同組換えを用いたポリヌクレオチドハイブリッド作製方法を元にした、少ない工程でより多様なハイブリッド遺伝子を簡便に作製するためのポリヌクレオチドハイブリッドの作製方法である。以下、本発明を詳細に説明する。
【0014】
本発明における第一のポリヌクレオチド及び第二のポリヌクレオチドは、それぞれ1種類だけであってもよく、また、2種類以上であってもよい。
【0015】
本発明における任意のベクターは特に限定されないが、通常、抗生物質耐性遺伝子などのマーカー遺伝子を含むものを使用する。
【0016】
本発明における相同組換え能を持つ微生物は特に限定されないが、通常、recA遺伝子を持つ大腸菌株を使用し、特に好ましくはrecBCsbcA変異株の大腸菌を使用する。
【0017】
本発明の請求項1に記載された方法に使用する第一のポリヌクレオチドと第二のポリヌクレオチドの両端を切断する制限酵素は、それぞれ異なる制限酵素であることが好ましいが、それぞれのポリヌクレオチドの5’末端を切断する制限酵素、あるいは3’末端を切断する制限酵素は同じ制限酵素であってもよい。また、本発明の請求項2に記載された方法に使用する制限酵素は、それぞれ異なる制限酵素である。なお、本発明の方法における各工程を2回以上繰り返す場合、使用する制限酵素は通常1回目に使用したものと同一のものを使うが、異なる制限酵素を使ってもよい。
【0018】
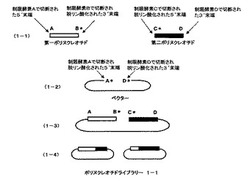
本発明の請求項1に記載の方法の概要を、図1及び図2を用いて説明する。第一のポリヌクレオチドと、それに相同な部分配列を持つ第二のポリヌクレオチドをベクターのmultiple cloning site(多クローニング部位)にクローン化したものを例に本発明を説明するが、本発明は相同性のある遺伝子断片すべてに適用できる。また、異なる制限酵素を、制限酵素A、B、C、Dとして説明する。制限酵素Aは、第一のポリヌクレオチドの5’末端あるいはそれより上流の遺伝子を切断する制限酵素、制限酵素Bは、第一のポリヌクレオチドの3’末端あるいはそれより下流の遺伝子を切断する制限酵素、制限酵素Cは、第二のポリヌクレオチドの5’末端側あるいはそれより上流の遺伝子を切断する制限酵素、制限酵素Dは、第二のポリヌクレオチドの3’末端側あるいはそれより下流の遺伝子を切断する制限酵素とする。
【0019】
第一のポリヌクレオチドをクローン化したベクターを、制限酵素Bで処理した後切断部位を脱リン酸化し、次いで、制限酵素Aで処理し、ポリヌクレオチドをベクターから切り離すことにより、第一のポリヌクレオチド断片を調製する(図1、1−1の第一ポリヌクレオチドとして示される)。同様に、第二のポリヌクレオチドをクローン化したベクターを、制限酵素Cで処理した後切断部位をアルカリフォスファターゼで処理することにより脱リン酸化し、次いで、制限酵素Dで処理し、ポリヌクレオチドをベクターから切り離すことにより、第二のポリヌクレオチド断片を調製する(図1、1−1の第二ポリヌクレオチドとして示される)。それぞれのポリヌクレオチドの末端のアルファベットは、切断した制限酵素部位を示している。星印(*)は脱リン酸化部位を示している。ベクターは酵素A、Dで切断し、アルカリフォスファターゼで処理することにより脱リン酸化したものを調製する(図1、1−2のベクターとして示される)。第一のポリヌクレオチド及び第二のポリヌクレオチドとベクターを混ぜ合わせ、ライゲーションするとB*、C*の部分は連結できないため、直鎖状分子ができる(図1、1−3として示される)。ライゲーション反応後、アガロースゲル電気泳動などで目的の直鎖状に連結した分子だけを回収し、相同組換え能を持つ微生物に導入、ベクターに応じた抗生物質を含んだ培地に塗布する。2種類のポリヌクレオチドの相同な部分での相同組換えが起こり、環状になった分子を持つ大腸菌のみが増殖する。抗生物質を含む培地で増殖したコロニーからプラスミドをまとめてバルクで精製し、一回組換えハイブリッドポリヌクレオチドライブラリー1−1とする(図1、1−4として示される)。プラスミドの抽出は、一般的な大腸菌からの抽出方法により行えばよく、市販されているプラスミド抽出キット(QIAprep、キアゲン社製)などを用いて行えばよい。ポリヌクレオチドライブラリー1−1は、5’末端部分が第一のポリヌクレオチドに由来し、3’末端部分が第二のポリヌクレオチドに由来したハイブリッドからなる(図1、1−4として示される)。
【0020】
続いて一回目の組換えで作製したハイブリッドポリヌクレオチドライブラリーに対して、二回目の組換えを行う。方法は一回目の方法と同じである。
【0021】
ポリヌクレオチドライブラリー1−1を、制限酵素Bで処理した後切断部位をアルカリフォスファターゼで処理することにより脱リン酸化し、次いで、制限酵素Aで処理し、ポリヌクレオチドをベクターから切り離し、第一のポリヌクレオチド断片を調製する(図2、2−1の第一ポリヌクレオチドとして示される)。同様に、ポリヌクレオチドライブラリー1−1を、制限酵素Cで処理した後切断部位をアルカリフォスファターゼで処理することにより脱リン酸化し、次いで、制限酵素Dで処理し、ポリヌクレオチドをベクターから切り離し、第二のポリヌクレオチド断片を調製する(図2、2−1の第二ポリヌクレオチドとして示される)。ベクターは酵素A、Dで切断し、アルカリフォスファターゼで処理することにより脱リン酸化したものを用意する(図2、2−2のベクターとして示される)。第一のポリヌクレオチド及び第二のポリヌクレオチドとベクターを混ぜ合わせ、ライゲーションするとB*、C*の部分は連結できないため、直鎖状分子ができる(図2、2−3として示される)。ライゲーション反応後、アガロースゲル電気泳動などで目的の直鎖状に連結した分子だけを回収し、相同組換え能を持つ微生物に導入、ベクターに応じた抗生物質を含んだ培地に塗布する。2種類のポリヌクレオチドの相同な部分での相同組換えが起こり、環状になった分子を持つ大腸菌のみが増殖する。抗生物質を含む培地で増殖したコロニーからプラスミドをまとめてバルクで精製し、二回組換えハイブリッドポリヌクレオチドライブラリー1−2とする(図2、2−4として示される)。ポリヌクレオチドライブラリー1−2のポリヌクレオチドの部分は、5’末端部分が第一のポリヌクレオチドに由来し、続いて第二のポリヌクレオチドに由来した部分、続いて第一のポリヌクレオチド由来した部分からなり、3’末端部分が第二のポリヌクレオチドに由来したハイブリッドからなるクローン、及び5’末端部分が第一のポリヌクレオチドに由来し3’末端部分が第二のポリヌクレオチドに由来したハイブリッドからなるクローンからなる。(図2、2−4として示される)。
【0022】
二回目の組換えで作製したハイブリッドポリヌクレオチドライブラリーに対して、三回目の組換え、三回組換えで作製したハイブリッドポリヌクレオチドライブラリーに対して、四回目の組換え、と順次組換えを行うことができる。方法は一回目の組換えと同じである。これにより、少ない工程でより多様なハイブリッド遺伝子を簡便に作製することが可能である。
【0023】
また、第一のポリヌクレオチドと第二のポリヌクレオチドとを入れ換えて同様の操作により組換えを行っても、同様の効果が期待できる。
【0024】
本発明の請求項2に記載の方法の概要を、図3及び図4を用いて説明する。第一のポリヌクレオチドと、それに相同な部分配列を持つ第二のポリヌクレオチドをベクターのmultiple cloning siteにクローン化したものを例に本発明を説明するが、本発明は相同性のある遺伝子断片すべてに適用できる。また、異なる制限酵素を、制限酵素E、H、P、Fとして説明する。制限酵素Eは、第一のポリヌクレオチドの5’末端側あるいはそれより上流の遺伝子を切断する制限酵素、制限酵素H、は第一のポリヌクレオチドの3’末端側あるいはそれより下流の遺伝子を切断する制限酵素、制限酵素Pは、第二のポリヌクレオチドの3’末端側あるいはそれより下流の遺伝子を切断し且つ制限酵素Hよりも第二のポリヌクレオチドに近い部分を切断する制限酵素、制限酵素Fは、第二のポリヌクレオチドの5’末端側あるいはそれより上流の遺伝子を切断し且つ制限酵素Eよりも第二のポリヌクレオチドに近い部分を切断する制限酵素とする。第一のポリヌクレオチドをクローン化したベクターを、制限酵素EとHで切断し、ポリヌクレオチドをベクターから切り離し、さらに両末端のリン酸基を脱リン酸化することにより第一のポリヌクレオチド断片を調製する(図3、3−1の第一ポリヌクレオチドとして示される)。第一のポリヌクレオチドと相同な配列をもつ第二のポリヌクレオチドがクローン化されたベクターを、制限酵素Pで切断した後切断部位のリン酸基をアルカリフォスファターゼで処理することにより脱リン酸化し、次いで、制限酵素Hで処理することにより第二のポリヌクレオチド断片を含むベクター遺伝子を調製する(図3、3−1の第二ポリヌクレオチドとして示される)。それぞれのポリヌクレオチドの末端のアルファベットは、切断した制限酵素部位を示している。星印(*)は脱リン酸化部位を示している。第一のポリヌクレオチドと第二のポリヌクレオチドを含むベクターを混ぜ合わせライゲーションすると制限酵素Hによる切断部位でのみ結合がおこり、直鎖状分子ができる(図3、3−2として示される)。ライゲーション反応後、アガロースゲル電気泳動などで目的の直鎖状に連結した分子だけを回収し、相同組換え能を持つ微生物に導入、ベクターに応じた抗生物質を含んだ培地に塗布する。2種類のポリヌクレオチドの相同な部分での相同組換えが起こり、環状になった分子を持つ大腸菌のみが増殖する。抗生物質を含む培地で増殖したコロニーからプラスミドをまとめてバルクで精製し、一回組み換えハイブリッドポリヌクレオチドライブラリー3−1とする(図3、3−3として示される)。ポリヌクレオチドライブラリー3−1は5’末端部分が第二のポリヌクレオチドに由来し、3’末端部分が第一のポリヌクレオチドに由来したハイブリッドからなる(図3、3−3として示される)。
【0025】
続いて一回目の組換えで作製したハイブリッドポリヌクレオチドライブラリーに対して、二回目の組換えを行う。方法は一回目の方法と同じである。
【0026】
ポリヌクレオチドライブラリー3−1を制限酵素EとHで切断しポリヌクレオチドをベクターから切り離し、さらに両末端のリン酸基を脱リン酸化することにより第一のポリヌクレオチド断片を調製する(図4、4−1の第一ポリヌクレオチドとして示される)。一方、ポリヌクレオチドライブラリー3−1を、制限酵素Pで切断した後切断部位のリン酸基をアルカリフォスファターゼで処理することにより脱リン酸化し、次いで、制限酵素Hで処理することにより第二のポリヌクレオチド断片を含むベクター遺伝子を調製する(図4、4−1の第二ポリヌクレオチドとして示される)。第一のポリヌクレオチドと第二のポリヌクレオチドを含むベクターを混ぜ合わせライゲーションすると制限酵素Hによる切断部位でのみ結合がおこり、直鎖状分子ができる(図4、4−2として示される)。ライゲーション反応後、アガロースゲル電気泳動などで目的の直鎖状に連結した分子だけを回収し、相同組換え能を持つ微生物に導入、ベクターに応じた抗生物質を含んだ培地に塗布する。2種類のポリヌクレオチドの相同な部分での相同組換えが起こり、環状になった分子を持つ大腸菌のみが増殖する。抗生物質を含む培地で増殖したコロニーからプラスミドをまとめてバルクで精製し、一回組み換えハイブリッドポリヌクレオチドライブラリー3−2とする(図4、4−3として示される)。
【0027】
ポリヌクレオチドライブラリー3−2のポリヌクレオチドの部分は、5’末端部分が第一のポリヌクレオチドに由来し、続いて第二のポリヌクレオチドに由来した部分、続いて第一のポリヌクレオチド由来した部分からなり、3’末端部分が第二のポリヌクレオチドに由来したハイブリッドからなるクローン、及び5’末端部分が第一のポリヌクレオチドに由来し3’末端部分が第二のポリヌクレオチドに由来したハイブリッドからなるクローンからなる。(図4、4−3として示される)。
【0028】
二回目の組換えで作製したハイブリッドポリヌクレオチドライブラリーに対して、三回目の組換え、三回組換えで作製したハイブリッドポリヌクレオチドライブラリーに対して、四回目の組換え、と順次組換えを行うことができる。方法は二回目の組換えと同様組換えを起こしたいポリヌクレオチドの5’末端が、第一のポリヌクレオチドあるいは第二のポリヌクレオチドのどちらか一方に由来するポリヌクレオチドライブラリーを使用して行えばよい。これにより、少ない工程でより多様なハイブリッド遺伝子を簡便に作製することが可能である。
【0029】
また、第二のポリヌクレオチドがクローン化されたベクターを、第二のポリヌクレオチドの5’末端で切断する制限酵素Fで切断し、切断部位をアルカリフォスファターゼで処理することにより脱リン酸化した後、該ベクターの3’末端を制限酵素Eで切断した第二のポリヌクレオチド断片を含むベクター遺伝子を用いて、図3の3−1に示す第一のポリヌクレオチドとライゲーション及び相同組換えを行っても同様の効果が期待できる。
【0030】
以上述べた本発明の請求項2の方法の一部を変更した方法によっても本発明の請求項2の方法と同様のハイブリッドポリヌクレオチドライブラリーを作製できる。以下、本発明の請求項2の方法の一部を変更した方法について、図5を用いて説明する。第一のポリヌクレオチドと、それに相同な部分配列を持つ第二のポリヌクレオチドをベクターのmultiple cloning siteにクローン化したものを例に本発明を説明するが、本発明は相同性のある遺伝子断片すべてに適用できる。また、異なる制限酵素を、制限酵素E、H、P、Fとして説明する。制限酵素Eは、第一のポリヌクレオチドの5’末端側あるいはそれより上流の遺伝子を切断する制限酵素、制限酵素H、は第一のポリヌクレオチドの3’末端側あるいはそれより下流の遺伝子を切断する制限酵素、制限酵素Pは、第二のポリヌクレオチドの3’末端側あるいはそれより下流の遺伝子を切断し且つ制限酵素Hよりも第二のポリヌクレオチドに近い部分を切断する制限酵素、制限酵素Fは、第二のポリヌクレオチドの5’末端側あるいはそれより上流の遺伝子を切断し且つ制限酵素Eよりも第二のポリヌクレオチドに近い部分を切断する制限酵素とする。
【0031】
第一のポリヌクレオチドをクローン化したベクターを、制限酵素Eで切断し切断部位のリン酸基をアルカリフォスファターゼで処理することにより脱リン酸化した後、制限酵素Hでさらに切断し第一のポリヌクレオチドをベクターから切り離す(図5、5−1の第一ポリヌクレオチドとして示される)。第一のポリヌクレオチドと相同な配列をもつ第二のポリヌクレオチドがクローン化されたベクターを制限酵素PとHで切断した後切断部位のリン酸基を脱リン酸化することにより第二のポリヌクレオチド断片を含むベクター遺伝子を調製する(図5、5−1の第二ポリヌクレオチドとして示される)。それぞれのポリヌクレオチドの末端のアルファベットは、切断した制限酵素部位を示している。星印(*)は脱リン酸化部位を示している。第一のポリヌクレオチドと第二のポリヌクレオチドを含むベクターを混ぜ合わせライゲーションすると制限酵素Hによる切断部位でのみ結合がおこり、直鎖状分子ができる(図5、5−2として示される)。ライゲーション反応後、アガロースゲル電気泳動などで目的の直鎖状に連結した分子だけを回収し、相同組換え能を持つ微生物に導入、ベクターに応じた抗生物質を含んだ培地に塗布する。2種類のポリヌクレオチドの相同な部分での相同組換えが起こり、環状になった分子を持つ大腸菌のみが増殖する。抗生物質を含む培地で増殖したコロニーからプラスミドをまとめてバルクで精製し、一回組み換えハイブリッドポリヌクレオチドライブラリー4−1とする(図5、5−3として示される)。ポリヌクレオチドライブラリー4−1は5’末端部分が第二のポリヌクレオチドに由来し、3’末端部分が第一のポリヌクレオチドに由来したハイブリッドからなる(図5、5−3として示される)。
【0032】
続いて一回目の組換えで作製したハイブリッドポリヌクレオチドライブラリーに対して、二回目の組換えを行う。方法は一回目の方法と同じである。2回目以降の組換えは、組換えを起こしたいポリヌクレオチドの5’末端が、第一のポリヌクレオチドあるいは第二のポリヌクレオチドのどちらか一方に由来するポリヌクレオチドライブラリーを使用し、上記と同様に行うことにより、本発明の請求項2の方法と同様のハイブリッドポリヌクレオチドライブラリーが得られる。これにより、少ない工程でより多様なハイブリッド遺伝子を簡便に作製することが可能である。また、第二のポリヌクレオチドがクローン化されたベクターを、第二のポリヌクレオチドの5’末端あるいはそれより上流の遺伝子で切断する制限酵素Fで切断し、切断部位をアルカリフォスファターゼで処理することにより脱リン酸化した後、該ベクターの3’末端を制限酵素Eで切断した第二のポリヌクレオチド断片を含むベクター遺伝子を用いて、第一のポリヌクレオチドとライゲーション及び相同組換えを行っても同様の効果が期待できる。
【発明の効果】
【0033】
本発明に従えば、遺伝子の断片化を行うことなく、大腸菌内での相同組換えを利用して、少ない工程でより多様なハイブリッド遺伝子を簡便に作製することができる。本発明は、親和性や特異性に優れた抗体の創出、耐熱性に優れた酵素や基質特異性の変化した酵素の創出など、既存のタンパク質の機能の高機能化や、全く新しい機能を持ったタンパク質の創出に有効である。
【実施例】
【0034】
以下に、発明を更に詳細に説明するために実施例を示すが、本発明はこれら実施例に限定されるものではない。
【0035】
実施例1 一回目の組換えのための直鎖状抗体遺伝子の調製
相同な2種類の、同じ抗原に対する抗体遺伝子E06及びE30をベクターpFCAH10のmultiple cloning siteにそれぞれクローン化し、pE06、pE30とした。遺伝子をクローン化したプラスミドpE06を制限酵素XhoIと制限酵素NheIで切断し、精製後shrimp alkaline phosphatase (SAP)で脱リン酸化し、pE06(X*/N*)を得た。
【0036】
プラスミドpE30を制限酵素SfiIで切断、精製後SAPによって脱リン酸化した。さらに制限酵素NheIで切断し、pE30(S*/N)を得た。これと上記のpE06(X*/N*)を混ぜ合わせ、T4 ligaseによって連結反応を行った。反応後、全量をアガロースゲル電気泳動に供し、5.7kbの大きさの断片をゲルから回収し、フェノール抽出、エタノール沈殿による精製を行った。
【0037】
実施例2 一回組み換えハイブリッド遺伝子ライブラリーの作製
実施例1で調製した直鎖状遺伝子を、大腸菌のrecBCsbcA変異株JC8679株にエレクトロポレーションによって導入した。カルベニシリンを含んだ培地上でコロニーを増殖させ、コロニーをランダムに選び各コロニーからプラスミドを精製し、プラスミド上の遺伝子断片の塩基配列を決定した。その結果、5’末端部分がpE06由来、3’末端部分がpE30由来のハイブリッド遺伝子が形成されていた(図6の6−1)。
【0038】
そこで、カルベニシリンを含む培地で増殖したこれら形質転換された菌からプラスミドを調製し、一回組み換えハイブリッド遺伝子ライブラリーpE06/30−1とし、クローンNoとしてE06/30−1−14などとした枝番号を付与した。
【0039】
実施例3 二回目の組換えのための直鎖状抗体遺伝子の調製
ハイブリッド遺伝子ライブラリーpE06/30−1をXhoIとNheIで切断し、精製後shrimp alkaline phosphatase (SAP)で脱リン酸化し、pE06/30−1(X*/N*)を得た。又ハイブリッド遺伝子ライブラリーpE06/30−1をSfiIで切断、精製後SAPによって脱リン酸化した。さらにNheIで切断し、pE06/30−1(S*/N)を得た。これと上記のpE06/30−1(X*/N*)を混ぜ合わせ、T4 ligaseによって連結反応を行った。反応後、全量をアガロースゲル電気泳動に供し、5.7kbの大きさの断片をゲルから回収し、フェノール抽出、エタノール沈殿による精製を行った。
【0040】
実施例4 二回組み換えハイブリッド遺伝子ライブラリーの作製
実施例3で調製した直鎖状遺伝子を、大腸菌のrecBCsbcA変異株JC8679株にエレクトロポレーションによって導入した。カルベニシリンを含んだ培地上でコロニーを増殖させ、コロニーをランダムに選び各コロニーからプラスミドを精製し、プラスミド上の遺伝子断片の塩基配列を決定した。
【0041】
その結果、5’末端部分がpE06に由来し、続いてpE30に由来した部分、続いてpE06に由来した部分からなり、3’末端部分がpE30に由来したハイブリッドからなる遺伝子、及び5‘末端部分がpE06由来、3’末端部分がpE30由来のハイブリッド遺伝子が形成されていた(図6の6−2)。
【0042】
そこで、カルベニシリンを含む培地で増殖したこれら形質転換された菌からプラスミドを調製し、二回組み換えハイブリッド遺伝子ライブラリーpE06/30−2とし、クローンNoとしてE06/30−2−4などとした枝番号を付与した。
【0043】
実施例5 三回組み換えハイブリッド遺伝子ライブラリーの作製
同様に、三回目の相同組換えを二回組み換えハイブリッド遺伝子ライブラリーpEpE06/30−2を用いて一回目及び二回目の相同組換えと同様に行った。その結果、二回目とは異なった5’末端部分がpE06に由来し、続いてpE30に由来した部分、続いてpE06に由来した部分からなり、3’末端部分がpE30に由来したハイブリッドからなる遺伝子、及び5‘末端部分がpE06由来、3’末端部分がpE30由来のハイブリッド遺伝子が形成されていた(図6の6−3)。
【0044】
そこで、カルベニシリンを含む培地で増殖したこれら形質転換された菌からプラスミドを調製し、三回組み換えハイブリッド遺伝子ライブラリーpE06/30−3とし、クローンNoとしてE06/30−3−33などとした枝番号を付与した。
【図面の簡単な説明】
【0045】
【図1】請求項1に記載の方法の概要を示し、1回目の組換えに関する方法を示す図であり、図1中、Aは、第一のポリヌクレオチドの5’末端あるいはそれより上流の遺伝子を切断する制限酵素、Bは、第一のポリヌクレオチドの3’末端あるいはそれより下流の遺伝子を切断する制限酵素、Cは、第二のポリヌクレオチドの5’末端側あるいはそれより上流の遺伝子を切断する制限酵素、Dは、第二のポリヌクレオチドの3’末端側あるいはそれより下流の遺伝子を切断する制限酵素を示し、星印(*)は脱リン酸化部位を、白抜きの四角は第一のポリヌクレオチドを、黒抜きの四角は第二のポリヌクレオチドを示す。
【図2】請求項1に記載の方法の概要を示し、2回目の組換えに関する方法を示す図であり、図2中、A、B、C、D、星印(*)、白抜きの四角、黒抜きの四角は図1と同様である。
【図3】請求項2に記載の方法の概要を示し、1回目の組換えに関する方法を示す図であり、図3中、Eは、第一のポリヌクレオチドの5’末端側あるいはそれより上流の遺伝子を切断する制限酵素、H、は第一のポリヌクレオチドの3’末端側あるいはそれより下流の遺伝子を切断する制限酵素、Pは、第二のポリヌクレオチドの3’末端側あるいはそれより下流の遺伝子を切断し且つ制限酵素Hよりも第二のポリヌクレオチドに近い部分を切断する制限酵素を示し、星印(*)は脱リン酸化部位を、白抜きの四角は第一のポリヌクレオチドを、黒抜きの四角は第二のポリヌクレオチドを示す。
【図4】請求項2に記載の方法の概要を示し、2回目の組換えに関する方法を示す図であり、図4中、E、H、P、星印(*)、白抜きの四角、黒抜きの四角は図3と同様である。
【図5】本発明の請求項2の方法の一部を変更した方法の概要を示し、1回目の組換えに関する方法を示す図であり、E、H、P、星印(*)、白抜きの四角、黒抜きの四角は図3と同様である。
【図6】実施例1から5で得られたpE06とpE30のハイブリッド遺伝子の構造であり、各四角いは組換え前あるいは組換え後の遺伝子を示し、白抜きの四角は抗体遺伝子E06由来のポリヌクレオチドを、黒抜きの四角は抗体遺伝子E30由来のポリヌクレオチドを示し、横軸は、遺伝子の長さを示す。
【技術分野】
【0001】
本発明は、相同組換えを用いた遺伝子組換え方法において、既存の蛋白質をコードする遺伝子に少ない工程で効率的により多くの遺伝子変異を導入する、ハイブリッドポリヌクレオチドの作製方法に関するものである。
【背景技術】
【0002】
既存のタンパク質をコードする遺伝子に遺伝子変異を導入し、新たな機能を持たせることは、古くから行われている。その方法には、PCRを行う際にDNAポリメラーゼがある一定の割合で遺伝子を読み間違う性質を利用したエラープローンPCR(Plymerase Chain Reaction)と呼ばれるものや、変異原性物質や紫外線により細胞を処理し、遺伝子に突然変異を起こす方法がある。
【0003】
また、既存のタンパク質のアミノ酸配列の一部を他の配列と置換し、タンパク質を改良する試みも行われている。その中で共通の祖先分子に由来した、同じタンパク質ファミリーに属する2種類以上のタンパク質の間でハイブリッドを作製する方法が近年開発されている。その方法には、目的のタンパク質をコードする複数の遺伝子(親遺伝子)を断片化し、PCRによりin vitroで遺伝子断片を再結合することで、複数の親遺伝子がランダムに結合した多数のハイブリッド遺伝子を作製することができるSexal PCRやファミリーシャフリングと呼ばれる方法や(例えば、特許文献1参照)、遺伝子の断片化を制限酵素で行うことにより、より効率良くハイブリッド遺伝子を形成させる方法がある(例えば、特許文献2参照)。
【0004】
一方、大腸菌などの微生物内における相同組換えを利用し、in vivoで既存のタンパク質の遺伝子配列の一部を他の配列と置換したハイブリッド遺伝子を作製し、既存のタンパク質に新たな機能を持たせることが試みられている。その方法には、大腸菌におけるRecAタンパク質による相同組換えを利用しハイブリッド遺伝子を作製する方法があり、数多く報告されている。この方法は、ベクター上に相同な2種類の遺伝子を同じ向きにクローン化したプラスミドを作製し、2つの遺伝子間を制限酵素で切断することにより直鎖状遺伝子にし、続いて該直鎖状遺伝子を大腸菌に導入し、RecAタンパク質による相同遺伝子間での相同組換えによって遺伝子を環状化することにより、ハイブリッド遺伝子を得る方法である。この方法では比較的相同性の低い遺伝子間からもハイブリッド遺伝子を作製することができる。また、遺伝子断片を含む環状ベクターを制限酵素で切断するのではなく、予め直鎖状のベクターを作製し、これに遺伝子断片の一方の末端だけを連結することによって直鎖状DNAを作製する方法がある(例えば、特許文献3参照)。この方法では相同組換えする度に遺伝子のクローン化をする必要がなく、また、一度の反応で複数の組み合わせのハイブリッド遺伝子を作製することが可能である。
【0005】
【特許文献1】特表平10−50561号公報
【特許文献2】特開2000−245473号公報
【特許文献3】特開2006−42737号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
これら各種の遺伝子変異導入方及びハイブリッド遺伝子作製法は、いずれも有効な方法であるが、いくつかの改善すべき課題がある。
【0007】
すなわち、エラープローンPCRや、変異原性物質や紫外線による細胞処理は、遺伝子の突然変異か無作為に起こるため、目的タンパク質の機能的な構造が破壊されてしまったり、細胞が死滅してしまう場合がある。既存のin vitroでのファミリーシャフリングでは、何らかの方法で遺伝子の不特定の部位あるいは特定の部位を切断し遺伝子を断片化しなければならないという煩雑な工程が存在する。また、試験管内で、PCRを利用した遺伝子断片の再結合を行うため、制限酵素による断片化であっても、80%以上という比較的高い相同性が要求される。そのため、相同性が高い遺伝子配列のハイブリッドを作製するには有効であるが、相同性が低い遺伝子間でのハイブリッド遺伝子作製には適さない場合がある。一方in vivoでの相同組換えを用いる方法では、一度の反応で一回の相同組換えしか起こらず、得られるハイブリッド遺伝子の種類がファミリーシャフリング法に比べて少ないことや、得られるハイブリッド遺伝子の種類を増やすために二回目、三回目の相同組換えを行う場合、その都度遺伝子のクローン化を行わなければならないという課題がある。
【0008】
また、予め直鎖状のベクターを作製し、これに相同な2種類の遺伝子断片(それぞれ第一のポリヌクレオチド及び第二のポリヌクレオチドとすると)のそれぞれ一方の末端だけを連結することによって直鎖状DNAを作製する方法においても、二度の組換えで得られるポリヌクレオチドは5’末端部分が第一のポリヌクレオチドに由来し、中央部分が第二のポリヌクレオチドに由来し、3’末端部分が第一のポリヌクレオチドに由来したハイブリッドのみであり、これ以上の変異を導入しようとする場合、さらに組換えを行わなければならない。また、二回目以降の組換えを行う場合、直鎖状遺伝子の5’末端部分が第一のポリヌクレオチドに由来するキメラ遺伝子と、3’末端部分が第一のポリヌクレオチドに由来するキメラ遺伝子の両方を調製しなければならず、煩雑である。
【0009】
本発明の目的は、微生物細胞内でのin vivo相同組換えを用いた方法を元にした、少ない工程でより多様なハイブリッド遺伝子を簡便に作製するための手段として、ハイブリッドポリヌクレオチドの作製方法を提供することにある。
【課題を解決するための手段】
【0010】
従来の微生物内での相同組換え法は、2種類の相同な遺伝子をダンデムにクローン化した後、これを制限酵素で切断して直鎖状DNAとし、次いで、該直鎖状DNAを大腸菌内での相同組換えによって環状化した後、それぞれ別に組換えを行った5’末端部分が第一のポリヌクレオチドに由来するキメラ遺伝子と、3’末端部分が第一のポリヌクレオチドに由来するキメラ遺伝子を用いて、2回目以降の組換えを行っていた。
【0011】
本発明者らは、2回目以降の組換えを行う場合に、5’末端部分が第一のポリヌクレオチドに由来するキメラ遺伝子のみを用いることによって、多様なハイブリッド遺伝子を簡便に作製する方法を見出した。
【0012】
すなわち本発明は、従来の相同組換え法のように2回目以降の組換えに5’末端部分が第一のポリヌクレオチドに由来するキメラ遺伝子と、3’末端部分が第一のポリヌクレオチドに由来するキメラ遺伝子の両方を調製する必要がなく、多様なハイブリッド遺伝子を作製することが可能である。
【0013】
従って本発明は、微生物細胞内でのin vivo相同組換えを用いたポリヌクレオチドハイブリッド作製方法を元にした、少ない工程でより多様なハイブリッド遺伝子を簡便に作製するためのポリヌクレオチドハイブリッドの作製方法である。以下、本発明を詳細に説明する。
【0014】
本発明における第一のポリヌクレオチド及び第二のポリヌクレオチドは、それぞれ1種類だけであってもよく、また、2種類以上であってもよい。
【0015】
本発明における任意のベクターは特に限定されないが、通常、抗生物質耐性遺伝子などのマーカー遺伝子を含むものを使用する。
【0016】
本発明における相同組換え能を持つ微生物は特に限定されないが、通常、recA遺伝子を持つ大腸菌株を使用し、特に好ましくはrecBCsbcA変異株の大腸菌を使用する。
【0017】
本発明の請求項1に記載された方法に使用する第一のポリヌクレオチドと第二のポリヌクレオチドの両端を切断する制限酵素は、それぞれ異なる制限酵素であることが好ましいが、それぞれのポリヌクレオチドの5’末端を切断する制限酵素、あるいは3’末端を切断する制限酵素は同じ制限酵素であってもよい。また、本発明の請求項2に記載された方法に使用する制限酵素は、それぞれ異なる制限酵素である。なお、本発明の方法における各工程を2回以上繰り返す場合、使用する制限酵素は通常1回目に使用したものと同一のものを使うが、異なる制限酵素を使ってもよい。
【0018】
本発明の請求項1に記載の方法の概要を、図1及び図2を用いて説明する。第一のポリヌクレオチドと、それに相同な部分配列を持つ第二のポリヌクレオチドをベクターのmultiple cloning site(多クローニング部位)にクローン化したものを例に本発明を説明するが、本発明は相同性のある遺伝子断片すべてに適用できる。また、異なる制限酵素を、制限酵素A、B、C、Dとして説明する。制限酵素Aは、第一のポリヌクレオチドの5’末端あるいはそれより上流の遺伝子を切断する制限酵素、制限酵素Bは、第一のポリヌクレオチドの3’末端あるいはそれより下流の遺伝子を切断する制限酵素、制限酵素Cは、第二のポリヌクレオチドの5’末端側あるいはそれより上流の遺伝子を切断する制限酵素、制限酵素Dは、第二のポリヌクレオチドの3’末端側あるいはそれより下流の遺伝子を切断する制限酵素とする。
【0019】
第一のポリヌクレオチドをクローン化したベクターを、制限酵素Bで処理した後切断部位を脱リン酸化し、次いで、制限酵素Aで処理し、ポリヌクレオチドをベクターから切り離すことにより、第一のポリヌクレオチド断片を調製する(図1、1−1の第一ポリヌクレオチドとして示される)。同様に、第二のポリヌクレオチドをクローン化したベクターを、制限酵素Cで処理した後切断部位をアルカリフォスファターゼで処理することにより脱リン酸化し、次いで、制限酵素Dで処理し、ポリヌクレオチドをベクターから切り離すことにより、第二のポリヌクレオチド断片を調製する(図1、1−1の第二ポリヌクレオチドとして示される)。それぞれのポリヌクレオチドの末端のアルファベットは、切断した制限酵素部位を示している。星印(*)は脱リン酸化部位を示している。ベクターは酵素A、Dで切断し、アルカリフォスファターゼで処理することにより脱リン酸化したものを調製する(図1、1−2のベクターとして示される)。第一のポリヌクレオチド及び第二のポリヌクレオチドとベクターを混ぜ合わせ、ライゲーションするとB*、C*の部分は連結できないため、直鎖状分子ができる(図1、1−3として示される)。ライゲーション反応後、アガロースゲル電気泳動などで目的の直鎖状に連結した分子だけを回収し、相同組換え能を持つ微生物に導入、ベクターに応じた抗生物質を含んだ培地に塗布する。2種類のポリヌクレオチドの相同な部分での相同組換えが起こり、環状になった分子を持つ大腸菌のみが増殖する。抗生物質を含む培地で増殖したコロニーからプラスミドをまとめてバルクで精製し、一回組換えハイブリッドポリヌクレオチドライブラリー1−1とする(図1、1−4として示される)。プラスミドの抽出は、一般的な大腸菌からの抽出方法により行えばよく、市販されているプラスミド抽出キット(QIAprep、キアゲン社製)などを用いて行えばよい。ポリヌクレオチドライブラリー1−1は、5’末端部分が第一のポリヌクレオチドに由来し、3’末端部分が第二のポリヌクレオチドに由来したハイブリッドからなる(図1、1−4として示される)。
【0020】
続いて一回目の組換えで作製したハイブリッドポリヌクレオチドライブラリーに対して、二回目の組換えを行う。方法は一回目の方法と同じである。
【0021】
ポリヌクレオチドライブラリー1−1を、制限酵素Bで処理した後切断部位をアルカリフォスファターゼで処理することにより脱リン酸化し、次いで、制限酵素Aで処理し、ポリヌクレオチドをベクターから切り離し、第一のポリヌクレオチド断片を調製する(図2、2−1の第一ポリヌクレオチドとして示される)。同様に、ポリヌクレオチドライブラリー1−1を、制限酵素Cで処理した後切断部位をアルカリフォスファターゼで処理することにより脱リン酸化し、次いで、制限酵素Dで処理し、ポリヌクレオチドをベクターから切り離し、第二のポリヌクレオチド断片を調製する(図2、2−1の第二ポリヌクレオチドとして示される)。ベクターは酵素A、Dで切断し、アルカリフォスファターゼで処理することにより脱リン酸化したものを用意する(図2、2−2のベクターとして示される)。第一のポリヌクレオチド及び第二のポリヌクレオチドとベクターを混ぜ合わせ、ライゲーションするとB*、C*の部分は連結できないため、直鎖状分子ができる(図2、2−3として示される)。ライゲーション反応後、アガロースゲル電気泳動などで目的の直鎖状に連結した分子だけを回収し、相同組換え能を持つ微生物に導入、ベクターに応じた抗生物質を含んだ培地に塗布する。2種類のポリヌクレオチドの相同な部分での相同組換えが起こり、環状になった分子を持つ大腸菌のみが増殖する。抗生物質を含む培地で増殖したコロニーからプラスミドをまとめてバルクで精製し、二回組換えハイブリッドポリヌクレオチドライブラリー1−2とする(図2、2−4として示される)。ポリヌクレオチドライブラリー1−2のポリヌクレオチドの部分は、5’末端部分が第一のポリヌクレオチドに由来し、続いて第二のポリヌクレオチドに由来した部分、続いて第一のポリヌクレオチド由来した部分からなり、3’末端部分が第二のポリヌクレオチドに由来したハイブリッドからなるクローン、及び5’末端部分が第一のポリヌクレオチドに由来し3’末端部分が第二のポリヌクレオチドに由来したハイブリッドからなるクローンからなる。(図2、2−4として示される)。
【0022】
二回目の組換えで作製したハイブリッドポリヌクレオチドライブラリーに対して、三回目の組換え、三回組換えで作製したハイブリッドポリヌクレオチドライブラリーに対して、四回目の組換え、と順次組換えを行うことができる。方法は一回目の組換えと同じである。これにより、少ない工程でより多様なハイブリッド遺伝子を簡便に作製することが可能である。
【0023】
また、第一のポリヌクレオチドと第二のポリヌクレオチドとを入れ換えて同様の操作により組換えを行っても、同様の効果が期待できる。
【0024】
本発明の請求項2に記載の方法の概要を、図3及び図4を用いて説明する。第一のポリヌクレオチドと、それに相同な部分配列を持つ第二のポリヌクレオチドをベクターのmultiple cloning siteにクローン化したものを例に本発明を説明するが、本発明は相同性のある遺伝子断片すべてに適用できる。また、異なる制限酵素を、制限酵素E、H、P、Fとして説明する。制限酵素Eは、第一のポリヌクレオチドの5’末端側あるいはそれより上流の遺伝子を切断する制限酵素、制限酵素H、は第一のポリヌクレオチドの3’末端側あるいはそれより下流の遺伝子を切断する制限酵素、制限酵素Pは、第二のポリヌクレオチドの3’末端側あるいはそれより下流の遺伝子を切断し且つ制限酵素Hよりも第二のポリヌクレオチドに近い部分を切断する制限酵素、制限酵素Fは、第二のポリヌクレオチドの5’末端側あるいはそれより上流の遺伝子を切断し且つ制限酵素Eよりも第二のポリヌクレオチドに近い部分を切断する制限酵素とする。第一のポリヌクレオチドをクローン化したベクターを、制限酵素EとHで切断し、ポリヌクレオチドをベクターから切り離し、さらに両末端のリン酸基を脱リン酸化することにより第一のポリヌクレオチド断片を調製する(図3、3−1の第一ポリヌクレオチドとして示される)。第一のポリヌクレオチドと相同な配列をもつ第二のポリヌクレオチドがクローン化されたベクターを、制限酵素Pで切断した後切断部位のリン酸基をアルカリフォスファターゼで処理することにより脱リン酸化し、次いで、制限酵素Hで処理することにより第二のポリヌクレオチド断片を含むベクター遺伝子を調製する(図3、3−1の第二ポリヌクレオチドとして示される)。それぞれのポリヌクレオチドの末端のアルファベットは、切断した制限酵素部位を示している。星印(*)は脱リン酸化部位を示している。第一のポリヌクレオチドと第二のポリヌクレオチドを含むベクターを混ぜ合わせライゲーションすると制限酵素Hによる切断部位でのみ結合がおこり、直鎖状分子ができる(図3、3−2として示される)。ライゲーション反応後、アガロースゲル電気泳動などで目的の直鎖状に連結した分子だけを回収し、相同組換え能を持つ微生物に導入、ベクターに応じた抗生物質を含んだ培地に塗布する。2種類のポリヌクレオチドの相同な部分での相同組換えが起こり、環状になった分子を持つ大腸菌のみが増殖する。抗生物質を含む培地で増殖したコロニーからプラスミドをまとめてバルクで精製し、一回組み換えハイブリッドポリヌクレオチドライブラリー3−1とする(図3、3−3として示される)。ポリヌクレオチドライブラリー3−1は5’末端部分が第二のポリヌクレオチドに由来し、3’末端部分が第一のポリヌクレオチドに由来したハイブリッドからなる(図3、3−3として示される)。
【0025】
続いて一回目の組換えで作製したハイブリッドポリヌクレオチドライブラリーに対して、二回目の組換えを行う。方法は一回目の方法と同じである。
【0026】
ポリヌクレオチドライブラリー3−1を制限酵素EとHで切断しポリヌクレオチドをベクターから切り離し、さらに両末端のリン酸基を脱リン酸化することにより第一のポリヌクレオチド断片を調製する(図4、4−1の第一ポリヌクレオチドとして示される)。一方、ポリヌクレオチドライブラリー3−1を、制限酵素Pで切断した後切断部位のリン酸基をアルカリフォスファターゼで処理することにより脱リン酸化し、次いで、制限酵素Hで処理することにより第二のポリヌクレオチド断片を含むベクター遺伝子を調製する(図4、4−1の第二ポリヌクレオチドとして示される)。第一のポリヌクレオチドと第二のポリヌクレオチドを含むベクターを混ぜ合わせライゲーションすると制限酵素Hによる切断部位でのみ結合がおこり、直鎖状分子ができる(図4、4−2として示される)。ライゲーション反応後、アガロースゲル電気泳動などで目的の直鎖状に連結した分子だけを回収し、相同組換え能を持つ微生物に導入、ベクターに応じた抗生物質を含んだ培地に塗布する。2種類のポリヌクレオチドの相同な部分での相同組換えが起こり、環状になった分子を持つ大腸菌のみが増殖する。抗生物質を含む培地で増殖したコロニーからプラスミドをまとめてバルクで精製し、一回組み換えハイブリッドポリヌクレオチドライブラリー3−2とする(図4、4−3として示される)。
【0027】
ポリヌクレオチドライブラリー3−2のポリヌクレオチドの部分は、5’末端部分が第一のポリヌクレオチドに由来し、続いて第二のポリヌクレオチドに由来した部分、続いて第一のポリヌクレオチド由来した部分からなり、3’末端部分が第二のポリヌクレオチドに由来したハイブリッドからなるクローン、及び5’末端部分が第一のポリヌクレオチドに由来し3’末端部分が第二のポリヌクレオチドに由来したハイブリッドからなるクローンからなる。(図4、4−3として示される)。
【0028】
二回目の組換えで作製したハイブリッドポリヌクレオチドライブラリーに対して、三回目の組換え、三回組換えで作製したハイブリッドポリヌクレオチドライブラリーに対して、四回目の組換え、と順次組換えを行うことができる。方法は二回目の組換えと同様組換えを起こしたいポリヌクレオチドの5’末端が、第一のポリヌクレオチドあるいは第二のポリヌクレオチドのどちらか一方に由来するポリヌクレオチドライブラリーを使用して行えばよい。これにより、少ない工程でより多様なハイブリッド遺伝子を簡便に作製することが可能である。
【0029】
また、第二のポリヌクレオチドがクローン化されたベクターを、第二のポリヌクレオチドの5’末端で切断する制限酵素Fで切断し、切断部位をアルカリフォスファターゼで処理することにより脱リン酸化した後、該ベクターの3’末端を制限酵素Eで切断した第二のポリヌクレオチド断片を含むベクター遺伝子を用いて、図3の3−1に示す第一のポリヌクレオチドとライゲーション及び相同組換えを行っても同様の効果が期待できる。
【0030】
以上述べた本発明の請求項2の方法の一部を変更した方法によっても本発明の請求項2の方法と同様のハイブリッドポリヌクレオチドライブラリーを作製できる。以下、本発明の請求項2の方法の一部を変更した方法について、図5を用いて説明する。第一のポリヌクレオチドと、それに相同な部分配列を持つ第二のポリヌクレオチドをベクターのmultiple cloning siteにクローン化したものを例に本発明を説明するが、本発明は相同性のある遺伝子断片すべてに適用できる。また、異なる制限酵素を、制限酵素E、H、P、Fとして説明する。制限酵素Eは、第一のポリヌクレオチドの5’末端側あるいはそれより上流の遺伝子を切断する制限酵素、制限酵素H、は第一のポリヌクレオチドの3’末端側あるいはそれより下流の遺伝子を切断する制限酵素、制限酵素Pは、第二のポリヌクレオチドの3’末端側あるいはそれより下流の遺伝子を切断し且つ制限酵素Hよりも第二のポリヌクレオチドに近い部分を切断する制限酵素、制限酵素Fは、第二のポリヌクレオチドの5’末端側あるいはそれより上流の遺伝子を切断し且つ制限酵素Eよりも第二のポリヌクレオチドに近い部分を切断する制限酵素とする。
【0031】
第一のポリヌクレオチドをクローン化したベクターを、制限酵素Eで切断し切断部位のリン酸基をアルカリフォスファターゼで処理することにより脱リン酸化した後、制限酵素Hでさらに切断し第一のポリヌクレオチドをベクターから切り離す(図5、5−1の第一ポリヌクレオチドとして示される)。第一のポリヌクレオチドと相同な配列をもつ第二のポリヌクレオチドがクローン化されたベクターを制限酵素PとHで切断した後切断部位のリン酸基を脱リン酸化することにより第二のポリヌクレオチド断片を含むベクター遺伝子を調製する(図5、5−1の第二ポリヌクレオチドとして示される)。それぞれのポリヌクレオチドの末端のアルファベットは、切断した制限酵素部位を示している。星印(*)は脱リン酸化部位を示している。第一のポリヌクレオチドと第二のポリヌクレオチドを含むベクターを混ぜ合わせライゲーションすると制限酵素Hによる切断部位でのみ結合がおこり、直鎖状分子ができる(図5、5−2として示される)。ライゲーション反応後、アガロースゲル電気泳動などで目的の直鎖状に連結した分子だけを回収し、相同組換え能を持つ微生物に導入、ベクターに応じた抗生物質を含んだ培地に塗布する。2種類のポリヌクレオチドの相同な部分での相同組換えが起こり、環状になった分子を持つ大腸菌のみが増殖する。抗生物質を含む培地で増殖したコロニーからプラスミドをまとめてバルクで精製し、一回組み換えハイブリッドポリヌクレオチドライブラリー4−1とする(図5、5−3として示される)。ポリヌクレオチドライブラリー4−1は5’末端部分が第二のポリヌクレオチドに由来し、3’末端部分が第一のポリヌクレオチドに由来したハイブリッドからなる(図5、5−3として示される)。
【0032】
続いて一回目の組換えで作製したハイブリッドポリヌクレオチドライブラリーに対して、二回目の組換えを行う。方法は一回目の方法と同じである。2回目以降の組換えは、組換えを起こしたいポリヌクレオチドの5’末端が、第一のポリヌクレオチドあるいは第二のポリヌクレオチドのどちらか一方に由来するポリヌクレオチドライブラリーを使用し、上記と同様に行うことにより、本発明の請求項2の方法と同様のハイブリッドポリヌクレオチドライブラリーが得られる。これにより、少ない工程でより多様なハイブリッド遺伝子を簡便に作製することが可能である。また、第二のポリヌクレオチドがクローン化されたベクターを、第二のポリヌクレオチドの5’末端あるいはそれより上流の遺伝子で切断する制限酵素Fで切断し、切断部位をアルカリフォスファターゼで処理することにより脱リン酸化した後、該ベクターの3’末端を制限酵素Eで切断した第二のポリヌクレオチド断片を含むベクター遺伝子を用いて、第一のポリヌクレオチドとライゲーション及び相同組換えを行っても同様の効果が期待できる。
【発明の効果】
【0033】
本発明に従えば、遺伝子の断片化を行うことなく、大腸菌内での相同組換えを利用して、少ない工程でより多様なハイブリッド遺伝子を簡便に作製することができる。本発明は、親和性や特異性に優れた抗体の創出、耐熱性に優れた酵素や基質特異性の変化した酵素の創出など、既存のタンパク質の機能の高機能化や、全く新しい機能を持ったタンパク質の創出に有効である。
【実施例】
【0034】
以下に、発明を更に詳細に説明するために実施例を示すが、本発明はこれら実施例に限定されるものではない。
【0035】
実施例1 一回目の組換えのための直鎖状抗体遺伝子の調製
相同な2種類の、同じ抗原に対する抗体遺伝子E06及びE30をベクターpFCAH10のmultiple cloning siteにそれぞれクローン化し、pE06、pE30とした。遺伝子をクローン化したプラスミドpE06を制限酵素XhoIと制限酵素NheIで切断し、精製後shrimp alkaline phosphatase (SAP)で脱リン酸化し、pE06(X*/N*)を得た。
【0036】
プラスミドpE30を制限酵素SfiIで切断、精製後SAPによって脱リン酸化した。さらに制限酵素NheIで切断し、pE30(S*/N)を得た。これと上記のpE06(X*/N*)を混ぜ合わせ、T4 ligaseによって連結反応を行った。反応後、全量をアガロースゲル電気泳動に供し、5.7kbの大きさの断片をゲルから回収し、フェノール抽出、エタノール沈殿による精製を行った。
【0037】
実施例2 一回組み換えハイブリッド遺伝子ライブラリーの作製
実施例1で調製した直鎖状遺伝子を、大腸菌のrecBCsbcA変異株JC8679株にエレクトロポレーションによって導入した。カルベニシリンを含んだ培地上でコロニーを増殖させ、コロニーをランダムに選び各コロニーからプラスミドを精製し、プラスミド上の遺伝子断片の塩基配列を決定した。その結果、5’末端部分がpE06由来、3’末端部分がpE30由来のハイブリッド遺伝子が形成されていた(図6の6−1)。
【0038】
そこで、カルベニシリンを含む培地で増殖したこれら形質転換された菌からプラスミドを調製し、一回組み換えハイブリッド遺伝子ライブラリーpE06/30−1とし、クローンNoとしてE06/30−1−14などとした枝番号を付与した。
【0039】
実施例3 二回目の組換えのための直鎖状抗体遺伝子の調製
ハイブリッド遺伝子ライブラリーpE06/30−1をXhoIとNheIで切断し、精製後shrimp alkaline phosphatase (SAP)で脱リン酸化し、pE06/30−1(X*/N*)を得た。又ハイブリッド遺伝子ライブラリーpE06/30−1をSfiIで切断、精製後SAPによって脱リン酸化した。さらにNheIで切断し、pE06/30−1(S*/N)を得た。これと上記のpE06/30−1(X*/N*)を混ぜ合わせ、T4 ligaseによって連結反応を行った。反応後、全量をアガロースゲル電気泳動に供し、5.7kbの大きさの断片をゲルから回収し、フェノール抽出、エタノール沈殿による精製を行った。
【0040】
実施例4 二回組み換えハイブリッド遺伝子ライブラリーの作製
実施例3で調製した直鎖状遺伝子を、大腸菌のrecBCsbcA変異株JC8679株にエレクトロポレーションによって導入した。カルベニシリンを含んだ培地上でコロニーを増殖させ、コロニーをランダムに選び各コロニーからプラスミドを精製し、プラスミド上の遺伝子断片の塩基配列を決定した。
【0041】
その結果、5’末端部分がpE06に由来し、続いてpE30に由来した部分、続いてpE06に由来した部分からなり、3’末端部分がpE30に由来したハイブリッドからなる遺伝子、及び5‘末端部分がpE06由来、3’末端部分がpE30由来のハイブリッド遺伝子が形成されていた(図6の6−2)。
【0042】
そこで、カルベニシリンを含む培地で増殖したこれら形質転換された菌からプラスミドを調製し、二回組み換えハイブリッド遺伝子ライブラリーpE06/30−2とし、クローンNoとしてE06/30−2−4などとした枝番号を付与した。
【0043】
実施例5 三回組み換えハイブリッド遺伝子ライブラリーの作製
同様に、三回目の相同組換えを二回組み換えハイブリッド遺伝子ライブラリーpEpE06/30−2を用いて一回目及び二回目の相同組換えと同様に行った。その結果、二回目とは異なった5’末端部分がpE06に由来し、続いてpE30に由来した部分、続いてpE06に由来した部分からなり、3’末端部分がpE30に由来したハイブリッドからなる遺伝子、及び5‘末端部分がpE06由来、3’末端部分がpE30由来のハイブリッド遺伝子が形成されていた(図6の6−3)。
【0044】
そこで、カルベニシリンを含む培地で増殖したこれら形質転換された菌からプラスミドを調製し、三回組み換えハイブリッド遺伝子ライブラリーpE06/30−3とし、クローンNoとしてE06/30−3−33などとした枝番号を付与した。
【図面の簡単な説明】
【0045】
【図1】請求項1に記載の方法の概要を示し、1回目の組換えに関する方法を示す図であり、図1中、Aは、第一のポリヌクレオチドの5’末端あるいはそれより上流の遺伝子を切断する制限酵素、Bは、第一のポリヌクレオチドの3’末端あるいはそれより下流の遺伝子を切断する制限酵素、Cは、第二のポリヌクレオチドの5’末端側あるいはそれより上流の遺伝子を切断する制限酵素、Dは、第二のポリヌクレオチドの3’末端側あるいはそれより下流の遺伝子を切断する制限酵素を示し、星印(*)は脱リン酸化部位を、白抜きの四角は第一のポリヌクレオチドを、黒抜きの四角は第二のポリヌクレオチドを示す。
【図2】請求項1に記載の方法の概要を示し、2回目の組換えに関する方法を示す図であり、図2中、A、B、C、D、星印(*)、白抜きの四角、黒抜きの四角は図1と同様である。
【図3】請求項2に記載の方法の概要を示し、1回目の組換えに関する方法を示す図であり、図3中、Eは、第一のポリヌクレオチドの5’末端側あるいはそれより上流の遺伝子を切断する制限酵素、H、は第一のポリヌクレオチドの3’末端側あるいはそれより下流の遺伝子を切断する制限酵素、Pは、第二のポリヌクレオチドの3’末端側あるいはそれより下流の遺伝子を切断し且つ制限酵素Hよりも第二のポリヌクレオチドに近い部分を切断する制限酵素を示し、星印(*)は脱リン酸化部位を、白抜きの四角は第一のポリヌクレオチドを、黒抜きの四角は第二のポリヌクレオチドを示す。
【図4】請求項2に記載の方法の概要を示し、2回目の組換えに関する方法を示す図であり、図4中、E、H、P、星印(*)、白抜きの四角、黒抜きの四角は図3と同様である。
【図5】本発明の請求項2の方法の一部を変更した方法の概要を示し、1回目の組換えに関する方法を示す図であり、E、H、P、星印(*)、白抜きの四角、黒抜きの四角は図3と同様である。
【図6】実施例1から5で得られたpE06とpE30のハイブリッド遺伝子の構造であり、各四角いは組換え前あるいは組換え後の遺伝子を示し、白抜きの四角は抗体遺伝子E06由来のポリヌクレオチドを、黒抜きの四角は抗体遺伝子E30由来のポリヌクレオチドを示し、横軸は、遺伝子の長さを示す。
【特許請求の範囲】
【請求項1】
以下の(1)〜(8)の工程を含むことを特徴とするハイブリッドポリヌクレオチドの作製方法、
(1)異なる制限酵素で両末端が切断され、且つ3’末端が脱リン酸化されている第一のポリヌクレオチドを作製する工程、
(2)異なる制限酵素で両末端が切断され、且つ5’末端が脱リン酸化されている、第一のポリヌクレオチドと相同な配列を持つ第二のポリヌクレオチドを作製する工程、
(3)任意のベクターを、第一のポリヌクレオチドの5’末端を切断した制限酵素及び第二のポリヌクレオチドの3’末端を切断した制限酵素と接触させ切断する工程、
(4)工程(3)で作製した直鎖状ベクターの両末端を脱リン酸化する工程
(5)工程(4)で作製した両末端が脱リン酸化された直鎖状ベクターと、工程(1)で作製した第一のポリヌクレオチド及び工程(2)で作製した第二のポリヌクレオチドを接触させ、それぞれ同じ制限酵素での切断末端を介して、前記直鎖状ベクターの3’末端に第一のポリヌクレオチドを、前記直鎖状ベクターの5’末端に第二のポリヌクレオチドを連結させ、直鎖状分子を作製する工程、
(6)工程(5)で作製した直鎖状分子を、相同組換え能を持つ微生物に導入し、前記直鎖状分子内の第一及び第二のポリヌクレオチド上に存在する相同な配列を持つ部分で相同組換えを起こすことにより、前記直鎖状分子が環状化した微生物を選抜する工程、
(7)工程(6)で選抜した微生物からハイブリッドポリヌクレオチドを含むベクターを採取する工程、
(8)工程(7)で採取したポリヌクレオチドを、第一のポリヌクレオチド及び第二のポリヌクレオチドとし、(1)〜(7)の工程を2回以上繰り返し、その繰り返し工程において、2回目以降の第一のポリヌクレオチド及び第二のポリヌクレオチド共にその5’末端が、前回組換えに用いた第一のポリヌクレオチドあるいは第二のポリヌクレオチドのどちらか一方に由来するポリヌクレオチドのみを組換えに用いる工程。
【請求項2】
以下の(1)〜(6)の工程を含むことを特徴とするハイブリッドポリヌクレオチドの作製方法、
(1)異なる制限酵素で両末端が切断された(a)5’末端及び3’末端の両方が脱リン酸化されているか、又は(b)5’末端のみが脱リン酸化されているか、又は(c)3’末端のみが脱リン酸化されている第一のポリヌクレオチドを作製する工程、
(2)(a)第一のポリヌクレオチドの5’末端及び3’末端の両方が脱リン酸化されている場合には、第一のポリヌクレオチドと相同な配列を持つ第二のポリヌクレオチドを3’末端側に含み、5’末端が第一のポリヌクレオチドの3’末端を切断した制限酵素による切断末端で、3’末端が他の制限酵素による切断末端であり、且つ3’末端が脱リン酸化されている直鎖状ベクター、又は第一のポリヌクレオチドと相同な配列を持つ第二のポリヌクレオチドを5’末端側に含み、5’末端がある制限酵素による切断末端で、3’末端が第一のポリヌクレオチドの5’末端を切断した制限酵素による切断末端であり、且つ5’末端が脱リン酸化されている直鎖状ベクターを作製し、(b)第一のポリヌクレオチドの5’末端のみが脱リン酸化されている場合には、第二のポリヌクレオチドを3’末端側に含み、その5’末端が第一のポリヌクレオチドの3’末端を切断した制限酵素による切断末端で3’末端が他の制限酵素による切断末端であり、両末端が脱リン酸化されている直鎖状ベクターを作製し、(c)第一のポリヌクレオチドの3’末端のみが脱リン酸化されている場合には、第二のポリヌクレオチドを5’末端側に含み、5’末端が他の制限酵素による切断末端で3’末端が第一のポリヌクレオチドの5’末端を切断した制限酵素による切断末端であり、両末端が脱リン酸化されている直鎖状ベクターを作製する工程、
(3)工程(2)で作製した直鎖状ベクターと、第一のポリヌクレオチドを混合し、それぞれ同じ制限酵素での切断末端を介して連結させ、直鎖状分子を作製する工程、
(4)工程(3)で作製した直鎖状分子を、相同組換え能を持つ微生物に導入し、前記直鎖状分子内の第一及び第二のポリヌクレオチド上に存在する相同な配列を持つ部分で相同組換えを起こすことにより、前記直鎖状分子が環状化した微生物を選抜する工程
(5)工程(4)で選抜した微生物からハイブリッドポリヌクレオチドを含むベクターを採取する工程。
(6)工程(5)で採取したポリヌクレオチドを、第一のポリヌクレオチド及び第二のポリヌクレオチドとし、(1)〜(5)の工程を2回以上繰り返し、その繰り返し工程において、2回目以降の第一のポリヌクレオチド及び第二のポリヌクレオチド共にその5’末端が、前回組換えに用いた第一のポリヌクレオチドあるいは第二のポリヌクレオチドのどちらか一方に由来するポリヌクレオチドのみを組換えに用いる工程。
【請求項1】
以下の(1)〜(8)の工程を含むことを特徴とするハイブリッドポリヌクレオチドの作製方法、
(1)異なる制限酵素で両末端が切断され、且つ3’末端が脱リン酸化されている第一のポリヌクレオチドを作製する工程、
(2)異なる制限酵素で両末端が切断され、且つ5’末端が脱リン酸化されている、第一のポリヌクレオチドと相同な配列を持つ第二のポリヌクレオチドを作製する工程、
(3)任意のベクターを、第一のポリヌクレオチドの5’末端を切断した制限酵素及び第二のポリヌクレオチドの3’末端を切断した制限酵素と接触させ切断する工程、
(4)工程(3)で作製した直鎖状ベクターの両末端を脱リン酸化する工程
(5)工程(4)で作製した両末端が脱リン酸化された直鎖状ベクターと、工程(1)で作製した第一のポリヌクレオチド及び工程(2)で作製した第二のポリヌクレオチドを接触させ、それぞれ同じ制限酵素での切断末端を介して、前記直鎖状ベクターの3’末端に第一のポリヌクレオチドを、前記直鎖状ベクターの5’末端に第二のポリヌクレオチドを連結させ、直鎖状分子を作製する工程、
(6)工程(5)で作製した直鎖状分子を、相同組換え能を持つ微生物に導入し、前記直鎖状分子内の第一及び第二のポリヌクレオチド上に存在する相同な配列を持つ部分で相同組換えを起こすことにより、前記直鎖状分子が環状化した微生物を選抜する工程、
(7)工程(6)で選抜した微生物からハイブリッドポリヌクレオチドを含むベクターを採取する工程、
(8)工程(7)で採取したポリヌクレオチドを、第一のポリヌクレオチド及び第二のポリヌクレオチドとし、(1)〜(7)の工程を2回以上繰り返し、その繰り返し工程において、2回目以降の第一のポリヌクレオチド及び第二のポリヌクレオチド共にその5’末端が、前回組換えに用いた第一のポリヌクレオチドあるいは第二のポリヌクレオチドのどちらか一方に由来するポリヌクレオチドのみを組換えに用いる工程。
【請求項2】
以下の(1)〜(6)の工程を含むことを特徴とするハイブリッドポリヌクレオチドの作製方法、
(1)異なる制限酵素で両末端が切断された(a)5’末端及び3’末端の両方が脱リン酸化されているか、又は(b)5’末端のみが脱リン酸化されているか、又は(c)3’末端のみが脱リン酸化されている第一のポリヌクレオチドを作製する工程、
(2)(a)第一のポリヌクレオチドの5’末端及び3’末端の両方が脱リン酸化されている場合には、第一のポリヌクレオチドと相同な配列を持つ第二のポリヌクレオチドを3’末端側に含み、5’末端が第一のポリヌクレオチドの3’末端を切断した制限酵素による切断末端で、3’末端が他の制限酵素による切断末端であり、且つ3’末端が脱リン酸化されている直鎖状ベクター、又は第一のポリヌクレオチドと相同な配列を持つ第二のポリヌクレオチドを5’末端側に含み、5’末端がある制限酵素による切断末端で、3’末端が第一のポリヌクレオチドの5’末端を切断した制限酵素による切断末端であり、且つ5’末端が脱リン酸化されている直鎖状ベクターを作製し、(b)第一のポリヌクレオチドの5’末端のみが脱リン酸化されている場合には、第二のポリヌクレオチドを3’末端側に含み、その5’末端が第一のポリヌクレオチドの3’末端を切断した制限酵素による切断末端で3’末端が他の制限酵素による切断末端であり、両末端が脱リン酸化されている直鎖状ベクターを作製し、(c)第一のポリヌクレオチドの3’末端のみが脱リン酸化されている場合には、第二のポリヌクレオチドを5’末端側に含み、5’末端が他の制限酵素による切断末端で3’末端が第一のポリヌクレオチドの5’末端を切断した制限酵素による切断末端であり、両末端が脱リン酸化されている直鎖状ベクターを作製する工程、
(3)工程(2)で作製した直鎖状ベクターと、第一のポリヌクレオチドを混合し、それぞれ同じ制限酵素での切断末端を介して連結させ、直鎖状分子を作製する工程、
(4)工程(3)で作製した直鎖状分子を、相同組換え能を持つ微生物に導入し、前記直鎖状分子内の第一及び第二のポリヌクレオチド上に存在する相同な配列を持つ部分で相同組換えを起こすことにより、前記直鎖状分子が環状化した微生物を選抜する工程
(5)工程(4)で選抜した微生物からハイブリッドポリヌクレオチドを含むベクターを採取する工程。
(6)工程(5)で採取したポリヌクレオチドを、第一のポリヌクレオチド及び第二のポリヌクレオチドとし、(1)〜(5)の工程を2回以上繰り返し、その繰り返し工程において、2回目以降の第一のポリヌクレオチド及び第二のポリヌクレオチド共にその5’末端が、前回組換えに用いた第一のポリヌクレオチドあるいは第二のポリヌクレオチドのどちらか一方に由来するポリヌクレオチドのみを組換えに用いる工程。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2009−125008(P2009−125008A)
【公開日】平成21年6月11日(2009.6.11)
【国際特許分類】
【出願番号】特願2007−304018(P2007−304018)
【出願日】平成19年11月26日(2007.11.26)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成21年6月11日(2009.6.11)
【国際特許分類】
【出願日】平成19年11月26日(2007.11.26)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

