ハイブリッド体の検出によるサンプル核酸の検出方法に用いる前記プローブセットの設計方法
【課題】より高感度かつ高特異的な微少量の検出をするための、ハイブリッド体を検出することによるサンプル核酸の検出方法に用いるプローブセットの設計方法を提供する。
【解決手段】ハイブリッド体の70%以上が(1)前記サンプル核酸のターゲット鎖の有する標的配列と、前記プローブセットの該標的配列に相補的である該プローブ核酸の有するプローブ配列とにより形成されたハイブリット部を介して結合、(2)前記サンプル核酸のターゲット鎖は前記プローブ核酸よりも長く、該ターゲット鎖の5’末端は前記標的配列の5’側端部から5’方向に少なくとも前記プライマーの塩基分伸びた部分の先端にありかつ該ターゲット鎖の3’末端は前記標的配列の3’側端部から3’方向に少なくとも前記プライマーの塩基分伸びた部分にあり、L1≦L2を満たすように設計する。
【解決手段】ハイブリッド体の70%以上が(1)前記サンプル核酸のターゲット鎖の有する標的配列と、前記プローブセットの該標的配列に相補的である該プローブ核酸の有するプローブ配列とにより形成されたハイブリット部を介して結合、(2)前記サンプル核酸のターゲット鎖は前記プローブ核酸よりも長く、該ターゲット鎖の5’末端は前記標的配列の5’側端部から5’方向に少なくとも前記プライマーの塩基分伸びた部分の先端にありかつ該ターゲット鎖の3’末端は前記標的配列の3’側端部から3’方向に少なくとも前記プライマーの塩基分伸びた部分にあり、L1≦L2を満たすように設計する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、固相上プローブとサンプル核酸の安定したハイブリッド体の形成に関する。また、本発明は、かかるハイブリッド体の形成に利用されるプローブ、プローブ担体PCR用プライマー、およびそれらの設計方法にも関する。
【背景技術】
【0002】
ヒトゲノム計画に代表されるように各種の生物の遺伝子が解明され、生命活動のメカニズム、病気、体質等と遺伝子との関連が次々と調べられている。そして、遺伝子の有無やその存在量(発現量)を知ることで、例えば病気などのより詳細な特徴やタイピング、あるいは効果的な治療方法の選択などが可能となることがわかってきた。
【0003】
検体に含まれている特定の遺伝子の有無やその存在量を調べる方法は、昔から多くの方法が考案されているが、その中でも応用範囲が広く検出対象によらず適用可能な方法として、検出対象とする遺伝子あるいは核酸の特徴的な部分配列を選び、その部分配列の有無や量を調べることにより、その有無あるいは存在量を調べる方法が広く用いられている。具体的には選び出された部分配列の相補鎖に相当する核酸配列(プローブ)を用意し、検体とプローブとがハイブリダイゼーションすることを何らかの手段で検出することにより、検体中の核酸配列の有無を調べる方法である。
【0004】
ハイブリダイゼーションを利用した特定の核酸の検出方法は、固相、液相を問わず用いることが可能である。例えば液相中で行う場合には、二本鎖形成時に分光特性が変化する標識物質を結合させたプローブ溶液を準備し、これを検体に添加し、その分光特性の変化を測定することで検体中の特定核酸の有無を調べる方法がその一例である。
【0005】
固相上でハイブリダイゼーションを行う場合には、プローブを固相上に固定または吸着させておき、その固相上に何らかの検出可能な標識物質により標識した検体を添加し、固相上からの標識物質の信号を測定することにより検出する方法が代表的である。中でもプローブをガラスや金属などの平面基板上に固定したマイクロアレイ、あるいは微少粒子表面へ固定したビーズ等は代表的な固相ハイブリダイゼーションの形態である。固相上のハイブリダイゼーションが好まれる理由は、B/F分離が容易であること、検出領域を物理的に微小化でき高感度化が期待できること、複数種のプローブを物理的に隔離することにより同時多項目の検出が可能であること、固相ゆえにその取り扱いや応用が容易に出来るからである。
【0006】
たとえば米国アフィメトリックス社では、平面基板上に合成されたオリゴDNAに対し、標識された核酸を作用させ、そのハイブリダイゼーションを蛍光検出により測定することで、検体中に含まれる特定の核酸の有無や量を検出している(特許文献1参照)。また富士フィルム社においては、あらかじめアミノ基が導入された基板を用いてDNAアレイを作製し、これを用いて標識された22merの一本鎖DNAを検出している(特許文献2参照)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】米国特許第6410229号明細書
【特許文献2】特開2001−128683号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
固相上のハイブリダイゼーションを利用した検出方法は従来技術の中にも記載したように、他の検出方法に比べて高感度であるという長所はあるが、微少量の核酸検出に対するニーズはそれ以上に高く、より高感度かつ高特異的な検出をするためのさらなる改良が求められている。
【0009】
検出性能の向上に対応するために、様々な角度から改善が試みられている。改善方法としては、例えばターゲットを捕らえるプローブのTm値を高くし、プローブとターゲットの結合力を高める方法がある。また、ターゲットに対する標識率を高める、強い信号を出す標識物質を結合させる、あるいは標識物質そのものを複数の標識物質で多重増幅(増感剤)するなどの方法が取られている。
【0010】
しかし、プローブの結合力を高める方法は、非特異的な吸着や結合を引き起こし、特異性を大きく低下させる場合があり、その効果は限定的である。また、標識方法を改善する方法は、S/N比や定量性を著しく低下させる場合があり、やはりその効果は限定的である。
【0011】
プローブの改良や標識方法以外に、ハイブリダイゼーション効率を改善する方法としては、プローブとターゲットが形成するハイブリッド体を安定化させる方法がある。ハイブリッド体の安定化を行うためには、ハイブリダイゼーション反応の環境、すなわち塩濃度や変性剤濃度の最適化を行う必要があるが、やはり、特異性、S/N比の低下等が生じる場合があった。
【0012】
従って、核酸検出においてより効果的となる、安定したハイブリッド体の形成方法、そのためのプローブ設計方法、検体調製方法の開発等が強く望まれていた。
【課題を解決するための手段】
【0013】
上記課題を解決するため鋭意研究を重ねた結果、固相上のプローブと、プローブがハイブリダイズするサンプル核酸を、特定の条件を満たす配列上の位置関係に設定することで、プローブとサンプル核酸が安定したハイブリッド体を形成することを見出した。
【0014】
本発明によるハイブリッド体は、
固相に固定されたプローブ核酸とサンプル核酸とが、該サンプル核酸のターゲット鎖の有する標的配列と、該標的配列に相補的である該プローブ核酸の有するプローブ配列とにより形成されたハイブリット部を介して結合したハイブリッド体であって、
前記サンプル核酸のターゲット鎖が前記プローブ核酸のプローブ配列より長いことによって、少なくとも該ターゲット鎖の5'末端を含む部分が前記標的配列の5'側に伸びており、
かつ、該ターゲット鎖の3'末端は前記標的配列の3'側端部に相当するか、あるいは前記標的配列の3'側端部から3'方向に少なくとも1塩基分伸びた部分の先端にあり、
前記ターゲット鎖の5'末端を含む部分の塩基数をL1、前記ターゲット鎖の3'末端の前記標的配列の3'末端部分より伸びた部分の塩基数をL2(但し、前記ターゲット鎖の3'末端が前記標的配列の3'側端部に相当する場合をL2=0とする)と表わしたときに、L1/L2の値が0〜1.5の関係を満たすことを特徴とするハイブリッド体である。
【0015】
本発明にかかるプローブは、標的配列を有するターゲット鎖に対して、上記のハイブリッド体の構成をなすように設計されたプローブであって、前記ターゲット鎖が、検出対象としての配列を有する試料、該検出対象としての配列を含むPCR増幅産物または該検出対象としての配列の逆転写産物であることを特徴とするプローブである。
【0016】
本発明にかかるプローブセットは、上記プローブが2つ以上含まれるプローブのセットであり、本発明のプローブ担体は、担体上の全プローブ数の50%以上が上記プローブセットであるプローブ担体である。
【0017】
本発明にかかるプローブ設計方法は、標的配列を有するターゲット鎖に対して、上記のハイブリッド体の構成をなすようにプローブを設計するプローブ設計方法であって、前記ターゲット鎖が、検出対象としての配列を有する試料、該検出対象としての配列を含むPCR増幅産物または該検出対象としての配列の逆転写産物であることを特徴とするプローブ設計方法である。
【0018】
本発明にかかるPCR用プライマーは、上記のプローブに対して、上記のハイブリッド体の構成が可能であるようなサンプル核酸を調製するためのPCR用プライマーである。
【0019】
本発明にかかるサンプル核酸の検出方法は、固相に固定されたプローブ核酸に、該プローブ核酸よりも長いサンプル核酸を反応させて得られるハイブリッド体を検出することによるサンプル核酸の検出方法において、
前記プローブ核酸の配列を、以下の構成(1)及び(2)を満たすハイブリッド体を形成可能に設計されていることを特徴とする検出方法である。
(1)前記プローブ核酸とサンプル核酸とが、該サンプル核酸のターゲット鎖の有する標的配列と、該標的配列に相補的である該プローブ核酸の有するプローブ配列とにより形成されたハイブリット部を介して結合したハイブリッド体であって、
(2)前記サンプル核酸が有するターゲット鎖の5'末端は前記標的配列の5'側端部から5'方向に少なくとも1塩基分伸びた部分の先端にあり、かつ、該ターゲット鎖の3'末端は前記標的配列の3'側端部にあるか、あるいは前記標的配列の3'側端部から3'方向に少なくとも1塩基分伸びた部分にあり、
前記ターゲット鎖の5'末端の前記標的配列の5'末端部分より伸びた部分の塩基数をL1、前記ターゲット鎖の3'末端の前記標的配列の3'末端部分より伸びた部分の塩基数をL2(但し、前記ターゲット鎖の3'末端が前記標的配列の3'側端部にある場合をL2=0とする)と表わしたときに、L1/L2の値が0〜1.5の関係を満たすものである。
【0020】
この方法におけるサンプル核酸が検体核酸をテンプレートとしたPCRによる増幅産物である場合は、このPCR用のプライマーと前記プローブを、前記構成(1)及び(2)を満たすハイブリッド体を形成可能に設計することが好ましい。
【0021】
本発明にかかるサンプル核酸検出用のキットは、検体核酸から標的配列を有するターゲット鎖を有するサンプル核酸を増幅させるためのPCR用のプライマーと、該検体核酸をテンプレートとして該プライマーを用いて増幅した増幅産物中での前記標的配列の有無を確認するための固相に固定化されたプローブ核酸とを有するサンプル核酸検出用のキットにおいて、
前記プライマーと前記プローブ核酸の配列が、以下の構成(1)及び(2)を満たすハイブリッド体を形成可能に設計されていることを特徴とするキット。
(1)前記プローブ核酸とサンプル核酸とが、該サンプル核酸のターゲット鎖の有する標的配列と、該標的配列に相補的である該プローブ核酸の有するプローブ配列とにより形成されたハイブリット部を介して結合したハイブリッド体であって、
(2)前記サンプル核酸が有するターゲット鎖の5'末端は前記標的配列の5'側端部から5'方向に少なくとも1塩基分伸びた部分の先端にあり、かつ、該ターゲット鎖の3'末端は前記標的配列の3'側端部にあるか、あるいは前記標的配列の3'側端部から3'方向に少なくとも1塩基分伸びた部分にあり、
前記ターゲット鎖の5'末端の前記標的配列の5'末端部分より伸びた部分の塩基数をL1、前記ターゲット鎖の3'末端の前記標的配列の3'末端部分より伸びた部分の塩基数をL2(但し、前記ターゲット鎖の3'末端が前記標的配列の3'側端部にある場合をL2=0とする)と表わしたときに、L1/L2の値が0〜1.5の関係を満たすものである。
【0022】
本発明によるハイブリッド体は、固相に固定されたプローブ核酸とサンプル核酸とのハイブリッド体であればいかなる組み合わせでも実施可能である。この中でも、DNAマイクロアレイに代表されるように、プローブとしてオリゴヌクレオチドやcDNAなどのDNAを平面基板上に固定させ、検出可能な標識により標識されたサンプル核酸とハイブリダイゼーションさせたハイブリッド体は本発明を実施する上で好適な一例である。
【0023】
固相上に固定させるプローブは、さまざまな方式により固定化することが可能であり、代表的な固定の方法としては、共有結合、イオン結合、吸着等があるが、本発明のハイブリッド体はいずれの固定方法でも実施可能である。
【0024】
これらのうち、共有結合による固定方法は、ハイブリダイゼーションに伴う様々な条件変化(例えば加熱や高い塩濃度)にも比較的影響されにくく、安定なハイブリッド体を形成する上で好ましい結合方式である。共有結合の具体的な結合方法としては、固相上に導入可能な官能基と核酸プローブ側に導入可能な官能基の組み合わせにより、各種の結合方式が特に制限無く適用可能であるが、プローブに合成オリゴヌクレオチドを使用する場合、チオール基やアミノ基、あるいはその誘導体が修飾官能基として比較的容易に導入しやすいため、よく用いられている。なかでも、オリゴヌクレオチドの5'末端や3'末端に上記の官能基を導入する方法が、合成上容易であり、オリゴヌクレオチドの末端に修飾した官能基を介して固相に固定化したプローブは、本発明によるハイブリッド体に好適に用いることができる。
【0025】
また、5'末端、3'末端以外でも、オリゴヌクレオチド配列中間部の核酸に由来する官能基や、人工的に合成したヌクレオチド誘導体をサンプル核酸中に取り込ませ、その官能基を利用して固定化することが可能である。
【0026】
また、DNAはリン酸エステル結合によりその骨格を形成していることから、分子全体として負の電荷を有しており、例えば固相上に導入した正電荷を有するコーティング剤や固相自体に吸着させることも可能である。
【0027】
固相に固定したプローブとしては、様々な鎖長を有するプローブを用いることが可能である。鎖長により特異性、結合力等、それぞれ特徴があるが、15〜30mer、31〜50mer、51mer〜80merの各鎖長を有するオリゴヌクレオチドは、固相表面に固定化するプローブとしてよく用いられ、本発明のハイブリッド体を構成するプローブとして好適に用いられるプローブの塩基長である。
【0028】
また、一般的にはプローブとしてオリゴヌクレオチドなどの核酸が用いられることが多いが、強いハイブリダイゼーションが期待できるペプチド核酸(PNA)をプローブとして用いることも可能であり、本発明によるL1とL2の関係を有するハイブリッド体を形成することにより、より安定なハイブリッド体とすることが可能である。
【0029】
L1とL2の関係はL1/L2の値が0〜1.5の関係を満たすのであれば本発明の安定なハイブリッド体は形成可能である。なかでもL1/L2の値が0〜1の範囲、すなわちL1≦L2である場合にはより一層、安定なハイブリッド体の形成が可能である。
【0030】
サンプル核酸は、検査対象としての検体自体、あるいは検体から各種の方法で取り出された核酸断片としてプローブとの反応に用いられるものであり、プローブとハイブリダイズする部分である標的配列を有するものである。この標的配列は、検体が有すると想定される配列を特定できるものであればよく、サンプル核酸の種類によって、検体中に直接含まれる検出対象としての配列の一部それ自体であっても、その相補配列であってもよい。サンプル核酸は、プローブとハイブリダイずる標的配列(プローブの有するプローブ配列と相補的である)を有するターゲット鎖を有するもので、例えば、二本鎖DNA、一本鎖DNA、RNAいずれの核酸でも、適当な条件下で固相プローブとハイブリダイゼーション可能であれば本発明は適用可能である。例えば、一本鎖DNAの場合は、それ自身がターゲット鎖になる。
【0031】
また、サンプル核酸の調製方法は特に制限なく適用可能であるが、よく用いられる調製方法として、PCR増幅法、RNAの逆転写があり、それらの調製方法で得られる、PCR産物、逆転写産物は本発明のハイブリッド体を形成するために好適に用いることが可能である。
【0032】
DNAマイクロアレイなどに代表されるように、固相上ハイブリダイゼーションを特定の塩基配列の検出のために用いる場合、多くはサンプル核酸に何らかの標識物質を結合させるが、標識物質が取り込まれたサンプル核酸であっても、本発明によるハイブリッド体の形成は好適に適用可能である。
【0033】
標識物質としては、取り扱いも容易で高感度な検出が可能である蛍光物質が一般によく用いられるが、放射線同位体による標識も感度という点では優れており好適に用いることが可能である。蛍光物質を利用する場合、蛍光物質の種類は多岐にわたっておりいずれの蛍光色素も用いることが可能であるが、Cy3やCy5などの蛍光色素は広く利用されており、本発明によるハイブリッド体にも好適に用いることが可能である。
【0034】
サンプル核酸の鎖長は特に制限なくハイブリッド体を形成できるが、なかでもサンプル核酸の鎖長が500bp以上の場合にはより安定したハイブリッド体の形成が可能である。さらには鎖長が500bp以上2500bp以下の場合、より安定したハイブリッド体の形成が可能である。
【0035】
本発明では、サンプル核酸に対し、上記のハイブリッド体を形成させるために設計されたプローブも提案する。すなわち、サンプル核酸において、本発明によるハイブリッド体を形成させることが可能な位置にプローブ捕捉領域を設定し、固相プローブとサンプル核酸が本発明による位置関係を有するハイブリッド体を形成するようなプローブを提案する。
【0036】
また、異なる種類のプローブが2つ以上で構成されるプローブセットも提案する。
また、上記プローブを提供するにあたってはプローブの配列等を設計する必要があるが、そのためのプローブ設計方法も提案する。
【0037】
標的核酸(配列)検出のためのプローブを効果的に利用するためには、B/F分離を容易にするために、固体担体上にプローブを固定しておく場合があるが、そのために、本発明によるプローブを少なくとも1つ以上、固体担体上に固定したプローブ担体も提案する。1つ以上のプローブを固体担体上に固定化したプローブ担体としてDNAマイクロアレイがあげられるが、DNAマイクロアレイも本発明によるプローブ固定化担体として好適な一例である。
【0038】
また、サンプル核酸としては、上述したようにPCR産物が用いられることが多いが、PCR産物を調製するにあたり、上記のL1とL2の条件を満たすよう設計されるPCR用のプライマーも提案する。
【発明の効果】
【0039】
本発明により、固相上のプローブとサンプル核酸が形成するハイブリッド体において、より安定したハイブリッド体を得ることができ、またその形成する条件を得ることが出来る。さらに、本発明の条件を満たすプローブ、プライマー、さらにそれらの設計の方法、加えてそれらのハイブリッド体が形成されたプローブ担体も合わせて提供することができる。本発明により、固相上でのハイブリダイゼーションを利用した核酸検出方法において、効率的かつ高感度な検出が可能となる。
【図面の簡単な説明】
【0040】
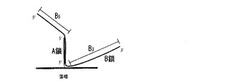
【図1】固相に固定したA鎖プローブとサンプル核酸であるB鎖とのハイブリッド体を示した図である。サンプル核酸においてハイブリッド形成部よりも5'側の塩基鎖長をB5、3'側の塩基鎖長をB3で示した。
【図2】pUC118 EcoRI/BAPにおいて、3つのプライマーの位置を示した図であり、矢印はそれぞれのプライマーにおいて5'から3'に向かう方向を示している。
【図3】pUC118 EcoRI/BAPにおいて、3つのプライマー、および3つのプローブを示した図である。
【図4】pUC118 EcoRI/BAPにおいて、フォワードプライマーF1からF8、リバースプライマーR1からR7、計15種のプライマーの位置関係を示した図であり、矢印はそれぞれのプライマーにおいて5'から3'に向かう方向を示している。
【図5】pUC118 EcoRI/BAPにおいて、各プライマー、および3つのプローブの位置関係を示した図である。
【図6】25merのプローブにおけるL1/L2に対する輝度値をプロットしたグラフである。
【図7】40merのプローブにおけるL1/L2に対する輝度値をプロットしたグラフである。
【図8】60merのプローブにおけるL1/L2に対する輝度値をプロットしたグラフである。
【図9】3’末端を固定したプローブとターゲット鎖とのハイブリッド体、およびL1、L2の位置関係を示した図である。
【図10】3’末端固定の25merのプローブにおけるL1/L2に対する輝度値をプロットしたグラフである。
【発明を実施するための形態】
【0041】
本発明によるハイブリッド体についてさらに詳しく説明する。
【0042】
本発明により提供されるハイブリッド体は、固相上に存在するプローブと、配列の一部に相補的な配列を有するサンプル核酸と、から形成されるハイブリッド体であって、サンプル核酸の捕捉対象領域よりも5'側にある塩基鎖長をL1とし、3'側にある塩基鎖長をL2としたときに、L1/L2の値が0〜1.5の関係を有するハイブリッド体である。5'末端が固相に固定された一本鎖プローブ(A鎖)と、相補的な配列を有する一本鎖核酸(B鎖)とのハイブリッド体の模式図を図1に示した。この図において、B鎖のプローブ結合領域よりも5'側の塩基鎖長B5とし、3'側の塩基鎖長をB3としたときに、B5≦B3となる関係を有するハイブリッド体が本発明の一例を示すハイブリッド体である。
【0043】
L1/L2の値が0〜1.5であれば本発明の安定したハイブリッド体を形成することは可能であるが、より安定したハイブリッド体を形成するためには、L1/L2の値が0〜1であることが望ましい。
【0044】
プローブは何らかの固相上または固相表面に固定化されていれば、その固定の形態に制限無く本発明のハイブリッド体は形成可能である。このうち、ガラス基板に核酸を固定化したDNAマイクロアレイはその代表例であり、様々な種類のDNAマイクロアレイが本発明のハイブリッド体に適用可能である。固相に用いられる材質としては、ガラス以外にも、樹脂、金属、金属薄膜、繊維等でも適用可能であり、またその外観上の形態も、微粒子、光ファイバー先端、多孔質材料、繊維等、時に制限無く利用可能である。
【0045】
結合様式としては吸着、化学結合等様々な方式が存在するが、いずれの結合様式でもハイブリッド体は形成可能である。例えば、課題を解決するための手段に記載したイオン結合では、アミノ基をコートしてあるガラス基板または樹脂表面に対し、通常の核酸を供するだけでイオン的に結合させることができる。
【0046】
また、5'末端、3'末端、あるいは配列の中部にチオール基、アミノ基等の官能基を修飾した修飾オリゴヌクレオチドを用い、導入した官能基の反応を利用して固定化することも可能である。例えばアミノ基を利用する場合、固相表面にアミノ基と効率的に反応するスクシイミド基をあらかじめ結合させておき、5'末端や3'末端などにアミノ基を修飾したオリゴヌクレオチドを固相表面に供給することにより、容易に共有結合を形成させることができ、本発明のハイブリッド体を構成するプローブとして好適に用いることが可能である。
【0047】
またチオール基を用いる場合には、例えば固相にマレイミド基を結合させておくことにより、アミノ基の場合と同様、共有結合を容易に形成し、本発明のハイブリッド体として好適に用いることが出来る。
【0048】
プローブの種類としては、DNAなどのほかに、PNAなども用いることができる。プローブとしてはcDNAなども用いることができるが、より精度の高いハイブリッド体の形成を行うためには、化学的な手法により合成されたオリゴヌクレオチドをプローブに使用することが多く、そのプローブの塩基鎖長としては、15〜30mer、31〜50mer、51〜80merのプローブがそれぞれの特性に応じて利用されることが多い。
【0049】
本発明のハイブリッド体を形成するサンプル核酸は、固相上のプローブ鎖長よりも長ければ特に制限無く本発明のハイブリッド体に用いることが出来る。
【0050】
本発明によるハイブリッド体は、核酸配列の検出を目的としたDNAマイクロアレイ、ビーズ等でよく用いられる。この場合、サンプル核酸はPCRにより増幅されたPCR産物、転写物、逆転写産物等がよく用いられるが、これらの核酸は本発明のハイブリット体に対して好適に用いることが可能である。すなわち、サンプル核酸は二本鎖、一本鎖いずれでもよく、また、DNA、RNAどちらであっても本発明のハイブリッド体を形成できる。
【0051】
また、ハイブリッド体の形成を分光学的な手法により検出する場合、サンプル核酸に対し何らかの標識物質、たとえば蛍光物質、放射性物質等によって標識する必要がある場合があるが、このような標識物質を含むサンプル核酸でも、本発明のハイブリッド体は形成可能である。中でも、Cy3、Cy5を代表とするCy Dye (アマシャムファルマシア製)は、核酸標識用の蛍光物質としてよく用いられ、これらの蛍光物質が含まれたサンプル核酸は何ら問題となることなく本発明のハイブリッド体に適用可能である。
【0052】
また、蛍光物質と同レベルの検出感度を有する標識材料として32P等の放射性同位体などが用いられることも多いが、この場合でも、本発明のハイブリッド体は充分、形成可能である。
【0053】
本発明のハイブリッド体はサンプル核酸の鎖長によらず形成可能であるが、なかでも500bp以上の場合により安定したハイブリッド体の形成が可能であり、さらには500bp以上かつ2500bp以下の鎖長を有するサンプル核酸の場合より安定したハイブリッド体の形成が可能である。
【0054】
サンプル核酸が例えば二本鎖DNAの場合、プローブとのハイブリッド形成部以外の部分は、サンプル核酸自体がその相補鎖と二本鎖を形成していることもあるが、そのような場合でも、本発明のハイブリッド体は形成可能である。すなわち、固相上プローブとサンプル核酸が形成するハイブリッド体のうち、部分的であっても、上記のL1とL2との関係を有する部分が存在すれば、本発明が示す、安定性の高いハイブリッド体の形成は可能である。
【0055】
また、プローブとサンプル核酸の二本鎖形成部分の鎖長がプローブ長よりも短い場合、すなわちプローブがミスマッチを含む状態でサンプル核酸とハイブリッドを形成している場合であっても、安定したハイブリッド体の形成は可能なサンプル核酸である。その際には、サンプル核酸の5'末端から二本鎖形成部分の末端部分までの鎖長をL1とし、3'末端から同じく二本鎖形成部分の末端部分までの鎖長をL2として、上記L1とL2の関係を満たすのであれば、本発明のハイブリッド体を形成できる。
【0056】
特定の塩基配列を認識し、固相上プローブとのハイブリッド体形成により検出対象物の有無を検出するためのプローブ設計は、サンプル核酸を特異的かつ高感度に検出できるよう配慮して設計されることが多い。これらの設計方法の多くは、塩基配列のみを設計のために用いているため、液相系ハイブリダイゼーションでは有効に設計できるが、固相上でのハイブリダイゼーションに対しては、必ずしも最適なプローブ設計ができなかった。本発明のハイブリッド体形成条件は、固相上におけるハイブリッド体安定性に関する指標を与える。そこで、本発明においては、固相上プローブの設計において先に挙げた条件を満たすプローブ設計方法も提案する。
【0057】
また、このプローブ設計方法により設計された、プローブも提案する。さらにはそれらのプローブが2つ以上集まったプローブセットも提案する。
【0058】
複数の異なる種類のプローブが固体担体上に固定化されたプローブ担体の一例として、DNAマイクロアレイが挙げられるが、このようなプローブ担体を構成するプローブとして、本発明によるプローブを利用する場合には、担体上の全プローブ数のうち50%以上が、本発明のプローブによって構成されていることが好ましく、さらには70%以上の構成比率であることが好ましいが、本発明においては、そのような複数のプローブ(プローブセット)が固定化されたプローブ担体も提案する。
【0059】
条件を満たすプローブ数の割合は50%以上であればよいが、75%以上であればさらに好ましい。
【0060】
即ち、本願発明のプローブセットの設計方法は、固相上に複数のスポットとして固定された、複数種類のプローブ核酸からなるプローブセットと、PCR用のプライマーを用いて増幅されたサンプル核酸が有するターゲット鎖の該プライマーよりも3’側の標的配列と、を反応させて得られる1種類以上のハイブリッド体を検出することによるサンプル核酸の検出方法に用いる前記プローブセットの設計方法であって、前記プローブセットの前記複数種類の前記プローブ核酸が、前記サンプル核酸とハイブリダイズしたときに、70%以上の前記ハイブリッド体が以下の(1)および(2)の関係を満たすように設計することを特徴とする設計方法:
(1)前記プローブ核酸とサンプル核酸とが、該サンプル核酸のターゲット鎖の有する標的配列と、前記プローブセットの該標的配列に相補的である該プローブ核酸の有するプローブ配列とにより形成されたハイブリット部を介して結合したハイブリット体であって、
(2)前記サンプル核酸が有するターゲット鎖は、前記プローブ核酸よりも長く、該ターゲット鎖の5’末端は前記標的配列の5’側端部から5’方向に少なくとも前記プライマーの塩基分伸びた部分の先端にあり、かつ、該ターゲット鎖の3’末端は前記標的配列の3’側端部から3’方向に少なくとも前記プライマーの塩基分伸びた部分にあり、前記ターゲット鎖の5’末端の前記標的配列の5’末端部分より伸びた部分の塩基数をL1、前記ターゲット鎖の3’末端の前記標的配列の3’末端部分より伸びた部分の塩基数をL2と表したときに、L1≦L2の関係を満たすものである。
【0061】
サンプル核酸がPCR産物等の場合、サンプル核酸の配列中における相対的なプローブ領域は、PCR増幅を実施するために設計されたプライマーの設計により変わってくる。サンプル核酸の塩基配列中、プローブ領域として選択される部分が上記の条件を満たすように設計できれば望ましいが、特異性等の観点から、必ずしもこの条件でプローブが設定できない場合もある。その場合にはプローブ領域を設定したのちに、設定したプローブ領域が請求項1の条件を満たすようなサンプル核酸のプライマー設定を行えばよい。本発明では設定したプローブ領域に対し上記の条件を満たすようなハイブリッド体を形成するためのサンプル核酸増幅用のプライマーも提案する。
【実施例】
【0062】
以下、実施例により、本発明をさらに具体的に説明する。ただし、以下に述べる実施例は、本発明にかかる最良の実施形態の一例ではあるが、本発明の技術的範囲はこれら実施例に限定されるものではない。
【0063】
I.pUC118 EcoRI/BAPのPCR
(1)プライマーの設計
検査対象の配列を有する検体のモデルとして、市販のTakara社製ベクター pUC118 EcoRI/BAP(全長3162bp)を選択し、その塩基配列中より、下記の配列を有するプライマー3種を設計した。なお、pUC118 EcoRI/BAPの全塩基配列情報に関しては、Takara社より提供されており、また、公開されているデータベース等からも入手可能である。
【0064】
プライマーの設計にあたっては、pUC118 EcoRI/BAPの中の、所望の部分塩基配列がPCR増幅により特異的かつ効率的に増幅されるよう、配列、GC%、融解温度(Tm値)に充分配慮して設計を行った。
【0065】
設計されたプライマーはフォワード側(F)2種、リバース側(R)1種の計3種である。pUC118 EcoRI/BAPをテンプレートとし、F1とR1、またはF2とR1の組み合わせでPCR増幅することにより、それぞれ1324bp(PCR産物1)、940bp(PCR産物2)のPCR産物が増幅されることになる。設計されたプライマーの塩基配列およびTm値を表1に示す。
【0066】
【表1】

【0067】
またpUC118 EcoRI/BAP全長における3種のプライマーの位置を図2に示す。なお、この図において矢印の示す方向は、各プライマー鎖において5'末端から3'末端に向かう方向を示している。
【0068】
(2)プライマーの合成
実施例1の(1)で設計した3種のプライマーを合成した。各プライマーの合成は、それぞれの塩基配列を有するDNA鎖を定法に従ってDNA合成機で合成した。精製は、カートリッジ精製により行い、3種のプライマーを得た。得られたプライマーは、TEバッファーにて10μMの濃度に希釈した。
【0069】
(3)PCR増幅反応
実施例1の(2)で合成した3種のプライマー、鋳型遺伝子DNAとするTakara社製ベクター pUC118 EcoRI/BAP、およびQIAGEN社製PCRキット HotStarTaq Master Mix を用いて、PCR増幅反応を行った。Master Mix中にはdATP、dCTP、dTTP、dGTPの4種のデオキシヌクレオチドが含まれているが、PCR産物を蛍光標識により標識するため、アマシャムファルマシア社製のCy3dUTPを加えて、PCR産物をCy3により標識した。
【0070】
フォワード・プライマーとリバース・プライマーの組み合わせとして、(1)中に記載した2組の組み合わせでPCR増幅を行った。PCRの反応条件は、下記のプロトコルによって、下記表2に示す組成の反応液の調製を行った。
【0071】
【表2】

【0072】
調製された反応液について、市販のサーマルサイクラーを用いて、下記表3の温度サイクル・プロトコルに従って、PCR増幅反応を行った。すなわち、95℃/15分の保持の後、92℃(変性)/45秒、55℃(アニーリング)/45秒および72℃(伸長)/45秒を1サイクルとして25サイクル、最後に72℃/10分保持した。
【0073】
【表3】

【0074】
増幅反応終了後、PCR増幅産物は精製用カラム(Qiagen QIAquick PCR Purification Kit)を用いて精製した。精製後、PCR増幅産物溶液の液量は、50μlとなるよう調製した。得られた精製済PCR増幅産物溶液の一部を取り、定法に従って電気泳動を行い、2種のPCR産物それぞれにおいて所望の塩基長を有するバンドが出ていることを確認した。
【0075】
II.DNAマイクロアレイの作製
(1)プローブの設計及び合成
上記、PCR産物1に対して、3種のプローブを設計した。設計はプライマーの設計と同様、各プローブが、検体中に選択した部分塩基配列(標的配列)を特異的に認識できるよう、配列、GC%、融解温度(Tm値)に充分配慮して設計を行った。
【0076】
設計されたプローブの塩基配列およびTm値を表4に示す。
【0077】
【表4】

【0078】
このプローブ設計においては、プローブとハイブリダイゼーションし、プローブとハイブリッド体を形成するのは、R1のプライマーから伸長したDNA鎖である。
【0079】
またP2およびP3はプローブとしてPCR産物2に対してもハイブリッド体を形成する。
【0080】
PCR産物1および2と各プローブとのハイブリッド体において、ハイブリッド部よりも5'側に存在するターゲット鎖の鎖長をL1とし、3'側に存在する鎖長をL2として、各PCR産物に対する各プローブのL1、L2およびL1/L2の値を表5に示す。
【0081】
【表5】

【0082】
pUC118 EcoRI/BAP全長における3種のプローブ、3種のプライマーの位置を図3に示す。
【0083】
(2)ガラス基板の洗浄
合成石英のガラス基板(サイズ(W×L×T):25mm×75mm×1mm、飯山特殊ガラス社製)を耐熱、耐アルカリ性のラックに入れ、所定の濃度に調製した超音波洗浄用の洗浄液に浸した。一晩、洗浄液中で浸した後、20分間超音波洗浄を行った。続いて、ガラス基板を取り出し、軽く純水で漱いだ後、超純水中で20分間、超音波洗浄を行った。次に、80℃に加熱した1N水酸化ナトリウム水溶液中に10分間、ガラス基板を浸した。再び、純水洗浄と超純水洗浄を行い、DNAマイクロアレイ用の洗浄済石英ガラス基板を用意した。
【0084】
(3)表面処理
シランカップリング剤KBM−603(信越シリコーン社製)を、1%の濃度となるように純水中に溶解させ、2時間室温で攪拌した。続いて、洗浄済石英ガラス基板を、このシランカップリング剤水溶液に浸し、20分間室温で放置した。ガラス基板を引き上げ、軽く純水で表面を洗浄した後、ガラス基板の両面に窒素ガスを吹き付けて乾燥させた。次に、窒素ブロー乾燥したガラス基板を、120℃に加熱したオーブン中で1時間ベークし、カップリング剤処理を完結させた。このカップリング剤処理により、ガラス基板表面にシランカップリング剤由来のアミノ基が導入された。
【0085】
一方、同仁化学研究所社製のN−マレイミドカプロイロキシスクシイミド(N−(6−Maleimidocaproyloxy)succinimido);以下、EMCSと略す)を、ジメチルスルホキシドとエタノールの1:1混合溶媒中に最終濃度が0.3mg/mlとなるように溶解したEMCS溶液を用意した。ベーク終了後、カップリング剤処理済ガラス基板を放冷し、調製したEMCS溶液中に室温で2時間浸した。この浸漬処理間に、カップリング剤処理済ガラス基板の表面に導入されているアミノ基とEMCSのスクシイミド基とが反応し、ガラス基板表面にEMCS由来のマレイミド基が導入された。EMCS溶液から引き上げたガラス基板を、先述のジメチルスルホキシドとエタノールの混合溶媒を用いて洗浄し、さらに、エタノールにより洗浄した後、窒素ガス雰囲気下で乾燥させた。
【0086】
(4)プローブ用DNAの合成
上記(1)で設計した3種のプローブを合成した。
【0087】
プローブDNAは、上記の表面にマレイミド基が導入されガラス基板に対して共有結合させるため、定法に従って、5'末端にチオール化処理を施した。その後、DNA合成時における副反応を避けるために、保護を施している保護基を脱保護し、さらにHPLC精製および脱塩処理を施した。
【0088】
得られたプローブDNAは、純水に溶解し、それぞれ、最終濃度(インク溶解時)10μMとなるように分注した後、凍結乾燥を行い、水分を除いた。
【0089】
(5)BJプリンターによるプローブDNA吐出、および基板表面への結合
グリセリン7.5重量%、チオジグリコール7.5重量%、尿素7.5重量%、アセチレノールEH(川研ファインケミカル社製)1.0重量%を含む水溶液を用意した。続いて、分注したプローブDNAを上記の混合溶媒に規定濃度(10μM)となるように溶解した。得られたプローブDNA溶液をバブルジェット(登録商標)プリンター(商品名:BJF−850 キヤノン社製)用インクタンクに充填し、印字ヘッドに装着した。
【0090】
なお、前記バブルジェットプリンターは、平板へのインクジェット印刷が可能なように改造を施したものである。また、該改造バブルジェットプリンターは、所定のファイル作成方法に従って印字パターンを入力することにより、約5plのDNA溶液液滴を、約120μmピッチでスポッティングすることが可能となっている。
【0091】
続いて、この改造バブルジェットプリンターを用いて、ガラス基板表面にプローブDNA溶液のスポッティング操作をおこなった。DNAマイクロアレイ1枚あたり、プローブごとに16スポットの吐出が行われるよう印字のパターンを予め作成し、インクジェット印字した。目的のパターンにDNA溶液のスポッティングが確実に行われていることを拡大鏡等により確認した後、30分間常温で加湿チャンバー内に静置し、ガラス基板表面のマレイミド基とプローブDNA5'末端のチオール基とを反応させた。
【0092】
(6)洗浄
加湿チャンバー内における30分間の反応後、100mMのNaClを含む10mMのリン酸緩衝液(pH7.0)により、ガラス基板表面に残った未反応のプローブDNAを洗い流した。ガラス基板表面に、1枚あたり16スポットに所定の一本鎖プローブDNAが、それぞれ固定された、DANマイクロアレイを得た。
【0093】
III.ハイブリダイゼーション反応
IIで作製したDNAマイクロアレイと、サンプル核酸検体としてIで作製したPCR増幅産物2種を用いて、マイクロアレイ上でのハイブリダイゼーションを行った。
【0094】
(1)DNAマイクロアレイのブロッキング
BSA(牛血清アルブミンFraction V:Sigma社製)を1重量%となるように、100mM NaCl/10mM リン酸バッファーに溶解し、この溶液にIIで作製したDNAマイクロアレイを室温で2時間浸し、ガラス基板面のブロッキングを行った。ブロッキング終了後、0.1重量%SDS(ドデシル硫酸ナトリウム)を含む2×SSC溶液(NaCl 300mM、Sodium Citrate(trisodium citrate dihydrate,C6H5Na3・2H2O) 30mM、pH7.0)で洗浄を行った後、純水でリンスした。その後、スピン・ドライ装置でDNAマイクロアレイの水切りを行った。
【0095】
(2)ハイブリダイゼーション溶液の調製
各PCR産物は互いに等モルとなるよう調製したうえで、PCR増幅産物溶液を用いて最終濃度が下記の構成となるよう、各PCR産物に対しハイブリダイゼーション溶液を調製した。
【0096】
<ハイブリダイゼーション溶液>
6×SSPE/10% Form amide/PCR増幅産物溶液
(6×SSPE: NaCl 900mM、NaH2PO4・H2O 60mM、EDTA 6mM、pH7.4)
(3)ハイブリダイゼーション
水切りしたDNAマイクロアレイを、ハイブリダイゼーション装置(Genomic Solutions Inc. Hybridization Station)にセットし、上記組成のハイブリダイゼーション溶液を用いて、下記手順・条件でハイブリダイゼーション反応を行った。
【0097】
<ハイブリダイゼーション条件・手順>
上記ハイブリダイゼーション溶液を、65℃に加温し3分間保持したあと、さらに92℃で2分間、続いて55℃で4時間保持した。そのあと、その後、2×SSCおよび0.1%SDSを用いて、25℃で洗浄をした。さらに2×SSCを用いて20℃で洗浄を行い、必要に応じて通常のマニュアルに従い純水でリンスして、最後にスピン・ドライ装置で水切りを行い乾燥させた。
【0098】
【表6】

【0099】
(4)蛍光測定
ハイブリダイゼーション反応終了後、スピン・ドライ乾燥したDNAマイクロアレイについて、DNAマイクロアレイ用蛍光検出装置(Axon社製、Genepix 4000B)を用いて、ハイブリッド体に由来する蛍光測定を行った。PCR増幅産物1、2の蛍光輝度を各プローブに対して測定した結果を下記の表7に示す。
【0100】
輝度の算出にあたっては、DNAマイクロアレイ上、プローブDNAのスポットの無い部分において観測される蛍光強度をバックグランド値として、各スポットからの見掛けの蛍光強度より、バックグランド値を差し引いた値を、蛍光強度の実測値とした。また測定は2回実施し、その平均値を示す。
【0101】
【表7】

【0102】
この結果から、同一のサンプル核酸に対しほぼ同一のTm値を有するように設計したプローブであっても、蛍光輝度値が大きく異なる、すなわち安定性が大きく異なる。蛍光輝度値が上昇するということは、ハイブリッド体がより多く形成していることを示し、すなわちハイブリッド体が安定であることを示している。さらに、ハイブリッド形成部よりも5'側、3'側にある部分の塩基鎖長比(L1/L2)によって、ハイブリッド体の安定性が異なり、特に5'側の塩基鎖長が3'側の塩基鎖長に比べて短いほうがより安定したハイブリッド体を形成していることがわかった。
【0103】
[実施例2]
I.pUC118 EcoRI/BAPのPCR
(1)プライマーの設計
検査対象の配列を有する検体のモデルとして、市販のTakara社製ベクター pUC118 EcoRI/BAP(全長3162bp)を選択し、その塩基配列中より、下記の配列を有するプライマーを設計した。なお、pUC118 EcoRI/BAPの全塩基配列情報に関しては、Takara社より提供されており、また、公開されているデータベース等からも入手可能である。
【0104】
プライマーの設計にあたっては、pUC118 EcoRI/BAPの中の、所望の部分塩基配列がPCR増幅により特異的かつ効率的に増幅されるよう、配列、GC%、融解温度(Tm値)に充分配慮して設計を行った。
【0105】
設計されたプライマーはフォワード側(F)8種、リバース側(R)7種の計15種である。pUC118 EcoRI/BAPをテンプレートとし、フォワード側とリバース側のプライマーを各1種ずつ組み合わせてPCR増幅することにより、104bpから2345bpの様々な鎖長のPCR産物が増幅されることになる。
設計されたプライマーの塩基配列を表8に示す。
【0106】
【表8】

【0107】
またpUC118 EcoRI/BAPにおける15種のプライマーの位置関係の概略を図4に示す。なお、この図において矢印の示す方向は、各プライマー鎖において5'末端から3'末端に向かう方向を示している。
【0108】
(2)プライマーの合成
実施例2の(1)で設計した15種のプライマーを合成した。各プライマーの合成は、それぞれの塩基配列を有するDNA鎖を定法に従ってDNA合成機で合成した。精製は、カートリッジ精製により行い、15種のプライマーを得た。得られたプライマーは、TEバッファーにて10μMの濃度に希釈した。
【0109】
(3)PCR増幅反応
実施例2の(2)で合成した15種のプライマー、鋳型遺伝子DNAとするTakara社製ベクター pUC118 EcoRI/BAP、およびInvitrogen社製PCRキットAccuPrime Taq DNA Polymerase Systemを用いて、PCR増幅反応を行った。AccuPrimeのキットに含まれる専用のBuffer中にはdATP、dCTP、dTTP、dGTPの4種のデオキシヌクレオチドが含まれているが、PCR産物を蛍光物質により標識するため、アマシャムファルマシア社製のCy3dUTPを加えて、PCR増幅反応を行った。
【0110】
フォワードプライマーとリバースプライマーを、表9に示すように24通りに組み合わせ、各組み合わせごとにPCR増幅反応を行った。なお、PCR産物長の単位はbpである。
【0111】
【表9】

【0112】
反応条件は、下記のプロトコルによって、下記表10に示す組成の反応液の調製を行った。
【0113】
【表10】

【0114】
調製された反応液について、市販のサーマルサイクラーを用いて、下記表11の温度サイクル・プロトコルに従って、PCR増幅反応を行った。すなわち、94℃/2分の保持の後、92℃(変性)/30秒、55℃(アニーリング)/45秒、および72℃(伸長)/60秒を1サイクルとして30サイクル、最後に72℃/10分間保持した。
【0115】
【表11】

【0116】
増幅反応終了後、PCR増幅産物は精製用カラム(Qiagen QIAquick PCR Purification Kit)を用いて精製した。精製後、PCR増幅産物溶液の液量は、50μlとなるよう調製した。得られた精製済PCR増幅産物溶液の一部を取り、定法に従って電気泳動を行い、24種のPCR産物それぞれにおいて所望の塩基長を有するバンドが出ていることと、各PCR産物の生成量を確認した。
【0117】
II.DNAマイクロアレイの作製
(1)プローブの設計
上記、24種のPCR産物を検出するために、pUC118 EcoRI上の3つの領域に対してプローブを設計した。図5にpUC118 EcoRI上のプローブ領域を示す。3つの領域に対して、各領域ごとに鎖長の異なる3つのプライマーを設計した。鎖長は25mer、40mer、60merの3種である。設計はプライマーの設計と同様、各プローブが、検体中に選択した部分塩基配列(標的配列)を特異的に認識できるような配列を選び、さらに各プローブごとに、GC%、融解温度(Tm値)に充分配慮して設計を行った。
【0118】
計9種の設計されたプローブの名称、塩基配列、およびTm値を表12に示す。
【0119】
【表12】

【0120】
上記のプローブは、pUC118 EcoRIの配列上において、フォワードプライマーと同じ配列上にある配列であることから、このプローブとハイブリダイゼーションし二本鎖を形成するのは、相補鎖であるリバースプライマー側の配列(リバースプライマー伸長鎖)である。
【0121】
各PCR産物(ターゲット鎖)と各プローブとのハイブリッド体において、ハイブリッド部よりも5'側に存在するターゲット鎖の鎖長をL1とし、3'側に存在する鎖長をL2として、各PCR産物に対する各プローブのL1、L2およびL1/L2の値を表に示す。25merのプローブA25、B25、C25については表13に、40merのプローブについては表14に、60merのプローブについては表15に示す。
【0122】
【表13】

【0123】
【表14】

【0124】
【表15】

【0125】
(2)マイクロアレイの作製
上記プローブの合成からマイクロアレイ作製までは実施例1と同様に行った。本実施例においては、9種のプローブは同一マイクロアレイ上にはのせず、プローブごとにマイクロアレイを作製した。実施例1と同様に、1枚のマイクロアレイ上に16のスポットを固定した。
【0126】
III.ハイブリダイゼーション反応
IIで作製したDNAマイクロアレイと、サンプル核酸検体としてIで作製したPCR増幅産物を用いて、マイクロアレイ上でのハイブリダイゼーションを行った。
【0127】
マイクロアレイは9種のプローブごとに作製し、PCR産物も24種作成した。これらを用いて表13から表15に記載されている全243通りのハイブリダイゼーションを行った。
【0128】
(1)DNAマイクロアレイのブロッキング
実施例1と同様にBSAを用いてブロッキングを行った。
【0129】
(2)ハイブリダイゼーション溶液の調製
各PCR産物はそれぞれが等モルとなるよう調製したうえで、PCR増幅産物溶液を用いて最終濃度が下記の構成となるよう、各PCR産物に対しハイブリダイゼーション溶液を調製した。
【0130】
<ハイブリダイゼーション溶液>
6×SSPE/10% Form amide/0.05% SDS/PCR増幅産物溶液(6×SSPE: NaCl 900mM、NaH2PO4・H2O 60mM、EDTA 6mM、pH7.4)
(3)ハイブリダイゼーション
水切りしたDNAマイクロアレイを、ハイブリダイゼーション装置(Genomic Solutions Inc. Hybridization Station)にセットし、上記組成のハイブリダイゼーション溶液を用いて、下記手順・条件でハイブリダイゼーション反応を行った。
【0131】
<ハイブリダイゼーション条件・手順>
上記ハイブリダイゼーション溶液を、65℃でマイクロアレイに添加したのち、92℃で2分間、続いて55℃で4時間保持した。そのあと、その後、2×SSCおよび0.1%SDSを用いて、25℃で洗浄をした。さらに2×SSCを用いて20℃で洗浄を行い、必要に応じて通常のマニュアルに従い純水でリンスして、最後にスピン・ドライ装置で水切りを行い乾燥させた。
【0132】
【表16】

【0133】
(4)蛍光測定
ハイブリダイゼーション反応終了後の蛍光測定は実施例1と同様に行った。各PCR産物の輝度値を、プローブ長ごとに表17から表19に示す。輝度の算出も実施例1と同様に行った。
【0134】
【表17】

【0135】
【表18】

【0136】
【表19】

【0137】
IV.結果の解析
続いて、この結果をもとに、L1/L2の値に対する輝度値のグラフを作成した。わかりやすくするため、縦軸、横軸ともに対数表示にした。25merのグラフを図6に、40merを図7に、60merを図8に示す。
【0138】
この結果から、同一のサンプル核酸に対しプローブ長に応じてほぼ同一のTm値を有するように設計したプローブに対し、同一濃度の検体をハイブリダイゼーションした場合であっても、蛍光輝度値が大きく異なる、すなわち安定性が大きく異なることがわかる。L1/L2の値が0から1.5の範囲では大きな輝度値が得られ安定したハイブリッド体が得られることがわかる。特にL1/L2の値が0から1の場合には、特に安定したハイブリッド体が得られていることがわかった。またこれとは逆に、L1/L2の値が2以上の場合には一部の例外を除いてきわめて輝度の低い蛍光輝度しか得られず、ハイブリッド体の安定性が極めて低いことがわかった。
【0139】
[実施例3]
(1)プローブの設計
実施例2で設計した9種のプローブのうち、25merの3種について3’末端にチオール基を修飾した下記のプローブを作製した。チオール基は3’末端にのみ修飾してあり、5’末端にはチオール基は結合していない。
【0140】
計3種の設計されたプローブの名称、塩基配列、およびTm値を表20に示す。
【0141】
【表20】

【0142】
実施例2と同様に、このプローブとハイブリダイゼーションし二本鎖を形成するのは、相補鎖であるリバースプライマー側の配列(リバースプライマー伸長鎖)である。
【0143】
ここで合成した3種のプローブと、実施例2で合成した各PCR産物(ターゲット鎖)と各プローブとのハイブリッド体において、ハイブリッド部よりも5'側に存在するターゲット鎖の鎖長をB5とし、3'側に存在する鎖長をB3として、ハイブリッド体を示す図を図9に示す。また、実施例2で合成した各PCR産物に対する各プローブのL1、L2およびL1/L2の値を表21に示す。プローブと各PCR産物産物(ターゲット鎖)との位置関係は変わらないため、L1、L2およびL1/L2の値は実施例2と同じである。
【0144】
【表21】

【0145】
(2)マイクロアレイの作製
3種のプローブを用いたDNAマイクロアレイの作製は、実施例2と同様に各プローブごとに行い、1マイクロアレイあたり16スポットのDNAマイクロアレイを作製した。
【0146】
(3)ハイブリダイゼーション反応および蛍光測定
ハイブリダイゼーション反応および、反応終了後の蛍光測定は実施例2と同様に行った。各マイクロアレイから得られた輝度値を、表22に示す。
【0147】
【表22】

【0148】
(4)結果の解析
実施例2と同様に、L1/L2の値に対する輝度値のグラフを作成し、図10に示した。本実施例においても、縦軸、横軸ともに対数表示にした。このグラフからL1/L2の値が0から1.5の間において高い輝度が得られており、安定したハイブリッド体を形成していることがわかる。また、その傾向は特に0から1の間で顕著であることもわかった。
【0149】
この結果は、3’末端のチオール基を介して固定されたプローブにおいても、5’末端固定の場合と同様にL1とL2の値に応じて安定したハイブリッド体が得られることを示しており、プローブの固定方法によらず、本発明による安定したハイブリッド体が得られることを示している。
【技術分野】
【0001】
本発明は、固相上プローブとサンプル核酸の安定したハイブリッド体の形成に関する。また、本発明は、かかるハイブリッド体の形成に利用されるプローブ、プローブ担体PCR用プライマー、およびそれらの設計方法にも関する。
【背景技術】
【0002】
ヒトゲノム計画に代表されるように各種の生物の遺伝子が解明され、生命活動のメカニズム、病気、体質等と遺伝子との関連が次々と調べられている。そして、遺伝子の有無やその存在量(発現量)を知ることで、例えば病気などのより詳細な特徴やタイピング、あるいは効果的な治療方法の選択などが可能となることがわかってきた。
【0003】
検体に含まれている特定の遺伝子の有無やその存在量を調べる方法は、昔から多くの方法が考案されているが、その中でも応用範囲が広く検出対象によらず適用可能な方法として、検出対象とする遺伝子あるいは核酸の特徴的な部分配列を選び、その部分配列の有無や量を調べることにより、その有無あるいは存在量を調べる方法が広く用いられている。具体的には選び出された部分配列の相補鎖に相当する核酸配列(プローブ)を用意し、検体とプローブとがハイブリダイゼーションすることを何らかの手段で検出することにより、検体中の核酸配列の有無を調べる方法である。
【0004】
ハイブリダイゼーションを利用した特定の核酸の検出方法は、固相、液相を問わず用いることが可能である。例えば液相中で行う場合には、二本鎖形成時に分光特性が変化する標識物質を結合させたプローブ溶液を準備し、これを検体に添加し、その分光特性の変化を測定することで検体中の特定核酸の有無を調べる方法がその一例である。
【0005】
固相上でハイブリダイゼーションを行う場合には、プローブを固相上に固定または吸着させておき、その固相上に何らかの検出可能な標識物質により標識した検体を添加し、固相上からの標識物質の信号を測定することにより検出する方法が代表的である。中でもプローブをガラスや金属などの平面基板上に固定したマイクロアレイ、あるいは微少粒子表面へ固定したビーズ等は代表的な固相ハイブリダイゼーションの形態である。固相上のハイブリダイゼーションが好まれる理由は、B/F分離が容易であること、検出領域を物理的に微小化でき高感度化が期待できること、複数種のプローブを物理的に隔離することにより同時多項目の検出が可能であること、固相ゆえにその取り扱いや応用が容易に出来るからである。
【0006】
たとえば米国アフィメトリックス社では、平面基板上に合成されたオリゴDNAに対し、標識された核酸を作用させ、そのハイブリダイゼーションを蛍光検出により測定することで、検体中に含まれる特定の核酸の有無や量を検出している(特許文献1参照)。また富士フィルム社においては、あらかじめアミノ基が導入された基板を用いてDNAアレイを作製し、これを用いて標識された22merの一本鎖DNAを検出している(特許文献2参照)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】米国特許第6410229号明細書
【特許文献2】特開2001−128683号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
固相上のハイブリダイゼーションを利用した検出方法は従来技術の中にも記載したように、他の検出方法に比べて高感度であるという長所はあるが、微少量の核酸検出に対するニーズはそれ以上に高く、より高感度かつ高特異的な検出をするためのさらなる改良が求められている。
【0009】
検出性能の向上に対応するために、様々な角度から改善が試みられている。改善方法としては、例えばターゲットを捕らえるプローブのTm値を高くし、プローブとターゲットの結合力を高める方法がある。また、ターゲットに対する標識率を高める、強い信号を出す標識物質を結合させる、あるいは標識物質そのものを複数の標識物質で多重増幅(増感剤)するなどの方法が取られている。
【0010】
しかし、プローブの結合力を高める方法は、非特異的な吸着や結合を引き起こし、特異性を大きく低下させる場合があり、その効果は限定的である。また、標識方法を改善する方法は、S/N比や定量性を著しく低下させる場合があり、やはりその効果は限定的である。
【0011】
プローブの改良や標識方法以外に、ハイブリダイゼーション効率を改善する方法としては、プローブとターゲットが形成するハイブリッド体を安定化させる方法がある。ハイブリッド体の安定化を行うためには、ハイブリダイゼーション反応の環境、すなわち塩濃度や変性剤濃度の最適化を行う必要があるが、やはり、特異性、S/N比の低下等が生じる場合があった。
【0012】
従って、核酸検出においてより効果的となる、安定したハイブリッド体の形成方法、そのためのプローブ設計方法、検体調製方法の開発等が強く望まれていた。
【課題を解決するための手段】
【0013】
上記課題を解決するため鋭意研究を重ねた結果、固相上のプローブと、プローブがハイブリダイズするサンプル核酸を、特定の条件を満たす配列上の位置関係に設定することで、プローブとサンプル核酸が安定したハイブリッド体を形成することを見出した。
【0014】
本発明によるハイブリッド体は、
固相に固定されたプローブ核酸とサンプル核酸とが、該サンプル核酸のターゲット鎖の有する標的配列と、該標的配列に相補的である該プローブ核酸の有するプローブ配列とにより形成されたハイブリット部を介して結合したハイブリッド体であって、
前記サンプル核酸のターゲット鎖が前記プローブ核酸のプローブ配列より長いことによって、少なくとも該ターゲット鎖の5'末端を含む部分が前記標的配列の5'側に伸びており、
かつ、該ターゲット鎖の3'末端は前記標的配列の3'側端部に相当するか、あるいは前記標的配列の3'側端部から3'方向に少なくとも1塩基分伸びた部分の先端にあり、
前記ターゲット鎖の5'末端を含む部分の塩基数をL1、前記ターゲット鎖の3'末端の前記標的配列の3'末端部分より伸びた部分の塩基数をL2(但し、前記ターゲット鎖の3'末端が前記標的配列の3'側端部に相当する場合をL2=0とする)と表わしたときに、L1/L2の値が0〜1.5の関係を満たすことを特徴とするハイブリッド体である。
【0015】
本発明にかかるプローブは、標的配列を有するターゲット鎖に対して、上記のハイブリッド体の構成をなすように設計されたプローブであって、前記ターゲット鎖が、検出対象としての配列を有する試料、該検出対象としての配列を含むPCR増幅産物または該検出対象としての配列の逆転写産物であることを特徴とするプローブである。
【0016】
本発明にかかるプローブセットは、上記プローブが2つ以上含まれるプローブのセットであり、本発明のプローブ担体は、担体上の全プローブ数の50%以上が上記プローブセットであるプローブ担体である。
【0017】
本発明にかかるプローブ設計方法は、標的配列を有するターゲット鎖に対して、上記のハイブリッド体の構成をなすようにプローブを設計するプローブ設計方法であって、前記ターゲット鎖が、検出対象としての配列を有する試料、該検出対象としての配列を含むPCR増幅産物または該検出対象としての配列の逆転写産物であることを特徴とするプローブ設計方法である。
【0018】
本発明にかかるPCR用プライマーは、上記のプローブに対して、上記のハイブリッド体の構成が可能であるようなサンプル核酸を調製するためのPCR用プライマーである。
【0019】
本発明にかかるサンプル核酸の検出方法は、固相に固定されたプローブ核酸に、該プローブ核酸よりも長いサンプル核酸を反応させて得られるハイブリッド体を検出することによるサンプル核酸の検出方法において、
前記プローブ核酸の配列を、以下の構成(1)及び(2)を満たすハイブリッド体を形成可能に設計されていることを特徴とする検出方法である。
(1)前記プローブ核酸とサンプル核酸とが、該サンプル核酸のターゲット鎖の有する標的配列と、該標的配列に相補的である該プローブ核酸の有するプローブ配列とにより形成されたハイブリット部を介して結合したハイブリッド体であって、
(2)前記サンプル核酸が有するターゲット鎖の5'末端は前記標的配列の5'側端部から5'方向に少なくとも1塩基分伸びた部分の先端にあり、かつ、該ターゲット鎖の3'末端は前記標的配列の3'側端部にあるか、あるいは前記標的配列の3'側端部から3'方向に少なくとも1塩基分伸びた部分にあり、
前記ターゲット鎖の5'末端の前記標的配列の5'末端部分より伸びた部分の塩基数をL1、前記ターゲット鎖の3'末端の前記標的配列の3'末端部分より伸びた部分の塩基数をL2(但し、前記ターゲット鎖の3'末端が前記標的配列の3'側端部にある場合をL2=0とする)と表わしたときに、L1/L2の値が0〜1.5の関係を満たすものである。
【0020】
この方法におけるサンプル核酸が検体核酸をテンプレートとしたPCRによる増幅産物である場合は、このPCR用のプライマーと前記プローブを、前記構成(1)及び(2)を満たすハイブリッド体を形成可能に設計することが好ましい。
【0021】
本発明にかかるサンプル核酸検出用のキットは、検体核酸から標的配列を有するターゲット鎖を有するサンプル核酸を増幅させるためのPCR用のプライマーと、該検体核酸をテンプレートとして該プライマーを用いて増幅した増幅産物中での前記標的配列の有無を確認するための固相に固定化されたプローブ核酸とを有するサンプル核酸検出用のキットにおいて、
前記プライマーと前記プローブ核酸の配列が、以下の構成(1)及び(2)を満たすハイブリッド体を形成可能に設計されていることを特徴とするキット。
(1)前記プローブ核酸とサンプル核酸とが、該サンプル核酸のターゲット鎖の有する標的配列と、該標的配列に相補的である該プローブ核酸の有するプローブ配列とにより形成されたハイブリット部を介して結合したハイブリッド体であって、
(2)前記サンプル核酸が有するターゲット鎖の5'末端は前記標的配列の5'側端部から5'方向に少なくとも1塩基分伸びた部分の先端にあり、かつ、該ターゲット鎖の3'末端は前記標的配列の3'側端部にあるか、あるいは前記標的配列の3'側端部から3'方向に少なくとも1塩基分伸びた部分にあり、
前記ターゲット鎖の5'末端の前記標的配列の5'末端部分より伸びた部分の塩基数をL1、前記ターゲット鎖の3'末端の前記標的配列の3'末端部分より伸びた部分の塩基数をL2(但し、前記ターゲット鎖の3'末端が前記標的配列の3'側端部にある場合をL2=0とする)と表わしたときに、L1/L2の値が0〜1.5の関係を満たすものである。
【0022】
本発明によるハイブリッド体は、固相に固定されたプローブ核酸とサンプル核酸とのハイブリッド体であればいかなる組み合わせでも実施可能である。この中でも、DNAマイクロアレイに代表されるように、プローブとしてオリゴヌクレオチドやcDNAなどのDNAを平面基板上に固定させ、検出可能な標識により標識されたサンプル核酸とハイブリダイゼーションさせたハイブリッド体は本発明を実施する上で好適な一例である。
【0023】
固相上に固定させるプローブは、さまざまな方式により固定化することが可能であり、代表的な固定の方法としては、共有結合、イオン結合、吸着等があるが、本発明のハイブリッド体はいずれの固定方法でも実施可能である。
【0024】
これらのうち、共有結合による固定方法は、ハイブリダイゼーションに伴う様々な条件変化(例えば加熱や高い塩濃度)にも比較的影響されにくく、安定なハイブリッド体を形成する上で好ましい結合方式である。共有結合の具体的な結合方法としては、固相上に導入可能な官能基と核酸プローブ側に導入可能な官能基の組み合わせにより、各種の結合方式が特に制限無く適用可能であるが、プローブに合成オリゴヌクレオチドを使用する場合、チオール基やアミノ基、あるいはその誘導体が修飾官能基として比較的容易に導入しやすいため、よく用いられている。なかでも、オリゴヌクレオチドの5'末端や3'末端に上記の官能基を導入する方法が、合成上容易であり、オリゴヌクレオチドの末端に修飾した官能基を介して固相に固定化したプローブは、本発明によるハイブリッド体に好適に用いることができる。
【0025】
また、5'末端、3'末端以外でも、オリゴヌクレオチド配列中間部の核酸に由来する官能基や、人工的に合成したヌクレオチド誘導体をサンプル核酸中に取り込ませ、その官能基を利用して固定化することが可能である。
【0026】
また、DNAはリン酸エステル結合によりその骨格を形成していることから、分子全体として負の電荷を有しており、例えば固相上に導入した正電荷を有するコーティング剤や固相自体に吸着させることも可能である。
【0027】
固相に固定したプローブとしては、様々な鎖長を有するプローブを用いることが可能である。鎖長により特異性、結合力等、それぞれ特徴があるが、15〜30mer、31〜50mer、51mer〜80merの各鎖長を有するオリゴヌクレオチドは、固相表面に固定化するプローブとしてよく用いられ、本発明のハイブリッド体を構成するプローブとして好適に用いられるプローブの塩基長である。
【0028】
また、一般的にはプローブとしてオリゴヌクレオチドなどの核酸が用いられることが多いが、強いハイブリダイゼーションが期待できるペプチド核酸(PNA)をプローブとして用いることも可能であり、本発明によるL1とL2の関係を有するハイブリッド体を形成することにより、より安定なハイブリッド体とすることが可能である。
【0029】
L1とL2の関係はL1/L2の値が0〜1.5の関係を満たすのであれば本発明の安定なハイブリッド体は形成可能である。なかでもL1/L2の値が0〜1の範囲、すなわちL1≦L2である場合にはより一層、安定なハイブリッド体の形成が可能である。
【0030】
サンプル核酸は、検査対象としての検体自体、あるいは検体から各種の方法で取り出された核酸断片としてプローブとの反応に用いられるものであり、プローブとハイブリダイズする部分である標的配列を有するものである。この標的配列は、検体が有すると想定される配列を特定できるものであればよく、サンプル核酸の種類によって、検体中に直接含まれる検出対象としての配列の一部それ自体であっても、その相補配列であってもよい。サンプル核酸は、プローブとハイブリダイずる標的配列(プローブの有するプローブ配列と相補的である)を有するターゲット鎖を有するもので、例えば、二本鎖DNA、一本鎖DNA、RNAいずれの核酸でも、適当な条件下で固相プローブとハイブリダイゼーション可能であれば本発明は適用可能である。例えば、一本鎖DNAの場合は、それ自身がターゲット鎖になる。
【0031】
また、サンプル核酸の調製方法は特に制限なく適用可能であるが、よく用いられる調製方法として、PCR増幅法、RNAの逆転写があり、それらの調製方法で得られる、PCR産物、逆転写産物は本発明のハイブリッド体を形成するために好適に用いることが可能である。
【0032】
DNAマイクロアレイなどに代表されるように、固相上ハイブリダイゼーションを特定の塩基配列の検出のために用いる場合、多くはサンプル核酸に何らかの標識物質を結合させるが、標識物質が取り込まれたサンプル核酸であっても、本発明によるハイブリッド体の形成は好適に適用可能である。
【0033】
標識物質としては、取り扱いも容易で高感度な検出が可能である蛍光物質が一般によく用いられるが、放射線同位体による標識も感度という点では優れており好適に用いることが可能である。蛍光物質を利用する場合、蛍光物質の種類は多岐にわたっておりいずれの蛍光色素も用いることが可能であるが、Cy3やCy5などの蛍光色素は広く利用されており、本発明によるハイブリッド体にも好適に用いることが可能である。
【0034】
サンプル核酸の鎖長は特に制限なくハイブリッド体を形成できるが、なかでもサンプル核酸の鎖長が500bp以上の場合にはより安定したハイブリッド体の形成が可能である。さらには鎖長が500bp以上2500bp以下の場合、より安定したハイブリッド体の形成が可能である。
【0035】
本発明では、サンプル核酸に対し、上記のハイブリッド体を形成させるために設計されたプローブも提案する。すなわち、サンプル核酸において、本発明によるハイブリッド体を形成させることが可能な位置にプローブ捕捉領域を設定し、固相プローブとサンプル核酸が本発明による位置関係を有するハイブリッド体を形成するようなプローブを提案する。
【0036】
また、異なる種類のプローブが2つ以上で構成されるプローブセットも提案する。
また、上記プローブを提供するにあたってはプローブの配列等を設計する必要があるが、そのためのプローブ設計方法も提案する。
【0037】
標的核酸(配列)検出のためのプローブを効果的に利用するためには、B/F分離を容易にするために、固体担体上にプローブを固定しておく場合があるが、そのために、本発明によるプローブを少なくとも1つ以上、固体担体上に固定したプローブ担体も提案する。1つ以上のプローブを固体担体上に固定化したプローブ担体としてDNAマイクロアレイがあげられるが、DNAマイクロアレイも本発明によるプローブ固定化担体として好適な一例である。
【0038】
また、サンプル核酸としては、上述したようにPCR産物が用いられることが多いが、PCR産物を調製するにあたり、上記のL1とL2の条件を満たすよう設計されるPCR用のプライマーも提案する。
【発明の効果】
【0039】
本発明により、固相上のプローブとサンプル核酸が形成するハイブリッド体において、より安定したハイブリッド体を得ることができ、またその形成する条件を得ることが出来る。さらに、本発明の条件を満たすプローブ、プライマー、さらにそれらの設計の方法、加えてそれらのハイブリッド体が形成されたプローブ担体も合わせて提供することができる。本発明により、固相上でのハイブリダイゼーションを利用した核酸検出方法において、効率的かつ高感度な検出が可能となる。
【図面の簡単な説明】
【0040】
【図1】固相に固定したA鎖プローブとサンプル核酸であるB鎖とのハイブリッド体を示した図である。サンプル核酸においてハイブリッド形成部よりも5'側の塩基鎖長をB5、3'側の塩基鎖長をB3で示した。
【図2】pUC118 EcoRI/BAPにおいて、3つのプライマーの位置を示した図であり、矢印はそれぞれのプライマーにおいて5'から3'に向かう方向を示している。
【図3】pUC118 EcoRI/BAPにおいて、3つのプライマー、および3つのプローブを示した図である。
【図4】pUC118 EcoRI/BAPにおいて、フォワードプライマーF1からF8、リバースプライマーR1からR7、計15種のプライマーの位置関係を示した図であり、矢印はそれぞれのプライマーにおいて5'から3'に向かう方向を示している。
【図5】pUC118 EcoRI/BAPにおいて、各プライマー、および3つのプローブの位置関係を示した図である。
【図6】25merのプローブにおけるL1/L2に対する輝度値をプロットしたグラフである。
【図7】40merのプローブにおけるL1/L2に対する輝度値をプロットしたグラフである。
【図8】60merのプローブにおけるL1/L2に対する輝度値をプロットしたグラフである。
【図9】3’末端を固定したプローブとターゲット鎖とのハイブリッド体、およびL1、L2の位置関係を示した図である。
【図10】3’末端固定の25merのプローブにおけるL1/L2に対する輝度値をプロットしたグラフである。
【発明を実施するための形態】
【0041】
本発明によるハイブリッド体についてさらに詳しく説明する。
【0042】
本発明により提供されるハイブリッド体は、固相上に存在するプローブと、配列の一部に相補的な配列を有するサンプル核酸と、から形成されるハイブリッド体であって、サンプル核酸の捕捉対象領域よりも5'側にある塩基鎖長をL1とし、3'側にある塩基鎖長をL2としたときに、L1/L2の値が0〜1.5の関係を有するハイブリッド体である。5'末端が固相に固定された一本鎖プローブ(A鎖)と、相補的な配列を有する一本鎖核酸(B鎖)とのハイブリッド体の模式図を図1に示した。この図において、B鎖のプローブ結合領域よりも5'側の塩基鎖長B5とし、3'側の塩基鎖長をB3としたときに、B5≦B3となる関係を有するハイブリッド体が本発明の一例を示すハイブリッド体である。
【0043】
L1/L2の値が0〜1.5であれば本発明の安定したハイブリッド体を形成することは可能であるが、より安定したハイブリッド体を形成するためには、L1/L2の値が0〜1であることが望ましい。
【0044】
プローブは何らかの固相上または固相表面に固定化されていれば、その固定の形態に制限無く本発明のハイブリッド体は形成可能である。このうち、ガラス基板に核酸を固定化したDNAマイクロアレイはその代表例であり、様々な種類のDNAマイクロアレイが本発明のハイブリッド体に適用可能である。固相に用いられる材質としては、ガラス以外にも、樹脂、金属、金属薄膜、繊維等でも適用可能であり、またその外観上の形態も、微粒子、光ファイバー先端、多孔質材料、繊維等、時に制限無く利用可能である。
【0045】
結合様式としては吸着、化学結合等様々な方式が存在するが、いずれの結合様式でもハイブリッド体は形成可能である。例えば、課題を解決するための手段に記載したイオン結合では、アミノ基をコートしてあるガラス基板または樹脂表面に対し、通常の核酸を供するだけでイオン的に結合させることができる。
【0046】
また、5'末端、3'末端、あるいは配列の中部にチオール基、アミノ基等の官能基を修飾した修飾オリゴヌクレオチドを用い、導入した官能基の反応を利用して固定化することも可能である。例えばアミノ基を利用する場合、固相表面にアミノ基と効率的に反応するスクシイミド基をあらかじめ結合させておき、5'末端や3'末端などにアミノ基を修飾したオリゴヌクレオチドを固相表面に供給することにより、容易に共有結合を形成させることができ、本発明のハイブリッド体を構成するプローブとして好適に用いることが可能である。
【0047】
またチオール基を用いる場合には、例えば固相にマレイミド基を結合させておくことにより、アミノ基の場合と同様、共有結合を容易に形成し、本発明のハイブリッド体として好適に用いることが出来る。
【0048】
プローブの種類としては、DNAなどのほかに、PNAなども用いることができる。プローブとしてはcDNAなども用いることができるが、より精度の高いハイブリッド体の形成を行うためには、化学的な手法により合成されたオリゴヌクレオチドをプローブに使用することが多く、そのプローブの塩基鎖長としては、15〜30mer、31〜50mer、51〜80merのプローブがそれぞれの特性に応じて利用されることが多い。
【0049】
本発明のハイブリッド体を形成するサンプル核酸は、固相上のプローブ鎖長よりも長ければ特に制限無く本発明のハイブリッド体に用いることが出来る。
【0050】
本発明によるハイブリッド体は、核酸配列の検出を目的としたDNAマイクロアレイ、ビーズ等でよく用いられる。この場合、サンプル核酸はPCRにより増幅されたPCR産物、転写物、逆転写産物等がよく用いられるが、これらの核酸は本発明のハイブリット体に対して好適に用いることが可能である。すなわち、サンプル核酸は二本鎖、一本鎖いずれでもよく、また、DNA、RNAどちらであっても本発明のハイブリッド体を形成できる。
【0051】
また、ハイブリッド体の形成を分光学的な手法により検出する場合、サンプル核酸に対し何らかの標識物質、たとえば蛍光物質、放射性物質等によって標識する必要がある場合があるが、このような標識物質を含むサンプル核酸でも、本発明のハイブリッド体は形成可能である。中でも、Cy3、Cy5を代表とするCy Dye (アマシャムファルマシア製)は、核酸標識用の蛍光物質としてよく用いられ、これらの蛍光物質が含まれたサンプル核酸は何ら問題となることなく本発明のハイブリッド体に適用可能である。
【0052】
また、蛍光物質と同レベルの検出感度を有する標識材料として32P等の放射性同位体などが用いられることも多いが、この場合でも、本発明のハイブリッド体は充分、形成可能である。
【0053】
本発明のハイブリッド体はサンプル核酸の鎖長によらず形成可能であるが、なかでも500bp以上の場合により安定したハイブリッド体の形成が可能であり、さらには500bp以上かつ2500bp以下の鎖長を有するサンプル核酸の場合より安定したハイブリッド体の形成が可能である。
【0054】
サンプル核酸が例えば二本鎖DNAの場合、プローブとのハイブリッド形成部以外の部分は、サンプル核酸自体がその相補鎖と二本鎖を形成していることもあるが、そのような場合でも、本発明のハイブリッド体は形成可能である。すなわち、固相上プローブとサンプル核酸が形成するハイブリッド体のうち、部分的であっても、上記のL1とL2との関係を有する部分が存在すれば、本発明が示す、安定性の高いハイブリッド体の形成は可能である。
【0055】
また、プローブとサンプル核酸の二本鎖形成部分の鎖長がプローブ長よりも短い場合、すなわちプローブがミスマッチを含む状態でサンプル核酸とハイブリッドを形成している場合であっても、安定したハイブリッド体の形成は可能なサンプル核酸である。その際には、サンプル核酸の5'末端から二本鎖形成部分の末端部分までの鎖長をL1とし、3'末端から同じく二本鎖形成部分の末端部分までの鎖長をL2として、上記L1とL2の関係を満たすのであれば、本発明のハイブリッド体を形成できる。
【0056】
特定の塩基配列を認識し、固相上プローブとのハイブリッド体形成により検出対象物の有無を検出するためのプローブ設計は、サンプル核酸を特異的かつ高感度に検出できるよう配慮して設計されることが多い。これらの設計方法の多くは、塩基配列のみを設計のために用いているため、液相系ハイブリダイゼーションでは有効に設計できるが、固相上でのハイブリダイゼーションに対しては、必ずしも最適なプローブ設計ができなかった。本発明のハイブリッド体形成条件は、固相上におけるハイブリッド体安定性に関する指標を与える。そこで、本発明においては、固相上プローブの設計において先に挙げた条件を満たすプローブ設計方法も提案する。
【0057】
また、このプローブ設計方法により設計された、プローブも提案する。さらにはそれらのプローブが2つ以上集まったプローブセットも提案する。
【0058】
複数の異なる種類のプローブが固体担体上に固定化されたプローブ担体の一例として、DNAマイクロアレイが挙げられるが、このようなプローブ担体を構成するプローブとして、本発明によるプローブを利用する場合には、担体上の全プローブ数のうち50%以上が、本発明のプローブによって構成されていることが好ましく、さらには70%以上の構成比率であることが好ましいが、本発明においては、そのような複数のプローブ(プローブセット)が固定化されたプローブ担体も提案する。
【0059】
条件を満たすプローブ数の割合は50%以上であればよいが、75%以上であればさらに好ましい。
【0060】
即ち、本願発明のプローブセットの設計方法は、固相上に複数のスポットとして固定された、複数種類のプローブ核酸からなるプローブセットと、PCR用のプライマーを用いて増幅されたサンプル核酸が有するターゲット鎖の該プライマーよりも3’側の標的配列と、を反応させて得られる1種類以上のハイブリッド体を検出することによるサンプル核酸の検出方法に用いる前記プローブセットの設計方法であって、前記プローブセットの前記複数種類の前記プローブ核酸が、前記サンプル核酸とハイブリダイズしたときに、70%以上の前記ハイブリッド体が以下の(1)および(2)の関係を満たすように設計することを特徴とする設計方法:
(1)前記プローブ核酸とサンプル核酸とが、該サンプル核酸のターゲット鎖の有する標的配列と、前記プローブセットの該標的配列に相補的である該プローブ核酸の有するプローブ配列とにより形成されたハイブリット部を介して結合したハイブリット体であって、
(2)前記サンプル核酸が有するターゲット鎖は、前記プローブ核酸よりも長く、該ターゲット鎖の5’末端は前記標的配列の5’側端部から5’方向に少なくとも前記プライマーの塩基分伸びた部分の先端にあり、かつ、該ターゲット鎖の3’末端は前記標的配列の3’側端部から3’方向に少なくとも前記プライマーの塩基分伸びた部分にあり、前記ターゲット鎖の5’末端の前記標的配列の5’末端部分より伸びた部分の塩基数をL1、前記ターゲット鎖の3’末端の前記標的配列の3’末端部分より伸びた部分の塩基数をL2と表したときに、L1≦L2の関係を満たすものである。
【0061】
サンプル核酸がPCR産物等の場合、サンプル核酸の配列中における相対的なプローブ領域は、PCR増幅を実施するために設計されたプライマーの設計により変わってくる。サンプル核酸の塩基配列中、プローブ領域として選択される部分が上記の条件を満たすように設計できれば望ましいが、特異性等の観点から、必ずしもこの条件でプローブが設定できない場合もある。その場合にはプローブ領域を設定したのちに、設定したプローブ領域が請求項1の条件を満たすようなサンプル核酸のプライマー設定を行えばよい。本発明では設定したプローブ領域に対し上記の条件を満たすようなハイブリッド体を形成するためのサンプル核酸増幅用のプライマーも提案する。
【実施例】
【0062】
以下、実施例により、本発明をさらに具体的に説明する。ただし、以下に述べる実施例は、本発明にかかる最良の実施形態の一例ではあるが、本発明の技術的範囲はこれら実施例に限定されるものではない。
【0063】
I.pUC118 EcoRI/BAPのPCR
(1)プライマーの設計
検査対象の配列を有する検体のモデルとして、市販のTakara社製ベクター pUC118 EcoRI/BAP(全長3162bp)を選択し、その塩基配列中より、下記の配列を有するプライマー3種を設計した。なお、pUC118 EcoRI/BAPの全塩基配列情報に関しては、Takara社より提供されており、また、公開されているデータベース等からも入手可能である。
【0064】
プライマーの設計にあたっては、pUC118 EcoRI/BAPの中の、所望の部分塩基配列がPCR増幅により特異的かつ効率的に増幅されるよう、配列、GC%、融解温度(Tm値)に充分配慮して設計を行った。
【0065】
設計されたプライマーはフォワード側(F)2種、リバース側(R)1種の計3種である。pUC118 EcoRI/BAPをテンプレートとし、F1とR1、またはF2とR1の組み合わせでPCR増幅することにより、それぞれ1324bp(PCR産物1)、940bp(PCR産物2)のPCR産物が増幅されることになる。設計されたプライマーの塩基配列およびTm値を表1に示す。
【0066】
【表1】

【0067】
またpUC118 EcoRI/BAP全長における3種のプライマーの位置を図2に示す。なお、この図において矢印の示す方向は、各プライマー鎖において5'末端から3'末端に向かう方向を示している。
【0068】
(2)プライマーの合成
実施例1の(1)で設計した3種のプライマーを合成した。各プライマーの合成は、それぞれの塩基配列を有するDNA鎖を定法に従ってDNA合成機で合成した。精製は、カートリッジ精製により行い、3種のプライマーを得た。得られたプライマーは、TEバッファーにて10μMの濃度に希釈した。
【0069】
(3)PCR増幅反応
実施例1の(2)で合成した3種のプライマー、鋳型遺伝子DNAとするTakara社製ベクター pUC118 EcoRI/BAP、およびQIAGEN社製PCRキット HotStarTaq Master Mix を用いて、PCR増幅反応を行った。Master Mix中にはdATP、dCTP、dTTP、dGTPの4種のデオキシヌクレオチドが含まれているが、PCR産物を蛍光標識により標識するため、アマシャムファルマシア社製のCy3dUTPを加えて、PCR産物をCy3により標識した。
【0070】
フォワード・プライマーとリバース・プライマーの組み合わせとして、(1)中に記載した2組の組み合わせでPCR増幅を行った。PCRの反応条件は、下記のプロトコルによって、下記表2に示す組成の反応液の調製を行った。
【0071】
【表2】

【0072】
調製された反応液について、市販のサーマルサイクラーを用いて、下記表3の温度サイクル・プロトコルに従って、PCR増幅反応を行った。すなわち、95℃/15分の保持の後、92℃(変性)/45秒、55℃(アニーリング)/45秒および72℃(伸長)/45秒を1サイクルとして25サイクル、最後に72℃/10分保持した。
【0073】
【表3】

【0074】
増幅反応終了後、PCR増幅産物は精製用カラム(Qiagen QIAquick PCR Purification Kit)を用いて精製した。精製後、PCR増幅産物溶液の液量は、50μlとなるよう調製した。得られた精製済PCR増幅産物溶液の一部を取り、定法に従って電気泳動を行い、2種のPCR産物それぞれにおいて所望の塩基長を有するバンドが出ていることを確認した。
【0075】
II.DNAマイクロアレイの作製
(1)プローブの設計及び合成
上記、PCR産物1に対して、3種のプローブを設計した。設計はプライマーの設計と同様、各プローブが、検体中に選択した部分塩基配列(標的配列)を特異的に認識できるよう、配列、GC%、融解温度(Tm値)に充分配慮して設計を行った。
【0076】
設計されたプローブの塩基配列およびTm値を表4に示す。
【0077】
【表4】

【0078】
このプローブ設計においては、プローブとハイブリダイゼーションし、プローブとハイブリッド体を形成するのは、R1のプライマーから伸長したDNA鎖である。
【0079】
またP2およびP3はプローブとしてPCR産物2に対してもハイブリッド体を形成する。
【0080】
PCR産物1および2と各プローブとのハイブリッド体において、ハイブリッド部よりも5'側に存在するターゲット鎖の鎖長をL1とし、3'側に存在する鎖長をL2として、各PCR産物に対する各プローブのL1、L2およびL1/L2の値を表5に示す。
【0081】
【表5】

【0082】
pUC118 EcoRI/BAP全長における3種のプローブ、3種のプライマーの位置を図3に示す。
【0083】
(2)ガラス基板の洗浄
合成石英のガラス基板(サイズ(W×L×T):25mm×75mm×1mm、飯山特殊ガラス社製)を耐熱、耐アルカリ性のラックに入れ、所定の濃度に調製した超音波洗浄用の洗浄液に浸した。一晩、洗浄液中で浸した後、20分間超音波洗浄を行った。続いて、ガラス基板を取り出し、軽く純水で漱いだ後、超純水中で20分間、超音波洗浄を行った。次に、80℃に加熱した1N水酸化ナトリウム水溶液中に10分間、ガラス基板を浸した。再び、純水洗浄と超純水洗浄を行い、DNAマイクロアレイ用の洗浄済石英ガラス基板を用意した。
【0084】
(3)表面処理
シランカップリング剤KBM−603(信越シリコーン社製)を、1%の濃度となるように純水中に溶解させ、2時間室温で攪拌した。続いて、洗浄済石英ガラス基板を、このシランカップリング剤水溶液に浸し、20分間室温で放置した。ガラス基板を引き上げ、軽く純水で表面を洗浄した後、ガラス基板の両面に窒素ガスを吹き付けて乾燥させた。次に、窒素ブロー乾燥したガラス基板を、120℃に加熱したオーブン中で1時間ベークし、カップリング剤処理を完結させた。このカップリング剤処理により、ガラス基板表面にシランカップリング剤由来のアミノ基が導入された。
【0085】
一方、同仁化学研究所社製のN−マレイミドカプロイロキシスクシイミド(N−(6−Maleimidocaproyloxy)succinimido);以下、EMCSと略す)を、ジメチルスルホキシドとエタノールの1:1混合溶媒中に最終濃度が0.3mg/mlとなるように溶解したEMCS溶液を用意した。ベーク終了後、カップリング剤処理済ガラス基板を放冷し、調製したEMCS溶液中に室温で2時間浸した。この浸漬処理間に、カップリング剤処理済ガラス基板の表面に導入されているアミノ基とEMCSのスクシイミド基とが反応し、ガラス基板表面にEMCS由来のマレイミド基が導入された。EMCS溶液から引き上げたガラス基板を、先述のジメチルスルホキシドとエタノールの混合溶媒を用いて洗浄し、さらに、エタノールにより洗浄した後、窒素ガス雰囲気下で乾燥させた。
【0086】
(4)プローブ用DNAの合成
上記(1)で設計した3種のプローブを合成した。
【0087】
プローブDNAは、上記の表面にマレイミド基が導入されガラス基板に対して共有結合させるため、定法に従って、5'末端にチオール化処理を施した。その後、DNA合成時における副反応を避けるために、保護を施している保護基を脱保護し、さらにHPLC精製および脱塩処理を施した。
【0088】
得られたプローブDNAは、純水に溶解し、それぞれ、最終濃度(インク溶解時)10μMとなるように分注した後、凍結乾燥を行い、水分を除いた。
【0089】
(5)BJプリンターによるプローブDNA吐出、および基板表面への結合
グリセリン7.5重量%、チオジグリコール7.5重量%、尿素7.5重量%、アセチレノールEH(川研ファインケミカル社製)1.0重量%を含む水溶液を用意した。続いて、分注したプローブDNAを上記の混合溶媒に規定濃度(10μM)となるように溶解した。得られたプローブDNA溶液をバブルジェット(登録商標)プリンター(商品名:BJF−850 キヤノン社製)用インクタンクに充填し、印字ヘッドに装着した。
【0090】
なお、前記バブルジェットプリンターは、平板へのインクジェット印刷が可能なように改造を施したものである。また、該改造バブルジェットプリンターは、所定のファイル作成方法に従って印字パターンを入力することにより、約5plのDNA溶液液滴を、約120μmピッチでスポッティングすることが可能となっている。
【0091】
続いて、この改造バブルジェットプリンターを用いて、ガラス基板表面にプローブDNA溶液のスポッティング操作をおこなった。DNAマイクロアレイ1枚あたり、プローブごとに16スポットの吐出が行われるよう印字のパターンを予め作成し、インクジェット印字した。目的のパターンにDNA溶液のスポッティングが確実に行われていることを拡大鏡等により確認した後、30分間常温で加湿チャンバー内に静置し、ガラス基板表面のマレイミド基とプローブDNA5'末端のチオール基とを反応させた。
【0092】
(6)洗浄
加湿チャンバー内における30分間の反応後、100mMのNaClを含む10mMのリン酸緩衝液(pH7.0)により、ガラス基板表面に残った未反応のプローブDNAを洗い流した。ガラス基板表面に、1枚あたり16スポットに所定の一本鎖プローブDNAが、それぞれ固定された、DANマイクロアレイを得た。
【0093】
III.ハイブリダイゼーション反応
IIで作製したDNAマイクロアレイと、サンプル核酸検体としてIで作製したPCR増幅産物2種を用いて、マイクロアレイ上でのハイブリダイゼーションを行った。
【0094】
(1)DNAマイクロアレイのブロッキング
BSA(牛血清アルブミンFraction V:Sigma社製)を1重量%となるように、100mM NaCl/10mM リン酸バッファーに溶解し、この溶液にIIで作製したDNAマイクロアレイを室温で2時間浸し、ガラス基板面のブロッキングを行った。ブロッキング終了後、0.1重量%SDS(ドデシル硫酸ナトリウム)を含む2×SSC溶液(NaCl 300mM、Sodium Citrate(trisodium citrate dihydrate,C6H5Na3・2H2O) 30mM、pH7.0)で洗浄を行った後、純水でリンスした。その後、スピン・ドライ装置でDNAマイクロアレイの水切りを行った。
【0095】
(2)ハイブリダイゼーション溶液の調製
各PCR産物は互いに等モルとなるよう調製したうえで、PCR増幅産物溶液を用いて最終濃度が下記の構成となるよう、各PCR産物に対しハイブリダイゼーション溶液を調製した。
【0096】
<ハイブリダイゼーション溶液>
6×SSPE/10% Form amide/PCR増幅産物溶液
(6×SSPE: NaCl 900mM、NaH2PO4・H2O 60mM、EDTA 6mM、pH7.4)
(3)ハイブリダイゼーション
水切りしたDNAマイクロアレイを、ハイブリダイゼーション装置(Genomic Solutions Inc. Hybridization Station)にセットし、上記組成のハイブリダイゼーション溶液を用いて、下記手順・条件でハイブリダイゼーション反応を行った。
【0097】
<ハイブリダイゼーション条件・手順>
上記ハイブリダイゼーション溶液を、65℃に加温し3分間保持したあと、さらに92℃で2分間、続いて55℃で4時間保持した。そのあと、その後、2×SSCおよび0.1%SDSを用いて、25℃で洗浄をした。さらに2×SSCを用いて20℃で洗浄を行い、必要に応じて通常のマニュアルに従い純水でリンスして、最後にスピン・ドライ装置で水切りを行い乾燥させた。
【0098】
【表6】

【0099】
(4)蛍光測定
ハイブリダイゼーション反応終了後、スピン・ドライ乾燥したDNAマイクロアレイについて、DNAマイクロアレイ用蛍光検出装置(Axon社製、Genepix 4000B)を用いて、ハイブリッド体に由来する蛍光測定を行った。PCR増幅産物1、2の蛍光輝度を各プローブに対して測定した結果を下記の表7に示す。
【0100】
輝度の算出にあたっては、DNAマイクロアレイ上、プローブDNAのスポットの無い部分において観測される蛍光強度をバックグランド値として、各スポットからの見掛けの蛍光強度より、バックグランド値を差し引いた値を、蛍光強度の実測値とした。また測定は2回実施し、その平均値を示す。
【0101】
【表7】

【0102】
この結果から、同一のサンプル核酸に対しほぼ同一のTm値を有するように設計したプローブであっても、蛍光輝度値が大きく異なる、すなわち安定性が大きく異なる。蛍光輝度値が上昇するということは、ハイブリッド体がより多く形成していることを示し、すなわちハイブリッド体が安定であることを示している。さらに、ハイブリッド形成部よりも5'側、3'側にある部分の塩基鎖長比(L1/L2)によって、ハイブリッド体の安定性が異なり、特に5'側の塩基鎖長が3'側の塩基鎖長に比べて短いほうがより安定したハイブリッド体を形成していることがわかった。
【0103】
[実施例2]
I.pUC118 EcoRI/BAPのPCR
(1)プライマーの設計
検査対象の配列を有する検体のモデルとして、市販のTakara社製ベクター pUC118 EcoRI/BAP(全長3162bp)を選択し、その塩基配列中より、下記の配列を有するプライマーを設計した。なお、pUC118 EcoRI/BAPの全塩基配列情報に関しては、Takara社より提供されており、また、公開されているデータベース等からも入手可能である。
【0104】
プライマーの設計にあたっては、pUC118 EcoRI/BAPの中の、所望の部分塩基配列がPCR増幅により特異的かつ効率的に増幅されるよう、配列、GC%、融解温度(Tm値)に充分配慮して設計を行った。
【0105】
設計されたプライマーはフォワード側(F)8種、リバース側(R)7種の計15種である。pUC118 EcoRI/BAPをテンプレートとし、フォワード側とリバース側のプライマーを各1種ずつ組み合わせてPCR増幅することにより、104bpから2345bpの様々な鎖長のPCR産物が増幅されることになる。
設計されたプライマーの塩基配列を表8に示す。
【0106】
【表8】

【0107】
またpUC118 EcoRI/BAPにおける15種のプライマーの位置関係の概略を図4に示す。なお、この図において矢印の示す方向は、各プライマー鎖において5'末端から3'末端に向かう方向を示している。
【0108】
(2)プライマーの合成
実施例2の(1)で設計した15種のプライマーを合成した。各プライマーの合成は、それぞれの塩基配列を有するDNA鎖を定法に従ってDNA合成機で合成した。精製は、カートリッジ精製により行い、15種のプライマーを得た。得られたプライマーは、TEバッファーにて10μMの濃度に希釈した。
【0109】
(3)PCR増幅反応
実施例2の(2)で合成した15種のプライマー、鋳型遺伝子DNAとするTakara社製ベクター pUC118 EcoRI/BAP、およびInvitrogen社製PCRキットAccuPrime Taq DNA Polymerase Systemを用いて、PCR増幅反応を行った。AccuPrimeのキットに含まれる専用のBuffer中にはdATP、dCTP、dTTP、dGTPの4種のデオキシヌクレオチドが含まれているが、PCR産物を蛍光物質により標識するため、アマシャムファルマシア社製のCy3dUTPを加えて、PCR増幅反応を行った。
【0110】
フォワードプライマーとリバースプライマーを、表9に示すように24通りに組み合わせ、各組み合わせごとにPCR増幅反応を行った。なお、PCR産物長の単位はbpである。
【0111】
【表9】

【0112】
反応条件は、下記のプロトコルによって、下記表10に示す組成の反応液の調製を行った。
【0113】
【表10】

【0114】
調製された反応液について、市販のサーマルサイクラーを用いて、下記表11の温度サイクル・プロトコルに従って、PCR増幅反応を行った。すなわち、94℃/2分の保持の後、92℃(変性)/30秒、55℃(アニーリング)/45秒、および72℃(伸長)/60秒を1サイクルとして30サイクル、最後に72℃/10分間保持した。
【0115】
【表11】

【0116】
増幅反応終了後、PCR増幅産物は精製用カラム(Qiagen QIAquick PCR Purification Kit)を用いて精製した。精製後、PCR増幅産物溶液の液量は、50μlとなるよう調製した。得られた精製済PCR増幅産物溶液の一部を取り、定法に従って電気泳動を行い、24種のPCR産物それぞれにおいて所望の塩基長を有するバンドが出ていることと、各PCR産物の生成量を確認した。
【0117】
II.DNAマイクロアレイの作製
(1)プローブの設計
上記、24種のPCR産物を検出するために、pUC118 EcoRI上の3つの領域に対してプローブを設計した。図5にpUC118 EcoRI上のプローブ領域を示す。3つの領域に対して、各領域ごとに鎖長の異なる3つのプライマーを設計した。鎖長は25mer、40mer、60merの3種である。設計はプライマーの設計と同様、各プローブが、検体中に選択した部分塩基配列(標的配列)を特異的に認識できるような配列を選び、さらに各プローブごとに、GC%、融解温度(Tm値)に充分配慮して設計を行った。
【0118】
計9種の設計されたプローブの名称、塩基配列、およびTm値を表12に示す。
【0119】
【表12】

【0120】
上記のプローブは、pUC118 EcoRIの配列上において、フォワードプライマーと同じ配列上にある配列であることから、このプローブとハイブリダイゼーションし二本鎖を形成するのは、相補鎖であるリバースプライマー側の配列(リバースプライマー伸長鎖)である。
【0121】
各PCR産物(ターゲット鎖)と各プローブとのハイブリッド体において、ハイブリッド部よりも5'側に存在するターゲット鎖の鎖長をL1とし、3'側に存在する鎖長をL2として、各PCR産物に対する各プローブのL1、L2およびL1/L2の値を表に示す。25merのプローブA25、B25、C25については表13に、40merのプローブについては表14に、60merのプローブについては表15に示す。
【0122】
【表13】

【0123】
【表14】

【0124】
【表15】

【0125】
(2)マイクロアレイの作製
上記プローブの合成からマイクロアレイ作製までは実施例1と同様に行った。本実施例においては、9種のプローブは同一マイクロアレイ上にはのせず、プローブごとにマイクロアレイを作製した。実施例1と同様に、1枚のマイクロアレイ上に16のスポットを固定した。
【0126】
III.ハイブリダイゼーション反応
IIで作製したDNAマイクロアレイと、サンプル核酸検体としてIで作製したPCR増幅産物を用いて、マイクロアレイ上でのハイブリダイゼーションを行った。
【0127】
マイクロアレイは9種のプローブごとに作製し、PCR産物も24種作成した。これらを用いて表13から表15に記載されている全243通りのハイブリダイゼーションを行った。
【0128】
(1)DNAマイクロアレイのブロッキング
実施例1と同様にBSAを用いてブロッキングを行った。
【0129】
(2)ハイブリダイゼーション溶液の調製
各PCR産物はそれぞれが等モルとなるよう調製したうえで、PCR増幅産物溶液を用いて最終濃度が下記の構成となるよう、各PCR産物に対しハイブリダイゼーション溶液を調製した。
【0130】
<ハイブリダイゼーション溶液>
6×SSPE/10% Form amide/0.05% SDS/PCR増幅産物溶液(6×SSPE: NaCl 900mM、NaH2PO4・H2O 60mM、EDTA 6mM、pH7.4)
(3)ハイブリダイゼーション
水切りしたDNAマイクロアレイを、ハイブリダイゼーション装置(Genomic Solutions Inc. Hybridization Station)にセットし、上記組成のハイブリダイゼーション溶液を用いて、下記手順・条件でハイブリダイゼーション反応を行った。
【0131】
<ハイブリダイゼーション条件・手順>
上記ハイブリダイゼーション溶液を、65℃でマイクロアレイに添加したのち、92℃で2分間、続いて55℃で4時間保持した。そのあと、その後、2×SSCおよび0.1%SDSを用いて、25℃で洗浄をした。さらに2×SSCを用いて20℃で洗浄を行い、必要に応じて通常のマニュアルに従い純水でリンスして、最後にスピン・ドライ装置で水切りを行い乾燥させた。
【0132】
【表16】

【0133】
(4)蛍光測定
ハイブリダイゼーション反応終了後の蛍光測定は実施例1と同様に行った。各PCR産物の輝度値を、プローブ長ごとに表17から表19に示す。輝度の算出も実施例1と同様に行った。
【0134】
【表17】

【0135】
【表18】

【0136】
【表19】

【0137】
IV.結果の解析
続いて、この結果をもとに、L1/L2の値に対する輝度値のグラフを作成した。わかりやすくするため、縦軸、横軸ともに対数表示にした。25merのグラフを図6に、40merを図7に、60merを図8に示す。
【0138】
この結果から、同一のサンプル核酸に対しプローブ長に応じてほぼ同一のTm値を有するように設計したプローブに対し、同一濃度の検体をハイブリダイゼーションした場合であっても、蛍光輝度値が大きく異なる、すなわち安定性が大きく異なることがわかる。L1/L2の値が0から1.5の範囲では大きな輝度値が得られ安定したハイブリッド体が得られることがわかる。特にL1/L2の値が0から1の場合には、特に安定したハイブリッド体が得られていることがわかった。またこれとは逆に、L1/L2の値が2以上の場合には一部の例外を除いてきわめて輝度の低い蛍光輝度しか得られず、ハイブリッド体の安定性が極めて低いことがわかった。
【0139】
[実施例3]
(1)プローブの設計
実施例2で設計した9種のプローブのうち、25merの3種について3’末端にチオール基を修飾した下記のプローブを作製した。チオール基は3’末端にのみ修飾してあり、5’末端にはチオール基は結合していない。
【0140】
計3種の設計されたプローブの名称、塩基配列、およびTm値を表20に示す。
【0141】
【表20】

【0142】
実施例2と同様に、このプローブとハイブリダイゼーションし二本鎖を形成するのは、相補鎖であるリバースプライマー側の配列(リバースプライマー伸長鎖)である。
【0143】
ここで合成した3種のプローブと、実施例2で合成した各PCR産物(ターゲット鎖)と各プローブとのハイブリッド体において、ハイブリッド部よりも5'側に存在するターゲット鎖の鎖長をB5とし、3'側に存在する鎖長をB3として、ハイブリッド体を示す図を図9に示す。また、実施例2で合成した各PCR産物に対する各プローブのL1、L2およびL1/L2の値を表21に示す。プローブと各PCR産物産物(ターゲット鎖)との位置関係は変わらないため、L1、L2およびL1/L2の値は実施例2と同じである。
【0144】
【表21】

【0145】
(2)マイクロアレイの作製
3種のプローブを用いたDNAマイクロアレイの作製は、実施例2と同様に各プローブごとに行い、1マイクロアレイあたり16スポットのDNAマイクロアレイを作製した。
【0146】
(3)ハイブリダイゼーション反応および蛍光測定
ハイブリダイゼーション反応および、反応終了後の蛍光測定は実施例2と同様に行った。各マイクロアレイから得られた輝度値を、表22に示す。
【0147】
【表22】

【0148】
(4)結果の解析
実施例2と同様に、L1/L2の値に対する輝度値のグラフを作成し、図10に示した。本実施例においても、縦軸、横軸ともに対数表示にした。このグラフからL1/L2の値が0から1.5の間において高い輝度が得られており、安定したハイブリッド体を形成していることがわかる。また、その傾向は特に0から1の間で顕著であることもわかった。
【0149】
この結果は、3’末端のチオール基を介して固定されたプローブにおいても、5’末端固定の場合と同様にL1とL2の値に応じて安定したハイブリッド体が得られることを示しており、プローブの固定方法によらず、本発明による安定したハイブリッド体が得られることを示している。
【特許請求の範囲】
【請求項1】
固相上に複数のスポットとして固定された、複数種類のプローブ核酸からなるプローブセットと、PCR用のプライマーを用いて増幅されたサンプル核酸が有するターゲット鎖の該プライマーよりも3’側の標的配列と、を反応させて得られる1種類以上のハイブリッド体を検出することによるサンプル核酸の検出方法に用いる前記プローブセットの設計方法であって、
前記プローブセットの前記複数種類の前記プローブ核酸が、前記サンプル核酸とハイブリダイズしたときに、70%以上の前記ハイブリッド体が以下の(1)および(2)の関係を満たすように設計することを特徴とする設計方法:
(1)前記プローブ核酸とサンプル核酸とが、該サンプル核酸のターゲット鎖の有する標的配列と、前記プローブセットの該標的配列に相補的である該プローブ核酸の有するプローブ配列とにより形成されたハイブリット部を介して結合したハイブリット体であって、
(2)前記サンプル核酸が有するターゲット鎖は、前記プローブ核酸よりも長く、該ターゲット鎖の5’末端は前記標的配列の5’側端部から5’方向に少なくとも前記プライマーの塩基分伸びた部分の先端にあり、かつ、該ターゲット鎖の3’末端は前記標的配列の3’側端部から3’方向に少なくとも前記プライマーの塩基分伸びた部分にあり、前記ターゲット鎖の5’末端の前記標的配列の5’末端部分より伸びた部分の塩基数をL1、前記ターゲット鎖の3’末端の前記標的配列の3’末端部分より伸びた部分の塩基数をL2と表したときに、L1≦L2の関係を満たすものである。
【請求項2】
前記プローブがDNAであることを特徴とする請求項1に記載の設計方法。
【請求項3】
固相に固定されたプローブDNAが共有結合により固定されていることを特徴とする請求項2に記載の設計方法。
【請求項4】
固相に固定されたプローブDNAが5’側の末端に導入された官能基を介して固定されていることを特徴とする、請求項2または3に記載の設計方法。
【請求項5】
固相に固定されたプローブDNAが3’側の末端に導入された官能基を介して固定されていることを特徴とする、請求項2または3に記載の設計方法。
【請求項6】
固相に固定されたプローブDNAが配列中に導入された官能基を介して固定されていることを特徴とする、請求項2または3に記載の設計方法。
【請求項7】
導入された官能基がチオール基であることを特徴とする、請求項4〜6のいずれか一項に記載の設計方法。
【請求項8】
プローブがPNAであることを特徴とする請求項1に記載の設計方法。
【請求項9】
プローブの塩基鎖長が15〜30merであることを特徴とする請求項1〜8のいずれか一項に記載の設計方法。
【請求項10】
プローブの塩基鎖長が31〜50merであることを特徴とする請求項1〜8のいずれか一項に記載の設計方法。
【請求項11】
プローブの塩基鎖長が51〜80merであることを特徴とする請求項1〜8のいずれか一項に記載の設計方法。
【請求項12】
検体核酸から標的配列を有するターゲット鎖を有するサンプル核酸を増幅させるための該標的配列よりも5’側のPCR用のプライマーと、該検体核酸をテンプレートとして該プライマーを用いて増幅した増幅産物中での前記標的配列の有無を確認するための固相に複数のスポットとして固定化された複数種類のプローブ核酸のセットと、を有し、該プローブ核酸と、前記標的配列と、を反応させて得られる1種類以上のハイブリッド体を検出することによりサンプル核酸を検出するサンプル核酸検出用のキットの設計方法において、
前記セットの前記プローブ核酸が前記サンプル核酸とハイブリダイズしたときに、70%以上の前記ハイブリッド体が以下の(1)および(2)の関係を満たすように前記検体核酸に対して前記プローブ核酸および前記プライマーが設計されていることを特徴とするサンプル核酸検出用のキットの設計方法;
(1)前記プローブ核酸とサンプル核酸とが、該サンプル核酸のターゲット鎖の有する標的配列と、前記プローブセットの該標的配列に相補的である該プローブ核酸の有するプローブ配列とにより形成されたハイブリッド部を介して結合したハイブリッド体であって、
(2)前記サンプル核酸が有するターゲット鎖は前記プローブ核酸よりも長く、該ターゲット鎖の5’末端は前記標的配列の5’側端部から5’方向に少なくとも前記プライマーの塩基分伸びた部分の先端にあり、かつ、該ターゲット鎖の3'末端は前記標的配列の3’端部から3'方向に少なくとも前記プライマーの塩基分伸びた部分にあり、前記ターゲット鎖の5’末端の前記標的配列の5’末端部分より伸びた部分の塩基数をL1、前記ターゲット鎖の3’末端の前記標的配列の3’末端部分より伸びた部分の塩基数をL2と表したときに、L1≦L2の関係を満たすものである。
【請求項1】
固相上に複数のスポットとして固定された、複数種類のプローブ核酸からなるプローブセットと、PCR用のプライマーを用いて増幅されたサンプル核酸が有するターゲット鎖の該プライマーよりも3’側の標的配列と、を反応させて得られる1種類以上のハイブリッド体を検出することによるサンプル核酸の検出方法に用いる前記プローブセットの設計方法であって、
前記プローブセットの前記複数種類の前記プローブ核酸が、前記サンプル核酸とハイブリダイズしたときに、70%以上の前記ハイブリッド体が以下の(1)および(2)の関係を満たすように設計することを特徴とする設計方法:
(1)前記プローブ核酸とサンプル核酸とが、該サンプル核酸のターゲット鎖の有する標的配列と、前記プローブセットの該標的配列に相補的である該プローブ核酸の有するプローブ配列とにより形成されたハイブリット部を介して結合したハイブリット体であって、
(2)前記サンプル核酸が有するターゲット鎖は、前記プローブ核酸よりも長く、該ターゲット鎖の5’末端は前記標的配列の5’側端部から5’方向に少なくとも前記プライマーの塩基分伸びた部分の先端にあり、かつ、該ターゲット鎖の3’末端は前記標的配列の3’側端部から3’方向に少なくとも前記プライマーの塩基分伸びた部分にあり、前記ターゲット鎖の5’末端の前記標的配列の5’末端部分より伸びた部分の塩基数をL1、前記ターゲット鎖の3’末端の前記標的配列の3’末端部分より伸びた部分の塩基数をL2と表したときに、L1≦L2の関係を満たすものである。
【請求項2】
前記プローブがDNAであることを特徴とする請求項1に記載の設計方法。
【請求項3】
固相に固定されたプローブDNAが共有結合により固定されていることを特徴とする請求項2に記載の設計方法。
【請求項4】
固相に固定されたプローブDNAが5’側の末端に導入された官能基を介して固定されていることを特徴とする、請求項2または3に記載の設計方法。
【請求項5】
固相に固定されたプローブDNAが3’側の末端に導入された官能基を介して固定されていることを特徴とする、請求項2または3に記載の設計方法。
【請求項6】
固相に固定されたプローブDNAが配列中に導入された官能基を介して固定されていることを特徴とする、請求項2または3に記載の設計方法。
【請求項7】
導入された官能基がチオール基であることを特徴とする、請求項4〜6のいずれか一項に記載の設計方法。
【請求項8】
プローブがPNAであることを特徴とする請求項1に記載の設計方法。
【請求項9】
プローブの塩基鎖長が15〜30merであることを特徴とする請求項1〜8のいずれか一項に記載の設計方法。
【請求項10】
プローブの塩基鎖長が31〜50merであることを特徴とする請求項1〜8のいずれか一項に記載の設計方法。
【請求項11】
プローブの塩基鎖長が51〜80merであることを特徴とする請求項1〜8のいずれか一項に記載の設計方法。
【請求項12】
検体核酸から標的配列を有するターゲット鎖を有するサンプル核酸を増幅させるための該標的配列よりも5’側のPCR用のプライマーと、該検体核酸をテンプレートとして該プライマーを用いて増幅した増幅産物中での前記標的配列の有無を確認するための固相に複数のスポットとして固定化された複数種類のプローブ核酸のセットと、を有し、該プローブ核酸と、前記標的配列と、を反応させて得られる1種類以上のハイブリッド体を検出することによりサンプル核酸を検出するサンプル核酸検出用のキットの設計方法において、
前記セットの前記プローブ核酸が前記サンプル核酸とハイブリダイズしたときに、70%以上の前記ハイブリッド体が以下の(1)および(2)の関係を満たすように前記検体核酸に対して前記プローブ核酸および前記プライマーが設計されていることを特徴とするサンプル核酸検出用のキットの設計方法;
(1)前記プローブ核酸とサンプル核酸とが、該サンプル核酸のターゲット鎖の有する標的配列と、前記プローブセットの該標的配列に相補的である該プローブ核酸の有するプローブ配列とにより形成されたハイブリッド部を介して結合したハイブリッド体であって、
(2)前記サンプル核酸が有するターゲット鎖は前記プローブ核酸よりも長く、該ターゲット鎖の5’末端は前記標的配列の5’側端部から5’方向に少なくとも前記プライマーの塩基分伸びた部分の先端にあり、かつ、該ターゲット鎖の3'末端は前記標的配列の3’端部から3'方向に少なくとも前記プライマーの塩基分伸びた部分にあり、前記ターゲット鎖の5’末端の前記標的配列の5’末端部分より伸びた部分の塩基数をL1、前記ターゲット鎖の3’末端の前記標的配列の3’末端部分より伸びた部分の塩基数をL2と表したときに、L1≦L2の関係を満たすものである。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2012−105666(P2012−105666A)
【公開日】平成24年6月7日(2012.6.7)
【国際特許分類】
【出願番号】特願2012−36351(P2012−36351)
【出願日】平成24年2月22日(2012.2.22)
【分割の表示】特願2004−268334(P2004−268334)の分割
【原出願日】平成16年9月15日(2004.9.15)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
【公開日】平成24年6月7日(2012.6.7)
【国際特許分類】
【出願日】平成24年2月22日(2012.2.22)
【分割の表示】特願2004−268334(P2004−268334)の分割
【原出願日】平成16年9月15日(2004.9.15)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
[ Back to top ]

