ハナスゲANEMARRHENAASPHODELOIDESBUNGEの抽出物を使用する抗癌方法
ハナスゲAnemarrhena asphodeloides Bungeの選択的アポトーシス性抽出物が提供される。また、特定の細胞において、特にヒトにおいてアポトーシスを誘導するために前記抽出物を使用する方法が提供される。さらにまた、生物においてアポトーシスを選択的に誘導するための医薬を製造するためのハナスゲの抽出物の使用が提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、植物抽出物組成物に関し、さらに詳しくはハナスゲ種Anemarrhena asphodeloides Bungeに属する植物種の抽出物を含有する組成物に関する。また、本発明は、このような植物抽出物組成物を使用する方法及び調製する方法に関する。
【0002】
(相互参照及び優先権主張)
本出願は、米国特許法35U.S.C.§119(3)の下で2008年9月3日付け出願の米国特許仮出願第61/094,005号及び2008年4月11日付け出願の米国特許仮出願第61/044,403号の優先権を主張する。これらの米国特許仮出願は、その全体を参照することにより本明細書において援用される。
【背景技術】
【0003】
癌細胞の特徴は、制御されていない増殖にある。確認されている制御されない増殖の原因の中で、見たところ重要な1つは、プログラムされた細胞死(アポトーシスとしても知られている)のプロセスに対する抵抗性である。アポトーシスは、多細胞生物が、制御されない細胞増殖を阻止するために及び病気になっている細胞、極めて有害になっている細胞又は必要がなくなっている細胞を除くために用いるプロセスである。アポトーシスのプロセスは、タンパク分解酵素及びDNAエンドヌクレアーゼの共同作用によって細胞が内部から分解され、アポトーシス小体の形成をもたらし、次いでこれがスカベンジャー細胞によって取り除かれるという多段階カスケードを含む。現在までの研究により、細胞内分解の多くは、アスパラギン酸残基に隣接して開裂するタンパク分解酵素のファミリーであるカスパーゼの作用によって行われることが明らかにされている。
【0004】
乳癌治療の最近の進歩にもかかわらず、現行の治療計画は、多くの場合、有害な(時には治療を制限する)副作用をもたらす。また、現行の治療は、転移性乳癌に対してはほとんど効果がない。早期スクリーニング及び治療は、多くの患者について予後を向上させることができるが、このようなスクリーニングは、一様ではなく、幾つかの癌は、日常的なスクリーニングでは初期の段階で検出できないほど早く増殖する。毒性が低いか、後期癌に対して活性であるか又はその両方である治療選択肢に対する要求が依然としてある。
【0005】
ハナスゲの種々の栽培品種が、中国の湖南省、湖北省、福建省、江蘇省、浙江省及び江西省で栽培されている。種子の乾燥未熟(green)胚が秋に採取される。これは、きれいに洗浄され、乾燥される。
【0006】
ハナスゲの抽出物を、多細胞生物、例えば哺乳動物、特にヒトの癌の選択的アポトーシス治療のために使用するという報告は、知られていない。
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明者は、ハナスゲの抽出物を含有する組成物がアポトーシス作用を有することを確認した。特に、ハナスゲの抽出物を含有する組成物は、癌細胞においてアポトーシスを選択的に誘導するが、非癌細胞は、前記抽出物の細胞障害作用に耐性を示す。従って、本明細書に記載の抽出物、すなわちハナスゲの抽出物、及びこのような抽出物を含有する組成物は、細胞の過剰増殖に特徴がある疾患状態、例えば癌及び良性の過形成性疾患、例えばBPH及び再狭窄を治療するのに有用な選択的アポトーシス剤である。
【課題を解決するための手段】
【0008】
従って、本明細書に記載の実施形態は、多細胞生物においてアポトーシスを選択的に誘導する方法であって、前記生物に、分類学上のハナスゲ種から選択される植物種の抽出物であって少なくとも1つの過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量の抽出物を含有する医薬組成物を投与することからなる、方法を提供する。幾つかの実施形態において、前記生物は、哺乳動物生物、例えばラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、過剰増殖細胞集団は、癌である。幾つかの実施形態において、癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌、子宮癌である。幾つかの実施形態において、過剰増殖細胞集団は、固形腫瘍である。幾つかの実施形態において、固形腫瘍は、乳癌、子宮癌、子宮頸癌、膣癌又は前立腺癌である。幾つかの実施形態において、過剰増殖細胞集団は、良性の過剰増殖性疾患である。幾つかの実施形態において、良性の過剰増殖性疾患は、良性の前立腺肥大、乾癬又は再狭窄である。幾つかの実施形態において、過剰増殖細胞集団は、転移性癌である。幾つかの実施形態において、転移性癌は、転移性乳癌である。
【0009】
本明細書の幾つかの実施形態は、多細胞生物の少なくとも1つの過剰増殖細胞集団においてアポトーシスを選択的に誘導することができる医薬を調製するのに有効な量の分類学上のハナスゲ種から選択される植物種の抽出物を含有する組成物の使用を提供する。幾つかの実施形態において、前記生物は、哺乳動物生物、例えばラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、過剰増殖細胞集団は、癌である。幾つかの実施形態において、癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌、子宮癌である。幾つかの実施形態において、過剰増殖細胞集団は、固形腫瘍である。幾つかの実施形態において、固形腫瘍は、乳癌、子宮癌、子宮頸癌、膣癌又は前立腺癌である。幾つかの実施形態において、過剰増殖細胞集団は、良性の過剰増殖性疾患である。幾つかの実施形態において、良性の過剰増殖性疾患は、良性の前立腺肥大、乾癬又は再狭窄である。幾つかの実施形態において、過剰増殖細胞集団は、転移性癌である。幾つかの実施形態において、転移性癌は、転移性乳癌である。
【0010】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記生物に、前記癌を治療するのに有効な量の分類学上のハナスゲ種から選択される植物種の抽出物を含有する医薬組成物を投与することからなる、方法を提供する。幾つかの実施形態において、前記生物は、哺乳動物生物、例えばラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌、子宮癌である。幾つかの実施形態において、癌は、固形腫瘍である。幾つかの実施形態において、固形腫瘍は、乳癌、子宮癌、子宮頸癌、膣癌又は前立腺癌である。幾つかの実施形態において、癌は、転移性癌である。幾つかの実施形態において、転移性癌は、転移性乳癌である。
【0011】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する医薬を調製するための、有効な量の分類学上のハナスゲ種から選択される植物種の抽出物を含有する組成物の使用を提供する。幾つかの実施形態において、前記生物は、哺乳動物生物、例えばラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌、子宮癌である。幾つかの実施形態において、癌は、固形腫瘍である。幾つかの実施形態において、固形腫瘍は、乳癌、子宮癌、子宮頸癌、膣癌又は前立腺癌である。幾つかの実施形態において、癌は、転移性癌である。幾つかの実施形態において、転移性癌は、転移性乳癌である。
【0012】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2とを含有する、組成物を提供する。
【0013】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3を含有する、組成物を提供する。
【0014】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2を含有する、組成物を提供する。
【0015】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンA3とチモサポニンB2とを含有する有効量の医薬組成物を投与することからなる、方法を提供する。
【0016】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンA3を含有する有効量の医薬組成物を投与することからなる、方法を提供する。
【0017】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンB2を含有する有効量の医薬組成物を投与することからなる、方法を提供する。
【0018】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する医薬を製造するための、チモサポニンA3、チモサポニンB2、又はチモサポニンA3とチモサポニンB2の両方を含有する組成物の使用を提供する。
【0019】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、チモサポニンA3とチモサポニンB2とを含有する有効量の医薬組成物を投与することからなる、方法を提供する。
【0020】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、チモサポニンA3を含有する有効量の医薬組成物を投与することからなる、方法を提供する。
【0021】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する法であって、前記多細胞生物に、チモサポニンB2を含有する有効量の医薬組成物を投与することからなる、方法を提供する。
【0022】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する医薬を製造するための、チモサポニンA3、チモサポニンB2、又はチモサポニンA3とチモサポニンB2の両方を含有する組成物の使用を提供する。
【0023】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物を含有する、組成物を提供する。
【0024】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記多細胞生物に、ハナスゲの抽出物を含有する有効量の医薬組成物を投与することからなる、方法を提供する。
【0025】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する医薬を製造するための、ハナスゲの抽出物を含有する組成物の使用を提供する。
【0026】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、ハナスゲの抽出物を含有する有効量の医薬組成物を投与することからなる、方法を提供する。
【0027】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する医薬を製造するための、ハナスゲの抽出物を含有する組成物の使用を提供する。
【0028】
本明細書に述べた全ての刊行物及び特許出願は、あたかもそれぞれ個々の刊行物又は特許出願が参照することにより援用されることが具体的に及び個々に示されているかのように同じ程度に参照することより本明細書において援用される。
【図面の簡単な説明】
【0029】
本発明の新規な特徴を、特に添付の特許請求の範囲に記載する。本発明の特徴及び利点のより良い理解は、本発明の原理が利用される例示的実施形態を示す以下の詳細な説明、及び以下の添付図面を参照することにより得られるであろう。
【0030】
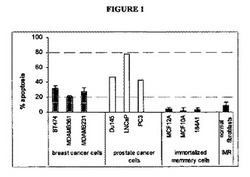
【図1】BN108による細胞死の誘導を表す。腫瘍及び非形質転換細胞株並びに細胞を、0.5mg/mlのBN108で24時間処理した。グラフは、アネキシンVを結合した細胞の割合を示す。
【図2】カスパーゼ4は、BN108処理細胞において活性化される。BT474細胞を、特定のカスパーゼ4阻害剤の存在下で又は不存在下で、BN108で処理した。カスパーゼ4及び9の活性を、蛍光アッセイ(Fluorimetric.tm. assays)(Biovision Inc.)を使用して定量した。明らかに、カスパーゼ4の阻害は、カスパーゼ4の活性化がアポトーシスプロセスの頂点にあることを示すカスパーゼ9活性の阻害をもたらす。
【図3A−3B】図3Aは、BN108が、REDD1を誘導し且つ乳癌細胞においてmTORC1シグナル伝達を阻害することを表す。REDD1の発現のウェスタンブロット分析及び乳癌細胞株BT474におけるmTOR標的s6キナーゼ及び4eBPのリン酸化。これらの変化のいずれも、不死化非形質転換乳腺上皮細胞株MCF10Aでは観察されなかった(図には示さない)。図3Bは、BN108が、乳癌細胞ではAKTの活性を阻害するが、MCF10A細胞では阻害しないことを表す。
【図4A−4B】図4Aは、BN108による処理が、乳癌細胞BT474ではAKTキナーゼを不活性化するが、正常乳腺上皮細胞MCF10Aでは不活性化しないことを表す。図4Bは、SREBP2が、上記両方の細胞株においてBN108によって活性化されることを表す。活性化AKTは、活性キナーゼにおいてのみリン酸化されるホスホセリン473(phospho−AKT)に対する抗体を使用して検出された。SREBPに対する抗体は、120kDの不活性前駆物質及び60kDの開裂した活性核の両方を検出する。
【図5】乳癌細胞(BT474)及び正常上皮細胞(MCF10A)の生存率に対するチモサポニンA3及びB2の効果を表す。細胞は、0.5mg/mlのBN108、4μg/mlのチモサポニンA3又は50μg/mlのチモサポニンB2、4μg/mlの不活性化ラマリナーゼ(lamarinase)単独又はラマリナーゼ処理B2で24時間処理した。
【図6】アポトーシス促進性遺伝子REDD1が、前立腺癌細胞株Dul45においてBN108(0.5mg/ml)及びチモサポニンA3(7.5μM)で処理することによって誘導されることを表す。
【図7】精製チモサポニンA3及びBN108抽出物が、elF2aのリン酸化及びSREBP2の活性化並びにSREBP2標的遺伝子IDI1上での発現に対して、同様の効果を有することを表す。BT474細胞は、TspA3(5μM)又はBN108(0.5mg/ml)で処理した。
【図8】精製チモサポニンA3及びBN108抽出物が、乳癌細胞MM23及び正常MCF10A細胞でのコレステロール合成に対して同様の効果を有することを表す。細胞を、図に示した時間でBN108又はTspA3で処理し、細胞抽出物をコレステロール含有量について分析し、これをタンパク質含有量に対して標準化した。
【図9】チモサポニンA3及びBN108抽出物の細胞障害効果が、コレステロール(CHL、250mM)によって強く阻害され、カスパーゼ4阻害剤(LEVD)によって部分的に阻害されることを表す。BT474細胞を24時間処理し、生存細胞の割合を、ヨウ化プロピジウム及びアネキシンVの結合について死滅細胞の透過性に基づいてFACScanで分析した。
【図10】様々な乳房細胞、前立腺細胞、不死化乳腺細胞及び正常線維芽細胞におけるBN108細胞障害作用を表す。BN108は、癌細胞ではアポトーシスを生じたが、非癌性不死化乳腺細胞及び正常線維芽細胞では比較的わずかなアポトーシスしか観察されなかった。
【図11】BN108で処理した前立腺及び乳癌細胞におけるカスパーゼ4の阻害が、これらを細胞死から部分的に保護することを表す。
【図12】H460及びA549細胞株でのBN108のCyQuant細胞増殖アッセイを表す。
【図13】HCT116、SW480及びDLD1細胞株でのBN108のCyQuant細胞増殖アッセイを表す。
【図14】Dul45、LNCaP及びPC3細胞株でのBN108のCyQuant細胞増殖アッセイを表す。
【図15】ラマリナーゼによるチモサポニンB2のチモサポニンA3への転化が、飛行時間型質量分析(TOF MS)で確認されたことを表す。チモサポニンB2の消失及びチモサポニンA3の出現は、不活性化ラマリナーゼ及びチモサポニンB2の存在下での16%から活性化ラマリナーゼ及びチモサポニンB2の存在下では53%までの細胞死の上昇をもたらす。
【発明を実施するための形態】
【0031】
本明細書において、特にハナスゲと呼ばれる植物の分類学上の種の抽出物を含有する医薬組成物が開示される。本明細書に開示される別の実施形態は、本明細書に記載の組成物を使用する選択的アポトーシス方法を提供する。本明細書に記載の選択的アポトーシス組成物は、異常分裂細胞、例えば癌細胞でアポトーシスを誘導し、同時に正常細胞の正常な細胞プロセスを妨害しない活性を有する。理論によって制限されることを望まないが、開示された医薬組成物の有効成分は、カスパーゼ経路によって作用して、アポトーシスのプロセスにより自己調節能を失っている細胞においてアポトーシスを誘導すると考えられる。このような有効成分(これらは、ハナスゲ、特にその果実から抽出される)は、癌細胞においてAKT及びmTORキナーゼの活性を阻害し、それによって癌性細胞においてアポトーシスを誘導するか又は修復する活性を示唆する。
【0032】
ハナスゲの水性抽出物(水溶液1mL当たり乾燥固形抽出物0.5mg)による乳癌細胞の処理は、癌細胞株の多数において顕著な細胞死を誘導する。正常な乳房上皮細胞及び線維芽細胞は、ハナスゲ抽出物の細胞障害作用に耐性がある。ハナスゲ抽出物に感受性であった乳癌細胞は、アポトーシス細胞死を起こす(DNA断片化、カスパーゼ活性化、PARPの切断及びアネキシンV染色によって確認される)。カスパーゼ3の他に、カスパーゼ4及び9(これらは、小胞体ストレスによって誘導されるアポトーシスに関連している)の活性化もまた、ハナスゲの水性抽出物0.5mg/mLによって誘導されることが観察された。この溶液は、乳癌においてAKT及びmTORキナーゼの急速な不活性化を誘導するが、非形質転換細胞では誘導しなかった。周知のアポトーシス促進特性及び抗増殖特性を有する幾つかの遺伝子の発現もまた、ハナスゲの水性抽出物によって誘導された。従って、本発明の態様は、多細胞生物、例えば哺乳動物、特にヒトの治療用のハナスゲの抽出物の選択的アポトーシス促進作用を利用することにある。
【0033】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2とを含有する、組成物を提供する。幾つかの実施形態において、前記組成物は、チモサポニンA3とチモサポニンB2とのみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、総合重量で、約50〜1,000mgのチモサポニンA3とチモサポニンB2、好ましくは約100〜800mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンA3とチモサポニンB2を含有する。幾つかの実施形態において、前記組合せは、総合重量で、約1〜100mgのチモサポニンA3とチモサポニンB2、好ましくは約1〜50mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンA3とチモサポニンB2を含有する。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物はヒトである。幾つかの実施形態において、前記の癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0034】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3を含有する、組成物を提供する。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物はヒトである。幾つかの実施形態において、前記の癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0035】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2を含有する、組成物を提供する。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物はヒトである。幾つかの実施形態において、前記の癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0036】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンA3とチモサポニンB2とを含有する有効量の医薬組成物を投与することからなる、多細胞生物の癌を治療方法を提供する。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2とのみから本質的になる。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物はヒトである。幾つかの実施形態において、前記の癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0037】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンA3を含有する有効量の医薬組成物を投与することからなる、方法を提供する。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3のみから本質的になる。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物はヒトである。幾つかの実施形態において、前記の癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0038】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンB2を含有する有効量の医薬組成物を投与することからなる、方法を提供する。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2のみから本質的になる。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物はヒトである。幾つかの実施形態において、前記の癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0039】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する医薬を製造するための、チモサポニンA3、チモサポニンB2、又はチモサポニンA3とチモサポニンB2の両方を含有する組成物の使用を提供する。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2の両方のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、総合重量で、約50〜1,000mgのチモサポニンA3とチモサポニンB2、好ましくは約100〜800mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンA3とチモサポニンB2を含有する。幾つかの実施形態において、前記組成物は、総合重量で、約1〜100mgのチモサポニンA3とチモサポニンB2、好ましくは約1〜50mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンA3とチモサポニンB2を含有する。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、約50〜1,000mgのチモサポニンA3、好ましくは約100〜800mgのチモサポニンA3、さらに好ましくは約200〜600mgのチモサポニンA3を含有する。幾つかの実施形態において、前記組成物は、約1〜100mgのチモサポニンA3、好ましくは約1〜50mgのチモサポニンA3、さらに好ましくは約1〜20mgのチモサポニンA3を含有する。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、約50〜1,000mgのチモサポニンB2、好ましくは約100〜800mgのチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンB2を含有する。幾つかの実施形態において、前記組成物は、約1〜100mgのチモサポニンB2、好ましくは約1〜50mgのチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンB2を含有する。幾つかの実施形態において、前記医薬組成物は経口製剤である。幾つかの実施形態において、前記多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、前記多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0040】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、チモサポニンA3とチモサポニンB2とを含有する有効量の医薬組成物を投与することからなる、提供する。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2とのみから本質的になる。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は経口製剤である。幾つかの実施形態において、前記多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、前記多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0041】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、チモサポニンA3を含有する有効量の医薬組成物を投与することからなる、方法を提供する。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3のみから本質的になる。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、前記多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0042】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、チモサポニンB2を含有する有効量の医薬組成物を投与することからなる、方法を提供する。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンB2のみから本質的になる。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、前記多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0043】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する医薬を製造するための、チモサポニンA3、チモサポニンB2、又はチモサポニンA3とチモサポニンB2の両方を含有する組成物の使用を提供する。幾つかの実施形態において、前記組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2の両方のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、総合重量で、約50〜1,000mgのチモサポニンA3とチモサポニンB2、好ましくは約100〜800mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンA3とチモサポニンB2を含有する。幾つかの実施形態において、前記組成物は、総合重量で、約1〜100mgのチモサポニンA3とチモサポニンB2、好ましくは約1〜50mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンA3とチモサポニンB2を含有する。幾つかの実施形態において、前記組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、約50〜1,000mgのチモサポニンA3、好ましくは約100〜800mgのチモサポニンA3、さらに好ましくは約200〜600mgのチモサポニンA3を含有する。幾つかの実施形態において、前記組成物は、約1〜100mgのチモサポニンA3、好ましくは約1〜50mgのチモサポニンA3、さらに好ましくは約1〜20mgのチモサポニンA3を含有する。幾つかの実施形態において、前記組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンB2のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、約50〜1,000mgのチモサポニンB2、好ましくは約100〜800mgのチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンB2を含有する。幾つかの実施形態において、前記組成物は、約1〜100mgのチモサポニンB2、好ましくは約1〜50mgのチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンB2を含有する。幾つかの実施形態において、前記医薬組成物は、経口製剤である。幾つかの実施形態において、前記多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、前記多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0044】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物を投与することからなる、組成物を提供する。幾つかの実施形態において、前記組成物は、ハナスゲの抽出物のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は経口製剤である。幾つかの実施形態において、前記多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、前記多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0045】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記多細胞生物に、ハナスゲの抽出物を含有する有効量の医薬組成物を投与することからなる、方法を提供する。幾つかの実施形態において、医薬組成物は、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物のみから本質的になる。幾つかの実施形態において、医薬組成物は、多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、医薬組成物は、有効量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物は、ヒトである。幾つかの実施形態において、前記の癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物は、ヒトである。幾つかの実施形態において、前記の癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0046】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する医薬を製造するための、ハナスゲの抽出物を含有する組成物の使用を提供する。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、総合重量で、約50〜50,000mgのハナスゲの抽出物、好ましくは約1000〜40,000mgのハナスゲの抽出物、さらに好ましくは約2000〜35,000mgのハナスゲの抽出物を含有する。幾つかの実施形態において、前記組成物は、総合重量で、約100〜1000mgのハナスゲの抽出物、好ましくは約100〜500mgのハナスゲの抽出物、さらに好ましくは約10〜200mgのハナスゲの抽出物を含有する。幾つかの実施形態において、前記医薬組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0047】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、ハナスゲの抽出物を含有する有効量の医薬組成物を投与することからなる、方法を提供する。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のハナスゲの抽出物のみから本質的になる。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0048】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する医薬を製造するための、ハナスゲの抽出物を含有する組成物の使用を提供する。幾つかの実施形態において、前記組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のハナスゲのみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、総合重量で、約50〜50,000mgのハナスゲの抽出物、好ましくは約1000〜40,000mgのハナスゲの抽出物、さらに好ましくは約2000〜35,000mgのハナスゲの抽出物を含有する。幾つかの実施形態において、前記組成物は、総合重量で、約100〜1000mgのハナスゲの抽出物、好ましくは約100〜500mgのハナスゲの抽出物、さらに好ましくは約10〜200mgのハナスゲの抽出物を含有する。幾つかの実施形態において、前記医薬組成物は、経口製剤である。幾つかの実施形態において、前記多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、前記多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0049】
本明細書で使用される「含有すること(comprising)」又は「含有する(comprise(s))」という用語及びその文法上の変化は、さらなる列挙されていない要素又は方法工程を、含むか又は制約がなく且つ除外しない。「含む(include(s))」、[含有する(contain(s)/containing)」及びこれらの文法上の変化は、同様に含む。
【0050】
本明細書で使用される「のみからなる」という語句は、文章の以下の部分に特定されていない任意の要素、工程又は成分を除外する。
【0051】
本明細書で使用される「のみから本質的になる」という語句は、文章の以下の部分の範囲を、特定された物質又は工程並びに特許請求された発明の基本的及び新規な特徴に実質的に影響を及ぼさない物質又は工程に限定する。
【0052】
ハナスゲの抽出物
幾つかの実施形態において、前記植物種は、植物種ハナスゲであり、ハナスゲの種々の栽培品種である。
【0053】
植物物質とは、ハナスゲ種由来の少なくとも1つの植物の任意の1つ又は複数の部分を意味する。植物物質とは、植物全体、あるいは該植物の任意の1つ又は複数の部分、例えば根、樹皮、木質、葉、花(又は花、例えば萼片、花弁、雄ずい、雌ずいなど)、果実、種子及び/又は前記のいずれかの部分又は混合物を包含する。植物物質は、切断直後、乾燥物(凍結乾燥物を含む)、凍結物などであってもよい。植物物質は、その全体であってもよいし又はより小さい部分に分けられていてもよい。例えば、葉は、細断、寸断又は粉砕されていてもよく、根は、細断又は粉砕されていてもよく、果実は、細断されていてもよいし、薄切りされていてもよいし又は混合されてもよく、種子は、細断又は粉砕されていてもよく、茎は、寸断、細断又は粉砕されていてもよい。本発明の具体的な実施形態においては、使用される植物部分は、ハナスゲの地下茎である。
【0054】
本発明の植物抽出物組成物は、ハナスゲの少なくとも1つの抽出物を含有する。「抽出物」とは、植物部分を、抽出溶媒と、植物由来の1種又はそれ以上の化合物に適した条件下で接触させて植物物質から抽出溶媒に分配する際に得られる溶液、濃縮液又は残留物である。前記溶液は、次いで、場合により濃縮されて濃縮物又は残留物を形成する。
【0055】
本発明に適した抽出媒体としては、水及びエチルアルコールが挙げられる。具体的には、水が抽出溶媒である場合には、精製水が適している。精製水としては、蒸留水、脱イオン水、注射用水、限外濾過水、及び精製された他の形態の水が挙げられる。本発明の幾つかの実施形態において用いられるエチルアルコールは、穀粒エタノール、特に未変性エタノール(例えば、場合により若干の水、例えば最大約10%までの水を含有していてもよい純穀粒エタノール)である。幾つかの実施形態において、抽出溶媒は、水、エタノール又はこれらの混合物である。濃縮物又は残留物は、抽出液を濃縮する(例えば、蒸発させるか又は凍結乾燥する)ことによって調製してもよい。最初の抽出溶媒、濃縮物又は残留物の形態にかかわらず、これらの調製物のそれぞれは、本発明の目的の「抽出物」とみなされる。
【0056】
本発明の植物抽出物の製造方法は、場合により、植物物質を、その表面積と容積との比を増大させ且つ抽出プロセスの効率を同時に高めるために最初に粉砕することからなる。植物物質を粉砕する方法は、粉砕、細断、混合、寸断、微粉砕、磨砕などを含む。
【0057】
次いで、抽出媒体(溶媒)は、植物物質と、1種又はそれ以上の植物化学物質、特に選択的アポトーシス植物化学物質を生じさせるのに適した条件下で接触させ、植物物質から抽出溶媒に分配させる。このような条件としては、幾つかの場合には、室温を超える温度までの抽出媒体の加熱、撹拌、接触時間などが挙げられる。典型的な抽出温度は、約50℃から抽出溶媒の沸点までである。水が抽出溶媒である場合は、抽出温度は、一般的に室温から約100℃までであり、約50℃から約80℃までの温度が特に適しており、約75℃の温度が特に適している。抽出溶媒としてエタノールの場合には、抽出温度は、一般的に室温から約78.5℃までであり、約50℃から約78℃までの温度が特に適しており、約75℃の温度が特に適している。当業者には、一方の抽出効率と、他方の植物化学物質の安定性との間で適切な均衡が設けられるべきであることが認識されるであろう。
【0058】
抽出媒体と植物物質が組み合わされると、これらは、場合により、植物物質から抽出媒体への選択的アポトーシス化合物の効率的な交換を確実にするために撹拌され、植物物質から抽出媒体への有用な量の植物化学物質を抽出するのに十分な時間を接触させておく。このような時間(例えば、約5分〜約10時間、さらに詳しくは約10分〜約5時間、特に約30分〜約2時間)が経過した後に、植物化学物質を含有する抽出媒体は、植物物質から分離される。このような分離は、当該技術で認識されている方法で、例えば濾過、デカントなどによって達成される。
【0059】
本発明の組成物としては、本明細書に記載の植物抽出物又は本明細書に記載の植物抽出物を含有する組成物が挙げられる。このような実施形態において、本明細書に記載の組成物は、場合により1種又はそれ以上の追加成分を含有していていもよい。このような追加成分は、不活性であってもよいし又は活性であってもよい。不活性成分としては、溶媒、賦形剤又は他の担体が挙げられる。活性成分としては、活性医薬成分(API)、例えば本明細書に記載の植物抽出物と組み合わせて相乗活性を示す活性医薬成分が挙げられる。
【0060】
本明細書に開示の幾つかの実施形態は、分類学上のハナスゲ種Anemarrhena asphodeloides Bungの抽出物を含有する医薬組成物を提供する。「抽出物」とは、植物物質から1種又はそれ以上の化合物を抽出媒体に取り出すのに適した条件下で、抽出媒体(溶媒)と植物物質とを接触させ、抽出溶液を形成することによって部分的に調製される物質の組成物である。次いで、抽出溶液は、植物物質から分離され、場合によっては希釈又は濃縮され(例えば、蒸発、昇華又は凍結乾燥によって)、抽出物を形成する。
【0061】
ユリ科のハナスゲ種ナスゲAnemarrhena asphodeloides Bungはまた、ハナスゲZhi Muとも様々に呼ばれ、0.5m〜1mに育つ常緑多年生植物である。これは、8月から9月まで開花している。花は、両性花である(雄性器官と雌性器官の両方をもつ)。この植物は、軽質土壌(砂質)、中質土壌(ローム質)及び重質土壌(粘土)を好み、これらの土壌は、pHで酸性〜中性であり、湿っている。この植物は、強風に耐えられるが、海洋曝露には耐えられない。
【0062】
抽出媒体は、適当な液状溶媒、例えば酢酸エチル、水、メタノール、エタノール又はこれらの2つ又はそれ以上の混合物である。抽出媒体は、ある場合には酢酸エチル、水、エタノール、メタノール又は別の比較的極性の液状溶媒である。ある場合には、抽出媒体は、アルコール水溶液、例えばエタノール又はメタノール水溶液である。幾つかの実施形態において、抽出媒体は、メタノール水溶液である。ある場合には、抽出媒体は、希釈又は濃縮される。抽出媒体は、完全に濃縮されていてもよく、それによって抽出物は残留物(残留抽出物)の形態をとる。従って、抽出物は、場合により溶媒に溶解されていてもよい少なくとも1種又はそれ以上の植物由来の化合物(植物化学物質)であって、これらは、抽出媒体と植物又は植物部分を接触させる1つ又はそれ以上の工程によって抽出媒体中に取り出される化合物を含有する。濃縮抽出物又は残留抽出物は、再構成抽出物を形成するために、適当な希釈剤、例えば酢酸エチル、水及び/又はエタノールを加えることによって再構成されていてもよい。
【0063】
幾つかの実施形態において、植物抽出物を含有する組成物は、純粋な抽出物又は分配抽出物(抽出物中の1種又はそれ以上の選択的アポトーシス活性化合物に富む抽出物を含む)及びこのような抽出物と1種又はそれ以上の追加成分の組み合わせを含む。幾つかの実施形態において、前記組成物は、固体、半固体、液体、コロイドなどを含め種々の物理的形状の組成物を含む。組成物が医薬用途を目的とする場合には、追加成分は、製薬学的に許容できる。本発明の組成物が生体に関するものではないアッセイ又はその他の用途を目的とする場合には、添加成分(1つ又は複数)は製薬学的に許容できるものであってもよいし又は許容できないものであってもよい。
【0064】
幾つかの実施形態において、純粋な抽出物は、1種又はそれ以上の有機溶媒と組み合わせてもよい。このような有機溶媒は、種々の極性をもつものであってもよい。幾つかの実施形態において、適当な溶媒は、酢酸エチル、アセトニトリル、ヘキサン類、(C1−C4)アルコール(例えば、メタノール、エタノール、i−プロパノール、n−プロパノール、n−ブタノール、t−ブタノール、s−ブタノール、i−ブタノールなど)、クロロホルム、アセトン、シクロヘキサン、シクロヘプタン、石油エーテル、並びにその他の溶媒、例えば製薬学的に許容し得る溶媒及びヒトに使用するのに安全であると一般的にみなされている(GRAS)溶媒を包含する。
【0065】
幾つかの実施形態において、前記組成物は、純粋な抽出物を含有するか、あるいは抽出物と1種又はそれ以上の追加溶媒との組み合わせを含有する。幾つかの実施形態において、抽出物は、分配されるか又はさらに精製された抽出物を包含する。分配又は精製は、クロマトグラフィーを含め種々の分離法を使用して行ってもよい。幾つかの実施形態において、抽出物は、抽出物中の活性薬剤をさらに濃縮するために、陰イオン交換クロマトグラフィー、陽イオン交換クロマトグラフィー、逆相クロマトグラフィー、順相クロマトグラフィー、アフィニティークロマトグラフィー又は排除クロマトグラフィーによって得られる精製又は分配抽出物である。幾つかの実施形態において、精製又は分配抽出物は、液体クロマトグラフィー、例えば高速液体クロマトグラフィー(HPLC)の1つ又はそれ以上の工程によって得られる。幾つかの実施形態において、高速液体クロマトグラフィーは、分取規模の高速液体クロマトグラフィーである。幾つかの実施形態において、HPLCは、逆相クロマトグラフィー又はイオン交換クロマトグラフィーである。その他の分離の手段、例えば分液ロートあるいはその他の二相又は多相分離メカニズムでの分離を、抽出物を精製又は分配するのに使用してもよい。幾つかの実施形態において、精製又は分配抽出物は、1種又はそれ以上の追加の活性又は不活性成分、例えば溶媒、希釈剤などと組み合わせてもよい。幾つかの実施形態において、適当な溶媒は、酢酸エチル、アセトニトリル、ヘキサン類、(C1−C4)アルコール(例えば、メタノール、エタノール、i−プロパノール、n−プロパノール、n−ブタノール、t−ブタノール、s−ブタノール、i−ブタノールなど)、クロロホルム、アセトン、シクロヘキサン、シクロヘプタン、石油エーテル、並びにその他の溶媒、例えば製薬学的に許容し得る溶媒及びヒトに使用するのに安全であると一般的にみなされている(GRAS)溶媒を包含し得る。
【0066】
適当な追加成分としては、溶媒が挙げられる。溶媒は、製薬学的に許容し得る溶媒及び非製薬学的に許容し得る溶媒に細分化し得る。これに関連して、幾つかの製薬学的に許容し得る溶媒として注射用水(WFI)が挙げられ、これは予め選択されたpH又はpH範囲、例えば約2〜約8、さらに具体的には約4.0〜約7.5、さらに詳しくは約4.9〜約7.2にpH調整されていてもよい及び/又は緩衝されていてもよいことが理解されるべきであり。
【0067】
製薬学的に許容し得る溶媒は、さらに、1種又はそれ以上の製薬学的に許容し得る酸、塩基、塩又はその他の化合物、例えば担体、賦形剤などを含有していてもよい。製薬学的に許容し得る酸としては、HCl、H2SO4、H3PO4、安息香酸などが挙げられる。製薬学的に許容し得る塩基としては、NaOH、KOH、NaHCO3などが挙げられる。製薬学的に許容し得る塩としては、NaCl、NaBr、KClなどが挙げられる。酸及び塩基は、特定の予め選択されたpH、特別には約2〜8の範囲内のpH、さらに特別には約5.0〜約7.2の範囲内のpHで、製薬学的に許容し得る溶液を緩衝するために適当な割合で加えてもよい。
【0068】
ハナスゲの抽出物からチモサポニンA3とチモサポニンB2の精製
本発明者は、チモサポニンA3(本明細書では「チモサポニンA−III」ともいう)(これは、ハナスゲの乾燥抽出物1000mg当たり約2mgに相当する)が、生体外(in vitro)で種々の癌細胞においてアポトーシスを誘導するが、非癌性細胞ではアポトーシスを誘導しないことを見出した。また、本発明者は、チモサポニンB2(本明細書では「チモサポニンB−II」ともいう)(これは、ハナスゲの乾燥抽出物1000mg当たり約79mgに相当する)は、生体外でアポトーシスを誘導しないことを見出した。しかし、チモサポニンB2は、ラマリナーゼによってチモサポニンA3に転化し得るし、また腸管内菌叢の作用によって生体内でチモサポニンA3に転化し得る。実際に、生体外実験により、生体外でのラマリナーゼ(腸管内菌叢によって一般に発現される酵素)によるチモサポニンB2の処理は、チモサポニンB2を癌細胞においてアポトーシスを誘導するのに活性にすることが明らかにされた。
【0069】
チモサポニンA3とチモサポニンB2は、高速液体クロマトグラフィーによりハナスゲの抽出物から分離され、飛行時間型質量分析(TOF−MS)によって確認された。ハナスゲの乾燥抽出物の試料の全質量に対するチモサポニンA3とチモサポニンB2の寄与が、ハナスゲの試料の乾燥質量と、分離プロセスの最後に回収されたチモサポニンA3とチモサポニンB2の質量とに基づいて算出された。チモサポニンA3とチモサポニンB2の構造及び分子量を、以下に示す:
チモサポニンA−III
【化1】

C39H64O13
正確な質量:740.43
分子量:740.92
m/e:740.43(100.0%)、741.44(43.4%)、742.44(11.9%)、743.44(2.3%)
C:63.22; H:8.71; O:28.07
チモサポニンB−II
【化2】

化学式:C45H76O19
正確な質量:920.50
分子量:921.07
m/e:920.50(100%)、921.50(50.3%)、922.50(15.5%)、923.51(3.9%)
元素分析値: C:58.68; H:8.32; O:33.00
【0070】
医薬組成物
ハナスゲの抽出物、チモサポニンA3、チモサポニンB2、及びチモサポニンA3とチモサポニンB2の混合物は、前記のようにして溶液又は乾燥形態で調製し得る。溶液形態では、ハナスゲの抽出物、チモサポニンA3、チモサポニンB2、及びチモサポニンA3とチモサポニンB2の混合物は、フレーバーティー(tea)又はノンフレーバーティーの形態で投与してもよい。幾つかの実施形態において、幾つかの香味料、例えば甘味料が、抽出物の苦味を中和するために望ましいものであり得る。溶液もまた、乾燥抽出物からティー又はエリキシルの形態で調製できる。また、香味料、例えば甘味料が望ましいものであり得る。風味のマスキングを、患者の医薬組成物の許容性を向上させるために用いてもよい。
【0071】
ハナスゲの乾燥抽出物、チモサポニンA3、チモサポニンB2、及びチモサポニンA3とチモサポニンB2の混合物は、経口利用できる形態、例えばカプセル剤、錠剤、カプレットなどとして製剤し得る。カプセルは、適量の前記乾燥抽出物を1つ又はそれ以上のゼラチンカプセルシェルに測り取り、カプセルを組み立てることによって調製し得る。錠剤及びカプレットは、前記乾燥抽出物を、1種又はそれ以上の賦形剤、例えば製薬学的に不活性な結合剤、充填剤、潤滑剤、希釈剤、崩壊剤、徐放剤など(これらは、当該技術において一般に知られている)と組み合わせることによって調製し得る。植物繊維が、本発明の目的のための充填剤とみなされることは、注目される。幾つかの実施形態において、本発明は、植物由来の繊維以外の充填剤を含有する固形製剤を意図する。他の実施形態は、充填剤としてある量の可溶性植物繊維を保有することを意図する。別の実施形態は、充填剤として植物繊維の添加を意図する。錠剤、カプレット、カプセル剤などは、例えば、胃の不調を防止するために腸溶性コーティング又はその他のコーティング、例えば酸素防護障壁で被覆されていてもよい。
【0072】
ハナスゲの乾燥抽出物、チモサポニンA3、チモサポニンB2、及びチモサポニンA3とチモサポニンB2の混合物、又はハナスゲの抽出物、チモサポニンA3、チモサポニンB2、及びチモサポニンA3とチモサポニンB2の混合物の濃縮溶液は、1種又はそれ以上のゲル化剤と組み合わせ、ゲルカプセルに挿入してもよい。あるいは、ハナスゲの乾燥抽出物、チモサポニンA3、チモサポニンB2、及びチモサポニンA3とチモサポニンB2の混合物、又はハナスゲの抽出物、チモサポニンA3、チモサポニンB2、及びチモサポニンA3とチモサポニンB2の混合物の濃縮溶液は、ゲル化剤と、場合により食用ゲルとして経口投与するための1種又はそれ以上の香味料と組み合わせてもよい。あるいはノンフレーバー変種(variant)を、直腸坐薬ゲル又はゲルカプセルとして投与してもよい。
【0073】
ハナスゲの抽出物の単位用量は、剤形内に含まれる当量の乾燥抽出物によって特徴付けられる。例えば、幾つかの実施形態において、単位投薬量は、1mg〜約10gの乾燥抽出物又はその均等物を含有し得る。幾つかの実施形態において、前記単位用量は、約1mg〜約10mg、約1mg〜約100mg、約1mg〜約1000mg(1g)、約1mg〜約10000mg(10g)の乾燥抽出物又はその均等物を含有するであろう。幾つかの実施形態において、前記単位用量は、約10mg〜約100mg、約10mg〜約1000mg又は約10mg〜約10000mgの乾燥抽出物又はその均等物を含有する。幾つかの実施形態において、前記単位用量は、約100mg〜約5000mg、約100mg〜約2500mg、約100mg〜約2000mg、約100mg〜約1500mg、約100〜約1000、約100〜約800mgの乾燥抽出物又はその均等物を含有する。ハナスゲの乾燥抽出物の均等物は、ハナスゲの乾燥抽出物と同じ量のアポトーシス活性成分(active)を含有するハナスゲのある量の乾燥物、液体、ゲル又は他の混合物である。従って、ハナスゲの乾燥抽出物0.5mg/mLを含有するティー(tea)30mLは、15mgの乾燥ハナスゲに相当する単位用量である。ハナスゲの乾燥抽出物、結合剤、充填剤、崩壊剤のそれぞれを100mg含有する錠剤は、100mgの乾燥抽出物それ自体(neat)に相当する。
【0074】
本明細書に記載の所見に基づいて、チモサポニンA3、チモサポニンB2又はチモサポニンA3及びB2の混合物の有効量は、約1〜1000mg/用量の範囲内にあり、1回の用量で又は分割した用量で、1日当たり1回、2回、3回、4回又はそれ以上の用量(約1〜4000mg/日)で提供されると推測される。幾つかの実施形態において、チモサポニンA3、チモサポニンB2又はチモサポニンA3及びB2の混合物の用量は、約5〜約500mg/用量であり、1回の用量で又は分割した用量で、1日当たり1回、2回、3回、4回又はそれ以上の用量(約5〜2000mg/日)で提供し得る。幾つかの実施形態において、チモサポニンA3、チモサポニンB2又はチモサポニンA3及びB2の混合物の用量は、約100mg/用量〜約500mg/用量であり、1回の用量で又は分割した用量で、1日当たり1回、2回、3回、4回又はそれ以上の用量で提供し得る。幾つかの実施形態において、チモサポニンA3、チモサポニンB2又はチモサポニンA3及びB2の混合物の用量は、約50mg/用量、約100mg/用量、約150mg/用量、約200mg/用量、約250mg/用量、約300mg/用量、約350mg/用量、約400mg/用量、約450mg/用量、約500mg/用量、約550mg/用量、約600mg/用量、約650mg/用量、約700mg/用量、約750mg/用量、約800mg/用量であり、1回の用量で又は分割した用量で、1日当たり1回、2回、3回、4回又はそれ以上の用量で提供し得る。従って、幾つかの実施形態において、チモサポニンA3、チモサポニンB2又はチモサポニンA3及びB2の混合物の1日用量は、50mg/日、約100mg/日、約150mg/日、約200mg/日、約250mg/日、約300mg/日、約350mg/日、約400mg/日、約450mg/日、約500mg/日、約550mg/日、約600mg/日、約650mg/日、約700mg/日、約750mg/日、約800mg/日、約900mg/日、約1000mg/日、約1150mg/日、約1100mg/日、約1200mg/日、約1300mg/日、約1350mg/日、約1400mg/日、約1500mg/日、約1600mg/日、約1650mg/日、約1800mg/日、約1950mg/日、約2000mg/日、約2100mg/日、約2250mg/日、約2400mg/日、約2600mg/日、約2800mg/日、約3000mg/日、約3200mg/日で有り得る。チモサポニンA3、チモサポニンB2又はチモサポニンA3及びB2の混合物のこれらの量は、適当な液体、ゲル又は固形賦形剤、例えば適当な不活性な担体、希釈剤、崩壊剤、流動促進剤、結合剤、香味料、風味マスキング剤、徐放剤と組み合わせて、適当な剤形、例えば液剤、ゲル剤、錠剤、カプレット又はカプセル剤を形成してもよい。
【0075】
治療方法
ハナスゲの抽出物並びに本明細書に記載のようにして単離され、精製されたチモサポニンA3を含有する医薬組成物は、癌細胞、例えば乳癌細胞及び前立腺癌細胞においてアポトーシス活性を有する。また、チモサポニンB2は、ラマリナーゼの活性によりチモサポニンA3に転化するので、哺乳動物患者、例えばヒトの腸内でチモサポニンA3に転化することが予期されるであろう。従って、ハナスゲの抽出物の医薬組成物、並びに単離され、精製されたチモサポニンA3、チモサポニンB2、又はチモサポニンA3とチモサポニンB2の組み合わせの医薬組成物は、異常細胞増殖に特徴がある種々の疾患、例えば生物体、器官、組織又は細胞株において正常なアポトーシスプロセスの不全によって引き起こされる疾患状態の治療において活性を有するであろう。本明細書に記載の組成物を用いて治療できると想定される疾患の中に、癌、例えば以下に限定されないが、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織の肉腫、皮膚癌、骨髄軸腫瘍、胃癌又は子宮癌がある。幾つかの実施形態において、本明細書に記載の組成物は、固形腫瘍、例えば乳癌、肺癌、結腸癌、脳腫瘍、前立腺癌、胃癌、膵臓癌、卵巣癌、皮膚癌(黒色腫)、内分泌系癌、子宮癌、精巣癌及び膀胱癌の中から選択される1種又はそれ以上の癌と診断されている患者に投与される。
【0076】
幾つかの実施形態において、本明細書に記載のハナスゲの抽出物並びに本明細書に記載のようにして単離され、精製されたチモサポニンA3を含有する組成物は、良性の増殖性疾患、例えば良性の前立腺肥大、乾癬又は再狭窄(例えば、移植ステントの再狭窄)を治療するのに有効である。
【0077】
幾つかの実施形態において、本明細書に記載のハナスゲの抽出物並びに本明細書に記載のようにして単離され、精製されたチモサポニンA3を含有する医薬組成物は、異常な細胞増殖、例えば癌、固形腫瘍、良性過剰増殖性疾患などの治療に有用な別の薬剤と組み合わせてもよい。このような追加薬剤は、有糸分裂阻害剤、アルキル化剤、代謝拮抗物質、挿入抗生物質、増殖因子阻害剤、細胞周期阻害剤、酵素、トポイソメラーゼ阻害剤、生物学的反応調節剤、抗体、細胞障害性薬物、抗ホルモン及び抗アンドロゲンの中から選択し得る。
【0078】
ハナスゲの抽出物並びに本明細書に記載のようにして単離され、精製されたチモサポニンA3を含有する医薬組成物の有効量は、本明細書に記載の多細胞生物において治療効果を生じるのに有効な量である。幾つかの実施形態において、前記有効量は、生物において過剰増殖性細胞の1つ又はそれ以上の集団においてアポトーシスを誘導するのに十分な量である。幾つかの実施形態において、前記有効量は、生物体において過剰増殖性細胞疾患、例えば癌の1つ又はそれ以上の症状の軽減を生じるのに十分な量である。幾つかの実施形態において、前記有効量は、過剰増殖細胞疾患の進行を著しく遅らせるか、前記過剰増殖性疾患の部分的又は完全寛解を生じるか、前記過剰増殖細胞疾患の再発、広がり又は悪性増殖に対して部分的又は完全な予防を提供するのに十分な量である。幾つかの実施形態において、前記用量は、治療計画の成功に臨界的であり得る。ハナスゲの抽出物は、極めて無毒性であると思われるので、前記有効量は、以下で詳細に論じるように、乾燥抽出物、あるいはその溶液又はその他の製薬学的に許容し得る形態の均等物の1日当たり患者当たり約1mgから約10gまで変化させ得る。幾つかの実施形態において、前記有効量は、1日当たり患者当たり約1mg〜約10mg、約1mg〜約100mg、約1mg〜約1000mg(1g)、約1mg〜約10000mg(10g)である。幾つかの実施形態において、前記有効量は、1日当たり患者当たり約10mg〜約100mg、約10mg〜約1000mg又は約10mg〜約10000mgである。幾つかの実施形態において、前記有効量は、1日当たり患者当たり約100mg〜約5000、約100mg〜約2500mg、約100mg〜約2000mg、約100mg〜約1500mg、約100〜約1000、約100〜約800mgである。幾つかの実施形態において、治療日数は、非治療日数によって変化させてもよい。例えば、治療は、1日目に前記の有効量を用いて開始し得、3日目、5日目、7日目(又は8日目)、9日目、11日目、13日目などに有効量の投与が反復される。治療は、まる1週間1日に1回投与し、次いで1週間治療を休止し、次いで治療に少なくともさらに1週間投与し得る。ハナスゲの抽出物を用いた治療は、別の抗癌治療と交互に入れ替えてもよいし、又は癌治療の併用効果の利点を得るために別の抗癌治療と組み合わせてもよい。
【0079】
さらなる癌治療としては、以下に限定されないが、固形腫瘍の全部又は一部の外科的切除、放射線治療、補助化学療法、抗炎症薬、鎮痛薬などが挙げられる。
【0080】
疾患、障害、症候群、状態又は症状の治療(及びその文法的変化 − 例えば、治療する、治療するために、治療しつつある、治療されたなど)は、臨床医がこのような治療を受ける被検体を確認し、この被検体に本発明の組成物を投与するという段階を含む。従って、治療は、本発明の選択的アポトーシス植物抽出物を被検体に投与することによって回復され、軽減され、改善され、除去され、治癒される可能性がある疾患、症候群、状態又は症状の診断を含む。治療はまた、疾患、障害、症候群、状態又は症状の同時回復、軽減、改善、除去又は治癒も含む。幾つかの実施形態において、治療とは、疾患、障害、症候群、状態又は症状の発症の防止又は遅延(すなわち、予防)、疾患、障害、症候群、状態又は症状の進行の防止又は遅延、及び/又は疾患、障害、症候群、状態又は症状の重症度の軽減を意味する。特に、新生物増殖の場合には、治療は、新生物増殖の軽減、及び逆転、停止又は遅延を含む。これに関して、治療はまた、寛解、例えば完全寛解及び部分寛解も含む。更年期症状の場合には、治療は、種々の症状の予防及び軽減を含む。
【0081】
疾患、障害、症候群、状態又は症状の予防(及びその文法的変化)は、疾患、障害、症候群、状態又は症状を発症するリスクがある被検者を確認し、その被検体に前記の疾患、障害、症候群、状態又は症状の発症を未然に防ぐ又は遅らせる可能性のある十分な量の本明細書に記載の植物抽出物を投与することを含む。ある場合には、予防は、臨床医が、要求にかなう水準の医療を施し、ホルモン補充療法の必要があると考える閉経後の女性を確認し、その女性に本発明の植物抽出物を投与し、それによって1つ又はそれ以上の更年期症状を阻止するか又は遅らせることを含む。幾つかの実施形態において、骨粗鬆症の予防は、予防は、臨床医が、要求にかなう水準の医療を施し、骨粗鬆症を発症するリスクがあると考える閉経後の女性を確認し、その女性に本発明の植物抽出物を投与し、それによって骨量減少の開始を阻止するか又は遅らせることを含む。
【0082】
軽減は、疾患、障害、症候群、状態又は症状の重症度、発生の回数及び/又は頻度の減少を含む。更年期症状の軽減には、ほてり、不眠症、失禁、うつ病などの頻度及び/又は重症度を減少させることを含む。
ハナスゲの抽出物の投与
【0083】
本発明の医薬組成物の投与は、前記植物抽出物の1つ又はそれ以上がその経路によって組織を標的とするのに利用できる限りは、一般的に使用されている投与経路によるであろう。挙げ得る幾つかの投与経路としては、経口、経鼻、口腔、直腸、膣及び/又は局所(経皮)が挙げられる。あるいは、投与は、同所、皮内、皮下、筋肉内、腹腔内又は静脈内注射であってもよい。このような組成物は、通常は上記に記載された製薬学に許容し得る組成物として投与される。
【実施例】
【0084】
本発明は、以下の例示的及び非限定的な実施例を参照してさらに十分に理解し得る。
【実施例1】
【0085】
実施例1:生体外試験
ハナスゲの植物抽出物は、癌細胞においてアポトーシスを選択的に誘導する。図1において認めることができるように、腫瘍及び非形質転換細胞株並びに細胞を、ハナスゲの乾燥抽出物0.5mg/mLを含有する溶液で処理した。(このハナスゲの乾燥抽出物0.5mg/mLを含有する溶液は、本明細書ではBN108ともいう。)図1は、3種類の乳癌細胞株、3種類の前立腺癌細胞株、3種類の不死化乳腺細胞株及び正常線維芽細胞について処理24時間後のアネキシンVを結合した細胞の割合を表す。BN108処理乳癌及び前立腺癌細胞のアポトーシス率(%)は、20%から80%までの範囲に及び、これに対してBN108処理不死化乳腺細胞のアポトーシス率は、無視し得るほど低く、またBN108処理正常線維芽細胞のアポトーシス率は、10%未満であった。従って、BN108は、癌細胞ではアポトーシスを誘導するが、正常細胞及び非癌性不死化細胞ではアポトーシスを誘導しないことを認めることができる。
【0086】
BN108は、BT474細胞においてカスパーゼ4及びカスパーゼ9(これらは、小胞体ストレスによって誘導されるアポトーシスに関連する)の活性化を誘導する。図2において認めることができるように、BT474細胞を、特定のカスパーゼ4阻害剤の存在下で又は不存在下で、BN108で処理した。カスパーゼ4及びカスパーゼ9の活性を、蛍光アッセイ(Biovision、Inc.)を使用して定量した。これらのアポトーシス関連カスパーゼの両方の発現レベルは、対照の存在下でのこれらのカスパーゼの発現レベルと比べて数倍上昇していた。カスパーゼ4及びカスパーゼ9の両方の発現レベルは、BN108とカスパーゼ4阻害剤の存在下では、対照の発現レベル以下に低下した。明らかに、カスパーゼ4の阻害は、カスパーゼ9活性の阻害を招き、カスパーゼ4の活性化が、BN108によって誘導されるアポトーシスプロセスの頂点であることを示す。
【0087】
BN108による乳癌細胞の処理は、AKTキナーゼ及びmTORキナーゼの活性を阻害する。BN108で誘導された変化の発現アレイ分析により、アップレギュレートされる増殖停止及び/又はアポトーシスにおいて役割を有する数種の転写物が確認された。増殖停止及び/又はアポトーシスにおいて役割を有するアップレギュレートされる遺伝子の中に、p21CIP、ストラチフィン、サイクリンG2、GDF15及びBimがある。コレステロール合成経路において酵素をコードする多数のmRNA。ダウンレギュレートされる遺伝子:増殖因子、VEGF、アンフィレギュリン、miR17−92及びC−myc。対応するタンパク質の発現の変化を、ウェスタンブロッティングにより確認した。また、BN108は、REDD1/DDIT4(そのタンパク質産物は、mTORC1の陰性調節因子である)の発現を誘導する。
【0088】
図3において認めることができるように、BN108は、REDD1(その発現がアポトーシスに関連する遺伝子)を誘導し、乳癌細胞においてmTORC1のシグナル伝達を阻害する。図3Aは、REDD1の発現のウェスタンブロット分析並びに乳癌細胞株BT474でのmTOR標的s6キナーゼ及び4eBPのリン酸化を表す。これらの変化のいずれも、不死化非形質転換乳腺上皮細胞株MCF10Aでは観察されなかった(図には示さない)。図3Bは、BN108はまた、乳癌においてAKTの活性を阻害するが、MCF10A細胞ではAKTの活性を阻害しないことを表す。
【0089】
図4Aに示されように、BN108による処理は、乳癌細胞BT474ではAKTキナーゼを不活性化するが、正常乳腺上皮細胞MCF10AではAKTキナーゼ不活性化しない。図4Bにおいて、SREBP2が、癌細胞(BT474)及び非癌性細胞(MCF10A)の両方においてBN108によって活性化されることを、認めることができる。
【0090】
BN108誘導細胞死は、カスパーゼ活性及びDNA断片化を伴う。BN108は、活性酸素種の生成、DNA損傷又はミトコンドリア機能障害を誘導しない。BN108は、乳癌においてAKTキナーゼ及びmTORキナーゼの急速不活性化を誘導した。特に、BN108によるストレス応答遺伝子REDD1の誘導は、REDD1がTORCの陰性調節因子であることから、mTOR複合体の活性の観察された阻害に関連するであろう。
【実施例2】
【0091】
実施例2:ハナスゲの抽出物からのチモサポニンA3及びチモサポニンB2の単離
チモサポニンA3とチモサポニンB2は、本明細書において上記に一般的に記載されたようにして、ハナスゲの抽出物から単離された。単離されたチモサポニンA3とチモサポニンB2は、本明細書において上記に記載のようにGC質量分析によって特定された。
【実施例3】
【0092】
実施例3:チモサポニンA3及びチモサポニンB2を用いた生体外実験
乳癌細胞及び正常上皮細胞の生存率に対するチモサポニンA3及びB2の効果を、0.5mg/mLのBN108、4μg/mLのチモサポニンA3、50μg/mLのチモサポニンB2、不活性化ラマリナーゼ単独又はラマリナーゼ処理チモサポニンB2(4μg/mL)を用いて細胞を24時間処理することによって試験した。図5において認めることができるように、BN108及びチモサポニンA3(「TspA3」)は、BT474細胞において細胞死を誘導した。これに対してチモサポニンB2(「TspB2」)及びラマリナーゼ単独は、BT474細胞において細胞死を誘導しなかった。また、ラマリナーゼによる4μg/mLのチモサポニンB2の処理は、4μg/mLのチモサポニンA3によって誘導されたBT474細胞における細胞死とほぼ同じ程度の大きさのBT474細胞における細胞死の誘導をもたらした。チモサポニンB2(920Da)及びチモサポニンA3(740Da)の分子量の商(quotient)が、チモサポニンA3とラマリナーゼ処理チモサポニンB2における%死滅細胞の比にほぼ相当することを考慮に入れると、チモサポニンA3とラマリナーゼ処理チモサポニンB2の間の活性の相違は、モル基準で、おそらくは無視できるであろう。従って、ほぼ全部のチモサポニンB2が、ラマリナーゼの存在下でチモサポニンA3に転化し、アポトーシスを誘導するのに活性であると推測できる。ラマリナーゼによるチモサポニンB2のチモサポニンA3への転化は、図15において認めることができるように、飛行時間型質量分析(TOF MS)によって確認された。図15において認めることができるように、チモサポニンB2の消失及びチモサポニンA3の出現は、不活性化ラマリナーゼとチモサポニンB2の存在下での細胞死16%から、活性化ラマリナーゼとチモサポニンB2の存在下での細胞死53%まで細胞死の上昇をもたらした。
【0093】
BN108とチモサポニンA3の両方が、前立腺癌細胞においてアポトーシス促進性遺伝子REDD1を誘導する。図6において認めることができるように、アポトーシス促進性遺伝子REDD1は、Dul45前立腺癌細胞において、BN108(ハナスゲの乾燥抽出物0.5mg/mL)及びチモサポニンA3(7.5μM)で処理することによって誘導される。図7において認めることができるように、チモサポニンA3(5μM)及びBN108(0.5mg/mL)は、elF2aのリン酸化を増加させ、SREBP2の発現を増大させ且つIDI1の発現を増大させる。
【0094】
BN108とチモサポニンA3は、癌細胞及び正常細胞においてコレステロール(CHL)合成に対して同様の効果を有する。図8において認めることができるように、チモサポニンA3とBN108は、癌性(MM23)乳房細胞においてコレステロール合成をわずかに高め且つ正常(MCF10A)乳房細胞において処理後少なくとも最初の8時間の間、コレステロール合成を抑制する傾向があった。
【0095】
BN108とチモサポニンA3の細胞障害作用は、コレステロール(CHL)とカスパーゼ4阻害剤LEVDとによって弱められる。図9において認めることができるように、未処理(UT)BT474細胞は、対照溶液による処理後24時間で90%を越える生存能力があったが、チモサポニンA3又はBN108で処理された細胞は、40%が24時間生存しただけであった(ヨウ化プロピジウムに対する死滅細胞の透過性についてのFACScan及びアネキシンVの結合に基づいて)。250mMのコレステロールによるBT474細胞の処理は、チモサポニンA3とBN108の影響から細胞を保護し、細胞の約80%がコレステロール(CHL)の存在下で24時間生存する。同様の効果が、カスパーゼ4阻害剤LEVDの存在下で認められた。図9において認めることができるように、LEVDによる処理は、チモサポニンA3とBN108の効果の減衰をもたらし、LEVDとチモサポニンA3又はBN108とで処理したBT474細胞の55〜60%が、処理後24時間生存する。この実験の結果を、以下の表に要約する。
【表1】

【0096】
本発明の好ましい実施形態を本明細書で示し、説明したが、このような実施形態が単なる例として提供されることは、当業者には明らかであろう。当業者は、本発明から逸脱することなく、多数の改変、変化及び置換を思い付くであろう。本発明の実施において本明細書に記載される本発明の実施形態の種々の代替を使用し得ることが、理解されるべきである。以下の特許請求の範囲が本発明の範囲を定義すること及びそれによってこれらの特許請求の範囲内の方法及び構造並びにこれらの均等物が保護されることが意図される。
【技術分野】
【0001】
本発明は、植物抽出物組成物に関し、さらに詳しくはハナスゲ種Anemarrhena asphodeloides Bungeに属する植物種の抽出物を含有する組成物に関する。また、本発明は、このような植物抽出物組成物を使用する方法及び調製する方法に関する。
【0002】
(相互参照及び優先権主張)
本出願は、米国特許法35U.S.C.§119(3)の下で2008年9月3日付け出願の米国特許仮出願第61/094,005号及び2008年4月11日付け出願の米国特許仮出願第61/044,403号の優先権を主張する。これらの米国特許仮出願は、その全体を参照することにより本明細書において援用される。
【背景技術】
【0003】
癌細胞の特徴は、制御されていない増殖にある。確認されている制御されない増殖の原因の中で、見たところ重要な1つは、プログラムされた細胞死(アポトーシスとしても知られている)のプロセスに対する抵抗性である。アポトーシスは、多細胞生物が、制御されない細胞増殖を阻止するために及び病気になっている細胞、極めて有害になっている細胞又は必要がなくなっている細胞を除くために用いるプロセスである。アポトーシスのプロセスは、タンパク分解酵素及びDNAエンドヌクレアーゼの共同作用によって細胞が内部から分解され、アポトーシス小体の形成をもたらし、次いでこれがスカベンジャー細胞によって取り除かれるという多段階カスケードを含む。現在までの研究により、細胞内分解の多くは、アスパラギン酸残基に隣接して開裂するタンパク分解酵素のファミリーであるカスパーゼの作用によって行われることが明らかにされている。
【0004】
乳癌治療の最近の進歩にもかかわらず、現行の治療計画は、多くの場合、有害な(時には治療を制限する)副作用をもたらす。また、現行の治療は、転移性乳癌に対してはほとんど効果がない。早期スクリーニング及び治療は、多くの患者について予後を向上させることができるが、このようなスクリーニングは、一様ではなく、幾つかの癌は、日常的なスクリーニングでは初期の段階で検出できないほど早く増殖する。毒性が低いか、後期癌に対して活性であるか又はその両方である治療選択肢に対する要求が依然としてある。
【0005】
ハナスゲの種々の栽培品種が、中国の湖南省、湖北省、福建省、江蘇省、浙江省及び江西省で栽培されている。種子の乾燥未熟(green)胚が秋に採取される。これは、きれいに洗浄され、乾燥される。
【0006】
ハナスゲの抽出物を、多細胞生物、例えば哺乳動物、特にヒトの癌の選択的アポトーシス治療のために使用するという報告は、知られていない。
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明者は、ハナスゲの抽出物を含有する組成物がアポトーシス作用を有することを確認した。特に、ハナスゲの抽出物を含有する組成物は、癌細胞においてアポトーシスを選択的に誘導するが、非癌細胞は、前記抽出物の細胞障害作用に耐性を示す。従って、本明細書に記載の抽出物、すなわちハナスゲの抽出物、及びこのような抽出物を含有する組成物は、細胞の過剰増殖に特徴がある疾患状態、例えば癌及び良性の過形成性疾患、例えばBPH及び再狭窄を治療するのに有用な選択的アポトーシス剤である。
【課題を解決するための手段】
【0008】
従って、本明細書に記載の実施形態は、多細胞生物においてアポトーシスを選択的に誘導する方法であって、前記生物に、分類学上のハナスゲ種から選択される植物種の抽出物であって少なくとも1つの過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量の抽出物を含有する医薬組成物を投与することからなる、方法を提供する。幾つかの実施形態において、前記生物は、哺乳動物生物、例えばラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、過剰増殖細胞集団は、癌である。幾つかの実施形態において、癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌、子宮癌である。幾つかの実施形態において、過剰増殖細胞集団は、固形腫瘍である。幾つかの実施形態において、固形腫瘍は、乳癌、子宮癌、子宮頸癌、膣癌又は前立腺癌である。幾つかの実施形態において、過剰増殖細胞集団は、良性の過剰増殖性疾患である。幾つかの実施形態において、良性の過剰増殖性疾患は、良性の前立腺肥大、乾癬又は再狭窄である。幾つかの実施形態において、過剰増殖細胞集団は、転移性癌である。幾つかの実施形態において、転移性癌は、転移性乳癌である。
【0009】
本明細書の幾つかの実施形態は、多細胞生物の少なくとも1つの過剰増殖細胞集団においてアポトーシスを選択的に誘導することができる医薬を調製するのに有効な量の分類学上のハナスゲ種から選択される植物種の抽出物を含有する組成物の使用を提供する。幾つかの実施形態において、前記生物は、哺乳動物生物、例えばラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、過剰増殖細胞集団は、癌である。幾つかの実施形態において、癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌、子宮癌である。幾つかの実施形態において、過剰増殖細胞集団は、固形腫瘍である。幾つかの実施形態において、固形腫瘍は、乳癌、子宮癌、子宮頸癌、膣癌又は前立腺癌である。幾つかの実施形態において、過剰増殖細胞集団は、良性の過剰増殖性疾患である。幾つかの実施形態において、良性の過剰増殖性疾患は、良性の前立腺肥大、乾癬又は再狭窄である。幾つかの実施形態において、過剰増殖細胞集団は、転移性癌である。幾つかの実施形態において、転移性癌は、転移性乳癌である。
【0010】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記生物に、前記癌を治療するのに有効な量の分類学上のハナスゲ種から選択される植物種の抽出物を含有する医薬組成物を投与することからなる、方法を提供する。幾つかの実施形態において、前記生物は、哺乳動物生物、例えばラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌、子宮癌である。幾つかの実施形態において、癌は、固形腫瘍である。幾つかの実施形態において、固形腫瘍は、乳癌、子宮癌、子宮頸癌、膣癌又は前立腺癌である。幾つかの実施形態において、癌は、転移性癌である。幾つかの実施形態において、転移性癌は、転移性乳癌である。
【0011】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する医薬を調製するための、有効な量の分類学上のハナスゲ種から選択される植物種の抽出物を含有する組成物の使用を提供する。幾つかの実施形態において、前記生物は、哺乳動物生物、例えばラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌、子宮癌である。幾つかの実施形態において、癌は、固形腫瘍である。幾つかの実施形態において、固形腫瘍は、乳癌、子宮癌、子宮頸癌、膣癌又は前立腺癌である。幾つかの実施形態において、癌は、転移性癌である。幾つかの実施形態において、転移性癌は、転移性乳癌である。
【0012】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2とを含有する、組成物を提供する。
【0013】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3を含有する、組成物を提供する。
【0014】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2を含有する、組成物を提供する。
【0015】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンA3とチモサポニンB2とを含有する有効量の医薬組成物を投与することからなる、方法を提供する。
【0016】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンA3を含有する有効量の医薬組成物を投与することからなる、方法を提供する。
【0017】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンB2を含有する有効量の医薬組成物を投与することからなる、方法を提供する。
【0018】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する医薬を製造するための、チモサポニンA3、チモサポニンB2、又はチモサポニンA3とチモサポニンB2の両方を含有する組成物の使用を提供する。
【0019】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、チモサポニンA3とチモサポニンB2とを含有する有効量の医薬組成物を投与することからなる、方法を提供する。
【0020】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、チモサポニンA3を含有する有効量の医薬組成物を投与することからなる、方法を提供する。
【0021】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する法であって、前記多細胞生物に、チモサポニンB2を含有する有効量の医薬組成物を投与することからなる、方法を提供する。
【0022】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する医薬を製造するための、チモサポニンA3、チモサポニンB2、又はチモサポニンA3とチモサポニンB2の両方を含有する組成物の使用を提供する。
【0023】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物を含有する、組成物を提供する。
【0024】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記多細胞生物に、ハナスゲの抽出物を含有する有効量の医薬組成物を投与することからなる、方法を提供する。
【0025】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する医薬を製造するための、ハナスゲの抽出物を含有する組成物の使用を提供する。
【0026】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、ハナスゲの抽出物を含有する有効量の医薬組成物を投与することからなる、方法を提供する。
【0027】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する医薬を製造するための、ハナスゲの抽出物を含有する組成物の使用を提供する。
【0028】
本明細書に述べた全ての刊行物及び特許出願は、あたかもそれぞれ個々の刊行物又は特許出願が参照することにより援用されることが具体的に及び個々に示されているかのように同じ程度に参照することより本明細書において援用される。
【図面の簡単な説明】
【0029】
本発明の新規な特徴を、特に添付の特許請求の範囲に記載する。本発明の特徴及び利点のより良い理解は、本発明の原理が利用される例示的実施形態を示す以下の詳細な説明、及び以下の添付図面を参照することにより得られるであろう。
【0030】
【図1】BN108による細胞死の誘導を表す。腫瘍及び非形質転換細胞株並びに細胞を、0.5mg/mlのBN108で24時間処理した。グラフは、アネキシンVを結合した細胞の割合を示す。
【図2】カスパーゼ4は、BN108処理細胞において活性化される。BT474細胞を、特定のカスパーゼ4阻害剤の存在下で又は不存在下で、BN108で処理した。カスパーゼ4及び9の活性を、蛍光アッセイ(Fluorimetric.tm. assays)(Biovision Inc.)を使用して定量した。明らかに、カスパーゼ4の阻害は、カスパーゼ4の活性化がアポトーシスプロセスの頂点にあることを示すカスパーゼ9活性の阻害をもたらす。
【図3A−3B】図3Aは、BN108が、REDD1を誘導し且つ乳癌細胞においてmTORC1シグナル伝達を阻害することを表す。REDD1の発現のウェスタンブロット分析及び乳癌細胞株BT474におけるmTOR標的s6キナーゼ及び4eBPのリン酸化。これらの変化のいずれも、不死化非形質転換乳腺上皮細胞株MCF10Aでは観察されなかった(図には示さない)。図3Bは、BN108が、乳癌細胞ではAKTの活性を阻害するが、MCF10A細胞では阻害しないことを表す。
【図4A−4B】図4Aは、BN108による処理が、乳癌細胞BT474ではAKTキナーゼを不活性化するが、正常乳腺上皮細胞MCF10Aでは不活性化しないことを表す。図4Bは、SREBP2が、上記両方の細胞株においてBN108によって活性化されることを表す。活性化AKTは、活性キナーゼにおいてのみリン酸化されるホスホセリン473(phospho−AKT)に対する抗体を使用して検出された。SREBPに対する抗体は、120kDの不活性前駆物質及び60kDの開裂した活性核の両方を検出する。
【図5】乳癌細胞(BT474)及び正常上皮細胞(MCF10A)の生存率に対するチモサポニンA3及びB2の効果を表す。細胞は、0.5mg/mlのBN108、4μg/mlのチモサポニンA3又は50μg/mlのチモサポニンB2、4μg/mlの不活性化ラマリナーゼ(lamarinase)単独又はラマリナーゼ処理B2で24時間処理した。
【図6】アポトーシス促進性遺伝子REDD1が、前立腺癌細胞株Dul45においてBN108(0.5mg/ml)及びチモサポニンA3(7.5μM)で処理することによって誘導されることを表す。
【図7】精製チモサポニンA3及びBN108抽出物が、elF2aのリン酸化及びSREBP2の活性化並びにSREBP2標的遺伝子IDI1上での発現に対して、同様の効果を有することを表す。BT474細胞は、TspA3(5μM)又はBN108(0.5mg/ml)で処理した。
【図8】精製チモサポニンA3及びBN108抽出物が、乳癌細胞MM23及び正常MCF10A細胞でのコレステロール合成に対して同様の効果を有することを表す。細胞を、図に示した時間でBN108又はTspA3で処理し、細胞抽出物をコレステロール含有量について分析し、これをタンパク質含有量に対して標準化した。
【図9】チモサポニンA3及びBN108抽出物の細胞障害効果が、コレステロール(CHL、250mM)によって強く阻害され、カスパーゼ4阻害剤(LEVD)によって部分的に阻害されることを表す。BT474細胞を24時間処理し、生存細胞の割合を、ヨウ化プロピジウム及びアネキシンVの結合について死滅細胞の透過性に基づいてFACScanで分析した。
【図10】様々な乳房細胞、前立腺細胞、不死化乳腺細胞及び正常線維芽細胞におけるBN108細胞障害作用を表す。BN108は、癌細胞ではアポトーシスを生じたが、非癌性不死化乳腺細胞及び正常線維芽細胞では比較的わずかなアポトーシスしか観察されなかった。
【図11】BN108で処理した前立腺及び乳癌細胞におけるカスパーゼ4の阻害が、これらを細胞死から部分的に保護することを表す。
【図12】H460及びA549細胞株でのBN108のCyQuant細胞増殖アッセイを表す。
【図13】HCT116、SW480及びDLD1細胞株でのBN108のCyQuant細胞増殖アッセイを表す。
【図14】Dul45、LNCaP及びPC3細胞株でのBN108のCyQuant細胞増殖アッセイを表す。
【図15】ラマリナーゼによるチモサポニンB2のチモサポニンA3への転化が、飛行時間型質量分析(TOF MS)で確認されたことを表す。チモサポニンB2の消失及びチモサポニンA3の出現は、不活性化ラマリナーゼ及びチモサポニンB2の存在下での16%から活性化ラマリナーゼ及びチモサポニンB2の存在下では53%までの細胞死の上昇をもたらす。
【発明を実施するための形態】
【0031】
本明細書において、特にハナスゲと呼ばれる植物の分類学上の種の抽出物を含有する医薬組成物が開示される。本明細書に開示される別の実施形態は、本明細書に記載の組成物を使用する選択的アポトーシス方法を提供する。本明細書に記載の選択的アポトーシス組成物は、異常分裂細胞、例えば癌細胞でアポトーシスを誘導し、同時に正常細胞の正常な細胞プロセスを妨害しない活性を有する。理論によって制限されることを望まないが、開示された医薬組成物の有効成分は、カスパーゼ経路によって作用して、アポトーシスのプロセスにより自己調節能を失っている細胞においてアポトーシスを誘導すると考えられる。このような有効成分(これらは、ハナスゲ、特にその果実から抽出される)は、癌細胞においてAKT及びmTORキナーゼの活性を阻害し、それによって癌性細胞においてアポトーシスを誘導するか又は修復する活性を示唆する。
【0032】
ハナスゲの水性抽出物(水溶液1mL当たり乾燥固形抽出物0.5mg)による乳癌細胞の処理は、癌細胞株の多数において顕著な細胞死を誘導する。正常な乳房上皮細胞及び線維芽細胞は、ハナスゲ抽出物の細胞障害作用に耐性がある。ハナスゲ抽出物に感受性であった乳癌細胞は、アポトーシス細胞死を起こす(DNA断片化、カスパーゼ活性化、PARPの切断及びアネキシンV染色によって確認される)。カスパーゼ3の他に、カスパーゼ4及び9(これらは、小胞体ストレスによって誘導されるアポトーシスに関連している)の活性化もまた、ハナスゲの水性抽出物0.5mg/mLによって誘導されることが観察された。この溶液は、乳癌においてAKT及びmTORキナーゼの急速な不活性化を誘導するが、非形質転換細胞では誘導しなかった。周知のアポトーシス促進特性及び抗増殖特性を有する幾つかの遺伝子の発現もまた、ハナスゲの水性抽出物によって誘導された。従って、本発明の態様は、多細胞生物、例えば哺乳動物、特にヒトの治療用のハナスゲの抽出物の選択的アポトーシス促進作用を利用することにある。
【0033】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2とを含有する、組成物を提供する。幾つかの実施形態において、前記組成物は、チモサポニンA3とチモサポニンB2とのみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、総合重量で、約50〜1,000mgのチモサポニンA3とチモサポニンB2、好ましくは約100〜800mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンA3とチモサポニンB2を含有する。幾つかの実施形態において、前記組合せは、総合重量で、約1〜100mgのチモサポニンA3とチモサポニンB2、好ましくは約1〜50mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンA3とチモサポニンB2を含有する。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物はヒトである。幾つかの実施形態において、前記の癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0034】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3を含有する、組成物を提供する。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物はヒトである。幾つかの実施形態において、前記の癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0035】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2を含有する、組成物を提供する。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物はヒトである。幾つかの実施形態において、前記の癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0036】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンA3とチモサポニンB2とを含有する有効量の医薬組成物を投与することからなる、多細胞生物の癌を治療方法を提供する。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2とのみから本質的になる。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物はヒトである。幾つかの実施形態において、前記の癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0037】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンA3を含有する有効量の医薬組成物を投与することからなる、方法を提供する。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3のみから本質的になる。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物はヒトである。幾つかの実施形態において、前記の癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0038】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンB2を含有する有効量の医薬組成物を投与することからなる、方法を提供する。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2のみから本質的になる。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物はヒトである。幾つかの実施形態において、前記の癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0039】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する医薬を製造するための、チモサポニンA3、チモサポニンB2、又はチモサポニンA3とチモサポニンB2の両方を含有する組成物の使用を提供する。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2の両方のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、総合重量で、約50〜1,000mgのチモサポニンA3とチモサポニンB2、好ましくは約100〜800mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンA3とチモサポニンB2を含有する。幾つかの実施形態において、前記組成物は、総合重量で、約1〜100mgのチモサポニンA3とチモサポニンB2、好ましくは約1〜50mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンA3とチモサポニンB2を含有する。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、約50〜1,000mgのチモサポニンA3、好ましくは約100〜800mgのチモサポニンA3、さらに好ましくは約200〜600mgのチモサポニンA3を含有する。幾つかの実施形態において、前記組成物は、約1〜100mgのチモサポニンA3、好ましくは約1〜50mgのチモサポニンA3、さらに好ましくは約1〜20mgのチモサポニンA3を含有する。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、約50〜1,000mgのチモサポニンB2、好ましくは約100〜800mgのチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンB2を含有する。幾つかの実施形態において、前記組成物は、約1〜100mgのチモサポニンB2、好ましくは約1〜50mgのチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンB2を含有する。幾つかの実施形態において、前記医薬組成物は経口製剤である。幾つかの実施形態において、前記多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、前記多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0040】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、チモサポニンA3とチモサポニンB2とを含有する有効量の医薬組成物を投与することからなる、提供する。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2とのみから本質的になる。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は経口製剤である。幾つかの実施形態において、前記多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、前記多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0041】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、チモサポニンA3を含有する有効量の医薬組成物を投与することからなる、方法を提供する。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3のみから本質的になる。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、前記多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0042】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、チモサポニンB2を含有する有効量の医薬組成物を投与することからなる、方法を提供する。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンB2のみから本質的になる。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、前記多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0043】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する医薬を製造するための、チモサポニンA3、チモサポニンB2、又はチモサポニンA3とチモサポニンB2の両方を含有する組成物の使用を提供する。幾つかの実施形態において、前記組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2の両方のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、総合重量で、約50〜1,000mgのチモサポニンA3とチモサポニンB2、好ましくは約100〜800mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンA3とチモサポニンB2を含有する。幾つかの実施形態において、前記組成物は、総合重量で、約1〜100mgのチモサポニンA3とチモサポニンB2、好ましくは約1〜50mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンA3とチモサポニンB2を含有する。幾つかの実施形態において、前記組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、約50〜1,000mgのチモサポニンA3、好ましくは約100〜800mgのチモサポニンA3、さらに好ましくは約200〜600mgのチモサポニンA3を含有する。幾つかの実施形態において、前記組成物は、約1〜100mgのチモサポニンA3、好ましくは約1〜50mgのチモサポニンA3、さらに好ましくは約1〜20mgのチモサポニンA3を含有する。幾つかの実施形態において、前記組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンB2のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、約50〜1,000mgのチモサポニンB2、好ましくは約100〜800mgのチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンB2を含有する。幾つかの実施形態において、前記組成物は、約1〜100mgのチモサポニンB2、好ましくは約1〜50mgのチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンB2を含有する。幾つかの実施形態において、前記医薬組成物は、経口製剤である。幾つかの実施形態において、前記多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、前記多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0044】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物を投与することからなる、組成物を提供する。幾つかの実施形態において、前記組成物は、ハナスゲの抽出物のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は経口製剤である。幾つかの実施形態において、前記多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、前記多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0045】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する方法であって、前記多細胞生物に、ハナスゲの抽出物を含有する有効量の医薬組成物を投与することからなる、方法を提供する。幾つかの実施形態において、医薬組成物は、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物のみから本質的になる。幾つかの実施形態において、医薬組成物は、多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、医薬組成物は、有効量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物は、ヒトである。幾つかの実施形態において、前記の癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物は、ヒトである。幾つかの実施形態において、前記の癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0046】
本明細書に記載の幾つかの実施形態は、多細胞生物の癌を治療する医薬を製造するための、ハナスゲの抽出物を含有する組成物の使用を提供する。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物のみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、総合重量で、約50〜50,000mgのハナスゲの抽出物、好ましくは約1000〜40,000mgのハナスゲの抽出物、さらに好ましくは約2000〜35,000mgのハナスゲの抽出物を含有する。幾つかの実施形態において、前記組成物は、総合重量で、約100〜1000mgのハナスゲの抽出物、好ましくは約100〜500mgのハナスゲの抽出物、さらに好ましくは約10〜200mgのハナスゲの抽出物を含有する。幾つかの実施形態において、前記医薬組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0047】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、ハナスゲの抽出物を含有する有効量の医薬組成物を投与することからなる、方法を提供する。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のハナスゲの抽出物のみから本質的になる。幾つかの実施形態において、前記医薬組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、経口製剤である。幾つかの実施形態において、多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0048】
本明細書に記載の幾つかの実施形態は、多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する医薬を製造するための、ハナスゲの抽出物を含有する組成物の使用を提供する。幾つかの実施形態において、前記組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のハナスゲのみから本質的になる。幾つかの実施形態において、前記組成物は、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる。幾つかの実施形態において、前記組成物は、総合重量で、約50〜50,000mgのハナスゲの抽出物、好ましくは約1000〜40,000mgのハナスゲの抽出物、さらに好ましくは約2000〜35,000mgのハナスゲの抽出物を含有する。幾つかの実施形態において、前記組成物は、総合重量で、約100〜1000mgのハナスゲの抽出物、好ましくは約100〜500mgのハナスゲの抽出物、さらに好ましくは約10〜200mgのハナスゲの抽出物を含有する。幾つかの実施形態において、前記医薬組成物は、経口製剤である。幾つかの実施形態において、前記多細胞生物は、ラット、マウス、ヒト、サル又はイヌである。幾つかの実施形態において、前記多細胞生物は、ヒトである。幾つかの実施形態において、前記癌は、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される。
【0049】
本明細書で使用される「含有すること(comprising)」又は「含有する(comprise(s))」という用語及びその文法上の変化は、さらなる列挙されていない要素又は方法工程を、含むか又は制約がなく且つ除外しない。「含む(include(s))」、[含有する(contain(s)/containing)」及びこれらの文法上の変化は、同様に含む。
【0050】
本明細書で使用される「のみからなる」という語句は、文章の以下の部分に特定されていない任意の要素、工程又は成分を除外する。
【0051】
本明細書で使用される「のみから本質的になる」という語句は、文章の以下の部分の範囲を、特定された物質又は工程並びに特許請求された発明の基本的及び新規な特徴に実質的に影響を及ぼさない物質又は工程に限定する。
【0052】
ハナスゲの抽出物
幾つかの実施形態において、前記植物種は、植物種ハナスゲであり、ハナスゲの種々の栽培品種である。
【0053】
植物物質とは、ハナスゲ種由来の少なくとも1つの植物の任意の1つ又は複数の部分を意味する。植物物質とは、植物全体、あるいは該植物の任意の1つ又は複数の部分、例えば根、樹皮、木質、葉、花(又は花、例えば萼片、花弁、雄ずい、雌ずいなど)、果実、種子及び/又は前記のいずれかの部分又は混合物を包含する。植物物質は、切断直後、乾燥物(凍結乾燥物を含む)、凍結物などであってもよい。植物物質は、その全体であってもよいし又はより小さい部分に分けられていてもよい。例えば、葉は、細断、寸断又は粉砕されていてもよく、根は、細断又は粉砕されていてもよく、果実は、細断されていてもよいし、薄切りされていてもよいし又は混合されてもよく、種子は、細断又は粉砕されていてもよく、茎は、寸断、細断又は粉砕されていてもよい。本発明の具体的な実施形態においては、使用される植物部分は、ハナスゲの地下茎である。
【0054】
本発明の植物抽出物組成物は、ハナスゲの少なくとも1つの抽出物を含有する。「抽出物」とは、植物部分を、抽出溶媒と、植物由来の1種又はそれ以上の化合物に適した条件下で接触させて植物物質から抽出溶媒に分配する際に得られる溶液、濃縮液又は残留物である。前記溶液は、次いで、場合により濃縮されて濃縮物又は残留物を形成する。
【0055】
本発明に適した抽出媒体としては、水及びエチルアルコールが挙げられる。具体的には、水が抽出溶媒である場合には、精製水が適している。精製水としては、蒸留水、脱イオン水、注射用水、限外濾過水、及び精製された他の形態の水が挙げられる。本発明の幾つかの実施形態において用いられるエチルアルコールは、穀粒エタノール、特に未変性エタノール(例えば、場合により若干の水、例えば最大約10%までの水を含有していてもよい純穀粒エタノール)である。幾つかの実施形態において、抽出溶媒は、水、エタノール又はこれらの混合物である。濃縮物又は残留物は、抽出液を濃縮する(例えば、蒸発させるか又は凍結乾燥する)ことによって調製してもよい。最初の抽出溶媒、濃縮物又は残留物の形態にかかわらず、これらの調製物のそれぞれは、本発明の目的の「抽出物」とみなされる。
【0056】
本発明の植物抽出物の製造方法は、場合により、植物物質を、その表面積と容積との比を増大させ且つ抽出プロセスの効率を同時に高めるために最初に粉砕することからなる。植物物質を粉砕する方法は、粉砕、細断、混合、寸断、微粉砕、磨砕などを含む。
【0057】
次いで、抽出媒体(溶媒)は、植物物質と、1種又はそれ以上の植物化学物質、特に選択的アポトーシス植物化学物質を生じさせるのに適した条件下で接触させ、植物物質から抽出溶媒に分配させる。このような条件としては、幾つかの場合には、室温を超える温度までの抽出媒体の加熱、撹拌、接触時間などが挙げられる。典型的な抽出温度は、約50℃から抽出溶媒の沸点までである。水が抽出溶媒である場合は、抽出温度は、一般的に室温から約100℃までであり、約50℃から約80℃までの温度が特に適しており、約75℃の温度が特に適している。抽出溶媒としてエタノールの場合には、抽出温度は、一般的に室温から約78.5℃までであり、約50℃から約78℃までの温度が特に適しており、約75℃の温度が特に適している。当業者には、一方の抽出効率と、他方の植物化学物質の安定性との間で適切な均衡が設けられるべきであることが認識されるであろう。
【0058】
抽出媒体と植物物質が組み合わされると、これらは、場合により、植物物質から抽出媒体への選択的アポトーシス化合物の効率的な交換を確実にするために撹拌され、植物物質から抽出媒体への有用な量の植物化学物質を抽出するのに十分な時間を接触させておく。このような時間(例えば、約5分〜約10時間、さらに詳しくは約10分〜約5時間、特に約30分〜約2時間)が経過した後に、植物化学物質を含有する抽出媒体は、植物物質から分離される。このような分離は、当該技術で認識されている方法で、例えば濾過、デカントなどによって達成される。
【0059】
本発明の組成物としては、本明細書に記載の植物抽出物又は本明細書に記載の植物抽出物を含有する組成物が挙げられる。このような実施形態において、本明細書に記載の組成物は、場合により1種又はそれ以上の追加成分を含有していていもよい。このような追加成分は、不活性であってもよいし又は活性であってもよい。不活性成分としては、溶媒、賦形剤又は他の担体が挙げられる。活性成分としては、活性医薬成分(API)、例えば本明細書に記載の植物抽出物と組み合わせて相乗活性を示す活性医薬成分が挙げられる。
【0060】
本明細書に開示の幾つかの実施形態は、分類学上のハナスゲ種Anemarrhena asphodeloides Bungの抽出物を含有する医薬組成物を提供する。「抽出物」とは、植物物質から1種又はそれ以上の化合物を抽出媒体に取り出すのに適した条件下で、抽出媒体(溶媒)と植物物質とを接触させ、抽出溶液を形成することによって部分的に調製される物質の組成物である。次いで、抽出溶液は、植物物質から分離され、場合によっては希釈又は濃縮され(例えば、蒸発、昇華又は凍結乾燥によって)、抽出物を形成する。
【0061】
ユリ科のハナスゲ種ナスゲAnemarrhena asphodeloides Bungはまた、ハナスゲZhi Muとも様々に呼ばれ、0.5m〜1mに育つ常緑多年生植物である。これは、8月から9月まで開花している。花は、両性花である(雄性器官と雌性器官の両方をもつ)。この植物は、軽質土壌(砂質)、中質土壌(ローム質)及び重質土壌(粘土)を好み、これらの土壌は、pHで酸性〜中性であり、湿っている。この植物は、強風に耐えられるが、海洋曝露には耐えられない。
【0062】
抽出媒体は、適当な液状溶媒、例えば酢酸エチル、水、メタノール、エタノール又はこれらの2つ又はそれ以上の混合物である。抽出媒体は、ある場合には酢酸エチル、水、エタノール、メタノール又は別の比較的極性の液状溶媒である。ある場合には、抽出媒体は、アルコール水溶液、例えばエタノール又はメタノール水溶液である。幾つかの実施形態において、抽出媒体は、メタノール水溶液である。ある場合には、抽出媒体は、希釈又は濃縮される。抽出媒体は、完全に濃縮されていてもよく、それによって抽出物は残留物(残留抽出物)の形態をとる。従って、抽出物は、場合により溶媒に溶解されていてもよい少なくとも1種又はそれ以上の植物由来の化合物(植物化学物質)であって、これらは、抽出媒体と植物又は植物部分を接触させる1つ又はそれ以上の工程によって抽出媒体中に取り出される化合物を含有する。濃縮抽出物又は残留抽出物は、再構成抽出物を形成するために、適当な希釈剤、例えば酢酸エチル、水及び/又はエタノールを加えることによって再構成されていてもよい。
【0063】
幾つかの実施形態において、植物抽出物を含有する組成物は、純粋な抽出物又は分配抽出物(抽出物中の1種又はそれ以上の選択的アポトーシス活性化合物に富む抽出物を含む)及びこのような抽出物と1種又はそれ以上の追加成分の組み合わせを含む。幾つかの実施形態において、前記組成物は、固体、半固体、液体、コロイドなどを含め種々の物理的形状の組成物を含む。組成物が医薬用途を目的とする場合には、追加成分は、製薬学的に許容できる。本発明の組成物が生体に関するものではないアッセイ又はその他の用途を目的とする場合には、添加成分(1つ又は複数)は製薬学的に許容できるものであってもよいし又は許容できないものであってもよい。
【0064】
幾つかの実施形態において、純粋な抽出物は、1種又はそれ以上の有機溶媒と組み合わせてもよい。このような有機溶媒は、種々の極性をもつものであってもよい。幾つかの実施形態において、適当な溶媒は、酢酸エチル、アセトニトリル、ヘキサン類、(C1−C4)アルコール(例えば、メタノール、エタノール、i−プロパノール、n−プロパノール、n−ブタノール、t−ブタノール、s−ブタノール、i−ブタノールなど)、クロロホルム、アセトン、シクロヘキサン、シクロヘプタン、石油エーテル、並びにその他の溶媒、例えば製薬学的に許容し得る溶媒及びヒトに使用するのに安全であると一般的にみなされている(GRAS)溶媒を包含する。
【0065】
幾つかの実施形態において、前記組成物は、純粋な抽出物を含有するか、あるいは抽出物と1種又はそれ以上の追加溶媒との組み合わせを含有する。幾つかの実施形態において、抽出物は、分配されるか又はさらに精製された抽出物を包含する。分配又は精製は、クロマトグラフィーを含め種々の分離法を使用して行ってもよい。幾つかの実施形態において、抽出物は、抽出物中の活性薬剤をさらに濃縮するために、陰イオン交換クロマトグラフィー、陽イオン交換クロマトグラフィー、逆相クロマトグラフィー、順相クロマトグラフィー、アフィニティークロマトグラフィー又は排除クロマトグラフィーによって得られる精製又は分配抽出物である。幾つかの実施形態において、精製又は分配抽出物は、液体クロマトグラフィー、例えば高速液体クロマトグラフィー(HPLC)の1つ又はそれ以上の工程によって得られる。幾つかの実施形態において、高速液体クロマトグラフィーは、分取規模の高速液体クロマトグラフィーである。幾つかの実施形態において、HPLCは、逆相クロマトグラフィー又はイオン交換クロマトグラフィーである。その他の分離の手段、例えば分液ロートあるいはその他の二相又は多相分離メカニズムでの分離を、抽出物を精製又は分配するのに使用してもよい。幾つかの実施形態において、精製又は分配抽出物は、1種又はそれ以上の追加の活性又は不活性成分、例えば溶媒、希釈剤などと組み合わせてもよい。幾つかの実施形態において、適当な溶媒は、酢酸エチル、アセトニトリル、ヘキサン類、(C1−C4)アルコール(例えば、メタノール、エタノール、i−プロパノール、n−プロパノール、n−ブタノール、t−ブタノール、s−ブタノール、i−ブタノールなど)、クロロホルム、アセトン、シクロヘキサン、シクロヘプタン、石油エーテル、並びにその他の溶媒、例えば製薬学的に許容し得る溶媒及びヒトに使用するのに安全であると一般的にみなされている(GRAS)溶媒を包含し得る。
【0066】
適当な追加成分としては、溶媒が挙げられる。溶媒は、製薬学的に許容し得る溶媒及び非製薬学的に許容し得る溶媒に細分化し得る。これに関連して、幾つかの製薬学的に許容し得る溶媒として注射用水(WFI)が挙げられ、これは予め選択されたpH又はpH範囲、例えば約2〜約8、さらに具体的には約4.0〜約7.5、さらに詳しくは約4.9〜約7.2にpH調整されていてもよい及び/又は緩衝されていてもよいことが理解されるべきであり。
【0067】
製薬学的に許容し得る溶媒は、さらに、1種又はそれ以上の製薬学的に許容し得る酸、塩基、塩又はその他の化合物、例えば担体、賦形剤などを含有していてもよい。製薬学的に許容し得る酸としては、HCl、H2SO4、H3PO4、安息香酸などが挙げられる。製薬学的に許容し得る塩基としては、NaOH、KOH、NaHCO3などが挙げられる。製薬学的に許容し得る塩としては、NaCl、NaBr、KClなどが挙げられる。酸及び塩基は、特定の予め選択されたpH、特別には約2〜8の範囲内のpH、さらに特別には約5.0〜約7.2の範囲内のpHで、製薬学的に許容し得る溶液を緩衝するために適当な割合で加えてもよい。
【0068】
ハナスゲの抽出物からチモサポニンA3とチモサポニンB2の精製
本発明者は、チモサポニンA3(本明細書では「チモサポニンA−III」ともいう)(これは、ハナスゲの乾燥抽出物1000mg当たり約2mgに相当する)が、生体外(in vitro)で種々の癌細胞においてアポトーシスを誘導するが、非癌性細胞ではアポトーシスを誘導しないことを見出した。また、本発明者は、チモサポニンB2(本明細書では「チモサポニンB−II」ともいう)(これは、ハナスゲの乾燥抽出物1000mg当たり約79mgに相当する)は、生体外でアポトーシスを誘導しないことを見出した。しかし、チモサポニンB2は、ラマリナーゼによってチモサポニンA3に転化し得るし、また腸管内菌叢の作用によって生体内でチモサポニンA3に転化し得る。実際に、生体外実験により、生体外でのラマリナーゼ(腸管内菌叢によって一般に発現される酵素)によるチモサポニンB2の処理は、チモサポニンB2を癌細胞においてアポトーシスを誘導するのに活性にすることが明らかにされた。
【0069】
チモサポニンA3とチモサポニンB2は、高速液体クロマトグラフィーによりハナスゲの抽出物から分離され、飛行時間型質量分析(TOF−MS)によって確認された。ハナスゲの乾燥抽出物の試料の全質量に対するチモサポニンA3とチモサポニンB2の寄与が、ハナスゲの試料の乾燥質量と、分離プロセスの最後に回収されたチモサポニンA3とチモサポニンB2の質量とに基づいて算出された。チモサポニンA3とチモサポニンB2の構造及び分子量を、以下に示す:
チモサポニンA−III
【化1】

C39H64O13
正確な質量:740.43
分子量:740.92
m/e:740.43(100.0%)、741.44(43.4%)、742.44(11.9%)、743.44(2.3%)
C:63.22; H:8.71; O:28.07
チモサポニンB−II
【化2】

化学式:C45H76O19
正確な質量:920.50
分子量:921.07
m/e:920.50(100%)、921.50(50.3%)、922.50(15.5%)、923.51(3.9%)
元素分析値: C:58.68; H:8.32; O:33.00
【0070】
医薬組成物
ハナスゲの抽出物、チモサポニンA3、チモサポニンB2、及びチモサポニンA3とチモサポニンB2の混合物は、前記のようにして溶液又は乾燥形態で調製し得る。溶液形態では、ハナスゲの抽出物、チモサポニンA3、チモサポニンB2、及びチモサポニンA3とチモサポニンB2の混合物は、フレーバーティー(tea)又はノンフレーバーティーの形態で投与してもよい。幾つかの実施形態において、幾つかの香味料、例えば甘味料が、抽出物の苦味を中和するために望ましいものであり得る。溶液もまた、乾燥抽出物からティー又はエリキシルの形態で調製できる。また、香味料、例えば甘味料が望ましいものであり得る。風味のマスキングを、患者の医薬組成物の許容性を向上させるために用いてもよい。
【0071】
ハナスゲの乾燥抽出物、チモサポニンA3、チモサポニンB2、及びチモサポニンA3とチモサポニンB2の混合物は、経口利用できる形態、例えばカプセル剤、錠剤、カプレットなどとして製剤し得る。カプセルは、適量の前記乾燥抽出物を1つ又はそれ以上のゼラチンカプセルシェルに測り取り、カプセルを組み立てることによって調製し得る。錠剤及びカプレットは、前記乾燥抽出物を、1種又はそれ以上の賦形剤、例えば製薬学的に不活性な結合剤、充填剤、潤滑剤、希釈剤、崩壊剤、徐放剤など(これらは、当該技術において一般に知られている)と組み合わせることによって調製し得る。植物繊維が、本発明の目的のための充填剤とみなされることは、注目される。幾つかの実施形態において、本発明は、植物由来の繊維以外の充填剤を含有する固形製剤を意図する。他の実施形態は、充填剤としてある量の可溶性植物繊維を保有することを意図する。別の実施形態は、充填剤として植物繊維の添加を意図する。錠剤、カプレット、カプセル剤などは、例えば、胃の不調を防止するために腸溶性コーティング又はその他のコーティング、例えば酸素防護障壁で被覆されていてもよい。
【0072】
ハナスゲの乾燥抽出物、チモサポニンA3、チモサポニンB2、及びチモサポニンA3とチモサポニンB2の混合物、又はハナスゲの抽出物、チモサポニンA3、チモサポニンB2、及びチモサポニンA3とチモサポニンB2の混合物の濃縮溶液は、1種又はそれ以上のゲル化剤と組み合わせ、ゲルカプセルに挿入してもよい。あるいは、ハナスゲの乾燥抽出物、チモサポニンA3、チモサポニンB2、及びチモサポニンA3とチモサポニンB2の混合物、又はハナスゲの抽出物、チモサポニンA3、チモサポニンB2、及びチモサポニンA3とチモサポニンB2の混合物の濃縮溶液は、ゲル化剤と、場合により食用ゲルとして経口投与するための1種又はそれ以上の香味料と組み合わせてもよい。あるいはノンフレーバー変種(variant)を、直腸坐薬ゲル又はゲルカプセルとして投与してもよい。
【0073】
ハナスゲの抽出物の単位用量は、剤形内に含まれる当量の乾燥抽出物によって特徴付けられる。例えば、幾つかの実施形態において、単位投薬量は、1mg〜約10gの乾燥抽出物又はその均等物を含有し得る。幾つかの実施形態において、前記単位用量は、約1mg〜約10mg、約1mg〜約100mg、約1mg〜約1000mg(1g)、約1mg〜約10000mg(10g)の乾燥抽出物又はその均等物を含有するであろう。幾つかの実施形態において、前記単位用量は、約10mg〜約100mg、約10mg〜約1000mg又は約10mg〜約10000mgの乾燥抽出物又はその均等物を含有する。幾つかの実施形態において、前記単位用量は、約100mg〜約5000mg、約100mg〜約2500mg、約100mg〜約2000mg、約100mg〜約1500mg、約100〜約1000、約100〜約800mgの乾燥抽出物又はその均等物を含有する。ハナスゲの乾燥抽出物の均等物は、ハナスゲの乾燥抽出物と同じ量のアポトーシス活性成分(active)を含有するハナスゲのある量の乾燥物、液体、ゲル又は他の混合物である。従って、ハナスゲの乾燥抽出物0.5mg/mLを含有するティー(tea)30mLは、15mgの乾燥ハナスゲに相当する単位用量である。ハナスゲの乾燥抽出物、結合剤、充填剤、崩壊剤のそれぞれを100mg含有する錠剤は、100mgの乾燥抽出物それ自体(neat)に相当する。
【0074】
本明細書に記載の所見に基づいて、チモサポニンA3、チモサポニンB2又はチモサポニンA3及びB2の混合物の有効量は、約1〜1000mg/用量の範囲内にあり、1回の用量で又は分割した用量で、1日当たり1回、2回、3回、4回又はそれ以上の用量(約1〜4000mg/日)で提供されると推測される。幾つかの実施形態において、チモサポニンA3、チモサポニンB2又はチモサポニンA3及びB2の混合物の用量は、約5〜約500mg/用量であり、1回の用量で又は分割した用量で、1日当たり1回、2回、3回、4回又はそれ以上の用量(約5〜2000mg/日)で提供し得る。幾つかの実施形態において、チモサポニンA3、チモサポニンB2又はチモサポニンA3及びB2の混合物の用量は、約100mg/用量〜約500mg/用量であり、1回の用量で又は分割した用量で、1日当たり1回、2回、3回、4回又はそれ以上の用量で提供し得る。幾つかの実施形態において、チモサポニンA3、チモサポニンB2又はチモサポニンA3及びB2の混合物の用量は、約50mg/用量、約100mg/用量、約150mg/用量、約200mg/用量、約250mg/用量、約300mg/用量、約350mg/用量、約400mg/用量、約450mg/用量、約500mg/用量、約550mg/用量、約600mg/用量、約650mg/用量、約700mg/用量、約750mg/用量、約800mg/用量であり、1回の用量で又は分割した用量で、1日当たり1回、2回、3回、4回又はそれ以上の用量で提供し得る。従って、幾つかの実施形態において、チモサポニンA3、チモサポニンB2又はチモサポニンA3及びB2の混合物の1日用量は、50mg/日、約100mg/日、約150mg/日、約200mg/日、約250mg/日、約300mg/日、約350mg/日、約400mg/日、約450mg/日、約500mg/日、約550mg/日、約600mg/日、約650mg/日、約700mg/日、約750mg/日、約800mg/日、約900mg/日、約1000mg/日、約1150mg/日、約1100mg/日、約1200mg/日、約1300mg/日、約1350mg/日、約1400mg/日、約1500mg/日、約1600mg/日、約1650mg/日、約1800mg/日、約1950mg/日、約2000mg/日、約2100mg/日、約2250mg/日、約2400mg/日、約2600mg/日、約2800mg/日、約3000mg/日、約3200mg/日で有り得る。チモサポニンA3、チモサポニンB2又はチモサポニンA3及びB2の混合物のこれらの量は、適当な液体、ゲル又は固形賦形剤、例えば適当な不活性な担体、希釈剤、崩壊剤、流動促進剤、結合剤、香味料、風味マスキング剤、徐放剤と組み合わせて、適当な剤形、例えば液剤、ゲル剤、錠剤、カプレット又はカプセル剤を形成してもよい。
【0075】
治療方法
ハナスゲの抽出物並びに本明細書に記載のようにして単離され、精製されたチモサポニンA3を含有する医薬組成物は、癌細胞、例えば乳癌細胞及び前立腺癌細胞においてアポトーシス活性を有する。また、チモサポニンB2は、ラマリナーゼの活性によりチモサポニンA3に転化するので、哺乳動物患者、例えばヒトの腸内でチモサポニンA3に転化することが予期されるであろう。従って、ハナスゲの抽出物の医薬組成物、並びに単離され、精製されたチモサポニンA3、チモサポニンB2、又はチモサポニンA3とチモサポニンB2の組み合わせの医薬組成物は、異常細胞増殖に特徴がある種々の疾患、例えば生物体、器官、組織又は細胞株において正常なアポトーシスプロセスの不全によって引き起こされる疾患状態の治療において活性を有するであろう。本明細書に記載の組成物を用いて治療できると想定される疾患の中に、癌、例えば以下に限定されないが、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織の肉腫、皮膚癌、骨髄軸腫瘍、胃癌又は子宮癌がある。幾つかの実施形態において、本明細書に記載の組成物は、固形腫瘍、例えば乳癌、肺癌、結腸癌、脳腫瘍、前立腺癌、胃癌、膵臓癌、卵巣癌、皮膚癌(黒色腫)、内分泌系癌、子宮癌、精巣癌及び膀胱癌の中から選択される1種又はそれ以上の癌と診断されている患者に投与される。
【0076】
幾つかの実施形態において、本明細書に記載のハナスゲの抽出物並びに本明細書に記載のようにして単離され、精製されたチモサポニンA3を含有する組成物は、良性の増殖性疾患、例えば良性の前立腺肥大、乾癬又は再狭窄(例えば、移植ステントの再狭窄)を治療するのに有効である。
【0077】
幾つかの実施形態において、本明細書に記載のハナスゲの抽出物並びに本明細書に記載のようにして単離され、精製されたチモサポニンA3を含有する医薬組成物は、異常な細胞増殖、例えば癌、固形腫瘍、良性過剰増殖性疾患などの治療に有用な別の薬剤と組み合わせてもよい。このような追加薬剤は、有糸分裂阻害剤、アルキル化剤、代謝拮抗物質、挿入抗生物質、増殖因子阻害剤、細胞周期阻害剤、酵素、トポイソメラーゼ阻害剤、生物学的反応調節剤、抗体、細胞障害性薬物、抗ホルモン及び抗アンドロゲンの中から選択し得る。
【0078】
ハナスゲの抽出物並びに本明細書に記載のようにして単離され、精製されたチモサポニンA3を含有する医薬組成物の有効量は、本明細書に記載の多細胞生物において治療効果を生じるのに有効な量である。幾つかの実施形態において、前記有効量は、生物において過剰増殖性細胞の1つ又はそれ以上の集団においてアポトーシスを誘導するのに十分な量である。幾つかの実施形態において、前記有効量は、生物体において過剰増殖性細胞疾患、例えば癌の1つ又はそれ以上の症状の軽減を生じるのに十分な量である。幾つかの実施形態において、前記有効量は、過剰増殖細胞疾患の進行を著しく遅らせるか、前記過剰増殖性疾患の部分的又は完全寛解を生じるか、前記過剰増殖細胞疾患の再発、広がり又は悪性増殖に対して部分的又は完全な予防を提供するのに十分な量である。幾つかの実施形態において、前記用量は、治療計画の成功に臨界的であり得る。ハナスゲの抽出物は、極めて無毒性であると思われるので、前記有効量は、以下で詳細に論じるように、乾燥抽出物、あるいはその溶液又はその他の製薬学的に許容し得る形態の均等物の1日当たり患者当たり約1mgから約10gまで変化させ得る。幾つかの実施形態において、前記有効量は、1日当たり患者当たり約1mg〜約10mg、約1mg〜約100mg、約1mg〜約1000mg(1g)、約1mg〜約10000mg(10g)である。幾つかの実施形態において、前記有効量は、1日当たり患者当たり約10mg〜約100mg、約10mg〜約1000mg又は約10mg〜約10000mgである。幾つかの実施形態において、前記有効量は、1日当たり患者当たり約100mg〜約5000、約100mg〜約2500mg、約100mg〜約2000mg、約100mg〜約1500mg、約100〜約1000、約100〜約800mgである。幾つかの実施形態において、治療日数は、非治療日数によって変化させてもよい。例えば、治療は、1日目に前記の有効量を用いて開始し得、3日目、5日目、7日目(又は8日目)、9日目、11日目、13日目などに有効量の投与が反復される。治療は、まる1週間1日に1回投与し、次いで1週間治療を休止し、次いで治療に少なくともさらに1週間投与し得る。ハナスゲの抽出物を用いた治療は、別の抗癌治療と交互に入れ替えてもよいし、又は癌治療の併用効果の利点を得るために別の抗癌治療と組み合わせてもよい。
【0079】
さらなる癌治療としては、以下に限定されないが、固形腫瘍の全部又は一部の外科的切除、放射線治療、補助化学療法、抗炎症薬、鎮痛薬などが挙げられる。
【0080】
疾患、障害、症候群、状態又は症状の治療(及びその文法的変化 − 例えば、治療する、治療するために、治療しつつある、治療されたなど)は、臨床医がこのような治療を受ける被検体を確認し、この被検体に本発明の組成物を投与するという段階を含む。従って、治療は、本発明の選択的アポトーシス植物抽出物を被検体に投与することによって回復され、軽減され、改善され、除去され、治癒される可能性がある疾患、症候群、状態又は症状の診断を含む。治療はまた、疾患、障害、症候群、状態又は症状の同時回復、軽減、改善、除去又は治癒も含む。幾つかの実施形態において、治療とは、疾患、障害、症候群、状態又は症状の発症の防止又は遅延(すなわち、予防)、疾患、障害、症候群、状態又は症状の進行の防止又は遅延、及び/又は疾患、障害、症候群、状態又は症状の重症度の軽減を意味する。特に、新生物増殖の場合には、治療は、新生物増殖の軽減、及び逆転、停止又は遅延を含む。これに関して、治療はまた、寛解、例えば完全寛解及び部分寛解も含む。更年期症状の場合には、治療は、種々の症状の予防及び軽減を含む。
【0081】
疾患、障害、症候群、状態又は症状の予防(及びその文法的変化)は、疾患、障害、症候群、状態又は症状を発症するリスクがある被検者を確認し、その被検体に前記の疾患、障害、症候群、状態又は症状の発症を未然に防ぐ又は遅らせる可能性のある十分な量の本明細書に記載の植物抽出物を投与することを含む。ある場合には、予防は、臨床医が、要求にかなう水準の医療を施し、ホルモン補充療法の必要があると考える閉経後の女性を確認し、その女性に本発明の植物抽出物を投与し、それによって1つ又はそれ以上の更年期症状を阻止するか又は遅らせることを含む。幾つかの実施形態において、骨粗鬆症の予防は、予防は、臨床医が、要求にかなう水準の医療を施し、骨粗鬆症を発症するリスクがあると考える閉経後の女性を確認し、その女性に本発明の植物抽出物を投与し、それによって骨量減少の開始を阻止するか又は遅らせることを含む。
【0082】
軽減は、疾患、障害、症候群、状態又は症状の重症度、発生の回数及び/又は頻度の減少を含む。更年期症状の軽減には、ほてり、不眠症、失禁、うつ病などの頻度及び/又は重症度を減少させることを含む。
ハナスゲの抽出物の投与
【0083】
本発明の医薬組成物の投与は、前記植物抽出物の1つ又はそれ以上がその経路によって組織を標的とするのに利用できる限りは、一般的に使用されている投与経路によるであろう。挙げ得る幾つかの投与経路としては、経口、経鼻、口腔、直腸、膣及び/又は局所(経皮)が挙げられる。あるいは、投与は、同所、皮内、皮下、筋肉内、腹腔内又は静脈内注射であってもよい。このような組成物は、通常は上記に記載された製薬学に許容し得る組成物として投与される。
【実施例】
【0084】
本発明は、以下の例示的及び非限定的な実施例を参照してさらに十分に理解し得る。
【実施例1】
【0085】
実施例1:生体外試験
ハナスゲの植物抽出物は、癌細胞においてアポトーシスを選択的に誘導する。図1において認めることができるように、腫瘍及び非形質転換細胞株並びに細胞を、ハナスゲの乾燥抽出物0.5mg/mLを含有する溶液で処理した。(このハナスゲの乾燥抽出物0.5mg/mLを含有する溶液は、本明細書ではBN108ともいう。)図1は、3種類の乳癌細胞株、3種類の前立腺癌細胞株、3種類の不死化乳腺細胞株及び正常線維芽細胞について処理24時間後のアネキシンVを結合した細胞の割合を表す。BN108処理乳癌及び前立腺癌細胞のアポトーシス率(%)は、20%から80%までの範囲に及び、これに対してBN108処理不死化乳腺細胞のアポトーシス率は、無視し得るほど低く、またBN108処理正常線維芽細胞のアポトーシス率は、10%未満であった。従って、BN108は、癌細胞ではアポトーシスを誘導するが、正常細胞及び非癌性不死化細胞ではアポトーシスを誘導しないことを認めることができる。
【0086】
BN108は、BT474細胞においてカスパーゼ4及びカスパーゼ9(これらは、小胞体ストレスによって誘導されるアポトーシスに関連する)の活性化を誘導する。図2において認めることができるように、BT474細胞を、特定のカスパーゼ4阻害剤の存在下で又は不存在下で、BN108で処理した。カスパーゼ4及びカスパーゼ9の活性を、蛍光アッセイ(Biovision、Inc.)を使用して定量した。これらのアポトーシス関連カスパーゼの両方の発現レベルは、対照の存在下でのこれらのカスパーゼの発現レベルと比べて数倍上昇していた。カスパーゼ4及びカスパーゼ9の両方の発現レベルは、BN108とカスパーゼ4阻害剤の存在下では、対照の発現レベル以下に低下した。明らかに、カスパーゼ4の阻害は、カスパーゼ9活性の阻害を招き、カスパーゼ4の活性化が、BN108によって誘導されるアポトーシスプロセスの頂点であることを示す。
【0087】
BN108による乳癌細胞の処理は、AKTキナーゼ及びmTORキナーゼの活性を阻害する。BN108で誘導された変化の発現アレイ分析により、アップレギュレートされる増殖停止及び/又はアポトーシスにおいて役割を有する数種の転写物が確認された。増殖停止及び/又はアポトーシスにおいて役割を有するアップレギュレートされる遺伝子の中に、p21CIP、ストラチフィン、サイクリンG2、GDF15及びBimがある。コレステロール合成経路において酵素をコードする多数のmRNA。ダウンレギュレートされる遺伝子:増殖因子、VEGF、アンフィレギュリン、miR17−92及びC−myc。対応するタンパク質の発現の変化を、ウェスタンブロッティングにより確認した。また、BN108は、REDD1/DDIT4(そのタンパク質産物は、mTORC1の陰性調節因子である)の発現を誘導する。
【0088】
図3において認めることができるように、BN108は、REDD1(その発現がアポトーシスに関連する遺伝子)を誘導し、乳癌細胞においてmTORC1のシグナル伝達を阻害する。図3Aは、REDD1の発現のウェスタンブロット分析並びに乳癌細胞株BT474でのmTOR標的s6キナーゼ及び4eBPのリン酸化を表す。これらの変化のいずれも、不死化非形質転換乳腺上皮細胞株MCF10Aでは観察されなかった(図には示さない)。図3Bは、BN108はまた、乳癌においてAKTの活性を阻害するが、MCF10A細胞ではAKTの活性を阻害しないことを表す。
【0089】
図4Aに示されように、BN108による処理は、乳癌細胞BT474ではAKTキナーゼを不活性化するが、正常乳腺上皮細胞MCF10AではAKTキナーゼ不活性化しない。図4Bにおいて、SREBP2が、癌細胞(BT474)及び非癌性細胞(MCF10A)の両方においてBN108によって活性化されることを、認めることができる。
【0090】
BN108誘導細胞死は、カスパーゼ活性及びDNA断片化を伴う。BN108は、活性酸素種の生成、DNA損傷又はミトコンドリア機能障害を誘導しない。BN108は、乳癌においてAKTキナーゼ及びmTORキナーゼの急速不活性化を誘導した。特に、BN108によるストレス応答遺伝子REDD1の誘導は、REDD1がTORCの陰性調節因子であることから、mTOR複合体の活性の観察された阻害に関連するであろう。
【実施例2】
【0091】
実施例2:ハナスゲの抽出物からのチモサポニンA3及びチモサポニンB2の単離
チモサポニンA3とチモサポニンB2は、本明細書において上記に一般的に記載されたようにして、ハナスゲの抽出物から単離された。単離されたチモサポニンA3とチモサポニンB2は、本明細書において上記に記載のようにGC質量分析によって特定された。
【実施例3】
【0092】
実施例3:チモサポニンA3及びチモサポニンB2を用いた生体外実験
乳癌細胞及び正常上皮細胞の生存率に対するチモサポニンA3及びB2の効果を、0.5mg/mLのBN108、4μg/mLのチモサポニンA3、50μg/mLのチモサポニンB2、不活性化ラマリナーゼ単独又はラマリナーゼ処理チモサポニンB2(4μg/mL)を用いて細胞を24時間処理することによって試験した。図5において認めることができるように、BN108及びチモサポニンA3(「TspA3」)は、BT474細胞において細胞死を誘導した。これに対してチモサポニンB2(「TspB2」)及びラマリナーゼ単独は、BT474細胞において細胞死を誘導しなかった。また、ラマリナーゼによる4μg/mLのチモサポニンB2の処理は、4μg/mLのチモサポニンA3によって誘導されたBT474細胞における細胞死とほぼ同じ程度の大きさのBT474細胞における細胞死の誘導をもたらした。チモサポニンB2(920Da)及びチモサポニンA3(740Da)の分子量の商(quotient)が、チモサポニンA3とラマリナーゼ処理チモサポニンB2における%死滅細胞の比にほぼ相当することを考慮に入れると、チモサポニンA3とラマリナーゼ処理チモサポニンB2の間の活性の相違は、モル基準で、おそらくは無視できるであろう。従って、ほぼ全部のチモサポニンB2が、ラマリナーゼの存在下でチモサポニンA3に転化し、アポトーシスを誘導するのに活性であると推測できる。ラマリナーゼによるチモサポニンB2のチモサポニンA3への転化は、図15において認めることができるように、飛行時間型質量分析(TOF MS)によって確認された。図15において認めることができるように、チモサポニンB2の消失及びチモサポニンA3の出現は、不活性化ラマリナーゼとチモサポニンB2の存在下での細胞死16%から、活性化ラマリナーゼとチモサポニンB2の存在下での細胞死53%まで細胞死の上昇をもたらした。
【0093】
BN108とチモサポニンA3の両方が、前立腺癌細胞においてアポトーシス促進性遺伝子REDD1を誘導する。図6において認めることができるように、アポトーシス促進性遺伝子REDD1は、Dul45前立腺癌細胞において、BN108(ハナスゲの乾燥抽出物0.5mg/mL)及びチモサポニンA3(7.5μM)で処理することによって誘導される。図7において認めることができるように、チモサポニンA3(5μM)及びBN108(0.5mg/mL)は、elF2aのリン酸化を増加させ、SREBP2の発現を増大させ且つIDI1の発現を増大させる。
【0094】
BN108とチモサポニンA3は、癌細胞及び正常細胞においてコレステロール(CHL)合成に対して同様の効果を有する。図8において認めることができるように、チモサポニンA3とBN108は、癌性(MM23)乳房細胞においてコレステロール合成をわずかに高め且つ正常(MCF10A)乳房細胞において処理後少なくとも最初の8時間の間、コレステロール合成を抑制する傾向があった。
【0095】
BN108とチモサポニンA3の細胞障害作用は、コレステロール(CHL)とカスパーゼ4阻害剤LEVDとによって弱められる。図9において認めることができるように、未処理(UT)BT474細胞は、対照溶液による処理後24時間で90%を越える生存能力があったが、チモサポニンA3又はBN108で処理された細胞は、40%が24時間生存しただけであった(ヨウ化プロピジウムに対する死滅細胞の透過性についてのFACScan及びアネキシンVの結合に基づいて)。250mMのコレステロールによるBT474細胞の処理は、チモサポニンA3とBN108の影響から細胞を保護し、細胞の約80%がコレステロール(CHL)の存在下で24時間生存する。同様の効果が、カスパーゼ4阻害剤LEVDの存在下で認められた。図9において認めることができるように、LEVDによる処理は、チモサポニンA3とBN108の効果の減衰をもたらし、LEVDとチモサポニンA3又はBN108とで処理したBT474細胞の55〜60%が、処理後24時間生存する。この実験の結果を、以下の表に要約する。
【表1】

【0096】
本発明の好ましい実施形態を本明細書で示し、説明したが、このような実施形態が単なる例として提供されることは、当業者には明らかであろう。当業者は、本発明から逸脱することなく、多数の改変、変化及び置換を思い付くであろう。本発明の実施において本明細書に記載される本発明の実施形態の種々の代替を使用し得ることが、理解されるべきである。以下の特許請求の範囲が本発明の範囲を定義すること及びそれによってこれらの特許請求の範囲内の方法及び構造並びにこれらの均等物が保護されることが意図される。
【特許請求の範囲】
【請求項1】
多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2とを含有する、組成物。
【請求項2】
チモサポニンA3とチモサポニンB2とのみから本質的になる、請求項1に記載の組成物。
【請求項3】
前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項1に記載の組成物。
【請求項4】
総合重量で、約50〜1,000mgのチモサポニンA3とチモサポニンB2、好ましくは約100〜800mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンA3とチモサポニンB2を含有する、請求項1〜3のいずれか一項に記載の組成物。
【請求項5】
総合重量で、約1〜100mgのチモサポニンA3とチモサポニンB2、好ましくは約1〜50mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンA3とチモサポニンB2を含有する、請求項1〜3のいずれか一項に記載の組成物。
【請求項6】
前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3を含有する、多細胞生物の癌を治療するための組成物。
【請求項7】
前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3のみから本質的になる、請求項6に記載の組成物。
【請求項8】
前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項6に記載の組成物。
【請求項9】
前記医薬組成物が、約50〜1,000mgのチモサポニンA3、好ましくは約100〜800mgのチモサポニンA3、さらに好ましくは約200〜600mgのチモサポニンA3を含有する、請求項6〜8のいずれか一項に記載の組成物。
【請求項10】
前記医薬組成物が、約1〜100mgのチモサポニンA3、好ましくは約1〜50mgのチモサポニンA3、さらに好ましくは約1〜20mgのチモサポニンA3を含有する、請求項6〜8のいずれか一項に記載の組成物。
【請求項11】
前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2を含有する、多細胞生物の癌を治療するための組成物。
【請求項12】
前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2のみから本質的になる、請求項11に記載の組成物。
【請求項13】
前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項11に記載の組成物。
【請求項14】
前記医薬組成物が、約50〜1,000mgのチモサポニンB2、好ましくは約100〜800mgのチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンB2を含有する、請求項11〜13のいずれか一項に記載の組成物。
【請求項15】
前記医薬組成物が、約1〜100mgのチモサポニンB2、好ましくは約1〜50mgのチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンB2を含有する、請求項11〜13のいずれか一項に記載の組成物。
【請求項16】
経口製剤である、請求項1〜15のいずれか一項に記載の組成物。
【請求項17】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項1〜16のいずれか一項に記載の組成物。
【請求項18】
前記多細胞生物がヒトである、請求項17に記載の組成物。
【請求項19】
前記癌が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項17又は18に記載の方法。
【請求項20】
多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンA3とチモサポニンB2とを含有する有効量の医薬組成物を投与することからなる、方法。
【請求項21】
前記医薬組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2とのみから本質的になる、請求項20に記載の方法。
【請求項22】
前記医薬組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項20に記載の方法。
【請求項23】
総合重量で、約50〜1,000mgのチモサポニンA3とチモサポニンB2、好ましくは約100〜800mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンA3とチモサポニンB2を含有する、請求項20〜22のいずれか一項に記載の方法。
【請求項24】
総合重量で、約1〜100mgのチモサポニンA3とチモサポニンB2、好ましくは約1〜50mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンA3とチモサポニンB2を含有する、請求項20〜22のいずれか一項に記載の方法。
【請求項25】
多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンA3を含有する有効量の医薬組成物を投与することからなる、方法。
【請求項26】
前記医薬組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3のみから本質的になる、請求項25に記載の方法。
【請求項27】
前記医薬組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項25に記載の方法。
【請求項28】
前記医薬組成物が、約50〜1,000mgのチモサポニンA3、好ましくは約100〜800mgのチモサポニンA3、さらに好ましくは約200〜600mgのチモサポニンA3を含有する、請求項25〜27のいずれか一項に記載の方法。
【請求項29】
前記医薬組成物が、約1〜100mgのチモサポニンA3、好ましくは約1〜50mgのチモサポニンA3、さらに好ましくは約1〜20mgのチモサポニンA3を含有する、請求項25〜27のいずれか一項に記載の方法。
【請求項30】
多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンB2を含有する有効量の医薬組成物を投与することからなる、方法。
【請求項31】
前記医薬組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2のみから本質的になる、請求項30に記載の方法。
【請求項32】
前記医薬組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項35に記載の方法。
【請求項33】
前記医薬組成物が、約50〜1,000mgのチモサポニンB2、好ましくは約100〜800mgのチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンB2を含有する、請求項30〜32のいずれか一項に記載の方法。
【請求項34】
前記医薬組成物が、約1〜100mgのチモサポニンB2、好ましくは約1〜50mgのチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンB2を含有する、請求項30〜32のいずれか一項に記載の方法。
【請求項35】
前記医薬組成物が経口製剤である、請求項25〜34のいずれか一項に記載の方法。
【請求項36】
前記多細胞生物が、ラット、マウス、ヒト、サル又はイヌである、請求項25〜35のいずれか一項に記載の方法。
【請求項37】
前記多細胞生物がヒトである、請求項36に記載の方法。
【請求項38】
前記癌が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項36又は37に記載の方法。
【請求項39】
前記多細胞生物の癌を治療する医薬を製造するための、チモサポニンA3、チモサポニンB2、又はチモサポニンA3とチモサポニンB2の両方を含有する組成物の使用。
【請求項40】
前記組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2の両方のみから本質的になる、請求項39に記載の使用。
【請求項41】
前記組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項39に記載の使用。
【請求項42】
前記組成物が、総合重量で、約50〜1,000mgのチモサポニンA3とチモサポニンB2、好ましくは約100〜800mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンA3とチモサポニンB2を含有する、請求項39〜41のいずれか一項に記載の使用。
【請求項43】
前記組成物が、総合重量で、約1〜100mgのチモサポニンA3とチモサポニンB2、好ましくは約1〜50mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンA3とチモサポニンB2を含有する、請求項39〜41のいずれか一項に記載の使用。
【請求項44】
前記組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3のみから本質的になる、請求項43に記載の使用。
【請求項45】
前記組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項43に記載の使用。
【請求項46】
前記組成物が、約50〜1,000mgのチモサポニンA3、好ましくは約100〜800mgのチモサポニンA3、さらに好ましくは約200〜600mgのチモサポニンA3を含有する、請求項43〜45のいずれか一項に記載の使用。
【請求項47】
前記組成物が、約1〜100mgのチモサポニンA3、好ましくは約1〜50mgのチモサポニンA3、さらに好ましくは約1〜20mgのチモサポニンA3を含有する、請求項43〜45のいずれか一項に記載の使用。
【請求項48】
前記組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2のみから本質的になる、請求項47に記載の使用。
【請求項49】
前記組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項47に記載の使用。
【請求項50】
前記組成物が、約50〜1,000mgのチモサポニンB2、好ましくは約100〜800mgのチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンB2を含有する、請求項48又は49に記載の使用。
【請求項51】
前記組成物が、約1〜100mgのチモサポニンB2、好ましくは約1〜50mgのチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンB2を含有する、請求項48又は49に記載の使用。
【請求項52】
前記医薬組成物が経口製剤である、請求項39〜51のいずれか一項に記載の使用。
【請求項53】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項39〜52のいずれか一項に記載の使用。
【請求項54】
前記多細胞生物がヒトである、請求項53に記載の使用。
【請求項55】
前記癌が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項53又は54に記載の使用。
【請求項56】
多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、チモサポニンA3とチモサポニンB2とを含有する有効量の医薬組成物を投与することからなる、方法。
【請求項57】
前記医薬組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2とのみから本質的になる、請求項56に記載の方法。
【請求項58】
前記医薬組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項56に記載の方法。
【請求項59】
前記医薬組成物が、総合重量で、約50〜1,000mgのチモサポニンA3とチモサポニンB2、好ましくは約100〜800mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンA3とチモサポニンB2を含有する、請求項56〜58のいずれか一項に記載の方法。
【請求項60】
前記医薬組成物が、総合重量で、約1〜100mgのチモサポニンA3とチモサポニンB2、好ましくは約1〜50mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンA3とチモサポニンB2を含有する、請求項56〜58のいずれか一項に記載の方法。
【請求項61】
多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、チモサポニンA3を含有する有効量の医薬組成物を投与することからなる、方法。
【請求項62】
前記医薬組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3のみから本質的になる、請求項61に記載の方法。
【請求項63】
前記医薬組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項61に記載の方法。
【請求項64】
前記医薬組成物が、約50〜1,000mgのチモサポニンA3、好ましくは約100〜800mgのチモサポニンA3、さらに好ましくは約200〜600mgのチモサポニンA3を含有する、請求項61〜63のいずれか一項に記載の方法。
【請求項65】
前記医薬組成物が、約1〜100mgのチモサポニンA3、好ましくは約1〜50mgのチモサポニンA3、さらに好ましくは約1〜20mgのチモサポニンA3を含有する、請求項61〜63のいずれか一項に記載の方法。
【請求項66】
多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、チモサポニンB2を含有する有効量の医薬組成物を投与することからなる、方法。
【請求項67】
前記医薬組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンB2のみから本質的になる、請求項66に記載の方法。
【請求項68】
前記医薬組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項66に記載の方法。
【請求項69】
前記医薬組成物が、約50〜1,000mgのチモサポニンB2、好ましくは約100〜800mgのチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンB2を含有する、請求項66〜68のいずれか一項に記載の方法。
【請求項70】
前記医薬組成物が、約1〜100mgのチモサポニンB2、好ましくは約1〜50mgのチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンB2を含有する、請求項66〜68のいずれか一項に記載の方法。
【請求項71】
前記医薬組成物が経口製剤である、請求項56〜70のいずれか一項に記載の方法。
【請求項72】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項56〜71のいずれか一項に記載の方法。
【請求項73】
前記多細胞生物がヒトである、請求項72に記載の方法。
【請求項74】
前記増殖細胞集団が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項71又は72に記載の方法。
【請求項75】
多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する医薬を製造するための、チモサポニンA3、チモサポニンB2、又はチモサポニンA3とチモサポニンB2の両方を含有する組成物の使用。
【請求項76】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2の両方のみから本質的になる、請求項75に記載の使用。
【請求項77】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項75に記載の使用。
【請求項78】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項75に記載の使用。
【請求項79】
前記組成物が、総合重量で、約50〜1,000mgのチモサポニンA3とチモサポニンB2、好ましくは約100〜800mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンA3とチモサポニンB2を含有する、請求項75〜78のいずれか一項に記載の使用。
【請求項80】
前記組成物が、総合重量で、約1〜100mgのチモサポニンA3とチモサポニンB2、好ましくは約1〜50mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンA3とチモサポニンB2を含有する、請求項75〜78のいずれか一項に記載の使用。
【請求項81】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3のみから本質的になる、請求項80に記載の使用。
【請求項82】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項75に記載の使用。
【請求項83】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項75に記載の使用。
【請求項84】
前記組成物が、約50〜1,000mgのチモサポニンA3、好ましくは約100〜800mgのチモサポニンA3、さらに好ましくは約200〜600mgのチモサポニンA3を含有する、請求項81〜83のいずれか一項に記載の使用。
【請求項85】
前記組成物が、約1〜100mgのチモサポニンA3、好ましくは約1〜50mgのチモサポニンA3、さらに好ましくは約1〜20mgのチモサポニンA3を含有する、請求項81〜83のいずれか一項に記載の使用。
【請求項86】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンB2のみから本質的になる、請求項75に記載の使用。
【請求項87】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項75に記載の使用。
【請求項88】
前記組成物が、約50〜1,000mgのチモサポニンB2、好ましくは約100〜800mgのチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンB2を含有する、請求項86〜87のいずれか一項に記載の使用。
【請求項89】
前記組成物が、約1〜100mgのチモサポニンB2、好ましくは約1〜50mgのチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンB2を含有する、請求項86〜87のいずれか一項に記載の使用。
【請求項90】
前記医薬組成物が経口製剤である、請求項75〜89のいずれか一項に記載の使用。
【請求項91】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項75〜90のいずれか一項に記載の使用。
【請求項92】
前記多細胞生物がヒトである、請求項91に記載の使用。
【請求項93】
前記癌が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項91又は92に記載の使用。
【請求項94】
多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のハナスゲAnemarrhena asphodeloides Bungeの抽出物を投与することからなる、組成物。
【請求項95】
ハナスゲの抽出物のみから本質的になる、請求項94に記載の組成物。
【請求項96】
前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項94に記載の組成物。
【請求項97】
前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項94に記載の組成物。
【請求項98】
約50〜50,000mgのハナスゲの抽出物、好ましくは約1000〜40,000mgのハナスゲの抽出物、さらに好ましくは約2000〜35,000mgのハナスゲの抽出物を含有する、請求項94〜97のいずれか一項に記載の組成物。
【請求項99】
約100〜1000mgのハナスゲの抽出物、好ましくは約100〜500mgのハナスゲの抽出物、さらに好ましくは約10〜200mgのハナスゲの抽出物を含有する、請求項94〜97のいずれか一項に記載の組成物。
【請求項100】
前記医薬組成物が経口製剤である、請求項94〜99のいずれか一項に記載の組成物。
【請求項101】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項94〜100のいずれか一項に記載の組成物
【請求項102】
前記多細胞生物がヒトである、請求項101に記載の組成物。
【請求項103】
前記癌が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項101又は102に記載の組成物。
【請求項104】
多細胞生物の癌を治療する方法であって、前記多細胞生物に、ハナスゲの抽出物を含有する有効量の医薬組成物を投与することからなる、方法。
【請求項105】
前記医薬組成物が、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物のみから本質的になる、請求項104に記載の方法。
【請求項106】
前記医薬組成物が、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項104に記載の方法。
【請求項107】
前記医薬組成物が、約50〜50,000mgのハナスゲの抽出物、好ましくは約1000〜40,000mgのハナスゲの抽出物、さらに好ましくは約2000〜35,000mgのハナスゲの抽出物を含有する、請求項104〜106のいずれか一項に記載の方法。
【請求項108】
前記医薬組成物が、約100〜1000mgのハナスゲの抽出物、好ましくは約100〜500mgのハナスゲの抽出物、さらに好ましくは約10〜200mgのハナスゲの抽出物を含有する、請求項104〜106のいずれか一項に記載の方法。
【請求項109】
前記医薬組成物が経口製剤である、請求項104〜108のいずれか一項に記載の方法。
【請求項110】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項104〜109のいずれか一項に記載の方法。
【請求項111】
前記多細胞生物がヒトである、請求項110に記載の方法。
【請求項112】
前記癌が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項110又は111に記載の方法。
【請求項113】
多細胞生物の癌を治療する医薬を製造するための、ハナスゲの抽出物を含有する組成物の使用。
【請求項114】
前記組成物が、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物のみから本質的になる、請求項113に記載の使用。
【請求項115】
前記組成物が、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項113に記載の使用。
【請求項116】
前記組成物が、総合重量で、約50〜50,000mgのハナスゲの抽出物、好ましくは約1000〜40,000mgのハナスゲの抽出物、さらに好ましくは約2000〜35,000mgのハナスゲの抽出物を含有する、請求項113〜115のいずれか一項に記載の使用。
【請求項117】
前記組成物が、総合重量で、約100〜1000mgのハナスゲの抽出物、好ましくは約100〜500mgのハナスゲの抽出物、さらに好ましくは約10〜200mgのハナスゲの抽出物を含有する、請求項113〜115のいずれか一項に記載の使用。
【請求項118】
前記医薬組成物が経口製剤である、請求項113〜117のいずれか一項に記載の使用。
【請求項119】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項113〜118のいずれか一項に記載の使用。
【請求項120】
前記多細胞生物がヒトである、請求項119に記載の使用。
【請求項121】
前記癌が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項119又は120に記載の使用。
【請求項122】
多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、ハナスゲの抽出物を含有する有効量の医薬組成物を投与することからなる、方法。
【請求項123】
前記医薬組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のハナスゲの抽出物のみから本質的になる、請求項122に記載の方法。
【請求項124】
前記医薬組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項122に記載の方法。
【請求項125】
前記医薬組成物が、約50〜50,000mgのハナスゲの抽出物、好ましくは約1000〜40,000mgのハナスゲの抽出物、さらに好ましくは約2000〜35,000mgのハナスゲの抽出物を含有する、請求項122〜124のいずれか一項に記載の方法。
【請求項126】
前記医薬組成物が、約100〜1000mgのハナスゲの抽出物、好ましくは約100〜500mgのハナスゲの抽出物、さらに好ましくは約10〜200mgのハナスゲの抽出物を含有する、請求項122〜124のいずれか一項に記載の方法。
【請求項127】
前記医薬組成物が経口製剤である、請求項122〜126のいずれか一項に記載の方法。
【請求項128】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項122〜127のいずれか一項に記載の方法。
【請求項129】
前記多細胞生物がヒトである、請求項128に記載の方法。
【請求項130】
前記過剰増殖細胞集団が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項128又は129に記載の方法。
【請求項131】
多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する医薬を製造するための、ハナスゲの抽出物を含有する組成物の使用。
【請求項132】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のハナスゲのみから本質的になる、請求項131に記載の使用。
【請求項133】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項131に記載の使用。
【請求項134】
前記組成物が、総合重量で、約50〜50,000mgのハナスゲの抽出物、好ましくは約1000〜40,000mgのハナスゲの抽出物、さらに好ましくは約2000〜35,000mgのハナスゲの抽出物を含有する、請求項131〜133のいずれか一項に記載の使用。
【請求項135】
前記組成物が、総合重量で、約100〜1000mgのハナスゲの抽出物、好ましくは約100〜500mgのハナスゲの抽出物、さらに好ましくは約10〜200mgのハナスゲの抽出物を含有する、請求項131〜133のいずれか一項に記載の使用。
【請求項136】
前記医薬組成物が経口製剤である、請求項131〜135のいずれか一項に記載の使用。
【請求項137】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項131〜136のいずれか一項に記載の使用。
【請求項138】
前記多細胞生物がヒトである、請求項137に記載の使用。
【請求項139】
前記癌が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項137又は138に記載の使用。
【請求項1】
多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2とを含有する、組成物。
【請求項2】
チモサポニンA3とチモサポニンB2とのみから本質的になる、請求項1に記載の組成物。
【請求項3】
前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項1に記載の組成物。
【請求項4】
総合重量で、約50〜1,000mgのチモサポニンA3とチモサポニンB2、好ましくは約100〜800mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンA3とチモサポニンB2を含有する、請求項1〜3のいずれか一項に記載の組成物。
【請求項5】
総合重量で、約1〜100mgのチモサポニンA3とチモサポニンB2、好ましくは約1〜50mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンA3とチモサポニンB2を含有する、請求項1〜3のいずれか一項に記載の組成物。
【請求項6】
前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3を含有する、多細胞生物の癌を治療するための組成物。
【請求項7】
前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3のみから本質的になる、請求項6に記載の組成物。
【請求項8】
前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項6に記載の組成物。
【請求項9】
前記医薬組成物が、約50〜1,000mgのチモサポニンA3、好ましくは約100〜800mgのチモサポニンA3、さらに好ましくは約200〜600mgのチモサポニンA3を含有する、請求項6〜8のいずれか一項に記載の組成物。
【請求項10】
前記医薬組成物が、約1〜100mgのチモサポニンA3、好ましくは約1〜50mgのチモサポニンA3、さらに好ましくは約1〜20mgのチモサポニンA3を含有する、請求項6〜8のいずれか一項に記載の組成物。
【請求項11】
前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2を含有する、多細胞生物の癌を治療するための組成物。
【請求項12】
前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2のみから本質的になる、請求項11に記載の組成物。
【請求項13】
前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項11に記載の組成物。
【請求項14】
前記医薬組成物が、約50〜1,000mgのチモサポニンB2、好ましくは約100〜800mgのチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンB2を含有する、請求項11〜13のいずれか一項に記載の組成物。
【請求項15】
前記医薬組成物が、約1〜100mgのチモサポニンB2、好ましくは約1〜50mgのチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンB2を含有する、請求項11〜13のいずれか一項に記載の組成物。
【請求項16】
経口製剤である、請求項1〜15のいずれか一項に記載の組成物。
【請求項17】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項1〜16のいずれか一項に記載の組成物。
【請求項18】
前記多細胞生物がヒトである、請求項17に記載の組成物。
【請求項19】
前記癌が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項17又は18に記載の方法。
【請求項20】
多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンA3とチモサポニンB2とを含有する有効量の医薬組成物を投与することからなる、方法。
【請求項21】
前記医薬組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2とのみから本質的になる、請求項20に記載の方法。
【請求項22】
前記医薬組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項20に記載の方法。
【請求項23】
総合重量で、約50〜1,000mgのチモサポニンA3とチモサポニンB2、好ましくは約100〜800mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンA3とチモサポニンB2を含有する、請求項20〜22のいずれか一項に記載の方法。
【請求項24】
総合重量で、約1〜100mgのチモサポニンA3とチモサポニンB2、好ましくは約1〜50mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンA3とチモサポニンB2を含有する、請求項20〜22のいずれか一項に記載の方法。
【請求項25】
多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンA3を含有する有効量の医薬組成物を投与することからなる、方法。
【請求項26】
前記医薬組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3のみから本質的になる、請求項25に記載の方法。
【請求項27】
前記医薬組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項25に記載の方法。
【請求項28】
前記医薬組成物が、約50〜1,000mgのチモサポニンA3、好ましくは約100〜800mgのチモサポニンA3、さらに好ましくは約200〜600mgのチモサポニンA3を含有する、請求項25〜27のいずれか一項に記載の方法。
【請求項29】
前記医薬組成物が、約1〜100mgのチモサポニンA3、好ましくは約1〜50mgのチモサポニンA3、さらに好ましくは約1〜20mgのチモサポニンA3を含有する、請求項25〜27のいずれか一項に記載の方法。
【請求項30】
多細胞生物の癌を治療する方法であって、前記多細胞生物に、チモサポニンB2を含有する有効量の医薬組成物を投与することからなる、方法。
【請求項31】
前記医薬組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2のみから本質的になる、請求項30に記載の方法。
【請求項32】
前記医薬組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項35に記載の方法。
【請求項33】
前記医薬組成物が、約50〜1,000mgのチモサポニンB2、好ましくは約100〜800mgのチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンB2を含有する、請求項30〜32のいずれか一項に記載の方法。
【請求項34】
前記医薬組成物が、約1〜100mgのチモサポニンB2、好ましくは約1〜50mgのチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンB2を含有する、請求項30〜32のいずれか一項に記載の方法。
【請求項35】
前記医薬組成物が経口製剤である、請求項25〜34のいずれか一項に記載の方法。
【請求項36】
前記多細胞生物が、ラット、マウス、ヒト、サル又はイヌである、請求項25〜35のいずれか一項に記載の方法。
【請求項37】
前記多細胞生物がヒトである、請求項36に記載の方法。
【請求項38】
前記癌が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項36又は37に記載の方法。
【請求項39】
前記多細胞生物の癌を治療する医薬を製造するための、チモサポニンA3、チモサポニンB2、又はチモサポニンA3とチモサポニンB2の両方を含有する組成物の使用。
【請求項40】
前記組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2の両方のみから本質的になる、請求項39に記載の使用。
【請求項41】
前記組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項39に記載の使用。
【請求項42】
前記組成物が、総合重量で、約50〜1,000mgのチモサポニンA3とチモサポニンB2、好ましくは約100〜800mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンA3とチモサポニンB2を含有する、請求項39〜41のいずれか一項に記載の使用。
【請求項43】
前記組成物が、総合重量で、約1〜100mgのチモサポニンA3とチモサポニンB2、好ましくは約1〜50mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンA3とチモサポニンB2を含有する、請求項39〜41のいずれか一項に記載の使用。
【請求項44】
前記組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3のみから本質的になる、請求項43に記載の使用。
【請求項45】
前記組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項43に記載の使用。
【請求項46】
前記組成物が、約50〜1,000mgのチモサポニンA3、好ましくは約100〜800mgのチモサポニンA3、さらに好ましくは約200〜600mgのチモサポニンA3を含有する、請求項43〜45のいずれか一項に記載の使用。
【請求項47】
前記組成物が、約1〜100mgのチモサポニンA3、好ましくは約1〜50mgのチモサポニンA3、さらに好ましくは約1〜20mgのチモサポニンA3を含有する、請求項43〜45のいずれか一項に記載の使用。
【請求項48】
前記組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2のみから本質的になる、請求項47に記載の使用。
【請求項49】
前記組成物が、前記多細胞生物の癌を治療するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項47に記載の使用。
【請求項50】
前記組成物が、約50〜1,000mgのチモサポニンB2、好ましくは約100〜800mgのチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンB2を含有する、請求項48又は49に記載の使用。
【請求項51】
前記組成物が、約1〜100mgのチモサポニンB2、好ましくは約1〜50mgのチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンB2を含有する、請求項48又は49に記載の使用。
【請求項52】
前記医薬組成物が経口製剤である、請求項39〜51のいずれか一項に記載の使用。
【請求項53】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項39〜52のいずれか一項に記載の使用。
【請求項54】
前記多細胞生物がヒトである、請求項53に記載の使用。
【請求項55】
前記癌が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項53又は54に記載の使用。
【請求項56】
多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、チモサポニンA3とチモサポニンB2とを含有する有効量の医薬組成物を投与することからなる、方法。
【請求項57】
前記医薬組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2とのみから本質的になる、請求項56に記載の方法。
【請求項58】
前記医薬組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項56に記載の方法。
【請求項59】
前記医薬組成物が、総合重量で、約50〜1,000mgのチモサポニンA3とチモサポニンB2、好ましくは約100〜800mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンA3とチモサポニンB2を含有する、請求項56〜58のいずれか一項に記載の方法。
【請求項60】
前記医薬組成物が、総合重量で、約1〜100mgのチモサポニンA3とチモサポニンB2、好ましくは約1〜50mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンA3とチモサポニンB2を含有する、請求項56〜58のいずれか一項に記載の方法。
【請求項61】
多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、チモサポニンA3を含有する有効量の医薬組成物を投与することからなる、方法。
【請求項62】
前記医薬組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3のみから本質的になる、請求項61に記載の方法。
【請求項63】
前記医薬組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項61に記載の方法。
【請求項64】
前記医薬組成物が、約50〜1,000mgのチモサポニンA3、好ましくは約100〜800mgのチモサポニンA3、さらに好ましくは約200〜600mgのチモサポニンA3を含有する、請求項61〜63のいずれか一項に記載の方法。
【請求項65】
前記医薬組成物が、約1〜100mgのチモサポニンA3、好ましくは約1〜50mgのチモサポニンA3、さらに好ましくは約1〜20mgのチモサポニンA3を含有する、請求項61〜63のいずれか一項に記載の方法。
【請求項66】
多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、チモサポニンB2を含有する有効量の医薬組成物を投与することからなる、方法。
【請求項67】
前記医薬組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンB2のみから本質的になる、請求項66に記載の方法。
【請求項68】
前記医薬組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項66に記載の方法。
【請求項69】
前記医薬組成物が、約50〜1,000mgのチモサポニンB2、好ましくは約100〜800mgのチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンB2を含有する、請求項66〜68のいずれか一項に記載の方法。
【請求項70】
前記医薬組成物が、約1〜100mgのチモサポニンB2、好ましくは約1〜50mgのチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンB2を含有する、請求項66〜68のいずれか一項に記載の方法。
【請求項71】
前記医薬組成物が経口製剤である、請求項56〜70のいずれか一項に記載の方法。
【請求項72】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項56〜71のいずれか一項に記載の方法。
【請求項73】
前記多細胞生物がヒトである、請求項72に記載の方法。
【請求項74】
前記増殖細胞集団が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項71又は72に記載の方法。
【請求項75】
多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する医薬を製造するための、チモサポニンA3、チモサポニンB2、又はチモサポニンA3とチモサポニンB2の両方を含有する組成物の使用。
【請求項76】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2の両方のみから本質的になる、請求項75に記載の使用。
【請求項77】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項75に記載の使用。
【請求項78】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3とチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項75に記載の使用。
【請求項79】
前記組成物が、総合重量で、約50〜1,000mgのチモサポニンA3とチモサポニンB2、好ましくは約100〜800mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンA3とチモサポニンB2を含有する、請求項75〜78のいずれか一項に記載の使用。
【請求項80】
前記組成物が、総合重量で、約1〜100mgのチモサポニンA3とチモサポニンB2、好ましくは約1〜50mgのチモサポニンA3とチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンA3とチモサポニンB2を含有する、請求項75〜78のいずれか一項に記載の使用。
【請求項81】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3のみから本質的になる、請求項80に記載の使用。
【請求項82】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項75に記載の使用。
【請求項83】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンA3と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項75に記載の使用。
【請求項84】
前記組成物が、約50〜1,000mgのチモサポニンA3、好ましくは約100〜800mgのチモサポニンA3、さらに好ましくは約200〜600mgのチモサポニンA3を含有する、請求項81〜83のいずれか一項に記載の使用。
【請求項85】
前記組成物が、約1〜100mgのチモサポニンA3、好ましくは約1〜50mgのチモサポニンA3、さらに好ましくは約1〜20mgのチモサポニンA3を含有する、請求項81〜83のいずれか一項に記載の使用。
【請求項86】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンB2のみから本質的になる、請求項75に記載の使用。
【請求項87】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のチモサポニンB2と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項75に記載の使用。
【請求項88】
前記組成物が、約50〜1,000mgのチモサポニンB2、好ましくは約100〜800mgのチモサポニンB2、さらに好ましくは約200〜600mgのチモサポニンB2を含有する、請求項86〜87のいずれか一項に記載の使用。
【請求項89】
前記組成物が、約1〜100mgのチモサポニンB2、好ましくは約1〜50mgのチモサポニンB2、さらに好ましくは約1〜20mgのチモサポニンB2を含有する、請求項86〜87のいずれか一項に記載の使用。
【請求項90】
前記医薬組成物が経口製剤である、請求項75〜89のいずれか一項に記載の使用。
【請求項91】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項75〜90のいずれか一項に記載の使用。
【請求項92】
前記多細胞生物がヒトである、請求項91に記載の使用。
【請求項93】
前記癌が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項91又は92に記載の使用。
【請求項94】
多細胞生物の癌を治療するための組成物であって、前記多細胞生物の癌を治療するのに有効な量のハナスゲAnemarrhena asphodeloides Bungeの抽出物を投与することからなる、組成物。
【請求項95】
ハナスゲの抽出物のみから本質的になる、請求項94に記載の組成物。
【請求項96】
前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項94に記載の組成物。
【請求項97】
前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項94に記載の組成物。
【請求項98】
約50〜50,000mgのハナスゲの抽出物、好ましくは約1000〜40,000mgのハナスゲの抽出物、さらに好ましくは約2000〜35,000mgのハナスゲの抽出物を含有する、請求項94〜97のいずれか一項に記載の組成物。
【請求項99】
約100〜1000mgのハナスゲの抽出物、好ましくは約100〜500mgのハナスゲの抽出物、さらに好ましくは約10〜200mgのハナスゲの抽出物を含有する、請求項94〜97のいずれか一項に記載の組成物。
【請求項100】
前記医薬組成物が経口製剤である、請求項94〜99のいずれか一項に記載の組成物。
【請求項101】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項94〜100のいずれか一項に記載の組成物
【請求項102】
前記多細胞生物がヒトである、請求項101に記載の組成物。
【請求項103】
前記癌が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項101又は102に記載の組成物。
【請求項104】
多細胞生物の癌を治療する方法であって、前記多細胞生物に、ハナスゲの抽出物を含有する有効量の医薬組成物を投与することからなる、方法。
【請求項105】
前記医薬組成物が、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物のみから本質的になる、請求項104に記載の方法。
【請求項106】
前記医薬組成物が、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項104に記載の方法。
【請求項107】
前記医薬組成物が、約50〜50,000mgのハナスゲの抽出物、好ましくは約1000〜40,000mgのハナスゲの抽出物、さらに好ましくは約2000〜35,000mgのハナスゲの抽出物を含有する、請求項104〜106のいずれか一項に記載の方法。
【請求項108】
前記医薬組成物が、約100〜1000mgのハナスゲの抽出物、好ましくは約100〜500mgのハナスゲの抽出物、さらに好ましくは約10〜200mgのハナスゲの抽出物を含有する、請求項104〜106のいずれか一項に記載の方法。
【請求項109】
前記医薬組成物が経口製剤である、請求項104〜108のいずれか一項に記載の方法。
【請求項110】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項104〜109のいずれか一項に記載の方法。
【請求項111】
前記多細胞生物がヒトである、請求項110に記載の方法。
【請求項112】
前記癌が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項110又は111に記載の方法。
【請求項113】
多細胞生物の癌を治療する医薬を製造するための、ハナスゲの抽出物を含有する組成物の使用。
【請求項114】
前記組成物が、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物のみから本質的になる、請求項113に記載の使用。
【請求項115】
前記組成物が、前記多細胞生物の癌を治療するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項113に記載の使用。
【請求項116】
前記組成物が、総合重量で、約50〜50,000mgのハナスゲの抽出物、好ましくは約1000〜40,000mgのハナスゲの抽出物、さらに好ましくは約2000〜35,000mgのハナスゲの抽出物を含有する、請求項113〜115のいずれか一項に記載の使用。
【請求項117】
前記組成物が、総合重量で、約100〜1000mgのハナスゲの抽出物、好ましくは約100〜500mgのハナスゲの抽出物、さらに好ましくは約10〜200mgのハナスゲの抽出物を含有する、請求項113〜115のいずれか一項に記載の使用。
【請求項118】
前記医薬組成物が経口製剤である、請求項113〜117のいずれか一項に記載の使用。
【請求項119】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項113〜118のいずれか一項に記載の使用。
【請求項120】
前記多細胞生物がヒトである、請求項119に記載の使用。
【請求項121】
前記癌が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項119又は120に記載の使用。
【請求項122】
多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する方法であって、前記多細胞生物に、ハナスゲの抽出物を含有する有効量の医薬組成物を投与することからなる、方法。
【請求項123】
前記医薬組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のハナスゲの抽出物のみから本質的になる、請求項122に記載の方法。
【請求項124】
前記医薬組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項122に記載の方法。
【請求項125】
前記医薬組成物が、約50〜50,000mgのハナスゲの抽出物、好ましくは約1000〜40,000mgのハナスゲの抽出物、さらに好ましくは約2000〜35,000mgのハナスゲの抽出物を含有する、請求項122〜124のいずれか一項に記載の方法。
【請求項126】
前記医薬組成物が、約100〜1000mgのハナスゲの抽出物、好ましくは約100〜500mgのハナスゲの抽出物、さらに好ましくは約10〜200mgのハナスゲの抽出物を含有する、請求項122〜124のいずれか一項に記載の方法。
【請求項127】
前記医薬組成物が経口製剤である、請求項122〜126のいずれか一項に記載の方法。
【請求項128】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項122〜127のいずれか一項に記載の方法。
【請求項129】
前記多細胞生物がヒトである、請求項128に記載の方法。
【請求項130】
前記過剰増殖細胞集団が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項128又は129に記載の方法。
【請求項131】
多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導する医薬を製造するための、ハナスゲの抽出物を含有する組成物の使用。
【請求項132】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のハナスゲのみから本質的になる、請求項131に記載の使用。
【請求項133】
前記組成物が、前記多細胞生物の過剰増殖細胞集団においてアポトーシスを選択的に誘導するのに有効な量のハナスゲの抽出物と;賦形剤、結合剤、充填剤、希釈剤、カプセル形成剤、徐放剤、香味料及び風味マスキング剤からなる群の1つ又はそれ以上の構成要素とのみからなる、請求項131に記載の使用。
【請求項134】
前記組成物が、総合重量で、約50〜50,000mgのハナスゲの抽出物、好ましくは約1000〜40,000mgのハナスゲの抽出物、さらに好ましくは約2000〜35,000mgのハナスゲの抽出物を含有する、請求項131〜133のいずれか一項に記載の使用。
【請求項135】
前記組成物が、総合重量で、約100〜1000mgのハナスゲの抽出物、好ましくは約100〜500mgのハナスゲの抽出物、さらに好ましくは約10〜200mgのハナスゲの抽出物を含有する、請求項131〜133のいずれか一項に記載の使用。
【請求項136】
前記医薬組成物が経口製剤である、請求項131〜135のいずれか一項に記載の使用。
【請求項137】
前記多細胞生物がラット、マウス、ヒト、サル又はイヌである、請求項131〜136のいずれか一項に記載の使用。
【請求項138】
前記多細胞生物がヒトである、請求項137に記載の使用。
【請求項139】
前記癌が、骨癌、脳幹神経膠腫、乳癌、副腎皮質癌、肛門部癌、膀胱癌、内分泌系癌、食道癌、頭部又は頸部癌、腎臓癌または尿管癌、副甲状腺癌、陰茎癌、小腸癌、甲状腺癌、尿道癌、子宮頸癌、子宮内膜癌、卵管癌、腎盂癌、膣癌、外陰癌、慢性又は急性白血病、結腸癌、皮膚又は眼内黒色腫、神経膠腫、ホジキン病、肺癌、リンパ球性リンパ腫、中枢神経系(CNS)の新生物、卵巣癌、膵癌、下垂体腺腫、原発性CNSリンパ腫、前立腺癌、直腸癌、腎細胞癌、肉腫、例えば軟組織肉腫、皮膚癌、骨髄軸腫瘍、胃癌及び子宮癌からなる群から選択される、請求項137又は138に記載の使用。
【図1】


【図2】


【図3A】


【図3B】


【図4A】


【図4B】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15−1】


【図15−2】


【図15−3】




【図2】


【図3A】


【図3B】


【図4A】


【図4B】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15−1】


【図15−2】


【図15−3】


【公表番号】特表2012−500776(P2012−500776A)
【公表日】平成24年1月12日(2012.1.12)
【国際特許分類】
【出願番号】特願2011−504222(P2011−504222)
【出願日】平成21年4月10日(2009.4.10)
【国際出願番号】PCT/US2009/040269
【国際公開番号】WO2009/151762
【国際公開日】平成21年12月17日(2009.12.17)
【出願人】(507200569)バイオノボ・インコーポレーテッド (24)
【Fターム(参考)】
【公表日】平成24年1月12日(2012.1.12)
【国際特許分類】
【出願日】平成21年4月10日(2009.4.10)
【国際出願番号】PCT/US2009/040269
【国際公開番号】WO2009/151762
【国際公開日】平成21年12月17日(2009.12.17)
【出願人】(507200569)バイオノボ・インコーポレーテッド (24)
【Fターム(参考)】
[ Back to top ]

