ハーフエステルの合成方法
本発明は、エステルを加水分解する方法を提供するものであり、本発明が提供する方法によれば、第1のエステル部分及び第2のエステル部分を有する化合物Aについて、第1のエステル部分がカルボキシル部分に変換され、第2のエステル部分がそのまま残るように、MaXbの組成を有する塩基と、液状媒体中において反応させることにより行われる。なお、ここにおいて液状媒体中における比率[Xk−]:[A]が1.6以下であり、またk>0である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、一般的にはエステル類の化学合成方法に関し、詳細にはジエステルからハーフエステルを合成する方法に関する。
【背景技術】
【0002】
ハーフエステルは化学合成において非常に汎用性の高い合成構造単位であり、広範な最終化合物に対する有用な合成中間体である。ハーフエステル自身は、対称ジエステルの選択的モノ加水分解反応により、都合良く合成することができる。対称ジエステルの多くは安価な原料から容易に調製できるものであり、販売価格に見合った種々の品質のものが市販されており、ハーフエステルを中間体として経由する合成法は、経済的且つ汎用的な付加価値を高めるものである。
【0003】
ジエステルからハーフエステルを合成する確立された方法としては、鹸化及びアルカリ加水分解の両者が存在する。しかしながら、この方法を対称ジエステルからハーフエステルの調製に適用すると、出発原料であるジエステルにおける二つの同一の官能基を化学的に区別することが困難であることから、複雑化することとなる。その結果、この方法を適用した場合には、一般的には、ジカルボン酸、モノカルボン酸、及び出発原料であるジエステルの複雑な混合物が生成することとなってしまう。
ジカルボン酸や他の反応副生成物の生成による明白な収率ロスとはまた別に、化学的類似性からみて、これら反応副生成物から目的とするハーフエステルを分離することは困難である。事実、最近までは、文献に報告されている対称ジエステルからハーフエステルを合成する唯一の有効な方法は、酵素を用いた方法であった。しかしながら、かかる合成方法は、その反応性を予想することができない点で望ましいものとはいえない。
【0004】
更に最近になって、対称ジエステルからハーフエステルを製造する新たな合成ルートが提案されている。この方法は、ジエステルの選択的な加水分解と、それに引き続く酸性化によるものであり、副生成物の生成が比較的無く、溶液中で比較的高収率でハーフエステルを得る方法である(非特許文献1:S.ニワヤマ、「対称ジエステルの効率的、選択的モノ加水分解」、J. Org. Chem., 2000, 5834頁を参照)。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】S.ニワヤマ、「対称ジエステルの効率的、選択的モノ加水分解」、J. Org. Chem., 2000, 5834頁
【0006】
この方法は、以下の合成スキームIに要約することができる。
【0007】
(スキームI)
【0008】
【化1】

【図面の簡単な説明】
【0009】
【図1】ジエステルのモノ加水分解反応の時間依存性を示すグラフである。
【0010】
【図2】ジエステルのモノ加水分解反応の時間依存性を示すグラフである。
【発明の概要】
【0011】
本発明の一つの態様として、ジエステル類またはポリエステル類を加水分解して、カルボキシル部分及びエステル部分の両者を有するハーフエステル類または他の化合物を製造する方法が提供される。本方法は、第1及び第2のエステル部分を有する化合物Aに適用される。当該化合物Aは、第1のエステル部分がカルボキシル部分に変換され、第2のエステル部分がそのまま残るように、MaXbの組成を有する塩基と液状媒体中で反応することにより行われる。なお、ここにおいて、液状媒体中における比[Xk−]:[A]またはXのAに対する当量数が1.6以下であり、またXアニオンの価数をkとしたときk>0である。
【0012】
本発明の他の態様として、エステルの加水分解方法が提供され、当該方法は、第1及び第2のエステル部分を有する化合物において、化合物のモル当量数に対する塩基のモル当量数の比が1.6以下で、当該化合物を塩基と反応させることからなる。
【0013】
本発明の更なる態様として、エステルの加水分解方法が提供され、当該方法は、第1及び第2エステル部分を有する化合物を、93容量%より多い水を含む水性媒体中で当該化合物を塩基と反応させることからなる。
【0014】
本発明の更に別の態様として、エステルの加水分解方法が提供され、当該方法は、(a)第1及び第2のエステル部分を有する第1化合物に対して、(b)当該第1化合物のモル当量数に対する塩基のモル当量数の比が3より大きくなるように水性媒体中で当該化合物を塩基と反応させること、及び(c)総反応時間が90分以下となるように反応を終了させることからなる。
【発明を実施するための形態】
【0015】
上記した合成スキームIに要約された方法は、対称ジエステルから様々なハーフエステルを製造する非常に有効な合成方法であり、上記の非特許文献1において実施されているように、本方法は、ある種のハーフエステルに対して最適の収率が得られることが見出されている。例えば、上記の非特許文献1では、ビシクロヘプタジエンジメチルカルボキシレート及びビシクロヘプタジエンジエチルカルボキシレートの各ハーフエステルの製造において、99%以上の高い収率を報告している。しかしながらその一方で、本非特許文献1にあっては、コハク酸ジメチルのモノ加水分解によって形成されるモノエステルの生成はたった70%の収率であることを報告している。さらに上記非特許文献1において実施されているように、当該方法がマロン酸モノメチル等のある種の他のハーフエステルの合成に適用した場合には、はるかに低い収率でしか得られておらず、それはわずか22%である。
【0016】
上記の合成ルートにおけるある種のモノエステルの生成収率が、反応溶液中における塩基に対する出発原料のジエステルの比を調整すること、特に、溶液中の塩基の当量数(あるいは濃度)に対する出発原料のジエステルの当量数(あるいは濃度)の比を上げることで、著しく向上することを見出した。
したがって、例えば、この方法を用いることで、マロン酸ジメチルに対応するハーフエステルであるマロン酸モノメチルが、合成スキームIに要約された方法で得られるよりも実質的に高い収率(THF溶媒中では84%、アセトニトリル溶媒中では85%)で得られている。これらのパラメータを最適化することで、その収率はさらに向上することが期待される。
【0017】
また、あるケースの場合には、本発明が開示する合成方法論により、従来得られるものより、より安定な形態の目的化合物を製造することができることが判明した。したがって、例えば、文献ではマロン酸モノメチルとマロン酸モノエチルの両者は不安定であると報告されている(事実、マロン酸モノメチルは対応するカリウム塩として、しばしば市販されている)が、驚くべきことに、本発明が開示する方法にしたがって合成すれば、これらの化合物は実質的に安定性が向上することが判明した。
【0018】
本発明が開示する方法は、以下の合成スキームIIに記載した方法であると理解されたい。その合成スキームにおいて理解されるように、本発明の方法は、第1及び第2のエステル部分を有する化合物Aに適用されるものである。当該化合物Aを、第1のエステル部分がカルボキシル部分に変換され、第2のエステル部分はそのまま残るように、MaXbの組成を有する塩基と液状媒体中で反応させる。液状媒体中における比[Xk−]:[A](または場合によっては、Aに対する塩基の当量数)は、典型的には1.6以下であり(少なくとも直鎖状ジエステルの場合)、またk>0である。本反応は、その後酸性化することで、モノエステルが得られる。
【0019】
(スキームII)
【0020】
【化2】

【0021】
当該方法は、一般的に、第1及び第2のエステル基を有する化合物に適用することができ、またエステル基の一つをカルボン酸基に変換するのに使用することができる。第1及び第2のエステル基は同一または異なっていてもよい。したがって、R1及びR2は同一または異なっていてもよく、例えば、置換または非置換アルキル基、アリール基またはアルキルアリール基からなる群から独立的に選択されるものであってもよい。ある実施態様においては、出発原料のエステルは2個より多いエステル基を有していてもよい。しかしながら、本発明が提供する方法は、特に対称ジエステルからハーフエステルを合成するのに有用であることを理解されたい。これは上述したように、ハーフエステルを調製する従来の方法を対称ジエステルに適用すると、当該物質における二つのエステル基を化学的に区別しがたいことから、一般的には低収率となってしまうからである。そのようなハーフエステルとしては、例えば、マロン酸モノエチル、マロン酸モノプロピル、マロン酸モノブチルのようなマロン酸モノアルキルエステル、並びにアジピン酸モノアルキルエステル等が挙げられる。
【0022】
連結基Lは種々の鎖長を有するものであってよく、ある実施態様においては、例えばN、O、またはSなどの1以上のヘテロ原子を含んでいてもよい。当該連結基は、種々の官能基、芳香族基または不飽和基を包含していてもよく、これらの基は連結基の主鎖に含まれていてもよく、または有機連結基中の1以上の水素原子と置換されていてもよい。ある実施態様においては、Lは環式または多環式部分であってもよい。また、他の実施態様においては、Lは直鎖状部分であってもよい。
【0023】
好ましくは、Lは1〜10の炭素原子を含む連結基、または、式:−[CH2]n−(式中、nは整数である)の構造を有する連結基である。ある実施態様においては、nは非常に大きいものであってもよく、例えば100より大きく、さらには1000より大きなものであってもよい。しかしながら、通常は、nは1〜50程度の範囲であり、好ましくは、nは1〜20程度の範囲であり、さらに好ましくは、nは1〜10程度の範囲であり、最も好ましくは、nは1〜5の範囲である。
【0024】
本発明が提供する方法において用いられる塩基としては、好ましくは1以上の水酸基を有するものであり、さらに好ましくは金属水酸化物である。最も好ましくは、塩基としては、水酸化ナトリウム、水酸化カリウム、水酸化リチウム、又は水酸化セシウムのようなアルカリ金属水酸化物である。しかしながら、ある実施態様においては、2価あるいは多価金属水酸化物も用いることができる。その例としては、水酸化カルシウム、水酸化バリウム、水酸化マグネシウム、水酸化ストロンチウムなどである。また他の実施態様においては、水酸化アンモニウムやある種の有機水酸化物などのような非金属水酸化物であってもよい。
【0025】
本発明の方法において、塩基は、好ましくは反応溶液中に少量ずつ添加される。そのような手段としては、個別かつ複数のバッチに塩基を加える方法、連続的に塩基を滴下して加える方法、またはシリンジのような器具を用いて反応容器内にゆっくりと投入する方法で行うことができる。塩基の添加にあたっては、反応溶液を磁気攪拌棒(マグネチックスターラー)による攪拌、或いは他の適切な手段によって継続的に攪拌するのがよい。
【0026】
上記したように、液状媒体中における比[Xk−]:[A](または場合によっては、Aに対する塩基の当量数)は、少なくとも直鎖状のジエステルの場合には、典型的には1.6以下である。一般的に、この比は、約0.7〜約1.5の範囲内であり、より好ましくは約0.8〜約1.4の範囲内であり、さらに好ましくは約0.9〜約1.3の範囲内であり、最も好ましくは約1.0〜約1.2の範囲内である。
【0027】
環状エステル、または炭素−炭素結合の回転が阻害されているか、若しくは立体的な障害のあるエステルの場合(特に、エステル部分が、その様な結合の炭素原子に隣接して結合している場合)、またはハーフエステル若しくは部分加水分解エステルが塩基存在下にあって比較的安定である場合には、加水分解反応に際して、より多量の塩基を用いてもよい。そのような実施態様の場合、出発原料のエステルまたはジエステルのモル当量数に対する塩基のモル当量数の比は、直鎖状ジエステルの場合よりも大きなものであってもよい。その様な実施態様において用いる塩基の好ましい量は、塩基の種類、反応速度、塩基存在下におけるハーフエステル又は部分加水分解エステルの相対的な安定性、用いる反応媒体、反応媒体の温度などの要因に依存する。しかしながら、場合によっては、出発原料のエステルまたはジエステルのモル当量数に対する塩基のモル当量数の比は、例えば、3より大きく、5より大きく、7より大きく、または約10よりも大きくてもよい。
【0028】
反応時間もまた、多くの要因、例えば塩基の種類、反応速度、塩基存在下におけるハーフエステル又は部分加水分解エステルの相対的な安定性、用いる反応溶媒、反応溶媒の温度等の要因に依存して変化させてもよく、反応は、所望の反応時間経過後に終了させることができる。しかしながら、一般的には、反応時間は90分以下であり、好ましくは約60分以下である。さらに好ましくは、反応時間は約10分〜約60分の範囲内であり、最も好ましくは、反応時間は約20分〜約60分の範囲内である。
【0029】
反応溶液は、塩基を添加する際、またはその後しばらくの間のいずれかの間、冷却されるのが好ましい。これは例えば、反応容器を氷浴のような冷却浴に浸すことで行うことできる。一般的に、反応溶液は室温未満の温度、好ましくは15℃未満、より好ましくは10℃未満、さらに好ましくは5℃未満に冷却される。好ましくは、反応溶液は約−15℃〜約15℃の範囲内の温度に冷却され、より好ましくは約−10℃〜約10℃の範囲内の温度に、さらに好ましくは約−5℃〜約5℃の範囲内の温度に冷却される。最も好ましくは、反応溶液は約0℃に冷却される。しかしながら、特別な場合における最適な温度は、反応物質、溶媒系又は液状媒体の選択、所望の生成物などの要因に依存しうることを理解されたい。
【0030】
用いる反応溶液としては、好ましくはTHFと塩基の水溶液との混合物である。しかしながら、他の溶媒、共溶媒または液状媒体を上記混合物の代わりに、またはそれと組み合わせて用いてもよいことを理解されたい。したがって、例えば反応は、THF、CH3CN、CH2Cl2、メタノール、エタノール、1−プロパノール、2−プロパノール、DMSO及び前記した様々な混合物を含んでなる液状媒体中で行うことができる。ある実施態様においては水を唯一の溶媒又は液状媒体として用いることができ、その様な実施態様においては、特に環境に優しい化学の適用分野において望ましいものである。一般的に、反応媒体は少なくとも70容量%の水を含むことができる。好ましくは、反応媒体は少なくとも80容量%の水を含んでなり、さらに好ましくは少なくとも90容量%の水を含んでなり、最も好ましくは少なくとも約93容量%の水を含むことができる。しかしながら、ある実施態様においては、水の容量をさらに高くすることができ、その様な実施態様においては、反応媒体は少なくとも約97容量%の水を、また少なくとも約99容量%の水を、または実質的に100容量%の水を含むことができる。
【0031】
塩基との反応が完了した後、反応溶液は酸性化される。本発明が提供する方法における種々の実施態様において、その目的のためには様々な酸を用いてもよいが、好ましくは、HClを用いて行われる。また、その様な他の酸としては、特に限定されないが、硫酸、硝酸及び種々のカルボン酸を挙げることができる。
【0032】
これらの材料の調製は特に限定されないが、本発明が提供する方法は、特にマロン酸、アジピン酸、コハク酸、グルタル酸、及び他の直鎖状ジエステルのモノエステルを調製する際に有用であるが、これに限定されない。下記の合成スキームIIIには、本発明が提供する方法によるマロン酸モノメチルの合成例を説明し、また同様の方法により調製することができる他のマロン酸モノエステルの化学構造を示した。
【0033】
(スキームIII)
【0034】
【化3】

【0035】
以下に、限定する意図のない具体的な例を説明することにより、本発明が開示、提供する方法の特徴を説明する。
【0036】
[比較例1]
【0037】
この比較例は、S.ニワヤマ、「対称ジエステルの効率的、選択的モノ加水分解」、J. Org. Chem., 2000, 65, 5834-5836頁に報告されている方法による、マロン酸モノメチルの合成を説明するものである。
【0038】
マロン酸ジメチル(1.2mmol)をTHF2mLに溶解し、水20mLを加えた。反応混合物を氷水浴に浸し0℃に冷却した。薄層クロマトグラフィーにて出発原料のジエステルの消費が検出されるまで、この反応混合物に0.25MのNaOH8mLを少量ずつ攪拌しながら加えた。反応を約30〜60分間、同じ温度で攪拌することにより行い、反応混合物を0℃で1MのHClで酸性とした。NaClにより飽和溶液とし、酢酸エチルで3〜4回抽出し、硫酸ナトリウムで乾燥した。抽出溶媒を減圧濃縮し、酢酸エチルを溶離液として用いたシリカゲルカラムクロマトグラフィーで精製することにより、ハーフエステルであるマロン酸モノメチルを22%の収率で得た。
【0039】
[実施例1]
【0040】
この実施例は、本発明の方法によるマロン酸モノメチルの合成を説明するものであり、比較例1に対して反応収率の点における改善を説明するものである。
【0041】
マロン酸ジメチル(159mg、1.20mmol)をTHF2mLに溶解し、水20mLを加えた。反応混合物を氷水浴中で0℃に冷却した。この混合物に、表3に示す各当量の0.25MのNaOH、KOH、またはLiOH水溶液を加えた。各々のケースにおいて、塩基は攪拌しながら滴下して加えた。反応混合物を30〜60分間攪拌した後、0℃で1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出溶媒を減圧下で濃縮し、ヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを典型的な溶離液として用いたシリカゲルカラムクロマトグラフィーで精製し、マロン酸モノメチルを得た。収量は119mg(84%)であり、比較例1の収率より62%向上した。
【0042】
[実施例2〜9]
【0043】
これらの実施例は、本発明の方法によるモノエステルを合成する際の溶媒系の影響を説明するものであり、特にTHFの比率変化による反応収率への効果を説明する。
【0044】
古典的な鹸化と、本発明におけるモノ加水分解反応の好ましい実施態様との間の顕著な相違点は、反応媒体である。特に、従来の固体塩基とアルコール系媒体の使用に対するものとして、0℃にてTHF水溶液媒体中に、好ましい実施態様としてNaOH、またはKOH水溶液を用いることにより、実質的により純粋な反応混合物を作り出すことができる。
【0045】
以上の観点から、本反応系における溶媒の影響について、THFの比率を変化させて検討を行った。特に、ビシクロ[2.2.1]ヘプト−2,5−ジエン−2,3−ジカルボン酸ジメチルの選択的モノ加水分解において(下記合成スキームIV)、共溶媒としてのTHFの比率を下記表1に記載するように変更して、S.ニワヤマ、J. Org. Chem., 2000, 65, 5834-5836頁に報告されている全般的な条件を追試した。
【0046】
表1に示した結果から明らかなように、THFの比率を7%未満としても、反応速度は顕著には影響を受けていない。一方、THFの比率を増やすと、反応速度は著しく低下し、収率が下がった。理論的な点は別にして、この結果はTHFの水への溶解性を反映するものと考えられ、THFの比率が上がるとカルボメトキシ基がNaOH水溶液に曝されることが減ることによるものと考えられる。
【0047】
表1:環状ジエステルのモノ加水分解におけるTHF量(容量)の影響
【0048】
【表1】

【0049】
a:ハーフエステルの単離収率。回収されたジエステルはカッコ内に示す。
b:実験の部における手順Bによって得られる。
c:実験の部における手順Cによって得られる。
d:S.ニワヤマ、J. Org. Chem., 2000, 65, 5834頁において報告されているものと同一条件。
【0050】
(スキームIV)
【0051】
【化4】

【0052】
[実施例10〜16]
【0053】
これらの実施例は、本発明の方法におけるモノエステルの合成に対する溶媒系の影響を説明するものであり、特に、共溶媒の変化による収率及び反応速度への効果を説明する。
【0054】
ビシクロ[2.2.1]ヘプト−2,5−ジエン−2,3−ジカルボン酸ジメチルの選択的モノ加水分解において(下記、合成スキームV)、上記の実施例7と同様の7%共溶媒と反応温度の一般的な条件を用いて、様々な共溶媒について検討を行った。その結果を、以下の表2に示す。
【0055】
これらの結果から明らかなように、水との混和性がほとんど無い塩化メチレンは著しく反応速度を低下させるものであり、カルボアルコキシ基がNaOH水溶液に曝されることが減る結果によるものであることが再び考えられた。この結果は、表1に示したように、THFの割合を増やした場合と同様である。他方、水との混和性が小さい、或いはある程度大きい共溶媒の他の検討では、反応速度は著しく変化していないようである。ハーフエステルの単離収率は、THF、アセトニトリルあるいは共溶媒無しの場合が最も高く、アルコールを共溶媒として用いた場合には若干低下した。これらの結果から、収率が低下したのは少量の対応する二価酸(ジカルボン酸)が形成したためか、及び/又は生成物を抽出することが困難であるためであろうと考えられる。全体としては、本実施例において検討された溶媒の中で、THF及びアセトニトリルが選択的モノ加水分解反応に対して最もよい共溶媒であるといえる。
【0056】
理論的な点は別にして、上記の結果と実施例2〜9の結果を共に考えると、(a)反応混合物中で少量のTHF、またはアセトニトリルが多量の水に溶解し、それによって一つの水相を形成し、(b)ジエステルが第2相として反応に関与し、(c)水相とジエステルとの間の接触面においてモノ加水分解が起きる、ということを示唆しているように見受けられる。共溶媒としてのTHF、またはアセトニトリルの主たる役割は、反応媒体全体にわたって、よりスムースに出発原料のジエステルを分散することであるように思われる。この役割は出発原料のジエステルが固体である場合に特に有効である。
【0057】
この溶媒効果を、同様にマロン酸誘導体のジエステルの選択的モノ加水分解に適用した。その結果、THFの代わりにアセトニトリルを用いると、ハーフエステルの収率が若干改善されることが判明した。
【0058】
近年、水を媒体とする反応は、環境に優しい化学(グリーンケミストリー)における環境に優しい反応として重要になりつつある。本発明が提供する反応は、非対称化反応に適用される水を媒体とする反応の最初の例示であると考えられる。
【0059】
表2:マロン酸ジメチルのモノ加水分解における共溶媒の影響
【0060】
【表2】

【0061】
a:ハーフエステルの単離収率。回収されたジエステルはカッコ内に示す。
b:実験の部における手順Bによって得られる。
c:実験の部における手順Cによって得られる。
d:S.ニワヤマ、J. Org. Chem., 2000, 65, 5834頁において報告されているものと同一条件。
【0062】
(スキームV)
【0063】
【化5】

【0064】
[実施例17〜25]
【0065】
これらの実施例は、本発明が提供するタイプのモノ加水分解反応において、異なる当量で用いる、異なる塩基の収率に対する効果を説明するものである。
【0066】
マロン酸ジメチルの選択的モノ加水分解を、S.ニワヤマ、J. Org. Chem., 2000, 65, 5834-5836頁に報告されている条件にしたがって行ったところ、対応するハーフエステルが22%しか得られなかった。理論的な点は別にして、この結果は出発原料のジエステルの理想的な配座の欠如に加え、脱カルボキシル化と塩基の過剰使用による可能性があると考えられる。そこで、マロン酸ジメチルのモノ加水分解(下記、合成スキームVI)における、様々なアルカリ金属水酸化物を、様々な量で用いた場合(1.2、1.0又は0.8当量)における反応収率に対する効果を調査した。反応操作は、上記した方法と同様である。上記と同様に、その結果を下記表3に塩基の種類、当量、反応時間としてまとめて示す。
【0067】
表3:塩基の収率への影響
【0068】
【表3】

【0069】
a:ハーフエステルの単離収率。回収されたジエステルの量はカッコ内に示す(%)。
【0070】
(スキームVI)
【0071】
【化6】

【0072】
これらの結果が示すように、同等の選択性において、反応性はKOHを用いるとNaOHより若干高くなり、一方、LiOHは選択性、反応性共に若干低くなった。これらの反応において、ハーフエステル及びジエステルの単離収率によれば、二価酸(マロン酸)が少量形成される可能性はあるが、処理段階では抽出されなかった。この結果は、この化合物の小さな疎水性部分によるものかもしれないが、本反応の利点の一つを示すものである。本モノ加水分解反応の生成物であるマロン酸モノメチル(実施例54参照)は、これらの中でも最も多く有機合成に適用される。この方法は、わずか約1時間の反応時間で、マロン酸モノメチルの非常に実用的な合成であるように見受けられ、モノ加水分解の合成的有用性を説明するものである。
【0073】
[実施例26〜37]
【0074】
これらの実施例では、より高濃度でのマロン酸ジメチルのモノ加水分解に対する共溶媒と塩基のタイプ及び当量数の効果を説明するものである。
【0075】
実施例37は、以下の手順(合成スキームVII)にしたがって実施した。
マグネチックスターラーを備えた1Lの一口フラスコに、158.33g(1.2mol)のマロン酸ジメチルを入れ、10mLのアセトニトリルを加えてマロン酸ジメチルを溶解させた。溶液を1分間攪拌した後、反応混合物を氷水浴で0℃に冷却した。この混合物に、100mLの水を加え、30分間攪拌した。この反応混合物に、5MのKOH水溶液(1.2mol)の240mLを、滴下ロートを用いて攪拌しながら15分間に渡って滴下して加えた(5MのKOH溶液は0.5Mシュウ酸20mLで滴定した。シュウ酸はマリンクロット社(ミズーリ州、ヘーゼルウッド)から購入した)。添加が完了した後、反応混合物は更に60分間攪拌した。攪拌中は、ストッパーで覆いをして、氷水浴中に保持した。
【0076】
反応混合物を、氷水浴中で12MのHCl水溶液150mLで酸性とし、NaClで飽和化させ、1Lの分液ロートを用いて500mLの酢酸エチルで5回抽出した。抽出液を飽和NaCl水溶液500mLで洗浄した。酢酸エチル抽出液を約100gの無水硫酸ナトリウムで乾燥した。乾燥剤を重力濾過で濾別した後、酢酸エチル溶液をロータリーエバポレータで濃縮し、さらに2.5mmHgの減圧下で蒸留した。沸点91〜92℃の画分を集め、無色オイルとしてマロン酸モノメチルを得た。収率は114.77g(81%)であり、45℃でマロン酸ジメチル4%を回収し、マロン酸1%が検出された。
【0077】
実施例26〜36は、実施例37の一般的な手順を用い、また以下の表4に記した部分的に変更された反応条件を用いて実施した。
【0078】
表4:より高濃度条件下でのマロン酸ジメチルの加水分解
【0079】
【表4】

【0080】
(スキームVII)
【0081】
【化7】

【0082】
[実施例38〜53]
【0083】
これらの実施例は、塩基としてNaOHまたはKOH水溶液を用いてマロン酸ジアルキル及びその誘導体の幅広い範囲において、本発明の方法が適用されることを説明するものである。
【0084】
実施例1の方法を、下記表5に示す様々なジエステルを用いて繰り返した。その結果を表5に要約した。なお、これらのジエステルの大部分は市販されている。また、いくつかのジエステルは標準的なフィッシャーのエステル合成法にしたがって調製した。
【0085】
複雑な黄色の反応混合物を生成しがちな古典的モノ鹸化反応とは異なり、これらの反応の全ての場合において、純粋なハーフエステルのみが生成し、そして(まれなケースではあるが)出発物質、及びもし生成しているのであれば、二価酸(ジカルボン酸)が回収された。いくつかのケースにおいては、生成したハーフエステルと回収したジエステルの収率からみれば、少量の二価酸が生成しているようであるが、これらの二価酸は、反応混合物の処理段階では抽出されなかった。生成したハーフエステルは、全てにおいて非常に高い純度であり、元素分析でシャープな結果を得た。いずれのモノ加水分解反応においても脱カルボキシル化された生成物は検出されなかった。
【0086】
全体として、下記表5に示した結果から判明するように、KOHはNaOHよりも反応性が高く、また若干選択性が高い傾向にある。この傾向はフェニルマロン酸ジエチルのモノ加水分解(実施例50〜51)において最もよく認められたものであった。同じジエステルのモノ加水分解に際して、NaOHを用いて得た以前の結果と比べて、KOHを用いると反応性及び選択性共に向上したことを示した(上記参照)。
【0087】
下記の表5の結果では、選択性は分子の疎水性に従って高くなることを示している。例えば、ジエステルのモノ加水分解と比較して、ハーフエステルの収率は、より疎水性の高いエステル基に従って高くなっている(表5、実施例50〜53参照)。ハーフエステルの収率は、分子中にメチル基またはフェニル基が導入されると、さらに高くなる(実施例42〜53参照)。理論的な点は別として、このモノ加水分解反応においては、疎水性置換基同士の引き合いにより形成したアグリゲートが、さらなる加水分解を保護していると考えられていることから、2つの同一のエステル基のモノ加水分解においては、分子の残りの部分内で分子間及び/又は分子内疎水性引力相互作用が、この高選択性に重要な役割を担いうると考えられる。したがって、この傾向によってそのような可能性のある疎水性相互作用を説明しうる。
【0088】
前記した見解に対する唯一の例外は、フェニルマロン酸ジプロピルのモノ加水分解の場合である(実施例52及び53)。この結果は、反応時間の長さによるものと考えられ、時として対応する二価酸が明らかに単離された。ここで、THFの代わりに共溶媒としてアセトニトリル(水と若干混和性を有する別の弱極性非プロトン性溶媒)を使用することで、若干反応時間を早めることができ、約10%ハーフエステルの収率を高めることができた。なお、以前に、このモノ加水分解における共溶媒の影響を検討しており、水と若干の混和性を有する弱極性非プロトン性溶媒が、有効な共溶媒となり得ることを見出している。また、いくつかの嵩高い基の導入は、この選択性に対する好ましい配置を阻害する可能性もある。
【0089】
表5:ジエステルの加水分解
【0090】
【表5】

【0091】
a:ハーフエステルの単離収率。回収されたジエステルの量はカッコ内に示す(%)。
b:共溶媒としてTHFの代わりにアセトニトリルを使用した。
【0092】
要約すれば、一連のマロン酸ジアルキル及びその誘導体の選択的モノ加水分解に対する優れた実用的条件として、0℃にて、共溶媒としてTHFまたはアセトニトリルを用い、KOHまたはNaOH水溶液を使用することが見出された。その場合の収率は、以前に報告されている収率の中で、最も高いものである。生成した全てのハーフエステルは優れた純度を示しており、長期間にわたり安定であった。また、一般的に選択性は、エステル基の疎水性が高くなるにつれ高くなっていることが判明した。このような傾向からみて、疎水性引力相互作用がこの選択性において重要な役割を担いうることを示している。
【0093】
[実施例54]
【0094】
本実施例は、マロン酸モノメチルの合成を説明するものである。
【0095】
マグネチックスターラーを備えた100mLの一口フラスコに、マロン酸ジメチル(アクロスケミカルズ社より購入)を15.833g(0.12mol)を入れ、THF1mLを加えてこのマロン酸ジメチルを溶解させた。1分間攪拌した後、反応混合物を氷水浴にて0℃に冷却した。この混合物に10mLの水を加えて30分間攪拌した。この反応混合物に5MのNaOH水溶液(97%純度;EMDケミカルス社(ニュージャージー州、ギブスタウン)より)の26.4mL(1.1当量)を攪拌下に5分間にわたり滴下して加えた。滴下完了後、反応混合物を更に30分間攪拌した。攪拌中は、ストッパーで覆いをして、氷水浴中に保持した。
【0096】
反応混合物を、氷水浴中で6MのHCl水溶液30mLにて酸性とし、NaClで飽和させ、250mLの分液ロートを用い、50mLの酢酸エチルで5回抽出した。酢酸エチル抽出液を飽和NaCl水溶液50mLで洗浄し、約10gの無水硫酸ナトリウムで乾燥した。乾燥剤を重力濾過で濾別した後、酢酸エチル溶液をロータリーエバポレータで濃縮し、さらに2.5mmHgの減圧下で蒸留した。沸点91〜92℃の画分を集め、無色オイルとしてマロン酸モノメチルを得た。収率は82%であった。
【0097】
マロン酸モノメチル:オイル状物質。
1H NMR(300MHz、CDCl3)δ:3.47(2H,s),3.79(3H,s),11.4(1H,br.s)、
13C NMR(75MHz、CDCl3)δ:40.50,52.50,167.03,171.46、
IR(neat,cm−1):1741,1746,2960−3185、
元素分析:計算値(C4H6O4):C,40.68;H,5.12、測定値:C,40.51;H,5.34。
【0098】
[実施例55]
【0099】
本実施例は、マロン酸モノエチルの合成を説明するものである。
【0100】
THF2mLにマロン酸ジエチル(192mg,1.2mmol)を溶解し、水20mLを加えた。反応混合物を氷水浴にて0℃に冷却し、この混合物に0.25MのNaOH水溶液又はKOH水溶液の指示当量分を、攪拌しながら滴下して加えた。反応混合物を1時間攪拌し、0℃にて1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出物を減圧下で濃縮し、残渣を、初めにヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、マロン酸モノエチルを得た。
【0101】
マロン酸モノエチル:オイル状物質。
1H NMR(300MHz、CDCl3)δ:1.31(3H,t,J=7.2),3.44(2H,s),4.25(2H,q,J=7.2),10.62(1H,br.s)、
13C NMR(75MHz、CDCl3)δ:13.90,40.78,61.90,166.87,171.48、
IR(neat,cm−1):1736,1741,2914−3182、
元素分析:計算値(C5H8O4):C,45.46;H,6.10、測定値:C,45.83;H,6.30。
【0102】
[実施例56]
【0103】
本実施例は、マロン酸モノプロピルの合成を説明するものである。
【0104】
THF2mLにマロン酸ジプロピル(226mg,1.2mmol)を溶解し、水20mLを加えた。反応混合物を氷水浴にて0℃に冷却し、この混合物に0.25MのNaOH水溶液又はKOH水溶液の指示当量分を、攪拌しながら滴下して加えた。反応混合物を30分から1時間攪拌し、0℃にて1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出液を減圧下で濃縮し、残渣を、初めにヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、マロン酸モノプロピルを得た。
【0105】
マロン酸モノプロピル:オイル状物質。
1H NMR(300MHz、CDCl3)δ:0.96(3H,t,J=7.7),1.70(2H,m),3.46(2H,s),4.15(2H,q,J=7.2),10.18(1H,br.s)、
13C NMR(75MHz、CDCl3)δ:10.12,21.69,40.89,67.42,166.81,171.74、
IR(neat,cm−1)1723,1740,2883−3181、
元素分析:計算値(C6H10O4):C,49.31;H,6.90、測定値:C,49.43;H,7.14。
【0106】
[実施例57]
【0107】
本実施例はメチルマロン酸モノメチルの合成を説明するものである。
【0108】
THF2mLにメチルマロン酸ジメチル(175mg,1.2mmol)を溶解し、水20mLを加えた。反応混合物を氷水浴にて0℃に冷却し、この混合物に0.25MのNaOH水溶液又はKOH水溶液の1.2当量を、攪拌しながら滴下して加えた。反応混合物を1.5時間攪拌し、0℃にて1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出液を減圧下で濃縮し、残渣を、初めにヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、メチルマロン酸モノメチルを得た。
【0109】
メチルマロン酸モノメチル:オイル状物質。
1H NMR(300MHz、CDCl3)δ:1.43(3H,t,J=7.2),3.47(1H,q,J=7.2),3.73(3H,s),9.42(1H,br.s);
13C NMR(75MHz、CDCl3)δ:13.08,45.45,52.39,170.16,175.38、
IR(neat,cm−1)1721,1739,2956−3202、
元素分析:計算値(C5H8O4):C,45.46;H,6.10、測定値:C,45.65;H,5.94。
【0110】
[実施例58]
【0111】
本実施例は、メチルマロン酸モノエチルの合成を説明するものである。
【0112】
THF2mLにメチルマロン酸ジエチル(209mg,1.2mmol)を溶解し、水20mLを加えた。反応混合物を氷水浴にて0℃に冷却し、この混合物に0.25MのNaOH水溶液又はKOH水溶液の1.2当量を、攪拌しながら滴下して加えた。反応混合物を1.5時間攪拌し、0℃にて1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出液を減圧下で濃縮し、残渣を、初めにヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、メチルマロン酸モノエチルを得た。
【0113】
メチルマロン酸モノエチル:オイル状物質。
1H NMR(300MHz、CDCl3)δ:1.24(3H,t,J=7.2),1.40(3H,d,J=7.5),3.44(1H,q,J=7.2),4.18(2H,q,J=7.2),11.21(1H,br.s)、
13C NMR(75MHz、CDCl3)δ:13.44,13.90,45.93,61.70,169.83,176.00、
IR(neat,cm−1)1722,1735,2946−3200、
元素分析:計算値(C6H10O4):C,49.31;H,6.90、測定値:C,49.68;H,6.75。
【0114】
[実施例59]
【0115】
本実施例は、メチルマロン酸モノプロピルの合成を説明するものである。
【0116】
THF2mLにメチルマロン酸ジプロピル(243mg,1.2mmol)を溶解し、水20mLを加えた。反応混合物を氷水浴にて0℃に冷却し、この混合物に0.25MのNaOH水溶液又はKOH水溶液の1.2当量を、攪拌しながら滴下して加えた。反応混合物を1時間45分攪拌し、0℃にて1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出液を減圧下で濃縮し、残渣を、初めにヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、メチルマロン酸モノプロピルを得た。
【0117】
メチルマロン酸モノプロピル:オイル状物質。
1H NMR(300MHz、CDCl3)δ:0.90(3H,t,J=7.5),1.42(3H,d,J=7.2),1.64(2H,m),3.46(1H,q,J=7.2),4.09(2H,q,J=7.2),10.62(1H,br.s)、
13C NMR(75MHz、CDCl3)δ:10.17,13.51,21.77,45.94,67.24,169.93,175.96、
IR(neat,cm−1)1717,1739,2883−2971、
元素分析:計算値(C7H12O4):C,52.49;H,7.55、測定値:C,52.74;H,7.49。
【0118】
[実施例60]
【0119】
本実施例は、フェニルマロン酸モノメチルの合成を説明するものである。
【0120】
THF2mLにフェニルマロン酸ジメチル(250mg,1.2mmol)を溶解し、水20mLを加えた。反応混合物を氷水浴にて0℃に冷却し、この混合物に0.25MのNaOH水溶液又はKOH水溶液の1.2当量を、攪拌しながら滴下して加えた。反応混合物を1時間攪拌し、0℃にて1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出液を減圧下で濃縮し、残渣を、初めにヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、フェニルマロン酸モノメチルを得た。
【0121】
フェニルマロン酸モノメチル:白色固体、融点92〜93℃、
1H NMR(300MHz、CDCl3)δ:3.75(3H,s),4.65(2H,s),7.4(5H,m),9.0(1H,br.s)、
13C NMR(75MHz、CDCl3)δ:53.06,57.33,128.55,128.77,129.15,131.96,168.59,173.25、
IR(neat,cm−1)1717,1740,2956−3212、
元素分析:計算値(C10H10O4):C,61.85;H,5.19、測定値:C,61.92;H,5.40。
【0122】
[実施例61]
【0123】
本実施例はフェニルマロン酸モノエチルの合成を説明するものである。
【0124】
THF2mLにフェニルマロン酸ジメチル(284mg,1.2mmol)を溶解し、水20mLを加えた。反応混合物を氷水浴にて0℃に冷却し、この混合物に0.25MのNaOH水溶液又はKOH水溶液の1.2当量を、攪拌しながら滴下して加えた。反応混合物を5時間攪拌し、0℃にて1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出液を減圧下で濃縮し、残渣を、初めにヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、フェニルマロン酸モノエチルを得た。
【0125】
フェニルマロン酸モノエチル:白色固体、融点74℃(文献値:76−77℃)。
1H NMR(300MHz、CDCl3)δ:1.25(3H,t,J=7.2),4.24(2H,q,J=7.2),4.65(1H,s),7.4(5H,m),9.78(1H,br.s)、
13C NMR(75MHz、CDCl3)δ:13.81,57.51,62.10,128.39,128.62,129.13,132.01,167.95,173.84、
IR(neat,cm−1)1717,1737,2941−3190、
元素分析:計算値(C11H12O4):C,63.45;H,5.81、測定値:C,63.30;H,5.80。
【0126】
[実施例62]
【0127】
本実施例は、フェニルマロン酸モノプロピルの合成を説明するものである。
【0128】
アセトニトリル2mLにフェニルマロン酸ジプロピル(317mg,1.2mmol)を溶解し、水20mLを加えた。反応混合物を冷却室内、氷水浴にて0℃に冷却した。この混合物に0.25MのNaOH水溶液又はKOH水溶液の0.8当量を、攪拌しながら滴下して加えた。反応混合物を4℃に維持しながら33時間冷却室内で攪拌し、0℃にて1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出液を減圧下で濃縮し、残渣を、初めにヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、フェニルマロン酸モノプロピルを得た。
【0129】
フェニルマロン酸モノプロピル:オイル状物質。
1H NMR(300MHz、CDCl3)δ:0.87(3H,t,J=7.5),1.64(2H,m,J=7.2),4.11(2H,m),4.64(1H,s),7.4(5H,m),8.02(1H,br.s)、
13C NMR(75MHz、CDCl3)δ:10.15,21.74,57.47,67.72,128.48,128.74,129.12,132.21,168.41,173.07、
IR(neat,cm−1)1717,1736,2881−3067、
元素分析:計算値(C12H14O4):C,64.85;H,6.35、測定値:C,65.17;H,6.61。
【0130】
[実施例63〜65]
【0131】
これらの実施例は、エステル基の疎水性が与える反応時間に対する効果を説明するものである。
【0132】
以下に示す一般的な反応条件を用いて、順に疎水性が高くなるアルキル基を有する一連のハーフエステルを調製し(合成スキームVIII)、エステル部分の一連の類似体に対する反応時間を検討した。その結果を以下の表6に示す。
【0133】
表6:カルボキシル基の疎水性の効果
【0134】
【表6】

【0135】
(スキームVIII)
【0136】
【化8】

【0137】
これらの結果から明らかなように、アルキル基Rの疎水性が高くなるにつれ、反応時間が対応して長くなっていった。本反応に用いた環状ジエステルの場合には、反応時間は塩基を追加することで、生成物の収率の顕著な減少を伴うことなく、短くすることができる(後記の実施例82を参照)。これに対して、例えばマロン酸ジアルキルエステルやアジピン酸ジアルキルエステルのような直鎖状ジエステルの場合には、塩基を追加すると生成物の収率の減少を引き起こすことが観察された。
【0138】
[実施例66〜81]
【0139】
これらの実施例は、二価酸(ジカルボン酸)とハーフエステルとの生成比率に及ぼす、反応時間並びに塩基の選択における効果を説明するものである。
【0140】
以下の合成スキームIXに示す加水分解反応において、種々の塩基を使用した。生成した二価酸(ジカルボン酸)に対するハーフエステルの比率は、1H NMRスペクトルによって求め、その結果を以下の表7〜表10に示す。
【0141】
(スキームIX)
【0142】
【化9】

【0143】
表7:塩基としてLiOHを用いた場合の反応時間
【0144】
【表7】

【0145】
表8:塩基としてNaOHを用いた場合の反応時間
【0146】
【表8】

【0147】
表9:塩基としてKOHを用いた場合の反応時間
【0148】
【表9】

【0149】
表10:塩基としてCsOHを用いた場合の反応時間
【0150】
【表10】

【0151】
これらの結果から明らかなように、検討した上記の直鎖状ジエステルの場合においては、反応時間がある時間以上長くなると、ハーフエステルの生成量が減少し、二価酸(ジカルボン酸)の生成量が増えるものであった。この結果は、検討した上記の塩基4種の全てで観察されていた。
【0152】
[実施例82]
【0153】
この実施例は、環状ジエステルのモノ加水分解の時間依存性を説明するものである。
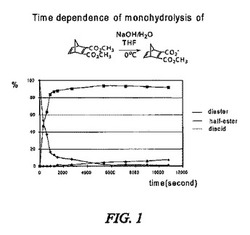
【0154】
ビシクロ[2.2.1]ヘプト−2,5−ジエン−2,3−ジカルボン酸ジメチル(1.2mmol)をTHF2mLに溶解し、水20mLを加えた。反応混合物を氷水浴に浸して0℃に冷却し、この混合物に攪拌下に、0.25MのNaOH水溶液8mLを少量ずつ加えた。混合物の反応を、一定時間毎に終結させ、その時間の生成物を1H NMRで観察した。生成したジエステル、ハーフエステル及び二価酸(ジカルボン酸)に帰属されるピークに対応する積分曲線により、ジエステル、ハーフエステル及び二価酸(ジカルボン酸)の生成モル比を算出した。その結果を図1に示す。
【0155】
図中に示した結果から明らかなように、ビシクロ[2.2.1]ヘプト−2,5−ジエン−2,3−ジカルボン酸ジメチルの加水分解の場合には、反応は実質的に完結しており(この点は、原料のジエステルの残量で示される)、ハーフエステルの生成量は、経時的に若干減少しており、それに伴い、二価酸(ジカルボン酸)の生成量が経時的に若干増加しているのみであった。
他の環状エステルにおいても同様の結果が観察された。これらの結果から、このタイプのハーフエステルは比較的塩基に対して安定であることが示唆された。
【0156】
[実施例83〜86]
【0157】
これらの実施例は、直鎖状ジエステルのモノ加水分解の時間依存性を説明するものである。
【0158】
上記のビシクロ[2.2.1]ヘプト−2,5−ジエン−2,3−ジカルボン酸ジメチルに代えてアジピン酸ジメチルを用い、また、4種の異なる当量の塩基(0.7,1.0,1.2及び1.5)を用いること以外は、実施例82と同様に実施した。生成したジエステル、ハーフエステル及び二価酸(ジカルボン酸)に対応するピークをHPLCで観察し、対応する生成比率を図2に示すようにプロットした。
【0159】
図中に示した結果から明らかなように、使用する塩基の量が増えるに従って、二価酸(ジカルボン酸)の収率も高くなった。
他の直鎖状ジエステルのモノ加水分解においても同様の結果が観察された。これらの結果から、このタイプのハーフエステルは、実施例82で検討されたタイプの環状ジエステルよりも塩基に対して安定性が低いことが示唆された。
したがって、環状ジエステルの場合には、塩基をさらに追加することで生成物収率に顕著な悪影響を与えることなく反応速度を高めることが可能であるが、直鎖状ジエステルの場合には、そのようなことは当てはまらないものといえる。
【0160】
上記した本発明の開示内容は、例示的なものであって、これに限定することを意図していない。
したがって、本発明の範囲を逸脱することなく様々な付加、置換、変更を行い得るものであることを理解すべきであり、本発明の範囲は、添付の請求の範囲を参照して解釈されるものである。
【技術分野】
【0001】
本発明は、一般的にはエステル類の化学合成方法に関し、詳細にはジエステルからハーフエステルを合成する方法に関する。
【背景技術】
【0002】
ハーフエステルは化学合成において非常に汎用性の高い合成構造単位であり、広範な最終化合物に対する有用な合成中間体である。ハーフエステル自身は、対称ジエステルの選択的モノ加水分解反応により、都合良く合成することができる。対称ジエステルの多くは安価な原料から容易に調製できるものであり、販売価格に見合った種々の品質のものが市販されており、ハーフエステルを中間体として経由する合成法は、経済的且つ汎用的な付加価値を高めるものである。
【0003】
ジエステルからハーフエステルを合成する確立された方法としては、鹸化及びアルカリ加水分解の両者が存在する。しかしながら、この方法を対称ジエステルからハーフエステルの調製に適用すると、出発原料であるジエステルにおける二つの同一の官能基を化学的に区別することが困難であることから、複雑化することとなる。その結果、この方法を適用した場合には、一般的には、ジカルボン酸、モノカルボン酸、及び出発原料であるジエステルの複雑な混合物が生成することとなってしまう。
ジカルボン酸や他の反応副生成物の生成による明白な収率ロスとはまた別に、化学的類似性からみて、これら反応副生成物から目的とするハーフエステルを分離することは困難である。事実、最近までは、文献に報告されている対称ジエステルからハーフエステルを合成する唯一の有効な方法は、酵素を用いた方法であった。しかしながら、かかる合成方法は、その反応性を予想することができない点で望ましいものとはいえない。
【0004】
更に最近になって、対称ジエステルからハーフエステルを製造する新たな合成ルートが提案されている。この方法は、ジエステルの選択的な加水分解と、それに引き続く酸性化によるものであり、副生成物の生成が比較的無く、溶液中で比較的高収率でハーフエステルを得る方法である(非特許文献1:S.ニワヤマ、「対称ジエステルの効率的、選択的モノ加水分解」、J. Org. Chem., 2000, 5834頁を参照)。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】S.ニワヤマ、「対称ジエステルの効率的、選択的モノ加水分解」、J. Org. Chem., 2000, 5834頁
【0006】
この方法は、以下の合成スキームIに要約することができる。
【0007】
(スキームI)
【0008】
【化1】

【図面の簡単な説明】
【0009】
【図1】ジエステルのモノ加水分解反応の時間依存性を示すグラフである。
【0010】
【図2】ジエステルのモノ加水分解反応の時間依存性を示すグラフである。
【発明の概要】
【0011】
本発明の一つの態様として、ジエステル類またはポリエステル類を加水分解して、カルボキシル部分及びエステル部分の両者を有するハーフエステル類または他の化合物を製造する方法が提供される。本方法は、第1及び第2のエステル部分を有する化合物Aに適用される。当該化合物Aは、第1のエステル部分がカルボキシル部分に変換され、第2のエステル部分がそのまま残るように、MaXbの組成を有する塩基と液状媒体中で反応することにより行われる。なお、ここにおいて、液状媒体中における比[Xk−]:[A]またはXのAに対する当量数が1.6以下であり、またXアニオンの価数をkとしたときk>0である。
【0012】
本発明の他の態様として、エステルの加水分解方法が提供され、当該方法は、第1及び第2のエステル部分を有する化合物において、化合物のモル当量数に対する塩基のモル当量数の比が1.6以下で、当該化合物を塩基と反応させることからなる。
【0013】
本発明の更なる態様として、エステルの加水分解方法が提供され、当該方法は、第1及び第2エステル部分を有する化合物を、93容量%より多い水を含む水性媒体中で当該化合物を塩基と反応させることからなる。
【0014】
本発明の更に別の態様として、エステルの加水分解方法が提供され、当該方法は、(a)第1及び第2のエステル部分を有する第1化合物に対して、(b)当該第1化合物のモル当量数に対する塩基のモル当量数の比が3より大きくなるように水性媒体中で当該化合物を塩基と反応させること、及び(c)総反応時間が90分以下となるように反応を終了させることからなる。
【発明を実施するための形態】
【0015】
上記した合成スキームIに要約された方法は、対称ジエステルから様々なハーフエステルを製造する非常に有効な合成方法であり、上記の非特許文献1において実施されているように、本方法は、ある種のハーフエステルに対して最適の収率が得られることが見出されている。例えば、上記の非特許文献1では、ビシクロヘプタジエンジメチルカルボキシレート及びビシクロヘプタジエンジエチルカルボキシレートの各ハーフエステルの製造において、99%以上の高い収率を報告している。しかしながらその一方で、本非特許文献1にあっては、コハク酸ジメチルのモノ加水分解によって形成されるモノエステルの生成はたった70%の収率であることを報告している。さらに上記非特許文献1において実施されているように、当該方法がマロン酸モノメチル等のある種の他のハーフエステルの合成に適用した場合には、はるかに低い収率でしか得られておらず、それはわずか22%である。
【0016】
上記の合成ルートにおけるある種のモノエステルの生成収率が、反応溶液中における塩基に対する出発原料のジエステルの比を調整すること、特に、溶液中の塩基の当量数(あるいは濃度)に対する出発原料のジエステルの当量数(あるいは濃度)の比を上げることで、著しく向上することを見出した。
したがって、例えば、この方法を用いることで、マロン酸ジメチルに対応するハーフエステルであるマロン酸モノメチルが、合成スキームIに要約された方法で得られるよりも実質的に高い収率(THF溶媒中では84%、アセトニトリル溶媒中では85%)で得られている。これらのパラメータを最適化することで、その収率はさらに向上することが期待される。
【0017】
また、あるケースの場合には、本発明が開示する合成方法論により、従来得られるものより、より安定な形態の目的化合物を製造することができることが判明した。したがって、例えば、文献ではマロン酸モノメチルとマロン酸モノエチルの両者は不安定であると報告されている(事実、マロン酸モノメチルは対応するカリウム塩として、しばしば市販されている)が、驚くべきことに、本発明が開示する方法にしたがって合成すれば、これらの化合物は実質的に安定性が向上することが判明した。
【0018】
本発明が開示する方法は、以下の合成スキームIIに記載した方法であると理解されたい。その合成スキームにおいて理解されるように、本発明の方法は、第1及び第2のエステル部分を有する化合物Aに適用されるものである。当該化合物Aを、第1のエステル部分がカルボキシル部分に変換され、第2のエステル部分はそのまま残るように、MaXbの組成を有する塩基と液状媒体中で反応させる。液状媒体中における比[Xk−]:[A](または場合によっては、Aに対する塩基の当量数)は、典型的には1.6以下であり(少なくとも直鎖状ジエステルの場合)、またk>0である。本反応は、その後酸性化することで、モノエステルが得られる。
【0019】
(スキームII)
【0020】
【化2】

【0021】
当該方法は、一般的に、第1及び第2のエステル基を有する化合物に適用することができ、またエステル基の一つをカルボン酸基に変換するのに使用することができる。第1及び第2のエステル基は同一または異なっていてもよい。したがって、R1及びR2は同一または異なっていてもよく、例えば、置換または非置換アルキル基、アリール基またはアルキルアリール基からなる群から独立的に選択されるものであってもよい。ある実施態様においては、出発原料のエステルは2個より多いエステル基を有していてもよい。しかしながら、本発明が提供する方法は、特に対称ジエステルからハーフエステルを合成するのに有用であることを理解されたい。これは上述したように、ハーフエステルを調製する従来の方法を対称ジエステルに適用すると、当該物質における二つのエステル基を化学的に区別しがたいことから、一般的には低収率となってしまうからである。そのようなハーフエステルとしては、例えば、マロン酸モノエチル、マロン酸モノプロピル、マロン酸モノブチルのようなマロン酸モノアルキルエステル、並びにアジピン酸モノアルキルエステル等が挙げられる。
【0022】
連結基Lは種々の鎖長を有するものであってよく、ある実施態様においては、例えばN、O、またはSなどの1以上のヘテロ原子を含んでいてもよい。当該連結基は、種々の官能基、芳香族基または不飽和基を包含していてもよく、これらの基は連結基の主鎖に含まれていてもよく、または有機連結基中の1以上の水素原子と置換されていてもよい。ある実施態様においては、Lは環式または多環式部分であってもよい。また、他の実施態様においては、Lは直鎖状部分であってもよい。
【0023】
好ましくは、Lは1〜10の炭素原子を含む連結基、または、式:−[CH2]n−(式中、nは整数である)の構造を有する連結基である。ある実施態様においては、nは非常に大きいものであってもよく、例えば100より大きく、さらには1000より大きなものであってもよい。しかしながら、通常は、nは1〜50程度の範囲であり、好ましくは、nは1〜20程度の範囲であり、さらに好ましくは、nは1〜10程度の範囲であり、最も好ましくは、nは1〜5の範囲である。
【0024】
本発明が提供する方法において用いられる塩基としては、好ましくは1以上の水酸基を有するものであり、さらに好ましくは金属水酸化物である。最も好ましくは、塩基としては、水酸化ナトリウム、水酸化カリウム、水酸化リチウム、又は水酸化セシウムのようなアルカリ金属水酸化物である。しかしながら、ある実施態様においては、2価あるいは多価金属水酸化物も用いることができる。その例としては、水酸化カルシウム、水酸化バリウム、水酸化マグネシウム、水酸化ストロンチウムなどである。また他の実施態様においては、水酸化アンモニウムやある種の有機水酸化物などのような非金属水酸化物であってもよい。
【0025】
本発明の方法において、塩基は、好ましくは反応溶液中に少量ずつ添加される。そのような手段としては、個別かつ複数のバッチに塩基を加える方法、連続的に塩基を滴下して加える方法、またはシリンジのような器具を用いて反応容器内にゆっくりと投入する方法で行うことができる。塩基の添加にあたっては、反応溶液を磁気攪拌棒(マグネチックスターラー)による攪拌、或いは他の適切な手段によって継続的に攪拌するのがよい。
【0026】
上記したように、液状媒体中における比[Xk−]:[A](または場合によっては、Aに対する塩基の当量数)は、少なくとも直鎖状のジエステルの場合には、典型的には1.6以下である。一般的に、この比は、約0.7〜約1.5の範囲内であり、より好ましくは約0.8〜約1.4の範囲内であり、さらに好ましくは約0.9〜約1.3の範囲内であり、最も好ましくは約1.0〜約1.2の範囲内である。
【0027】
環状エステル、または炭素−炭素結合の回転が阻害されているか、若しくは立体的な障害のあるエステルの場合(特に、エステル部分が、その様な結合の炭素原子に隣接して結合している場合)、またはハーフエステル若しくは部分加水分解エステルが塩基存在下にあって比較的安定である場合には、加水分解反応に際して、より多量の塩基を用いてもよい。そのような実施態様の場合、出発原料のエステルまたはジエステルのモル当量数に対する塩基のモル当量数の比は、直鎖状ジエステルの場合よりも大きなものであってもよい。その様な実施態様において用いる塩基の好ましい量は、塩基の種類、反応速度、塩基存在下におけるハーフエステル又は部分加水分解エステルの相対的な安定性、用いる反応媒体、反応媒体の温度などの要因に依存する。しかしながら、場合によっては、出発原料のエステルまたはジエステルのモル当量数に対する塩基のモル当量数の比は、例えば、3より大きく、5より大きく、7より大きく、または約10よりも大きくてもよい。
【0028】
反応時間もまた、多くの要因、例えば塩基の種類、反応速度、塩基存在下におけるハーフエステル又は部分加水分解エステルの相対的な安定性、用いる反応溶媒、反応溶媒の温度等の要因に依存して変化させてもよく、反応は、所望の反応時間経過後に終了させることができる。しかしながら、一般的には、反応時間は90分以下であり、好ましくは約60分以下である。さらに好ましくは、反応時間は約10分〜約60分の範囲内であり、最も好ましくは、反応時間は約20分〜約60分の範囲内である。
【0029】
反応溶液は、塩基を添加する際、またはその後しばらくの間のいずれかの間、冷却されるのが好ましい。これは例えば、反応容器を氷浴のような冷却浴に浸すことで行うことできる。一般的に、反応溶液は室温未満の温度、好ましくは15℃未満、より好ましくは10℃未満、さらに好ましくは5℃未満に冷却される。好ましくは、反応溶液は約−15℃〜約15℃の範囲内の温度に冷却され、より好ましくは約−10℃〜約10℃の範囲内の温度に、さらに好ましくは約−5℃〜約5℃の範囲内の温度に冷却される。最も好ましくは、反応溶液は約0℃に冷却される。しかしながら、特別な場合における最適な温度は、反応物質、溶媒系又は液状媒体の選択、所望の生成物などの要因に依存しうることを理解されたい。
【0030】
用いる反応溶液としては、好ましくはTHFと塩基の水溶液との混合物である。しかしながら、他の溶媒、共溶媒または液状媒体を上記混合物の代わりに、またはそれと組み合わせて用いてもよいことを理解されたい。したがって、例えば反応は、THF、CH3CN、CH2Cl2、メタノール、エタノール、1−プロパノール、2−プロパノール、DMSO及び前記した様々な混合物を含んでなる液状媒体中で行うことができる。ある実施態様においては水を唯一の溶媒又は液状媒体として用いることができ、その様な実施態様においては、特に環境に優しい化学の適用分野において望ましいものである。一般的に、反応媒体は少なくとも70容量%の水を含むことができる。好ましくは、反応媒体は少なくとも80容量%の水を含んでなり、さらに好ましくは少なくとも90容量%の水を含んでなり、最も好ましくは少なくとも約93容量%の水を含むことができる。しかしながら、ある実施態様においては、水の容量をさらに高くすることができ、その様な実施態様においては、反応媒体は少なくとも約97容量%の水を、また少なくとも約99容量%の水を、または実質的に100容量%の水を含むことができる。
【0031】
塩基との反応が完了した後、反応溶液は酸性化される。本発明が提供する方法における種々の実施態様において、その目的のためには様々な酸を用いてもよいが、好ましくは、HClを用いて行われる。また、その様な他の酸としては、特に限定されないが、硫酸、硝酸及び種々のカルボン酸を挙げることができる。
【0032】
これらの材料の調製は特に限定されないが、本発明が提供する方法は、特にマロン酸、アジピン酸、コハク酸、グルタル酸、及び他の直鎖状ジエステルのモノエステルを調製する際に有用であるが、これに限定されない。下記の合成スキームIIIには、本発明が提供する方法によるマロン酸モノメチルの合成例を説明し、また同様の方法により調製することができる他のマロン酸モノエステルの化学構造を示した。
【0033】
(スキームIII)
【0034】
【化3】

【0035】
以下に、限定する意図のない具体的な例を説明することにより、本発明が開示、提供する方法の特徴を説明する。
【0036】
[比較例1]
【0037】
この比較例は、S.ニワヤマ、「対称ジエステルの効率的、選択的モノ加水分解」、J. Org. Chem., 2000, 65, 5834-5836頁に報告されている方法による、マロン酸モノメチルの合成を説明するものである。
【0038】
マロン酸ジメチル(1.2mmol)をTHF2mLに溶解し、水20mLを加えた。反応混合物を氷水浴に浸し0℃に冷却した。薄層クロマトグラフィーにて出発原料のジエステルの消費が検出されるまで、この反応混合物に0.25MのNaOH8mLを少量ずつ攪拌しながら加えた。反応を約30〜60分間、同じ温度で攪拌することにより行い、反応混合物を0℃で1MのHClで酸性とした。NaClにより飽和溶液とし、酢酸エチルで3〜4回抽出し、硫酸ナトリウムで乾燥した。抽出溶媒を減圧濃縮し、酢酸エチルを溶離液として用いたシリカゲルカラムクロマトグラフィーで精製することにより、ハーフエステルであるマロン酸モノメチルを22%の収率で得た。
【0039】
[実施例1]
【0040】
この実施例は、本発明の方法によるマロン酸モノメチルの合成を説明するものであり、比較例1に対して反応収率の点における改善を説明するものである。
【0041】
マロン酸ジメチル(159mg、1.20mmol)をTHF2mLに溶解し、水20mLを加えた。反応混合物を氷水浴中で0℃に冷却した。この混合物に、表3に示す各当量の0.25MのNaOH、KOH、またはLiOH水溶液を加えた。各々のケースにおいて、塩基は攪拌しながら滴下して加えた。反応混合物を30〜60分間攪拌した後、0℃で1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出溶媒を減圧下で濃縮し、ヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを典型的な溶離液として用いたシリカゲルカラムクロマトグラフィーで精製し、マロン酸モノメチルを得た。収量は119mg(84%)であり、比較例1の収率より62%向上した。
【0042】
[実施例2〜9]
【0043】
これらの実施例は、本発明の方法によるモノエステルを合成する際の溶媒系の影響を説明するものであり、特にTHFの比率変化による反応収率への効果を説明する。
【0044】
古典的な鹸化と、本発明におけるモノ加水分解反応の好ましい実施態様との間の顕著な相違点は、反応媒体である。特に、従来の固体塩基とアルコール系媒体の使用に対するものとして、0℃にてTHF水溶液媒体中に、好ましい実施態様としてNaOH、またはKOH水溶液を用いることにより、実質的により純粋な反応混合物を作り出すことができる。
【0045】
以上の観点から、本反応系における溶媒の影響について、THFの比率を変化させて検討を行った。特に、ビシクロ[2.2.1]ヘプト−2,5−ジエン−2,3−ジカルボン酸ジメチルの選択的モノ加水分解において(下記合成スキームIV)、共溶媒としてのTHFの比率を下記表1に記載するように変更して、S.ニワヤマ、J. Org. Chem., 2000, 65, 5834-5836頁に報告されている全般的な条件を追試した。
【0046】
表1に示した結果から明らかなように、THFの比率を7%未満としても、反応速度は顕著には影響を受けていない。一方、THFの比率を増やすと、反応速度は著しく低下し、収率が下がった。理論的な点は別にして、この結果はTHFの水への溶解性を反映するものと考えられ、THFの比率が上がるとカルボメトキシ基がNaOH水溶液に曝されることが減ることによるものと考えられる。
【0047】
表1:環状ジエステルのモノ加水分解におけるTHF量(容量)の影響
【0048】
【表1】

【0049】
a:ハーフエステルの単離収率。回収されたジエステルはカッコ内に示す。
b:実験の部における手順Bによって得られる。
c:実験の部における手順Cによって得られる。
d:S.ニワヤマ、J. Org. Chem., 2000, 65, 5834頁において報告されているものと同一条件。
【0050】
(スキームIV)
【0051】
【化4】

【0052】
[実施例10〜16]
【0053】
これらの実施例は、本発明の方法におけるモノエステルの合成に対する溶媒系の影響を説明するものであり、特に、共溶媒の変化による収率及び反応速度への効果を説明する。
【0054】
ビシクロ[2.2.1]ヘプト−2,5−ジエン−2,3−ジカルボン酸ジメチルの選択的モノ加水分解において(下記、合成スキームV)、上記の実施例7と同様の7%共溶媒と反応温度の一般的な条件を用いて、様々な共溶媒について検討を行った。その結果を、以下の表2に示す。
【0055】
これらの結果から明らかなように、水との混和性がほとんど無い塩化メチレンは著しく反応速度を低下させるものであり、カルボアルコキシ基がNaOH水溶液に曝されることが減る結果によるものであることが再び考えられた。この結果は、表1に示したように、THFの割合を増やした場合と同様である。他方、水との混和性が小さい、或いはある程度大きい共溶媒の他の検討では、反応速度は著しく変化していないようである。ハーフエステルの単離収率は、THF、アセトニトリルあるいは共溶媒無しの場合が最も高く、アルコールを共溶媒として用いた場合には若干低下した。これらの結果から、収率が低下したのは少量の対応する二価酸(ジカルボン酸)が形成したためか、及び/又は生成物を抽出することが困難であるためであろうと考えられる。全体としては、本実施例において検討された溶媒の中で、THF及びアセトニトリルが選択的モノ加水分解反応に対して最もよい共溶媒であるといえる。
【0056】
理論的な点は別にして、上記の結果と実施例2〜9の結果を共に考えると、(a)反応混合物中で少量のTHF、またはアセトニトリルが多量の水に溶解し、それによって一つの水相を形成し、(b)ジエステルが第2相として反応に関与し、(c)水相とジエステルとの間の接触面においてモノ加水分解が起きる、ということを示唆しているように見受けられる。共溶媒としてのTHF、またはアセトニトリルの主たる役割は、反応媒体全体にわたって、よりスムースに出発原料のジエステルを分散することであるように思われる。この役割は出発原料のジエステルが固体である場合に特に有効である。
【0057】
この溶媒効果を、同様にマロン酸誘導体のジエステルの選択的モノ加水分解に適用した。その結果、THFの代わりにアセトニトリルを用いると、ハーフエステルの収率が若干改善されることが判明した。
【0058】
近年、水を媒体とする反応は、環境に優しい化学(グリーンケミストリー)における環境に優しい反応として重要になりつつある。本発明が提供する反応は、非対称化反応に適用される水を媒体とする反応の最初の例示であると考えられる。
【0059】
表2:マロン酸ジメチルのモノ加水分解における共溶媒の影響
【0060】
【表2】

【0061】
a:ハーフエステルの単離収率。回収されたジエステルはカッコ内に示す。
b:実験の部における手順Bによって得られる。
c:実験の部における手順Cによって得られる。
d:S.ニワヤマ、J. Org. Chem., 2000, 65, 5834頁において報告されているものと同一条件。
【0062】
(スキームV)
【0063】
【化5】

【0064】
[実施例17〜25]
【0065】
これらの実施例は、本発明が提供するタイプのモノ加水分解反応において、異なる当量で用いる、異なる塩基の収率に対する効果を説明するものである。
【0066】
マロン酸ジメチルの選択的モノ加水分解を、S.ニワヤマ、J. Org. Chem., 2000, 65, 5834-5836頁に報告されている条件にしたがって行ったところ、対応するハーフエステルが22%しか得られなかった。理論的な点は別にして、この結果は出発原料のジエステルの理想的な配座の欠如に加え、脱カルボキシル化と塩基の過剰使用による可能性があると考えられる。そこで、マロン酸ジメチルのモノ加水分解(下記、合成スキームVI)における、様々なアルカリ金属水酸化物を、様々な量で用いた場合(1.2、1.0又は0.8当量)における反応収率に対する効果を調査した。反応操作は、上記した方法と同様である。上記と同様に、その結果を下記表3に塩基の種類、当量、反応時間としてまとめて示す。
【0067】
表3:塩基の収率への影響
【0068】
【表3】

【0069】
a:ハーフエステルの単離収率。回収されたジエステルの量はカッコ内に示す(%)。
【0070】
(スキームVI)
【0071】
【化6】

【0072】
これらの結果が示すように、同等の選択性において、反応性はKOHを用いるとNaOHより若干高くなり、一方、LiOHは選択性、反応性共に若干低くなった。これらの反応において、ハーフエステル及びジエステルの単離収率によれば、二価酸(マロン酸)が少量形成される可能性はあるが、処理段階では抽出されなかった。この結果は、この化合物の小さな疎水性部分によるものかもしれないが、本反応の利点の一つを示すものである。本モノ加水分解反応の生成物であるマロン酸モノメチル(実施例54参照)は、これらの中でも最も多く有機合成に適用される。この方法は、わずか約1時間の反応時間で、マロン酸モノメチルの非常に実用的な合成であるように見受けられ、モノ加水分解の合成的有用性を説明するものである。
【0073】
[実施例26〜37]
【0074】
これらの実施例では、より高濃度でのマロン酸ジメチルのモノ加水分解に対する共溶媒と塩基のタイプ及び当量数の効果を説明するものである。
【0075】
実施例37は、以下の手順(合成スキームVII)にしたがって実施した。
マグネチックスターラーを備えた1Lの一口フラスコに、158.33g(1.2mol)のマロン酸ジメチルを入れ、10mLのアセトニトリルを加えてマロン酸ジメチルを溶解させた。溶液を1分間攪拌した後、反応混合物を氷水浴で0℃に冷却した。この混合物に、100mLの水を加え、30分間攪拌した。この反応混合物に、5MのKOH水溶液(1.2mol)の240mLを、滴下ロートを用いて攪拌しながら15分間に渡って滴下して加えた(5MのKOH溶液は0.5Mシュウ酸20mLで滴定した。シュウ酸はマリンクロット社(ミズーリ州、ヘーゼルウッド)から購入した)。添加が完了した後、反応混合物は更に60分間攪拌した。攪拌中は、ストッパーで覆いをして、氷水浴中に保持した。
【0076】
反応混合物を、氷水浴中で12MのHCl水溶液150mLで酸性とし、NaClで飽和化させ、1Lの分液ロートを用いて500mLの酢酸エチルで5回抽出した。抽出液を飽和NaCl水溶液500mLで洗浄した。酢酸エチル抽出液を約100gの無水硫酸ナトリウムで乾燥した。乾燥剤を重力濾過で濾別した後、酢酸エチル溶液をロータリーエバポレータで濃縮し、さらに2.5mmHgの減圧下で蒸留した。沸点91〜92℃の画分を集め、無色オイルとしてマロン酸モノメチルを得た。収率は114.77g(81%)であり、45℃でマロン酸ジメチル4%を回収し、マロン酸1%が検出された。
【0077】
実施例26〜36は、実施例37の一般的な手順を用い、また以下の表4に記した部分的に変更された反応条件を用いて実施した。
【0078】
表4:より高濃度条件下でのマロン酸ジメチルの加水分解
【0079】
【表4】

【0080】
(スキームVII)
【0081】
【化7】

【0082】
[実施例38〜53]
【0083】
これらの実施例は、塩基としてNaOHまたはKOH水溶液を用いてマロン酸ジアルキル及びその誘導体の幅広い範囲において、本発明の方法が適用されることを説明するものである。
【0084】
実施例1の方法を、下記表5に示す様々なジエステルを用いて繰り返した。その結果を表5に要約した。なお、これらのジエステルの大部分は市販されている。また、いくつかのジエステルは標準的なフィッシャーのエステル合成法にしたがって調製した。
【0085】
複雑な黄色の反応混合物を生成しがちな古典的モノ鹸化反応とは異なり、これらの反応の全ての場合において、純粋なハーフエステルのみが生成し、そして(まれなケースではあるが)出発物質、及びもし生成しているのであれば、二価酸(ジカルボン酸)が回収された。いくつかのケースにおいては、生成したハーフエステルと回収したジエステルの収率からみれば、少量の二価酸が生成しているようであるが、これらの二価酸は、反応混合物の処理段階では抽出されなかった。生成したハーフエステルは、全てにおいて非常に高い純度であり、元素分析でシャープな結果を得た。いずれのモノ加水分解反応においても脱カルボキシル化された生成物は検出されなかった。
【0086】
全体として、下記表5に示した結果から判明するように、KOHはNaOHよりも反応性が高く、また若干選択性が高い傾向にある。この傾向はフェニルマロン酸ジエチルのモノ加水分解(実施例50〜51)において最もよく認められたものであった。同じジエステルのモノ加水分解に際して、NaOHを用いて得た以前の結果と比べて、KOHを用いると反応性及び選択性共に向上したことを示した(上記参照)。
【0087】
下記の表5の結果では、選択性は分子の疎水性に従って高くなることを示している。例えば、ジエステルのモノ加水分解と比較して、ハーフエステルの収率は、より疎水性の高いエステル基に従って高くなっている(表5、実施例50〜53参照)。ハーフエステルの収率は、分子中にメチル基またはフェニル基が導入されると、さらに高くなる(実施例42〜53参照)。理論的な点は別として、このモノ加水分解反応においては、疎水性置換基同士の引き合いにより形成したアグリゲートが、さらなる加水分解を保護していると考えられていることから、2つの同一のエステル基のモノ加水分解においては、分子の残りの部分内で分子間及び/又は分子内疎水性引力相互作用が、この高選択性に重要な役割を担いうると考えられる。したがって、この傾向によってそのような可能性のある疎水性相互作用を説明しうる。
【0088】
前記した見解に対する唯一の例外は、フェニルマロン酸ジプロピルのモノ加水分解の場合である(実施例52及び53)。この結果は、反応時間の長さによるものと考えられ、時として対応する二価酸が明らかに単離された。ここで、THFの代わりに共溶媒としてアセトニトリル(水と若干混和性を有する別の弱極性非プロトン性溶媒)を使用することで、若干反応時間を早めることができ、約10%ハーフエステルの収率を高めることができた。なお、以前に、このモノ加水分解における共溶媒の影響を検討しており、水と若干の混和性を有する弱極性非プロトン性溶媒が、有効な共溶媒となり得ることを見出している。また、いくつかの嵩高い基の導入は、この選択性に対する好ましい配置を阻害する可能性もある。
【0089】
表5:ジエステルの加水分解
【0090】
【表5】

【0091】
a:ハーフエステルの単離収率。回収されたジエステルの量はカッコ内に示す(%)。
b:共溶媒としてTHFの代わりにアセトニトリルを使用した。
【0092】
要約すれば、一連のマロン酸ジアルキル及びその誘導体の選択的モノ加水分解に対する優れた実用的条件として、0℃にて、共溶媒としてTHFまたはアセトニトリルを用い、KOHまたはNaOH水溶液を使用することが見出された。その場合の収率は、以前に報告されている収率の中で、最も高いものである。生成した全てのハーフエステルは優れた純度を示しており、長期間にわたり安定であった。また、一般的に選択性は、エステル基の疎水性が高くなるにつれ高くなっていることが判明した。このような傾向からみて、疎水性引力相互作用がこの選択性において重要な役割を担いうることを示している。
【0093】
[実施例54]
【0094】
本実施例は、マロン酸モノメチルの合成を説明するものである。
【0095】
マグネチックスターラーを備えた100mLの一口フラスコに、マロン酸ジメチル(アクロスケミカルズ社より購入)を15.833g(0.12mol)を入れ、THF1mLを加えてこのマロン酸ジメチルを溶解させた。1分間攪拌した後、反応混合物を氷水浴にて0℃に冷却した。この混合物に10mLの水を加えて30分間攪拌した。この反応混合物に5MのNaOH水溶液(97%純度;EMDケミカルス社(ニュージャージー州、ギブスタウン)より)の26.4mL(1.1当量)を攪拌下に5分間にわたり滴下して加えた。滴下完了後、反応混合物を更に30分間攪拌した。攪拌中は、ストッパーで覆いをして、氷水浴中に保持した。
【0096】
反応混合物を、氷水浴中で6MのHCl水溶液30mLにて酸性とし、NaClで飽和させ、250mLの分液ロートを用い、50mLの酢酸エチルで5回抽出した。酢酸エチル抽出液を飽和NaCl水溶液50mLで洗浄し、約10gの無水硫酸ナトリウムで乾燥した。乾燥剤を重力濾過で濾別した後、酢酸エチル溶液をロータリーエバポレータで濃縮し、さらに2.5mmHgの減圧下で蒸留した。沸点91〜92℃の画分を集め、無色オイルとしてマロン酸モノメチルを得た。収率は82%であった。
【0097】
マロン酸モノメチル:オイル状物質。
1H NMR(300MHz、CDCl3)δ:3.47(2H,s),3.79(3H,s),11.4(1H,br.s)、
13C NMR(75MHz、CDCl3)δ:40.50,52.50,167.03,171.46、
IR(neat,cm−1):1741,1746,2960−3185、
元素分析:計算値(C4H6O4):C,40.68;H,5.12、測定値:C,40.51;H,5.34。
【0098】
[実施例55]
【0099】
本実施例は、マロン酸モノエチルの合成を説明するものである。
【0100】
THF2mLにマロン酸ジエチル(192mg,1.2mmol)を溶解し、水20mLを加えた。反応混合物を氷水浴にて0℃に冷却し、この混合物に0.25MのNaOH水溶液又はKOH水溶液の指示当量分を、攪拌しながら滴下して加えた。反応混合物を1時間攪拌し、0℃にて1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出物を減圧下で濃縮し、残渣を、初めにヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、マロン酸モノエチルを得た。
【0101】
マロン酸モノエチル:オイル状物質。
1H NMR(300MHz、CDCl3)δ:1.31(3H,t,J=7.2),3.44(2H,s),4.25(2H,q,J=7.2),10.62(1H,br.s)、
13C NMR(75MHz、CDCl3)δ:13.90,40.78,61.90,166.87,171.48、
IR(neat,cm−1):1736,1741,2914−3182、
元素分析:計算値(C5H8O4):C,45.46;H,6.10、測定値:C,45.83;H,6.30。
【0102】
[実施例56]
【0103】
本実施例は、マロン酸モノプロピルの合成を説明するものである。
【0104】
THF2mLにマロン酸ジプロピル(226mg,1.2mmol)を溶解し、水20mLを加えた。反応混合物を氷水浴にて0℃に冷却し、この混合物に0.25MのNaOH水溶液又はKOH水溶液の指示当量分を、攪拌しながら滴下して加えた。反応混合物を30分から1時間攪拌し、0℃にて1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出液を減圧下で濃縮し、残渣を、初めにヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、マロン酸モノプロピルを得た。
【0105】
マロン酸モノプロピル:オイル状物質。
1H NMR(300MHz、CDCl3)δ:0.96(3H,t,J=7.7),1.70(2H,m),3.46(2H,s),4.15(2H,q,J=7.2),10.18(1H,br.s)、
13C NMR(75MHz、CDCl3)δ:10.12,21.69,40.89,67.42,166.81,171.74、
IR(neat,cm−1)1723,1740,2883−3181、
元素分析:計算値(C6H10O4):C,49.31;H,6.90、測定値:C,49.43;H,7.14。
【0106】
[実施例57]
【0107】
本実施例はメチルマロン酸モノメチルの合成を説明するものである。
【0108】
THF2mLにメチルマロン酸ジメチル(175mg,1.2mmol)を溶解し、水20mLを加えた。反応混合物を氷水浴にて0℃に冷却し、この混合物に0.25MのNaOH水溶液又はKOH水溶液の1.2当量を、攪拌しながら滴下して加えた。反応混合物を1.5時間攪拌し、0℃にて1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出液を減圧下で濃縮し、残渣を、初めにヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、メチルマロン酸モノメチルを得た。
【0109】
メチルマロン酸モノメチル:オイル状物質。
1H NMR(300MHz、CDCl3)δ:1.43(3H,t,J=7.2),3.47(1H,q,J=7.2),3.73(3H,s),9.42(1H,br.s);
13C NMR(75MHz、CDCl3)δ:13.08,45.45,52.39,170.16,175.38、
IR(neat,cm−1)1721,1739,2956−3202、
元素分析:計算値(C5H8O4):C,45.46;H,6.10、測定値:C,45.65;H,5.94。
【0110】
[実施例58]
【0111】
本実施例は、メチルマロン酸モノエチルの合成を説明するものである。
【0112】
THF2mLにメチルマロン酸ジエチル(209mg,1.2mmol)を溶解し、水20mLを加えた。反応混合物を氷水浴にて0℃に冷却し、この混合物に0.25MのNaOH水溶液又はKOH水溶液の1.2当量を、攪拌しながら滴下して加えた。反応混合物を1.5時間攪拌し、0℃にて1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出液を減圧下で濃縮し、残渣を、初めにヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、メチルマロン酸モノエチルを得た。
【0113】
メチルマロン酸モノエチル:オイル状物質。
1H NMR(300MHz、CDCl3)δ:1.24(3H,t,J=7.2),1.40(3H,d,J=7.5),3.44(1H,q,J=7.2),4.18(2H,q,J=7.2),11.21(1H,br.s)、
13C NMR(75MHz、CDCl3)δ:13.44,13.90,45.93,61.70,169.83,176.00、
IR(neat,cm−1)1722,1735,2946−3200、
元素分析:計算値(C6H10O4):C,49.31;H,6.90、測定値:C,49.68;H,6.75。
【0114】
[実施例59]
【0115】
本実施例は、メチルマロン酸モノプロピルの合成を説明するものである。
【0116】
THF2mLにメチルマロン酸ジプロピル(243mg,1.2mmol)を溶解し、水20mLを加えた。反応混合物を氷水浴にて0℃に冷却し、この混合物に0.25MのNaOH水溶液又はKOH水溶液の1.2当量を、攪拌しながら滴下して加えた。反応混合物を1時間45分攪拌し、0℃にて1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出液を減圧下で濃縮し、残渣を、初めにヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、メチルマロン酸モノプロピルを得た。
【0117】
メチルマロン酸モノプロピル:オイル状物質。
1H NMR(300MHz、CDCl3)δ:0.90(3H,t,J=7.5),1.42(3H,d,J=7.2),1.64(2H,m),3.46(1H,q,J=7.2),4.09(2H,q,J=7.2),10.62(1H,br.s)、
13C NMR(75MHz、CDCl3)δ:10.17,13.51,21.77,45.94,67.24,169.93,175.96、
IR(neat,cm−1)1717,1739,2883−2971、
元素分析:計算値(C7H12O4):C,52.49;H,7.55、測定値:C,52.74;H,7.49。
【0118】
[実施例60]
【0119】
本実施例は、フェニルマロン酸モノメチルの合成を説明するものである。
【0120】
THF2mLにフェニルマロン酸ジメチル(250mg,1.2mmol)を溶解し、水20mLを加えた。反応混合物を氷水浴にて0℃に冷却し、この混合物に0.25MのNaOH水溶液又はKOH水溶液の1.2当量を、攪拌しながら滴下して加えた。反応混合物を1時間攪拌し、0℃にて1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出液を減圧下で濃縮し、残渣を、初めにヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、フェニルマロン酸モノメチルを得た。
【0121】
フェニルマロン酸モノメチル:白色固体、融点92〜93℃、
1H NMR(300MHz、CDCl3)δ:3.75(3H,s),4.65(2H,s),7.4(5H,m),9.0(1H,br.s)、
13C NMR(75MHz、CDCl3)δ:53.06,57.33,128.55,128.77,129.15,131.96,168.59,173.25、
IR(neat,cm−1)1717,1740,2956−3212、
元素分析:計算値(C10H10O4):C,61.85;H,5.19、測定値:C,61.92;H,5.40。
【0122】
[実施例61]
【0123】
本実施例はフェニルマロン酸モノエチルの合成を説明するものである。
【0124】
THF2mLにフェニルマロン酸ジメチル(284mg,1.2mmol)を溶解し、水20mLを加えた。反応混合物を氷水浴にて0℃に冷却し、この混合物に0.25MのNaOH水溶液又はKOH水溶液の1.2当量を、攪拌しながら滴下して加えた。反応混合物を5時間攪拌し、0℃にて1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出液を減圧下で濃縮し、残渣を、初めにヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、フェニルマロン酸モノエチルを得た。
【0125】
フェニルマロン酸モノエチル:白色固体、融点74℃(文献値:76−77℃)。
1H NMR(300MHz、CDCl3)δ:1.25(3H,t,J=7.2),4.24(2H,q,J=7.2),4.65(1H,s),7.4(5H,m),9.78(1H,br.s)、
13C NMR(75MHz、CDCl3)δ:13.81,57.51,62.10,128.39,128.62,129.13,132.01,167.95,173.84、
IR(neat,cm−1)1717,1737,2941−3190、
元素分析:計算値(C11H12O4):C,63.45;H,5.81、測定値:C,63.30;H,5.80。
【0126】
[実施例62]
【0127】
本実施例は、フェニルマロン酸モノプロピルの合成を説明するものである。
【0128】
アセトニトリル2mLにフェニルマロン酸ジプロピル(317mg,1.2mmol)を溶解し、水20mLを加えた。反応混合物を冷却室内、氷水浴にて0℃に冷却した。この混合物に0.25MのNaOH水溶液又はKOH水溶液の0.8当量を、攪拌しながら滴下して加えた。反応混合物を4℃に維持しながら33時間冷却室内で攪拌し、0℃にて1MのHClで酸性とし、NaClで飽和させ、酢酸エチルで抽出し(4回)、Na2SO4で乾燥した。この抽出液を減圧下で濃縮し、残渣を、初めにヘキサン:酢酸エチル(3:1)、次いで酢酸エチルを溶離液とするシリカゲルカラムクロマトグラフィーにて精製し、フェニルマロン酸モノプロピルを得た。
【0129】
フェニルマロン酸モノプロピル:オイル状物質。
1H NMR(300MHz、CDCl3)δ:0.87(3H,t,J=7.5),1.64(2H,m,J=7.2),4.11(2H,m),4.64(1H,s),7.4(5H,m),8.02(1H,br.s)、
13C NMR(75MHz、CDCl3)δ:10.15,21.74,57.47,67.72,128.48,128.74,129.12,132.21,168.41,173.07、
IR(neat,cm−1)1717,1736,2881−3067、
元素分析:計算値(C12H14O4):C,64.85;H,6.35、測定値:C,65.17;H,6.61。
【0130】
[実施例63〜65]
【0131】
これらの実施例は、エステル基の疎水性が与える反応時間に対する効果を説明するものである。
【0132】
以下に示す一般的な反応条件を用いて、順に疎水性が高くなるアルキル基を有する一連のハーフエステルを調製し(合成スキームVIII)、エステル部分の一連の類似体に対する反応時間を検討した。その結果を以下の表6に示す。
【0133】
表6:カルボキシル基の疎水性の効果
【0134】
【表6】

【0135】
(スキームVIII)
【0136】
【化8】

【0137】
これらの結果から明らかなように、アルキル基Rの疎水性が高くなるにつれ、反応時間が対応して長くなっていった。本反応に用いた環状ジエステルの場合には、反応時間は塩基を追加することで、生成物の収率の顕著な減少を伴うことなく、短くすることができる(後記の実施例82を参照)。これに対して、例えばマロン酸ジアルキルエステルやアジピン酸ジアルキルエステルのような直鎖状ジエステルの場合には、塩基を追加すると生成物の収率の減少を引き起こすことが観察された。
【0138】
[実施例66〜81]
【0139】
これらの実施例は、二価酸(ジカルボン酸)とハーフエステルとの生成比率に及ぼす、反応時間並びに塩基の選択における効果を説明するものである。
【0140】
以下の合成スキームIXに示す加水分解反応において、種々の塩基を使用した。生成した二価酸(ジカルボン酸)に対するハーフエステルの比率は、1H NMRスペクトルによって求め、その結果を以下の表7〜表10に示す。
【0141】
(スキームIX)
【0142】
【化9】

【0143】
表7:塩基としてLiOHを用いた場合の反応時間
【0144】
【表7】

【0145】
表8:塩基としてNaOHを用いた場合の反応時間
【0146】
【表8】

【0147】
表9:塩基としてKOHを用いた場合の反応時間
【0148】
【表9】

【0149】
表10:塩基としてCsOHを用いた場合の反応時間
【0150】
【表10】

【0151】
これらの結果から明らかなように、検討した上記の直鎖状ジエステルの場合においては、反応時間がある時間以上長くなると、ハーフエステルの生成量が減少し、二価酸(ジカルボン酸)の生成量が増えるものであった。この結果は、検討した上記の塩基4種の全てで観察されていた。
【0152】
[実施例82]
【0153】
この実施例は、環状ジエステルのモノ加水分解の時間依存性を説明するものである。
【0154】
ビシクロ[2.2.1]ヘプト−2,5−ジエン−2,3−ジカルボン酸ジメチル(1.2mmol)をTHF2mLに溶解し、水20mLを加えた。反応混合物を氷水浴に浸して0℃に冷却し、この混合物に攪拌下に、0.25MのNaOH水溶液8mLを少量ずつ加えた。混合物の反応を、一定時間毎に終結させ、その時間の生成物を1H NMRで観察した。生成したジエステル、ハーフエステル及び二価酸(ジカルボン酸)に帰属されるピークに対応する積分曲線により、ジエステル、ハーフエステル及び二価酸(ジカルボン酸)の生成モル比を算出した。その結果を図1に示す。
【0155】
図中に示した結果から明らかなように、ビシクロ[2.2.1]ヘプト−2,5−ジエン−2,3−ジカルボン酸ジメチルの加水分解の場合には、反応は実質的に完結しており(この点は、原料のジエステルの残量で示される)、ハーフエステルの生成量は、経時的に若干減少しており、それに伴い、二価酸(ジカルボン酸)の生成量が経時的に若干増加しているのみであった。
他の環状エステルにおいても同様の結果が観察された。これらの結果から、このタイプのハーフエステルは比較的塩基に対して安定であることが示唆された。
【0156】
[実施例83〜86]
【0157】
これらの実施例は、直鎖状ジエステルのモノ加水分解の時間依存性を説明するものである。
【0158】
上記のビシクロ[2.2.1]ヘプト−2,5−ジエン−2,3−ジカルボン酸ジメチルに代えてアジピン酸ジメチルを用い、また、4種の異なる当量の塩基(0.7,1.0,1.2及び1.5)を用いること以外は、実施例82と同様に実施した。生成したジエステル、ハーフエステル及び二価酸(ジカルボン酸)に対応するピークをHPLCで観察し、対応する生成比率を図2に示すようにプロットした。
【0159】
図中に示した結果から明らかなように、使用する塩基の量が増えるに従って、二価酸(ジカルボン酸)の収率も高くなった。
他の直鎖状ジエステルのモノ加水分解においても同様の結果が観察された。これらの結果から、このタイプのハーフエステルは、実施例82で検討されたタイプの環状ジエステルよりも塩基に対して安定性が低いことが示唆された。
したがって、環状ジエステルの場合には、塩基をさらに追加することで生成物収率に顕著な悪影響を与えることなく反応速度を高めることが可能であるが、直鎖状ジエステルの場合には、そのようなことは当てはまらないものといえる。
【0160】
上記した本発明の開示内容は、例示的なものであって、これに限定することを意図していない。
したがって、本発明の範囲を逸脱することなく様々な付加、置換、変更を行い得るものであることを理解すべきであり、本発明の範囲は、添付の請求の範囲を参照して解釈されるものである。
【特許請求の範囲】
【請求項1】
第1及び第2のエステル部分を有する第1化合物Aに対して、当該化合物を液体媒体中においてMaXbの組成を有する塩基と反応させることにより、第1のエステル部分がカルボキシル部分に変換され、第2のエステル部分がそのまま残る第2の化合物を得ることを特徴とするエステルの加水分解方法であって、液状媒体中における比[Xk−]:[A]が1.6以下であり、またk>0である、エステルを加水分解する方法。
【請求項2】
X=OHであり、[A]:[OH−]が1.6以下である請求項1に記載のエステルを加水分解する方法。
【請求項3】
[A]:[OH−]が約0.5〜1.6の範囲内である請求項2に記載のエステルを加水分解する方法。
【請求項4】
[A]:[OH−]が約0.7〜1.5の範囲内である請求項2に記載のエステルを加水分解する方法。
【請求項5】
[A]:[OH−]が約0.8〜1.4の範囲内である請求項2に記載のエステルを加水分解する方法。
【請求項6】
[A]:[OH−]が約0.9〜1.3の範囲内である請求項2に記載のエステルを加水分解する方法。
【請求項7】
[A]:[OH−]が約1.0〜1.2の範囲内である請求項2に記載のエステルを加水分解する方法。
【請求項8】
Mが金属である請求項1に記載のエステルを加水分解する方法。
【請求項9】
Mがアルカリ金属である請求項8に記載のエステルを加水分解する方法。
【請求項10】
塩基がLiOH、NaOH、KOH及びCsOHからなる群から選ばれるものである請求項1に記載のエステルを加水分解する方法。
【請求項11】
塩基がNaOHである請求項10に記載のエステルを加水分解する方法。
【請求項12】
塩基がKOHである請求項10に記載のエステルを加水分解する方法。
【請求項13】
k=1である請求項1に記載のエステルを加水分解する方法。
【請求項14】
化合物Aが以下の化学式:
【化1】

式中、Lは連結基であり、R1及びR2は独立して置換又は非置換アルキル基、アリール基、またはアルキルアリール基の群から選択される基を表す、
で示される請求項1に記載のエステルを加水分解する方法。
【請求項15】
式中、R1及びR2が同一である請求項14に記載のエステルを加水分解する方法。
【請求項16】
式中、Lが−[CH2]n−構造を有する連結基であり、nは整数である請求項14に記載のエステルを加水分解する方法。
【請求項17】
nが1〜約50の範囲内である請求項16に記載のエステルを加水分解する方法。
【請求項18】
nが1〜約20の範囲内である請求項16に記載のエステルを加水分解する方法。
【請求項19】
nが1〜約10の範囲内である請求項16に記載のエステルを加水分解する方法。
【請求項20】
nが1〜5の範囲内である請求項16に記載のエステルを加水分解する方法。
【請求項21】
連結基LがN、O及びSからなる群から選択される少なくとも1つのヘテロ原子を含む連結基である請求項15に記載のエステルを加水分解する方法。
【請求項22】
式中、R2はメチル基、エチル基、プロピル基及びブチル基からなる群から選ばれる請求項15に記載のエステルを加水分解する方法。
【請求項23】
式中、R2が1〜20の炭素原子を有するアルキル基である請求項14に記載のエステルを加水分解する方法。
【請求項24】
化合物Aがジエステルであり、当該化合物を塩基と反応させることからなる、次式:
【化2】

で示される化合物Bであるモノエステルを得る請求項14に記載のエステルを加水分解する方法。
【請求項25】
化合物Aがマロン酸ジメチルである請求項1に記載のエステルを加水分解する方法。
【請求項26】
化合物Bがマロン酸モノメチルである請求項24に記載のエステルを加水分解する方法。
【請求項27】
化合物Aがマロン酸ジエチルである請求項1に記載のエステルを加水分解する方法。
【請求項28】
化合物Bがマロン酸モノエチルである請求項27に記載のエステルを加水分解する方法。
【請求項29】
化合物Aがマロン酸ジプロピルである請求項1に記載のエステルを加水分解する方法。
【請求項30】
化合物Bがマロン酸モノプロピルである請求項29に記載のエステルを加水分解する方法。
【請求項31】
化合物Aがマロン酸ジブチルである請求項1に記載のエステルを加水分解する方法。
【請求項32】
化合物Bがマロン酸モノブチルである請求項31に記載のエステルを加水分解する方法。
【請求項33】
化合物Aを15℃未満の温度Tで塩基と反応させる請求項1に記載のエステルを加水分解する方法。
【請求項34】
化合物Aを10℃未満の温度Tで塩基と反応させる請求項1に記載のエステルを加水分解する方法。
【請求項35】
化合物Aを5℃未満の温度Tで塩基と反応させる請求項1に記載のエステルを加水分解する方法。
【請求項36】
化合物Aを−15℃〜15℃の温度Tで塩基と反応させる請求項1に記載のエステルを加水分解する方法。
【請求項37】
化合物Aを−10℃〜10℃の温度Tで塩基と反応させる請求項1に記載のエステルを加水分解する方法。
【請求項38】
化合物Aを−5℃〜5℃の温度Tで塩基と反応させる請求項1に記載のエステルを加水分解する方法。
【請求項39】
第1及び第2のエステル部分を有する化合物を、当該化合物のモル当量数に対する塩基のモル当量数の比が1.6以下である塩基と反応させることを特徴とするエステルを加水分解する方法。
【請求項40】
化合物が直鎖状ジエステルである請求項39に記載のエステルを加水分解する方法。
【請求項41】
反応によりハーフエステルが製造される請求項40に記載のエステルを加水分解する方法。
【請求項42】
反応を水性媒体中で行う請求項39に記載のエステルを加水分解する方法。
【請求項43】
反応を水及び、THF、CH3CN、CH2Cl2、メタノール、エタノール、1−プロパノール、2−プロパノール及びDMSOからなる群から選ばれる第2物質を含む媒体中で行われる請求項39に記載のエステルを加水分解する方法。
【請求項44】
第2物質がTHF及びCH3CNから選ばれるものである請求項43に記載のエステルを加水分解する方法。
【請求項45】
混合前の反応媒体の成分の容量によって測定される第2物質の容量パーセントが7%未満である請求項43に記載のエステルを加水分解する方法。
【請求項46】
混合前の反応媒体の成分の容量によって測定される第2物質の容量パーセントが5%未満である請求項43に記載のエステルを加水分解する方法。
【請求項47】
混合前の反応媒体の成分の容量によって測定される第2物質の容量パーセントが3%未満である請求項43に記載のエステルを加水分解する方法。
【請求項48】
混合前の反応媒体の成分の容量によって測定される第2物質の容量パーセントが実質的に100%である請求項43に記載のエステルを加水分解する方法。
【請求項49】
第1及び第2のエステル部分を有する化合物を、93容量%より多い水を含む水性媒体中で当該化合物を塩基と反応させることを特徴とするエステルを加水分解する方法。
【請求項50】
当該媒体が95容量%より多い水を含むものである請求項49に記載のエステルを加水分解する方法。
【請求項51】
当該媒体が97容量%より多い水を含むものである請求項49に記載のエステルを加水分解する方法。
【請求項52】
当該媒体が実質的に100容量%の水を含むものである請求項49に記載のエステルを加水分解する方法。
【請求項53】
化合物が直鎖状ジエステルであり、当該化合物を塩基と反応させ、ハーフエステルを製造することからなる請求項49に記載のエステルを加水分解する方法。
【請求項54】
化合物が環状ジエステルであり、当該化合物を塩基と反応させ、ハーフエステルを製造することからなる請求項49に記載のエステルを加水分解する方法。
【請求項55】
化合物のモル当量数に対する塩基のモル当量数の比が1.6以下である請求項49に記載のエステルを加水分解する方法。
【請求項56】
第1及び第2のエステル部分を有する第1化合物に対して、
水性媒体中で当該第1化合物のモル当量数に対する塩基のモル当量数の比が3より大きくなるような塩基と反応させること;および
総反応時間が90分以下となるように反応を終了させること、
からなることを特徴とするエステルを加水分解する方法。
【請求項57】
当該第1化合物のモル当量数に対する塩基のモル当量数の比が5より大きいものである請求項56に記載のエステルを加水分解する方法。
【請求項58】
当該第1化合物のモル当量数に対する塩基のモル当量数の比が7より大きいものである請求項56に記載のエステルを加水分解する方法。
【請求項59】
当該第1化合物のモル当量数に対する塩基のモル当量数の比が10より大きいものである請求項56に記載のエステルを加水分解する方法。
【請求項60】
当該第1化合物が環状化合物である請求項56に記載のエステルを加水分解する方法。
【請求項61】
当該第1化合物が二環式化合物である請求項56に記載のエステルを加水分解する方法。
【請求項62】
当該第1化合物が二環式ジエンである請求項61に記載のエステルを加水分解する方法。
【請求項63】
当該第1化合物が環状ジエステルである請求項56に記載のエステルを加水分解する方法。
【請求項64】
総反応時間が60分以下である請求項56に記載のエステルを加水分解する方法。
【請求項65】
総反応時間が約10分〜約60分の範囲内である請求項56に記載のエステルを加水分解する方法。
【請求項66】
総反応時間が約20分〜約60分の範囲内である請求項56に記載のエステルを加水分解する方法。
【請求項67】
反応によりハーフエステルである第2化合物を製造することからなる請求項56に記載のエステルを加水分解する方法。
【請求項68】
第1のエステル部分と第2のエステル部分が隣接する第1及び第2の炭素原子に結合しており、当該第1及び第2の炭素原子は互いに二重結合で結合しているものである請求項56に記載のエステルを加水分解する方法。
【請求項69】
第1及び第2の炭素原子が環構造の一部である請求項68に記載のエステルを加水分解する方法。
【請求項70】
環構造が二環式構造の一部である請求項69に記載のエステルを加水分解する方法。
【請求項1】
第1及び第2のエステル部分を有する第1化合物Aに対して、当該化合物を液体媒体中においてMaXbの組成を有する塩基と反応させることにより、第1のエステル部分がカルボキシル部分に変換され、第2のエステル部分がそのまま残る第2の化合物を得ることを特徴とするエステルの加水分解方法であって、液状媒体中における比[Xk−]:[A]が1.6以下であり、またk>0である、エステルを加水分解する方法。
【請求項2】
X=OHであり、[A]:[OH−]が1.6以下である請求項1に記載のエステルを加水分解する方法。
【請求項3】
[A]:[OH−]が約0.5〜1.6の範囲内である請求項2に記載のエステルを加水分解する方法。
【請求項4】
[A]:[OH−]が約0.7〜1.5の範囲内である請求項2に記載のエステルを加水分解する方法。
【請求項5】
[A]:[OH−]が約0.8〜1.4の範囲内である請求項2に記載のエステルを加水分解する方法。
【請求項6】
[A]:[OH−]が約0.9〜1.3の範囲内である請求項2に記載のエステルを加水分解する方法。
【請求項7】
[A]:[OH−]が約1.0〜1.2の範囲内である請求項2に記載のエステルを加水分解する方法。
【請求項8】
Mが金属である請求項1に記載のエステルを加水分解する方法。
【請求項9】
Mがアルカリ金属である請求項8に記載のエステルを加水分解する方法。
【請求項10】
塩基がLiOH、NaOH、KOH及びCsOHからなる群から選ばれるものである請求項1に記載のエステルを加水分解する方法。
【請求項11】
塩基がNaOHである請求項10に記載のエステルを加水分解する方法。
【請求項12】
塩基がKOHである請求項10に記載のエステルを加水分解する方法。
【請求項13】
k=1である請求項1に記載のエステルを加水分解する方法。
【請求項14】
化合物Aが以下の化学式:
【化1】

式中、Lは連結基であり、R1及びR2は独立して置換又は非置換アルキル基、アリール基、またはアルキルアリール基の群から選択される基を表す、
で示される請求項1に記載のエステルを加水分解する方法。
【請求項15】
式中、R1及びR2が同一である請求項14に記載のエステルを加水分解する方法。
【請求項16】
式中、Lが−[CH2]n−構造を有する連結基であり、nは整数である請求項14に記載のエステルを加水分解する方法。
【請求項17】
nが1〜約50の範囲内である請求項16に記載のエステルを加水分解する方法。
【請求項18】
nが1〜約20の範囲内である請求項16に記載のエステルを加水分解する方法。
【請求項19】
nが1〜約10の範囲内である請求項16に記載のエステルを加水分解する方法。
【請求項20】
nが1〜5の範囲内である請求項16に記載のエステルを加水分解する方法。
【請求項21】
連結基LがN、O及びSからなる群から選択される少なくとも1つのヘテロ原子を含む連結基である請求項15に記載のエステルを加水分解する方法。
【請求項22】
式中、R2はメチル基、エチル基、プロピル基及びブチル基からなる群から選ばれる請求項15に記載のエステルを加水分解する方法。
【請求項23】
式中、R2が1〜20の炭素原子を有するアルキル基である請求項14に記載のエステルを加水分解する方法。
【請求項24】
化合物Aがジエステルであり、当該化合物を塩基と反応させることからなる、次式:
【化2】

で示される化合物Bであるモノエステルを得る請求項14に記載のエステルを加水分解する方法。
【請求項25】
化合物Aがマロン酸ジメチルである請求項1に記載のエステルを加水分解する方法。
【請求項26】
化合物Bがマロン酸モノメチルである請求項24に記載のエステルを加水分解する方法。
【請求項27】
化合物Aがマロン酸ジエチルである請求項1に記載のエステルを加水分解する方法。
【請求項28】
化合物Bがマロン酸モノエチルである請求項27に記載のエステルを加水分解する方法。
【請求項29】
化合物Aがマロン酸ジプロピルである請求項1に記載のエステルを加水分解する方法。
【請求項30】
化合物Bがマロン酸モノプロピルである請求項29に記載のエステルを加水分解する方法。
【請求項31】
化合物Aがマロン酸ジブチルである請求項1に記載のエステルを加水分解する方法。
【請求項32】
化合物Bがマロン酸モノブチルである請求項31に記載のエステルを加水分解する方法。
【請求項33】
化合物Aを15℃未満の温度Tで塩基と反応させる請求項1に記載のエステルを加水分解する方法。
【請求項34】
化合物Aを10℃未満の温度Tで塩基と反応させる請求項1に記載のエステルを加水分解する方法。
【請求項35】
化合物Aを5℃未満の温度Tで塩基と反応させる請求項1に記載のエステルを加水分解する方法。
【請求項36】
化合物Aを−15℃〜15℃の温度Tで塩基と反応させる請求項1に記載のエステルを加水分解する方法。
【請求項37】
化合物Aを−10℃〜10℃の温度Tで塩基と反応させる請求項1に記載のエステルを加水分解する方法。
【請求項38】
化合物Aを−5℃〜5℃の温度Tで塩基と反応させる請求項1に記載のエステルを加水分解する方法。
【請求項39】
第1及び第2のエステル部分を有する化合物を、当該化合物のモル当量数に対する塩基のモル当量数の比が1.6以下である塩基と反応させることを特徴とするエステルを加水分解する方法。
【請求項40】
化合物が直鎖状ジエステルである請求項39に記載のエステルを加水分解する方法。
【請求項41】
反応によりハーフエステルが製造される請求項40に記載のエステルを加水分解する方法。
【請求項42】
反応を水性媒体中で行う請求項39に記載のエステルを加水分解する方法。
【請求項43】
反応を水及び、THF、CH3CN、CH2Cl2、メタノール、エタノール、1−プロパノール、2−プロパノール及びDMSOからなる群から選ばれる第2物質を含む媒体中で行われる請求項39に記載のエステルを加水分解する方法。
【請求項44】
第2物質がTHF及びCH3CNから選ばれるものである請求項43に記載のエステルを加水分解する方法。
【請求項45】
混合前の反応媒体の成分の容量によって測定される第2物質の容量パーセントが7%未満である請求項43に記載のエステルを加水分解する方法。
【請求項46】
混合前の反応媒体の成分の容量によって測定される第2物質の容量パーセントが5%未満である請求項43に記載のエステルを加水分解する方法。
【請求項47】
混合前の反応媒体の成分の容量によって測定される第2物質の容量パーセントが3%未満である請求項43に記載のエステルを加水分解する方法。
【請求項48】
混合前の反応媒体の成分の容量によって測定される第2物質の容量パーセントが実質的に100%である請求項43に記載のエステルを加水分解する方法。
【請求項49】
第1及び第2のエステル部分を有する化合物を、93容量%より多い水を含む水性媒体中で当該化合物を塩基と反応させることを特徴とするエステルを加水分解する方法。
【請求項50】
当該媒体が95容量%より多い水を含むものである請求項49に記載のエステルを加水分解する方法。
【請求項51】
当該媒体が97容量%より多い水を含むものである請求項49に記載のエステルを加水分解する方法。
【請求項52】
当該媒体が実質的に100容量%の水を含むものである請求項49に記載のエステルを加水分解する方法。
【請求項53】
化合物が直鎖状ジエステルであり、当該化合物を塩基と反応させ、ハーフエステルを製造することからなる請求項49に記載のエステルを加水分解する方法。
【請求項54】
化合物が環状ジエステルであり、当該化合物を塩基と反応させ、ハーフエステルを製造することからなる請求項49に記載のエステルを加水分解する方法。
【請求項55】
化合物のモル当量数に対する塩基のモル当量数の比が1.6以下である請求項49に記載のエステルを加水分解する方法。
【請求項56】
第1及び第2のエステル部分を有する第1化合物に対して、
水性媒体中で当該第1化合物のモル当量数に対する塩基のモル当量数の比が3より大きくなるような塩基と反応させること;および
総反応時間が90分以下となるように反応を終了させること、
からなることを特徴とするエステルを加水分解する方法。
【請求項57】
当該第1化合物のモル当量数に対する塩基のモル当量数の比が5より大きいものである請求項56に記載のエステルを加水分解する方法。
【請求項58】
当該第1化合物のモル当量数に対する塩基のモル当量数の比が7より大きいものである請求項56に記載のエステルを加水分解する方法。
【請求項59】
当該第1化合物のモル当量数に対する塩基のモル当量数の比が10より大きいものである請求項56に記載のエステルを加水分解する方法。
【請求項60】
当該第1化合物が環状化合物である請求項56に記載のエステルを加水分解する方法。
【請求項61】
当該第1化合物が二環式化合物である請求項56に記載のエステルを加水分解する方法。
【請求項62】
当該第1化合物が二環式ジエンである請求項61に記載のエステルを加水分解する方法。
【請求項63】
当該第1化合物が環状ジエステルである請求項56に記載のエステルを加水分解する方法。
【請求項64】
総反応時間が60分以下である請求項56に記載のエステルを加水分解する方法。
【請求項65】
総反応時間が約10分〜約60分の範囲内である請求項56に記載のエステルを加水分解する方法。
【請求項66】
総反応時間が約20分〜約60分の範囲内である請求項56に記載のエステルを加水分解する方法。
【請求項67】
反応によりハーフエステルである第2化合物を製造することからなる請求項56に記載のエステルを加水分解する方法。
【請求項68】
第1のエステル部分と第2のエステル部分が隣接する第1及び第2の炭素原子に結合しており、当該第1及び第2の炭素原子は互いに二重結合で結合しているものである請求項56に記載のエステルを加水分解する方法。
【請求項69】
第1及び第2の炭素原子が環構造の一部である請求項68に記載のエステルを加水分解する方法。
【請求項70】
環構造が二環式構造の一部である請求項69に記載のエステルを加水分解する方法。
【図1】


【図2】




【図2】


【公表番号】特表2010−533644(P2010−533644A)
【公表日】平成22年10月28日(2010.10.28)
【国際特許分類】
【出願番号】特願2010−510367(P2010−510367)
【出願日】平成20年5月30日(2008.5.30)
【国際出願番号】PCT/US2008/006907
【国際公開番号】WO2008/150487
【国際公開日】平成20年12月11日(2008.12.11)
【出願人】(509328685)
【Fターム(参考)】
【公表日】平成22年10月28日(2010.10.28)
【国際特許分類】
【出願日】平成20年5月30日(2008.5.30)
【国際出願番号】PCT/US2008/006907
【国際公開番号】WO2008/150487
【国際公開日】平成20年12月11日(2008.12.11)
【出願人】(509328685)

【Fターム(参考)】
[ Back to top ]

