ハーブ抽出物の抗酸化剤及びFe2+キレート形成剤としての特性
本件発明は、北米薬用ニンジン(特許権のある抽出物HT1001)を、単独で、或いはイチョウ(GB)、西洋オトギリソウ(SJW)、ギンコライド、フラボノイド、ジンセノシド、ヒペリシン、及び/又はヒペルフォリンと組み合わせた医薬組成物に関する。本件発明に係る抗酸化剤及び増殖抑制剤は、Fe2+が触媒機能を果たす脂質の過酸化とFe2+とキレートを形成する挙動を有意に抑制し、ヒドロキシルフリーラジカルを除去する能力、神経芽細胞腫の細胞数を低減する能力、及び/又は神経突起伸長を促進する能力を示す。これらの効果は、Fe2+キレート剤の挙動と一致し、個々の化学成分が示す、効果の種類と大きさの違いは、作用が相乗的であることを示唆している。
【発明の詳細な説明】
【背景技術】
【0001】
幾多の世紀に渡って、多種多様な神経症や軽病に対応するための漢方薬には、薬用ニンジン、イチョウ(Ginko biloba)(GB)、及び西洋オトギリソウ(Hypericum perforum、SJW)を有効活用してきた。最近のメタアナリシスは、GB抽出物が備える、認知、気分や感情の機能、痴呆の治療に向けたクオリティオブライフ(生活の質)に対する副作用のない有効性に言及してきた。しかし、より大規模な臨床試験の必要性が強調されている[Birks J,Grimley EV,van DM「Ginkgo biloba for cognitive impairment and dementia」Cochrane Database Syst Rev 2002;(4):CD003120]。同様に、北米薬用ニンジン(Panax quinquefolius)抽出物についても、記憶力を改善し[Sloley BD,Pang PK,Huang BH,Ba F,Li FL,Benishin CG,Greenshaw AJ,Shan JJ「American ginseng extract reduces scopolamine−induced amnesia in a spatial learning task」J Psychiatry Neurosci 1999 November;24(5):442〜52]、その成分ジンセノシドRb1及びRg1は、神経保護効果を発揮する[Rudakewich M,Ba F,Benishin CG「Neurotrophic and neuroprotective actions of ginsenosides Rb(1)and Rg(1)」Planta Med 2001 August;67(6):533〜7]ことが報告されている。薬用ニンジンの有益な特性は、そのサポニン含有物、集約してジンセノシドと呼ばれているダンマラントリテルペングルコシドの混合物に起因すると考えられる。ある種のジンセノシドは単離されており、その構造が決定されている。このようなジンセノシドには、Rb1、Rb2、Rc、Rd、Re、Rf及びRgが含まれている(特許文献1参照)。最近のメタアナリシスによれば、ドイツでは軽症及び中等症鬱病の治療に関して承認されているSJWは、合成抗鬱薬に較べて明らかに優れた結果を示しており、副作用の面からもより好ましいとされている。[Roder C,Schaefer M,Leucht S「Meta−analysis of effectiveness and tolerability of treatment of mild to moderate depression with St.John’s Wort」Fortschr Neurol Psychiatr 2004 July;72(6):330〜43]。
【0002】
酸化的ストレスは、種々の神経学的病理に関連しており、それゆえ、GB、北米薬用ニンジン、及びSJW抽出物の効果の若干は、それらの固有の抗酸化作用に起因している可能性がある。GB及びSJW中に含まれる主な生理的に活性な成分であることが知られているフラボノイドは、脂質の過酸化防止、フリーラジカルの除去、及びFe2+のキレート化をはじめとする抗酸化作用を有することがわかっている[Rice−Evans CA,Miller NJ,Paganga G「Structure−antioxidant activity relationships of flavonoids and phenolic acids」Free Radic Biol Med 1996;20(7):933〜56;Sloley BD,Urichuk LJ,Morley P,Durkin J,Shan JJ,Pang PK,Coutts RT「Identification of kaempferol as a monoamine oxidase inhibitor and potential Neuroprotectant in extracts of Ginkgo biloba leaves」J Pharm Pharmacol 2000 May;52(4):451〜9;Sloley BD,Urichuk LJ,Ling L,Gu LD,Coutts RT,Pang PK,Shan JJ「Chemical and pharmacological evaluation of Hypericum perforatum extracts」Acta Pharmacol Sin 2000;21(12):1145〜52]。
【0003】
また、抗酸化作用は、ジンセノシド、Rb1及びRg3については[Kim YC,Kim SR,Markelonis GJ,Oh TH「Ginsenosides Rb1 and Rg3 protect cultured rat cortical cells from glutamate−induced neurodegeneration」J Neurosci Res 1998 September 15;53(4):426〜32;Lim JH,Wen TC,Matsuda S,Tanaka J,Maeda N,Peng H,Aburaya J,Ishihara K,Sakanaka M「Protection of ischemic hippocampal neurons by ginsenoside Rb1,a main ingredient of ginseng root」Neurosci Res 1997 July;28(3):191〜200]に、SJW抽出物については[Jang MH,Lee TH,Shin MC,Bahn GH,Kim JW,Shin DH,Kim EH,Kim CJ「Protective effect of Hypericum perforatum Linn(St,John’s wort)against hydrogen peroxide−induced apoptosis on human neuroblastoma cells」Neurosci Lett 2002 September 30;329(2):177〜80]に記載されている。Fe2+のキレート化に伴う抗酸化作用により細胞を保護する効果を発揮する抽出物は、使用されるモデルの状態及びその性質に応じて、増殖抑制効果/アポトーシス促進効果を示すとの仮説を立てることができる。Fe2+は、細胞の増殖にとって決定的に重要な要素なので、新生細胞のFe2+に対する要求は大きい。Fe2+キレート剤の抗癌作用は、また、神経芽細胞腫をはじめとする種々の病理に対して臨床例が報告されている[Donfrancesco A,Deb G,De SL,Cozza R,Castellano A「Role of deferoxamine in tumor therapy」Acta Haematol 1996;95(1):66〜9]。それらの明らかにされた増殖抑制効果[Renton FJ,Jeitner TM「Cell cycle−dependent inhibition of the proliferation of human neural tumor cell lines by iron chelators」Biochem Pharmacol 1996 July 14;51(11):1553〜61]に加えて、Fe2+キレート剤は、また、アポトーシスを誘発し[Fan L,Iyer J,Zhu S,Frick KK,Wada RK,Eskenazi AE,Berg PE,Ikegaki N,Kennett RH,Frantz CN「Inhibition of N−myc expression and induction of apoptosis by iron chelation in human neuroblastoma cells」Cancer Res 2001 March 1;61(3):1073〜9]、且つ、胎児性癌腫F9を含むいくつかの腫瘍系における細胞の分別化を促進する[Tanaka T,Muto N,Ido Y,Itoh N,Tanaka K「Induction of embryonal carcinoma cell differentiation by deferoxamine,a potent therapeutic iron chelator」Biochim Biophys Acta 1997 July 5;1357(1):91〜7]。
【0004】
最近、注意欠陥多動障害(ADHD)の治療で使用されている、特許製品である北米薬用ニンジン抽出物HT1001とGBとを含む特異な抽出物配合製品(CVT−E033、AD−fX(登録商標)、CV Technologies、Edmonton、アルバータ州)に関する試験的な研究では、これらが、認知問題を含むADHD症候を改善する可能性があることを示唆している[Lyon MR,Cline JC,Totosy de ZJ,Shan JJ,Pang P,Benishin C「Effect of the herbal extract combination Panax quinquefolium and Ginkgo biloba on attention−deficit hyperactivity disorder:a pilot study」J Psychiatry Neurosci 2001 June;26(3):221〜8]。この研究は、北米薬用ニンジン、GB、及びSJWの神経保護/神経向性及び抗酸化作用に関する報告に止まらず、それぞれの物質とそれらの組み合わせ、CVT−E033及びCVT−E036(Menta−fX(登録商標);GB、北米薬用ニンジン、及びSJW)の作用機構に関する研究を促進することになった。
【0005】
特許文献2及び特許文献3は、従来技術による抽出物に触れている。特許文献2及び特許文献3が開示している内容は、本出願でも引用している。特許文献2は、ジンセノシドRb1及びRg1が、大脳皮質及び海馬領域におけるAChのアベイラビリティを高め、アルツハイマー型老人性痴呆の症状を軽減することを開示している。該特許は、また、ジンセノシドRb1の単離方法を開示している。特許文献3は、薬用ニンジンに由来する医薬組成物、及び各種の脳の健康状態又は病気の治療方法、加えて鬱又は一般的認知の改善を開示している。
【0006】
【特許文献1】米国特許第4157894号
【特許文献2】米国特許第5137878号
【特許文献3】米国特許第6083932号
【0007】
[発明の効果]
本発明者らは、北米薬用ニンジンの特定の抽出物、GB及びSJWの抽出物、及びそれらの生理的に活性な成分である、ジンセノシドRb1、Rg1、Rc、Rd、Re;ギンコライドA及びB;フラボノイドのクエルセチン及びルチン;ヒペリシン及びヒペルフォリンは、抗酸化作用及び増殖抑制作用を有することを見出した。本発明者らがHT1001と呼び、約15〜50%、好ましくは約25〜40%の総ジンセノシド(サポニンとしても知られている)を含有する特定の薬用ニンジン抽出物は、抗酸化剤又は増殖抑制剤として単独で或いはGB及び/又はSJWと組み合わせて投与できる。
【0008】
[発明を実施するための最良の形態]
本件発明者らは、専売品である北米薬用ニンジンの抽出物(HT1001)は、単独或いはGB及び/又はSJWと組み合わせて、抗酸化作用及び抗癌作用を有することを見出した。試験の結果、化学成分であるギンコライド、フラボノイド、ジンセノシド、ヒペリシン、及びヒペルフォリンも抗酸化作用を有することを見出した。試験に供したハーブ抽出物及びそれらの組み合わせのすべてについて、Fe2+が触媒機能を果たす脂質の過酸化を抑制する能力、無菌化学分析装置内でFe2+をキレート化する能力、そして、GB及びCVT−E033(北米薬用ニンジン+GB)の場合にはフリーラジカルの除去によって抗酸化作用が確認された。更に、Fe2+キレート剤の示す挙動と同様、すべてのハーブ抽出物の増殖抑制効果及び/又は分別化促進効果が、いくつかの神経芽細胞腫モデルで立証された。
【0009】
抗酸化作用は、すべての被試験ハーブ抽出物及びそれらの化学成分のいくつかに見られた。CVT−E033(北米薬用ニンジン+GB)及びCVT−E036(北米薬用ニンジン、GB、及びSJW)は、ヒト神経芽細胞腫細胞系SH−SY5YにおいてFe2+が触媒機能を果たす脂質の過酸化を抑制することがわかった。このことは、Fe2+が触媒機能を果たす脂質の過酸化をすべて個別に抑制するHT1001、GB、及びSJWが寄与していると考えられる。GB(Ramassamy C,Girbe F,Christen Y、Costentin J「Ginkgo biloba extract EGb761 or trolox C prevent the ascorbic acid/Fe2+induced decrease in synaptosomal membrane fluidity」Free Radic Res Commun 1993;19(5):341〜50)、北米薬用ニンジン(Kitts DD,Wijewickreme AN,Hu C「Antioxidant properties of a North American ginseng extract」Mol Cell Biochem 2000 February;203(1〜2):1〜10)、及びSJW(Zou Y,Lu Y,Wei D「Antioxidant activity of a flavonoid−rich extract of Hypericum perforatum L. in vitro」J Agric Food Chem 2004 September 11;52(16):5032〜9)、及びフラボノイドの構成成分(Chen YT,Zheng RL,Jia ZK,Ju Y「Flavonoids as superoxide scavengers and antioxidants」Free Radic Biol Med 1990;9(1):19〜21)の抽出物は、脂質又はリポソームの過酸化を抑制することが報告されている。Fe2+が触媒機能を果たす脂質の過酸化は、フリーラジカルの除去又はFe2+のキレート化によって直接的に防止され得る。CVT−E033は、適度のフリーラジカルの除去性を示したが、これは、検知可能な効果を有さない薬用ニンジン抽出物HT1001よりはむしろ、かなりのフリーラジカルの除去性を備えるGB成分抽出物によるものと考えられる。このことは、GB抽出物によるフリーラジカルの除去性に関する別の報告(Ramassamy C,Naudin B,Christen Y,Clostre F,Costentin J「Prevention by Ginkgo biloba extract(EGb761) and trolox C of the decrease in synaptosomal dopamine or serotonin uptake following incubation」Biochem Pharmacol 1992;44(12):2395〜401)と一致している。更に、化学モデルでは、すべての抽出物が同程度までのFe2+のキレート化を示した。これら抽出物の純化学成分のいくつかに関する試験では、クエルセチン(Sestili P,Guidarelli A,Dacha M,Cantoni O「Quercetin prevents DNA single strand breakage and cytotoxicity caused by tert−butylhydroperoxide:free radical scavenging versus iron chelating mechanism」Free Radic Biol Med 1998 August 15;25(2):196〜200に報告済み)、ヒペリシン、並びに20−(s)−プロトパナキサジオールジンセノシドRb1、Rc、及びRdは、特異構造と効果との相関を暗示する、Fe2+とキレートを形成する挙動を示し、20−(s)−プロトパナキサトリオールジンセノシドRg1及びReの効果は顕著でない。後の実施例で示すデータは、CVT−E033、GB、HT1001、SJW、及びCVT−E036は、Fe2+キレート剤として機能する可能性のある異なる化学的成分を有していることを示唆している。しかし、個々の成分をハーブ抽出物中におけるそれらの含有量を反映した濃度で試験すると、極めてわずかな効果しか示さないため、Fe2+の固定は、抽出物の各成分の相乗効果、又は総合効果であると考えられる。
【0010】
各種の神経芽細胞腫細胞系に対する増殖抑制効果及び/又は分別化促進効果は、すべての抽出物に観察された。すべてのハーブ調合剤がFe2+キレート剤の挙動を示したことは、これらが神経芽細胞腫中で抗癌特性及び増殖抑制特性を示した物質であることからすれば驚くべきことではない(Donfrancesco A,Deb G,De SL,Cozza R,Castellano A「Role of deferoxamine in tumor therapy」Acta Haematol 1996;95(1):66〜9)。この研究で使用された神経芽細胞腫培養モデルでは、Fe2+キレート形成に関連する神経保護(すなわち、生存促進)効果(血清欠乏モデル中で試験された)と増殖抑制効果/分別化促進効果との間におけるバランスは、後者よりと考えられる。試験した化学成分の中では、クエルセチン及びヒペルフォリンのみが、神経芽細胞腫の細胞数の抑制を示している。ヒペルフォリン(Dona M,Dell’Aica I,Pezzato E,Sartor L,Calabrese F,Della BM,Donella−Deana A,Appendino G,Borsarini A,Caniato R,Garbisa S「Hyperforin inhibits cancer invasion and metastasis」Cancer Res 2004 October 1;64(17):6225〜32)、GB、及び一部のフラボノイドは、他の新生物モデルでは増殖抑制効果/アポトーシス促進効果を発揮することが報告されている(Huang YT,Hwang JJ,Lee PP,Ke FC,Huang JH,Huang CJ,Kandaswami C,Middleton E Jr,Lee MT「Effects of luteolin and quercetin,inhibitors of tyrosine kinase,on cell growth and metastasis−associated properties in A431 cells overexpressing epidermal growth factor receptor」Br J Pharmacol 1999 December;128(5):999〜1010)。若干の特定ジンセノシドは、既にヒト白血病(THP−1)細胞をはじめとする種々の新生物モデルにおいて増殖抑制効果及びアポトーシス促進効果を発揮することがわかっているが(Popovich DG,Kitts DD「Structure−function relationship exists for ginsenosides in reducing cell proliferation and inducing apoptosis in the human leukemia(THP−1)cell line」Arch Biochem Biophys 2002 November 1;406(1):1〜8)、この研究で試験されたジンセノシド(Rb1、Rg1、Rc、Rd及びRe)では顕著でなかったことは、本明細書の結果と一致している。このことは、また、北米薬用ニンジン抽出物HT1001が、単独では、神経芽細胞腫の細胞数抑制と関連していなかったという知見と一致している。HT1001とGBの間には相乗効果が観察される。CVT−E033及びCVT−E036は、双方とも、個々の材料と比較した場合、低血清条件(ストレス)下で細胞数を減少させる。CVT−E036は、また、非ストレス条件下でこれを行なうことができる。本件発明者らが抽出物の組み合わせ中におけるそれらの比率を反映した濃度で個々の成分の効果を分析した際には、細胞数に対して有意な効果は観察されなかった(図9)。従って、該成分は相乗的に作用すると思われる。
【0011】
また、Fe2+キレート剤は、増殖抑制効果/アポトーシス促進効果の他に、細胞を分別化する効果を備えることが報告されている(Tanaka T,Muto N,Itoh N,Dota A,Nishina Y,Inada A, Tanaka K「Induction of differentiation of embryonal carcinoma F9 cells by iron chelators」Res Commun Mol Pathol Pharmacol 1995 December;90(2):211〜20)。この研究では、神経芽細胞腫を区別する指標を得るために、神経突起伸長の程度を定量化している。CVT−E033、GB及びHT1001のすべては、N1E115細胞に対して、かなりの神経突起伸長を同じ程度まで誘発することが見出された。GB抽出物は、高濃度で培養神経芽細胞中で細胞死を誘発することが観察されたが、生き残ったものは、極めて高度の神経突起伸長を示した。HT1001は、神経芽細胞腫の細胞数を抑制せず、SH−SY5Y細胞では細胞数をわずかに増すことさえあったので、北米薬用ニンジン抽出物は、未知の機構を介して細胞の生き残りを高めること、及び分別化を起こすことの双方で作用する可能性がある。いくつかの薬用ニンジン粗抽出物、並びにジンセノシドRb1及びRg1は、神経突起伸長を直接的に促進するか、或いはN1E115細胞中での神経突起伸長に対して神経成長因子(NGF)の刺激効果を増強することが既に示されている(Rudakewich M,Ba F,Benishin CG「Neurotrophic and neuroprotective actions of ginsenosides Rb(1) and Rg(1)」Planta Med 2001 August;67(6):533〜7)。更に、ジンセノシドRb1及びRb3、並びにノトジンセノシドR4、6及びFa7も、SK−N−SH細胞中で神経突起伸長を促進する能力を示している(Zou K,Zhu S,Meselhy MR,Tohda C,Cai S,Komatsu K「Dammarane−type Saponins from Panax japonicus and their neurite outgrowth activity in SK−N−SH cells」J Nat Prod 2002 October;65(9):1288〜92)。
【0012】
北米薬用ニンジン、GB、及びSJWの抽出物に関して、in vitro及びin vivoの両方で、且つ、神経向性と神経保護効果の両方について多数の報告がなされている。これらの効果の多くは、神経伝達物質系に対する特定の効果に帰することができ、抗酸化作用も、実質的な貢献要因である可能性がある。本件発明は、神経芽細胞腫に対する、5つの標準的なハーブと北米薬用ニンジン、GB、及びSJWとの配合物の抗酸化作用、鉄キレート形成性、及び増殖抑制効果/分別化促進効果に関する。本件発明は、また、ジンセノシド(20−(s)−プロトパナキサジオールジンセノシド)がFe2+とキレートを形成する挙動を備えることを示し、特異構造と効果との相関を解明し、SJW抽出物成分であるヒペリシンを提供する。被試験抽出物及びそれらが含む生物学的に活性な若干の純粋な化学成分がFe2+とキレートを形成する挙動は、神経芽細胞腫の悪性細胞系で観察される増殖抑制効果及び分別化促進効果の少なくとも一部分であると考えられる。
【0013】
HT1001の好ましい抽出法は、特許文献3に記載されている。この方法では、出発原料として乾燥、粉砕された300kgの薬用ニンジン粉末を使用する。必要に応じて、薬用ニンジンをフィッツミルに入れ、約80メッシュまで粉砕してもよい。次いで、薬用ニンジンを、エタノールを使用する抽出工程に供する。濃度85%のエタノールを使用することが望ましいが、当業者であれば通常の技術の範囲内で調整可能である。固形物:溶剤比は約1:5〜1:10とするが、1:8が好ましい。抽出は、必要に応じて約1〜5時間行なう。好ましい抽出時間は、3時間である。抽出温度は、80℃〜105℃の範囲とできるが、90℃〜95℃が好ましい。撹拌することが推奨される。液相と固相とは、排出ラインに25ミクロンのインラインカートリッジフィルターを備えた、速度が約4200rpmのデカンター遠心分離機を用いれば好ましく分離できる。
【0014】
多数回の抽出を行なうのであれば、上澄み液を保管しておく。いずれにしても、上澄み液を濃縮工程に供してエタノールを回収する。真空蒸留法を用いることが好ましい。目標とする固形物含有量は、約10°〜12°(ブリックス)である。温度は、好ましくは約50℃とし、15インチHg、220〜225kg/hの速度で供給する。濃縮を避けるためには、水を添加してもよい。
【0015】
濃縮された抽出物は、フリーズドライ、オーブン乾燥、又はドラム乾燥してもよいが、好ましくは、約42℃〜58℃の温度とし、約20kg/hで供給して噴霧乾燥するのが好ましい。入り口の温度は、好ましくは約150℃〜175℃であり、出口の温度は、好ましくは約70℃〜90℃である。乾燥したら、抽出物を粉砕し、塊があれば必要に応じて取り除く。0.065インチのスクリーンを取り付けたフィッツミルを使用するのが好ましい。次いで、抽出物をブレンドして約20%の製品とすることが好ましい。
【0016】
イチョウ抽出物は、Acta Pharmacal(Sunnyvale、カリフォルニア州)などを通じて市場で入手できる。イチョウ葉の標準的な抽出物は、Sloley BD,Urichuk LJ,Morley P,Durkin J,Shan JJ,Pang PK,Coutts RTが「Identification of kaempferol as a monoamine oxidase inhibitor and potential Neuroprotectant in extracts of Ginkgo biloba leaves」(J Pharm Pharmacol 2000 May;52(4):451〜9)で論じているように、約24%のイチョウフラボングリコシド及び約6%のテルペンラクトンを含有している。
【0017】
西洋オトギリソウ抽出物は市場で入手でき、Sloley BD,Urichuk LJ,Ling L,Gu LD,Coutts RT,Pang PK,Shan JJ等が「Chemical and pharmacological evaluation of Hypericum perforatum extracts」(Acta Pharmacol Sin 2000;21(12):1145〜52)中で論じているように、一般には、0.3%のヒペリシンを含有するものが標準品である。
【0018】
特殊な薬用ニンジン抽出物であるHT1001は、ジンセノシド(サポニンとしても知られている)の総量で約15〜50%、好ましくは約25〜40%を含有し、単独で、又はGB、SJW、ギンコライド、フラボノイド、ジンセノシド、ヒペリシン、及び/又はヒペルフォリンと組み合わせて、抗酸化剤又は増殖抑制剤として投与できる。
【0019】
本件発明に係る抗酸化剤又は増殖抑制剤は、経口、肺に送達するためのエアゾール又はその他のデバイス、鼻腔スプレー、静脈内、筋内、腹膜内、膣、直腸、及び局所若しくは経皮をはじめとする任意の好適な経路で投与できる。抗酸化剤又は増殖抑制剤を送達するための担持体として使用できる賦形剤は、当業者にとっては明らかである。例えば、抗酸化剤又は増殖抑制剤は、乾燥した形態でもよく、静脈注射による投与の直前に溶解してもよい。HT1001を単独又はBB、SJW及び/又はそれらの活性成分と組み合わせた場合の好ましい投与手段は、経口又は静脈投与である。経口投与するのであれば、HT1001は、好ましくは、100mg入りのカプセルにする。CVT−E033(HT1001とGBとの組み合わせ)は、好ましくは、125mg入りのカプセルにする。CVT−E036(HT1001とGBの組み合わせ)は、好ましくは、325mg(SJW:HT1001:GB、200mg:100mg:25mg)入りのカプセルにする。
【0020】
好適なキャリア、希釈剤又は賦形剤は、医薬組成物の調製に関する技術分野では公知である。このような好適な希釈剤又は賦形剤には、水、塩溶液、アルコール、アラビアガム、植物油、ポリエチレングリコール、ゼラチン、乳糖、アミロース、ステアリン酸マグネシウム、タルク、コーン又はポテトデンプンなどのデンプン、ケイ酸、粘性パラフィン、脂肪酸のモノグリセリド及びジグリセリド、ペンタエリスリトール脂肪酸エステル、ヒドロキシメチルセルロース、ポリビニルピロリドンなどを含むが、これらに限定はされない。医薬組成物は殺菌してもよく、必要に応じて滑沢剤、保存剤、安定剤、湿潤剤、乳化剤、浸透圧を変えるための塩、緩衝剤、着色料、着香料及び/又は芳香性物質などの補助剤と混合できる。単独で投与する場合には、75kgの個体に対して、有効薬剤HT1001を1日当り10mg〜1000mgの投与量範囲で投与するのが好ましい。そして、1日当り75mg〜500mgの投与量とするのがより好ましく、1日当り100mg〜200mgの投与量とするのが最も好ましい。
【0021】
本明細書中で「有効量」と言う場合は、HT1001を、単独で、或いはGB、SJW、ギンコライド、フラボノイド、ジンセノシド、ヒペリシン、及び/又はヒペルフォリンと組み合わせて投与する量を含む。HT1001を別の抗酸化剤又は増殖抑制剤と共に投与するのであれば、HT1001の通常の有効量を削減できる。従って、用語「有効量」とは、その材料を組み合わせることが効果的であり、且つ各材料の投与量を比例的に低減できるその他の有効材料と組み合わせたHT1001の使用量を包むものと解釈する。例えば、HT1001が、通常、1個体当り1日につき100mg投与するのが効果的であり、イチョウが、通常、1個体当り1日につき100mg投与するのが効果的であるなら、2種の材料を組み合わせて使用すれば、各々を1日につき個体当り50mgの投与にできる。このように組み合わせて使用すれば、多くの医薬がそうであるように、その他の有効材料(HT1001以外の)が高価であるなら、消費者にとっては経済的である。
【0022】
本件発明に係る組成物は、酸化的ストレス、鉄過剰症を治療し、且つ/又は神経突起伸長を促進するのに使用できる。酸化的ストレス及び鉄過剰症は、限定はされないが、癌、アルツハイマー病、結核、パーキンソン病、鎌状赤血球、ウィルソン病、肝損傷、βサラセミア、心臓疾患、多発性硬化症、炎症性腸疾患(クローン病及び潰瘍性大腸炎)、感染症、新生物、心筋症、及び/又は関節症をはじめとする多くの健康状態及び疾患を引き起こす。特定細胞組織への鉄負荷は、疾患リスクの増大と関連している(Eugene D.Weinberg「Iron Loading and Disease Surveillance」Emerging Infectious Disease,Vol.5,No.3,May〜June 1999 346〜352)。鉄は、フリーラジカルとして知られている物質が体内で傷害作用を刺激する酸化促進剤として作用する。各種細胞組織中での鉄過剰症と関連する疾患を、以下の表1に示す。
【0023】
【表1】

【実施例】
【0024】
[材料]
フェロジン、デスフェロキサミン(DFO)、クエルセチン、ルチン、ギンコライドA、及びギンコライドBは、Sigmaから入手した。すべての抽出物(HT1001、GB、SJW、CVT−E033、及びCVT−E036)とその化学成分であるジンセノシド(Rb1、Rg1、Rc、Rd、及びRe)は、CV Technologies(Edmonton、アルバータ州、カナダ)で調製し、精製した。北米薬用ニンジン抽出物HT1001(REMEMBER−fX(登録商標))(Sloley BD,Pang PK,Huang BH,Ba F,Li FL,Benishin CG,Greenshaw AJ,Shan JJ「American ginseng extract reduces scopolamine−induced amnesia in a spatial learning task」J Psychiatry Neurosci 1999 November;24(5):442〜52)、GB抽出物(Sloley BD,Urichuk LJ,Morley P,Durkin J,Shan JJ,Pang PK,Coutts RT「Identification of kaempferol as a monoamine oxidase inhibitor and potential Neuroprotectant in extracts of Ginkgo biloba leaves」J Pharm Pharmacol 2000 May;52(4):451〜9)及びSJW(Sloley BD,Urichuk LJ,Ling L,Gu LD,Coutts RT,Pang PK,Shan JJ「Chemical and pharmacological evaluation of Hypericum perforatum extracts」Acta Pharmacol Sin 2000;21(12):1145〜52)の化学同定結果は前述の通りである。CVT−E033(AD−fX(登録商標)、HT1001:GB抽出物が4:1(w/w))、及びCVT−E036(MENTA−fX(登録商標)、SJWの標準的な抽出物:HT1001:GB抽出物が8:4:1(w/w))は、ChemBioPrint(商標)が組み合わせを標準化した製品であり、CV Technologiesから商業的に入手可能である。WST−1細胞増殖試薬は、F.Hoffmann−La Roche Ltd.(Postfach、スイス)から購入した。細胞培養試薬は、Gibco Life Technologies Canada(Burlington、オンタリオ州、カナダ)から購入した。その他のすべての化学試薬は、Sigma−Aldrich Chemical Co.(Oakville、オンタリオ州、カナダ)又はFisher Chemical Co.(Edmonton、アルバータ州、カナダ)から購入した。水溶性ジンセノシドを除くすべての試料は、まずDMSOに溶解し、その後水で希釈して実験に用いた。
【0025】
[脂質の過酸化抑制性の調査]
ハーブ抽出物が脂質の過酸化を抑制する能力を、Ohkawaらが開発したチオバルビツール酸分析法(Ohkawa H,Ohishi N,Yagi K「Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction」Anal Biochem 1979 July;95(2):351〜8)、及びカテコールアミン作動性神経芽細胞腫の細胞系SH−SY5Y(Saskatchewan大学、Peter Yu博士からの寛大な贈呈物)を使用して評価した。細胞は、10%ウシ胎児血清(FBS)(v/v)及び1%抗生物質混合物(ペニシリン50μg/mL、ストレプトマイシン50μg/mL、100μg/mL;PSN)を添加したダルベッコ変性イーグル培地(DMEM)中にほぼ90〜100%の集密度になるまで維持した。次いで、それらを、6−ウェルのNunclon組織培養プレートに1×106細胞/ウェルで接種して24時間増殖させ、その後、0.1mMの硫酸第一鉄(FeSO4)の存在下又は不在下でハーブ抽出物に48時間曝露した。次いで、細胞を採取し、使い捨てガラス培養チューブに入れ、遠心分離し、ペレットを0.4mLの1.15%塩化カリウム中に再懸濁し、超音波除膜器(dismembrator)を用いて均一にした。次いで、300μLのアリコートを、テトラエトキシプロパンを参照基準品とし、Ohkawaらの方法を使用して脂質の過酸化物を分析した。残りの材料を用い、Lowryの方法を使用してタンパク質含有量を分析した。
【0026】
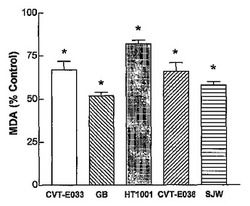
0.1mMのFe2+の存在下又は不在下での脂質の過酸化抑制に対するハーブ抽出物の効果を図1に示す。すべての試料が、Fe2+存在下でのみ脂質の過酸化を有意(P<0.05)に抑制したが、Fe2+の不在下では効果がなかった(データは示していない)。有効性は、GB>SJW>CVT−E033=CVT−E036>HT1001の順番であった。
【0027】
[フリーラジカルの除去性の調査]
ハーブ抽出物及び純粋化学成分のヒドロキシルフリーラジカルの除去能力を、Arnaoらが開発した動的な方法を応用して評価した(Arnao MB,Cano A,Hernandez−Ruiz J,Garcia−Canovas F,Acosta M「Inhibition by L−ascorbic acid and other antioxidants of the 2,2’−azino−bis(3−ethylbenzthiazoline−6−sulfonic acid)oxidation catalyzed by peroxidase:a new approach for determining total antioxidant status of foods」Anal Biochem 1996 June 1;236(2):255〜61)。簡潔に説明すると、ハーブ抽出物を、50mM Tris−HCl緩衝液(pH7.2)中で、過酸化水素と2,2’−アジノ−ビス(3−エチルベンズチアゾリン−6−スルホン酸)(ABTS)とを混合し、2nMの西洋ワサビ過酸化酵素で反応を開始させた。有色のABTSラジカル(405nmでの吸光度)の形成を防止する能力によって、試料のヒドロキシルラジカルの除去効果を推測した。各試料に関するフリーラジカルの除去性を、アスコルビン酸で作成した標準曲線と比較した。
【0028】
抽出物GB、HT1001、及びCVT−E033のフリーラジカルの除去能力を以下の表2に示す。ヒドロキシラジカルの除去効果を、過酸化酵素触媒として形成されるABTSラジカルの形成を防止する能力から推測した。CVT−E033、そしてより大きな程度でGBは、かなりのヒドロキシルラジカルの除去効果を示したが、HT1001は、検知可能な効果を示していない。
【0029】
【表2】

【0030】
表2では、北米薬用ニンジン抽出物HT1001、GB抽出物、及び組み合わせCVT−E033(HT1001+GB)によるフリーラジカルの除去性を調査している。具体的には、ハーブ抽出物を過酸化水素及びABTSと共に培養し、西洋ワサビ過酸化酵素を添加して反応を開始した。そして、試料のヒドロキシルラジカルの除去効果を、有色のABTSラジカルの形成を抑制する能力によって推測した(405nmでの吸光度)。更に、各試料に関するフリーラジカルの除去性を、アスコルビン酸を用いて作成した標準曲線と比較し、重量%アスコルビン酸として表現している。
【0031】
[Fe2+とのキレート形成挙動の調査]
ハーブ抽出物又は純粋な化学成分が無菌分析装置内でFe2+をキレート化する能力を、以下に示すFeSO4とFe2+キレートを形成する色素発生バクテリアであるフェロジンを培養して追跡し、有色のFe(フェロジン)32+錯体の形成を抑制する効果で評価した。フェロジンは、以前、フェリチンが放出する遊離Fe2+の測定に活用されていた。試験対象であるすべてのハーブ抽出物及び純粋化学物質は、4%DMSO水溶液を用い、それぞれを5mg/mL及び0.2mg/mLで調製した。50μLのアリコートを、96−ウェルのマイクロタイタープレート(MTP)中で50μLの1mM FeSO4溶液と共に室温で30分間培養した。次いで、得られた50μLのアリコート溶液を、新たな96−ウェルMTPに移し、50μLの2mM(飽和濃度)フェロジン溶液と合わせた。HT1001、GB、SJW、CVT−E033、及びCVT−E036を1.25mg/mLで試験し、純粋化学成分を50μg/mL(最終濃度)で試験した。発色は瞬間的であり、562nmで吸光度を読み取った。結果を参照試料との比較で表し、試料の効果を既知のFe2+キレート剤であるDFOと比較した。DMSOは、Fe(フェロジン)32+錯体の形成を抑制できたので、試験抽出物及び化学成分毎にDMSO参照試料と比較したパーセンテージで示した。
【0032】
すべてのハーブ抽出物、及び純粋化学成分、ギンコライドA及びB、フラボノイドのクエルセチン及びルチン、ヒペルフォリン、ヒペリシン、並びに5種のジンセノシド、Rb1、Rg1、Rc、Rd、及びReを、無菌化学分析装置中でフェロジンとFe2+との結合を抑制する能力について試験した。Fe(フェロジン)32+錯体に対して十分な吸光度を信号として得るために、非生理学的濃度のFe2+を選択してフェロジンと反応させた。そのため、Fe2+をキレート化するように、ハーブ抽出物及び各成分を高濃度にした。同程度のFe(フェロジン)32+錯体形成に対する投薬量に依存する阻害効果が、CVT−E033、GB、HT1001、SJW、及びCVT−E036について観察された(図3)。図2に示す既知のFe2+キレート剤、DFOの投薬量に対する応答曲線から、DFOは、我々の分析装置ではFe(フェロジン)32+錯体生成を抑制できることを示している。ギンコライドA及びB、並びにフラボノイド・ルチンを滴加した曲線は効果を示していないが、フラボノイド・クエルセチンは、Fe(フェロジン)32+錯体生成を抑制できている(図4)。20−(s)−プロトパナキサトリオールジンセノシドRg1及びReを除き、20−(s)−プロトパナキサジオールジンセノシドRb1、Rc、及びRdも、フェロジンとFe2+との相互作用を抑制する能力を示した(図5)。SJWから分析される主な既知の生活性成分では、ヒペルフォリンを除き、ヒペリシンはFe(フェロジン)32+錯体の形成を抑制できる(図6)。纏めて考えると、これらのデータは、CVT−E033、GB、HT1001、SJW、及びCVT−E036が、Fe2+キレート剤として機能できる化学成分を明確に含んでいることを示唆している。しかし、各成分を、ハーブ抽出物におけるそれらの含有量を反映した濃度で試験した場合に、効果はほとんど認められず、抽出物の各成分が、Fe2+の結合にたいして相乗的に寄与するか、或いは総合的に効果を表すことを示唆している。
【0033】
[神経芽細胞腫の生存能力調査]
SH−SY5Y、N1E115、及びSK−N−SH(ATCC、Rockville、メリーランド州、米国)神経芽細胞腫細胞を、10容量%のFBS、1mMピルビン酸ナトリウム、2mM L−グルタミン及びMEM非必須アミノ酸混合物を補充した最小必須培地(MEM)中で、5%CO2と95%空気のもとに37℃で継代培養することによって維持した。ほぼ80%の集密度になったところで細胞を採取し、ハーブ抽出物又は純粋な化学成分、及び異なる量のFBSを含有する96−ウェルの培養プレート中に1×104細胞/ウェルで接種した。DMSOの最終濃度は、0.05%を超えないようにした。製造業者の示す仕様書に従って各試料ウェルにWST−1細胞増殖試薬を添加し、96時間後に細胞数に対する効果を評価した。細胞数は、細胞増殖試薬WST−1法を使用し、指示通りに判定した(Ba F,Pang PK,Benishin CG「The establishment of reliable cytotoxic system with SK−N−SH neuroblastoma cell culture」J Neurosci Method 2003 March 15;123(1):11〜22)。伝統的なトリパンブルー排除法の細胞計数に比較した場合のWST−1法の精度は、2つの方法の間に強い相関があることを示した。結果を参照試料との比較として示した。
【0034】
すべての抽出物の効果を、通常(10%)と低(2%)の両方の血清条件下において、50μg/mLで3種の神経芽細胞腫細胞系に対して比較した。結果を図7〜図9に示す。イチョウ含有抽出物GB、CVT−E033及びCVT−E036では、最も多くの図で細胞数の抑制を示している。具体的には、GBは、ヒト神経芽細胞腫系SK−N−SH細胞(低血清及び通常血清)及びSH−SY5Y(低血清)で細胞数を抑制した。CVT−E033は、対照的に、SH−SY5Y(低血清)及びハツカネズミ神経芽細胞腫細胞系N1E115(低血清及び通常血清)で細胞数を有意に抑制し、CVT−E036は、低血清条件の3種すべての細胞系で、更に通常血清条件のN1E115で細胞数を抑制した。SJWの抽出物も、SH−SY5Yでは低血清条件で、N1E115細胞では双方の条件で細胞数を抑制した。HT1001は、細胞数に対して抑制効果をもたず、高血清条件下のSH−SY5Y細胞に細胞数の小さな刺激を生み出した。Fe2+キレート剤DFOは、また、N1E115細胞で神経芽細胞腫の細胞数を抑制する(図10)が、SH−SY5Y細胞では二相の効果を発揮している。
【0035】
個々の成分を、抽出物中における比率を反映した濃度で分析した場合には、いずれの細胞系においても、細胞数に対する有意な効果は観察されなかった。化合物の若干の部分は、濾過中に失われていると推測されるので、投薬量に対する応答曲線は、ハツカネズミモデル(N1E115)及びヒト神経芽細胞腫モデル(SH−SY5Y)の双方ですべての成分に対して作図した。GB抽出物、CVT−E033及びCVT−E036が含むギンコライド(A及びB)と、SJW中が付加的に含むフラボノイド(クエルセチン及びルチン)との投薬量に対する応答曲線を図11(N1E115細胞)及び図12(SH−SY5Y)に示す。クエルセチンのみが、ヒトSH−SY5Y及びマウスN1E115細胞系の双方において、5μg/mLで初めて明らかな有意性(P<0.05)で細胞数のかなりの抑制効果を示した。ジンセノシド及びヒペルフォリンに関する結果を示す図13(N1E115細胞)及び図14(SH−SY5Y細胞)によれば、ヒペルフォリンのみが、双方の細胞系で、投薬量にかなり依存する細胞数の抑制効果を示すことを表している。
【0036】
[神経突起伸長性の調査]
ハツカネズミ神経芽細胞腫細胞系N1E115を使用して、ハーブ抽出物HT1001、GB、及びCVT−E003の神経突起伸長に対する効果を調査した。N1E115細胞を、10容量%FBS及び1容量%PSN抗生物質を補充した37℃のDMEM中で、100cm2の組織培養皿に接種し、維持した。次いで、細胞を機械的に取り出し、コラーゲンで被覆された組織培養皿に2×104細胞/皿の密度で塗り広げた。細胞突起成長は、ハーブ抽出物と共存させて培養した7日後又は14日後に、細胞の代表的な細胞フィールドについて定量化した。各処理皿について2つの細胞フィールドを写真撮影し、神経突起伸長の程度を以下のように評点化した。
S1:細胞が伸びた状態になるか、或いは極めてわずかな神経突起が成長した状態。
S2:細胞本体から2つを超える小さな神経突起が伸びた状態。
S3:1つ又は2つの神経突起が、細胞本体直径の少なくとも2倍に成長した状態。
S4:2つを超える長い突起が存在する状態。
神経突起指標は以下の数1で計算した。
【0037】
【数1】

【0038】
CVT−E033、HT1001、GBの神経突起伸長に対する効果の纏めを図15に示す。試験したすべてのハーブ抽出物は50μg/mLから、N1E115神経芽細胞腫細胞からの神経突起伸長を同程度まで誘発する能力を示した。GB及びHT1001の効果は、投薬量に依存していた。GBは、細胞死を誘導するが(細胞数に関する上記研究で支持されるように)、残存している細胞に対しては神経突起伸長を刺激することが観察された。
【0039】
[統計的な解析]
特記しない限り、一元分散分析(ANOVA)(スチューデント−ニューマン−クルーズ検定)を使用し、有意水準を0.05に設定して有意差を判定した。すべての結果を、平均±平均の標準誤差(SEM)として表した。統計的な解析は、GraphPad Prism又はSigmaStatのグラフ及び統計ソフトウェアを使用して実施した。
【図面の簡単な説明】
【0040】
【図1】SH−SY5Y神経芽細胞腫細胞におけるFe2+が触媒機能を果たす脂質の過酸化を抑制する能力に対するハーブ調合剤の効果を示す図である。細胞を、1×106細胞/ウェルで接種し、24時間増殖させ、その後、0.1mM FeSO4の存在下又は不在下でハーブ抽出物に48時間曝露した。次いで、細胞膜を採取し、過酸化脂質を分析した。過酸化脂質の存在は、有色のMDA生成物の形成で示され、結果を参照試料との比較で表している。ハーブ調合剤を用いた場合は、未加工の吸光度値と対比すると*P<0.05の有意差で参照試料と異なる。
【図2】ハーブ抽出物によるFe2+とフェロジンとの相互作用の抑制効果を示す図である。種々のハーブ抽出物(図3)及び強力なFe2+キレート剤DFO(図2)を、無菌化学分析装置の中で0.5mM FeSO4溶液と共に指示された濃度で培養し、その後、色原体フェロジン(1mM、最終濃度)と共に培養した。適切な参照試料と比較した、試験試料の562nmでの吸光度の結果を示している。
【図3】ハーブ抽出物によるFe2+とフェロジンとの相互作用の抑制効果を示す図である。
【図4】いくつかのハーブ抽出物中の純粋な化学成分によるFe2+とフェロジンとの相互作用の抑制効果を示す図である。純粋な化学物質であるクエルセチン、ルチン、ギンコライドA及びギンコライドB(図4)、ジンセノシドRb1、Rg1、Rc、Rd、Re(図5)、並びにヒペリシン及びヒペルフォリン(図6)を、無菌化学分析装置中で0.5mM FeSO4溶液と共に指示された濃度で培養し、その後、色原体フェロジン(1mM、最終濃度)と共に培養した。適切な参照試料と比較した、試験試料の562nmでの吸光度の結果を示している。
【図5】いくつかのハーブ抽出物中の純粋な化学成分によるFe2+とフェロジンとの相互作用の抑制効果を示す図である。
【図6】いくつかのハーブ抽出物中の純粋な化学成分によるFe2+とフェロジンとの相互作用の抑制効果を示す図である。
【図7】低血清及び通常血清条件での神経芽細胞腫の細胞増殖に対するハーブ抽出物の効果を示す図である。種々のハーブ抽出物又は担持体そのもの(参照試料)を、低(2%)FBS又は通常(10%)FBS中で培養した、SK−N−SH(図7)、SH−SY5Y(図8)及びN1E115(図9)細胞と共に50μg/mLで培養した。Fe2+キレート剤DFOの細胞数に対する効果も、N1E115(固形シンボル)及びSH−SY5Y(非定形シンボル)細胞(図10)の双方について調査した。生存細胞数は、試薬WST−1を使用して判定した。細胞数の抑制効果の有意性は*P<0.05又は**P<0.001で判定し、細胞数への刺激性は同一血清条件の参照試料に対する有意性#P<0.05で判定している。
【図8】低血清及び通常血清条件での神経芽細胞腫の細胞増殖に対するハーブ抽出物の効果を示す図である。
【図9】低血清及び通常血清条件での神経芽細胞腫の細胞増殖に対するハーブ抽出物の効果を示す図である。
【図10】低血清及び通常血清条件での神経芽細胞腫の細胞増殖に対するハーブ抽出物の効果を示す図である。
【図11】ギンコライド、フラボノイド、ジンセノシド、及びヒペルフォリンの神経芽細胞腫細胞に対する効果を示す図である。ギンコライドA(GA)及びB(GB)並びにフラボノイドであるルチン及びクエルセチン(Q)(図11、図12)、或いはヒペルフォリン又はジンセノシドRb1、Rg1、Rc、Rd、及びRe(図13、図14)、或いは担持体そのもの(参照試料)を、培養したN1E115(図11、図13)、SH−SY5Y(図12、図14)細胞と共に図に示す濃度で96時間培養した。生存細胞数は、試薬WST−1を使用して判定した。有意性は、参照試料に対して有意性*P<0.05、**P<0.001、***P<0.0001で判定している。
【図12】ギンコライド、フラボノイド、ジンセノシド、及びヒペルフォリンの神経芽細胞腫細胞に対する効果を示す図である。
【図13】ギンコライド、フラボノイド、ジンセノシド、及びヒペルフォリンの神経芽細胞腫細胞に対する効果を示す図である。
【図14】ギンコライド、フラボノイド、ジンセノシド、及びヒペルフォリンの神経芽細胞腫細胞に対する効果を示す図である。
【図15】ハーブ抽出物のN1E115の神経突起伸長に対する投薬量に依存する効果を示す図である。CVT−E033、HT1001、及びGBを、培養したN1E115神経芽細胞腫細胞と共に図に示す濃度で7日間培養し、神経突起伸長評点を判定した。参照試料に対する有意性は、*P<0.05、**P<0.001で判定している。
【背景技術】
【0001】
幾多の世紀に渡って、多種多様な神経症や軽病に対応するための漢方薬には、薬用ニンジン、イチョウ(Ginko biloba)(GB)、及び西洋オトギリソウ(Hypericum perforum、SJW)を有効活用してきた。最近のメタアナリシスは、GB抽出物が備える、認知、気分や感情の機能、痴呆の治療に向けたクオリティオブライフ(生活の質)に対する副作用のない有効性に言及してきた。しかし、より大規模な臨床試験の必要性が強調されている[Birks J,Grimley EV,van DM「Ginkgo biloba for cognitive impairment and dementia」Cochrane Database Syst Rev 2002;(4):CD003120]。同様に、北米薬用ニンジン(Panax quinquefolius)抽出物についても、記憶力を改善し[Sloley BD,Pang PK,Huang BH,Ba F,Li FL,Benishin CG,Greenshaw AJ,Shan JJ「American ginseng extract reduces scopolamine−induced amnesia in a spatial learning task」J Psychiatry Neurosci 1999 November;24(5):442〜52]、その成分ジンセノシドRb1及びRg1は、神経保護効果を発揮する[Rudakewich M,Ba F,Benishin CG「Neurotrophic and neuroprotective actions of ginsenosides Rb(1)and Rg(1)」Planta Med 2001 August;67(6):533〜7]ことが報告されている。薬用ニンジンの有益な特性は、そのサポニン含有物、集約してジンセノシドと呼ばれているダンマラントリテルペングルコシドの混合物に起因すると考えられる。ある種のジンセノシドは単離されており、その構造が決定されている。このようなジンセノシドには、Rb1、Rb2、Rc、Rd、Re、Rf及びRgが含まれている(特許文献1参照)。最近のメタアナリシスによれば、ドイツでは軽症及び中等症鬱病の治療に関して承認されているSJWは、合成抗鬱薬に較べて明らかに優れた結果を示しており、副作用の面からもより好ましいとされている。[Roder C,Schaefer M,Leucht S「Meta−analysis of effectiveness and tolerability of treatment of mild to moderate depression with St.John’s Wort」Fortschr Neurol Psychiatr 2004 July;72(6):330〜43]。
【0002】
酸化的ストレスは、種々の神経学的病理に関連しており、それゆえ、GB、北米薬用ニンジン、及びSJW抽出物の効果の若干は、それらの固有の抗酸化作用に起因している可能性がある。GB及びSJW中に含まれる主な生理的に活性な成分であることが知られているフラボノイドは、脂質の過酸化防止、フリーラジカルの除去、及びFe2+のキレート化をはじめとする抗酸化作用を有することがわかっている[Rice−Evans CA,Miller NJ,Paganga G「Structure−antioxidant activity relationships of flavonoids and phenolic acids」Free Radic Biol Med 1996;20(7):933〜56;Sloley BD,Urichuk LJ,Morley P,Durkin J,Shan JJ,Pang PK,Coutts RT「Identification of kaempferol as a monoamine oxidase inhibitor and potential Neuroprotectant in extracts of Ginkgo biloba leaves」J Pharm Pharmacol 2000 May;52(4):451〜9;Sloley BD,Urichuk LJ,Ling L,Gu LD,Coutts RT,Pang PK,Shan JJ「Chemical and pharmacological evaluation of Hypericum perforatum extracts」Acta Pharmacol Sin 2000;21(12):1145〜52]。
【0003】
また、抗酸化作用は、ジンセノシド、Rb1及びRg3については[Kim YC,Kim SR,Markelonis GJ,Oh TH「Ginsenosides Rb1 and Rg3 protect cultured rat cortical cells from glutamate−induced neurodegeneration」J Neurosci Res 1998 September 15;53(4):426〜32;Lim JH,Wen TC,Matsuda S,Tanaka J,Maeda N,Peng H,Aburaya J,Ishihara K,Sakanaka M「Protection of ischemic hippocampal neurons by ginsenoside Rb1,a main ingredient of ginseng root」Neurosci Res 1997 July;28(3):191〜200]に、SJW抽出物については[Jang MH,Lee TH,Shin MC,Bahn GH,Kim JW,Shin DH,Kim EH,Kim CJ「Protective effect of Hypericum perforatum Linn(St,John’s wort)against hydrogen peroxide−induced apoptosis on human neuroblastoma cells」Neurosci Lett 2002 September 30;329(2):177〜80]に記載されている。Fe2+のキレート化に伴う抗酸化作用により細胞を保護する効果を発揮する抽出物は、使用されるモデルの状態及びその性質に応じて、増殖抑制効果/アポトーシス促進効果を示すとの仮説を立てることができる。Fe2+は、細胞の増殖にとって決定的に重要な要素なので、新生細胞のFe2+に対する要求は大きい。Fe2+キレート剤の抗癌作用は、また、神経芽細胞腫をはじめとする種々の病理に対して臨床例が報告されている[Donfrancesco A,Deb G,De SL,Cozza R,Castellano A「Role of deferoxamine in tumor therapy」Acta Haematol 1996;95(1):66〜9]。それらの明らかにされた増殖抑制効果[Renton FJ,Jeitner TM「Cell cycle−dependent inhibition of the proliferation of human neural tumor cell lines by iron chelators」Biochem Pharmacol 1996 July 14;51(11):1553〜61]に加えて、Fe2+キレート剤は、また、アポトーシスを誘発し[Fan L,Iyer J,Zhu S,Frick KK,Wada RK,Eskenazi AE,Berg PE,Ikegaki N,Kennett RH,Frantz CN「Inhibition of N−myc expression and induction of apoptosis by iron chelation in human neuroblastoma cells」Cancer Res 2001 March 1;61(3):1073〜9]、且つ、胎児性癌腫F9を含むいくつかの腫瘍系における細胞の分別化を促進する[Tanaka T,Muto N,Ido Y,Itoh N,Tanaka K「Induction of embryonal carcinoma cell differentiation by deferoxamine,a potent therapeutic iron chelator」Biochim Biophys Acta 1997 July 5;1357(1):91〜7]。
【0004】
最近、注意欠陥多動障害(ADHD)の治療で使用されている、特許製品である北米薬用ニンジン抽出物HT1001とGBとを含む特異な抽出物配合製品(CVT−E033、AD−fX(登録商標)、CV Technologies、Edmonton、アルバータ州)に関する試験的な研究では、これらが、認知問題を含むADHD症候を改善する可能性があることを示唆している[Lyon MR,Cline JC,Totosy de ZJ,Shan JJ,Pang P,Benishin C「Effect of the herbal extract combination Panax quinquefolium and Ginkgo biloba on attention−deficit hyperactivity disorder:a pilot study」J Psychiatry Neurosci 2001 June;26(3):221〜8]。この研究は、北米薬用ニンジン、GB、及びSJWの神経保護/神経向性及び抗酸化作用に関する報告に止まらず、それぞれの物質とそれらの組み合わせ、CVT−E033及びCVT−E036(Menta−fX(登録商標);GB、北米薬用ニンジン、及びSJW)の作用機構に関する研究を促進することになった。
【0005】
特許文献2及び特許文献3は、従来技術による抽出物に触れている。特許文献2及び特許文献3が開示している内容は、本出願でも引用している。特許文献2は、ジンセノシドRb1及びRg1が、大脳皮質及び海馬領域におけるAChのアベイラビリティを高め、アルツハイマー型老人性痴呆の症状を軽減することを開示している。該特許は、また、ジンセノシドRb1の単離方法を開示している。特許文献3は、薬用ニンジンに由来する医薬組成物、及び各種の脳の健康状態又は病気の治療方法、加えて鬱又は一般的認知の改善を開示している。
【0006】
【特許文献1】米国特許第4157894号
【特許文献2】米国特許第5137878号
【特許文献3】米国特許第6083932号
【0007】
[発明の効果]
本発明者らは、北米薬用ニンジンの特定の抽出物、GB及びSJWの抽出物、及びそれらの生理的に活性な成分である、ジンセノシドRb1、Rg1、Rc、Rd、Re;ギンコライドA及びB;フラボノイドのクエルセチン及びルチン;ヒペリシン及びヒペルフォリンは、抗酸化作用及び増殖抑制作用を有することを見出した。本発明者らがHT1001と呼び、約15〜50%、好ましくは約25〜40%の総ジンセノシド(サポニンとしても知られている)を含有する特定の薬用ニンジン抽出物は、抗酸化剤又は増殖抑制剤として単独で或いはGB及び/又はSJWと組み合わせて投与できる。
【0008】
[発明を実施するための最良の形態]
本件発明者らは、専売品である北米薬用ニンジンの抽出物(HT1001)は、単独或いはGB及び/又はSJWと組み合わせて、抗酸化作用及び抗癌作用を有することを見出した。試験の結果、化学成分であるギンコライド、フラボノイド、ジンセノシド、ヒペリシン、及びヒペルフォリンも抗酸化作用を有することを見出した。試験に供したハーブ抽出物及びそれらの組み合わせのすべてについて、Fe2+が触媒機能を果たす脂質の過酸化を抑制する能力、無菌化学分析装置内でFe2+をキレート化する能力、そして、GB及びCVT−E033(北米薬用ニンジン+GB)の場合にはフリーラジカルの除去によって抗酸化作用が確認された。更に、Fe2+キレート剤の示す挙動と同様、すべてのハーブ抽出物の増殖抑制効果及び/又は分別化促進効果が、いくつかの神経芽細胞腫モデルで立証された。
【0009】
抗酸化作用は、すべての被試験ハーブ抽出物及びそれらの化学成分のいくつかに見られた。CVT−E033(北米薬用ニンジン+GB)及びCVT−E036(北米薬用ニンジン、GB、及びSJW)は、ヒト神経芽細胞腫細胞系SH−SY5YにおいてFe2+が触媒機能を果たす脂質の過酸化を抑制することがわかった。このことは、Fe2+が触媒機能を果たす脂質の過酸化をすべて個別に抑制するHT1001、GB、及びSJWが寄与していると考えられる。GB(Ramassamy C,Girbe F,Christen Y、Costentin J「Ginkgo biloba extract EGb761 or trolox C prevent the ascorbic acid/Fe2+induced decrease in synaptosomal membrane fluidity」Free Radic Res Commun 1993;19(5):341〜50)、北米薬用ニンジン(Kitts DD,Wijewickreme AN,Hu C「Antioxidant properties of a North American ginseng extract」Mol Cell Biochem 2000 February;203(1〜2):1〜10)、及びSJW(Zou Y,Lu Y,Wei D「Antioxidant activity of a flavonoid−rich extract of Hypericum perforatum L. in vitro」J Agric Food Chem 2004 September 11;52(16):5032〜9)、及びフラボノイドの構成成分(Chen YT,Zheng RL,Jia ZK,Ju Y「Flavonoids as superoxide scavengers and antioxidants」Free Radic Biol Med 1990;9(1):19〜21)の抽出物は、脂質又はリポソームの過酸化を抑制することが報告されている。Fe2+が触媒機能を果たす脂質の過酸化は、フリーラジカルの除去又はFe2+のキレート化によって直接的に防止され得る。CVT−E033は、適度のフリーラジカルの除去性を示したが、これは、検知可能な効果を有さない薬用ニンジン抽出物HT1001よりはむしろ、かなりのフリーラジカルの除去性を備えるGB成分抽出物によるものと考えられる。このことは、GB抽出物によるフリーラジカルの除去性に関する別の報告(Ramassamy C,Naudin B,Christen Y,Clostre F,Costentin J「Prevention by Ginkgo biloba extract(EGb761) and trolox C of the decrease in synaptosomal dopamine or serotonin uptake following incubation」Biochem Pharmacol 1992;44(12):2395〜401)と一致している。更に、化学モデルでは、すべての抽出物が同程度までのFe2+のキレート化を示した。これら抽出物の純化学成分のいくつかに関する試験では、クエルセチン(Sestili P,Guidarelli A,Dacha M,Cantoni O「Quercetin prevents DNA single strand breakage and cytotoxicity caused by tert−butylhydroperoxide:free radical scavenging versus iron chelating mechanism」Free Radic Biol Med 1998 August 15;25(2):196〜200に報告済み)、ヒペリシン、並びに20−(s)−プロトパナキサジオールジンセノシドRb1、Rc、及びRdは、特異構造と効果との相関を暗示する、Fe2+とキレートを形成する挙動を示し、20−(s)−プロトパナキサトリオールジンセノシドRg1及びReの効果は顕著でない。後の実施例で示すデータは、CVT−E033、GB、HT1001、SJW、及びCVT−E036は、Fe2+キレート剤として機能する可能性のある異なる化学的成分を有していることを示唆している。しかし、個々の成分をハーブ抽出物中におけるそれらの含有量を反映した濃度で試験すると、極めてわずかな効果しか示さないため、Fe2+の固定は、抽出物の各成分の相乗効果、又は総合効果であると考えられる。
【0010】
各種の神経芽細胞腫細胞系に対する増殖抑制効果及び/又は分別化促進効果は、すべての抽出物に観察された。すべてのハーブ調合剤がFe2+キレート剤の挙動を示したことは、これらが神経芽細胞腫中で抗癌特性及び増殖抑制特性を示した物質であることからすれば驚くべきことではない(Donfrancesco A,Deb G,De SL,Cozza R,Castellano A「Role of deferoxamine in tumor therapy」Acta Haematol 1996;95(1):66〜9)。この研究で使用された神経芽細胞腫培養モデルでは、Fe2+キレート形成に関連する神経保護(すなわち、生存促進)効果(血清欠乏モデル中で試験された)と増殖抑制効果/分別化促進効果との間におけるバランスは、後者よりと考えられる。試験した化学成分の中では、クエルセチン及びヒペルフォリンのみが、神経芽細胞腫の細胞数の抑制を示している。ヒペルフォリン(Dona M,Dell’Aica I,Pezzato E,Sartor L,Calabrese F,Della BM,Donella−Deana A,Appendino G,Borsarini A,Caniato R,Garbisa S「Hyperforin inhibits cancer invasion and metastasis」Cancer Res 2004 October 1;64(17):6225〜32)、GB、及び一部のフラボノイドは、他の新生物モデルでは増殖抑制効果/アポトーシス促進効果を発揮することが報告されている(Huang YT,Hwang JJ,Lee PP,Ke FC,Huang JH,Huang CJ,Kandaswami C,Middleton E Jr,Lee MT「Effects of luteolin and quercetin,inhibitors of tyrosine kinase,on cell growth and metastasis−associated properties in A431 cells overexpressing epidermal growth factor receptor」Br J Pharmacol 1999 December;128(5):999〜1010)。若干の特定ジンセノシドは、既にヒト白血病(THP−1)細胞をはじめとする種々の新生物モデルにおいて増殖抑制効果及びアポトーシス促進効果を発揮することがわかっているが(Popovich DG,Kitts DD「Structure−function relationship exists for ginsenosides in reducing cell proliferation and inducing apoptosis in the human leukemia(THP−1)cell line」Arch Biochem Biophys 2002 November 1;406(1):1〜8)、この研究で試験されたジンセノシド(Rb1、Rg1、Rc、Rd及びRe)では顕著でなかったことは、本明細書の結果と一致している。このことは、また、北米薬用ニンジン抽出物HT1001が、単独では、神経芽細胞腫の細胞数抑制と関連していなかったという知見と一致している。HT1001とGBの間には相乗効果が観察される。CVT−E033及びCVT−E036は、双方とも、個々の材料と比較した場合、低血清条件(ストレス)下で細胞数を減少させる。CVT−E036は、また、非ストレス条件下でこれを行なうことができる。本件発明者らが抽出物の組み合わせ中におけるそれらの比率を反映した濃度で個々の成分の効果を分析した際には、細胞数に対して有意な効果は観察されなかった(図9)。従って、該成分は相乗的に作用すると思われる。
【0011】
また、Fe2+キレート剤は、増殖抑制効果/アポトーシス促進効果の他に、細胞を分別化する効果を備えることが報告されている(Tanaka T,Muto N,Itoh N,Dota A,Nishina Y,Inada A, Tanaka K「Induction of differentiation of embryonal carcinoma F9 cells by iron chelators」Res Commun Mol Pathol Pharmacol 1995 December;90(2):211〜20)。この研究では、神経芽細胞腫を区別する指標を得るために、神経突起伸長の程度を定量化している。CVT−E033、GB及びHT1001のすべては、N1E115細胞に対して、かなりの神経突起伸長を同じ程度まで誘発することが見出された。GB抽出物は、高濃度で培養神経芽細胞中で細胞死を誘発することが観察されたが、生き残ったものは、極めて高度の神経突起伸長を示した。HT1001は、神経芽細胞腫の細胞数を抑制せず、SH−SY5Y細胞では細胞数をわずかに増すことさえあったので、北米薬用ニンジン抽出物は、未知の機構を介して細胞の生き残りを高めること、及び分別化を起こすことの双方で作用する可能性がある。いくつかの薬用ニンジン粗抽出物、並びにジンセノシドRb1及びRg1は、神経突起伸長を直接的に促進するか、或いはN1E115細胞中での神経突起伸長に対して神経成長因子(NGF)の刺激効果を増強することが既に示されている(Rudakewich M,Ba F,Benishin CG「Neurotrophic and neuroprotective actions of ginsenosides Rb(1) and Rg(1)」Planta Med 2001 August;67(6):533〜7)。更に、ジンセノシドRb1及びRb3、並びにノトジンセノシドR4、6及びFa7も、SK−N−SH細胞中で神経突起伸長を促進する能力を示している(Zou K,Zhu S,Meselhy MR,Tohda C,Cai S,Komatsu K「Dammarane−type Saponins from Panax japonicus and their neurite outgrowth activity in SK−N−SH cells」J Nat Prod 2002 October;65(9):1288〜92)。
【0012】
北米薬用ニンジン、GB、及びSJWの抽出物に関して、in vitro及びin vivoの両方で、且つ、神経向性と神経保護効果の両方について多数の報告がなされている。これらの効果の多くは、神経伝達物質系に対する特定の効果に帰することができ、抗酸化作用も、実質的な貢献要因である可能性がある。本件発明は、神経芽細胞腫に対する、5つの標準的なハーブと北米薬用ニンジン、GB、及びSJWとの配合物の抗酸化作用、鉄キレート形成性、及び増殖抑制効果/分別化促進効果に関する。本件発明は、また、ジンセノシド(20−(s)−プロトパナキサジオールジンセノシド)がFe2+とキレートを形成する挙動を備えることを示し、特異構造と効果との相関を解明し、SJW抽出物成分であるヒペリシンを提供する。被試験抽出物及びそれらが含む生物学的に活性な若干の純粋な化学成分がFe2+とキレートを形成する挙動は、神経芽細胞腫の悪性細胞系で観察される増殖抑制効果及び分別化促進効果の少なくとも一部分であると考えられる。
【0013】
HT1001の好ましい抽出法は、特許文献3に記載されている。この方法では、出発原料として乾燥、粉砕された300kgの薬用ニンジン粉末を使用する。必要に応じて、薬用ニンジンをフィッツミルに入れ、約80メッシュまで粉砕してもよい。次いで、薬用ニンジンを、エタノールを使用する抽出工程に供する。濃度85%のエタノールを使用することが望ましいが、当業者であれば通常の技術の範囲内で調整可能である。固形物:溶剤比は約1:5〜1:10とするが、1:8が好ましい。抽出は、必要に応じて約1〜5時間行なう。好ましい抽出時間は、3時間である。抽出温度は、80℃〜105℃の範囲とできるが、90℃〜95℃が好ましい。撹拌することが推奨される。液相と固相とは、排出ラインに25ミクロンのインラインカートリッジフィルターを備えた、速度が約4200rpmのデカンター遠心分離機を用いれば好ましく分離できる。
【0014】
多数回の抽出を行なうのであれば、上澄み液を保管しておく。いずれにしても、上澄み液を濃縮工程に供してエタノールを回収する。真空蒸留法を用いることが好ましい。目標とする固形物含有量は、約10°〜12°(ブリックス)である。温度は、好ましくは約50℃とし、15インチHg、220〜225kg/hの速度で供給する。濃縮を避けるためには、水を添加してもよい。
【0015】
濃縮された抽出物は、フリーズドライ、オーブン乾燥、又はドラム乾燥してもよいが、好ましくは、約42℃〜58℃の温度とし、約20kg/hで供給して噴霧乾燥するのが好ましい。入り口の温度は、好ましくは約150℃〜175℃であり、出口の温度は、好ましくは約70℃〜90℃である。乾燥したら、抽出物を粉砕し、塊があれば必要に応じて取り除く。0.065インチのスクリーンを取り付けたフィッツミルを使用するのが好ましい。次いで、抽出物をブレンドして約20%の製品とすることが好ましい。
【0016】
イチョウ抽出物は、Acta Pharmacal(Sunnyvale、カリフォルニア州)などを通じて市場で入手できる。イチョウ葉の標準的な抽出物は、Sloley BD,Urichuk LJ,Morley P,Durkin J,Shan JJ,Pang PK,Coutts RTが「Identification of kaempferol as a monoamine oxidase inhibitor and potential Neuroprotectant in extracts of Ginkgo biloba leaves」(J Pharm Pharmacol 2000 May;52(4):451〜9)で論じているように、約24%のイチョウフラボングリコシド及び約6%のテルペンラクトンを含有している。
【0017】
西洋オトギリソウ抽出物は市場で入手でき、Sloley BD,Urichuk LJ,Ling L,Gu LD,Coutts RT,Pang PK,Shan JJ等が「Chemical and pharmacological evaluation of Hypericum perforatum extracts」(Acta Pharmacol Sin 2000;21(12):1145〜52)中で論じているように、一般には、0.3%のヒペリシンを含有するものが標準品である。
【0018】
特殊な薬用ニンジン抽出物であるHT1001は、ジンセノシド(サポニンとしても知られている)の総量で約15〜50%、好ましくは約25〜40%を含有し、単独で、又はGB、SJW、ギンコライド、フラボノイド、ジンセノシド、ヒペリシン、及び/又はヒペルフォリンと組み合わせて、抗酸化剤又は増殖抑制剤として投与できる。
【0019】
本件発明に係る抗酸化剤又は増殖抑制剤は、経口、肺に送達するためのエアゾール又はその他のデバイス、鼻腔スプレー、静脈内、筋内、腹膜内、膣、直腸、及び局所若しくは経皮をはじめとする任意の好適な経路で投与できる。抗酸化剤又は増殖抑制剤を送達するための担持体として使用できる賦形剤は、当業者にとっては明らかである。例えば、抗酸化剤又は増殖抑制剤は、乾燥した形態でもよく、静脈注射による投与の直前に溶解してもよい。HT1001を単独又はBB、SJW及び/又はそれらの活性成分と組み合わせた場合の好ましい投与手段は、経口又は静脈投与である。経口投与するのであれば、HT1001は、好ましくは、100mg入りのカプセルにする。CVT−E033(HT1001とGBとの組み合わせ)は、好ましくは、125mg入りのカプセルにする。CVT−E036(HT1001とGBの組み合わせ)は、好ましくは、325mg(SJW:HT1001:GB、200mg:100mg:25mg)入りのカプセルにする。
【0020】
好適なキャリア、希釈剤又は賦形剤は、医薬組成物の調製に関する技術分野では公知である。このような好適な希釈剤又は賦形剤には、水、塩溶液、アルコール、アラビアガム、植物油、ポリエチレングリコール、ゼラチン、乳糖、アミロース、ステアリン酸マグネシウム、タルク、コーン又はポテトデンプンなどのデンプン、ケイ酸、粘性パラフィン、脂肪酸のモノグリセリド及びジグリセリド、ペンタエリスリトール脂肪酸エステル、ヒドロキシメチルセルロース、ポリビニルピロリドンなどを含むが、これらに限定はされない。医薬組成物は殺菌してもよく、必要に応じて滑沢剤、保存剤、安定剤、湿潤剤、乳化剤、浸透圧を変えるための塩、緩衝剤、着色料、着香料及び/又は芳香性物質などの補助剤と混合できる。単独で投与する場合には、75kgの個体に対して、有効薬剤HT1001を1日当り10mg〜1000mgの投与量範囲で投与するのが好ましい。そして、1日当り75mg〜500mgの投与量とするのがより好ましく、1日当り100mg〜200mgの投与量とするのが最も好ましい。
【0021】
本明細書中で「有効量」と言う場合は、HT1001を、単独で、或いはGB、SJW、ギンコライド、フラボノイド、ジンセノシド、ヒペリシン、及び/又はヒペルフォリンと組み合わせて投与する量を含む。HT1001を別の抗酸化剤又は増殖抑制剤と共に投与するのであれば、HT1001の通常の有効量を削減できる。従って、用語「有効量」とは、その材料を組み合わせることが効果的であり、且つ各材料の投与量を比例的に低減できるその他の有効材料と組み合わせたHT1001の使用量を包むものと解釈する。例えば、HT1001が、通常、1個体当り1日につき100mg投与するのが効果的であり、イチョウが、通常、1個体当り1日につき100mg投与するのが効果的であるなら、2種の材料を組み合わせて使用すれば、各々を1日につき個体当り50mgの投与にできる。このように組み合わせて使用すれば、多くの医薬がそうであるように、その他の有効材料(HT1001以外の)が高価であるなら、消費者にとっては経済的である。
【0022】
本件発明に係る組成物は、酸化的ストレス、鉄過剰症を治療し、且つ/又は神経突起伸長を促進するのに使用できる。酸化的ストレス及び鉄過剰症は、限定はされないが、癌、アルツハイマー病、結核、パーキンソン病、鎌状赤血球、ウィルソン病、肝損傷、βサラセミア、心臓疾患、多発性硬化症、炎症性腸疾患(クローン病及び潰瘍性大腸炎)、感染症、新生物、心筋症、及び/又は関節症をはじめとする多くの健康状態及び疾患を引き起こす。特定細胞組織への鉄負荷は、疾患リスクの増大と関連している(Eugene D.Weinberg「Iron Loading and Disease Surveillance」Emerging Infectious Disease,Vol.5,No.3,May〜June 1999 346〜352)。鉄は、フリーラジカルとして知られている物質が体内で傷害作用を刺激する酸化促進剤として作用する。各種細胞組織中での鉄過剰症と関連する疾患を、以下の表1に示す。
【0023】
【表1】

【実施例】
【0024】
[材料]
フェロジン、デスフェロキサミン(DFO)、クエルセチン、ルチン、ギンコライドA、及びギンコライドBは、Sigmaから入手した。すべての抽出物(HT1001、GB、SJW、CVT−E033、及びCVT−E036)とその化学成分であるジンセノシド(Rb1、Rg1、Rc、Rd、及びRe)は、CV Technologies(Edmonton、アルバータ州、カナダ)で調製し、精製した。北米薬用ニンジン抽出物HT1001(REMEMBER−fX(登録商標))(Sloley BD,Pang PK,Huang BH,Ba F,Li FL,Benishin CG,Greenshaw AJ,Shan JJ「American ginseng extract reduces scopolamine−induced amnesia in a spatial learning task」J Psychiatry Neurosci 1999 November;24(5):442〜52)、GB抽出物(Sloley BD,Urichuk LJ,Morley P,Durkin J,Shan JJ,Pang PK,Coutts RT「Identification of kaempferol as a monoamine oxidase inhibitor and potential Neuroprotectant in extracts of Ginkgo biloba leaves」J Pharm Pharmacol 2000 May;52(4):451〜9)及びSJW(Sloley BD,Urichuk LJ,Ling L,Gu LD,Coutts RT,Pang PK,Shan JJ「Chemical and pharmacological evaluation of Hypericum perforatum extracts」Acta Pharmacol Sin 2000;21(12):1145〜52)の化学同定結果は前述の通りである。CVT−E033(AD−fX(登録商標)、HT1001:GB抽出物が4:1(w/w))、及びCVT−E036(MENTA−fX(登録商標)、SJWの標準的な抽出物:HT1001:GB抽出物が8:4:1(w/w))は、ChemBioPrint(商標)が組み合わせを標準化した製品であり、CV Technologiesから商業的に入手可能である。WST−1細胞増殖試薬は、F.Hoffmann−La Roche Ltd.(Postfach、スイス)から購入した。細胞培養試薬は、Gibco Life Technologies Canada(Burlington、オンタリオ州、カナダ)から購入した。その他のすべての化学試薬は、Sigma−Aldrich Chemical Co.(Oakville、オンタリオ州、カナダ)又はFisher Chemical Co.(Edmonton、アルバータ州、カナダ)から購入した。水溶性ジンセノシドを除くすべての試料は、まずDMSOに溶解し、その後水で希釈して実験に用いた。
【0025】
[脂質の過酸化抑制性の調査]
ハーブ抽出物が脂質の過酸化を抑制する能力を、Ohkawaらが開発したチオバルビツール酸分析法(Ohkawa H,Ohishi N,Yagi K「Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction」Anal Biochem 1979 July;95(2):351〜8)、及びカテコールアミン作動性神経芽細胞腫の細胞系SH−SY5Y(Saskatchewan大学、Peter Yu博士からの寛大な贈呈物)を使用して評価した。細胞は、10%ウシ胎児血清(FBS)(v/v)及び1%抗生物質混合物(ペニシリン50μg/mL、ストレプトマイシン50μg/mL、100μg/mL;PSN)を添加したダルベッコ変性イーグル培地(DMEM)中にほぼ90〜100%の集密度になるまで維持した。次いで、それらを、6−ウェルのNunclon組織培養プレートに1×106細胞/ウェルで接種して24時間増殖させ、その後、0.1mMの硫酸第一鉄(FeSO4)の存在下又は不在下でハーブ抽出物に48時間曝露した。次いで、細胞を採取し、使い捨てガラス培養チューブに入れ、遠心分離し、ペレットを0.4mLの1.15%塩化カリウム中に再懸濁し、超音波除膜器(dismembrator)を用いて均一にした。次いで、300μLのアリコートを、テトラエトキシプロパンを参照基準品とし、Ohkawaらの方法を使用して脂質の過酸化物を分析した。残りの材料を用い、Lowryの方法を使用してタンパク質含有量を分析した。
【0026】
0.1mMのFe2+の存在下又は不在下での脂質の過酸化抑制に対するハーブ抽出物の効果を図1に示す。すべての試料が、Fe2+存在下でのみ脂質の過酸化を有意(P<0.05)に抑制したが、Fe2+の不在下では効果がなかった(データは示していない)。有効性は、GB>SJW>CVT−E033=CVT−E036>HT1001の順番であった。
【0027】
[フリーラジカルの除去性の調査]
ハーブ抽出物及び純粋化学成分のヒドロキシルフリーラジカルの除去能力を、Arnaoらが開発した動的な方法を応用して評価した(Arnao MB,Cano A,Hernandez−Ruiz J,Garcia−Canovas F,Acosta M「Inhibition by L−ascorbic acid and other antioxidants of the 2,2’−azino−bis(3−ethylbenzthiazoline−6−sulfonic acid)oxidation catalyzed by peroxidase:a new approach for determining total antioxidant status of foods」Anal Biochem 1996 June 1;236(2):255〜61)。簡潔に説明すると、ハーブ抽出物を、50mM Tris−HCl緩衝液(pH7.2)中で、過酸化水素と2,2’−アジノ−ビス(3−エチルベンズチアゾリン−6−スルホン酸)(ABTS)とを混合し、2nMの西洋ワサビ過酸化酵素で反応を開始させた。有色のABTSラジカル(405nmでの吸光度)の形成を防止する能力によって、試料のヒドロキシルラジカルの除去効果を推測した。各試料に関するフリーラジカルの除去性を、アスコルビン酸で作成した標準曲線と比較した。
【0028】
抽出物GB、HT1001、及びCVT−E033のフリーラジカルの除去能力を以下の表2に示す。ヒドロキシラジカルの除去効果を、過酸化酵素触媒として形成されるABTSラジカルの形成を防止する能力から推測した。CVT−E033、そしてより大きな程度でGBは、かなりのヒドロキシルラジカルの除去効果を示したが、HT1001は、検知可能な効果を示していない。
【0029】
【表2】

【0030】
表2では、北米薬用ニンジン抽出物HT1001、GB抽出物、及び組み合わせCVT−E033(HT1001+GB)によるフリーラジカルの除去性を調査している。具体的には、ハーブ抽出物を過酸化水素及びABTSと共に培養し、西洋ワサビ過酸化酵素を添加して反応を開始した。そして、試料のヒドロキシルラジカルの除去効果を、有色のABTSラジカルの形成を抑制する能力によって推測した(405nmでの吸光度)。更に、各試料に関するフリーラジカルの除去性を、アスコルビン酸を用いて作成した標準曲線と比較し、重量%アスコルビン酸として表現している。
【0031】
[Fe2+とのキレート形成挙動の調査]
ハーブ抽出物又は純粋な化学成分が無菌分析装置内でFe2+をキレート化する能力を、以下に示すFeSO4とFe2+キレートを形成する色素発生バクテリアであるフェロジンを培養して追跡し、有色のFe(フェロジン)32+錯体の形成を抑制する効果で評価した。フェロジンは、以前、フェリチンが放出する遊離Fe2+の測定に活用されていた。試験対象であるすべてのハーブ抽出物及び純粋化学物質は、4%DMSO水溶液を用い、それぞれを5mg/mL及び0.2mg/mLで調製した。50μLのアリコートを、96−ウェルのマイクロタイタープレート(MTP)中で50μLの1mM FeSO4溶液と共に室温で30分間培養した。次いで、得られた50μLのアリコート溶液を、新たな96−ウェルMTPに移し、50μLの2mM(飽和濃度)フェロジン溶液と合わせた。HT1001、GB、SJW、CVT−E033、及びCVT−E036を1.25mg/mLで試験し、純粋化学成分を50μg/mL(最終濃度)で試験した。発色は瞬間的であり、562nmで吸光度を読み取った。結果を参照試料との比較で表し、試料の効果を既知のFe2+キレート剤であるDFOと比較した。DMSOは、Fe(フェロジン)32+錯体の形成を抑制できたので、試験抽出物及び化学成分毎にDMSO参照試料と比較したパーセンテージで示した。
【0032】
すべてのハーブ抽出物、及び純粋化学成分、ギンコライドA及びB、フラボノイドのクエルセチン及びルチン、ヒペルフォリン、ヒペリシン、並びに5種のジンセノシド、Rb1、Rg1、Rc、Rd、及びReを、無菌化学分析装置中でフェロジンとFe2+との結合を抑制する能力について試験した。Fe(フェロジン)32+錯体に対して十分な吸光度を信号として得るために、非生理学的濃度のFe2+を選択してフェロジンと反応させた。そのため、Fe2+をキレート化するように、ハーブ抽出物及び各成分を高濃度にした。同程度のFe(フェロジン)32+錯体形成に対する投薬量に依存する阻害効果が、CVT−E033、GB、HT1001、SJW、及びCVT−E036について観察された(図3)。図2に示す既知のFe2+キレート剤、DFOの投薬量に対する応答曲線から、DFOは、我々の分析装置ではFe(フェロジン)32+錯体生成を抑制できることを示している。ギンコライドA及びB、並びにフラボノイド・ルチンを滴加した曲線は効果を示していないが、フラボノイド・クエルセチンは、Fe(フェロジン)32+錯体生成を抑制できている(図4)。20−(s)−プロトパナキサトリオールジンセノシドRg1及びReを除き、20−(s)−プロトパナキサジオールジンセノシドRb1、Rc、及びRdも、フェロジンとFe2+との相互作用を抑制する能力を示した(図5)。SJWから分析される主な既知の生活性成分では、ヒペルフォリンを除き、ヒペリシンはFe(フェロジン)32+錯体の形成を抑制できる(図6)。纏めて考えると、これらのデータは、CVT−E033、GB、HT1001、SJW、及びCVT−E036が、Fe2+キレート剤として機能できる化学成分を明確に含んでいることを示唆している。しかし、各成分を、ハーブ抽出物におけるそれらの含有量を反映した濃度で試験した場合に、効果はほとんど認められず、抽出物の各成分が、Fe2+の結合にたいして相乗的に寄与するか、或いは総合的に効果を表すことを示唆している。
【0033】
[神経芽細胞腫の生存能力調査]
SH−SY5Y、N1E115、及びSK−N−SH(ATCC、Rockville、メリーランド州、米国)神経芽細胞腫細胞を、10容量%のFBS、1mMピルビン酸ナトリウム、2mM L−グルタミン及びMEM非必須アミノ酸混合物を補充した最小必須培地(MEM)中で、5%CO2と95%空気のもとに37℃で継代培養することによって維持した。ほぼ80%の集密度になったところで細胞を採取し、ハーブ抽出物又は純粋な化学成分、及び異なる量のFBSを含有する96−ウェルの培養プレート中に1×104細胞/ウェルで接種した。DMSOの最終濃度は、0.05%を超えないようにした。製造業者の示す仕様書に従って各試料ウェルにWST−1細胞増殖試薬を添加し、96時間後に細胞数に対する効果を評価した。細胞数は、細胞増殖試薬WST−1法を使用し、指示通りに判定した(Ba F,Pang PK,Benishin CG「The establishment of reliable cytotoxic system with SK−N−SH neuroblastoma cell culture」J Neurosci Method 2003 March 15;123(1):11〜22)。伝統的なトリパンブルー排除法の細胞計数に比較した場合のWST−1法の精度は、2つの方法の間に強い相関があることを示した。結果を参照試料との比較として示した。
【0034】
すべての抽出物の効果を、通常(10%)と低(2%)の両方の血清条件下において、50μg/mLで3種の神経芽細胞腫細胞系に対して比較した。結果を図7〜図9に示す。イチョウ含有抽出物GB、CVT−E033及びCVT−E036では、最も多くの図で細胞数の抑制を示している。具体的には、GBは、ヒト神経芽細胞腫系SK−N−SH細胞(低血清及び通常血清)及びSH−SY5Y(低血清)で細胞数を抑制した。CVT−E033は、対照的に、SH−SY5Y(低血清)及びハツカネズミ神経芽細胞腫細胞系N1E115(低血清及び通常血清)で細胞数を有意に抑制し、CVT−E036は、低血清条件の3種すべての細胞系で、更に通常血清条件のN1E115で細胞数を抑制した。SJWの抽出物も、SH−SY5Yでは低血清条件で、N1E115細胞では双方の条件で細胞数を抑制した。HT1001は、細胞数に対して抑制効果をもたず、高血清条件下のSH−SY5Y細胞に細胞数の小さな刺激を生み出した。Fe2+キレート剤DFOは、また、N1E115細胞で神経芽細胞腫の細胞数を抑制する(図10)が、SH−SY5Y細胞では二相の効果を発揮している。
【0035】
個々の成分を、抽出物中における比率を反映した濃度で分析した場合には、いずれの細胞系においても、細胞数に対する有意な効果は観察されなかった。化合物の若干の部分は、濾過中に失われていると推測されるので、投薬量に対する応答曲線は、ハツカネズミモデル(N1E115)及びヒト神経芽細胞腫モデル(SH−SY5Y)の双方ですべての成分に対して作図した。GB抽出物、CVT−E033及びCVT−E036が含むギンコライド(A及びB)と、SJW中が付加的に含むフラボノイド(クエルセチン及びルチン)との投薬量に対する応答曲線を図11(N1E115細胞)及び図12(SH−SY5Y)に示す。クエルセチンのみが、ヒトSH−SY5Y及びマウスN1E115細胞系の双方において、5μg/mLで初めて明らかな有意性(P<0.05)で細胞数のかなりの抑制効果を示した。ジンセノシド及びヒペルフォリンに関する結果を示す図13(N1E115細胞)及び図14(SH−SY5Y細胞)によれば、ヒペルフォリンのみが、双方の細胞系で、投薬量にかなり依存する細胞数の抑制効果を示すことを表している。
【0036】
[神経突起伸長性の調査]
ハツカネズミ神経芽細胞腫細胞系N1E115を使用して、ハーブ抽出物HT1001、GB、及びCVT−E003の神経突起伸長に対する効果を調査した。N1E115細胞を、10容量%FBS及び1容量%PSN抗生物質を補充した37℃のDMEM中で、100cm2の組織培養皿に接種し、維持した。次いで、細胞を機械的に取り出し、コラーゲンで被覆された組織培養皿に2×104細胞/皿の密度で塗り広げた。細胞突起成長は、ハーブ抽出物と共存させて培養した7日後又は14日後に、細胞の代表的な細胞フィールドについて定量化した。各処理皿について2つの細胞フィールドを写真撮影し、神経突起伸長の程度を以下のように評点化した。
S1:細胞が伸びた状態になるか、或いは極めてわずかな神経突起が成長した状態。
S2:細胞本体から2つを超える小さな神経突起が伸びた状態。
S3:1つ又は2つの神経突起が、細胞本体直径の少なくとも2倍に成長した状態。
S4:2つを超える長い突起が存在する状態。
神経突起指標は以下の数1で計算した。
【0037】
【数1】

【0038】
CVT−E033、HT1001、GBの神経突起伸長に対する効果の纏めを図15に示す。試験したすべてのハーブ抽出物は50μg/mLから、N1E115神経芽細胞腫細胞からの神経突起伸長を同程度まで誘発する能力を示した。GB及びHT1001の効果は、投薬量に依存していた。GBは、細胞死を誘導するが(細胞数に関する上記研究で支持されるように)、残存している細胞に対しては神経突起伸長を刺激することが観察された。
【0039】
[統計的な解析]
特記しない限り、一元分散分析(ANOVA)(スチューデント−ニューマン−クルーズ検定)を使用し、有意水準を0.05に設定して有意差を判定した。すべての結果を、平均±平均の標準誤差(SEM)として表した。統計的な解析は、GraphPad Prism又はSigmaStatのグラフ及び統計ソフトウェアを使用して実施した。
【図面の簡単な説明】
【0040】
【図1】SH−SY5Y神経芽細胞腫細胞におけるFe2+が触媒機能を果たす脂質の過酸化を抑制する能力に対するハーブ調合剤の効果を示す図である。細胞を、1×106細胞/ウェルで接種し、24時間増殖させ、その後、0.1mM FeSO4の存在下又は不在下でハーブ抽出物に48時間曝露した。次いで、細胞膜を採取し、過酸化脂質を分析した。過酸化脂質の存在は、有色のMDA生成物の形成で示され、結果を参照試料との比較で表している。ハーブ調合剤を用いた場合は、未加工の吸光度値と対比すると*P<0.05の有意差で参照試料と異なる。
【図2】ハーブ抽出物によるFe2+とフェロジンとの相互作用の抑制効果を示す図である。種々のハーブ抽出物(図3)及び強力なFe2+キレート剤DFO(図2)を、無菌化学分析装置の中で0.5mM FeSO4溶液と共に指示された濃度で培養し、その後、色原体フェロジン(1mM、最終濃度)と共に培養した。適切な参照試料と比較した、試験試料の562nmでの吸光度の結果を示している。
【図3】ハーブ抽出物によるFe2+とフェロジンとの相互作用の抑制効果を示す図である。
【図4】いくつかのハーブ抽出物中の純粋な化学成分によるFe2+とフェロジンとの相互作用の抑制効果を示す図である。純粋な化学物質であるクエルセチン、ルチン、ギンコライドA及びギンコライドB(図4)、ジンセノシドRb1、Rg1、Rc、Rd、Re(図5)、並びにヒペリシン及びヒペルフォリン(図6)を、無菌化学分析装置中で0.5mM FeSO4溶液と共に指示された濃度で培養し、その後、色原体フェロジン(1mM、最終濃度)と共に培養した。適切な参照試料と比較した、試験試料の562nmでの吸光度の結果を示している。
【図5】いくつかのハーブ抽出物中の純粋な化学成分によるFe2+とフェロジンとの相互作用の抑制効果を示す図である。
【図6】いくつかのハーブ抽出物中の純粋な化学成分によるFe2+とフェロジンとの相互作用の抑制効果を示す図である。
【図7】低血清及び通常血清条件での神経芽細胞腫の細胞増殖に対するハーブ抽出物の効果を示す図である。種々のハーブ抽出物又は担持体そのもの(参照試料)を、低(2%)FBS又は通常(10%)FBS中で培養した、SK−N−SH(図7)、SH−SY5Y(図8)及びN1E115(図9)細胞と共に50μg/mLで培養した。Fe2+キレート剤DFOの細胞数に対する効果も、N1E115(固形シンボル)及びSH−SY5Y(非定形シンボル)細胞(図10)の双方について調査した。生存細胞数は、試薬WST−1を使用して判定した。細胞数の抑制効果の有意性は*P<0.05又は**P<0.001で判定し、細胞数への刺激性は同一血清条件の参照試料に対する有意性#P<0.05で判定している。
【図8】低血清及び通常血清条件での神経芽細胞腫の細胞増殖に対するハーブ抽出物の効果を示す図である。
【図9】低血清及び通常血清条件での神経芽細胞腫の細胞増殖に対するハーブ抽出物の効果を示す図である。
【図10】低血清及び通常血清条件での神経芽細胞腫の細胞増殖に対するハーブ抽出物の効果を示す図である。
【図11】ギンコライド、フラボノイド、ジンセノシド、及びヒペルフォリンの神経芽細胞腫細胞に対する効果を示す図である。ギンコライドA(GA)及びB(GB)並びにフラボノイドであるルチン及びクエルセチン(Q)(図11、図12)、或いはヒペルフォリン又はジンセノシドRb1、Rg1、Rc、Rd、及びRe(図13、図14)、或いは担持体そのもの(参照試料)を、培養したN1E115(図11、図13)、SH−SY5Y(図12、図14)細胞と共に図に示す濃度で96時間培養した。生存細胞数は、試薬WST−1を使用して判定した。有意性は、参照試料に対して有意性*P<0.05、**P<0.001、***P<0.0001で判定している。
【図12】ギンコライド、フラボノイド、ジンセノシド、及びヒペルフォリンの神経芽細胞腫細胞に対する効果を示す図である。
【図13】ギンコライド、フラボノイド、ジンセノシド、及びヒペルフォリンの神経芽細胞腫細胞に対する効果を示す図である。
【図14】ギンコライド、フラボノイド、ジンセノシド、及びヒペルフォリンの神経芽細胞腫細胞に対する効果を示す図である。
【図15】ハーブ抽出物のN1E115の神経突起伸長に対する投薬量に依存する効果を示す図である。CVT−E033、HT1001、及びGBを、培養したN1E115神経芽細胞腫細胞と共に図に示す濃度で7日間培養し、神経突起伸長評点を判定した。参照試料に対する有意性は、*P<0.05、**P<0.001で判定している。
【特許請求の範囲】
【請求項1】
イチョウ、西洋オトギリソウ、ギンコライド、フラボノイド、ジンセノシド、ヒペリシン、及びヒペルフォリンからなる群から選択される少なくとも1種の薬剤と組み合わせたHT1001を含むことを特徴とする医薬組成物。
【請求項2】
前記HT1001は、ジンセノシドの総含有量が約15〜50重量%の薬用ニンジン抽出物である請求項1に記載の医薬組成物。
【請求項3】
前記薬剤がイチョウである、請求項1に記載の医薬組成物。
【請求項4】
前記薬剤が西洋オトギリソウである、請求項1に記載の医薬組成物。
【請求項5】
酸化的ストレスの治療方法であって、イチョウ、西洋オトギリソウ、ギンコライド、フラボノイド、ジンセノシド、ヒペリシン、及びヒペルフォリンからなる群から選択される少なくとも1種の薬剤と組み合わせたHT1001を含む医薬組成物を、治療を必要とする患者に対して酸化的ストレスの低減に有効な量投与することを特徴とする酸化的ストレスの治療方法。
【請求項6】
前記酸化的ストレスが癌に起因するものである請求項5に記載の酸化的ストレスの治療方法。
【請求項7】
鉄過剰症の治療方法であって、イチョウ、西洋オトギリソウ、ギンコライド、フラボノイド、ジンセノシド、ヒペリシン、及びヒペルフォリンからなる群から選択される少なくとも1種の薬剤と組み合わせたHT1001を含む医薬組成物を、治療を必要とする患者に対して鉄過剰を低減するのに有効な量投与することを特徴とする鉄過剰症の治療方法。
【請求項8】
前記鉄過剰症が、癌、アルツハイマー病、結核、パーキンソン病、鎌状赤血球、ウィルソン病、肝損傷、βサラセミア、心臓疾患、多発性硬化症、炎症性腸疾患(クローン病及び潰瘍性大腸炎)、感染症、新生物、心筋症、又は関節症に起因するものである請求項7に記載の鉄過剰症の治療方法。
【請求項9】
神経突起伸長の促進方法であって、イチョウ、西洋オトギリソウ、ギンコライド、フラボノイド、ジンセノシド、ヒペリシン、及びヒペルフォリンからなる群から選択される少なくとも1種の薬剤と組み合わせたHT1001を含む医薬組成物を、治療を必要とする患者に対して神経突起伸長を促進するのに有効な量投与することを特徴とする神経突起伸長の促進方法。
【請求項1】
イチョウ、西洋オトギリソウ、ギンコライド、フラボノイド、ジンセノシド、ヒペリシン、及びヒペルフォリンからなる群から選択される少なくとも1種の薬剤と組み合わせたHT1001を含むことを特徴とする医薬組成物。
【請求項2】
前記HT1001は、ジンセノシドの総含有量が約15〜50重量%の薬用ニンジン抽出物である請求項1に記載の医薬組成物。
【請求項3】
前記薬剤がイチョウである、請求項1に記載の医薬組成物。
【請求項4】
前記薬剤が西洋オトギリソウである、請求項1に記載の医薬組成物。
【請求項5】
酸化的ストレスの治療方法であって、イチョウ、西洋オトギリソウ、ギンコライド、フラボノイド、ジンセノシド、ヒペリシン、及びヒペルフォリンからなる群から選択される少なくとも1種の薬剤と組み合わせたHT1001を含む医薬組成物を、治療を必要とする患者に対して酸化的ストレスの低減に有効な量投与することを特徴とする酸化的ストレスの治療方法。
【請求項6】
前記酸化的ストレスが癌に起因するものである請求項5に記載の酸化的ストレスの治療方法。
【請求項7】
鉄過剰症の治療方法であって、イチョウ、西洋オトギリソウ、ギンコライド、フラボノイド、ジンセノシド、ヒペリシン、及びヒペルフォリンからなる群から選択される少なくとも1種の薬剤と組み合わせたHT1001を含む医薬組成物を、治療を必要とする患者に対して鉄過剰を低減するのに有効な量投与することを特徴とする鉄過剰症の治療方法。
【請求項8】
前記鉄過剰症が、癌、アルツハイマー病、結核、パーキンソン病、鎌状赤血球、ウィルソン病、肝損傷、βサラセミア、心臓疾患、多発性硬化症、炎症性腸疾患(クローン病及び潰瘍性大腸炎)、感染症、新生物、心筋症、又は関節症に起因するものである請求項7に記載の鉄過剰症の治療方法。
【請求項9】
神経突起伸長の促進方法であって、イチョウ、西洋オトギリソウ、ギンコライド、フラボノイド、ジンセノシド、ヒペリシン、及びヒペルフォリンからなる群から選択される少なくとも1種の薬剤と組み合わせたHT1001を含む医薬組成物を、治療を必要とする患者に対して神経突起伸長を促進するのに有効な量投与することを特徴とする神経突起伸長の促進方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【公表番号】特表2009−512675(P2009−512675A)
【公表日】平成21年3月26日(2009.3.26)
【国際特許分類】
【出願番号】特願2008−536143(P2008−536143)
【出願日】平成18年10月16日(2006.10.16)
【国際出願番号】PCT/IB2006/002880
【国際公開番号】WO2007/045959
【国際公開日】平成19年4月26日(2007.4.26)
【出願人】(508120673)エフエックス ライフ サイエンス インターナショナル ジーエムビーエイチ (1)
【Fターム(参考)】
【公表日】平成21年3月26日(2009.3.26)
【国際特許分類】
【出願日】平成18年10月16日(2006.10.16)
【国際出願番号】PCT/IB2006/002880
【国際公開番号】WO2007/045959
【国際公開日】平成19年4月26日(2007.4.26)
【出願人】(508120673)エフエックス ライフ サイエンス インターナショナル ジーエムビーエイチ (1)
【Fターム(参考)】
[ Back to top ]

