バイオセンサ
【課題】電気化学バイオセンサでは、通常、プローブに触媒を使用する。しかし、そのシグナルは低いので、このような電気化学バイオセンサの適用には限界がある。目的の標的分子を正確に検出するために、ノイズ比に対してより高い信号を有する新規のバイオセンサが必要である。
【解決手段】標的検出用のバイオセンサを示す。ある例示されるセンサは、第1の電極を含む。第1の電極は、第1の電子導電分子および第1のプローブを含む。第1のプローブは、第2の電子導電分子を含む。第1のプローブを、溶液中の目的の標的に結合するように構成する。第1および第2の電子導電分子は異なっている。
【解決手段】標的検出用のバイオセンサを示す。ある例示されるセンサは、第1の電極を含む。第1の電極は、第1の電子導電分子および第1のプローブを含む。第1のプローブは、第2の電子導電分子を含む。第1のプローブを、溶液中の目的の標的に結合するように構成する。第1および第2の電子導電分子は異なっている。
【発明の詳細な説明】
【背景技術】
【0001】
バイオセンサは、生体分子などの標的分子を検出するための分析装置である。ほとんどのバイオセンサは光バイオセンサである。光バイオセンサは金属からなり、光を吸収して金属表面上に電子波を生じる。電子波は、入射光のある特定の角度および特定の波長で生じ得るので、金属表面に強く依存する。生体分子が金属上に付着すると、測定可能なシグナルが生じ得る。
【0002】
いくつかのバイオセンサは電気化学バイオセンサである。電気化学バイオセンサでは、通常、プローブに触媒を使用する。しかし、そのシグナルは低いので、このような電気化学バイオセンサの適用には限界がある。目的の標的分子を正確に検出するために、ノイズ比に対してより高い信号を有する新規のバイオセンサが必要である。
【発明の概要】
【0003】
本開示のいくつかの実施形態は、一般的に、標的検出用のセンサに関する。ある例示されるセンサは、第1の電子導電分子で処理された電極と、第2の電子導電分子と共役したプローブと、を有する。このプローブを、第1の電極に取り付け、標的と結合するように構成する。第1および第2の電子導電分子は異なっていてもよい。
【0004】
本開示のいくつかのさらなる実施形態は、一般的に、標的の検出方法に関する。ある例示される方法は、標的含有が疑われるサンプルと上記のセンサとを接触させる工程を有する。この標的がプローブに結合すると、シグナルが生成される。このシグナルが検出された場合、これは、標的がサンプル中に存在することを指し示している。
【0005】
本開示のさらなる実施形態は、一般的に、電子導電分子に共役する抗体などから成るプローブに関する。このような抗体分子は、明細書内で記載されるセンサにおいて使用される。ある例示される抗体は、ピリジン化合物、ポリアセチレンポリマー、アゾール化合物、ポリアニリンポリマー、またはそれらの誘導体と共役する。電子導電分子に共役したプローブ、例えば、ピリジン化合物、ポリアセチレンポリマー、アゾール化合物、ポリアニリンポリマー、またはそれらの誘導体に共役した抗体を含む電極も提供する。
【0006】
上記概要は例示のみを目的とし、どのような手法においても制限されるものではない。上記の例示される態様、実施形態、および特徴に加えて、さらなる態様、実施形態、および特徴は、図面および以下の詳細な説明を参照することから明らかとなるであろう。
【図面の簡単な説明】
【0007】
【図1】生体分子検出用のセンサを例示する実施形態を示す。
【図2】生体分子の検出方法を例示する実施形態のフローチャートを示す。
【図3A】生体分子検出用のセンサにおける2つの電極を準備する方法を例示する実施形態を示す。
【図3B】生体分子検出用のセンサにおける2つの電極を準備する方法を例示する実施形態を示す。
【図3C】生体分子検出用のセンサにおける2つの電極を準備する方法を例示する実施形態を示す。
【図3D】生体分子検出用のセンサにおける2つの電極を準備する方法を例示する実施形態を示す。
【図3E】生体分子検出用のセンサにおける2つの電極を準備する方法を例示する実施形態を示す。
【図3F】生体分子検出用のセンサにおける2つの電極を準備する方法を例示する実施形態を示す。
【図4A】ヒトパピローマウイルス16(HPV16)感染症患者サンプルおよび標準サンプルから希釈された種々の濃度において検出された電流を例示する実施形態のチャートを示す。
【図4B】印加バイアス電圧(約0.01ボルト)においてコンダクティブ原子間力顕微鏡法によって走査された、ビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)と共役した抗(HPV HR)モノクローナル抗体を含む電極の導電性画像を示す。
【図4C】エンテロウイルス71(EV71)感染症患者サンプルおよび標準サンプルから希釈された種々の濃度において検出された電流を例示する実施形態のチャートを示す。
【図4D】白血球細胞由来ケモタキシン−2感染症患者サンプルおよび標準サンプルから希釈された種々の濃度において検出された電流を例示する実施形態のチャートを示す。
【発明を実施するための形態】
【0008】
以下の詳細な説明では、明細書の一部である添付の図面を参照する。図面において、文脈がそう述べない限り、典型的には、類似の記号は類似の要素を指し示す。詳細な説明、図面、および特許請求の範囲に記載の例示される実施形態は、限定されるものではない。本明細書中に示される主題の精神または範囲から逸脱することなしに、その他の実施形態を活用することができ、またその他の変更が可能である。本明細書中に一般的に記載され、且つ図面に示されたような本開示の態様は、広範な種々の異なる構成に配置、置換、組み合わせ、デザインされることができ、その全ては明確に熟考され本開示の一部となることは容易に理解されるであろう。
【0009】
本開示では、「電子導電分子」という語は、一般的に、電子を導電する化合物を示す。電子導電分子は重複するp軌道の領域を有し、隣接するように配列したp軌道上でのπ電子の非局在化を可能にする。電子導電分子のコンダクタンスは、コンダクティブ原子間力顕微鏡法によって調べることができる。いくつかの実施形態では、本明細書中に記載のバイオセンサ用チップにおいて有用な電子導電分子のコンダクタンスは、約0.01ボルトの印可電圧時で約1μΩ-1〜約10μΩ-1である。
【0010】
「プローブ」という語は、一般的に、目的の標的(例えば、生体分子)に結合することができる化合物を示す。例えば、標的へのプローブの結合の親和力は、約100ピコニュートン〜約500ピコニュートンとなり得る。限定されないプローブの例としては、抗体、目的の標的に結合する能力を保持する抗体フラグメント、核酸(例えば、DNA、RNA、アプタマー)、アプタマー、抗原、および酵素が挙げられる。
【0011】
「標的」という語は、一般的に、本明細書中に記載のバイオセンサによって検出可能な任意の分子をいう。標的には生体分子が含まれるが、これに限定されない。本明細書中に記載のバイオセンサによって検出可能な標的の例としては、生体分子(例えば、ウイルス、タンパク質、核酸、および炭水化物)および脂質、ハプテン、毒素などの他の小分子タイプが挙げられるが、これらに限定されない。
【0012】
ここで、プローブは、電子導電分子を含む。プローブの電子移送の挙動は、電子導電分子による重複p軌道によって誘発される。結果として、標的がプローブに結合すると、標的とプローブの結合に伴って電場の変化が増幅され得る。
【0013】
いくつかの実施形態では、生体分子検出用のセンサは、第1の電極、第1のプローブ、第1および第2の電子導電分子を含む。第1のプローブは、サンプル中の目的の標的を認識して結合する。いくつかの実施形態では、第1および第2の電子導電分子は異なっている。第1の電極は、第1の電子導電分子で処理される。第1の電子導電分子は、第1の電極との第1の化学結合を形成する。第1の化学結合は共有結合であってもよい。いくつかの実施形態では、第1のプローブは、第1の電極と化学結合、例えば、共有結合を形成する。
【0014】
いくつかの実施形態では、第1のプローブは、第2の電子導電分子で処理される。いくつかの実施形態では、第2の電子導電分子を、第1のプローブに共役させる、例えば、直接的にまたはリンカー分子を介して第1のプローブに共有結合させる。いくつかの実施形態では、第1のプローブは、第1の電子導電分子と第2の化学結合を形成する。したがって、第1のプローブは、第1の化学結合および第2の化学結合を介して第1の電極に付着し、付着した第2の電子導電分子をも含む。
【0015】
第1のプローブは、センサによって検出すべき標的とは「錠前と鍵」の関係を形成している。例えば、第1のプローブは、DNA、RNA、タンパク質、抗体、抗体フラグメント、アプタマー、抗原、または酵素であり得る。いくつかの実施形態では、第1のプローブは抗体であり、標的はその抗体が結合する抗原である。潜在的に標的を含む第1のサンプルをセンサに導入した後、第1の電極上に流すと、第1の電極に伴う第1の電場は、第1のプローブに結合する標的に合わせて変化する。第1の電場の変化に基づいて第1のシグナルが得られる。センサは、第1のシグナルが検出されるように構成されたプロセッサを有する。いくつかの実施形態では、第1のシグナルの検出は、第1のサンプルが標的を含むことを指し示している。第2の電子導電分子を第1のプローブに処理することにより、例えば、第1のプローブへ第2の電子導電分子を付着させることにより、第1のプローブの導電率が増加する。したがって、標的がプローブに結合すると、結合に伴う電場の変化は更に容易に検出されるようになる。ある実施形態では、このセンサは、第1の流路を有し、その第1の流路は、第1の電極に接触し、標的を含む疑いのある第1のサンプルがその流路を流れ、標的が第1のプローブに結合するとその流路でシグナルが生成される。
【0016】
いくつかの実施形態では、このセンサは、第3の電子導電分子および第2のプローブを含む第2の電極を有する。第2のプローブは、センサによって検出すべき標的とカップリングしないように構成される。いくつかの実施形態では、第2のプローブの標的に対する結合親和力は、約50ピコニュートン未満である。第3の電子導電分子は、第1または第2の電子導電分子と同一であるまたは異なっていてもよい。ある実施形態では、第3の電子導電分子は、第1の電子導電分子と同一である。
【0017】
いくつかの実施形態では、第3の電子導電分子は、第1の電極と第3の化学結合を形成する。この化学結合は共有結合であってもよい。いくつかの実施形態では、第2のプローブは、第1の電極と化学結合を形成する。この化学結合は共有結合であってもよい。
【0018】
いくつかの実施形態では、第2のプローブは、第4の電子導電分子を含み、これは、第1または第2の電子導電分子と同一であるまたは異なっていてもよく、第3の電子導電分子と同一であるまたは異なっていてもよい。ある実施形態では、第3の電子導電分子は、第3の化学結合を介して、例えば、共有結合的に第2の電極に付着し、第2のプローブは、第4の化学結合を介して、例えば、共有結合的に第3の認識分子に付着する。第4の電子導電分子は、例えば、共有結合的に第2のプローブに付着する。例えば、第2のプローブは、第3の化学結合および第4の化学結合を介して第1の電極に付着し、付着した第4の電子導電分子をも含む。
【0019】
第2のプローブは、センサによって検出すべき標的とは異なる生体分子と「錠前と鍵」の関係を形成する。いくつかの限定されない実施形態では、第2のプローブは、DNA、RNA、タンパク質、抗体、抗体フラグメント、アプタマー、抗原、または酵素であり得る。いくつかの実施形態では、第2のプローブは、検出すべき標的以外の抗原を認識する抗体である。
【0020】
いくつかの実施形態では、このセンサは、第1の電極と接触した第1の流路および第2の電極と接触した第2の流路を有する。このセンサは、目的の標的を含む疑いのある第1のサンプルが第1の流路および第2の流路を同時に流れるように構成される、あるいは、第1のサンプルが第1および第2の流路を非同時に流れるように構成される。第1のシグナルは、上記で述べたような第1の流路で生成される。第2の電極に伴う第2の電場は、第1のサンプルに合わせて変化する。第2のシグナルは、第2の電場の変化に基づいて得られる。第1のシグナルおよび第2のシグナルは、さらなる処理のために記録される。
【0021】
いくつかの実施形態では、目的の標的を実質的に含まない第2のサンプルを、それぞれ、第1の電極および第2の電極を介してセンサに導入する。第3のシグナルは、第2のサンプルが第1の電極を流れるのに合わせて第1の流路で生成される。第4のシグナルは、第2のサンプルが第2の電極を流れるのに合わせて第2の流路で生成される。第1のシグナルと第3のシグナル間の第1の相違と、第2のシグナルと第4のシグナル間の第2の相違との比に基づいて、このセンサは、標的が第1のサンプル中に存在するかどうかを決定する。
【0022】
いくつかの実施形態では、少なくとも2つの電極を有するバイオセンサであって、一方の電極が少なくとも1つのプローブおよび1つの電子導電分子を含み、他方の電極が少なくとも1つのプローブおよび2つの電子導電分子を含む、バイオセンサを提供する。
【0023】
ある実施形態では、(a)本明細書中に記載の第1のプローブおよび本明細書中に記載の第1の電子導電分子を含み、第1のプローブがサンプル中の目的の標的に結合するように構成された、第1の電極と、(b)第2の電子導電分子および第3の電子導電分子を含む第2のプローブを含み、このプローブが目的の標的に結合せず、第1の電子導電分子は第2または第3の電子導電分子と同一であるまたは異なっている、第2の電極と、を含む、バイオセンサを提供する。上記で述べたように、このようなバイオセンサは、目的の標的分子の検出方法において使用される。
【0024】
いくつかの実施形態では、第1、第2、第3、および/または任意の第4の電子導電分子は、芳香族化合物、ピリジン化合物、ポリアセチレンポリマー、チオフェン化合物、アゾール化合物、ポリアニリンポリマー、またはそれら誘導体のうちの1つであり得る。いくつかの例示される電子導電分子には、3−(チオフェン−2−イル)プロパナール(3−(thiophen−2−yl)propanal)、3−フェニルプロパナール(3−phenylpropanal)、3−(1−ピロール−2−イル)プロパナール(3−(1−pyrrol−2−yl)propanal)、3−(ピリジン−2−イル)プロパナール(3−(pyridin−2−yl)propanal)、(E)−4−フェニルブト−3−エナール((E)−4−phenylbut−3−enal)、(E)−4−(4−(E)−スチリルフェニル)ブト−3−エナール((E)−4−(4−(E)−styrylphenyl)but−3−enal)、(E)−4−(ピリジン−2−イル)ブト−3−エナール((E)−4−(pyridin−2−yl)but−3−enal)、(E)−4−(5−((E)−2−(ピリジン−2−イル)ビニル)ピリジン−2−イル)ブト−3−エナール((E)−4−(5−((E)−2−(pyridin−2−yl)vinyl)pyridin−2−yl)but−3−enal)、(E)−ヘプタ−4,6−ジエナール((E)−hepta−4,6−dienal)、(Z)−ヘプタ−4,6−ジエナール((Z)−hepta−4,6−dienal)、(E)−4−(シクロヘキサ−2−エニリデン)ブタナール((E)−4−(cyclohex−2−enylidene)butanal)、2−(ナフタレン−2−イル)アセトアルデヒド(2−(naphthalen−2−yl)acetaldehyde)、5’’−フォルマル−5−カルボキシル−2,2’,5’,2’’−トリチオフェン(5’’−formal−5−carboxyl−2,2’,5’,2’’−trithiophene)、p−4’−フォルマル−4−カルボキシル−1,1’−ビベンゼン(p−4’−formal−4−carboxyl−1,1’−bibenzene)、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)、およびそれら誘導体のうちの1つが含まれるが、これらに限定されない。
【0025】
いくつかの実施形態では、標的の検出方法が開示される。本方法は、上記の任意のセンサを、標的を含む疑いのある第1のサンプルと接触させる工程、および標的が第1のプローブと結合すると上記で述べたように第1のシグナルを検出する工程を含む。いくつかの実施形態では、この第1のシグナルの検出は、標的が第1のサンプル中に存在することを指し示している。任意に、第2のシグナル、第3のシグナル、および第4のシグナルを上記のように検出し、第1、第2、第3、および第4のシグナルを処理して、標的が第1のサンプル中に存在するかどうかを決定する。
【0026】
いくつかの実施形態では、本方法は、第1の電子導電分子で第1の電極を処理する工程、第1のプローブを第2の電子導電分子と共役させる工程、および第1の電極上に第1のプローブを付着させる工程を含む。第1のプローブは、標的に結合するように構成される。
【0027】
本方法は、更に、同じ第1の電子導電分子で第2の電極を処理する工程、および第2の電極上に第2のプローブを付着させる工程を含む。第2のプローブは、標的に結合しないように構成される。
【0028】
本方法は、更に、第1の電極および第2の電極を同時に流れるように、標的を潜在的に含む第1のサンプルを導入して、第1のシグナルおよび第2のシグナルをそれぞれ得る工程を含む。本方法は、更に、第1の電極および第2の電極を同時に流れるように、標的を実質的に含まない第2のサンプルを導入して、第3のシグナルおよび第4のシグナルを得る工程を含む。本方法は、更に、上記のように、第1、第2、第3、および第4のシグナルの定量化に基づいて第1のサンプルが標的を含むかどうかを決定する工程を含む。
【0029】
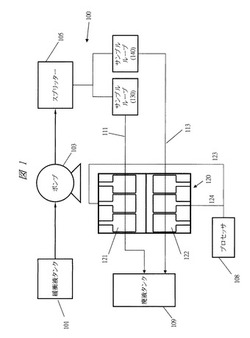
図1は、目的の標的の検出用センサ100を例示する実施形態である。センサ100は、緩衝液タンク101、ポンプ103、スプリッター105、第1のサンプルループ130、第2のサンプルルール140、バイオチップ120、廃液タンク109、およびプロセッサ108を有する。第1のサンプルループ130および第2のサンプルルール140は、センサによって検出すべき標的を潜在的に含むサンプルを保存するように構成される。センサが起動された後、ポンプ103は緩衝液タンク101中に貯蔵された緩衝液を汲み上げて第1のサンプルループ130および第2のサンプルルール140上を洗い流す。次いで、サンプルを緩衝液と混合し、第1の流路111および第2の流路113からバイオチップ120内に流入させる。バイオチップ120は、第1の電極セット121および第2の電極セット122を有する。サンプルは、バイオチップ120内を流れた後、最終的に廃液タンク109において回収される。
【0030】
第1のプローブを第1の電極セット121上に付着させ、この第1のプローブは、センサ100によって検出されるべき標的に結合するように構成される。第2のプローブを第2の電極セット122上に付着させ、この第2のプローブは、センサ100によって検出されるべき標的に結合しないように構成される。
【0031】
サンプルが第1の電極セット121および第2の電極セット122を流れると、第1の電極セット121および第2の電極セット122のそれぞれの電場が変化する。次いで、第1の電極セット121および第2の電極セット122の電場の変化を反映したシグナルが、さらなる処理のためにワイヤ123および124を介してプロセッサ108に送られる。プロセッサ108は、センサによって検出されるべき標的がサンプル中に存在するかどうかを決定するように構成される。
【0032】
図2は、生体分子の検出方法200を例示する実施形態のフローチャートを示す。この方法200は、工程201、203、および205を含む。工程201では、電極は、第1の電子導電分子で処理される。第1の電子導電分子は、この電極と共有結合を形成する。この電極は、金属、例えば、金、白金、銅などから成る。いくつかの例示される第1の電子導電分子として、3−(チオフェン−2−イル)プロパナール(3−(thiophen−2−yl)propanal)、3−フェニルプロパナール(3−phenylpropanal)、3−(1−ピロール−2−イル)プロパナール(3−(1−pyrrol−2−yl)propanal)、3−(ピリジン−2−イル)プロパナール(3−(pyridin−2−yl)propanal)、(E)−4−フェニルブト−3−エナール((E)−4−phenylbut−3−enal)、(E)−4−(4−(E)−スチリルフェニル)ブト−3−エナール((E)−4−(4−(E)−styrylphenyl)but−3−enal)、(E)−4−(ピリジン−2−イル)ブト−3−エナール((E)−4−(pyridin−2−yl)but−3−enal)、(E)−4−(5−((E)−2−(ピリジン−2−イル)ビニル)ピリジン−2−イル)ブト−3−エナール((E)−4−(5−((E)−2−(pyridin−2−yl)vinyl)pyridin−2−yl)but−3−enal)、(E)−ヘプタ−4,6−ジエナール((E)−hepta−4,6−dienal)、(Z)−ヘプタ−4,6−ジエナール((Z)−hepta−4,6−dienal)、(E)−4−(シクロヘキサ−2−エニリデン)ブタナール((E)−4−(cyclohex−2−enylidene)butanal)、2−(ナフタレン−2−イル)アセトアルデヒド(2−(naphthalen−2−yl)acetaldehyde)、5’’−フォルマル−5−カルボキシル−2,2’,5’,2’’−トリチオフェン(5’’−formal−5−carboxyl−2,2’,5’,2’’−trithiophene)、p−4’−フォルマル−4−カルボキシル−1,1’−ビベンゼン(p−4’−formal−4−carboxyl−1,1’−bibenzene)、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)、およびそれら誘導体のうちの1つが挙げられるが、これらに限定されない。
【0033】
工程203では、プローブは、第2の電子導電分子と共役する。このプローブは、DNA、RNA、タンパク質、抗体、抗原、または酵素から成る。第2の電子導電分子は、第1の電子導電分子と異なっていてもよい。いくつかの例示される第2の電子導電分子として、3−(チオフェン−2−イル)プロパナール(3−(thiophen−2−yl)propanal)、3−フェニルプロパナール(3−phenylpropanal)、3−(1−ピロール−2−イル)プロパナール(3−(1−pyrrol−2−yl)propanal)、3−(ピリジン−2−イル)プロパナール(3−(pyridin−2−yl)propanal)、(E)−4−フェニルブト−3−エナール((E)−4−phenylbut−3−enal)、(E)−4−(4−(E)−スチリルフェニル)ブト−3−エナール((E)−4−(4−(E)−styrylphenyl)but−3−enal)、(E)−4−(ピリジン−2−イル)ブト−3−エナール((E)−4−(pyridin−2−yl)but−3−enal)、(E)−4−(5−((E)−2−(ピリジン−2−イル)ビニル)ピリジン−2−イル)ブト−3−エナール((E)−4−(5−((E)−2−(pyridin−2−yl)vinyl)pyridin−2−yl)but−3−enal)、(E)−ヘプタ−4,6−ジエナール((E)−hepta−4,6−dienal)、(Z)−ヘプタ−4,6−ジエナール((Z)−hepta−4,6−dienal)、(E)−4−(シクロヘキサ−2−エニリデン)ブタナール((E)−4−(cyclohex−2−enylidene)butanal)、2−(ナフタレン−2−イル)アセトアルデヒド(2−(naphthalen−2−yl)acetaldehyde)、5’’−フォルマル−5−カルボキシル−2,2’,5’,2’’−トリチオフェン(5’’−formal−5−carboxyl−2,2’,5’,2’’−trithiophene)、p−4’−フォルマル−4−カルボキシル−1,1’−ビベンゼン(p−4’−formal−4−carboxyl−1,1’−bibenzene)、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)、およびそれら誘導体のうちの1つが挙げられるが、これらに限定されない。
【0034】
工程205では、このプローブを電極上に付着させる。このプローブは、第1の電子導電分子と共有結合を形成する。プローブと第1の電子導電分子との間の共有結合および第1の電子導電分子と電極との間の共有結合を介して、このプローブを電極上に付着させる。
【0035】
図3A〜3Fは、生体分子検出用センサにおける2つの電極の準備方法を例示する実施形態を示す。図3Aでは、第1の金電極301を、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)で処理している。5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)を電子導電分子として使用し、処理された第1の金電極301’と第1の共有結合を形成する。そうすると、処理された第1の金電極301’の電子導電率が促進される。いくつかの実施形態では、処理された第1の金電極301’は、センサの第1の流路中に配置される。
【0036】
図3Bでは、第2の金電極302を、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)で処理している。5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)を電子導電分子として使用し、処理された第2の金電極302’と第2の共有結合を形成する。そうすると、処理された第2の金電極302’の電子導電率が促進される。いくつかの実施形態では、処理された第2の金電極302’は、センサの第2の流路中に配置される。
【0037】
図3Cでは、ビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)が、処理された抗(HPV HR)抗体303’と共役するように、抗(HPV HR)抗体303をビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)で処理する。ビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)を電子導電分子として使用している。処理された抗(HPV HR)抗体303’の電子導電率が促進される。
【0038】
図3Dでは、ビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)が、処理された抗カフェイン抗体304’と共役するように、抗カフェイン抗体304をビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)で処理している。ビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)を電子導電分子として使用する。処理された抗カフェイン抗体304’の電子導電率が促進される。
【0039】
図3Eでは、処理された抗(HPV HR)抗体303’を、処理された第1の金電極301’上に付着させている。いくつかの実施形態では、処理された抗(HPV HR)抗体303’のアミン基は、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)と第3の共有結合を形成する。第1および第3の共有結合を介して、処理された抗(HPV HR)抗体303’を、処理された第1の金電極301’上に付着させる。
【0040】
図3Fでは、処理された抗カフェイン抗体304’を、処理された第2の金電極302’上に付着させている。いくつかの実施形態では、処理された抗カフェイン抗体304’のアミン基は、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)と第4の共有結合を形成する。第2および第4の共有結合を介して、処理された抗カフェイン抗体304’を、処理された第2の金電極302’上に付着させる。
【実施例1】
【0041】
2つの金電極セットを含む裸のセンサチップを、Vsensor(登録商標)V11A3センサ(Vsense Biotech.Ltd,Taipei,Taiwan)に取り付けた。このセンサにおいて、第1の流路は第1の金電極セットと交差しており、第2の流路は第2の金電極セットと交差している。センサを起動させた後、ポンプで緩衝液タンクからリン酸緩衝生理食塩水(PBS)の緩衝液を汲み上げた。PBS緩衝液はpH7.2であり、20μl/分の速度でセンサチップ上に流された。次いで、電子導電分子である10mMの5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)溶液をセンサに注入し、PBS緩衝液で流した。次いで、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)溶液およびPBS緩衝液を、第1の金電極セットおよび第2の金電極セット上に5分間流した。最後に、第1の金電極セットおよび第2の金電極セットを、PBS緩衝液でさらに15分間洗浄した。
【0042】
200μg/mlの抗(HPV HR)モノクローナル抗体(Abcam,ab75574,Cambridge,UK)溶液を、PBS緩衝液で作成した。別の電子導電分子である、50%エタノール/50%水から成る10mMのビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)(MerckSchuchardt OHG,8.41238.0010,Hohenbrunn,Germany)溶液を、抗体溶液に添加した。十分に混合した後、共役した抗(HPV HR)モノクローナル抗体溶液が作成された。
【0043】
200μg/mlの抗カフェインモノクローナル抗体(Abcam,ab15221,Cambridge,UK)溶液を、PBS緩衝液で作成した。別の電子導電分子である、50%エタノール/50%水から成る10mMのビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)(MerckSchuchardtOHG,8.41238.0010,Hohenbrunn,Germany)溶液を、抗体溶液に添加した。十分に混合した後、共役した抗カフェインモノクローナル抗体溶液が作成された。
【0044】
次いで、共役した抗(HPV HR)モノクローナル抗体溶液を、第1のサンプルループを介してセンサに注入し、次いで、第1の金電極セット上に流した。次いで、第1の金電極セット上を、PBS緩衝液で洗い流した。PBS緩衝液の流速は、10分間で20μl/分であった。次いで、第1の金電極セットを、再度、PBS緩衝液でさらに10分間洗浄し、この時のPBS緩衝液の流速は20μl/分に保持された。
【0045】
共役した抗カフェインモノクローナル抗体溶液を、第2のサンプルループを介してセンサに注入し、次いで、第2の金電極セット上に流した。次いで、第2の金電極セットを、PBS緩衝液で洗い流した。PBS緩衝液の流速は、10分間で20μl/分であった。次いで、第2の金電極セットを、再度、PBS緩衝液でさらに10分間洗浄し、この時のPBS緩衝液の流速は20μl/分に保持された。
【0046】
ヒトパピローマウイルス16(HPV16)感染症患者サンプルを、0.1%、1%、2%、5%、および10%に希釈した。希釈したサンプルを順にセンサに注入した。各希釈サンプルを、第1の金電極セットおよび第2の金電極セット上に同時に流した。
【0047】
本発明者らは、同一のチップを繰り返し使用して、患者サンプルの各希釈濃度を検討した。この繰り返し使用は、酸性グリシン緩衝液(0.1M、pH2.5)で関連のHPV16を洗い流すことによって行うことができた。
【0048】
健康なヒト由来のサンプルを、標準グループとして使用した。この標準サンプルも、0.1%、1%、2%、5%、および10%に希釈した。希釈した標準サンプルを順にセンサに注入した。各希釈標準サンプルを、第1の金電極セットおよび第2の金電極セット上に同時に流した。本発明者らはまた、酸性グリシン緩衝液を使用して、2つの注入の合間にチップ上を洗い流した。
【0049】
各注入に対応してセンサによって検出された電流を、図4Aに示した。図4Aでは、患者サンプルの濃度がそれぞれ1%、2%、5%、および10%である時、HPV16感染症患者サンプルで比較的高い電流が検出された。(ポイントa−ポイントb)/(ポイントc−ポイントd)の電流値の比を使用して、HPV16抗原が希釈サンプル中に存在するかどうかを決定した。
【0050】
図4Bは、印可バイアス電圧(約0.01ボルト)におけるコンダクティブ原子間力顕微鏡法によって走査された、ビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)と共役した抗(HPV HR)モノクローナル抗体を含む電極の導電画像を示す。この画像は、電極表面上のコンダクタンスのプロフィールを示している。X軸の単位はμm、Y軸の単位はμmである。より明るい部分は、比較的高いコンダクタンス(例えば、約99.98ナノアンペア)を示している。より暗い部分は、比較的低いコンダクタンス(例えば、約0ナノアンペア)を示している。
【実施例2】
【0051】
2つの金電極セットを含む裸のセンサチップを、Vsensor(登録商標)V11A3センサ(Vsense Biotech.Ltd,Taipei,Taiwan)に取り付けた。このセンサにおいて、第1の流路は第1の金電極セットと交差しており、第2の流路は第2の金電極セットと交差している。センサを起動させた後、ポンプで緩衝液タンクからリン酸緩衝生理食塩水(PBS)の緩衝液を汲み上げた。PBS緩衝液はpH7.2であり、20μl/分の速度でセンサチップ上を流れた。次いで、電子導電分子である10mMの5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)溶液を、サンプルループを介してセンサに注入し、PBS緩衝液で洗い流した。次いで、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)溶液およびPBS緩衝液を、第1の金電極セットおよび第2の金電極セット上に5分間流した。最後に、第1の金電極セットおよび第2の金電極セット上を、PBS緩衝液でさらに15分間洗浄した。
【0052】
200μg/mlの抗(EV71)モノクローナル抗体(Millipore,3321,Billerica,MA,USA)溶液を、PBS緩衝液で作成した。別の電子導電分子である、50%エタノール/50%水から成る10mMのビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)(MerckSchuchardt OHG,8.41238.0010,Hohenbrunn,Germany)溶液を、抗体溶液に添加した。十分に混合した後、共役した抗(EV71)モノクローナル抗体溶液が作成された。
【0053】
200μg/mlの抗アクロソームモノクローナルタンパク質(Abcam,ab4569,Cambridge,UK)溶液を、PBS緩衝液で作成した。50%エタノール/50%水から成る10mMのビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)(MerckSchuchardt OHG,8.41238.0010,Hohenbrunn,Germany)溶液を、抗アクロソームタンパク質溶液に添加した。十分に混合した後、共役した抗アクロソームタンパク質溶液が作成された。
【0054】
次いで、共役した抗(EV71)モノクローナル抗体溶液を、第1のサンプルループを介してセンサに注入し、次いで、第1の金電極セット上に流した。次いで、第1の金電極セット上を、PBS緩衝液で洗い流した。PBS緩衝液の流速は、10分間で20μl/分であった。次いで、第1の金電極セットを、再度、PBS緩衝液でさらに10分間洗浄し、この時のPBS緩衝液の流速は20μl/分に保持された。
【0055】
次いで、共役した抗アクロソームタンパク質溶液を、第2のサンプルループを介してセンサに注入し、次いで、第2の金電極セット上に流した。次いで、第2の金電極セット上を、PBS緩衝液で洗い流した。PBS緩衝液の流速は、10分間で20μl/分であった。次いで、第2の金電極セットを、再度、PBS緩衝液でさらに10分間洗浄し、この時のPBS緩衝液の流速は20μl/分に保持された。
【0056】
EV71感染症患者サンプルを、0.1%、1%、2%、5%、および10%に希釈した。希釈したサンプルを順にセンサに注入した。各希釈サンプルを、第1の金電極セットおよび第2の金電極セット上に同時に流した。
【0057】
本発明者らは、同一のチップを繰り返し使用して、患者サンプルの各希釈濃度を検討した。この繰り返し使用は、酸性グリシン緩衝液(0.1M、pH2.5)で関連のEV71を洗い流すことによって行うことができた。
【0058】
健康なヒト由来のサンプルを標準グループとして使用した。この標準サンプルも、0.1%、1%、2%、5%、および10%に希釈した。希釈した標準サンプルを順にセンサに注入した。各希釈標準サンプルを、第1の金電極セットおよび第2の金電極セット上に同時に流した。本発明者らはまた、酸性グリシン緩衝液を使用して、2つの注入の合間にチップ上を洗い流した。
【0059】
各注入に対応してセンサによって検出された電流を、図4Cに示した。図4Cでは、患者サンプルの濃度がそれぞれ0.1%、1%、2%、5%、および10%である時、EV71感染症患者サンプルで比較的高い電流が検出された。(ポイントa−ポイントb)/(ポイントc−ポイントd)の電流値の比を使用して、EV71抗原が希釈サンプル中に存在するかどうかを決定した。
【実施例3】
【0060】
2つの金電極セットを含む裸のセンサチップを、Vsensor(登録商標)V11A3センサ(Vsense Biotech.Ltd,Taipei,Taiwan)に取り付けた。このセンサにおいて、第1の流路は第1の金電極セットと交差しており、第2の流路は第2の金電極セットと交差している。センサを起動させた後、ポンプで緩衝液タンクからリン酸緩衝生理食塩水(PBS)の緩衝液を汲み上げた。PBS緩衝液はpH7.2であり、50μl/分の速度でセンサチップ上を流れた。次いで、電子導電分子である10mMのp−4’−フォルマル−4−カルボキシル−1,1’−ビベンゼン(p−4’−formal−4−carboxyl−1,1’−bibenzene)(CHO−(C6H4)2−COOH)溶液を、サンプルループを介してセンサに注入し、PBS緩衝液で洗い流した。次いで、p−4’−フォルマル−4−カルボキシル−1,1’−ビベンゼン(p−4’−formal−4−carboxyl−1,1’−bibenzene)溶液およびPBS緩衝液を、第1の金電極セットおよび第2の金電極セット上に18分間流した。最後に、第1の金電極セットおよび第2の金電極セット上を、PBS緩衝液でさらに15分間洗浄した。次いで、400mMのEDCと100nMのNHSとの混合物(EDCの体積/NHSの体積=1/1)を注入し、流速20μl/分で15分間センサチップ上に流した。
【0061】
200μg/mlの抗(Lect2)モノクローナル抗体(Santa Cruz,sc−99036,Santa Cruz,CA,USA)溶液を、酢酸緩衝液(pH4.8)で作成した。別の電子導電分子である、50%エタノール/50%水から成る10mMのビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)(MerckSchuchardt OHG,8.41238.0010,Hohenbrunn,Germany)溶液を、抗体溶液に添加した。十分に混合した後、共役した抗(Lect2)モノクローナル抗体溶液が作成された。
【0062】
200μg/mlの抗アクロソームモノクローナルタンパク質(Abcam,ab4569,Cambridge,UK)溶液を、PBS緩衝液で作成した。50%エタノール/50%水から成る10mMのビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)(MerckSchuchardtOHG,8.41238.0010,Hohenbrunn,Germany)溶液を、抗アクロソームタンパク質溶液に添加した。十分に混合した後、共役した抗アクロソームタンパク質溶液が作成された。
【0063】
次いで、共役した抗(Lect2)モノクローナル抗体溶液を、第1のサンプルループを介してセンサに注入し、次いで、第1の金電極セット上に流した。次いで、第1の金電極セット上を、PBS緩衝液で洗い流した。PBS緩衝液の流速は、10分間で20μl/分であった。次いで、第1の金電極セット上を、再度、PBS緩衝液でさらに10分間洗浄し、この時のPBS緩衝液の流速は20μl/分に保持された。
【0064】
次いで、共役した抗アクロソームタンパク質溶液を、第2のサンプルループを介してセンサに注入し、次いで、第2の金電極セット上に流した。次いで、第2の金電極セット上を、PBS緩衝液で洗い流した。PBS緩衝液の流速は、10分間で20μl/分であった。次いで、第2の金電極セット上を、再度、PBS緩衝液でさらに10分間洗浄し、この時のPBS緩衝液の流速は20μl/分に保持された。
【0065】
Lect2バイオマーカー分子含有HCC(肝細胞癌)患者サンプルを、0.1%、1%、2%、5%、および10%に希釈した。希釈したサンプルを順にセンサに注入した。流路スイッチによって、各希釈サンプルが、第1の金電極セットおよび第2の金電極セット上を同時に流れるように制御した。
【0066】
本発明者らは、同一のチップを繰り返し使用して、患者サンプルの各希釈濃度を検討した。この繰り返し使用は、酸性グリシン緩衝液(0.1M、pH2.5)で関連のLect2を洗い流すことによって行うことができた。
【0067】
健康なヒト由来のサンプルを標準グループとして使用した。この標準サンプルも、0.1%、1%、2%、5%、および10%に希釈した。希釈した標準サンプルを順にセンサに注入した。流路スイッチによって、各希釈標準サンプルが、第1の金電極セットおよび第2の金電極セット上を同時に流れるように制御した。本発明者らはまた、酸性グリシン緩衝液を使用して、2つの注入の合間にチップ上を洗い流した。
【0068】
各注入に対してセンサによって検出された電流を、図4Dに示した。図4Dでは、患者サンプルの濃度がそれぞれ0.1%、1%、2%、5%、および10%である時、Lect2バイオマーカー分子含有HCC(肝細胞癌)患者サンプルで比較的高い電流が検出された。(ポイントa−ポイントb)/(ポイントc−ポイントd)の電流値の比を使用して、HPV16抗原が希釈サンプル中に存在するかどうかを決定した。
【0069】
前述の発明は、理解を明確にするために、図および例を使用してある程度詳細に記載されているが、本発明の精神および範囲を逸脱することなく、一定の変更および修正を実施することができるということは、当業者にとって明らかであろう。したがって、上記説明は本発明の範囲を制限すると解釈されるべきではない。
【0070】
本明細書中に引用された全ての刊行物、特許、および特許出願は、各個別の刊行物、特許、および特許出願が具体的且つ個別に参考として援用されるのと同じように、全ての目的においてその全体が本明細書中で参考として援用される。
【背景技術】
【0001】
バイオセンサは、生体分子などの標的分子を検出するための分析装置である。ほとんどのバイオセンサは光バイオセンサである。光バイオセンサは金属からなり、光を吸収して金属表面上に電子波を生じる。電子波は、入射光のある特定の角度および特定の波長で生じ得るので、金属表面に強く依存する。生体分子が金属上に付着すると、測定可能なシグナルが生じ得る。
【0002】
いくつかのバイオセンサは電気化学バイオセンサである。電気化学バイオセンサでは、通常、プローブに触媒を使用する。しかし、そのシグナルは低いので、このような電気化学バイオセンサの適用には限界がある。目的の標的分子を正確に検出するために、ノイズ比に対してより高い信号を有する新規のバイオセンサが必要である。
【発明の概要】
【0003】
本開示のいくつかの実施形態は、一般的に、標的検出用のセンサに関する。ある例示されるセンサは、第1の電子導電分子で処理された電極と、第2の電子導電分子と共役したプローブと、を有する。このプローブを、第1の電極に取り付け、標的と結合するように構成する。第1および第2の電子導電分子は異なっていてもよい。
【0004】
本開示のいくつかのさらなる実施形態は、一般的に、標的の検出方法に関する。ある例示される方法は、標的含有が疑われるサンプルと上記のセンサとを接触させる工程を有する。この標的がプローブに結合すると、シグナルが生成される。このシグナルが検出された場合、これは、標的がサンプル中に存在することを指し示している。
【0005】
本開示のさらなる実施形態は、一般的に、電子導電分子に共役する抗体などから成るプローブに関する。このような抗体分子は、明細書内で記載されるセンサにおいて使用される。ある例示される抗体は、ピリジン化合物、ポリアセチレンポリマー、アゾール化合物、ポリアニリンポリマー、またはそれらの誘導体と共役する。電子導電分子に共役したプローブ、例えば、ピリジン化合物、ポリアセチレンポリマー、アゾール化合物、ポリアニリンポリマー、またはそれらの誘導体に共役した抗体を含む電極も提供する。
【0006】
上記概要は例示のみを目的とし、どのような手法においても制限されるものではない。上記の例示される態様、実施形態、および特徴に加えて、さらなる態様、実施形態、および特徴は、図面および以下の詳細な説明を参照することから明らかとなるであろう。
【図面の簡単な説明】
【0007】
【図1】生体分子検出用のセンサを例示する実施形態を示す。
【図2】生体分子の検出方法を例示する実施形態のフローチャートを示す。
【図3A】生体分子検出用のセンサにおける2つの電極を準備する方法を例示する実施形態を示す。
【図3B】生体分子検出用のセンサにおける2つの電極を準備する方法を例示する実施形態を示す。
【図3C】生体分子検出用のセンサにおける2つの電極を準備する方法を例示する実施形態を示す。
【図3D】生体分子検出用のセンサにおける2つの電極を準備する方法を例示する実施形態を示す。
【図3E】生体分子検出用のセンサにおける2つの電極を準備する方法を例示する実施形態を示す。
【図3F】生体分子検出用のセンサにおける2つの電極を準備する方法を例示する実施形態を示す。
【図4A】ヒトパピローマウイルス16(HPV16)感染症患者サンプルおよび標準サンプルから希釈された種々の濃度において検出された電流を例示する実施形態のチャートを示す。
【図4B】印加バイアス電圧(約0.01ボルト)においてコンダクティブ原子間力顕微鏡法によって走査された、ビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)と共役した抗(HPV HR)モノクローナル抗体を含む電極の導電性画像を示す。
【図4C】エンテロウイルス71(EV71)感染症患者サンプルおよび標準サンプルから希釈された種々の濃度において検出された電流を例示する実施形態のチャートを示す。
【図4D】白血球細胞由来ケモタキシン−2感染症患者サンプルおよび標準サンプルから希釈された種々の濃度において検出された電流を例示する実施形態のチャートを示す。
【発明を実施するための形態】
【0008】
以下の詳細な説明では、明細書の一部である添付の図面を参照する。図面において、文脈がそう述べない限り、典型的には、類似の記号は類似の要素を指し示す。詳細な説明、図面、および特許請求の範囲に記載の例示される実施形態は、限定されるものではない。本明細書中に示される主題の精神または範囲から逸脱することなしに、その他の実施形態を活用することができ、またその他の変更が可能である。本明細書中に一般的に記載され、且つ図面に示されたような本開示の態様は、広範な種々の異なる構成に配置、置換、組み合わせ、デザインされることができ、その全ては明確に熟考され本開示の一部となることは容易に理解されるであろう。
【0009】
本開示では、「電子導電分子」という語は、一般的に、電子を導電する化合物を示す。電子導電分子は重複するp軌道の領域を有し、隣接するように配列したp軌道上でのπ電子の非局在化を可能にする。電子導電分子のコンダクタンスは、コンダクティブ原子間力顕微鏡法によって調べることができる。いくつかの実施形態では、本明細書中に記載のバイオセンサ用チップにおいて有用な電子導電分子のコンダクタンスは、約0.01ボルトの印可電圧時で約1μΩ-1〜約10μΩ-1である。
【0010】
「プローブ」という語は、一般的に、目的の標的(例えば、生体分子)に結合することができる化合物を示す。例えば、標的へのプローブの結合の親和力は、約100ピコニュートン〜約500ピコニュートンとなり得る。限定されないプローブの例としては、抗体、目的の標的に結合する能力を保持する抗体フラグメント、核酸(例えば、DNA、RNA、アプタマー)、アプタマー、抗原、および酵素が挙げられる。
【0011】
「標的」という語は、一般的に、本明細書中に記載のバイオセンサによって検出可能な任意の分子をいう。標的には生体分子が含まれるが、これに限定されない。本明細書中に記載のバイオセンサによって検出可能な標的の例としては、生体分子(例えば、ウイルス、タンパク質、核酸、および炭水化物)および脂質、ハプテン、毒素などの他の小分子タイプが挙げられるが、これらに限定されない。
【0012】
ここで、プローブは、電子導電分子を含む。プローブの電子移送の挙動は、電子導電分子による重複p軌道によって誘発される。結果として、標的がプローブに結合すると、標的とプローブの結合に伴って電場の変化が増幅され得る。
【0013】
いくつかの実施形態では、生体分子検出用のセンサは、第1の電極、第1のプローブ、第1および第2の電子導電分子を含む。第1のプローブは、サンプル中の目的の標的を認識して結合する。いくつかの実施形態では、第1および第2の電子導電分子は異なっている。第1の電極は、第1の電子導電分子で処理される。第1の電子導電分子は、第1の電極との第1の化学結合を形成する。第1の化学結合は共有結合であってもよい。いくつかの実施形態では、第1のプローブは、第1の電極と化学結合、例えば、共有結合を形成する。
【0014】
いくつかの実施形態では、第1のプローブは、第2の電子導電分子で処理される。いくつかの実施形態では、第2の電子導電分子を、第1のプローブに共役させる、例えば、直接的にまたはリンカー分子を介して第1のプローブに共有結合させる。いくつかの実施形態では、第1のプローブは、第1の電子導電分子と第2の化学結合を形成する。したがって、第1のプローブは、第1の化学結合および第2の化学結合を介して第1の電極に付着し、付着した第2の電子導電分子をも含む。
【0015】
第1のプローブは、センサによって検出すべき標的とは「錠前と鍵」の関係を形成している。例えば、第1のプローブは、DNA、RNA、タンパク質、抗体、抗体フラグメント、アプタマー、抗原、または酵素であり得る。いくつかの実施形態では、第1のプローブは抗体であり、標的はその抗体が結合する抗原である。潜在的に標的を含む第1のサンプルをセンサに導入した後、第1の電極上に流すと、第1の電極に伴う第1の電場は、第1のプローブに結合する標的に合わせて変化する。第1の電場の変化に基づいて第1のシグナルが得られる。センサは、第1のシグナルが検出されるように構成されたプロセッサを有する。いくつかの実施形態では、第1のシグナルの検出は、第1のサンプルが標的を含むことを指し示している。第2の電子導電分子を第1のプローブに処理することにより、例えば、第1のプローブへ第2の電子導電分子を付着させることにより、第1のプローブの導電率が増加する。したがって、標的がプローブに結合すると、結合に伴う電場の変化は更に容易に検出されるようになる。ある実施形態では、このセンサは、第1の流路を有し、その第1の流路は、第1の電極に接触し、標的を含む疑いのある第1のサンプルがその流路を流れ、標的が第1のプローブに結合するとその流路でシグナルが生成される。
【0016】
いくつかの実施形態では、このセンサは、第3の電子導電分子および第2のプローブを含む第2の電極を有する。第2のプローブは、センサによって検出すべき標的とカップリングしないように構成される。いくつかの実施形態では、第2のプローブの標的に対する結合親和力は、約50ピコニュートン未満である。第3の電子導電分子は、第1または第2の電子導電分子と同一であるまたは異なっていてもよい。ある実施形態では、第3の電子導電分子は、第1の電子導電分子と同一である。
【0017】
いくつかの実施形態では、第3の電子導電分子は、第1の電極と第3の化学結合を形成する。この化学結合は共有結合であってもよい。いくつかの実施形態では、第2のプローブは、第1の電極と化学結合を形成する。この化学結合は共有結合であってもよい。
【0018】
いくつかの実施形態では、第2のプローブは、第4の電子導電分子を含み、これは、第1または第2の電子導電分子と同一であるまたは異なっていてもよく、第3の電子導電分子と同一であるまたは異なっていてもよい。ある実施形態では、第3の電子導電分子は、第3の化学結合を介して、例えば、共有結合的に第2の電極に付着し、第2のプローブは、第4の化学結合を介して、例えば、共有結合的に第3の認識分子に付着する。第4の電子導電分子は、例えば、共有結合的に第2のプローブに付着する。例えば、第2のプローブは、第3の化学結合および第4の化学結合を介して第1の電極に付着し、付着した第4の電子導電分子をも含む。
【0019】
第2のプローブは、センサによって検出すべき標的とは異なる生体分子と「錠前と鍵」の関係を形成する。いくつかの限定されない実施形態では、第2のプローブは、DNA、RNA、タンパク質、抗体、抗体フラグメント、アプタマー、抗原、または酵素であり得る。いくつかの実施形態では、第2のプローブは、検出すべき標的以外の抗原を認識する抗体である。
【0020】
いくつかの実施形態では、このセンサは、第1の電極と接触した第1の流路および第2の電極と接触した第2の流路を有する。このセンサは、目的の標的を含む疑いのある第1のサンプルが第1の流路および第2の流路を同時に流れるように構成される、あるいは、第1のサンプルが第1および第2の流路を非同時に流れるように構成される。第1のシグナルは、上記で述べたような第1の流路で生成される。第2の電極に伴う第2の電場は、第1のサンプルに合わせて変化する。第2のシグナルは、第2の電場の変化に基づいて得られる。第1のシグナルおよび第2のシグナルは、さらなる処理のために記録される。
【0021】
いくつかの実施形態では、目的の標的を実質的に含まない第2のサンプルを、それぞれ、第1の電極および第2の電極を介してセンサに導入する。第3のシグナルは、第2のサンプルが第1の電極を流れるのに合わせて第1の流路で生成される。第4のシグナルは、第2のサンプルが第2の電極を流れるのに合わせて第2の流路で生成される。第1のシグナルと第3のシグナル間の第1の相違と、第2のシグナルと第4のシグナル間の第2の相違との比に基づいて、このセンサは、標的が第1のサンプル中に存在するかどうかを決定する。
【0022】
いくつかの実施形態では、少なくとも2つの電極を有するバイオセンサであって、一方の電極が少なくとも1つのプローブおよび1つの電子導電分子を含み、他方の電極が少なくとも1つのプローブおよび2つの電子導電分子を含む、バイオセンサを提供する。
【0023】
ある実施形態では、(a)本明細書中に記載の第1のプローブおよび本明細書中に記載の第1の電子導電分子を含み、第1のプローブがサンプル中の目的の標的に結合するように構成された、第1の電極と、(b)第2の電子導電分子および第3の電子導電分子を含む第2のプローブを含み、このプローブが目的の標的に結合せず、第1の電子導電分子は第2または第3の電子導電分子と同一であるまたは異なっている、第2の電極と、を含む、バイオセンサを提供する。上記で述べたように、このようなバイオセンサは、目的の標的分子の検出方法において使用される。
【0024】
いくつかの実施形態では、第1、第2、第3、および/または任意の第4の電子導電分子は、芳香族化合物、ピリジン化合物、ポリアセチレンポリマー、チオフェン化合物、アゾール化合物、ポリアニリンポリマー、またはそれら誘導体のうちの1つであり得る。いくつかの例示される電子導電分子には、3−(チオフェン−2−イル)プロパナール(3−(thiophen−2−yl)propanal)、3−フェニルプロパナール(3−phenylpropanal)、3−(1−ピロール−2−イル)プロパナール(3−(1−pyrrol−2−yl)propanal)、3−(ピリジン−2−イル)プロパナール(3−(pyridin−2−yl)propanal)、(E)−4−フェニルブト−3−エナール((E)−4−phenylbut−3−enal)、(E)−4−(4−(E)−スチリルフェニル)ブト−3−エナール((E)−4−(4−(E)−styrylphenyl)but−3−enal)、(E)−4−(ピリジン−2−イル)ブト−3−エナール((E)−4−(pyridin−2−yl)but−3−enal)、(E)−4−(5−((E)−2−(ピリジン−2−イル)ビニル)ピリジン−2−イル)ブト−3−エナール((E)−4−(5−((E)−2−(pyridin−2−yl)vinyl)pyridin−2−yl)but−3−enal)、(E)−ヘプタ−4,6−ジエナール((E)−hepta−4,6−dienal)、(Z)−ヘプタ−4,6−ジエナール((Z)−hepta−4,6−dienal)、(E)−4−(シクロヘキサ−2−エニリデン)ブタナール((E)−4−(cyclohex−2−enylidene)butanal)、2−(ナフタレン−2−イル)アセトアルデヒド(2−(naphthalen−2−yl)acetaldehyde)、5’’−フォルマル−5−カルボキシル−2,2’,5’,2’’−トリチオフェン(5’’−formal−5−carboxyl−2,2’,5’,2’’−trithiophene)、p−4’−フォルマル−4−カルボキシル−1,1’−ビベンゼン(p−4’−formal−4−carboxyl−1,1’−bibenzene)、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)、およびそれら誘導体のうちの1つが含まれるが、これらに限定されない。
【0025】
いくつかの実施形態では、標的の検出方法が開示される。本方法は、上記の任意のセンサを、標的を含む疑いのある第1のサンプルと接触させる工程、および標的が第1のプローブと結合すると上記で述べたように第1のシグナルを検出する工程を含む。いくつかの実施形態では、この第1のシグナルの検出は、標的が第1のサンプル中に存在することを指し示している。任意に、第2のシグナル、第3のシグナル、および第4のシグナルを上記のように検出し、第1、第2、第3、および第4のシグナルを処理して、標的が第1のサンプル中に存在するかどうかを決定する。
【0026】
いくつかの実施形態では、本方法は、第1の電子導電分子で第1の電極を処理する工程、第1のプローブを第2の電子導電分子と共役させる工程、および第1の電極上に第1のプローブを付着させる工程を含む。第1のプローブは、標的に結合するように構成される。
【0027】
本方法は、更に、同じ第1の電子導電分子で第2の電極を処理する工程、および第2の電極上に第2のプローブを付着させる工程を含む。第2のプローブは、標的に結合しないように構成される。
【0028】
本方法は、更に、第1の電極および第2の電極を同時に流れるように、標的を潜在的に含む第1のサンプルを導入して、第1のシグナルおよび第2のシグナルをそれぞれ得る工程を含む。本方法は、更に、第1の電極および第2の電極を同時に流れるように、標的を実質的に含まない第2のサンプルを導入して、第3のシグナルおよび第4のシグナルを得る工程を含む。本方法は、更に、上記のように、第1、第2、第3、および第4のシグナルの定量化に基づいて第1のサンプルが標的を含むかどうかを決定する工程を含む。
【0029】
図1は、目的の標的の検出用センサ100を例示する実施形態である。センサ100は、緩衝液タンク101、ポンプ103、スプリッター105、第1のサンプルループ130、第2のサンプルルール140、バイオチップ120、廃液タンク109、およびプロセッサ108を有する。第1のサンプルループ130および第2のサンプルルール140は、センサによって検出すべき標的を潜在的に含むサンプルを保存するように構成される。センサが起動された後、ポンプ103は緩衝液タンク101中に貯蔵された緩衝液を汲み上げて第1のサンプルループ130および第2のサンプルルール140上を洗い流す。次いで、サンプルを緩衝液と混合し、第1の流路111および第2の流路113からバイオチップ120内に流入させる。バイオチップ120は、第1の電極セット121および第2の電極セット122を有する。サンプルは、バイオチップ120内を流れた後、最終的に廃液タンク109において回収される。
【0030】
第1のプローブを第1の電極セット121上に付着させ、この第1のプローブは、センサ100によって検出されるべき標的に結合するように構成される。第2のプローブを第2の電極セット122上に付着させ、この第2のプローブは、センサ100によって検出されるべき標的に結合しないように構成される。
【0031】
サンプルが第1の電極セット121および第2の電極セット122を流れると、第1の電極セット121および第2の電極セット122のそれぞれの電場が変化する。次いで、第1の電極セット121および第2の電極セット122の電場の変化を反映したシグナルが、さらなる処理のためにワイヤ123および124を介してプロセッサ108に送られる。プロセッサ108は、センサによって検出されるべき標的がサンプル中に存在するかどうかを決定するように構成される。
【0032】
図2は、生体分子の検出方法200を例示する実施形態のフローチャートを示す。この方法200は、工程201、203、および205を含む。工程201では、電極は、第1の電子導電分子で処理される。第1の電子導電分子は、この電極と共有結合を形成する。この電極は、金属、例えば、金、白金、銅などから成る。いくつかの例示される第1の電子導電分子として、3−(チオフェン−2−イル)プロパナール(3−(thiophen−2−yl)propanal)、3−フェニルプロパナール(3−phenylpropanal)、3−(1−ピロール−2−イル)プロパナール(3−(1−pyrrol−2−yl)propanal)、3−(ピリジン−2−イル)プロパナール(3−(pyridin−2−yl)propanal)、(E)−4−フェニルブト−3−エナール((E)−4−phenylbut−3−enal)、(E)−4−(4−(E)−スチリルフェニル)ブト−3−エナール((E)−4−(4−(E)−styrylphenyl)but−3−enal)、(E)−4−(ピリジン−2−イル)ブト−3−エナール((E)−4−(pyridin−2−yl)but−3−enal)、(E)−4−(5−((E)−2−(ピリジン−2−イル)ビニル)ピリジン−2−イル)ブト−3−エナール((E)−4−(5−((E)−2−(pyridin−2−yl)vinyl)pyridin−2−yl)but−3−enal)、(E)−ヘプタ−4,6−ジエナール((E)−hepta−4,6−dienal)、(Z)−ヘプタ−4,6−ジエナール((Z)−hepta−4,6−dienal)、(E)−4−(シクロヘキサ−2−エニリデン)ブタナール((E)−4−(cyclohex−2−enylidene)butanal)、2−(ナフタレン−2−イル)アセトアルデヒド(2−(naphthalen−2−yl)acetaldehyde)、5’’−フォルマル−5−カルボキシル−2,2’,5’,2’’−トリチオフェン(5’’−formal−5−carboxyl−2,2’,5’,2’’−trithiophene)、p−4’−フォルマル−4−カルボキシル−1,1’−ビベンゼン(p−4’−formal−4−carboxyl−1,1’−bibenzene)、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)、およびそれら誘導体のうちの1つが挙げられるが、これらに限定されない。
【0033】
工程203では、プローブは、第2の電子導電分子と共役する。このプローブは、DNA、RNA、タンパク質、抗体、抗原、または酵素から成る。第2の電子導電分子は、第1の電子導電分子と異なっていてもよい。いくつかの例示される第2の電子導電分子として、3−(チオフェン−2−イル)プロパナール(3−(thiophen−2−yl)propanal)、3−フェニルプロパナール(3−phenylpropanal)、3−(1−ピロール−2−イル)プロパナール(3−(1−pyrrol−2−yl)propanal)、3−(ピリジン−2−イル)プロパナール(3−(pyridin−2−yl)propanal)、(E)−4−フェニルブト−3−エナール((E)−4−phenylbut−3−enal)、(E)−4−(4−(E)−スチリルフェニル)ブト−3−エナール((E)−4−(4−(E)−styrylphenyl)but−3−enal)、(E)−4−(ピリジン−2−イル)ブト−3−エナール((E)−4−(pyridin−2−yl)but−3−enal)、(E)−4−(5−((E)−2−(ピリジン−2−イル)ビニル)ピリジン−2−イル)ブト−3−エナール((E)−4−(5−((E)−2−(pyridin−2−yl)vinyl)pyridin−2−yl)but−3−enal)、(E)−ヘプタ−4,6−ジエナール((E)−hepta−4,6−dienal)、(Z)−ヘプタ−4,6−ジエナール((Z)−hepta−4,6−dienal)、(E)−4−(シクロヘキサ−2−エニリデン)ブタナール((E)−4−(cyclohex−2−enylidene)butanal)、2−(ナフタレン−2−イル)アセトアルデヒド(2−(naphthalen−2−yl)acetaldehyde)、5’’−フォルマル−5−カルボキシル−2,2’,5’,2’’−トリチオフェン(5’’−formal−5−carboxyl−2,2’,5’,2’’−trithiophene)、p−4’−フォルマル−4−カルボキシル−1,1’−ビベンゼン(p−4’−formal−4−carboxyl−1,1’−bibenzene)、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)、およびそれら誘導体のうちの1つが挙げられるが、これらに限定されない。
【0034】
工程205では、このプローブを電極上に付着させる。このプローブは、第1の電子導電分子と共有結合を形成する。プローブと第1の電子導電分子との間の共有結合および第1の電子導電分子と電極との間の共有結合を介して、このプローブを電極上に付着させる。
【0035】
図3A〜3Fは、生体分子検出用センサにおける2つの電極の準備方法を例示する実施形態を示す。図3Aでは、第1の金電極301を、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)で処理している。5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)を電子導電分子として使用し、処理された第1の金電極301’と第1の共有結合を形成する。そうすると、処理された第1の金電極301’の電子導電率が促進される。いくつかの実施形態では、処理された第1の金電極301’は、センサの第1の流路中に配置される。
【0036】
図3Bでは、第2の金電極302を、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)で処理している。5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)を電子導電分子として使用し、処理された第2の金電極302’と第2の共有結合を形成する。そうすると、処理された第2の金電極302’の電子導電率が促進される。いくつかの実施形態では、処理された第2の金電極302’は、センサの第2の流路中に配置される。
【0037】
図3Cでは、ビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)が、処理された抗(HPV HR)抗体303’と共役するように、抗(HPV HR)抗体303をビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)で処理する。ビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)を電子導電分子として使用している。処理された抗(HPV HR)抗体303’の電子導電率が促進される。
【0038】
図3Dでは、ビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)が、処理された抗カフェイン抗体304’と共役するように、抗カフェイン抗体304をビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)で処理している。ビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)を電子導電分子として使用する。処理された抗カフェイン抗体304’の電子導電率が促進される。
【0039】
図3Eでは、処理された抗(HPV HR)抗体303’を、処理された第1の金電極301’上に付着させている。いくつかの実施形態では、処理された抗(HPV HR)抗体303’のアミン基は、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)と第3の共有結合を形成する。第1および第3の共有結合を介して、処理された抗(HPV HR)抗体303’を、処理された第1の金電極301’上に付着させる。
【0040】
図3Fでは、処理された抗カフェイン抗体304’を、処理された第2の金電極302’上に付着させている。いくつかの実施形態では、処理された抗カフェイン抗体304’のアミン基は、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)と第4の共有結合を形成する。第2および第4の共有結合を介して、処理された抗カフェイン抗体304’を、処理された第2の金電極302’上に付着させる。
【実施例1】
【0041】
2つの金電極セットを含む裸のセンサチップを、Vsensor(登録商標)V11A3センサ(Vsense Biotech.Ltd,Taipei,Taiwan)に取り付けた。このセンサにおいて、第1の流路は第1の金電極セットと交差しており、第2の流路は第2の金電極セットと交差している。センサを起動させた後、ポンプで緩衝液タンクからリン酸緩衝生理食塩水(PBS)の緩衝液を汲み上げた。PBS緩衝液はpH7.2であり、20μl/分の速度でセンサチップ上に流された。次いで、電子導電分子である10mMの5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)溶液をセンサに注入し、PBS緩衝液で流した。次いで、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)溶液およびPBS緩衝液を、第1の金電極セットおよび第2の金電極セット上に5分間流した。最後に、第1の金電極セットおよび第2の金電極セットを、PBS緩衝液でさらに15分間洗浄した。
【0042】
200μg/mlの抗(HPV HR)モノクローナル抗体(Abcam,ab75574,Cambridge,UK)溶液を、PBS緩衝液で作成した。別の電子導電分子である、50%エタノール/50%水から成る10mMのビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)(MerckSchuchardt OHG,8.41238.0010,Hohenbrunn,Germany)溶液を、抗体溶液に添加した。十分に混合した後、共役した抗(HPV HR)モノクローナル抗体溶液が作成された。
【0043】
200μg/mlの抗カフェインモノクローナル抗体(Abcam,ab15221,Cambridge,UK)溶液を、PBS緩衝液で作成した。別の電子導電分子である、50%エタノール/50%水から成る10mMのビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)(MerckSchuchardtOHG,8.41238.0010,Hohenbrunn,Germany)溶液を、抗体溶液に添加した。十分に混合した後、共役した抗カフェインモノクローナル抗体溶液が作成された。
【0044】
次いで、共役した抗(HPV HR)モノクローナル抗体溶液を、第1のサンプルループを介してセンサに注入し、次いで、第1の金電極セット上に流した。次いで、第1の金電極セット上を、PBS緩衝液で洗い流した。PBS緩衝液の流速は、10分間で20μl/分であった。次いで、第1の金電極セットを、再度、PBS緩衝液でさらに10分間洗浄し、この時のPBS緩衝液の流速は20μl/分に保持された。
【0045】
共役した抗カフェインモノクローナル抗体溶液を、第2のサンプルループを介してセンサに注入し、次いで、第2の金電極セット上に流した。次いで、第2の金電極セットを、PBS緩衝液で洗い流した。PBS緩衝液の流速は、10分間で20μl/分であった。次いで、第2の金電極セットを、再度、PBS緩衝液でさらに10分間洗浄し、この時のPBS緩衝液の流速は20μl/分に保持された。
【0046】
ヒトパピローマウイルス16(HPV16)感染症患者サンプルを、0.1%、1%、2%、5%、および10%に希釈した。希釈したサンプルを順にセンサに注入した。各希釈サンプルを、第1の金電極セットおよび第2の金電極セット上に同時に流した。
【0047】
本発明者らは、同一のチップを繰り返し使用して、患者サンプルの各希釈濃度を検討した。この繰り返し使用は、酸性グリシン緩衝液(0.1M、pH2.5)で関連のHPV16を洗い流すことによって行うことができた。
【0048】
健康なヒト由来のサンプルを、標準グループとして使用した。この標準サンプルも、0.1%、1%、2%、5%、および10%に希釈した。希釈した標準サンプルを順にセンサに注入した。各希釈標準サンプルを、第1の金電極セットおよび第2の金電極セット上に同時に流した。本発明者らはまた、酸性グリシン緩衝液を使用して、2つの注入の合間にチップ上を洗い流した。
【0049】
各注入に対応してセンサによって検出された電流を、図4Aに示した。図4Aでは、患者サンプルの濃度がそれぞれ1%、2%、5%、および10%である時、HPV16感染症患者サンプルで比較的高い電流が検出された。(ポイントa−ポイントb)/(ポイントc−ポイントd)の電流値の比を使用して、HPV16抗原が希釈サンプル中に存在するかどうかを決定した。
【0050】
図4Bは、印可バイアス電圧(約0.01ボルト)におけるコンダクティブ原子間力顕微鏡法によって走査された、ビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)と共役した抗(HPV HR)モノクローナル抗体を含む電極の導電画像を示す。この画像は、電極表面上のコンダクタンスのプロフィールを示している。X軸の単位はμm、Y軸の単位はμmである。より明るい部分は、比較的高いコンダクタンス(例えば、約99.98ナノアンペア)を示している。より暗い部分は、比較的低いコンダクタンス(例えば、約0ナノアンペア)を示している。
【実施例2】
【0051】
2つの金電極セットを含む裸のセンサチップを、Vsensor(登録商標)V11A3センサ(Vsense Biotech.Ltd,Taipei,Taiwan)に取り付けた。このセンサにおいて、第1の流路は第1の金電極セットと交差しており、第2の流路は第2の金電極セットと交差している。センサを起動させた後、ポンプで緩衝液タンクからリン酸緩衝生理食塩水(PBS)の緩衝液を汲み上げた。PBS緩衝液はpH7.2であり、20μl/分の速度でセンサチップ上を流れた。次いで、電子導電分子である10mMの5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)溶液を、サンプルループを介してセンサに注入し、PBS緩衝液で洗い流した。次いで、5’−(メチル)チオール−5−フォルマル−2,2’−ビチオフェン(5’−(methyl)thiol−5−formal−2,2’−bithiophene)溶液およびPBS緩衝液を、第1の金電極セットおよび第2の金電極セット上に5分間流した。最後に、第1の金電極セットおよび第2の金電極セット上を、PBS緩衝液でさらに15分間洗浄した。
【0052】
200μg/mlの抗(EV71)モノクローナル抗体(Millipore,3321,Billerica,MA,USA)溶液を、PBS緩衝液で作成した。別の電子導電分子である、50%エタノール/50%水から成る10mMのビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)(MerckSchuchardt OHG,8.41238.0010,Hohenbrunn,Germany)溶液を、抗体溶液に添加した。十分に混合した後、共役した抗(EV71)モノクローナル抗体溶液が作成された。
【0053】
200μg/mlの抗アクロソームモノクローナルタンパク質(Abcam,ab4569,Cambridge,UK)溶液を、PBS緩衝液で作成した。50%エタノール/50%水から成る10mMのビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)(MerckSchuchardt OHG,8.41238.0010,Hohenbrunn,Germany)溶液を、抗アクロソームタンパク質溶液に添加した。十分に混合した後、共役した抗アクロソームタンパク質溶液が作成された。
【0054】
次いで、共役した抗(EV71)モノクローナル抗体溶液を、第1のサンプルループを介してセンサに注入し、次いで、第1の金電極セット上に流した。次いで、第1の金電極セット上を、PBS緩衝液で洗い流した。PBS緩衝液の流速は、10分間で20μl/分であった。次いで、第1の金電極セットを、再度、PBS緩衝液でさらに10分間洗浄し、この時のPBS緩衝液の流速は20μl/分に保持された。
【0055】
次いで、共役した抗アクロソームタンパク質溶液を、第2のサンプルループを介してセンサに注入し、次いで、第2の金電極セット上に流した。次いで、第2の金電極セット上を、PBS緩衝液で洗い流した。PBS緩衝液の流速は、10分間で20μl/分であった。次いで、第2の金電極セットを、再度、PBS緩衝液でさらに10分間洗浄し、この時のPBS緩衝液の流速は20μl/分に保持された。
【0056】
EV71感染症患者サンプルを、0.1%、1%、2%、5%、および10%に希釈した。希釈したサンプルを順にセンサに注入した。各希釈サンプルを、第1の金電極セットおよび第2の金電極セット上に同時に流した。
【0057】
本発明者らは、同一のチップを繰り返し使用して、患者サンプルの各希釈濃度を検討した。この繰り返し使用は、酸性グリシン緩衝液(0.1M、pH2.5)で関連のEV71を洗い流すことによって行うことができた。
【0058】
健康なヒト由来のサンプルを標準グループとして使用した。この標準サンプルも、0.1%、1%、2%、5%、および10%に希釈した。希釈した標準サンプルを順にセンサに注入した。各希釈標準サンプルを、第1の金電極セットおよび第2の金電極セット上に同時に流した。本発明者らはまた、酸性グリシン緩衝液を使用して、2つの注入の合間にチップ上を洗い流した。
【0059】
各注入に対応してセンサによって検出された電流を、図4Cに示した。図4Cでは、患者サンプルの濃度がそれぞれ0.1%、1%、2%、5%、および10%である時、EV71感染症患者サンプルで比較的高い電流が検出された。(ポイントa−ポイントb)/(ポイントc−ポイントd)の電流値の比を使用して、EV71抗原が希釈サンプル中に存在するかどうかを決定した。
【実施例3】
【0060】
2つの金電極セットを含む裸のセンサチップを、Vsensor(登録商標)V11A3センサ(Vsense Biotech.Ltd,Taipei,Taiwan)に取り付けた。このセンサにおいて、第1の流路は第1の金電極セットと交差しており、第2の流路は第2の金電極セットと交差している。センサを起動させた後、ポンプで緩衝液タンクからリン酸緩衝生理食塩水(PBS)の緩衝液を汲み上げた。PBS緩衝液はpH7.2であり、50μl/分の速度でセンサチップ上を流れた。次いで、電子導電分子である10mMのp−4’−フォルマル−4−カルボキシル−1,1’−ビベンゼン(p−4’−formal−4−carboxyl−1,1’−bibenzene)(CHO−(C6H4)2−COOH)溶液を、サンプルループを介してセンサに注入し、PBS緩衝液で洗い流した。次いで、p−4’−フォルマル−4−カルボキシル−1,1’−ビベンゼン(p−4’−formal−4−carboxyl−1,1’−bibenzene)溶液およびPBS緩衝液を、第1の金電極セットおよび第2の金電極セット上に18分間流した。最後に、第1の金電極セットおよび第2の金電極セット上を、PBS緩衝液でさらに15分間洗浄した。次いで、400mMのEDCと100nMのNHSとの混合物(EDCの体積/NHSの体積=1/1)を注入し、流速20μl/分で15分間センサチップ上に流した。
【0061】
200μg/mlの抗(Lect2)モノクローナル抗体(Santa Cruz,sc−99036,Santa Cruz,CA,USA)溶液を、酢酸緩衝液(pH4.8)で作成した。別の電子導電分子である、50%エタノール/50%水から成る10mMのビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)(MerckSchuchardt OHG,8.41238.0010,Hohenbrunn,Germany)溶液を、抗体溶液に添加した。十分に混合した後、共役した抗(Lect2)モノクローナル抗体溶液が作成された。
【0062】
200μg/mlの抗アクロソームモノクローナルタンパク質(Abcam,ab4569,Cambridge,UK)溶液を、PBS緩衝液で作成した。50%エタノール/50%水から成る10mMのビフェニル−4−カルボアルデヒド(biphenyl−4−carbaldehyde)(MerckSchuchardtOHG,8.41238.0010,Hohenbrunn,Germany)溶液を、抗アクロソームタンパク質溶液に添加した。十分に混合した後、共役した抗アクロソームタンパク質溶液が作成された。
【0063】
次いで、共役した抗(Lect2)モノクローナル抗体溶液を、第1のサンプルループを介してセンサに注入し、次いで、第1の金電極セット上に流した。次いで、第1の金電極セット上を、PBS緩衝液で洗い流した。PBS緩衝液の流速は、10分間で20μl/分であった。次いで、第1の金電極セット上を、再度、PBS緩衝液でさらに10分間洗浄し、この時のPBS緩衝液の流速は20μl/分に保持された。
【0064】
次いで、共役した抗アクロソームタンパク質溶液を、第2のサンプルループを介してセンサに注入し、次いで、第2の金電極セット上に流した。次いで、第2の金電極セット上を、PBS緩衝液で洗い流した。PBS緩衝液の流速は、10分間で20μl/分であった。次いで、第2の金電極セット上を、再度、PBS緩衝液でさらに10分間洗浄し、この時のPBS緩衝液の流速は20μl/分に保持された。
【0065】
Lect2バイオマーカー分子含有HCC(肝細胞癌)患者サンプルを、0.1%、1%、2%、5%、および10%に希釈した。希釈したサンプルを順にセンサに注入した。流路スイッチによって、各希釈サンプルが、第1の金電極セットおよび第2の金電極セット上を同時に流れるように制御した。
【0066】
本発明者らは、同一のチップを繰り返し使用して、患者サンプルの各希釈濃度を検討した。この繰り返し使用は、酸性グリシン緩衝液(0.1M、pH2.5)で関連のLect2を洗い流すことによって行うことができた。
【0067】
健康なヒト由来のサンプルを標準グループとして使用した。この標準サンプルも、0.1%、1%、2%、5%、および10%に希釈した。希釈した標準サンプルを順にセンサに注入した。流路スイッチによって、各希釈標準サンプルが、第1の金電極セットおよび第2の金電極セット上を同時に流れるように制御した。本発明者らはまた、酸性グリシン緩衝液を使用して、2つの注入の合間にチップ上を洗い流した。
【0068】
各注入に対してセンサによって検出された電流を、図4Dに示した。図4Dでは、患者サンプルの濃度がそれぞれ0.1%、1%、2%、5%、および10%である時、Lect2バイオマーカー分子含有HCC(肝細胞癌)患者サンプルで比較的高い電流が検出された。(ポイントa−ポイントb)/(ポイントc−ポイントd)の電流値の比を使用して、HPV16抗原が希釈サンプル中に存在するかどうかを決定した。
【0069】
前述の発明は、理解を明確にするために、図および例を使用してある程度詳細に記載されているが、本発明の精神および範囲を逸脱することなく、一定の変更および修正を実施することができるということは、当業者にとって明らかであろう。したがって、上記説明は本発明の範囲を制限すると解釈されるべきではない。
【0070】
本明細書中に引用された全ての刊行物、特許、および特許出願は、各個別の刊行物、特許、および特許出願が具体的且つ個別に参考として援用されるのと同じように、全ての目的においてその全体が本明細書中で参考として援用される。
【特許請求の範囲】
【請求項1】
目的の標的を検出するためのセンサであって、
(i)第1の電子導電分子、および(ii)第2の電子導電分子を含む第1のプローブを含む、第1の電極を有し、
前記第1のプローブは溶液中の目的の標的に結合するように構成され、
前記第1および第2の電子導電分子は異なっていること、を特徴とするセンサ。
【請求項2】
請求項1に記載のセンサにおいて、前記第1の電子導電分子は前記第1の電極に共有結合することを特徴とするセンサ。
【請求項3】
請求項1に記載のセンサにおいて、前記第1のプローブは前記第1の電極に共有結合することを特徴とするセンサ。
【請求項4】
請求項2に記載のセンサにおいて、前記第1のプローブは前記第1の電子導電分子に共有結合することを特徴とするセンサ。
【請求項5】
請求項1に記載のセンサにおいて、前記センサは、第1の流路を更に有し、その第1の流路は、前記第1の電極に接触し、前記目的の標的を含むサンプルが前記第1の流路を流れ、前記目的の標的が前記第1のプローブに結合すると、第1のシグナルを生成するように構成されることを特徴とするセンサ。
【請求項6】
請求項5に記載のセンサにおいて、前記センサは、前記第1のシグナルが検出されるように構成されたプロセッサを更に有することを特徴とするセンサ。
【請求項7】
請求項6に記載のセンサにおいて、前記第1のシグナルの検出は前記サンプルが前記目的の標的を含むことを指し示すことを特徴とするセンサ。
【請求項8】
請求項1に記載のセンサにおいて、前記センサは、更に第2の電極を有し、前記第2の電極は第3の電子導電分子および第2のプローブを含み、前記第2のプローブは前記目的の標的に結合せず、前記第3の電子導電分子は前記第1または第2の電子導電分子と同一であるまたは異なることを特徴とするセンサ。
【請求項9】
請求項8に記載のセンサにおいて、前記第3の電子導電分子は前記第1の電子導電分子と同一であることを特徴とするセンサ。
【請求項10】
請求項8に記載のセンサにおいて、前記第3の電子導電分子は前記第2の電極に共有結合することを特徴とするセンサ。
【請求項11】
請求項8に記載のセンサにおいて、前記第2のプローブは第4の電子導電分子を含み、前記第4の電子導電分子は前記第3の電子導電分子と同一であるまたは異なることを特徴とするセンサ。
【請求項12】
請求項11に記載のセンサにおいて、前記第4の電子導電分子は前記第2の電子導電分子と同一であることを特徴とするセンサ。
【請求項13】
請求項10に記載のセンサにおいて、前記第2のプローブは前記第3の電子導電分子に共有結合することを特徴とするセンサ。
【請求項14】
請求項11に記載のセンサにおいて、前記第3の電子導電分子は前記第2の電極に共有結合し、前記第2のプローブは前記第3の電子導電分子に共有結合することを特徴とするセンサ。
【請求項15】
請求項8に記載のセンサにおいて、前記センサは、第1の流路を更に有し、その第1の流路は、前記第1の電極に接触し、前記目的の標的を含むサンプルが前記第1の流路を流れ、前記標的が前記第1のプローブに結合すると、第1のシグナルを生成するように構成され、かつ、第2の流路を更に有し、その第2の流路は、前記第2の電極に接触し、前記サンプルが前記第2の流路を流れ、第2のシグナルを生成するように構成されることを特徴とするセンサ。
【請求項16】
請求項15に記載のセンサにおいて、前記センサは、前記第1のシグナルおよび前記第2のシグナルが検出されるように構成されたプロセッサを更に有することを特徴とするセンサ。
【請求項17】
請求項16に記載のセンサにおいて、前記目的の標的は、前記第1および第2のシグナルに伴う値を所定の値と比較することによって検出され、前記所定の値より大きな値は、目的の標的が前記サンプル中に存在することを指し示していることを特徴とするセンサ。
【請求項18】
請求項1に記載のセンサにおいて、前記第1および第2の電子導電分子は、芳香族化合物、ピリジン化合物、ポリアセチレンポリマー、チオフェン化合物、アゾール化合物、ポリアニリンポリマー、またはそれらの誘導体から選択される異なる分子同士であることを特徴とするセンサ。
【請求項19】
請求項8に記載のセンサにおいて、前記第3の電子導電分子は、芳香族化合物、ピリジン化合物、ポリアセチレンポリマー、チオフェン化合物、アゾール化合物、ポリアニリンポリマー、またはそれらの誘導体であることを特徴とするセンサ。
【請求項20】
請求項11に記載のセンサにおいて、前記第4の電子導電分子は、芳香族化合物、ピリジン化合物、ポリアセチレンポリマー、チオフェン化合物、アゾール化合物、ポリアニリンポリマー、またはそれらの誘導体であることを特徴とするセンサ。
【請求項21】
請求項1に記載のセンサにおいて、前記第1のプローブは、DNA、RNA、タンパク質、抗体、前記生体分子に結合する能力を有する抗体フラグメント、アプタマー、抗原、またはエピトープであることを特徴とするセンサ。
【請求項22】
請求項8に記載のセンサにおいて、前記第2のプローブは、DNA、RNA、タンパク質、抗体、前記生体分子に結合する能力を有する抗体フラグメント、アプタマー、抗原、または酵素であることを特徴とするセンサ。
【請求項23】
センサと標的を含むサンプルとを接触させる工程を有する、目的の標的を検出するための方法であって、
上記センサは、(i)第1の電子導電分子、および(ii)第2の電子導電分子を含む第1のプローブを含む、第1の電極を有し、前記第1のプローブは前記標的に結合するように構成され、前記第1および第2の電子導電分子は異なり、
前記標的が前記第1のプローブに結合すると、第1のシグナルが生成され、
前記第1のシグナルの検出は、生体分子が前記サンプル中に存在することを指し示していることを特徴とする方法。
【請求項24】
請求項23に記載の方法において、前記方法は、前記サンプルが第1の流路を流れるように、且つ前記第1の電極に接触するように、前記サンプルを第1の流路に導入する工程を更に有し、前記第1のシグナルは前記第1の流路で生成されることを特徴とする方法。
【請求項25】
請求項23に記載の方法において、前記第1の電子導電分子は前記第1の電極に共有結合することを特徴とする方法。
【請求項26】
請求項23に記載の方法において、前記第1のプローブは前記第1の電極に共有結合することを特徴とする方法。
【請求項27】
請求項25に記載の方法において、前記第1のプローブは前記第1の電子導電分子に共有結合することを特徴とする方法。
【請求項28】
請求項24に記載の方法において、前記センサは、前記第1のシグナルが検出されるように構成されたプロセッサを更に有することを特徴とする方法。
【請求項29】
請求項23に記載の方法において、前記センサは第2の電極を有し、前記第2の電極は第3の電子導電分子および第2のプローブを含み、前記第2のプローブは前記標的と結合せず、前記第3の電子導電分子は前記第1または第2の電子導電分子と同一であるまたは異なることを特徴とする方法。
【請求項30】
請求項29に記載の方法において、前記第3の電子導電分子は前記第1の電子導電分子と同一であることを特徴とする方法。
【請求項31】
請求項29に記載の方法において、前記第3の電子導電分子は前記第2の電極に共有結合することを特徴とする方法。
【請求項32】
請求項29に記載の方法において、前記第2のプローブは第4の電子導電分子を含み、前記第4の電子導電分子は前記第3の電子導電分子と同一であるまたは異なることを特徴とする方法。
【請求項33】
請求項32に記載の方法において、前記第4の電子導電分子は前記第2の電子導電分子と同一であることを特徴とする方法。
【請求項34】
請求項31に記載の方法において、前記第2のプローブは前記第3の電子導電分子に共有結合することを特徴とする方法。
【請求項35】
請求項32に記載の方法において、前記第3の電子導電分子は前記第2の電極に共有結合し、前記第2のプローブは前記第3の電子導電分子に共有結合することを特徴とする方法。
【請求項36】
請求項29に記載の方法において、上記センサは、第1の流路を更に有し、その第1の流路は、前記第1の電極に接触し、前記サンプルが前記第1の流路を流れるように構成され、第1のシグナルは前記第1の流路で生成され、かつ、第2の流路を更に有し、その第2の流路は、前記第2の電極に接触し、前記サンプルが前記第2の流路を流れ、第2のシグナルを生成するように構成されることを特徴とする方法。
【請求項37】
請求項36に記載の方法において、前記センサは、前記第1のシグナルおよび第2のシグナルが検出されるように構成されたプロセッサを更に有することを特徴とする方法。
【請求項38】
請求項37に記載の方法において、前記標的は、前記第1および第2のシグナルに伴う値を所定の値と比較することによって検出され、このシグナルの検出は、目的の標的が前記サンプル中に存在することを指し示していることを特徴とする方法。
【請求項39】
請求項23に記載の方法において、前記第1および第2の電子導電分子は、芳香族化合物、ピリジン化合物、ポリアセチレンポリマー、チオフェン化合物、アゾール化合物、ポリアニリンポリマー、またはそれら誘導体から選択される異なる分子同士であることを特徴とする方法。
【請求項40】
請求項29に記載の方法において、前記第3の電子導電分子は、芳香族化合物、ピリジン化合物、ポリアセチレンポリマー、チオフェン化合物、アゾール化合物、ポリアニリンポリマー、またはそれらの誘導体であることを特徴とする方法。
【請求項41】
請求項32に記載の方法において、前記第4の電子導電分子は、芳香族化合物、ピリジン化合物、ポリアセチレンポリマー、チオフェン化合物、アゾール化合物、ポリアニリンポリマー、またはそれらの誘導体であることを特徴とする方法。
【請求項42】
請求項23に記載の方法において、前記第1のプローブは、DNA、RNA、タンパク質、抗体、前記生体分子に結合する能力を有する抗体フラグメント、アプタマー、抗原、またはエピトープであることを特徴とする方法。
【請求項43】
請求項29に記載の方法において、前記第2のプローブは、DNA、RNA、タンパク質、抗体、前記生体分子に結合する能力を有する抗体フラグメント、アプタマー、抗原、またはエピトープであることを特徴とする方法。
【請求項44】
ピリジン化合物、ポリアセチレンポリマー、アゾール化合物、ポリアニリンポリマー、またはそれらの誘導体から選択される電子導電分子に共役するセンサプローブであって、前記プローブは目的の標的に結合するように構成されることを特徴とするセンサプローブ。
【請求項45】
請求項44に記載のセンサプローブにおいて、前記プローブは、電極と第2の共有結合を形成するように構成された前記電子導電分子に共有結合することを特徴とするセンサプローブ。
【請求項46】
請求項44に記載のセンサプローブにおいて、前記プローブは、DNA、RNA、タンパク質、抗体、前記生体分子に結合する能力を有する抗体フラグメント、アプタマー、抗原、またはエピトープであることを特徴とするセンサプローブ。
【請求項47】
請求項44に記載のセンサプローブを含む電極。
【請求項48】
請求項47に記載の電極において、前記プローブは前記電子導電分子に共有結合し、前記電子導電分子は前記電極に共有結合することを特徴とする電極。
【請求項1】
目的の標的を検出するためのセンサであって、
(i)第1の電子導電分子、および(ii)第2の電子導電分子を含む第1のプローブを含む、第1の電極を有し、
前記第1のプローブは溶液中の目的の標的に結合するように構成され、
前記第1および第2の電子導電分子は異なっていること、を特徴とするセンサ。
【請求項2】
請求項1に記載のセンサにおいて、前記第1の電子導電分子は前記第1の電極に共有結合することを特徴とするセンサ。
【請求項3】
請求項1に記載のセンサにおいて、前記第1のプローブは前記第1の電極に共有結合することを特徴とするセンサ。
【請求項4】
請求項2に記載のセンサにおいて、前記第1のプローブは前記第1の電子導電分子に共有結合することを特徴とするセンサ。
【請求項5】
請求項1に記載のセンサにおいて、前記センサは、第1の流路を更に有し、その第1の流路は、前記第1の電極に接触し、前記目的の標的を含むサンプルが前記第1の流路を流れ、前記目的の標的が前記第1のプローブに結合すると、第1のシグナルを生成するように構成されることを特徴とするセンサ。
【請求項6】
請求項5に記載のセンサにおいて、前記センサは、前記第1のシグナルが検出されるように構成されたプロセッサを更に有することを特徴とするセンサ。
【請求項7】
請求項6に記載のセンサにおいて、前記第1のシグナルの検出は前記サンプルが前記目的の標的を含むことを指し示すことを特徴とするセンサ。
【請求項8】
請求項1に記載のセンサにおいて、前記センサは、更に第2の電極を有し、前記第2の電極は第3の電子導電分子および第2のプローブを含み、前記第2のプローブは前記目的の標的に結合せず、前記第3の電子導電分子は前記第1または第2の電子導電分子と同一であるまたは異なることを特徴とするセンサ。
【請求項9】
請求項8に記載のセンサにおいて、前記第3の電子導電分子は前記第1の電子導電分子と同一であることを特徴とするセンサ。
【請求項10】
請求項8に記載のセンサにおいて、前記第3の電子導電分子は前記第2の電極に共有結合することを特徴とするセンサ。
【請求項11】
請求項8に記載のセンサにおいて、前記第2のプローブは第4の電子導電分子を含み、前記第4の電子導電分子は前記第3の電子導電分子と同一であるまたは異なることを特徴とするセンサ。
【請求項12】
請求項11に記載のセンサにおいて、前記第4の電子導電分子は前記第2の電子導電分子と同一であることを特徴とするセンサ。
【請求項13】
請求項10に記載のセンサにおいて、前記第2のプローブは前記第3の電子導電分子に共有結合することを特徴とするセンサ。
【請求項14】
請求項11に記載のセンサにおいて、前記第3の電子導電分子は前記第2の電極に共有結合し、前記第2のプローブは前記第3の電子導電分子に共有結合することを特徴とするセンサ。
【請求項15】
請求項8に記載のセンサにおいて、前記センサは、第1の流路を更に有し、その第1の流路は、前記第1の電極に接触し、前記目的の標的を含むサンプルが前記第1の流路を流れ、前記標的が前記第1のプローブに結合すると、第1のシグナルを生成するように構成され、かつ、第2の流路を更に有し、その第2の流路は、前記第2の電極に接触し、前記サンプルが前記第2の流路を流れ、第2のシグナルを生成するように構成されることを特徴とするセンサ。
【請求項16】
請求項15に記載のセンサにおいて、前記センサは、前記第1のシグナルおよび前記第2のシグナルが検出されるように構成されたプロセッサを更に有することを特徴とするセンサ。
【請求項17】
請求項16に記載のセンサにおいて、前記目的の標的は、前記第1および第2のシグナルに伴う値を所定の値と比較することによって検出され、前記所定の値より大きな値は、目的の標的が前記サンプル中に存在することを指し示していることを特徴とするセンサ。
【請求項18】
請求項1に記載のセンサにおいて、前記第1および第2の電子導電分子は、芳香族化合物、ピリジン化合物、ポリアセチレンポリマー、チオフェン化合物、アゾール化合物、ポリアニリンポリマー、またはそれらの誘導体から選択される異なる分子同士であることを特徴とするセンサ。
【請求項19】
請求項8に記載のセンサにおいて、前記第3の電子導電分子は、芳香族化合物、ピリジン化合物、ポリアセチレンポリマー、チオフェン化合物、アゾール化合物、ポリアニリンポリマー、またはそれらの誘導体であることを特徴とするセンサ。
【請求項20】
請求項11に記載のセンサにおいて、前記第4の電子導電分子は、芳香族化合物、ピリジン化合物、ポリアセチレンポリマー、チオフェン化合物、アゾール化合物、ポリアニリンポリマー、またはそれらの誘導体であることを特徴とするセンサ。
【請求項21】
請求項1に記載のセンサにおいて、前記第1のプローブは、DNA、RNA、タンパク質、抗体、前記生体分子に結合する能力を有する抗体フラグメント、アプタマー、抗原、またはエピトープであることを特徴とするセンサ。
【請求項22】
請求項8に記載のセンサにおいて、前記第2のプローブは、DNA、RNA、タンパク質、抗体、前記生体分子に結合する能力を有する抗体フラグメント、アプタマー、抗原、または酵素であることを特徴とするセンサ。
【請求項23】
センサと標的を含むサンプルとを接触させる工程を有する、目的の標的を検出するための方法であって、
上記センサは、(i)第1の電子導電分子、および(ii)第2の電子導電分子を含む第1のプローブを含む、第1の電極を有し、前記第1のプローブは前記標的に結合するように構成され、前記第1および第2の電子導電分子は異なり、
前記標的が前記第1のプローブに結合すると、第1のシグナルが生成され、
前記第1のシグナルの検出は、生体分子が前記サンプル中に存在することを指し示していることを特徴とする方法。
【請求項24】
請求項23に記載の方法において、前記方法は、前記サンプルが第1の流路を流れるように、且つ前記第1の電極に接触するように、前記サンプルを第1の流路に導入する工程を更に有し、前記第1のシグナルは前記第1の流路で生成されることを特徴とする方法。
【請求項25】
請求項23に記載の方法において、前記第1の電子導電分子は前記第1の電極に共有結合することを特徴とする方法。
【請求項26】
請求項23に記載の方法において、前記第1のプローブは前記第1の電極に共有結合することを特徴とする方法。
【請求項27】
請求項25に記載の方法において、前記第1のプローブは前記第1の電子導電分子に共有結合することを特徴とする方法。
【請求項28】
請求項24に記載の方法において、前記センサは、前記第1のシグナルが検出されるように構成されたプロセッサを更に有することを特徴とする方法。
【請求項29】
請求項23に記載の方法において、前記センサは第2の電極を有し、前記第2の電極は第3の電子導電分子および第2のプローブを含み、前記第2のプローブは前記標的と結合せず、前記第3の電子導電分子は前記第1または第2の電子導電分子と同一であるまたは異なることを特徴とする方法。
【請求項30】
請求項29に記載の方法において、前記第3の電子導電分子は前記第1の電子導電分子と同一であることを特徴とする方法。
【請求項31】
請求項29に記載の方法において、前記第3の電子導電分子は前記第2の電極に共有結合することを特徴とする方法。
【請求項32】
請求項29に記載の方法において、前記第2のプローブは第4の電子導電分子を含み、前記第4の電子導電分子は前記第3の電子導電分子と同一であるまたは異なることを特徴とする方法。
【請求項33】
請求項32に記載の方法において、前記第4の電子導電分子は前記第2の電子導電分子と同一であることを特徴とする方法。
【請求項34】
請求項31に記載の方法において、前記第2のプローブは前記第3の電子導電分子に共有結合することを特徴とする方法。
【請求項35】
請求項32に記載の方法において、前記第3の電子導電分子は前記第2の電極に共有結合し、前記第2のプローブは前記第3の電子導電分子に共有結合することを特徴とする方法。
【請求項36】
請求項29に記載の方法において、上記センサは、第1の流路を更に有し、その第1の流路は、前記第1の電極に接触し、前記サンプルが前記第1の流路を流れるように構成され、第1のシグナルは前記第1の流路で生成され、かつ、第2の流路を更に有し、その第2の流路は、前記第2の電極に接触し、前記サンプルが前記第2の流路を流れ、第2のシグナルを生成するように構成されることを特徴とする方法。
【請求項37】
請求項36に記載の方法において、前記センサは、前記第1のシグナルおよび第2のシグナルが検出されるように構成されたプロセッサを更に有することを特徴とする方法。
【請求項38】
請求項37に記載の方法において、前記標的は、前記第1および第2のシグナルに伴う値を所定の値と比較することによって検出され、このシグナルの検出は、目的の標的が前記サンプル中に存在することを指し示していることを特徴とする方法。
【請求項39】
請求項23に記載の方法において、前記第1および第2の電子導電分子は、芳香族化合物、ピリジン化合物、ポリアセチレンポリマー、チオフェン化合物、アゾール化合物、ポリアニリンポリマー、またはそれら誘導体から選択される異なる分子同士であることを特徴とする方法。
【請求項40】
請求項29に記載の方法において、前記第3の電子導電分子は、芳香族化合物、ピリジン化合物、ポリアセチレンポリマー、チオフェン化合物、アゾール化合物、ポリアニリンポリマー、またはそれらの誘導体であることを特徴とする方法。
【請求項41】
請求項32に記載の方法において、前記第4の電子導電分子は、芳香族化合物、ピリジン化合物、ポリアセチレンポリマー、チオフェン化合物、アゾール化合物、ポリアニリンポリマー、またはそれらの誘導体であることを特徴とする方法。
【請求項42】
請求項23に記載の方法において、前記第1のプローブは、DNA、RNA、タンパク質、抗体、前記生体分子に結合する能力を有する抗体フラグメント、アプタマー、抗原、またはエピトープであることを特徴とする方法。
【請求項43】
請求項29に記載の方法において、前記第2のプローブは、DNA、RNA、タンパク質、抗体、前記生体分子に結合する能力を有する抗体フラグメント、アプタマー、抗原、またはエピトープであることを特徴とする方法。
【請求項44】
ピリジン化合物、ポリアセチレンポリマー、アゾール化合物、ポリアニリンポリマー、またはそれらの誘導体から選択される電子導電分子に共役するセンサプローブであって、前記プローブは目的の標的に結合するように構成されることを特徴とするセンサプローブ。
【請求項45】
請求項44に記載のセンサプローブにおいて、前記プローブは、電極と第2の共有結合を形成するように構成された前記電子導電分子に共有結合することを特徴とするセンサプローブ。
【請求項46】
請求項44に記載のセンサプローブにおいて、前記プローブは、DNA、RNA、タンパク質、抗体、前記生体分子に結合する能力を有する抗体フラグメント、アプタマー、抗原、またはエピトープであることを特徴とするセンサプローブ。
【請求項47】
請求項44に記載のセンサプローブを含む電極。
【請求項48】
請求項47に記載の電極において、前記プローブは前記電子導電分子に共有結合し、前記電子導電分子は前記電極に共有結合することを特徴とする電極。
【図1】


【図2】


【図3A】


【図3B】


【図4A】


【図4C】


【図4D】


【図3C】


【図3D】


【図3E】


【図3F】


【図4B】




【図2】


【図3A】


【図3B】


【図4A】


【図4C】


【図4D】


【図3C】


【図3D】


【図3E】


【図3F】


【図4B】


【公開番号】特開2013−3140(P2013−3140A)
【公開日】平成25年1月7日(2013.1.7)
【国際特許分類】
【出願番号】特願2012−107976(P2012−107976)
【出願日】平成24年5月9日(2012.5.9)
【出願人】(312007179)國立台灣大學 (1)
【氏名又は名称原語表記】National Taiwan University
【住所又は居所原語表記】No.1,Sec.4,Roosevelt Road,Taipei 10617,Taiwan R.O.C.
【Fターム(参考)】
【公開日】平成25年1月7日(2013.1.7)
【国際特許分類】
【出願日】平成24年5月9日(2012.5.9)
【出願人】(312007179)國立台灣大學 (1)
【氏名又は名称原語表記】National Taiwan University
【住所又は居所原語表記】No.1,Sec.4,Roosevelt Road,Taipei 10617,Taiwan R.O.C.
【Fターム(参考)】
[ Back to top ]

