バイオチップのための解析ツールとしての原子間力顕微鏡の使用
本願は、流体媒体中における標的リガンドの存在を検出する方法であって、(i)流体媒体を、その表面上にデンドロンのアレイを含む固体基板と接触させる工程であって、デンドロンの各々が、中心原子、任意にリンカーを介して、中心原子と結合しているプローブ、及び中心原子と結合しているベース部分であって固体支持体の表面と結合している複数の末端を有するベース部分を含む、接触させる工程と、(ii)結合したリガンドと原子間力顕微鏡(「AFM」)の探針につなぎ留められた検出分子との間の結合力を測定することによりプローブ−標的リガンド複合体の存在を決定する工程であって、検出分子はリガンドに対する親和性を有し、AFMによるプローブ−標的リガンド複合体と検出分子との間の力の増大の測定がプローブ−標的リガンド複合体の存在を示す、決定する工程とを含む、流体媒体中における標的リガンドの存在を検出する方法を開示する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、包括的に、原子間力顕微鏡(AFM)と、チップ上でこれを使用する、装置、及び生体分子間の分子間相互作用を測定する方法とに関する。本発明は、チップ上での生体分子間の相互作用力の測定における、デンドロンでコーティングしたバイオ−AFM探針の使用に関する。
【0002】
[関連出願の相互参照]
本願は、2007年6月14日付けで出願された米国仮特許出願第60/944056号明細書に係る出願を基礎とする優先権を主張し、該出願の内容はその全体が参照により本明細書に援用される。
【背景技術】
【0003】
生物分析科学及び生体工学における最近の進歩は、DNAチップ非特許文献1,非特許文献2、小型バイオセンサー非特許文献3,非特許文献4及び微小流体素子(例えば微小電気機械システム又はバイオMEMS)非特許文献5−7の発達をもたらした。特に、このDNAマイクロアレイ技術は、遺伝子解析を大幅に加速させるので、重要性が増大しているツールである。DNAマイクロアレイ技術は、遺伝子発現と、変異検出と、単一ヌクレオチド多型解析と、他の多くの用途とのモニタリングに使用されてきた非特許文献8。しかし従来のマイクロアレイは、柔軟性、速度、費用及び感度に限界がある。加えて、生体分子は直接的な高感度検出に有用な固有の特性を欠くので、ほとんどの生化学的アッセイは、標識の二次的検出を必要とする。生物学的診断において最も一般的に使用される標識は、有機蛍光色素である。しかし、それでもなお、有機色素には多くの用途におけるその使用を妨げる光退色及び離散励起バンド等の制約がある非特許文献9。
【0004】
単一分子の受容体/リガンド対の解離速度論を研究するための、また単一の生体高分子の機械的特性を探索するための、超高感度の力の測定方法の能力を実証する研究の数が増大している非特許文献10−13。かかる研究は、生物学的プロセスの領域における(例えば、細胞接着における、タンパク質アンフォールディングにおける、及びDNA/RNAオリゴヌクレオチド二本鎖の解離に対する)力の役割に対して多くの見識をもたらした非特許文献14−16。しかしこれらの発達の多くは、表面の機能性及び/又は均一性が高度に規定された表面及び機器を作り出すことがまだ普通のことでないという点において、利用可能な生体分子表面結合方法により現在妨げられている。本発明者らは、デンドロンアレイの形成に基づき、かかる問題に対処する新しいアプローチを報告した。相補的DNAオリゴヌクレオチドで官能化したデンドロン表面の間の力の測定を通じて、本発明者らは、このアプローチにより修飾した表面の幾つかの独特な特性を観察した非特許文献17。
【0005】
その繰り返し単位が1つのコアから直接伸びている錐形分子であるデンドロンは、均一なサイズ及び分子量と、十分に規定された構造とを有する高分枝ポリマーである。表面上での効果的な自己集合のために、そのサイズを正確に制御すること、及びその反応性末端を利用することが可能であるので、デンドロンは、その表面の特徴を分子レベルで精密に調整した新しい材料を作り出すための理想的な構成要素であると考えられる非特許文献18。錐形によりもたらされるメソ空間形成(mesospacing)は、表面に固定化した捕捉プローブDNAの各々に、入ってきた標的DNAとの結合のための十分な空間を提供し、溶液(100:1)中で観察されたのと同様の動力学及び選択性の増強をもたらし、DNAマイクロアレイの有効性を顕著に向上させることが見出された。さらに、観察された高いハイブリダイゼーション量は、隣接するDNAプローブとの間に十分な空間形成がなされたDNAプローブが、ハイブリダイゼーション時に隣接するプローブ又は標的によって最小限度の立体障害しか被っていないことを実証する。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】(1) Fodor, S. P. A. Science 1991, 251, 161-113.
【非特許文献2】(2) Schena, M.; Shalon, D.; Davis, R. W.; Brown, P. O. Science 1995, 270, 467-470.
【非特許文献3】(3) Clark, H. A.; Hoyer, M.; Philbert, M. A.; Kopelman, R. Anal. Chem. 1999, 71, 4831-4836.
【非特許文献4】(4) Dickinson, T. A.; Michael, K. L.; Kauer, J. S.; Walt, D. R. Anal. Chem. 1999, 71, 2192-2198.
【非特許文献5】(5) Harrison, D. J. Science 1993, 261, 895-897.
【非特許文献6】(6) Ramsey, J. M.; Jacobson, S. C; Knapp, M. R. Nat. Med. 1995, 1, 1093-1096.
【非特許文献7】(7) Woolley, A. T.; Mathies, R. A. Proc. Natl. Acad. Sci. USA 1994, 91, 11348- 11352.
【非特許文献8】(8) Christof M. Niemeyer, D. B. Angewandte Chemie International Edition 1999, 38, 2865-2869.
【非特許文献9】(9) Gerion, D.; Chen, F.; Kannan, B.; Fu, A.; Parak, W. J.; Chen, D. J.; Majumdar, A.; Alivisatos, A. P. Anal. Chem. 2003, 75, 4766-4772.
【非特許文献10】(10) Allen, S. R.-S., S. M.; Harris, H.; Davies, M. C; O'Shea, P. Biochemical Society Transactions 2003, 31, 1052-1057. .
【非特許文献11】(11) Clausen-Schaumann, H.; Seitz, M.; Krautbauer, R.; Gaub, H. E. Current Opinion in Chemical Biology 2000, 4, 524-530.
【非特許文献12】(12) Kellermayer, M. S. AA .; Smith, S. B.; Granzier, H. L.; Bustamante, C. Science1997, 276, 1112-1116.
【非特許文献13】(13) Hummer, G.; Szabo, A. Acc. Chem. Res. 2005, 38, 504-513.
【非特許文献14】(14) Bayas, M. V.; Leung, A.; Evans, E.; Leckband, D. Biophys. J. 2006, 90, 1385- 1395.
【非特許文献15】(15) Evans, E.; Leung, A.; Heinrich, V.; Zhu, C. Proceedings of the National Academy of Sciences 2004, 101, 11281-11286.
【非特許文献16】(16) Benoit, M.; Gabriel, D.; Gerisch, G.; Gaub, H. E. Nat Cell Biol 2000, 2, 313-317.
【非特許文献17】(17) Jung, Y. J.; Hong, B. J.; Zhang, W.; Tendler, S. J. B.; Williams, P. M.; Allen, S.; Park, J. W. J. Am. Chem. Soc. 2007, 129, 9349-9355.
【非特許文献18】(18) Hong, B. J.; Oh, S. J.; Youn, T. O.; Kwon, S. H.; Park, J. W. Langmuir 2005, 21, 4257-4261.
【非特許文献19】(19) Schweitzer, B.; Kingsmore, S. Current Opinion in Biotechnology 2001, 12, 21-27 '.
【非特許文献20】(20) Zhao, X.; Tapec-Dytioco, R.; Tan, W. J. Am. Chem. Soc. 2003, 125, 11474-11475.
【非特許文献21】(21) Nygaard, V.; Holden, M.; Loland, A.; Langaas, M.; Myklebost, O.; Hovig, E. BMC Genomics 2005, 6.
【非特許文献22】(22) Eastman, P. S.; Ruan, W.; Doctolero, M.; Nuttall, R.; deFeo, G.; Park, J. S.; Chu, J. S. F.; Cooke, P.; Gray, J. W.; Li, S.; Chen, F. F. Nano Lett. 2006, 6, 1059-1064.
【発明の概要】
【0007】
本願では、出願人は、遺伝子型決定及び遺伝子発現を研究することができる、単純且つ標識不要だが高感度の、力基準の原子間力顕微鏡を使用する本発明のアプローチを説明する。この仕事において本発明者らは、力基準のAFMにより、デンドロンで修飾した表面上のプローブDNAとハイブリダイズした標的DNAと、AFM探針上の検出DNAとの間の力を測定することにより、遺伝子型決定及び遺伝子発現プロファイリングを試験した。デンドロンで修飾した表面、及びAFM探針と組み合わせた本検出方法により、その感度は、蛍光標識法を必要とする従来のDNAマイクロアレイの感度よりも優れていた。
【0008】
本発明の一態様では、標識するプロセスを有しない、遺伝子型決定及び遺伝子発現プロファイリングのための解析ツールとしての力基準の原子間力顕微鏡を対象とする。本発明は、ハイブリダイゼーション/結合の事象に関して十分に測定可能な力をもたらす、DNAを固定化するためのナノスケールで操作したデンドロン表面にも関する。本発明の方法は、高密度マイクロアレイシステムで実現可能な105という数字よりも良好であり、且つ遺伝子型決定研究のための定量PCR(qPCR)に対して通常観察される103〜104のレベルに接近するレベルである、≦103の標的DNAを標識することなく検出可能な感度を示す。バイオAFM測定の感度は、遺伝子発現プロファイリングのための従来のマイクロアレイに対して105倍増大した。デンドロンで修飾した表面の側方空間形成は、高度に予測可能な大きさであり得る。力基準のAFMは、他のバイオチップシステムと容易に適合させることが可能である。
【0009】
別の態様では、本発明は、流体媒体中における標的リガンドの存在を検出する方法であって、(i)流体媒体を固体基板と接触させることであって、固体基板がその表面上にデンドロンのアレイを含み、デンドロンの各々が、中心原子、任意にリンカーを介して、中心原子と結合しているプローブ、及び中心原子と結合しているベース部分であって、固体支持体の表面と結合している複数の末端を有するベース部分を含む、並びに(ii)結合したリガンドとリガンドに対する親和性を有する検出分子との間の結合力を測定することによりプローブ−標的リガンド複合体の存在を決定することであって、検出分子が原子間力顕微鏡(「AFM」)の探針の表面につなぎ留められており、プローブ−標的リガンド複合体と検出分子との間の力の増大の測定が該プローブ−標的リガンド複合体の存在を示す、流体媒体中における標的リガンドの存在を検出する方法を対象とする。
【0010】
好ましい一実施形態では、プローブ−標的リガンド複合体は、オリゴヌクレオチド−相補的核酸複合体である。プローブ−標的リガンド複合体は、低濃度の標的リガンドの存在下で検出されてもよく、該リガンドは少なくとも約1aM、又は約1aM〜約1000aMの濃度である。上記方法は、オリゴヌクレオチド−相補的核酸複合体における単一ヌクレオチド多型を識別することができる。
【0011】
検出分子は、検出核酸であり得る。検出分子は、RNAのポリ−dAセクションと十分に相補的なポリ−dTオリゴマーを含み得る。固体基板は、無孔性の固体支持体であり得る。固体基板は、シリカを含むがこれに限定されない、平面的な無孔性の固体支持体であり得る。原子間力顕微鏡(「AFM」)の探針は、デンドロンでコーティングされていてもよい。別の実施形態では、標的リガンドは、標識されていなくてもよい。本方法は、架橋結合したプローブ−リガンド複合体をさらに含み得る。又は、プローブ−リガンド複合体は、親和性分子と共有結合していてもよく、且つ検出分子は、親和性分子と特異的に結合する。親和性分子は、抗原又は抗体であり得る。検出分子は、二本鎖DNAと選択的に結合するタンパク質であり得る。又は、プローブ−リガンド複合体は、検出分子と三重らせん構造を形成し得る。検出分子は、DNA挿入剤であり得る。検出分子は、二本鎖DNAのミスマッチセクションと選択的に結合するタンパク質でもあり得る。また、アレイは、チップ上で表示され得る。
【0012】
本発明は、標的核酸を検出するシステムであって、(i)プローブ分子を固定化したチップと、(ii)その上に検出分子をつなぎ留めた探針を含む原子間力顕微鏡(「AFM」)とを含む、標的核酸を検出するシステムも対象とする。該チップは、その上にプローブ分子をつなぎ留めたデンドロンでコーティングされていてもよい。また、AFMの探針は、その上に検出分子を固定化したデンドロンでコーティングされていてもよい。
【0013】
本発明のこれらの、及び他の目的は、以下の本発明の説明と、ここで添付した参照図面と、ここで添付した特許請求の範囲とにより、より十分に理解されるであろう。
【0014】
本発明は、以下に提供する詳細な説明と、添付した図面とからより十分に理解されるであろう。この詳細な説明と図面とは、例示として与えられているにすぎず、したがって本発明を限定するものではない。
【図面の簡単な説明】
【0015】
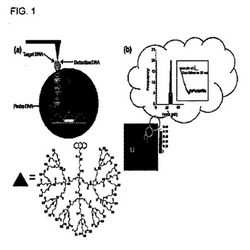
【図1】a:本研究の範囲内で説明する測定のために採用した実験設定の概要を示す図である。標的DNAを、デンドロンで修飾した表面上に固定化したプローブDNAとハイブリダイズさせた後、検出DNAをつなぎ留めているAFM探針と、基板とを離接させることにより、力の測定値を記録した。 b:典型的な測定(挿入図:出力の減少(retract traces)(青色の曲線))、及び相補的な15merの配列に対して記録した接着力の分布を示す図である。
【図2】a:成熟真核生物mRNAの構造を示す図である。十分にプロセシングされたmRNAは、5’キャップ、5’UTR、コード領域、3’UTR及びポリAテールを含む。 b:デンドロン表面上に固定化した64種類のプローブDNAと、ユニバーサルヒト基準全RNA(UHRR)から調製したcDNAとの間のハイブリダイゼーション後のDNAマイクロアレイ実験の蛍光画像を示す図である。白い矢印は、プローブ番号62のDNAを示す。 c:0.62fg/μlのUHRRとのハイブリダイゼーション後の力のマッピング画像を示す図である。
【図3】a:蛍光標識を使用するDNAチップアッセイを示す図である。 b:バイオ−AFMを使用するDNAチップアッセイを示す図である。
【図4】a:蛍光標識を使用するDNAチップアッセイを示す図である(標的DNA 1pM)。 b:蛍光標識を使用するDNAチップアッセイを示す図である(標的DNA 100fM)。
【図5】a:バイオ−AFMを使用する標的DNAと検出DNAとの間の力の地図を示す図である(標的DNA 1pM)。 b:バイオ−AFMを使用する標的DNAと検出DNAとの間の力の地図を示す図である(標的DNA 10fM)。 c:バイオ−AFMを使用する標的DNAと検出DNAとの間の力の地図を示す図である(標的DNA 100aM)。 d:バイオ−AFMを使用する標的DNAと検出DNAとの間の力の地図を示す図である(標的DNA 1aM)。
【図6】標的DNAと検出DNAとの間の力−距離測定結果を示す図である。
【図7】標的DNA濃度と検出感度との間の直線関係を示す図である。
【図8】バイオ−AFMを使用する非相補的な標的DNAと検出DNAとの間の力の地図を示す図である。
【図9】架橋結合したプローブDNA及び標的DNAのDNAチップアッセイを示す図である。
【図10】ストレプトアビジン−ビオチン結合のDNAチップアッセイを示す図である。
【図11】抗原−抗体結合のDNAチップアッセイを示す図である。
【図12】タンパク質−DNA結合のDNAチップアッセイを示す図である。
【図13】三本鎖DNA構造のDNAチップアッセイを示す図である。
【図14】挿入したDNAのDNAチップアッセイを示す図である。
【図15】MutSタンパク質を使用する一塩基変異のDNAチップアッセイを示す図である。
【図16】DNA間の力の測定を使用するデンドロン表面のDNAチップアッセイを示す図である。
【図17】バイオ−AFMを使用する遺伝子発現決定を示す図である。
【発明を実施するための形態】
【0016】
本願において「a」及び「an」は、単数及び複数の両方の対象を表すために使用される。
【0017】
本明細書で用いられるところの「アプタマー」は、一本鎖の、部分的に一本鎖の、部分的に二本鎖の、又は二本鎖のヌクレオチド配列、有利には複製可能なヌクレオチド配列であって、ワトソン−クリック塩基対形成又は三本鎖形成以外のメカニズムにより、選択された非オリゴヌクレオチド分子又は分子群を特異的に認識することができるヌクレオチド配列を意味する。
【0018】
本明細書で用いられるところの「親和性分子」は、プローブ/標的リガンド複合体と結合している分子を表す。親和性分子は、プローブ、標的リガンド又は両方と結合することができ、このプローブ、標的リガンド又は両方は、プローブ/標的リガンド複合体の存在を検出するために、後に検出分子により検出される。親和性分子は、いずれかのタイプの生体分子であり得る。かかる親和性分子の例は抗原であり、これは上記複合体と結合し、原子間力顕微鏡の探針の表面に取り付けられた検出抗体により検出される。別の例は、ストレプトアビジンと結合したプローブ/標的リガンド複合体を含む。原子間力顕微鏡の探針の表面につなぎ留められた「検出ビオチン」は、間接的にプローブ/リガンド複合体の存在を示すストレプトアビジンの存在を検出するために使用される。
【0019】
本明細書で用いられるところの「アレイ」及び「ライブラリ」は、本明細書では交換可能な用語として使用され、無作為又は無作為でない、分子、材料、表面、構造的形状、表面特徴、又は任意に且つ非限定的に、様々な化学的部分(chemical entities)、モノマー、ポリマー、構造、前駆体、生成物、修正物(modifications)、誘導体、物質、立体構造、形状若しくは特徴の、混合物、収集物又は組合せ(assortment)を表す。「アレイ」又は「固体支持体上の領域のアレイ」は、固体支持体の表面に形成される、各々が有限の面積を有する好ましくは分離した領域の、線形アレイ又は二次元アレイを表す。
【0020】
本明細書で用いられるところの「アレイライブラリ(arrayed library)」は、固体基板上のマイクロタイター(マルチウェル)ディッシュ又はプレートにおける二次元アレイに設置される個々のプローブ分子を表す。プレートの同一性と、そのプレート上のクローンの位置(行及び列)とが重要である。クローンのアレイライブラリは、特定の遺伝子又は目的の遺伝子領域についてのスクリーニング、及び物理地図の作成、遺伝子型決定、SNPの同定、遺伝子発現プロファイリング等を含む、多くの用途のために使用され得る。
【0021】
本明細書で用いられるところの「二官能性」、「三官能性」及び「多官能性」は、合成ポリマー又は多価ホモポリマー性若しくはヘテロポリマー性ハイブリッド構造に関して使用される場合には、2つ、3つ若しくは複数の特異的認識要素、規定された配列セグメント、若しくは結合部位であり得るか、又はそれらを含む場合のように、二価、三価又は多価を意味する。
【0022】
本明細書で用いられるところの「バイオチップ」又は「チップ」は、より高いスループット及び速度を実現するために、多くの試験を同時に行うことを可能にする、固体基板上に配置した小型試験部位の収集物(マイクロアレイ又はナノアレイ)である。バイオチップは、伝統的に大きな検知ツールをさらに小さい空間に詰め込むために使用される。これらのチップは、本質的に、何百又は何千もの生化学反応を同時に行うことができる小型の実験室である。バイオチップは、研究者が、疾患診断からバイオテロ剤の検出までの様々な目的のために多数の生物学的分析対象を迅速にスクリーニングすることを可能にする。実際の検知用構成部分(すなわち「チップ」)は、分析システム全体のほんの一部分である。実際の検知事象(DNA結合、酸化/還元等)をコンピュータが理解可能な形式(力、電圧、光強度、質量等の測定値)に翻訳するために、変換が行われる必要があり、それによりその後、付加的な分析とヒトが読むことができる最終的な出力をもたらすための処理とが可能となる。チップは、典型的には、集積回路を製作するために伝統的に使用されるマイクロリソグラフィー法を使用して製造される。
【0023】
本明細書で用いられるところの「生体模倣(biomimetic)」は、生物学的な分子、分子群、構造を模倣する分子、基、多分子構造又は方法を意味する。
【0024】
本明細書で用いられるところの、基板上に固定化したプローブライブラリに関して使用される「cDNAライブラリ」は、標的リガンドに特異的であり得るプローブ分子から構成されるライブラリを表す。
【0025】
本明細書で用いられるところの「樹枝状分子」は、コアまで又はコアから分枝した層の連続付加又は段階付加(generationaladdition)により形成される規則的な樹枝状分枝を示す分子である。
【0026】
「デンドロン」という用語は、コアまで又はコアから分枝した層の連続付加又は段階付加により形成される規則的な樹枝状分枝を示すポリマーを表す。樹枝状ポリマーという用語は、コアと、少なくとも1つの内部分枝層と、表面分枝層とを特徴とする「デンドリマー」を包含する(例えば、Petar et al. Pages 641-645 In Chem. in Britain、(August 1994)を参照されたい)。「デンドロン」は、焦点又は中心原子から分枝が出ているデンドリマーの一種であり、直接的に、又は連結部分を介してコアに連結されており、又は連結されることがあり、デンドリマーを形成する。多くのデンドリマーは、共通のコアに連結された2つ以上のデンドロンを含む。
【0027】
デンドロンは、対称的及び非対称的な分枝デンドリマー、カスケード分子、アルボロール(arborol)等を含むが、これらに限定されない。幾つかの実施形態では、分枝アームは、長さが等しい。しかし、非対称的なデンドリマーも使用され得ることも意図される。
【0028】
さらに、分枝層の規則的な連続付加により形成されるのではない場合であっても、高分枝ポリマー、例えば高分枝ポリオールは、分枝パターンがデンドリマーの分枝パターンに近い程度の規則性を示す樹枝状ポリマーと均等であり得ることが理解される。
【0029】
本明細書で用いられるところの、「検出DNA」、「検出リガンド」、「検出オリゴマー」等の「検出分子」は、プローブ/標的複合体における結合力を決定するために使用されるAFMの探針と結合している分子を表す。
【0030】
本明細書で用いられるところの、巨大分子又はデンドロン構造を説明するために使用される「高分枝」又は「分枝」は、基板と共有結合又はイオン結合することができる複数の末端を有する複数のポリマーを表すことを意味する。一実施形態では、分枝構造又は高分枝構造を含む巨大分子は、「予め作製され(pre-made)」、次に基板と結合する。したがって、本発明の巨大分子は、米国特許第5,624,711号明細書(Sundberg et al.)に開示される架橋結合法によるポリマーを除く。
【0031】
本明細書で用いられるところの「固定化した」は、不溶化したこと、又は不溶性の、部分的に不溶性の、コロイド性の、粒子性の、分散した、懸濁した及び/又は脱水した物質、若しくは固体支持体を含む若しくは固体支持体と結合している分子若しくは固相を含むこと、これと結合していること若しくはこれと操作可能に関連することを意味する。
【0032】
本明細書で用いられるところの「リンカー分子」及び「リンカー」は、分枝/直鎖ポリマー等の大きさを制御した巨大分子の分枝部分を保護基又はリガンドに連結する分子に関して使用され得る。リンカーは、例えばスペーサ分子、例えばリガンドをデンドロンと結合することができる選択された分子を含み得るが、これらに限定されない。
【0033】
本明細書で用いられるところの、標的リガンドが検出可能であるように必要とされる「低濃度」の標的リガンドは、本発明の標的リガンド検出方法の強力な感度を示すために、本明細書において使用される。この標的リガンドの検出可能な量の濃度のかかる下限は、1aM〜10000aM、1aM〜1000aM、1aM〜100aM、又は1aM〜10aMの濃度を含み得る。
【0034】
本明細書で用いられるところの「低密度」は、1nm2当たり約0.005〜約0.5のプローブ、好ましくは1nm2当たり約0.01〜約0.2のプローブ、より好ましくは1nm2当たり約0.01〜約0.1のプローブ、及び最も好ましくは1nm2当たり約0.05のプローブを表す。
【0035】
本明細書で用いられるところの「マイクロアレイ」は、分離した領域の密度が少なくとも約100/cm2、好ましくは少なくとも約1000/cm2である、領域のアレイを表す。マイクロアレイにおける領域は、例えば約10μm〜250μmの範囲の直径のような典型的な寸法を有し、アレイ中においておよそ同じ距離で他の領域と分離され得る。マイクロアレイは、転写の発現、又は一連の細胞における発現した遺伝子のプロファイル、又は遺伝子中における変異の検出を試験するために採用することができる、選択された一連のプローブ分子を含み得る。
【0036】
本明細書で用いられるところの「ナノアレイ」は、分離した領域の密度が少なくとも約1000/mm2、好ましくは少なくとも約100000/mm2である、領域のアレイを表す。ナノアレイにおける領域は、例えば約10nm〜1000nmの範囲の直径のような典型的な寸法を有し、アレイ中においておよそ同じ距離で他の領域と分離され得る。ナノアレイは、転写の発現、又は一連の細胞における発現した遺伝子のプロファイル、又は遺伝子中における変異の検出を試験するために採用することができる、選択された一連のプローブ分子を含み得る。
【0037】
本明細書で用いられるところの「分子模倣体(molecular mimics)」及び「模倣体(mimetics)」は、例えば天然分子、生物学的分子又は選択性分子のような別の分子又は分子群の構造又は機能と同等又は類似の構造又は機能を有するように設計、選択、製造、修飾又は操作された(engineered)天然又は合成のヌクレオチド分子又は非ヌクレオチド分子又は分子群である。分子模倣体は、天然分子、合成分子、選択性分子又は生物学的分子の置換形態(replacements)、代替形態、改良形態(upgrades)、改善形態(improvements)、構造的類似体又は機能的類似体として機能することができる分子及び多分子構造を含む。
【0038】
本明細書で用いられるところの「ヌクレオチド類似体」は、核酸合成及び加工、好ましくは酵素的及び化学的な合成及び加工において天然の塩基の代わりに使用することができる分子、特に塩基対形成が可能な修飾ヌクレオチドと、任意にアデニン、グアニン、シトシン、チミジン、ウラシル又は微量塩基を含まない合成塩基とを表す。この用語は、修飾プリン及びピリミジンと、微量塩基と、変換可能なヌクレオシドと、プリン及びピリミジンの構造的類似体と、標識、誘導体化及び修飾したヌクレオシド及びヌクレオチドと、複合体形成したヌクレオシド及びヌクレオチドと、配列修飾剤と、末端修飾剤と、スペーサ修飾剤と、骨格を修飾したヌクレオチドとを含むがこれらに限定されず、該骨格を修飾したヌクレオチドは、リボース修飾ヌクレオチドと、ホスホロアミデートと、ホスホロチオエートと、ホスホンアミダイト(phosphonamidites)と、メチルホスホネートと、メチルホスホラミダイトと、メチルホスホンアミダイト(methylphosphonamidites)と、5’−β−シアノエチルホスホラミダイトと、メチレンホスホネートと、ホスホロジチオエートと、ペプチド核酸と、アキラル及び中性ヌクレオチド間結合と、ポリエチレングリコール、芳香族ポリアミド及び脂質等の非ヌクレオチド架橋とを含むが、これらに限定されない。
【0039】
本明細書で用いられるところの「ポリマー」又は「分枝ポリマー/直鎖ポリマー」は、分枝部分が基板と結合し直鎖部分がリガンド、プローブ又は保護基と結合するように、分子の1つの端に分枝構造を、及び他の端に直鎖部分を有する分子を表す。
【0040】
本明細書で用いられるところの「ポリペプチド」、「ペプチド」、及び「タンパク質」は、アミノ酸残基のポリマーを表すために、本明細書では交換可能な用語として使用される。この用語は、1つ又は複数のアミノ酸残基が対応天然アミノ酸の人工的な化学的類似体であるアミノ酸ポリマーと、天然アミノ酸ポリマーとに適用される。この用語は、ポリペプチドを構成するアミノ酸を連結する伝統的なペプチド結合についての変異体も含み得る。
【0041】
本明細書で用いられるところの「保護基」は、分子上の反応基(例えばヒドロキシル又はアミン)と連結した基を表す。保護基は、化学反応の1つ又は複数の工程時における特定の遊離基の反応を防止するために選択される。一般的に特定の保護基は、分子中に存在する他の反応基を変化させずに反応基を復元するために後で除去することができるように、選択される。保護基の選択は、保護すべき特定の遊離基と、該遊離基が曝露される化合物とに応じて決まる。保護基の選択は、当業者に既知である。例えば、Greene etal., Protective Groups in Organic Synthesis, 2nd ed., John Wiley & Sons,Inc. Somerset, N.J. (1991)(その内容は、その全体が参照により本明細書に援用される)を参照されたい。
【0042】
本明細書で用いられるところの「保護されたアミン」は、アミノ保護基と反応したアミンを表す。アミノ保護基は、直鎖の先端の官能基がアミノ基である状況において、固体支持体への分枝末端の結合時におけるアミド機能の反応を防止する。アミノ保護基は、後で除去し、分子中に存在する他の反応基を変化させずにアミノ基を復元することができる。例えば、環外アミンを、ジメチルホルムアミドジエチルアセタールと反応させ、ジメチルアミノメチレンアミノ(dimethylaminomethylenamino)機能を形成することができる。アミノ保護基は一般に、カルバメートと、ベンジルラジカルと、イミデートと、当業者に既知の他のものとを含む。好ましいアミノ保護基は、p−ニトロフェニルエトキシカルボニル又はジメチルアミノメチレンアミノを含むが、これらに限定されない。
【0043】
本明細書で用いられるところの「規則的な間隔」は、大きさを制御した巨大分子の先端の間の空間形成を表し、それは、実質的に立体障害なしに標的特異的リガンドと標的との間で相互作用する空間をもたらすための、約1nm〜約100nmの距離である。したがって、基板上の巨大分子の層の密度は高すぎないため、特異的な分子相互作用が生じ得る。
【0044】
本明細書で用いられるところの「固体支持体」は固定化マトリクスを含む組成物を表し、該固定化マトリクスは、不溶化した物質、固相、表面、基板、層、コーティング、織り繊維若しくは不織繊維、マトリクス、結晶、膜、不溶性ポリマー、プラスチック、ガラス、生物学的若しくは生体適合性若しくは生体侵食性(bioerodible)若しくは生分解性のポリマー若しくはマトリクス、マイクロ粒子又はナノ粒子を含むがこれらに限定されない。固体支持体は、例えば、単一層、二重層、商業的膜、樹脂、マトリクス、繊維、分離媒体、クロマトグラフィー支持体、ポリマー、プラスチック、ガラス、雲母、金、ビーズ、マイクロスフェア、ナノスフェア、シリコン、ヒ化ガリウム、有機金属及び無機金属、半導体、絶縁体、マイクロ構造並びにナノ構造を含むがこれらに限定されない。マイクロ構造及びナノ構造は、超小型、ナノメートルスケール且つ超分子のプローブ、探針、バー、ペグ、プラグ、棒、スリーブ、ワイヤ、フィラメント及びチューブを含み得るが、これらに限定されない。
【0045】
本明細書で用いられるところの「特異的結合」は、リガンドとその特異的結合パートナーとの間の、又は規定の配列セグメントと選択された分子又は選択された核酸配列との間の、測定可能であり且つ再現性がある程度の引力を表す。引力の程度は、最適であるために最大である必要はない。弱い、中程度の又は強い引力が、様々な用途にとって適当であり得る。これらの相互作用において起こる特異的結合は、当業者に既知である。規定の合成配列セグメントと、合成アプタマーと、合成ヘテロポリマーと、ヌクレオチドリガンドと、ヌクレオチド受容体と、形状認識要素と、特異的に引力を有する表面とに関して使用され得る。「特異的結合」という用語は、構造的形状及び表面特徴の特異的認識を含み得る。その他、特異的結合は、いずれかの特異的結合パートナーとの化学的同一性(すなわち、1つ又は複数の同一の化学的な群)又は分子認識特性(すなわち、分子結合特異性)を共有する第3の分子(すなわち、競合体)により競合的に阻害され得る2つの分子(すなわち、特異的結合パートナー)の間の特異的、飽和的及び非共有的な相互作用を明確に表す。競合体は、例えば交差反応体、又は抗体若しくはその抗原の類似体、リガンド若しくはその受容体、又はアプタマー若しくはその標的であり得る。抗体とその抗原との間の特異的結合は、例えば、交差反応する抗体により、又は交差反応する抗原により、競合的に阻害され得る。「特異的結合」という用語は、特異的結合及び構造的形状認識の両方を含む特異的認識のサブセットの概略を示す又はそれを省略するために、便宜的に使用され得る。
【0046】
本明細書で用いられるところの「基板」は、物質、構造、表面又は材料に関して使用される場合には、特異的結合、ハイブリダイゼーション若しくは触媒認識部位、又は複数の様々な認識部位、又は表面、構造若しくは材料を含む様々な分子種の数を超える多数の様々な認識部位を含むことが今までに知られていない非生物学的な、合成的な、無生物の、平面的な、球形の、又は扁平な表面を含む組成物を意味する。基板は、例えば半導体、合成(有機)金属、合成半導体、絶縁体及びドーパント;金属、合金、要素、化合物及びミネラル;合成の、切断した、エッチングした、リソグラフした、プリンティングした、機械加工した、及び微細加工したスライド、素子、構造及び表面;工業的ポリマー、プラスチック、膜;シリコン、ケイ酸塩、ガラス、金属及びセラミック;木、紙、段ボール紙、綿、羊毛、衣類、織り繊維若しくは不織繊維、材料及び布;分枝/直鎖ポリマーを介するプローブ分子の固定化により修飾されていないナノ構造及びマイクロ構造を含み得るが、これらに限定されない。
【0047】
本明細書で用いられるところの、アレイシステムとの関連での「標的(target)」又は「標的化すること(targeting)」は、プローブを使用することによりその同一性又は存在量を検出しようとする遊離の核酸転写産物又はそのcDNAを表し、そのためにプローブ分子が作製される個々の遺伝子を特に表す。或る特定の文脈では、「標的化すること」は、プローブ分子を内因的に発現した転写産物又はそのcDNAと結合すること、又は結合させることを意味する。標的ヌクレオチド配列は、限定されることなく、いずれかの遺伝子から選択され得る。
【0048】
本明細書で用いられるところの、標的ライブラリに関して使用される「標的cDNAライブラリ」は、逆転写酵素により全てがcDNA分子に変換された、細胞又は生物中に存在するmRNA分子の全ての収集物を表すので、ライブラリは目的の特異的なcDNA(及びしたがってmRNA)に対して探索され得る。
【0049】
本明細書で用いられるところの「標的−プローブ結合」は、少なくとも1つが選択された分子である2つ以上の分子であって、特異的な様式で互いに結合している、2つ以上の分子を意味する。典型的には、第1の選択された分子は、第2の分子と、間接的に、例えばスペーサアーム、基、分子、架橋、担体若しくは特異的認識パートナーを介して、又は直接的に、すなわち、スペーサアーム、基、分子、架橋、担体若しくは特異的認識パートナーを介さずに、有利には直接の結合により、結合し得る。選択された分子は、ハイブリダイゼーションを介してヌクレオチドと特異的に結合し得る。ヌクレオチド及び非ヌクレオチド分子の複合体形成のための他の非共有的結合の手段は、例えばイオン結合、疎水的相互作用、リガンド−ヌクレオチド結合、キレート剤/金属イオン対形成、又はアビジン/ビオチン、ストレプトアビジン/ビオチン、抗フルオレセイン抗体/フルオレセイン、抗2,4−ジニトロフェノール(DNP)抗体/DNP、抗ペルオキシダーゼ抗体/ペルオキシダーゼ、抗ジゴキシゲニン抗体/ジゴキシゲニン、若しくはより一般的には受容体/リガンド等の特異的結合対形成を含む。例えば標識する目的でアビジン/ビオチン、ストレプトアビジン/ビオチン、抗フルオレセイン抗体/フルオレセイン、抗ペルオキシダーゼ抗体/ペルオキシダーゼ、抗DNP抗体/DNP、抗ジゴキシゲニン抗体/ジゴキシゲニン若しくは受容体/リガンドを使用して、(すなわち、直接的結合又は共有的結合しているのではなく)選択された分子若しくは選択された核酸配列と結合している、例えば、アルカリホスファターゼ、西洋ワサビペルオキシダーゼ、β−ガラクトシダーゼ、ウレアーゼ、ルシフェラーゼ、ローダミン、フルオレセイン、フィコエリトリン、ルミノール、イソルミノール、アクリジニウムエステル、又は蛍光マイクロスフェア等のレポーター分子は、特異的結合対により、選択された分子若しくは選択された核酸配列と複合体を形成し得る。
【0050】
文脈上他に必要な場合以外は、「リガンド」という用語は、プローブと選択的に結合することができるいずれかの物質を表す。リガンドは、抗原、抗体、オリゴヌクレオチド、オリゴペプチド(タンパク質、ホルモン等を含む)、酵素、基質、薬剤、薬剤−受容体、細胞表面、受容体アゴニスト、部分アゴニスト、混合アゴニスト、アンタゴニスト、応答誘発性若しくは刺激性分子、薬剤、ホルモン、フェロモン、伝達物質、オータコイド、増殖因子、サイトカイン、補欠分子族、補酵素、補因子、基質、前駆体、ビタミン、毒素、調節因子、抗原、ハプテン、炭水化物、分子模倣体、構造分子、エフェクター分子、選択性分子、ビオチン、ジゴキシゲニン、交差反応体、類似体、競合体、又はこれらの分子の誘導体と、選択された標的と特異的に結合することができるライブラリで選択された非オリゴヌクレオチド分子と、これらの分子のいずれかを第2の分子と結合させることにより形成される複合体と、対応プローブに選択的に結合するいずれかの他の分子とであり得る。
【0051】
文脈上他に必要な場合以外は、「プローブ」という用語は、基板表面に結合しており、対応リガンドと選択的に結合することができるいずれかの物質を表す。プローブは、抗原、抗体、オリゴヌクレオチド、オリゴペプチド(タンパク質、ホルモン等を含む)、酵素、基質、薬剤、薬剤−受容体、細胞表面、及び対応リガンドに選択的に結合するいずれかの他の分子であり得る。
【0052】
「リガンド」及び「プローブ」という用語は、いずれかの特定の物質又は大きさの関係を表さないことが理解されるべきである。これらの用語は、リガンドと対応プローブとの間の選択的な結合を示す操作上の用語であるにすぎず、基板表面に結合する部分をプローブと称し、プローブと選択的に結合するいずれかの物質をリガンドと称する。したがって抗体が基板表面に結合している場合には、抗体がプローブであり、対応する抗原がリガンドである。しかし、抗原が基板表面に結合している場合には、抗原がプローブであり対応する抗体がリガンドである。
【0053】
基板表面上におけるプローブの濃度は、固定化したプローブとその対応リガンドとの間の相互作用に影響を及ぼす、鍵となる要因の1つである。幾つかの利点にも関わらず、高密度で固定化したプローブは、自然環境に存在する同一のプローブの特性と実質的に異なる化学的及び生物学的特性を有することが多い。さらに、不活性でない高密度のプローブは、非特異的なプローブ−リガンド相互作用を促進し得る。表面材料を立体障害から解放する一方で、バイオセンサー及びバイオチップ等の用途に十分なシグナル強度と、特異性と、見かけの結合容量とを維持するためにも、表面に結合したプローブの密度を変化させることが望ましい。
【0054】
従来から、薄膜の官能基密度は、不活性な吸着質と官能化した吸着質との両方の同時成膜により、通常調整される。しかし、特に基間の強い相互作用が存在する場合には、相異なる官能基を有するマイクロスケール又はナノスケールの微視的領域への相分離を防止することは困難である。
【0055】
本発明の組成物及び方法は、相分離を顕著に低減するプローブ密度を提供する。本発明の幾つかの実施形態は、その表面上に複数の錐形のデンドリマーを含む基板を提供する。これらの実施形態の範囲内において、幾つかの例では各デンドリマーの末端は基板表面と結合することができ、各デンドリマーの先端はプローブの固定化に対して反応性である。
【0056】
遺伝子型決定のための、バイオ−AFMを使用する標的DNAの検出
DNAマイクロアレイは、多数の遺伝子についてのハイスループットの多重解析のための革命的なツールである。微量の遺伝物質しか入手できないことがあるため、マイクロアレイに基づく解析のための高感度の検出方法を開発することが重要である。典型的にはシグナル出力は、2つの分類、すなわち標的増幅とシグナル増幅とに分類される増幅方法により増強される非特許文献19。遺伝子発現解析における標的増幅の利点及び欠点が、最近レビューされた非特許文献20。広範な利用可能性に関わらず、PCRによる標的増幅は、単位複製配列のキャリーオーバーによる材料の汚染、多重化のための能力の制限、増幅効率の変動等の欠点を有する。小量のコピーの試料からのmRNAの増幅も、初期RNA比の歪みと、ノイズ比の増大との問題を有する非特許文献21。
【0057】
加えて、生体分子は直接的な高感度検出に有用な固有の特性を欠くので、ほとんどの生化学的アッセイは、標識の二次的検出を必要とする。生物学的診断において最も一般的に使用される標識は、有機蛍光色素である。しかし、それでもなお、有機色素には多くの用途におけるその使用を妨げる光退色及び離散励起バンド等の制約がある。
【0058】
過去の研究において、本発明者らは、相補的DNAオリゴヌクレオチドのアレイを含むナノスケールで操作したデンドロン表面がどのようにしてハイブリダイゼーションの事象に関する測定可能な引力及び接着力をもたらすことができるのかを示した。重要なことに、本発明者らは、10の塩基対の差異を有するDNA二本鎖間を識別することができる引力及び接着力を検出するためにこのシステムを使用することができ、この測定方法も1つ及び2つの塩基対のミスマッチを検出する感度を有することを示した非特許文献17。
【0059】
以下の実施例1〜実施例4で説明するように、1aMの標的DNA(35オリゴマー)をデンドロンで修飾した表面上のプローブDNA(15オリゴマー)とハイブリダイズすると、標的DNAと検出DNAとの間の特定の力(ヒストグラム曲線においてガウスフィッティングにより26±0.6pN)を測定する確率は80%であり、20%の力−距離曲線では力は観察されなかった(図1(b))。本発明の方法は、高密度マイクロアレイシステムで実現可能な105という数字よりも良好であり、且つ定量PCR(qPCR)に対して通常観察される103〜104のレベルに接近するレベルである、≦103の標的分子を標識することなく検出可能な感度を示す。
【0060】
したがって、デンドロンで修飾した表面は一塩基変異さえも検出するプラットホームとして使用することができるので、本発明のAFMシステムは、遺伝子型決定だけでなく標的DNAにおける単一ヌクレオチド多型(SNP)の検出にも適用することができる。一塩基がミスマッチを生じている標的DNAについては、表面上のプローブDNAと結合する標的DNAの数は、相補的標的DNAの結合数よりも小さい。したがって、表面に結合した標的DNAの数の減少を測定することにより、一塩基がミスマッチを生じている標的DNAと相補的標的DNAとを識別することができる。
【0061】
遺伝子発現プロファイリング研究のための、バイオ−AFMを使用するcDNA標的の検出
発現プロファイリング研究は、実験条件を変化させたときに、統計的に有意な差異を示した遺伝子を報告することが一般的である。DNAマイクロアレイとqPCRとの両方が、相補的核酸配列の選択的(preferential)結合又は「塩基対形成」を利用し、両方が遺伝子発現プロファイリングにおいて、しばしば連続的に、使用される。ハイスループットDNAマイクロアレイはqPCRの定量精度を欠くが、qPCRにより数十の遺伝子の遺伝子発現を測定するには、DNAマイクロアレイを使用して全ゲノムを測定するのに必要な時間とほぼ同じ時間がかかる。したがって、候補遺伝子を同定するために半定量DNAマイクロアレイ解析実験を行い、その後、最も関心のある候補遺伝子の幾つかに対してqPCRを行いマイクロアレイの結果を有効にすることが意味をなすことが多い。しかし、本発明のバイオ−AFMは、DNAマイクロアレイ及びqPCRの幾つかの利点を組み合わせることができる。
【0062】
ポリアデニル化は、核におけるDNAからRNAへの転写後に起こる。ポリアデニル化のシグナルが転写された後、RNAポリメラーゼと関連したエンドヌクレアーゼ複合体の作用によりmRNA鎖は切断される。切断部位は、該切断部位近くの塩基配列AAUAAAの存在を特徴とする。mRNAが切断された後、50個〜250個のアデニン残基を、切断部位で非結合の3’末端に付加する。この反応は、ポリアデニル酸ポリメラーゼにより触媒される(図2(a))。以下の実施例1〜実施例4で示すように、バイオ−AFM測定の感度は、マイクロアレイの105倍増大した(図2(c))。
【0063】
マイクロアレイシステム
プローブ分子を含む様々なタイプの特定のアレイが、多様な動物、植物及び微生物の細胞又は組織において差示的に発現した遺伝子を同定するために、本発明により提供される。これらのタイプのアレイは、発生アレイ、癌アレイ、アポトーシスアレイ、発癌遺伝子及び腫瘍抑制因子アレイ、細胞周期遺伝子アレイ、サイトカイン及びサイトカイン受容体アレイ、増殖因子及び増殖因子受容体アレイ、神経アレイ(neuroarray)等を含むがこれらに限定されない。
【0064】
本発明のアレイは、他の用途の中でも、差示的な遺伝子発現アッセイにおいて使用することができる。例えばアレイは、(a)疾患状態(例えば新生物又は正常)、(b)様々な組織のタイプ、(c)発生段階、(d)外的又は内的刺激への応答、(e)治療への応答、等の差示的な発現解析において有用であり得る。アレイはまた、薬剤の発見及び研究のための大規模の発現スクリーニングにおいて、有用であり得る。加えて、遺伝子発現に対する特定の細胞タイプにおける活性作用物質の効果を研究することにより、薬剤毒性、発癌性、環境モニタリング等についての情報を取得及び解析することができる。
【0065】
一態様では、本発明は、約1cm2未満の表面積において少なくとも103の相異なるプローブ分子のマイクロアレイを有する表面を有する基板を含む。各々の相異なるプローブ分子は、(i)アレイにおける別々の、規定の位置に配置されており、且つ(ii)約0.1フェムトモル〜100ナノモルの規定量で存在する。
【0066】
標的cDNAが取得される細胞は、正常細胞等の目的の細胞から、又は肝臓癌、肺癌、胃癌、乳癌、膀胱癌、直腸癌、大腸癌、前立腺癌、甲状腺癌及び皮膚癌等の様々なタイプの癌細胞、並びに肥満症、毛包、自己免疫疾患及び代謝障害の細胞から選択され得る。
【0067】
好ましい一実施形態では、各マイクロアレイは、約1cm2未満の表面積当たり少なくとも103種類の相異なるプローブ分子を含有する。マイクロアレイは、約16mm2の面積中に少なくとも約400の領域、又は1cm2当たり2.5×103の領域を含有し得る。また、好ましい一実施形態では、各マイクロアレイ領域におけるプローブ分子は、ポリヌクレオチドの場合においては、約0.1フェムトモル〜100ナノモルの規定量で存在し得る。
【0068】
また、好ましい一実施形態では、プローブ(proble)ポリヌクレオチドは、少なくともヌクレオチド数約10の長さを有し、様々なin situでの合成スキームにより、高密度アレイにおいて形成され得る。
【0069】
デンドロン
本発明の幾つかの態様は、デンドロンのアレイを提供する。一般的には、アレイは、少なくとも第1の表面を有する固体支持体と、固体支持体の第1の表面と結合している複数のデンドロンとを含む。各デンドロンが、典型的には、中心原子と、任意にリンカーを介して中心原子と結合している官能基又は保護された形態の官能基と、中心原子と結合しているベース部分であって、固体支持体の第1の表面と結合している複数の末端を有するベース部分とを含む。本明細書で用いられるところの「中心原子」という用語は、分枝が出ている焦点原子を表す。例えば中心原子は、以下の式Iにおいて、Q1として表わされる。デンドロンを表すときの「ベース部分」という用語は、中心原子から出ている複数の分枝を含む部分を表す。幾つかの実施形態では、デンドロンは、固体支持体表面と結合している錐体のベース部分を有する錐形として記載され、又は概略的に示され得る。
【0070】
官能基(又は部分)は、化学反応に関与する分子内の原子又は原子群を表す。一般的には、官能基はヘテロ原子(ハロゲン、酸素、窒素、硫黄、リン(phosphorous)等)又は不飽和(例えば、炭素−炭素二重結合又は三重結合)を含む。代表的な官能基は、アシルハロゲン化物、アルコール、ケトン、アルデヒド、炭酸酸(エステルを含む)、カルボン酸塩、カルボン酸、エーテル、ヒドロペルオキシド、過酸化物、ハロゲン化物、オレフィン、アルキン、アミド、アミン、イミン、イミド、アジド、アゾ、シアン酸塩、イソシアン酸塩、硝酸塩、ニトリル、亜硝酸塩、ニトロ、ニトロソ、ホスフィン、ホスホジエステル、ホスホン酸、ホスホン酸塩、硫化物、チオエーテル、スルホン、スルホン酸、スルホキシド、チオール、チオシアン酸塩、二硫化物、チオアミド、チオエステル、チオケトンを含むがこれらに限定されない。官能基は、求核反応又は求電子反応の対象となることが多い。幾つかの実施形態では、デンドロンの官能基は、求核反応に参加することができる。したがって官能基は、求核試薬又は求電子試薬であり得る。官能基は、プローブを結合するようになっていることが多い。特定の一例では、官能基は求核置換反応によりプローブと結合を形成することができる。
【0071】
官能基は広範なプローブを結合するために使用され、その後該プローブを流体媒体における対応リガンドの存在を検出するために使用することができる。典型的には、官能基がプローブと結合している場合には、プローブの識別効率(例えば、非特異的結合と比較したときの標的特異的結合の量)は、少なくとも約50%、多くの場合少なくとも約70%、より多くの場合少なくとも約80%、最も多くの場合少なくとも約90%である。特定の一実施形態では、官能基がヌクレオチド数15のオリゴヌクレオチドプローブと結合しており、溶液中におけるヌクレオチド数15のオリゴヌクレオチド標的が使用される場合には、単一ヌクレオチド多型(SNP)識別効率は、少なくとも約80%(1:0.2)、多くの場合少なくとも約90%(1:0.1)、より多くの場合少なくとも約95%(1:0.05)、より多くの場合少なくとも99%(1:0.01)である。
【0072】
プローブの識別効率は、様々な方法のいずれかにより、例えば、実質的に同様の反応条件下でのプローブ−リガンド複合体形成の効率及び/又は選択性の比較により、決定することができる。SNP識別効率も、同様に決定することができる。識別効率を測定する代表的な1つの方法は、基板表面に結合した標的特異的プローブのシグナル強度を、基板に結合した標的非特異的プローブのシグナル強度とを比較することである。例えば、基板表面と結合した標的特異的プローブが10nMの標的濃度で100のシグナル強度をもたらし、基板表面と結合した標的非特異的プローブが同じ標的濃度で30のシグナル強度をもたらす場合には、基板表面上におけるプローブの識別効率は、(100−30)/100、すなわち70%(1:0.3)である。
【0073】
幾つかの実施形態では、官能基がヌクレオチド数15〜21のオリゴヌクレオチドプローブと結合している場合には、基板と結合した標的非特異的オリゴヌクレオチドプローブ(例えば、標的特異的オリゴヌクレオチドプローブと、少なくとも1個、多くの場合少なくとも2個、より多くの場合少なくとも3個のヌクレオチドが異なるオリゴヌクレオチドプローブ)のシグナル強度は、基板と結合した標的特異的オリゴヌクレオチドプローブ(例えば、標的DNAの全体又は一部分と完全に相補的なオリゴヌクレオチドプローブ)のシグナル強度と比較して、少なくとも約70%、多くの場合少なくとも約80%、より多くの場合少なくとも約95%、さらにより多くの場合少なくとも約99%低減する。一般的に、異なるオリゴヌクレオチドプローブは、異なる識別効率を有し得る。
【0074】
特定の一実施形態では、官能基がヌクレオチド数15のオリゴヌクレオチドプローブと結合している場合には、特異的結合の量に対する非特異的結合の相対量は、非デンドロンと結合しているオリゴヌクレオチドプローブと比較して、少なくとも約50%、多くの場合少なくとも約60%、より多くの場合少なくとも80%、さらにより多くの場合少なくとも約90%低減する。さらに、非特異的結合を測定する1つの方法は、実施例の節における方法を含む本明細書で説明される方法である。非特異的結合の相対量の低減を決定する特定の方法の1つは、以下の式で与えられる。
【0075】
[(A−B)/A]×100%
【0076】
式中、Aは非デンドロン分子(例えば、APDES修飾表面)を使用する非特異的結合の相対量であり、Bはデンドロンで修飾した表面を使用する非特異的結合の相対量である。C:Tのミスマッチに対する特異的結合の量に対する非特異的結合の相対量は、少なくとも95%[(0.12−0.006)/0.12×100%=95%]低減し得る。
【0077】
さらに他の実施形態では、デンドロンの先端と結合している官能基又は任意のリンカーは、α−ヘリックスを形成しない。いかなる理論にも拘束されるものではないが、α−ヘリックスの存在が識別効率を低減し、及び/又は非特異的結合を増大させ、それによりデンドロンの有用性を低減すると考えられる。
【0078】
本発明の幾つかの態様では、デンドロンは以下の式を有する。
【0079】
Z−[R1]m−Q1−{[R2−Q2]a−{(R3−Q3)b−[(R4−Q4)c−(R5−Y)x]y}z}n
式I
【0080】
式中、
m、a、b及びcの各々は独立して0又は1であり、
cが0の場合にはxは1であり、又はcが1の場合にはxは1からQ4の酸化状態−1までの整数であり、
bが0の場合にはyは1であり、又はbが1の場合にはyは1からQ3の酸化状態−1までの整数であり、
aが0の場合にはzは1であり、又はaが1の場合にはzは1からQ2の酸化状態−1までの整数であり、
nは1からQ1の酸化状態−1までの整数であり、
Q1は酸化状態が少なくとも3の中心原子であり、
Q2、Q3及びQ4の各々は独立して酸化状態が少なくとも3の分枝原子であり、
R1、R2、R3、R4及びR5の各々は独立してリンカーであり、Zは任意に保護される官能基であり、
Yの各々は独立して上記ベース部分の末端上における官能基であり、複数のYが上記固体支持体の上記第1の表面と結合しており、
ただしn、x、y及びzの積は少なくとも3である。
【0081】
a、b又はcが1であり、且つ対応するz、y又はxがそれぞれQ2の酸化状態−1、Q3の酸化状態−1又はQ4の酸化状態−1未満である場合には、Q2、Q3又はQ4と結合している残りの原子はそれぞれ水素であることが理解されるべきである。本明細書で用いられるところの「Q」は、Q1、Q2、Q3、Q4のいずれか1つ又は全てを表す。典型的には、Qは、周期表のIVA群又はVA群の任意の原子である。Qについての代表的な原子は、N、P、C、Si、Ge等を含むがこれらに限定されない。QはN、P、C又はSiであることが多い。
【0082】
式Iに見られるように、Zは、任意にリンカーR1を介して、中心原子に結合している。mは1であり、その結果ZはリンカーR1を介して中心原子に結合していることが多い。さらに、Z又はその非保護形態(すなわち、Zが保護された官能基である場合)は、プローブを結合するようになっている。幾つかの実施形態では、Zは求核試薬である。求核試薬は、結合している電子の両方を供与することによりその反応パートナー(すなわち、求電子試薬)と化学結合を形成する原子又は原子群である。典型的には、求核試薬は、N、P、O及びS等のヘテロ原子、又はカルボアニオン、特に共鳴により、及び/又は近くの電子求引基(複数可)の存在により安定化するカルボアニオンである。有機化学分野の当業者は、式Iのデンドロンに適切な求核試薬を容易に認識することができる。代表的な求核試薬の幾つかは、代表的な官能基において上で開示されている。
【0083】
他の実施形態では、Zは求電子試薬である。求電子試薬は、電子に引きつけられ、求核試薬と結合するために電子対を受容することにより化学反応に参加する原子又は原子群である。たいていの求電子試薬は、正に荷電しているか、部分的な正の電荷を保有する原子を有するか、又は電子のオクテットを有しない原子を有する。典型的には、求電子試薬は、求電子中心と結合している、又は求電子中心の近くにある1つ又は複数の電気陰性原子(例えば、ハロゲン化物又は他のヘテロ原子)のために、少なくとも正の双極子モーメントを有する炭素原子である。有機化学分野の当業者は、式Iのデンドロンに適切な求電子試薬を容易に認識することができる。代表的な求電子試薬の幾つかは、代表的な官能基において上で開示されている。
【0084】
さらに他の実施形態では、Zは、N、O、S、Pから成る群から選択されるヘテロ原子と、それらの組合せとを含む。
【0085】
各々のYは、独立して官能基であり得る。すなわち、各々のYは、他のYの群と無関係であり得る。しかし、Yの全てが同じ官能基であることが多い。しかし、概してZ及びYは異なる官能基である。幾つかの例では、Z及びYは同じ官能基であり得るが、一方又は他方が保護された形態である。官能基、及び/又は保護基の存在におけるかかる差異は、Z及びYの反応性を識別することを可能にし、それにより複数のYを介してデンドロンを固体支持体と結合させることを可能にし、Z上へのプローブの結合を可能にする。
【0086】
リンカー
再び式Iを参照すると、デンドロンは、一般的に様々なリンカー、例えばR1、R2、R3、R4、R5を含む。各リンカーは、分枝原子Q2、Q3又はQ4により別のリンカーと連結されている。末端のリンカーは官能基Yを含み、それにより固体支持体と結合することができる。
【0087】
各リンカーの長さは、固体支持体と結合している分枝官能基の数、固体支持体との結合の強度、所望の空間形成等を含む様々な因子により決定され得る。したがって、リンカーはいずれかの特定の長さのいずれかの特定のタイプの鎖又はポリマーに限定されないことが理解される。しかし、一般的な指針として、リンカーの長さは、約0.5nm〜約20nm、典型的には約0.5nm〜約10nm、多くの場合約0.5nm〜約5nmであり得る。代替的に、各リンカーは、独立して、約1個〜約100個の原子、典型的には約1個〜約50個の原子、多くの場合約1個〜約25個の原子、より多くの場合約3個〜約10個の原子の鎖長を有する鎖である。リンカーの化学的構成は、例えば置換又は非置換のアルキル、アルケニル、アルキニル、シクロアルキル、シクロアルケニル、アリール、エーテル、ポリエーテル、エステル、アミノアルキル、ポリアルケニルグリコール等を含むがこれらに限定されない直鎖又は分枝の有機的部分を含むがこれらに限定されない。
【0088】
リンカーR1、R2、R3、R4、R5は、同じであり得る又は異なり得る。典型的には、各リンカーは、繰り返し単位、直鎖又は分枝の有機的部分である。しかし、全てのリンカーが同じ繰り返し単位でなければならないわけではないことも理解される。また、リンカーについての全ての結合価の位置が繰り返し単位で充たされなければならないわけでもない。例えば、R2の全てが同じ繰り返し単位であり得る。又は、1つ又は複数のR2が繰り返し単位であってもよく、残りのR2はH又は他の化学的部分であり得る。同様に、1つ又は複数の各々のR3、R4又はR5が、独立して、繰り返し単位、H、又はいずれかの他の化学的部分であり得る。したがって、様々なポリマーの形状がこのように作製され得る。したがって、デンドロンは約3個〜約81個の官能基Yを有し得ると考え得る。典型的にはデンドロンは、約6個〜約81個の官能基Yを、約6個〜約54個の官能基Yを、約6個〜約27個の官能基Yを、約8個〜約27個の官能基Yを、約9個〜約27個の官能基Yを、約9個〜約18個の官能基Yを、又は約9個〜約12個の官能基Yを有する。
【0089】
官能基Y
各官能基Yは、付加反応又は置換反応の対象となるのに十分な反応性を有する。官能基(又は部分)は、化学反応に関与する分子内の原子又は原子群を表す。一般的には、官能基はヘテロ原子(ハロゲン、酸素、窒素、硫黄、リン等)又は不飽和(例えば、炭素−炭素二重結合又は三重結合)を含む。代表的な官能基は、アシルハロゲン化物、ヒドロキシ、ケトン、アルデヒド、炭酸酸(エステルを含む)、カルボン酸塩、カルボン酸、尿素、エーテル、ヒドロペルオキシド、過酸化物、オキシラニル、ハロゲン化物、オレフィン、アルキン、アミド、アミン、イミン、イミド、アジド、アジリジニル、アゾ、シアン酸塩、イソシアン酸塩、硝酸塩、ニトリル、亜硝酸塩、ニトロ、ニトロソ、オキサゾリニル、イミダゾリニル、ホスフィン、ホスホジエステル、ホスホン酸、ホスホン酸塩、硫化物、チオエーテル、スルホン、スルホン酸、スルホキシド、チオール、チオシアン酸塩、イソチオシアン酸塩、二硫化物、チオアミド、チオエステル、チオケトン、シラニル(silanyl)と、化学反応の対象となることが知られている他の基とを含むがこれらに限定されない。官能基は、求核反応又は求電子反応の対象となることが多い。
【0090】
保護基
存在する場合、保護基の選択は、多数の因子に依存する。したがって、本発明は、その官能基と別の化学的部分との反応を防止する機能をもたらし、且つ所望の特定の条件下で除去することができる限りにおいては、いかなる特定の保護基にも限定されない。典型的には、使用される保護基は、比較的容易に除去することができる。
【0091】
代表的な適切な保護基は、以下のものを含むがこれらに限定されない:
【0092】
アミノ酸保護基:メチル、ホルミル、エチル、アセチル、t−ブチル、アニシル、ベンジル、トリフルオロアセチル、N−ヒドロキシスクシンイミド、t−ブチルオキシカルボニル、ベンゾイル、4−メチルベンジル、チオアニジル(Thioanizyl)、チオクレシル(Thiocresyl)、ベンジルオキシメチル、4−ニトロフェニル、ベンジルオキシカルボニル、2−ニトロベンゾイル、2−ニトロフェニルスルフェニル(2-Nitrophenylsulphenyl)、4−トルエンスルホニル、ペンタフルオロフェニル、ジフェニルメチル(Dpm)、2−クロロベンジルオキシカルボニル、2,4,5−トリクロロフェニル、2−ブロモベンジルオキシカルボニル、9−フルオレニルメチルオキシカルボニル、トリフェニルメチル、2,2,5,7,8−ペンタメチル−クロマン−6−スルホニル、フタロイル、3−ニトロフタロイル、4,5−ジクロロフタロイル、テトラブロモフタロイル及びテトラクロロフタロイル。
【0093】
ヒドロキシ保護基:p−アニシルオキシメチル(p−AOM)、ベンジルオキシメチル(BOM),t−ブトキシメチル、2−クロロテトラヒドロフラン(THF)、グアヤコールメチル(GUM)、(1R)−メントキシメチル(Menthoxymethyl)(MM)、p−メトキシベンジルオキシメチル(PMBM)、メトキシエトキシメチル(MEM)、メトキシメチル(MOM)、o−ニトロベンジルオキシメチル、(フェニルジメチルシリル)メトキシメチル(SMOM)及び2−(トリメチルシリル)エトキシメチル(SEM)。
【0094】
DNA、RNA保護試薬:2’−OMe−Ac−C−CE ホスホラミダイト、2’−OMe−Ac−RNA CPG、2’−OMe−I−CE ホスホラミダイト、2’−OMe−5−Me−C−CE ホスホラミダイト、Ac−C−CE ホスホラミダイト、Ac−C−RNA 500、dmf−dG−CE ホスホラミダイト、dmf−dG−CPG 500及び2−アミノ−dA−CE ホスホラミダイト。
【0095】
様々な官能基に対する他の適切な保護基が、当業者に既知である。例えば、T.W. Greene and P. G. M. Wuts, Protective Groups in OrganicSynthesis, 3rd edition, John Wiley & Sons, New York, 1999と、Harrisonand Harrison et al., Compendium of Synthetic Organic Methods, Vols. 1-8 (JohnWiley and Sons, 1971-1996)とを参照されたい。
【0096】
下記の表1は、様々なタイプの代表的な化合物を列挙している。しかし、X、R1、Q、R及びYにおける変形形態が本発明に包含されることが理解されるべきである。
【0097】
表1−代表的且つ例示的な巨大分子化合物
【表1−1】

【表1−2】

【表1−3】

【0098】
本発明の幾つかの態様では、固体支持体は無孔性の固体基板である。適切な無孔性の固体基板は、金属、金属合金、セラミックス、プラスチック、シリコン及びケイ酸塩(ガラス及び半導体ウェハ等)を含むがこれらに限定されない。固体支持体は、スライド、粒子、ビーズ又はマイクロウェル(micro-well)の形態であり得る。幾つかの実施形態では、固体支持体は無孔性の固体基板である。これらの実施形態の範囲内において、幾つかの例では固体支持体はガラスである。
【0099】
本発明の他の態様では、固体支持体は多孔性の固体基板である。代表的な多孔性材料は、膜、ビーズ(制御孔ビーズを含む)、ゼラチン及びハイドロゲルを含むがこれらに限定されない。
【0100】
本発明の別の態様は、その表面に複数のデンドロンを含む固体支持体を製造する方法を提供する。固体支持体は、デンドロンと結合を形成するための表面官能基を含む第1の表面を少なくとも含む。デンドロンは、中心原子と、任意にリンカーを介して中心原子と結合している官能基と、中心原子と結合しており複数の末端を有するベース部分とを含み、ベース部分の各末端は官能基を含む。この方法は概して、固体支持体の第1の表面上の表面官能基とベース部分の末端上の官能基との間の結合を形成するのに十分な条件下で、複数のデンドロンを固体支持体表面と接触させることであって、その結果、デンドロンのベース部分と固体支持体の第1の表面との間に複数の結合が形成される、接触させることを含む。
【0101】
幾つかの実施形態では、固体支持体の第1の表面上の表面官能基とベース部分の末端上の官能基との間に形成される結合は、共有結合である。
【0102】
さらに他の実施形態では、固体支持体の第1の表面上の表面官能基とベース部分の末端上の官能基との間の結合は、求核置換反応により形成される。適切な求核置換反応のための反応条件は、当業者に既知である。例えば、Harrison and Harrison et al., Compendium of Synthetic OrganicMethods, Vols. 1-8 (John Wiley and Sons, 1971-1996)を参照されたい。
【0103】
様々な固体支持体が、本発明の方法において使用され得る。適切な固体支持体が、本明細書で論じられ、無孔性固体支持体と多孔性固体支持体とを含む。使用され得る代表的な固体支持体は、上述したものを含む。幾つかの実施形態では、固体支持体は無孔性固体支持体である。これらの実施形態の範囲内において、幾つかの例では、固体支持体は無孔性固体支持体である。特定の一実施形態では、無孔性固体支持体はガラスである。
【0104】
幾つかの実施形態では、任意にリンカーを介して中心原子と結合している官能基は、その反応性を低減又は防止するために、デンドロンを固体支持体表面と結合する前に保護される。このようにして、ベース部分の末端上の官能基が固体支持体上の表面官能基との結合形成反応の対象となるのに対して、中心原子と結合している官能基(又はデンドロンの先端に存在する官能基)は反応条件下で相対的に不活性な状態を維持する。特定の官能基の反応性を低減又は防止するための保護基の使用は、当業者に既知である。例えば、T. W. Greene and P. G. M. Wuts, Protective Groups in OrganicSynthesis, 3rd edition, John Wiley & Sons, New York, 1999と、Harrisonand Harrison et al., Compendium of Synthetic Organic Methods, Vols. 1-8 (JohnWiley and Sons, 1971-1996)とを参照されたい(これらの内容は、その全体が参照により本明細書に援用される)。代表的なヒドロキシ保護基は、アシル基、ベンジル及びトリチルエーテル、テトラヒドロピラニルエーテル、トリアルキルシリルエーテル及びアリルエーテルを含む。代表的なアミノ保護基は、ホルミル、アセチル、トリフルオロアセチル、ベンジル、ベンジルオキシカルボニル(CBZ)、tert−ブトキシカルボニル(Boc)、トリメチルシリル(TMS)、2−トリメチルシリル−エタンスルホニル(SES)、トリチル基及び置換トリチル基、アリルオキシカルボニル、9−フルオレニルメチルオキシカルボニル(FMOC)、ニトロ−ベラトリルオキシカルボニル(NVOC)等を含む。しかし、幾つかの例ではベース部分の末端上の官能基の反応性と、任意にリンカーを介して中心原子と結合している官能基(すなわち「先端官能基」)の反応性とは、先端官能基を保護する必要なく固体基板表面上へのデンドロンの結合を可能にする程度に十分に異なることが理解されるべきである。
【0105】
デンドロンが固体支持体と結合すれば、保護基が存在する場合には、その保護基を先端官能基から除去することができる。その後目的のプローブを、適切な反応条件を使用して、先端官能基と結合させることができる。
【0106】
幾つかの実施形態では、デンドロンは、固体支持体の所定の領域と結合している。かかる結合は、当業者に既知の様々な方法のいずれかを使用して、例えば湿式又は乾式コーティング技術を使用することにより、実現することができる。
【0107】
本発明の他の態様は、その表面上にデンドロンのアレイを含む固体支持体を使用して流体媒体中におけるリガンドの存在を検出する方法を提供する。デンドロンのベース部分は固体支持体と結合しており、先端官能基は所与のリガンドに対して選択的なプローブを含む。この方法は概して、リガンドが流体媒体中に存在する場合にプローブ−リガンド複合体を選択的に形成するのに十分な条件下で流体媒体を固体基板と接触させること、及び目的のプローブ−リガンド複合体の存在を決定することを含む。目的のプローブ−リガンド複合体の存在は、その流体媒体がリガンドを含むことの指標である。
【0108】
幾つかの実施形態では、目的のプローブ−リガンド複合体は、オリゴヌクレオチド−相補的オリゴヌクレオチド複合体若しくはオリゴヌクレオチド−相補的ポリヌクレオチド複合体、オリゴペプチド−結合性オリゴペプチド複合体若しくはオリゴペプチド−結合性ポリペプチド複合体、PNA−相補的オリゴヌクレオチド複合体若しくはPNA−相補的ポリヌクレオチド複合体、LNA−相補的オリゴヌクレオチド複合体若しくはLNA−相補的ポリヌクレオチド複合体、又は受容体−基質複合体である。これらの実施形態の範囲内において、幾つかの例では、受容体−基質複合体は、薬剤−薬剤受容体複合体、酵素−酵素基質複合体、抗体−抗原複合体、又はアプタマー−タンパク質複合体を含む。
【0109】
幾つかの実施形態では、本発明の方法は、オリゴヌクレオチドプローブ−相補的DNA複合体(ここで、オリゴヌクレオチドプローブは、ヌクレオチド数が少なくとも約75のヌクレオチド配列を有し、多くの場合ヌクレオチド数が少なくとも約50のヌクレオチド配列を有し、より多くの場合ヌクレオチド数が少なくとも約30のヌクレオチド配列を有し、最も多くの場合ヌクレオチド数が少なくとも約15のヌクレオチド配列を有する)における単一ヌクレオチド多型を識別することができる。かかる選択性を決定するための1つの方法は、モデル系、及び/又は実施例の節において開示されるp53遺伝子における7つのホットスポットのコドン175を有するDNAマイクロアレイを解析することである。
【0110】
さらに幾つかの実施形態では、本発明の方法はオリゴペプチドプローブ−特異的ペプチド標的複合体(ここで、オリゴペプチドプローブは、少なくとも約200個のアミノ酸、少なくとも約50個のアミノ酸、少なくとも約20個のアミノ酸、又は少なくとも約10個のアミノ酸を有する)における単一アミノ酸のミスマッチを識別することができる。
【0111】
固体支持体上の複数のデンドロン間のプローブ間の距離は、約0.1nm〜約100nm、約1nm〜約100nm、約2nm〜約50nm、約2nm〜約30nm、又は約2nm〜約10nmの範囲であり得る。
【0112】
標的特異的リガンドすなわちプローブ
ポリマーと結合していることがある、プローブとしても知られる標的特異的リガンドは、化学物質、生化学的物質、生物活性化合物等を含む様々な化合物を含む。これに関して、プローブは、核酸、オリゴヌクレオチド、RNA、DNA、PNA、LNA、アプタマー、抗原、抗体等であり得る。オリゴヌクレオチドは、天然核酸又はその類似体であり得る。したがって、プローブは、天然アミノ酸又は合成アミノ酸から構成されるポリペプチドであり得る。プローブは、ポリマーの官能基と結合することができる限りにおいて、核酸、アミノ酸、炭水化物、又は他の任意の化学物質の組合せであり得る。特にプローブは、トリアジン骨格に基づく化学物質等の、化学物質であってもよく、コンビナトリアル化学ライブラリ、特にトリアジンタグ化ライブラリの成分として使用され得る。
【0113】
固体支持体
固体支持体は、ポリマーを結合していることがあるいずれかの固体材料であり得る。典型的には、ポリマーは、共有結合又はイオン結合を介して固体支持体表面と結合する。固体支持体は官能化してもよく、それにより、ポリマーのベース部分上に存在する官能基との結合が生ずる。固体支持体の表面は、当業者の必要性に応じて様々な表面であり得る。マイクロアレイ又はバイオチップの形式が望まれる場合には、典型的には酸化型シリコンウェハ、溶融シリカ又はガラスが、基板であり得る。幾つかの実施形態では、固体支持体はスライドガラスである。他の代表的な固体支持体は、ニトロセルロース又はナイロンを含むがこれらに限定されないメンブレンフィルターを含む。固体支持体は、親水性又は極性であり得るし、コーティングの前後において負電荷又は正電荷を有し得る。
【0114】
マイクロアレイ
マイクロアレイの性能を向上させるために、プローブ設計、スポッティング時の反応条件、ハイブリダイゼーション条件及び洗浄条件、非特異的結合の抑制、生体分子と表面との間の距離、及び/又は固定化した生体分子間の空間等の様々な問題を考慮するべきである。これらの因子のほとんどはマイクロアレイ表面の性質と関連するので、表面の最適化は、マイクロアレイ研究における主要な目的の1つとなっている。本発明の幾つかの態様は、表面に結合したデンドロンを含む固体支持体を提供する。幾つかの実施形態ではデンドロンは、錐形であり、溶液の値(1:0.01)に近い単一ヌクレオチド多型(すなわちSNP)の識別効率を有するオリゴヌクレオチドマイクロアレイを提供するか、非特異的結合を低減するか、又はその両方の効果をもたらす。
【0115】
固体支持体の表面は、当業者に既知の様々な方法のいずれかを使用して調製され得る。例えば、ヒドロキシル化したガラスの表面は、Maskis et al. in Nucleic Acids Res., 1992, 20, 1679-1684により開示される方法を使用することにより調製され得る。酸化型シリコンウェハ、溶融シリカ及びスライドガラスを含め、固体支持体は、(3−グリシドキシプロピル)メチルジエトキシシラン(GPDES)及びエチレングリコール(EG)で修飾され得る。典型的には、デンドロンの先端官能基(例えば、カルボン酸基)と固体支持体表面上の官能基(例えば、ヒドロキシル基)との間のカップリング反応を使用して、例えば、4−ジメチルアミノピリジン(DMAP)の存在下で1−[3−(ジメチルアミノ)プロピル]−3−エチルカルボジイミド塩酸塩(EDC)又は1,3−ジシクロヘキシルカルボジイミド(DCC)を使用することにより、デンドロンを固体支持体表面と結合させた。
【0116】
幾つかの例では、デンドロンを結合した後における厚みの増大は11±2Åであったが、これはイオン結合と同程度である。固定化後、デンドロンのアントラセン部分に起因するUV吸収ピークは、257nmで観察された。分子層は十分に安定であり、ジメチルホルムアミド中での1日間の撹拌に対して、厚み及び吸収特性に関して変化を示さなかった。タッピングモード原子間力顕微鏡(AFM)により得られる組織分布画像も、得られた層が、顕著な凝集物又は穴を有さず非常に滑らか且つ実質的に均質であることを示した。化合物を固体支持体表面上に結合するためのいずれかの従来から知られる方法が、本発明のマイクロアレイを製造するために使用され得る。
【0117】
幾つかの実施形態では、オリゴヌクレオチドマイクロアレイの調製は、先端官能基を脱保護することを含む。先端官能基が保護形態である場合には、かかる工程しか必要でないことが理解されるべきである。先端官能基が保護されていない場合には、かかる工程は必要でない。従来から、表面の反応性アミン基を有する固体支持体については、チオールテザー(thiol-tethered)オリゴヌクレオチドと、サクシニミジル 4−マレイミドブチレート(SMB)又はスルホサクシニミジル−4−(N−マレイミドメチル)シクロヘキサン−1−カルボキシレート(SSMCC)等のヘテロ二官能性リンカーとが利用される。対照的に、本発明の幾つかの実施形態は、DSC等のリンカーを使用し、これはアミンテザー(amine-tethered)オリゴヌクレオチドのスポッティングを可能にする。したがって、本発明の方法及び組成物の幾つかの利点は、費用対効果に優れていること、及び容易に酸化されるチオールテザーオリゴヌクレオチドの使用を回避できることである。しかし、チオールテザーオリゴヌクレオチドは或る特定の条件下で有用であり得ることが理解されるべきである。
【0118】
本発明は、本明細書で説明した特定の実施形態によりその範囲を限定されるべきではない。実際に、本明細書で説明した実施形態に加えて本発明の様々な修正形態が、上述の説明と添付した図面とから当業者に明らかとなるであろう。かかる修正形態は、添付した特許請求の範囲の範囲内にあることを意図している。以下の実施例は、限定としてでなく本発明の例示として提供される。
【実施例】
【0119】
実施例1−材料及び方法
総則。シランカップリング剤N−(3−(トリエトキシシリル)プロピル)−O−ポリエチレンオキシドウレタン(TPU)は、Gelest Inc.から購入した。他の全ての化学物質は、Sigma-Aldrichから入手した試薬グレードのものである。UVグレード溶融シリカプレートは、CVILaser Co.から購入した。研磨加工プライムSi(100)ウェハ(ドーパント、リン;抵抗率、1.5Ω・cm〜2.1Ω・cm)は、MEMCElectronic Materials Inc.から購入した。脱イオン水(18MΩ・cm)は、Barnstead E−pure 3−モジュールシステムに蒸留水を通過させることにより得た。
【0120】
実施例2−試料調製。
実施例2.1−基板の洗浄。シリコンウェハ(及び、デンドロン表面被覆度分析のための溶融シリカプレート;支援情報を参照されたい)を、ピラニア溶液(濃硫酸/30%H2O2=7:3(v/v))中で4時間超音波処理した(注意:ピラニア溶液は、有機材料を爆発的に酸化し得る。酸化しやすい材料と接触させてはならない)。超音波処理後、基板を脱イオン水で十分に洗浄及びリンスした。その後、Teflonビーカー中に容れた脱イオン水、濃縮アンモニア溶液及び30%過酸化水素の混合物(5:1:1(v/v/v))中に、基板を浸漬した。ビーカーをウォーターバス中に置き、80℃で10分間加熱した。基板を溶液から取り出し、脱イオン水で十分にリンスした。さらに、脱イオン水、濃塩酸及び30%過酸化水素の混合物(6:1:1(v/v/v))を含有するTeflonビーカー中に基板を置いた。ビーカーを80℃で10分間(or)加熱した。基板を溶液から取り出し、大量の脱イオン水で十分に洗浄及びリンスした。きれいな基板を真空チャンバー(30mTorr〜40mTorr)中で約20分間乾燥し、直ぐに次の工程に使用した。
【0121】
実施例2.2.−AFMプローブの前処理。
錐体の先端を有する標準V型シリコン窒化物カンチレバー(MLCT−AUNM)(Veeco Instruments;k=10pN/nm)を、初めに、10%の硝酸中に浸漬すること、及び80℃で20分間加熱することにより酸化した。カンチレバーを溶液から取り出し、大量の脱イオン水で十分に洗浄及びリンスした。きれいなカンチレバーを真空チャンバー(30mTorr〜40mTorr)中で約20分間乾燥し、直ぐに次の工程に使用した。
【0122】
実施例2.3.−シリル化。薄シリカ最上層を用意するために、シリコン/シリカ基板と、上述のように前処理したカンチレバーとを、窒素雰囲気下でカップリング剤(0.20mL)を含有する無水トルエン(20mL)中に浸漬し、溶液中に6時間置いた。シリル化後、基板及びカンチレバーをトルエンで洗浄し、その後110℃で30分間焼いた。基板を、トルエンと、トルエン−メタノール(1:1(v/v))と、メタノールとに連続的に浸漬し、各洗浄溶液中で3分間超音波処理した。カンチレバーを、トルエンとメタノールとで連続的に十分にリンスした。最後に、基板及びカンチレバーを真空(30mTorr〜40mTorr)下で乾燥した。GPDESでのシリル化のための実験手順と、その後のエチレングリコールでのエポキシドの開環とは、他非特許文献18で説明する。
【0123】
実施例2.4.−デンドロンで修飾した表面の調製。上記のヒドロキシル化した基板及びカンチレバーを、4−ジメチルアミノピリジン(DMAP)(2.7mM)の存在下で、デンドロン(1.0mM)を溶解している小量のDMFと、カップリング剤である1,3−ジシクロヘキシルカルボジイミド(DCC)(27mM)とを有する塩化メチレン溶液中に4時間浸漬した。この仕事で使用したデンドロンである9−アントリルメチル−3−({[トリス({[(1−{トリス[(2−{[(トリス{[2−カルボキシエトキシ]メチル}メチル)アミノ]カルボニル}エトキシ)メチル]メチル}アミノ)カルボニル]−2−エトキシ}メチル)メチル]アミノ}カルボニル)プロピルカルバメートを、このグループで調製した。反応後、基板を、塩化メチレンと、メタノールと、水とに連続的に浸漬し、各洗浄工程で3分間超音波処理した。カンチレバーを、塩化メチレンと、メタノールと、水とで連続的に十分にリンスした。最後に、基板及びカンチレバーをメタノールで洗浄し、真空(30mTorr〜40mTorr)下で乾燥した。
【0124】
実施例2.5.− 9−アントリルメトキシカルボニル基の脱保護。デンドロンで修飾した基板及びカンチレバーを、1.0Mのトリフルオロ酢酸(TFA)を有する塩化メチレン溶液中に浸漬し、2時間撹拌した。反応後、20%(v/v)のジイソプロピルエチルアミン(DIPEA)を有する塩化メチレン溶液中に10分間浸漬した。基板を塩化メチレン及びメタノール中で各3分間超音波処理し、カンチレバーを塩化メチレンとメタノールとで連続的に十分にリンスした。基板及びカンチレバーを真空(30mTorr〜40mTorr)下で乾燥した。
【0125】
実施例2.6.−NHSで修飾した基板の調製。上記脱保護した基板及びカンチレバーを、窒素雰囲気下で、ジ(N−サクシニミジル)カーボネート(DSC)(25mM)及びDIPEA(1.0mM)を有するアセトニトリル溶液中に4時間浸漬した。反応後、基板及びカンチレバーを撹拌したジメチルホルムアミド中に30分間置き、メタノールで洗浄した。基板及びカンチレバーを、真空(30mTorr〜40mTorr)下で乾燥した。
【0126】
実施例2.7.−プローブ/検出DNAの固定化。上記NHSで修飾した基板及びカンチレバーを、DNA溶液(5.0mMのMgCl2を有する25mMのNaHCO3緩衝液(pH8.5)中において、20μM)中に4時間浸漬した。反応後、基板及びカンチレバーを、ハイブリダイゼーション緩衝溶液(7.0mMのドデシル硫酸ナトリウムを含有する2×SSPE緩衝液(pH7.4))中において37℃で30分間、及び水中において1分間撹拌し、非特異的に結合したオリゴヌクレオチドを除去した。最後に基板及びカンチレバーを、真空(30mTorr〜40mTorr)下で乾燥した。
【0127】
実施例2.8.−標的DNAのハイブリダイゼーション。上記のプローブDNAをつなぎ留めた基板を、標的DNA溶液(20μM)中に1時間浸漬した。反応後、基板を37℃で30秒間撹拌し、ハイブリダイゼーション緩衝溶液(7.0mMのドデシル硫酸ナトリウムを含有する2×SSPE緩衝液(pH7.4))中において1分間浸漬し、さらに繰り返した(repeat)。基板を、30mMの塩化ナトリウムと3.0mMのクエン酸ナトリウムとを含有する0.2×SSC緩衝液により1分間洗浄し、非特異的に結合したオリゴヌクレオチドを除去した。
【0128】
実施例2.9.−遺伝子発現プロファイリングのためのプローブDNAの固定化。対照実験のために、96種類の10μMのプローブDNA(Operon companyから入手したホモ・サピエンス(ヒト)試料v4.0.1)を、マイクロアレイヤー(Genetixから入手したQArraymini)を4時間用いて、スポッティング緩衝溶液(5.0mMのMgCl2を有する25mMのNaHCO3緩衝液(pH8.5))中において、デンドロンで修飾したスライドガラス上に固定化した。反応後、基板を、ハイブリダイゼーション緩衝溶液(7.0mMのドデシル硫酸ナトリウムを含有する2×SSPE緩衝液(pH7.4))中において37℃で30分間、及び水中において1分間撹拌し、非特異的に結合したオリゴヌクレオチドを除去した。最後に基板を、真空(30mTorr〜40mTorr)下で乾燥した。
【0129】
実施例2.10.−基準全RNAからのcDNA調製。Cy5標識cDNAを、Superscript(商標)Indirect cDNA標識キット(Invitrogen)での逆転写により、5μl当たり10μgのユニバーサルヒト基準RNA(UHRR、Statagene)から(form)調製した。QIAGENから入手したMINELute精製キットで、精製プロセスを実施した。NanoDropTechnologies, Inc. から入手したND−1000分光光度計により、260nmでのUVの吸光度を用いて、cDNA濃度を算出した。
【0130】
実施例2.11.−cDNAハイブリダイゼーション/蛍光分析。95℃でのアニーリングの後、3.5×SSC及び0.3%SDS緩衝液中におけるCy5標識cDNAを、Agilentのハイブリダイゼーションキットで、デンドロンで修飾したスライドガラス上における96種類のプローブDNAと、45℃で12時間ハイブリダイズさせた。反応後、基板を37℃で30秒間撹拌し、ハイブリダイゼーション緩衝溶液(7.0mMのドデシル硫酸ナトリウムを含有する2×SSPE緩衝液(pH7.4))中で1分間浸漬し、それを繰り返した。基板を、30mMの塩化ナトリウムと3.0mMのクエン酸ナトリウムとを含有する0.2×SSC緩衝液で1分間洗浄し、非特異的に結合したオリゴヌクレオチドを除去した。cDNAの蛍光強度を、MolecularDevicesから入手したGenePix(登録商標)Personal 4100Aにより測定した。
【0131】
実施例3−AFM力測定。全ての力測定は、Nano Wizard AFM(JPK Instrument)で行った。各実験の前に、各AFM探針のばね定数を、熱変動法により、溶液中で較正した。採用したカンチレバーのばね定数は、1nm当たり12pN〜15pNの間で変動した。全ての測定は、新たなPBS緩衝液(pH7.4)中において室温で実施した。力曲線を、基板上の10μm×10μmの領域中における100ピクセルの1つの位置で、20回より多数回、常に記録し、且つ同じ表面に対して少なくとも3つの他の領域を試験した。様々な探針及び試料を使用して実験を多数回繰り返したこと、及び報告される力のデータは一貫して再現性を有していたことも留意されるべきである。
【0132】
実施例4−結果
遺伝子型決定−本発明者らは、表面上のプローブDNAとハイブリダイズした標的DNAと、AFM−探針上の検出DNAとの間の力を、力基準のAFMにより測定することにより、標的DNAを検出する感度を試験した(図1(a))。全ての実験において、DNAオリゴヌクレオチドは、先に説明したデンドロンに基づく表面官能化方法の修正方法を使用して、シリコン基板又はシリコン窒化物AFM探針と共有結合した(表2)。
【0133】
表2.遺伝子型決定実験に使用したDNAの名称及び配列
【表2】

【0134】
35merの標的DNAをデンドロンで修飾した基板上に固定化した15merのプローブDNAとハイブリダイズさせた後、次に力対距離の測定値を、AFM探針上の官能化した15merの検出DNAとハイブリダイゼーション事象に関与しない残りの15merの標的DNAの表面とを離接しながら記録した。AFM力実験を、10μm×10μmの面積の100個の位置で、実施した。力の測定を、1つの位置当たり20回実施した。1aMの標的DNAをプローブDNAとハイブリダイズさせると、標的DNAが存在する2つの位置でDNA間の力が観察された。標的DNAと検出DNAとの間の特定の力(ヒストグラム曲線においてガウスフィッティングにより26±0.6pN)を測定する確率は80%であり、DNAが見出された1つの位置において20%の力−距離曲線では力は観察されなかった(図1(b))。かかる極めて低い量の生物学的試料の検出は、臨床的診断及び検出にとっての重要な挑戦である。本発明の方法は、高密度マイクロアレイシステムで実現可能な105という数字よりも良好であり、且つ定量PCR(qPCR)に対して通常観察される103〜104のレベルに接近するレベルである、≦103の標的分子を標識することなく検出可能な感度を示す22。
【0135】
このシステムは、遺伝子型決定だけでなく標的DNAにおける単一ヌクレオチド多型(SNP)にも適用することができる。過去の仕事において、デンドロンの表面は、一塩基変異を検出する高いSNP能力を示した。一塩基変異を有する標的DNAとのハイブリダイゼーションの場合においては、基板上に二本鎖として存在する標的DNAの数は、相対的により相補的な標的DNA(完全に相補的なDNA等)とハイブリダイズするプローブDNAの数より小さい。したがって、結合した標的DNAを観察する確率は、点変異を含有する標的DNAの場合には減少した。この方法は、単一ヌクレオチド多型から相対的により相補的な標的DNAを識別することができる。
【0136】
遺伝子発現プロファイリング−cDNAは、逆転写によりmRNAから調製したので、5’末端に50個〜250個のチミン残基を有する。したがって、30個のアデニン残基から成る検出DNAを使用した場合には、バイオ−AFM測定によりcDNAの存在を確認することが可能である(表3)。バイオ−AFMを使用する方法の検出限界の向上を確認するために、DNAマイクロアレイ実験を実施し、高い蛍光強度を有するプローブDNAを選択した。標準的な蛍光に基づくマイクロアレイ実験の検出限界は、62pg/μlであった。cDNAが検出された2個のスポットは、使用するcDNA濃度を0.62fg/μlとした場合に、バイオ−AFM実験で見出され得る。換言すれば、バイオ−AFM測定の感度は、マイクロアレイの105倍増大した(図2(c))。
【0137】
表3.遺伝子発現プロファイリング実験で使用したDNAの名称及び配列
【表3】

【0138】
検出DNAとしてポリチミン残基を使用した場合には、このシステムは、mRNAからcDNAを調製する複雑なプロセスなしに、mRNAの直接検出に適用され得る。たいていのmRNAは3’末端にポリアデニン残基を有するので、検出DNAの配列を変更することなく、1つのAFM探針が複数の標的mRNAを検出することができる。すなわち、バイオ−AFM法は、qPCRと同様の感度を有し、標識することなくDNAマイクロアレイ同様の並行検出を実施することができる。
【0139】
デンドロンにより実現される広範なウィンドウの側方空間形成は、別の顕著な利点である。3nmより大きい、推定では最大10nmの空間形成が意図される。より大きい空間形成は、側方立体障害を最小としながら、より大きな生体分子を固定化するのに有効である。したがって、本発明のシステムは、遺伝子型決定又は遺伝子発現プロファイリングだけでなく、DNA−タンパク質相互作用、及びタンパク質−タンパク質相互作用を決定するためのバイオチップにも適用される。
【0140】
実施例5
蛍光標識を使用する従来のDNAチップアッセイ技法の限界を決定するために、本発明者らは、図3(a)に示すように、チップ表面上に塩基数20のDNAプローブを結合し、5’末端にCy3蛍光標識を含有する塩基数35の標識DNAとハイブリダイズさせた。
【0141】
本発明者らが高レベルから低レベルまで標的DNAの濃度を変化させて蛍光スキャナーを使用してDNAチップを試験すると、図4に示すように、1pMもの低さでDNA検出がなされた。
【0142】
蛍光法との比較でバイオ−AFMを使用して、本発明者らは、標的DNAと検出DNAとの間の力を測定することにより、図5に示すように、10μm×10μmの面積中に100個のスポットを有する力の地図を取得することができた。検出DNAと標的DNAとの両方を、GC部分が60%となるように調整した。本発明者らは、プローブDNAが検出DNAよりも塩基を5個多く含有するものとすることにより、プローブDNAと標的DNAとの間の相互作用力を、検出DNAと標的DNAとの間の相互作用力よりも増大させた。このことが、標的DNAがAFM探針に引きつけられるのを防止するため、連続的な力の測定が可能である。
【0143】
図5に示すように、標的DNAが存在しないと想定される場合には相互作用力は検出されず、標的DNAが図6でハイブリダイズした場合には標的DNAと検出DNAとの間に27pNの相互作用力が測定された。加えて、バイオ−AFM法は、蛍光法よりもさらに増強した1aMもの低さの標的DNAを検出することができた。この濃度レベルでもPCRなしでDNAアッセイを行うことができ、このことは本発明の方法が有する蛍光アッセイ等の光学アッセイより優れた別の利点である。さらに図7は、標的DNAの濃度と検出感度との間の直線関係を示す。
【0144】
上述したように、PCRによる増幅はバイオ−AFM法に必要とされないので、標的DNAが存在するかどうかは、前処理なしでの単純なバイオ−AFM実験により試験され得る。これまで、ナノ粒子、銀液(silver liquid)添加及び電気的特性を使用することによりDNA検出限界を減少させるために多くの努力がなされてきた。しかし、それらは、複雑な前処理手順を必要とし、再現性が低いという点において、不利益を有する。バイオ−AFMは、再現性のあるデータを提供し、標的DNAの前操作を必要としない。
【0145】
実施例5.1−非特異的DNA力測定
本発明者らは、標的DNAが存在しない場合には、検出DNAとプローブDNAとの間の相互作用力は全く検出されないことを確認した。本発明者らは、検出DNAと結合する標的DNAの領域を非相補的なものとなるように修飾し、プローブDNAと結合する標的DNAを相補的なものとなるように設計した。この実験において、本発明者らは、図8に示すように、標的DNAと検出DNAとの間に非特異的結合が生じないことを観察した。
【0146】
実施例5.2−一塩基変異検出実験
DNAチップ上での一塩基変異に対するバイオ−AFMの検出能力を決定する。この実験からは、プローブDNAと標的DNAとの間で一塩基が異なるという結果が観察される。プローブDNAと標的DNAとの間で一塩基変異が存在する場合には、ハイブリダイゼーション率は減少し、検出DNAと標的DNAとの間の力測定率が同様に減少する。
【0147】
実施例5.3−プローブDNA及び標的DNAの架橋結合を使用するDNAチップアッセイ
プローブDNAと標的DNAとをハイブリダイズした後、ハイブリダイズしたDNAを、化学的方法を含むがこれらに限定されない様々な方法を使用して架橋結合し、標的DNAと検出DNAとの間の力を測定する(is measure)。図9に示すように、様々な種類の標的DNAが、プローブDNAの塩基長にかかわらず、検出され得る。
【0148】
実施例5.4−ストレプトアビジン−ビオチン結合を使用する、検出感度の向上
上述した架橋結合方法を使用したプローブDNAと標的DNAとの結合の後、標的DNAの末端でストレプトアビジンと結合を形成する場合には、標的DNAは、ビオチンと結合しているAFM探針を使用してストレプトアビジンとビオチンとの間の結合強度を測定することにより、検出することができる。特に、塩基数15のDNAの間のハイブリダイゼーション強度は、約27pNである。これは実際のノイズと大きさにおいてさほど変わらず、差異を識別するのは困難である。ストレプトアビジンとビオチンとの間の結合強度は100pNより大きいので、図10に示すように、シグナル対ノイズの比は向上する。
【0149】
実施例5.5−抗原−抗体結合を使用する検出感度の向上
プローブDNA及び標的DNAを架橋結合した後、抗原を標的DNAの末端に結合する。抗体と結合しているAFM探針を使用して抗原−抗体結合の強度を測定することにより、図11に示すように標的DNAを検出することができる。
【0150】
実施例5.6−タンパク質−DNA結合のDNAチップアッセイ
一本鎖DNAと、AFM探針表面上のDNAと選択的に結合することができるタンパク質とを結合した後、DNAチップアッセイを実施することができる。タンパク質と一本鎖DNAとの間の力の測定率は、標的DNAが高濃度で存在する場合には、減少する。標的DNAの濃度レベルをより低い程度まで低下させると、力の測定率は増大するであろうし、その場合、これをDNAチップアッセイとして使用することができる。タンパク質−DNA結合を検出する条件を最適化することは、当業者の技能の範囲内であるであろう。
【0151】
一方で、二本鎖DNAと選択的に結合するタンパク質が、AFM探針表面に結合している。DNAチップアッセイを実施する。低濃度の標的DNA中でハイブリダイズさせた後でタンパク質と標的DNAとの間の力を測定する実験を行った場合、二本鎖DNAが存在する確率は減少するであろう。標的DNAの濃度を増大させることにより、二本鎖DNAを検出する確率は増大し、タンパク質と二本鎖DNAとの間の力の測定率も増大する(図12)。
【0152】
実施例5.7−三本鎖DNA構造に対するDNAチップアッセイ
特定の塩基配列を有する検出DNAをAFM探針上に結合し、三本鎖形成を誘発する化学物質又はタンパク質を添加した後に、DNAチップアッセイを実施する。標的DNAとプローブDNAとがハイブリダイズする領域では、三本鎖DNAが形成される。三本鎖DNAが形成されると、バイオ−AFMは力を測定することができ、標的DNAの存在を確認することができる(図13)。
【0153】
実施例5.8−挿入したDNAのDNAチップアッセイ
EtBr(エチジウムブロマイド)等の二本鎖核酸挿入剤が、AFM探針と結合している。標的DNAとプローブDNAとがハイブリダイズする二本鎖領域での力を測定することによりDNAアッセイを実施することができる(図14)。
【0154】
実施例5.9−MutSタンパク質を使用する一塩基変異アッセイのためのDNAアッセイチップ開発
MutSタンパク質は、完全に相補的なDNAよりもむしろ一塩基変異を有する二本鎖DNAに選択的に結合する。AFM探針上にMutSタンパク質を結合させること、及びDNAとタンパク質との間の結合力を測定することにより、DNAアッセイを実施する。相補的DNA二本鎖が存在する領域においては、力は測定されない。一塩基変異が存在する領域においては、力が測定される。一塩基変異に対するDNAチップアッセイは、検出率が観察される間接的な方法としてではなく、直接的に力を測定することにより実施される(図15)。
【0155】
実施例5.10−DNA間の力測定を使用するデンドロン表面上におけるDNAチップアッセイ
制御されたメソ空間を有するデンドロン固体基板が開示される。表面上の分子種間の空間は、望ましくない立体障害を低減するために維持され、分子種間の相互作用を検出するための環境をもたらす。分子種は、タンパク質、抗原、抗体、シグナルペプチド、膜タンパク質、小分子、ステロイド、グルコース、DNA、RNA等を含むがこれらに限定されない。したがって、例えば、バイオ−AFMにより標的DNAと検出DNAとの間の力を測定するためにデンドロンの表面を使用することは、非特異的結合を生じないので、分子種間の空間が制御されない環境、又は空間を制御するために混合的な自己集合が使用される環境と比較して性能を向上させるであろう。特に、ストレプトアビジン−ビオチン法又は抗原−抗体法により検出感度を増大させる方法はDNAより大きなタンパク質を含み、デンドロンの拡張的生成は、潜在的な立体障害の問題を解決するであろう。
【0156】
デンドロンを調製する方法と、デンドロンで表面又は基板をコーティングする方法と、及びデンドロンの末端に分子種を結合する方法とは、国際公開第2005/026191号パンフレット及び国際公開第2006/016787号パンフレットで説明され、その内容は、デンドロンを作製する方法と、表面又は基板をコーティングする際におけるデンドロンの使用と、デンドロンの先端への分子種の設置とのために、その全体が参照により本明細書に援用される。ナノレベル又はマイクロレベルのプローブDNAプリンティングのためのディップペン法又はマイクロコンタクトプリンティング法は、前処理したガラス若しくはシリコン表面又は基板上で実施される。分子種が結合し、アレイが作製される。その後標的DNAをハイブリダイズし、上述のバイオ−AFMを使用して、標的DNAと検出DNAとの間の力が測定される(図16)。アッセイは、架橋結合を使用するストレプトアビジン−ビオチン法、又は抗原−抗体力測定法等の、上述の様々な他の修正した方法により、実施することができる。
【0157】
実施例5.11−DNA間の力の測定による、遺伝子発現研究
DNAチップでの従来の遺伝子発現決定では、組織又は細胞から抽出したmRNAを逆転写し、蛍光色素を付加し、様々な種類のプローブDNAが結合しているチップ上でハイブリダイズすることにより、cDNAを作製する。スポットの蛍光強度を解析する。或る特定の遺伝子の発現レベルをモニタリングすることができる。バイオ−AFMによる力測定を、このシステムにおいて適用し、遺伝子発現研究の新しい概念を見出すことができる。バイオ−AFMによる力測定は、DNA間の力を測定するための上述の方法、又は架橋結合を使用するストレプトアビジン−ビオチン法、又は抗原−抗体間の力測定法であり得る。
【0158】
バイオ−AFM力測定法を使用する遺伝子発現決定の例は、以下の通りである。mRNAの3’末端は20個〜250個のポリAを有するので、逆転写によりcDNAを作製すると、該cDNAは相補的なポリTを含有する。cDNA上のポリTを検出DNAに対する結合領域とし、AFM探針上のポリA検出DNA配列を結合させる。力は、次にA−Tハイブリダイゼーションにより測定される。したがって、cDNAと様々なプローブDNAとの間の結合強度の力を測定し、検出率を決定することにより、他と比較してより強く発現している遺伝子が発見される(図17)。
【0159】
加えて、組織又は細胞から抽出されるmRNAがアッセイには小量であるので、この遺伝子発現研究においては、逆転写によりmRNAから作製されるcDNAの量は、遺伝子発現研究には概して十分でない。このため、cDNAの量を、線形増幅等の増幅方法により増大させる。しかし、バイオ−AFM実験では、検出限界をアトモルレベルまで低減することができる。したがって、mRNA発現レベルの差異についてのアッセイは、逆転写又は増幅を行うことなく直接にプローブDNAを使用して実施することができる。例として、AFMと結合しているポリTオリゴヌクレオチド検出DNAは、mRNAのポリAと直接結合する。付加的な処理手順なしに、力を測定し、直接mRNAを検出する。
【0160】
実施例5.12−DNAナノアレイの実施
従来のDNAマイクロアレイシステムでは、プローブのアレイをスポットする基板表面は、約1mm2の面積を含む。対照的に、ナノアレイは、約10nm2〜100nm2の面積を含む。かかるナノアレイは機器の小型化に有用であり、ケア製品、MEMS及びNEMSの点において適用される。DNAアレイは、ディップペン法又はマイクロコンタクトプリンティング法を使用することにより、ナノレベルで製造される。直接的な標的DNA検出は、溶液中において、約1nm2〜10nm2の面積を有する基板表面上で、実施される。
【0161】
本明細書で引用された全ての引用文献は、その全体が参照により援用される。
【0162】
当業者は、日常的な実験のみを使用して、本明細書で具体的に説明した本発明の特定の実施形態との多くの均等物を認識するだろう、又は確認することができるであろう。かかる均等物は、特許請求の範囲に包含されることが意図される。
【技術分野】
【0001】
本発明は、包括的に、原子間力顕微鏡(AFM)と、チップ上でこれを使用する、装置、及び生体分子間の分子間相互作用を測定する方法とに関する。本発明は、チップ上での生体分子間の相互作用力の測定における、デンドロンでコーティングしたバイオ−AFM探針の使用に関する。
【0002】
[関連出願の相互参照]
本願は、2007年6月14日付けで出願された米国仮特許出願第60/944056号明細書に係る出願を基礎とする優先権を主張し、該出願の内容はその全体が参照により本明細書に援用される。
【背景技術】
【0003】
生物分析科学及び生体工学における最近の進歩は、DNAチップ非特許文献1,非特許文献2、小型バイオセンサー非特許文献3,非特許文献4及び微小流体素子(例えば微小電気機械システム又はバイオMEMS)非特許文献5−7の発達をもたらした。特に、このDNAマイクロアレイ技術は、遺伝子解析を大幅に加速させるので、重要性が増大しているツールである。DNAマイクロアレイ技術は、遺伝子発現と、変異検出と、単一ヌクレオチド多型解析と、他の多くの用途とのモニタリングに使用されてきた非特許文献8。しかし従来のマイクロアレイは、柔軟性、速度、費用及び感度に限界がある。加えて、生体分子は直接的な高感度検出に有用な固有の特性を欠くので、ほとんどの生化学的アッセイは、標識の二次的検出を必要とする。生物学的診断において最も一般的に使用される標識は、有機蛍光色素である。しかし、それでもなお、有機色素には多くの用途におけるその使用を妨げる光退色及び離散励起バンド等の制約がある非特許文献9。
【0004】
単一分子の受容体/リガンド対の解離速度論を研究するための、また単一の生体高分子の機械的特性を探索するための、超高感度の力の測定方法の能力を実証する研究の数が増大している非特許文献10−13。かかる研究は、生物学的プロセスの領域における(例えば、細胞接着における、タンパク質アンフォールディングにおける、及びDNA/RNAオリゴヌクレオチド二本鎖の解離に対する)力の役割に対して多くの見識をもたらした非特許文献14−16。しかしこれらの発達の多くは、表面の機能性及び/又は均一性が高度に規定された表面及び機器を作り出すことがまだ普通のことでないという点において、利用可能な生体分子表面結合方法により現在妨げられている。本発明者らは、デンドロンアレイの形成に基づき、かかる問題に対処する新しいアプローチを報告した。相補的DNAオリゴヌクレオチドで官能化したデンドロン表面の間の力の測定を通じて、本発明者らは、このアプローチにより修飾した表面の幾つかの独特な特性を観察した非特許文献17。
【0005】
その繰り返し単位が1つのコアから直接伸びている錐形分子であるデンドロンは、均一なサイズ及び分子量と、十分に規定された構造とを有する高分枝ポリマーである。表面上での効果的な自己集合のために、そのサイズを正確に制御すること、及びその反応性末端を利用することが可能であるので、デンドロンは、その表面の特徴を分子レベルで精密に調整した新しい材料を作り出すための理想的な構成要素であると考えられる非特許文献18。錐形によりもたらされるメソ空間形成(mesospacing)は、表面に固定化した捕捉プローブDNAの各々に、入ってきた標的DNAとの結合のための十分な空間を提供し、溶液(100:1)中で観察されたのと同様の動力学及び選択性の増強をもたらし、DNAマイクロアレイの有効性を顕著に向上させることが見出された。さらに、観察された高いハイブリダイゼーション量は、隣接するDNAプローブとの間に十分な空間形成がなされたDNAプローブが、ハイブリダイゼーション時に隣接するプローブ又は標的によって最小限度の立体障害しか被っていないことを実証する。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】(1) Fodor, S. P. A. Science 1991, 251, 161-113.
【非特許文献2】(2) Schena, M.; Shalon, D.; Davis, R. W.; Brown, P. O. Science 1995, 270, 467-470.
【非特許文献3】(3) Clark, H. A.; Hoyer, M.; Philbert, M. A.; Kopelman, R. Anal. Chem. 1999, 71, 4831-4836.
【非特許文献4】(4) Dickinson, T. A.; Michael, K. L.; Kauer, J. S.; Walt, D. R. Anal. Chem. 1999, 71, 2192-2198.
【非特許文献5】(5) Harrison, D. J. Science 1993, 261, 895-897.
【非特許文献6】(6) Ramsey, J. M.; Jacobson, S. C; Knapp, M. R. Nat. Med. 1995, 1, 1093-1096.
【非特許文献7】(7) Woolley, A. T.; Mathies, R. A. Proc. Natl. Acad. Sci. USA 1994, 91, 11348- 11352.
【非特許文献8】(8) Christof M. Niemeyer, D. B. Angewandte Chemie International Edition 1999, 38, 2865-2869.
【非特許文献9】(9) Gerion, D.; Chen, F.; Kannan, B.; Fu, A.; Parak, W. J.; Chen, D. J.; Majumdar, A.; Alivisatos, A. P. Anal. Chem. 2003, 75, 4766-4772.
【非特許文献10】(10) Allen, S. R.-S., S. M.; Harris, H.; Davies, M. C; O'Shea, P. Biochemical Society Transactions 2003, 31, 1052-1057. .
【非特許文献11】(11) Clausen-Schaumann, H.; Seitz, M.; Krautbauer, R.; Gaub, H. E. Current Opinion in Chemical Biology 2000, 4, 524-530.
【非特許文献12】(12) Kellermayer, M. S. AA .; Smith, S. B.; Granzier, H. L.; Bustamante, C. Science1997, 276, 1112-1116.
【非特許文献13】(13) Hummer, G.; Szabo, A. Acc. Chem. Res. 2005, 38, 504-513.
【非特許文献14】(14) Bayas, M. V.; Leung, A.; Evans, E.; Leckband, D. Biophys. J. 2006, 90, 1385- 1395.
【非特許文献15】(15) Evans, E.; Leung, A.; Heinrich, V.; Zhu, C. Proceedings of the National Academy of Sciences 2004, 101, 11281-11286.
【非特許文献16】(16) Benoit, M.; Gabriel, D.; Gerisch, G.; Gaub, H. E. Nat Cell Biol 2000, 2, 313-317.
【非特許文献17】(17) Jung, Y. J.; Hong, B. J.; Zhang, W.; Tendler, S. J. B.; Williams, P. M.; Allen, S.; Park, J. W. J. Am. Chem. Soc. 2007, 129, 9349-9355.
【非特許文献18】(18) Hong, B. J.; Oh, S. J.; Youn, T. O.; Kwon, S. H.; Park, J. W. Langmuir 2005, 21, 4257-4261.
【非特許文献19】(19) Schweitzer, B.; Kingsmore, S. Current Opinion in Biotechnology 2001, 12, 21-27 '.
【非特許文献20】(20) Zhao, X.; Tapec-Dytioco, R.; Tan, W. J. Am. Chem. Soc. 2003, 125, 11474-11475.
【非特許文献21】(21) Nygaard, V.; Holden, M.; Loland, A.; Langaas, M.; Myklebost, O.; Hovig, E. BMC Genomics 2005, 6.
【非特許文献22】(22) Eastman, P. S.; Ruan, W.; Doctolero, M.; Nuttall, R.; deFeo, G.; Park, J. S.; Chu, J. S. F.; Cooke, P.; Gray, J. W.; Li, S.; Chen, F. F. Nano Lett. 2006, 6, 1059-1064.
【発明の概要】
【0007】
本願では、出願人は、遺伝子型決定及び遺伝子発現を研究することができる、単純且つ標識不要だが高感度の、力基準の原子間力顕微鏡を使用する本発明のアプローチを説明する。この仕事において本発明者らは、力基準のAFMにより、デンドロンで修飾した表面上のプローブDNAとハイブリダイズした標的DNAと、AFM探針上の検出DNAとの間の力を測定することにより、遺伝子型決定及び遺伝子発現プロファイリングを試験した。デンドロンで修飾した表面、及びAFM探針と組み合わせた本検出方法により、その感度は、蛍光標識法を必要とする従来のDNAマイクロアレイの感度よりも優れていた。
【0008】
本発明の一態様では、標識するプロセスを有しない、遺伝子型決定及び遺伝子発現プロファイリングのための解析ツールとしての力基準の原子間力顕微鏡を対象とする。本発明は、ハイブリダイゼーション/結合の事象に関して十分に測定可能な力をもたらす、DNAを固定化するためのナノスケールで操作したデンドロン表面にも関する。本発明の方法は、高密度マイクロアレイシステムで実現可能な105という数字よりも良好であり、且つ遺伝子型決定研究のための定量PCR(qPCR)に対して通常観察される103〜104のレベルに接近するレベルである、≦103の標的DNAを標識することなく検出可能な感度を示す。バイオAFM測定の感度は、遺伝子発現プロファイリングのための従来のマイクロアレイに対して105倍増大した。デンドロンで修飾した表面の側方空間形成は、高度に予測可能な大きさであり得る。力基準のAFMは、他のバイオチップシステムと容易に適合させることが可能である。
【0009】
別の態様では、本発明は、流体媒体中における標的リガンドの存在を検出する方法であって、(i)流体媒体を固体基板と接触させることであって、固体基板がその表面上にデンドロンのアレイを含み、デンドロンの各々が、中心原子、任意にリンカーを介して、中心原子と結合しているプローブ、及び中心原子と結合しているベース部分であって、固体支持体の表面と結合している複数の末端を有するベース部分を含む、並びに(ii)結合したリガンドとリガンドに対する親和性を有する検出分子との間の結合力を測定することによりプローブ−標的リガンド複合体の存在を決定することであって、検出分子が原子間力顕微鏡(「AFM」)の探針の表面につなぎ留められており、プローブ−標的リガンド複合体と検出分子との間の力の増大の測定が該プローブ−標的リガンド複合体の存在を示す、流体媒体中における標的リガンドの存在を検出する方法を対象とする。
【0010】
好ましい一実施形態では、プローブ−標的リガンド複合体は、オリゴヌクレオチド−相補的核酸複合体である。プローブ−標的リガンド複合体は、低濃度の標的リガンドの存在下で検出されてもよく、該リガンドは少なくとも約1aM、又は約1aM〜約1000aMの濃度である。上記方法は、オリゴヌクレオチド−相補的核酸複合体における単一ヌクレオチド多型を識別することができる。
【0011】
検出分子は、検出核酸であり得る。検出分子は、RNAのポリ−dAセクションと十分に相補的なポリ−dTオリゴマーを含み得る。固体基板は、無孔性の固体支持体であり得る。固体基板は、シリカを含むがこれに限定されない、平面的な無孔性の固体支持体であり得る。原子間力顕微鏡(「AFM」)の探針は、デンドロンでコーティングされていてもよい。別の実施形態では、標的リガンドは、標識されていなくてもよい。本方法は、架橋結合したプローブ−リガンド複合体をさらに含み得る。又は、プローブ−リガンド複合体は、親和性分子と共有結合していてもよく、且つ検出分子は、親和性分子と特異的に結合する。親和性分子は、抗原又は抗体であり得る。検出分子は、二本鎖DNAと選択的に結合するタンパク質であり得る。又は、プローブ−リガンド複合体は、検出分子と三重らせん構造を形成し得る。検出分子は、DNA挿入剤であり得る。検出分子は、二本鎖DNAのミスマッチセクションと選択的に結合するタンパク質でもあり得る。また、アレイは、チップ上で表示され得る。
【0012】
本発明は、標的核酸を検出するシステムであって、(i)プローブ分子を固定化したチップと、(ii)その上に検出分子をつなぎ留めた探針を含む原子間力顕微鏡(「AFM」)とを含む、標的核酸を検出するシステムも対象とする。該チップは、その上にプローブ分子をつなぎ留めたデンドロンでコーティングされていてもよい。また、AFMの探針は、その上に検出分子を固定化したデンドロンでコーティングされていてもよい。
【0013】
本発明のこれらの、及び他の目的は、以下の本発明の説明と、ここで添付した参照図面と、ここで添付した特許請求の範囲とにより、より十分に理解されるであろう。
【0014】
本発明は、以下に提供する詳細な説明と、添付した図面とからより十分に理解されるであろう。この詳細な説明と図面とは、例示として与えられているにすぎず、したがって本発明を限定するものではない。
【図面の簡単な説明】
【0015】
【図1】a:本研究の範囲内で説明する測定のために採用した実験設定の概要を示す図である。標的DNAを、デンドロンで修飾した表面上に固定化したプローブDNAとハイブリダイズさせた後、検出DNAをつなぎ留めているAFM探針と、基板とを離接させることにより、力の測定値を記録した。 b:典型的な測定(挿入図:出力の減少(retract traces)(青色の曲線))、及び相補的な15merの配列に対して記録した接着力の分布を示す図である。
【図2】a:成熟真核生物mRNAの構造を示す図である。十分にプロセシングされたmRNAは、5’キャップ、5’UTR、コード領域、3’UTR及びポリAテールを含む。 b:デンドロン表面上に固定化した64種類のプローブDNAと、ユニバーサルヒト基準全RNA(UHRR)から調製したcDNAとの間のハイブリダイゼーション後のDNAマイクロアレイ実験の蛍光画像を示す図である。白い矢印は、プローブ番号62のDNAを示す。 c:0.62fg/μlのUHRRとのハイブリダイゼーション後の力のマッピング画像を示す図である。
【図3】a:蛍光標識を使用するDNAチップアッセイを示す図である。 b:バイオ−AFMを使用するDNAチップアッセイを示す図である。
【図4】a:蛍光標識を使用するDNAチップアッセイを示す図である(標的DNA 1pM)。 b:蛍光標識を使用するDNAチップアッセイを示す図である(標的DNA 100fM)。
【図5】a:バイオ−AFMを使用する標的DNAと検出DNAとの間の力の地図を示す図である(標的DNA 1pM)。 b:バイオ−AFMを使用する標的DNAと検出DNAとの間の力の地図を示す図である(標的DNA 10fM)。 c:バイオ−AFMを使用する標的DNAと検出DNAとの間の力の地図を示す図である(標的DNA 100aM)。 d:バイオ−AFMを使用する標的DNAと検出DNAとの間の力の地図を示す図である(標的DNA 1aM)。
【図6】標的DNAと検出DNAとの間の力−距離測定結果を示す図である。
【図7】標的DNA濃度と検出感度との間の直線関係を示す図である。
【図8】バイオ−AFMを使用する非相補的な標的DNAと検出DNAとの間の力の地図を示す図である。
【図9】架橋結合したプローブDNA及び標的DNAのDNAチップアッセイを示す図である。
【図10】ストレプトアビジン−ビオチン結合のDNAチップアッセイを示す図である。
【図11】抗原−抗体結合のDNAチップアッセイを示す図である。
【図12】タンパク質−DNA結合のDNAチップアッセイを示す図である。
【図13】三本鎖DNA構造のDNAチップアッセイを示す図である。
【図14】挿入したDNAのDNAチップアッセイを示す図である。
【図15】MutSタンパク質を使用する一塩基変異のDNAチップアッセイを示す図である。
【図16】DNA間の力の測定を使用するデンドロン表面のDNAチップアッセイを示す図である。
【図17】バイオ−AFMを使用する遺伝子発現決定を示す図である。
【発明を実施するための形態】
【0016】
本願において「a」及び「an」は、単数及び複数の両方の対象を表すために使用される。
【0017】
本明細書で用いられるところの「アプタマー」は、一本鎖の、部分的に一本鎖の、部分的に二本鎖の、又は二本鎖のヌクレオチド配列、有利には複製可能なヌクレオチド配列であって、ワトソン−クリック塩基対形成又は三本鎖形成以外のメカニズムにより、選択された非オリゴヌクレオチド分子又は分子群を特異的に認識することができるヌクレオチド配列を意味する。
【0018】
本明細書で用いられるところの「親和性分子」は、プローブ/標的リガンド複合体と結合している分子を表す。親和性分子は、プローブ、標的リガンド又は両方と結合することができ、このプローブ、標的リガンド又は両方は、プローブ/標的リガンド複合体の存在を検出するために、後に検出分子により検出される。親和性分子は、いずれかのタイプの生体分子であり得る。かかる親和性分子の例は抗原であり、これは上記複合体と結合し、原子間力顕微鏡の探針の表面に取り付けられた検出抗体により検出される。別の例は、ストレプトアビジンと結合したプローブ/標的リガンド複合体を含む。原子間力顕微鏡の探針の表面につなぎ留められた「検出ビオチン」は、間接的にプローブ/リガンド複合体の存在を示すストレプトアビジンの存在を検出するために使用される。
【0019】
本明細書で用いられるところの「アレイ」及び「ライブラリ」は、本明細書では交換可能な用語として使用され、無作為又は無作為でない、分子、材料、表面、構造的形状、表面特徴、又は任意に且つ非限定的に、様々な化学的部分(chemical entities)、モノマー、ポリマー、構造、前駆体、生成物、修正物(modifications)、誘導体、物質、立体構造、形状若しくは特徴の、混合物、収集物又は組合せ(assortment)を表す。「アレイ」又は「固体支持体上の領域のアレイ」は、固体支持体の表面に形成される、各々が有限の面積を有する好ましくは分離した領域の、線形アレイ又は二次元アレイを表す。
【0020】
本明細書で用いられるところの「アレイライブラリ(arrayed library)」は、固体基板上のマイクロタイター(マルチウェル)ディッシュ又はプレートにおける二次元アレイに設置される個々のプローブ分子を表す。プレートの同一性と、そのプレート上のクローンの位置(行及び列)とが重要である。クローンのアレイライブラリは、特定の遺伝子又は目的の遺伝子領域についてのスクリーニング、及び物理地図の作成、遺伝子型決定、SNPの同定、遺伝子発現プロファイリング等を含む、多くの用途のために使用され得る。
【0021】
本明細書で用いられるところの「二官能性」、「三官能性」及び「多官能性」は、合成ポリマー又は多価ホモポリマー性若しくはヘテロポリマー性ハイブリッド構造に関して使用される場合には、2つ、3つ若しくは複数の特異的認識要素、規定された配列セグメント、若しくは結合部位であり得るか、又はそれらを含む場合のように、二価、三価又は多価を意味する。
【0022】
本明細書で用いられるところの「バイオチップ」又は「チップ」は、より高いスループット及び速度を実現するために、多くの試験を同時に行うことを可能にする、固体基板上に配置した小型試験部位の収集物(マイクロアレイ又はナノアレイ)である。バイオチップは、伝統的に大きな検知ツールをさらに小さい空間に詰め込むために使用される。これらのチップは、本質的に、何百又は何千もの生化学反応を同時に行うことができる小型の実験室である。バイオチップは、研究者が、疾患診断からバイオテロ剤の検出までの様々な目的のために多数の生物学的分析対象を迅速にスクリーニングすることを可能にする。実際の検知用構成部分(すなわち「チップ」)は、分析システム全体のほんの一部分である。実際の検知事象(DNA結合、酸化/還元等)をコンピュータが理解可能な形式(力、電圧、光強度、質量等の測定値)に翻訳するために、変換が行われる必要があり、それによりその後、付加的な分析とヒトが読むことができる最終的な出力をもたらすための処理とが可能となる。チップは、典型的には、集積回路を製作するために伝統的に使用されるマイクロリソグラフィー法を使用して製造される。
【0023】
本明細書で用いられるところの「生体模倣(biomimetic)」は、生物学的な分子、分子群、構造を模倣する分子、基、多分子構造又は方法を意味する。
【0024】
本明細書で用いられるところの、基板上に固定化したプローブライブラリに関して使用される「cDNAライブラリ」は、標的リガンドに特異的であり得るプローブ分子から構成されるライブラリを表す。
【0025】
本明細書で用いられるところの「樹枝状分子」は、コアまで又はコアから分枝した層の連続付加又は段階付加(generationaladdition)により形成される規則的な樹枝状分枝を示す分子である。
【0026】
「デンドロン」という用語は、コアまで又はコアから分枝した層の連続付加又は段階付加により形成される規則的な樹枝状分枝を示すポリマーを表す。樹枝状ポリマーという用語は、コアと、少なくとも1つの内部分枝層と、表面分枝層とを特徴とする「デンドリマー」を包含する(例えば、Petar et al. Pages 641-645 In Chem. in Britain、(August 1994)を参照されたい)。「デンドロン」は、焦点又は中心原子から分枝が出ているデンドリマーの一種であり、直接的に、又は連結部分を介してコアに連結されており、又は連結されることがあり、デンドリマーを形成する。多くのデンドリマーは、共通のコアに連結された2つ以上のデンドロンを含む。
【0027】
デンドロンは、対称的及び非対称的な分枝デンドリマー、カスケード分子、アルボロール(arborol)等を含むが、これらに限定されない。幾つかの実施形態では、分枝アームは、長さが等しい。しかし、非対称的なデンドリマーも使用され得ることも意図される。
【0028】
さらに、分枝層の規則的な連続付加により形成されるのではない場合であっても、高分枝ポリマー、例えば高分枝ポリオールは、分枝パターンがデンドリマーの分枝パターンに近い程度の規則性を示す樹枝状ポリマーと均等であり得ることが理解される。
【0029】
本明細書で用いられるところの、「検出DNA」、「検出リガンド」、「検出オリゴマー」等の「検出分子」は、プローブ/標的複合体における結合力を決定するために使用されるAFMの探針と結合している分子を表す。
【0030】
本明細書で用いられるところの、巨大分子又はデンドロン構造を説明するために使用される「高分枝」又は「分枝」は、基板と共有結合又はイオン結合することができる複数の末端を有する複数のポリマーを表すことを意味する。一実施形態では、分枝構造又は高分枝構造を含む巨大分子は、「予め作製され(pre-made)」、次に基板と結合する。したがって、本発明の巨大分子は、米国特許第5,624,711号明細書(Sundberg et al.)に開示される架橋結合法によるポリマーを除く。
【0031】
本明細書で用いられるところの「固定化した」は、不溶化したこと、又は不溶性の、部分的に不溶性の、コロイド性の、粒子性の、分散した、懸濁した及び/又は脱水した物質、若しくは固体支持体を含む若しくは固体支持体と結合している分子若しくは固相を含むこと、これと結合していること若しくはこれと操作可能に関連することを意味する。
【0032】
本明細書で用いられるところの「リンカー分子」及び「リンカー」は、分枝/直鎖ポリマー等の大きさを制御した巨大分子の分枝部分を保護基又はリガンドに連結する分子に関して使用され得る。リンカーは、例えばスペーサ分子、例えばリガンドをデンドロンと結合することができる選択された分子を含み得るが、これらに限定されない。
【0033】
本明細書で用いられるところの、標的リガンドが検出可能であるように必要とされる「低濃度」の標的リガンドは、本発明の標的リガンド検出方法の強力な感度を示すために、本明細書において使用される。この標的リガンドの検出可能な量の濃度のかかる下限は、1aM〜10000aM、1aM〜1000aM、1aM〜100aM、又は1aM〜10aMの濃度を含み得る。
【0034】
本明細書で用いられるところの「低密度」は、1nm2当たり約0.005〜約0.5のプローブ、好ましくは1nm2当たり約0.01〜約0.2のプローブ、より好ましくは1nm2当たり約0.01〜約0.1のプローブ、及び最も好ましくは1nm2当たり約0.05のプローブを表す。
【0035】
本明細書で用いられるところの「マイクロアレイ」は、分離した領域の密度が少なくとも約100/cm2、好ましくは少なくとも約1000/cm2である、領域のアレイを表す。マイクロアレイにおける領域は、例えば約10μm〜250μmの範囲の直径のような典型的な寸法を有し、アレイ中においておよそ同じ距離で他の領域と分離され得る。マイクロアレイは、転写の発現、又は一連の細胞における発現した遺伝子のプロファイル、又は遺伝子中における変異の検出を試験するために採用することができる、選択された一連のプローブ分子を含み得る。
【0036】
本明細書で用いられるところの「ナノアレイ」は、分離した領域の密度が少なくとも約1000/mm2、好ましくは少なくとも約100000/mm2である、領域のアレイを表す。ナノアレイにおける領域は、例えば約10nm〜1000nmの範囲の直径のような典型的な寸法を有し、アレイ中においておよそ同じ距離で他の領域と分離され得る。ナノアレイは、転写の発現、又は一連の細胞における発現した遺伝子のプロファイル、又は遺伝子中における変異の検出を試験するために採用することができる、選択された一連のプローブ分子を含み得る。
【0037】
本明細書で用いられるところの「分子模倣体(molecular mimics)」及び「模倣体(mimetics)」は、例えば天然分子、生物学的分子又は選択性分子のような別の分子又は分子群の構造又は機能と同等又は類似の構造又は機能を有するように設計、選択、製造、修飾又は操作された(engineered)天然又は合成のヌクレオチド分子又は非ヌクレオチド分子又は分子群である。分子模倣体は、天然分子、合成分子、選択性分子又は生物学的分子の置換形態(replacements)、代替形態、改良形態(upgrades)、改善形態(improvements)、構造的類似体又は機能的類似体として機能することができる分子及び多分子構造を含む。
【0038】
本明細書で用いられるところの「ヌクレオチド類似体」は、核酸合成及び加工、好ましくは酵素的及び化学的な合成及び加工において天然の塩基の代わりに使用することができる分子、特に塩基対形成が可能な修飾ヌクレオチドと、任意にアデニン、グアニン、シトシン、チミジン、ウラシル又は微量塩基を含まない合成塩基とを表す。この用語は、修飾プリン及びピリミジンと、微量塩基と、変換可能なヌクレオシドと、プリン及びピリミジンの構造的類似体と、標識、誘導体化及び修飾したヌクレオシド及びヌクレオチドと、複合体形成したヌクレオシド及びヌクレオチドと、配列修飾剤と、末端修飾剤と、スペーサ修飾剤と、骨格を修飾したヌクレオチドとを含むがこれらに限定されず、該骨格を修飾したヌクレオチドは、リボース修飾ヌクレオチドと、ホスホロアミデートと、ホスホロチオエートと、ホスホンアミダイト(phosphonamidites)と、メチルホスホネートと、メチルホスホラミダイトと、メチルホスホンアミダイト(methylphosphonamidites)と、5’−β−シアノエチルホスホラミダイトと、メチレンホスホネートと、ホスホロジチオエートと、ペプチド核酸と、アキラル及び中性ヌクレオチド間結合と、ポリエチレングリコール、芳香族ポリアミド及び脂質等の非ヌクレオチド架橋とを含むが、これらに限定されない。
【0039】
本明細書で用いられるところの「ポリマー」又は「分枝ポリマー/直鎖ポリマー」は、分枝部分が基板と結合し直鎖部分がリガンド、プローブ又は保護基と結合するように、分子の1つの端に分枝構造を、及び他の端に直鎖部分を有する分子を表す。
【0040】
本明細書で用いられるところの「ポリペプチド」、「ペプチド」、及び「タンパク質」は、アミノ酸残基のポリマーを表すために、本明細書では交換可能な用語として使用される。この用語は、1つ又は複数のアミノ酸残基が対応天然アミノ酸の人工的な化学的類似体であるアミノ酸ポリマーと、天然アミノ酸ポリマーとに適用される。この用語は、ポリペプチドを構成するアミノ酸を連結する伝統的なペプチド結合についての変異体も含み得る。
【0041】
本明細書で用いられるところの「保護基」は、分子上の反応基(例えばヒドロキシル又はアミン)と連結した基を表す。保護基は、化学反応の1つ又は複数の工程時における特定の遊離基の反応を防止するために選択される。一般的に特定の保護基は、分子中に存在する他の反応基を変化させずに反応基を復元するために後で除去することができるように、選択される。保護基の選択は、保護すべき特定の遊離基と、該遊離基が曝露される化合物とに応じて決まる。保護基の選択は、当業者に既知である。例えば、Greene etal., Protective Groups in Organic Synthesis, 2nd ed., John Wiley & Sons,Inc. Somerset, N.J. (1991)(その内容は、その全体が参照により本明細書に援用される)を参照されたい。
【0042】
本明細書で用いられるところの「保護されたアミン」は、アミノ保護基と反応したアミンを表す。アミノ保護基は、直鎖の先端の官能基がアミノ基である状況において、固体支持体への分枝末端の結合時におけるアミド機能の反応を防止する。アミノ保護基は、後で除去し、分子中に存在する他の反応基を変化させずにアミノ基を復元することができる。例えば、環外アミンを、ジメチルホルムアミドジエチルアセタールと反応させ、ジメチルアミノメチレンアミノ(dimethylaminomethylenamino)機能を形成することができる。アミノ保護基は一般に、カルバメートと、ベンジルラジカルと、イミデートと、当業者に既知の他のものとを含む。好ましいアミノ保護基は、p−ニトロフェニルエトキシカルボニル又はジメチルアミノメチレンアミノを含むが、これらに限定されない。
【0043】
本明細書で用いられるところの「規則的な間隔」は、大きさを制御した巨大分子の先端の間の空間形成を表し、それは、実質的に立体障害なしに標的特異的リガンドと標的との間で相互作用する空間をもたらすための、約1nm〜約100nmの距離である。したがって、基板上の巨大分子の層の密度は高すぎないため、特異的な分子相互作用が生じ得る。
【0044】
本明細書で用いられるところの「固体支持体」は固定化マトリクスを含む組成物を表し、該固定化マトリクスは、不溶化した物質、固相、表面、基板、層、コーティング、織り繊維若しくは不織繊維、マトリクス、結晶、膜、不溶性ポリマー、プラスチック、ガラス、生物学的若しくは生体適合性若しくは生体侵食性(bioerodible)若しくは生分解性のポリマー若しくはマトリクス、マイクロ粒子又はナノ粒子を含むがこれらに限定されない。固体支持体は、例えば、単一層、二重層、商業的膜、樹脂、マトリクス、繊維、分離媒体、クロマトグラフィー支持体、ポリマー、プラスチック、ガラス、雲母、金、ビーズ、マイクロスフェア、ナノスフェア、シリコン、ヒ化ガリウム、有機金属及び無機金属、半導体、絶縁体、マイクロ構造並びにナノ構造を含むがこれらに限定されない。マイクロ構造及びナノ構造は、超小型、ナノメートルスケール且つ超分子のプローブ、探針、バー、ペグ、プラグ、棒、スリーブ、ワイヤ、フィラメント及びチューブを含み得るが、これらに限定されない。
【0045】
本明細書で用いられるところの「特異的結合」は、リガンドとその特異的結合パートナーとの間の、又は規定の配列セグメントと選択された分子又は選択された核酸配列との間の、測定可能であり且つ再現性がある程度の引力を表す。引力の程度は、最適であるために最大である必要はない。弱い、中程度の又は強い引力が、様々な用途にとって適当であり得る。これらの相互作用において起こる特異的結合は、当業者に既知である。規定の合成配列セグメントと、合成アプタマーと、合成ヘテロポリマーと、ヌクレオチドリガンドと、ヌクレオチド受容体と、形状認識要素と、特異的に引力を有する表面とに関して使用され得る。「特異的結合」という用語は、構造的形状及び表面特徴の特異的認識を含み得る。その他、特異的結合は、いずれかの特異的結合パートナーとの化学的同一性(すなわち、1つ又は複数の同一の化学的な群)又は分子認識特性(すなわち、分子結合特異性)を共有する第3の分子(すなわち、競合体)により競合的に阻害され得る2つの分子(すなわち、特異的結合パートナー)の間の特異的、飽和的及び非共有的な相互作用を明確に表す。競合体は、例えば交差反応体、又は抗体若しくはその抗原の類似体、リガンド若しくはその受容体、又はアプタマー若しくはその標的であり得る。抗体とその抗原との間の特異的結合は、例えば、交差反応する抗体により、又は交差反応する抗原により、競合的に阻害され得る。「特異的結合」という用語は、特異的結合及び構造的形状認識の両方を含む特異的認識のサブセットの概略を示す又はそれを省略するために、便宜的に使用され得る。
【0046】
本明細書で用いられるところの「基板」は、物質、構造、表面又は材料に関して使用される場合には、特異的結合、ハイブリダイゼーション若しくは触媒認識部位、又は複数の様々な認識部位、又は表面、構造若しくは材料を含む様々な分子種の数を超える多数の様々な認識部位を含むことが今までに知られていない非生物学的な、合成的な、無生物の、平面的な、球形の、又は扁平な表面を含む組成物を意味する。基板は、例えば半導体、合成(有機)金属、合成半導体、絶縁体及びドーパント;金属、合金、要素、化合物及びミネラル;合成の、切断した、エッチングした、リソグラフした、プリンティングした、機械加工した、及び微細加工したスライド、素子、構造及び表面;工業的ポリマー、プラスチック、膜;シリコン、ケイ酸塩、ガラス、金属及びセラミック;木、紙、段ボール紙、綿、羊毛、衣類、織り繊維若しくは不織繊維、材料及び布;分枝/直鎖ポリマーを介するプローブ分子の固定化により修飾されていないナノ構造及びマイクロ構造を含み得るが、これらに限定されない。
【0047】
本明細書で用いられるところの、アレイシステムとの関連での「標的(target)」又は「標的化すること(targeting)」は、プローブを使用することによりその同一性又は存在量を検出しようとする遊離の核酸転写産物又はそのcDNAを表し、そのためにプローブ分子が作製される個々の遺伝子を特に表す。或る特定の文脈では、「標的化すること」は、プローブ分子を内因的に発現した転写産物又はそのcDNAと結合すること、又は結合させることを意味する。標的ヌクレオチド配列は、限定されることなく、いずれかの遺伝子から選択され得る。
【0048】
本明細書で用いられるところの、標的ライブラリに関して使用される「標的cDNAライブラリ」は、逆転写酵素により全てがcDNA分子に変換された、細胞又は生物中に存在するmRNA分子の全ての収集物を表すので、ライブラリは目的の特異的なcDNA(及びしたがってmRNA)に対して探索され得る。
【0049】
本明細書で用いられるところの「標的−プローブ結合」は、少なくとも1つが選択された分子である2つ以上の分子であって、特異的な様式で互いに結合している、2つ以上の分子を意味する。典型的には、第1の選択された分子は、第2の分子と、間接的に、例えばスペーサアーム、基、分子、架橋、担体若しくは特異的認識パートナーを介して、又は直接的に、すなわち、スペーサアーム、基、分子、架橋、担体若しくは特異的認識パートナーを介さずに、有利には直接の結合により、結合し得る。選択された分子は、ハイブリダイゼーションを介してヌクレオチドと特異的に結合し得る。ヌクレオチド及び非ヌクレオチド分子の複合体形成のための他の非共有的結合の手段は、例えばイオン結合、疎水的相互作用、リガンド−ヌクレオチド結合、キレート剤/金属イオン対形成、又はアビジン/ビオチン、ストレプトアビジン/ビオチン、抗フルオレセイン抗体/フルオレセイン、抗2,4−ジニトロフェノール(DNP)抗体/DNP、抗ペルオキシダーゼ抗体/ペルオキシダーゼ、抗ジゴキシゲニン抗体/ジゴキシゲニン、若しくはより一般的には受容体/リガンド等の特異的結合対形成を含む。例えば標識する目的でアビジン/ビオチン、ストレプトアビジン/ビオチン、抗フルオレセイン抗体/フルオレセイン、抗ペルオキシダーゼ抗体/ペルオキシダーゼ、抗DNP抗体/DNP、抗ジゴキシゲニン抗体/ジゴキシゲニン若しくは受容体/リガンドを使用して、(すなわち、直接的結合又は共有的結合しているのではなく)選択された分子若しくは選択された核酸配列と結合している、例えば、アルカリホスファターゼ、西洋ワサビペルオキシダーゼ、β−ガラクトシダーゼ、ウレアーゼ、ルシフェラーゼ、ローダミン、フルオレセイン、フィコエリトリン、ルミノール、イソルミノール、アクリジニウムエステル、又は蛍光マイクロスフェア等のレポーター分子は、特異的結合対により、選択された分子若しくは選択された核酸配列と複合体を形成し得る。
【0050】
文脈上他に必要な場合以外は、「リガンド」という用語は、プローブと選択的に結合することができるいずれかの物質を表す。リガンドは、抗原、抗体、オリゴヌクレオチド、オリゴペプチド(タンパク質、ホルモン等を含む)、酵素、基質、薬剤、薬剤−受容体、細胞表面、受容体アゴニスト、部分アゴニスト、混合アゴニスト、アンタゴニスト、応答誘発性若しくは刺激性分子、薬剤、ホルモン、フェロモン、伝達物質、オータコイド、増殖因子、サイトカイン、補欠分子族、補酵素、補因子、基質、前駆体、ビタミン、毒素、調節因子、抗原、ハプテン、炭水化物、分子模倣体、構造分子、エフェクター分子、選択性分子、ビオチン、ジゴキシゲニン、交差反応体、類似体、競合体、又はこれらの分子の誘導体と、選択された標的と特異的に結合することができるライブラリで選択された非オリゴヌクレオチド分子と、これらの分子のいずれかを第2の分子と結合させることにより形成される複合体と、対応プローブに選択的に結合するいずれかの他の分子とであり得る。
【0051】
文脈上他に必要な場合以外は、「プローブ」という用語は、基板表面に結合しており、対応リガンドと選択的に結合することができるいずれかの物質を表す。プローブは、抗原、抗体、オリゴヌクレオチド、オリゴペプチド(タンパク質、ホルモン等を含む)、酵素、基質、薬剤、薬剤−受容体、細胞表面、及び対応リガンドに選択的に結合するいずれかの他の分子であり得る。
【0052】
「リガンド」及び「プローブ」という用語は、いずれかの特定の物質又は大きさの関係を表さないことが理解されるべきである。これらの用語は、リガンドと対応プローブとの間の選択的な結合を示す操作上の用語であるにすぎず、基板表面に結合する部分をプローブと称し、プローブと選択的に結合するいずれかの物質をリガンドと称する。したがって抗体が基板表面に結合している場合には、抗体がプローブであり、対応する抗原がリガンドである。しかし、抗原が基板表面に結合している場合には、抗原がプローブであり対応する抗体がリガンドである。
【0053】
基板表面上におけるプローブの濃度は、固定化したプローブとその対応リガンドとの間の相互作用に影響を及ぼす、鍵となる要因の1つである。幾つかの利点にも関わらず、高密度で固定化したプローブは、自然環境に存在する同一のプローブの特性と実質的に異なる化学的及び生物学的特性を有することが多い。さらに、不活性でない高密度のプローブは、非特異的なプローブ−リガンド相互作用を促進し得る。表面材料を立体障害から解放する一方で、バイオセンサー及びバイオチップ等の用途に十分なシグナル強度と、特異性と、見かけの結合容量とを維持するためにも、表面に結合したプローブの密度を変化させることが望ましい。
【0054】
従来から、薄膜の官能基密度は、不活性な吸着質と官能化した吸着質との両方の同時成膜により、通常調整される。しかし、特に基間の強い相互作用が存在する場合には、相異なる官能基を有するマイクロスケール又はナノスケールの微視的領域への相分離を防止することは困難である。
【0055】
本発明の組成物及び方法は、相分離を顕著に低減するプローブ密度を提供する。本発明の幾つかの実施形態は、その表面上に複数の錐形のデンドリマーを含む基板を提供する。これらの実施形態の範囲内において、幾つかの例では各デンドリマーの末端は基板表面と結合することができ、各デンドリマーの先端はプローブの固定化に対して反応性である。
【0056】
遺伝子型決定のための、バイオ−AFMを使用する標的DNAの検出
DNAマイクロアレイは、多数の遺伝子についてのハイスループットの多重解析のための革命的なツールである。微量の遺伝物質しか入手できないことがあるため、マイクロアレイに基づく解析のための高感度の検出方法を開発することが重要である。典型的にはシグナル出力は、2つの分類、すなわち標的増幅とシグナル増幅とに分類される増幅方法により増強される非特許文献19。遺伝子発現解析における標的増幅の利点及び欠点が、最近レビューされた非特許文献20。広範な利用可能性に関わらず、PCRによる標的増幅は、単位複製配列のキャリーオーバーによる材料の汚染、多重化のための能力の制限、増幅効率の変動等の欠点を有する。小量のコピーの試料からのmRNAの増幅も、初期RNA比の歪みと、ノイズ比の増大との問題を有する非特許文献21。
【0057】
加えて、生体分子は直接的な高感度検出に有用な固有の特性を欠くので、ほとんどの生化学的アッセイは、標識の二次的検出を必要とする。生物学的診断において最も一般的に使用される標識は、有機蛍光色素である。しかし、それでもなお、有機色素には多くの用途におけるその使用を妨げる光退色及び離散励起バンド等の制約がある。
【0058】
過去の研究において、本発明者らは、相補的DNAオリゴヌクレオチドのアレイを含むナノスケールで操作したデンドロン表面がどのようにしてハイブリダイゼーションの事象に関する測定可能な引力及び接着力をもたらすことができるのかを示した。重要なことに、本発明者らは、10の塩基対の差異を有するDNA二本鎖間を識別することができる引力及び接着力を検出するためにこのシステムを使用することができ、この測定方法も1つ及び2つの塩基対のミスマッチを検出する感度を有することを示した非特許文献17。
【0059】
以下の実施例1〜実施例4で説明するように、1aMの標的DNA(35オリゴマー)をデンドロンで修飾した表面上のプローブDNA(15オリゴマー)とハイブリダイズすると、標的DNAと検出DNAとの間の特定の力(ヒストグラム曲線においてガウスフィッティングにより26±0.6pN)を測定する確率は80%であり、20%の力−距離曲線では力は観察されなかった(図1(b))。本発明の方法は、高密度マイクロアレイシステムで実現可能な105という数字よりも良好であり、且つ定量PCR(qPCR)に対して通常観察される103〜104のレベルに接近するレベルである、≦103の標的分子を標識することなく検出可能な感度を示す。
【0060】
したがって、デンドロンで修飾した表面は一塩基変異さえも検出するプラットホームとして使用することができるので、本発明のAFMシステムは、遺伝子型決定だけでなく標的DNAにおける単一ヌクレオチド多型(SNP)の検出にも適用することができる。一塩基がミスマッチを生じている標的DNAについては、表面上のプローブDNAと結合する標的DNAの数は、相補的標的DNAの結合数よりも小さい。したがって、表面に結合した標的DNAの数の減少を測定することにより、一塩基がミスマッチを生じている標的DNAと相補的標的DNAとを識別することができる。
【0061】
遺伝子発現プロファイリング研究のための、バイオ−AFMを使用するcDNA標的の検出
発現プロファイリング研究は、実験条件を変化させたときに、統計的に有意な差異を示した遺伝子を報告することが一般的である。DNAマイクロアレイとqPCRとの両方が、相補的核酸配列の選択的(preferential)結合又は「塩基対形成」を利用し、両方が遺伝子発現プロファイリングにおいて、しばしば連続的に、使用される。ハイスループットDNAマイクロアレイはqPCRの定量精度を欠くが、qPCRにより数十の遺伝子の遺伝子発現を測定するには、DNAマイクロアレイを使用して全ゲノムを測定するのに必要な時間とほぼ同じ時間がかかる。したがって、候補遺伝子を同定するために半定量DNAマイクロアレイ解析実験を行い、その後、最も関心のある候補遺伝子の幾つかに対してqPCRを行いマイクロアレイの結果を有効にすることが意味をなすことが多い。しかし、本発明のバイオ−AFMは、DNAマイクロアレイ及びqPCRの幾つかの利点を組み合わせることができる。
【0062】
ポリアデニル化は、核におけるDNAからRNAへの転写後に起こる。ポリアデニル化のシグナルが転写された後、RNAポリメラーゼと関連したエンドヌクレアーゼ複合体の作用によりmRNA鎖は切断される。切断部位は、該切断部位近くの塩基配列AAUAAAの存在を特徴とする。mRNAが切断された後、50個〜250個のアデニン残基を、切断部位で非結合の3’末端に付加する。この反応は、ポリアデニル酸ポリメラーゼにより触媒される(図2(a))。以下の実施例1〜実施例4で示すように、バイオ−AFM測定の感度は、マイクロアレイの105倍増大した(図2(c))。
【0063】
マイクロアレイシステム
プローブ分子を含む様々なタイプの特定のアレイが、多様な動物、植物及び微生物の細胞又は組織において差示的に発現した遺伝子を同定するために、本発明により提供される。これらのタイプのアレイは、発生アレイ、癌アレイ、アポトーシスアレイ、発癌遺伝子及び腫瘍抑制因子アレイ、細胞周期遺伝子アレイ、サイトカイン及びサイトカイン受容体アレイ、増殖因子及び増殖因子受容体アレイ、神経アレイ(neuroarray)等を含むがこれらに限定されない。
【0064】
本発明のアレイは、他の用途の中でも、差示的な遺伝子発現アッセイにおいて使用することができる。例えばアレイは、(a)疾患状態(例えば新生物又は正常)、(b)様々な組織のタイプ、(c)発生段階、(d)外的又は内的刺激への応答、(e)治療への応答、等の差示的な発現解析において有用であり得る。アレイはまた、薬剤の発見及び研究のための大規模の発現スクリーニングにおいて、有用であり得る。加えて、遺伝子発現に対する特定の細胞タイプにおける活性作用物質の効果を研究することにより、薬剤毒性、発癌性、環境モニタリング等についての情報を取得及び解析することができる。
【0065】
一態様では、本発明は、約1cm2未満の表面積において少なくとも103の相異なるプローブ分子のマイクロアレイを有する表面を有する基板を含む。各々の相異なるプローブ分子は、(i)アレイにおける別々の、規定の位置に配置されており、且つ(ii)約0.1フェムトモル〜100ナノモルの規定量で存在する。
【0066】
標的cDNAが取得される細胞は、正常細胞等の目的の細胞から、又は肝臓癌、肺癌、胃癌、乳癌、膀胱癌、直腸癌、大腸癌、前立腺癌、甲状腺癌及び皮膚癌等の様々なタイプの癌細胞、並びに肥満症、毛包、自己免疫疾患及び代謝障害の細胞から選択され得る。
【0067】
好ましい一実施形態では、各マイクロアレイは、約1cm2未満の表面積当たり少なくとも103種類の相異なるプローブ分子を含有する。マイクロアレイは、約16mm2の面積中に少なくとも約400の領域、又は1cm2当たり2.5×103の領域を含有し得る。また、好ましい一実施形態では、各マイクロアレイ領域におけるプローブ分子は、ポリヌクレオチドの場合においては、約0.1フェムトモル〜100ナノモルの規定量で存在し得る。
【0068】
また、好ましい一実施形態では、プローブ(proble)ポリヌクレオチドは、少なくともヌクレオチド数約10の長さを有し、様々なin situでの合成スキームにより、高密度アレイにおいて形成され得る。
【0069】
デンドロン
本発明の幾つかの態様は、デンドロンのアレイを提供する。一般的には、アレイは、少なくとも第1の表面を有する固体支持体と、固体支持体の第1の表面と結合している複数のデンドロンとを含む。各デンドロンが、典型的には、中心原子と、任意にリンカーを介して中心原子と結合している官能基又は保護された形態の官能基と、中心原子と結合しているベース部分であって、固体支持体の第1の表面と結合している複数の末端を有するベース部分とを含む。本明細書で用いられるところの「中心原子」という用語は、分枝が出ている焦点原子を表す。例えば中心原子は、以下の式Iにおいて、Q1として表わされる。デンドロンを表すときの「ベース部分」という用語は、中心原子から出ている複数の分枝を含む部分を表す。幾つかの実施形態では、デンドロンは、固体支持体表面と結合している錐体のベース部分を有する錐形として記載され、又は概略的に示され得る。
【0070】
官能基(又は部分)は、化学反応に関与する分子内の原子又は原子群を表す。一般的には、官能基はヘテロ原子(ハロゲン、酸素、窒素、硫黄、リン(phosphorous)等)又は不飽和(例えば、炭素−炭素二重結合又は三重結合)を含む。代表的な官能基は、アシルハロゲン化物、アルコール、ケトン、アルデヒド、炭酸酸(エステルを含む)、カルボン酸塩、カルボン酸、エーテル、ヒドロペルオキシド、過酸化物、ハロゲン化物、オレフィン、アルキン、アミド、アミン、イミン、イミド、アジド、アゾ、シアン酸塩、イソシアン酸塩、硝酸塩、ニトリル、亜硝酸塩、ニトロ、ニトロソ、ホスフィン、ホスホジエステル、ホスホン酸、ホスホン酸塩、硫化物、チオエーテル、スルホン、スルホン酸、スルホキシド、チオール、チオシアン酸塩、二硫化物、チオアミド、チオエステル、チオケトンを含むがこれらに限定されない。官能基は、求核反応又は求電子反応の対象となることが多い。幾つかの実施形態では、デンドロンの官能基は、求核反応に参加することができる。したがって官能基は、求核試薬又は求電子試薬であり得る。官能基は、プローブを結合するようになっていることが多い。特定の一例では、官能基は求核置換反応によりプローブと結合を形成することができる。
【0071】
官能基は広範なプローブを結合するために使用され、その後該プローブを流体媒体における対応リガンドの存在を検出するために使用することができる。典型的には、官能基がプローブと結合している場合には、プローブの識別効率(例えば、非特異的結合と比較したときの標的特異的結合の量)は、少なくとも約50%、多くの場合少なくとも約70%、より多くの場合少なくとも約80%、最も多くの場合少なくとも約90%である。特定の一実施形態では、官能基がヌクレオチド数15のオリゴヌクレオチドプローブと結合しており、溶液中におけるヌクレオチド数15のオリゴヌクレオチド標的が使用される場合には、単一ヌクレオチド多型(SNP)識別効率は、少なくとも約80%(1:0.2)、多くの場合少なくとも約90%(1:0.1)、より多くの場合少なくとも約95%(1:0.05)、より多くの場合少なくとも99%(1:0.01)である。
【0072】
プローブの識別効率は、様々な方法のいずれかにより、例えば、実質的に同様の反応条件下でのプローブ−リガンド複合体形成の効率及び/又は選択性の比較により、決定することができる。SNP識別効率も、同様に決定することができる。識別効率を測定する代表的な1つの方法は、基板表面に結合した標的特異的プローブのシグナル強度を、基板に結合した標的非特異的プローブのシグナル強度とを比較することである。例えば、基板表面と結合した標的特異的プローブが10nMの標的濃度で100のシグナル強度をもたらし、基板表面と結合した標的非特異的プローブが同じ標的濃度で30のシグナル強度をもたらす場合には、基板表面上におけるプローブの識別効率は、(100−30)/100、すなわち70%(1:0.3)である。
【0073】
幾つかの実施形態では、官能基がヌクレオチド数15〜21のオリゴヌクレオチドプローブと結合している場合には、基板と結合した標的非特異的オリゴヌクレオチドプローブ(例えば、標的特異的オリゴヌクレオチドプローブと、少なくとも1個、多くの場合少なくとも2個、より多くの場合少なくとも3個のヌクレオチドが異なるオリゴヌクレオチドプローブ)のシグナル強度は、基板と結合した標的特異的オリゴヌクレオチドプローブ(例えば、標的DNAの全体又は一部分と完全に相補的なオリゴヌクレオチドプローブ)のシグナル強度と比較して、少なくとも約70%、多くの場合少なくとも約80%、より多くの場合少なくとも約95%、さらにより多くの場合少なくとも約99%低減する。一般的に、異なるオリゴヌクレオチドプローブは、異なる識別効率を有し得る。
【0074】
特定の一実施形態では、官能基がヌクレオチド数15のオリゴヌクレオチドプローブと結合している場合には、特異的結合の量に対する非特異的結合の相対量は、非デンドロンと結合しているオリゴヌクレオチドプローブと比較して、少なくとも約50%、多くの場合少なくとも約60%、より多くの場合少なくとも80%、さらにより多くの場合少なくとも約90%低減する。さらに、非特異的結合を測定する1つの方法は、実施例の節における方法を含む本明細書で説明される方法である。非特異的結合の相対量の低減を決定する特定の方法の1つは、以下の式で与えられる。
【0075】
[(A−B)/A]×100%
【0076】
式中、Aは非デンドロン分子(例えば、APDES修飾表面)を使用する非特異的結合の相対量であり、Bはデンドロンで修飾した表面を使用する非特異的結合の相対量である。C:Tのミスマッチに対する特異的結合の量に対する非特異的結合の相対量は、少なくとも95%[(0.12−0.006)/0.12×100%=95%]低減し得る。
【0077】
さらに他の実施形態では、デンドロンの先端と結合している官能基又は任意のリンカーは、α−ヘリックスを形成しない。いかなる理論にも拘束されるものではないが、α−ヘリックスの存在が識別効率を低減し、及び/又は非特異的結合を増大させ、それによりデンドロンの有用性を低減すると考えられる。
【0078】
本発明の幾つかの態様では、デンドロンは以下の式を有する。
【0079】
Z−[R1]m−Q1−{[R2−Q2]a−{(R3−Q3)b−[(R4−Q4)c−(R5−Y)x]y}z}n
式I
【0080】
式中、
m、a、b及びcの各々は独立して0又は1であり、
cが0の場合にはxは1であり、又はcが1の場合にはxは1からQ4の酸化状態−1までの整数であり、
bが0の場合にはyは1であり、又はbが1の場合にはyは1からQ3の酸化状態−1までの整数であり、
aが0の場合にはzは1であり、又はaが1の場合にはzは1からQ2の酸化状態−1までの整数であり、
nは1からQ1の酸化状態−1までの整数であり、
Q1は酸化状態が少なくとも3の中心原子であり、
Q2、Q3及びQ4の各々は独立して酸化状態が少なくとも3の分枝原子であり、
R1、R2、R3、R4及びR5の各々は独立してリンカーであり、Zは任意に保護される官能基であり、
Yの各々は独立して上記ベース部分の末端上における官能基であり、複数のYが上記固体支持体の上記第1の表面と結合しており、
ただしn、x、y及びzの積は少なくとも3である。
【0081】
a、b又はcが1であり、且つ対応するz、y又はxがそれぞれQ2の酸化状態−1、Q3の酸化状態−1又はQ4の酸化状態−1未満である場合には、Q2、Q3又はQ4と結合している残りの原子はそれぞれ水素であることが理解されるべきである。本明細書で用いられるところの「Q」は、Q1、Q2、Q3、Q4のいずれか1つ又は全てを表す。典型的には、Qは、周期表のIVA群又はVA群の任意の原子である。Qについての代表的な原子は、N、P、C、Si、Ge等を含むがこれらに限定されない。QはN、P、C又はSiであることが多い。
【0082】
式Iに見られるように、Zは、任意にリンカーR1を介して、中心原子に結合している。mは1であり、その結果ZはリンカーR1を介して中心原子に結合していることが多い。さらに、Z又はその非保護形態(すなわち、Zが保護された官能基である場合)は、プローブを結合するようになっている。幾つかの実施形態では、Zは求核試薬である。求核試薬は、結合している電子の両方を供与することによりその反応パートナー(すなわち、求電子試薬)と化学結合を形成する原子又は原子群である。典型的には、求核試薬は、N、P、O及びS等のヘテロ原子、又はカルボアニオン、特に共鳴により、及び/又は近くの電子求引基(複数可)の存在により安定化するカルボアニオンである。有機化学分野の当業者は、式Iのデンドロンに適切な求核試薬を容易に認識することができる。代表的な求核試薬の幾つかは、代表的な官能基において上で開示されている。
【0083】
他の実施形態では、Zは求電子試薬である。求電子試薬は、電子に引きつけられ、求核試薬と結合するために電子対を受容することにより化学反応に参加する原子又は原子群である。たいていの求電子試薬は、正に荷電しているか、部分的な正の電荷を保有する原子を有するか、又は電子のオクテットを有しない原子を有する。典型的には、求電子試薬は、求電子中心と結合している、又は求電子中心の近くにある1つ又は複数の電気陰性原子(例えば、ハロゲン化物又は他のヘテロ原子)のために、少なくとも正の双極子モーメントを有する炭素原子である。有機化学分野の当業者は、式Iのデンドロンに適切な求電子試薬を容易に認識することができる。代表的な求電子試薬の幾つかは、代表的な官能基において上で開示されている。
【0084】
さらに他の実施形態では、Zは、N、O、S、Pから成る群から選択されるヘテロ原子と、それらの組合せとを含む。
【0085】
各々のYは、独立して官能基であり得る。すなわち、各々のYは、他のYの群と無関係であり得る。しかし、Yの全てが同じ官能基であることが多い。しかし、概してZ及びYは異なる官能基である。幾つかの例では、Z及びYは同じ官能基であり得るが、一方又は他方が保護された形態である。官能基、及び/又は保護基の存在におけるかかる差異は、Z及びYの反応性を識別することを可能にし、それにより複数のYを介してデンドロンを固体支持体と結合させることを可能にし、Z上へのプローブの結合を可能にする。
【0086】
リンカー
再び式Iを参照すると、デンドロンは、一般的に様々なリンカー、例えばR1、R2、R3、R4、R5を含む。各リンカーは、分枝原子Q2、Q3又はQ4により別のリンカーと連結されている。末端のリンカーは官能基Yを含み、それにより固体支持体と結合することができる。
【0087】
各リンカーの長さは、固体支持体と結合している分枝官能基の数、固体支持体との結合の強度、所望の空間形成等を含む様々な因子により決定され得る。したがって、リンカーはいずれかの特定の長さのいずれかの特定のタイプの鎖又はポリマーに限定されないことが理解される。しかし、一般的な指針として、リンカーの長さは、約0.5nm〜約20nm、典型的には約0.5nm〜約10nm、多くの場合約0.5nm〜約5nmであり得る。代替的に、各リンカーは、独立して、約1個〜約100個の原子、典型的には約1個〜約50個の原子、多くの場合約1個〜約25個の原子、より多くの場合約3個〜約10個の原子の鎖長を有する鎖である。リンカーの化学的構成は、例えば置換又は非置換のアルキル、アルケニル、アルキニル、シクロアルキル、シクロアルケニル、アリール、エーテル、ポリエーテル、エステル、アミノアルキル、ポリアルケニルグリコール等を含むがこれらに限定されない直鎖又は分枝の有機的部分を含むがこれらに限定されない。
【0088】
リンカーR1、R2、R3、R4、R5は、同じであり得る又は異なり得る。典型的には、各リンカーは、繰り返し単位、直鎖又は分枝の有機的部分である。しかし、全てのリンカーが同じ繰り返し単位でなければならないわけではないことも理解される。また、リンカーについての全ての結合価の位置が繰り返し単位で充たされなければならないわけでもない。例えば、R2の全てが同じ繰り返し単位であり得る。又は、1つ又は複数のR2が繰り返し単位であってもよく、残りのR2はH又は他の化学的部分であり得る。同様に、1つ又は複数の各々のR3、R4又はR5が、独立して、繰り返し単位、H、又はいずれかの他の化学的部分であり得る。したがって、様々なポリマーの形状がこのように作製され得る。したがって、デンドロンは約3個〜約81個の官能基Yを有し得ると考え得る。典型的にはデンドロンは、約6個〜約81個の官能基Yを、約6個〜約54個の官能基Yを、約6個〜約27個の官能基Yを、約8個〜約27個の官能基Yを、約9個〜約27個の官能基Yを、約9個〜約18個の官能基Yを、又は約9個〜約12個の官能基Yを有する。
【0089】
官能基Y
各官能基Yは、付加反応又は置換反応の対象となるのに十分な反応性を有する。官能基(又は部分)は、化学反応に関与する分子内の原子又は原子群を表す。一般的には、官能基はヘテロ原子(ハロゲン、酸素、窒素、硫黄、リン等)又は不飽和(例えば、炭素−炭素二重結合又は三重結合)を含む。代表的な官能基は、アシルハロゲン化物、ヒドロキシ、ケトン、アルデヒド、炭酸酸(エステルを含む)、カルボン酸塩、カルボン酸、尿素、エーテル、ヒドロペルオキシド、過酸化物、オキシラニル、ハロゲン化物、オレフィン、アルキン、アミド、アミン、イミン、イミド、アジド、アジリジニル、アゾ、シアン酸塩、イソシアン酸塩、硝酸塩、ニトリル、亜硝酸塩、ニトロ、ニトロソ、オキサゾリニル、イミダゾリニル、ホスフィン、ホスホジエステル、ホスホン酸、ホスホン酸塩、硫化物、チオエーテル、スルホン、スルホン酸、スルホキシド、チオール、チオシアン酸塩、イソチオシアン酸塩、二硫化物、チオアミド、チオエステル、チオケトン、シラニル(silanyl)と、化学反応の対象となることが知られている他の基とを含むがこれらに限定されない。官能基は、求核反応又は求電子反応の対象となることが多い。
【0090】
保護基
存在する場合、保護基の選択は、多数の因子に依存する。したがって、本発明は、その官能基と別の化学的部分との反応を防止する機能をもたらし、且つ所望の特定の条件下で除去することができる限りにおいては、いかなる特定の保護基にも限定されない。典型的には、使用される保護基は、比較的容易に除去することができる。
【0091】
代表的な適切な保護基は、以下のものを含むがこれらに限定されない:
【0092】
アミノ酸保護基:メチル、ホルミル、エチル、アセチル、t−ブチル、アニシル、ベンジル、トリフルオロアセチル、N−ヒドロキシスクシンイミド、t−ブチルオキシカルボニル、ベンゾイル、4−メチルベンジル、チオアニジル(Thioanizyl)、チオクレシル(Thiocresyl)、ベンジルオキシメチル、4−ニトロフェニル、ベンジルオキシカルボニル、2−ニトロベンゾイル、2−ニトロフェニルスルフェニル(2-Nitrophenylsulphenyl)、4−トルエンスルホニル、ペンタフルオロフェニル、ジフェニルメチル(Dpm)、2−クロロベンジルオキシカルボニル、2,4,5−トリクロロフェニル、2−ブロモベンジルオキシカルボニル、9−フルオレニルメチルオキシカルボニル、トリフェニルメチル、2,2,5,7,8−ペンタメチル−クロマン−6−スルホニル、フタロイル、3−ニトロフタロイル、4,5−ジクロロフタロイル、テトラブロモフタロイル及びテトラクロロフタロイル。
【0093】
ヒドロキシ保護基:p−アニシルオキシメチル(p−AOM)、ベンジルオキシメチル(BOM),t−ブトキシメチル、2−クロロテトラヒドロフラン(THF)、グアヤコールメチル(GUM)、(1R)−メントキシメチル(Menthoxymethyl)(MM)、p−メトキシベンジルオキシメチル(PMBM)、メトキシエトキシメチル(MEM)、メトキシメチル(MOM)、o−ニトロベンジルオキシメチル、(フェニルジメチルシリル)メトキシメチル(SMOM)及び2−(トリメチルシリル)エトキシメチル(SEM)。
【0094】
DNA、RNA保護試薬:2’−OMe−Ac−C−CE ホスホラミダイト、2’−OMe−Ac−RNA CPG、2’−OMe−I−CE ホスホラミダイト、2’−OMe−5−Me−C−CE ホスホラミダイト、Ac−C−CE ホスホラミダイト、Ac−C−RNA 500、dmf−dG−CE ホスホラミダイト、dmf−dG−CPG 500及び2−アミノ−dA−CE ホスホラミダイト。
【0095】
様々な官能基に対する他の適切な保護基が、当業者に既知である。例えば、T.W. Greene and P. G. M. Wuts, Protective Groups in OrganicSynthesis, 3rd edition, John Wiley & Sons, New York, 1999と、Harrisonand Harrison et al., Compendium of Synthetic Organic Methods, Vols. 1-8 (JohnWiley and Sons, 1971-1996)とを参照されたい。
【0096】
下記の表1は、様々なタイプの代表的な化合物を列挙している。しかし、X、R1、Q、R及びYにおける変形形態が本発明に包含されることが理解されるべきである。
【0097】
表1−代表的且つ例示的な巨大分子化合物
【表1−1】

【表1−2】

【表1−3】

【0098】
本発明の幾つかの態様では、固体支持体は無孔性の固体基板である。適切な無孔性の固体基板は、金属、金属合金、セラミックス、プラスチック、シリコン及びケイ酸塩(ガラス及び半導体ウェハ等)を含むがこれらに限定されない。固体支持体は、スライド、粒子、ビーズ又はマイクロウェル(micro-well)の形態であり得る。幾つかの実施形態では、固体支持体は無孔性の固体基板である。これらの実施形態の範囲内において、幾つかの例では固体支持体はガラスである。
【0099】
本発明の他の態様では、固体支持体は多孔性の固体基板である。代表的な多孔性材料は、膜、ビーズ(制御孔ビーズを含む)、ゼラチン及びハイドロゲルを含むがこれらに限定されない。
【0100】
本発明の別の態様は、その表面に複数のデンドロンを含む固体支持体を製造する方法を提供する。固体支持体は、デンドロンと結合を形成するための表面官能基を含む第1の表面を少なくとも含む。デンドロンは、中心原子と、任意にリンカーを介して中心原子と結合している官能基と、中心原子と結合しており複数の末端を有するベース部分とを含み、ベース部分の各末端は官能基を含む。この方法は概して、固体支持体の第1の表面上の表面官能基とベース部分の末端上の官能基との間の結合を形成するのに十分な条件下で、複数のデンドロンを固体支持体表面と接触させることであって、その結果、デンドロンのベース部分と固体支持体の第1の表面との間に複数の結合が形成される、接触させることを含む。
【0101】
幾つかの実施形態では、固体支持体の第1の表面上の表面官能基とベース部分の末端上の官能基との間に形成される結合は、共有結合である。
【0102】
さらに他の実施形態では、固体支持体の第1の表面上の表面官能基とベース部分の末端上の官能基との間の結合は、求核置換反応により形成される。適切な求核置換反応のための反応条件は、当業者に既知である。例えば、Harrison and Harrison et al., Compendium of Synthetic OrganicMethods, Vols. 1-8 (John Wiley and Sons, 1971-1996)を参照されたい。
【0103】
様々な固体支持体が、本発明の方法において使用され得る。適切な固体支持体が、本明細書で論じられ、無孔性固体支持体と多孔性固体支持体とを含む。使用され得る代表的な固体支持体は、上述したものを含む。幾つかの実施形態では、固体支持体は無孔性固体支持体である。これらの実施形態の範囲内において、幾つかの例では、固体支持体は無孔性固体支持体である。特定の一実施形態では、無孔性固体支持体はガラスである。
【0104】
幾つかの実施形態では、任意にリンカーを介して中心原子と結合している官能基は、その反応性を低減又は防止するために、デンドロンを固体支持体表面と結合する前に保護される。このようにして、ベース部分の末端上の官能基が固体支持体上の表面官能基との結合形成反応の対象となるのに対して、中心原子と結合している官能基(又はデンドロンの先端に存在する官能基)は反応条件下で相対的に不活性な状態を維持する。特定の官能基の反応性を低減又は防止するための保護基の使用は、当業者に既知である。例えば、T. W. Greene and P. G. M. Wuts, Protective Groups in OrganicSynthesis, 3rd edition, John Wiley & Sons, New York, 1999と、Harrisonand Harrison et al., Compendium of Synthetic Organic Methods, Vols. 1-8 (JohnWiley and Sons, 1971-1996)とを参照されたい(これらの内容は、その全体が参照により本明細書に援用される)。代表的なヒドロキシ保護基は、アシル基、ベンジル及びトリチルエーテル、テトラヒドロピラニルエーテル、トリアルキルシリルエーテル及びアリルエーテルを含む。代表的なアミノ保護基は、ホルミル、アセチル、トリフルオロアセチル、ベンジル、ベンジルオキシカルボニル(CBZ)、tert−ブトキシカルボニル(Boc)、トリメチルシリル(TMS)、2−トリメチルシリル−エタンスルホニル(SES)、トリチル基及び置換トリチル基、アリルオキシカルボニル、9−フルオレニルメチルオキシカルボニル(FMOC)、ニトロ−ベラトリルオキシカルボニル(NVOC)等を含む。しかし、幾つかの例ではベース部分の末端上の官能基の反応性と、任意にリンカーを介して中心原子と結合している官能基(すなわち「先端官能基」)の反応性とは、先端官能基を保護する必要なく固体基板表面上へのデンドロンの結合を可能にする程度に十分に異なることが理解されるべきである。
【0105】
デンドロンが固体支持体と結合すれば、保護基が存在する場合には、その保護基を先端官能基から除去することができる。その後目的のプローブを、適切な反応条件を使用して、先端官能基と結合させることができる。
【0106】
幾つかの実施形態では、デンドロンは、固体支持体の所定の領域と結合している。かかる結合は、当業者に既知の様々な方法のいずれかを使用して、例えば湿式又は乾式コーティング技術を使用することにより、実現することができる。
【0107】
本発明の他の態様は、その表面上にデンドロンのアレイを含む固体支持体を使用して流体媒体中におけるリガンドの存在を検出する方法を提供する。デンドロンのベース部分は固体支持体と結合しており、先端官能基は所与のリガンドに対して選択的なプローブを含む。この方法は概して、リガンドが流体媒体中に存在する場合にプローブ−リガンド複合体を選択的に形成するのに十分な条件下で流体媒体を固体基板と接触させること、及び目的のプローブ−リガンド複合体の存在を決定することを含む。目的のプローブ−リガンド複合体の存在は、その流体媒体がリガンドを含むことの指標である。
【0108】
幾つかの実施形態では、目的のプローブ−リガンド複合体は、オリゴヌクレオチド−相補的オリゴヌクレオチド複合体若しくはオリゴヌクレオチド−相補的ポリヌクレオチド複合体、オリゴペプチド−結合性オリゴペプチド複合体若しくはオリゴペプチド−結合性ポリペプチド複合体、PNA−相補的オリゴヌクレオチド複合体若しくはPNA−相補的ポリヌクレオチド複合体、LNA−相補的オリゴヌクレオチド複合体若しくはLNA−相補的ポリヌクレオチド複合体、又は受容体−基質複合体である。これらの実施形態の範囲内において、幾つかの例では、受容体−基質複合体は、薬剤−薬剤受容体複合体、酵素−酵素基質複合体、抗体−抗原複合体、又はアプタマー−タンパク質複合体を含む。
【0109】
幾つかの実施形態では、本発明の方法は、オリゴヌクレオチドプローブ−相補的DNA複合体(ここで、オリゴヌクレオチドプローブは、ヌクレオチド数が少なくとも約75のヌクレオチド配列を有し、多くの場合ヌクレオチド数が少なくとも約50のヌクレオチド配列を有し、より多くの場合ヌクレオチド数が少なくとも約30のヌクレオチド配列を有し、最も多くの場合ヌクレオチド数が少なくとも約15のヌクレオチド配列を有する)における単一ヌクレオチド多型を識別することができる。かかる選択性を決定するための1つの方法は、モデル系、及び/又は実施例の節において開示されるp53遺伝子における7つのホットスポットのコドン175を有するDNAマイクロアレイを解析することである。
【0110】
さらに幾つかの実施形態では、本発明の方法はオリゴペプチドプローブ−特異的ペプチド標的複合体(ここで、オリゴペプチドプローブは、少なくとも約200個のアミノ酸、少なくとも約50個のアミノ酸、少なくとも約20個のアミノ酸、又は少なくとも約10個のアミノ酸を有する)における単一アミノ酸のミスマッチを識別することができる。
【0111】
固体支持体上の複数のデンドロン間のプローブ間の距離は、約0.1nm〜約100nm、約1nm〜約100nm、約2nm〜約50nm、約2nm〜約30nm、又は約2nm〜約10nmの範囲であり得る。
【0112】
標的特異的リガンドすなわちプローブ
ポリマーと結合していることがある、プローブとしても知られる標的特異的リガンドは、化学物質、生化学的物質、生物活性化合物等を含む様々な化合物を含む。これに関して、プローブは、核酸、オリゴヌクレオチド、RNA、DNA、PNA、LNA、アプタマー、抗原、抗体等であり得る。オリゴヌクレオチドは、天然核酸又はその類似体であり得る。したがって、プローブは、天然アミノ酸又は合成アミノ酸から構成されるポリペプチドであり得る。プローブは、ポリマーの官能基と結合することができる限りにおいて、核酸、アミノ酸、炭水化物、又は他の任意の化学物質の組合せであり得る。特にプローブは、トリアジン骨格に基づく化学物質等の、化学物質であってもよく、コンビナトリアル化学ライブラリ、特にトリアジンタグ化ライブラリの成分として使用され得る。
【0113】
固体支持体
固体支持体は、ポリマーを結合していることがあるいずれかの固体材料であり得る。典型的には、ポリマーは、共有結合又はイオン結合を介して固体支持体表面と結合する。固体支持体は官能化してもよく、それにより、ポリマーのベース部分上に存在する官能基との結合が生ずる。固体支持体の表面は、当業者の必要性に応じて様々な表面であり得る。マイクロアレイ又はバイオチップの形式が望まれる場合には、典型的には酸化型シリコンウェハ、溶融シリカ又はガラスが、基板であり得る。幾つかの実施形態では、固体支持体はスライドガラスである。他の代表的な固体支持体は、ニトロセルロース又はナイロンを含むがこれらに限定されないメンブレンフィルターを含む。固体支持体は、親水性又は極性であり得るし、コーティングの前後において負電荷又は正電荷を有し得る。
【0114】
マイクロアレイ
マイクロアレイの性能を向上させるために、プローブ設計、スポッティング時の反応条件、ハイブリダイゼーション条件及び洗浄条件、非特異的結合の抑制、生体分子と表面との間の距離、及び/又は固定化した生体分子間の空間等の様々な問題を考慮するべきである。これらの因子のほとんどはマイクロアレイ表面の性質と関連するので、表面の最適化は、マイクロアレイ研究における主要な目的の1つとなっている。本発明の幾つかの態様は、表面に結合したデンドロンを含む固体支持体を提供する。幾つかの実施形態ではデンドロンは、錐形であり、溶液の値(1:0.01)に近い単一ヌクレオチド多型(すなわちSNP)の識別効率を有するオリゴヌクレオチドマイクロアレイを提供するか、非特異的結合を低減するか、又はその両方の効果をもたらす。
【0115】
固体支持体の表面は、当業者に既知の様々な方法のいずれかを使用して調製され得る。例えば、ヒドロキシル化したガラスの表面は、Maskis et al. in Nucleic Acids Res., 1992, 20, 1679-1684により開示される方法を使用することにより調製され得る。酸化型シリコンウェハ、溶融シリカ及びスライドガラスを含め、固体支持体は、(3−グリシドキシプロピル)メチルジエトキシシラン(GPDES)及びエチレングリコール(EG)で修飾され得る。典型的には、デンドロンの先端官能基(例えば、カルボン酸基)と固体支持体表面上の官能基(例えば、ヒドロキシル基)との間のカップリング反応を使用して、例えば、4−ジメチルアミノピリジン(DMAP)の存在下で1−[3−(ジメチルアミノ)プロピル]−3−エチルカルボジイミド塩酸塩(EDC)又は1,3−ジシクロヘキシルカルボジイミド(DCC)を使用することにより、デンドロンを固体支持体表面と結合させた。
【0116】
幾つかの例では、デンドロンを結合した後における厚みの増大は11±2Åであったが、これはイオン結合と同程度である。固定化後、デンドロンのアントラセン部分に起因するUV吸収ピークは、257nmで観察された。分子層は十分に安定であり、ジメチルホルムアミド中での1日間の撹拌に対して、厚み及び吸収特性に関して変化を示さなかった。タッピングモード原子間力顕微鏡(AFM)により得られる組織分布画像も、得られた層が、顕著な凝集物又は穴を有さず非常に滑らか且つ実質的に均質であることを示した。化合物を固体支持体表面上に結合するためのいずれかの従来から知られる方法が、本発明のマイクロアレイを製造するために使用され得る。
【0117】
幾つかの実施形態では、オリゴヌクレオチドマイクロアレイの調製は、先端官能基を脱保護することを含む。先端官能基が保護形態である場合には、かかる工程しか必要でないことが理解されるべきである。先端官能基が保護されていない場合には、かかる工程は必要でない。従来から、表面の反応性アミン基を有する固体支持体については、チオールテザー(thiol-tethered)オリゴヌクレオチドと、サクシニミジル 4−マレイミドブチレート(SMB)又はスルホサクシニミジル−4−(N−マレイミドメチル)シクロヘキサン−1−カルボキシレート(SSMCC)等のヘテロ二官能性リンカーとが利用される。対照的に、本発明の幾つかの実施形態は、DSC等のリンカーを使用し、これはアミンテザー(amine-tethered)オリゴヌクレオチドのスポッティングを可能にする。したがって、本発明の方法及び組成物の幾つかの利点は、費用対効果に優れていること、及び容易に酸化されるチオールテザーオリゴヌクレオチドの使用を回避できることである。しかし、チオールテザーオリゴヌクレオチドは或る特定の条件下で有用であり得ることが理解されるべきである。
【0118】
本発明は、本明細書で説明した特定の実施形態によりその範囲を限定されるべきではない。実際に、本明細書で説明した実施形態に加えて本発明の様々な修正形態が、上述の説明と添付した図面とから当業者に明らかとなるであろう。かかる修正形態は、添付した特許請求の範囲の範囲内にあることを意図している。以下の実施例は、限定としてでなく本発明の例示として提供される。
【実施例】
【0119】
実施例1−材料及び方法
総則。シランカップリング剤N−(3−(トリエトキシシリル)プロピル)−O−ポリエチレンオキシドウレタン(TPU)は、Gelest Inc.から購入した。他の全ての化学物質は、Sigma-Aldrichから入手した試薬グレードのものである。UVグレード溶融シリカプレートは、CVILaser Co.から購入した。研磨加工プライムSi(100)ウェハ(ドーパント、リン;抵抗率、1.5Ω・cm〜2.1Ω・cm)は、MEMCElectronic Materials Inc.から購入した。脱イオン水(18MΩ・cm)は、Barnstead E−pure 3−モジュールシステムに蒸留水を通過させることにより得た。
【0120】
実施例2−試料調製。
実施例2.1−基板の洗浄。シリコンウェハ(及び、デンドロン表面被覆度分析のための溶融シリカプレート;支援情報を参照されたい)を、ピラニア溶液(濃硫酸/30%H2O2=7:3(v/v))中で4時間超音波処理した(注意:ピラニア溶液は、有機材料を爆発的に酸化し得る。酸化しやすい材料と接触させてはならない)。超音波処理後、基板を脱イオン水で十分に洗浄及びリンスした。その後、Teflonビーカー中に容れた脱イオン水、濃縮アンモニア溶液及び30%過酸化水素の混合物(5:1:1(v/v/v))中に、基板を浸漬した。ビーカーをウォーターバス中に置き、80℃で10分間加熱した。基板を溶液から取り出し、脱イオン水で十分にリンスした。さらに、脱イオン水、濃塩酸及び30%過酸化水素の混合物(6:1:1(v/v/v))を含有するTeflonビーカー中に基板を置いた。ビーカーを80℃で10分間(or)加熱した。基板を溶液から取り出し、大量の脱イオン水で十分に洗浄及びリンスした。きれいな基板を真空チャンバー(30mTorr〜40mTorr)中で約20分間乾燥し、直ぐに次の工程に使用した。
【0121】
実施例2.2.−AFMプローブの前処理。
錐体の先端を有する標準V型シリコン窒化物カンチレバー(MLCT−AUNM)(Veeco Instruments;k=10pN/nm)を、初めに、10%の硝酸中に浸漬すること、及び80℃で20分間加熱することにより酸化した。カンチレバーを溶液から取り出し、大量の脱イオン水で十分に洗浄及びリンスした。きれいなカンチレバーを真空チャンバー(30mTorr〜40mTorr)中で約20分間乾燥し、直ぐに次の工程に使用した。
【0122】
実施例2.3.−シリル化。薄シリカ最上層を用意するために、シリコン/シリカ基板と、上述のように前処理したカンチレバーとを、窒素雰囲気下でカップリング剤(0.20mL)を含有する無水トルエン(20mL)中に浸漬し、溶液中に6時間置いた。シリル化後、基板及びカンチレバーをトルエンで洗浄し、その後110℃で30分間焼いた。基板を、トルエンと、トルエン−メタノール(1:1(v/v))と、メタノールとに連続的に浸漬し、各洗浄溶液中で3分間超音波処理した。カンチレバーを、トルエンとメタノールとで連続的に十分にリンスした。最後に、基板及びカンチレバーを真空(30mTorr〜40mTorr)下で乾燥した。GPDESでのシリル化のための実験手順と、その後のエチレングリコールでのエポキシドの開環とは、他非特許文献18で説明する。
【0123】
実施例2.4.−デンドロンで修飾した表面の調製。上記のヒドロキシル化した基板及びカンチレバーを、4−ジメチルアミノピリジン(DMAP)(2.7mM)の存在下で、デンドロン(1.0mM)を溶解している小量のDMFと、カップリング剤である1,3−ジシクロヘキシルカルボジイミド(DCC)(27mM)とを有する塩化メチレン溶液中に4時間浸漬した。この仕事で使用したデンドロンである9−アントリルメチル−3−({[トリス({[(1−{トリス[(2−{[(トリス{[2−カルボキシエトキシ]メチル}メチル)アミノ]カルボニル}エトキシ)メチル]メチル}アミノ)カルボニル]−2−エトキシ}メチル)メチル]アミノ}カルボニル)プロピルカルバメートを、このグループで調製した。反応後、基板を、塩化メチレンと、メタノールと、水とに連続的に浸漬し、各洗浄工程で3分間超音波処理した。カンチレバーを、塩化メチレンと、メタノールと、水とで連続的に十分にリンスした。最後に、基板及びカンチレバーをメタノールで洗浄し、真空(30mTorr〜40mTorr)下で乾燥した。
【0124】
実施例2.5.− 9−アントリルメトキシカルボニル基の脱保護。デンドロンで修飾した基板及びカンチレバーを、1.0Mのトリフルオロ酢酸(TFA)を有する塩化メチレン溶液中に浸漬し、2時間撹拌した。反応後、20%(v/v)のジイソプロピルエチルアミン(DIPEA)を有する塩化メチレン溶液中に10分間浸漬した。基板を塩化メチレン及びメタノール中で各3分間超音波処理し、カンチレバーを塩化メチレンとメタノールとで連続的に十分にリンスした。基板及びカンチレバーを真空(30mTorr〜40mTorr)下で乾燥した。
【0125】
実施例2.6.−NHSで修飾した基板の調製。上記脱保護した基板及びカンチレバーを、窒素雰囲気下で、ジ(N−サクシニミジル)カーボネート(DSC)(25mM)及びDIPEA(1.0mM)を有するアセトニトリル溶液中に4時間浸漬した。反応後、基板及びカンチレバーを撹拌したジメチルホルムアミド中に30分間置き、メタノールで洗浄した。基板及びカンチレバーを、真空(30mTorr〜40mTorr)下で乾燥した。
【0126】
実施例2.7.−プローブ/検出DNAの固定化。上記NHSで修飾した基板及びカンチレバーを、DNA溶液(5.0mMのMgCl2を有する25mMのNaHCO3緩衝液(pH8.5)中において、20μM)中に4時間浸漬した。反応後、基板及びカンチレバーを、ハイブリダイゼーション緩衝溶液(7.0mMのドデシル硫酸ナトリウムを含有する2×SSPE緩衝液(pH7.4))中において37℃で30分間、及び水中において1分間撹拌し、非特異的に結合したオリゴヌクレオチドを除去した。最後に基板及びカンチレバーを、真空(30mTorr〜40mTorr)下で乾燥した。
【0127】
実施例2.8.−標的DNAのハイブリダイゼーション。上記のプローブDNAをつなぎ留めた基板を、標的DNA溶液(20μM)中に1時間浸漬した。反応後、基板を37℃で30秒間撹拌し、ハイブリダイゼーション緩衝溶液(7.0mMのドデシル硫酸ナトリウムを含有する2×SSPE緩衝液(pH7.4))中において1分間浸漬し、さらに繰り返した(repeat)。基板を、30mMの塩化ナトリウムと3.0mMのクエン酸ナトリウムとを含有する0.2×SSC緩衝液により1分間洗浄し、非特異的に結合したオリゴヌクレオチドを除去した。
【0128】
実施例2.9.−遺伝子発現プロファイリングのためのプローブDNAの固定化。対照実験のために、96種類の10μMのプローブDNA(Operon companyから入手したホモ・サピエンス(ヒト)試料v4.0.1)を、マイクロアレイヤー(Genetixから入手したQArraymini)を4時間用いて、スポッティング緩衝溶液(5.0mMのMgCl2を有する25mMのNaHCO3緩衝液(pH8.5))中において、デンドロンで修飾したスライドガラス上に固定化した。反応後、基板を、ハイブリダイゼーション緩衝溶液(7.0mMのドデシル硫酸ナトリウムを含有する2×SSPE緩衝液(pH7.4))中において37℃で30分間、及び水中において1分間撹拌し、非特異的に結合したオリゴヌクレオチドを除去した。最後に基板を、真空(30mTorr〜40mTorr)下で乾燥した。
【0129】
実施例2.10.−基準全RNAからのcDNA調製。Cy5標識cDNAを、Superscript(商標)Indirect cDNA標識キット(Invitrogen)での逆転写により、5μl当たり10μgのユニバーサルヒト基準RNA(UHRR、Statagene)から(form)調製した。QIAGENから入手したMINELute精製キットで、精製プロセスを実施した。NanoDropTechnologies, Inc. から入手したND−1000分光光度計により、260nmでのUVの吸光度を用いて、cDNA濃度を算出した。
【0130】
実施例2.11.−cDNAハイブリダイゼーション/蛍光分析。95℃でのアニーリングの後、3.5×SSC及び0.3%SDS緩衝液中におけるCy5標識cDNAを、Agilentのハイブリダイゼーションキットで、デンドロンで修飾したスライドガラス上における96種類のプローブDNAと、45℃で12時間ハイブリダイズさせた。反応後、基板を37℃で30秒間撹拌し、ハイブリダイゼーション緩衝溶液(7.0mMのドデシル硫酸ナトリウムを含有する2×SSPE緩衝液(pH7.4))中で1分間浸漬し、それを繰り返した。基板を、30mMの塩化ナトリウムと3.0mMのクエン酸ナトリウムとを含有する0.2×SSC緩衝液で1分間洗浄し、非特異的に結合したオリゴヌクレオチドを除去した。cDNAの蛍光強度を、MolecularDevicesから入手したGenePix(登録商標)Personal 4100Aにより測定した。
【0131】
実施例3−AFM力測定。全ての力測定は、Nano Wizard AFM(JPK Instrument)で行った。各実験の前に、各AFM探針のばね定数を、熱変動法により、溶液中で較正した。採用したカンチレバーのばね定数は、1nm当たり12pN〜15pNの間で変動した。全ての測定は、新たなPBS緩衝液(pH7.4)中において室温で実施した。力曲線を、基板上の10μm×10μmの領域中における100ピクセルの1つの位置で、20回より多数回、常に記録し、且つ同じ表面に対して少なくとも3つの他の領域を試験した。様々な探針及び試料を使用して実験を多数回繰り返したこと、及び報告される力のデータは一貫して再現性を有していたことも留意されるべきである。
【0132】
実施例4−結果
遺伝子型決定−本発明者らは、表面上のプローブDNAとハイブリダイズした標的DNAと、AFM−探針上の検出DNAとの間の力を、力基準のAFMにより測定することにより、標的DNAを検出する感度を試験した(図1(a))。全ての実験において、DNAオリゴヌクレオチドは、先に説明したデンドロンに基づく表面官能化方法の修正方法を使用して、シリコン基板又はシリコン窒化物AFM探針と共有結合した(表2)。
【0133】
表2.遺伝子型決定実験に使用したDNAの名称及び配列
【表2】

【0134】
35merの標的DNAをデンドロンで修飾した基板上に固定化した15merのプローブDNAとハイブリダイズさせた後、次に力対距離の測定値を、AFM探針上の官能化した15merの検出DNAとハイブリダイゼーション事象に関与しない残りの15merの標的DNAの表面とを離接しながら記録した。AFM力実験を、10μm×10μmの面積の100個の位置で、実施した。力の測定を、1つの位置当たり20回実施した。1aMの標的DNAをプローブDNAとハイブリダイズさせると、標的DNAが存在する2つの位置でDNA間の力が観察された。標的DNAと検出DNAとの間の特定の力(ヒストグラム曲線においてガウスフィッティングにより26±0.6pN)を測定する確率は80%であり、DNAが見出された1つの位置において20%の力−距離曲線では力は観察されなかった(図1(b))。かかる極めて低い量の生物学的試料の検出は、臨床的診断及び検出にとっての重要な挑戦である。本発明の方法は、高密度マイクロアレイシステムで実現可能な105という数字よりも良好であり、且つ定量PCR(qPCR)に対して通常観察される103〜104のレベルに接近するレベルである、≦103の標的分子を標識することなく検出可能な感度を示す22。
【0135】
このシステムは、遺伝子型決定だけでなく標的DNAにおける単一ヌクレオチド多型(SNP)にも適用することができる。過去の仕事において、デンドロンの表面は、一塩基変異を検出する高いSNP能力を示した。一塩基変異を有する標的DNAとのハイブリダイゼーションの場合においては、基板上に二本鎖として存在する標的DNAの数は、相対的により相補的な標的DNA(完全に相補的なDNA等)とハイブリダイズするプローブDNAの数より小さい。したがって、結合した標的DNAを観察する確率は、点変異を含有する標的DNAの場合には減少した。この方法は、単一ヌクレオチド多型から相対的により相補的な標的DNAを識別することができる。
【0136】
遺伝子発現プロファイリング−cDNAは、逆転写によりmRNAから調製したので、5’末端に50個〜250個のチミン残基を有する。したがって、30個のアデニン残基から成る検出DNAを使用した場合には、バイオ−AFM測定によりcDNAの存在を確認することが可能である(表3)。バイオ−AFMを使用する方法の検出限界の向上を確認するために、DNAマイクロアレイ実験を実施し、高い蛍光強度を有するプローブDNAを選択した。標準的な蛍光に基づくマイクロアレイ実験の検出限界は、62pg/μlであった。cDNAが検出された2個のスポットは、使用するcDNA濃度を0.62fg/μlとした場合に、バイオ−AFM実験で見出され得る。換言すれば、バイオ−AFM測定の感度は、マイクロアレイの105倍増大した(図2(c))。
【0137】
表3.遺伝子発現プロファイリング実験で使用したDNAの名称及び配列
【表3】

【0138】
検出DNAとしてポリチミン残基を使用した場合には、このシステムは、mRNAからcDNAを調製する複雑なプロセスなしに、mRNAの直接検出に適用され得る。たいていのmRNAは3’末端にポリアデニン残基を有するので、検出DNAの配列を変更することなく、1つのAFM探針が複数の標的mRNAを検出することができる。すなわち、バイオ−AFM法は、qPCRと同様の感度を有し、標識することなくDNAマイクロアレイ同様の並行検出を実施することができる。
【0139】
デンドロンにより実現される広範なウィンドウの側方空間形成は、別の顕著な利点である。3nmより大きい、推定では最大10nmの空間形成が意図される。より大きい空間形成は、側方立体障害を最小としながら、より大きな生体分子を固定化するのに有効である。したがって、本発明のシステムは、遺伝子型決定又は遺伝子発現プロファイリングだけでなく、DNA−タンパク質相互作用、及びタンパク質−タンパク質相互作用を決定するためのバイオチップにも適用される。
【0140】
実施例5
蛍光標識を使用する従来のDNAチップアッセイ技法の限界を決定するために、本発明者らは、図3(a)に示すように、チップ表面上に塩基数20のDNAプローブを結合し、5’末端にCy3蛍光標識を含有する塩基数35の標識DNAとハイブリダイズさせた。
【0141】
本発明者らが高レベルから低レベルまで標的DNAの濃度を変化させて蛍光スキャナーを使用してDNAチップを試験すると、図4に示すように、1pMもの低さでDNA検出がなされた。
【0142】
蛍光法との比較でバイオ−AFMを使用して、本発明者らは、標的DNAと検出DNAとの間の力を測定することにより、図5に示すように、10μm×10μmの面積中に100個のスポットを有する力の地図を取得することができた。検出DNAと標的DNAとの両方を、GC部分が60%となるように調整した。本発明者らは、プローブDNAが検出DNAよりも塩基を5個多く含有するものとすることにより、プローブDNAと標的DNAとの間の相互作用力を、検出DNAと標的DNAとの間の相互作用力よりも増大させた。このことが、標的DNAがAFM探針に引きつけられるのを防止するため、連続的な力の測定が可能である。
【0143】
図5に示すように、標的DNAが存在しないと想定される場合には相互作用力は検出されず、標的DNAが図6でハイブリダイズした場合には標的DNAと検出DNAとの間に27pNの相互作用力が測定された。加えて、バイオ−AFM法は、蛍光法よりもさらに増強した1aMもの低さの標的DNAを検出することができた。この濃度レベルでもPCRなしでDNAアッセイを行うことができ、このことは本発明の方法が有する蛍光アッセイ等の光学アッセイより優れた別の利点である。さらに図7は、標的DNAの濃度と検出感度との間の直線関係を示す。
【0144】
上述したように、PCRによる増幅はバイオ−AFM法に必要とされないので、標的DNAが存在するかどうかは、前処理なしでの単純なバイオ−AFM実験により試験され得る。これまで、ナノ粒子、銀液(silver liquid)添加及び電気的特性を使用することによりDNA検出限界を減少させるために多くの努力がなされてきた。しかし、それらは、複雑な前処理手順を必要とし、再現性が低いという点において、不利益を有する。バイオ−AFMは、再現性のあるデータを提供し、標的DNAの前操作を必要としない。
【0145】
実施例5.1−非特異的DNA力測定
本発明者らは、標的DNAが存在しない場合には、検出DNAとプローブDNAとの間の相互作用力は全く検出されないことを確認した。本発明者らは、検出DNAと結合する標的DNAの領域を非相補的なものとなるように修飾し、プローブDNAと結合する標的DNAを相補的なものとなるように設計した。この実験において、本発明者らは、図8に示すように、標的DNAと検出DNAとの間に非特異的結合が生じないことを観察した。
【0146】
実施例5.2−一塩基変異検出実験
DNAチップ上での一塩基変異に対するバイオ−AFMの検出能力を決定する。この実験からは、プローブDNAと標的DNAとの間で一塩基が異なるという結果が観察される。プローブDNAと標的DNAとの間で一塩基変異が存在する場合には、ハイブリダイゼーション率は減少し、検出DNAと標的DNAとの間の力測定率が同様に減少する。
【0147】
実施例5.3−プローブDNA及び標的DNAの架橋結合を使用するDNAチップアッセイ
プローブDNAと標的DNAとをハイブリダイズした後、ハイブリダイズしたDNAを、化学的方法を含むがこれらに限定されない様々な方法を使用して架橋結合し、標的DNAと検出DNAとの間の力を測定する(is measure)。図9に示すように、様々な種類の標的DNAが、プローブDNAの塩基長にかかわらず、検出され得る。
【0148】
実施例5.4−ストレプトアビジン−ビオチン結合を使用する、検出感度の向上
上述した架橋結合方法を使用したプローブDNAと標的DNAとの結合の後、標的DNAの末端でストレプトアビジンと結合を形成する場合には、標的DNAは、ビオチンと結合しているAFM探針を使用してストレプトアビジンとビオチンとの間の結合強度を測定することにより、検出することができる。特に、塩基数15のDNAの間のハイブリダイゼーション強度は、約27pNである。これは実際のノイズと大きさにおいてさほど変わらず、差異を識別するのは困難である。ストレプトアビジンとビオチンとの間の結合強度は100pNより大きいので、図10に示すように、シグナル対ノイズの比は向上する。
【0149】
実施例5.5−抗原−抗体結合を使用する検出感度の向上
プローブDNA及び標的DNAを架橋結合した後、抗原を標的DNAの末端に結合する。抗体と結合しているAFM探針を使用して抗原−抗体結合の強度を測定することにより、図11に示すように標的DNAを検出することができる。
【0150】
実施例5.6−タンパク質−DNA結合のDNAチップアッセイ
一本鎖DNAと、AFM探針表面上のDNAと選択的に結合することができるタンパク質とを結合した後、DNAチップアッセイを実施することができる。タンパク質と一本鎖DNAとの間の力の測定率は、標的DNAが高濃度で存在する場合には、減少する。標的DNAの濃度レベルをより低い程度まで低下させると、力の測定率は増大するであろうし、その場合、これをDNAチップアッセイとして使用することができる。タンパク質−DNA結合を検出する条件を最適化することは、当業者の技能の範囲内であるであろう。
【0151】
一方で、二本鎖DNAと選択的に結合するタンパク質が、AFM探針表面に結合している。DNAチップアッセイを実施する。低濃度の標的DNA中でハイブリダイズさせた後でタンパク質と標的DNAとの間の力を測定する実験を行った場合、二本鎖DNAが存在する確率は減少するであろう。標的DNAの濃度を増大させることにより、二本鎖DNAを検出する確率は増大し、タンパク質と二本鎖DNAとの間の力の測定率も増大する(図12)。
【0152】
実施例5.7−三本鎖DNA構造に対するDNAチップアッセイ
特定の塩基配列を有する検出DNAをAFM探針上に結合し、三本鎖形成を誘発する化学物質又はタンパク質を添加した後に、DNAチップアッセイを実施する。標的DNAとプローブDNAとがハイブリダイズする領域では、三本鎖DNAが形成される。三本鎖DNAが形成されると、バイオ−AFMは力を測定することができ、標的DNAの存在を確認することができる(図13)。
【0153】
実施例5.8−挿入したDNAのDNAチップアッセイ
EtBr(エチジウムブロマイド)等の二本鎖核酸挿入剤が、AFM探針と結合している。標的DNAとプローブDNAとがハイブリダイズする二本鎖領域での力を測定することによりDNAアッセイを実施することができる(図14)。
【0154】
実施例5.9−MutSタンパク質を使用する一塩基変異アッセイのためのDNAアッセイチップ開発
MutSタンパク質は、完全に相補的なDNAよりもむしろ一塩基変異を有する二本鎖DNAに選択的に結合する。AFM探針上にMutSタンパク質を結合させること、及びDNAとタンパク質との間の結合力を測定することにより、DNAアッセイを実施する。相補的DNA二本鎖が存在する領域においては、力は測定されない。一塩基変異が存在する領域においては、力が測定される。一塩基変異に対するDNAチップアッセイは、検出率が観察される間接的な方法としてではなく、直接的に力を測定することにより実施される(図15)。
【0155】
実施例5.10−DNA間の力測定を使用するデンドロン表面上におけるDNAチップアッセイ
制御されたメソ空間を有するデンドロン固体基板が開示される。表面上の分子種間の空間は、望ましくない立体障害を低減するために維持され、分子種間の相互作用を検出するための環境をもたらす。分子種は、タンパク質、抗原、抗体、シグナルペプチド、膜タンパク質、小分子、ステロイド、グルコース、DNA、RNA等を含むがこれらに限定されない。したがって、例えば、バイオ−AFMにより標的DNAと検出DNAとの間の力を測定するためにデンドロンの表面を使用することは、非特異的結合を生じないので、分子種間の空間が制御されない環境、又は空間を制御するために混合的な自己集合が使用される環境と比較して性能を向上させるであろう。特に、ストレプトアビジン−ビオチン法又は抗原−抗体法により検出感度を増大させる方法はDNAより大きなタンパク質を含み、デンドロンの拡張的生成は、潜在的な立体障害の問題を解決するであろう。
【0156】
デンドロンを調製する方法と、デンドロンで表面又は基板をコーティングする方法と、及びデンドロンの末端に分子種を結合する方法とは、国際公開第2005/026191号パンフレット及び国際公開第2006/016787号パンフレットで説明され、その内容は、デンドロンを作製する方法と、表面又は基板をコーティングする際におけるデンドロンの使用と、デンドロンの先端への分子種の設置とのために、その全体が参照により本明細書に援用される。ナノレベル又はマイクロレベルのプローブDNAプリンティングのためのディップペン法又はマイクロコンタクトプリンティング法は、前処理したガラス若しくはシリコン表面又は基板上で実施される。分子種が結合し、アレイが作製される。その後標的DNAをハイブリダイズし、上述のバイオ−AFMを使用して、標的DNAと検出DNAとの間の力が測定される(図16)。アッセイは、架橋結合を使用するストレプトアビジン−ビオチン法、又は抗原−抗体力測定法等の、上述の様々な他の修正した方法により、実施することができる。
【0157】
実施例5.11−DNA間の力の測定による、遺伝子発現研究
DNAチップでの従来の遺伝子発現決定では、組織又は細胞から抽出したmRNAを逆転写し、蛍光色素を付加し、様々な種類のプローブDNAが結合しているチップ上でハイブリダイズすることにより、cDNAを作製する。スポットの蛍光強度を解析する。或る特定の遺伝子の発現レベルをモニタリングすることができる。バイオ−AFMによる力測定を、このシステムにおいて適用し、遺伝子発現研究の新しい概念を見出すことができる。バイオ−AFMによる力測定は、DNA間の力を測定するための上述の方法、又は架橋結合を使用するストレプトアビジン−ビオチン法、又は抗原−抗体間の力測定法であり得る。
【0158】
バイオ−AFM力測定法を使用する遺伝子発現決定の例は、以下の通りである。mRNAの3’末端は20個〜250個のポリAを有するので、逆転写によりcDNAを作製すると、該cDNAは相補的なポリTを含有する。cDNA上のポリTを検出DNAに対する結合領域とし、AFM探針上のポリA検出DNA配列を結合させる。力は、次にA−Tハイブリダイゼーションにより測定される。したがって、cDNAと様々なプローブDNAとの間の結合強度の力を測定し、検出率を決定することにより、他と比較してより強く発現している遺伝子が発見される(図17)。
【0159】
加えて、組織又は細胞から抽出されるmRNAがアッセイには小量であるので、この遺伝子発現研究においては、逆転写によりmRNAから作製されるcDNAの量は、遺伝子発現研究には概して十分でない。このため、cDNAの量を、線形増幅等の増幅方法により増大させる。しかし、バイオ−AFM実験では、検出限界をアトモルレベルまで低減することができる。したがって、mRNA発現レベルの差異についてのアッセイは、逆転写又は増幅を行うことなく直接にプローブDNAを使用して実施することができる。例として、AFMと結合しているポリTオリゴヌクレオチド検出DNAは、mRNAのポリAと直接結合する。付加的な処理手順なしに、力を測定し、直接mRNAを検出する。
【0160】
実施例5.12−DNAナノアレイの実施
従来のDNAマイクロアレイシステムでは、プローブのアレイをスポットする基板表面は、約1mm2の面積を含む。対照的に、ナノアレイは、約10nm2〜100nm2の面積を含む。かかるナノアレイは機器の小型化に有用であり、ケア製品、MEMS及びNEMSの点において適用される。DNAアレイは、ディップペン法又はマイクロコンタクトプリンティング法を使用することにより、ナノレベルで製造される。直接的な標的DNA検出は、溶液中において、約1nm2〜10nm2の面積を有する基板表面上で、実施される。
【0161】
本明細書で引用された全ての引用文献は、その全体が参照により援用される。
【0162】
当業者は、日常的な実験のみを使用して、本明細書で具体的に説明した本発明の特定の実施形態との多くの均等物を認識するだろう、又は確認することができるであろう。かかる均等物は、特許請求の範囲に包含されることが意図される。
【特許請求の範囲】
【請求項1】
流体媒体中における標的リガンドの存在を検出する方法であって、
(i)該流体媒体を固体基板と接触させることであって、該固体基板が、
その表面上にデンドロンのアレイを含み、前記デンドロンの各々が、
中心原子、
任意にリンカーを介して、該中心原子と結合しているプローブ、及び
該中心原子と結合しているベース部分であって該固体支持体の表面と結合している複数の末端を有するベース部分、
を含む、並びに
(ii)該結合したリガンドと該リガンドに対する親和性を有する検出分子との間の結合力を測定することによりプローブ−標的リガンド複合体の存在を決定することであって、該検出分子が原子間力顕微鏡(「AFM」)の探針の表面につなぎ留められており、該プローブ−標的リガンド複合体と該検出分子との間の力の増大の測定が該プローブ−標的リガンド複合体の存在を示す、
を含む、流体媒体中における標的リガンドの存在を検出する方法。
【請求項2】
該プローブ−標的リガンド複合体がオリゴヌクレオチド−相補的核酸複合体である、請求項1に記載の方法。
【請求項3】
該プローブ−標的リガンド複合体が低濃度の該標的リガンドの存在下で検出され、該標的リガンドは少なくとも約1aMの濃度である、請求項1に記載の方法。
【請求項4】
該標的リガンドが約1aM〜約1000aMの濃度である、請求項3に記載の方法。
【請求項5】
前記方法が、オリゴヌクレオチド−相補的核酸複合体における単一ヌクレオチド多型を識別することができる、請求項2に記載の方法。
【請求項6】
該検出分子が検出核酸である、請求項1に記載の方法。
【請求項7】
該検出分子がRNAのポリ−dAセクションと十分に相補的なポリ−dTオリゴマーを含む、請求項1に記載の方法。
【請求項8】
該固体基板が無孔性の固体支持体である、請求項1に記載の方法。
【請求項9】
該固体基板が平面的な無孔性の固体支持体である、請求項8に記載の方法。
【請求項10】
該固体基板がバイオチップである、請求項1に記載の方法。
【請求項11】
該原子間力顕微鏡(「AFM」)の該探針がデンドロンでコーティングされている、請求項1に記載の方法。
【請求項12】
該標的リガンドが標識されていない、請求項1に記載の方法。
【請求項13】
架橋結合した該プローブ−リガンド複合体をさらに含む、請求項1に記載の方法。
【請求項14】
該プローブ−リガンド複合体が親和性分子と共有結合しており、且つ検出分子が該親和性分子と特異的に結合する、請求項1に記載の方法。
【請求項15】
該親和性分子が抗原又は抗体である、請求項14に記載の方法。
【請求項16】
該検出分子が二本鎖DNAと選択的に結合するタンパク質である、請求項1に記載の方法。
【請求項17】
該プローブ−リガンド複合体が、該検出分子と三重らせん構造を形成する、請求項1に記載の方法。
【請求項18】
該検出分子がDNA挿入剤である、請求項1に記載の方法。
【請求項19】
該検出分子が、二本鎖DNAのミスマッチセクションと選択的に結合するタンパク質である、請求項1に記載の方法。
【請求項20】
標的核酸を検出するシステムであって、(i)プローブ分子を固定化したバイオチップと、(ii)その上に検出分子をつなぎ留めた探針を含む原子間力顕微鏡(「AFM」)とを含む、標的核酸を検出するシステム。
【請求項21】
該バイオチップが、その上にプローブ分子をつなぎ留めたデンドロンでコーティングされている、請求項20に記載のシステム。
【請求項22】
該AFMの該探針が、その上に検出分子を固定化したデンドロンでコーティングされている、請求項21に記載のシステム。
【請求項1】
流体媒体中における標的リガンドの存在を検出する方法であって、
(i)該流体媒体を固体基板と接触させることであって、該固体基板が、
その表面上にデンドロンのアレイを含み、前記デンドロンの各々が、
中心原子、
任意にリンカーを介して、該中心原子と結合しているプローブ、及び
該中心原子と結合しているベース部分であって該固体支持体の表面と結合している複数の末端を有するベース部分、
を含む、並びに
(ii)該結合したリガンドと該リガンドに対する親和性を有する検出分子との間の結合力を測定することによりプローブ−標的リガンド複合体の存在を決定することであって、該検出分子が原子間力顕微鏡(「AFM」)の探針の表面につなぎ留められており、該プローブ−標的リガンド複合体と該検出分子との間の力の増大の測定が該プローブ−標的リガンド複合体の存在を示す、
を含む、流体媒体中における標的リガンドの存在を検出する方法。
【請求項2】
該プローブ−標的リガンド複合体がオリゴヌクレオチド−相補的核酸複合体である、請求項1に記載の方法。
【請求項3】
該プローブ−標的リガンド複合体が低濃度の該標的リガンドの存在下で検出され、該標的リガンドは少なくとも約1aMの濃度である、請求項1に記載の方法。
【請求項4】
該標的リガンドが約1aM〜約1000aMの濃度である、請求項3に記載の方法。
【請求項5】
前記方法が、オリゴヌクレオチド−相補的核酸複合体における単一ヌクレオチド多型を識別することができる、請求項2に記載の方法。
【請求項6】
該検出分子が検出核酸である、請求項1に記載の方法。
【請求項7】
該検出分子がRNAのポリ−dAセクションと十分に相補的なポリ−dTオリゴマーを含む、請求項1に記載の方法。
【請求項8】
該固体基板が無孔性の固体支持体である、請求項1に記載の方法。
【請求項9】
該固体基板が平面的な無孔性の固体支持体である、請求項8に記載の方法。
【請求項10】
該固体基板がバイオチップである、請求項1に記載の方法。
【請求項11】
該原子間力顕微鏡(「AFM」)の該探針がデンドロンでコーティングされている、請求項1に記載の方法。
【請求項12】
該標的リガンドが標識されていない、請求項1に記載の方法。
【請求項13】
架橋結合した該プローブ−リガンド複合体をさらに含む、請求項1に記載の方法。
【請求項14】
該プローブ−リガンド複合体が親和性分子と共有結合しており、且つ検出分子が該親和性分子と特異的に結合する、請求項1に記載の方法。
【請求項15】
該親和性分子が抗原又は抗体である、請求項14に記載の方法。
【請求項16】
該検出分子が二本鎖DNAと選択的に結合するタンパク質である、請求項1に記載の方法。
【請求項17】
該プローブ−リガンド複合体が、該検出分子と三重らせん構造を形成する、請求項1に記載の方法。
【請求項18】
該検出分子がDNA挿入剤である、請求項1に記載の方法。
【請求項19】
該検出分子が、二本鎖DNAのミスマッチセクションと選択的に結合するタンパク質である、請求項1に記載の方法。
【請求項20】
標的核酸を検出するシステムであって、(i)プローブ分子を固定化したバイオチップと、(ii)その上に検出分子をつなぎ留めた探針を含む原子間力顕微鏡(「AFM」)とを含む、標的核酸を検出するシステム。
【請求項21】
該バイオチップが、その上にプローブ分子をつなぎ留めたデンドロンでコーティングされている、請求項20に記載のシステム。
【請求項22】
該AFMの該探針が、その上に検出分子を固定化したデンドロンでコーティングされている、請求項21に記載のシステム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公表番号】特表2010−529474(P2010−529474A)
【公表日】平成22年8月26日(2010.8.26)
【国際特許分類】
【出願番号】特願2010−511747(P2010−511747)
【出願日】平成20年6月16日(2008.6.16)
【国際出願番号】PCT/IB2008/003959
【国際公開番号】WO2009/109809
【国際公開日】平成21年9月11日(2009.9.11)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.TEFLON
【出願人】(505282042)ポステック・アカデミー‐インダストリー・ファウンデーション (34)
【出願人】(502258417)ポスコ (73)
【Fターム(参考)】
【公表日】平成22年8月26日(2010.8.26)
【国際特許分類】
【出願日】平成20年6月16日(2008.6.16)
【国際出願番号】PCT/IB2008/003959
【国際公開番号】WO2009/109809
【国際公開日】平成21年9月11日(2009.9.11)
【公序良俗違反の表示】
(特許庁注:以下のものは登録商標)
1.TEFLON
【出願人】(505282042)ポステック・アカデミー‐インダストリー・ファウンデーション (34)
【出願人】(502258417)ポスコ (73)
【Fターム(参考)】
[ Back to top ]

