バイオチップ用基板の製造方法
【課題】バックグランドノイズを低減可能なバイオチップ用基板の製造方法を提供する。
【解決手段】被検対象の生体物質と特異的な化学反応をするプローブを設けたバイオチップ用基板であって、第1の層上に配置された第2の層の一部を選択的にエッチングし、第1の層を表出させるステップと、第1の層をナトリウム溶液に浸し、第1の層表面に複数の水酸基を導入するステップとを含むバイオチップ用基板の製造方法。
【解決手段】被検対象の生体物質と特異的な化学反応をするプローブを設けたバイオチップ用基板であって、第1の層上に配置された第2の層の一部を選択的にエッチングし、第1の層を表出させるステップと、第1の層をナトリウム溶液に浸し、第1の層表面に複数の水酸基を導入するステップとを含むバイオチップ用基板の製造方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は生体分子検出技術に関し、特にバイオチップ用基板の製造方法に関する。
【背景技術】
【0002】
バイオチップは、被検対象の生体物質と特異的な化学反応をするプローブをチップ表面の特定位置に固定した素子の総称である。バイオチップの代表例であるDNAチップは、血液や細胞の抽出液に含まれるターゲットDNAの種類と量を検出するために使用されている。DNAチップは、例えばスライドガラス板のような基板の上に、それぞれ既知の配列を有する1本鎖DNAであるプローブDNAを、数千〜数万種類、アレイ状に配列したものである。このDNAチップに蛍光標識させたターゲットDNAを含む被験液を供給すると、配列がプローブDNAと相補関係にあるターゲットDNAのみがプローブDNAと水素結合により互いに結合して2本鎖を形成する。そのため、ターゲットDNAが固定された部分が蛍光発色するので、チップ上の蛍光発色位置とその発色強度を測定することにより、ターゲットDNAの種類と量を知ることができる。このようにして使用されるDNAチップを作成する際には、したがって、基板表面の所定部分に、所定配列のプローブDNAを固定することが必要である。
【0003】
プローブDNAの固定方法に関しては、大別して2種類の方法がある。第1の方法はマイクロアレイ方式と呼ばれている。これは、予め化学合成して作成するかまたは対象とする生体から抽出したプローブDNAを、基板の上にアレイ状に滴下、あるいは印刷して固定する方法である。第2の方法は、基板の上に、チミン(T: Thymine)、アデニン(A: Adenine)、シトシン(C: Cytosine)、グアニン(G: Guanine)の4種類の塩基を用いて、設計図に基づく所定配列の1本鎖DNAであるプローブDNAを、直接化学合成する方法である。この第2の固定方法の場合、化学合成に用いる基板の表面には、設計目的のプローブDNAの合成反応を進めるための反応領域と、その合成反応には関与しない非反応領域とが明確に分離された状態で形成されることが必要となる。
【0004】
第2の固定方法が採用されるチップの場合、基板の材料としては石英(SiO2)等を用いる。また反応領域と非反応領域を分離して形成するためにフォトリソグラフィー技術が用いられる。プローブDNAの化学合成時には、反応領域における1本鎖DNAの活性化処理に紫外線照射技術を適用して、1本鎖DNAを順次組み立てる。このチップでは、1板の基板の上に、1スポットが約20μm四方の大きさである反応領域が20万スポット程度形成されており、1スポット内には約200万本程度の同一種類のプローブDNAが固定されている。スポットはチップ上に高密度に形成されているので、1度の試験で非常に多数のターゲットDNAを検査することができる。
【0005】
他に提案されているチップとしてアレープレートがある。アレープレートは次のようにして製造されている。まず、シリコン(Si)基板の表面をフルオロアルキルシランと反応させて、そこに一旦、疎水性のフルオロアルキルシロキサンの薄膜を形成する。次に、この薄膜を所定の平面パターンで除去し、薄膜を除去した部分にSi基板の表面を露出させ、最後にその露出面をヒドロキシシランまたはアルキルシランと反応させることにより、露出面にOH基を導入する(例えば、特許文献1参照。)。したがって、アレープレートの場合、Si基板の表面には表面張力が大きい疎水性薄膜のサイトと親水性のOH基を有するサイトが存在する。そのため、生体物質に対して前者は非反応領域、後者は反応領域としてそれぞれ機能する。アレープレートの使用に際しては、親水性サイトで合成反応が進められ、その後そこに被験液が供給される。この親水性サイトの周囲に位置する疎水性薄膜の大きな表面張力によって、被験液は親水性サイト内に確保されることになる。しかしながらアレープレートの場合、反応領域と非反応領域の高低差が事実上ないため、供給した被験液の確保という点で安定性に欠け、使いづらいということができる。また、反応領域と非反応領域の形成は、いずれも、Si表面と他の化学物質との化学反応に依存しており、その反応が100%の収率で進行するとはいえないので、両領域の境界が不明確化することもあり得る。さらには、疎水性薄膜や親水性サイトが外傷を受けやすいという問題もある。
【0006】
被験液の確保という点でいえば、上記した構造のアレープレートに比べると、被験液を収容し保持可能な構造である複数のウェルが設けられた基板の方が好適である。このような基板として、プローブDNAの直接合成に用いる基板と、それを用いたプローブDNAの化学合成が開示されている(例えば、特許文献2参照。)。この基板Aは、図61に示すように、Si等からなる半導体基板1の一方の表面に複数個のウェル2が所定の配列をなして形成されている。ウェル2の直径は1〜1000μm、深さは1〜500μm程度であり、ここがプローブDNAを化学合成するための反応領域として機能する。そして、このウェル以外の表面部分は非反応領域になっている。この基板Aは次のようにして製造される。
【0007】
工程a1:半導体基板1の一方の表面1aにフォトリソグラフィー技術とエッチング技術を適用して、ウェル2Aを形成して、図62で示すような中間体A1を製造する。
【0008】
工程a2:中間体A1における半導体基板の表面1aとウェル2Aの表面(底面と側面)に対して例えば熱酸化処理を施して、図63で示すように、それら表面の表層部のみが厚み0.5μm程度のシリコン酸化物(SiO2)層3に転化している中間体A2を製造する。
【0009】
工程a3:中間体A2のSi酸化物層3の表面にシラン化処理が施される。具体的には、水酸化ナトリウム(NaOH)を用いたブラウンプロセス(Brown Process)を適用してSi酸化物層3の表面をアルカリで処理したのち、例えばエポキシシラン型の官能化されたシラン処理剤で処理する。さらにシラン処理剤のリンク化、エポキシ樹脂の加水分解を順次行う。
その結果、Si酸化物層3の表面にシランカップリング層4が形成され、図64で示すような中間体A3が得られる。この中間体A3は、その表面全体にシランのOH基が存在しているので、その表面全体はDNAホスホアミダイトとの間で反応可能な状態になっている。
【0010】
工程a4:中間体A3の表面にホスホアミダイト法を適用することにより、DNAホスホアミダイトT(Thymine)を用いて5塩基ほどの長さの1本鎖DNAを合成して、シランカップリング層4の上にオリゴヌクレオチドスペーサ(5T)から成るスペーサ層5を形成し、図65で示すようなウェルを有する中間体A4を製造する。なお、合成されたオリゴヌクレオチドスペーサ(5T)の末端は、ジメトキシトリチル(DMT)で保護されている。この中間体A4は、その表面全体がDMTで保護されたオリゴヌクレオチドスペーサ(5T)のスペーサ層5で覆われた状態になっている。したがって、末端を保護するDMTを脱離(脱トリチル化:Detritylation)してオリゴヌクレオチドスペーサの末端を活性化させれば、そこでプローブDNAを合成することが可能である。すなわち、この中間体A4の場合、DNAチップの作成時においては、オリゴヌクレオチドスペーサ(5T)からなるスペーサ層5の表面全体が反応領域として機能することになる。しかしながら、この状態では、ウェルは反応領域、その他の部分は非反応領域として分離されなければならないというプローブDNA合成用基板としての必要条件を満たしていない。したがって、この中間体A4のスペーサ層5に対し、ウェルの部分は反応領域として残し、その他の部分は非反応領域に転化させる処理を行うことが必要となる。その処理が、次工程で行う不活性化処理(Capping)である。
【0011】
工程a5:図66で示すように、中間体A4におけるウェルの中にのみ樹脂液滴6を充填し、その状態でスペーサ層5の不活性化処理(Capping)が行われる。具体的には、オリゴヌクレオチドスペーサ(5T)のスペーサ層5に対して脱トリチル化処理を行ってオリゴヌクレオチドスペーサ(5T)の末端を活性化し、次に、トリクロロ酢酸、無水酢酸、ジメチルアミノピリジンなどを用いてオリゴヌクレオチドスペーサ(5T)の活性化している末端をブロックして不活性化し、スペーサ層5を非活性スペーサ層5aに転化させる。その後、例えばテトラヒドロフランのような有機溶剤を用いてウェル内に充填されている樹脂液滴6を溶解及び除去して、ウェル内のスペーサ層5を表出させる。この不活性化処理の過程で、ウェル内には樹脂液滴が充填されているので、ウェル内のオリゴヌクレオチドスペーサ(5T)からなるスペーサ層5は、不活性化処理を受けず、反応可能な状態を維持している。しかし、ウェル以外の部分のオリゴヌクレオチドスペーサ(5T)は不活性化処理されることにより合成反応が起こらない状態になる。このようにして、図67で示す断面構造のプローブDNAが合成される基板A6が製造されている。
【0012】
この基板A6では、半導体基板の表面に凹没部であるウェル2が所定のパターンをなして形成されている。半導体基板1の表面は、全面にわたってSi酸化物層3が形成されており、Si酸化物層3の上には全面にわたってシランカップリング層4が形成されている。そして、ウェル2の底面2aと側面2bには、末端がDMTで保護されたオリゴヌクレオチドスペーサ(5T)からなるスペーサ層5が表出していて、その部分がプローブDNAを合成するための反応領域になっている。しかし、非活性スペーサ層5aは不活性化処理された部分であって、そこは非反応領域になっている。この基板Aを用いてホスホアミダイト法でDNAチップを作成する場合、プローブDNAの化学合成はウェル2の領域内で進行する。
【0013】
しかしながら、この基板A6には次のような問題がある。第1の問題は、この基板A6の場合、反応領域と非反応領域の境界は、工程a5における樹脂液滴の充填状態で律せられることである。一般に、ウェルへの樹脂液滴の充填はピエゾインジェクタを用いて行われているが、その充填量はpl〜μlオーダという極微量である。そのため、工程a5では、充填量が多すぎて樹脂液滴がウェルから溢れ出たり、逆に少なすぎてウェルを完全に満たさないこともある。前者の場合には、ウェルの周辺表面も溢れ出た樹脂液滴で被覆されることになる。そのため、次の不活性化処理時においても上記した周辺表面は不活性化処理されることなく合成反応が可能な状態のままで残ることになる。したがって、DNAチップの作成時には、このウェルの周辺表面でもプローブDNAが化学合成されていく。そのため、作成したDNAチップを用いてターゲットDNAを検査したときに、ウェルの部分だけでなく、樹脂液滴が溢れ出たウェルの周辺部分でも蛍光発色が起こることになる。その結果、正確な蛍光標識の読みとりが阻害される。
【0014】
また、樹脂液滴の充填量が不足する場合には、ウェル内部の表面を被覆する樹脂液滴の厚みが薄くなるので、不活性化処理時に用いる酸液で樹脂液滴が浸食されやすくなる。その結果、ウェル内に位置するオリゴヌクレオチドスペーサ(5T)の層も一部不活性化処理されることがある。したがって、DNAチップの作成時に、ウェルの内部でプローブDNAが充分に化学合成されないこともあり、その結果、ターゲットDNAの検査時に、ウェルの部分は充分な強度で蛍光発色しないことがある。さらに、工程a5における不活性化処理(Capping)が不充分な場合は、やはり、作成したDNAチップの使用時に、ウェルの部分だけではなく、不活性化処理が不充分な部分も蛍光発色して、バックグラウンドノイズが発生しやすくなる。また、工程a1において、ウェル2Aを形成する際に、その深さはエッチング時間の長短で決まってくるので、エッチング処理時の時間管理を正確に行わない場合には、設計基準に則った正確な深さのウェルが形成されないことがある。
【先行技術文献】
【特許文献】
【0015】
【特許文献1】特表平9−500568号公報
【特許文献2】特表2002−537869号公報
【発明の概要】
【発明が解決しようとする課題】
【0016】
本発明は、バックグランドノイズを低減可能なバイオチップ用基板の製造方法を提供する。
【課題を解決するための手段】
【0017】
上記目的を達成するために本発明の第1の特徴は、(イ)シリコン酸化物層と、(ロ)シリコン酸化物層の上に配置され、シリコン酸化物層に達する複数のウェルが設けられた非反応層と、(ハ)ウェルを介して表出するシリコン酸化物層の表面に配置された生体物質とを備えるバイオチップ用基板であることを要旨とする。
【0018】
本発明の第2の特徴は、(イ)ガラス板と、(ロ)ガラス板の上に配置され、シリコン酸化物層に達する複数のウェルが設けられた非反応層と、(ハ)ウェルを介して表出するガラス板の表面に配置された生体物質とを備えるバイオチップ用基板であることを要旨とする。
【0019】
本発明の第3の特徴は、(イ)非反応層と、(ロ)非反応層に設けられたウェルの底面に配置されたシリコン酸化物層と、(ハ)シリコン酸化物層の表面上に配置された生体物質とを備えるバイオチップ用基板であることを要旨とする。
【0020】
本発明の第4の特徴は、(イ)表面に複数の水酸基を導入可能な第1の層と、(ロ)第1の層上に配置され、第1の層に達する複数のウェル及び複数のウェルを連結する複数の流路のそれぞれが設けられ、第1の層と異なる材料からなる第2の層とを備えることをバイオチップ用基板であることを要旨とする。
【0021】
本発明の第5の特徴は、(イ)第1の層上に配置された第2の層の一部を選択的にエッチングし、第1の層を表出させるステップと、(ロ)第1の層をナトリウム溶液に浸し、第1の層表面に複数の水酸基を導入するステップとを含むバイオチップ用基板の製造方法であることを要旨とする。
【発明の効果】
【0022】
本発明によれば、バックグランドノイズを低減可能なバイオチップ用基板の製造方法を提供することができる。
【図面の簡単な説明】
【0023】
【図1】本発明の第1の実施の形態に係るバイオチップ用基板の第1の断面図である。
【図2】本発明の第1の実施の形態に係るバイオチップ用基板の第2の断面図である。
【図3】本発明の第1の実施の形態に係るバイオチップ用基板の第1の工程断面図である。
【図4】本発明の第1の実施の形態に係るバイオチップ用基板の第2の工程断面図である。
【図5】本発明の第1の実施の形態に係るバイオチップ用基板の第3の工程断面図である。
【図6】本発明の第1の実施の形態に係るバイオチップ用基板の第4の工程断面図である。
【図7】本発明の第1の実施の形態に係るバイオチップ用基板の第5の工程断面図である。
【図8】本発明の第1の実施の形態に係るバイオチップ用基板の変形例の第1の断面図である。
【図9】本発明の第1の実施の形態に係るバイオチップ用基板の変形例の第2の断面図である。
【図10】本発明の第1の実施の形態に係るバイオチップ用基板の変形例の第3の断面図である。
【図11】本発明の第1の実施の形態に係るバイオチップの第1の工程断面図である。
【図12】本発明の第1の実施の形態に係るバイオチップの第2の工程断面図である。
【図13】本発明の第1の実施の形態に係るバイオチップの第3の工程断面図である。
【図14】本発明の第1の実施の形態に係るバイオチップの第4の工程断面図である。
【図15】本発明の第1の実施の形態に係るバイオチップの第5の工程断面図である。
【図16】本発明の第2の実施の形態に係るバイオチップの検出結果を示す写真である。
【図17】従来のバイオチップの検出結果を示す写真である。
【図18】本発明の第3の実施の形態に係るバイオチップ用基板の上面図である。
【図19】本発明の第3の実施の形態に係るバイオチップ用基板の第1の断面図である。
【図20】本発明の第3の実施の形態に係るバイオチップ用基板の第2の断面図である。
【図21】本発明の第3の実施の形態に係るバイオチップ用基板の第1の拡大断面図である。
【図22】本発明の第3の実施の形態に係るバイオチップ用基板の第3の断面図である。
【図23】本発明の第3の実施の形態に係るバイオチップ用基板の第2の拡大断面図である。
【図24】本発明の第3の実施の形態に係るバイオチップ用基板の第3の拡大断面図である。
【図25】本発明の第3の実施の形態に係るカバープレートの上面図である。
【図26】本発明の第3の実施の形態に係るカバープレートの断面図である。
【図27】本発明の第3の実施の形態に係るバイオチップ用基板とカバープレートの断面図である。
【図28】本発明の第3の実施の形態に係るバイオチップ用基板の第1の工程断面図である。
【図29】本発明の第3の実施の形態に係るバイオチップ用基板の第2の工程断面図である。
【図30】本発明の第3の実施の形態に係るバイオチップ用基板の第3の工程断面図である。
【図31】本発明の第3の実施の形態に係るバイオチップ用基板の第1の工程上面図である。
【図32】本発明の第3の実施の形態に係るバイオチップ用基板の第4の工程断面図である。
【図33】本発明の第3の実施の形態に係るバイオチップ用基板の第5の工程断面図である。
【図34】本発明の第3の実施の形態に係るバイオチップ用基板の第6の工程断面図である。
【図35】本発明の第3の実施の形態に係るバイオチップ用基板の第7の工程断面図である。
【図36】本発明の第3の実施の形態に係るバイオチップ用基板の第8の工程断面図である。
【図37】本発明の第3の実施の形態に係るバイオチップ用基板の第9の工程断面図である。
【図38】本発明の第3の実施の形態に係るバイオチップ用基板の第10の工程断面図である。
【図39】本発明の第3の実施の形態に係るバイオチップ用基板の第11の工程断面図である。
【図40】本発明の第3の実施の形態に係る塩基を示す化学式である。
【図41】本発明の第3の実施の形態に係るバイオチップ用基板の第12の工程断面図である。
【図42】本発明の第3の実施の形態に係るバイオチップ用基板の第13の工程断面図である。
【図43】本発明の第3の実施の形態に係るヌクレオシドホスホロアミダイトを示す化学式である。
【図44】本発明の第3の実施の形態に係るバイオチップ用基板の第14の工程断面図である。
【図45】本発明の第3の実施の形態に係るバイオチップ用基板の第15の工程断面図である。
【図46】本発明の第3の実施の形態に係るバイオチップ用基板の第16の工程断面図である。
【図47】本発明の第3の実施の形態に係るバイオチップ用基板の第17の工程断面図である。
【図48】本発明の第3の実施の形態に係る脱保護された塩基の化学式である。
【図49】本発明の第3の実施の形態に係るバイオチップ用基板の第18の工程断面図である。
【図50】本発明の第3の実施の形態に係るバイオチップの検出結果を示す写真である。
【図51】本発明の第3の実施の形態の第1の変形例に係るバイオチップ用基板の第1の工程断面図である。
【図52】本発明の第3の実施の形態の第1の変形例に係るバイオチップ用基板の第2の工程断面図である。
【図53】本発明の第3の実施の形態の第1の変形例に係るバイオチップ用基板の第3の工程断面図である。
【図54】本発明の第3の実施の形態の第1の変形例に係るバイオチップ用基板の第4の工程断面図である。
【図55】本発明の第3の実施の形態の第1の変形例に係るバイオチップ用基板の第5の工程断面図である。
【図56】本発明のその他の実施の形態に係るバイオチップ用基板の上面図である。
【図57】本発明のその他の実施の形態に係るバイオチップ用基板の断面図である。
【図58】本発明のその他の実施の形態に係るカバープレートの平面図である。
【図59】本発明のその他の実施の形態に係るカバープレートの断面図である。
【図60】本発明のその他の実施の形態に係るバイオチップ用基板とカバープレートの断面図である。
【図61】従来のバイオチップ用基板の斜視図である。
【図62】従来のバイオチップ用基板の第1の工程断面図である。
【図63】従来のバイオチップ用基板の第2の工程断面図である。
【図64】従来のバイオチップ用基板の第3の工程断面図である。
【図65】従来のバイオチップ用基板の第4の工程断面図である。
【図66】従来のバイオチップ用基板の第5の工程断面図である。
【図67】従来のバイオチップ用基板の第6の工程断面図である。
【発明を実施するための形態】
【0024】
以下に本発明の実施の形態を説明する。以下の図面の記載において、同一又は類似の部分には同一又は類似の符号で表している。但し、図面は模式的なものである。したがって、具体的な寸法等は以下の説明を照らし合わせて判断するべきものである。また、図面相互間においても互いの寸法の関係や比率が異なる部分が含まれていることは勿論である。
(第1の実施の形態)
第1の実施の形態に係るバイオチップ用基板は、DNAホスホアミダイトを用いてプローブDNAを組立てる反応を行うことができる反応領域と、その反応を行わない非反応領域が表面に設けられている。ここで、図67に示した従来の基板Aでは、非反応領域が不活性化処理(Capping)によって形成されていた。これに対し、第1の実施の形態に係るバイオチップ用基板では、反応領域は反応性を持つ材料で形成され、その他の領域は反応に不活性な材料で確実に形成されている。そのため、Capping等の表面の不活性化処理をしなくても反応領域と非反応領域が明確に区別されているという特徴を有している。
【0025】
まず、第1の実施の形態に係るバイオチップ用基板B0の一例を図1に示す。バイオチップ用基板B0は、2つのSi等からなる半導体層131の間にSi酸化物層132が介在しているサンドウィッチ構造をした板状体を有する。ここで、一方の半導体層131に、所定の配列パターンで、Si酸化物層132の表面132aにまで至るウェル13Aが設けられている。したがってバイオチップ用基板B0の場合、ウェル13Aの底面のみにSi酸化物層132の表面132aが表出していて、他の部分の表面は総てSiになっている。よって、ウェル13Aを介して表出するSi酸化物層132の表面のみが例えば1本鎖DNAを合成するための反応領域として機能し、他の表面は総て非反応領域として機能する。
【0026】
図2は、上記したバイオチップ用基板B0を用いて製造された別の基板の1例B1を示す。この基板B1は、バイオチップ用基板B0におけるウェル13Aの底面にのみシランカップリング層14が形成されている。そしてシランカップリング層14の上にDNAホスホアミダイトTを5段に連続して合成させたオリゴヌクレオチドスペーサ(5T)からなるスペーサ層135が配置されている。この基板B1の場合、ウェル13Aの底面135aのみに、プローブDNA合成を可能とするオリゴヌクレオチドスペーサ(5T)のスペーサ層135が配置されており、ウェル13Aの側面135bと半導体層131の表面131aはいずれもSiのままになっている。したがって、この基板B1では、ウェル13Aの底面のみがプローブDNA合成用の反応領域として機能し、ウェル13Aの側面や基板表面など他の部分は、Capping処理等による表面の不活性化が施されていなくてもそれ自体がプローブDNAの化学合成にとっては非反応領域になっている。なお、この基板B1において、シランカップリング層14は、オリゴヌクレオチドスペーサ(5T)からなるスペーサ層135の合成を効率的に行うために配置されているが、必ずしも必要ではない。オリゴヌクレオチドスペーサ(5T)からなるスペーサ層135を直接Si酸化物層132の表面132aに合成してもよい。
【0027】
この基板B1は次のようにして製造することができる。まず、図3で示すように、2つの半導体層131の間にSi酸化物層132がサンドウィッチされている構造の板状体を用意する。このとき、一方の半導体層131の厚みは、形成すべきウェルの深さと略同じとする。このような板状体としては、例えば、信越半導体(株)から市販されているSOI(Silicon on Insulator)ウェハが好適である。
【0028】
次に図4で示すように、一方の半導体層131の表面131aをレジスト16で全面被覆し、その上に、形成すべきウェルと同径の開口を有するマスクを配置したのち紫外線を照射し、さらに、マスクを除去して全体を現像する。その結果、図5で示すように、形成すべきウェルと同径の開口がレジスト16に形成され、そこから半導体層131の表面131aが表出する。
【0029】
次にレジスト16をマスクにして、半導体層131に対してSiのエッチャントを用いたエッチング処理を行い、Si酸化物層132の表面132aにまで至るウェル13Aを形成する。エッチング作用は、半導体層のエッチングが進んでSi酸化物層132の表面132aに到達した時点で自動的に停止する。その結果図6で示すように、ウェル13Aの底面でのみSi酸化物層132の表面132aが表出し、他の表面部分は総てSiから成る部材が得られる。そして、この部材におけるウェル13Aは、形成すべきウェルと直径及び深さが略同じになっている。
【0030】
次にシラン化処理を行う。シラン化反応はSi酸化物層表面のみで進行するため、図7に示すようにウェル13Aで表出するSi酸化物層132の表面132aにのみシランカップリング層14が形成される。そして最後に、ホスホアミダイト法を適用することによりシランカップリング層14にDNAホスホアミダイトTを反応させ、5merのTから成る1本鎖DNAを有するオリゴヌクレオチドスペーサ(5T)からなるスペーサ層135を形成し、図2で示す基板B1が完成する。この過程で、DNAホスホアミダイトTは、シランカップリング層14のOH基とのみ共有結合するので、ウェル13Aによって表出するSi酸化物層132の表面132a上のみで合成反応が進む。ここでDNAホスホアミダイトTは、Siが表出している他の部分とは反応しないので、従来の基板Aの場合のように不活性化処理(Capping)が施す必要がない。
【0031】
第1の実施の形態に係るバイオチップ用基板B0と、前記した従来の基板Aの製造工程を対比すると次のことが明らかである。まず従来の基板Aの場合、前記した工程a2でSiウェハの表面を熱酸化してSi酸化物層を形成することが必要であるが、第1の実施の形態に係るバイオチップ用基板B0の場合はこの工程a2が不要となる。また従来の基板Aの場合、前記した工程a5においてウェル内への樹脂液滴の充填、不活性化処理(Capping)、及び樹脂液滴の溶解及び除去という一連の操作が不可欠であった。これに対し第1の実施の形態に係るバイオチップ用基板B0の場合は、これらの操作は全く不要になる。したがって第1の実施の形態に係るバイオチップ用基板B0の場合、樹脂液滴の充填量の過不足によって発生していた問題は解消され、反応領域と非反応領域の境界は明瞭となり、しかも反応領域はリソグラフィー技術とエッチング技術を適用して形成したウェル13Aの底面のみになり、他の部分は総て非反応領域になる。そのため、これを用いて作成したDNAチップの使用時における蛍光標識の精度は高くなり、またバックグラウンドノイズも発生しなくなる。
【0032】
さらに従来の基板Aの場合、設計基準に則った深さのウェルを形成するためには、工程a1のエッチング処理時にエッチング時間の管理を正確に行うことが必要であった。これに対し第1の実施の形態に係るバイオチップ用基板B0の場合は、半導体層131を掘り進むエッチング作用はSi酸化物層の表面に到達した時点で自動的に停止する。そして、形成されたウェル13Aの深さは、用いた半導体層131の厚みで一義的に決まるので、形成されたウェル13Aの深さは極めて正確になる。
【0033】
基板の他の例B2を図8に示す。この基板B2では、例えば熱酸化して一方の表層部分のみがSi酸化物層141aになっているSi等からなる半導体基板141のSi酸化物層141aの上に、例えばDNAホスホアミダイトTのような生体物質と反応せず、またDNA合成時に用いる各種の有機溶剤、酸液、アルカリ液などにも浸蝕されない材料から成る所定厚みの非反応層142が配置されている。そしてこの非反応層142の厚み方向には、所定の直径を有するウェル23がSi酸化物層141aの表面141bにまで所定の配列パターンで設けられている。そして、Si酸化物層141aの表面141bには、シランカップリング層14,DNAホスホアミダイトTを反応させて5merから成る1本鎖DNAを有するオリゴヌクレオチドスペーサ(5T)からなるスペーサ層135がこの順序で配置されている。この基板B2の場合、ウェル23の底面のみからDNAホスホアミダイトTとの反応が可能であるオリゴヌクレオチドスペーサ(5T)からなるスペーサ層135の表面が表出して反応領域を構成し、他の表面は不活性化処理が施されていないが、総てDNAホスホアミダイトTと反応しない材料から成る非反応領域になっている。
【0034】
ここで、上記した非反応領域を形成する非反応層142の材料としては、例えば、単結晶シリコン、酸化物を形成しにくい白金などの金属、窒化シリコンなどの窒化物、ポリエチレン、ポリスチレンのような反応性の官能基をもたないプラスチックなどをあげることができる。また非反応層142は、上記した材料部材のSi酸化物層への直接接合、上記材料のSi酸化物層表面への真空蒸着やCVD、モノマーを原料とした気相重合のような成膜法などによって形成することができる。そして、ウェル23の形成に関しては、例えばフォトリソグラフィー技術とエッチング技術などを適用して形成することができる。
【0035】
基板の他の例B3を図9に示す。この基板B3は、ガラス板151の表面に、基板B2の場合と同じ非反応層142が配置され、この層の厚み方向に、ガラス板151の表面151aにまで至るウェル152が設けられされ、ウェル152の底面から表出するガラス板の表面151aにのみシランカップリング層14、オリゴヌクレオチドスペーサ(5T)からなるスペーサ層135が配置された構造になっている。
【0036】
この基板B3の場合、ウェル152の底面151aのみにオリゴヌクレオチドスペーサ(5T)層の表面が表出し、そこが反応領域を構成し、ウェルの側面や非反応層142の表面は、不活性化処理が施されることなく総て非反応領域になっている。
【0037】
基板の他の例B4を図10に示す。この基板B4は、DNAホスホアミダイトTと反応せず、またDNA合成時に用いる有機溶剤、酸液、アルカリ液などに浸蝕されない単一の材料から成る板状体161の表面161aから内部に向かって、所定の直径と深さを有するウェル162が設けられている。ウェル162の底面161aにはSi酸化物層163が配置され、さらにSi酸化物層の上にシランカップリング層14及びオリゴヌクレオチドスペーサ(5T)からなるスペーサ層135が順次配置されている。この基板B4の場合も、DNAホスホアミダイトTと反応可能な部分はウェルの底面に位置するオリゴヌクレオチドスペーサからなるスペーサ層135のみであり、他の部分は非反応領域になっている。この非反応領域を構成する単一の材料としては、例えば、Siや、窒化シリコンなどの窒化物をあげることができる。そして、Siからなる板状体を用いた場合、上記したウェルは、例えば、反応性イオンエッチング、イオンミリングなどのドライエッチング、またはウェットエッチングなどを適用して形成することができる。
【0038】
なお、Si板の表面から内部に向かって酸素イオンをイオン注入するSIMOX(Separation by IMplanted Oxygen)法を適用することにより、Si板の内部にその表面からある深さの位置にSi酸化物層を形成し、次にSi板の表面からそのSi酸化物層までウェルを形成してもよい。また、Si板の表面を一旦酸化したのち、その表面のSi酸化物層にフォトリソグラフィー技術とエッチング技術を適用して所定のパターンで配列する開口部を形成し、その後、開口部に表出しているSiの表面から上記したSIMOX法で酸素イオンをイオン注入し、次に、表面のSi酸化物層をエッチング除去することにより、前記した開口部の直下に、Si板の内部にその表面からある深さの位置にSi酸化物層の分離構造を形成することができる。そして、開口部の位置で、Si板の表面からSi酸化物層までウェルを形成してもよい。
【0039】
次に、本発明のバイオチップ用基板を用いてバイオチップを作成する工程を、図2で示す基板B1を用い、ホスホアミダイト法でプローブDNAが固定されたDNAチップを作成する場合を例にして説明する。
【0040】
まず、基板B1を用意する。基板B1は、図11で模式的に示すように、基板B1にアレイ状に配列している総てのウェル13は、その底面にのみ、末端をDMTで保護されたオリゴヌクレオチドスペーサ(5T)からなるスペーサ層135が固定されている。
【0041】
工程b1:ウェルに樹脂マスキングを行う。具体的には、配列するウェルのうち、例えばDNAホスホアミダイトC:( Cytosine)との化学合成を行わせるウェルを除き、他のウェルの総てに樹脂液滴6を充填する。図12で示すように、樹脂液滴6が充填されたウェル内のオリゴヌクレオチドスペーサ(5T)は樹脂で封止されるが、樹脂液滴6が充填されていないウェル内のオリゴヌクレオチドスペーサ(5T)は末端のDMTが脱離可能な状態にある。
【0042】
工程b2:基板上面全体に、トリクロロ酢酸のような酸液を均等に供給して脱トリチル化処理(Detritilation)を行う。その結果、図13で示すように、樹脂液滴が充填されていないウェルでは、オリゴヌクレオチドスペーサ(5T)のDMTが脱離して、そこのオリゴヌクレオチドスペーサ(5T)は活性化する。このようにして、基板B1に設けられたウェルのうち、特定のウェル(樹脂液滴を充填しないウェル)内のオリゴヌクレオチドスペーサ(5T)のみがDNAホスホアミダイトCと反応可能な状態になる。
【0043】
工程b3:基板表面に、有機溶媒を供給して、ウェルに充填されている樹脂液滴を溶解及び除去する。その結果、図14で示すように、基板に配列しているウェルの底面には、活性化したオリゴヌクレオチドスペーサ(5T)と、末端をDMTで保護されているオリゴヌクレオチドスペーサ(5T)が表出する。
【0044】
工程b4:基板の表面全体に、末端がDMTで保護されたDNAホスホアミダイトCの試薬を均等に供給してDNA合成(Coupling)を行う。その結果、図15で示すように、特定のウェル内では、活性化していたオリゴヌクレオチドスペーサ(5T)と供給されたDNAホスホアミダイトCとの間で合成反応が進行して両者は化学結合し、オリゴヌクレオチドは1mer伸長する。そして伸長したオリゴヌクレオチドの末端はDMTで保護される。他方、残りのウェル内では、表出するオリゴヌクレオチドスペーサ(5T)は末端がDMTで保護されているので不活性である。そのため、供給されたDNAホスホアミダイトCとの間で合成反応は進まない。
【0045】
このように、工程b1〜工程b4を1サイクルとするDNA合成反応を進めることにより、樹脂液滴を充填しないウェルでのみオリゴヌクレオチドは上記1サイクルで1mer伸長し、樹脂液滴を充填したウェルでは合成反応開始前の状態が維持される。そして、反応させるDNAホスホアミダイトはT、A、C、Gの4種類であるので、さらにウェルに固定されているオリゴヌクレオチドを1mer伸長させるためには上記したサイクルを4回実施すればよい。このようにして、基板B1のウェルの底面でのみ、設計図に基づいた配列のプローブDNAを固定することができる。
【0046】
この基板B1を用いてDNAチップを作成する場合、DNA合成反応はウェルの底面でのみ進行し、他の部分は合成反応に全く関与しない。したがって、例えば、工程b1で充填する樹脂液滴がウェルから仮に溢れ出たとしても、それが隣接するウェルに流入しない限り、DNA合成反応とは無関係であり、蛍光識別時に何の悪影響も及ぼさない。また従来の基板Aの場合に行っていた不活性処理(Capping)も行う必要がない。
【0047】
なお、以上の説明において、基板B1,B2,B3,B4はいずれも、基板B0のSi酸化物層の表面にシラン層を形成することにより、プローブDNAの合成反応を可能にするDNAチップ用基板に関するものである。しかし、第1の実施の形態に係るバイオチップ用基板はこれに限定されるものではなく、ウェルの底面(反応領域)を構成する材料として、被検対象の生体物質と特異的な結合をする生体物質を固定できる材料を選定することにより、各種のチップを製造することが可能である。
【0048】
例えば図1で示す基本構造の基板B0のSi酸化物層の表面に、被検対象の生体物質と特異的な結合をする各種のリンカー成分を固定することにより、その部分を生体物質に対する反応領域に特化させることができる。その場合、基板における他の部分はその生体物質にとっての非反応領域となり、2つの領域の境界は画分されることになる。
【0049】
例えばリンカー成分として、アミノプロピルメトキシシランのようなシランカップリング剤や、エポキシ基、トシル基、活性化カルボキシル基、アミノ基、チオール基、ブロモアトアミド基のような官能基を有するものを用いれば、アミノ基、チオール基、水酸基、カルボキシル基、ブロモアトアミド基などを末端にもつ生体物質をリンカー成分を介して基板B0のSi酸化物層の表面に固定することができる。
【0050】
また生体物質として、2本鎖DNA、タンパク質、ペプチド、糖鎖、RNA―タンパク質複合体、糖質―タンパク質複合体を用いれば、2本鎖DNAの特異的塩基配列を認識して結合する転写因子群を検出するチップ、ペプチド検出用チップ、タンパク質検出用チップ、糖鎖検出用チップ、タンパク質を消化するためのチップなどを製造することができる。
【0051】
(第2の実施の形態)
SOIウェハを出発素材とし、図3から図7で示した工程を経て、最終的に図2で示した構造のバイオチップ用基板B1を製造した。このバイオチップ用基板B1の仕様は以下の通りである。大きさは1cm×1cm、ウェルの形状は直径300μm、深さ20μmである。このウェルが基板上に縦9個、横14個格子状に形成されている。シランカップリング層は、5,6-エポキシトリエトキシシランを用いて形成され、オリゴヌクレオチドスペーサ層はDNA合成試薬を用いたホスホアミダイト法で形成されている。このバイオチップ用基板B1を用い、ホスホアミダイト法を適用して、ウェル内に、下記の配列のプローブDNAを合成してDNAチップを作成する。
【0052】
1. 3’-ATCTCACACGTCAAATAG-5’ 2. 3’-ATCTCACTCAAATAG-5’ 3. 3’-ATCTCACGCAAATAG-5’ 4. 3’-ATCTCACCCAAATAG-5’ 5. 3’-ATCTCACACAAATAG-5’ 6. 3’-ATCTCACCAAATAG-5’ このDNAチップを用いて、蛍光標識されたターゲットDNAの検出試験を行った結果を図16に示す。ここで、プローブ4のスポットの蛍光強度が最も高いため、ターゲットDNAの配列は、5’-TAGAGTGGGTTTATC-3’であることが分かる。なお、プローブ2、プローブ3、プローブ5は、いずれも、配列の中心に位置する塩基がミスマッチしている。またプローブ1は塩基配列が長すぎ、プローブ6は短かすぎてミスマッチしている。
【0053】
比較のために、特表2002−537869号公報に開示されている方法に準拠して不活性化処理(Capping)を行って、図67で示した構造の基板Aを製造する。そしてこの基板Aを用い、第2の実施の形態に係るDNAチップと同様にして6種類の配列のプローブDNAを移植してDNAチップを作成し、ターゲットDNAの検出試験を行った結果を図17に示す。この場合もプローブ4のスポットにおける蛍光強度が最も高く、ターゲットDNAの配列が5’-TAGAGTGGGTTTATC-3’であることが分かる。しかし図17から明らかなように、従来の基板Aから作成したDNAチップでは、各スポットの周囲も蛍光発色している。そのためバックグラウンドノイズが発生し、発光スポットと基板表面との境界が不鮮明になっている。これは、基板製造時における樹脂液滴のウェルへの充填時に、樹脂液滴がウェルからその周辺に溢れ出て、その部分が不活性化処理されなかった結果である。また、プローブ4のスポットの場合、スポットの中心部における蛍光発色が弱い。これは、樹脂液滴の充填量が過少であったためである。しかし、全体の蛍光強度が高いのは、ここに移植されているプローブDNAがターゲットDNAと相補関係にあるからである。
【0054】
この従来の基板Aと対比すると、第2の実施の形態のバイオチップ用基板B1から作成されたDNAチップは、発光スポットと基板表面との境界が極めて明瞭であり、バックグラウンドノイズの発生は実質的にないといってもよい。また、各発光スポットにおける蛍光強度も均質化していて、測定データは安定している。
【0055】
(第3の実施の形態)
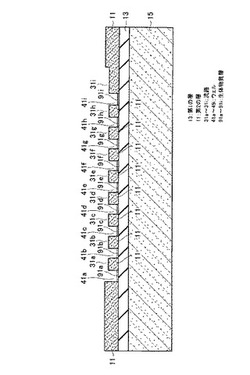
本発明の第3の実施の形態に係るバイオチップ用基板は、図18、図18のA-A方向から見た断面図である図19に示すように、半導体基板15、半導体基板15上に配置され、酸化珪素(SiO2)からなり、表面に水酸(-OH)基を導入可能な第1の層13、第1の層13上に配置され、第1の層13に達する複数のウェル41a, 41b, 41c, 41d, 41e, 41f, 41g, 41h, 41i, 42a, 42b, 42c, 42d, 42e, 42f, 42g, 42h, 42i, 43a, 43b, 43c, 43d, 43e, 43f, 43g, 43h, 43i, 44a, 44b, 44c, 44d, 44e, 44f, 44g, 45a, 45b, 45c, 45d, 45e, 45f, 45g, 46a, 46b, 46c, 46d, 46e, 46f, 46g, 47a, 47b, 47c, 47d, 47e, 47f, 47g, 47h, 47i, 48a, 48b, 48c, 48d, 48e, 48f, 48g, 48h, 48i, 49a, 49b, 49c, 49d, 49e, 49f, 49g, 49h, 49iを有する第2の層11を有する。第2の層11は第1の層13と異なる材料からなり、第2の層11と比較して表面に水酸(-OH)基を導入しにくい結晶シリコン(Si)等の材料からなる。第1の層13は、第2の層11よりも高い親水性を有する。したがって、第1の層13は第2の層11と比較して容易に水酸化される。
【0056】
さらに図18に示すバイオチップ用基板は、複数のウェル41a〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれを接続する、第2の層11に設けられた複数の流路31a, 31b, 31c, 31d, 31e, 31f, 31g, 31h, 31i, 32a, 32b, 32c, 32d, 32e, 32f, 32g, 32h, 32i, 33a, 33b, 33c, 33d, 33e, 33f, 33g, 33h, 33i, 34a, 34b, 34c, 34d, 34e, 34f, 34g, 35a, 35b, 35c, 35d, 35e, 35f, 35g, 36a, 36b, 36c, 36d, 36e, 36f, 36g, 37a, 37b, 37c, 37d, 37e, 37f, 37g, 37h, 37i, 38a, 38b, 38c, 38d, 38e, 38f, 38g, 38h, 38i, 39a, 39b, 39c, 39d, 39e, 39f, 39g, 39hを有する。流路31aは、図19及び図18のB-B方向から見た断面図である図20に示すように、ウェル41aとウェル41bを結ぶ溝である。他の複数の流路31b〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれも、複数のウェル41b〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれの間に第2の層11に設けられた溝である。複数の流路31a〜39hにより複数のウェル41a〜49iのそれぞれを同じ溶液で満たすことが可能となる。
【0057】
図19に示すように、複数のウェル41a〜41iのそれぞれを介して表出する第1の層13の表面には、生体物質層91a, 91b, 91c, 91d, 91e, 91f, 91g, 91h, 91iが配置されている。生体物質層91a〜91iのそれぞれにおいては、複数のデオキシリボ核酸(DNA)、複数のリボ核酸(RNA)、複数のペプチド核酸(PNA)、あるいは複数のたんぱく質等の複数の生体分子のそれぞれの官能基が、図21に示すように第1の層13表面の水酸(-OH)基と共有結合している。生体分子がDNA、RNA、あるいはPNAである場合は、それぞれの配列はターゲットとなる生体分子と相補的となるよう設計される。
【0058】
なお、第1の層13表面に直接生体物質層91a〜91iのそれぞれを配置することに第3の実施の形態は限定されない。図22に示す例では、第1の層13の複数のウェル41a〜41iのそれぞれを介して表出する部分の表面上に、シランカップリング層81a, 81b, 81c, 81d, 81e, 81f, 81g, 81h, 81iが配置されている。シランカップリング層81a〜81iのそれぞれにおいては、図23に示すように、複数のシランカップリング剤のそれぞれのメチル基(-CH3)あるいはエチル基(-C2H5)が第1の層13表面の水酸(-OH)基と酸塩基反応で化学結合している。
【0059】
複数のシランカップリング剤のそれぞれには、3-グリシドキシプロピルトリメトキシシラン、3-グリシドキシプロピルメチルジエトキシシラン、3-グリシドキシプロピルトリエトキシシラン、N-2(アミノエチル)3-アミノプロピルメチルジメトキシシラン、N-2(アミノエチル)3-アミノプロピルトリメトキシシラン、N-2(アミノエチル)3-アミノプロピルトリエトキシシラン、3-アミノプロピルトリメトキシシラン、3-アミノプロピルトリエトキシシラン等が使用可能である。
【0060】
シランカップリング層81a〜81iのそれぞれの上には、生体物質層91a, 91b, 91c, 91d, 91e, 91f, 91g, 91h, 91iが配置されている。生体物質層91a〜91iのそれぞれにおいては、例えば、複数の生体分子のそれぞれに導入された活性エステルがシランカップリング剤のアミノ(-NH2)基とアミド(-NH-CO-)結合している。
【0061】
あるいは、シランカップリング剤と生体分子は架橋剤を介して結合してもよい。例えば、受容体、リガンド、アンタゴニスト、抗体、抗原等のタンパク質に含まれるリジン(Lys)のアミノ(-NH2)基、アスパラギン酸(Asp)及びグルタミン酸(Glu)のカルボキシル(-COOH)基、チロシン(Tyr)のフェノール(-C6H4(OH))基、ヒスチジン(His)のイミダゾール(-C3H3N2)基、システイン(Cys)のチオール(-SH)基等の官能基と、シランカップリング剤のアミノ基やエポキシ基とを架橋剤で結合してもよい。図24に示す例においては、シランカップリング剤のアミノ基と抗体95a, 95b, 95cのアミノ基とを、両端でアミノ基と反応する架橋剤であるジスクシンイミジルスベレート(Disuccinimidyl suberate : DSS)で結合している。
【0062】
架橋剤としては、他に、両端でアミノ基と反応するビスサルフォスクシンイミジルスベレート(Bis [Sulfosuccinimidyl] suberate : BS3)、ジメチルスベルイミデート(Dimethyl suberimidate・HCl : DMS)、ジスクシンイミジルグルタレート(Disuccinimidyl glutarate : DSG)、ローマン試薬(Loman's Reagent)、 3, 3' - ジチオビスサルフォスクシンイミジルプロピオネート(3, 3' - Dithiobis [sulfosuccinimidyl propionate] : DTSSP)、 エチレングリコールビススクシンイミジルスクシネート(Ethylene glycol bis [succinimidylsuccinate] : EGS)、アミノ基とカルボキシル基と反応する1-エチル - 3 - [3 - ジメチルアミノプロピル]カルボジイミドヒドロクロライド(1 - Ethyl - 3 - [3 - Dimethylaminopropyl] carbodiimide Hydrochloride : EDC)等が使用可能である。
【0063】
またさらに架橋剤としては、アミノ基とチオール基と反応するm-マレイミドベンジル-N-ヒドロキシスクシンイミドエステル(m - Maleimidobenzyl - N - hydroxysuccinimide ester : MBS)、 スクシンイミジル4 - [N - マレイミドメチル] - シクロヘキサン - 1 - カルボキシレート(Succinimidyl 4 - [N - maleimidomethyl] - cyclohexane - 1 - carboxylate : SMCC)、 スクシンイミジル 4 - [p - マレイミドフェニル] - ブチレート(Succinimidyl 4 - [p - maleimidophenyl] - buthrate : SMPB)、 N-スクシンイミジル3-(2-ピリジルジチオ)プロピオネート(N - Succinimidyl 3 - [2 - pyridyldithio] propionate : SPDP)、N-(γ-マレイミドブチリルオキシ)サルフォスクシンイミドエステル(N - [γ - Maleimidobutyloxy] sulfosuccinimide ester : Sulfo - GMBS)、 サルフォスクシンイミジル6 - [3' (2 - ピリジルジチオ) - プロピオンアミド] ヘキサノエート(Sulfosuccinimidyl 6 - [3' (2 - pyridyldithio) - propionamide] hexanoate : Sulfo - LC - SPDP)、m-マレイミドベンゾイル-N-ヒドロキシサルフォスクシンイミドエステル(m - Maleimidebenzoyl - N - hydoroxysulfo - succinimide ester : Sulfo - MBS)、サルフォスクシンイミジル-4-(N-マレイミドメチル)シクロヘキサン-1-カルボキシレート(Sulfosuccinimidyl 4 [N - maleimidomethyl] - cyclohexane - 1 - carboxylate : Sulfo - SMCC)、サルフォスクシンイミジル-4-(p-マレイミドフェニル)ブチレート(Sulfosuccinimidy 4 - [p - maleimidophenyl] - butyrate : Sulfo - SMPB)等が使用可能である。
【0064】
図18に示す他の複数のウェル42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれの断面図は、図19あるいは図22と同様であるので説明は省略する。なお、図19及び図22に示す第1の層13の材料にはSiO2以外にシリカガラス等が使用可能である。この場合、半導体基板15は省略してもよい。また第2の層11の材料には結晶Si以外に、ポリテトラフルオロエチレン、不溶性エポキシ系レジスト等の樹脂が使用可能である。
【0065】
図18乃至図24に示したバイオチップ用基板の上部には、図25及び図25のA-A方向から見た断面図である図26に示すように、開口27及び開口28を有するカバープレート25が配置される。カバープレート25の材料としては、石英ガラス、アクリル樹脂、及びポリカーボネート等が使用可能である。図18に示すバイオチップ用基板上部にカバープレート25が配置された場合の、A-A方向から見た断面図を図27に示す。開口27からCy3あるいはCy5等の蛍光試薬でラベルされた生体分子サンプルを含む検査溶液が注入され、開口28より内部の空気が吸引されると、ウェル41a〜41i、及び流路31a〜31iのそれぞれは順次検査溶液で充填されていく。さらに、図18に示す他の複数のウェル42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49i、及び他の複数の流路32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれも順次検査溶液で充填される。
【0066】
したがって、図27に示す生体物質層91a〜91iに固定された生体分子と相補的に結合するターゲット生体分子が検査溶液に含まれている場合、ターゲット生体分子は生体物質層91a〜91iにトラップされる。そのため、検査溶液中に含まれるサンプル生体分子を予めCy3等の蛍光試薬で標識しておけば、検査溶液を吸引した後、複数のウェル41a〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49i、及び複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれを洗浄した後、蛍光反応を確認することで、検査溶液中にターゲット生体分子が含まれていたかどうかを確認することが可能となる。なお、複数のウェル41a〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれの直径を600mm以上にすれば、肉眼で蛍光反応を確認することも可能である。
【0067】
以上、図18乃至図27に示したバイオチップ用基板は、複数のウェル41a〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49i、及び複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれが第2の層11上に設けられているため、カバープレート25を配置する際に高精度な位置あわせが必要ない。また、必要な検査溶液の量は、複数のウェル41a〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49i、及び複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれを充填するに足る量でよいので、希少サンプルの検査も容易になる。また、複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hが設けられているため、複数のウェル41a〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれをスポッタ等の装置で個別に検査溶液で充填する必要がなく、検査時間の短縮をも可能とする。
【0068】
次に、図28乃至図49を用いて、第3の実施の形態に係るバイオチップ用基板の製造方法について説明する。
【0069】
(a) まず図28に示すように、半導体基板15、半導体基板15上に配置されたSiO2からなる第1の層13、第1の層13上に配置された結晶Siからなる第2の層11、第2の層11上に配置された自然酸化膜12を有するSOI(Silicon On Insulator)基板を用意する。次に図29に示すように、自然酸化膜12上にレジスト21をスピン塗布する。
【0070】
(b) リソグラフィ技術によりレジスト21の一部を除去し、図30に示すように開口51a, 51b, 51c, 51d, 51e, 51f, 51g, 51h, 51iのそれぞれを設ける。次に開口51a〜51iのそれぞれから表出する自然酸化膜12及び第2の層11の一部を異方性エッチング等により選択的に除去し、図31及び図31のA-A方向から見た断面図である図32に示すように流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれを第2の層11に形成させる。
【0071】
(c) 図33に示すように、自然酸化膜12上にレジスト22をスピン塗布する。その後リソグラフィ技術によりレジスト22の一部を除去し、図34に示すように開口61a, 61b, 61c, 61d, 61e, 61f, 61g, 61h, 61iのそれぞれを設ける。次に開口61a〜61iのそれぞれから表出する自然酸化膜12及び第2の層11の一部を異方性エッチング等により第1の層13が表出するまで選択的に除去し、図35に示すようにウェル41a〜41iのそれぞれを第2の層11に形成させる。
【0072】
(d) SOI基板を撹拌された水酸化ナトリウム(NaOH)溶液中に室温で2時間放置する。ここでNaOH溶液とは、98gのNaOH、294mlの蒸留水、及び392mlのエタノールを混合した溶液である。NaOH溶液中に放置することにより、図36に示すように第2の層11表面の自然酸化膜12が除去される。さらにウェル41a〜41iのそれぞれから表出する第1の層13の表面に、図37に示すように、複数の水酸(-OH)基が導入される。
【0073】
(e) 3-グリシドキシプロピルメチルジエトキシシラン、3-グリシドキシプロピルトリエトキシシラン等の官能基にエポキシを有するシランカップリング剤、あるいはN-2(アミノエチル)3-アミノプロピルトリエトキシシラン、3-アミノプロピルトリメトキシシラン、3-アミノプロピルトリエトキシシラン等の官能基にアミンを有するシランカップリン剤等を図36に示すウェル41a〜41iのそれぞれから表出する第1の層13の表面上に滴下し、図38に示すシランカップリング層81a, 81b, 81c, 81d, 81e, 81f, 81g, 81h, 81iのそれぞれを形成させる。例えば、3-アミノプロピルトリメトキシシランを滴下した場合、図39に示すように、第1の層13表面に複数のアミノ(-NH2)基が導入される。なお、第1の層13表面に残った未反応のOH基は、例えば、無水酢酸と1-メチルイミダゾール(テトラヒドロフラン溶液)で処理してアセチル化し、キャッピングする。
【0074】
(f) 活性エステルが導入され、5’末端がジメトキシトリチル(DMTr)基で保護、及び図40に示すようにアデニン、シトシン、及びグアニン等の塩基のアミノ基が保護された1塩基目のヌクレオシドを図38に示すシランカップリング層81aに滴下する。アデニンとシトシンのアミノ基はベンゾイル基で保護されている。グアニンのアミノ基はイソブチル基で保護されている。滴下により、1塩基目のヌクレオシドの活性エステルとシランカップリング剤のアミノ基(-NH2)とを反応させ、図41に示すように、アミド結合(-NH-CO-)を形成させる。次に、1塩基目のヌクレオシドのジメトキシトリチル(DMTr)基を3%トリクロロ酢酸/ジクロロメタン酸性溶剤で脱保護し、図42に示すように5’水酸(-OH)基を1塩基目のヌクレオシドに導入する。
【0075】
(g) テトラゾールと図43に示すヌクレオシドホスホロアミダイトをシランカップリング層81a〜81iに滴下し、1塩基目のヌクレオシドの5’水酸(-OH)基にヌクレオシドホスホロアミダイトのN, N-ジイソプロピルアミノ基を縮合反応させる。縮合反応により、図44に示すように、1塩基目のヌクレオシドに2塩基目のヌクレオシドが共有結合される。なお、1塩基目のヌクレオシドの未反応の5’水酸(-OH)基は無水酢酸と1-メチルイミダゾール(テトラヒドロフラン溶液)で処理してアセチル化し、キャッピングする。
【0076】
(h) 縮合反応で生じた亜リン酸トリエステル結合は、ヨウ素と水(ピリジン含有テトラヒドロフラン溶液)で酸化し、図45に示すように、より安定なリン酸トリエステル結合に変換させる。その後、2塩基目のジメトキシトリチル(DMTr)基を除去し、図46に示すように目的のDNA鎖長になるまでヌクレオシドホスホロアミダイトとの縮合反応を繰り返す。
【0077】
(i) アンモニア水処理により、図47に示すように、リン酸基に結合したシアノエチル保護基を脱離させる。また、図40に示したアミノ基が保護された塩基をアンモニア水で図48に示すように脱保護する。最後に末端のジメトキシトリチル(DMTr)基を図49に示すように脱保護する。図41乃至図49に示した工程を図38に示したシランカップリング層81b〜81iのそれぞれについても実施し、図22に示すように生体物質層91a〜91iを形成させる。
【0078】
以上示した第3の実施の形態に係るバイオチップ用基板の製造方法によれば、図36で説明したように、NaOH溶液でSOI基板を処理することにより、第1の層13の表面のみに水酸(-OH)基が導入される。また、第2の層11がSiである場合、自然酸化膜12の膜厚は通常2nm以下であるが、室温で2時間NaOH溶液に浸すことにより自然酸化膜12は除去される。そのため、後の工程で滴下されるシランカップリング剤は第1の層13表面の水酸(-OH)基のみと反応し、第2の層11表面には結合しない。従来においては、残存する自然酸化膜12にシランカップリング剤が結合すると、自然酸化膜12上にも蛍光標識されたターゲット生体分子が結合し、バックグランドノイズになることがあった。特に微量検定においては、複数のウェル41a〜41i, 41b〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれの底部にのみターゲット生体分子がトラップされ、第2の層11上にはターゲット生体分子がトラップされないようにして、蛍光検定のコントラストの向上を図ることを可能にする技術の登場がのぞまれていた。これに対し、第3の実施の形態に係るバイオチップ用基板の製造方法によれば、第1の層13表面にのみ水酸(-OH)基を導入し、かつ同時に第2の層11表面の自然酸化膜12を除去することを可能とする。そのため、バックグランドノイズの極めて低いバイオチップ用基板の製造が可能となる。
【0079】
図50(a)は、図18に示したウェル41a〜42i, 42a〜42iが、蛍光試薬でラベルされたサンプルDNAで、図21に示した生体物質層91aに固定されたDNAと相補的な配列を有するものを含む検査溶液にさらされた時の顕微鏡写真の一例を示している。図50(b)は、図62乃至図67に示した従来のバイオチップ用基板が蛍光試薬でラベルされたサンプルDNAで、基板に固定されたDNAと相補的な配列を有するものを含む検査溶液にさらされた時の顕微鏡写真の一例を示している。従来の基板では、サンプルDNAがウェルの底だけでなく、他の領域にも結合していることが分かる。また、ウェルの底にもコンタミネーションが観察される。しかし、第3の実施の形態に係るバイオチップ用基板は、図50(a)に示すように、ターゲットDNAをウェルの底だけにハイブリダイズすることが可能である。また、ウェルにおける蛍光の均一性をも実現している。
【0080】
なお図30乃至図35においては、先に複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれを形成した後に、複数のウェル41a〜41i, 41b〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれを形成する方法を説明したが、先に複数のウェル41a〜41i, 41b〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれを形成した後に複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれを形成してもよい。ただし、複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれの深さの方が、複数のウェル41a〜41i, 41b〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれの深さよりも浅いため、先に複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれを形成した方がレジストの均一なスピン塗布が容易になる。
【0081】
また、図38乃至図49においては、第1の層13上にシランカップリング層81a〜81iを形成した後に生体物質層91a〜91iを形成する方法を説明したが、図37に示した複数の水酸基のそれぞれに生体分子をシランカップリング層81a〜81iを介さずに固定してもかまわないのは勿論である。
【0082】
さらに、図28乃至図49においては、SOI基板を使用する例を示したが、ガラス基板とポリテトラフルオロエチレン基板の貼り合わせ基板を使用してバイオチップ用基板を製造してもよい。すなわち、第1の層13にガラス基板を用い、第2の層11にポリテトラフルオロエチレン基板を用いることにより、SOI基板と同様にバイオチップ用基板を製造することが可能である。
【0083】
(第1の変形例)
バイオチップ用基板の製造方法は、以上示した方法に限定されない。以下、エポキシ系ネガ型レジストを用いたバイオチップ用基板の製造方法について説明する。
【0084】
(a) 図51に示すガラス等からなる第1の層115の表面にエポキシ系ネガ型の第1レジスト111をスピン塗布する。次に、図52に示すように、形成されるウェルに対応する遮光パターン140a, 140b, 140c, ・・・を有するフォトマスク40を用いて第1レジスト111を露光する。
【0085】
(b) 図53に示すように、第1レジスト111の表面に、さらにエポキシ系ネガ型の第2レジスト211をスピン塗布し、第2の層11を形成させる。次に、図54に示すように、形成されるウェル及び流路に対応する遮光パターン150を有するフォトマスク50を用いて第2レジスト211を露光する。
【0086】
(c) 第1レジスト111及び第2レジスト211をベーク処理する。なお、ベーク処理により、第1レジスト111及び第2レジスト211のそれぞれは緩衝液等に対して不溶性になる。その後、アルカリ現像液等で現像処理を行うことにより、図55に示すようにウェル41a〜41i及び流路31a〜31iのそれぞれが第2の層11に形成される。以下、図37乃至図49に示した方法を実施することにより、バイオチップ用基板が完成する。
【0087】
(その他の実施の形態)
上記のように、本発明は実施の形態によって記載したが、この開示の一部をなす記述及び図面はこの発明を限定するものであると理解するべきではない。この開示から当業者には様々な代替実施の形態、実施の形態及び運用技術が明らかになるはずである。
【0088】
例えば、図56及び図56のA-A方向から見た断面図である図57に示す第2の変形例に係るバイオチップ用基板は、図18及び図19に示したバイオチップ用基板と異なり、複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれが第2の層11に設けられていない。一方、図58及び図58のB-B方向から見た断面図である図59に示す第2の変形例に係るカバープレート25は、図25及び図26に示したカバープレート25と異なり、図56及び図57に示したバイオチップ用基板と貼り合わされた場合に、複数のウェル41a〜41i, 41b〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれを接続する流路300を有する。
【0089】
図56に示すバイオチップ用基板上に図58に示すカバープレート25を貼り合わせた場合の断面図である図60に示すように、開口27から注入される検査溶液はウェル41aを充填した後、流路300を辿って順次ウェル41b〜41iを充填していく。したがって、第3の実施の形態と同様、図56に示すバイオチップ用基板及び図58に示すカバープレート25を用いることにより、必要な検査溶液の量を減少させることが可能となる。
【0090】
この様に、本発明はここでは記載していない様々な実施の形態等を包含するということを理解すべきである。したがって、本発明はこの開示から妥当な特許請求の範囲の発明特定事項によってのみ限定されるものである。
【符号の説明】
【0091】
A1, A2, A3, A4…中間体
A, B0, B1,B2,B3,B4…基板
1, 15, 141…半導体基板
2, 2A, 13A, 23, 41a〜41i, 152, 162…ウェル
3, 132, 141a, 163…Si酸化物層
4, 14, 81a〜81i…シランカップリング層
5a…非活性スペーサ層
5, 135…スペーサ層
6…樹脂液滴
11…第2の層
12…自然酸化膜
13, 115…第1の層
16, 21, 22…レジスト
25…カバープレート
27, 28, 51a〜51i, 61a〜61i…開口
31a〜31i, 32a〜32i, 300…流路
40, 50…フォトマスク
91a〜91i…生体物質層
95a, 95b, 95c…抗体
111…第1レジスト
131…半導体層
140a〜140c…遮光パターン
142…非反応層
150…遮光パターン
151…ガラス板
161…板状体
211…第2レジスト
【技術分野】
【0001】
本発明は生体分子検出技術に関し、特にバイオチップ用基板の製造方法に関する。
【背景技術】
【0002】
バイオチップは、被検対象の生体物質と特異的な化学反応をするプローブをチップ表面の特定位置に固定した素子の総称である。バイオチップの代表例であるDNAチップは、血液や細胞の抽出液に含まれるターゲットDNAの種類と量を検出するために使用されている。DNAチップは、例えばスライドガラス板のような基板の上に、それぞれ既知の配列を有する1本鎖DNAであるプローブDNAを、数千〜数万種類、アレイ状に配列したものである。このDNAチップに蛍光標識させたターゲットDNAを含む被験液を供給すると、配列がプローブDNAと相補関係にあるターゲットDNAのみがプローブDNAと水素結合により互いに結合して2本鎖を形成する。そのため、ターゲットDNAが固定された部分が蛍光発色するので、チップ上の蛍光発色位置とその発色強度を測定することにより、ターゲットDNAの種類と量を知ることができる。このようにして使用されるDNAチップを作成する際には、したがって、基板表面の所定部分に、所定配列のプローブDNAを固定することが必要である。
【0003】
プローブDNAの固定方法に関しては、大別して2種類の方法がある。第1の方法はマイクロアレイ方式と呼ばれている。これは、予め化学合成して作成するかまたは対象とする生体から抽出したプローブDNAを、基板の上にアレイ状に滴下、あるいは印刷して固定する方法である。第2の方法は、基板の上に、チミン(T: Thymine)、アデニン(A: Adenine)、シトシン(C: Cytosine)、グアニン(G: Guanine)の4種類の塩基を用いて、設計図に基づく所定配列の1本鎖DNAであるプローブDNAを、直接化学合成する方法である。この第2の固定方法の場合、化学合成に用いる基板の表面には、設計目的のプローブDNAの合成反応を進めるための反応領域と、その合成反応には関与しない非反応領域とが明確に分離された状態で形成されることが必要となる。
【0004】
第2の固定方法が採用されるチップの場合、基板の材料としては石英(SiO2)等を用いる。また反応領域と非反応領域を分離して形成するためにフォトリソグラフィー技術が用いられる。プローブDNAの化学合成時には、反応領域における1本鎖DNAの活性化処理に紫外線照射技術を適用して、1本鎖DNAを順次組み立てる。このチップでは、1板の基板の上に、1スポットが約20μm四方の大きさである反応領域が20万スポット程度形成されており、1スポット内には約200万本程度の同一種類のプローブDNAが固定されている。スポットはチップ上に高密度に形成されているので、1度の試験で非常に多数のターゲットDNAを検査することができる。
【0005】
他に提案されているチップとしてアレープレートがある。アレープレートは次のようにして製造されている。まず、シリコン(Si)基板の表面をフルオロアルキルシランと反応させて、そこに一旦、疎水性のフルオロアルキルシロキサンの薄膜を形成する。次に、この薄膜を所定の平面パターンで除去し、薄膜を除去した部分にSi基板の表面を露出させ、最後にその露出面をヒドロキシシランまたはアルキルシランと反応させることにより、露出面にOH基を導入する(例えば、特許文献1参照。)。したがって、アレープレートの場合、Si基板の表面には表面張力が大きい疎水性薄膜のサイトと親水性のOH基を有するサイトが存在する。そのため、生体物質に対して前者は非反応領域、後者は反応領域としてそれぞれ機能する。アレープレートの使用に際しては、親水性サイトで合成反応が進められ、その後そこに被験液が供給される。この親水性サイトの周囲に位置する疎水性薄膜の大きな表面張力によって、被験液は親水性サイト内に確保されることになる。しかしながらアレープレートの場合、反応領域と非反応領域の高低差が事実上ないため、供給した被験液の確保という点で安定性に欠け、使いづらいということができる。また、反応領域と非反応領域の形成は、いずれも、Si表面と他の化学物質との化学反応に依存しており、その反応が100%の収率で進行するとはいえないので、両領域の境界が不明確化することもあり得る。さらには、疎水性薄膜や親水性サイトが外傷を受けやすいという問題もある。
【0006】
被験液の確保という点でいえば、上記した構造のアレープレートに比べると、被験液を収容し保持可能な構造である複数のウェルが設けられた基板の方が好適である。このような基板として、プローブDNAの直接合成に用いる基板と、それを用いたプローブDNAの化学合成が開示されている(例えば、特許文献2参照。)。この基板Aは、図61に示すように、Si等からなる半導体基板1の一方の表面に複数個のウェル2が所定の配列をなして形成されている。ウェル2の直径は1〜1000μm、深さは1〜500μm程度であり、ここがプローブDNAを化学合成するための反応領域として機能する。そして、このウェル以外の表面部分は非反応領域になっている。この基板Aは次のようにして製造される。
【0007】
工程a1:半導体基板1の一方の表面1aにフォトリソグラフィー技術とエッチング技術を適用して、ウェル2Aを形成して、図62で示すような中間体A1を製造する。
【0008】
工程a2:中間体A1における半導体基板の表面1aとウェル2Aの表面(底面と側面)に対して例えば熱酸化処理を施して、図63で示すように、それら表面の表層部のみが厚み0.5μm程度のシリコン酸化物(SiO2)層3に転化している中間体A2を製造する。
【0009】
工程a3:中間体A2のSi酸化物層3の表面にシラン化処理が施される。具体的には、水酸化ナトリウム(NaOH)を用いたブラウンプロセス(Brown Process)を適用してSi酸化物層3の表面をアルカリで処理したのち、例えばエポキシシラン型の官能化されたシラン処理剤で処理する。さらにシラン処理剤のリンク化、エポキシ樹脂の加水分解を順次行う。
その結果、Si酸化物層3の表面にシランカップリング層4が形成され、図64で示すような中間体A3が得られる。この中間体A3は、その表面全体にシランのOH基が存在しているので、その表面全体はDNAホスホアミダイトとの間で反応可能な状態になっている。
【0010】
工程a4:中間体A3の表面にホスホアミダイト法を適用することにより、DNAホスホアミダイトT(Thymine)を用いて5塩基ほどの長さの1本鎖DNAを合成して、シランカップリング層4の上にオリゴヌクレオチドスペーサ(5T)から成るスペーサ層5を形成し、図65で示すようなウェルを有する中間体A4を製造する。なお、合成されたオリゴヌクレオチドスペーサ(5T)の末端は、ジメトキシトリチル(DMT)で保護されている。この中間体A4は、その表面全体がDMTで保護されたオリゴヌクレオチドスペーサ(5T)のスペーサ層5で覆われた状態になっている。したがって、末端を保護するDMTを脱離(脱トリチル化:Detritylation)してオリゴヌクレオチドスペーサの末端を活性化させれば、そこでプローブDNAを合成することが可能である。すなわち、この中間体A4の場合、DNAチップの作成時においては、オリゴヌクレオチドスペーサ(5T)からなるスペーサ層5の表面全体が反応領域として機能することになる。しかしながら、この状態では、ウェルは反応領域、その他の部分は非反応領域として分離されなければならないというプローブDNA合成用基板としての必要条件を満たしていない。したがって、この中間体A4のスペーサ層5に対し、ウェルの部分は反応領域として残し、その他の部分は非反応領域に転化させる処理を行うことが必要となる。その処理が、次工程で行う不活性化処理(Capping)である。
【0011】
工程a5:図66で示すように、中間体A4におけるウェルの中にのみ樹脂液滴6を充填し、その状態でスペーサ層5の不活性化処理(Capping)が行われる。具体的には、オリゴヌクレオチドスペーサ(5T)のスペーサ層5に対して脱トリチル化処理を行ってオリゴヌクレオチドスペーサ(5T)の末端を活性化し、次に、トリクロロ酢酸、無水酢酸、ジメチルアミノピリジンなどを用いてオリゴヌクレオチドスペーサ(5T)の活性化している末端をブロックして不活性化し、スペーサ層5を非活性スペーサ層5aに転化させる。その後、例えばテトラヒドロフランのような有機溶剤を用いてウェル内に充填されている樹脂液滴6を溶解及び除去して、ウェル内のスペーサ層5を表出させる。この不活性化処理の過程で、ウェル内には樹脂液滴が充填されているので、ウェル内のオリゴヌクレオチドスペーサ(5T)からなるスペーサ層5は、不活性化処理を受けず、反応可能な状態を維持している。しかし、ウェル以外の部分のオリゴヌクレオチドスペーサ(5T)は不活性化処理されることにより合成反応が起こらない状態になる。このようにして、図67で示す断面構造のプローブDNAが合成される基板A6が製造されている。
【0012】
この基板A6では、半導体基板の表面に凹没部であるウェル2が所定のパターンをなして形成されている。半導体基板1の表面は、全面にわたってSi酸化物層3が形成されており、Si酸化物層3の上には全面にわたってシランカップリング層4が形成されている。そして、ウェル2の底面2aと側面2bには、末端がDMTで保護されたオリゴヌクレオチドスペーサ(5T)からなるスペーサ層5が表出していて、その部分がプローブDNAを合成するための反応領域になっている。しかし、非活性スペーサ層5aは不活性化処理された部分であって、そこは非反応領域になっている。この基板Aを用いてホスホアミダイト法でDNAチップを作成する場合、プローブDNAの化学合成はウェル2の領域内で進行する。
【0013】
しかしながら、この基板A6には次のような問題がある。第1の問題は、この基板A6の場合、反応領域と非反応領域の境界は、工程a5における樹脂液滴の充填状態で律せられることである。一般に、ウェルへの樹脂液滴の充填はピエゾインジェクタを用いて行われているが、その充填量はpl〜μlオーダという極微量である。そのため、工程a5では、充填量が多すぎて樹脂液滴がウェルから溢れ出たり、逆に少なすぎてウェルを完全に満たさないこともある。前者の場合には、ウェルの周辺表面も溢れ出た樹脂液滴で被覆されることになる。そのため、次の不活性化処理時においても上記した周辺表面は不活性化処理されることなく合成反応が可能な状態のままで残ることになる。したがって、DNAチップの作成時には、このウェルの周辺表面でもプローブDNAが化学合成されていく。そのため、作成したDNAチップを用いてターゲットDNAを検査したときに、ウェルの部分だけでなく、樹脂液滴が溢れ出たウェルの周辺部分でも蛍光発色が起こることになる。その結果、正確な蛍光標識の読みとりが阻害される。
【0014】
また、樹脂液滴の充填量が不足する場合には、ウェル内部の表面を被覆する樹脂液滴の厚みが薄くなるので、不活性化処理時に用いる酸液で樹脂液滴が浸食されやすくなる。その結果、ウェル内に位置するオリゴヌクレオチドスペーサ(5T)の層も一部不活性化処理されることがある。したがって、DNAチップの作成時に、ウェルの内部でプローブDNAが充分に化学合成されないこともあり、その結果、ターゲットDNAの検査時に、ウェルの部分は充分な強度で蛍光発色しないことがある。さらに、工程a5における不活性化処理(Capping)が不充分な場合は、やはり、作成したDNAチップの使用時に、ウェルの部分だけではなく、不活性化処理が不充分な部分も蛍光発色して、バックグラウンドノイズが発生しやすくなる。また、工程a1において、ウェル2Aを形成する際に、その深さはエッチング時間の長短で決まってくるので、エッチング処理時の時間管理を正確に行わない場合には、設計基準に則った正確な深さのウェルが形成されないことがある。
【先行技術文献】
【特許文献】
【0015】
【特許文献1】特表平9−500568号公報
【特許文献2】特表2002−537869号公報
【発明の概要】
【発明が解決しようとする課題】
【0016】
本発明は、バックグランドノイズを低減可能なバイオチップ用基板の製造方法を提供する。
【課題を解決するための手段】
【0017】
上記目的を達成するために本発明の第1の特徴は、(イ)シリコン酸化物層と、(ロ)シリコン酸化物層の上に配置され、シリコン酸化物層に達する複数のウェルが設けられた非反応層と、(ハ)ウェルを介して表出するシリコン酸化物層の表面に配置された生体物質とを備えるバイオチップ用基板であることを要旨とする。
【0018】
本発明の第2の特徴は、(イ)ガラス板と、(ロ)ガラス板の上に配置され、シリコン酸化物層に達する複数のウェルが設けられた非反応層と、(ハ)ウェルを介して表出するガラス板の表面に配置された生体物質とを備えるバイオチップ用基板であることを要旨とする。
【0019】
本発明の第3の特徴は、(イ)非反応層と、(ロ)非反応層に設けられたウェルの底面に配置されたシリコン酸化物層と、(ハ)シリコン酸化物層の表面上に配置された生体物質とを備えるバイオチップ用基板であることを要旨とする。
【0020】
本発明の第4の特徴は、(イ)表面に複数の水酸基を導入可能な第1の層と、(ロ)第1の層上に配置され、第1の層に達する複数のウェル及び複数のウェルを連結する複数の流路のそれぞれが設けられ、第1の層と異なる材料からなる第2の層とを備えることをバイオチップ用基板であることを要旨とする。
【0021】
本発明の第5の特徴は、(イ)第1の層上に配置された第2の層の一部を選択的にエッチングし、第1の層を表出させるステップと、(ロ)第1の層をナトリウム溶液に浸し、第1の層表面に複数の水酸基を導入するステップとを含むバイオチップ用基板の製造方法であることを要旨とする。
【発明の効果】
【0022】
本発明によれば、バックグランドノイズを低減可能なバイオチップ用基板の製造方法を提供することができる。
【図面の簡単な説明】
【0023】
【図1】本発明の第1の実施の形態に係るバイオチップ用基板の第1の断面図である。
【図2】本発明の第1の実施の形態に係るバイオチップ用基板の第2の断面図である。
【図3】本発明の第1の実施の形態に係るバイオチップ用基板の第1の工程断面図である。
【図4】本発明の第1の実施の形態に係るバイオチップ用基板の第2の工程断面図である。
【図5】本発明の第1の実施の形態に係るバイオチップ用基板の第3の工程断面図である。
【図6】本発明の第1の実施の形態に係るバイオチップ用基板の第4の工程断面図である。
【図7】本発明の第1の実施の形態に係るバイオチップ用基板の第5の工程断面図である。
【図8】本発明の第1の実施の形態に係るバイオチップ用基板の変形例の第1の断面図である。
【図9】本発明の第1の実施の形態に係るバイオチップ用基板の変形例の第2の断面図である。
【図10】本発明の第1の実施の形態に係るバイオチップ用基板の変形例の第3の断面図である。
【図11】本発明の第1の実施の形態に係るバイオチップの第1の工程断面図である。
【図12】本発明の第1の実施の形態に係るバイオチップの第2の工程断面図である。
【図13】本発明の第1の実施の形態に係るバイオチップの第3の工程断面図である。
【図14】本発明の第1の実施の形態に係るバイオチップの第4の工程断面図である。
【図15】本発明の第1の実施の形態に係るバイオチップの第5の工程断面図である。
【図16】本発明の第2の実施の形態に係るバイオチップの検出結果を示す写真である。
【図17】従来のバイオチップの検出結果を示す写真である。
【図18】本発明の第3の実施の形態に係るバイオチップ用基板の上面図である。
【図19】本発明の第3の実施の形態に係るバイオチップ用基板の第1の断面図である。
【図20】本発明の第3の実施の形態に係るバイオチップ用基板の第2の断面図である。
【図21】本発明の第3の実施の形態に係るバイオチップ用基板の第1の拡大断面図である。
【図22】本発明の第3の実施の形態に係るバイオチップ用基板の第3の断面図である。
【図23】本発明の第3の実施の形態に係るバイオチップ用基板の第2の拡大断面図である。
【図24】本発明の第3の実施の形態に係るバイオチップ用基板の第3の拡大断面図である。
【図25】本発明の第3の実施の形態に係るカバープレートの上面図である。
【図26】本発明の第3の実施の形態に係るカバープレートの断面図である。
【図27】本発明の第3の実施の形態に係るバイオチップ用基板とカバープレートの断面図である。
【図28】本発明の第3の実施の形態に係るバイオチップ用基板の第1の工程断面図である。
【図29】本発明の第3の実施の形態に係るバイオチップ用基板の第2の工程断面図である。
【図30】本発明の第3の実施の形態に係るバイオチップ用基板の第3の工程断面図である。
【図31】本発明の第3の実施の形態に係るバイオチップ用基板の第1の工程上面図である。
【図32】本発明の第3の実施の形態に係るバイオチップ用基板の第4の工程断面図である。
【図33】本発明の第3の実施の形態に係るバイオチップ用基板の第5の工程断面図である。
【図34】本発明の第3の実施の形態に係るバイオチップ用基板の第6の工程断面図である。
【図35】本発明の第3の実施の形態に係るバイオチップ用基板の第7の工程断面図である。
【図36】本発明の第3の実施の形態に係るバイオチップ用基板の第8の工程断面図である。
【図37】本発明の第3の実施の形態に係るバイオチップ用基板の第9の工程断面図である。
【図38】本発明の第3の実施の形態に係るバイオチップ用基板の第10の工程断面図である。
【図39】本発明の第3の実施の形態に係るバイオチップ用基板の第11の工程断面図である。
【図40】本発明の第3の実施の形態に係る塩基を示す化学式である。
【図41】本発明の第3の実施の形態に係るバイオチップ用基板の第12の工程断面図である。
【図42】本発明の第3の実施の形態に係るバイオチップ用基板の第13の工程断面図である。
【図43】本発明の第3の実施の形態に係るヌクレオシドホスホロアミダイトを示す化学式である。
【図44】本発明の第3の実施の形態に係るバイオチップ用基板の第14の工程断面図である。
【図45】本発明の第3の実施の形態に係るバイオチップ用基板の第15の工程断面図である。
【図46】本発明の第3の実施の形態に係るバイオチップ用基板の第16の工程断面図である。
【図47】本発明の第3の実施の形態に係るバイオチップ用基板の第17の工程断面図である。
【図48】本発明の第3の実施の形態に係る脱保護された塩基の化学式である。
【図49】本発明の第3の実施の形態に係るバイオチップ用基板の第18の工程断面図である。
【図50】本発明の第3の実施の形態に係るバイオチップの検出結果を示す写真である。
【図51】本発明の第3の実施の形態の第1の変形例に係るバイオチップ用基板の第1の工程断面図である。
【図52】本発明の第3の実施の形態の第1の変形例に係るバイオチップ用基板の第2の工程断面図である。
【図53】本発明の第3の実施の形態の第1の変形例に係るバイオチップ用基板の第3の工程断面図である。
【図54】本発明の第3の実施の形態の第1の変形例に係るバイオチップ用基板の第4の工程断面図である。
【図55】本発明の第3の実施の形態の第1の変形例に係るバイオチップ用基板の第5の工程断面図である。
【図56】本発明のその他の実施の形態に係るバイオチップ用基板の上面図である。
【図57】本発明のその他の実施の形態に係るバイオチップ用基板の断面図である。
【図58】本発明のその他の実施の形態に係るカバープレートの平面図である。
【図59】本発明のその他の実施の形態に係るカバープレートの断面図である。
【図60】本発明のその他の実施の形態に係るバイオチップ用基板とカバープレートの断面図である。
【図61】従来のバイオチップ用基板の斜視図である。
【図62】従来のバイオチップ用基板の第1の工程断面図である。
【図63】従来のバイオチップ用基板の第2の工程断面図である。
【図64】従来のバイオチップ用基板の第3の工程断面図である。
【図65】従来のバイオチップ用基板の第4の工程断面図である。
【図66】従来のバイオチップ用基板の第5の工程断面図である。
【図67】従来のバイオチップ用基板の第6の工程断面図である。
【発明を実施するための形態】
【0024】
以下に本発明の実施の形態を説明する。以下の図面の記載において、同一又は類似の部分には同一又は類似の符号で表している。但し、図面は模式的なものである。したがって、具体的な寸法等は以下の説明を照らし合わせて判断するべきものである。また、図面相互間においても互いの寸法の関係や比率が異なる部分が含まれていることは勿論である。
(第1の実施の形態)
第1の実施の形態に係るバイオチップ用基板は、DNAホスホアミダイトを用いてプローブDNAを組立てる反応を行うことができる反応領域と、その反応を行わない非反応領域が表面に設けられている。ここで、図67に示した従来の基板Aでは、非反応領域が不活性化処理(Capping)によって形成されていた。これに対し、第1の実施の形態に係るバイオチップ用基板では、反応領域は反応性を持つ材料で形成され、その他の領域は反応に不活性な材料で確実に形成されている。そのため、Capping等の表面の不活性化処理をしなくても反応領域と非反応領域が明確に区別されているという特徴を有している。
【0025】
まず、第1の実施の形態に係るバイオチップ用基板B0の一例を図1に示す。バイオチップ用基板B0は、2つのSi等からなる半導体層131の間にSi酸化物層132が介在しているサンドウィッチ構造をした板状体を有する。ここで、一方の半導体層131に、所定の配列パターンで、Si酸化物層132の表面132aにまで至るウェル13Aが設けられている。したがってバイオチップ用基板B0の場合、ウェル13Aの底面のみにSi酸化物層132の表面132aが表出していて、他の部分の表面は総てSiになっている。よって、ウェル13Aを介して表出するSi酸化物層132の表面のみが例えば1本鎖DNAを合成するための反応領域として機能し、他の表面は総て非反応領域として機能する。
【0026】
図2は、上記したバイオチップ用基板B0を用いて製造された別の基板の1例B1を示す。この基板B1は、バイオチップ用基板B0におけるウェル13Aの底面にのみシランカップリング層14が形成されている。そしてシランカップリング層14の上にDNAホスホアミダイトTを5段に連続して合成させたオリゴヌクレオチドスペーサ(5T)からなるスペーサ層135が配置されている。この基板B1の場合、ウェル13Aの底面135aのみに、プローブDNA合成を可能とするオリゴヌクレオチドスペーサ(5T)のスペーサ層135が配置されており、ウェル13Aの側面135bと半導体層131の表面131aはいずれもSiのままになっている。したがって、この基板B1では、ウェル13Aの底面のみがプローブDNA合成用の反応領域として機能し、ウェル13Aの側面や基板表面など他の部分は、Capping処理等による表面の不活性化が施されていなくてもそれ自体がプローブDNAの化学合成にとっては非反応領域になっている。なお、この基板B1において、シランカップリング層14は、オリゴヌクレオチドスペーサ(5T)からなるスペーサ層135の合成を効率的に行うために配置されているが、必ずしも必要ではない。オリゴヌクレオチドスペーサ(5T)からなるスペーサ層135を直接Si酸化物層132の表面132aに合成してもよい。
【0027】
この基板B1は次のようにして製造することができる。まず、図3で示すように、2つの半導体層131の間にSi酸化物層132がサンドウィッチされている構造の板状体を用意する。このとき、一方の半導体層131の厚みは、形成すべきウェルの深さと略同じとする。このような板状体としては、例えば、信越半導体(株)から市販されているSOI(Silicon on Insulator)ウェハが好適である。
【0028】
次に図4で示すように、一方の半導体層131の表面131aをレジスト16で全面被覆し、その上に、形成すべきウェルと同径の開口を有するマスクを配置したのち紫外線を照射し、さらに、マスクを除去して全体を現像する。その結果、図5で示すように、形成すべきウェルと同径の開口がレジスト16に形成され、そこから半導体層131の表面131aが表出する。
【0029】
次にレジスト16をマスクにして、半導体層131に対してSiのエッチャントを用いたエッチング処理を行い、Si酸化物層132の表面132aにまで至るウェル13Aを形成する。エッチング作用は、半導体層のエッチングが進んでSi酸化物層132の表面132aに到達した時点で自動的に停止する。その結果図6で示すように、ウェル13Aの底面でのみSi酸化物層132の表面132aが表出し、他の表面部分は総てSiから成る部材が得られる。そして、この部材におけるウェル13Aは、形成すべきウェルと直径及び深さが略同じになっている。
【0030】
次にシラン化処理を行う。シラン化反応はSi酸化物層表面のみで進行するため、図7に示すようにウェル13Aで表出するSi酸化物層132の表面132aにのみシランカップリング層14が形成される。そして最後に、ホスホアミダイト法を適用することによりシランカップリング層14にDNAホスホアミダイトTを反応させ、5merのTから成る1本鎖DNAを有するオリゴヌクレオチドスペーサ(5T)からなるスペーサ層135を形成し、図2で示す基板B1が完成する。この過程で、DNAホスホアミダイトTは、シランカップリング層14のOH基とのみ共有結合するので、ウェル13Aによって表出するSi酸化物層132の表面132a上のみで合成反応が進む。ここでDNAホスホアミダイトTは、Siが表出している他の部分とは反応しないので、従来の基板Aの場合のように不活性化処理(Capping)が施す必要がない。
【0031】
第1の実施の形態に係るバイオチップ用基板B0と、前記した従来の基板Aの製造工程を対比すると次のことが明らかである。まず従来の基板Aの場合、前記した工程a2でSiウェハの表面を熱酸化してSi酸化物層を形成することが必要であるが、第1の実施の形態に係るバイオチップ用基板B0の場合はこの工程a2が不要となる。また従来の基板Aの場合、前記した工程a5においてウェル内への樹脂液滴の充填、不活性化処理(Capping)、及び樹脂液滴の溶解及び除去という一連の操作が不可欠であった。これに対し第1の実施の形態に係るバイオチップ用基板B0の場合は、これらの操作は全く不要になる。したがって第1の実施の形態に係るバイオチップ用基板B0の場合、樹脂液滴の充填量の過不足によって発生していた問題は解消され、反応領域と非反応領域の境界は明瞭となり、しかも反応領域はリソグラフィー技術とエッチング技術を適用して形成したウェル13Aの底面のみになり、他の部分は総て非反応領域になる。そのため、これを用いて作成したDNAチップの使用時における蛍光標識の精度は高くなり、またバックグラウンドノイズも発生しなくなる。
【0032】
さらに従来の基板Aの場合、設計基準に則った深さのウェルを形成するためには、工程a1のエッチング処理時にエッチング時間の管理を正確に行うことが必要であった。これに対し第1の実施の形態に係るバイオチップ用基板B0の場合は、半導体層131を掘り進むエッチング作用はSi酸化物層の表面に到達した時点で自動的に停止する。そして、形成されたウェル13Aの深さは、用いた半導体層131の厚みで一義的に決まるので、形成されたウェル13Aの深さは極めて正確になる。
【0033】
基板の他の例B2を図8に示す。この基板B2では、例えば熱酸化して一方の表層部分のみがSi酸化物層141aになっているSi等からなる半導体基板141のSi酸化物層141aの上に、例えばDNAホスホアミダイトTのような生体物質と反応せず、またDNA合成時に用いる各種の有機溶剤、酸液、アルカリ液などにも浸蝕されない材料から成る所定厚みの非反応層142が配置されている。そしてこの非反応層142の厚み方向には、所定の直径を有するウェル23がSi酸化物層141aの表面141bにまで所定の配列パターンで設けられている。そして、Si酸化物層141aの表面141bには、シランカップリング層14,DNAホスホアミダイトTを反応させて5merから成る1本鎖DNAを有するオリゴヌクレオチドスペーサ(5T)からなるスペーサ層135がこの順序で配置されている。この基板B2の場合、ウェル23の底面のみからDNAホスホアミダイトTとの反応が可能であるオリゴヌクレオチドスペーサ(5T)からなるスペーサ層135の表面が表出して反応領域を構成し、他の表面は不活性化処理が施されていないが、総てDNAホスホアミダイトTと反応しない材料から成る非反応領域になっている。
【0034】
ここで、上記した非反応領域を形成する非反応層142の材料としては、例えば、単結晶シリコン、酸化物を形成しにくい白金などの金属、窒化シリコンなどの窒化物、ポリエチレン、ポリスチレンのような反応性の官能基をもたないプラスチックなどをあげることができる。また非反応層142は、上記した材料部材のSi酸化物層への直接接合、上記材料のSi酸化物層表面への真空蒸着やCVD、モノマーを原料とした気相重合のような成膜法などによって形成することができる。そして、ウェル23の形成に関しては、例えばフォトリソグラフィー技術とエッチング技術などを適用して形成することができる。
【0035】
基板の他の例B3を図9に示す。この基板B3は、ガラス板151の表面に、基板B2の場合と同じ非反応層142が配置され、この層の厚み方向に、ガラス板151の表面151aにまで至るウェル152が設けられされ、ウェル152の底面から表出するガラス板の表面151aにのみシランカップリング層14、オリゴヌクレオチドスペーサ(5T)からなるスペーサ層135が配置された構造になっている。
【0036】
この基板B3の場合、ウェル152の底面151aのみにオリゴヌクレオチドスペーサ(5T)層の表面が表出し、そこが反応領域を構成し、ウェルの側面や非反応層142の表面は、不活性化処理が施されることなく総て非反応領域になっている。
【0037】
基板の他の例B4を図10に示す。この基板B4は、DNAホスホアミダイトTと反応せず、またDNA合成時に用いる有機溶剤、酸液、アルカリ液などに浸蝕されない単一の材料から成る板状体161の表面161aから内部に向かって、所定の直径と深さを有するウェル162が設けられている。ウェル162の底面161aにはSi酸化物層163が配置され、さらにSi酸化物層の上にシランカップリング層14及びオリゴヌクレオチドスペーサ(5T)からなるスペーサ層135が順次配置されている。この基板B4の場合も、DNAホスホアミダイトTと反応可能な部分はウェルの底面に位置するオリゴヌクレオチドスペーサからなるスペーサ層135のみであり、他の部分は非反応領域になっている。この非反応領域を構成する単一の材料としては、例えば、Siや、窒化シリコンなどの窒化物をあげることができる。そして、Siからなる板状体を用いた場合、上記したウェルは、例えば、反応性イオンエッチング、イオンミリングなどのドライエッチング、またはウェットエッチングなどを適用して形成することができる。
【0038】
なお、Si板の表面から内部に向かって酸素イオンをイオン注入するSIMOX(Separation by IMplanted Oxygen)法を適用することにより、Si板の内部にその表面からある深さの位置にSi酸化物層を形成し、次にSi板の表面からそのSi酸化物層までウェルを形成してもよい。また、Si板の表面を一旦酸化したのち、その表面のSi酸化物層にフォトリソグラフィー技術とエッチング技術を適用して所定のパターンで配列する開口部を形成し、その後、開口部に表出しているSiの表面から上記したSIMOX法で酸素イオンをイオン注入し、次に、表面のSi酸化物層をエッチング除去することにより、前記した開口部の直下に、Si板の内部にその表面からある深さの位置にSi酸化物層の分離構造を形成することができる。そして、開口部の位置で、Si板の表面からSi酸化物層までウェルを形成してもよい。
【0039】
次に、本発明のバイオチップ用基板を用いてバイオチップを作成する工程を、図2で示す基板B1を用い、ホスホアミダイト法でプローブDNAが固定されたDNAチップを作成する場合を例にして説明する。
【0040】
まず、基板B1を用意する。基板B1は、図11で模式的に示すように、基板B1にアレイ状に配列している総てのウェル13は、その底面にのみ、末端をDMTで保護されたオリゴヌクレオチドスペーサ(5T)からなるスペーサ層135が固定されている。
【0041】
工程b1:ウェルに樹脂マスキングを行う。具体的には、配列するウェルのうち、例えばDNAホスホアミダイトC:( Cytosine)との化学合成を行わせるウェルを除き、他のウェルの総てに樹脂液滴6を充填する。図12で示すように、樹脂液滴6が充填されたウェル内のオリゴヌクレオチドスペーサ(5T)は樹脂で封止されるが、樹脂液滴6が充填されていないウェル内のオリゴヌクレオチドスペーサ(5T)は末端のDMTが脱離可能な状態にある。
【0042】
工程b2:基板上面全体に、トリクロロ酢酸のような酸液を均等に供給して脱トリチル化処理(Detritilation)を行う。その結果、図13で示すように、樹脂液滴が充填されていないウェルでは、オリゴヌクレオチドスペーサ(5T)のDMTが脱離して、そこのオリゴヌクレオチドスペーサ(5T)は活性化する。このようにして、基板B1に設けられたウェルのうち、特定のウェル(樹脂液滴を充填しないウェル)内のオリゴヌクレオチドスペーサ(5T)のみがDNAホスホアミダイトCと反応可能な状態になる。
【0043】
工程b3:基板表面に、有機溶媒を供給して、ウェルに充填されている樹脂液滴を溶解及び除去する。その結果、図14で示すように、基板に配列しているウェルの底面には、活性化したオリゴヌクレオチドスペーサ(5T)と、末端をDMTで保護されているオリゴヌクレオチドスペーサ(5T)が表出する。
【0044】
工程b4:基板の表面全体に、末端がDMTで保護されたDNAホスホアミダイトCの試薬を均等に供給してDNA合成(Coupling)を行う。その結果、図15で示すように、特定のウェル内では、活性化していたオリゴヌクレオチドスペーサ(5T)と供給されたDNAホスホアミダイトCとの間で合成反応が進行して両者は化学結合し、オリゴヌクレオチドは1mer伸長する。そして伸長したオリゴヌクレオチドの末端はDMTで保護される。他方、残りのウェル内では、表出するオリゴヌクレオチドスペーサ(5T)は末端がDMTで保護されているので不活性である。そのため、供給されたDNAホスホアミダイトCとの間で合成反応は進まない。
【0045】
このように、工程b1〜工程b4を1サイクルとするDNA合成反応を進めることにより、樹脂液滴を充填しないウェルでのみオリゴヌクレオチドは上記1サイクルで1mer伸長し、樹脂液滴を充填したウェルでは合成反応開始前の状態が維持される。そして、反応させるDNAホスホアミダイトはT、A、C、Gの4種類であるので、さらにウェルに固定されているオリゴヌクレオチドを1mer伸長させるためには上記したサイクルを4回実施すればよい。このようにして、基板B1のウェルの底面でのみ、設計図に基づいた配列のプローブDNAを固定することができる。
【0046】
この基板B1を用いてDNAチップを作成する場合、DNA合成反応はウェルの底面でのみ進行し、他の部分は合成反応に全く関与しない。したがって、例えば、工程b1で充填する樹脂液滴がウェルから仮に溢れ出たとしても、それが隣接するウェルに流入しない限り、DNA合成反応とは無関係であり、蛍光識別時に何の悪影響も及ぼさない。また従来の基板Aの場合に行っていた不活性処理(Capping)も行う必要がない。
【0047】
なお、以上の説明において、基板B1,B2,B3,B4はいずれも、基板B0のSi酸化物層の表面にシラン層を形成することにより、プローブDNAの合成反応を可能にするDNAチップ用基板に関するものである。しかし、第1の実施の形態に係るバイオチップ用基板はこれに限定されるものではなく、ウェルの底面(反応領域)を構成する材料として、被検対象の生体物質と特異的な結合をする生体物質を固定できる材料を選定することにより、各種のチップを製造することが可能である。
【0048】
例えば図1で示す基本構造の基板B0のSi酸化物層の表面に、被検対象の生体物質と特異的な結合をする各種のリンカー成分を固定することにより、その部分を生体物質に対する反応領域に特化させることができる。その場合、基板における他の部分はその生体物質にとっての非反応領域となり、2つの領域の境界は画分されることになる。
【0049】
例えばリンカー成分として、アミノプロピルメトキシシランのようなシランカップリング剤や、エポキシ基、トシル基、活性化カルボキシル基、アミノ基、チオール基、ブロモアトアミド基のような官能基を有するものを用いれば、アミノ基、チオール基、水酸基、カルボキシル基、ブロモアトアミド基などを末端にもつ生体物質をリンカー成分を介して基板B0のSi酸化物層の表面に固定することができる。
【0050】
また生体物質として、2本鎖DNA、タンパク質、ペプチド、糖鎖、RNA―タンパク質複合体、糖質―タンパク質複合体を用いれば、2本鎖DNAの特異的塩基配列を認識して結合する転写因子群を検出するチップ、ペプチド検出用チップ、タンパク質検出用チップ、糖鎖検出用チップ、タンパク質を消化するためのチップなどを製造することができる。
【0051】
(第2の実施の形態)
SOIウェハを出発素材とし、図3から図7で示した工程を経て、最終的に図2で示した構造のバイオチップ用基板B1を製造した。このバイオチップ用基板B1の仕様は以下の通りである。大きさは1cm×1cm、ウェルの形状は直径300μm、深さ20μmである。このウェルが基板上に縦9個、横14個格子状に形成されている。シランカップリング層は、5,6-エポキシトリエトキシシランを用いて形成され、オリゴヌクレオチドスペーサ層はDNA合成試薬を用いたホスホアミダイト法で形成されている。このバイオチップ用基板B1を用い、ホスホアミダイト法を適用して、ウェル内に、下記の配列のプローブDNAを合成してDNAチップを作成する。
【0052】
1. 3’-ATCTCACACGTCAAATAG-5’ 2. 3’-ATCTCACTCAAATAG-5’ 3. 3’-ATCTCACGCAAATAG-5’ 4. 3’-ATCTCACCCAAATAG-5’ 5. 3’-ATCTCACACAAATAG-5’ 6. 3’-ATCTCACCAAATAG-5’ このDNAチップを用いて、蛍光標識されたターゲットDNAの検出試験を行った結果を図16に示す。ここで、プローブ4のスポットの蛍光強度が最も高いため、ターゲットDNAの配列は、5’-TAGAGTGGGTTTATC-3’であることが分かる。なお、プローブ2、プローブ3、プローブ5は、いずれも、配列の中心に位置する塩基がミスマッチしている。またプローブ1は塩基配列が長すぎ、プローブ6は短かすぎてミスマッチしている。
【0053】
比較のために、特表2002−537869号公報に開示されている方法に準拠して不活性化処理(Capping)を行って、図67で示した構造の基板Aを製造する。そしてこの基板Aを用い、第2の実施の形態に係るDNAチップと同様にして6種類の配列のプローブDNAを移植してDNAチップを作成し、ターゲットDNAの検出試験を行った結果を図17に示す。この場合もプローブ4のスポットにおける蛍光強度が最も高く、ターゲットDNAの配列が5’-TAGAGTGGGTTTATC-3’であることが分かる。しかし図17から明らかなように、従来の基板Aから作成したDNAチップでは、各スポットの周囲も蛍光発色している。そのためバックグラウンドノイズが発生し、発光スポットと基板表面との境界が不鮮明になっている。これは、基板製造時における樹脂液滴のウェルへの充填時に、樹脂液滴がウェルからその周辺に溢れ出て、その部分が不活性化処理されなかった結果である。また、プローブ4のスポットの場合、スポットの中心部における蛍光発色が弱い。これは、樹脂液滴の充填量が過少であったためである。しかし、全体の蛍光強度が高いのは、ここに移植されているプローブDNAがターゲットDNAと相補関係にあるからである。
【0054】
この従来の基板Aと対比すると、第2の実施の形態のバイオチップ用基板B1から作成されたDNAチップは、発光スポットと基板表面との境界が極めて明瞭であり、バックグラウンドノイズの発生は実質的にないといってもよい。また、各発光スポットにおける蛍光強度も均質化していて、測定データは安定している。
【0055】
(第3の実施の形態)
本発明の第3の実施の形態に係るバイオチップ用基板は、図18、図18のA-A方向から見た断面図である図19に示すように、半導体基板15、半導体基板15上に配置され、酸化珪素(SiO2)からなり、表面に水酸(-OH)基を導入可能な第1の層13、第1の層13上に配置され、第1の層13に達する複数のウェル41a, 41b, 41c, 41d, 41e, 41f, 41g, 41h, 41i, 42a, 42b, 42c, 42d, 42e, 42f, 42g, 42h, 42i, 43a, 43b, 43c, 43d, 43e, 43f, 43g, 43h, 43i, 44a, 44b, 44c, 44d, 44e, 44f, 44g, 45a, 45b, 45c, 45d, 45e, 45f, 45g, 46a, 46b, 46c, 46d, 46e, 46f, 46g, 47a, 47b, 47c, 47d, 47e, 47f, 47g, 47h, 47i, 48a, 48b, 48c, 48d, 48e, 48f, 48g, 48h, 48i, 49a, 49b, 49c, 49d, 49e, 49f, 49g, 49h, 49iを有する第2の層11を有する。第2の層11は第1の層13と異なる材料からなり、第2の層11と比較して表面に水酸(-OH)基を導入しにくい結晶シリコン(Si)等の材料からなる。第1の層13は、第2の層11よりも高い親水性を有する。したがって、第1の層13は第2の層11と比較して容易に水酸化される。
【0056】
さらに図18に示すバイオチップ用基板は、複数のウェル41a〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれを接続する、第2の層11に設けられた複数の流路31a, 31b, 31c, 31d, 31e, 31f, 31g, 31h, 31i, 32a, 32b, 32c, 32d, 32e, 32f, 32g, 32h, 32i, 33a, 33b, 33c, 33d, 33e, 33f, 33g, 33h, 33i, 34a, 34b, 34c, 34d, 34e, 34f, 34g, 35a, 35b, 35c, 35d, 35e, 35f, 35g, 36a, 36b, 36c, 36d, 36e, 36f, 36g, 37a, 37b, 37c, 37d, 37e, 37f, 37g, 37h, 37i, 38a, 38b, 38c, 38d, 38e, 38f, 38g, 38h, 38i, 39a, 39b, 39c, 39d, 39e, 39f, 39g, 39hを有する。流路31aは、図19及び図18のB-B方向から見た断面図である図20に示すように、ウェル41aとウェル41bを結ぶ溝である。他の複数の流路31b〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれも、複数のウェル41b〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれの間に第2の層11に設けられた溝である。複数の流路31a〜39hにより複数のウェル41a〜49iのそれぞれを同じ溶液で満たすことが可能となる。
【0057】
図19に示すように、複数のウェル41a〜41iのそれぞれを介して表出する第1の層13の表面には、生体物質層91a, 91b, 91c, 91d, 91e, 91f, 91g, 91h, 91iが配置されている。生体物質層91a〜91iのそれぞれにおいては、複数のデオキシリボ核酸(DNA)、複数のリボ核酸(RNA)、複数のペプチド核酸(PNA)、あるいは複数のたんぱく質等の複数の生体分子のそれぞれの官能基が、図21に示すように第1の層13表面の水酸(-OH)基と共有結合している。生体分子がDNA、RNA、あるいはPNAである場合は、それぞれの配列はターゲットとなる生体分子と相補的となるよう設計される。
【0058】
なお、第1の層13表面に直接生体物質層91a〜91iのそれぞれを配置することに第3の実施の形態は限定されない。図22に示す例では、第1の層13の複数のウェル41a〜41iのそれぞれを介して表出する部分の表面上に、シランカップリング層81a, 81b, 81c, 81d, 81e, 81f, 81g, 81h, 81iが配置されている。シランカップリング層81a〜81iのそれぞれにおいては、図23に示すように、複数のシランカップリング剤のそれぞれのメチル基(-CH3)あるいはエチル基(-C2H5)が第1の層13表面の水酸(-OH)基と酸塩基反応で化学結合している。
【0059】
複数のシランカップリング剤のそれぞれには、3-グリシドキシプロピルトリメトキシシラン、3-グリシドキシプロピルメチルジエトキシシラン、3-グリシドキシプロピルトリエトキシシラン、N-2(アミノエチル)3-アミノプロピルメチルジメトキシシラン、N-2(アミノエチル)3-アミノプロピルトリメトキシシラン、N-2(アミノエチル)3-アミノプロピルトリエトキシシラン、3-アミノプロピルトリメトキシシラン、3-アミノプロピルトリエトキシシラン等が使用可能である。
【0060】
シランカップリング層81a〜81iのそれぞれの上には、生体物質層91a, 91b, 91c, 91d, 91e, 91f, 91g, 91h, 91iが配置されている。生体物質層91a〜91iのそれぞれにおいては、例えば、複数の生体分子のそれぞれに導入された活性エステルがシランカップリング剤のアミノ(-NH2)基とアミド(-NH-CO-)結合している。
【0061】
あるいは、シランカップリング剤と生体分子は架橋剤を介して結合してもよい。例えば、受容体、リガンド、アンタゴニスト、抗体、抗原等のタンパク質に含まれるリジン(Lys)のアミノ(-NH2)基、アスパラギン酸(Asp)及びグルタミン酸(Glu)のカルボキシル(-COOH)基、チロシン(Tyr)のフェノール(-C6H4(OH))基、ヒスチジン(His)のイミダゾール(-C3H3N2)基、システイン(Cys)のチオール(-SH)基等の官能基と、シランカップリング剤のアミノ基やエポキシ基とを架橋剤で結合してもよい。図24に示す例においては、シランカップリング剤のアミノ基と抗体95a, 95b, 95cのアミノ基とを、両端でアミノ基と反応する架橋剤であるジスクシンイミジルスベレート(Disuccinimidyl suberate : DSS)で結合している。
【0062】
架橋剤としては、他に、両端でアミノ基と反応するビスサルフォスクシンイミジルスベレート(Bis [Sulfosuccinimidyl] suberate : BS3)、ジメチルスベルイミデート(Dimethyl suberimidate・HCl : DMS)、ジスクシンイミジルグルタレート(Disuccinimidyl glutarate : DSG)、ローマン試薬(Loman's Reagent)、 3, 3' - ジチオビスサルフォスクシンイミジルプロピオネート(3, 3' - Dithiobis [sulfosuccinimidyl propionate] : DTSSP)、 エチレングリコールビススクシンイミジルスクシネート(Ethylene glycol bis [succinimidylsuccinate] : EGS)、アミノ基とカルボキシル基と反応する1-エチル - 3 - [3 - ジメチルアミノプロピル]カルボジイミドヒドロクロライド(1 - Ethyl - 3 - [3 - Dimethylaminopropyl] carbodiimide Hydrochloride : EDC)等が使用可能である。
【0063】
またさらに架橋剤としては、アミノ基とチオール基と反応するm-マレイミドベンジル-N-ヒドロキシスクシンイミドエステル(m - Maleimidobenzyl - N - hydroxysuccinimide ester : MBS)、 スクシンイミジル4 - [N - マレイミドメチル] - シクロヘキサン - 1 - カルボキシレート(Succinimidyl 4 - [N - maleimidomethyl] - cyclohexane - 1 - carboxylate : SMCC)、 スクシンイミジル 4 - [p - マレイミドフェニル] - ブチレート(Succinimidyl 4 - [p - maleimidophenyl] - buthrate : SMPB)、 N-スクシンイミジル3-(2-ピリジルジチオ)プロピオネート(N - Succinimidyl 3 - [2 - pyridyldithio] propionate : SPDP)、N-(γ-マレイミドブチリルオキシ)サルフォスクシンイミドエステル(N - [γ - Maleimidobutyloxy] sulfosuccinimide ester : Sulfo - GMBS)、 サルフォスクシンイミジル6 - [3' (2 - ピリジルジチオ) - プロピオンアミド] ヘキサノエート(Sulfosuccinimidyl 6 - [3' (2 - pyridyldithio) - propionamide] hexanoate : Sulfo - LC - SPDP)、m-マレイミドベンゾイル-N-ヒドロキシサルフォスクシンイミドエステル(m - Maleimidebenzoyl - N - hydoroxysulfo - succinimide ester : Sulfo - MBS)、サルフォスクシンイミジル-4-(N-マレイミドメチル)シクロヘキサン-1-カルボキシレート(Sulfosuccinimidyl 4 [N - maleimidomethyl] - cyclohexane - 1 - carboxylate : Sulfo - SMCC)、サルフォスクシンイミジル-4-(p-マレイミドフェニル)ブチレート(Sulfosuccinimidy 4 - [p - maleimidophenyl] - butyrate : Sulfo - SMPB)等が使用可能である。
【0064】
図18に示す他の複数のウェル42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれの断面図は、図19あるいは図22と同様であるので説明は省略する。なお、図19及び図22に示す第1の層13の材料にはSiO2以外にシリカガラス等が使用可能である。この場合、半導体基板15は省略してもよい。また第2の層11の材料には結晶Si以外に、ポリテトラフルオロエチレン、不溶性エポキシ系レジスト等の樹脂が使用可能である。
【0065】
図18乃至図24に示したバイオチップ用基板の上部には、図25及び図25のA-A方向から見た断面図である図26に示すように、開口27及び開口28を有するカバープレート25が配置される。カバープレート25の材料としては、石英ガラス、アクリル樹脂、及びポリカーボネート等が使用可能である。図18に示すバイオチップ用基板上部にカバープレート25が配置された場合の、A-A方向から見た断面図を図27に示す。開口27からCy3あるいはCy5等の蛍光試薬でラベルされた生体分子サンプルを含む検査溶液が注入され、開口28より内部の空気が吸引されると、ウェル41a〜41i、及び流路31a〜31iのそれぞれは順次検査溶液で充填されていく。さらに、図18に示す他の複数のウェル42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49i、及び他の複数の流路32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれも順次検査溶液で充填される。
【0066】
したがって、図27に示す生体物質層91a〜91iに固定された生体分子と相補的に結合するターゲット生体分子が検査溶液に含まれている場合、ターゲット生体分子は生体物質層91a〜91iにトラップされる。そのため、検査溶液中に含まれるサンプル生体分子を予めCy3等の蛍光試薬で標識しておけば、検査溶液を吸引した後、複数のウェル41a〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49i、及び複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれを洗浄した後、蛍光反応を確認することで、検査溶液中にターゲット生体分子が含まれていたかどうかを確認することが可能となる。なお、複数のウェル41a〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれの直径を600mm以上にすれば、肉眼で蛍光反応を確認することも可能である。
【0067】
以上、図18乃至図27に示したバイオチップ用基板は、複数のウェル41a〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49i、及び複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれが第2の層11上に設けられているため、カバープレート25を配置する際に高精度な位置あわせが必要ない。また、必要な検査溶液の量は、複数のウェル41a〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49i、及び複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれを充填するに足る量でよいので、希少サンプルの検査も容易になる。また、複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hが設けられているため、複数のウェル41a〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれをスポッタ等の装置で個別に検査溶液で充填する必要がなく、検査時間の短縮をも可能とする。
【0068】
次に、図28乃至図49を用いて、第3の実施の形態に係るバイオチップ用基板の製造方法について説明する。
【0069】
(a) まず図28に示すように、半導体基板15、半導体基板15上に配置されたSiO2からなる第1の層13、第1の層13上に配置された結晶Siからなる第2の層11、第2の層11上に配置された自然酸化膜12を有するSOI(Silicon On Insulator)基板を用意する。次に図29に示すように、自然酸化膜12上にレジスト21をスピン塗布する。
【0070】
(b) リソグラフィ技術によりレジスト21の一部を除去し、図30に示すように開口51a, 51b, 51c, 51d, 51e, 51f, 51g, 51h, 51iのそれぞれを設ける。次に開口51a〜51iのそれぞれから表出する自然酸化膜12及び第2の層11の一部を異方性エッチング等により選択的に除去し、図31及び図31のA-A方向から見た断面図である図32に示すように流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれを第2の層11に形成させる。
【0071】
(c) 図33に示すように、自然酸化膜12上にレジスト22をスピン塗布する。その後リソグラフィ技術によりレジスト22の一部を除去し、図34に示すように開口61a, 61b, 61c, 61d, 61e, 61f, 61g, 61h, 61iのそれぞれを設ける。次に開口61a〜61iのそれぞれから表出する自然酸化膜12及び第2の層11の一部を異方性エッチング等により第1の層13が表出するまで選択的に除去し、図35に示すようにウェル41a〜41iのそれぞれを第2の層11に形成させる。
【0072】
(d) SOI基板を撹拌された水酸化ナトリウム(NaOH)溶液中に室温で2時間放置する。ここでNaOH溶液とは、98gのNaOH、294mlの蒸留水、及び392mlのエタノールを混合した溶液である。NaOH溶液中に放置することにより、図36に示すように第2の層11表面の自然酸化膜12が除去される。さらにウェル41a〜41iのそれぞれから表出する第1の層13の表面に、図37に示すように、複数の水酸(-OH)基が導入される。
【0073】
(e) 3-グリシドキシプロピルメチルジエトキシシラン、3-グリシドキシプロピルトリエトキシシラン等の官能基にエポキシを有するシランカップリング剤、あるいはN-2(アミノエチル)3-アミノプロピルトリエトキシシラン、3-アミノプロピルトリメトキシシラン、3-アミノプロピルトリエトキシシラン等の官能基にアミンを有するシランカップリン剤等を図36に示すウェル41a〜41iのそれぞれから表出する第1の層13の表面上に滴下し、図38に示すシランカップリング層81a, 81b, 81c, 81d, 81e, 81f, 81g, 81h, 81iのそれぞれを形成させる。例えば、3-アミノプロピルトリメトキシシランを滴下した場合、図39に示すように、第1の層13表面に複数のアミノ(-NH2)基が導入される。なお、第1の層13表面に残った未反応のOH基は、例えば、無水酢酸と1-メチルイミダゾール(テトラヒドロフラン溶液)で処理してアセチル化し、キャッピングする。
【0074】
(f) 活性エステルが導入され、5’末端がジメトキシトリチル(DMTr)基で保護、及び図40に示すようにアデニン、シトシン、及びグアニン等の塩基のアミノ基が保護された1塩基目のヌクレオシドを図38に示すシランカップリング層81aに滴下する。アデニンとシトシンのアミノ基はベンゾイル基で保護されている。グアニンのアミノ基はイソブチル基で保護されている。滴下により、1塩基目のヌクレオシドの活性エステルとシランカップリング剤のアミノ基(-NH2)とを反応させ、図41に示すように、アミド結合(-NH-CO-)を形成させる。次に、1塩基目のヌクレオシドのジメトキシトリチル(DMTr)基を3%トリクロロ酢酸/ジクロロメタン酸性溶剤で脱保護し、図42に示すように5’水酸(-OH)基を1塩基目のヌクレオシドに導入する。
【0075】
(g) テトラゾールと図43に示すヌクレオシドホスホロアミダイトをシランカップリング層81a〜81iに滴下し、1塩基目のヌクレオシドの5’水酸(-OH)基にヌクレオシドホスホロアミダイトのN, N-ジイソプロピルアミノ基を縮合反応させる。縮合反応により、図44に示すように、1塩基目のヌクレオシドに2塩基目のヌクレオシドが共有結合される。なお、1塩基目のヌクレオシドの未反応の5’水酸(-OH)基は無水酢酸と1-メチルイミダゾール(テトラヒドロフラン溶液)で処理してアセチル化し、キャッピングする。
【0076】
(h) 縮合反応で生じた亜リン酸トリエステル結合は、ヨウ素と水(ピリジン含有テトラヒドロフラン溶液)で酸化し、図45に示すように、より安定なリン酸トリエステル結合に変換させる。その後、2塩基目のジメトキシトリチル(DMTr)基を除去し、図46に示すように目的のDNA鎖長になるまでヌクレオシドホスホロアミダイトとの縮合反応を繰り返す。
【0077】
(i) アンモニア水処理により、図47に示すように、リン酸基に結合したシアノエチル保護基を脱離させる。また、図40に示したアミノ基が保護された塩基をアンモニア水で図48に示すように脱保護する。最後に末端のジメトキシトリチル(DMTr)基を図49に示すように脱保護する。図41乃至図49に示した工程を図38に示したシランカップリング層81b〜81iのそれぞれについても実施し、図22に示すように生体物質層91a〜91iを形成させる。
【0078】
以上示した第3の実施の形態に係るバイオチップ用基板の製造方法によれば、図36で説明したように、NaOH溶液でSOI基板を処理することにより、第1の層13の表面のみに水酸(-OH)基が導入される。また、第2の層11がSiである場合、自然酸化膜12の膜厚は通常2nm以下であるが、室温で2時間NaOH溶液に浸すことにより自然酸化膜12は除去される。そのため、後の工程で滴下されるシランカップリング剤は第1の層13表面の水酸(-OH)基のみと反応し、第2の層11表面には結合しない。従来においては、残存する自然酸化膜12にシランカップリング剤が結合すると、自然酸化膜12上にも蛍光標識されたターゲット生体分子が結合し、バックグランドノイズになることがあった。特に微量検定においては、複数のウェル41a〜41i, 41b〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれの底部にのみターゲット生体分子がトラップされ、第2の層11上にはターゲット生体分子がトラップされないようにして、蛍光検定のコントラストの向上を図ることを可能にする技術の登場がのぞまれていた。これに対し、第3の実施の形態に係るバイオチップ用基板の製造方法によれば、第1の層13表面にのみ水酸(-OH)基を導入し、かつ同時に第2の層11表面の自然酸化膜12を除去することを可能とする。そのため、バックグランドノイズの極めて低いバイオチップ用基板の製造が可能となる。
【0079】
図50(a)は、図18に示したウェル41a〜42i, 42a〜42iが、蛍光試薬でラベルされたサンプルDNAで、図21に示した生体物質層91aに固定されたDNAと相補的な配列を有するものを含む検査溶液にさらされた時の顕微鏡写真の一例を示している。図50(b)は、図62乃至図67に示した従来のバイオチップ用基板が蛍光試薬でラベルされたサンプルDNAで、基板に固定されたDNAと相補的な配列を有するものを含む検査溶液にさらされた時の顕微鏡写真の一例を示している。従来の基板では、サンプルDNAがウェルの底だけでなく、他の領域にも結合していることが分かる。また、ウェルの底にもコンタミネーションが観察される。しかし、第3の実施の形態に係るバイオチップ用基板は、図50(a)に示すように、ターゲットDNAをウェルの底だけにハイブリダイズすることが可能である。また、ウェルにおける蛍光の均一性をも実現している。
【0080】
なお図30乃至図35においては、先に複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれを形成した後に、複数のウェル41a〜41i, 41b〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれを形成する方法を説明したが、先に複数のウェル41a〜41i, 41b〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれを形成した後に複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれを形成してもよい。ただし、複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれの深さの方が、複数のウェル41a〜41i, 41b〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれの深さよりも浅いため、先に複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれを形成した方がレジストの均一なスピン塗布が容易になる。
【0081】
また、図38乃至図49においては、第1の層13上にシランカップリング層81a〜81iを形成した後に生体物質層91a〜91iを形成する方法を説明したが、図37に示した複数の水酸基のそれぞれに生体分子をシランカップリング層81a〜81iを介さずに固定してもかまわないのは勿論である。
【0082】
さらに、図28乃至図49においては、SOI基板を使用する例を示したが、ガラス基板とポリテトラフルオロエチレン基板の貼り合わせ基板を使用してバイオチップ用基板を製造してもよい。すなわち、第1の層13にガラス基板を用い、第2の層11にポリテトラフルオロエチレン基板を用いることにより、SOI基板と同様にバイオチップ用基板を製造することが可能である。
【0083】
(第1の変形例)
バイオチップ用基板の製造方法は、以上示した方法に限定されない。以下、エポキシ系ネガ型レジストを用いたバイオチップ用基板の製造方法について説明する。
【0084】
(a) 図51に示すガラス等からなる第1の層115の表面にエポキシ系ネガ型の第1レジスト111をスピン塗布する。次に、図52に示すように、形成されるウェルに対応する遮光パターン140a, 140b, 140c, ・・・を有するフォトマスク40を用いて第1レジスト111を露光する。
【0085】
(b) 図53に示すように、第1レジスト111の表面に、さらにエポキシ系ネガ型の第2レジスト211をスピン塗布し、第2の層11を形成させる。次に、図54に示すように、形成されるウェル及び流路に対応する遮光パターン150を有するフォトマスク50を用いて第2レジスト211を露光する。
【0086】
(c) 第1レジスト111及び第2レジスト211をベーク処理する。なお、ベーク処理により、第1レジスト111及び第2レジスト211のそれぞれは緩衝液等に対して不溶性になる。その後、アルカリ現像液等で現像処理を行うことにより、図55に示すようにウェル41a〜41i及び流路31a〜31iのそれぞれが第2の層11に形成される。以下、図37乃至図49に示した方法を実施することにより、バイオチップ用基板が完成する。
【0087】
(その他の実施の形態)
上記のように、本発明は実施の形態によって記載したが、この開示の一部をなす記述及び図面はこの発明を限定するものであると理解するべきではない。この開示から当業者には様々な代替実施の形態、実施の形態及び運用技術が明らかになるはずである。
【0088】
例えば、図56及び図56のA-A方向から見た断面図である図57に示す第2の変形例に係るバイオチップ用基板は、図18及び図19に示したバイオチップ用基板と異なり、複数の流路31a〜31i, 32a〜32i, 33a〜33i, 34a〜34g, 35a〜35g, 36a〜36g, 37a〜37i, 38a〜38i, 39a〜39hのそれぞれが第2の層11に設けられていない。一方、図58及び図58のB-B方向から見た断面図である図59に示す第2の変形例に係るカバープレート25は、図25及び図26に示したカバープレート25と異なり、図56及び図57に示したバイオチップ用基板と貼り合わされた場合に、複数のウェル41a〜41i, 41b〜41i, 42a〜42i, 43a〜43i, 44a〜44g, 45a〜45g, 46a〜46g, 47a〜47i, 48a〜48i, 49a〜49iのそれぞれを接続する流路300を有する。
【0089】
図56に示すバイオチップ用基板上に図58に示すカバープレート25を貼り合わせた場合の断面図である図60に示すように、開口27から注入される検査溶液はウェル41aを充填した後、流路300を辿って順次ウェル41b〜41iを充填していく。したがって、第3の実施の形態と同様、図56に示すバイオチップ用基板及び図58に示すカバープレート25を用いることにより、必要な検査溶液の量を減少させることが可能となる。
【0090】
この様に、本発明はここでは記載していない様々な実施の形態等を包含するということを理解すべきである。したがって、本発明はこの開示から妥当な特許請求の範囲の発明特定事項によってのみ限定されるものである。
【符号の説明】
【0091】
A1, A2, A3, A4…中間体
A, B0, B1,B2,B3,B4…基板
1, 15, 141…半導体基板
2, 2A, 13A, 23, 41a〜41i, 152, 162…ウェル
3, 132, 141a, 163…Si酸化物層
4, 14, 81a〜81i…シランカップリング層
5a…非活性スペーサ層
5, 135…スペーサ層
6…樹脂液滴
11…第2の層
12…自然酸化膜
13, 115…第1の層
16, 21, 22…レジスト
25…カバープレート
27, 28, 51a〜51i, 61a〜61i…開口
31a〜31i, 32a〜32i, 300…流路
40, 50…フォトマスク
91a〜91i…生体物質層
95a, 95b, 95c…抗体
111…第1レジスト
131…半導体層
140a〜140c…遮光パターン
142…非反応層
150…遮光パターン
151…ガラス板
161…板状体
211…第2レジスト
【特許請求の範囲】
【請求項1】
第1の層上に配置された第2の層の一部を選択的にエッチングし、前記第1の層を表出させるステップと、
前記第1の層をナトリウム溶液に浸し、前記第1の層表面に複数の水酸基を導入するステップ
とを含むことを特徴とするバイオチップ用基板の製造方法。
【請求項2】
前記第2の層の一部を選択的にエッチングし、流路を形成するステップを更に含むことを特徴とする請求項1に記載のバイオチップ用基板の製造方法。
【請求項3】
前記第2の層を前記ナトリウム溶液に浸し、前記第2の層表面の自然酸化膜を除去するステップを更に含むことを特徴とする請求項1又は2に記載のバイオチップ用基板の製造方法。
【請求項4】
前記複数の水酸基のそれぞれに生体物質を結合させるステップを更に含むことを特徴とする請求項1乃至請求項3のいずれか1項に記載のバイオチップ用基板の製造方法。
【請求項5】
前記複数の水酸基のそれぞれに生体物質を結合させるステップは、前記複数の水酸基のそれぞれにシランカップリング剤を結合させるステップを更に含むことを特徴とする請求項4に記載のバイオチップ用基板の製造方法。
【請求項1】
第1の層上に配置された第2の層の一部を選択的にエッチングし、前記第1の層を表出させるステップと、
前記第1の層をナトリウム溶液に浸し、前記第1の層表面に複数の水酸基を導入するステップ
とを含むことを特徴とするバイオチップ用基板の製造方法。
【請求項2】
前記第2の層の一部を選択的にエッチングし、流路を形成するステップを更に含むことを特徴とする請求項1に記載のバイオチップ用基板の製造方法。
【請求項3】
前記第2の層を前記ナトリウム溶液に浸し、前記第2の層表面の自然酸化膜を除去するステップを更に含むことを特徴とする請求項1又は2に記載のバイオチップ用基板の製造方法。
【請求項4】
前記複数の水酸基のそれぞれに生体物質を結合させるステップを更に含むことを特徴とする請求項1乃至請求項3のいずれか1項に記載のバイオチップ用基板の製造方法。
【請求項5】
前記複数の水酸基のそれぞれに生体物質を結合させるステップは、前記複数の水酸基のそれぞれにシランカップリング剤を結合させるステップを更に含むことを特徴とする請求項4に記載のバイオチップ用基板の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図39】


【図40】


【図41】


【図42】


【図43】


【図44】


【図45】


【図46】


【図47】


【図48】


【図49】


【図51】


【図52】


【図53】


【図54】


【図55】


【図56】


【図57】


【図58】


【図59】


【図60】


【図61】


【図62】


【図63】


【図64】


【図65】


【図66】


【図67】


【図16】


【図17】


【図50】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図39】


【図40】


【図41】


【図42】


【図43】


【図44】


【図45】


【図46】


【図47】


【図48】


【図49】


【図51】


【図52】


【図53】


【図54】


【図55】


【図56】


【図57】


【図58】


【図59】


【図60】


【図61】


【図62】


【図63】


【図64】


【図65】


【図66】


【図67】


【図16】


【図17】


【図50】


【公開番号】特開2011−107154(P2011−107154A)
【公開日】平成23年6月2日(2011.6.2)
【国際特許分類】
【出願番号】特願2011−6344(P2011−6344)
【出願日】平成23年1月14日(2011.1.14)
【分割の表示】特願2005−194381(P2005−194381)の分割
【原出願日】平成17年7月1日(2005.7.1)
【出願人】(000006666)株式会社山武 (1,808)
【Fターム(参考)】
【公開日】平成23年6月2日(2011.6.2)
【国際特許分類】
【出願日】平成23年1月14日(2011.1.14)
【分割の表示】特願2005−194381(P2005−194381)の分割
【原出願日】平成17年7月1日(2005.7.1)
【出願人】(000006666)株式会社山武 (1,808)
【Fターム(参考)】
[ Back to top ]

