バイオマーカーの探索方法及びそれにより見出されたバイオマーカーを用いたがんの検出方法
【課題】細胞のバイオマーカー、特に、がんの検査診断、治療剤開発、がんの予後判定等に利用可能なバイオマーカーの探索方法を提供すること
【解決手段】バイオマーカーの探索方法は、物質透過性を有し、細胞が透過しない固相基質の両面上で、各面ごとに互いに異なる種類の細胞をそれぞれ接着培養する工程と、培養後の細胞を回収してその遺伝子発現データを得る工程と、得られた遺伝子発現データから同種細胞を培養した場合に比べて発現が変化した遺伝子を特定する工程とを含む。発現が変化した遺伝子のmRNA又は該遺伝子の直接的若しくは間接的産物若しくは該産物に起因して増大若しくは減少する物質をバイオマーカーであると判定する。
【解決手段】バイオマーカーの探索方法は、物質透過性を有し、細胞が透過しない固相基質の両面上で、各面ごとに互いに異なる種類の細胞をそれぞれ接着培養する工程と、培養後の細胞を回収してその遺伝子発現データを得る工程と、得られた遺伝子発現データから同種細胞を培養した場合に比べて発現が変化した遺伝子を特定する工程とを含む。発現が変化した遺伝子のmRNA又は該遺伝子の直接的若しくは間接的産物若しくは該産物に起因して増大若しくは減少する物質をバイオマーカーであると判定する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、バイオマーカーの探索方法及びそれにより見出されたバイオマーカーを用いたがんの検出方法に関する。
【背景技術】
【0002】
がんは、我が国死亡率第一位の疾患であり、その検査診断法、治療法、予防法の確立が強く求められている。このため、検査診断や治療の標的となる細胞の分子(バイオマーカー)を探索同定する試みは広く行われており、種々の手法が開発されているが、簡便で迅速に探索同定する手法の開発は依然として求められている。
【0003】
バイオマーカー探索で最も有望とされるのは、がん病巣でがん部と非がん部の遺伝子やタンパク質の発現を比較し、そこでがん部にのみ特異的に発現している因子を同定することである。しかしこの手法の場合、がん部と非がん部を明確に分離して採取することが必須であることから、浸潤性のがんのように、がん細胞と周囲の非がんの間質細胞が混在する場合には適用はできなくなる。浸潤性のがんは増殖転移を起こしやすく、予後が悪いため、浸潤性のがん細胞のバイオマーカーこそ医療上の開発する意義が高いにもかかわらず、その探索には多くの困難が伴う。また、実際のがん組織は病理学的には不均一な細胞集団からなり、多様ながん細胞の細胞集団とそこで発現する多様なバイオマーカーが混在することになることから、特定の少数のバイオマーカーを選択することは極めて難しい。さらにがん細胞周囲の正常細胞は、がん細胞との共存によって形質転化が起こり、本来の正常細胞とは異なる機能をもつことが報告されている。これらの状況は、がん組織の多様性とがんの微小環境として捉えられ、個別のがん細胞を調べると同時に細胞間の相互作用(細胞間クロストーク)も加味した手法で、バイオマーカーを探索することが重要であることを示している(非特許文献1)。
【0004】
他方、多様性に富むがんの病理組織を利用する方法に比べて、樹立された均一ながん培養細胞株を利用する方法は簡便であり、広く活用されている。ただし、培養がん細胞で上記のがんの微小環境までを考慮した評価方法は少なく、直接混ぜて培養する方法(非特許文献2)、隔離された培養細胞ウェルを同一培養液中で培養する方法(非特許文献3)や三次元のスフェロイドで培養する方法(非特許文献4)などの少数例が挙げられるに過ぎない。異種細胞同士を培養する例で考えると、隔離された培養細胞間では細胞同士分泌物質を介した細胞間相互作用(細胞間クロストーク)は希薄で、がんの微小環境を十分に反映しているとは言い難く、一方、三次元スフェロイドの混合培養では培養中の細胞の混在比が制御できず、かつ培養後の細胞集団を細胞種ごとに個別分離して分析する手間が大きく、簡便にバイオマーカーを探索できる手法とは言い難い。
【0005】
こうした状況を考えると、本来多様性に富むがん細胞と多面的な相互作用が起こるがんの微小環境を簡便に構築し、がんのバイオマーカーを探索する方法があれば、有用なバイオマーカーを取得することに有用であることがわかる。同時に、そこから得られたバイオマーカーは病態に則して選択して用いることにより、がんの検査診断と治療法の開発に有用である。
【0006】
実際、バイオマーカー探索の重要性は、早期発見と早期治療が有効ながんの診断・治療分野で大きく、増加している難治性がんの領域では特に重要性が高い。たとえば、乳がんは日本では現在約20人に1人が罹患する女性がんで最大の疾患であり、罹患率、 死亡率ともに増加しており、大きな社会問題となっている。近年、特異的受容体(エストロゲン受容体=ER、プロゲステロン受容体=PgR、HER2受容体)に対する分子標的薬 が開発され一定の治療効果を得ているが、全体の約20%を占める "トリプルネガ ティブ(TN)型(三種の受容体発現を欠く)乳がん"は、適切な治療法が無く予後が悪いことから、現在乳がん治療上の最大の課題となっている。このようなTN 型乳がんの非侵襲的早期診断に有用なバイオマーカーを探索・同定することで重要である。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】「がんと微小環境」実験医学増刊Vol.27 No.2、羊土社、2009年
【非特許文献2】S.J. Bidarraaら、Stem Cell Research (2011) 7, 186-197
【非特許文献3】B.Vinciら、Biotechnol J. 2011 Aug 1. doi: 10.1002/biot.201100177
【非特許文献4】N.Maggioら、Biomaterials 32 (2011) 321e329
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明の目的は、細胞のバイオマーカー、特に、がんの検査診断、治療剤開発、がんの予後判定等に利用可能なバイオマーカーの探索方法を提供することである。また、本発明の目的は、この方法により見出されたバイオマーカーを用いたがんの検出方法を提供することである。
【課題を解決するための手段】
【0009】
本願発明者らは鋭意研究の結果、物質透過性を有し、細胞が透過しない固相基質の両面上で、各面ごとに互いに異なる種類の細胞をそれぞれ接着培養することにより、これらの異なる細胞同士が互いに影響する環境下で培養を行うことができ、このような環境下で培養した細胞の遺伝子発現を調べることにより、生体内での疾患の状態をより的確に模倣した状態下での遺伝子発現を調べることができ、それによって、実際の疾患のバイオマーカーをより的確に見出すことが可能になることに想到し、本発明に至った。
【0010】
すなわち、本発明は、物質透過性を有し、細胞が透過しない固相基質の両面上で、各面ごとに互いに異なる種類の細胞をそれぞれ接着培養する工程と、
培養後の細胞を回収してその遺伝子発現データを得る工程と、
得られた遺伝子発現データから同種細胞を培養した場合に比べて発現が変化した遺伝子を特定する工程とを含み、
発現が変化した遺伝子のmRNA又は該遺伝子の直接的若しくは間接的産物若しくは該産物に起因して増大若しくは減少する物質をバイオマーカーであると判定する、バイオマーカーの探索方法を提供する。
【0011】
また、本発明は、生体から分離された試料中の、FGFBP1、MAL、ALPP、KLK10、SERPINB5、LTB、ARHGDIB、SNX10、KLK5、ESRP1、PLS1及びNEURLから選ばれる少なくとも1つ以上の遺伝子の発現を指標とし、該遺伝子の発現増大ががんの存在を示す、がんの検出方法を提供する。
【発明の効果】
【0012】
本発明により、異なる細胞同士が互いに影響する環境下において、すなわち、生体内での疾患の状態をより的確に模倣した状態下において、疾患の検出等に役立つバイオマーカーをより的確に見出すことができる、バイオマーカーの探索方法が初めて提供された。本発明の方法によれば、がんの微小環境に関わる種々の細胞を個別に培養評価できるので、がん組織から分泌されているものの、実はがんの周辺の非がん細胞から分泌されているというような、個別細胞が産生する因子の判別が可能となり、がん細胞自身の産生因子とがん周辺の非がん細胞の産生因子との判別利用により、より明確な病態の検査とモニタリングが可能となる。また、がん細胞自身が産生する因子や細胞表面抗原が特定できるため、これらを標的とした分子標的治療薬の開発にも貢献する。また、本発明の方法により、がん、特に乳がんのバイオマーカーとして有用な複数のバイオマーカーが見出され、それらを用いたがん、特に乳がんの新規な検出方法が提供された。
【図面の簡単な説明】
【0013】
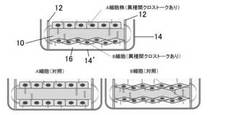
【図1】本発明の方法において、固相基質の両面上で異なる種類の細胞を培養する方法の一例を模式的に示す図である。
【図2】本発明の方法において、複数枚の固相基質を積層して配置し、それらの各固相基質の両面上で互いに異なる種類の細胞を培養する方法の一例を模式的に示す図である。
【発明を実施するための形態】
【0014】
上記の通り、本発明の方法では、物質透過性を有し、細胞が透過しない固相基質を用いる。ここで、「物質透過性を有する」とは、細胞が分泌したり、細胞内に侵入したり、細胞表面上のレセプター等に結合したりする種々のペプチド(タンパク質や糖タンパク質を包含する)や生理活性物質を溶解している溶液が透過することを意味する。「細胞が透過しない」とは、固相基質の片面上で培養されている細胞が遊走して、固相基質を貫通して反対側の面に現れることがないことを意味する。これらの条件を満足する固相基質としては、後者の条件を満足するために孔径が5μm以下の多孔性の固相基質であればよい。前者の条件は、細胞の固相培養に用いられている多孔性の固相基質であれば、通常満足される。また、本発明の方法に用いられる固相基質は、自己支持性の膜状の固相基質であることが好ましい。ここで、「自己支持性」とは、周縁部のみを支持した状態で空中で膜状の形態を維持できる(すなわち、自重により膜が破壊されない)ことを意味する。自己支持性の膜状の固相基質を用いれば、後述のように固相基質の周縁部のみをスペーサー等で支持することにより、膜を空中に保持できるので、培養器内で膜の両面上に細胞を容易に培養することが可能になり、また、周縁部のスペーサーを積層することにより、単一の培養器内で複数枚の膜を互いに間隙をあけた状態で保持することが可能になる(後述)ので好ましい。物質透過性を有し、細胞が透過しない自己支持性の固相基質は公知であり、例えば、コラーゲン膜、スキャフォード線維、ポリカーボネート膜、ニトロセルロース膜、ポリフッ化ビニリデン膜などが挙げられる。これらのうち、特にコラーゲン膜を好ましく用いることができる。物質透過性を有し、細胞が透過しない自己支持性のコラーゲン膜であって、その周縁部がリング状のスペーサーで支持されているものが市販されており(例えば、AteloCell(商品名)コラーゲン膜、高研社製)、このような市販のコラーゲン膜を好適に用いることができる。
【0015】
本発明の方法では、上記した固相基質の両面上で、各面ごとに互いに異なる種類の細胞をそれぞれ接着培養する。「各面ごとに互いに異なる種類の細胞をそれぞれ接着培養する」とは、すなわち、固相基質の一方の面上で細胞A、他方の面上で細胞Aとは種類が異なる細胞Bを培養するという意味である。周縁部にスペーサーを設けた、自己支持性の膜状の固相基質の各面ごとに互いに異なる種類の細胞をそれぞれ接着培養する方法を図1に模式的に示す。
【0016】
図1に示す例では、自己支持性の膜状の固相基質10の周縁部に、所定の厚さを有するスペーサー12が設けられている。スペーサー12は、培養に影響を与えないプラスチックや金属等の任意の材料で形成することができ、その平面形状(膜面を水平に配置した状態で上から見た形状)も円形や多角形など任意である。培養容器の平面形状がマイクロプレートのウェルのように円形の場合が多いので、スペーサー12の平面形状も通常、円形であるが特に限定されるものではない。スペーサー12を周縁部に有する膜状固相基質を平面上、例えば、培養容器14の底面14’上に載置した際に該スペーサー12によって、該固相基質10の下面(固相基質の膜を水平に配置した際に下になる面)と該底面14’との間に空隙16が形成される。この空隙の高さ(底面14’と固相基質10の下面との距離)は、固相基質10の下面上で培養される細胞が底面14’に接触しない程度以上あればよく、通常、2mm〜20mm程度、好ましくは5mm〜10mm程度である。
【0017】
図1に示すように、固相基質10の上面上と下面上でそれぞれ異なる種類の細胞を接着培養する。図1に示す例では、上面上にA細胞株、下面上でB細胞を培養している。培養は、通常、両面上の細胞が培養液で被覆されるようにして行う。すなわち、図1に示す例では、培養容器14内に、A細胞株が被覆される量の培養液を入れた状態で培養を行う。従って、培養容器14の底面14’と固相基質10の下面との間の空隙16にも培養液が満たされ、これによって固相基質10の下面上で培養されるB細胞も培養液で被覆される。培養方法自体はその細胞に適した周知の方法により行うことができる。例えば、ヒト細胞の場合には、常法に従い、通常、37℃、5%CO2の条件下で行われるが必ずしもこれに限定されるものではない。培養時間は特に限定されないが、通常、24時間〜144時間程度、好ましくは、36時間〜96時間程度である。培養液も、培養される細胞の培養液として常用されているものを用いることができる。
【0018】
固相基質10の両面上で細胞を接着培養する方法は例えば次のようにして行うことができる。すなわち、まず十分に膜全面にコンフルエントになるだけの細胞数をフラスコ等で別途培養しておき、トリプシン処理で細胞を回収したあと、速やかに固相基質の片面上に細胞を播種し、37℃で1日間培養して片面に細胞が確実に接着した後、固相基質を裏返し、同様に別途フラスコ等で培養した別種の細胞を空いた片面に播種し、この状態で上記の通り共培養を続けることにより行うことができる。
【0019】
なお、本発明の方法では、後述する工程において、固相基質の両面上で異なる種類の細胞を培養した場合の遺伝子発現データを、両面上で同種の細胞を培養した場合の遺伝子発現データと比較するので、対照として、図1の下部に示すように、固相基質10の両面上で同種の細胞(すなわち、図示のように、両面上でA細胞株を培養する場合と両面上でB細胞を培養する場合)を上記と同様に培養することも行う。
【0020】
培養する細胞の種類は、特に限定されず、バイオマーカーを探索する目的に照らし、対象となる疾患に関与する細胞等から適宜選択することができ、例えば、固相基質の両面上で培養する細胞の組み合わせを、がん細胞、線維芽細胞、血管内皮細胞、上皮細胞、脂肪前駆細胞、筋細胞、骨芽細胞、グリア細胞、樹状細胞、マクロファージ、神経細胞、筋肉細胞、心筋細胞、ES細胞、iPS細胞から選ぶことができる。例えば、バイオマーカーとしてがんマーカーを探索したい場合には、対象となるがん細胞と、生体内において、該がん細胞と接触する可能性がある細胞との組合せを採用することができる。すなわち、例えば、がんの微小環境を想定して培養系を構築する場合には、上皮系がん細胞−線維芽細胞、上皮系がん細胞−血管内皮細胞、上皮系がん細胞−脂肪前駆細胞、上皮系がん細胞−筋線維細胞、上皮系がん細胞−骨芽細胞、上皮系がん細胞−グリア細胞、上皮系がん細胞−マクロファージ等の組み合わせが挙げられる。
【0021】
上記した共培養を行うことにより、各細胞から分泌された物質は、図1に矢印で示すように物質透過性の固相基質10を透過して反対側の面上で培養されている細胞に到達し、互いに影響し合う(クロストーク)。さらに、スペーサー12は、単に培養容器14の底面14’上に載置しているだけであり、水密な構造にはなっていないので、スペーサー12の外側を介してもクロストークが行われる。このようにして、同種細胞だけを培養する場合に比べ、生体内での微小環境がより的確に模倣される。
【0022】
なお、図1に示す例では、1枚の固相基質10を単一の培養容器14内で培養しているが、単一の培養容器内に複数枚の固相基質を入れてより多くの種類の細胞を同時培養することもできる。周縁部にスペーサー12を有する自己支持性膜の膜状の固相基質を、単一の培養容器内に積層して配置した例を図2に示す。この場合、各固相基質10同士の間には、各スペーサー12によって間隙が形成されるので、各面上の細胞同士が直接接触することはない。また、複数枚の固相基質を単一の培養容器内に平面的に並べて配置することもでき、さらに、積層と平面的な配置を組み合わせることもできる。このようにして単一の培養容器内で培養する細胞の種類を増やすことにより、人工的ながん微小環境をより的確に構築することが可能になる。例えば、乳がんの微小環境を模して培養する場合、乳がん細胞の片面にそれぞれ線維芽細胞、血管内皮細胞、乳腺上皮細胞、前脂肪細胞を培養した4枚の両面共培養膜を1つの培養容器に入れて培養することにより、各細胞は、培養基材を通過する物質を通して高密度な細胞間クロストークが、同時に各細胞が培地中に分泌する液性因子による低密度な細胞間クロストークが行われ、各細胞を個別に反応する条件を設定できる。
【0023】
本発明の方法において、片面上で培養した細胞ごとにあらかじめ薬剤処理を行い、そのうえで細胞間クロトークを行わせることができる。たとえば、片面に抗がん剤で事前処理したがん細胞、その裏面は非処理のがん細胞という組み合わせで両面共培養すると、抗がん剤が投与された生体中で血流に接するがん細胞と血流に接しないがん細胞が共存する環境を模することができる。がん組織中では、体外から投与された薬剤が必ずしも均一に到達せず、かつ細胞間クロストークによってがん細胞のアポトーシスやサバイバルが影響を受けるため、こうした評価系が価値がある。さらにがん病巣に存在するがん細胞が、悪性度や分化度、薬剤感受性などが不均一のヘテロな集団であることから、こうした各種条件の細胞を任意の組み合わせで培養でき、その後の細胞層ごとの分析ができることは非常に有用性が高い。
【0024】
次に、培養後の細胞を回収してその遺伝子発現データを得る。遺伝子発現データは、その遺伝子のmRNA又は遺伝子産物等を指標として得ることができる。この工程は、それ自体周知の方法により行うことができる。例えば、両面共培養によって培養された細胞は、細胞表面を洗浄して培地成分を除去した後、片面ごとに膜の表面に細胞溶解液(マイクロアレイ解析用)または蒸留水(タンパク質分析用)を添加し、セルスクレーパーで細胞溶解液を回収する。細胞溶解液は、目的に応じて、タンパク質、ペプチド、糖、脂質、核酸、代謝物等の分析に供する。マイクロアレイを用いた解析であれば、mRNAやマイクロRNA、ペプチド、糖タンパク質糖鎖などを直接解析することができる。また、タンパク質分析には、質量分析装置や電気泳動装置にそのまま供することができる。ヒト由来の多数のDNA断片を固定化したマイクロアレイが市販されているので、このような市販のマイクロアレイを用いてmRNAを測定することが簡便に網羅的な解析を行うことができるので好ましい。
【0025】
次の工程では、得られた遺伝子発現データから同種細胞を培養した場合に比べて発現が変化した遺伝子を特定する。すなわち、得られた解析データの処理では、同種間あるいは同条件下で共培養した細胞を対照として、それぞれ異種間あるいは異条件下で培養した細胞のデータを、細胞間クロストークの反映結果として判定することができる。こうしたデータ解析は、遺伝子あるいはペプチドのデータリストを、汎用バイオインフォマティクス解析ソフトやウェッブツール(たとえば、米国NCBI製PubMed、米国NIH/NIAID提供の“DAVID”、米国南カリフォルニア大学製”Panther”、Ingenuity System社製“IPA”、ThomsonReuter社製”MetaCore”、医薬分子設計研究所製の“KeyMolnet”等)で行うことができる。たとえば、がん細胞と両面共培養した線維芽細胞の発現遺伝子群をオントロジー解析でアポトーシス関連の遺伝子発現が多かった場合、線維芽細胞はがん細胞からの細胞死シグナルの細胞間クロストークを得ていることがわかる。
【0026】
上記方法により特定された、発現が変化した遺伝子のmRNA又は該遺伝子の直接的若しくは間接的産物(すなわち、該産物に起因して増大若しくは減少する物質(例えば、遺伝子産物が酵素の場合、その酵素反応により生成する生成物や、酵素反応により消費される基質等))をバイオマーカーであると判定する。がん細胞の場合、しばしば、発現が増大される遺伝子が存在することがあるので、がんマーカーの探索の場合、発現が増大した遺伝子を特定してもよい。
【0027】
実際の検査において、見出されたバイオマーカーを定量する方法自体は周知であり、例えば、DNAアレイを用いてバイオマーカーのmRNAを測定したり、リアルタイム検出RT-PCR等の定量的PCRによりmRNAを測定したり、免疫測定によりバイオマーカーのタンパク質やペプチド等を定量することができる。
【0028】
下記実施例においては、上記方法により乳がん細胞株と線維芽細胞を共培養して解析した結果、複数のバイオマーカーが見出された。これらのうちのいくつかは乳がんのバイオマーカーとして既に公知のものであったが、これまでに乳がんのバイオマーカーとしては知られていないものも見出された。すなわち、下記実施例において、乳がんにおいて、FGFBP1、MAL、ALPP、KLK10、SERPINB5、LTB、ARHGDIB、SNX10、KLK5、ESRP1、PLS1及びNEURLの各遺伝子の発現が増大した。従って、生体から分離された試料中の、これらの遺伝子から選ばれる少なくとも1つ以上の遺伝子の発現を指標とし、該遺伝子の発現増大ががんの存在を示す、がんの検出方法も本発明により初めて提供された。上記各遺伝子自体は、いずれも公知であり、その塩基配列及びそれがコードするポリペプチドのアミノ酸配列も公知である。各遺伝子のcDNAの塩基配列及びそれがコードするアミノ酸配列を配列表に示す。なお、周知の通り、遺伝子にはSNP等の天然の変異が存在する場合があるので、それらの天然の変異を有するものも上記各遺伝子に包含される。なお、生体から分離された試料としては、がんの疑いがある部分からの生検細胞や、血液等の体液を挙げることができる。
【0029】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【実施例】
【0030】
実施例1 乳がん細胞と線維芽細胞の両面共培養による発現遺伝子検出
公知の継代用培地(10%胎児血清を含むDMEM培地)で培養したTN型HCC1937株化乳がん細胞を、PBS(-)で洗浄後、トリプシン溶液で培養フラスコから剥離させ、継代用培地で1.5×105 cells/mLに調製した。培養ディッシュに継代用培地を6 mL/dish加え、自己支持性の膜状固相基質(AteloCell(商品名)コラーゲン膜)を膜下面に気泡が入らないように入れた。コラーゲン膜(表)に細胞液を1.5 mL播種し、炭酸ガスインキュベーター内(37℃、5%CO2)で1日培養した。同様に継代用培地で培養した及びNHDF(NB)正常ヒト線維芽細胞を、PBS(-)で洗浄後、トリプシン溶液で培養フラスコから剥離させ、継代用培地で2×105 cells/mLに調製した。
【0031】
HCC1937細胞が接着培養されたコラーゲン膜を取り出し表面をPBS(-)で2回洗浄し、新しい培養ディッシュに継代用培地を6 mL/dish加え、コラーゲン膜を裏返して入れた。コラーゲン膜(裏)に線維芽細胞液を1.5 mL播種し、炭酸ガスインキュベーター内(37℃、5%CO2)で72 ±2時間培養した。
【0032】
コラーゲン膜を培養ディッシュから取り出し、膜の両面をPBS(-)で2回洗浄した。膜の表面に細胞溶解液(マイクロアレイ解析用)または蒸留水(タンパク質分析用)を350μL添加し、セルスクレーパーで細胞溶解液を回収した(膜2〜3枚分をプールしn=1とする)。次に、膜の裏面も同様に処理し、細胞溶解液を回収した。ボルテックスミキサーで撹拌後、超低温フリーザーで凍結保存した。
【0033】
凍結融解した細胞溶解液からRNA抽出キット(インビトロジェン社TRIZOL(登録商標) Reagent)を用いてRNA画分を抽出し、精製RNA画分 をOD値で 260/280 比が 1.8-2.1となったことを確認後、アミノアリルaRNAをCy5にてラベル化、断片化した後(アンビオン株式会社のAmino Allyl MessageAmpTM II aRNA Amplification kitとGEヘルスケア バイオサイエンス株式会社のCy5 Mono-Reactive Dye PackによるaRNA間接標識法を使用)、mRNA解析用マイクロアレイ(東レ製3D-Geneチップ)上でハイブリダイゼーション後、3D-Gene プロトコールにしたがってチップを洗浄した後、3D-Geneスキャナー(東レ)にてスキャンした。得られた画像ファイル(tiffファイル)から、数値化解析ソフトウェア等により各スポットの蛍光強度を数値データに変換し、また数値データからバックグラウンドの減算処理、データの標準化(グローバルノーマライゼーション)を行い、各遺伝子の発現比を算出した。
【0034】
その結果、表1に示した因子の遺伝子群が、HCC1937乳がん細胞に特異的に強発現し、かつ線維芽細胞との共培養によってさらに増強されることがわかった。したがって、これらの因子は、乳がんの増殖・浸潤バイオマーカーとして利用できる。表1にまとめた因子群のうち、EPCAM、KRT18、SAA1の3種はすでにがん関連バイオマーカーとして報告例があり、公知であるので、これら3種を除いた因子が、本発明によって新たに見出されたバイオマーカーである。
【0035】
【表1】

【0036】
参考例1: 生体内バイオマーカーの産生細胞の推定と診断用途の妥当性の評価
本発明は、生体内におけるバイオマーカーの産生系をシミレーションしたものであるが、本発明を利用すると生体内バイオマーカーを診断用途に用いる妥当性を検討することができるので、その事例を示す。
【0037】
Diamandisらは、肺がん患者203名とヘビースモーカー180名の血清を調べ、Pentraxin-3 (PTX3) が肺がんの血清中バイオマーカーとなる可能性を報告している(Clin Cancer Res. 2011 ; 17(8): 2395-9)。実施例1の分析結果をPTX3に注目して解析してみると、共培養後はPTX3の発現は線維芽細胞は1.2倍(シグナル値:4,216)に増加し、HCC1937乳がん細胞も1.4倍(同:193)に増加したが、シグナル強度を細胞間で比べると、線維芽細胞はHCC1937細胞の約20倍に達していた。すなわち、PTX3は線維芽細胞の産生能が非常に高いので、同様の現象が肺がん組織中でも起きている可能性があり、血中PTX3のほとんどあるいは一部は線維芽細胞から由来している可能性がある。この線維芽細胞の共培養時の相対的なPTX3高産生は本発明技術によって初めて明らかにされた。線維芽細胞は、炎症にも鋭敏に反応して各種因子を産生するので、がん細胞との共存に限らずにPTX3を産生することも想定される。
【0038】
したがって、上記論文のとおり、PTX3を肺がんのバイオマーカーとして開発する場合、がん細胞だけに由来する因子ではなく、線維芽細胞が高濃度に産生し得る因子であるために、結果としてフォールスポジティブ生じやすく、がん診断のための血清バイオマーカーには適さない可能性もあることから、十分な検討が必要となる。PTX3に限らず、がん診断のための血清バイオマーカーは、がん細胞特異的に産生される因子が最も望ましい。
【0039】
参考例2: 生体内バイオマーカーの産生細胞の推定と診断用妥当性の評価
本発明は、生体内におけるバイオマーカーの産生系をシミュレーションしたものであるが、本発明を利用すると生体内バイオマーカーの診断用途に用いることを検討することができるので、その事例を示す。
【0040】
Morrisseyらは、腎がん患者42名で、病巣切除前後の尿中バイオマーカーを調べたところ、健常人より高値で、しかも切除後に有意に減少するマーカーとしてadipophilin (ADFP)とaquaporin-1 (AQP1)を見出し、これらは初期の腎がんのマーカーなる可能性を報告している(Mayo Clin Proc. 2010;85(5):413-21)。
【0041】
実施例1の分析結果をADFPに注目して解析してみると、共培養後はADFPの発現は線維芽細胞は2.5倍(シグナル値:5,281)に増加し、HCC1937乳がん細胞も1.4倍(同:2,488)に増加した。シグナル強度を細胞間で比べると、線維芽細胞はADFPの産生量はHCC1937細胞の約2倍であり、尿中に移行したADFPの多くあるいは一部は腎がん組織中の線維芽細胞から産生されたものである可能性がある。すなわち、線維芽細胞のADFPの産生能が高いので、同様の現象が腎がん組織中でも起きている可能性があり、尿中ADFPの多くあるいは一部は線維芽細胞由来の可能性がある。この線維芽細胞の相対的なADFP高産生は本発明技術によって初めて明らかにされた。線維芽細胞は、炎症にも鋭敏に反応して各種因子を産生するので、がん細胞との共存に限らずにADFPを産生することが想定される。したがって、上記論文のとおり、ADFPを腎がんのバイオマーカーとして開発する場合、がん細胞だけが由来する因子ではないためにフォールスポジティブを生じやすく、がん診断のための尿中バイオマーカーにはADFPは適さない可能性もあることから、十分な検討が必要となる。PTX3に限らず、がん診断のための尿中バイオマーカーは、がん細胞特異的に産生される因子が最も望ましい。
【産業上の利用可能性】
【0042】
上記の通り、本発明の方法は、がん等の検出に有用な、的確なバイオマーカーの探索に有用であり、ひいてはがん等の検出に有用である。
【符号の説明】
【0043】
10 自己支持性の膜状の固相基質
12 スペーサー
14 培養容器
16 間隙
【技術分野】
【0001】
本発明は、バイオマーカーの探索方法及びそれにより見出されたバイオマーカーを用いたがんの検出方法に関する。
【背景技術】
【0002】
がんは、我が国死亡率第一位の疾患であり、その検査診断法、治療法、予防法の確立が強く求められている。このため、検査診断や治療の標的となる細胞の分子(バイオマーカー)を探索同定する試みは広く行われており、種々の手法が開発されているが、簡便で迅速に探索同定する手法の開発は依然として求められている。
【0003】
バイオマーカー探索で最も有望とされるのは、がん病巣でがん部と非がん部の遺伝子やタンパク質の発現を比較し、そこでがん部にのみ特異的に発現している因子を同定することである。しかしこの手法の場合、がん部と非がん部を明確に分離して採取することが必須であることから、浸潤性のがんのように、がん細胞と周囲の非がんの間質細胞が混在する場合には適用はできなくなる。浸潤性のがんは増殖転移を起こしやすく、予後が悪いため、浸潤性のがん細胞のバイオマーカーこそ医療上の開発する意義が高いにもかかわらず、その探索には多くの困難が伴う。また、実際のがん組織は病理学的には不均一な細胞集団からなり、多様ながん細胞の細胞集団とそこで発現する多様なバイオマーカーが混在することになることから、特定の少数のバイオマーカーを選択することは極めて難しい。さらにがん細胞周囲の正常細胞は、がん細胞との共存によって形質転化が起こり、本来の正常細胞とは異なる機能をもつことが報告されている。これらの状況は、がん組織の多様性とがんの微小環境として捉えられ、個別のがん細胞を調べると同時に細胞間の相互作用(細胞間クロストーク)も加味した手法で、バイオマーカーを探索することが重要であることを示している(非特許文献1)。
【0004】
他方、多様性に富むがんの病理組織を利用する方法に比べて、樹立された均一ながん培養細胞株を利用する方法は簡便であり、広く活用されている。ただし、培養がん細胞で上記のがんの微小環境までを考慮した評価方法は少なく、直接混ぜて培養する方法(非特許文献2)、隔離された培養細胞ウェルを同一培養液中で培養する方法(非特許文献3)や三次元のスフェロイドで培養する方法(非特許文献4)などの少数例が挙げられるに過ぎない。異種細胞同士を培養する例で考えると、隔離された培養細胞間では細胞同士分泌物質を介した細胞間相互作用(細胞間クロストーク)は希薄で、がんの微小環境を十分に反映しているとは言い難く、一方、三次元スフェロイドの混合培養では培養中の細胞の混在比が制御できず、かつ培養後の細胞集団を細胞種ごとに個別分離して分析する手間が大きく、簡便にバイオマーカーを探索できる手法とは言い難い。
【0005】
こうした状況を考えると、本来多様性に富むがん細胞と多面的な相互作用が起こるがんの微小環境を簡便に構築し、がんのバイオマーカーを探索する方法があれば、有用なバイオマーカーを取得することに有用であることがわかる。同時に、そこから得られたバイオマーカーは病態に則して選択して用いることにより、がんの検査診断と治療法の開発に有用である。
【0006】
実際、バイオマーカー探索の重要性は、早期発見と早期治療が有効ながんの診断・治療分野で大きく、増加している難治性がんの領域では特に重要性が高い。たとえば、乳がんは日本では現在約20人に1人が罹患する女性がんで最大の疾患であり、罹患率、 死亡率ともに増加しており、大きな社会問題となっている。近年、特異的受容体(エストロゲン受容体=ER、プロゲステロン受容体=PgR、HER2受容体)に対する分子標的薬 が開発され一定の治療効果を得ているが、全体の約20%を占める "トリプルネガ ティブ(TN)型(三種の受容体発現を欠く)乳がん"は、適切な治療法が無く予後が悪いことから、現在乳がん治療上の最大の課題となっている。このようなTN 型乳がんの非侵襲的早期診断に有用なバイオマーカーを探索・同定することで重要である。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】「がんと微小環境」実験医学増刊Vol.27 No.2、羊土社、2009年
【非特許文献2】S.J. Bidarraaら、Stem Cell Research (2011) 7, 186-197
【非特許文献3】B.Vinciら、Biotechnol J. 2011 Aug 1. doi: 10.1002/biot.201100177
【非特許文献4】N.Maggioら、Biomaterials 32 (2011) 321e329
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明の目的は、細胞のバイオマーカー、特に、がんの検査診断、治療剤開発、がんの予後判定等に利用可能なバイオマーカーの探索方法を提供することである。また、本発明の目的は、この方法により見出されたバイオマーカーを用いたがんの検出方法を提供することである。
【課題を解決するための手段】
【0009】
本願発明者らは鋭意研究の結果、物質透過性を有し、細胞が透過しない固相基質の両面上で、各面ごとに互いに異なる種類の細胞をそれぞれ接着培養することにより、これらの異なる細胞同士が互いに影響する環境下で培養を行うことができ、このような環境下で培養した細胞の遺伝子発現を調べることにより、生体内での疾患の状態をより的確に模倣した状態下での遺伝子発現を調べることができ、それによって、実際の疾患のバイオマーカーをより的確に見出すことが可能になることに想到し、本発明に至った。
【0010】
すなわち、本発明は、物質透過性を有し、細胞が透過しない固相基質の両面上で、各面ごとに互いに異なる種類の細胞をそれぞれ接着培養する工程と、
培養後の細胞を回収してその遺伝子発現データを得る工程と、
得られた遺伝子発現データから同種細胞を培養した場合に比べて発現が変化した遺伝子を特定する工程とを含み、
発現が変化した遺伝子のmRNA又は該遺伝子の直接的若しくは間接的産物若しくは該産物に起因して増大若しくは減少する物質をバイオマーカーであると判定する、バイオマーカーの探索方法を提供する。
【0011】
また、本発明は、生体から分離された試料中の、FGFBP1、MAL、ALPP、KLK10、SERPINB5、LTB、ARHGDIB、SNX10、KLK5、ESRP1、PLS1及びNEURLから選ばれる少なくとも1つ以上の遺伝子の発現を指標とし、該遺伝子の発現増大ががんの存在を示す、がんの検出方法を提供する。
【発明の効果】
【0012】
本発明により、異なる細胞同士が互いに影響する環境下において、すなわち、生体内での疾患の状態をより的確に模倣した状態下において、疾患の検出等に役立つバイオマーカーをより的確に見出すことができる、バイオマーカーの探索方法が初めて提供された。本発明の方法によれば、がんの微小環境に関わる種々の細胞を個別に培養評価できるので、がん組織から分泌されているものの、実はがんの周辺の非がん細胞から分泌されているというような、個別細胞が産生する因子の判別が可能となり、がん細胞自身の産生因子とがん周辺の非がん細胞の産生因子との判別利用により、より明確な病態の検査とモニタリングが可能となる。また、がん細胞自身が産生する因子や細胞表面抗原が特定できるため、これらを標的とした分子標的治療薬の開発にも貢献する。また、本発明の方法により、がん、特に乳がんのバイオマーカーとして有用な複数のバイオマーカーが見出され、それらを用いたがん、特に乳がんの新規な検出方法が提供された。
【図面の簡単な説明】
【0013】
【図1】本発明の方法において、固相基質の両面上で異なる種類の細胞を培養する方法の一例を模式的に示す図である。
【図2】本発明の方法において、複数枚の固相基質を積層して配置し、それらの各固相基質の両面上で互いに異なる種類の細胞を培養する方法の一例を模式的に示す図である。
【発明を実施するための形態】
【0014】
上記の通り、本発明の方法では、物質透過性を有し、細胞が透過しない固相基質を用いる。ここで、「物質透過性を有する」とは、細胞が分泌したり、細胞内に侵入したり、細胞表面上のレセプター等に結合したりする種々のペプチド(タンパク質や糖タンパク質を包含する)や生理活性物質を溶解している溶液が透過することを意味する。「細胞が透過しない」とは、固相基質の片面上で培養されている細胞が遊走して、固相基質を貫通して反対側の面に現れることがないことを意味する。これらの条件を満足する固相基質としては、後者の条件を満足するために孔径が5μm以下の多孔性の固相基質であればよい。前者の条件は、細胞の固相培養に用いられている多孔性の固相基質であれば、通常満足される。また、本発明の方法に用いられる固相基質は、自己支持性の膜状の固相基質であることが好ましい。ここで、「自己支持性」とは、周縁部のみを支持した状態で空中で膜状の形態を維持できる(すなわち、自重により膜が破壊されない)ことを意味する。自己支持性の膜状の固相基質を用いれば、後述のように固相基質の周縁部のみをスペーサー等で支持することにより、膜を空中に保持できるので、培養器内で膜の両面上に細胞を容易に培養することが可能になり、また、周縁部のスペーサーを積層することにより、単一の培養器内で複数枚の膜を互いに間隙をあけた状態で保持することが可能になる(後述)ので好ましい。物質透過性を有し、細胞が透過しない自己支持性の固相基質は公知であり、例えば、コラーゲン膜、スキャフォード線維、ポリカーボネート膜、ニトロセルロース膜、ポリフッ化ビニリデン膜などが挙げられる。これらのうち、特にコラーゲン膜を好ましく用いることができる。物質透過性を有し、細胞が透過しない自己支持性のコラーゲン膜であって、その周縁部がリング状のスペーサーで支持されているものが市販されており(例えば、AteloCell(商品名)コラーゲン膜、高研社製)、このような市販のコラーゲン膜を好適に用いることができる。
【0015】
本発明の方法では、上記した固相基質の両面上で、各面ごとに互いに異なる種類の細胞をそれぞれ接着培養する。「各面ごとに互いに異なる種類の細胞をそれぞれ接着培養する」とは、すなわち、固相基質の一方の面上で細胞A、他方の面上で細胞Aとは種類が異なる細胞Bを培養するという意味である。周縁部にスペーサーを設けた、自己支持性の膜状の固相基質の各面ごとに互いに異なる種類の細胞をそれぞれ接着培養する方法を図1に模式的に示す。
【0016】
図1に示す例では、自己支持性の膜状の固相基質10の周縁部に、所定の厚さを有するスペーサー12が設けられている。スペーサー12は、培養に影響を与えないプラスチックや金属等の任意の材料で形成することができ、その平面形状(膜面を水平に配置した状態で上から見た形状)も円形や多角形など任意である。培養容器の平面形状がマイクロプレートのウェルのように円形の場合が多いので、スペーサー12の平面形状も通常、円形であるが特に限定されるものではない。スペーサー12を周縁部に有する膜状固相基質を平面上、例えば、培養容器14の底面14’上に載置した際に該スペーサー12によって、該固相基質10の下面(固相基質の膜を水平に配置した際に下になる面)と該底面14’との間に空隙16が形成される。この空隙の高さ(底面14’と固相基質10の下面との距離)は、固相基質10の下面上で培養される細胞が底面14’に接触しない程度以上あればよく、通常、2mm〜20mm程度、好ましくは5mm〜10mm程度である。
【0017】
図1に示すように、固相基質10の上面上と下面上でそれぞれ異なる種類の細胞を接着培養する。図1に示す例では、上面上にA細胞株、下面上でB細胞を培養している。培養は、通常、両面上の細胞が培養液で被覆されるようにして行う。すなわち、図1に示す例では、培養容器14内に、A細胞株が被覆される量の培養液を入れた状態で培養を行う。従って、培養容器14の底面14’と固相基質10の下面との間の空隙16にも培養液が満たされ、これによって固相基質10の下面上で培養されるB細胞も培養液で被覆される。培養方法自体はその細胞に適した周知の方法により行うことができる。例えば、ヒト細胞の場合には、常法に従い、通常、37℃、5%CO2の条件下で行われるが必ずしもこれに限定されるものではない。培養時間は特に限定されないが、通常、24時間〜144時間程度、好ましくは、36時間〜96時間程度である。培養液も、培養される細胞の培養液として常用されているものを用いることができる。
【0018】
固相基質10の両面上で細胞を接着培養する方法は例えば次のようにして行うことができる。すなわち、まず十分に膜全面にコンフルエントになるだけの細胞数をフラスコ等で別途培養しておき、トリプシン処理で細胞を回収したあと、速やかに固相基質の片面上に細胞を播種し、37℃で1日間培養して片面に細胞が確実に接着した後、固相基質を裏返し、同様に別途フラスコ等で培養した別種の細胞を空いた片面に播種し、この状態で上記の通り共培養を続けることにより行うことができる。
【0019】
なお、本発明の方法では、後述する工程において、固相基質の両面上で異なる種類の細胞を培養した場合の遺伝子発現データを、両面上で同種の細胞を培養した場合の遺伝子発現データと比較するので、対照として、図1の下部に示すように、固相基質10の両面上で同種の細胞(すなわち、図示のように、両面上でA細胞株を培養する場合と両面上でB細胞を培養する場合)を上記と同様に培養することも行う。
【0020】
培養する細胞の種類は、特に限定されず、バイオマーカーを探索する目的に照らし、対象となる疾患に関与する細胞等から適宜選択することができ、例えば、固相基質の両面上で培養する細胞の組み合わせを、がん細胞、線維芽細胞、血管内皮細胞、上皮細胞、脂肪前駆細胞、筋細胞、骨芽細胞、グリア細胞、樹状細胞、マクロファージ、神経細胞、筋肉細胞、心筋細胞、ES細胞、iPS細胞から選ぶことができる。例えば、バイオマーカーとしてがんマーカーを探索したい場合には、対象となるがん細胞と、生体内において、該がん細胞と接触する可能性がある細胞との組合せを採用することができる。すなわち、例えば、がんの微小環境を想定して培養系を構築する場合には、上皮系がん細胞−線維芽細胞、上皮系がん細胞−血管内皮細胞、上皮系がん細胞−脂肪前駆細胞、上皮系がん細胞−筋線維細胞、上皮系がん細胞−骨芽細胞、上皮系がん細胞−グリア細胞、上皮系がん細胞−マクロファージ等の組み合わせが挙げられる。
【0021】
上記した共培養を行うことにより、各細胞から分泌された物質は、図1に矢印で示すように物質透過性の固相基質10を透過して反対側の面上で培養されている細胞に到達し、互いに影響し合う(クロストーク)。さらに、スペーサー12は、単に培養容器14の底面14’上に載置しているだけであり、水密な構造にはなっていないので、スペーサー12の外側を介してもクロストークが行われる。このようにして、同種細胞だけを培養する場合に比べ、生体内での微小環境がより的確に模倣される。
【0022】
なお、図1に示す例では、1枚の固相基質10を単一の培養容器14内で培養しているが、単一の培養容器内に複数枚の固相基質を入れてより多くの種類の細胞を同時培養することもできる。周縁部にスペーサー12を有する自己支持性膜の膜状の固相基質を、単一の培養容器内に積層して配置した例を図2に示す。この場合、各固相基質10同士の間には、各スペーサー12によって間隙が形成されるので、各面上の細胞同士が直接接触することはない。また、複数枚の固相基質を単一の培養容器内に平面的に並べて配置することもでき、さらに、積層と平面的な配置を組み合わせることもできる。このようにして単一の培養容器内で培養する細胞の種類を増やすことにより、人工的ながん微小環境をより的確に構築することが可能になる。例えば、乳がんの微小環境を模して培養する場合、乳がん細胞の片面にそれぞれ線維芽細胞、血管内皮細胞、乳腺上皮細胞、前脂肪細胞を培養した4枚の両面共培養膜を1つの培養容器に入れて培養することにより、各細胞は、培養基材を通過する物質を通して高密度な細胞間クロストークが、同時に各細胞が培地中に分泌する液性因子による低密度な細胞間クロストークが行われ、各細胞を個別に反応する条件を設定できる。
【0023】
本発明の方法において、片面上で培養した細胞ごとにあらかじめ薬剤処理を行い、そのうえで細胞間クロトークを行わせることができる。たとえば、片面に抗がん剤で事前処理したがん細胞、その裏面は非処理のがん細胞という組み合わせで両面共培養すると、抗がん剤が投与された生体中で血流に接するがん細胞と血流に接しないがん細胞が共存する環境を模することができる。がん組織中では、体外から投与された薬剤が必ずしも均一に到達せず、かつ細胞間クロストークによってがん細胞のアポトーシスやサバイバルが影響を受けるため、こうした評価系が価値がある。さらにがん病巣に存在するがん細胞が、悪性度や分化度、薬剤感受性などが不均一のヘテロな集団であることから、こうした各種条件の細胞を任意の組み合わせで培養でき、その後の細胞層ごとの分析ができることは非常に有用性が高い。
【0024】
次に、培養後の細胞を回収してその遺伝子発現データを得る。遺伝子発現データは、その遺伝子のmRNA又は遺伝子産物等を指標として得ることができる。この工程は、それ自体周知の方法により行うことができる。例えば、両面共培養によって培養された細胞は、細胞表面を洗浄して培地成分を除去した後、片面ごとに膜の表面に細胞溶解液(マイクロアレイ解析用)または蒸留水(タンパク質分析用)を添加し、セルスクレーパーで細胞溶解液を回収する。細胞溶解液は、目的に応じて、タンパク質、ペプチド、糖、脂質、核酸、代謝物等の分析に供する。マイクロアレイを用いた解析であれば、mRNAやマイクロRNA、ペプチド、糖タンパク質糖鎖などを直接解析することができる。また、タンパク質分析には、質量分析装置や電気泳動装置にそのまま供することができる。ヒト由来の多数のDNA断片を固定化したマイクロアレイが市販されているので、このような市販のマイクロアレイを用いてmRNAを測定することが簡便に網羅的な解析を行うことができるので好ましい。
【0025】
次の工程では、得られた遺伝子発現データから同種細胞を培養した場合に比べて発現が変化した遺伝子を特定する。すなわち、得られた解析データの処理では、同種間あるいは同条件下で共培養した細胞を対照として、それぞれ異種間あるいは異条件下で培養した細胞のデータを、細胞間クロストークの反映結果として判定することができる。こうしたデータ解析は、遺伝子あるいはペプチドのデータリストを、汎用バイオインフォマティクス解析ソフトやウェッブツール(たとえば、米国NCBI製PubMed、米国NIH/NIAID提供の“DAVID”、米国南カリフォルニア大学製”Panther”、Ingenuity System社製“IPA”、ThomsonReuter社製”MetaCore”、医薬分子設計研究所製の“KeyMolnet”等)で行うことができる。たとえば、がん細胞と両面共培養した線維芽細胞の発現遺伝子群をオントロジー解析でアポトーシス関連の遺伝子発現が多かった場合、線維芽細胞はがん細胞からの細胞死シグナルの細胞間クロストークを得ていることがわかる。
【0026】
上記方法により特定された、発現が変化した遺伝子のmRNA又は該遺伝子の直接的若しくは間接的産物(すなわち、該産物に起因して増大若しくは減少する物質(例えば、遺伝子産物が酵素の場合、その酵素反応により生成する生成物や、酵素反応により消費される基質等))をバイオマーカーであると判定する。がん細胞の場合、しばしば、発現が増大される遺伝子が存在することがあるので、がんマーカーの探索の場合、発現が増大した遺伝子を特定してもよい。
【0027】
実際の検査において、見出されたバイオマーカーを定量する方法自体は周知であり、例えば、DNAアレイを用いてバイオマーカーのmRNAを測定したり、リアルタイム検出RT-PCR等の定量的PCRによりmRNAを測定したり、免疫測定によりバイオマーカーのタンパク質やペプチド等を定量することができる。
【0028】
下記実施例においては、上記方法により乳がん細胞株と線維芽細胞を共培養して解析した結果、複数のバイオマーカーが見出された。これらのうちのいくつかは乳がんのバイオマーカーとして既に公知のものであったが、これまでに乳がんのバイオマーカーとしては知られていないものも見出された。すなわち、下記実施例において、乳がんにおいて、FGFBP1、MAL、ALPP、KLK10、SERPINB5、LTB、ARHGDIB、SNX10、KLK5、ESRP1、PLS1及びNEURLの各遺伝子の発現が増大した。従って、生体から分離された試料中の、これらの遺伝子から選ばれる少なくとも1つ以上の遺伝子の発現を指標とし、該遺伝子の発現増大ががんの存在を示す、がんの検出方法も本発明により初めて提供された。上記各遺伝子自体は、いずれも公知であり、その塩基配列及びそれがコードするポリペプチドのアミノ酸配列も公知である。各遺伝子のcDNAの塩基配列及びそれがコードするアミノ酸配列を配列表に示す。なお、周知の通り、遺伝子にはSNP等の天然の変異が存在する場合があるので、それらの天然の変異を有するものも上記各遺伝子に包含される。なお、生体から分離された試料としては、がんの疑いがある部分からの生検細胞や、血液等の体液を挙げることができる。
【0029】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【実施例】
【0030】
実施例1 乳がん細胞と線維芽細胞の両面共培養による発現遺伝子検出
公知の継代用培地(10%胎児血清を含むDMEM培地)で培養したTN型HCC1937株化乳がん細胞を、PBS(-)で洗浄後、トリプシン溶液で培養フラスコから剥離させ、継代用培地で1.5×105 cells/mLに調製した。培養ディッシュに継代用培地を6 mL/dish加え、自己支持性の膜状固相基質(AteloCell(商品名)コラーゲン膜)を膜下面に気泡が入らないように入れた。コラーゲン膜(表)に細胞液を1.5 mL播種し、炭酸ガスインキュベーター内(37℃、5%CO2)で1日培養した。同様に継代用培地で培養した及びNHDF(NB)正常ヒト線維芽細胞を、PBS(-)で洗浄後、トリプシン溶液で培養フラスコから剥離させ、継代用培地で2×105 cells/mLに調製した。
【0031】
HCC1937細胞が接着培養されたコラーゲン膜を取り出し表面をPBS(-)で2回洗浄し、新しい培養ディッシュに継代用培地を6 mL/dish加え、コラーゲン膜を裏返して入れた。コラーゲン膜(裏)に線維芽細胞液を1.5 mL播種し、炭酸ガスインキュベーター内(37℃、5%CO2)で72 ±2時間培養した。
【0032】
コラーゲン膜を培養ディッシュから取り出し、膜の両面をPBS(-)で2回洗浄した。膜の表面に細胞溶解液(マイクロアレイ解析用)または蒸留水(タンパク質分析用)を350μL添加し、セルスクレーパーで細胞溶解液を回収した(膜2〜3枚分をプールしn=1とする)。次に、膜の裏面も同様に処理し、細胞溶解液を回収した。ボルテックスミキサーで撹拌後、超低温フリーザーで凍結保存した。
【0033】
凍結融解した細胞溶解液からRNA抽出キット(インビトロジェン社TRIZOL(登録商標) Reagent)を用いてRNA画分を抽出し、精製RNA画分 をOD値で 260/280 比が 1.8-2.1となったことを確認後、アミノアリルaRNAをCy5にてラベル化、断片化した後(アンビオン株式会社のAmino Allyl MessageAmpTM II aRNA Amplification kitとGEヘルスケア バイオサイエンス株式会社のCy5 Mono-Reactive Dye PackによるaRNA間接標識法を使用)、mRNA解析用マイクロアレイ(東レ製3D-Geneチップ)上でハイブリダイゼーション後、3D-Gene プロトコールにしたがってチップを洗浄した後、3D-Geneスキャナー(東レ)にてスキャンした。得られた画像ファイル(tiffファイル)から、数値化解析ソフトウェア等により各スポットの蛍光強度を数値データに変換し、また数値データからバックグラウンドの減算処理、データの標準化(グローバルノーマライゼーション)を行い、各遺伝子の発現比を算出した。
【0034】
その結果、表1に示した因子の遺伝子群が、HCC1937乳がん細胞に特異的に強発現し、かつ線維芽細胞との共培養によってさらに増強されることがわかった。したがって、これらの因子は、乳がんの増殖・浸潤バイオマーカーとして利用できる。表1にまとめた因子群のうち、EPCAM、KRT18、SAA1の3種はすでにがん関連バイオマーカーとして報告例があり、公知であるので、これら3種を除いた因子が、本発明によって新たに見出されたバイオマーカーである。
【0035】
【表1】

【0036】
参考例1: 生体内バイオマーカーの産生細胞の推定と診断用途の妥当性の評価
本発明は、生体内におけるバイオマーカーの産生系をシミレーションしたものであるが、本発明を利用すると生体内バイオマーカーを診断用途に用いる妥当性を検討することができるので、その事例を示す。
【0037】
Diamandisらは、肺がん患者203名とヘビースモーカー180名の血清を調べ、Pentraxin-3 (PTX3) が肺がんの血清中バイオマーカーとなる可能性を報告している(Clin Cancer Res. 2011 ; 17(8): 2395-9)。実施例1の分析結果をPTX3に注目して解析してみると、共培養後はPTX3の発現は線維芽細胞は1.2倍(シグナル値:4,216)に増加し、HCC1937乳がん細胞も1.4倍(同:193)に増加したが、シグナル強度を細胞間で比べると、線維芽細胞はHCC1937細胞の約20倍に達していた。すなわち、PTX3は線維芽細胞の産生能が非常に高いので、同様の現象が肺がん組織中でも起きている可能性があり、血中PTX3のほとんどあるいは一部は線維芽細胞から由来している可能性がある。この線維芽細胞の共培養時の相対的なPTX3高産生は本発明技術によって初めて明らかにされた。線維芽細胞は、炎症にも鋭敏に反応して各種因子を産生するので、がん細胞との共存に限らずにPTX3を産生することも想定される。
【0038】
したがって、上記論文のとおり、PTX3を肺がんのバイオマーカーとして開発する場合、がん細胞だけに由来する因子ではなく、線維芽細胞が高濃度に産生し得る因子であるために、結果としてフォールスポジティブ生じやすく、がん診断のための血清バイオマーカーには適さない可能性もあることから、十分な検討が必要となる。PTX3に限らず、がん診断のための血清バイオマーカーは、がん細胞特異的に産生される因子が最も望ましい。
【0039】
参考例2: 生体内バイオマーカーの産生細胞の推定と診断用妥当性の評価
本発明は、生体内におけるバイオマーカーの産生系をシミュレーションしたものであるが、本発明を利用すると生体内バイオマーカーの診断用途に用いることを検討することができるので、その事例を示す。
【0040】
Morrisseyらは、腎がん患者42名で、病巣切除前後の尿中バイオマーカーを調べたところ、健常人より高値で、しかも切除後に有意に減少するマーカーとしてadipophilin (ADFP)とaquaporin-1 (AQP1)を見出し、これらは初期の腎がんのマーカーなる可能性を報告している(Mayo Clin Proc. 2010;85(5):413-21)。
【0041】
実施例1の分析結果をADFPに注目して解析してみると、共培養後はADFPの発現は線維芽細胞は2.5倍(シグナル値:5,281)に増加し、HCC1937乳がん細胞も1.4倍(同:2,488)に増加した。シグナル強度を細胞間で比べると、線維芽細胞はADFPの産生量はHCC1937細胞の約2倍であり、尿中に移行したADFPの多くあるいは一部は腎がん組織中の線維芽細胞から産生されたものである可能性がある。すなわち、線維芽細胞のADFPの産生能が高いので、同様の現象が腎がん組織中でも起きている可能性があり、尿中ADFPの多くあるいは一部は線維芽細胞由来の可能性がある。この線維芽細胞の相対的なADFP高産生は本発明技術によって初めて明らかにされた。線維芽細胞は、炎症にも鋭敏に反応して各種因子を産生するので、がん細胞との共存に限らずにADFPを産生することが想定される。したがって、上記論文のとおり、ADFPを腎がんのバイオマーカーとして開発する場合、がん細胞だけが由来する因子ではないためにフォールスポジティブを生じやすく、がん診断のための尿中バイオマーカーにはADFPは適さない可能性もあることから、十分な検討が必要となる。PTX3に限らず、がん診断のための尿中バイオマーカーは、がん細胞特異的に産生される因子が最も望ましい。
【産業上の利用可能性】
【0042】
上記の通り、本発明の方法は、がん等の検出に有用な、的確なバイオマーカーの探索に有用であり、ひいてはがん等の検出に有用である。
【符号の説明】
【0043】
10 自己支持性の膜状の固相基質
12 スペーサー
14 培養容器
16 間隙
【特許請求の範囲】
【請求項1】
物質透過性を有し、細胞が透過しない固相基質の両面上で、各面ごとに互いに異なる種類の細胞をそれぞれ接着培養する工程と、
培養後の細胞を回収してその遺伝子発現データを得る工程と、
得られた遺伝子発現データから同種細胞を培養した場合に比べて発現が変化した遺伝子を特定する工程とを含み、
発現が変化した遺伝子のmRNA又は該遺伝子の直接的若しくは間接的産物若しくは該産物に起因して増大若しくは減少する物質をバイオマーカーであると判定する、バイオマーカーの探索方法。
【請求項2】
前記異なる種類の細胞が、がん細胞、線維芽細胞、血管内皮細胞、上皮細胞、脂肪前駆細胞、筋細胞、骨芽細胞、グリア細胞、樹状細胞、マクロファージ、神経細胞、筋肉細胞、心筋細胞、ES細胞、iPS細胞から選ばれる請求項1記載の方法。
【請求項3】
前記異なる種類の細胞の組合せが、がん細胞と、生体内において、該がん細胞と接触する可能性がある細胞との組合せである請求項2記載の方法。
【請求項4】
発現が変化した遺伝子として、発現が増大した遺伝子を特定する請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記固相基質が自己支持性の膜状の基質である請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記自己支持性の膜状の基質が、コラーゲン膜から成る請求項5記載の方法。
【請求項7】
前記自己支持性の膜状の基質の周縁部にスペーサーが設けられ、該培地を平面上に載置した際に該スペーサーによって、該培地の下面と該平面との間に空隙が形成される請求項5又は6記載の方法。
【請求項8】
単一の培養容器内に複数枚の基質を入れて培養を行う請求項1〜7のいずれか1項に記載の方法。
【請求項9】
生体から分離された試料中の、FGFBP1、MAL、ALPP、KLK10、SERPINB5、LTB、ARHGDIB、SNX10、KLK5、ESRP1、PLS1及びNEURLから選ばれる少なくとも1つ以上の遺伝子の発現を指標とし、該遺伝子の発現増大ががんの存在を示す、がんの検出方法。
【請求項10】
前記がんが乳癌である請求項9記載の方法。
【請求項1】
物質透過性を有し、細胞が透過しない固相基質の両面上で、各面ごとに互いに異なる種類の細胞をそれぞれ接着培養する工程と、
培養後の細胞を回収してその遺伝子発現データを得る工程と、
得られた遺伝子発現データから同種細胞を培養した場合に比べて発現が変化した遺伝子を特定する工程とを含み、
発現が変化した遺伝子のmRNA又は該遺伝子の直接的若しくは間接的産物若しくは該産物に起因して増大若しくは減少する物質をバイオマーカーであると判定する、バイオマーカーの探索方法。
【請求項2】
前記異なる種類の細胞が、がん細胞、線維芽細胞、血管内皮細胞、上皮細胞、脂肪前駆細胞、筋細胞、骨芽細胞、グリア細胞、樹状細胞、マクロファージ、神経細胞、筋肉細胞、心筋細胞、ES細胞、iPS細胞から選ばれる請求項1記載の方法。
【請求項3】
前記異なる種類の細胞の組合せが、がん細胞と、生体内において、該がん細胞と接触する可能性がある細胞との組合せである請求項2記載の方法。
【請求項4】
発現が変化した遺伝子として、発現が増大した遺伝子を特定する請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記固相基質が自己支持性の膜状の基質である請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記自己支持性の膜状の基質が、コラーゲン膜から成る請求項5記載の方法。
【請求項7】
前記自己支持性の膜状の基質の周縁部にスペーサーが設けられ、該培地を平面上に載置した際に該スペーサーによって、該培地の下面と該平面との間に空隙が形成される請求項5又は6記載の方法。
【請求項8】
単一の培養容器内に複数枚の基質を入れて培養を行う請求項1〜7のいずれか1項に記載の方法。
【請求項9】
生体から分離された試料中の、FGFBP1、MAL、ALPP、KLK10、SERPINB5、LTB、ARHGDIB、SNX10、KLK5、ESRP1、PLS1及びNEURLから選ばれる少なくとも1つ以上の遺伝子の発現を指標とし、該遺伝子の発現増大ががんの存在を示す、がんの検出方法。
【請求項10】
前記がんが乳癌である請求項9記載の方法。
【図1】


【図2】




【図2】


【公開番号】特開2013−111053(P2013−111053A)
【公開日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願番号】特願2011−262353(P2011−262353)
【出願日】平成23年11月30日(2011.11.30)
【出願人】(504132272)国立大学法人京都大学 (1,269)
【Fターム(参考)】
【公開日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願日】平成23年11月30日(2011.11.30)
【出願人】(504132272)国立大学法人京都大学 (1,269)
【Fターム(参考)】
[ Back to top ]

