バチルスバリスモルティスBS07M菌株、微生物製剤、及び作物育成方法
【課題】作物の生育促進及び耐寒性増強効果を有する新規な微生物及び微生物製剤を提供すること。
【解決手段】配列番号1に示し、作物の生育促進、植物病原性菌への抗菌活性能、植物病に対する作物の免疫機能活性能、及び作物の耐寒性増強効果を有する新規微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【解決手段】配列番号1に示し、作物の生育促進、植物病原性菌への抗菌活性能、植物病に対する作物の免疫機能活性能、及び作物の耐寒性増強効果を有する新規微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、バチルスバリスモルティスBS07M菌株、微生物製剤、及び作物育成方法に関する。
【背景技術】
【0002】
最近、化学農薬の濫用による農業生態系の汚染と安全農産物に対する社会的関心が高まるにつれて、化学農薬で防除し難い各種病害を対象に、微生物を用い環境に調和した生物防除方法が試みられている。
【0003】
従来では、主に病原菌に対する抗菌作用を有する微生物を生物防除に利用してきた。さらに、最近では病害に対する抵抗性を作物に誘導するために、微生物を予め作物に接種し作物体内で誘導される抵抗性反応(Induced Systemic Resistance、ISR)を利用する生物防除方法が試みられている。
【0004】
このような植物病に対する抵抗性を誘導する微生物は、細菌に属した様々な種類の微生物が知られており、それらの中でもバチルス(Bacillus)属などが特に抵抗性を誘導する微生物として知られている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】大韓民國特許第10−0578743号公報
【特許文献2】大韓民國特許第10−0868385号公報
【特許文献3】大韓民國特許第10−0834252号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかし、このような植物病に対する抵抗性を誘導する微生物において、実用化される菌株は少数に過ぎず、同一の属名に属する菌株でも種によって作物に対する抵抗性の誘導機能の活性は大きく異なるという問題があった。
【0007】
このために、植物病に対する抵抗性の誘導機能を安定的に示し、作物の育苗期に効率よく処理することにより作物の生育後期まで作物が免疫機能を示すような優れた抵抗性誘導機能を有する菌株の選抜が求められている。
【0008】
そこで、本発明は、上記問題に鑑みてなされたものであり、本発明の目的とするところは、作物の生育を促進することが可能な新規な微生物バチルスバリスモルティスBS07M菌株、及び微生物製剤、及び作物育成方法を提供することにある。
【0009】
本発明が解決しようとする技術的課題は上述した技術的課題に制限されず、上述していない他の技術的課題は以下の記載から本発明の属する技術分野における通常の知識を有する者に明確に理解できるであろう。
【課題を解決するための手段】
【0010】
上記課題を解決するために、本発明のある観点によれば、配列番号1に示し、作物の生育を促進する、微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BPが提供される。
【0011】
前記作物は、トウガラシ、キュウリ、及びタバコの中から選ばれたいずれか一つであってもよい。
【0012】
また、上記課題を解決するために、本発明の別の観点によれば、配列番号1に示し、植物病原性菌への抗菌活性能を有する、微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BPが提供される。
【0013】
前記植物病原性菌は、コレトリクム・アクタツム(Colletorichum acutatum)、アルテルナリア・アルテルネート(Alternaria alternate)、ボトリティス・シネレア(Botrytis Cinerea)、ペニシリウム・イタリクム(Penicillium italicum)、ペニシリウム・エクスパンスム(Penicillium expansum)、フザリウム・オキシスポルム(Fusarium oxysporum)、リゾクトニア・ソラニー(Rhizoctonia solani)、及びスクレロティニア・スクレロチオラム(Sclerotinia sclerotiorum)の中から選ばれたいずれか一つであってもよい。
【0014】
また、上記課題を解決するために、本発明のさらに別の観点によれば、配列番号1に示し、植物病に対する作物の免疫機能活性能を有する、微生物バチルスバリスモルティスBS07M菌株KCTC11991BPが提供される。
【0015】
前記植物病は、トウガラシ疫病(Phytophthora capsici)、トウガラシ軟化病(Pectobacterium carotovora)、トウガラシ炭疽病(Colletotrichum acutatum)、及びキュウリモザイクウイルス(cucumber mosaic virus)の中から選ばれたいずれか一つであってもよい。
【0016】
また、上記課題を解決するために、本発明のさらに別の観点によれば、配列番号1に示し、作物の耐寒性増大能を有する微生物バチルスバリスモルティスBS07M菌株KCTC11991BPが提供される。
【0017】
前記バチルスバリスモルティスBS07M菌株KCTC11991BPは、微生物農薬、微生物肥料、種子コーティング剤、土壌改良剤、堆肥腐熟剤、葉面撒布剤、及び灌注撒布剤のいずれか一つの有効成分として用いられてもよい。
【0018】
また、上記課題を解決するために、本発明のさらに別の観点によれば、配列番号1に示し、作物の生育を促進能、植物病原性菌への抗菌活性能、植物病に対する作物の免疫機能活性能、及び作物の耐寒性増大能の少なくともいずれか一つを有する微生物バチルスバリスモルティスBS07M菌株KCTC11991BPが提供される。
【0019】
また、上記課題を解決するために、本発明のさらに別の観点によれば、配列番号1に示す微生物バチルスバリスモルティスBS07M菌株KCTC11991BPの菌体、またはその培養液を含む微生物製剤が提供される。
【0020】
また、上記課題を解決するために、本発明のさらに別の観点によれば、配列番号1に示す微生物バチルスバリスモルティスBS07M菌株の菌体、またはその培養液から生産されるイツリン(Iturin)系化合物を含む、微生物製剤が提供される。
【0021】
前記微生物製剤を作物に撒布または土壌灌注し、作物の生育を促進する作物育成方法を用いてもよい。
【0022】
前記微生物製剤を作物に撒布または土壌灌注し、植物病原性菌を防除する作物育成方法を用いてもよい。
【0023】
前記微生物製剤を作物に撒布または土壌灌注し、作物の耐寒性を増強させる作物育成方法を用いてもよい。
【発明の効果】
【0024】
以上説明したように本発明によれば、作物の生育を促進することができる。
【図面の簡単な説明】
【0025】
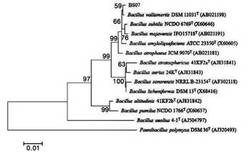
【図1】本発明に係るバチルスバリスモルティスBS07M菌株の16S rRNA遺伝子配列(gene sequence)を用いた系統分類学的分析を示す図である。
【図2】本発明に係るバチルスバリスモルティスBS07M菌株の土壌灌注処理によるトウガラシ育苗の生育増進効果を示す図である。
【図3】本発明に係るバチルスバリスモルティスBS07M菌株処理によるトウガラシ果実の生育増進効果を示す図である。
【図4】本発明に係るバチルスバリスモルティスBS07M菌株の植物病原性菌に対する抗菌活性を示す図である。
【図5】BS07部分(YC329B8k)の精製HPLCデータを示すグラフ図である。
【図6】BS07部分のHPLCスペクトル結果を示すグラフ図である。
【図7】イツリンA2のプロトンNMRスペクトル結果を示すグラフ図である。
【図8】イツリンA3のプロトンNMRスペクトル結果を示すグラフ図である。
【図9】イツリンA4のプロトンNMRスペクトル結果を示すグラフ図である。
【図10】イツリンA2、A3、A4の化学構造を示す説明図である。
【図11】本発明に係るバチルスバリスモルティスBS07M菌株の処理による病抵抗性遺伝子の発現を示す図である。
【図12】本発明に係るバチルスバリスモルティスBS07M菌株の処理によるキュウリ幼苗の根のリグニン集積を示す図である。
【図13】本発明に係るバチルスバリスモルティスBS07M菌株処理時のトウガラシ幼苗のペクトバクテリウムカロトボーラ(Pectobacterium carotovora)SCC1に対する誘導抵抗性の発現を示す図である。
【図14】露地栽培条件でバチルスバリスモルティスBS07M菌株処理時のトウガラシ炭疽病抑制効果を示す図である。
【図15】本発明に係るバチルスバリスモルティスBS07M菌株処理時のキュウリモザイクウイルスの抑制効果を示す図である。
【図16】本発明に係るバチルスバリスモルティスBS07M菌株の処理によるキュウリの耐寒性増大効果を示す図である。
【図17】本発明に係るバチルスバリスモルティスBS07M菌株の処理によるタバコ幼苗の耐寒性増大効果を示す図である。
【発明を実施するための形態】
【0026】
以下に添付図面を参照しながら、本発明の好適な実施の形態について詳細に説明する。なお、本明細書及び図面において、実質的に同一の機能構成を有する構成要素については、同一の符号を付することにより重複説明を省略する。本明細書に記載された用語、技術などは、特別な限定がない限り、本発明の属する技術分野で一般に用いられる意味で使用される。
【0027】
本発明では、作物の生育促進、耐災害性増加、及び植物病防除効果に優れる、新規なバチルスバリスモルティスBSO7M(Bacillus vallismortis BS07M)菌株を選抜した。
【0028】
本発明に係るバチルスバリスモルティスBS07M菌株は、作物の生育促進、及び耐寒性増強効果を有する。具体的には、植物病原性菌に対し直接的な抑制能を有し、植物病原性菌の生育を抑制するだけでなく、誘導抵抗性による作物の免疫機能を活性化させ作物の生育を促進し、かつ作物の耐寒性も増強させることができる。
【0029】
選抜された菌株から収得した16S rRNAの相同性を比較分析したところ、本発明に係る新規微生物は、バチルスバリスモルティスの新規な菌株であることが明らかになった。これをバチルスバリスモルティスBS07M(Bacillus vallismortis BS07M)と命名し、この菌株を韓国生命工学研究院に寄託して、2011年7月29日に受託番号KCTC11991BPを付与された。
【0030】
本発明の新規微生物バチルスバリスモルティスBS07Mは、配列番号1に示す塩基配列全体またはその一部からなり、1478bp(base pair )のオープンリーディングフレーム(ORF)から構成される。
【0031】
上記新規菌株の菌体または該菌体の培養液を含む微生物製剤を用いて作物の生育促進及び免疫機能強化を確認したところ、作物の種類を問わず、その生育促進、免疫機能強化効果、及び耐寒性増強効果を得ることができることが分かった。特に、トウガラシ、キュウリ、タバコに対して最も優れた生育促進、免疫機能強化効果、及び耐寒性増強効果を示すことを確認した。すなわち、前述の新規菌株でトウガラシを処理した場合、トウガラシの収量が30%以上増加する。
【0032】
また、上記新規菌株は、炭疽病などの主要植物病原菌を抑制する強力な抗菌物質も生産し、供試病原菌であるトウガラシ疫病(Phytophthora capsici)、トウガラシ軟化病(Pectobacterium carotovora)、トウガラシ炭疽病(Colletotrichum acutatum)、キュウリモザイクウイルス(cucumber mosaic virus)などに対する複合的な病害抵抗性をも示すことがわかった。新規菌株が生産する抗菌物質を分析したところ、イツリン(Iturin)系A2、A3、A4の3種の誘導体が同定された。
【0033】
また、新規菌株を用いた作物は、植物病の抵抗遺伝子が発現してサリチル酸(salicylic acid:SA)回路による免疫機能が強化されていることが分かった。
【0034】
また、新規菌株で作物を処理すると、4℃以下の低温にて24時間以上曝露しても100%の生存率を示すため、作物の耐寒性をも増大させることが分かった。
【0035】
本発明によれば、作物の耐寒性が増して冷害に耐える特徴を有する新規微生物バチルスバリスモルティスBS07Mが提供される。また、新規微生物バチルスバリスモルティスBS07Mは、植物病害抑制及び植物生育促進効果が従来よりも顕著に優れる。このため、本発明の微生物及びこれを含む微生物製剤を用いることにより、植物病原菌を効果的に抑制し、植物免疫機能の活性増大により病害が顕著に減少し、その結果として優れた作物生育促進効果が得られる。よって、本発明の新規微生物及びこれを含む微生物製剤は環境調和型農業に有用に活用される。
【0036】
<実施例>
以下、本発明の内容を実施例、及び実験例によってさらに具体的に説明する。
【0037】
[実施例1]菌株の分離及び選抜
植物病に対する作物の免疫機能を活性化させる優れた菌を分離するために、全国各地の農耕地から植物の根圏土壌を採取した。
【0038】
採取した試料を滅菌水に入れて振盪した後、希釈平板法によって段階別に希釈液を製造して固体培地としてTSA(Tryptic Soy Agar)培地を用いて塗抹した。
【0039】
30℃で2日間培養した後、培地の表面に現れた細菌菌株を純粋分離した。
【0040】
純粋分離された菌株を対象に、キュウリ炭疽病(Colletotrichum orbiculare)に対する誘導抵抗性を検定した。
【0041】
キュウリ(品種:ウンソン白ダダキ)の種子を1%の塩化ナトリウムで表面殺菌した後、プラスチックポットに播種して2週後に純粋分離した菌株の懸濁液を灌注処理した。
【0042】
1週後、灌注処理された葉にキュウリ炭疽病菌の胞子懸濁液を撒布し形成された病斑を調査し、植物病に対する最も高い抵抗性誘導能を示す菌株である、バチルスバリスモルティスBS07Mを選抜した。
【0043】
[実施例2]新規菌株の同定
実施例1で選抜した菌株の同定は16S rRNA遺伝子塩基配列分析を用いた。
【0044】
(1)16S rRNA塩基配列分析
細菌の同定のためには16S rRNA遺伝子塩基配列分析を用いた。すなわち、DNA抽出キット(DNA extraction kit)で分離菌株のDNAを抽出した後、ユニバーサルプライマー(universal primer)としてfD1(5’−AGAGTTTGATCCTGGCTCAG−3’)とrP2(5’−ACGGCTACCTTGTTACGACTT−3’)を用いて16S rDNA遺伝子をPCRによって増幅した。
【0045】
こうして得られたPCR産物を、DNAシークエンシングキット(DNA sequencing kit)で反応させた後、遺伝子分析器(3100 Genetic Analyzer)を用いて塩基配列の分析を行った。塩基配列はNCBIサーバー(server)のBLASTプログラムによって属(genus)まで同定した。
【0046】
菌株間の類縁関係を分析するために、得られた16S rDNA塩基配列はCLUSTAL Wプログラムを用いて標準菌株の塩基配列と整列させた。データセットの進化系統数の作成はMEGA versionプログラムを用いた。branchの安定性(bootstrap value)は1000回の再標本化(resampling)として調査した。
【0047】
分子系統分類学的分析の結果、図1に示すように、バチルスバリスモルティスBS07M菌株は、バチルスサブティルス(Bacillus subtilis)、バチルスモジャベンシス(Bacillus mojavensis)、バチルスバリスモルティス(Bacillus vallismortis)との類縁関係が高かった。その中でも、バチルスバリスモルティス(Bacillus vallismortis)との類縁関係が最も高いため、バチルスバリスモルティス(Bacillus vallismortis)と同定した。これによって、2011年7月28日に韓国生命工学研究院に当該新規菌株を寄託した。受託番号はKCTC11991BPであり、この新規微生物はバチルスバリスモルティス(Bacillus vallismortis)BS07Mと命名された。
【0048】
[実施例3]バチルスバリスモルティスBS07M菌株の培養
超低温槽(−80℃)に保管しているバチルスバリスモルティスBS07Mを、滅菌したTSA培地に塗抹し、30℃で48時間培養して再活性化させた。この際に、滅菌したTSB(Tryptic Soy broth)液体培地にバチルスバリスモルティスBS07Mを接種した後、30℃で48時間培養して再活性化させてもよい。
【0049】
上述のように培養された菌体を収去して1Lの滅菌水または0.2M−リン酸緩衝液(phosphate buffer)に入れて109〜1010cfu/mL(Colony Forming Unit/mL)の菌体懸濁液を準備した。
【0050】
この菌体懸濁液を106〜107cfu/mLの濃度で希釈して下記土壌灌注及び植物処理実験に使用した。
【0051】
[実験例1]バチルスバリスモルティスBS07M菌株のトウガラシ生育促進能の確認
1)ビニールハウス条件
上述した実施例3にてバチルスバリスモルティスBS07M菌株の菌体懸濁液を準備した。
【0052】
ビニールハウス条件で育苗期に根圏土壌へ上記の菌体懸濁液を灌注処理した。
【0053】
具体的には、まず本葉2〜3葉期にバチルスバリスモルティスBS07M菌体(109cfu/mL)懸濁液を100倍希釈して灌注した。その後、10日間隔で2回根圏土壌に灌注した。
【0054】
その結果を図2及び下記表1、2に示す。
【0055】
すなわち、図2に示すように、バチルスバリスモルティスBS07M菌株処理区では、著しく良好な育苗期の生育促進効果を示すことを確認した。特に、生育量が増加することが分かる。
【0056】
【表1】

*LSD(least significant difference):最小有意差
【0057】
また、表1に示すように、草丈、茎直径の生育量は、対照区及び病抵抗性誘導剤であるBTHを0.1mM処理したBTH処理区に比べて、本発明のバチルスバリスモルティスBS07M菌株処理区の方が大きく、トウガラシの収量に影響する株当たりの果数も、本発明のバチルスバリスモルティスBS07M菌株処理区の方が顕著に多いことを確認した。
【0058】
【表2】

【0059】
また、表2に示すように、他のバチルス(Bacillus)の菌株に対しても本発明のバチルスバリスモルティスBS07M菌株は、有意な差を示すことを確認した。すなわち、トウガラシの総果重について、他のバチルス菌株に比べて本発明のバチルスバリスモルティスBS07M菌株処理区が最も高く、優れた収量の増加効果を示すことが分かった。
【0060】
2)路地条件
育苗期は、上記のビニールハウス条件と同様にして、ビニールハウス内の根圏土壌に本発明の菌体懸濁液を灌注処理した。その後、定植期に路地に定植して対照区と比較を行った。その結果を下記表3に示す。
【0061】
【表3】

*LSD(least significant difference):最小有意差
【0062】
表3に示すように、バチルスバリスモルティスBS07M菌株処理区では、トウガラシの草丈、果実の内径、果皮の厚さなどが慣行区(対照区)に比べて著しく優れ、さらに、果実の数と収量が増加することを確認した。
【0063】
また、図3に示すように、バチルスバリスモルティスBS07M菌株処理区は、トウガラシ果実の大きさが慣行区(対照区)に比べてさらに太くて長いため、その生育量が増加したことを確認した。
【0064】
[実験例2]バチルスバリスモルティスBS07M菌株の植物病原菌に対する抗菌活性効果の確認
バチルスバリスモルティスBS07M菌株の主要植物病原菌に対する抗菌活性効果は、図4に示すとおりである。すなわち、本発明のバチルスバリスモルティスBS07M菌株は、植物病原性真菌である、コレトリクム・アクタツム(Colletorichum acutatum)、アルテルナリア・アルテルネート(Alternaria alternate)、ボトリティス・シネレア(Botrytis Cinerea)、ペニシリウム・イタリクム(Penicillium italicum)、ペニシリウム・エクスパンスム(Penicillium expansum)、フザリウム・オキシスポルム(Fusarium oxysporum)、リゾクトニア・ソラニー(Rhizoctonia solani)、及びスクレロティニア・スクレロチオラム(Sclerotinia sclerotiorum)に対する抗菌活性を示すことを確認した。
【0065】
その中でも、特にコレトリクム・アクタツム(Colletorichum acutatum)、アルテルナリア・アルテルネート(Alternaria alternate)、ボトリティス・シネレア(Botrytis Cinerea)、及びスクレロティニア・スクレロチオラム(Sclerotinia sclerotiorum)を抑制し、上述した植物病原菌に対して高い抗菌活性を示すことが分かった。
【0066】
[実験例3]抗菌物質の分離及び同定と生物活性の確認
BS07M菌株から抗菌物質を分離するために、TSA培地10Lをペトリ皿(15.0×1.5cm)に分注した後、BS07M菌株を接種して7日間培養し、しかる後に、80%メタノールで2回浸漬抽出した後、セライトフィルターで濾過して菌体を除去した。その後、濃縮してC−18、シリカG60、及びLH20カラムクロマトグラフィーなどを用いて抗菌活性物質を分離した。この際、生物活性はリゾクトニア・ソラニー(Rhizoctonia solani)でモニタリングした。
【0067】
溶媒条件としてはメタノール勾配(MeOH/H2O)0〜100%とブタノール勾配(0〜100%)で分画し、リゾクトニア・ソラニー(Rhizoctonia solani)に対して活性を有する分画を分離した。分離された分画はHPLCによって精製した(図5、図6)
【0068】
また、これらの3種の分離分画の成分をNMR分析によって同定した。
【0069】
各分画のNMR分析の結果を図7〜図10に示す。図7〜図10に示すように、各分画成分として、イツリンA2、A3、A4の3種の誘導体が同定された。
【0070】
同定されたイツリンA2の植物病原菌に対する抑制効果を確認した。その結果を下記表4に示す。
【0071】
【表4】

【0072】
表4に示すように、同定されたイツリンA2は500ppmの濃度でR.ソラニー(R. solani)、C.アクタツム(C. acutatum)、B.シネレア(B. cinerea)、S.スクレロチオラム(S. sclerotiorum)などの植物病原菌に対して抑制効果を示した。同様にイツリンA3、A4も植物病原菌に対して抑制効果を示した(図示せず)。
【0073】
[実験例4]バチルスバリスモルティスBS07M菌株の処理による誘導抵抗性増進活性の確認
1)実験方法
(1)シロイヌナズナ植物体の栽培
バチルスバリスモルティスBS07M菌株が有する植物の誘導抵抗性増進効果による抗真菌性遺伝子の発現変化を確認した。確認には、シロイヌナズナ野生型(Col 0)、形質転換株(親シロイヌナズナ生態型に由来したPR遺伝子を発現することができないように形質転換されたシロイヌナズナ(nah G:SA分解能を有する)、及び遺伝子で形質転換されたシロイヌナズナ(etr3−5、npr1)を使用した。
【0074】
この時、シロイヌナズナ野生型(Col 0)はセンターから得た。nah G形質転換植物(シロイヌナズナ)は、サリチル酸デヒドロゲナーゼ(salicylate dehydrogenase)を遺伝子にコードされ、サリチル酸(SA)を分解するものと知られている。
【0075】
シロイヌナズナの種子を表面殺菌(70%エタノールに2分間浸漬し、1%次亜塩素酸ナトリウムに20分間日浸漬)し、滅菌された蒸留水で3回洗浄した。その後、0.8%寒天及び1.5%スクロースを含有し、pH5.2に調節された1/2濃度のMS(Murashige−Skoog)培地の入ったペトリ皿にのせた。しかる後に、光を遮断した4℃状態で2日間種子の発芽を促進させた後、12時間明期12時間暗期の光周期に設定された植物生長床に入れて40W蛍光灯の下で放置した。
【0076】
相対湿度50〜60%で22±1℃の温度に維持し、2週の後、苗を、24時間の間隔をおいて2回高圧蒸気滅菌した、鉢植え用栄養土(potting soil)混合物が含まれた60mLの植木鉢に植え替えた。
【0077】
苗を植木鉢に植え替える前に、鉢植え用栄養土は、バチルスバリスモルティスBS07M菌株の懸濁液または同一用量の殺菌蒸留水で処理した。育った植物体は70%の相対湿度の下で9時間昼(200μE/m2s、24℃)及び15時間夜(20℃)の周期にて植物生長床で栽培した。
【0078】
育った植物体は1日おきに潅水し、1週1回、1/2濃度に調整したホーグランド栄養分溶液(Hoagland nutrient solution)を加えた。2週後、シロイヌナズナ植物体に実施例3で得られたバチルスバリスモルティスBS07M菌株の菌体懸濁液を土壌灌注した。
【0079】
(2)バチルスバリスモルティスBS07M菌株の処理による防御遺伝子発現の確認
前述のように準備されたシロイヌナズナ植物体に実施例3で得られたバチルスバリスモルティスBS07M菌株の菌体懸濁液を108cfu/mLの濃度で土壌灌注した後、1週後、RNA分析のために植物体から葉の組織を収得した。
【0080】
シロイヌナズナの総RNAは、少なくとも2gの凍った組織を同一用量の抽出緩衝溶液(0.35Mグリシン、0.048M NaOH、0.34M NaCl、0.04M EDTA、4%(w/v)SDS)に均質化して抽出した。その後、均質懸濁液をフェノール及びクロロホルムを用いて抽出し、RNAはLiClで沈殿させた。
【0081】
RT−PCRはEx Taq(登録商標)ポリメラーゼを用いて行った。
【0082】
反応混合物は20μLの緩衝溶液にcDNA0.1μg、正方向及び逆方向プライマーそれぞれ10pMol、dNTP250nM、並びに0.5UのEx Taq(登録商標)ポリメラーゼを含むようにした。
【0083】
PCRは、94℃で5分間処理した後、94℃1分、57℃1分の処理を1サイクルとして25サイクル行い、最終的に72℃で10分間延長反応を行った。
【0084】
防御遺伝子に対するプライマーは、PDF1.2遺伝子に対するプライマーとして、正方向プライマー5’−TGCGGTAACACCGAACCATAC−3’(配列番号A)及び逆方向プライマー5’−CGACAGTTGCATTGGTCCTCT−3’(配列番号B)を使用し、PR−1遺伝子に対するプライマーとして、正方向プライマー5’−AACCGCCAAAAGCAAACGCA−3’(配列番号C)及び逆方向プライマー5’−TCACGGAGGCACAACCAAGTC−3’(配列番号D)を使用した。
【0085】
増幅されたPCR産物は、1.2%アガロースゲルを用いて分析し、分析後のゲルを記録した。
【0086】
微生物の感染または誘導抵抗性発現物質によって植物の誘導抵抗性が発現すると、過敏性反応が発生し、続いて誘導抵抗性メカニズムとしてグルカナーゼ(glucanase)、キチナーゼ(chitinase)などのPR(pathogenesis related protein)タンパクが増加し、植物細胞のリグニン化が誘導され、フィトアレキシン(Phytoalexin)及びフェノール化合物などの抵抗性物質が蓄積されて抵抗性反応が示される。
【0087】
これと同様に、非病原性であるバチルスバリスモルティスBS07M菌株の根圏処理によって植物の免疫機能が誘発される。
【0088】
2)実験結果
バチルスバリスモルティスBS07M菌株の処理による植物体の病抵抗性遺伝子の発現は、図11に示すように、前述にて処理された野性型シロイヌナズナからの病抵抗性遺伝子PR1の発現が確認されたが、NahG変異株では発現しないことからみて、SAによる病抵抗性経路によると判断され、当該病抵抗性経路により植物の免疫活性が増大するものと判断される。
【0089】
ここで、図11において、1.Col 0:シロイヌナズナ野生型、2.etr3−5:遺伝子で形質転換されたシロイヌナズナ、3.nah G:PR遺伝子を発現することができないように形質転換されたシロイヌナズナ、4.npr1:遺伝子で形質転換されたシロイヌナズナの結果である。
【0090】
また、前記実験を証明するために、バチルスバリスモルティスBS07M菌株を処理して根の反応を確認した結果、図12に示すように植物根組織におけるリグニン化の誘導が見られた。すなわち、赤色で表示されたリグニン形成は、病抵抗性反応の一つを示すものであって、植物細胞壁が厚くなることを意味する。よって、本発明のバチルスバリスモルティスBS07M菌株を処理することにより、キュウリの根の細胞壁が厚くなって植物病原菌が侵入できなくなることが分かった。
【0091】
[実験例5]バチルスバリスモルティスBS07M菌株の誘導抵抗性発現による植物病抑制効果
バチルスバリスモルティスBS07M菌株の誘導抵抗性発現による植物病抑制効果を調べるために、室内及び圃場試験条件で行った。
【0092】
バチルスバリスモルティスBS07M菌株の処理によるトウガラシの病抵抗性発現は、幼苗期及び圃場から採取したトウガラシの葉及び果実に病原菌を接種して試験した。
【0093】
軟化病の場合、室内試験では、バチルスバリスモルティスBS07M菌株の処理されたトウガラシ栽培区と、バチルスバリスモルティスBS07M菌株の処理されていない栽培区を区分し、幼苗期の葉と路地栽培状態のトウガラシの葉を採取して試験を行った。
【0094】
その後、ペクトバクテリウムカロトボーラSCC1(Pectobacterium carotovora SCC1)に対する誘導抵抗性発現を試験した。その結果、トウガラシ幼苗の葉は下記表5と図13のとおりであった。
【0095】
【表5】

*LSD(least significant difference):最小有意差
【0096】
表5と図13に示すように、対照区は42%の病斑面積率を示したが、これに対し、バチルスバリスモルティスBS07M菌株処理区は、病斑が発生せず、効果的に病斑を抑制することを確認した。
【0097】
また、路地状態の葉の場合は、下記表6のとおりであった。
【0098】
【表6】

*LSD(least significant difference):最小有意差
【0099】
表6に示すように、対照区は一次、二次においてそれぞれ71.7%、53.7%の軟化病感染率を示したが、処理区はそれぞれ20.0%、0.0%と顕著に抑制される結果を示した。
【0100】
トウガラシ炭疽病の場合、室内試験では、路地で栽培したトウガラシの果実を採取してトウガラシ炭疽病抑制効果を試験した。
【0101】
滅菌水に懸濁してトウガラシ炭疽病菌(Colletotrichum acutatum)胞子を105spore/mLの濃度に調整し、展着剤を添加して十分に撒布した。
【0102】
しかる後に、相対湿度100%で24時間置いた後、取り出して温室内に静置し、その後7日目に病の発生を調べた。バチルスバリスモルティスBS07M菌株の処理されたトウガラシ栽培区と、バチルスバリスモルティスBS07M菌株の処理されていない栽培区から採取したトウガラシ栽培区を区分して調査した。
【0103】
その結果、表6のように、慣行区は15%の感染率を示したが、バチルスバリスモルティスBS07M処理区は1%の最も低い感染率を示し、炭疽病抑制効果が最も大きかった。
【0104】
また、トウガラシ炭疽病の場合、圃場試験は露地栽培条件で行った。
【0105】
トウガラシ炭疽病菌胞子を滅菌水に懸濁して105spore/mLの濃度に調整し、展着剤を添加してトウガラシの葉及び果実に十分に撒布した。その後、約15日間隔で4回にわたって炭疽病の発生を調べた。
【0106】
その結果は、図14に示すように、圃場条件でもバチルスバリスモルティスBS07M菌株の処理によって大きな炭疽病抑制効果が得られた。
【0107】
また、キュウリモザイクウイルス(cucumber mosaic virus、CMV)に対する抑制効果も確認した。
【0108】
具体的には、バチルスバリスモルティスBS07M菌株の胞子懸濁液を灌注処理した播種2週後のキュウリ(品種:ウンソン白ダダキ)幼苗1本葉に、キュウリモザイクウイルス(CMV)に感染したキュウリの葉を摩砕してカーボランダム粉末と共に擦って接種した。その後、常温の温室に静置し、1週目に形成されたモザイクウイルス感染有無を調査した。無処理とは、殺菌蒸留水を灌注処理し、同一の方法でCMVウイルスを接種したものを指す。
【0109】
その結果、図15に示すように、バチルスバリスモルティスBS07Mにて処理されたキュウリ幼苗は、CMVウイルスによる感染症状が全くないことが分かった。よって、バチルスバリスモルティスBS07Mは、ウイルス防除効果に優れることが分かった。
【0110】
[実験例6]バチルスバリスモルティスBS07M菌株の植物処理による植物の耐寒性増大効果
バチルスバリスモルティスBS07Mの植物根圏処理の後、キュウリ幼苗及びタバコ幼苗の耐寒性を調べた。
【0111】
4℃で24時間処理した後、温室に6時間放置し、冷害被害による葉の変色度合いを肉眼で観察して調べた。
【0112】
図16及び図17に示すように、対照区は、低温処理によって冷害を受け、葉緑体が破壊されて葉の表面が縮まり、灰白色に変色したが、これに対し、バチルスバリスモルティスBS07M菌株を処理した場合は、低温に耐性が強くなり冷害を受けず耐寒性が増大することが分かった。
【0113】
よって、本発明の新規微生物は、作物処理によって耐寒性を増大させ4℃の低温条件でも冷害に耐える優れた特徴を作物に与える。本発明は、植物病害抑制、及び植物生育促進効果が従来技術よりも顕著に優れるため、有用であることが分かる。
【0114】
さらに、本発明の新規微生物は、植物病原菌を効果的に抑制し植物免疫機能の活性増大をもたらすため、病害を顕著に減少させることができる。また、本発明の新規微生物は、作物生育促進効果にも優れるため、環境調和型農業に有用であることがわかる。
【0115】
以上、添付図面を参照しながら本発明の好適な実施形態について詳細に説明したが、本発明はかかる例に限定されない。本発明の属する技術の分野における通常の知識を有する者であれば、特許請求の範囲に記載された技術的思想の範疇内において、各種の変更例または修正例に想到し得ることは明らかであり、これらについても、当然に本発明の技術的範囲に属するものと了解される。
【受託番号】
【0116】
寄託機関名:韓国生命工学研究院
受託番号:KCTC11991BP
受託日付:2011年7月28日
【技術分野】
【0001】
本発明は、バチルスバリスモルティスBS07M菌株、微生物製剤、及び作物育成方法に関する。
【背景技術】
【0002】
最近、化学農薬の濫用による農業生態系の汚染と安全農産物に対する社会的関心が高まるにつれて、化学農薬で防除し難い各種病害を対象に、微生物を用い環境に調和した生物防除方法が試みられている。
【0003】
従来では、主に病原菌に対する抗菌作用を有する微生物を生物防除に利用してきた。さらに、最近では病害に対する抵抗性を作物に誘導するために、微生物を予め作物に接種し作物体内で誘導される抵抗性反応(Induced Systemic Resistance、ISR)を利用する生物防除方法が試みられている。
【0004】
このような植物病に対する抵抗性を誘導する微生物は、細菌に属した様々な種類の微生物が知られており、それらの中でもバチルス(Bacillus)属などが特に抵抗性を誘導する微生物として知られている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】大韓民國特許第10−0578743号公報
【特許文献2】大韓民國特許第10−0868385号公報
【特許文献3】大韓民國特許第10−0834252号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかし、このような植物病に対する抵抗性を誘導する微生物において、実用化される菌株は少数に過ぎず、同一の属名に属する菌株でも種によって作物に対する抵抗性の誘導機能の活性は大きく異なるという問題があった。
【0007】
このために、植物病に対する抵抗性の誘導機能を安定的に示し、作物の育苗期に効率よく処理することにより作物の生育後期まで作物が免疫機能を示すような優れた抵抗性誘導機能を有する菌株の選抜が求められている。
【0008】
そこで、本発明は、上記問題に鑑みてなされたものであり、本発明の目的とするところは、作物の生育を促進することが可能な新規な微生物バチルスバリスモルティスBS07M菌株、及び微生物製剤、及び作物育成方法を提供することにある。
【0009】
本発明が解決しようとする技術的課題は上述した技術的課題に制限されず、上述していない他の技術的課題は以下の記載から本発明の属する技術分野における通常の知識を有する者に明確に理解できるであろう。
【課題を解決するための手段】
【0010】
上記課題を解決するために、本発明のある観点によれば、配列番号1に示し、作物の生育を促進する、微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BPが提供される。
【0011】
前記作物は、トウガラシ、キュウリ、及びタバコの中から選ばれたいずれか一つであってもよい。
【0012】
また、上記課題を解決するために、本発明の別の観点によれば、配列番号1に示し、植物病原性菌への抗菌活性能を有する、微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BPが提供される。
【0013】
前記植物病原性菌は、コレトリクム・アクタツム(Colletorichum acutatum)、アルテルナリア・アルテルネート(Alternaria alternate)、ボトリティス・シネレア(Botrytis Cinerea)、ペニシリウム・イタリクム(Penicillium italicum)、ペニシリウム・エクスパンスム(Penicillium expansum)、フザリウム・オキシスポルム(Fusarium oxysporum)、リゾクトニア・ソラニー(Rhizoctonia solani)、及びスクレロティニア・スクレロチオラム(Sclerotinia sclerotiorum)の中から選ばれたいずれか一つであってもよい。
【0014】
また、上記課題を解決するために、本発明のさらに別の観点によれば、配列番号1に示し、植物病に対する作物の免疫機能活性能を有する、微生物バチルスバリスモルティスBS07M菌株KCTC11991BPが提供される。
【0015】
前記植物病は、トウガラシ疫病(Phytophthora capsici)、トウガラシ軟化病(Pectobacterium carotovora)、トウガラシ炭疽病(Colletotrichum acutatum)、及びキュウリモザイクウイルス(cucumber mosaic virus)の中から選ばれたいずれか一つであってもよい。
【0016】
また、上記課題を解決するために、本発明のさらに別の観点によれば、配列番号1に示し、作物の耐寒性増大能を有する微生物バチルスバリスモルティスBS07M菌株KCTC11991BPが提供される。
【0017】
前記バチルスバリスモルティスBS07M菌株KCTC11991BPは、微生物農薬、微生物肥料、種子コーティング剤、土壌改良剤、堆肥腐熟剤、葉面撒布剤、及び灌注撒布剤のいずれか一つの有効成分として用いられてもよい。
【0018】
また、上記課題を解決するために、本発明のさらに別の観点によれば、配列番号1に示し、作物の生育を促進能、植物病原性菌への抗菌活性能、植物病に対する作物の免疫機能活性能、及び作物の耐寒性増大能の少なくともいずれか一つを有する微生物バチルスバリスモルティスBS07M菌株KCTC11991BPが提供される。
【0019】
また、上記課題を解決するために、本発明のさらに別の観点によれば、配列番号1に示す微生物バチルスバリスモルティスBS07M菌株KCTC11991BPの菌体、またはその培養液を含む微生物製剤が提供される。
【0020】
また、上記課題を解決するために、本発明のさらに別の観点によれば、配列番号1に示す微生物バチルスバリスモルティスBS07M菌株の菌体、またはその培養液から生産されるイツリン(Iturin)系化合物を含む、微生物製剤が提供される。
【0021】
前記微生物製剤を作物に撒布または土壌灌注し、作物の生育を促進する作物育成方法を用いてもよい。
【0022】
前記微生物製剤を作物に撒布または土壌灌注し、植物病原性菌を防除する作物育成方法を用いてもよい。
【0023】
前記微生物製剤を作物に撒布または土壌灌注し、作物の耐寒性を増強させる作物育成方法を用いてもよい。
【発明の効果】
【0024】
以上説明したように本発明によれば、作物の生育を促進することができる。
【図面の簡単な説明】
【0025】
【図1】本発明に係るバチルスバリスモルティスBS07M菌株の16S rRNA遺伝子配列(gene sequence)を用いた系統分類学的分析を示す図である。
【図2】本発明に係るバチルスバリスモルティスBS07M菌株の土壌灌注処理によるトウガラシ育苗の生育増進効果を示す図である。
【図3】本発明に係るバチルスバリスモルティスBS07M菌株処理によるトウガラシ果実の生育増進効果を示す図である。
【図4】本発明に係るバチルスバリスモルティスBS07M菌株の植物病原性菌に対する抗菌活性を示す図である。
【図5】BS07部分(YC329B8k)の精製HPLCデータを示すグラフ図である。
【図6】BS07部分のHPLCスペクトル結果を示すグラフ図である。
【図7】イツリンA2のプロトンNMRスペクトル結果を示すグラフ図である。
【図8】イツリンA3のプロトンNMRスペクトル結果を示すグラフ図である。
【図9】イツリンA4のプロトンNMRスペクトル結果を示すグラフ図である。
【図10】イツリンA2、A3、A4の化学構造を示す説明図である。
【図11】本発明に係るバチルスバリスモルティスBS07M菌株の処理による病抵抗性遺伝子の発現を示す図である。
【図12】本発明に係るバチルスバリスモルティスBS07M菌株の処理によるキュウリ幼苗の根のリグニン集積を示す図である。
【図13】本発明に係るバチルスバリスモルティスBS07M菌株処理時のトウガラシ幼苗のペクトバクテリウムカロトボーラ(Pectobacterium carotovora)SCC1に対する誘導抵抗性の発現を示す図である。
【図14】露地栽培条件でバチルスバリスモルティスBS07M菌株処理時のトウガラシ炭疽病抑制効果を示す図である。
【図15】本発明に係るバチルスバリスモルティスBS07M菌株処理時のキュウリモザイクウイルスの抑制効果を示す図である。
【図16】本発明に係るバチルスバリスモルティスBS07M菌株の処理によるキュウリの耐寒性増大効果を示す図である。
【図17】本発明に係るバチルスバリスモルティスBS07M菌株の処理によるタバコ幼苗の耐寒性増大効果を示す図である。
【発明を実施するための形態】
【0026】
以下に添付図面を参照しながら、本発明の好適な実施の形態について詳細に説明する。なお、本明細書及び図面において、実質的に同一の機能構成を有する構成要素については、同一の符号を付することにより重複説明を省略する。本明細書に記載された用語、技術などは、特別な限定がない限り、本発明の属する技術分野で一般に用いられる意味で使用される。
【0027】
本発明では、作物の生育促進、耐災害性増加、及び植物病防除効果に優れる、新規なバチルスバリスモルティスBSO7M(Bacillus vallismortis BS07M)菌株を選抜した。
【0028】
本発明に係るバチルスバリスモルティスBS07M菌株は、作物の生育促進、及び耐寒性増強効果を有する。具体的には、植物病原性菌に対し直接的な抑制能を有し、植物病原性菌の生育を抑制するだけでなく、誘導抵抗性による作物の免疫機能を活性化させ作物の生育を促進し、かつ作物の耐寒性も増強させることができる。
【0029】
選抜された菌株から収得した16S rRNAの相同性を比較分析したところ、本発明に係る新規微生物は、バチルスバリスモルティスの新規な菌株であることが明らかになった。これをバチルスバリスモルティスBS07M(Bacillus vallismortis BS07M)と命名し、この菌株を韓国生命工学研究院に寄託して、2011年7月29日に受託番号KCTC11991BPを付与された。
【0030】
本発明の新規微生物バチルスバリスモルティスBS07Mは、配列番号1に示す塩基配列全体またはその一部からなり、1478bp(base pair )のオープンリーディングフレーム(ORF)から構成される。
【0031】
上記新規菌株の菌体または該菌体の培養液を含む微生物製剤を用いて作物の生育促進及び免疫機能強化を確認したところ、作物の種類を問わず、その生育促進、免疫機能強化効果、及び耐寒性増強効果を得ることができることが分かった。特に、トウガラシ、キュウリ、タバコに対して最も優れた生育促進、免疫機能強化効果、及び耐寒性増強効果を示すことを確認した。すなわち、前述の新規菌株でトウガラシを処理した場合、トウガラシの収量が30%以上増加する。
【0032】
また、上記新規菌株は、炭疽病などの主要植物病原菌を抑制する強力な抗菌物質も生産し、供試病原菌であるトウガラシ疫病(Phytophthora capsici)、トウガラシ軟化病(Pectobacterium carotovora)、トウガラシ炭疽病(Colletotrichum acutatum)、キュウリモザイクウイルス(cucumber mosaic virus)などに対する複合的な病害抵抗性をも示すことがわかった。新規菌株が生産する抗菌物質を分析したところ、イツリン(Iturin)系A2、A3、A4の3種の誘導体が同定された。
【0033】
また、新規菌株を用いた作物は、植物病の抵抗遺伝子が発現してサリチル酸(salicylic acid:SA)回路による免疫機能が強化されていることが分かった。
【0034】
また、新規菌株で作物を処理すると、4℃以下の低温にて24時間以上曝露しても100%の生存率を示すため、作物の耐寒性をも増大させることが分かった。
【0035】
本発明によれば、作物の耐寒性が増して冷害に耐える特徴を有する新規微生物バチルスバリスモルティスBS07Mが提供される。また、新規微生物バチルスバリスモルティスBS07Mは、植物病害抑制及び植物生育促進効果が従来よりも顕著に優れる。このため、本発明の微生物及びこれを含む微生物製剤を用いることにより、植物病原菌を効果的に抑制し、植物免疫機能の活性増大により病害が顕著に減少し、その結果として優れた作物生育促進効果が得られる。よって、本発明の新規微生物及びこれを含む微生物製剤は環境調和型農業に有用に活用される。
【0036】
<実施例>
以下、本発明の内容を実施例、及び実験例によってさらに具体的に説明する。
【0037】
[実施例1]菌株の分離及び選抜
植物病に対する作物の免疫機能を活性化させる優れた菌を分離するために、全国各地の農耕地から植物の根圏土壌を採取した。
【0038】
採取した試料を滅菌水に入れて振盪した後、希釈平板法によって段階別に希釈液を製造して固体培地としてTSA(Tryptic Soy Agar)培地を用いて塗抹した。
【0039】
30℃で2日間培養した後、培地の表面に現れた細菌菌株を純粋分離した。
【0040】
純粋分離された菌株を対象に、キュウリ炭疽病(Colletotrichum orbiculare)に対する誘導抵抗性を検定した。
【0041】
キュウリ(品種:ウンソン白ダダキ)の種子を1%の塩化ナトリウムで表面殺菌した後、プラスチックポットに播種して2週後に純粋分離した菌株の懸濁液を灌注処理した。
【0042】
1週後、灌注処理された葉にキュウリ炭疽病菌の胞子懸濁液を撒布し形成された病斑を調査し、植物病に対する最も高い抵抗性誘導能を示す菌株である、バチルスバリスモルティスBS07Mを選抜した。
【0043】
[実施例2]新規菌株の同定
実施例1で選抜した菌株の同定は16S rRNA遺伝子塩基配列分析を用いた。
【0044】
(1)16S rRNA塩基配列分析
細菌の同定のためには16S rRNA遺伝子塩基配列分析を用いた。すなわち、DNA抽出キット(DNA extraction kit)で分離菌株のDNAを抽出した後、ユニバーサルプライマー(universal primer)としてfD1(5’−AGAGTTTGATCCTGGCTCAG−3’)とrP2(5’−ACGGCTACCTTGTTACGACTT−3’)を用いて16S rDNA遺伝子をPCRによって増幅した。
【0045】
こうして得られたPCR産物を、DNAシークエンシングキット(DNA sequencing kit)で反応させた後、遺伝子分析器(3100 Genetic Analyzer)を用いて塩基配列の分析を行った。塩基配列はNCBIサーバー(server)のBLASTプログラムによって属(genus)まで同定した。
【0046】
菌株間の類縁関係を分析するために、得られた16S rDNA塩基配列はCLUSTAL Wプログラムを用いて標準菌株の塩基配列と整列させた。データセットの進化系統数の作成はMEGA versionプログラムを用いた。branchの安定性(bootstrap value)は1000回の再標本化(resampling)として調査した。
【0047】
分子系統分類学的分析の結果、図1に示すように、バチルスバリスモルティスBS07M菌株は、バチルスサブティルス(Bacillus subtilis)、バチルスモジャベンシス(Bacillus mojavensis)、バチルスバリスモルティス(Bacillus vallismortis)との類縁関係が高かった。その中でも、バチルスバリスモルティス(Bacillus vallismortis)との類縁関係が最も高いため、バチルスバリスモルティス(Bacillus vallismortis)と同定した。これによって、2011年7月28日に韓国生命工学研究院に当該新規菌株を寄託した。受託番号はKCTC11991BPであり、この新規微生物はバチルスバリスモルティス(Bacillus vallismortis)BS07Mと命名された。
【0048】
[実施例3]バチルスバリスモルティスBS07M菌株の培養
超低温槽(−80℃)に保管しているバチルスバリスモルティスBS07Mを、滅菌したTSA培地に塗抹し、30℃で48時間培養して再活性化させた。この際に、滅菌したTSB(Tryptic Soy broth)液体培地にバチルスバリスモルティスBS07Mを接種した後、30℃で48時間培養して再活性化させてもよい。
【0049】
上述のように培養された菌体を収去して1Lの滅菌水または0.2M−リン酸緩衝液(phosphate buffer)に入れて109〜1010cfu/mL(Colony Forming Unit/mL)の菌体懸濁液を準備した。
【0050】
この菌体懸濁液を106〜107cfu/mLの濃度で希釈して下記土壌灌注及び植物処理実験に使用した。
【0051】
[実験例1]バチルスバリスモルティスBS07M菌株のトウガラシ生育促進能の確認
1)ビニールハウス条件
上述した実施例3にてバチルスバリスモルティスBS07M菌株の菌体懸濁液を準備した。
【0052】
ビニールハウス条件で育苗期に根圏土壌へ上記の菌体懸濁液を灌注処理した。
【0053】
具体的には、まず本葉2〜3葉期にバチルスバリスモルティスBS07M菌体(109cfu/mL)懸濁液を100倍希釈して灌注した。その後、10日間隔で2回根圏土壌に灌注した。
【0054】
その結果を図2及び下記表1、2に示す。
【0055】
すなわち、図2に示すように、バチルスバリスモルティスBS07M菌株処理区では、著しく良好な育苗期の生育促進効果を示すことを確認した。特に、生育量が増加することが分かる。
【0056】
【表1】

*LSD(least significant difference):最小有意差
【0057】
また、表1に示すように、草丈、茎直径の生育量は、対照区及び病抵抗性誘導剤であるBTHを0.1mM処理したBTH処理区に比べて、本発明のバチルスバリスモルティスBS07M菌株処理区の方が大きく、トウガラシの収量に影響する株当たりの果数も、本発明のバチルスバリスモルティスBS07M菌株処理区の方が顕著に多いことを確認した。
【0058】
【表2】

【0059】
また、表2に示すように、他のバチルス(Bacillus)の菌株に対しても本発明のバチルスバリスモルティスBS07M菌株は、有意な差を示すことを確認した。すなわち、トウガラシの総果重について、他のバチルス菌株に比べて本発明のバチルスバリスモルティスBS07M菌株処理区が最も高く、優れた収量の増加効果を示すことが分かった。
【0060】
2)路地条件
育苗期は、上記のビニールハウス条件と同様にして、ビニールハウス内の根圏土壌に本発明の菌体懸濁液を灌注処理した。その後、定植期に路地に定植して対照区と比較を行った。その結果を下記表3に示す。
【0061】
【表3】

*LSD(least significant difference):最小有意差
【0062】
表3に示すように、バチルスバリスモルティスBS07M菌株処理区では、トウガラシの草丈、果実の内径、果皮の厚さなどが慣行区(対照区)に比べて著しく優れ、さらに、果実の数と収量が増加することを確認した。
【0063】
また、図3に示すように、バチルスバリスモルティスBS07M菌株処理区は、トウガラシ果実の大きさが慣行区(対照区)に比べてさらに太くて長いため、その生育量が増加したことを確認した。
【0064】
[実験例2]バチルスバリスモルティスBS07M菌株の植物病原菌に対する抗菌活性効果の確認
バチルスバリスモルティスBS07M菌株の主要植物病原菌に対する抗菌活性効果は、図4に示すとおりである。すなわち、本発明のバチルスバリスモルティスBS07M菌株は、植物病原性真菌である、コレトリクム・アクタツム(Colletorichum acutatum)、アルテルナリア・アルテルネート(Alternaria alternate)、ボトリティス・シネレア(Botrytis Cinerea)、ペニシリウム・イタリクム(Penicillium italicum)、ペニシリウム・エクスパンスム(Penicillium expansum)、フザリウム・オキシスポルム(Fusarium oxysporum)、リゾクトニア・ソラニー(Rhizoctonia solani)、及びスクレロティニア・スクレロチオラム(Sclerotinia sclerotiorum)に対する抗菌活性を示すことを確認した。
【0065】
その中でも、特にコレトリクム・アクタツム(Colletorichum acutatum)、アルテルナリア・アルテルネート(Alternaria alternate)、ボトリティス・シネレア(Botrytis Cinerea)、及びスクレロティニア・スクレロチオラム(Sclerotinia sclerotiorum)を抑制し、上述した植物病原菌に対して高い抗菌活性を示すことが分かった。
【0066】
[実験例3]抗菌物質の分離及び同定と生物活性の確認
BS07M菌株から抗菌物質を分離するために、TSA培地10Lをペトリ皿(15.0×1.5cm)に分注した後、BS07M菌株を接種して7日間培養し、しかる後に、80%メタノールで2回浸漬抽出した後、セライトフィルターで濾過して菌体を除去した。その後、濃縮してC−18、シリカG60、及びLH20カラムクロマトグラフィーなどを用いて抗菌活性物質を分離した。この際、生物活性はリゾクトニア・ソラニー(Rhizoctonia solani)でモニタリングした。
【0067】
溶媒条件としてはメタノール勾配(MeOH/H2O)0〜100%とブタノール勾配(0〜100%)で分画し、リゾクトニア・ソラニー(Rhizoctonia solani)に対して活性を有する分画を分離した。分離された分画はHPLCによって精製した(図5、図6)
【0068】
また、これらの3種の分離分画の成分をNMR分析によって同定した。
【0069】
各分画のNMR分析の結果を図7〜図10に示す。図7〜図10に示すように、各分画成分として、イツリンA2、A3、A4の3種の誘導体が同定された。
【0070】
同定されたイツリンA2の植物病原菌に対する抑制効果を確認した。その結果を下記表4に示す。
【0071】
【表4】

【0072】
表4に示すように、同定されたイツリンA2は500ppmの濃度でR.ソラニー(R. solani)、C.アクタツム(C. acutatum)、B.シネレア(B. cinerea)、S.スクレロチオラム(S. sclerotiorum)などの植物病原菌に対して抑制効果を示した。同様にイツリンA3、A4も植物病原菌に対して抑制効果を示した(図示せず)。
【0073】
[実験例4]バチルスバリスモルティスBS07M菌株の処理による誘導抵抗性増進活性の確認
1)実験方法
(1)シロイヌナズナ植物体の栽培
バチルスバリスモルティスBS07M菌株が有する植物の誘導抵抗性増進効果による抗真菌性遺伝子の発現変化を確認した。確認には、シロイヌナズナ野生型(Col 0)、形質転換株(親シロイヌナズナ生態型に由来したPR遺伝子を発現することができないように形質転換されたシロイヌナズナ(nah G:SA分解能を有する)、及び遺伝子で形質転換されたシロイヌナズナ(etr3−5、npr1)を使用した。
【0074】
この時、シロイヌナズナ野生型(Col 0)はセンターから得た。nah G形質転換植物(シロイヌナズナ)は、サリチル酸デヒドロゲナーゼ(salicylate dehydrogenase)を遺伝子にコードされ、サリチル酸(SA)を分解するものと知られている。
【0075】
シロイヌナズナの種子を表面殺菌(70%エタノールに2分間浸漬し、1%次亜塩素酸ナトリウムに20分間日浸漬)し、滅菌された蒸留水で3回洗浄した。その後、0.8%寒天及び1.5%スクロースを含有し、pH5.2に調節された1/2濃度のMS(Murashige−Skoog)培地の入ったペトリ皿にのせた。しかる後に、光を遮断した4℃状態で2日間種子の発芽を促進させた後、12時間明期12時間暗期の光周期に設定された植物生長床に入れて40W蛍光灯の下で放置した。
【0076】
相対湿度50〜60%で22±1℃の温度に維持し、2週の後、苗を、24時間の間隔をおいて2回高圧蒸気滅菌した、鉢植え用栄養土(potting soil)混合物が含まれた60mLの植木鉢に植え替えた。
【0077】
苗を植木鉢に植え替える前に、鉢植え用栄養土は、バチルスバリスモルティスBS07M菌株の懸濁液または同一用量の殺菌蒸留水で処理した。育った植物体は70%の相対湿度の下で9時間昼(200μE/m2s、24℃)及び15時間夜(20℃)の周期にて植物生長床で栽培した。
【0078】
育った植物体は1日おきに潅水し、1週1回、1/2濃度に調整したホーグランド栄養分溶液(Hoagland nutrient solution)を加えた。2週後、シロイヌナズナ植物体に実施例3で得られたバチルスバリスモルティスBS07M菌株の菌体懸濁液を土壌灌注した。
【0079】
(2)バチルスバリスモルティスBS07M菌株の処理による防御遺伝子発現の確認
前述のように準備されたシロイヌナズナ植物体に実施例3で得られたバチルスバリスモルティスBS07M菌株の菌体懸濁液を108cfu/mLの濃度で土壌灌注した後、1週後、RNA分析のために植物体から葉の組織を収得した。
【0080】
シロイヌナズナの総RNAは、少なくとも2gの凍った組織を同一用量の抽出緩衝溶液(0.35Mグリシン、0.048M NaOH、0.34M NaCl、0.04M EDTA、4%(w/v)SDS)に均質化して抽出した。その後、均質懸濁液をフェノール及びクロロホルムを用いて抽出し、RNAはLiClで沈殿させた。
【0081】
RT−PCRはEx Taq(登録商標)ポリメラーゼを用いて行った。
【0082】
反応混合物は20μLの緩衝溶液にcDNA0.1μg、正方向及び逆方向プライマーそれぞれ10pMol、dNTP250nM、並びに0.5UのEx Taq(登録商標)ポリメラーゼを含むようにした。
【0083】
PCRは、94℃で5分間処理した後、94℃1分、57℃1分の処理を1サイクルとして25サイクル行い、最終的に72℃で10分間延長反応を行った。
【0084】
防御遺伝子に対するプライマーは、PDF1.2遺伝子に対するプライマーとして、正方向プライマー5’−TGCGGTAACACCGAACCATAC−3’(配列番号A)及び逆方向プライマー5’−CGACAGTTGCATTGGTCCTCT−3’(配列番号B)を使用し、PR−1遺伝子に対するプライマーとして、正方向プライマー5’−AACCGCCAAAAGCAAACGCA−3’(配列番号C)及び逆方向プライマー5’−TCACGGAGGCACAACCAAGTC−3’(配列番号D)を使用した。
【0085】
増幅されたPCR産物は、1.2%アガロースゲルを用いて分析し、分析後のゲルを記録した。
【0086】
微生物の感染または誘導抵抗性発現物質によって植物の誘導抵抗性が発現すると、過敏性反応が発生し、続いて誘導抵抗性メカニズムとしてグルカナーゼ(glucanase)、キチナーゼ(chitinase)などのPR(pathogenesis related protein)タンパクが増加し、植物細胞のリグニン化が誘導され、フィトアレキシン(Phytoalexin)及びフェノール化合物などの抵抗性物質が蓄積されて抵抗性反応が示される。
【0087】
これと同様に、非病原性であるバチルスバリスモルティスBS07M菌株の根圏処理によって植物の免疫機能が誘発される。
【0088】
2)実験結果
バチルスバリスモルティスBS07M菌株の処理による植物体の病抵抗性遺伝子の発現は、図11に示すように、前述にて処理された野性型シロイヌナズナからの病抵抗性遺伝子PR1の発現が確認されたが、NahG変異株では発現しないことからみて、SAによる病抵抗性経路によると判断され、当該病抵抗性経路により植物の免疫活性が増大するものと判断される。
【0089】
ここで、図11において、1.Col 0:シロイヌナズナ野生型、2.etr3−5:遺伝子で形質転換されたシロイヌナズナ、3.nah G:PR遺伝子を発現することができないように形質転換されたシロイヌナズナ、4.npr1:遺伝子で形質転換されたシロイヌナズナの結果である。
【0090】
また、前記実験を証明するために、バチルスバリスモルティスBS07M菌株を処理して根の反応を確認した結果、図12に示すように植物根組織におけるリグニン化の誘導が見られた。すなわち、赤色で表示されたリグニン形成は、病抵抗性反応の一つを示すものであって、植物細胞壁が厚くなることを意味する。よって、本発明のバチルスバリスモルティスBS07M菌株を処理することにより、キュウリの根の細胞壁が厚くなって植物病原菌が侵入できなくなることが分かった。
【0091】
[実験例5]バチルスバリスモルティスBS07M菌株の誘導抵抗性発現による植物病抑制効果
バチルスバリスモルティスBS07M菌株の誘導抵抗性発現による植物病抑制効果を調べるために、室内及び圃場試験条件で行った。
【0092】
バチルスバリスモルティスBS07M菌株の処理によるトウガラシの病抵抗性発現は、幼苗期及び圃場から採取したトウガラシの葉及び果実に病原菌を接種して試験した。
【0093】
軟化病の場合、室内試験では、バチルスバリスモルティスBS07M菌株の処理されたトウガラシ栽培区と、バチルスバリスモルティスBS07M菌株の処理されていない栽培区を区分し、幼苗期の葉と路地栽培状態のトウガラシの葉を採取して試験を行った。
【0094】
その後、ペクトバクテリウムカロトボーラSCC1(Pectobacterium carotovora SCC1)に対する誘導抵抗性発現を試験した。その結果、トウガラシ幼苗の葉は下記表5と図13のとおりであった。
【0095】
【表5】

*LSD(least significant difference):最小有意差
【0096】
表5と図13に示すように、対照区は42%の病斑面積率を示したが、これに対し、バチルスバリスモルティスBS07M菌株処理区は、病斑が発生せず、効果的に病斑を抑制することを確認した。
【0097】
また、路地状態の葉の場合は、下記表6のとおりであった。
【0098】
【表6】

*LSD(least significant difference):最小有意差
【0099】
表6に示すように、対照区は一次、二次においてそれぞれ71.7%、53.7%の軟化病感染率を示したが、処理区はそれぞれ20.0%、0.0%と顕著に抑制される結果を示した。
【0100】
トウガラシ炭疽病の場合、室内試験では、路地で栽培したトウガラシの果実を採取してトウガラシ炭疽病抑制効果を試験した。
【0101】
滅菌水に懸濁してトウガラシ炭疽病菌(Colletotrichum acutatum)胞子を105spore/mLの濃度に調整し、展着剤を添加して十分に撒布した。
【0102】
しかる後に、相対湿度100%で24時間置いた後、取り出して温室内に静置し、その後7日目に病の発生を調べた。バチルスバリスモルティスBS07M菌株の処理されたトウガラシ栽培区と、バチルスバリスモルティスBS07M菌株の処理されていない栽培区から採取したトウガラシ栽培区を区分して調査した。
【0103】
その結果、表6のように、慣行区は15%の感染率を示したが、バチルスバリスモルティスBS07M処理区は1%の最も低い感染率を示し、炭疽病抑制効果が最も大きかった。
【0104】
また、トウガラシ炭疽病の場合、圃場試験は露地栽培条件で行った。
【0105】
トウガラシ炭疽病菌胞子を滅菌水に懸濁して105spore/mLの濃度に調整し、展着剤を添加してトウガラシの葉及び果実に十分に撒布した。その後、約15日間隔で4回にわたって炭疽病の発生を調べた。
【0106】
その結果は、図14に示すように、圃場条件でもバチルスバリスモルティスBS07M菌株の処理によって大きな炭疽病抑制効果が得られた。
【0107】
また、キュウリモザイクウイルス(cucumber mosaic virus、CMV)に対する抑制効果も確認した。
【0108】
具体的には、バチルスバリスモルティスBS07M菌株の胞子懸濁液を灌注処理した播種2週後のキュウリ(品種:ウンソン白ダダキ)幼苗1本葉に、キュウリモザイクウイルス(CMV)に感染したキュウリの葉を摩砕してカーボランダム粉末と共に擦って接種した。その後、常温の温室に静置し、1週目に形成されたモザイクウイルス感染有無を調査した。無処理とは、殺菌蒸留水を灌注処理し、同一の方法でCMVウイルスを接種したものを指す。
【0109】
その結果、図15に示すように、バチルスバリスモルティスBS07Mにて処理されたキュウリ幼苗は、CMVウイルスによる感染症状が全くないことが分かった。よって、バチルスバリスモルティスBS07Mは、ウイルス防除効果に優れることが分かった。
【0110】
[実験例6]バチルスバリスモルティスBS07M菌株の植物処理による植物の耐寒性増大効果
バチルスバリスモルティスBS07Mの植物根圏処理の後、キュウリ幼苗及びタバコ幼苗の耐寒性を調べた。
【0111】
4℃で24時間処理した後、温室に6時間放置し、冷害被害による葉の変色度合いを肉眼で観察して調べた。
【0112】
図16及び図17に示すように、対照区は、低温処理によって冷害を受け、葉緑体が破壊されて葉の表面が縮まり、灰白色に変色したが、これに対し、バチルスバリスモルティスBS07M菌株を処理した場合は、低温に耐性が強くなり冷害を受けず耐寒性が増大することが分かった。
【0113】
よって、本発明の新規微生物は、作物処理によって耐寒性を増大させ4℃の低温条件でも冷害に耐える優れた特徴を作物に与える。本発明は、植物病害抑制、及び植物生育促進効果が従来技術よりも顕著に優れるため、有用であることが分かる。
【0114】
さらに、本発明の新規微生物は、植物病原菌を効果的に抑制し植物免疫機能の活性増大をもたらすため、病害を顕著に減少させることができる。また、本発明の新規微生物は、作物生育促進効果にも優れるため、環境調和型農業に有用であることがわかる。
【0115】
以上、添付図面を参照しながら本発明の好適な実施形態について詳細に説明したが、本発明はかかる例に限定されない。本発明の属する技術の分野における通常の知識を有する者であれば、特許請求の範囲に記載された技術的思想の範疇内において、各種の変更例または修正例に想到し得ることは明らかであり、これらについても、当然に本発明の技術的範囲に属するものと了解される。
【受託番号】
【0116】
寄託機関名:韓国生命工学研究院
受託番号:KCTC11991BP
受託日付:2011年7月28日
【特許請求の範囲】
【請求項1】
配列番号1に示し、作物の生育を促進する、微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項2】
前記作物は、トウガラシ、キュウリ及びタバコの中から選ばれたいずれか一つであることを特徴とする、請求項1に記載の微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項3】
配列番号1に示し、植物病原性菌への抗菌活性能を有する、微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項4】
前記植物病原性菌が、コレトリクム・アクタツム(Colletorichum acutatum)、アルテルナリア・アルテルネート(Alternaria alternate)、ボトリティス・シネレア(Botrytis Cinerea)、ペニシリウム・イタリクム(Penicillium italicum)、ペニシリウム・エクスパンスム(Penicillium expansum)、フザリウム・オキシスポルム(Fusarium oxysporum)、リゾクトニア・ソラニー(Rhizoctonia solani)、及びスクレロティニア・スクレロチオラム(Sclerotinia sclerotiorum)の中から選ばれたいずれか一つであることを特徴とする、請求項3に記載の微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項5】
配列番号1に示し、植物病に対する作物の免疫機能活性能を有する、微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項6】
前記植物病が、トウガラシ疫病(Phytophthora capsici)、トウガラシ軟化病(Pectobacterium carotovora)、トウガラシ炭疽病(Colletotrichum acutatum)、及びキュウリモザイクウイルス(cucumber mosaic virus)の中から選ばれたいずれか一つであることを特徴とする、請求項5に記載の微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項7】
配列番号1に示し、作物の耐寒性増大能を有する、請求項1〜6のいずれか1項に記載の微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項8】
微生物農薬、微生物肥料、種子コーティング剤、土壌改良剤、堆肥腐熟剤、葉面撒布剤、及び灌注撒布剤のいずれか一つの有効成分として用いられる、請求項1〜7のいずれか1項に記載の微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項9】
配列番号1に示し、作物の生育を促進能、植物病原性菌への抗菌活性能、植物病に対する作物の免疫機能活性能、及び作物の耐寒性増大能の少なくともいずれか一つを有する微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項10】
配列番号1に示す微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BPの菌体またはその培養液を含む、微生物製剤。
【請求項11】
配列番号1に示す微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BPの菌体またはその培養液から生産されるイツリン(Iturin)系化合物を含む、微生物製剤。
【請求項12】
請求項10または11の微生物製剤を作物に撒布または土壌灌注し、作物の生育を促進する作物育成方法。
【請求項13】
請求項10または11の微生物製剤を作物に撒布または土壌灌注し、植物病原性菌を防除する作物育成方法。
【請求項14】
請求項10または11の微生物製剤を作物に撒布または土壌灌注し、作物の耐寒性を増強させる作物育成方法。
【請求項1】
配列番号1に示し、作物の生育を促進する、微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項2】
前記作物は、トウガラシ、キュウリ及びタバコの中から選ばれたいずれか一つであることを特徴とする、請求項1に記載の微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項3】
配列番号1に示し、植物病原性菌への抗菌活性能を有する、微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項4】
前記植物病原性菌が、コレトリクム・アクタツム(Colletorichum acutatum)、アルテルナリア・アルテルネート(Alternaria alternate)、ボトリティス・シネレア(Botrytis Cinerea)、ペニシリウム・イタリクム(Penicillium italicum)、ペニシリウム・エクスパンスム(Penicillium expansum)、フザリウム・オキシスポルム(Fusarium oxysporum)、リゾクトニア・ソラニー(Rhizoctonia solani)、及びスクレロティニア・スクレロチオラム(Sclerotinia sclerotiorum)の中から選ばれたいずれか一つであることを特徴とする、請求項3に記載の微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項5】
配列番号1に示し、植物病に対する作物の免疫機能活性能を有する、微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項6】
前記植物病が、トウガラシ疫病(Phytophthora capsici)、トウガラシ軟化病(Pectobacterium carotovora)、トウガラシ炭疽病(Colletotrichum acutatum)、及びキュウリモザイクウイルス(cucumber mosaic virus)の中から選ばれたいずれか一つであることを特徴とする、請求項5に記載の微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項7】
配列番号1に示し、作物の耐寒性増大能を有する、請求項1〜6のいずれか1項に記載の微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項8】
微生物農薬、微生物肥料、種子コーティング剤、土壌改良剤、堆肥腐熟剤、葉面撒布剤、及び灌注撒布剤のいずれか一つの有効成分として用いられる、請求項1〜7のいずれか1項に記載の微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項9】
配列番号1に示し、作物の生育を促進能、植物病原性菌への抗菌活性能、植物病に対する作物の免疫機能活性能、及び作物の耐寒性増大能の少なくともいずれか一つを有する微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BP。
【請求項10】
配列番号1に示す微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BPの菌体またはその培養液を含む、微生物製剤。
【請求項11】
配列番号1に示す微生物バチルスバリスモルティス(Bacillus vallismortis)BS07M菌株KCTC11991BPの菌体またはその培養液から生産されるイツリン(Iturin)系化合物を含む、微生物製剤。
【請求項12】
請求項10または11の微生物製剤を作物に撒布または土壌灌注し、作物の生育を促進する作物育成方法。
【請求項13】
請求項10または11の微生物製剤を作物に撒布または土壌灌注し、植物病原性菌を防除する作物育成方法。
【請求項14】
請求項10または11の微生物製剤を作物に撒布または土壌灌注し、作物の耐寒性を増強させる作物育成方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公開番号】特開2013−66467(P2013−66467A)
【公開日】平成25年4月18日(2013.4.18)
【国際特許分類】
【出願番号】特願2012−210175(P2012−210175)
【出願日】平成24年9月24日(2012.9.24)
【出願人】(502305043)
【氏名又は名称原語表記】REPUBLIC OF KOREA (RURAL DEVELOPMENT ADMINISTRATION)
【Fターム(参考)】
【公開日】平成25年4月18日(2013.4.18)
【国際特許分類】
【出願日】平成24年9月24日(2012.9.24)
【出願人】(502305043)

【氏名又は名称原語表記】REPUBLIC OF KOREA (RURAL DEVELOPMENT ADMINISTRATION)
【Fターム(参考)】
[ Back to top ]

