バティアクセラ属フィターゼの変異体
フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) とは異なるアミノ酸配列を備えるフィターゼ変異体であって、そのアミノ酸配列には、SEQ ID NO: 1のアミノ酸の位置75, 76, 77, 198, 367または374に相当する位置の少なくとも1以上の位置における変異が含まれる、フィターゼ変異体。
【発明の詳細な説明】
【技術分野】
【0001】
<クロスリファレンス>
本願は、2008年4月18日出願の米国仮出願第61/046,324号に基づく優先権を主張し、この仮出願の全てが参照として本願に組み込まれる。
【0002】
本願は、改良されたバティアクセラ(Buttiauxella)属フィターゼの変異体、このフィターゼ変異体をコードする核酸、この核酸を含むベクター及び宿主細胞、並びにこのフィターゼを産出する方法に関する。本願のフィターゼは、例えば澱粉の液化、アルコール発酵や、食品や飼料中のリン酸塩の分解の促進等、様々な用途に用いることができる。
【背景技術】
【0003】
フィチン酸エステルは、穀物及びマメ科植物におけるリンの主要な貯蔵形態である。しかし、豚、家禽、魚等の単胃動物はフィチン酸エステル(またはフィチン酸)を代謝または吸収することができず、フィチン酸エステルをそのまま排泄する。このため、牧畜業が盛んに行われている地域においてリン汚染が生じる。
さらに、フィチン酸はカルシウム、銅、亜鉛等の金属とキレートを形成し、単胃動物において非栄養成分として作用する。
【発明の概要】
【0004】
これらの動物に十分なリン酸塩を与えて健全に生育させるために、飼料に無機リン酸が添加されている。このようなリンの添加は費用がかかり、また環境汚染の問題が増大する。
【0005】
通常、フィチン酸エステルはフィターゼの作用により加水分解され、低級イノシトール-リン酸塩と無機リン酸になる。フィターゼは飼料の添加剤として有用である。フィターゼにより、動物の有機リン酸の摂取可能量が増加し、リン酸塩による環境汚染が低減される(Wodzinski R J, Ullah A H. Adv Appl Microbiol. 42, 263-302 (1996))。
【0006】
文献に、多数の菌類由来のフィターゼ (Wyss M. et al., Appl. Environ. Microbiol. 65 (2), 367-373 (1999); Berka R. M. et al., Appl. Environ. Microbiol. 64 (11), 4423-4427 (1998); Lassen S. et al., Appl. Environ. Microbiol. 67 (10), 4701-4707 (2001))、及び細菌由来のフィターゼ (Greiner R. et al Arch. Biochem. Biophys. 303 (1), 107-113 (1993); Kerovuo et al., Appl. Environ. Microbiol. 64 (6), 2079-2085 (1998); Kim H. W. et al., Biotechnol. Lett. 25, 1231-1234 (2003); Greiner R. et al., Arch. Biochem. Biophys. 341 (2), 201-206 (1997); Yoon S. J. et al., Enzyme and microbial technol. 18, 449-454 (1996); Zinin N. V. et al., FEMS Microbiol. Lett. 236, 283-290 (2004)) が記載されている。
【課題を解決するための手段】
【0007】
第一の側面では、この発明により、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1)とはアミノ酸配列が異なり、1以上の有用な性質を備えるフィターゼ変異体が提供される。このような有用な性質は、熱安定性、温度/活性依存性、pH/活性依存性、比活性度、及びpH/プロテアーゼ感受性等であるが、これらに限定されない。
【0008】
別の側面では、この発明は、位置75, 76及び374からなる群から選択される1以上の位置に置換を有するフィターゼから成るフィターゼの変異体に関する。ここで、各位置は、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1)のアミノ酸配列における位置に相当する。
【0009】
また別の側面では、この発明の実施形態により、本願のフィターゼ変異体をコードする核酸と、この核酸を含むベクター及び宿主細胞が提供される。また別の実施形態では、この配列はフィターゼ変異体を産出するプロセスにおいて用いられる。
【0010】
さらに、この発明の実施形態はフィターゼの基質、特にフィチン酸エステルまたはフィチン酸由来の無機リン酸塩からリンを放出させるフィターゼ変異体の使用に関する。この発明のフィターゼ変異体は、澱粉の液化、あるいは食料及び飼料のリン酸塩分解の促進等の工業的用途において好適に用いることができる。この発明の実施形態に係るフィターゼ変異体は、アルコール発酵プロセスおよび/またはアルコール製造において好適に用いることができる。
【0011】
別の側面では、この発明の実施形態は、本願に開示するフィターゼ変異体から成る酵素組成物に関する。この酵素組成物は、商業的用途に適し、好適に用いられる。
ひとつの実施形態では、酵素組成物は飼料用組成物である。別の実施形態では、酵素組成物は、澱粉加水分解(例えば液状化)プロセスに用いられる。好ましい実施形態では、フィターゼ変異体および/または酵素組成物は、アルコール発酵プロセスに用いられる。別の実施形態では、本願に係るフィターゼから成る酵素組成物に、別の酵素が含まれる。このような別の酵素の例は、グルコアミラーゼ、α-アミラーゼ、プロテアーゼ、セルラーゼ、ヘミセルラーゼ、リパーゼ、ペクチナーゼ、プルラナーゼ、グルコースオキシダーゼ、β-グルコシダーゼ、ラッカーゼ、オキシダーゼ、クチナーゼ、ホスファターゼ、別のフィターゼ、及びこれらの組み合わせが含まれる。
【0012】
また別の側面では、この発明の実施形態は、宿主細胞中で転写活性を示すプロモータを備えたDNA構築体により宿主細胞を形質転換し、形質転換された宿主細胞を、フィターゼを発現させフィターゼを産出させることができる適切な培地中で培養することにより、宿主細胞中にフィターゼ変異体を産出させる方法に関する。この方法には、産出されたフィターゼを回収する工程が含まれていてもよい。
ひとつの実施形態では、宿主細胞は細菌、または植物細胞、または菌類細胞(例えばトリコデルマ・リーゼイ(Trichoderma reesei) 等のトリコデルマの細胞)、または酵母である。
この発明の実施形態では、フィターゼ変異体のアミノ酸配列は、SEQ ID NO: 1のアミノ酸配列に対し少なくとも80%、少なくとも85%、少なくとも90 %、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%の配列同一性を有する。
この発明の好ましい実施形態では、フィターゼはSEQ ID NO: 2のアミノ酸配列を有する。
【0013】
この発明の酵素は、特許請求の範囲と明細書に規定されるものである。この発明の酵素には、例えばシグナルペプチドの切断等のように、発現の間に、翻訳と同時または翻訳後に加工された活性ポリペプチドが含まれていてもよい。翻訳後の切断は、C-末端で生じてもよい。すなわち、好ましい実施形態では、有効な断片(機能性断片とも呼ぶ)は、天然の宿主または適切な発現宿主から産出された成熟タンパク質である。
【0014】
即ち一側面では、本願のフィターゼは、本願に規定する変異体をコードする核酸配列の一部または全部により発現されたアミノ酸配列か、または発現され得るアミノ酸配列を備えることを特徴とする。
【0015】
一側面では、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1)と比較して、熱活性が少なくとも約5℃改善されたフィターゼ変異体が提供される。ひとつの実施形態では、SEQ ID NO: 1のフィターゼと比較して熱活性が少なくとも約17℃改善されたフィターゼ変異体が提供される。別の実施形態では、熱活性が約17℃から約21℃の範囲で改善される。また別の実施形態では、熱活性が約17.4℃から約20.2℃の範囲で改善される。
【0016】
別の側面では、熱安定性フィターゼ変異体が提供される。この熱安定性フィターゼ変異体は、pH 5.5の緩衝液中で相対的高温に10分間曝された後、その活性を50%以上保持することができ、ここで相対的高温は、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1)の活性を50%以上保持することができる温度より少なくとも約5℃高い温度である。
ひとつの側面では、相対的高温は少なくとも約20.5℃高い温度である。別の側面では、相対的高温は約20.5℃から約27℃高い温度範囲である。また別の側面では、相対的高温は約20.2℃から約26.8℃高い温度範囲である。
【0017】
別の側面では、フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) とは異なるアミノ酸配列を備えるフィターゼ変異体が提供される。ここで、フィターゼ変異体のアミノ酸配列には、SEQ ID NO: 1のアミノ酸の位置75, 76, 77, 198, 367 または374に相当する位置の1以上の位置における変異が含まれる。
ひとつの実施形態では、フィターゼ変異体にはさらに1以上の別の変異が含まれ、この変異は92A, 164E/S, 171I/V, 192A または 256A/E/Pのいずれかである。別の実施形態では、位置75, 76, 77, 198, 367 または374の1以上の位置における変異がそれぞれ75P, 76R, 77S, 198R, 367Lまたは 374Pであり、フィターゼ変異体にはさらに別の変異が含まれ、この変異は92A, 164E/S, 171V, 192Aまたは256A/E/Pである。
また別の実施形態では、フィターゼ変異体には1以上の別の変異が含まれ、1以上の別の変異の位置は、26, 37, 89, 134, 160, 176, 178, 188, 190, 207, 209, 211, 235, 261, 270, 303または318のいずれかである。
また別の実施形態では、26, 37, 89, 134, 160, 176, 178, 188, 190, 207, 209, 211, 235, 261, 270, 303または318の1以上の位置における変異はそれぞれ、26E, 037Y, 089T, 134I/V, 160R, 176K, 178P, 188N, 190E, 207E/T, 209S, 211C, 235V, 261E, 270K, 303Fまたは318Dのいずれかである。
また別の実施形態では、フィターゼ変異体には1以上の別の変異が含まれ、1以上の別の変異の位置は、1, 10, 11, 38, 66, 71, 81, 92, 109, 111, 119, 120, 121, 141, 142, 152, 155, 193, 214, 239, 245, 248, 255, 268, 277, 283, 285, 287, 288, 293, 296, 314, 337, 345, 350, 364, 371, 372, 396, 399, 406または413のいずれかである。
また別の実施形態では、1, 10, 11, 38, 66, 71, 81, 92, 109, 111, 119, 120, 121, 141, 142, 152, 155, 193, 214, 239, 245, 248, 255, 268, 277, 283, 285, 287, 288, 293, 296, 314, 337, 345, 350, 364, 371, 372, 396, 399, 406または413の1以上の位置における変異がそれぞれ、1S, 10I, 11I, 38S, 66E, 71K, 81A, 92E, 109Q, 111G, 119N, 120L, 121E, 141R, 142L, 152M, 155E, 193Q, 211C, 214V, 235V, 239K, 245D, 248L, 255A, 261E, 268A/T, 270K, 277T, 283D, 285K, 287D, 288A, 293Gまたは296Sのいずれかである。
【0018】
別の側面では、フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) のアミノ酸配列とは異なるアミノ酸配列を備えるフィターゼ変異体が提供され、このフィターゼ変異体のアミノ酸配列はSEQ ID NO: 1に対し少なくとも1の変異を有し、このフィターゼ変異体の配列の変異は、下記のa)〜t)のいずれかである。
a) N37Y, S75P, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K198R, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
b) N37Y, G77S, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K198R, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
c) N37Y, S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
d) N37Y, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256P, A261E, N270K, A374P
e) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
f) N37Y, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
g) N37Y, Q76R, A89T, D92A, T134I, F164S, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256A, A261E, N270K, A374P
h) S75P, A89T, D92A, T134I, F164E, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
i) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, P367L, A374P
j) N37Y, A89T, D92A, T134I, F164E, T171I, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
k) N37Y, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
l) N37Y, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
m) N37Y, S75P, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, K207E, A209S, A235V, S248L, Q256A, A261E, N270K, A374P
n) N37Y, S75P, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
o) N37Y, A89T, D92A, T134I, H160R, F164S, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256E, A261E, N270K, A374P
p) A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
q) N37Y, S75P, A89T, D92A, T134I, H160R, F164S, T171V, T176K, A178P, S188P, K207E, A209S, S248L, Q256H, A261E, N270K, A374P
r) N37Y, S75P, A89T, D92A, T134I, F164S, T171V, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
s) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P; または
t) N37Y, Q76R, A89T, D92A, T134I, H160R, F164S, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P.
ひとつの実施形態では、フィターゼ変異体の配列の変異は、N37Y, S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374Pである。
【0019】
また、本願に開示するフィターゼに対し最小配列同一性パーセントおよび/または最小相同性パーセントを有するフィターゼが提供され、ここで最小配列同一性パーセントおよび/または最小相同性パーセントは少なくとも50%、少なくとも60%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも93%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%である。
【0020】
一側面では、フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) のアミノ酸配列とは異なるアミノ酸配列を備えるフィターゼ変異体が提供され、このフィターゼ変異体のアミノ酸配列はSEQ ID NO: 1に対し少なくとも1の変異を有し、このフィターゼ変異体の変異の位置は、アミノ酸位置70, 193, 197, 221 及び407の少なくともいずれか1である。ひとつの実施形態では、フィターゼ変異体は少なくともN70Y, H193R, F197E, S221P 及びA407Pの変異を有する。
【0021】
また別の側面では、本願に開示するフィターゼのいずれかをコードする核酸が提供される。
別の側面では、本願に開示するフィターゼのいずれかをコードする核酸を含むベクターが提供される。
また別の側面では、本願に開示する核酸および/またはベクターを含む宿主細胞が提供される。
【0022】
別の側面では、宿主細胞中で本願に開示するフィターゼ変異体を産出する方法が提供され、この方法は、
a) 本願に開示するフィターゼ変異体のいずれかをコードする核酸を含むDNA構築体で宿主細胞を形質転換する工程、及び
b) 形質転換された宿主細胞を適切な培地において培養する工程を備える。
ひとつの実施形態では、宿主細胞は菌類細胞、細菌細胞、または植物性細胞である。
【0023】
一側面では、本願に開示する方法で産出されたフィターゼが提供される。
【0024】
一側面では、本願に開示するフィターゼの少なくとも1と、グルコアミラーゼ、アルファ-アミラーゼ、プロテアーゼ、プルラナーゼ、イソアミラーゼ、セルラーゼ、ヘミセルラーゼ、キシラナーゼ、シクロデキストリングリコトランスフェラーゼ、リパーゼ、ラッカーゼ、オキシダーゼ、エステラーゼ、クチナーゼ、別のフィターゼ、及びこれらの組み合わせの内の1以上とから成る酵素組成物に関する。
ひとつの実施形態では、この組成物にはアルファ-アミラーゼが含まれる。
【0025】
別の側面は、本願に開示するフィターゼまたは本願に開示する酵素組成物の、澱粉液化、澱粉糖化、澱粉発酵または澱粉同時糖化-発酵における使用に関する。ひとつの実施形態では、発酵アルコールを製造するために、澱粉液化、澱粉糖化、澱粉発酵または澱粉同時糖化-発酵を行う。別の実施形態では、アルコールはエタノールまたはブタノールである。別の実施形態では、基質を澱粉液化、澱粉糖化、澱粉発酵または澱粉同時糖化-発酵させる。ひとつの実施形態では、基質には澱粉が含まれる。別の実施形態では、基質には穀粒または穀物が含まれる。別の実施形態では、穀粒または穀物は小麦、大麦、ライ麦、オート麦、 トウモロコシ、ソルガム、トウモロコシグルテン、可溶性物質添加乾燥蒸留穀物残渣(Distillers Dried Grain Solubles (DDGS))、小麦フスマ、小麦ミドリング粉、小麦ショーツ、米、 オート麦殻、 パーム核油、果実の搾りかすまたはこれらの組合せである。ひとつの実施形態では、米には米ぬかまたは米殻が含まれる。
【0026】
別の側面は、少なくとも1の本願に開示するフィターゼの、食品または飼料における添加剤としての使用に関する。別の側面は、少なくとも1の本願に開示するフィターゼの、可溶性物質添加乾燥蒸留穀物残渣(DDGS)を含む食品または飼料における添加剤としての使用に関する。
【0027】
別の側面では、食品または飼料を製造する方法が提供され、この方法には、少なくとも1の本願に開示するフィターゼまたは酵素組成物と、食品または飼料の原料とを混合して食品または飼料を製造する工程が含まれる。
【0028】
別の側面では、食品または飼料を製造する方法が提供され、この方法には、少なくとも1の液体状の本願に開示するフィターゼまたは酵素組成物を、食品または飼料にスプレーする工程が含まれる。
一側面では、食品または飼料を製造する方法が提供され、この方法には、少なくとも1の固体状の本願に開示するフィターゼまたは酵素組成物を、食品または飼料と混合する工程が含まれる。
【0029】
別の側面では、飼料を製造する方法が提供され、この方法には、少なくとも1の本願に開示するフィターゼまたは酵素組成物を、食品または飼料原料と混合して飼料を製造する工程が含まれる。
また別の側面では、飼料を製造する方法が提供され、この方法には、少なくとも1の液体状の本願に開示するフィターゼまたは酵素組成物を、飼料にスプレーする工程が含まれる。
さらに別の側面では、飼料を製造する方法が提供され、この方法には、少なくとも1の固体状の本願に開示するフィターゼまたは酵素組成物を、飼料と混合する工程が含まれる。
【0030】
別の側面では食品または飼料の組成物が提供され、この組成物には、i) 少なくとも1の本願に開示するフィターゼまたは酵素組成物、および/またはii) 本願に開示する方法で製造された食品または飼料のいずれかが含まれる。
また別の側面では飼料組成物が提供され、この飼料組成物には、i) 少なくとも1の本願に開示するフィターゼまたは酵素組成物、および/またはii) 本願に開示する方法で製造された食品または飼料のいずれかが含まれる。
一側面は、少なくとも1の本願に開示するフィターゼまたは酵素組成物の食品または飼料への使用に関する。
別の側面は、少なくとも1の本願に開示するフィターゼまたは酵素組成物の飼料への使用に関する。
【0031】
別の側面では、動物の排泄物に含まれるリンの濃度を低減させる方法が提供され、この方法は、少なくとも1の本願に開示するフィターゼまたは酵素組成物、または本願に開示する方法で製造された飼料、または本願に開示する組成物を動物に与え、前記フィターゼの量が飼料中に含有されるフィチン酸エステルを変換するために必要な量であることを特徴とする。
【0032】
一側面は、少なくとも1の本願に開示するフィターゼまたは酵素組成物、または本願に開示する方法で製造された飼料、または本願に開示する組成物の、前記フィターゼポリペプチドが与えられた動物の排泄物に含まれるリンの濃度を下げるための飼料の製造における使用に関する。
【図面の簡単な説明】
【0033】
【図1】野生型バティアクセラ種P1-29フィターゼ (BP-WT) のアミノ酸配列を表わす(SEQ ID NO: 1)。
【図2】この発明に係る1の有用な変異体のアミノ酸配列を表わす(SEQ ID NO: 2)。
【図3】野生型バティアクセラ種P1-29の核酸配列 (SEQ ID NO: 3) を表わす。
【図4】図2に示すこの発明に係る1の有用な変異体の核酸配列 (SEQ ID NO: 4) を表わす。
【図5】この発明に係る3種類の酵素(BP 110, BP-111及びBP-112)のアミノ酸配列、並びにBP-17及び野生型のアミノ酸配列を表わす。
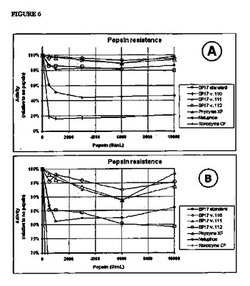
【図6】バティアクセラ、BP-17, BP-110, BP-111及びBP-112各変異体、並びにPhyzyme XP, Natuphos, 及びRonozyme Pに由来するフィターゼの、ペプシン濃度の増加に対する耐性を表わす図である。各データは、ペプシン無添加でpH 2における培養に対する相対比で示されている。A: 全てのデータ、B: 70%以上リカバリーしたデータのみ。
【図7】実施例11で用いた飼料加工装置(飼料のペレット化)の模式図である。
【図8】データのグラフである。
【図9】データのグラフである。
【図10】データのグラフである。
【図11】データのグラフである。
【図12】データのグラフである。
【図13】データのグラフである。
【図14】データのグラフである。
【図15】HPLCデータをプロットした図である。
【図16】HPLCデータをプロットした図である。
【発明を実施するための形態】
【0034】
本願は、バティアクセラ属フィターゼの変異体に関し、この変異体は澱粉液状化、アルコール発酵、及び食品及び飼料中のリン酸塩の消化を促進するための方法等を含む工業的用途に用いられる。この発明のフィターゼ変異体は、特に燃料用エタノール製造プロセスの澱粉液化工程におけるフィチン酸エステル分解に有用である。この発明のフィターゼ変異体は、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1)のアミノ酸配列に対し、1以上の変異(置換、挿入、及び欠失を含む)を有する。好ましい実施形態では、この発明のフィターゼ変異体のアミノ酸配列は、SEQ. ID NO: 1のアミノ酸配列に対し少なくとも1の変異を有する。前記少なくとも1の変異は、アミノ酸位置75, 76及び374から成る群から選択される1, 2または3つの位置にある。ここで各アミノ酸位置は、SEQ ID NO: 1のアミノ酸配列上の位置に対応する。
【0035】
例えば、この発明の実施形態に係るフィターゼ変異体における変異は、SEQ ID NO: 1の位置に対応して、S75, Q76及びA374から成る群から選択されることが好ましい。
【0036】
この発明の好ましい実施形態では、フィターゼ変異体における変異は置換であり、この置換はS75P, Q76R 及びA374Pから成る群から選択される。ここで各アミノ酸位置は、SEQ ID NO: 1のアミノ酸配列上の位置に対応する。
【0037】
別の好ましい実施形態では、この発明のフィターゼ変異体はさらに、N37, G77, H160, F164, , T171, S188, G192, K198, A235, Q256および/またはP367から成る群から選択される変異を備える。ここで各アミノ酸位置は、SEQ ID NO: 1のアミノ酸配列上の位置に対応する。
【0038】
また別の好ましい実施形態では、この発明のフィターゼ変異体における変異は置換であり、前記置換はN37Y, G77S, H160R, F164E, F164S, T171V, T171I, S188P, G192A, K198R, A235V, Q256P, Q256A, Q256Eおよび/またはP367Lから成る群から選択される1以上の位置にある。
【0039】
また別の好ましい実施形態では、この発明のフィターゼ変異体にはさらに、A89, D92, T134, F164, T176, A178, K207, A209, S248, Q256, A26Eおよび/またはN270から成る群から選択される1以上の位置にある変異が含まれる。
【0040】
また別の好ましい実施形態では、この発明のフィターゼ変異体にはさらに、A89T, D92A, T134I, F164S, T176K, A178P, K207E, A209S, S248L, Q256Y, A261Eおよび/またはN270Kから成る群から選択される1以上の位置の変異が含まれる。
【0041】
また別の好ましい実施形態では、この発明のフィターゼ変異体にはSEQ ID NO: 2のアミノ酸配列が含まれている。
【0042】
この発明の好ましいフィターゼ変異体は、下記のa)からt)から成る群から選択される変異を有するアミノ酸配列を備える:
a) N37Y, S75P, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K198R, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
b) N37Y, G77S, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K198R, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
c) N37Y, S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
d) N37Y, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256P, A261E, N270K, A374P
e) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
f) N37Y, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
g) N37Y, Q76R, A89T, D92A, T134I, F164S, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256A, A261E, N270K, A374P
h) S75P, A89T, D92A, T134I, F164E, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
i) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, P367L, A374P
j) N37Y, A89T, D92A, T134I, F164E, T171I, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
k) N37Y, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
l) N37Y, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
m) N37Y, S75P, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, K207E, A209S, A235V, S248L, Q256A, A261E, N270K, A374P
n) N37Y, S75P, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
o) N37Y, A89T, D92A, T134I, H160R, F164S, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256E, A261E, N270K, A374P
p) A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
q) N37Y, S75P, A89T, D92A, T134I, H160R, F164S, T171V, T176K, A178P, S188P, K207E, A209S, S248L, Q256H, A261E, N270K, A374P
r) N37Y, S75P, A89T, D92A, T134I, F164S, T171V, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
s) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
t) N37Y, Q76R, A89T, D92A, T134I, H160R, F164S, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P。
【0043】
この発明の実施形態には、配列a)からt)に示すいずれかのフィターゼ変異体も含まれ、このフィターゼ変異体はフィターゼ活性を有するとともに、配列a)からt)に示すフィターゼ変異体に対し、少なくとも50%、少なくとも60%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも93%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性パーセントおよび/または相同性パーセントを有する。
【0044】
本願では、アミノ酸はそのアミノ酸の名称、3文字の略号、または1文字の略号を用いて表記する。下記の表に、アミノ酸の名称とその略号の一覧を示す。
【表1】

【0045】
特定のアミノ酸変異体、及びこの変異体をコードする核酸に加え、本願により保存アミノ酸置換の変異体が提供される。このような置換は保存されたアミノ酸の置換であり、例えばアミノ酸変異体は、同種に属する別のアミノ酸によって置き換えられている。
アミノ酸はその側鎖の構造に応じて、酸性、塩基性、中性で極性、中性で非極性および/または芳香性に分類される。変異体アミノ酸位置における好ましい置換基には、その位置におけるアミノ酸変異体の分類と同様の1以上の分類を備える置換基が含まれる。すなわち、Lys, Arg, 及びHisは塩基性アミノ酸であり、アスパラギン酸及びグルタミン酸は酸性アミノ酸であり、Ser, Thr, Cys, Gln, 及びAsnは中性で極性のアミノ酸であり、Gly, Ala, Val, Ile, 及びLeuは非極性の脂肪族アミノ酸であり、Phe, Trp, 及びTyrは芳香族アミノ酸である。Gly及びAlaは小さなアミノ酸であり、Val, Ile及びLeuは脂肪族アミノ酸である。
【0046】
特に断りの無い限り、全ての技術用語及び科学用語は、通常の意味に従う。以下の用語について、その意味を明確にするために定義する。本願で用いる用語の意義の解釈には、Singleton, et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY, 20 ED., John Wiley and Sons, New York (1994)、及びHale & Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY, Harper Perennial, NY (1991)を辞書として用いることができる。
【0047】
この発明は、本願に例示した方法及び材料に限定されず、この発明を実施する際には、本願に開示した方法及び材料と同様または均等なものを用いることができる。数値範囲には、その範囲を規定する数値も含まれる。特に断りの無い限り、核酸配列は5' から 3'方向が左から右方向になるように記載し、アミノ酸の配列はアミノ基からカルボキシル基方向が左から右方向になるように記載する。
【0048】
文中の見出しはこの発明の様々な態様を限定するものではなく、明細書全体にわたり参照される。すなわち下記の定義は、明細書全体を参照してより完全に定義される。
【0049】
フィチン酸 (ミオ-イノシトールヘキサキスホスフェート)は、穀類、豆類、油料種子作物中の重要な成分である。その塩の形態であるフィチン酸エステルは、これらの植物におけるリンの主要な貯蔵形態である。
【0050】
フィターゼは、フィチン酸のリン酸モノエステルの加水分解を触媒して、段階的にミオ-イノシトールペンタキス-、テトラキス-、トリス-、ビス-、及びモノ-ホスフェートを生成させるとともに、無機リンを放出させる
【0051】
「フィターゼ変異体」または「変異体」または「改変された形態」とは、親フィターゼのアミノ酸配列に由来するアミノ酸配列を有し、1以上のアミノ酸置換、挿入および/または欠失を備えるフィターゼ酵素を意味し、これらは共に「突然変異体」と呼ばれる。
【0052】
「親フィターゼ」または「親酵素」とは、フィターゼ変異体の派生元のフィターゼ酵素を意味する。親フィターゼは野生型フィターゼであり、あるいは別のフィターゼ変異体であってもよい。特に、本願では「親フィターゼ」はバティアクセラ属に由来する。好ましくは、「親フィターゼ」は、本願にアミノ酸配列を開示するバティアクセラ株P1-29に由来する。
【0053】
「フィターゼ」または「フィターゼ活性」とは、フィチン酸エステルの加水分解を触媒して(1) ミオ-イノシトール、および/または (2) そのモノ-、ジ-、トリ-、テトラ- および/またはペンタ-リン酸塩、及び (3) 無機リン酸塩を生成させることができるタンパク質またはポリペプチドを意味する。例えば、Enzyme CommissionのEC番号3.1.3.8またはEC番号3.1.3.26に定義された酵素活性を有する酵素が挙げられる。
【0054】
「バティアクセラ属フィターゼ」とは、バティアクセラ属から得られたフィターゼタンパク質を意味する。ひとつの実施形態では、バティアクセラ属フィターゼは、受託番号NCIMB 41248 (National Collections of Industrial Marine and Food Bacteria, Scotland, UK)で寄託された株に由来するアミノ酸配列を備える。好ましい実施形態では、バティアクセラ属フィターゼはSEQ ID NO: 2に示すアミノ酸配列を有する。
【0055】
「バティアクセラ属フィターゼに相当する」とは、バティアクセラ属フィターゼと同等の機能的性質または配列を1以上備える酵素を意味する。この酵素は、バティアクセラ属から得られた酵素である必要は無い。
【0056】
「バティアクセラ」とは、腸内細菌科のグラム陰性で通性嫌気性細菌の属を意味し、バティアクセラ属にはB.アグレスティス(agrestis)、B.ブレンネラーゼ(brennerase)、B. フェラグティアエ(ferragutiae)、B. ガビニアエ(gaviniae)、B. イザルディイ(izardii)、B. ノアキアエ(noackiae)、及びB. ワームボールディアエ(warmboldiae) が含まれる。バティアクセラ属の株は、例えばAmerican Type Culture Collection (ATCC)や、German National Resource Centre for Biological Material (DSMZ) から入手できる。
【0057】
「野生型フィターゼ」または「野生型」とは、天然のアミノ酸配列を有する酵素を意味する。特に、野生型フィターゼはSEQ ID. No. 1に示すものである。
【0058】
「バティアクセラ属フィターゼの変異体」または「フィターゼ変異体」とは、SEQ. ID NO: 1のフィターゼのアミノ酸配列と比較して、少なくとも1のアミノ酸の置換、挿入、および/または欠失を有する点で異なるアミノ酸配列を有するフィターゼ酵素を意味する。
「変異体」及び「変異」とは、単にフィターゼ変異体のアミノ酸配列とSEQ. ID NO: 1のアミノ酸配列との間に相違点があることを意味する。「変異体」及び「変異」は、出発物質として用いたSEQ. ID NO: 1のアミノ酸配列またはヌクレオチド配列または他のフィターゼを意味せず、および/または、変異体を得るためにこれらを物理的に改変、突然変異導入、修飾またはその他の変更を加えたこと意味しない。
本願のフィターゼ変異体(アミノ酸配列及びヌクレオチド配列を含む)は任意の方法により産出させることができる。フィターゼ変異体を産出させる様々な方法は当業者にとって公知であり、そのいくつかを本願に示す。
【0059】
本願で「タンパク質」というときは、タンパク質、ポリペプチド、及びペプチドを含む意味で用いる。
【0060】
本願では、「に等価なアミノ酸残基」、「に相当するアミノ酸」、及びこれらと同義の語は、特定のタンパク質における特定のアミノ酸配列中のアミノ酸残基として指定されたアミノ酸残基と同様の位置、及び機能を有するアミノ酸残基の意味で用いる。当業者であれば、フィターゼタンパク質との比較における特定のアミノ酸残基の等価性を識別できるであろう。
【0061】
2つのアミノ酸配列またはポリヌクレオチド配列について「配列同一性パーセント」というときは、2つの配列を適切にアライメントさせたときに、2つの配列間で同一となる残基数のパーセンテージを意味する。すなわち、80%のアミノ酸配列同一性とは、適切にアライメントさせた2つのポリペプチド配列中の80%のアミノ酸が同一であることを意味する。
配列同一性パーセントは、例えば2つの分子中の各配列をアライメントさせ、2つ配列の情報を直接比較し、アライメントさせた2つのアミノ酸配列間で一致するアミノ酸数を数え、その配列の長さで割り算した結果に100を掛けて求めることができる。
この分析に、入手が容易なコンピュータプログラムを用いることができる。このようなプログラムには、Smith and Waterman (1981) Advances in Appl. Math. 2:482-489に記載されたペプチド分析用の局所的相同性アルゴリズムが適用された"Atlas of Protein Sequence and Structure", M.O. Dayhoff et., Suppl. 3:353-358, National Biomedical Research Foundation, Washington, DC中のALIGN, Dayhoff, M.O.等がある。
ヌクレオチド配列同一性を求めるプログラムは、Wisconsin Sequence Analysis Package, Version 8 (販売元Genetics Computer Group社, Madison, WI) 中に含まれており、例えばSmith とWatermanのアルゴリズムを利用したBESTFIT, FASTA 及びGAPプログラムを用いることができる。これらのプログラムは、製造者が推奨し、上記のWisconsin Sequence Analysis Packageにも記載されているように、初期パラメータを5に設定することにより、容易に使用することができる。配列同一性の決定に適したアルゴリズムの例として、Altschul, et al., J. Mol. Biol. 215:403-410 (1990) に記載されたBLASTアルゴリズムが挙げられる。BLAST分析を行うためのソフトウエアは、National Center for Biotechnology Information (http://www.ncbi.nlm.nih.gov/) から自由に入手できる。また、相同性パーセントを決定するためのコンピュータプログラムも容易に入手できる。
【0062】
「性質」、またはポリペプチドに関する文脈上これと同義で用いられる語は、ポリペプチドの検出または選択可能な性質または属性を意味する。このような性質の非限定的例示として酸化安定性、基質特異性、触媒活性、熱安定性、活性の温度および/またはpH依存性、加工安定性、及び 分泌能力が挙げられる。
【0063】
高温下や低pHでの安定性等の性質に関して「改善された安定性」というときは、例えばSEQ ID NO: 1のフィターゼ等の他のフィターゼと比較して、より高い酵素活性が長時間保持されることを意味する。本願では、比較する他のフィターゼが特定されていない限り、「改善された安定性」というときは、SEQ ID NO: 1のフィターゼに対しより高い酵素活性が長時間保持されることを意味する。
【0064】
「熱的に安定」及び「熱安定性」とは、この発明のフィターゼが、高温に曝された後、特定の値の酵素活性を保持していることを意味する。この発明のフィターゼ変異体は、pH 5.5の緩衝液中で10分間特定の温度に曝された後その活性を50%以上保持している場合、特定の温度において熱安定性であるものとする。
【0065】
この発明のフィターゼ変異体について「改善された熱活性」というときは、そのフィターゼ変異体が高温下において、SEQ ID NO: 1等の他のフィターゼの酵素活性と比較して、同等又はより高い酵素活性を示すことを意味する。本願では、他のフィターゼが特定されていない限り、「改善された熱活性」とはSEQ ID NO: 1のフィターゼの熱活性と比較した、この発明のフィターゼ変異体の熱活性を意味する。熱活性に関しては、後述する実施例6にさらに詳しく説明する。
【0066】
本願では「ポリヌクレオチド」と「核酸」を同義で用い、任意の長さの高分子状のヌクレオチドを意味し、リボヌクレオチドまたはデオキシリボヌクレオチドのいずれかを意味する。これらの用語には、単鎖、二重鎖、三重鎖DNA、ゲノムDNA、cDNA、RNA、ハイブリッドDNA-RNA、またはプリン及びピリミジン塩基から成るポリマー、またはその他の天然、化学的、生化学的に修飾された非天然または誘導体化されたヌクレオチド塩基が含まれる。
【0067】
「遺伝子」とは、ポリペプチドをコードするポリヌクレオチド(例えばDNAセグメント)を意味し、コード領域の上流側及び下流側の領域と、各コードセグメント(エクソン)間の中間配列(イントロン)とを含む。
【0068】
本願では「DNA構築体」、「形質転換DNA」、及び「発現ベクター」を同義で用い、これらの用語は宿主細胞または有機対中に配列を導入するために用いられるDNAを意味する。DNAはPCR、または公知の他の適切な方法によってin vitroで調製する。DNA構築体、形質転換DNA、又は組み換え発現カセットを、プラスミド、染色体、ミトコンドリアDNA、プラスチドDNA、ウイルス、または核酸の断片に組み込むことができる。
通常、発現ベクター、DNA構築体、または形質転換DNAの組み換え発現カセット部位は、他の配列に加え、転写される核酸配列とプロモータとを備える。好ましい実施形態では、発現ベクターは宿主細胞中に非相同DNA断片を導入して発現させることができる。
【0069】
本願で「ベクター」というときは、核酸を1以上の細胞型中に導入するために設計されたポリヌクレオチド構築体を意味する。ベクターには、クローン化ベクター、発現ベクター、シャトルベクター、プラスミド、カセット等が含まれる。
【0070】
細胞中への核酸配列の導入に関して「導入した」というときは、細胞中への核酸配列の移送に適した任意の方法を意味する。このような導入方法の非限定的例示として、原形質融合、トランスフェクション、形質転換、接合、形質導入が挙げられる。また核酸配列が細胞のゲノムに導入され(例えば染色体、プラスミド、プラスチド、またはミトコンドリアDNA)、自立的レプリコンに転換されるか、または過渡的に発現される(例えばトランスフェクトRNA)、真核性または原核性細胞への核酸配列の導入を参照することができる。
【0071】
「最適アライメント」とは、最も高い配列同一性パーセントを与えるアライメントを意味する。
【0072】
本願では「タンパク質」と「ポリペプチド」を同義で用いる。本願では、アミノ酸残基について従来用いられている1文字及び3文字のコードを使用する。アミノ酸の3文字のコードはIUPACIUB Joint Commission on Biochemical Nomenclature (JCBN) の定義に従う。遺伝子コードの縮重のため、ポリペプチドは1以上のヌクレオチド配列でコードされる。
【0073】
本願の変異体は、以下の命名法により記載する。[SEQ. ID NO: 1の元のアミノ酸残基/SEQ. ID NO: 1の元のアミノ酸残基の位置/置換したアミノ酸残基] 。
例えばSEQ ID NO: 2では、SEQ ID NO: 1における位置89にあった元のアラニン(A)のスレオニンによる置換はA89Tと表わされる。置換される位置が特定のアミノ酸を示すことなく指定されている場合、任意のアミノ酸がその位置にあるアミノ酸残基により置換されることを意味する。
フィターゼ変異体が、他のフィターゼとの比較において欠失を有する場合、欠失を「*」で表示する。例えばSEQ. ID NO: 1の位置89の欠失は、A89*と表わす。連続した2以上のアミノ酸の欠失は、例えば(89 - 91)* と表記する。
【0074】
「シグナル配列」または「シグナルペプチド」とは、成熟タンパク質または前駆体タンパク質の分泌に関与するヌクレオチドおよび/またはアミノ酸配列を意味する。
このシグナル配列の定義は機能面に関するものであり、タンパク質遺伝子のN-末端部位によりコードされ、タンパク質の分泌に関与する全てのアミノ酸配列を包含することを意図している。「シグナル配列」または「シグナルペプチド」は、タンパク質のN-末端部位または前駆体タンパク質のN-末端部位に結合していることが多いが、槽でない場合もある。
【0075】
「宿主株」または「宿主細胞」とは、この発明のDNAを含む発現ベクターに適した宿主を意味する。
【0076】
本願で「から誘導された」または「から得られた」というときは、対象とする有機体の株から産出された、または産出され得るフィターゼだけでなく、このような株から単離されたDNA配列でコードされ、このようなDNA配列を有する宿主有機体中で産出されたフィターゼを意味する。さらに、これらの用語は、合成および/またはcDNA起源のDNA配列でコードされたフィターゼであって、対象とするフィターゼと同等の性質を備えるフィターゼを意味する。
すなわち、別のフィターゼ「から誘導された」または「から得られた」フィターゼは、そのフィターゼが別のフィターゼから物理的に誘導され物理的に得られたものである必要は無く、対象とするフィターゼが、別のフィターゼに関する知見から得られた知見又はアイデアを用いて産出されたものであってもよい。
【0077】
「機能性断片」とは、ポリペプチドの断片であって、そのポリペプチドの特徴的性質を保持している断片を意味する。本願では、フィターゼ酵素の機能性断片とは、このタンパク質全体が有するフィターゼ活性を保持している断片を意味する。
【0078】
「単離された」、「回収された」、または「精製された」とは、その元の状態から取り出された物質を意味する。「実質的に精製された」とは、その物質が少なくとも有意な程度に精製されたことを意味する。
【0079】
一側面では、ヌクレオチドまたはアミノ酸配列は単離された形態であることが好ましい。「単離された」とは、その配列が、少なくとも天然においてその配列とともに存在する少なくとも1の成分を実質的に含まないことを意味する。
【0080】
一側面では、ヌクレオチドまたはアミノ酸配列は精製された形態であることが好ましい。「精製された」とは、その配列が相対的に純粋であことを意味し、純度は少なくとも1%または5%、より好ましくは少なくとも20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%である。好ましい実施形態では、ポリペプチドについて言及するとき、上記の純度はSDS-PAGE電気泳動によって他のポリペプチドから精製されたものについて測定する。好ましい実施形態では、好ましい実施形態では、ポリヌクレオチドについて言及するとき、上記の純度は他のポリヌクレオチドから精製したものについて測定する。
【0081】
本願で「発現」、「発現する」、「発現された」、及び「発現可能」という用語は、それぞれ「転写」、「転写する」、「転写された」、及び「転写可能」と同義で用いる。
【0082】
本願では、「形質転換」及び「トランスフェクション」という用語は、核酸配列を宿主、宿主細胞、組織または器官に導入する方法を意味する。
【0083】
本願で「産出」、「産出する」、「産出された」、「産出可能」という用語は、「生産」、「生産する」、「生産された」、「調製」、「製造された」、「製造」及び「生産可能」と同義で用いる。
【0084】
「飼料」及び「食品」は、動物(飼料)またはヒト(食品)によって食べられ、食され、消化されるために適するか、またはこれらを目的とした天然または人工的な食用品、食物等、またはこのような食物等の成分を意味する。
【0085】
「食品または飼料用添加剤」とは、食品または飼料への添加に適するか、または添加を目的とした化合物、または多成分から成る組成物を意味する。食品または飼料用添加剤は、ビタミン、ミネラル、飼料強化酵素とその担体および/または賦形剤等の、1以上の化合物から成るが、そうでなくてもよい。飼料用添加剤は、通常飼料への添加に適した形態で供給される。
【0086】
「澱粉液状化」とは、澱粉をより短鎖で低粘度のデキストリンに転換するプロセスを意味する。
【0087】
「基質」とは、この発明の酵素の作用を受け得る少なくとも1の成分が含まれる物質を意味する。このような成分の例として、フィチン酸エステル、及びイノシトール・ペンタホスフェート、イノシトール・テトラホスフェート、イノシトール・トリホスフェート、イノシトール・ジホスフェート、及びイノシトール・モノホスフェート等の、フィチン酸エステルの分解中間生成物等が挙げられる。このような成分を含む基質の例として、例えば飼料の原料、液状化、糖化、発酵、同時糖化/発酵 、および/または例えば発酵アルコール(例えばエタノールまたはブタノール)製造の一段階プロセスにおいて用いられる穀粒、穀物、その他の植物性物質または炭水化物、またはアルコール(例えばエタノールまたはブタノール)製造時の発酵に用いられる糖、または他の製品(例えば非アルコール製品)の製造に用いられる糖が挙げられる。
【0088】
「アルコール発酵」とは、微生物(例えば酵母)が基質をアルコール(例えばエタノールまたはブタノール)に分類される代謝産物に転換する発酵プロセスを意味する。
【0089】
「プロモータ」とは、RNAポリメラーゼの結合に関与して遺伝子の転写を開始する調節配列を意味する。
【0090】
「転写制御下」という用語は周知であり、ポリヌクレオチド配列、通常はDNA配列の転写が、その配列が動作可能に結合し、転写の開始または促進に寄与するエレメントに依存することを示している。
【0091】
「翻訳制御下」という用語は周知であり、mRNAが形成された後に生じる制御プロセスを意味する。
【0092】
本願でタンパク質と、そのタンパク質をコードする遺伝子について記述する際、遺伝子は原文ではイタリックで表記した(例えばバティアクセラフィターゼをコードする遺伝子)。タンパク質は原文ではイタリック体で記載せず、最初の文字を大文字にして表記した。
【0093】
「動作可能に結合」とは、複数のエレメントが相互に機能的に関連し得るように配置された並列関係を意味する。例えば、プロモータが配列の転写を制御している場合、プロモータはコード配列に動作可能に結合している。
【0094】
「選択マーカ」とは、宿主細胞中で発現することができる遺伝子であって、核酸またはベクターが導入された宿主細胞の選択を容易することができる遺伝子を意味する。
選択可能マーカの非限定的例示として、抗生物質耐性の賦与(例えばハイグロマイシン、ブレオマイシン、またはクロラムフェニコール)、および/または、宿主細胞への栄養的選択性の賦与等、代謝選択性を賦与する遺伝子が挙げられる。
【0095】
ポリヌクレオチドまたはタンパク質に関して「非相同」と言うときは、天然の宿主細胞中には生じないポリヌクレオチドまたはタンパク質を意味する。
【0096】
ポリヌクレオチドまたはタンパク質に関して「内因性」と言うときは、天然の宿主細胞中に生じるポリヌクレオチドまたはタンパク質を意味する。
【0097】
「回収された」、「単離された」、及び「分離された」とは、天然においてその化合物等とともに存在する少なくとも1の成分が除去された化合物、タンパク質、細胞、核酸またはアミノ酸を意味する。
【0098】
細胞に関して「形質転換された」、「安定的に形質転換された」、及び「遺伝子組換え」と言うときは、その細胞がゲノムに組み込まれるか、またはエピソーム・プラスミドとしての非天然(例えば非相同)核酸配列を、数世代にわたり保有することを意味する。
【0099】
「発現」とは、遺伝子の核酸配列に基づいてポリペプチドが産出されるプロセスを意味する。このプロセスには転写と翻訳とが含まれる。
【0100】
この発明の実施または試験には、本願に開示した方法及び材料と同一または均等の方法及び材料を用いることができる。以下、好ましい方法及び材料の例を示す。本願に記載した全ての刊行物は、刊行物に記載された方法および/または材料であって本願に開示するに関連する事項を、必要な範囲において本願に参照として組み込まれる。
【0101】
その他の用語の定義は明細書に随時記載する。この発明の実施形態を詳しく例示する前に、本願は実施形態に限定されず、適宜変更できることを理解されたい。また、本願で用いる用語は特定の実施形態を説明するためだけのものであり、この発明の範囲は特許請求の範囲によってのみ定められることを理解されたい。
【0102】
数値範囲が記載されているとき、文脈上そうはでないことが明らかではない限り、上限値と下限値の間の中間の数値が、下限値の単位の十分の一まで開示されているものとする。本願に示す数値範囲の中間の値の上限値と、本願に示す数値範囲の中間の別の値の下限値の間のより狭い数値範囲も、本願の範囲に含まれる。このような狭い数値範囲の上・下限値はそれぞれ独立してその数値範囲に含まれるか、または含まれない。また、本願に開示する範囲から特に除外されているかにより、上・下限値のいずれか、または両方が狭い数値範囲に含まれるか、または含まれない範囲も本願発明の範囲に含まれる。本願に開示する範囲に上・下限値のいずれか、または両方が含まれている場合、上・下限値のいずれか、または両方を除外した範囲も本願発明の範囲に含まれる。
【0103】
特に断りの無い限り、原文の"a", "an,"及び"the"等の単数形には、複数形も含まれる。すなわち、原文で" a gene "というときは複数の遺伝子も含まれ、"the cell"というときは複数の細胞及び公知の均等な細胞等が含まれる。
【0104】
本願に記載した刊行物は、単に本願出願前の先行技術を開示するものである。これら刊行物がこの発明の範囲の先行技術を構成することを認めたものと解釈してはならない。
【0105】
親酵素または前駆体酵素として用いられるフィターゼ酵素にはバティアクセラ属フィターゼ、及びバティアクセラ属フィターゼに相当する酵素が含まれる。いくつかの実施形態では、親バティアクセラ属フィターゼは、受託番号NCIMB 41248で寄託された株に由来するアミノ酸配列を備える。いくつかの実施形態では、親バティアクセラ属フィターゼは、SEQ ID NO: 1に示すアミノ酸配列を備える。
いくつかの実施形態では、親バティアクセラ属フィターゼは、B.アグレスティス、B.ブレンネラーゼ、B. フェラグティアエ、B. ガビニアエ、B. イザルディイ、B. ノアキアエ、及びB. ワームボールディアエに由来する。親バティアクセラ属から得られるか、または由来するフィターゼ、及び親バティアクセラ属フィターゼ酵素に相当する酵素を開示しており、本願に参照として組み込まれるWO 2006/043178が参照される。
いくつかの実施形態では、野生型バティアクセラ属フィターゼ変異体は、SEQ ID NO: 1のポリペプチドに対し、アミノ酸配列同一性を少なくとも50%、少なくとも60%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも93%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%有する。
【0106】
この発明のひとつの実施形態は、フィターゼ変異体に関する(例えばバティアクセラ属フィターゼ変異体)。特にWO 2006/043178には、そこに開示されたSEQ ID NO: 3のアミノ酸配列を有する野生型フィターゼ酵素の突然変異導入が開示されている。WO 2006/043178には多数の好ましい突然変異導入が開示されている。
フィターゼ変異体は少なくとも1のアミノ酸置換、欠失、または挿入を有し、通常アミノ酸置換が好ましい。アミノ酸置換、欠失、または挿入は、フィターゼのペプチドの任意の残基において生じる。本願のフィターゼ変異体は、本願に開示するSEQ ID NO: 1のアミノ酸配列と同一のアミノ酸配列を備えていない変異体である。
【0107】
本願の好ましい実施形態では、本願のフィターゼ変異体はバティアクセラ属フィターゼに対し置換を有し、より詳しくはSEQ ID NO: 1の等価な位置に対応する置換を有する。いくつかの実施形態では、置換はA, C, D, E, F, 0, H, I, K, L, M, N, P, Q, R, S, T, V, WまたはYに相当する、残りの19のアミノ酸からなる。しかし、合成アミノ酸または他のアミノ酸を用いることもできる。
【0108】
フィターゼ変異体は、変異体を産出させるためのカセット法、PCR変異導入法、またはその他の方法等の公知の方法により、フィターゼタンパク質をコードするDNA中のヌクレオチドにランダム変異導入、部位飽和変異導入、及び部位特異的変異導入し、その後細胞培地で培養することにより産出させることができる。Morinaga et al., (1984) Biotechnology 2: 646 -649; Nelson and Long, (1989) Analytical Biochem., 180: 147 - 151 及びSarkar and Sommer (1999) Biotechniques 8: 404-407を参照することができる。公知の方法を用いたin vitro合成によりフィターゼ変異体タンパク質の断片を調製することもできる。
【0109】
ポリヌクレオチドは公知の標準的な方法で得ることができ、例えばクローン化DNA(例えばDNAライブラリー)、化学合成、cDNAクローン化、PCR (USP 4,683,202 またはSaiki et al., Science 239:487 - 491(1988))、公知の合成的方法(Beucage et al., (1981) Tetrahedron Letters 22: 1859 -1869 及びMatthes et al, EMBO J. 3:801 - 895(1984))、またはゲノムDNAのクローン化またはここから派生する断片、例えばバティアクセラ属等の所望の細胞からの精製により得ることができる(例えば Sambrook et al., 2001, Molecular Cloning, A Laboratory Manual, 3d Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York; Glover, DM and Hames, BD (Eds.), 1995, DNA Cloning 1: A Practical Approach and DNA Cloning 2: A Practical Approach, Oxford University Press, Oxford参照)。ゲノムDNAに由来する核酸配列、及びこの核酸配列からの派生物には、コード領域に加え、調節領域が含まれていてもよい。
【0110】
ポリペプチドを発現させるために、公知の組換体DNA発現法(例えばGoeddel; Gene Expression Technology. Methods in Enzymology 185, Academic Press, San Diego, Calif. (1990)参照)を用いることができる。例えば、所望のポリペプチドをコードするDNAを発現ベクター中に挿入し、次にこの発現ベクターを適切な宿主細胞中に形質転換することができる。発現ベクターの設計は、調節配列の選択も含め、選択する宿主細胞の種類、目的のタンパク質を発現させる量、発現が構成的であるか誘導的であるか等の要因に依存する。
【0111】
発現ベクターの宿主細胞中へのトランスフェクションは、電気穿孔、リン酸カルシウム共沈法、及びDEAE-デキストラントランスフェクション等の、公知の方法によって行うことができる。本願のベクター中のDNAの発現またはクローン化に適した宿主細胞は、原核生物、酵母、または上記の植物性細胞等の真核生物の細胞である。原核生物に加え、糸状菌または酵母等の真核性微生物も、本願のフィターゼ変異体のクローン化宿主または発現宿主に適している。
【0112】
タンパク質を産出させるために、宿主細胞を上記の発現ベクターまたはクローン化ベクターで形質転換し、プロモータの誘導、形質転換体の選択、または所望の配列をコードする遺伝子の増幅に適するように改良した公知の栄養培地で培養することができる。温度、pH等の培養条件は、発現用に選択した宿主細胞の培養条件と同じであり、当業者であれば容易に理解できる。
【0113】
宿主細胞から産出されたポリペプチドは、例えばヒドロキシアパタイトクロマトグラフィー、ゲル電気泳動、透析、及びアフィニティクロマトグラフィー等により精製することができる。
【0114】
いくつかの実施形態では、本願のフィターゼ変異体は改変された性質を有する。好ましくは、本願の実施形態に係るフィターゼ変異体は、SEQ. ID NO: 1の野生型フィターゼと比較して改良された性質を有する。いくつかの実施形態では、改変された性質、例えば改良された性質は、熱安定性、熱活性、飼料加工時の安定性、および/または比活性度である(図2参照)。
【0115】
いくつかの実施形態では、本願のフィターゼ変異体は公知のバティアクセラ属フィターゼ(例えばSEQ ID NO: 1に示すバティアクセラ属フィターゼ)と比較して、改善された熱安定性を有する。
いくつかの実施形態では、本願のフィターゼ変異体は野生型バティアクセラ属フィターゼ(BP-WT)と比較して少なくとも21.9℃、少なくとも22.4℃、少なくとも22.6℃、少なくとも22.9℃、少なくとも23.2℃、少なくとも23.4℃、少なくとも23.5℃、少なくとも23.5℃、少なくとも23.7℃、少なくとも24.1℃、少なくとも24.2℃、少なくとも24.4℃、少なくとも24.9℃、少なくとも25.0℃、少なくとも25.9℃、少なくとも26.5℃及び少なくとも26.8℃改善された熱安定性差(TD)を有する。
【0116】
いくつかの実施形態では、本願のフィターゼ変異体はSEQ. ID NO: 1に示す野生型フィターゼと比較して高温において改善された安定性を示す。いくつかの実施形態では、本願のフィターゼ変異体は約65℃、約70℃、約75℃、約80℃、またはそれ以上の温度において熱安定性である。上記のように、本願のフィターゼ変異体は、pH 5.5において指定された温度に10分間曝した後、酵素活性を50%以上保持しているとき、熱安定性であるものとする。
【0117】
いくつかの実施形態では、本願のフィターゼ変異体は相対的に高い熱活性を有する。いくつかの実施形態では、本願のフィターゼ変異体はBP-WTと比較して少なくとも17.4℃、少なくとも17.5℃、少なくとも17.6℃、少なくとも17.8℃、少なくとも17.9℃、少なくとも18.4℃、少なくとも18.7℃、少なくとも18.8℃、少なくとも18.9℃、少なくとも19.0℃、少なくとも19.3℃、少なくとも19.5℃、少なくとも20.0℃、少なくとも20.1℃及び少なくとも20.2℃高い熱活性差(TAD)を有する。
【0118】
いくつかの実施形態では、本願のフィターゼ変異体は1000U/mg、少なくとも1200U/mg、少なくとも1400U/mg、少なくとも1600U/mg、少なくとも1800U/mg、少なくとも2000U/mg、少なくとも2200U/mg、少なくとも2300U/mg、少なくとも2400U/mg及び少なくとも2500U/mgの比活性度を有する。
ここで、実施例3に詳しく示すように、比活性度は10mMのフィターゼと1mMのCaC12を含むpH 5.5の200 mM酢酸ナトリウム緩衝液を用いて67℃においてフィターゼを培養することにより測定する。
【0119】
いくつかの実施形態では、本願のフィターゼ変異体は少なくとも800U/mg、少なくとも1000U/mg、少なくとも1200U/mg、少なくとも1400U/mg、少なくとも1600U/mg、少なくとも1800U/mg、少なくとも2000U/mg、少なくとも2200U/mg、少なくとも2300U/mg、少なくとも2400U/mg、少なくとも2500U/mg及び少なくとも2600U/mgの比活性度を有する。ここで、実施例3に詳しく示すように、比活性度は10mMのフィターゼと1mMのCaC12を含むpH 5.5の200 mM酢酸ナトリウム緩衝液を用いて、80℃においてフィターゼを培養することにより測定する。
【0120】
いくつかの実施形態では、本願のフィターゼ変異体は80℃において熱安定性である。すなわち、pH 5.5において80℃に10分間曝した後、活性を50%保持しているとともに、比活性度が80℃において少なくとも2500U/mgで、67℃において少なくとも2300U/mgである。ここで、実施例3に詳しく示すように、比活性度は10mMのフィターゼと1mMのCaC12を含むpH 5.5の200 mM酢酸ナトリウム緩衝液を用いて、指定された温度においてフィターゼを培養することにより測定する。
【0121】
いくつかの実施形態では、本願のフィターゼ変異体は、本願のフィターゼ変異体(例えばSEQ ID NO: 2に示す変異体)でフィチン酸エステルを処理する工程を含む、リン酸塩化合物を製造する方法において用いることができる。フィチン酸エステルは、ミオ-イノシトールジ-、トリ-、テトラおよび/またはペンタホスフェートである。このほかの適切な有機リン酸塩にはイノシトール-テトラホスフェート、及びイノシトール-オリゴホスフェートが含まれる。
【0122】
いくつかの実施形態では、本願のフィターゼ変異体は実質的にBP-WTと同等の比活性度を保持しているが、BP-WTと比較して高温、高pHおよび/または低pHにおける安定性が向上している。
【0123】
いくつかの実施形態では、本願のフィターゼ変異体は実質的にBP-WTと同等の比活性度を保持しているが、熱安定性が向上している。
【0124】
いくつかの実施形態では、本願に開示するフィターゼ活性を有する酵素を産出させる方法が提供され、この方法には (a)本願のフィターゼ変異体をコードするポリヌクレオチドを含む発現ベクターで形質転換された宿主細胞を調製する工程と、(b) 形質転換された宿主細胞を、この宿主細胞がフィターゼ変異体を産出させるために適した条件下で培養する工程と、(c) 産出されたフィターゼ変異体を回収する工程とが含まれる。
【0125】
いくつかの実施形態では、発現ベクターには、図2に示す各位置に対応するアミノ酸残基における置換を有するアミノ酸配列を含むフィターゼをコードするポリヌクレオチドが含まれている。
【0126】
いくつかの実施形態では、宿主株は、非相同フィターゼ、または本願に開示するフィターゼ活性を有するフィターゼ変異体を発現するように、遺伝子組み換えされている。
【0127】
本願のフィターゼ変異体の産出に有用な宿主細胞は、細菌細胞、菌類細胞、及び植物性細胞である。宿主細胞にはその細胞と子孫細胞の両者、及びこれらの細胞に由来するプロトプラストが含まれ、このプロトプラストを本願のフィターゼ変異体の産出に用いることができる。
【0128】
DNA構築体を有する有用なベクターには、本願のフィターゼ変異体をコードするポリヌクレオチドが含まれ、宿主細胞の形質転換方法は公知であり、公知の技術及び方法を用いることができる。
【0129】
本願では、本願のフィターゼ変異体をコードする核酸を含むDNA構築体は、宿主細胞中でフィターゼ変異体を輸送および/または発現するように構築される。ひとつの実施形態では、DNA構築体は発現ベクターにより宿主細胞に輸送される。この発現ベクターには、フィターゼ変異体のコード配列に動作可能に結合した調整配列(例えばプロモータ、リボソーム結合部位、転写開始及び終止配列、翻訳開始及び終止配列、エンハンサー、IS活性化配列、細胞特異的発現配列、シグナル配列、および/またはターミネータ)が含まれる。
【0130】
フィターゼ変異体をコードするポリヌクレオチドを備えるDNA構築体を含む発現ベクターは、所与の菌類宿主有機体中で自己複製可能なベクター、または宿主のDNA中に組込み可能なベクターであれば、どのようなベクターでもよい。いくつかの実施形態では、発現ベクターはプラスミドまたはバクテリオファージである。いくつかの実施形態では、発現ベクターは予め構築されており、高レベルの転写に必要な配列と選択マーカを有する。いくつかの実施形態では、発現ベクターが発現構造体プロモータ配列及びターミネータ配列の転写制御下にあるようにして、フィターゼ変異体遺伝子のコード領域またはその一部を、汎用発現ベクターに挿入する。いくつかの実施形態では、遺伝子またはその一部を、強cbh1プロモータの下流に挿入する。
【0131】
菌類宿主細胞中でのフィターゼの産出については、上記のSambrook et al., (1989), 上記の Ausubel (1987), van den Hondel et al. (1991) in Bennett and Lasure (Eds.) MORE GENE MANIPULATIONS IN FUNGI, Academic Press (1991) pp. 70 -76 及び 396-428; Nunberg et al., (1984) Mol. Cell BioI. 4:2306-2315; Boel et al., (1984) 30 EMBO J. 3:1581-1585; Finkelstein in BIOTECHNOLOGY OF FILAMENTOUS FUNGI, Finkelstein et al. Eds. Butterworth-Heinemann, Boston, MA (1992), Chap. 6; Kinghorn et al. (1992) APPLIED MOLECULAR GENETICS OF FILAMENTOUS FUNGI, Blackie Academic and Professional, Chapman and Hall, London; Kelley et al., (1985) EMBO J. 4:475 - 479; Penttila et al., (1987) Gene 61: 155-164; 及び U.S. Patent No. 5,874,276が参照される。
好ましいベクターのリストは、Fungal Genetics Stock Center Catalogue of Strains (FGSC, www at fgsc.net)に示されている。
菌類宿主細胞での使用に適したベクターは、pFB6, pBR322, pUC 18, pUC100, pDONTM201, pDONRTM221, pENTRTM, pGEMTM3Z and pGEMTM4Z等のベクターである。
【0132】
いくつかの実施形態では、ベクターは、菌類宿主細胞中に導入されたとき宿主細胞のゲノムに組み込まれて複製されるベクターであれば、どのようなベクターでもよい。このようなベクターの非限定的例示としてFungal Genetics Stock Center Catalogue of Strains (FGSC, <www.fgsc.net>)に示されたベクターが挙げられる。好ましい発現または組込みベクターの別の例は、上記のSambrook et al., (1989), 上記のAusubel (1987), van den Hondel et al. (1991) in Bennett and Lasure (Eds.) MORE GENE MANIPULATIONS IN FUNGI, Academic Press. 396-428 及び U.S. Patent No. 5,874,276等である。
特に好ましいベクターは、pTREX, pFB6, pBR322, PUCI8, pUCI00 及び pENTR/Dである。細菌細胞中での使用に適したプラスミドは、E.coli中で複製可能なpBR322 及びpUC19、または例えばバシラス(Bacillus) 中で複製可能なpE194等である。
【0133】
いくつかの実施形態では、本願のフィターゼ変異体をコードする核酸は、宿主細胞中で転写活性を示す適切なプロモータに、動作可能に結合している。通常、フィターゼ変異体の発現は、公知または今後発見される適切なプロモータの下で行なわれる。いくつかの実施形態では、フィターゼ変異体は宿主の天然のプロモータの下で発現される。いくつかの実施形態では、フィターゼ変異体は宿主細胞中で活性な非相同プロモータの下で発現される。例えば、宿主細胞としてトリコデルマ(Trichoderma)の細胞を用いた場合、プロモータはトリコデルマ宿主細胞中で活性であることが好ましい。
【0134】
いくつかの実施形態では、プロモータは構成的または誘導的プロモータである。「構成的プロモータ」とは、ほとんどの環境的及び発生的条件下で活性なプロモータである。「誘導的プロモータ」または「抑制的」プロモータとは、環境的または発生的規制下で活性なプロモータである。いくつかの実施形態では、プロモータは誘導的または抑制的なものである。
これは、公知のように炭素、窒素または他の栄養素の入手可能性、温度、pH、浸透圧、重金属の存在、インヒビターの濃度、ストレス、またはこれらの組合せ等の環境的要因が変化するためである。いくつかの実施形態では、誘導的または抑制的プロモータは、所定の炭素源の濃度、所定のエネルギー源の濃度、所定の異化生成物の濃度、またはこれらの組合せ等の代謝要素によって誘導または抑制される。
ひとつの実施形態では、プロモータは宿主細胞の天然のプロモータである。例えば、T. リーゼイ(reesei)が宿主細胞の場合、プロモータは、例えばGenBankに受託番号D86235で寄託されたcbh1プロモータ等の、天然のT. リーゼイのプロモータである。
【0135】
好ましいプロモータの非限定的例示としてcbh1, cbh2, egl1, egl2, egl3, egl4, egl5, xyn1, 及び xyn2、 P.クリソゲヌス(chrysogenus)の酸抑制的ホスファターゼ遺伝子(phoA)プロモータ(例えばGraessle et al., (1997) Appl. Environ. Microbiol., 63 :753-756参照)、グルコース抑制的PCK1プロモータ(例えばLeuker et al., (1997), Gene, 192:235-240参照)、マルトース誘導的、グルコース抑制的MET3プロモータ(Liu et al., (2006), Eukary. Cell, 5:638-649参照)、pKi プロモータ、及びcpc1 プロモータが挙げられる。
他の好ましいプロモータの例として、A. アワモリ(awamori)及びA.ニガー(niger)グルコアミラーゼ遺伝子由来のプロモータが挙げられる(例えばNunberg et al., (1984) Mol. Cell Biol. 15 4:2306-2315 and Boel et al., (1984) EMBO J. 3:1581-1585参照)。また、T.リーゼイのxln1遺伝子のプロモータを用いることもできる(例えばEPA 137280Al参照)。
【0136】
いくつかの実施形態では、発現ベクターは構造的遺伝子の下流に転写終結配列を有し、効率的に終結する。いくつかの実施形態では、終結配列とプロモータは同一起源に由来する。別の実施形態では、終結配列は宿主細胞と相同である。特に好ましい終結配列はトリコデルマ株、特にT.リーゼイに由来するcbh1である。他の有用な菌類の終結配列の例には、A.アワモリ及びA.ニガーグルコアミラーゼ遺伝子由来の終結配列が含まれる(例えば上記のNunberg et al. (1984),及び上記のBoel et al., (1984)参照)。
【0137】
フィターゼ変異体をコードするポリヌクレオチド、プロモータ、ターミネータ及びその他の配列から成るDNA構築体を結紮する方法、及びこれらを適切なベクターに挿入する方法は公知である。結合は、適切な制限酵素認識部位を結紮することにより行われる。制限酵素認識部位が無い場合は、公知の方法に従って合成オリゴヌクレオチドリンカーを用いる(例えば上記のSambrook (1989)、及びBennett and Lasure, MORE GENE MANIPULATIONS IN FUNGI, Academic Press, San Diego (1991) pp 70-76参照)。さらに、ベクターは公知の組み換え技術により構築することができる(例えばInvitrogen Life Technologies, Gateway Technology)。
【0138】
<宿主細胞の形質転換、発現及び培養>
DNA構築体またはベクターの宿主細胞中への導入は、形質転換; 電気穿孔; 核ミクロインジェクション; 形質導入; トランスフェクション (例えばリポフェクション媒介及びDEAE-デキストリン媒介トランスフェクション); リン酸カルシウムDNA共沈法による培養; DNA-被覆微粒子の高速ボンバーメント(bombardment); 及び原形質融合等により行うことができる。
【0139】
アスペルギルス(Aspergillus)株及びトリコデルマ株の形質転換方法は、例えばYelton et al. (1984) Proc. Natl. Acad. Sci. USA 81: 1470 - 1474; Berka et al., (1991) in Applications of Enzyme Biotechnology, Eds. Kelly and Baldwin, Plenum Press (NY); Cao et al., (2000) Sci. 9:991 - 1001; Campbell et al., (1989) Curro Genet. 16:53-56; Pentilla et al., (1987) Gene 61:155 - 164); de Groot et al., (1998) Nat. Biotechnol. 16:839 - 842; USP 6,022,725; USP 6,268,328 及びEP 238 023に記載されている。
トリコデルマ株中での非相同タンパク質の発現は、USP 6,022,725; USP 6,268,328; Harkki et al (1991); Enzyme Microb. Technol. 13:227-233; Harkki et al., (1989) Bio Technol. 7:596-603; EP 244,234; EP 215,594; 及びNevalainen et al., "The Molecular Biology of Trichoderma and its Application to the Expression of Both Homologous and Heterologous Genes", in MOLECULAR INDUSTRIAL MYCOLOGY, Eds. Leong and Berka, Marcel Dekker Inc., NY (1992) pp. 129 - 148)に記載されている。
また、フザリウム(Fusarium)株の形質転換については、W096100787 及びBajar et al., (1991) Proc. Natl. Acad. Sci. USA 88:8202 -28212が参照される。
【0140】
また、植物の形質転換に有用なDNA構築体を調製する方法、及び植物を形質転換する方法も公知である。このような方法には、アグロバクテリウム・ツメフアシェンス(Agrobacterium tumefaciens)媒介遺伝子導入、微粒子ボンバードメント、PEG媒介原形質体形質転換、電気穿孔等がある。
例えばUSP 5,780,708; USP 6,803,499; USP 6,777,589; Fromm et al. (1990) Biotechnol. 8:833-839; Potrykus et al. (1985) Mol.Gen. Genet. 199:169 - 177; Brisson et al., (1984) Nature 310:511-514; Takamatsu et al., (1987) EMBO J 6:307-311; Coruzzi et al., (1984) EMBO J 3:1671-1680; Broglie et al. (1984) Science 224:838-843; Winter J and Sinibaldi RM (1991) Results Probl Cell Differ 17:85-105; Hobbs S or Murry LE (1992) in McGraw Hill Yearbook of Science and Technology, McGraw Hill, New York, N.Y., pp 191-196; 及び Weissbach and Weissbach (1988) Methods for Plant Molecular Biology, Academic Press, New York, N.Y., pp 421-463が参照される。
形質転換された細胞は、公知の方法を用い、適切な条件下において振蕩フラスコ培養、実験室、または工業用培養槽における小スケールまたは大スケールの培養(連続式、バッチ式、流加培養を含む)により、生理食塩水及び栄養素(例えば Pourquie, J. et al., BIOCHEMISTRY AND GENETICS OF CELLULOSE DEGRADATION, eds. Aubert, J. P. et al., Academic Press, pp. 71-86,1988及びIlmen, M. et al., (1997) Appl. Environ. Microbiol. 63: 1298-1306参照)を用いて培養することができる。
この発明では、一般的な市販の培地(例えばYeast Malt Extract (YM) ブロス, Luria Bertani (LB) ブロス、及び Sabouraud Dextrose (SD) ブロス)を用いることができる。菌類細胞に適した培養条件は公知であり、科学技術文献や、American Type Culture Collection and Fungal Genetics Stock Center等の菌類の供給元から知得することができる。
【0141】
いくつかの実施形態では、ベクター系により遺伝子的に安定な形質転換体が構築され、フィターゼ変異体をコードする核酸が宿主株の染色体中に安定に組み込まれる。次に、形質転換体を公知の方法により精製する。
【0142】
本願発明に係るフィターゼ活性を有するフィターゼ変異体をコードする非相同ポリヌクレオチドで形質転換された細胞株によるフィターゼ活性を有するフィターゼ変異体の発現を評価するために、フィターゼ活性および/または産出について、タンパク質レベル、RNAレベルでのアッセイ、または機能的バイオアッセイを用いて分析を行うことができる。
通常、このような分析には、ノーザンブロット、ドットブロット(DNAまたはRNA分析)、RT-PCR (逆転写ポリメラーゼ連鎖反応)、または適切にラベルされたプローブ(核酸コード配列に基づく)を用いたin situハイブリッド化、及び公知のサウザンブロッド及びオートラジオグラフィー等が含まれる。
【0143】
さらに、フィターゼ活性を有するフィターゼ変異体の発現または産出は、例えば無機リン酸塩の放出に基づいてフィターゼ活性(FTU)を直接評価することにより、サンプルから直接測定することができる。無機リン酸塩は酸性のバナジウム酸塩-モリブデン酸塩試薬と黄色の錯体を形成する。分光光度計を用いてこの黄色錯体を波長415nmにおいて測定し、無機リン酸塩検量線を用いて放出された無機リン酸塩を定量した。フィターゼ (FTU)の1単位は、フィチン酸エステルから1分間に1マイクロモルの無機リン酸塩(Pi)を放出させる酵素の量である。
【0144】
さらに遺伝子の発現は、例えば細胞、組織切片の免疫染色、または例えばウエスタンブロットまたはELISAによる組織培養基の免疫学的分析等の、免疫学的方法により評価することができる。このような免疫学的方法は、フィターゼの発現の定量分析または定性分析に用いることができる。このような免疫学的方法は公知であり、免疫学的方法に用いる様々な試薬が市販されている。
【0145】
フィターゼ活性の評価方法は公知であり、一例としてFiskeとSubbaRowらが開発した(Journal of Biological Chemistry 66:375-392 (1925))無機リン酸塩の放出を測定する古典的方法が挙げられる。この方法の変形例は、Mitchell et al., Microbiol. 143:245-252 (1997)に記載されている。また別の方法が、FOOD CHEMICALS CODEX, 4th Edition, Committee on Food Chemicals Codex, Institute of Medicine, National Academy Press, Washington, DC, 1996の809-810ページに記載されている。これらの文献を参照として本願に組み込む。
このような評価方法では、分光光度計を用いて比色分析を行い、濃度が既知の無機リン酸塩(Pi)の対照群、またはフィターゼ活性が既知の酵素との反応により調製した対照群と対比する。フィターゼ活性の1単位は、所定の反応条件下でフィチン酸エステルから1分間に1 μmol のPiを放出させるために必要な酵素サンプルの量と定義される。USP 6,221,644及びUSP 6,139,902も参照することができる。
【0146】
この発明のいくつかの実施形態では、トリコデルマまたはアスペルギルス宿主細胞から発現されフィターゼ活性を有するフィターゼ変異体の量は、タンパク質1グラム/培地1リットル(g/l)以上であり、あるいは2 g/l以上、5 g/l以上、10 g/l以上、20 g/l以上、25 g/l以上、30 g/l以上、50 g/l以上、または100 g/l以上である。
【0147】
本願の核酸配列の発現により産出されたポリペプチドは、公知の様々な方法により、細胞発酵培地から単離または回収して実質的に精製することができる。当業者であれば、適切な分離精製方法を選択することができる。
本願のフィターゼ変異体は、培地または宿主細胞の溶解物から回収することができる。膜結合している場合、適切な界面活性剤溶液(例えばTriton-X 100)または酵素分解によって放出させることができる。
フィターゼの発現に用いた細胞は、例えば凍結融解の繰返し、超音波処理、機械的細胞破砕、または細胞溶解試薬等の様々な化学的または物理的方法によって崩壊させることができる。組み換え細胞タンパク質またはポリペプチド由来のフィターゼを精製することが望ましい。
次に示す方法は、適切な精製方法の例示である:イオン交換カラムによる分画;エタノール沈殿法;逆相HPLC; シリカまたはDEAE等の陽イオン交換樹脂によるクロマトグラフィー;クロマト分画法;SDS-PAGE法;硫酸アンモニウム沈殿法;例えばephadex G-75を用いたゲル濾過法;Protein Aセファロースカラムによる混入物の除去;金属キレートカラムによるエピトープ標識されたフィターゼの結合。
様々なタンパク質精製方法を使用することができる。このような方法は公知であり、例えばDeutscher, METHODS IN ENZYMOLOGY, 182 (1990); Scopes, PROTEIN PURIFICATION: PRINCIPLES AND PRACTICE, Springer-Verlag, New York (1982)に記載されている。
精製方法は、例えば使用する産出プロセスの性質や、産出されるフィターゼの性質に応じて選択される。
【0148】
細胞培地において産出されたフィターゼ、またはフィターゼ変異体(SEQ ID NO: 1で示されるフィターゼを含む)は、培地中に分泌され、例えば細胞培地から不要な成分を除去することにより、精製または単離される。
フィターゼ変異体が細胞中で産出され、細胞溶解物からのフィターゼ変異体の回収が必要となる場合もある。このような場合、公知の方法を用いて、フィターゼ変異体が産出された細胞からフィターゼ変異体を精製する。
このような方法の非限定的例示として、アフィニティクロマトグラフィー法 (例えばTilbeurgh et al., (1984) FEBS Lett. 16:215参照);高溶解能の物質を用いるイオン交換法を含む(例えばMedve et al., (1998) J Chromatography A 808: 153参照)イオン交換クロマトグラフィー法 (例えばGoyal et al., (1991) Biores. Technol. 36:37; Fliess et al., (1983) Eur. J Appl. Microbiol. Biotechnol. 17:314; Bhikhabhai et al. (1984) J Appl. Biochem. 6:336; 及びEllouz et al., (1987) Chromatography 396:307参照);疎水性相互作用クロマトグラフィー法(例えばTomaz and Queiroz, (1999) J Chromatography A 865: 123参照); 二相分配法(例えばBrumbauer, et al., (1999) Bioseparation 7:287参照);エタノール沈殿法;逆相HPLC;シリカまたはDEAE等の陽イオン交換樹脂によるクロマトグラフィー;クロマト分画法;SDS-PAGE法;硫酸アンモニウム沈殿法;および/または、Sephadex G-75を用いたゲル濾過法等が挙げられる。
【0149】
この発明のいくつかの実施形態では、バッチ式または連続式発酵条件下で、非相同のフィターゼ変異体を発現する菌類細胞を培養する。古典的なバッチ式発酵法はクローズドシステムである。
バッチ式発酵法では、発酵を開始するとき培地の各成分を仕込み、発酵中は培地に手を加えない。すなわち、発酵を開始するとき培地に所定の有機体を植菌する。この方法では、系に追加成分を何も添加せずに発酵を行なう。通常、バッチ式発酵は炭素源の添加に関して「バッチ式」であり、通常はpHや酸素濃度等を制御して行われる。バッチ式発酵において、代謝産物及びバイオマス組成物の組成は、発酵を停止させるまで常に変化する。バッチ式発酵の培地内では、細胞は静的誘導期から高成長対数期を経て、成長速度が低下または停止する静止期に至る。なにも処置しない場合、静止期の細胞はやがて死滅する。通常、対数期の細胞が大部分の最終産品の産出に関与する。
【0150】
標準的なバッチ式発酵の変形例は、この発明でも有用な「流加式発酵(fed-batch fermentation)」である。この標準的なバッチ式発酵の変形例では、発酵が進むに従って、基質添加量を漸増させる。流加発酵法は、異化生成物の抑制により細胞の代謝が抑止され、培地中の基質の量を制限することが好ましい場合に適している。流加発酵法における実際の基質濃度の測定は困難であるため、pH、溶解酸素量、CO2等の廃ガスの分圧等の、測定可能な因子の変化に基づいて推定する。バッチ式および流加式発酵は公知である。
【0151】
連続式発酵はオープンシステムであり、所定量の発酵培地を連続的にバイオリアクターへ供給すると同時に、同量の処理された培地を抜き出して、さらに加工する。連続式発酵では、培地を一定の高密度に保ち、細胞を予め対数期まで成長させておく。
【0152】
連続培養法では、細胞の成長および/または最終産品に影響する1以上の因子を調節することができる。例えば、一例では炭素源または窒素源の濃度等の栄養素を一定値に保ちながら他の因子を調節する。別の例では、例えば培養液の懸濁度から求めた細胞濃度を一定に保ちながらその他の細胞の成長に影響する複数の因子を継続的に調節する。
連続培養法では、安定な成長状態を維持するように努める。すなわち、培地の抜き出しによる細胞の減少を、発酵による細胞の増加で補う。連続培養法における栄養素と成長因子の調節方法と、製品の産出速度を最大にする方法は分子生物学の分野では公知である。
【0153】
この発明のひとつの実施形態では、少なくとも1の本願に係るフィターゼ変異体を含む酵素組成物が提供される。本願に係る酵素組成物は、公知の方法を用いて、液体または乾燥固体の形態の組成物として調製することができる。
【0154】
液状組成物には、フィターゼ変異体酵素以外の成分が含まれている必要な無い。フィターゼ変異体酵素は、実質的に精製されているか、または少なくとも一部精製された形態であり、実質的に精製されていることが好ましい。グリセロール、ソルビトール、またはモノプロピレングリコール等の安定剤を添加することもできる。液状組成物に、塩、糖、保存料、pH-調整剤(すなわち緩衝剤)、タンパク質、またはフィチン酸エステル(フィターゼの基質)等の1以上の他の添加剤が含まれていてもよい。一般的な液状組成物は、水またはオイルベースのスラリーである。
【0155】
乾燥固体状組成物はスプレー-ドライにより得られる組成物である。この場合、乾燥された状態において、この組成物にフィターゼ変異体酵素以外の成分が含まれている必要は無い。しかし通常は、乾燥固体状組成物はいわゆる顆粒で、例えば食品や飼料の成分と容易に混合可能であり、あるいは好ましくは混合物の1成分である。顆粒状酵素の粒径は、好ましくは混合物中の他の成分の粒径と適合し得るものである。
【0156】
いくつかの実施形態では、この発明のフィターゼ変異体を含む酵素組成物を、次に示す酵素のいずれかと組み合わせて用いることもできる。グルコアミラーゼ、アルファ-アミラーゼ、プロテアーゼ、プルラナーゼ、イソアミラーゼ、セルラーゼ、ヘミセルラーゼ、キシラナーゼ、シクロデキストリングリコトランスフェラーゼ、リパーゼ、フィターゼ、ラッカーゼ、オキシダーゼ、エステラーゼ、クチナーゼ、ペクチナーゼ、グルコースオキシダーゼ、ベータグルコシダーゼ、フォスファターゼ、ベータ-アミラーゼ、ヒドララーゼ、トランスフェラーゼ、別のフィターゼ、及びこれらの組み合わせ。
【0157】
いくつかの実施形態では、フィターゼ変異体の組成物は、食品または動物飼料用組成物である。食品または動物飼料用組成物中のフィターゼ変異体の濃度は、食品または飼料1kg当たり10から15,000 U(例えば食品または飼料1kg 当たり100から5,000 U、200から2,000 U、または 500から1000 U)である。フィターゼ変異体組成物は、次に示す家畜または動物の消化管において活性な添加剤として用いられる。家禽、ブタ、アルパカ、バイソン、ラクダ、ウシ、チンチラ、シカ、ロバ、アヒル、魚、カエル、ヤギ、ガチョウ、家禽、ウマ、ラマ、ミンク、ラバ、ダチョウ、ハト、トナカイ、ヒツジ、七面鳥、ヤク、水牛、ネコ、チンパンジー、イヌ、フェレット、アレチネズミ、金魚、モルモット、ハムスター、サル、インコ、爬虫類、齧歯動物、及びえび等の魚類や貝類を含む水産養殖動物。
SEQ. ID NO: 1に示す野生型フィターゼと比較して、この発明のフィターゼ変異体はこれらの動物が有するプロテアーゼに対し改善された耐性を示し、あるいはこれらの動物の消化管において活性を長時間示す。
本願は食品または飼料を製造する方法に関し、本願発明に係るフィターゼ変異体を食品または飼料と混合することを特徴とする。フィターゼ変異体の液状組成物は、食品または飼料をペレット化してから添加することができる。
いくつかの実施形態では、飼料には次に示す成分の1以上が含まれている。a) 小粒穀粒(例えば小麦、大麦、ライ麦、オート麦、及びこれらの組合せ)および/またはトウモロコシ、ソルガム等の大粒穀粒等の穀物;b) トウモロコシグルテン、可溶性物質添加乾燥蒸留穀物残渣(DDGS)、小麦フスマ、小麦ミドリング粉、小麦ショーツ、米ぬか、米殻、オート麦殻、 パーム核油、果実の搾りかす等の穀物の副産物;c) 大豆、ヒマワリ、ピーナッツ、ルピン、エンドウ、ソラマメ、コットン、キャノーラ、魚粉、乾燥結晶タンパク質、肉骨粉、ポテトタンパク質、ホエー、コプラ、ゴマ等から得られたタンパク質;d) 植物及び動物から得られた油脂;e) ミネラル及びビタミン;f) 酵素、ベタイン、香味料、精油、 抗生物質成長プロモータ、抗コクシジウム剤、プロバイオティクス、及びプレバイオティクス等の補助的成分。
【0158】
また、動物の排泄物の中のリンの濃度を下げる方法が提供され、この方法は、飼料中のフィチン酸エステルを転換するために十分な量の本願に係るフィターゼ変異体を含む飼料を、動物に与える。
【0159】
さらに、本願に係るフィターゼ変異体組成物を、澱粉加水分解法において用いることができる。本願のフィターゼ変異体組成物は、澱粉の液状化工程、糖化工程、および/または発酵工程において添加することができる。原料に粉砕穀粒等の植物性材料を用いた澱粉の加水分解プロセス(例えば発酵プロセス、醸造または製パンプロセス)において、アルファ-アミラーゼを用いて澱粉の1-4結合を切断する。澱粉の分解にはアミラーゼが必要であるが、アミラーゼに十分な活性を発揮させることが困難な場合がある。
従来、フィチン酸エステルがアミラーゼに対し阻害作用を示すことが知られている。従って、この発明のフィターゼ変異体を含む酵素組成物を澱粉の加水分解プロセスにおいて用いることにより、アルファ-アミラーゼに対するフィチン酸エステルの阻害作用を低減させることができる。
【0160】
フィターゼ、フィチン酸エステル、及び低級フィチン酸リン酸エステルは、パーソナルケア製品、医薬品、及び食品または補助栄養食品、さらに特にクリーニング、テキスタイル、リソグラフィーやケミカルアート等の工業的用途等、多くの用途に用いることができる。好ましくは、例えばこの発明のフィターゼ変異体をアルコール発酵、例えばバイオ燃料の製造に用いることができる。
【0161】
<フィターゼの使用>
上記のように、この発明はまた、本願に係るフィターゼの産出に関する。
【0162】
特に、この発明はさらに、本願に開示するアミノ酸配列の、有機または無機リン酸塩化合物の製造における使用に関する。
【0163】
すなわち、この発明はさらに、フィターゼ変異体をコードするヌクレオチド配列の、発現ベクターの調製における使用、またはフィターゼ変異体を発現させるシステムにおける使用に関する。
【0164】
さらにこの発明は、このような発現ベクターまたはシステムの、フィターゼ変異体を発現する宿主細胞の調製における使用に関する。
【0165】
この発明はさらに、修飾された宿主細胞の、有機または無機リン酸塩化合物の前駆体の調製における使用、または特定の有機リン酸塩化合物の調製における使用に関する。
【0166】
適切な有機または無機リン酸塩化合物には、ミオ-イノシトールペンタキス-、テトラキス-、トリス-、ビス-、及びモノ-ホスフェートが含まれる。
【0167】
すなわち、この発明により、本願に係るフィターゼ変異体によるフィチン酸エステルの処理に適した工程を含む、有機リン酸塩化合物を製造する方法が提供される。好ましくは、有機リン酸塩化合物はフィチン酸エステル、またはミオ-イノシトールジ-、トリ-、テトラ-、及びペンタホスフェートの全立体異性体である。他の好ましい有機リン酸塩化合物は、イノシトール-テトラホスフェート及びイノシトール-オリゴホスフェートである。好ましい実施形態では、この方法はin vivoのバイオテクノロジー的プロセスである。
【0168】
好ましくは、この有機リン酸塩化合物を製造する方法は、
a) 本願のフィターゼ変異体から成る発現可能な導入遺伝子(expressible transgenes)を備える宿主細胞を調製する工程と、
b) 導入遺伝子有機体を、導入遺伝子の発現に適した条件下で培養する工程と、
c) 培地から有機リン酸塩化合物を回収する工程とから成る。
有機リン酸塩化合物は、フィターゼの性質分析等の多数の用途に用いることができる。いくつかのイノシトールホスフェートは細胞内調節のシグナル分子として含有されており、リサーチ化学薬品として使用することができる。
【0169】
別の側面では、食品または飼料を製造する方法が提供される。通常、飼料は飼料粉砕機で製造される。飼料粉砕機において、原料を適切な粒径に粉砕し、次に適切な添加剤と混合する。
飼料は、マッシュまたはペレットの形態で製造される。ペレットは、温度を目標値まで上げ、次に飼料をダイに通過させて特定のサイズのペレットにする方法により製造される。次に、脂肪や酵素等の液状添加剤を添加する。ペレットは、移送する前に冷却する。飼料の製造工程にはさらに、ペレット化工程の前に、特に少なくともスチームの使用等の適切な方法による膨張工程、または押出工程等の追加工程が含まれる。
【0170】
このように、この発明により、フィターゼをコードするアミノ酸配列またはフィターゼを産出するためのフィターゼを発現する宿主細胞の、食品または飼料の製造における使用が提供される。
一側面では、本願のアミノ酸配列の、食品または飼料の製造における使用が提供される。別の側面では、この発明の宿主細胞の、食品または飼料の製造における使用が提供される。別の側面では、この発明の発現ベクターまたはシステムの、食品または飼料の製造における使用が提供される。
【0171】
またこの発明は、動物に与える他の成分を含む配合飼料の一成分として、本願に係る酵素を用いることにも関する。
【0172】
<他の成分との組み合わせ>
この発明のフィターゼ変異体は、他の成分または単体と組み合わせて用いることができる。他の成分の例は、本願に既に説明した。これらの成分や、さらに別の成分について説明する。
【0173】
飼料用酵素に適した単体には小麦(粗びき粉)が含まれる。さらに、脂肪/ワックスや植物ゴムの添加等による、様々なカプセル化方法が知られている。
【0174】
他の成分の例として、増粘剤、ゲル化剤、乳化剤、バインダー、結晶改良剤、甘味料(人工甘味料を含む)、レオロジー改良剤、安定剤、酸化防止剤、染料、酵素、担体、ビヒクル、賦形剤、希釈剤、潤滑剤、香料、着色剤、懸濁剤、崩壊剤、顆粒結合剤等が挙げられる。これらの他の成分は天然のものである。これらの他の成分は化学的および/または酵素的方法で合成されたものでもよい。
【0175】
「増粘剤またはゲル化剤」とは、非混和性液体の液滴、気泡、または不溶性固体の粒子の動きを遅くするかまたは防止して、分離を防ぐ物質を意味する。
【0176】
「安定剤」とは、製品(例えば食品)の経時的変化を防止する材料または材料の組合せを意味する。
【0177】
「乳化剤」とは、エマルジョンの分離を防止する材料(例えば食品用の材料)を意味する。
【0178】
「バインダー」とは、物理的または化学的反応により、製品を結合させる材料(例えば食品用の材料)を意味する。
【0179】
「結晶改良剤」とは、脂肪または水の結晶化に影響を及ぼす材料(例えば食品用の材料)を意味する。
【0180】
「担体」または「ビヒクル」とは、化合物投与に適した物質を意味し、例えば、組成物中の成分に悪影響を及ぼさず、無毒の液体、ゲル、溶媒、液状希釈剤、可溶化剤等の公知の物質である。
【0181】
栄養的に許容される担体の例として、穀物、水、塩の溶液、アルコール、シリコーン、ワックス、ワセリン、植物油等が挙げられる。
【0182】
賦形剤の例として、微結晶性セルロースやその他のセルロース、ラクトース、クエン酸ナトリウム、炭酸カルシウム、二塩基性リン酸カルシウム、グリシン、澱粉、乳糖、高分子量ポリエチレングリコールのいずれか1以上が挙げられる。
【0183】
崩壊剤の例として、澱粉(好ましくはコーン、イモ、またはタピオカ澱粉)、デンプングリコール酸ナトリウム、クロスカルメロースナトリウム、所定の複合ケイ酸塩のいずれか1以上が挙げられる。
【0184】
顆粒結合剤の例として、ポリビニルピロリドン、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルセルロース(HPC)、サッカロース、マルトース、ゼラチン、及びアカシアのいずれか1以上が挙げられる。
【0185】
潤滑剤の例として、ステアリン酸マグネシウム、ステアリン酸、モノベヘン酸グリセリル、タルクのいずれか1以上が挙げられる。
【0186】
希釈剤の例として、水、エタノール、プロピレングリコール、及びグリセリン及びこれらの組み合わせのいずれか1以上が挙げられる。
【0187】
他の成分は、同時に用いる(例えば各成分が混合されている場合、あるいは別々の経路から供給されて予め混合される場合)こともできるし、順次用いる(例えば別々の経路から供給される場合)こともできる。
【0188】
本願で「動物またはヒトの摂取に適した成分」というときは、本願の組成物に補助栄養素として添加することができるか、または添加する化合物を意味する。この補助栄養素は、栄養面での利点を有し、食品繊維の代替となり、または摂取者に何らかの有利な効果をもたらすものである。
【0189】
このような成分の例は、アルギン酸塩、キサンタン、ペクチン、ローカスビーンガム(LBG)、イヌリン、グアーガム、ガラクト-オリゴサッカライド(GOS)、フルクト-オリゴサッカライド(FOS)、ラクトサッカロース、大豆オリゴサッカライド、パラチノース、イソマルト-オリゴサッカライド、グルコ-オリゴサッカライド、及びキシロ-オリゴサッカライド等のプレバイオティックスである。
【0190】
<食品及び飼料>
本願に係る物質を食品及び飼料として使用するか、または食品及び飼料の製造に用いることができる。本願では、「食品」を広い意味で用い、ヒト用の食品及び食物製品だけでなく、動物用の食品(すなわち飼料)も意味する。「飼料」という用語は、家畜の飼育において動物に与える製品の意味で用いる。好ましい側面では、食品または飼料をブタ、家禽、魚等の単胃動物に与える。
【0191】
食品または飼料の形態は、使用目的および/または使用の態様、および/または与え方に応じて、溶液または固体にすることができる。
【0192】
<食品または飼料の原材料及び補助的原料>
本願に係る物質を食品または飼料の原材料に用いることができる。
【0193】
本願で「食品または飼料の原材料」と言うときは、食品または食品に添加するか添加することができる配合物が含まれ、また様々な製品に低濃度で用いられる配合物が含まれる。
【0194】
食品の原材料の形態は、使用目的および/または使用の態様、および/または与え方に応じて、溶液または固体にすることができる。
【0195】
本願に係る物質は補助食品であるか、または補助食品に添加することができる。
【0196】
<食品または飼料組成物>
単胃動物用の飼料組成物には、通常、フィチン酸エステルを含む植物性物質を含有する組成物が含まれている。このような組成物には、コーンミール、大豆ミール、菜種ミール、綿実ミール、トウモロコシ、小麦、大麦、及びソルガムベース飼料が含まれる。
【0197】
本願のフィターゼは、食品または飼料用の物質または組成物であるか、または食品または飼料用の物質または組成物に添加することができる。
【0198】
またこの発明により、食品または飼料用の原材料または補助食品を製造する方法が提供され、この方法には本願の方法により産出されたフィターゼ、または本願に係る組成物と、別の食品原材料とを混合する工程が含まれる。
またこの発明の別の側面は、食品原材料の製造方法に関する。動物の飼料の製造方法は上記のとおりである。フィターゼ変異体を固体状の配合物、またはプレミックス等の飼料用添加剤の形態で添加することができる。固体状の配合物は、混合工程の前または混合工程中に添加し、液状の場合はペレット化工程の後に添加する。
【0199】
<賦形>
この発明の産品および/または化合物は、単独で用いられるか組成物として用いられるかにかかわらず、適宜賦形して用いることができる。また、本願により産出されたフィターゼ(すなわち食品原材料、機能性食品原材料または医薬品原材料等の原材料)は、適宜賦形して用いることができる。
【0200】
賦形の好ましい例は、即効性、遅延放出、放出調節、徐放性、パルス放出、または放出制御用の錠剤、ピル、カプセル、胚珠、溶液または懸濁液のいずれか1以上であり、香料または着色料が含まれていてもよい。
【0201】
一例として、本願の産品および/または組成物を、例えば機能性原材料として錠剤に賦形して用いる場合、この錠剤に賦形剤、崩壊剤、顆粒結合剤、または潤滑剤のいずれか1以上が含まれていてもよい。
【0202】
賦形において用いられ、栄養的に許容される担体の例として、水、塩の溶液、アルコール、シリコーン、ワックス、ワセリン等が挙げられる。
【0203】
賦形に用いる好ましい賦形剤は、ラクトース、澱粉、セルロース、乳糖、または高分子量ポリエチレングリコール等である。
【0204】
水性懸濁液またはエリクサーの形態の場合、フィターゼ分解化合物を、様々な甘味料または香味料、着色剤または染料、乳化剤および/または懸濁剤、及び水、エタノール、プロピレングリコール、グリセリン、及びこれらの組み合わせ等の希釈剤とともに用いることができる。
【0205】
賦形には、ゼラチンカプセル、ファイバーカプセル、ファイバータブレット等も含まれる。
【0206】
以下の実施例は説明を目的としたものであり、この発明の範囲を限定することは意図していない。
【実施例】
【0207】
<実施例と方法>
<実施例で使用する酵素の命名>
フィターゼBP-17(BP 17と呼ぶことがある)は、例えばPCT出願WO 2008/097619に開示されたフィターゼであり、Danisco A/Sから入手することができる。そのアミノ酸配列をSEQ ID NO:5に示す。
【0208】
BP-110(BP 17 var. 110、またはBP17-110、またはBP17 110と呼ぶことがある)は、本願に開示するフィターゼであり、Danisco A/Sから入手することができる。そのアミノ酸配列をSEQ ID NO:6に示す。
【0209】
BP-111(BP 17 var. 111、またはBP17-111、またはBP17 111と呼ぶことがある)は、本願に開示するフィターゼであり、Danisco A/Sから入手することができる。そのアミノ酸配列をSEQ ID NO:7に示す。
【0210】
BP-112(BP 17 var. 112、またはBP17-112、またはBP17 112と呼ぶことがある)は、本願に開示するフィターゼであり、Danisco A/Sから入手することができる。そのアミノ酸配列をSEQ ID NO:2に示す。
【0211】
図5に、BP-17 (SEQ ID NO: 5), BP-110 (SEQ ID NO:6), BP-111 (SEQ ID NO:7) 及びBP-112 (SEQ ID NO:2) のアミノ酸配列を示す。また図2に、BP-112のアミノ酸配列を示す。図4に、BP-112の核酸配列をSEQ ID NO:4として示す。
Phyzyme XP − Danisco A/S社製のフィターゼである。
Natuphos − BASF社製のフィターゼである。
Ronozyme P − Novozymes社製のフィターゼである。
【0212】
<パートA>
<実施例1. フィターゼ酵素の精製>
フィターゼ酵素の精製は、フィターゼ酵素のN-末端に融合した6His-tagを用いて行った。6His-tagフィターゼ酵素をコードするプラスミドで形質転換したB.スブチリスを、ネオマイシン20 mg/lを添加した標準LB培地を用い、振蕩フラスコ中で37℃において160 rpmで撹拌しながら培養した。この段階で、培養培地のフィターゼ活性が顕著に増加した。
約2リットルの培養ブロスのpHを8.0に調整し、濾過した後、Ni-NTAセファロースレジン(Qiagen社)10mlを充填したカラムに通した。このカラムを、OD280が0.05より低くなるまで、pH 8.0の300 mM NaCl, 50 mM Tris-HCl緩衝液で洗浄した。次に、イミダゾールヒドロクロリド250 mMを含む同緩衝液を用いて、結合したフィターゼを流出させた。
流出液をpH 5.0の50 mM酢酸ナトリウムに対し透析し、4℃で保管した。この酵素溶液を、pH 5.0の20 mM酢酸ナトリウム緩衝液で平衡化したResource Sカラムに通し、10カラム容量の0-1 M NaCl塩勾配を用いて溶出させた。任意に、溶出液をpH 5.0の20 mM酢酸ナトリウム緩衝液に対し透析した後、4℃で保管した。
【0213】
<実施例2. フィターゼ活性評価>
マイクロタイタープレートを用いてフィターゼ活性を評価した。反応液の総容積は100マイクロリットルで、後述する緩衝液、フィターゼ10mM、塩化カルシウム1 mM、及び0.05 % (w/v)のPluronic F68が含まれていた。反応は、所定の温度、例えば37℃から90℃の間の温度で、30分間行った。
【0214】
フィターゼ活性の指標となるフィチン酸エステルからのリン酸塩の放出は、少量のサンプル(通常5 μl)を含む、総容積50 μlのリン酸塩検出分析液を37℃で1時間培養して行った。
この分析液には、次の最終濃度となる化合物が含まれていた:1 M Tris/HCl, pH 7.0, 0.01% (v/v) Triton X-100, 0.025 mM ADHP (MoBiTec社, Gottingen, Germany), 0.2 U/ml マルトースホスホリラーゼ, 0.25 mM マルトース, 1.25 U/ml グルコースオキシダーゼ, 0.25 U/ml ホースラディッシュペルオキシダーゼ, 1 mM EDTA, 0.35 mg/ml BSA。
反応は、2700 U/mlのカタラーゼ水溶液30 μlを添加することにより停止させた。次に535 nmの励起波長を用いて、595 nmの蛍光を測定した。リン酸塩の量は、濃度既知のリン酸塩溶液による検量線を用いて求めた。1酵素単位は、リン酸塩放出量1マイクロモル/分と定義される。
【0215】
異なるpHにおけるフィターゼ活性を測定するときは、次の緩衝液を用いた: pH 2.0からpH 3.5の範囲では200 mMグリシン/HCl、pH 4.0からpH 5.5の範囲では100 mM酢酸ナトリウム/酢酸。
【0216】
<実施例. 3比活性度>
実施例1の方法により精製した酵素を用いて、BP-WTとフィターゼ酵素変異体の比活性度を測定した。
【0217】
結合酵素アッセイ法(coupled enzymatic assay)を用いて、マイクロタイター中でフィターゼ活性を測定した。
酵素溶液を希釈緩衝液(50 mM 酢酸ナトリウム, 0.05% Pluronic F-68, 1 mg/ml BSA)で希釈した。5 μlから10 μlの酵素溶液のサンプルを含む総容積80 μlのフィチン酸エステル分析溶液を培養した。
分析溶液には以下の最終濃度となる緩衝液、基質、及び塩が含まれていた:200 mM 酢酸ナトリウム, pH 5.5, 10 mM フィチン酸エステル, 1 mM CaCl2, 0.05 % (w/v) Pluronic F-68。
BP-WTフィターゼの分析溶液は37℃で30分間培養し、フィターゼ酵素変異体の分析溶液は67℃または80℃で30分間培養した。
【0218】
フィターゼ活性の指標となるフィチン酸エステルからのリン酸塩の放出は、少量の各サンプル(通常5 μl)を含む総容積50 μlのリン酸塩検出分析液を37℃で1時間培養して行った。
この分析液には、次の最終濃度となる化合物が含まれていた:1 M Tris/HCl, pH 7.0, 0.01% (v/v) Triton X-100, 0.025 mM ADHP (MoBiTec社, Gottingen, Germany), 0.2 U/ml マルトースホスホリラーゼ, 0.25 mM マルトース, 1.25 U/ml グルコースオキシダーゼ, 0.25 U/ml ホースラディッシュペルオキシダーゼ, 1 mM EDTA, 0.35 mg/ml BSA。
反応は、2700 U/mlのカタラーゼ水溶液30 μlを添加することにより停止させた。次に535 nmの励起波長を用いて、595 nmの蛍光を測定した。リン酸塩の量は、濃度既知のリン酸塩溶液による検量線を用いて求めた。1酵素単位は、リン酸塩放出量1マイクロモル/分と定義される。
【0219】
フィターゼの濃度は、溶液の280 nmの吸光度と、各フィターゼ変異体のそれぞれの吸光係数から求めた。吸光度は、Gill and von Hippel, Analytical Biochemistry 182:319-326 (1989)に記載された方法に従い、タンパク質のアミノ酸組成に基づいて計算した。
【表2−1】

【表2−2】

【表2−3】

【0220】
<実施例4. フィターゼ変異体の調製と分析>
フィターゼ変異体は、フィターゼタンパク質をコードするDNAの様々な突然変異生成法、例えばカセット、PCR突然変異生成、またはその他の突然変異生成法等の周知の方法を用いて調製した。これらの方法には、例えばMorinaga et al., Biotechnology 2:646-649 (1984); in Nelson and Long, Analytical Biochemistry 180:147-151(1989)、あるいはWO 92/18645に開示されたError Threshold Mutagenesis法等の、上記に示した方法が含まれる。PCR突然変異生成法の他の好ましい方法は、Cadwell and Joyce, PCR Methods Appl. 3:136-140(1994)に開示されている。
【0221】
フィターゼ変異体は、次の1以上の発現宿主中で非相同的に発現させた:サッカロミセス・セレビシアエ(Saccharomyces cerevisiae)、バシラス・スブチリス、エシェリキア・コリ(Escherichia coli)。
【0222】
<実施例5. 熱安定性>
フィターゼ変異体の熱安定性は、フィターゼ変異体の不活性化温度により評価した。不活性化温度は、フィターゼ酵素を異なる温度においてpH 5.5で10分間培養し、次に37℃で60分間培養した後の残留活性により評価した。残留活性は、pH 3.5 、37℃において60分間フィターゼ活性を測定して求めた。
不活性化温度は、室温において同一条件下で同一時間培養した後の残留活性と比較して、残留活性が50%になる温度と定義される。活性測定データを外挿または内挿することにより、残留活性が50%になる温度を求めた。異なる2種の酵素の不活性化温度の差を計算することにより、単位℃で表す熱安定性差 (TD)を求めた。
【表3】

【0223】
<実施例6.熱活性>
フィターゼの熱活性を、その温度依存性から評価した。フィターゼ熱活性の温度依存性の指標として、T50を設定した。T50とは、そのフィターゼ変異体の最適温度における基質の酵素代謝回転(enzymatic turnover)と比較して、温度を除き同じ条件で反応させたときの基質の総酵素代謝回転が50%になる温度である。
フィターゼ熱活性の温度依存性は、実施例2に示した条件下でpH 5.5及び種々の温度においてフィターゼ酵素を培養することにより測定した。T50の値は、測定データの内挿及び外挿により求めた。異なる2種の酵素のT50値の差を計算することにより、単位℃で表す熱活性差 (TAD)をより求めた。
【表4−1】

【表4−2】

【0224】
<実施例7 - フィターゼ変異体の性質>
Table 4に、上記の実施例3, 5 及び6のフィターゼ変異体の比活性度、熱安定性、及び熱活性を示す。
【表5−1】

【表5−2】

【表5−3】

【0225】
<パートB>
<実施例8−イントロダクション>
この発明は、特に飼料用酵素として有用で有効な性質を備える新規なフィターゼを提供できるという優れた効果を奏する。特に、この発明は本願に開示する単離および/または精製された新規なフィターゼポリペプチド、または機能性断片、またはこれらの変異体または修飾された形態、またはこれらの修飾された形態に関する。この発明はまた、本願のフィターゼをコードする核酸配列に関する。
【0226】
食品または飼料用の酵素添加剤として有効であるためには、フィターゼは多数の異なる性質を備えている必要がある。動物の胃の中の酸性環境下でフィチン酸を分解できるために、低pHにおいて活性である必要があり、好ましくは広いpH範囲において活性である必要がある。
さらに、フィターゼは高い比活性度を有する必要があり、またペレット飼料等の飼料を製造する際に一般的に用いられている高温度に耐えることが可能な、高い熱安定性を有することが好ましい。
【0227】
また、フィターゼはフィチン酸エステルだけでなく、イノシトール・ペンタホスフェート、テトラホスフェート、及びトリホスフェート等の、フィチン酸エステル分解における中間体も加水分解することができる、幅広い基質特異性を有することが重要である。さもないと、これらのイノシトールオリゴホスフェートは小腸及び大腸に不溶性の状態で残留し、動物及び腸内微生物から産出されるアルカリ性ホスファターゼがアクセスできないことが、ブタにおけるフィチン酸エステルの分解の研究から解明されている。異なる酵素の基質特異性プロファイルのバリエーションが明らかにされている。例えば、B. スブチリス由来のフィターゼから産出されたイノシトール-トリホスフェートは、この酵素によるさらなる加水分解に対し耐性を示す。
【0228】
本願の変異体は、以下のいずれかについて改善された性質を示す。温度安定性、pH範囲、ペプシン安定性、比活性度、基質特異性、及び広範な基質特異性。これらの性質の測定に適した方法は、本願に開示されている。
【0229】
フィターゼの性質の改良は特に、食品及び飼料加工条件下での酵素安定性、消化器系における酵素安定性、ヒトまたは動物の胃および/または腸管における酵素活性及び安定性に向けられ、改良された変異体を補助飼料として特に好適に用いられるようにしている。すなわち、このような改善には、高温、好ましくは65℃を超える温度での安定性の向上、タンパク質分解消化、好ましくはペプシン等の消化管のプロテアーゼに対する安定性の向上、低pHでの触媒活性の向上、好ましくはpH 5.5未満での触媒活性の向上、及びフィチン酸エステル、好ましくはこれに加えイノシトールホスフェートからのホスフェート基の放出の一般的効率が含まれる。
【0230】
この発明のフィターゼの性質の改善は、食品及び飼料製造での使用、及び食品及び飼料製品用の添加剤としての使用に向けられている。特にこの発明のフィターゼの性質の改善は、食品及び飼料加工条件下での酵素安定性、消化器系における酵素安定性、ヒトまたは動物の胃および/または腸管における酵素活性及び安定性に向けられている。このような改善には、高温、好ましくは65℃を超える温度での安定性の向上、タンパク質分解消化、好ましくは消化管のプロテアーゼに対する安定性の向上、低pHでの触媒活性の向上、好ましくはpH 5.5未満での触媒活性の向上、及びフィチン酸エステルからのホスフェート基の放出の一般的効率が含まれる。
【0231】
高温での安定性の増大は、酵素の不活性化温度により定量的に分析する。不活性化温度は、フィターゼ酵素を所定の時間培養して室温まで冷却した後の残留活性が、同じフィターゼ酵素を室温において同一時間かつ同一条件下で培養したときの残留活性の50%になる温度と定義される。熱安定性差は2つの酵素の不活性化温度の差であり、単位℃で表される。
【0232】
<実施例9. ペプシン安定性>
<Phyzyme XP, Natuphos,及び Ronozyme Pと比較した、バティアクセラ(Buttiauxella)由来フィターゼ変異体BP-17, BP-110, BP-111, 及びBP-112の、pH 2におけるペプシン耐性>
<使用した材料と方法>
<緩衝液>
ペプシン培養緩衝液: 0.1 Mグリシン-HCl,pH 2.0、BSA 3 mg/ml、 無水塩化ナトリウム 2.9 mg /mL、 塩化カルシウム 0.73 mg/mL。
ペプシン溶液については、ペプシン (Sigma P-7000, 10000 U/mg 、27 mg/mlに相当)を500, 1000, 3000, 6000, または 10000 U/ml含む培養緩衝液をそれぞれ調製した。
1ペプシン単位は、ヘモグロビン(Food Chemical Codex社)を基質に用いたTCA溶解性製品としてpH 2.0で37℃において測定したとき、ΔOD280の増加が毎分0.001となる量の酵素と定義される。
フィターゼ分析用緩衝液:250 mM緩衝酢酸溶液, pH 5.5
BSAを含むフィターゼ分析用緩衝液:BSAを3 mg/ml含む250 mM緩衝酢酸溶液, pH 5.5
【0233】
<ペプシン濃度の増加に対する耐性>
全てのフィターゼ酵素は同様にして準備した:フィターゼ酵素を含む6種のサンプルを調製した(各2件):4種のサンプルについては、緩衝液中のペプシン濃度を増加させ (pH 2)、1種のサンプルについては、ペプシン無添加で、培養緩衝液(pH2)のみを用い、1種のポジティブ・コントロールサンプルは、BSAを含む分析用緩衝液中にフィターゼを含有していた(pH 5.5)。
【0234】
各サンプルについて、100 μlのフィターゼ酵素溶液と、900 μlのフィターゼ分析用緩衝液、またはペプシンを含まない培養緩衝液、またはペプシン濃度が増加する培養緩衝液とを混合し、40℃で培養した。120分間培養した後、100 μlを抜き出し、フィターゼ分析用緩衝液900 μlと混合した。その後直ちに、ISO国際規格ISO/DIS 30024に記載されたリン酸塩検量線に対し、各サンプルのフィターゼの分析をpH 5.5において行った。
【0235】
<結果>
<ペプシン耐性>
全てのバティアクセラ由来の変異体は、pH 2においてペプシンに対し優れた安定性を示した。これに対し、Natuphosの活性は、ペプシン濃度が500 U/mlのとき大幅に低下し、その後さらに活性が低下し、ペプシン濃度3000 U/mlにおいて約45%で一定になることが認められた。
Ronozyme Pの場合はさらに劣っており、ペプシン濃度が500 U/mlのとき20%まで低下した(Fig 6A と Table 4参照)。
【0236】
Figure 6に、バティアクセラ由来のP-17, BP-110, BP-111, BP-112フィターゼ変異体、及びPhyzyme XP, Natuphos, Ronozyme Pフィターゼの、異なるペプシン濃度におけるペプシン耐性を示す。データは、ペプシン無添加でpH 2において培養したときの値に対する相対値である。
A:全ての測定点、 B: 70%以上の値を示した測定点
【表6】

【0237】
バティアクセラ由来の変異体の間にも幾分違いが認められる。すなわち、BP-17 var.110変異体は、最も高いペプシン濃度の10000 U/mLにおいて2時間培養した後でも95%の活性を示し、最も優れた安定性を示す。これに対し、BP-17を2時間培養した後の活性は85%であった。
【0238】
また、バティアクセラ由来のフィターゼは優れた酸安定性を示した。pH 2またはpH 5.5で2時間培養した後、pH 5.5で活性を測定し比較したところ、4種のバティアクセラ由来のフィターゼはいずれもpH 2で2時間培養したときでも活性は低下しなかったが、Phyzyme XP, Natuphos, 及び new Ronozyme Pは若干乃至顕著に活性が低下した(Table 6)。
【表7】

【0239】
<データのまとめ>
この発明のバティアクセラ由来のフィターゼは、pH 2、37℃、ペプシン10000 U/mlにおいて2時間培養したとき、ペプシンを含まないサンプルを同一条件下で培養したときの活性と比較して、活性を75%以上保持している。
【0240】
<実施例10. 酵素活性のリカバリー>
<酵素活性のリカバリーの測定>
<使用した材料と方法>
酵素が添加された小麦をペレット化した後の、酵素活性のリカバリーを測定した。顆粒化した小麦に酵素をスプレーし、乾燥した後に飼料と混合し、次いでペレット化した。
【0241】
液状酵素を小麦全粒粉に添加し、乾燥固形成分量が90%になるまで乾燥した。ペレット化工程での熱ストレスによる酵素の不活性化を、KoldingのTechnological Instituteにあるペレット化装置(Figure 7に模式図を示す)を用いて測定した。試験用サンプルをプレミックス10 kgに添加し、10分間混合した。次に、プレミックス10 kgを飼料150kgに添加し、15分間混合し (大型水平混合機)、次にコンディショニング/スチーム処理を行った。ペレット化する前に、飼料を90℃/95℃で30秒間処理した。温度は、カスケード混合機の出口で測定した。ペレット化プレスから離れた後、直ちにペレットを室温まで冷却した。
【0242】
フィターゼ活性は、実施例10に示した方法で測定した。
ペレット化する前の、マッシュ状態の飼料中のフィターゼ活性は、5単位/gである。
【0243】
<結果>
結果をFigure 8から10に示す。
Figure 8に、この発明に係る3種のフィターゼ変異体のペレット化試験結果を示す。これらの酵素を全粒小麦粉に添加し、水分が約10%になるまで乾燥させた。ここで、BP 17 var 111のペレット化後のフィターゼ活性のリカバリーは、90℃において90%であり、これに対しBP 17の90℃におけるリカバリーは19%であった。
比較用の、E coli由来フィターゼであるPhyzyme XPを全粒小麦粉に添加した。結果をFigure 9に示す。Phyzyme XPを全粒小麦粉に添加した3バッチに関しては、90℃でペレット化した後のフィターゼ活性のリカバリーは47%である。
【0244】
Ronozymeについても試験した。この製品は、ペレット化工程での熱から酵素を保護するため、被覆された状態で販売されている。この試験では、被覆された製品からフィターゼを抽出し、全粒小麦粉に添加して、フィターゼ分子の熱安定性を保護されていない状態で測定した。この結果をFigure 10に示す。
【0245】
<データのまとめ>
全粒小麦粉に添加された本願発明のバティアクセラ由来のフィターゼ変異体は、90℃でのペレット化の後、70%を超えるリカバリーを示した。
【0246】
<実施例11. フィチン酸分解>
<フィターゼによるフィチン酸分解試験結果>
【0247】
<溶液>
培養には、3種類の緩衝液を用いた。これらの緩衝液は以下の通りである。
250mMアセテート、pH 5.5;
250 mM アセテートM、pH 3.5;
250 mM HCl グリシン、pH 2.5.
培養に用いた全てのフィターゼは、分析用緩衝液により酵素濃度が1 U/mlになるまで希釈した。
培養に用いたフィチン酸エステル基質溶液は、1%フィチン酸エステル溶液(1g/100ml 緩衝液)である。
この基質溶液は、反応中のpHを一定にするため、フィターゼの希釈に用いたものと同じ緩衝液を用いて調製した。
反応は、1M HCl溶液を添加して停止させた。
【0248】
<培養>
培養時の容積は、1.5 または 3.0 mlのフィチン酸エステル + 0.25 ml 酵素 + 37℃の3.25 または 1.75 ml 緩衝液、全容積5.0 mlであった。
ここから、異なる時間毎 (0, 30, 60及び90分) に、0.5 mlの少量のサンプルを採取した。
【0249】
少量のサンプルを採取する際、予め準備しておいた、1M HClを0.2 ml入れたエッペンドルフチューブを用いた。培養から抜き出した少量のサンプルにHClを混ぜることにより、反応を停止させた。
【0250】
<HPLC法>
<フィチン酸エステル及びイノシトール異性体の高速イオンクロマトグラフィー(HPIC)による分析>
この測定方法は、SkoglundとCarlssonらにより開示されている(J. Agric. Food Chem., 45(1997), 451-436 5. J. Agric. Food Chem., 46 (1998), 1877-1882; 及び J. Agric. Food Chem., 49(2001), 11695-1701)。使用するカラムは、4 x 50 mmのプレ-カラムを備える、Dionex社の強アニオン交換体(4 x 250mm)である。Solvent AはMilliQ水、Solvent Bは1N HCl 水溶液である。勾配は、30分間2.5%から49% B、次いで流量0.8 ml/分における50%でのアイソクラティック3分間、及び2.5%でのアイソクラティック2分間である。各測定は35分間である。フィターゼは理論的に大量のIP異性体を産出し得ないため、測定時間を25分間に短縮することもできる。
溶出物を、流量が0.4 ml/分で0.1% Fe(NO3)3 . 9HO2及び2% 過塩素酸(HClO4)を含む水溶液を用いて、インラインで誘導体化した。フィチン酸エステル及びIP異性体は、290 nmのポジティブピークにより検出した。これは、フィチン酸エステル-Fe3+-ClO4- 複合体の形成による。60%過塩素酸は、Sigma社から購入した。
【0251】
<結果>
結果をFigure 11〜14に示す。
【0252】
<データのまとめ>
この発明の全ての酵素は好ましい性質を示した。この発明のフィターゼは、試験した全てのpH値においてフィチン酸エステルを分解した。
この発明の酵素はpH 5.5において高い活性を示す。
BP 110及びBP 111は、pH 2.5及び3.5において同様の活性を示す。
BP 110及びBP 111はpH 2.5及び3.5の両者において、培養中に添加されたフィチン酸エステルを90分後に全て分解する。
BP112はpH 2.5及び3.5の両者において、培養中に添加されたフィチン酸エステルを90分後に75%分解する。
【0253】
この発明の酵素は、pH 2.5においてRonozyme 及びNatuphosよりも優れた性質を示す(例えばFigure 14参照)。(Fig. 11〜13の場合より酵素濃度が高いため、バティアクセラBP17を参照として示した。)
【0254】
<実施例12. 液状化物中でのフィチン酸の加水分解>
<フィチン酸測定:フィチン酸含有量>
5%スラリー(乾燥サンプルの場合)のpHをpH 10に調整することにより、フィチン酸をサンプルから抽出し、次にイオン交換カラムを用いたHPLCでフィチン酸を測定した。NaOH濃度勾配システムを用いて、フィチン酸をカラムから流出させた。流出液中のフィチン酸濃度を、フィチン酸の検量線と比較して求めた。
【0255】
<結果>
異なる熱安定性BP変異体フィターゼ、すなわちBP110, BP111及びBP112による全粒コーン液状化物のフィチン酸の加水分解に及ぼす温度の影響を調べた。全粒コーン液状化物は、従来の乾燥粉粒液状化プロセス(供給源: Illinois River Energy社, Monroe, Illinois)による液状化物を用いた。
32 % ds (乾燥固形分)全粒コーンdsコーン液状化物のpHをpH 5.0に調整し、85℃から89℃に保たれた水浴中に入れた。温度が一定になった後、BP-フィターゼを4.0 FTU/gds.コーンとなるように添加した。20分後にサンプルを採取し、10 mM水酸化ナトリウム(1から10倍に希釈)を添加して酵素反応を停止させた。希釈したサンプルを濾過し、HPLCを用いてサンプル中のフィチン酸エステル誘導体の分布(IP1からIP6)を分析した。
Figure 15及び16に示すHPLCクロマトグラムから明らかなように、3種のフィターゼの変異体はいずれも、85℃より高温においてフィチン酸の加水分解を触媒した。
全粒コーン液状化物中のフィチン酸含有量(フィチン酸(IP6) 及び中間体のIP1からIP5)は1.7% ds.コーンであり、Figure 15のデータは、95 %を超えるフィチン酸が、現状の液状化条件下で熱安定性フィターゼにより加水分解されたことを示している。特に、89℃で培養したサンプルのHPLCのデータから、BP-111は他の2種のフィターゼ変異体より高い熱安定性を示すことが分かる(Figure 16のBP-110及びBP-112参照)。
【0256】
<特徴のまとめ>
この発明の特徴を、箇条書きにしてまとめた。
1. フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) とは異なるアミノ酸配列を備えるフィターゼ変異体であって、このフィターゼ変異体のアミノ酸配列はSEQ ID NO: 1のアミノ酸と比較して少なくとも1の変異を有し、前記少なくとも1の変異がSEQ ID NO: 1の位置75, 76 及び374から選択される位置にあり、前記少なくとも1の変異の各々は同一または異なっており、置換、欠失、または挿入のいずれかである。
2. 前記少なくとも1の変異が、S75, Q76及びA374から成る群から選択される、1,2,または3つの位置における変異である、第1項に記載のフィターゼ変異体。
3. 前記少なくとも1の変異が、S75P, Q76R 及びA374Pから成る群から選択される変異である、第2項に記載のフィターゼ変異体。
4. 前記少なくとも1の変異に、さらにN37, G77, H160, F164, T171, S188, G192, K198, A235, Q256 および/またはP367から成る群から選択される1以上の位置における変異が含まれる、第1項から第3項に記載のフィターゼ変異体。
5. 前記少なくとも1の変異が、N37Y, G77S, H160R, F164E, F164S, T171V, T171I, S188P, G192A, K198R, A235V, Q256P, Q256A, Q256Eおよび/またはP367Lから成る群から選択される少なくとも1の変異から成る、第4項に記載のフィターゼ変異体。
6. 前記少なくとも1の変異に、さらにA89, D92, T134, F164, T176, A178, K207, A209, S248, Q256, A261および/またはN270から成る群から選択される1以上の位置における変異が含まれる、第1項から第5項に記載のフィターゼ変異体。
7. 前記少なくとも1の変異が、A89T, D92A, T134I, F164S, T176K, A178P, K207E, A209S, S248L, Q256Y, A261Eおよび/またはN270Kから成る群から選択される1以上の位置における変異から成る、第6項に記載のフィターゼ変異体。
8. 前記フィターゼ変異体が、SEQ ID NO: 2の配列を備える、第7項に記載のフィターゼ変異体。
9. 前記フィターゼ変異体が、下記のa)〜t)から成る群から選択される変異を含む配列を備える、第1項から第8項に記載のフィターゼ変異体。
a) N37Y, S75P, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K198R, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
b) N37Y, G77S, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K198R, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
c) N37Y, S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
d) N37Y, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256P, A261E, N270K, A374P
e) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
f) N37Y, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
g) N37Y, Q76R, A89T, D92A, T134I, F164S, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256A, A261E, N270K, A374P
h) S75P, A89T, D92A, T134I, F164E, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
i) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, P367L, A374P
j) N37Y, A89T, D92A, T134I, F164E, T171I, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
k) N37Y, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
l) N37Y, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
m) N37Y, S75P, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, K207E, A209S, A235V, S248L, Q256A, A261E, N270K, A374P
n) N37Y, S75P, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
o) N37Y, A89T, D92A, T134I, H160R, F164S, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256E, A261E, N270K, A374P
p) A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
q) N37Y, S75P, A89T, D92A, T134I, H160R, F164S, T171V, T176K, A178P, S188P, K207E, A209S, S248L, Q256H, A261E, N270K, A374P
r) N37Y, S75P, A89T, D92A, T134I, F164S, T171V, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
s) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P; and
t) N37Y, Q76R, A89T, D92A, T134I, H160R, F164S, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P.
10. 第1項から第9項のいずれかに記載のフィターゼ変異体に対し最小配列同一性パーセントおよび/または最小相同性パーセントを有するフィターゼ変異体であって、前記最小配列同一性パーセントおよび/または最小相同性パーセントが少なくとも50%、少なくとも60%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも93%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%から成る群から選択されるフィターゼ変異体。
11. SEQ ID NO: 1のフィターゼに対し少なくとも1の改善された性質を有する第1項から第10項のいずれかに記載のフィターゼ変異体であって、前記改善された性質が、改善された比活性度、1以上のプロテーゼに対する感受性の低下、改善された熱活性、改善された熱安定性、改善された酸性pH下での安定性、改善された塩基性pH下での安定性、改善された飼料加工時の安定性から成る群から選択されるフィターゼ変異体。
12. 前記少なくとも1の改善された性質が、ヒト、アルパカ、バイソン、ラクダ、ウシ、ニワトリ、家禽、チンチラ、シカ、ロバ、アヒル、魚、カエル、ヤギ、ガチョウ、家禽、ウマ、ラマ、ミンク、ラバ、ダチョウ、ハト、トナカイ、ヒツジ、 貝、ブタ、七面鳥、ヤク、水牛、ネコ、チンパンジー、イヌ、フェレット、アレチネズミ、金魚、モルモット、ハムスター、サル、インコ、爬虫類、齧歯動物から成る群から選択される動物において見出される1以上のプロテアーゼに対する感受性の低下である、第10項のフィターゼ変異体。
13. SEQ ID NO: 1のフィターゼと比較して、ヒト、アルパカ、バイソン、ラクダ、ウシ、ニワトリ、家禽、チンチラ、シカ、ロバ、アヒル、魚、カエル、ヤギ、ガチョウ、家禽、ウマ、ラマ、ミンク、ラバ、ダチョウ、ハト、トナカイ、ヒツジ、 貝、ブタ、七面鳥、ヤク、水牛、ネコ、チンパンジー、イヌ、フェレット、アレチネズミ、金魚、モルモット、ハムスター、サル、インコ、爬虫類、齧歯動物から成る群から選択される動物の消化管において長期間活性を有する、第1項から第11項のいずれかに記載のフィターゼ変異体。
14. 第1項から第13項のいずれかに記載のフィターゼ変異体をコードする核酸。
15. 第14項に記載の核酸を含むベクター。
16. 第14項に記載の核酸を含む宿主細胞。
17. 第1項から第13項のいずれかに記載のフィターゼ変異体の少なくとも1を含む酵素組成物。
18. 第1項から第13項のいずれかに記載のフィターゼ変異体の少なくとも1を含む酵素組成物であって、澱粉の液状化に有用な酵素組成物。
19. 第1項から第13項のいずれかに記載のフィターゼ変異体を宿主細胞中に産出させる方法であって、
a) 第1項から第13項のいずれかに記載のフィターゼ変異体をコードする核酸を含むDNA構築体で宿主細胞を形質転換する工程、及び
b) 形質転換された宿主細胞を適切な培地において培養する工程を備える方法。
20. 宿主細胞が菌類細胞、細菌細胞、または植物性細胞である、第19項に記載の方法。
21. フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) のアミノ酸配列とは異なるアミノ酸配列を備えるフィターゼ変異体であって、このフィターゼ変異体のアミノ酸配列はSEQ ID NO: 1のアミノ酸と比較して少なくとも1の変異を有し、このフィターゼ変異体は位置70, 193, 197, 221 及び407の内の少なくとも1以上の位置に変異を有する、フィターゼ変異体。好ましくは、このフィターゼ変異体は位置70, 193, 197, 221 及び407の内の少なくとも2以上の位置に変異を有する。好ましくは、このフィターゼ変異体は位置70, 193, 197, 221 及び407の内の少なくとも3以上の位置に変異を有する。好ましくは、このフィターゼ変異体は位置70, 193, 197, 221 及び407の内の少なくとも4以上の位置に変異を有する。好ましくは、このフィターゼ変異体は少なくとも位置70, 193, 197, 221 及び407に変異を有する。
22. フィターゼ変異体が少なくともN70Y, H193R, F197E, S221P及びA407Pの変異を有する、第21項に記載のフィターゼ変異体。
23. 食品または飼料を製造する方法であって、第1項から第13項または第21項または第22項のいずれか1項に記載のポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物と、別の食品または飼料原料とを混合する工程を含む、食品または飼料を製造する方法。
24. 食品または飼料を製造する方法であって、第1項から第13項または第21項または第22項のいずれか1項に記載のポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物を、液体の状態で前記食品または飼料にスプレーする工程を含む、食品または飼料を製造する方法。
25. 食品または飼料を製造する方法であって、第1項から第13項または第21項または第22項のいずれか1項に記載のポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物を、固体の状態で前記食品または飼料と混合する工程を含む、食品または飼料を製造する方法。
26. 飼料を製造する方法であって、第1項から第13項または第21項または第22項のいずれか1項に記載のポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物と、別の食品または飼料原料とを混合する工程を含む、飼料を製造する方法。
27. 飼料を製造する方法であって、第1項から第13項または第21項または第22項のいずれか1項に記載のポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物を、液体の状態で前記飼料にスプレーする工程を含む、飼料を製造する方法。
28. 飼料を製造する方法であって、第1項から第13項または第21項または第22項のいずれか1項に記載のポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物を、固体の状態で前記飼料と混合する工程を含む、飼料を製造する方法。
29. i) 第1項から第13項または第21項または第22項のいずれか1項に記載のフィターゼ、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物、および/またはii) 第23項から第28項記載の方法で製造された食品または飼料の何れかから成る、食品または飼料組成物。
30. 第1項から第13項または第21項または第22項のいずれか1項に記載のフィターゼ、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物、および/またはii) 第23項から第28項記載の方法で製造された飼料の何れかから成る、飼料組成物。
31. 第1項から第13項または第21項または第22項のいずれか1項に記載のフィターゼポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物の、食品または飼料における使用。
32. 第1項から第13項または第21項または第22項のいずれか1項に記載のフィターゼポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物の、飼料における使用。
33. 動物の排泄物中のリンの量を低下させる方法であって、第1項から第13項または第21項または第22項のいずれか1項に記載のフィターゼポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物、または第29項または第30項に記載の飼料を動物に与え、フィターゼの量が飼料中のフィチン酸エステルを分解するために十分な量であることを特徴とする方法。
34. 第1項から第13項または第21項または第22項のいずれか1項に記載のフィターゼポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物、または第29項または第30項に記載の飼料の、前記フィターゼポリペプチドを与えられた動物の排泄物中のリンの量を低下させるための飼料の製造における使用。
【0257】
明細書に記載した全ての文献、及びこれらの文献に引用された参照文献は、本願に参照として組み込まれる。当業者にとって、本願発明の要旨から逸脱しない範囲で本願に開示した方法及びシステムを種々変更して実施できることは明らかであろう。本願発明について特定の実施形態に基づき説明したが、特許請求の範囲に係る発明はこれらの特定の実施形態に限定されない。本願発明の実施に当り、分子生物学及びその関連技術分野に属する当業者にとって明らかな本願に開示した実施形態の様々な変更は、本願発明の範囲に含まれる。
【技術分野】
【0001】
<クロスリファレンス>
本願は、2008年4月18日出願の米国仮出願第61/046,324号に基づく優先権を主張し、この仮出願の全てが参照として本願に組み込まれる。
【0002】
本願は、改良されたバティアクセラ(Buttiauxella)属フィターゼの変異体、このフィターゼ変異体をコードする核酸、この核酸を含むベクター及び宿主細胞、並びにこのフィターゼを産出する方法に関する。本願のフィターゼは、例えば澱粉の液化、アルコール発酵や、食品や飼料中のリン酸塩の分解の促進等、様々な用途に用いることができる。
【背景技術】
【0003】
フィチン酸エステルは、穀物及びマメ科植物におけるリンの主要な貯蔵形態である。しかし、豚、家禽、魚等の単胃動物はフィチン酸エステル(またはフィチン酸)を代謝または吸収することができず、フィチン酸エステルをそのまま排泄する。このため、牧畜業が盛んに行われている地域においてリン汚染が生じる。
さらに、フィチン酸はカルシウム、銅、亜鉛等の金属とキレートを形成し、単胃動物において非栄養成分として作用する。
【発明の概要】
【0004】
これらの動物に十分なリン酸塩を与えて健全に生育させるために、飼料に無機リン酸が添加されている。このようなリンの添加は費用がかかり、また環境汚染の問題が増大する。
【0005】
通常、フィチン酸エステルはフィターゼの作用により加水分解され、低級イノシトール-リン酸塩と無機リン酸になる。フィターゼは飼料の添加剤として有用である。フィターゼにより、動物の有機リン酸の摂取可能量が増加し、リン酸塩による環境汚染が低減される(Wodzinski R J, Ullah A H. Adv Appl Microbiol. 42, 263-302 (1996))。
【0006】
文献に、多数の菌類由来のフィターゼ (Wyss M. et al., Appl. Environ. Microbiol. 65 (2), 367-373 (1999); Berka R. M. et al., Appl. Environ. Microbiol. 64 (11), 4423-4427 (1998); Lassen S. et al., Appl. Environ. Microbiol. 67 (10), 4701-4707 (2001))、及び細菌由来のフィターゼ (Greiner R. et al Arch. Biochem. Biophys. 303 (1), 107-113 (1993); Kerovuo et al., Appl. Environ. Microbiol. 64 (6), 2079-2085 (1998); Kim H. W. et al., Biotechnol. Lett. 25, 1231-1234 (2003); Greiner R. et al., Arch. Biochem. Biophys. 341 (2), 201-206 (1997); Yoon S. J. et al., Enzyme and microbial technol. 18, 449-454 (1996); Zinin N. V. et al., FEMS Microbiol. Lett. 236, 283-290 (2004)) が記載されている。
【課題を解決するための手段】
【0007】
第一の側面では、この発明により、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1)とはアミノ酸配列が異なり、1以上の有用な性質を備えるフィターゼ変異体が提供される。このような有用な性質は、熱安定性、温度/活性依存性、pH/活性依存性、比活性度、及びpH/プロテアーゼ感受性等であるが、これらに限定されない。
【0008】
別の側面では、この発明は、位置75, 76及び374からなる群から選択される1以上の位置に置換を有するフィターゼから成るフィターゼの変異体に関する。ここで、各位置は、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1)のアミノ酸配列における位置に相当する。
【0009】
また別の側面では、この発明の実施形態により、本願のフィターゼ変異体をコードする核酸と、この核酸を含むベクター及び宿主細胞が提供される。また別の実施形態では、この配列はフィターゼ変異体を産出するプロセスにおいて用いられる。
【0010】
さらに、この発明の実施形態はフィターゼの基質、特にフィチン酸エステルまたはフィチン酸由来の無機リン酸塩からリンを放出させるフィターゼ変異体の使用に関する。この発明のフィターゼ変異体は、澱粉の液化、あるいは食料及び飼料のリン酸塩分解の促進等の工業的用途において好適に用いることができる。この発明の実施形態に係るフィターゼ変異体は、アルコール発酵プロセスおよび/またはアルコール製造において好適に用いることができる。
【0011】
別の側面では、この発明の実施形態は、本願に開示するフィターゼ変異体から成る酵素組成物に関する。この酵素組成物は、商業的用途に適し、好適に用いられる。
ひとつの実施形態では、酵素組成物は飼料用組成物である。別の実施形態では、酵素組成物は、澱粉加水分解(例えば液状化)プロセスに用いられる。好ましい実施形態では、フィターゼ変異体および/または酵素組成物は、アルコール発酵プロセスに用いられる。別の実施形態では、本願に係るフィターゼから成る酵素組成物に、別の酵素が含まれる。このような別の酵素の例は、グルコアミラーゼ、α-アミラーゼ、プロテアーゼ、セルラーゼ、ヘミセルラーゼ、リパーゼ、ペクチナーゼ、プルラナーゼ、グルコースオキシダーゼ、β-グルコシダーゼ、ラッカーゼ、オキシダーゼ、クチナーゼ、ホスファターゼ、別のフィターゼ、及びこれらの組み合わせが含まれる。
【0012】
また別の側面では、この発明の実施形態は、宿主細胞中で転写活性を示すプロモータを備えたDNA構築体により宿主細胞を形質転換し、形質転換された宿主細胞を、フィターゼを発現させフィターゼを産出させることができる適切な培地中で培養することにより、宿主細胞中にフィターゼ変異体を産出させる方法に関する。この方法には、産出されたフィターゼを回収する工程が含まれていてもよい。
ひとつの実施形態では、宿主細胞は細菌、または植物細胞、または菌類細胞(例えばトリコデルマ・リーゼイ(Trichoderma reesei) 等のトリコデルマの細胞)、または酵母である。
この発明の実施形態では、フィターゼ変異体のアミノ酸配列は、SEQ ID NO: 1のアミノ酸配列に対し少なくとも80%、少なくとも85%、少なくとも90 %、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%の配列同一性を有する。
この発明の好ましい実施形態では、フィターゼはSEQ ID NO: 2のアミノ酸配列を有する。
【0013】
この発明の酵素は、特許請求の範囲と明細書に規定されるものである。この発明の酵素には、例えばシグナルペプチドの切断等のように、発現の間に、翻訳と同時または翻訳後に加工された活性ポリペプチドが含まれていてもよい。翻訳後の切断は、C-末端で生じてもよい。すなわち、好ましい実施形態では、有効な断片(機能性断片とも呼ぶ)は、天然の宿主または適切な発現宿主から産出された成熟タンパク質である。
【0014】
即ち一側面では、本願のフィターゼは、本願に規定する変異体をコードする核酸配列の一部または全部により発現されたアミノ酸配列か、または発現され得るアミノ酸配列を備えることを特徴とする。
【0015】
一側面では、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1)と比較して、熱活性が少なくとも約5℃改善されたフィターゼ変異体が提供される。ひとつの実施形態では、SEQ ID NO: 1のフィターゼと比較して熱活性が少なくとも約17℃改善されたフィターゼ変異体が提供される。別の実施形態では、熱活性が約17℃から約21℃の範囲で改善される。また別の実施形態では、熱活性が約17.4℃から約20.2℃の範囲で改善される。
【0016】
別の側面では、熱安定性フィターゼ変異体が提供される。この熱安定性フィターゼ変異体は、pH 5.5の緩衝液中で相対的高温に10分間曝された後、その活性を50%以上保持することができ、ここで相対的高温は、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1)の活性を50%以上保持することができる温度より少なくとも約5℃高い温度である。
ひとつの側面では、相対的高温は少なくとも約20.5℃高い温度である。別の側面では、相対的高温は約20.5℃から約27℃高い温度範囲である。また別の側面では、相対的高温は約20.2℃から約26.8℃高い温度範囲である。
【0017】
別の側面では、フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) とは異なるアミノ酸配列を備えるフィターゼ変異体が提供される。ここで、フィターゼ変異体のアミノ酸配列には、SEQ ID NO: 1のアミノ酸の位置75, 76, 77, 198, 367 または374に相当する位置の1以上の位置における変異が含まれる。
ひとつの実施形態では、フィターゼ変異体にはさらに1以上の別の変異が含まれ、この変異は92A, 164E/S, 171I/V, 192A または 256A/E/Pのいずれかである。別の実施形態では、位置75, 76, 77, 198, 367 または374の1以上の位置における変異がそれぞれ75P, 76R, 77S, 198R, 367Lまたは 374Pであり、フィターゼ変異体にはさらに別の変異が含まれ、この変異は92A, 164E/S, 171V, 192Aまたは256A/E/Pである。
また別の実施形態では、フィターゼ変異体には1以上の別の変異が含まれ、1以上の別の変異の位置は、26, 37, 89, 134, 160, 176, 178, 188, 190, 207, 209, 211, 235, 261, 270, 303または318のいずれかである。
また別の実施形態では、26, 37, 89, 134, 160, 176, 178, 188, 190, 207, 209, 211, 235, 261, 270, 303または318の1以上の位置における変異はそれぞれ、26E, 037Y, 089T, 134I/V, 160R, 176K, 178P, 188N, 190E, 207E/T, 209S, 211C, 235V, 261E, 270K, 303Fまたは318Dのいずれかである。
また別の実施形態では、フィターゼ変異体には1以上の別の変異が含まれ、1以上の別の変異の位置は、1, 10, 11, 38, 66, 71, 81, 92, 109, 111, 119, 120, 121, 141, 142, 152, 155, 193, 214, 239, 245, 248, 255, 268, 277, 283, 285, 287, 288, 293, 296, 314, 337, 345, 350, 364, 371, 372, 396, 399, 406または413のいずれかである。
また別の実施形態では、1, 10, 11, 38, 66, 71, 81, 92, 109, 111, 119, 120, 121, 141, 142, 152, 155, 193, 214, 239, 245, 248, 255, 268, 277, 283, 285, 287, 288, 293, 296, 314, 337, 345, 350, 364, 371, 372, 396, 399, 406または413の1以上の位置における変異がそれぞれ、1S, 10I, 11I, 38S, 66E, 71K, 81A, 92E, 109Q, 111G, 119N, 120L, 121E, 141R, 142L, 152M, 155E, 193Q, 211C, 214V, 235V, 239K, 245D, 248L, 255A, 261E, 268A/T, 270K, 277T, 283D, 285K, 287D, 288A, 293Gまたは296Sのいずれかである。
【0018】
別の側面では、フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) のアミノ酸配列とは異なるアミノ酸配列を備えるフィターゼ変異体が提供され、このフィターゼ変異体のアミノ酸配列はSEQ ID NO: 1に対し少なくとも1の変異を有し、このフィターゼ変異体の配列の変異は、下記のa)〜t)のいずれかである。
a) N37Y, S75P, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K198R, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
b) N37Y, G77S, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K198R, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
c) N37Y, S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
d) N37Y, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256P, A261E, N270K, A374P
e) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
f) N37Y, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
g) N37Y, Q76R, A89T, D92A, T134I, F164S, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256A, A261E, N270K, A374P
h) S75P, A89T, D92A, T134I, F164E, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
i) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, P367L, A374P
j) N37Y, A89T, D92A, T134I, F164E, T171I, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
k) N37Y, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
l) N37Y, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
m) N37Y, S75P, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, K207E, A209S, A235V, S248L, Q256A, A261E, N270K, A374P
n) N37Y, S75P, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
o) N37Y, A89T, D92A, T134I, H160R, F164S, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256E, A261E, N270K, A374P
p) A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
q) N37Y, S75P, A89T, D92A, T134I, H160R, F164S, T171V, T176K, A178P, S188P, K207E, A209S, S248L, Q256H, A261E, N270K, A374P
r) N37Y, S75P, A89T, D92A, T134I, F164S, T171V, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
s) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P; または
t) N37Y, Q76R, A89T, D92A, T134I, H160R, F164S, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P.
ひとつの実施形態では、フィターゼ変異体の配列の変異は、N37Y, S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374Pである。
【0019】
また、本願に開示するフィターゼに対し最小配列同一性パーセントおよび/または最小相同性パーセントを有するフィターゼが提供され、ここで最小配列同一性パーセントおよび/または最小相同性パーセントは少なくとも50%、少なくとも60%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも93%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%である。
【0020】
一側面では、フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) のアミノ酸配列とは異なるアミノ酸配列を備えるフィターゼ変異体が提供され、このフィターゼ変異体のアミノ酸配列はSEQ ID NO: 1に対し少なくとも1の変異を有し、このフィターゼ変異体の変異の位置は、アミノ酸位置70, 193, 197, 221 及び407の少なくともいずれか1である。ひとつの実施形態では、フィターゼ変異体は少なくともN70Y, H193R, F197E, S221P 及びA407Pの変異を有する。
【0021】
また別の側面では、本願に開示するフィターゼのいずれかをコードする核酸が提供される。
別の側面では、本願に開示するフィターゼのいずれかをコードする核酸を含むベクターが提供される。
また別の側面では、本願に開示する核酸および/またはベクターを含む宿主細胞が提供される。
【0022】
別の側面では、宿主細胞中で本願に開示するフィターゼ変異体を産出する方法が提供され、この方法は、
a) 本願に開示するフィターゼ変異体のいずれかをコードする核酸を含むDNA構築体で宿主細胞を形質転換する工程、及び
b) 形質転換された宿主細胞を適切な培地において培養する工程を備える。
ひとつの実施形態では、宿主細胞は菌類細胞、細菌細胞、または植物性細胞である。
【0023】
一側面では、本願に開示する方法で産出されたフィターゼが提供される。
【0024】
一側面では、本願に開示するフィターゼの少なくとも1と、グルコアミラーゼ、アルファ-アミラーゼ、プロテアーゼ、プルラナーゼ、イソアミラーゼ、セルラーゼ、ヘミセルラーゼ、キシラナーゼ、シクロデキストリングリコトランスフェラーゼ、リパーゼ、ラッカーゼ、オキシダーゼ、エステラーゼ、クチナーゼ、別のフィターゼ、及びこれらの組み合わせの内の1以上とから成る酵素組成物に関する。
ひとつの実施形態では、この組成物にはアルファ-アミラーゼが含まれる。
【0025】
別の側面は、本願に開示するフィターゼまたは本願に開示する酵素組成物の、澱粉液化、澱粉糖化、澱粉発酵または澱粉同時糖化-発酵における使用に関する。ひとつの実施形態では、発酵アルコールを製造するために、澱粉液化、澱粉糖化、澱粉発酵または澱粉同時糖化-発酵を行う。別の実施形態では、アルコールはエタノールまたはブタノールである。別の実施形態では、基質を澱粉液化、澱粉糖化、澱粉発酵または澱粉同時糖化-発酵させる。ひとつの実施形態では、基質には澱粉が含まれる。別の実施形態では、基質には穀粒または穀物が含まれる。別の実施形態では、穀粒または穀物は小麦、大麦、ライ麦、オート麦、 トウモロコシ、ソルガム、トウモロコシグルテン、可溶性物質添加乾燥蒸留穀物残渣(Distillers Dried Grain Solubles (DDGS))、小麦フスマ、小麦ミドリング粉、小麦ショーツ、米、 オート麦殻、 パーム核油、果実の搾りかすまたはこれらの組合せである。ひとつの実施形態では、米には米ぬかまたは米殻が含まれる。
【0026】
別の側面は、少なくとも1の本願に開示するフィターゼの、食品または飼料における添加剤としての使用に関する。別の側面は、少なくとも1の本願に開示するフィターゼの、可溶性物質添加乾燥蒸留穀物残渣(DDGS)を含む食品または飼料における添加剤としての使用に関する。
【0027】
別の側面では、食品または飼料を製造する方法が提供され、この方法には、少なくとも1の本願に開示するフィターゼまたは酵素組成物と、食品または飼料の原料とを混合して食品または飼料を製造する工程が含まれる。
【0028】
別の側面では、食品または飼料を製造する方法が提供され、この方法には、少なくとも1の液体状の本願に開示するフィターゼまたは酵素組成物を、食品または飼料にスプレーする工程が含まれる。
一側面では、食品または飼料を製造する方法が提供され、この方法には、少なくとも1の固体状の本願に開示するフィターゼまたは酵素組成物を、食品または飼料と混合する工程が含まれる。
【0029】
別の側面では、飼料を製造する方法が提供され、この方法には、少なくとも1の本願に開示するフィターゼまたは酵素組成物を、食品または飼料原料と混合して飼料を製造する工程が含まれる。
また別の側面では、飼料を製造する方法が提供され、この方法には、少なくとも1の液体状の本願に開示するフィターゼまたは酵素組成物を、飼料にスプレーする工程が含まれる。
さらに別の側面では、飼料を製造する方法が提供され、この方法には、少なくとも1の固体状の本願に開示するフィターゼまたは酵素組成物を、飼料と混合する工程が含まれる。
【0030】
別の側面では食品または飼料の組成物が提供され、この組成物には、i) 少なくとも1の本願に開示するフィターゼまたは酵素組成物、および/またはii) 本願に開示する方法で製造された食品または飼料のいずれかが含まれる。
また別の側面では飼料組成物が提供され、この飼料組成物には、i) 少なくとも1の本願に開示するフィターゼまたは酵素組成物、および/またはii) 本願に開示する方法で製造された食品または飼料のいずれかが含まれる。
一側面は、少なくとも1の本願に開示するフィターゼまたは酵素組成物の食品または飼料への使用に関する。
別の側面は、少なくとも1の本願に開示するフィターゼまたは酵素組成物の飼料への使用に関する。
【0031】
別の側面では、動物の排泄物に含まれるリンの濃度を低減させる方法が提供され、この方法は、少なくとも1の本願に開示するフィターゼまたは酵素組成物、または本願に開示する方法で製造された飼料、または本願に開示する組成物を動物に与え、前記フィターゼの量が飼料中に含有されるフィチン酸エステルを変換するために必要な量であることを特徴とする。
【0032】
一側面は、少なくとも1の本願に開示するフィターゼまたは酵素組成物、または本願に開示する方法で製造された飼料、または本願に開示する組成物の、前記フィターゼポリペプチドが与えられた動物の排泄物に含まれるリンの濃度を下げるための飼料の製造における使用に関する。
【図面の簡単な説明】
【0033】
【図1】野生型バティアクセラ種P1-29フィターゼ (BP-WT) のアミノ酸配列を表わす(SEQ ID NO: 1)。
【図2】この発明に係る1の有用な変異体のアミノ酸配列を表わす(SEQ ID NO: 2)。
【図3】野生型バティアクセラ種P1-29の核酸配列 (SEQ ID NO: 3) を表わす。
【図4】図2に示すこの発明に係る1の有用な変異体の核酸配列 (SEQ ID NO: 4) を表わす。
【図5】この発明に係る3種類の酵素(BP 110, BP-111及びBP-112)のアミノ酸配列、並びにBP-17及び野生型のアミノ酸配列を表わす。
【図6】バティアクセラ、BP-17, BP-110, BP-111及びBP-112各変異体、並びにPhyzyme XP, Natuphos, 及びRonozyme Pに由来するフィターゼの、ペプシン濃度の増加に対する耐性を表わす図である。各データは、ペプシン無添加でpH 2における培養に対する相対比で示されている。A: 全てのデータ、B: 70%以上リカバリーしたデータのみ。
【図7】実施例11で用いた飼料加工装置(飼料のペレット化)の模式図である。
【図8】データのグラフである。
【図9】データのグラフである。
【図10】データのグラフである。
【図11】データのグラフである。
【図12】データのグラフである。
【図13】データのグラフである。
【図14】データのグラフである。
【図15】HPLCデータをプロットした図である。
【図16】HPLCデータをプロットした図である。
【発明を実施するための形態】
【0034】
本願は、バティアクセラ属フィターゼの変異体に関し、この変異体は澱粉液状化、アルコール発酵、及び食品及び飼料中のリン酸塩の消化を促進するための方法等を含む工業的用途に用いられる。この発明のフィターゼ変異体は、特に燃料用エタノール製造プロセスの澱粉液化工程におけるフィチン酸エステル分解に有用である。この発明のフィターゼ変異体は、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1)のアミノ酸配列に対し、1以上の変異(置換、挿入、及び欠失を含む)を有する。好ましい実施形態では、この発明のフィターゼ変異体のアミノ酸配列は、SEQ. ID NO: 1のアミノ酸配列に対し少なくとも1の変異を有する。前記少なくとも1の変異は、アミノ酸位置75, 76及び374から成る群から選択される1, 2または3つの位置にある。ここで各アミノ酸位置は、SEQ ID NO: 1のアミノ酸配列上の位置に対応する。
【0035】
例えば、この発明の実施形態に係るフィターゼ変異体における変異は、SEQ ID NO: 1の位置に対応して、S75, Q76及びA374から成る群から選択されることが好ましい。
【0036】
この発明の好ましい実施形態では、フィターゼ変異体における変異は置換であり、この置換はS75P, Q76R 及びA374Pから成る群から選択される。ここで各アミノ酸位置は、SEQ ID NO: 1のアミノ酸配列上の位置に対応する。
【0037】
別の好ましい実施形態では、この発明のフィターゼ変異体はさらに、N37, G77, H160, F164, , T171, S188, G192, K198, A235, Q256および/またはP367から成る群から選択される変異を備える。ここで各アミノ酸位置は、SEQ ID NO: 1のアミノ酸配列上の位置に対応する。
【0038】
また別の好ましい実施形態では、この発明のフィターゼ変異体における変異は置換であり、前記置換はN37Y, G77S, H160R, F164E, F164S, T171V, T171I, S188P, G192A, K198R, A235V, Q256P, Q256A, Q256Eおよび/またはP367Lから成る群から選択される1以上の位置にある。
【0039】
また別の好ましい実施形態では、この発明のフィターゼ変異体にはさらに、A89, D92, T134, F164, T176, A178, K207, A209, S248, Q256, A26Eおよび/またはN270から成る群から選択される1以上の位置にある変異が含まれる。
【0040】
また別の好ましい実施形態では、この発明のフィターゼ変異体にはさらに、A89T, D92A, T134I, F164S, T176K, A178P, K207E, A209S, S248L, Q256Y, A261Eおよび/またはN270Kから成る群から選択される1以上の位置の変異が含まれる。
【0041】
また別の好ましい実施形態では、この発明のフィターゼ変異体にはSEQ ID NO: 2のアミノ酸配列が含まれている。
【0042】
この発明の好ましいフィターゼ変異体は、下記のa)からt)から成る群から選択される変異を有するアミノ酸配列を備える:
a) N37Y, S75P, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K198R, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
b) N37Y, G77S, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K198R, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
c) N37Y, S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
d) N37Y, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256P, A261E, N270K, A374P
e) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
f) N37Y, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
g) N37Y, Q76R, A89T, D92A, T134I, F164S, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256A, A261E, N270K, A374P
h) S75P, A89T, D92A, T134I, F164E, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
i) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, P367L, A374P
j) N37Y, A89T, D92A, T134I, F164E, T171I, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
k) N37Y, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
l) N37Y, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
m) N37Y, S75P, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, K207E, A209S, A235V, S248L, Q256A, A261E, N270K, A374P
n) N37Y, S75P, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
o) N37Y, A89T, D92A, T134I, H160R, F164S, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256E, A261E, N270K, A374P
p) A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
q) N37Y, S75P, A89T, D92A, T134I, H160R, F164S, T171V, T176K, A178P, S188P, K207E, A209S, S248L, Q256H, A261E, N270K, A374P
r) N37Y, S75P, A89T, D92A, T134I, F164S, T171V, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
s) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
t) N37Y, Q76R, A89T, D92A, T134I, H160R, F164S, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P。
【0043】
この発明の実施形態には、配列a)からt)に示すいずれかのフィターゼ変異体も含まれ、このフィターゼ変異体はフィターゼ活性を有するとともに、配列a)からt)に示すフィターゼ変異体に対し、少なくとも50%、少なくとも60%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも93%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性パーセントおよび/または相同性パーセントを有する。
【0044】
本願では、アミノ酸はそのアミノ酸の名称、3文字の略号、または1文字の略号を用いて表記する。下記の表に、アミノ酸の名称とその略号の一覧を示す。
【表1】

【0045】
特定のアミノ酸変異体、及びこの変異体をコードする核酸に加え、本願により保存アミノ酸置換の変異体が提供される。このような置換は保存されたアミノ酸の置換であり、例えばアミノ酸変異体は、同種に属する別のアミノ酸によって置き換えられている。
アミノ酸はその側鎖の構造に応じて、酸性、塩基性、中性で極性、中性で非極性および/または芳香性に分類される。変異体アミノ酸位置における好ましい置換基には、その位置におけるアミノ酸変異体の分類と同様の1以上の分類を備える置換基が含まれる。すなわち、Lys, Arg, 及びHisは塩基性アミノ酸であり、アスパラギン酸及びグルタミン酸は酸性アミノ酸であり、Ser, Thr, Cys, Gln, 及びAsnは中性で極性のアミノ酸であり、Gly, Ala, Val, Ile, 及びLeuは非極性の脂肪族アミノ酸であり、Phe, Trp, 及びTyrは芳香族アミノ酸である。Gly及びAlaは小さなアミノ酸であり、Val, Ile及びLeuは脂肪族アミノ酸である。
【0046】
特に断りの無い限り、全ての技術用語及び科学用語は、通常の意味に従う。以下の用語について、その意味を明確にするために定義する。本願で用いる用語の意義の解釈には、Singleton, et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY, 20 ED., John Wiley and Sons, New York (1994)、及びHale & Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY, Harper Perennial, NY (1991)を辞書として用いることができる。
【0047】
この発明は、本願に例示した方法及び材料に限定されず、この発明を実施する際には、本願に開示した方法及び材料と同様または均等なものを用いることができる。数値範囲には、その範囲を規定する数値も含まれる。特に断りの無い限り、核酸配列は5' から 3'方向が左から右方向になるように記載し、アミノ酸の配列はアミノ基からカルボキシル基方向が左から右方向になるように記載する。
【0048】
文中の見出しはこの発明の様々な態様を限定するものではなく、明細書全体にわたり参照される。すなわち下記の定義は、明細書全体を参照してより完全に定義される。
【0049】
フィチン酸 (ミオ-イノシトールヘキサキスホスフェート)は、穀類、豆類、油料種子作物中の重要な成分である。その塩の形態であるフィチン酸エステルは、これらの植物におけるリンの主要な貯蔵形態である。
【0050】
フィターゼは、フィチン酸のリン酸モノエステルの加水分解を触媒して、段階的にミオ-イノシトールペンタキス-、テトラキス-、トリス-、ビス-、及びモノ-ホスフェートを生成させるとともに、無機リンを放出させる
【0051】
「フィターゼ変異体」または「変異体」または「改変された形態」とは、親フィターゼのアミノ酸配列に由来するアミノ酸配列を有し、1以上のアミノ酸置換、挿入および/または欠失を備えるフィターゼ酵素を意味し、これらは共に「突然変異体」と呼ばれる。
【0052】
「親フィターゼ」または「親酵素」とは、フィターゼ変異体の派生元のフィターゼ酵素を意味する。親フィターゼは野生型フィターゼであり、あるいは別のフィターゼ変異体であってもよい。特に、本願では「親フィターゼ」はバティアクセラ属に由来する。好ましくは、「親フィターゼ」は、本願にアミノ酸配列を開示するバティアクセラ株P1-29に由来する。
【0053】
「フィターゼ」または「フィターゼ活性」とは、フィチン酸エステルの加水分解を触媒して(1) ミオ-イノシトール、および/または (2) そのモノ-、ジ-、トリ-、テトラ- および/またはペンタ-リン酸塩、及び (3) 無機リン酸塩を生成させることができるタンパク質またはポリペプチドを意味する。例えば、Enzyme CommissionのEC番号3.1.3.8またはEC番号3.1.3.26に定義された酵素活性を有する酵素が挙げられる。
【0054】
「バティアクセラ属フィターゼ」とは、バティアクセラ属から得られたフィターゼタンパク質を意味する。ひとつの実施形態では、バティアクセラ属フィターゼは、受託番号NCIMB 41248 (National Collections of Industrial Marine and Food Bacteria, Scotland, UK)で寄託された株に由来するアミノ酸配列を備える。好ましい実施形態では、バティアクセラ属フィターゼはSEQ ID NO: 2に示すアミノ酸配列を有する。
【0055】
「バティアクセラ属フィターゼに相当する」とは、バティアクセラ属フィターゼと同等の機能的性質または配列を1以上備える酵素を意味する。この酵素は、バティアクセラ属から得られた酵素である必要は無い。
【0056】
「バティアクセラ」とは、腸内細菌科のグラム陰性で通性嫌気性細菌の属を意味し、バティアクセラ属にはB.アグレスティス(agrestis)、B.ブレンネラーゼ(brennerase)、B. フェラグティアエ(ferragutiae)、B. ガビニアエ(gaviniae)、B. イザルディイ(izardii)、B. ノアキアエ(noackiae)、及びB. ワームボールディアエ(warmboldiae) が含まれる。バティアクセラ属の株は、例えばAmerican Type Culture Collection (ATCC)や、German National Resource Centre for Biological Material (DSMZ) から入手できる。
【0057】
「野生型フィターゼ」または「野生型」とは、天然のアミノ酸配列を有する酵素を意味する。特に、野生型フィターゼはSEQ ID. No. 1に示すものである。
【0058】
「バティアクセラ属フィターゼの変異体」または「フィターゼ変異体」とは、SEQ. ID NO: 1のフィターゼのアミノ酸配列と比較して、少なくとも1のアミノ酸の置換、挿入、および/または欠失を有する点で異なるアミノ酸配列を有するフィターゼ酵素を意味する。
「変異体」及び「変異」とは、単にフィターゼ変異体のアミノ酸配列とSEQ. ID NO: 1のアミノ酸配列との間に相違点があることを意味する。「変異体」及び「変異」は、出発物質として用いたSEQ. ID NO: 1のアミノ酸配列またはヌクレオチド配列または他のフィターゼを意味せず、および/または、変異体を得るためにこれらを物理的に改変、突然変異導入、修飾またはその他の変更を加えたこと意味しない。
本願のフィターゼ変異体(アミノ酸配列及びヌクレオチド配列を含む)は任意の方法により産出させることができる。フィターゼ変異体を産出させる様々な方法は当業者にとって公知であり、そのいくつかを本願に示す。
【0059】
本願で「タンパク質」というときは、タンパク質、ポリペプチド、及びペプチドを含む意味で用いる。
【0060】
本願では、「に等価なアミノ酸残基」、「に相当するアミノ酸」、及びこれらと同義の語は、特定のタンパク質における特定のアミノ酸配列中のアミノ酸残基として指定されたアミノ酸残基と同様の位置、及び機能を有するアミノ酸残基の意味で用いる。当業者であれば、フィターゼタンパク質との比較における特定のアミノ酸残基の等価性を識別できるであろう。
【0061】
2つのアミノ酸配列またはポリヌクレオチド配列について「配列同一性パーセント」というときは、2つの配列を適切にアライメントさせたときに、2つの配列間で同一となる残基数のパーセンテージを意味する。すなわち、80%のアミノ酸配列同一性とは、適切にアライメントさせた2つのポリペプチド配列中の80%のアミノ酸が同一であることを意味する。
配列同一性パーセントは、例えば2つの分子中の各配列をアライメントさせ、2つ配列の情報を直接比較し、アライメントさせた2つのアミノ酸配列間で一致するアミノ酸数を数え、その配列の長さで割り算した結果に100を掛けて求めることができる。
この分析に、入手が容易なコンピュータプログラムを用いることができる。このようなプログラムには、Smith and Waterman (1981) Advances in Appl. Math. 2:482-489に記載されたペプチド分析用の局所的相同性アルゴリズムが適用された"Atlas of Protein Sequence and Structure", M.O. Dayhoff et., Suppl. 3:353-358, National Biomedical Research Foundation, Washington, DC中のALIGN, Dayhoff, M.O.等がある。
ヌクレオチド配列同一性を求めるプログラムは、Wisconsin Sequence Analysis Package, Version 8 (販売元Genetics Computer Group社, Madison, WI) 中に含まれており、例えばSmith とWatermanのアルゴリズムを利用したBESTFIT, FASTA 及びGAPプログラムを用いることができる。これらのプログラムは、製造者が推奨し、上記のWisconsin Sequence Analysis Packageにも記載されているように、初期パラメータを5に設定することにより、容易に使用することができる。配列同一性の決定に適したアルゴリズムの例として、Altschul, et al., J. Mol. Biol. 215:403-410 (1990) に記載されたBLASTアルゴリズムが挙げられる。BLAST分析を行うためのソフトウエアは、National Center for Biotechnology Information (http://www.ncbi.nlm.nih.gov/) から自由に入手できる。また、相同性パーセントを決定するためのコンピュータプログラムも容易に入手できる。
【0062】
「性質」、またはポリペプチドに関する文脈上これと同義で用いられる語は、ポリペプチドの検出または選択可能な性質または属性を意味する。このような性質の非限定的例示として酸化安定性、基質特異性、触媒活性、熱安定性、活性の温度および/またはpH依存性、加工安定性、及び 分泌能力が挙げられる。
【0063】
高温下や低pHでの安定性等の性質に関して「改善された安定性」というときは、例えばSEQ ID NO: 1のフィターゼ等の他のフィターゼと比較して、より高い酵素活性が長時間保持されることを意味する。本願では、比較する他のフィターゼが特定されていない限り、「改善された安定性」というときは、SEQ ID NO: 1のフィターゼに対しより高い酵素活性が長時間保持されることを意味する。
【0064】
「熱的に安定」及び「熱安定性」とは、この発明のフィターゼが、高温に曝された後、特定の値の酵素活性を保持していることを意味する。この発明のフィターゼ変異体は、pH 5.5の緩衝液中で10分間特定の温度に曝された後その活性を50%以上保持している場合、特定の温度において熱安定性であるものとする。
【0065】
この発明のフィターゼ変異体について「改善された熱活性」というときは、そのフィターゼ変異体が高温下において、SEQ ID NO: 1等の他のフィターゼの酵素活性と比較して、同等又はより高い酵素活性を示すことを意味する。本願では、他のフィターゼが特定されていない限り、「改善された熱活性」とはSEQ ID NO: 1のフィターゼの熱活性と比較した、この発明のフィターゼ変異体の熱活性を意味する。熱活性に関しては、後述する実施例6にさらに詳しく説明する。
【0066】
本願では「ポリヌクレオチド」と「核酸」を同義で用い、任意の長さの高分子状のヌクレオチドを意味し、リボヌクレオチドまたはデオキシリボヌクレオチドのいずれかを意味する。これらの用語には、単鎖、二重鎖、三重鎖DNA、ゲノムDNA、cDNA、RNA、ハイブリッドDNA-RNA、またはプリン及びピリミジン塩基から成るポリマー、またはその他の天然、化学的、生化学的に修飾された非天然または誘導体化されたヌクレオチド塩基が含まれる。
【0067】
「遺伝子」とは、ポリペプチドをコードするポリヌクレオチド(例えばDNAセグメント)を意味し、コード領域の上流側及び下流側の領域と、各コードセグメント(エクソン)間の中間配列(イントロン)とを含む。
【0068】
本願では「DNA構築体」、「形質転換DNA」、及び「発現ベクター」を同義で用い、これらの用語は宿主細胞または有機対中に配列を導入するために用いられるDNAを意味する。DNAはPCR、または公知の他の適切な方法によってin vitroで調製する。DNA構築体、形質転換DNA、又は組み換え発現カセットを、プラスミド、染色体、ミトコンドリアDNA、プラスチドDNA、ウイルス、または核酸の断片に組み込むことができる。
通常、発現ベクター、DNA構築体、または形質転換DNAの組み換え発現カセット部位は、他の配列に加え、転写される核酸配列とプロモータとを備える。好ましい実施形態では、発現ベクターは宿主細胞中に非相同DNA断片を導入して発現させることができる。
【0069】
本願で「ベクター」というときは、核酸を1以上の細胞型中に導入するために設計されたポリヌクレオチド構築体を意味する。ベクターには、クローン化ベクター、発現ベクター、シャトルベクター、プラスミド、カセット等が含まれる。
【0070】
細胞中への核酸配列の導入に関して「導入した」というときは、細胞中への核酸配列の移送に適した任意の方法を意味する。このような導入方法の非限定的例示として、原形質融合、トランスフェクション、形質転換、接合、形質導入が挙げられる。また核酸配列が細胞のゲノムに導入され(例えば染色体、プラスミド、プラスチド、またはミトコンドリアDNA)、自立的レプリコンに転換されるか、または過渡的に発現される(例えばトランスフェクトRNA)、真核性または原核性細胞への核酸配列の導入を参照することができる。
【0071】
「最適アライメント」とは、最も高い配列同一性パーセントを与えるアライメントを意味する。
【0072】
本願では「タンパク質」と「ポリペプチド」を同義で用いる。本願では、アミノ酸残基について従来用いられている1文字及び3文字のコードを使用する。アミノ酸の3文字のコードはIUPACIUB Joint Commission on Biochemical Nomenclature (JCBN) の定義に従う。遺伝子コードの縮重のため、ポリペプチドは1以上のヌクレオチド配列でコードされる。
【0073】
本願の変異体は、以下の命名法により記載する。[SEQ. ID NO: 1の元のアミノ酸残基/SEQ. ID NO: 1の元のアミノ酸残基の位置/置換したアミノ酸残基] 。
例えばSEQ ID NO: 2では、SEQ ID NO: 1における位置89にあった元のアラニン(A)のスレオニンによる置換はA89Tと表わされる。置換される位置が特定のアミノ酸を示すことなく指定されている場合、任意のアミノ酸がその位置にあるアミノ酸残基により置換されることを意味する。
フィターゼ変異体が、他のフィターゼとの比較において欠失を有する場合、欠失を「*」で表示する。例えばSEQ. ID NO: 1の位置89の欠失は、A89*と表わす。連続した2以上のアミノ酸の欠失は、例えば(89 - 91)* と表記する。
【0074】
「シグナル配列」または「シグナルペプチド」とは、成熟タンパク質または前駆体タンパク質の分泌に関与するヌクレオチドおよび/またはアミノ酸配列を意味する。
このシグナル配列の定義は機能面に関するものであり、タンパク質遺伝子のN-末端部位によりコードされ、タンパク質の分泌に関与する全てのアミノ酸配列を包含することを意図している。「シグナル配列」または「シグナルペプチド」は、タンパク質のN-末端部位または前駆体タンパク質のN-末端部位に結合していることが多いが、槽でない場合もある。
【0075】
「宿主株」または「宿主細胞」とは、この発明のDNAを含む発現ベクターに適した宿主を意味する。
【0076】
本願で「から誘導された」または「から得られた」というときは、対象とする有機体の株から産出された、または産出され得るフィターゼだけでなく、このような株から単離されたDNA配列でコードされ、このようなDNA配列を有する宿主有機体中で産出されたフィターゼを意味する。さらに、これらの用語は、合成および/またはcDNA起源のDNA配列でコードされたフィターゼであって、対象とするフィターゼと同等の性質を備えるフィターゼを意味する。
すなわち、別のフィターゼ「から誘導された」または「から得られた」フィターゼは、そのフィターゼが別のフィターゼから物理的に誘導され物理的に得られたものである必要は無く、対象とするフィターゼが、別のフィターゼに関する知見から得られた知見又はアイデアを用いて産出されたものであってもよい。
【0077】
「機能性断片」とは、ポリペプチドの断片であって、そのポリペプチドの特徴的性質を保持している断片を意味する。本願では、フィターゼ酵素の機能性断片とは、このタンパク質全体が有するフィターゼ活性を保持している断片を意味する。
【0078】
「単離された」、「回収された」、または「精製された」とは、その元の状態から取り出された物質を意味する。「実質的に精製された」とは、その物質が少なくとも有意な程度に精製されたことを意味する。
【0079】
一側面では、ヌクレオチドまたはアミノ酸配列は単離された形態であることが好ましい。「単離された」とは、その配列が、少なくとも天然においてその配列とともに存在する少なくとも1の成分を実質的に含まないことを意味する。
【0080】
一側面では、ヌクレオチドまたはアミノ酸配列は精製された形態であることが好ましい。「精製された」とは、その配列が相対的に純粋であことを意味し、純度は少なくとも1%または5%、より好ましくは少なくとも20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%である。好ましい実施形態では、ポリペプチドについて言及するとき、上記の純度はSDS-PAGE電気泳動によって他のポリペプチドから精製されたものについて測定する。好ましい実施形態では、好ましい実施形態では、ポリヌクレオチドについて言及するとき、上記の純度は他のポリヌクレオチドから精製したものについて測定する。
【0081】
本願で「発現」、「発現する」、「発現された」、及び「発現可能」という用語は、それぞれ「転写」、「転写する」、「転写された」、及び「転写可能」と同義で用いる。
【0082】
本願では、「形質転換」及び「トランスフェクション」という用語は、核酸配列を宿主、宿主細胞、組織または器官に導入する方法を意味する。
【0083】
本願で「産出」、「産出する」、「産出された」、「産出可能」という用語は、「生産」、「生産する」、「生産された」、「調製」、「製造された」、「製造」及び「生産可能」と同義で用いる。
【0084】
「飼料」及び「食品」は、動物(飼料)またはヒト(食品)によって食べられ、食され、消化されるために適するか、またはこれらを目的とした天然または人工的な食用品、食物等、またはこのような食物等の成分を意味する。
【0085】
「食品または飼料用添加剤」とは、食品または飼料への添加に適するか、または添加を目的とした化合物、または多成分から成る組成物を意味する。食品または飼料用添加剤は、ビタミン、ミネラル、飼料強化酵素とその担体および/または賦形剤等の、1以上の化合物から成るが、そうでなくてもよい。飼料用添加剤は、通常飼料への添加に適した形態で供給される。
【0086】
「澱粉液状化」とは、澱粉をより短鎖で低粘度のデキストリンに転換するプロセスを意味する。
【0087】
「基質」とは、この発明の酵素の作用を受け得る少なくとも1の成分が含まれる物質を意味する。このような成分の例として、フィチン酸エステル、及びイノシトール・ペンタホスフェート、イノシトール・テトラホスフェート、イノシトール・トリホスフェート、イノシトール・ジホスフェート、及びイノシトール・モノホスフェート等の、フィチン酸エステルの分解中間生成物等が挙げられる。このような成分を含む基質の例として、例えば飼料の原料、液状化、糖化、発酵、同時糖化/発酵 、および/または例えば発酵アルコール(例えばエタノールまたはブタノール)製造の一段階プロセスにおいて用いられる穀粒、穀物、その他の植物性物質または炭水化物、またはアルコール(例えばエタノールまたはブタノール)製造時の発酵に用いられる糖、または他の製品(例えば非アルコール製品)の製造に用いられる糖が挙げられる。
【0088】
「アルコール発酵」とは、微生物(例えば酵母)が基質をアルコール(例えばエタノールまたはブタノール)に分類される代謝産物に転換する発酵プロセスを意味する。
【0089】
「プロモータ」とは、RNAポリメラーゼの結合に関与して遺伝子の転写を開始する調節配列を意味する。
【0090】
「転写制御下」という用語は周知であり、ポリヌクレオチド配列、通常はDNA配列の転写が、その配列が動作可能に結合し、転写の開始または促進に寄与するエレメントに依存することを示している。
【0091】
「翻訳制御下」という用語は周知であり、mRNAが形成された後に生じる制御プロセスを意味する。
【0092】
本願でタンパク質と、そのタンパク質をコードする遺伝子について記述する際、遺伝子は原文ではイタリックで表記した(例えばバティアクセラフィターゼをコードする遺伝子)。タンパク質は原文ではイタリック体で記載せず、最初の文字を大文字にして表記した。
【0093】
「動作可能に結合」とは、複数のエレメントが相互に機能的に関連し得るように配置された並列関係を意味する。例えば、プロモータが配列の転写を制御している場合、プロモータはコード配列に動作可能に結合している。
【0094】
「選択マーカ」とは、宿主細胞中で発現することができる遺伝子であって、核酸またはベクターが導入された宿主細胞の選択を容易することができる遺伝子を意味する。
選択可能マーカの非限定的例示として、抗生物質耐性の賦与(例えばハイグロマイシン、ブレオマイシン、またはクロラムフェニコール)、および/または、宿主細胞への栄養的選択性の賦与等、代謝選択性を賦与する遺伝子が挙げられる。
【0095】
ポリヌクレオチドまたはタンパク質に関して「非相同」と言うときは、天然の宿主細胞中には生じないポリヌクレオチドまたはタンパク質を意味する。
【0096】
ポリヌクレオチドまたはタンパク質に関して「内因性」と言うときは、天然の宿主細胞中に生じるポリヌクレオチドまたはタンパク質を意味する。
【0097】
「回収された」、「単離された」、及び「分離された」とは、天然においてその化合物等とともに存在する少なくとも1の成分が除去された化合物、タンパク質、細胞、核酸またはアミノ酸を意味する。
【0098】
細胞に関して「形質転換された」、「安定的に形質転換された」、及び「遺伝子組換え」と言うときは、その細胞がゲノムに組み込まれるか、またはエピソーム・プラスミドとしての非天然(例えば非相同)核酸配列を、数世代にわたり保有することを意味する。
【0099】
「発現」とは、遺伝子の核酸配列に基づいてポリペプチドが産出されるプロセスを意味する。このプロセスには転写と翻訳とが含まれる。
【0100】
この発明の実施または試験には、本願に開示した方法及び材料と同一または均等の方法及び材料を用いることができる。以下、好ましい方法及び材料の例を示す。本願に記載した全ての刊行物は、刊行物に記載された方法および/または材料であって本願に開示するに関連する事項を、必要な範囲において本願に参照として組み込まれる。
【0101】
その他の用語の定義は明細書に随時記載する。この発明の実施形態を詳しく例示する前に、本願は実施形態に限定されず、適宜変更できることを理解されたい。また、本願で用いる用語は特定の実施形態を説明するためだけのものであり、この発明の範囲は特許請求の範囲によってのみ定められることを理解されたい。
【0102】
数値範囲が記載されているとき、文脈上そうはでないことが明らかではない限り、上限値と下限値の間の中間の数値が、下限値の単位の十分の一まで開示されているものとする。本願に示す数値範囲の中間の値の上限値と、本願に示す数値範囲の中間の別の値の下限値の間のより狭い数値範囲も、本願の範囲に含まれる。このような狭い数値範囲の上・下限値はそれぞれ独立してその数値範囲に含まれるか、または含まれない。また、本願に開示する範囲から特に除外されているかにより、上・下限値のいずれか、または両方が狭い数値範囲に含まれるか、または含まれない範囲も本願発明の範囲に含まれる。本願に開示する範囲に上・下限値のいずれか、または両方が含まれている場合、上・下限値のいずれか、または両方を除外した範囲も本願発明の範囲に含まれる。
【0103】
特に断りの無い限り、原文の"a", "an,"及び"the"等の単数形には、複数形も含まれる。すなわち、原文で" a gene "というときは複数の遺伝子も含まれ、"the cell"というときは複数の細胞及び公知の均等な細胞等が含まれる。
【0104】
本願に記載した刊行物は、単に本願出願前の先行技術を開示するものである。これら刊行物がこの発明の範囲の先行技術を構成することを認めたものと解釈してはならない。
【0105】
親酵素または前駆体酵素として用いられるフィターゼ酵素にはバティアクセラ属フィターゼ、及びバティアクセラ属フィターゼに相当する酵素が含まれる。いくつかの実施形態では、親バティアクセラ属フィターゼは、受託番号NCIMB 41248で寄託された株に由来するアミノ酸配列を備える。いくつかの実施形態では、親バティアクセラ属フィターゼは、SEQ ID NO: 1に示すアミノ酸配列を備える。
いくつかの実施形態では、親バティアクセラ属フィターゼは、B.アグレスティス、B.ブレンネラーゼ、B. フェラグティアエ、B. ガビニアエ、B. イザルディイ、B. ノアキアエ、及びB. ワームボールディアエに由来する。親バティアクセラ属から得られるか、または由来するフィターゼ、及び親バティアクセラ属フィターゼ酵素に相当する酵素を開示しており、本願に参照として組み込まれるWO 2006/043178が参照される。
いくつかの実施形態では、野生型バティアクセラ属フィターゼ変異体は、SEQ ID NO: 1のポリペプチドに対し、アミノ酸配列同一性を少なくとも50%、少なくとも60%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも93%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%有する。
【0106】
この発明のひとつの実施形態は、フィターゼ変異体に関する(例えばバティアクセラ属フィターゼ変異体)。特にWO 2006/043178には、そこに開示されたSEQ ID NO: 3のアミノ酸配列を有する野生型フィターゼ酵素の突然変異導入が開示されている。WO 2006/043178には多数の好ましい突然変異導入が開示されている。
フィターゼ変異体は少なくとも1のアミノ酸置換、欠失、または挿入を有し、通常アミノ酸置換が好ましい。アミノ酸置換、欠失、または挿入は、フィターゼのペプチドの任意の残基において生じる。本願のフィターゼ変異体は、本願に開示するSEQ ID NO: 1のアミノ酸配列と同一のアミノ酸配列を備えていない変異体である。
【0107】
本願の好ましい実施形態では、本願のフィターゼ変異体はバティアクセラ属フィターゼに対し置換を有し、より詳しくはSEQ ID NO: 1の等価な位置に対応する置換を有する。いくつかの実施形態では、置換はA, C, D, E, F, 0, H, I, K, L, M, N, P, Q, R, S, T, V, WまたはYに相当する、残りの19のアミノ酸からなる。しかし、合成アミノ酸または他のアミノ酸を用いることもできる。
【0108】
フィターゼ変異体は、変異体を産出させるためのカセット法、PCR変異導入法、またはその他の方法等の公知の方法により、フィターゼタンパク質をコードするDNA中のヌクレオチドにランダム変異導入、部位飽和変異導入、及び部位特異的変異導入し、その後細胞培地で培養することにより産出させることができる。Morinaga et al., (1984) Biotechnology 2: 646 -649; Nelson and Long, (1989) Analytical Biochem., 180: 147 - 151 及びSarkar and Sommer (1999) Biotechniques 8: 404-407を参照することができる。公知の方法を用いたin vitro合成によりフィターゼ変異体タンパク質の断片を調製することもできる。
【0109】
ポリヌクレオチドは公知の標準的な方法で得ることができ、例えばクローン化DNA(例えばDNAライブラリー)、化学合成、cDNAクローン化、PCR (USP 4,683,202 またはSaiki et al., Science 239:487 - 491(1988))、公知の合成的方法(Beucage et al., (1981) Tetrahedron Letters 22: 1859 -1869 及びMatthes et al, EMBO J. 3:801 - 895(1984))、またはゲノムDNAのクローン化またはここから派生する断片、例えばバティアクセラ属等の所望の細胞からの精製により得ることができる(例えば Sambrook et al., 2001, Molecular Cloning, A Laboratory Manual, 3d Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York; Glover, DM and Hames, BD (Eds.), 1995, DNA Cloning 1: A Practical Approach and DNA Cloning 2: A Practical Approach, Oxford University Press, Oxford参照)。ゲノムDNAに由来する核酸配列、及びこの核酸配列からの派生物には、コード領域に加え、調節領域が含まれていてもよい。
【0110】
ポリペプチドを発現させるために、公知の組換体DNA発現法(例えばGoeddel; Gene Expression Technology. Methods in Enzymology 185, Academic Press, San Diego, Calif. (1990)参照)を用いることができる。例えば、所望のポリペプチドをコードするDNAを発現ベクター中に挿入し、次にこの発現ベクターを適切な宿主細胞中に形質転換することができる。発現ベクターの設計は、調節配列の選択も含め、選択する宿主細胞の種類、目的のタンパク質を発現させる量、発現が構成的であるか誘導的であるか等の要因に依存する。
【0111】
発現ベクターの宿主細胞中へのトランスフェクションは、電気穿孔、リン酸カルシウム共沈法、及びDEAE-デキストラントランスフェクション等の、公知の方法によって行うことができる。本願のベクター中のDNAの発現またはクローン化に適した宿主細胞は、原核生物、酵母、または上記の植物性細胞等の真核生物の細胞である。原核生物に加え、糸状菌または酵母等の真核性微生物も、本願のフィターゼ変異体のクローン化宿主または発現宿主に適している。
【0112】
タンパク質を産出させるために、宿主細胞を上記の発現ベクターまたはクローン化ベクターで形質転換し、プロモータの誘導、形質転換体の選択、または所望の配列をコードする遺伝子の増幅に適するように改良した公知の栄養培地で培養することができる。温度、pH等の培養条件は、発現用に選択した宿主細胞の培養条件と同じであり、当業者であれば容易に理解できる。
【0113】
宿主細胞から産出されたポリペプチドは、例えばヒドロキシアパタイトクロマトグラフィー、ゲル電気泳動、透析、及びアフィニティクロマトグラフィー等により精製することができる。
【0114】
いくつかの実施形態では、本願のフィターゼ変異体は改変された性質を有する。好ましくは、本願の実施形態に係るフィターゼ変異体は、SEQ. ID NO: 1の野生型フィターゼと比較して改良された性質を有する。いくつかの実施形態では、改変された性質、例えば改良された性質は、熱安定性、熱活性、飼料加工時の安定性、および/または比活性度である(図2参照)。
【0115】
いくつかの実施形態では、本願のフィターゼ変異体は公知のバティアクセラ属フィターゼ(例えばSEQ ID NO: 1に示すバティアクセラ属フィターゼ)と比較して、改善された熱安定性を有する。
いくつかの実施形態では、本願のフィターゼ変異体は野生型バティアクセラ属フィターゼ(BP-WT)と比較して少なくとも21.9℃、少なくとも22.4℃、少なくとも22.6℃、少なくとも22.9℃、少なくとも23.2℃、少なくとも23.4℃、少なくとも23.5℃、少なくとも23.5℃、少なくとも23.7℃、少なくとも24.1℃、少なくとも24.2℃、少なくとも24.4℃、少なくとも24.9℃、少なくとも25.0℃、少なくとも25.9℃、少なくとも26.5℃及び少なくとも26.8℃改善された熱安定性差(TD)を有する。
【0116】
いくつかの実施形態では、本願のフィターゼ変異体はSEQ. ID NO: 1に示す野生型フィターゼと比較して高温において改善された安定性を示す。いくつかの実施形態では、本願のフィターゼ変異体は約65℃、約70℃、約75℃、約80℃、またはそれ以上の温度において熱安定性である。上記のように、本願のフィターゼ変異体は、pH 5.5において指定された温度に10分間曝した後、酵素活性を50%以上保持しているとき、熱安定性であるものとする。
【0117】
いくつかの実施形態では、本願のフィターゼ変異体は相対的に高い熱活性を有する。いくつかの実施形態では、本願のフィターゼ変異体はBP-WTと比較して少なくとも17.4℃、少なくとも17.5℃、少なくとも17.6℃、少なくとも17.8℃、少なくとも17.9℃、少なくとも18.4℃、少なくとも18.7℃、少なくとも18.8℃、少なくとも18.9℃、少なくとも19.0℃、少なくとも19.3℃、少なくとも19.5℃、少なくとも20.0℃、少なくとも20.1℃及び少なくとも20.2℃高い熱活性差(TAD)を有する。
【0118】
いくつかの実施形態では、本願のフィターゼ変異体は1000U/mg、少なくとも1200U/mg、少なくとも1400U/mg、少なくとも1600U/mg、少なくとも1800U/mg、少なくとも2000U/mg、少なくとも2200U/mg、少なくとも2300U/mg、少なくとも2400U/mg及び少なくとも2500U/mgの比活性度を有する。
ここで、実施例3に詳しく示すように、比活性度は10mMのフィターゼと1mMのCaC12を含むpH 5.5の200 mM酢酸ナトリウム緩衝液を用いて67℃においてフィターゼを培養することにより測定する。
【0119】
いくつかの実施形態では、本願のフィターゼ変異体は少なくとも800U/mg、少なくとも1000U/mg、少なくとも1200U/mg、少なくとも1400U/mg、少なくとも1600U/mg、少なくとも1800U/mg、少なくとも2000U/mg、少なくとも2200U/mg、少なくとも2300U/mg、少なくとも2400U/mg、少なくとも2500U/mg及び少なくとも2600U/mgの比活性度を有する。ここで、実施例3に詳しく示すように、比活性度は10mMのフィターゼと1mMのCaC12を含むpH 5.5の200 mM酢酸ナトリウム緩衝液を用いて、80℃においてフィターゼを培養することにより測定する。
【0120】
いくつかの実施形態では、本願のフィターゼ変異体は80℃において熱安定性である。すなわち、pH 5.5において80℃に10分間曝した後、活性を50%保持しているとともに、比活性度が80℃において少なくとも2500U/mgで、67℃において少なくとも2300U/mgである。ここで、実施例3に詳しく示すように、比活性度は10mMのフィターゼと1mMのCaC12を含むpH 5.5の200 mM酢酸ナトリウム緩衝液を用いて、指定された温度においてフィターゼを培養することにより測定する。
【0121】
いくつかの実施形態では、本願のフィターゼ変異体は、本願のフィターゼ変異体(例えばSEQ ID NO: 2に示す変異体)でフィチン酸エステルを処理する工程を含む、リン酸塩化合物を製造する方法において用いることができる。フィチン酸エステルは、ミオ-イノシトールジ-、トリ-、テトラおよび/またはペンタホスフェートである。このほかの適切な有機リン酸塩にはイノシトール-テトラホスフェート、及びイノシトール-オリゴホスフェートが含まれる。
【0122】
いくつかの実施形態では、本願のフィターゼ変異体は実質的にBP-WTと同等の比活性度を保持しているが、BP-WTと比較して高温、高pHおよび/または低pHにおける安定性が向上している。
【0123】
いくつかの実施形態では、本願のフィターゼ変異体は実質的にBP-WTと同等の比活性度を保持しているが、熱安定性が向上している。
【0124】
いくつかの実施形態では、本願に開示するフィターゼ活性を有する酵素を産出させる方法が提供され、この方法には (a)本願のフィターゼ変異体をコードするポリヌクレオチドを含む発現ベクターで形質転換された宿主細胞を調製する工程と、(b) 形質転換された宿主細胞を、この宿主細胞がフィターゼ変異体を産出させるために適した条件下で培養する工程と、(c) 産出されたフィターゼ変異体を回収する工程とが含まれる。
【0125】
いくつかの実施形態では、発現ベクターには、図2に示す各位置に対応するアミノ酸残基における置換を有するアミノ酸配列を含むフィターゼをコードするポリヌクレオチドが含まれている。
【0126】
いくつかの実施形態では、宿主株は、非相同フィターゼ、または本願に開示するフィターゼ活性を有するフィターゼ変異体を発現するように、遺伝子組み換えされている。
【0127】
本願のフィターゼ変異体の産出に有用な宿主細胞は、細菌細胞、菌類細胞、及び植物性細胞である。宿主細胞にはその細胞と子孫細胞の両者、及びこれらの細胞に由来するプロトプラストが含まれ、このプロトプラストを本願のフィターゼ変異体の産出に用いることができる。
【0128】
DNA構築体を有する有用なベクターには、本願のフィターゼ変異体をコードするポリヌクレオチドが含まれ、宿主細胞の形質転換方法は公知であり、公知の技術及び方法を用いることができる。
【0129】
本願では、本願のフィターゼ変異体をコードする核酸を含むDNA構築体は、宿主細胞中でフィターゼ変異体を輸送および/または発現するように構築される。ひとつの実施形態では、DNA構築体は発現ベクターにより宿主細胞に輸送される。この発現ベクターには、フィターゼ変異体のコード配列に動作可能に結合した調整配列(例えばプロモータ、リボソーム結合部位、転写開始及び終止配列、翻訳開始及び終止配列、エンハンサー、IS活性化配列、細胞特異的発現配列、シグナル配列、および/またはターミネータ)が含まれる。
【0130】
フィターゼ変異体をコードするポリヌクレオチドを備えるDNA構築体を含む発現ベクターは、所与の菌類宿主有機体中で自己複製可能なベクター、または宿主のDNA中に組込み可能なベクターであれば、どのようなベクターでもよい。いくつかの実施形態では、発現ベクターはプラスミドまたはバクテリオファージである。いくつかの実施形態では、発現ベクターは予め構築されており、高レベルの転写に必要な配列と選択マーカを有する。いくつかの実施形態では、発現ベクターが発現構造体プロモータ配列及びターミネータ配列の転写制御下にあるようにして、フィターゼ変異体遺伝子のコード領域またはその一部を、汎用発現ベクターに挿入する。いくつかの実施形態では、遺伝子またはその一部を、強cbh1プロモータの下流に挿入する。
【0131】
菌類宿主細胞中でのフィターゼの産出については、上記のSambrook et al., (1989), 上記の Ausubel (1987), van den Hondel et al. (1991) in Bennett and Lasure (Eds.) MORE GENE MANIPULATIONS IN FUNGI, Academic Press (1991) pp. 70 -76 及び 396-428; Nunberg et al., (1984) Mol. Cell BioI. 4:2306-2315; Boel et al., (1984) 30 EMBO J. 3:1581-1585; Finkelstein in BIOTECHNOLOGY OF FILAMENTOUS FUNGI, Finkelstein et al. Eds. Butterworth-Heinemann, Boston, MA (1992), Chap. 6; Kinghorn et al. (1992) APPLIED MOLECULAR GENETICS OF FILAMENTOUS FUNGI, Blackie Academic and Professional, Chapman and Hall, London; Kelley et al., (1985) EMBO J. 4:475 - 479; Penttila et al., (1987) Gene 61: 155-164; 及び U.S. Patent No. 5,874,276が参照される。
好ましいベクターのリストは、Fungal Genetics Stock Center Catalogue of Strains (FGSC, www at fgsc.net)に示されている。
菌類宿主細胞での使用に適したベクターは、pFB6, pBR322, pUC 18, pUC100, pDONTM201, pDONRTM221, pENTRTM, pGEMTM3Z and pGEMTM4Z等のベクターである。
【0132】
いくつかの実施形態では、ベクターは、菌類宿主細胞中に導入されたとき宿主細胞のゲノムに組み込まれて複製されるベクターであれば、どのようなベクターでもよい。このようなベクターの非限定的例示としてFungal Genetics Stock Center Catalogue of Strains (FGSC, <www.fgsc.net>)に示されたベクターが挙げられる。好ましい発現または組込みベクターの別の例は、上記のSambrook et al., (1989), 上記のAusubel (1987), van den Hondel et al. (1991) in Bennett and Lasure (Eds.) MORE GENE MANIPULATIONS IN FUNGI, Academic Press. 396-428 及び U.S. Patent No. 5,874,276等である。
特に好ましいベクターは、pTREX, pFB6, pBR322, PUCI8, pUCI00 及び pENTR/Dである。細菌細胞中での使用に適したプラスミドは、E.coli中で複製可能なpBR322 及びpUC19、または例えばバシラス(Bacillus) 中で複製可能なpE194等である。
【0133】
いくつかの実施形態では、本願のフィターゼ変異体をコードする核酸は、宿主細胞中で転写活性を示す適切なプロモータに、動作可能に結合している。通常、フィターゼ変異体の発現は、公知または今後発見される適切なプロモータの下で行なわれる。いくつかの実施形態では、フィターゼ変異体は宿主の天然のプロモータの下で発現される。いくつかの実施形態では、フィターゼ変異体は宿主細胞中で活性な非相同プロモータの下で発現される。例えば、宿主細胞としてトリコデルマ(Trichoderma)の細胞を用いた場合、プロモータはトリコデルマ宿主細胞中で活性であることが好ましい。
【0134】
いくつかの実施形態では、プロモータは構成的または誘導的プロモータである。「構成的プロモータ」とは、ほとんどの環境的及び発生的条件下で活性なプロモータである。「誘導的プロモータ」または「抑制的」プロモータとは、環境的または発生的規制下で活性なプロモータである。いくつかの実施形態では、プロモータは誘導的または抑制的なものである。
これは、公知のように炭素、窒素または他の栄養素の入手可能性、温度、pH、浸透圧、重金属の存在、インヒビターの濃度、ストレス、またはこれらの組合せ等の環境的要因が変化するためである。いくつかの実施形態では、誘導的または抑制的プロモータは、所定の炭素源の濃度、所定のエネルギー源の濃度、所定の異化生成物の濃度、またはこれらの組合せ等の代謝要素によって誘導または抑制される。
ひとつの実施形態では、プロモータは宿主細胞の天然のプロモータである。例えば、T. リーゼイ(reesei)が宿主細胞の場合、プロモータは、例えばGenBankに受託番号D86235で寄託されたcbh1プロモータ等の、天然のT. リーゼイのプロモータである。
【0135】
好ましいプロモータの非限定的例示としてcbh1, cbh2, egl1, egl2, egl3, egl4, egl5, xyn1, 及び xyn2、 P.クリソゲヌス(chrysogenus)の酸抑制的ホスファターゼ遺伝子(phoA)プロモータ(例えばGraessle et al., (1997) Appl. Environ. Microbiol., 63 :753-756参照)、グルコース抑制的PCK1プロモータ(例えばLeuker et al., (1997), Gene, 192:235-240参照)、マルトース誘導的、グルコース抑制的MET3プロモータ(Liu et al., (2006), Eukary. Cell, 5:638-649参照)、pKi プロモータ、及びcpc1 プロモータが挙げられる。
他の好ましいプロモータの例として、A. アワモリ(awamori)及びA.ニガー(niger)グルコアミラーゼ遺伝子由来のプロモータが挙げられる(例えばNunberg et al., (1984) Mol. Cell Biol. 15 4:2306-2315 and Boel et al., (1984) EMBO J. 3:1581-1585参照)。また、T.リーゼイのxln1遺伝子のプロモータを用いることもできる(例えばEPA 137280Al参照)。
【0136】
いくつかの実施形態では、発現ベクターは構造的遺伝子の下流に転写終結配列を有し、効率的に終結する。いくつかの実施形態では、終結配列とプロモータは同一起源に由来する。別の実施形態では、終結配列は宿主細胞と相同である。特に好ましい終結配列はトリコデルマ株、特にT.リーゼイに由来するcbh1である。他の有用な菌類の終結配列の例には、A.アワモリ及びA.ニガーグルコアミラーゼ遺伝子由来の終結配列が含まれる(例えば上記のNunberg et al. (1984),及び上記のBoel et al., (1984)参照)。
【0137】
フィターゼ変異体をコードするポリヌクレオチド、プロモータ、ターミネータ及びその他の配列から成るDNA構築体を結紮する方法、及びこれらを適切なベクターに挿入する方法は公知である。結合は、適切な制限酵素認識部位を結紮することにより行われる。制限酵素認識部位が無い場合は、公知の方法に従って合成オリゴヌクレオチドリンカーを用いる(例えば上記のSambrook (1989)、及びBennett and Lasure, MORE GENE MANIPULATIONS IN FUNGI, Academic Press, San Diego (1991) pp 70-76参照)。さらに、ベクターは公知の組み換え技術により構築することができる(例えばInvitrogen Life Technologies, Gateway Technology)。
【0138】
<宿主細胞の形質転換、発現及び培養>
DNA構築体またはベクターの宿主細胞中への導入は、形質転換; 電気穿孔; 核ミクロインジェクション; 形質導入; トランスフェクション (例えばリポフェクション媒介及びDEAE-デキストリン媒介トランスフェクション); リン酸カルシウムDNA共沈法による培養; DNA-被覆微粒子の高速ボンバーメント(bombardment); 及び原形質融合等により行うことができる。
【0139】
アスペルギルス(Aspergillus)株及びトリコデルマ株の形質転換方法は、例えばYelton et al. (1984) Proc. Natl. Acad. Sci. USA 81: 1470 - 1474; Berka et al., (1991) in Applications of Enzyme Biotechnology, Eds. Kelly and Baldwin, Plenum Press (NY); Cao et al., (2000) Sci. 9:991 - 1001; Campbell et al., (1989) Curro Genet. 16:53-56; Pentilla et al., (1987) Gene 61:155 - 164); de Groot et al., (1998) Nat. Biotechnol. 16:839 - 842; USP 6,022,725; USP 6,268,328 及びEP 238 023に記載されている。
トリコデルマ株中での非相同タンパク質の発現は、USP 6,022,725; USP 6,268,328; Harkki et al (1991); Enzyme Microb. Technol. 13:227-233; Harkki et al., (1989) Bio Technol. 7:596-603; EP 244,234; EP 215,594; 及びNevalainen et al., "The Molecular Biology of Trichoderma and its Application to the Expression of Both Homologous and Heterologous Genes", in MOLECULAR INDUSTRIAL MYCOLOGY, Eds. Leong and Berka, Marcel Dekker Inc., NY (1992) pp. 129 - 148)に記載されている。
また、フザリウム(Fusarium)株の形質転換については、W096100787 及びBajar et al., (1991) Proc. Natl. Acad. Sci. USA 88:8202 -28212が参照される。
【0140】
また、植物の形質転換に有用なDNA構築体を調製する方法、及び植物を形質転換する方法も公知である。このような方法には、アグロバクテリウム・ツメフアシェンス(Agrobacterium tumefaciens)媒介遺伝子導入、微粒子ボンバードメント、PEG媒介原形質体形質転換、電気穿孔等がある。
例えばUSP 5,780,708; USP 6,803,499; USP 6,777,589; Fromm et al. (1990) Biotechnol. 8:833-839; Potrykus et al. (1985) Mol.Gen. Genet. 199:169 - 177; Brisson et al., (1984) Nature 310:511-514; Takamatsu et al., (1987) EMBO J 6:307-311; Coruzzi et al., (1984) EMBO J 3:1671-1680; Broglie et al. (1984) Science 224:838-843; Winter J and Sinibaldi RM (1991) Results Probl Cell Differ 17:85-105; Hobbs S or Murry LE (1992) in McGraw Hill Yearbook of Science and Technology, McGraw Hill, New York, N.Y., pp 191-196; 及び Weissbach and Weissbach (1988) Methods for Plant Molecular Biology, Academic Press, New York, N.Y., pp 421-463が参照される。
形質転換された細胞は、公知の方法を用い、適切な条件下において振蕩フラスコ培養、実験室、または工業用培養槽における小スケールまたは大スケールの培養(連続式、バッチ式、流加培養を含む)により、生理食塩水及び栄養素(例えば Pourquie, J. et al., BIOCHEMISTRY AND GENETICS OF CELLULOSE DEGRADATION, eds. Aubert, J. P. et al., Academic Press, pp. 71-86,1988及びIlmen, M. et al., (1997) Appl. Environ. Microbiol. 63: 1298-1306参照)を用いて培養することができる。
この発明では、一般的な市販の培地(例えばYeast Malt Extract (YM) ブロス, Luria Bertani (LB) ブロス、及び Sabouraud Dextrose (SD) ブロス)を用いることができる。菌類細胞に適した培養条件は公知であり、科学技術文献や、American Type Culture Collection and Fungal Genetics Stock Center等の菌類の供給元から知得することができる。
【0141】
いくつかの実施形態では、ベクター系により遺伝子的に安定な形質転換体が構築され、フィターゼ変異体をコードする核酸が宿主株の染色体中に安定に組み込まれる。次に、形質転換体を公知の方法により精製する。
【0142】
本願発明に係るフィターゼ活性を有するフィターゼ変異体をコードする非相同ポリヌクレオチドで形質転換された細胞株によるフィターゼ活性を有するフィターゼ変異体の発現を評価するために、フィターゼ活性および/または産出について、タンパク質レベル、RNAレベルでのアッセイ、または機能的バイオアッセイを用いて分析を行うことができる。
通常、このような分析には、ノーザンブロット、ドットブロット(DNAまたはRNA分析)、RT-PCR (逆転写ポリメラーゼ連鎖反応)、または適切にラベルされたプローブ(核酸コード配列に基づく)を用いたin situハイブリッド化、及び公知のサウザンブロッド及びオートラジオグラフィー等が含まれる。
【0143】
さらに、フィターゼ活性を有するフィターゼ変異体の発現または産出は、例えば無機リン酸塩の放出に基づいてフィターゼ活性(FTU)を直接評価することにより、サンプルから直接測定することができる。無機リン酸塩は酸性のバナジウム酸塩-モリブデン酸塩試薬と黄色の錯体を形成する。分光光度計を用いてこの黄色錯体を波長415nmにおいて測定し、無機リン酸塩検量線を用いて放出された無機リン酸塩を定量した。フィターゼ (FTU)の1単位は、フィチン酸エステルから1分間に1マイクロモルの無機リン酸塩(Pi)を放出させる酵素の量である。
【0144】
さらに遺伝子の発現は、例えば細胞、組織切片の免疫染色、または例えばウエスタンブロットまたはELISAによる組織培養基の免疫学的分析等の、免疫学的方法により評価することができる。このような免疫学的方法は、フィターゼの発現の定量分析または定性分析に用いることができる。このような免疫学的方法は公知であり、免疫学的方法に用いる様々な試薬が市販されている。
【0145】
フィターゼ活性の評価方法は公知であり、一例としてFiskeとSubbaRowらが開発した(Journal of Biological Chemistry 66:375-392 (1925))無機リン酸塩の放出を測定する古典的方法が挙げられる。この方法の変形例は、Mitchell et al., Microbiol. 143:245-252 (1997)に記載されている。また別の方法が、FOOD CHEMICALS CODEX, 4th Edition, Committee on Food Chemicals Codex, Institute of Medicine, National Academy Press, Washington, DC, 1996の809-810ページに記載されている。これらの文献を参照として本願に組み込む。
このような評価方法では、分光光度計を用いて比色分析を行い、濃度が既知の無機リン酸塩(Pi)の対照群、またはフィターゼ活性が既知の酵素との反応により調製した対照群と対比する。フィターゼ活性の1単位は、所定の反応条件下でフィチン酸エステルから1分間に1 μmol のPiを放出させるために必要な酵素サンプルの量と定義される。USP 6,221,644及びUSP 6,139,902も参照することができる。
【0146】
この発明のいくつかの実施形態では、トリコデルマまたはアスペルギルス宿主細胞から発現されフィターゼ活性を有するフィターゼ変異体の量は、タンパク質1グラム/培地1リットル(g/l)以上であり、あるいは2 g/l以上、5 g/l以上、10 g/l以上、20 g/l以上、25 g/l以上、30 g/l以上、50 g/l以上、または100 g/l以上である。
【0147】
本願の核酸配列の発現により産出されたポリペプチドは、公知の様々な方法により、細胞発酵培地から単離または回収して実質的に精製することができる。当業者であれば、適切な分離精製方法を選択することができる。
本願のフィターゼ変異体は、培地または宿主細胞の溶解物から回収することができる。膜結合している場合、適切な界面活性剤溶液(例えばTriton-X 100)または酵素分解によって放出させることができる。
フィターゼの発現に用いた細胞は、例えば凍結融解の繰返し、超音波処理、機械的細胞破砕、または細胞溶解試薬等の様々な化学的または物理的方法によって崩壊させることができる。組み換え細胞タンパク質またはポリペプチド由来のフィターゼを精製することが望ましい。
次に示す方法は、適切な精製方法の例示である:イオン交換カラムによる分画;エタノール沈殿法;逆相HPLC; シリカまたはDEAE等の陽イオン交換樹脂によるクロマトグラフィー;クロマト分画法;SDS-PAGE法;硫酸アンモニウム沈殿法;例えばephadex G-75を用いたゲル濾過法;Protein Aセファロースカラムによる混入物の除去;金属キレートカラムによるエピトープ標識されたフィターゼの結合。
様々なタンパク質精製方法を使用することができる。このような方法は公知であり、例えばDeutscher, METHODS IN ENZYMOLOGY, 182 (1990); Scopes, PROTEIN PURIFICATION: PRINCIPLES AND PRACTICE, Springer-Verlag, New York (1982)に記載されている。
精製方法は、例えば使用する産出プロセスの性質や、産出されるフィターゼの性質に応じて選択される。
【0148】
細胞培地において産出されたフィターゼ、またはフィターゼ変異体(SEQ ID NO: 1で示されるフィターゼを含む)は、培地中に分泌され、例えば細胞培地から不要な成分を除去することにより、精製または単離される。
フィターゼ変異体が細胞中で産出され、細胞溶解物からのフィターゼ変異体の回収が必要となる場合もある。このような場合、公知の方法を用いて、フィターゼ変異体が産出された細胞からフィターゼ変異体を精製する。
このような方法の非限定的例示として、アフィニティクロマトグラフィー法 (例えばTilbeurgh et al., (1984) FEBS Lett. 16:215参照);高溶解能の物質を用いるイオン交換法を含む(例えばMedve et al., (1998) J Chromatography A 808: 153参照)イオン交換クロマトグラフィー法 (例えばGoyal et al., (1991) Biores. Technol. 36:37; Fliess et al., (1983) Eur. J Appl. Microbiol. Biotechnol. 17:314; Bhikhabhai et al. (1984) J Appl. Biochem. 6:336; 及びEllouz et al., (1987) Chromatography 396:307参照);疎水性相互作用クロマトグラフィー法(例えばTomaz and Queiroz, (1999) J Chromatography A 865: 123参照); 二相分配法(例えばBrumbauer, et al., (1999) Bioseparation 7:287参照);エタノール沈殿法;逆相HPLC;シリカまたはDEAE等の陽イオン交換樹脂によるクロマトグラフィー;クロマト分画法;SDS-PAGE法;硫酸アンモニウム沈殿法;および/または、Sephadex G-75を用いたゲル濾過法等が挙げられる。
【0149】
この発明のいくつかの実施形態では、バッチ式または連続式発酵条件下で、非相同のフィターゼ変異体を発現する菌類細胞を培養する。古典的なバッチ式発酵法はクローズドシステムである。
バッチ式発酵法では、発酵を開始するとき培地の各成分を仕込み、発酵中は培地に手を加えない。すなわち、発酵を開始するとき培地に所定の有機体を植菌する。この方法では、系に追加成分を何も添加せずに発酵を行なう。通常、バッチ式発酵は炭素源の添加に関して「バッチ式」であり、通常はpHや酸素濃度等を制御して行われる。バッチ式発酵において、代謝産物及びバイオマス組成物の組成は、発酵を停止させるまで常に変化する。バッチ式発酵の培地内では、細胞は静的誘導期から高成長対数期を経て、成長速度が低下または停止する静止期に至る。なにも処置しない場合、静止期の細胞はやがて死滅する。通常、対数期の細胞が大部分の最終産品の産出に関与する。
【0150】
標準的なバッチ式発酵の変形例は、この発明でも有用な「流加式発酵(fed-batch fermentation)」である。この標準的なバッチ式発酵の変形例では、発酵が進むに従って、基質添加量を漸増させる。流加発酵法は、異化生成物の抑制により細胞の代謝が抑止され、培地中の基質の量を制限することが好ましい場合に適している。流加発酵法における実際の基質濃度の測定は困難であるため、pH、溶解酸素量、CO2等の廃ガスの分圧等の、測定可能な因子の変化に基づいて推定する。バッチ式および流加式発酵は公知である。
【0151】
連続式発酵はオープンシステムであり、所定量の発酵培地を連続的にバイオリアクターへ供給すると同時に、同量の処理された培地を抜き出して、さらに加工する。連続式発酵では、培地を一定の高密度に保ち、細胞を予め対数期まで成長させておく。
【0152】
連続培養法では、細胞の成長および/または最終産品に影響する1以上の因子を調節することができる。例えば、一例では炭素源または窒素源の濃度等の栄養素を一定値に保ちながら他の因子を調節する。別の例では、例えば培養液の懸濁度から求めた細胞濃度を一定に保ちながらその他の細胞の成長に影響する複数の因子を継続的に調節する。
連続培養法では、安定な成長状態を維持するように努める。すなわち、培地の抜き出しによる細胞の減少を、発酵による細胞の増加で補う。連続培養法における栄養素と成長因子の調節方法と、製品の産出速度を最大にする方法は分子生物学の分野では公知である。
【0153】
この発明のひとつの実施形態では、少なくとも1の本願に係るフィターゼ変異体を含む酵素組成物が提供される。本願に係る酵素組成物は、公知の方法を用いて、液体または乾燥固体の形態の組成物として調製することができる。
【0154】
液状組成物には、フィターゼ変異体酵素以外の成分が含まれている必要な無い。フィターゼ変異体酵素は、実質的に精製されているか、または少なくとも一部精製された形態であり、実質的に精製されていることが好ましい。グリセロール、ソルビトール、またはモノプロピレングリコール等の安定剤を添加することもできる。液状組成物に、塩、糖、保存料、pH-調整剤(すなわち緩衝剤)、タンパク質、またはフィチン酸エステル(フィターゼの基質)等の1以上の他の添加剤が含まれていてもよい。一般的な液状組成物は、水またはオイルベースのスラリーである。
【0155】
乾燥固体状組成物はスプレー-ドライにより得られる組成物である。この場合、乾燥された状態において、この組成物にフィターゼ変異体酵素以外の成分が含まれている必要は無い。しかし通常は、乾燥固体状組成物はいわゆる顆粒で、例えば食品や飼料の成分と容易に混合可能であり、あるいは好ましくは混合物の1成分である。顆粒状酵素の粒径は、好ましくは混合物中の他の成分の粒径と適合し得るものである。
【0156】
いくつかの実施形態では、この発明のフィターゼ変異体を含む酵素組成物を、次に示す酵素のいずれかと組み合わせて用いることもできる。グルコアミラーゼ、アルファ-アミラーゼ、プロテアーゼ、プルラナーゼ、イソアミラーゼ、セルラーゼ、ヘミセルラーゼ、キシラナーゼ、シクロデキストリングリコトランスフェラーゼ、リパーゼ、フィターゼ、ラッカーゼ、オキシダーゼ、エステラーゼ、クチナーゼ、ペクチナーゼ、グルコースオキシダーゼ、ベータグルコシダーゼ、フォスファターゼ、ベータ-アミラーゼ、ヒドララーゼ、トランスフェラーゼ、別のフィターゼ、及びこれらの組み合わせ。
【0157】
いくつかの実施形態では、フィターゼ変異体の組成物は、食品または動物飼料用組成物である。食品または動物飼料用組成物中のフィターゼ変異体の濃度は、食品または飼料1kg当たり10から15,000 U(例えば食品または飼料1kg 当たり100から5,000 U、200から2,000 U、または 500から1000 U)である。フィターゼ変異体組成物は、次に示す家畜または動物の消化管において活性な添加剤として用いられる。家禽、ブタ、アルパカ、バイソン、ラクダ、ウシ、チンチラ、シカ、ロバ、アヒル、魚、カエル、ヤギ、ガチョウ、家禽、ウマ、ラマ、ミンク、ラバ、ダチョウ、ハト、トナカイ、ヒツジ、七面鳥、ヤク、水牛、ネコ、チンパンジー、イヌ、フェレット、アレチネズミ、金魚、モルモット、ハムスター、サル、インコ、爬虫類、齧歯動物、及びえび等の魚類や貝類を含む水産養殖動物。
SEQ. ID NO: 1に示す野生型フィターゼと比較して、この発明のフィターゼ変異体はこれらの動物が有するプロテアーゼに対し改善された耐性を示し、あるいはこれらの動物の消化管において活性を長時間示す。
本願は食品または飼料を製造する方法に関し、本願発明に係るフィターゼ変異体を食品または飼料と混合することを特徴とする。フィターゼ変異体の液状組成物は、食品または飼料をペレット化してから添加することができる。
いくつかの実施形態では、飼料には次に示す成分の1以上が含まれている。a) 小粒穀粒(例えば小麦、大麦、ライ麦、オート麦、及びこれらの組合せ)および/またはトウモロコシ、ソルガム等の大粒穀粒等の穀物;b) トウモロコシグルテン、可溶性物質添加乾燥蒸留穀物残渣(DDGS)、小麦フスマ、小麦ミドリング粉、小麦ショーツ、米ぬか、米殻、オート麦殻、 パーム核油、果実の搾りかす等の穀物の副産物;c) 大豆、ヒマワリ、ピーナッツ、ルピン、エンドウ、ソラマメ、コットン、キャノーラ、魚粉、乾燥結晶タンパク質、肉骨粉、ポテトタンパク質、ホエー、コプラ、ゴマ等から得られたタンパク質;d) 植物及び動物から得られた油脂;e) ミネラル及びビタミン;f) 酵素、ベタイン、香味料、精油、 抗生物質成長プロモータ、抗コクシジウム剤、プロバイオティクス、及びプレバイオティクス等の補助的成分。
【0158】
また、動物の排泄物の中のリンの濃度を下げる方法が提供され、この方法は、飼料中のフィチン酸エステルを転換するために十分な量の本願に係るフィターゼ変異体を含む飼料を、動物に与える。
【0159】
さらに、本願に係るフィターゼ変異体組成物を、澱粉加水分解法において用いることができる。本願のフィターゼ変異体組成物は、澱粉の液状化工程、糖化工程、および/または発酵工程において添加することができる。原料に粉砕穀粒等の植物性材料を用いた澱粉の加水分解プロセス(例えば発酵プロセス、醸造または製パンプロセス)において、アルファ-アミラーゼを用いて澱粉の1-4結合を切断する。澱粉の分解にはアミラーゼが必要であるが、アミラーゼに十分な活性を発揮させることが困難な場合がある。
従来、フィチン酸エステルがアミラーゼに対し阻害作用を示すことが知られている。従って、この発明のフィターゼ変異体を含む酵素組成物を澱粉の加水分解プロセスにおいて用いることにより、アルファ-アミラーゼに対するフィチン酸エステルの阻害作用を低減させることができる。
【0160】
フィターゼ、フィチン酸エステル、及び低級フィチン酸リン酸エステルは、パーソナルケア製品、医薬品、及び食品または補助栄養食品、さらに特にクリーニング、テキスタイル、リソグラフィーやケミカルアート等の工業的用途等、多くの用途に用いることができる。好ましくは、例えばこの発明のフィターゼ変異体をアルコール発酵、例えばバイオ燃料の製造に用いることができる。
【0161】
<フィターゼの使用>
上記のように、この発明はまた、本願に係るフィターゼの産出に関する。
【0162】
特に、この発明はさらに、本願に開示するアミノ酸配列の、有機または無機リン酸塩化合物の製造における使用に関する。
【0163】
すなわち、この発明はさらに、フィターゼ変異体をコードするヌクレオチド配列の、発現ベクターの調製における使用、またはフィターゼ変異体を発現させるシステムにおける使用に関する。
【0164】
さらにこの発明は、このような発現ベクターまたはシステムの、フィターゼ変異体を発現する宿主細胞の調製における使用に関する。
【0165】
この発明はさらに、修飾された宿主細胞の、有機または無機リン酸塩化合物の前駆体の調製における使用、または特定の有機リン酸塩化合物の調製における使用に関する。
【0166】
適切な有機または無機リン酸塩化合物には、ミオ-イノシトールペンタキス-、テトラキス-、トリス-、ビス-、及びモノ-ホスフェートが含まれる。
【0167】
すなわち、この発明により、本願に係るフィターゼ変異体によるフィチン酸エステルの処理に適した工程を含む、有機リン酸塩化合物を製造する方法が提供される。好ましくは、有機リン酸塩化合物はフィチン酸エステル、またはミオ-イノシトールジ-、トリ-、テトラ-、及びペンタホスフェートの全立体異性体である。他の好ましい有機リン酸塩化合物は、イノシトール-テトラホスフェート及びイノシトール-オリゴホスフェートである。好ましい実施形態では、この方法はin vivoのバイオテクノロジー的プロセスである。
【0168】
好ましくは、この有機リン酸塩化合物を製造する方法は、
a) 本願のフィターゼ変異体から成る発現可能な導入遺伝子(expressible transgenes)を備える宿主細胞を調製する工程と、
b) 導入遺伝子有機体を、導入遺伝子の発現に適した条件下で培養する工程と、
c) 培地から有機リン酸塩化合物を回収する工程とから成る。
有機リン酸塩化合物は、フィターゼの性質分析等の多数の用途に用いることができる。いくつかのイノシトールホスフェートは細胞内調節のシグナル分子として含有されており、リサーチ化学薬品として使用することができる。
【0169】
別の側面では、食品または飼料を製造する方法が提供される。通常、飼料は飼料粉砕機で製造される。飼料粉砕機において、原料を適切な粒径に粉砕し、次に適切な添加剤と混合する。
飼料は、マッシュまたはペレットの形態で製造される。ペレットは、温度を目標値まで上げ、次に飼料をダイに通過させて特定のサイズのペレットにする方法により製造される。次に、脂肪や酵素等の液状添加剤を添加する。ペレットは、移送する前に冷却する。飼料の製造工程にはさらに、ペレット化工程の前に、特に少なくともスチームの使用等の適切な方法による膨張工程、または押出工程等の追加工程が含まれる。
【0170】
このように、この発明により、フィターゼをコードするアミノ酸配列またはフィターゼを産出するためのフィターゼを発現する宿主細胞の、食品または飼料の製造における使用が提供される。
一側面では、本願のアミノ酸配列の、食品または飼料の製造における使用が提供される。別の側面では、この発明の宿主細胞の、食品または飼料の製造における使用が提供される。別の側面では、この発明の発現ベクターまたはシステムの、食品または飼料の製造における使用が提供される。
【0171】
またこの発明は、動物に与える他の成分を含む配合飼料の一成分として、本願に係る酵素を用いることにも関する。
【0172】
<他の成分との組み合わせ>
この発明のフィターゼ変異体は、他の成分または単体と組み合わせて用いることができる。他の成分の例は、本願に既に説明した。これらの成分や、さらに別の成分について説明する。
【0173】
飼料用酵素に適した単体には小麦(粗びき粉)が含まれる。さらに、脂肪/ワックスや植物ゴムの添加等による、様々なカプセル化方法が知られている。
【0174】
他の成分の例として、増粘剤、ゲル化剤、乳化剤、バインダー、結晶改良剤、甘味料(人工甘味料を含む)、レオロジー改良剤、安定剤、酸化防止剤、染料、酵素、担体、ビヒクル、賦形剤、希釈剤、潤滑剤、香料、着色剤、懸濁剤、崩壊剤、顆粒結合剤等が挙げられる。これらの他の成分は天然のものである。これらの他の成分は化学的および/または酵素的方法で合成されたものでもよい。
【0175】
「増粘剤またはゲル化剤」とは、非混和性液体の液滴、気泡、または不溶性固体の粒子の動きを遅くするかまたは防止して、分離を防ぐ物質を意味する。
【0176】
「安定剤」とは、製品(例えば食品)の経時的変化を防止する材料または材料の組合せを意味する。
【0177】
「乳化剤」とは、エマルジョンの分離を防止する材料(例えば食品用の材料)を意味する。
【0178】
「バインダー」とは、物理的または化学的反応により、製品を結合させる材料(例えば食品用の材料)を意味する。
【0179】
「結晶改良剤」とは、脂肪または水の結晶化に影響を及ぼす材料(例えば食品用の材料)を意味する。
【0180】
「担体」または「ビヒクル」とは、化合物投与に適した物質を意味し、例えば、組成物中の成分に悪影響を及ぼさず、無毒の液体、ゲル、溶媒、液状希釈剤、可溶化剤等の公知の物質である。
【0181】
栄養的に許容される担体の例として、穀物、水、塩の溶液、アルコール、シリコーン、ワックス、ワセリン、植物油等が挙げられる。
【0182】
賦形剤の例として、微結晶性セルロースやその他のセルロース、ラクトース、クエン酸ナトリウム、炭酸カルシウム、二塩基性リン酸カルシウム、グリシン、澱粉、乳糖、高分子量ポリエチレングリコールのいずれか1以上が挙げられる。
【0183】
崩壊剤の例として、澱粉(好ましくはコーン、イモ、またはタピオカ澱粉)、デンプングリコール酸ナトリウム、クロスカルメロースナトリウム、所定の複合ケイ酸塩のいずれか1以上が挙げられる。
【0184】
顆粒結合剤の例として、ポリビニルピロリドン、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルセルロース(HPC)、サッカロース、マルトース、ゼラチン、及びアカシアのいずれか1以上が挙げられる。
【0185】
潤滑剤の例として、ステアリン酸マグネシウム、ステアリン酸、モノベヘン酸グリセリル、タルクのいずれか1以上が挙げられる。
【0186】
希釈剤の例として、水、エタノール、プロピレングリコール、及びグリセリン及びこれらの組み合わせのいずれか1以上が挙げられる。
【0187】
他の成分は、同時に用いる(例えば各成分が混合されている場合、あるいは別々の経路から供給されて予め混合される場合)こともできるし、順次用いる(例えば別々の経路から供給される場合)こともできる。
【0188】
本願で「動物またはヒトの摂取に適した成分」というときは、本願の組成物に補助栄養素として添加することができるか、または添加する化合物を意味する。この補助栄養素は、栄養面での利点を有し、食品繊維の代替となり、または摂取者に何らかの有利な効果をもたらすものである。
【0189】
このような成分の例は、アルギン酸塩、キサンタン、ペクチン、ローカスビーンガム(LBG)、イヌリン、グアーガム、ガラクト-オリゴサッカライド(GOS)、フルクト-オリゴサッカライド(FOS)、ラクトサッカロース、大豆オリゴサッカライド、パラチノース、イソマルト-オリゴサッカライド、グルコ-オリゴサッカライド、及びキシロ-オリゴサッカライド等のプレバイオティックスである。
【0190】
<食品及び飼料>
本願に係る物質を食品及び飼料として使用するか、または食品及び飼料の製造に用いることができる。本願では、「食品」を広い意味で用い、ヒト用の食品及び食物製品だけでなく、動物用の食品(すなわち飼料)も意味する。「飼料」という用語は、家畜の飼育において動物に与える製品の意味で用いる。好ましい側面では、食品または飼料をブタ、家禽、魚等の単胃動物に与える。
【0191】
食品または飼料の形態は、使用目的および/または使用の態様、および/または与え方に応じて、溶液または固体にすることができる。
【0192】
<食品または飼料の原材料及び補助的原料>
本願に係る物質を食品または飼料の原材料に用いることができる。
【0193】
本願で「食品または飼料の原材料」と言うときは、食品または食品に添加するか添加することができる配合物が含まれ、また様々な製品に低濃度で用いられる配合物が含まれる。
【0194】
食品の原材料の形態は、使用目的および/または使用の態様、および/または与え方に応じて、溶液または固体にすることができる。
【0195】
本願に係る物質は補助食品であるか、または補助食品に添加することができる。
【0196】
<食品または飼料組成物>
単胃動物用の飼料組成物には、通常、フィチン酸エステルを含む植物性物質を含有する組成物が含まれている。このような組成物には、コーンミール、大豆ミール、菜種ミール、綿実ミール、トウモロコシ、小麦、大麦、及びソルガムベース飼料が含まれる。
【0197】
本願のフィターゼは、食品または飼料用の物質または組成物であるか、または食品または飼料用の物質または組成物に添加することができる。
【0198】
またこの発明により、食品または飼料用の原材料または補助食品を製造する方法が提供され、この方法には本願の方法により産出されたフィターゼ、または本願に係る組成物と、別の食品原材料とを混合する工程が含まれる。
またこの発明の別の側面は、食品原材料の製造方法に関する。動物の飼料の製造方法は上記のとおりである。フィターゼ変異体を固体状の配合物、またはプレミックス等の飼料用添加剤の形態で添加することができる。固体状の配合物は、混合工程の前または混合工程中に添加し、液状の場合はペレット化工程の後に添加する。
【0199】
<賦形>
この発明の産品および/または化合物は、単独で用いられるか組成物として用いられるかにかかわらず、適宜賦形して用いることができる。また、本願により産出されたフィターゼ(すなわち食品原材料、機能性食品原材料または医薬品原材料等の原材料)は、適宜賦形して用いることができる。
【0200】
賦形の好ましい例は、即効性、遅延放出、放出調節、徐放性、パルス放出、または放出制御用の錠剤、ピル、カプセル、胚珠、溶液または懸濁液のいずれか1以上であり、香料または着色料が含まれていてもよい。
【0201】
一例として、本願の産品および/または組成物を、例えば機能性原材料として錠剤に賦形して用いる場合、この錠剤に賦形剤、崩壊剤、顆粒結合剤、または潤滑剤のいずれか1以上が含まれていてもよい。
【0202】
賦形において用いられ、栄養的に許容される担体の例として、水、塩の溶液、アルコール、シリコーン、ワックス、ワセリン等が挙げられる。
【0203】
賦形に用いる好ましい賦形剤は、ラクトース、澱粉、セルロース、乳糖、または高分子量ポリエチレングリコール等である。
【0204】
水性懸濁液またはエリクサーの形態の場合、フィターゼ分解化合物を、様々な甘味料または香味料、着色剤または染料、乳化剤および/または懸濁剤、及び水、エタノール、プロピレングリコール、グリセリン、及びこれらの組み合わせ等の希釈剤とともに用いることができる。
【0205】
賦形には、ゼラチンカプセル、ファイバーカプセル、ファイバータブレット等も含まれる。
【0206】
以下の実施例は説明を目的としたものであり、この発明の範囲を限定することは意図していない。
【実施例】
【0207】
<実施例と方法>
<実施例で使用する酵素の命名>
フィターゼBP-17(BP 17と呼ぶことがある)は、例えばPCT出願WO 2008/097619に開示されたフィターゼであり、Danisco A/Sから入手することができる。そのアミノ酸配列をSEQ ID NO:5に示す。
【0208】
BP-110(BP 17 var. 110、またはBP17-110、またはBP17 110と呼ぶことがある)は、本願に開示するフィターゼであり、Danisco A/Sから入手することができる。そのアミノ酸配列をSEQ ID NO:6に示す。
【0209】
BP-111(BP 17 var. 111、またはBP17-111、またはBP17 111と呼ぶことがある)は、本願に開示するフィターゼであり、Danisco A/Sから入手することができる。そのアミノ酸配列をSEQ ID NO:7に示す。
【0210】
BP-112(BP 17 var. 112、またはBP17-112、またはBP17 112と呼ぶことがある)は、本願に開示するフィターゼであり、Danisco A/Sから入手することができる。そのアミノ酸配列をSEQ ID NO:2に示す。
【0211】
図5に、BP-17 (SEQ ID NO: 5), BP-110 (SEQ ID NO:6), BP-111 (SEQ ID NO:7) 及びBP-112 (SEQ ID NO:2) のアミノ酸配列を示す。また図2に、BP-112のアミノ酸配列を示す。図4に、BP-112の核酸配列をSEQ ID NO:4として示す。
Phyzyme XP − Danisco A/S社製のフィターゼである。
Natuphos − BASF社製のフィターゼである。
Ronozyme P − Novozymes社製のフィターゼである。
【0212】
<パートA>
<実施例1. フィターゼ酵素の精製>
フィターゼ酵素の精製は、フィターゼ酵素のN-末端に融合した6His-tagを用いて行った。6His-tagフィターゼ酵素をコードするプラスミドで形質転換したB.スブチリスを、ネオマイシン20 mg/lを添加した標準LB培地を用い、振蕩フラスコ中で37℃において160 rpmで撹拌しながら培養した。この段階で、培養培地のフィターゼ活性が顕著に増加した。
約2リットルの培養ブロスのpHを8.0に調整し、濾過した後、Ni-NTAセファロースレジン(Qiagen社)10mlを充填したカラムに通した。このカラムを、OD280が0.05より低くなるまで、pH 8.0の300 mM NaCl, 50 mM Tris-HCl緩衝液で洗浄した。次に、イミダゾールヒドロクロリド250 mMを含む同緩衝液を用いて、結合したフィターゼを流出させた。
流出液をpH 5.0の50 mM酢酸ナトリウムに対し透析し、4℃で保管した。この酵素溶液を、pH 5.0の20 mM酢酸ナトリウム緩衝液で平衡化したResource Sカラムに通し、10カラム容量の0-1 M NaCl塩勾配を用いて溶出させた。任意に、溶出液をpH 5.0の20 mM酢酸ナトリウム緩衝液に対し透析した後、4℃で保管した。
【0213】
<実施例2. フィターゼ活性評価>
マイクロタイタープレートを用いてフィターゼ活性を評価した。反応液の総容積は100マイクロリットルで、後述する緩衝液、フィターゼ10mM、塩化カルシウム1 mM、及び0.05 % (w/v)のPluronic F68が含まれていた。反応は、所定の温度、例えば37℃から90℃の間の温度で、30分間行った。
【0214】
フィターゼ活性の指標となるフィチン酸エステルからのリン酸塩の放出は、少量のサンプル(通常5 μl)を含む、総容積50 μlのリン酸塩検出分析液を37℃で1時間培養して行った。
この分析液には、次の最終濃度となる化合物が含まれていた:1 M Tris/HCl, pH 7.0, 0.01% (v/v) Triton X-100, 0.025 mM ADHP (MoBiTec社, Gottingen, Germany), 0.2 U/ml マルトースホスホリラーゼ, 0.25 mM マルトース, 1.25 U/ml グルコースオキシダーゼ, 0.25 U/ml ホースラディッシュペルオキシダーゼ, 1 mM EDTA, 0.35 mg/ml BSA。
反応は、2700 U/mlのカタラーゼ水溶液30 μlを添加することにより停止させた。次に535 nmの励起波長を用いて、595 nmの蛍光を測定した。リン酸塩の量は、濃度既知のリン酸塩溶液による検量線を用いて求めた。1酵素単位は、リン酸塩放出量1マイクロモル/分と定義される。
【0215】
異なるpHにおけるフィターゼ活性を測定するときは、次の緩衝液を用いた: pH 2.0からpH 3.5の範囲では200 mMグリシン/HCl、pH 4.0からpH 5.5の範囲では100 mM酢酸ナトリウム/酢酸。
【0216】
<実施例. 3比活性度>
実施例1の方法により精製した酵素を用いて、BP-WTとフィターゼ酵素変異体の比活性度を測定した。
【0217】
結合酵素アッセイ法(coupled enzymatic assay)を用いて、マイクロタイター中でフィターゼ活性を測定した。
酵素溶液を希釈緩衝液(50 mM 酢酸ナトリウム, 0.05% Pluronic F-68, 1 mg/ml BSA)で希釈した。5 μlから10 μlの酵素溶液のサンプルを含む総容積80 μlのフィチン酸エステル分析溶液を培養した。
分析溶液には以下の最終濃度となる緩衝液、基質、及び塩が含まれていた:200 mM 酢酸ナトリウム, pH 5.5, 10 mM フィチン酸エステル, 1 mM CaCl2, 0.05 % (w/v) Pluronic F-68。
BP-WTフィターゼの分析溶液は37℃で30分間培養し、フィターゼ酵素変異体の分析溶液は67℃または80℃で30分間培養した。
【0218】
フィターゼ活性の指標となるフィチン酸エステルからのリン酸塩の放出は、少量の各サンプル(通常5 μl)を含む総容積50 μlのリン酸塩検出分析液を37℃で1時間培養して行った。
この分析液には、次の最終濃度となる化合物が含まれていた:1 M Tris/HCl, pH 7.0, 0.01% (v/v) Triton X-100, 0.025 mM ADHP (MoBiTec社, Gottingen, Germany), 0.2 U/ml マルトースホスホリラーゼ, 0.25 mM マルトース, 1.25 U/ml グルコースオキシダーゼ, 0.25 U/ml ホースラディッシュペルオキシダーゼ, 1 mM EDTA, 0.35 mg/ml BSA。
反応は、2700 U/mlのカタラーゼ水溶液30 μlを添加することにより停止させた。次に535 nmの励起波長を用いて、595 nmの蛍光を測定した。リン酸塩の量は、濃度既知のリン酸塩溶液による検量線を用いて求めた。1酵素単位は、リン酸塩放出量1マイクロモル/分と定義される。
【0219】
フィターゼの濃度は、溶液の280 nmの吸光度と、各フィターゼ変異体のそれぞれの吸光係数から求めた。吸光度は、Gill and von Hippel, Analytical Biochemistry 182:319-326 (1989)に記載された方法に従い、タンパク質のアミノ酸組成に基づいて計算した。
【表2−1】

【表2−2】

【表2−3】

【0220】
<実施例4. フィターゼ変異体の調製と分析>
フィターゼ変異体は、フィターゼタンパク質をコードするDNAの様々な突然変異生成法、例えばカセット、PCR突然変異生成、またはその他の突然変異生成法等の周知の方法を用いて調製した。これらの方法には、例えばMorinaga et al., Biotechnology 2:646-649 (1984); in Nelson and Long, Analytical Biochemistry 180:147-151(1989)、あるいはWO 92/18645に開示されたError Threshold Mutagenesis法等の、上記に示した方法が含まれる。PCR突然変異生成法の他の好ましい方法は、Cadwell and Joyce, PCR Methods Appl. 3:136-140(1994)に開示されている。
【0221】
フィターゼ変異体は、次の1以上の発現宿主中で非相同的に発現させた:サッカロミセス・セレビシアエ(Saccharomyces cerevisiae)、バシラス・スブチリス、エシェリキア・コリ(Escherichia coli)。
【0222】
<実施例5. 熱安定性>
フィターゼ変異体の熱安定性は、フィターゼ変異体の不活性化温度により評価した。不活性化温度は、フィターゼ酵素を異なる温度においてpH 5.5で10分間培養し、次に37℃で60分間培養した後の残留活性により評価した。残留活性は、pH 3.5 、37℃において60分間フィターゼ活性を測定して求めた。
不活性化温度は、室温において同一条件下で同一時間培養した後の残留活性と比較して、残留活性が50%になる温度と定義される。活性測定データを外挿または内挿することにより、残留活性が50%になる温度を求めた。異なる2種の酵素の不活性化温度の差を計算することにより、単位℃で表す熱安定性差 (TD)を求めた。
【表3】

【0223】
<実施例6.熱活性>
フィターゼの熱活性を、その温度依存性から評価した。フィターゼ熱活性の温度依存性の指標として、T50を設定した。T50とは、そのフィターゼ変異体の最適温度における基質の酵素代謝回転(enzymatic turnover)と比較して、温度を除き同じ条件で反応させたときの基質の総酵素代謝回転が50%になる温度である。
フィターゼ熱活性の温度依存性は、実施例2に示した条件下でpH 5.5及び種々の温度においてフィターゼ酵素を培養することにより測定した。T50の値は、測定データの内挿及び外挿により求めた。異なる2種の酵素のT50値の差を計算することにより、単位℃で表す熱活性差 (TAD)をより求めた。
【表4−1】

【表4−2】

【0224】
<実施例7 - フィターゼ変異体の性質>
Table 4に、上記の実施例3, 5 及び6のフィターゼ変異体の比活性度、熱安定性、及び熱活性を示す。
【表5−1】

【表5−2】

【表5−3】

【0225】
<パートB>
<実施例8−イントロダクション>
この発明は、特に飼料用酵素として有用で有効な性質を備える新規なフィターゼを提供できるという優れた効果を奏する。特に、この発明は本願に開示する単離および/または精製された新規なフィターゼポリペプチド、または機能性断片、またはこれらの変異体または修飾された形態、またはこれらの修飾された形態に関する。この発明はまた、本願のフィターゼをコードする核酸配列に関する。
【0226】
食品または飼料用の酵素添加剤として有効であるためには、フィターゼは多数の異なる性質を備えている必要がある。動物の胃の中の酸性環境下でフィチン酸を分解できるために、低pHにおいて活性である必要があり、好ましくは広いpH範囲において活性である必要がある。
さらに、フィターゼは高い比活性度を有する必要があり、またペレット飼料等の飼料を製造する際に一般的に用いられている高温度に耐えることが可能な、高い熱安定性を有することが好ましい。
【0227】
また、フィターゼはフィチン酸エステルだけでなく、イノシトール・ペンタホスフェート、テトラホスフェート、及びトリホスフェート等の、フィチン酸エステル分解における中間体も加水分解することができる、幅広い基質特異性を有することが重要である。さもないと、これらのイノシトールオリゴホスフェートは小腸及び大腸に不溶性の状態で残留し、動物及び腸内微生物から産出されるアルカリ性ホスファターゼがアクセスできないことが、ブタにおけるフィチン酸エステルの分解の研究から解明されている。異なる酵素の基質特異性プロファイルのバリエーションが明らかにされている。例えば、B. スブチリス由来のフィターゼから産出されたイノシトール-トリホスフェートは、この酵素によるさらなる加水分解に対し耐性を示す。
【0228】
本願の変異体は、以下のいずれかについて改善された性質を示す。温度安定性、pH範囲、ペプシン安定性、比活性度、基質特異性、及び広範な基質特異性。これらの性質の測定に適した方法は、本願に開示されている。
【0229】
フィターゼの性質の改良は特に、食品及び飼料加工条件下での酵素安定性、消化器系における酵素安定性、ヒトまたは動物の胃および/または腸管における酵素活性及び安定性に向けられ、改良された変異体を補助飼料として特に好適に用いられるようにしている。すなわち、このような改善には、高温、好ましくは65℃を超える温度での安定性の向上、タンパク質分解消化、好ましくはペプシン等の消化管のプロテアーゼに対する安定性の向上、低pHでの触媒活性の向上、好ましくはpH 5.5未満での触媒活性の向上、及びフィチン酸エステル、好ましくはこれに加えイノシトールホスフェートからのホスフェート基の放出の一般的効率が含まれる。
【0230】
この発明のフィターゼの性質の改善は、食品及び飼料製造での使用、及び食品及び飼料製品用の添加剤としての使用に向けられている。特にこの発明のフィターゼの性質の改善は、食品及び飼料加工条件下での酵素安定性、消化器系における酵素安定性、ヒトまたは動物の胃および/または腸管における酵素活性及び安定性に向けられている。このような改善には、高温、好ましくは65℃を超える温度での安定性の向上、タンパク質分解消化、好ましくは消化管のプロテアーゼに対する安定性の向上、低pHでの触媒活性の向上、好ましくはpH 5.5未満での触媒活性の向上、及びフィチン酸エステルからのホスフェート基の放出の一般的効率が含まれる。
【0231】
高温での安定性の増大は、酵素の不活性化温度により定量的に分析する。不活性化温度は、フィターゼ酵素を所定の時間培養して室温まで冷却した後の残留活性が、同じフィターゼ酵素を室温において同一時間かつ同一条件下で培養したときの残留活性の50%になる温度と定義される。熱安定性差は2つの酵素の不活性化温度の差であり、単位℃で表される。
【0232】
<実施例9. ペプシン安定性>
<Phyzyme XP, Natuphos,及び Ronozyme Pと比較した、バティアクセラ(Buttiauxella)由来フィターゼ変異体BP-17, BP-110, BP-111, 及びBP-112の、pH 2におけるペプシン耐性>
<使用した材料と方法>
<緩衝液>
ペプシン培養緩衝液: 0.1 Mグリシン-HCl,pH 2.0、BSA 3 mg/ml、 無水塩化ナトリウム 2.9 mg /mL、 塩化カルシウム 0.73 mg/mL。
ペプシン溶液については、ペプシン (Sigma P-7000, 10000 U/mg 、27 mg/mlに相当)を500, 1000, 3000, 6000, または 10000 U/ml含む培養緩衝液をそれぞれ調製した。
1ペプシン単位は、ヘモグロビン(Food Chemical Codex社)を基質に用いたTCA溶解性製品としてpH 2.0で37℃において測定したとき、ΔOD280の増加が毎分0.001となる量の酵素と定義される。
フィターゼ分析用緩衝液:250 mM緩衝酢酸溶液, pH 5.5
BSAを含むフィターゼ分析用緩衝液:BSAを3 mg/ml含む250 mM緩衝酢酸溶液, pH 5.5
【0233】
<ペプシン濃度の増加に対する耐性>
全てのフィターゼ酵素は同様にして準備した:フィターゼ酵素を含む6種のサンプルを調製した(各2件):4種のサンプルについては、緩衝液中のペプシン濃度を増加させ (pH 2)、1種のサンプルについては、ペプシン無添加で、培養緩衝液(pH2)のみを用い、1種のポジティブ・コントロールサンプルは、BSAを含む分析用緩衝液中にフィターゼを含有していた(pH 5.5)。
【0234】
各サンプルについて、100 μlのフィターゼ酵素溶液と、900 μlのフィターゼ分析用緩衝液、またはペプシンを含まない培養緩衝液、またはペプシン濃度が増加する培養緩衝液とを混合し、40℃で培養した。120分間培養した後、100 μlを抜き出し、フィターゼ分析用緩衝液900 μlと混合した。その後直ちに、ISO国際規格ISO/DIS 30024に記載されたリン酸塩検量線に対し、各サンプルのフィターゼの分析をpH 5.5において行った。
【0235】
<結果>
<ペプシン耐性>
全てのバティアクセラ由来の変異体は、pH 2においてペプシンに対し優れた安定性を示した。これに対し、Natuphosの活性は、ペプシン濃度が500 U/mlのとき大幅に低下し、その後さらに活性が低下し、ペプシン濃度3000 U/mlにおいて約45%で一定になることが認められた。
Ronozyme Pの場合はさらに劣っており、ペプシン濃度が500 U/mlのとき20%まで低下した(Fig 6A と Table 4参照)。
【0236】
Figure 6に、バティアクセラ由来のP-17, BP-110, BP-111, BP-112フィターゼ変異体、及びPhyzyme XP, Natuphos, Ronozyme Pフィターゼの、異なるペプシン濃度におけるペプシン耐性を示す。データは、ペプシン無添加でpH 2において培養したときの値に対する相対値である。
A:全ての測定点、 B: 70%以上の値を示した測定点
【表6】

【0237】
バティアクセラ由来の変異体の間にも幾分違いが認められる。すなわち、BP-17 var.110変異体は、最も高いペプシン濃度の10000 U/mLにおいて2時間培養した後でも95%の活性を示し、最も優れた安定性を示す。これに対し、BP-17を2時間培養した後の活性は85%であった。
【0238】
また、バティアクセラ由来のフィターゼは優れた酸安定性を示した。pH 2またはpH 5.5で2時間培養した後、pH 5.5で活性を測定し比較したところ、4種のバティアクセラ由来のフィターゼはいずれもpH 2で2時間培養したときでも活性は低下しなかったが、Phyzyme XP, Natuphos, 及び new Ronozyme Pは若干乃至顕著に活性が低下した(Table 6)。
【表7】

【0239】
<データのまとめ>
この発明のバティアクセラ由来のフィターゼは、pH 2、37℃、ペプシン10000 U/mlにおいて2時間培養したとき、ペプシンを含まないサンプルを同一条件下で培養したときの活性と比較して、活性を75%以上保持している。
【0240】
<実施例10. 酵素活性のリカバリー>
<酵素活性のリカバリーの測定>
<使用した材料と方法>
酵素が添加された小麦をペレット化した後の、酵素活性のリカバリーを測定した。顆粒化した小麦に酵素をスプレーし、乾燥した後に飼料と混合し、次いでペレット化した。
【0241】
液状酵素を小麦全粒粉に添加し、乾燥固形成分量が90%になるまで乾燥した。ペレット化工程での熱ストレスによる酵素の不活性化を、KoldingのTechnological Instituteにあるペレット化装置(Figure 7に模式図を示す)を用いて測定した。試験用サンプルをプレミックス10 kgに添加し、10分間混合した。次に、プレミックス10 kgを飼料150kgに添加し、15分間混合し (大型水平混合機)、次にコンディショニング/スチーム処理を行った。ペレット化する前に、飼料を90℃/95℃で30秒間処理した。温度は、カスケード混合機の出口で測定した。ペレット化プレスから離れた後、直ちにペレットを室温まで冷却した。
【0242】
フィターゼ活性は、実施例10に示した方法で測定した。
ペレット化する前の、マッシュ状態の飼料中のフィターゼ活性は、5単位/gである。
【0243】
<結果>
結果をFigure 8から10に示す。
Figure 8に、この発明に係る3種のフィターゼ変異体のペレット化試験結果を示す。これらの酵素を全粒小麦粉に添加し、水分が約10%になるまで乾燥させた。ここで、BP 17 var 111のペレット化後のフィターゼ活性のリカバリーは、90℃において90%であり、これに対しBP 17の90℃におけるリカバリーは19%であった。
比較用の、E coli由来フィターゼであるPhyzyme XPを全粒小麦粉に添加した。結果をFigure 9に示す。Phyzyme XPを全粒小麦粉に添加した3バッチに関しては、90℃でペレット化した後のフィターゼ活性のリカバリーは47%である。
【0244】
Ronozymeについても試験した。この製品は、ペレット化工程での熱から酵素を保護するため、被覆された状態で販売されている。この試験では、被覆された製品からフィターゼを抽出し、全粒小麦粉に添加して、フィターゼ分子の熱安定性を保護されていない状態で測定した。この結果をFigure 10に示す。
【0245】
<データのまとめ>
全粒小麦粉に添加された本願発明のバティアクセラ由来のフィターゼ変異体は、90℃でのペレット化の後、70%を超えるリカバリーを示した。
【0246】
<実施例11. フィチン酸分解>
<フィターゼによるフィチン酸分解試験結果>
【0247】
<溶液>
培養には、3種類の緩衝液を用いた。これらの緩衝液は以下の通りである。
250mMアセテート、pH 5.5;
250 mM アセテートM、pH 3.5;
250 mM HCl グリシン、pH 2.5.
培養に用いた全てのフィターゼは、分析用緩衝液により酵素濃度が1 U/mlになるまで希釈した。
培養に用いたフィチン酸エステル基質溶液は、1%フィチン酸エステル溶液(1g/100ml 緩衝液)である。
この基質溶液は、反応中のpHを一定にするため、フィターゼの希釈に用いたものと同じ緩衝液を用いて調製した。
反応は、1M HCl溶液を添加して停止させた。
【0248】
<培養>
培養時の容積は、1.5 または 3.0 mlのフィチン酸エステル + 0.25 ml 酵素 + 37℃の3.25 または 1.75 ml 緩衝液、全容積5.0 mlであった。
ここから、異なる時間毎 (0, 30, 60及び90分) に、0.5 mlの少量のサンプルを採取した。
【0249】
少量のサンプルを採取する際、予め準備しておいた、1M HClを0.2 ml入れたエッペンドルフチューブを用いた。培養から抜き出した少量のサンプルにHClを混ぜることにより、反応を停止させた。
【0250】
<HPLC法>
<フィチン酸エステル及びイノシトール異性体の高速イオンクロマトグラフィー(HPIC)による分析>
この測定方法は、SkoglundとCarlssonらにより開示されている(J. Agric. Food Chem., 45(1997), 451-436 5. J. Agric. Food Chem., 46 (1998), 1877-1882; 及び J. Agric. Food Chem., 49(2001), 11695-1701)。使用するカラムは、4 x 50 mmのプレ-カラムを備える、Dionex社の強アニオン交換体(4 x 250mm)である。Solvent AはMilliQ水、Solvent Bは1N HCl 水溶液である。勾配は、30分間2.5%から49% B、次いで流量0.8 ml/分における50%でのアイソクラティック3分間、及び2.5%でのアイソクラティック2分間である。各測定は35分間である。フィターゼは理論的に大量のIP異性体を産出し得ないため、測定時間を25分間に短縮することもできる。
溶出物を、流量が0.4 ml/分で0.1% Fe(NO3)3 . 9HO2及び2% 過塩素酸(HClO4)を含む水溶液を用いて、インラインで誘導体化した。フィチン酸エステル及びIP異性体は、290 nmのポジティブピークにより検出した。これは、フィチン酸エステル-Fe3+-ClO4- 複合体の形成による。60%過塩素酸は、Sigma社から購入した。
【0251】
<結果>
結果をFigure 11〜14に示す。
【0252】
<データのまとめ>
この発明の全ての酵素は好ましい性質を示した。この発明のフィターゼは、試験した全てのpH値においてフィチン酸エステルを分解した。
この発明の酵素はpH 5.5において高い活性を示す。
BP 110及びBP 111は、pH 2.5及び3.5において同様の活性を示す。
BP 110及びBP 111はpH 2.5及び3.5の両者において、培養中に添加されたフィチン酸エステルを90分後に全て分解する。
BP112はpH 2.5及び3.5の両者において、培養中に添加されたフィチン酸エステルを90分後に75%分解する。
【0253】
この発明の酵素は、pH 2.5においてRonozyme 及びNatuphosよりも優れた性質を示す(例えばFigure 14参照)。(Fig. 11〜13の場合より酵素濃度が高いため、バティアクセラBP17を参照として示した。)
【0254】
<実施例12. 液状化物中でのフィチン酸の加水分解>
<フィチン酸測定:フィチン酸含有量>
5%スラリー(乾燥サンプルの場合)のpHをpH 10に調整することにより、フィチン酸をサンプルから抽出し、次にイオン交換カラムを用いたHPLCでフィチン酸を測定した。NaOH濃度勾配システムを用いて、フィチン酸をカラムから流出させた。流出液中のフィチン酸濃度を、フィチン酸の検量線と比較して求めた。
【0255】
<結果>
異なる熱安定性BP変異体フィターゼ、すなわちBP110, BP111及びBP112による全粒コーン液状化物のフィチン酸の加水分解に及ぼす温度の影響を調べた。全粒コーン液状化物は、従来の乾燥粉粒液状化プロセス(供給源: Illinois River Energy社, Monroe, Illinois)による液状化物を用いた。
32 % ds (乾燥固形分)全粒コーンdsコーン液状化物のpHをpH 5.0に調整し、85℃から89℃に保たれた水浴中に入れた。温度が一定になった後、BP-フィターゼを4.0 FTU/gds.コーンとなるように添加した。20分後にサンプルを採取し、10 mM水酸化ナトリウム(1から10倍に希釈)を添加して酵素反応を停止させた。希釈したサンプルを濾過し、HPLCを用いてサンプル中のフィチン酸エステル誘導体の分布(IP1からIP6)を分析した。
Figure 15及び16に示すHPLCクロマトグラムから明らかなように、3種のフィターゼの変異体はいずれも、85℃より高温においてフィチン酸の加水分解を触媒した。
全粒コーン液状化物中のフィチン酸含有量(フィチン酸(IP6) 及び中間体のIP1からIP5)は1.7% ds.コーンであり、Figure 15のデータは、95 %を超えるフィチン酸が、現状の液状化条件下で熱安定性フィターゼにより加水分解されたことを示している。特に、89℃で培養したサンプルのHPLCのデータから、BP-111は他の2種のフィターゼ変異体より高い熱安定性を示すことが分かる(Figure 16のBP-110及びBP-112参照)。
【0256】
<特徴のまとめ>
この発明の特徴を、箇条書きにしてまとめた。
1. フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) とは異なるアミノ酸配列を備えるフィターゼ変異体であって、このフィターゼ変異体のアミノ酸配列はSEQ ID NO: 1のアミノ酸と比較して少なくとも1の変異を有し、前記少なくとも1の変異がSEQ ID NO: 1の位置75, 76 及び374から選択される位置にあり、前記少なくとも1の変異の各々は同一または異なっており、置換、欠失、または挿入のいずれかである。
2. 前記少なくとも1の変異が、S75, Q76及びA374から成る群から選択される、1,2,または3つの位置における変異である、第1項に記載のフィターゼ変異体。
3. 前記少なくとも1の変異が、S75P, Q76R 及びA374Pから成る群から選択される変異である、第2項に記載のフィターゼ変異体。
4. 前記少なくとも1の変異に、さらにN37, G77, H160, F164, T171, S188, G192, K198, A235, Q256 および/またはP367から成る群から選択される1以上の位置における変異が含まれる、第1項から第3項に記載のフィターゼ変異体。
5. 前記少なくとも1の変異が、N37Y, G77S, H160R, F164E, F164S, T171V, T171I, S188P, G192A, K198R, A235V, Q256P, Q256A, Q256Eおよび/またはP367Lから成る群から選択される少なくとも1の変異から成る、第4項に記載のフィターゼ変異体。
6. 前記少なくとも1の変異に、さらにA89, D92, T134, F164, T176, A178, K207, A209, S248, Q256, A261および/またはN270から成る群から選択される1以上の位置における変異が含まれる、第1項から第5項に記載のフィターゼ変異体。
7. 前記少なくとも1の変異が、A89T, D92A, T134I, F164S, T176K, A178P, K207E, A209S, S248L, Q256Y, A261Eおよび/またはN270Kから成る群から選択される1以上の位置における変異から成る、第6項に記載のフィターゼ変異体。
8. 前記フィターゼ変異体が、SEQ ID NO: 2の配列を備える、第7項に記載のフィターゼ変異体。
9. 前記フィターゼ変異体が、下記のa)〜t)から成る群から選択される変異を含む配列を備える、第1項から第8項に記載のフィターゼ変異体。
a) N37Y, S75P, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K198R, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
b) N37Y, G77S, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K198R, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
c) N37Y, S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
d) N37Y, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256P, A261E, N270K, A374P
e) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
f) N37Y, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
g) N37Y, Q76R, A89T, D92A, T134I, F164S, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256A, A261E, N270K, A374P
h) S75P, A89T, D92A, T134I, F164E, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
i) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, P367L, A374P
j) N37Y, A89T, D92A, T134I, F164E, T171I, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
k) N37Y, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
l) N37Y, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
m) N37Y, S75P, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, K207E, A209S, A235V, S248L, Q256A, A261E, N270K, A374P
n) N37Y, S75P, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
o) N37Y, A89T, D92A, T134I, H160R, F164S, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256E, A261E, N270K, A374P
p) A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
q) N37Y, S75P, A89T, D92A, T134I, H160R, F164S, T171V, T176K, A178P, S188P, K207E, A209S, S248L, Q256H, A261E, N270K, A374P
r) N37Y, S75P, A89T, D92A, T134I, F164S, T171V, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
s) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P; and
t) N37Y, Q76R, A89T, D92A, T134I, H160R, F164S, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P.
10. 第1項から第9項のいずれかに記載のフィターゼ変異体に対し最小配列同一性パーセントおよび/または最小相同性パーセントを有するフィターゼ変異体であって、前記最小配列同一性パーセントおよび/または最小相同性パーセントが少なくとも50%、少なくとも60%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも93%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%から成る群から選択されるフィターゼ変異体。
11. SEQ ID NO: 1のフィターゼに対し少なくとも1の改善された性質を有する第1項から第10項のいずれかに記載のフィターゼ変異体であって、前記改善された性質が、改善された比活性度、1以上のプロテーゼに対する感受性の低下、改善された熱活性、改善された熱安定性、改善された酸性pH下での安定性、改善された塩基性pH下での安定性、改善された飼料加工時の安定性から成る群から選択されるフィターゼ変異体。
12. 前記少なくとも1の改善された性質が、ヒト、アルパカ、バイソン、ラクダ、ウシ、ニワトリ、家禽、チンチラ、シカ、ロバ、アヒル、魚、カエル、ヤギ、ガチョウ、家禽、ウマ、ラマ、ミンク、ラバ、ダチョウ、ハト、トナカイ、ヒツジ、 貝、ブタ、七面鳥、ヤク、水牛、ネコ、チンパンジー、イヌ、フェレット、アレチネズミ、金魚、モルモット、ハムスター、サル、インコ、爬虫類、齧歯動物から成る群から選択される動物において見出される1以上のプロテアーゼに対する感受性の低下である、第10項のフィターゼ変異体。
13. SEQ ID NO: 1のフィターゼと比較して、ヒト、アルパカ、バイソン、ラクダ、ウシ、ニワトリ、家禽、チンチラ、シカ、ロバ、アヒル、魚、カエル、ヤギ、ガチョウ、家禽、ウマ、ラマ、ミンク、ラバ、ダチョウ、ハト、トナカイ、ヒツジ、 貝、ブタ、七面鳥、ヤク、水牛、ネコ、チンパンジー、イヌ、フェレット、アレチネズミ、金魚、モルモット、ハムスター、サル、インコ、爬虫類、齧歯動物から成る群から選択される動物の消化管において長期間活性を有する、第1項から第11項のいずれかに記載のフィターゼ変異体。
14. 第1項から第13項のいずれかに記載のフィターゼ変異体をコードする核酸。
15. 第14項に記載の核酸を含むベクター。
16. 第14項に記載の核酸を含む宿主細胞。
17. 第1項から第13項のいずれかに記載のフィターゼ変異体の少なくとも1を含む酵素組成物。
18. 第1項から第13項のいずれかに記載のフィターゼ変異体の少なくとも1を含む酵素組成物であって、澱粉の液状化に有用な酵素組成物。
19. 第1項から第13項のいずれかに記載のフィターゼ変異体を宿主細胞中に産出させる方法であって、
a) 第1項から第13項のいずれかに記載のフィターゼ変異体をコードする核酸を含むDNA構築体で宿主細胞を形質転換する工程、及び
b) 形質転換された宿主細胞を適切な培地において培養する工程を備える方法。
20. 宿主細胞が菌類細胞、細菌細胞、または植物性細胞である、第19項に記載の方法。
21. フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) のアミノ酸配列とは異なるアミノ酸配列を備えるフィターゼ変異体であって、このフィターゼ変異体のアミノ酸配列はSEQ ID NO: 1のアミノ酸と比較して少なくとも1の変異を有し、このフィターゼ変異体は位置70, 193, 197, 221 及び407の内の少なくとも1以上の位置に変異を有する、フィターゼ変異体。好ましくは、このフィターゼ変異体は位置70, 193, 197, 221 及び407の内の少なくとも2以上の位置に変異を有する。好ましくは、このフィターゼ変異体は位置70, 193, 197, 221 及び407の内の少なくとも3以上の位置に変異を有する。好ましくは、このフィターゼ変異体は位置70, 193, 197, 221 及び407の内の少なくとも4以上の位置に変異を有する。好ましくは、このフィターゼ変異体は少なくとも位置70, 193, 197, 221 及び407に変異を有する。
22. フィターゼ変異体が少なくともN70Y, H193R, F197E, S221P及びA407Pの変異を有する、第21項に記載のフィターゼ変異体。
23. 食品または飼料を製造する方法であって、第1項から第13項または第21項または第22項のいずれか1項に記載のポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物と、別の食品または飼料原料とを混合する工程を含む、食品または飼料を製造する方法。
24. 食品または飼料を製造する方法であって、第1項から第13項または第21項または第22項のいずれか1項に記載のポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物を、液体の状態で前記食品または飼料にスプレーする工程を含む、食品または飼料を製造する方法。
25. 食品または飼料を製造する方法であって、第1項から第13項または第21項または第22項のいずれか1項に記載のポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物を、固体の状態で前記食品または飼料と混合する工程を含む、食品または飼料を製造する方法。
26. 飼料を製造する方法であって、第1項から第13項または第21項または第22項のいずれか1項に記載のポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物と、別の食品または飼料原料とを混合する工程を含む、飼料を製造する方法。
27. 飼料を製造する方法であって、第1項から第13項または第21項または第22項のいずれか1項に記載のポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物を、液体の状態で前記飼料にスプレーする工程を含む、飼料を製造する方法。
28. 飼料を製造する方法であって、第1項から第13項または第21項または第22項のいずれか1項に記載のポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物を、固体の状態で前記飼料と混合する工程を含む、飼料を製造する方法。
29. i) 第1項から第13項または第21項または第22項のいずれか1項に記載のフィターゼ、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物、および/またはii) 第23項から第28項記載の方法で製造された食品または飼料の何れかから成る、食品または飼料組成物。
30. 第1項から第13項または第21項または第22項のいずれか1項に記載のフィターゼ、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物、および/またはii) 第23項から第28項記載の方法で製造された飼料の何れかから成る、飼料組成物。
31. 第1項から第13項または第21項または第22項のいずれか1項に記載のフィターゼポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物の、食品または飼料における使用。
32. 第1項から第13項または第21項または第22項のいずれか1項に記載のフィターゼポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物の、飼料における使用。
33. 動物の排泄物中のリンの量を低下させる方法であって、第1項から第13項または第21項または第22項のいずれか1項に記載のフィターゼポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物、または第29項または第30項に記載の飼料を動物に与え、フィターゼの量が飼料中のフィチン酸エステルを分解するために十分な量であることを特徴とする方法。
34. 第1項から第13項または第21項または第22項のいずれか1項に記載のフィターゼポリペプチド、または第17項または第18項に記載の酵素組成物、または第19項または第20項に記載の方法で製造された物、または第29項または第30項に記載の飼料の、前記フィターゼポリペプチドを与えられた動物の排泄物中のリンの量を低下させるための飼料の製造における使用。
【0257】
明細書に記載した全ての文献、及びこれらの文献に引用された参照文献は、本願に参照として組み込まれる。当業者にとって、本願発明の要旨から逸脱しない範囲で本願に開示した方法及びシステムを種々変更して実施できることは明らかであろう。本願発明について特定の実施形態に基づき説明したが、特許請求の範囲に係る発明はこれらの特定の実施形態に限定されない。本願発明の実施に当り、分子生物学及びその関連技術分野に属する当業者にとって明らかな本願に開示した実施形態の様々な変更は、本願発明の範囲に含まれる。
【特許請求の範囲】
【請求項1】
野生型バティアクセラ属フィターゼ(SEQ ID NO: 1)と比較して、少なくとも約5℃改善された熱活性を有するフィターゼ変異体。
【請求項2】
前記SEQ ID NO: 1のフィターゼと比較して、前記改善された熱活性が少なくとも約17℃である、請求項1に記載のフィターゼ変異体。
【請求項3】
前記改善された熱活性が少なくとも約17℃から約21℃の範囲である、請求項1または2に記載のフィターゼ変異体。
【請求項4】
前記改善された熱活性が少なくとも約17.4℃から約20.2℃の範囲である、請求項1から3のいずれか1項に記載のフィターゼ変異体。
【請求項5】
pH 5.5の緩衝液中で相対的高温に10分間曝された後、活性を少なくとも50%以上保持することができる熱安定性フィターゼ変異体であって、前記相対的高温が、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1)の活性が少なくとも50%以上保持される温度より少なくとも約5 ℃高い温度である、熱安定性フィターゼ変異体。
【請求項6】
前記相対的高温が少なくとも約20.5 ℃高い温度である、請求項5に記載の熱安定性フィターゼ変異体。
【請求項7】
前記相対的高温が約20.5 ℃から約27 ℃高い温度範囲である、請求項5または6に記載の熱安定性フィターゼ変異体。
【請求項8】
前記相対的高温が約20.2 ℃から約26.8 ℃高い温度範囲である、請求項5から7のいずれか1項に記載の熱安定性フィターゼ変異体。
【請求項9】
フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) とは異なるアミノ酸配列を備えるフィターゼ変異体であって、そのアミノ酸配列には、SEQ ID NO: 1のアミノ酸の位置75, 76, 77, 198, 367または374に相当する位置の少なくとも1以上の位置における変異が含まれる、フィターゼ変異体。
【請求項10】
さらに1以上の別の変異が含まれ、前記変異が92A, 164E/S, 171I/V, 192Aまたは256A/E/Pのいずれかである、請求項9に記載のフィターゼ変異体。
【請求項11】
前記位置75, 76, 77, 198, 367または374の1以上の位置における変異がそれぞれ75P, 76R, 77S, 198R, 367Lまたは374Pであり、さらに別の変異が含まれ、前記別の変異が92A, 164E/S, 171V, 192Aまたは256A/E/Pである、請求項9または10に記載のフィターゼ変異体。
【請求項12】
さらに1以上の別の変異が含まれ、前記1以上の別の変異の位置が、26, 37, 89, 134, 160, 176, 178, 188, 190, 207, 209, 211, 235, 261, 270, 303または318のいずれかである、請求項9から11のいずれか1項に記載のフィターゼ変異体。
【請求項13】
前記26, 37, 89, 134, 160, 176, 178, 188, 190, 207, 209, 211, 235, 261, 270, 303または318の1以上の位置における変異がそれぞれ、26E, 037Y, 089T, 1341/V, 160R, 176K, 178P, 188N, 190E, 207E/T, 209S, 211C, 235V, 261E, 270K, 303Fまたは318Dのいずれかである、請求項12に記載のフィターゼ変異体。
【請求項14】
さらに1以上の別の変異が含まれ、前記1以上の別の変異の位置が、1, 10, 11, 38, 66, 71, 81, 92, 109, 111, 119, 120, 121, 141, 142, 152, 155, 193, 214, 239, 245, 248, 255, 268, 277, 283, 285, 287, 288, 293, 296, 314, 337, 345, 350, 364, 371, 372, 396, 399, 406または413のいずれかである、請求項9から13のいずれか1項に記載のフィターゼ変異体。
【請求項15】
前記1, 10, 11, 38, 66, 71, 81, 92, 109, 111, 119, 120, 121, 141, 142, 152, 155, 193, 214, 239, 245, 248, 255, 268, 277, 283, 285, 287, 288, 293, 296, 314, 337, 345, 350, 364, 371, 372, 396, 399, 406または413の1以上の位置における変異がそれぞれ、1S, 10I, 11I, 38S, 66E, 71K, 81A, 92E, 109Q, 111G, 119N, 120L, 121E, 141R, 142L, 152M, 155E, 193Q, 211C, 214V, 235V, 239K, 245D, 248L, 255A, 261E, 268A/T, 270K, 277T, 283D, 285K, 287D, 288A, 293Gまたは296Sのいずれかである、請求項14に記載のフィターゼ変異体。
【請求項16】
フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) のアミノ酸配列とは異なるアミノ酸配列を備えるフィターゼ変異体であって、前記フィターゼ変異体のアミノ酸配列はSEQ ID NO: 1に対し少なくとも1の変異を有し、前記フィターゼ変異体の配列の前記変異が下記のa)〜t)のいずれかである、フィターゼ変異体。
a) N37Y, S75P, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K198R, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
b) N37Y, G77S, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K198R, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
c) N37Y, S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
d) N37Y, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256P, A261E, N270K, A374P
e) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
f) N37Y, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
g) N37Y, Q76R, A89T, D92A, T134I, F164S, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256A, A261E, N270K, A374P
h) S75P, A89T, D92A, T134I, F164E, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
i) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, P367L, A374P
j) N37Y, A89T, D92A, T134I, F164E, T171I, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
k) N37Y, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
l) N37Y, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
m) N37Y, S75P, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, K207E, A209S, A235V, S248L, Q256A, A261E, N270K, A374P
n) N37Y, S75P, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
o) N37Y, A89T, D92A, T134I, H160R, F164S, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256E, A261E, N270K, A374P
p) A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
q) N37Y, S75P, A89T, D92A, T134I, H160R, F164S, T171V, T176K, A178P, S188P, K207E, A209S, S248L, Q256H, A261E, N270K, A374P
r) N37Y, S75P, A89T, D92A, T134I, F164S, T171V, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
s) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P; または
t) N37Y, Q76R, A89T, D92A, T134I, H160R, F164S, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P。
【請求項17】
フィターゼ変異体の配列の前記変異が、N37Y, S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374Pである、請求項16に記載のフィターゼ変異体。
【請求項18】
請求項1から17のいずれか1項に記載のフィターゼに対する最小配列同一性パーセントおよび/または最小相同性パーセントが少なくとも50%、少なくとも60%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも93%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%であるフィターゼ。
【請求項19】
フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) のアミノ酸配列とは異なるアミノ酸配列を備えるフィターゼ変異体であって、前記フィターゼ変異体のアミノ酸配列がSEQ ID NO: 1と比較して少なくとも1の変異を有し、前記フィターゼ変異体の変異の位置が、アミノ酸位置70, 193, 197, 221 及び407の内の少なくともいずれか1である、フィターゼ変異体。
【請求項20】
少なくともN70Y, H193R, F197E, S221P 及びA407Pの変異を有する、請求項19に記載のフィターゼ変異体。
【請求項21】
請求項1から4のいずれか1項に記載のフィターゼ変異体であって、請求項5から8、および/または請求項9から15、および/または請求項16または17、および/または請求項18、および/または請求項19または20のいずれか1以上に記載の特徴を備えるフィターゼ変異体。
【請求項22】
請求項5から8のいずれか1項に記載のフィターゼ変異体であって、請求項1から4、および/または請求項9から15、および/または請求項16または17、および/または請求項18、および/または請求項19または20のいずれか1以上に記載の特徴を備えるフィターゼ変異体。
【請求項23】
請求項9から15のいずれか1項に記載のフィターゼ変異体であって、請求項1から4、および/または請求項5から8、および/または請求項16または17、および/または請求項18、および/または請求項19または20のいずれか1以上に記載の特徴を備えるフィターゼ変異体。
【請求項24】
請求項16または17に記載のフィターゼ変異体であって、請求項1から4、および/または請求項5から8、および/または請求項9から15、および/または請求項18、および/または請求項19または20のいずれか1以上に記載の特徴を備えるフィターゼ変異体。
【請求項25】
請求項18に記載のフィターゼ変異体であって、請求項1から4、および/または請求項5から8、および/または請求項9から15、および/または請求項16または17、および/または請求項19または20のいずれか1以上に記載の特徴を備えるフィターゼ変異体。
【請求項26】
請求項19または20に記載のフィターゼ変異体であって、請求項1から4、および/または請求項5から8、および/または請求項9から15、および/または請求項16または17、および/または請求項18のいずれか1以上に記載の特徴を備えるフィターゼ変異体。
【請求項27】
請求項1から26のいずれか1項に記載のフィターゼ変異体をコードする核酸。
【請求項28】
請求項27に記載の核酸を含むベクター。
【請求項29】
請求項27に記載の核酸、または請求項28に記載のベクターを含む宿主細胞。
【請求項30】
宿主細胞中で請求項1から26のいずれか1項に記載のフィターゼ変異体を産出させる方法であって、
a) 請求項1から26のいずれか1項に記載のフィターゼ変異体をコードする核酸を含むDNA構築体で宿主細胞を形質転換する工程、及び
b) 形質転換された前記宿主細胞を適切な培地において培養する工程を備える方法。
【請求項31】
前記宿主細胞が菌類細胞、細菌細胞、または植物性細胞である、請求項19に記載の方法。
【請求項32】
請求項30または31に記載の方法で産出されたフィターゼ変異体。
【請求項33】
請求項1から26、または請求項32のいずれか1項に記載のフィターゼ変異体と、
グルコアミラーゼ、アルファ-アミラーゼ、プロテアーゼ、プルラナーゼ、イソアミラーゼ、セルラーゼ、ヘミセルラーゼ、キシラナーゼ、シクロデキストリングリコトランスフェラーゼ、リパーゼ、ラッカーゼ、オキシダーゼ、エステラーゼ、クチナーゼ、別のフィターゼ、及びこれらの組み合わせの内の1以上とから成る、酵素組成物。
【請求項34】
アルファ-アミラーゼが含まれる、請求項33に記載の酵素組成物。
【請求項35】
澱粉液化、澱粉糖化、澱粉発酵または澱粉同時糖化-発酵における、請求項1から26、または請求項32のいずれか1項に記載のフィターゼ変異体、又は請求項33又は34に記載の酵素組成物の使用。
【請求項36】
前記澱粉液化、澱粉糖化、澱粉発酵または澱粉同時糖化-発酵が、発酵アルコールの製造を目的とする、請求項35に記載の使用。
【請求項37】
アルコールがエタノールまたはブタノールである、請求項36に記載の使用。
【請求項38】
基質を澱粉液化、澱粉糖化、澱粉発酵または澱粉同時糖化-発酵させる、請求項35から37のいずれか1項に記載の使用。
【請求項39】
前記基質が澱粉から成る、請求項38に記載の使用。
【請求項40】
前記基質に穀粒または穀物が含まれる、請求項38または39に記載の使用。
【請求項41】
前記穀粒または穀物が、小麦、大麦、ライ麦、オート麦、 トウモロコシ、ソルガム、トウモロコシグルテン、可溶性物質添加乾燥蒸留穀物残渣 (DDGS)、小麦フスマ、小麦ミドリング粉、小麦ショーツ、米、 オート麦殻、 パーム核油、果実の搾りかす、またはこれらの組合せである、請求項40に記載の使用。
【請求項42】
前記米に米ぬか、または米殻が含まれる、請求項41に記載の使用。
【請求項43】
請求項1から26、または請求項32のいずれか1項に記載のフィターゼ変異体の、食品または飼料における添加剤としての使用。
【請求項44】
請求項1から26、または請求項32のいずれか1項に記載のフィターゼ変異体の、食品または可溶性物質添加乾燥蒸留穀物残渣 (DDGS)を含む飼料における添加剤としての使用。
【請求項45】
食品または飼料を製造する方法であって、請求項1から26または請求項32のいずれか1項に記載のフィターゼ変異体または請求項33または34に記載の酵素組成物の少なくとも1と、食品または飼料の原料とを混合して、食品または飼料を製造する工程を含む方法。
【請求項46】
食品または飼料を製造する方法であって、液体状の請求項1から26または請求項32のいずれか1項に記載のフィターゼ変異体または請求項33または34に記載の酵素組成物の少なくとも1を、食品または飼料の原料にスプレーして、食品または飼料を製造する工程を含む方法。
【請求項47】
食品または飼料を製造する方法であって、固体状の請求項1から26または請求項32のいずれか1項に記載のフィターゼ変異体または請求項33または34に記載の酵素組成物の少なくとも1と、食品または飼料の原料とを混合して、食品または飼料を製造する工程を含む方法。
【請求項48】
飼料を製造する方法であって、請求項1から26または請求項32のいずれか1項に記載のフィターゼ変異体または請求項33または34に記載の酵素組成物の少なくとも1と、食品または飼料の原料とを混合して、飼料を製造する工程を含む方法。
【請求項49】
飼料を製造する方法であって、液体状の請求項1から26または請求項32のいずれか1項に記載のフィターゼ変異体または請求項33または34に記載の酵素組成物の少なくとも1を、飼料の原料にスプレーして、飼料を製造する工程を含む方法。
【請求項50】
飼料を製造する方法であって、固体状の請求項1から26または請求項32のいずれか1項に記載のフィターゼ変異体または請求項33または34に記載の酵素組成物の少なくとも1と、飼料の原料とを混合して、飼料を製造する工程を含む方法。
【請求項51】
食品用または飼料用の組成物であって、i) 請求項1から26または請求項32のいずれか1項に記載の少なくとも1のフィターゼ変異体または請求項33または34に記載の酵素組成物、および/またはii) 請求項45から50のいずれか1項に記載の方法で製造された食品または飼料のいずれかが含まれる、食品用または飼料用の組成物。
【請求項52】
飼料用の組成物であって、i) 請求項1から26または請求項32のいずれか1項に記載の少なくとも1のフィターゼ変異体または請求項33または34に記載の酵素組成物、および/またはii) 請求項45から50のいずれか1項に記載の方法で製造された食品または飼料のいずれかが含まれる、飼料用の組成物。
【請求項53】
請求項1から26または請求項32のいずれか1項に記載の少なくとも1のフィターゼ変異体または請求項33または34に記載の酵素組成物の、食品または飼料における使用。
【請求項54】
請求項1から26または請求項32のいずれか1項に記載の少なくとも1のフィターゼ変異体または請求項33または34に記載の酵素組成物の、飼料における使用。
【請求項55】
家畜の排泄物に含まれるリンの濃度を低減させる方法であって、請求項1から26または請求項32のいずれか1項に記載の少なくとも1のフィターゼ変異体、または請求項33または34に記載の酵素組成物、または請求項45から50のいずれか1項に記載の方法で製造された飼料、または請求項51または52に記載の組成物を家畜に与え、前記フィターゼの量が前記飼料中に含有されるフィチン酸塩を変換するために必要な量であることを特徴とする方法。
【請求項56】
前記フィターゼ変異体を与えられた家畜の排泄物中のリン濃度を低下させるための飼料の製造における、請求項1から26または請求項32のいずれか1項に記載の少なくとも1のフィターゼ変異体、または請求項33または34に記載の酵素組成物、または請求項45から50のいずれか1項に記載の方法で製造された飼料、または請求項51または52に記載の組成物の使用。
【請求項57】
図面および/または配列表を参照して本願に実質的に開示されているフィターゼ変異体。
【請求項1】
野生型バティアクセラ属フィターゼ(SEQ ID NO: 1)と比較して、少なくとも約5℃改善された熱活性を有するフィターゼ変異体。
【請求項2】
前記SEQ ID NO: 1のフィターゼと比較して、前記改善された熱活性が少なくとも約17℃である、請求項1に記載のフィターゼ変異体。
【請求項3】
前記改善された熱活性が少なくとも約17℃から約21℃の範囲である、請求項1または2に記載のフィターゼ変異体。
【請求項4】
前記改善された熱活性が少なくとも約17.4℃から約20.2℃の範囲である、請求項1から3のいずれか1項に記載のフィターゼ変異体。
【請求項5】
pH 5.5の緩衝液中で相対的高温に10分間曝された後、活性を少なくとも50%以上保持することができる熱安定性フィターゼ変異体であって、前記相対的高温が、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1)の活性が少なくとも50%以上保持される温度より少なくとも約5 ℃高い温度である、熱安定性フィターゼ変異体。
【請求項6】
前記相対的高温が少なくとも約20.5 ℃高い温度である、請求項5に記載の熱安定性フィターゼ変異体。
【請求項7】
前記相対的高温が約20.5 ℃から約27 ℃高い温度範囲である、請求項5または6に記載の熱安定性フィターゼ変異体。
【請求項8】
前記相対的高温が約20.2 ℃から約26.8 ℃高い温度範囲である、請求項5から7のいずれか1項に記載の熱安定性フィターゼ変異体。
【請求項9】
フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) とは異なるアミノ酸配列を備えるフィターゼ変異体であって、そのアミノ酸配列には、SEQ ID NO: 1のアミノ酸の位置75, 76, 77, 198, 367または374に相当する位置の少なくとも1以上の位置における変異が含まれる、フィターゼ変異体。
【請求項10】
さらに1以上の別の変異が含まれ、前記変異が92A, 164E/S, 171I/V, 192Aまたは256A/E/Pのいずれかである、請求項9に記載のフィターゼ変異体。
【請求項11】
前記位置75, 76, 77, 198, 367または374の1以上の位置における変異がそれぞれ75P, 76R, 77S, 198R, 367Lまたは374Pであり、さらに別の変異が含まれ、前記別の変異が92A, 164E/S, 171V, 192Aまたは256A/E/Pである、請求項9または10に記載のフィターゼ変異体。
【請求項12】
さらに1以上の別の変異が含まれ、前記1以上の別の変異の位置が、26, 37, 89, 134, 160, 176, 178, 188, 190, 207, 209, 211, 235, 261, 270, 303または318のいずれかである、請求項9から11のいずれか1項に記載のフィターゼ変異体。
【請求項13】
前記26, 37, 89, 134, 160, 176, 178, 188, 190, 207, 209, 211, 235, 261, 270, 303または318の1以上の位置における変異がそれぞれ、26E, 037Y, 089T, 1341/V, 160R, 176K, 178P, 188N, 190E, 207E/T, 209S, 211C, 235V, 261E, 270K, 303Fまたは318Dのいずれかである、請求項12に記載のフィターゼ変異体。
【請求項14】
さらに1以上の別の変異が含まれ、前記1以上の別の変異の位置が、1, 10, 11, 38, 66, 71, 81, 92, 109, 111, 119, 120, 121, 141, 142, 152, 155, 193, 214, 239, 245, 248, 255, 268, 277, 283, 285, 287, 288, 293, 296, 314, 337, 345, 350, 364, 371, 372, 396, 399, 406または413のいずれかである、請求項9から13のいずれか1項に記載のフィターゼ変異体。
【請求項15】
前記1, 10, 11, 38, 66, 71, 81, 92, 109, 111, 119, 120, 121, 141, 142, 152, 155, 193, 214, 239, 245, 248, 255, 268, 277, 283, 285, 287, 288, 293, 296, 314, 337, 345, 350, 364, 371, 372, 396, 399, 406または413の1以上の位置における変異がそれぞれ、1S, 10I, 11I, 38S, 66E, 71K, 81A, 92E, 109Q, 111G, 119N, 120L, 121E, 141R, 142L, 152M, 155E, 193Q, 211C, 214V, 235V, 239K, 245D, 248L, 255A, 261E, 268A/T, 270K, 277T, 283D, 285K, 287D, 288A, 293Gまたは296Sのいずれかである、請求項14に記載のフィターゼ変異体。
【請求項16】
フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) のアミノ酸配列とは異なるアミノ酸配列を備えるフィターゼ変異体であって、前記フィターゼ変異体のアミノ酸配列はSEQ ID NO: 1に対し少なくとも1の変異を有し、前記フィターゼ変異体の配列の前記変異が下記のa)〜t)のいずれかである、フィターゼ変異体。
a) N37Y, S75P, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K198R, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
b) N37Y, G77S, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K198R, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
c) N37Y, S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
d) N37Y, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256P, A261E, N270K, A374P
e) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
f) N37Y, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
g) N37Y, Q76R, A89T, D92A, T134I, F164S, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256A, A261E, N270K, A374P
h) S75P, A89T, D92A, T134I, F164E, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
i) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, P367L, A374P
j) N37Y, A89T, D92A, T134I, F164E, T171I, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
k) N37Y, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256Y, A261E, N270K, A374P
l) N37Y, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
m) N37Y, S75P, Q76R, A89T, D92A, T134I, F164E, T171V, T176K, A178P, K207E, A209S, A235V, S248L, Q256A, A261E, N270K, A374P
n) N37Y, S75P, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
o) N37Y, A89T, D92A, T134I, H160R, F164S, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256E, A261E, N270K, A374P
p) A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P
q) N37Y, S75P, A89T, D92A, T134I, H160R, F164S, T171V, T176K, A178P, S188P, K207E, A209S, S248L, Q256H, A261E, N270K, A374P
r) N37Y, S75P, A89T, D92A, T134I, F164S, T171V, T176K, A178P, S188P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P
s) S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171V, T176K, A178P, G192A, K207E, A209S, S248L, Q256A, A261E, N270K, A374P; または
t) N37Y, Q76R, A89T, D92A, T134I, H160R, F164S, T171V, T176K, A178P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374P。
【請求項17】
フィターゼ変異体の配列の前記変異が、N37Y, S75P, Q76R, A89T, D92A, T134I, H160R, F164E, T171I, T176K, A178P, S188P, G192A, K207E, A209S, A235V, S248L, Q256Y, A261E, N270K, A374Pである、請求項16に記載のフィターゼ変異体。
【請求項18】
請求項1から17のいずれか1項に記載のフィターゼに対する最小配列同一性パーセントおよび/または最小相同性パーセントが少なくとも50%、少なくとも60%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも93%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%であるフィターゼ。
【請求項19】
フィターゼ活性を備えるとともに、野生型バティアクセラ属フィターゼ(SEQ ID NO: 1) のアミノ酸配列とは異なるアミノ酸配列を備えるフィターゼ変異体であって、前記フィターゼ変異体のアミノ酸配列がSEQ ID NO: 1と比較して少なくとも1の変異を有し、前記フィターゼ変異体の変異の位置が、アミノ酸位置70, 193, 197, 221 及び407の内の少なくともいずれか1である、フィターゼ変異体。
【請求項20】
少なくともN70Y, H193R, F197E, S221P 及びA407Pの変異を有する、請求項19に記載のフィターゼ変異体。
【請求項21】
請求項1から4のいずれか1項に記載のフィターゼ変異体であって、請求項5から8、および/または請求項9から15、および/または請求項16または17、および/または請求項18、および/または請求項19または20のいずれか1以上に記載の特徴を備えるフィターゼ変異体。
【請求項22】
請求項5から8のいずれか1項に記載のフィターゼ変異体であって、請求項1から4、および/または請求項9から15、および/または請求項16または17、および/または請求項18、および/または請求項19または20のいずれか1以上に記載の特徴を備えるフィターゼ変異体。
【請求項23】
請求項9から15のいずれか1項に記載のフィターゼ変異体であって、請求項1から4、および/または請求項5から8、および/または請求項16または17、および/または請求項18、および/または請求項19または20のいずれか1以上に記載の特徴を備えるフィターゼ変異体。
【請求項24】
請求項16または17に記載のフィターゼ変異体であって、請求項1から4、および/または請求項5から8、および/または請求項9から15、および/または請求項18、および/または請求項19または20のいずれか1以上に記載の特徴を備えるフィターゼ変異体。
【請求項25】
請求項18に記載のフィターゼ変異体であって、請求項1から4、および/または請求項5から8、および/または請求項9から15、および/または請求項16または17、および/または請求項19または20のいずれか1以上に記載の特徴を備えるフィターゼ変異体。
【請求項26】
請求項19または20に記載のフィターゼ変異体であって、請求項1から4、および/または請求項5から8、および/または請求項9から15、および/または請求項16または17、および/または請求項18のいずれか1以上に記載の特徴を備えるフィターゼ変異体。
【請求項27】
請求項1から26のいずれか1項に記載のフィターゼ変異体をコードする核酸。
【請求項28】
請求項27に記載の核酸を含むベクター。
【請求項29】
請求項27に記載の核酸、または請求項28に記載のベクターを含む宿主細胞。
【請求項30】
宿主細胞中で請求項1から26のいずれか1項に記載のフィターゼ変異体を産出させる方法であって、
a) 請求項1から26のいずれか1項に記載のフィターゼ変異体をコードする核酸を含むDNA構築体で宿主細胞を形質転換する工程、及び
b) 形質転換された前記宿主細胞を適切な培地において培養する工程を備える方法。
【請求項31】
前記宿主細胞が菌類細胞、細菌細胞、または植物性細胞である、請求項19に記載の方法。
【請求項32】
請求項30または31に記載の方法で産出されたフィターゼ変異体。
【請求項33】
請求項1から26、または請求項32のいずれか1項に記載のフィターゼ変異体と、
グルコアミラーゼ、アルファ-アミラーゼ、プロテアーゼ、プルラナーゼ、イソアミラーゼ、セルラーゼ、ヘミセルラーゼ、キシラナーゼ、シクロデキストリングリコトランスフェラーゼ、リパーゼ、ラッカーゼ、オキシダーゼ、エステラーゼ、クチナーゼ、別のフィターゼ、及びこれらの組み合わせの内の1以上とから成る、酵素組成物。
【請求項34】
アルファ-アミラーゼが含まれる、請求項33に記載の酵素組成物。
【請求項35】
澱粉液化、澱粉糖化、澱粉発酵または澱粉同時糖化-発酵における、請求項1から26、または請求項32のいずれか1項に記載のフィターゼ変異体、又は請求項33又は34に記載の酵素組成物の使用。
【請求項36】
前記澱粉液化、澱粉糖化、澱粉発酵または澱粉同時糖化-発酵が、発酵アルコールの製造を目的とする、請求項35に記載の使用。
【請求項37】
アルコールがエタノールまたはブタノールである、請求項36に記載の使用。
【請求項38】
基質を澱粉液化、澱粉糖化、澱粉発酵または澱粉同時糖化-発酵させる、請求項35から37のいずれか1項に記載の使用。
【請求項39】
前記基質が澱粉から成る、請求項38に記載の使用。
【請求項40】
前記基質に穀粒または穀物が含まれる、請求項38または39に記載の使用。
【請求項41】
前記穀粒または穀物が、小麦、大麦、ライ麦、オート麦、 トウモロコシ、ソルガム、トウモロコシグルテン、可溶性物質添加乾燥蒸留穀物残渣 (DDGS)、小麦フスマ、小麦ミドリング粉、小麦ショーツ、米、 オート麦殻、 パーム核油、果実の搾りかす、またはこれらの組合せである、請求項40に記載の使用。
【請求項42】
前記米に米ぬか、または米殻が含まれる、請求項41に記載の使用。
【請求項43】
請求項1から26、または請求項32のいずれか1項に記載のフィターゼ変異体の、食品または飼料における添加剤としての使用。
【請求項44】
請求項1から26、または請求項32のいずれか1項に記載のフィターゼ変異体の、食品または可溶性物質添加乾燥蒸留穀物残渣 (DDGS)を含む飼料における添加剤としての使用。
【請求項45】
食品または飼料を製造する方法であって、請求項1から26または請求項32のいずれか1項に記載のフィターゼ変異体または請求項33または34に記載の酵素組成物の少なくとも1と、食品または飼料の原料とを混合して、食品または飼料を製造する工程を含む方法。
【請求項46】
食品または飼料を製造する方法であって、液体状の請求項1から26または請求項32のいずれか1項に記載のフィターゼ変異体または請求項33または34に記載の酵素組成物の少なくとも1を、食品または飼料の原料にスプレーして、食品または飼料を製造する工程を含む方法。
【請求項47】
食品または飼料を製造する方法であって、固体状の請求項1から26または請求項32のいずれか1項に記載のフィターゼ変異体または請求項33または34に記載の酵素組成物の少なくとも1と、食品または飼料の原料とを混合して、食品または飼料を製造する工程を含む方法。
【請求項48】
飼料を製造する方法であって、請求項1から26または請求項32のいずれか1項に記載のフィターゼ変異体または請求項33または34に記載の酵素組成物の少なくとも1と、食品または飼料の原料とを混合して、飼料を製造する工程を含む方法。
【請求項49】
飼料を製造する方法であって、液体状の請求項1から26または請求項32のいずれか1項に記載のフィターゼ変異体または請求項33または34に記載の酵素組成物の少なくとも1を、飼料の原料にスプレーして、飼料を製造する工程を含む方法。
【請求項50】
飼料を製造する方法であって、固体状の請求項1から26または請求項32のいずれか1項に記載のフィターゼ変異体または請求項33または34に記載の酵素組成物の少なくとも1と、飼料の原料とを混合して、飼料を製造する工程を含む方法。
【請求項51】
食品用または飼料用の組成物であって、i) 請求項1から26または請求項32のいずれか1項に記載の少なくとも1のフィターゼ変異体または請求項33または34に記載の酵素組成物、および/またはii) 請求項45から50のいずれか1項に記載の方法で製造された食品または飼料のいずれかが含まれる、食品用または飼料用の組成物。
【請求項52】
飼料用の組成物であって、i) 請求項1から26または請求項32のいずれか1項に記載の少なくとも1のフィターゼ変異体または請求項33または34に記載の酵素組成物、および/またはii) 請求項45から50のいずれか1項に記載の方法で製造された食品または飼料のいずれかが含まれる、飼料用の組成物。
【請求項53】
請求項1から26または請求項32のいずれか1項に記載の少なくとも1のフィターゼ変異体または請求項33または34に記載の酵素組成物の、食品または飼料における使用。
【請求項54】
請求項1から26または請求項32のいずれか1項に記載の少なくとも1のフィターゼ変異体または請求項33または34に記載の酵素組成物の、飼料における使用。
【請求項55】
家畜の排泄物に含まれるリンの濃度を低減させる方法であって、請求項1から26または請求項32のいずれか1項に記載の少なくとも1のフィターゼ変異体、または請求項33または34に記載の酵素組成物、または請求項45から50のいずれか1項に記載の方法で製造された飼料、または請求項51または52に記載の組成物を家畜に与え、前記フィターゼの量が前記飼料中に含有されるフィチン酸塩を変換するために必要な量であることを特徴とする方法。
【請求項56】
前記フィターゼ変異体を与えられた家畜の排泄物中のリン濃度を低下させるための飼料の製造における、請求項1から26または請求項32のいずれか1項に記載の少なくとも1のフィターゼ変異体、または請求項33または34に記載の酵素組成物、または請求項45から50のいずれか1項に記載の方法で製造された飼料、または請求項51または52に記載の組成物の使用。
【請求項57】
図面および/または配列表を参照して本願に実質的に開示されているフィターゼ変異体。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公表番号】特表2011−519274(P2011−519274A)
【公表日】平成23年7月7日(2011.7.7)
【国際特許分類】
【出願番号】特願2011−505239(P2011−505239)
【出願日】平成21年4月17日(2009.4.17)
【国際出願番号】PCT/US2009/041011
【国際公開番号】WO2009/129489
【国際公開日】平成21年10月22日(2009.10.22)
【出願人】(509240479)ダニスコ・ユーエス・インク (81)
【Fターム(参考)】
【公表日】平成23年7月7日(2011.7.7)
【国際特許分類】
【出願日】平成21年4月17日(2009.4.17)
【国際出願番号】PCT/US2009/041011
【国際公開番号】WO2009/129489
【国際公開日】平成21年10月22日(2009.10.22)
【出願人】(509240479)ダニスコ・ユーエス・インク (81)
【Fターム(参考)】
[ Back to top ]

