バリアントアクチビン受容体ポリペプチドおよびその使用
本発明は、アクチビンA、ミオスタチンまたはGDF−11を結合してその活性を阻害することができる、バリアントアクチビンIIB可溶性受容体ポリペプチドおよびタンパク質を提供する。本発明は、これらのバリアントポリペプチドおよびタンパク質を産生することができるポリヌクレオチド、ベクター、ならびに宿主細胞をも提供する。筋消耗性その他の疾患および障害を処置するための組成物および方法も提供される。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願の引照
本出願は、米国仮特許出願番号61/065,474、2008年2月11日出願、および米国仮特許出願番号60/905,459、2007年3月6日出願に基づく優先権を主張し、それらの開示内容に依存し、それらを本明細書に援用する。
【0002】
発明の技術分野
本発明の技術分野は、トランスフォーミング増殖因子−β(TGF−β)ファミリーのメンバーおよび可溶性TGF−βの受容体、ならびに種々の障害の処置のためにTGF−βファミリーのメンバーの活性を調節する方法に関する。
【背景技術】
【0003】
トランスフォーミング増殖因子−β(TGF−β)ファミリーのタンパク質には、トランスフォーミング増殖因子−β(TGF−β)、アクチビン、骨形態形成タンパク質(BMP)、神経増殖因子(NGF)、脳由来神経栄養因子(BDNF)、および増殖/分化因子(GDF)が含まれる。これらのファミリーメンバーは、細胞の増殖、分化、および他の機能を含めた広範な生物学的プロセスの調節に関与する。
【0004】
ミオスタチンとも呼ばれる増殖/分化因子8(GDF−8)は、大部分が発育中および成体の骨格筋組織の細胞に発現するTGF−βファミリーのメンバーである。ミオスタチンは骨格筋の増殖の負の制御において本質的な役割を果たすと思われる(McPherron et al., Nature (London) 387, 83-90 (1997))。ミオスタチンに対する拮抗は動物の除脂肪筋量(lean muscle mass)を増加させることが示された(McFerron et al., 前掲, Zimmers et al., Science 296:1486 (2002))。
【0005】
TGF−βファミリーのタンパク質の他のメンバーは、関連の増殖/分化因子GDF−11である。GDF−11はミオスタチンのアミノ酸配列の約90%の同一性をもつ。GDF−11は発育中の動物の中軸パターン形成において役割をもち(Oh et al, Genes Dev 11:1812-26 (1997))、骨格筋の発育および増殖においても役割を果たすと思われる。
【0006】
アクチビンA、BおよびABは、2つのポリペプチド鎖βAおよびβBのそれぞれホモ二量体およびヘテロ二量体である(Vale et al. Nature 321, 776-779 (1986), Ling et al., Nature 321, 779-782 (1986))。アクチビンは最初は卵胞刺激ホルモン合成の調節に関与する生殖腺ペプチドとして発見され、現在では多数の生物活性の調節に関与すると考えられている。アクチビンAが主要な形態のアクチビンである。
【0007】
アクチビン、ミオスタチン、GDF−11、および他のTGF−βスーパーファミリーのメンバーは、アクチビンII型とアクチビンIIB型の組合わせ受容体を結合し、これによりシグナル伝達する;これらは両方とも膜貫通セリン/トレオニンキナーゼである(Harrison et al., J. Biol. Chem. 279, 28036-28044 (2004))。架橋試験により、ミオスタチンはアクチビンII型受容体ActRIIAおよびActRIIBをインビトロで結合しうると判定された(Lee et al., PNAS USA 98:9306-11 (2001))。GDF−11がActRIIAおよびActRIIBの両方に結合するという証拠もある(Oh et al., Genes Dev 16:2749-54 (2002))。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】McPherron et al., Nature (London) 387, 83-90 (1997)
【非特許文献2】Zimmers et al., Science 296:1486 (2002)
【非特許文献3】Oh et al, Genes Dev 11:1812-26 (1997)
【非特許文献4】Vale et al. Nature 321, 776-779 (1986)
【非特許文献5】Ling et al., Nature 321, 779-782 (1986)
【非特許文献6】Harrison et al., J. Biol. Chem. 279, 28036-28044 (2004)
【非特許文献7】Lee et al., PNAS USA 98:9306-11 (2001)
【非特許文献8】Oh et al., Genes Dev 16:2749-54 (2002)
【発明の概要】
【発明が解決しようとする課題】
【0009】
TGF−βタンパク質の発現は多様な疾患および障害と関連することが知られている。したがって、幾つかのTGF−βタンパク質に同時に拮抗しうる療法用分子は、これらの疾患および障害に特に有効な可能性がある。
【0010】
さらに、タンパク質療法薬の製造はタンパク質の発現および精製に際して起きる問題によって複雑となる可能性がある。ひとつの問題は、発現または精製に際してのタンパク質の凝集である。細胞培養状態で高濃度のタンパク質が蓄積すると、凝集が生じる可能性がある。精製過程でタンパク質がいっそうの凝集を促進する追加要因に曝露される可能性がある(Cromwell, M.E.M. et al., The AAPS Journal 8:E572-E579, 2006)。凝集を引き起こす要因を軽減する試みを行なうことはできるが、凝集を生じる傾向が低くなるようにタンパク質を設計することが求められる。本発明は、TGF−β関連の疾病状態を処置するのに有用なタンパク質を効率的に製造するために、療法用分子に対する、多数のリガンドに結合し、かつ凝集が少なく、したがって改良された製造適性をもつという要望を満たす。
【課題を課題するための手段】
【0011】
本発明は、バリアントヒトアクチビン受容体IIB(vActRIIBと表示する)ポリペプチドを含む単離されたタンパク質を提供する。本明細書中で用いる用語vActRIIBポリペプチドは、ヒトvActRIIBポリペプチドおよびヒトvActRIIB5ポリペプチドの両方を表わす。1態様において、タンパク質はSEQ ID NO:2または18の位置E28もしくはR40のいずれかまたは位置E28およびR40の両方のアミノ酸が他の非−自然(non−native)アミノ酸で置換されたアミノ酸配列をもつポリペプチドを含み、このポリペプチドはミオスタチン、アクチビンA、またはGDF−11を結合することができる。1態様において、タンパク質はSEQ ID NO:2または18の位置E28もしくはR40のいずれかまたは位置E28およびR40の両方のアミノ酸が非−自然アミノ酸で置換され、かつシグナルペプチドが除去されたアミノ酸配列をもつポリペプチドを含み、このポリペプチドはミオスタチン、アクチビンA、またはGDF−11を結合することができる。1態様において、タンパク質はSEQ ID NO:2または18の位置E28もしくはR40のいずれかまたは位置E28およびR40の両方のアミノ酸が別のアミノ酸で置換され、シグナルペプチドが除去され、かつ成熟ポリペプチドのN−末端がトランケートしたアミノ酸配列をもつポリペプチドを含み、このポリペプチドはミオスタチン、アクチビンA、またはGDF−11を結合することができる。1態様において、N−末端トランケートした成熟vActRIIBポリペプチドは成熟配列のN−末端の4個のアミノ酸またはN−末端の6個のアミノ酸を欠如し、このポリペプチドはミオスタチン、アクチビンA、またはGDF−11を結合することができる。1態様において、位置E28における置換はW、YおよびAからなる群から選択される。他の態様において、位置E28における置換はA、F、Q、V、I、L、M、K、H、WおよびYからなるアミノ酸の群から選択される。他の態様において、位置R40における置換はG、Q、M、H、KおよびNからなるアミノ酸の群から選択される。他の態様において、位置E28における置換はA、F、Q、V、I、L、M、K、H、WおよびYからなるアミノ酸の群から選択され、かつ位置R40における置換はA、G、Q、M、H、KおよびNからなるアミノ酸の群から選択される。他の態様において、このポリペプチドはさらにヘテロロガスタンパク質を含む。1態様において、ヘテロロガスタンパク質はFcドメインである。他の態様において、FcドメインはヒトIgG Fcドメインである。
【0012】
1態様において、タンパク質はSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、70、72、87、88、91、93、95、および97に示すアミノ酸配列をもつポリペプチドを含む。
【0013】
他の態様において、タンパク質はSEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、67、69、71、92、94、96に示す配列またはその相補配列をもつポリヌクレオチドによりコードされるポリペプチドを含む。
【0014】
他の観点において、本発明はvActRIIBポリペプチドをコードするポリヌクレオチドを含む単離された核酸分子を提供する。1態様において、核酸分子はSEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、69、71、92、94、96に示す核酸配列またはその相補配列をもつポリヌクレオチドを含む。
【0015】
他の態様において、核酸分子はSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97からなる群に示すアミノ酸配列からなるポリペプチドをコードするポリヌクレオチドを含む。他の態様において、核酸分子はさらに転写または翻訳調節配列を含む。他の観点においては、vActRIIB核酸分子を含む組換えベクターが提供される。他の観点においては、この組換えベクターを含む宿主細胞が提供され、vActRIIBポリペプチドを製造する方法が提供される。
【0016】
本発明はさらに、少なくとも1種類の本発明のvActRIIBポリペプチドまたはタンパク質を含有する組成物を提供する。1態様において、組成物はvActRIIBポリペプチドまたはタンパク質を医薬的に許容できるキャリヤーと混合したものを含有する医薬組成物である。
【0017】
他の観点において、本発明は、vActRIIBポリペプチドまたはタンパク質を含有する療法用組成物を対象に投与することにより、その障害を伴う対象において筋消耗性疾患を治療または予防する方法を提供する。筋消耗性疾患には下記の状態またはそれから生じるものが含まれるが、これらに限定されない:癌性悪液質、筋ジストロフィー、筋萎縮性側索硬化症、うっ血性閉塞性肺疾患、慢性心不全、化学的悪液質、HIV/エイズによる悪液質、腎不全、尿毒症、リウマチ性関節炎、加齢性サルコペニア、加齢性虚弱質、臓器萎縮症、手根管症候群、アンドロゲン欠乏、ならびに長期間の床上安静、脊髄損傷、卒中、骨折、および加齢による非活動に帰因する筋消耗。筋消耗は、宇宙飛行による無重力、インスリン抵抗性、火傷による筋消耗、アンドロゲン欠乏、および他の障害から生じる可能性もある。他の観点において、本発明はアクチビンAの発現に相関する疾患を処置する方法を提供する。1態様において、疾患は癌である。他の観点において、本発明は、代謝障害を処置する方法であって、その処置を必要とする対象に療法用組成物を投与することを含む方法を提供する;その際、代謝障害は骨損失、糖尿病、肥満症、糖耐性障害、高血糖症、アンドロゲン欠乏、およびメタボリックシンドロームから選択される。他の観点において、本発明は、前記の障害を処置するための医薬の製造における療法用組成物の使用を提供する。他の観点において、本発明は、その必要がある対象に本発明のvActRIIBポリペプチドまたはタンパク質をコードするベクターを投与することを含む遺伝子療法を提供する;その際、ベクターは対象においてvActRIIBポリペプチドまたはタンパク質を発現することができる。
【図面の簡単な説明】
【0018】
【図1】図1は、野生型可溶性ActRIIB−ヒトIgG1 Fcのアミノ酸配列(SEQ ID NO:98)を示す。シグナルペプチド配列は太字であり、これに続いて成熟ActRIIB細胞外ドメイン、および部分ヒンジ部を含むイタリック体のヒトIgG1 Fcがある。アミノ酸E28およびR40に下線を施してある。リンカー配列GGGGS(SEQ ID NO:75)はイタリック体であり、かつ下線を施してある。
【図2】図2は、可溶性ActRIIB5−ヒトIgG1 Fcのアミノ酸配列(SEQ ID NO:99)を示す。シグナルペプチド配列は太字であり、これに続いて成熟ActRIIB可溶性ドメインがあり、部分ヒンジ部を含むヒトIgG1 Fcはイタリック体である。アミノ酸E28およびR40に下線を施してある。リンカー配列(GGGGS)(SEQ ID NO:75)はイタリック体であり、かつ下線を施してある。
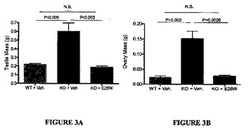
【図3】図3は、インヒビン−αノックアウトマウスにおいて可溶性vActRIIB−Fc E28W処置が精巣(図3A)および卵巣(図3B)の質量に及ぼす影響を示す。
【図4】図4は、可溶性vActRIIB−Fc E28W処置が雄(図4A)および雌(図4B)のインヒビン−αノックアウトマウスの生存率に及ぼす影響を示す。
【図5】図5は、大腸26腫瘍を保有するマウスにおいて可溶性vActRIIB−Fc E28W処置が体重に及ぼす影響を示す。
【図6】図6は、大腸26腫瘍を保有するマウスの生存率に可溶性vActRIIB−Fc E28W処置が及ぼす影響を示す。
【発明を実施するための形態】
【0019】
バリアントヒトアクチビンIIB受容体(vActRIIB)ポリペプチドを含むタンパク質を開示する。これらのタンパク質およびポリペプチドは、3種類のTGF−βタンパク質であるミオスタチン(GDF−8)、アクチビンA、およびGDF−11のうち少なくとも1つに結合してこれらのタンパク質の活性を阻害するそれらの能力を特徴とする。これらのタンパク質およびポリペプチドは、本明細書に開示する修飾を含まないポリペプチドと比較して低い凝集傾向をも示す。これらの修飾は、寄託番号NP 001097(SEQ ID NO:47)の野生型ActRIIB、およびActRIIBの細胞外ドメイン(SEQ ID NO:18)またはActRIIB5の細胞外ドメイン(SEQ ID NO:2)と対比して、位置28、40、または28と40の両方におけるアミノ酸置換からなる。
【0020】
本明細書中で用いる用語”TGF−βファミリーのメンバー”または”TGF−βタンパク質”は、トランスフォーミング増殖因子ファミリーの構造関連増殖因子を表わし、これにはアクチビン、ならびに増殖および分化因子(GDF)タンパク質が含まれる(Kingsley et al. Genes Dev. 8: 133-146 (1994), McPherron et al. Growth factors and cytokines in health and disease, Vol. 1B, D. LeRoith and C.Bondy. ed., JAI Press Inc., Greenwich, Conn, USA: pp 357-393)。
【0021】
ミオスタチンとも呼ばれるGDF−8は、骨格筋組織の負の調節物質である(McPherron et al. PNAS USA 94:12457-12461 (1997))。ミオスタチンは、長さ約375アミノ酸の不活性タンパク質複合体として合成され、ヒトについてGenBank寄託番号AAB86694(SEQ ID NO:49)をもつ。この前駆タンパク質が4塩基プロセシング部位におけるタンパク質分解開裂によって活性化されて、N−末端不活性プロドメイン、および約109アミノ酸のC−末端タンパク質を生成し、これが二量体化して約25kDaのホモ二量体を形成する。このホモ二量体が生物活性をもつ成熟タンパク質である(Zimmers et al., Science 296, 1486 (2002))。
【0022】
本明細書中で用いる用語“プロドメイン”または“プロペプチド”は不活性N−末端タンパク質を表わし、これが開裂除去されて活性C−末端タンパク質が放出される。本明細書中で用いる用語“ミオスタチン”または“成熟ミオスタチン”は、生物活性をもつ成熟C−末端ポリペプチド(単量体、二量体または他の形態)、および生物活性フラグメントまたは関連ポリペプチドを表わし、これには対立遺伝子バリアント、スプライスバリアント、ならびに融合したペプチドおよびポリペプチドが含まれる。成熟ミオスタチンは、ヒト、マウス、ニワトリ、ブタ、シチメンチョウおよびラットを含めた多くの種間で100%の配列同一性をもつと報告されている(Lee et al., PNAS 98, 9306 (2001))。
【0023】
本明細書中で用いるGDF−11は、Swissprot寄託番号O95390(SEQ ID NO:50)をもつBMP(骨形態形成タンパク質)、ならびにそのタンパク質のバリアントおよび種ホモログを表わす。GDF−11は、ミオスタチンに対してアミノ酸レベルで約90%の配列同一性をもつ。GDF−11は、中軸骨格の前/後パターン形成の調節に関与する(McPherron et al, Nature Genet. 22 (93): 260-264 (1999); Gamer et al, Dev. Biol. 208 (1), 222-232 (1999))が、生後の機能は分かっていない。
【0024】
アクチビンAはポリペプチド鎖βAのホモ二量体である。本明細書中で用いる用語“アクチビンA”は、GenBank寄託番号NM 002192(SEQ ID NO:48)をもつアクチビンタンパク質、ならびにそのタンパク質のバリアントおよび種ホモログを表わす。
【0025】
アクチビン受容体
本明細書中で用いる用語アクチビンIIB型受容体(ActRIIB)は、寄託番号NP 001097(SEQ ID NO:47)をもつヒトアクチビン受容体を表わす。可溶性ActRIIBという用語には、ActRIIBの細胞外ドメイン(SEQ ID NO:18)、ActRIIB5の細胞外ドメイン(SEQ ID NO:2)、ならびにこれらの配列の位置64のアルギニンがアラニンで置換されたものも含まれる。
【0026】
バリアント可溶性ActRIIBポリペプチド
本発明は、ヒトバリアント可溶性ActRIIB受容体ポリペプチド(本明細書中でvActRIIBポリペプチド、またはバリアントポリペプチドと表示する)を含む単離されたタンパク質を提供する。本明細書中で用いる用語“vActRIIBタンパク質”は、vActRIIBポリペプチドを含むタンパク質を表わす。本明細書中で用いる用語”単離された”は、内因性物質からある程度精製されたタンパク質またはポリペプチド分子を表わす。これらのポリペプチドおよびタンパク質は、アクチビンA、ミオスタチン、またはGDF−11のいずれか1つに結合してその活性を阻害する能力をもつことを特徴とする。ある態様において、アクチビンA、ミオスタチン、またはGDF−11に対するバリアントポリペプチドの結合親和性は野生型ポリペプチドと比較して改良されている。
【0027】
1態様において、vActRIIBポリペプチドはSEQ ID NO:2または18の位置E28もしくはR40のいずれかまたは位置E28およびR40の両方のアミノ酸が他の非−自然アミノ酸で置換されたアミノ酸配列をもち、このポリペプチドはミオスタチン、アクチビンA、またはGDF−11を結合することができる。他の態様において、vActRIIBポリペプチドはこれらの配列の成熟型またはトランケートした成熟型である。本明細書中で用いる用語“成熟vActRIIBポリペプチド”は、アミノ酸シグナル配列が除去されたポリペプチドを表わす。1態様において、成熟配列は、たとえばSEQ ID NO:2のアミノ酸19〜160、およびSEQ ID NO:18のアミノ酸19〜134であり、その際、位置28および40の一方または両方のアミノ酸が他の非−自然アミノ酸で置換されており、このポリペプチドはアクチビンA、ミオスタチン、またはGDF−11に結合する能力を保持する。本明細書中で用いる用語トランケートした成熟vActRIIBポリペプチドは、シグナル配列およびさらに成熟ポリペプチドのN−末端からのアミノ酸が除去されたポリペプチドを表わす。1態様においては、成熟ポリペプチドの成熟N−末端の4個のアミノ酸またはN−末端の6個のアミノ酸が除去されている。この態様において、トランケートした成熟配列は、たとえばSEQ ID NO:2のアミノ酸23〜160、またはSEQ ID NO:2のアミノ酸25〜160;およびSEQ ID NO:18のアミノ酸23〜134、またはSEQ ID NO:18のアミノ酸25〜134であり、その際、位置28および40の一方または両方のアミノ酸が他の非−野生型アミノ酸で置換されており、これはアクチビンA、ミオスタチン、またはGDF−11に結合する能力を保持する。本明細書中で用いる用語“位置28”および“位置40”(すなわち、E28およびR40)は、18アミノ酸のシグナル配列を含むSEQ ID NO:2および18に関するアミノ酸の位置を表わす。一貫性をもたせるために、成熟vActRIIBポリペプチドが位置10および/または22に置換をもつ場合、あるいはトランケートした成熟ポリペプチドが成熟配列またはトランケートした成熟配列に対して位置6および/または18に置換をもつ場合、あるいは位置4および/または16に置換をもつ場合、これらのバリアントもなお全長SEQ ID NO:2および18について、または図1または2に示すように、すなわち位置E28および/またはR40におけるアミノ酸置換について表示する。そのような成熟態様またはN−末端トランケートした態様を後記に例示する。
【0028】
1態様において、位置28における置換はW、YおよびAからなるアミノ酸の群から選択される。1態様において、位置28における置換はWである。他の態様において、位置28における置換はA、F、Q、V、I、L、M、K、H、WおよびYからなるアミノ酸の群から選択される。他の態様において、位置40における置換はG、Q、M、H、KおよびNからなるアミノ酸の群から選択される。他の態様において、位置28における置換はA、F、Q、V、I、L、M、K、H、WおよびYからなるアミノ酸の群から選択され、かつ位置40における置換はA、G、Q、M、H、KおよびNからなるアミノ酸の群から選択される。1態様において、タンパク質はSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97からなる群から選択されるアミノ酸配列をもつポリペプチドを含む。他の態様において、タンパク質はSEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、67、69、71、92、94、96からなる群に示す配列またはその相補配列をもつポリヌクレオチドによりコードされるポリペプチドを含む。
【0029】
1態様においては、シグナル配列がvActRIIBポリペプチドから除去されて、成熟バリアントポリペプチドが残る。本発明のポリペプチドの製造には多様なシグナルペプチドを使用できる。シグナルペプチドは、図1および2に示す配列(SEQ ID NO:73)、またはオルタナティブシグナル配列、たとえばSEQ ID NO:74、すなわちSEQ ID NO:2および18に対するシグナル配列をもつことができる。vActRIIBまたはvActRIIB5ポリペプチドの発現に有用な他のいかなるシグナルペプチドも使用できる。
【0030】
他の態様において、vActRIIBポリペプチドは実質的にSEQ ID NO:2および18に類似する配列をもつ。本明細書中で用いる用語“実質的に類似する”は、SEQ ID NO:2および18に示すアミノ酸配列に対して少なくとも約80%の同一性、少なくとも約85%の同一性、少なくとも約90%の同一性、少なくとも約95%の同一性、少なくとも約98%の同一性、または少なくとも約99%の同一性をもつポリペプチドを表わし、その際、位置28および/または40の一方または両方のアミノ酸が非−野生型アミノ酸で置換されており、このポリペプチドはSEQ ID NO:2および18のポリペプチドの活性、すなわちミオスタチン、アクチビンAまたはGDF−11を結合して阻害する能力を保持する。さらに、用語vActRIIBポリペプチドは、SEQ ID NO:2または18の位置28および/または40に本明細書に記載する置換を含むフラグメント、たとえばNおよびC末端トランケーション配列を包含し、その際、このポリペプチドはミオスタチン、アクチビンAまたはGDF−11を結合して阻害することができる。
【0031】
本明細書中で用いるvActRIIBおよびvActRIIB5ポリペプチドの“誘導体”という用語は、共有または凝集コンジュゲートを形成する少なくとも1つの追加の化合物部分または少なくとも1つの追加のポリペプチド、たとえばグリコシル基、脂質、アセチル基の付加、またはC−末端もしくはN−末端融合ポリペプチド、PEG分子へのコンジュゲーション、および他の修飾を表わす;これらについては後記にさらに詳細に記載する。バリアントActRIIB受容体ポリペプチド(vActRIIB)は他の修飾体および誘導体をも含むことができ、これには多様な細胞タイプ、たとえば哺乳動物細胞、大腸菌(E.coli)、酵母、および他の組換え宿主細胞における発現によるプロセシングから生じるCおよびN末端への修飾が含まれる。さらに、vActRIIBポリペプチドフラグメント、ならびにSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97に示すポリペプチド配列の不活性化されたN−グリコシル化部位(1以上)、不活性化されたプロテアーゼプロセシング部位(1以上)、または保存的アミノ酸置換(1以上)を含むポリペプチドが含まれる。
【0032】
本明細書中で用いる用語“vActRIIBまたはvActRIIB5ポリペプチド活性”あるいは“可溶性vActRIIBまたはvActRIIB5ポリペプチドの生物活性”は、vActRIIBおよびvActRIIB5ポリペプチドの1以上のインビトロまたはインビボ活性を表わし、これには後記の実施例中で証明するものが含まれるが、これらに限定されない。vActRIIBポリペプチドの活性には、ミオスタチンまたはアクチビンAまたはGDF−11に結合する能力、およびミオスタチンまたはアクチビンAまたはGDF−11の活性を低下または中和する能力が含まれるが、これらに限定されない。本明細書中で用いる、ミオスタチン、アクチビンA、またはGDF−11に“結合することができる”という用語は、当技術分野で既知の方法、たとえば後記の実施例2に記載するBiacore法により測定した結合を表わす。実施例2においては、pMARE C2C12細胞ベースのアッセイによりアクチビンA中和活性、ミオスタチン中和活性、およびGDF−11中和活性も測定する。インビボ活性には、動物モデルにおいて証明され、当技術分野で既知であるように、体重の増加、除脂肪筋量の増加、骨格筋量の増加、脂肪量の減少が含まれるが、これらに限定されない。生物活性には、さらに特定のタイプの腫瘍により起きる悪液質の軽減または予防、特定のタイプの腫瘍の増殖の予防、および特定の動物モデルの生存率の向上が含まれる。vActRIIBポリペプチド活性についての考察をさらに後記に示す。
【0033】
本発明のポリペプチドはさらに、vActRIIBポリペプチドに直接またはリンカー配列により付加して融合タンパク質を形成したヘテロロガスポリペプチドを含む。本明細書中で用いる用語“融合タンパク質”は、ヘテロロガスポリペプチドが組換えDNA技術により付加したタンパク質を表わす。ヘテロロガスポリペプチドには下記のものが含まれるが、これらに限定されない:バリアントActRIIBのオリゴマー化および安定化を促進するFcポリペプチド、hisタグ、およびロイシンジッパードメイン;たとえばWO 00/29581に記載され、これを本明細書に援用する。1態様において、ヘテロロガスポリペプチドはFcポリペプチドまたはドメインである。1態様において、FcドメインはヒトIgG1、IgG2、およびIgG4 Fcドメインから選択される。これらをSEQ ID NO:80、82および84に示す。vActRIIBは、さらにIgG1、IgG2、またはIgG4の各IgG Fc領域に隣接するヒンジ配列の全部または一部を含むことができる。IgG1、IgG2、およびIgG4の全ヒンジ配列をそれぞれSEQ ID NO:76、77、および78に示す。
【0034】
vActRIIBポリペプチドは、場合によりさらに“リンカー”配列を含むことができる。リンカーは主に、ポリペプチドと第2のヘテロロガスポリペプチドもしくは他のタイプの融合配列との間の、または2以上のバリアントActRIIBポリペプチド間の、スペーサーとして作用する。1態様において、リンカーは互いにペプチド結合により連結したアミノ酸、好ましくはペプチド結合により連結した1〜20個のアミノ酸から構成され、その際、アミノ酸は20種類の天然アミノ酸から選択される。当業者に理解されるように、これらのアミノ酸のうち1以上がグリコシル化されていてもよい。1態様において、これらの1〜20個のアミノ酸はグリシン、アラニン、プロリン、アスパラギン、グルタミン、およびリジンから選択される。好ましくは、リンカーは大部分が立体障害のないアミノ酸、たとえばグリシンおよびアラニンから構成される。リンカーの例はポリグリシン(特に(Gly)5、(Gly)8、ポリ(Gly−Ala)、およびポリアラニンである。後記の実施例中に示す適切なリンカーの一例は、(Gly)4Ser(SEQ ID NO:75)である。他の例において、vActRIIBはヒンジリンカーを含むことができる;すなわち、SEQ ID NO:79に示すように、リンカー配列がヒンジ部に隣接して付与されている。
【0035】
リンカーは非ペプチドリンカーであってもよい。たとえば、アルキルリンカー、たとえば−NH−(CH2)s−C(O)−を使用でき、ここでs=2〜20である。これらのアルキルリンカーはさらに、立体障害をもたらさないいずれかの基、たとえば低級アルキル(たとえばC1〜C6)低級アシル、ハロゲン(たとえばCl、Br)、CN、NH2、フェニルなどで置換されていてもよい。
【0036】
1態様においては、vActRIIBポリペプチドをFcポリペプチドに直接に、またはリンカーにより、またはヒンジリンカーにより付加することができる。1態様において、FcはヒトIgG Fcである。Fcに付加したvActRIIBには、表1および2に示すように、また本明細書の実施例に記載するように、たとえばvActRIIB−IgG1Fc、E28A(SEQ ID NO:60);vActRIIB−IgG1Fc、E28W(SEQ ID NO:62)、vActRIIB−IgG1Fc、E28Y(SEQ ID NO:64)、vActRIIB−IgG Fc、R40G(SEQ ID NO:66)、vActRIIB5−IgG1Fc、E28A(SEQ ID NO:70)、およびvActRIIB5−IgG1Fc E28W(SEQ ID NO:72)が含まれる。他の態様には、vActRIIB−IgG2 Fc、E28W(SEQ ID NO:91)、vActRIIB−IgG2 Fc、E28Y(SEQ ID NO:93)、およびvActRIIB−IgG2 Fc(SEQ ID NO:95)が含まれる。これらのバリアントは、後記の実施例内で証明するように、生じる凝集が野生型ActRIIB−IgG2 IgG2と比較して少ないことが証明された。
【0037】
本明細書に開示するvActRIIBポリペプチドは、ActRIIBポリペプチドの分解の減少および/または半減期の延長、毒性の低下、免疫原性の低下、および/または生物活性の増大などの目的特性を付与するために、非ポリペプチド分子に付加することもできる。例示分子には、線状ポリマー、たとえばポリエチレングリコール(PEG)、ポリリジン、デキストラン;脂質;コレステロール群(たとえばステロイド);炭水化物、またはオリゴ糖分子が含まれるが、これらに限定されない。
【0038】
他の観点において、本発明は本発明のvActRIIBポリペプチドをコードするポリヌクレオチドを含む単離された核酸分子を提供する。本明細書中で用いる用語“単離された”は、内因性物質からある程度精製された核酸分子を表わす。1態様において、本発明の核酸分子はSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97のポリペプチドをコードするポリヌクレオチドを含む。1より多いコドンが同一アミノ酸をコードすることができる既知の遺伝子コード縮重のため、DNA配列がSEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、67、69、71、92、94、および96に示すもの、またはSEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、67、69、71、92、94、および96の相補鎖と異なり、なおSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97のアミノ酸配列をもつポリペプチドをコードするという可能性がある。そのようなバリアントDNA配列は、産生中に起きるサイレント変異から生じる可能性があり、あるいはこれらの配列の意図的な変異形成の生成物であってもよい。
【0039】
他の態様において、本発明の核酸分子はSEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、67、69、71、92、94、および96に示すポリヌクレオチド配列をもつポリヌクレオチド、またはSEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、67、69、71、92、94、および96の相補鎖を含む。他の態様において、本発明は、ストリンジェントなまたは中等度の条件下でSEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、67、69、71、92、94、および96のポリペプチドコード領域とハイブリダイズする核酸分子を提供し、その際、コードされるポリペプチドはSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97に示すアミノ酸配列を含み、コードされるポリペプチドはvActRIIBポリペプチドの活性を保持する。
【0040】
本発明の核酸分子には、一本鎖および二本鎖の両方の形のDNA、ならびにそのRNA相補配列が含まれる。DNAには、たとえばcDNA、ゲノムDNA、合成DNA、PCRにより増幅したDNA、およびその組合わせが含まれる。ゲノムDNAは、常法により、たとえばSEQ ID NO:1もしくは17のDNAまたはその適切なフラグメントをプローブとして用いることにより単離できる。ActRIIBポリペプチドをコードするゲノムDNAは、多数の種について入手できるゲノムライブラリーから得られる。合成DNAは、オーバーラップするオリゴヌクレオチドフラグメントを化学合成し、続いてそれらのフラグメントを組み立ててコード領域およびフランキング配列の一部または全部を再構成することにより得ることができる。RNAは、mRNAの高レベル合成を指令する原核細胞発現ベクター、たとえばT7プロモーターを用いるベクターおよびRNAポリメラーゼから得ることができる。cDNAは、ActRIIBを発現する種々の組織から単離されたmRNAから調製したライブラリーから得られる。本発明のDNA分子には、全長の遺伝子ならびにそのポリヌクレオチドおよびフラグメントが含まれる。全長遺伝子は、N−末端シグナル配列をコードする配列をも含むことができる。
【0041】
本発明の他の観点においては、前記の核酸配列を含む発現ベクター、およびそのようなベクターで形質転換した宿主細胞、およびvActRIIBポリペプチドを製造する方法も提供される。用語“発現ベクター”は、ポリヌクレオチド配列からポリペプチドを発現させるためのプラスミド、ファージ、ウイルスまたはベクターを表わす。vActRIIBポリペプチドを発現させるためのベクターは、ベクターの増殖およびクローニングされた挿入配列の発現に必要な最小配列を含む。発現ベクターは、下記のアセンブリーを含む転写ユニットを含む:(1)遺伝子発現における調節の役割をもつ遺伝子エレメント(1以上)、たとえばプロモーターまたはエンハンサー、(2)mRNAに転写されてタンパク質に翻訳されるべき、vActRIIBポリペプチドをコードする配列、ならびに(3)適切な転写開始配列および転写終止配列。これらの配列はさらに選択マーカーを含むことができる。宿主細胞における発現に適切なベクターは容易に入手でき、前記の核酸分子を標準的な組換えDNA技術によりそれらのベクターに挿入する。そのようなベクターは、特定の組織において機能するプロモーター、および標的とするヒトまたは動物の細胞におけるvActRIIB発現のためのウイルスベクターを含むことができる。vActRIIBの発現に適切な発現ベクターの例は、vActRIIBポリヌクレオチドを含むpDSRa(WO 90/14363に記載、本明細書に援用する)およびそれの誘導体、ならびに当技術分野で既知の、または後記の他のいずれか適切なベクターである。
【0042】
本発明は、さらにvActRIIBポリペプチドを製造する方法を提供する。他の多様な発現系/宿主系を使用できる。これらの系には下記のものが含まれるが、これらに限定されない:組換えバクテリオファージ、プラスミドもしくはコスミドDNA発現ベクターで形質転換した微生物、たとえば細菌;酵母発現ベクターで形質転換した酵母;ウイルス発現ベクター(たとえばバキュロウイルス)を感染させた昆虫細胞系;ウイルス発現ベクター(たとえば、カリフラワーモザイクウイルス、CaMV;タバコモザイクウイルス、TMV)でトランスフェクションした、もしくは細菌発現ベクター(たとえば、TiまたはpBR322プラスミド)で形質転換した、植物細胞系;または動物細胞系。組換えタンパク質の製造に有用な哺乳動物細胞には下記のものが含まれるが、これらに限定されない:VERO細胞、HeLa細胞、チャイニーズハムスター卵巣(CHO)細胞系、またはそれらの誘導系、たとえば無血清培地中で増殖するVeggie CHOおよび関連細胞系(参照:Rasmussen et al., 1998, Cytotechnology 28:31)、またはDHFRを欠如するCHO株DX−B11(参照:Urlaub et al., 1980, Proc. Natl. Acad. Sci. USA 77:4216-20)COS細胞、たとえばCOS−7系列のサル腎細胞(ATCC CRL 1651)(参照:Gluzman et al., 1981, Cell 23:175)、W138、BHK、HepG2、3T3(ATCC CCL 163)、RIN、MDCK、A549、PC12、K562、L細胞、C127細胞、BHK(ATCC CRL 10)細胞系列、アフリカミドリザル腎細胞系列CV1に由来するCV1/EBNA細胞系列(ATCC CCL 70)(参照:McMahan et al., 1991, EMBO J. 10:2821)、ヒト胚腎細胞、たとえば293、293 EBNAもしくはMSR 293、ヒト上皮A431細胞、ヒトColo205細胞、他の形質転換した霊長類細胞系列、正常二倍体細胞、初代組織のインビトロ培養に由来する細胞株、初代外植体、HL−60、U937、HaKもしくはジャーカット細胞。哺乳動物発現により分泌型または可溶性のポリペプチドを産生することができ、これを増殖培地から回収できる。
【0043】
適切な宿主−ベクター系を用いて、本発明の核酸分子を含む発現ベクターで形質転換した宿主細胞を産生が可能な条件下で培養することにより、vActRIIBポリペプチドを組換え製造する。形質転換した細胞を長期間の高収率ポリペプチド製造に使用できる。そのような細胞を、目的とする発現カセットのほか選択マーカーを含むベクターで形質転換すると、それらの細胞を富化培地中で1〜2日間増殖させた後、選択培地に切り替えることができる。選択マーカーは、導入した配列をうまく発現する細胞を増殖させて回収することができるように設計される。安定に形質転換された耐性細胞塊を、用いる細胞系列に適切な組織培養法により増殖させることができる。組換えタンパク質の発現についての概説は、Methods of Enzymology, v. 185, Goeddell, D.V., ed., Academic Press (1990)中に見ることができる。
【0044】
ある場合、たとえば原核細胞系を用いるそのような発現の場合には、生物活性にするために、発現した本発明ポリペプチドを“再フォールディング”および酸化して適正な三次元構造にしかつジスルフィド結合を生成させることが必要な可能性がある。再フォールディングは、当技術分野で周知であるいくらかの方法を用いて達成できる。そのような方法には、たとえば可溶化したポリペプチドを、カオトロピック剤の存在下で通常は7より高いpHに曝露することが含まれる。カオトロピック剤の選択は封入体可溶化のために用いる選択と同様であるが、一般にカオトロピック剤をより低い濃度で用いる。カオトロピック剤の例はグアニジンおよび尿素である。大部分の場合、再フォールディング/酸化溶液は、システイン橋形成のためのジスルフィドシャフリングを起こさせる特定の酸化還元電位を生じる特定比率の還元剤およびその酸化形をも含有するであろう。若干の慣用される酸化還元対には、システイン/シスタミン、グルタチオン/ジチオビスGSH、塩化銅(II)、ジチオトレイトールDTT/ジチアンDTT、および2−メルカプトエタノール(bME)/ジチオ−bMEが含まれる。多くの場合、再フォールディングの効率を高めるために共溶媒を使用できる。慣用される共溶媒には、グリセロール、種々の分子量のポリエチレングリコール、およびアルギニンが含まれる。
【0045】
さらに、前記のポリペプチドは常法に従って溶液中または固体支持体上で合成できる。種々の自動合成装置が市販されており、既知のプロトコルに従って使用できる。たとえば、Stewart and Young, Solid Phase Peptide Synthesis, 2d.Ed., Pierce Chemical Co. (1984); Tam et al., J Am Chem Soc, 105:6442, (1983); Merrifield, Science 232:341-347 (1986); Barany and Merrifield, The Peptides, Gross and Meienhofer, eds, Academic Press, New York, 1-284; Barany et al., Int J Pep Protein Res, 30:705-739 (1987)を参照。
【0046】
本発明のポリペプチドおよびタンパク質は、当業者に周知のタンパク質精製法に従って精製できる。これらの方法は、ある段階でタンパク質画分と非タンパク質画分の粗分画を伴う。ペプチドポリペプチドを他のタンパク質から分離すると、目的とするペプチドまたはポリペプチドをクロマトグラフィー法および電気泳動法によりさらに精製して、部分または完全精製(または均質になるまでの精製)を達成することができる。本明細書中で用いる用語“単離されたポリペプチド”または“精製されたポリペプチド”は、他の成分から単離可能な組成物であって、そのポリペプチドが自然界で得られるそれの状態と比較して何らかの程度精製された組成物を表わすものとする。したがって、精製したポリペプチドはそれが自然界で存在する可能性のある環境から遊離したポリペプチドをも表わす。一般に“精製した”は、他の種々の成分を除去するための分画が施されたポリペプチド組成物であって、発現したそれの生物活性を実質的に保持している組成物を表わすであろう。“実質的に精製された”という用語を用いる場合、この表記は、ペプチドまたはポリペプチド組成物においてそのポリペプチドまたはペプチドがその組成物の主成分を形成するもの、たとえば組成物中のタンパク質の約50%、約60%、約70%、約80%、約85%、もしくは約90%またはそれ以上を構成するものを表わすであろう。
【0047】
精製に用いるのに適切な多様な方法が当業者に周知であろう。これらには、たとえば硫酸アンモニウム、PEG、抗体(免疫沈降法)などまたは熱変性による沈殿に続く遠心分離;クロマトグラフィー、たとえばアフィニティークロマトグラフィー(プロテイン−Aカラム)、イオン交換、ゲル濾過、逆相、ヒドロキシルアパタイト、疎水性相互作用クロマトグラフィー;等電点フォーカシング;ゲル電気泳動;およびこれらの方法の組合わせが含まれる。当技術分野で一般に知られているように、種々の精製工程を実施する順序を変更し、あるいは特定の工程を省いてもなお、実質的に精製されたポリペプチドを製造するのに適切な方法とすることができると考えられる。精製工程の例を後記の実施例に提示する。
【0048】
ポリペプチドの精製度を定量するための種々の方法が、本明細書の開示からみて当業者に既知であろう。これらには、たとえば活性画分の特異的結合活性を測定するもの、またはSDS/PAGE分析により画分中のペプチドもしくはポリペプチドの量を評価するものが含まれる。ポリペプチド画分の純度を評価するための好ましい方法は、その画分の結合活性を計算して、それを最初の抽出物の結合活性と比較し、これにより、本明細書中で“精製倍数”により評価する精製度を計算するものである。結合活性の量を表わすために用いる実際の単位はもちろん、精製を追跡するために選択した個々のアッセイ法、およびそのポリペプチドまたはペプチドが検出可能な結合活性を示すか否かに依存するであろう。
【0049】
バリアントアクチビンIIB型ポリペプチドは筋分解カスケードを活性化するリガンドに結合する。リガンドであるアクチビンA、ミオスタチン、および/またはGDF−11を結合してその活性を阻害することができるvActRIIBポリペプチドは、後記の実施例に示すように、筋萎縮を伴う疾患に対する療法効力、ならびに特定の癌および他の疾患を処置する効力をもつ。
【0050】
しかし、野生型ActRIIBまたはActRIIB5ポリペプチドの発現または精製に際しては凝集が起きる可能性がある。この凝集には、発現中における構造化オリゴマー形成、ならびに発現中およびポリペプチド精製後の両方における非構造化凝集体生成が含まれる。
【0051】
構造分析、分子モデリング、および質量分析を組み合わせた方法で、グリコシレーションされていないActRIIBポリペプチド間の静電相互作用および水素結合相互作用により補助された分子間ジスルフィド結合形成によってActRIIBポリペプチドに多量体形成が生じる可能性のあることが指摘された。2つのActRIIB分子の境界;たとえば1つのActRIIBのE28側鎖と他のActRIIBのR40側鎖との間に、有意の水素結合がある。さらに、1つのActRIIBのE28と他のActRIIBのR40との間に、重大な静電相互作用がある。
【0052】
これらの静電相互作用は、一時的なActRIIB二量体の集団を増加させ、その結果ActRIIB単位間の非共有結合および/または共有結合の形成を促進する、著しい原因となる可能性がある。残基E28とR40間の相互作用は、これらの相互作用のうち最も重大なものである;これら2残基は二重の水素結合および強い静電相互作用に関与するからである。残基E28およびR40はActRIIB:ActRIIB相互作用に関与し、ActRIIB:リガンド相互作用には関与しない。したがって、残基28および40を本発明に従って非−自然アミノ酸と置換して、これら受容体ポリペプチドの溶解度を改善し、凝集を低下させることができる。したがって、後記に示すように、E28およびR40をそれぞれ他の可能な天然アミノ酸で置換し、発現させ、Biacoreにより試験した。Biacoreにより測定した結合を後記の実施例2の表1Aおよび1Bに示す。さらに、vActRIIBポリペプチドの凝集率を後記において測定する。
【0053】
後記実施例の結果は、本明細書に記載するアミノ酸置換をもつvActRIIBポリペプチドおよびタンパク質について、ミオスタチン、アクチビンA、またはGDF−11を結合および中和する能力を保持した状態で凝集が低下することを示す。
【0054】
抗体
本発明はさらに、バリアントActRIIBポリペプチドに結合する抗体を含み、これには本発明のvActRIIBポリペプチドに特異的に結合するものが含まれる。本明細書中で用いる用語“特異的に結合する”は、vActRIIBポリペプチドに対して106M−1以上の結合親和性(Ka)をもつ抗体を表わす。本明細書中で用いる用語“抗体”は、たとえば下記のものを含めた無傷の抗体を表わす:ポリクローナル抗体(たとえばAntibodies: A Laboratory Manual, Harlow and Lane (eds), Cold Spring Harbor Press, (1988)を参照)、およびモノクローナル抗体(たとえばU.S.Patent Nos.RE 32,011、4,902,614、4,543,439および4,411,993、ならびにMonoclonal Antibodies: A New Dimension in Biological Analysis, Plenum Press, Kennett, McKearn and Bechtol (eds.) (1980)を参照)。本明細書中で用いる用語“抗体”は、抗体のフラグメント、たとえばF(ab)、F(ab’)、F(ab’)2、Fv、Fc、および一本鎖抗体をも表わし、これらは組換えDNA技術により、または無傷抗体の酵素開裂もしくは化学的開裂により製造される。用語“抗体”は二重特異性または二重機能性抗体をも表わし、これらは2つの異なる重鎖/軽鎖対および2つの異なる結合部位をもつ人工ハイブリッド抗体である。二重特異性抗体は、ハイブリドーマの融合またはFab’フラグメントの連結を含めた多様な方法により製造できる(参照:Songsivilai et al, Clin. Exp. Immunol. 79:315-321 (1990), Kostelny et al., J. Immunol.148:1547-1553 (1992))。
【0055】
本明細書中で用いる用語“抗体”は、キメラ抗体、すなわちヒト抗体免疫グロブリン定常ドメインが1以上の非ヒト抗体免疫グロブリン可変ドメインに結合した抗体、またはそのフラグメントをも表わす(たとえばU.S.Patent No.5,595,898およびU.S.Patent No.5,693,493を参照)。抗体は“ヒト化”抗体(たとえばU.S.Pat.No.4,816,567およびWO 94/10332を参照)、ミニボディー(minibodies)(WO 94/09817)、マキシボディー(maxibodies)、およびトランスジェニック動物が産生する抗体をも表わし、その際、ある割合のヒト抗体産生遺伝子を含むけれども内因性抗体の産生を欠如するトランスジェニック動物は、ヒト抗体を産生することができる(たとえば、Mendez et al., Nature Genetics 15:146-156 (1997)、およびU.S.Patent No.6,300,129を参照)。用語“抗体”には、多量体抗体、すなわちより高次のタンパク質複合体、たとえばヘテロ二量体抗体、および抗イディオタイプ抗体も含まれる。“抗体”には、抗イディオタイプ抗体も含まれる。vActRIIBに対する抗体を用いて、たとえばvActRIIBをインビトロおよびインビボで同定および定量することができる。
【0056】
いずれかの哺乳動物からのポリクローナル抗体、たとえばマウスおよびラットの抗体、ならびにウサギ抗体であって、SEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97を含めた本明細書に記載するvActRIIBポリペプチドに特異的に結合するものも含まれる。
【0057】
そのような抗体は研究用ツールとして、および本明細書に開示するポリペプチドを検出およびアッセイするための定量アッセイに利用される。そのような抗体は、本明細書に記載する方法および当技術分野で既知の方法を用いて調製できる。
【0058】
医薬組成物
本発明のvActRIIBタンパク質およびポリペプチドを含有する医薬組成物も提供される。そのような組成物は、治療または予防に有効な量のポリペプチドまたはタンパク質を医薬的に許容できる物質および生理的に許容できる配合物質と混合したものを含む。医薬組成物は、たとえば組成物のpH、モル浸透圧、粘度、澄明度、色、等張性、臭気、無菌性、安定性、溶解もしくは放出の速度、吸着または透過を改変、維持または保持するための配合物質を含有することができる。適切な配合物質には下記のものが含まれるが、これらに限定されない:アミノ酸(たとえばグリシン、グルタミン、アスパラギン、アルギニンまたはリジン);抗微生物薬;抗酸化剤(たとえばアスコルビン酸、亜硫酸ナトリウムまたは亜硫酸水素ナトリウム);緩衝剤(たとえばホウ酸塩、炭酸水素塩、トリス−HCl、クエン酸塩、リン酸塩、他の有機酸);増量剤(たとえばマンニトールまたはグリシン)、キレート化剤(たとえばエチレンジアミン四酢酸(EDTA));複合体形成剤(たとえばカフェイン、ポリビニルピロリドン、ベータ−シクロデキストリンまたはヒドロキシプロピル−ベータ−シクロデキストリン);充填剤;単糖類;二糖類および他の炭水化物(たとえばグルコース、マンノース、またはデキストリン);タンパク質(たとえば血清アルブミン、ゼラチンまたは免疫グロブリン);着色剤;着香剤および希釈剤;乳化剤;親水性ポリマー(たとえばポリビニルピロリドン);低分子量ポリペプチド;塩形成性の対イオン(たとえばナトリウム);保存剤(たとえば塩化ベンザルコニウム、安息香酸、サリチル酸、チメロサール、フェネチルアルコール、メチルパラベン、プロピルパラベン、クロルヘキシジン、ソルビン酸、または過酸化水素);溶剤(たとえばグリセリン、プロピレングリコール、またはポリエチレングリコール);糖アルコール(たとえばマンニトールまたはソルビトール);懸濁化剤;界面活性剤または湿潤剤(たとえばpluronic類、PEG、ソルビタンエステル、polysorbate類、たとえばpolysorbate 20、polysorbate 80、トライトン(triton)、トロメタミン(tromethamine)、レシチン、コレステロール、チロキサパル(tyloxapal));安定性向上剤(ショ糖またはソルビトール);張性増強剤(たとえばアルカリ金属ハロゲン化物(好ましくは塩化ナトリウムまたは塩化カリウム、マンニトールソルビトール));送達ビヒクル;希釈剤;賦形剤および/または医薬佐剤(Remington’s Pharmaceutical Sciences, 18thEdition, A.R. Gennaro, ed., Mack Publishing Company, 1990)。
【0059】
最適な医薬組成物は、たとえば意図する投与経路、送達方式、および目的投与量に応じて当業者により決定されるであろう。たとえば前掲のRemington’s Pharmaceutical Sciencesを参照。そのような組成物は、ポリペプチドの物理的状態、安定性、インビボ放出速度、およびインビボクリアランス速度に影響を及ぼすことができる。たとえば、適切な組成物は非経口投与用の注射用水、生理食塩水の溶液であってもよい。
【0060】
医薬組成物中の主なビヒクルまたはキャリヤーは、水性または非水性であってよい。たとえば、適切なビヒクルまたはキャリヤーは注射用水、生理食塩溶液、または人工脳脊髄液に、おそらく非経口投与用の組成物に慣用される他の物質を補ったものであってもよい。中性緩衝化した生理食塩水または血清アルブミンと混合した生理食塩水は、ビヒクルのさらに他の例である。医薬組成物の他の例は、約pH7.0〜8.5のトリス緩衝液、または約pH4.0〜5.5の酢酸緩衝液を含み、これらはさらにソルビトールまたはその適切な代替物を含有することができる。本発明の1態様において、組成物は目的純度の選択した組成物を任意配合剤(前掲のRemington’s Pharmaceutical Sciences)と混合することにより、凍結乾燥ケークまたは水溶液の形で保存用として調製できる。さらに、前記の療法用組成物は、適切な賦形剤、たとえばショ糖を用いて、凍結乾燥品として配合することができる。
【0061】
前記の配合物を多様な方法で、たとえば吸入療法、経口、または注射により送達できる。非経口投与を意図する場合、本発明に使用するための療法用組成物は、目的ポリペプチドを医薬的に許容できるビヒクル中に含む、発熱物質を含まない、非経口用として許容できる水溶液の形であってもよい。非経口注射に特に適切なビヒクルは無菌蒸留水であり、これにポリペプチドを適正に保存処理した無菌等張溶液として配合できる。さらに他の調製法は、製剤の制御放出または持続放出をもたらす注射可能なマイクロスフェア、生分解性粒子、ポリマー化合物(ポリ乳酸、ポリグリコール酸)、ビーズ、またはリポソームなどの物質を目的分子に配合することを伴い、次いで製剤をデポー注射により送達することができる。ヒアルロン酸も使用でき、これは循環中における持続滞留を促進する効果をもつことができる。目的分子を導入するのに適切な他の手段には、埋込み可能な薬物送達デバイスが含まれる。
【0062】
他の観点において、注射投与に適切な医薬配合物は、水溶液中に、好ましくは生理的に適合性の緩衝液、たとえばハンクス液、リンガー液、または緩衝化生理食塩水中に配合できる。水性の注射用懸濁液剤は、懸濁液の粘度を増大させる物質、たとえばカルボキシメチルセルロースナトリウム、ソルビトール、またはデキストランを含有することができる。さらに、有効化合物の懸濁液剤は、適宜、油性の注射用懸濁液剤として調製することができる。適切な親油性の溶剤またはビヒクルには、脂肪油、たとえばゴマ油、または合成脂肪酸エステル、たとえばオレイン酸エチル、トリグリセリド、またはリポソームが含まれる。非脂質系のポリカチオン性アミノポリマーも送達のために使用できる。場合により懸濁液剤は、適切な安定剤、または化合物の溶解度を高めて高濃度液剤を調製するための物質をも含有することができる。他の態様において、医薬組成物は吸入用として配合することができる。吸入用液剤には、エアゾール送達のための噴射剤を配合することもできる。さらに他の態様において、液剤を噴霧することができる。肺投与については、化学修飾したタンパク質の肺送達を記載したPCT出願No.PCT/US94/001875に詳細に記載されている。
【0063】
特定の配合物は経口投与できることも考慮される。本発明の1態様において、この様式で投与される分子には、固体剤形、たとえば錠剤およびカプセル剤の配合に慣用されるキャリヤーを配合してもよく、配合しなくてもよい。たとえばカプセル剤は、生物学的利用能が最大となりかつ全身前分解(pre−systemic degradation)が最小限に抑えられる胃腸管の地点で配合物の有効部分を放出するように設計することができる。療法分子の吸収を容易にする追加物質を含有させることができる。希釈剤、着香剤、低融点ろう、植物油、滑沢剤、懸濁化剤、錠剤崩壊剤、および結合剤も使用できる。経口投与用の医薬組成物は、当技術分野で周知の医薬的に許容できるキャリヤーを経口投与に適切な量で用いて配合することもできる。そのようなキャリヤーにより、医薬組成物を患者が摂取できる錠剤、丸剤、糖衣丸、カプセル剤、液剤、ゲル剤、シロップ剤、スラリー剤、懸濁液剤などとして配合することが可能になる。
【0064】
経口用の医薬製剤は、有効化合物を固体賦形剤と混和し、得られた顆粒混合物を(場合により粉砕した後に)加工して錠剤または糖衣丸コアを得ることにより得ることができる。所望により、適切な助剤を添加することができる。適切な賦形剤には、炭水化物またはタンパク質系の充填剤、たとえば糖類が含まれ、これには乳糖、ショ糖、マンニトール、およびソルビトール;トウモロコシ、コムギ、コメ、バレイショ、または他の植物からのデンプン;セルロース、たとえばメチルセルロース、ヒドロキシプロピルメチルセルロース、またはカルボキシメチルセルロースナトリウム;アラビアゴムおよびトラガントゴムを含めたゴム;ならびにタンパク質、たとえばゼラチンおよびコラーゲンが含まれる。所望により、崩壊剤または可溶化剤、たとえば架橋ポリビニルピロリドン、寒天、およびアルギン酸またはその塩、たとえばアルギン酸ナトリウムを添加してもよい。
【0065】
糖衣丸コアを適切なコーティング、たとえば濃厚な糖溶液と共に使用でき、これはアラビアゴム、タルク、ポリビニルピロリドン、カルボポール(carbopol)ゲル、ポリエチレングリコール、および/または二酸化チタン、ラッカー溶液、ならびに適切な有機溶剤または溶剤混合物を含有することもできる。製品の識別のために、または有効化合物の量、すなわち投与量の特徴付けのために、染料または色素を錠剤または糖衣丸のコーティングに添加してもよい。
【0066】
経口使用できる医薬製剤は、ゼラチン製の滑り嵌めカプセル、およびゼラチン製の密閉型軟カプセル、ならびにコーティング、たとえばグリセロールまたはソルビトールをも含むことができる。滑り嵌めカプセルは、有効成分を充填剤または結合剤、たとえば乳糖またはデンプン、滑沢剤、たとえばタルクまたはステアリン酸マグネシウム、および場合により安定剤と混合したものを収容することができる。軟カプセルの場合、安定剤を含むかまたは含まない適切な液体、たとえば脂肪油、液体、または液体ポリエチレングリコールに、有効化合物を溶解または懸濁することができる。
【0067】
他の医薬組成物は当業者に自明であろう;これには、持続送達または制御送達配合物中にポリペプチドを含む配合物が含まれる。多様な他の持続送達または制御送達手段、たとえばリポソームキャリヤー、生分解性微粒子または多孔質ビーズおよびデポー注射剤を配合するための方法も当業者に既知である。たとえば、医薬組成物を送達するための多孔質ポリマー微粒子の制御放出を記載したPCT/US93/00829を参照。持続放出製剤の他の例には、造形品、たとえばフィルムまたはマイクロカプセルの形の半透性ポリマーマトリックスが含まれる。持続放出マトリックスには、ポリエステル、ヒドロゲル、ポリラクチド(U.S.3,773,919、EP 58,481)、L−グルタミン酸およびガンマ−L−グルタミン酸エチルのコポリマー(Sidman et al., Biopolymers, 22:547-556 (1983)、ポリ(2−ヒドロキシエチル−メタクリレート)(Langer et al., J. Biomed. Mater. Res., 15:167-277, (1981); Langer et al., Chem. Tech.,12:98-105(1982))、エチレンビニルアセテート(Langer et al.、前掲)、またはポリ−D(−)−3−ヒドロキシ酪酸(EP 133,988)を含めることができる。持続放出組成物はリポソームも含むことができ、これは当技術分野で既知の幾つかの方法のいずれかにより調製できる。たとえばEppstein et al., PNAS (USA), 82:3688 (1985);EP 36,676;EP 88,046;EP 143,949を参照。
【0068】
インビボ投与に用いる医薬組成物は、一般に無菌でなけれぱならない。これは無菌濾過膜を通して濾過することにより達成できる。組成物を凍結乾燥する場合、この方法による無菌処理は凍結乾燥および再構成の前または後に実施できる。非経口投与用の組成物は、凍結乾燥した形または溶液で貯蔵できる。さらに、非経口組成物は一般に、無菌取出し口を備えた容器、たとえば皮下注射針で穿孔できるストッパー付きの静脈内投与用液剤バッグまたはバイアルに入れられる。
【0069】
医薬組成物が配合されると、それを無菌バイアル内に液剤、懸濁液剤、ゲル剤、乳剤、固体、または脱水もしくは凍結乾燥した粉末として貯蔵できる。それらの配合物はそのまま使用できる剤形または投与前に再構成する必要がある剤形(たとえば凍結乾燥品)で貯蔵できる。
【0070】
特定の態様において、本発明は一回量投与単位を調製するためのキットに関する。これらのキットは、それぞれ乾燥タンパク質を入れた第1容器と水性配合物を入れた第2容器の両方を収容することができる。本発明の範囲には、単一チャンバーおよび多チャンバー型の充填済み注射器(たとえば液剤注射器および凍結乾燥製剤注射器(lyosyringe))を収容したキットも含まれる。
【0071】
療法に用いる医薬組成物の有効量は、たとえば療法の状況および目的に依存するであろう。したがって、処置に適切な投与量レベルが、一部は、送達される分子、前記のポリペプチドを用いる適応症、投与経路、ならびに患者の体格(体重、体表面積または臓器サイズ)および状態(年齢および全般的な健康状態)に応じて異なることは、当業者に認識されるであろう。したがって、最適な療法効果を得るために臨床医が投与量を判定し、投与経路を改変することができる。一般的な投与量は、前記に述べた要因に応じて約0.1mg/kgから約100mg/kgの範囲にまで及ぶことができる。ポリペプチド組成物は、好ましくは静脈内に注射または投与することができる。持効性の医薬組成物は、その配合物の半減期およびクリアランス速度に応じて3〜4日毎、毎週、または隔週に投与することができる。投与頻度は、用いる配合物中のポリペプチドの薬物動態パラメーターに依存するであろう。一般に、目的効果を達成する量に達するまで組成物を投与する。したがって、本発明組成物を一回量として、または多数回量として(同一または異なる濃度/用量で)経時的に、または連続注入として投与することができる。さらに適量の改良をルーティンに行なう。適量は適宜な用量−応答データの使用により確認できる。
【0072】
医薬組成物の投与経路は既知の方法に従う;たとえば経口;注射:静脈内、腹腔内、脳内(実質内)、脳室内、筋肉内、眼内、動脈内、門脈内、病変部内経路、骨髄内、クモ膜下、心室内、経皮、皮下、もしくは腹腔内による;および鼻腔内、腸内、局所、舌下、尿道、膣、もしくは直腸手段、持続放出系による、または埋込みデバイスによる。所望により、組成物をボーラス注射により、または連続的に注入により、または埋込みデバイスにより投与することができる。あるいは、またはさらに、目的分子を吸収または封入した膜、スポンジその他の適切な材料の埋込みにより、組成物を局所投与することができる。埋込みデバイスを用いる場合、デバイスをいずれか適切な組織または臓器に埋め込むことができ、目的分子の送達は拡散、定時放出ボーラス、または連続投与によるものであってもよい。
【0073】
ある場合には、本明細書に記載した方法で遺伝子工学的に処理した特定の細胞を移植してポリペプチドを発現および分泌させることにより、本発明のvActRIIBポリペプチドを送達することができる。そのような細胞は動物細胞またはヒト細胞であってもよく、オートロガス(autologous)、ヘテロロガス(heterologous)、または異種(xenogeneic)であってもよい。場合により、細胞は不死化していてもよい。免疫応答の機会を減らすために、細胞を封入して周囲組織の浸潤を避けることができる。封入材料は一般に、ポリペプチド生成物(1以上)の放出は可能であるけれども患者の免疫系または周囲組織からの他の有害因子による細胞破壊を阻止する生体適合性、半透性のポリマー系封入材または膜である。
【0074】
vActRIIBまたはvActRIIB誘導体をコードする核酸分子を対象に直接導入する、インビボでのvActRIIB遺伝子療法も想定される。たとえば、vActRIIBをコードする核酸配列を、適宜な送達ベクター、たとえばアデノ随伴ウイルスベクターを用いて、または用いずに、核酸構築体の局所注射により標的細胞に導入する。選択しうるウイルスベクターには、レトロウイルス、アデノウイルス、単純ヘルペス、ウイルスおよびパピローマウイルスベクターが含まれるが、これらに限定されない。このウイルスベクターの物理的トランスファーは、インビボで、目的とする核酸構築体、または目的とする核酸配列を含む他の適切な送達ベクターの局所注射、リポソーム仲介トランスファー、直接注射(裸のDNA)、または微粒子衝突(遺伝子銃)により達成できる。
【0075】
vActRIIB組成物の使用
本発明は、ミオスタチン、アクチビンA、またはGDF−11の量または活性を、これらのポリペプチドとvActRIIBポリペプチドの接触によりインビボおよびインビトロで減少または中和するための方法および医薬組成物を提供する。vActRIIBポリペプチドは、ミオスタチン、アクチビンA、およびGDF−11に対して高い親和性をもち、ミオスタチン、アクチビンA、およびGDF−11のうち少なくとも1つの生物活性を低下および阻害することができる。ある態様において、vActRIIBポリペプチドは野生型ActRIIBポリペプチドと比較して改良された活性を示す。これを後記の実施例において証明する。
【0076】
1観点において本発明は、有効量のvActRIIB組成物を対象に投与することにより、その処置を必要とする対象においてミオスタチン関連および/またはアクチビンA関連の障害を処置するための方法および薬剤を提供する。本明細書中で用いる用語“対象”は、いずれかの動物、たとえばヒトを含めた哺乳動物を表わす。
【0077】
本発明の組成物は、体重に対するパーセントとしての除脂肪筋量を増加させ、体重に対するパーセントとしての脂肪量を減少させるために用いられる。
【0078】
vActRIIB組成物により処置できる障害には、種々の形の筋消耗、ならびに代謝障害、たとえば糖尿病および関連障害、ならびに骨変性性疾患、たとえば骨粗鬆症が含まれるが、これらに限定されない。vActRIIB組成物は、後記の実施例3に示す種々の疾患モデルにおいて筋消耗性障害の処置に有効であることが証明された。これは、インヒビン−α−ノックアウトマウスの処置、大腸−26悪液質モデルにおける筋消耗の処置、後足懸垂モデルにおける筋萎縮の予防、OXY雌の処置において、除脂肪筋量の増加、脂肪量の減少および骨無機質含量の増加を示すことを証明した。
【0079】
筋消耗性障害には、ジストロフィー、たとえばデュシェンヌ型筋ジストロフィー、進行性筋ジストロフィー、ベッカー型筋ジストロフィー、デジェリーヌ−ランドジー型筋ジストロフィー、エルプ型筋ジストロフィー、および乳児神経軸索性筋ジストロフィーも含まれる。さらに他の筋消耗性障害は、慢性の疾患または障害、たとえば筋萎縮性側索硬化症、うっ血性閉塞性肺疾患、癌、エイズ、腎不全、臓器萎縮、アンドロゲン欠乏、およびリウマチ性関節炎から生じる。
【0080】
ミオスタチンおよび/またはアクチビンの過剰発現は、悪液質、重篤な筋および脂肪消耗症候群をもたらす可能性がある。動物モデルにおける悪液質の処置に際してのvActRIIBポリペプチドの有効性を後記の実施例3に示す。悪液質は、リウマチ性関節炎、糖尿病性腎障害、腎不全、化学療法、火傷による傷害、および他の原因によっても生じる。他の例において、ミオスタチン−免疫反応性タンパク質の血清濃度および筋内濃度がエイズ関連の筋消耗を示す雄において上昇することが見いだされ、これらは除脂肪体重と逆相関していた(Gonzalez-Cadavid et al., PNAS USA 95: 14938-14943 (1998))。ミオスタチン濃度は火傷傷害に応答して上昇し、その結果、筋異化作用が生じることも示された(Lang et al, FASEB J 15, 1807-1809 (2001))。筋消耗をもたらす他の状態は、能力障害による非活動、たとえば車椅子拘束、長期間の床上安静:卒中、疾病、脊髄損傷、骨折または外傷によるもの、および極微重力環境(宇宙飛行)における筋萎縮から生じる可能性がある。たとえば、血漿ミオスタチン免疫反応性タンパク質は、長期間の床上安静後に増加することが見いだされた(Zachwieja et al. J Gravit Physiol. 6(2): 11(1999)。スペースシャトル飛行中に極微重力環境に曝露されたラットの筋は曝露されなかったラットの筋と比較してミオスタチン量の増加を示すことも見いだされた(Lalani et al., J.Endocrin 167 (3): 417-28 (2000))。
【0081】
さらに、加齢に伴う脂肪−対−筋比の増大、および加齢性筋萎縮はミオスタチンに関連すると思われる。たとえば、平均血清ミオスタチン免疫反応性タンパク質は青年期(19〜35歳)、中年期(36〜75歳)、および高年期(76〜92歳)の男性および女性のグループにおいて年齢と共に増加し、一方、平均筋量および除脂肪体重はこれらのグループにおいて年齢と共に減少した(Yarasheski et al. J Nutr Aging 6(5):343-8 (2002))。さらに、ミオスタチンは心筋に低濃度で発現し、梗塞後の心筋細胞において発現がアップレギュレートされることが、現在認められている(Sharma et al., J Cell Physiol. 180 (1):1-9 (1999))。したがって、心筋においてミオスタチン濃度を低下させると梗塞後の心筋が回復する可能性がある。
【0082】
ミオスタチンは、2型糖尿病、非インスリン依存型糖尿病、高血糖症、および肥満症を含めた代謝障害にも影響を及ぼすと思われる。たとえば、ミオスタチン欠如が肥満症および糖尿病の表現型の2匹のマウスモデルを改善することが示された(Yen et al. FASEB J. 8:479 (1994)。米国特許出願no:11/590,962、米国特許出願公開No:2007/0117130に、AAV−ActRIIB5ベクターが、動物において、特に肥満症の動物モデルについて、筋−対−脂肪比を増大させることが証明されている。本発明のvActRIIBポリペプチド、たとえばSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95は、そのような用途に適切である。したがって、本発明の組成物を投与することにより脂肪組成を低下させると、動物において糖尿病、肥満症、および高血糖の状態が改善されるであろう。さらに、ActRIIBポリペプチドについて米国特許出願no:11/590,962、米国特許出願公開No:2007/0117130において証明されたように、vActRIIBポリペプチドを含有する組成物は肥満症の個体において食物摂取量を減少させることができる。
【0083】
本発明のActRIIBポリペプチドを投与すると、骨強度を改善し、骨粗鬆症および他の変性性骨疾患を軽減することができる。これは後記のOVXマウスモデルにおいて証明された。たとえばミオスタチン欠損マウスは、マウス上腕骨の無機質含量および密度の増大、ならびに骨梁骨および皮質骨の筋付着領域における無機質含量増大、ならびに筋量増加を示すことも見いだされた(Hamrick et al. Calcif Tissue Int 71(1):63-8 (2002))。さらに、本発明のvActRIIB組成物は、アンドロゲン欠乏、たとえば前立腺癌の処置に用いるアンドロゲン欠乏療法の影響を処置するために使用できる。
【0084】
本発明は、有効量のvActRIIBタンパク質を動物に投与することにより食用動物において筋量を増加させるための方法および組成物をも提供する。成熟C−末端ミオスタチンポリペプチドは試験したすべての種において同一であるので、vActRIIBポリペプチドは、ウシ、ニワトリ、シチメンチョウ、およびブタを含めた農業に重要ないかなる種においても、筋量を増加させ、脂肪を減少させるのに有効であると期待される。
【0085】
本発明のvActRIIBポリペプチドおよび組成物は、アクチビンAの活性にも拮抗する。アクチビンAは、特定のタイプの癌、特に生殖腺腫瘍、たとえば卵巣癌において発現し、重篤な悪液質を引き起こすことが知られている(Ciprano et al. Endocrinol 141 (7):2319-27 (2000), Shou et al., Endocrinol 138 (11):5000-5 (1997); Coerver et al, Mol Endocrinol 10(5):534-43 (1996); Ito et al. British J Cancer 82(8):1415-20 (2000), Lambert-Messerlian, et al, Gynecologic Oncology 74:93-7 (1999)。後記の実施例3において、本発明のvActRIIBポリペプチドは重篤な悪液質の処置、腫瘍サイズの縮小、および生存率の延長に有効であることがインヒビン−α−ノックアウトマウスモデルおよび大腸−26悪液質マウスモデルにおいて証明された。したがって、本明細書に開示する組成物を用いて、アクチビンAの過剰発現およびミオスタチンの発現に関連する状態、たとえば特定の癌により生じる悪液質を処置し、特定の生殖腺タイプの腫瘍を処置することができる。
【0086】
本明細書に開示する組成物は、単独で、または他の療法薬と組み合わせてそれらの療法効果を高めるかまたは潜在的な副作用を軽減するために、使用できる。これらの特性には、活性の増大、溶解度の増大、分解の減少、半減期の延長、毒性の低下、および免疫原性の低下が含まれる。したがって、本明細書に開示する組成物は長期間の処置計画に有用である。さらに、本発明化合物の親水性と疎水性の特性はバランスが良く、これによりインビトロおよび特にインビボの両方におけるそれらの有用性が高まる。具体的には、本明細書に開示する化合物は、体内での吸収および生物学的利用能を可能にする水性媒質中で適度な溶解度をもち、一方、化合物が細胞膜を越えて推定機能部位、たとえば特定の筋塊へ移行するのを可能にする脂質中でもある程度の溶解度をもつ。
【0087】
さらに、本発明のvActRIIBポリペプチドは多数のアッセイ法のいずれかにおいてミオスタチン、アクチビンA、またはGDF−11を検出および定量するのに有用である。一般に本発明のActRIIBポリペプチドは、多様なアッセイ法においてミオスタチン、アクチビンA、またはGDF−11を結合および固定化するための捕獲剤として有用である;たとえばAsai, ed., Methods in Cell Biology, 37, Antibodies in Cell Biology, Academic Press, Inc., ニューヨーク(1993)に記載のものと同様。これらのポリペプチドをある様式で標識することができ、あるいはミオスタチンを検出および定量できるように標識された第3の分子、たとえば抗体と反応させることができる。たとえば、ポリペプチドまたは第3の分子を検出可能な部分、たとえばビオチンで修飾し、次いでこれを第4の分子、たとえば酵素標識ストレプトアビジンまたは他のタンパク質により結合することができる(Akerstrom, J Immunol 135:2589 (1985); Chaubert, Mod Pathol 10:585 (1997))。
【実施例】
【0088】
本発明について記載したが、以下の実施例は説明のために提示され、限定のためのものではない。
【0089】
実施例1
vActRIIBポリペプチドの発現および精製
バリアントActRIIBポリペプチドの発現および精製のために下記の方法を用いた。
【0090】
ヒトアクチビンタイプIIB受容体のcDNAをヒト精巣由来のcDNAライブラリー(Clontech,Inc.)から単離し、米国特許出願no:11/590,962、米国特許出願公開No:2007/0117130の記載に従ってクローニングした。
【0091】
アミノ酸置換の決定
構造分析、分子モデリング、および質量分析を組み合わせた方法で、グリコシレーションされていないActRIIBポリペプチド間の静電相互作用および水素結合相互作用により誘発された分子間ジスルフィド結合形成によってActRIIBに凝集(オリゴマー形成)が生じる可能性のあることが指摘された。残基28および40はActRIIB:ActRIIB相互作用に関与し、ActRIIBとそれのリガンドとの相互作用には関与しないと判定された。
【0092】
まず、ActRIIB−Fc上のE28およびR40をそれぞれの位置においてAで置換した。光散乱および質量分析により、完全グリコシレーションされたvActRIIB−IgG1Fc E28A、およびvActRIIB−IgG1Fc R40Aの画分が野生型と比較して有意に増加したことが確認された。E28AおよびR40A vActRIIB−IgG1Fcを37℃で6日間インキュベートした結果、野生型と比較してほとんどまたは全く凝集が生じなかった。野生型ActRIIB(SEQ ID NO:2および18)の発現および精製に際して起きる可能性のある凝集を軽減または阻止するために、位置28および40(シグナル配列を含むSEQ ID NO:2および18に関して)におけるアミノ酸置換を行なった。この凝集は、発現中における構造化オリゴマー形成、ならびに発現中およびタンパク質精製後の両方における非構造化凝集体生成であることが確認されている。
【0093】
産生および精製プロセスの種々の段階での凝集を、下記の方法に従ってサイズ排除クロマトグラフィーにより測定した。
【0094】
以下に例示した方法を用いて、バリアントActRIIBポリペプチド(vActRIIBおよびvActRIIB5)を製造した。vActRIIB E28Wをコードするポリヌクレオチド(SEQ ID NO:23)を、ヒトIgG1 Fcドメインをコードするポリヌクレオチド(SEQ ID NO:82)またはヒトIgG2 Fcをコードするポリヌクレオチド(SEQ ID NO:84)に、ヒンジリンカー配列(SEQ ID NO:79をコードするヌクレオチド)を介して、E28Wを生じる変異を含むプライマーを用いるPCRオーバーラップ延長により融合させた。この全長ポリヌクレオチド配列はSEQ ID NO:61である。二本鎖DNAフラグメントを、pTT5(Biotechnology Research Institute, National Research Council Canada (NRCC), 6100 Avenue Royalmount, Montreal (Quebec) Canada H4P 2R2)、pDSRα(WO/9014363に記載)、および/またはpDSRαの誘導体中へサブクローニングした。他の態様においては、vActRIIBポリペプチドをコードするポリヌクレオチドを、リンカーGGGGS(SEQ ID NO:75)もしくはその多量体、および/またはヒンジリンカー(たとえばSEQ ID NO:79)をコードするポリヌクレオチドに付加した。
【0095】
操作したvActRIIB−FcおよびvActRIIB5−Fcの一過性発現を下記に従って実施した。
【0096】
前記2種類の分子の操作したバリアントを、無血清懸濁に適応させた293−6E細胞(National Research Council of Canada、カナダ国オタワ)において一過性発現させた;細胞は、250μg/mlのゲネチシン(geneticin)(Invitrogen)および0.1% Pluronic F68(Invitrogen)を補充したFreeStyle(商標)培地(Invitrogen Corporation、カリフォルニア州カールズバッド)中に維持された。トランスフェクションを1Lの培養として実施した。要約すると、細胞接種物を1.1´106細胞/mlになるまで4Lのフェルンバッハ振とうフラスコ(Corning,Inc.)内で増殖させた。この振とうフラスコ培養を、37℃および5% CO2に維持した加湿インキュベーターに入れたInnova 2150シェーカープラットフォーム(News Brunswick Scientific、ニュージャージー州エディソン)上、65RPMで維持した。トランスフェクションの時点で、293−6E細胞を1.0´106細胞/mlに希釈した。
【0097】
トランスフェクション複合体を100mlのFreeStyle培地中で形成した。1mgのプラスミドDNAをまず培地に添加し、続いて3mlのFuGene HDトランスフェクション試薬(Roche Applied Science、インディアナ州インディアナポリス)を添加した。このトランスフェクション複合体を室温で約15分間インキュベートし、次いで振とうフラスコ内の細胞に添加した。トランスフェクションの24時間後に、20%(w/v)のペプトンTN1(OrganoTechnie S.A.,TeknieScience、カナダ国ケベック)を最終濃度0.5%(w/v)に達するまで添加した。このトランスフェクション/発現を4〜7日間実施した後、コンディショニングした培地を4,000RPM、4℃で60分間の遠心分離により収穫した。
【0098】
安定トランスフェクションおよび発現を下記に従って実施した。vActRIIB−ヒト(hu)IgG2−Fc細胞系列は、標準エレクトロポレーション法により、安定なCHO宿主細胞に発現プラスミドpDC323−vActRIIB(E28W)−huIgG2 FcおよびpDC324−vActRIIB(E28W)−huIgG2 Fcをトランスフェクションすることによって作製された(Bianchi et al., Biotech and Bioengineering, 84(4):439-444 (2003)に従う)。宿主細胞系列に発現プラスミドをトランスフェクションした後、GHTを含まない無血清選択培地中で細胞を2〜3週間増殖させてプラスミドを選択し、細胞を回収した。細胞を85%以上の生存率に達するまで選択した。このトランスフェクションした細胞のプールを、次いで150nMのメトトレキセートを含有する培地中で培養した。
【0099】
細胞系列クローニング
下記の方法に従って、選択したクローンから細胞バンクを調製した。安定トランスフェクションした細胞の増殖プールを96−ウェルプレートに播種し、候補クローンを増殖および生産性能について小規模試験で評価した。約60個のバイアルのプレマスター細胞バンク(pre−master cell bank(PMCB))を、選択したクローンから調製した。すべてのPMCBを無菌性、マイコプラズマおよびウイルスについて試験した。
【0100】
vActRIIB−Fc発現細胞系列を一般的な供給−バッチ法(fed−batch process)により規模拡大した。細胞をWaveバイオリアクター(Wave Biotech LLC)に接種した。培養物にボーラス供給物を3回供給した。10Lを10日目に収穫し、残りを11日目に収穫した;両収穫物を深層濾過(depth filtration)し、続いて無菌濾過した。コンディショニングした培地を10インチの0.45/0.2ミクロンプレフィルターで濾過し、続いて6インチの0.2ミクロンフィルターで濾過した。
【0101】
タンパク質の精製
ActRIIB−Fc(IgG1およびIgG2の両方)、ActRIIB5−Fc (IgG1およびIgG2の両方)、およびこれらのバリアントを含有する約5Lのコンディショニングした培地を、5ft2の10Kメンブレン接線流フィルター(Pall)で濃縮した。濃縮された材料を、PBS(Dulbecco;塩化マグネシウムまたは塩化カルシウムを含まないもの)で平衡化した5mLのProtein A High Performance Column(商標)(GE Healthcare)にアプライした。カラムを280nmにおける吸光度(OD280)が0.1未満になるまでこの平衡化用緩衝液で洗浄した後、結合しているタンパク質を0.1Mグリシン−HCl、pH2.7で溶離し、直ちに1Mトリス−HCl、pH8.5で中和した。中和した溶出プールを1mlの体積に濃縮し、PBS(Dulbecco;塩化マグネシウムまたは塩化カルシウムを含まないもの)中で平衡化した320mlのSephacryl−200カラム(GE Healthcare)にアプライした。4〜20% SDS PAGEゲル(Invitrogen)に流して、プールすべき画分を判定した。これらのポリペプチドを活性および凝集度について下記に従って試験した。
【0102】
場合により、たとえばShp−Sepharoseカラムを用いてポリペプチドをさらに精製することができる。OD280により濃度を測定した。
【0103】
実施例2
インビトロ活性アッセイ
前記に従って精製したvActRIIBポリペプチドの試料をリン酸緩衝化生理食塩水(PBS:2.67mMの塩化カリウム、138mMの塩化ナトリウム、1.47mMの一塩基性リン酸カリウム、8.1mMの二塩基性リン酸ナトリウム、pH7.4)で0.2mg/mlに希釈し、37℃で6日間インキュベートし、次いでMALDI−MS(matrix-assisted laser desorption/ionization mass spectrometry、マトリックス支援レーザー脱離/イオン化質量分析)、SECおよび/またはSEC−LS分析を行なった。下記に従って、プロテインA精製工程後の野生型およびバリアントポリペプチドの凝集をSECまたはSEC−LSにより判定し、これらの分子の分子量をMALDI−MS法により確認した。
【0104】
サイズ排除クロマトグラフィー(SEC).2本のカラム(TOSOHAAS G3000swxl、7.8x300mm)を縦列に備えたAgilent 1100 HPLCシステムで実験を行なった。2xPBSを移動相として0.5ml/分で用いた。
【0105】
サイズ排除クロマトグラフィー−光散乱(SEC−LS).Superdex−200ゲル濾過カラム(Amersham Pharmacia、ウィスコンシン州ウォーキショー)を備えたAgilent 1100 HPLCシステムで実験を行なった。次いで試料をWyatt miniDawn LSレーザー光散乱検出器およびWyatt Optilab DSP屈折計(Wyatt Technology Co.、カリフォルニア州サンタバーバラ)に導通して分子質量を測定した。PBSを移動相として0.4ml/分で用いた。
【0106】
マトリックス支援レーザー脱離/イオン化質量分析.試料をシナピン酸(sinapinic acid)と混合し(1:1)、MALDI−MS(Applied Biosystems Voyager System 2009)に付与した。この方法を用いて前記分子の分子量を確認した。
【0107】
下記に従ってアクチビンおよびミオスタチンに対する結合親和性を測定し、IC50値を求めた。
【0108】
定量BIAcore(登録商標)アッセイ.IgG1 Fcとの融合体において、前記に従ってE28およびR40をそれぞれ他の天然アミノ酸で置換した。これらは後記の表に示すようにリンカーを用いて、または用いずに作製された。コンディショニングした培地からそれぞれのvActRIIB−IgG1Fc試料を、ヤギ抗ヒトIgG1 Fc抗体(Jackson Immuno Research,cat# 109−005−098,lot 63550)コーティングしたCM5表面に捕獲した。20nMのアクチビンAを、BIACore2000(BIACore Life Sciences、ニュージャージー州ピスカッタウェイ)により捕獲試料の表面に注入した。得られたセンサーグラムを、捕獲されたvActRIIB−IgG1FcバリアントのRL(500RU)に対して正規化した。若干のバリアントについての正規化した結合応答(RU)を表2に示し、以下にさらに記載する。アクチビンに対する相対親和性を、哺乳動物細胞の発現から得られたコンディショニングした培地を用いてBiacore測定により同様に判定した。アクチビンA(20nM)を用いて、コンディショニングした培地中の可溶性受容体ポリペプチドを捕獲し、測定したSPR信号を正規化した。正規化したSPR +++++:>60,++++:40〜60,+++:20〜40,++:10〜20,+:5〜10,−:<5。
【0109】
表1Aおよび表1Bに、相対結合データの結果をまとめる。下記の表は、特定の態様のvActRIIB−IgG1Fcが特に、野生型より高い親和性でアクチビンAに結合し、あるいは野生型に匹敵する親和性を保持したことを示す。
【0110】
【表1A】

【0111】
【表1B】

【0112】
C2C12細胞ベースの活性アッセイ
vActRIIB5−IgG1FcおよびvActRIIB−IgG1Fcバリアントを前記に従って製造した。これらのバリアントがアクチビンIIB受容体へのアクチビンAまたはミオスタチンの結合を阻害する能力を、下記に従って細胞ベースの活性アッセイにより試験した。
【0113】
ミオスタチン/アクチビン/GDF−11応答性レポーター細胞系列は、C2C12筋芽細胞(ATCC No:CRL−1772)にpMARE−luc構築体をトランスフェクションすることにより作製した。pMARE−luc構築体は、ミオスタチン/アクチビン応答エレメントであるCAGA配列(Dennler et al. EMBO 17: 3091-3100 (1998))の12反復配列をpLuc−MCSレポーターベクター(Stratagene cat #219087)のTATAボックスの上流にクローニングすることにより作製される。C2C12細胞は、アクチビン受容体IIBをそれらの細胞表面に自然発現する。ミオスタチン/アクチビンA/GDF−11が細胞の受容体を結合すると、Smad経路が活性化され、リン酸化されたSmadが前記の応答エレメントに結合し(Macias-Silva et al. Cell 87:1215 (1996))、その結果ルシフェラーゼ遺伝子が発現する。次いでルシフェラーゼ活性を市販のルシフェラーゼレポーターアッセイキット(cat # E4550、Promega、ウィスコンシン州マディソン)により製造業者のプロトコルに従って測定した。pMARE−lucでトランスフェクションした安定な系列のC2C12細胞(C2C12/pMARE)を用い、下記の方法に従って活性を測定した。レポーター細胞を96ウェル培養器に播種した。野生型および前記に従って構築したバリアントActRIIB−IgG1 Fc融合体の希釈液を用いたスクリーニングを、4nMアクチビンに固定した濃度で実施した。アクチビンAを数種類の濃度の受容体と共にプレインキュベートした。処理した培養物中のルシフェラーゼ活性を判定することによりアクチビン活性を測定した。各ポリペプチドについてIC50値を判定した。これらを表2に示す。ミオスタチンの測定のために、前記に従って製造したActRIIB−huIgG2 Fc融合体について同じ操作を行なった。プロテインA精製した野生型およびバリアントを、ミオスタチンについて同じ方法によるIC50値の判定に用いた。この測定のために、ポリペプチドを4nMミオスタチンと共にプレインキュベートした。さらに、前記の方法を用いて凝集度を測定した。これらの値を下記の表3に示す。
【0114】
表1Aに挙げた一組のActRIIB5−IgG1 Fcバリアントのうち数種類のActRIIB−IgG1 Fcバリアントおよび3種類のActRIIB5−IgG1 Fcバリアントを野生型ポリペプチドと共にさらに精製し、SPR(表面プラズモン共鳴)により20nMのアクチビンAにおいて分析した。表2は、アクチビンに対する選択したvActRIIB−IgG1 FcポリペプチドのSPR結合親和性を示す。アクチビンA(20nM)を用いて試料中のvActRIIBポリペプチドを捕獲し、測定したSPR信号を正規化した。前記の細胞ベースのアクチビン阻害アッセイからIC50値を求めた。標準誤差はすべての結果について10%未満であった。
【0115】
【表2】

【0116】
上記の表2に前記で示したように、野生型と比較して、アクチビン遮断に対するvActRIIB−IgG1Fc(E28W)のIC50値は2.07nMであり、vActRIIB−IgG1Fc(E28Y)のIC50値は2.1nMであった。さらに、vActRIIB−IgG1FcのE28WおよびE28Yバリアントはいったん精製すると安定であり、凝集しなかった。
【0117】
他のバリアントポリペプチドについても細胞ベースのミオスタチン遮断アッセイにおいてIC50値を判定した。これらのバリアントは、シグナル配列およびN−末端の最初の6個のアミノ酸を欠如するトランケートした成熟vActRIIBポリペプチドであった。これらの配列を表3に示す。表3は、プロテインA精製後のタンパク質の凝集率、およびミオスタチンに対するIC50値を示す。凝集率は野生型と比較してバリアントポリペプチドの方がはるかに低いことが分かる。シグナル配列およびN−末端の4個のアミノ酸を含まず、下記に示すものと同一の置換をもつトランケートした成熟vActRIIBポリペプチドについても、同様な結果が得られた。
【0118】
表3
【0119】
【表3−1】

【0120】
【表3−2】

【0121】
表4は、配列表のSEQ ID NO:1〜99に対応する配列を確認する。
【0122】
【表4−1】

【0123】
【表4−2】

【0124】
【表4−3】

【0125】
【表4−4】

【0126】
実施例3
vActRIIBを用いたインビボ処置
下記の動物実験はすべて、トランケートした成熟vActRIIB−IgG2 Fc(E28W)ポリペプチド(SEQ ID NO:91)を用い、下記の方法に従って実施された。
【0127】
インヒビン−α−欠損マウスにおける筋消耗の処置
インヒビン−αは自然界に存在するアクチビンA阻害物質である。インヒビン−αを欠如するマウスは、有意に上昇した循環中アクチビンA濃度を示し、腫瘍、たとえば卵巣癌、精巣癌および副腎癌の自然形成に関連する致命的な消耗症候群を伴う(Matzuk et al., PNAS 91(19):8817-21 (1994), Cipriano et al. Endocrinology 121(7): 2319-27(2000), Matzuk et al., Nature 360(6402):313-9 (1992))。下記の実験のために、インヒビン-αノックアウトマウス(C57BL/6J)をCharles River Laboratoriesから入手した。vActRIIB−IgG2 Fc E28W(SEQ ID NO:91)(以下、E28W、またはE28Wポリペプチド、または可溶性受容体E28W)が体重および筋量に及ぼす影響を、インヒビン−αノックアウトマウスにおいて調べた。8週齢の雄のインヒビン−αノックアウトマウスにおける14日間の一回注射試験を実施した。8週齢の時点で、雄のインヒビン−αノックアウトマウスは同齢の野生型同腹仔対照マウスと比較して体重が25%以上減少していた。5匹のノックアウトマウスに一回のE28W(30mg/kg)皮下注射を行ない、一方、5匹のノックアウトマウスに等体積のPBS(ビヒクル)を0日目に皮下投与した。ベースライン対照として、5匹の同齢の野生型マウスに0日目にビヒクルの一回皮下注射を行なった。マウスを0、7および14日目に秤量した。14日目の終了時にすべての動物を屠殺し、それらの除脂肪屠殺体重および腓筋量を剖検により分析した。14日間の試験期間にわたって、ビヒクル処置したノックアウトマウスの体重は0日目の22.5gから14日目の21.4gまで約1.1g減少した。これに対し、E28W処置したノックアウトマウスの平均体重は、0日目の22.1gから14日目の33.1gまで11gの劇的な増加を示した。最終剖検分析により、下記に示すようにインヒビン−αノックアウトマウスにおいてE28Wポリペプチドは除脂肪屠殺体重および腓筋量を実質的に倍増させることが明らかになった。E28W処置したノックアウトマウスの平均除脂肪屠殺体重は、約14.9gであった;ビヒクル処置したノックアウトマウスについての約8.0g、およびビヒクル処置した野生型マウスについての約12.1gと比較。E28W処置したノックアウトマウスの腓筋重量(両足からのもの)は、約426mgであった;ビヒクル処置したノックアウトマウスについての約209mg、およびビヒクル処置した野生型マウスについての約324mgと比較。これらの結果は、体重減少および筋消耗の疾病状態の処置に対するE28Wポリペプチドの有効性を示し、それらを下記の表にまとめる。
【0128】
【表5】

【0129】
*:野生型+ビヒクルと比較してP<0.05;#:ノックアウト+ビヒクルと比較してP<0.05。
【0130】
E28Wポリペプチドの投与が精巣および卵巣の腫瘍の形成率に及ぼす影響を、それぞれ雄および雌のインヒビン−αノックアウトマウスにおいて試験した。この試験では、8週齢の雄(n=5)および9週齢の雌(n=6)を含む11匹のインヒビン−αノックアウトマウスを一回のE28W(30mg/kg)皮下注射により処置し、一方、同齢の雄(n=5)および雌(n=6)を含む他の11匹のインヒビン−αノックアウトマウスに等体積のPBS(ビヒクル)を一回注射した。さらに、同齢の雄(n=5)および雌(n=6)を含む11匹の野生型同腹仔対照マウスに一回のビヒクル注射を行なった。処置の2週間後、マウスを屠殺し、剖検して、目視確認可能な精巣および卵巣の腫瘍の形成率を調べた。ビヒクル処置したノックアウトマウス11匹中の10匹が確認可能な腫瘍を発症したことが観察された。具体的には、精巣および卵巣の腫瘍形成が、試験した5匹中5匹の雄、および6匹中5匹の雌にそれぞれ見られた。これらの腫瘍のサイズは対応する野生型対照マウスの正常な精巣または卵巣より2〜3倍大きいことが認められた。これを図3に示す。E28W処置したインヒビン−αノックアウトマウスのうちわずか10%(11匹中の1匹)が目視確認可能な腫瘍形成を示した。具体的には、雌の場合はE28W処置したノックアウトマウス6匹中の1匹が確認可能な卵巣腫瘍を発症し、一方、処置しなかった6匹中5匹のノックアウト雌は同齢の野生型対照と比較して卵巣のサイズまたは目視形態にほとんどまたは全く変化がなかった。E28W処置した雄のノックアウトマウス5匹中5匹が目視可能な腫瘍を示さず、同齢の野生型対照と比較して精巣のサイズまたは目視形態にほとんどまたは全く変化がなかった。これらの結果は、E28W投与がインヒビン−αノックアウトマウスにおいて精巣および卵巣の腫瘍形成を減少させるのに有効であったことを証明し、癌療法における可溶性受容体療法の臨床有用性を示唆する。
【0131】
食欲低下症の処置におけるE28Wポリペプチドの有効性を雄のインヒビン−αノックアウトマウスにおいて調べた。この試験で、インヒビン−αノックアウトマウス(n=5)における飼料消費量は、同齢の野生型マウス(n=10)と比較して有意に減少した。E28W処置したインヒビン−αノックアウトマウスの飼料摂取量は、3週間の試験期間中に有意に増加することが観察された。E28W処置したノックアウトマウスにおける1週間の平均飼料摂取量は同齢の野生型対照マウスのものよりわずかに高いレベルまで増加し、ビヒクルで処置したノックアウトの1週間の平均飼料摂取量より約50%多かった。したがって、このデータはE28W処置がインヒビン−αノックアウトマウスにおいて食欲低下症の改善にきわめて有効であったことを示す。
【0132】
E28W処置が生存率に及ぼす影響を、それぞれ雄および雌のインヒビン−αノックアウトマウスにおいて調べた。雄については約50日齢のインヒビン−αノックアウトマウス25匹にE28Wポリペプチドを投与し(10mg/kg/週、皮下)、一方、同齢のインヒビン−αノックアウト雄マウス26匹にビヒクル(PBS)を投与した。同齢の野生型雄マウス19匹にビヒクルを投与し、ベースライン対照として用いた。ビヒクル処置したノックアウトマウスは試験の15日目(約65日齢)に死亡し始めた。実験の34日目(約84日齢)までに、ビヒクル処置したノックアウトマウスの50%が死亡し、78日目(約128日齢)までに、それらの100%が死亡した。これに対し、E28Wポリペプチドで処置した25匹のノックアウトマウス、またはビヒクル処置した19匹の野生型対照マウスは、試験の78日目(約128日齢)以前には全く死亡しなかった。E28W処置したノックアウトマウスにおいては、25匹中の1匹が試験の78日目(約128日齢)に死亡し、25匹中の24匹が100日目(約150日齢)を超えて生存した。ビヒクル処置した野生型対照マウスは100日の試験期間中、死亡しなかった。雌のインヒビン−αノックアウトマウスにおいても同様な生存結果が得られた。約50日齢の雌のインヒビン−αノックアウトマウス22匹をE28Wで処置し(10mg/kg/週、皮下)、一方、同齢の雌のインヒビン−αノックアウトマウス23匹をPBS(ビヒクル)で処置した。その間に17匹の野生型雌対照マウスをビヒクルで処置した。ビヒクル処置した雌のノックアウトマウスは試験の40日目(約90日齢)に死亡し始めた。実験の58日目(約108日齢)までに、ビヒクル処置した雌のノックアウトマウスの50%が死亡し、86日目(約136日齢)までに、それらの100%が死亡した。これに対し、E28W処置した雌のノックアウトマウスの約5%(22匹中の1匹)が死亡したにすぎず、一方、約90%(22匹中の20匹)が試験の120日目(約170日齢)を超えて生存した。ビヒクル処置した野生型対照マウスは120日の試験期間中、死亡しなかった。したがって、このデータはE28Wポリペプチド療法が雄および雌両方のインヒビン−αノックアウトマウスの生存を劇的に延長するのに有効であることを証明する。雄および雌両方のインヒビン−αノックアウトマウスについての模式的な生存率曲線のプロットを図4に示す。
【0133】
大腸−26腫瘍を保有するマウスにおける筋消耗の処置
大腸−26腫瘍を保有するマウスは、癌性悪液質の研究のための前臨床動物モデルとして広く用いられている(Fujita et al., Int J Cancer 68(5):637-43 (1996), Kwak et al., Cancer Research 64(22):8193-8 (2004))。E28Wポリペプチドが体重変化、筋量および生存率に及ぼす影響を、この腫瘍保有マウスにおいて調べた。大腸−26(C−26)腫瘍細胞を10週齢の雄CDF1マウス40匹にマウス当たり0.5x106細胞で皮下移植した。腫瘍の移植を0日目に実施した。腫瘍移植後5日目に開始して、20匹のC−26マウスを10mg/kgのvActRIIB IgG2 Fc E28W(SEQ ID NO:91)の皮下注射により毎週処置し、一方、20匹のC−26マウスをビヒクル(PBS)で処置した。同時に10匹の同齢および同体重の正常マウスをビヒクル(PBS)のみで処置した。体重および飼料摂取量を週3回測定した。腫瘍保有マウスを生存について1日2回検査した。腫瘍サイズを、PCコンピューターに接続したカリパス(Ultra−Cal IV IP65電気カリパス、Fred V Fowler Co.、マサチュセッツ州ボストン)で測定し、数値をMicrosoft Excelデータファイルのワークシートに自動的に記録した。図5に示すように、腫瘍移植の2週間後に、C−26腫瘍を保有するマウスは重篤な悪液質を発症し、それらの体重が劇的に減少した。E28W処置は、腫瘍保有マウスにおいて体重減少を効果的に軽減した。E28Wで処置した腫瘍保有マウスの平均体重は、ビヒクルで処置した腫瘍保有マウスのものより有意に高かった(p<0.001、腫瘍移植後7日目から33日目まで、不対T検定、Graph pad Software Inc.、カリフォルニア州サンディエゴ)。
【0134】
E28Wポリペプチド処置グループとビヒクル処置グループの間に腫瘍サイズの変化はなく、これはこの処置がC−26腫瘍の増殖に対しては影響をもたなかったことを示唆する。最終剖検分析は、E28W処置したC−26腫瘍保有マウスの平均除脂肪屠殺体重および腓筋重量がビヒクルで処置した腫瘍保有マウスのものより有意に高いことを示した(p<0.001、除脂肪屠殺体重および腓筋重量の両方について)。E28WがC−26腫瘍保有マウスの生存率に及ぼす影響を図6に示す。ビヒクル処置マウスは、腫瘍移植後、約14日目に死亡し始めた。腫瘍移植後35日目に、ビヒクル処置したC−26腫瘍保有マウス20匹すべてが死亡した;しかし、E28Wで処置したC−26腫瘍保有マウス20匹中の17匹がなお生存していた。したがって、E28W処置はC−26腫瘍保有マウスの有意の生存延長をもたらした(p<0.0001、カイ二乗検定)。したがって、E28Wポリペプチドは、C−26腫瘍保有マウスの体重および筋量の維持だけでなく、生存延長にも有効であった。
【0135】
後足懸垂マウスの処置
後足懸垂マウスモデルを用いて、vActRIIB−IgG2 Fc E28W(SEQ ID NO:91)が非活動状態の筋量に及ぼす影響を調べた。後足懸垂法は、先にCarlson CJ el al(Carlson CJ, Booth FW and Gordon SE: Am J Physiol Regul Integr Comp Physiol. 277: R601-RR606, 1999)が報告したものと本質的に同じである。9週齢の雌C57BL/6マウスを試験に用いた。合計60匹のマウスを下記に従って3グループに分けた:1.懸垂しないベースライン対照グループ(20匹)をビヒクル(PBS)で処置したもの、2.後足懸垂グループ(20匹)をビヒクルで処置したもの、および3.後足懸垂マウスグループ(20匹)をvActRIIB−IgG2 Fc,E28Wで処置したもの。具体的には、30mg/kgのvActRIIB−IgG2 Fc E28Wまたはビヒクルの一回皮下注射を、前記のグループそれぞれに後足懸垂の開始時点で行なった。長期間にわたり体重変化を週2〜3回測定した。各グループから5匹のマウスを下記の4つの異なる時点で屠殺した:1日目、3日目、7日目、および14日目。腓筋重量を剖検により測定した。
【0136】
下記の表に示すように、後足懸垂により最高10%の有意の体重減少が生じた。ANOVAにより分析したところ、後足懸垂マウスをvActRIIB−IgG2 Fc E28Wで処置すると、ビヒクル処置した後足懸垂グループまたは懸垂しなかったベースライン対照グループより高いレベルにまで有意の体重増加が生じた。2週間の試験期間中、vActRIIB−IgG2 Fc E28W(SEQ ID NO:91)処置グループの平均体重増加は12.6%であった;それぞれ、ビヒクル処置した懸垂グループの0.2%減少、および懸垂しなかったベースライン対照グループの4.8%増加と比較。時間経過剖検結果は、後足の筋量が体重と平行して変化することを示した。懸垂マウスをvActRIIB−IgG2 Fc(E28W)で処置すると、筋損失は完全に軽減した。したがって、この実験の結果はE28Wが非活動に関連する筋萎縮の処置に有効であることを示す。
【0137】
【表6】

【0138】
OVXマウスの処置
卵巣摘除した雌C57Bl6マウス(OVX)は、雌の生殖腺機能低下症および骨粗鬆症のモデルであるとみなされる。24匹の雌C57Bl6マウスを3カ月齢で卵巣摘除し、3カ月間回復させた。6カ月齢で24匹のOVXマウスおよび24匹の同齢の擬似手術した対照C57Bl6マウスを、体重、筋量および脂肪量(NMRにより)、ならびに骨量(PIXImus-GE LUNAR Corporation)の長期間にわたる変化について3カ月間の処置期間にわたって測定した。この期間の終了時に動物を屠殺し、最終剖検に際して骨組織を採集し、Faxitron X線分析およびmicroCT分析(Faxitron X−ray CorporationおよびGE Medical system)を行なった。E28Wバリアント受容体(SEQ ID NO:91)は体重、具体的には除脂肪筋量および骨量を増加させ、一方ではマウスの脂肪含量を卵巣摘除していないマウスにみられるレベルまで低下させるのに有効であることが証明された。具体的には、12週間にわたって、除脂肪筋量はE28Wで処置したOVXマウスについて20gから27.0gまで増加した;E28Wで処置した擬似手術マウスについての20gから27.5gまでと比較、OVX+ビヒクルまたは擬似手術+ビヒクルについて除脂肪筋量がほとんど増加しなかった(OVX+ビヒクルについては約19g、野生型+ビヒクルについては約20g)のと比較。同じ試験において、E28Wで処置したOVXマウスは、12週間の試験の終了時までに動物当たり8g平均から動物当たり4g平均までの脂肪量減少を示した;これは擬似手術した動物に匹敵する。これに対し、ビヒクルで処置したOVXマウスは、試験期間中のいずれの時点でも脂肪量が減少しなかった。最後に、骨量は、E28Wで処置したOVXマウスにおいてビヒクル処置したOVXマウスと比較して増加した。最終剖検に際して採集した大腿骨/脛骨のBMC(骨無機質含量)分析をpQCT分析(Peripheral Quantitative Computed Tomography、末梢定量コンピュータ断層撮影)により行なった。E28Wで処置したOVXマウスは、約0.045g/cmのBMCが12週間の試験の終了時に約0.055g/cmに増加した;これは擬似手術したビヒクル処置動物の最終BMCに匹敵する。ビヒクルで処置したOVXマウスは、12週間の試験の終了時にほぼ同じ約0.045g/cmのBMCを示した。E28W処置した野生型マウスは、12週間の試験の終了時に0.054g/cmから約0.065g/cmまでのBMC増加を示した。これらの試験は、加齢における虚弱質、骨粗鬆症、および肥満症の有望な処置としてのE28Wポリペプチドの有効性を証明する。
【0139】
本発明は本明細書に記載する具体例による範囲に限定されない;これらは本発明の個々の観点の一例としてのものにすぎず、機能的に均等な方法および構成要素は本発明の範囲に含まれる。実際に、以上の記載および添付の図面から、本明細書に提示および記載したもののほか、本発明の種々の態様が当業者に自明であろう。そのような態様は特許請求の範囲に含まれるものとする。
【技術分野】
【0001】
関連出願の引照
本出願は、米国仮特許出願番号61/065,474、2008年2月11日出願、および米国仮特許出願番号60/905,459、2007年3月6日出願に基づく優先権を主張し、それらの開示内容に依存し、それらを本明細書に援用する。
【0002】
発明の技術分野
本発明の技術分野は、トランスフォーミング増殖因子−β(TGF−β)ファミリーのメンバーおよび可溶性TGF−βの受容体、ならびに種々の障害の処置のためにTGF−βファミリーのメンバーの活性を調節する方法に関する。
【背景技術】
【0003】
トランスフォーミング増殖因子−β(TGF−β)ファミリーのタンパク質には、トランスフォーミング増殖因子−β(TGF−β)、アクチビン、骨形態形成タンパク質(BMP)、神経増殖因子(NGF)、脳由来神経栄養因子(BDNF)、および増殖/分化因子(GDF)が含まれる。これらのファミリーメンバーは、細胞の増殖、分化、および他の機能を含めた広範な生物学的プロセスの調節に関与する。
【0004】
ミオスタチンとも呼ばれる増殖/分化因子8(GDF−8)は、大部分が発育中および成体の骨格筋組織の細胞に発現するTGF−βファミリーのメンバーである。ミオスタチンは骨格筋の増殖の負の制御において本質的な役割を果たすと思われる(McPherron et al., Nature (London) 387, 83-90 (1997))。ミオスタチンに対する拮抗は動物の除脂肪筋量(lean muscle mass)を増加させることが示された(McFerron et al., 前掲, Zimmers et al., Science 296:1486 (2002))。
【0005】
TGF−βファミリーのタンパク質の他のメンバーは、関連の増殖/分化因子GDF−11である。GDF−11はミオスタチンのアミノ酸配列の約90%の同一性をもつ。GDF−11は発育中の動物の中軸パターン形成において役割をもち(Oh et al, Genes Dev 11:1812-26 (1997))、骨格筋の発育および増殖においても役割を果たすと思われる。
【0006】
アクチビンA、BおよびABは、2つのポリペプチド鎖βAおよびβBのそれぞれホモ二量体およびヘテロ二量体である(Vale et al. Nature 321, 776-779 (1986), Ling et al., Nature 321, 779-782 (1986))。アクチビンは最初は卵胞刺激ホルモン合成の調節に関与する生殖腺ペプチドとして発見され、現在では多数の生物活性の調節に関与すると考えられている。アクチビンAが主要な形態のアクチビンである。
【0007】
アクチビン、ミオスタチン、GDF−11、および他のTGF−βスーパーファミリーのメンバーは、アクチビンII型とアクチビンIIB型の組合わせ受容体を結合し、これによりシグナル伝達する;これらは両方とも膜貫通セリン/トレオニンキナーゼである(Harrison et al., J. Biol. Chem. 279, 28036-28044 (2004))。架橋試験により、ミオスタチンはアクチビンII型受容体ActRIIAおよびActRIIBをインビトロで結合しうると判定された(Lee et al., PNAS USA 98:9306-11 (2001))。GDF−11がActRIIAおよびActRIIBの両方に結合するという証拠もある(Oh et al., Genes Dev 16:2749-54 (2002))。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】McPherron et al., Nature (London) 387, 83-90 (1997)
【非特許文献2】Zimmers et al., Science 296:1486 (2002)
【非特許文献3】Oh et al, Genes Dev 11:1812-26 (1997)
【非特許文献4】Vale et al. Nature 321, 776-779 (1986)
【非特許文献5】Ling et al., Nature 321, 779-782 (1986)
【非特許文献6】Harrison et al., J. Biol. Chem. 279, 28036-28044 (2004)
【非特許文献7】Lee et al., PNAS USA 98:9306-11 (2001)
【非特許文献8】Oh et al., Genes Dev 16:2749-54 (2002)
【発明の概要】
【発明が解決しようとする課題】
【0009】
TGF−βタンパク質の発現は多様な疾患および障害と関連することが知られている。したがって、幾つかのTGF−βタンパク質に同時に拮抗しうる療法用分子は、これらの疾患および障害に特に有効な可能性がある。
【0010】
さらに、タンパク質療法薬の製造はタンパク質の発現および精製に際して起きる問題によって複雑となる可能性がある。ひとつの問題は、発現または精製に際してのタンパク質の凝集である。細胞培養状態で高濃度のタンパク質が蓄積すると、凝集が生じる可能性がある。精製過程でタンパク質がいっそうの凝集を促進する追加要因に曝露される可能性がある(Cromwell, M.E.M. et al., The AAPS Journal 8:E572-E579, 2006)。凝集を引き起こす要因を軽減する試みを行なうことはできるが、凝集を生じる傾向が低くなるようにタンパク質を設計することが求められる。本発明は、TGF−β関連の疾病状態を処置するのに有用なタンパク質を効率的に製造するために、療法用分子に対する、多数のリガンドに結合し、かつ凝集が少なく、したがって改良された製造適性をもつという要望を満たす。
【課題を課題するための手段】
【0011】
本発明は、バリアントヒトアクチビン受容体IIB(vActRIIBと表示する)ポリペプチドを含む単離されたタンパク質を提供する。本明細書中で用いる用語vActRIIBポリペプチドは、ヒトvActRIIBポリペプチドおよびヒトvActRIIB5ポリペプチドの両方を表わす。1態様において、タンパク質はSEQ ID NO:2または18の位置E28もしくはR40のいずれかまたは位置E28およびR40の両方のアミノ酸が他の非−自然(non−native)アミノ酸で置換されたアミノ酸配列をもつポリペプチドを含み、このポリペプチドはミオスタチン、アクチビンA、またはGDF−11を結合することができる。1態様において、タンパク質はSEQ ID NO:2または18の位置E28もしくはR40のいずれかまたは位置E28およびR40の両方のアミノ酸が非−自然アミノ酸で置換され、かつシグナルペプチドが除去されたアミノ酸配列をもつポリペプチドを含み、このポリペプチドはミオスタチン、アクチビンA、またはGDF−11を結合することができる。1態様において、タンパク質はSEQ ID NO:2または18の位置E28もしくはR40のいずれかまたは位置E28およびR40の両方のアミノ酸が別のアミノ酸で置換され、シグナルペプチドが除去され、かつ成熟ポリペプチドのN−末端がトランケートしたアミノ酸配列をもつポリペプチドを含み、このポリペプチドはミオスタチン、アクチビンA、またはGDF−11を結合することができる。1態様において、N−末端トランケートした成熟vActRIIBポリペプチドは成熟配列のN−末端の4個のアミノ酸またはN−末端の6個のアミノ酸を欠如し、このポリペプチドはミオスタチン、アクチビンA、またはGDF−11を結合することができる。1態様において、位置E28における置換はW、YおよびAからなる群から選択される。他の態様において、位置E28における置換はA、F、Q、V、I、L、M、K、H、WおよびYからなるアミノ酸の群から選択される。他の態様において、位置R40における置換はG、Q、M、H、KおよびNからなるアミノ酸の群から選択される。他の態様において、位置E28における置換はA、F、Q、V、I、L、M、K、H、WおよびYからなるアミノ酸の群から選択され、かつ位置R40における置換はA、G、Q、M、H、KおよびNからなるアミノ酸の群から選択される。他の態様において、このポリペプチドはさらにヘテロロガスタンパク質を含む。1態様において、ヘテロロガスタンパク質はFcドメインである。他の態様において、FcドメインはヒトIgG Fcドメインである。
【0012】
1態様において、タンパク質はSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、70、72、87、88、91、93、95、および97に示すアミノ酸配列をもつポリペプチドを含む。
【0013】
他の態様において、タンパク質はSEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、67、69、71、92、94、96に示す配列またはその相補配列をもつポリヌクレオチドによりコードされるポリペプチドを含む。
【0014】
他の観点において、本発明はvActRIIBポリペプチドをコードするポリヌクレオチドを含む単離された核酸分子を提供する。1態様において、核酸分子はSEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、69、71、92、94、96に示す核酸配列またはその相補配列をもつポリヌクレオチドを含む。
【0015】
他の態様において、核酸分子はSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97からなる群に示すアミノ酸配列からなるポリペプチドをコードするポリヌクレオチドを含む。他の態様において、核酸分子はさらに転写または翻訳調節配列を含む。他の観点においては、vActRIIB核酸分子を含む組換えベクターが提供される。他の観点においては、この組換えベクターを含む宿主細胞が提供され、vActRIIBポリペプチドを製造する方法が提供される。
【0016】
本発明はさらに、少なくとも1種類の本発明のvActRIIBポリペプチドまたはタンパク質を含有する組成物を提供する。1態様において、組成物はvActRIIBポリペプチドまたはタンパク質を医薬的に許容できるキャリヤーと混合したものを含有する医薬組成物である。
【0017】
他の観点において、本発明は、vActRIIBポリペプチドまたはタンパク質を含有する療法用組成物を対象に投与することにより、その障害を伴う対象において筋消耗性疾患を治療または予防する方法を提供する。筋消耗性疾患には下記の状態またはそれから生じるものが含まれるが、これらに限定されない:癌性悪液質、筋ジストロフィー、筋萎縮性側索硬化症、うっ血性閉塞性肺疾患、慢性心不全、化学的悪液質、HIV/エイズによる悪液質、腎不全、尿毒症、リウマチ性関節炎、加齢性サルコペニア、加齢性虚弱質、臓器萎縮症、手根管症候群、アンドロゲン欠乏、ならびに長期間の床上安静、脊髄損傷、卒中、骨折、および加齢による非活動に帰因する筋消耗。筋消耗は、宇宙飛行による無重力、インスリン抵抗性、火傷による筋消耗、アンドロゲン欠乏、および他の障害から生じる可能性もある。他の観点において、本発明はアクチビンAの発現に相関する疾患を処置する方法を提供する。1態様において、疾患は癌である。他の観点において、本発明は、代謝障害を処置する方法であって、その処置を必要とする対象に療法用組成物を投与することを含む方法を提供する;その際、代謝障害は骨損失、糖尿病、肥満症、糖耐性障害、高血糖症、アンドロゲン欠乏、およびメタボリックシンドロームから選択される。他の観点において、本発明は、前記の障害を処置するための医薬の製造における療法用組成物の使用を提供する。他の観点において、本発明は、その必要がある対象に本発明のvActRIIBポリペプチドまたはタンパク質をコードするベクターを投与することを含む遺伝子療法を提供する;その際、ベクターは対象においてvActRIIBポリペプチドまたはタンパク質を発現することができる。
【図面の簡単な説明】
【0018】
【図1】図1は、野生型可溶性ActRIIB−ヒトIgG1 Fcのアミノ酸配列(SEQ ID NO:98)を示す。シグナルペプチド配列は太字であり、これに続いて成熟ActRIIB細胞外ドメイン、および部分ヒンジ部を含むイタリック体のヒトIgG1 Fcがある。アミノ酸E28およびR40に下線を施してある。リンカー配列GGGGS(SEQ ID NO:75)はイタリック体であり、かつ下線を施してある。
【図2】図2は、可溶性ActRIIB5−ヒトIgG1 Fcのアミノ酸配列(SEQ ID NO:99)を示す。シグナルペプチド配列は太字であり、これに続いて成熟ActRIIB可溶性ドメインがあり、部分ヒンジ部を含むヒトIgG1 Fcはイタリック体である。アミノ酸E28およびR40に下線を施してある。リンカー配列(GGGGS)(SEQ ID NO:75)はイタリック体であり、かつ下線を施してある。
【図3】図3は、インヒビン−αノックアウトマウスにおいて可溶性vActRIIB−Fc E28W処置が精巣(図3A)および卵巣(図3B)の質量に及ぼす影響を示す。
【図4】図4は、可溶性vActRIIB−Fc E28W処置が雄(図4A)および雌(図4B)のインヒビン−αノックアウトマウスの生存率に及ぼす影響を示す。
【図5】図5は、大腸26腫瘍を保有するマウスにおいて可溶性vActRIIB−Fc E28W処置が体重に及ぼす影響を示す。
【図6】図6は、大腸26腫瘍を保有するマウスの生存率に可溶性vActRIIB−Fc E28W処置が及ぼす影響を示す。
【発明を実施するための形態】
【0019】
バリアントヒトアクチビンIIB受容体(vActRIIB)ポリペプチドを含むタンパク質を開示する。これらのタンパク質およびポリペプチドは、3種類のTGF−βタンパク質であるミオスタチン(GDF−8)、アクチビンA、およびGDF−11のうち少なくとも1つに結合してこれらのタンパク質の活性を阻害するそれらの能力を特徴とする。これらのタンパク質およびポリペプチドは、本明細書に開示する修飾を含まないポリペプチドと比較して低い凝集傾向をも示す。これらの修飾は、寄託番号NP 001097(SEQ ID NO:47)の野生型ActRIIB、およびActRIIBの細胞外ドメイン(SEQ ID NO:18)またはActRIIB5の細胞外ドメイン(SEQ ID NO:2)と対比して、位置28、40、または28と40の両方におけるアミノ酸置換からなる。
【0020】
本明細書中で用いる用語”TGF−βファミリーのメンバー”または”TGF−βタンパク質”は、トランスフォーミング増殖因子ファミリーの構造関連増殖因子を表わし、これにはアクチビン、ならびに増殖および分化因子(GDF)タンパク質が含まれる(Kingsley et al. Genes Dev. 8: 133-146 (1994), McPherron et al. Growth factors and cytokines in health and disease, Vol. 1B, D. LeRoith and C.Bondy. ed., JAI Press Inc., Greenwich, Conn, USA: pp 357-393)。
【0021】
ミオスタチンとも呼ばれるGDF−8は、骨格筋組織の負の調節物質である(McPherron et al. PNAS USA 94:12457-12461 (1997))。ミオスタチンは、長さ約375アミノ酸の不活性タンパク質複合体として合成され、ヒトについてGenBank寄託番号AAB86694(SEQ ID NO:49)をもつ。この前駆タンパク質が4塩基プロセシング部位におけるタンパク質分解開裂によって活性化されて、N−末端不活性プロドメイン、および約109アミノ酸のC−末端タンパク質を生成し、これが二量体化して約25kDaのホモ二量体を形成する。このホモ二量体が生物活性をもつ成熟タンパク質である(Zimmers et al., Science 296, 1486 (2002))。
【0022】
本明細書中で用いる用語“プロドメイン”または“プロペプチド”は不活性N−末端タンパク質を表わし、これが開裂除去されて活性C−末端タンパク質が放出される。本明細書中で用いる用語“ミオスタチン”または“成熟ミオスタチン”は、生物活性をもつ成熟C−末端ポリペプチド(単量体、二量体または他の形態)、および生物活性フラグメントまたは関連ポリペプチドを表わし、これには対立遺伝子バリアント、スプライスバリアント、ならびに融合したペプチドおよびポリペプチドが含まれる。成熟ミオスタチンは、ヒト、マウス、ニワトリ、ブタ、シチメンチョウおよびラットを含めた多くの種間で100%の配列同一性をもつと報告されている(Lee et al., PNAS 98, 9306 (2001))。
【0023】
本明細書中で用いるGDF−11は、Swissprot寄託番号O95390(SEQ ID NO:50)をもつBMP(骨形態形成タンパク質)、ならびにそのタンパク質のバリアントおよび種ホモログを表わす。GDF−11は、ミオスタチンに対してアミノ酸レベルで約90%の配列同一性をもつ。GDF−11は、中軸骨格の前/後パターン形成の調節に関与する(McPherron et al, Nature Genet. 22 (93): 260-264 (1999); Gamer et al, Dev. Biol. 208 (1), 222-232 (1999))が、生後の機能は分かっていない。
【0024】
アクチビンAはポリペプチド鎖βAのホモ二量体である。本明細書中で用いる用語“アクチビンA”は、GenBank寄託番号NM 002192(SEQ ID NO:48)をもつアクチビンタンパク質、ならびにそのタンパク質のバリアントおよび種ホモログを表わす。
【0025】
アクチビン受容体
本明細書中で用いる用語アクチビンIIB型受容体(ActRIIB)は、寄託番号NP 001097(SEQ ID NO:47)をもつヒトアクチビン受容体を表わす。可溶性ActRIIBという用語には、ActRIIBの細胞外ドメイン(SEQ ID NO:18)、ActRIIB5の細胞外ドメイン(SEQ ID NO:2)、ならびにこれらの配列の位置64のアルギニンがアラニンで置換されたものも含まれる。
【0026】
バリアント可溶性ActRIIBポリペプチド
本発明は、ヒトバリアント可溶性ActRIIB受容体ポリペプチド(本明細書中でvActRIIBポリペプチド、またはバリアントポリペプチドと表示する)を含む単離されたタンパク質を提供する。本明細書中で用いる用語“vActRIIBタンパク質”は、vActRIIBポリペプチドを含むタンパク質を表わす。本明細書中で用いる用語”単離された”は、内因性物質からある程度精製されたタンパク質またはポリペプチド分子を表わす。これらのポリペプチドおよびタンパク質は、アクチビンA、ミオスタチン、またはGDF−11のいずれか1つに結合してその活性を阻害する能力をもつことを特徴とする。ある態様において、アクチビンA、ミオスタチン、またはGDF−11に対するバリアントポリペプチドの結合親和性は野生型ポリペプチドと比較して改良されている。
【0027】
1態様において、vActRIIBポリペプチドはSEQ ID NO:2または18の位置E28もしくはR40のいずれかまたは位置E28およびR40の両方のアミノ酸が他の非−自然アミノ酸で置換されたアミノ酸配列をもち、このポリペプチドはミオスタチン、アクチビンA、またはGDF−11を結合することができる。他の態様において、vActRIIBポリペプチドはこれらの配列の成熟型またはトランケートした成熟型である。本明細書中で用いる用語“成熟vActRIIBポリペプチド”は、アミノ酸シグナル配列が除去されたポリペプチドを表わす。1態様において、成熟配列は、たとえばSEQ ID NO:2のアミノ酸19〜160、およびSEQ ID NO:18のアミノ酸19〜134であり、その際、位置28および40の一方または両方のアミノ酸が他の非−自然アミノ酸で置換されており、このポリペプチドはアクチビンA、ミオスタチン、またはGDF−11に結合する能力を保持する。本明細書中で用いる用語トランケートした成熟vActRIIBポリペプチドは、シグナル配列およびさらに成熟ポリペプチドのN−末端からのアミノ酸が除去されたポリペプチドを表わす。1態様においては、成熟ポリペプチドの成熟N−末端の4個のアミノ酸またはN−末端の6個のアミノ酸が除去されている。この態様において、トランケートした成熟配列は、たとえばSEQ ID NO:2のアミノ酸23〜160、またはSEQ ID NO:2のアミノ酸25〜160;およびSEQ ID NO:18のアミノ酸23〜134、またはSEQ ID NO:18のアミノ酸25〜134であり、その際、位置28および40の一方または両方のアミノ酸が他の非−野生型アミノ酸で置換されており、これはアクチビンA、ミオスタチン、またはGDF−11に結合する能力を保持する。本明細書中で用いる用語“位置28”および“位置40”(すなわち、E28およびR40)は、18アミノ酸のシグナル配列を含むSEQ ID NO:2および18に関するアミノ酸の位置を表わす。一貫性をもたせるために、成熟vActRIIBポリペプチドが位置10および/または22に置換をもつ場合、あるいはトランケートした成熟ポリペプチドが成熟配列またはトランケートした成熟配列に対して位置6および/または18に置換をもつ場合、あるいは位置4および/または16に置換をもつ場合、これらのバリアントもなお全長SEQ ID NO:2および18について、または図1または2に示すように、すなわち位置E28および/またはR40におけるアミノ酸置換について表示する。そのような成熟態様またはN−末端トランケートした態様を後記に例示する。
【0028】
1態様において、位置28における置換はW、YおよびAからなるアミノ酸の群から選択される。1態様において、位置28における置換はWである。他の態様において、位置28における置換はA、F、Q、V、I、L、M、K、H、WおよびYからなるアミノ酸の群から選択される。他の態様において、位置40における置換はG、Q、M、H、KおよびNからなるアミノ酸の群から選択される。他の態様において、位置28における置換はA、F、Q、V、I、L、M、K、H、WおよびYからなるアミノ酸の群から選択され、かつ位置40における置換はA、G、Q、M、H、KおよびNからなるアミノ酸の群から選択される。1態様において、タンパク質はSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97からなる群から選択されるアミノ酸配列をもつポリペプチドを含む。他の態様において、タンパク質はSEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、67、69、71、92、94、96からなる群に示す配列またはその相補配列をもつポリヌクレオチドによりコードされるポリペプチドを含む。
【0029】
1態様においては、シグナル配列がvActRIIBポリペプチドから除去されて、成熟バリアントポリペプチドが残る。本発明のポリペプチドの製造には多様なシグナルペプチドを使用できる。シグナルペプチドは、図1および2に示す配列(SEQ ID NO:73)、またはオルタナティブシグナル配列、たとえばSEQ ID NO:74、すなわちSEQ ID NO:2および18に対するシグナル配列をもつことができる。vActRIIBまたはvActRIIB5ポリペプチドの発現に有用な他のいかなるシグナルペプチドも使用できる。
【0030】
他の態様において、vActRIIBポリペプチドは実質的にSEQ ID NO:2および18に類似する配列をもつ。本明細書中で用いる用語“実質的に類似する”は、SEQ ID NO:2および18に示すアミノ酸配列に対して少なくとも約80%の同一性、少なくとも約85%の同一性、少なくとも約90%の同一性、少なくとも約95%の同一性、少なくとも約98%の同一性、または少なくとも約99%の同一性をもつポリペプチドを表わし、その際、位置28および/または40の一方または両方のアミノ酸が非−野生型アミノ酸で置換されており、このポリペプチドはSEQ ID NO:2および18のポリペプチドの活性、すなわちミオスタチン、アクチビンAまたはGDF−11を結合して阻害する能力を保持する。さらに、用語vActRIIBポリペプチドは、SEQ ID NO:2または18の位置28および/または40に本明細書に記載する置換を含むフラグメント、たとえばNおよびC末端トランケーション配列を包含し、その際、このポリペプチドはミオスタチン、アクチビンAまたはGDF−11を結合して阻害することができる。
【0031】
本明細書中で用いるvActRIIBおよびvActRIIB5ポリペプチドの“誘導体”という用語は、共有または凝集コンジュゲートを形成する少なくとも1つの追加の化合物部分または少なくとも1つの追加のポリペプチド、たとえばグリコシル基、脂質、アセチル基の付加、またはC−末端もしくはN−末端融合ポリペプチド、PEG分子へのコンジュゲーション、および他の修飾を表わす;これらについては後記にさらに詳細に記載する。バリアントActRIIB受容体ポリペプチド(vActRIIB)は他の修飾体および誘導体をも含むことができ、これには多様な細胞タイプ、たとえば哺乳動物細胞、大腸菌(E.coli)、酵母、および他の組換え宿主細胞における発現によるプロセシングから生じるCおよびN末端への修飾が含まれる。さらに、vActRIIBポリペプチドフラグメント、ならびにSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97に示すポリペプチド配列の不活性化されたN−グリコシル化部位(1以上)、不活性化されたプロテアーゼプロセシング部位(1以上)、または保存的アミノ酸置換(1以上)を含むポリペプチドが含まれる。
【0032】
本明細書中で用いる用語“vActRIIBまたはvActRIIB5ポリペプチド活性”あるいは“可溶性vActRIIBまたはvActRIIB5ポリペプチドの生物活性”は、vActRIIBおよびvActRIIB5ポリペプチドの1以上のインビトロまたはインビボ活性を表わし、これには後記の実施例中で証明するものが含まれるが、これらに限定されない。vActRIIBポリペプチドの活性には、ミオスタチンまたはアクチビンAまたはGDF−11に結合する能力、およびミオスタチンまたはアクチビンAまたはGDF−11の活性を低下または中和する能力が含まれるが、これらに限定されない。本明細書中で用いる、ミオスタチン、アクチビンA、またはGDF−11に“結合することができる”という用語は、当技術分野で既知の方法、たとえば後記の実施例2に記載するBiacore法により測定した結合を表わす。実施例2においては、pMARE C2C12細胞ベースのアッセイによりアクチビンA中和活性、ミオスタチン中和活性、およびGDF−11中和活性も測定する。インビボ活性には、動物モデルにおいて証明され、当技術分野で既知であるように、体重の増加、除脂肪筋量の増加、骨格筋量の増加、脂肪量の減少が含まれるが、これらに限定されない。生物活性には、さらに特定のタイプの腫瘍により起きる悪液質の軽減または予防、特定のタイプの腫瘍の増殖の予防、および特定の動物モデルの生存率の向上が含まれる。vActRIIBポリペプチド活性についての考察をさらに後記に示す。
【0033】
本発明のポリペプチドはさらに、vActRIIBポリペプチドに直接またはリンカー配列により付加して融合タンパク質を形成したヘテロロガスポリペプチドを含む。本明細書中で用いる用語“融合タンパク質”は、ヘテロロガスポリペプチドが組換えDNA技術により付加したタンパク質を表わす。ヘテロロガスポリペプチドには下記のものが含まれるが、これらに限定されない:バリアントActRIIBのオリゴマー化および安定化を促進するFcポリペプチド、hisタグ、およびロイシンジッパードメイン;たとえばWO 00/29581に記載され、これを本明細書に援用する。1態様において、ヘテロロガスポリペプチドはFcポリペプチドまたはドメインである。1態様において、FcドメインはヒトIgG1、IgG2、およびIgG4 Fcドメインから選択される。これらをSEQ ID NO:80、82および84に示す。vActRIIBは、さらにIgG1、IgG2、またはIgG4の各IgG Fc領域に隣接するヒンジ配列の全部または一部を含むことができる。IgG1、IgG2、およびIgG4の全ヒンジ配列をそれぞれSEQ ID NO:76、77、および78に示す。
【0034】
vActRIIBポリペプチドは、場合によりさらに“リンカー”配列を含むことができる。リンカーは主に、ポリペプチドと第2のヘテロロガスポリペプチドもしくは他のタイプの融合配列との間の、または2以上のバリアントActRIIBポリペプチド間の、スペーサーとして作用する。1態様において、リンカーは互いにペプチド結合により連結したアミノ酸、好ましくはペプチド結合により連結した1〜20個のアミノ酸から構成され、その際、アミノ酸は20種類の天然アミノ酸から選択される。当業者に理解されるように、これらのアミノ酸のうち1以上がグリコシル化されていてもよい。1態様において、これらの1〜20個のアミノ酸はグリシン、アラニン、プロリン、アスパラギン、グルタミン、およびリジンから選択される。好ましくは、リンカーは大部分が立体障害のないアミノ酸、たとえばグリシンおよびアラニンから構成される。リンカーの例はポリグリシン(特に(Gly)5、(Gly)8、ポリ(Gly−Ala)、およびポリアラニンである。後記の実施例中に示す適切なリンカーの一例は、(Gly)4Ser(SEQ ID NO:75)である。他の例において、vActRIIBはヒンジリンカーを含むことができる;すなわち、SEQ ID NO:79に示すように、リンカー配列がヒンジ部に隣接して付与されている。
【0035】
リンカーは非ペプチドリンカーであってもよい。たとえば、アルキルリンカー、たとえば−NH−(CH2)s−C(O)−を使用でき、ここでs=2〜20である。これらのアルキルリンカーはさらに、立体障害をもたらさないいずれかの基、たとえば低級アルキル(たとえばC1〜C6)低級アシル、ハロゲン(たとえばCl、Br)、CN、NH2、フェニルなどで置換されていてもよい。
【0036】
1態様においては、vActRIIBポリペプチドをFcポリペプチドに直接に、またはリンカーにより、またはヒンジリンカーにより付加することができる。1態様において、FcはヒトIgG Fcである。Fcに付加したvActRIIBには、表1および2に示すように、また本明細書の実施例に記載するように、たとえばvActRIIB−IgG1Fc、E28A(SEQ ID NO:60);vActRIIB−IgG1Fc、E28W(SEQ ID NO:62)、vActRIIB−IgG1Fc、E28Y(SEQ ID NO:64)、vActRIIB−IgG Fc、R40G(SEQ ID NO:66)、vActRIIB5−IgG1Fc、E28A(SEQ ID NO:70)、およびvActRIIB5−IgG1Fc E28W(SEQ ID NO:72)が含まれる。他の態様には、vActRIIB−IgG2 Fc、E28W(SEQ ID NO:91)、vActRIIB−IgG2 Fc、E28Y(SEQ ID NO:93)、およびvActRIIB−IgG2 Fc(SEQ ID NO:95)が含まれる。これらのバリアントは、後記の実施例内で証明するように、生じる凝集が野生型ActRIIB−IgG2 IgG2と比較して少ないことが証明された。
【0037】
本明細書に開示するvActRIIBポリペプチドは、ActRIIBポリペプチドの分解の減少および/または半減期の延長、毒性の低下、免疫原性の低下、および/または生物活性の増大などの目的特性を付与するために、非ポリペプチド分子に付加することもできる。例示分子には、線状ポリマー、たとえばポリエチレングリコール(PEG)、ポリリジン、デキストラン;脂質;コレステロール群(たとえばステロイド);炭水化物、またはオリゴ糖分子が含まれるが、これらに限定されない。
【0038】
他の観点において、本発明は本発明のvActRIIBポリペプチドをコードするポリヌクレオチドを含む単離された核酸分子を提供する。本明細書中で用いる用語“単離された”は、内因性物質からある程度精製された核酸分子を表わす。1態様において、本発明の核酸分子はSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97のポリペプチドをコードするポリヌクレオチドを含む。1より多いコドンが同一アミノ酸をコードすることができる既知の遺伝子コード縮重のため、DNA配列がSEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、67、69、71、92、94、および96に示すもの、またはSEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、67、69、71、92、94、および96の相補鎖と異なり、なおSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97のアミノ酸配列をもつポリペプチドをコードするという可能性がある。そのようなバリアントDNA配列は、産生中に起きるサイレント変異から生じる可能性があり、あるいはこれらの配列の意図的な変異形成の生成物であってもよい。
【0039】
他の態様において、本発明の核酸分子はSEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、67、69、71、92、94、および96に示すポリヌクレオチド配列をもつポリヌクレオチド、またはSEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、67、69、71、92、94、および96の相補鎖を含む。他の態様において、本発明は、ストリンジェントなまたは中等度の条件下でSEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、67、69、71、92、94、および96のポリペプチドコード領域とハイブリダイズする核酸分子を提供し、その際、コードされるポリペプチドはSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97に示すアミノ酸配列を含み、コードされるポリペプチドはvActRIIBポリペプチドの活性を保持する。
【0040】
本発明の核酸分子には、一本鎖および二本鎖の両方の形のDNA、ならびにそのRNA相補配列が含まれる。DNAには、たとえばcDNA、ゲノムDNA、合成DNA、PCRにより増幅したDNA、およびその組合わせが含まれる。ゲノムDNAは、常法により、たとえばSEQ ID NO:1もしくは17のDNAまたはその適切なフラグメントをプローブとして用いることにより単離できる。ActRIIBポリペプチドをコードするゲノムDNAは、多数の種について入手できるゲノムライブラリーから得られる。合成DNAは、オーバーラップするオリゴヌクレオチドフラグメントを化学合成し、続いてそれらのフラグメントを組み立ててコード領域およびフランキング配列の一部または全部を再構成することにより得ることができる。RNAは、mRNAの高レベル合成を指令する原核細胞発現ベクター、たとえばT7プロモーターを用いるベクターおよびRNAポリメラーゼから得ることができる。cDNAは、ActRIIBを発現する種々の組織から単離されたmRNAから調製したライブラリーから得られる。本発明のDNA分子には、全長の遺伝子ならびにそのポリヌクレオチドおよびフラグメントが含まれる。全長遺伝子は、N−末端シグナル配列をコードする配列をも含むことができる。
【0041】
本発明の他の観点においては、前記の核酸配列を含む発現ベクター、およびそのようなベクターで形質転換した宿主細胞、およびvActRIIBポリペプチドを製造する方法も提供される。用語“発現ベクター”は、ポリヌクレオチド配列からポリペプチドを発現させるためのプラスミド、ファージ、ウイルスまたはベクターを表わす。vActRIIBポリペプチドを発現させるためのベクターは、ベクターの増殖およびクローニングされた挿入配列の発現に必要な最小配列を含む。発現ベクターは、下記のアセンブリーを含む転写ユニットを含む:(1)遺伝子発現における調節の役割をもつ遺伝子エレメント(1以上)、たとえばプロモーターまたはエンハンサー、(2)mRNAに転写されてタンパク質に翻訳されるべき、vActRIIBポリペプチドをコードする配列、ならびに(3)適切な転写開始配列および転写終止配列。これらの配列はさらに選択マーカーを含むことができる。宿主細胞における発現に適切なベクターは容易に入手でき、前記の核酸分子を標準的な組換えDNA技術によりそれらのベクターに挿入する。そのようなベクターは、特定の組織において機能するプロモーター、および標的とするヒトまたは動物の細胞におけるvActRIIB発現のためのウイルスベクターを含むことができる。vActRIIBの発現に適切な発現ベクターの例は、vActRIIBポリヌクレオチドを含むpDSRa(WO 90/14363に記載、本明細書に援用する)およびそれの誘導体、ならびに当技術分野で既知の、または後記の他のいずれか適切なベクターである。
【0042】
本発明は、さらにvActRIIBポリペプチドを製造する方法を提供する。他の多様な発現系/宿主系を使用できる。これらの系には下記のものが含まれるが、これらに限定されない:組換えバクテリオファージ、プラスミドもしくはコスミドDNA発現ベクターで形質転換した微生物、たとえば細菌;酵母発現ベクターで形質転換した酵母;ウイルス発現ベクター(たとえばバキュロウイルス)を感染させた昆虫細胞系;ウイルス発現ベクター(たとえば、カリフラワーモザイクウイルス、CaMV;タバコモザイクウイルス、TMV)でトランスフェクションした、もしくは細菌発現ベクター(たとえば、TiまたはpBR322プラスミド)で形質転換した、植物細胞系;または動物細胞系。組換えタンパク質の製造に有用な哺乳動物細胞には下記のものが含まれるが、これらに限定されない:VERO細胞、HeLa細胞、チャイニーズハムスター卵巣(CHO)細胞系、またはそれらの誘導系、たとえば無血清培地中で増殖するVeggie CHOおよび関連細胞系(参照:Rasmussen et al., 1998, Cytotechnology 28:31)、またはDHFRを欠如するCHO株DX−B11(参照:Urlaub et al., 1980, Proc. Natl. Acad. Sci. USA 77:4216-20)COS細胞、たとえばCOS−7系列のサル腎細胞(ATCC CRL 1651)(参照:Gluzman et al., 1981, Cell 23:175)、W138、BHK、HepG2、3T3(ATCC CCL 163)、RIN、MDCK、A549、PC12、K562、L細胞、C127細胞、BHK(ATCC CRL 10)細胞系列、アフリカミドリザル腎細胞系列CV1に由来するCV1/EBNA細胞系列(ATCC CCL 70)(参照:McMahan et al., 1991, EMBO J. 10:2821)、ヒト胚腎細胞、たとえば293、293 EBNAもしくはMSR 293、ヒト上皮A431細胞、ヒトColo205細胞、他の形質転換した霊長類細胞系列、正常二倍体細胞、初代組織のインビトロ培養に由来する細胞株、初代外植体、HL−60、U937、HaKもしくはジャーカット細胞。哺乳動物発現により分泌型または可溶性のポリペプチドを産生することができ、これを増殖培地から回収できる。
【0043】
適切な宿主−ベクター系を用いて、本発明の核酸分子を含む発現ベクターで形質転換した宿主細胞を産生が可能な条件下で培養することにより、vActRIIBポリペプチドを組換え製造する。形質転換した細胞を長期間の高収率ポリペプチド製造に使用できる。そのような細胞を、目的とする発現カセットのほか選択マーカーを含むベクターで形質転換すると、それらの細胞を富化培地中で1〜2日間増殖させた後、選択培地に切り替えることができる。選択マーカーは、導入した配列をうまく発現する細胞を増殖させて回収することができるように設計される。安定に形質転換された耐性細胞塊を、用いる細胞系列に適切な組織培養法により増殖させることができる。組換えタンパク質の発現についての概説は、Methods of Enzymology, v. 185, Goeddell, D.V., ed., Academic Press (1990)中に見ることができる。
【0044】
ある場合、たとえば原核細胞系を用いるそのような発現の場合には、生物活性にするために、発現した本発明ポリペプチドを“再フォールディング”および酸化して適正な三次元構造にしかつジスルフィド結合を生成させることが必要な可能性がある。再フォールディングは、当技術分野で周知であるいくらかの方法を用いて達成できる。そのような方法には、たとえば可溶化したポリペプチドを、カオトロピック剤の存在下で通常は7より高いpHに曝露することが含まれる。カオトロピック剤の選択は封入体可溶化のために用いる選択と同様であるが、一般にカオトロピック剤をより低い濃度で用いる。カオトロピック剤の例はグアニジンおよび尿素である。大部分の場合、再フォールディング/酸化溶液は、システイン橋形成のためのジスルフィドシャフリングを起こさせる特定の酸化還元電位を生じる特定比率の還元剤およびその酸化形をも含有するであろう。若干の慣用される酸化還元対には、システイン/シスタミン、グルタチオン/ジチオビスGSH、塩化銅(II)、ジチオトレイトールDTT/ジチアンDTT、および2−メルカプトエタノール(bME)/ジチオ−bMEが含まれる。多くの場合、再フォールディングの効率を高めるために共溶媒を使用できる。慣用される共溶媒には、グリセロール、種々の分子量のポリエチレングリコール、およびアルギニンが含まれる。
【0045】
さらに、前記のポリペプチドは常法に従って溶液中または固体支持体上で合成できる。種々の自動合成装置が市販されており、既知のプロトコルに従って使用できる。たとえば、Stewart and Young, Solid Phase Peptide Synthesis, 2d.Ed., Pierce Chemical Co. (1984); Tam et al., J Am Chem Soc, 105:6442, (1983); Merrifield, Science 232:341-347 (1986); Barany and Merrifield, The Peptides, Gross and Meienhofer, eds, Academic Press, New York, 1-284; Barany et al., Int J Pep Protein Res, 30:705-739 (1987)を参照。
【0046】
本発明のポリペプチドおよびタンパク質は、当業者に周知のタンパク質精製法に従って精製できる。これらの方法は、ある段階でタンパク質画分と非タンパク質画分の粗分画を伴う。ペプチドポリペプチドを他のタンパク質から分離すると、目的とするペプチドまたはポリペプチドをクロマトグラフィー法および電気泳動法によりさらに精製して、部分または完全精製(または均質になるまでの精製)を達成することができる。本明細書中で用いる用語“単離されたポリペプチド”または“精製されたポリペプチド”は、他の成分から単離可能な組成物であって、そのポリペプチドが自然界で得られるそれの状態と比較して何らかの程度精製された組成物を表わすものとする。したがって、精製したポリペプチドはそれが自然界で存在する可能性のある環境から遊離したポリペプチドをも表わす。一般に“精製した”は、他の種々の成分を除去するための分画が施されたポリペプチド組成物であって、発現したそれの生物活性を実質的に保持している組成物を表わすであろう。“実質的に精製された”という用語を用いる場合、この表記は、ペプチドまたはポリペプチド組成物においてそのポリペプチドまたはペプチドがその組成物の主成分を形成するもの、たとえば組成物中のタンパク質の約50%、約60%、約70%、約80%、約85%、もしくは約90%またはそれ以上を構成するものを表わすであろう。
【0047】
精製に用いるのに適切な多様な方法が当業者に周知であろう。これらには、たとえば硫酸アンモニウム、PEG、抗体(免疫沈降法)などまたは熱変性による沈殿に続く遠心分離;クロマトグラフィー、たとえばアフィニティークロマトグラフィー(プロテイン−Aカラム)、イオン交換、ゲル濾過、逆相、ヒドロキシルアパタイト、疎水性相互作用クロマトグラフィー;等電点フォーカシング;ゲル電気泳動;およびこれらの方法の組合わせが含まれる。当技術分野で一般に知られているように、種々の精製工程を実施する順序を変更し、あるいは特定の工程を省いてもなお、実質的に精製されたポリペプチドを製造するのに適切な方法とすることができると考えられる。精製工程の例を後記の実施例に提示する。
【0048】
ポリペプチドの精製度を定量するための種々の方法が、本明細書の開示からみて当業者に既知であろう。これらには、たとえば活性画分の特異的結合活性を測定するもの、またはSDS/PAGE分析により画分中のペプチドもしくはポリペプチドの量を評価するものが含まれる。ポリペプチド画分の純度を評価するための好ましい方法は、その画分の結合活性を計算して、それを最初の抽出物の結合活性と比較し、これにより、本明細書中で“精製倍数”により評価する精製度を計算するものである。結合活性の量を表わすために用いる実際の単位はもちろん、精製を追跡するために選択した個々のアッセイ法、およびそのポリペプチドまたはペプチドが検出可能な結合活性を示すか否かに依存するであろう。
【0049】
バリアントアクチビンIIB型ポリペプチドは筋分解カスケードを活性化するリガンドに結合する。リガンドであるアクチビンA、ミオスタチン、および/またはGDF−11を結合してその活性を阻害することができるvActRIIBポリペプチドは、後記の実施例に示すように、筋萎縮を伴う疾患に対する療法効力、ならびに特定の癌および他の疾患を処置する効力をもつ。
【0050】
しかし、野生型ActRIIBまたはActRIIB5ポリペプチドの発現または精製に際しては凝集が起きる可能性がある。この凝集には、発現中における構造化オリゴマー形成、ならびに発現中およびポリペプチド精製後の両方における非構造化凝集体生成が含まれる。
【0051】
構造分析、分子モデリング、および質量分析を組み合わせた方法で、グリコシレーションされていないActRIIBポリペプチド間の静電相互作用および水素結合相互作用により補助された分子間ジスルフィド結合形成によってActRIIBポリペプチドに多量体形成が生じる可能性のあることが指摘された。2つのActRIIB分子の境界;たとえば1つのActRIIBのE28側鎖と他のActRIIBのR40側鎖との間に、有意の水素結合がある。さらに、1つのActRIIBのE28と他のActRIIBのR40との間に、重大な静電相互作用がある。
【0052】
これらの静電相互作用は、一時的なActRIIB二量体の集団を増加させ、その結果ActRIIB単位間の非共有結合および/または共有結合の形成を促進する、著しい原因となる可能性がある。残基E28とR40間の相互作用は、これらの相互作用のうち最も重大なものである;これら2残基は二重の水素結合および強い静電相互作用に関与するからである。残基E28およびR40はActRIIB:ActRIIB相互作用に関与し、ActRIIB:リガンド相互作用には関与しない。したがって、残基28および40を本発明に従って非−自然アミノ酸と置換して、これら受容体ポリペプチドの溶解度を改善し、凝集を低下させることができる。したがって、後記に示すように、E28およびR40をそれぞれ他の可能な天然アミノ酸で置換し、発現させ、Biacoreにより試験した。Biacoreにより測定した結合を後記の実施例2の表1Aおよび1Bに示す。さらに、vActRIIBポリペプチドの凝集率を後記において測定する。
【0053】
後記実施例の結果は、本明細書に記載するアミノ酸置換をもつvActRIIBポリペプチドおよびタンパク質について、ミオスタチン、アクチビンA、またはGDF−11を結合および中和する能力を保持した状態で凝集が低下することを示す。
【0054】
抗体
本発明はさらに、バリアントActRIIBポリペプチドに結合する抗体を含み、これには本発明のvActRIIBポリペプチドに特異的に結合するものが含まれる。本明細書中で用いる用語“特異的に結合する”は、vActRIIBポリペプチドに対して106M−1以上の結合親和性(Ka)をもつ抗体を表わす。本明細書中で用いる用語“抗体”は、たとえば下記のものを含めた無傷の抗体を表わす:ポリクローナル抗体(たとえばAntibodies: A Laboratory Manual, Harlow and Lane (eds), Cold Spring Harbor Press, (1988)を参照)、およびモノクローナル抗体(たとえばU.S.Patent Nos.RE 32,011、4,902,614、4,543,439および4,411,993、ならびにMonoclonal Antibodies: A New Dimension in Biological Analysis, Plenum Press, Kennett, McKearn and Bechtol (eds.) (1980)を参照)。本明細書中で用いる用語“抗体”は、抗体のフラグメント、たとえばF(ab)、F(ab’)、F(ab’)2、Fv、Fc、および一本鎖抗体をも表わし、これらは組換えDNA技術により、または無傷抗体の酵素開裂もしくは化学的開裂により製造される。用語“抗体”は二重特異性または二重機能性抗体をも表わし、これらは2つの異なる重鎖/軽鎖対および2つの異なる結合部位をもつ人工ハイブリッド抗体である。二重特異性抗体は、ハイブリドーマの融合またはFab’フラグメントの連結を含めた多様な方法により製造できる(参照:Songsivilai et al, Clin. Exp. Immunol. 79:315-321 (1990), Kostelny et al., J. Immunol.148:1547-1553 (1992))。
【0055】
本明細書中で用いる用語“抗体”は、キメラ抗体、すなわちヒト抗体免疫グロブリン定常ドメインが1以上の非ヒト抗体免疫グロブリン可変ドメインに結合した抗体、またはそのフラグメントをも表わす(たとえばU.S.Patent No.5,595,898およびU.S.Patent No.5,693,493を参照)。抗体は“ヒト化”抗体(たとえばU.S.Pat.No.4,816,567およびWO 94/10332を参照)、ミニボディー(minibodies)(WO 94/09817)、マキシボディー(maxibodies)、およびトランスジェニック動物が産生する抗体をも表わし、その際、ある割合のヒト抗体産生遺伝子を含むけれども内因性抗体の産生を欠如するトランスジェニック動物は、ヒト抗体を産生することができる(たとえば、Mendez et al., Nature Genetics 15:146-156 (1997)、およびU.S.Patent No.6,300,129を参照)。用語“抗体”には、多量体抗体、すなわちより高次のタンパク質複合体、たとえばヘテロ二量体抗体、および抗イディオタイプ抗体も含まれる。“抗体”には、抗イディオタイプ抗体も含まれる。vActRIIBに対する抗体を用いて、たとえばvActRIIBをインビトロおよびインビボで同定および定量することができる。
【0056】
いずれかの哺乳動物からのポリクローナル抗体、たとえばマウスおよびラットの抗体、ならびにウサギ抗体であって、SEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97を含めた本明細書に記載するvActRIIBポリペプチドに特異的に結合するものも含まれる。
【0057】
そのような抗体は研究用ツールとして、および本明細書に開示するポリペプチドを検出およびアッセイするための定量アッセイに利用される。そのような抗体は、本明細書に記載する方法および当技術分野で既知の方法を用いて調製できる。
【0058】
医薬組成物
本発明のvActRIIBタンパク質およびポリペプチドを含有する医薬組成物も提供される。そのような組成物は、治療または予防に有効な量のポリペプチドまたはタンパク質を医薬的に許容できる物質および生理的に許容できる配合物質と混合したものを含む。医薬組成物は、たとえば組成物のpH、モル浸透圧、粘度、澄明度、色、等張性、臭気、無菌性、安定性、溶解もしくは放出の速度、吸着または透過を改変、維持または保持するための配合物質を含有することができる。適切な配合物質には下記のものが含まれるが、これらに限定されない:アミノ酸(たとえばグリシン、グルタミン、アスパラギン、アルギニンまたはリジン);抗微生物薬;抗酸化剤(たとえばアスコルビン酸、亜硫酸ナトリウムまたは亜硫酸水素ナトリウム);緩衝剤(たとえばホウ酸塩、炭酸水素塩、トリス−HCl、クエン酸塩、リン酸塩、他の有機酸);増量剤(たとえばマンニトールまたはグリシン)、キレート化剤(たとえばエチレンジアミン四酢酸(EDTA));複合体形成剤(たとえばカフェイン、ポリビニルピロリドン、ベータ−シクロデキストリンまたはヒドロキシプロピル−ベータ−シクロデキストリン);充填剤;単糖類;二糖類および他の炭水化物(たとえばグルコース、マンノース、またはデキストリン);タンパク質(たとえば血清アルブミン、ゼラチンまたは免疫グロブリン);着色剤;着香剤および希釈剤;乳化剤;親水性ポリマー(たとえばポリビニルピロリドン);低分子量ポリペプチド;塩形成性の対イオン(たとえばナトリウム);保存剤(たとえば塩化ベンザルコニウム、安息香酸、サリチル酸、チメロサール、フェネチルアルコール、メチルパラベン、プロピルパラベン、クロルヘキシジン、ソルビン酸、または過酸化水素);溶剤(たとえばグリセリン、プロピレングリコール、またはポリエチレングリコール);糖アルコール(たとえばマンニトールまたはソルビトール);懸濁化剤;界面活性剤または湿潤剤(たとえばpluronic類、PEG、ソルビタンエステル、polysorbate類、たとえばpolysorbate 20、polysorbate 80、トライトン(triton)、トロメタミン(tromethamine)、レシチン、コレステロール、チロキサパル(tyloxapal));安定性向上剤(ショ糖またはソルビトール);張性増強剤(たとえばアルカリ金属ハロゲン化物(好ましくは塩化ナトリウムまたは塩化カリウム、マンニトールソルビトール));送達ビヒクル;希釈剤;賦形剤および/または医薬佐剤(Remington’s Pharmaceutical Sciences, 18thEdition, A.R. Gennaro, ed., Mack Publishing Company, 1990)。
【0059】
最適な医薬組成物は、たとえば意図する投与経路、送達方式、および目的投与量に応じて当業者により決定されるであろう。たとえば前掲のRemington’s Pharmaceutical Sciencesを参照。そのような組成物は、ポリペプチドの物理的状態、安定性、インビボ放出速度、およびインビボクリアランス速度に影響を及ぼすことができる。たとえば、適切な組成物は非経口投与用の注射用水、生理食塩水の溶液であってもよい。
【0060】
医薬組成物中の主なビヒクルまたはキャリヤーは、水性または非水性であってよい。たとえば、適切なビヒクルまたはキャリヤーは注射用水、生理食塩溶液、または人工脳脊髄液に、おそらく非経口投与用の組成物に慣用される他の物質を補ったものであってもよい。中性緩衝化した生理食塩水または血清アルブミンと混合した生理食塩水は、ビヒクルのさらに他の例である。医薬組成物の他の例は、約pH7.0〜8.5のトリス緩衝液、または約pH4.0〜5.5の酢酸緩衝液を含み、これらはさらにソルビトールまたはその適切な代替物を含有することができる。本発明の1態様において、組成物は目的純度の選択した組成物を任意配合剤(前掲のRemington’s Pharmaceutical Sciences)と混合することにより、凍結乾燥ケークまたは水溶液の形で保存用として調製できる。さらに、前記の療法用組成物は、適切な賦形剤、たとえばショ糖を用いて、凍結乾燥品として配合することができる。
【0061】
前記の配合物を多様な方法で、たとえば吸入療法、経口、または注射により送達できる。非経口投与を意図する場合、本発明に使用するための療法用組成物は、目的ポリペプチドを医薬的に許容できるビヒクル中に含む、発熱物質を含まない、非経口用として許容できる水溶液の形であってもよい。非経口注射に特に適切なビヒクルは無菌蒸留水であり、これにポリペプチドを適正に保存処理した無菌等張溶液として配合できる。さらに他の調製法は、製剤の制御放出または持続放出をもたらす注射可能なマイクロスフェア、生分解性粒子、ポリマー化合物(ポリ乳酸、ポリグリコール酸)、ビーズ、またはリポソームなどの物質を目的分子に配合することを伴い、次いで製剤をデポー注射により送達することができる。ヒアルロン酸も使用でき、これは循環中における持続滞留を促進する効果をもつことができる。目的分子を導入するのに適切な他の手段には、埋込み可能な薬物送達デバイスが含まれる。
【0062】
他の観点において、注射投与に適切な医薬配合物は、水溶液中に、好ましくは生理的に適合性の緩衝液、たとえばハンクス液、リンガー液、または緩衝化生理食塩水中に配合できる。水性の注射用懸濁液剤は、懸濁液の粘度を増大させる物質、たとえばカルボキシメチルセルロースナトリウム、ソルビトール、またはデキストランを含有することができる。さらに、有効化合物の懸濁液剤は、適宜、油性の注射用懸濁液剤として調製することができる。適切な親油性の溶剤またはビヒクルには、脂肪油、たとえばゴマ油、または合成脂肪酸エステル、たとえばオレイン酸エチル、トリグリセリド、またはリポソームが含まれる。非脂質系のポリカチオン性アミノポリマーも送達のために使用できる。場合により懸濁液剤は、適切な安定剤、または化合物の溶解度を高めて高濃度液剤を調製するための物質をも含有することができる。他の態様において、医薬組成物は吸入用として配合することができる。吸入用液剤には、エアゾール送達のための噴射剤を配合することもできる。さらに他の態様において、液剤を噴霧することができる。肺投与については、化学修飾したタンパク質の肺送達を記載したPCT出願No.PCT/US94/001875に詳細に記載されている。
【0063】
特定の配合物は経口投与できることも考慮される。本発明の1態様において、この様式で投与される分子には、固体剤形、たとえば錠剤およびカプセル剤の配合に慣用されるキャリヤーを配合してもよく、配合しなくてもよい。たとえばカプセル剤は、生物学的利用能が最大となりかつ全身前分解(pre−systemic degradation)が最小限に抑えられる胃腸管の地点で配合物の有効部分を放出するように設計することができる。療法分子の吸収を容易にする追加物質を含有させることができる。希釈剤、着香剤、低融点ろう、植物油、滑沢剤、懸濁化剤、錠剤崩壊剤、および結合剤も使用できる。経口投与用の医薬組成物は、当技術分野で周知の医薬的に許容できるキャリヤーを経口投与に適切な量で用いて配合することもできる。そのようなキャリヤーにより、医薬組成物を患者が摂取できる錠剤、丸剤、糖衣丸、カプセル剤、液剤、ゲル剤、シロップ剤、スラリー剤、懸濁液剤などとして配合することが可能になる。
【0064】
経口用の医薬製剤は、有効化合物を固体賦形剤と混和し、得られた顆粒混合物を(場合により粉砕した後に)加工して錠剤または糖衣丸コアを得ることにより得ることができる。所望により、適切な助剤を添加することができる。適切な賦形剤には、炭水化物またはタンパク質系の充填剤、たとえば糖類が含まれ、これには乳糖、ショ糖、マンニトール、およびソルビトール;トウモロコシ、コムギ、コメ、バレイショ、または他の植物からのデンプン;セルロース、たとえばメチルセルロース、ヒドロキシプロピルメチルセルロース、またはカルボキシメチルセルロースナトリウム;アラビアゴムおよびトラガントゴムを含めたゴム;ならびにタンパク質、たとえばゼラチンおよびコラーゲンが含まれる。所望により、崩壊剤または可溶化剤、たとえば架橋ポリビニルピロリドン、寒天、およびアルギン酸またはその塩、たとえばアルギン酸ナトリウムを添加してもよい。
【0065】
糖衣丸コアを適切なコーティング、たとえば濃厚な糖溶液と共に使用でき、これはアラビアゴム、タルク、ポリビニルピロリドン、カルボポール(carbopol)ゲル、ポリエチレングリコール、および/または二酸化チタン、ラッカー溶液、ならびに適切な有機溶剤または溶剤混合物を含有することもできる。製品の識別のために、または有効化合物の量、すなわち投与量の特徴付けのために、染料または色素を錠剤または糖衣丸のコーティングに添加してもよい。
【0066】
経口使用できる医薬製剤は、ゼラチン製の滑り嵌めカプセル、およびゼラチン製の密閉型軟カプセル、ならびにコーティング、たとえばグリセロールまたはソルビトールをも含むことができる。滑り嵌めカプセルは、有効成分を充填剤または結合剤、たとえば乳糖またはデンプン、滑沢剤、たとえばタルクまたはステアリン酸マグネシウム、および場合により安定剤と混合したものを収容することができる。軟カプセルの場合、安定剤を含むかまたは含まない適切な液体、たとえば脂肪油、液体、または液体ポリエチレングリコールに、有効化合物を溶解または懸濁することができる。
【0067】
他の医薬組成物は当業者に自明であろう;これには、持続送達または制御送達配合物中にポリペプチドを含む配合物が含まれる。多様な他の持続送達または制御送達手段、たとえばリポソームキャリヤー、生分解性微粒子または多孔質ビーズおよびデポー注射剤を配合するための方法も当業者に既知である。たとえば、医薬組成物を送達するための多孔質ポリマー微粒子の制御放出を記載したPCT/US93/00829を参照。持続放出製剤の他の例には、造形品、たとえばフィルムまたはマイクロカプセルの形の半透性ポリマーマトリックスが含まれる。持続放出マトリックスには、ポリエステル、ヒドロゲル、ポリラクチド(U.S.3,773,919、EP 58,481)、L−グルタミン酸およびガンマ−L−グルタミン酸エチルのコポリマー(Sidman et al., Biopolymers, 22:547-556 (1983)、ポリ(2−ヒドロキシエチル−メタクリレート)(Langer et al., J. Biomed. Mater. Res., 15:167-277, (1981); Langer et al., Chem. Tech.,12:98-105(1982))、エチレンビニルアセテート(Langer et al.、前掲)、またはポリ−D(−)−3−ヒドロキシ酪酸(EP 133,988)を含めることができる。持続放出組成物はリポソームも含むことができ、これは当技術分野で既知の幾つかの方法のいずれかにより調製できる。たとえばEppstein et al., PNAS (USA), 82:3688 (1985);EP 36,676;EP 88,046;EP 143,949を参照。
【0068】
インビボ投与に用いる医薬組成物は、一般に無菌でなけれぱならない。これは無菌濾過膜を通して濾過することにより達成できる。組成物を凍結乾燥する場合、この方法による無菌処理は凍結乾燥および再構成の前または後に実施できる。非経口投与用の組成物は、凍結乾燥した形または溶液で貯蔵できる。さらに、非経口組成物は一般に、無菌取出し口を備えた容器、たとえば皮下注射針で穿孔できるストッパー付きの静脈内投与用液剤バッグまたはバイアルに入れられる。
【0069】
医薬組成物が配合されると、それを無菌バイアル内に液剤、懸濁液剤、ゲル剤、乳剤、固体、または脱水もしくは凍結乾燥した粉末として貯蔵できる。それらの配合物はそのまま使用できる剤形または投与前に再構成する必要がある剤形(たとえば凍結乾燥品)で貯蔵できる。
【0070】
特定の態様において、本発明は一回量投与単位を調製するためのキットに関する。これらのキットは、それぞれ乾燥タンパク質を入れた第1容器と水性配合物を入れた第2容器の両方を収容することができる。本発明の範囲には、単一チャンバーおよび多チャンバー型の充填済み注射器(たとえば液剤注射器および凍結乾燥製剤注射器(lyosyringe))を収容したキットも含まれる。
【0071】
療法に用いる医薬組成物の有効量は、たとえば療法の状況および目的に依存するであろう。したがって、処置に適切な投与量レベルが、一部は、送達される分子、前記のポリペプチドを用いる適応症、投与経路、ならびに患者の体格(体重、体表面積または臓器サイズ)および状態(年齢および全般的な健康状態)に応じて異なることは、当業者に認識されるであろう。したがって、最適な療法効果を得るために臨床医が投与量を判定し、投与経路を改変することができる。一般的な投与量は、前記に述べた要因に応じて約0.1mg/kgから約100mg/kgの範囲にまで及ぶことができる。ポリペプチド組成物は、好ましくは静脈内に注射または投与することができる。持効性の医薬組成物は、その配合物の半減期およびクリアランス速度に応じて3〜4日毎、毎週、または隔週に投与することができる。投与頻度は、用いる配合物中のポリペプチドの薬物動態パラメーターに依存するであろう。一般に、目的効果を達成する量に達するまで組成物を投与する。したがって、本発明組成物を一回量として、または多数回量として(同一または異なる濃度/用量で)経時的に、または連続注入として投与することができる。さらに適量の改良をルーティンに行なう。適量は適宜な用量−応答データの使用により確認できる。
【0072】
医薬組成物の投与経路は既知の方法に従う;たとえば経口;注射:静脈内、腹腔内、脳内(実質内)、脳室内、筋肉内、眼内、動脈内、門脈内、病変部内経路、骨髄内、クモ膜下、心室内、経皮、皮下、もしくは腹腔内による;および鼻腔内、腸内、局所、舌下、尿道、膣、もしくは直腸手段、持続放出系による、または埋込みデバイスによる。所望により、組成物をボーラス注射により、または連続的に注入により、または埋込みデバイスにより投与することができる。あるいは、またはさらに、目的分子を吸収または封入した膜、スポンジその他の適切な材料の埋込みにより、組成物を局所投与することができる。埋込みデバイスを用いる場合、デバイスをいずれか適切な組織または臓器に埋め込むことができ、目的分子の送達は拡散、定時放出ボーラス、または連続投与によるものであってもよい。
【0073】
ある場合には、本明細書に記載した方法で遺伝子工学的に処理した特定の細胞を移植してポリペプチドを発現および分泌させることにより、本発明のvActRIIBポリペプチドを送達することができる。そのような細胞は動物細胞またはヒト細胞であってもよく、オートロガス(autologous)、ヘテロロガス(heterologous)、または異種(xenogeneic)であってもよい。場合により、細胞は不死化していてもよい。免疫応答の機会を減らすために、細胞を封入して周囲組織の浸潤を避けることができる。封入材料は一般に、ポリペプチド生成物(1以上)の放出は可能であるけれども患者の免疫系または周囲組織からの他の有害因子による細胞破壊を阻止する生体適合性、半透性のポリマー系封入材または膜である。
【0074】
vActRIIBまたはvActRIIB誘導体をコードする核酸分子を対象に直接導入する、インビボでのvActRIIB遺伝子療法も想定される。たとえば、vActRIIBをコードする核酸配列を、適宜な送達ベクター、たとえばアデノ随伴ウイルスベクターを用いて、または用いずに、核酸構築体の局所注射により標的細胞に導入する。選択しうるウイルスベクターには、レトロウイルス、アデノウイルス、単純ヘルペス、ウイルスおよびパピローマウイルスベクターが含まれるが、これらに限定されない。このウイルスベクターの物理的トランスファーは、インビボで、目的とする核酸構築体、または目的とする核酸配列を含む他の適切な送達ベクターの局所注射、リポソーム仲介トランスファー、直接注射(裸のDNA)、または微粒子衝突(遺伝子銃)により達成できる。
【0075】
vActRIIB組成物の使用
本発明は、ミオスタチン、アクチビンA、またはGDF−11の量または活性を、これらのポリペプチドとvActRIIBポリペプチドの接触によりインビボおよびインビトロで減少または中和するための方法および医薬組成物を提供する。vActRIIBポリペプチドは、ミオスタチン、アクチビンA、およびGDF−11に対して高い親和性をもち、ミオスタチン、アクチビンA、およびGDF−11のうち少なくとも1つの生物活性を低下および阻害することができる。ある態様において、vActRIIBポリペプチドは野生型ActRIIBポリペプチドと比較して改良された活性を示す。これを後記の実施例において証明する。
【0076】
1観点において本発明は、有効量のvActRIIB組成物を対象に投与することにより、その処置を必要とする対象においてミオスタチン関連および/またはアクチビンA関連の障害を処置するための方法および薬剤を提供する。本明細書中で用いる用語“対象”は、いずれかの動物、たとえばヒトを含めた哺乳動物を表わす。
【0077】
本発明の組成物は、体重に対するパーセントとしての除脂肪筋量を増加させ、体重に対するパーセントとしての脂肪量を減少させるために用いられる。
【0078】
vActRIIB組成物により処置できる障害には、種々の形の筋消耗、ならびに代謝障害、たとえば糖尿病および関連障害、ならびに骨変性性疾患、たとえば骨粗鬆症が含まれるが、これらに限定されない。vActRIIB組成物は、後記の実施例3に示す種々の疾患モデルにおいて筋消耗性障害の処置に有効であることが証明された。これは、インヒビン−α−ノックアウトマウスの処置、大腸−26悪液質モデルにおける筋消耗の処置、後足懸垂モデルにおける筋萎縮の予防、OXY雌の処置において、除脂肪筋量の増加、脂肪量の減少および骨無機質含量の増加を示すことを証明した。
【0079】
筋消耗性障害には、ジストロフィー、たとえばデュシェンヌ型筋ジストロフィー、進行性筋ジストロフィー、ベッカー型筋ジストロフィー、デジェリーヌ−ランドジー型筋ジストロフィー、エルプ型筋ジストロフィー、および乳児神経軸索性筋ジストロフィーも含まれる。さらに他の筋消耗性障害は、慢性の疾患または障害、たとえば筋萎縮性側索硬化症、うっ血性閉塞性肺疾患、癌、エイズ、腎不全、臓器萎縮、アンドロゲン欠乏、およびリウマチ性関節炎から生じる。
【0080】
ミオスタチンおよび/またはアクチビンの過剰発現は、悪液質、重篤な筋および脂肪消耗症候群をもたらす可能性がある。動物モデルにおける悪液質の処置に際してのvActRIIBポリペプチドの有効性を後記の実施例3に示す。悪液質は、リウマチ性関節炎、糖尿病性腎障害、腎不全、化学療法、火傷による傷害、および他の原因によっても生じる。他の例において、ミオスタチン−免疫反応性タンパク質の血清濃度および筋内濃度がエイズ関連の筋消耗を示す雄において上昇することが見いだされ、これらは除脂肪体重と逆相関していた(Gonzalez-Cadavid et al., PNAS USA 95: 14938-14943 (1998))。ミオスタチン濃度は火傷傷害に応答して上昇し、その結果、筋異化作用が生じることも示された(Lang et al, FASEB J 15, 1807-1809 (2001))。筋消耗をもたらす他の状態は、能力障害による非活動、たとえば車椅子拘束、長期間の床上安静:卒中、疾病、脊髄損傷、骨折または外傷によるもの、および極微重力環境(宇宙飛行)における筋萎縮から生じる可能性がある。たとえば、血漿ミオスタチン免疫反応性タンパク質は、長期間の床上安静後に増加することが見いだされた(Zachwieja et al. J Gravit Physiol. 6(2): 11(1999)。スペースシャトル飛行中に極微重力環境に曝露されたラットの筋は曝露されなかったラットの筋と比較してミオスタチン量の増加を示すことも見いだされた(Lalani et al., J.Endocrin 167 (3): 417-28 (2000))。
【0081】
さらに、加齢に伴う脂肪−対−筋比の増大、および加齢性筋萎縮はミオスタチンに関連すると思われる。たとえば、平均血清ミオスタチン免疫反応性タンパク質は青年期(19〜35歳)、中年期(36〜75歳)、および高年期(76〜92歳)の男性および女性のグループにおいて年齢と共に増加し、一方、平均筋量および除脂肪体重はこれらのグループにおいて年齢と共に減少した(Yarasheski et al. J Nutr Aging 6(5):343-8 (2002))。さらに、ミオスタチンは心筋に低濃度で発現し、梗塞後の心筋細胞において発現がアップレギュレートされることが、現在認められている(Sharma et al., J Cell Physiol. 180 (1):1-9 (1999))。したがって、心筋においてミオスタチン濃度を低下させると梗塞後の心筋が回復する可能性がある。
【0082】
ミオスタチンは、2型糖尿病、非インスリン依存型糖尿病、高血糖症、および肥満症を含めた代謝障害にも影響を及ぼすと思われる。たとえば、ミオスタチン欠如が肥満症および糖尿病の表現型の2匹のマウスモデルを改善することが示された(Yen et al. FASEB J. 8:479 (1994)。米国特許出願no:11/590,962、米国特許出願公開No:2007/0117130に、AAV−ActRIIB5ベクターが、動物において、特に肥満症の動物モデルについて、筋−対−脂肪比を増大させることが証明されている。本発明のvActRIIBポリペプチド、たとえばSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95は、そのような用途に適切である。したがって、本発明の組成物を投与することにより脂肪組成を低下させると、動物において糖尿病、肥満症、および高血糖の状態が改善されるであろう。さらに、ActRIIBポリペプチドについて米国特許出願no:11/590,962、米国特許出願公開No:2007/0117130において証明されたように、vActRIIBポリペプチドを含有する組成物は肥満症の個体において食物摂取量を減少させることができる。
【0083】
本発明のActRIIBポリペプチドを投与すると、骨強度を改善し、骨粗鬆症および他の変性性骨疾患を軽減することができる。これは後記のOVXマウスモデルにおいて証明された。たとえばミオスタチン欠損マウスは、マウス上腕骨の無機質含量および密度の増大、ならびに骨梁骨および皮質骨の筋付着領域における無機質含量増大、ならびに筋量増加を示すことも見いだされた(Hamrick et al. Calcif Tissue Int 71(1):63-8 (2002))。さらに、本発明のvActRIIB組成物は、アンドロゲン欠乏、たとえば前立腺癌の処置に用いるアンドロゲン欠乏療法の影響を処置するために使用できる。
【0084】
本発明は、有効量のvActRIIBタンパク質を動物に投与することにより食用動物において筋量を増加させるための方法および組成物をも提供する。成熟C−末端ミオスタチンポリペプチドは試験したすべての種において同一であるので、vActRIIBポリペプチドは、ウシ、ニワトリ、シチメンチョウ、およびブタを含めた農業に重要ないかなる種においても、筋量を増加させ、脂肪を減少させるのに有効であると期待される。
【0085】
本発明のvActRIIBポリペプチドおよび組成物は、アクチビンAの活性にも拮抗する。アクチビンAは、特定のタイプの癌、特に生殖腺腫瘍、たとえば卵巣癌において発現し、重篤な悪液質を引き起こすことが知られている(Ciprano et al. Endocrinol 141 (7):2319-27 (2000), Shou et al., Endocrinol 138 (11):5000-5 (1997); Coerver et al, Mol Endocrinol 10(5):534-43 (1996); Ito et al. British J Cancer 82(8):1415-20 (2000), Lambert-Messerlian, et al, Gynecologic Oncology 74:93-7 (1999)。後記の実施例3において、本発明のvActRIIBポリペプチドは重篤な悪液質の処置、腫瘍サイズの縮小、および生存率の延長に有効であることがインヒビン−α−ノックアウトマウスモデルおよび大腸−26悪液質マウスモデルにおいて証明された。したがって、本明細書に開示する組成物を用いて、アクチビンAの過剰発現およびミオスタチンの発現に関連する状態、たとえば特定の癌により生じる悪液質を処置し、特定の生殖腺タイプの腫瘍を処置することができる。
【0086】
本明細書に開示する組成物は、単独で、または他の療法薬と組み合わせてそれらの療法効果を高めるかまたは潜在的な副作用を軽減するために、使用できる。これらの特性には、活性の増大、溶解度の増大、分解の減少、半減期の延長、毒性の低下、および免疫原性の低下が含まれる。したがって、本明細書に開示する組成物は長期間の処置計画に有用である。さらに、本発明化合物の親水性と疎水性の特性はバランスが良く、これによりインビトロおよび特にインビボの両方におけるそれらの有用性が高まる。具体的には、本明細書に開示する化合物は、体内での吸収および生物学的利用能を可能にする水性媒質中で適度な溶解度をもち、一方、化合物が細胞膜を越えて推定機能部位、たとえば特定の筋塊へ移行するのを可能にする脂質中でもある程度の溶解度をもつ。
【0087】
さらに、本発明のvActRIIBポリペプチドは多数のアッセイ法のいずれかにおいてミオスタチン、アクチビンA、またはGDF−11を検出および定量するのに有用である。一般に本発明のActRIIBポリペプチドは、多様なアッセイ法においてミオスタチン、アクチビンA、またはGDF−11を結合および固定化するための捕獲剤として有用である;たとえばAsai, ed., Methods in Cell Biology, 37, Antibodies in Cell Biology, Academic Press, Inc., ニューヨーク(1993)に記載のものと同様。これらのポリペプチドをある様式で標識することができ、あるいはミオスタチンを検出および定量できるように標識された第3の分子、たとえば抗体と反応させることができる。たとえば、ポリペプチドまたは第3の分子を検出可能な部分、たとえばビオチンで修飾し、次いでこれを第4の分子、たとえば酵素標識ストレプトアビジンまたは他のタンパク質により結合することができる(Akerstrom, J Immunol 135:2589 (1985); Chaubert, Mod Pathol 10:585 (1997))。
【実施例】
【0088】
本発明について記載したが、以下の実施例は説明のために提示され、限定のためのものではない。
【0089】
実施例1
vActRIIBポリペプチドの発現および精製
バリアントActRIIBポリペプチドの発現および精製のために下記の方法を用いた。
【0090】
ヒトアクチビンタイプIIB受容体のcDNAをヒト精巣由来のcDNAライブラリー(Clontech,Inc.)から単離し、米国特許出願no:11/590,962、米国特許出願公開No:2007/0117130の記載に従ってクローニングした。
【0091】
アミノ酸置換の決定
構造分析、分子モデリング、および質量分析を組み合わせた方法で、グリコシレーションされていないActRIIBポリペプチド間の静電相互作用および水素結合相互作用により誘発された分子間ジスルフィド結合形成によってActRIIBに凝集(オリゴマー形成)が生じる可能性のあることが指摘された。残基28および40はActRIIB:ActRIIB相互作用に関与し、ActRIIBとそれのリガンドとの相互作用には関与しないと判定された。
【0092】
まず、ActRIIB−Fc上のE28およびR40をそれぞれの位置においてAで置換した。光散乱および質量分析により、完全グリコシレーションされたvActRIIB−IgG1Fc E28A、およびvActRIIB−IgG1Fc R40Aの画分が野生型と比較して有意に増加したことが確認された。E28AおよびR40A vActRIIB−IgG1Fcを37℃で6日間インキュベートした結果、野生型と比較してほとんどまたは全く凝集が生じなかった。野生型ActRIIB(SEQ ID NO:2および18)の発現および精製に際して起きる可能性のある凝集を軽減または阻止するために、位置28および40(シグナル配列を含むSEQ ID NO:2および18に関して)におけるアミノ酸置換を行なった。この凝集は、発現中における構造化オリゴマー形成、ならびに発現中およびタンパク質精製後の両方における非構造化凝集体生成であることが確認されている。
【0093】
産生および精製プロセスの種々の段階での凝集を、下記の方法に従ってサイズ排除クロマトグラフィーにより測定した。
【0094】
以下に例示した方法を用いて、バリアントActRIIBポリペプチド(vActRIIBおよびvActRIIB5)を製造した。vActRIIB E28Wをコードするポリヌクレオチド(SEQ ID NO:23)を、ヒトIgG1 Fcドメインをコードするポリヌクレオチド(SEQ ID NO:82)またはヒトIgG2 Fcをコードするポリヌクレオチド(SEQ ID NO:84)に、ヒンジリンカー配列(SEQ ID NO:79をコードするヌクレオチド)を介して、E28Wを生じる変異を含むプライマーを用いるPCRオーバーラップ延長により融合させた。この全長ポリヌクレオチド配列はSEQ ID NO:61である。二本鎖DNAフラグメントを、pTT5(Biotechnology Research Institute, National Research Council Canada (NRCC), 6100 Avenue Royalmount, Montreal (Quebec) Canada H4P 2R2)、pDSRα(WO/9014363に記載)、および/またはpDSRαの誘導体中へサブクローニングした。他の態様においては、vActRIIBポリペプチドをコードするポリヌクレオチドを、リンカーGGGGS(SEQ ID NO:75)もしくはその多量体、および/またはヒンジリンカー(たとえばSEQ ID NO:79)をコードするポリヌクレオチドに付加した。
【0095】
操作したvActRIIB−FcおよびvActRIIB5−Fcの一過性発現を下記に従って実施した。
【0096】
前記2種類の分子の操作したバリアントを、無血清懸濁に適応させた293−6E細胞(National Research Council of Canada、カナダ国オタワ)において一過性発現させた;細胞は、250μg/mlのゲネチシン(geneticin)(Invitrogen)および0.1% Pluronic F68(Invitrogen)を補充したFreeStyle(商標)培地(Invitrogen Corporation、カリフォルニア州カールズバッド)中に維持された。トランスフェクションを1Lの培養として実施した。要約すると、細胞接種物を1.1´106細胞/mlになるまで4Lのフェルンバッハ振とうフラスコ(Corning,Inc.)内で増殖させた。この振とうフラスコ培養を、37℃および5% CO2に維持した加湿インキュベーターに入れたInnova 2150シェーカープラットフォーム(News Brunswick Scientific、ニュージャージー州エディソン)上、65RPMで維持した。トランスフェクションの時点で、293−6E細胞を1.0´106細胞/mlに希釈した。
【0097】
トランスフェクション複合体を100mlのFreeStyle培地中で形成した。1mgのプラスミドDNAをまず培地に添加し、続いて3mlのFuGene HDトランスフェクション試薬(Roche Applied Science、インディアナ州インディアナポリス)を添加した。このトランスフェクション複合体を室温で約15分間インキュベートし、次いで振とうフラスコ内の細胞に添加した。トランスフェクションの24時間後に、20%(w/v)のペプトンTN1(OrganoTechnie S.A.,TeknieScience、カナダ国ケベック)を最終濃度0.5%(w/v)に達するまで添加した。このトランスフェクション/発現を4〜7日間実施した後、コンディショニングした培地を4,000RPM、4℃で60分間の遠心分離により収穫した。
【0098】
安定トランスフェクションおよび発現を下記に従って実施した。vActRIIB−ヒト(hu)IgG2−Fc細胞系列は、標準エレクトロポレーション法により、安定なCHO宿主細胞に発現プラスミドpDC323−vActRIIB(E28W)−huIgG2 FcおよびpDC324−vActRIIB(E28W)−huIgG2 Fcをトランスフェクションすることによって作製された(Bianchi et al., Biotech and Bioengineering, 84(4):439-444 (2003)に従う)。宿主細胞系列に発現プラスミドをトランスフェクションした後、GHTを含まない無血清選択培地中で細胞を2〜3週間増殖させてプラスミドを選択し、細胞を回収した。細胞を85%以上の生存率に達するまで選択した。このトランスフェクションした細胞のプールを、次いで150nMのメトトレキセートを含有する培地中で培養した。
【0099】
細胞系列クローニング
下記の方法に従って、選択したクローンから細胞バンクを調製した。安定トランスフェクションした細胞の増殖プールを96−ウェルプレートに播種し、候補クローンを増殖および生産性能について小規模試験で評価した。約60個のバイアルのプレマスター細胞バンク(pre−master cell bank(PMCB))を、選択したクローンから調製した。すべてのPMCBを無菌性、マイコプラズマおよびウイルスについて試験した。
【0100】
vActRIIB−Fc発現細胞系列を一般的な供給−バッチ法(fed−batch process)により規模拡大した。細胞をWaveバイオリアクター(Wave Biotech LLC)に接種した。培養物にボーラス供給物を3回供給した。10Lを10日目に収穫し、残りを11日目に収穫した;両収穫物を深層濾過(depth filtration)し、続いて無菌濾過した。コンディショニングした培地を10インチの0.45/0.2ミクロンプレフィルターで濾過し、続いて6インチの0.2ミクロンフィルターで濾過した。
【0101】
タンパク質の精製
ActRIIB−Fc(IgG1およびIgG2の両方)、ActRIIB5−Fc (IgG1およびIgG2の両方)、およびこれらのバリアントを含有する約5Lのコンディショニングした培地を、5ft2の10Kメンブレン接線流フィルター(Pall)で濃縮した。濃縮された材料を、PBS(Dulbecco;塩化マグネシウムまたは塩化カルシウムを含まないもの)で平衡化した5mLのProtein A High Performance Column(商標)(GE Healthcare)にアプライした。カラムを280nmにおける吸光度(OD280)が0.1未満になるまでこの平衡化用緩衝液で洗浄した後、結合しているタンパク質を0.1Mグリシン−HCl、pH2.7で溶離し、直ちに1Mトリス−HCl、pH8.5で中和した。中和した溶出プールを1mlの体積に濃縮し、PBS(Dulbecco;塩化マグネシウムまたは塩化カルシウムを含まないもの)中で平衡化した320mlのSephacryl−200カラム(GE Healthcare)にアプライした。4〜20% SDS PAGEゲル(Invitrogen)に流して、プールすべき画分を判定した。これらのポリペプチドを活性および凝集度について下記に従って試験した。
【0102】
場合により、たとえばShp−Sepharoseカラムを用いてポリペプチドをさらに精製することができる。OD280により濃度を測定した。
【0103】
実施例2
インビトロ活性アッセイ
前記に従って精製したvActRIIBポリペプチドの試料をリン酸緩衝化生理食塩水(PBS:2.67mMの塩化カリウム、138mMの塩化ナトリウム、1.47mMの一塩基性リン酸カリウム、8.1mMの二塩基性リン酸ナトリウム、pH7.4)で0.2mg/mlに希釈し、37℃で6日間インキュベートし、次いでMALDI−MS(matrix-assisted laser desorption/ionization mass spectrometry、マトリックス支援レーザー脱離/イオン化質量分析)、SECおよび/またはSEC−LS分析を行なった。下記に従って、プロテインA精製工程後の野生型およびバリアントポリペプチドの凝集をSECまたはSEC−LSにより判定し、これらの分子の分子量をMALDI−MS法により確認した。
【0104】
サイズ排除クロマトグラフィー(SEC).2本のカラム(TOSOHAAS G3000swxl、7.8x300mm)を縦列に備えたAgilent 1100 HPLCシステムで実験を行なった。2xPBSを移動相として0.5ml/分で用いた。
【0105】
サイズ排除クロマトグラフィー−光散乱(SEC−LS).Superdex−200ゲル濾過カラム(Amersham Pharmacia、ウィスコンシン州ウォーキショー)を備えたAgilent 1100 HPLCシステムで実験を行なった。次いで試料をWyatt miniDawn LSレーザー光散乱検出器およびWyatt Optilab DSP屈折計(Wyatt Technology Co.、カリフォルニア州サンタバーバラ)に導通して分子質量を測定した。PBSを移動相として0.4ml/分で用いた。
【0106】
マトリックス支援レーザー脱離/イオン化質量分析.試料をシナピン酸(sinapinic acid)と混合し(1:1)、MALDI−MS(Applied Biosystems Voyager System 2009)に付与した。この方法を用いて前記分子の分子量を確認した。
【0107】
下記に従ってアクチビンおよびミオスタチンに対する結合親和性を測定し、IC50値を求めた。
【0108】
定量BIAcore(登録商標)アッセイ.IgG1 Fcとの融合体において、前記に従ってE28およびR40をそれぞれ他の天然アミノ酸で置換した。これらは後記の表に示すようにリンカーを用いて、または用いずに作製された。コンディショニングした培地からそれぞれのvActRIIB−IgG1Fc試料を、ヤギ抗ヒトIgG1 Fc抗体(Jackson Immuno Research,cat# 109−005−098,lot 63550)コーティングしたCM5表面に捕獲した。20nMのアクチビンAを、BIACore2000(BIACore Life Sciences、ニュージャージー州ピスカッタウェイ)により捕獲試料の表面に注入した。得られたセンサーグラムを、捕獲されたvActRIIB−IgG1FcバリアントのRL(500RU)に対して正規化した。若干のバリアントについての正規化した結合応答(RU)を表2に示し、以下にさらに記載する。アクチビンに対する相対親和性を、哺乳動物細胞の発現から得られたコンディショニングした培地を用いてBiacore測定により同様に判定した。アクチビンA(20nM)を用いて、コンディショニングした培地中の可溶性受容体ポリペプチドを捕獲し、測定したSPR信号を正規化した。正規化したSPR +++++:>60,++++:40〜60,+++:20〜40,++:10〜20,+:5〜10,−:<5。
【0109】
表1Aおよび表1Bに、相対結合データの結果をまとめる。下記の表は、特定の態様のvActRIIB−IgG1Fcが特に、野生型より高い親和性でアクチビンAに結合し、あるいは野生型に匹敵する親和性を保持したことを示す。
【0110】
【表1A】

【0111】
【表1B】

【0112】
C2C12細胞ベースの活性アッセイ
vActRIIB5−IgG1FcおよびvActRIIB−IgG1Fcバリアントを前記に従って製造した。これらのバリアントがアクチビンIIB受容体へのアクチビンAまたはミオスタチンの結合を阻害する能力を、下記に従って細胞ベースの活性アッセイにより試験した。
【0113】
ミオスタチン/アクチビン/GDF−11応答性レポーター細胞系列は、C2C12筋芽細胞(ATCC No:CRL−1772)にpMARE−luc構築体をトランスフェクションすることにより作製した。pMARE−luc構築体は、ミオスタチン/アクチビン応答エレメントであるCAGA配列(Dennler et al. EMBO 17: 3091-3100 (1998))の12反復配列をpLuc−MCSレポーターベクター(Stratagene cat #219087)のTATAボックスの上流にクローニングすることにより作製される。C2C12細胞は、アクチビン受容体IIBをそれらの細胞表面に自然発現する。ミオスタチン/アクチビンA/GDF−11が細胞の受容体を結合すると、Smad経路が活性化され、リン酸化されたSmadが前記の応答エレメントに結合し(Macias-Silva et al. Cell 87:1215 (1996))、その結果ルシフェラーゼ遺伝子が発現する。次いでルシフェラーゼ活性を市販のルシフェラーゼレポーターアッセイキット(cat # E4550、Promega、ウィスコンシン州マディソン)により製造業者のプロトコルに従って測定した。pMARE−lucでトランスフェクションした安定な系列のC2C12細胞(C2C12/pMARE)を用い、下記の方法に従って活性を測定した。レポーター細胞を96ウェル培養器に播種した。野生型および前記に従って構築したバリアントActRIIB−IgG1 Fc融合体の希釈液を用いたスクリーニングを、4nMアクチビンに固定した濃度で実施した。アクチビンAを数種類の濃度の受容体と共にプレインキュベートした。処理した培養物中のルシフェラーゼ活性を判定することによりアクチビン活性を測定した。各ポリペプチドについてIC50値を判定した。これらを表2に示す。ミオスタチンの測定のために、前記に従って製造したActRIIB−huIgG2 Fc融合体について同じ操作を行なった。プロテインA精製した野生型およびバリアントを、ミオスタチンについて同じ方法によるIC50値の判定に用いた。この測定のために、ポリペプチドを4nMミオスタチンと共にプレインキュベートした。さらに、前記の方法を用いて凝集度を測定した。これらの値を下記の表3に示す。
【0114】
表1Aに挙げた一組のActRIIB5−IgG1 Fcバリアントのうち数種類のActRIIB−IgG1 Fcバリアントおよび3種類のActRIIB5−IgG1 Fcバリアントを野生型ポリペプチドと共にさらに精製し、SPR(表面プラズモン共鳴)により20nMのアクチビンAにおいて分析した。表2は、アクチビンに対する選択したvActRIIB−IgG1 FcポリペプチドのSPR結合親和性を示す。アクチビンA(20nM)を用いて試料中のvActRIIBポリペプチドを捕獲し、測定したSPR信号を正規化した。前記の細胞ベースのアクチビン阻害アッセイからIC50値を求めた。標準誤差はすべての結果について10%未満であった。
【0115】
【表2】

【0116】
上記の表2に前記で示したように、野生型と比較して、アクチビン遮断に対するvActRIIB−IgG1Fc(E28W)のIC50値は2.07nMであり、vActRIIB−IgG1Fc(E28Y)のIC50値は2.1nMであった。さらに、vActRIIB−IgG1FcのE28WおよびE28Yバリアントはいったん精製すると安定であり、凝集しなかった。
【0117】
他のバリアントポリペプチドについても細胞ベースのミオスタチン遮断アッセイにおいてIC50値を判定した。これらのバリアントは、シグナル配列およびN−末端の最初の6個のアミノ酸を欠如するトランケートした成熟vActRIIBポリペプチドであった。これらの配列を表3に示す。表3は、プロテインA精製後のタンパク質の凝集率、およびミオスタチンに対するIC50値を示す。凝集率は野生型と比較してバリアントポリペプチドの方がはるかに低いことが分かる。シグナル配列およびN−末端の4個のアミノ酸を含まず、下記に示すものと同一の置換をもつトランケートした成熟vActRIIBポリペプチドについても、同様な結果が得られた。
【0118】
表3
【0119】
【表3−1】

【0120】
【表3−2】

【0121】
表4は、配列表のSEQ ID NO:1〜99に対応する配列を確認する。
【0122】
【表4−1】

【0123】
【表4−2】

【0124】
【表4−3】

【0125】
【表4−4】

【0126】
実施例3
vActRIIBを用いたインビボ処置
下記の動物実験はすべて、トランケートした成熟vActRIIB−IgG2 Fc(E28W)ポリペプチド(SEQ ID NO:91)を用い、下記の方法に従って実施された。
【0127】
インヒビン−α−欠損マウスにおける筋消耗の処置
インヒビン−αは自然界に存在するアクチビンA阻害物質である。インヒビン−αを欠如するマウスは、有意に上昇した循環中アクチビンA濃度を示し、腫瘍、たとえば卵巣癌、精巣癌および副腎癌の自然形成に関連する致命的な消耗症候群を伴う(Matzuk et al., PNAS 91(19):8817-21 (1994), Cipriano et al. Endocrinology 121(7): 2319-27(2000), Matzuk et al., Nature 360(6402):313-9 (1992))。下記の実験のために、インヒビン-αノックアウトマウス(C57BL/6J)をCharles River Laboratoriesから入手した。vActRIIB−IgG2 Fc E28W(SEQ ID NO:91)(以下、E28W、またはE28Wポリペプチド、または可溶性受容体E28W)が体重および筋量に及ぼす影響を、インヒビン−αノックアウトマウスにおいて調べた。8週齢の雄のインヒビン−αノックアウトマウスにおける14日間の一回注射試験を実施した。8週齢の時点で、雄のインヒビン−αノックアウトマウスは同齢の野生型同腹仔対照マウスと比較して体重が25%以上減少していた。5匹のノックアウトマウスに一回のE28W(30mg/kg)皮下注射を行ない、一方、5匹のノックアウトマウスに等体積のPBS(ビヒクル)を0日目に皮下投与した。ベースライン対照として、5匹の同齢の野生型マウスに0日目にビヒクルの一回皮下注射を行なった。マウスを0、7および14日目に秤量した。14日目の終了時にすべての動物を屠殺し、それらの除脂肪屠殺体重および腓筋量を剖検により分析した。14日間の試験期間にわたって、ビヒクル処置したノックアウトマウスの体重は0日目の22.5gから14日目の21.4gまで約1.1g減少した。これに対し、E28W処置したノックアウトマウスの平均体重は、0日目の22.1gから14日目の33.1gまで11gの劇的な増加を示した。最終剖検分析により、下記に示すようにインヒビン−αノックアウトマウスにおいてE28Wポリペプチドは除脂肪屠殺体重および腓筋量を実質的に倍増させることが明らかになった。E28W処置したノックアウトマウスの平均除脂肪屠殺体重は、約14.9gであった;ビヒクル処置したノックアウトマウスについての約8.0g、およびビヒクル処置した野生型マウスについての約12.1gと比較。E28W処置したノックアウトマウスの腓筋重量(両足からのもの)は、約426mgであった;ビヒクル処置したノックアウトマウスについての約209mg、およびビヒクル処置した野生型マウスについての約324mgと比較。これらの結果は、体重減少および筋消耗の疾病状態の処置に対するE28Wポリペプチドの有効性を示し、それらを下記の表にまとめる。
【0128】
【表5】

【0129】
*:野生型+ビヒクルと比較してP<0.05;#:ノックアウト+ビヒクルと比較してP<0.05。
【0130】
E28Wポリペプチドの投与が精巣および卵巣の腫瘍の形成率に及ぼす影響を、それぞれ雄および雌のインヒビン−αノックアウトマウスにおいて試験した。この試験では、8週齢の雄(n=5)および9週齢の雌(n=6)を含む11匹のインヒビン−αノックアウトマウスを一回のE28W(30mg/kg)皮下注射により処置し、一方、同齢の雄(n=5)および雌(n=6)を含む他の11匹のインヒビン−αノックアウトマウスに等体積のPBS(ビヒクル)を一回注射した。さらに、同齢の雄(n=5)および雌(n=6)を含む11匹の野生型同腹仔対照マウスに一回のビヒクル注射を行なった。処置の2週間後、マウスを屠殺し、剖検して、目視確認可能な精巣および卵巣の腫瘍の形成率を調べた。ビヒクル処置したノックアウトマウス11匹中の10匹が確認可能な腫瘍を発症したことが観察された。具体的には、精巣および卵巣の腫瘍形成が、試験した5匹中5匹の雄、および6匹中5匹の雌にそれぞれ見られた。これらの腫瘍のサイズは対応する野生型対照マウスの正常な精巣または卵巣より2〜3倍大きいことが認められた。これを図3に示す。E28W処置したインヒビン−αノックアウトマウスのうちわずか10%(11匹中の1匹)が目視確認可能な腫瘍形成を示した。具体的には、雌の場合はE28W処置したノックアウトマウス6匹中の1匹が確認可能な卵巣腫瘍を発症し、一方、処置しなかった6匹中5匹のノックアウト雌は同齢の野生型対照と比較して卵巣のサイズまたは目視形態にほとんどまたは全く変化がなかった。E28W処置した雄のノックアウトマウス5匹中5匹が目視可能な腫瘍を示さず、同齢の野生型対照と比較して精巣のサイズまたは目視形態にほとんどまたは全く変化がなかった。これらの結果は、E28W投与がインヒビン−αノックアウトマウスにおいて精巣および卵巣の腫瘍形成を減少させるのに有効であったことを証明し、癌療法における可溶性受容体療法の臨床有用性を示唆する。
【0131】
食欲低下症の処置におけるE28Wポリペプチドの有効性を雄のインヒビン−αノックアウトマウスにおいて調べた。この試験で、インヒビン−αノックアウトマウス(n=5)における飼料消費量は、同齢の野生型マウス(n=10)と比較して有意に減少した。E28W処置したインヒビン−αノックアウトマウスの飼料摂取量は、3週間の試験期間中に有意に増加することが観察された。E28W処置したノックアウトマウスにおける1週間の平均飼料摂取量は同齢の野生型対照マウスのものよりわずかに高いレベルまで増加し、ビヒクルで処置したノックアウトの1週間の平均飼料摂取量より約50%多かった。したがって、このデータはE28W処置がインヒビン−αノックアウトマウスにおいて食欲低下症の改善にきわめて有効であったことを示す。
【0132】
E28W処置が生存率に及ぼす影響を、それぞれ雄および雌のインヒビン−αノックアウトマウスにおいて調べた。雄については約50日齢のインヒビン−αノックアウトマウス25匹にE28Wポリペプチドを投与し(10mg/kg/週、皮下)、一方、同齢のインヒビン−αノックアウト雄マウス26匹にビヒクル(PBS)を投与した。同齢の野生型雄マウス19匹にビヒクルを投与し、ベースライン対照として用いた。ビヒクル処置したノックアウトマウスは試験の15日目(約65日齢)に死亡し始めた。実験の34日目(約84日齢)までに、ビヒクル処置したノックアウトマウスの50%が死亡し、78日目(約128日齢)までに、それらの100%が死亡した。これに対し、E28Wポリペプチドで処置した25匹のノックアウトマウス、またはビヒクル処置した19匹の野生型対照マウスは、試験の78日目(約128日齢)以前には全く死亡しなかった。E28W処置したノックアウトマウスにおいては、25匹中の1匹が試験の78日目(約128日齢)に死亡し、25匹中の24匹が100日目(約150日齢)を超えて生存した。ビヒクル処置した野生型対照マウスは100日の試験期間中、死亡しなかった。雌のインヒビン−αノックアウトマウスにおいても同様な生存結果が得られた。約50日齢の雌のインヒビン−αノックアウトマウス22匹をE28Wで処置し(10mg/kg/週、皮下)、一方、同齢の雌のインヒビン−αノックアウトマウス23匹をPBS(ビヒクル)で処置した。その間に17匹の野生型雌対照マウスをビヒクルで処置した。ビヒクル処置した雌のノックアウトマウスは試験の40日目(約90日齢)に死亡し始めた。実験の58日目(約108日齢)までに、ビヒクル処置した雌のノックアウトマウスの50%が死亡し、86日目(約136日齢)までに、それらの100%が死亡した。これに対し、E28W処置した雌のノックアウトマウスの約5%(22匹中の1匹)が死亡したにすぎず、一方、約90%(22匹中の20匹)が試験の120日目(約170日齢)を超えて生存した。ビヒクル処置した野生型対照マウスは120日の試験期間中、死亡しなかった。したがって、このデータはE28Wポリペプチド療法が雄および雌両方のインヒビン−αノックアウトマウスの生存を劇的に延長するのに有効であることを証明する。雄および雌両方のインヒビン−αノックアウトマウスについての模式的な生存率曲線のプロットを図4に示す。
【0133】
大腸−26腫瘍を保有するマウスにおける筋消耗の処置
大腸−26腫瘍を保有するマウスは、癌性悪液質の研究のための前臨床動物モデルとして広く用いられている(Fujita et al., Int J Cancer 68(5):637-43 (1996), Kwak et al., Cancer Research 64(22):8193-8 (2004))。E28Wポリペプチドが体重変化、筋量および生存率に及ぼす影響を、この腫瘍保有マウスにおいて調べた。大腸−26(C−26)腫瘍細胞を10週齢の雄CDF1マウス40匹にマウス当たり0.5x106細胞で皮下移植した。腫瘍の移植を0日目に実施した。腫瘍移植後5日目に開始して、20匹のC−26マウスを10mg/kgのvActRIIB IgG2 Fc E28W(SEQ ID NO:91)の皮下注射により毎週処置し、一方、20匹のC−26マウスをビヒクル(PBS)で処置した。同時に10匹の同齢および同体重の正常マウスをビヒクル(PBS)のみで処置した。体重および飼料摂取量を週3回測定した。腫瘍保有マウスを生存について1日2回検査した。腫瘍サイズを、PCコンピューターに接続したカリパス(Ultra−Cal IV IP65電気カリパス、Fred V Fowler Co.、マサチュセッツ州ボストン)で測定し、数値をMicrosoft Excelデータファイルのワークシートに自動的に記録した。図5に示すように、腫瘍移植の2週間後に、C−26腫瘍を保有するマウスは重篤な悪液質を発症し、それらの体重が劇的に減少した。E28W処置は、腫瘍保有マウスにおいて体重減少を効果的に軽減した。E28Wで処置した腫瘍保有マウスの平均体重は、ビヒクルで処置した腫瘍保有マウスのものより有意に高かった(p<0.001、腫瘍移植後7日目から33日目まで、不対T検定、Graph pad Software Inc.、カリフォルニア州サンディエゴ)。
【0134】
E28Wポリペプチド処置グループとビヒクル処置グループの間に腫瘍サイズの変化はなく、これはこの処置がC−26腫瘍の増殖に対しては影響をもたなかったことを示唆する。最終剖検分析は、E28W処置したC−26腫瘍保有マウスの平均除脂肪屠殺体重および腓筋重量がビヒクルで処置した腫瘍保有マウスのものより有意に高いことを示した(p<0.001、除脂肪屠殺体重および腓筋重量の両方について)。E28WがC−26腫瘍保有マウスの生存率に及ぼす影響を図6に示す。ビヒクル処置マウスは、腫瘍移植後、約14日目に死亡し始めた。腫瘍移植後35日目に、ビヒクル処置したC−26腫瘍保有マウス20匹すべてが死亡した;しかし、E28Wで処置したC−26腫瘍保有マウス20匹中の17匹がなお生存していた。したがって、E28W処置はC−26腫瘍保有マウスの有意の生存延長をもたらした(p<0.0001、カイ二乗検定)。したがって、E28Wポリペプチドは、C−26腫瘍保有マウスの体重および筋量の維持だけでなく、生存延長にも有効であった。
【0135】
後足懸垂マウスの処置
後足懸垂マウスモデルを用いて、vActRIIB−IgG2 Fc E28W(SEQ ID NO:91)が非活動状態の筋量に及ぼす影響を調べた。後足懸垂法は、先にCarlson CJ el al(Carlson CJ, Booth FW and Gordon SE: Am J Physiol Regul Integr Comp Physiol. 277: R601-RR606, 1999)が報告したものと本質的に同じである。9週齢の雌C57BL/6マウスを試験に用いた。合計60匹のマウスを下記に従って3グループに分けた:1.懸垂しないベースライン対照グループ(20匹)をビヒクル(PBS)で処置したもの、2.後足懸垂グループ(20匹)をビヒクルで処置したもの、および3.後足懸垂マウスグループ(20匹)をvActRIIB−IgG2 Fc,E28Wで処置したもの。具体的には、30mg/kgのvActRIIB−IgG2 Fc E28Wまたはビヒクルの一回皮下注射を、前記のグループそれぞれに後足懸垂の開始時点で行なった。長期間にわたり体重変化を週2〜3回測定した。各グループから5匹のマウスを下記の4つの異なる時点で屠殺した:1日目、3日目、7日目、および14日目。腓筋重量を剖検により測定した。
【0136】
下記の表に示すように、後足懸垂により最高10%の有意の体重減少が生じた。ANOVAにより分析したところ、後足懸垂マウスをvActRIIB−IgG2 Fc E28Wで処置すると、ビヒクル処置した後足懸垂グループまたは懸垂しなかったベースライン対照グループより高いレベルにまで有意の体重増加が生じた。2週間の試験期間中、vActRIIB−IgG2 Fc E28W(SEQ ID NO:91)処置グループの平均体重増加は12.6%であった;それぞれ、ビヒクル処置した懸垂グループの0.2%減少、および懸垂しなかったベースライン対照グループの4.8%増加と比較。時間経過剖検結果は、後足の筋量が体重と平行して変化することを示した。懸垂マウスをvActRIIB−IgG2 Fc(E28W)で処置すると、筋損失は完全に軽減した。したがって、この実験の結果はE28Wが非活動に関連する筋萎縮の処置に有効であることを示す。
【0137】
【表6】

【0138】
OVXマウスの処置
卵巣摘除した雌C57Bl6マウス(OVX)は、雌の生殖腺機能低下症および骨粗鬆症のモデルであるとみなされる。24匹の雌C57Bl6マウスを3カ月齢で卵巣摘除し、3カ月間回復させた。6カ月齢で24匹のOVXマウスおよび24匹の同齢の擬似手術した対照C57Bl6マウスを、体重、筋量および脂肪量(NMRにより)、ならびに骨量(PIXImus-GE LUNAR Corporation)の長期間にわたる変化について3カ月間の処置期間にわたって測定した。この期間の終了時に動物を屠殺し、最終剖検に際して骨組織を採集し、Faxitron X線分析およびmicroCT分析(Faxitron X−ray CorporationおよびGE Medical system)を行なった。E28Wバリアント受容体(SEQ ID NO:91)は体重、具体的には除脂肪筋量および骨量を増加させ、一方ではマウスの脂肪含量を卵巣摘除していないマウスにみられるレベルまで低下させるのに有効であることが証明された。具体的には、12週間にわたって、除脂肪筋量はE28Wで処置したOVXマウスについて20gから27.0gまで増加した;E28Wで処置した擬似手術マウスについての20gから27.5gまでと比較、OVX+ビヒクルまたは擬似手術+ビヒクルについて除脂肪筋量がほとんど増加しなかった(OVX+ビヒクルについては約19g、野生型+ビヒクルについては約20g)のと比較。同じ試験において、E28Wで処置したOVXマウスは、12週間の試験の終了時までに動物当たり8g平均から動物当たり4g平均までの脂肪量減少を示した;これは擬似手術した動物に匹敵する。これに対し、ビヒクルで処置したOVXマウスは、試験期間中のいずれの時点でも脂肪量が減少しなかった。最後に、骨量は、E28Wで処置したOVXマウスにおいてビヒクル処置したOVXマウスと比較して増加した。最終剖検に際して採集した大腿骨/脛骨のBMC(骨無機質含量)分析をpQCT分析(Peripheral Quantitative Computed Tomography、末梢定量コンピュータ断層撮影)により行なった。E28Wで処置したOVXマウスは、約0.045g/cmのBMCが12週間の試験の終了時に約0.055g/cmに増加した;これは擬似手術したビヒクル処置動物の最終BMCに匹敵する。ビヒクルで処置したOVXマウスは、12週間の試験の終了時にほぼ同じ約0.045g/cmのBMCを示した。E28W処置した野生型マウスは、12週間の試験の終了時に0.054g/cmから約0.065g/cmまでのBMC増加を示した。これらの試験は、加齢における虚弱質、骨粗鬆症、および肥満症の有望な処置としてのE28Wポリペプチドの有効性を証明する。
【0139】
本発明は本明細書に記載する具体例による範囲に限定されない;これらは本発明の個々の観点の一例としてのものにすぎず、機能的に均等な方法および構成要素は本発明の範囲に含まれる。実際に、以上の記載および添付の図面から、本明細書に提示および記載したもののほか、本発明の種々の態様が当業者に自明であろう。そのような態様は特許請求の範囲に含まれるものとする。
【特許請求の範囲】
【請求項1】
バリアントアクチビンIIB受容体ポリペプチド(vActRIIB)を含む単離されたタンパク質であって、該ポリペプチドが、位置28または位置40における一アミノ酸置換以外はポリペプチド配列SEQ ID NO:2またはSEQ ID NO:18を含み、該ポリペプチドがミオスタチン、アクチビンAまたはGDF−11を結合することができる、前記タンパク質。
【請求項2】
バリアントアクチビンIIB受容体ポリペプチド(vActRIIB)を含む単離されたタンパク質であって、該ポリペプチドが、位置28および位置40における一アミノ酸置換以外はポリペプチド配列SEQ ID NO:2およびSEQ ID NO:18を含み、該ポリペプチドがミオスタチン、アクチビンAまたはGDF−11を結合することができる、前記タンパク質。
【請求項3】
vActRIIBポリペプチドの位置28における置換が、Eに代わってA、F、Q、V、I、L、M、K、H、WおよびYからなる群から選択される、請求項1のタンパク質。
【請求項4】
vActRIIBポリペプチドの位置28における置換が、Eに代わってA、F、Q、V、I、L、M、K、H、WおよびYからなる群から選択される、請求項2のタンパク質。
【請求項5】
vActRIIBポリペプチドの位置28における置換が、Eに代わってA、WおよびYからなるアミノ酸の群から選択される、請求項1のタンパク質。
【請求項6】
vActRIIBポリペプチドの位置28における置換が、Eに代わってA、WおよびYからなるアミノ酸の群から選択される、請求項2のタンパク質。
【請求項7】
vActRIIBポリペプチドの位置40における置換が、Rに代わってG、Q、M、H、KおよびNからなるアミノ酸の群から選択される、請求項1のタンパク質。
【請求項8】
vActRIIBポリペプチドの位置40における置換が、Rに代わってA、G、Q、M、H、KおよびNからなるアミノ酸の群から選択される、請求項2のタンパク質。
【請求項9】
vActRIIBポリペプチドの位置28における置換がEに代わってA、F、Q、V、I、L、M、K、H、WおよびYからなるアミノ酸の群から選択され、かつ位置40における置換がRに代わってA、G、Q、M、H、KおよびNのアミノ酸の群から選択される、請求項2のタンパク質。
【請求項10】
vActRIIBポリペプチドの位置28における置換が、Eに代わってWである、請求項1のタンパク質。
【請求項11】
vActRIIBポリペプチドの位置28における置換がEに代わってAであり、かつ位置40における置換がRに代わってAである、請求項2のタンパク質。
【請求項12】
vActRIIBポリペプチドがN−末端シグナル配列を欠如する、請求項1〜11のいずれか1項のタンパク質。
【請求項13】
vActRIIBポリペプチドがN−末端酸シグナル配列および成熟N−末端の4または6個のアミノ酸を欠如する、請求項1〜11のいずれか1項のタンパク質。
【請求項14】
vActRIIBポリペプチドが少なくとも1つのヘテロロガスポリペプチドに融合している、請求項12のタンパク質。
【請求項15】
vActRIIBポリペプチドが少なくとも1つのヘテロロガスポリペプチドに融合している、請求項13のタンパク質。
【請求項16】
ヘテロロガスポリペプチドがヒトFcドメインである、請求項14のタンパク質。
【請求項17】
ヘテロロガスポリペプチドがヒトFcドメインである、請求項15のタンパク質。
【請求項18】
ポリペプチドがSEQ ID NO:60、62、64、68、70および72からなる群から選択される、請求項16のタンパク質。
【請求項19】
ポリペプチドがSEQ ID NO:91、93、95および97からなる群から選択される、請求項17のタンパク質。
【請求項20】
vActRIIBポリペプチドを含む単離されたタンパク質であって、ポリペプチドがSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97の配列を有するポリペプチドの群から選択されるタンパク質。
【請求項21】
下記からなる群から選択されるポリヌクレオチドを含む、単離された核酸分子:
(a)SEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、67、69、71、92、94、および96からなる群に示す配列を有するポリヌクレオチドまたはその相補体;ならびに
(b)SEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97からなる群に示すアミノ酸配列を有するポリペプチドをコードするポリヌクレオチド。
【請求項22】
ポリヌクレオチドが転写または翻訳調節配列に作動可能な状態で結合している、請求項21の核酸分子。
【請求項23】
転写または翻訳配列が転写プロモーターまたはエンハンサーを含む、請求項22の核酸分子。
【請求項24】
請求項21の核酸分子の発現を指令する組換えベクター。
【請求項25】
請求項21の核酸分子を発現するように遺伝子工学的に処理された宿主細胞。
【請求項26】
宿主細胞が哺乳動物細胞である、請求項25の宿主細胞。
【請求項27】
請求項20のタンパク質を産生するように遺伝子工学的に処理された宿主細胞。
【請求項28】
vActRIIBポリペプチドを製造する方法であって、請求項27の宿主細胞を該タンパク質の発現を促進する条件下で培養し、そして該タンパク質を回収することを含む、前記方法。
【請求項29】
有効量の請求項20のタンパク質を医薬的に許容できるキャリヤーと混合したものを含む医薬組成物。
【請求項30】
その処置を必要とする対象においてミオスタチン活性を阻害する方法であって、療法有効量の請求項29の組成物を対象に投与することを含む、前記方法。
【請求項31】
その処置を必要とする対象において除脂肪筋量を増加させる方法であって、療法有効量の請求項29の組成物を対象に投与することを含む、前記方法。
【請求項32】
その処置を必要とする対象において脂肪に対する除脂肪筋量の比率を高める方法であって、療法有効量の請求項29の組成物を対象に投与することを含む、前記方法。
【請求項33】
その処置を必要とする対象において筋消耗性の疾患または障害を処置する方法であって、療法有効量の請求項29の組成物を対象に投与することを含む、前記方法。
【請求項34】
筋消耗性の疾患が癌性悪液質である、請求項33の方法。
【請求項35】
筋消耗性の疾患または障害が、筋ジストロフィー、筋萎縮性側索硬化症、うっ血性閉塞性肺疾患、慢性心不全、癌性悪液質、エイズ、腎不全、尿毒症、リウマチ性関節炎、加齢性サルコペニア、臓器萎縮症、手根管症候群、アンドロゲン欠乏、火傷傷害、糖尿病、および長期間の床上安静、脊髄損傷、卒中、骨折、加齢または極微重力曝露による筋消耗から選択される、請求項33の方法。
【請求項36】
その処置を必要とする対象において代謝障害を処置する方法であって、療法有効量の請求項29の組成物を対象に投与することを含む、前記方法。
【請求項37】
代謝障害が、糖尿病、肥満症、高血糖症、および骨損失から選択される、請求項36の方法。
【請求項38】
代謝障害が骨損失である、請求項36の方法。
【請求項39】
その処置を必要とする対象においてアクチビンが過剰発現する疾患を処置する方法であって、療法有効量の請求項29の組成物を対象に投与することを含む、前記方法。
【請求項40】
疾患が癌である、請求項39の方法。
【請求項41】
疾患が精巣または卵巣の癌である、請求項40の方法。
【請求項42】
その処置を必要とする対象において悪液質を処置する方法であって、有効量の請求項29の組成物を対象に投与することを含む、前記方法。
【請求項43】
悪液質が、癌、糖尿病性腎障害、火傷傷害、腎不全、およびリウマチ性関節炎から生じる、請求項42の方法。
【請求項44】
その処置を必要とする対象において腫瘍塊のサイズを縮小する方法であって、有効量の請求項29の組成物を対象に投与することを含む、前記方法。
【請求項45】
腫瘍塊が精巣または卵巣の癌から生じる、請求項44の方法。
【請求項46】
その処置を必要とする対象において筋消耗性障害を処置する方法であって、請求項24のベクターを対象に投与することを含み、その際ベクターは対象においてvActRIIBポリペプチドの発現を指令することができる、前記方法。
【請求項47】
ベクターがAAVベクターである、請求項46の方法。
【請求項1】
バリアントアクチビンIIB受容体ポリペプチド(vActRIIB)を含む単離されたタンパク質であって、該ポリペプチドが、位置28または位置40における一アミノ酸置換以外はポリペプチド配列SEQ ID NO:2またはSEQ ID NO:18を含み、該ポリペプチドがミオスタチン、アクチビンAまたはGDF−11を結合することができる、前記タンパク質。
【請求項2】
バリアントアクチビンIIB受容体ポリペプチド(vActRIIB)を含む単離されたタンパク質であって、該ポリペプチドが、位置28および位置40における一アミノ酸置換以外はポリペプチド配列SEQ ID NO:2およびSEQ ID NO:18を含み、該ポリペプチドがミオスタチン、アクチビンAまたはGDF−11を結合することができる、前記タンパク質。
【請求項3】
vActRIIBポリペプチドの位置28における置換が、Eに代わってA、F、Q、V、I、L、M、K、H、WおよびYからなる群から選択される、請求項1のタンパク質。
【請求項4】
vActRIIBポリペプチドの位置28における置換が、Eに代わってA、F、Q、V、I、L、M、K、H、WおよびYからなる群から選択される、請求項2のタンパク質。
【請求項5】
vActRIIBポリペプチドの位置28における置換が、Eに代わってA、WおよびYからなるアミノ酸の群から選択される、請求項1のタンパク質。
【請求項6】
vActRIIBポリペプチドの位置28における置換が、Eに代わってA、WおよびYからなるアミノ酸の群から選択される、請求項2のタンパク質。
【請求項7】
vActRIIBポリペプチドの位置40における置換が、Rに代わってG、Q、M、H、KおよびNからなるアミノ酸の群から選択される、請求項1のタンパク質。
【請求項8】
vActRIIBポリペプチドの位置40における置換が、Rに代わってA、G、Q、M、H、KおよびNからなるアミノ酸の群から選択される、請求項2のタンパク質。
【請求項9】
vActRIIBポリペプチドの位置28における置換がEに代わってA、F、Q、V、I、L、M、K、H、WおよびYからなるアミノ酸の群から選択され、かつ位置40における置換がRに代わってA、G、Q、M、H、KおよびNのアミノ酸の群から選択される、請求項2のタンパク質。
【請求項10】
vActRIIBポリペプチドの位置28における置換が、Eに代わってWである、請求項1のタンパク質。
【請求項11】
vActRIIBポリペプチドの位置28における置換がEに代わってAであり、かつ位置40における置換がRに代わってAである、請求項2のタンパク質。
【請求項12】
vActRIIBポリペプチドがN−末端シグナル配列を欠如する、請求項1〜11のいずれか1項のタンパク質。
【請求項13】
vActRIIBポリペプチドがN−末端酸シグナル配列および成熟N−末端の4または6個のアミノ酸を欠如する、請求項1〜11のいずれか1項のタンパク質。
【請求項14】
vActRIIBポリペプチドが少なくとも1つのヘテロロガスポリペプチドに融合している、請求項12のタンパク質。
【請求項15】
vActRIIBポリペプチドが少なくとも1つのヘテロロガスポリペプチドに融合している、請求項13のタンパク質。
【請求項16】
ヘテロロガスポリペプチドがヒトFcドメインである、請求項14のタンパク質。
【請求項17】
ヘテロロガスポリペプチドがヒトFcドメインである、請求項15のタンパク質。
【請求項18】
ポリペプチドがSEQ ID NO:60、62、64、68、70および72からなる群から選択される、請求項16のタンパク質。
【請求項19】
ポリペプチドがSEQ ID NO:91、93、95および97からなる群から選択される、請求項17のタンパク質。
【請求項20】
vActRIIBポリペプチドを含む単離されたタンパク質であって、ポリペプチドがSEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97の配列を有するポリペプチドの群から選択されるタンパク質。
【請求項21】
下記からなる群から選択されるポリヌクレオチドを含む、単離された核酸分子:
(a)SEQ ID NO:3、5、7、9、11、13、15、19、21、23、25、27、29、31、33、35、37、39、41、43、45、51、53、55、59、61、63、65、67、69、71、92、94、および96からなる群に示す配列を有するポリヌクレオチドまたはその相補体;ならびに
(b)SEQ ID NO:4、6、8、10、12、14、16、20、22、24、26、28、30、32、34、36、38、40、42、44、46、52、54、56、60、62、64、66、68、70、72、87、88、91、93、95、および97からなる群に示すアミノ酸配列を有するポリペプチドをコードするポリヌクレオチド。
【請求項22】
ポリヌクレオチドが転写または翻訳調節配列に作動可能な状態で結合している、請求項21の核酸分子。
【請求項23】
転写または翻訳配列が転写プロモーターまたはエンハンサーを含む、請求項22の核酸分子。
【請求項24】
請求項21の核酸分子の発現を指令する組換えベクター。
【請求項25】
請求項21の核酸分子を発現するように遺伝子工学的に処理された宿主細胞。
【請求項26】
宿主細胞が哺乳動物細胞である、請求項25の宿主細胞。
【請求項27】
請求項20のタンパク質を産生するように遺伝子工学的に処理された宿主細胞。
【請求項28】
vActRIIBポリペプチドを製造する方法であって、請求項27の宿主細胞を該タンパク質の発現を促進する条件下で培養し、そして該タンパク質を回収することを含む、前記方法。
【請求項29】
有効量の請求項20のタンパク質を医薬的に許容できるキャリヤーと混合したものを含む医薬組成物。
【請求項30】
その処置を必要とする対象においてミオスタチン活性を阻害する方法であって、療法有効量の請求項29の組成物を対象に投与することを含む、前記方法。
【請求項31】
その処置を必要とする対象において除脂肪筋量を増加させる方法であって、療法有効量の請求項29の組成物を対象に投与することを含む、前記方法。
【請求項32】
その処置を必要とする対象において脂肪に対する除脂肪筋量の比率を高める方法であって、療法有効量の請求項29の組成物を対象に投与することを含む、前記方法。
【請求項33】
その処置を必要とする対象において筋消耗性の疾患または障害を処置する方法であって、療法有効量の請求項29の組成物を対象に投与することを含む、前記方法。
【請求項34】
筋消耗性の疾患が癌性悪液質である、請求項33の方法。
【請求項35】
筋消耗性の疾患または障害が、筋ジストロフィー、筋萎縮性側索硬化症、うっ血性閉塞性肺疾患、慢性心不全、癌性悪液質、エイズ、腎不全、尿毒症、リウマチ性関節炎、加齢性サルコペニア、臓器萎縮症、手根管症候群、アンドロゲン欠乏、火傷傷害、糖尿病、および長期間の床上安静、脊髄損傷、卒中、骨折、加齢または極微重力曝露による筋消耗から選択される、請求項33の方法。
【請求項36】
その処置を必要とする対象において代謝障害を処置する方法であって、療法有効量の請求項29の組成物を対象に投与することを含む、前記方法。
【請求項37】
代謝障害が、糖尿病、肥満症、高血糖症、および骨損失から選択される、請求項36の方法。
【請求項38】
代謝障害が骨損失である、請求項36の方法。
【請求項39】
その処置を必要とする対象においてアクチビンが過剰発現する疾患を処置する方法であって、療法有効量の請求項29の組成物を対象に投与することを含む、前記方法。
【請求項40】
疾患が癌である、請求項39の方法。
【請求項41】
疾患が精巣または卵巣の癌である、請求項40の方法。
【請求項42】
その処置を必要とする対象において悪液質を処置する方法であって、有効量の請求項29の組成物を対象に投与することを含む、前記方法。
【請求項43】
悪液質が、癌、糖尿病性腎障害、火傷傷害、腎不全、およびリウマチ性関節炎から生じる、請求項42の方法。
【請求項44】
その処置を必要とする対象において腫瘍塊のサイズを縮小する方法であって、有効量の請求項29の組成物を対象に投与することを含む、前記方法。
【請求項45】
腫瘍塊が精巣または卵巣の癌から生じる、請求項44の方法。
【請求項46】
その処置を必要とする対象において筋消耗性障害を処置する方法であって、請求項24のベクターを対象に投与することを含み、その際ベクターは対象においてvActRIIBポリペプチドの発現を指令することができる、前記方法。
【請求項47】
ベクターがAAVベクターである、請求項46の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2010−519931(P2010−519931A)
【公表日】平成22年6月10日(2010.6.10)
【国際特許分類】
【出願番号】特願2009−552758(P2009−552758)
【出願日】平成20年3月6日(2008.3.6)
【国際出願番号】PCT/US2008/003119
【国際公開番号】WO2008/109167
【国際公開日】平成20年9月12日(2008.9.12)
【出願人】(500203709)アムジェン インコーポレイテッド (76)
【Fターム(参考)】
【公表日】平成22年6月10日(2010.6.10)
【国際特許分類】
【出願日】平成20年3月6日(2008.3.6)
【国際出願番号】PCT/US2008/003119
【国際公開番号】WO2008/109167
【国際公開日】平成20年9月12日(2008.9.12)
【出願人】(500203709)アムジェン インコーポレイテッド (76)
【Fターム(参考)】
[ Back to top ]

