パパイア発酵物を有効成分とする末梢血単核球細胞の活性調節用組成物
【課題】本発明は、優れた末梢血単核球細胞の活性調節用組成物を提供することにある。
【解決手段】本発明の発明者らはパパイア発酵物の有効性について鋭意研究を重ねた結果、該発酵物に末梢血単核球細胞の活性を調節する優れた作用を有することを見出し本発明の完成するに至った。即ち、本発明はパパイア発酵物を有効成分として含有する末梢血単核球細胞の活性調節用組成物を提供するものである。本発明にかかる組成物は、末梢血単核球細胞の活性調節作用を有するパパイア発酵物を含むことから、末梢血単核球細胞の活性を調節する作用を有する。また、本発明はパパイア発酵物を有効成分として含有する末梢血単核球細胞の活性調節用組成物を含む飲食物、健康食品又は飼料添加物(以下、飲食物等)を提供するものである。本発明にかかる組成物を含む飲食物等には、末梢血単核球細胞の活性調節作用を有するパパイア発酵物を含むことから、末梢血単核球細胞の活性を調節する作用を有する。
【解決手段】本発明の発明者らはパパイア発酵物の有効性について鋭意研究を重ねた結果、該発酵物に末梢血単核球細胞の活性を調節する優れた作用を有することを見出し本発明の完成するに至った。即ち、本発明はパパイア発酵物を有効成分として含有する末梢血単核球細胞の活性調節用組成物を提供するものである。本発明にかかる組成物は、末梢血単核球細胞の活性調節作用を有するパパイア発酵物を含むことから、末梢血単核球細胞の活性を調節する作用を有する。また、本発明はパパイア発酵物を有効成分として含有する末梢血単核球細胞の活性調節用組成物を含む飲食物、健康食品又は飼料添加物(以下、飲食物等)を提供するものである。本発明にかかる組成物を含む飲食物等には、末梢血単核球細胞の活性調節作用を有するパパイア発酵物を含むことから、末梢血単核球細胞の活性を調節する作用を有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、末梢血単核球細胞の活性調節用組成物に関する。
【背景技術】
【0002】
病原体やウイルス等が生体内に侵入する際又は侵入後に、種々の細胞が生体防御に関与している。生体防御に関わる細胞は総称して白血球と呼ばれている。白血球は末梢血中に存在し、内訳は、リンパ球、顆粒球及び単球から構成される。リンパ球等の細胞が互いに協調し活性化することで、生体防御の能力を高めている。また、これらの細胞が活性化しすぎた場合であっても、各細胞が互いに協調しあって細胞活性を抑制している。リンパ球等の細胞活性の調節には、インターロイキン(IL)やインターフェロン(IFN)等のサイトカインが関与しており、細胞間のシグナル伝達の一役を担っている。
【0003】
一方、健康食品による白血球の活性化については不明な点が多かったが、Toll-like Receptor(TLR)の発見以来医学的証拠が提出されだした。シイタケから抽出した多糖類(レンチナン)、スエヒロタケから抽出したシゾフィラン(ソニフィラン(登録商標))などのβ-1.3グルカンなどは昔から免疫活性増強剤として、よく知られている。また、グラム陽性菌のペプチドグリカン(ピシバニール(登録商標))やグラム陰性菌由来のリポ多糖であるLPSなどはTLRを刺激し、時に免疫活性を上げるとの報告は多い(非特許文献1)。
【0004】
健康食品として、また発酵食品としても古くから知られている納豆においても、様々な生理活性を有することが知られており、その抽出物にはIL-12の産生誘導活性及びIL-4の産生抑制活性があることが知られている(特許文献1)。しかし、発酵食品の代表例である納豆からも明らかなように、発酵食品には特有の臭みやヌメリを有することから、好みに個人差があり健康促進機能を有していても敬遠する人が多い。従って、リンパ球等の細胞の活性を調節する機能を有し且つ手軽に摂取することができる発酵食品の登場が強く望まれていた。
【0005】
芳醇な甘みと仄かな酸味を有するフルーツであるパパイア(学名:Carica papaya Linn)は、デザートやケーキ等の嗜好品として好まれている。一方で、パパイアの発酵物は、発酵食品特有の臭みやヌメリのない健康食品として認知されているが、サプリメントのように単一の成分ではなく、発酵分解物を含め、種々の成分を含んでいる食品である。その成分の1つに抗酸化機能が報告され、フリーラジカルの消去及びラット脳での脂質過酸化を有意に抑制(非特許文献2)、ラット褐色細胞腫でのH2O2によるDNA 損傷の抑制(非特許文献3)、また銅イオンを介するアルツハイマー病発症モデルで活性酸素抑制効果(非特許文献4)、血糖値低下の作用(非特許文献5)など、パパイア発酵物の健康増進への多彩な効果が報告されている。これらの多くは、抗酸化能と深い関係を示唆しており、とりわけヒドロキシラジカル消去活性に有効であることが特許公報2及び3には報告されている。また、接触アレルギーを予防する治療的な能力がある可能性が非特許文献6に記載されている。
【0006】
しかし、個体レベルにおけるパパイア発酵物の有効性についての研究は非特許文献6等の通りであるが、細胞レベルにおける具体的な解析はされておらず、リンパ球等の細胞活性に伴う生体の防御に関する詳細は不明のままであった。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2006-001922号公報
【特許文献2】特許第4036385号公報
【特許文献3】特開2009-102247号公報
【非特許文献】
【0008】
【非特許文献1】大野尚仁: Dojin News. 号:114 頁:1-10 (2010)
【非特許文献2】IMAO K. et al: Biochemistry and Molecular Biology International, 45(1), PP. 11-23 (1998)
【非特許文献3】Aruoma OI, et al: Biofactors. 2006;26(2):147-59.
【非特許文献4】Zhang et al: NEUROSCIENCE Volume 143, Number 1, November 17, (2006)
【非特許文献5】Danese C, et al:Clin Ter. May-Jun;157(3):195-8.(2006)
【非特許文献6】Keiichi H. et al:Journal of the Science of Food and Agriculture Volume 88 Issue 7, Pages 1151-1157 (2008)
【非特許文献7】Dannull J. et al : The Journal of the Clinical Investigation 2005 Dec;115(12):3623-33. Epub 2005 Nov 23.
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、優れた末梢血単核球細胞の活性調節用組成物を提供することにある。
【課題を解決するための手段】
【0010】
本発明の発明者らはパパイア発酵物の有効性について鋭意研究を重ねた結果、該発酵物に末梢血単核球細胞の活性を調節する優れた作用を有することを見出し、本発明を完成するに至った。
【0011】
即ち、本発明はパパイア発酵物を有効成分として含有する末梢血単核球細胞の活性調節用組成物を提供するものである。本発明にかかる組成物は、末梢血単核球細胞の活性調節作用を有するパパイア発酵物を含むことから、末梢血単核球細胞の活性を調節する作用を有する。
【0012】
また、本発明はパパイア発酵物を有効成分として含有する末梢血単核球細胞の活性調節用組成物を含む飲食物、健康食品又は飼料添加物(以下、飲食物等)を提供するものである。本発明にかかる組成物を含む飲食物等には、末梢血単核球細胞の活性調節作用を有するパパイア発酵物を含むことから、末梢血単核球細胞の活性を調節する作用を有する。
【発明の効果】
【0013】
本発明が提供する組成物は、末梢血単核球細胞の活性を調節すること、即ちリンパ球等の細胞活性を促進する一方で、過剰なリンパ球等の細胞活性を抑制することで生体防御機能を発揮することができる。
【図面の簡単な説明】
【0014】
【図1】パパイア発酵物を含有する組成物の製造例を示す流れ図である。
【図2】マウス樹状細胞からのTNF-αとIL-6の分泌を示すフローサイトメトリーの実験結果を表す図である。
【図3】ヒト末梢血単核球細胞からのIL-6の分泌を示すグラフ図である。
【図4】ヒト末梢血単核球細胞からのIL-1βとTNF-αの分泌を示すグラフ図である。
【図5】副腎皮質ホルモン剤又は免疫抑制剤を使用するアトピー患者のヒト末梢血単核球細胞からのIFNγの分泌を示すグラフ図である。
【図6】CD8+T細胞、CD4+T細胞及びCD14+マクロファージからのIL-1βの分泌を示すグラフ図である。
【図7】PHA刺激による非特異的細胞増殖の抑制を示すグラフ図である。
【図8】健康成人及び成人アトピー患者由来の制御性T細胞の増殖抑制を示すグラフ図である。
【発明を実施するための最良の形態】
【0015】
<末梢血単核球細胞の活性調節>
本実施形態は、パパイア発酵物を有効成分として含有する末梢血単核球細胞の活性調節用組成物である。
【0016】
ここで末梢血単核球細胞の「活性調節」とは、末梢血単核球細胞の活性促進及び/又は末梢血単核球細胞の活性抑制を意味する。
【0017】
また、「末梢血単核球細胞(以下、PBMC)」とは血液中に含まれる白血球の内、「リンパ球」と「単球」を含む細胞の総称名であり、PBMCが活性化することで種々のサイトカインを分泌し病原体やウイルス等から生体を防御することが可能になる。「リンパ球」には、T細胞、B細胞、ナチュラルキラー細胞(NK細胞)等の種類があり、ウイルスや腫瘍細胞等に対する生体防御の中心的役割を担っている。一方、「単球」は樹状細胞やマクロファージに分化するとされ、感染細胞の貪食や抗原提示、種々のサイトカインの産生等を通じて生体防御を担っている。
【0018】
本実施形態においてPBMCの活性促進は、PBMCのIL-6、IFNγ、腫瘍壊死因子α(TNF-α)とIL-1βの分泌促進を含む。後述する実施例で示すように、PBMCを本実施形態における組成物で刺激することで、PBMCのIL-6、IFNγ、TNF-αとIL-1βの分泌が確認された。
【0019】
ここで、PBMCのIL-6の分泌促進とは、本実施形態における組成物で刺激していない、即ち非刺激のPBMCから分泌されるIL-6の分泌量と比較して、本組成物による刺激によりIL-6の分泌が促進されることを意味する。具体的には、IL-6の分泌量が、非刺激のPBMCから分泌されるIL-6の分泌量と比較して、好ましくは2.0倍以上、より好ましくは2.2倍以上、さらに好ましくは2.5倍以上である。なお、被刺激細胞数等の実験条件及び実験手法は、後述の実施例を参考にすることができる。
【0020】
また、PBMCのIFNγ、TNF-αとIL-1βの分泌促進とは、陰性対照であるグルコースによる刺激と比較して分泌が促進されることを意味する。具体的には、IFNγの分泌量が、好ましくは200 pg/ml以上、より好ましくは400 pg/ml以上、さらに好ましくは600 pg/ml以上の場合であり、さらに本実施形態における組成物を摂取している者の末梢血より得られたPBMCの場合は、IFNγの分泌量が、陰性対照であるグルコースによる刺激と比較して、好ましくは1.5倍以上、より好ましくは2.0倍以上、さらに好ましくは3.0倍以上である。また、TNF-αの分泌量は、陰性対照であるグルコースによる刺激と比較して、好ましくは1.5倍以上、より好ましくは2.0倍、さらに好ましくは2.5倍以上の場合である。一方、IL-1βの分泌量は、好ましくは500 pg/ml以上、より好ましくは600 pg/ml以上、さらに好ましくは700 pg/ml以上の場合である。なお、被刺激細胞数等の実験条件及び実験手法は、後述の実施例を参考にすることができる。
【0021】
また、本実施形態におけるIL-1βの分泌を促進させるPBMCは、CD8+T細胞、CD4+T細胞とCD14+マクロファージを含む。後述する実施例で示すように、CD8+T細胞、CD4+T細胞とCD14+マクロファージを本実施形態における組成物で刺激することでIL-1βの分泌が確認された。
【0022】
ここで、CD8+T細胞、CD4+T細胞とCD14+マクロファージのIL-1βの分泌促進とは、陰性対照であるグルコースによる刺激と比較して分泌が促進されることを意味する。具体的には、CD8+T細胞のIL-1βの分泌量が、好ましくは100 pg/ml以上、より好ましくは150 pg/ml以上、さらに好ましくは200 pg/ml以上の場合である。また、CD4+T細胞のIL-1βの分泌量は、好ましくは100 pg/ml以上、より好ましくは150 pg/ml以上、さらに好ましくは200 pg/ml以上の場合である。一方、CD14+マクロファージのIL-1βの分泌量は、好ましくは300 pg/ml以上、より好ましくは400 pg/ml以上、さらに好ましくは500 pg/ml以上の場合である。なお、各被刺激細胞数等の実験条件及び実験手法は、後述の実施例を参考にすることができる。
【0023】
ここでIFNγとは、サイトカインの一種であり、CD4+細胞から分化するTh1細胞及びTh2細胞のうちTh1細胞を優位な状態に維持することが知られている。Th1細胞が優位な状態になると、NK細胞の活性化のみならず、マクロファージの活性化や細胞傷害性Tリンパ球(CTL)の誘導を引き起こし、癌細胞に対する抵抗性を向上させることが報告されている。一方、Th2細胞は、花粉症やアレルギー性鼻炎、気管支喘息、アトピー性皮膚炎等の疾患を引き起こしている場合に優位な状態になることから、Th1細胞が優位な状態である場合は、上記疾患の治療や予防につながることが知られている。
【0024】
また、TNF-αは抗腫瘍作用を有し、細胞死(アポトーシス)を誘導するサイトカインである。一方、IL-1βは生体内で産生されるIL-1の内、約90%を占めるもので、リンパ球活性化因子として知られている。
【0025】
「リンパ球」の1つであるT細胞は、その細胞表面に発現している分子マーカーの種類によりCD8+T細胞とCD4+細胞に分けることができる。
【0026】
CD8+T細胞は、ウイルスに感染した細胞の表面に存在するウイルス断片や腫瘍細胞の表面に存在する腫瘍細胞特異的なペプチド等を認識することで細胞傷害活性を発揮しウイルス感染細胞や腫瘍細胞を壊死させる。
【0027】
一方、CD4+T細胞は抗原提示細胞である樹状細胞から抗原提示を受けると共に、樹状細胞等の細胞表面に発現しているCD40等の共刺激分子(コスティミュレーター)がCD4+T細胞上の共刺激分子と結合することでCD4+T細胞の細胞レベルでの反応が進展する。これにより、CD4+T細胞は他のT細胞の機能発現の誘導やB細胞の分化誘導等の補助を行うことが可能になる。また、IL-1等のサイトカインにも液性因子としてコスティミュレーター活性があることが知られている。活性化したCD4+T細胞は、B細胞に対して様々なシグナルを送り込む。この結果、B細胞は分化し、抗体の産生が可能となり、生体防御としての役割を担う。
【0028】
本実施形態において樹状細胞の活性促進は、TNF-α及び/又はIL-6の分泌促進を含む。後述する実施例で示すように、樹状細胞を本実施形態における組成物で刺激することでTNF-αとIL-6の分泌の促進が確認された。
【0029】
ここで、樹状細胞のTNF-α及び/又はIL-6の分泌促進とは、陰性対照であるグルコースによる刺激と比較して分泌が促進されることを意味する。また、樹状細胞のTNF-αの分泌量が、陰性対照であるグルコースによる刺激と比較して、好ましくは1.4倍以上、より好ましくは1.6倍以上、さらに好ましくは1.8倍以上の場合である。一方、樹状細胞のIL-6の分泌量が、陰性対照であるグルコースによる刺激と比較して、好ましくは2.0倍以上、より好ましくは2.5倍以上、さらに好ましくは2.8倍以上の場合である。なお、被刺激細胞数等の実験条件及び実験手法は、後述の実施例を参考にすることができる。
【0030】
「単球」から分化する樹状細胞は、生体内において抗原を取り込むことで抗原を提示する抗原提示細胞としての中心的な役割を担っている。樹状細胞が活性化すると、細胞表面に共刺激分子であるCD80やCD86、CD40等が発現し樹状細胞の成熟マーカーとして用いられている。樹状細胞は、TNF-αの刺激により成熟樹状細胞に分化することが知れている。また成熟化した樹状細胞はIL-6を分泌し、B細胞の増殖や抗体産生細胞への分化を誘導することで生体防御としての役割を担う。
【0031】
従って、本実施形態における組成物は生体防御能が低下している時に使用するのが好適である。即ち、リンパ球や単球を含む白血球の低下を引き起こす抗癌剤治療、化学療法、放射線治療又は外科的侵襲後に使用するのが好適である。また、リンパ球や単球を含む白血球の減少を引き起こす風邪やウイルス疾患等の治療や予防に対して使用するのも好適である。
【0032】
また、本実施形態における組成物を使用する対象の疾患が、上記疾患又は2種以上の疾患が併発している場合であっても、本組成物を使用することが可能である。さらに本組成物を単独で使用する他、免疫賦活剤や造血因子(マクロファージコロニー刺激因子や顆粒球コロニー刺激因子、顆粒球マクロファージコロニー刺激因子、エリスロポエチン、トロンボポエチン、血小板由来成長因子等)、各種サイトカイン等を含有させて又は併用して使用することも可能である。
【0033】
<IFNγの分泌抑制からの回復>
本実施形態においてPBMCの活性促進は、副腎皮質ホルモン剤や免疫抑制剤の使用により分泌が抑制されているIFNγの分泌を促進させる作用を有する。後述する実施例で示すように、本実施形態における組成物を摂取することで副腎皮質ホルモン剤や免疫抑制剤の使用により分泌が抑制されているIFNγの分泌の回復が確認された。
【0034】
ここで、副腎皮質ホルモン剤や免疫抑制剤の使用により分泌が抑制されているIFNγの分泌の回復とは、副腎皮質ホルモン剤や免疫抑制剤の使用によりIFNγの分泌を抑制されている者が本実施形態における組成物を摂取することで、陰性対照であるグルコースによる刺激と比較して、IFNγの分泌が回復することを意味する。具体的には、本実施形態における組成物を摂取している者の末梢血より得られたPBMCを本組成物で刺激した場合に分泌されるIFNγの量が、陰性対照であるグルコースの刺激と比較して、好ましくは10倍以上、より好ましくは12倍以上、さらに好ましくは14倍以上の場合である。なお、被刺激細胞数等の実験条件及び実験手法は、後述の実施例を参考にすることができる。
【0035】
細菌やウイルス等の感染やアレルギー反応、異常代謝物の生成、紫外線、外傷、熱傷等による炎症反応を抑制するために使用される副腎皮質ホルモン剤や免疫抑制剤は、各種インターロイキンやインターフェロン等のサイトカイン遺伝子の転写を阻害し、インターロイキン等の産生を阻害し、リンパ球等の活性を低下させることで炎症反応を抑制する。その一方で、各種サイトカインの分泌を抑制する作用から、リンパ球等の生体防御に関わる細胞の活性低下を引き起こし、感染症の誘発や悪化等のリスクが増大する。従って、副腎皮質ホルモン剤や免疫抑制剤を使用している場合であっても、分泌が抑制されているサイトカインの分泌を回復させることで、感染症等のリスクを回避することができる。
【0036】
ここで、副腎皮質ホルモン剤又は免疫抑制剤を使用する患者の疾患として、呼吸器疾患(喘息性気管支炎(小児喘息性気管支炎を含む)やサルコイドーシス、血清病気管支喘息、薬剤その他化学物質によるアレルギー・中毒等、消化器疾患(潰瘍性大腸炎や限局性腸炎等)、肝疾患(重症肝炎や劇症肝炎、胆汁鬱滞型急性肝炎、活動型慢性肝炎、急性再燃型慢性肝炎、胆汁鬱滞型慢性肝炎、肝硬変等)、腎疾患(ネフローゼ症候群等)、神経疾患(多発性硬化症や筋強直症、脳脊髄炎、重症筋無力症、小舞踏病、顔面神経麻痺、脊髄蜘網膜炎、末梢神経炎等)、内分泌疾患(亜急性甲状腺炎や続発性慢性副腎皮質機能不全原発性慢性副腎皮質機能不全、医原性慢性副腎皮質機能不全、下垂体性慢性副腎皮質機能不全、急性副腎皮質機能不全、副腎性器症候群、甲状腺中毒症等)、皮膚疾患(急性急性湿疹や慢性湿疹、接触性皮膚炎、アトピー性皮膚炎、脂漏性皮膚炎、貨幣状湿疹、自家感作性皮膚炎、鬱滞性皮膚炎、皮脂欠乏性湿疹、進行性指掌角皮症、女子顔面黒皮症、ビダール苔癬、放射線皮膚炎、日光皮膚炎等)等を一例としてあげることができる。
【0037】
また、副腎皮質ホルモン剤とは、糖質コルチコイドを意味し、一例としてコルチゾールやベタメタゾン、プレドニゾロン、パラメタゾン、ジフルコルトロン、メチルプレドニゾロン、フルドロコルチゾン、コルチゾン、コルチコステロン、ジフルプレドナート、トリアムシノロン、デキサメタゾン等が挙げられ、上記疾患に対して医学的な見地により適切に選択される。
【0038】
また、免疫抑制剤としてシクロスポリンやタクロリムス、ミゾリビン、シクロホスファミド、ザフィルルカスト等を例示することができ、上記疾患に対して医学的な見地により適切に選択される。
【0039】
本実施形態において副腎皮質ホルモン剤又は免疫抑制剤は塗り薬や飲み薬、注射薬、吸入薬等の形で投与が可能であるが、各疾患の治療において医学的に最適な投与方法に従う限り特段の制限を設けることはない。
【0040】
本実施形態における組成物をIFNγの分泌抑制からの回復に用いる場合は、本組成物の摂取期間に特段の設定することはないが、副腎皮質ホルモン剤又は免疫抑制剤を使用している間は、摂取することが望ましい。
【0041】
<腫瘍免疫療法>
本実施形態におけるPBMCの活性抑制にはT細胞の増殖抑制を含む。後述する実施例で示すように、非特異的な増殖刺激を受けているPBMCを本実施形態における組成物で刺激するとT細胞の増殖を抑制することが確認された。
【0042】
ここで、T細胞の増殖の抑制とは、陰性対照であるグルコースによる刺激と比較してT細胞の増殖が抑制されていることを意味する。具体的には、T細胞の細胞数が、グルコースによる刺激と比較して、好ましくは0.8倍以下、より好ましくは0.6倍以下の場合である。なお、被刺激細胞数等の実験条件及び実験手法は、後述の実施例を参考にすることができる。
【0043】
本実施形態におけるPBMCの活性抑制にはTregの増殖の抑制を含む。後述する実施例で示すように、非特異的な増殖刺激を受けているPBMCを本実施形態における組成物で刺激するとTregの増殖を抑制することが確認された。
【0044】
ここで、Tregの増殖の抑制とは、陰性対照であるグルコースによる刺激と比較してTregの増殖が抑制されていることを意味する。具体的には、健康成人由来のCD4+T細胞中のFoxp3の存在割合が、陰性対照であるグルコースによる刺激と比較して、好ましくは0.7倍以下、より好ましくは0.5倍以下の場合である。一方、成人アトピー患者由来のCD4+T細胞中のFoxp3の存在割合が、陰性対照であるグルコースによる刺激と比較して、好ましくは0.7倍以下、より好ましくは0.5倍以下、さらに好ましくは0.3倍以下の場合である。なお、被刺激細胞数等の実験条件及び実験手法は、後述の実施例を参考にすることができる。
【0045】
TregはCD4+T細胞から分化し、Tregの働きにより過剰に反応したT細胞は過剰反応を抑制する方向へ制御されることが知られている。Tregは、転写因子であるFoxp3がCD4+T細胞内において発現することで分化することが指摘されている。従って、Tregは、通常、生体内の過剰なT細胞の反応を抑制する役割を担っている。
【0046】
さらには、本実施形態における組成物にはTregの増殖を抑制する効果を有することから、Tregにより効果が制限される腫瘍免疫療法の有効性を高めることが可能である。
【0047】
癌患者においてはTregが過剰に存在し、この過剰なTregの存在によって癌患者の抗腫瘍免疫応答は抑制され、癌治療を困難にする一因となっている。癌患者にはTregが多数存在することから、腫瘍免疫療法の有効性が制限されている。Tregを特異的に殺減する手段としてジフテリアトキシン結合リコンビナントIL-2を用いて腫瘍免疫療法の有効性を高める治療法が考案されている(非特許文献7)。しかし、上記治療法はトキシン結合のIL-2等の高価な組み替えタンパク質を用いることから、費用の面で大きな障害となっている。従って、安価であり且つ安全にTregの増殖を抑制する高価な組み換えタンパク質等の代替物の登場が望まれていた。
【0048】
ここで、「腫瘍免疫療法」とは、腫瘍細胞又は組織若しくは生物工学的に作製した腫瘍抗原などを用いて免疫細胞の免疫力を高めることで癌を抑制する治療法である。腫瘍は、大腸癌や胃癌、肺癌、乳癌等を意味する。腫瘍免疫療法には、LAK療法、CTL療法、自家腫瘍ワクチン療法、樹状細胞ワクチン療法、DNAワクチン療法及びペプチドワクチン療法等を含む。腫瘍抗原は、細胞の癌化に伴い、新たに産生される腫瘍特異抗原と、癌化する前の正常組織や腫瘍組織においても産生する腫瘍関連抗原を含み、(1)ウイルス(子宮頸癌のヒトパピローマウイルスやヒトTリンパ好性ウイルス等)由来の遺伝子産物による抗原、(2)癌遺伝子(srcやras遺伝子等)や癌抑制遺伝子(p53やBRCA1等)の変異による抗原、(3)癌化の際に産生する抗原(前立腺特異抗原や悪性黒色腫の抗原等)、(4)胚発生期のみに発現する抗原(癌胎児性抗原等)などがある。
【0049】
本実施形態における組成物の使用によりTregの増殖を抑制することで、治療効果を高めることができるのであれば、いずれの腫瘍免疫療法を採用してもよい。特に樹状細胞ワクチン療法が好適である。また2種以上の腫瘍免疫療法を併用してもよい。
【0050】
また、腫瘍抗原は、いずれを選択することも可能であるが、核酸によりコードされたタンパク質又はペプチドが好適である。また、腫瘍細胞又は組織そのものを用いることも可能であり、さらには、抗原性の高い部分、エピトープを用いることも可能である。
【0051】
本実施形態における組成物を用いて腫瘍免疫療法を行う場合は、服用期間に特段の設定することはないが、Tregの増殖を抑制することが腫瘍免疫療法の効果を有効にするところ、腫瘍免疫療法の期間中は摂取し続けることが望ましい。
【0052】
<パパイア発酵物を含有する組成物の製造方法>
パパイア発酵物を含有する組成物は、粉砕し摩砕したパパイアに糖質を添加し熟成又は発酵させた混合物1を濾過により濾液1と残渣1に分画した後、残渣1に糖質を添加し熟成又は発酵させた混合物2を濾過により濾液2を分画し、濾液1と濾液2を混合した物(混合濾液)に糖質を添加した中間原料を発酵させ、更に糖質を添加し、乾燥させた後、長期熟成させることで得られる。混合濾液に添加する糖質の量は、混合濾液に対して40から60質量%になるよう調製することが好適である。熟成させる場合の期間は、4から10日間の期間が好適であり、より好適な熟成の期間は、7から10日間である。一方、長期熟成期間は6ヶ月以上が好適である。
【0053】
パパイアとは、パパイア科パパイア属の果実である「パパイア(学名:Carica papaya Linn)」をいい、果物として店頭にならんでいる黄色の成熟パパイアだけでなく、野菜として料理に用いられる緑色の未成熟パパイアも含まれる。パパイアは熱帯から亜熱帯にかけて広く栽培されているが、原産地を特に制限するものではなく、いずれも使用することが可能である。また、成熟又は未成熟を問わずいずれのパパイアを発酵の対象として使用することも可能であるが、野生の未成熟パパイアを用いるのが好適である。
【0054】
本実施形態においてパパイアの発酵には酵母を用いることができる。用いる酵母としては、パパイアを発酵できるものであれば特に限定しないが、例としてカンジダ属(Candida)やピキア属(Pichia)、クリベロマイセス属(Kluyveromyces)、サッカロマイセス属(Saccharomyces)、シゾサッカロマイセス属(Schizosaccaromyces)等を挙げることができるが、好ましくは、サッカロマイセス属の酵母である。また、パパイアに付着又は存在する天然の酵母をそのまま発酵に用いてもよい。パパイアを発酵できるものであれば、通常の方法で凍結乾燥させ調製したもの又は冷蔵で保存しているものであってもよい。酵母発酵の至適条件は、各酵母依存的であり、製造工程の条件や目的製品の状態に合わせて使用方法及び条件を適宜選択することが可能である。さらには、1又は2種以上の酵母を同時又は逐次的に使用することも可能である。
【0055】
本実施形態においてパパイアの発酵には乳酸菌を用いることができる。用いる乳酸菌としては、パパイアを発酵できるものであれば特に限定しないが、例としてストレプトコッカス属(Streptococcus)やラクトバチルス属(Lactobacillus)、ラクトコッカス属(Lactococcus)、ビフィドバクテリウム属(Bifidobacterium)、ロイコノストック属(Leuconostoc)、ペディオコッカス属(Pediococcus)などを挙げることができる。好ましくは、ストレプトコッカス属(Streptococcus)の乳酸菌である。また、パパイアに付着又は存在する天然の乳酸菌をそのまま発酵に用いてもよい。いずれの乳酸菌であっても、パパイアを発酵できるのであれば、通常の方法で凍結乾燥させ調製したもの又は冷蔵で保存しているものであってもよい。乳酸菌発酵の至適条件は、各乳酸菌依存的であり、製造工程の条件や目的製品の状態に合わせて使用方法及び条件を適宜選択することが可能である。さらには、1又は2種以上の乳酸菌を同時又は逐次的に使用することも可能である。
【0056】
本実施形態においてパパイアの発酵にはアミラーゼを用いることができる。アミラーゼは澱粉中に含まれるアミロースやアミロペクチンのグリコシド結合を加水分解することができる消化酵素であり、目的とする製品の製造工程において充分な活性を有するものであれば、特段の制限を設けることはない。アミラーゼの至適条件は、使用する酵素依存的であり、製造工程の条件や目的製品の状態に合わせて使用する酵素を適宜選択することが可能である。さらには、1又は2種以上のアミラーゼを同時又は逐次的に使用することも可能である。
【0057】
本実施形態においてパパイアの発酵には味噌用酵素を用いることができる。味噌用酵素とは、味噌や醤油等の発酵食品の製造に用いられるアスペルギルス属(Aspergillus)の分泌物等を含む。アスペルギルス属に含まれる微生物としてアスペルギルス・オリゼーやアスペルギルス・ニガー、アスペルギルス・ソーエー等を一例として挙げることができる。好ましくは、アスペルギルス・オリゼーである。味噌用酵素は要求される目的製品の品質を満たすものであれば必ずしも精製されている酵素である必要はなく、粗精製のものでもあってもよく、更には菌体そのものを使用することも可能である。味噌用酵素の至適条件は、酵素依存的であり、製造工程の条件や目的製品の状態に合わせて使用方法及び条件を適宜選択することが可能である。さらには、1又は2種以上の味噌用酵素を同時又は逐次的に使用することも可能である。
【0058】
微生物等の混入を防ぐ目的で発酵前にパパイアを低温殺菌(蒸気や熱湯等)や高温殺菌(加熱蒸気や熱湯等)、マイクロ波、高周波、赤外線、遠赤外線、紫外線、γ線、X線、電子線、オゾン殺菌等の殺菌処理を施すことも可能である。成熟パパイアを用いて発酵する場合は、微生物等による腐敗を引き起こしやすいことから殺菌処理を施すことが好適である。一方で、野生の未成熟パパイアを用いる場合は、未成熟パパイアに付着又は存在する微生物(酵母や乳酸菌等)が発酵に有益である場合には殺菌処理を施さないのが好適である。
【0059】
発酵促進の目的で加える糖質は、澱粉やモルト、デキストラン、スクロース(蔗糖)、マルトース(麦芽糖)、グルコース(ブドウ糖)等を用いることが可能であるが、パパイアの酵素を不活性化し腐敗を防止する観点から、同じ質量の糖質でも細胞内浸透圧を高くし原形質膜分離を引き起こすことが可能である低分子の糖質を用いるのが好適であり、特に単糖であるグルコースを用いることが好適である。
【0060】
<本実施形態における組成物の形態等>
本実施形態においる組成物の形態は、乳白色の粉末であるが、そのままの形態で使用することも可能である。また他の形態として、散剤や錠剤、カプセル剤、軟カプセル剤、液剤、シロップ剤、丸剤等の任意の形態に調製することができるが、特にこれらに限定されるものではない。
【0061】
本実施形態における組成物の1回の摂取あたりの含有量は、例えば、体重60kgのヒトを対象とする場合は、中間原料1g(液体質量)から2.5g(乾燥質量)の組成物が得られた場合を基準とすると、乾燥質量換算で1gから15g/(60kg体重)であることが好適であり、更に3gから12g/(60kg体重)であることがより好適である。また、上記基準を基に組成物の含有量を増減させることが好適である。本実施形態における組成物は安全性が高いことから、特段の摂取量上限値を設定することはない。
【0062】
<飲食物、健康食品又は飼料添加物>
本実施形態における組成物を飲食物、健康食品又は飼料添加物(以下、飲食物等)として使用することができる。
【0063】
本実施形態における組成物を飲食物又は健康食品として用いる場合に、本組成物をそのままの形態で使用することも可能であるが、他の形態を例示すると賦形剤(グルコースや澱粉、炭酸カルシウム等)や添加剤(グァーガムやグリシン等)、甘味料、酸味料、香味料、ビタミン又はミネラル等を組み合わせて顆粒や細粒、粉末、タブレット、ドロップ、トローチ、ゲル、シロップ、ドリンク等の形態とすることが挙げられる。
【0064】
また、他の形態としてクッキーやケーキ、パン、チョコレート、羊羹、お汁粉、アイスクリーム、プリン、クラッカー、チップス等の菓子類、茶、コーヒー、ジュース、牛乳、アルコール等の飲料水、スパゲッティ、うどん、蕎麦、ラーメン等の麺類、ハム、ソーセージ、はんぺん、かまぼこ等の練り製品、ドレッシング、味噌、醤油、マヨネーズ、ふりかけ等の調味料、カレー、シチュー等のスープ類等が挙げられる。
【0065】
本実施形態における組成物は飼料添加物として用いることも可能である。例示すると、家畜(牛や豚等)や家禽(鶏や鶉等)、養殖魚類(鯛や鰻等)、ペット類(犬や猫等)等の飼料に添加することができる。いずれの飼料に添加する場合であっても、本組成物をそのままの形態で添加することも可能であり、また顆粒や細粒、粉末、タブレット、カプセル等の形態で添加することも可能である。
【0066】
本実施形態における組成物を飲食物等として使用する場合の添加量は、中間原料1g(液体質量)から2.5g(乾燥質量)の組成物が得られた場合を基準とすると、飲食物等に対して、好ましくは1.0質量%以上、より好ましくは3.0質量%以上、さらに好ましくは5.0質量%以上の時、官能評価上、飲食物等として好ましい状態となる。また、上記基準を基に組成物の添加量は増減させることが好適である。
【0067】
本実施形態における組成物を飲食物等として使用する場合は、例えば、体重60kg1回の摂取量あたりの組成物の含有量は、中間原料1g(液体質量)から2.5g(乾燥質量)の組成物が得られた場合を基準とすると、乾燥質量換算で1gから15g/(体重60kg)であることが好適であり、更に3gから12g/(体重60kg)であることがより好適である。また、上記基準を基に組成物の含有量を増減させることが好適である。本実施形態における組成物は安全性が高いことから、特段の摂取量上限値を設定することはない。
【0068】
本実施形態における組成物は、ヒト以外にも使用することが可能である。対象となるヒト以外の動物として、犬や猫等のペットや、牛や豚等の家畜、鶏や鶉等の家禽、鯛や鰻等の養殖水産動物等に対しても使用することが可能である。
【実施例】
【0069】
以下、実施例によって本発明をさらに説明する。但し、下記の実施例は発明を例示するためのものであり、本発明をいかなる意味においても限定するものではない。
【0070】
<実施例1>
図1に示すパパイア発酵物を含有する組成物の製造例を示す流れ図を基にして以下において、その製造方法を記載する。
【0071】
1)パパイア発酵に用いる中間原料の製造例
白色の種子を有する野生の未成熟パパイア100kgを採取し、異物除去のため水洗いをした後、ヘタ部分及び果実の底部を除いた。パパイアを皮ごとスライスした後、粉砕し摩砕することでマッシュ品85kgを得た。マッシュ品にグルコース20kgを添加し、良く混和した後、4日間静置することで熟成した混合物1を得た。混合物1を濾過し、果汁液である濾液1とその残渣1を得た。60kgの残渣1に対して、グルコース10kgを添加し、良く混和した後、4日間静置することで熟成させた混合物2を得た。混合物2を濾過し、果汁液である濾液2を得た。濾液1と濾液2を混合した混合濾液に、グルコース2kgを添加し、良く混和することで目的とする中間原料を40kg得た。
【0072】
2)パパイア発酵物を含有する組成物の製造例
上記中間原料40kgを、20kg(中間原料1)、15kg(中間原料2)、5kg(中間原料3)に分け、中間原料1に味噌用酵素0.5kgを、中間原料2に乳酸菌0.5kg及び味噌用酵素0.1kgを、中間原料3にアミラーゼ0.1kgを添加し、良く混和し、40℃にて48時間発酵させることで、それぞれ発酵物1、2、3を得た。発酵物1にグルコース60kgを、発酵物2にグルコース30kgを、発酵物3にグルコース10kgを添加し、良く混和した後、18℃、1ヶ月間乾燥させ、粉砕し、組成物1、2及び3を得た。組成物1、2及び3を合わせて混合均質化し、ガスバリヤー製の高いアルミ包材内で6ヶ月以上熟成し、パパイア発酵物を含有する組成物(最終組成物を100kg得た。
【0073】
<実施例2> パパイア発酵物を含有する組成物及びグラム陰性菌リポ多糖(LPS)の調整
パパイア発酵物を含有する組成物の粉末4gを6mlのphosphate buffered saline (PBS)に懸濁し、37℃、1時間、充分に撹拌し、さらにPBSを加えて10mlに調製(40%溶液)した。その後、2000rpm、10分、遠心し、上清を0.45μmのフィルターで濾過した(ストック溶液400 mg/ml)。陽性対照としてLPS(E.coli 由来cat. L-4516,Sigma)を用いた。LPSはPBSで100μg/mlになるように希釈しストック溶液とした。パパイア発酵物を含有する組成物(P)及びLPS(L)ストック溶液をそれぞれ試験に用いる培地(例: 10% FCS/RPMI培養液)で希釈し目的とする最終濃度として調整した。なお、本実施例で使用するパパイア発酵物を含有する組成物は、発酵過程で用いる糖質としてグルコースを選択しており、最終製品のグルコース濃度は試験をする上で無視できない量が含まれている。従って、本実施例においては、試験結果が、本組成物中に含まれるグルコースによる効果ではないこと明らかにする目的で陰性対照としてグルコース(片山化学)を用いることとした。
【0074】
<実施例3> マウス樹状細胞の誘導及びパパイア発酵物を含有する組成物でのマウス樹状細胞刺激
BALB/cマウス大腿骨より骨髄細胞を採取し、IL-4及びGM-CSFを共に10 ng/mlの濃度で1週間培養した。その後LPS 1 μg/mlにて刺激し、24時間後の浮遊している細胞を成熟樹状細胞とした。パパイア発酵物を含有する組成物(P)及びLPS(L)をそれぞれ10% FCS/RPMI培養液で希釈し、最終濃度をそれぞれ5 mg/ml、1ng/mlとしてマウス樹状細胞を刺激し、陰性対照であるグルコースの濃度は5 mg/mlとして刺激した。マウス樹状細胞の被刺激細胞数を1x105 cells/wellとして刺激し、24時間の培養後の培養液中のサイトカイン濃度をCBA(Cytometric Bead Array)を用い、フローサイトメーターで網羅的に解析した。CBAは、蛍光標識(APC蛍光色素で標識、蛍光濃度を6段階にかえている)したビーズとあらかじめ測定したいサイトカインに対する抗体をあらかじめ結合させておき、培養テストサンプル50μlと反応させた後、PE蛍光標識された各々の抗体でサンドイッチする事で、多項目の同時測定を可能にする定量法である。各サイトカインの量はBD CBA Human and Mouse inflammatoryキット(Cat no. 551811及び552364, BD Biosciences)、Human Th1/Th2 Cytokineキット(Cat no. 550749, BD Biosciences)を用いて、マニュアルに従い定量した。Human Inflammatoryキットは、IL-1βやIL-6、IL-8、IL-10、IL-12p70、TNF-αを、Mouse Inflammatory キットはIFNγやMCP-1、IL-6、IL-10、IL-12p70、TNF-αを、Human Th1/Th2 CytokineキットはIFNγやTNF-α、IL-2、IL-4、IL-5、IL-10が同時に測定可能である。
【0075】
培養上清中のサイトカイン量の測定結果を図2に示した。この結果から明らかなように、パパイア発酵物を含有する組成物(P)の刺激によりマウス樹状細胞からTNF-αとIL-6の分泌が認められた。従って、パパイア発酵物にはマウス樹状細胞を活性化しTNF-αとIL-6の分泌を促進する能力があることが明らかとなった。
【0076】
<実施例4> ヒト末梢血単核球細胞(PBMC)の刺激法
ヒトPBMCを200μlの10% FCS/RPMI培養液中で1x105 cells/wellとなるように細胞数を調整し、本組成物(P)のストック溶液(400 mg/ml)を1μl刻みで1〜5μl加え(最終濃度はそれぞれ2、4、6、8及び10 mg/ml)、ヒトPBMC細胞を刺激した。陰性対照には本組成物(P)のストック溶液を無添加の条件に設定している。24時間の培養後、培養液中のIL-6の濃度をELISAにて測定した。培養後の上清中のサイトカインIL-6をELISAキット(R&D, Minneapolis, USA)を使用し製品マニュアルに従って定量した。
【0077】
培養上清中のサイトカイン量の測定結果を図3に示した。この結果から明らかなように、パパイア発酵物を含有する組成物(P)の刺激によりヒトPBMCからIL-6の分泌が認められた。従って、パパイア発酵物にはヒトPBMCを活性化しIL-6の分泌を促進する能力があることが明らかとなった。
【0078】
<実施例5> 健康成人(HD)及び成人アトピー患者(AD)のPBMCにおける刺激
健康成人(HD)及び成人アトピー患者(AD)のヒトのPBMCにおける刺激効果を調べた。アトピー患者は、副腎皮質ホルモン剤又は各種免疫抑制剤を定期的に体躯及び顔面に塗布している状態である。健康成人及びアトピー患者からヒトヘパリン化末梢血を採取後、ヒストパック(Sigma-Aldrich cat.107)でPBMCを分離した。分離したヒトPBMCの被刺激細胞数を1×105 cells/well(IFNγのみ1×106 cells/well)として、平底96穴プレートに播き、LPS(L)を1μg/ml、パパイア発酵物を含有する組成物(P)を10mg/mlの濃度で刺激し、24時間培養した。
【0079】
培養後の上清中のサイトカインIL-1β及びTNF-αをELISAキット(R&D, Minneapolis,USA)を使用し製品マニュアルに従って定量した。またIFNγは、Capture抗体として抗ヒトIFNγmAb(1-D1K, MABTECH AB)を炭酸バッファー(pH9.6)で500倍に希釈したものを使用し、抗ヒトIFNγウサギ血清を5% FCS/PBSで600倍に希釈したものを使用し、二次抗体としてヤギ抗ラビットIgG-HRP(MBL)を5% FCS/PBSで2000倍に希釈したものを使用し、サンドイッチ法を用いて測定した。発色はOPDA(和光純薬、3mg/10ml クエン酸バッファー, pH5.0)に31% H202(三菱ガス科学)を10μl添加し、490nmでOD値を測定した。L+PはLPS(L)及びパパイア発酵物を含有する組成物(P)両者を共存させたウェルである。陰性対照として10mg/mlのグルコースを用いた。刺激後24時間培養した上清を回収し、ELISAを実施した。IFNγの産生に関しては、実験後、パパイア発酵物を含有する組成物を朝食後に毎日3g、2カ月間継続服用した後、再び採血し同様の実験を行った。なお、本実験は、各被験者に対してインフォームドコンセントの同意を得た上で採血し、実験を実施した。
【0080】
ヒトPBMCにおける刺激の結果を図4に示した。図4から明らかなように、HD及びAD共に、パパイア発酵物を含有する組成物(P)の刺激によりヒトPBMCからIL-1βとTNF-αの分泌を確認することができた。従って、パパイア発酵物にはヒトPBMCを活性化しIL-1βとTNF-αの分泌を促進する能力があることが明らかとなった。
【0081】
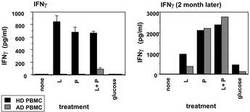
IFNγの分泌結果を図5に示した。パパイア発酵物を含有する組成物(P)でHDのPBMCを刺激することでIFNγの分泌を促進することが明らかとなった。一方、ADのPBMCをパパイア発酵物を含有する組成物(P)で刺激しても検出可能なレベルまでIFNγの分泌を促進することが出来なかった。一方で、2ヶ月間、毎日朝食後3gのパパイア発酵物を含有する組成物(P)を摂取した場合は、ADのIFNγの分泌が、HDと同程度のレベルまで回復することが明らかとなった。
【0082】
以上の結果から、パパイア発酵物を摂取することで、副腎皮質ホルモン剤又は免疫抑制剤を使用したアトピー患者であっても、健康成人が分泌するIFNγ量と同程度にまでIFNγの分泌量が回復することが明らかとなった。
【0083】
<実施例6> CD8+T細胞、CD4+T細胞及びCD14+マクロファージにおける刺激
ヒトPBMCをMACS磁気ビーズを用いてそれぞれCD8+T細胞、CD4+T細胞及びCD14+マクロファージ系に分画し、それぞれ1×105 cells/wellに調製した。パパイア発酵物を含有する組成物(P)は10mg/mlの濃度で、LPS(L)は1μg/mlの濃度で、グルコースは10mg/mlの濃度でそれぞれ培地に添加し24時間刺激した。24時間後の培養上清中のIL-1βをELISAキット(R&D, Minneapolis, USA)を使用し製品マニュアルに従って定量した。
【0084】
IL-1βの分泌結果を図6に示した。パパイア発酵物を含有する組成物(P)で刺激した場合は、CD8+T細胞、CD4+T細胞及びCD14+マクロファージのいずれにおいてもIL-1βの分泌を確認することができた。従って、パパイア発酵物にはCD8+T細胞、CD4+T細胞及びCD14+マクロファージを活性化しIL-1βの分泌を促進する能力があることが明らかとなった。
【0085】
<実施例7> ヒトPBMCのフィトヘマグルチニン(PHA)刺激へのパパイア発酵物の関与
PHAを用いてヒトPBMCを非特異的に増殖刺激し、10%FCS/RPMI培養液にパパイア発酵物を含有する組成物(P)を加えその関与を検討した。PHAはT細胞のみを増殖させる試薬として知られている。6穴プレートを用いて、ヒトPBMC 1×105 cells/well をPHA 10μg/ml及びIL-2 25 IU/mlの条件で非特異的な増殖刺激をおこない、パパイア発酵物を含有する組成物(P)を 10mg/mlの濃度になるように添加した。陰性対象としてグルコースを用いて10mg/mlの濃度になるように添加した。6日間培養し、細胞数をカウントした。
【0086】
PHAを用いた非特異的刺激の結果を図7に示した。図7から明らかなように、パパイア発酵物を含有する組成物(P)を添加すると、ヒトPBMCの増殖を抑制した。PHAはT細胞のみを特異的に増殖させることから、パパイア発酵物を含有する組成物で刺激することでT細胞の増殖を抑制することが明らかとなった。従って、パパイア発酵物にはT細胞の増殖を抑制する作用を有することが明らかとなった。
【0087】
<実施例8> PHA刺激後におけるTregの動態
健康成人(HD)及び成人アトピー患者(AD)から単離したヒトPBMCを実施例7に記載の実験後に、MACS磁気ビーズ(Miltenyi Biotec, USA)を用いて、マニュアルに従いCD4+T細胞を単離し、Tregの指標である細胞内Foxp3の発現を解析した。ヒトFoxp3は細胞内測定キット(eBioscinece)を使用し、製品マニュアルに従って測定した。測定にはBD FACS Calibur (BD Biosciences)を使用し、解析はCell Questソフトウェアを用いた。
【0088】
Foxp3の発現解析の結果を図8に示した。図8から明らかなように、健康成人(HD)のFoxp3の割合はグルコース添加の2.2 %に対し、パパイア発酵物を含有する組成物(P)の添加で0.96 %と約1/2に低下していた。従って、パパイア発酵物には健康成人(HD)のTregの増殖を抑制する作用を有することが明らかとなった。また、成人アトピー患者(AD)のTregの割合はグルコース添加の5.1%に対して、パパイア発酵物を含有する組成物(P)の添加で1.2%と約1/4に低下していた。
【0089】
<考察>
本実施例で使用したパパイア発酵物を含有する組成物にはグルコースを多量に含むことから陰性対照としてグルコースを用いて試験を行った。いずれの試験においてもグルコースによる末梢血単核球細胞の活性調節は観察されなかった。また、グラム陰性菌のリポ多糖であるLPSは、空気中にも存在する。故に他の多くの健康食品に見られる種々の効果は外部から混入したLPSによる効果の場合が往々にしてある。しかし、パパイア発酵物を含有する組成物は、LPSの経路とは異なる経路でヒトPBMCを刺激していることを明らかにした(結果は示さない)。従って、末梢血単核球細胞の活性調節はパパイア発酵物による作用であり、組成物中に含まれるグルコース等の糖質や混入したLPSの作用によるものではないことが明らかとなった。
【産業上の利用可能性】
【0090】
本発明において記載したパパイア発酵物を含有する末梢血単核球細胞の活性調節用組成物は、長期間服用しても安全で優れた官能的性質を有する。本発明に組成物を摂取することで、ヒトPBMCを活性化させるだけではなく活性を抑制することができることから優れた末梢血単核球細胞の活性調節能を提供することができる。また、本組成物はIFNγの分泌を促進させることから、Th1細胞を優勢な状態に維持しアトピーやアレルギー体質の改善に寄与する。従って、生体防御能力の向上等の健康増進を目的とする食品等への利用のみならず、癌予防等の医療分野においても応用することが可能である。
【0091】
また、IFNγにはNK細胞及びマクロファージの活性化、CTL細胞の誘導等の重要な働きを担っていることから、パパイア発酵物を含有する組成物を摂取することでIFNγの分泌が促進され、癌細胞の免疫学的監視能力を高める可能性が示唆された。
【技術分野】
【0001】
本発明は、末梢血単核球細胞の活性調節用組成物に関する。
【背景技術】
【0002】
病原体やウイルス等が生体内に侵入する際又は侵入後に、種々の細胞が生体防御に関与している。生体防御に関わる細胞は総称して白血球と呼ばれている。白血球は末梢血中に存在し、内訳は、リンパ球、顆粒球及び単球から構成される。リンパ球等の細胞が互いに協調し活性化することで、生体防御の能力を高めている。また、これらの細胞が活性化しすぎた場合であっても、各細胞が互いに協調しあって細胞活性を抑制している。リンパ球等の細胞活性の調節には、インターロイキン(IL)やインターフェロン(IFN)等のサイトカインが関与しており、細胞間のシグナル伝達の一役を担っている。
【0003】
一方、健康食品による白血球の活性化については不明な点が多かったが、Toll-like Receptor(TLR)の発見以来医学的証拠が提出されだした。シイタケから抽出した多糖類(レンチナン)、スエヒロタケから抽出したシゾフィラン(ソニフィラン(登録商標))などのβ-1.3グルカンなどは昔から免疫活性増強剤として、よく知られている。また、グラム陽性菌のペプチドグリカン(ピシバニール(登録商標))やグラム陰性菌由来のリポ多糖であるLPSなどはTLRを刺激し、時に免疫活性を上げるとの報告は多い(非特許文献1)。
【0004】
健康食品として、また発酵食品としても古くから知られている納豆においても、様々な生理活性を有することが知られており、その抽出物にはIL-12の産生誘導活性及びIL-4の産生抑制活性があることが知られている(特許文献1)。しかし、発酵食品の代表例である納豆からも明らかなように、発酵食品には特有の臭みやヌメリを有することから、好みに個人差があり健康促進機能を有していても敬遠する人が多い。従って、リンパ球等の細胞の活性を調節する機能を有し且つ手軽に摂取することができる発酵食品の登場が強く望まれていた。
【0005】
芳醇な甘みと仄かな酸味を有するフルーツであるパパイア(学名:Carica papaya Linn)は、デザートやケーキ等の嗜好品として好まれている。一方で、パパイアの発酵物は、発酵食品特有の臭みやヌメリのない健康食品として認知されているが、サプリメントのように単一の成分ではなく、発酵分解物を含め、種々の成分を含んでいる食品である。その成分の1つに抗酸化機能が報告され、フリーラジカルの消去及びラット脳での脂質過酸化を有意に抑制(非特許文献2)、ラット褐色細胞腫でのH2O2によるDNA 損傷の抑制(非特許文献3)、また銅イオンを介するアルツハイマー病発症モデルで活性酸素抑制効果(非特許文献4)、血糖値低下の作用(非特許文献5)など、パパイア発酵物の健康増進への多彩な効果が報告されている。これらの多くは、抗酸化能と深い関係を示唆しており、とりわけヒドロキシラジカル消去活性に有効であることが特許公報2及び3には報告されている。また、接触アレルギーを予防する治療的な能力がある可能性が非特許文献6に記載されている。
【0006】
しかし、個体レベルにおけるパパイア発酵物の有効性についての研究は非特許文献6等の通りであるが、細胞レベルにおける具体的な解析はされておらず、リンパ球等の細胞活性に伴う生体の防御に関する詳細は不明のままであった。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2006-001922号公報
【特許文献2】特許第4036385号公報
【特許文献3】特開2009-102247号公報
【非特許文献】
【0008】
【非特許文献1】大野尚仁: Dojin News. 号:114 頁:1-10 (2010)
【非特許文献2】IMAO K. et al: Biochemistry and Molecular Biology International, 45(1), PP. 11-23 (1998)
【非特許文献3】Aruoma OI, et al: Biofactors. 2006;26(2):147-59.
【非特許文献4】Zhang et al: NEUROSCIENCE Volume 143, Number 1, November 17, (2006)
【非特許文献5】Danese C, et al:Clin Ter. May-Jun;157(3):195-8.(2006)
【非特許文献6】Keiichi H. et al:Journal of the Science of Food and Agriculture Volume 88 Issue 7, Pages 1151-1157 (2008)
【非特許文献7】Dannull J. et al : The Journal of the Clinical Investigation 2005 Dec;115(12):3623-33. Epub 2005 Nov 23.
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、優れた末梢血単核球細胞の活性調節用組成物を提供することにある。
【課題を解決するための手段】
【0010】
本発明の発明者らはパパイア発酵物の有効性について鋭意研究を重ねた結果、該発酵物に末梢血単核球細胞の活性を調節する優れた作用を有することを見出し、本発明を完成するに至った。
【0011】
即ち、本発明はパパイア発酵物を有効成分として含有する末梢血単核球細胞の活性調節用組成物を提供するものである。本発明にかかる組成物は、末梢血単核球細胞の活性調節作用を有するパパイア発酵物を含むことから、末梢血単核球細胞の活性を調節する作用を有する。
【0012】
また、本発明はパパイア発酵物を有効成分として含有する末梢血単核球細胞の活性調節用組成物を含む飲食物、健康食品又は飼料添加物(以下、飲食物等)を提供するものである。本発明にかかる組成物を含む飲食物等には、末梢血単核球細胞の活性調節作用を有するパパイア発酵物を含むことから、末梢血単核球細胞の活性を調節する作用を有する。
【発明の効果】
【0013】
本発明が提供する組成物は、末梢血単核球細胞の活性を調節すること、即ちリンパ球等の細胞活性を促進する一方で、過剰なリンパ球等の細胞活性を抑制することで生体防御機能を発揮することができる。
【図面の簡単な説明】
【0014】
【図1】パパイア発酵物を含有する組成物の製造例を示す流れ図である。
【図2】マウス樹状細胞からのTNF-αとIL-6の分泌を示すフローサイトメトリーの実験結果を表す図である。
【図3】ヒト末梢血単核球細胞からのIL-6の分泌を示すグラフ図である。
【図4】ヒト末梢血単核球細胞からのIL-1βとTNF-αの分泌を示すグラフ図である。
【図5】副腎皮質ホルモン剤又は免疫抑制剤を使用するアトピー患者のヒト末梢血単核球細胞からのIFNγの分泌を示すグラフ図である。
【図6】CD8+T細胞、CD4+T細胞及びCD14+マクロファージからのIL-1βの分泌を示すグラフ図である。
【図7】PHA刺激による非特異的細胞増殖の抑制を示すグラフ図である。
【図8】健康成人及び成人アトピー患者由来の制御性T細胞の増殖抑制を示すグラフ図である。
【発明を実施するための最良の形態】
【0015】
<末梢血単核球細胞の活性調節>
本実施形態は、パパイア発酵物を有効成分として含有する末梢血単核球細胞の活性調節用組成物である。
【0016】
ここで末梢血単核球細胞の「活性調節」とは、末梢血単核球細胞の活性促進及び/又は末梢血単核球細胞の活性抑制を意味する。
【0017】
また、「末梢血単核球細胞(以下、PBMC)」とは血液中に含まれる白血球の内、「リンパ球」と「単球」を含む細胞の総称名であり、PBMCが活性化することで種々のサイトカインを分泌し病原体やウイルス等から生体を防御することが可能になる。「リンパ球」には、T細胞、B細胞、ナチュラルキラー細胞(NK細胞)等の種類があり、ウイルスや腫瘍細胞等に対する生体防御の中心的役割を担っている。一方、「単球」は樹状細胞やマクロファージに分化するとされ、感染細胞の貪食や抗原提示、種々のサイトカインの産生等を通じて生体防御を担っている。
【0018】
本実施形態においてPBMCの活性促進は、PBMCのIL-6、IFNγ、腫瘍壊死因子α(TNF-α)とIL-1βの分泌促進を含む。後述する実施例で示すように、PBMCを本実施形態における組成物で刺激することで、PBMCのIL-6、IFNγ、TNF-αとIL-1βの分泌が確認された。
【0019】
ここで、PBMCのIL-6の分泌促進とは、本実施形態における組成物で刺激していない、即ち非刺激のPBMCから分泌されるIL-6の分泌量と比較して、本組成物による刺激によりIL-6の分泌が促進されることを意味する。具体的には、IL-6の分泌量が、非刺激のPBMCから分泌されるIL-6の分泌量と比較して、好ましくは2.0倍以上、より好ましくは2.2倍以上、さらに好ましくは2.5倍以上である。なお、被刺激細胞数等の実験条件及び実験手法は、後述の実施例を参考にすることができる。
【0020】
また、PBMCのIFNγ、TNF-αとIL-1βの分泌促進とは、陰性対照であるグルコースによる刺激と比較して分泌が促進されることを意味する。具体的には、IFNγの分泌量が、好ましくは200 pg/ml以上、より好ましくは400 pg/ml以上、さらに好ましくは600 pg/ml以上の場合であり、さらに本実施形態における組成物を摂取している者の末梢血より得られたPBMCの場合は、IFNγの分泌量が、陰性対照であるグルコースによる刺激と比較して、好ましくは1.5倍以上、より好ましくは2.0倍以上、さらに好ましくは3.0倍以上である。また、TNF-αの分泌量は、陰性対照であるグルコースによる刺激と比較して、好ましくは1.5倍以上、より好ましくは2.0倍、さらに好ましくは2.5倍以上の場合である。一方、IL-1βの分泌量は、好ましくは500 pg/ml以上、より好ましくは600 pg/ml以上、さらに好ましくは700 pg/ml以上の場合である。なお、被刺激細胞数等の実験条件及び実験手法は、後述の実施例を参考にすることができる。
【0021】
また、本実施形態におけるIL-1βの分泌を促進させるPBMCは、CD8+T細胞、CD4+T細胞とCD14+マクロファージを含む。後述する実施例で示すように、CD8+T細胞、CD4+T細胞とCD14+マクロファージを本実施形態における組成物で刺激することでIL-1βの分泌が確認された。
【0022】
ここで、CD8+T細胞、CD4+T細胞とCD14+マクロファージのIL-1βの分泌促進とは、陰性対照であるグルコースによる刺激と比較して分泌が促進されることを意味する。具体的には、CD8+T細胞のIL-1βの分泌量が、好ましくは100 pg/ml以上、より好ましくは150 pg/ml以上、さらに好ましくは200 pg/ml以上の場合である。また、CD4+T細胞のIL-1βの分泌量は、好ましくは100 pg/ml以上、より好ましくは150 pg/ml以上、さらに好ましくは200 pg/ml以上の場合である。一方、CD14+マクロファージのIL-1βの分泌量は、好ましくは300 pg/ml以上、より好ましくは400 pg/ml以上、さらに好ましくは500 pg/ml以上の場合である。なお、各被刺激細胞数等の実験条件及び実験手法は、後述の実施例を参考にすることができる。
【0023】
ここでIFNγとは、サイトカインの一種であり、CD4+細胞から分化するTh1細胞及びTh2細胞のうちTh1細胞を優位な状態に維持することが知られている。Th1細胞が優位な状態になると、NK細胞の活性化のみならず、マクロファージの活性化や細胞傷害性Tリンパ球(CTL)の誘導を引き起こし、癌細胞に対する抵抗性を向上させることが報告されている。一方、Th2細胞は、花粉症やアレルギー性鼻炎、気管支喘息、アトピー性皮膚炎等の疾患を引き起こしている場合に優位な状態になることから、Th1細胞が優位な状態である場合は、上記疾患の治療や予防につながることが知られている。
【0024】
また、TNF-αは抗腫瘍作用を有し、細胞死(アポトーシス)を誘導するサイトカインである。一方、IL-1βは生体内で産生されるIL-1の内、約90%を占めるもので、リンパ球活性化因子として知られている。
【0025】
「リンパ球」の1つであるT細胞は、その細胞表面に発現している分子マーカーの種類によりCD8+T細胞とCD4+細胞に分けることができる。
【0026】
CD8+T細胞は、ウイルスに感染した細胞の表面に存在するウイルス断片や腫瘍細胞の表面に存在する腫瘍細胞特異的なペプチド等を認識することで細胞傷害活性を発揮しウイルス感染細胞や腫瘍細胞を壊死させる。
【0027】
一方、CD4+T細胞は抗原提示細胞である樹状細胞から抗原提示を受けると共に、樹状細胞等の細胞表面に発現しているCD40等の共刺激分子(コスティミュレーター)がCD4+T細胞上の共刺激分子と結合することでCD4+T細胞の細胞レベルでの反応が進展する。これにより、CD4+T細胞は他のT細胞の機能発現の誘導やB細胞の分化誘導等の補助を行うことが可能になる。また、IL-1等のサイトカインにも液性因子としてコスティミュレーター活性があることが知られている。活性化したCD4+T細胞は、B細胞に対して様々なシグナルを送り込む。この結果、B細胞は分化し、抗体の産生が可能となり、生体防御としての役割を担う。
【0028】
本実施形態において樹状細胞の活性促進は、TNF-α及び/又はIL-6の分泌促進を含む。後述する実施例で示すように、樹状細胞を本実施形態における組成物で刺激することでTNF-αとIL-6の分泌の促進が確認された。
【0029】
ここで、樹状細胞のTNF-α及び/又はIL-6の分泌促進とは、陰性対照であるグルコースによる刺激と比較して分泌が促進されることを意味する。また、樹状細胞のTNF-αの分泌量が、陰性対照であるグルコースによる刺激と比較して、好ましくは1.4倍以上、より好ましくは1.6倍以上、さらに好ましくは1.8倍以上の場合である。一方、樹状細胞のIL-6の分泌量が、陰性対照であるグルコースによる刺激と比較して、好ましくは2.0倍以上、より好ましくは2.5倍以上、さらに好ましくは2.8倍以上の場合である。なお、被刺激細胞数等の実験条件及び実験手法は、後述の実施例を参考にすることができる。
【0030】
「単球」から分化する樹状細胞は、生体内において抗原を取り込むことで抗原を提示する抗原提示細胞としての中心的な役割を担っている。樹状細胞が活性化すると、細胞表面に共刺激分子であるCD80やCD86、CD40等が発現し樹状細胞の成熟マーカーとして用いられている。樹状細胞は、TNF-αの刺激により成熟樹状細胞に分化することが知れている。また成熟化した樹状細胞はIL-6を分泌し、B細胞の増殖や抗体産生細胞への分化を誘導することで生体防御としての役割を担う。
【0031】
従って、本実施形態における組成物は生体防御能が低下している時に使用するのが好適である。即ち、リンパ球や単球を含む白血球の低下を引き起こす抗癌剤治療、化学療法、放射線治療又は外科的侵襲後に使用するのが好適である。また、リンパ球や単球を含む白血球の減少を引き起こす風邪やウイルス疾患等の治療や予防に対して使用するのも好適である。
【0032】
また、本実施形態における組成物を使用する対象の疾患が、上記疾患又は2種以上の疾患が併発している場合であっても、本組成物を使用することが可能である。さらに本組成物を単独で使用する他、免疫賦活剤や造血因子(マクロファージコロニー刺激因子や顆粒球コロニー刺激因子、顆粒球マクロファージコロニー刺激因子、エリスロポエチン、トロンボポエチン、血小板由来成長因子等)、各種サイトカイン等を含有させて又は併用して使用することも可能である。
【0033】
<IFNγの分泌抑制からの回復>
本実施形態においてPBMCの活性促進は、副腎皮質ホルモン剤や免疫抑制剤の使用により分泌が抑制されているIFNγの分泌を促進させる作用を有する。後述する実施例で示すように、本実施形態における組成物を摂取することで副腎皮質ホルモン剤や免疫抑制剤の使用により分泌が抑制されているIFNγの分泌の回復が確認された。
【0034】
ここで、副腎皮質ホルモン剤や免疫抑制剤の使用により分泌が抑制されているIFNγの分泌の回復とは、副腎皮質ホルモン剤や免疫抑制剤の使用によりIFNγの分泌を抑制されている者が本実施形態における組成物を摂取することで、陰性対照であるグルコースによる刺激と比較して、IFNγの分泌が回復することを意味する。具体的には、本実施形態における組成物を摂取している者の末梢血より得られたPBMCを本組成物で刺激した場合に分泌されるIFNγの量が、陰性対照であるグルコースの刺激と比較して、好ましくは10倍以上、より好ましくは12倍以上、さらに好ましくは14倍以上の場合である。なお、被刺激細胞数等の実験条件及び実験手法は、後述の実施例を参考にすることができる。
【0035】
細菌やウイルス等の感染やアレルギー反応、異常代謝物の生成、紫外線、外傷、熱傷等による炎症反応を抑制するために使用される副腎皮質ホルモン剤や免疫抑制剤は、各種インターロイキンやインターフェロン等のサイトカイン遺伝子の転写を阻害し、インターロイキン等の産生を阻害し、リンパ球等の活性を低下させることで炎症反応を抑制する。その一方で、各種サイトカインの分泌を抑制する作用から、リンパ球等の生体防御に関わる細胞の活性低下を引き起こし、感染症の誘発や悪化等のリスクが増大する。従って、副腎皮質ホルモン剤や免疫抑制剤を使用している場合であっても、分泌が抑制されているサイトカインの分泌を回復させることで、感染症等のリスクを回避することができる。
【0036】
ここで、副腎皮質ホルモン剤又は免疫抑制剤を使用する患者の疾患として、呼吸器疾患(喘息性気管支炎(小児喘息性気管支炎を含む)やサルコイドーシス、血清病気管支喘息、薬剤その他化学物質によるアレルギー・中毒等、消化器疾患(潰瘍性大腸炎や限局性腸炎等)、肝疾患(重症肝炎や劇症肝炎、胆汁鬱滞型急性肝炎、活動型慢性肝炎、急性再燃型慢性肝炎、胆汁鬱滞型慢性肝炎、肝硬変等)、腎疾患(ネフローゼ症候群等)、神経疾患(多発性硬化症や筋強直症、脳脊髄炎、重症筋無力症、小舞踏病、顔面神経麻痺、脊髄蜘網膜炎、末梢神経炎等)、内分泌疾患(亜急性甲状腺炎や続発性慢性副腎皮質機能不全原発性慢性副腎皮質機能不全、医原性慢性副腎皮質機能不全、下垂体性慢性副腎皮質機能不全、急性副腎皮質機能不全、副腎性器症候群、甲状腺中毒症等)、皮膚疾患(急性急性湿疹や慢性湿疹、接触性皮膚炎、アトピー性皮膚炎、脂漏性皮膚炎、貨幣状湿疹、自家感作性皮膚炎、鬱滞性皮膚炎、皮脂欠乏性湿疹、進行性指掌角皮症、女子顔面黒皮症、ビダール苔癬、放射線皮膚炎、日光皮膚炎等)等を一例としてあげることができる。
【0037】
また、副腎皮質ホルモン剤とは、糖質コルチコイドを意味し、一例としてコルチゾールやベタメタゾン、プレドニゾロン、パラメタゾン、ジフルコルトロン、メチルプレドニゾロン、フルドロコルチゾン、コルチゾン、コルチコステロン、ジフルプレドナート、トリアムシノロン、デキサメタゾン等が挙げられ、上記疾患に対して医学的な見地により適切に選択される。
【0038】
また、免疫抑制剤としてシクロスポリンやタクロリムス、ミゾリビン、シクロホスファミド、ザフィルルカスト等を例示することができ、上記疾患に対して医学的な見地により適切に選択される。
【0039】
本実施形態において副腎皮質ホルモン剤又は免疫抑制剤は塗り薬や飲み薬、注射薬、吸入薬等の形で投与が可能であるが、各疾患の治療において医学的に最適な投与方法に従う限り特段の制限を設けることはない。
【0040】
本実施形態における組成物をIFNγの分泌抑制からの回復に用いる場合は、本組成物の摂取期間に特段の設定することはないが、副腎皮質ホルモン剤又は免疫抑制剤を使用している間は、摂取することが望ましい。
【0041】
<腫瘍免疫療法>
本実施形態におけるPBMCの活性抑制にはT細胞の増殖抑制を含む。後述する実施例で示すように、非特異的な増殖刺激を受けているPBMCを本実施形態における組成物で刺激するとT細胞の増殖を抑制することが確認された。
【0042】
ここで、T細胞の増殖の抑制とは、陰性対照であるグルコースによる刺激と比較してT細胞の増殖が抑制されていることを意味する。具体的には、T細胞の細胞数が、グルコースによる刺激と比較して、好ましくは0.8倍以下、より好ましくは0.6倍以下の場合である。なお、被刺激細胞数等の実験条件及び実験手法は、後述の実施例を参考にすることができる。
【0043】
本実施形態におけるPBMCの活性抑制にはTregの増殖の抑制を含む。後述する実施例で示すように、非特異的な増殖刺激を受けているPBMCを本実施形態における組成物で刺激するとTregの増殖を抑制することが確認された。
【0044】
ここで、Tregの増殖の抑制とは、陰性対照であるグルコースによる刺激と比較してTregの増殖が抑制されていることを意味する。具体的には、健康成人由来のCD4+T細胞中のFoxp3の存在割合が、陰性対照であるグルコースによる刺激と比較して、好ましくは0.7倍以下、より好ましくは0.5倍以下の場合である。一方、成人アトピー患者由来のCD4+T細胞中のFoxp3の存在割合が、陰性対照であるグルコースによる刺激と比較して、好ましくは0.7倍以下、より好ましくは0.5倍以下、さらに好ましくは0.3倍以下の場合である。なお、被刺激細胞数等の実験条件及び実験手法は、後述の実施例を参考にすることができる。
【0045】
TregはCD4+T細胞から分化し、Tregの働きにより過剰に反応したT細胞は過剰反応を抑制する方向へ制御されることが知られている。Tregは、転写因子であるFoxp3がCD4+T細胞内において発現することで分化することが指摘されている。従って、Tregは、通常、生体内の過剰なT細胞の反応を抑制する役割を担っている。
【0046】
さらには、本実施形態における組成物にはTregの増殖を抑制する効果を有することから、Tregにより効果が制限される腫瘍免疫療法の有効性を高めることが可能である。
【0047】
癌患者においてはTregが過剰に存在し、この過剰なTregの存在によって癌患者の抗腫瘍免疫応答は抑制され、癌治療を困難にする一因となっている。癌患者にはTregが多数存在することから、腫瘍免疫療法の有効性が制限されている。Tregを特異的に殺減する手段としてジフテリアトキシン結合リコンビナントIL-2を用いて腫瘍免疫療法の有効性を高める治療法が考案されている(非特許文献7)。しかし、上記治療法はトキシン結合のIL-2等の高価な組み替えタンパク質を用いることから、費用の面で大きな障害となっている。従って、安価であり且つ安全にTregの増殖を抑制する高価な組み換えタンパク質等の代替物の登場が望まれていた。
【0048】
ここで、「腫瘍免疫療法」とは、腫瘍細胞又は組織若しくは生物工学的に作製した腫瘍抗原などを用いて免疫細胞の免疫力を高めることで癌を抑制する治療法である。腫瘍は、大腸癌や胃癌、肺癌、乳癌等を意味する。腫瘍免疫療法には、LAK療法、CTL療法、自家腫瘍ワクチン療法、樹状細胞ワクチン療法、DNAワクチン療法及びペプチドワクチン療法等を含む。腫瘍抗原は、細胞の癌化に伴い、新たに産生される腫瘍特異抗原と、癌化する前の正常組織や腫瘍組織においても産生する腫瘍関連抗原を含み、(1)ウイルス(子宮頸癌のヒトパピローマウイルスやヒトTリンパ好性ウイルス等)由来の遺伝子産物による抗原、(2)癌遺伝子(srcやras遺伝子等)や癌抑制遺伝子(p53やBRCA1等)の変異による抗原、(3)癌化の際に産生する抗原(前立腺特異抗原や悪性黒色腫の抗原等)、(4)胚発生期のみに発現する抗原(癌胎児性抗原等)などがある。
【0049】
本実施形態における組成物の使用によりTregの増殖を抑制することで、治療効果を高めることができるのであれば、いずれの腫瘍免疫療法を採用してもよい。特に樹状細胞ワクチン療法が好適である。また2種以上の腫瘍免疫療法を併用してもよい。
【0050】
また、腫瘍抗原は、いずれを選択することも可能であるが、核酸によりコードされたタンパク質又はペプチドが好適である。また、腫瘍細胞又は組織そのものを用いることも可能であり、さらには、抗原性の高い部分、エピトープを用いることも可能である。
【0051】
本実施形態における組成物を用いて腫瘍免疫療法を行う場合は、服用期間に特段の設定することはないが、Tregの増殖を抑制することが腫瘍免疫療法の効果を有効にするところ、腫瘍免疫療法の期間中は摂取し続けることが望ましい。
【0052】
<パパイア発酵物を含有する組成物の製造方法>
パパイア発酵物を含有する組成物は、粉砕し摩砕したパパイアに糖質を添加し熟成又は発酵させた混合物1を濾過により濾液1と残渣1に分画した後、残渣1に糖質を添加し熟成又は発酵させた混合物2を濾過により濾液2を分画し、濾液1と濾液2を混合した物(混合濾液)に糖質を添加した中間原料を発酵させ、更に糖質を添加し、乾燥させた後、長期熟成させることで得られる。混合濾液に添加する糖質の量は、混合濾液に対して40から60質量%になるよう調製することが好適である。熟成させる場合の期間は、4から10日間の期間が好適であり、より好適な熟成の期間は、7から10日間である。一方、長期熟成期間は6ヶ月以上が好適である。
【0053】
パパイアとは、パパイア科パパイア属の果実である「パパイア(学名:Carica papaya Linn)」をいい、果物として店頭にならんでいる黄色の成熟パパイアだけでなく、野菜として料理に用いられる緑色の未成熟パパイアも含まれる。パパイアは熱帯から亜熱帯にかけて広く栽培されているが、原産地を特に制限するものではなく、いずれも使用することが可能である。また、成熟又は未成熟を問わずいずれのパパイアを発酵の対象として使用することも可能であるが、野生の未成熟パパイアを用いるのが好適である。
【0054】
本実施形態においてパパイアの発酵には酵母を用いることができる。用いる酵母としては、パパイアを発酵できるものであれば特に限定しないが、例としてカンジダ属(Candida)やピキア属(Pichia)、クリベロマイセス属(Kluyveromyces)、サッカロマイセス属(Saccharomyces)、シゾサッカロマイセス属(Schizosaccaromyces)等を挙げることができるが、好ましくは、サッカロマイセス属の酵母である。また、パパイアに付着又は存在する天然の酵母をそのまま発酵に用いてもよい。パパイアを発酵できるものであれば、通常の方法で凍結乾燥させ調製したもの又は冷蔵で保存しているものであってもよい。酵母発酵の至適条件は、各酵母依存的であり、製造工程の条件や目的製品の状態に合わせて使用方法及び条件を適宜選択することが可能である。さらには、1又は2種以上の酵母を同時又は逐次的に使用することも可能である。
【0055】
本実施形態においてパパイアの発酵には乳酸菌を用いることができる。用いる乳酸菌としては、パパイアを発酵できるものであれば特に限定しないが、例としてストレプトコッカス属(Streptococcus)やラクトバチルス属(Lactobacillus)、ラクトコッカス属(Lactococcus)、ビフィドバクテリウム属(Bifidobacterium)、ロイコノストック属(Leuconostoc)、ペディオコッカス属(Pediococcus)などを挙げることができる。好ましくは、ストレプトコッカス属(Streptococcus)の乳酸菌である。また、パパイアに付着又は存在する天然の乳酸菌をそのまま発酵に用いてもよい。いずれの乳酸菌であっても、パパイアを発酵できるのであれば、通常の方法で凍結乾燥させ調製したもの又は冷蔵で保存しているものであってもよい。乳酸菌発酵の至適条件は、各乳酸菌依存的であり、製造工程の条件や目的製品の状態に合わせて使用方法及び条件を適宜選択することが可能である。さらには、1又は2種以上の乳酸菌を同時又は逐次的に使用することも可能である。
【0056】
本実施形態においてパパイアの発酵にはアミラーゼを用いることができる。アミラーゼは澱粉中に含まれるアミロースやアミロペクチンのグリコシド結合を加水分解することができる消化酵素であり、目的とする製品の製造工程において充分な活性を有するものであれば、特段の制限を設けることはない。アミラーゼの至適条件は、使用する酵素依存的であり、製造工程の条件や目的製品の状態に合わせて使用する酵素を適宜選択することが可能である。さらには、1又は2種以上のアミラーゼを同時又は逐次的に使用することも可能である。
【0057】
本実施形態においてパパイアの発酵には味噌用酵素を用いることができる。味噌用酵素とは、味噌や醤油等の発酵食品の製造に用いられるアスペルギルス属(Aspergillus)の分泌物等を含む。アスペルギルス属に含まれる微生物としてアスペルギルス・オリゼーやアスペルギルス・ニガー、アスペルギルス・ソーエー等を一例として挙げることができる。好ましくは、アスペルギルス・オリゼーである。味噌用酵素は要求される目的製品の品質を満たすものであれば必ずしも精製されている酵素である必要はなく、粗精製のものでもあってもよく、更には菌体そのものを使用することも可能である。味噌用酵素の至適条件は、酵素依存的であり、製造工程の条件や目的製品の状態に合わせて使用方法及び条件を適宜選択することが可能である。さらには、1又は2種以上の味噌用酵素を同時又は逐次的に使用することも可能である。
【0058】
微生物等の混入を防ぐ目的で発酵前にパパイアを低温殺菌(蒸気や熱湯等)や高温殺菌(加熱蒸気や熱湯等)、マイクロ波、高周波、赤外線、遠赤外線、紫外線、γ線、X線、電子線、オゾン殺菌等の殺菌処理を施すことも可能である。成熟パパイアを用いて発酵する場合は、微生物等による腐敗を引き起こしやすいことから殺菌処理を施すことが好適である。一方で、野生の未成熟パパイアを用いる場合は、未成熟パパイアに付着又は存在する微生物(酵母や乳酸菌等)が発酵に有益である場合には殺菌処理を施さないのが好適である。
【0059】
発酵促進の目的で加える糖質は、澱粉やモルト、デキストラン、スクロース(蔗糖)、マルトース(麦芽糖)、グルコース(ブドウ糖)等を用いることが可能であるが、パパイアの酵素を不活性化し腐敗を防止する観点から、同じ質量の糖質でも細胞内浸透圧を高くし原形質膜分離を引き起こすことが可能である低分子の糖質を用いるのが好適であり、特に単糖であるグルコースを用いることが好適である。
【0060】
<本実施形態における組成物の形態等>
本実施形態においる組成物の形態は、乳白色の粉末であるが、そのままの形態で使用することも可能である。また他の形態として、散剤や錠剤、カプセル剤、軟カプセル剤、液剤、シロップ剤、丸剤等の任意の形態に調製することができるが、特にこれらに限定されるものではない。
【0061】
本実施形態における組成物の1回の摂取あたりの含有量は、例えば、体重60kgのヒトを対象とする場合は、中間原料1g(液体質量)から2.5g(乾燥質量)の組成物が得られた場合を基準とすると、乾燥質量換算で1gから15g/(60kg体重)であることが好適であり、更に3gから12g/(60kg体重)であることがより好適である。また、上記基準を基に組成物の含有量を増減させることが好適である。本実施形態における組成物は安全性が高いことから、特段の摂取量上限値を設定することはない。
【0062】
<飲食物、健康食品又は飼料添加物>
本実施形態における組成物を飲食物、健康食品又は飼料添加物(以下、飲食物等)として使用することができる。
【0063】
本実施形態における組成物を飲食物又は健康食品として用いる場合に、本組成物をそのままの形態で使用することも可能であるが、他の形態を例示すると賦形剤(グルコースや澱粉、炭酸カルシウム等)や添加剤(グァーガムやグリシン等)、甘味料、酸味料、香味料、ビタミン又はミネラル等を組み合わせて顆粒や細粒、粉末、タブレット、ドロップ、トローチ、ゲル、シロップ、ドリンク等の形態とすることが挙げられる。
【0064】
また、他の形態としてクッキーやケーキ、パン、チョコレート、羊羹、お汁粉、アイスクリーム、プリン、クラッカー、チップス等の菓子類、茶、コーヒー、ジュース、牛乳、アルコール等の飲料水、スパゲッティ、うどん、蕎麦、ラーメン等の麺類、ハム、ソーセージ、はんぺん、かまぼこ等の練り製品、ドレッシング、味噌、醤油、マヨネーズ、ふりかけ等の調味料、カレー、シチュー等のスープ類等が挙げられる。
【0065】
本実施形態における組成物は飼料添加物として用いることも可能である。例示すると、家畜(牛や豚等)や家禽(鶏や鶉等)、養殖魚類(鯛や鰻等)、ペット類(犬や猫等)等の飼料に添加することができる。いずれの飼料に添加する場合であっても、本組成物をそのままの形態で添加することも可能であり、また顆粒や細粒、粉末、タブレット、カプセル等の形態で添加することも可能である。
【0066】
本実施形態における組成物を飲食物等として使用する場合の添加量は、中間原料1g(液体質量)から2.5g(乾燥質量)の組成物が得られた場合を基準とすると、飲食物等に対して、好ましくは1.0質量%以上、より好ましくは3.0質量%以上、さらに好ましくは5.0質量%以上の時、官能評価上、飲食物等として好ましい状態となる。また、上記基準を基に組成物の添加量は増減させることが好適である。
【0067】
本実施形態における組成物を飲食物等として使用する場合は、例えば、体重60kg1回の摂取量あたりの組成物の含有量は、中間原料1g(液体質量)から2.5g(乾燥質量)の組成物が得られた場合を基準とすると、乾燥質量換算で1gから15g/(体重60kg)であることが好適であり、更に3gから12g/(体重60kg)であることがより好適である。また、上記基準を基に組成物の含有量を増減させることが好適である。本実施形態における組成物は安全性が高いことから、特段の摂取量上限値を設定することはない。
【0068】
本実施形態における組成物は、ヒト以外にも使用することが可能である。対象となるヒト以外の動物として、犬や猫等のペットや、牛や豚等の家畜、鶏や鶉等の家禽、鯛や鰻等の養殖水産動物等に対しても使用することが可能である。
【実施例】
【0069】
以下、実施例によって本発明をさらに説明する。但し、下記の実施例は発明を例示するためのものであり、本発明をいかなる意味においても限定するものではない。
【0070】
<実施例1>
図1に示すパパイア発酵物を含有する組成物の製造例を示す流れ図を基にして以下において、その製造方法を記載する。
【0071】
1)パパイア発酵に用いる中間原料の製造例
白色の種子を有する野生の未成熟パパイア100kgを採取し、異物除去のため水洗いをした後、ヘタ部分及び果実の底部を除いた。パパイアを皮ごとスライスした後、粉砕し摩砕することでマッシュ品85kgを得た。マッシュ品にグルコース20kgを添加し、良く混和した後、4日間静置することで熟成した混合物1を得た。混合物1を濾過し、果汁液である濾液1とその残渣1を得た。60kgの残渣1に対して、グルコース10kgを添加し、良く混和した後、4日間静置することで熟成させた混合物2を得た。混合物2を濾過し、果汁液である濾液2を得た。濾液1と濾液2を混合した混合濾液に、グルコース2kgを添加し、良く混和することで目的とする中間原料を40kg得た。
【0072】
2)パパイア発酵物を含有する組成物の製造例
上記中間原料40kgを、20kg(中間原料1)、15kg(中間原料2)、5kg(中間原料3)に分け、中間原料1に味噌用酵素0.5kgを、中間原料2に乳酸菌0.5kg及び味噌用酵素0.1kgを、中間原料3にアミラーゼ0.1kgを添加し、良く混和し、40℃にて48時間発酵させることで、それぞれ発酵物1、2、3を得た。発酵物1にグルコース60kgを、発酵物2にグルコース30kgを、発酵物3にグルコース10kgを添加し、良く混和した後、18℃、1ヶ月間乾燥させ、粉砕し、組成物1、2及び3を得た。組成物1、2及び3を合わせて混合均質化し、ガスバリヤー製の高いアルミ包材内で6ヶ月以上熟成し、パパイア発酵物を含有する組成物(最終組成物を100kg得た。
【0073】
<実施例2> パパイア発酵物を含有する組成物及びグラム陰性菌リポ多糖(LPS)の調整
パパイア発酵物を含有する組成物の粉末4gを6mlのphosphate buffered saline (PBS)に懸濁し、37℃、1時間、充分に撹拌し、さらにPBSを加えて10mlに調製(40%溶液)した。その後、2000rpm、10分、遠心し、上清を0.45μmのフィルターで濾過した(ストック溶液400 mg/ml)。陽性対照としてLPS(E.coli 由来cat. L-4516,Sigma)を用いた。LPSはPBSで100μg/mlになるように希釈しストック溶液とした。パパイア発酵物を含有する組成物(P)及びLPS(L)ストック溶液をそれぞれ試験に用いる培地(例: 10% FCS/RPMI培養液)で希釈し目的とする最終濃度として調整した。なお、本実施例で使用するパパイア発酵物を含有する組成物は、発酵過程で用いる糖質としてグルコースを選択しており、最終製品のグルコース濃度は試験をする上で無視できない量が含まれている。従って、本実施例においては、試験結果が、本組成物中に含まれるグルコースによる効果ではないこと明らかにする目的で陰性対照としてグルコース(片山化学)を用いることとした。
【0074】
<実施例3> マウス樹状細胞の誘導及びパパイア発酵物を含有する組成物でのマウス樹状細胞刺激
BALB/cマウス大腿骨より骨髄細胞を採取し、IL-4及びGM-CSFを共に10 ng/mlの濃度で1週間培養した。その後LPS 1 μg/mlにて刺激し、24時間後の浮遊している細胞を成熟樹状細胞とした。パパイア発酵物を含有する組成物(P)及びLPS(L)をそれぞれ10% FCS/RPMI培養液で希釈し、最終濃度をそれぞれ5 mg/ml、1ng/mlとしてマウス樹状細胞を刺激し、陰性対照であるグルコースの濃度は5 mg/mlとして刺激した。マウス樹状細胞の被刺激細胞数を1x105 cells/wellとして刺激し、24時間の培養後の培養液中のサイトカイン濃度をCBA(Cytometric Bead Array)を用い、フローサイトメーターで網羅的に解析した。CBAは、蛍光標識(APC蛍光色素で標識、蛍光濃度を6段階にかえている)したビーズとあらかじめ測定したいサイトカインに対する抗体をあらかじめ結合させておき、培養テストサンプル50μlと反応させた後、PE蛍光標識された各々の抗体でサンドイッチする事で、多項目の同時測定を可能にする定量法である。各サイトカインの量はBD CBA Human and Mouse inflammatoryキット(Cat no. 551811及び552364, BD Biosciences)、Human Th1/Th2 Cytokineキット(Cat no. 550749, BD Biosciences)を用いて、マニュアルに従い定量した。Human Inflammatoryキットは、IL-1βやIL-6、IL-8、IL-10、IL-12p70、TNF-αを、Mouse Inflammatory キットはIFNγやMCP-1、IL-6、IL-10、IL-12p70、TNF-αを、Human Th1/Th2 CytokineキットはIFNγやTNF-α、IL-2、IL-4、IL-5、IL-10が同時に測定可能である。
【0075】
培養上清中のサイトカイン量の測定結果を図2に示した。この結果から明らかなように、パパイア発酵物を含有する組成物(P)の刺激によりマウス樹状細胞からTNF-αとIL-6の分泌が認められた。従って、パパイア発酵物にはマウス樹状細胞を活性化しTNF-αとIL-6の分泌を促進する能力があることが明らかとなった。
【0076】
<実施例4> ヒト末梢血単核球細胞(PBMC)の刺激法
ヒトPBMCを200μlの10% FCS/RPMI培養液中で1x105 cells/wellとなるように細胞数を調整し、本組成物(P)のストック溶液(400 mg/ml)を1μl刻みで1〜5μl加え(最終濃度はそれぞれ2、4、6、8及び10 mg/ml)、ヒトPBMC細胞を刺激した。陰性対照には本組成物(P)のストック溶液を無添加の条件に設定している。24時間の培養後、培養液中のIL-6の濃度をELISAにて測定した。培養後の上清中のサイトカインIL-6をELISAキット(R&D, Minneapolis, USA)を使用し製品マニュアルに従って定量した。
【0077】
培養上清中のサイトカイン量の測定結果を図3に示した。この結果から明らかなように、パパイア発酵物を含有する組成物(P)の刺激によりヒトPBMCからIL-6の分泌が認められた。従って、パパイア発酵物にはヒトPBMCを活性化しIL-6の分泌を促進する能力があることが明らかとなった。
【0078】
<実施例5> 健康成人(HD)及び成人アトピー患者(AD)のPBMCにおける刺激
健康成人(HD)及び成人アトピー患者(AD)のヒトのPBMCにおける刺激効果を調べた。アトピー患者は、副腎皮質ホルモン剤又は各種免疫抑制剤を定期的に体躯及び顔面に塗布している状態である。健康成人及びアトピー患者からヒトヘパリン化末梢血を採取後、ヒストパック(Sigma-Aldrich cat.107)でPBMCを分離した。分離したヒトPBMCの被刺激細胞数を1×105 cells/well(IFNγのみ1×106 cells/well)として、平底96穴プレートに播き、LPS(L)を1μg/ml、パパイア発酵物を含有する組成物(P)を10mg/mlの濃度で刺激し、24時間培養した。
【0079】
培養後の上清中のサイトカインIL-1β及びTNF-αをELISAキット(R&D, Minneapolis,USA)を使用し製品マニュアルに従って定量した。またIFNγは、Capture抗体として抗ヒトIFNγmAb(1-D1K, MABTECH AB)を炭酸バッファー(pH9.6)で500倍に希釈したものを使用し、抗ヒトIFNγウサギ血清を5% FCS/PBSで600倍に希釈したものを使用し、二次抗体としてヤギ抗ラビットIgG-HRP(MBL)を5% FCS/PBSで2000倍に希釈したものを使用し、サンドイッチ法を用いて測定した。発色はOPDA(和光純薬、3mg/10ml クエン酸バッファー, pH5.0)に31% H202(三菱ガス科学)を10μl添加し、490nmでOD値を測定した。L+PはLPS(L)及びパパイア発酵物を含有する組成物(P)両者を共存させたウェルである。陰性対照として10mg/mlのグルコースを用いた。刺激後24時間培養した上清を回収し、ELISAを実施した。IFNγの産生に関しては、実験後、パパイア発酵物を含有する組成物を朝食後に毎日3g、2カ月間継続服用した後、再び採血し同様の実験を行った。なお、本実験は、各被験者に対してインフォームドコンセントの同意を得た上で採血し、実験を実施した。
【0080】
ヒトPBMCにおける刺激の結果を図4に示した。図4から明らかなように、HD及びAD共に、パパイア発酵物を含有する組成物(P)の刺激によりヒトPBMCからIL-1βとTNF-αの分泌を確認することができた。従って、パパイア発酵物にはヒトPBMCを活性化しIL-1βとTNF-αの分泌を促進する能力があることが明らかとなった。
【0081】
IFNγの分泌結果を図5に示した。パパイア発酵物を含有する組成物(P)でHDのPBMCを刺激することでIFNγの分泌を促進することが明らかとなった。一方、ADのPBMCをパパイア発酵物を含有する組成物(P)で刺激しても検出可能なレベルまでIFNγの分泌を促進することが出来なかった。一方で、2ヶ月間、毎日朝食後3gのパパイア発酵物を含有する組成物(P)を摂取した場合は、ADのIFNγの分泌が、HDと同程度のレベルまで回復することが明らかとなった。
【0082】
以上の結果から、パパイア発酵物を摂取することで、副腎皮質ホルモン剤又は免疫抑制剤を使用したアトピー患者であっても、健康成人が分泌するIFNγ量と同程度にまでIFNγの分泌量が回復することが明らかとなった。
【0083】
<実施例6> CD8+T細胞、CD4+T細胞及びCD14+マクロファージにおける刺激
ヒトPBMCをMACS磁気ビーズを用いてそれぞれCD8+T細胞、CD4+T細胞及びCD14+マクロファージ系に分画し、それぞれ1×105 cells/wellに調製した。パパイア発酵物を含有する組成物(P)は10mg/mlの濃度で、LPS(L)は1μg/mlの濃度で、グルコースは10mg/mlの濃度でそれぞれ培地に添加し24時間刺激した。24時間後の培養上清中のIL-1βをELISAキット(R&D, Minneapolis, USA)を使用し製品マニュアルに従って定量した。
【0084】
IL-1βの分泌結果を図6に示した。パパイア発酵物を含有する組成物(P)で刺激した場合は、CD8+T細胞、CD4+T細胞及びCD14+マクロファージのいずれにおいてもIL-1βの分泌を確認することができた。従って、パパイア発酵物にはCD8+T細胞、CD4+T細胞及びCD14+マクロファージを活性化しIL-1βの分泌を促進する能力があることが明らかとなった。
【0085】
<実施例7> ヒトPBMCのフィトヘマグルチニン(PHA)刺激へのパパイア発酵物の関与
PHAを用いてヒトPBMCを非特異的に増殖刺激し、10%FCS/RPMI培養液にパパイア発酵物を含有する組成物(P)を加えその関与を検討した。PHAはT細胞のみを増殖させる試薬として知られている。6穴プレートを用いて、ヒトPBMC 1×105 cells/well をPHA 10μg/ml及びIL-2 25 IU/mlの条件で非特異的な増殖刺激をおこない、パパイア発酵物を含有する組成物(P)を 10mg/mlの濃度になるように添加した。陰性対象としてグルコースを用いて10mg/mlの濃度になるように添加した。6日間培養し、細胞数をカウントした。
【0086】
PHAを用いた非特異的刺激の結果を図7に示した。図7から明らかなように、パパイア発酵物を含有する組成物(P)を添加すると、ヒトPBMCの増殖を抑制した。PHAはT細胞のみを特異的に増殖させることから、パパイア発酵物を含有する組成物で刺激することでT細胞の増殖を抑制することが明らかとなった。従って、パパイア発酵物にはT細胞の増殖を抑制する作用を有することが明らかとなった。
【0087】
<実施例8> PHA刺激後におけるTregの動態
健康成人(HD)及び成人アトピー患者(AD)から単離したヒトPBMCを実施例7に記載の実験後に、MACS磁気ビーズ(Miltenyi Biotec, USA)を用いて、マニュアルに従いCD4+T細胞を単離し、Tregの指標である細胞内Foxp3の発現を解析した。ヒトFoxp3は細胞内測定キット(eBioscinece)を使用し、製品マニュアルに従って測定した。測定にはBD FACS Calibur (BD Biosciences)を使用し、解析はCell Questソフトウェアを用いた。
【0088】
Foxp3の発現解析の結果を図8に示した。図8から明らかなように、健康成人(HD)のFoxp3の割合はグルコース添加の2.2 %に対し、パパイア発酵物を含有する組成物(P)の添加で0.96 %と約1/2に低下していた。従って、パパイア発酵物には健康成人(HD)のTregの増殖を抑制する作用を有することが明らかとなった。また、成人アトピー患者(AD)のTregの割合はグルコース添加の5.1%に対して、パパイア発酵物を含有する組成物(P)の添加で1.2%と約1/4に低下していた。
【0089】
<考察>
本実施例で使用したパパイア発酵物を含有する組成物にはグルコースを多量に含むことから陰性対照としてグルコースを用いて試験を行った。いずれの試験においてもグルコースによる末梢血単核球細胞の活性調節は観察されなかった。また、グラム陰性菌のリポ多糖であるLPSは、空気中にも存在する。故に他の多くの健康食品に見られる種々の効果は外部から混入したLPSによる効果の場合が往々にしてある。しかし、パパイア発酵物を含有する組成物は、LPSの経路とは異なる経路でヒトPBMCを刺激していることを明らかにした(結果は示さない)。従って、末梢血単核球細胞の活性調節はパパイア発酵物による作用であり、組成物中に含まれるグルコース等の糖質や混入したLPSの作用によるものではないことが明らかとなった。
【産業上の利用可能性】
【0090】
本発明において記載したパパイア発酵物を含有する末梢血単核球細胞の活性調節用組成物は、長期間服用しても安全で優れた官能的性質を有する。本発明に組成物を摂取することで、ヒトPBMCを活性化させるだけではなく活性を抑制することができることから優れた末梢血単核球細胞の活性調節能を提供することができる。また、本組成物はIFNγの分泌を促進させることから、Th1細胞を優勢な状態に維持しアトピーやアレルギー体質の改善に寄与する。従って、生体防御能力の向上等の健康増進を目的とする食品等への利用のみならず、癌予防等の医療分野においても応用することが可能である。
【0091】
また、IFNγにはNK細胞及びマクロファージの活性化、CTL細胞の誘導等の重要な働きを担っていることから、パパイア発酵物を含有する組成物を摂取することでIFNγの分泌が促進され、癌細胞の免疫学的監視能力を高める可能性が示唆された。
【特許請求の範囲】
【請求項1】
パパイア発酵物を有効成分として含有する末梢血単核球細胞の活性調節用組成物。
【請求項2】
前記末梢血単核球細胞の活性調節が末梢血単核球細胞の活性促進及び/又は末梢血単核球細胞の活性抑制である請求項1記載の組成物。
【請求項3】
前記末梢血単核球細胞の活性促進が前記組成物を摂取することで副腎皮質ホルモン剤又は免疫抑制剤の使用により抑制された末梢血単核球細胞のインターフェロンγの分泌促進である請求項2記載の組成物。
【請求項4】
前記末梢血単核球細胞の活性抑制が制御性T細胞の増殖抑制である請求項2記載の組成物。
【請求項5】
前記組成物を摂取することで、前記制御性T細胞の増殖抑制により腫瘍免疫療法の有効性を高める請求項4記載の組成物。
【請求項6】
前記末梢血単核球細胞がアトピー患者由来である請求項3から5のいずれか記載の組成物。
【請求項7】
前記末梢血単核球細胞の活性抑制がT細胞の増殖抑制である請求項2記載の組成物。
【請求項8】
前記末梢血単核球細胞の活性促進がインターロイキン6、インターフェロンγ及び腫瘍壊死因子αからなる群より選択される1種以上の分泌促進である請求項2記載の組成物。
【請求項9】
前記末梢血単核球細胞の活性促進が樹状細胞の腫瘍壊死因子α及び/又はインターロイキン6の分泌促進である請求項2記載の組成物。
【請求項10】
前記末梢血単核球細胞の活性促進が末梢血単核球細胞のインターロイキン1βの分泌促進である請求項2記載の組成物。
【請求項11】
前記末梢血単核球細胞がCD8+T細胞、CD4+T細胞及びCD14+マクロファージからなる群より選択される1種以上である請求項10記載の組成物。
【請求項12】
請求項1から11のいずれか記載の組成物を含む飲食物、健康食品又は飼料添加物。
【請求項1】
パパイア発酵物を有効成分として含有する末梢血単核球細胞の活性調節用組成物。
【請求項2】
前記末梢血単核球細胞の活性調節が末梢血単核球細胞の活性促進及び/又は末梢血単核球細胞の活性抑制である請求項1記載の組成物。
【請求項3】
前記末梢血単核球細胞の活性促進が前記組成物を摂取することで副腎皮質ホルモン剤又は免疫抑制剤の使用により抑制された末梢血単核球細胞のインターフェロンγの分泌促進である請求項2記載の組成物。
【請求項4】
前記末梢血単核球細胞の活性抑制が制御性T細胞の増殖抑制である請求項2記載の組成物。
【請求項5】
前記組成物を摂取することで、前記制御性T細胞の増殖抑制により腫瘍免疫療法の有効性を高める請求項4記載の組成物。
【請求項6】
前記末梢血単核球細胞がアトピー患者由来である請求項3から5のいずれか記載の組成物。
【請求項7】
前記末梢血単核球細胞の活性抑制がT細胞の増殖抑制である請求項2記載の組成物。
【請求項8】
前記末梢血単核球細胞の活性促進がインターロイキン6、インターフェロンγ及び腫瘍壊死因子αからなる群より選択される1種以上の分泌促進である請求項2記載の組成物。
【請求項9】
前記末梢血単核球細胞の活性促進が樹状細胞の腫瘍壊死因子α及び/又はインターロイキン6の分泌促進である請求項2記載の組成物。
【請求項10】
前記末梢血単核球細胞の活性促進が末梢血単核球細胞のインターロイキン1βの分泌促進である請求項2記載の組成物。
【請求項11】
前記末梢血単核球細胞がCD8+T細胞、CD4+T細胞及びCD14+マクロファージからなる群より選択される1種以上である請求項10記載の組成物。
【請求項12】
請求項1から11のいずれか記載の組成物を含む飲食物、健康食品又は飼料添加物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2012−92044(P2012−92044A)
【公開日】平成24年5月17日(2012.5.17)
【国際特許分類】
【出願番号】特願2010−240632(P2010−240632)
【出願日】平成22年10月27日(2010.10.27)
【出願人】(500099386)株式会社済度 (6)
【Fターム(参考)】
【公開日】平成24年5月17日(2012.5.17)
【国際特許分類】
【出願日】平成22年10月27日(2010.10.27)
【出願人】(500099386)株式会社済度 (6)
【Fターム(参考)】
[ Back to top ]

